Автор: Петров Р.В. Хаитов Р.М
Теги: иммуногенност медицинская микробиология и паразитология общая терапия иммунология вакцины
ISBN: 978-5-9704-1868-0
Год: 2011
Текст
Р.В. Петров
Р.М. ХаитовБИБЛИОТЕКАИММУНОЛОГИЯИммуногены
И вакцины
нового поколенияИЗДАТЕЛЬСКАЯ ГРУППА«ГЭОТАР-Медиа»
Р.В. Петров
Р.М. ХаитовБИБЛИОТЕКА^^ВРАЧАСЩШХСТХИММУНОЛОГИЯИммуногены
и вакцины нового
поколенияМоскваИЗДАТЕЛЬСКАЯ ГРУППА«ГЭОТАР-Медиа»2011
УДК 616-097
ББК52.6+53.53
ПЗОПетров Рэм ВикторовичАкадемик РАН, РАМН и РАСХН, профессор, Герой Социалистического Труда,
лауреат Государственной премии и премии Правительства РФ, Почетный
председатель Всероссийского научного общества иммунологов.Хаитов Рахим МусаевичАкадемик РАН и РАМН, профессор, директор ГНЦ «Институт иммунологии«>
ФМБА России, лауреат Государственной премии и дважды лауреат премии
Правительства РФ, президент Российской ассоциации аллергологов и иммунологов.Научный редактор — л-р биол. наук, проф. Манько Виктор Михайлович (ГНЦ «Институт
иммунологии» ФМБА России).Иллюстративный материал — Закурдаева Алла Юрьевна (ГНЦ «Инсти тут иммунологии»
ФМБА России).ПЗО Петров Р.В., Хаитов P.M.Иммуногены и вакцины нового поколения. — м.: ГЭОТАР-Медиа, 2011. — 608 с.:
ил. (Серия «Библиотека нрача-сиециалиста»)ISBN 978-5-9704-1868-0Книга посвящена созданию эффективных иммуногенов и конструир1)ванию на их
основе вакцин нового поколения с повышенными иммунизирующими свойствами
против ряда актуальных инфекций {грипп, гепатиты, ВИЧ/СПИД, рак, 1'уберкулез,
сальмонеллез и др.), а также аллергий. Характеризуются очишенные фрагменты и
эпитопы выделенных антигенов различных вирусов, бактерий и простейших,
минимальная структура которых в сочетании с современными адъювантами
обеспечивает развитие высокого иммунно1’0 о твета. Рассматриваются достиже1ШЯ в
области создания ДНК- и других генетических вакцин, обратных вакцин,
растительных рекомбинантных вакцин, теранев1ических вакцин и вакцин против
соматических (неинфекционных) болезней. Особое внимание уделяется
конструированию нановакцин и созданию наноантител. Характеризуются
внедренные в медицинскую практику полимерсубъединичные вакцины против
гриппа, ироходящие клинические испытания вакцина против ВИ4/СПИДа и
аллсрготропины для специфической иммунотерапии аллергий. Анализируются
результаты исследований по включению адъювантов с контролируемой структурой
в состав создаваемых вакцин с целью повышения эффективности.Книга предназначена для паз-чных сотрудников, врачей, студентов, аспирантов,
ординаторов и преподавателей в области иммуноло1’ии и смежных диспиплие! —
молекулярной биологии, микробиологии, биохимии, биофизики и др.УДК 616-097
ББК 52.6+53.53Права на данное издание принадлежат ООО Шдателы-тш группа *ГЮЧ'АР-Медиа». Воспроизведение и распросящнечие
в каком бы то ни бшо «иде части или иеяого издания не могут быть оиу/цествлены без письменного разрешения ООО
Издательская группа •'ГЭОТАР-Медиа».© Петров Р.В., Хаитов P.M., 2010
TQR1V078 Ч П © ООО Изщшельскал ipyiifia «ГЭОТАР-Медиа», 2010LODL'f У/о-э-У/W4-1000-U ^ Изда1^:льская ipyiiiia «ГЭОТАР-Медиа», оформление. 2010
ОГЛАВЛЕНИЕПредисловие •. , 8Введение 10Список сокращений, часто встречающихся в тексте 15ГЛАВА 1. Естественные защитные силы организма:«Врожденный иммунитет» 181.1. Гуморальные факторы 191.2. Клеточные факторы 271.3. Рецепторы системы врожденного иммунитета 331.3.1. Общая характеристика рецепторов, распознающих
молекулярный образ патогена (PRR) 341.3.2. Классификация рецепторов, распознающих
молекулярный образ патогена 371.3.2.1. Классификация по структуре 371.3.2.2. Классификация по функции 391.3.3. Рецепторы семейства То11-подо6ных рецепторов {TLR),
распознающие молекулярный образ патогена 401.3.3.1. LRR-домен Toll-подобных рецепторов 431.3.3.2. TIR-домсн ТоП-подобных рецепторов 431.3.4. Рецепторы семейства NLR, распознающие
молекулярный образ патогена, и инфламмасома 441.3.5. Рецепторы семейства RLR, распознающие
молекулярный образ патогена 461.3.6. Рецепторы семейства DAI, рас[1озмаю1л,ие
молекулярный образ патогена 471.3.7. Рецепторы семейства CLR, распознающие
молекулярный образ патогена 481.3.8. Внутри- и межгру[И1овое взаимодействие рецепторов,
распознающих молекулярный образ патогена 491.3.9. Негативная регуляция активацио1П1ых рецепторов,
распознающих молекулярный образ патогена 501.3.10. Распознавание патогенных и комменсальных
микроорганизмов 511.3.11. Экспрессия Toll-подобных реце(ггоровТ- и В-клетками 52
Оглавление1.3.12. Активирующее и инструктивное влияние
врожденного иммунитета на Т-клстки 521.3.13. Активирующее влияние клеток адаптивного иммунитета
на врожденный иммунный ответ 54ГЛАВА 2. Структура и функции иммунной системы об2.1. Строение иммунной системы, разновидности лимфоцитови молекулярные основы распознавания антигенов 562.2. Иммунная система при ответе на антигены. Молекулярные
основы иммунного реагирования 632.3. Изменения в иммунной системе при иммунном ответеи после его завершения 72ГЛАВА 3. Гены иммунного ответа 773.1. Строение главного комплекса|'истосовмести мости (МНС) 773.2. Гены главного комплекса гистосовместимостичеловека (HLA) и их продукты 873.3. Основные функции главного комплексагистосовместимости 95ГЛАВА 4. Возбуждение и торможение иммунной системы 1254.1. Молекулярные механизмы проведения сигналоввнутрь клетки 1254.1.1. Молекулярные механизмы формирования
активирующих сигнальных путей фагоцитов,
опосредованные через Fc- и ТоИ-подобные рецепторы 1264.1.2. Формирование активирующих сигнальных путей,
оносредонанное через антигенраспознающиерецепторы Т- (TCR) и В- (BCR) лимфоцитов 1364.1.3. Формирование сигнальных путей, опосредованноечерез активацию рецепторов для цитокинов 1394.1.4. Сигналпроводящие рецепторы естественныхклеток-киллеров 1404.1.5. Формирование сиг нальных путей, подавляющих
функциональную активность клеток 1454.2. Апоптоз и его место в развитии и функционировании
иммунной системы 1484.2.1. Апоптоз как разновидность гибели клеток 148
Оглавление4.2.2. Место апоптоза в иммунологических процессах 1494.2.3. Механизмы и сигнальные пути, вовлекаемыев развитие аиоито.^а 1514.2.3.1. Рецепторный механизм нключёния апоптоза 1524.2.3.2. Митохондриальный механизм включения
апоптоза 1544.2.3.3. Активация каспаз и реализация их действия 158ГЛАВА 5. От аттенуированных штаммов к субъединичным
препаратам 1625.1. Живые аттеиуироканные вакцины 1635.2. Убитые и разрун1енные «химические» вакцины 1705.3. Вакцины против дифтерии, столбняка, коклюта (АКДС) ... 1725.4. Поствакцйнальные реакции и осложнения 1745.5. Субъединичные вакцины 176ГЛАВА 6. Генно-инженерные (рекомбинантные) вакцины
(г-вакцины) 1806.1. Создание и разработка генно-инженерных вакцин 1806.1.1. Генно-инженерные белковые рекомбинантные
конструкции 1846.1.2. Гетерологичные бактерии или вирусы, используемыекак носители соответствующих векторов 1856.1.3. Искусственно аттенуированные, высокоиммуногенные
штаммы, содержащие протсктивныс антигены, из генома
которых удалены гены, определяющие вирулентностьи токсичность 1876.1.4. Вакцинные вирусоподобные конструкции,лишенные генома 1876.1.5. Генетические конструкции, включающие
иммуио1’енную составляюп^ую и компонент,определяюн1,ий другие свойства 1886.2. Сложности получения и ограничения использования
генно-инженерных вакцин 1896.2.1. Факторы, влияющие на стоимость разработки 1896.2.2. Сложности хранения и транспортировки 1896.2.3. Недостаточная активация клеточногоиммунного ответа 190
ОглавлениеГЛАВА 7. Синтетические иммуногены и вакцины 1927.1. Первые синтетические анти1'ены 1927.2. Пептидные антигены 1957.3. Полипептиды вирусов 2017.4. Полипептиды бактерий 2117.5. Полииентиды простейших 2217.6. Поливалентные комплексы 222ГЛАВА 8. Конъюгированные вакцины 2248.1. Конъюгированные антигены и иммуногены 2248.2. Синтетические иммуномодуляторы для вакциннового поколения (новые адъюванты) 2268.2.1. Синтетические аналоги природных адъювантных
структур 2268.2.2. Синтетические полиэлектролиты 2378.2.3. Клеточные механизмы иммунопотенцирующего
действия синтетических полиионов 2448.2.4. Молекулярные механизмы активации
иммунокомпетентной клетки полиионами 2978.2.5. Влияние на иммунный ответ 3108.3. Конъюгированные антиген-полимерные иммуногены 3288.3.1. Гаптен-полиэлектролит 3288.3.2. Гаптен-неионогенный полимер 3318.3.3. Белок-полиэлектролит 3398.3.4. Пептид-полиэлсктролит 3458.3.5. Полисахарид-полиэлектролит и полисахарид-
белок-полиэлектролит 3498.3.6. Свойства (Т-иезакисимость, формирование
иммунологической памяти) конъюгированных антиген-
полимерных иммуногенов 352ГЛАВА 9. Фенотипическая коррекция и врожденный иммунитет:
новые концепции в вакцинологии 3679.1. Щ-независимость конъюгированных иммуногенов на основе
полиионов и концепция фенотипической коррекции 3679.2. Фенотипическая коррекция генн010 контроля иммунного
ответа на гриппозную вакцину 379
Оглавление9.3. Стимуляция врожденного иммунитета 3869.4. Новые концепции в вакцинологии, базирующиесяна процессах активации врожденного иммунитета 391ГЛАВА 10. Конъюгированные полимер-субъединичные вакцины .. 39710.1. Экспериментальные вакцины: от конъюгированных
антигенов к конъюгированным вакцинам 39710.1.1. Сальмонеллезные вакцииы 39810.1.2. Гриппозные вакцины 40210.1.3. Аллерготропины 41610.1.4. Вакцины против ВИЧ/СПИДа 44210.1.5. Вакцины против рака 48910.1.5.1. Опухолеассоциированные антигены 49010.1.5.2. Адъюванты 49110.1.5.3. Противоопухолевые вакцины 49610.2. Вакцина «Гриппол» 501ГЛАВА 11. Нанобиотехнология, нановакциньц наноантитела 507ГЛАВА 12. Новая вакцинология и вакцины будущего 52612.1. ДНК-вакцииы и другие генетические вакцины 52712.2. «Обратные вакцины» (reverse vaccines) 53112.3. Растительные рекомбинантные вакцины(съедобные вакцины) 53212.4. Терапевтические вакцины 53712.5. Вакцины против соматических (неинфекционных)болезней 53812.5.1.Вакцинные ДНК-конструкции, стимулирующиеТЫ-ответ, влечении аллергических заболеваний 53912.5.2. Вакцины, подавляющие аутоиммунные реакции 54012.5.3. Вакцинотерапия болезии Альцгеймера 540Список литературы 543
ПРЕДИСЛОВИЕЗа 40 лет совместной работы в области стремительно развиваюшейся
иммунологии мы опубликовали сотни статей, несколько кииг, моногра¬
фий, научных руководств и учебников. Все они следовали и следуют не
столько духу учитель—ученик, сколько духу взаимосвязанного и равно¬
правного сотрудничества как в экспериментальных исследованиях, так
и в публикациях. Естественно, в наибольшей степени мы концентри¬
ровали внимание на тех направлениях, которые удалось «застолбить»
нам самим, развить эти направления, довести их не только до уровня
приоритетных публикаций, но и до уровня практического внедрения.
Среди этих приоритетных направлений и инноваций следует выделить
несколько наиболее значимых с нашей точки зрения.1. Обнаружен генетический контроль иммунного ответа в отноше¬
нии патогенных микроорганизмов и гетерологичньтх клеток живот¬
ного происхождения; установлен доминантный характер наследова¬
ния силы иммунного ответа.2. Изучены характеристики миграции кроветворных стволовых
клеток в организме и их взаимодействие с лимфоцитами, выражаю¬
щееся в том, что генетически чужеродные стволовые клетки инак¬
тивируются, а генетически тождественные — изменяют направление
своей дифференцировки.3. Открыты пептиды-медиаторы взаимодействия костномозговых
клеток с лимфоидными продуцентами антител; обнаружены В-лим-
фоциты-супрессоры, блокирующие иммунопоэз на территории кост¬
ного мозга.4. Исследованы новые гены главного комплекса гистосовмести¬
мости человека, ответственные за процессинг и презентацию анти¬
генных пептидов. С разработкой этой проблемы связаны перспективы
генодиагностики и лечения онкологических, аутоиммунных, инфек¬
ционных и аллергических заболеваний.5. Созданы ранее неизвестные искусственные антигены, состоя¬
щие из простейших гаптенных молекул и карбоцепных полиэлектро¬
литов.6. Показано, что широкий ряд полиэлектролитов при определен¬
ной длине молекулы обладают способностью стимулировать цирку¬
ляцию и кооперацию стволовых и лимфоидных клеток, усиливают
иммунитет при иммунизации даже самыми слабыми антигенами и
обеспечивают обход генного контроля иммунного ответа — феноти¬
пическую коррекцию слабого реагирования, обусловленного генами
низкого иммунного ответа.
Предисловие7. Разработаны и внедрены в медицинскую практику новые эффек¬
тивные иммуномодуляторы (миелопид, серамил, прочие родственные
миелопептиды, Т-активин, ликопид, полиоксидоний, имму'номакс
и др.).8. Разработаны и используются в медицинской практике вакцины
нового поколения — нановакцины — против нескольких социально
значимых инфекционных заболеваний.9. Созданы и внедряются в клиническую практику аллерготропи¬
мы — средства для лечения аллергий.Все вышеперечисленное, составляющее костяк настоящей книги,
конечно же, наработано совместно с нашими коллегами — сотрудни¬
ками Отдела иммунологии Института биофизики М3 СССР, который
стал основой для создания в 1983 г. Института иммунологии М3 СССР
(ныне Институт иммунологии Федерального медико-биологического
агентства России).Мы приносим глубокую благодарность Н.Ю. Алексеевой,
Л.П. Алексееву, П.Г. Апарину, Р.И. Атауллаханову, В.П. Евдакову,
A.C. Ивановой, И.И. Ильиной, Е.В. Кожиновой, В.М. Манько,
А.И. Мартынову, A.A. Михайловой, A.B. Некрасову, А.Ш. Норимову,
И.Г. Пучковой, Л.С. Сеславиной, И.Г. Сидоровичу, Р.Н. Степаненко.Особую благодарность мы выражаем нашему другу, безвременно
покинувшему нас, академику В.А. Кабанову, бывшему заведующе¬
му кафедрой высокомолекулярных соединений МГУ. Большинство
химических идей поиска полимерных иммуностимуляторов и поли¬
мерных носителей для антигенов было задумано и реализовано при
его активном участии.Академик Р.В, Петров
Академик Р.М, Хаитов
ВВЕДЕНИЕПроблема новых искусственных (синтезированных генно-инже¬
нерными или химическими методами) вакцин чаще всего воспри¬
нимается и трактуется подобно проблемам искусственных гормонов,
витаминов, антибиотиков, которые складываются из трех основных
звеньев: выявление биологически активного соединения, расшифров¬
ка его молекулярной структуры и искусственный синтез (ресинтез).
Третье звено осуш;ествляется или чисто химическими, или генно-
инженерными методами, в последнем случае синтезируется коди-
руюшая заданный белок ДНК, которая интродуцируется в клетки
микроорганизмов (прокариоты и низшие эукариоты) или высших
эукариот для наработки продукта биотехнологическими методами.
Альтернативный вариант (обратная вакцинология): расшифровыва¬
ются фрагменты генома и затем на их основе осуществляется синтез
их продуктов — пептидов и белков.Такая постановка проблемы справедлива только в отношении
искусственных антигенов, но не искусственных вакцин, поскольку
антиген — это всего лишь конкретное биоорганическое соединение,
а вакцина — препарат, обеспечивающий развитие иммунитета, раз¬
витие невосприимчивости к возбудителю. Создание искусственного
инсулина или, скажем, бактериального полисахарида, типичного для
бактерий кишечной группы, — это одновременно создание искус¬
ственного антигена, ибо любой белок или полисахарид представляет
собой антиген. Но искусственный антиген не есть искусственная
вакцина, так как формирование иммунитета представляет собой
функцию иммунной системы организма, реагирующего на введение
антигена, а не функцию самого антигена. Последнее было осмысле¬
но по-настоящему недавно. Стало ясно, что на один и тот же анти¬
ген индивидуумы одного генотипа реагируют развитием высокого
иммунного ответа, в то время как другие индивидуумы развивают
слабую реакцию или не реагируют совсем. И наоборот, один и тот же
индивидуум высоко реагирует на одни антигены и не реагирует на
другие. Именно поэтому искусственный антиген — это еще далеко
не искусственная вакцина. Проблема искусственных антигенов фак¬
тически полностью решена современной биоорганической химией,
поскольку любое искусственно синтезированное биоорганическое
соединение суть искусственный антиген.Перед создателями искусственных вакцин стоит особая зада¬
ча: не просто ресинтезировать определенный антиген или ответс¬
твенную антигенную детерминанту (эпитоп), а искусственно
создать препарат, который бы обеспечил развитие иммунитета даже
Введение Ив том случае, когда против данного антигена иммунитета не возни¬
кает. Поясним это положение следующими примерами. У человека,
переболевшего венерическими болезнями, малярией и некоторыми
другими инфекциями, не возникает иммунитета к повторному зара¬
жению данными возбудителями, хотя возбудители перечисленных
болезней несут соответствующие чужеродные человеку антигенные
субстанции. А это значит, что выделение этих субстанций, расшиф¬
ровка их строения и использование для вакцинации не приведет к
успеху, поскольку организм не в состоянии развить иммунитет даже
при заражении самим возбудителем. Следовательно, задача, стоящая
перед наукой при создании новых вакцин, более сложная, чем простое
копирование того или иного антигена. Необходимо создать такой
искусственный биоорганический комплекс, который бы обеспечил
иммунный ответ организма на данный антиген вопреки его генети¬
чески предопределенной низкой отвечаемости. Только в этом случае
вакцины нового поколения окажутся существенным шагом вперед
по сравнению с естественными, представляющими собой препараты
из ослабленных или убитых возбудителей инфекционных болезней
или препараты выделенных из них очищенных антигенных детер¬
минант (субъединичные вакцины). Конечно, копирование опреде¬
ленных антигенов и антигенных детерминант — это важнейшее дело
современной молекулярной биологии и биотехнологии, но на пути
простого копирования нет принципиально новых подходов к реше¬
нию проблемы еще не побежденных инфекций человека и животных,
поскольку если иммунитет не возникает против реальных антигенов,
он не возникнет и против их искусственных копий.Искусственное копирование антигенных детерминант в лучшем слу¬
чае приведет к созданию вакцин без балласта, т.е. без ненужных приме¬
сей, но не решит проблему непобежденных инфекций. А именно эту цель
необходимо ставить при разработке вакцин нового поколения.Используемые в повседневной практике вакцины — это мало¬
контролируемая сверхкомплексная смесь с огромным количеством
балластных, в том числе высокотоксических, загрязняющих компо¬
нентов из микробных клеток, питательной среды из клеток, на кото¬
рых выращиваются вирусы (клеточные культуры, куриные эмбрионы,
эпидермис телят, мозг кролика и др.). Необходимыми для создания
иммунитета являются 1—2 антигенные детерминанты, а вводится в
организм сотня сложнейших комплексов. Отсюда возникают тяжелые
реакции, осложнения, аллергизация прививаемых.
12 ВведениеВ ряде случаев достигнут большой прогресс в очистке антигенов
микробов или бактериальных токсинов. Но это еще далеко не все.
Из вируса или бактерии необходимо выделить ответственную моле¬
кулу — антиген. Но и в этом антигене, так же как и в очищенном
микробном токсине, ответственной за создание иммунитета является
лишь определенная, в большинстве случаев пока еше неизвестная,
часть. Задача состоит в том, чтобы выявить данную анти! енную моле¬
кулу, расшифровать ее структуру, определить «ответственну ю» часть
и научиться синтезировать эту молекулу или ее часть. Идеальной
иммунизирующей компонентой являлась бы эта часть — без загрязне¬
ний, без балласта, без токсичных неконтролируемых примесей.Проблема искусственных вакцин в высокой степени актуальна
даже применительно к побежденным инфекциям (оспе, полиомиели¬
ту, кори и некоторым другим). Под словом «побежденные» имеются в
виду те инфекции, против которых созданы высокоэффективные вак¬
цины. Конечно, эти вакцины токсичны, контаминированы, аллерген¬
ны, но они есть. И здесь проблема искусственных вакцин — проблема
их оптимизации, повышения безвредности, создания еди1юй мно¬
гокомпонентной вакцины. Подразумевается возможность создания
искусственной макромолекулы или комплекса, вакцинирующего
поливалентно сразу против нескольких инфекций.Высшей степени актуальности проблема искуссгвснных вакцин
достигает в области создания эффективных препаратов против еще
не побежденных инфекций, т.е. тех, против которых до сих пор нет
надежных вакцин. Среди них могут быть названы паразитарные
инфекции (в том числе малярия); некоторые вирусные болезни,
включая СПИД, вирусные гепатиты, особенно С, африканскую чуму
свиней и другие инфекции сельскохозяйственных животных; ряд
инфекционных болезней кишечной группы у людей и животных.
Венерические болезни также относятся к категории непобежденных
инфекций: вакцин против них нет.Особенность антигенов большинства возбудителей непобежден¬
ных инфекций состоит в том, что они относятся к категории так
называемых слабых антигенов, т.е. против них не развивается выра¬
женный иммунный ответ. Иммунитет не возникает не только после
вакцинации выделенными антигенами, но и после иммунизации
живым ослабленным возбудителем. Даже перенесенная болезнь не
оставляет стойкого и длительного иммунитета. Иначе говоря, имму¬
низируем ый организм в отношении некоторых антигенов не в состоя-
Введение 13НИИ развить быструю и высокую иммунную реакцию. В течение более
120 лет создания вакцин по пастеровскому принципу (использование
ослабленного инфекционного агента) оставалось загадкой, поче¬
му не возникает иммунитета против ряда микроорганизмов после
введения ослабленных или уби1ых вакцин или выделенных из них
антигенов. Быстро идущей изменчивостью возбудителей это объяс¬
нить невозможно, так как у всех серотипов и других вариантов того
или иного возбудителя имеются общие антигенные детерминанты.
Однако иммунный ответ против них почему-то не срабатывает.В последнее десятилетие обнаружены причины низкой отвеча-
смости, которые, как оказалось, имеют генетически детерминиро¬
ванный характер. Изучены механизмы генетического контроля силы
иммунного реагирования. Открыты комплексы генов или отдельные
гены иммунного ответа - /г-гены и гены иммунной супрессии — Ь-
гены. Имеются //--гены высокого ответа к определенным антигенам
и /г-гены низкого ответа к данным антигенам. Стало ясно: если
индивидуум или большая часть популяции содержит /г-ген низкого
ответа и(или) /^-ген сильной супрессии к главным антигенам какого-
либо инфекционного агента, то вызвать у такого индивидуума или
популяции эффективный иммунный ответ традиционным способом
вакцинации невозможно. Нужны новые принципы, которые бы пре¬
дусматривали нахождение способов стимуляции иммунитета вопре¬
ки генетически детерминированной низкой реагируемости. Создание
искусственных вакцин особого типа (оптимальных молекулярных
наноконструкций) с включением в }1их стимулирующих компонентов
открывает такую возможность. Высокая иммуногенность достигается
целенаправленным воздействием на иммунную систему организма
на основе знания путей реализации контроля иммунного ответа и
ранее нсизвестЕ1ых механизмов врожденного иммунитета. Поэтому
в книге уделено большое внимание фундаментальным механизмам
развития иммунных реакций (главы 1—4). Если исторически разра¬
ботчики лекарств и вакцин в целом и иммунофармакрлоги в частно¬
сти в результате скрининга большого количества субстратов находили
биологически активное соединение, а затем изучали механизмы его
действия, то мы действовали альтернативно: искали точки воздей¬
ствия на ключевые механизмы развития иммунного ответа, на важ¬
нейшие клетки, определяющие эффективность иммунных реакций,
а затем окончательно формировали молекулу иммуномодулятора или
вакцины (нанопрепараты).
¡4 ВведениеВ заключение следует подчеркнуть, что создание, производство и
применение вакцин будет непрерывно возрастать за счет:а) расширения спектра препаратов и календаря вакцинаций про¬
тив инфекционных заболеваний;б) создания и использования вакцин для профилактики и имму¬
нотерапии соматических, аутоиммунных, аллергических, онкологи¬
ческих и других болезней;в) разработки и применения вакцин для профилактики хрониче¬
ских процессов.Все это говорит о том, что вакцинация (профилактическая и тера¬
певтическая) будет и должна развиваться как универсальный способ
достижения здоровья людей независимо от их социального статуса и
страны проживания. Задачи новой вакцинологии мы видим в разра¬
ботке, создании, промышленном производстве и внедрении в прак¬
тику новых технологий получения вакцин для защиты от социально
значимых инфекционных болезней, еще непобежденных инфекций,
для борьбы с эпидемиями, пандемиями и актами биотерроризма,
для профилактики и лечения аутоиммунных, аллергических, онколо¬
гических и других неинфекционных болезней.
список СОКРАЩЕНИИ,
ЧАСТО ВСТРЕЧАЮЩИХСЯ В ТЕКСТЕАК — акриловая кислотаАОК — антитслообразующая клеткаАПК — антигенпредставляющая клеткаАСИТ — аллергенспецифическая иммунотерапияАФП — а-фетопротеинБГГ — бычий у-глобудинБОФ — белки острой фазыБСА — бычий сывороточный альбуминВИЧ — вирус иммунодефицита человека (см. HIV)ВПЧ — вирусоподобная частицаВЭБ — вирус Эпштейна-БаррГЦА — гомоцитотропные антителаД — дальтон (величина молекулярной массы вещества)ДК — дендритная клетка
ДНФ ~ динитрофенол
ДС — декстран-сульфат
ДТ — дифтерийный токсинДЧГГ — дезагрегированный человеческий у-глобулин
ЕКК — естественные клетки-киллеры (см. NK)ИАЖ — иммунная асцитическая жидкость
ИЗСД — инсулинзависимый сахарный диабет
ИЛ — интерлейкин
ИНФ — интерферон
кД — килоДальтонКОЕ-С — селезеночные колониеобразующие единицы (стволовые
клетки, образующие колонии кроветворных клеток в селезенке облу¬
ченных животных)КонА — конканавалин А
КСФ — колониестимулирующий фактор
Г-КСФ — гранулоцитарный колониестимулирующий фактор
ГМ-КСФ — гранулоцитарно-макрофагальный колониестимулирую¬
щий факторМ-КСФ — макрофагальный колониестимулирующий факторЛПС — липополисахаридМВП — 2-метил-5-винилпиридингМДП — мурамилдипептидММ — молекулярная массаМСП — модифицированные сополимеры
16 Список сокращений, часто встречающихся в текстеМ-СП — конъюгат М-белка вируса гриппа с сополимеромНАФ — неполный адъювант ФрейндаПА — полибетаиныПАБ — парааминобензойная кислотаПАК — полиакриловая кислотаПАФ — полный адъювант ФрейндаП ВД — поливинилнирролидонПВП — поли-4-винилпиридинПК А — пассивная кожная анафилаксияПЛЛ — поли-Ь-лизинПМВП — поли-2-метил-5-винил пиридинПС — полисахаридПЭГ — полиэтиленгликольРПАН — рекомбинантная псевдоаденовирусная наночастицаРПГА — реакция пассивной гемагглютинацииСИТ — специфическая иммунотерапияСК — стволовая клеткаСКК — стволовая кроветворная клеткаСП — сополимерСП-1 — сополимер, содержащий МВП и 44 мол% звеньев акриловой
кислотыСП-2 ~ сополимер, содержащий МВП и 50 мол% звеньев акриловой
кислотыСП-3 — сополимер, содержащий МВП и 60 мол% звеньев акриловой
кислотыСПИД — синдром приобретенного иммунодефицитаСРБ — С-реактиБный белокТЗА — тимусзависимый антигенТНА — тимуснезависимый антигенТИФ — тринитрофенилФГА — фитогемагглютининФЛА — флагеллинФИО — фактор некроза опухолиЧГГ — человеческий у-глобулинЭБ — эритроциты баранаЭЛ — эритроциты лошадиЯА — яичный альбуминBCR (В cell receptor) — антигенраспознающий рецептор В-лимфоцитов
CD (Cluster of differentiation) — кластер дифференциации
Список сокращений, часто встречающихся в тексте 17CLR (C-type lectine-Iike receptor) — рецептор класса лектинов типа С
CR (Complement receptor) — рецептор для комплемента или его ком¬
понентаDAI (DNA-dependent activator of IFN-regulatory factor) — ДНК-зависи-
МЫЙ активатор фактора, регулирующего продукцию интерферона
F/A -- пептид активации слияния (N-концевой фрагмент легкой дени
гемагглютинина вируса гриппа типа А, удлиненный с С-конца на
остаток глицина)НА — гемагглютинин вируса гриппаHIV (Human Immunodeficiency Virus) — вирус иммунодефицита человека
IgG-AOK — клетка, продуцирующая антитела класса IgG
IgM-AOK — клетка, продуцирующая антитела класса TgM
МНС (Major histocompatibility complex) — главный комплекс гистосов¬
местимостиМНС-1 — гены (антигены) главного комплекса гистосовместимости
класса IМНС-П — гены (антигены) главного комплекса го^стосовместимости
класса 11mig — мембранный иммуноглобулин
N-ВПД — N-винилпирролидон
N А ~ нейраминидаза вируса гриппаNK (Natural killers) — естественные клетки-киллсры (см. ЕКК)NLR (NOD-like receptor) — NOD-подобный рецепторРАМР - Pathogen-associated molecular pattern (молекулярный образпатогена)PPD ~ очищенный белковый дериват туберкулинаPRR - Pattern-recognition receptors (паттерн-распознающие или образ-распознающие рецепторы)RLR (RIG-like receptor) — RIG-подобный рецепторTCR (Т cell receptor) — антигенраспознающий рецептор Т-лимфоцитовTLR (Toll-like receptor) — Toll-подобный рецептор
Глава 1ЕСТЕСТВЕННЫЕ ЗАЩИТНЫЕ СИЛЫ
ОРГАНИЗМА: «ВРОЖДЕННЫЙ ИММУНИТЕТ»Органом иммунной системы является лимфоидная ткань, в кото¬
рой главные клеточные популяции, участвующие в поддержании
генетического постоянства внутренней среды организма, — фагоци¬
тирующие, антигенпредставляющие клетки и иммунокомпетентные
лимфоциты.Иммунная защита, осуществляемая клетками системы иммуните¬
та, включает два взаимосвязанных компонента. Более древний из них
связан с воспалительной реакцией и реализуется на базе функцио¬
нирования сенсорных и рецепторных структур, эволюционно отсе-
лекционированных для того, чтобы отличить вообще «чужое», в виде
высококонсервативных молекул различных патогенов, отсутствую¬
щих у млекопитающих, от «своего» [453J. Эти реакции выполняются
преимущественно макрофагами и дендритными клетками, осуществ¬
ляющими главным образом антигенпредставляющие функции, и
служат фундаментом, на котором развертываются более гонкие анти-
генспецифические процессы, осуществляемые лимфоидными клет¬
ками, способными обнаружить малейшие отличия в молекулярном
строении различных антигенных структур, включая патогенные, от
«своего». Б соответствии с развивающимися процессами и функция¬
ми, выполняемыми этими защитными компонентами, первый из них
обозначают как врожденный или естественный иммунитет (Innate
immunity), второй — как адаптивный иммунитет (Adaptive immunity)
или как иммунный ответ (Immune response).В физиологических реакциях организма, направленных на под¬
держание генетического постоянства внутренней среды организма,
важнейшую роль играют факторы естественной резистентности,
действие которых направлено на защиту организма от вне- и внутри¬
клеточных микроорганизмов и продуктов повреждения собственных
клеток. Эти факторы включаются в защиту мгновенно после преодо¬
ления возбудителем кожных или слизистых оболочек и внедрения его
во внутреннюю среду организма. Их влияние продолжается в течение
1.1. Гуморальные факторы 19всего периода борьбы организма с инфекцией, но наиболее эффек¬
тивно действие таких факторов развивается в течение первых 4 часов
после внедрения микроба, когда они являются практически един¬
ственными защитниками организма.На пути проникшего в организм микроба стоят две мощные пре¬
грады: клеточные (тканевые макрофаги, нейтрофилы, естественные
киллерные клетки ~ ЕКК) и гуморальные (1§С-антитела, компле¬
мент) факторы естественной резистентности. К факторам естест¬
венной резистентности относят также микробицидные экзосекреты
(бактерицидные компоненты слюны, соляная кислота желудка, лити-
ческие пищеварительные ферменты кишечника и др.), белки острой
фазы и другие организменные структуры и субстанции.1.1. ГУМОРАЛЬНЫЕ ФАКТОРЫСреди гуморальных факторов, участвующих в нротивомикробной
защите, важная роль принадлежит системе комплемента, впрочем,
так же как и в реализации отдельных эффекторных механизмов позд¬
него иммунного ответа. Эта система включает около 30 взаимодей¬
ствующих белков плазмы крови и рецепторов клеточной поверхности.
В таблице 1 показаны основные компоненты системы комплемента, в
таблице 2 — клеточные рецепторы для этих компонентов.Функции системы комплемента многообразны. Ряд компонентов
системы комплемента характеризуется ферментативными функция¬
ми (протеазы), другие выполняют иные функции: связываются с мик¬
робами и клеточными мембранами, с комплексами антиген-антите¬
ло, активируют тучные клетки, обеспечивают развитие сосудистых
реакций воспаления, перфорацию мембран бактериаль1!ых клеток,
опсонизируя микробы (связывание компонента системы с микро¬
бом и рецептором для компонента на клетке), активируют функции
фагоцитов. В норме, при отсутствии распада собственных тканей и
микробного заражения, система комплемента находится в покоя¬
щемся состоянии. Однако при запросе, вызванном определенными
раздражителями, система комплемента активируется тремя возмож¬
ными путями — классическим, альтернативным и лектиновым, что,
по сути, представляет собой первую линию активной защиты против
инфекции.
20Глава /. Естественные защитные силы организма,,.Основные комлоненты системы комплементаТаблица 1ФункцииОбозначенияСвязывание с комплексом антиген-антителоClqСвязывание с мсмбраіюй бактерий и оисонизация к фагоцитозуС4ЬСЗЬПротеазы, активирующие другие компоненты системы путем
растепленияСІГClsС2ЬВЬDМедиаторы воспаления (дегранул я и ия тучных клеток,
сосудистые реакции)С5аСЗаС4аКомплекс белков атаки на мембрану (перфорация мембраны
клеток-мишеней)С5ЬС6С7С8С9Комилемснтрегулирующие белки (ингибиторы активации,
блокаторы активности)ClinhС4ЬрCR1мерDAF
Фактор Н
Фактор I
Фактор Р
CD59Примечание; Clinh (от Cl-inhibitor) — ингибитор компонента С1; МСР (от Membrane
cofacLor proteolysis) — мембранный кофактор протеолиза, белок, связываюший
компонент СЗЬ, что обеспечивает доступность компонента СЗЬ для деградации
протеазой — <})актором 1; DAF (от Decay accelerating factor) — фактор, усиливающий
растепление, белок мембраны клеток млекопитающих, ускоряющий деградаиию
(инактивацию)компонента С2Ь; Н — фактор Н —сывороточная протеаза, деградиру¬
ющая компонент СЗЬ; фактор I — протеаза, деградирующая компоненты СЗЬ и С4Ь;
фактор Р (пропердин) — стабилизатор активного комплекса СЗЬ/ВЬ; CD59 — белок
мембраны клеток млекопитающих, препятствующий лизису собственных клеток,
вызванному комплементом.
LI. гуморальные факторы21Таблица 2Клеточные рецепторы для компонентов системы комплементаРецепторСвязываемыйкомпоненткомплементаЭкспрессия рецеп¬
тора на клеткахЭффект связыванияCR1(CD35)СЗЬ,С4Ь,ТСЗЬМоноциты,
макрофаги,
нейтрофилы,
эозинофилы,
фолликулярные
дендритные клет¬
ки, В-лимфоциты,
эритроцитыСпособствует разруше¬
нию компонентов СЗЬ и
С4Ь. Опсонизированный
фагоцитоз. Активагтия
В-лимфоцитов, Транспорт
иммунных комплексов на
эритроцитахCR2(CD21)C3d,C3dg,сзы,EBVФолликулярные
дендритные клет¬
ки. Зрелые В-лим¬
фоцитыКомпонент корецеп-
торного комплекса для
антигена на В-лимфоци-
тах. Рецептор для вируса
Эпштейна-БаррCR3
(CDilb/
CD 18)СЗЬІМоноциты,
макрофаги,
нейтрофилы,
гранулоцит ы,
фолликулярные
дендритные клет¬
ки, ЕККОпсонизированный фаго¬
цитоз. Нефагоцитируемое
связывание комплексов
антиген-антитело на фол¬
ликулярных дендритных
клеткахCR4(GDI 1с/
CD18)сзыТканевые макро¬
фаги, дендритные
клеткиОпсонизированный фаго¬
цитозClqRClq(коллагено¬подобнаячасть)Макрофаги,
МОНОЦИТЕїІ, В-лим¬
фоциты, тромбо¬
циты, эндотелийСвязывание иммунных
комплексовРецептор
для СЗаС5аМакрофаги, туч¬
ные клеткиАктивация макрофагов.
Дегрануляиия и активация
тучных клетокПримечание: CR — Complement receptor type 1, 2 и т.д.; EBV — вирус Эпштейиа-Барр.
22Глава L Естественные защитные силы организма...Альтернативный путьЛещиновый путьMBLMASP*1MASP-2MASP-3СЗСЗа СЗЬ
MB OnС4С2««Ж»С5а С5Ь
MB \С5Ь,С6,С7.С8.С9МКРис. 1, Схема активации белков системы комплеменча по классическому, аль¬
тернативному и лектиновому путям:С1—С9 — компоненты системы комплемента; В — сывороточный фактор В;
MB — медиатор воспаления (анафилатоксин); On — опсонин; МК — мембраноата¬
кующий комплекс; MBL (Mannan-hinding lectin) — маннансвязывающий лектин;
MASP- i, -2, -3 (MBL-associated serine protease-1, -2, -3) — ассоциированная с MBL
сериновая протеаза-1, -2, -3. Пояснения в текстеАльтернативный путь активации системы комплемента (рис. 1)
инициируется спонтанным расщеп лением компонента СЗ или в резуль¬
тате его взаимодействия со специфическими сахарами на поверхности
патогена. Этот способ самоактивации молекулы СЗ образно называют
«заведенным мотором». Расщепление СЗ сопровождается образованием
компонентов СЗа и СЗЬ. Молекула СЗЬ выполняет функции опсонинаи, будучи ковалентно связанной с микробом, нековалентно связывает
сывороточный фактор В, который становится субстратом для серино-
вой протеазы — белка О системы комплемента. Фактор О расщепляет
фактор В на фрагменты Ва и ВЬ. Фактор ВЬ остается связанным с
компонентом СЗЬ на поверхности микроба и образует активный ком¬
1.1. Гуморальные факторы 23плекс СЗЬВЬ, в котором фрагмент ВЬ является активной протеазой, а
сам комплекс СЗЬВЬ представляет собой СЗ-конвертазу альтернатив¬
ного пути, гомологичную СЗ-конвертазе (С4Ь2а) классического пути
активации системы комплемента. Комплекс СЗЬВЬ стабилизируется
на мембране сывороточным белком Р (пропердин). Это приводит к
массивной наработке компонента СЗЬ^ связывающегося с микробом и
вновь воспроизводящего указанный путь активации системы. Более
того, комплекс СЗЬВЬ, присоединяя молекулу СЗЬ (формируется ком¬
плекс СЗЬВЬЗЬ), является активной С5-конвертазой, обеспечивагошей
расщепление компонента С5 до фрагментов С5а и С5Ь. Следует отме¬
тить, что фрагмент С5а, как и фрагмент СЗа, является анафилатокси-
ном ~ активирует тучные клетки (секрецию содержимого гранул) и
гладкие мыщцы (сокращение). Кроме того, фрагмент С5а активирует
моноциты и нейтрофилы, а также экспрессию на фагоцитах рецеп¬
торов для компонентов комплемента — CR1 и CR3. Под влиянием
фрагмента С5Ь в реакцию вступают компоненты комплемента С6, С7,
С8 и С9. Реакция завершается образованием мембраноатакующего
комплекса С5Ь, С6, С7, С8, С9, перфорирующего мембрану микроба и
вызывающего его лизис. Заключительные этапы активации системы
протекают следующим образом: молекула С5Ь связывает компонент
С6, комплекс С5Ь6 присоединяет компонент С7. Через гидрофобный
домен компонента С7 комплекс С5Ь67 встраивается в фосфолипид-
ный бислой микроба. К комплексу С5Ь67 гидрофобными доменами
пристраиваются компоненты С8 и С9. Фрагмент С8р компонента С8
присоединяется к молекуле С5Ь, а фрагмент С8ау встраивается в фос-
фолипидный бислой клетки-мишени. При этом фрагмент С8ау ката¬
лизирует 10—16 молекул С9, в результате чего образующийся полимер
формирует неспадающиеся поры в микробной мембране.Классический путь активации системы комплемента (см. рис. 1)
инициируется комплексом антиген-антитело (IgM, TgG), который
связывает фрагмент Clq компонента С1 на поверхности микроба, но
не в растворе. Компонент С1 состоит из восьми фрагментов — С1г,
Cls и щести молекул Clq, процесс активации индуцируется присо¬
единением не менее двух молекул Clq к Fc-фрагментам иммуног¬
лобулина комплекса антиген—антитело и активацией протеазы С1г,
отщепляющей от компонента С1 сериновую протеазу Cls. Эти ранние
этапы активации системы комплемента сопровождаются образова¬
нием активного комплекса антиген—антитело—Clqr2S2, сериновая
протеаза которого расщепляет компонент системы комплемента С4
/лава 1, Естественные защитные силы организма.,.до фрагментов С4а и С4Ь, а С2 расщепляется до фрагментов С2а и
С2Ь. Фрагмент С4а функционирует как слабый анафилатоксин, а
фрагмент С4Ь — как слабый опсонин. Следует отметить, что белок
системы комплемента С2 гомологичен белку В, а С4 — гомологичен
белку СЗ. Результатом расщепления компонентов С4 и С2 и актива¬
ции их фрагментов является образование комплекса С4Ь2а, являю¬
щегося активной СЗ-конвертазой классического пути (расщепляет СЗ
на СЗа и СЗЬ), а затем и комплекса С4Ь2аЗЬ в качестве С5-конвертазы
классического пути активации белков системы комплемента. С обра¬
зованием СЗ- и С5-конвертаз дальнейщий каскад реакций становится
подобным тому, который регистрируется при альтернативном пути
активации системы комплемента. Следует отметить, что активация
белков системы комплемента по альтернативному и классическому
пути происходит параллельно, усиливая друг друга.Пектиновый путь активации системы комплемента (см. рис, 1) ини¬
циируется маннозосвязывающим лектином MBL (от Man nan-binding
lectin), связывающим углеводные структуры микробной поверхности.
С маннозосвязывающим лектином ассоциированы три известные
сериновые протеазы — MASP-1 (от MBL-associated serine protease-i),
MASP-2, MASP-3. Сериновые протеазы MASP-1 (гомологична ком¬
поненту Clr) и MASP-2 (гомологична компоненту Cls) способны
эффективно расщеплять белки С2 и С4 [706], функции сериновой
протеазы MASP-3 неизвестны. Считается, что MASP-2 в составе ком¬
плекса MBL-MASP-2 обеспечивает расщепление С4, тогда как комп¬
лекс MBL-MASP-1 способен непосредственно активировать белок СЗ
[392]. Дальнейшие пути активации системы комплемента по лектино¬
вому пути те же, что и при активации по классическому пути.Современные представления о каскадной активации белков систе¬
мы комплемента указанными путями, так же как детальная характе¬
ристика этих белков, подробно описаны в работах [184, 392].В регуляции активации системы комплемента участвуют гумо¬
ральные и клеточные компоненты, объединенные в семейство RCA
(от Regulators of complement activation). Компоненты этого семейс¬
тва характеризуются короткими повторяющимися доменами SCD
(Short consensus domain) и способностью связывать молекулы системы
комплемента СЗЬ и С4Ь, контролируются генетическим кластером,
локализованным в хромосоме 1 в локусе q3.2. Гуморальные факторы
семейства RCA включают компоненты С4Ьр (от С4 binding protein) и fH
(от factor H). C4bp ускоряет распад СЗ-конвертазы классического пути
/./. Гуморальные факторы 25активации комплемента, fH ускоряет распад СЗ-конверта^ы альтерна¬
тивного пути активации комплемента. Оба компонента действуют как
кофакторы для фактора I, обеспечивающего деградацию компонентов
комплемента СЗЬ и С4Ь. Сходные функции проявляют интегральные
мембранные белки семейства RCA, которые включают компоненты
CR1 (CD35), CR2 (CD21), МСР (от Membrane cofactor protein; CD46) и
DAF (от Decay accelerating factor; CD55). CRI и DAF ускоряют распад
СЗ-конвертазы классического и альтернативного путей активации
комплемента; CR2 связывает компонент комплемента C3d, связан¬
ный с антигеном; МСР, CR1 и CR2 действуют как кофакторы для
фактора I, обеспечивающего деградат^ию компонентов комплемента
СЗЬ и С4Ь. С9Ьр (от С9 binding protein), известный как фактор инги-
биции мембраноатакующего комплекса, также способен подавлять
активацию комплемента, однако он не включен в семейство белков
RCA [184, 500, 767].Другое семейство гуморальных факторов физиологических защит¬
ных систем организма — белки острой фазы (БОФ) — также характе¬
ризуется многокомпонентностью. К ним относят С-реактивный белок
(СРБ), маннозосвязывающий лектин, белки SP-A и SP-D сурфактан¬
та, фибриноген и ряд других белков. Их синтез осуществляется пре¬
имущественно в печени, уровень БОФ в крови нарастает более чем на
25% в ранние сроки защитной реакции на повреждение (Петров Р.В.
и др. [101, 108, 111]), задолго до развития специфического иммунного
ответа [144, 184]. Запуск синтеза БОФ осуществляется под влиянием
ИЛ-1 и ИЛ-6, действие других цитокинов, например фактора некроза
опухоли, носит опосредованный характер.СРБ относится к семейству пентраксинов, пентамерная структура
которых представлена пятью одинаковыми по структуре мономера¬
ми, соединенными зависимой от Са^+ нековалентной связью. СРБ
имеет химическое сродство к фосфорилхолину, компоненту клеточ¬
ных стенок ряда бактерий и одноклеточных грибов, но не клеток
млекопитающих. В мембране последних фосфорилхолин находится
в форме, недоступной для связывания СРБ. Результатом связывания
СРБ с бактериями является активация компонента комплемента Clq,
первого инициирующего компонента классического пути активации
этой белковой системы, и опсонизация бактерий для фагоцитоза.
Показано также связывание СРБ бактериальных порообразующих
экзотоксинов — стрептолизина О и тетанолизина, в результате чего
отменяется их цитотоксическое и гемолитическое действие [144].
26 Глава I. Естественные защитные силы организма,,.Маннан-связывающий лектин MBL [184,327] относится к семейству
коллективов (Collectins), способных связывать углеводные структуры
(остатки маннозы) на поверхности разных патогенных организмов ~
бактерий, дрожжей, вирусов, простейших, но не клеток млекопита¬
ющих. В последнем случае углеводные структуры экранированы и
недоступны для их связывания CRD-доменом маннан-связывающе-
го лектина (см. ниже). Характерным эффектом связывания MBL с
микробом является оисонизация последнего для фагоцитоза моно¬
цитами, которые, в отличие от более зрелых макрофагов, не экспрес¬
сируют рецептор для маннозы. По вторичной структуре и функциям
MBL подобен компоненту комплемента Clq, В результате связывания
с микробом MBL приобретает способность активировать протеазы,
расщепляющие компоненты комплемента С4 и С2 и инициирующие
активацию белков системы комплемента по лектиновому пути.Белки SP-A (от Surfactant protein А) и SP-D (от Surfactant protein D)
сурфактанта, являясь гуморальными факторами физиологических
защитных систем организма, как и маннозосвязывающий лектин,
относятся к семейству коллектинов, в частности легочных коллекти-
нов, синтезируемых и секретируемых в воздушное пространство и в
воздухоносные пути легких альвеолярными клетками типа П и эпи¬
телиальными клетками бронхиол. У некоторых видов SP-A экспрес¬
сируется также в железах подслизистой трахеи, евстахиевой трубыи, возможно, в некоторых других тканях. SP-D, наоборот, широко
экспрессируется во многих участках эпителия, включая верхние отде¬
лы дыхательных путей, ротоглотку и трахео-бронхиальные железы.
Несмотря на то что оба белка выявляются в легочных смывах, мик-
роанатомические места их локализации, по-видимому, различны.
Большая часть SP-A выделяется из легких в связи с сурфактантным
липидом и является составной частью тубулярного миелина, тогда
как SP-D выделяется в виде растворимого белка [492, 495, 571]. По
структуре SP-A и SP-D подобны и включают четыре домена — NHj-
терминальный перекрестносвязываемый домен, коллагеновый домен,
щейку или связывающий домен, и CRD-домен лектинов С-типа (от
Carbohydrate recognition domain). Отличия заключаются в размерах
коллагенового домена (он больше у SP-D) и в участках N-сцепленного
гликозилирования. Кроме того, SP-A представляет собой сборку в
виде 18-цепочечной молекулы, состоящей из шести гомо- и гетеро-
тримеров, тогда как SP-D — 12-цепочечная молекула, состоящая из
четырех гомотримерных молекул [327J. Мишенями для сурфактант¬
1.2. Клеточные факторы 27ных белков являются многие грамотрицательные и грамположитель-
ные бактерии, респираторные вирусы, грибы (А. fumigatus, Р. carinii,
С albicans), микобактерии. Связывая патогенные субстанции, сур¬
фактантные белки нейтрализуют ингалируемые микробы, влияют на
их поглощение фагоцитами, детоксицируют и очищают организм от
вредных микроорганизмов.К категории гуморальных факторов врожденного иммунитета
относят также интерфероны I типа (а и ß), продуцируемые лимфо¬
идными дендритными клетками, ряд провоспалительных цитокинов
(ИЛ-1, ИЛ-6, ФИО и др.), хемокины (более 40), пептиды — антибио¬
тики (более 400), простагландины, лейкотриены и др. Эти факторы в
дополнение к описанным выше вносят существенный вклад в проти-
воинфекционную защиту организма.Таким образом, гуморальные факторы физиологических защит¬
ных систем организма проявляют бактерицидные и противовирус¬
ные свойства, опсонизируют микробы для более эффективного их
поглощения фагоцитами, активируя клетки собственного организма,
подготовляют основу для включения в процесс защиты фагоцитов
и последующего развития специфического иммунного ответа. Для
большей надежности этих функций многие из них дублируются.1.2. КЛЕТОЧНЫЕ ФАКТОРЫПервыми клетками, с которыми взаимодействуют проникшие во
внутреннюю среду организма и не инактивированные гуморальными
факторами микробы, являются фагоциты (моноциты или макрофаги,
нейтрофилы, дендритные клетки). Роль этих клеток в защите организма
от инфекций огромна, достаточно сказать, что число инфекций у млеко¬
питающих существенно меньше по сравнению с численностью микробов
в окружающей среде. Это означает, что неуемному размножению микро¬
организмов препятствуют механизмы естественного иммунитета, в зна¬
чительной степени определяемые активностью фагоцитирующих клеток.До недавнего времени считалось, что процесс фагоцитоза, как
защитная функция врожденного иммунитета, носит полностью
неспецифический характер. Основанием для этого служило пред¬
ставление о том, что фагоциты не имеют соответствующих упоря¬
доченных рецепторов, позволяющих отличать «свое» от «не своего».
28 Глава I. Естественные защитные силы организма,..Фагоцитирование микробов, способность поглощать механические
частицы и наличие на макрофагах «рецепторов для уборки мусора»
(Scavenger receptors), связывающих характерные для млекопитаю¬
щих углеводы погибающих и деградирующих клеток собственно¬
го организма, служили дополнительным обоснованием для такого
заключения. Однако накапливающиеся данные вносят коррективы в
существующие представления и показывают, что фагоциты хозяина
могут отличать микробы как «чужое» от «своего» с помощью семей¬
ства трансмембранных белков. Распознавая и связывая микробы,
фагоциты их поглощают и убивают, активируются и синтезируют
растворимые молекулы — цитокины. Опсонизированные микробы
значительно интенсивнее захватываются и убиваются фагоцитарны¬
ми клетками по сравнению с неопсонизированными. Этот тип эли¬
минации возбудителя эффективен только в отношении внеклеточных
условно-патогенных бактерий со слабой вирулентностью.Затем, как правило, вступает второй, более мощный, эшелон защи¬
ты организма от инфекции — ранний индуцибельный ответ, действие
которого длится в течение 96 часов, пока не начнут работать факторы
специфического иммунитета. В нем также выделяются клеточные и
гуморальные факторы. К первым относятся активированные мак¬
рофаги, нейтрофилы и ЕКК, ко вторым — цитокины и БОФ, проду¬
цируемые клетками печени под влиянием этих цитокинов. Тканевые
макрофаги, активированные бактериальными антигенами в процессе
фагоцитоза возбудителя, вырабатывают ряд цитокинов (монокинов):
ФНОа, ИЛ-Ір, ИЛ-6, ИЛ-8, ИЛ-12, ИНФа, ГМ-КСФ и др., которые
оказывают активирующее воздействие на новые популяции клеток,
мигрирующих в воспалительный очаг, — моноциты, нейтрофилы,
ЕКК. Эти клеточные популяции также начинают продуцировать
цитокины, вовлекая в процесс защиты все новые и новые клетки.
Кроме того, в процессе разрушения микроба образуются микробные
пептиды, которые макрофаг в комплексе с антигенами главного ком¬
плекса гистосовместимости класса П (см. ниже) представляет Т-лим-
фоцитам. Это важнейший этап, без которого невозможно развитие
специфического иммунитета.Действие цитокинов, продуцируемых макрофагами в течение ран¬
него индуцибельного ответа, определяет основные механизмы анти-
инфекционной защиты на первых этапах развития инфекционного
процесса. Важнейшим цитокином, продуцируемым активированны¬
ми макрофагами в течение раннего индуцибельного ответа, является
/.2. Клеточные факторы 29ИЛ-12. Следует отметить, что от этого цитокина зависит характер
иммунного ответа: преимущественное развитие реакций клеточного
или гуморального типов, ИЛ-12 активирует моноциты (макрофаги),
нейтрофилы и ЕКК. Активированные таким путем фагоциты более
интенсивно поглощают микробы, быстрее их убивают и переваривают.
Активированные ЕКК приобретают большую цитотоксическую актив¬
ность по отношению к клеткам, инфицированным возбудителем.ИЛ-1, ИЛ-6, ФИО, ИЛ-8, ГМ-КСФ и другие цитокины, проду¬
цируемые макрофагами в течение раннего индуцибельного ответа,
являются провоспалительными цитокинами. Их действие полностью
определяет развитие воспалительного процесса, развивающегося при
внедрении микроба в макроорганизм. Приведем конкретные приме¬
ры их участия в развитии воспаления.• Повышение температуры при инфекционных процессах зависит от
действия на центральную нервную систему (ЦНС) ИЛ-1 и ИЛ-6.• Синтез БОФ: С-реактивного белка, маннозосвязывающего белка
и др. — зависит от действия на клетки печени ИЛ-1 и ИЛ-6. БОФ
обладают выраженной способностью опсопизировать внедрив¬
шиеся в организм микробы.• Развитие классических признаков воспаления: опухоли, покрас¬
нения, боли, жара — полностью зависит от действия ФИО.• Лейкоцитоз в периферической крови, как характерная черта
воспаления, зависит от ГМ-КСФ, Г-КСФ, М-КСФ, усиливающих
пролиферацию и дифференцировку клеток-предшественников
костного мозга и ускоряющих их созревание до зрелых грануло-
цитов с 7 до 1,5 дня.• Миграция нейтрофилов и моноцитов в очаг воспаления зависит
от а-(ИЛ-8) и р-хемокинов, а также ГМ-КСФ, являющихся мощ¬
ными индукторами движения фагоцитов.В воспалительном очаге наряду с тканевыми макрофагами — глав¬
ными инициаторами воспаления — существенное значение в борьбе
с инфекцией приобретают и другие клеточные элементы. Это прежде
всего нейтрофилы и ЕКК.Важными защитниками организма от внеклеточных бактерий на
стадии раннего индуцибельного ответа являются нейтрофилы. Они
составляют бульшую часть лейкоцитов крови (60—70%), в норме не
мигрируют в периферические ткани. Однако они первые участники
воспалительного процесса, при воспалении характеризуются нали¬
чием двух важных функций. Во-первых, они поглощают и убивают
30 Глава 1. Естественные защитные силы организма...бактерии. Этот процесс резко усиливается при опсонизации возбу¬
дителей и активации нейтрофилов цитокинами, вырабатываемыми
макрофагами и ЕКК. Во-вторых, они сами являются мошными про¬
дуцентами цитокинов: ИЛ-ф, ИЛ-8, ИЛ-12, ФНОа, ГМ-КСФ, ИНФа,
фактора активирующего тромбоциты, фактора роста фибробластов, с
помощью которых активируются и вовлекаются в борьбу с возбудите¬
лем новые эшелоны клеток, прибывших в очаг воспаления.В нротивомикробной активности нейтрофилов существенная роль
принадлежит пептидам-антибиотикам — а-дефензинам (HNP-l, -2, -3
и -4), первоначально названными лизосомными катионными белками.
а-Дефензины являются основным компонентом азурофильных гранул
нейтрофилов, содержащих миелопероксидазу. Будучи положителыю
заряженными, они связываются и проникают в отрицательно заряжен¬
ную стенку и фосфолипидную мембрану микробов, образуют поры в
микробах и нарушают синтез их ДНК, РНК и белка. Микробицидное
действие а-дефензинов распространяется на многие грамотрицатель¬
ные и грамположительные бактерии, дрожжевые грибы, отдельные обо-
лочечные вирусы. Экспрессия а-дефензинов зарегистрирована также в
отдельных популяциях Т-лимфоцитов человека и в ЕКК. Сходной
активностью характеризуются (З-дефензины (НВО-1, -2, -3), отлича¬
ющиеся от а-дефензинов положением и связью цистеинов. Однако в
отличие от а-дефензинов они экспрессируются в эпителиальных клет¬
ках мочеполового тракта, почек и в некоторых железах. Так, экспрессия
НВВ-1 зарегистрирована в клетках слюнных желез, трахеи, простаты,
плаценты. Синтез НВВ-2 индуцируется в кератиноцитах кожи, хотя
эти молекулы не являются конституциональными для этих клеток.Из других десяти известных пептидов-антибиотиков, именуемых
кателицидинами и выявляемых в нейтрофилах крупного рогатого
скота, свиней, овец и коз, один (ЬСАР-18/ЕЕ-37) обнаружен у чело¬
века. Следует отметить, что пептиды-антибиотики могут не только
опосредовать антимикробную резистентность, но и содействовать
позднему развитию гуморального и клеточного иммунитета.Главными защитниками организма от разного рода инфекций на
стадии раннего индуцибельного ответа являются ЕКК. Эти клет¬
ки относятся к категории основных эффекторов естественного или
врожденного иммунитета, играющих важнейшую роль в обеспечении
естественной резистентности организма к различным возбудите¬
лям инфекций — бактериальных (грамположительных, грамотри-
цательных, внутриклеточных) и протозойных, в противовирусном
1.2. Клеточные факторы 31и в противоопухолевом иммунитете. ЕКК не экспрессируют анти¬
генраспознающие рецепторы типа TCR или BCR, непосредственно
лизируют клетки-мишени без предварительной активации и без
ограничений со стороны главного комплекса гистосовместимости,
проявляют антителозависимую клеточную цитотоксичностъ, поми¬
мо активирующих, несут на поверхности рецепторы ингибирующего
типа (подробнее см. в главе 4), лигандами для которых являются
антигены гистосовместимости класса I — HLA-A, -В, -С, -Е, -G. При
этом активность и аффинность ингибиторных рецепторов превали¬
рует над таковыми активирующих структур. В связи с постоянным
прессингом молекул МНС класса Т нормальным физиологическим
состоянием ЕКК является их неактивированная форма. Однако при
отсутствии на клеточной мембране антигенов МНС класса I или при
снижении их экспрессии, например вследствие клеточной трансфор¬
мации при развивающихся новообразованиях или при инфицирова¬
нии, ЕКК активируются, клетки, не несущие на мембране «своего»,
распознаются как чужеродные и уничтожаются.Лизис мишеней происходит в результате высвобождения ЕКК
преформированных цитоплазматических гранул, содержащих перфо-
рин и гранзимы. В плазматической мембране клеток-мишеней белок
(перфорин) полимеризуется и образует поры, через которые в клетку
проникают индуцирующие апоптоз сериновые эстеразы — гранзимы.
Этот эффект получил название гранулярного экзоцитоза. Гранзимы
могут проникать в клетки-мищени и через рецептор для манно-
зо-6-фосфата, а их разрушение может также индуцироваться через
механизм, компонентами которого являются молекулы Fas и TRAIL
(от TNFa-related apoptosis-inducing ligand) (подробнее см. в главе 4).Важность ЕКК в защите организма от внутриклеточных микробов
демонстрируется следующим опытом: мутантные мыщи, не содержа¬
щие Т- и В-лимфоцитов, но имеющие ЕКК, не чувствительны к инфек¬
ции, вызванной листериями {Listeria monocytogenes). Однако мутантные
мыши, не содержащие ЕКК, но нормальные по Т- и В-лимфоцитам,
погибают от этой инфекции в течение 2—3 дней после заражения.Активность ЕКК по отнощению к инфицированным клеткам
может быть многократно усилена под влиянием ИЛ-12 и ИНФа,
продуцируемых моноцитами (макрофагами) и ИНФр, вырабатывае¬
мого фибробластами. Кроме того, ИЛ-12 совместно с ФНО обладает
способностью индуцировать синтез ЕКК ИНФу, также обладающего
выраженной способностью активировать нейтрофилы, моноциты
32 Глава I. Естественные защитные силы организма...(макрофаги) и новые ЕКК. Таким образом, задолго до включения в
процесс защиты антигенспецифических Т-лимфоцитов — главных
продуцентов ИНФу — ЕКК начинают вырабатывать эти важные для
зашиты организма от внутриклеточных возбудителей молекулярные
продукты. ЕКК обладают также способностью продуцировать ИНФа,
ИНФу, ГМ-КСФ, ИЛ-3, И Л-8 и другие хемокины.В защитных реакциях естественной резистентности значимую
роль играют также lLL-лимфоциты (от Innate-like lymphocytes) Bl,
MzB, NK-T, у5ТВI-лимфоциты локализуются, и их пул поддерживается стволовыми
кроветворными клетками не в костном мозгу, а в прибарьерных полос¬
тях ~ брюшной, плевральной. Предназначение В1-лимфоцитов —
быстрая реакция на «просачивающиеся» в прибарьерные полости
инфекционные микроорганизмы из числа широко распространен¬
ных. Иммуноглобулины, секретируемые В1-лимфоцитами, не очень
разнообразны, но полиспецифичны. Почти все они относятся к
классу низкоавидных IgM, распознающих наиболее распространен¬
ные соединения клеточных стенок бактерий. Преобладающая часть
иммуноглобулинов сыворотки крови здоровых лиц синтезируется
лимфоцитами В1. Эти иммуноглобулины рассматриваются в качестве
естественных антител, служат ранним барьером на путях поступаю¬
щих в организм микробов.убТ-лимфоциты локализуются в крови, перитонеальной полости,
печени, слизистых, в эпителии пищевода, трахеи, языка, мочевого
пузыря. Клетки дифференцируются экстратимически, прежде всего
в ЖКТ, экспрессируют антигенраспознающий рецептор, отличаю¬
щийся по строению от TCR обычных арТ-лимфоцитов. Отличиями
в строении характеризуется и корецептор CD8. Особенностью ySTCR
является распознавание им не комплекса МНС-1-пептид, а комплекса
CDl-пептид. При этом без участия АПК убТ-лимфоциты распознают
широкий спектр антигенов — фосфолипидные антигены микобакте¬
рий, углеводы, белки теплового шока. Взаимодействуя с В1-лимфо-
цитами, убТ-клетки обладают способностью распознавать отдельные
тимуснезависимые антигены (TI-2).NK-T-лимфоциты, являясь переходными клеточными формами
между врожденным и приобретенным иммунитетом, проявляют
свойства, характерные как для NK-, так и для Т-клеток. NK-T-лимфо-
циты распознают липиды или гликолипиды, представляемые антиге¬
ном CD1, но не МНС, способны индуцировать перфорин-гранзимо-
1.3. Рецепторы системы врожденного иммунитета 33вый лизис клеток-мишеней, однако подобно В1- и у5Т-лимфоцитам
клетки памяти не формируют, секретируя ИЛ-4, ИЛ-10 и ИНФу,
проявляют регуляторную активность.Как уже отмечалось, факторы естественной резистентности и
раннего индуцибельного ответа осуществляют защиту организ¬
ма в течение первых 96 часов после инфицирования. Примерно в
эти сроки начинает развиваться приобретенный или адаптивный
иммунный ответ, т.е. собственно специфический иммунитет, пред¬
ставляющий заключительный и наиболее мощный эшелон защиты
организма.1.3. РЕЦЕПТОРЫ СИСТЕМЫ ВРОЖДЕННОГО
ИММУНИТЕТАПоследние 2—3 года значительно расширили существующие
представления о строении и функциях рецепторного аппарата
клеток, с помощью которых система врожденного иммунитета
распознает «чужое» и отличает патогенные микроорганизмы от
комменсальных, обнаружены молекулярные сенсоры всех типов
патогенов, кроме многоклеточных паразитов, расшифрована крис¬
таллическая структура отдельных рецепторов врожденного имму¬
нитета, достигнут значительный прогресс в понимании их сиг¬
нальных путей и взаимодействий, оценена роль таких рецепторов
в формировании реакций адаптивного иммунитета. Это открывает
широкие возможности использования накопленных фактов в при¬
кладных исследованиях.Как отмечалось выше, система врожденного иммунитета образует
первую линию защиты на пути проникающих в организм микробов.
Ее защитная эффективность в значительной степени зависит от того,
насколько надежно она распознает микробную инвазию. Для этого
системой врожденного иммунитета высших позвоночных использу¬
ется два способа.Один из них — распознавание чужеродных для организма моле¬
кулярных структур микробного происхождения. Такие структуры
именуют «молекулярный образ патогена» или «молекулярная мозаика
патогена» РАМР (Pathogen-associated molecular patterns) [452], Как ока¬
залось, РАМР экспрессируются не только патогенной, но и коммен-
34 Глава i. Естественные защитные силы организма...сальной микрофлорой. Рецепторы, распознающие РАМР, называют
«рецепторы, распознающими молекулярный образ патогена», или
«образраспознающие рецепторы» — PRR (Pattern recognition receptors)
[452]. PRR экспрессируются клетками миелоидного ряда, плазма-
цитоидными пре-ДК, а также эпителиоиитами, эндотелиоцитами
и фибробластами. Некоторые PRR экспрессируются также Т-, В- и
NK-клетками [257, 466, 757], но играют в их функциях лишь вспомо¬
гательную роль.Другой способ обнаружения инфекции, используемый врожден¬
ным иммунитетом, — распознавание эндогенных факторов, возник¬
ших в ответ на инфекцию (распознавание «измененного своего»).
Такой способ был впервые обнаружен для NK-клеток, которые унич¬
тожают инфицированные или опухолевые клетки с пониженной экс¬
прессией антигенов МНС класса 1 (распознаваемых киллинг-инги-
бирующими рецепторами) и повышенной экспрессией определенных
поверхностных молекул, распознаваемых киллинг-активируюшими
рецепторами [474]. Однако распознавание эндогенных факторов, как
выяснилось, имеет более широкое значение в иммунной системе.В 1994 г. П. Матцингер выдвинула так называемую «теорию опас¬
ности» (danger theory), согласно которой иммунная система реагирует
не только на микробную инвазию, но на любое изменение, опасное
для организма, например на некротическую гибель собственных кле¬
ток [394]. По аналогии с понятием «РАМР» появился термин «danger-
associated molecular patterns» (DAMP) — эндогенные молекулы, которые
при инфекции или ином клеточном дистрессе либо синтезируются de
novo, либо появляются в «необычных» для них территориях. В роли
DAMP могут выступать даже нарушения ионного баланса в клетке.
При этом многие PRR реагируют как на РАМР, так и на DAMP.Распознавая разнообразные классы микроорганизмов, PRR в то же
время обеспечивают по возможности индивидуализированную реак¬
цию врожденного иммунитета на разные типы инфекций,1,3.1. ОБЩАЯ ХАРАКТЕРИСТИКА РЕЦЕПТОРОВ, РАСПОЗНАЮЩИХ
МОЛЕКУЛЯРНЫЙ ОБРАЗ ПАТОГЕНА (PRR)Основные свойства PRR перечислены в таблице 3, где для срав¬
нения приведены свойства антигенраспознающих рецепторов адап¬
тивного иммунитета — Т- и В-клеточных рецепторов (TCR и BCR
1.3. Рецепторы системы врожденного иммунитета35соответственно), в отличие от TCR и BCR распознающие рецепторы
врожденного иммунитета кодируются в гаметах и не подвергаются
соматической перестройке, их разнообразие ограничено и является
исключительно результатом филогенеза. В связи с этим ограничено и
число микробных лигандов, которые эти рецепторы могут распознать.
Эволюционно были отобраны те рецепторы, которые распознают
РАМР, т.е. молекулярные структуры, присущие больщим группам
микроорганизмов, жизненно для них необходимые, эволюционно
консервативные и не встречающиеся у многоклеточных эукариот.
«Классические» РАМР приведены в таблице 4.Таблица 3Сравнительная характеристика распознающих рецепторов врожденного (PRR)
и приобретенного (TCR, BCR) иммунитетаСвойстваPRRTCR, BCRСоматическая перестройка
генов--ьРазнообразиеНизкое,определяетсяэволюционноВысокое, является
результатом соматиче¬
ской перестройки геновКлональное распределение
на клетках иммунной сис¬
темы-+Селекция рецепторов, рас¬
познающих эндогенные
лиганды--нАффинность взаимодей¬
ствия с лигандамиНизкаяВысокаяДетерминированность ответа+-Потребность в кости мул иру-
ющих сигналах для актива-
иии клетки-+Большинство РАМР — это либо инвариантные компоненты кле¬
точной стенки бактерий и грибов (ЛПС, липопептиды, пептидогликан
и его фрагменты, р-глюкан), либо микробные нуклеиновые кислоты.
Лишь немногие РАМР являются белками (флагеллин, профилин).
36Глава 1, Естественные защитные силы организма...Хотя PR R распознают меньшее число лигандов и взаимодействуют
с ними с меньшей аффинностью по сравнению с антигенраспознаю-
щими рецепторами адаптивного иммунитета, ответ системы врож¬
денного иммунитета развивается быстрее по сравнению с системой
адаптивного иммунитета, так как связан меньшим количеством регу¬
ляторных ограничений и не требует клональной экспансии редких
клеток-предшественников. PRR обеспечивают быструю мобилиза¬
цию иммунной системы на борьбу с патогенами.Некоторые активационные PRR и их лиганды
[220, 377, 382, 537, 540, 654, 788, 791, 849,864,871]Таблица 4РецепторЛигандыэкзогенные (РАМР)эндогенные (DAMP)TLR2:TLR1Триац и л-л ипопептид ы9TLR6;TLRiДиацил-липопеитиды7TLR2;TLR1илиTLR6:TLR1Полимерный пептидогликан,
тейхоевые кислоты, липотейхое-
выс кислоты, зимозан, липоара-
биноманпан7TLR3дцРНКАуто-РНКTLR4ЛПС, таксол, Р-белок респира¬
торно-синцитиального вируса,
фимбрии 1-го и Р-типаБелки теплового пюка
(Hsp60, Hsp72), Р-дефензи-
ны, гиалуронан, HMGB-1TLR5Флагеллин9TLR7Одноцепочечная РНК вирусов,
аналоги нуклеозидов (имикви-
мод, Н-848, локсорибин)Ауто-РНК, рибонуклеоп-
ротеиныTLR8Одноцепочечная РНК вирусов,
аналоги нуклеозидов (R-848)Ауто-РНК, рибонуклео-
протеины (РНП),PHП-содержащие имму¬
нокомплексыTLR9Микробная ДНК и синтетиче¬
ские олиголезоксинуклеотиды,
содержащие неметилированные
СрО-тандемыАуто-ДНК, хроматин и
хроматинсодержашие
иммунокомплексьт.
HMGB-]TLRIO7?
i.3. Рецепторы системы врожденного иммунитета37Окончание табл. 4РецепторЛигандыэкзогенные (РАМР)эндогенные (DAMP)TLR II*Профилин, уропатогенная
кишечная палочкаДектин-1р-глюканыN0D1Цитозольный мурамилтрипеп-
тил с концевой мезодиаминопи-
мелиновой кислотойNOD2Цитозольный мурамилдипептид,
цитозольный мурамилтри пептид
с концевым L-лизиномR1G-IRLRЦитозольная дцРНК, цитозоль¬
ная одноцепочечпая PH К с 5’-
трифосфатомПродукты расщепления
ауто-РНКDATЦитозольная ДНКТЬКИ, а также TLR12 и ТЬК13 имеются только у мыши, ТЬКЮ и TLR8 — только у
человека.Кульминацией и одним из основных проявлений врожденного
иммунного ответа является воспаление. Полагают, что врожденный
иммунный ответ нередко ведет к элиминации патогенов без участия
адаптивной иммунной системы [600].1.3.2. КЛАССИФИКАЦИЯ РЕЦЕПТОРОВ. РАСПОЗНАЮЩИХ
МОЛЕКУЛЯРНЫЙ ОБРАЗ ПАТОГЕНА1.3.2.1 Классификация по структуреВ отличие от адаптивной иммунной реакции, где распознавание
антигена осуществляют всего два типа рецепторов из суперсемейства
иммуноглобулинов, PRR представлены белками различных семейств.
Как правило, в молекуле PRR присутствуют один или несколько
консервативных доменов. Разнообразие PRR создается как ограни¬
ченными структурными вариациями в пределах одного домена, так
и различными сочетаниями доменов [656J. Структурная классифика¬
ция PRR приведена в таблице 5.
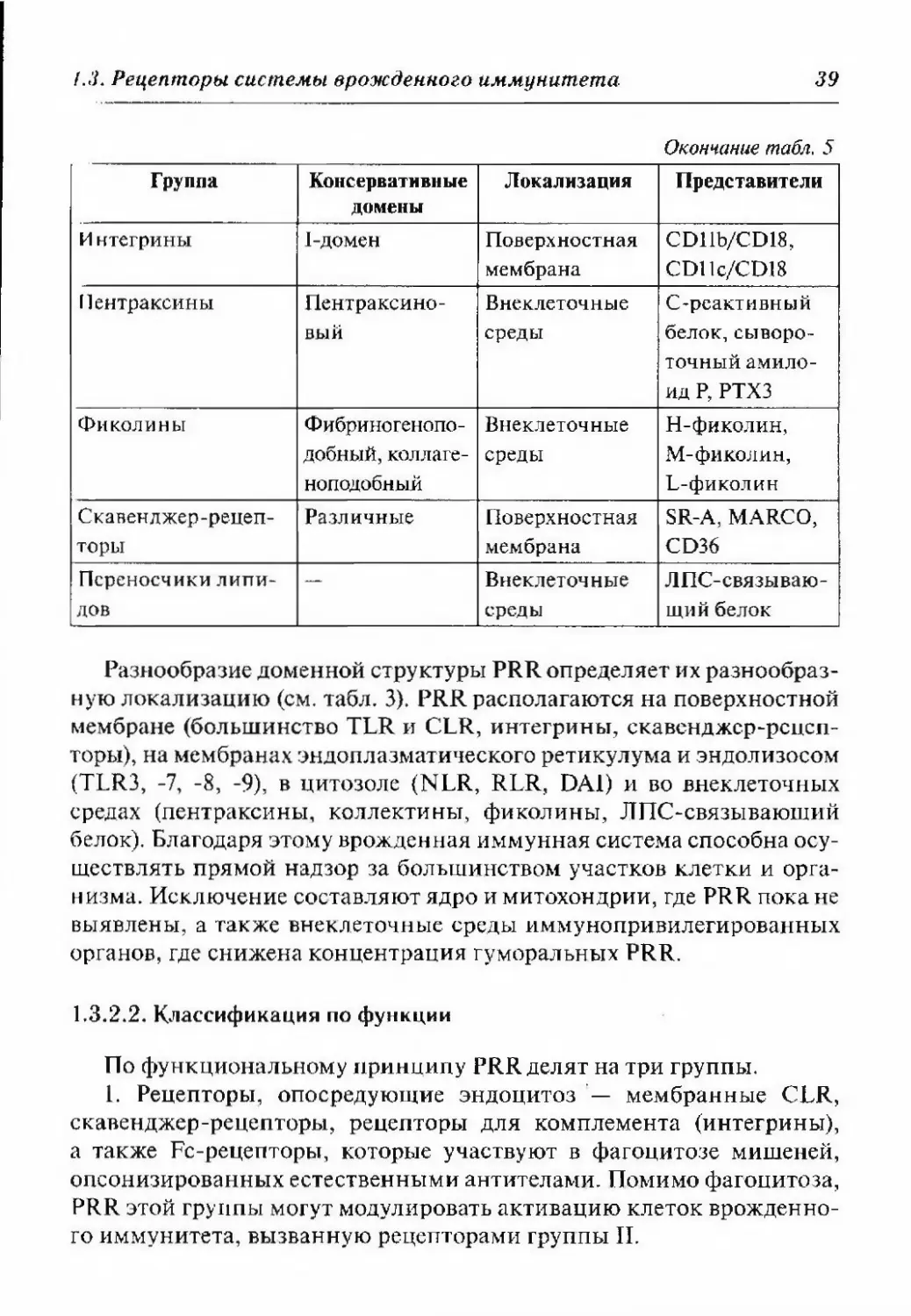
38Глава I. Естественные защитные силы организма...Классификация PRRТаблица 5ГруппаКонсервативныедоменыЛокализацияПредставителиТо11-подобные рецеп¬
торы (Toll-like recep¬
tors, TLR)LRR, TIRПоверхностная
мембрана, мем¬
браны ЭПР и
эндолизосомTLR1-TLR10
(у человека)
TLR1-TLR9,
TLRH-TLR13
(у мыши)NOD-подобные
рецепторы (NOD-Икс
receptors, NLR);
NOD-рецепторы
NALP-рецепторы
NAlP-peueiiTopHLRR, NOD, CARD
LRR, NOD, PYD
LRR, NOD, BIRЦитозольЦитозольЦитозольN0D1,N0D2,IPAF
NALPl, NALP3
NAIPRIG-подобные
рецепторы (RIG-like
reccptors, RLR)РНК-хеликаз-
НЫЙ, CARDЦитозольRIG-L MDA5Цитозольные сенсо¬
ры ДНКДомен связыва¬
ния Z-ДНКЦитозольDAIРецепторы класса
лектинов С-типа (С-
type lectinc-like recep¬
tors, CLR):
лектины II группы
(траисмембранные II
типа, Са-зависимые);
лектины III группы
(коллектины) (гумо¬
ральные лектины);
лектины V группы
(трансмембранные II
типа, Са-независи-
мые);лектины VI группы
(трансмембранныс I
типа)CTLDCTLD, коллаге-
нонодобныйCTLD, ITAM-
мотивCTLDПоверхностнаямембранаВнеклеточныесредыПоверхностнаямембранаПоверхностнаямембранаДектин-2,
CD207, CD209Мапнозосвязы-
ваюший лектин,
SP-A, SP-D
Дектин-1CD205, CD206
Рецепторы системы врожденного иммунитета39Окончание табл, 5ГруппаКонсервативныедоменыЛокализацияПредставителиИ нтегрины1-доменПоверхностнаямембранаCDllb/CD18,CDllc/CDlSИентраксиныПентраксино-выйВнеклеточныесредыС-реактивный
белок, сыворо¬
точный амило¬
ид Р, РТХЗФи КОЛИНЫФибриногенопо¬
добный, коллаге¬
ноподобныйВнеклеточныесредыН-фиколин,
М-фиколин,
L-фи КОЛИНСкавенджер-рецеп-торыРазличныеПоверхностнаямембранаSR-A, MARCO,
CD36Переносчики липи¬
довВнеклеточныесредыЛПС-связываю-
щий белокРазнообразие доменной структуры PRR определяет их разнообраз¬
ную локализацию (см. табл, 3). PRR располагаются на поверхностной
мембране (большинство TLR и CLR, интегрины, скавенджср-рсцсп-
торы), на мембранах эндоплазматического ретикулума и эндолизосом
(TLR3, -7, -8, -9), в цитозоле (NLR, RLR, DA1) и во внеклеточных
средах (пентраксины, коллектины, фиколины, ЛПС-связываюший
белок). Благодаря этому врожденная иммунная система способна осу¬
ществлять прямой надзор за большинством участков клетки и орга¬
низма. Исключение составляют ядро и митохондрии, где PRR пока не
выявлены, а также внеклеточные среды иммунопривилегированных
органов, где снижена концентрация гуморальных PRR.1.3.2.2. Классификация по функцииПо функциональному принципу PRR делят на три группы.1. Рецепторы, опосредующие эндоцитоз — мембранные CLR,
скавенджер-рецепторы, рецепторы для комплемента (интегрины),
а также Fc-рецепторы, которые участвуют в фагоцитозе мишеней,
опсонизированных естественными антителами. Помимо фагоцитоза,
PRR этой группы могут модулировать активацию клеток врожденно¬
го иммунитета, вызванную рецепторами группы П.
40 Глава 1. Естественные защитные силы организма...2, Рецепторы, опосредующие активацию клеток врожденного
иммунитета — TLR, NLR, RLR, DAI, а также некоторые мембран¬
ные CLR (дектин-1). Эти рецепторы играют наиболее важную роль,
поскольку они индуцируют основные защитные реакции врожден¬
ного иммунитета: воспаление, продукцию антимикробных пептидов,
пирогенную реакцию и выработку ИНФ типа I.3. Опсонины и рецепторы, активирующие комплемент, - гумо¬
ральные PRR, известные также как белки острой фазы (коллектины,
пентраксины, фиколины, ЛПС-связывающий белок), а также так
называемые естественные антитела, которые вырабатываются В1-
лимфоцитами. Биологическая роль PRR этой группы состоит либо
в опсонизации РАМР-несущих корпускулярных мишеней, либо в
доставке растворимых РАМР к мембранным PRR, либо в актива¬
ции комплемента. Гуморальные PRR расширяют спектр микробных
лигандов, которые могут быть распознаны мембранными PRR.Сенсоры к основным молекулам РАМР располагаются как на
мембранах (поверхностных или эндолизосомных), так и в цитозоле
клетки. При этом рецепторы к нуклеиновым кислотам (эндосомные
TLR, RLR, DAI) индуцируют интерфероновый ответ независимо от
их локализации, хотя локализация влияет на конкретные характерис¬
тики этого ответа [790]. Поверхностные структуры PRR, распознаю¬
щие компоненты клеточной стенки (TLR1, -2, -4, -5, -6, дектин-1), в
основном индуцируют экспрессию провоспалительных цитокинов и
антимикробных пептидов [382J. В цитозоле сенсорами компонентов
клеточной стенки бактерий являются NLR [472]. По крайней мере,
некоторые из этих рецепторов (NOD1, N0D2) тоже могут индуциро¬
вать экспрессию провоспалительных и антимикробных факторов,
однако другой их важной функцией является активация инфламма-
сом — мультипротеиновых комплексов, необходимых для секреции
цитокинов семейства ИЛ-1 (ИЛ-ір, ИЛ-18, ИЛ-33) [672].Рассмотрим пять наиболее важных (активационных) семейств
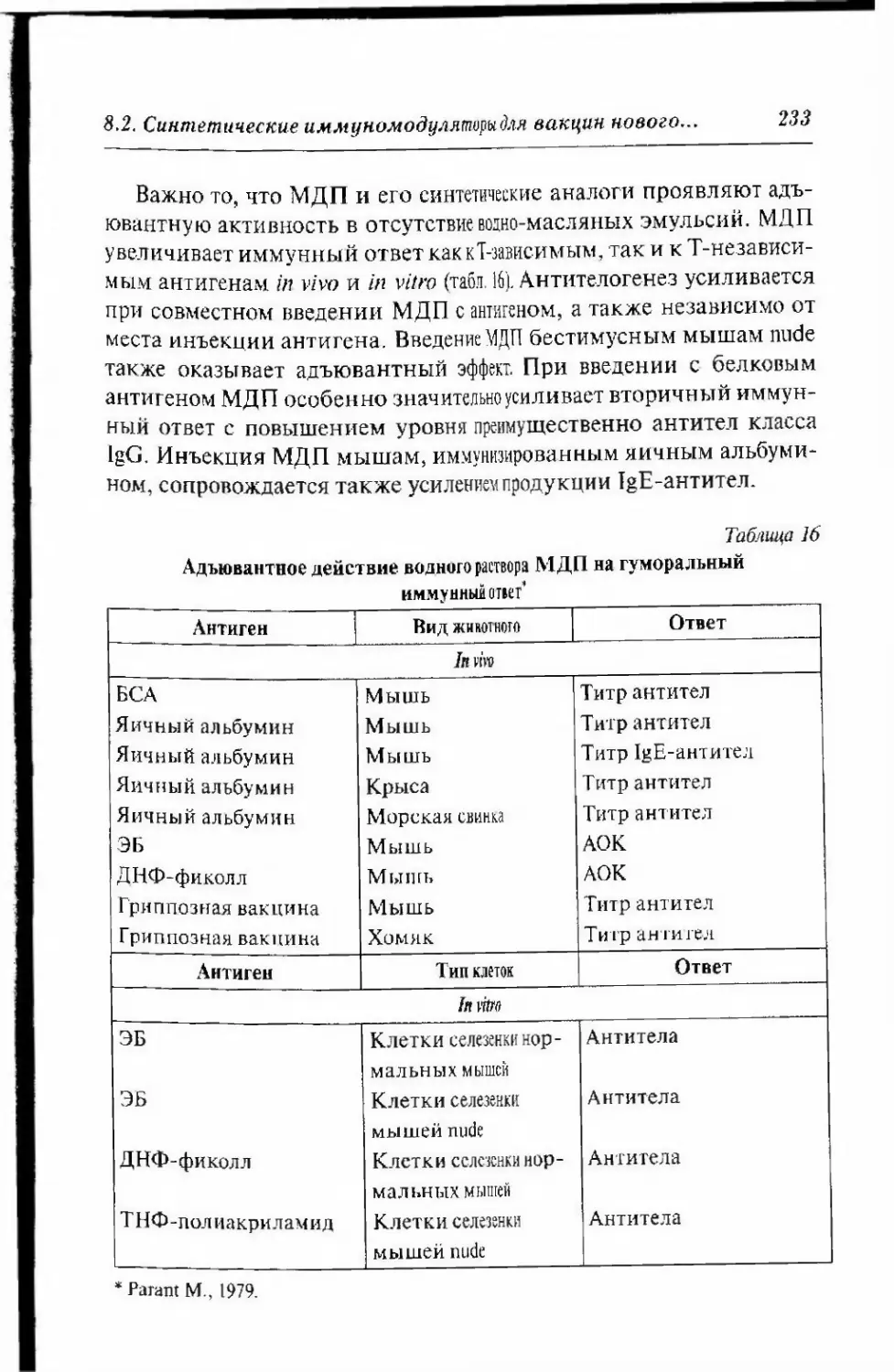
PRR; TLR, NLR, RLR, DA1 и CLR.1.3.3. РЕЦЕПТОРЫ СЕМЕЙСТВА TOLL-ПОДОБНЫХ РЕЦЕПТОРОВ
(TLR), РАСПОЗНАЮЩИЕ МОЛЕКУЛЯРНЫЙ ОБРАЗ ПАТОГЕНАНаиболее хорошо изученной подгруппой PRR, играющей ключе¬
вую роль в индукции врожденной защитной реакции при различных
1.3. Рецепторы системы врожденного иммунитета 41бактериальных и вирусных инфекциях, являются TLR. Активация
TLR приводит к активации факторов транскрипции семейств NF-kB,
1RF и АР-1, которые в свою очередь индуцируют экспрессию сотен
генов, участвующих во врожденном иммунном ответе, у человека
имеется 10 функционирующих TLR, у мыши — 11 (см. табл. 5).TLR — это трансмембранные гликопротеины I типа с молекуляр¬
ной массой 90—115 кД, один раз пронизывающие мембрану. N-koh-
цевая часть TLR представлена LRR-доменом (Leucine-Rich Repeat
domain), ответственным за связывание лиганда. С-концевая часть
рецептора представлена TIR-доменом (Toll, Interleukin-l receptor
and Resistance domain), который находится в цитоплазме и отвечает
за взаимодействие с адаптерными молекулами сигнальных путей.
Между LRR- и TIR-доменами находится короткий трансмембранный
участок, который обеспечивает внутриклеточную сортировку моле¬
кул TLR. TLR3, -7, -8 и -9 после синтеза остаются в эндоплазматиче-
ском ретикулуме и при активации клетки транслоцируются в эндоли-
зосомный отдел, тогда как TLR1, -2, -4, -5, ~6 и -10 сразу направляются
на поверхность клетки [244, 642].Эндолизосомная локализация TLR, распознающих нуклеиновые
кислоты (TLR3, -7, -8 и -9), имеет важный биологический смысл.
В лизосомах происходит «раздевание» вирусов и деградация бактерий,
без чего невозможен контакт их нуклеиновых кислот с рецепторами.
Более того, лизосомная локализация позволяет предотвратить «слу¬
чайную» активацию этих рецепторов собственными нуклеиновыми
кислотами. Показано, что TLR9, «перенаправленный» на поверхность
клетки, сохраняет способность распознавать ДНК, в том числе ауто-
ДНК, и активировать NF-kB [2441. Поскольку разлотия микробных и
эукариотических нуклеиновых кислот не абсолютны, TLR не всегда
способны определить источник ДНК и РНК лишь по химической струк¬
туре. Поэтому распознавание данного вида РАМР основано не только
на структуре, но и на локализации: в эндолизосомах ДНК и РНК в норме
отсутствуют, а их появление свидетельствует об их микробном проис¬
хождении [244]. Однако и этот контрольный механизм не всегда достато¬
чен, и при попадании собственных нуклеиновых кислот в эндолизосомы
(например, при массивном некрозе или нарушениях апоптоза) происхо¬
дит неоправданная активация клеток врожденной иммунной системы,
что может вести к аутоиммунным заболеваниям [578].TLR распознают большое количество лигандов, наибольшее их
количество приходится на рецепторы TLR4 и TLR2 (см. табл. 4). Помимо
42 Глава 1, Естественные защитные силы организма.,.ЛПС, рецептор TLR4 обеспечивает распознавание таких различных
соединений, как алкалоид таксол, F-белок респираторно-синцитиаль¬
ного вируса, фимбрии и различные эндогенные факторы, в том числе
белки теплового шока, дефензины, гиалуронаны и белок HMGB-1 [220,
377, 600, 690]. Среди множественных агонистов TLR4 некоторые явля¬
ются эндогенными молекулами и, вероятно, играют роль DAMP. Не
исключено, что разные агонисты взаимодействуют с различными сай¬
тами LRR-домена TLR4. Другим рекордсменом по количеству лигандов
является TLR2 (см. табл. 4), который распознает различные РАМР: как
нерастворимый и растворимый пептидогликан, три- и диацил-липо-
пептиды, липотейхоевые кислоты, липоарабиноманнан и зимозан
[220], Частично это объясняется способностью TLR2 образовывать
комплексы с другими поверхностными молекулами.Взаимодействием с большим количеством молекулярных структур
характеризуются и другие TLR. Так, TLR9, помимо бактериальной
ДНК и синтетических CpG-олигодезоксинуклеотидов (CpG-ОДН)
[515], взаимодействует и с эукариотической ДНК, причем это взаи¬
модействие не подчиняется тем жестким структурным требованиям,
которые предъявляются к ОДН [865]. Рецепторы TLR7 и TLR8, поми¬
мо вирусной одноцепочечной РНК [434], могут распознавать ауто-
РНК [346]. Иммуностимулируюш,ая активность ауто-ДНК и ауто-
РНК усиливается, если они даются в составе иммуиокомплексов [241,
537]. Распознавание собственных нуклеиновых кислот играет важную
роль в патогенезе аутоиммунных заболеваний, в частности системной
красной волчанки.Все TLR, за исключением TLR1 и TLR6, функционируют в виде
гомодимеров. TLR1 и TLR6 активны только как гетеродимеры с TLR2
[642, 654]. TLRiO может образовывать как гомодимеры, так и гетероди¬
меры с TLR1 и TLR2 [432]. Описаны также гетеродимеры TLR7fTLR8
и TLR9:TLR8 [837]. Примечательно, что гетеродимеры образуются
только между структурно родственными TLR, каковыми являются
TLR1/2/6/10, с одной стороны, и TLR7/8/9 — с другой [701], Полагают,
что TLR-димеры образуются и в отсутствие лиганда, но являются
неактивными [650]. Связывание лиганда приводит к сближению и
определенной взаимной ориентации субъединиц димера, что ведет
к его активации [250, 460, 497, 536]. Помимо димеризации, связыва¬
ние лиганда приводит к конформационным изменениям в каждой
отдельно взятой субъединице димера. Эти изменения передаются
с LRR- на TIR-домен посредством атипичного С-концевого LRR-
1.3. Рецепторы системы врожденного иммунитета 43мотива, богатого цистеином; делеция этого участка или замена в нем
некоторых цистеинов на тирозин приводит к конституциональной
активации рецептора [6011-КЗ.3.1, LRR-домен ТоП-подобных рецепторовLRR-домен — эволюционно древний и широко распространенный
в природе тип белкового домена, представленный у бактерий, вирусов
и эукариот и входящий в состав более чем 6 тыс. белков [584]. LRR-
домен образован повторяющимися структурными элементами длиной
20-30 аминокислотных остатков — так называемыми LRR-мотивами
или LRR-повторами. Каждый LRR-мотив состоит из консервативно¬
го и вариабельного сегментов. Консервативные сегменты, как прави¬
ло, имеют вид LxxLxLxxNx(x)L, где L — остатки лейцина, изолейцина
или валина; N — остатки аспарагина, серина, треонина или цистеина;
X — остатки любой аминокислоты. Вариабельные сегменты отвечают
своему названию, однако по ряду свойств их можно классифициро¬
вать на семь типов [366J. Необычно высокое содержание лейцина и
других гидрофобных аминокислот в сочетании с повторяемостью
структурных элементов дает название всему домену.В То11-подобных рецепторах LRR-мотивы, как правило, имеют вид
xLxxLxLxxNxFxxFxxxxFxxLx, где L — любой гидрофобный остаток;
F — остаток фенилаланина [252, 584J. Количество LRR-повторов в
TLR варьирует от 19 до 25; при этом наибольшее их число имеется у
TLR3, -7, -8 и -9, т.е. у рецепторов, распознающих нуклеиновые кисло¬
ты. Методом рентгеноструктурного анализа изучена кристаллическая
структура LRR-доменов TLR3 [251, 314], TLR4 [497] и димера TLR1;
TLR2 [460].Помимо TLR, LRR-домен имеется у другого большого семейства
PRR — NOD-подобных рецепторов.1.3.3.2. TIR-домен ТоП-подобных рецепторовTIR-домен — консервативный сигнальный домен, который имеет¬
ся у многоклеточных животных начиная с дрозофилы, а также у рас¬
тений [858]. У млекопитающих T1R-домены, помимо TLR, имеются в
рецепторах к цитокинам семейства ИЛ-1, а также в адаптерных бел¬
ках, участвующих в сигнализации с этих рецепторов. Расшифрована
кристаллическая структура TIR-доменов TLR1, TLR2 и TLR10 [646,
858]. TIR-домены TLR передают активационный сигнал посредством
44 Глава 1. Естественные защитные силы организма...гомофильных взаимодействий: 1) с TlR-доменом другой молекулы
TLR; 2) с TIR-домепом адаптерных белков.t.3.4. РЕЦЕПТОРЫ СЕМЕЙСТВА NLR, РАСПОЗНАЮЩИЕ
МОЛЕКУЛЯРНЫЙ ОБРАЗ ПАТОГЕНА, И ИНФЛАММАСОМАВ отличие от TLR NLR располагаются в цитозоле, в реакциях
врожденного иммунитета зарегистрировано участие пяти представи¬
телей этого семейства — N0D1, NOD2,1PAF» NALP1, NALP3 [472],Практически все NLR состоят из трех доменов: N-концевого
сигнального домена, центрального NOD-домена, необходимого для
олигомеризации, и С-концевого LRR-домена, необходимого для свя¬
зывания лиганда. В зависимости от строения N-концевого домена
NLRделятся натри подсемейства (см. табл, 5). N-концевым доменом
у подсемейства NOD-рецепторов является CARD-домен (Caspase
recruitment domain), у NALP-рецепторов — PYD-домен (Pyrin domain),
у NAIP-рецепторов — три последовательно расположенных BIR-доме¬
на (Baculovirus inhibitor repeat domain) [4721.NOD-рецепторы (NODI и N0D2) распознают мурамилпептиды —
фрагменты пептидогликана клеточной стенки, которые образуются
либо под действием лизоцима в фаголизосомах, либо как промежу¬
точные продукты синтеза пептидогликана в самих бактериях. NODI
распознает мурамилпептиды с концевой мезо-диаминопимелиновой
кислотой (meso-DAP) [408]. Такие структурные мотивы присут¬
ствуют в пептидогликане грамотрицательных бактерий. Наиболее
активным лигандом для N0D1 является так называемый мурамил-
трипептид (IVlurNAc - L-Ala - y-D-Glu - meso-DAP), хотя рецептор
распознает также трипептид L-Ala — y-D-Glu — meso-DAP и дипептид
y-D-Glu - meso-DAP [409]. Минимальным активирующим мотивом
для NOD2 является мурамилдипептид (МДП), имеющий формулу
MurNAc — L-Ala — y-D-GIu (y-D-Gln). Этот структурный мотив при¬
сутствует в пептидогликане как грамотрицательных, так и грамполо¬
жительных бактерий. NOD2 распознает также мурамилтри пептиды
с концевым L-лизином, присущие грамположительным бактериям.
Мурамилпептиды с концевой meso-DAP не активируют NOD2, одна¬
ко приобретают эту способность после конъюгации с уридинди-
фосфатной группировкой (именно в таком виде мурамилпептиды
синтезируются in vivo) [409]. Таким образом, N0D1 и N0D2 являются
L3. Рецепторы системы врожденного иммунитета 45сенсорами пептидогликана грамотрицательных баю ери й и ксех бак¬
терий соответственно.Полагают, что NOD-рецепторы, а также другие NLR распознают
лиганды посредством LRR-домена [847]. Как и TLR, NOD-рецепторы
передают активационный сигнал с помощью гомофильных взаи¬
модействий. Полагают, что в отсутствие лиганда NOD-рецепторы
(а также другие NLR) имеют неактивную «свернутую» конформацию,
в которой LRR-домен прикрывает NOD- и CARD-домены [472, 672].
После связывания с агонистом молекула разворачивается, в резуль¬
тате чего NOD- и CARD-домены приобретают возможность взаимо¬
действовать с другими белками.Еще один NOD-рецептор ~ 1R\F, а также NALP-рецепторы NALP1
и NALP3 играют соверщенно другую роль во врожденном иммунном
ответе, а именно активируют каспазу-1, необходимую для процессинга
и последующей секреции цитокинов семейства ИЛ-1 [472]. Агонистом
для IPAF служит флагеллин жгутиковых бактерий [383J. NALP1 акти¬
вируется под действием летального токсина В. anthracis, МДП, а также
при механическом разрушении клетки [279, 373, 472]. NALP3 активи¬
руется под действием целого ряда соединений, в том числе МДП, ЛПС,
пептидогликана, тейхоевых кислот, вирусной ДНК, а также кристаллов
урата натрия и пирофосфата кальция [472, 581, 628].Индуцированная лигандом мультимеризация рецепторов IPAF и
NALP является первым шагом в сборке так называемой инфламма-
сомы — надмолекулярного комплекса, где происходит преврашение
неактивной прокаспазы-1 в активный фермент. Помимо рецептора,
в состав инфламмасомы входит адагггер ASC (состоящий из CARD-
и PYD-доменов) и сама прокаспаза-1 [672], которая тоже содержит
CARD-домен. Сближение молекул прокаспазы-1, достигаемое в
инфламмасомах, является необходимым условием для превраще¬
ния проэнзима в активную каспазу-1 [373]. Сходным образом могут
активироваться другие воспалительные каспазы человека (каспаза-4
и -5). 1PAF, NALP1 и NALP3 необходимы для борьбы с бактериями,
реплицирующимися в цитозоле (сальмонеллы, легионеллы, фран-
цисселлы) [472].Важным итогом активации рецепторных структур является про¬
дукция цитокинов семейства ИЛ-1. Оказалось, что для секреции
ИЛ-1р, ИЛ-18 и ИЛ-33 необходимы два сигнала. Один из них, акти¬
вирующий транскрипцию, который поступает, как правило, от TLR,
N0D1 или N0D2 через транскрииционный фактор NF-kB, и другой,
46 Глава 1, Естественные защитные силы организма...активирующий процессинг, который поступает от IPAF, NALP1 или
NALP3 и приводит к активации инфламмасомы.1.3,5. РЕЦЕПТОРЫ СЕМЕЙСТВА RLR, РАСПОЗНАЮЩИЕ
МОЛЕКУЛЯРНЫЙ ОБРАЗ ПАТОГЕНАRLR (RIG-like receptors) являются TLR-пезависимыми сенсорами,
распознающими виды РНК, характерные для вирусов и отсутствующие
в цитозоле неинфицированных клеток, и реагирующими на инфекцию
РНК-вирусами путем индукции ИНФ типа I [477, 768, 788, 791, 867].RLR присутствуют, видимо, во всех клетках, кроме плазмацитоид-
ных пре-ДК, что делает их универсальными сенсорами РНК-вирусов.
В плазмацитоидных пре-ДК за распознавание РНК-вирусов отвечает
исключительно TLR7 [475]. Плазмацитоидные пре-ДК, которые зна¬
чительно превосходят все другие клетки по способности вырабаты¬
вать ИНФ типа 1, при инфекциях РНК-вирусами in vivo обеспечивают
системную защиту, а также индукцию адаптивного противовирусно¬
го ответа, RLR-индуцированные интерфероны действуют в основном
пара- и аутокринно, обеспечивая локальную защиту [513, 519].К семейству RLR относятся рецепторы R1G-1 и MDA5 [477, 867].
Они состоят из двух N-концсвых сигнальных CARD-доменов, распо¬
ложенных тандемом, и С-концевого РНК-хеликазного домена, ответ¬
ственного за распознавание РНК. Хеликазный домен RLR структур¬
но сходен с аналогичными доменами некоторых РНКаз, в частности
фермента Dicer [791].R1G-T распознает некэпированную одноиепочечную РНК, несущую
5’-трифосфатную группировку. И RÍG-I, и MDA5 распознают дцРНК;
при этом дцРНК длиной менее 2000 пар оснований активирует пре¬
имущественно RTG-I, а более длинные молекулы — преимущественно
MDA5 [476]. RLR не распознают 5’-дефосфорилированную одноиепо¬
чечную РНК и кэпированную мРНК клеток [444], а также очень корот¬
кие дцРНК длиной менее 20 пар оснований [476]; последнее обстоя¬
тельство играет важную роль в технологии РНК-интерференции.Роль RIG-I и MDA5 в распознавании конкретных РНК-вирусов
определяется экспрессией соответствующей вирусной РНК. Так,
RIG-1 играет преимущественную роль в распознавании парамиксо-
вирусов и вируса везикулярного стоматита (образующих короткие
дцРНК в ходе репликации), а также вируса гриппа и вируса гепатита С
1.3. Рецепторы системы врожденного иммунитета 47(образующих одноцепочечную РНК с 5’-трифосфатом) [476, 477, 721].
Пикорнавирусы (вирус энцефаломиокардита) образуют длинные
дцРНК в ходе репликации и распознаются рецептором MDA5 [476,
721]. Геномная дцРНК реовирусов содержит фрагменты разной длины
и распознается обоими RLR. Значимость рецепторов RIG-I и 1VIDA5
в продукции ИНФ типа 1 подтверждается данными, свидетельству¬
ющими о том, что фибробласты и миелоидные ДК, полученные от
RIG-I“/“MDA5-/“ мышей, неспособны вырабатывать этот цитокин
при инфицировании животных РНК-вирусами [476].Помимо прямого распознавания вирусной РНК, RLR могут рас¬
познавать также фрагменты ауто-РНК, образующиеся в ходе вирусной
инфекции. Вирусная дцРНК активирует 2’-5’-олигоаденилатсинтазу
(2’-5’-ОАС), которая полимеризует АТФ с образованием 2’-5’-олиго-
аденилата. Последний активирует РНКазу L-эндонуклеазу, которая
расщепляет клеточную РНК на фрагменты длиной менее 200 осно¬
ваний. Эти короткие одноцепочечные фрагменты РНК не содержат
5’-фосфатов и тем не менее активируют RIG-1 и MDA5. Возможно,
RLR в данном случае распознают дуплексные структуры РНК [573].1.3.6. РЕЦЕПТОРЫ СЕМЕЙСТВА DA1, РАСПОЗНАЮЩИЕ
МОЛЕКУЛЯРНЫЙ ОБРАЗ ПАТОГЕНАПервый цитозольный сенсор ДНК был обнаружен в 2007 г. и назван
DAI (DNA-dependent activator of TFN-reguIatory factors) [788]. Рецептор
распознает дцДНК как бактериального, так и эукариотического про¬
исхождения, а также синтетическую дцДНК в различных конформа¬
циях (В, Z). Показана способность DAI распознавать вирус простого
герпеса I типа. DAI связывает ДНК посредством двух N-концевых
Z-доменов (Z-DNA binding domains) и дополнительного участка D3,
пока не отнесенного к какому-либо типу доменов. Активация DAI,
вероятно, сопровождается мультимеризацией рецептора, о чем кос¬
венно свидетельствует тот факт, что длинные молекулы ДНК вызы¬
вают более мощную активацию DA1, чем короткие [841]. Сигнальным
является С-конец молекулы DAL Как и RLR, DAT активирует сиг¬
нальный путь ТВК1 — IRF3/1RF7 и индуцирует экспрессию как
ИНФа, так и ИНФр. Ген DA1 сам является ИНФ-индуцибельным, что
приводит к формированию кольца положительной обратной связи.
Цитозольная ДНК распознается также NALP3 и, вероятно, другими
48 Глава 1. Естественные защитные силы организма...КАЬР-рецепторами [628], что в сочетании с ОА1-зависимой актива¬
цией NF-кB ведет к индукции секреции ИЛ-1.1.3.7. РЕЦЕПТОРЫ СЕМЕЙСТВА CLR, РАСПОЗНАЮЩИЕ
МОЛЕКУЛЯРНЫЙ ОБРАЗ ПАТОГЕНАCLR (C-type lectin-like receptors) расположены на цитоплазмати¬
ческой мембране и распознают различные сахара микробного проис¬
хождения, в частности Р-глюканьт, терминальную маннозу, фукозу и
N-ацетилглюкозамин. Название «CLR» обусловлено тем, что все ПРР
данного типа содержат так называемый CTLD-домен (C-type lectin¬
like domain), третичная структура которого сходна с таковой у класси¬
ческих лектинов С-типа [849].Лектины С-типа классифицируются на 17 групп, из которых роль
PRR играют представители II группы (дектин-2, лангсрин/С0207,
DC-SIGN/CD209), III группы — коллектины (маннозосвязываю¬
щий лектин, сурфактантные белки А и D), V группы (дектин-1) и VI
группы (макрофагальный маннозный рецептор CD206, DEC-205/
CD205) (см. табл. 3) [869]. В основном лектины С-типа опосредуют
эндоцитоз и либо не имеют какой-либо сигнальной функции, либо
модулируют (ингибируют) активационные сигналы, исходящие от
TLR [594, 849].Наиболее важным сигнальным CLR является дектин-1, который
распознает р-гл юканы дрожжевы х форм грибов и поэтому играет клю¬
чевую роль в ответе на грибковые инвазии [285]. Цитоплазматический
домен дектина-1 состоит всего из 44 аминокислотных остатков, однако
содержит активационный 1ТАМ-мотив [224]. Стимуляция дектина-1
приводит к индукции широкого спектра провоспалительных генов, в
том числе ФНОа ииклооксигеназы-2 и цитокинов, необходимых для
индукции ответа Thl7 (ИЛ-6, ИЛ-23) [285, 405].Способность активировать NF-kB приписывается также мак-
рофагальному маннозному рецептору (CD206), который является
трансмембранным белком типа I, содержащим восемь доменов CTLD
[849]. CD206 распознает терминальные остатки маннозы, фукозы и
N-ацетилглюкозамина, используя Са^"^ как кофактор. Рецептор CD206
лишен сколь-нибудь протяженного цитоплазматического домена,
может индуцировать синтез ИЛ-10 и подавлять эффективный ответ
на инфекцию С. albicans [709].
L3. Рецепторы системы врожденного иммунитета 491.3.8. ВНУТРИ- И МЕЖГРУППОВОЕ ВЗАИМОДЕЙСТВИЕ
РЕЦЕПТОРОВ, РАСПОЗНАЮЩИХ МОЛЕКУЛЯРНЫЙ
ОБРАЗ ПАТОГЕНАВ отличие от условий in vitro при реальных инфекциях in vivo на
нрожденную систему иммунитета одновременно действуют несколь¬
ко РАМР, которые распознаются отдельными PRR [807]. Поэтому
конкретный врожденный иммунный ответ на тот или иной пато¬
ген обусловлен активацией не только определенных PRR, но и их
определенных сочетаний, причем эти PRR могут находиться как на
одном, так и на разных типах клеток. Сочетанно активируемые PRR
могут взаимозаменять, дополнять либо модулировать действие друг
друга.Взаимозаменяемость PRR, очевидно, играет важную роль во врож¬
денном иммунном ответе, так что «выключение» даже больших
групп PRR сопровождается не общим снижением резистентности к
инфекциям, а повышенной восприимчивостью лишь к отдельным
патогенам. Так, мутация гена UNC3B1 блокирует активность всех
ИФН-индуцирующих TLR, однако резистентность снижается только
к вирусу простого герпеса [2991.Аддитивное или синергическое действие на клеточном уровне ока¬
зывают те PRR, которые активируют неперекрывающиеся или частич¬
но перекрывающиеся сигнальные пути. Так, агонисты TLR3 или TLR4
(TRlF-зависимых) и агонисты TLR7 или TLR8 взаимно потенцируют
действие друг друга [399, 632]. Синергизм в целом наблюдается также
между TLR и N0D1/N0D2 [387]. В то же время NOD2 может ингибиро¬
вать TLR 2-индуцированн у ю выработку ИЛ-12 [843]. Для индукции сек¬
реции ИЛ-1 необходима сочетанная активация TLR или N0D1/N0D2,
с одной стороны, и ÍPAF/NALP — с другой [472]. На уровне организма
взаимно дополняющее действие при вирусных инфекциях оказывают
RLRh TLR: первые обеспечивают локальную защиту, вторые вступают
в действие при прорыве вирусом эпителиальных барьеров и участвуют в
системной защите [519]. TLR- и NLR-индуцированный ИЛ-6 усиливает
выработку гуморальных PRR (белки острой фазы) в печени.Напротив, PRR, активирующие один и тот же сигнальный путь,
могут десенситизировать друг друга [237]. Некоторые PRR (TLR2,
CD206, DC-SIGN) могут индуцировать выработку ИЛ-10 и частично
ингибировать эффекты других PRR [555, 650, 709]. Скавенджер-
рецепторы поглощают РАМР из внеклеточных сред, но при этом не
50 Глава /. Естественные защитные силы организма,..активируют клетки, что уменьшает TLR-индуцированную актива¬
цию [685],L3.9. НЕГАТИВНАЯ РЕГУЛЯЦИЯ АКТИВАЦИОННЫХ РЕЦЕПТОРОВ,
РАСПОЗНАЮЩИХ МОЛЕКУЛЯРНЫЙ ОБРАЗ ПАТОГЕНАНеконтролируемая активация PRR потенциально опасна для орга¬
низма, поскольку может вести к гиперэргическому воспалению и
избыточной пирогенной реакции. Поэтому чувствительность системы
PRR должна поддерживаться на таком уровне, который обеспечивал
бы достаточно надежное распознавание микробов, но по возможности
минимизировал повреждение тканей. Приведем два примера. Вирус
Западного Нила активирует TLR3 в эндотелиоцитах ЦНС у мышей,
что облегчает доступ вируса в ЦНС и ведет к летальному энцефали¬
ту; TLR3^/~ мыши выживают [839]. У людей описан полиморфизм
TIRAP (S180L), который снижает сродство T1RAP к TLR2 и умень¬
шает интенсивность воспалительного ответа. Лица, гетерозиготные
по данному аллелю, менее чувствительны к малярии, туберкулезу и
пневмококковой пневмонии, чем гомозиготные носители нормально¬
го аллеля [493].Ряд основных механизмов характеризует негативную регуляцию
PRR.Гуморальные варианты мембранных рецепторов, распознающих
молекулярный образ патогена (рецепторы-ловушки). Описаны рас¬
творимые формы TLR2 и TLR4, которые конкурируют с мембран¬
ными вариантами этих рецепторов за связывание с лигандом [555],
К рецепторам-ловушкам, по-видимому, относится также цитозоль¬
ный белок LGP2, который конкурирует с RLR за связывание с лиган¬
дом, но не передает активационный сигнал [720].Ингибирование поверхностной экспрессии рецепторов, распознаю¬
щих молекулярный образ патогена. Было показано, что стимуляция
TLR ведет к их интернализации [468]. Это делает TLR временно недо¬
ступными для последующей стимуляции.Ингибирование внутриклеточных сигнальных путей. Эти механизмы
крайне разнообразны и могут воздействовать практически на любой
компонент сигнальных путей. Среди них наиболее значимыми явля¬
ются конкурирование ложных адаптеров с активными, подавление
активации сигнальных киназ, протеасомная деградация сигнальных
1.3. Рецепторы системы врожденного иммунитета 51факторов, инактивация активных киназ и адаптеров путем дефосфо-
рилирования или дсубиквитилирования и др. 1481].1.3.10. РАСПОЗНАВАНИЕ ПАТОГЕННЫХ И КОММЕНСАЛЬНЫХ
МИКРООРГАНИЗМОВКомменсальная микрофлора заселяет кишечник, кожу и верхние
дыхательные пути и необходима для нормального функционирования
человеческого организма, в частности для поддержания гомеостаза в
кишечной стенке [691]. Комменсалы обладают теми же РАМР/МАМР,
что и патогенные микроорганизмы, однако не вызывают реакций
врожденного иммунитета (точнее, вызывают ослабленный ответ).
В отличие от комменсальной микрофлоры, патогенные микробы
обладают факторами вирулентности, которые, однако, не являются
классическими РАМР. Вопрос о том, как иммунная система различа¬
ет патогенную и комменсальную микрофлору, — один из ключевых
в биологии врожденного иммунитета.Одним из основных факторов, определяющих отличия в распо¬
знавании патогенов и комменсалов, является фактор локализации.
Комменсальные микроорганизмы ни при каких условиях не пере¬
секают эпителиальные барьеры и не появляются в цитозоле клетки,
поэтому появление РАМР во внутренних средах организма или в
цитозоле свидетельствует об инфекции.Другой фактор, обеспечивающий отличия в распознавании пато¬
генов и комменсалов, может заключаться в подавлении ответа на ком¬
менсальную флору кишечника благодаря специфическому цитокино-
вому микроокружению. Цитокины ТФРр и ИЛ-10, вырабатываемые в
кишечнике, являются негативными регуляторами сигнальных путей
от TLR [555], источником ИЛ-10 и ТФРр в кишечнике могут быть
клетки Treg. Таким образом, речь здесь может идти об антигенспсци-
фической толерантности к комменсалам.Наконец, имеются работы, в которых показана способность неко¬
торых TLR прямо распознавать факторы вирулентности. Так, TLR4,
экспрессирующийся на эпител иоцитах мочевьтводящих путей, может
распознавать фимбрии — органеллы адгезии Е. coli и ряда других бак¬
терий [377]. Распознавание фимбрий происходит атипичным путем, без
участия CD14 и MD-2. При этом Р-фимбрии и фимбрии типа Т активи¬
руют различные пути прохождения внутриклеточного сигнала [377].
52 Глава i. Естественные защитные силы организма.,.1.3.11. ЭКСПРЕССИЯ TOLL-ПОДОБНЫХ РЕЦЕПТОРОВ
Т- И В-КЛЕТКАМИПроблема экспрессии TLR Т-лимфоцитами активно разрабатыва¬
ется. Возможна индукция некоторых TLR при активации Т-клеток
[466]. Наиболее убедительно показана роль TLR2 в функционировании
супрессорных клеток Treg: стимуляция TLR2 на мышиных Treg одно¬
временно с активацией TCR вызывает экспансию клеток Treg, хотя и
временно подавляет их супрессорную активность [777]. В ;гюбом случае
TLR могут оказывать на Т-клетки лишь костимулирующий эффект,
действенный только при одновременной активации TCR.Несомненна роль TLR в функционировании В-клеток. У мышей
с селек! ивным нокаутом MyD88 (адаптер, с помощью которого фор¬
мируется внутриклеточный сигнальный путь, передаваемый от TLR)
в В-клстках резко снижен антительный ответ на Т~зависимьге анти¬
гены, хотя функция Т-хелперов у таких животных не нарушена [663].
«Наивные» В-клетки человека не экспрессируют TLR, однако акти¬
вация BCR индуцирует экспрессию TLR7 и TLR9, которая сохра¬
няется на последующих стадиях дифференцировки В-клеток [257].
Соответственно, агонисты TLR7 и TLR9 усиливают пролиферацию
«наивных» В-клеток и их дифференцировку в плазмациты. Следует
отметить, что активация «наивных» В-клеток невозможна без актива¬
ции BCR; этим обеспечивается специфичность В-клеточного ответа.
Однако для активации В-клеток памяти стимуляция TLR7/TLR9
является достаточной. Поликлональная индуцированная РАМР-
стимуляция В-клеток памяти может быть одним из ключевых меха¬
низмов поддержания серологической памяти [258]. Такая стимуляция
может иметь место, например, при острых инфекциях.1.3.12. АКТИВИРУЮЩЕЕ И ИНСТРУКТИВНОЕ ВЛИЯНИЕ
ВРОЖДЕННОГО ИММУНИТЕТА НА Т-КЛЕТКИPRR реализуют свое влияние на адаптивный иммунный ответ в
основном с помощью антигенпредставляющих дендритных клеток
(ДК). Незрелые ДК являются слабыми активаторами Т-клеток, но
активно поглотают антиген, для чего используют широкий набор
эндоцитарных PRR, а также макропиноцитоз [238]. Миелоидные
ДК экспрессируют все известные активационные PRR, кроме TLR7
и TLR9, которые экспрессируются плазмацитоидными пре-ДК [285,
1.3. Рецепторы системы врожденного иммунитета 53467, 791]. Это позволяет системе деидритных клеток распознавать
патогены любого класса.ДК, активированные PRR, и пре-ДК претерпевают процесс созре¬
вания, т.е. превращения в профессиональные антигенпредставляющие
клетки (АПК). Роль профессиональных АПК могут и грать и некоторые
другие клетки врожденного иммунитета, в частности макрофаги, акти¬
вированные ИНФу, и клетки микроглии, а также В-клетки.PRR участвуют в нескольких аспектах деятельности АПК. Для
индукции противовирусного ответа Т-клетками фенотипов CD4 и
CD8, которые могут индуцироваться при стимуляции как TLR, так
и RLR, необходимы ИНФ типа 1. Для этого необходима стимуля¬
ция TLR в плазмацитоидных пре-ДК [513]. TLR в представлении АГ
играют не прямую, но важную роль: селективное представление
антигена ДК возможно только из PAM.F'-, но не из РАМР -частиц.
Значимость этого механизма определяется предотвращением аутоим¬
мунного ответа, например, на апоптотические тельца. За поглощение
и сортировку внеклеточных антигенов ответственны в основном
несигнальные PRR (CLR, скавенджер-рецепторы).Созревание ДК — сложный процесс, который характеризуется утра¬
той способности поглощать антиген, закислением эндосом, усилением
активности лизосомных протеаз, усилением представления ранее по¬
глощен ных антигенов, индукцией экспрессии костимулирующих моле¬
кул, индукцией экспрессии различных цитокинов и приобретением
способности мигрировать в Т-клеточные зоны вторичных лимфоидных
органов [238]. Все это наделяет ДК уникальной способностью активи¬
ровать Т-клетки. В зависимости от конкретных условий созревание ДК
индуцируется путем активации PRR или их сочетаний, а также ауто- и
паракринным действием цитокинов (ИЛ-1, ФНОа, ИНФ типа Т).Временное «выключение» клеток Treg. Клетки Treg, активирован¬
ные ауто- или микробными антигенами, способны подавлять акти¬
вацию наивных Т-клеток любой специфичности [463, 753]. Механизм
необходим для предотвращения аутоиммунного ответа; однако в этих
условиях становится невозможным и Т-клеточный ответ на патоге¬
ны. Эта тупиковая ситуация разрешается путем временной отмены
супрессивного действия клеток Treg на ранней стадии инфекции.
Данный эффект опосредуется, в частности, ИЛ-6, который вырабаты¬
вается ДК и макрофагами после их TLR-активации. ИЛ-6 действует
не на клетки Treg, а на наивные Т-клетки, делая их не чувствительны¬
ми к супрессорному влиянию Treg [662].
54Глава 1. Естественные защитные силы организма...Поскольку ил-6 вырабатывается лишь в первые часы после акти¬
вации TLR, то отмена супрессивного действия клеток Treg на «обыч¬
ные» Т-клетки является временной, образуя «окно», достаточное для
индукции Т-клеточного ответа на инфекционный возбудительИнструктивное влияние факторов врожденного иммунитета на тин
Т-хелнерного ответа. При анализе формирования Т-хелперных клеток
(см. главу 2) становится очевидным, что формирование субклассов
Т-хелперов, необходимых для борьбы с внутриклеточными и
внеклеточными инфекциями, определяется не только антигенспеци-
фическим и костимулирующим сигналами, но и инструктивным
сигналом. Инструктивный сигнал передается от ДК к Т~хелперам в
основном с помощью цитокинов, реже - с помощью поверхностных
молекул, экспрессируемых ДК в момент взаимодействия с Т-хелпером.
Кроме того, характер дифференцировки Т.^елперов зависит от силы
стимуляции их TCR (сильная стимуляция способствует Thl-ответу
слабая - ТЬ2-ответу) [529, 793]. Сила стимуляции TCR зависит от
количества доступных зрелых ДК- и АГ-представляющей способнос¬
ти, что, в свою очередь, регулируется активацией PRR. Было пока¬
зано, что изолированная активация NOD1 достаточна для индукции
ТК2-ответа на растворимые антигены (ТЬ2-ответ, вероятно, может
развиваться и в отсутствие РАМР, что имеет место при аллергиях).
ТЫ- и Th 17-ответ развивался при сочета^,ной активации NOD1 и
TLR [388]. Основными индукторами ответа Thl являются димер ИЛ-
12 и интерфероны типа I [632], поэтому активация NOD-рецепторов
может не быть обязательным условием Иїідуї^цли ответа Tlil. Для
развития ТЫ7-ответа необходимы ИЛ-6, Тфрр^ ИЛ-23 и ИЛ-1р [593]
Оптимальная коиндукция ИЛ-6, ИЛ-23 и иЛ-ір наблюдается при
стимуляции дектина-1 или дектина-1 в сочетании с TLR2 [405]; источ¬
ником ТФРр могут служить клетки Treg [593]1.3.13. АКТИВИРУЮЩЕЕ ВЛИЯНИЕ КЛЕТОК АДАПТИВНОГО
ИММУНИТЕТА НА ВРОЖДЕННЫЙ ИММУННЫЙ ОТВЕТЭффекторные механизмы адаптивного Иммунитета позволяют ему
бороться с некоторыми внутриклеточными инфекциями (Т-клетки
фенотипа CD8 уничтожают инфицированные мишени, экспрес¬
сирующие антигены МНС-1) и с экзотоксинами (нейтрализующие
антитела). В остальных случаях защитные реакции реализуются через
1.3. Рецепторы системы врожденного иммунитета 55эффекторные механизмы врожденного иммунитета. В 50-е годы XX в.
выдающийся отечественный иммунолог Л.А. Зильбер высказал точку
зрения, согласно которой система адаптивного иммунитета (антите¬
ла) специфически направляет неспецифические защитные средства
системы врожденного иммунитета (комплемент). Антитела, содей¬
ствующие фагоцитозу, И.И. Мечников называл опсонинами. Это
положение остается принципиально верным до сих пор. Характерно,
что Т-хелперное звено адаптивного иммунитета активирует тот отдел
врожденного иммунитета, откуда пришел соответствующий инструк¬
тивный сигнал. Так, наиболее мощными индукторами Thl-ответа
являются эндолизосомные TLR [515, 632]. В свою очередь ТЫ-клетки
путем выработки ИНФу усиливают способность макрофагов уби¬
вать микробы, паразитирующие в эндосомальных везикулах [416].
Наиболее мощными индукторами ТЬ2-ответа являются многоклеточ¬
ные паразиты, В свою очередь ТЬ2-клетки, вырабатывая ИЛ-4, ИЛ-5
и ИЛ-13, усиливают способность макрофагов убивать внеклеточные
патогены, индуцируют выработку IgE-антител, а также активируют
базофилы, эозинофилы и тучные клетки — систему борьбы с много¬
клеточными паразитами [416, 600]. Наиболее мощным индуктором
ТЫ7-ответа являются дрожжевые формы грибов, которые действуют
через дектин-1 и TLR2 [405]. В свою очередь клетки ТЫ? вырабаты¬
вают ИЛ-17, который индуцирует выработку хемокинов эпителио- и
эндотелиоцитами (что ведет к привлечению нейтрофилов), а также
ИЛ-22, который усиливает выработку антимикробных пептидов. Все
это обеспечивает оптимальный ответ на внеклеточные формы грибов
и бактерий [653].
Глава 2СТРУКТУРА И ФУНКЦИИ
ИММУННОЙ СИСТЕМЫ2.1. СТРОЕНИЕ ИММУННОЙ СИСТЕМЫ,
РАЗНОВИДНОСТИ ЛИМФОЦИТОВ и МОЛЕКУЛЯРНЫЕ
ОСНОВЫ РАСПОЗНАВАНИЯ АНТИГЕНОВВ отличие от других органов, характеризующихся определенной
локализацией, лимфоидная ткань распределена по всему телу в виде
структурных образований, подразделяющихся на центральные (кост¬
ный мозг, тимус) и периферические (лимфатические узлы, селезенка,
миндалины, пейеровы бляшки, аппендикс, кровь, лимфа) органы
иммунной системы, к периферическому отделу иммунной системы
относится также ряд лимфоидных скоплений в нелимфоидных орга¬
нах — Lamina propria (собственная пластинка) кишечника и матки,
солитарные фолликулы слизистых, внутриэпителиальные лимфо¬
циты слизистых и кожи, молочные пятна сальника (Хаитов Р,М. (171,
172]) [486, 516, 624, 682].Это определяет принципиально важные особенности иммунной
системы, лежащие в основе ее функционирования, — постоянная
рециркуляция клеток иммунной системы и взаимодействие состав¬
ляющих ее иммуноцитов.в центральных и периферических лимфоидных органах осуществ¬
ляется развитие и функционирование лимфоцитов. Лимфоцитам
принадлежит ключевая роль в осуществлении процессов, лежащих в
основе иммунитета:• распознавании антигена;• формировании реакций клеточного и гуморального типов,
направленных на удаление антигена из организма;• запоминании структуры контактирующего антигена.Как и другие клетки крови, лимфоциты происходят от общих пред¬
шественников — стволовых кроветворных клеток (СКК), которые
локализуются в основном в костном мозгу (см. рис. 2). в нем проис¬
ходит развитие В-лимфоцитов млекопитающих; у птиц центральным
2.1. Строение иммунной системы, разновидности лимфоцитов... 57Цемтрапыше органы иммунной системыКОСТНЫЙ мозг
{В.М.ПТИМУС (Т):ігСелезенка] гЛимфа¬тическиеузлы□ е:Лимфо¬иднаятканьслизистых1.ГЛимфо¬
идная
ткань,
ассоции¬
рованная
с кожей].ГПериферические органы иммунной системыРис. 2. Органы и ткани иммунной системы:В — В-лимфоциты; Т — Т-лимфоциты; М — макрофаги; Г
пре-Т — предшественники Т-лимфоцитовгранулоциты;органом, специализированным для дифференцировки В-лимфоци-
тов, является бурса (сумка) Фабриция, от которой и происходит
название клеток (В — от «бурсазависимые»). Развитие Т*(тимусзави¬
симых) лимфоцитов осуществляется в вилочковой железе или тимусе,
куда из костного мозга мигрируют их предшественники. На рисунке 3
представлена общая схема дифференцировки лимфоцитов.Значимую роль в формировании иммунной системы в процес¬
се онтогенеза и в функционировании врожденного иммунитета,
обеспечивающего естественную защиту организма от патогенных
агентов, играет печень. Помимо обменной, желчеобразующей и деток-
сикационной функций, в эмбриональном периоде развития печень
выполняет функции органа кроветворения, одним из центральных
этапов которого является образование лимфоцитов и других имму-
нокомпетентных клеток из кроветворных клеток-предшественников.
Иначе говоря, в эмбриональном периоде печень является главным
источником СКК. Более того, при отдельных патологических состоя¬
ниях (например, при лейкозах) в печени могут возникать очаги
экстрамедуллярного гемопоэза [88]. У половозрелых мышей в пере¬
58Глава 2. Структура и функции иммунной системыМиелоидные клетки Эритроидные клеткиЛимфоидные клеткиРис. 3. Схема дифференцировки лимфоцитов;т1ф1, mIgD — мембранные иммуноглобулины классов IgM и IgD; NK — нормальный
(естественный) киллер; TCR (Т cell receptor) — рецептор (антигенраспознающий)
Т-клеток. Остальные обозначения те же, что и на рисунке 2счете на целый орган в печени выявляется более 100 КОЕ-С или около
10 КОЕ-С, на 500 тыс. изолированных мононуклеаров. У мышей с
врожденным отсутствием тимуса число КОЕ-С в печени в 7-15 раз
выше [203]. Субпопуляиионный состав лимфоцитов печени (-25%
числа непаренхиматозных клеток печени, 2—15 млн на 1 г печеноч¬
ной ткани), в процентах от общего количества лимфоцитов печени,
представлен: В-лимфоцитами (не более 5%), Тар-лимфоцитами (20%),
Туб-лимфоцитами (-^3%), ЕКК-лимфоцитами (20%), уникальными
лимфоцитами, сочетающими в себе признаки Т- и ЕКК-лимфоцитов
(50%). Помимо лимфоцитов, иммунная система печени включает и
анатомический субстрат циркуляции лимфы — пространства Диссе.
С большой долей вероятности предполагается, что лимфоциты пече¬
ни обеспечивают постоянное поддержание иммунологической толе¬
рантности к веществам пищевых продуктов. Макрофаги печени —
купферовские клетки составляют около 15% общего числа клеток
2.1. Строение иммунной системы, разновидности лимфоцитов... 59печени и около 80% всех макрофагов тела (Хаитов P.M. и др. [184]).
В печени синтезируются белки системы комплемента, в том числе С1,
и белки острой фазы — С-реактивный белок и маннозосвязывающий
лектин. Роль этих белков, так же как и макрофагов, во врожденном
иммунитете рассмотрена выше (см. главу 1). Печень является также
источником кининогенов — неактивных предшественников белко¬
вой природы, образующих кинины под действием специфических
тканевых ферментов и ферментов плазмы крови — кининогеназ
(калликреинов). Одним из изученных кининов плазмы крови чело¬
века является нонапептид брадикинин, усиливающий капиллярную
проницаемость и являющийся медиатором аллергических реакций
немедленного типа.Способность распознавать антиген — важнейшее свойство лим¬
фоцитов, что обеспечивается присутствием на их поверхности спе¬
циализированных антигенраспознающих рецепторов (исключение
составляют ЕКК, не имеющие такого рецептора). И у В- и у Т-лимфо-
цитов антигенраспознающий рецептор представляет собой белковую
молекулу, состоящую из нескольких полипептидных цепей, один
конец которой встроен в мембрану, а противоположный, направлен¬
ный наружу клетки, образует вариабельный (V) участок, или домен,
который фактически уникален для каждого рецептора [454, 614, 875].
V-домены двух полипептидных цепей образуют антигенсвязывающий
участок. На поверхности каждого лимфоцита содержатся рецепто¬
ры, идентичные по структуре этого участка, который определяет
специфичность рецептора в отношении антигена (точнее участка
молекулы антигена — эпитопа). Специфичность обеспечивается про¬
странственным соответствием (комплементарностью) конфигураций
связывающего участка рецептора и эпитопа. Несмотря на принципи¬
альное сходство структурной организации, рецепторы В- и Т-клеток
различны (рис. 4), Рецепторы В-клеток (BCR) представляют собой
молекулы иммуноглобулинов, содержащих по две тяжелых и легких
цепи; потомки В-клеток вырабатывают антитела, которые представ¬
ляют собой растворимую форму рецептора той же специфичности.
Рецепторы Т-клеток (TCR) бывают двух типов, каждый из которых
содержит две разные полипептидные цепи. Обозначение этих цепей
определяет название рецепторов — ар- и у8-рецепторы.Иммуноглобулины и, по-видимому, у5-рецепторы распознают
антигенный эпитоп как таковой, вне связи с другими молекулами,
Т-клеточный ар-рецептор распознает антигенный эпитоп (обычно
60Глава 2. Структура и функции иммунной системыBCRTCR-CD3Рис. 4. Структура рецептора для распознавания антигена на Т- и В-лимфоцитах
BCR — В-клетонный антигенраспознающий рецептор; TCR-CD3 — антигенраспоз¬
нающий рецепторный комплекс Т-лимфоцитов. Остальные обозначения те же, что
и на рисунке 3пептидный фрагмент белка), встроенный в состав особых мембран¬
ных молекул — продуктов главного комплекса гистосовместимости
(МНС — от Major Histocompatibility Complex) (Хаитов P.M., Алексеев
Л.П. [174]; Хаитов P.M. и др. [179]) [404, 454, 614, 875]. В связи с этим
говорят, что Т-лимфоциты аР-типа распознают не «чужое», а «изме¬
ненное свое». Название этих крайне вариабельных молекул связано с
тем, что первоначально они были идентифицированы как генетиче¬
ские структуры, определяющие отторжение чужеродных тканей
(см. главу 3). Молекулы МНС, связывающие антигенный пептид,
относят к классам I и 11. Первые локализуются на любых клетках орга¬
низма, вторые — только на особых «антигенпредставляющих клетках»
(АПК), к которым относятся дендритные клетки, макрофаги, а также
В-лимфоциты [239, 404, 875].Разнообразие антигенсвязывающих рецепторов детерминируется
генами, присутствующими в лимфоцитах, и лишь в малой степени гена¬
ми, находящимися во всех других клетках организма [293, 639]. Число
К-генов каждой полипептидной цепи рецептора не превышает 100.
2.1. Строение иммунной системы, разновидности лимфоцитов... 61Однако в процессе созревания В-клеток в костном мозгу и Т-кле¬
ток в тимусе происходит перестройка К-генов, в результате которой
число их вариантов достигает 10'^ — 10’^. В основе перестройки лежит
целый комплекс процессов, включающий изъятие части генетическо¬
го материала, случайную стыковку образующихся при этом свобод¬
ных концов ДНК, нематричную достройку олигонуклеотидов и т.д.
Этому процессу в определенной последовательности подвергаются
гены различных цепей рецепторов. При этом срабатывают механиз¬
мы, обеспечивающие невозможность формирования на клетке более
чем одного типа рецепторов. В результате каждый созревающий лим¬
фоцит имеет рецепторы, уникальные по специфичности.Это означает, что каждая индивидуальная клетка может распо¬
знать только одну молекулярную конфигурацию (точнее семейство
родственных конфигураций) и лишь популяция лимфоцитов в
целом способна распознать всю совокупность антигенных эпито¬
пов. Полный набор рецепторов, формирующихся при созревании
лимфоцитов, определяет «первичный антигенраспознающий репер¬
туар» лимфоидных популяций. Данный репертуар нуждается в кор¬
ректировке, поскольку среди рецепторов много ненужных, а также
потенциально опасных, распознающих собственные антигены орга-
иизма-хозяина. Корректировка репертуара осуществляется в форме
селекции клонов лимфоцитов (о клонах в данном случае говорят
потому, что лимфоциты со сформировавшимися рецепторами перед
началом селекции успевают несколько раз поделиться и сформиро¬
вать клон клеток) [454, 639]*Селекция клонов детально изучена на примере Т-клеток аР-типа,
для которых такая корректировка особенно важна, поскольку спе¬
цифичность их рецепторов в конечном счете обеспечивает эффек¬
тивность и безопасность любых типов иммунного ответа [293, 639].
Назначение положительной селекции состоит в поддержке клонов,
способных распознать собственные молекулы МНС, комплексиро-
ванные с любыми пептидными эпитопами (таким образом, как бы
осваивается язык Т-клеточного распознавания). Поддержка клона
означает получение сигнала, обеспечивающего выживание и размно¬
жение клетки (остальные клоны практически неизбежно гибнут).
Отрицательная селекция состоит в «выбраковке» клонов, специ¬
фичных к комплексам аутологичных пептидов с аутологичными
молекулами МНС (т.е, потенциально аутоагрессивных клонов), кото¬
рые подвергаются «программированной гибели», или апоптозу [827].
62 Глава 2. Структура и функции иммунной системыСелекцию осуществляют клетки стромы тимуса [401, 486]. Считается,
что за положительную селекцию тимоцитов ответственны эпители¬
альные клетки, а за отрицательную — дендритные клетки тимуса.Выжившие в результате селекции клоны Т-лимфоцитов несут
рецепторы, способные распознавать чужеродные пептиды в комп¬
лексе с аутологичными молекулами МНС [503]. Специфичность этих
клонов определяет «вторичный антигенраспознающий (клональный)
репертуар» лимфоцитов, т.е. специфику реакций зрелых лимфоцитов
на антигены. Селекции, несколько отличающейся по содержанию от
выщеописанных процессов, подвергаются созревающие В-лимфоци¬
ты и Т-клетки у5-типа [330].В состав антигенраспознающих рецепторов В- и Т-клеток (BCR и
TCR) входит несколько дополнительныхполипептидных цепей, участ¬
вующих в передаче сигнала в клетку о связывании антигена [698].
С TCR-ap связаны молекулы так называемых корецепторов, которые
облегчают распознавание комплексов антигенных пептидов с моле¬
кулами МНС (рис. 5). Существует два типа корецепторов Т-клеток —
CD4 и CD8 [303]. На зрелых Т-клетках присутствует только один тип
корецепторных молекул, что определяет существование двух субпо¬
пуляций Т-клеток ар-типа (CD4 и CD8). Они обладают сродством к
молекулам МНС соответственно классов П и I. Это определяет осо¬
бенности распознавания антигена Т-клетками фенотипов CD4 и CD8
и в некоторой степени — их функции [569]. Поскольку молекулы МНС
класса П присутствуют только на АПК, С04-Т-клетки распознают
антиген исключительно «с подачи» этих клеток (отсюда их обозна¬
чение — «антигенпредставляющие клетки»). Лимфоидные клетки,
созревающие после воздействия антигена на С04-лимфоциты, сохра¬
няют способность взаимодействовать с АПК, включая В-лимфоциты
и макрофаги, что приводит к усилению функциональной активности
названных клеток. Поэтому регуляторные Т-клетки фенотипа CD4
называют Т-хелперами, т.е. помощниками. СВ8-Т-клетки распознают
антигенный пептид, представляемый любыми клетками организма,
несущими чужеродную генетическую информацию (вирусную, бак¬
териальную, мутантную и др.), поскольку на всех этих клетках при¬
сутствуют молекулы МНС класса I (см. рис. 5). Эффекторные клетки,
образующиеся из С08-лимфоцитов, также распознают комплексы
чужеродного пептида с молекулами МНС класса I и при этом убивают
такие измененные клетки. Поэтому С08-Т-клетки называют цито-
токсическими Т-лимфоцитами (ДТЛ) или Т-киллерами.
2.2. Иммунная система при ответе на антигены,..63TCRTCRАПККл-мишеньМНС iiMHGiРис. 5. Схема распознавания комплекса антигенного пептида с молекулами
МНС классов I и П рецептором и корецептором Т-лимфоцита:TCR — Т-клетинный (антигенраспознающий) рецептор; Th — Т-хетер; Тк — Т-киллер;
CD4 и CD8 — корецепторы; АПК — антигенпредставляющая клетка; МНС - главный
комплекс гистосовместимости; MHCI, MHCU— антигены классов 1иП главного ком¬
плекса гистосовместимости. Пояснения в текстеТаким образом, процесс развития лимфоцитов завершается фор¬
мированием ряда функциональных субпопуляций (В-лимфоциты,
Т-лимфоциты у6- и ар-типов, Т-киллеры, Т-хелперы), каждая из кото¬
рых обладает клональным разнообразием, определяемым специфич¬
ностью антигенраспознающих рецепторов.2.2. ИММУННАЯ СИСТЕМА ПРИ ОТВЕТЕ НА АНТИГЕНЫ.
МОЛЕКУЛЯРНЫЕ ОСНОВЫ ИММУННОГО
РЕАГИРОВАНИЯПусковым моментом для включения специфического иммунного
ответа является взаимодействие Т-хелпера с АПК (при первичном
иммунном ответе — дендритной клеткой), на поверхности которой
присутствует антигенный пептид, комплексированный с молекулой
МНС класса П (Петров Р.В, [102]) [404, 569, 639]. АПК лишены какой-
64Глава 2. Структура и функции иммунной системыАнтигенпредставляющая клеткаCD72 CD40 CD86 CD15 (|САМИ)^С0105 ^СЮ58 /R UI л Шк CD54CD154
{CD40L) CD26
CUA-4
(CD152)Т-лимфоцитCD49d/29CD11a/18
CD62L (LFA-1)(ич^леК'тин)Рис. 6. Молекулярные основы межклеточной адгезии;
ЛГ — антиген. Пояснения в текстелибо специфичности в отнощении представляемого антигена. На их
поверхности присутствуют молекулы МНС класса II, связавшие пеп¬
тидные фрагменты тех молекул, которые поступили путем эндоцитоза
внутрь клетки из окружающей среды. При этом на долю комплексов
молекул МНС класса II с чужеродным пептидом приходится чрезвы¬
чайно малая доля всех экспрессируемых МНС-пептидных комплексов.
С другой стороны, клоны Т-хелперов, которые несут рецептор, способ¬
ный распознать «искомый» комплекс молекул МНС класса П-пептид,
составляют ничтожно малую часть всей субпопуляции С04-лимфо-
цитов [454, 569]. Это делает проблематичной вероятность непосред¬
ственного контакта АПК и Т-хелпера, способных взаимодействовать
на основе распознавания рецептором TCR комплекса молекул МНС
класса П-пептид. Вероятность такой встречи повышается благодаря
механизму «улавливания» рециркулирующих лимфоцитов [682].Распознаванию антигенсодержащего комплекса (рис. 6) предшест¬
вует установление между клетками слабых контактов, обеспечивающих
взаимное «прощупывание». Вероятно, эти контакты обусловлены взаи¬
модействием молекул адгезии CD2 (на Т-клетках) и CD58 (на АПК). Это
создает предпосылку для специфического распознавания антигенсо¬
держащей структуры рецептором Т-хелпера (Хаитов P.M. [171, 172]) [239,
2.2. Иммунная система при ответе на антигены...65Рис. 7. Схема взаимодействия Т-хелперов и антигенпредставляющих клеток.
Роль кости мул ирующих молекул.Обозначения те же, что и на рисунках 5и 6293]. Однако само по себе это взаимодействие слишком слабо, чтобы
удержать клетки в контакте. Участие корецептора CD4 существенно
повышает сродство комплексов, но все равно требуются дополнительные
межмолекулярные взаимодействия для того, чтобы сохранить контакт.
Стабилизация взаимодействия Т-хелперов и АПК достигается благодаря
попарному взаимодействию молекул адгезии, присутствующих на их
поверхности или появляющихся в процессе установления контакта [454,
569, 875]. Помимо уже упомянутой пары CD2 - CD58, эта адгезия обус¬
ловлена связыванием других молекул, в особенности Р|- и |32-интегринов
поверхности Т-хелперов с их рецепторами (молекулами ICAM, VCAM),
локализованными на АПК (см. рис. 6).Взаимодействие антигена с рецептором недостаточно не только для
того, чтобы обеспечить прочный контакт, но и для того, чтобы вызвать
активацию лимфоцитов, заставить их функционировать. Оно лишь
«отмечает» те клопы, которые должны быть вовлечены в иммунный
ответ. Участие корецепторов CD4 и CD8, а также ряда вспомогательных
молекул, входящих в состав рецепторов, хотя и необходимо для запуска
активационного сигнала, но также недостаточно для его формирова¬
ния. Ключевая рольв запуске активации Т-хелперов и стимуляции АПК
принадлежит взаимодействию пар костимулирующих молекул CD28 —
CD80/86 (В7.1, В7.2) и CD40L (CD154) — CD40 (в каждой паре первы¬
ми названы молекулы, экспрессируемые на Т-хелперах, вторыми —
на АПК) (рис. 7). Из этих молекул CD80 (в меньшей степени CD86) и
CD40L появляются на поверхности клеток в ходе их взаимодействия.
При связывании CD28 с молекулами CD80/86 генерируемый сигнал
66 Глава 2. Структура и функции иммунной системыпоступает через CD28 в Т-клетку, при взаимодействии CD40 и CD154 —
через CD40 в АПК (в том числе В-клетку) [303, 542, 557, 771].При сочетании сигналов, поступающих в Т-хелпер через рецеп¬
торный комплекс TCR—CD3 и костимулирующую молекулу CD28,
формируется сигнал, приводящий к активации клетки, т.е. к выходу
ее из фазы покоя Go в фазу клеточного цикла Gj [820]. Это подготов¬
ляет клетку к пролиферации, которая лежит в основе любых форм
проявления активности лимфоцитов. Особая роль пролиферации
понятна: исходная численность любого клона слишком мала, чтобы
эффективно обеспечить удаление антигена из организма. Но для раз¬
вития пролиферации требуется участие ростовых факторов (в случае
Т-клеток в первую очередь — ИЛ-2). Основной результат активации
Т-клеток и состоит в индукции экспрессии генов ростовых факторов
и их рецепторов (рис. 8).Природа активационных сигналов и механизмы активации лим¬
фоцитов рассматриваются ниже (см. главу 4). Здесь отметим лишь:
суть передачи активационного сигнала состоит в развитии каскада
реакций, завершающихся формированием транскрипционных фак¬
торов, которые связываются с регуляторными участками упомянутых
генов, что приводит к их экспрессии, в случае Т-клеток формирую¬
щиеся в процессе передачи сигнала транскрипционные факторы АР-1,
NF-AT, NFkB вызывают экспрессию генов ростового фактора ИЛ-2
и его рецептора, что создает условия для деления активированных
Т-клеток. Смысл костимулирующего эффекта, возникающего при
связывании молекулы CD28, состоит во взаимодействии сигналов,
поступающих от этой молекулы и от рецептора, что приводит к усиле¬
нию конечного эффекта (экспрессии ИЛ-2 и его рецептора) [542, 557].Зависимость активации лимфоцитов не только от связывания
антигена, но и от дополнительных сигналов проявляется и при во¬
влечении в иммунный ответ других типов лимфоцитов (Хаитов P.M.
[170]) [293, 820]. Источником костимулирующих сигналов для них
обычно служат Т-хелперы. Костимуляция при этом осуществляется
как в форме контактных взаимодействий, так и с участием цитокинов,
секретируемых Т-хелперами.Т-хелперы дифференцируются из С04-Т-клеток вслед за их про¬
лиферацией, вызванной описанными выше процессами. При этом
образуются две основные разновидности Т-хелперов, отличающиеся
набором секретируемых цитокинов — ТЫ и Th2 [222, 665, 708,
741]. Дифференцировка Т-хелперов контролируется по преимуществу
2.2. Иммунная система при ответе на антигены...67Активация:
экспрессия ИЛ-2Р : щ 1
и ил>2р1 ^і • ИЛВ^мЬд^бтвйе
ИЛ-2 и ИЛ-2РИЛ-2Рис. 8, Последствия взаимодействия Т-лимфоцитов и антигенпредставляю-
ших клеток:ИЛ-2Р — рецептор для ИЛ-2; ИЛ-2 — интерлейкт-2; ТЫ и Th2 — субпопуляции
Т-хелперов. Остальные обозначения те же, что и на рисунках 4и 5цитокинами: ИЛ-12 способствует развитию ТЫ, а ИЛ-4 — ТЬ2 (рис. 9).
Ключевыми цитокинами, продуцируемыми ТЫ, являются ИЛ-2
и ИНФу. Первый служит фактором роста Т-клеток и обеспечивает
дифференцировку цитотоксических лимфоцитов (Т, ЕКК), второй
активирует макрофаги и служит провоспалительным цитокином.
В результате ТЫ выполняют функции хелперов реакций клеточного
типа, в том числе реализуемых при участии макрофагов (гиперчув¬
ствительность замедленного типа — ГЗТ) и цитотоксических лимфо¬
цитов. Т1г2 вырабатывают комплекс цитокинов, в котором доминиру¬
ют ИЛ-4, ИЛ-5, ИЛ-6. ИЛ-4 служит фактором роста В-клеток, способ-
6SГлава 2. Структура и функции иммунной системыTh2Рис. 9. Процесс дифференцировки ТЫ- и ТЬ2-клеток и продуцируемые ими
цитокины:ДК — дендритные клетки; МФ — макрофаги; МН — мононуклеары; ТК — тучные
клетки;МК — естественные клетки-киллеры; ТНО — предшественник Т-хелперов;
ИНФу — интерферои-у; ФНОа — фактор некроза опухоли-а. Остальные обозначе¬
ния те же, что и на рисунках 5 и ^ствует выработке IgE (аллергических антител) и реализации других
процессов, способствующих формированию аллергических реакций.
ИЛ-5 является фактором роста и дифференцировки эозинофилов и
фактором роста В-клеток. Среди широкого спектра эффектов ИЛ-6 —
поддержка развития и пролиферации В-клеток и их потомков —
плазматических клеток, образующих антитела. Таким образом, Th2
являются хелперами гуморального иммунного ответа и способству¬
ют развитию аллергических реакций. Между ТЫ и Th2 существуют
отношения антагонизма, реализуемые с участием их продуктов —
соответственно ИНФу и ИЛ-4 или ИЛ-10. Поэтому возникающее
доминирование одного типа хелперов над другим в дальнейшем
закрепляется, что определяет преобладающую форму иммунного
ответа [623, 697, 708].
'¿,2. Иммунная система при ответе на антигены...69MHCI! TCR .J—~т ~ ■CD80/86 CD28ЦитокиныCD 154Рис. 10. Развитие 1'уморального (антительного) иммунного ответа:В-.щ — В-лимфоцит. Остальные обозначения те же, что и на предыдущих рисункахЭффективным регулятором воспалительного процесса являются
ТЫ7. Эта субпопуляция Т-хелисров продуцирует ИЛ-17, так же как
ТЫ и Th2, образуется из ThO. В формировании ТЫ7 важную роль
играют N0D1 и TLR (см. главу 1, раздел 1.3.) и такие цитокины, как
ИЛ-6, ТФРр, ИЛ-23, ИЛ-lp [217].Для развития гуморального ответа (рис. 10), который приводит
к образованию антител, способных специфически связывать анти¬
ген, необходимо как действие цитокинов, секретируемых Th2, так
и контактные взаимодействия В-клеток и Т-хелперов [644, 661, 666].
Поскольку В-лимфоциты параллельно выполняют функции АПК,
при взаимодействии с Т-хелперами В-клетки обычно выполняют
двойную роль — АПК и предшественников клеток, секретирующих
антитела. При этом происходит рассмотренное выше взаимодействие
70 Глава 2. Структура и функции иммунной системыкостимулирующих молекул CD28 — В7.1/2 и CD40 — CD40L, причем
для активации В-лимфоцитов важен сигнал, поступающий через
молекулу CD40 (см, рис. 7),Основные события, связанные с активацией и последующей про¬
лиферацией В-лимфоцитов, происходят в фолликулах лимфоидных
органов, о которых мы говорили как о местах сосредоточения В-кле¬
ток (295, 644]. При воздействии антигена в фолликулы мигрируют
Т-лимфоциты, и в них формируются центры размножения (зародыше¬
вые центры). Стимулированные антигеном и Т-хелперами В-лимфо¬
циты начинают интенсивно делиться. При этом происходит два важ¬
ных процесса, затрагивающих гены иммуноглобулинов. Во-первых,
происходит переключение С-генов, в результате которого на поверх¬
ности клеток появляются иммуноглобулины класса IgG, реже —
IgA и IgE (вместо IgM и IgD, свойственных «наивным» В-клеткам),
Во-вторых, в их К-генах резко (на несколько порядков) повышает¬
ся частота мутаций. Это приводит к формированию многочислен¬
ных новых вариантов рецепторов и соответственно — субклонов
В-лимфоцитов. Образовавшиеся субклоны подвергаются селекции.
В случае, если мутации приводят к ослаблению сродства рецептора к
антигену, клоны не получают поддерживающих сигналов со стороны
дендритных клеток зародышевых центров (на которых фиксирован
антиген) и гибнут. Наоборот, в случае повышения сродства рецептора
к антигену клоны выживают и получают преимущества в отношении
взаимодействия с Т-хелперами и последующей пролиферации. Такие
клетки затем покидают фолликул, мигрируют в мозговые шнуры
лимфатического узла, красную пульпу селезенки, а также (особен¬
но при вторичном ответе) в костный мозг, где дифференцируются в
плазматические клетки и секретируют антитела. В случае, если сти¬
муляция В-клеток произошла в пейеровых бляшках или брыжеечных
лимфатических узлах, В-лимфоциты мигрируют в подслизистый слой
слизистой кишечника и дифференцируются преимущественно в IgA-
секретирующие плазматические клетки. IgA-антитела осуществляют
защиту слизистых оболочек и обладают способностью секретировать-
ся в просвет кишечника.Активация ЦТЛ (рис. 11) требует помимо связывания антигена,
комплексированного с молекулами МНС класса I, воздействия ИЛ-2,
источником которого служат Thl или сами С08-Т-клетки (418, 740].
Процессы индуцированной антигеном пролиферации и дифферен¬
цировки Т-лимфоцитов происходят в тимусзависимых зонах — пара-
2.2. Иммунная система при ответе на антигены...71Рис. 11. Формирование и активация цитотоксических Т-лимфоцитов:ЦТЛ — цитотоксический Т-лимфоцит; Кл — клетка. Остальные обозначения те
же, что и на предыдущих рисункахкортикальной зоне лимфатических узлов и периартериальных муфтах
селезенки. Затем они поступают в рециркуляцию и расселяются в
организме, проникая в очаги воспаления благодаря формированию в
них участков повышенной проницаемости, обусловленной активаци¬
ей эндотелиальных клеток и экспрессией эндотелиальными клетками
молекул адгезии. Т-лимфоциты, получившие сигнал от антигена в
структурах кишечника и других отделов иммунной системы, связан¬
ной со слизистыми, после завершения дифференцировки возвраща¬
ются в слизистые оболочки и локализуются между эпителиальными
клетками.Результат рассмотренных выше реакций лимфоцитов на антиген —
формирование эффекторных клеток. Ими являются плазматические
клетки, секретирующие антитела, ЦТЛ (фенотип CD8) и эффекторы
ГЗТ Мы не будем рассматривать пути и механизмы реализации эффек-
горных иммунных функций. Отметим лишь, что при этом происхо¬
дит взаимодействие и взаимное усиление неспецифических и анти¬
генспецифических эффекторных факторов. Антигенспецифические
эффекторные факторы, сами по себе способные обусловливать
иммунную защиту, при их комбинации с неспецифическими
72 Глава 2. Структура и функции иммунной системыфакторами придают последним прицельность и резко повышают
эффективность их действия (Петров Р.В. и др. U28]; Хаитров P.M.
[170]) [418, 665].2.3. ИЗМЕНЕНИЯ В ИММУННОЙ СИСТЕМЕ
ПРИ ИММУННОМ ОТВЕТЕ И ПОСЛЕ ЕГО ЗАВЕРШЕНИЯМорфогенетические процессы, индуцируемые при иммунном
ответе, существенно изменяют структуру иммунной системы, что
затрудняет реализацию ее функций в случае атаки друг их агрессивных
агентов. Однако существуют механизмы обратного развития иммун¬
ного ответа, направленные на восстановление структуры иммунной
системы до состояния, близкого к исходному. Важную роль играет
при этом прекращение вовлечения в реакцию новых клеток в связи
с устранением антигенного стимула. Срабатывает также ряд меха¬
низмов активной иммуносупрессии (Петров Р.В., Хаитов P.M. [116];
Хаитов P.M. [170]) [503]. Так, на поверхности Т-клеток в процессе
их активации появляются молекулы CTLA4, родственные CD28 по
структуре и обладающие даже более высоким сродством к костиму-
лирующим молекулам В7. Однако вместо костимуляции через CTLA4
подается сигнал к подавлению активации Т-клетки. Ингибирующий
сигнал передается в клетки (В-лимфоцитьт, макрофаги и т.д.) через
Fc-рецепторы, связывающие молекулы иммуноглобулинов (как пра¬
вило, комплексированные с антигеном) через их константные домены.
Поэтому при накоплении комплексов антиген—антите.1ю при избытке
последних активность клеток, несущих Fc-рецепторы, в частности
В-лимфоцитов, подавляется.Значительная роль в ограничении иммунного ответа придается
супрессорным Т-лимфоцитам [516, 574, 874]. Однако, несмотря на
огромные усилия исследователей, вопрос о природе супрессорной
активности Т-клеток остается открытым. В настоящее время сущест¬
вование специализированной субпопуляции антигенспецифических
Т-супрессоров отрицается. Это связано с тем, что не удалось обнару¬
жить какие-либо специфические маркеры таких клеток, проследить
их дифференцировку в тимусе, клонировать, выявить особенности
распознавания ими антигена и его связь с молекулами МНС. Кроме
того, потерпели неудачу попытки выделить и охарактеризовать анти-
2.3. Изменения в иммунной системе при иммунном ответе и после... 73[’енспецифические гуморальные супрессорные факторы: все полу-
менные в этой области данные оказались артефактами. Детальное
исследование проблемы Т-клеточной супрессии, предпринятое в
последние годы, привело к обнаружению Т-регуляторных клеток с
[выраженной супрессорной активностью. К категории супрессирую-
щих Т-лимфоцитов относят клетки с маркерами CD4^CD25+, РохРЗ и
CD8^CD28“. Помимо этого, по-видимому, Т-клетки, как и макрофа¬
ги, генерируют неспецифические супрессорные системы, направлен-
н ые на ограничение и прекращение иммунного ответа.Особая разновидность супрессорных клеток — В-лимфоцитов
была описана сотрудниками Института иммунологии (Петров Р.В.
и др. [1211; Хаитов P.M. [169]; Petrov R.V., Khaitov R.M. [675]; Petrov R.V.
et al, [679]). Активация этих клеток предотвращает реализацию
эффекторного потенциала клеток иммунной системы, локализую¬
щихся в костном мозгу, что могло бы препятствовать осуществле¬
нию основной функции костного мозга, связанной с гемопоэзом.
Современные представления о В-клеточной супрессии даны в работе
RM. Хаитова [173].В конечном счете при успешной элиминации антигена и несущих
его агентов иммунная система возвращается к состоянию, во многом
напоминающему исходное. Однако в ней появ.дяются некоторые новые
и весьма существенные черты, из которых самое важное — присутствие
клеток памяти. Значимость иммунологической памяти обусловлена
тем, что она обеспечивает более быструю и эффективную защиту при
повторном поступлении чужеродного агента. Это очень важно, если
учесть, что позвоночные (которые располагают иммунной системой в
рассматриваемом виде) существуют в конкретной экологической среде
и вероятность повторного контакта (в том числе в форме агрессии) с
окружающими патогенами реальна и достаточно высока.Развитие иммунологической памяти реализуется путем диффе¬
ренцировки в процессе иммунного ответа клеток памяти (рис, 12).
Они могут относиться к классам В и Т [764], Развитие клеток памяти
происходит параллельно дифференцировке эффекторных клеток из
тех же клеток-предщественников. Это происходит при первичном
иммунном ответе, хотя в его реализации клетки памяти не участвуют.
В настоящее время принято считать, что В-кдетки памяти представ¬
ляют особую линию дифференцировки В-лимфоцитов, тогда как
Т-клетки памяти — обычные эффекторные клетки, которые приобре¬
ли способность к продолжительному выживанию (развитие апоптоза
74Глава 2. Структура и функции иммунной системыВ-клеткиТ-клетт►АнтителаРис. 12, Образование В- и Т-клеток памяти (пояснения в тексте)в них подавлено высокой экспрессией ингибирующих его молекул
Вс1-2 и Bc1-Xl).Морфологически клетки памяти не отличаются от «наивных»
малых лимфоцитов [874]. В-клетки памяти несут рецепторные имму¬
ноглобулины классов IgG или IgA (а не IgM и IgD, как наивные
В-лимфоциты). Их F-гены содержат «следы» активного мутационного
процесса, совершавщегося в зародышевых центрах, Т-клеткам памяти
присущи некоторые особенности экспрессии молекул адгезии; на них
содержится мало молекул L-селектина и много молекул CD44. Это
благоприятствует активной рециркуляции и несколько видоизменяет
специфичность хоминга; клетки памяти в большей степени способны
возвращаться именно в те лимфоидные структуры, где они сфор¬
мировались. Функциональный смысл другой особенности Т-клеток
памяти пока непонятен: если на поверхности «наивных» Т-клеток
представлена наиболее полная по протяженности форма молекулы
тирозинфосфатазы CD45 (CD45RA), то на Т-клетках памяти содер¬
жится ее «усеченный» вариант (CD45RO).Очевидно, что каждый клон лимфоцитов, контактировавших с
антигеном, содержит больше клеток, чем аналогичные клоны «наив¬
ных» лимфоцитов, и это создает благоприятную «стартовую пози¬
цию», способствует более быстрому развитию ответа при вторичном
контакте с антигеном. Рецепторы В-клеток памяти обладают более
высоким сродством к антигену, так как эти клетки прошли процесс
селекции в зародышевых центрах [764]. В то же время молекулярные
2.3. Изменения в иммунной системе при иммунном ответе и после... 75основы повышенной эффективности ответа клеток памяти выяснены
отнюдь не до конца.С учетом изменений, вносимых в лимфоидные популяции пред¬
шествующим иммунным ответом, можно заключить, что структура
иммунной системы по мере «накопления опыта» отражения био¬
логической агрессии с возрастом должна изменяться и постепен¬
но отклоняться от структуры иммунной системы новорожденных.
Действительно, популяция лимфоцитов взрослого человека содер¬
жит 40—50% клеток, ранее контактировавщих с антигеном (в случае
Н-клеток это определяется путем учета последствий переключения
С-генов и мутаций 1^-генов иммуноглобулинов, в случае Т-клеток —
но экспрессии антигенов С045К0 и С044) [764, 874].Напомним, что две составляющие реальной лимфоидной попу¬
ляции — «наивные» клетки и клетки памяти — отличаются сроком
жизни и интенсивностью рециркуляции (и то и другое выше у кле-
гок памяти), кроме того, клетки памяти склонны мигрировать в те
органы и ткани, где они впервые контактировали с антигеном, тогда
как миграция «наивных» лимфоцитов ограничивается лишь общими
«правилами хоминга» без конкретизации относительно определен¬
ных органов. Еще более существенно, что эти клетки отличаются
также спектром антигенраспознающих рецепторов и, следовательно,
клональной структурой лимфоидных популяций. Этот спектр ^е у
клеток памяти, и их клонотип ограничивается клонами, распозна¬
ющими те антигены, которые несут патогены, ранее проникавшие
(в том числе повторно) в организм хозяина. Поскольку эти патогены
постоянно присутствуют в среде обитания, клетки памяти, специ-
([)ичные к их антигенам, возникают уже в первые годы жизни. Так
формируется двойственность клональной структуры лимфоидных
популяций, с одной стороны, сохраняется огромный набор клонов
лимфоцитов, специфичных ко всем мыслимым антигенным эпито¬
пам, включая те, которые отсутствуют в природе, с другой стороны,
создается более узкая, но и более значимая для реального существо¬
вания в конкретной среде обитания «библиотека» клонов, которая
отбирается, умножается и совершенствуется (в результате повышения
сродства рецепторов вследствие мутаций К-генов в В-клетках) под
влиянием контактов организма с окружающими патогенами. Именноэ гот узкий набор клонов актуален с точки зрения защиты от внешней
агрессии. Однако обойтись без широкого спектра «абстрактных»
специфичностей, рассчитанных на непредсказуемые ситуации, не
76Глава 2. Структура и функции иммунной системыудается. Вероятно, к таким ситуациям может быть отнесена защита от
внутренней агрессии, связанной с зарождением опухолевых клеток,
антигены которых предсказуемы в меньщей степени, чем антигены
внешних патогенов.Рассматриваемые два набора клонов отличаются также по темпу и
механизму обновления. «Наивные» лимфоциты дифференцируются
из костномозговых предшественников и проходят весь положенный
путь дифференцировки (в случае ар-Т-клеток — включая развитие и
селекцию в тимусе) [698, 707, 827]. Клетки памяти, с одной стороны,
живут дольше, с другой стороны, приобретают определенную авто¬
номность, обусловленную способностью к самоподдержанию. Эта
способность реализуется, как полагают, при условии персистенции в
организме соответствующих антигенов (будучи перенесены в другой
организм, не контактировавший с соответствующим антигеном, эти
клетки быстро исчезают). Считается, что местом хранения антигена
служат отростки дендритных клеток зародышевых центров. В таких
условиях продолжительность жизни Т-клеток памяти оказывается
сопоставимой со сроком жизни организма, а их размножение стано¬
вится независимым от тимуса [503, 703], Постепенное освобождение
популяции Т-клеток из-под зависимости от тимуса не менее характер¬
но для взрослеющего организма, чем формирование «двойственного»
клонотипа лимфоидных популяций, и отражает возрастающую роль
«актуальных» клонов, представленных клетками памяти. Ответом
на эту ситуацию является возрастная атрофия тимуса [401]. Однако,
поскольку гуморальные факторы тимуса необходимы для поддержа¬
ния функционального тонуса Т-клеток, далеко зашедшая атрофия
приводит к постепенному ослаблению функциональной активности
Т-клеточной популяции, что служит проявлением старения иммун¬
ной системы.Таким образом, структура иммунной системы в течение индиви¬
дуальной жизни организма претерпевает определенные изменения,
связанные с действием факторов среды в форме антигенных атак со
стороны окружающих патогенов. При этом происходит «актуализа¬
ция» структуры иммунной системы за счет формирования клонов
клеток памяти из лимфоцитов, распознающих антигены, регулярно
попадающие в организм, а также ослабляется зависимость иммунной
системы от тимуса.
Глава 3ГЕНЫ ИММУННОГО ОТВЕТА3.1. СТРОЕНИЕ ГЛАВНОГО КОМПЛЕКСА
ГИСТОСОВМЕСТИМОСТИ (МНС)Анализ физиологической роли иммунного ответа свидетельствует0 том, что его регуляция является одной из основных функций орга¬
низма. Эта функция принадлежит генам главного комплекса гисто-
совместимости — МНС (от Major Histocompatibility Complex). При этом
следует принять во внимание, что само это название отражает скорее
историю открытия данной генетической системы, чем ее основную
функцию. Дело в том, что история открытия первых продуктов генов
главного комплекса гистосовместимости, называемых у человека
антигенами HLA (от Human Leucocyte Antigens), связана именно с
1юявлением и развитием трансплантационной иммунологии, когда
возникла необходимость подбора тканесовместимых пар донора и
реципиента [207]. Сегодня же мы знаем, что роль системы МНС в
отторжении трансплантата является лишь одной из частных физио¬
логических функций этой системы.По современным представлениям система HLA, обеспечивая регу¬
ляцию иммунного ответа, осуществляет такие важнейщие физиоло¬
гические функции, как взаимодействие всех иммунокомпетентньтх
клеток организма, распознавание своих и чужеродных, в том числе
измененных собственных клеток, запуск и реализацию иммунною
ответа, обеспечение временной толерантности организма матери к1 каненесовместимому плоду в период его вынашивания, и в целом,
обеспечивает выживание человека как вида в условиях экзогенной и
эндогенной агрессии [272].Основные функции системы МНС перечислены в таблице 6. Все
многообразие указанных функций обеспечивается строением главно¬
го комплекса гистосовместимости. Данные в таблице представленияо физиологических функциях системы HLA свидетельствуют о том,
что именно эта система осуществляет регуляцию функций иммун¬
ной системы человека, В 1980-х годах даже дискутировался вопрос о
переименовании системы HLA в главный комплекс генов иммунного
78Глава 3. Гены иммунного ответаответа человека, но учитывая то, что старое историческое название
давно укоренилось среди исследователей, решено было не менять его.Основные физиологические функции системы HLAТаблица 61. Обеспечение взаимодействия клеток организма.2. Распознавание собственных, чужеродных и собственных измененных
клеток, запуск и реализация иммунного ответа против носителей гене¬
тической чужеродности (антигены клеток, вирусов и пр.).3. Обеспечение позитивной и негативной селекции Т-клеточных клонов.4. Обеспечение процессинга и представления иммунодоминаптных пепти¬
дов — индукторов и мишеней иммунного ответа.5. Обеспечение генетического разнообразия и выживаемости человека как
вида в условиях экзогенной и эндогенной агрессии.Система HLA, открытая более чем 40 лет назад, по-прежнему оста¬
ется одной из самых сложных, наиболее хорошо изученных и вместе с
тем загадочных генетических структур в геноме человека. Так, если еще
в 1987 г. расстояние между его условными границами оценивалось в
2000 кЬ, то на сегодняшний день оно расширено более чем в 2 раза,
причем протяженность отдельных его элементов — генных кластеров —
колеблется в широких пределах в зависимости от HLA-гаплотипа [760].Современная карта главного комплекса гистосовместимости чело¬
века представлена на рисунке 13. Следует отметить, что все гены HLA
локализованы в коротком плече хромосомы 6 и разделяются на три
группы, экспрессирующие охарактеризованные гены, псевдогены
и гены с неустановленной функцией. На основании исследования
главных комплексов гистосовместимости различных видов высших
организмов был сделан вывод о том, что этот генный комплекс рас¬
ширялся за счет дупликации, что в свою очередь давало определен¬
ные преимущества организмам с более полиморфной системой HLA
в процессе эволюции. Однако вопрос о том, какие причины привели
к подавлению экспрессии ранее функционировавших генов в составе
МНС, остается открытым (271, 508].Представления о строении системы HLA развивались и развива¬
ются в течение всего периода ее изучения, однако, как указывалось
выше, за последние годы произошел качественный скачок в развитии
этой проблемы. Раньше, когда основным объектом исследования
могли служить только белки — антигены HLA, представления о
■и. Строение главного комплекса ^истос„емес,пи.„г„.. (ШС)79Область генов класса ItDPB1 DMADPA2DPB2\\\LMf>7DOADPA1 ^DMB 75глГ''tr-rIIIIOIIilQII—P_300—r~400~T~500~T~600DRA'T-700~T—800~~r^9001000C4^ C4AФАКТОР8
C21400“1 1500Обяаапь генов macea щHSP^70III OilI160017001800MICBMICA/~T—
19002000I—p_
2100~~T~220028002900Область генов к/юсса i•í A3300woo—3500360037003800Рие. 13. C««a системы HLA, пояснен«, в тексте. Шкала - в kbкомплексе генов HLA могли (Ьопмип^^KocReHHT^TY лnмттмv Т>1.тт ^^Р^ироваться в основном на анализекосвенных данных, включают л X ттт *1.ИИХ, семейном анализе, в реакциях HLA-антигенов в популя-ш.тигены, ИТ.Д. Теперь, благодаря “™РЬ«б“ли HLA-молекулярной иммунологии, по^илГ"“ "шлпы'гг. ‘^^^явилась возможность не только про¬водить тонкии анализ антигенов Hi л ui аио и изучить сами гены HLA-1;СООеННЫИ прогресс в этом наппат^гт^^ти ^‘^правлении произошел после открытияи внедрения в исследования систем^.! UT Апой реакции (ПЦР), тюзволяющего “^''^исследований участки ДНК, чтТв» в свою очередь открывало широкие
80Глава 3. Гены иммунного ответавозможности для быстрого и точного анализа молекулярного поли¬
морфизма системы HLA [605].Внедрение в исследования системы HLA молекул я рно-генетиче¬
ских методов не только позволило конкретизировать представления о
системе HLA, но и значительно расширило представления о ее поли-
морфизме, при этом были открыты многие новые аллели классов Т,
И и III, а общее количество только известных специфичностей HLA
классов 1 и II увеличилось более чем в 10 раз.Как следует из рисунка 14, молекулы HLA класса I состоят из
полиморфной а-цепи с молекулярной массой приблизительно 45 кД
и неполиморфной ~ Эг'Микроглобулина с молекулярноймассой П,5 кД, кодируемой геном, локализованным в хромосоме
15 [842]. Гликозилированная а-цепь состоит из трех экстрацеллюляр-
ных доменов (а,, аз, и аз), трансмембранного домена и интрацеллю-
лярного якоря (см. рис. 14 ~ верхняя половина). Экзон-интронная
структура генов класса I в общем отражает деление на функциональ¬
ные домены (см. рис. 14 — нижняя половина). Как правило, гены HLA
класса I состоят из восьми экзонов общей протяженностью 3,5 кЬ.
Основной полиморфизм локализован в доменах а, и кодируемых
экзонами 2 и 3. Пространственная структура антигенов HLA класса I
была определена на примере антигена HLA-A2 [266, 267], Для этих
целей использовали растворимый антиген HLA-A2, полученный
отщеплением с помощью пап айна надмембранного участка молеку¬
лы. Проведенный рентгеноструктурный анализ позволил построить
пространственную модель антигена с точностью 0,26 нм. Было уста¬
новлено, что антиген HLA-A2 состоит из двух наборов структурно
гомологичных доменов: один набор образуется за счет аз- и ра-т-доме-
нов, расположенных по соседству с мембраной; другой набор форми¬
руется аг и «2-доменами, расположенными в отдалении от поверхнос¬
ти клетки. Общий вид молекулы представлен на рисунке \5, а, 6.Как видно из рисунка 15, аз- и рз-т^-домены имеют структуру
р-складчатого листа и, таким образом, напоминают констант!1Ый
участок иммуноглобулина, ]Иолекула образуется за счет двух анти-
параллельных р-складок, соединенных внутренним дисульфидным
мостиком. Одна складка состоит из четырех, а вторая — из трех р-по¬
следов ательностей. Общая укладка а,- и aj-доменов не имеет ничего
общего с константными и вариабельными участками иммуноглобу¬
линов, хотя а2-домен и содержит дисульфидную связь, напоминаю¬
щую связь подобного рода в иммуноглобулиновых доменах. Между
//./. Строение главного комплекса гистосовместимости (МИС)SJКлассКласс}}Рис. 14. Взаимосвязь белковой и генной организации .молекул HLA классов
I и U;Показана экзон/иитронная организация а-цепи антигенов HLA класса I, а- и
^-цепей антигенов HLA класса Л и полипептидные домены молекул Н1А, которые
они кодируют. L — лидериый пептид; ТЫ — трансмембраниый регион; Cyt — внут¬
риклеточный регион; 3’UT —3’ — нетранслируемыйрегионР2-П1 и а,- и аг'Доменами наблюдают более плотный контакт, чем
между а,- и аг и наиболее близким к поверхности клетки а^-доме-
иом. Таким образом, {Зз-т как бы поддерживает пространственно
ориентированные аг и аг-домены. Кроме того, рз-т-домен является
стержневым для укладки аз-домена. Наибольший интерес представ¬
ляет, безусловно, организация а, - и а^-доменов, поскольку именно эта
часть молекулы ответственна за НЬА-рестриктированное распозна¬
вание антигенов Т“Клеточными рецепторами [397, 570]. Несмотря на
то что гомология между такими доменами мекее выражена, они имеют
общую структурную организацию и происхождение, поскольку по¬
явились вследствие дупликации генов.
82Глава 3. Гены иммунного ответаРис. 15. Пространственное строение антигена Н1А-А2 класса Т по данным
рентгеноструктурного анализа:а — вид сбоку; б — вид сверху. Стрелками изображены участки антипараллелыюй
^-структуры, спиралями — а-спиральные фрагменты
3.1. Строение главного комплекса гистосовместимости (МНС) 83Каждый из доменов состоит из антипаралдельных р-тяжей, сфор¬
мированных четырьмя фрагментами молекулы, дающими в итоге
N-концевую часть каждого из доменов. Далее у каждого из доменов
имеется С-концевой а-спиральный район. При объединении доменов
(1)ормируется «платформа» из р-тяжей двух доменов. а-Спирали рас¬
полагаются по бокам этой сформированной «платформы» под углом
40° к ее оси, т.е. ар и аз-домены образуют желоб или «корзину», дно
которой образовано Р-структурой, а боковые части» а-спиралями.
Данный регион по размеру приблизительно составляет 0,25 0,1-0,11 нм
и может связывать пептиды длиной 9-11 аминокислот. Спиральные
участки аг и о^-доменов состоят из двух а-спиралей. Первая спираль
«I-домена является более короткой (1,5 оборота, аминокислотных
остатков 50—55), за которой следует более длинная вторая а-спи-
раль (7,5-8 оборотов, аминокислотных остатков 57—85); угол между
и ими 110°. Спиральный район а2-домена также начинается с короткой
(х-спиральной последовательности (около трех оборотов, аминокис¬
лотных остатков 138—148), затем следует длинная спираль (аминокис¬
лотных остатков 150—175); угол между ними 130“. Глубокий «желоб»
между а-спиралями а,- и аг-доменов является антигенсвязывающим
участком. На дне его имеются углубления — «карманы», принимаю¬
щие непосредственное участие в связывании пептидов. Размер всей
молекулы составляет 0,7 нм в длину, а ее экстрацеллюлярная часть —
от 0,4 до 0,5 нм в поперечнике [760].Вслед за кристаллографическим анализом антигена НЬА-А2 был
выполнен анализ антигенов класса 1, кодируемых аллельными вари¬
антами НЬА-А*0201, НЬА-А*6801 и НЬА-В*2705 [397, 570].Сравнительный анализ пространственной структуры этих антиге¬
нов выявил их принципиальную близость. В то же время оказалось,
что аминокислотные остатки а^ и аз-доменов варьируют между
аллельными вариантами молекул НЬА класса Т. Так, при сравнении
трех молекул Н1А-А*0201, НЬА-А*6801 и НТА-В*2705 было установле¬
но, что различие между ними касается 11 аминокислот, находящихся
в антигенсвязывающей бороздке. Эти различия при кристаллографи¬
ческом анализе, в свою очередь, меняют очертания карманов анти-
генсвязывающего сайта [397, 570]. Как указывалось, размер желоба
гаков, что в нем может разместиться пептид, состоящий из 9—11 ами¬
нокислотных остатков. При этом концы желоба у антигенов гистосов¬
местимости класса I закрыты в результате взаимодействия боковых
цепей аминокислотных остатков а-спиральных участков и крайних
84Глава 3. Гены иммунного ответар-тяжей. Подобная рельефная структура пептидсвязывающего участ¬
ка антит енов гистосовмсстимости, отличающая их от более плоского
антигенсвязываюшего центра антител, не позволяет образовывать
комплексы с нативными белками.Исследование структуры пептидов, способных взаимодействовать
с определенным аллельным вариантом антигена гистосовместимос¬
ти, позволило установить, что они имеют общие структурные черты,
а именно наличие 2—3 консервативных аминокислотных остатков,
расположенных в определенных положениях пептида. Боковые цепи
этих аминокислот располагаются в карманах дна корзины, обеспе¬
чивая достаточно прочное связываЕше пептида. Как правило, пара
карманов находится на участках, где располагаются N- и С-концевые
фрагменты пептида, в то время как его центральная часть располага¬
ется свободно, что позволяет размещаться в щели пептидам разного
размера и различной структуры. Профиль и характер (ионный, гид¬
рофильный, гидрофобный) карманов варьируют от аллеля к аллелю,
что обеспечивает разнообразие специфичностей антигенов гистосов¬
местимости [760].По данным рентгеноструктурного анализа [286], пространствен¬
ная структура пептидсвязывающего участка антигена HLA класса П
(HLA-DR1) имеет те же главные черты, что и антигенов HLA-A, -В.
Молекулы HLA класса II (см. рис. 14 — верхняя половина) состоят
из тяжелой а- и легкой р-цепи с приблизительной молекулярной
массой 33—35 и 29 кД соответственно. Обе цепи имеют два экстра-
целлюлярных домена (а,, аз и p¡, рз), трансмембранный регион и
интрацеллюлярньтй якорь (см. рис. 14). N-концевые а,- и р,-домены
вместе образуют антигенсвязывающую бороздку молекул класса II.
Трехмерная структура молекул HLA класса ТТ имеет выраженное
сходство с молекулами класса 1 [266, 809); это относится, в частности,
и к антигенсвязывающей бороздке, которая также состоит из восьми¬
полосного р-складчатого листочка и двух а-спиралей.В отличие от молекул HLA класса I антигенсвязывающая бороздка
молекул HLA класса И «открыта» с двух сторон, поэтому она может
связывать более длинные фрагменты белков (15-30 аминокислот).
При этом они могут выступать за пределы антигенсвязывающей
бороздки (см. ниже). Ген а-цепи класса TI состоит из пяти экзонов.
Ген р-цепи несет добавочный экзон, кодирующий последователь¬
ности цитоплазматического домена. Наибольшим полиморфизмом
отличаются N-концевые а,- и ррдомены, кодируемые экзоном 2.
J,/. Строение главного комплекса гистосовместимости (МНС) 85ilpM этом связывающие сайты а^-димеров имеют противоположную
направленность.Размер пептидов, элюированных с антигенов гисто совмести мости
класса ТТ, достигал 30 аминокислотных остатков. Пептид располага¬
ется в желобе в вытянутом положении [760].Модель комплекса, образуемого пептидами с антигенами HLA,
основана на представлении о том, что вариабельные аминокислотные
остатки антигена, расположенные внутри желоба, ответственны за
связывание с пептидами, а аминокислотные остатки, локализованные
на находящихся внутри желоба участках а-спиралей или на их наруж¬
ной поверхности, взаимодействуют с Т-клеточным рецептором.Структурные исследования комплексов пептид—молекула HLA
показывают, что один и тот же аллельный вариант антигена HLA
может связывать иелый ряд пептидов, обладающих общими структур¬
ными чертами (якорными аминокислотными остатками). Благодаря
этому антигены, кодируемые различными аллелями HLA класса I и П,
могут связывать тысячи различных пептидов [448]. При этом еще раз
следует напомнить, что антигены HLA, серологически выявляемые
как один антиген, но включающие в свой состав различные аллельные
варианты, характеризуются различающимся профилем связи с этими
пептидами. Понимание этого принципиально важно. Поскольку
речь идет о белковых молекулах HLA, осуществляющих презентацию
тех или иных пептидов, то только на основании геномного анализа
(HLA-генотипироБания) можно прогнозировать какие пептиды и
как будут представлены соответствующими структурами комплекса
HLA [660]. Таким образом, различия, выявляемые на аллельном уров¬
не, реализуются в возможности связывания конкретных пептидов
внутри пептидсвязывающей бороздки [712]. Следует также отметить,
что имеется достаточно выраженный межаллельный полиморфизм
в отношении связывания и презентации не только чужеродных, но
и собственных пептидов — компонентов молекул HLA. Последняя
функция, физиологическая роль которой, по-видимому, состоит в
распознавании «свое—чужое», может также реализоваться и в пато¬
логическом процессе в случае нарушения количественного уровня
представляемых аутопептидов, что имеет место, например, при раз¬
витии аутоиммунных заболеваний [371, 448, 517]. Говоря о разнооб¬
разии в связывании и представлении пептидов, которое обеспечивает
аллельный полиморфизм системы HLA, следует также отметить, что
не все молекулы HLA, различающиеся по кодирующему их аллель¬
86Глава 3. Гены иммунного ответаному варианту, имеют равные количества лигандов, принимающих
участие в связывании тех или иных пептидов, а следовательно, и рав¬
ные возможности такого связывания. Так, например, одна лишь спе¬
цифичность — молекула HLA-A2, кодируемая аллельным вариантом
HLA-A*0201, имеет 258 уже охарактеризованных лигандов, в то время
как для Vj молекул HLA-A (учитывая все их аллельные варианты) эта
цифра не превышает 10 [731].Такого рода различия не могут не сказаться на определенных
физиологических преимуществах или, напротив, «изъянах» как в
обеспечении развития специфического противовирусного иммуни¬
тета, так и в выявлении злокачественно трансформированных кле¬
ток и, соответственно, в предотвращении развития онкологических
заболеваний [403]. Таким образом, наличие в HLA-генотипе челове¬
ка определенных аллельных вариантов тех или иных молекул HLA
оказывает значительное влияние на реализацию иммунного ответа
против факторов, существенным образом влияющих на выживание
данного индивида. Не случаен поэтому тот факт, что HLA-A*0201
является одним из высокочастотных аллельных вариантов, во всяком
случае, в большинстве европеоидных популяций. Этот факт является
еще одним проявлением физиологической роли системы HLA в обес¬
печении выживаемости человека как биологического вида.Анализ показывает, что отдельно взятая молекула антигена гис¬
тосовместимости способна связывать ограниченный круг пептидов.
Поэтому, для того чтобы отдельные чужеродные белки не могли избе¬
жать иммунологического распознавания, необходимо присутствие на
клеточной мембране целого набора антигенов гистосовместимости,
включающих в гетерозиготном состоянии по два антигена каждого из
локусов системы HLA.Скорость связывания пептида с молекулами HLA для живых кле¬
ток достаточно высока. Так, равновесие в связывании достигается уже
через 60 мин [301]. Как указывалось выше, некоторые пептиды могут
представляться различными антигенами гистосовместимости класса
И, но в то же время Б некоторых случаях Т-клеточный рецептор не
способен распознать пептид, представляемый конкретными антиге¬
нами класса И [702], результатом чего и является ассоциированная с
конкретным HLA-аллелем «неотвечаемость» организма на какой-то
конкретный агент.Следует также отметить, что подобная ситуация известна для анти¬
генов HLA класса 1, когда среди HLA-аллелей класса I (локусы А и В),
3.2. Гены главного комплекса гистосовместимости человека... 87представляющих пептиды вируса гриппа, были выявлены аллельные
варианты, при которых не происходило Т-клеточного распознавания
в HLA-рестриктированном ответе [ЗП].На сегоднящний день анализ HLA-генотипов на уровне установле¬
ния аллельного полиморфизма в сопоставлении с данными об имму-
ногенных эпитопах тех или иных возбудителей заболеваний позволяет
не только объяснить факты резистентности отдельных индивидов к
тем или иным инфекциям [297, 438], но и предсказать, каким образом
та или иная вакцина, и в первую очередь построенная на пептидной
основе, будет «работать» среди представителей той или иной этни¬
ческой группы в зависимости от HLA-профиля последней (687, 756].
Естественно, что необходимым компонентом для реализации указан¬
ного достижения молекулярной генетики является необходимость зна¬
ния HLA-профиля этнических групп, населяющих ту или иную страну
или регион. Это особенно важно для такой многонациональной стра¬
ны, как Россия, в которой HLA-профиль населяющих ее этнических
групп, как показано нашими данным (см. ниже), весьма различен.Таким образом, следует еще раз подчеркнуть, что выполнению
всего многообразия физиологических функций системы HLA спо¬
собствует ее крайне выраженный полиморфизм, который определяет¬
ся как наличием различных классов антигенов HLA, так и достаточно
сложной их организацией. Этому же способствует кодоминантный
тип наследования HLA-антигенов, при котором каждый человек
получает по половине своего HLA-генотипа от каждого из родителей,
т.е. из каждого локуса, кодирующего два антигена, один наследует от
отца и один от матери.3.2. ГЕНЫ ГЛАВНОГО КОМПЛЕКСА
ГИСТОСОВМЕСТИМОСТИ ЧЕЛОВЕКА (HLA)
И ИХ ПРОДУКТЫГены HLA класса 1, которые иногда по традиции называют генами,
кодирующими трансплантационные антигены, первоначально были
подразделены на три локуса, называемые А, В и С. Однако сегодня
кроме генов этих локусов в класс I системы HLA включаются еще
18 генов, 11 из которых являются псевдогенами, а 7 ассоциированы с
продуктами транскрипции [610, 760].
88Глава 3. ГеныРасположение генов А, ВиС на хромосоме следующее: ^
центромере локус HLA-B, на 0,2 сМ [1 сМ соответствует Мопаросно-
ваний (и.о.) ДНК] в сторону теломеры расположен локус HLA-C^ на
0,8 сМ в сторону теломеры расположен локус HLA-A [508],
кластера генов HLAкласса I является ген, относящийся кклассуНЬ ""
С2, расстояние до которого от HLA-B составляет 0,6510 п,о Всего же
размер кластера генов HLA класса Í составляет 1,4-Ш п.о.Организация генов HLA класса Т имеет высокую степень гомоло¬
гии. В них содержится восемь экзонов (см. рис. 14). Экзон
сигнальную последовательность; 2, 3, 4 ~ домены а,, Oj и
ственно, молекулы HLA, Экзон 5 кодирует трансмембранный
цепи, цитоплазматический участок кодируют экзоны 6 и I
нетранслируемый участок кодирует экзон 8 (3’UT).Межэкзонные различия между генами локусов А, В и С состоят в
том, что гены HLA-A и -В содержат втрое больше нуклеотидов®
экзоне 5 по сравнению с генами локуса HLA-C.В дополнение к «классическим» локусам HLA-A, -В и -Скк.#У ^
относятся также гены локусов HLA-E, -F, -G (см. рис. 13).
са Е локализованы между локусами HLA-C и -J, а кодируемые
антигены экспрессируются на покоящихся (зрелых) периферичг^*^^’’^
Т-лимфоцитах и клетках карциномы человека [508]. ГенылокТ^®
HLA-F и -G картированы в сторону от теломеры на расстоянии SO
[508] (см. рис. 13).Благодаря использованию метода ДНК-генотипированияспрИ'
менением сиквенс-специфических олигонуклеотидов в 1994 г при
сиквенсе ДНК генов HLA-E установлено пять аллельных вариант®’
хотя соответствующие белки еще не выявлены [270]. Антигены,к®®'
руемые генами локуса HLA-F, также еще не установлены.Антигены, кодируемые локусом HLA-G, экспрессированы*^^
клетках линии хориокарциномы, а также на мембране кдетокПР^^
хроническом цитотрофобластозе [363]. Как будет показано
физиологическая функция связана с репродукцией.Методом PCR-RFLP был установлен аллельный полимор#^^
генов HLA-G в экзонах 2 и 3 [652]. Всего к настоящему времени^г^'
новлено 14 аллельных вариантов HLA-G.Несколько новых генов с необычной периодической структурой)
оказавшихся псевдогенами, идентифицированы на расстоянии
от локуса HLA-A в центромерном направлении. В этом же субрегион^
комплекса HLA идентифицирован экспрессирующий ген, обишчен-
:L2. Гены главного комплекса гистосовместимости человека... 89||Ь[й как CD12 (на рис. 13 не указан) и расположенный на расстоянии
SO kb от гена HLA-A. Кодируемый им белок по своей структуре отли¬
чается от классических антигенов класса Г [339J.К антигенам HLA класса I относятся также гены локуса MIC {MICA
и MICB) [509]. Аббревиатура генов MIC происходит от МНС class 1
chain-related genes. Эти гены локализуются на хромосоме 6 в непо¬
средственной близости от локуса HLA-B [455]. Молекула MÍCA состоит
из 383 аминокислотных остатков и имеет молекулярную массу 43 кД.
Антигены локуса MIC обладают способностью связывать пептиды и
другие короткие лиганды. При нуклеотидном сиквенсе установлено
17 аллельных вариантов генов MICA и MICE [509], в геноме MICA обна¬
ружено 5 различных аллельных вариантов, полиморфных по микро-
сателлитным участкам [610]. Установлена взаимосвязь между микро-
сателлитным полиморфизмом гена MICA и болезнью Бехчста. Данная
ассоциация оказалась более выраженной, чем известные ранее ассо¬
циации болезни Бехчета с классическими HLA-антигенами.В последнее время обнаружено, что антигены MICA участвуют
в активации взаимодействия молекулы TCR МНС в развитии опо¬
средованной Т-лимфоцитами цитотоксичности и активности ЕКК,
тем самым, в частности, играя роль в обеспечении противоракового
иммунитета [245]. Таким образом, по-видимому, антигены MIC по
своей физиологической значимости приближаются к таковой, уста¬
новленной для классических антигенов HLA класса Т.Молекулярно-генетический анализ позволяет разделить регион
HLA класса II на отдельные локусы (см. рис. L3). Внутри локуса HLA-
DR локализуются относительно неполиморфный ген а-цепи — DRÁ
(два аллельных варианта) и несколько генов р-цепи — DRB1—DRB4. Из
данных генов р-цепи экспрессируются -DRBI, -DRB3, -DRB4 и -DRB5.
Показано, что количество генов -DRB на данной хромосоме зависит от
DR-специфичности гаплотипа.Внутри регионов HLA-DQ и -DP кодируются два гена а- и два гена
р-цепи. Однако экспрессированы только гены -DQA1, -DQBI и -DPA1,
-DPBLСледует отметить, что каждая HLA-молекула несет только одну
антигенсвязывающую бороздку, которая тем не менее должна обеспе¬
чить представление всего разнообразия пептидов. Это обеспечивается
за счет экстремально высокого уровня HLA-аллельного полиморфиз¬
ма. Помимо этого, двум из локусов HLA класса II — HLA-DQ и HLA-
DP — присуща еще одна особенность: продукты этих генов имеют
90Глава 3. Гены иммунного ответаразличные функционально активные молекулы, в зависимости от
CIS- и trans-положения при ассоциации а- и (3-цепей.Для идентификации аллельных вариантов генов HLA Номен¬
клатурный комитет ВОЗ ввел новую официальную номенклатуру,
отличную от таковой, ранее существовавшей для идентифика¬
ции антигенов HLA [270]. Естественно, что количество аллельных
вариантов генов HLA значительно превосходит количество ранее
известных соответствующих антигенов HLA. Более того, в отноше¬
нии ряда HLA-локусов обнаружены не только количественные, но и
качественные отличия, поскольку серологическими или клеточно¬
опосредованными методами продукты ряда генов таких локусов не
выявляются.Для сопоставления возможностей выявления HLA-специфич¬
ностей на уровне антигенов с таковыми на молекулярно-генети¬
ческом уровне приведена таблица 7. Из этой таблицы следует, что
молекулярно-генетическое HLA-генотипирование не только поз¬
воляет идентифицировать почти на порядок большее количество
HLA-специфичностей, по сравнению с серологическими и клеточно¬
опосредованными методами, но и идентифицировать новые гены как
в классе I, так и в классе Н. Помимо этого, в классе П в локусах HLA-
DQ и -DP идентифицируются аллельные варианты, определяемые
полиморфизмом отдельных цепей, например -DQA1 и -DQB1.Полиморфизм отдельных генов HLA различен. Так, гены локуса
DR включают только один низкополиморфный регион, кодирующий
а-цепь. Более того, для гена HLA-DRA установлены только два его
аллельных варианта [368]. Напротив, в высокополиморфном регионе
HLA-B полиморфизм проявляется на уровне как экспрессирующих
генов, так и псевдогенов. Наиболее полиморфным из генов HLA-DRB
является ген HLA-DRB1, насчитывающий к настоящему времени более
300 аллельных вариантов.Локус DQ комплекса HLA класса II содержит по две пары генов А
и В (см. рис. 13), однако, хотя гены -Z>(3<42 и -Z)Q52 транскрибированы,
их белковые продукты еще не установлены, и поэтому в настоящее
время принято считать, что единственными экспрессирующими
генами локуса DQ являются -AJ и ~В1. При этом в отличие от локуса
DR полиморфизм локуса DQ связан с генами как HLA-DQA, так и HLA-
DQB. Полиморфизм локуса DQ в значительной степени связан с поли¬
морфизмом генов -DRB, причем эта связь значительно более выражена
для генов -DQA по сравнению с генами -DQB.
3.2. Гены главного комплекса гистосовместимости человека...91Два уровня выявления HLA-лолиморфизмаТаблица 7Максимальное (ХИ11HWC 2004 ) количество специфичностей,
выявляемых при НЬЛ-типироваиииКласс IКласс П2861102413830956316715563698127 5720 1081828Примечание.I — Белковый (серотипирование, клеточно-опосредован нос тииирование).II — Молекулярно-генетическое ДНК-генотипирование.Третьим ИЗ «хорошо изученных» локусов HLA класса П является
регион DP, в котором экспрессирующими являются также два гена
-DFA1 и -DPB1, в то время как гены -DPA2 и -DPB2 являются псевдо¬
генами [750]. Исследования сиквенса генов -DPA позволили устано¬
вить к 1989 г. наличие 8 аллелей, в регионе -DPB1 было установлено
38 аллелей. Следует отметить, что для антигенов локуса HLA-DP уста¬
новлен значительно более низкий уровень полиморфизма (на уровне
аминокислотных последовательностей) по сравнению с генами локу¬
сов HLA-DR и -DQ.Помимо «хорошо изученных» генов HLAкласса П, в регионе HLA-D
обнаружены «новые» гены HLA (см. рис. 13), среди них в первую оче¬
редь необходимо остановиться на генах HLA-DQB, HLA-DPA и особен¬
но HLA-DM (-DMA и -DMB), -LMP и -ТАР. Три последних локуса обес¬
печивают такую важнейшую функцию, как процессинг и экспрессию
антигенов HLA на поверхности клеток [302, 323].Для генов установлена 70%-ная нуклеотидная гомологияс генами DRB, DQB^л DPB. Гены картированы между локуса-
92Глава 3, Гены иммунного ответами DQ и DP, их экспрессия установлена на уровне мРНК в В- и Т-кле¬
точных линиях, стимулированных ИНФу [760].Гены HLA-DPA локализованы в непосредственной близости от
генов HLA- DQB в сторону центромеры (см. рис. 13).Гены HLA класса IH занимают на хромосоме пространственное
положение между генами HLA классов 1 и П (см. рис. 13). Значительная
физиологическая роль генов HLA класса III определяется целым рядом
выполняемых ими важнейших биологических функций. Так, продук¬
том гена CYP21 (на рис. 13 не показан) является антиген HLA-B42, но
основная его функция - контроль активности фермента цитохрома
Р450. Дефицит этого фермента приводит к развитию синдрома кон-
генеальной адренальной гиперплазии, частота которой составляет в
популяции европеоидов 1:10000. Известно также, что дефицит 21 гид-
роксилазы (2ЮН) в 25% случаев обусловлен делецией не только гена
CYP21B, но и гена С4В в результате генной конверсии [437].Гены локуса С4 (С4А и С4В) кодируют четыре компонента комп¬
лемента. Продукт этого локуса — сывороточный белок С4 с молеку¬
лярной массой 200 кД синтезируется как молекула-предшественник,
которая при созревании образует белок, состоящий из трех цепей:
а, ß и Y с молекулярной массой 756, 95 и 30 кД соответственно.
Компоненты комплемента С4а и С4Ь, кодируемые генами С4А и С4В,
различаются как по физическим свойствам, так и по биологической
эффективности. Так, компонент С4а в 100 раз эффективнее по срав¬
нению с компонентом С4Ь связывает аминовые группы.Исследование полиморфизма локуса С4 в различных популя¬
циях представляет значительный интерес для проблемы «HLA и
болезни». Так, в популяциях европеоидов наличие «С4А нулевого
аллеля» в большинстве случаев ассоциировано с делецией сегмента
региона HLA класса III, включающего гены С4А и CYP21A (см. выше).
Помимо этого, наличие «нулевого аллеля» в гаплотипе ассоцииро¬
вано с предрасположенностью к системной красной волчанке (SLE)
и другим аутоиммунным патологиям. Следует отметить, что полное
отсутствие локуса генов С4 (результат гомозиготности в обоих локу¬
сах) также имеет выраженную ассоциацию с SLE, Что касается ассо¬
циации SLE и гаплотипа HLA в целом, то наиболее сильная связь с
предрасположенностью к SLE установлена для гаплотипа HLA-A1,
-В8, -DR3, -С4.Непосредственно к гену С4В примыкает (в сторону теломеры) блок
генов G1—13 [729] (на рис. 13 не показан).
:і,2. гены главного комплекса гистосовместимости человека... 93Недавно установленный ген GI, кодирующий полипептид, состо¬
ящий из 93 аминокислот, характеризуется 35%-ной идентичностью с
ннутриклеточным Са^+-связывающим белком калмодулином [649] и,
iLO-видимому, выполняет аналогичную калмодулину функцию.Ген G11 экспрессирован в моноцитах, макрофагах, Т- и В-лимфо-
иитах и клетках печени, кодирует белок с молекулярной массой 28 кД,
ІЮ его функция не известна.Ген G13 кодирует белок с молекулярной массой 77 кД [491], прини¬
мающий участие в процессах транскрипции HLA. Ген картирован на
ближайшем к гену Ш>1-конце региона HLA класса ПТ.Непосредственно к гену С4А примыкает ген Bf, продукт которого
(|)актор В является компонентом альтернативного пути активации
комплемента и структурно сходен с компонентом классического пути
активации комплемента С2 (см. главу 1). Ген С2 расположен на расстоя-II ИИ 0,65 и.о. от локуса HLA-B,Ген В {Bf} функционирует в значительной степени совместно с
геном С2, принимая участие в «запуске» активации каскада комп¬
лемента, включая активацию компонентов комплемента СЗ и С5,
кодирующихся генами, находящимися вне системы HLA. Дефицит
фактора В описан только в гетерозиготе [803]. В гомозиготе дефицит
В-фактора не описан и, по-видимому, является летальным. Как С2-,
так и ^-гены — полиморфные. Наибольшая частота встречаемости из
аллелей гена С2 — С2С. Наиболее частотными аллелями гена 5/явля¬
ются /’и iS.Между генами Bf ш С4 локализуются два недавно открытых гена,
обозначенных SK12W и DQM3Z (на рис. 13 не показаны).Дефицит компонента С2 является наиболее частой формой недо¬
статочности системы комплемента у человека (частота отсутствия
компонента С2 в гомозиготе составляет 1:10000). Следует отме-
1 ить, что дефицит фактора С2 обнаружен у 40% больных SLE [718].
Отсутствие компонента С2 связано не с делецией участка ДНК, а с
нарушением транскрипции мРНК [715],На расстоянии 92 кЬ от гена С2в сторону от центромеры находится
локус генов теплового шока 70 (HSP70), состоящий из двух генов —
HSP01 и HSP02. Они занимают участок в 12 кЬ и кодируют идентичные
белковые продукты, состоящие из 641 аминокислотного остатка [608].
Третий ген локуса HSP70 — HSP70-HOMлокализирован на расстоянии4 кЬ в сторону теломеры от гена HSP01 и кодирует белок, содержа¬
щий 641 аминокислотный остаток. Гомология между генами HSP01
94Глава 3. Гены иммунного ответаи HSP70-HOM составляет 90%. Гены HSP01 и NSPQ2 экспрессируются
на высоком уровне в организменных клетках при тепловом шоке при
температуре 42 "С. Продукты локуса HSP70 играют определенную
роль во внутриклеточном транспорте пептидов и вызывают развер¬
тывание белка перед преципитацией антигена [659]. Проведенными
исследованиями установлен полиморфизм гена HSPOÎ на уровне
промоторного региона и гена HSP-70-HOM — на уровне кодирующего
участка [608].Крайним в сторону теломеры среди генов HLA класса П1 явля¬
ется локус TNF, отстоящий на 600 кЬ от локуса HLA-B [763]. В локус
входят два гена — TNFA, кодирующий белок из 156 аминокислот, и
TNFB, кодирующий белок, включающий 171 аминокислоту. Гены
локуса TNF характеризуются 35%-ной гомологией, кодируемые ими
белки соответствуют TNFa и TNFß. Оба белка секретируются акти¬
вированными макрофагами и Т-лимфоцитами и оказывают плео-
тропное действие на различные клеточные типы, включая различные
субпопуляции лимфоцитов, нейтрофилы и эпителий сосудов [482].
Указанные механизмы действия белков TNF, а также их влияние на
воспалительный процесс, опосредованный ими цитолитический и
цитотоксический эффекты против раковых клеток, свидетельству¬
ют о важнейшей биологической функции локуса TNF [670]. Помимо
этого, белки TNF участвуют в регуляции экспрессии антигенов HLA
класса I на эндотелии сосудов [533], что свидетельствует об участии
продуктов локуса TNF в развитии аутоиммунных патологий и при
развитии реакций отторжения трансплантата.Гены HLA блока G (класса ПТ, относящиеся к группе G) распре¬
делены в регионе HLA класса ÎTI дискретно. И часть их (гены ВАТ) в
настоящее время рассматривается как отдельный локус.В регионе генов HLA класса ТН выявлено большое количество
новых генов, причем экспрессирующих, к ним следует отнести гены
BATI—9 (В-ассоциированные транскриптеры). Авторы, открывшие
эти гены, не исключают возможности идентификации в этом регионе
более чем 19 генов. К настоящему времени установлены белковые про¬
дукты двух генов, входящих в локус -ВАТ — ВАТ2 и ВАТЗ. Это богатые
пролином белки с молекулярной массой 228 и ПО кД соответственно.Безусловно, обнаружение новых генов как в составе комплекса МНС,
так и во фланкирующих его фрагментах ДНК имеет большую значи¬
мость. До сих пор не исключается возможность развития заболеваний
человека, обусловленных нарушениями в структуре генов, локализо-
Основные функции главного комплекса гистосовместимости 95ИЯ иных рядом с генами главного комплекса гистосовместимости клас¬
сов I и II, или функциональной активностью кодируемых этими гена¬
ми белковых продуктов. Кандидатами на эту роль могут быть в первую
очередь гены серии ВАТ. Вполне возможно, что их белковые продукты
участвуют во внутриклеточном процессинге антигенов, их транспорте
и в других событиях, которые также выполняют молекулы МНС клас¬
сов 1, II и ТП. Но в то же время это нисколько не противоречит данным,
убедительно свидетельствующим о том, что аминокислотные замены в
полиморфных эпитопах молекул гистосовместимости класса II играют
ключевую роль в нарушении физиологического иммунного гомеостаза
и в запуске таких аутоиммунных заболеваний, как инсулинзависимый
сахарный диабет (ИЗСД), псориаз и целиакия.3.3. ОСНОВНЫЕ ФУНКЦИИ ГЛАВНОГО КОМПЛЕКСА
ГИСТОСОВМЕСТИМОСТИКак указывалось выше, одной из важнейших физиологических
(()ункций системы HLA, лежащей в основе развития и регуляции
иммунного ответа, является обеспечение процессинга и представле¬
ння иммунодоминантных пептидов, являющихся продуктом внут¬
риклеточного протеолиза чужеродных антигенов, против которых
будет индуцирован, а затем и развиваться сам иммунный ответ [284,
422, 448]. Этой функции антигенов системы МНС способствует само
строение ее молекул, которое, несмотря на выраженные различия в
структуре антигенов класса I и II молекул HLA, позволяет образовать
на внешнем их конце так называемую пептидсвязывающую борозд¬
ку, где и удерживается представляемый для распознавания пептид.Разработка проблемы представления пептидов антигенами HLA
класса I и класса II установила, что антигенпредставляющая клет¬
ка осуществляет свое специфическое взаимодействие, представляя
пептид в контексте собственной молекулы HLA, идентичной таковой
на клетке, воспринимающей информацию. Именно за установле¬
ние этого феномена, названного феноменом двойного распознава¬
ния, Цинкернагель и Догерти были удостоены Нобелевской премии.
Установление этого феномена явилось ключевым моментом в пони¬
мании основ физиологической регуляции иммунного ответа. В то же
время имеются и существенные различия между взаимодействием,
96Глава 3. Гены иммунного ответаобеспечиваемым в процессе иммунного ответа антигенами HLA
класса I и П. Во-первых, антигены HLA класса И обеспечивают взаи¬
модействие антигенпредставляющей клетки с Т-хелпером, а антигены
HLA класса I — с Т-эффектором-киллером. Во-вторых, помогают
им в этом различные молекулы-корецепторы - CD4 для Т-хелперов
и CD8 для Т-киллеров. Естественно, что различны и эффекты этого
взаимодействия. Так, распознавание пептидов в контексте молекулы
HLA класса И ведст к формированию популяции клеток ТЫ и Th2,
одни из которых индуцируют развитие гуморального иммунного
ответа (Th2), а другие будут необходимым компонентом в индукции
Т-киллеров (ТЫ) [6221. Что же касается антигенов гистосовместимос¬
ти класса I, то Т-киллер, индуцированный против иммунодоминант-
ного пептида, экпрессированного на поверхности клеток-мишеней
в контексте антигенов HLA класса 1, идентичных таковым, экспрес¬
сированным на Т-киллере, уничтожит эти клетки-мишени. Следует
еще раз подчеркнуть, что оба эти важнейших звена «нормального»,
т.е. физиологического, иммунного ответа строго ограничены набором
антигенов HLA, кодируемых конкретным аллельным вариантом,
характерным для конкретного человека. В том случае, если пеп¬
тид представляется для распознавания клеткой, отличающейся по
HLA-антигенам от распознающих клеток, то иммунный ответ разви¬
вается против этих представляющих клеток, т.е. в этом случае речь
идет о развитии трансплантационного иммунитета.Большое значение для формирования современных представленийо физиологической роли антигенов HLA имело установление роли
«новых» HLA-генов -DM, -LMP и -ТАР. Это в свою очередь позволило
конкретизировать представление о реализации функции антигенов
НЕА(рис. 16).Так, из числа антигенов, кодируемых системой HLA, первыми в
систему процессинга антигенов, имеющих эндогенное происхожде¬
ние (собственные измененные и даже неизмененные антигены), вклю¬
чаются продукты локуса LMP (гены -LMP2, -LMP7), активируемые
ИНФу и затем инкорпорируемые в цротеосомы [283, 818]. Ген -LMP2
также известен как -RINGJ2, а ген -LMP7~ksik -RJNG10. Аббревиатура
LMP происходит от Large IVlultifunctional Protease, а аббревиатура
RING обозначает Really Interesting New Genes. Ген -LMP2 находится
в неравновесном сцеплении с геном -ТАР]. Впервые данные гены
были описаны и картированы между генами в хромосоме 6 [412,
484], Четыре входящие в систему HLA гена —LMP2, -LMP7n -RJNG4,
,1.4. Основные функции главного комплекса гистосовместимости97аСлЯоаС
98Глава 3. Гены иммунного ответа-Ä/M7I1 — составляют кластер генов, ответственный за индукцию
интерферонов [339, 350, 398], и именно с этим связан механизм дей¬
ствия генов -LMP2 и -LMP7, обеспечивающих активацию протеосом.
Возможным механизмом действия продуктов генов -LMP2 и ~LMP7
является замена ими под влиянием индукции ИНФу двух протеосом-
ных субъединиц Y и X [217, 374].Молекулы МНС класса I синтезируются в цитозоле клетки, где до
появления соответствующего пептида находятся в связи с так назы¬
ваемым тирозинкалретикулиновым комплексом. После связывания
с пептидом происходит высвобождение молекул HLA и транспорт на
поверхность клеток также кодируемых МНС «пептидных насосов»
ТАР (от Transporter associated with Antigen Processing) [282, 8І0]. Данные
гены {LMP) известны также как RING4 vi 12 н PSF1 и 2, соответствен¬
но. Аббревиатура PSF — Peptide Supply Factor. Последнее название
отражает функцию данных молекул, которая в целом состоит в том,
что они регулируют размер и специфичность пептидов, приводя их
в «соответствие» со связывающими сайтами молекул МНС класса I
[283]. Эти гены аналогичны Harnl и Нат2, открытым ранее у мышей.В 1993 г. было прямо показано, что ТАР! и ТАР2 представляют
собой гетеродимеры и участвуют в окончательной сборке молекул
антигенов класса I, а также в представлении эндогенных пептидов
[635]. Молекулы, кодируемые геном -ТАР2, находятся в неравновес¬
ном сцеплении с антигенами HLA-DR, между генами -TAPI и -ТАР2
имеется высокая частота рекомбинаций [329, 457]. Установлено, что
некоторые мутации в районе генов HLA-TAP ведут к утрате функции
представления антигенов гистосовместимости класса I [302]. Вполне
возможно, что с нарушением антигенпредставляющей функции анти¬
генов ТАР может быть связан высокий уровень ассоциации между
аллелями гена -ТАР! и предрасположенностью к развитию такого
аутоиммунного заболевания, как ИЗСД [4, 450]. В то же время прове¬
дено исследование, показывающее, что один из аллелей локуса -TAPJ,
а именно R659Q, для которого характерен дефект транскрипции РНК,
выявляется на клетках мелкоклеточного рака легких [312]. Наконец,
имеются данные [337, 338] о том, что при синдроме Луи-Бар, характе¬
ризующемся наличием «голых Т-лимфоцитов», нарушение экспрес¬
сии антигенов HLA класса I связано с гомозиготным состоянием
аллелей гена -ТАР2,В отличие от молекулы класса 1 обе цепи молекулы МНС класса II
синтезируются в эндоплазматическом ретикулуме, откуда после их
:L3. Основные функции главного комплекса гистосовместимости 99иременного соединения с третьей инвариантной цепью они транс¬
портируются в эндоцитарный отдел, где или встречаются и затем
связываются с пептидом, имеющим экзогенное происхождение, или
же (если этого не произошло) деградируют в лизосомах. После связи
i; пептидом, заменяющим инвариантную цепь, молекулы МНС клас¬
са П переходят на клеточную мембрану [283J. Вытеснение пептидом
инвариантной цепи молекул HLA класса ТТ обеспечивают белки,
1акже кодируемые системой HLA и названные HLA-DM. Эти белки
катализируют замену «временного» пептида инвариантной цепи на
специфический пептид [283],В систему DM входят два гена -DMA и -DMB, картируемые Р. Morris
и соавт. [621] между локусами -DP и -DQ (см. рис. 13). Роль антигенов
П LA-DM является решающей в представлении экзогенных пептидов
молекулами класса II [621]. Механизм их действия состоит в удалении
молекулы CLTP, которая временно связывала иммуногенный пептид
(см. рис. 16), и освобождении связывающего сайта молекулы HLA
класса И для его замещения пептидом, происходящим из экзогенного
агента. Дефект функции HLA-DM ведет к нарушению замены моле¬
кулы CLIP на пептид и отмене антигенпредставляющей функции
молекул класса II [845].Следует отметить, что, хотя данные о «новых» системах LMP, ТАР и
DM комплекса HLA являются далеко не окончательными, уже сейчас
ясно, что они выполняют в иммунном ответе важнейшую роль, обес¬
печивая физиологическую презентацию процессированных пептидов
для дальнейшего развития иммунного ответа. По-видимому, с нару¬
шениями их функций связаны некоторые формы иммунодефицит-
пых состояний человека, в основе которых лежит утрата возможности
экспрессии антигенов HLA на иммунокомпетентных клетках [568].
Утрата способности к экспрессии молекул HLA на мембранах клеток
является также одним из основных патогенетических звеньев разви¬
тия онкологических заболеваний.Как указывалось выше, в целом связь между молекулами HLA
и пептидами имеет много общего для антигенов HLA класса 1 и II.
Однако и здесь имеются серьезные отличия.Так, пептид удерживается в связывающей складке молекулы HLA
как класса I за счет связи его N- и С-окончаний с определенным
мотивом «аллель-специфического» участка МНС, так и боковых
цепей пептида с боковыми карманами молекулы МНС. Уже отмеча¬
лось (см, раздел 3,1), что длина пептидов, связывающихся с молекулой
100 Глава 3. Гены иммунного ответаHLA класса 1, составляет 9-11 аминокислот [282]. Пептиды, связыва-
юшисся с молекулой HLA класса И, более гетерогенны — 15—30 ами¬
нокислот, Связывающая бороздка молекул HLA класса И, в отличие
от молекул HLA класса 1, «открыта» для связывания с двух сторон, что
создаст возможность большего полиморфизма в связях HLA + пептид.
Более того, в молекуле класса П зоны связывания могут выходить
даже за связывающую складку. Все это дает возможность «аккомода¬
ции» более широкого спектра пептидов к молекулам HLA класса Н по
сравнению с классом I [283].Переход исследований HLA на молекулярно-генетический уровень
позволил открыть новые грани физиологической функции системы
HLA. Так, молекулы МНС приобретают стабильную форму и соот¬
ветствующую трехмерную конфигурацию только после того, как в свя¬
зывающий сайт ее складки встраивается пептид. Только после этого
молекула МНС способна мигрировать на поверхность клетки, где она
готова выполнить свои функции. Удаление пептида из пептидсвязы¬
вающей структуры МНС, экспрессированной на клеточной мембране,
нарушает ее трехмерную конфигурацию, лишая ее возможности функ¬
ционировать, и ведет к гибели этой структуры [455, 704]. Комплекс
МНС + пептид является чрезвычайно стабильным, очишается и крис¬
таллизируется в единой структуре. Этот комплекс остается на поверх¬
ности клетки в течение нескольких недель, что позволяет многим
«проходящим» Т“клеткам сканировать пептид, представленный соб¬
ственной молекулой МНС. Наконец, каждый пептид связывается
(и удерживается в складке) с инвариантным участком, характерным для
каждого из аллелей молекулы МНС и имеющим определенный мотив
аминокислотных остатков, участвующий в таком связывании. Таким
образом, в связь с конкретным пептидом вовлекаются конкретные
же участки антигенов — аллельные варианты молекул МНС, что, по
сути, и является основой генетического контроля иммунного ответа.
Это положение хорошо иллюстрируют данные о том, что пептид виру¬
са герпеса связывается с гаплотипом HLA~DQAl*0501/-DQBl*2001,
но не HLA-DQAl*0201/-DQBl*2001. Различие между ними в цепи
DQA1 составляет 15 аминокислотных остатков [508].Установление этого факта и имеющаяся в настоящее время воз¬
можность анализировать аминокислотные последовательности всех
аллельных вариантов антигенов HLA, включая участки, определяю¬
щие их специфичность, а также структуру пептидов, определяющих
специфичность различных чужеродных агентов, включая болезне-
3.3. Основные функции главного комплекса гистосовместимости tOJIнорные, позволяет заранее предсказать соответствие тех или иных
иммунодоминантных пептидов тем или иным участком молекулы
М НС. Таким образом, можно заранее предсказать генетическую отве-
‘шемость или неотвечаемость на тот или иной агент.В свою очередь, это даст возможность ие только заранее решить
lionpoc о том, ответит ли данный индивидуум на вакцинацию против
того или иного болезнетворного агента, но и предсказать, насколько
) гот ответ будет физиологичен, что позволит прогнозировать возмож¬
ность развития ряда заболеваний аутоиммунного генеза (например,
ревматоидный артрит и ИЗСД), в генезе которых, возможно, лежитI акже комплементарность иммунодоминантных пептидов инфекии-
(>нных агентов конкретным эпитопам аллелей HLA [235, 402].Благодаря такому важнейшему свойству системы HLA, как ес
экстремальный полиморфизм, стала возможной взаимная компле-
ментарность иммунодоминантных сайтов молекул огромного числа
различных инфекционных возбудителей и конкретных антигенов
гистосовместимости, в свою очередь, это явилось эффективным
средством сохранения человека как вида в условиях постоянно изме¬
няющегося генетического разнообразия микробного окружения.Таким образом, экстремальный аллельный полиморфизм системы
HLA является мощным механизмом вариабельности и естественного
отбора человека как вида и позволяет ему противостоять постоянно эво¬
люционирующему множеству патогенов. Доказательством этому в исто¬
рическом плане может служить почти полное вымирание целых народов
(в первую очередь американских индейцев в период открытия Америки),
обладающих — как мы точно теперь знаем — весьма низким по сравне¬
нию с другими этническими группами полиморфизмом системы HLA.Наглядно о межрасовом и межэтническом разнообразии можно
судить на основании представленных на рисунке 17 данных о частоте
встречаемости трех выбранных нами специфичностей HLA-DRBI
(HLA'DRBPOl, HLA-DRB1*04 и HLA-DRB1*09) (типированных на
уровне низкого разрешения) в 10 этнических группах, относящихся
по расовой принадлежности или к европеоидам (кавказоидам) —
русские (две группы, одна — жители Москвы, вторая — поморы
Архангельской области, коренные жители побережья Белого моря),
мари (Республика Марий Эл), татары (Республика Татарстан) или к
ориентам (монголоидам) — удмурты (Удмурдская Республика), ненцы
(Ямало-Ненецкий автономный округ), тувинцы (Республика Тыва),
буряты (Республика Бурятия), калмыки (Республика Калмыкия),
W2Глава 3. Гены иммунного ответаРис, П. Межэтнический полиморфизм в распределении трех специфичнос¬
тей НЬА-ОК-В1 в 10 популяционных группах;Русские М — русские-москвичи; Русские П — русские-поморыузбеки (Узбекистан). Расовая принадлежность саамов (Республика
Карелия) является объектом дискуссий среди антропологов.Как следует из представленных данных, три этнические группы
европеоидов (две группы русских и татары) имеют сходное по своему
характеру распределение исследованных специфичностей: наиболее
высоким уровнем характеризуется специфичность HLA-DRB1*04,
несколько меньшим — специфичность HLA-DRB1*01 и наиболее
низким уровнем — специфичность HLA-DRB1*09. В количественном
отношении частоты всех указанных специфичностей наиболее высоки
у поморов, вслед за ними идут москвичи, а затем — татары. В целом же
и характер этого распределения, и абсолютные частотные значения
укладываются в характерные показатели для всех других популяций
центра и севера Европы. В отличие от указанных этнических групп
европеоидов у мари имеются выраженные отличия — чрезвычайно
высока частота специфичности HLA-DRB1*01, а частота специфич¬
ности HLA-DRB1*04 оказалась наиболее низкой.Более выражены различия по изученным специфичностям внутри
групп ориентов. Оказалось, что частота специфичности HLA-DRBl*01
наиболее высока среди удмуртов и наиболее низка среди тувинцев и
бурят; частота специфичности HLA-DRB1*04 была высока у всех
3.3. Основные функции главного комплекса гистосовместимости 103изученных групп за исключением удмуртов, у которых она является
самой низкой среди всех изученных групп в целом. Что же касается
HLA-DRB1*09, то частота данной специфичности практически оди¬
накова у всех указанных этнических групп за исключением ненцев,
у которых она более чем в 3 раза выше по сравнению с остальными
группами. Наиболее вероятным объяснением этому является тот
факт, что в отличие от других этнических групп ориентов, связанных
между собой азиатским происхождением, группа ненцев связана с
американскими ориентами (индейцами). Для последних также харак¬
терна высокая частота специфичности HLA-DRB1*09.По распределению антигенов HLA саамы, расовая принадлеж¬
ность и происхождение которых спорны, отличаются определенны¬
ми особенностями. Эта этническая группа характеризуется тем, что
частота специфичности HLA-DRB1*04 у них чрезвычайно высока и
не имеет аналога по сравнению с другими исследованными популя¬
ционными группами мира. Характер распределения других специ¬
фичностей у саамов скорее всего является промежуточным между
ориентами и европеоидами, при большем сходстве с последними.
Возможно саамы, которых чаще всего относят к реликтовым группам
севера Западной Европы, могли оказать влияние на формирование
HLA-профиля европеоидных популяций.Приведенные данные достаточно красноречиво свидетельствуют о
наличии межрасового и межэтнического различия по HLA-специфич¬
ностям, которое весьма четко проявляется среди этнических групп,
населяющих в течение многих столетий Россию, Примечательно, что
имеется принципиальное сходство HLA-профиля у групп ориентов
(тувинцы, буряты), проживающих в течение исторических эпох в
окружении других групп ориентов и ориентов (калмыки), проживаю¬
щих в окружении европеоидных групп.Как было сказано выше, представленная часть данных явилась резуль¬
татом HLA-генотипирования на уровне низкого разрешения. Для того
чтобы показать возможности HLA-генотипирования на уровне высокого
разрешения, мы сочли целесообразным представить данные о межэтни¬
ческом HLA-разнообразии на уровне аллельного полиморфизма одной
лишь специфичности — HLA-DRB1*04. Выбор этой специфичности
не случаен, поскольку с аллелями HLA-DRB1*0401, HLA-DRBl*0404
и HLA-DRB1*0405 гена HLA-DRB1*04 ассоциирована предрасположен¬
ность к такому аутоиммунному заболеванию, как ИЗСД. В то же время
с другим аллелем — HLA-DRBl*0403 — ассоциирована устойчивость к
104Глава 3. Гены иммунного ответаразвитию этого заболевания. Как известно, генетические факторы игра¬
ют решающую роль в развитии ИЗСД [4,46].Использование для проводимого анализа специфичности HLA-
DRBT*04 позволило впервые установить выраженные различия в HLA-
полиморфизме не только на межэтническом, но и навнутриэтническом
уровне (Хаитов RM., Алексеев Л.П. [175,176]). В таблице 8 представлены
данные по исследованию частоты встречаемости аллельных вариантов
гена HLA-DRB1*04 в семи популяционных группах России.Из представленных данных видно, что во всех популяциях, за
исключением ненцев, высока частота аллеля HLA-DRBl*040l, но в
трех популяциях: саамы, тувинцы, ненцы — высока частота и аллеля-
протектора (8,38; 5,75 и 7J6 соответственно). И именно в этих попу¬
ляциях практически отсутствует заболеваемость ИЗСД. Аналогичная
ситуация имеет место и в отношении двух других аллелей *0404 и
*0405. Частота первого из них является достаточно высокой у саамов
и ненцев (5,33 и 10,14 соответственно), а частота аллеля *0405 повыше¬
на у тувинцев (5,75). Таким образом, протективный эффект является
превалирующим по отношению к предрасполагающему.Эта же таблица служит наглядным доказательством внутриэтни-
ческих различий по распределению аллелей HLA. Так, внутри русской
популяции между москвичами и жителями Архангельской области
выявлены выраженные различия по аллелям HLA-DRB1*0401 и HLA-
DRB1*0404. Оказалось, что оба аллеля имеют выраженную ассоциа¬
цию с предрасположенностью к ИЗСД, частота которого достаточно
высока в обеих указанных группах.Таким образом, ясно, что полиморфизм системы HLA, характер¬
ный для каждой конкретной группы населения, оказывает сущест¬
венное или даже определяющее влияние на биологическую стабиль¬
ность данной группы.Хотя описанный выше механизм распознавания пептидов в кон¬
тексте антигенов гистосовместимости является в целом универсаль¬
ным, из него, по-видимому, есть отдельные исключения, и в первую
очередь это может относиться к распознаванию чужеродных (алло-
генных) антигенов гистосовместимости. Такая ситуация имеет место
по крайней мере в двух случаях: во-первых, при пересадке органов и
тканей; а во-вторых, при беременности.Что касается первой из указанных возможностей, то по первона¬
чально сформировавшемуся представлению, наиболее полно изло-
Основные функции главного комплекса гистосовместимости Í05жснному в исследовании Ф. Баха и соавт. [236], Т-клетки реципиента
распознают непосредственно целую молекулу чужеродного антигена
(донорского происхождения) гистосовместимости. Причем Т-хелперы
распознают чужеродные молекулы класса И, а Т-киллеры — чужерод¬
ные молекулы класса I. Такого рода распознавание целой непроцес-
сированной молекулы чужеродных антигенов гистосовместимости
принято называть прямым.В последующие годы в связи с формированием представлений о
роли иммунодоминантных пептидов, происходящих из целых анти¬
генных молекул, естественно возник вопрос о том, не имеет ли
место и в случае трансплантационного иммунитета описанный выще
общий механизм антигенного процессинга и экспрессии. При этом
были получены данные о реальной возможности распознавания про-I лессированных пептидов чужеродных антигенов гистосовместимос¬
ти, Одной из наиболее значимых в этом отношении явилась работа
S, КНош-у et al. [494].Авторы показали в изящной экспериментальной системе, основан¬
ной на индукции иммунного ответа к пептидам класса И, возмож¬
ность непрямой индукции иммунного ответа отдельными пептидами
«донорских» антигенов гистосовместимости класса П, индуцирую¬
щими ответ клонов фенотипа CD4. Более того, авторы установили,
что эти клоны, способные продуцировать ИНФу, относятся к Thl-
клонам, и высказали обоснованное предположение о возможной роли
непрямого распознавания антигенов тканевой совместимости (т.е.
прошедших стадию процессинга) как в реакции отторжения, так и в
индукции толерантности.В 2000 г. были получены прямые доказательства того, что оба типа
распознавания — прямое и непрямое — могут реализовываться одно¬
временно [704]. Во всяком случае, было установлено, что индукция
ЦТЛ против антигенов класса I HLA-A и HLA-B осуществляется в
прямом распознавании, в то время как специфические Т-киллеры,
реагирующие в цитотоксическом тесте против антигенов HLA-C,
индуцируются только при распознавании иммуногенных сайтов
этих пептидов, т.е, в непрямом распознавании. Поэтому в реакции
отторжения органного трансплантата антигены HLA-C практически
не принимают участия. Именно благодаря этому хорошо установлен¬
ному факту подбор по антигенам HLA-C в клинике трансплантации
органов не используется уже более 10 лет.
106Глава 3. Гены иммунного ответаТаблица 8Частота встречаемости аллельных вариантов гена Н1А-ВКВ1*94 в различных
популяционных группах России№Русские -
москвичиРусские -
поморыСаамыТатарыМариТувинцыНенцы0411,6435,3733,5217,7816,3428,7417,390401*3,8016,219,145,6112,6512,130,7304021,660,760,930403*^0,951,478,381,871,055,757,160404^3,0917,695,337,90,531,2810,140405’5,7504071,660,5304081,1916,001,871,582,9304101,28* Ассоциация с предрасположенностью к ИЗСД.
** Ассоциация с устойчивостью к ИЗСД.В ТО же Время при пересадке костного мозга селекция по всему
набору аллелей HLA-C является абсолютно необходимой, и, более
того, она имеет большее удельное значение по сравнению с селекцией
по антигенам HLA-A и HLA-B. Практически та же самая ситуация
имеет место и в отношении антигенов класса Н. В этом случае для
эффективной пересадки органных трансплантатов абсолютно доста¬
точна селекция на уровне выявления антигенов HLA класса Н или же
специфичностей -DR-B1, выявляемых при генотипировании методом
низкого разрешения (общее количество таких специфичностей не
более 18), Напротив, при трансплантации костного мозга неродствен¬
ного происхождения абсолютно необходим подбор донора на уровне
отдельных аллельных вариантов генов HLA, общее количество кото¬
рых на сегодняшний день превышает 2 тыс.Есть достаточно оснований предположить, что при первичной
пересадке органных трансплантатов имеет место прямое распо¬
знавание чужеродных антигенов HLA класса И, в то время как при
пересадке костного мозга имеет место распознавание пептидных
мотивов аллельных вариантов, которое, естественно, обеспечивается
непрямым вариантом распознавания. Эти различия имеют принци¬
пиальное значение для прикладной трансплантологии. И если для
.'{.3. Основные функции главного комплекса гистосовместимости 107эффективного подбора трансплантата костного мозга необходимо
располагать базой данных о миллионах HLA-генотипированных
доноров, то при органной трансплантации для подбора HLA-гис-
тосовместимого донора количество реципиентов в листе ожидания
(в этом случае один донор скринируется на листе ожидания реципи¬
ентов, а не наоборот, как при трансплантации костного мозга) может
не превышать 1 тыс. человек.Что касается вопроса о роли прямого и непрямого распознавания
чужеродных антигенов гистосовместимости в процессе беременности,
ю он до настоящего времени является практически неразработанным.
Хотя сам вопрос о физиологическом значении HLA-совместимости
матери и плода имеет большое значение и будет рассмотрен ниже.Как отмечалось выше, помимо регуляции иммунного ответа на его
начальных и продуктивных этапах, система HLA обеспечивает также
и такой «терминальный» этап регуляции этой реакции, как апоптоз
различных типов АПК. При этом следует отметить, что этот эффект
касается как профессиональных АПК (макрофаги и моноциты, диф¬
ференцировавшиеся из клеток фенотипа CD34 в клеточной культуре,
дендритные клетки), так и В-лимфоцитов.Так, коллективом исследователей, работающих под руководством
профессора Д. Шаррона [259], было установлено, что воздействие
моноклонального антитела L243 на молекулы HLA-DR, экспресси¬
рованные на различных типах АПК, блокирует их апоптоз, опреде¬
ляемый с помощью изотиоцианата, меченного аннексином V. Во всех
указанных клетках после блокирования молекул -DR отмечалось
значительное снижение апоптоза. При этом развитие опосредованно¬
го молекулами HLA-DR апоптоза дендритных клеток не изменялось
даже при использовании высокой концентрапии таких ингибиторов,
как z-VAD-fmk и z-DEVD-fmk. Авторы считают, что регуляция апоп¬
тоза дифференцирующихся АПК осуществляется через молекулы
HLA-DR и это может явиться решающим механизмом.для ограниче¬
ния их жизни. При этом следует отметить, что роль антигенов HLA-DR
не ограничивается регуляцией апоптоза «профессиональных» АПК.
Они принимают также непосредственное участие в апоптозе В-лим¬
фоцитов.В целом все эти данные свидетельствуют в пользу ключевой физио¬
логической роли молекул HLA-DR в регуляции апоптоза всех типов
АПК. Последнее, по сути, является регуляцией одного из важнейших
этапов развития иммунного ответа и еще раз свидетельствует в пользу
108 Глава 3. Гены иммунного ответатого, что при современном уровне знаний о физиологической роли
генов HLA-DR можно считать, что именно они в действительности
являются генами иммунного ответа человека.Генам МНС, помимо вышеописанной физиологической функции
генетического контроля специфического иммунного ответа, прина¬
длежит еще ряд важнейших физиологических функций (Хаитов RM.,
Алексеев Л.П. [177]). Описанию одной из них — генетическому кон¬
тролю качества иммунного ответа — были посвящены работы [8] и
(Хаитов P.M., Алексеев Л.П. [178]). Напомним читателю, что речь
идет об ассоциированном с системой HLA контроле активности
различных субпопуляций иммунокомпетентных клеток, что в свою
очередь существенным образом сказывается на конечном уровне
иммунного ответа, т.е. на его качестве. При этом очевидно, что эта
функция является «вторичной» и реализуется только в том случае,
если организм человека генетически способен отвечать на данный
агент. Предпосылкой развития данного направления можно счи¬
тать предположение, выдвинутое в. Бодмером еще в 1978 г. [273],о том, что на формирование HLA-профиля европеоидной попу¬
ляции в значительной степени оказали влияние имевшие место в
средние века эпидемии таких заболеваний, как чума, оспа, холера
и т.д. В результате этого среди выживших оказался значительный
процент людей с определенными HLA-генотипами, в первую оче¬
редь с генотипом HLA-A1, -В8, -DR3. Как предположил В. Бодмер,
этот генотип, обеспечивающий более высокую резистентность к
инфекционным заболеваниям, является на сегодняшний день гене¬
тическим маркером европеоидной популяции. Следует отметить,
что это предположение было подтверждено на примере вспышек
брюшного типа в Суринаме, когда среди выживших европеои¬
дов значительный процент составили лица с гаплотипом HLA-A1,
~В8, -DR3. Одновременно с этим В. Бодмер высказал справедливое
предположение о том, что реализация данного эффекта могла быть
осуществлена только за счет ассоциаций между конкретными HLA-
специфичностями и гаплотипами и иммунным ответом. Учитывая
тот факт, что с одними и теми же гаплотипами HLA оказалась свя¬
зана устойчивость к самым различным инфекционным агентам,
логично было предположить, что подобного рода ассоциация может
быть связана не только с самой генетически обусловленной отвечае-
мостью к конкретному инфекционному агенту, но и с теми звеньями
иммунного ответа, которые принимают участие в его реализации,
,'L3. Основные функции главного комплекса гистосовместимости 109i .е. в конечном эффекте. Именно это в настоящее время и подразуме¬
вается под качеством иммунного ответа. И именно иод таким назва¬
нием в программу XII рабочего совещания и конференции по HLA
(Париж, 1999) оно вошло как новое отдельное направление изучения
(|>изиологической функции комплекса генов HLA. Следует отметить,
что в данном направлении исследований отечественные иммуноло-I и имеют несомненный приоритет [209], хотя само это направление
ранее именовалось как исследование ассоциации между генами HLA
и иммунным статусом человека [208, 210].К настоящему времени достаточно хорошо известно, что между
отдельными HLA-специфичностями и HLA-гаплотипами существу¬
ют положительные и отрицательные ассоциации с теми или иными
показателями иммунного статуса, как то: количество и функциональ¬
ная активность клеток фенотипов CD4, CD8, ЕКК, фагоцитарной
([)ункции нейтрофилов и т.д. Следует, однако, отметить, что абсолют¬
ное число работ в этом направлении ранее выполнялось при изучении
кавказоидной популяции [219, 572, 587, 588, 612].В последние годы нам удалось показать, что ассоциированные с
генами HLA показатели иммунного статуса могут быть отличающи¬
мися в различных этнических группах [8]. Пример этого — исследова¬
ние ассоциаций между отдельными параметрами иммунного статуса
и HLA-специфичностями в двух этнических группах — русские (кав-
казоиды), буряты (ориенты). Данные приведены в таблице 9.Таблица 9НТА-антигены, связанные со сходными параметрами иммунного статуса
в бурятской и русской аопуляцияхПараметрыБурятыРусскиеIgMHLA-AlT, Bl5i, B40iHLA-B5tIgGHLA-A2Í, B7l—ФагоцитозHLA-B12Í, B40tHLA-B27ÍРБТЛ-слHLA-B16Í, B404HLA-B7, DR2ÍРБТЛ-ФГАHLA-AlOi, DR2lHLA-B8t, DQ2tИнтерлсйкин-2HLA-B16Í, DR7tHLA-B7T, DR4i, DQ34^Примечание: i — сниженный; t — повышенный уровень исследованного параметра,
маркируемый данным антителом; прочерк — отсутствие связи параметра с антигена¬
ми системы HLA; РБТЛ-сп — спонтанная реакция бласттрансформации лимфоцитов;
РБТЛ-ФГА — реакция бласттрансформации лимфоцитов, индуцированная фитоге-
магглютинином (ФГА).
iiO Глава 3. Гены иммунного ответаАнализ этих данных свидетельствует о целесообразности даль¬
нейшего межэтнического подхода к изучению ассоциированного с
генами HLA качества иммунного ответа. Следует также отметить,
что исследование данной физиологической функции системы HLA,
несмотря на то что оно началось относительно недавно, является
весьма перспективным как в фундаментальном аспекте — в плане
установления молекулярных механизмов указанных ассоциаций, так
и в практическом, поскольку это направление имеет значение в плане
прогноза возможности неблагоприятных воздействий (в том числе
техногенных) окружающей среды на представителей различных этни¬
ческих групп.Отдельно следует отметить, что, как стало известно в самое по¬
следнее время, главному комплексу гистосовместимости принадлежит
существенная роль в регуляции активности популяции клеток, сто¬
ящих на грани между факторами, определяющими специфический и
естественный иммунитет. Это так называемые естественные клетки-
киллеры (ЕКК).Данной популяции клеток, как известно, принадлежит весьма
существенная роль в обеспечении противоинфекционной, в первую
очередь противовирусной, защиты организма (см. главу I). Они также
несут ответственность и за обеспечение элиминации из организма
мутирующих, в том числе раковых, клеток, которые распознаются
ЕКК по отсутствию или даже сниже1{ию на их поверхности антигенов
МНС [355, 618].При этом следует отметить, что роль в запуске активности ЕКК-
клеток играет не только уровень экспрессии молекул HLA, но и их
специфичность. Существуют данные о том, что в организме имеет
место своего рода «приспособление» популяции ЕКК к HLA-генотипу.
Это приспособление происходит в процессе дифференцировки ЕКК,
когда из их популяции элиминируются клетки, рецепторы которых
не связываются с антигенами HLA, входящими в генотип организма
[355, 618]. Таким образом исключается возможность повреждения
собственных «нормальных» клеток, и активность ЕКК реализуется по
отнощении к клеткам с потерянной или ослабленной способностью
экспрессии HLA-антигенов.В целом можно заключить, что сам факт наличия ассоциации
между конкретными HLA-специфичностями, гаплотипами и геноти¬
пами, с одной стороны, и определенными показателями иммунного
статуса человека, с другой стороны, является непреложной истиной.
3.3, Основные функции главного комплекса гистосовместимости ///Однако развитие современной иммунологии несет в себе возможность
совершенно иной трактовки самой основы этих ассоциаций.Дело в том, что многие, если не все иммунологические парамет¬
ры, в отношении которых установлены эти ассоциации, относятся
к показателям не адаптивного, а естественного, или врожденного,
иммунитета человека, изучению которого в последние несколько лет
современная иммунология оказывает все более пристальное внима¬
ние (см. главу 1).Естественный, или, как чаше принято писать в зарубежной литера¬
туре, врожденный иммунитет осуществляет первую и самую быструю
реакцию на вторгающиеся микроорганизмы, такие как грибковые,
вирусы и бактерии. Эффекторные клетки, реализующие естествен¬
ный ответ, разнообразны, но имеют общую способность распознавать
чужеродные агенты, осуществляющие агрессию, и тем самым иници¬
ировать эффективную защиту [390].Безусловно, к факторам естественного иммунитета можно отнести
фагоцитоз и ЕКК. Что касается ответа Т- и В-лимфоцитов на поли¬
клональные митогены, то и в этом случае, хотя целью такого рода
стимуляции является попытка оценить функциональные возможнос¬
ти Т- и В-системы иммунитета, речь скорее идет о врожденном, чем о
приобретенном иммунитете.Учитывая вышесказанное, можно предположить, что правомоч¬
ным может быть альтернативный по отношению к существующему на
сегоднящний день взгляд на вышеуказанные функции иммунитета
как на обеспечение качества иммунного ответа, И соответственно,
альтернативным будет и взгляд на механизмы ассоциаций между
определенными HLA-специфичностями, гаплотипами и генотипами,
с одной стороны, и показателями иммунного статуса — с другой.Такой альтернативой может явиться точка зрения о том, что в основе
этих ассоциаций лежит в действительности ассоциация HLA с уровнем
активности естественного иммунитета (Хаитов P.M., Алексеев Л.П,
[176]). При этом сама по себе гипотеза В, Бодмера, нашедшая свое
реальное подтверждение, о том, что на HLA-профиль отдельных
популяций могли оказать влияние средневековые пандемии, остается
верным, но реализуется она не/или не только через качество иммун¬
ного ответа, ассоциированное с HLA, а/и через ассоциацию HLA с
естественным иммунитетом.При этом следует принять во внимание следующее. Несмотря на
то что исследования в области ассоциаций генов комплекса HLA и
П2Глава 3. Гены иммунного ответакачества иммунного ответа ведутся уже более 20 лет, до настоящего
времени они носят в основном феноменологический характер и меха¬
низмы их реализации пока еще не установлены.Что же касается возможных механизмов ассоциаций HLA и факто¬
ров естественного иммунитета, то следует принять во внимание сле¬
дующие соображения. Во-первых, существуют данные об определен¬
ной взаимосвязи между антигенпредставляющей функцией семейства
молекул CDI, относящихся к факторам естественного иммунитета, и
антигенпредставляющей функцией молекул HLA [616]. Во-вторых,
известно, что такой фактор естественного иммунитета, как ИНФу,
принимает активное участие в процессинге пептидов и их представ¬
лении молекулами HLA (Хаитов P.M. [173]). И наконец, в-третьих,
гены такого важнейшего фактора естественного иммунитета, как
ФНО, относятся к генам системы HLA класса П1 [577]. Помимо этого,
недавно в ГНЦ РФ «Институте иммунологии М3 РФ» были получены
данные об ассоциации определенных специфичностей HLA с актив¬
ностью ИНФу и ряда интерлейкинов.Одной из важнейших физиологических функций системы HLA,
которая, впрочем, довольно тесно связана и с ее основной (или воз¬
можно более известной) функцией — контролем иммунного ответа,
является участие этой системы в процессе репродукции человека.Изучение физиологической роли генов HLA в этой области нача¬
лось в 60-70-е годы прошлого столетия практически одновременно
с работами по изучению возможностей использования доступных в
то время методов HLA-ТИП и рования при селекции пар донор-реци¬
пиент в клинической трансплантологии. Одними из основных пред¬
посылок начала этих исследований явились следующие соображения.
Поскольку плод можно рассматривать как «природный аллотранс¬
плантат», то такого рода работы могут, с одной стороны, быть полез¬
ными при изучении возможности индукции толерантности — цели
клинических трансплантологов, а с другой стороны, могут дать ответ
на вопросы, связанные с такими видами акушерской патологии, как
привычное невынашивание и бесплодие неясной этиологии. При
этом в то время была популярной точка зрения, согласно которой
указанные осложнения беременности могли быть связаны с высоким
уровнем гистонесовместимости матери и плода, т.е. исходили из воз¬
можности прямой аналогии с трансплантациоііньїм иммунитетом.За прошедшие годы эта точка зрения изменилась на прямо про¬
тивоположную, иначе и не могло быть, поскольку беременность —
3.3. Основные функции главного комплекса гистосовместимости ИЗфизиологическая функция организма, в основе которой лежит вре¬
менная иммунологическая толерантность матери к плоду. Напротив,
сама но себе трансплантация отнюдь не является физиологической
процедурой. В действительности же физиологическое проявление
функции иммунитета — отторжение трансплантата.В настоящее время мы знаем, что репродуктивный этап жизнедея¬
тельности млекопитающих, в том числе человека, является одним из
наиболее ярких примеров того, как главный комплекс гистосовмес¬
тимости обеспечивает генетическое разнообразие животного мира.
Хорошо известно, что мыши, крысы и ряд других животных распо¬
знают своих сексуальных партнеров из сородичей и «осуществляют»
дифференциацию между ними именно с помощью молекул МНС.
Причем мыши и крысы «дифференцируют» различие не только на
уровне молекул МНС класса I других животных, но и «улавливают»
даже точечные мутации в этих молекулах. Не совсем ясно, различают¬
ся ли сами полиморфные фрагменты молекул МНС класса I или одо-
ранты, избирательно переносимые антигенами МНС класса I н мочу
животных. Болес вероятен последний вариант, так как обонятельные
органы воспринимают летучие вещества только с молекулярной
массой менее I тыс. Д. Данная функция системы МНС у животных
служит снижению инбридинга гюпуляции животных, так как улавли¬
вание молекул, аналогичных собственным антигенам HLA класса I,
служит табу для сексуального контакта между животными. До недав¬
него времени считалось, что у человека данный механизм ослаблен
или полностью отсутствует. Однако в самое последнее время эта точка
зрения пересмотрена (см. ниже). Хотя следует отметить, что и ранее
было известно, что повышение количества HLA-гомози гот в резуль¬
тате инбридинга как следствия близкородственных браков — крайне
неблагоприятный фактор для здоровья потомства такого рода. Так,
инбридинг резко возрастает в «замкнутых» популяциях, какими до
последнего времени являлись малые этнические группы населения,
проживающие в труднодоступных районах. Естественно, что анало¬
гичная ситуация имеет место и в этнических кастовых или сослов¬
ных группах (нанример, в королевских семьях, где браки по родству
превалировали в течение нескольких поколений). Хорошо известно,
что уже благодаря накоплению генов (и появлению их в гомозиготном
состоянии), связанных с различными нарушениями развития, среди
представителей различных королевских домов зачастую отмечалось
увеличение числа насз1едственных заболеваний и уродств. В послед¬
1І4Глава 3. Гены иммунного ответанее время точка зрения о том, что обоняние человека, в отличие от
животного, не дает возможность оценить совместимость по HLA с
предполагаемым партнером по браку была пересмотрена, но в опре¬
деленных случаях браки заключаются между мужчиной и женщиной
частично, а иногда и полностью HLA-идентичными. Последнее может
быть связано с тем, что при заключении брака партнерами принима¬
ются во внимание и многие социальные, материальные и психологи¬
ческие факторы, комплекс которых может иметь для будущей семьи
решающее значение.Что же касается полной HLA-совместимости супругов, то на пер¬
вый взгляд, теоретическая вероятность ее более чем ничтожна, по¬
скольку из-за крайне высокой степени полиморфизма системы HLA
средняя вероятность полной HLA-идентичности двух произвольно
взятых людей приближается к 1 на миллион. Однако на практике
вероятность негативного проявления HLA-совместимости значитель¬
но выше. Во-первых, имеет значение не только полная совместимость,
но и частичная, и, по-видимому, наиболее отрицательную роль может
играть совместимость по специфичностям гена HLA-DRB{, который,
как указано выше, относится к локусу HLA-DR, в который входят
гены иммунного ответа человека и совместимость по которому (игра¬
ет) вносит наибольший вклад в случае подбора тканесовместимых
пар при трансплантации органов. Необходимо отметить также, что
в большинстве популяций мира совместимость по специфичностям
гена HLA-DRBI встречается приблизительно на два порядка чаще, чем
полная HLA-совместимость.Во-вторых, даже в больших популяционных группах имеется
значительное количество людей, в генотипе которых отдельные или
группы генов HLA находятся в гомозиготном состоянии. Так, напри¬
мер, в популяции русских, проживающих в Москве, количество гомо¬
зигот по специфичностям HLA-DRB1 класса И составляет более 15%.
В данной ситуации достаточно, чтобы в HLA-генотипе гетерозигот¬
ного партнера присутствовал один из HLA-антигенов, находящихся в
гомозиготном состоянии у другого. Исходя из законов наследования
HLA-антигенов (кодоминантный принцип), по которым строго поло¬
вина HLA-набора ребенка наследуется от отца, а вторая половина —
от матери, результатом с высокой вероятностью может явиться иден¬
тичность матери и плода по антигенам, которые присутствовали у
одного из родителей в гомозиготном состоянии. Следующей причи¬
ной, повышающей вероятность первой, является тот факт, что часто¬
,'L3. Основные функции главного комплекса гистосовместимости 115та HLA-анти генов в популяциях весьма варьируется — от тысячных
долей процента до десятков процентов. И естественно, что люди,
имеюшие в HLA-генотипе «высокочастотные» HLA-антигены, имеют
более высокую вероятность встречи с человеком, имеющим этот
же антиген HLA в гетерозиготном состоянии. Наконец, последней
причиной, относящейся далеко не ко всем популяционным и этни¬
ческим группам, является то, что на земном шаре помимо больших
этнических групп или групп, проживающих в условиях постоянного
контакта этноса в течение исторически значимого периода, име¬
ются малые этнические изолированно проживающие группы. Эти
группы, в отличие от первых, «пользующихся» практически всем
HLA-разнообразием (в этих группах с той или иной частотой встре¬
чаются практически все HLА-специфичности), «используют» весьма
ограниченный набор HLA-специфичностей. Естественно, что в по¬
следних группах весьма высок уровень частотных HLA-антигенов и
HLA-гомозигот. На территории России, особенно на севере, прожива¬
ет значительное количество таких групп. Помимо этого, существуют
искусственно сформировавшиеся группы, для которых характерна та
же самая ситуация. Примером могут служить некоторые религиозные
секты, принадлежащие к большим этническим группам, но в течение
длительного времени проживающие малыми группами в условиях
изоляции.Так или иначе, ясно, что для человека, в отличие от животных,
вероятность идентичности супругов хотя бы по части HLA-антигенов
достаточно высока, и это, естественно, предоставило возможность
природе наглядно продемонстрировать возможные последствия этого.Одним из наиболее демонстративных таких проявлений является
роль HLА-совместимости супругов в репродукции.Следует отметить, что с проблемой «HLA и репродукция» в опре¬
деленной степени связано само становление и развитие изучения
системы HLA. Дело в том, что первооткрыватель системы HLA фран¬
цузский иммуногематолог, лауреат Нобелевской премии Ж. Доссе,
поставивший перед собой задачу найти способ выявления антигенов
гистосовместимости, исходил в своей работе из следующей цепи
предпосылок. Ребенок, находящийся в утробе матери, содержит часть
антигенов, полученных от отца, и против них иммунная система
матери должна развивать иммунный ответ, т.е. против этих антигенов
должны появиться антитела. Эти антитела можно будет выделить из
крови матери и затем использовать для идентификации антигенов,
116Глава 3. Гены иммунного ответапротив которых они были выработаны. Идея оказалась полностью
верной и плодотворной, поскольку Ж. Доссе действительно уда¬
лось получить антитела, идентифицирующие первый HLA-антиген,
названный им «МАС», и индуцировать целый поток работ по выяв¬
лению других HLА-специфичностей с помощью предложенного им
подхода. Впоследствии была организована целая Международная
неправительственная организация по изучению системы HLA, объ¬
единяющая в настоящее время несколько тысяч научных коллекти¬
вов, издающая собственные журналы, проводящая международные
конгрессы и конференции, ж. Доссе, который остается до настоящего
времени одним из руководителей этого объединения, во время цере¬
монии вручения ему Нобелевской премии за открытие системы HLA,
сказал, что данная область науки является наиболее ярким примером
гуманитарного сотрудничества, в которой неприемлемо даже патен¬
тование результатов исследования.Что же касается проблемы «HLA и репродукция», то после первых
успехов в области получения указанным выше путем HLA-типиру-
ющих сывороток от рожавших женщин вполне естественным было
появление мнения о том, что с иммунологической точки зрения
плод следует рассматривать как природный трансплантат. А отсюда
также закономерным являлось, как было указано выше, и проведе¬
ние ряда более широких аналогий между плодом и трансплантатом.
И поскольку к началу 1960-х годов уже было накоплено достаточно
данных о механизмах трансплантационного иммунитета, который
также является одной из физиологических функций иммунной
системы, многие представления о нем были перенесены на про¬
блему «Иммунология репродукции». А исходя из этого можно было
предположить, что, как и в трансплантационном иммунитете, обна¬
руженные цитотоксические анти-НЕА-ангитела в крови, являясь
проявлением иммунного ответа на плод, одновременно выполняют
неблагоприятную роль в развитии последнего, а возможно, и участ¬
вуют в реализации механизмов акушерских патологий. Следующим,
вытекающим из предыдущего, явилось заключение о том, что небла¬
гоприятным является и наличие HLA-несовместимости между мате¬
рью и плодом, как, собственно, это имеет место и при транспланта¬
ции органов. Таким образом, можно сказать, что сформировалось
представление, согласно которому система МНС играла в репродук¬
ции человека прямо противоположную роль той, которую, как мы
знаем теперь, она играет у животных.
:{.3. Основные функции главного комплекса гистосовместимости 1J7В последующем это представление претерпело более чем серьез¬
ные изменения, и сегодня ясно, что и у человека система HLA создает
условия, препятствующие появлению HLA-гомозиготного потом¬
ства, и хотя медицинские мероприятия в ряде случаев могут «преодо¬
леть противодействие», отдельные HLA-гомозиготные индивидуумы
имеют повышенный риск развития целого ряда патологий.Что же касается конкретной роли HLA в репродукции, то сле¬
дует отметить, что неблагоприятные последствия даже «неполной»
HLA-совместимости прослеживаются на различных этапах бере¬
менности. Так, одной из акушерских патологий, где проявляется
неблагоприятная роль совместимости матери и плода по антигенам
HLA, является такая патология беременности, как привычное, или
идиопатическое, невынащивание [6, 7]. Эта патология характеризу¬
ется многократными выкидыщами у женщин, всестороннее обследо-
1шние которых не позволяет выявить каких-либо видимых оснований
для выкидыша. Примечательно также, что многие из этих женщин в
новых браках имеют нормальную беременность.Было проведено сопоставление HLA-совместимых по антигенам
HLA классов I и П супругов в группе с нормально протекающей бере¬
менностью и беременностью, неоднократно прерывающейся спон¬
танными абортами. В результате было установлено, что в группе с
физиологически протекающей беременностью более чем в половине
случаев муж и жена были полностью HLA-несовместимы. Процент
HLA-совместимых пар по антигенам класса I составил около 2% при
полном отсутствии совместимых пар по антигенам HLA класса П.Напротив, в группе женщин с привычной невьтнащиваемостью
только в 26% муж и жена оказались несовместимыми по антигенам
HLA класса I, в то время как в более чем половине случаев они оказа¬
лись совместимы по антигенам HLA класса И.Другой акушерской патологией, при которой проявляется роль
антигенов HLA в репродукции, является так называемая переношен¬
ная беременность.В исследовании, выполненном Л.П. Алексеевым и соавт. [6, 7],
было установлено, что в организме женщин с переношенной беремен¬
ностью в отличие от женщин с физиологически протекающей бере¬
менностью в момент родоразрешения полностью отсутствуют ЦТЛ,
специфическая активность которых была бы направлена против кле¬
ток мужа. Оказалось, что в период беременности и вплоть до родораз-
решения активность этих ЦТЛ, как и реакция в СКЛ против клеток
ÍIS Глава 3. Гены иммунного ответамужа, была угнетена. Но в случае нормально протекающей беремен¬
ности, где муж и жена были HLA-неидентичны, в период родоразре-
щения наблюдали активацию ЦТЛ и резкое повыщение уровня СКЛ
в комбинации жена-муж. Установлено также, что в значительном
проценте случаев перенощенной беременности имеет место совмес¬
тимость между супругами по HLA-антигенам. Правомочность пред¬
положения, что специфическая активация аллореактивных клеток
в процессе родоразрсщения может служить одним из полноценных
(а возможно, и основным) участником процесса родоразрешения, под¬
тверждается тем, что, как известно, аллоиммунный ответ, т.е, ответ на
антигены МНС, является наиболее сильным из известных ответов на
чужеродные антигены [705, 752]. Более того, можно предположить, что
уникальный по силе характер именно этого вида иммунного ответа
определяется тем, что его физиологической ролью является именно
обеспечение процесса родоразрешения.Таким образом, совместимость супругов, которая в ряде случаев
приводила к HLA-совместимости между матерью и плодом, не позво¬
ляла активироваться Т-эффекторам, активно участвующим в процес¬
се физиологического родоразрешения.Естественно, что для человека данный вид патологии не является,
как правило, летальным для потомства, как это, по-видимому, имело
бы место в животном мире.Таким образом, система HLA у человека, по-видимому, частично
утеряв функцию выбора сексуального партнера, тем не менее пыта¬
ется защитить его от появления HLA-гомозигот, поскольку, как это
обсуждалось ранее, именно высокий HLA-полиморфизм является
необходимым условием для осуществления полноценной иммуно-
регуляторной функции системы HLA. Этот сделанный нами вывод
(Хаитов P.M. [173]) практически полностью подтвержден А. Ziegler
et al. [872], прищедщим к заключению о том, что именно участие сис¬
темы HLA в контроле за репродуктивным процессом уже на самом
начальном уровне (взаимодействие сперматозоид—яйцеклетка) поз¬
воляет избежать дорогостоящих вложений в эмбрион с потенциально
неоптимальными генетическими и иммунологическими свойствами.К указанному заключению А, Ziegler привели данные, полученные
им и сотрудниками его лаборатории при исследовании влияния на
«выбор партнера» и участие в инициации репродуктивного процесса
ассоциированных с HLA генов, кодирующих олфакторный рецеп¬
тор. При проведении данной работы было обнаружено, что выявля¬
3,3. Основные функции главного комплекса гистосовместимости ¡19емые в сперматоцитах в первой стадии и сперматозоидах антигены
HLA класса I не имеют в своей структуре р^-т и, являясь по существу
неполной молекулой HLA, не могут участвовать в иммунных про¬
цессах. Функция этих иммунологически неполноценных молекул
связана с функцией олфакторных рецепторов и ограничивается
лишь участием в репродуктивном процессе, обеспечивая процесс
селект^ии на сперматозоидах только тех олфакторных рецепторов,
которые не способны распознавать собственные молекулы. Поэтому
экспрессированные на сперме олфакторные рецепторы внутри жен¬
ского пути репродукции способны распознавать только лиганды,
отличающиеся от тех, с которыми олфакторные рецепторы взаимо¬
действовали при тестикулярной селекции. Именно таким образом,
ио-видимому, может осуществляться участие HLA-системы, реали¬
зуемой через партнера.Все вышеприведенные данные касались исследования роли HLA-
совместимости партнеров без попытки анализа того, могут ли отдель¬
ные конкретные HLA-специфичности в генотипе партнера или парт¬
нерши влиять на выбор партнера, возникновение и течение беремен¬
ности. Разумеется, такого рода исследования проводились и ранее, и
наибольшее их количество приходится на конец 60-х - начало 70-х
годов прошлого века. Можно сказать, что только в одном из них [326],
выполненном на значительном материале, были получены достовер¬
ные результаты. Авторам удалось показать, что при данной патологии
у женщин повышена частота специфичности HLA-DRP04.В самое последнее время в ГНЦ РФ «Институт иммунологии М3 РФ»
проведено исследование, в котором была предпринята попытка изу¬
чения особенностей генотипа HLA-DRB1 у обоих партнеров в парах с
привычной невынашиваемостью беременности. При этом не только
было подтверждено повышение частоты специфичности -DRB1*04 у
женщин, но и установлены специфичности, наличие которых отрица¬
тельно ассоциировано с данной патологией. Ими оказались -DRBl*07 —
у женщин и -DRBl*01, *06 ~ у мужчин [25,274,275]. Эти данные, помимо
возможности их использования в клинике акушерства и гинекологии,
могут быть рассмотрены и с фундаментальной точки зрения. Дело в
том, что наличие отрицательных и положительных ассоциаций между
конкретными HLA-специфичностями и патологиями беременности,
препятствующих, или наоборот, способствующих репродуктивному
процессу у лиц, несущих в генотипе данные специфичности, влияет на
частоту этих специфичностей в популяции.
120Глава 3. Гены иммунного ответаТаким образом, при рассмотрении формирования генетическо¬
го профиля популяции в значительных временных этапах данный
феномен может оказать влияние на HLA-полиморфизм, сопоставимое
с действием средневековых эпидемий и пандемий, результатом кото¬
рых, как считается [272, 273, 420], является HLA-профиль основных
европейских популяций.Все вышесказанное касалось так называемых «классических»
HLA-антигенов, описанных и хорошо изученных в 1960-1980-е годы.
В разделе 3.2 были приведены также данные о так называемых новых
антигенах, генах и локусах, открытых в последние годы. Среди них
шла речь о молекулах локусов HLA-G и HLA-E класса I, функция
которых еще недавно была неясна. Как отмечалось в указанном раз¬
деле, первоначально антигены, кодируемые локусом HLA-G, были
выявлены на хориокарциномной клеточной линии, а также на мем¬
бране клеток больных хроническим цитотрофобластозом [363]. Это
послужило основанием для предположения о том, что физиологиче¬
ская функция этих HLA-молекул может быть связана с репродукцией.К настоящему времени биологическая функция аллелей локуса
HLA-G и их продуктов значительно более исследована. Так, оказа¬
лось, что в отличие от молекул HLA классов Н и I (за исключением
антигенов локуса HLA-C), которые не экспрессированы на трофо-
бласте [512J, молекулы локуса HLA-G экспрессируются на данном
виде тканей [738], так же как и молекулы локуса HLA-E [498]. Эта экс¬
прессия, в свою очередь, отражает, как это было установлено позже,
биологическую роль молекул HLA-G — их участие в процессе репро¬
дукции [816]. При этом появился ряд работ, связывающих функцию
антигенов локуса HLA-G с ролью в репродуктивном процессе ЕКК.
Так, в работе Т. Yamamoto et al. [860] была установлена взаимосвязь
между уровнем активности ЕКК и экспрессией антигенов локуса
HLA-G, с одной стороны, и характером течения беременности —
с другой. Низкая экспрессия молекул HLA-G на уровне высокой
активности NK-клеток была ассоциирована с развитием повторных
спонтанных выкидышей. Данные, полученные при исследовании
динамики экспрессии молекул HLA-G, позволили Р. Le Bouteiller
et al. [539] и L. Pazmany et al. [667] сделать заключение о том, что
физиологическая функция указанных молекул может лежать в основе
развития толерантности организма матери по отношению к плоду
и что реализация этого механизма осуществляется через блокаду
активности ЕКК. Результаты последующего изучения механизмов
:L3. Основные функции главного комплекса гистосовместимости 121(|)ункций антигенов HLA-G и HLA-E были подведены на состояв¬
шемся в июне 2003 г. (Родос, Греция) IV Международном конгрессе
Европейского общества иммунологии репродукции и развития. На
конгрессе значительное число сообщений так или иначе было посвя¬
щено новейшим данным о роли антигенов HLA-G при физиологиче¬
ской беременности и ее патологиях. Одно из значимых результатов
рассмотренных и обсужденных сообщений — существенное расшире¬
ние представлений о роли ЕКК в этих процессах. Последнее связано
с тем, что именно продукты локуса HLA-G, а также локуса HLA-E
участвуют в регуляции активности ЕКК, которые в свою очередь
являются, как это стало известно, одним из важнейших участников
перестройки иммунной системы, сопровождающей беременность и
определяющей ее течение — физиологическое или патологическое
1539, 645, 686]. Так, Е. Ntrivalas et al. [645J показали, что в лютеаль-
ной фазе менструального цикла увеличивается количество ЕКК, их
количество еще более возрастает в первый триместр беременности.
Этот процесс отражает физиологическую роль ЕЕК в контроле чрез¬
мерной инвазии трофобластов и в предотвращении местной инфек¬
ции. Однако при избыточной функции ЕКК могут возникать такие
осложнения, как преэклампсия и повторное невынашивание. В этом
процессе участвуют ЕКК, несущие маркер CD69, а антигены HLA-G
выступают в качестве фактора, регулирующего активность ЕКК этого
фенотипа. При нормально протекающей беременности на клетках
трофобласта экспрессируются антигены HLA-G (отсутствуют в орга¬
низме вне беременности), подавляющие активность ЕКК [539, 645,
686]. Принципиальная схема взаимоотношений экспрессии белков
HLA-G и HLA-E на трофобласте и активности ЕКК при физиологи¬
ческой беременности приведена на рисунке 18. И именно недостаточ¬
ность экспрессии HLA-G на трофобласте является пусковым меха¬
низмом для развития вышеуказанных патологических состояний.
При этом следует отметить, что иммунизация лимфоцитарной взве¬
сью приводит к повышению экспрессии на трофобласте HLA-G анти¬
генов [686] и обеспечивает благоприятный терапевтический эффект.Экспрессия на трофобласте антигенов HLA-G в мембранно-свя¬
занной и (или) в растворимой формах является не единственной функ¬
цией генов HLA-G и их продуктов. По-видимому, они принимают
непосредствешюе участие в регуляции иммунной системы и другими
способами. Так, по данным Р, Le Bouteiller et al. [539|, зарегистрирова¬
на экспрессия антигенов локуса HLA-G на клетках эндоваскулярного
122Глава 3. Гены иммунного ответаNK активность HLA-G, -Е экспрессияNK J +Рис. 18. Принципиальная схема взаимоотношений экспрессии белков HLA-
G и HLA-E на трофобласте и активности ЕКК при физиологической бере¬
менностиэпителия сосудов матки, в растворимой форме антигены HLA-G кон¬
тролируют процесс васкуляризации плаценты. Этими же авторами
установлено, что помимо регуляции активности ЕКК антигены локу¬
са HLA-G оказывают прямое супрессивное действие на функциональ¬
ную активность Т-лимфоцитов фенотипов CD4 и CD8. Более того,
Т-лимфоциты фенотипа CDS, специфичные к иммунодоминантным
пептидам ЦМВ, проявляют цитотоксическую активность, ограни¬
ченную антигенами локуса HLA-G [539].Следует отметить, что представленные данные — это лишь пер¬
вые сведения о физиологической значимости антигенов HLA-G.
Предстоит дальнейшее изучение этой проблемы. Один из актуальных
Л.З. Основные функции главного комплекса гистосовместимости 123іюпросов, требующих решения, заключается в анализе роли поли¬
морфизма генов, кодирующих эти молекулы, в осуществлении их
полноценной функции. На сегодняшний день ответ на этот вопрос
неоднозначен. Так, по данным К. Van der Ven et al. [815], взаимосвя-
т между конкретными аллельными вариантами антигенов HLA-G
и их физиологической активностью не установлены. В то же время
М. Grzywacz. et al. [421] представили данные о наличии ассоциации
между аллельным вариантом HLA-G*01018 и осложнениями беремен¬
ности, связанными с нарушением экспрессии антигенов HLA-G на
I канях, обеспечивающих физиологическую беременность.Из числа «неклассических» HLA-антигенов помимо антигенов
локуса HLA-G, в регуляции иммунитета при репродукции принима¬
ют участие и специфичности локуса HLA-E [782]. Однако в отличие
от функции молекул HLA-G активность этих антигенов направлена
на регуляцию цитотоксичности не ЕКК, а Т-лимфоцитов, в частнос¬
ти их субпопуляции, экспрессирующей молекулы Vdelta 2. Авторами
показано, что при физиологической беременности антигены HLA-
Е, экспрессированные на трофобласте, распознаются указанным
субтипом Т-лимфоцитов через рецепторы CD94/NKG2. Результатом
этого взаимодействия является запуск апоптоза субпопуляции, экс¬
прессирующей антиген Vdelta 2. Нарушение этого эффекта и возрас¬
тание процента указанной субпопуляции цитотоксических Т-клеток
на фоне снижения численности клеток, экспрессирующих антиген
Vdelta 1, играет важную роль в развитии патологии беременности.Как зачастую это имеет место в биологии и медицине, та или иная
физиологическая функция при изменении качественных и количе¬
ственных параметров может перейти в свою противоположность, т.е.
принять участие в развитии патологического процесса. Это относится
и к описанным выше молекулам «неклассических» HLA-антигенов.
Так, в работе R. Marin et al. [576], исследовавших экспрессию антиге¬
нов HLA-E на 40 линиях опухолевого происхождения, были опреде¬
лены молекулы HLA-E, экспрессированные на их поверхности. Более
того, С. Pangault et al. [658] выявили экспрессию антигенов HLA-G на
опухолевых клетках больных раком легких.Несмотря на то что такого рода работы относятся к пилотным
исследованиям, можно предположить, ЧТО дальнейшие разработки в
данном направлении могут оказаться перспективными как для пони¬
мания патогенеза онкологических заболеваний, так и для разработки
новых подходов к их диагностике и прогнозированию.
124 Глава З, Гены иммунного ответаПодводя итоги изложению современных представлений о физио¬
логической роли системы HLA, следует еще раз напомнить, что пред¬
ставленные в настоящей главе данные свидетельствуют о ключевой
роли молекул HLA не только в развитии иммунного ответа, но и в
обеспечении целого ряда важнейших физиологических функций
человека и что возможность такого многообразия функций системы
HLA напрямую связана с чрезвычайно высоким уровнем полимор¬
физма данного генетического комплекса. Следует при этом добавить,
что наши представления об этом уровне отнюдь не являются оконча¬
тельными. Так, на состоявшемся летом 2004 г. в Монреале (Канада)
Международном конгрессе по иммунологии была представлена целая
группа сообщений, посвяиіенньїх изучеіїию репертуара Т-клеточно¬
го рецептора, взаимодействующего с молекулами МНС в развитии
иммунного ответа. При этом было установлено, что одна и та же
молекула МНС способна взаимодействовать с различными участ¬
ками Т-клеточного рецептора, что проявляется в вариабельности
иммунного ответа. Таким образом, естественно, молекула МНС ока¬
зывается вовлеченной и в этот вид полиморфизма иммунного ответа.
Установлению этих данных способствовало создание принципиально
новых методических подходов, в основе которых лежит эффект взаи¬
модействия молекулы МНС и представляемого ею пептида. Это так
называемые системы МНС-тетрамеров и МНС-пентамеров, которым
принадлежит будущее как в фундаментальных, так и в прикладных
исследованиях. Это обусловлено тем, что данные системы, осно¬
ванные на визуализации специфического взаимодействия молеку¬
лы МНС/пептид, позволяют всесторонне оценивать специфический
иммунный ответ на любой иммуноген вирусного, бактериального
или собственного измененного происхождения. Естественно, что этот
подход, который на сегодняшний день в основном продемонстриро¬
ван на экспериментальных моделях, займет свое место и при дальней¬
шем изучении физиологической роли системы HLA.На этом же конгрессе была подведена черта под дискуссией о воз¬
можности включения в состав системы HLA двух новых неклассиче¬
ских HLA-генов. Речь идет о генах, кодирующих молекулы CDlu,
CDlb и CDlc, участвующих в регуляции естественного иммуните¬
та. Их включение в состав системы HLA фактически расширяет ее
физиологическую функцию и, естественно, открывает новую страни¬
цу в ее изучении.
Глава 4ВОЗБУЖДЕНИЕ И ТОРМОЖЕНИЕ
ИММУННОЙ СИСТЕМЫ4J. МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ПРОВЕДЕНИЯ
СИГНАЛОВ ВНУТРЬ КЛЕТКИКак отмечалось выше (см. главу 2), клетки системы иммунитета
находятся в состоянии непрерывного взаимодействия как с лиганда¬
ми клеточных элементов, включая клетки системы иммунитета, так
и с лигандами других биологически активных веществ — цитоки¬
нов, гормонов, нейромедиаторов, патогенов, продуктов взаимодейс¬
твия патогенов с тканями организма, лекарств, Это взаимодействие
обеспечивается связыванием молекул лигандов, химически компле¬
ментарных связывающим структурам поверхностного рецепторно¬
го аппарата клетки. Исключение для связывания поверхностными
рецепторами составляют лиганды, которые комплементарны рецеп¬
торам внутриклеточных органелл.Связывание лиганд—рецептор сопровождается изменением конфи¬
гурации последнего и является первичным пусковым этапом в цепи
каскадного взаимодействия соответствующих внутриклеточных моле¬
кул, обеспечивающего передачу сигнала внутрь клетки и приводящего
(в зависимости от рецептора и взаимодействующего с ним лиганда, а
также от участия в проведении сигнала внутриклеточных регулятор¬
ных молекул) к активации или торможению ее функций [695, 846].
Проведение сигнала внутрь клетки является также одним из механиз¬
мов развития апоптоза — программируемой клеточной гибели.Ключевой этап клеточной активации, опосредуемой через рецеп¬
торы активирующего типа — фосфорилирование цитоплазматических
доменов, содержащих аминокислотные последовательности ІТАМ
(от Immunoreceptor tyrosine-based activation motif, тирозинсодержащие
активационные последовательности аминокислот в иммунорецепто¬
рах) и в дальнейшем именуемых доменами ІТЛМ. Эти домены харак¬
теризуются наличием двух функционально различных участков [775]
с аминокислотной последовательностью YxxL/1. Участки отделены
126Глава 4. Возбуждение и торможение иммунной системыдруг от друга семью аминокислотами и в общем виде могут быть пред¬
ставлены как YxxL/1-xxxxxxx-YxxL/I, где Y — тирозин; L — лейцин;
I — изолейцин; X — какой-нибудь аминокислотный остаток 1278, 822].
Домены 1ТАМ являются частью цитоплазматического региона цепей
рецепторного комплекса, содержатся в разных количествах в составе
различных активационных рецепторов фагоцитов, NK-клеток, Т- и
В-лимфоцитов.Интенсивные исследования последних лет, направленные на
изучение механизмов образования сигнальных молекул, активиру¬
ющих клеточные функции, выявили каскадный характер процесса
формирования сигнальных путей, показали наличие разных типов
сигнальных молекул, охарактеризовали молекулярные процессы,
индуцируемые взаимодействием лиганд-рецептор, установили обще-
биологическую значимость процессов возбуждения и торможения
иммунной системы в защите организма от генетической чужероднос¬
ти, показали роль сигнальных путей в развитии иммунопатологий
(аутоиммунные нарушения, воспалительные заболевания, новооб¬
разования и др.) при их врожденной недостаточности, генетическом
нокауте или мутациях. Было установлено, что в целом механизмы
формирования клетками системы иммунитета сигнальных путей
достаточно консервативны. Вместе с тем наряду с идентичностью
многих этапов формирования и прохождения сигналов, индуциру¬
емых активацией указанных доменов рецепторных структур, имеются
и существенные различия, определяемые наличием отдельных специ¬
ализированных внутриклеточных молекул сигнального пути, харак¬
терных для этих клеток. Их характеристика дана ниже.4J.1. МОЛЕКУЛЯРНЬГЕ МЕХАНИЗМЫ ФОРМИРОВАНИЯАКТИВИРУЮЩИХ СИГНАЛЬНЫХ ПУТЕЙ ФАГОЦИТОВ,
ОПОСРЕДОВАННЫЕ ЧЕРЕЗ ЕС* И TOLL-ПОДОБНЫЕ РЕЦЕПТОРЫКак уже отмечалось, фагоцитоз — одна из важнейших защитных
клеточных реакций врожденного иммунитета, направленных на эли¬
минацию попавших в организм патогенов. Значимость фагоцитоза в
системе защитных реакций организма определяется и тем, что форми¬
руемые при этом процессы являются пусковыми для индукции реак¬
ций адаптивного иммунитета. Без осуществления конечной реакции
фагоцитарного процесса — представления комплекса собственных
4. f. Молекулярные механизмы проведения сигналов внутрь клетки 127;1нтигенов МНС и пептидов переваренного фагоцитами антигена для
его распознавания лимфоцитами — развитие специализированных
реакций гуморального или клеточного иммунитета невозможно.
Процессы активации фагоцитов в существенной степени определя¬
ются формированием сигнальных путей, индуцируемых взаимодейс-I вием лигандов с Fc- и ТоИ-подобными рецепторами — TLR (Toll-Iike
receptors) фагоцитов [187].Многочисленными исследованиями установлено, что распозна¬
вание и связывание поверхностными рецепторами соответствующих
лигандов (например, рецепторами для Fc-фрагмента иммуноглобули¬
нов класса IgG, опсонизирующих микробную клетку) сопровождает¬
ся полимеризацией цитоплазматического G-актина в Р-актин в зоне
контакта лиганд-рецептор, обволакиванием обогащенной актином
мембраной фагоцитированной частицы с образованием фагосомы,
слиянием фагосомы с богатой кислыми протеазами и гидролазами
л изосомой и расщеплением литическими ферментами фагоцитиро¬
ванного материала.Одни из ключевых регуляторов состояния актина цитоскелета —
члены семейства молекул низкомолекулярньтх гуанозинтрифосфатаз
Rho — Rae, Rho, Cdc42 [813]. Эти молекулы координируют динамику
изменений актина в процессе адгезии клетки, ее миграции, участвуют
в сигнальном каскаде, включая активацию киназ МАР (Mitogen-acti-
vated protein kinase, МАРК) при воспалительном ответе, индуциро¬
ванном в процессе фагоцитоза, и последующую активацию факторов
транскрипции, таких как белок АР-1 (Activator protein-1).В результате активации профессиональные фагоциты (макрофа¬
ги, моноциты, нейтрофилы), продуцируя и секретируя биологически
активные молекулы (цитокины, компоненты комплемента, литиче-
ские ферменты, окислительные радикалы, гормоны и др,), обеспечи¬
вают развитие доиммунного воспаления и, представляя молекулы
переработанного антигена антигенраспознающим лимфоцитам, учас¬
твуют в становлении приобретенного иммунитета. Эти превращения
клетки, начиная от полимеризации актина до секреции продуктов
фагоцитов, осуществляются под влиянием сигналов, генерируемых в
результате взаимодействия лиганд-рецептор.Важнейщий этап фагоцитоза, индуцирующего формирование
сигнального пути, — фосфорилирование цитоплазматических сиг-
налпроводящих доменов Fc-рецепторов — молекул ТТАМ проте-
интирозинкиназами — РТК (Protein tyrosine kinase) семейства Src.
i2SГлава 4. Возбуждение и торможение иммунной системыВзаимодействие этих молекул приводит к блокированию ингибито¬
ров тирозинкиназ, что обеспечивает дальнейшее прохождение сигна¬
ла в клетку.РТК семейства Src содержат молекулы Fyn, Lyn, Lek, Вік, c-Src и др.
[317, 822], характеризуются конститутивной связью с клеточной мем¬
браной и наличием гомологичных доменов SH (Src-homology), прояв¬
ляющих киназную активность (домен SH1) или взаимодействующих с
другими молекулами белков (домены SH2 и SH3). При этом домен SH2
связывается с молекулой ITAM по фосфотирозину, а домен СНЗ —
с другими белками по участкам, обогащенным пролином. Другими
словами, возникают так называемые белок-белковые взаимодейс¬
твия, играющие важнейшую роль в функционировании сигнальных
механизмов. Ферментативная активность киназ семейства Src в зна¬
чительной степени определяется степенью фосфорилированности
важнейших участков этих молекул — киназного домена и С-концево-
го участка [822]. В зависимости от места фосфорилирования тирозина
молекула фермента становится активной, ее каталитическая актив¬
ность существенно возрастает (фосфорилирование киназного домена)
или, наоборот, киназа теряет активность и фермент инактивируется
(фосфорилирование в области С-концевого участка).Фосфорилирование С-конца киназ семейства Src осуществляет
РТК Csk (С-terminal Src kinase), конститутивно активная в неделящих-
ся клетках. В свою очередь ингибирующая активность киназы Csk
существенно зависит от активности трансмембранной протеинтиро-
зинфосфатазы (РТР) CD45 (общий антиген всех лейкоцитов), удаля¬
ющей фосфат с остатка тирозина в С-конце молекул киназ семейства
Src. Это отменяет ингибиторное действие киназы Csk на Src и усили¬
вает сигнал, индуцируемый взаимодействием лиганд-рецептор [800].Фосфорилирование киназами семейства Src цитоплазматических
доменов Fc-рецепторов — молекул ITAM — вовлекает в процесс даль¬
нейшего формирования сигнального пути молекулы Syk — 8Н2-содер-
жащие РТК [304,535,819,822,846], как и Src, подавляющие активность
блокаторов тирозинкиназ [822]. Показано, что Syk экспрессируют не
только макрофаги, но и В-лимфоциты, тучные клетки, тромбоциты,
незрелые тимоциты и Т-клетки, ЕКК. Эти РТК также регулируются
процессами фосфорилирования по тирозиновым остаткам,Фосфорилирование тирозина киназного домена молекулярных
структур семейства Syk сопровождается ферментативной активацией
этих молекул и опосредуется процессами аутофосфорилирования или
4. /. Молекулярные механизмы проведения сигналов внутрь клетки 129киназами семейства Src. Ингибиторное фосфорилирование киназ
семейства Syk, особенно в связующем (линкерном) домене, приво¬
дит к угнетению их активности вследствие вовлечения в реакцию
негативного регулятора — молекулы с-СЫ (продукт протонкогена).
Эти молекулы экспрессируются макрофагами, Т- и В-лимфоцитами,
тучными клетками, они способны связываться с киназами Src, Syk,
РІЗ, адаптерным белком Grb-2 и другими белковыми молекулами.
Другая молекула семейства СЫ — СЫ-Ъ также играет критическую
роль в формировании сигнального пути. При рецепторной активации
СЫ-Ь, как и с-СЫ, фосфорилируется киназами Src и Syk, способна
связываться с киназами Src, Syk, РІЗ, PLCy и другими белковыми
молекулами и оказывать ингибирующее действие на формирование
сигнального пути [567, 714, 799].Помимо киназ семейств Src, Syk и СЫ, важнейшую роль в формиро¬
вании каскадного сигнального пути фагоцитов и ряда других клеточ¬
ных популяций системы иммунитета играет семейство киназ МАР. Это
семейство характеризуется наличием щести модулей. Наиболее изу¬
чены из них три — киназы, регулируемые внеклеточным сигналом —
ERK (Extracellular signal regulated kinases), протеинкиназы, активиру¬
емые стрессом — SAPK (Stress activated protein kinases) или NHj-терми¬
нальные киназы c-Jun — JNK (c-Jun N-terminal kinases) и киназы p38
(p38 kinase) [292, 579, 792]. Семейство киназ MAP контролирует экс¬
прессию генов, регулирующих многие клеточные функции, включая
пролиферацию клеток, их дифференцировку, выживание и апоптоз.Процесс формирования сигнального пути с участием киназ
семейства МАР представлен на рисунке 19. Как уже отмечалось, в
результате фосфорилирования на молекуле ТТАМ формируются учас¬
тки связывания для различных клеточных белков, содержащих домен
SH2 — РТК и адаптерных белков, обеспечивающих связь с другими
молекулами формирующегося сигнального пути и прохождения сиг¬
нала внутрь клетки. В результате активации рецептора лигандами,
например факторами роста или дифференцировочными факторами
(рис. 19, а), через такие участки ITAM связывается с SH2-несущим
адаптерным белком She, который в свою очередь связывается с дру¬
гим адаптерным белком Grb2 (Growth-factor-receptor-bound protein 2),
конститутивно ассоциированным с фактором Sos (Son of sevenless) —
фактором замещения гуаниннуклеотидов (GEF, Guanine-nucleotide
Exchange Factor) в малых G-белках, в частности в белках Ras. Под вли¬
янием Sos/GEF происходит замещение гуаниндифосфата на гуанин-
ЇЗОГлава 4. Возбуждение и торможение иммунной системытрифосфат, замена Ras-GDP на Ras-GTP и, как следствие, активация
белка Ras, заякоренного в клеточной мембране.В этих реакциях важная роль принадлежит протеинкиназе Raf.
Связываясь N-концевым доменом с активированным белком Ras,
киназа Raf транслоцируется в клеточную мембрану, фосфорилирует
и активирует киназу МЕК (MAPK/ERK kinase), соединяясь с ней
С-концевым доменом. Киназа МЕК, будучи ферментом с двойной
специфичностью, способным фосфорилировать молекулы по треони-
новым и тирозиновым остаткам [343], фосфорилирует и активирует
киназу ERK, которая способна фосфорилировать и активировать
более 50 различных субстратных молекул, включая цитоплазматиче¬
ские факторы транскрипции [507].Аналогичные процессы наблюдаются при активации клеточного
рецептора другими факторами — провоспалительными цитокинами,
микробной инфекцией, УФ-облучением, осмотическим стрессом
и др, (рис. 19, 6). В этом случае под влиянием внеклеточных сигналов
активируются молекулы гуанозинтрифосфатаз Rho (семейство Ras/
Rho), которые через адаптерный белок TRAF-2 (Tumor necrosis factor
receptor-associated factor 2) вовлекают в формирование сигнального
пути, фосфорилируют и активируют ряд протеинкиназ МАРККК —
групп ASK (ASK1, ASK2), МЕК (МЕК1-4), MLK (MLK1-3), киназ
ТАКІ и Т1р-2, фосфорилирующих и активирующих протеинкиназы
МАРКК - МККЗ, МКК4, МКК6 и МКК7, которые в свою очередь
фосфорилируют и активируют киназы р38 и JNK семейства МАРК
[336, 427]. В активации индуцируемых киназ JNK и р38, как отмеча¬
лось выше, принимают участие молекулы семейства Rho (см. рис. 19,6),
в активации киназы ERK — белки Ras через протеинкиназу Raf (см.
рис. 19, а). Перемещаясь в ядро, киназы р38 и JNK связывают и фосфо¬
рилируют ряд субстратных белков: р38 — MEF-2C, Е1к-1, ATF2; JNK —
C-Jun, Е1к-1, ATF2, обеспечивающих, как и фактор транскрипции АР-1,
активацию экспрессии соответствующих генов.Существенную роль в генерации сигнала, необходимого для по¬
глощения фагоцитируемого материала, играют по меньшей мере 5
из 12 описанных форм протеинкиназы С (РКС — Protein kinase С) —а, ß, Є, 6 и С,. Блокирование активности РКС подавляет образова¬
ние филаментов актина под участками связывания фагоцитируемых
частиц и блокирует поглощение частиц, опсонизированных IgG,
комплементом или зимозаном. РКС участвует также в индукции
выработки клеткой цитокинов и необходима для ее противомикроб-
4.1. Молекулярные механизмы проведения сигналов внутрь клетки 131.^/фактор ростаКлет<зчная мембранаITAMITAMВнеклеточный сигнал
Кле!точная мембранаМАРККК(ASK1-2, МЕК1Ч MLK1-3, TAK1, Tip-2)мм^кк(МККЗ, МКК6, МКК4, МКК7)Л/РК1«ГЯдроФакторы транскрипции др-1Транскрипция
(o^un/c-foe)’МКРElk-1.MEF-2C, c-jun. Elk-1,
ATF-2 ATF-2Активация геновРис. 19. Активация каскадного модуля МАРК при действии на клетку фак¬
торов роста (а) или внеклеточных сигналов (провоспалительные цитокины,
микробная инфекция, УФ-облучение, осмотический стресс и др.) (б) (пояс¬
нения в тексте):Akt (Kinase autologous tumor killing) — киназа, разрушающая аутологичную опухоль;
АР~! (Activator protein-1) — белок-активатор 1; ERK (Extracellular signal regulated
kinase) — киназа, активируемая внеклеточным сигналом; GDP — гуанипдифосфат;
Grb2 (Growth-factor-receptor-bound protein 2) — адаптерный бепок 2, связанный с
рецептором для фактора роста; GTR — гуапинтрифосфат; /ТАМ (immunoreceptor
tyrosine-based activation motif) — тирозинсодержащие активационные последова¬
тельности аминокиают в иммунорецепторах; JNK (c-Jun N-terminal kinase) —
N-терминальная киназа c-Jun; МАРК (Mitigen-activated protein kinase) — протеинки-
наза, активируемая митогеном; МАРКК (МАРК kinase) — киназа МАРК; МАРККК
(МАРК kinase kinase) — киназа киназы МАРК; МЕК (MAPK/ERK kinase) —
киназа МЕК; р38 — киназа р38; PI-3K (Phosphatidylinositol 3-kinase) — фосфати-
дилинозит 3-киназа; R ~~ рецептор; Raf — протеинкиназа Raf; Rho — семейство
гуанинтрифосфатаз Rho; She — адаптерный белок; Sos (Son of sevenless) — фактор
замещения гуаниннуклеотидов в белках Ras (малые 0-белки); TRAF-2 (Tumor necrosis
factor receptor- associated factor 2) — фактор 2, ассоциированный с рецептором для
фактора некроза опухоли
132Глава 4. Возбуждение и торможение иммунной системыной активации, индуцируемой разными агентами. В активации РКС
важная роль принадлежит фосфолипазе Су (PLCy — Phospholipase
Су). Активацию PLCy обеспечивает белок G, связанный с рядом
рецепторов фагоцита (для молекул адгезии, иммунных комплексов,
хемотаксических агентов и др.) и диссоциируемый при взаимодейс¬
твии лиганд-рецептор. Механизм активации РКС фосфолипазой
С включает расщепление этим ферментом фосфатидилинозит-4,5-
бифосфата — (PIP2 — Phosphatidylinositol-4,5-biphosphate) до молекул
инозиттрифосфата (IP3 — Inositol triphosphate) и диацилглицерина
(DAG — Diacylglycerol), вторичных мессенджеров, которые соот¬
ветственно мобилизуют запасы внутриклеточного Са^+ и активиру¬
ют семейство молекул РКС. Фосфорилирование PIPj катализирует
фосфатидилинозит-З-киназа (Р1-ЗК — Phosphatidylinositol 3-kinase).
Образующийся при этом фосфолипид фосфатидилинозит-3, 4,
5-трифосфат (PIP3 — Phosphatidylinositol-3,4,5-triphosphate) вовлекает
в процесс фагоцитоза ряд сигнальных молекул, в частности серин/
треониновую киназу Akt/PkB (Kinase autologous tumor killing/protein
kinase B). Будучи активированной, киназа Akt/PkB проявляет мно¬
жественные функции — индуцирует фосфорилирование киназы IKK
(1-кВ kinase) и тем самым активирует фактор транскрипции NF-kB
[4731, активирует фактор транскрипции E2F — регулятор клеточного
цикла [281], регулирует активность сигналпроводящего семейства
МАР [873], проявляет антиапоптотическую активность во многих
клеточных формах [348].Как отмечалось в главе 1, в процессе функционирования фаго¬
цитов и индукции ими первичных этапов адаптивного иммуни¬
тета значимую роль играет способность таких клеток распозна¬
вать молекулярную мозаику патогена — РАМР (Pathogen-associated
molecular pattern) при помощи ряда экспрессируемых ими рецеп¬
торных структур. Среди последних сигналпередающая активность
наиболее изучена у ТоП-иодобных рецепторов — TLR. Считается,
что TLR являются сенсорными структурами фагоцитов, распозна¬
ющими РАМР-структуры и играющими критическую роль в воспали¬
тельном и иммунном ответе инфицированного хозяина [469].Липополисахарид (ЛПС) — одна из наиболее хорошо известных
структур РАМР — является основным компонентом внешней мем¬
браны грамотрицательных бактерий. ЛПС обладает способностью
стимулировать продукцию провоспалительных цитокинов антиген-
представляющими клетками (АПК) и экспрессию ряда костимули-
4.1. Молекулярные механизмы проведения сигналов внутрь клетки 133рующих молекул, например CD40, относящейся к суперсемейству
фактора некроза опухоли (ФНО). Костимулирующие молекулы необ¬
ходимы для рецепции сигналов, сопровождающихся процессами про¬
лиферации и дифференцировки клеток, переключения изотипов Ig в
В-лимфоцитах, для продукции цитокинов дендритными клетками и
макрофагами. При избытке ЛПС могут возникать явления эндотокси-
ческого шока с высоким смертельным исходом.При попадании микробов в организм процесс распознавания и свя¬
зывания ЛПС осуществляется сывороточным белком LBR (LPS bind¬
ing protein) (рис. 20, этап а). Этот белок относится к реактантам острой
фазы, его концентрация в сыворотке возрастает после различных
воспалительных стимулов в любом возможном анатомическом учас¬
тке организма — при ожогах, перитоните, сепсисе, туберкулезе, арт¬
рите, родах, при различных химических стимулах и др. Регуляторами
являются ИЛ-1, ИЛ-6, ФНО. Являясь опсонином и повышая чувс¬
твительность клеток к Л ПС, LBR обладает уникальной способностью
не только связываться с ЛПС фрагментов бактериальной мембраны,
но и обеспечивать перемещение ЛПС к клеткам-мишеням, экспрес¬
сирующим на мембране рецептор CD14. Этот рецептор связывает
комплекс ЛПС-LBR, удерживает его на мембране в течение периода,
необходимого для распознавания ЛПС, но не способен к проведению
сигнала внутрь клетки. Рецептор CD14 не имеет трансмембранного
и внутриклеточного доменов и заякорен в клеточной мембране через
его хвостовую часть — гликозилфосфатидилинозит (GPI — Giycosyl—
phosphatidylinositol) [65].Роль сигнального трансдуктора выполняет клеточная структура
TLR4-MD2 [469], расположенная на поверхности макрофага вблизи
от рецептора CD14, распознающая Л ПС и взаимодействующая с ком¬
плексом ЛПС-С014 (рис. 20, этап б) при помощи домена TTR (Toll/IL-
1R homology domain), гомологичного цитоплазматическому домену
рецептора для ИЛ-1 [772]. В комплексе TLR4-MD2 молекула TIR
является цитоплазматическим доменом рецептора TLR4, обеспечива¬
ющим проведение сигнала внутрь клетки, а MD2 — это секреторная
молекула, которая ассоциирована с TLR4, регулирует его экспрессию
на клеточной поверхности и отвечаемость на ЛПС (может связываться
с ЛПС независимо от LBR и CD14). Взаимодействие ЛПС с комплек¬
сом TLR4-MD2 сопровождается его димеризацией [216] и взаимодейс¬
твием домена TIR с цитоплазматической молекулой MyD88 (Myeloid
differentiation factor 88) через адаптерный белок TIRAP (TIR-containing
134Глава 4. Возбуждение и торможение иммунной системыКлеточная
нембіквнаPI-3K-AWIIRAK-1а «T р38 JNH
Яор<у^гч™ Активация
геновРис. 20. Молекулярная структура сигнального пути, формируемого под
влиянием активации липополисахаридом (ЛПС) То11-подобного рецептора 4
(TLR4): (пояснения в тексте)а, б, в иг — этапы прохождения активирующего сигнала внутрь клетки.ЛПС — липополисахарид; Akt/PkB (Kinase autologous tumor killing/protein kinase B) —
киназа, разрушающая аутологичную опухоль/протеинкиназа В; DD (Death domain) —
домен смерти; E2F—регулятор клеточного цикла (фактор транскрипции E2F); GPI
(Glycosylphosphatidylinositol) — гликозилфосфатидилинозит; ІКК (1-кВ kinase) —
киназа 1-кВ; iRAK (Interleukin-1 receptor-associated kinase) — киназа, ассоциирован¬
ная с рецептором àяя интерлейкина-1; LBP (LPS binding protein) — сывороточный
белок, связывающий ЛПС; MD2 — ассоциированная с TLR4 секреторная молекула;
MyD88 (Myeloid différentiation factor 88) — фактор 88 миелоидной дифференцировки;
NF-кB(Nuclearfactor-кlgBlymphocytes)—ядepныüфaкmop,ycuлuвaющuй транскрип¬
цию легкой цепи к иммуноглобулинов В-лимфоцитов; NIK (NF-KB-inducing kinase) —
NF-кВ-индуцирующая киназа; PDKl (3^-phosphoinositide-dependent kinase-1) —
3 ^-фосфоиносшпид-зависимая киназа I; TAB-1, -2 (ТАКІ binding protein 1, 2) - белок I, 2,
связывающий молекулу ТАКІ; ТАКІ (Transforming growth factor-ji-acti\>ated kinase) —
киназа, активированная трансформирующим фактором роста Д’ TIR (Toll-like/
Interieukin-1 receptor) — Toll-подобный рецептор, гомологичный рецептору для
интерлейкина-!; домен TIR (TIR-domain) — цитоплазматический домен рецептора
TIR; TRAF-6 (Tumor necrosis factor receptor-associated factor 6) — фактор 6, ассоци¬
ированный с рецептором для фактора некроза опухоли.Остальные обозначения те же, что и на рисунке 19adapter protein) [443] или Mai (MyD88-adapter-Iike) [380], обычно име¬
нуемый TIRAP/Mal [8591- Эта молекула обеспечивает сигнальную
специфичность для TLR и также содержит домен T1R.
4.1. Молекулярные механизмы проведения сигналов внутрь клетки 135Связываясь с TIR-доменом, молекула MyD88 через консервативный
домен смерти DD (Death domain), компонент апоптотических белков
взаимодействует с протеинкиназой IRAK и вовлекает ее в процесс
формирования сигнального пути. Последняя содержит четыре моле¬
кулы — две активные (IRAK-1, IRAK-4) и две неактивные (TRAK-2,
IRAK-M) [456]. Все четыре киназы способны активировать ядерный
фактор транскрипции NF-kB и сигнальные пути, опосредуемые через
киназы семейства МАР (МАРК pathways). Активация РТК IRAK-4
в процессе образования комплекса сопровождается гиперфосфори-
лированием киназы IRAK-1, которая вовлекает в процесс передачи
сигнала белок TRAF-6 (Tumor necrosis factor receptor-associated factor 6)
[778] — один из шести (TRAF-1-6) идентифицированных адаптерных
белков этого семейства [280, 833].Конформационные изменения, возникающие при образовании струк¬
турного объединения молекул IRAK-4/IRAK-1/TRAF-6, приводят к его
отделению от рецепторного комплекса и взаимодействию со связанным
с мембраной белком ТАВ2 (ТАК 1-binding protein 2), активирующим кас¬
кадное образование комплекса ТАВ2/ТАК1 (Transforming growth factor-
ß-activated kinase)/TABl/TRAF-6 (рис. 20, этап в). Сформировавшийся
комплекс TAB2/TAK1/TAB1/TRAF-6 отделяется от молекул IRAK и
транслоцируется в цитозоль. В результате молекулярных взаимодейс¬
твий белок TRAF-6 активирует киназу ТАКІ, которая в свою очередь
активирует каскадный модуль киназ семейства МАР (р38, JNK) и
фосфорилирует киназу IKK через фосфорилирование киназы NIK.
Фосфорилирование освобождает фактор транскрипции NF-kB от его
ингибитора — киназы IKK — и фактор транскрипции транслоцируется
в ядро, где активирует соответствующие гены.Многочисленными исследованиями установлено, что NF-kB
является плейотропным фактором транскрипции. Он регулирует
экспрессию генов, контролирующих множественные реакции —
воспаление, стрессовый ответ, программируемую клеточную гибель
и др., т.е. многие биологигческие феномены, определяющие экспрессию
ряда провоспалительных цитокинов, хемокинов, иммунорецепторов,
поверхностных молекул адгезии, ряда важнейших параметров кле¬
точного функционирования, таких как деление, дифференцировка,
выживание и др. [287, 462, 551, 838].При активации рецепторного комплекса фагоцита молекулы TLR
активируют также киназу PI-3K, в клеточную мембрану вовлекается
киназа Akt/PkB, которая связывается с продуктами PI-3K, активиру¬
136Глава 4. Возбуждение и торможение иммунной системыется киназой PDK1 и открепляется от клеточной мембраны (рис. 20,
этап г). Будучи активированной, киназа Akt/PkB проявляет множес¬
твенные функции (см. выше), включая регуляцию каскадного модуля
киназ семейства МАР.В целом действие факторов транскрипции обеспечивает про¬
дукцию клетками провоспалительных цитокинов (ИЛ-1, -6, -8, -12,
ФНОа, ГМ-КСФ и др.), хемокинов, индукцию экспрессии кости¬
мулирующих молекул (CD80 и CD86). Происходит мобилизация
дендритных клеток и их миграция из очага внедрения патогена в реги¬
ональные лимфатические узлы, инициация адаптивного иммунного
ответа. Происходит также активация генов, кодирующих молекулы
адгезии (VCAM, ICAM, ELAM и др.), острофазные белки, противо-
микобные пептиды (р-дефензины и др.) и др. Одновременно с индук¬
цией цитокиновой сети запускается процесс апоптоза через каскад
каспаз (см. ниже). Описанный сигнальный путь у млекопитающих,
завершающийся генной транскрипцией, во многом сходен с таковым
у растений и насекомых, что дает основания отнести его к древним
механизмам защитной сигнальной системы [322, 713].4.1.2. ФОРМИРОВАНИЕ АКТИВИРУЮЩИХ СИГНАЛЬНЫХ ПУТЕЙ,
ОПОСРЕДОВАННОЕ ЧЕРЕЗ АНТИГЕНРАСПОЗНАЮЩИЕ
РЕЦЕПТОРЫ Т- (TCR) И В- (BCR) ЛИМФОЦИТОВКак отмечалось выше, формирование сигнальных путей Т- и
В-лимфоцитов во многом сходно с процессами, развивающимися
при рецепторной активации фагоцитирующих клеток [189]. Как и в
случае фагоцитов, пусковым сигналом молекулярных превращений,
ведущих к активации лимфоцитов, является взаимодействие лиганд-
рецептор, в частности — взаимодействие антигена с антигенраспозна-
ющими рецепторами TCR и BCR.Последующие этапы формирования сигнальных путей включают
связывание и перекрестное сшивание рецепторов, их кластеризацию
и фосфорилирование концевых доменов TCR и BCR — молекул ITAM
тирозинкиназами семейства Src. Помимо молекул Src, в процессе
фосфорилирования доменов ITAM и формирования сигнального
пути участвуют протеинтирозинкиназы (РТК) Syk и Btk [822].Дефицит киназ Src может компенсироваться функциями РТК Syk
[535]. На различных клетках системы иммунитета экспрессируются
4.1. Молекулярные механизмы проведения сигналов внутрь клетка 137разные белки семейства Src [317, 822]. РТК Lyn, Fyn и Вік экспрессиру¬
ют В-лимфоциты, Lck и Fyn — Т-лимфоциты [471, 521].При активации антигеном BCR и фосфорилировании цитоплаз¬
матических доменов ITAM белками семейства Src в процесс форми¬
рования сигнального пути вовлекаются киназы Syk, фосфорилиру-
юшие адаптерный белок BLNK (B-cell-linker protein) или SLP-65 (SHj
domain-containing leukocyte protein of 65 kDa). Последний связывается
с тирозинкиназой Брутона — Btk (Bruton’s tyrosine kinase) [547, 862]
и одновременно активирует семейство киназ МАР. Как отмечалось
выше (см. раздел 4.1.1), процесс каскадной активации компонентов
семейства МАР приводит в конечном итоге к активации факторов
транскрипции, в частности AP-L Фосфорилирование Btk киназой Syk
сопровождается активацией фосфолипазы РЬСу2 и затем протеинки¬
назы С (РКС). Последующие этапы активации сигнальных молекул
не отличаются от тех, которые регистрируются при активации фаго¬
цитов (см. раздел 4.1.1) и характеризуются процессами образования
факторов транскрипции NFAT и NF-kB, активирующими функции
соответствующих генов.В процессах формирования сигнальных путей и активации
В-лимфоцитов существенную роль играют корецепторные струк¬
туры — CD19, CD21, CD81. Из молекул корецепторного комплекса
наиболее значимой является CD21 — характеризуется как CR2, экс¬
прессируется преимущественно на зрелых В-клетках фенотипа TgM%
IgD^. Активация корецепторного комплекса осуществляется в резуль¬
тате взаимодействия рецептора CD21 с микробной клеткой через
молекулу C3d и последующего фосфорилирования рецептора CD 19.
Активированная молекула CD19 вовлекает в процесс фосфорилиро¬
вания домена ITAM тирозинкиназу семейства Src и одновременно
активирует фосфатидилинозит-3-киназу (Р1-ЗК), которая усиливает
активацию киназы Btk и фосфолипазы PLCy2, Процессы дальнейшей
каскадной активации сигнальных путей рассмотрены выше. Участие
корецепторных молекул в процессах активации клеток примерно в
100 раз усиливает процесс генерирования сигнала. Роль участвующего
в этих процессах корецептора CD81 полностью не охарактеризована.В отличие от доменов ТТАМ BCR, фосфорилируемых РТК Вік,
Fyn и Lyn семейства Src, домены ТТАМ TCR, как отмечалось выше,
фосфорилируют киназы Fyn и Lck. При этом в отличие от киназы
Fyn киназа Lck связана с корецепторами Т-лимфоцитов CD4 и CD8.
Однако при активации рецепторного комплекса Т-клеток в процессы
138Глава 4. Возбуждение и торможение иммунной системыфосфорилирования доменов ITAM TCR вовлекается и киназа Тхк
(521, 471]. Другое отличие в формировании сигнальных путей Т-клет¬
ками заключается в вовлечении при фосфорилировании молекул
ITAM TCR тирозинкиназы ZAP-70 ((¡^-chain-associated protein of 70
rDa) семейства Syk, a не киназы Syk этого же семейства» как в случае
В-лимфоцитов. Активация киназы ZAP-70 сопровождается фосфо-
рилированием адаптерных белков LAT (Linker of activated Т cells) и
SLP-76 (SHj domain-containing leukocyte-specific phosphoprotein of 76
KDa). Последующие этапы формирования сигнальных путей сходны
с описанными выше.Активированный белок LAT взаимодействует с молекулой Grb-2-
Sos, активирует семейство киназ МАР и фактор транскрипции AP-L
Одновременно белокLATсвязываетфосфолипазуРТСу1 ивзаимодейс-
твует с адаптерным белком She, конститутативно связанным с белком
SLP-76. Связываясь с киназой Itk семейства Тес, SLP-76 способствует
активации фосфолипазы PLCyl, которую фосфорилирует киназа Itk.
В результате активации фосфолипаза связывается с фосфатидилино-
зит-4,5-бифосфатом (РТРг), расщепляет его на инозиттрифосфат (IP3)
и диацилглицерин (DAG) и в конечном счете обеспечивает активацию
факторов транскрипции NFAT и NF-kB. Эти стадии формирования
сигнальных путей характеризуют те же процессы, которые описаны
выше (см. раздел 4Л.1).Факторы транскрипции АР-1 (c-jun/c-fos), NF-kB и NFAT, транс-
лоцируясь в клеточное ядро, обеспечивают активацию генетического
материала клетки и, как следствие, активацию ее функциональной
активности. Активации клетки способствует фосфорилирование
доменов ITAM корецепторных молекул CD4 и CD8 и, как следствие,
активация транскрипционного фактора NF-kB.Среди ряда костимулирующих молекул основной для TCR является
CD28 [723]. Эта молекула Т-клеток своим цитоплазматическим доменом
контактирует с киназой PI-3K. При перекрестном сшивании TCR без
участия CD28 киназа Р1-ЗК активируется слабо, интенсивная акти¬
вация этого фермента и его перемещение в мембрану обеспечивается
лишь в результате связывания как TCR, так и CD28 [212]. При фосфо¬
рилировании молекулы CD28 в процесс формирования сигнального
пути вовлекается киназа PI-3K, которая способствует активации киназ
семейства МАР и активирует киназу Akt. Последняя также участвует
в активации киназ семейства МАР через активацию белка Vav [186].
Механизмы активации киназ семейства МАР рассмотрены в разделе 4.1.1.
4, i. Молекулярные механизмы проведения сигналов внутрь клетки 1394.1.3. ФОРМИРОВАНИЕ СИГНАЛЬНЫХ ПУТЕЙ, ОПОСРЕДОВАННОЕ
ЧЕРЕЗ АКТИВАЦИЮ РЕЦЕПТОРОВ ДЛЯ ЦИТОКИНОВСигнализация, запускаемая цитокинами, — важнейший этап в
продвижении клетки по циклу, включенному активацией TCR или
BCR, и необходимый механизм перехода клетки из субфазы в суб¬
фазу G)b клеточного цикла. В состоянии покоя цитоплазматические
домены цепей рецепторов для цитокинов связаны нековалентной свя¬
зью с ключевыми тирозинкиназами цитокинового сигнального кас¬
када — с киназами Янус семейства JAK (Yanus-associated family kinase).
Это семейство включает ряд близких по структуре белков — JAK1,
JAK2, JAK3, TYK1, TYK2, связывающихся в клетке в различных соот¬
ношениях с разными цепями в разных рецепторных структурах. Так,
например, а-цепь (CD25) рецептора для ИЛ-2 связывает лиганд, тогда
как ß- и у-цепи обеспечивают проведение сигнала. При этом р-цепь
(CD122) рецептора связывает киназу JAK1, а у-цепь — киназу JAK3.
В отличие от рецептора для ИЛ-2, рецептор для ИНФу (CD119) состо¬
ит из двух цепей — а (связывает киназу JAK1) и ß (связывает киназу
JAK2) (рис. 21). К особенностям рецептора для И Л-12 следует отнести
то, что одна из двух его субъединиц (ßl) связывает киназу JAK2, тогда
как другая (ß2) — киназу TYK2. Однако вне зависимости от строения
рецептора и его цепей, связывающихся с киназами семейства JAK, в
результате связывания рецептора с лигандом рецептор димеризуется,
молекулы JAK активируются и фосфорилируют тирозиновые остатки
цитоплазматических участков рецептора. Через домен SH2 с фос-
форилированными участками рецептора соединяются цитозольные
белки семейства STAT (Signal transducers and activators of transcription),
содержащие, как и белки JAK, близкие по строению структуры —1,2,3, 4, 5а, 5Ь, 6. При этом к цепям различных рецепторов присоединя¬
ются разные молекулы STAT. Рецептор для ИЛ-2 включает молекулы
STAT1, 3, 5а и 5Ь, рецептор для ИНФу — STAT1, рецептор для ИЛ-12 -
STAT4 и т.д. Один из этих белков фосфорилируется киназой JAK и
через фосфорилированный участок соединяется с другой молеку¬
лой STAT. Димер фосфорилированных молекул STAT отделяется от
рецептора и транслоцируется в ядро клетки, где активирует транс¬
крипцию соответствующего гена.По данным [212], в процесс формирования сигнального пути, опос¬
редованного через активацию цитокиновых рецепторов, может вовле¬
каться каскад киназ МАР, активируемых белками Ras и киназой Raf-1
140Глава 4, Возбуждение и торможение иммунной системыИНФуКлеточнаяКлеточнаямембранаРАктивация геновАктивация геновРис, 21. Формирование сигнальної о пути, опосредованного через активацию
рецептора для цитокинов (на примере интерферона-у) (пояснения в тексте)(см. рис. 21). При этом активация киназ МАР под влиянием цитокинов,
например ИНФу, в результате каскадной цепи реакций обеспечивает
регуляцию факторов транскрипции [470]. Помимо Ras-Raf, активация
киназ семейства МАР может обеспечиваться и другими путями [189].4.1.4. СИГНАЛПРОВОДЯЩИЕ РЕЦЕПТОРЫ ЕСТЕСТВЕННЫХ
КЛЕТОК-КИЛЛЕРОВЕстественные клетки-киллеры (ЕКК), выполняя эффекторные
функции врожденного иммунитета и будучи третьей популяцией
лимфоцитов, обеспечивающих поддержание генетического гомеос¬
таза, фенотипически и функционально существенно отличаются
4,L Молекулярные механизмы проведения сигналов внутрь клетки 141от основных эффекторов адаптивного иммунитета — Т- и В-лим¬
фоцитов. Эти особенности ЕКК рассмотрены выше (см. главу 1),
Особенностями характеризуется и рецепторный аппарат этих клеток
1188]. ЕКК экспрессируют множество мембранных структур, одни
из которых преимущественно определяются на естественных клет-
ках-киллерах, тогда как другие выявляются также на многих других
клеточных формах. К числу регуляторных сигнал проводящих уни¬
кальных рецепторных структур, экспрессирующихся на ЕКК, отно¬
сят их четыре основных типа — NCR, KIR, ILT и CD94/NKG2. Для
трех из них ~ KIR, ILT и CD94/NKG2 — в качестве лигандов высту¬
пают молекулы МНС класса I, лиганды для NCR неизвестны. Другие
рецепторы, которые могут обеспечить активацию ЕКК (CD2, CDI6,
CD26, CD69, р,-интегрины), не являются для них уникальными, их
экспрессия выявляется на многих других типах клеток. Активация
ЕКК может индуцироваться также в результате связывания молекул
антител, специфичных к лигандам клеток-мишеней [825].Репепторы естественной цитотксичности NCR (Natural cytotoxicity
receptor) — активирующие, специфические для ЕКК, описаны в
работе [619], включают структуры NKp30, NKp44 и NKp46, характе¬
ризующиеся как белки типа I, относящиеся к иммуноглобулиновому
суперсемейству [804]. Лиганды клеток-мишеней этих рецепторов, как
уже отмечалось, неизвестны, однако литическая активность ЕКК
непосредственно связана с их наличием на клеточной мембране.Из 14 описанных рецепторов семейства KIR (Killer immunoglobulin-
like receptors) активирующими цитолитическую активность ЕКК явля¬
ются 6: KIR2DS1 (CD158h), KIR3DS1 (CD158e2), KIR2DS2 (CD158J),
K1R2DS4 (CD158Í), KIR2DS5 (CD158g), KIR2DS6 (CD158c). Другие
рецепторы - K1R2DL1 (CDI58а), KIR3DL1 (CDl58el), KTR2DL2
(CD158bl), KIR3DL2 (CDI58k), KIR2DL3 (CD158b2), KIR2DL4 (CD158d),
KIR2DL5 (CDI580, KIR3DL7 (CD158z) — оказались ингибирующими.
Активирующие и ингибирующие рецепторы ЕКК отдельных семейств
показаны на рисунках 22 и 23 соответственно.Лигандами для рецепторов KIR служат антигены HLA класса I. Так,
например, лигандом для рецепторов K1R2D являются антигены HLA-
С, для рецепторов KIR3D — антигены HLA-A и HLA-B. Рецепторы
KÍR контролируются генами кластера LRC (Leuckocyte receptor clus¬
ter) хромосомы 19 (19ql3.4). Исследование генетической организации
хромосомгюго участка KIR выявило свыше 100 высокогомологичных
вариантов аминокислотных последовательностей KIR и ряда аллелей
Í42Глава 4. Возбуждение и торможение иммунной системыЛигандыРецепторыHLA-A HLA-C HLAI
Н1Л-ВHLA-EMICAMICBРис. 22. Активирующие рецепторы естественных киллеров, их лиганды и
адамтерные белки, опосредующие формирование и передачу в клетку акти¬
вирующего сигналадля каждого локуса. Обнаружено по меньшей мере 15 ганлотипов, осно¬
ванных на наличии или отсутствии тех или иных локусов KIR, что объ¬
ясняет наличие множества различных генотипов. При этом оказалось,
что три локуса KIR — 2DL4, 3DL2 и 3DL7 (ранее был обозначен как
локус 3DL3) — присутствуют во всех гаплотипах [243, 746, 8511. Регион
LRC, помимо генов KIR, включает также гены рецепторов семейства
1LT, LAIR (Leukocyte-associated inhibitory receptor), FcaR и NKp46 [243].Рецепторы семейства ILT (immunoglobulin-like transcript), сино¬
нимы — CD85, LIR (Leukocyte immunoglobulin-hke receptor), и MIR
(Macrophage immunoglobulin-like receptor) входят в состав иммуногло¬
булинового суперсемейства. Лигандами для рецепторов этого семейс¬
тва служат антигены HLA класса I, рецепторы ILT на EJCK преиму¬
щественно характеризуются как ингибиторные, восемь рецепторов
несут цитоплазматиченский домен ТТШ [695], фосфорилирование
которого сопровождается формированием сигнального пути ингиби¬
торного характера (см. раздел 4.L5).Активирующие рецепторы семейства ILT — рецепторы ILT1(L1R7),
ILT7 и TLT8 [630, 695, 822]. Показано, что TLT1, как и другие рецепторы
семейства ILT, имеет четыре иммуноглобулиноподобных внеклеточ¬
ных домена, но не имеет цитоплазматических сигналпроводящих
структур и заякорен в плазматической мембране клетки. Через основ¬
ной аминокислотный остаток в трансмембранной области (аргинин)
рецептор связан с кислотным остатком (аспарагиновая кислота) адап-
4.1. Молекулярные механизмы проведения сигналов внутрь клетки 143ЛигандыРецепторыHLA-A-BHLA-G?HLA-AHLA-G?HLA-A-BHLA43HLA-F?UL18HLA-EКлеточнаямембранаРис. 23. Ингибиторные рецепторы естественных киллеров, их лиганды и
алаптерные белки, опосредующие формирование и передачу в клетку инги¬
бирующего сигнала:D0—D4 — различная конфигурация внеклеточных иммуноглобулиноподобных доменов.
ITSM (immunoreceptor tyrosine-based switch motif) — домен белковых структур, свя¬
зывающих ЗИ2-содержащую протеинтирозинфосфатазу SHP-2 и инозитфосфатазу
SHIP, а также адаптерный белок 1А, содержащий домен SH2терного ІТАМ-несущего белка FceRIy, передающего активирующий
сигнал внутрь клетки [531J. Связью с ІТАМ-содержащим мембранным
адаптерным белком FceRIy характеризуется и рецептор ILT7 [695],Большинство рецепторов — членов семейства лектинов С-типа —
экспрессируется на ЕКК в виде гетеродимеров CD94/NKG2, обра¬
зуемых в результате ковалентного связывания рецепторов семейства
NKG2 с молекулой CD94 [278, 534]. Антиген CD94 — член подсемей¬
ства лектиноподобных рецепторов типа D для молекул МНС типа 1 с
внеклеточным участком, содержащим лектиновый домен типа С [65].
Вследствие короткого цитоплазматического сегмента, CD94 сигналь¬
ной фуіікцией не обладает, ее проявляет ковалентно связанный с ним
рецептор NKG2 [695].Часть молекул семейства CD94/NKG2 характеризуется в качес¬
тве активирующих рецепторов, другая — в качестве ингибитор¬
Í44Глава 4. Возбуждение и торможение иммунной системыных. Выявлена зависимость активирующих и ингибиторных свойств
рецепторов от структурного строения их трансмембранных и цито¬
плазматических доменов [563]. Активирующими формами рецептора
являются молекулы CD94/NKG2C, CD94/NKG2E и CD94/NKG2H,
ингибиторными — CD94/NKG2A и CD94/NKG2B [278, 564J.Лигандом для большинства форм рецептора CD94/NKG2 является
HLA-E — неклассическая молекула МНС класса 1 [564, 814]. Однако
для молекул CD94/NKG2E и CD94/NKG2H лиганд не определен.
Более того, HLA-E не является лигандом для CD94/NKG2H [255].Цитоплазматический регион активирующих ЕКК рецепторов
CD94/NKG2C, CD94/NKG2E и CD94/NKG2H домена ITAM не содер¬
жит, но связывается с противоположно заряженным в трансмембран¬
ной области ІТАМ-содержащим адаптерным белком DAP12, способ¬
ным связывать 8Н2-несущие молекулы [532]. Связывание и активация
DAP12 сопровождается вовлечением в сигнальный процесс и связы¬
ванием через 8Н2-содержащий домен протеинтирозинкиназы — РТК
(Protein tyrosine kinase) семейства Syk [278] и дальнейшим каскадным
процессом формирования сигнального пути с образованием фактора
транскрипции и активацией функций клетки.К активирующим молекулам ЕКК относится также рецептор
N KG2D. Этот рецептор не образует димер с молекулой CD94 и экспрес¬
сируется на ЕКК как гомодимер [855]. Его лиганды — антигены MICA
и MICB (МНС class I chain-related genes) МНС класса 1 [246, 325], а также
молекулы ULBP [65, 83, 99]. Помимо ЕКК, рецептор NKG2D опреде¬
ляется на Т-лимфоцитах, является костимулируюшей молекулой для
CD8-позитивных Т-клеток. Рецептор NKG2D, подобно активирующим
рецепторам CD94/NKG2C, CD94/NKG2E и CD94/NKG2H, домена
1ТАМ не содержит, но связывается с противоположно заряженным
в трансмембранной области ІТАМ-содержащим адаптерным белком
DAP10, способным связывать SH2-нecyщиe молекулы. В отличие от
DAP12, DAP10 вместо домена ІТАМ содержит подобный ему домен (см.
рис. 22) с аминокислотной последовательностью YxxM, где У — тиро¬
зин; М — метионин; х — какой-либо аминокислотный остаток. Этот
домен связывает домен SH2 субъединицы киназы PI3 (Phosphatidil ino¬
sitol-3-kinase) [855], участвующей в активации фосфолипазы Су — одной
из ключевых молекул активирующего сигналпроводящего пути [187].Несмотря на то что сигнальные пути, активирующие функции
ЕКК, подобны тем, которые описаны выше для Т- и В-лимфоцитов,
имеется ряд особенностей в их формировании, которые существенно
4.Í, Молекулярные механизмы проведения сигналов внутрь клетки 145отличают сигнальные пути эффекторов врожденного иммунитета
(ЕКК) от таковых адаптивного иммунного ответа (Т- и В-клетки);— ЕКК характеризуются одновременной экспрессией множества
рецепторов активирующего типа, ассоцииронанных с разны¬
ми 1ТАМ-содержащими цепями;— ЕКК экспрессируют множество РТК семейства Src (Lck, Fyn,
Src, Yes, Lyn, Fgr), участвующих в фосфорилировании доменов
ТТАМ, центрального события в процессе формирования сиг¬
нальных путей, индуцируемых взаимодействием с лигандами
разных рецепторных структур;— как отмечалось выше (см. раздел 4.1.2), в процесс фосфорили¬
рования доменов ТТАМ рецептора BCR В-лимфоцитов вовле¬
каются киназы Syk этого же семейства, в фосфорилирование
доменов ТТАМ рецепторного комплекса TCR Т-лимфоцитов ~
киназы ZAP-70 семейства Syk. В отличие от этого в про¬
цесс фосфорилирования доменов ТТАМ ЕКК вовлекаются обе
киназы семейства Syk — ZAP-70 и Syk;— R формировании сигнальных путей ЕКК отмечается меньшая
роль адаптерных белков, в частности SLP-76, по сравнению с
той ролью, которую они играют в процессах формирования
сигнальных путей Т- и В-клеток.4.L5. ФОРМИРОВАНИЕ СИГНАЛЬНЫХ ПУТЕЙ, ПОДАВЛЯЮЩИХ
ФУНКЦИОНАЛЬНУЮ АКТИВНОСТЬ КЛЕТОКПредставленные выше данные показывают, что механизмы фор¬
мирования сигнальных путей, опосредованные через рецепторные
структуры клеток иммунной системы, включают множество моле¬
кул, особенность действия которых заключается в их каскадной
активации, обеспечивающей в конечном итоге доставку активи¬
рующего сигнала к соответствующим молекулярным структурам
(факторов транскрипции), необходимым для активации генетичес¬
кого материала клетки и последующих ее функций. Совершенно
очевидно, что блокирование любого ключевого этапа этого каскада
вследствие генетических причин или внешних воздействий преры¬
вает дальнейшее прохождение активирующего сигнала, предотвра¬
щает активацию клетки и ее иммунологическое реагирование. Такое
заключение подтверждается различными примерами блокирования
146Глава 4. Возбуждение и торможение иммунной системысигнализации и, как следствие, клеточной активации. Показано,
например, что блокирование прохождения сигнала происходит в
случаях подавляющих воздействий на активность различных фер¬
ментных систем клетки — семейства молекул гуанинтрифосфатаз
Rho, протеинкиназы С (РКС), фосфатидилинозит-3-киназы (PI-3K),
фосфолипазы С (PLC) и др. [173] или при дефиците отдельных эле¬
ментов сигналпроводящего пути [186, 188].Блокирование формирования и прохождения активирующего сиг¬
нала внутрь клетки обеспечивается и другими механизмами — путем
активации мембранных структур иного, нестимулирующего, харак¬
тера. В процессе исследования особенностей действия различных
молекул, оказывающих регуляторный эффект на функции имму¬
нокомпетентных клеток, установлено, что наряду с рецепторами,
обеспечивающими формирование сигнальных путей, приводящих
к активации клеточных функций, на лимфоцитах различных попу¬
ляций (Т, В, ЕКК) экспрессируются также особые рецепторы, свя¬
зывание которых с соответствующими лигандами сопровождается
подавлением внутриклеточных процессов. У человека на ЕКК пре¬
имущественно экспрессируются ингибиторные рецепторы семейства
ILT, ряд рецепторов семейства K1R, отдельные рецепторы семейства
лектиноподобных рецепторов типа С (см. рис. 23), на Т-лимфоцитах
ингибиторный рецептор CTLA-4, на В-лимфоцитах — CD5, CD22,
CD66a, CD72, FcyRHB, ILT, LAIR-1, PD-L У мышей ингибиторные
рецепторы — PIR-B, Ly49A-I, gp49Bl [695].Как оказалось, в отличие от активирующих рецепторов с цито¬
плазматическим доменом 1ТАМ, фосфорилирование которого инду¬
цирует проведение внутриклеточного активирующего сигнала (см.
рис. 19), ингибирующие рецепторы несут цитоплазматический домен
IT IM (Immunoreceptor tyrosine-based inhibitory motif, тирозинсодер¬
жащие ингибирующие последовательности аминокислот в иммуно¬
рецепторах). Домен имеет следующую аминокислотную последова¬
тельность: I/V/L/SxYxxL/V, где I — изолецин; V — валин; L — лейцин;
S — серин; У — тирозин; х — какой-нибудь аминокислотный остаток
[278, 822]. Его фосфорилирование сопровождается формированием
каскадно развивающегося ингибиторного сигнального пути и подав¬
лением клеточной активации. Домены IT1M, как и домены ITAM, в
разных рецепторах содержатся в различных количествах — от одного
до четырех, И тем не менее, индукция иммуносупрессивного действия
ингибиторных рецепторов не обязательно связана с фосфорилиро-
4.1. Молекулярные механизмы проведения сигналов внутрь клетки 147ванием домена IT1M. Например, ингибиторный рецептор CTLA-4
домена IT1M не содержит. По-видимому, определяющим все же явля¬
ется последующее каскадное взаимодействие молекул, изначально
активируемых взаимодействием лиганд—рецептор, с молекулами,
характеризующимися как депрессивные.Фосфорилирование ITIM по тирозину, индуцируемое кластери¬
зацией ингибирующих рецепторов в результате их взаимодействия
с лигандом, обеспечивается тирозинкиназами семейства Src. При
этом в доменах ITIM ингибирующих рецепторов, например ILT и
LA1R-1, экспрессируемых на различных клетках иммунной сис¬
темы (Т, В, ЕКК, клетки миелоидного ряда), образуются участки,
доступные для связывания домена SH2 тирозинфосфатаз SHP-1 и
SHP-2, а также инозитфосфатазы SHIP, обеспечивающих отмену
прохождения активирующего сигнала внутрь клетки. Эти пути не
перекрываются, а молекулы SHP-1 и SHIP связываются с доменами
ІТІМ разных ингибирующих рецепторов, например PIR-B и FcyRHB
В-лимфоцитов соответственно. В развивающихся процессах SHP-1
характеризуется выраженной ингибиторной активностью, а SHP-2 в
формировании сигнального пути играет положительную роль 1483].
Вместе с тем, максимальная каталитическая фосфатазная актив¬
ность наблюдается при одновременном связывании доменов ITIM
с доменами SH2 фосфатаз SHP-1 и SHP-2 [290]. Поскольку молекула
SHP-1 вовлекается в ингибиторный процесс прохождения сигнала
на ранних стадиях клеточной активации, то действие этого фер¬
мента приводит к блокированию последующих каскадных этапов,
включая мобилизацию кальция, секрецию цитокинов, активацию
процесса транскрипции и пролиферации клеток. У мышей с дефи¬
цитом тирозинфосфатазы SHP-1 развиваются признаки тяжелого
комбинированного иммунодефицита и аутоиммунных поражений,
в первую неделю жизни регистрируются легочные осложнения [695].
Показано также, что фосфатаза SHP-1 способна обеспечивать дефос-
форилирование как киназ семейства Src, так и протеинтирозинкиназ
ZAP-70 и Syk, а также адаптерных белков SLP-76 и LAT. Указанные
молекулы являются важнейшими компонентами сигнального пути
ЕКК, Т- и В-клеток.В целом накопленный к настоящему времени материал по анал изу
механизмов, обеспечивающих активацию функциональной актив¬
ности иммунокомпетентных клеток или, наоборот, ее подавление,
показывает, что конечный результат определяется по меньшей мере
148Глава 4. Возбуждение и торможение иммунной системыдвумя факторами — генетически детерминированными особенностя¬
ми формирования сигнального пути в конкретной популяции клеток
(от строения клеточных рецепторов, взаимодействующих с соответс¬
твующими лигандами, и последовательного включения в сигналь¬
ный процесс различных цитоплазматических молекул до продукции
специфических медиаторов, через которые опосредуется функцио¬
нальная активность данной клеточной популяции) и эффективнос¬
тью взаимодействия лиганда с соответствующим рецептором. Иначе
говоря, экспрессия на иммунокомпетентных клетках активирующих
и ингибирующих рецепторов и их функционирование определяют
физиологический процесс активации иммунокомпетентных клеток
или, наоборот, торможение их функций [173, 186]. По-видимому, при
конструировании вакцинирующих препаратов нового поколения
целесообразны учет факторов, ингибирующих или активирующих
клеточные функции, и создание условий, максимально благоприят¬
ствующих функционированию клеточных популяций, заинтересо¬
ванных в развитии высокого иммунного ответа.4,2. АПОПТОЗ И ЕГО МЕСТО В РАЗВИТИИ
И ФУНКЦИОНИРОВАНИИ ИММУННОЙ СИСТЕМЫ4.2.1. АПОПТОЗ КАК РАЗНОВИДНОСТЬ ГИБЕЛИ КЛЕТОКСуществует два варианта гибели клеток — некроз (гибель, вызван¬
ная прямым химическим, механическим или иным грубым повреж¬
дением или нарущением условий существования клетки) и апоптоз,
или программированная гибель (осуществляется в ответ на действие
физиологических сигналов или в процессе срабатывания генетиче¬
ской программы клетки, является необходимой составляющей суще¬
ствования многоклеточных организмов) [98].Оба типа клеточной гибели отличаются по морфологическим
признакам [190]. Некроз проявляется в нарушении целостности
клеточной мембраны с последующим набуханием клетки, лизисом
гранул и ядра, неупорядоченной деградацией ДНК. При апоптозе
наблюдается сморщивание клетки, уменьшение ее размеров, уплот¬
нение наружной и внутриклеточных мембран (при сохранении ее
4,2, Апоптоз и его место в развитии и функционировании,,, 149целостности) с утратой микроворсинок и формированием вздутий,
деполяризацией митохондрий, а также с уменьшением размеров,
уплотнением и фрагментацией ядра. При этом происходит деграда¬
ция ДНК с формированием сначала крупных (50-200 кД), а затем
мелких фрагментов. В последнем случае разрывы ДНК локализуют¬
ся между нуклеосомами, в результате чего образуются фрагменты,
кратные 180—190 пар оснований (размер нуклеосомы). От клетки,
подвергшейся апоптозу, могут отшнуровываться «апоптотические
тельца» — фрагменты ядра, окруженные мембраной. Уже в ходе
реализации апоптоза гибнущие клетки подвергаются апоптозу.
В результате продукты распада клеток не поступают в межклеточ¬
ное пространство и не вызывают воспалительной реакции, которая
обычно сопутствует некрозу клеток.4.2.2. МЕСТО АПОПТОЗА В ИММУНОЛОГИЧЕСКИХ ПРОЦЕССАХВ целом, апоптоз представляет собой активную и относительно
медленно развивающуюся форму гибели клетки в ответ на внешние
или внутренние сигналы, реализуемую в том случае, когда гибель
отдельных клеток выгодна для нормального функционирования
многоклеточного организма. Апоптоз является столь же фундамен¬
тальным процессом в жизни клетки, как пролиферация и диффе¬
ренцировка. Широко известные примеры реализации апоптоза в
интересах целостного организма — гибель клеток в ходе гистогенеза
при эмбриональном развитии организма; гибель клеток в процессах
позитивной и негативной селекции лимфоцитов в костном мозгу и
тимусе в период формирования антигенраспознающего рецептора
лимфоцитов, апоптоз клеток в тимусе при образовании лимфоци¬
тов, индуцирующих реакции гуморального (CD4) или клеточного
(CD8) иммунитета или в процессе выбраковки клеток, развивающих
иммунологические реакции против антигенов собственного организ¬
ма; элиминация клеток, несущих хромосомные дефекты; цитолиз
инфицированных или чужеродных клеток, провзаимодействовавших
с естественными киллерами или с цитолитичскими Т-лимфоцита¬
ми; устранение «лишних» клеток при их образовании сверх нормы
и др. Особо значимые и изученные проявления апоптоза лимфоцитов
показаны в таблице 10.
¡50Глава 4, Возбуждение и торможение иммунной системыТаблица 10Участие апоптоза в формировании иммунной системы и реализации
иммунологических процессовЭтап развития и
функционированияСобытиеПроявление (в скобках механиз¬
мы апоптоза)ФормированиесубпопуляцийлимфоцитовРанние этапы форми¬
рования популяцийГибель избыточных клеток
(вследствие дефицита факторов
выживания)Формирование анти-генраспознаюшихрецепторовВыбраковка клеток с дефектом
реанжировки рецепторных
генов (отсутствие сигналов от
стромальных клеток)Селекция клоновГибель клеток, не распознаю-
ших аутологичные комплексы
МНС-пептид (апоптоз «по
умолчанию«^) при положи¬
тельной селекции, и гибель
аутоспецифических клеток
(активационный апоптоз) при
отрицательной селекцииДифференцировкасубпопуляцийАпоптоз Т-клеток
при несоответствии
специфического рецептора
и корецептораЗрелыепокоящиесяклеткиГомеостатический
контроль зрелых
клетокГибель избыточных клеток
(дефицит гомеостатических
факторов выживания)Элиминация старых
клетокАпоптоз старых клеток (вклю¬
чение эндогенной программы
апоптоза?)Иммунный ответАктивация и проли¬
ферация лимфоцитовАктивационный апоптоз (сиг¬
нализация через мембранные
рецепторы)Созревание аффини¬
тета антителГибель низкоаффинных
клонов В-клеток
(конкуренция за антиген
и помощь Т-хелперов)
4.2. Апоптоз и его место в развитии и функционировании...151Окончание табл. ЮЭтап развития и
функционированияСобытиеПроявление (в скобках механиз¬
мы апоцтоза)Элиминация эффек¬
торных клетокАпоптоз отработавших клеток
(включение эндогенной про¬
граммы апоптоза?)Реализация цитоток-
сического эффекта
лимфоцитовГибелъ клеток-мишеней цито¬
токсических лимфоцитов
(передача апоптотического
сигнала по перфорин/гранзим-
ному механизму)4.2.3. МЕХАНИЗМЫ И СИГНАЛЬНЫЕ ПУТИ, ВОВЛЕКАЕМЫЕ
В РАЗВИТИЕ АПОПТОЗАМожно выделить три фазы развития апоптоза (рис. 24). Суть первой
из них — рецепция сигнала и начальные этапы его передачи. Эта фаза
обратима. Вторая фаза — активация каспаз — является ключевым собы¬
тием в развитии апоптоза; она приводит к необратимым последствиям.
Третья фаза состоит в реализации гибели клетки, запрограммирован¬
ной на предыдущем этапе. Проявления первой фазы развития апоптоза
многообразны. Вторая и третья фазы протекают более стандартно.Индукция апоптозаМиюкондриальный
: ¡механйзм. : ;
Актй^й^ каопазы 9Необратимая фаза
программирования
апоптозаРеализация апоптозаРецепторный .
механизм.!
Акшвация каспазы 8Рис. 24. Стадии развития апоптоза
і52 Глава 4. Возбуждение и торможение иммунной системы4.2.3.1. Рецепторный механизм включения апоптозаВ настоящее время пути и механизмы запуска апоптоза сводят к
двум механизмам — рецепторному и митохондриальному. Наиболее
детально изучен рецепторный механизм включения апоптоза {рис. 25)
[190, 211]. На поверхности клеток могут экспрессироваться специали¬
зированные рецепторы, передающие сигналы к развитию апоптоза.
Их общее обозначение — рецепторы смерти (Death receptors — DR).
Эти рецепторы относятся к семейству рецепторов фактора некроза
опухоли а (TNFa — Tumor necrosis factor a) [561]. От других рецепто¬
ров этой группы они отличаются наличием в цитоплазматической
части специального домена смерти (Death domain), содержащего
около 80 аминокислотных остатков, который необходим для вклю¬
чения внутриклеточного сигнала, приводящего к развитию апоптоза
[449]. К настоящему времени описано шесть DR-рецепторов. Среди
них наиболее известен Fas-рецептор (АРО-1, CD95) [806, 866]. Его
лигандом служит гримерная молекула, относящаяся к семейству
TNFa — Fas-лигаид (FasL, CD178) [514]. Известны мембранная и
растворимая формы FasL, из которых первая является значительно
более эффективным индуктором апоптоза клеток, несущих рецеп¬
тор CD95, по сравнению со второй. К семейству DR относится также
рецептор TNF типа I — TNF-R1 (р55, CD120a), тогда как рецептор
типа И (р75, CD120b) лишен домена смерти и непосредственно не
включает апоптогенные сигналы [835]. Лигандом для TNF-R1 служат
молекулы семейства TNF — TNFa и лимфотоксин а (ФНОр — фактор
некроза опухоли р). Рецептор DR3 передает сигналы от недостаточно
охарактеризованной молекулы DR3L (AP03-L), DR4 и DR5 служат
рецепторами для молекулы TRAIL (TNF-related apoptosis-inducing
ligand) [415]. Этот тример, также относящийся к семейству ФНО,
связывается, кроме того, с рецепторами-ловушками DcRl и DcR2,
обусловливающими разрушение TRAIL. В связи с этим TRAIL не
играет существенной роли в индукции апоптоза нормальных клеток,
однако он включает апоптоз опухолевых клеток, на которых рецепто¬
ры-лову щки отсутствуют РІЛИ экспрессируются слабо [840]. Природа
лиганда DR6 изучена слабо.Во всех случаях взаимодействие гримерных лигандов с рецептора¬
ми приводит к тримеризации последних, что является обязательным
условием их функционирования в качестве передатчиков апоптоти¬
ческих сигналов. При этом домены смерти приобретают способность
взаимодействовать с аналогичными доменами адапторных белков
4.2. Апоптоз и его место в развитии и функционировании...153TRAILFASL TNFРис. 25, Рецепторный механизм включения апоптоза:FADD (Fas-associated death domain) — домен смерти рецептора Fas; Fas — рецептор
Fas; FasL (Fas ligand) — лиганд для рецептора Fas; TNF (Tumornecrosis factor) — фак¬
тор некроза опухоли; TNFRI (TNF receptor I) — рецептор I для фактора некроза опу¬
холи; TRADD (TNF-receptor associated death domain) — домен смерти рецептора для
фактора некроза опухоли; TRAIL (TNF-related apoptosis-inducing ligand) — лиганд,
индуцирующий связанный с фактором некроза опухали апоптоз
Í54 Глава 4. Возбуждение и торможение иммунной системыFADD (Fas-associated death domain) и TRADD (TNF-receptor death
domain). FADD узнает домены смерти в составе прокаспазы 8 и, вза¬
имодействуя с ними, обусловливает активацию каспазы 8 (см. ниже).
Результат действия TRADD аналогичен, но он реализуется через по¬
средство FADD. Формирующиеся в результате указанных взаимодейс¬
твий молекулярные комплексы называют DISC (Death-inducing signal¬
ing complex) [501]. Рецепторный путь включения апоптоза не требует
синтеза РНК и белка de novo, но требует затрат энергии.4.2.3.2. Митохондриальный механизм включения апоптозаДругая группа механизмов включения апоптоза реализуется в
условиях дефицита ростовых факторов, когда клетка как бы пре¬
доставляется сама себе (апоптоз «по умолчанию», или пассивный
апоптоз). Этот механизм апоптоза называют также митохондриаль¬
ным (рис. 26) [838]. В отсутствие сигналов выживания в клетке нару¬
шается функция митохондрий, в частности механизмы гликолиза и
дефосфорилирования АТФ. Поскольку АДФ и продукт гликолиза —
пируват необходимы для нормального осуществления окислительно¬
го фосфорилирования, транспорта электронов и создания градиента
протонов, эти процессы нарушаются, что приводит к повреждению
мембраны митохондрий [683]. Механизм «митохондриального» апоп¬
тоза реализуется при гибели клеток под действием стрессорных фак¬
торов (в том числе облучения, гипоксии), глюкокортикоидов и ряда
токсических агентов, например цитостатиков, применяемых в онко¬
логической практике. В этих случаях основой апоптоза служат про¬
цессы, сводящиеся к повышению проницаемости мембраны митохон¬
дрий для проаноптотических факторов семейства Вс1-2 [669].Белки этого семейства делятся на несколько групп. Часть из них
содержат 3-4 ВН-домена (ВН — от «Вс1-2 homology») и подразде¬
ляются на антиапоптотические (Вс1-2, Bc1-Xl, Мс1-1 и т,д.) и про-
апоптотические (Вах, Вак, Вс1-Х^ и т.д.) факторы. Особую группу
составляют «толъко-ВНЗ»-белки («ВНЗ-оп1у» — Bad, Bid, Вік, Bim,
Noxa, Puma, Bbc3 и т.д.), которые, в соответствии с названием, содер¬
жат только один ВН-домен — ВНЗ, а в остальном не отличаются от
белков рассматриваемого семейства. Именно «только-ВНЗ»-белкам,
прежде всего Bim, мобилизуемому из цитоскелета, отводят роль пус¬
ковых факторов апоптоза по умолчанию [447, 575[. Экспрессия или
активация «только-ВНЗ»-белков происходит в условиях дефицита
цитокинов и других факторов выживания, а также при активации
4.2. Апоптоз и его место в развитии и функционировании...1558im/Bd-2АпоптосомаBikmci-2Рис. 26, Митохондриальный механизм включения апоптоза:Araf-1 (Apoptoseproiease activation factor-i) — фактор 1 активации апоптотической
протеазы; Eel (В-cell lymphoma) — В-клеточная лимфома; Вс1-2 — семейство белковf
контролирующих терминальную стадию апоптоза. Белок Bct-2 — антиапопто'
тический член семейства Вс1~2; Вік — индуктор апоптоза, член семейства Вс1-2;
Bik/Bcl-2 — продукт гена; Віт — проапоптотический член семейства Вс1-2белка р53 (см, далее) [857]. «Только-ВНЗ»-белки блокируют антиа¬
поптотические факторы типа Вс1-2, образуя с ними димеры, и спо¬
собствуют проявлению активности проапоптотических факторов.
Ключевым проявлением активности последних является формиро¬
вание трансмембранных пор, которые образуются в результате оли¬
гомеризации Вах и Вак, в норме подавляемой антиапоптотическими
факторами [546].Через поры в мембране митохондрий в цитозоль выходят
цитохром с, факторы Apaf-1 (Apoptose protease activation factor 1) и
Smac/DIABLO [560, 651). Apaf-1 освобождается из мембраны мито¬
хондрий: фактор Вік вытесняет его из гетеродимера с факторами
/56Глава 4. Возбуждение и торможение иммунной системыВс1-2 или в составе которого он удерживается в мембране.Apaf-l и цитохром с в присутствии АТФ образуют комплекс с неак¬
тивной каспазой — прокаспазой 9. Этот комплекс называют апоп-
тосомой. В ней под влиянием Apaf-1, распознающего гомологичный
домен в прокаспазе, происходит активация каспазы 9 [876]. Роль
фактора Smac состоит в связывании и инактивации ингибиру¬
ющих факторов семейства IAP (Inhibitors of apoptotic proteins) [351[.
В отличие от рецепторного механизма реализация митохондриаль¬
ного пути включения апоптоза требует экспрессии ряда генов и
синтеза de novo РНК и белка.Два рассмотренных пути включения апоптоза не являются абсо¬
лютно автономными. Так, установлено, что каспаза 8, активируемая
по рецепторному механизму, может включать митохондриальный
путь апоптоза, усиливая освобождение из митохондрий и актива¬
цию проапоптотических «только-ВНЗ»-факторов, в частности Bid.
Этот механизм включения апоптоза срабатывает не во всех клетках с
рецептором Fas (CD95): он реализуется в гепатоцитах, но не в лимфо¬
цитах [735J.До активации каспаз процесс развития апоптоза обратим.
Блокада распространения апоптотического сигнала при двух путях
осуществляется по-разному. Рецепторный механизм апоптоза может
быть прерван благодаря активации группы факторов FLIP (FLICE-
inhibitory protein; FLICE — старое название каспазы 8), которые
содержат эффекторные домены смерти, свойственные каспазе 8, но
лищены ее каталитического центра. В результате они конкурентно
блокируют действие этой каспазы [801]. Митохондриальный меха¬
низм включения апоптоза блокируется упоминавшимися выше
антиапоптотическими факторами семейства Вс1-2, прежде всего
самим Вс1-2 и Bc1-Xl [840]. Действие молекулы Bel-2 связано глав¬
ным образом с ее способностью связывать «только-ВНЗ*»-факторы
и предотвращать их стимулирующее действие на формирование
комплексов Вах-Вак. Вс1-2 способен также связываться непосредс¬
твенно с Вах и Вак, а также с Apaf-L Эти механизмы препятствуют
образованию трансмембранных пор в митохондриях и (или) фор¬
мированию апоптосом [313].Примером сложности процесса регуляции апоптоза и его нераз¬
рывной связи с регуляцией клеточного цикла может служить конт¬
роль экспрессии и функционирования белка р53. Это транскрипци¬
4.2. Апоптоз и его место в развитии и функционировании... 157онный фактор, который обусловливает задержку клеточною цикла и
развитие апоптоза, действуя несколькими параллельными путями —
через влияние на экспрессию белка цитоскелета WAS1, циклинов
и их киназ, регуляторов клеточного цикла Rb и с-туе, а также Fas-
рецептора на активацию «только-ВНЗ»-белков Bad, Noxa и Puma
и т.д. [439]. Экспрессия этого фактора контролируется по меньшей
мере 10 петлями обратной связи, среди которых преобладают отри¬
цательные связи [431]. Наиболее важную роль при этом играют
лигазы убиквитина, прежде всего фактор MDM-2, который обуслов¬
ливает убиквитинизацию белка р53, тем самым подготовляя его к
деградации [602]. В норме усиление экспрессии р53 уравновешивает¬
ся усилением экспрессии MDM-2. При наличии нерепарированных
разрывов ДНК (например, после облучения), в условиях гипоксии
и при ряде других стрессорных ситуаций баланс факторов, конт¬
ролирующих уровень р53, нарушается. Это приводит к повышению
его содержания в клетке, обусловливаюшему остановку клеточного
цикла и развитие апоптоза. В опухолевых клетках часто происходят
мутации гена р53\ в результате белок р53 выходит из-под внутрик¬
леточного контроля и утрачивает функцию эндогенного индуктора
апоптоза [439]. С этим связана характерная для многих опухолевых
клеток устойчивость к апоптозу.Необходимо упомянуть также о «сфингомиелиновом реостате» —
механизме контроля баланса пролиферации и апоптоза, осуществля¬
емого метаболитами сфингомиелина, среди которых роль проапоп-
тотического фактора принадлежит церамиду [647]. Церамид образу¬
ется из сфингомиелина под действием сфингомиелиназ. Активация
нейтральной сфингомиелиназы происходит под влиянием TNFa
[331], кислой сфингомиелиназы — под влиянием облучения, дейс¬
твия ультрафиолета, теплового шока. В последнем случае происхо¬
дит перемещение кислой сфингомиелиназы на поверхности клетки
с образованием мембранных платформ, обогащенных церамидом,
которые служат источником сигнализации, приводящей к развитию
апоптоза [424]. Действие церамид а реализуется через механизмы
митохондриального (через активацию фактора Вах) и рецепторного
(через Fas-рецептор) путей. При действии на сфингозин (проапоп¬
тотический продукт сфингомиелина) фермента сфингозинкиназы
образуется сфингозин-1-фосфат, обладающий антиапоптотическим
эффектом [506].
158 Глава 4, Возбуждение и торможение иммунной системы4.2.3.3. Активация каспаз и реализация их действияКак рецепторный, так и митохондриальный путь включения
апоптоза приводит к активации каспаз (рис. 27). Каспазы пред¬
ставляют собой группу цистеиновых протеаз, которые расщепля¬
ют полипептидную связь после остатков аспарагиновой кислоты.
Различие отдельных каспаз ио специфичности сводится к распоз¬
наванию различных тетрапептйдов, прилегающих к месту разрыва с
NHj-Konna [801]. Как уже отмечалось, рецепторный путь приводит к
активации каспазы 8 (реже — каспаз 2 и 10), митохондриальный — к
активации каспазы 9. Эти ферменты относятся к группе инициатор-
ных каспаз. В неактивной форме (прокаспазы) они содержат наряду с
двумя протеазными доменами два домена смерти (прокаспазы 8 и 10)
для взаимодействия с FADD и другими адапторными белками или
домен, рекрутирующий прокаспазу в состав апоптосомы (прокас¬
пазы 9 и 2). Их активация является следствием агрегации, возника¬
ющей вследствие взаимодействия с адапторными белками (FADD,
Apaf-l) и вызывающей аутокаталитическое отщепление длинного
N-концевого участка. В процессе активации молекулы происходит
реорганизация доменов и формирование активного гетеродимера
(тетрамер р18/р11-р18/р11 в случае каспазы 8, тример - в случае кас¬
пазы 9) [693]. После активации инициаторных каспаз процесс апоп¬
тоза становится необратимым.Инициаторные каспазы вызывают частичный протеолиз (отщеп¬
ление короткого продомена) и вследствие этого активацию исполни¬
тельных, или эффекторных, каспаз — 3, 6 и 7 [638], Наиболее важной и
универсальной по своему участию в осуществлении апоптоза является
каспаза 3 [840]. Активная каспаза 3 представляет собой димер р17/р12.
Исполнительные каспазы формируются также при действии гранзи-
ма В — сериновой протеазы, транспортируемой в клетки-мишени из
киллерных лимфоцитов (Т и NK). Гранзим В расщепляет каспазы 7 и
10, из которых последняя вызывает протеолиз каспазы 3, а первая сама
является исполнительной каспазой [389].Известно до 280 молекул-мишеней исполнительных каспаз [378].
Значительная часть их мишеней локализуется в ядре [328]. Расщепление
молекул-мишеней определяет весь спектр проявлений апоптоза [693],
Действие каспаз на фактор ретинобластомы (Rb) и 5-изоформу про¬
теинкиназы С определяет нарушение контроля клеточного цикла.
Расщепление киназ МЕКК-1 и FAK приводит к изменениям, имеющим
следствием ослабление адгезионной способности клетки, а расщепле-
4.2. Апоптоз и его место я развитии и функционировании...159Каспаза 9Каспаза 8Прокаспаза 3Каспаза 3, ^тжжшж*мишени эффекторных (шспаз:,.
ЭкЯйре ^ :CAD, РА№^ D^A-PKcs» ,
SREBPi Df%-45, РКС5^и 0.1^,
MEICKi 1шмйьгй т,д.;
вцитоппагштштРис. 27. Эффекторная фаза апоптоза:CAD (Caspase-activated DNAase) — активированная каспазой ДНКаза; DFF-45 (DNA-
fragmentation factor-45) — фактор фрагментации ДНК-45; DNA-PK (DNA-dependent
protein kinase) — ДНК-зависимая протеинкиназа; ERK (Extracellular signal regulated
kinase) — киназа, регулируемая внеклеточным сигналом; МАРК (Mitogen-activated
protein kinase) — активированная митогеном протеинкиназа; МЕКК (MAPK/ERK
kinase kinase) — киназа киназы MAPK/ERK; PARP{Poly(ADP-riboside)polymeraseJ —
поли-АДФ-рибозилполимераза; РКС (Protein kinase С) — протеинкиназа С
ІвО Глава 4. Возбуждение и торможение иммунной системыние гельсолина и киназы РАК определяет характерные изменения кле¬
точной морфологии. Расщепление той же каспазой ядерных ферментов
PARP (Poly-ADP-ribose polymerase), а также ДНК-зависимой протеин¬
киназы нарушает процесс репарации ДНК [693].Одна из главных мищеней каспазы 3 — нейтральная эндонуклеаза
CAD (Caspase-activated DNase) активируется в результате расщепле¬
ния каспазой ингибиторного субкомпонента (ICAD) [722, 853]. Она
ответственна за осуществление межнуклеосомной фрагментации
ДНК в апоптотических клетках: в изолированных клетках мышей,
дефицитных по гену CAD, апоптоз не сопровождается деградацией
ДНК [480]. Активированная CAD осуществляет разрывы ДНК с обра¬
зованием гидроксильных групп на 3’-конце. Это делает их субстратом
терминальной дезоксирибонуклеотидилтрансферазы, что использу¬
ется при постановке TUNEL-теста на апоптотические клетки. В силу
особенностей четвертичной структуры CAD для ее действия доступны
участки молекулы ДНК, расположенные между нуклеосомами [852].В случаях дефицита CAD межнуклеосомная фрагментация ДНК
апоптотических клеток все равно осуществляется, однако это про¬
исходит не автономно в клетке, подвергающейся апоптозу, а внут¬
ри макрофагов, которые поглощают эти клетки [595]. Фагоцитозу
апоптотических клеток способствует экспрессия на их поверхности
ряда молекул, которые служат для фагоцитов источником сигналов
«съещь меня» [357]. Так, при апоптозе нарушается асимметрия мем¬
браны и фосфатидилсерин, в норме локализующийся на внутренней
поверхности мембраны, оказывается экспонированным на ее вне-
щней поверхности. Определение мембранного фосфатидилсерина
по связыванию его меченого лиганда — аннексина V служит осно¬
вой распространенного цитофлуорометрического теста на апоптоз
[817]. Фосфатидилсерин, а также тромбоспондин и десиалирован-
ные остатки мембранных гликоконъюгатов, также появляющиеся на
поверхности апоптотических клеток, распознаются мембранными
молекулами фагоцитов (как профессиональных, так и факультатив¬
ных), что обеспечивает осуществление фагоцитоза [732]. ДНК фаго¬
цитированных апоптотических клеток подвергается фрагментации
лизосомной ДНКазой Н в условиях кислой среды; при этом разрывы
ДНК также локализуются между нуклеосомами [480J.В последние годы появились данные, обосновывающие сущест¬
вование (по крайней мерс, у млекопитающих) механизма развития
апоптоза, реализуемого в присутствии ингибиторов каспаз, т.е. неза-
4.2, Апоптоз и его место в развитии и функционировании,,, 161висимого от активации каспаз. Однако при этом, как и при класси¬
ческом апоптозе, происходит фрагментации ДНК клетки. Механизмы
этой разновидности апоптоза изучены слабо; показано лишь участие
в осуществлении расщепления ДНК (но не протеолиза) факторов A1F
(Apoptosis-inducing Factor) и эндонуклеазы G [575].Показана причинная связь гибели клетки с фрагментацией ДНК:
введение в клетку гена, кодирующего активную форму CAD, вызы¬
вают ее гибель [776]. С другой стороны, блокада фрагментации
не предотвращает гибель клетки в процессе апоптоза [722], что
свидетельствует о множественности причин гибели. Среди других
причин апоптотической гибели клетки называют исчерпание ее
энергетических ресурсов вследствие нарушения функции митохон¬
дрий и неконтролируемых расходов энергии на репарацию ДНК.
Эффективное завершение апоптоза в виде фрагментация ДНК и
фагоцитоза апоптотических клеток чрезвычайно важно для орга¬
низма в целом, поскольку предотвращает поступление внутрикле¬
точных компонентов, включая ДНК, в межклеточное пространство.
Накопление этих продуктов при нарушении механизмов апоптоза
инициирует развитие воспаления и аутоиммунных процессов, в том
числе (при системной красной волчанке) образования аутоанител к
ДНК [629]. На этом основании сделан вывод о ключевой роли дегра¬
дации ДНК если не в осуществлении гибели апоптотических клеток
(деградация ДНК является не единственной причиной гибели кле¬
ток), то в поддержании гомеостаза и предотвращении аутоиммун¬
ных процессов [480, 629].
Глава 5ОТ АТТЕНУИРОВАННЫХ ШТАММОВ
К СУБЪЕДИНИЧНЫМ ПРЕПАРАТАМв соответствии с Законом «Об иммунопрофилакл ике инфекционных
болезней человека» (1998) вакцинация, будучи частью государственной
политики в области здравоохранения, является приоритетной системой
мероприятий, осуществляемых в целях предупреждения, ограничения
распространения и ликвидации инфекций, Вакгщнация является важ¬
нейшим достижением медицины и по праву считается наиболее эффек¬
тивным средством предупреждения инфекционных заболеваний [84].Впервые о возможности защиты от смертельно опасной инфек¬
ции — натуральной оспы — стало известно в 1721 г., когда после
возвращения из Африки американский адвокат С. Mather сообщил,
что для защиты от инфекции коренное население втирает заразный
материал в кожу. В то время медицинская общественность не оцени¬
ла этот метод как принципиально новый в профилактике заболева¬
ний. Только спустя несколько десятилетий, в 1796 г., английский врач
Е. Jenner испол ьзовал подобный метод для защиты от натурал ьной оспы.
Когда L. Pasteur открыл метод аттенуации микроорганизмов, началась
эпоха вакцинации, в развитии которой можно выделить три периода.1. 1890-1950 гг, С появлением технологии культивирования бакте¬
рий стало возможным создание бактериальных вакцин и анатоксинов
(туберкулез, дифтерия, коклюш, столбняк).2. 1950—1970 гт. С развитием вирусологии и культивирования виру¬
сов в культуре тканей появились вакцины против полиомиелита,
кори, паротита, краснухи, ветряной оспы.3. С 1970 г. началась эра молекулярной биологии, разработки новых
технологий и создания вакцин нового типа. К ним относятся реком¬
бинантные вакцины против гепатита В, конъюгированные на осно¬
ве носителя 1ЮЛИ0КСИД0НИЯ («Гриппол», «Гриппол плюс», «Гриппол
Нео»), субъединичные (инфанрикс, агрипал, инфлювак) и расщеплен¬
ные (сплит) вакцины против гриппа (ваксигрип, флюарикс, бегривак),
конъюгированные полисахаридные (против гемофильной инфекции),
полисахаридные, рекомбинантные векторные (против ЦМВ), ДНК-
вакцины и многие другие (см. главы 6 и 12).Данные периоды точно соответствуют развитию различных раз¬
делов науки — микробиологии, иммунологии, молекулярной био¬
5./. Живые аттенуированные вакцины І63логии и молекулярной генетики. Совершенствование вакцин шло в
двух направлениях — повышение эффективности, оцениваемое ио
снижению инфекционной заболеваемости, и повышение безопас¬
ности, т.е, снижение поствакцинальных осложнений, в том числе у
лиц с нарушениями иммунитета (Bloom B.R., Lambert R-H,, 2003)
[84], Эти нарушения могут быть следствием врожденной иммунной
недостаточности, лейкемии, лимф омы, опухоли с множественными
метастазами, а также лучевой терапии и лечения алкилирующими
препаратами, антиметаболитами или кортикостероидами. Кроме
того, в последнее время серьезной проблемой становится снижение
инфекционной заболеваемости и эффективная вакцинация в регио¬
нах с экологически неблагоприятной обстановкой, где у значительной
части населения отмечается снижение функциональной активности
иммунной системы.В настоящее время используют разнообразные вакцины, которые
обычно разделяют на так называемые традиционные и вакцины ново¬
го поколения. К традиционным вакцинам относятся: живые или атте¬
нуированные вакцины, инактивированные (химическим путем или
нагреванием) вакцины и анатоксины. К вакцинам нового поколения —
субъединичные и конъюгированные вакцины, в которых иммунизи¬
рующие структуры совмещены с фрагментами, обладающими адъю¬
вантными свойствами.В данной главе будут рассмотрены типичные свойства традицион¬
ных живых, убитых и химических вакцин, осложняющие их исполь¬
зование и определяющие разработку безопасных эффективных вак¬
цинных препаратов — субъединичных вакцин.5.1. ЖИВЫЕ АТТЕНУИРОВАННЫЕ ВАКЦИНЫИммунизация живыми вакцинами обычно предпочтительнее
иммунизации убитыми вакцинами из-за более высокого уровня и
длительного ответа. Часто достаточ1ю одной иммунизирующей дозы
для обеспечения эффективного иммунитета (корь). Хотя, например,
для защиты от полиомиелита рекомендуются множественные вакци¬
нации, чтобы перекрыть другую возможную энтеровирусную инфек¬
цию и потенциальную интерференцию между тремя штаммами,
входящими в вакцину. Длительность иммунитета к некоторым вирус¬
ным инфекциям не вполне объяснена. Многие авторы не исключают
164 Глава 5. От аттенуированных штаммов к субъединичным..,бустериый эффект естественными инфекциями, циркулирующими в
популяции (Bloom В.R., Lambert R-H., 2003).Как описано в главе 1, элиминация различных бактерий, ДНК- и
РНК-вирусов, а также грибов обусловлена взаимодействием системы
врожденного и адаптивного, специфического иммунитета. Такой же
механизм реализуется и при использовании живых аттенуированных
вакцин, формирующих стойкий специфический иммунный ответ.
Эффективность вакцинации живыми вакцинами, как правило, свя¬
зывают с персистенцией вакцинного штамма в организме и разнооб¬
разием эпитопов, в отношении которых реализуется иммунный ответ.
Помимо этого, эффективность вакцинации связана и с разнообрази¬
ем патоген-ассоциированных молекулярных частиц, формирующих
молекулярный образ патогена (РАМР), т.е. сигналов, стимулирующих
рецепторы врожденного иммунитета (см. главу 1, раздел 1.3). Однако
критическим для эффективной вакцины является наличие компо¬
нента, определяющего синтез и секрецию ключевого, инициирующе¬
го иммунный ответ цитокина — ИЛ-lß,Секреция ИЛ-lß при вакцинации самыми разнообразными вак¬
цинными препаратами происходит в два этапа. На первом этапе
патоген-ассоциированная молекулярная частица взаимодействует с
соответствующими рецепторами TLR или NOD. Данное взаимодейс¬
твие приводит к активации фактора транскрипции NFkB и синтезу
предшественника ИЛ-lß. Второй этап — формирование инфламма¬
сомы и активация фермента семейства Cys-Asp-протеазы (каспазы 1),
расщепляющей предшественника ИЛ-lß, в результате чего происхо¬
дит выделение ИЛ-lß.Формирование и активация комплекса, называемого инфламма-
сомой и необходимого для активации каспаз, происходит в цитозоле
при взаимодействии молекул NALP и ASC. В молекуле NALP, прина¬
длежащей к семейству NLR (NOD-like receptor), можно выделить три
структурных домена — С-концевой домен LRR (Leucine-rich repeat
domain), средний NACHT- или PYD-домен (Pyrin domain) и N-конце-
вой домен CARD (Caspase recruitment domain) [386, 520]. Молекула ASC
(Apoptosis-associated speck-like protein) состоит из двух доменов: С-кон¬
цевого CARD и N-концевого PYD. Домен PYD, принадлежащий ASC,
может взаимодействовать с доменом PYD различных NALP, в то время
как домен CARD молекулы ASC может взаимодействовать только с
прокаспазой-1. ASC активируется при появлении в цитозоле внеядер-
ной ДНК или других молекул опасности, в том числе и бактериально¬
5.1. Живые аттенуированные вакцины 165го или вирусного происхождения [384]. Взаимодействие NALP и ASC
приводит к активации каспазы-1. На сегодняшний день известны
несколько типов инфламмасом. NALPl-инфламмасома состоит из
NALP1, ASC, каспазы-1 и каспазы-5. NALP2/3-инфламмасомы состо¬
ят из NALP2/3, ASC и только каспазы-L Четвертая инфламмасома
состоит из 1PAF, ASC и каспазы-1. NALP12 не формирует инфламма¬
сомы, но регулирует интенсивность выделения провоспалительных
цитокинов за счет интерференции с 1RAK-1, входящим в TLR-зави¬
симый сигнальный путь [384, 795]. Необходимость формирования
инфламмасом и активация касиазы-1 для продукции ИЛ-1|3 и ИЛ-18
были обнаружены и в макрофагах, и в моноцитах. Таким образом,
важнейшим условием эффективной вакцинации является активация
молекулы NALP3, определяющей формирование инфламмасомы,
необходимой для стимуляции врожденного иммунитета и иницииру¬
ющей специфический иммунный ответ. Однако функции семейства
NALP этим не ограничиваются, и их важнейшей физиологической
функцией является включение митоген-активированного сигнально¬
го пути и контроль активации каспаз, обусловливающих как воспале¬
ние, так и апоптоз (см. главу 4, раздел 4.2) [384, 795J.Роль рецепторов семейства NLRs наглядно демонстрируют дан¬
ные, показывающие, что мутации в генах, кодирующих молекулы
NALPs, приводят к развитию многочисленных воспалительных и
аутоиммунных заболеваний, включая болезнь Крона, Блау-синдром,
ранний саркоидоз и атопические заболевания [384, 795].Таким образом, семейство NOD-рецепторов играет центральную
роль как в развитии иммунного ответа на разнообразные инфекцион¬
ные агенты, так и в развитии патологии, определяемой инфекцион¬
ным или вакцинальным процессом. Какая же это патология?Прежде всего, при иммунизации живыми бактериальными вакци¬
нами пациентов с иммунодефицитными состояниями могут развиться
ассоциированные с вакциной инфекции (Bloom B.R., Lambert Р.-Н,,
2003). Введение живых аттенуированных вирусных вакцин больным
с нарушениями иммунитета может вызывать у них репликацию вак¬
цинного вируса полиомиелита, краснухи, паротита и т.п. и развитие
поствакцинальных осложнений в виде местных реакций [254, 335, 369,
755]. Однако мировой опыт показал возможность вакцинации пациен¬
тов с иммунодефицитными состояниями при соблюдении некоторых
условий, в частности, живыми вирусными вакцинами можію имму¬
низировать пациентов с лейкемией в стадии ремиссии, не получавших
166 Глава 5. От аттенуированных штаммов к субъединичным...химиотерапии на протяжение трех месяцев, или минимум за две неде¬
ли до начала лечения цитостатиками (Bloom B.R., Lambert Р.-Н., 2003).Мы не будем разбирать особенности вакцинации у ВИЧ-инфици¬
рованных пациентов. Этой проблеме посвящен ряд обзоров. Отметим
только, что больщинство исследователей сходятся во мнении, что
частота поствакцинальных осложнений в ответ на введение инакти¬
вированных вакцин у ВИЧ-инфицированных, как больных СПИДом,
так и у асимптоматичных пациентов, не выше, чем у здоровых. Это, в
частности, подтверждено на привитых АКДС и гемофильной В вак¬
цинами [428, 716, 717], а также вакциной против гепатита В [580].Необходимо отметить, что пассивная иммунопрофилактика имму¬
ноглобулинами может назначаться иммунокомпрометированным
пациентам вместо или в дополнение к вакцинации. При контакте с
больным вакциноконтролируемым заболеванием, таким, как корь,
дети с тяжелыми нарушениями иммунитета считаются подвержен¬
ными данному заболеванию независимо от того, получали ли они
вакцинацию раньше (Bloom B.R., Lambert R-H., 2003).Вакцина BCGПрививки против туберкулеза вакциной BCG рассматриваются
ВОЗ как наиболее доступное и рентабельное мероприятие по про¬
филактике туберкулеза. Нормальный вакцинальный процесс обус¬
ловливает развитие в месте введения через 4—6 нед, а в отдельных
случаях в более поздние сроки небольшого инфильтрата (диаметр6,5—8 мм). Инфильтраты диаметром более 10 мм оцениваются как
сильная местная реакция [3]. К осложнениям после прививки относят
лимфадениты, келлоидные рубцы, остеомиелит, генерализованную
BCG-инфекцию [2]. Противотуберкулезная иммунизация обычно
безопасна. Осложнения встречаются не более чем в 0,01—0,06% слу¬
чаев, в основном у детей с дефектами иммунитета [2, 3, 41, 49, 142,
145]. Наиболее тяжелой формой осложнений является генерализация
BCG-инфекции по типу тяжелого общего заболевания с полиморфной
клинической симптоматикой, обусловленной поражением различных
органов, она большей частью заканчивается летально. На аутопсии
обнаруживают поражения внутренних органов (миллиарньте бугорки,
очаги казеоза), из которых можно выделить микобактерии вакцинно¬
го штамма. По данным исследования, проведенного в 1979—1983 гг. в
шести странах, частота генерализованной BCG-инфекции у новорож¬
денных составила 4,29, а у детей, привитых в более старшем возрасте, —
5. /. Живые аттенуированные вакцины Í673,58 на 1 млн [221, 277, 370, 406J. У детей с иммунодефицитами BCG-
вакцинация часто оказывается фатальной уже в первые месяцы
жизни, для пациентов с хронической фанулематозной болезнью (ХГБ)
характерны очаговые поражения в виде подмышечного лимфаденита,
иногда в ассоциации с легочным BCG. По некоторым оценкам, такие
реакции встречаются у половины детей с ХГБ [298, 320]. Патогенез
диссеминации или затягивания BCG-инфекции при ХГБ оконча¬
тельно не выяснен. Некоторое влияние на характер осложнений BCG
оказывает возраст иммунизации [41, 298]. Так, по данным некоторых
авторов, остеит развивается лишь у детей, иммунизированных в пери¬
оде новорожденности (Palomino J.C. et al., 2007). Эти факты объясняют
обусловленной возрастом незрелостью фагоцитарных функций, осо¬
бенно хемотаксиса (Palomino J.C. et al., 2007) [41]. Основное значение
в формировании устойчивости к микобактериальной инфекции при¬
дается Т-лимфоцитам и их взаимодействию с макрофагами. Лечение
BCG специфическими препаратами не заменяет антибактериальной
терапии как основного лечебно-профилактического подхода при ХГБ.
В то же время BCG, как ранний признак ХГБ, является своеобразным
клиническим маркером, при его выявлении необходимо проводить
целенаправленное иммунологическое обследование с целью исклю¬
чения первичного иммунодефицита (Palomino J.C. et а!., 2007).Живая вакцина против полиомиелитаВ России и большинстве стран мира применяется живая вакцина,
изготовленная из аттенуированных штаммов А. Сейбинатрех иммуно¬
логических типов (I, П, П1) вируса полиомиелита. Высокоэффективная
вакцина справедливо считается наименее реактогенной среди вирус¬
ных вакцинных препаратов. Благодаря массовой вакцинопрофи-
лактике заболеваемость паралитическим полиомиелитом в США
снизилась с 160 тыс. случаев в довакцинальный период до 10 случаев
в год в период 1980—1984 гг. В Советском Союзе заболеваемость была
снижена с 10,7 в 1957 г. до 0,04 на 100 тыс. в 1984—1985 гг. Процессы,
вызванные введением вакцины, обычно клинически не проявляются.
У детей раннего возраста, особенно с неустойчивым стулом, в первые
2—3 дня возможно учащение стула без нарушения общего состо¬
яния. Имеются единичные сообщения о развитии аллергических
реакций немедленного типа (кожные сыпи, отек Квинке). Исключи¬
тельно редко с введением вакцины связывают судорожные реакции
(Bloom B.R., Lambert Р-Н., 2003).
168 Глава 5. От аттенуированных штаммов к субъединичным,..Серьезную проблему составляет вакцино-ассоцмироваиный по¬
лиомиелит (ВАП), который может развиться в интервале от 4-го до
30-го дня после вакцинации у привитого и до 60-го дня с момента
контакта с привитым у невакцинированного. ВАП вызывает вялый
парез конечностей, чаще нижних, диагноз основывается помимо
самого факта введения или тесного контакта с привитым на эпиде¬
миологических данных и связи между вакцинацией или контактом
и появлением клинической симптоматики. С 1973 по 1984 г. в США
105 (76%) из 138 случаев паралитического полиомиелита расценены
как ВАП, из них более половины составили лица, контактировавшие
с привитыми. В Англии описан случай бульбарного полиомиели¬
та у 23-летнего мужчины, 7-месячный сын которого за 47 дней до
этого был впервые вакцинирован живой полиомиелитной вакциной.
В связи с возможностью инфицирования рекомендуют одновременно
с ребенком вакцинировать родителей и лиц, ранее не привитых и кон¬
тактирующих с привитыми. По американским данным, частота ВАП
у получивших первую дозу составляет 1;520 тыс, доз, у получивших
последуютцие дозы 1:12 300 тыс. доз. В Венгрии и Японии до 1969 г.
наиболее часто ВАП связывали с ПТ типом хюлиовируса. Путем отбо¬
ра высокоиммуногенных серий с 1970 г. число случаев, связанных с
III типом, сократилось, основная часть ВАП связывается со 11 сероти-
пом (Bloom B.R., Lambert Р.-Н., 2003) [84].Считается, что дефекты гуморального иммунного ответа (агамма-
глобулинемия — АГГ) увеличивают риск ВАП, однако по другим све¬
дениям у большинства заболевших такой недостаточности установить
не удалось (Bloom B.R., Lambert Р.-Н., 2003). Больные с избирательным
дефектом антителопродукции обычно хорошо переносят вирусные
инфекции и вакцины, хотя не способны вырабатывать полноценный
иммунитет. Однако больные с АГГ имеют высокую частоту осложне¬
ний на полиовакцину в виде паралитических поражений, в 10 тыс. раз
превышающую частоту у иммунокомпетентных детей. Это связано с
возможностью реверсии аттенуированных штаммов в вирулентные в
желудочно-кишечном тракте больных, с помощью различных методов,
в том числе при использовании моноклональных антител и метода оли-
гонуклеотидного картирования, показаны антигенные и молекулярные
вариации типов полиовируса в условиях пассирования через кишечник
человека. Вакциноподобные вирусы с измененной характеристикой
могут быть непосредственной причиной ВАП, особенно при суи1;ествеи'
ном ограничении циркуляции вирулентного вируса [20, 844].
5.L Живые аттенуированные вакцины 169Учитывая, 4 10 вакцинированные лица выделяют вирус, нет необхо¬
димости вакцинировать домашнее окружение. Чтобы избежать ВАП,
ряд стран применяют инактивированную вакцину против полиоми¬
елита. Из-за недостаточной иммуногенности препарата разрабаты¬
ваются комбинированные схемы иммунизации инактивированной и
живой полиомиелитной вакциной. Во время вспышки полиомиелита
в Финляндии в 1985 г. и проведения массовой вакцинации пациенты
с недостаточностью иммунной системы и их домашние «контакты»
вакцинировались убитой вакциной Солка, что сопровождалось уве¬
личением у них продукции антител и уберегало детей от заболевания
полиомиелитом (Bloom B.R., Lambert Р.-Н.> 2003).Живая коревая вакцинаАттенуированный вирус кори может вызвать специфическую реак¬
цию на прививку со слабо выраженными симптомами естественной
коревой инфекции: повышением температуры, катаральными явле¬
ниями, интоксикацией (ухудшение самочувствия, вялость, снижение
аппетита, головная боль), сыпью. Эти явления и слабая гиперемия
соответствуют обычной реакции и не имеют отношения к побочному
действию препарата. Частота сильных реакций (температура 38,6° и
выше с выраженными, но кратковременными симптомами интокси¬
кации) в соответствии с нормативно-технической документацией не
должна превышать 4%. На высоте вакцинального процесса (8—10-й
день) возможны лимфопения f844J, нерезко выраженная лейкопения
и эозинофилопения, тромбоцитопения; с последней связаны случаи
геморрагического васкулита или геморрагической пурпуры [254, 386].
Как специфическую реакцию некоторые авторы расценивают абдо¬
минальный синдром (острые приступообразные боли в животе) [844].
В отдельных случаях возможна энцефалическая реакция, обычно в
виде судорожного синдрома. Судороги, как правило, фебрильные, раз¬
виваются на фоне гипертермии в пределах 14 дней после вакцинации,
у большинства — на 6—10-й день; чаще они бывают однократными,
клоникотоническими, могут сопровождаться кратковременной поте¬
рей сознания и другими общемозговыми расстройствами; состояние
быстро восстанавливается. В основе таких реакций лежат гемодинами-
ческие нарушения. Учитывая срок их развития, предполагают участие
в их генезе вакцинного вируса, что подтверждается электроэнцефалог¬
рафически. По данным ВОЗ, частота судорог составляет 0,02—190 на
100 тыс. вакцинированных, тогда как при кори она достигает 0,5—1%
170 Глава 5. От аттенуированных штаммов к субъединичным...(500—1000 на 100 тыс. заболевших). Вакцинация против кори рассмат¬
ривается как эффективный метод предупреждения коревых энцефали¬
тов и энцефаломиелитов, частота которых составляет 1:1 млн вакцини¬
рованных (при кори 1:1 тыс. заболевших). Под влиянием вакцинации в
10 раз снизилась частота подострого склерозируюш;его панэнцефалита.
Имеются указания на то, что в генезе поствакцинального энцефалита
участвует вирус коревой вакцины. Об этом свидетельствует выделение
вируса кори из спинномозговой жидкости больных в характерные
сроки развития осложнения и вакциноподобная характеристика выде¬
ленного вируса. Отмечается, что диссеминации вируса в организме
привитого может способствовать иммуносупрессия [844].К неспецифическим осложнениям, не связанным с вакцинным
вирусом, относят аллергические сыпи, отек Квинке, артралгии [30].Системные реакции немедленного типа с цианозом, отеком, кра¬
пивницей встречаются исключительно редко, их развитие связывают
с гиперчувствительностью к компонентам вакцины: яичному белку,
антибиотикам. Описаны единичные случаи развития у привитых
специфической коревой пневмонии, которая может быть связана с
диссеминацией вируса коревой вакцины в условиях иммунной недо¬
статочности [39].Дети с иммунодефицитными состояниями, получающие имму-
носупрессивную терапию или стероиды в дозе, эквивалентной2 мг/кг преднизолона и выше, не должны прививаться живой коревой
вакциной. В последнее время рекомендуют прививать против кори
детей с ВИЧ-инфекцией, в том числе симптоматической, так как
дикая инфекция подвергает их высокому риску летального исхода
(Bioom B.R,, Lambert Р.-Н., 2003).Таким образом, основной опасностью вакпинации живыми вак¬
цинами лиц с иммунодефицитными состояниями является развитие
у них вакцинальных инфекций. В отличие от живых вакцин ина¬
ктивированные могут вводиться без риска развития вакцинальной
инфекции (Bloom B.R., Lambert Р.-П., 2003) [84].5.2. УБИТЫЕ И РАЗРУШЕННЫЕ «ХИМИЧЕСКИЕ»
ВАКЦИНЫУбитые вакцины представляют собой структурные компоненты
микроорганизма или детоксицированные (обезвреженные) бакте¬
5.2. Убитые и разрушенные «химические» вакцины 171риальные продукты (токсоиды), которые стимулируют продукцию
антитоксинов. Большинство убитых вакцин вызывают лишь кратко¬
временный иммунный ответ, поэтому для поддержания умеренного
уровня защиты от некоторых возбудителей необходимы реиммуни¬
зации, хотя после иммунизации столбнячным анатоксином антитела
сохраняются до 10 лет. Широкое распространение убитых или ина¬
ктивированных вакцин обусловлено их меньшей опасностью. Более
того, они рекомендуются для вакцинации пациентов с иммунодефи¬
цитами. При этом пациенты с нарушениями иммунитета часто дают
пониженный ответ на вакцины по сравнению со здоровыми людьми,
так что у них может возникать потребность в более высоких или бус-
терных дозах (Bloom B.R., Lambert Р.-Н., 2003) [84].Более низкая иммуногенность убитых или инактивированных
вакцин, обусловленная неспособностью к инфекционному процессу
используемого материала, требует введения в конструкцию вакцины
компонентов, усиливающих иммунный ответ, или адъювантов — мас¬
ляно-водных эмульсий, сапонинов, препаратов алюминия, которые,
как считалось, формируют иммунокомпетентное окружение в месте
введения вакцины (Bloom B.R., Lambert Р.-Н., 2003) [84]. Наиболее
широкое распространение получили алюминийсодержащие адъю¬
ванты (АСА).Практически все работы последних лет, посвященные изучению
их действия, начинались со слов; «В настоящее время при вакцина¬
ции разнообразными вакцинами наиболее широкое распростране¬
ние получили алюминийсодержащие адъюванты, однако механизм
их действия остается непонятным...». Далее описывали результаты
исследований, показывающих, что под влиянием АСА дендритные
клетки (ДК) приобретают способность стимулировать ТЫ-, а моно¬
нуклеары периферической крови — ТН2-ответ, что оба типа клеток
секретируют ИЛ-1 и ИЛ-18, но только дендритные клетки секретиру¬
ют еше и интерферон-гам ма (ИНФу) [761],К 2007 г. были получены данные, показывающие, что предетер-
минированный алюминиевыми адъювантами ТК2-иммунный ответ
может быть модифицирован. Оказалось, что ДК, стимулированные
тимуснезависимыми антигенами в присутствии АСА, вызывают диф¬
ференцировку «наивных» CD4 клеток в Thl. Кроме того, активиро¬
ванные С04-клетки были способны индуцировать в дендритных
клетках синтез как ИЛ-4 и ИЛ-5, так и ИНФу [761, 808]. Гидроокись
алюминия по способности стимулировать иммунный ответ значи-
172 Глава 5. От аттенуированных штаммов к субъединичным...гсльно превосходит фосфат алюминия. По-видимому, это связано с
тем, что только гидроокись алюминия способна усиливать экспрес¬
сию молекул CD80, хотя оба адъюванта одинаково хорошо стимули¬
ровали экспрессию молекулы CD86 [761].Механизм действия АСА был установлен совсем недавно —
в 2008 г. [808], Его активность проявляется только при формировании
инфламмасомы: у мышей, дефицитных по молекулам NALP3, ASC
или каспазы-1 (элементов инфламмасомы), не наблюдалось значи¬
мого антителообразования или продукции ИЛ-lß, хотя сохранялось
антителообразование при использовании адъюванта Фрейнда [361,
673]. Принципиальное значение молекулы NALP3 и формирование
инфламмасом при стимуляции иммунного ответа АСА было описа¬
но при использовании различных антигенов. Таким образом, при
использовании убитых или инактивированных вакцин, содержащих
АСА, механизм стимуляции иммунного ответа также определяется
формированием инфламмасом. При этом мутации в молекуле NALP3
могут привести к осложнениям, которые встречаются и при вакцина¬
ции живыми вакцинами f61, 510, 550, 673].5.3. ВАКЦИНЫ ПРОТИВ ДИФТЕРИИ, СТОЛБНЯКА,
КОКЛЮША (АКДС)В рамках Расширенной программы иммунизации ВОЗ для вакци¬
нации против дифтерии, столбняка и коклюша используется АКДС-
вакцина. Эпидемиологическая эффективность вакцинонрофилак-
тики коклюпш, дифтерии и столбняка, проводимой практически во
всех странах мира АКДС-вакциной, общепризнана. Трехкратная вак¬
цинация АКДС-вакциной, содержащей цельные микробные клетки
В.pertussis, при 82%-м охвате вакцинацией всех детей, проживающих
на земном шаре, предотвращает ежегодно 85 млн заболеваний коклю¬
шем и 762 тыс. летальных исходов от коклюша у детей [300].Наибольший эффект был зарегистрирован в развитых странах, где
заболеваемость клинически диагностированным коклюшем соста¬
вила всего 3—10 случаев на 100 тыс. населения, а в некоторых странах
Европы (Бельгия, Болгария, Португалия) этот показатель был ниже —
1 на 100 тыс. Вместе с тем в некоторых регионах от коклюша умирает
1 ребенок младше 5 лет каждые 52 секунды. Увеличилось число забо¬
5.3, Вакцины против дифтерии, столбняка, коклюша (АКДС) 173леваний среди взрослых, поэтому обсуждаются перспективы вакци-
напии [300].В России в 1964—1965 гг. началась массовая иммунизация АКДС-
вакииной, когда заболеваемость составляла 415 на 100 тыс., а в 2003 г.
показатель заболеваемости составил 8,7 на 100 тыс. Эффективность
вакцинации была убедительно доказана [84].Вместе с тем АКДС-вакцина является реактогенным препаратом,
преимушественно за счет к0рпускулярн010 коклюшного компонента
[261, 268, 556]. Наибольшую опасность представляют осложнения со
стороны ЦНС, из которых чаще всего встречаются энцефалические
реакции, протекающие по двум типам. КI относятся тонические или
клоникотонические судороги, появляющиеся при повышенной тем¬
пературе и интоксикации в первые 48 ч после прививки. Они сопро¬
вождаются потерей сознания, продолжаются от нескольких секунд до
1—2 мин и у большинства детей не повторяются. Ко И типу относят
тонические (клоникотонические) судороги или малые судорожные
припадки, развивающиеся при нормальной температуре и удовлетво¬
рительном самочувствии в более поздние сроки (4—20-е сутки). Эти
реакции более злокачественны, труднее поддаются лечению и чаще
приводят к остаточным явлениям, в том числе к формированию эпи¬
лепсии 1300]. Частота энцефалических реакций после АКДС-вакци-
нации на 10 тыс. прививок составляла в Германии 0,4, в Голландии —0,25-3,6, в Великобритании — 0,66. Более высокая частота (от 5 до 20)
установлена в США (Bloom B.R., Lasmbert Р.-Н., 2003).Следует учитывать, что не все заболевания с подобной клиникой
являются поствакцинальным осложнением, аналогичная симптома¬
тика в большинстве случаев определяется нсйротоксикозом, связан¬
ным с сопутствующими заболеваниями бактериальной или вирусной
природы [162, 201].К неврологическим осложнениям относят также пронзитель¬
ный крик необычно высокого тона, обусловленный внутричерепной
гипертензией, который отмечается у детей первых 6 мсс жизни в тече¬
ние первых часов после прививки. В ряде случаев он служит одним из
первых симптомов эииефалита [90, 162, 201].У привитых коклюшной вакциной описана внезапная смерть.
Ее риск после введения любой вакцины (АКДС, АДС, менингококко-
вой) в 3-месячном возрасте составляет; в Великобритании — 5, США —
1,5 на 1 млн доз. Основной причиной смерти в первые 24 ч после АКДС-
вакиинации являются инфекции верхних дыхательных путей и легких
174 Глава 5, От аттенуированных штаммов к субъединичным.,,[854]. Исследования последних лет исключают связь между введением
коклюшной вакцины и синдромом внезапной смерти детей.Развитию неврологических осложнений в основном способствуют
неблагоприятный неврологический анамнез (судороги при ранее пере¬
несенных заболеваниях, перинатальная энцефалопатия, патологиче¬
ские роды и т.д.). Центром контроля побочных реакций после иммуни¬
зации США установлено, что вероятность развития судорог больше у
детей с судорогами в индивидуальном анамнезе в 7 раз и семейном —
в 4,5 раза. В связи с этим в большинстве зарубежных инструкций забо¬
левания нервной системы и судороги в индивидуальном и семейном
анамнезе отнесены к противопоказаниям к применению АКДС-вак-
цины. Однако в некоторых работах авторы обоснованно считают, что
семейная история судорог не является противопоказанием к использо¬
ванию коклюшной, равно как и АКДС-вакцины [162, 201].Среди аллергических осложнений наиболее тяжелым является
анафилактический шок, который обычно развивается в 1-е сутки
после повторного введения препарата. К более легким формам аллер¬
гических реакций относят разнообразные сыпи, отек Квинке, артрал¬
гии, сывороточную болезнь, геморрагический синдром [162, 201].5.4. поствакцйнальные реакции и ОСЛОЖНЕНИЯИз предыдущих разделов следуег, что в ответ на введение тра¬
диционной (классической пастеровской) вакцины могут возникать
побочные реакции, т.е, изменение функции органов и систем после
прививок, не связанное с развитием специфической невосприимчи¬
вости [84].Как принято в общеклинической практике, среди побочных реак¬
ций учитывают местные реакции (гиперемия, отек, инфильтрация на
месте введения вакцины) и общие (повышение температуры, разжи¬
жение стула) (Bloom B.R., Lambert Р.-Н., 2003) [84].Поствакцинальным осложнением (ПВО) считают выраженные
функциональные и органические изменения органов и систем необ¬
ратимого характера, возникающие в ответ на введение вакцины.
Как известно, ПВО могут быть обусловлены токсическим (фар¬
макологическим) действием вакцинного препарата, вакцинальным
инфекционным процессом, реверсией вирулентных свойств ВаКЦИН'
5.4. Поствакцйнальные реакции и осложнения 175ного агента (вируса), сенсибилизацией и индукцией аутоиммунных
процессов (Bloom B.R., Lambert Р.-Н., 2003).Все ПВО подразделяют на специфические и неспецифические.
Специфическими считаются осложнения, характерные для той или
иной вакцины: для BCG — лимфаденит, остеомиелит, келлоидный
рубец, генерализованная ВСО-инфекция; для пероральной полио-
вакцины — ассоциированный с вакциной полиомиелит, судорожные
реакции, энцефалические реакции (тонические или тоникоклони-
ческие судороги) на фоне фебрильной температуры, афебрильные
судороги, энцефалит, гломерулонефрит, миокардит, системный вас-
кулит, тромбоцитопеническая пурпура (Palomino J.C. et al., 2007) [20].
Неспецифические поствакцйнальные осложнения: системные реакции
немедленного типа (цианоз, отек, крапивница), аллергические сыпи,
отек Квинке, протеинурия, гематурия.Некоторые реакции специфичны для иммунизирующего агента:
артрит и артралгии — на вакцину краснухи, судороги — на коклющ-
ную вакцину. Однако все побочные явления гораздо более редки и
мягче осложнений естественной инфекции. Повторные иммуниза¬
ции дифтерийно-столбнячным анатоксином могут сопровождаться
ростом местных реакций, поэтому имеется тенденция к уменьше¬
нию числа ревакцинаций. Считается, что аллергические реакции
могут наблюдаться у детей с аллергией к яичному альбумину при
иммунизации против кори, паротита, гриппа, так как эти вирусы
выращивают на куриных эмбрионах. Однако следует отметить,
что присутствие яичного альбумина и консервирующих агентов
(неомипин, мертиолят) в вакцинах минимальное. На практике
рекомендуют предварять вакцинацию у детей кожными тестами
с разведенной вакциной. Широкие исследования показали, что,
несмотря на го, проводится предварительное кожное тестирование
или нет, вакцгтнация, как правило, проходит хорошо (Bloom B.R.,
Lambert Р.-Н., 2003).Уникальные осложнения вакцинации встречаются у иммуно-
компрометированных лиц. Общим правилом является то, что живые
вакцины не должны вводиться детям, получающим цитостатики,
алкилирующие агенты, лучевую терапию, гормоны в иммуносупрес-
сиру ющих дозах, а также детям с установленным или предполагаемым
врожденным или приобретенным дефектом клеточного иммуните¬
та: тяжелой комбинированной иммунологической недостаточностью
(ТКИН), лейкозами, лимфомами [84]. Так, введение вакцины BCG
176 Глава 5. От аттенуированных штаммов к субъединичным...больным с ТКИН приводит к генерализации инфекции по типу
милиарного туберкулеза и смерти (Ра1отшо Д.С, е1 а!., 2007).Именно развитие разнообразных осложнений послужило толчком
к созданию безопасных субъединичных вакцин.5.5. СУБЪЕДИНИЧНЫЕ ВАКЦИНЫВ 1999 г. в журнале «Вакцинация» [117] была опубликована статья
Р.В. Петрова и P.M. Хаитова «Новая отечественная тривалентная
конъюгированная полимерсубъединичная вакцина — «Гриппол» (см.
главу 10), В сравнении с другими вакцинами нового поколения —
«расщепленными» или сплит-вакцинами — субъединичные вакци¬
ны отличаются более высоким уровнем безопасности. Они содержат
только или преимущественно протективные антигены.Теперь принципы разработки безопасных, эффективных, субъ¬
единичных вакцин, апробированные при создании вакцины к вирусу
гриппа, используются для получения вакцин к социально значимым
и опасным инфекциям, таким как туберкулез. Разработке вакцины
предшествуют несколько этапов.1. Обоснование необходимости создания новой вакцины.2. Обоснование активации протективного для данной инфекции
иммунного ответа.3. Выявление эпитопа, индуцирующего протективный иммунитет.Данная стратегия наглядно иллюстрируется при разработке субъ¬
единичных вакцин, защищающих от туберкулеза. Разберем реализа¬
цию данной стратегии по пунктам.1. Проблема создания новой вакцины при туберкулезе обусловлена
несколькими причинами. Во-первых, повсеместным ростом заболе¬
ваемости как в индустриально развитых, так и развивающихся стра¬
нах. Во-вторых, распространением ассоциированной с туберкулезом
ВИЧ-инфекции, В-третьих, развитием туберкулеза с множественной
и широкой лекарственной устойчивостью. И наконец, низкой протек-
тивной активностью вакцины BCG в отношении реинфицирования
(Palomino J.C. et al., 2007).2. Туберкулез и другие микобактериозы являются яркими предста¬
вителями иммунологически полярных инфекций с преобладанием
Thl- или ТЬ2-ответа. Сейчас накоплен огромный материал, пока¬
5.5. Субъединичные вакцины 177зывающий, что благоприятное течение туберкулеза сопровождается
высокой активностью клеточного иммунного ответа — присутствием
в очагах клеток, продуцирующих ИНФу, ИЛ-12, ФНОа, ИЛ-18 и экс¬
прессирующих гены NO-синтазы. Генетические дефекты системы
интерферона (ИНФу и ИЛ-12) вызывали фатальную инфекцию.
Неблагоприятное течение туберкулеза наблюдалось у пациентов с
иммунодефицитными состояниями на фоне высокого уровня АТ
к М. tuberculosis (Palomino IC. et al., 2007),3. Поиск значимых, Т-клеточных антигенов, определяющих про¬
тективный иммунитет, проводили у людей и в экспериментальных
моделях на мыщах, морских свинках, приматах. Были использова¬
ны два критерия — иммунологические и культуральные свойства
штаммов микобактерий. При этом оценивалась способность лим¬
фоцитов в ответ на стимуляцию антигенами экспрессировать гены
или секретировать ИЛ-12 и ИНФу и защищать от инфекции мор¬
ских свинок и приматов. Согласно второму критерию отбирались
только те антигены, которые при культивировании микобактерий
секретировались в среду. В результате различных эксперименталь¬
ных подходов было отобрано три антигена, которые могли стать
основой для создания убитых, субъединичных вакцин, пригод¬
ных для проведения клинических испытаний. Первый — антиген
85 представлял собой три варианта белковых молекул, функциони¬
рующих как миколовые трансферазы. Они обладали наибольшим
адъювантным эффектом. Второй — ESAT6 (early secretory antigenic
target, молекулярная масса 6 кД) — иммунодоминантный ТБ-анти-
ген, обладающий высокой способностью защищать от ингаляци¬
онного заражения мышей и обезьян. ESAT6 в сочетании с липо-
фильным адъювантом создавал у лабораторных животных такую
же степень защиты, как и BCG. Ген ESAT6 стабильно определялся
в различных штаммах М. tuberculosis и отсутствовал в М. bovis BCG.
Генно-инженерная конструкция, основанная на ESAT6 и антигене
85В, в сочетании с синтетическим адъювантом 1С31 вызывала у
мышей и обезьян длительный иммунный ответ и определяла защи¬
ту от аэрозольного заражения.Третий антиген 72f (полипротеин с молекулярной массой 72 кД,
кодированный как Mtb32(C)-Mtb39-Mtb32(N), имел в свой структуре
Т-эпитоп, распознавемый Thl-клетками различного происхождения.
Для иммунизации антигеном 72f использовали адъювант AS01B.
Антиген 72f, полученнный из культурального фильтрата, был исполь¬
178 Глава 5. От аттенуированных штаммов к субъединичным.,.зован как моновакцина для ревакцинации в I фазе клинических
испытаний «стратегия ревакцинации» (EU/TBVAC 5,16).Выраженное побочное действие корпускулярной коклюшной вак¬
цины стимулировало разработку менее реактогенного препарата.
С 1996 г. в России зарегистрирована 3-компонентная бесклеточная
вакцина «Инфанрикс» на основе трех антигенов В. pertussis: коклюш¬
ного токсина (КТ), филаментозного геммаглютинина (Фил-ГА) и
пертактина. Данная вакцина является родоначальницей профилак¬
тических бесклеточных вакцинных препаратов [436],Коклюшный токсин обусловливает формирование протективного
иммунитета. Он определяет развитие антителообразования у человека
как при вакцинации, так и при естественной коклюшной инфекции.Филаментозный гемагглютинин (Фил ГА) является компонентом
клеточной стенки бактерии и участвует в прикреплении микроор¬
ганизма к эпителиоцитам респираторного тракта. С учетом этого
ФилГА рассматривается как важный антиген в составе коклюшных
вакцин. Действительно, антитела к ФилГА ассоциированы с эффек¬
тивным иммунным ответом. Кроме того, антиген сам обладает адъю¬
вантными свойствами.Включение бесклеточных, субъединичных вакцин против кок¬
люша в программы вакцинации привело к значительному снижению
количества случаев коклюша по всему миру. Добавление пертактина
к двум компонентам (коклюшному анатоксину и филаментозному
гемагглютинину) значительно увеличило эффективность вакцины.
При высокой эффективности бесклеточная вакцина существенно
превосходила цельноклеточную вакцину по безопасности — процент
развивающихся в течение 72 ч местных и общих реакций был в 3—5 раз
ниже [300].Внедрение в практику здравоохранения субъединичной коклюш¬
ной вакцины, лишенной липополисахарида, включающей детокси¬
цированный коклюшный токсин и филаментозный гемагглютинин,
привело к снижению частоты осложнений со стороны ЦНС до 19 на
100 млн доз.По данным ВОЗ, поствакцинальный иммунитет после серии из
трех прививок АКДС и одной ревакцинации на 2-м году жизни угаса¬
ет через 5 лет [671]. Вторая ревакцинация цельноклеточной вакциной
АКДС представляет определенную проблему из-за высокой вероят¬
ности нежелательных явлений при повторных введениях цельнокле¬
точных вакцин. С появлением субъединичных АКДС-вакцин откры¬
5.5. Субъединичные вакцины 179лась возможность проведения ревакцинации против коклюша в 6oj]ee
старшем возрасте. При этом могут быть использованы три различные
стратегии ревакцинации:— сдвиг ревакцинации на более старший возраст;— введение дополнительных ревакцинаций в старших возраст¬
ных когортах;— селективная вакцинация взрослых из группы риска (медицин¬
ские работники, в ходе планирования семьи);В 2006 г. восточноевропейская группа экспертов ВОЗ в области
вакцинопрофилактики рекомендовала ввести дополнительную вто¬
рую ревакцинацию против коклюша в возрасте 5 лет [671].Безопасность и эффективность бесклеточных, субъединичных вак¬
цин открыла перспективы их комбинации. В настоящее время на осно¬
ве субъединичной вакцины АКДС существуют тетра-, гепта- и гекса¬
вакцины, включающие помимо АКДС компоненты против Haemophilus
influenza типа Ь, полиомиелита и гепатита В. Данная комбинация вак¬
цин показала высокую эффективность в Кении и Замбии [634].
Глава 6ГЕННО-ИНЖЕНЕРНЫЕ (РЕКОМБИНАНТНЫЕ)
ВАКЦИНЫ (R-ВАКЦИНЫ)6.1. СОЗДАНИЕ И РАЗРАБОТКА
ГЕННО-ИНЖЕНЕРНЫХ ВАКЦИНВ настоящее время Всемирной организацией здравоохранения
определены приоритеты в борьбе с инфекционными заболеваниями —
это туберкулез, ВИЧ-инфекция и малярия. Кроме того, поставле¬
на задача разработки высокоэффективных вакцин для профилак¬
тики инфекций, вызывающих высокую смертность (Bloom B.R.,
Lambert R-H., 2003) [84]. В данной главе будут рассмотрены генно-
инженерные вакцины против этих инфекций. Вакцины против ВИЧ-
инфекции описаны в главе 10.Достижения молекулярной биологии и генетики позволили целе¬
направленно манипулировать фрагментами нуклеиновых кислот
и получать различные комбинации наследственного материала.
В основе этих достижений лежат универсальность генетического
кода, возможность получать в изолированном виде фрагменты генов
и нуклеиновых кислот, синтезировать exyivo фрагменты нуклеиновых
кислот и объединять их в единое целое [64].Таким образом, изменение наследственных свойств организма
с помощью генной инженерии сводится к конструированию из
различных фрагментов нового генетического материала, введение
этого материала в реципиентный организм, создание условий для
его функционирования и стабильного наследования [64]. А созда¬
ние генно-инженерных вакцин сводится к целенаправленному
получению рекомбинантных бактерий или вирусов, безвредных
для макроорганизма, обладающих высокой иммуногенностью и
активирующих длительный протективный иммунитет. Возможна
обратная ситуация — искусственное аттенуирование, когда из
генома бактерии или вируса удаляют фрагменты ДНК, определя¬
ющие их вирулентность и патогенность. При сохранении протек-
тивных свойств искусственно аттенуированные бактерии и вирусы
6.1. Создание и разработка генно-инженерных вакцин 181могут быть вакцинными препаратами или служить основой для
получения рекомбинантных вакцин. Кроме того, генно-инже¬
нерная технология позволяет получать рекомбинантные субъ¬
единичные вакцины, выделяемые во внешнюю среду штаммами
продуцентами — дрожжевыми клетками или Е. coli (Bloom В.R.,
Lambert Р.-Н., 2003) [84].Существует несколько методов получения генно-инженерных
конструкций. Наибольшее распространение получили плазмидная
технология клонирования генов и фаговый метод. При клонирова¬
нии генов целевой фрагмент ДНК, контролируюш;ий образование
определенных белков, выделяют, вводят в различные бактерии и
размножают (амплифицируют). Благодаря клонированию генов
появилась возможность вырабатывать в больших количествах
белки, определяющие вакцинную конструкцию. Эта технология
основана на следующем принципе; помимо своей собственной
кольцевой хромосомы, бактерии часто содержат дополнительные
маленькие кольцевидные молекулы двухцепочной ДНК, называ¬
емые плазмидами. Плазмидную ДНК можно выделить и расщепить
соответствующей рестриктазой только в одном сайтс, превратив
кольцевую молекулу в линейную, с «липкими» концами. Далее
фрагменты любой чужеродной ДНК с такими же липкими концами
(полученными после разрезания аналогичной рестриктазой) можно
сшить с плазмидной ДНК с помощью лигазы. Рекомбинантную
конструкцию вводят затем в бактерию, где она реплицируется. При
получении рекомбинантных вакцин в качестве источника экзо¬
генной ДНК можно использовать бактериальную, вирусную ДНК,
а также ДНК, полученную из клеток человека, или искусственно
синтезированные гены [64].Кроме бактериальных плазмид в качестве векторов (носителей)
ДНК используют фаги. Часть генома этого фага не обязательна для
его размножения в бактерии. Вместо него можно ввести чужеродную
ДНК, которая будет размножаться вместе с фаговой после инфициро¬
вания бактерий [64].Для создания векторных живых вирусных вакцин использу¬
ют аттенуированный ДНК-содержащий вирус, в геном которого
встраивается необходимый клонированный ген. Вирус — носитель
вектора — активно размножается, а продукт встроенного гена
обеспечивает формирование иммунитета. Вектор может содержать
несколько встроенных генов, отвечающих за транскри[щию и
J82 Глава 6. Генно-инженерные (рекомбинантные) вакцины...трансляцию соответствующих чужеродных антигенов (Bloom B.R.,
Lambert Р.-Н., 2003).На интернет-сайте Национального центра биотехнологической
информации National Center for Biotechnology Information (NCBI) раз¬
мещено более 170 тыс. публикаций, касающихся создания, свойств
и использования вакцин. Однако по принципам конструирования и
носителю вектора рекомбинантные вакцины могут быть разделены на
ограниченное число групп:1) генно-инженерные белковые рекомбинантные конструкции;2) гетерологичные бактерии или вирусы, используемые как носи¬
тели соответствующих векторов;3) искусственно аттенуированные, высокоиммуногенные штаммы,
содержащие протективные антигены, из генома которых удале¬
ны гены, определяющие вирулентность и токсичность;4) вирусоподобные конструкции, лишенные генома;5) генетические конструкции, включающие иммуногенную состав¬
ляющую и компонент, определяющий другие свойства.Все эти группы генетических конструкций, за исключением груп¬
пы 3, представлены в рекомбинантных вакцинах против туберкулеза
(табл. 11, 12), с которыми связывают будущее снижение заболеваемос¬
ти туберкулезом [479].Из таблиц следует, что при необходимости субъединичные антигены
могут быть использованы в виде различных вакцинных препаратов.Развитие молекулярной биологии и методов генной инженерии
позволило создать одноцепочечную двухкомпонентную субъединич-
ную рекомбинантную вакцину на основе конъюгата антигенов 85В-
ESAT6. Ген 85а был использован для получения вектора для вакцин
на основе BCG и других бактерий [530].Необходимо отметить, что создание субъединичных вакцин по¬
служило отправной точкой для соверщенствования живых вакцин
на основе BCG. В частности, был получен рекомбинантный штамм
BCG, в который был встроен ген D1, кодирующий синтез антигена
ESAT6 [530].В настоящее время для получения высокоэффективных вакцин
BCG используется рекомбинантная техника (rBCG). Как следует из
таблицы 12, она может быть реализована в различных вариантах.
Прежде всего, это рекомбинантная вакцина rBCG 30, продуциру¬
ющая и секретирующая большое количество протективного антигена —
главного секреторного протеина М. tuberculosis, молекулярная масса
6./. Создание и разработка генно-инженерных вакцин18330 кД, называемого Ag85B, rBCG 30 существенно лучше и дольще
защищала лабораторных животных от ингаляционного заражения
высоковирулентным штаммом М. tuberculosis по сравнению с исход¬
ным штаммом BCG [445, 446],Вакцинный щтамм М. bovis BCG утратил по сравнению с исход¬
ным М. bovis очень важный протективный антиген ESAT6, продукт
региона-различия RD1 (región-of-difference 1). Сейчас получена реком¬
бинантная вакцина rBCG-RDI с включенным утраченным регионом,
секретирующая протекивный антиген ESAT6,Рестриктированные по антигенам МНС-1 клетки фенотипа CD8
играют очень важную роль в протективном противотуберкулез¬
ном иммунитете. Для их активации была получена биологически
активная конструкция вакцины BCG, продуцирующая listeriolysin —
фактор, обусловливающий эффективную презентазию АГ Listeria
monocytogenes и интенсивный клеточный иммунный ответ. Данная
вакцина (hly+-rBCG) с делецией гена уреазы, в отличие от исходной
BCG, обусловливала высокий уровень протекции против аэрозольно¬
го инфицирования М. tuberculosis (419, 435].Кандидаты на вакцины против туберкулеза, тестированные
в I и II фазах клинических испытанийТаблица 11Тип вакциныИспользуемыйантигенСтадияисследованияФармацевтическая
компания
или исследовательская
группа85B-ESAT6Рекомбинантныйантиген1 фаза клиниче¬
ских испытаний
«стратегия ревак¬
цинации»SSI (EU/TBVac)
[530]ВакцинныйвекторMVA-85AРекомбинантный
модифицирован¬
ный вакцинный
вектор Апкага-
85АI фаза клиниче¬
ских испытаний
«стратегия ревак¬
цинации»Oxford University,
United Kingdom
(EU/TBVac)[598]Живая вак¬
цина
гВСОЗОРекомбинантный
85А, экспресси¬
рованный в BCGI фаза клиниче¬
ских испытанийUCLA/N IH/Aeras
[446]
J84Глава 6. Генно-инженерные (рекомбинантные) вакцины...Живые туберкулезные рекомбинантные вакциныТаблица 12Тип вакциныХарактеристикавакциныИсследовательскаягруппаrBCGiRDlРекомбинантная BCG RD-1 of
М, íuberculom представлена для
клинических испытанийInstitut Pasteur Paris,
France (EU/TBVac) [435]rBCG-ure-hlyРекомбинантная BCG с деле¬
цией гена урсазы и введенным
геном листериолизина Listeria
monocytogenes представлена для
клинических испытанийMax-Planck Institute
Berlin, Germany (EU/
TBVac)1419]M. tuberculosis
phoP mutantЦеленаправленно аттенуиро¬
ванный клинический изолят
м. tuberculosis с делецией гена
вирулентностиZaragoza University,
Spain Institut Pasteur
(EU/TBVac) [727]M. tuberculosis(муіантьійаутотроф)Целенаправленно аттенуиро¬
ванный М. tuberculosis Н 3 7 Rv
с panCD делециейAlbert Einstein College
of Medicine, New York,
USA(NIH) (Palomino
J.C. et al., 2007)И наконец, нельзя не остановиться на исключительной особеннос¬
ти вакцинного штамма BCG. Он оказался пригоден для экспрессии
антигенов самых разнообразных патогенов. Сейчас ставится задача по¬
строения rBCG-мультивалентной вакцины, эффективной против вирус¬
ных, бактериальных и паразитарных заболеваний. Многообещающие
результаты в этом направлении были получены при испытаииях вак¬
цин на мышах и приматах (Palomino J.C. et al., 2007) [689].6.1Л. ГЕННО-ИНЖЕНЕРНЫЕ БЕЛКОВЫЕ
РЕКОМБИНАНТНЫЕ КОНСТРУКЦИИГенно-инженерные рекомбинантные конструкции, с одной сто¬
роны, сами могут быть достаточно эффективными вакцинами и,
с другой стороны, создание таких конструкций является этапом
для построения вектора и получения живой аттенуированной вак-
6,1. Создание и разработка генно-инженерных вакцин 185цины. В частности, для профилактики туберкулеза использовали
генно-инженерную конструкцию из двух секретируемых в среду
протективных антигенов — А85 и ESAT6 (см. главу 5). Генно-инже¬
нерная конструкция, ESAT6-85B, в сочетании с синтетическим адъ¬
ювантом IC31 вызывала у мышей и обезьян длительный иммунный
ответ и защищала от аэрозольного заражения [530]. В дальнейшем
ее использовали для получения живой аттенуированной вакцины
rBCG-ESAT6-85B [727].6.1.2. ГЕТЕРОЛОГИЧНЫЕ БАКТЕРИИ ИЛИ ВИРУСЫ,
ИСПОЛЬЗУЕМЫЕ КАК НОСИТЕЛИ СООТВЕТСТВУЮЩИХ
ВЕКТОРОВВ первом издании книги «Вакцинология* (1999) [84] Н.В. Медуницын
отмечал перспективность создания вакцин на основе бактерий кишеч¬
ной группы. В настоящее время такой подход реализован прежде всего
для профилактики энтеральной патологии, вызванной патогенны¬
ми соИ — Enteropathogenic Е. соН (ЕРЕС), Enteroinvasive Е. соИ (EIEC),
Enterohemorrhagic Е. соН (ЕНЕС), Eníeroaggregative Е. соН (ЕАЕС), проду¬
цирующие сильнейшие экзотоксины (Rendon М.А. et al,, 2007).Патогенный штамм Е. соИ (ЕТЕС) продуцирует два энтеротоксина:
большой энтеротоксин LT, по своей структуре и свойствам подобный
холерному токсину, и маленький энтеротоксин ST, определяющий
выход электролитов из клетки. ЕТЕС вызывает кишечную патологию,
известную как «диарея путешественников». Ежегодно отмечается
более 200 млн случаев диареи и около 400 тыс. смертей, преимуще¬
ственно детей в возрасте до 5 лет в развивающихся странах
(Rendon М.А. et al., 2007). Для профилактики инфекции, вызванной
ЕТЕС, в качестве основы носителей векторов, экспрессирующих
LT или LS, а также фактор колонизации Е. cali — CFA, используют
шигеллы [218, 242] и сальмонеллы [423, 598]. В настоящее время полу¬
чены результаты, показывающие, что для создания протективного
клеточного иммунитета перспективно использование rBCG, в част¬
ности, генетической конструкции, состоящей из трех протективных
антигенов м. tuberculosis Ag85A, Ag85B, Ag85C с антигеном М. leprae —
МРВ51. Полученная конструкция rBCG/BA51 была высокоэффектив¬
на у лабораторных животных [648].
1&6 Глава 6. Генно-инженерные (рекомбинантные) вакцины...При конструировании вакцин на основе вирусов наиболее часто
используют аденовирус человека серотипа 5, аденовирус шимпанзе
серотипа 63 (АД5, 63), вирус везикулярного стоматита (ВВС) и цито-
мегаловирус (ЦМВ).Вакцинация против Р. falciparum снизила заболеваемость и смерт¬
ность среди детей в возрасте до 5 лет. В настоящее время используют
конструкции на основе серотипа АД5. Кроме того, сконструирована
вакцина на основе не реплицирующегося в человеческом организме
аденовируса шимпанзе серотипа 63 [352].Первоначально АД5 использовался как терапевтический трансген
для лечения гснстичсских дефектов [590] (см. главу 12). Однако уни¬
кальная способность АД5 вызывать стойкий иммунный ответ даже
при иммунодефицитных состояниях сделала АД5 очень привлека¬
тельным для создания на его основе векторов для генно-инженер¬
ных вакцин [633], в частности для профилактики геморрагической
лихорадки, вызванной вирусом Эбола (ЭБОВ). Вакцинация реком¬
бинантной конструкцией АД-ZGP [гликопротеин оболочки Zaire
ebolavirus (ZEBOV)] мышей, морских свинок и шимпанзе вызывала
стойкий протективный эффект при летальном заражении [504, 773,
774]. Проводится 1 фаза клинических испытаний на добровольцах.
Полученные данные показали высокую иммуногенность вакцины
NCT00374309.Аттенуированный штамм ВВС, традиционно служивший векто¬
ром для создания рекомбинантных вакцин (Clarke D.K. et al,, 2006),
использовался в качестве основы для экспрессии поверхностного
гликопротеина ЭБОВ. Данную конструкцию использовали в экс¬
перименте на лабораторных животных как в профилактических,
так и в лечебных целях 1724, 773]. Введение указанной вакцины не
позже чем через 24 ч после летального заражения вирусом приводило
к 50 и 100%-ному выживанию морских свинок и мышей соответствен¬
но, хотя 50%-ную защиту макак данная вакцина обеспечивала только
при введении не позднее 20—30 мин [359]. Конструкция на основе
ВВС — VSVDeltaG/ZEBOVGP была эффективна у обезьян, инфи¬
цированных вирусом иммунодефицита обезьян (Geisber T.W.,
Daddari-Dicaprio K.M.L., 2008).Промотер немедленных ранних генов (IEG) ЦМВ имеет высокий
уровень экспрессии в различных клетках млекопитающих. Этот эле¬
мент широко используется для создания генно-инженерных векторов
[381]. Для оптимизации трансляции промотер немедленных ранних
6.1, Создание и разработка генно-инженерных вакцин 187генов ЦМВ был использован для получения эффективной вакцины к
вирусу Эбола на основе аденовируса V типа (AD-CMVZGP) [643].6.1.3. ИСКУССТВЕННО АТТЕНУИРОВАННЫЕ,
ВЫСОКОИММУНОГЕННЫЕ ШТАММЫ, СОДЕРЖАШ,ИЕ
ПРОТЕКТИВНЫЕ АНТИГЕНЫ, ИЗ ГЕНОМА КОТОРЫХ УДАЛЕНЫ
ГЕНЫ, ОПРЕДЕЛЯЮШ,ИЕ ВИРУЛЕНТНОСТЬ И ТОКСИЧНОСТЬРезистентность к патогенным бактериям Е. coli определяется
интенсивностью иммунного ответа к фактору колонизации (CFA).
Для профилактики инфекции, вызванной ЕТЕС, вакцина должна
представлять собой линию, экспрессирующую общий CFA. Ранее
было показано, что вакцина-кандидат (PTL003), токсин-негативный
штамм ЕТЕС, линия Е1392/75 имели общий фактор колонизации
СРАП. Данный штамм нес мутации делеции в генах агоС, отрС и отрЕ
При вакцинации волонтеров он вызывал интенсивный и стойкий
иммунный ответ. Подобно описанному, на основе штамма ЕТЕС,
линии WS1858, экспрессирующего CFA1 был создан чувствительный
к антибиотикам, несущий мутации делеции в генах агоС, отрС и ompF
штамм АСАМ2010, который теперь рассматривается как важнейший
компонент живой аттенуированной вакцины. Делеция определенных
участков хромосом была проведена с помощью нового суциидального
вектора — pJCB12, что привело к утрате способности АСАМ2010 про¬
дуцировать LT [8П]. Данный штамм вызывал как системный, так и
мукозальный иммунитет.6.1.4, ВАКЦИННЫЕ ВИРУСОПОДОБНЫЕ КОНСТРУКЦИИ,
ЛИШЕННЫЕ ГЕНОМАВирус папилломы человека (ВПЧ) играет драматическую роль в
развитии фоновых и предраковых заболеваний шейки матки и явля¬
ется облигатным фактором развития аденокарцином генитального
тракта. По данным Международного агентства по исследованию
рака (IARC), ежегодно во всем мире регистрируется более 500 тыс.
случаев рака шейки матки и 270 тыс. смертей. Наибольшее число
случаев зарегистрировано в Латинской Америке и Субсахарной
Африке — более 30 случаев на 100 тыс. населения. Именно в этих
188 Глава 6. Генно-инженерные (рекомбинантные) вакцины..,странах была убедительно доказана эффективность вакцины ново¬
го типа — вирусоподобной частицы. Она представляет собой сфе¬
рический капсид ВПЧ, из которого удалена двухцепочечная ДНК
и сохранены структурные поздние белки — LIh L2 (Bloom B.R.,
Lambert Р.-Н., 2003).При естественном заражении значимый уровень антител к ВПЧ
определяется только у 50% женщин. Между тем антитела к ВПЧ игра¬
ют ключевую роль в предотвращении инфицртрования (Bloorn B.R.,
Lambert R-H., 2003). Это послужило основанием для разработки вак¬
цин с доминантными антигенами L1 и L2. Носителем этих антигенов
служили вирусоподобные частицы. Необходимо отметить, что обя¬
зательным компонентом данной вакцины является специально раз¬
работанный адъювант. Помимо гидроокиси алюминия, он содержит
монофосфориллииид А, полученный из сальмонеллы minisotae [773].
Это позволило в соответствии с современной стратегией получения
эффективных вакцин ввести в конструируемую структуру компонен¬
ты, стимулирующие как специфический, так и врожденный иммуни¬
тет. в настоящее время широко используются две вакцииы «Гардасил»
и «Церварикс» (см. главу 10).Вирусоподобные конструкции апробированы в эксперименте и
при индукции антител к другим структурам, в частности к хемокино-
вому рецептору CCR5, играющему определенную роль в прикрепле¬
нии ВИЧ к клетке.6.1.5. ГЕНЕТИЧЕСКИЕ КОНСТРУКЦИИ, ВКЛЮЧАЮЩИЕ
ИММУНОГЕННУЮ СОСТАВЛЯЮЩУЮ И КОМПОНЕНТ,
ОПРЕДЕЛЯЮЩИЙ ДРУГИЕ СВОЙСТВАРазработка вакцин для профилактики инфекций, при которых
протективный эффект зависит от интенсивности клеточного имму¬
нитета, определила внедрение новых генетических конструкций.
В настоящее время реализован еще один подход в получении конс¬
трукций на основе BCG. В частности, используются векторы, в кото¬
рые встроены не только гены, контролирующие синтез протективных
антигенов, но и гены, кодирующие различные цитокины, определя¬
ющие развитие и интенсивность клеточного иммунного ответа, вклю¬
чая ИЛ-2, ИНФу и другие цитокины, усиливающие иммуностимули¬
рующие свойства BCG (Ohara N., Yamada Т., 2001).
6.2. Сложности получения и ограничения использования.,. 1896.2. СЛОЖНОСТИ ПОЛУЧЕНИЯ И ОГРАНИЧЕНИЯ
ИСПОЛЬЗОВАНИЯ ГЕННО-ИНЖЕНЕРНЫХ ВАКЦИН6.2.1. ФАКТОРЫ, ВЛИЯЮЩИЕ НА СТОИМОСТЬ РАЗРАБОТКИПрактическое воплощение программ ВОЗ по внедрению генно-
И11женсрнътх вакцин в практику здравоохранения привело к сни¬
жению заболеваемости, вызванной социально значимыми и особо
опасными инфекциями. В предыдущих разделах были рассмотрены
свойства генно-инженерных вакцин, отражающие эффективность
и простоту их применения. Однако в характеристике вакцины есть
параметр, который в конечном итоге определяет ее использование, —
это стоимость (Bloom B.R., Lambert Р.-Н., 2003). А она зависит от
многих факторов и прежде всего — от сложности получения. Многие
инфекционные агенты сложно и культивировать и масштабиро¬
вать. Технологии производства большинства применяемых сегодня
вакцин чрезвычайно разнообразны и во многом зависят от особен¬
ностей возбудителя заболевания, против которого разработана вак¬
цина. Однако даже специально разработанные методы получения
конкретной г-вакцины не гарантируют размножения бактерий и
репликации целевого фрагмента, определяющего иммунный ответ.
А если этого и удалось добиться, то необходимо еще индуцировать
экспрессию гена, трансляцию и транскрипцию синтезируемой моле¬
кулы. Получать эффективную векторную вакцину на основе бакте¬
рий достаточно трудно из-за нестабильности трансфекции генного
материала, токсичности чужеродного антигена для бактерий, мало¬
го количества экспрессированного антигена [84]. Кроме того, натив¬
ные молекулы антигена и генно-инженерный целевой продукт могут
иметь различный профиль гликозилирования, что критическим
образом может влиять на иммуногенность. В совокупности решение
указанных задач существенным образом влияет на стоимость разра¬
ботки вакцины.6.2.2. СЛОЖНОСТИ ХРАНЕНИЯ И ТРАНСПОРТИРОВКИСерьезной проблемой использования аттенуированных г-вакцин
является непрерывность «ХОЛОДОВОЙ цепочки» — фактически нсукос-
190 Глава 6. Генно-инженерные (рекомбинантные) вакцины,..нительное исполнение температурного режима от производства до
конечной точки потребления. Сложность ситуации усугубляется тем,
что в современных условиях в снижении инфекционной заболевае¬
мости нуждается население развивающихся стран Юго-Восточной
Азии, Центральной и Южной Африки и в них на поддержание «холо-
довых цепочек» приходится около 80% стоимости проведения одной
вакцинации.6.2.3. НЕДОСТАТОЧНАЯ АКТИВАЦИЯ КЛЕТОЧНОГО
ИММУННОГО ОТВЕТАДля активации протективного иммунитета, обусловленного спе¬
цифическими антителами, используют г-вакцины в сочетании с
различными, в некоторых случаях специально разработанными адъ¬
ювантами [84]. Действительно, современные генно-инженерные конс¬
трукции демонстрируют эффективную способность индуцировать
антителообразование и препятствуют развитию развернутой карти¬
ны инфекционных заболеваний, в патогенезе которых есть стадии,
прерываемые достаточным количеством антител. Также очевидна
роль антител в предотвращении патологии, связанной с продукцией
инфекционным агентом различных токсинов.Между тем современные генно-инженерные вакцины в предо¬
твращении патологии, при которой протективный эффект обус¬
ловлен клеточным иммунитетом, малоэффективны, а если быть до
конца объективным — неэффективны. И связано это с самой сутью
реакций клеточного иммунитета, которые обусловлены не только
эффекторами клеточного иммунитета или различными популяция¬
ми цитотоксических клеток, но и рекрутированными клетками. По
существу, клетки, определяющие специфический иммунный ответ,
являются центрами привлечения и активации неспецифических
эффекторов клеточного иммунитета. Более того, в некоторых случа¬
ях, в частности при микобактериальных инфекциях, протективный
эффект связан с активацией врожденных механизмов резистентнос¬
ти, обусловленных продукцией оксида азота [479], Иными словами,
без активации цепочки: продукция ИНФу—его рецепция—актива¬
ция и завершение STAT1 сигнального пути—активация синтеза NO-
синтазы и продукции свободных форм N0 — элиминация мико¬
бактерий слабо реализуема [479]. Это означает, что использование
6.2, Сложности получения и ограничения использования... 191для вакцинации антигенов, активирующих клеточный иммунный
ответ, является необходимым, но недостаточным условием; необхо¬
дима еще активация врожденного клеточного иммунитета. Именно
поэтому была создана генно-инженерная вакцинная конструкция,
в которую включены элементы, продуцирующие ИНФу (Ohara N.,
Yamada Т., 2001). Все это свидетельствует о том, что современные
генно-инженерные вакцины тоже не пригодны для активации кле¬
точного иммунного ответа и разработка генно-инженерных конс¬
трукций, обусловливающих клеточный иммунный ответ, является
задачей ближайщей перспективы.
Глава 7СИНТЕТИЧЕСКИЕ ИММУНОГЕНЫ И ВАКЦИНЫ7.1. ПЕРВЫЕ СИНТЕТИЧЕСКИЕ АНТИГЕНЫБольшинство природных антигенов (белки, полисахариды и др.)
являются сложными комплексными соединениями, которые вызы¬
вают иммунный ответ, направленный на серию антигенных детер¬
минант, расположенных в единой молекуле. Даже при иммунизации
однородным и химически чистым белковым антигеном всегда обра¬
зуется несколько типов антител, каждое из которых комплементарно
одной из детерминант этого антигена. Именно поэтому большая часть
информации о молекулярных механизмах антигенного действия
получена в исследованиях, в которых антигенами служили белки,
несущие небольшие детерминантные группы известного химиче¬
ского состава. Это были первые искусственные конъюгированные
антигены, иммунизация которыми приводила к выработке антител
заданной специфичности [527],Посредством диазосвязей К. Ландштейнер конъюгировал с бел¬
ками через тирозиновый остаток относительно простые химиче¬
ские группировки, например аминобензойные, аминофениларсино-
вые, аминобензолсульфоновые кислоты и т,п. в последующие годы
наибольшее распространение в исследовательских целях получили
конъюгированные антигены, состоящие из того или иного белка и
динитрофен ильной или тринитрофенильной группы, присоединен¬
ной через е-аминогруппу лизина:$-СН5-МН-((^ ^>-N0,
Бв1П0кИскусственные антигены К. Ландштейнера сыграли очень боль-
игую роль в молекулярной иммунологии, с их помощью было введе110
в науку понятие о детерминантной группе антигена, т.е. о той группе,
7.1. Первые синтетические антигены 193которая определяет анти генную специфичность всей макромолекулы.
Была продемонстрирована способность антител различать малейшие
отличия детерминантиых групп антигенов: заменыЗОдНа на АзОзН NHгили параположения ЗО^Н на мета- или ортоположение достаточно,
чтобы в организме вырабатывались антитела другой специфичности,
соединяющиеся только со своей детерминантой; динитрофенильные
и тринитрофенильные детерминанты стимулируют выработку анти¬
тел двух разных специфичностей. Достаточно простые соединения,
которые сами по себе не стимулируют выработку антител, но при
соединении с белковой молекулой приобретают эту способность,
получили название гаптенов.С получением конъюгированных антигенов появилась возмож¬
ность искусственно создавать антигены с определенным, в том числе
с новым, типом специфичности, в последующем подобного рода
искусственные антигены стали широко использоваться для получе¬
ния антител, специфичных по отнощению к конкретным, входящим
в состав антигена химическим группам. Иммунизация конъюгиро¬
ванными белками индуцирует образование антител к детерминантам
исходного белка, гаптена и к новым спепифичностям, образующимся
при конъюгации.Описанные ниже синтетические гомополимеры, а также сополиме¬
ры аминокислот успешно выполняют функцию носителей гаптенов.
В этом случае ландштейнеровские конъюгированные антигены ста¬
новятся полностью искусственными. Скажем, парааминобензойная
кислота (ПАБ) или динитрофенол (ДНФ), присоединенные к поли¬
лизину, — это полностью синтетические антигены, стимулирующие
у животных выработку антител против ПАБ или ДНФ. Такие сконс¬
труированные антигены явились эффективным инструментом для
изучения закономерностей иммунологических реакций, индуциру¬
емых антигенной детерминантой, соединенной с полиаминокислотным
полимерным носителем или белком, и их вакцинирующих свойств.Первые искусственные антигены с повышенной иммуногеннос¬
тью, индуцируемой конъюгированными с ними синтетическими
194 Глава 7. Синтетические иммуногены и вакциныполиэлектролитами небелковой и неполиаминокислотной приро¬
ды, создали Р.В. Петров, P.M. Хаитов и соавт. в середине 70-х годов
прошлого столетия. Среди множества созданных и апробированных
конструкций наибольший интерес представляют конъюгаты гаптс-
нов, пептидов, белков и полисахаридов с карбоцепными и другими
ионогенными полимерами, которые служат в качестве систем, моде¬
лирующих возможные конструкции вакцинирующих препаратов.
Именно поэтому получение искусственных антигенов с повышенны¬
ми иммуногенными свойствами, апробация и изучение механизмов
действия полученных конъюгатов представляются важными этапами
на пути создания новых иммуногенов и вакцин нового поколения.В последующих сравнительных исследованиях были изучены
молекулы, различающиеся химической структурой антигенной части
и конъюгированного с антигеном полиэлектролита. Полученные
результаты были не только абсолютно новыми. Они стали конс¬
труктивными вехами на путях создания новых, существенно более
эффективных вакцинирующих препаратов. Оказалось, что гаптеньт,
конъюгированные с синтетической неприродиой макромолекулой,
индуцируют у животных иммунный ответ без применения адъюван¬
та, обязательного при иммунизации животных гаптеном на белковых
носителях. Более того, конъюгаты гаптен-полиэлектролит вызывают
у животных формирование выраженной иммунологической памяти и
развитие эффективного вторичного ответа. Проведенная нами конъ¬
югация с полиионными носителями белковых антигенов различной
природы (сывороточных, бактериальных, вирусных) сопровожда¬
лась значительным увеличением их иммуногенности. Аналогичные
результаты получены с синтетическими пептидами, воспроизводящи¬
ми отдельные фрагменты разных микробов. Конъюгирование таких
пептидов с полиэлектролитами характеризовалось не только усиле¬
нием их иммуногенности, но и способностью продуцируемых антител
специфически взаимодействовать с пептидной детерминантой как в
составе конъюгатов, так и вирусных частиц. Значительное усиление
иммуногенности полисахарида из О-антигена сальмонелл было полу¬
чено нами в результате создания конъюгата полисахарид-полиион
или при соединении полисахарида с комплексом полиэлектролит-
жгутиковый антиген сальмонелл. При иммунизации мышей двух¬
компонентным комплексом полисахарид—полиион число клеток —
продуцентов специфических антител у животных увеличивалось на
порядок по сравнению с введением только свободного полисахарида,
7.2, Пептидные антигены 195а при иммунизации животных трехкомпонентным комплексом поли-
сахарид-жгутиковый антиген-полиион регистрировали выраженный
специфический как первичный, так и вторичный иммунный ответ
(см. главу 8).Важным результатом апробации искусственных антигенов яви¬
лось и то, что высокий иммунный ответ, регистрируемый при имму¬
низации животных конъюгатом антиген—полиэлектролит может быть
получен в условиях отсутствия Т-лимфоцитов. Иначе говоря, имму¬
низация животных конъюгатом Т-зависимого антигена с полиэлект¬
ролитом приводит к формированию Т-независимого иммунного отве¬
та. Наконец, самым важным является то, что с помощью конъюгатов
антиген—полиэлектролит удается индуцировать высокий иммунный
ответ у генетически низкореагирующих особей на данный иммуноген
(см. главу 9).Помимо установленных фактов, в создании иммуногенов и вакцин
нового поколения важнейшую роль играет включение в состав конс¬
труируемых комплексов синтетических молекул, имитирующих анти¬
генные детерминанты различных инфекционных агентов. Именно
поэтому ниже анализируются успехи в получении пептидных антиге¬
нов, полипептидов вирусов, бактерий, простейших и поливалентных
комплексов, включающих более двух синтетических пептидов.7.2. ПЕПТИДНЫЕ АНТИГЕНЫСоздание и изучение синтетических пептидов началось в 60-х
годах прощлого века [407, 585, 586, 592 , 744]. Это был следующий
щаг в развитии проблемы искусственных антигенов. Синтетические
полипептидные антигены являются удобными аналогами природ¬
ных антигенов, так как они индуцируют те же иммунологические
реакции (клеточный и гуморальный иммунный ответ, иммуноло¬
гическая толерантность, антигенная конкуренция и др.) и являются
тимусзависимыми (ТЗА) или тимуснезависимыми (ТНА). Вместе с
тем использование синтетических полипептидных антигенов дает
важные преимущества, заключающиеся в том, что они имеют огра¬
ниченный спектр детерминант с самостоятельной специфичностью.
Простота антигенных моделей позволяет выявлять детерминантно-
специфический генетический контроль иммунного ответа.
196 Глава 7. Синтетические иммуногены и вакциныФундаментальные исследования синтетических полиаминокис-
лотных антигенов позволили сделать ряд крупных открытий и обоб¬
щений современной иммунологии и иммуногенетики. Наиболее
важным следует считать открытие /г-генов. Было доказано, что если
у особи отсутствует ген сильного иммунного ответа к определенному
антигену, антитела к этому антигену не будут вырабатываться, хотя
к другим антигенам ответ выражен. Это в свою очередь поставило
на повестку дня важнейший вопрос о фенотипической коррекции
иммунного ответа, т.е. об обходе /г-генного контроля.На основе синтетических полиаминокислот, используя их в качес¬
тве носителя, можно получить искусственные иммуногены, спо¬
собные индуцировать синтез антител практически любой заданной
специфичности (Sela М., 1969). Иммуногеньт синтезируют путем при¬
соединения к полипептидам таких вешеств, как сахара, нуклеотиды,
гаптены и др.В иммунологических исследованиях используется большое число
линейных полимеров различного аминокислотного состава и моле¬
кулярной массы. Широкое распространение в качестве иммуногенов
получили сополимеры 2-4 различных аминокислотных остатков и
более. Большинство ли нейных сополимеров, используем Ы X в качестве
иммуногенов, получали путем случайной сополимеризации N-кар-
бокси-а-аминокислотных ангидридов соответствующих аминокис¬
лот в подходящем молекулярном отнощении [745]. Этот метод полиме¬
ризации позволил получить сополимеры, не обладающие уникальной
аминокислотной последовательностью или конформацией.Другой метод заключался в получении полипептидов, которые
характеризовались повторяющейся аминокислотной последова¬
тельностью и в определенных случаях уникальной конформацией.
Такие полимеры получали путем полимеризации коротких пептидов,
что обеспечило уникальную повторяющуюся последовательность.
Использование в иммунологических исследованиях таких полимеров
представляло особый интерес, поскольку антигенные детерминанты
этих иммуногенов контролируются определенной трехмерной кон¬
фигурацией молекулы, а не только непосредственно аминокислотной
последовательностью.Помимо линейных полимеров, в качестве иммуиогенов также
использовали многоцепочечные полимеры с разветвленными цепями,
в которых линейные полипептидные цепи присоединяли к полифун-
кциональному ядру, или, по вошедшей в литературу терминологии, к
7.2, Пептидные антигены197«костяку». Многоцепочечные полиаминокислоты получали иници¬
ацией полимеризации N-карбокси-а-аминокислотных ангидридов
полифункционалъными инициаторами. В качестве полифункцио-
нальных инициаторов использовали как белки, так и синтетические
полипептиды, содержащие многочисленные свободные аминогруп¬
пы. Полимеризация N-карбоксиангидридов аминокислот на синте¬
тических полипептидах (например, на полилизине, полиорнитине
или сополимерах, содержащих эти основные аминокислоты) позво¬
лила получить синтетические многоцепочечные (или разветвленные)
полиаминокислоты. Такие разветвленные многоцепочечньте сопо¬
лимеры, состоящие из четырех аминокислот, были синтезированы
М. Sela и начали использоваться в иммунологических исследованиях
с 1965 г. [592]. К пол ил изи новой цепи были наращены боковые цепоч¬
ки из полиаланина, к конечной группировке которых присоединяли
остатки тирозина и глутаминовой кислоты или гистидина и глутами¬
новой кислоты;ТирТирТирГлуГлуГлуЛизJ1—ЛизJIЛизII Ала——Ала——Ала— Апа——Ала——Ала——ЛизЛизII Ала——Ала——Ала—JI—ЛизJ1ЛизВ первом случае антиген имеет структуру (Т, Г) — А — Л, во втором -
(Гис, Г) - А - Л. При использовании фенилаланина вместо тирозина
получается третий антиген - (Ф, Г) - А - Л. Несущую (шлепперную)
функцию выполняет полилизиновая цепь, антигенные детерминанты
формируются из тирозина — глутаминовой кислоты, гистидина —
глутаминовой кислоты или фенилаланина — глутаминовой кислоты.Синтетические антигены иммуногены для кроликов, морских сви¬
нок, мышей, крыс, коз, овец, обезьян и человека. Для индукции
иммунного ответа полиаминокислоты вводятся в очень низких дозах
(микрограммы) вместе с адъювантами Фрейнда. Водные растворы
полиаминокислотных антигенов используются редко, в основном для
индукции иммунологической толерантности и супрессорных Т-клеток.
в качестве синтетического антигена в иммунологических и особенно в
198 Глава 7, Синтетические иммуногены и вакциныиммуногенетических исследованиях чаще всего использовали три
вида аминокислотных полимеров: линейные случайно расположенные
L-аминокислоты; конъюгаты гаптенов с гомополимерами аминокис¬
лот, например 2,4-динитрофенил-поли-Ь-лизин (ДНФ-ПЛЛ); разветв¬
ленные многоцепочечные ам инокислотные сополимеры.Следует отметить, что гомополимеры L-аминокислот неиммуноген-
ны при обычных условиях иммунизации, за исключением поли-L-npo-
лина, который вызывает образование антител при введении морским
свинкам. Вместе с тем антитела против гомополимеров могут быть
получены при использовании их в качестве гаптена (Sela М., 1969). Это
может быть достигнуто либо химическим присоединением гомопепти¬
да к белковой молекуле, либо, в случае полиэлектролитов, путем сме¬
шивания гомополимера с иммуногенным полиэлектролитом, несущим
противоположный заряд. Так, полиглутаминовая кислота, несущая
отрицательные заряды, вызывает образование специфических антител
при комплексировании с положительно заряженным метилированным
бычьим сывороточным альбумином (БСА) [586].Образование антител кполилизину и полиорнитину можно вызвать
при инъекции кроликам комплексов этих полиоснований с фос-
форилированным БСА [821]. Электростатический комплекс между
L-глутаминовой кислотой и поли-L-лизином при введении живот¬
ным вызывает образование антител против каждого индивидуально¬
го гомополимера [407].Использование синтетических полиаминокислотных антигенов
выявило интересные видовые различия в способности развивать на
них иммунный ответ. Так, полимеры двух различных аминокислот —
иммуногены у кроликов и морских свинок, но не у мыщей и человека.
Вместе с тем большинство синтетических полипептидных антигенов
являются сравнительно слабыми иммуногенами по сравнению со
многими природными белками и вызывают существенный иммунный
ответ только при иммунизации с адъювантами. Чаще всего используют
полный адъювант Фрейнда (ПАФ), алюмокалиевые преципитаты,в 1971 г. в лаборатории М. Села (Агпоп R. et al., 1971) синтетически
воспроизвели фрагмент куриного лизоцима с 60-го по 83-й аминокис¬
лотный остаток, отграниченный межцепочечной дисульфидной связью.
Исследования развивались в несколько этапов. Вначале [228J из лизоци¬
ма белка куриного яйца (удобный для исследования антиген с извест¬
ной первичной и пространственной структурой) комбинацией ограни¬
ченного протеолиза с мягкой редукцртей был выделен иммунологически
7.2. Пептидные антигены 199активный фрагмент молекулы. Этот фрагмент, так называемая петля,
состоит, как уже упоминалось, из 24 аминокислотных остатков лизо¬
цима и содержит одну межцепочечную дисульфидную связь. Антитела,
специфичные к этой области, избирательно изолируются из анти л изо-
цимной сыворотки адсорбцией на соответствующем «петлевом» имму¬
носорбенте. Аитипетлевые антитела, изолированные таким образом,
демонстрируют, как ожидалось, меньшую гетерогенность, чем антитела
против тотального лизоцима. Антитела такой же специфичности могут
быть приготовлены альтернативным, более интересным методом (Агаоп
R. et al., 1971). Изолированный «петлевой» пептид прикрепляли к син¬
тетическому макромолекулярному носителю (многоцепочечному поли-
0,Ь-аланину). Иммунизация этим конъюгатом коз и кроликов привела
к выработке антител, реагирующих с лизоцимом. Более детальные
специфические исследования показали, что эти антитела направлены
против конформационно-зависимых детерминант. Это свидетельствует
об их способности как распознавать структуру шетли» в нативном лизо-
циме, так и различать «петлю» и его открытую пептидную цепь (Sela М.,
1974), т.е. антипетлевые антитела взаимодействуют с нативным лизоци¬
мом, распознавая структуру «петли».Поскольку аминокислотная последовательность области «петли»
была известной, аналогичный, подобный «петле», фрагмент (рис. 28)
приготовили химическим синтезом (Агпоп R. et al., 1971). Полученный
синтетический продукт прикрепили к макромолекулярному син¬
тетическому носителю — многоцепочечному поли-0,Ь-аланину
Иммунизация кроликов и коз этим конъюгатом в ПАФ привела к
образованию антител, ничем не отличающихся от антител, выраба¬
тываемых при иммунизации конъюгатом природной лизоцимной
«петли». Иначе говоря, иммунизация кроликов «петлей», посаженной
на многоиепочечный поли-0,Ь-аланин, привела к накоплению анти¬
тел, которые специфически взаимодействовали как с искусственным
пептидом, так и с целой молекулой лизоцима. Это впервые продемонс¬
трировало возможность использования полностью синтетической
молекулы для выработки антител, реагирующих с нативным белком.
Вместе с тем образующиеся антитела были направлены к уникально¬
му ограниченному району белка.С помощью новых методов (230, 544] изучения иммуногенных
сайтов белковых молекул с использованием антител против синтети¬
ческих пептидов и моноклональных антител к различным эпитопам
цельных белков можно определять антигенность специфических
200Глава Г. Синтетические иммуногены и вакциныДеблокирование петидаI 2HOOGРис. 28. Твердофазный синтез «петлевого» пептида лизоцима, состоящего из
остатков 64-82. Остаток Су8-76 замещен аланином;/ — отделение пептида от носителя и удаление блокирующих групп безводным НР;
2 — восстановление меркаптоэтанолом и окисление воздухомучастков различных протеинов, зависимость между антигенностью
и протеиновой структурой. Необходимо подчеркнуть, что при имму¬
низации цельными белковыми молекулами антитела образуются к
определенным иммунодоминантным сайтам или эпитопам с опре¬
деленной последовательностью аминокислотных остатков. В серии
опубликованных работ [786, 787, 850] показана роль локальной атом¬
ной подвижности или гибкости в антигенности и иммуногенности
тех или иных сайтов белковых молекул. Молекулярный анализ с
использованием рентгенокристаллографии и температурных факто-
7.а. Полипептиды вирусов 201()<)И ряда различных белков показал возможное і ь достаточно точной
идентификации подвижных участков молекулы. Установлено, что
интипсптидные антитела против высокоподвижных (гибких) райо¬
нов молекулы белка с высокой степенью специфичности реагируют
с нативным белком. Антипептидные антитела, полученные против
ригидных (конформационно-ограниченных) районов молекулы, не
и »аимодействовали с белком. Таким образом, локальная подвижность
антигенных сайтов является важным фактором в распознавании
имтактных белков антителами, направленными против синтетиче¬
ских пептидных антигенов. Надо отметить, что многие антигенные
детерминанты содержат подвижные участки из К- и С-терминаль-
ных остатков [787], Эти участки эффективно связывают антитела,
полученные при иммунизации интактными белковыми молекулами.
Установлено, что факторы гидрофильности (или гидрофобности),
влияющие на антигенность, также коррелируют с атомной подвиж¬
ностью. Корреляция между подвижностью и антигенностью сайтов в
составе того или иного белка свидетельствует о том, что такие макро-
молекулярные взаимодействия реализуются благодаря способности к
максимально мобильной комплементарности.7.3. ПОЛИПЕПТИДЫ ВИРУСОВПервая публикация о том, что небольшой пептидный фрагмент
из вирусного белка может индуцировать выработку антител против
целого белка и данного вируса, относится к 1963 г. F,A, Anderer (1963)
выделил из оболочки вируса табачной мозаики С-концевой гекса¬
пептид Thr-Ser-Gly-Pro-Ala-Thr. В качестве носителя для него был
использован БСА. Иммунизация кроликов этим искусственным
комплексом привела к выработке антител против вируса табачной
мозаики. Добавление этих антител к вирусу ингибировало формиро¬
вание вирусных повреждений на табачных листьях. Гексапептид был
выделен, а не синтезирован. Тем не менее это был первый ш[аг на пути
создания искусственных иммуногенов.Второй шаг в этом направлении был сделан в 1976 г., когда в лабо¬
ратории М. Села [528] провели подобные опыты с вирусными пепти¬
дами оболочки колифага MS-2. Этот фаг является РНК-содержащим
вирусом, капсида которого состоит из 180 идентичных субъединиц
202 Глава 7. Синтетические иммуногены и вакциныбелковой оболочки (с ММ 13, 7 кД каждая) и отдельной молекулы
другого белка — протеина А. Белковая оболочка содержит отдельную
полипептидную цепь из 129 аминокислотных остатков, последова¬
тельно соединенных друг с другом 1743].Ala - Ser - Asn - Phe - Ttir > Gin - Phe > Val - Leu - Val - Asp - Asn - Gly - Gly - Thr - Glv -
5 10 15Asp - Vai - Thr - Val - Ala - Pro - Ser - Asn - Phe -Wa - Asn - Gly - Val - Ala - Giy -Tro -26 30lie - Ser ’ Ser - Asn - Ser - Ang - Ser - Gtn - Aia - Туг - Lys - Val - Thr - Gys - Ser - Vai -40 45Arg - Gin - Ser - Ser * Ala - Gin - Asn - Ang - Lys - Tyr - Thr - Ite - Lys - Val - Gtu - Val -
50 55 60Pro - Lys - Val - Ala - Thr - Gin - Thr- V^l - Gly - Gly - Val - Glu - Leu - Pro - Val - Ala -
65 70 75 60Ala - Trp - Arg - Ser - Tyr - Leu - Asn«Met - Gtu - Leu - l>ir - He - Pro - He - Pbe - Ala -
85 90 95Thr - Asn - Ser - Asp - Gys - Glu - Leu - Be - Val - Lys - Ala - Met - Gin - Gly - Leu - Leu -
100 105 110Lys - Asp - Gly - Asn - Pro - He - Pro - Ser - Wa - He - Ala - Ala - Asn - Ser - Gly - He - Tyr
115 120 125При расщеплении белка оболочки бактериофага цианогенбромидом
получены три фрагмента, несущие соответственно последовательности
1—88 (Pi), 89—108 (Р2) и 109—129 (Pj). Синтезированные пептиды, соот¬
ветствующие по аминокислотной последовательности фрагментам Рз и
Рз, ковалентно конъюгировали с многоцепочечным поли-0,Ь-аланином.
Иммунизация кроликов только искусственным иммуногеном Р2-ПОЛИ-
0,Ь-аланин-(Р2-А-Ь) в ПАФ обеспечила выработку антител, взаимодейс¬
твующих с целым белком и нейтрализующих исходный бактериофаг.Таким образом, впервые было продемонстрировано, что полностью
синтетический антиген можно использовать для индукции иммунно¬
го ответа, приводящего к нейтрализации вируса.В последующей работе (Langbeheim Н., 1978) показано, что Pj-A-L,
ковалентно связанный с пептидогликаном, выделенным из Bacillus
megaterium, обеспечивает продукцию фагнейтрал изу ющих антител при
введении его в НАФ морским свинкам. Наконец, Pj-A-L (табл. 13),
конъюгированный с МДП, вызывает у кроликов иммунный ответ (титр
фагнейтрализующих антител 1:180), приближающийся по высоте к
ответу животных (1:256), иммунизированных Pj-A-L в ПАФ [229].
7.3. Полипептиды вирусов 203Таблица ¡3Вируснейтрализующая активность антисывороток к пептидуИммуногенСредний титрТитр индивидуальных сыворотокPj-A-L
Рг-А-Ь+МДП
Ра-А-Ь-МДП
p2-A-L в ПАФ<1:101:481:1801:256<1;101:25-1:2001:50-1:10001:100-1:1500В 1982—1984 гг. была опубликована серия работ, посвященных
искусственным иммуногенам’ и первым попыткам достижения вак¬
цинирующего эффекта. Группа R. Агпоп [230, 627] синтезировала
пептид, содержащий 18 аминокислотных остатков, которые соот¬
ветствовали известной последовательности 91-108 молекулы гемаг¬
глютинина (НА1) — поверхностного белка вируса гриппа H3N2.
Этот фрагмент соответствует константному участку молекулы НА1,
т,с. он является общим для многих разновидностей вируса гриппа А
(как минимум для 12 штаммов H3N2). Такие консервативные участки
молекулы антигена представляют наибольший интерес в плане созда¬
ния вакцины, эффективной сразу против нескольких разновидностей
возбудителя. В качестве несущего белка для создания иммуногена
использовали столбнячный анатоксин, В этих опытах помимо выра¬
ботки антител, реагирующих с синтетическим пептидом и нейтрали¬
зующих цитопатический эффект нескольких штаммов вируса гриппа
А in vitro, зарегистрирован некоторый протективный эффект у мышей,
многократно получавших конъюгированный с анатоксином пептид в
ПАФ. После заражения в несмертельной дозе вирусом мышей линий,
генетически высокоотвечающих на конъюгат, в несколько меньшем
числе случаев по сравнению с неиммунизированными животными
был выявлен вирус в легких.в описанных экспериментах [627J иммунизирующий эффект конъ¬
югата проявлялся только у мышей линии, гнетически высокоотвеча-
ющей на этот иммуноген, в данной работе — линии СЗН, Мыши линии
C57BL не отвечали на конъюгат. Такой потенциальный стимулятор
для синтетических антигенов, как МДП, обладающий адъювантным
действием, еще больше контрастирует генетические различия в силеОписываемые искусственные комплексы называют иммуногенами, а не вакцина¬
ми, так как речь идет об иммунном ответе в виде выработки антител, а не о вакцини¬
рующем эффекте, обеспечивающем защиту организма от заражения.
204 Глава 7. Синтетические иммуногены и вакциныиммунного ответа [625]. Опираясь на данные подобного рода, для
целей успешной вакцинации людей предлагается учитывать сцепле¬
ние между HLA-генами (/г-генами) и способностью отвечать на кон¬
кретную антигенную детерминанту или молекулу носителя (Sela М.,
Mozes E., 1979) [7, 16]. Иначе говоря, авторы считают, что в будущем
вакцинацию населения и животных следует проводить синтетиче¬
скими антигенами, комбинируя их методами молекулярной инже¬
нерии с различными носителями и адъювантами, ориентируясь на
генетический контроль иммунитета с целью обеспечить вакцинацию
такими иммуногенами, на которые индивидуум заведомо должен
реагировать по сильному типу. Следует заметить, что принцип инди¬
видуализации вакцин выдвинут нами еще в 1968 г. (Петров Р.В., 1968).
Такой подход, разумеется, весьма сложен, особенно при вакцинации
больших контингентов. Указанные трудности можно преодолеть в
случае успешной реализации принципа фенотипической коррекции
генного контроля иммунного ответа с помощью искусственных вак¬
цин нового типа (см, главу 9 и раздел 10.2 главы 10).Детальный анализ аминокислотной последовательности консер¬
вативной области молекулы гемагглютинина позволил выделить ряд
новых фрагментов и синтезировать четыре из них [227]. Два пептида
соответствовали последовательности 139—146, различающиеся в пози¬
ции 144 по наличию Gly или Asp. Третий пептид соответствовал по¬
следовательности 147-164, а четвертый включал оба района и, таким
образом, соответствовал последовательности 138-164. Показано, что
короткие пептиды, хотя и распознаются антивирусными антителами,
сами не способны их индуцировать, в то время как длинный пептид
138-164 обеспечивал вируснейтрализующий эффект in vivo. Группа
R. Агпоп [751] показала, что синтетический пептид, соответствующий
последовательности 138—164 гемагглютинина вируса гриппа, конъ¬
югированный со столбнячным анатоксином, вызывает образование
антител, распознающих на пептиде участок петли (139—146) и осталь¬
ную часть пептида (147—164). Замена в положении 144 остатка Asp на
Gly приводила к образованию антител, которые, хотя и реагировали
перекрестно с пептидами, содержащими Aspl44, предпочтительнее
взаимодействовали с гомологичным пептидом. Это согласуется с дан¬
ными об изменении серологической специфичности вируса гриппа
при единственной замене Gly на Asp.Группа R-A. Lerner [417, 754] синтезировала 20 пептидов из разных
районов молекулы HAL Эта серия пептидов размером от 14 до 20 а ми-
Z.5. Полипептиды вирусов 205нокислот охватывала более 75% первичной последовательности моле¬
кулы НА1. Кроме того, синтезировали шесть пептидов, воспроизво¬
дящих отдельные фрагменты антигенного сайта с участком стыковки
НА1 и НА2 [754]. Каждый пептид был конъюгирован с гемоцианином
улитки и использован в смеси с ПАФ и алюминиевыми квасцами для
многократной иммунизации кроликов. Практически все пептиды
оказались способными стимулировать образование антител, реагиру¬
ющих как с гемагглютинином, так и с интактным вирусом, и в боль¬
шинстве случаев (13 антисывороток) нейтрализовывать цитопатиче¬
ский эффект вируса in vitro. Иммунизация мышей смесью полученных
конъюгатов с адъювантами в некоторых случаях защищала мышей от
заражения смертельной дозой адаптированного к ним (Х-47) виру¬
са гриппа [754]. Два пептида, будучи введенными с адъювантами, в
отдельности (не в смеси) также защищали мышей. Следует отметить,
что в этих экспериментах, в отличие от работ, проводимых М. Sela,
не ставилась цель имитировать третичную структуру соответству¬
ющих участков белка, так как в предварительных исследованиях [544J
было показано, что пептид, соответствующий определенному участку
белка, может индуцировать образование антител, реагирующих с бел¬
ком, Поэтому нет необходимости точно репродуцировать третичную
конформацию данного участка белка, и упомянутые выше пептиды
не были обязательно ограничены участками хорошо известных четы¬
рех иммунодоминантных антигенных сайтов НА1.Таким образом, пептиды (синтезированные или изолированные
и очищенные) могут индуцировать образование антител, которые
обычно не продуцируются при иммунном ответе на нативный белок.
Ни один из 20 синтезированных пептидов [417] не реагировал с анти¬
телами, индуцированными нативным гемагглютинином, т.е. с анти¬
телами, образовавшимися к иммунодоминантным сайтам. Важно
также отмстить, что из 18 пептидов, которые индуцировали выработ¬
ку антител, реагирующих с НА-1,15 были внутренними фрагментами,
представляющими собой несколько разных вторичных и третичных
структур молекулы гемагглютинина.Следует подчеркнуть, что в упомянутых выше исследованиях
антитела к пептидам, которые соответствовали аминокислотной по¬
следовательности, обшей для гемагглютининов всех использованных
штаммов вируса гриппа А, нейтрализовали все эти штаммы вируса.
Антитела, полученные против интактного вируса (Х-47, субтип Н3),
нейтрализовали только гомологичный штамм вируса. Таким образом,
206 Глава 7, Синтетические иммуногены и вакциныни интактный вирус гриппа, ни интактный гемагглютинин не могут
индуцировать перекрестный субтипоспецифический нейтрализую¬
щий ответ, так как большая часть образующихся антител направлена
против четырех иммунодоминантных сайтов (которые не несут общих
аминокислотных последовательностей). Следовательно, при помощи
синтетических пептидов можно вызвать образование нейтрализую¬
щих антител, которые обычно не синтезируются в ответ на иммуни¬
зацию цельными вирионами или их поверхностными антигенами,
несущими доминантные детерминанты.Другие исследователи [231] синтезировали пептиды, воспро¬
изводящие участки НА2 (остатки 1-11) вируса гриппа А (РК/А) и
В (РК/В): С1у-Ьеи-РЬе-С1у-А1а-11е-А1а-01у-РЬе-Пе-01и (РК/А-пеп-
тид) и 01у-РЬе-РНе-01у-А1а-11е-А1а-С1у-Р11е-11е-С1и (РК/В-пептид).
В качестве носителей использовали БСА и лизоиим. Показано, что
оба пептида связывают антитела козьих и кроличьих антисьтвороток
против НА или вируса А и В, а также сывороток людей, переболев¬
ших гриппом А. Иммунизация пептидами индуцирует образование
антител, связываюищх НА и интактные вирусные частицы соответс¬
твующей линии, но эти антитела не обладают вируснейтрализующей
активностью.В отличие от результатов, полученных многими авторами, в работе
[636] из семи синтезированных пептидов (сегменты гемагглютинина
вируса гриппа) лишь несколько вообще оказались иммуногенны¬
ми, несмотря на конъюгирование с гемоцианином и использование
ПАФ. Антитела к гемагглютинину и вирусу связывались лишь с
С-концевым пептидом НА, только антитела к С-концевому пептиду
связывались с интактным НА, но не с восстановленным или алки-
лированным НА.Серьезные исследования проведены с одним из расшифрован¬
ных белковых антигенов вируса ящура [264, 754], Этот пикорнави-
рус содержит в своей оболочке 240 молекул четырех типов — УР1,
УР2, УРЗ и УР4, по 60 молекул каждого типа. Вирусный белок 1
(УР1) считается основным протективным антигеном, вызывающим
образование вируснейтрализующего иммунного ответа. Семь пеп¬
тидов, соответствующих району УР1, в том числе пептид 141-, 160,
синтезировали и использовали после конъюгации с белком-носи¬
телем для иммунизации кроликов и морских свинок [264]. Участок
141—160 наиболее сильно варьирует у разных серотипов вируса,
т.е. определяет иммунологические разновидности возбудителя.
7.5. Полипептиды вирусов 207Показано, что антисыворотки к трем пептидам, включая пептид
141-160, нейтрализуют вирус ящура in vitro, В опытах in vivo морс¬
ких свинок иммунизировали подкожно конъюгатами этих пепти¬
дов в ПАФ или с гидроокисью алюминия. Спустя 35 дней, когда в
сыворотке определяли вируснейтрализующие антитела, животных
заражали вирусом ящура в дозе 10^ LD50 [754], Большинство вак¬
цинированных свинок не заболело, у них отсутствовали типич¬
ные поражения лап. Группой R.A. Lerner начато и продолжается
выполнение работ по синтезу вакцин, которые должны обеспечить
зашиту против всех серотипов вируса ящура (А, О и С) путем конъ-
югирования пептидов, соответствующих каждому серотипу, на
общем носителе [754].В Институте биоорганической химии АН СССР [33] синтезировали
последовательность 145-159 (Arg, Gly, Asp, Leu, Gin, Val, Leu, Ala, Gin,
Lys, Val, Ala, Arg, Thr, Leu) и ее части 149-159, 149-156 и 145-156 VPl
вируса ящура. Носителем служили гемоцианин улитки, БСА, глико¬
пептид Glc NAc(ß-^u)Mur-NAc-Ala-D-iGln. Была зарегистрирована
иммуногенность, начаты испытания вакцинирующих эффектов.Синтезировано пять пептидов, содержащих аминокислотные
последовательности структурного белка VP1 вируса полиомиелита
типа I [365].Патид H„N - Tvf fflv - Glv - Aro. Ser - Ага - Ser ■ Glu - Ser - Gly - COOHПвгтгид » Cv8 - Glv - Glv-Arg - Ser »Am - Ser Gtu - Ser- Ser »He > Glu - Ser - Phe - COOHПвтцд - Туг - G<v - Gly » Ser - Thr • Thr »Agn-Lva-Aga-Lys‘Gly-COOHПептид H^N - Tw - Glv - Glv - Asp -Asn - Pro - Ala - Ser ■ Thr -Thr-Asn - Lys - Asp - Lvs - COOH3Пептид H^N - Tvr - Gtv - Glv - Aso - Авп - Thr - VW - Arg - Glu - Ttif - Gly - COOH5Присоединенный к белковому носителю (БСА, гемоцианин улит¬
ки), каждый из этих пептидов способен праймировать иммунную
систему кроликов к продукции серотипоспецифических антител
после введения животным интактного вируса. Иначе говоря, введение
только конъюгатов пептид-белок в большинстве случаев (четыре из
пяти антигенов) не индуцирует образование антивирусных антител,
продукция которых начинается только после попадания в организм
208 Глава 7. Синтетические иммуногены и вакциныинтактного вируса. Правда, один пептид (пептид 3) с иммунодо-
минантной последовательностью 93—103 индуцировал продукцию
вируснейтрализующих антител без дополнительного введения вирус¬
ных частиц.Весьма интенсивно ведутся исследования по синтезу антигенов
вируса гепатита В. В значительной степени это объясняется невоз¬
можностью получения антигенов этого вируса из-за трудностей,
связанных с его культивированием. Как известно, поверхностный
антиген вируса гепатита В (HBsAg) можно получить только из крови
людей — хронических вирусоносителей.R.A. Lerner et al. [545] синтезировали 13 пептидов, перекрывающих
всю последовательность пептидной цепи HBsAg, содержащей 226
аминокислотных остатков, предсказанной исходя из нуклеотидной
последовательности HBsAg. Конъюгаты семи пептидов с гемоциа¬
нином улитки после многократной иммунизации кроликов вместе с
адъювантами вызывали специфический антипептидный иммунный
ответ. Антитела к четырем пептидам, содержащим более 10 аминокис¬
лот, особенно с последовательностью 95—109, реагировали с натив¬
ным HBsAg и специфически преципитировали вирусные частицы с
молекулярной массой 23 тыс. и 28 тыс. Dreesman G.R. и соавт. [349] на
основании результатов компьютерного анализа вторичной структуры
и гидрофобности цепи HBsAg выбрали в качестве «ответственной»
части антигена область дисульфидной «петли» между аминокисло¬
тами 117 и 137 и синтезировали два циклических пептида, кольца
которых содержали остатки 117—137 и 122—137 аминокислот цепи
HBsAg. Показано, что иммунизация этими пептидами с различными
адъювантами приводит к образованию антител к HBsAg у 50% мышей.
Конъюгирование пептида 122-137 со столбнячным анатоксином
повысило его иммуногенность и способность обеспечивать вторич¬
ный ответ [440].Синтезировали также тетрадекапептид (Н-пептид), содержащий
аминокислоты 138—149 HBsAg, с двумя остатками глицина в качестве
спейсерной группы [442]. Этот Н-пептид был избран для синтеза на
основе компьютерного анализа последовательности HBsAg с целью
определения эпитопа данного антигена. При помощи моноспецифи-
ческих антител против субдетерминант а, d и v HBsAg показано, что
Н-пептид перекрестно реагирует с антителами к HBsAg/a и HBsAg/d,
т.е. антигенная детерминанта была предсказана достаточно точно.
Иммунизация мышей Н-пептидом, конъюгированным с эритроцита¬
7,3. Полипептиды вирусов 209ми человека с помощью глутаральдегида, индуцировала образование
антител к HBsAg. Конъюгирование Н-пептида с пальмитиновой кис¬
лотой усилило его иммуногенность [441]:О н
II ICH3-(GH2)i4-C~N-Lys-rСНз-(СН2),4-|-Мо н•1:носитель - дипальмитиллиэин - спейсерGly — Gly — Ala — Ala — Thr — Lys “ Pro — Thr — Asp —OII- Gly ““ Asn Ala - Thr ~ Ala - Gly - С - OHантигенная детерминанта пептидаP.К, ßhatnagar и соавт. [262] в качестве антигенной детерминан¬
ты HBsAg выбрали область между аминокислотными остатками
121-160. Синтезировали 17 пептидов, перекрывающих эту после¬
довательность, конъюгировали их с гемоцианином и иммунизиро¬
вали кроликов. Пептиды 139—147, 139—158 и 140—158 индуцировали
выработку антител к HBsAg в низких титрах и взаимодействовали с
антителами к нативному HBsAg. Подчеркивается, что нонапептид-
ная последовательность 139—147, подобно описанному выще Н-пептиду
[441, 688], представляет собой часть детерминанты HBsAg, которая
является общей для всех серотипов вируса. Синтезирован пептид,
соответствующий области 135—155 [637]. Конъюгаты этого пептида
с некоторыми белковыми носителями индуцировали у кроликов
образование гетерогенной популяции TgM- и IgG-антител, из кото¬
рых только одна сублопуляция реагировала с HBsAg при низкой
константе связывания.Следует обратить внимание на то, что ни в одной из работ по получе¬
нию синтетических HBsAg не была показана протекция от инфекции.Синтезированы пептиды ядерного антигена вируса Эпштейна-
Барр (ВЭБ) [699]. Для изучения деталей строения ВЭБ синтезировали
2Í0 Глава 7. Синтетические иммуногены и вакцинынесколько пептидов, имитирующих строение участка раннего вирус¬
ного ядерного антигена (EBNA), обогащенного последовательностя¬
ми Gly-Ala. Получено две группы пептидов с различными сочетания¬
ми таких последовательностей, которые использовали для получения
антител у кроликов, а также для проверки иммунного ответа на
антиген ВЭБ у человека. Показана и индукция образования у кро¬
ликов высокоаффинных антител к EBNA с помощью иммунизации
конъюгатами пептидов с гемоцианином. Пептиды реагировали как с
антипептидными антителами кроликов, так и с сыворотками вирусо¬
носителей. Помимо больных инфекционным мононуклеозом, имею¬
щим высокие титры антител к EBNA, такие антитела выявили также
у больных аутоиммунными болезнями (ревматоидным артритом и
системным прогрессирующим склерозом).Важно также отметить, что расщифровка первичной структу¬
ры антигенов ряда вирусов на основе определения нуклеотидной
последовательности вирусной ДНК, кодирующей соответствующий
поверхностный белок, трансляция ее согласно генетическому коду в
аминокислотную последовательность иммунодоминантной области
белка и создание компьютерных методов определения детермина-
нтных эпитопов позволили разработать рекомендации для селекции
пептидов, которые могут быть использованы как антигены [458, 754].
Суть этих рекомендаций сводится к следующему. Во-первых, пептид
должен содержать контролируемое число полярных или заряжен¬
ных аминокислот, обеспечивающих его растворимость в водных
растворах. Во-вторых, пептиды должны быть длиннее, чем пентаме¬
ры, так как если пептиды короче, то они неиммуногенны; пептиды
длиннее 10 остатков обладают высокой способностью индуцировать
образование антител, реагирующих с нативным белком. В-треть¬
их, пептиды, содержащие пролиновые остатки дополнительно к
полярным или заряженным остаткам, как правило, индуцируют
образование антител, реагирующих с конформационно нативным
белком. Синтезированные в соответствии с этими критериями пеп¬
тиды более чем в 90% случаев вызывали образование антител, реаги¬
рующих с нативным белком. Однако во всех случаях для индукции
антителообразования синтезированные пептиды соединяли с бел-
ком-носителем. Поэтому синтетические пептиды должны содержать
остаток, через который их присоединяют к носителю. Обычно конъ¬
югируют через цистеи новый остаток, используя ш-малимидобензоил-
7.4. Полипептиды бактерий 211N-oкcиcyкцинaмид или в случае свободных аминогрупп — глутараль-
дегид. В качестве носителей обычно применяют гемоцианин, БСА,
тиреоглобулин, эдестин и синтетические полиаминокислотные носи¬
тели. Существенный иммунный ответ индуцируется на большинство
пептидов при иммунизации по следующей схеме. В 1-й день кроли¬
кам в подушечки лап вводили 200 мкг пептида (конъюгированного с
носителем) в ПАФ. На 14-й и 28-й дни внутрибрюшинно вводили 200
мкг пептида в НАФ. Сыворотки для определения антител получали
на 35-й день.7.4. ПОЛИПЕПТИДЫ БАКТЕРИЙF. Audibert и соавт. [233, 234J сделали попытку получить синтети¬
ческую дифтерийную вакцину. Известно, что молекула дифтерийного
токсина (ДТ) представляет собой отдельную полипептидную цепь с
двумя дисульфидными мостиками, ее молекулярная масса составля¬
ет 62 кД. Для вакцинации обычно используют анатоксин, который
индуцирует образование антител, взаимодействующих с нативным
токсином и нейтрализующих его токсичность. В 1981 г. [233] был син¬
тезирован тетрадекапептид — пептидный фрагмент ДТ, состоящий
из 14 аминокислот (188—201), замкнутых подобно петле лизоцима
дисульфидным мостиком с N-конца молекулы. Связанный с белком
(БСА) с помощью глутаральдегида, этот тетрадекапептид при вве¬
дении морским свинкам с ПАФ стимулировал выработку антител,
которые специфически связывали и нейтрализовывали ДТ, т.е. он
выполнял функцию искусственного иммуногена.Вслед за тетрадекапептидом 188—201 были синтезированы два его
структурных аналога — гексадекапептид и октадекапептид, которые,
включая декапептид, были присоединены к носителю — многоцепо¬
чечному поли-ОЬ-аланил-поли-Ь-лизину [234]. Синтетические пеп¬
тидные фрагменты ДТ выглядят следующим образом.Естественная петля ДТ~Cys~Ala-Gly-Asn~Arg-Val~Arg-Arg-Ser-Val-<3ly-Ser-Ser-Leu-Lys~Cys-
186 190 195 201
212Глава 7. Синтетические иммуногены и вакциныСинтетический пептид
Тетрадекапептид:NH,-Gly(188) Cys-CONH,(201)ISHГексадекапептид:NH.-Cys<186) Cys~CONH,(201)I ISH SHОктодвка пептиды;NH5-Ala-Ala-Cys(186) Cys-CONH,(201)I Is sI iACM ACMSODP(SH)‘^COOH: NHj-Ala-Aia-Cys^l 86) Cys-COOH(201)I ISH SHИммунизация этими конъюгатами морских свинок и мышей в
ПАФ или вместе с МДП привела к образованию антител, нейтра¬
лизующих при пассивном переносе морским свинкам кожно-некро¬
тическую активность токсина. Такие же данные были получены в
случае присоединения к синтетическому конъюгату МДП для замены
ПАФ. Способность синтетического олигопептида (тетрадекапептида
188—201) ДТ вызывать образование антитоксических антител под¬
тверждена в работе [276].Авторы работы {247J индуцировали типоспецифический протектив¬
ный иммунный ответ специфическим пептидом М-белка Streptococcus
pyogenes. Этот поверхностный белок обеспечивает резистентность
стрептококков группы А к фагоцитозу в неиммунном организме.
В иммунном организме типоспецифические антитела против М-
белка нейтрализуют его антифагоцитарный эффект и содействуют
элиминации стептококков. В связи с тем что сыворотка крови боль¬
ных ревматизмом перекрестно реагирует с антигенами тканей сердца
и определенными стрептококковыми антигенами, высказывается
опасение, что иммунизация интактной М-протеиновой вакциной
может привести к ревматическому поражению сердца. Поэтому был
синтезирован пептид из 35 аминокислотных остагков, соответству¬
7.4. Полипептиды бактерий 213ющих последовательности дианогенбромидного фрагмента С-В7 М-
белка типа 24 [247] :5Asn “ Phe»Ssr - Thr - Ala - Asp - Ser * Ala - Lys -10 15lie - Lys - Thr - Leu - Gtu -Aia - Glu * Lys - Ala - Ala -20 25Leu - Ala “ Ala - Arg - Lys - Ala - Asp - Leu - Glu - Lys >30 35Ala - Leu - Glu - Gly -^a - MetТакже были синтезированы два 20-членных пептида [333] из белка
М типа V. Конъюгаты этих пептидов со столбнячным анатоксином
или полилизином, введенные кроликам в ПАФ, индуцировали кле¬
точный и гуморальный иммунный ответ к интактному М-белку.
Перенос иммунной кроличьей сыворотки (пассивная иммуниза¬
ция) мышам обеспечивает типоспецифическую защиту от заражения
стрептококками.Был синтезирован [214] пептид (цианогенбромидный фрагмент 7),
повторяющий цепь из 34 аминокислот мембранного белка S. pyogenes
тип XXIV, которым в комплексе с синтетическим дериватом МДП
иммунизировали мышей. Реиммунизацию производили неиммуно-
генной дозой пептида. Без адъюванта антитела не продуцировались
даже после многократной иммунизации. При использовании адъю¬
ванта антитела не выявлялись после первой иммунизации, но после
повторной стимуляции определялись антитела к синтетическому
пептиду и его природному фрагменту. Таким образом, синтезирован¬
ный пептид стимулировал иммунологическую память независимо от
его способности индуцировать образование антител в определенных
количествах.Предпринята попытка определения наименьшего фрагмента
стрептококкового М-белка, вызывающего образование антител, спе¬
цифически реагирующих с нативным М-белком [332]. Показано, что
этот эпитоп находится в последовательности 14—20 М-белка.Многократная иммунизация синтетическими фрагментами
М-белка S. pyogenes тип XXIV по специальной схеме в сочетании с адъ¬
ювантами и нативными фрагментами М-белка добровольцев вызвала
увеличение титров сывороточных антител к М-белку [309J,
214 Глава 7. Синтетические иммуногены и вакциныВ лаборатории М. Sela [451] был предпринят синтетический под¬
ход к индукции иммунного ответа на холерный токсин, который,
как известно, состоит из двух субъединиц — А и В. Субъединица
А активирует аденилатциклазу, которая включает биологическую
активность, в то время как субъединица В ответственна за связывание
с клеточным рецептором и экспрессирует наиболее важную имму¬
ногенную детерминанту [227]. Антитела к В-субъединице способны
нейтрализовывать биологическую активность интактного холерного
токсина у кроликов, В-субъединица (холерагеноид) представляет
собой пентамер, каждая из цепей которого содержит 103 аминокис¬
лотных остатка известной последовательности [524]*,10Thr- Pro - Gin - Asn - lie - Thr - Asp - Leu - Cys - Ala - Glu - Tyr ~ His - Asn -
20Thr - Gin - Ile - His ■■ Thr - Leu - Asn -Asn - Lys - Tte - Phe - Sw- Tyr - Thr -30 40Glu - Ser - Leu - - Gly - Lys - Arg - Glu - Met - Ala - Ile - Ile »■ Thr - Phs -50Lys-Asn - Glv - Ala - Thr ~ Phe - Glu - Val - Glu - Val - Pro - Gly - Ser - Gin -60 70His - Ile - Asp - Ser - Gin - Lys - Lys - Aia - Ile - Giu - Arg - Met - Lys-Asn -80Thr - Leu - Arg - Ile ' Ala - Tyr^Leu - TI^GIu - Ata - Lys - Val - Glu - Lys -
90Leu 'Cys - Val - Trp - Asn - Asn - Lys - Thr - Pro - His - Ala - Ile - Ala - Ala -100 103Tie - Ser - Met - Ala - AsnВ связи с тем что строение эпитопных групп В-субъединицы не
было известно, синтезировали шесть пептидов, в основном пере¬
крывающих аминокислотную последовательность указанной цепи
В-субъединицы: 8—20, 30—42, 50—64,69-85,75—85 и 83—97, обозначен¬
ных соответственно СТР1-СТР6 [451].Конъюгаты всех шести пептидов со столбнячным анатоксином
вызывают образование пептидспецифических антител. Четыре из
шести антисьтвороток реагировали с различной степенью специфич¬
ности также с интактной В-субъединицей и нативным холернымСинтезированные фра1менты подчеркнуты,
7A. Полипептиды бактерий 215токсином, однако два пептида — СТР2 и СТР5 — индуцировали обра¬
зование только антипептидных антител. Антисыворотки против пеп¬
тидов СТР1 и СТР6 с высокой степенью специфичности реагировали с
гомологичным пептидом, но существенно менее активно с интактной
В-су6ъединицей или холерным токсином. Однако пептид СТРЗ (ами¬
нокислотные остатки 50-61) индуцировал синтез антител, которые
взаимодействовали с интактным токсином.Антитела к различным пептидам оценивались по их способнос¬
ти нейтрализовать биологическую активность холерного токсина.
Только антисыворотка к пептиду СТРЗ нейтрализовывала биологи¬
ческий эффект этого токсина (показано в кожном тесте, в котором
повышение проницаемости кожи кролика, индуцированное токси¬
ном, ингибировалось антителами, и на модели изолированной петли
тонкой кишки по способности предотвращать накопление жидкости,
индуцированной холерным токсином, в изолированной петле тонкой
кишки кролика). Сыворотка к пептиду СТРЗ в разведении 1:10 ока¬
зывала такой же эффект, как и антитела сыворотки против нативного
токсина в разведении 1:200.С помощью твердофазного метода синтезирован пептид, представ¬
ляющий собой копию фрагмента 30—50 ß-цепи холерного токсина,
который предлагается использовать в качестве носителя для белков
при оральной иммунизации [696].Проведены исследования, направленные на получение синтети¬
ческой вакцины против энтеротоксигенных штаммов Е. соИ [499].
Надо сказать, что острые диарейные заболевания, вызываемые энте¬
ротоксинами кишечной палочки, транзиторно колонизирующей
тонкую кишку, — важная проблема не только здравоохранения, но
и ветеринарии. Дело в том, что кол и бактериозы являются основ¬
ной причиной (наряду с ротавирусами) широко распространенных
острых диарей среди новорожденных животных, особенно ягнят
и поросят. Для получения искусственной колибактериозной вак¬
цины синтезировали пептид, состоящий из последовательности
18 аминокислотных остатков очищенного термостабильного ток¬
сина (СТ), выделенного из человеческой Е. coli, штамм 18D, Этот
синтетический 18-членный СТ конъюгировали с нетоксичной субъ¬
единицей В термолабильного токсина (ЛТ) Е. соИ, штамм 711, с
помощью карбодиимида, изменяя полярные соотношения исходных
компонентов, что позволило получить конъюгаты различного соста¬
2Í6 Глава 7. Синтетические иммуногены и вакциныва [499]. Многократная иммунизация крыс парентерально и перо¬
рально конъюгатом, содержащим 39% СТ и 61% субъединицы В ЛТ с
очень небольшой остаточной токсичностью СТ (0,06%), обеспечила
4-7-кратное повышение уровня сывороточного IgG-антитоксина и
титров секреторного IgA-антитоксина в слизистой оболочке кишеч¬
ника к каждому из компонентов, входящих в состав конъюгата.
Иммунизированные таким образом животные были резистентны к
заражению ЛТ или СТ так же, как и к заражению гетерологичными
штаммами Е. соН, продуцирующими эти токсины. Об устойчивости
к заражению судили по секреции в петле дистальной части тон¬
кой кишки иммунизированных крыс по сравнению с контролем
(неиммунизированные животные). Таким образом, перекрестный
конъюгат синтетического СТ и субъединицы В представляет собой
нетоксичный иммуноген, защищающий от всех типов энтероток-
сикогенных штаммов Е. coli, которые продуцируют любые формы
(СТ или ЛТ) токсина. Подчеркивается перспективность создания
вакцин против колибактериозов на основе перекрестно-реагирую-
щих токсинов, а не штаммоспсцифических антигенов (например,
фимбриальные антигены), защищающих только от гомологичных
штаммов бактерий.Заслуживают упоминания исследования, направленные на полу¬
чение синтетической туберкулезной вакцины. Так, синтезированы
октапептид Asp-Gly-Gly-Ser-Glu-Ser-Glu-Gly и гексапептид Asp-Gly-
Gly-S er-Glu-Ser-Gly-G ly-Lys “Asn-Gly-Ser-G ln-Met-Arg-Leu, которые
воспроизводят фрагменты туберкул инактивного внутриклеточного
микобактериального белка [733], Синтетические пептиды вызывали
аллергическую реакцию замедленного типа в кожном тесте у мор¬
ских свинок, сенсибилизированных микобактериям и туберкулеза, т.е.
обладали активностью туберкулина (PPD). Показано, что PPD — очи¬
щенный белковый дериват туберкулина, представляющий собой ком¬
плексную смесь белков неизвестного состава, которые экскретируют-
ся в культуральную среду бактериями М. tuberculosis, — дает слабую
перекрестную реакцию с синтетическим октапептидом.Заслуживает также внимания перспективность использования в
качестве иммуногенов синтетических фосфолипидов. Во-первых,
липофильные группы могут сами активировать лимфоциты путем
изменения свойств липидов плазматической мембраны [119], т.е. дейс¬
твовать как модуляторы мембраны лимфоцита. Во-вторых, такие ran-
7.4. Полипептиды бактерий 217гены могут обеспечить перекрестный типоспецйфический иммунный
ответ. Попытка получения общевидового иммуногена пневмококков
на основе эпитопной группы фосфохолина — гаптена клеточной стен¬
ки пневмококков — увенчалась успехом [836]. Конъюгат фосфохолина
с гемоцианином индуцировал образование IgM- и lgGЗ-aнтитeл,
обеспечивающих защиту от нескольких вирулентных типов пнев¬
мококков. Такую же протекцию обеспечивала иммунизация капсу¬
лярным полисахаридным антигеном, но в этом случае защита была
типоспецифической.Следует отметить, что фосфохолин — гаптенная дентерминан-
та С-нолисахарида клеточной стенки и форсмановского антигена
Streptococcus pneumoniae — индуцирует продукцию трех различных
семейств антител, по отношению к которым известные фосфохолин-
связывающие миеломные белки Т15, М603 и М5И/М167 являются
репрезентативными прототипами [836]. Интересно также, что естес¬
твенные антитела к фосфохолину (антифосфохолиновые антите¬
ла нормальных неиммунных сывороток), как и гибридомные, при
пассивном переносе обеспечивают защиту от экспериментальной
пневмококковой инфекции. Можно предположить, что малые моле¬
кулы фосфохолина, являющиеся компонентом клеточных стенок
пневмококков разных типов, обеспечивают типонеспецифический
(видовой) иммунитет благодаря идентичной структуре. Возможно,
антифосфохолиновые антитела взаимодействуют и с другими клетка¬
ми. Действительно, есть данные, показывающие довольно широкую
перекрестную реагируемость антифосфохолиновых антител с фос-
фохолином из разных источников. Поэтому нельзя исключать воз¬
можность возникновения аутоиммунных и аллергических реакций
при использовании гаптенов, свойственных для разных клеток, в том
числе общих для клеток микроорганизмов и человека- Этот вопрос
требует пристального рассмотрения.Антигены сальмонелл (группа бактерий, включающих возбу¬
дителей брюшного тифа и паратифа) относятся к наиболее хорошо
изученным бактериальным антигенам. Липополисахаридный анти¬
ген, выделенный из сальмонеллезных клеток, назван 0-антигеном.
Кроме того, в жгутиках этих бактерий содержится другой белковый
антиген, названный Н-антигеном. Антигенная специфичность каж¬
дого типа сальмонелл (всего их насчитывается более 20) определяется
именно О-антигеном. Имеются основания полагать, что иммунитет
218Глава 7. Синтетические иммуногены и вакцинык сальмонеллезам также обеспечивается преимущественно за счет
реакции макроорганизма на 0-антиген [362]. Именно этим объясня¬
ется прогресс в изучении химического состава и структуры О-анти¬
гена. Как уже упоминалось, О-антиген является ЛПС, состоящим
из липидной и полисахаридной частей. ЛПС является Т-независи-
мым антигеном, обычно вызывающим сильный иммунный ответ.
Иммуногенность ЛПС обеспечивается липидной частью молекулы
[779]. Но именно липидная часть (липид А) ответственна за высокую
токсичность ЛПС. Удаление липидной части приводит к получению
нетоксичного полисахаридного антигена, который неиммуногенен,
т.е, не вызывает образования антител. Иначе говоря, сам по себе
полисахаридный компонент О-антигена является гаптеном. Но
именно 0-полисахарид — та специфическая детерминанта, которая
антигенно отличает разные типы сальмонелл.Все сальмонеллы, независимо от типовой специфичности, содер¬
жат полисахарид, в состав которого входит гептозофосфат и N-аце¬
тилглюкозамин. Липид присоединен к концевому остатку кето-
оксиоктоната, а полигептозофосфатная цепь несет боковые цепи,
состоящие из повторяющихся единиц, каждая из которых содержит
связанные между собой различные сахара или аминосахара. По этим
сахарам различаются 0-антигены бактерий всей коли-тифозной
группы. При этом повторяющиеся единицы содержат специальный
для каждого представителя данной группы бактерий сахар. Эти
сахара получили название тивелоза (у S. typhi), паратоза (у 5. para¬
typhi), колитоза (у Е. соИ) и т.д. Строение специфической части О-
антигена показано ниже*.СахI Глк I \ I Пая j I Геп j Р-ЭА | КДО |-Р~ЭАМан Н Ра“1Н Н Н"Гея И Гвп Н КДО |-{|едО Н Липид А'[0-специфическая цепьПолисахаридный корСах — абеквоза, паратоза или тивелоза; Ман — манноза; Рам ~ рамноза; Гал —
галактоза; Глк — глюкоза; Глк N — N-ацетилглюкозамин; Геп — гептоза; КДО — кето-
оксиоктоновая кислота; Р — остаток фосфорной кислоты; ЭА — этанола мин.
7.4. Полипептиды бактерий 219Был синтезирован [779, 780] ряд сахар-протеиновых конъюгатов со
специфичностью О-антигена Salmonella typhimutium. Синтетические
сахаридные детерминанты для придания им иммуногенности конъ¬
югировали с природными белками, в частности с БСА, тем самым
получая Т-зависимые сахарид-протеиновые антигены. Многократная
иммунизация мышей наиболее оптимальным вариантом искусствен¬
ного сальмонеллезного О-сахарид-протеинового конъюгата с исполь¬
зованием ПАФ защищает животных от последующего заражения
смертельной дозой Salmonella typhimutium SH-2201. Такая иммунизация
позволила увеличить LD50 в отдельных экспериментах примерно в
10 раз (вакцинация убитыми бактериями повыщала LD50 в 100 раз).
Однако следует отметить, что иммунизирующий эффект полученных
конъюгатов проявлялся лишь у мышей тех линий, которые были гене¬
тически высокоотвечающими на носитель — БСА. Введение конъюга¬
та О-сахарид—БСА животным тех линий, которые были генетически
низкоотвечающими на БСА (например, мышам линии C57BL), совер¬
шенно не оказывает иммунизирующего действия. Для получения
иммунизирующего эффекта требовалась замена БСА в искусственном
антигене на другой носитель — дифтерийный токсин, по отношению
к которому мыши линии C57BL являются высокоотвечающими [780].Данные исследования, как и многие другие работы, демонстриру¬
ют важность решения проблемы фенотипической коррекции генного
контроля иммунитета, которой посвящены многие наши исследова¬
ния (см. главу 9).Н.К. Кочеткову и соавт. (1979) [71] удалось найти способы хими¬
ческого синтеза специфических бактериальных полисахаридов, по¬
строенных из повторяющихся олигосахаридных звеньев. Химический
синтез этих фрагментов позволяет решить проблему получения гапте¬
нов сразу в форме, удобной для связывания с носителем. В качестве
носителей авторы прежде всего использовали высокомолекулярные
белки, обеспечивающие при введении их конъюгатов с синтетиче¬
скими олигосахаридами в ПАФ достаточно высокий иммунный ответ.
Эти же авторы [71] синтезировали и исследовали антигенные свойства
углеводсодержащих искусственных антигенов со специфичностью
0-факторов сальмонелл после перевода углеводной детерминанты
в высокомолекулярное состояние в результате сополимеризации с
акриламидом. Антигены такого типа в качестве детерминанты содер¬
жат полное трисахаридное повторяющееся звено бактериального
полисахарида:
220Глава 7. Синтетические иммуногены и вакциныHOCH,ГNонCONHj CONH” (CHj - СН)х “ СИ - СИ - (СНз - СН)у -АкриламидТрисахаридное звеноПолученный антиген специфически взаимодействовал с антисы¬
вороткой кролика, иммунизированного соответствующей группой
сальмонелл. Это доказывает наличие у сополимера монофакторной
специфичности.Описанные сополимеры олигосахаридных детерминант со специ¬
фичностью О-полисахаридов обладали при многократных иммуниза¬
циях определенными иммуногенными и протективными свойствами
в опытах на мыщах, зараженных 3-5 LD^o Salmonella anatum [143].Полусинтетическая вакцина к Streptococcus pneumoniae типа И!
получена на основе гексасахарида [^3) GlcpAp (1->>4) Glcpp (1->]рз,
выделенного при частичном кислотном гидролизе из капсульного
полисахарида S3 [759J. Гексасахарид конъюгировали со стеарилами-
ном и инкорпорировали в липосому. Такие гаптенированные липо-
сомы индуцировали IgM-ответ и защищали мышей от заражения
25LD5y S. pneumoniae типа ТТТ, но не XI.Детальное исследование искусственных модельных антигенов
«олигосахарид-белковый носитель» проведено с использованием син¬
тетических аналогов разветвленных и линейных декстранов, манна-
нов и глюкоманнанов f700J. На примере 17 синтезированных ди- и
трисахаридов, которые присоединяли к БСА, гемоцианину или эдес-
тину, показано, что минимальный иммуногенный эпитоп должен
состоять из 1—2 сахаров; выявлены оптимальные соотнощения в
эпитопной плотности олигосахаридных групп. Полученные антитела
7.5. Полипептиды простейших 221перекрестно реагировали с синтетическими полимерами и их при¬
родными аналогами, несущими соответствующие эпитопы.7.5. ПОЛИПЕПТИДЫ ПРОСТЕЙШИХВсе виды плазмодиев, вызывающих малярию, на стадии споро-
зоитов содержат структурный поверхностный белок, который, по-
видимому, играет важную роль в процессе инвазии паразита в клетки
печени хозяина [868]. Около 10—20% белка, синтезированного споро-
зоитами в слюнных железах комара, приходятся на этот структурный
протеин.В связи с тем, что сиорозоиты не культивируются in vitro, а полу¬
чить их в достаточном количестве из инфицированных комаров
невозможно, проблему выделения и изучения их поверхностного
белка удалось решить с помощью клонирования фрагментов ДНК,
кодирующих эпитопы этого протеина [413]. Аминокислотная после¬
довательность иммунореактивного поверхностного белка спорозоита
была определена исходя из нуклеотидной последовательности кло¬
нированных фрагментов ДНК. Установлено, что иммунореактивная
область поверхностною белка малярийного паразита Р. knowlesi обе¬
зьян состоит из попарно расположенных 12 повторяющихся субъеди¬
ниц, каждая из которых содержит 12 аминокислот. На эту область
приходится 1/3 всей аминокислотной последовательности белка.
Полученные данные послужили предпосылкой для синтеза доде-
капептида NH2-Gln-Ala-Gln-Gly-Asp-Gly-Ala-Asn-Ala-Gly-Gly-Gln и
полной иммунорсактивной области из 24 аминокислот, представляю¬
щей попарно повторяю1цийся додекапептид [413]. Синтезированный
24-члснный пептид обладал свойствами эпитопа поверхностного
антигена. Он связывался несколькими моноклональными антитела¬
ми против поверхностного антигена и специфически конкурировал
в иммунорадиометрическом тесте с аутентичным поверхностным
белком р. knowlesi. Показано, что этот синтетический пептид дейс¬
твительно содержит аминокислотную последовательность эпитопа
структурного поверхностного антигена.Если удастся синтезировать конъюгаты описанного додекапептида
с носителем, обеспечивающим образование антипептидных антител,
которые реа1Ируют с мембраной спорозоитов и нейтрализуют их
222 Глава 7. Синтетические иммуногены и вакциныинфекционность, то это будет синтетическая малярийная вакцина.
Структурные поверхностные белки возбудителей малярии животных
и человека организованы в принципе одинаково.7.6. ПОЛИВАЛЕНТНЫЕ КОМПЛЕКСЫИдеальной вакциной будущего представляется комплексная
макромолекула, одновременно несущая несколько антигенных
детерминант, каждая из которых характерна для того или иного
инфекционного агента, т.е. синтетическая поливалентная вакци¬
на. Уже делаются первые попытки создания таких поливалентных
комплексов. Конъюгировали три синтетических пептида [308],
копирующих фрагменты дифтерийного токсина, М-белка стреп¬
тококков типа XXIV и поверхностного антигена вируса гепати¬
та В вместе со столбнячным анатоксином (ММ 160 кД) при помощи
глутаральдегида. Мышам вводили по 100 мкг конъюгата, содер¬
жащего от 10 до 20 мкг каждого из трех синтетических пептидов.
Если мышей иммунизировали поливалентным конъюгатом в ПАФ,
наблюдали выраженный первичный и вторичный иммунный ответ
на все три пептида. Одновременно регистрировались высокие титры
антител против столбнячного анатоксина. Антительная реактив¬
ность к каждому синтетическому пептиду, тестированная имму-
ноферментным методом, ингибировалась только гомологичным
пептидом, т.е, поливалентный иммуноген индуцирует образование
высокоспецифических антител к каждому антигену, входящему
в состав конъюгата. Показано, что антитела, индуцированные
поливалентным иммуногеном, реагируют с нативными белками —
дифтерийным токсином и стрептококковым протеином М24 —
и не отличаются по авидности от антител, индудированных моно¬
валентным иммуногеном. Антитела, индуцированные поливалент¬
ным иммуногеном, нейтрализуют дифтерийный токсин и повыша¬
ют фагоцитоз стрептококков [308]. Принципиально аналогичные
данные получены в другой работе. Синтетический дифтерийный
пептид и пептид антигена вируса гепатита В конъюгировали с про¬
теином М24 (ММ 42 кД) малярийного пептида, контролирующего
тандемно повторяющиеся эпитопы белка Plasmodium knowlesi [426].
Авторы работы [461] получили четырехвалентный синтетический
7.6. Поливалентные комплексы223конъюгат, двукратная иммунизация которым мышей и морских
свинок в смеси с синтетическим адъювантом мурабутидом или
ПАФ обеспечивала образование антител ко всем четырем пептид¬
ным компонентам: дифтерийному, стрептококковому, пептидам
HBsAg и Р. knowlesi. Таким образом, фактически получены искусст¬
венные поливалентные вакцины, которые необходимо испытывать
на протективную слособность в опытах in vivo. Примером искусст¬
венных многокомпонентных вакцин, оказывающих протективный
эффект в опытах с заражением вирулентными микроорганизмами,
могут служить конъюгаты, содержащие несколько бактериальных
или вирусных антигенов, которые соединены с общим полиион-
ным иммунопотенциатором.
Глава 8КОНЪЮГИРОВАННЫЕ ВАКЦИНЫ8.1. КОНЪЮГИРОВАННЫЕ АНТИГЕНЫ И ИММУНОГЕНЫДля эффективного иммунного ответа на многие антигены, особен¬
но растворимые, токсины, анатоксины и вакцины требуется допол¬
нительное введение вместе со специфической иммунизирующей
субстанцией того или иного адъюванта. Адъюванты — это агенты раз¬
нообразной природы, неспсцифически стимулируюишс иммунный
ответ к специфическим антигенам. В зависимости от дозы и способа
введения адъюванты могут также оказывать иммунодепрессивное
действие. Поэтому их нередко относят к иммуномодуляторам.в последние годы выявлены новые природные и искусствен¬
ные синтетические соединения, обладающие высокой адъювантной
активностью, которые можно разделить на три основные группы;1) природные высокополимерные соединения (полисахариды бак¬
териального и растительного происхождения, бактериальные
гликопептиды, нуклеиновые кислоты);2) искусственно синтезированные аналоги природных полимер¬
ных соединений (синтетические полинуклеотиды, полипепти¬
ды, гликопептиды);3) искусственно синтезированные полимерные соединения, не
имеющие природных аналогов (синтетические карбоцепные и
гетероцепные полианионы и поликатионы).Входящие в эти группы растворимые в воде иммуностимуляторы
лишены многих побочных эффектов, сопровождающих введение
нерастворимых природных адъювантов, как-то: образование фиброз¬
ных капсул и гранулем в месте инъекции, полиартриты, сенсибилиза¬
ция к микобактериальным антигенам и эндотоксинам, аллергические
и аутоиммунные реакции, индуцирование опухолей, гипергрофия
лимфоидных органов и др. (Jolies Р., Paraf А., 1973) [34]. Это прежде
всего относится к адъювантам типа смесей Фрейнда. Представление
о том, что адъюванты — это обязательно «агрессивные» и нераство¬
римые субстанции, начало отходить в прошлое, особенно после того,
s.I. Конъюгированные антигены и иммуногены 225как были получены и искусственно синтезированы химически про¬
стые молекулы, обладающие иммуностимулирующими свойствами.Как оказалось, такие молекулы не только не обладают способнос¬
тью индуцировать побочные реакции, но проявляют свойства, обеспе¬
чивающие активацию основных функций системы иммунитета. Было
установлено, что синтетические полиэлектролиты активируют функ¬
ции стволовых элементов, антигенпредставляющих клеток, популяций
лимфоидных регуляторных и эффекторных клеток. Стимулирующее
действие полиэлектролитов проявляется в активации процессов миг¬
рации и рециркуляции иммунокомпетентных клеток, включая ство¬
ловые, в пролиферации и кооперации макрофагов, Т- и В-лимфоцитов,
в стимуляции процессов их дифференцировки, в активации функций
зрелых форм элементов иммунной системы. Соединение синтезиро¬
ванных полиэлектролитов с гаптенами и антигенами различной при¬
роды гаптенами, белками, пептидами, полисахаридами — привело
к образованию принципиально новых антигенных молекул с выра¬
женными новыми свойствами. Прежде всего существенно повысилась
иммуногенность полученных конъюгатов без утраты их специфичес¬
ких антигенных свойств. Доказано, что под влиянием полиэлектро¬
литов тимусзависимые антигены получают статус тимуснезависимых,
не требующих участия Т-хелперов в индукции иммунологических
реакций. Более того, было установлено, что конъюгаты антиген-син¬
тетический полиэлектролит индуцируют иммунный ответ независимо
от активности генов иммунного ответа. Способность индуцировать
иммунный ответ повышенного типа вне зависимости от активности
//•-генов характеризует важнейщие свойства конъюгатов антиген—поли¬
электролит, обосновывающие возможность конструирования на этой
основе вакцины нового поколения с повышенными иммунизирую¬
щими свойствами. Еще одна, также весьма существенная, особенность
таких конъюгатов заключается в их способности нормализовать физио¬
логический баланс регуляторных клеток (Thl иТН2), необходимых для
продукции антител, и обеспечивать реверсию аллергического ответа в
иммунный со сменой продукции аллергических IgE-антител на бло¬
кирующие антитела класса IgG без изменения их специфичности. Эти
свойства конъюгатов открывают другую возможность в конструирова¬
нии иммуногенов нового поколения — в создании вакцин (аллерготро-
пинов) для терапии аллергических заболеваний.Несмотря на значительные достижения в создании синтетических
молекул, способных не только усиливать (полианионы и поликати¬
226 Глава 8. Конъюгированные вакциныоны), но и подавлять (полиамфолиты) иммунологический ответ на
антигенный материал, поиск иммуностимулирующих носителей для
антигена, обладающих высокими показателями соотношения эффек¬
тивности и безопасности, продолжается [14]. Значимость такого поис¬
ка определяется необходимостью создания большого количества
эффективных и безопасных вакцин нового поколения с профилакти¬
ческими и лечебными свойствами. Имеются в виду не только вакци¬
нирующие препараты против непобежденных инфекций, но и вакци¬
ны, уже созданные против многих инфекций, но в силу объективных
причин недостаточно эффективные и требующие модификации как
их эффективности, так и безопасности.8.2, СИНТЕТИЧЕСКИЕ ИММУНОМОДУЛЯТОРЫ ДЛЯ
ВАКЦИН НОВОГО ПОКОЛЕНИЯ (НОВЫЕ АДЪЮВАНТЫ)8.2.1. СИНТЕТИЧЕСКИЕ АНАЛОГИ
ПРИРОДНЫХ АДЪЮВАНТНЫХ СТРУКТУРСреди различного рода синтетических адъювантов важным типом
молекул являются водорастворимые адъюванты — аналоги природ¬
ных полимеров.Синтетические полинуклеотиды. Спиральные комплексы полиаде-
ниловой и полиуридиловой (поли-А:11) или полиинозиновой и поли-
цитидиловой (поли-1:С) кислот, полученные их смешиванием в при¬
сутствии ионов натрия, благодаря низкой токсичности, химической
гомогенности и охарактеризованности, нащли применение в иммуно¬
логических исследованиях и интенсивно изучаются в течение ряда лет.В таблице 14 суммированы (Cone R.E., 1979) данные различных
авторов о влиянии полинуклеотидов поли-А:и и поли-1:С на гумо¬
ральный иммунный ответ. Как видно из таблицы, полинуклеотиды
усиливают продукцию антител к растворимым и корпускулярным
антигенам. В целом анализ, проведенный R.E. Cone (1979), показы¬
вает, что полинуклеотидные комплексы повышают титры сыворо¬
точных антител классов TgM, IgG и IgE при первичном иммунном
ответе, снижают индуктивный период антителопродукции и увели¬
чивают время циркуляции антител в высоких титрах. Вместе с тем
полинуклеотиды не влияют на анамнестический иммунный ответ,
8.2, Синтетические иммуномодуляторы для вакцин нового.,.227Таблица 14Адъювантное действие полинуклеотидных комплексов
на гуморальный иммунный ответАнтигенЭффект ш vivoЭритроциты баранаУскоряется время появления
антителосекретирующих клеток.
Повышается число антителосекре-
тирующих клеток в селезенке. Не
влияет на число фокусобразующих
клеток. Ускоряется повышение числа
антигенсвязывающих Т- и В-клстокБычий гамма-глобулинПовышается уровень TgM- и IgG-
антителБычий сывороточный альбумин.
Человеческий гамма-глобулин.
Ферритин, У!-антигенПовышается эффект примированияАнтигены спермы. Вакцина против
гриппа свиттей. Вирус венесуэльско¬
го энцефаломиелита лошадейПовышается продукция антителБычий гамма-глобулинИнгибируется создание толерант¬
ностиЭффект in vitroЭритроциты баранаПовышается или понижается
(в зависимости от дозы полинуклео¬
тида) продукция АОКДНФ-полимеризованный флагеллинНе влияет на прдукцию АОКно при введении в момент индукции первичного ответа усиливают
эффект примирования. Розеткообразующие клетки и АОК в селе¬
зенке мышей, иммунизированных ЭБ после введения поди-А:и,
выявляются на 24-48 ч раньше по сравнению с контролем [324],
22S Глава 8. Конъюгированные вакциныОднако максимальное число АОК у контрольных и обработанных
110ли-А:и животных было одинаковым. Поли-А:и не влияет на число
гтредшественников АОК, оцениваемых методом подсчета численнос¬
ти фокус-образующих единиц. Таким образом, поли-А:и усиливает
самые ранние стадии иммунного ответа, не влияя на число клеток,
отвечающих на антиген и дифференцирующихся в АОК. В культуре
клеток in vitro показано, что действие гголи-А:и на иммунный ответ
зависит от дозы полинуклеотида: низкие дозы стимулируют, а высо¬
кие угнетают его (Cone R.E., 1979). Супрессивіюе действие поли-А:и
не связано с кеспецифическим токсическим влиянием на культивиру¬
емые клетки. Интересно, что поли-А:и не действовал на продукцию
АОК к ТНА (ДНФ-нолимеризованный флагеллин), однако в таких же
культурах модулировал (стимуляция или супрессия в зависимости от
дозы) иммунный ответ на ЭБ.Комплексы поли-А:и и поли-1:С оказывают выраженный адъ¬
ювантный эффект на клеточный иммунитет. Как видно из дан¬
ных таблицы 15 (Cone R.E,, 1979), исследовали влияние поли¬
нуклеотидов на различные реакции Т-клеточного иммунитета.
Иммуностимулирующее действие на Т-клеточный иммунный ответ
зависит от силы антигенного стимула. Так, поли-А:и незначитель¬
но усиливает реакцию отторжения Н-2-несовместимого кожно¬
го трансплантата и супрессирует реакцию ГЗТ, индуцированную
оптимальной дозой антигена. Напротив, этот полинуклеотид зна¬
чительно ускоряет отторжение H-Y-нссовместимого трансплантата
и стимулирует ГЗТ, индуцированную субоптимальной дозой анти¬
гена. Полинуклеотидные комплексы усиливают реакцию «транс¬
плантат против хозяина» и индукцию аутоиммунных поражений.
Некомплексированные гомополимеры поли-А, поли-U или поли-С
усиливают экспериментальный аутоиммунный энцефаломиелит,
индуцированный иммунизацией нервной ткани, хотя в большинстве
случаев отдельные спиральные гомополимеры не обладают сущест¬
венной адъювантной активностью (Cone R.E., 1979). В эксперимен¬
тах in vitro показано, что поли-А: U усиливает бласттрансформацию
и синтез ДНК Т-клетками при развитии ответа на субоптимальные
количества растворимых антигенов или аллогенных клеток, ускоря¬
ет образование цитотоксических Т-клеток в смешанных культурах
лимфоцитов с аллогенными лимфоидными или сингенными опухо¬
левыми клетками, несущими опухолеспецифические транспланта¬
ционные антигены.
8.2. Синтетические иммуномодуляторы для вакцин нового...229Адъювантное действие полинуклеотидных комплексов
на Т-клеточные иммунные реакцииТаблица 15АнтигенАдъювантМетод определенияН-2Н-2H-YPPDОсновной белок
миелина
Гомогенат
спинного мозгаPPDСтолбнячный
анатоксин
Аллогенные клеткин-2Поли-А: иПоли-А: и
Поли-1;С
Поли-А:иПоли-UПоли-А: и
Пол и-и
Поли-СПоли-АіІІПоли-А:иПоли-А:иПоли-А:и1п vivoТрансплантация кожи неонатально
тимэктомированным половозрелым
мышамРеакция «трансплантат против хозяина»
Трансплантация кожи
Оценка кожной реакции к фактору, инги¬
бирующему миграцию
Экспери менталън ы й аутоимму н ный
энцефаломиелитЭкспериментальный аутоиммунный
энцефаломиелитIn vitroБласттрансформация, синтез ДНК
Бласттрансформация, синтез ДНКСинтез ДНКОбразование цитотоксических Т-клетокВажная роль в иммуномодулируюш,ем действии синтетических
полинуклеотидов отводится спиральной структуре и молекулярным
размерам. Гомополимеры поли-А или поли-U не обладают адъювант¬
ными свойствами, которые возникают после формирования полинук¬
леотидных спиральных комплексов (Cone R.E., 1979). Предполагают,
что спиральные структуры этих комплексов содействуют их лучшему
связыванию с мембранами клеток и защищают полинуклеотиды
от действия сывороточных нуклеаз. Не исключено, что абсорбция
полинуклеотидов клетками зависит, во всяком случае частично, от
заряда, так как предварительная обработка клеток поли-L-лизином
усиливает абсорбцию на них поли-А:и [737]. Поскольку большинство
клеток несет отрицательные поверхностные заряды, изменение заря¬
да поверхности этим поликатионом логично связать с повышением
230 Глава 8. Конъюгированные вакцинысвязывания отрицательно заряженного полинуклеотида. Вместе с тем
важная роль в связывании полинуклеотидов с клетками отводится их
конформации (Cone R.E., 1979).Как отмечалось выше, полинуклеотидные адъюванты влияют на
ранние сроки иммунного ответа. Показано, что поли-А:и увеличи¬
вает число кроветворных стволовых клеток [597]. Экспериментально
доказана возможность дифференцировки Т-клеток из их предшест¬
венников в культуре in vitro [736] и наведение хелперной Т-клеточной
активности in vivo [324]. Совместная инкубация макрофагов с антиге¬
ном и полинуклеотидами in vitro приводит к усилению способности
антигенпредставляющих клеток к индукции иммунного ответа при
переносе in vivo (Johnson H.G., Johnson A.G., 1971).Инкубация in vitro Т-клеток с поли-А:и в отсутствие макрофагов и
(или) антигена индуцирует поликлональную активацию с превращени¬
ем их в цитотоксические Т-клетки (Віск R, Möller G., 1977). Инкубация
тимоцитов с поли-А:11 значительно ускоряет время продукции хел-
перного фактора. Иммуносупрессивные эффекты полинуклеотидов
опосредуются через действие Т-супрессоров (Cone R.E., 1979). В целом
поли-А:и способен в зависимости от использованной дозы усиливать
активность как супрессорных, так и хелперных Т-клеток.Таким образом, мишенями для реализации иммуномодулирую¬
щего действия синтетических полинуклеотидов являются Т-клетки
и макрофаги. Вместе с тем имеется сообщение о том, что высокие
концентрации полинуклеотидов в культуре in vitro оказывают мито-
генное действие на В-клетки независимо от Т-клеток (Diamantstein Т.,
Blittstein-Willinger E., 1975). Не исключено, что полинуклеотиды в
данной экспериментальной системе действуют, замещая хелперный
сигнал Т-клеток.В заключение следует отметить, что иммуномодулирующий
эффект полинуклеотидных адъювантов проявляется при их одновре¬
менном введении с антигенами. Ограниченная токсичность и хими¬
ческая гомогенность этих синтетических стимуляторов позволяют
надеяться, что они найдут применение в практической иммунологии
для повышения эффекта иммунизации или вакцинации. Так, вве¬
дение поли-А:и или поли-1:С вместе с некоторыми вирусными вак¬
цинами (вирусы мышиной пневмонии, Сендая, гриппа) повышают
продукцию антител и устойчивость при заражении соответствующим
вирусом (Cone R.E., 1979). Получено также повышение устойчивости
к ряду бактериальных и паразитарных инфекций при иммунизации
8.2. Синтетические иммуномодуляторы для вакцин нового... 23fвместе с введением полинуклеотидов. Заслуживает внимания спо¬
собность синтетических полинуклеотидов усиливать иммунопро-
тективный ответ против некоторых опухолей (мышиной саркомы,
лейкемии, химически индуцированной опухоли).Синтетические гликопептиды. Гликоиептиды клеточных стенок,
обладающие адъювантной активностью, выделены из многих мик¬
роорганизмов. Наиболее хорошо изучены пептидогликаны микобак¬
терий и коринебактерий [307, 834]. К ним относятся нерастворимые
адъюванты: пептидогликолипид (скелет клеточной оболочки), разные
метаноловьте и хлороформенные экстракты клеточных стенок, три-
фалоза-6,6-димиколат и водорастворимые адъюванты; гликопептид
мурамовой кислоты, связанной с арабиногалактаном, и N-ацетилму-
рамил-Ь-аланил-О-изоглутамин (т.е, МДП).МДП — компонент водорастворимого адъюванта — обладает выра¬
женными иммуностимулирующими свойствами и представляет собой
минимальную адъювантно-активную структуру бактериальных пеп-
гидогликанов [310].Показано сходство химической структуры гликопептидов из раз¬
ных микроорганизмов, обладающих адъювантной активностью. Были
синтезированы различные гликопептиды (МДП, разные аналоги, сте¬
реоизомеры и производные) и выявлена корреляция между их хими¬
ческой структурой и адъювантной активностью. Все эти субстанции
стимулируют продукцию антител и реакции ГЗТ при введении вместе
с антигеном в водно-масляных эмульсиях. Наиболее хорошо изучен
МДП, синтезированный (Kotani S. et al., 1975; Merser P. et al., 1975)
1364] на основе водорастворимого гликопептида аналогично соответс¬
твующей структурной субъединице этого пептидогликана (рис. 29).
Молекулярная масса МДП равна 500 Д.Важным достоинством МДП является то, что он сравнительно
малотоксичен, не является антигеном в отличие от водорастворимых
фракций микобактерий, оказывает адъювантное действие при инъек¬
ции в водном растворе, при раздельном введении с антигеном и даже
при пероральном введении (Audibert F. et al., 1976) [307]. МДП очень
быстро выводится из организма с мочой. У мышей более 50% вве¬
денного подкожно или внутривенно 1'‘[С]-МДП выявляли в моче уже
через 30 мин и более 90% — через 2 ч (Parant М., 1979).К сожалению, МДП обладает рядом нежелательных побочных
эффектов: пирогенностью, вызывает тромбоцитолиз и лейкопению
(Lederer E., 1980). В то же время молекула МДП является весьма
232Глава 8, Конъюгированные вакциныподходящей моделью для молекулярной инженерии, так как на ее
основе можно синтезировать большое число аналогов МДП, изменяя
каждую их трех (см. рис. 29) основных частей молекулы. В настоящее
время синтезировано несколько сотен производных МДП. Среди них
имеются аналоги МДП, утратившие пирогенность, но сохранившие
адъювантный эффект,В процессе изучения действия МДП на гуморальный иммунный
ответ было показано, что введение МДП, так же как и некоторых его
синтетических аналогов, в водно-масляных эмульсиях животным
для стимуляции иммунного ответа полностью замещает иммуномо-
дулирующее действие микобактерий в ПАФ (Souvannavong V, et al,
1978) [8051. Иначе говоря, МДП и его аналоги представляют собой
простейшую структурную единицу бактериальных пептидогликанов,
способную замещать целые убитые микобактерии или их компоненты
в ПАФ, При введении морским свинкам яичного альбумина в НАФ,
дополненном МДП или микобактериями, наблюдаемое усиление
продукции антител было таким же или даже более сильным в случае
использования МДП по сравнению с микобактериями (Souvannavong V.
et al., 1978). Адъювантное действие МДП на продукцию антител к ЭБ
было меньше по сравнению с ПАФ.
8.2. Синтетические иммуномодуляторыдля вакцин нового.233Важно то, что МДП и его синтетические аналоги проявляют адъ¬
ювантную активность в отсутствие водно-масляных эмульсий. МДП
увеличивает иммунный ответ каккТ-зависимътм, так и к Т-независи-
мым антигенам in vivo и in vitro (табл. 16). Антителогенез усиливается
при совместном введении МДП с антигеном, а также независимо от
места инъекции антигена. Введение МДП бестимусным мышам nude
также оказывает адъювантный эффект. При введении с белковым
антигеном МДП особенно значительно усиливает вторичный иммун¬
ный ответ с повышением уровня преимуш^ественно антител класса
IgG. Инъекция МДП мышам, иммунизированным яичным альбуми¬
ном, сопровождается также усилением продукции IgE-антител.Таблица 16Адъювантное действие водного раствора МДП на гуморальный■xb^KavuuLiu пта^тАнтигенВид животногоОтвет1п viroБСАМышьТитр антителЯичный альбуминМышьТитр антителЯичный альбуминМышьТитр IgE-антителЯичный альбуминКрысаТитр антителЯичный альбуминМорская свинкаТитр антителЭБМышьАОКДНФ-фиколлМытьАОКГриппозная вакцинаМышьТитр антителГриппозная вакцинаХомякТигр ан гигелАнтигенТип клетокОтветЭБКлетки селезенки нор¬Антителамальных мышейЭБКлетки селезенкиАнтителамышей nudeДНФ-фиколлКлетки сслсжнки нор¬Антителамальных мышейТНФ-полиакриламидКлетки селезенкиАнтителамышей nude' Parant М., 1979.
234Глава 8. Конъюгированные вакциныСинтетические гликопептиды эффективно стимулируют антите¬
логенез в культуре лимфоидных клеток in vitro. При этом адъювантные
свойства МДП и его производных проявляются в Т-дефицитных куль¬
турах и при ответе на ТЗА и ТНА.1п vitro в зависимости от условий культивирования клеток, геноти¬
па клеток, концентрации МДП, легко демонстрируется и его имму-
носупрессивный эффект (Souvannavong K., Adam A., 1980). In vivo в
проявлении иммунодепрессивного действия МДП и его аналогов
установлена роль дозы и времени их введения.Таким образом, синтетические гликопептиды подобно другим
адъювантам, в том числе синтетическим полинуклеотидам, могут
усиливать или супрессировать продукцию антител в зависимости от
условий эксперимента.При оценке действия МДП на Т-клеточный иммунный ответ было
установлено, что введение МДП и его синтетических производных
животным вместе с растворимыми белковыми или гаптен-белок-
антигенами в НАФ обеспечивает такое же эффективное развитие
ГЗТ, как и введение этих антигенов в ПАФ (табл. 17). На моделях ГЗТ
в опытах на морских свинках показано, что химическая структура
синтетических гликопептидов тесно связана с их адъювантной актив¬
ностью [307]. Введение мышам МДП в высоких дозах сопровождается
угнетением образования цитотоксических Т-клеток при инкубации
лимфоидных клеток, обработанных МДП доноров с клетками син-
генной мастоцитомы (Ledere С. et al., 1979).Таблица 17Адъювантное действие МДП, введенного в водно-масляной эмульсии,
на Т-клеточный иммунный ответ*АнтигенВид животногоОтветЯичный альбумин
Аллогенные клетки
Яичный альбумин
Бактериальная а-амилаза
Основной белок миелинаСинтетический эндефа-
лито-генный гексапептидМорская свинка
Морская свинка
КрысаМорская свинка
Морская свинкаМорская свинкаГЗТ, продукция МИФ
Цитотоксический эффект
ГЗТ
ГЗТЭкспериментальный аутоим¬
мунный энцефаломиелит
Экспериментальный аутоим¬
мунный энцефаломиелит* Parant М., 1979.
8.2. Синтетические иммуномодуляторы для вакцин нового,.. 235При анализе возможных механизмов действия синтетических
гликопептидов на иммуногенез и перспектив их использования уста¬
новили, что адъювантный эффект МДП и других синтетических гли¬
копептидов реализуется на уровне клеток, участвующих в иммунном
ответе. Показано, что одной из мишеней для адъювантного действия
МДП являются макрофаги. Установлено, что МДП может непо¬
средственно влиять на макрофаги, индуцируя продукцию моноки¬
нов, активирующих Т- и В-клетки [376, 655]. В экспериментах in vitro
показано, что активированные МДП макрофаги секретируют колла-
геназу, фактор', стимулирующий пролиферацию фибробластов, фак¬
тор, активирующий лимфоциты, колониестимулирующий фактор,
продуцируют простагландины, эндогенные пирогены (Openheim J,J.
et al., 1980) [831].Получены данные о способности МДП вызывать поликлональную
активацию лимфоцитов. В культуре нормальных клеток селезенки
МДП повыщает число «фоновых» АОК без антигенной стимуляции
(Ledere С. et al., 1979), т.е. МДП функционирует как поликлональный
активатор.МДП обладает митогенными свойствами, которые выражены зна¬
чительно слабее по сравнению с ЛПС (Damais et al., 1978). Способность
МДП стимулировать синтез ДНК наиболее отчетливо выявляется в
культурах лимфоидных клеток, инкубируемых в бессывороточной
среде, дополненной 2-меркаптоэтанолом. Митогенная активность
(способность усиливать синтез ДНК) МДП зависит от генотипа
используемых клеток селезенки: высокоотвечающими были мыши
линий DBA/2, BALB/c, СВА; низкоотвечающими — C57BL/6, C3H/HJ.
Для ответа на вопрос о том, какие лимфоциты могут быть мишенью
для МДП, были проведены эксперименты по изучению влияния МДП
на синтез ДНК в культурах, содержащих преимущественно либо
В-, либо Т-клетки (Parant М., 1979). МДП стимулировал синтез ДНК
только в культурах В-клеток. Это заключение подтверждается также
экспериментами, в которых показано, что МДП и его синтетические
аналоги стимулируют иммунный ответ на ТЗА в Т-дефицитных куль¬
турах спленоцитов и у мышей nude. Вместе с тем предполагается, что
МДП может индуцировать созревание Т-хелперов из их предшествен¬
ников (Watson J., Whitlook С., 1978). При клеточном анализе в системе
адоптивного переноса выявлено, что МДП усиливает активность спе¬
цифических к носителю Т-хелперов, т.е. адъювантный эффект МДП
удалось перенести Т-клетками (Lowy 1. et al., 1977).
256 Глава S. Конъюгированные вакциныВажным преимуществом МДП и его низкомолекулярных син¬
тетических аналогов является то, что они не содержат ни одной из
большого числа различных антигенных детерминант, существующих
на целых микобактериях.Введение МДП в НАФ морским свинкам не сенсибилизирует их к
туберкулину, водорастворимому адъюванту микобактерий и другим
субстанциям клеточной стенки микобактерий и даже к самому МДП
(Parant М., 1979) [307]. После сенсибилизации ПАФ наблюдается раз¬
витие ГЗТ к туберкулину, другим компонентам стенки микобактерий,
но не МДП. Вместе с тем иммунный ответ на МДП можно получить,
используя его в качестве гаптена при конъюгации с белковыми носи¬
телями (Parant М., 1979). Антитела, полученные при иммунизации
такими конъюгатами, могут распознавать МДП. В ряде случаев пока¬
зана эффективность МДП и его дериватов при вакцинации с целью
индукции специфического протективного иммунитета против вирус¬
ной или паразитарной инфекции (Lederer E., 1980).Наличие серии эффективных синтетических адъювантов — глико-
пептидов — открывает перспективы их использования для стимуляции
неспецифической резистентности против инфекций и опухолей, имму¬
носупрессии (D-D-стереоизомеры МДП обладают иммуносупрессив-
ными свойствами), усиления иммунного ответа при иммунизации
очищенными антигенами, а также в качестве лабораторного реагента с
целью получения высокоактивных антисывороток к разным антигенам
(Chedid L., Lederer E., 1978; Parant M., 1979; Lederer E., 1980).В последние годы МДП и его синтетические производные все шире
используются в качестве адъювантов, а также в качестве ковалентно
связанного компонента в составе экспериментальных синтетических
вакцин [232], Синтезированы дисахаридные гликопептиды, прояв¬
ляющие иммуномодулирующие свойства [И], которые отличаются
от мурамилпептидов наличием N-ацетилглюкозаминового остатка,
присоединенного р(1^4)-гликозидной связью к N-анетилмурамоно-
вой кислоте.В заключение следует также кратко упомянуть о еще одном классе
синтетических адъювантов — аналогах природных липопептидов.
Синтезированы N-терминальные липопептиды липопротеида Е, coli,
в частности трипальмитоил — пентапептид и ряд его производных
[464]. Синтетические N-терминальные липопептиды, несущие от двух
до пяти аминокислот, индуцировали митозы и продукцию иммуно¬
глобулинов в культурах лимфо11.итов мышей, т.е. поликлонально акти-
H.2. Синтетические иммуномодуляторы для вакцин нового... 237пировали В-клетки [260]. Конъюгаты синтетического липопептидного
¿«дъюванта с неиммуногенным олигопептидом (синтетический фраг¬
мент рецептора эпидермального фактора роста) вызывают продукцию
специфических антител к олигопептидному фрагменту.Синтетические липопептиды усиливают первичный и вторичный
иммунный ответ к корпускулярным антигенам in vivo и in vitro [548].
Добавление синтетических липопетидных фрагментов к убитым
ацетоном микробам Salmonella typhimurium позволяет существенно
снизить дозу этой вакцины (Schlecht S. et al., 1986). Предполагают, что
первым звеном в механизме действия липопептидов является их вза¬
имодействие с плазматической мембраной клетки путем включения
липофильных групп в липидный бислой и связывание с мембранны¬
ми белками.8.2.2. СИНТЕТИЧЕСКИЕ ПОЛИЭЛЕКТРОЛИТЫОбнаружение иммуномодулирующего влияния синтетических
полиэлектролитоБ, не имеющих природных аналогов, относится к
первой половине 1970-х годов. Эти в полном смысле слова искусст¬
венные полимеры (полианионы, поликатионы) представляют собой
простые в химическом отношении макромолекулы, приобретаю¬
щие в водных растворах множественные электрические заряды, т.е.
являются полиионами. Простота химического синтеза и строения
полиэлектролитов, возможность получения полимерных цепочек
в широком диапазоне молекулярных масс, т.е. различной длины,
растворимость в воде и ряд других свойств (способность к конфор¬
мационным превращениям, образование комплексов с белками,
прочность которых регулируется степенью кватернизации боковы¬
ми углеводородными радикалами и др.) открыли широкие перспек¬
тивы для их использования в иммунологических исследованиях.
У экспериментальных животных были описаны феномены усиле¬
ния иммунного ответа на различные антигены при использовании
в качестве водорастворимых адъювантов полианионов — полиак-
ри.ювой кислоты (ПАК), декстран-сульфата (ДС) (Diamanstein Т.
et al., 1971 [344]; Петров Р.В. и др., 1974) или поликатионов —
поли-4-винилпиридина (ПВП), поли-2-метил-5-винилпиридина
(ПМВП) и других ионогенных производных этих полиоснований
(Петров Р.В. и др. Ц26]; Хаитов P.M. и др., 1975).
238Глава 8. Конъюгированные вакциныВ наших исследованиях особое внимание было уделено полностью
искусственным карбоцепным и гетероцепным полимерам со строго
контролируемой структурой. Работа в этом направлении позволила
одновременно получить данные о механизме влияния на иммуногенез
искусственных полиионов, с одной стороны, и использовать эти моле¬
кулы как инструмент для анализа механизмов иммунного ответа —
с другой. Приведем структурные формулы некоторых синтетических
полимерных иммуностимуляторов.(-сн,~сн-),
соонПолиафиловая
кислота (ПАК)(-СН2-СН“)пн.(-СН2~-СН-)пПоли-4-винилпиридин {ПВП)(-сн^-сн-)^т X©С2Н5Поли-2-мвлгил-5-винилпиридин Четвертичная соль(ПМВП) поли-4-еинилпиридима (ПBП-R1)Г®„©С2Н5В? 'СН2-СН2-С2Н5®вр 'СНз-СН,-л-гпсн.СН^СеНбЧетвертичные соли поликонидинаСНд-
8.2, Синтетические иммуномодуляторы для вакцин нового...239Ни одно из приведенных соединений само по себе не является
антигеном. Несмотря на существенные различия в строении и даже
в самой химической природе элементарных звеньев макромолекул
указанных полимеров, их иммуностимулирующая активность близка
по величине. Мономерные аналоги звеньев этих полимеров (пропио-
новая кислота, этилпиридин) не проявляют иммуностимулирующего
действия. Механизм действия полиионных иммуностимуляторов
обусловлен Б первую очередь их макромолекулярной природой, точнее
некоторыми их общими свойствами, привносимыми полимерностью
(Кабанов В.А, и др. [55, 57]). Одно из таких свойств макромолекул —
способность к многоточечному кооперативному взаимодействию
с другими комплементарными макромолекулами с образованием
устойчивых интерполимерных комплексов или к прочной многото¬
чечной кооперативной абсорбции на химически комплементарных
поверхностях (Кабанов В.А. и др., 1977 [55, 57]). В этой связи кле¬
точные мембраны со встроенными в них белками (рис. 30) благода¬
ря большому разнообразию поверхностных функциональных групп
являются универсальными сорбентами для разнообразных классов
полиэлектролитов. В работах В.А. Кабанова и соавт, (1977) [55, 57]
анализировалась гипотеза об определяющей роли кооперативной
адсорбции полиэлектролитов на поверхности иммунокомпетентных
клеток в стимулировании иммунопоэза, рассмотрены физико-хими-Внешняя поверхностьЦитоплазмаРис. 30. Поперечный разрез клеточной мембраны (схематическое изображение)
2401'лава 8. Конъюгированные вакциныческие механизмы иммунопотенпипполикатионов и полиамфолитов. действия полиионов,
Известно, что при кооперативномстанта связывания является экспон макромолекул кон-цией их степени полимеризации возрастающей функ-вания как функция « резко возраст степень связы-к 1, в достаточно узком интервале измГ'" ^ значения, близкогоминает критическое. Поэтому устанп ^^^о явление напо-зависимости иммуностимулирующег критического характерадлины макромолекул имеет решающе полиэлектролитов от
ности упомянутых выше механизмов!достовер-В качестве объектов исследования а ^^^^^ов и др. 1551).тичных солей поликонидина (ПК)- выбраны фракции четвер-JnВ XHj-CHj”где Ri — этил; — бензил- г+„~.фракции пoли-4-винил-N-этилпиn ^ такжеполи-4-винилпиридина (ПВП) и (ПВП — Ri),Изучали влияние полиэлектполи!^^^^^^^^^^^” кислоты (ПАК),
ответ на ЭБ. ^«тoв на гуморальный иммунныйЭБ вводили в дозе 2x10’ на мышк r
цитов в процессе продукции АОК Д^^^'^мадеиствие Т- и в-лимфо-
тивного переноса соответствующиу *^^<^ледовали в условиях адоп-
ш vivo. Для этого летально облучен^^^^^'*^^^^ суспензий в культуре
трансплантировали 10^ клеток костт^^^^^ реципиентам внутривенно
10’ клеток костного мозга и 2x10? vn (В-лимфоциты), смесьфоциты) с 2x10’ ЭБ. Полимеры вилочковой железы (Т-лим-одновременно с ЭБ. ^одили однократно внутривенноНа рисунке 31 а в полулогарифм^х..
лены зависимости иммуностимулип ^ координатах представ-
четвертичных солей ПК от п. Они активности полимерныхвыражены как отношение числа
Рис. 31. Зависимость относительного числа АОК, образующихся в ответ на
введение ЭБ, от степени полимеризации (п) полиионов:
а-ПК- К,, К2 О) и ПК-К2 (2); 6 - ПАК (1) и ПВП (2)АОК в эксперименте к числу АОК в контролях (Кабанов В.А. и др.
[55]). Видно, что адъювантное действие проявляется лишь начиная
с некоторых критических значений л, резко нарастает и затем прак¬
тически достигает предела. Таким образом, экспериментальные
данные полностью согласуются с предположением о кооперативном
взаимодействии полиионов с компонентами иммунной системы како ключевом факторе, определяющем их участие в запуске иммунного
ответа.Важно отметить, что ПК — К,, Яг и ПК — Кг начинают «работать»
при разных значениях п. По всей вероятности, присутствие в первом
относительно гидрофобных бензильных радикалов усиливает спо¬
собность его звеньев сорбироваться на поверхности иммунокомпе¬
тентных клеток. Поэтому кооперативное «прилипание» к мембране
при прочих равных условиях достигается при меньшей длине цепи
молекулы. Если принять во внимание, что мембраны разных клеток
(Т-лимфоциты, В-лимфоциты, макрофаги, моноциты и др.) различа¬
ются по составу и структуре, то становится ясно, что обнаруженная
чувствительность явления к гидрофобно-гидрофильному балансу
полиэлектролита в принципе открывает возможности «нацеливания»
242 Глава 8. Конъюгированные вакциныполимерного адъюванта на клетки нужного типа, т.е для повышения
избирательности действия и предотвращения нежелательных побоч¬
ных эффектов. Такое избирательное действие полимера показано,
например, для ПАК, которая, как оказалось, является митогеном и
активатором В-клеток, но не взаимодействует с Т-клетками. Вместе
с тем обработка Т-клеток нейраминидазой, удаляющей с их поверх¬
ности сиаловые кислоты, что снижает отрицательный мембранный
потенциал, делает возможным воздействие ПАК на эти модифициро¬
ванные Т-лимфоциты.Для ПВП и ПАК аналогичные зависимости при фиксированных
весовых концентрациях вводимых препаратов выражены менее отчет¬
ливо, Однако если при инъекции соответствующих фракций каждый
раз вводить постоянное число макромолекул полимерного адъюван¬
та, то оказывается, что ПВП и ПАК, как и четвертичные соли ПК,
проявляют активность только при п, превышающих определенные
критические значения (рис. 31 б).Критический характер зависимости относительного числа АОК
от длины молекул полиионов обнаружен также при изучении их
влияния на кооперацию Т- и В-лимфоцитов. Интересно отметить,
что качественно такой же характер имеет зависимость от способнос¬
ти ПВП-К, склеивать отрицательно заряженные частицы водного
полимерного латекса, регистрируемой по нарастанию оптической
плотности (О) системы при добавлении водных растворов полиэлект¬
ролита (Кабанов В.А. и др., 1980 [55]).Описанные результаты имеют принципиально важное значение
для понимания природы иммуностимулирующей активности ионо¬
генных макромолекул, а также механизмов действия нового типа
искусственных антигенов и вакцин, представляющих собой комп¬
лексы или конъюгаты природных антигенов или их детерминант с
синтетическими полиэлектролитами. Влияние степени полимери¬
зации на иммуностимулирующие свойства полимерных иммунопо-
теициаторов описано и для других полиэлектролитов (Норимов А.Ш.
и др., 1983).Выше подчеркивалось структурно-химическое разнообразие
полимерных адъювантов, примерно эквивалентных по силе имму¬
ностимулирующего действия. Но это не означает, что функцию
адъюванта может выполнять любой высокомолекулярный полиэлек¬
тролит. Рамки такого разнообразия ограничиваются способностью
8.2. Синтетические иммуномодуляторы для вакцин нового...243полимерных соединений путем многоточечного кооперативного
взаимодействия скреплять компоненты антигеы-клеточных комп¬
лексов (Кабанов В.А. и др. 155, 57, 465]). Вместе с тем известно, что
полиэлектролиты, адсорбируясь на поверхности дисперсной фазы,
могут не только флоккулировать, но и, наоборот, стабилизировать
золи, т.е. препятствовать слипанию коллоидных частиц, например в
результате их перезарядки. Переход от полимерных флоккулянтов к
стабилизаторам в каждом отдельном случае определяется совокуп¬
ностью факторов, среди которых важную роль играет электростати¬
ческий баланс макромолекулы. Поэтому нет оснований удивляться,
что в отличие от гомополимеров ПМВП и ПАК их сополимеры
промежуточного состава (1:1 и 3:1) не только не стимулируют, но,
наоборот, резко угнетают Т-В-кооперацию (Петров Р.В., Хаитов P.M.,
1978) [50]. Подробно действие таких сополимеров и антигенов со сни¬
женной иммуногенностью, построенных на их основе, описано ниже
(см. главу 10).(СН, - СН -СН,(-СН2~СН-)„соонНакопленный обширный экспериментальный материал показы¬
вает, что путем совместного введения с антигеном синтетического
полиэлектролита можно в 3—5 раз повысить интенсивность выра¬
ботки специфических антител, увеличить содержание в селезенке
и лимфатических узлах АОК, активизировать реакцию ГЗТ, а также
реакцию «трансплантат против хозяина». Удается стимулировать
иммунные реакции на различные антигены ~ белки, полисахариды,
чужеродные клетки у лабораторных животных разных видов (мыши,
крысы, кролики, морские свинки, собаки) (Петров Р.В,, Хаитов P.M.,
1978 [ИЗ, 114]; Петров Р.В. и др. [119, 128, 136]). Из данных табли¬
цы 18 видно влияние некоторых синтетических полиэлектролитов на
иммунный ответ на наиболее широко используемый в лабораторных
экспериментах антигенный материал — ЭБ.
244Глава 8. Конъюгированные вакциныТаблица 18Влияние некоторых синтетических полиионов на продукцию АОК
при иммунизации мышей эритроцитами баранаПолимер
(50 мг/кг)Мол. масса
полимераЧисломышейЧисло АОК
в селезенкеКонтроль (инъ¬
екция изотони¬
ческого раствора
хлорида натрия)
ПВП
ПАКСополимер акри¬
ловой кислоты с
N-BПД50 ООО
80 ООО
100 ООО
40 ООО201614
171524 300±120096 400±2750
102 700±3200
86 900+1840
56 200±2500Обнаружение факта стимуляции синтеза антител или Т-клеточной
иммунной реакции в ответ на совместное введение антигена с синтети¬
ческим полиионом свидетельствовало лишь об усилении интегральной
реакции иммунитета как цельной системы. Уровни влияния поли¬
электролита в организме животного были неизвестны настолько, что
нельзя было отвергать даже опосредованного действия полимера через
гормональную систему или систему кроветворения и лимфопоэза, что
также могло в конечном счете увеличить интегральный ответ иммун¬
ной системы на чужеродный антиген. Необходимо было исследовать
влияние полиионов на все основные звенья иммуногенеза — от генера¬
ции клеток-предшественников до конечных эффекторных звеньев.8.2.3. КЛЕТОЧНЫЕ МЕХАНИЗМЫ
ИММУНОПОТЕНЦИРУЮЩЕГО ДЕЙСТВИЯ СИНТЕТИЧЕСКИХПОЛИИОНОВИзучение клеточных механизмов действия синтетических полиио¬
нов велось на экспериментальных моделях, воспроизводяших различ¬
ные звенья иммуногенеза.Стимуляция миграции и пролиферации стволовых кроветворных клеток.Стволовые клетки (СК) костного мозга служат своего рода «семенным»
материалом для всех лимфоидных тканей, В этом смысле костный мозг,
бесспорно, является одним из центральных органов иммунитета. До сих
8.2. Синтетические иммуномодуляторы для вакцин нового... 245пор не удалось выделить одиночную СК и охарактеризовать ее структур¬
ные свойства. Оказалось возможным изучать функциональные парамет¬
ры СК, а именно их митотическую активность, способность к миграции
из костного мозга в лимфоидные органы и, наконец, дифференцировку
этих клеток в эритроциты, тромбоциты и лейкоциты.Экспериментальные модели для изучения указанных функций
С К весьма разнообразны. Наиболее информативна и популярна
модель регистрации кроветворных колоний, вырастающих в селе¬
зенке облученных мышей из эндо- или экзогенных стволовых клеток
(Till J.E., McCulloch Е.А., 1961). В основе развития гемоцитарной
колонии из единичной СК, прикрепившейся к строме селезеночной
ткани, лежат два процесса — деление и созревание СК. Поэтому с
помощью данного метода с успехом можно исследовать митотическую
активность СК, интенсивность и направление их дифференцировки.В естественных условиях СК образуются в костном мозгу.
Следовательно, процессы их пролиферации и дифференцировки в
лимфоидных органах (вилочковая железа, селезенка) жестко зависят от
интенсивности их м играции из костного мозга. Нами была разработана
экспериментальная модель для изучения миграционных характерис¬
тик СК, которая используется для количественной оценки влияния
различных факторов химической, биологической и физической приро¬
ды на миграцию СК (рис. 32) (Петров Р.В., Хаитов P.M., 1972).Мышам во время летального облучения экранировали учас¬
ток костного мозга (часть задней конечности, обычно до уровня
1/2 голени). Спустя 7—8 сут после облучения определяли число колоний
в селезенке, образовавшихся мигрировавшими СК из экранирован¬
ного участка. Модель позволяет оценивать важные количественные
параметры миграции СК — абсолютное количество мигрировавших
в селезенку СК, а также число СК, мигрирующих в единицу времени.
Последнее возможно благодаря произвольному прекращению мигра¬
ции путем локального облучения экранированного участка костного
мозга через 1—24 ч после первого облучения. Использование методики
позволяет одновременно изучать способность СК к миграции, проли¬
ферации и дифференцировке. В 1-е сутки преимущественно происхо¬
дило переселение СК из костного мозга в селезенку, а в последующие
дни — деление и дифференцировка СК, задержавшихся в селезенке.
Причем сравнение результатов роста ко;юний в указанной модели с
результатами роста при внутривенном введении СК позволяло выде¬
ли! ь собственно процесс миграции СК из костного мозга. В частности,
246Глава 8. Конъюгированные вакцины//ШорЖ\//mwwww/////Ж\\\\\+Препарат А+Препарат В«I2 4 6
Дни после облучения8Рис. 32. Метод для количественной оценки влияния различных агентов на
миграцию кроветворных стволовых клеток по числу колоний R селезенке:} — угнетение миграции; 2 — контроль; 3 ■— усиление миграциинам удалось обнаружить ряд факторов, влияющих на миграцию, но не
действующих на пролиферацию и дифференцировку СК. Так, было
установлено, что гормоны коры надпочечников значительно угнетают
выселение СК из костного мозга. Напротив, после адреналэктомии
резко усиливается выброс СК в циркуляцию (Khaitov R.M. et al. [490]).Важной функциональной характеристикой СК является их иролифе-
ративная активность in situ — в костном мозгу. Интересно, что, несмотря
на значительную «незрелость» СК, лишь 20-40% этих клеток вступает
в цикл клеточного деления, остальные СК остаются в покое. По-види-
мому, выход СК в митотический цикл тесно сопряжен с началом их
дифференцировки. Нет сомнений, что в костном мозгу имеет место кон¬
троль над процессом выхода СК из состояния покоя в цикл клеточного
деления. По всей вероятности, контроль этот многокомпонентен. Нам
удалось обнаружить одно из звеньев механизма регуляции деления СК;
идентифицированы и изучены клетки-супрессоры, тормозящие проли¬
ферацию СК в костном мозге (Petrov R.V., Khaitov R.M. et al. [391,675]).Методы изучения соотношения делящихся и покоящихся СК сводятся
к определению общего числа СК по колониеобразующей способности и
8.2. Синтетические иммуномодуляторы для вакцин нового...247числа СК, подверженных токсическому действию клеточных ядов, влия¬
ющих только на делящиеся клетки. Элиминацию пролиферирующих СК
осуществляют, например, путем введения в организм оксимочевины или
Ш-тимидина с высокой удельной радиоактивностью. В обоих случаях
гибнут стволовые клетки, вступающие в S-фазу клеточного цикла.Таким образом, упомянутые методические подходы позволяют изу¬
чать процессы миграции, деления и дифференцировки СК. Именно
эти процессы послужили предметом нащего исследования при вве¬
дении синтетических полиионов в организм животного. В таблице 19
приведены данные о влиянии поликатиона ПВП и полианиона ПАК
на способность кроветворных стволовых клеток к пролиферации (Пет¬
ров Р.В., Хаитов P.M. [114]), которую тестировали в системе эндогенного
колониеобразования в селезенке сублетально облученных мышей [802].
Из данных таблицы 19 видно, что ПВП и ПАК значительно повыша¬
ют число селезеночных кроветворных колоний, которые образуются
в результате пролиферации отдельных стволовых клеток, выжив¬
ших после сублетального облучения. Стимулирующий эффект поли¬
электролитов зависит от их дозы и молекулярной массы. Приведенные
результаты коррелируют с данными о том, что ПВП и ПАК обладают
митогенными свойствами. Так, инкубация клеток селезенки с ПВП или
ПАК приводит к усилению синтеза ДНК (Кабанова Е.А. и др., 1978).Таблица 19Влияние ПВП и ПАК на эндогенное колониеобразование
в зависимости от дозы н молекулярной массыМолеку¬лярнаяСтимуляция эндогенного колониеобразования (в %) при дозе полиме¬
ра, мг/кгмасса5102050250ПАК3000Не влияетНе влияетНе влияетНе влияетНе влияет16 000Не влияет120110140Не исследовали80 ООО140180260340Токсический эффект100 000150200240Тоже200 ООО200300400ТожеПВП9000Не влияет16015012040 ОООНе влияет200300Не исследовали50 000Не влияет200270Тоже100 ОООНе влияет250300Тоже
250 Глава S. Конъюгированные вакциныНесмотря на существование единого дотимусного предшествен¬
ника, популяция посттимических Т-лимфоцитов в целом характе¬
ризуется весьма выраженной гетерогенностью. «Разветвление» на
субпопуляции начинается в вилочковой железе и завершается на тер¬
ритории периферических лимфоидных органов.В настоящее время все Т-лимфоциты разделены на субклассы
(Т-хелперът по меньщей мере трех подтипов, Т-регуляторные клетки,
Т-эффекторы и др.), для идентификации которых используют раз¬
личные поверхностные маркеры. Следует подчеркнуть, что изуче¬
ние поверхностных антигенов лимфоцитов, относящихся к разным
функциональным субпопуляциям, ведется очень активно многими
исследователями. Идентифицируются новые маркеры, подтверж¬
дается или отвергается существование ранее описанных антигенов,
уточняются и согласуются названия идентичных поверхностных
детерминант и т.п.Хелперные Т-клетки (Т-В-хелперы) помогают В-клеткам продуци¬
ровать антитела к ТЗА, несут на поверхности маркерный антиген CD4,
характеризуются как Т-хелперы второго порядка (Th2). Т-хелперы для
цитотоксических эффекторных клеток имеют на мембране такой же
поверхностный антиген — CD4, но отличаются по продукции цито¬
кинов, активно рециркулируют и относятся к лимфоцитам-хелперам
первого порядка (Thl). Thl7 продуцируют цитокины, не вырабатыва¬
емые Thl или Th2 (интерлейкин-17), помогают клетками миелоидного
ряда в развитии воспаления.Т-инициаторы после предварительной сенсибилизации аллоанти¬
генами, введенные мышам, в отличие от нестимулированных Т-кле¬
ток, мигрируют в региональный лимфатический узел, накапливаются
в нем и взаимодействуют с Т-лимфоцитами, которые потенциально
способны развивать реакции клеточного иммунитета, в частности
реакцию «трансплантат против хозяина».Т-эффекторы ГЗТ при контакте с антигеном привлекают другие
клетки (в частности, моноциты) к участию в развитии реакций ГЗТ,
при которой моноциты дифференцируются в макрофаги, вызыва¬
ющие повреждение ткани. Т-клетки, индуцирующие ГЗТ, взаимо¬
действуют также с базофильными и эозинофильными лейкоцитами,
привлекая их в места развития этой реакции [358]. Например, имму¬
низация многими паразитами ведет к развитию такой формы ГЗТ, при
которой клетки привлекают в места реакции эозинофилы. Все эти
типы клеток, привлекаемые Т-лимфоцитами к участию в ГЗТ, в норме
8.2. Синтетические иммуномодуляторы для вакцин нового... 251не поступают из крови в лимфу и ткани. Т-эффекторы ГЗТ при разви¬
тии иммунологической реакции на поступивший в организм антиген
кооперируют с Т-хелперами.Т-эффекторы цитотоксических реакций или Т-киллеры, как и
эффекторы ГЗТ, маркируются мембранным антигеном CD8, специ¬
фически разрушают клетки-мишени. Мишенями для Т-киллеров
служат опухолевые клетки. Т-киллеры играют важную роль в реакци¬
ях отторжения пересаженных тканей и в противовирусном иммуните¬
те, они убивают инфицированные вирусом клетки, экспрессирующие
на поверхности кодируемые вирусом антигены. Т-регуляторные лим¬
фоциты (фенотип CD4+CD25+ и CD8'^CD28"), контролируя интен¬
сивность развития иммунологических реакций, подавляют функции
Т- и В-клеток.Важным свойством большинства субклассов Т-клеток является их
способность к миграции и рециркуляции в организме. Разработана
специальная экспериментальная модель для изучения миграции
Т-хелперов, пригодная для оценки влияния различных веществ
и воздействий на процессы расселения Т-клеток (Хаитов P.M.,
1975). У облученных в летальной дозе мышей при экранировании
области тимуса происходит репопуляция периферических лимфо¬
идных органов Т-клетками, мигрирующими из него. В 1-е сутки
после облучения эти животные являются практически Т-мышами.
Поэтому иммунизация ТЗА облученных мышей с экранированным
тимусом приводит к незначительному накоплению АОК в селезенке.
Перенос таким мышам В-клеток сопровождается резким повыше¬
нием иммунного ответа за счет кооперации с мигрировавшими в
селезенку тимоцитами. Поскольку накопление АОК в селезенке
облученных реципиентов, получивших стандартную дозу В-клеток,
находится в прямой зависимости от числа Т-хелперов, изменение
миграции тимоцитов приводит к изменению эффекта кооперации
и в конечном счете силы иммунного ответа. Таким образом, если
облученным в летальной дозе мышам экранировать только тимус
и вводить им лимитированную дозу В-клеток, то выход из тимуса
Т-клеток окажется переменной величиной, по которой можно судитьо высоте иммунного ответа.Иначе говоря, накопление АОК при иммунизации ТЗА в данной
модели целиком зависит от интенсивности миграции Т-клеток из
тимуса. Данная модель (рис. 34) используется для изучения влияния
различных веществ на миграцию Т-хелперов,
252Глава 8. Конъюгированные вакцины///800Р\\\/////Л!П\\\ „
////Шй\\\\ Препарат+А +ЭБ и 10^ КМ- +ЭБи107КМ+В +ЭБи107КМ
1__1 ^2 4 6 8
Дни после облучения10Рус. 34. Метод для оценки влияния различных агентов на миграцию Т-лим¬
фоцитов по числу АОК в селезенке;КМ — клетки костного мозга; ЭБ — эритроциты барана; 1 — угнетение миграции;
2 — контроль; 3 — усиление миграцииПопуляция В-лимфоцитов, так же как и Т-лимфоцитов, характе¬
ризуется выраженной гетерогенностью, весьма неоднородна по анти¬
генному и рецепторному составу клеточной поверхности, различается
по функциональной активности.Как известно, предшественники В-клеток образуются из стволо¬
вых элементов у птиц в фабрициевой сумке, а у млекопитающих —
в костном мозгу. В настоящее время накоплено достаточно данных,
свидетельствующих о том, что в костном мозгу образуются предшес¬
твенники В-клеток и происходит их дифференцировка в незрелые
В-клетки. Окончательное созревание В-клеток осуществляется как в
костном мозгу, так и после их расселения в периферических лимфоид¬
ных органах. Аналогом фабрициевой сумки птиц у млекопитающих в
эмбриональном периоде служат кроветворные очаги печени, а в пост-
натальной стадии развития — костный мозг.Все этапы дифференцировки В-клеток являются антиген незави¬
симыми и Т-независимыми. Вместе с тем показано влияние антиге¬
нов внешней среды на пул В-клеток. Так, продукция В-лимфоцитов
снижена у безмикробных животных и усиливается при их контакте
S,2. Синтетические иммуномодуляторы для вакцин нового... 253с антигенами среды обитания (Owen 1980). Антигензависимыйэтап дифференцировки В-клеток с превращением их в плазматиче¬
ские клетки — продуценты антител — начинается после их контакта с
антигеном и может быть Т-зависимым и Т-независимым в зависимос¬
ти от природы антигена.Миграция из костного мозга и расселение в периферические
лимфоидные органы В-клеток являются важным этапом в развитии
иммунного ответа. Разработана специальная модель для изучения
миграции и расселения В-клеток из костного мозга (Хаитов P.M.,
1975), в которой использовано летальное облучение мышей при экра¬
нировании участка костного мозга. После такого облучения единс¬
твенным источником расселяющихся В-клеток является защищен¬
ный участок костного мозга. Поэтому у животных с экранированным
участком костного мозга в течение первых 7—10 дней после облучения
содержатся практически только В-клетки, расселяющиеся из защи¬
щенного участка, т.е. эти особи являются В-мышами. О миграции
в селезенку В-клеток можно судить по конечному накоплению АОК
при введении «экранированным» мышам стандартного количества
Т-клеток. Таким образом, при переносе облученным с экранирован¬
ным участком костного мозга мышам лимитированной дозы Т-клеток
усиление или уменьшение накопления АОК будет зависеть только
от интенсивности миграции В-клеток из экранированного костного
мозга в селезенку. Данная модель используется для изучения влияния
различных веществ на миграцию В-клеток из костного мозга (рис. 35).
Переселение Т-лимфоцитов из тимуса, а В-лимфоцитов из костного
мозга в селезенку и лимфатические узлы является важнейшим этапом
в генезе иммунной реакции. Именно в селезенке и лимфатических
узлах эти клетки дозревают и оказываются способными распознавать
чужеродный антиген и дифференцироваться в эффекторные клетки,
способные специфично элиминировать этот чужеродный агент по¬
средством специфических антител или других механизмов.Проведенное нами изучение миграционных процессов при вве¬
дении в организм иммуностимулирующих доз полиионов показало,
что синтетические полимерные адъюванты могут значительно интен¬
сифицировать процессы переселения Т- и В-лимфоцитов из цент¬
ральных в периферические органы иммунной системы (Петров Р.В.
и др., 1974; Хаитов P.M. [166]). Причем и полианионы, и поликатионы
усиливали миграцию как Т-клеток из тимуса, так и В-клеток из кос¬
тного мозга (табл. 21, 22). Эти данные были подтверждены в работе
254Глава 8. Конъюгированные вакцины/¡ш\т\\\///öPflPAW
//////ilU\\\
/////#^\\\\Препарат+ЭБи2*107кт+ЭБи2'107КТ+В +ЭБи2Ю7КТ
t i ^2 4 6 8Дни после облученияРис. 35. Метод для оценки влияния различных агентов на миграцию В-лим¬
фоцитов по числу АОК в селезенке:КТ — клетки тимуса. Остальные обозначения те же, что на рисунке 34A.C. Van der Ham и соавт. (1977), использовавших полианионы — поли-
метакриловую кислоту и декстан-сульфат (ДС). Авторы обнаружили
увеличение числа циркулирующих в кровотоке стволовых крове¬
творных клеток, Т- и В-лимфоцитов у мышей, получивших инъекцию
полианиона.А.М. Нажмитдинов и соавт. (1978) показали, что нетоксичные
сополимеры акриловой кислоты (АК) и N-ВПД (NA-5, NA-6) тоже
существенно стимулировали миграцию Т-лимфоцитов из тимуса и
В-клеток из костного мозга (рис. 36 а, 6).Таким образом, в результате введения в организм синтетических
полиэлектролитов усиливалась миграция Т-клеток из тимуса и В-кле¬
ток из костного мозга в селезенку. Именно в селезенке оба типа кле¬
ток, взаимодействуя, формируют антительную реакцию на антиген,
т.е. процессы миграции обеспечивают первое необходимое условие
взаимодействия Т- и В-клеток в антителогенезе — их пространствен¬
ное объединение (сближение) в пределах ткани селезенки. Второй
этап взаимодействия — функциональная Т-В-кооперация — зависит
от секреторной активности Т-клеток и акцепторной способности
8.2. Синтетические иммуномодуляторы для вакцин нового...255АОК7000500030001000*АОК70005000
3000
1000 -К12345678К1 2345678Рис. 36. Влияние полиэлектролитов и ПАФ на миграцию Т-клеток из тимуса
(а) и В-клеток из костного мозга (б):К - контроль; 1 - ПВП; 2 - ПАК; 3-П- N-ВПД; 4 - NA-!; 5 - NÁ-3; 6 -NA-5;
7 — NA-6; 8 — ПАФ. По оси ординат — число АОК на селезенкуВ-клеток. Для экспериментального исследования функциональной
Т-В-кооперации относительно давно утвердились и стали традицион¬
ными вполне определенные методические модели.Необходимость кооперации Т-хелперов с В-клетками для про¬
дукции антител была полностью осмыслена в 1969 г. (Claman H.N.,
Chaperon Е.А., 1969; Davies A.J.S., 1969; Miller J.F.A.R, Mitchel G.R
[607]). Однако еще в 1966 г. P. Claman и соавт. [319] показали, что про¬
исходящие из тимуса лимфоциты способны синергически взаимо¬
действовать с лимфоцитами костного мозга при гуморальном иммун¬
ном ответе на ЭБ. В этих экспериментах перенос смеси клеток тимуса
и костного мозга летально облученным мышам, иммунизированным
ЭБ, сопровождался накоплением намного большего числа АОК, чем
при простом суммировании их количеств, образующихся при раз¬
дельном переносе костномозговых или тимусных клеток.Однако смысл кооперации клеток тимусного и костномозгового
происхождения оставался еще неясным. Также было неизвестно, какие
256Глава S. Конъюгированные вакциныфункции выполняют клетки тимусного (Т) и костномозгового (В)
происхождения при кооперации. И только в серии блестящих работ
J.F.A.R Miller и его сотрудников (1968) [606,609] была установлена конк¬
ретная роль лимфоцитов тимусного и костномозгового происхождения
в иммунном ответе. Основной смысловой результат этих эксперимен¬
тов — АОК происходят из костномозговых клеток, а клетки тимуса
выполняют вспомогательную роль. Позднее эта роль Т-хелперов была
конкретизирована, изучены механизмы их взаимодействия с В-клет-
ками. Несмотря на усложнение наших познаний о Т-В-кооперации,
экспериментальная модель J.RA.R Miller остается гюлезной и в наши
дни. С ее помощью можно оценивать эффективность Т-В-кооперации в
первом приближении, не вычленяя элементы взаимодействующих кле¬
ток. Используя эту экспериментальную технику, мы изучили влияние
полиэлектролитов на антителогенез в организме летально облученного
реципиента, восстановленного сингенными Т- и В-клетками.Из данных таблицы 21 видно, что введение реципиентам, полу¬
чившим смесь Т- и В-клеток, ПВП (ММ 100 тыс. Д) или ПМВП (ММ
50 тыс. Д) приводит к пятикратному увеличению числа АОК, а ПАК
с молекулярной массой 50 тыс. и 80 тыс. Д повышает число АОК соот¬
ветственно в 1,5 и 3,4 раза (Петров Р.В. и др., 1974 [126]; Хаитов P.M.,
Батырбеков A.A. [183]). ПАК с молекулярной массой 3 тыс, Д и ПВП
с молекулярной массой 6 тыс. и 8 тыс, Д в дозе 50 мг/кг не влияли на
Т-В-кооперацию. Введение ПВП с молекулярной массой 40 тыс. Д
в очень большой дозе (250 мг/кг) увеличивает число АОК у реципи¬
ентов, получивших смесь Т- и В-клеток, в 2-3 раза (Хаустова Л.И.,
1981). Полиионы в разной степени усиливают продукцию АОК в селе¬
зенке реципиентов, получивших только клетки костного мозга, т.е. в
условиях Т-клеточного дефицита, и не влияют на этот процесс у живот¬
ных, инъецированных только тимоцитами. Последнее легко объяс¬
нимо, поскольку у таких реципиентов отсутствуют предшественники
АОК. Максимальное усиление иммунного ответа при введении поли-
электролитов наблюдается при переносе смеси Т- и В-лимфоцитов.
Таким образом, поликатионы ПВП и ПМВП, а также полианион ПАК
значительно интенсифицируют процессы кооперативного взаимодейс¬
твия Т- и В-клеток при иммунном ответе. Сополимеры АК и N-ВПД
тоже заметно стимулировали Т- и В-коопсрациго; причем наименее
токсичные NA-5 и NA-6 оказывали наибольшее стимулирующее дейс¬
твие. Индексы кооперации после введения NA-5 и NA-6 достигали,
соответственно, 25 и 30 по сравнению с 10 в контроле без адъюванта.
8.2. Синтетические иммуномодуляторы для вакцин нового...257Таблица 21Влияние ПВП и ПАК на кооперацию Т- и В-лимфоцитов в иммунном ответеКоличество введенных
клеток (х10^)костногомозгатимусаПолиэлек¬
тролит,
50 мг/кгМолеку¬лярнаямассаКоличество
АОК в селе¬
зенкеДовери¬
тельный
интервал
(Р <0,05)101010101010101010102020202020202020ПВППМВППАКПАКПВППАКПВППМВППАКПАК100 ООО
50 ООО
5000
80 000100 ООО
5000100 ООО
50 ООО
5000
80 ООО19,2±3,237,2±4,037,0±2,092,6+23,3319,8±27,732,2+5,116,9±1,89Д±2,42би±28,61266,0±242,01160,0±74,03868,0+676,0896,0+95,012,35x26,026,9x47,533,0x42,018,6x166,6251,9x387,721,7x42,712,65x21,13,5x14,6202,0x320,0644,0x1888,01000,0x1319,02306,6x5429,0632,0x1160,0Следует подчеркнуть, что полиионы при введении их летально
облученным реципиентам, защищенным только клетками костного
мозга (В-мыши) и иммунизированным ЭБ, повышают иммунный
ответ. Иначе говоря, полимеры способны в какой-то мере компенси¬
ровать дефицит Т-хелперов, по-видимому, прямо активируя В-клетку,
Причем ниже будет показано, что полианионы (например, ПАК или
ДС) активируют В-клетки, а поликатионы — к тому же и Т-клетки
(конечно, при их наличии).Для изучения кооперации Т- и В-клеток в иммунном ответе
используюгся различные модели in vivo и in vitro, эксперименты про¬
водят на инбредных животных, преимущественно грызунах. Опыты
по изучению Т-В-взаимодействия у крупных животных можно было
проводить только in vitro.Описана модельная система для оценки взаимодействия Т- и
В-клеток гп situ, которая отличается простотой, не требует инбредных
животных и, по-видимому, может быть воспроизведена на любом виде
животных (Хаитов P.M., 1975). Этот же прием Р.В. Петров и соавт.
258Глава 8. Конъюгированные вакцины(1978) использовали при разработке способа учета Т-В-взаимодейс¬
твия у крупных животных (в частности, собак).Собакам производили операцию выведения селезенки в подкож¬
ный карман, что позволяло пунктировать орган для определения
числа АОК в различные сроки после иммунизации. Через 2—4 нед
после операции животных облучали в дозе 600 Р с экранированием
либо тимуса, либо костного мозга задних конечностей, либо при сов¬
местном их экранировании. После облучения собакам вводили ЭБ и в
пунктатах селезенки на 3-14-е сутки после иммунизации подсчиты¬
вали число АОК.Значительное накопление АОК в селезенке было только при
совместном экранировании тимуса и костного мозга, что отра¬
жает эффект кооперации Т- и В-лимфоцитов в иммунном ответе.
Эта модельная система была использована для изучения влияния
сополимера NA-5 на кооперацию Т- и В-лимфоцитов в организме
облученных собак (Нажмитдинов А.М., 1981). Из данных табли¬
цы 22 видно, что лолианион NA-5 значительно усиливает эффект
Т-В-кооперации у собак, облученных с экранированием области
тимуса и костного мозга.Таблица 22Влияние сополимера NA-5 на кооперацию Т- и 6-лимфоцитов in situ у собак,
облученных в смертельной дозе и иммунизированных ЭБЭкранированныйучастокNA-5ЧисложивотныхЧисло АОК на 10* клеток селезен¬
ки на 7-е сутки после облученияТимус-245,2Костный мозг-286,0Тимус + костный мозг-2732,0Тимус+371,0Костный мозг+3165,5Тимус + костный мозг-ь31459,0Замещение хелперного сигнала Т-клеток. В связи с предположени¬
ями о прямом влиянии полиэлектролитов на В-клетки интересны
специальные эксперименты, проведенные нами на так называемых
В-мышах, которые практически не содержат Т-клеток.Тимэктомированным мышам через 8 сут после летального облу¬
чения и переноса клеток костного мозга одновременно с антигеном
8.2. Синтетические иммуномодуляторы для вакцин нового,.. 259вводили ПВП и ПАК в дозе 50 мг/кг (ММ, соответственно 100 тыс.
и 80 тыс. Д), иммунизировали их ЭБ и определяли количество АОК
в селезенке (Петров Р.В. и др. [126]). Показано, что В-мыши практи-
чеси не способны к развитию иммунного ответа на ЭБ, что связано с
дефицитом у них Т-лимфоцитов. Введение В-мышам ПВП или ПАК
приводит к развитию заметного иммунного ответа, в селезенке обра¬
зуется соответственно в 17 и 27 раз больше АОК (около 528 и 815 АОК,
30 АОК в контроле, р <0,001). В другой серии экспериментов полимер
вводили В-мышам одновременно с переносом клеток костного мозга,
а иммунизацию проводили через 7 и 14 сут. Максимальное увеличение
(в 7,5 раза) иммунного ответа наблюдалось при иммунизации через
14 сут после введения ПВП (1744 АОК, 229 АОК в контроле). Ранее
было установлено, что введение В-мышам синтетических полиионов
ДС и ПАК значительно повышает продукцию IgM- и TgG-антител
(Diamantstein Т, et al., 1971).Анализируя эти данные, можно прийти к следующему выводу.
Полианионы и поликатионы вызывают выраженное увеличение
продукции АОК в смешанных культурах in vivo Т- и В-клеток,
однако иммунный ответ в культурах В-клеток также повышается.
Следовательно, целесообразно говорить о двух уровнях действия
этих полиионов: усиления синтетическими полиэлектролитами
кооперативных взаимодействий Т- и В-лимфоцитов и индукции
под их влиянием антигензависимого превращения В-лимфоцитов
в АОК.Результаты экспериментов на Т-дефицитных животных с поли¬
электролитом NA-5 тоже указывают на возможность прямой актива¬
ции В-лимфоцитов (Нажмитдинов А.М. и др., 1980). Эксперименты
проводили с тимэктомированными (дефицит Т-клеток) мышами
или с мышами после тимэктомии, летального облучения и вос¬
становления сингенными клетками костного мозга (В-мыши).
Определяли продукцию АОК, специфичных к антигенам гетеро-
логичных эритроцитов. Введение NA-5 почти полностью восста¬
навливало заметно сниженный иммунный ответ Т-дефицитных
мышей, т.е. действие данного полимера способно компенсировать
функцию Т-клеток при иммунном ответе (табл. 23). В-мыши,
т.е. животные с тотальным дефицитом Т-лимфоцитов, который
распространяется на все классы Т-клеток, практически не способ¬
ны к иммунному ответу на ЭБ. Введение В-мышам NA-5 значитель¬
но повышало иммунный ответ.
260Глава 8. Конъюгированные вакциныТаблица 23Влияние NA-5 на иммунный ответ на ЭБ мышей (СВАхС57ВЬ)Р] с различной
степенью искусственного Т-дефицитаОпытЧисложивотныхЧисло АОК на селезенку
Мгеом ± 99% 1р (р ^ ,001)Нормальные мыши + ЭБ
Тимэктомированные мыши + ЭБ
Тимэктомированные мыши + ЭБ +
+ NA-5178 237,8 (150 314,0-211 348,9)
19 408,8 (13 722,0-27 352,6)101 157,9 (70 307,2-145 545,9)Нормальные мыши + ЭБ
В-мыши + ЭБ
В-мыши +ЭБ + NA-554 827,6 (43 651,5-68 865,2)
282,4 (171,0^466,6)
4225 (3 334,2-5 432,5)В таблице 24 приведены данные о влиянии NA-5 на первичный
и вторичный иммунный ответ у мышей nude. В этих опытах мышей
иммунизировали ЭБ в дозе ЗхЮ'’, вводили NA-5, через 14 дней имму¬
низировали ЭБ повторно в дозе 2x10^ На 14-е сутки после первичной
иммунизации в селезенке определяли продукцию IgM-AOK, а после
вторичной иммунизации — IgM- и IgG-AOK.Мыши nu/nu продуцируют весьма незначительное по сравнению
с нормальными животными количество IgM-AOK после первичной
иммунизаиии и практически не способны ко вторичному ответу.
Введение мышам nu/nu NA-5 многократно повышает продукцию
ígM-AOK при первичном ответе, а также количество IgM- и IgG-AOK
при вторичном иммунном ответе. Известно, что синтез IgG-антител,
в отличие от продукции IgM-антител, полностью тимуснезависимый
(Basten А., Howard J.C., 1973) [478]. Следовательно, можно предполо¬
жить, что действие NA-5 способно замещать функцию Т-клеток, обес¬
печивающих переключение синтеза IgM на IgG. Однако для оконча¬
тельного вывода требуются специальные исследования.Таким образом, введение мышам с искусственно вызванным или
генетически обусловленным Т-дефицитом синтетических полиэлек-
тролитов компенсирует недостаток Т-лимфоцитов хелперного типа.
Наконец, получены данные о том, что полиэлектролиты способ¬
ны непосредственно активировать В-клетки, вызывая их деление
и дифференцировку в антителообразующие клетки. Р,В. Петров и
соавт. [128] исследовали способность полиэлектролитов активировать
синтез антител В-лимфоцитами к ряду антигенов. Как показано на
8.2. Синтетические иммуномодуляторы для вакцин нового.,.261Таблица 24Влияние NA-5 на первичный и вторичный иммунный ответ на ЭБ у генетическибестимусных мышей nudeМышиВведе¬ниесопо¬лиме¬раЧисло АОК на селезенку, М^есы. +99% 1р (р^0,001)Первичный ответЧисломышейIgM-AOKВторичный ответЧисломышейIgM-AOKIgG-AOKC57BL/6nu/nu наосновеC57BL/6nu/nu наосновеC57BL/6СВАnu/nu наосновеСВАnu/nu наосновеСВА10101014 655,4(10 шм19 678,8)
401,2
(199,3-
924,3)
3741,1
(2398,8^
5834,4)
38309,0
(27856,4+
51044,8)
663,7
(472,0^
933,2)
6208,6
(3920,0-
9 840,0)10101137 325,0
(33496,5-4159.0)
891,2(599,3-1324.3)6324.1
(5128,6-7798.3)
107 894(95 087,3-
122433,4)2212.2
(1 306,0-3790.0)
12 345,0
(7783,0-
19 580,0)22 732,3
(20 882,8-
24 447,4)
663,7
(472,0-
933,2)
4255,9
(334,2-
5432,5)
60117
(57 942,8-
62373,4)
881,0
(507,5-
1 466,0)
6137,6
(3863,0-
9749,8)рисунке 37, при введении ЛПС, ПАК, ПВП, КА-З или NA-5 ин¬
тактным мышам происходит поликлональная активация В-клеток и в
селезенках животных накапливаются АОК различной специфичнос¬
ти. Так, на 4-е сутки выявляются АОК, вырабатываюшие антитела к
ЭБ, эритроцитам осла (ЭО), лошади (ЭЛ) и ТИФ, количество которых
в несколько раз превышает фоновое.Итак, использованные полиэлектролиты индуцируют трансфор¬
мацию разных клонов В-клеток в АОК, т.е. являются активаторами
В-лимфоцитов. Процесс активации В-клеток под влиянием синте¬
тических полиэлектролитов является Т-независимым. Как видно из
рисунка 38, при введении МА-5 в селезенках нормальных мышей и
262Глава &. Конъюгированные вакциныАОК2500200015001000500Js’V■ ч*-'.к
'i ик 1.l-s¿■4АОК1100090007000500030001000IГ'*?гГ-к 68 9Рис. 37. Число анти-ЭБ (а) и анти-ТНФ (б) АОК в селезенке мышей при введе¬
нии ЛПС (1), ПАК (2, 6), ПВП (3, 7), NA-3 (4, 9), NA-5 (5, 8):К — фоновый уровень АОК к каждому использованному тест-антигену. По оси орди¬
нат — число АОКмышей nude накапливается приблизительно одинаковое число АОК
против ЭБ и ТНФ. Количество анти-ЭБ- и анти-ТНФ-АОК, форми¬
рующихся в селезенках летально облученных мышей, защищенных
только клетками костного мозга (В-мыши) или смесью клеток
костного мозга и Т-клеток (восстановленные Т + В мыши), также
было одинаковым.Влияние полианионов и поликатионов на субклассы лимфоцитов.
Прямые данные о симулирующем влиянии полиионов на субклассы
лимфоцитов удалось получить в экспериментах на суспензионных
культурах лимфоцитов in vitro (Петров Р.В. и др., 1982; Хаитов P.M.,
Атауллаханов Р.И., 1982; Хаитов РМ. и др. [182]).В этих экспериментах мы использовали культуры клеток селе¬
зенки мышей с низкой клеточной плотностью — 10^-5x10^ клеток в
1 мл. в инициальный момент инкубирования в культуры добавляли
ПАК (ММ 80 тыс. Д) в концентрации 0,1-200 мкг/мл. Спустя 40-44 ч
в культурах определяли содержание лимфобластов (диаметр клеток
более 14-15 мкм), т.е. лимфоцитов, вступивших в стадию клеточно¬
го роста в цикле деления. По-видимому, в виде бластов определя¬
лись лимфоциты, находящиеся в поздних ОгЗ-Сг-фазах клеточного
U. Синтетические иммупомоіу„^^нового...263■*^^ 4 5 6 7Рис. 38. Способность NA-5 индуципот*яг^ n
В-лимфоцитов в анти-ЭБ (а) и а„ти тил/"/,<? - фоновый уровень АОК в селезен!.^ « ^ Т-дефицитных мышей:этим мышам NA-5; 3,10 - нисло АОК ~ введении\1Л А J. ^ ® <^ШЗеикеполучивших NA-5; 4 — фоновое число АОКмышеи с нормальным тимусам,
наем NA-5; 6— фоновое число АОК в се^ ^ В~мышеи; 5 — тоже с введе-лимфатических узлов; 7-то же г °^ьшей, получивших 5х1(Р Т-клеток^^^<=^^едениемШ-5. По оси ординат-число АОКцикла. В этих же культурах онрииоо...по включению ЧН]'Тимидина. интенсивность синтеза ДНКВ присутствии ПАК (200-500 мкг/ма^ . х,
число бластных форм лимфопитпп культурах увеличиваетсяз[Н]-тимидина,добавленио;овпДозы ПАК более I тыс. инкубирования (рис. 39).Интересно, что активирующее дейст^Ггр клеток,пересчете на культуру, чем на 10^ нкт более выражено приловлено увеличением числа клеток™"вследствие активации их деления итт ^ ПАК, по-видимому,Трансформацию клеток и синте. жизнеспособности,сительно слабо (величина коэЛЛипм ^ активировала отно-что могло быть связано с небольти стимуляции в пределах 2),
реагирующих делением на клеток-мишеней,была использована не самая оптим^і исключено также, чтоклетки селезенки. имальная схема воздействия ПАК на
264Глава 8. Конъюгированные вакциныС, мкг/млРис. 39. Зависимость эффекта активации синтеза ДНК (л:) и бласттрансформадии
лимфоцитов {о) от концентрации ПАК в обогащенной культуральной среде;
Интенсивность включения ^[Н]-тимидина в ДИК оценивали в период между
40~44~м часом после добавления ПАК. Содержание больших лимфобластов под¬
считывали через 44 ч культивирования. 1 — «фон» (без ПАК); 2 — с ПАК. По оси
ординат - коэффициент стимуляции включения ^(Н]-тимидина (слева) и содер¬
жание лимфобластов в процентах от общего числа живых клеток (справа). По оси
абсцисс — концентрация ПАК в культуреАнализ митогенного действия ЛПС, КонА и ПАКТаблица 25АктиваторКоэффициент стимуляции синтеза ДНКВ расчете на
культуруСреднееВ расчете на
10^ выживших
клетокСреднееЛПС2,53,32,62,65(20-50 мкг/мл)3,02,64,33,23.23,02,92,23,52,52,72,03,42,83,22,53,52,83,252,54,13,5
Н.2. Синтетические иммуномодуляторы для вакцин нового...265Окончание табл. 25АктиваторКоэффициент стимуляции синтеза ДНКВ расчете иа
культуруСреднееВ расчете на
10^ выживших
клетокСреднееКонА5,04,13,83,0(2-5 мкг/мл)4,43,53,02,14,73,23,42,54,53,0ПАК1,61,91,61,76(ММ80ТЫС.Д,2,22,0200—500 мкг/мл)1,81,51,91,62,11,81,91,92,251,72,42,02,01,71,81,81,91,9ПАК2,32,11,61,7(ММ 16 тыс. Д,2,01,7200-500 мкг/мл)2,31,92,11,61,841,61,91,7ЭПВПБ2,42,41,82,1(ММ 150 тыс. Д,2,62,21-10 мкг/мл)2.12,02,32,12,82,42,42,12,92,0Примечание. Коэффициенты стимуляции синтеза ДНК в ответ на митогены могут
быть существенно выше при некотором изменении условий эксперимента. Однако и в
этом случае для полиэлектролитов коэффициенты стимуляции были в 2—4 раза ниже,
чем для КонА или ЛПС (например, для ПАК — 1, а для КонА — 30).
266Глава 8, Конъюгированные вакциныКМинутыЧасыРис. 40. Зависимость митогенного эффекта от времени экспозиции клеток в
присутствии ПАК:Использована оптимальная митогенная доза ПАК, равная 500 мкг/мл. / — уровень
включения ^¡Н]-тимидина в контрольных культурах клеток селезенки, не содержа¬
щих ПАК (-¡¡фон»); 2—в присутствии ПАК. По оси ординат — коэффициент стиму¬
ляции бласттрансформации (о) и включения ^[Н]-тимидина (х)В процессе установления оптимального времени воздействия ПАК
на клетки выявлено следующее (рис. 40). Максимальная при действии
ПАК стимуляция синтеза ДНК и бласттрансформации наблюдались,
если вещество находилось в культуре клеток не более чем 30 мин,
а затем клетки отмывали центрифугированием в большом объеме
сбалансированного солевого раствора Хэнкса. Увеличение времени
действия ПАК на клетки до 2 ч приводило к значительному снижению
синтеза ДНК, а более 2 сут — даже к угнетению клеточной пролифера¬
ции. В последнем случае синтез ДНК оказался ниже, чем в контроль¬
ных культурах, не содержащих ПАК. При этом угнетение данного
процесса не было связано со снижением жизнеспособности клеток.Хорошо известна высокая вероятность образования комплексов
ПАК с различными белками в изотонических растворах. В связи с
этим можно было полагать, что при внесении ПАК в обогащенную
культуральную среду, содержащую 10% эмбриональной телячьей
8.2. Синтетические иммуномодуляторы для вакцин нового...267КС, мкг/млРис. 41. Изменение характеристики доза ПАК-миТ01 енный эффект в зави¬
симости от присутствия в культуральной среде эмбриональной телячьей
сыворотки (ЭТС):Митогенная реакция учитывалась спустя 40—44 ч после воздействия ПАК.
1 — «фон»; 2 — без ЭТС; 3 — с ЭТС. По оси ординат — коэффициент стимуля¬
ции включения ^¡Н]-тимидина (о) и бласттрансформации лимфоцитов По оси
абсцисс — то же, что на рисунке 39сыворотки, произойдет комплексообразование между ПАК и белка¬
ми сыворотки. Учитывая возможность активации клеточного деле¬
ния в течение 10—30 мин (см. рис. 40), мы получили характеристики
пролиферативного ответа клеток на ПАК в отсутствие белкового ком¬
понента среды при добавлении полимера (Хаитов P.M., Атауллаха¬
нов Р.И., 1982; Петров Р.В. и др. [119]). Для этого в суспензию клеток
селезенки в среде 199 добавляли ПАК в различных концентрациях,
затем 2-3 раза отмывали клетки большим объемом среды 199. После
этого их помещали в обогащенную культуральную среяу.Оказалось, что оптимальные митогенные дозы ПАК, установленные
при ее воздействии в присутствии эмбриональной телячьей сыворотки,
были токсичными для клеток при воздействии ПАК в отсутствие сыво¬
ротки (рис. 41). Оптимальная митогенная концентрация ПАК в отсутс¬
твие сыворотки уменьшалась более чем на порядок, при этом несколько
268Глава 8. Конъюгированные вакциныМинутыЧасыРис. 42. Зависимость митогенного эффекта от времени экспозиции клеток п
присутствии ПАК в бессывороточной среде:/ — -»фон», использованы оптимальные митогенные концентрации ПАК; 2— в бессы¬
вороточной среде, 50 мкг/мл; 3 среде с ЭТС, 500мкг/мл. По оси абсцисс — время
действия ПАК на клетки ш уЬго; по оси ординат — коэффициент стимуляции вклю¬
чения ^[Н]-тимидинаусиливался и сам эффект (величины коэффициентов стимуляции бласт-
трансформации и синтеза ДНК около 2,5—2,8). Вместе с тем при действии
ПАК в отсутствие сыворотки более отчетливо проявлялось оптимальное
время активации (рис. 42). Увеличение времени действия ПАК (при кон¬
центрации 50 мкг/мл) на клетки более 30 мин уже приводило к отчетли¬
вому ингибированию реакции, а более 60 мин — даже к гибели клеток.Таким образом, полу^1енные данные свидетельствуют об активи¬
рующем действии ПАК на синтез ДНК в клетках селезенки ш vitro.
Конечно, вопрос о том, стимулируется ли синтез ДНК в уже «запущен¬
ных» клетках или он активируется в ранее покоившихся клетках, может
быть решен при прямом определении числа клеток, вступающих в
S-фазу (с помощью радиоавтографи и). Однако наблюдается увеличение
числа клеток, проходящих стадию роста в цикле клеточного деления,
иначе говоря, повышение числа лимфобластов. Это, по-видимому,
свидетельствует о выходе в цикл деления клеток, ранее покоившихся
(во всяком случае в начальную стадию клеточного роста, G-фазу).
Н.2. Синтетические иммуномодуляторы для вакцин нового...269Кинетика активации синтеза ДНК под действием ПАК была срав¬
нена с кинетикой синтеза ДНК в клетках, подвергнутых действию
традиционных митогенов ~ ЛПС или КонА (Петров RB. и др. [П9]).Под действием ЛПС из Е. соИ (в концентрации 20-50 мкг/мл) син¬
тез ДНК начинал заметно активироваться уже через 16-18 ч после
добавления митогена. Приблизительно в это же время можно было
»арсгистрировать начало S-фазы и у клеток, отвечающих на КонА
(в концентрации 2-4 мкг/мл). Достоверное нарастание синтеза ДНК
под действием ПАК обнаружилось несколько позже, между 22 и 26 ч
после обработки митогенами. В дальнейшем динамика пролифератив-
ной реакции в целом была сходной при использовании всех трех аген-
I ов (рис. 43). Однако на основании данных об интенсивности включе-хЮ"* имп/мин
2.0х10^ имп/минРис. 43. Кинетика активации синтеза ДНК после воздействия на клетки
митогенных доз ПАК (2), ЛПС (3) или КонА {4)\/ _ интенсивность включения ^[Н]-тимидина в контрольных (без митогена) культу¬
рах. Клетки селезенки инкубировали с митогеном 10-30 мин, несколько раз отмыва¬
ли центрифугированием в среде 199, после чего помещали в обогащенную культураль¬
ную среду Интенсивность синтеза ДНК оценивали по включению ^[Щ-тимидина,
добавленного в культуры за 4 ч до момента анализа. По оси абсцисс — время инкуби¬
рования от момента активации; по оси ординат — включение ^[Щ-тимидина
272Глава S, Конъюгированные вакциныМы не случайно столь подробно остановились на описании мито¬
генного действия ПАК в модели in vitro. Все характерные признаки и
условия активации синтеза ДНК в клетках, присущие ПАК, харак¬
терны и для других полиионов. Все испытанные нами полиионы —
относительно слабые митогены (точнее активаторы синтеза ДНК),
их действующая концентрация ш vitro зависит от присутствия в среде
свободного белка; оптимальными для активации клеток являются
кратковременные воздействия. Кинетика клеточной реакции (синтез
ДНК) значительно отличается от таковой при ответе на КонА или
ЛПС. Активация синтеза ДНК длится относительно недолго: начав¬
шись около 20-24 ч после инициации процесса, она быстро заканчи¬
вается через 48 ч.Представленные данные позволяют заключить, что под влия¬
нием полииона клетки совершают не более одного цикла деления.
Напротив, после активации КонА или ЛПС клетки совершают не
менее 3-4 последовательных циклов деления.При исследовании влияния полиионов на субпопуляции клеток —
Т-, В-лимфоцитов и макрофагов — мы установили, что полиионы
(например, ПАК) могут активировать синтез ДНК в В-клетках, но
не влияют на отдельные формы Т-клеток (Хаитов P.M., Атауллаха¬
нов Р.И., 1982). Поликатионы могут активировать синтез ДНК как в
Т-, так и в В-клетках. Причем во всех случаях активация синтеза ДНК
в лимфоцитах значительно зависела от присутствия макрофагов. Без
макрофагов этот процесс был резко снижен. Такое обстоятельство
напоминает хорошо известные данные о двух последовательных
сигналах при активации синтеза ДНК в лимфоцитах с помощью
фитогемагглютинина (ФГА) (Waksman В,, Wagshal A.B., 1978 [830]).
Показано, что под влиянием ФГА покоящиеся Т-лимфоциты выхо¬
дят в фазу клеточного роста и подготовки синтеза ДНК (т.е. переход
Go->G]), но собственно синтез ДНК (переход Gj-^S) может акти¬
вироваться лишь между 12—16 ч после первого сигнала с помощью
специального, второго сигнала. Этот сигнал, вырабатываемый макро¬
фагами и воздействующий на Т-клетку через мембранный рецептор,
который функционально ассоциирован с гуанилатциклазой, был
назван авторами лимфоцитактивирующим фактором (Lymphocyte
activating factor), а впоследствии интерлейкином-1.Активация полиионами хелперных функций макрофагов. Как отме¬
чено выше, при активации полиэлектролитами синтеза ДНК в лим¬
фоцитах весьма существенную роль играют макрофаги. В дальнейших
s.2. Синтетические иммуномодуляторы для вакцин нового... 273жспериментах нам удалось установить, что адъювантное действие
полииона может реализовываться, хотя и не в полной мере, через
непосредственную активацию макрофагов (Петров Р.В. и др., 1982,
1983). В условиях культуры клеток селезенки in vitro индуцировали
иммунный ответ против антигенов ЭБ, На оптимальные дозы анти-
гена ответ достигал 1 тыс. АОК на 10^ выживших клеток через 4 сут
культивирования. На субоптимальные дозы антигена ответ был сни¬
жен в 4-5 раз (около 200 АОК на 10^* живых клеток). Кратковременная
предварительная обработка клеток селезенки полианионом (ПАК)
приводила к значительной стимуляции иммунного ответа в систе¬
ме. Образовывалось до 2000—2500 АОК в ответ на оптимальную дозу
антигена и до 1000-1200 АОК — на субоптимальную дозу. Если из
суспензии клеток селезенки до начала культивирования удаляли мак¬
рофаги либо с помощью каррагинана, либо путем двукратной адсор¬
бции на пластике, то ответ истощенной клеточной популяции (смесь
Т- и В-клеток) был резко снижен. После удаления макрофагов клетки
селезенки в ответ на оптимальную дозу антигена продуцировали
120-150, а на субоптимальную ~ 80-100 АОК. Ответ лимфоцитов
на антиген увеличивался до 600-800 АОК после внесения в «исто¬
щенную» суспензию клеток, снятых с пластика. Если прилипающие
к пластику клетки кратковременно экспонировали с адъювантной
дозой ПАК (20-50 мкг/мл), а затем 3 раза отмывали центрифугиро¬
ванием в большом объеме сбалансированного солевого раствора, то
такие клетки могли усиливать ответ «истощенной» суспензии обра¬
зованием до 1500-1600 АОК, т.е. прямым воздействием полианиона
на макрофаги удавалось получить заметную активацию лимфоидных
клеток на антиген. Мы предполагаем, что при этом могли активиро¬
ваться такие функции макрофагов, как фагоцитоз корпускулярных
частиц антигена, а также синтез и секреция растворимых факторов
типа интерлейкина.Функции макрофагов в иммуногенезе сложны и многообразны.
Их сложность определяется особенностями метаболизма и разнооб¬
разием функциональных свойств одиночной мононуклеарной клетки,
способной к паттерному распознаванию чужеродности, фагоцитозу,
представлению пептидов фрагментированного ею антигена Т-хелпе-
рам, рецепции многих регуляторных факторов, синтезу и секреции
ряда иммунорегуляторных медиаторов.Мы изучали некоторые функции макрофагов, непосредственно
относящиеся к процессу «обучения» и активации лимфоцитов. Для
274 Глава 8. Конъюгированные вакциныразвития иммунного ответа на ТЗА необходимы участие и взаимодейс¬
твие не только антигенспецифических хелперных Т-клеток и антиген¬
специфических В-клеток, но и макрофагов, которые играют сущест¬
венную роль как в гуморальном, так и в клеточном иммунном ответе.
Макрофаги участвуют в инициации и регуляции иммунного ответа
(Rosenthal A.S., 1978) [812]: перерабатывают и представляют анти¬
ген для стимуляции Т-клеток при иммунном ответе; для индукции
Т-лимфоцитарной пролиферации требуется их контактная ассоциация
с макрофагами, несущими антиген; макрофаги относятся к клеткам,
на которых экспрессируются гены иммунного ответа; они несут неко¬
торые мембранные рецепторы, такие, как рецептор к Fc-участку моле¬
кулы иммуноглобулина, который усиливает разрушение и фагоцитоз
неинфекционных агентов при вторичном ответе; секретируют био¬
логически активные молекулы, влияющие на развитие афферентных
звеньев иммунного ответа и аллергических воспалительных процес¬
сов; регулируют процессы дифференцировки Т-клеток.В настоящее время признано, что при иммунном ответе на ТЗА
основная роль макрофагов сводится к представлению антигена Т- и
В-лимфоцитам. Доказано, что антигенная детерминанта, представля¬
емая Т- и В-клеткам, должна быть в ассоциации с антигенами главного
комплекса гистосовместимости класса II. При этом, взаимодействуя с
макрофагом, Т-хелперы распознают как представляемые им пептиды
фракционированного антигена, так и антигены гистосовместимос¬
ти класса П, находящиеся в комплексе с молекулами разрушенного
антигена. Иначе говоря, имеет место процесс двойного распознавания
антигенного материала Т-хелперами — МНС-П и ассоциированных с
ними детерминант антигена. Доказано, что специфически активиро¬
ванные Т-клетки распознают только тот комплекс белков МНС-П с
антигеном, который был использован для иммунизации.Проведенные исследования показали, что необходимое для иммунно¬
го ответа взаимодействие макрофагов с лимфоидными клетками может
осуществляться посредством прямого контакта. В опытах in vitro образо¬
вывались «грозди», представляющие собой скопления лимфоцитов вокруг
иммунных макрофагов [711]. Этот процесс можно блокировать добавле¬
нием антигенспецифической сыворотки. При помощи световой и элек¬
тронной микроскопии установлено формирование цитоплазматических
мостиков между макрофагом и окружающими его лимфоцитами [558].При микрокиносъемке выявлено, что в период клеточного контак¬
та лимфоциты постоянно перемещаются на поверхности макрофага.
8.2. Синтетические иммуномодуляторы для вакцин нового... 275Проконтактировавший лимфоцит покидает макрофаг, и его место
занимает другой. В прямой физический контакт с макрофагом входят
как В-, так и Т-лимфоциты (Rosenthal А.S. et al., 1970). При этом реак¬
ция лимфоцита на контакт с макрофагом различна в зависимости от
наличия или отсутствия антигена на поверхности макрофага. В основ¬
ном наблюдается два типа контактного взаимодействия макрофагов и
лимфоцитов. Первый тип не зависит от антигена, т.е. нормальные
макрофаги вступают в контакт с нормальными (не стимулирован¬
ными антигеном) лимфоцитами. Этот тип взаимодействия требует
метаболически активных макрофагов, осуществляется в присутс-
тиии дивалентных катионов. Рецепторы макрофагов, через которые
происходит взаимодействие, чувствительны к трипсину. При данном
контакте макрофаги связывают сингенные Т- и В-лимфоциты, при¬
чем этот процесс носит обратимый характер. Такое взаимодействие
не приводит к пролиферации лимфоцитов. Контакт несущих антиген
макрофагов со специфически иммунными лимфоцитами сопровож¬
дается вторым типом взаимодействия. Этот тип зависит от наличия
антигена, требует идентичности между макрофагами и лимфоцитами
по продуктам генов главного комплекса гистосовместимости, харак¬
теризуется относительной необратимостью и приводит к активной
пролиферации лимфоцитов. Антигеннеспецифичсский компонент
взаимодействия наблюдается в том случае, когда лимфоцитарные
«грозди» или кластеры формируются вокруг антигенспецифических
центральных лимфоцитов. Антигенспецифическое взаимодействие
макрофаг—лимфоцит длится значительно дольше (24—72 ч), чем кон¬
такт между макрофагами и лимфоцитами (1-5 ч), происходящий в
отсутствие антигена (Горбачева Л.Д. и др., 1981) [256].Полученные данные свидетельствуют о том, что антиген неза¬
висимые взаимодействия макрофаг—лимфоцит могут обеспечивать
выполнение трофоцитарной функции и являются этапом в функцио¬
нальном созревании и дифференцировке лимфоцитов.В нашей лаборатории изучено взаимодействие макрофагов с син-
генными лимфоцитами Т-клеточной линии дифференцировки на
различных этапах их созревания [38j. Лимфоциты, вступившие в
контакт с макрофагами, образуют так называемые грозди (рис. 46).
Количественные параметры взаимодействия макрофаг—тимоцит в
случае сингенного сочетания практически одинаковы у различных
инбредных линий мышей. То же самое можно сказать и о контакте
макрофагов с лимфоцитами лимфатического узла. При изучении
276 Глава 8. Конъюгированные вакциныРис. 46. Моделирование взаимодействия макрофаг—лимфоцит: реакция
«гроздсобра зован ИЯ»контактного взаимодействия макрофагов с клетками тимуса, лимфа¬
тического узла и кортизонрезистентными тимоцитами отмечено, что
зрелость лимфоидных клеток определяет результат их контакта с мак¬
рофагами. Так, клетки лимфатического узла, являющиеся популяци¬
ей клеток более зрелых по сравнению с клетками тимуса, значительно
менее эффективно взаимодействуют с макрофагами. Такая же зако¬
номерность выявлялась и при анализе контакта макрофагов с Т-лим-
фоцитами селезенки и лимфатических узлов В-дефицитных мышей
(летально облученные животные, которым ввели клетки тимуса).
По сравнению с интактными клетками тимуса кортизонрезистентные
тимоциты образуют контакты с макрофагами значительно хуже. Это
позволяет сделать вывод о том, что результат взаимодействия лимфо¬
цитов Т-клеточной линии дифференцировки с макрофагами нахо¬
дится в обратной зависимости от степени их зрелости.В чем смысл антигеннезависимого взаимодействия макрофаг-лим-
фоцит? Выше уже упоминалось, что макрофаги регулируют про¬
лиферацию и дифференцировку лимфоцитов, выделяют факторы,
активирующие пролиферацию тимоцитов и усиливающие ответ на
8.2. Синтетические иммуномодуляторы для вакцин нового... 277митогены зрелых Т-клеток, продуцируют фактор, активирующий диф¬
ференцировку В-клеток в АОК, факторы, индуцирующие хелперные
Т-клетки, фактор, стимулирующий образование колоний гранулоцитов
и мононуклеарных клеток в культурах клеток костного мозга, и фактор,
индуцирующий функциональное созревание тимоцитов в культуре in
vitro. Последний фактор, получивший название тимоцитдифференци-
рующего фактора (ТДФ), секретируется макрофагами, выделенный из
тимических макрофагов или из макрофагов перитонеального экссудата
обладает идентичными свойствами, имеет молекулярную массу 40 кД
[253]. При инкубации фракции незрелых тимоцитов с ТДФ существен¬
но повышается экспрессия антигенов Н-2 на тимоцитах и усиливается
ответ на аллоантигены в культуре смешанных лимфоцитов. На осно¬
вании данных работы [253] полагают, что физиологическое значение
антигеннезависимого взаимодействия макрофаг—тимоцит сводится
к влиянию на созревание незрелых тимоцитов, когда они мигрируют
через кортикомедуллярную область тимуса в медуллярную (т.е. облас¬
ти, богатые макрофагами), где тимоциты созревают.Из отмеченного выше следует, что изучение контактного взаимодейс¬
твия макрофаг—лимфоцит при активации иммуногенеза полиионами
представляет значительный интерес для углубления знаний о механизме
иммуностимулирующего влияния синтетических полиэлектролитов.Была проведена оценка влияния концентрации вносимых в куль¬
туру полимерных молекул на интенсивность взаимодействия макро¬
фагов с сингенными тимоцитами. Полимеры вносили в смешанную
культуру взаимодействующих клеток в диапазоне доз 2—1000 мкг в
I мл инкубационной среды. Как видно из рисунка 47, стимулиру¬
ющая активность сополимера NA-5 проявляется в дозе 10—100 мкг
в 1 мл. Поливинил и ирролидон (ПВД) не стимулирует взаимодейс¬
твие макрофагов с тимоцитами. На основании полученных дан¬
ных в большинстве последующих экспериментов использовали дозу
NA-5, равную 100 мкг/мл. На рисунке 48 показано влияние сополи¬
мера на интенсивность реакции «гроздеобразования«> при внесении
его в систему взаимодействующих макрофагов и клеток тимуса.
Одновременная обработка сополимером макрофагов и лимфоидных
клеток приводит к выраженному усилению контактного взаимодейс¬
твия данных клеток. Аналогичные результаты были получены при
анализе влияния полимеров на взаимодействие макрофагов с клет¬
ками лимфатических узлов. В других экспериментах сополимерами
обрабатывали либо макрофаги (рис. 49) и изучали их взаимодействие
278Глава 8. Конъюгированные вакциныС, мкг/млРис. 47. Влияние концентрации полимеров на эффект взаимодействия мак¬
рофагов с сингенными тимоцитами:1 — взаимодействие в присутствии NA-5; 2 — в присутствии ПВД; 3 — контроль.
По оси абсцисс — концентрация полимеров. По оси ординат — количество тимоци¬
тов на 100 макрофаговВремя, минРис, 48. Влияние одновременной обработки полимерами макрофагов и тимо¬
цитов на процесс гроздеобразования в зависимости от времени инкубации:1 — влияние NA-5; 2 — влияние ПВД; 3 ~ контроль. По оси абсцисс — время инкуба¬
ции. По оси ординат — кааичество тимоцитов на 100 макрофагов
8.2. Синтетические иммуномодуляторы для вакцин нового...27910 20 30 4060120 180
Время, минРис. 49. Влияние инкубации макрофагов с полимерами на их взаимодействие
с интактными тимоцитами:Обозначения те же, что на рисунке 48С интактными клетками тимуса или лимфатических узлов, либо
клетки тимуса (рис. 50) или лимфатических узлов и анализировали
результаты их взаимодействия с интактными макрофагами, В обоих
вариантах опыта наблюдалась значительная стимуляция контактного
взаимодействия. Во всех экспериментах введение в культуру ПВД не
влияло на контакт макрофагов с лимфоидными клетками.Таким образом, совместная или раздельная инкубация макрофа¬
гов и клеток тимуса или лимфатических узлов с сополимером АК и
N-BПД приводит к выраженному усилению контактного взаимодейс¬
твия данных клеток. В связи с этим большой интерес представляет
возможность коррекции с помощью сополимера генетически ограни¬
ченного взаимодействия макрофагов с несингенными клетками.Исследован генетический контроль антигеннезависимого взаи¬
модействия макрофагов с лимфоцитами (Горбачева Л.Д. и др., 1981).
Показано, что различия по Н-2 системе между взаимодействующи¬
ми макрофагами и тимоцитами приводят к значительному снижению
реакции контактного взаимодействия (табл. 26). Аналогичные данные
получены при анализе взаимодействия макрофагов с клетками лимфа¬
тических узлов. Введение сополимера ЫА-5 в культуры макрофагов и
тимоцитов, различающиеся между собой по комплексу Н-2, 5—7-кратно
усиливает контактное взаимодействие (табл. 27). При анализе взаимо¬
действия в тех же межлинейных сочетаниях макрофагов с аллогенными
клетками лимфатических узлов, представляющими собой зрелую попу¬
ляцию клеток, выявилась сходная закономерность действия ЫА-5.
280Глава 8. Конъюгированные вакцины4003002001001020ЗО60Время, минРис. 50. Влияние инкубации тимоцитов с иолимерами на их вааимодействие
с интактными макрофагами:Обозначения те же, что на рисунке 24Таблица 26Эффективность реакции «гроздеобразования» между макрофагами мышей
линий С57ВЬ/6і и СВА с тимоцитами животных инбредных линий, различаю¬
щихся по системе Н-2ДонорГаллотип
взаимо¬
действую¬
щих клетокЧисло Тц
на 100 МфККоличество
макрофагов,
образующих
«грозди», %МфТцС57ВЬ/6іС57ВЬ/6іН-2Ь-Н-2Ь447±17-93,3+1,5С57ВЬ/б;СС57ВКН-2Ь-Н-2Ь341±18-91,2±1,1С57ВЬ/б;СВАН-2Ь-Н-2к168+112,6671,1+3,8С57ВЬ/61СЗН/НеН-2Ь-Н-2к140±26ЗД981,8±4,1С57ВЬ/6іВАЬВ/сН-2Ь-Н-2сі149±233,073,1±4,4С57ВЬ/61В10.02Н-2Ь-Н-2с1181±212,4774,1+6,2СВАСВАН-2к-Н-2к443+14-92,1±2,5
а.2. Синтетические иммуномодуляторы для вакцин нового...281Окончание табл. 26ДонорМфТцГаплотнп
взаимо¬
действую¬
щих клетокЧисло Тц
на 100 МфККоличество
макрофагов,
образующих
«грозди», %СВАСВАСВАСВА810,02В10.02СЗН/НеС57ВЬ/6ЛСС57ВКВАЬВ/сВ10.02С57ВЬ/б;Н-2к-Н-2кН-2к-Н-2ЬН-2к-Н-2ЬН-2к-Н-2аН-2с1-Н-2аН-2а-Н-2Ь279±25136±25135±19138±33539±31112±113,263,283,214,8174,0±5,554,4±11,663,0±4,4б1,5±7,294,9±2,359,2±3,8Примечание: Мф — макрофаг; Тц — ч имоцит; К — коэффициент снижения эффектив¬
ности взаимодействия Мф с аллогенными Тц. В опытах использовали реципрокные
сочетания макрофаг—лимфоцит от мышей линий СВА, С57ВЬ, СС57ВК, 010.02, ЫА-5
1Н10СИЛИ в систему взаимодействующих клеток, т.е. проводили одновременную обра¬
ботку макрофагов и лимфоидных клеток в течение 60 мин.Таблица 27Влияние NA-5 на взаимодействие макрофагов с несингенными тимоцитамиДонорВведе¬ниеNA-5Число Тц
на 100 Мф
(М±т)К*Довериелып>1Йинтервал(Р<0,05)Количество Мф,
образующих
«грозди», %МфТцСВАСВА-172111-150-19480,9±1,8СВАСВА+356±342,07287^42595,2±3,1СВАС57ВЬ/6-94+13-68^12067,8+1,7СВАС57ВЬ/6+455±224,84410-50096,2±2,7СС57ВКСВА-53+4-45^6146,4+4,1СС57ВКСВА+344+316,49281-40791,8+1,8С57ВЬ/6С57ВЬ/6-228+23-181-27584,5±3,8С57ВЬ/6С57ВЬ/6+527+282,31470-58494,2+2,9С57ВЬ/6СВА-64±7-50-7854,5±1,6С57ВЬ/6СВА+483±87,55467-49997,3±2,3С57ВЬ/6В10.Б2-63±6-51-7550,4±2,6С57ВЬ/6010.02+364±135,78338-39088,2±1,4К - коэффициент стимуляции эффекта взаимодействия под влиянием NA-5.
282 Глава 8, Конъюгированные вакциныИтак, под влиянием сополргмера происходит отмена генетических
ограничений взаимодействия макрофагов с лимфоцитами Т-кле¬
точной линии дифференцировки: стимуляция несингенного «гроз¬
деобразования» достигает уровня сингенного «гроздеобразования»,
стимулированного данным полиэлектролитом, т.е. наблюдается
фенотипическая коррекция взаимодействия макрофагов с лимфоид¬
ными клетками.ГГо-видимому, суть обнаруженного действия полииона NA-5 на
«гроздеобразование» заключается в «склеивании» двух клеточных
поверхностей через посредство заряженных полимерных молекул,
взаимодействующих с комплементарными заряженными группами
на клеточных мембранах.Облегчение контактного взаимодействия макрофагов с лимфоци¬
тами in vivo может служить одним из звеньев в механизме стимуляции
полиэлектролитом функциональной кооперации макрофаг-лимфо¬
цит Другим важным звеном, как уже отмечалось, может служить
усиление выработки макрофагальных факторов, стимулирующих
лимфоциты. Во всяком случае в непосредственных экспериментах
удалось обнаружить усиление «обучающего» влияния макрофагов на
Т-хелперы при воздействии полиэлектролитом, функциональным
следствием процесса взаимодействия макрофагов с тимоцитами явля¬
ется «дозревание» тимоцитов, т.е. превращение незрелых клеток
тимуса в зрелые, иммунокомпетентные. Иначе говоря, контакт тимо¬
цитов с макрофагами — важный этап в функциональном созревании
тимоцитов, поэтому мы решили исследовать хелперную активность
тимоцитов, проконтактировавших с макрофагами в присутствии
полиэлектролитов (Петров Р.В. и др., 1983).При индукции антигензависимой дифференцировки В-лимфо¬
цитов в АОК in vivo оценивали хелперную активность тимоцитов.
Введение 10^ клеток костного мозга и 10^ клеток лимфатических узлов
летально облученным реципиентам приводило к такому же коопера¬
тивному эффекту, как и введение 4x10^ клеток тимуса вместо клеток
лимфатического узла. Это объясняется тем, что незрелые клетки
тимуса обладают низкой хелперной активностью по сравнению с
Т-клетками лимфатического узла.Оказалось, что при инкубации одних тимоцитов с NA-5, ПАК или
ПВД не изменяется хелперная активность этих клеток, перенесенных
вместе с клетками костного мозга и ЭБ сингенным летально облучен¬
ным реципиентам, т.е. в культуру in vivo. При совместной инкубации
S.2. Синтетические иммуномодуляторы для вакцин нового... 283тимоцитов с макрофагами in vitro хелперная активность клеток тимуса
незначительно повысилась (в 1,6 раза). Однако добавление к совместно
инкубируемым in vitro тимоцитам и макрофагам синтетических поли¬
электролитов резко увеличило хелперную активность этих клеток,
перенесенных после инкубации вместе с сингенными клетками кос¬
тного мозга в культуру in vivo. Так, введение тимоцитов, проинкуби¬
рованных с макрофагами в присутствии NA-5, летально облученным
реципиентам вместе со стандартной дозой клеток костного мозга
привело к пятикратному повышению числа накапливаюшихся АОК
(до 4 тыс. по сравнению с 700-1000 в контроле). Принципиально такое
же действие оказывала ПАК. Введение в систему взаимодействующих
тимоцитов и макрофагов ПВД не сопровождалось изменением хелпер¬
ной активности клеток тимуса. В целом представленные данные пока¬
зывают, что совместная инкубация тимоцитов с макрофагами in vitro
приводит к стимуляции хелперной активности, которая значительно
повышается при введении в систему взаимодействующих клеток синте¬
тических полиэлектролитов (ПАК, NA-5). По-видимому, в механизме
стимулирующего действия синтетических полианионов на иммунный
ответ одним из важных факторов является макрофагальное звено.
В этом смысле полученные нами результаты хорошо согласуются с
данными [269], которые показали, что иммуномодифицирующее дейс¬
твие некоторых полианионов (каррагинан, декстран-сульфат, сурами н)
действительно может опосредоваться на уровне макрофагов.Функциональное состояние супрессорных (регуляторных) лимфо¬
цитов при активации иммунного ответа синтетическими полиэлект¬
ролитами. Иммуностимулирующие полиионы, как показано выше,
способны активировать метаболизм и функциональные свойства
макрофагов, Т-хелперов и В-клеток~предшественников АОК. В связи
с этим нельзя проигнорировать и возможность активации метаболиз¬
ма и функции других субпопуляций лимфоцитов, например клеток-
супрессоров.Исследовали адъювангное действие полиэлектролитов на актив¬
ность В-клеток-супрессоров, происходящих из костного мозга.
Как было установлено (Петров Р.В. и др., 1983), В-супрессоры из
костного мозга являются неспецифическими регуляторами проли¬
ферации незрелых клеток-предшественников in situ непосредственно
в костном мозгу. В частности, они ограничивают размножение ство¬
ловых кроветворных клеток, В-лимфоцитов предшественников АОК
и пре-В~клеток.
284 Глава 8. Конъюгированные вакциныДанные, получен ные при воздействии поликатионами (ПВЭПБ или
ДЭАЭ-декстран) на В-супрессоры, сводятся к возможности активации
функции этих клеток. В случае выраженной активности В-супрессоров
в контроле усиление их эффекта полиэлектролитом невелико (коэффи¬
циент усиления около 1,5). Несколько более значительную активацию
В-супрессоров можно было зарегистрировать на фоне их сниженной
активности в контроле (коэффициенты активации около 2—2,5).Несмотря на отсутствие прямых данных о влиянии полиэлект¬
ролитов на Т-супрессоры (Т-регуляторные клетки), по-видимому,
можно считать, что полиионы не дискриминируют клетки с суп¬
рессорной активностью. Следовательно, при введении в организм
полиионы-иммуностимуляторы способны активировать метаболизм
и функционирование как В-клеток-предшественников, Т-хелперов
и вспомогательных макрофагов, так и супрессорных лимфоцитов.
В связи с этим возникает необходимость оценить, в какой мере акти¬
вация супрессорных клеток может препятствовать проявлению акти¬
вации хелперных и эффекторных звеньев иммунной реакции.Рассмотрим результаты проведенных нами экспериментальных
исследований. Из них следует, что даже при наличии в организме
существенно активированного супрессорного звена полиэлектро¬
литы могут эффективно стимулировать антигензависимую диф¬
ференцировку В-лимфоцитов в антителопродуцирующие клетки
(Хаитов P.M. и др, [192]).Для индукции толерантности в качестве толерогена мы исполь¬
зовали дезагрегированный человеческий у-глобулин (ДЧГГ), а для
иммунизации в качестве иммуногена — агрегированную фракцию
глобулина (ДЧГГ). Через 15-30 дней после инъекции ДЧГГ (1 мг на
мышь) животным вводили внутривенно 200 мкг агрегированной
фракции совместно с ПАК или ПВП и определяли число АОК против
человеческого у-глобулина (ЧГГ) в селезенке.При введении ДЧГГ (толерогенная фракция) за 30 дней до иммуниза¬
ции агрегированной фракцией (иммуногенная фракция) формирование
специфических АОК против у-глобулина почти полностью тормозится
(табл. 28). Однако у мышей, получивших одновременно с ДЧГГ ПАК
или ПВП и иммунизированных спустя 25—30 дней агрегированной
фракцией, развивается выраженный антиглобулиновый гуморальный
ответ (до 9 тыс. АОК). Иначе говоря, при введении полиэлектролитов в
момент инъекции толерогенной формы толерантность не развивается.
Можно предпо1Южить, что присутствие полиэлсктролитов с мощным
8.2. Синтетические иммуномодуляторы для вакцин нового...285иммуностимулирующим действием в момент индукции толерантности
либо блокирует действие толерогена в начальной фазе формирования
«неотвечаемости» (формирование Т-супрессоров), либо содействует сня¬
тию толерантности (инактивация Т-супрессоров), замещая нсспеци-
фический сигнал, обеспечивающий размножение и дифференцировку
В-лимфоцитов в АОК. Имеется и третья возможность: полиэлектролит
обеспечивает эффективный адъювантный сигнал, активируя непосредс-I вен но В-лимфоциты, несмотря на присутствие активных Т-регулятор-
ных клеток, обладающих супрессорной активностью.Для проверки этих предположений толерантным мышам вводили
иммуногенную форму антигена вместе с ПАК или ПВП. Введение
АЧГГ вместе с пол и электролитам и приводит к формированию выра¬
женного иммунного ответа на этот белок (см. табл. 28).Таблица 28Влияние ПАК и ПВП на толерантиость, индуцированную ДЧГГ у мышейГруппа животныхЧисложивотныхЧисло АОК к ЧГГ
в селезенке, М±Тр (р <0,05)Мыши, иммунизированные АЧГГ157385,7 ± 959,2Мыши, получишиие ДЧГГ12420,8+110,0и иммунизированныечерез 30 дней АЧГГМытии, получившие ДЧГГГ113236,3± 1559,9и иммунизированныечерез 30 дней АЧГГ + ПАКМыши, получившие ДЧГГ1211650,0±1943,3и иммунизированныечерез 30 дней АЧГГ + ПВПМыши, получившие ДЧГГ + ПАК и148800,0±840,0иммунизированныечерез 30 дней АЧГГМыши, получившие ДЧГГ + ПВП и107220,0±1276,0иммунизированныечерез 30 дней АЧГГМыши, иммунизированные1122418,8±1439,9АЧГГ + ПАКМыши, иммунизированные1420169,2±2132,3АЧГГ + ПВП
286Глава 8. Конъюгированные вакциныПолученные данные показывают, что введение полиэлектро¬
литов ПВП или ПАК не только в момент инъекции толерогена, но
и во время формирования стойкой толерантности у животных
обеспечивает развитие иммунного ответа. Можно допустить, что
эти вещества стимулируют клоны В-лимфоцитов, отменяя угне¬
тающее действие Т-супрессоров. Введение полианионов ДС либо
ПАК [3451 или поликатиона ПВП [56] мышам с индуцированной
при помощи циклофосфамида толерантностью к ЭБ приводит к
продукции IgM-AOK, т.е. к срыву состояния иммунологической
толерантности. Поскольку отмена индуцированной при помощи
циклофосфамида толерантности достигается переносом ин-
тактных лимфоцитов грудного протока, полагают, что полианионы
стимулируют ответ В-клеток на эритроиитарные антигены, своим
действием замещая функцию Т-хелперов, блокированных под вли¬
янием Т-супрессоров.В последующих экспериментах мы изучали влияние синтетиче¬
ских полиэлектролитов на формирование Т-супрессоров (регу¬
ляторные Т-клетки) у животных, получивших гипериммунизи¬
рующую дозу ЭБ (Хаитов P.M. и др. [192]). При переносе клеток
селезенки гипериммунизированных доноров (КСГД) сингенным
реципиентам существенно угнетается продукция АОК. Доказано,
что 1ЕОдавление иммунного ответа у реципиентов, получивших
такие клетки, является функцией супрессорных Т-клеток. при
адоптивном переносе указанных клеток сингенным интактным
реципиентам, которым сразу после этого внутривенно водили ПВП
или ПАК, не наблюдалось угнетения иммунного ответа (рис. 51).
Выяснилось, что влияние полиэлектролитов на функцию сформи¬
ровавшихся супрессоров зависит от времени их введения относи¬
тельно момента инъекции клеток селезенки гипериммунизирован¬
ных мышей. Так, при инъекции полимеров сразу или через 4 ч после
переноса клеток селезенки развивался нормальный иммунный
ответ. Однако введение полимеров реципиентам спустя 24 ч после
трансплантации клеток селезенки и иммунизации оказалось менее
эффективным. Результаты этих экспериментов свидетельствуют о
том, что существует конкуренция между полимерами, обладающи¬
ми иммуностимулирующим действием, и т-супрессорами на уров¬
не стимуляции или ингибиции В-лимфоцитов и, по-видимому, эта
конкуренция определяет исход иммунного ответа. В случае функ¬
ционирования в системе Т-супрессоров их действие направлено на
8.2. Синтетические иммуномодуляторы для вакцин нового.287АОК800004000012 3 468Рис. 51, Влияние полиэлсктролитов на фазу индукции и функционирования
Т-супрессоров:По оси ординат — число АОК в селезенке мышей. По оси абсцисс: 1 — иммунизация
ЭБ (2х1С^); 2 — введение ЭБ и КСГД; 3 и 4 — введение ЭБ и КСГД, полученных от
мышей, которые в момент инъекции ЭБ (4x10*) получали либо ПАК (3), либо ПВП (4);
5 — введение ЭБ (2х]0^), КСГД и ПАК; 6 и 7 — то же, что и 5, но ПАК введен через
4 ч (6) и через 24 ч (7) после иммунизации ЭБ (2х1ф) и переноса КСГД; 8 — введение
ЭБ (2х]ф) и сыворотки мышей, примированных ЭБ в дозе 4х1(^; 9— то же, что и 8,
но вместе с сывороткой и ЭБ мыши получали ПАКугнетение функции Т-хелперов, Следовательно, полиэлектролиты
не конкурируют с Т-супрессорами, а запускают реакцию В-клеток
в отсутствие сигнала Т-хелперов, т.е. компенсируют функциональ¬
ный дефицит Т-хелперов.Эксперименты по отмене антигенной конкуренции полиэлектро¬
литами послужили еще одним доказательством того, что полимерный
адъювант может стимулировать дифференцировку В-клеток в ответ
на антиген, несмотря на присутствие активных Т-супрессоров.Феномен конкуренции антигенов описан в работе [604]. Введение
кроликам чужеродной сыворотки сопровождалось продукцией анти¬
тел против глобулина, но не альбумина. Инъекция животным только
альбуминовой фракции сыворотки приводила к образованию антител
к альбумину. В эти же годы эффект конкуренции антигенов проде¬
монстрирован на примере противоинфекционного иммунитета [385].
Одновременное введение кроликам холерных вибрионов и брюшно¬
тифозных бактерий подавляло иммунный ответ на вибрионы. Таким
образом, феномен антигенной конкуренции проявлялся в угнетении
288Глава 8. Конъюгированные вакциныиммунного ответа на один антиген или антигенную детерминанту при
введении в организм другого антигена или другой детерминанты.Различают внутримолекулярную и межмолекулярную формы кон¬
куренции антигенов [796]. Внутримолекулярной формой называется
такой вид конкуренции, когда разные конкурирующие антигены или
детерминанты присутствуют на одной молекуле иммуногена, напри¬
мер Fab- и Fc-фрагменты на одной молекуле IgG кролика. Введение
мышам IgG кролика приводит к образованию антител к Fc-фраг¬
менту, но иммунный ответ на РаЬ-фрагмент подавлен. Иммунизация
мышей только РаЬ-фрагментом способствует формированию выра¬
женного анти-РаЬ-иммунного ответа.Демонстративной моделью внутримолекулярной конкуренции
антигенов является угнетение иммунного ответа на одну из детер¬
минант некоторых синтетических антигенов под влиянием другой
детерминанты [797]. Иммунизация мышей линии СЗН/Не (Фен, Г)-А-Ь
приводит к продукции в высоких титрах антител к (Фен, Г). Однако
при иммунизации (Фен, Г)-Про-Л синтез антител к (Фен, Г) подав¬
лен благодаря присутствию детерминанты Про-Л. Межмолекулярная
форма конкуренции наблюдается в том случае, когда конкурирую¬
щие антигенные детерминанты присутствуют на разных молекулах.
Например, при одновременном введении смеси Fc- и РаЬ-фрагментов,
полученных перевариванием папаином кроличьего IgG, угнетается
иммунный ответ на Рс-фрагмент. При этом эффект конкуренции
зависит от соотношения в смеси фрагментов Fc и Fab; соотношение
3:1 является необходимым условием для проявления конкуренции.
Показано, что, изменяя соотношение антигенных компонентов во
многих смесях, в том числе в вакцине типа АКДС, содержащей смесь
дифтерийного и столбнячного анатоксинов с коклюшной вакциной,
можно добиться снижения феномена конкуренции [796]. Выявлено,
что дифтерийный и столбнячный анатоксины конкурируют друг с
другом, если их смесь заранее не сбалансирована.Разновидностью межмолекулярной конкуренции является такая
форма, которая проявляется при разновременном введении антигенов
(последовательная конкуренция). Например, при последовательном
введении с интервалом в 4 дня ЭБ и ЭЛ наблюдается подавление
образования антител против ЭЛ. Антиген, вызывающий угнетение
иммунного ответа, называется доминантным.Предполагают, что все три формы конкуренции антигенов опосре¬
дуются разными механизмами, связанными с функцией или дисфунк¬
8.2. Синтетические иммуномодуляторы для вакцин нового... 289цией клеток, участвующих в иммунном ответе, и их взаимодействием
1796]. Доказано, что клетками, ответственными за феномен конку¬
ренции антигенов, могут быть Т-супрессоры. В настоящее время не
вызывает сомнений, что межмолекулярная (при последовательном
или одновременном введении неродственных антигенов) конкуренция
антигенов опосредуется Т-супрессорным механизмом. Действительно,
феномеіі конкуренции антигенов опосредуется через действие неспе¬
цифического фактора с молекулярной массой 24 кД, который продуци¬
руется активированными антигеном Т-клетками [485]. По-видимому,
этот фактор способен блокировать конечные этапы дифференцировки
В'клеток, прекоммитированных к другому антигену.В практическом плане феномен конкуренции антигенов имеет
важное значение при иммунизации смесями антигенов, например
поливалентными вакцинами. Для успешного развития проблемы
создания синтетических полидетерминантных вакцин, каждая из
которых будет вызывать иммунный ответ на конкретный заданный
антиген, также требуется решение вопроса об антигенной конкурен¬
ции. Поэтому попытка повлиять на эффект антигенной конкуренции
с целью его отмены представляет большой интерес.в нашей лаборатории (Петров Р,В. и др., 1982) исследовано влияние
сополимера МА-5 на эффект последовательной антигенной конкурен¬
ции. Показано, что феномен связан с функционированием коротко-
живущих Т-супрессоров [796].Для индукции феномена антигенной конкуренции мышам линии
С57ВЬ вводили ЭЛ или ЭБ в дозе (доминантный антиген). Через
4 дня их иммунизировали соответственно эритроцитами другого вида —
2x10*^ ЭБ или ЭЛ (иммунизирующий антиген) и через 4—5 дней опре¬
деляли число АОК в селезенке.Корпускулярные антигены — ЭЛ и ЭБ являются практически
перекрестно не реагирующими антигенами [615]. Предварительное
введение ЭЛ до иммунизации ЭБ приводит к четырехкратному сни¬
жению ответа на ЭБ (рис. 28). То же происходит и в противоположной
ситуации — при иммунном ответе на ЭЛ в условиях предварительной
иммунизации ЭБ. Этот эффект зависит от природы доминантного
антигена, поскольку предварительное введение тимуснезависимого
антигена ПВД (ММ 360 кД) не приводит к снижению количества
антигенспецифичных АОК (Петров Р.В. и др., 1982).Введение КА-5 в дозе 50 мг/кг в момент инъекции доминант¬
ного антигена приводит к отмене подавления иммунного ответа
290Глава 8. Конъюгированные вакциныхЮ-з80ХІО'604020200150100501 2 3 4 5 6Рис. 52. Проявление феномена антигенной конкуренции при иммунизации
мышей ЭБ и ЭЛ:а — иммунный ответ на оптимальную дозу ЭБ интактиых мышей (1) или предвари¬
тельно иммунизированных ЭЛ (2) либо М-поливинштирролидоном (3); б — иммунный
ответ на оптимальную дозу ЭЛ интактньа мышей (4) или предварительно иммуни¬
зированных ЭБ (5) либо М-поливинилпирролидоном (6). По оси ординат — число АОК
в селезенке (у.10^^)(рис. 53), Введение NA-5 в момент инъекции иммунизирующего анти¬
гена оказалось оптимальным для отмены феномена антигенной кон¬
куренции, поскольку при этом наблюдался дополнительный прирост
числа специфических АОК. Скорее всего, влияние NA-5 в этом случае
объясняется прямой активацией В-лимфоцитов, несмотря на пред¬
шествующую активацию доминантным антигеном Т-супрессоров.Таким образом, представленные данные позволяют заключить,
что присутствие активных Т-супрессоров и даже некоторая активация
супрессорных клеток самим полиэлектролитом не могут препятство¬
вать активации антителогенеза через взаимодействие этого полиэлек¬
тролита непосредственно с В-клетками и макрофагами.Усиление активности естественных киллеров. Мы (Хаитов Р,М.
и др. [185]) изучали влияние на естественные киллерные клетки (ЕКК)
высокополимерных соединений поликатионной и полианионной
природы, а также полиамфолитов — макромолекул, которые содер¬
жат в одной полимерной цепи как кислые, так и основные группы.
Исследованы следующие соединения: поликатионы (поливинилтри-
8.2, Синтетические иммуномодуляторы для вакцин нового...291%10050rf-100 “1 2 34 5 6Рис. 53. Отмена антигенной конкуренции иод влиянием NA-5;
а — проявление феномена антигенной конкуренции при ответе на ЭБ без введения
NA-5(I), при инъекции NA-5 в момент введения доминантного антигена (ЭЛ) (2) или
при иммунизации ЭБ и NA-5 (3); 6 — проявление феномена антигенной конкуренции
при ответе на ЭЛ без введения NA-5 (4), при инъекции NA-5 в момент введения доми¬
нантного антигена (ЭБ) (5) или при иммунизации ЭЛ и NA-5 (6). По оси ординат —
иммунный ответ при предварителыюй иммунизации гетерологичным антигеном.
За 100% принимается ответ контрольной группы животных, иммунизированных
только ЭБ (а) или толысо ЭЛ (б)азол — ПВТА, четвертичные аммонийные соли поликонидина —
ЧСПК, ДЭЛЭ-декстран), полианионы (ПАК, сополимер акриловой
кислоты и N-BnД-NA, декстран-сульфат) и полиамфолиты [производ¬
ное гетероцепных полиаминов — МБ-4, модифицированный сополи¬
мер акриловой кислоты и N-ВПД, содержащий первичные аминогруп¬
пы в боковой цепи макромолекулы (NA-M), декстран с ММ 50—90 кД].Установлено, что введение мышам соединений поликатионной
природы — ЧСПК и ДЭАЭ-декстрана сопровождается резким усиле¬
нием естественной цитотоксичности. Активация ЕКК регистриру¬
ется и при использовании полиамфолитов, но степень повышения
уровня естественной цитотоксичности в этом случае менее выражена.
Из данных таблиц 29 и 30, в частности, видно, что МБ-4 и NA сущес¬
твенно стимулируют естественную цитотоксичность спленоцитов
мышей линии C57BL/6 по отношению к опухолевым клеткам YAC-L
292Глава 8. Конъюгироьанные вакциныТаблица 29Функциональная активность £КК селезенки мышей линии С57ВЬ/6
на 3-й день после введения полиэлектролитовПрепарат и доза, мг/кгЦитотоксичность,%Соотношение эффектор: мишень100:150:1-35,3±1,031,3±0,6МБ-4, 10059,6±2,559,9+1,7МБ-4, 5033,4±2,427,2+3,1NA, 10041,0+3,236,3±0,5ПВТА, 10028,9+1,324,8±1,4ПВТА, 5032,3+3,727,2±3,1Таблица 30Функциональная активность ЕКК селезенки мышей линии С57ВЬ/6 и А/5п
на 7-й день после введения полиэлектролитов№опытаЛиниямышейПрепарат и
доза, мг/кгЦитотоксичностъ, %Соотношение эффектор: мишень100: 150:120:110:11С57ВЬ/6-22,1±1,521,6+2,0--—«*>—МБ-4, 10030,6±!,127,3+2,7--— <я>—ЫА, 10030,4+3,626,7±1,8--ПВТА, 10021,9+0,320,8±0,5--А/5п-15,2±0,918,7±0,2--МБ-4, 10017,2±1,324,1 ±6,7--NA, 10020,8±3,39,4±2,4--—«»—ПВТА, 10010,1±0,711,6±0,6_-2С57ВЬ/6-9,7±2,18,2+2,6-1,4+1,5-0,1+0,2МБ-4, 10018,5+6,514,7+5,83,8±3,00,3±0,2NA, 10013,1+5,614,1+4,03,4±2,90,1 ±0,1
8.2, Синтетические иммуномодуляторы для вакцин нового... 293Представлялось интересным сравнить действие препаратов у
мышей с генетически детерминированными различиями в активнос¬
ти ЕКК. Известно, что мыши линий A/Sn и C57BL/6 характеризуются
невысокой активностью ЕКК. Как видно из рисунка 54 а, введение
МБ-4 и NA мышам линий BALB/c и СВА, обладающим высокой
активностью ЕКК, не приводит к стимуляции ЕКК ни в один из
исследованных сроков, хотя на 7-е сутки после введения полиэлектро¬
литов (рис. 54 и отмечается некоторое усиление цитотоксичности.
Напротив, мыши линии C57BL/6 на введение препаратов отвечают
существенным усилением активности ЕКК.В некоторых опытах из суспензий, содержащих ЕКК, предвари¬
тельно удаляли фракции прилипающих клеток. При элиминации
этих клеток из популяции спленоцитов мышей линий СВА и BALB/c,
обработанных препаратами, проявилось некоторое стимулирующее
действие полимеров.Затем мы анализировали влияние полиэлектролитов на слабые
(мембранотоксические и цитостатические) взаимодействия ЕКК и
опухолевых клеток. Эти исследования проведены в свете данных о
том, что иммуностимулирующее действие полиэлектролитов связано
с их способностью взаимодействовать с поверхностной мембраной
клетки, что обеспечивает активацию неспецифических мембранных
и цитоплазматических процессов, включающих лимфоциты в проли¬
ферацию и дифференцировку. Показано, что введение поликатиона
(ДЭАЭ-дестрана) мышам приводит к существенной активации естест¬
венной мембранотоксичности клеток селезенки по отношению к опу¬
холевым клеткам Р815 (Маджидов A.B., 1985). Следует отметить, что
поли катион также резко усиливает цитостатическую активность ЕКК
по отношению к клеткам-мишеням, выявляемую по степени угнете¬
ния последними синтеза РНК и ДНК. Таким образом, приведенные
данные позволяют убедиться в возможности модуляции активности
ЕКК синтетическими полиионными соединениями. Поликатионы
повышают как сильные (цитотоксичностъ), так и слабые (мембрано-
токсичность и цитотоксичностъ) варианты взаимодействия ЕКК и
клеток-мишеней.в результате проведенных исследований в системе in vitro было
установлено, что присутствие всех исследованных полиэлектро¬
литов в культуре взаимодействующих ЕКК и клеток-мишеней не
приводит к увеличению цитотоксичности в случае постановки
4-часового цитотоксического теста с использованием в качестве
294Глава 8. Конъюгированные вакцины50:1 100:150:1 100:150:1 100:1Рис. 54. Функциональная активность ЕКК селезенки мышей линий C57BL/6
(I), BALB/c (II) и СВА (ПТ) на 3-и (а) и 7-е сутки после введения полиэлект¬
ролитов:Вверху — цельная суспензия клеток селезенки, внизу — суспензия клеток селезенки
после элиминации прилипающих клеток (макрофагов); 1 — спленоциты ынтактных
животных; 2—3 — спленоциты мышей, обработанных NA (2) и МБ (3). По оси абсцисс —
соотношение эффектор-мишень по оси ординат — процент цитотоксичности
3.2. Синтетические иммуномодуляторы для вакцин нового,,. 295клеток-мишеней опухолевых клеток YAC-1. В равной мере это отно¬
сится и к экспериментам, в которых предварительной обработке
полиионами подвергались клетки-эффекторы. Отсутствие стимули¬
рующего действия полиионов в краткосрочной культуре in vitro при
наличии выраженной активации ЕКК в системах in vivo определен¬
ным образом могло свидетельствовать в пользу того, что стимуляция
естественной цитотоксичности не обусловлена прямым действием
полиионов на ЕКК. Иначе говоря, мы не исключали возможность
«включения» полиэлектролитами систем интерферонов и интерлей¬
кинов, как известно, регулирующих уровень естественной цитоток¬
сичности в организме.Было установлено, что присутствие поликатионов в относительно
длительной (20—24 ч) культуре взаимодействующих ЕКК и опухо¬
левых клеток миелолейкоза человека К-562 приводит к резкой сти¬
муляции естественной цитотоксичности клеток селезенки мышей
линий C57BL/6 и BALB/c. Аналогично полиэлектролиты усиливают
активность ЕКК периферической крови здоровых волонтеров. При
анализе возможности фенотипической коррекции уровня естес¬
твенной цитотоксичности при ряде аутоиммунных заболеваний
человека, таких, как системная красная волчанка, ревматоидный
артрит и склеродермия, выявлено, что степень активации ЕКК
полиионами в данных случаях в несколько раз более выражена
по сравнению с таковой, регистрируемой у здоровых волонтеров
(Маджидов A.B., 1985).В экспериментах, в которых предварительной обработке поли¬
катионом подвергались лимфоциты периферической крови чело¬
века и клетки миелолейкоза К-562 с дальнейшим использовани¬
ем их в реципрокных сочетаниях, было выявлено существенное
угнетение чувствительности обработанных клеток-мишеней к ЕКК.
Предварительная экспозиция лимфоцитов с ДЭАЭ-декстраном не
приводит к существенным изменениям их естественной цитотоксич¬
ности. Это также указывает на то, что «запуск» амплифайерных меха¬
низмов активации ЕКК поликатионом требует более длительного его
контакта с ЕКК.При изучении влияния поликатионов на процессы конъюгации
ЕКК и клеток-мишеней получены данные, прямо коррелирующие
с результатами, приведенными выше. Предварительная обработка
полиионами лимфоцитов периферической крови не приводит к уве¬
личению числа клеточных конъюгатов. Напротив, присутствие их
296 Глава 8. Конъюгированные вакциныв относительно длительной (20—24 ч) культуре взаимодействующих
ЕКК и клеток-мишеней сопровождается существенным увеличением
количества пар эффектор—мищень. Аналогичным образом ДЭАЭ-
дскстан усиливает процессы конъюгации у мышей на 2—3-й день
после введения, существенно не влияя на образование контактов
ЕКК-мишень в случае присутствия в краткосрочной культуре вза¬
имодействия ЕКК мышей и опухолевых клеток YAC-1. Изложенные
выше результаты позволили сделать заключение о том, что активация
естественных киллеров поликатионными соединениями не связана с
их прямым действием, а, видимо, опосредована через амплифайерные
механизмы.Известно, что уровень активности иммунокомпетентных клеток
регулируется семейством медиаторных молекул — лимфо- и моно¬
кинов, Среди них Т-клеточный фактор роста или интерлейкин-2
(ИЛ-2) играет ключевую роль в механизме действия цитотоксических
лимфоцитов. Поэтому исследовали (Хаитов Р.М, и др., 1986) влияние
полиэлектролитов на продукцию ИЛ-2 клетками селезенки мышей.
Установлено, что введение поликатионов приводит к существенно¬
му усилению продукции ИЛ-2 клетками селезенки мышей линий
BALB/c и C57BL/6. Таким образом, нами показана возможность акти¬
вации продукции ИЛ-2 соединениями поликатионной природы.Получены также данные о влиянии полиэлектролитов на продук¬
цию интерлейкина-1 (ИЛ-1) макрофагами перитонеальной полости
мышей. При использовании в качестве митогена оптимальной дозы
ЛПС мы получили существенные (в 1,5-2 раза) различия в продукции
ИЛ-1 макрофагами контрольных и обработанных поликатионами
мышей. Стимуляция продукции этого монокина поликатионами
регистрировалась в сравнительно ранние (1—3-й сутки) сроки иссле¬
дования.Следует отметить, что активация естественной цитотоксичности
полиэлектролитными соединениями регистрируется в сравнительно
ранние сроки после их введения. Именно в этот период отмечается
стимуляция данными соединениями продукции лимфо- и моно¬
кинов — ИЛ-1 и ИЛ-2. Принимая во внимание, что эти цитокины
выступают в роли эндогенных митогенных факторов, регулирующих
уровень естественной цитотоксичности в организме, а также приве¬
денные выше результаты, логично сделать вывод о том, что активация
естественной цитотоксичности синтетическими полиэлектролитами
опосредована через систему интерлейкинов.
8,2, Синтетические иммуномодуляторы для вакцин нового.,.2978.2,4. МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ АКТИВАЦИИ
ИММУНОКОМПЕТЕНТНОЙ КЛЕТКИ ПОЛИИОНАМИВыше было рассмотрено модулирующее действие полиэлектро¬
литов на те или иные субпопуляции клеток иммунной системы,
в проведенных исследованиях в лучшем случае могли быть опре¬
делены природа клеток, на которые влияют гюлиэлектролиты, и
конечный результат этого влияния. Однако оставалось непонятным,
каким образом и через посредство каких молекулярных процессов
экзогенный полимер модифицирует метаболизм иммунокомпетент¬
ной клетки, стимулируя ОС деление, дифференцировку или функци¬
ональную активность. Поиск триггерного механизма на уровне мем¬
браны привел нас к обнаружению наиболее значительных и быстрых
изменений в мембранной системе ионного транспорта (Петров Р.В.
и др., 1983, [120]). После воздействия полимером на клетку уже в первые
минуты наблюдается значительное повышение проницаемости плаз¬
матической мембраны для К"^ и Са^* (рис. 55, 56). Зарегистрировано
увеличение потоков этих катионов по градиенту их концентрации,
а именно К"" из клетки, а в клетку. Этот эффект не является
следствием угнетения N3"^-, К^- и Са^^-зависимых АТФаз. Более того,Время, минРис. 55. Кинетика вытекания К^ из лимфоцитов после воздействия in vitro
иолиионом — полиакриловой кислотой (ММ 80 кД), конечная концентрация
5x10'^ М:] — исходный уровень; 2 — введение полииона (обозначено стрелкой). По оси абсцисс —
время после инъекции полимера в суспензии} лимфоцитов in vitro. По оси ординат —
уровень iC (piC) во внеклеточной среде
298Глава 8, Конъюгированные вакциныимп/мин
4000 г3000 -2000 -1000 -Рис. 56, Интенсивность включения экзогенного '•^[Са] лимфоцитами, акти¬
вированными полиионами:По оси ординат — радиоактивность экстрактов из клеток, предварительно проин¬
кубированных в присутствии меченого кальция in vitro. По оси абсцисс: У — контроль¬
ные клетки (без полиионов); 2 — клетки инкубировали в присутствии поли-4-винил-
N-этилпиридиний бромида (средняя ММ 150 кД, конечная концентрация 10'^ М);
3 ~ клетки инкубировали в присутствии ПАК (средняя ММ 80 кД, конечная концен¬
трация 5x10'^ М). Приведены данные трех экспериментов (а, б, в)ионтранспортирующие АТФазы активируются после воздействия
полимерным стимулятором на клетку (Петров Р.В. и др., 1983, [13, 15,
120]). Действительно, зарегистрированное увеличение потоков и
Са^^ по градиенту их концентрации при более строгом анализе могло
трактоваться не как повышение проницаемости мембраны, а как
результат уменьшения встречного потока этих же ионов вследствие
угнетения На^-, К^- и Са^'^-зависимых АТФаз. После искусственного
блокирования Na+-, К+-зависимой АТФазы с помощью селективного
ингибитора наблюдается вытекание К+ из клеток, демонстрирующее
естественный поток этого катиона вследствие физической диффузии
8.2. Синтетические иммуномодуляторы для вакцин нового...299его по градиенту концентрации. В физиологических условиях поток
компенсируется работой Na^-, К+-зависимой АТФазы, и его не удается
зарегистрировать по накоплению во внеклеточной среде.При ингибировании Na^-, К+-зависимой АТФазы оуабаином уда¬
ется наблюдать «вытекание» К+ из клеток, определяющееся главным
образом проницаемостью мембраны для этого катиона (Петров RB. и
Др. [120]) [15]. Если на фоне полного блока Na+-, К'^-зависимой АТФазы
инъецировали в суспензию лимфоцитов митогенную дозу ПАК, то
наблюдали эффект «вытекания» К% по величине почти не уступа¬
ющий эффекту этого же полимера в суспензии идентичных клеток
с активно функционирующим ферментом (рис. 57). Этот результат
показывает, что повышение проницаемости клеточной мембраны под
действием иммуностимулирующего полииона не определяется инги¬
бированием ионтранспортирующих АТФаз мембраны. Более того,
прямое исследование активности Na"^-, К^- и Са^*-зависимых АТФаз
показало, что под влиянием экзогенного полииона происходит быст¬
рая и значительная активация мембранных АТФаз.Несколько фактов, полученных нами (Хаитов P.M., Атауллаха¬
нов Р.И, [181]; Петров Р.В. и др., 1983 (15, 120]), позволяют считать, что
способность полимера повышать проницаемость мембраны для ионов
есть главное свойство или одно из основных свойств, определяющее
его иммуностимулирующую активность.Время, минРис. 57. «Иотюфороподобное» действие полииона в условиях полного блоки¬
рования Na^-, К+-за виси мой АТФазы, чувствительной коуабаину:По оси ординат — уровень (pJC) во внеклеточной среде. По оси абсцисс — время
инкубирования лимфоцитов in vitro. Стрелками показаны моменты инт^екции in vitro:
1 — оуабаина (1(Г^ М) или 2 — ПАК(5>^}0~^ М)
300 Глава 8. Конъюгированные вакцины1. Только полимеры, способные увеличивать проницаемость кле¬
точной мембраны, активируют деление и антигензависимую диффе-
реыцировку лимфоцитов.2. Известные ранее стимуляторы лимфоцитов (митогены) приво¬
дят к сходному повышению проницаемости мембраны для ионов.3. Наконец, искусственное увеличение проницаемости мембраны с
помощью мембраноактивных эффекторов или ионофоров приводит к
значительной активации деления и антигензависимой дифференци¬
ровки лимфоцитов.Каков механизм повышения электропроводности мембраны?
По нашим данным, главное значение имеет кооперативное взаимо¬
действие полиэлектролита с белками мембраны, а не с липидным
матриксом. Наиболее правдоподобная гипотеза связывает увеличе¬
ние ионной проницаемости со способностью полимера агрегировать
белки в клеточной мембране. Например, полиионы способны комп-
лексироваться с белками и повышать проницаемость клеточной мем¬
браны. Нейтральные полимеры не обладают комплексообразующей
активностью, не увеличивают проницаемость клеточной мембраны и
не оказывают иммуностимулирующего действия. Укорочение поли¬
ионных цепей до размеров, соизмеримых с поперечником белко¬
вых глобул, приводит к утрате полимером способности перекрестно
сшивать (агрегировать) белки как в растворе, так, по-видимому, и в
мембране. Короткие полимерные цепи (около 100—500 нм) не могут
агрегировать белки, повышать проницаемость клеточной мембраны
для ионов и стимулировать иммунный ответ. Полученные экспери¬
ментальные факты, скорее всего, свидетельствуют о необходимос¬
ти агрегации белков мембраны для увеличения ее проницаемости.
Наконец, недавно нам, по-видимому, удалось визуализировать пред¬
полагаемые белковые агрегаты в клеточной мембране, образующиеся
после воздействия полиионом. Методами электронной микроскопии
показано, что полиионы, повышающие проницаемость плазматиче¬
ской мембраны для калия и кальция, индуцируют микроагрегацию
белков мембраны. При этом в клеточной мембране образуются клас¬
теры, состоящие в среднем из 20—50 белковых глобул.В результате специально проведенных экспериментов (Хаитов P.M.
и др., 1986) стало ясно следующее. Белки клеточной мембраны, соб¬
ранные в кластеры вследствие многоточечного электростатического
взаимодействия с полиэлектролитом, сохраняют свои специфиче¬
ские свойства. По крайней мере, это справедливо для тех белков и их
8.2. Синтетические иммуномодуляторы для вакцин нового... 301свойств, которые мы изучали, а именно для мембранных иммуно¬
глобулинов и ионтранспортирующих АТФаз. Например, на молекулах
белков, представленных на внешней клеточной мембране, антиген¬
ные детерминанты сохраняются нативными и доступными для спе¬
цифических экзогенных антител. Мембранные белки-ферменты тоже
не инактивируются после обработки клеток поликатионом. Несмотря
на кластеризацию интегральных белков мембраны, их латеральная
подвижность в плоскости мембраны остается практически неизмен¬
ной. Живая клетка способна защищаться от повреждающего действия
экзогенного полиэлектролита путем удаления образовавшихся в мем¬
бране комплексов (кластеров).Мы считали, что если экзогенный клеточный белок не вызвал
перераспределения собственных белков мембраны, то при последую¬
щей обработке клетки экзогенным полиэлектролитом меченые белко¬
вые комплексы поведут себя так же, как и нативные белки мембраны,
т.е. мы предполагали, что комплексы собственный белок мембраны—
экзогенный меченый белок при воздействии полиэлектролитом будут
перераспределены в микрокластеры (рис. 58).в экспериментах использовали иммунофлуоресцентную технику
при микроскопии лимфоидных клеток (Хаитов Р.М, и др., 1986). Клетки
обрабатывали меченными флуоресцеином антителами против имму¬
ноглобулинов (a-Tg-FITC), затем инкубировали в полноценных куль¬
туральных условиях и в течение 1 ч наблюдали кинетику картины
флуоресценции клеточной поверхности. В-лимфоциты селезенки, обра¬
ботанные a-Ig-FITC при 2 °С, имели характерное свечение, равномерное
по всему периметру клетки. Свечение почти не изменялось в течение1 ч инкубирования клеток при 2 °С в темноте. Напротив, инкубирование
идентичных клеток при 37 “С приводило к фрагментации перифериче¬
ского свечения (разрывы кольца флуоресценции) уже спустя 25-30 мин.
Позднее, через 40-50 мин, свечение перемещалось к одному полюсу
клетки. Наблюдавщиеся процессы хорошо известны как феномены,
отражающие латеральное (в плоскости мембраны) смещение кластеров,
образованных антителами. Описанные этапы перераспределения бел¬
ков поверхности принято называть соответственно patching и capping.
Процесс образования колпачка значительно ускорялся, если В-лимфо¬
циты подвергали двухэтапной обработке сначала антителами против
иммуноглобулинов и затем антителами, специфичными к детерми¬
нантам первых антител (так называемый сэндвич-метод). Можно было
ожидать, что дополнительная обработка клеток поликатионом приведет
302Глава 8. Конъюгированные вакциныРис. 58. Индуцированная полиэлектролитом кластеризация белков клеточ¬
ной мембраны (а) или комплексов этих белков со специфическими антитела¬
ми (б) (схематическое представление);1 — липидный матрикс мембраны; 2 — молекулы интегральных белков мембраны;
3 — свободные молекулы экзогенного полимера; 4 — молекулы экзогенного полимера,
связанные с мембранными протеинами; 5 — кластер мембранных белков; 6 — анти¬
генная детерминанта молекулы интегрального белка; 7 — антителок укрупнению кластеров и ускорит процессы разрыва и смещения кольца
флуоресценции. Однако этого не происходило. Методом люминесцент¬
ной микроскопии не удавалось обнаружить перераспределения меченых
8,2, Синтетические иммуномодуляторы для вакцин нового.,, 303белков мембраны даже при использовании тех доз поликатиона, которые
вызывали отчетливую кластеризацию белков, хорошо выявляемую с
1ЮМОЩБЮ электронной микроскопии.при люминесцентной микроскопии кольцо периферической флуо¬
ресценции клеток, меченных прямым методом, оставалось неизменным
гюсле обработки поликатионом и инкубирования при 2 X. Если такие
клетки инкубировали при 37 "С, то кинетика образования колпачка
существенно не изменялась по сравнению с таковой в соответствующем
контроле. Это означает, что при отсутствии активных передвижений
белков мембраны, обеспеченных сократительным аппаратом клетки
(при 2 “С блокированы метаболические процессы в клетке), поликати¬
оном индуцируется лишь образование микрокластеров (до нескольких
десятков молекул в каждом кластере) белков в мембране лимфоцита.
Такие кластеры можно увидеть при электронной микроскопии (уве¬
личение в 100—200 тыс. раз), но не при люминесцентной микроскопии
(увеличение в 400—500 раз). При 2 °С образованные полиэлектролитом
белковые кластеры не собираются в гигантские агрегаты (patch, cap)
в клеточной мембране. По-видимому, это невозможно в результате
фазового перехода липидов мембраны при этой температуре. При
37 “С, когда наблюдается латеральная подвижность белков в клеточной
мембране, комплексы мембранных иммуноглобулинов с экзогенными
антителами активно перемещаются. В этом случае кластеризация
белков мембраны, индуцированная полиэлектролитом, не ускоряет,
но и не препятствует процессу образования колпачка из комплексов
Ig—анти-lg, т.е. латеральная подвижность кластеризованных поли¬
электролитом белков остается близкой к нормальной.Небольшие изменения в описанной выше методике позволи¬
ли показать, что при кластеризации белков мембраны поликатио¬
ном не происходит маскирования антигенных детерминант белков.
Если В-лимфоциты обрабатывали поликатионом перед обработкой
мечеными антителами, то специфическое взаимодействие a-Ig-FITC
с мембранными иммуноглобулинами не нарушалось. В непрямом
(«сэндвич») методе обработка клеток поликатионом перед наслоением
как первых, так и вторых антител не препятствовала специфическому
взаимодействию антител с детерминантами молекул на клеточной
мембране. В этом случае оставались неизменными и доступными для
соответствующих антител детерминанты как собственных иммуно¬
глобулинов мембраны, так и первых a-lg, присоединенных к мембран¬
ным иммуноглобулинам (рис. 59).
304Глава 8, Конъюгированные вакциныРис. 59. Специфическое узнавание молекулами антител антигенных детер¬
минант белков мембраны интактной (а) или обработанной поликатионом
{6, е) клетки.Обозначения те же, что на рисунке 58
8.2. Синтетические иммуномодуляторы для вакцин нового... 305При изучении специфического взаимодействия экзогенных анти¬
тел с соответствующими антигенами на поверхности клеток, предва¬
рительно обработанных поликатионом, мы проверили возможность
появления неспецифической сорбции меченых молекул на клетке.
Был обнаружен интересный факт. На поверхности клеток, обрабо¬
танных поликатионом, возможна не специфическая сорбция молекул
белка, даже не имеющего специфических мест «посадки» на мембра¬
не. По-видимому, специфическая «посадка» экзогенного белка в этом
случае происходит вследствие электростатического взаимодействия
данного белка со свободными заряженными группами адсорбиро¬
ванного на мембране полиэлектролита (рис. 60). При этом число мест
неспецифической «посадки» зависит от насыщенности клеточной
мембраны молекулами поликатиона.Судя по интенсивности флуоресценции меченых клеток можно
утверждать следующее. В случае использования иммуностимулирую¬
щих доз поликатионов (10“®—10"^ М для полиионов со степенью поли¬
меризации 10^) число мест неспецифической «посадки» для меченых
экзогенных антиглобулинов в сотни и тысячи раз меньше, чем число
мест специфической «посадки» этих же антиглобулинов на молекулы
мембранных иммуноглобулинов. Известно, что на В-клетке находит¬
ся около 10-' молекул мембранных иммуноглобулинов. Следовательно,
после адсорбции поликатиона на мембране В-лимфоцита часть заря¬
дов (не более 1 тыс. групп) полимеров молекул остаются свободными.
Эти группы доступны для взаимодействия с внеклеточными белками.
В результате возможна адсорбция на клеточной мембране тех белков,
которые не находят специальных мест связывания.Несколько иная интерпретация этих же данных: любой белко¬
вый эффектор (вероятно, не только белковый) можно искусственно
адсорбировать на мембране даже тех клеток, которые не способны к
его акцепции. В этом случае молекулы поликатиона могут выполнять
роль универсального «клея» между экзогенными молекулами и кле¬
точной поверхностью или между двумя клеточными поверхностями.
Практическое использование таких «клеящих» свойств полиэлектро¬
литов трудно предсказать, оно может быть совершенно неожиданным.
В наших же опытах неспецифическая адсорбция экзогенных меченых
антител на свободных группах молекул поликатиона не препятство¬
вала изучению специфического узнавания экзогенными антителами
«своих» антигенных детерминант на молекулах кластеризованных
мембранных иммуноглобулинов.
306Глава 8. Конъюгированные вакциныРис. 60, Неспецифическая адсорбция экзогенного белка на мембране клеток,
обработанных поликатионом:а — поверхность интактной мембраны; б — многоточечное электростатическое
взаимодействие молекулы поликатиона с комплементарными зарядами поликатио¬
на, адсорбированного на мембране; в — адсорбция белка на обработанной мембране;
1 — липиды мембраны; 2 — интегральные белки; 3 — углеводные «цепи» гликопро¬
теидов и гликолипидов мембраны; 4 — отрицательно заряженные группы в составе
различных молекул; 5 ~ экзогенные белки, не имеющие специфических центров адсор¬
бции на интактной мембране
8.2, Синтетические иммуномодуляторы для вакцин нового... 307Таким образом, собранные поликатионом в микрокластеры белки
мембраны лимфоидных клеток сохраняют такие важные функцио-
нальные свойства, как способность к латеральной диффузии в плос¬
кости мембраны и нативность антигенных детерминант. В настоящее
время пока еще нет окончательных данных о состоянии акцепторных
мест связывания лектинов, рецепторных молекул для пептидных гор¬
монов и об активности каталитических белков, которые могут клас¬
теризоваться и (или) маскироваться поли ионом. Однако уже сейчас
можно обратиться к одному экспериментальному факту, указываю¬
щему на сохранение активной функции двух разных каталитических
молекул в мембране лимфоцитов, обработанных полиионом. Речь
идет о приведенных выше данных об активаций Ма% К^- и Са^' -зави¬
симых АТФфаз после воздействия на лимфоциты полиионами. Как
известно, указанные АТФазы — это белковые молекулы, каждая из
которых состоит из нескольких субъединиц. Эти комплексные белки
пронизывают мембрану насквозь и имеют довольно крупные внемем-
бранные фрагменты, функция которых очень важна.Внемембранные фрагменты молекул АТФаз гидрофильны, т.е.
имеют заряженные группы. Следовательно, с этими группами могут
взаимодействовать заряженные группы полиэлектролита. Несмотря
на такую возможность, мы не выявили инактивации мембранных
АТФаз после воздействия на клетки полиионами. Напротив, эти фер¬
менты даже активировались.Описанные выше данные доказывают, что под влиянием экзоген¬
ного полииона образуются микроагрегаты интегральных белков во
внешней мембране клетки. «Сшитые» полимером белковые молекулы
сохраняют способность к латеральному движению в плоскости мемб¬
раны. Остается возможность для объединения микрокластеров в более
крупные агрегаты, вплоть до «колпачка». Сохраняются такие важные
свойства белков мембраны, как нативность антигенных детерминант
и их доступность для экзогенных лигандов, а также каталитическая
активность белков-ферментов. Весьма важен конечный результат
этого процесса: клетка удаляет из мембраны кластеризованные белки
и, по-видимому, таким образом восстанавливает нарушенную про¬
ницаемость мембраны для ионов и воды. Здесь интересно вспомнить
данные о кинетике индуцированного полимером «вытекания» К"^ из
клеток (Петров Р.В. и др. [120]) [13].Было отмечено, что через 35—40 мин после воздействия полиионом
скорость «вытекания» К^ довольно быстро уменьшается практически
308 Глава 8. Конъюгированные вакциныдо нуля. Как уже упоминалось, в это же время из клеточной мембра¬
ны элиминируются кластеры белков, образовавшиеся под влиянием
полиэлектролита. Возможно, уменьшение проницаемости клеточной
мембраны до нормального уровня есть следствие удаления из мембра¬
ны белковых кластеров, являющихся ионпроводящими структурами.Выше отмечалось, что знак заряда (положительный или отри¬
цательный) ионогенных групп практически не влияет на мемб¬
ранную и адъювантную активность полиэлектролитов. Вместе с
тем обращалось внимание на неравнозначную чувствительность
разных типов лимфоцитов к положительно и отрицательно заря¬
женным полимерам: поликатионы активно взаимодействовали с
Т- и В-клетками селезенки, а полианионы — только с В-клетками.
Это побудило провести специальное исследование, целью которого
было изучить причины различия спектров чувствительных клеток-
мишеней для положительно и отрицательно заряженных полимеров
(Атауллаханов Р.И., 1984).Хорошо известно, что зрелые Т-лимфоциты из селезенки мыши
отличаются от прочих лимфоидных клеток значительно бульшим
отрицательным зарядом клеточной поверхности, который обеспе¬
чивается главным образом высокой плотностью концевых остатков
N-ацетилнейраминовой кислоты. Названные заряженные группы в
совокупности с другими заряженными цепями поли- и олигосаха¬
ридных фрагментов мембранных молекул гликолипидов и гликопро¬
теидов образуют отрицательно заряженную «шубу» вокруг Т-клетки.
С этой особенностью Т-лимфоцитов связаны их многие оригиналь¬
ные адсорбционные свойства. Данные клетки не сорбируются на
идентично заряженных поверхностях, например на монослое эрит¬
роцитов или на нейлоновой вате. Такие особенности Т-лимфоцитов
часто используют для их разделения с другими клетками — В-лимфо¬
цитами и макрофагами.Еще в работе Т. Diamantstein и Е. Blittstein-Willenger (1975) было
показано, что отрицательно заряженные полимеры (ПАК или ДС)
оказывают митогенное действие на В-, но не на Т-лимфоциты.
Как было описано ранее (Хаитов Р.М., Атауллаханов Р.И., 1982),
обнаружена избирательность воздействия ПАК на В-лимфоциты
не только по митогенному эффекту, но и по влиянию на площадь
клеточной поверхности (исследовано с помощью флуоресцентных
зондов), кроме того, изучено влияние ПАК на систему ионного
транспорта в мембране Т- и В-клеток селезенки (фракции получе-
8.2. Синтетические иммуномодуляторы для вакцин нового... 30911Ы на колонке с нейлоновой ватой). Регистрировали эффект акти¬
вации АТФаз [13] в ответ на инъекцию ПАК в культуры тех или
других лимфоцитов in vitro (рис. 61). Оказалось, что действие ПАК
значительно снижено при использовании Т-клеток из селезенки.
В клетки давали выраженную реакцию на полианион, В отличие
от зрелых Т-клеток незрелые Т-клетки из тимуса хорошо активи¬
ровались ПАК [13]. С помощью другой методической системы при
изучении изменения проницаемости клеточной мембраны для К^
показано, что поликатион активно взаимодействует с мембраной
клеток, поверхность которых имеет большой (эритроциты, зрелые
Т-клетки) или небольшой (В-лимфоцитьт) отрицательный заряд.
Напротив, полианион (ПАК) не влиял на проницаемость мембра¬
ны эритроцитов и зрелых Т-клеток, но увеличивал проницаемость
мембраны В-лимфоцитов.Из приведенных выше данных следовало, что отсутствие дей¬
ствия отрицательно заряженного полимера (полианиона) на мем¬
брану клеток, имеюш;их высокую плотность отрицательно заря¬
женных групп на клеточной поверхности, определяется чисто
электростатическими закономерностями, в основе которых
лежит взаимное отталкивание одноименно заряженных молекул.
Из такого предположения вытекало следствие: если уменьшить
плотность отрицательно заряженных групп на зрелых Т-лимфоци-
тах, то может быть облегчен доступ полианиона к мембране этих
клеток. Экспериментальная проверка подтвердила это предпо¬
ложение [15], Т-клетки селезенки, предварительно обработанные
нейраминидазой в условиях, приводящих к удалению с клеточной
поверхности концевых остатков N-ацетилнейраминовой кислоты,
приобретали способность реагировать на ПАК активацией мемб¬
ранных АТФаз (см. рис. 61), Следовательно, молекулы ПАК могут
взаимодействовать с мембраной Т-клеток, у поверхности которых
искусственно уменьшен отрицательный заряд, и приводить к повы¬
шению проницаемости мембраны для ионов,Таким образом, от знака заряда ионогенных групп полиэлектро¬
лита зависит спектр клеток-мишеней, метаболизм которых может
активироваться данным полимером. Исходя из накопленных экспе¬
риментальных данных, мы можем констатировать, что отрицательно
заряженные полимеры хорошо взаимодействуют с мембраной слабо¬
заряженных клеток (В-лимфоциты, тимоциты, макрофаги и селезе¬
ночные Т-лимфоциты, предварительно обработанные нейраминида-
310Глава 8, Конъюгированные вакциныКсРис. 61. Активация полианионом АТФаз в мембране клеток, различающихся
плотностью отрицательно заряженных групп, которые представлены на кле¬
точной поверхности:По оси ординат — коэффициент стимуляции (К^ суммарной клеточной АТФазы
(по суммарной интенсивности поглощения Oj клетками). По оси абсцисс — конечная
концентрация (С) полииона в суспензии лимфоцитов in Mitro. Контрольный уровень
(принят равным 1,0) — суммарная АТФ-потребляющая активность интактиых
лимфоцитов, измеренная непосредственно перед инъекцией полианиона in vitro (К).
Точками показаны значения ЛТФ-потребляющей активности клеток через 5—10мин
после инъекции в одну из следующих суспензий: 1 — фракция прилипающих к нейло¬
новой вате В-клеток из селезенки мыши; 2 — фракция неприлипающих к нейлоновой
вате зрелых Т-лимфоцитов из селезенки мыши; 3 — лимфоциты из тимуса молодой
мыши; 4 — зрелые Т-лимфоциты селезенки, предварительно проинкубированные в
присутствии активной нейраминидазы V. cholerae в условиях, приводящих к гидроли¬
тическому отщеплению концевых остатков N-ацетилнейраминовой кислотыЗОЙ). Напротив, взаимодействие полианионов с мембраной клеток,
имеющих большой отрицательный заряд поверхности (эритроциты,
зрелые Т-лимфоциты), значительно затруднено. Положительно заря¬
женные полимеры (поликатионы) активно взаимодействуют с клетка¬
ми всех исследованных типов.8.2.5, ВЛИЯНИЕ НА ИММУННЫМ ОТВЕТПриведенные выше материалы позволили экспериментально убе¬
диться в возможности направленно воздействовать на величину иммун¬
ной реакции путем изменения миграции стволовых клеток, Т- и В-лим¬
фоцитов и кооперативного взаимодействия Т- и В-клеток. Показано, что
8,2, Синтетические иммуномодуляторы для вакцин нового.,, 311синтетические нецриродные полианионы и поликатионы выраженно
стимулируют иммунный ответ в результате усиления процессов кле¬
точных миграций и Т-В-кооперации, замещения хелперной функции
Т-клеток, активации В-клеток — предшественников АОК и инактивации
Т-супрессоров, Установлено, что изменение некоторых свойств клеточ¬
ной мембраны (образование кластеров мембранных белков, повышение
проницаемости мембраны для ионов) под влиянием полиэлсктролитов
может приводить к формированию эффекторного иммуностимулирую¬
щего сигнала. Логично было ожидать, что эти полимерные соединения
должны обладать иммуностимулирующими свойствами у разных видов
животных и при индукции разных типов иммунного ответа.Влияние на антителогенез. Р.В. Петров и соавт, (1974) показали, что
введение ПВП нормальным мышам и крысам, иммунизированным
ЭБ, приводит к 4—6-кратному повышению иммунного ответа. При
введении мышам ПАК (ММ 20—30 кД) в диапазоне доз 30 мкг—2 мг
наблюдается прямая зависимость между повышением антителогенеза
и дозой полианиона (Diamantstein Т. et al., 1971). Е.А. Кабанова и соавт.
(1978) выявили, что под влиянием ПВП в селезенке мышей, иммуни¬
зированных ЭБ, повышается число как IgM-, так и IgG-AOK,На рисунке 62 показана зависимость доза-эффект при внут¬
ривенном введении разных доз сополимеров NA-3 и NA-5 мышам
(CBAxC57BL)F,, иммунизированным ЭБ (Нажмитдинов А.М,, 1981).
В целом наблюдается усиление продукции АОК с возрастанием дозы
полианиона от 25 до 3 тыс. мг/кг. При введении мышам 300 мг/кг NA-3
проявляется токсический эффект данного сополимера. NA-5 не оказы¬
вал токсического действия при всех испытанных дозах. Оптимальным
следует признать иммуностимулирующий эффект NA-5 в дозе 50 мг/кг.
Принципиально аналогичная зависимость наблюдается при изучении
иммуностимулирующего действия NA-5 в опытах на собаках (рис. 63).Наиболее эффективная стимуляция продукции сывороточных гемаг-
глютинирующих антител при иммунизации ЭБ кроликов и крыс отме¬
чалась при внутривенном введении NA-5 в дозе 20—50 мг/кг (Нажмитди¬
нов А,М., 1981). При сравнении иммуностимулирующего действия NA-5
при разных способах введения оказалось, что наиболее эффективным
является внутривенный. Иммуностимулирующий эффект NA-5 при
подкожном и внутрибрюшинном введении был одинаковым и менее
выраженным по сравнению с таковым при внутривенном способе.Особый интерес представляет изучение иммуностимулирующей актив¬
ности NA-5 при индукции иммунного ответа на антигены микробного
312Глава 8. Конъюгированные вакциныАОК, хЮ'З
400О 1300200100о 25 50 100 200 300Доза, мг/кгРис. 62. Стимуляция накопления АОК у мышей (СВАхС57ВЬ)р1, иммунизиро¬
ванных ЭБ в зависимости от дозы введенных сополимеров ЫА-З (1) и NA-5 (2):
К — контроль; по оси абсцисс — доза сополимера; по оси ординат — нисло АОК на
селезенку.АОК
3000 Ь20001000А102550100 200
Доза, мг/кгРис. 63. Зависимость иммуностимулирующего эффекта ЫА-5 от его дозы у
собак, иммунизированных ЭБ:по оси абсцисс — доза сполимера; по оси ординат — число АОК на !(^' клеток селе¬
зенки.
8.2. Синтетические иммуномодуляторы для вакцин нового...313происхождения, в том числе при вакцинации. Изучали влияние NA-5 на
специфический антителогенез при вакцинации столбнячным анатоксином
и коклюшной вакциной собак, кроликов и крыс (Петров Р.В. и др,, 1983).Коклюшную вакцину вводили подкожно собакам в дозе 10 млрд, кро¬
ликам и крысам — по 7 млрд клеток. Anatoocimm tetanicum (столбнячный
анатоксин) вводили подкожно собакам в дозе 10 ЕС, кроликам — 5 ЕС и
крысам — 3 ЕС. Сразу после инъекции вакцинных препаратов животным
внутривенно вводили NA-5 в водном растворе: собакам — в дозе 100 мг/кг,
кроликам и крысам — по 50 мг/кг. Через 8 дней после иммунизации опре¬
деляли титры антител методом пассивной гемагглютинации по Бойдену.Из данных таблицы 31 видно, что введение со1Юлимера животным
существенно повышает продукцию антител при вакцинации. Так, при
введении сополимера одновременно с иммунизацией столбнячным ана¬
токсином продукция антител по сравнению с контролем (только вакцина¬
ция) повышается: у собак более чем в 20 раз, у кроликов — в 4 раза, у крыс —
в 20 раз. Введение сополимера вместе с коклюшной вакциной повышает
титр антител по сравнению с контролем (только вакцинация): у собак —
в 12 раз, у кроликов — в 256 раз и у крыс — в 10 раз. Сделана попытка вос¬
становления иммунологической реактивности путем введения ПВП при
вторичной иммунологической недостаточности (Хаитов P.M. и др., 1975).Таблица 31В.11ияние NA-5 на продукцию антител у различных животных, иммунизирован¬
ных столбнячным анатоксином или коклюшной вакцинойЖивотныеЧисложивотныхВакцинаNA-5Титры антител
(log2), M±mСобаки6Столбнячный анатоксин—3,33±0,196То же+7,83±0,136Коклюшная вакцина-5,0±0,196Тоже+8,5±0,19Кролики11Столбнячный анатоксин—3,45+0,83иТо же+5,45+0,8310Коклюшная вакцина-0,6±0Д210То же+8,6±0,09Крысы12Столбнячный анатоксин—3,91±0,0812Тоже4-8,25±0,069Коклюшная вакцина-4,7±0,149То же+8,1±0Д1
314Глава S. Конъюгированные вакциныВ качестве модели вторичной иммунологической недостаточнос¬
ти использовали старых мышей, у которых иммунный ответ на ЭБ
снижен в 20—30 раз. Введение им ПВП в дозе 15 мг/кг практически не
влияло на накопление АОК в селезенке, а в дозе 50 мг/кг вызвало уве¬
личение количества АОК в селезенке до уровня, свойственного моло¬
дым мышам. Такие же данные получил А.М. Нажмитдинов (1982) при
обработке старых мышей разных линий NA-5. Известно, что возни¬
кающая в процессе старения вторичная иммунологическая недоста¬
точность обусловлена главным образом функциональным дефектом
Т-системы лимфоцитов, снижением интенсивности миграции ство¬
ловых клеток и Т-В-кооперации (Петров RB., Хаитов RM,, 1975).Учитывая данные о влиянии полиэлектролитов на отдельные
этапы иммуногенеза, можно сделать вывод о том, что их стимулирую¬
щее действие на иммунный ответ старых мышей связано с усилением
процессов клеточной кооперации и миграции. Введение NA-5 живот¬
ным с последующим вторичным иммунодефицитом усиливает их
способность к иммунному ответу (рис. 64).АОК X 10-3Рис. 64. Влияние КА-5 на продукцию АОК к ЭБ у сублетально (600 Р) облу¬
ченных мышей:1 — введение NA-5; 2 — контролы По оси абсцисс — время после облучения. По оси
ординат ~ число АОК на селезенку
8.2. Синтетические иммуномодуляторы для вакцин нового... 315В культуре клеток селезенок мышей in vitro индуцировали первич¬
ную продукцию антител против антигенов гетерологичных эритроци¬
тов (использовали ЭБ или водорастворимый антиген из ЭБ). Спустя 4-5
дней после «иммунизации» культур в них образовывалось от 500 до 1500
клеток, секретирующих специфические антитела против антигенов
ЭБ. В контрольных культурах (без антигена) вследствие поликлональ¬
ных митогенных и антигенных свойств эмбриональной телячьей сыво¬
ротки тоже формировалось некоторое количество АОК, специфичных
к ЭБ. Однако это «фоновое» число АОК (в расчете на 10^ живых клеток)
было обычно в 5—15 раз меньше, чем число АОК в иммунизированных
культурах. В описанной модельной системе мы изучили влияние ПАК
на продукцию АОК (Петров Р.В. и др., 1982; Хаитов Р.М, и др. [182]).Клетки обрабатывали оптимальной митогенной дозой ПАК
(50 мг/мл в бессывороточной среде) в течение 10 мин. Затем после
отмывания от полиэлектролита клетки помещали в культуральные
условия и стимулировали антигеном. Через 4 дня определяли число
АОК, специфичных к ЭБ, Аналогично в течение 30 мин индуцировали
начало пролиферативной реакции с помощью ЛПС или КонА, после
чего клетки отмывали центрифугированием, помещали в условия
культуры in vitro и добавляли антиген — ЭБ.Предварительное воздействие на клетки селезенки ПАК приво¬
дило к заметному увеличению их ответа на последующее внесение в
культуру антигена. Число АОК в культурах, обработанных ПАК, по
сравнению с контролем (без обработки ПАК) было выше в 2—3 раза
(рис. 65).Увеличение времени присутствия ПАК в культурах антигенсти-
мулированных клеток приводило к ингибированию продукции АОК.
Неожиданно было обнаружено вместо адъювантного выраженное
депрессивное действие митогенного влияния ЛПС. В течение 10 мин
клетки инкубировали в присутствии ЛПС, агент отмывали от внекле¬
точной среды. Выще было показано, что такое воздействие приводит
к запуску деления большого числа В-клеток в популяции клеток
селезенки. Но через 10 мин клетки еще не вышли в цикл, они лишь
получили митогенный сигнал. В это время добавление антигена уже
не приводило к продукции антител. Клетки отвечали на ЛПС акти¬
вацией деления, но не отвечали на ЭБ дифференцировкой в специ¬
фические АОК. Не было ответа на антиген и в случае одновременного
внесения в культуры ЛПС и водорастворимого антигена ЭБ, И в этом
случае развивался только митогенный ответ на ЛПС.
шГлава 8. Конъюгированные вакциныРис. 65. Влияние иолиэлектролитов и митогенов на первичный синтез анти¬
тел в культуре клеток т у/'/го:К'1етки инкубировали в течение 10—30 мин с митогенными дозами ПАК (2), ЛПС (3),
КонА (4), отмывали 3 раза центрифугированием в среде 199, после чего переносили в
кулыпуральную среду, содержащую водорастворимый антиген из ЭБ. 1 — продукция
АОК, специфичных к антигенам ЭБ, в контролышх культурах, не активированных
митогеном. По оси абсцисс — время инкубирования. По оси ординат — число АОК на
¡(^ клеток селезенкиВозникло предположение, что ЛПС активирует деление клеток,
обладающих способностью угнетать иммунный ответ, иначе говоря,
клеток-супрессоров. Спустя 1 или 2 дня гюсле активации культур
клеток селезенки ЛПС мы получали ЛПС-активированные клетки,
отмывали их и переносили в культуры сингенных клеток селезенки,
активированные антигеном. И в этом случае ЛПС-активированные
Н.2. Синтетические иммуномодуляторы для вакцин нового... 317клетки ингибировали иммунный ответ равного количества антиген-
активированных клеток селезенки.Интересно, что в культурах клеток, предварительно обработанных
КонА, еше в большей мере угнетался иммунный ответ (см. рис. 61).
при переносе клеток из КонА-стимулированных культур в антиген-
стимул ирован ные было установлено, что иммунодепрессивная актив¬
ность обеспечивается функционированием КонА-С1 имулированных
клеток. Однако этот факт не столь удивителен, так как хорошо из¬
вестно существование супрессорных клеток, активирующихся КонА.Весьма интересно, что кратковременная обработка клеток селезен¬
ки ПАК приводила к еще более выраженному адъювантному эффекту
в случае использования субоптимальных доз антигена (водораствори¬
мого антигена из ЭБ). Так, при введении субоптимальных концентра¬
ций (10 мкг/мл) этого антигена в культурах образовывалось в 4—5 раз
меньше АОК, чем при использовании оптимальной дозы (50 мкг/мл).
Предварительное воздействие на клетки ПАК увеличивало количест¬
во антителопродуцентов в 3,5-4 раза в культурах с низким содержани¬
ем антигена, т.е. приводило к развитию иммунного ответа, близкого к
оптимальному. В культурах, не содержащих антигена, клетки, пред¬
варительно подвергнутые воздействию ПАК, формировали довольно
большое количество клеток, секретирующих специфические антите¬
ла против антигенов ЭБ. Это действие ПАК можно было расценивать
как поликлональную активацию дифференцировки АОК. Однако
нельзя забывать, что в культуральной среде содержалась эмбрио¬
нальная телячья сыворотка, имеющая перекрестные антигены с ЭБ,
т.е. обнаруженное действие ПАК в культурах, в которые не вносили
антиген ЭБ, могло быть следствием не поликлональной активности, а
адъювантного действия полимера.Для более детального анализа поликлональной активности ПАК
мы исследовали содержание клеток, секретирующих антитела к цело¬
му спектру антигенов, в культурах, стимулированных или не стиму¬
лированных ПАК (Петров Р.В. и др., 1983). Определяли число АОК,
специфичных к ЭБ, к гаптену тринитрофенилу (ТНФ), к Н-антигену
из Salmonella typhimurium (штамм 415), к О-антигену из того же штам¬
ма сальмонелл и к Vi-антигену из Salmonella typhi. Установлено, что
предварительная обработка клеток ПАК значительно увеличивает
образование АОК против ТНФ или ЭБ в культурах, которые не содер¬
жали антигена. Число АОК, специфичных к антигенам сальмонелл,
было чрезвычайно мало. Не наблюдалось какого-либо заметного уве¬
318Глава 8, Конъюгированные вакциныличения их числа под действием ПАК. По-видимому, этот результат
можно расценивать как доказательство в пользу скорее адъювантного,
чем поликлонального действия ПАК. Иначе говоря, обработка клеток
ПАК приводила к повышению числа АОК к тем антигенам, которые
содержались в небольших концентрациях (эмбриональная телячья
сыворотка содержит антигены, дающие перекрестные реакции с ЭБ и
с ТНФ). ЛПС тоже незначительно увеличивал число АОК против ЭБ и
ТНФ, но не вызывал продукции АОК против микробных антигенов.Влияние на клеточный иммунитет. Р.В. Петров и соавт. [128]
исследовали влияние КА-5 на индукцию ГЗТ к ЭБ. ГЗТ вызывали
путем внутривенной сенсибилизации мышей 0,2 мл 1%-ной суспен¬
зии ЭБ с последующей внутрикожной инъекцией в подущечки лап
25 мкл 10%-ной суспензии ЭБ. Через 24 ч оценивали интенсивность
ГЗТ по припухлости подушечки лап, размеры которой определяли
микрометром. Оказалось, что введение NA-5 вместе с ЭБ в момент
сенсибилизации стимулирует развитие ГЗТ в ответ на ЭБ (рис. 66).
Аналогичный эффект наблюдается при введении ЫА-5 через 1—2 дня3 4
Время, сутРис. 66. Влияние ЫА-5 на ГЗТ к ЭБ в зависимости от времени введения пре¬
парата относительно иммунизации мышей линии СВА;
по оси абсцисс — время введения сополимера относительно момента иммунизации
ЭБ, в сут. К — контроль; по оси ординат — величина припухлости лапки, в которую
вводили антиген, % от толщины контрлатеральной лапки
8.2. Синтетические иммуномодуляторы для вакцин нового...319после сенсибилизации животных ЭБ, Однако предварительное вве¬
дение сополимера за 1-4 дня до сенсибилизации приводит к угнете-
II иго ГЗТ. Так, введение NA-5 за 4 дня до сенсибилизации животных
ЭБ обеспечивает почти полное подавление ГЗТ. Но дополнительное
«ведение сополимера в момент повторной инъекции ЭБ полностью
снимает супрессию, индуцированную этим же сополимером при
предварительной его инъекции.Таким образом, введение синтетического полианиона в момент
иммунизации приводит к стимуляции специфической ГЗТ незави¬
симо от того, вводился ли этот полимер интактным мышам или же
животным, ранее получившим его.Л.И. Хаустова и соавт. (1979) изучали влияние поликатиона ПВП на
нормальные киллерные Т-лимфоциты, блокирующие размножение
стволовых клеток in vivo. Показано, что ПВП усиливает киллерную
активность Т-клеток, направленную против несингенных стволовых
клеток. Исследовали влияние ПВП на инактивацию Т-лимфоцитами
мышей линии СВА стволовых клеток мышей линии C57BL и, наобо¬
рот, на инактивацию Т-клетками мышей линии C57BL стволовых
мементов генотипа СВА (табл. 32, 33). ПВП, введенный реципиентам,
[ЮЛучившим смесь аллогенных Т-лимфоцитов и стволовых клеток,
существенно повышает киллерную активность лимфоцитов на фоне
слабовыраженной инактивации.Таблица 32Влияние ПВП на инактивирующую активность лимфоцитов генотипа СВА,
направленную на СК генотипа С57ВЬДоза и генотип
трансплантирован¬
ных клетокСоотно¬шениеклетокСреднее число колоний
в селезенке реципиентовИндекс
инактивации,%СВА (лу)C57BL(км)в смесиконтроль¬ныхполучившихПВПКонтрольОпыт-1x10^-5,7±0,2 (32)9,5±0,2 (28)--1x10^1x10^1:15,4±0,2 (19)5,8±0,3 (20)33335x10^1x10^5:12,9±0,1 (31)1,1±0,06 (23)88,588,51x10*^1x10=Ш;10(10)0(10)100100Примечание: л у — лимфатические узлы; км — костный мозг. В скобках — число реци¬
пиентов.
320Глава 8, Конъюгированные вакциныТаблица 33Влияние ПВП на инактивирующую активность лимфоцитов геногииа С57ВЬ,
направленную на стволовые клеткн генотипа СВАДоза и генотип
трансплан¬
тированных
клетокC57BL,луСВА,кмСоотно¬
шение
клеток
в смесиСреднее число колоний в
селезенке реципиентовконтрольныхполучившихПВПИндексинактивации,КонтрольОпыт5x10^^2,5x10^5x10^5x10^^5x10^^5x10^ЗхЮ“»1;15:110;J23±0,5 (8)
22+0,5 (9)
22,3+0,4 (10)
18,5±0,4(10)35±0,6 (6)
25,7±7 (8)
21,7±0,7 (8)
17,7±0,7(10)3.52.6
24,526,33549,5Примечание; лу — лммфатическис узлы; км — костный мозг. В скобках — число реци¬
пиентов.Обработка ПВП лимфоцитов in vitro усиливает инактивацию ство¬
ловых клеток менее значительно. Результаты этих исследований пока¬
зали, что усиливающее влияние ПВП на инактивацию несингенных
стволовых клеток лимфоцитами наиболее четко проявляется при
введении поликатиона одновременно с переносом клеточной смеси
реципиентам. Это свидетельствует о том, что повышение инактивации
стволовых клеток киллерными Т-клетками максимально проявляется
в присутствии поликатиона в среде взаимодействующих клеток.Коррекция иммунного ответа у аутоиммунных мышей. У мышей
линии NZB и у мышей (NZBxNZW)F, (NZB/W) спонтанно разви¬
вается генетически детерминированное аутоиммунное заболевание
с продукцией аутоантител к эритроцитам, Т-лимфоцитам и нукле¬
иновым кислотам. Животные погибают в 14—18-месячном возрасте
в результате гемолитической анемии, малигнизации лимфоидных
тканей и нефрита, вызванного иммунными комплексами. Развитие
аутоиммунных процессов у мышей NZB и NZB/W сопровождается
угнетением иммунного ответа на гетерологичные ТЗА и усилением —
на ТНА. Иначе говоря, у аутоиммунных мышей наблюдается явное
нарушение регуляции иммуногенеза, т.е. развивается выраженный
дисбаланс иммунорегуляторных механизмов. Показано, что этот
дисбаланс является суммарным результатом сложных комплексных
процессов и проявляется на различных этапах иммуногенеза. Так, у
мышей NZB/W развитие аутоиммунных процессов ассоциируется с
8.2, Синтетические иммуномодуляторы для вакцин нового...321нарушением процессов миграции и дифференцировки кроветворных
стволовых клеток, регуляторного действия Т-супрессоров, В-суп¬
рессоров костного мозга и лимфатических узлов, снижением числа и
функциональной активности Т-хелперов (см. Петров Р.В. и др. [119]).Следует отметить, что аутоиммунный процесс у мышей NZB/W раз¬
вивается с 3-4-месячного возраста, достигая максимума манифестации
в 10—П мес. Поэтому использование молодых (здоровых) 1,5-2-, 4-5- и
10—U-месячных мышей позволяет вести исследования в норме, в начале
развития аутоиммунной патологии и в ее терминальной стадии.Из данных таблицы 34 видно, что у мышей NZB/W в возрасте4 мес миграция стволовых клеток из костного мозга усилена по срав¬
нению с этим процессом у здоровых 2-месячньтх животных. Однако
в возрасте 10—11 мес миграция стволовых клеток резко снижается.
Показано, что у мышей NZB/W при старении в процессе развития
аутоиммунной патологии наряду с уменьшением ч исла мигрирующих
из костного мозга стволовых клеток (вследствие снижения их абсо¬
лютного числа) имеет место истинное угнетение миграции стволовых
элементов (Хаитов P.M. и др., 1980). Введение мышам всех возрастных
rpyjui сополимера АК и N-ВПД (NA-5) усиливает миграцию стволо¬
вых клеток, причем наиболее значительно у 10-11-месячных мышей.
При этом у 10—11-месячных мышей, которым инъецировали NA-5, из
костного мозга выселяется такое же количество стволовых клеток, как
и у здоровых (2-месячных) особей, не получивших сополимера,Таблица 34Влияние NA-5 на миграцию стволовых клеток у мышей NZB/W
разного возрастаВозраст, месЧисло животныхВведение NA-5Число колоний в селезенке210-11,9 (9,6-14,2)29+18,8 (17,4^20,2)48-16,3(12,2-^20,4)410+23,1 (21,0-24,2)10-1110-5,0 (3,7-6,3)10-1111+12,2(10,7-13,7)Изданных таблицы 35 видно, что клетки лимфатических узлов (пре¬
имущественно Т-клетки) и костного мозга (преимущественно В-клет¬
ки) у старых (10—11-месячных) мышей с аутоиммунным заболеванием
практически не кооперируют. Использование рецинрокных сочетаний
322Глава 8. Конъюгированные вакциныдоноров костного мозга и доноров лимфатических узлов разного воз¬
раста показало, что неспособность к Т-В-кооперации у старых аутоим¬
мунных мышей опосредуется на уровне клеток лимфатических узлов.Таблица 35Влияние NA-5 на взаимодействие Т- и В-лимфоцитов мышей NZB/W
разного возрастаВозраст доноров, месКлетки км
(10x10«)Клетки лу
(1x10«^)ВведениеNA-5Числореципиен¬товЧисло АОК
на селезенку2210-110-110-1Ш-12210-110-110-110-110-110-110-110-122101010101010910
10
10
10
10
10
10
10
10363.4 (308,8-418,0)1002.3 (944,U1160,5)429.1 (376,4^481,5)
553,3 (483,8^624,0)5307,2 (4793,7^5820,7)
11092,2(10269,5^12914,9)107.7 (87,3-128,1)769.1 (683,4-854,8)179.1 (143,3-214,9)297.7 (247,7-340,7)
503,6(445,5-511,7)2498.4 (2166,3-2830,5)904.5 (866,4-942,6)
2378,6 (2032,0-2725,2)
4968,8 (4716,9-5220,7)
10190,3 (8805,9-11374,7)Примечание: л у — лимфатические узлы; км — костный мозг.Иначе говоря, с развитием аутоиммунной патологии у мышей NZB/W
нарушается хелперная функция Т-лимфоцитов, однако пул костно¬
мозговых В-клеток — предшественников АОК при этом сохраняет свою
активность. Поэтому представлялось вполне логичным попытаться ком¬
пенсировать дефицит Т-хелперов у аутоиммунных мышей введением им
NA-5, который обладает способностью замещать хелперную функцию
Т-лимфоцитов и усиливает Т-В-кооперацию при иммунном ответе.
Вместе с тем было выявлено повышение супрессорной активности кле¬
ток лимфатических узлов старых мышей. В этой связи следует вспомнить,
что NA-5 снижает или отменяет эффект супрессорных клеток в различ-
8.2. Синтетические иммуномодуляторы для вакцин нового...323ных экспериментальных системах. Введение NA-5 реципиентам, полу¬
чившим клетки костного мозга, среди которых содержатся В-лимфоци¬
ты, но практически нет Т-лимфоцитов, повышает выход АОК в 3-7 раз
(см. табл. 35). Это коррелирует с данными о том, что ЫА-5 способен
замещать функцию Т-хелперов. Введение КА-5 реципиентам клеток
лимфатических узлов повышает выход АОК всего в 1,3—1,6 раза, что
объясняется низким абсолютным числом В-клеток в трансплантиро¬
ванной суспензии. Инъекция NA-5 реципиентам смеси кооперирующих
Т- и В-клеток повышает число АОК в 2 раза. Пятикратная стимуляция
накопления АОК наблюдается при введении КА-5 реципиентам, полу¬
чившим смесь Т- и В-лимфоцитов 10—11-месячных доноров. Сильная
стимуляция Т-В-кооперации наблюдается и при введении NA-5 реци¬
пиентам, получившим клетки костного мозга от 2-месячного донора, а
лимфатических узлов (дефект Т-хелперов) — от 10—11-месячных живот¬
ных. При введении КА-5 реципиентам, получившим клетки костного
мозга от 10-11-месячных доноров и лимфатических узлов от 2-месячных
животных (нормальная активность Т-хелперов), наблюдается такая же
стимуляция продукции АОК, как и в случае переноса клеток костного
мозга и лимфатических узлов от нормальных 2-месячных животных.Таблица 36Влияние NA-5 на супрессорную активность клеток
лимфатических узлов старых мышей NZB/WТрансплантированные клетки (х10^)Введе¬ниеNA-5Числореци¬пиен¬товЧисло АОК
на селезенкуКмЛуВозраст доноров, мес2210-11101-144206,2 (3746,2-4666,2)1010--158750,0 (8210,0-9290,0)1011-145055,0(4615,0-5495,0)1015-121020,6 (760,5-1280,7)10110-12280,2 (240,2-320,2)101--1-И11092,2(10269,5-11914,9)1010-+1013138,0 (12409,0-13867,0)10Ї1+810311,2 (9567,9-11054,5)1015+148580,5 (7840,5-9520,5)10110+121868,0 (1298,0-2438,0)Примечание: яу — лимфатические узлы; км — костный мозг.
324 Глава 8. Конъюгированные вакциныТаким образом, сополимер NA-5 усиливает Т-В-кооперацию и
замещает в определенной степени функцию Т-хелперов у мышей с
аутоиммунным заболеванием.Для изучения влияния NA-5 на супрессорные клетки аутоим¬
мунных мышей к эффективно взаимодействующим клеткам лим¬
фатических узлов (Т-лимфоциты) и костного мозга (В-лимфоциты)
молодых 2-месячных мышей NZB/W добавляли разные дозы клеток
лимфатических узлов старых мышей (Петров Р.В. и др., 1983). Клетки
лимфатических узлов старых мышей проявляют выраженную имму-
носупрессивную, но не хелперную активность. Из таблицы 36 видно,
что такие клетки, добавленные к клеткам лимфатических узлов
молодых мышей в соотношении 1:1, не влияют на Т-В-кооперацию
у молодых доноров. Однако повышение дозы клеток лимфатических
узлов старых доноров (соотношение 5:1 и особенно 10:1) приводит к
супрессии кооперации Т- и В-клеток молодых доноров. Результаты
этих опытов показывают, что снижение кооперативной способности
Т- и В-лимфоцитов у мышей NZB/W при развивающемся аутоиммун¬
ном поражении связано, по-видимому, не только с количественным
или функциональным дефицитом Т-хелперов, но и с повышением
супрессорной активности, Введение реципиентам, у которых имеет
место супрессия Т-В-кооперации под влиянием клеток лимфатиче¬
ских узлов старых доноров, сополимера NA-5 существенно снижает
эффект супрессии иммуногенеза.В свете современных знаний о патогенезе аутоиммунных про¬
цессов коррекция иммунологического статуса при аутоиммунной
патологии требует избирательного восстановления нарушенных про¬
цессов иммуногенеза, а не подавления или стимуляции иммунного
ответа в целом.В свнзи с тем, что NA-5 корригирует процессы иммуногенеза,
нарушенные при аутоиммунной патологии, сделана попытка вос¬
становления иммунного ответа у мышей NZB/W на гетерологич-
ный Т-зависимый антиген ЭБ при помощи этого полиэлсктролита.
NA-5 значительно усиливает продукцию АОК к ЭБ у мышей с раз¬
вивающейся аутоиммунной патологией в ее терминальной стадии
(табл. 37).Таким образом, введение NA-5 аутоиммунным мышам обеспечи¬
вает в значительной степени коррекцию нарушенных при аутоиммун¬
ном поражении звеньев иммуногенеза и содействует восстановлению
иммунного ответа на ТЗА.
8,2. Синтетические иммуномодуляторы для вакцин нового.,.325Таблица 37Влияние NA-5 на иммунный ответ мышей NZB/W разного возрастаВозраст, месВведениеNA-5ЧисложивотныхЧисло АОК на селезенку224-54-510-1110-П999991275084,3 (63134,5-88455,3)
135860,8 (104-559,4-176532,8)
56266,6 (46804,4-67641,8)117219,5 (98446,4-139372,5)952,7 (749,2-1211,7)
12589,2 (10396,8-15244,0)Получены данные о том, что «лечение» аутоиммунных мышей
сополимером NA-5 снижает у них титры сывороточных аутоантител
к эритроцитам, тестированным методом Кумбса (Нажмитдинов Л.М.,
1982). Иначе говоря, восстановление иммунного статуса аутоиммунных
животных, в частности функциональная коррекция клеток иммунной
системы, сопровождается снижением аутоиммунного процесса.Приведенные в настоящем разделе результаты коррелируют с дан¬
ными I.D. Taurog и соавт. (1981) о том, что дефекты лимфоцитарных
популяций у мышей линии NZB первичны и развиваются независимо
от аутоиммунного процесса, который является следствием этих нару¬
шений. Путем прямого и возвратного скрещивания мышей линии NZB
с CBA/N в геном мышей NZB введена Х-хромосома мышей CBA/N,
которая несет ген xid, определяющий неспособность В-клеток к про¬
дукции аутоантител. Полученные от скрещивания мыши, несущие
все аутосомные гены NZB за исключением Х-хромосомы, не способны
вырабатывать аутоантитела к эритроцитам, Т-клеткам, ДНК, у них
нет признаков поражения внутренних органов и они характеризуются
нормальной выживаемостью. Вместе с тем мыши (NZBxCBA/N)Fi
имеют все патологические изменения Т-клеток, которые характерны
для животных линии NZB. Это, во-первых, свидетельствует о воз¬
можности изучения регуляторных дефектов Т-клеток мышей линии
NZB в отсутствие аутоантител к Т-клеткам и других аутоантител и,
во-вторых, показывает, что патология Т-клеток у мышей NZB не свя¬
зана с гиперактивностью В-клеток, т.е. с повышенной продукцией
аутоантител, в частности направленных против Т-клеток.Проблема получения нетоксичных иммуностимулирующих поли¬
электролитов. Б свете рассматриваемых в настоящей книге перс¬
326 Глава 8. Конъюгированные вакциныпектив использования полиэлектролитов возникает естественный
вопрос о токсичности полимерных иммуностимуляторов и об их
конечной судьбе в организме. Применение описанных выше мембра¬
ноактивных полиэлектролитов, а также построенных с их участием
искусственных антигенов и вакцин (см. следующие главы) не встре¬
чает затруднений при иммунизации животных с целью получения
соответствующих антисывороток и антител. Так, конъюгирование
полиэлектролитов с низкоиммуногенными белками (например, мат-
риксный белок вируса гриппа) или пептидами (синтетические пеп¬
тиды вируса гриппа, лимфоцитотропного ретровируса Т-клеток —
ТАУ/НТЬУ-П1) явилось эффективным способом получения гибри¬
дов, продуцирующих соответствующие моноклональные антитела
(Петров Р.В. и др. [138]; Лиознер А.Л, и др., 1986). Однако и проблема
клинического использования полимерных иммуностимуляторов, в
том числе искусственных антигенов и вакцин, построенных на их
основе, вполне разрешима. Отсутствие жестких структурно-хими¬
ческих требований к полимерным иммуностимуляторам в плане
достижения основного иммунологического эффекта позволяет вести
широкий поиск с целью уменьшения или полной отмены побочных
эффектов (Кабанов В.А. и др., 1984).В настоящее время на основании знаний о важнейших свойс¬
твах иммуностимулирующих полимеров и механизмах реагирова¬
ния иммунокомпетентной клетки мы можем выбрать или создать
оптимальную иммуностимулирующую структуру, которая способна
обеспечить сильный адъювантный эффект при запуске иммунного
ответа. Направленность действия этой адъювантной структуры на
специфический клон иммунокомпетентных клеток обеспечивает¬
ся объединением ее с антигенной детерминантой, против которой
необходимо индуцировать специфическую иммунную реакцию.
Что же касается задачи синтеза или подбора адекватных полимерных
иммуностимуляторов, которые были бы способны через определен¬
ный промежуток времени расщепляться (биодеградировать) и пол¬
ностью выводиться из организма, то она относится к области химии
полимеров и ее решение не вызывает каких-либо принципиальных
трудностей (Кабанов В.А. и др., 1984). Один из многих практически
реальных путей заключается, например, в следующем. Теперь, когда
в результате использования синтетических полимерных иммуно¬
стимуляторов самого различного строения сформулирован общий
принцип создания и функционирования искусственных антигенов
8.2. Синтетические иммуномодуляторы для вакцин нового... 327и вакцин нового типа (см. следующие главы), можно, руководствуясь
этим принципом, в качестве полиэлектролитных компонентов при¬
менить основные или кислые биодеградирующие природные или
синтетические полимеры и именно их комбинировать с заданными
антигенными детерминантами. Надо подчеркнуть, что такие неток¬
сичные биодеградирующие полимерные иммуностимуляторы созда¬
ны и используются в качестве встроенной адъювантной компоненты
в составе искусственных вакцин против гриппозной и сальмонел-
лезной инфекций (см. главу 10).Примерами, демонстрирующими принципиальную возможность
создания нетоксичных иммуностимулирующих иолиэлектролитов,
могут служить, в частности, уже упоминавшиеся сополимеры АК и
N-ВПД, которые практически лишены токсических свойств, но сохра¬
няют иммуностимулирующую активность [89J. В качестве компонен¬
та, «разбавляющего» цепь ПАК и снижающего ее токсичность, был
выбран N-ВПД. Известно, что его гомополимеры широко применяют
в клинической практике в качестве детоксиканта-кровезаменителя.
Вместе с тем N-ВПД обладает высокой комплексообразующей способ¬
ностью и растворим в воде. Полагали, что включение звеньев N-ВПД
в цепочку ПАК позволит уменьшить токсичность полиэлектролита с
сохранением иммуностимулирующей активности. Полученные сопо¬
лимеры различного состава представляют собой слабые полианионы,
хорошо растворимые в воде при нейтральных значениях pH. Общая
формула сополимеров следующая:(-СН2-СН-)„- (-СН2-СН-)„СООНс=оИз данных таблицы 38 видно, что сополимеры АК и N-ВПД про¬
являют различную степень токсичности. Токсичность снижается по
мере уменьшения содержания в них звеньев АК. LD^q для сополимеров
NA-5 и NA-6 была очень мала, т.е. это уже практически нетоксичные
вещества. Таким образом, методом радикальной сополимеризации
АК и N-ВПД удалось получить ряд сополимеров, существенно стиму¬
лирующих отдельные этапы иммуногенеза. Наиболее важным явля¬
328 Глава 8. Конъюгированные вакциныется то, что среди этих сополимеров выявлены практически неток¬
сичные NA-5 и NA-6, сохраняющие, однако, иммуностимулирующие
свойства ПАК. Следует подчеркнуть, что токсичность сополимеров
находилась в прямой зависимости от процентного содержания в них
звеньев АК — при их снижении с 91 до 25 токсичность уменьшалась в11,5 раза.Клеточные механизмы иммуностимулирующего действия сополи¬
меров АК и N-ВПД сходны с механизмом действия ПАК (см. выше).Разумеется, приведенный конкретный пример — лишь частный
случай. В целом можно полагать, что контролируемое «разбавление»
катионо- или анионогенных звеньев в макромолекулах инертны¬
ми гидрофильными звеньями — общий путь поиска необходимой
«вилки» между уровнями острой токсичности и достаточно выражен¬
ного иммуностимулирующего действия.8,3. КОНЪЮГИРОВАННЫЕ АНТИГЕН-ПОЛИМЕРНЫЕ
ИММУНОГЕНЫОписанные выше полиэлектролиты с контролируемой структу¬
рой являются веществами с выраженными иммуноадъювантньтми
свойствами. Усиление иммунной реакции при их введении складыва¬
ется из стимулирующего действия полиэлектролита на многие этапы
иммуногенеза и, что особенно важно, на пролиферацию и диффе¬
ренцировку отдельных иммунокомпетентных клеток. Обоснованная
выше возможность локализации активирующего действия полиэлек¬
тролита на клоне антигенсвязывающих клеток предполагает возмож¬
ность объединения двух составных частей ~ антигенной детерми¬
нанты и полиэлектролита — в единую молекулярную конструкцию.
Характеристика действия таких комплексов и особенности ответа на
их введение рассмотрены ниже.8.3.1. ГАПТЕН-ПОЛИЭЛЕКТРОЛИТБыли синтезированы соединения, в которых известные гаптены вве¬
дены в чисто синтетические неприродные макромолекулы (Петров Р.В.
и др. [104]). в качестве высокомолекулярных носителей (матрицы), обус¬
8.3. Конъюгированные антиген-полимерные иммуногены329ловливающих проявление иммуногенных свойств гаптена, были выбра¬
ны поли-2-метил-5-винилпиридин (ПМВП) и поли-4-винилпиридин
(ПВП) с молекулярной массой Ю“' Д, полученные радикальной полиме¬
ризацией соответствующих мономеров. Для определения иммуногенных
свойств синтезированных комплексов тринитрофенила (ТНФ) с поли¬
электролитом (ТНФ—ПМВП и ТНФ—ПВП) животных иммунизировали
различными дозами этих соединений и определяли продукцию АОК,
розсткообразующих клеток (РОК), экспрессирующих рецепторы к ТНФ,
и титры гемагглютининов к использованным комплексам при помощи
тринитрофенил ирован ных ЭБ. Оказалось, что комплекс ТНФ-ПМВП
(пикрат ПМВП) обладает выраженными антигенными свойствами.
Число АОК и РОК к ТНФ, которые накапливаются в селезенке мышей,
иммунизированных этим соединением, зависит от используемой дозы
ТНФ-ПМВП. Исследование уровня антител к ТНФ в сыворотке живот¬
ных показало, что максимальные титры регистрируются при введении
500 мкг ТНФ-ПМВП. Пикрат ПВП, полученный непосредственно из
ПВП и пикриновой кислоты, также обладал антигенными свойствами и
индуцировал продукцию АОК и синтез антител к ТНФ.Таблица 38Определение острой токсичности сополимеров АК и N-ВПДПрепаратАК,%Число мышейLD50, мг/кгТоксичностьИзотони¬
ческий р-р
натрия хло¬
рида018НетоксиченПАК1001870ТоксиченNA-l9118100NA-28518120— «*> —ЫА-З7018225МалотоксичснNA-46918350■■КА-54524625НетоксиченNA-62524800— ««> —Пoли-N-BПД0182500Следует отметить, что иммунизация животных гаптенами на бел¬
ковых носителях (БСА, глобулин и др.) приводит к развитию выра¬
женного иммунного ответа только при совместной инъекции их с адъ¬
330Глава 8. Конъюгированные вакциныювантами, стимулирующими иммунные реакции (например, ПАФ
и др.). Введение же пикрата ПМВП или ПВП обеспечивает развитие
иммунного ответа в отсутствие адъювантов.В качестве примера опищем получение и антигенные свойства
ТНФ-ПМВП (Петров Р.В. и др. [104]). При взаимодействии ТНФ и
ПМВП в растворе сразу образуется прочный солевой комплекс, ста¬
билизированный частичным переносом заряда с электрондонорного
мономерного звена на нитрофенолят-анион, являющийся электроно-
акцептором:СНд - СН - CHj - СН
'Н-CHg-CH-..,СН,©N-HСН,Реагенты смешивали в соотношении, при котором на каждые
100 звеньев ПМВП приходилось около 18 звеньев, несущих нитрофе¬
нолят-анионы. Нормальных мышей иммунизировали полученным
препаратом. В контрольных опытах проводили раздельные инъекции
одного или обоих компонентов. Об иммунологической активности
комплекса ТНФ с ПМВП можно судить по данным, приведенным в
таблице 39. Конъюгат ТНФ-ПМВП вызывает достаточно сильный
иммунный ответ. Проверка на специфичность показала, что образу¬
ются АОК, специфичные по отношению к ТНФ. Раздельные инъек¬
ции гаптена и носителя не дают эффекта. Повторная иммунизация
конъюгатом ТНФ-ПМВП приводит к сильно выраженному иммун¬
ному ответу по вторичному типу (анамнестическая реакция) с обра¬
зованием IgM- и IgG-AOK. Иначе говоря, искусственный антиген
ТНФ-ПМВП вызывает формирование сильно выраженной иммуно¬
логической памяти. Принципиально такие же результаты получали
8.3. Конъюгированные антиген-полимерные иммуногены331при иммунизаиии животных пикратом ПВП, полученным смешива¬
нием метанольного раствора ПВП с молекулярной массой 97 тыс. Д
с метанольным раствором пикриновой кислоты. Количество пик¬
риновой кислоты составляло 20 мол% по отношению к мономерным
звеньям ПВП.Иммуногенность комплекса ТНФ-ПМВПТаблица 39ИммуногенДоза иммуногена,
МкгЧисло антител,
специфичных к ТНФ{ 100800±100ТНФ-ПМВП1 1502300±2001 5003200+200ТНФ30140±25ТНФ + ПМВП70+70100±20(раздельныеинъекции)Фон (инъекиия-200±20изотоническогораствора хлорида натрия)8.3.2. ГАПТЕН-НЕИОНОГЕННЫЙ ПОЛИМЕРПомимо изучения особенностей иммунного ответа, индуцирован¬
ного комлексом гаптен-полиэлектролит, представляло интерес изу¬
чить свойства конъюгатов, в которых в качестве носителей гаптенной
группы используется не полиэлектролит, а водорастворимый неионо¬
генный полимер. В качестве такового был выбран полиэтиленгликоль
(ПЭГ). Известно, что он обладает способностью взаимодействовать
с билипидным слоем клеточных мембран. Полагают, что такая уни¬
кальная активность этого полимера по сравнению с другими водо¬
растворимыми неионогенными полимерами (например, декстраном)
обусловлена его повышенной способностью сольватировать полярные
головки липидов. Использование ПЭГ в качестве носителя антиген¬
ных детерминант перспективно также, учитывая его нетоксичность.
332 Глава 8. Конъюгированные вакциныПЭГ находится на концах полимерной цепи, позволяет фиксировать
определенные положения вводимых гаптенных групп.Ниже изложены результаты исследований (Кабанов В.А. и др.,
1984) по изучению иммуногенных свойств моно- и дизамещенных
нитроароматических производных ПЭГ. Синтезированы два типа
конъюгатов ПЭГ с различными нитроароматическими группиров¬
ками: дигаптенные производные на основе промышленных образ¬
цов ПЭГ с разной молекулярной массой, содержащих две концевые
гидроксильные группы (I), и моногаптенные производные на основе
ПЭГ, имеющих одну гидроксильную группу (II). Общая структурная
формула ПЭГ:НОН2С - ( - CHj - О -СН^-- СН., “ СН..ОНФормулы соответствующих производных;гг (СН2ОСН2) гг {})R (CHjOCHjínñ ГГ (II).где ГГ — гаптенная группа; К — концевая группа С4Н9О или НООС—;
п - степень полимеризации, равная 450 (ММ 2x10'') или 900 (ММ
4x10'*).В данной работе в качестве гаптенных групп использовали
2,4-динитрофенилъные (ДНФ),2,4,6- тринитрофенильные (ТНФ)
8,3. Конъюгированные антиген-полимерные иммуногены333и 2,4,6-тринитрофенилэтилъные группировки (ТНФЭ)..N0,о,м-СН^СНзНаряду с линейными производными ПЭГ был изучен также конъ¬
югат циклического полиэтиленоксида (ПЭО), синтез которого осу¬
ществляли по следующей схеме:СНг) О
О Н—С—ОН
СНг)п СНг{С2Нб)зМН—і—о ^—N02СНг) 9оСНг)п СН2)пДля всех конъюгатов получены молекулярно-массовые характерис¬
тики, свидетельствующие о том, что химическая модификация ПЭГ
не сопровождается деструкцией и сшиванием полимерных цепей.
Содержание гаптенных групп в конъюгатах в случае ДНФ-производ-
ных изучали путем их гидролитического расщепления с последую¬
щим фотометрическим определением выделившегося 2,4-ДНФ.Конъюгаты ПЭГ с нитроароматическими группами и чистый ПЭГ
в изотоническом растворе хлорида натрия вводили однократно внут¬
ривенно в зависимости от цели эксперимента в дозах от 5 до 5 тыс. мкг
334 Глава 8. Конъюгированные вакцинына мышь. Для подтверждения ТНФ-специфичности АОК использо¬
вали метод подавления образования «бляшек» с нагруженными ТНФ
эритроцитами при добавлении в агарозу ТНФ,7-БСА.Однократная иммунизация мышей ТНФЭ-монопроизводным ПЭГ
с молекулярной массой 2x10'* приводила к накоплению в селезенке
ТНФ-специфичных АОК (рис. 67 а). Выявлена дозовая зависимость
выработки АОК против ТНФ: при увеличении дозы от 5 до 1 тыс. мкг
количество АОК возрастало с 3300±200 до 10 500±380 (фоновый уро¬
вень 1970±100). Введение мышам ПЭГ с молекулярной массой 2x10'^ в
дозе 1 тыс. мкг приводило к незначительному повышению числа АОК
против ТНФ. Изучена дозовая зависимость накопления ТНФ-специ¬
фичных АОК при иммунизации мышей ДНФ-дизамещенным произ¬
водным ПЭГ (ДНФз-ПЭГ) с молекулярнрой массой 4x10"* (рис. 67 б).
При увеличении дозы ДНФз-ПЭГ с 5 до 1000 мкг наблюдалось лишь
незначительное повышение накопления АОК против ТНФ по сравне¬
нию с фоновым уровнем (в 1,7 раза): число АОК возрастало до 2370±170
при фоновом значении 1390±100. При увеличении дозы до 2 тыс. и5 тыс. мкг число ТНФ-специфичных АОК повышалось в 2 и 2,6 раза
по сравнению с фоновым уровнем; в селезенке накапливалось соот¬
ветственно 2800+150 и 36401225 АОК при фоновом значении 1390±100.Таким образом, дигаптенное ДНФ-производное ПЭГ по сравне¬
нию с моногаптенным ТНФ-производным обладало слабой иммуно-
генной активностью.Динамика накопления АОК против ТНФ при иммунизации мышей
ТНФЭ-монопроизводным ПЭГ с молекулярной массой 2x10'' и ДНФ-
производным с ММ 4x10“^ была следующей (рис. 68): накопление ТНФ-
специфичных АОК при иммунизации моногаптенным производным
ПЭГ было значительным уже на 2-е сутки. Пик ответа на ТНФ наблю¬
дался на 3-и сутки после иммунизации. Накопление ТНФ-специфичных
АОК при введении ТНФЭ-монозамещенного ПЭГ со степенью полиме-
ризацими 450 превышало фоновый уровень в 8-10 раз. При введении
неконъюгированного ПЭГ со степенью полимеризации 450 накопление
АОК против ТНФ превышало фоновый уровень лишь в 1,4 раза.Пик ответа при иммунизации мышей дигаптенным ДНФ-произ-
водным ПЭГ, как и в случае моногаптенного ТНФЭ-производного
ПЭГ, наблюдался на 3-и сутки после введения. Накопление анти-
ТНФ-АОК при введении ДНФ2-ПЭГ в данной серии экспериментов
превышало фоновое значение только в 1,8 раза (в селезенке накапли¬
валось 2200+155 АОК при фоновом значении 1220±120). На 1—5-7-е
8.3. Конъюгированные антиген-полимерные иммуногены335Рис. 67. Дозовая зависимость накопления ТНФ-специфичных АОК в селезен¬
ке мышей (СВАхС57ВЬ)р1 при введении моногаптенного ТНФЭ-производно-
го ПЭГ (ТНФЭ|-ПЭГ) с ММ 2x10'* (а) и дигаптенного ДНФ-производного ПЭГ
(ДНФ2-ПЭГ) с ММ 4x10^ (6):1 и 7— фоновый уровень анти-ТНФ-АОК; 2 — введение ПЭТ в дозе 1000мкг; введение
ТНФЭ^-ПЭГ в дозе: 3—5 мкг; 4 — 250 мкг; 5—1 тыс. мкг; введение ДНФ2-ПЭГ в
дозе: 8 — 5мкг; 9—50мкг; 10 — 200мкг; 11—1 тыс, мкг; 12—2тыс. мкг; 13 —
5 тыс. мкг. По оси ординат — число АОК на одну селезенку
336Глава 8. Конъюгированные вакциныАОКАОКВремя, сутРис. 68. Динамика накопления ТНФ-специфичных АОК в селезенке мышей
(СВАхС57ВЬ)Рі при введении: а — моногаптенного ТНФЭ-производного ПЭГ
(ТНФЭ,-ПЭГ) с ММ 2x10'^ (1) и ПЭГ с ММ 2x10^ (2) и б - дигаптенного ДНФ-
производного ПЭГ (ДНФ2-ПЭГ) с ММ 4x10^ (3) и ПЭГ с ММ 4x10'* (4).
Конъюгаты и ПЭГуказанньа молекулярных масс вводили однократно внутривенно в
дозе I тыс. мкг. Пунктирная линия — фоновый уровень. По оси абсцисс — время после
введения. По оси ординат — нисло АОК на селезенкуИ 20-е сутки накопление АОК против ТНФ определялось на уровне
фонового. Следовательно, динамика накопления АОК, специфичных
к ТНФ, при иммунизации мышей ДНФ2-ПЭГ характеризуется незна¬
чительным увеличением количества АОК на 3-й сутки, в остальные
сроки число анти-ТНФ-АОК не превышало фоновое.Таким образом, полученные данные свидетельствуют о слабой
иммуногенной активности дигаптенного ДНФ-производного ПЭГ с
молекулярной массой 4x10''.Было проведено сравнительное изучение иммуногенной активнос¬
ти моно- и дигаптенных ДНФ- и ТНФЭ-производных ПЭГ. Конъюгаты
вводили однократно внутривенно в дозе 1 тыс. мкг на мышь. Число
АОК против ТНФ, накапливающихся в селезенке, учитывали на3-й сутки, т.е. на пике иммунного ответа. Оказалось (табл. 40), что
при введении моногаптенных ДНФрПЭГ и ТНФЭрПЭГ в селезенке
происходит значительное накопление ТНФ-специфичных АОК. При
иммунизации ДНФ]-ПЭГ накопление АОК против ТНФ превыща-
ло фоновый уровень в 3,5 раза, при иммунизации ТНФЭ,-ПЭГ —
S.3, Конъюгированные антиген-полимерные иммуногены337в 12,5 раза. Введение мышам дигаптенных ДНФз-ПЭГ и ТНФЭ2-ПЭГ
приводило лишь к незначительному превышению накопления АОК,
специфичных к ТНФ — в 1,9 раза. Таким образом, наблюдается сущес¬
твенное различие в выраженности иммуногенных свойств у моно- и
дигаптенных производных ПЭГ. Дигаптенные ДНФ- и ТНФЭ-произ-
водные ПЭГ являются менее сильными иммуногенами по сравнению
с моногаптенными.Таблица 40Накопление ТНФ-специфичных АОК в селезенке мышей (CBAxC57BL)Fj
при введении моно- и дигаптенных ДНФ и ТНФЭ-цроизводных ПЭГКонъюгатЧисло анти-
ТНФ-АОК
(Л/±т)Фоновый уровень
анти-ТНФ-АОК
(М±т)Степень превыше¬
ния фонового уровня
анти-ТНФ-АОКДНФ2-ПЭГ450ДНФ,-ПЭГ450ТНФЭ^-ПЭГ^ооТНФЭ1-ПЭГ9003980±200 (9)
7950±420 (10)
8300±570(10)
12500+520 (9)20751150222011304300132010001901.93.51.912.5Одна из причин различия в свойствах ди- и моногаптенных
антигенов может заключаться в следующем. Нитроароматические
группировки обладают электронно-акцепторными свойствами, а
звенья полиэфирной цепи являются донорами электронов. Поэтому в
случае как моно-, так и дигаптенных ПЭГ между концевой группой и
основной цепью реализуются донорно-акцепторные взаимодействия,
макроскопическим проявлением которых является агрегация макро¬
молекул в растворе. Определение размеров образующихся агрегатов, а
также изучение спектральных характеристик донорно-акцепторных
комплексов, т.е. полос перноса заряда в УФ-спектрах, показывают,
что в случае дигаптенных конъюгатов размеры агрегатов и относи¬
тельные интенсивности полос переноса заряда существенно больше,
чем в случае монозамещенных. Отсюда следуег, что в дигаптенных
производных гаптенные группировки в большей степени вовлечены
в образование прочных связей с полимерной цепью по сравнению с
моногаптенными и поэтому оказываются стерически менее доступ¬
ными для рецепторных участков мембран В-лимфоцитов. Не исклю¬
чено, однако, что описанные различия связаны с иммунологической
спецификой воздействия моно- и дигаптенных антигенов на иммуно¬
компетентные клетки.
338 Глава 8. Конъюгированные вакциныПри сравнении иммуногенных свойств производных ПЭГ с общей
формулой С4Н90(СН2СН20)„—СН2СН2О-ГГ было показано, что про¬
изводные, содержащие в качестве гаптенных детерминант ди- и
тринитрофенильные группы, не различаются по способности инду¬
цировать ТНФ-специфичный иммунный ответ, в то время как введе¬
ние тринитрофенильных групп, т.е. включение Б структуру антигена
дополнительного диметиленового спейсера, заметно усиливает имму-
ногенные свойства монопроизводных ПЭГ. Это наводит на мысль об
участии гидрофобных взаимодействий в распознавании антигена
рецепторами поверхностной мембраны В-лимфроцита.При сравнении иммуногенных свойств моногаптенных ДНФ-
производных ПЭГ, различающихся противоположными концевыми
группами, и моно-ДНФ-производного циклического ПЭГ показано,
что они обладают примерно одинаковой иммуногенностью.Таким образом, исследованные ДНФ-, ТНФ- и ТНФЭ-мононит-
ропроизводные ПЭГ обладают иммуногенной активностью. При
сопоставлении иммунных свойств моно- и дигаптенных производных
видно, что первые являются более выраженными иммуногенами.Как и в выщеизложенных исследованиях (Петров Р.В, и др., 1982;
Кабанов В.А. и др., 1984), химически простые ДНФ-производные
(ДНФ-ПЭО) полиэтиленоксида (синоним — полиэтиленгликоль) с
известной структурой, различающиеся по размерам и формам, были
синтезированы и изучены [668]. В связи с тем что линейный ПЭО, как
уже отмечалось, бивалентен и может присоединять к себе только по
одной ДНФ-группе с каждого конца, использовали также разветвлен¬
ный полимер, который позволяет получить поливалентный материал,
содержащий до 80 ДНФ-групп на молекулу полимера. Показано, что
би- и поливалентные ДНФ-ПЭО индуцируют первичный анти-ДНФ
иммунный ответ в культуре клеток селезенки мыши с накоплением
IgM-AOK. Иммуногенность дивалентного антигена ДНФ2-ПЭО прямо
зависела от длины носителя, достигая оптимума при использовании
полимера с молекулярной массой 60 кД, ДНФ^о-ПЭО обладал средней
иммуногенностью, но в более низких дозах по сравнению с ДНФ2-
ПЭО. Исследование связи ДНФ-ПЭО с поверхностью лимфоцитов
через рецепторы к ДНФ показало, что вещества со средней молекуляр¬
ной массой (60 кД), обладающие существенной иммуногенностью,
имеют тенденцию связываться с мембраной бивалентно. Связывание
молекул ДНФ-ПЭО с меньшей молекулярной массой и более низкой
иммуногенностью происходит моновалентно. Как и в проведенных
8.3. Конъюгированные антиген-полимерные иммуногены 339нами экспериментах (Петров Р.В. и др., 1982; Кабанов В.А. и др., 1984),
в данном случае сам носитель ПЭО не влиял на иммунный ответ на
ТНФ или ДНФз-ПЭО и на Т-клеточные реакции. ПЭО также не про¬
являл поликлональных митогенных свойств.Таким образом, ионогенные полимеры — носители (поликатионы,
полианионы) и неионогенные полимеры — носители (ПЭГ) отлича¬
ются по способности влиять на иммуногенез. Высокопол и мерные
синтетические полиэлектролиты являются выраженными стимуля¬
торами иммунных реакций. ПЭГ, напротив, не обладает иммунос¬
тимулирующей активностью. Общим свойством использованных
полимеров является их способность к взаимодействию с клеточной
мембраной, которая благодаря большому разнообразию поверхност¬
ных функциональных групп является универсальным сорбентом для
полимеров самых разных классов.8.3.3. БЕЛОК-ПОЛИЭЛЕКТРОЛИТДля практики большое значение имеет получение высокоимму¬
ногенных искусственных молекул, несущих антигенные детерми¬
нанты вирусов, бактерий и паразитов, т.е. белковые, пептидные и
полисахаридные фрагменты. В этом плане весьма важна способность
полиэлектролитов к формированию комплексов с биологическими
макромолекулами. Удобными объектами для изучения механизма
и продуктов взаимодействия, например белков с полиэлектроли¬
тами, являются кватернизированные («нагруженные»- боковыми
N-aлкильными радикалами) поливинилпиридины, поскольку их
макромолекулы содержат фиксированное число положительно заря¬
женных звеньев, заряд которых сохраняется в достаточно широком
интервале pH среды (Кабанов В.А. и др., 1977), Комплексирование
не сопровождается разрушением структуры белка. В.А. Кабанов и
соавт. (1977) исследовали взаимодействие БСА с кватернизован¬
ным ПВП в водных растворах при pH 7. Оказалось, что в широком
интервале соотношений этих компонентов образуются растворимые
стабильные кооперативные комплексы. Физико-химическими мето¬
дами, а также с помощью электронной микроскопии показано, что
такие комплексы представляют собой стержнеобразные частицы,
собранные из глобул, которые стабилизированы цепочками поли¬
катиона.
340Глава 8. Конъюгированные вакциныСледующий шаг на пути создания искусственных высокоимму¬
ногенных антигенов состоял в испытании комплексов, полученных
присоединением к полимерным носителям весьма слабого белкового
антигена — БСА [56], а также их химических (ковалентно связанных)
конъюгатов (Петров Р.В. и др., 1979). В качестве носителей использо¬
вали две разновидности винилпиридиновых сополимеров. Первый
полимер имел строение... - СНз - СН - ” сн^- СН - ...СзН.С16*^33в нем в среднем на каждые 10 этиленпиридиниевых звеньев прихо¬
дилось 1 цетилпиридиниевое звено. Степень полимеризации состав¬
ляла 10\ При смешивании водного раствора сополимера с водным
раствором БСА образуется устойчивый комплекс. В данном случае с
каждым поликатионом связываются в среднем две белковые глобулы.
Связывание осуществляется за счет создания многоточечной системы
электростатических солевых контактов, которые стабилизируются
благодаря утапливанию гидрофобных цетильных радикалов в гид¬
рофобные полости белковых глобул. Последнее обеспечивает устой¬
чивость комплекса при физиологических значениях ионной силы.
Строение комплекса можно схематически представить:Полученный таким образом комплекс вводили интактным мышам
и наблюдали достаточно сильный иммунный ответ. Количество АОК,
8.3. Конъюгированные антиген-полимерные иммуногены341специфичных по отношению к БСА, примерно на 1-2 порядка пре-
пышало то их число, которое образуется при иммунизации животных
чистым БСА или при раздельных инъекциях БСА и полимерного
носителя (56]. Аналогичный результат был получен при использова¬
ния полимер'белкового конъюгата (Петров Р.В. и др., 1979) со следу¬
ющей структурой:- СН, - СН -... - СН^ - СН -Чч .
N~60%ы®IСН,соо'-40%СН2 - СНБСА.0СН^с=оМ—НСтепень полимеризации носителя здесь также составляла 10^
Однако в этом случае глобула БСА была прикреплена к носителю
ковалентной связью в среднем в соотношении одна глобула на одну
11епь. Схематически структуру конъюгата можно представить следу¬
ющим образом:На рисунке 69 приведены данные о кинетике накопления АОК
против БСА в ответ на введение полимер-белковых конъюгатов в
сравнении с данными контрольных опытов. Видно, что при комби¬
нировании слабого белкового антигена с полимерными адъюван-
342Глава 8, Конъюгированные вакциныАОКВремя, сутРис. 69. Кинетика накопления АОК в
селезенке мышей против БСА-детср-
минант искусственных антигенов,
полученных путем присоединения
БСА к сополимерам на основе ПВП.
Введение: 1 — ковалентного конъ¬
югата БСА-сополимер; 2 — ком¬
плекса, устойчивого при физиоло¬
гических значениях ионной силы
конъюгата БСА-сополимер, стабили¬
зированного цетильными радикалами;3 — электростатического комплекса
БСА-ПВП-Я2, относительно неустой¬
чивого при физиологических значениях
ионной силы; 4 — чистого БСА (дозы в
расчете на БСА во всех случаях одинако¬
вы). По оси абсцисс — время после имму¬
низации. По оси ординат — число АОКтами получаются очень сильные
искусственные антигены, вызы¬
вающие синтез антител, специ¬
фичных по отношению к белко¬
вой составляющей конъюгата.Наконец, в последней серии
экспериментов [57] описанный
выше поликатионный носитель,
содержащий цетильные группы,
соединяли с сильным тимусзави-
симым природным антигеном —
БГГ. В данном случае на каждый
линейный поликатион приходи¬
лось по одной глобуле БГГ:При иммунизации таким
конъюгатом интактиых мышей
сила иммунного ответа значи¬
тельно возрастала по сравнению
с контролем.Присоединение БСА к поли-
анионным иммунопотенциаторам
(например, ПАК) также привело
к получению вьтсокоиммуноген-
ного белок-полимерного конъ¬
югата (Абраменко ТВ. и др., 1983).
При исследовании иммунного
ответа мышей на конъюгат БСА-
ПАК установлено, что данный
искусственный антиген на осно¬
ве полианиона вызывает ранний
(уже на 4-е сутки) и гораздо более
8.3. Конъюгированные антиген-полимерные иммуногены343Время, сутРис. 70. Специфический иммунный ответ против БСА при иммунизаиии
БСА-ПАК мышей (СВАхСЗУВЬ)?!.Антителообразование при иммунизации: 1 — раствором конъюгата; 2 — эквива¬
лентной смесью БСА и ПАК; 3 — раствором чистого БСА; подавление гемагглюти¬
нации при добавлении 500 мкг/мл БСА в лунки титратора при тестировании анти¬
сывороток от животных, иммунизированных конъюгатом. По оси абсцисс — время
после иммунизации. По оси ординат — количество специфических антител против
БСА (-log2 титра)выраженный ответ с пиком на 10-е сутки по сравнению с простой
смесью БСА и ПАК, ответ на которую тестируется лишь на 10-14-е
сутки (рис. 70). Иммунная реакция на чистый белок, вводимый без
адъюванта, в использованной тест-системе (РПГА) не определяется.
Введение 50 мкг БСА в ПАФ индуцирует менее выраженный иммун¬
ный ответ (на пике ответа в 3-4 раза более низкий) по сравнению с
реакцией на конъюгат БСА-ПАК, содержащий эквивалентное коли¬
чество белка.Выше указывалось, что комплекс БСА—ПВП является антигеном
с резко выраженными иммуногенными свойствами. Следовательно,
замена иммуностимулятора (ПВП — поликатиона) на другой иммуно¬
адъювант (ПАК — полианион) принципиально не влияет на эффект
повышения иммуногенности белков с помощью соединения их с
полиэлектролитами, стимулирующими процессы иммуногенеза.
Принципиально аналогичные данные получены при комплекси¬
ровании полиионов с белковыми антигенами бактерий. Например,
комплексы очищенного белкового деривата туберкулина с кватернизо-
ванными ПВП проявляют свойства сильных иммуногенов (Петров Р.В.
и др., 1983).
344Глава 8. Конъюгированные вакциныПолучены комплексы PPD с сополимером 4-винил-N-этилпи-
ридиний и 4-винил-N-цeтилпиpидиний бромидов (ПЭ-1), с поли-4-винил-N-этилпиpидиний бромидом (ПЭ-2). Полученные комп¬
лексы PPD~n3-l и PPD-n3-2 внутрибрюшинно вводили мышам
(CBAxC57BL)Fi из расчета 450 мкг связанного в комплекс PPD на
мышь. Число АОК в селезенке мышей определяли при помощи ЭБ,
«нагруженных» чистым PPD. При исследовании комплексов PPD как
с ПЭ-1, так и с ПЭ-2 было обнаружено резкое повышение иммуно¬
генности этого антигена (по сравнению с исходным PPD) (табл, 41).
Иммуногенность комплекса РРО-ПЭ-1 существенно выше по сравне¬
нию с комплексом РРП-ПЭ-2,Таблица 41Число PPD-специфических АОК в селезенке мышей, которым вводили
чистый PPD или комплекс РРВ-ПЭ-1ВведенныйагентКоличество АОК в селезенке {М±1р <0,05)на 6-й деньна 10-й деньна 14-й леньКонтроль (без
иммунизации)
PPDРРО-ПЭ-1РРО-ПЭ-2ПЭ-1ПЭ-248,0+16,2 (10)364,4±66,9 (9)
824,0+130,2 (20)
3924,4±542,2 (18)
160,0±42,1 (7)
226,0+50,6(11)100,0±42Д (8)708,9±126,0(18)
3208+256,0 (10)
15558,4±1120,0 (26)
132,1 ±79,8 (13)
274,2+61,6 (8)84,0±12(11)413,0+152,0(14)
1920+256,0 (14)
6971,4±1632,0 (14)
100,0±44,0 (10)
160,0+74,0(10)Примечание: в скобках — число животных.Комплексы Н-антигена сальмонелл с цоликатионами также обла¬
дают резко повышенной иммуногенностью по сравнению с исходным
антигеном (Петров Р.В. и др. [119]),Следующим примером может служить усиление иммунного ответа
к матриксному (М) белку вируса гриппа путем его конъюгации с сопо¬
лимером АК и N-ВПД эквимолярного состава с молекулярной массой
100 тыс. Д (Петров Р.В. и др. [107]). Белок М характеризуется крайне
низкой иммуногенностью. Целью работы было получение сывороток,
содержащих анти-М-антитела в высоких титрах у мышей, и иммун¬
ных асцитических жидкостей (ИАЖ). Титры антител изотипа IgG
определяли в сыворотках или ИАЖ с помощью иммуноферментного
метода.
8,3, Конъюгированные антиген-полимерные иммуногены 345В препарате белка М не содержалось примесей других вирусных
белков, и его электрофоретическая подвижность при экстракции
не изменялась. Иммунизация мышей конъюгатом белка М с поли¬
электролитом сопровождалась чрезвычайно активным антитело-
образованием (титры сывороток и ИАЖ превышали 10 тыс.) как
у мышей инбредной линии, так и у аутбредных особей (табл. 37).
Однако введение одного белка М не сопровождалось в те же сроки
даже следовым антителообразованием. При использовании ПАФ
максимальный титр анти-М-антител не превышал 40. Титр анти¬
тел к белку М в сыворотках и ИАЖ после 10-го дня опыта быстро
снижался.В асцитических жидкостях иммунизированных мышей анти-М-
антитела обнаруживались либо в таком же титре, как и в сыворотках,
либо в титре, в 2 раза меньшем. Поскольку объем асцитической жид¬
кости, полученной от одной мыши, достигал 4-5 мл, общее количест¬
во антител в ней по сравнению с таковым в сыворотке было увеличено
примерно в 8—10 раз.Таким образом, в соответствии с данными, полученными ранее
для ряда антигенов, иммунизация конъюгатом белок М-полиэлект-
ролит приводила к созданию гипериммунных препаратов антител к
этому белку. Использование приема получения ИАЖ в сочетании с
высокоэффективной иммунизацией создает возможность приготов¬
ления таким методом препаратов антител к белку М не только для
исследовательских и клинико-диагностических, но и для производ¬
ственных целей, в связи с этим следует отметить, что иммунизация
конъюгатами антиген-полиэлектролит оказалась весьма успешным
подходом к получению гибридов, секретируют их моноклональные
антитела заданной специфичности [149].8,3.4. ПЕПТИД-ПОЛИЭЛЕКТРОЛИТВ главе 7 рассмотрены примеры получения синтетических пеп¬
тидов вирусов, бактерий, простейших. Отмечалось, что антигенные
фрагменты, полученные методами химического синтеза, а также
генной инженерии, как, впрочем, и высокоочищенные антигены и
их субъединичные формы, полученные методами препаративной
биохимии, независимо от их природы, как правило, обладают весьма
низкой иммуногенностью.
346 Глава 8. Конъюгированные вакциныНами сделаны успешные попытки придания иммуногенных
свойств неиммуногенным синтетическим пептидам, воспроизводя¬
щим определенные пептидные фрагменты вируса гриппа и лимфоци¬
тотропного вируса Т-клеток.В 1985 г (Петров Р.В. и др. [127]) синтезированы и исследованы
иммуногенные пептид-полиэлектролитные конъюгаты, антигенные
свойства которых тождественны свойствам консервативной анти¬
генной детерминанты легкой цепи гемагглютининов вирусов гриппа
типа А. Полученные полностью искусственные антигены, состоящие
из синтетического пептида и синтетического полиэлектролита, сти¬
мулируют продукцию антител с широким спектром реагирования,
распознающих гомологичную пептидную детерминанту в составе как
конъюгатов, так и вирусных частиц гриппа А разных серотипов.Следующий пример — синтез пептидов env и gag Т-лимфоцитотроп-
ного ретровируса LAV/HTLV-III (Петров Р.В. и др. [138]). Следует подчер¬
кнуть, что для ретровирусной инфекции характерна длительная персис-
тенция вируса в сочетании с циркулирующими антителами к основным
штаммспецифическим антигенам вируса [54]. Поэтому выявление анти¬
тел используется в качестве основного критерия диагностических и эпи¬
демиологических исследований при заболеваниях, вызываемых Т-лим-
фоцитотропными ретровирусами человека (Хаитов P.M. [168]). Созданы
диагностические наборы для определения антител к антигенам разру¬
шенных вирусных частиц — этиологического агента лимфоаденопатий
и пробретенных Т-иммунодефицитов человека [734]. Для верификации
определяемых с помощью коммереческих наборов положительных сыво¬
роток проводится проверка их реагирования с отдельными вирусными
полипептидами, выделяемыми с помощью электрофореза в полиакрила¬
мидном геле (иммуноблоттинг, или «вестерн-блот»-анализ) [730].Предпринято успешное применение в качестве антигенного ком¬
понента системы ИФА нового поколения синтетических пептидов,
специфичных для продуктов экспрессии основных структурных генов
env- ugag-LAV/HTLV-in, против которых обычно направлен гуморальный
иммунный ответ (Петров и др. [138]). При выборе участков белков, пред¬
ставляющих возможные эпитопы, исходили из опубликованных данных
о структуре соответствующих генов и продуктов их экспрессии [694,725,
832]. Расчет профилей гидрофильности этих белков по методу Хоппа-
Вуда [442] и элементов вторичной структуры методами Чоу—Фассмана
[315] и Кайта-Дулитла [522] позволил выявить фрагменты полипептид¬
ной цепи, являющиеся вероятными антигенными детерминантами.
8.3. Конъюгированные антиген-полимерные иммуногены347Таблица 42Образование антител нзотипа IgG к белку М вируса гриппа А при различных
вариантах иммунизации мышейМышиПрепарат белка
М 15 мкг на
мышьХарактеристика препаратов антител при
иммунофермептном методесывороткититрпула*за 30 мин
(максимальное
значение)**ИАЖтитрпулаE45Q за 30 мин
(максималь¬
ное значение)ЛинииСВАКонъюгат белка
М с полиэлект¬
ролитом
Белок М с ПАФ
Белок М1024040<100,80,30,1Аутбред-ныеКонъюгат белка
М с полиэлект¬
ролитом
Белок М20480<101,20,110240<101,00,1* В каждой экспериментальной группе бшо 10 мышей.** Достоверными являются показатели ^450 за 30 мин, равные или превышающие 0,2.После анализа полученных данных были отобраны три фрагмента
полипептидной цепи белка р24 вирусной сердцевины и ряд фрагментов
белков вр120 и $р41 оболочки длиной 5—12 аминокислотных остатков.
Синтез фрагментов провели классическими методами пептидной химии
в растворе: наращивание полипептидной цепи осуществлялось с помо¬
щью методов активированных эфиров, конденсации фрагментов — кар-
бодиимидным методом. Полученные пептиды конъюгировали с сукци-
нилированным БСА, карбоксильные группы которого активировались
путем их превращения в N-oкcи-cyкцинимидныe эфиры. Соотношение
пептида и белка, определенное с помощью аминокислотного анализа
кислых гидролизатов, составляло 5—10 моль пептида на 1 моль белка.Проведено параллельное исследование взаимодействия антител из
положительных сывороток с антигенами из коммерческих диагности¬
ческих наборов фирмы «Органон Текника» (Нидерланды) и с синте¬
тическими пептидными антигенными детерминантами.При получении иммуносорбентов для ИФА пептиды сорбировали
в лунках 96-луночных микротитровальных планшетов из полисти-
34SГлава 8. Конъюгированные ващины^492100.5НК1 2 3 4(©ПНК 1 2 3 4НК 1 2 3 4Рис. 71. Результаты ИФА с пептидным и вирусным диагностикумами:
а — БСА; 6 — конъюгат пептида р25gag-БCA; в — разрушенный вирус ЬАУ/НТЬУ~Ш;
НК — стандартная сыворотка человека; I, 2,3, 4— положительные в иммуноблот-
тинге сыворотки человека к ЬЛУ/НТЬУ-Н!рола непосредственно или в виде конъюгатов. Все процедуры микро-
ELISA проводили на диагностическом комплекте приборов «Органон
Текника»^ согласно инструкции для коммерческого ИФА-диагности-
кума этой фирмы.Наиболее четкие результаты получены при исследовании синте¬
тических пептидных антигенов из белка р24 gag, gp41 и gpl20 env. Как
показано на рисунке 71, положительные сыворотки № 1—4 давали чет¬
кую положительную реакцию как в стандартной тест-системе с анти¬
генами разрушенных вирусных частиц («Органон»), так и с конъюгата¬
ми пептидов группы «а» № 1 и 2, Стандартная нормальная сыворотка
человека и 10 произвольно подобранных сывороток здоровых лиц ни
в одном случае не давали реакции выше 0,200 при 00492, соответствуя
стандарту «Нормального контрольного уровня», рекомендованиого
для сероэпидемиологического применения ИФА [8261,
8.3. Конъюгированные антиген-полимерные иммуногены349Антитела из подобранных сывороток распознавали также неко¬
торые антигенные детерминанты env и gag, сформированные пеп¬
тидами непосредственно на полистироловом матриксе. В целом
синтетические пептидные антигены группы gag и env обеспечивали
практически 100% совпадения результатов тестирования сыворо¬
ток в сравнении с коммерческими тест-системами микро-ЕЫ8А.
Более низкие абсолютные значения экстинций при OD492 с пептид¬
ными антигенами связаны с моновалентным характером получа¬
емых антигенных детерминант. Разработанный диагностический
набор ИФА не выявляет антител к клеточным и другим пере¬
крестно реагирующим антигенам, затрудняющим работу с система¬
ми ИФА «первого поколения». Кроме того, не требуется культивиро¬
вания вируса с использованием дефицитных сред и факторов роста.
Присоединением к полимерам описанные синтетические пептиды
превращены в иммуногены.8.3.5. ПОЛИСАХАРИД-ПОЛИЭЛЕКТРОЛИТ
И ПОЛИСАХАРИД-БЕЛОК-ПОЛИЭЛЕКТРОЛИТПомимо описанных выше вариантов гаптен-полиэлектроит, белок-
полиэлектролит, исследована иммуногенность бифункциональных
иммуногенов, содержащих в качестве антигена полисахарид (Пет¬
ров Р.В. и др., 1983; Petrov R.V. et al., 1984). Для этой пели был исполь¬
зован О-антиген из сальмонелл.
350 Глава 8. Конъюгированные вакциныСначала выделяли О-антиген из Salmonella typhimurium, штамм
415, общепринятым методом. Полисахарид (ПС) получали из
О-антигена кислотным гидролизом с 1%-ной уксусной кислотой.
В качестве синтетических полимерных носителей — адъювантов
использовали сополимер (СП) акриловой кислоты (АК) и N-ВПД
или модифицированные СП, содержащие первичные аминогруппы
в боковой цепи макромолекулы (МСП). Применяли МСП, содержа¬
щий 20% первичных аминогрупп в боковой цепи макромолекулы
(Petrov R.V. et al., 1984). Синтез конъюгатов ПС с полиэлектро¬
литами проводили с использованием широко распространенных
методов активации ПС: окислительным введением в него реакци¬
онноспособных по отношению к аминогруппам альдегидных групп
(К-1), карбодиимидным способом (К-2) и методом цианбромидной
активации (К-3). Метод связывания, основанный на ацилировании
гидроксильных групп бромацетилбромидом с последующим алки-
лированием аминогрупп, менее распространен и был применен для
получения конъюгата К-4. Низкомолекулярные продукты, несвя¬
занные ПС и полиэлектролит разделяли с помощью гель-хромато¬
графии на колонке с сефадексом. Конъюгаты содержали 0,25 мг ПС
в 1 мг препарата.Введение мышам ПС в дозе 100 мкг всего в 1,5—2 раза повышает
число ПС-специфических АОК в селезенке по сравнению с фоном
(в предварительных опытах с введением ПС в дозах 1—625 мкг
было установлено, что только дозы 100-625 мкг вызывают
незначительное увеличение числа АОК). Конъюгаты К-1, К-2 и
К-3 в эквивалентной по ПС дозе существенно не увеличивают
числа АОК в селезенке иммунизированных животных (табл. 43).
Однако иммунизация мышей конъюгатом К-4 приводит к разви¬
тию выраженного ПС-специфического иммунного ответа. Число
АОК, формирующихся в селезенке мышей, иммунизированных
К-4, на порядок превышает число АОК в селезенке мышей, имму¬
низированных исходным ПС. Таким образом, путем ковалентного
соединения неиммуногенного ПС с синтетическим полиэлект¬
ролитом получен не имеющий природных аналогов искусствен¬
ный иммуноген со специфичностью О-антигена. Он вызывает
иммунный ответ при введении в водном растворе без дополни¬
тельного использования адъювантов.
8.3, Конъюгированные антиген-полимерные иммуногены351Таблица 43Иммуногенные свойства конъюгатов полисахарид-аолиэлектролитИммунизацияЧисло АОК, специфических к ПС, после иммунизациичерез 4 сутчерез 8 сутПСК-1к-2К-3к-4Изотонический
раствор NaCl199,4 (254,6-144,2)
135,0 (186,7^83,3)
47,7 (64,1-г31,3)
499,8(601,2-398,4)
1030,9(1402,0-659,8)
63,8(122,9-14,7)151,8 (174,4-125,2)290,0(395,9-184,1)194,3(258,2-130,4)2089,9(2602,3-1577,3)83,2(104,2-62,2)Полученные данные представляют большой интерес в плане созда¬
ния искусственной противосальмонеллезной вакцины на основе син¬
тетических полиэлектролитов (см. главу 10). Однако, как известно,
помимо полисахарида, входящего в состав основного соматического
О-антигена, другим основным антигеном сальмонелл является жгу¬
тиковый антиген — флагеллин (ФЛА) белковой природы. Поэтому
представлялось логичным, что оптимальным вариантом искусст¬
венной противосальмонеллезной вакцины может явиться комплекс,
несущий на полиэлектролитной основе сразу оба главных антигена
этих микробов — ПС и ФЛА. В отлргчие от полисахарида О-антигена
ФЛА — сам по себе достаточно сильный иммуноген для мышей. В этой
связи была сделана попытка выяснить, способен ли полиэлектролит-
ный носитель, будучи конъюгированным с относительно сильным
белковым антигеном сальмонелл, оказывать стимулирующее дей¬
ствие на его способность индуцировать анамнестиченский иммунный
ответ (Петров Р.В. и др., 1985). При этом в качестве антигена была
использована мономерная форма ФЛА. Установлено, что иммуниза¬
ция мышей конъюгатом ФЛА—ПАК или ФЛА—ПА приводит к разви¬
тию иммунного ответа на ФЛА. В следующем заключительном разде¬
ле экспериментов данной серии исследовали иммуногенные свойства
искусственных антигенов, представляющих собой комплексы поли¬
сахарид—белок-полиэлектролит. Синтез таких трехкомпонентньтх
конъюгатов был осуществлен в две стадии. На первом этапе с помо¬
щью карбодиимида получили конъюгат ФЛА с полиэлектролитом.
352 Глава 8. Конъюгированные вакциныНа второй стадии к конъюгату белок—полиэлектролИ1’ «пришивали»
полисахарид с помощью цианурхлорида. Оказалось, что трехкомпо¬
нентный конъюгат ПС—ФЛА-ПАК обладает резко выраженной спо¬
собностью вызывать первичный и вторичный иммунный ответ.8.3.6. свойства (Т-НЕЗАВИСИМОСТЬ, ФОРМИРОВАНИЕ
ИММУНОЛОГИЧЕСКОЙ ПАМЯТИ) КОНЪЮГИРОВАННЫХ
АНТИГЕН-ПОЛИМЕРНЫХ ИММУНОГЕНОВТ-независимость иммуногеыного действия искусственных антиген-
полимерных комплексов. При иммунизации животных искусствен¬
ными антигенами, полученными в результате включения производ¬
ных 2,4,6-тринитробензолсульфокислоты в макромолекулы ПВП или
ПМВП, индуцируется выраженный иммунный ответ с продукцией
ТНФ-специфических антител (Петров Р.В. и др. [104]). В связи с тем, что
действие полиэлектролитной части комплекса замещает хелперный
сигнал Т-клеток, т.е. в определенной степени обеспечивает Т-незави¬
симость, представляло интерес изучить Т-независимость иммунного
ответа на тринитрофенилированные поликатионы. Оказалось, что в
селезенке летально облученных реципиентов, защищенных синген¬
ными клетками костного мозга нормальных животных или клетками
селезенки в-мышей, накапливается значительное число ТНФ-спе¬
цифичных АОК (Петров Р.В., Хаитов P.M., 1978). Добавление к клет¬
кам костного мозга нормальных доноров или к клеткам селезенки
В-мышей нормальных тимоцитов не повышало числа АОК. В других
опытах ТНФ-ПМВП вводили непосредственно В-мышам. При этом
накапливалось такое же количество АОК, как и у нормальных мышей,
иммунизированных данным искусственным антигеном,В последующем исследовали Т-зависимость комплексов белков с
поликатионом [32]. В качестве поликатиона-комплексообразователя
выбрали сополимер 4-винил-N-этилпиpидиний и 4-винил-К-цетил-
пиридиний бромидов. Для приготовления комплексов использовали
БСА и БГГ. В отличие от БСА, как уже отмечалось, БГГ является
относительно хорошим иммуногеном для мышей. Каждая молекула
использованного сополимера длиной в 1 тыс. звеньев в водном рас¬
творе комплексируется с одной молекулой БГГ или двумя молекулами
БСА. Для изучения иммунологических свойств описанных комплек¬
сов мышам линии C57BL/6 и бестимусным мышам, гомозиготным по
8.3, Конъюгированные антиген-полимерные иммуногены 353гену пи (выведенным на основе линии C57BL/6), внутрибрюшинно
вводили либо раствор чистого белка, либо эквивалентное количество
этого же белка в комплексе с сополимером. Оказалось> что у мышей
nude иммунный ответ на чистый БГГ гораздо ниже, чем у нормальных
мышей, вследствие недоразвития Т-хелперов. Специфические АОК,
образующиеся в ответ на введение чистого БСА, у этих животных
вообще не определялись. Однако комплексирование БГГ или БСА с
сополимером не только компенсировало дефект Т-системы лимфоци¬
тов этих животных, но и приводило к дополнительному (по сравне¬
нию с иммунным ответом на чистый антиген у нормальных мышей)
появлению антигенспецифичных АОК,Таким образом, соединение как слабых, так и относительно силь¬
ных стандартных Т-зависимых белковых антигенов с полимерными
стимуляторами позволяет получать сильные Т-независимые искус¬
ственные иммуногены, индуцирующие выработку антител против
соответствующих белков. Иначе говоря, обеспечивается Т-незави¬
симость иммунного ответа на Т-зависимый антиген, включенный в
состав искусственного белок-полимерного комплекса.Присоединение сальмонеллезного полисахарида к полиэлект-
ролитным носителям также позволило получить искусственный
высокоиммуногенный антиген, проявляющий свойства «сильного»
Т-независимого антигена (Petrov R.V. et al. [680]).Приведенные результаты подтверждают предсказание о локализа¬
ции действия полиэлектролита на антигенсвязывающих клетках. По-
видимому, при введении комплексной молекулы антиген-полимер в
организм антигенная детерминанта выполняет селекционную фун¬
кцию, «отыскивая» клетки со специфическими рецепторами на по¬
верхности. Участки полиэлектролита, свободные от взаимодействия с
антигеном, с которым «сшит» полимер, способны к многоточечному
взаимодействию с комплементарными зарядами на клеточной по¬
верхности. Следовательно, можно предполагать, что при связывании
бифункциональной молекулы антиген—полиэлектролит с рецепто¬
рами антигенспецифической В-клетки в мембране последней про¬
изойдут перестройки, подобные тем, которые происходят в клеточ¬
ной мембране под влиянием полиэлектролитов. А именно, полимер
индуцирует агрегацию интегральных белков мембраны, повышение
мембранной проницаемости для ионов. Причем в случае введения
конъюгатов антиген—полиэлектролит такие изменения произойдут
преимущественно в мембране соответствующего клона антигенспе-
354Глава 8. Конъюгированные вакциныРис. 72. Строение комплекса белка с пол и катионом (а) и взаимодействие ком¬
плексного антигена с мембраной антигенспецифической В-клетки (6):/ — полиэлектролит; 2 — белковый антиген; 3 — антигенная детерминанта белка;4 ~ Jg-peцenmop, специфически связывающий 3; 5 — интегральные белки мембраны;
6 — матрикс плазматической мембраны антигенсвязывающей В-клеткицифичных клеток. Это приведет к активации В-лимфоцитов данной
специфичности даже без помощи вспомогательных клеток (рис. 72).Изучена также Т-зависимость процесса формирования ТНФ-
специфичных АОК при иммунизации ТНФЭ,—ПЭГ мышей nude.
S.3. Конъюгированные антиген-полимерные иммуногены355100008000600040002000•jV-yV'i.v1li111IVРис. 73. Т-независимость иммуногенного действия моиогаитенного ТНФЭ-
ироизводного ПЭГ (ТНФЭ,-ПЭГ) с ММ 2x10“*;а — накопление анти-ТНФ—АОК в селезенке мышей nude на основе линии СВА (I) ив
селезенке нормальных мышей линии СВА (II), б — накопление анти-ТНФ-АОК в селе¬
зенке мышей nude на основе линии C57BL (III) и в селезенке нормальных мышей линии
C57BL (IV); 1 — фоновый уровень анти-ТНФ-АОК; 2 — уровень анти-ТНФ-АОК при
иммунизации конъюгатом ТНФЭ—ПЭГ. Конъюгат вводили в дозе 1 тыс. мкгОказалось (рис. 73), что при введении конъюгата в селезенках бес¬
тимусных мышей наблюдалось формирование АОК против ТНФ,
сравнимое с уровнем выработки антителопродуцентов в селезенках
мышей с нормальным тимусом. Так, введение ТНФ,—ПЭГ мышам
nude, выведенным на основе мышей линии C57BL, также приводило к
формированию анти-ТНФ-АОК; их уровень по сравнению с фоновым
возрастал в 5 раз.Таким образом, моногаптенное ТНФЭ-производное ПЭГ проявля¬
ло свойства Т-независимого антигена.Рассмотренные выше ДНФг-ПЭО вызывают Т-независимый IgM-
иммунный ответ в культуре В-клеток селезенки мышей [668]. В этой
связи представляет интерес тот факт, что молекулярная структура ТНФ—
ПЭГ или ДНФ—ПЭО с одной или двумя гаптенными группами на конце
356 Глава 8. Конъюгированные вакцины(или концах) отличается от структуры стандартных ТНА, которые пред¬
ставлены полимерами с множественными повторяющимися антиген¬
ными детерминантами. Не исключено, что молекулы типа ТНФ—ПЭГ
(ДНФ-ПЭО) могут приобретать поливалентность в растворе (в жидкос¬
тях организма), взаимодействуя друг с другом с образованием молеку¬
лярных агрегатов. Предполагается также, что моновалентное связывание
ДНФ-ПЭО ДНФ-спетщфичными клетками может привести к образова¬
нию концентрированных и функционально поливалентных кластеров
ДНФ-групп, обладающих иммуногенностью [668]. Нам представляется,
что Т-независимость иммунного ответа на искусственные антигены
типа ТНФ1-ПЭГ или ТНФ2—ПЭГ (ДНФ2—ПЭО) имеет ту же молеку¬
лярную «базу»^, что и комплексы антиген (гаптен)-полиэлектролит. Хотя
ПЭГ не является ионогенным полимером, он, как и полиэлектролиты,
обладает выраженной мембранной активностью. Вполне возмож1ю, что
ПЭГ вызывает такие же молекулярно-мембранные перестройки в лим¬
фоцитах, как и полиэлектролиты.Помимо определения Т-независимости иммуногенного эффек¬
та искусственных антигенполимерных комплексов, для понимания
особенностей действия таких структур важным является изучение
зависимости между эффективностью естественных и искусствен¬
ных иммуиогенов и активностью генов иммунного ответа — /г-генов
(см. главу 3), контролирующих силу иммунологических реакций на тс
или иные конкретные антигены. Анализ характера /г-независимого
иммунного ответа на антиген-полиэлектролитные комплексы, опре¬
деляемого решением непосредственно связанной с ним проблемы —
фенотипической коррекции генного контроля иммунитета, представ¬
лен в главе 9.Иммунологическая память после иммунизации искусственными антн-
генполнмерными комплексами. С практической точки зрения большой
интерес вызывает вопрос о способности антигенполимерных комп¬
лексов индуцировать иммунологическую память и соответственно
вторичный (анамнестический) ответ на повторное введение антигена.
В главе 9 будет показано, что повторная иммунизация животных
только пептидом (Т,Г)-А-Л спустя месяц после первичной иммуни¬
зации конъюгатами этого пептида с полиэлектролитами вызывает
повышенный иммунный ответ по типу вторичного (анамнестическая
реакция). Таким образом, искусственные конъюгаты (Т,Г)-А-Л —
полиэлетролит усиливают как первичный, так и вторичный иммун¬
ный ответ у животных низкоотвечающего генотипа. В данном случае
8.3. Конъюгированные антиген-полимерные иммуногены 357особенно важна коррекция вторичного ответа, так как действие гена
Ir-JA проявляется при реализации иммунологической памяти после
повторного введения (Т,Г)-А-Л. Известно, что в механизме индукции
иммунологической памяти участвуют и Т- и В-лимфопиты [607J.
Так, В-мыши НС способны к развитию иммунологической памяти к
Т-зависимым антигенам. У «восстановленных» Т-клетками В-мышей
индуцируется иммунологическая память. В этом процессе участвуют
как В-, так и Т-лимфоциты.Эти данные позволяют объяснить индукцию иммунологической
памяти у неотвечающих на ТЗА особей Т-замещающим действием
полиэлектролйта, т.е. обеспечением Т-независимости (и /г-независи-
мости) иммунного ответа на ТЗА, включенные в состав искусственных
антигенполиэлектролитных комплексов. Показано, что синтетические
полиэлектролиты потенцируют индукцию иммунологической памяти и
к природным антигенам при их сочетанном использовании. Н.Е. Сивук
и соавт. (1985) первично вводили мышам ЭБ и полиэлектролит (ПАК
или сополимер акриловой кислоты и N-ВПД) либо комплекс БСА-поли-
электролит. Спустя месяц животных вторично иммунизировали только
антигеном (ЭБ или БСА) и определяли в селезенке число специфических
IgM- и IgG-синтезирующих АОК. Из рисунка 74 видно, что введение
животным ЭБ совместно с полиэлектролитом обеспечивает развитие
повышенного вторичного IgM- и IgG-ответа при повторной инъекции
ЭБ (без полимера) гю сравнению с контролем (двукратное введение
только ЭБ). В таблице 44 показано, что у мышей опытной группы (имму¬
низация комплексом БСА-полиэлектролит, спустя 30 дней — вторичная
иммунизация только БСА) образовывается в несколько сотен раз больше
IgM- и IgG-AOK по сравнению с контролем.Таким образом, как и в случае пептиддюлиэлектролигною комплек¬
са, белокполиэлектролитные искусственные антигены обеспечивают
после однократной иммунизации (без дополнительного использования
адъювантов) формирование выраженной иммунологической памяти.Следующий этап работ состоял в изучении вторичного иммунного
ответа на конъюгаты бактериальных антигенов с полиэлектролитами.
Р.В. Петров и соавт. (1985) мономерную форму флагеллина (ФЛА),
полученную деполимеризацией жгутиков S. typhimurium 415, конъ¬
югировали с ПАК. Сравнительное исследование гидродинамических
свойств конъюгатов мономерной и полимерной форм флагеллина сви¬
детельствовало о том, что в указанных условиях синтеза происходила
конъюгация с носителем ФЛА.
358Глава 8. Конъюгированные вакциныЩ ’ *Ml '? ’Я ^ 'wh *ВЧ 4’Рис, 74. Содержание анти-ЭБ TgM (а) и IgG (б) АОК в селезенке мышей, при¬
мированных ЭБ в присутствии ПАК или сополимера NA и иммунизирован¬
ных через месяц ЭБ,Содержание анти-ЭБ АОК в селезенке мышей: 1 — иммунизированных однократно
ЭБ в дозе 5xJ0^; 2 — примированных ЭБ (2xl(f) и иммунизированных через месяц ЭБ
(5'xlO^); 3 — примированных ЭБ (2x10^) в присутствии сополимера NA и иммунизиро¬
ванных через месяц ЭБ (5х !(/>). По оси ординат — число АОК в селезенке (у.}(Г^)Таблица 44Вторичный иммунный ответ на БСА у мышей« первично иммунизированных
только БСА и комплексом БСА-ПВПИммунизацияЧисломышейЧисло АОК через 7 сут после первичной или
вторичной иммунизации <М±1р, р<0,05)первичнаявторичнаяIgMIgGБСА-]823,5+25,5±2БСАБСА1120+46±2БСА-ПВП-153840±4703990+300БСА-ПВПБСА145920+7207450±680
8.3, Конъюгированные антиген-полимерные иммуногены359Доза, мкг6 8 10 12 14 16Рис. 75. Вторичный ответ на ФЛА: зависимость доза-эффект после первич¬
ной иммунизации конъюгатом ФЛА-ПАК и флагеллином:
розовые столбики — ФЛА, голубые — ФЛА-ПАК. По оси абсцисс — log2 титра анти-
Ш: 1,2-антител; по оси ординат — доза; слева — примирование, справа — реимму¬
низацияАнамнестический вторичный иммунный ответ изучали при реим¬
мунизации животных через месяц после первичной иммунизации.
Для сравнения первичного эффекта действия исходного флагеллина
и его конъюгата с ПАК мышам вводили препараты в дозах 0,001; 0,01;
0,1; 1 и 10 мкг по белку. Животных реиммунизировали только флагел¬
лином в дозе 10 мкг. Эта доза в предварительных опытах была опреде¬
лена как оптимальная для индукции иммунного ответа на флагеллин
из S. typhimurium (Hi; 1,2).Как видно из рисунка 75, первичная иммунизация мышей любой
дозой конъюгата ФЛА-ПАК приводила к развитию вторичного
иммунного ответа (-log2 титра анти-Hi; 1,2-антител >7). Вместе с тем
флагеллин оказывал иммунизирующее действие лишь при введении
в дозе 0,1 мкг и выше. Введение флагеллина в дозах 0,001 и 0,01 мкг
не приводило к развитию вторичного иммунного ответа (-logj титра
антител <5,5).Для анализа условий усиливающего действия ПАК на процесс пер¬
вичной иммунизации низкими дозами антигена на следующем этапе
работы параллельно с конъюгатом вводили различными способами
эквивалентные количества антигена и адъюванта (табл. 45). Наиболее
360Глава 8. Конъюгированные вакцинывыраженное действие оказывал конъюгат ФЛА-ПАК. Инъекция
смеси флагеллина с ПАК в эквивалентных количествах также инду¬
цировала ответ в том случае, если антиген и адъювант вводили в
одном шприце. По-видимому, в этих условиях образуется комплекс
флагеллина с ПАК, обладающего повышенным эффектом при пер¬
вичной иммунизации. Введение флагеллина в мономерной и поли¬
мерной формах не приводило к развитию вторичного ответа.Таблица 45Необходимость ковалентного связывания флагеллина с ПАК для низкодозовой
индукции вторичного иммунного ответаПримиро-
ваиие
(день 0)Доза, мкгСпособ введенияРеимму¬
низация
(день 30)Доза,мкгlog2 титра анти-
Ш: 1,2-антителФЛА-ПАК0,01-0,05В/в в видеФЛА0,019,80 (10,28-9,32)конъю1атаФЛА +0,01+0,05В/в смесьФЛА0,018,33 (8,5-8,16)ПАКв одном шприцеФЛА +0,01+0,05В/в в разныхФЛА0,017,28 (7,76-6,80)ПАКшприцахФЛА0,01В/вФЛА0,01 :7,11 (7,47-6,85)ФЛА0,01В/в--3,40 (3,78-3,02)---ФЛА0,017,06 (7,59-6,58)ПОЛ0,01В/вФЛА0,017,00 (7,33-6,66)Примечание: В/в — внутривенно. Каждое ци{1)ровое значение — сумма результатов
не менее трех опытов с числом животных до 20. в скобках — доверительные интерва¬
лы — 1ов2 титра анти-Н1: 1,2-антител. ПОЛ — полимерная форма флагеллина.Таким образом, выявлены дозовые различия в процессе инициации
гюпуляций клеток памяти между белковым а>ш4геном и его конъюгатом с
синтетическим полиэлектролитом. Конъюгат способен давать примирую-
1ЦИЙ эффект в существенно более низких дозах. Показатель анамнестиче¬
ского вторичного иммунного ответа - индекс памяти - в случае первич¬
ной иммунизации флагеллином в дозе 0,001 составил 0,69, в случае ФЛА-
ПАК в той же дозе — 0,94, фактор памяти — соответственно 0,2 и 0,82.Описанными выше экспериментами еще раз продемонстрирована
необходимость прочного присоединения антигена к молекуле поли¬
мерного иммуностимулятора для повышения его способности инду¬
цировать анамнестический (вторичный) иммунный ответ. Особенно
8.3. Конъюгированные антиген-полимерные иммуногены 361следует отметить эффективность действия весьма низких доз (0,004;
0,04 мкг) мембраноактивного полимера, значительно отличающихся от
его обычной иммуностимулирующей дозы в 1 мг при введении с анти¬
геном в виде простой смеси (антиген и полимер химически не связаны).
Это свидетельствует о фокусировке антигеном действия адъюванта на
предшественниках антигенспецифических клеток памяти.Представляло интерес выяснить вопрос о том, индуцируют ли
иммунологическую память конъюгаты полисахаридного антигена
сальмонелл с полиэлектролитами.Животных иммунизировали О-полисахаридом (О-ПС) или конъ¬
югатом 0-ПС с полиэлектролитом в дозе 100 мкг по О-ПС, Через 2 нед
некоторых животных иммунизировали О-ПС в дозе 100 мкг на мышь
и определяли титры анти-О-антител [680].Оказалось, что двукратное введение О-ПС не вызывало иммунного
ответа. Примирование конъюгатом О-ПС-полиэлектролит приводило
к развитию выраженного вторичного ответа. У животных, прими¬
рованных искусственным конъюгатом и рестимулированных О-ПС,
существенное количество образующихся антител относилось к IgG.
Содержание IgM было, как правило, намного меньше, чем IgG.Таким образом, полученные результаты убеждают в том, что непри¬
родные полиэлектролиты исследованного класса являются иммуно-
потенциаторами, обеспечивающими развитие высокоэффективного
вторичного иммунного ответа на антигены различной природы.Важно подчеркнуть, что искусственные антиген-полиэлек-
тролитные комплексы индуцируют иммунологическую память у
Т-дефицитных животных и у генетически низкореагирующих особей
(см. главу 9). Способность искусственных антигенов, построенных на
основе синтетических полиэлектролитов, обеспечивать повышенную
иммунологическую память и, как следствие этого, усиленный анам¬
нестический (вторичный) ответ имеет важное практическое значение
в плане создания искусственных вакцин нового типа.Новые принципы конструирования синтетических вакцин. Завершая
анализ адъювантного действия некоторых синтетических полинук¬
леотидов и пептидов, являющихся аналогами природных соединений
и неприродных полиэлектролитов, их структуры, свойств и механиз¬
мов действия, Т-независимости иммуногенного эффекта искусствен¬
ных антигенполимерных комплексов и иммунологической памяти,
развиваюшейся после их введения, следует отметить следующее.
Приведенные результаты исследований показали, что мишенями сти¬
362Глава 8. Конъюгированные вакцинымулирующего влияния полиэлектролитов могут являться различные
клетки иммунной системы. Повышение интегрального иммунного
ответа на чужеродный антиген, которое регистрируется по конечному
результату реакции (например, по уровню антител), складывается из
усиления отдельных этапов иммуногенеза. Так, полиэлектролиты
потенцируют процессы, лежащие в основе пространственной коопе¬
рации клеток, которые происходят из различных тканей. Под влияни¬
ем полиионов ускоряются процессы миграции стволовых кроветвор¬
ных клеток и предшественников АОК из костного мозга в селезенку, а
Т-клеток — из тимуса в селезенку (табл. 46). Это обеспечивает одно из
важных условий для кооперации Т- и В-лимфоцитов в антителоге¬
незе — сближение этих клеток Б пределах одной ткани.Таблица 46Клеточные механизмы действия синтетических полиионных
иммуномодуляторовУровень действия полиионов - адъювантовРезультатМиграцияКОЕ из костного мозга в селезенкуУсиливаетсяВ-клеток из костного мозга в селезенкуУсиливаетсяТ-клеток из тимуса в селезенкуУсиливаетсяПролиферацияКОЕ в селезенкеСтимулируетсяТ-клетокСтимулируется (поликатионами)В-клетокСтимулируетсяПоликлональная дифференцировка
В-клеток в Ig-секретирующиеАктивируется (слабо)Т-В-кооперация в антителогенезеУсиливаетсяХелперная функция макрофаговАктивируетсяТ-супрессия при антителогенезеОтменяется (точнее, В-клетки
активируются в присутствии
Т-супрессоров)Конкуренция антигеновУменьшаетсяАктивность ЕКУсиливается
8.3. Конъюгированные антиген-полимерные иммуногены 363Полиэлектролиты способны активировать метаболизм клеток,
чувствительных к их влиянию, в основе этой активации лежит интен¬
сификация таких важнейших метаболических процессов в клетке, как
биосинтез нуклеиновых кислот и белков. Следствием метаболических
[іерестроек, произошедших под влиянием полиэлектролита, является
усиление функций, присущих каждому типу клеток. Макрофаги и
Т-хелперы активнее приобретают способность дифференцироваться в
ответ на антигенный стимул даже в отсутствие хелперных медиаторов
Т-клеток. По-видимому, полиэлектролиты могут обеспечить первый
сигнал для начала митогенного цикла лимфоцитов (переход Су^О)).
Активация синтеза ДНК (переход 0,->5) требует участия макрофа¬
гальных факторов.Усиление функций хелперных клеток, а также улучшение условий
прямого межклеточного контакта, происходящие под влиянием полиэ¬
лектролита, способствуют эффективной кооперации Т-, В-лимфоцитов
и макрофагов при иммунном ответе. Активация всех перечисленных
этапов иммуногенеза приводит к значительному усилению интеграль¬
ного ответа системы независимо от уровня активности негативного
регуляторного звена (клеток с супрессирующей активностью).Рисунок 76 иллюстрирует молекулярно-мембранный меха¬
низм активации иммунокомпетентной клетки полиэлектролитом.
Поликатион индуцирует микроагрегацию белков мембраны. Это
сопровождается изменением ионного транспорта через плазматиче¬
скую мембрану клетки, вследствие чего в цитоплазме накапливаются
ионы натрия и кальция. Образование внутриклеточных градиентов
концентраций катионов служит, по-видимому, одним из пусковых
механизмов интенсификации процессов метаболизма, роста и диффе¬
ренцировки лимфоцитов.Учитывая перечисленные свойства полиионов, мы сочли целесо¬
образным осуществить синтез бифункциональных молекул, состоя¬
щих из антигенной детерминанты и полиэлектролита-иммуности¬
мулятора. Это направление оказалось плодотворным. Были созданы
бифункциональные иммуногены, содержащие в качестве антиген¬
ного центра гаптены, белки, полисахариды, антигенные детерми¬
нанты микробной или вирусной природы. В качестве адъювантной
части искусственных иммуногенов были использованы полиэлект¬
ролиты с разной структурой и свойствами, в том числе и полимерные
молекулы, не обладающие токсичностью и легко катализирующи¬
еся в организме. Большинство из синтезированных комплексных
364Глава 8. Конъюгированные вакциныРис, 76. Схематическое представление молекулярно-мембранного механизма
активации иммунокомпетентной клетки полиэлектролитом.В результате многоточечного электростатического взаимодействия полиэлек¬
тролита с белками югеточной поверхности (а) происходит перераспределение
интегральных белков мембраны в микроагрегаты (б). Собственно белковые кластеры0{ужат ионпроводящими структурами (в)
8.3. Конъюгированные антиген-полимерные иммуногены 365бифункциональных антигенов обладало мощными иммуногенными
свойствами.Сопоставление эффективности ионогенных полимеров— носителей
для антигена (поликатионы, полианионы) и неионогенных полимеров-
носителей — выявило их принципиальные отличия по способности
оказывать влияние на иммунный ответ. Исследования с исттользова-
пием различных экспериментальных систем позволили установить
выраженное стимулирующее действие на иммунологические реакции
иысокополимерных синтетических полиэлектролитов. Оказалось, что
интенсивность антителообразования в ответ на иммунизацию такими
гибридными молекулами в десятки или сотни раз выше по сравнению
с антительной реакцией на собственно антигенные молекулы, лишен¬
ные адъювантной компоненты. Неионогенные полимеры-носители,
наоборот, иммуностимулирующей способностью не обладают.Синтез антител в ответ на введение бифункциональных иммуноге¬
нов, построенных по схеме антиген—полиэлектролит, характеризуется
Т-независимостью и позволяет индуцировать высокую антительную
реакцию даже у животных с генетически детерминированной «неот-
вечаемостью на данный антиген.В монографии Р.В. Петрова и соавт. [119] суммированы основные
варианты построения искусственных иммунизирующих молекул, в
которых в качестве второго функционального центра (первый — это
гаптен или антиген) могут быть использованы различные модуляторы
лимфоцитарной активности. Другими словами, даны варианты для
конструирования различных би- и полифункциональных молекул.
Эти положения тестированы, экспериментально обоснованы и допол¬
нены в монографии Р.В. Петрова и P.M. Хаитова [И6]. На чем базиру¬
ются разработанные подходы? Прежде всего на анализе молекулярно-
мембранных механизмов активации лимфоцитов. Совершенно ясно,
что идеальный результат действия иммуногена есть «включение»
деления нужного клона предшественников АОК, синтезирующих
специфические антитела, или предшественников Т-эффекторов кле¬
точных иммунных реакций. Вместе с тем имеющиеся литератур¬
ные и собственные данные (Хаитов P.M., Атауллаханов Р.И. [181];
Петрова Р.В. и соавт. [П9]) позволяют считать, что добиться этого
можно, модифицируя свойства плазматической мембраны, на уровне
которой происходит не только узнавание антигена или митогенного
агента, но и формируется сигнал, включающий ответную реакцию
клетки. Анализ мембранозависимых механизмов регуляции метабо¬
366 Глава 8. Конъюгированные вакцинылизма клеток позволяет из множества процессов выделить наиболее
важные (ключевые) для активации лимфоцитов и перечислить опре¬
деленный выбор вариантов, которые целесообразно использовать при
синтезе вакцинирующих препаратов. Можно постулировать следу¬
ющий основной принцип конструирования синтетических вакцин,
В состав вакцинирующей молекулы должны входить два типа фраг¬
ментов или функциональных центров:1) фрагмент, специфически связывающийся с поверхностью кле¬
ток только «нужного» клона;2) фрагмент — модулятор плазматической мембраны.Отводя роль первого фрагмента специфическому естественному
или синтетическому антигену (гаптены, белки, пептиды, полисахари¬
ды), остается выбрать оптимальные варианты модуляторов мембраны.
В качестве последних лучще всего изучены синтетические полиэлек¬
тролиты. Этот класс модуляторов получил наибольшее применение
в наших исследованиях в качестве иммунопотенцирующей части
при создании искусственных антигенов и вакцин, в том числе при
конструировании вакцинирующих препаратов практической направ¬
ленности — вакцины против гриппа, ВИЧ/СПИДа, аллерготропинов
и др. (см. главу 10).
Глава 9ФЕНОТИПИЧЕСКАЯ КОРРЕКЦИЯ
И ВРОЖДЕННЫЙ ИММУНИТЕТ:
НОВЫЕ КОНЦЕПЦИИ В ВАКЦИНОЛОГИИ9.1. IR-НЕЗАВИСИМОСТЬ КОНЪЮГИРОВАННЫХ
ИММУНОГЕНОВ НА ОСНОВЕ ПОЛИИОНОВ
и КОНЦЕПЦИЯ ФЕНОТИПИЧЕСКОЙ КОРРЕКЦИИОдним из центральных постулатов современной иммунологии
является положение о генетическом контроле иммунного ответа,
определяемом генами иммунного ответа — Ir (от Immune Response
genes), от наличия которых зависит выраженность иммунного ответа
и оппозитность деления реагирующих на антиген особей — высоко- и
низкореагирующие (нереагирующие). Хорошо известно также то, что
/г-гены проявляют свои функции на уровне преимущественно Т-лим¬
фоцитов. Установление факта существования особей с генетически
обусловленной низкой реактивностью на конкретные антигены явля¬
ется основой для решения важнейшей научно-практической задачи —
перевода низкоотвечающих особей в разряд особей, высокореагиру-
ющих на применяемый антиген. Это новое, сформулированное нами
направление исследований получило название фенотипической кор¬
рекции генного контроля иммунного ответа.Суть разработанного принципа заключается в том, чтобы «заста¬
вить» генетически низкореагирующую или не реагирующую на
данный антиген особь реагировать сильно, развивая полноценный
иммунный ответ. Такая фенотипическая коррекция открывает новые,
ранее не существовавшие возможности создания вакцинных пре¬
паратов против еще непобежденных инфекций и, возможно, рака и
аллергий. Действительно, после открытия /г-генов стало очевидным,
что один и тот же организм (генотип) может быть высокоотвечающим
на одни антигены и низкоотвечающим на другие. И наоборот, один
и тот же антиген может стимулировать высокий иммунный ответ у
одних генотипов (high responders) и низкий у других (low responders).
368 Глава 9. Фенотипическая коррекция и врожденный иммунитет...Иначе говоря, с иммунологической точки зрения понятия «сильный»
и «слабый» антиген равнозначны понятиям «высокореагирующий и
низкореагирующий генотипы организмов», воспринимающих конк¬
ретные антигены (Петров Р.В. [103]). В иммунологии возникла совер¬
шенно новая, в высшей степени перспективная для вакцинного дела
задача — нахождение путей превращения генетически низкореагиру¬
ющих на данные антигены особей в высокореагирующие.Идею изыскания способов превращения генетически низкореа¬
гирующих индивидуумов в высокореагирующие мы развиваем начи¬
ная с 1976 г. В связи с этим была выдвинута общая задача получения
искусственных антигенов, которые позволили бы «обойти» /г-ген-
ный контроль иммунного ответа (Петров Р.В., Хаитов P.M. [ИЗ, 115];
Петров Р.В. и др. [119]; Хаитов ЕМ, [167]). Основной подход к решению
задачи заключался в фенотипической коррекции генетического кон¬
троля иммунного ответа на антигены или антигенные детерминанты,
присоединенные к полиэлектролитным носителям, обеспечивающим
Т- и //--независимость иммунных реакций. Описанные выше Т-неза-
висимые искусственные антигены являются ключом к решению этой
задачи и открывают путь к осуществлению и практическому решению
проблемы фенотипической коррекции /г-генного контроля иммун¬
ного ответа.Действительно, эффективность профилактической вакцинации
определяется созданием определенной прослойки иммунного насе¬
ления. Если же количество иммунопрореагировавших индивидуумов
после данной вакцинации ниже определенного уровня, то такой вак¬
циной не удается приостановить эпидемический процесс.Изыскание путей фенотипической коррекции стало возможным
благодаря расшифровке механизмов реализации иммунного ответа.
Иммунный ответ представляет собой каскад молекулярных и клеточ¬
ных событий, начинающихся в организме с распознавания чужерод¬
ных антигенов и заканчивающихся накоплением иммунных эффек¬
торных клеток (Т-клеточный ответ) и антител (В-клеточный ответ).
Современные модели формирования хелперных клеток (см. рис. 8, 9),
развития гуморального (см. рис. 10) и клеточного (см. рис. 11)иммуни-
тета приведены в главе 2. Что касается механизмов развития иммун¬
ного ответа, то он условно делится на три стадии: активацию, проли¬
ферацию и дифференцировку [356,781]. В конечном итоге, независимо
от того, по какому типу (Т- или В-клеточному) будет развиваться
иммунный ответ (часто оба процесса идут параллельно), начавшаяся
9.1. Ш-независимость конъюгированных иммуногенов...3691 г^1дМ1х!^|дА^|дО1д0|дЕ1г-геныРис. 77. Клеточные механизмы реализации действия генов иммунного ответапод влиянием антигена активация предшественников Т-эффекторов
(ЦТЛ-П) или В-клеток — предшественников АОК успешно заверша¬
ется их пролиферацией и дифференцировкой в эффекторные клетки
(ЦТЛ или АОК) только под влиянием медиаторов Т-хелперов, в общей
форме называемых Т-клеточными факторами.В связи с тем что мы уделили основное внимание активации син¬
теза антител искусственными антигенами (хотя по ходу изложения
будут анализироваться и данные, касающиеся активации Т-кле¬
точного иммунитета антиген-полиэлектролитными комплексами),
рассмотрим общую схему (рис. 77) реализации /г-генного контроля
иммунного ответа, не вычленяя отдельных элементов каскада акти¬
вированных Т-хелперов. Пептиды эндоцитированного и фрагмен¬
тированного антигенпредставляющей клеткой (АПК) антигена в
комплексе с антигенами гистосовместимости класса П (МНС-П) —
продукт /г-генов — распознаются Т-лимфоцитом. Предшественник
антителопродуцентов — В-лимфоцит — также распознает молекулы
антигена и получает дополнительный сигнал включения от стимули¬
рованного Т-лимфоцита. Только после этого начинается размножение
370 Глава 9. Фенотипическая коррекция и врожденный иммунитет...и дифференцировка В-лимфоцитов в АОК. Без помощи Т-лимфоцита
В-лимфоцит в большинстве случаев работать не начинает. Подача
Т-лимфоцитом включающего сигнала контролируется генами Ir.
Именно поиск средств обхода Т-клеточного и /г-генного контроля
привел нас к обнаружению высокоэффективных в этом отношении
веществ — неприродных иолиэлектролитов — с общей для всех них
способностью к многоточечным кооперативным взаимодействиям
(см. главу 8).Мы полагаем, что полиэлектролитная (несущая) компонента опи¬
санных в книге комплексных антигенов является той их частью,
которая удерживает антиген на иммунокомпетентной клетке и обес¬
печивает активацию неспецифических мембранных и цитоплазмати¬
ческих механизмов включения данной антигенспецифической клетки
в пролиферацию и дифференцировку в обход /г-генного и Т-клеточ¬
ного контроля.Таким образом, принципиальная новизна этого похода заключает¬
ся не только в том, что начато создание искусственных макромолекул,
которые имеют только необходимые антигенные детерминанты. Это
является, в конце концов, лишь совершенствованием идеи л. Пастера.
Действительно, если организм по своим генетическим особенностям
не в состоянии развивать выраженный иммунный ответ по отноше¬
нию к данному возбудителю, данному антигену или данной антиген¬
ной детерминанте, то и ее синтезированный аналог не сможет стиму¬
лировать иммунитет. Главное в современном этапе — это нахождение
путей фенотипической коррекции, обеспечивающих иммунный ответ
даже у не реагирующих на данный антиген особей. Основной путь к
этому — конструирование таких искусственных макромолекулярных
комплексов, в состав которых входят и необходимые антигенные
детерминанты, и стимулирующая (адъювантная) структура, обеспе¬
чивающая фенотипическую коррекцию.Работа в указанном направлении началась с попыток усиления
иммунного ответа у низкоотвечающих генотипов мышей путем введе¬
ния им Т-замещающих синтетических полиэлектролитов,Р.В, Петров и соавт. (1977) иммунизировали мышей различных
линий а-анатоксинами перфрингенс и эдематиенс и вводили им ПВП.
Высокий иммунный ответ на анатоксин перфрингенс давали мыши
линии BALB/c, на анатоксин эдематиенс — СЗН. Низкореагирующими
оказались мыши линий C57BL/6 и DBA/2. Иммунный ответ низко¬
реагирующих на данные анатоксины линий мышей повышался до
9./. fR-независимость конъюгированных иммуногенов...37iАОК
120000 -Рис. 78. Влияние полиэлсктролитов на иммунный ответ у мышей разных
линий;] — иммунизация ЭБ; 2 — иммунизация ЭБ + ПВП; 3 — иммунизация ЭБ + ПАК.
По оси ординат — нисло АОК в селезенкеуровня ответа животных высокореагирующих линий введением ПВП,
инъецируемого одновременно с анатоксинами. ПВП не усиливал
иммунный ответ у высокореагирующих на данные антигены линий
мышей. Осуществлена фенотипическая коррекция иммунного ответа
и на ЭБ, Иммунный ответ оценивали по розеткообразованию клетка¬
ми селезенки. Мышам линий СВА и C57BL/6 вводили ПВП или ПАК
и иммунизировали ЭБ или конъюгатом ДНФ-БГГ. Введение ПВП или
ПАК мышам низкореагирующей на эти антигены линии C57BL/6
приводило к накоплению в 2,5—3 раза большего количества РОК про¬
тив ЭБ и ДНФ.Как видно из рисунка 78, по способности продуцировать АОК к
ЭБ мыши использованных линий распределяются следующим обра¬
зом (Хаитов P.M., Батырбеков A.A. [183]). Наименьший иммунный
ответ на ЭБ наблюдался у мышей линий C57BL и А. У мышей линии
CC57BR вырабатывалось больше АОК. Максимальный иммунный
ответ отмечался у мышей линии СВА. Мыши линии СЗН занимали
промежуточное положение. Введение ПВП мышам линии C57BL,
иммунизированным ЭБ, приводило к резкому (пятикратному) повы¬
372 Глава 9. Фенотипическая коррекция и врожденный иммунитет...шению иммунного ответа. При введении этим мышам ПАК наблю¬
далось четырехкратное усиление иммунного ответа. Введение ПВП и
ПАК мышам линии А также приводило к увеличению в их селезенке
числа АОК соответственно в 2,5 и 2,8 раза. При введении ПВП мышам
линии CC57BR иммунный ответ повышался в 4 раза, под влиянием
ПАК — в 4,7 раза, а у мышей линии СЗН — соответственно в 2 и 2,4
раза. В целом с понижением иммунологической реактивности на ЭБ
у использованных линий мышей наблюдалось увеличение усиливаю¬
щего действия ПВП и ПАК на иммунный ответ.Принципиально аналогичные данные получены при коррекции
иммунного ответа у мышей разных линий на конъюгаты ТНФ—БГГ,
парааминобензойная кислота (ПАБ)—БСА и ПАБ-БГГ при помощи
сополимера NA-5 (Нажмитдинов А.М., 1982).Во всех описанных выше работах исследовали корригирующее
влияние синтетических полиэлектролитов на иммунный ответ на
комплексные многодетерминантные антигены (токсины, эритроци¬
ты, конъюгаты гаптен-белок), который находится под полигенным
контролем. Поэтому наибольший интерес представляют результаты
исследований влияния ПВП и ПАК на иммунный ответ на синтети¬
ческий полипептидный антиген (Т,Г)-А-Л, который контролируется
единственным /г-/Л-геном. ir-IA — это аутосомный доминантный ген,
сцепленный с главным комплексом гистосовместимости Н~2, контро¬
лирующий иммунный ответ на (Т,Г)~А—Л, (Гис,Г)—А—Л и (Ф,Г)—А—Л,
Максимальные различия между отвечающими и неотвечающими
линиями мышей проявляются на уровне синтеза IgG-антител.В системе адоптивного переноса показано (Taussig M.J. et al., 1974),
что IgM-ответ на (Т,Г)—А—Л также контролируется геном Тг-1А.Экспериментальную модель с иммунизацией мышей синтетиче¬
ским антигеном (Т,Г)—А-Л Р.В. Петров и соавт. [136J исгюльзовали для
изучения влияния ПВП и ПАК на иммунный ответ, контролируемый
геном 1г-1А. Помимо количественного анализа действия этих поли¬
электролитов на иммунный ответ, контролируемый одним геном, эта
модель позволяет также изучить влияние ПВП и ПАК на кооперацию
Т- и В-лимфоцитов. Это особенно важно, так как местом экспрессии
гена 1г~1А являются Т-хелперы, а ее проявлением — их способность к
взаимодействию с В-лимфоцитами.Для изучения влияния синтетических полиэлектролитов на коо-
[[срацию Т- и В-лимфоцитов летально облученным реципиентам
внутривенно вводили сингенные клетки костного мозга (10^) и тимуса
9.1. lR-независимость конъюгированных иммуногенов...373АОК, хЮ'^С8А1BALB/CС57В1Убта(CBAxC578L/6)F.j112 3 12 3Рис. 79- Кооперативное взаимодействие Т- и В-клсток мышей различных
линий при индукции первичного иммунного ответа к (Т,Г)—А—Л в системе
адоптивного переноса клеток;/ — тимоциты; 2 — клетки костного мозга; 3 — тимоциты + клетки костного
мозга. По оси ординат — нисло АОК в селезенке {х1(Г^)(4x10^ в смеси с (Т,Г)—А—Л в дозе 10 мкг на мышь и определяли число
IgM-AOK в селезенкс, используя ЭБ, покрытые (Т,Г)-А—Л.На рисунке 79 представлены данные, полученные при изуче¬
нии взаимодействия Т- и В-лимфоцитов при индукции иммунного
ответа на (Т,Г)—А—Л в системе адоптивного переноса (Петров Р.В.
и др. [136]). Как видно из рисунка 79, при введении клеток костного
мозга (В-лимфоцитов) вместе с (Т,Г)—А—Л формируется незначитель¬
ное количество АОК, синтезируюших антитела против (Т,Г)-А—Л.
Небольшое количество АОК к (Т,Г)—А—Л наблюдается также при
трансплантации тимоцитов (Т-лимфоцитов). Введение смеси клеток
костного мозга с тимоцитами приводит к накоплению АОК в коли¬
честве, в 8-10 раз превышающем общую сумму АОК, образующихся
при раздельном введении В- и Т-лимфоцитов. Эти опыты демонс¬
трируют необходимость кооперации между Т- и В-лимфоиитами для
включения иммунного ответа на (Т,Г)—А—Л, что хорошо согласуется с
ранее опубликованными данными (Taussig M.J. et al, 1974; Munro A.J.,
Taussig M.J., 1975).Как видно из рисунка 79, в системе адоптивного переноса Т- и
В-клеток наблюдаются межлинейные различия при индукции пер¬
вичного иммунного ответа на (Т,Г)-А-Л, т.е. на уровне формирова¬
ния IgM-AOK. Так, мыши линии C57BL/6 оказались высокоотвечаю¬
щими, СВА — низкоотвечающими, а BALB/c ~ среднеотвечающими.
У гибридов (CBAxC57BL/6)Fi способность продуцировать IgM-AOK в
374 Глава 9. Фенотипическая коррекция и врожденный иммунитет,..Рис. 80. Влияние ПВП и ПАК на кооперативное взаимодействие Т- и В-кле¬
ток в иммунном ответе на (Т,Г)-А—Л:1 — тимоциты + клетки костного мозга; 2 — тимоциты + клетки костного мозга
+ ПВП; 3 — тимоциты + клетки костного мозга + ПАК. По оси ординат — число
АОК в селезенкесистеме адоптивного переноса Т- и В-клеток по высокому типу насле¬
дуется как доминантный признак.При введении летально облученным сингенным реципиентам
смеси клеток костного мозга и тимоцитов вместе с ПАК в селе¬
зенке накапливается в 2—3 раза больше АОК к (Т,Г)—А—Л (рис. 80),
чем у реципиентов, получивших только смесь Т- и В-лимфоцитов.
Аналогичный результат получается и при введении ПВП с Т- и В-лим¬
фоцитами (см. рис. 80). Таким образом, при введении ПАК или ПВП
вместе с клетками костного мозга и тимуса наблюдается усиление
кооперативного Т-В-взаимодействия при индукции иммунного отве¬
та на (Т,Г)—А-Л. Следовательно, кооперативное взаимодействие Т- и
В-лимфоцитов при иммунном ответе на (Т,Г)-А—Л усиливается под
влиянием полиэлсктролитов в 2—3 раза у мышей высокоотвечающих
генотипов С57ВЬ/6, {СВАхС57ВЬ/6)Р, и в 3-5 раз — у низкоотвечаю¬
щих СВА. В результате иммунный ответ у низкоотвечающих мышей,
обработанных полиэлектролитом, повышается до уровня высокоот¬
вечающих особей, не получивших полиэлектролита, т.е. происходит
фенотипическая коррекция иммунного ответа на (Т,Г)-А-Л.
9.1. IR-независимость конъюгированных иммуногенов... 375В специальных опытах было показано, что под влиянием поли¬
электролитов усиливается процесс активирования хелперных Т-кле¬
ток синтетическим антигеном (Т,Г)-А-Л (Петров Р.В. и др. [136]).Таким образом, введение реципиентам Т- pi В-клеток синтети¬
ческих полиэлектролитов значительно стимулирует процессы акти¬
вирования Т-хелперов и Т-В-кооперации при индукции иммунного
ответа. Причем активация Т-В-кооперации более выражена у мышей
низкоотвечаюшего на (Т,Г)-А—Л генотипа. Как следствие этого,
происходит коррекция (стимуляция) низкого иммунного ответа,
контролируемого геном fr-IA. Полученные данные впервые проде¬
монстрировали возможность коррекции синтетическими полиэлек¬
тролитами иммунного ответа, контролируемого геном Ir. Механизм
усиления иммунного ответа связан с дополнительной стимуляцией
В-клеток полиэлектролитными молекулами, замешаюшими функ¬
цию Т-хелперов.Для строгой проверки предположения о возможности отмены Ir-
генного контроля силы иммунного ответа бьши синтезированы искус¬
ственные антигены, представляющие собой конъюгаты синтетиче¬
ского разветвленного полипептида (Т,Г)-А-Л с полиэлектролитами.
Полученные нами ковалентные конъюгаты (Т,Г)-А~Л с ПАК, сопо¬
лимерами акриловой кислоты и N-ВПД содержали 90—100 мкг поли¬
пептида на 1 мг конъюгата (Петров Р.В. и др., 1984; Kabanov V.A. et al.
[465]). Для индукции первичного антительного ответа на (Т,Г)—А—Л
мышей линий СВА и C57BL/6 внутрибрюшинно иммунизировали
растворами чистого (Т,Т)—А—Л (100 мкг) или конъюгатов (Т,Г)-А—Л
с ПАК или модифицированным сополимером акриловой кислоты и
N-ВПД (МСП) в дозе 1 мг. Для оценки вторичного иммунного ответа
иммунизированным животным через месяц внутрибрюшинно инъе¬
цировали раствор чистого (Т,Г)—А-Л в дозе 40 мкг.Из данных таблицы 47 видно, что в ответ на однократную имму¬
низацию (Т,Г)—А—Л в селезенке мышей накапливается относитель¬
но небольшое число IgM- и IgG-AOK против (Т,Г)-А-Л. Причем
мыши СВА и C57BL/6 практически одинаково отвечают на этот
антиген. Однако при вторичном иммунном ответе после повторной
иммунизации (Т,Г)—А—Л у мышей линии C57BL/6 формируется в
несколько раз больше АОК, чем у животных линии СВА (табл. 48).
Иначе говоря, мыши линии C57BL/6 являются оппозитными по
реакции на (Т,Г)—А—Л, что согласуется с данными литературы
(Seta М., 1969 [591, 592]).
376 Глава 9. Фенотипическая коррекция и врожденный иммунитет...Таблица 47Первичный иммунный ответ на (Т,Г)-А-Л, конъюгированный
с синтетическими полиэлектролитамиЛиниямышейИммуногенЧисломышейЧисло анти-(Т,Г)-А-Л-АОКIgMIgGC57BL/6(Т,Г)-А-ЛПАК-(Т,Г)-А-ЛСП-(Т,Г)-А-ЛМСП-(Т,Г)-А-Л211816171800+22013 120±262011 010±199010 480+2360820±160
1690±3440
17 540+293515 400+2670СВА(Т,Г)-А-ЛПАК-(Т,Г)-А-ЛСП-(Т,Г)-А-ЛМСП-(Т,Г)-А-Л141818171480±36011 420±202012 165+2920
11400±24306001200
17 120±2780
16 000+277016 720±3540Введение конъюгатов (Т,Г)—А-Л с полиэлектродитом мышам
любой из использованных линий обеспечивает существенный при¬
рост числа IgM- и IgG-AOK при первичном ответе по сравнению с
иммунизацией чистым (Т,Г)-А-Л (см. табл. 47). Число IgM-AOK после
иммунизации конъюгатами животных C57BL/6 возрастает в 20 раз, а
СВА — в 26—28 раз. Следовательно, все конъюгаты (Т,Г)—А—Л с поли¬
электролитами примерно одинаково стимулируют первичный иммун¬
ный ответ, независимо от тонких особенностей строения их звеньев.
Вторичная иммунизация (Т,Г)-А-Л мышей, первично иммунизиро¬
ванных конъюгатами (Т,Г)-А-Л-полиэлектролит, сопровождается
3-кратным повышением числа IgM-AOK и 3—5-кратным — IgG-AOK у
мышей линии C57BL/6, а также 4—7-кратным повышением числа IgM-
и б-Ю-кратным IgG-AOK у мышей линии СВА по сравнению с кон¬
тролем [двукратная иммунизация только (Т,Г)—А—Л} (см. табл. 48).
Таким образом, в результате предварительной иммунизации конъ¬
югатами (Т,Г)-А-Л-полиэлектролит не только происходит простое
повышение числа образующихся АОК, но и нивелируются межли¬
нейные различия, т.е. наблюдается фенотипическая коррекция вто¬
ричного анти-(Т,Г)-А-Л иммунного ответа, контролируемого геном
Ir-IA. Следовательно, при иммунизации животных искусственными
антигенами — конъюгатами (Т,Г)-А—Л с полиэлектролитами —
происходит индукция сильно выраженной иммунологической памя¬
ти независимо от действия гена Ir-IA.
9.1, iR-независимость конъюгированных иммуногенов...377Таблица 48Вторичный иммунный ответ на (Т,Г)-А-Л, конъюгированный
с синтетическими полиэлектролитамиЛиниямышейИммунизацияпервичнаявторичнаяЧисломышейЧисло
анти-(Т,Г)—А-Л- АОКIgMIgGC57BL/6(Т,Г)-А-Л
ПАК-(Т,Г)-А- Л
СП-(Т,Г)-А-Л
МСП-(Т,Г)-А-Л(Т,Г)-А-Л(Т,Г)-А-Л(Т,Г)-А-Л(Т,Г)--А-Л1618171611 390±2010
42 400±687037 01015600
34 800+489017 23014330
61 400+721079 360+873080 88013860СВА(Т,Г)-А-ЛПАК-(Т,Г)-А-ЛСП-(Т,Г)-А-ЛМСП-(Т,Г)-А-Л(Т,Г)-А-Л(Т,Г)-А-Л(Т,Г)-А-Л(Т,Г)-А-Л181817165300+740
21 4401466038 580+6801
36 910+62637300+920
44 25015800
78 88018460
85 400+9810Итак, модельные искусственные антигены, представляющие собой
конъюгаты (Т,Г)-А-Л с синтетическими полиэлектролитами, прояв¬
ляют свойства сильных иммуногенов, индуцирующих выраженный
/г-//4-независимый иммунный ответ. В результате генетически низ¬
кореагирующие на (Т,Г)-А-Л особи превращаются в фенотипически
высокореагирующие. В механизме этого эффекта роль полиэлектро¬
лита заключается в замещении триггерного (включающего) сигнала
Т-хелперов и усилении Т-В-кооперации (Петров Р.В. и др. [128, 136]).В отличие от искусственных антигенов, полученных комплекси-
рованием антигенных детерминант с неприродными полиэлектро¬
литами, искусственные антигены, полученные конъюгированием
полипептидных антигенов с адъювантами, синтезированными по
принципу их природных аналогов, не обеспечивают фенотипической
коррекции иммунного ответа. Так, был исследован [625] генетический
контроль иммунного ответа на синтетический антиген (Т,Г)—А—Л,
ковалентно связанный с низкомолекулярным адъювантом МДП —
МДП-(Т,Г)-А-Л. Введение МДП-(Т,Г)-А-Л в водном растворе
мышам с гаплотипом Н-2’’ [высокоотвечающие на (Т,Г)-А-Л линии]
вызывает существенный (Т,Г)-А-Л-специфический антительный
ответ, в то время как введение только (Т,Г)-А-Л не приводит к
продукции антител. Главный вывод, следующий из работы [625]:
свойство отвечать или не отвечать на (Т,Г)—А—Л, которое контроли¬
руется геном 1г-1А, при иммунизации МДП-(Т,Г)-А—Л не изменяется.
378 Глава 9. Фенотипическая коррекция и врожденный иммунитет...1дС АОК
(»10-3)80604020В ЭТИХ экспериментах две пары
конгенных линий мышей, имею¬
щих либо высокоотвечающий гап-
лотип Н-2^ (СЗН.$>У и ВАЬВ/с.ВЮ),
либо низкоотвечающий Н-2*"
(СЗН/018П и ВАЬВ.СЗН), имму¬
низировали МДП-(Т,Г)-А-Л.
Мыши с гаплотипом Н-г” разви¬
вали высокий (Т, Г)-А-Л-специ¬
фический ответ, а с гаплотипом
Н2^ не продуцировали антител.Итак, для получения эффек¬
тивного иммунного ответа на
синтетические антигены, кото¬
рые вызывают слабый ответ или не
вызывают его вовсе у неотвечаю¬
щих генотипов, необходимо соче¬
тать их с такими стимуляторами,
которые обеспечивают превра¬
щение низкоотвечающих особей
в высокоотвечающие, а имен¬
но с иммуностимуляторами —
полиэлектролитами с необходи¬
мой степенью полимеризации.Возможен поиск других носи¬
телей, вызывающих такой же
основной эффект — обеспече¬
ние Т- и /г-независимости иммунного ответа. Действительно, как
показали результаты описанных выше экспериментов, иммунизация
животных, низкоотвечающих на (Т,Г)—А—Л генотипов, искусствен¬
ными комплексами этого пептида с полиэлектролитами обеспечивает
эффект фенотипической коррекции генного контроля.Место действия гена 1г-1Л проявляется преимущественно на уровне
Т-хелперов, кооперирующихся с В-клетками при Т-зависимом иммун¬
ном ответе. Синтетические полиэлектролиты обеспечивают Т-незави¬
симость иммунного ответа на Т-зависимые антигены путем замещения
функционального эффекта гуморальных факторов Т-хелперов. Отсюда
можно предположить, что фенотипическая коррекция /г-генного кон¬
троля, которая наблюдается при иммунизации модельным антигеном12 12Рис. 81. Т-независимость иммунного
ответа на конъюгат синтетического
полиэлектролита с (Т,Г)—А—Л:
по оси ординат — содержание специ¬
фических к (Т,Г)—А—Л антителосек-
ретирующих клеток в селезенке мышей
С57В1 (пи/+) (а) и С57В1 (пи/пи) (б),
иммунизированных (Т,Г)-А-Л (1) или
конъюгатом (Т,Г)—А~Л с полиэлектро¬
литом (2)
.9.2. Фенотипическая коррекция генного контроля иммунного,,. 379(Т,Г)—А—Л-полиэлектролит, является результатом модификации антиге¬
на полиэлектролитом, придающим ему свойства Т-независимого анти¬
гена. Данные рисунка 81 полностью подтверждают это предположение.
Видно, что контакт (Т,Г)-А-Л с полиэлектролитом, в отличие от чистого
(Т,Г)—А-Л, вызывает сильный иммунный ответ у бестимусных мышей.9.2. ФЕНОТИПИЧЕСКАЯ КОРРЕКЦИЯ ГЕННОГО
КОНТРОЛЯ ИММУННОГО ОТВЕТА
НА ГРИППОЗНУЮ ВАКЦИНУОбоснование и формулирование концепции фенотипической кор¬
рекции генного контроля иммунитета и получение экспериментальных
доказательств возможности усиления иммунного ответа с помощью
отдельных иммуномодулирующих средств на модельные антигены
различной природы слабореагирующих особей до уровня высокореа¬
гирующих обусловило дальнейшую разработку проблемы в условиях,
максимально приближенных к запросам практической медицины.
В.М. Манько и соавт. [79] провели на мышах изучение эффекта фено¬
типической коррекции генного контроля ртммунитета с определением
продукции антител к гриппозным антигенам (гемагглютинин). В экс¬
периментах использовали конъюгированную полимер-субъединичную
противогриппозную вакцину «Гриппол» с повышенными иммунизи¬
рующими свойствами. Вакцина широко используется в практической
медицине для профилактики гриппа у детей и взрослых, представляет
собой конъюгат выделенных и очищенных антигенов вируса гриппа
(гемагглютинин, нейраминидаза) актуальных штаммов с высокомоле¬
кулярным синтетическим полиэлектролитом — полиоксидонием (см.
главу 10), применяемым в качестве адъюванта. Изучалась эффектив¬
ность вакцины на мышах разных линий, оппозитно реагирующих на
гриппозные антигены, определялась также возможность фармаколо¬
гического усиления генетически контролируемо! ^ слабо выраженного
иммунного ответа до уровня высоко выраженного с анализом опти¬
мальных форм достижения изучаемого эффекта.В опытах использовали половозрелых мышей линий A/Sn (Н-2а),
B10CW(H-2b), CC57W(H-2b), C57BL/6J (H-2b), DBA/2 (H-2d), BALB/c
(H-2d), CBA (H-2k), C3H/He (H-2k) и мышей (CBAxC57BL/6)F, (Н-2к/
H-2b) массой 16-18 г.
380 Глава 9, Фенотипическая коррекция и врожденный иммунитет.,.В качестве антигена применяли гриппозный гемагглютинин (ГА)
(вакцина «Гриппол», СЕ-АЖ серия 25, против вируса гриппа штаммов
В/Панама/30/90, А1/Виктория, A2-Nib-31) в дозе 1 мкг на мышь или
3 мкг на мышь. Дозу антигена подбирали в предварительных опы¬
тах на мышах (CBAxC57BL/6)Fi, основываясь на материалах работы
Р.В. Петрова и соавт. [106]. В качестве иммуностимулятора исполь¬
зовали полиоксидоний в лекарственной форме (ЛПО) в суммарной
дозе 500 мкг на мышь, свободный или в виде конъюгата с ГА штамма
В/Панама/30/90. Применяли также конъюгат трех указанных выше
штаммов с Л ПО (полимер-субъединичная вакцина ~ ИПС, серия 15).
Соотношение ГА-ЛПО в конъюгатах составляло 1:5. Препараты с
конъюгатом содержали также свободный Л ПО для достижения равно¬
го количества ЛПО (%) (мкг) в экспериментальных группах.Все препараты вводили внутрибрюшинно в 0,5 мл физиологиче¬
ского раствора мышам, разделенным на три группы (по 6—8 мышей
в группе). Животные одной группы получали только ГА, другой —
ГА и ЛПО, вводимые раздельно с минимальным интервалом времени
(ГА + ЛПО), животным третьей группы вводили конъюгат ГА и ЛПО в
тех же дозах (ГА-ЛПО). Через 6 нед указанные препараты в использо¬
ванных дозах вводили внутрибрюшинно повторно. За 1 сут до инъек¬
ции, через 2, 4 и 6 нед после первичной и через 2 нед после повторной
инъекции антигена из хвостовой вены одних и тех же мышей в капил¬
ляры брали кровь и в сыворотке иммуноферментным методом (ИФА)
[826] определяли уровень АТ к ГА.Для постановки ИФА применяли 96-луночные планшеты
(«Organon», «Flow») с сорбированным ГА вируса гриппа. С этой целью
в лунки планшета вносили по 100 мкл раствора ГА (2 мкг/мл) в фос¬
фатном буфере, планшеты инкубировали 15—20 ч при 4 "С и лунки
отмывали от несвязавшегося ГА. Затем в лунки вносили по 100 мкл
анализируемой сыворотки в двукратных разведениях, планшеты
инкубировали 1 ч при 37 “С, лунки промывали и добавляли в них по
100 мкл козьих антител класса IgG к иммуноглобулинам мыши, мечен¬
ных пероксидазой хрена. После инкубирования при 37 °С в течение 1 ч
и промывания лунок в них вносили по 100 мкл субстрата для перокси-
дазной реакции — 0,06%-ный раствор ортофенилендиамина в 0,15 М
цитрат-фосфатном буфере, в который непосредственно перед упот¬
реблением добавляли перекись мочевины (1 мг на 1 мл раствора). Через
15 мин реакцию останавливали внесением в лунки по 50 мкл 2,5 М
раствора серной кислоты. Выраженность реакции определяли на
9.2. Фенотипическая коррекция генного контроля иммунного...3SiА 492А 492Рис. 82. Уровень противогриппозных антител в сыворотке мышей разных
линий:а — однократная иммунизация только ГА вируса гриппа трех штаммов ~
В/Панама/ЗО/Щ А1/Виктория, А2-МШ-31 (вакцина «Гриппол», СЕ-АЖ); б — одно¬
кратная иммунизация ГА вируса гриппа трех указанных штаммов, конъюгированных
с полиоксидонием в лекарственной форме (полимер-субъединичная вакцина — ИПС).
По осям абсцисс — разведение антисыворотки; по осям ординат ~ оптическая
плотность в ИФА при длине ваты 492 нмфотометре «Multiscan МСС» («Flow») при длине волны 492 нм. Лунки
контрольных планшетов содержали все указанные ингредиенты за
исключением антител к ГА.При постановке ИФА во всех случаях отмывания лунок исполь¬
зовали физиологический раствор с 0,05% твина-20 («Merck»), лунки
отмывали трижды (по 1 мин). С целью приготовления разведений
анализируемых сывороток и растворов меченных пероксидазой анти¬
тел применяли фосфатный буфер с 0,05% твина-20 и 0,05% бычьего
сывороточного альбумина.Рисунок 82 демонстрирует результаты анализа иммуномодулирую-
шего действия ЛПО, конъюгированного с ГА трехвалентной вакцины
«Гриппол» (ИПС), по сравнению с инъекцией мышам только ГА трех¬
валентной вакцины «Гриппол». Из рисунка видно, что через 4 нед после
первичной иммунизации только ГА наибольшая продукция антител
регистрировалась у мышей линии СЗН/Не, наименьшая — у мышей
линий BALB/c, C57BL/6J и DBA/2, мыши линии СВА занимали по
382 Глава 9. Фенотипическая коррекция и врожденный иммунитет...А 492А 492А 492Рис. 83. Уровень противогриппозных антител в сыворотке мышей разттых
линий при однократном или повторном введении ГА вируса гриппа штамма
В/Панама/30/90:по осям абсцисс — время, в нед, определения уровня антител после первичной или
повторной инъекции антигена; по осям ординат — оптическая плотность в ИФА
(разведение антисыворотки 1:Ю 240) при дайне ваты 492 нм; а — введение толь¬
ко антигена; б — раздельное введение ГА и полиоксидония в лекарственной форме;
в — введение антигена, конъюгированного с полиоксидонием в лекарственной формеэтому Признаку промежуточное положение (рис. 82 й). В случае имму¬
низации мышей вакциной ИПС (конъюгат ГА-ЛПС) выработка анти¬
тел у животных исследованных линий усилилась, особенно у мышей
линий BALB/c, СВА и DBA/2 (рис. 82 б). Уровень продукции антител у
этих линий мышей был сопоставимым с величиной выработки антител
мышами высокоотвечающей линии СЗН/Не. Следовательно, можно
заключить, что вакцинные препараты, содержащие ГА вируса гриппа,
конъюгированные с иммуномодулятором (синтетический полиэлек¬
тролит — полиоксидоний), обеспечивают эффект фенотипической
коррекции у ряда особей и индуцируют у таких животных выработку
антител, характерную по уровню антителообразования для высокоот-
вечающего генотипа.На рисунке 83 показаны результаты сравнительных исследований
выработки противогриппозных антител мышами разных линий через
2, 4 и 6 нед после первичной и через 2 нед после вторичной иммуни¬
зации ГА (штамм В/Панама/30/90) — рис, 83 а, ГА + ЛПО — рис. 83 б
и ГА-ЛПО — рис. 83 в. Определяли оптическую плотность антисьт¬
вороток в разведении 1;10 240. Из рис. 83 а видно, что на всех сроках
9.2. Фенотипическая коррекция генного контроля иммунного... 383наблюдения первичный ответ мышей всех исследованных линий не
превышал базисного разведения антисыворотки. Через 2 нед после
повторной иммунизации ГА (рис. 83 а) наибольшая выработка анти¬
тел зарегистрирована у мышей линии B10CW, наименьшая — у мышей
линии СВА и CC57W, По данному признаку мыши линии A/Sn зани¬
мали промежуточное положение.При назначении мышам ГА в комбинации со свободным ЛПО
(см. рис. 83 6) картина сушественно изменилась. Наблюдалась тен¬
денция к усилению первичного ответа через 4 нед после иммунизации
животных. Отмечены резкое усиление вторичного иммунного ответа
у мышей линии A/Sn и достаточно выраженное усиление антителооб¬
разования у мышей линии СВА — высокореагирующие на действие
полиоксидония линии мышей, продукция антител у мышей линии
CC57W (слабореагирующая на ГА) возросла в небольшой степени, еще
менее выражено у мышей линии B10CW (сильнореагирующей на ГА).
Эти линии животных проявляют низкую реагирующую способность
на действие иммуномодулятора — полиоксидония.Данные проведенных опытов согласуются с ранее полученными
результатами по изучению влияния полиоксидония (высокомолеку¬
лярный синтетический иммуномодулятор МБ-100) и ПАК на выра¬
ботку антител к иному антигену — эритроцитам барана. Однократная
инъекция полиоксидония сопровождалась усилением иммунного
ответа на эритроцитарные антигены. Наибольший прирост титров
антител под влиянием иммуномодулятора был у мышей линии A/Sn,
наименьший ~ у мышей линий CC57W и B10CW. Другие линии
мышей (СВА) занимали по этому показателю промежуточное поло¬
жение между оппозитно реагирующими линиями животных. Эффект
усиления продукции антител определялся не только генотипом
животных, но и дозой иммуномодулятора (Манько В.М. и др. [771).
Выше продемонстрирована различная чувствительность линейных
животных, иммунизированных разными антигенами, к иммуности¬
мулирующему действию ПВП и ПАК (Петров Р.В. и др., 1977; Хаи¬
тов P.M., Батырбеков A.A. fl83J). В реакциях клеточного иммуните¬
та (ГЗТ на корпускулярные антигены), тестируемого у мышей раз¬
ных линий, также зарегистрирована разная стимулирующая актив¬
ность используемых иммуномодуляторов — полиоксидония и ПАК
(Манько В.М. и др. [78]).На рисунке 83 в показаны результаты определения оптичес¬
кой плотности в ИФА антисывороток мышей, получивших анти¬
384 Глава 9. Фенотипическая коррекция и врожденный иммунитет...ген, конъюгированный с полиоксидонием в лекарственной форме
(ГА-ЛПО). Из рисунка видно, что через 4 нед после первичной имму¬
низации продукция антител против ГА в случае введения ГА—ЛПО
была более выраженной по сравнению с раздельной инъекцией ГА и
ЛПО (ГА + ЛПО, см. рис. 83 б), отмечалась оппозитность в реакции
животных на введение иммуностимулятора. Однако в результате пов¬
торного введения животным конъюгата ГА-ЛПО межлинейные раз¬
личия нивелировались, все линии мышей характеризовались высо¬
ким ответом, достигнув уровня высокоотвечающих на ГА животных.Принципиально сходные результаты зарегистрированы при опре¬
делении титров антител методом ИФА. В таблице 49 представлен сред¬
ний log, титра антител в сыворотке мышей разных линий через 2 нед
после повторной иммунизации животных ГА вируса гриппа, штамм
В/Панама/30/90, ГА в сочетании с раздельно вводимым полиокси¬
донием (ГА + ЛПО) и ГА, конъюгированным с иммуномодулятором
(ГА-ЛПО). Из таблицы 49 видно, что под влиянием полиоксидония,
включенного в инъецируемый антигенный материал (ГА + ЛПО),
продукция антител к гриппозному ГА возрастает, наиболее сильно —
у мышей линий СВА и A/Sn. В случае иммунизации мышей конъюгатом
ГА и полиоксидония (ГА-ЛПО) log2 титра антител увеличился фактиче¬
ски до одних и тех же величин у всех исследованных линий м ышей.Таблица 49Выработка антител мышами разных линий через 2 нед после повторной
иммунизации ГА вируса гриппа штамма В/ТТанама/30/90, неконъюгироваииым
(ГА + ЛПО) или конъюгированным (ГА—Л ПО) с полиоксидонием
в лекарственной формеЛиниямышейСредний Log2 титра антител при
иммунизации мышейГАГА + ЛПОГА-ЛПОCC57W15,8±0,61б,6±0,521,2±0,5B10CW18,9+0,619Д±0,521,4+0,3СВА15,8±0,418,0+1,020,3±0,5A/Sn17,3±0,119,5+0,421,9±0,3Анализ полученных данных показывает, что при использовании
ЛПО в свободном (неконъюгированном) виде уровень гуморального
иммунного ответа определяется по меньшей мере двумя факторами:
9,2. Фенотипическая коррекция генного контроля иммунного... 385величиной исходной генетически контролируемой реакции особи на
антиген и чувствительностью особи к действию иммуномодулятора.
В случае генетически обусловленной низкой реактивности на антиген
и ее низкой чувствительности на иммуномодулятор в использованной
постановке опыта фенотипическая коррекция отсутствовала.Наиболее результативное иммуномодулируюшее действие поли¬
оксидония зарегистрировано при иммунизации мышей ГЛ, конъ¬
югированным с ЛПО. В этом случае наблюдается более выраженная
тенденция к усилению первичного иммунного ответа и одинаково
высокий урове11ь вторичного ответа у всех исследованных линий мышей
(см. рис. 83 в). Это показывает, что в отличие от свободного ЛПО,
обеспечивающего развитие эффекта фенотипической коррекции
иммунного ответа у чувствительных к полиоксидонию животных,
конъюгированный с антигеном иммуномодулятор может обеспечить
эффект фенотипической коррекции даже у слабореагирующих гено¬
типов как на антиген, так и на иммуностимулирующий препарат.
Такой эффект конъюгата особенно важен для успешной вакцинации
особей, характеризующихся генетически контролируемой врожден¬
ной резистентностью к действию той или иной противомикробной
вакцины и неспособных в силу генетических причин формировать
достаточно эффективные реакции гуморального или клеточного
иммунитета на используемый антиген.Таким образом, применение в качестве вакцин иммунизирующих
молекул, конъюгированных с деградируемыми в организме синтети¬
ческими полиионами, обладающими выраженными иммуностиму¬
лирующими свойствами, характеризуется огромным преимуществом
по сравнению с иммунизирующими инъекциями только антигенного
материала или антигена, вводимого в комбинации со свободным
иммуномодулятором. При введении в организм конъюгатов анти¬
гена и иммуномодулятора регистрируется не только более высокий
иммунный ответ, но и более выраженный эффект фенотипической
коррекции. Это заключение является особо значимым для дальней¬
шей разработки сформулированного нами и обоснованного направ¬
ления работ по созданию вакцин нового поколения с повышенными
иммунизирующими свойствами.В целом полученные данные показывают, что соединение как
слабых, так и сильных тимусзависимых белковых антигенов, а также
гаптенов и полисахаридов с полимерными (поликатионы, полианио¬
ны) иммунопотенциаторами позволяет получить высокойммуноген-
386 Глава 9. Фенотипическая коррекция и врожденный иммунитет...ные тимуснезависимые и //--независимые искусственные антигены,
индуцирующие выработку специфических антител и развитие сильно
выраженной иммунологической памяти. Последнее особенно важно
для создания искусственных вакцинирующих комплексов.Совокупность логических следствий, вытекающих из высказанной
нами гипотезы фенотипической коррекции генетического контро¬
ля иммунного ответа, подтвердилась в нескольких вариантах. Это
позволяет возвести гипотезу в разряд нового принципа создания
искусственных вакцинирующих макромолекулярных комплексов.
Принцип этот, коротко говоря, заключается в соединении антигенов
микроорганизмов с макромолекулами, способными к кооперативной
адсорбции на поверхности иммунокомпетентных клеток.9.3. СТИМУЛЯЦИЯ ВРОЖДЕННОГО ИММУНИТЕТАСовременная иммунология характеризуется огромным накоплен¬
ным опытом в области иммунофармакологии, направленным на поиск,
создание, изучение характеристики строения и механизмов действия
препаратов, оказывающих регуляторное действие на продукцию антител
и на накопление сенсибилизированных Т-лимфоцитов, осуществляю¬
щих реакции гуморального и клеточного иммунитета. Развитие этих
работ не прекращается и в наши дни, оно обусловлено запросами прак¬
тики, ищущей способы продления жизни трансплантированных алло¬
генных клеток, тканей и органов, лечения инфекционных осложнений,
аутоиммунных расстройств, болезней соединительной ткани, иммуно¬
дефицитов различного происхождения и др. Была и остается важнейшей
проблема создания носителей иммуностимулирующего типа для уси¬
ления иммуногенности генно-инженерных молекул, опухолевых анти¬
генов, антигенных детерминант, выделенных из фрагментированных
конгломератов растительного и микробного происхождения, и др.Разработка столь обширного круга задач требовала создания мето¬
дологии, соответствующей современному состоянию иммунологи¬
ческой науки и необходимой для оценки основных свойств имму¬
номодулирующих средств — их митостатических и избирательных
лимфотоксических свойств, оценки действия на стволовые крове¬
творные клетки, на функции субпопуляций иммуноцитов, их способ¬
ности к миграции, кооперативному взаимодействию и проч.
9.3. Стимуляция врожденного иммунитета 387Существенный вклад в рещение проблемы иммуномодуляции —
создание ряда эффективных иммуномодулирующих препаратов по¬
следнего поколения, разработка методов оценки наиболее значимых
свойств иммуностимуляторов и иммунодепрессантов, современных
дефиниций иммуномодулирующих средств — внес нащ коллектив
[76, по, 128, 194]. Был создан ряд препаратов, которые используются
в клинической практике — миелопид, полиоксидоний, ликопид, так-
тивин и др.Следует отметить, однако, что указанные успехи в развитии имму-
пофармакологии связаны или имеют непосредственное отнощение
к проблеме адаптивного иммунитета, регуляции его формирования
и проявления эффекторных функций. При этом проблемам регу¬
ляции врожденного иммунитета уделяется существенно меньщее
внимание. Между тем реакции врожденного иммунитета играют
важнейшую роль в поддержании генетического гомеостаза особей.
Множественные факторы врожденного иммунитета и их генетиче¬
ский контроль определяют различную степень естественной невос¬
приимчивости особей к ряду возбудителей инфекционных заболева¬
ний. Благодаря эффекторным функциям клеток миелоидного (вклю¬
чая элементы системы мононуклеарных фагоцитов) и лимфоидного
(В1-лимфоциты, клетки МгВ, у5Т-лимфоциты, естественные килле¬
ры, НК-Т-лимфоциты) типов, характеризующим клеточные факторы
врожденного иммунитета, обеспечивается защита особей от инфици¬
рования многими патогенами. Более того, исследования последних
лет показали невозможность формирования адаптивного иммунитета
без развития врожденного, отдельные этапы которого определяют
становление системы адаптивного иммунитета. Имеется в виду не
только процесс развития врожденного иммунитета, предшествую¬
щий антигенпредставляющим функциям макрофагов и дендритных
клеток Т-хелперам, но и их участие в определении направления реак¬
ций адаптивного иммунитета — в сторону гуморального или клеточ¬
ного иммунного ответа.Так, подавляющее большинство клеток миелоидного ряда обла¬
дают способностью эндоцитировать и затем фрагментировать по¬
глощенные частицы антигена. Антигенпредставляющие элементы
врожденного иммунитета — макрофаги и дендритные клетки соеди¬
няют в цитоплазме пептиды переваренного антигена с собственными
антигенами гисгосовместимости классов Т или ТТ и экспрессируют их
на клеточной мембране для распознавания антигенраспознающими
388 Глава 9. Фенотипическая коррекция и врожденный иммунитет...рецепторами Т-хелперов. Без эндоцитоза и представления на мемб¬
ране молекул переработанного антигена адаптивный иммунитет не
развивается. Поскольку Т-лимфоцитами распознаются не только пеп¬
тиды переваренного патогена, но и антигены гистосовместимости, с
которыми они представляются Т-хелперам (эффект двойного распоз¬
навания), распознавание антигенов гистосовместимости определяет
развитие иммунного ответа: в случае МНС I класса — по клеточному
пути, в случае МНС Н класса — по гуморальному. Однако этими базо¬
выми этапами не исчерпывается значение врожденного иммунитета
для становления адаптивного иммунного ответа. Как неоднократно
отмечалось на страницах книги, важнейшим этапом защитных фун¬
кций врожденного иммунитета является распознавание рецепторами
его системы — TLR, RLR, NOD, рецепторами-мусорщиками и др. (см.
главу 1) структур РАМР микробов. Распознавание фагоцитами чуже¬
родной структуры представляет собой центральный этап защитной
функции врожденного иммунитета, сопровождающийся поглоще¬
нием патогена, его переработкой, продукцией цитокинов, взаимо¬
действием клеток и других реакций, обеспечивающих развитие высо¬
коспециализированного адаптивного иммунитета.В противомикробной защите важную роль играют секретируемые
активированными клетками системы врожденного иммунитета биоло¬
гически активные молекулы, включая различные антимикробные пеп¬
тиды. Одними из них являются дефензины, относящиеся к суперсемейс¬
тву пептидов-антибиотиков. Дефензины, помимо непосредственного
микробицидного действия (убивают оболочечные вирусы, грамотрица¬
тельные и грамположительные бактерии, грибы), привлекаются также к
участию в воспалительных и иммунных процессах [26, 67, 395,459].Совершенно очевидно, что разработка средств, активирующих
реакции врожденного иммунитета, представляется важной задачей,
направленной на формирование полноценной иммунологической
защиты. Несмотря на актуалыюсть этой проблемы и ее значимость
для практической медицины, эта проблема разработана мало, как уже
отмечалось, направлена преимущественно на создание препаратов,
регулирующих высокоспециализированные реакции гуморального
и клеточного иммунитета. Между тем среди применяемых в клини¬
ческой практике иммуномодуляторов может быть уже обозначен ряд
препаратов, оказывающих стимулирующее действие на эффекторы
врожденного иммунитета, в частности на макрофаги. Функции от¬
дельных из этих препаратов рассматривались выше.
9.3. Стимуляция врожденного иммунитета 389— Полиоксидоний. Синтетический полиэлектролит (см. главу 10,
раздел 10,1,5.2). Активирует клетки системы мононуклеарных
фагоцитов, реакции гуморального и клеточного иммунитета,
синтез цитокинов [130, 131, 139, 140, 141, 195].— Иммуномакс. Кислый водорастворимый пептидогликан с
молекулярной массой 1200—40000. кД, получен из растений,
обладает мощным иммуностимулирующим действием [14].
Активирует N К- и дендритные клетки, макрофаги, моноциты,
усиливает выработку цитокинов и интерферона, при совмест¬
ном введении животным в смеси с антигеном усиливает про¬
дукцию специфических антител. При ковалентной конъюга¬
ции иммуномакса с яичным альбумином, с рекомбинантным
полипептидом, содержащим иммунодоминантные фрагменты
белков ВИЧ-1 (gag р17, р24, gpl20, gp4l) или с рекомбинантным
полипептидом (аминокислотные остатки і-76) белка оболоч¬
ки коронавируса, ассоциированного с атипичной пневмонией,
индуцирует 10—100-кратное повышение иммуногенности бел¬
кового антигена. В связи с этим эффективная иммунизация
достигается введением в 10—100 раз меньшей дозы антигена в
составе конъюгата с использованным носителем.— Ликопид. Производное мурамилдипептида — минимального
компонента пептидогликана, представляющего собой внутрен¬
ний слой клеточной стенки микобактерий. Характеризуется
как полусинтетический препарат (ГМДП) — N-ацетилглю-
козаминил-М-ацетилмурамил-Ь-аланил-О-изоглутамин,
являющийся продуктом прямой конденсации синтетического
дипептида Ь-аланил-О-изоглутамин с дисахаридом N-аце-
тилглюкозамин-Н-ацетилмурамил, выделенным из клеточной
стенки М lysodeicticus. Центральной мишенью действия лико-
пида являются макрофаги, активация которых обеспечивает
адъювантный, противоинфекционный, противоопухолевый,
лейкопоэтический и другие эффекты [74, 93].— Серамил. Синтетический аналог миелопептида-3. Преиму¬
шественно действует на макрофагальное звено системы имму¬
нитета — активирует фагоцитоз, стимулирует антигенпред-
ставляющую и цитотоксическую активность макрофагов [12,
23, 40].— Галавит. Производное фталгидрозида. Регулирует синтез
цитокинов макрофагами (ИЛ-І, ИЛ-6, ФНОа) и лимфоци-
390 Глава 9. Фенотипическая коррекция и врожденный иммунитет...тами (ИЛ-2), активирует функции Т-, В- и NK-лимфоцитов.
Обладает противовоспалительными и иммуномодулируюши-
ми свойствами. Основная эффективность галавита обусловле¬
на действием на функционально-метаболическую активность
макрофагов [35, 80].— Деринат. Натриевая соль деполимеризованной ДНК, полу¬
чаемой из молок осетровых и лососевых рыб, обладает малой
антигенной активностью (содержание белка — не более 1,5%).
Стимулирует фагоцитоз, нормализует иммунитет на клеточ¬
ном и гуморальном уровнях, снижает повышенную активность
ТЫ при органоспецифических заболеваниях (ревматоидный
артрит, рассеянный склероз и др.) и снижает активность Th2
при аллергиях [58].— Изофон. Сульфонопиримидиновое производное гидразида
изоникотиновой кислоты. Иммуномодулятор с антимикобак-
териальной активностью. Активирует макрофаги, стимулиру¬
ет реакции гуморального и клеточного иммунитета [36].Доказано также, что макрофаги являются мишенями практиче¬
ски всех иммуностимуляторов микробного происхождения, таких,
как пирогенал, продигиозан, нуклеинат натрия и др., а также пред¬
ставленных рибосомальными фракциями Streptococcus pneumoniae,
Streptococcus pyogenes, Haemophilus influenzae, рибосомами и пептидогли-
канами мембранной части Klebsiella pneumoniae (рибомунил) или лиза¬
тами И (имудон) или 19 бактериальных возбудителей (ИРС-19) и др.Способностью активировать функции макрофагов, дендритных
клеток, нейтрофилов, NK-лимфоцитов и других эффекторов врож¬
денного иммунитета обладают многие другие иммуномодулируюшие
средства.Дальнейшая разработка проблемы стимуляции врожденного
иммунитета, осуществляемая разными коллективами, ее дальнейшая
интенсификация и расширение спектра решаемых задач представля¬
ются высокоактуальными. Одна из этих задач, как отмечалось выше,
касается стимуляции иммунного ответа при использовании иммуно¬
генных молекул. Однако совершенно очевидно, что усиление имму¬
ногенности малоиммуногенных антигенов может быть достигнуто с
большей эффективностью путем воздействия иммуномодулирующих
препаратов не на уже развивающиеся реакции, а на реакции, нахо¬
дящиеся в процессе их становления, а следовательно, и более чувс¬
твительные к влиянию иммуностимулирующих препаратов, т.е. на
9.4. Новые концепции в вакцинологии, базирующиеся на процессах... 391первичные этапы врожденного иммунитета. Справедливость такого
заключения подтверждается экспериментальными данными: дейс¬
твие препаратов, активирующих фагоцитарную активность макрофа¬
гов, сопровождается усилением реакций гуморального и клеточного
иммунитета.Вместе с тем следует отметить, что поиск и конструирование имму¬
номодулирующих препаратов, действующих на процессы эндоцитоза
фагоцитов, представляют собой лишь начальный этап разработки
проблемы регуляции реакций врожденного иммунитета и, прежде
всего, проблемы его иммуностимуляции, представляется целесооб¬
разным вести поиск препаратов, воздействующих и на другие, более
специализированные этапы, определяющие развитие этих реакций.
Новые подходы к стимуляции реакций врожденного иммунитета
включают:— модификацию функций рецепторов врожденного иммунитета;— модуляцию этапов сигнального пути, определяющего
функциональную активность клеток-эффекторов врожден¬
ного иммунитета;— модификацию процесса формирования иммунологического
синапса и процессов взаимодействия клеток врожденного и
адаптивного иммунитета.Естественно, не исключаются и другие показатели, являющиеся
существенными для указанных целей. Проблема регуляции реакций
врожденного иммунитета на молекулярном уровне значима не только
для решения проблемы их активации на уровне инфицированного
организма, но и для возможной терапии патологических состояний,
вызванных мутациями в системе рецепторных структур или молекул,
формирующих внутриклеточные сигнальные пути.9.4. НОВЫЕ КОНЦЕПЦИИ В ВАКЦИНОЛОГИИ,
БАЗИРУЮЩИЕСЯ НА ПРОЦЕССАХ АКТИВАЦИИ
ВРОЖДЕННОГО ИММУНИТЕТАКак отмечалось ранее, одна из важнейших особенностей врожден¬
ного иммунитета заключается в быстроте происходящих реакций, не
требующих промежуточных этапов в их проведении и участия регуля¬
торных клеток, как и продуцируемых ими растворимых продуктов. Эта
392 Глава 9, Фенотипическая коррекция и врожденный иммунитет...генетически контролируемая особенность врожденного иммунитета
характеризует эффекторные клетки как миелоидного, так и лимфо¬
идного ряда. Быстрая доставка антигена непосредственно к клеткам-
мишеням и быстрая их активация, индуцируюшая развитие процес¬
сов формирования адаптивного иммунитета, представляются весьма
значимыми в формировании новых подходов к проблеме вакцинаций
и адресной доставки конструируемых вакцин. Если до недавнего вре¬
мени основной целью вакцинации была активация адаптивного имму¬
нитета с образованием антигенспецифических продуцентов антител,
сенсибилизированных лимфоцитов и Т-клеток памяти, то в настоящее
время представляется более важной активация создаваемыми вакци¬
нами врожденного иммунитета. Такая точка зрения требует не только
изменения в идеологии создания вакцин и вакцинации, но и разработ¬
ки новых подходов к их конструированию.Поиск и создание иммуномодуляторов, нацеленных на активацию
эффекторов врожденного иммунитета, крайне важны. В предыдущих
разделах книги неоднократно отмечалось на демонстрируемых при¬
мерах, что наибольший иммунный ответ формируется на конъюгат
антигена с иммуностимулятором. Раздельное введение антигена и
иммуностимулятора индуцирует существенно меньший иммунизи¬
рующий эффект. Именно поэтому наиболее эффективная активация
врожденного иммунитета ожидается не от использования имму¬
ностимулирующих структур, а от их применения в составе вакцин,
включающих помимо антигена иммуностимулирующий носитель,
конъюгированный с антигеном и нацеленный на антигенпредставля¬
ющие клетки врожденного иммунитета. Носители для таких вакцин,
эффективные и безвредные, требуют разработки или по меньшей
мере апробации среди уже имеющихся. Отдельные из них обозначены
выше. Среди них наибольшего внимания заслуживает полиоксидо¬
ний, мишенями которого являются клетки системы мононуклеарных
фагоцитов. Более того, как отмечалось выше, полиоксидоний раз¬
решен к использованию не только в качестве лекарственного препа¬
рата, но и в составе конструируемых вакцин в качестве адъюванта
(единственный в мире официально признанный адъювант нового
поколения синтетической природы с контролируемой структурой).
Его применение в составе вакцин против гриппа или ВИЧ/СПИДа
(см. ниже) дает высокий иммунный ответ.Другим перспективным в этом отношении препаратом является
ГМДП (Ликопид). В отличие от полиоксидония этот иммуностимуля¬
9.4. Новые концепции в вакцинологии, базирующиеся на процессах... 393тор характеризуется иным механизмом действия. Как известно, ГМДП
является РАМР-структурой (от Pathogen-associated pattem), взаимодейс¬
твующей с NOD2-peiienTopoM суперсемейства PRR (от Pattem-recogni-
tion receptors). Это взаимодействие специфично. Любые изменения в
структуре ГМДП приводят к отмене взаимодействия лиганд—рецептор
и к отмене образования фактора транскрипции NF-kB, регистриру¬
емого при их связывании. Под влиянием ГМДП возрастает уровень
молекул адгезии на лейкоцитах [334J, экспрессия антигенов главного
комплекса гистосовместимости класса П на макрофагах и В-клетках,
коррелирующая с его адъювантной активностью [93].Как было показано ранее, структуры РАМР экспрессируют толь¬
ко микробы. Например, ЛПС экспрессируется грамотринательными
бактериями, липотейхоевые кислоты — грамположительными бак¬
териями, пептидогликан — грамположительными и грамотрицатель-
ными бактериями, глюканы — грибами, маннаны и маннанопро-
теиды — низщими грибами, двуспиральная РНК — вирусами и т.д.
В связи с этим наличие в организме РАМР и ее взаимодействие с PRR
свидетельствует о наличии в организме инфекции. Поскольку разные
PRR-рецепторы (TLR, NOD, скавенджер и др.) взаимодействуют с
разными РАМР-структурами, иммуностимулирующие носители в
составе вакцин в целях их направленной доставки к клеткам-мише¬
ням должны нести соответствующие молекулы, обеспечивающие их
взаимодействие с искомыми клетками. Такое взаимодействие явля¬
ется тем более важным, что эффекторы врожденного иммунитета,
характеризующиеся разной функциональной активностью, экспрес¬
сируют различные PRR-рецепторьт. Последние подразделяются на
два основных типа. Одни из них характеризуются как эндоцитозные,
другие как сигнальные. Примером первых являются скавенджер- и
маннозные рецепторы, примером вторых — TLR и NOD.Эндоцитозные рецепторы преимущественно экспрессируются на
профессиональных антигенпредставляющих клетках, обеспечивают
распознавание структур РАМР и способствуют поглощению РАМР-
несущего антигена, приводящему к его фрагментации, соединению
с антигенами МНС хозяина и представлению комплекса Т-лимфо-
цитам. Иначе говоря, рецепторы эндоцитозного типа обеспечивают
индукцию классических механизмов развития иммунного ответа.
Активация PRR-рецепторов сигнального типа сопровождается акти¬
вацией генов цитокинов, значимых для развития иммунного ответа —
воспаления, усиления функций фагоцитирующих клеток, активации
394 Глава 9. Фенотипическая коррекция и врожденный иммунитет...лимфоцитов через взаимодействие с соответствующими рецепторны¬
ми структурами (см. главу 1), В связи с этим конструирование вакцин
на основе конъюгированных иммуногенов с применением выделенных
и очищенных протективных эпитопов должно сочетаться с использо¬
ванием специфических молекул, нацеленных на их взаимодействие с
определенными РКК-рецепторами. При этом перспективным явля¬
ется применение эпитопов, действующих на максимально возмож¬
ное число разных рецепторных РКК-структур. Создание вакцин для
активадии врожденного иммунитета может оказаться особенно важ¬
ным для борьбы с рядом инфекций, для которых традиционные пути
конструирования вакцин оказались неэффективными. Примером
могут служить малярия, венерические болезни, туберкулез, гепатит
С и др. Несомненным достоинством вакцин, базирующихся на акти¬
вации РКК-рецепторов РАМР-структурами и предназначенных для
активации врожденного иммунитета препаратами, которые содержат
иммуностимуляторы, конъюгированные с антигенами патогенов,
является быстрота их действия. По сравнению с вакцинирующими
препаратами, базирующимися на принципах активации реакций
адаптивного иммунитета и требующими для формирования иммуноло¬
гических реакций довольно большого периода времени (дни), актива¬
ция врожденного иммунитета с формированием защитных реакций
происходит значительно быстрее (часы). Эти реакции существенно
усиливаются включенными в состав вакцины тронными к фагоци¬
там иммуностимуляторами. Совершенно очевидно, что включение
в создаваемые конъюгированные полимер-субъединичные вакцины
не одного, а нескольких молекул РАМР, активирующих разные РКК-
рецепторы, по-видимому, обеспечит их большую эффективность.Малоизученным аспектом создания вакцин, активирующих реак¬
ции врожденного иммунитета, является генетический контроль
защитных реакций. Проблема фенотипической коррекции генного
контроля иммунологических реакций, реализуемых через функци¬
ональную активность Т-хелперов, решена, однако не исключается
другой уровень генетического контроля — на уровне эндоцитоза
молекул антигена, экспрессии РКК-рецепторов различных типов и
(или) формирования сигнального пути, экспрессии молекул адгезии,
антигенов МНС и др. Поскольку в условиях врожденного иммунитета
распознаванию подвергаются ие отдельные антигены, а консерва¬
тивные структуры, общие для разных патогенов, мутации отдельных
рецепторов могут внести определенный вклад в стратегию борьбы с
9.4. Новые концепции в вакцинологии, базирующиеся на процессах... 395инфекциями. Разработка проблем этого направления важна не толь¬
ко для создания основ конструирования совершенно нового типа
вакцин, но и для целей противодействия возможным террористиче¬
ским угрозам, решения проблем возможного возвращения опасных
для человека и животных инфекций (чума, холера и др.), образования
химерных микробов вследствие обмена генетическим материалом при
одновременном заражении особи двумя разными вирусами, образова¬
ния устойчивых форм микробов в результате их приспособительных
мутационных изменений или появления новых, неизвестных ранее
форм инфекций наподобие ВИЧ [37, 96]. Это тем более вероятно, что,
по свидетельству генерального директора ВОЗ Чон-вук-Ли [206], к
2005 г. специалистами уже выделено 150 вариантов вирусов гриппа,
которые могут привести к пандемии. Более того, новые опасные и
неизвестные ранее штаммы патогенов могут возникнуть из природ¬
ных очагов. Именно поэтому быстрота действия, эффективность и
полноценность формируемого ответа являются важными ориентира¬
ми при конструировании таких препаратов.В заключение следует отметить, что конъюгирование выделенных
и очищенных отдельных эпитопов антигена с синтетическими поли¬
ионами обеспечивает:- существенное усиление их иммуногенности;- независимость иммунологического реагирования на введение
конъюгата от генов иммунного ответа;- повышение иммунного ответа слабореагирующих особей на ту
или иную конкретную инфекцию до уровня высокореагиру¬
ющих особей, т.е. осуществляет фенотипическую коррекцию
генного контроля иммунитета.Вскрытые закономерности дают основания для заключения о том,
что данный экспериментально обоснованный и апробированный
принцип создания конъюгированных полимер-субъединичных вак¬
цин, обеспечивающих фенотипическую коррекцию генного контро¬
ля иммунитета, может быть использован для создания эффективных
вакцинирующих препаратов с повышенными иммунизирующими
свойствами против различных антигенных и гаптенных молекул.
Как будет показано ниже, указанный принцип был практически
применен для создания ряда вакцин (против гриппа, ВИЧ/СПИДа,
аллергий), продемонстрировал высокую эффективность. Этот же
принцип может быть успешно использован и для разработки вак¬
цин, активирующих реакции врожденного иммунитета. Открытие
396 Глава 9. Фенотипическая коррекция и врожденный иммунитет...структур, характеризующих консервативные молекулы микробов и
распознающих их рецепторов на антигенпредставляющих клетках
млекопитающих, открывает широкие перспективы для создания
таких вакцин. В значительной степени этому способствует наличие
ряда препаратов стимулирующего типа, тропных к клеткам эндоци¬
тирующего типа — макрофагам и дендритным клеткам. Такой іювьій
подход к созданию вакцин представляется высокоперспективным,
поскольку создаваемые препараты обеспечивают выраженную акти¬
вацию реакций врожденного иммунитета, являющихся важнейшими
для формирования адаптивного иммунитета. Поглощение и перева¬
ривание антигена, соединение его с антигенами главного комплекса
гистосовместимости собственного организма и представление такой
структуры Т-клеткам — базовые основы, без которых невозможно
формирование приобретенного иммунитета. Именно активация этих
процессов характеризует новые концепции в современной вакцино¬
логии.
Глава 10КОНЪЮГИРОВАННЫЕ
ПОЛИМЕР-СУБЪЕДИНИЧНЫЕ ВАКЦИНЫЮЛ. ЭКСПЕРИМЕНТАЛЬНЫЕ ВАКЦИНЫ:
ОТ КОНЪЮГИРОВАННЫХ АНТИГЕНОВ
К КОНЪЮГИРОВАННЫМ ВАКЦИНАМВыше был обоснован и экспериментально подтвержден новый
принцип создания искусственных антигенов и антигенных комплек¬
сов. Конечной целью сформулированной программы исследований
является создание в полном смысле слова искусственных вакцини-
руюших макромолекул, не имеющих аналогов в природе [109, ИЗ,
114, 115, 119]. Суть этого направления заключается в том, что искус¬
ственная вакцина должна нести на своих макромолекулах не только
дстерминантные фрагменты антигенов, но одновременно и такую
структуру, которая обеспечивала бы продукцию антител к разнооб¬
разным антигенам независимо от генетического «фона» иммунизиру¬
емой особи. Встраивание этих молекул в иммунизирующий комплекс
усиливает отдельные этапы иммуногенеза, в том числе врожденного
иммунитета, вызывает активацию В-клеток, обеспечивает замеще¬
ние функции хелперных Т-клеток, что в конечном итоге приводит к
значительному повышению иммунного ответа на разные антигены в
«обход» Т-клеточного и /г-генного контроля иммуногенеза. Следует
еще раз подчеркнуть, что с помощью синтетических поликатионов и
полианионов индуцируется высокий иммунный ответ у генетически
низкоотвечающих особей. Очень важным свойством синтетических
иолиэлектролитов является их способность отменять эффект кон¬
куренции антигенов (тоже результат обеспечения Т-независимости
иммунного ответа). Это позволяет полагать, что комплексы разных
антигенных молекул с полиэлектролитами будут вызывать эффектив¬
ный иммунный ответ на все детерминанты поликомплексов незави¬
симо от действия регуляторных клеток, обладающих супрессивными
свойствами (Т-супрессоры, В-супрессоры и др.).
398 Глава 10. Конъюгированные полимер-субъединичные вакциныТаким образом, сформулированный принцип создания конъ¬
югированных вакцинирующих препаратов предполагает получение
комплексных макромолекул, состоящих из необходимой антигенной
детерминанты и заданной искусственной части, которая обеспечива¬
ет адъювантность и независимость всей макромолекулы от /г-генного
контроля, антигенной конкуренции и некоторых других иммунобио¬
логических особенностей организма. Ниже приводятся данные, пока¬
зывающие достижения в разработке искусственных вакцин против
ряда актуальных инфекционных и неинфекционных антигенов,lO.t.l. САЛЬМОНЕЛЛЕЗНЫЕ ВАКЦИНЫИсследования (Петров Р.В. и др.) проводили на модели мыши¬
ного тифа, вызываемого Salmonella typhimurium [119, 680]. Известно
(Алексеева Н.Ю, и др. [9], Хаитов P.M. и др, [180]), что сила иммунного
ответа на основные антигены сальмонелл — О-антиген (ЛПС стенки
бактерий) и Н-антиген (белок жгутикового аппарата бактерий) —
коррелирует со степенью поствакцина л ьной резистентности живот¬
ных к этой инфекции [779]. Невозможность получения высокого
защитного эффекта при вакцинации животных связана с их низкой
отвечаемостью на данные антигены.В предварительных исследованиях было показано, что введение
мышам разных линий, наряду с полисахаридом, выделенным из
О-антигена, или Н-антигеном ПАК, ПВП или сополимера акриловой
кислоты (АК) и N-ВПД, обеспечивает усиление иммунного ответа
на оба антигена. При этом степень стимуляции антителогенеза была
выше у низкореагирующих на каждый антиген линий мышей (Хаи¬
тов P.M. и др. [180]). Таким образом, происходило нивелирование меж-
линейньтх различий иммунного ответа на полисахарид и Н-антиген.
Иными словами, использованные полиэлектролиты обеспечивают
фенотипическую коррекцию генного контроля иммунного ответа на
основные антигены сальмонелл. В дальнейшем были изучены протек¬
тивные свойства конъюгатов антигенов сальмонелл с синтетическими
полиэлектролитами (Петров Р.В. и др. [109, 680]).Выше были описаны конъюгированные иммуногены на основе
синтетических полиэлектролитов, несущих полисахаридную часть
О-антигена (двухкомпонентный антиген) или оба главных антигена
сальмонелл — полисахарид и флагеллин (трехкомпонентный анти¬
10.1. Экспериментальные вакцины: от конъюгированных... 399ген). Иммунизация этими иммуногенами обеспечивает развитие
иммунологической памяти и высокий вторичный ответ на оба анти¬
гена после однократной иммунизации без какой-либо дополнитель¬
ной обработки стандартными адъювантами.Протективную активность таких конъюгированных антигенов
изучали на модели естественной для мышей инфекции — мышиного
тифа, вызываемого Salmonella typhimurium. Для заражения использова¬
ли вирулентный штамм Salmonella typhimurium 415. До введения живот¬
ным бактерии культивировали в течение 16—18 ч на агаре Хоттингера.
Дозу для инфицирования устанавливали обычным методом, исполь¬
зуя оптический стандарт. Жизнеспособность бактерий в свежих куль¬
турах оценивали путем посевов. LD50 вирулентного штамма Salmonella
typhimurium 415 для мышей (CBAxC57BL/6)F, определяли для каждого
опыта, заражая группы животных дозами 10^, 10^, 10^ и 10^ мик¬
робных тел; расчет производили по общепринятой формуле Кербера.
Для изучения протективной активности исходные салъмонеллезные
антигены или конъюгаты вводили мышам однократно внутрибрю¬
шинно в дозах 1, 5, 25, 125 и 625 мкг. Через 2 нед животных заражали
вирулентным штаммом Salmonella typhimurium 415 в дозе 20-100 LD50.
В качестве критерия защитных свойств использовали показатель
ED50, который также рассчитывали по формуле Кербера.На основании опытов по изучению иммуногенности конъюгатов
полисахарид-полиион и полисахарид-белок-полиион в эксперимен¬
тах по изучению протективных свойств ПС-полимерного конъюгата
прежде всего исследовали конъюгат К-4. Гибель животных, иммуни¬
зированных ПС и К-4 и зараженных 20 LDso Salmonella typhimurium 415,
показала, что ПС обладает относительно слабо выраженными про¬
тективными свойствами и защищает животных лишь при введении
в очень высокой дозе — 625 мкг на мышь. Препарат К-1, несмотря на
меньшее содержание в нем ПС, создавал 100%-ю резистентность при
введении его в дозах 625, 125 и 25 мкг на мышь и более эффективно,
по сравнению с ПС, защищал животных, иммунизированных доза¬
ми 5 и 1 мкг. При введении, в качестве контроля заражения, 20 LD50
Salmonella typhimurium 415 интактным животным наблюдали 100%-ю
гибель в течение 5—7 сут.Сравнение защитной эффективности конъюгатов и ПС проводили
с помощью критерия ED50. После определения по формуле Кербера
ED50 для К-4 и ПС исходя из весовых отношений в конъюгате ПС: поли¬
мер рассчитывали ED50 для ПС в составе конъюгата. Показатель ED50
400 Глава 10. Конъюгированные полимер-субъединичные вакциныдля ПС в составе конъюгатов К-4 существенно меньше по сравнению
с введением исходного ПС. Расчет повышения защитных свойств ПС в
конъюгированном состоянии по отношению к неконъюгированному
ПС=(К*) производили, вычисляя отношение ED50 двух препаратов.Конъюгация ПС с MNA приводила к усилению его протективной
активности в среднем в 20—40 раз. Введение конъюгатов давало значи¬
тельный защитный эффект и при заражении мышей дозами 100 LD50
Salmonella typhimurium, т.е. при инфицировании животных сверхле-
тальными дозами возбудителя. Таким образом, иммунизация мышей
конъюгатами ПС из сальмонелл с синтетическими полиэлектроли¬
тами приводит к формированию приобретенной резистентности к
мышиному тифу. Сам ПС практически лишен протективных свойств.
Защита мышей от инфекции, наблюдаемая при введении самой высо¬
кой дозы ПС (625 мкг на мышь), связана, по-видимому, с формирова¬
нием неспецифической резистентности к инфекции.Иммунизация мышей трехкомпонентным искусственным имму¬
ногеном о-ПС-ФЛЛ-полиэлектролит обеспечивает более высокий
протективный эффект по сравнению с двухкомпонентным антигеном
О-ПС-полиэлектролит. Следует отметить, что замена ФЛА на БСА
не повышает протективного действия комплекса. Другими словами,
конъюгат О-ПС-БСА-полиэлектролит дает такую же защиту, как и
конъюгат О-ПС-полиэлектролит. На рисунке 84 показаны общая
схема экспериментов по испытанию конъюгированных противосаль-
монеллезных вакцинирующих комплексов, а также их протективная
активность.В литературе имеются данные о возможности усиления антиген¬
ных свойств О-специфического ПС из Salmonella typhimurium путем
его модификации. Были описаны конъюгаты ПС с белками, напри¬
мер с яичным альбумином. Многократная иммунизация животных
подобными комплексными антигенами в ПАФ вызывала образование
О-специфических антител, формирующих при пассивном переносе
мышам резистентность к экспериментальной инфекции. Однако
попытки активной иммунизации животных конъюгатами ПС на раз¬
личных носителях оказались малоэффективными.Следовательно, способность конъюгатов ПС и ФЛА с синтетически¬
ми полиэлектролитами обеспечивать активную иммунизацию мышей
связана именно с природой носителя-иммунопотенциатора. Следует
особо отметить, что для создания приобретенной резистентности
мышей к инфекции Salmonella typhimurium было достаточно од1юкратно-
10,1. Экспериментальные ващины: от конъюгированных...401ИммунизацияРис. 84. Эксперименты (схема) по испытанию противосальмонеллезных вак¬
цинирующих комплексов;а — антигены бактериального тела: 1 — полисахаридный и 2 ~ белковый анти¬
ген жгутика; б — антигенполимерные конъюгаты; в — данные по выживаемости
мышей, инфицированных абсолютно смертельной дозой вирулентных Salmonella
typhimurium 415, предварительно иммунизированных только полисахаридной фракци¬
ей (I) из О-антигена этих сальмонелл, конъюгатом полисахарида с полиэлектроли-
тш (3) и тройным конъюгатом ПС-флагеллин-ПЭ (4). Все 100% контрааьных мышей
(неиммунизированные) погибли в течение 5—7 сут после инфицированияГО введения полученных антигенполиэлектролитных конъюгатов без
дополнительного использования какого-либо адъюванта.Таким образом, получены конъюгированные иммуногены, спо¬
собные индуцировать выраженную иммунологическую память и, как
результат этого, сильный вторичный ответ на О- и- Н-протективные
специфичности Salmonella typhimurium. Полиэлектролитные конъюга¬
ты, несущие одновременно два антигена, дают максимальный про¬
тективный эффект. Все выщеизложенное позволяет отнести эти ком¬
плексы к принципиально новому типу вакцинирующих препаратов
с контролируемой структурой и иммуногенностью. Поскольку мик¬
робы Salmonella typhimurium вызывают свойственную мышам инфек¬
цию, а созданный препарат обеспечивает вакцинирующий эффект
402 Глава 10. Конъюгированные полимер-субъединичные вакциныс защитой животных от заражения данным возбудителем, есть все
основания утверждать, что получена первая вакцина нового типа
(конъюгированная вакцина) против реального инфекционного забо¬
левания — мыщиного тифа.10.1.2. ГРИППОЗНЫЕ ВАКЦИНЫРазработанный принцип создания конъюгированных вакциниру¬
ющих комплексов на основе синтетических полиэлектролитов нашел
подтверждение и в опытах на модели возбудителя вирусной инфекции
(Петров Р.В. и др. [105, 681]).Известно, что поверхностные антигены вируса гриппа — гемаг¬
глютинин (НА) и нейраминидаза (NA) — являются главными анти¬
генами вириона, индуцирующими в инфицированном организме
образование протективных антител [158, 215, 538]. Однако изолиро¬
ванные НА и NA, входящие в состав существующих субъединичных
вакцин, слабоиммуногенны и не способны индуцировать доста¬
точно сильный иммунный ответ. В этой связи разработка способов
повышения иммуногенности этих поверхностных антигенов вируса
гриппа представляется важным этапом создания принципиально
новых эффективных вакцин против гриппа. Мы [105, 681] выделя¬
ли поверхностные антигены вируса гриппа из высокоурожайных
рекомбинантных штаммов A/MRC-11 (содержит соответствующие
поверхностные антигены НЗНА и N2NA эпидемического штамма
А/Порт Чалмерс/1/73) и R-5 (содержит НЗНА и N2NA эпидемического
штамма А/СССР/05/80).Вирусы выращивали в аллантоисной полости 10-дневных кури¬
ных эмбрионов, очищали и концентрировали центрифугированием
в ступенчатом градиенте плотности сахарозы (20-60%) и гель-филь¬
трацией на колонке с сефарозой-4В. НА выделяли из очищенной
и концентрированной вирусной суспензии (2 мг вирусного белка в1 мл) с помощью протеазы бромелина. Сумму (НА + NA) изолиро¬
вали с использованием неионного детергента ß-октилглюкозида.
Изолированные вирусные антигены ковалентно связывали с синтети¬
ческим полиэлектролитом — сополимером (СП) акриловой кислоты и
N-ВПД состава 1:1. СП имел молекулярную массу около 100 кД.Синтез конъюгатов НА—СП и (НА + NA)-Cn проводили с использо¬
ванием реакции ацилирования в присутствии л-толуол-сульфонат-N-
iO,L Экспериментальные вакцины: от конъюгированных... 403циклoгeкcил-N-[2-(4-мopфoлиний) этил]-карбодиимида. Конъюгаты
отделяли от несвязавшегося белка и свободного сополимера 1^ль-филь-
грацией на колонке с Сефадексом G-150, диализовали против дистил¬
лированной воды и лиофилизировали. Для иммунизации использо¬
вали конъюгаты с содержанием 100-150 мкг вирусного белка на I мг
конъюгата. Мышей иммунизировали однократно внутрибрюшинно
изолированными белками (0,2 мл), механической смесью вирусных
aiiTHreHOB с СП — НА + СП и (НА + NA) + СП или конъюгатами
НА-СП и (НА + NA)—СП в дозах 1—16 мкг вирусного белка на мышь.Для тестирования защитного эффекта конъюгатов на 14-й день
гюсле иммунизации животных заражали патогенным вариантом
штамма А/СССР/05/80, полученным после 30 серийных пассажей
исходного штамма через легкие мышей. Патогенный вариант вызывал
гибель мышей в дозе 4,0 Ig LD50. Заражение проводили интраназально
летальной дозой 10 LD50. Гибель мышей регистрировали в течение14 дней после инфицирования.На рисунке 85 представлена динамика формирования IgM- и IgG-
AOK в селезенке мышей, однократно иммунизированных изолиро¬
ванными вирусными антигенами или соответствующими конъюгата¬
ми. При иммунизации изолированными НА и (НА + NA) в селезенке
формируется лишь незначительное количество IgM-AOK в течение
всего периода наблюдения. Количество таких АОК лишь в 2-2,5 раза
превышает число фоновых АОК, т.е. количество IgM-AOK в селезенке
неиммунизированных животных. В этих группах на 3-и и 7-е сутки
после иммунизации в селезенке животных IgG-AOK не выявлялись.
Введение механической смеси НА + СП или (НА + NA) + СП, ком¬
поненты которой химически не связаны друг с другом, обеспечивает
увеличение количества IgM- и IgG-AOK приблизительно в 5 и 7 раз
соответственно по сравнению с их количеством при иммунизации
изолированными антигенами. Иммунизация конъюгатами НА-СП
или (НА + NA)—СП приводит к значительно более высокому при¬
росту IgM- и IgG-AOK, содержание которых более чем в 50 и 100 раз
превышает количество АОК при иммунизации изолированными
вирусными антигенами. При иммунизации как механическими сме¬
сями НА -ь СП, (НА + NA) + СП, так и конъюгатами НА-СП и
(НА + NA)-Cn максимальное число IgM- и IgG-AOK регистрирова¬
лось соответственно на 7-е и 14-е сутки.Иммунизация мышей описанными конъюгатами приводит также
к повышению интенсивности реакции ГЗТ, т.е. Т-клеточного иммун-
404Глава 10. Конъюгированные полимер-субъединичные вакциныАОКАОКРис. 85. Динамика формирования вирусспецифических IgM и IgG у мышей
иммунизированных:а~ НА (1, 2), смесью НА + СП (3, 4) или конъюгатом НА-СП (5, 6); б ~ (ГА + НА)
(1, 2), смесью (НА + NA) + СП (3, 4) или конъюгатам (НА + NA) - СП (5, 6);
1, 2, 3 — IgM; 2,4,6— Igfj. АОК определяли с использованием ЭБ, покрытых гомоло¬
гичными вирусными частицами. По оси абсцисс — время после иммунизации. По оси
ординат нисло АОК в селезенке (х}0~^)ного ответа (тестировали по опуханию подушечек лап, развивающе¬
муся в ответ на повторное введение антигена).Поскольку иммунный ответ на НА и NA является вируснейтрализу-
ющим, можно было ожидать определенного протективного антивирус¬
ного действия конъюгатов, содержащих в своем составе эти антигены.
Как видно из рисунка 86, животные, иммунизированные конъюгатом
НА—СП, были полностью резистентны к патогенному варианту гомоло¬
гичного штамма вируса гриппа А/СССР/05/80. При иммунизации анало¬
гичной дозой изолированного НА выживаемость составляла лишь 23%.При иммунизации мышей различными дозами гомологичных НА
и ЫА как в изолированном состоянии, так и в составе конъюгатов
(рис. 87) получены следующие результаты. Однократная иммуниза-
10.1. Экспериментальные вакцины: от конъюгированных,..405Время, сутРис. 86- Динамика гибели мышей после их иммунизации изолированным НА
(2) или конъюгатом НА-СП (16 мкг на мышь) (У) и последующего заражения
патогенным вариантом вируса грипиа:3 — выживаемость контрольных (неиммунизированных) животных. По оси абсцисс —
время после заражения. По оси ординат — количество выживших животных%1006020IIIIIИ11□ зРис. 87. Заш;ита мышей, зараженных вирусом гриппа, после иммунизации
изолированным НА (а), (НА + NA) (б) или конъюгатами с полиэлсктроли-
том:/ — контроль (неиммунизированные мыши); 2—мыши, иммунизированные вирусными
белками, не конъюгированными с полимером; 3 — мыши, иммунизированные конъюга¬
тами вирусных белков с полимером. По оси ординат — количество выживших мышей
на /4-й день после заражения: 1—1 мкг на мышь; 11—4 мкг на мышь; П1 — 16 мкг
на мышь
406Глава 10. Конъюгированные полимер-субъединичные вакциныция сравнительно небольшой дозой НА-СП обеспечивает пример¬
но 80%-ную зашиту животных. В группе мышей, иммунизированных
конъюгатом (НА + КА)-СП в той же дозе, наблюдается абсолютная
невосприимчивость к вирусу. У мышей, иммунизированных конъ¬
югатами НА—СП или (НА + КА)—СП в дозе 1 мкг вирусного белка на
мышь, эффективность зашиты составляет соответственно 54 и 62%.
Выживаемость мышей, иммунизированных изолированными НА
или НА + КА, достигает всего лишь 11-14%. Конъюгаты в дозе 16 мкг
на мышь обеспечивают полную защиту. Одновременно выявляется
тенденция к некоторому усилению протективного эффекта конъ¬
югатов, содержащих сумму (НА + КА) по сравнению с таковым при
использовании конъюгатов, в составе которых имеется только НА.
На рисунке 88 приведена общая схема экспериментов по испытаниюРис. 88. Эксперименты (схема) по испытанию искусственных вакцин против
гриппозной инфекции, представляющих собой конъюгаты гемагглютинина
и нейраминидазы с синтетическими полиионами;а — вирус гриппа (1 — гемагглютинин; 2 — нейраминидаза); б — конъюгаты анти¬
ген-полимер (3 — гемаггаютинин-птимер; 4 — двойной конъюгат); в — выживае¬
мость мышей при иммунизации гемагглютинином шш конъюгатами (5 — введение
изотонического раствора хлорида натрия) с последующим заражением вирусом
гриппа; г — число АОК в селезенке мышей соответствующих групп
iO.L Экспериментальные вакцины: от конъюгированных... 407вакцин — конъюгатов поверхностных антигенов вируса гриппа А с
иолиионами и показана их защитная эффективность при заражении
патогенным вариантом гомологичного штамма вируса.Таким образом, полученные данные свидетельствуют о принци¬
пиально новой возможности превращения слабоиммуногенных
изолированных поверхностных антигенов вируса гриппа в высоко¬
иммуногенные препараты, обладающие сильным вакцинирующим
действием, путем ковалентного связывания их с неиммуногенны-
ми синтетическими полиэлектролитами — иммуностимуляторами.
Высокий протективный эффект использованных конъюгатов, наблю¬
даемый даже при однократной иммунизации животных, позволяет
полагать, что описанный подход при конструировании новых типов
вакцин окажется конструктивным при разработке препаратов не
только против гриппа, но и против других вирусных заболеваний
человека и животных.Особый интерес представляют результаты, полученные в экспери¬
ментах с внутренними антигенами вируса гриппа. Эти белки отно¬
сительно мало меняются в процессе антигенного дрейфа. Примером
может служить мембранный, или матриксный, белок (М-белок) вируса
гриппа, который является внутренним компонентом вирусной части¬
цы, тесно ассоциированным с ее липопротеидной оболочкой [27, 158,
525]. Полагают, что М-белок играет важную роль в инфекционном про¬
цессе на стадии сборки вирионов вируса гриппа и их отпочковывания от
плазматической мембраны инфицированной клетки. Перврічная струк¬
тура М-белка относительно консервативна и претерпевает в процессе
антигенного дрейфа, затрагивающего в основном НА и NA, лишь незна¬
чительные изменения. Считалось, что антитела к М-белку не являются
протективными при гриппозной инфекции, хотя их синтез происходит
одновременно или даже предшествует синтезу антител к НА.с учетом низкой иммуногенности М-белка мы (Петров Р.В.
и др. [107, 122, 681]) для стимуляции иммунного ответа использовали
описанный выше принцип конструирования эффективных конъ¬
югированных иммуногенов на основе синтетических полиэлект¬
ролитов. Изолированный из вирионов гриппа М-белок был кова¬
лентно конъюгирован с нетоксичным сополимером АК и N-ВПД
(ММ около 100 тыс.). Задачей экспериментов являлось изучение пер¬
вичного иммунного ответа животных (мышей) на М-белок при его
введении в составе такого конъюгата, а также оценка протективных
свойств конъюгата для защиты мышей от гриппозной инфекции.
408 Глава 10. Конъюгированные полимер-субъединичные вакциныРекомбинантный штамм вируса гриппа MRC-11 (H3N2), вири-
оны которого содержат М-белок вируса гриппа A/PR/8/34 (H1N1),
выращивали на куриных эмбрионах и очищали в ступенчатом гра¬
диенте плотности сахарозы (20—60%) и гель-фильтрацией на колонке
с сефарозой-4В. Из очищенных вирионов с помощью их обработки
протеазой бромелина получали субвирусньте частицы, содержащие
только внутренние белки вируса гриппа, М-белок выделяли из таких
частиц хлороформ-метанольной экстракцией. Чистоту препаратов
контролировали с помощью электрофореза в полиакриламидном
геле и методом двойной иммунодиффузии в агарозе. С помощью по¬
следнего метода было показано, что полученный препарат М-белка не
содержал примеси НА и не давал полосы преципитации с моноспеци-
фической кроличьей сывороткой к изолированному гемагглютинину.
Конъюгацию М-белка с СП проводили карбодиимидным методом
при 4 °С в 0,05 М фосфатном буфере (pH 60), Для иммунизации
использовали конъюгат М-СП с содержанием 0,045 мг М-белка на
1 мг конъюгата.Мышей линии СВА иммунизировали однократно внутрибрюшин¬
но изолированным М-белком или конъюгатом М-СП в дозах 4—20 мкг
М-белка на мышь. Через 14 сут в сыворотке крови определяли нали¬
чие антител к М-белку, используя метод твердофазного иммунофер¬
ментного анализа.Титры антител против М-белка в мышиных сыворотках, полу¬
ченных после иммунизации животных изолированным М-белком и
конъюгатом М-СП (в дозе 20 мкг белка на мышь), составляли соот¬
ветственно 1:20 и 1:3200. Таким образом, как и в случае с изолирован¬
ным НА вируса гриппа, слабоиммуногенный М-белок превращается
в составе конъюгата в высокоиммуногенный препарат.Представляло интерес выяснить, способна ли индуцированная
иммуностртмуляция М-белком в составе конъюгата защитить живот¬
ных от гриппозной инфекции. На рисунке 89 представлены данные
по изучению динамики гибели мышей, однократно иммунизирован¬
ных изолированным М-белком или конъюгатом М-СП (в дозе 20 мкг
М-белка на мышь) и зараженных патогенным для мышей вариан¬
том вируса гриппа А/СССР/05/80 (H3N2). Количество выживших
животных составило соответственно 13 и 38% (8% мышей выжили
в контрольной неиммунизированной группе). Данные рисунка 90
демонстрируют сравнительный защитный эффект при иммунргза-
ции мышей изолированным М-белком и двумя различными дозами
10.1. Экспериментальные вакцины: от конъюгированных.409Время, сутРнс. 89. Сравнительная динамика гибели мышей после иммунизации М-бел¬
ком и конъюгатом М-СП с последующим заражением вирусом гриппа:/ — контрольная группа (неиммунизированные мыши); 2 — группа, иммунизированная
М-белком; 3 — группа, иммунизированная конъюгатом М-СП. Доза иммунизации —20 мкг М-белка на мышь. По оси ординат — количество выживших животныхРис. 90. Сравнительная протективная активность М-белка вируса гриппа и
М-белка в составе конъюгата М-СП;а — контроль (неиммунизированные мыши); б — 2-й контроль (мыши, обработанные
СП); в — мыши, иммунизированные М-белком (20 мкг на мышь); г — мыши, имму¬
низированные конъюгатом М-СП (4 мкг М-белка в составе конъюгата на мышь);
д — мыши, иммунизированные конъюгатом М-СП (20 мкг М-белка в составе конъ¬
югата на мышь). По оси ординат — количество выживших животных
410Глава 10. Конъюгированные полимер-субъединичные вакциныРис. 91. Эксперименты (схема) по испытанию вакцин — конъюгатов матрикс-
ного (М) белка и белка нуклеопротеида (КР) с синтетическими полиионами:
а — вирус гриппа: / — нейраминидаза; 2 — гемагглютинин; 3 — М-белок; 4 — МР-белок;
б — конъюгаты антиген-полиэлектролит; 5 — с М-белком; 6 — двойной конъюгат;
в — М-специфический иммунный ответ (ЕЫЗА-титр); г — выживаемость, %,
мышейМ-белка в составе конъюгата. В группах неиммунизированных мышей
и мышей, получивших только сополимер (две группы контроля),
после заражения гриппом выжило соответственно 8 и 10% животных,
а при иммунизации конъюгатом М-СП в дозах 4 и 20 мкг М-белка на
мышь этот показатель составил соответственно 20 и 36%.На рисунке 91 показана схема экспериментов по испытанию вак¬
цин — конъюгатов типоспецифических антигенов вируса гриппа А
с полиионами и приведены усредненные данные четырех опытов по
их защитной эффективности от заражения патогенным вариантом
гетерологичного штамма вируса, отличающегося по поверхност¬
ным антигенам. Вакцинация мышей тройным конъюгатом М-белок-
полиион-белок нуклеопротеида повысила выживаемость животных,
инфицированных патогенным вариантом вируса гриппа гетерологич¬
ного штамма до 60-70%.Иммунизация животных исходным М-белком вируса гриппа
практически не оказывает протективного действия, что согласуется
10.1. Экспериментальные вакцины: от конъюгированных... 411с данными, полученными другими авторами [248, 249]. В то же время
наблюдается выраженный протективный эффект при иммунизации
животных М-белком, ковалентно конъюгированным с синтети¬
ческим полимерным иммуноадъювантом. В дозе 20 мкг белка на
мышь М-белок, изолированный из вируса гриппа 1934 г, выделения
(А/РК/8/34), в составе конъюгата обеспечивал защиту мышей,
зараженных патогенным вариантом вируса 1980 г. выделения (А/
СССР/05/80). В упомянутой выше работе [249] не было получено протек¬
тивного эффекта при иммунизации мышей М-белком в дозе 0,5-50 мкг
М-белка с использованием в качестве адъюванта гидроокиси алюми-
н ия. Важно отметить, что в этом исследовании (как и в нашей работе)
М-белок был выделен не из цельных вирионов гриппа, а из субвирусных
частиц, не содержащих в своем составе поверхностных гликопротеи¬
дов, в частности гемагглютинина. В связи с этим иммунизация живот¬
ных такими препаратами не могла инициировать выработку протек¬
тивных вируснейтрализующих анти-НА антител. Наблюдаемая же
нами относительно высокая протективная активность конъюгатов
М-СП, по-видимому, связана с принципиальным отличием меха¬
низмов иммуностимулирующего действия обычных адъювантов
(гидроокись алюминия, адъювант Фрейнда) и синтетических поли¬
мерных макромолекул, ковалентно связанных с антигеном белковой
природы.В связи с тем что, как уже указывалось, внутренние белки вируса
гриппа, в частности матриксный белок, являются типоспецифиче¬
скими антигенами, слабо изменяющимися в процессе антигенного
дрейфа вируса гриппа, можно надеяться, что предполагаемый нами
подход окажется полезным при создании нового поколения универ¬
сальных полимерсубъединичных вакцин против гриппа и других
вирусных заболеваний.Полностью искусственная вакцина против вируса гриппа. Следует
повторить, что конъюгаты внутренних белков (матриксный белок,
белок нуклеопротеида) вируса гриппа с полиионными иммунопо¬
тенциаторами существенно стимулировали протективный иммун¬
ный ответ у мышей на гетерологичные штаммы патогенного вируса.
Благодаря этому возникает возможность получения «нового поколе¬
ния» вакцин против вируса гриппа, защищающих вакцинированных
не только против того штамма вируса, из которого получена вакцина,
но и широкого спектра штаммов (серотипов) вируса гриппа. В связи с
этим при создании поливалентных вакцин целесообразно ориентиро¬
4Ï2 Глава 10. Конъюгированные полимер-субъединичные вакцинываться на наиболее консервативные пептидные фрагменты вирусных
белков, идентичных у разных серотипов.Мы получили и исследовали полностью искусственные иммуно¬
гены, представляющие собой химические конъюгаты синтетического
додекапептида субъединицы НА2 гемагглютинина вируса гриппа А
с неприроднмми полиионными иммуномодуляторами (Петров Р.В.
и др, [127]). По указанным выше соображениям в качестве антигенной
детерминанты был выбран N-концевой фрагмент легкой цепи гемаг¬
глютинина вируса А, удлиненный с С-конца на остаток глицина. Для
этого фрагмента, называемого пептидом активации слияния (F/A),
характерна высокая степень консервативности: он инвариантен во
всех штаммах вируса типа А и имеет лишь единичную замену — лей¬
цин на фенилаланин в вирусах типа В [231]. С пептидом активации
слияния связывают способность вируса гриппа проникать через мемб¬
рану клетки-хозяина с последующей инициацией инфекции. Участок
F/A является антигенным в нативной вирусной частице [249], а также
при получении методом пептидного синтеза [231]. Несмотря на обна¬
ружение антител к пептиду F/A при естественной форме инфекции
у человека, его введение мышам в составе конъюгатов пептид—белок
или в адъюванте Фрейнда не вызывает протективного эффекта,Додекапептид, соответствующий аминокислотной последова¬
тельности К-концевого участка НА2, синтезировали классическим
методом в растворе по схеме 4+4+4, При синтезе использовали как
метод ступенчатого наращивания пептидной цепи с помощью акти¬
вированных эфиров сукцинимидных и пентафторфениловых, так
и метод блочной конденсации фрагментов. Конденсация фрагмен¬
тов проведена карбодиимидным методом. Для временной защиты
групп NHj использовали группу Вое, которую удаляли обработкой
трифторуксусной кислотой, С-концевой остаток глицерина и группу
у-СООН защищали бензиловыми эфирами. При синтезе фрагментов
додекапептида применяли триметилсилильную кислоту. Защитные
группы удаляли с конечного продукта синтеза обработкой CFaCOOH
и каталитическими гидрогенолизом над Pd/чернью. Полученный
додекапептид имел следующую последовательность: Gly-Leu-Phe-
Gly-Ala-Ile-Aia-Gly-Phe-Ile-Glu-Gly.Деблокированный пептид конъюгировали с рядом носителей-
полиэлектролитов: сополимером акриловой кислоты и N-ВПД экви¬
молярного состава (СП) или сополимером поливинилпирролидона с
малеиновым ангидридом (NM). Конденсацию пептидов с носителем
10,1. Экспериментальные вакцины: от конъюгированных... 413проводили карбодиимидным методом или методом активированных
эфиров по N-концу пептидной цепи.Антигенные характеристики полученного додекапептида F/A, а
также F/A в составе конъюгатов с иммуностимулирующими полиэлек¬
тролитами исследовали методами твердофазного иммуноферментно¬
го анализа. При этом использовали ряд стандартных антисывороток
к гемагглютининам вирусов гриппа типа А (N/H, США), в качестве
контроля применяли антисыворотки к М-белку. В качестве антиге¬
нов использовали конъюгаты F/A-додекапептид с синтетическими
полиэлектролитами NM и СП (F/A-NM и F/A-СП), а также с БСА
(F/А-БСА). При этом было взято по два варианта конъюгатов, отлича¬
ющихся содержанием в них додекапептида F/A: 3,5М и 12М F/A на 1М
NM; 0,4M и 1,6М F/A на 1М СП. Мыщей линии СВА иммунизировали
однократно внутрибрюшинно различными дозами синтезированных
антигенов. В качестве тест-антигенов при определении иммунного
ответа использовали иммобилизованные частицы вируса гриппа
типа А серотипов H3N2, HONI и типа B/Singapore, а также конъюгат
F/А-БСА. Для оценки уровня антител к додекапептиду F/A применяли
меченные пероксидазой козьи IgG, полученные к IgG мыши. В качес¬
тве субстрата использовали 5-аминосалициловую кислотуЧастицы вируса гриппа A/Aichi, А/Техас (H3N2); A/PR 8 (H0N1) и
B/Singapore получали путем гель-хроматографии аллантоисных пре¬
паратов на модифицированном макропористом стекле ВИРОХРОМ
2000П.При изучении антигенных свойств полученного додекапептида
F/A было показано, что синтетический пептид F/A обладает антиген¬
ной активностью, соответствующей таковой консервативной анти¬
генной детерминанте легкой цепи гемагглютининов вирусов гриппа
А, причем эта активность сохранялась после получения конъюгатов
(Петров Р.В. и др. [127]). Эти результаты позволяют предположить,
что среди антител, полученных против нативного гемагглютинина,
существует популяция иммуноглобулинов со специфичностью к
искусственному фрагменту — пептиду F/A.При исследовании образования антител к додекапептиду при
первичной иммунизации мышей линии СВА конъюгатами F/A с
различными носителями было выявлено, что однократное введение
конъюгата F/А-БСА в дозах 1—30 мкг на мышь не приводило к появ¬
лению антипептидных и противовирусных антител. Использование
конъюгата F/A-NM в дозах по пептиду, равных 0,33; 0,8 и 1,7 мкг,
414 Глава 10. Конъюгированные полимер-субъединичные вакцинысопровождалось появлением антител изотипа IgG. На 7—9 сут после
иммунизации зарегистрирован пик выработки антител к иммобили¬
зованным частицам вируса гриппа А. На 6-8 сутки наблюдался пик
антител к конъюгату F/А-БСА. Наиболее эффективной для иммуни¬
зации оказалась доза, равная 0,8 мкг пептида F/A на мышь массой
около 20 г.Мы также исследовали иммуногенную активность двух конъ¬
югатов с низкой гаптенной плотностью пептида F/A на носителе СП
(0,4 и 1,6 М F/A на 1М СП). Синтетический носитель СП в дозах
100 и 500 мкг характеризовался большей иммуномодулируюшей
активностью по сравнению с таковой NM, Для иммунизации конъ¬
югаты использовали в дозах по пептиду, равных 2, 5 и 10 мкг, которые
соответствовали иммуногенной активности носителя. Увеличение
антителообразования происходило к 7-м суткам после однократной
иммунизации этими препаратами. Повышение гаптенной плотности,
приводящее при одинаковой дозе пептида F/A (2,5 мкг) к уменьшению
количества носителя соответственно с 500 до 125 мкг, вызывало воз¬
растание уровня антител. Увеличение продукции антител наблюда¬
лось также при повышении дозы пептида F/A с 2,5 до 10 мкг при посто¬
янном содержании носителя СП (500 мкг). При этом не было получено
значимых отличий в титрах антипептидных и противовирусных
антител, полученных при однократной иммунизации изучаемыми
конъюгатами пептида F/A (3,5 и 12 М F/A на 1 М носителя); возможны
снижение и даже полная утрата иммуномодулирующей активности.
Использование конъюгатов с низкой гаптенной плотностью показало
необходимость более детальной разработки оптимального соотноше¬
ния пептида F/A и носителя.На рисунке 92 показана общая схема полностью синтетического
иммуногена, представляющего собой конъюгат N-терминального
фрагмента легкой цепи гемагглютинина с согюлимером и N-ВПД.
Как видно, этот искусственный иммуноген стимулирует продукцию
антител с широким спектром реагирования против гемагглютининов
вирусных частиц гриппа А различных серотипов (левая часть рис. 92),
Он относится к разряду вакцинирующих препаратов, поскольку спо¬
собен вызывать значительный протективный эффект у иммунизиро¬
ванных животных (правая часть рис. 92).Таким образом, конъюгаты, содержащие синтетический доде¬
капептид константной части гемагглютинина, приобретают имму¬
ногенность за счет иммуномодулирующих полиионных носителей
Î0,Î, Экспериментальные вакцины: от конъюгированных...4151211109в7654321^NH-Gly-Leu-Phe-Gly-Ala--Ile-Ala-Gly-Phe-lle-Glu-Gly-й-Ш!
а 6
1ál.а б
2а б
312 3 4Рис. 92. Иммуногенный (левая часть рисунка) и протективный (правая часть
рисунка) эффекты полностью искусственной пептид-полииоиной (верхняя
часть рисунка) гриппозной вакцины:1 — конъюгат пептида F/A с сополимером полиакриловой кислоты и N-винилпир-
ролидона (0,03—0,02 мг пептида на 1 мг конъюгата); II — антителообразование
против искусственных антигенов, тестируемое твердофазным иммуноферментным
методом с конъюгатом F/A-BSÁ (1) и интактными вирусами A/Aichi (2); A/Texas (3);
A/PR/8 (4): а — иммунизация F/A-пептидным сополимерным комплексом (2,5 мкг F/A
на мышь линии СВА); б — иммунизация F/A-BSÁ в изотоническом расгпворе хлорида
натрия (2,5 мкг F/A на мышь линии СВА). По оси ординат — относительная I абсор¬
бция при 450 нм; Ш — защита мышей от инфекционного заражения (A/Aichi) через21 день после иммунизации: I — неиммунизированные контрольные мыши; 2 — F/A-
BSA (2,5мкг на мышь); 3 — F/A-пептидный сополимерный комплекс (2,5мкг на мышь);
4 — F/A-пептидный сополимерный комплекс (10 мкг на мышь). Но оси ординат —
относительный титр легочного вируса A/Aichi (-log
416 Глава 10. Конъюгированные полимер-субъединичные вакцины(конъюгаты F/А-БСА неиммуногенны). В проведенных другими
авторами исследованиях достоверный уровень антителообразования
достигался только при многократном введении конъюгатов пептида
F/A с высокомолекулярными белковыми носителями при обязатель¬
ном использовании адъюванта Фрейнда [231]. В наших экспериментах
однократное введение конъюгатов в короткие сроки вызывало обра¬
зование антител изотипа TgG без применения адъювантов. Хорошо
известно, что вируснейтрализующие антитела относятся к изотипу
IgG [215].Выбор антигенной детерминанты константной части гемагглюти¬
нина определил получение антител с широким спектром реагирова¬
ния, не только распознающих гомологичную антигенную детерми¬
нанту, но и реагирующих с гемагглютининами вирусов гриппа А всех
исследованных серотипов.Данные литературы указывают также на избирательную актива¬
цию синтетическими пептидами НА2 системы Т-киллеров и соот¬
ветствующих клеток памяти при гриппе [829]. Таким образом, на
основании полученных нами результатов, а также данных литературы
видна перспективность разработки полиспецифических противо¬
гриппозных вакцин на основе комплексов консервативный пептид-
пол иэлектрол ИТ.10.1.3. АЛЛЕРГОТРОПИНЫВ 1982 г. нами было опубликовано сообщение (Петров Р.В. и др.
[135]) об искусственных антигенах со сниженной иммуногенностью.
Снижение иммуногенности было достигнуто путем комплексиро-
вания высокоиммуногенного белка с карбоцепными линейными
полиамфолитами. Отправным моментом для проведения исследо¬
ваний с целью снижения иммуногенных свойств белковых и других
антигенных препаратов послужило обнаружение нами того факта,
что линейные сополимеры 2-метил-5-винилпиридина (IVÎBH) и акри¬
ловой кислоты, содержащие 5, 17, 34 и 50 мол% звеньев акриловой
кислоты, угнетают кооперативное взаимодействие Т- и В-лимфоци¬
тов при индукции иммунного ответа на эритроциты барана (ЭБ) [50].
Сополимеры, содержащие 66 и 71 мол% звеньев акриловой кислоты,
не влияют на этот процесс или усиливают его, однако в значительно
меньшей степени по сравнению с гомополимерами ПАК и ПМВП.
ÍO.l. Экспериментальные вакцины: от конъюгированных... 417Такие линейные макромолекулы, имеющие в одной полимерной
цепочке как кислые (анионные), так и основные (катионные) группы,
т.е. полиамфолиты, не обладают цитотоксическим или антипролифе-
ративным действием (Петров Р.В., Хаитов P.M., 1978).Введение мышам а-анатоксина Clostridiumperfringens вместе с поли-
амфолитом, содержащим звенья акриловой кислоты и МВП в соот¬
ношении 34:66, угнетает продукцию антител к а-анатоксину (Пет¬
ров Р.В. и др. [119]). Однако в отличие от значительного подавления
антителогенеза в культуре кооперирующих Т- и В-клеток in vivo при
инъекции полиамфолитов иммунный ответ in situ при раздельном
введении антигена и полиамфолита или их простой смеси в нормаль¬
ном организме снижался менее существенно или не угнетался вовсе.
Полученные данные определили необходимость изучить влияние на
иммуногенность белковых антигенов их прочного комплексирования
с полиамфолитами, избирательно угнетающими Т-В-кооперацию.Р.В. Петров и соавт. [135] использовали сополимеры МВП и акри¬
ловой кислоты, содержащие соответственно 44, 50 и 60 мол% звеньев
акриловой кислоты. Их условно обозначили СП-1, СП-2 и СП-3.
Полиамфолиты пролучали методом радикальной сополимеризации
МВП и акриловой кислоты. Взаимодействие полиамфолитов с белком
(в основных опытах использовали сравнительно высокоиммуноген¬
ный БГГ) исследовали с помощью скоростной седиментации в вод¬
ных средах при pH 7,5. Установлено, что между БГГ и СП-1, а также
СП-2 образуются растворимые пол и комплексы, СП-3 практически не
вступает во взаимодействие с БГГ. Анализ седиментограмм водных
растворов полиамфолитов показал, что самый высокий темп сни¬
жения концентрации свободных полиионов при добавлении белка
наблюдался в опытах с СП-1. При pH 7,5 глобулы БГГ и полиамфолиты
заряжены одноименно и, следовательно, электростатическое взаимо¬
действие препятствует образованию комплексов. Очевидно, в системе
БГГ—СП решающую роль при соединении одноименно заряженных
частиц играют водородные связи и неполярные взаимодействия гло¬
бул с углеводородными фрагментами цепи полиамфолита. Показано
образование более прочного комплекса в системе БГГ—СП-1 (более
плотное обволакивание белковых глобул цепочками СП-1, т.е. большее
число меж молекулярных контактов, приходящихся на одну глобулу).
На основе полученных данных и по аналогии с ранее опубликован¬
ными материалами (Кабанов В.А. и др. [57]) структуру образующихся
растворимых комплексов БГГ с сополимерами можно представить в
шГлава 10. Конъюгированные полимер-субъединичные вакцинывиде комплексных макромолекул, ассиметричные частицы которых,
вероятно, образованы контактирующими друг с другом глобулами
БГГ, «склеенными» цепочками линейного полиамфолита.Поликомплексами БГГ-СП-1, БГГ-СП-2 и смесью БГГ+СП-3 в
эквивалентных соотнощениях иммунизировали мышей. В предвари¬
тельных опытах проверяли влияние используемых полиамфолитов на
кооперацию Т- и В-лимфоцитов при иммунном ответе на ЭБ. После
инъекции СП-3 облученным реципиентам, получившим смесь Т- и
В-клеток, в их селезенке накапливается приблизительно такое же
число АОК, как и при переносе клеток без полимера (около 4500 на
селезенку), в селезенке животных, получивших Т- и В-лимфоциты и
СП-1, формируется в 3 раза меньше антителообразующих клеток (АОК)
по сравнению с контролем. СП-2 по влиянию на Т- и В-кооперацию
занимает промежуточное положение между СП-1 и СП-3 (табл. 50).Таблица 50Влияние полиамфолитов на кооперацию Т- и В-клеток in vivoВводимыйАК/Число транспланти¬ЧислоЧисло АОК всополимерМВП,рованных клетокреципи¬селезенке*(50 мг/кг массы)%Км (х10^)Тим (х10^)ентов--10-2098,7 (88Д±109,3)---2018152,4(134,8+169,0)--1020104414 (3836±4992)СП-360/401020124600 (4012±5188)СП-250/501020143701 (3113+4289)СП-144/66ш2091404 (1013+1795)*М±95%-Й. доверительный интервал. Км — клетки костного мозга; Тим — клетки
тимуса.Затем мы исследовали влияние прикрепления полиамфолитов к
молекулам БГГ на иммуногенность белковой части комплекса при
иммунизации нормальных мышей in situ. При введении растворов
СП-1, СП-2 или СП-3 с одинаковым содержанием БГГ число форми¬
рующихся в селезенке АОК различно (рис. 93). Так, при иммунизации
животных раствором БГГ + СП-3 в селезенке накапливается практи¬
чески такое же число БГГ-специфических АОК, как и при иммуни¬
зации эквивалентным количеством БГГ. Однако при иммунизации
растворами БГГ + СП-1 и БГГ + СП-2 формируется соответственно
IO.L Экспериментальные вакцины: от конъюгированных...419АОК
3000 г20001000Рис. 93. Иммунный ответ на БГГ при иммунизации раствором чистого
БГГ (7), смесью БГГ и СП-3 (2), БГГ и СП-2 (3), БГГ и СП-1 {4):
по оси ординат — число БГГ~специфичных АОКВ 3 и 2 раза меньше АОК по сравнению с контролем. Иначе говоря,
присутствие в растворе БГГ СП-1 и СП-2 приводит к выраженному
угнетению иммунного ответа на БГГ. Поскольку СП-3 не образует
комплексов с БГГ, СП-2 взаимодействует с БГГ, формируя нестабиль¬
ные комплексы, а СП-1 образует прочные комплексы с БГГ.В дальнейших опытах для выяснения роли комплексообразования
в растворах сополимеров и БГГ животным последовательно вводили
растворы чистого СП-1 и белка. Полученные данные свидетельствуют
о том, что СП-1 при раздельном введении существенно не влияет на
иммунный ответ к БГГ.Таким образом, сополимеры МВП и акриловой кислоты, угне¬
тающие Т- и В-кооперацию и образующие устойчивые комплексы с
БГГ, подавляют иммунный ответ на присоединенный к сополимерам
белковый антиген. То, что существенное угнетение иммунного ответа
на БГГ in situ наблюдается лишь при введении животным БГГ в ком¬
плексе с полиамфолитом, а последовательное введение компонентов
комплекса не влияет на степень иммунного ответа на БГГ, весьма
примечательно. Выше было показано, что комплексы поликатионов
с БСА или БГГ при введении мышам обеспечивают развитие выра¬
женного иммунного ответа на белковую часть комплекса. Комплексы
БСА с полиамфолитами (СП-1, СП-2) не обладают иммуногенностью.
420 Глава tO. Конъюгированные полимер-субъединичные вакциныУ мышей, иммунизированных такими комплексами, число АОК
против БСА не отличается от фонового. По-видимому, полимер
поликатион, находяш^ийся в составе комплекса, в отличие от поли¬
мера полиамфолита обеспечивает оптимальные условия для индук¬
ции эффективного иммунного ответа на белковую часть комплекса.
Подавление иммунного ответа на белок, комплексированный с поли¬
амфолитами, связано, очевидно, либо со снижением антигенности
молекулы белка в результате кооперативного связывания его с поли¬
амфолитом, либо с торможением под влиянием сополимера взаимо¬
действия иммунокомпетентных клеток, необходимого для индукции
иммунного ответа.в практическом отношении большой интерес представляют синтез
и поиск нетоксичных макромолекул, по своим иммунофармакологи-
ческим свойствам подобных полиамфолитам. Стабильные комплексы
разных белковых препаратов (гормоны, сывороточные белки и др.) с
полимерами, не вызывающие развития иммунологических осложне¬
ний (сенсибилизации, аллергии и др.), нашли бы широкое применение
в клинике. В этом плане интересны данные о том, что синтетический
поли-К-(2-оксипропил) метакриламид (дуксон), используемый в качес¬
тве заменителя плазмы крови (ММ 83 тыс.), подавляет отторжение кож¬
ных трансплантатов гибридных мышей и крыс, пересаженных живот¬
ным родительских линий, и реакцию аллогенных лимфоцитов человека
в смешан1юй культуре [657]. Вместе с тем он не угнетает пролифератив-
ную активность лимфоцитов и фибробластоидных (диплоидные) или
эпител иоидных (гетероплоидные) клеточных л иний. Выполнены рабо¬
ты, направленные на получение искусственных антигенов, по действию
имитирующих природные антигенные субстанции- Антигены этого
типа снижают иммунный ответ за счет активации супрессорных или
подавления хелперных механизмов. Так, конъюгат антигена Е, выделен¬
ного из пыльцы амброзии, с синтетическим сополимером D-глутамина и
D-лизина, введенный мышам, предварительно обработанным пыль¬
цой амброзии, приводит к избирательному угнетению синтеза антител
класса IgE к этому антигену [478]. Данный конъюгат не активировал
Т-супрессоры, поэтому предполагают, что он вызывает супрессию
синтеза IgE путем ингибирования Т-клеток, необходимых для синтеза
антител класса IgE.Описанный выше синтетический гликопротеид МДП может ока¬
зывать не только стимулирующее, но и иммуносупрессивное дейс¬
твие в зависимости от использованной дозы и времени введения
íú.í. Экспериментальные вакцины: от конъюгированных... 421в организм по отношению к инъекции антигена (Souvannavong V.,
Adam A., 1980). При конъюгации МДП с ДНФ или яичным альбумином
получен антиген, селективно супрессирующий продукцию TgE-анти-
тел за счет активации аллергенспецифических супрессорных Т-лимфо¬
цитов [502]. Синтетический сополимер (Сор 1), полученный полимери¬
зацией N-карбоксиангидридов тирозина, аланина, у-бензилглутамата
и е-трифторацетиллизина, перекрестно реагирует иммунологически
с основным энцефалитогенным белком, выделенным из спинного
мозга, предотвращает развитие экспериментального энцефаломиелита,
вызываемого сенсибилизацией гомогенатом спинного мозга [526]. Сам
Сор 1 не обладает энцефалолитогенными свойствами. Установлено, что
угнетение аллергического энцефаломиелита опосредуется активиро¬
ванными Сор 1 Т-супрессорами.Показано, что ковалентное присоединение молекул монометокси-
полиэтиленгликоля (мПЭГ) с различной длиной цепи (ММ 2 тыс. -
20 тыс. Д) к яичному альбумину (ЯА) приводит к превращению этого
антигена в иммунологически специфический толероген и к сниже¬
нию или полному исчезновению аллергенных свойств, т.е. способнос¬
ти вырабатывать антитела класса tgE [742]. Эффект зависел от эпитоп¬
ной плотности и молекулярной массы цепей мПЭГ, прикрепленных
к антигену, а также от дозы конъюгата. Установлено, что конъюгат
яичного альбумина с мПЭГ активирует специфические к яично¬
му альбумину Т-супрессоры, негативно регулирующие IgE-ответ.
Интересно, что многократные введения конъюгатов сенсибилизиро¬
ванным животным или больным аллергией оказывали оппозитное
действие на IgE- и TgG-антитела, т.е. уровень IgG-антител повыщался.
Супрессорная активность конъюгата объясняется [742] способностью
мПЭТ обеспечивать прикрепление конъюгата к клеткам в результате
взаимодействия цепей ПЭГ с липидным бислоем клеточной мембра¬
ны соответствующих Т- и В-лимфоцитов. Образующиеся комплексы
должны активировать Т-супрессоры. Полученные предварительные
клинические данные показывают, что введение больным конъюгатов
соответствующих аллергенов с мПЭГ снижает аллергические реак¬
ции. По-видимому, нет необходимости подробно перечислять, какие
заманчивые перспективы сулит создание молекул, специфически
угнетающих иммунную реакцию произвольно выбранной специфич¬
ности. Для иллюстрации потенциальной ценности таких эффекторов
достаточно вспомнить о необходимости угнетения многих реакций,
специфических к тем или другим иммуногенам и аллергенам.
422 Глава 10. Конъюгированные полимер-субъединичные вакциныКрайне желательно также, чтобы вновь создаваемые высокоэф¬
фективные вакцины, представляющие собой антигенполимерные
комплексы, не обладали аллергизирующим действием. В этой связи
прежде всего необходимо повторить, что все используемые нами для
создания конъюгированных иммуногенов и вакцин синтетические
полиэлектролиты не проявляют антигенных и аллергенных свойств
(Кабанов В.А и др. [55, 57]; Петров Р.В. и др. [109]). Искусственные
белок-полимерные вакцинирующие комплексы не обладали аллерги¬
зирующим действием (оценивали по анафилактогенной активности
на модели шока и активной кожной анафилаксии).Очень важно, что включение в состав комплекса белка с заведомо
выраженными аллергенными свойствами, с одной стороны, не уси¬
лило аллергенную активность, а с другой обеспечило повышенную
выработку блокирующих антител класса IgG. Такие данные полу¬
чены в опытах с яичным альбумином. Они характеризуют способ¬
ность конъюгатов антигена с полиэлектролитом вызывать продукцию
аллергических гомоцитотропных антител (ГЦА), ответственных за
развитие аллергической реакции (Петров RB. и др. [123]).В опытах использовали мышей линии СВА и трижды перекристал-
лизованный яичный альбумин (ЯА). Сополимер АК и N-ВПД экви¬
молярного (50:50) состава (СП) с MlVi около 100 кД конъюгировали
с ЯА. В полученном конъюгате ЯА и СП (ЯА—СП) количество белка
составило 400 мкг на 1 мг препарата.Иммунизировали животных по двум схемам:1) троекратно с интервалом в 4 нед внутрибрюшинно вводили по
0,5 мкг Я А [или ЯА-СП, или смеси Я А и СП (Я А + СП) в уравненных по Я А
дозах] с 0,5 мг А1(ОН)з в 0,5 мл изотонического раствора хлорида натрия;2) двукратно с интервалом в 4 нед внутрибрюшинно ваводили по
150 мкг Я А (или ЯА-СП, или смеси Я А и СП (ЯА + СП) в уравненных
по ЯА дозах) с 5 мг А1(ОН)з в 0,5 мл изотонического раствора хлорида
натрия.Титры IgG-ГЦА определяли в реакции пассивной кожной анафи¬
лаксии (ПКА) на белых беспородных мышах, а титры IgE-ГЦА — на
крысах. ПКА оценивали по прокрашиванию участков кожи через
30 мин после введения в хвостовую вену 0,2 мл (мышам) или 1,0 мл
(крысам) 0,5% раствора Эванса синего, содержащего ЯА. Мышам
вводили Я А по 0,5 м г, а крысам — ОД мг в расчете на 100 г массы тела.
Уровень общих антител класса TgG к Я А в сыворотке крови мышей
определяли иммуноферментным методом.
10.і. Экспериментальные вакцины: от конъюгированных...423\10 о
tt6НеделиРис. 94. Образование IgG]~riJ,A (а, в) и IgE-ГЦА {6, г) у мышей, иммунизиро¬
ванных Я А (/), ЯАНА (2) или смесью Я А и НА (3) в низких (0,5 мкг на мышь)
(а, б) или в высоких (150 мкг на мышь) {в, г) дозах, уравненных по ЯА.
Стрелкой показаны моменты иммунизации: по оси абсцисс — сроки иммунизации
(недели); по оси ординат —log2 титра антителИммунизация мышей низкой дозой антигена (0,5 мкг/мышь) при¬
водит к образованию IgG-ГЦА и IgE-ГЦА (рис. 94 а, б), опосредующих
немедленную аллергию, и не сопровождается заметным накоплением
суммарных IgG-антител (во всяком случае, выше фонового уров¬
ня), не обладающих гомоцитотропной активностью. Использование
ЯА-СП или смеси ЯА + СП в одной и той же, в пересчете на ЯА, дозе
(0,5 мкг на мышь) не изменяет характера накопления IgG-ГЦА и IgE-
ГЦА и заметно не стимулирует образование суммарных IgG-антител.Иммунизация мышей высокой дозой ЯА (150 мкг на мышь) сопро¬
вождается наряду с образованием IgG і-ГЦА и IgE-ГЦА (рис. 94 в, г)
появлением в крови суммарных IgG-антител (рис. 95). ЯА-СП (равно
как и смесь ЯА + СП) не усиливает продукцию аллергических анти¬
тел к ЯА как lgG[-, так и lgE-изотипа. Вместе с тем ЯА-СП резко
426 Глава 10. Конъюгированные полимер-субъединичные вакцины.-СН,1*- О^-СН2~СН2-‘МН^аллергоидРис. 96. Схема (а) и строение (б) аллерготропина и основные этапы его полу¬
чения:1 — полиоксидоний; 2 — аллергоид.Основные этапы получения аллерготропина:— выделение нативной формы аллергена;— создание аллергоидной формы аллергена с помощью его химической модификации;
~ конъюгация аллергоида с синтетическим полиэлектролитом — полиоксидониемреакции. Соотношение показателей специфических IgE/IgG рассмат¬
ривают как критический параметр, который может быть объектив¬
ным подтверждением успешной терапии [45, 134, 204].Классическим примером опосредованной IgE аллергической реак¬
ции является гиперчувствительность больных поллинозом к аллер¬
генам пыльцы растений, воздействующим на Т-клетки иммунной
системы, которым отводится главная роль в стимуляции синтеза
IgE-антител и аллергическом воспалении. Известно (см. главу 2), что
при аллергенной стимуляции, так же как и при антигенной, происхо¬
дит активация Т-клеток фенотипа CD4 с индукцией экспрессии генов
ростовых факторов и их рецепторов (например, ИЛ-2 и рецептора для
ИЛ-2). Вслед за активацией и пролиферацией CD4-Т-клеток (ThO) из
них под воздействием ИЛ-12 и ИЛ-4 образуются хелперные лимфо¬
циты Thl и Th2 (см. рис. 9). Сформировавшиеся субклассы Т-хелпе¬
ров отличаются наборами секретируемых цитокинов. Ключевыми
lOJ, Экспериментальные вакцины: от конъюгированных... 427цитокинами, продуцируемыми Thl, являются ИЛ-2 и ИНФу. ИЛ-2
служит фактором роста Т-клеток, ИНФу активирует макрофаги. Th2
вырабатывают комплекс цитокинов, в котором доминируют ИЛ-4,
ИЛ-5, ИЛ-10, ИЛ-13. Здесь важно отметить, что ИЛ-4 и ИЛ-5 служат
фактором роста В-клеток и способствуют выработке аллергических
IgE-антител. ИЛ-5 является также фактором роста и дифференциров¬
ки эозинофилов.Между ТЫ и ТЬ2, как уже упоминалось, существуют отношения
антагонизма (см. рис. 9), которые реализуются с участием их продук¬
тов, в частности ИНФу и ИЛ-4 или ИЛ-10. Доминирование одного
гипа хелперов над другим определяет форму иммунного ответа. Сдвиг
соотношения ТЫ и Th2 в пользу ТЬ2-клеток способствует развитию
аллергических реакций. Следовательно, для радикального лечения
аллергий представляется значимым восстановление физиологиче¬
ского баланса между ТЫ и Th2 и индукция конверсии аллергического
IgE-ответа в иммунный с образованием протективных IgG-блокиру¬
ющих антител, идентичных по специфичности IgE.В процессе разработки проблемы конверсии аллергического ответа
в иммунный нами установлено, что, используя определенные имму¬
ностимулирующие полиэлектролиты типа полиоксидония, можно
осуществить такую конверсию (рис. 97). Как было показано выше,
главным индуктором Thl-клеток и синтеза ИНФу является ИЛ-12,
вырабатываемый в основном макрофагами и дендритными клетками.
Применение полиоксидония, тройного к макрофагам и дендритным
клеткам и индуцирующего синтез ими цитокинов, в частности ИЛ-12,
направляющих дифференцировку Т-клеток по ТЫ-типу, оказалось
высокоэффективным. На рисунке 98 показано, что у лиц, больных
туберкулезом, получавших разрешенный к клиническому примене¬
нию иммуностимулирующий полиэлектролит — полиоксидоний —
существенно увеличивается по сравнению с нелечеными лицами чис¬
ленность CD4+INFy+-лимфоцитов, т.е. Thl-клеток, которые являют¬
ся ключевыми элементами клеточного иммунитета. Под влиянием
полиоксидония у лиц, больных туберкулезом, регистрируется также
повышенная секреция лимфоцитами ИНФу (рис. 99). Значимость
этого цитокина в регуляции иммунологических реакций велика, она
заключается, в частности, в ингибиции продукции ИЛ-4 и ИЛ-5,
играющих решающую роль в развитии аллергических реакций. Таким
образом, полученные данные свидетельствуют о возможности измене¬
ния характера дифференцировки ThO под влиянием полиоксидония
428Глава 10. Конъюгированные полимер-субъединичные вакциныРис. 97. Влияние полиоксидония (ПО) на процесс дифференцировки Th-кле¬
ток по ТЫ-типу.ПО стимулирует синтез интерлейкина 12 (ПЛ-12) — главного индуктора ТН1-
клеток, выполняющих функцию супрессоров синтеза JgE-omeema. ИЛ-2, ФНОа,
ИНФу — маркеры, характеризующие Th 1-клетки, участвующие в запуске и под¬
держании продукции IgG-блокирующих антител. ДК — дендритные клетки;
МФ — микрофаги; МН — моноциты
%2520151051**« .ІЄш-=к.тфіIм 'і'/,:234Рис. 98. Влияние полиоксидония на количестпо CD4^FNy^(Thl)-клеток у
больных туберкулезом./ — доноры; 2, 3,4— больные туберкулезом, ие получавшие полиоксидоний (2) и боль¬
ные через 10 дней (3) и 1 месяц (4) noaie его введения. По оси ординат — чиатнность
Thl-позитивных клеток* р <0,05 по сравнению с донорами.** р <0,05 по сравнению с больными (лечение без полиоксидония)
ÍO.L Экспериментальные вакцины: от конъюгированных...429п кг/мл
1800
1600
1400
1200
1000
800
600
400
200*г-i.ш1Рис. 99. Влияние полиоксидония на синтез интерферона-у лимфоцитами
(ТЫ) больных туберкулезом.Лимфоциты больных туберкулезом до введения полиоксидония (1) и через 10 дней (2) и
1 месяц (3) после его введения. По оси ординат — уровень синтеза IFNy *р <0,05со сдвигом соотношения ТЫ и Th2 в пользу ТЫ-к леток. Совершенно
очевидно, что возможность такого переключения представляется опре¬
деляющей в лечении и профилактике аллергических заболеваний.Эффективность полиоксидония в индукции синтеза цитокинов,
способных направлять дифференцировку Т-клеток по Thl-типу, и
разрешенная возможность его клинического применения в качест¬
ве самостоятельного иммуностимулирующего лечебного препарата
обусловили использование этого полиэлектролита в качестве носите¬
ля для пыльцевых аллергенов при конструировании аллерговакцин
с целью контроля аллергии. В основе разработки нового принципа
модификации аллергенов лежали ранее полученные факты, демонс¬
трирующие возможность получать сильный иммунный ответ на
белковую часть комплекса антиген-полиэлектролит. Для создания
конъюгатов аллерген-полиэлектролит использовали аллергоиды из
пыльцы тимофеевки, полыни, березы (Хаитов P.M. и др. [200J; Петров
Р.В. и др. [137]). Аллерговакцины по механизму их иммуномодули-
руюшего действия были названы аллерготропинами соответственно
используемой пыльце: из пыльцы тимофеевки — Тимпол, из пыльцы
березы — Берпол, из пыльцы полыни — Полпол. Определяющим фак¬
430 Глава 10. Конъюгированные полимер-субъединичные вакцинытором в разработке аллерготроп ных комплексов послужили наблю¬
дения (Petrov R.V. et al. [676]), показавшие, что иммуностимулиру¬
ющее действие полиоксидония не распространяется на продукцию
IgE-антител.При создании аллерготропинов использовали принцип выделе¬
ния и очистки пыльцевых аллергенов с последующей двухэтапной
модификацией формальдегидом нативных аллергенов и создания
аллергоидной формы. Получение аллергенов из пыльцы тимофе¬
евки, березы или полыни осуществлялось при сочетании методов
гель-хроматографии с последующей ионообменной хроматографией и
электрофореза. Фракционирование белков проводили в SDS-полиак-
риламидном геле. Конъюгат аллергоида с полиоксидонием (сополимер
К-окси-1,4-этиленпиперазина и К-карбоксиэтил-1,4-этиленпиперазо-
ний бромида) получали карбодиимидным методом с использованием
водорастворимого мета-п-толуолсульфоната 1-циклогексол-(2-мор-
фолиноэтил)карбодиимида («Aldrich», USA). Конъюгат выделяли и
анализировали методами хроматографии, УФ-спектроскопии и флуо¬
ресценции. Изучение специфичности и аллергенной активности моди¬
фицированных форм аллергенов проводили методом Prick-тестиро-
вания, в реакции специфического высвобождения гистамина (РСВГ),
ИФА, иммуноферментным методом ингибиции ИФА (ИИФА) и др.Испытания аллерготропинов установили, что полученные препа¬
раты сохраняли специфичность, однако их аллергенная активность
была снижена в сравнении с нативным водно-солевым экстрактом
пыльцы березы, полыни и тимофеевки и их аллергоидными формами
(Хаитов P.M. и др. [200]). Снижение IgE-связывающих свойств аллер¬
готропинов в процессе их получения может свидетельствовать о сни¬
женном риске стимуляции реакций анафилактического типа при вве¬
дении модифицированной формы в процессе АСИТ. Сравнительная
оценка специфической IgE-связывающей активности аллергена и
аллерготропина из пыльцы березы (Берпол) проводилась в тесте
ингибиции ИФА с сыворотками крови больных, страдающих гипер¬
чувствительностью к пыльце березы. Показано, что в эквивалентной
зоне (50% связывания) IgE-связывающая активность аллерготропина
Берпол в 1,8 раза ниже по сравнению с нативным немодифицирован-
ным препаратом (рис. 100).Показателем риска стимуляции в организме больного реакций ана¬
филактического типа является интенсивность высвобождения меди¬
атора аллергии гистамина из базофилов лиц, имеющих гиперчувс-
10.1. Экспериментальные вакцины: от конъюгированных...431т 2,0
ig- 1.8
с§ 1,6
^ 1.4
1.2
1,0
0,8
0,6
0,4
0,20,81 2
ОД по 50 % связыванию
(эквивалентная зона)Рис. 100. Результаты сравнительного анализа спедифической IgE-cвязывaю-
щей активности аллергена (2) и аллерготропина (Берпол) (7) в тесте ингиби¬
ции ИФАтвительность к специфическому пыльцевому аллергену. Проведен
сравнительный анализ активности аллергенов из пыльцы березы,
полыни, тимофеевки, их аллергоидных форм и аллерготропинов —
Берпола, Подпола и Тимпола в реакции аллергенспецифического
высвобождения гистамина из базофилов крови больных поллино¬
зом с гиперчувствительностью к соответствующему виду пыльцы на
аллерген, аллергоид и аллерготропин. Показано отсутствие риска
стимуляции реакций анафилактического шока при введении препа¬
ратов в сенсибилизированный организм. Показатели высвобождения
гистамина из базофилов в процентах по отношению к содержанию
гистамина в интактных клетках, принятому за 100%, показаны на
рисунке 101. Уровни высвобождения гистамина из базофилов на воз¬
действие аллергена составили от 22 до 23,4%, на аллергоид — от 14,9
до 15,1%, на аллерготропин — от 7,5 до 8,3%, Таким образом, снижение
способности к высвобождению гистамина из базофилов у больных
поллинозом на модифицированные аллергены выражалось в следую¬
щей последовательности: аллерген > аллергоид > аллерготропин. Это
является подтверждением возможности осуществления с помощью
432Глава 10. Конъюгированные полимер-субъединичные вакцины1 2 3
Аллергены1 2 3
Аллергоиды1 2 3
Аллерготропиныр<0,01Рис. 101. Активность пыльцевых аллергенов, аллергоид ов и аллерготропинов
в реакции аллергенспецифического высвобождения гистамина из базофилов
крови больных поллинозом:а~ с аллергией к пыльце березы; б — с аллергией к пыльце полыни; в — с аллергией к
пыльце тимофеевки.За 100% принимается содержание гистамина в интакптых базофилах. Препараты
из пыльцы: 1 — березы; 2 — полыни; 3 — тимофеевкиаллерготропинов конверсии аллергического процесса на этапе специ¬
фического связывания с IgE на клетках-мишенях (патохимическая ста¬
дия), что сопровождается сниженными показателями высвобождения
одного из ведущих медиаторов аллергической реакции — гистамина.
Следовательно, использование аллерготропинов при АСИТ позволяет
получить наименьшую степень риска наведения реакций анафилак¬
тического типа в сенсибилизированном организме, ибо гистаминоли-
берирующий эффект у таких препаратов наименьший по сравнению с
нативными аллергенами (р <0,05) (Петров Р.В, и др. [134]).Результаты кожного тестирования с алерготропинами у больных
поллинозом, страдающих гиперчувствительностью к указанным спе¬
цифическим пыльцевым аллергенам, подтвердили снижение риска
анафилактических реакций при введении больным с поллинозом
аллерготропинов в сравнении с аллергоидами и аллергенами (рис, 102),
Так, поданным сравнения показателей прик-тестов у 70 пациентов на
10,1. Экспериментальные вакцины: от конъюгированных...43374,7Рис. 102. Результаты кожных аллергических реакций на аллерген (а), аллер¬
гоид (б) и аллерготропин Берпол {в) у больных поллинозом с ги перчу ветви-
тсльностью к пыльце березыаллерген, аллергоид и аллерготропин из пыльцы березы, оказалось,
что специфический аллерген вызывал кожные аллергические реакции
величиной >20 мм в диаметре у 82,6% больных. На аллергоид реакции
такой интенсивности выявлены лишь у 8% пациентов, на Берпол —
лишь в 1,3% случаев зарегистрированы реакции. У 98,7% пациентов
интенсивность кожных аллергических реакций на аллерготропин
не превышала 10 мм. Низкий показатель кожных аллергических
реакций в прик-тестах на Берпол у лиц с гиперчувствительностью к
пыльце березы подтверждает факт снижения аллергенных свойств у
аллерготропина (р <0,01). Снижение интенсивности кожных тестов
у больных с гиперчувствительностью к пыльце тимофеевки отмече¬
но на Тимпол (5,1±0,5 мм) в сравнении с интенсивностью тестов на
аллерген (19,0±0,9) — р <0,05 (Petrov R. et al. [677]).Важным звеном аллергического ответа при АСИТ, как указыва¬
лось выше, является переключение в организме синтеза специфиче¬
ских lgE-ангител на IgG. Это обусловило изучение в опытах на мышах
динамики выработки специфических к аллергену гомоцитотропных
(IgE) и IgG-блoкиpyюш;иx антител при гипосенсибилизации с помо-
шью аллерготропина.
434 Глава 10. Конъюгированные полимер-субъединичные ващиныИзвестно, что курс АСИТ включает введение в организм больного
возрастающих доз причинного (специфического) аллергена. Принцип
введения возрастающих доз пыльцевых аллергенов, аллергоидов или
аллерготропинов был использован в опытах по гипосенсибилиза¬
ции мышей (CBAxC576BL)Fi, сенсибилизированных соответственно
аллергеном пыльцы березы (группа 1), тимофеевки (группа 2) или
полыни (группа 3).Сенсибилизацию мышей осуществляли введением аллергенов
внутрибрюшинно в дозе 20 мкг белка с адъювантом А1(0Н)з на
одно животное. На 21-й день осуществляли оценку состояния сен¬
сибилизации мышей по уровню гомоцитотропных (IgE) антител
(ГЦА) в реакции пассивной кожной анафилаксии (ПКА) по Ovary.
На высоте сенсибилизации в каждой из указанных групп животных,
сенсибилизированных одним из названных пыльцевых аллергенов,
формировали три подгруппы и вводили гипосенсибилизирующие
дозы аллергена, аллергоида или аллерготропина — Берпол, Тимпол
и Полпол соответственно (12 инъекций на животное, от 0,5 до 2 мкг
белка на одну инъекцию), полученных из указанных видов пыльцы.
Результат оценивали по величине местной ПКА и количеству элюата
Эванса в 1 мкгНа рисунеке 103 представлены уровни ГЦА у мышей до и после сен-
сибилицации аллергеном или аллерготропином. Уровни ГЦА после
гипосенсибилизации аллерготропинами — Берполом, Тимполом,
Полполом были достоверно ниже (соответственно р <0,05, р <0,01,
р <0,01) по сравнению с показателями ГЦА в группах животных, гипо¬
сенсибилизацию которых осуществляли аллергенами или их аллерго¬
идными формами.В дальнейшем оценивали в ИФА уровни специфических к аллер¬
генам IgG-блокирующих антител у мышей (CBAxC57BL)F, при гипо¬
сенсибилизации. Уровни специфических IgG-блокирующих антител
определяли до и после проведения гипосенсибилизации мышей
аллергеном, аллергоидом или аллерготропином, сенсибилизирован¬
ных нативной формой соответствующего специфического пыльцево¬
го аллергена.Схема эксперимента по гипосенсибилизации мышей повторяла
предыдущую (12 инъекций аллергена, аллергоида или аллерготро¬
пина в дозах от 0,5 до 2 мкг белка на инъекцию). Через 15 дней после
окончания гипосенсибилизации измеряли уровни специфических
IgG-антител.
¡0.1. Экспериментальные вакцины: от конъюгированных.435На пике После
сенси- жпосен-
били- сибипи-
зации зацииНа пике После
сенси- шпосен-
били- сибили-
эации зации§сНа пике После
сенси- гилосен-
били- сибияи-
зации зацииРис. 103. Показатели гомоцитотропных (специфических IgE) антител
у мышей (CBAxC57BL)Fi до и после гипосснсибилизации аллергеном (1)
и аллерготропином (2) (реакция пассивной кожной анафилаксии по Ovary).
Препараты из пыльцы: березы (а), тимофеевки (б), полыни (в).Уровни специфических IgG-блокирующих антител были мак¬
симальными при гипосенсибилизации мышей аллерготропином
{р <0,01). На рисунке 104 представлены результаты определения
IgG-блокирующих антител методом ИФА. Уровни специфических
IgG-блокирующих антител оказались достоверно выше {р <0,01) у
животных, гипосенсибилизация которых осуществлялась аллерго¬
тропинами: Полполом, Берполом или Тимполом. Следовательно, в
процессе гипосенсибилизации животных аллерготропинами удалось
наблюдать, с одной стороны, снижение показателей ГЦА и, с другой —
эффект стимуляции синтеза специфических IgG-блокирующих анти¬
тел, что свидетельствует о факте конверсии аллергенного ответа в
иммунный (Петров Р.В. и др. [124, 134, 137]),Таким образом, включение в состав конструируемых аллерготро¬
пинов неприродного полиэлектролита позволило не только повысить
иммуногенные свойства препарата, но и обеспечить его способность
стимулировать синтез специфических IgG (блокирующих)-антител.
436Глава 10. Конъюгированные полимер-субъединичные вакцины1 2 31 2 31 2 3Рис. 104. Уровни специфических IgG-блoкиpyющиx антител у мышей
(СВАхС57ВЬ)р1, сенсибилизированных нативными аллергенами пыльды
растений, до и после гипосенсибилизации аллергенами (7), аллергоидами (2)
и аллерготропинами (У)Более того, с помощью аллерготропинов, созданных на основе моди¬
фицированных природных пыльцевых аллергенов и иммуномодуля¬
тора получены свидетельства возможности осуществления эффекта
конверсии IgE-onocpeflOBaHiioro аллергического ответа в иммунный.
Эффект иммуноконверсии выражался в способности аллерготропинов
стимулировать в сенсибилизированном организме синтез антиаллер-
гичсских специфических IgG-блокируюших антител, формирующих¬
ся, как было указано выше, в результате переключения дифференци¬
ровки Th-клеток с Th-2- на Th-1-ответ, т.е. в процессе восстановления
физиологического баланса клеток Thl и Th2. О снижении igE-связы-
вающей способности аллерготропинов в сравнении с таковой натив¬
ных аллергенов и аллергоидов, а следовательно, и о сниженном риске
развития реакций анафилактического типа в сенсибилизированном
организме при гипосенсибилизации свидетельствовали показатели
гистами НОЛ ибера ции из клеток-мишеней, выявленные в следующей
последовательности: аллерген > аллергоид > аллерготропин. В связи
с этим можно полагать, что принцип создания аллерготропинов рас¬
ширяет возможности гииосенсибилизирующей терапии (АСИТ) без
риска наведения реакций анафилактического типа в сенсибилизи¬
lOJ. Экспериментальные вакцины: от конъюгированных... 437рованном организме. Это позволяет заключить, что аллерготропины
отвечают главным критериям качества лечебных форм аллергенов;
безвредности, специфичности, иммуногенности.Терапевтическая эффективность аллерготропинов. С целью оценки
терапевтической эффективности пыльцевых аллерготропинов про¬
вели рандомизированное, двойное слепое плацебо-контролируемое
клиническое исследование в трех параллельных группах в клинике
ГНЦ «Институт иммунологии ФМБА России» в соответствии с кри¬
териями GCP.Сравнение между группами до и после лечения проводили с
помощью двустороннего Манна-Уитни-и-теста для непрерывных
переменных, в ряде случаев использовали непараметрический W-тест
Вилкоксона. Оценку эффективности АСИТ проводили по данным
дневников самонаблюдения с унифицированной бальной оценкой и
стандартизованного международного вопросника по качеству жизни
при риноконъюнктивите (RQLO). Динамику изменений общего и
специфических IgE и IgG оценивали иммуноферментным методом
с использованием САР-System (Pharmacia CAP System, Pharmacia
Diagnostics, Uppsula, Sweden). Курс АСИТ состоял из 15 инъекций.
Аллерготропин вводили в возрастающих дозах от двух до 100 PNU
(1 PNU=0,000 01 мг/мл белкового азота). Суммарная курсовая доза
введенного препарата каждому больному составила 4555 PNU.После первого курса терапии аллерготропином у больных полли¬
нозом отмечали снижение длительности и интенсивности симптомов
заболевания. Более чем в 2 раза снижалась потребность в фармакоте¬
рапии. В период максимального пыления причинных растений: бере¬
зы, тимофеевки и полыни (апрель—август) у больных поллинозом,
леченных аллерготропином, клинические симптомы болезии были
либо слабо выражены, либо не проявлялись вовсе.Группе из 36 больных с аллергией к пыльце тимофеевки проведено
лечение Тимполом. Клиническое улучшение течения заболевания
отмечено у всех больных этой группы. Показатель эффективности
лечения по интенсивности проявления симптомов болезни (в бал¬
лах) после АСИТ составлял 6,73 в сравнении с показателем 17,8 до ее
проведения. Опрос пациентов с отличным результатом терапии пока¬
зал, что пациенты без проявления симптомов поллиноза удовлетво¬
рительно перенесли период палинации специфических растений —
злаковых трав. Сравнительное изучение методом ИФА динамики
уровней специфических сывороточных антител классов IgE и IgG до
438Глава ÍO. Конъюгированные полимер-субъединичные вакцинылечения, через 2 нед и 2 мес после проведения АСИТ (в период палина¬
ции причин но-значимых растений) не выявило увеличения уровней
ígE-антител при положительной динамике показателей «блокиру¬
ющих» антител класса TgG, У больных с отличными и хорошими
результатами АСИТ отмечалось увеличение уровней IgG-блокиру¬
ющих антител в 3—5 раз по сравнению с показателями до лечения
{р <0,02). У отдельных больных с отличным результатом АСИТ наблю¬
дали семикратное увеличение уровня IgG-блокирующих антител
после терапии (Петров Р.В. и др. [124]).Проведено изучение клинической эффективности АСИТ с анали¬
зом изменений специфической реактивности эффекторных тканей
к нативному аллергену. Оценивали показатели назальной и кож¬
ной чувствительности у больных, леченых аллерготропином. При
этом использовали различные разведения аллергена в провокаци¬
онном назальном тесте, определяя последнее разведение препарата,
на которое получен положительный ответ слизистой оболочки носа.
Показано, что в процессе АСИТ у больных поллинозом существен¬
но снижается чувствительность слизистых дыхательного тракта и
кожи («щоковых» тканей) к специфическому аллергену. Сравнение
кожной чувствительности к аллергену из пыльцы тимофеевки после
проведения АСИТ нативным аллергеном (группа 1 — 34 пациента)
и Тимполом (группа 2 — 36 пациентов) показало более выраженное
снижение показателей в группе 2 больных {р <0,05). На рисунке 105
показано снижение назальной чувствительности к специфическомуРис. 105. Назальная чувствительность пациентов к аллергену тимофеевки до
(/) и после (2) АСИТ аллергеном (л) или Тимполом {б)
10,1. Экспериментальные вакцины: от конъюгированных...4391 2 3
Реакция
на аллерген1 2 3
АСИТ
аллергоидом1 2 3
АСИТ
аллерготропиномРис. 106. Кожная чувствительность пациентов к специфическому аллергену
до и после АСИТ.1—3 — препараты из пыльцы: тимофеевки (1); березы (2); полыни (3)аллергену в процессе АСИТ Тимполом. Снижение чувствительности
кожи к специфическим пыльцевым аллергенам у больных, леченых
аллерготропином, демонстрирует рисунок 106.Исследована эффективность АСИТ аллерготропином у больных
бронхиальной астмой с гиперчувствительностью к пыльце тимофеев¬
ки. В результате проведенной терапии продолжительность проявле¬
ния пыльцевой аллергии у больных бронхиальной астмой в среднем
по группе снизилась с 50 до 12 дней, а по интенсивности проявления
симптомов пыльцевой аллергии — с 16 до 5,4 балла. Сократилось по¬
требление антигистаминных препаратов, исчезли симптомы насморка,
зуд век, кашель и др. Полученные результаты свидетельствуют о воз¬
можности проведения АСИТ с применением пыльцевых аллерготро¬
пинов и у больных бронхиальной астмой пыльцевой этиологии.В группе больных поллинозом с гиперчувствительностью к пыльце
березы эффективность лечения аллерготропином Берпол (35 пациен¬
тов) оценена следующими показателями (рис. 107): отличный эффект
выявлен у 55% пациентов, хороший — в 33% случаев, удовлетвори-
440Глава 10. Конъюгированные полимер-субъединичные вакциныАллергоидАллерготропинОтличный40%Удовлетворительный26%Хороший Отличный
33 % 55 %Удовлетворителы^ый12%Хороший33%Рис. 107. Сравнительная эффективность АСИТ аллергоидом и аллерготроии-
но.м Берпол больных с гиперчувствительностью к пыльце березытельный — у 12% больных, в группе больных поллинозом с гипер¬
чувствительностью к пыльце березы эффективность терапии соот¬
ветствующим аллергоидом (35 пациентов) выражалась следующими
показателями: отличный эффект — 40%, хороший — у 33%, удовлетво¬
рительный — у 26%, без эффекта — 1%. Иначе говоря, эффективность
терапии аллергоидом по сравнению с аллерготропином оказалась
ниже (р <0,05),При лечении «полынного» поллиноза Полполом у всех леченых
больных получен положительный результат. В период палинации
полыни снизилась интенсивность проявления симптомов полли¬
ноза с 17,55 до 7,92 балла, длительность обострения болезни, по¬
требность в антигистаминных препаратах (рис. 108). После АСИТ
Полполом кратность снижения интенсивности кожных аллергиче¬
ских реакций для соответствующей пары аллерген и аллерготропин
по размеру волдыря на концентрацию 10 тыс. PNU/мл составила
3,03±0,9, а по кожному индексу Si — 12,31±3,53; различия достовер¬
ны и для размеров реакций — р <0,001, и для Si — /? <0,01. Кратность
снижения интенсивности кожных аллергических реакций для соот¬
ветствующей пары аллергоид и аллерготропин по размеру волдыря
на концентрацию 10 тыс. PNU/мл составила 1,88±0,4, а по кожному
индексу Si — 3,92±1,7; различия достоверны и для размеров реакций ~
р <0,001, и для Si— р <0,001.
IO.L Экспериментальные вакцины: от конъюгированных.4412 20га 18иО16141210а642О_ 17,557,9213,55i 'h:6,9514,92■‘v ■
i-';í.íí'l-í
(rá;.', í p í'7.31úmЩ12 12 12Интенсивность Длительность Потребностьсимптомоа клинических в антигистаминныхпроявлений препаратахРис. 108, Результаты оценки клинической эффективности лечения
Полполом:1 — до лечения; 2 — после леченияТаким образом, полученные результаты позволяют сделать следу¬
ющие выводы.1. Разработаны пыльцевые аллерготропины (Тимпол, Берпол,
Полпол) для лечения поллинозов, вызванных сенсибилизацией к
пыльце тимофеевки, березы, полыни.2. Созданные аллерготропины обладают способностью индуци¬
ровать конверсию аллергического ответа в иммунный путем норма¬
лизации физиологического баланса Thl/Th2 и изменения синтеза
аллергических IgE-антител на образование протективных IgG-бло¬
кирующих антител.3. Пыльцевые аллерготропины обладают высокой терапевтической
эффективностью.4. Преимущества применения аллерготропинов в сравнении с
существующими нативными (немодифицированными) коммерчески¬
ми формами аллергенов заключаются:— в сниженном риске провокации реакций анафилактического
типа у больных при проведении АСИТ;
442 Глава 10. Конъюгированные полимер-субъединичные вакцины- в четырехкратном сокращении курса АСИТ (с 54 до 12-15 инъ¬
екций);- в подавлении симптомов поллиноза у больных в период пали¬
нации причинно-значимых растений.10.1.4. ВАКЦИНЫ ПРОТИВ ВИЧ/СПИДАИстория пандемии СПИД отсчитывает уже третий десяток лет с
того момента, когда впервые синдром приобретенного иммунодефи¬
цита человека был зарегистрирован в человеческой популяции летом
1981 г. Сегодня ВИЧ/СПИД входит в четверку лидирующих причин
смерти. По имеющимся в настоящее время данным, 14 тыс. человек
ежедневно заражаются ВИЧ, что составляет 5 млн в год, включая 600
тыс. детей младше 15 лет, при этом 95% из них живут в слабо развитых
странах. На начало 2007 г., по данным ВОЗ, общее число взрослых
и детей, живущих с ВИЧ/СПИДом достигло 43 млн, при этом коли¬
чество умирающих ежегодно от ВИЧ-инфекции составляет 3 млн
человек, с начала эпидемии от нее погибло более 25 млн человек.
Единственный путь покончить с эпидемией ВИЧ/СПИД лежит через
создание безопасной вакцины, способной эффективно защищать
человека от широкого спектра разнообразных изолятов ВИЧ.Возможность создания вакцины против ВИЧ/СПИДа обосновы¬
вается следующими наблюдениями.- Имеются, хотя и в небольшом числе, лица, незаражающиеся
ВИЧ даже в случае достоверно повторяющихся контактов с
ВИЧ-инфицированными индивидами.- У некоторых лиц в редких случаях обнаруживается мощный
клеточный иммунный ответ против ВИЧ, способный снизить
вирусную нагрузку до определенного уровня, в результате чего
замедляется прогрессия болезни и резко снижается риск пере¬
дачи вируса.- При естественном течении ВИЧ-инфекции клеточный имму¬
нитет подавляет репликацию вируса в течение достаточно дли¬
тельного периода, нередко в течение 10 лет.- Иммунизация обезьян живыми аттенуированными вакцинами
обеспечивает полный протективный эффект против соответ¬
ствующих штаммов вируса SIV (Simian immunodeficiency virus) —
вируса иммунодефицита обезьян, обычно вызывающих разви¬
тие СПИДа у этих животных.
10.1. Экспериментальные вакцины: от конъюгированных... 443— Некоторые нейтрализующие антитела против ВИЧ способны
защитить обезьян от вируса SHIV (Simian/Human immunodeficiency
virus) — гомологичного гибридного (обезьяна/человек) вируса
иммунодефицита [61].При разработке вакцин против ВИЧ/СПИДа живые аттенуиро¬
ванные вакцины для введения человеку из-за проблем безопасности
развития не получили. Несмотря на обнадеживающие результаты
(снижение виремии, предотвращение снижения уровня Т-клеток
фенотипа CD4), по этим же причинам вакцинные препараты на осно¬
ве инактивированного ВИЧ-1 для введения человеку также не раз-
рабшынаюгсм. Существенно более перспективным может оказаться
применение нереплицирующихся, не содержащих генома, непатоген¬
ных вирусоподобных частиц (ВПЧ), похожих по размеру и конформа¬
ции на интактные вирионы ВИЧ (самопроизвольно собирающиеся в
псевдовирионы или ВПЧ белки Gag и Env ВИЧ и содержащие только
белки оболочки и коры вируса). Введение ВПЧ-вакцин (различные
варианты проходят лабораторные и клинические испытания) через
слизистые может оказаться значимым для индукции мукозального и
системного иммунного ответа против ВИЧ [59, 347].Первое испытание вакцины против ВИЧ было проведено в США
н 1987 г. С тех пор зарегистрировано 38 кандидатных вакцин в Î и 11
фазах 70 клинических испытаний с участием более 10 тыс. здоровых
волонтеров. Одна из субъединичных вакцин на основе компонентов
оболочки вируса gpl 20 (VaxGen) прошла все три фазы испытаний,
но, к сожалению, не проявила эффективности ни в предотвращении
инфекции, ни в снижении вирусной нагрузки у вакцинированных
и заразившихся впоследствии волонтеров [321]. Другая кандидатная
субъединичная вакцина на основе rgpl20-B/E (AIDSVAX В/Е) прошла
клинические испытания III фазы и затем вошла в цикл клинических
испытаний 111 фазы для бустерной иммунизации по протоколу прайм-
буст. Испытания были начаты в 2003 г. в Таиланде при сотрудничес¬
тве Правительства США, Министерства здравоохранения Таиланда,
WRAIR, Sanofi-Pasteur и VaxGen. К участию в этом клиническом иссле¬
довании привлечены 16 тыс. добровольцев. Исследование было рассчи¬
тано на 6 —7 лети включало примирующую иммунизацию рекомби нант-
ной вирусной вакциной (ALVAC), экспрессирующей CRF-AE gpl20 и
белки Gag, Pol и Nef субтипа В с последующей бустерной иммунизаци¬
ей субъединичной вакциной rgpl20 [596). К числу сконструированных
вакцин можно отнести и вариант субъединичной вакцины, включа-
444 Глава 10, Конъюгированные полимер-субъединичные вакциныюищй гримерную молекулу gpl40, стабилизированную добавлением
гетерологичных тримеризирующих доменов С-концевого эктодомена
gp41, и аналогичные тримеры молекул gpl20, у которых вариабельная
петля V2 была удалена, чтобы открыть нейтрализующие эпитопы,
перекрывающие CD4-связывающий сайт. Этот вариант кандидатной
вакцины разработан компанией «Chiron» [765]. Кроликов и обезьян
иммунизировали ДНК-вакциной, кодирующей gp 140 южно-африкан-
ского штамма ВИЧ-1 субтипа С с делецией петли V2, с последующей
бустерной инъекцией олигомерного gpl40 с делецией петли V2 и адъ¬
юванта MF59. Такая иммунизация приводила к образованию высоких
титров Env-связывающих антител, но при этом уровни гетерологичных
нейтрализующих антител были низкими [553J.Предположение о том, что иммунный ответ, направленный против
анти1'енов, которые экспрессируются на самых ранних этапах жизненно¬
го цикла вируса, может привести к быстрой элиминации инфицирован¬
ных клеток, индуцировало разработку субъединичных вакцин на основе
неструктурных белков ВИЧ-1, в частности на основе вирусного трансак¬
тиватора Tat, Создана кандидатная вакцина, содержащая тримеры gpl40
с делецией петли V2 в смеси с молекулами Tat или Nef [367]. Апробация
двух кандидатных вакцин на основе молекул Tat в качестве превентив¬
ного и терапевти^юского препарата завершилась I фазой клинических
испытаний [296]. Фазу I клинических испытаний прошла также вакцина
компании «GSK», созданная на базе белка слияния Tat-Nef, встроенного
в вектор ]VÎVA. Выявлена сильная индукция Т-клеток фенотипа CD4 и
антител. Белок слияния Tat-аденилатциклаза в сочетании с рекомбинант¬
ной gp-140-субъединичной вакциной и адъювантом AS02A (водно-мас¬
ляная эмульсия с монофосфориллипидом А и производным сапонина
QS21) оказался способным предотвратить развитие СПИДа у макак-
резусов, зараженных патогенным штаммом SHIV [582, 828].В обширном спектре подходов к конструированию вакцин против
ВИЧ/СПИДа существенную роль играют работы, посвященные разра¬
ботке препаратов, стимулирующих Т-клеточный иммунный ответ, осу¬
ществляемый ВИЧ-специфическими цитотоксическими лимфоцитами
фенотипа CD8. Решение этой проблемы нашло отражение в создании
ДНК-вакцин и рекомбинантных векторных вакцин, получаемых с целью
контроля репликации вируса и снижения вирусной нагрузки, что в свою
очередь обеспечивает снижение вероятности передачи вируса серонега¬
тивным партнерам. С целью усиления иммуногенности вакцин приме¬
няли модификацию промотора, синтетические гены с оптимизирован¬
10.1. Экспериментальные вакцины: от конъюгированных... 445ными кодонами, вставку трансгенов в ренликоны с оптимизированными
кодонами, вставку трансгенов в репликоны альфа-вируса, коэкспрсссию
цитокинов — ИЛ-2 или ГМ-КСФ. В качестве вектора для создаваемых
вакцин применяли вирус осповакцины, нирус оспы канареек, вирус оспы
кур, дефектный по репликации аденовирус V типа, аттенуированный
VSV, неспособный к репликации вирус Сенлдай и др. Í199].Разработана и уже находится во ТТ фазе клинических испы¬
таний оригинальная кандидатная вакцина «ВИЧРЕПОЛ» против
ВИЧ/СПИДа [61, 199]. Вакцина вошла в топ-лист 22 наиболее перс¬
пективных кандидатных вакцин против ВИЧ/СПИДа, которые сей¬
час испытываются в мире.При вирусных заболеваниях важную роль играют как гуморальный,
так и клеточный иммунный ответ. Гуморальный ответ (нейтрали¬
зующие антитела) направлен на внеклеточную стадию жизненно¬
го цикла паразита и препятствует проникновению вируса в клетку
(рис. 109 а). Клеточный ответ направлен на внутриклеточную ста¬
дию; ЦТЛ фенотипа CD8 распознают клетки, зараженные вирусом, и
убивают их, препятствуя выходу нового зрелого вирусного потомства
(рис. 109 б). С учетом сказанного минимально-оптимальными требо¬
ваниями к вакцине против СПИДа является безопасность, возмож¬
ность индукции гуморального и клеточного ответа и консервативность
входящих в вакцину антигенов. Кроме того, важно, по возможности,
снизить антигенную нагрузку. Поэтому еще одной из задач разработки
вакцин против СПИДа является поиск иммуноадъювантов.Безопасность является главным требованием, предъявляемым
к любой вакцине. Но особенно важно обеспечение безопасности
вакцин против СПИДа, для которого неизвестно ни одного случая
выздоровления — самопроизвольного или при помощи лекарств.
Поэтому при конструировании вакцины против ВИЧ/СПИДа иссле¬
дователи пока отказались от методологии использования вакцин на
основе аттенуированного или убитого ВИЧ-1.Значительная часть разработок посвящена созданию препаратов на
основе рекомбинантных технологий. Ее основу составляет создание
рекомбинантных генных конструкций — экспрессирующих векто¬
ров, получаемых с помощью генно-инженерных манипуляций. Такие
конструкции содержат гены, кодирующие один или несколько белков
ВИЧ или их фрагментов, и могут размножаться в клетках бактерий,
дрожжей, насекомых или млекопитающих. В результате в этих клет¬
ках нарабатываются полипептиды, повторяющие антигены ВИЧ.
446Глава 10. Конъюгированные полимер-субъединичные вакциныНейтрализующие
антитела
препятствуют
заражению клетокCCR5ВИЧВирионыВИЧЦитотоксические лимфоциты
разрушают
зараженные ВИЧ клеткиРис. 109. Идеальная пакиина против ВИЧ/СПИДа должна индуцировать
гуморальный и клеточный иммунный ответ:а — гуморальный иммунный ответ: мишень ■— вирионы ВИЧ (внеклеточная стадия
жизненного цикла вируса), нтАТпрепятствуют заражению клеток;
б — клеточный иммунный ответ: мишень — инфицированные клетки (клеточная
стадия жизненного цикла вируса). ЦТЛ (фенотип CD8) узнают и разрушают клетки
(фенотип CD4), зараженные ВИЧ, до того, как в них нарабатываются новые вирионы
10.1. Экспериментальные вакцины: от конъюгированных...447Вакцинирующий препарат, полученный с помощью генно-инже¬
нерной технологии, бывает двух типов. Первый представляет собой
так называемый субъединичный антиген — очищенный рекомби¬
нантный белок, который содержит антигены ВИЧ и может использо¬
ваться для иммунизации в присутствии или в отсутствие иммуномо¬
дуляторов или адъювантов. Второй вариант — сама рекомбинантная
генная конструкция, которая может быть по-разному представлена
иммунной системе: в виде «голой» рекомбинантной ДНК (ДНК-вак-
цина), в составе непатогенного вируса (например, вируса осповакци¬
ны) или в составе аттенуированного штамма бактерии (например,
сальмонеллы). Во всех этих случаях белки, повторяющие антигены
ВИЧ, нарабатываются внутри самого иммунизируемого организма.При разработке профилактических вакцин большое внимание уде¬
ляется комбинированной стратегии, получившей название шрайм-
буст», когда проводятся две или больше иммунизаций, при которых
используются разные типы вакцинирующих препаратов. Например,
для первой иммунизации используется ДНК-вакцина, а для второй —
рекомбинантный белок (рис. 110) или для первой иммунизации
используется ДНК-вакцина, а для второй — вирус осповакцины.
Целью стратегии прайм-буст является индукция как гуморального,
так и клеточного ответа. С учетом сказанного выше о вакцинах, инду-1-я вакцинация ("прайм")ДНК-вакцина
(рекомбинантная ДНК)ВИЧ-
специфическая
вставкаИндукция СТ1:
плазмида р(24-41)Рис. ПО. Стратегия прайм-буст, обеспечивающая индукцию гуморального и
клеточного ответа идеальной вакциной против ВИЧ/СПИДа
448 Глава 10, Конъюгированные полимер-субъединичные вакциныцирующих Т-клеточный ответ, можно рассматривать применение
вакцинации по схеме прайм-буст не только для профилактики, но и
для иммунотерпии ВИЧ-инфекции/СПИДа.Все эти соображения был и положены нами в основу разработки вак¬
цин против ВИЧ/СПИДа, проводимой в рамках Межведомственной
научно-технической программы «Вакцины нового поколения и меди¬
цинские диагностические системы будущего». Результатом явилось
создание вакцины «ВИЧРЕПОЛ» — первой отечественной вакцины
против ВИЧ/СПИДа, получившей разрещение на проведение клини¬
ческих испытаний. Предполагается, что вакцина «ВИЧРЕПОЛ» может
использоваться сама по себе и в схеме прайм-буст. В последнем случае
препарат «ВИЧРЕПОЛ» будет использован для бустерной иммуниза¬
ции, а для примирования — ДНК-вакцина. Было принято решение,
что ВИЧ-специфическая часть рекомбинантной плазмиды, входящая
в состав ДНК-вакцииы, и рекомбинантной плазмиды, кодирующей
белок, будут в основном одинаковыми. Неизбежные различия связа¬
ны с необходимостью внесения модификаций при введении вакцины
млекопитающим — экспериментальных животным и человеку.Вакцина «ВИЧРЕПОЛ» представляет собой химерный рекомби¬
нантный полипептид, копирующий актуальные антигенные детер¬
минанты белков ВИЧ-1 и конъюгированный с иммуностимулятором
полиоксидонием (см. раздел 10.1.5.2) для усиления иммунного ответа.Общая схема разработки вакцины «ВИЧРЕПОЛ» включает пере¬
численные ниже этапы.• Выбор ВИЧ-специфической нуклеотидной последовательности
для включения в состав рекомбинантных плазмид.• Получение экспрессирующего вектора.• Выделение и очистка целевого белка.• Анализ целевого белка. Доказательство чистоты и подтверждение
структуры белка.• Исследование иммуногенности и безопасности целевого белка.• Конъюгация целевого белка с полиоксидонием.• Сравнительные испытания иммуногенности белка и его конъ¬
югата с полиоксидонием (вакцины «ВИЧРЕПОЛ»).• Доклинические испытания вакцины «ВИЧРЕПОЛ».■ Клинические испытания вакцины «ВИЧРЕПОЛ».Схемы нескольких этапов разработки вакцины (от выбора после¬
довательности до исследования иммуногенности), так же как строение
вириона ВИЧ-1, приведены на рисунках 111 и 112.
IO.L Экспериментальные вакцины: от конъюгированных...449Внутренние белки
консервативны.
Внутренние белки
и белки оболочки
содержат эпитопы
для ЦТЛ и ТЬдр41др120Белки оболочки
(др120идр41)
индуцир^яот
образование
нейтрализующих
антителр66/51,р31Структурные
белкиГены,П ЩаШгШ
iРис. 111. Выбор последовательности ВИЧ-сисцифического рекомбинантною
гена и антигена для вакциныттт Выбор ВИЧ-специфической последовательности
I Получение вектора экспрессииОРекомбинантная плазмидаI Трансформация Е. coliЭскпрессия рекомбинантного белкаОчистка и рефолдированиеОчищенный рекомбинантный белокИммунизацияОценка иммуногенности:
ИФА, иммуноблот,
лимфопролиферативный ответ,
нейтрализация ВИЧ in vitro.
Оценка безопасностиРис. 112. Получение и анализ иммуногенности рекомбинантного белка
гес(24-41)
450 Глава 10, Конъюгированные полимер-субъединичные вакциныВыбор ВИЧ-специфической нуклеотидной последовательности
для создания рекомбинантных плазмидБыли проанализированы базы данных последовательностей ВИЧ
[518] и выбраны гены (фрагменты генов), кодирующие оптимальные
антигенные детерминанты для включения в состав кандидатной вак¬
цины. При выборе использовались следующие критерии.1. Вакцина должна индуцировать образование вирус-нейтрали-
зующих антител. Нейтрализация вируса обеспечивается антителами
к поверхностным белкам, кодируемым геном env, В связи с этим в
состав рекомбинантной плазмиды был введен фрагмент гена, кодиру¬
ющего трансмембранный белок ВИЧ-1 —gp41.2. Вакцина должна индуцировать клеточный и лимфогтролифера-
тивный ответ. Для этого в состав рекомбинантной плазмиды был вве¬
ден ген, кодирующий полноразмерный внутренний белок ВИЧ-1 —
р24, на котором расположены многочисленные эпитопы для Т-хелле-
ров и ЦТЛ.3. Еще одно требование к вакцине — консервативность ВИЧ-
специфических генов (и, соответственно, антигенов), что позволяет
добиться иммунного ответа широкого спектра действия. Этому тре¬
бованию удовлетворяет ген gag, кодирующий внутренний белок р24,
так и выбранный нами фрагмент гена env, кодирующий участок аа
584-615 gp41.Как уже отмечалось, на рисунке 111 представлено строение вири¬
она ВИЧ-1, показаны структурные гены и кодируемые ими анти¬
гены. С учетом перечисленных критериев для создания вакцины
против ВИЧ/СПИДа была определена последовательность ВИЧ-спе-
цифического гена, который был включен в состав рекомбинантной
плазмиды. В соответствии с выбранными фрагментами генома ВИЧ
белковый продукт экспрессии этого гена — химерный рекомбинант¬
ный белок — получил название гес(24-41). Нуклеотидная после¬
довательность гена и определенная по ней аминокислогная после¬
довательность белка гес(24—41) (трехбуквенный код) приведены на
рисунке 113 [152, 154].Схема строения белка гес(24—41) показана в нижней части рисун¬
ка 114. Как видно из рисунков ИЗ и 114, на N-конце белка гес(24—41)
находится последовательность из шести гистидинов. Эта последова*
тельность введена для целей очистки белкового продукта.
10.1. Экспериментальные вакцины: от конъюгированных.451£виёои<и05ои£?о<оÜои(Sиоя!н;>ооSниU>%Q0ооосл<и0осо<у.22<irинW<Sин<жон<£он<ази(-.2<иоосл<иёо1/1<и>»05о¡5«Тв>S1X>.с3Он£L<§<ьUсб0Ri<dоа6<бсQ§я<5ОU<<<S<ейi-Hв.tЛ-<;>¡UiS0.ниÜа<оэОо2Ud5о5Кв1SОSSоÍсÜÁ-0оооdОи>::!<<аО§1он0iÍйÍ2&ниÜt~-аС<<сÜсбU.UиÜноС0(Йнио<1иннiUÍнсо<нÜоо.<В*л<сс<бдОо£fLби5ОсбÍо=3S<б1рОн<UUЛ<<<VСЛо1§U«нии<i“<о<ииой<<0о<о01<3О<<03«>hJUслб|_Wiх:ннSUÍН00»-1<я<боScuнииV3о><лбн£нt:оеч<'Оио1ииU£Со1>
НеА5ПС1иС1иА1аА1а01иТгрАхрAгgУа1Н1яРгоУа1А1аС1уРго11сА1аАТСЛАТОАССААостОСАОААТССОАТАСАСТАСАТССАОТОСАТССАОООССТАТТОСАРшС1у01пМс1АГ£С]цРгоАт§С1у5егАкрИеА1а01уТЬгТИг5егТНгЬси01пССАСОССАОАТСАОАСААССААС СССААОТОАСАТАОСАООААСТАСТАОТАСССТТСАОС1и01пНе01уТгрМе1ГЬгАь.пАзпРгоРгоНеРгоУа1С1уС1иИеТугLysArgОААСАААТАСОЛТООАТСАСАААТААТССАССТАТСССАСТАСОАОАААТТТАТ,\АААОАТгрНеНеLtx^01уЬеиАхпЬу5НеУа!ArgМе1Туг5егРгоТЬг8егНеЬеиА$рТООАТААТССТОООАТТАААТААААТАСТААОААТОТАТАССССТАССАССАТТСТООАСНеАг$01пС1уРгоЬук01иРгоРЬеАГ8АхрТугУа1АкрАгмРКеТугЬу5ТЬг1еиАТААСАСААООАССААААСААСС1ТТТАОАОАСТАТСТАОАССССТТСТАТААААСТСТААг§А1а01иС1пА1а5ег01пС1иУа1ЬукА5ПТгрМс1ТЫС1иТЬгЬеи1.еиУи1С]пАОАсссОАССААОСТТСАСАССАОСТААААААТТООАТСАСАОАААССТТСТТССТССААА$пА 1аА$пРгоА$рСузЬу«ТНгНеЬеиЬу5А1аТ-еиС1уРгоА1аА1аТЬгЬеиС1иААТОССААСССАСАТТОТААСАСТАТТТТААЛЛССАТТОССАССАОССССТАСАСТАСАА01иМегМе1ТЬгА]аСу5С1пС1уУа1С1уС1уРгоС1уН15ЬУ5А1аАг8Уа]ЬеиА1аСАААТОАТОАСАОСАТОТСАССОАСТАССАССАСССССССАТААСССААСАСТТТТСОСТРис. 113. Нуклеотидная последовательность гена, кодирующего рекомбинантный химерный белок гес(24—41),
и аминокислотная последовательность белка гес(24-41) {Продолжение)р24р1701иА1аМсс5сгС1пУа1ТЬгАвпТЬгА1аТЬгНеМе1Ме1С1пАгё01уА5ПРЬеАг|ОААССААТОАСССААОТААСАААТАСАОСТАССАТААТОАТССАСАОАООСААТТТТАССР7<Г-АхпС1пАг£Ьу8МегУа1ЬеиА$рЬеиС1уТЬгА$рА5РАзрАзрЬу5А1аМс1А1аИеААССАААОАААОАТООТТТТССАТСТОССТАСССАССАССАССАСААССССАТСссоАТА8Р41->■5егАхрЬеиС1п.Лар8егAгgУа1ЬеиАзпУа1С1иArgТугЬеиАгвЛ8рС1пС1пЬеитссОАТСТССАООАТТСАОСТСТТСААССТтлеСТСССТСАССАОСАОСТССТСОСТАТС8р414-ЬеиС1уНеТгр01уСу55егС1уЬузЬеиТ1сСухТЬгТЬгА1аУа1РгоТгрТООССТТССТСТССТАААСТТСААССССТСАТСТССАССАССОСТОТТССОТССРис. 113. Нуклеотидная последовательность гена, кодирующего рекомбинантный химерный белок гес(24-41),
и аминокислотная последовательность белка гес(24-41) {Окончание)
454Глава 10. Конъюгированные полимер-субъединичные вакциныEC0R1 (8350)
С1а I (24)Pst I (7600)Hind m (1520)Bam Н I (2134)Pst I (210)Hind til (2430)rec(24-41)Xbal (3070)Pst I (2730)Bam H I (2960)Рекомбинантный антиген гес(24-41)Рис. 114. Вектор экспрессии и рекомбинантный антиген гес(24—41)Получение экспрессирующего вектора — плазмиды, экспрессирую*
щей целевой ВИЧ-специфический химерный рекомбинантный антиген
гес(24—41) в Е. соИ
Получение плазмиды рЕТ15раг |152]Плазмиду рЕТ 15Ь гидролизовали рестриктазой Hind 1П, достра¬
ивали липкие концы ДНК-полимеразой Т4, плазмиду выделяли
набором «Qiagen» и лигировали с раг-локусом, полученным по
P.A. Меасоск и соавт. [599]. Полученной лигазной смесью транс¬
формировали клетки Е, coli, штамм Nova-Blue (Novagen), согласно
Т. Маниатису и соавт. [75]. Трансформированные клетки высевали на
Í0,L Экспериментальные вакцины: от конъюгированных... 455чашки с агаром LB, содержащим 25 мкг/мл канамицина. Выросшие
колонии проверяли на наличие рекомбинантных плазмид. Для этого
бактериальные клетки лизировали и выделяли плазмидную ДНК.
Выделенную плазмидную ДНК обрабатывали рестриктазами Pst 1 и
Hind HI и гидролизах исследовали электрофорезом в 1%-ной агарозе.
Гидролизах плазмид ной ДНК рЕТ15-раг имеет на электрофореграмме
полосу ДНК размером 2270 пар оснований.Получение плазмиды рЕТ15раг(24-41) [152]Олигонуклеотиды для получения gp41 кинировали с помощью
ДНК-киназы согласно Т. Маниатису и соавт. [75], смешивали в экви-
молярном соотношении, инкубировали при 95 °С 30 мин и отжигали
до 15 °С в течение 2 ч в термостате, добавляли ДНК-лигазу и инкуби¬
ровали ночь при 15 “С. Целевой фрагмент ДНК гее gp41 выделяли с
помощью набора для выделения ДНК фирмы «Qiagen<^.Структура олигонуклеотидов для получения синтетического фраг¬
мента gp41 представлена ниже.5Т GAT CTG GOT ACC GAC GAC
GAC GAC A AG AAG GCC ATG
G CG ATA TCG GAT CTG CAG CGT
GTT CTG GCT GTT GAA CGT TAC
CTG AAA GAC CAG CAG CTG CTG
GGTATC TGG GGTTGC TCT GGTAAA
CTG АТС TGC ACC ACC GCT GTT CCG TGG ТА A ТА A G 3T’51 GA TCC TTA TTA CCA CGG AAC AGC GGT
GOT GCA GAT CAG TTT ACC AGA GCA
ACC CCA GAT ACC CAG CAG CTG CTG
GTC TTT CAG GTA ACG TTC AAC
AGC CAG AAC ACG CTG CAG АТС CGA TAT CGC CAT
GGCCTT CTT GTC GTC GTC GTC GGT ACC CA ЗГДля получения фрагмента rec p24 плазмиду рВН-10, содержащую
полноразмерный геном ВИЧ-1 [626], амплифицировали с помощью
праймеров N1 и N2. Фрагмент ДНК выделяли с помощью набора
для выделения ДНК фирмы «Qiagen», гидролизовали рестриктазой
BamHl и очищали электрофорезом в 1%-ной агарозе.
456 Глава 10. Конъюгированные полимер-субъединичные вакциныСтруктура олигонуклеотидов для получения ПЦР-фрагмента р24
и ПЦР-фрагмента 24—41 представлена ниже.N1 GGGG GAT ССТ САД ЛАТ TAC ССТ АТА GTG
N2 GGGG GG АТС CAA TAG TTG GCT CAT TGC TTC
N3 GGGGG GAT CCT TAT TAC CAC GCA AC
T7 AAT ACG ACT CAC TAT AGДля получения полноразмерного фрагмента ДНК, кодирующего
белок гес(24-41), в пробирке 0,5 мл смешивали оба фрагмента ДНК
(р24 и gp41) и проводили ПЦР с использованием праймеров N1 и N3,
Целевой фрагмент выделяли как описано выше, гидролизовали рест¬
риктазой BamHl и лигировали с вектором рЕТ15-раг, гидролизован¬
ным той же рестриктазой.Трансформация Е. coli [152]Полученной лигазной смесью трансформировали клетки
Е. coli, штамм Nova-Blue {Novagen), по Т. Маниатису и соавт. [75].
Трансформированные клетки высевали на чашки с агаром LB, содер¬
жащим 25 мкг/мл канамицина. Выросшие колонии проверяли на
наличие рекомбинантных плазмид. Для этого бактериальные клоны
выращивали и выделяли плазмидную ДНК. Выделенную плазмид¬
ную ДНК анализировали ПЦР с использованием праймеров N3 и Т7.
Структуру ДНК фрагмента подтверждали секвенированием по методу
Сэнгера с использованием праймеров Т7 и N3 [75], Структура ДНК
фрагмента показана на рисунке ИЗ, схема конструкции экспрессиру¬
ющего вектора приведена на рисунке 114.Доказательство экспрессии ВИЧ-специфического белка
с помощью иммуноблота и селекция колоний, содержащих
требуемую вставкуИспользуя чашки Петри с выросшими бактериальными клонами,
готовили два идентичных отпечатка на нитроцеллюлозных фильтрах.
Затем один фильтр выдерживали с разведенной сывороткой крови ВИЧ-
инфицированного пациента, а другой — с разведенной сывороткой
крови ВИ Ч-негативного донора. Далее фильтры отмывали отмывающим
буфером и выдерживали с конъюгатом пероксидазы с кроличьими анти¬
телами против IgG человека. Фильтры вновь отмывали и обрабатывали
буферным раствором, содержащим субстрат пероксидазы — перекись
водорода и хромоген 4-хлор-1-нафтол. Колонии бактерий, содержащие
ÍO.l. Экспериментальные вакцины: от конъюгированных...457ВИЧ-специфическую вставку, экспрессировали ВИЧ-специфический
белок гес(24-41) и взаимодействовали с антителами против ВИЧ, содер¬
жащимися в сыворотке инфицированного человека, давая окрашенное
пятно на отпечатке. На контрольном фильтре, обработанном негативной
сывороткой, окрашенные пятна отсутствовали.Экспрессия, выделение и очистка гес(24-41) ВИЧ-1 [152|Штамм Е. соИ BL21 (DE3), содержащий плазмиду рЕТ15раг(24—41),
выращивали в 1 л среды LB, содержащей 25 мг/л канамицина, при
37 *С до плотности 0,5 ОЕ (при 600 нм), добавляли изопропилтиог-
люкопиранозид (ИПТГ) до концентрации 1 мМ, инкубировали еще в
течение 4 ч и собирали клетки центрифугированием при 4000 g. Клетки
суспендировали в 50 мл 6 М мочевины, обрабатывали ультразвуком, к
осветленному лизату добавляли тетратионат калия и сульфит натрия до
концентрации 25 и 100 мМ, соответственно, инкубировали 16 ч и смесь
хроматографировали на аффинной колонке с Ni2‘^-arapo3on (Qiagen) по
прописи фирмы-производителя. Схема очистки приведена на рисунке 115.
Поскольку на N-конце белка гес(24—41) находятся шесть остатков
гистидина, такая очистка за одну стадию позволяет получить продукт
чистотой примерно 80—85 %. Загрязнения препарата после очистки
представлены бактериальными белками, в которых имеются распо-N¡2"Рис. П5. Препаративная очистка белка гес(24-41):Этап 1. Аффинная хроматография на металл-хелатирующем сорбенте (Ni-NTA
агарозе)
458Глава 10. Конъюгированные полимер-субъединичные вакциныЫаС1, тМ
250200ложенные подряд два или три
остатка гистидина.Для удаления этих загрязне¬
ний проводили ионообменную
хроматографию на колонке с р-
сефарозой (РЬагшас1а) в 6 М моче¬
вине и линейном градиенте НаС1
(0-0,2 М). Профиль элюции пре¬
парата с О-сефарозы представлен
на рисунке П6. На этой стадии
собирали основной пик, представ¬
ляющий собой белок гес(24—41), а
«плечи» «отрезали». После очистки
на О-сефарозе продукт представ¬
лен белком гес(24-41) с чистотой
около 99%, в виде мономера, диме¬
ра и полимерной фракции. Для
удаления полимерной фракции
проводили гельфильтрацию на
колонке с 5ирег(1ех-200. Профиль
элюции препарата с 8ирег(1ех-
200 представлен на рисунке 117.
Первый пик продукта, элюиру¬
ющийся в объеме исключения,
представляет собой полимерную
фракцию белка гес(24—41), а вто¬
рой представлен в основном мономерной формой, а также содержит
небольшое количество димеров белка гес(24—41). Эти продукты разде¬
ления представляют собой ВИЧ-специфический белок гес(24-41), как
показано с помощью иммуноблота (см. рис. 127). В связи с этим, а также
с тем, что попытка разделить мономеры и димеры многократно увеличи¬
вает себестоимость продукта, для работы была использована суммарная
фракция мономеров и димеров (см. пик 2 на рис. 117).Рис. 116. Препаративная очистка
белка гес(24-41):Этап 2. Ионообменная хроматография на
О-сефарозе. Стартовый буфер: 8М моче¬
вина, 20 тМ іт-НСІ (pH 8,8), 100 тМ
МаС1, финальный буфер: 8 М мочевина,
20 тМґгіз-На (pH 8,8), 200 тМКаС1Анализ чистоты белка гес(24—41) (чистота, гомогенность,
молекулярная масса)Чистоту белка гес(24—41) оценивали по результатам аналити¬
ческой хроматографии на колонках с 0-сефарозой и 5ирег(1ех-200,
ÎO.l. Экспериментальные вакцины: от конъюгированных.459OD226
0,020'0,01540,010-Полимернаяфракция1і
1гес(24-41)I12 341 аРис. 117. Препаративная очистка белка гес(24-41):Этап 3. Гель-фильтрация на колонке с Superdex-200по спектру поглощения (рис. 118-121) и по электрофоре¬
зу в PAAG. При аналитической хроматографии профиль элю¬
ции очищенного продукта с обеих колонок должен представ¬
лять собой острый равноплечий пик. Картина аналитической
хроматографии белка (на примере серии 15 16 01) приведена на
рисунках 118 и 119, UV-спектр поглощения очищенного белка —
на рисунке 120. Как видно из рисунков 118 и 119, профиль элюции
очищенного продукта с обеих колонок (Q-сефарозы и Superdex-200)
представляет собой острый равноплечий пик, что свидетель¬
ствует о чистоте продукта. При электрофорезе в ПААГ очищен¬
ный препарат представлен одной полосой с Мг около 30 кД, что
также свидетельствует о его чистоте и гомогенности (см. рис. 121).
Теоретическая масса белка, рассчитанная по аминокислотной
последовательности, составляет 34,950 кД. Такое расхождение
укладывается в величину погрешности определения Мг с помощью
электрофореза.Анализ белка гес(24—41) с помощью МАЬ01-Т0Г (подтверждение
молекулярной массы и определение М-концевых пептидов)Целью анализа белка гес(24—41) методом масс-спектрометрии
является подтверждение его первичной структуры, что включает
460Глава 10, Конъюгированные полимер-субъединичные вакцины0D 226NaCi, тМ OD 226
200 0.020-Рис. 118. Аналитическая хромато¬
графия очищенного белка гес(24—41)
на колонке с Q-сефарозой.
Стартовый буфер: 8 Ммочевина, 20тМ
tris~HCl (pH 8,8), 100 тМ NaCl; финаль-
ный буфер: 8 Ммочевина, 20тМ tris-HCl
(pH 8,8), 200 тМ NaCÎ. Профиль в виде
одного острого равиоплечевого пика сви¬
детельствует о чистоте продукта0D0,015-0.010-0.005-гес(24-41)1 23451 11115 10 15 20 25
V, т1Рис. 119. Аналитическая хромато¬
графия очищенного белка гес(24-41)
на колонке с 5ирег<Лех-200,Маркеры: 1 — объем исключения; 2 —1^0;
3 — БСА; 4—яичный альбумин; 5— цито¬
хром.Профиль в виде одного острого равно¬
плечевого пика свидетельствует о чис¬
тоте продуктаX, нмРис. 120. UV-cncKip поглощения очищенного белка гес(24-41)
10.1. Экспериментальные вакцины: от конъюгированных...46130 кОРис. 121. Анализ белка гес(24—41)
с помощью электрофореза в 508-
РААО:1—маркеры молекулярной массы; 2—гру¬
бый бактериальный лизат; 3 — очищен¬
ный белок гес(24—41)В себя подтверждение молеку¬
лярной массы и определение К-
концевых пептидов, кроме того,
методом молекулярного иона
была определена молекулярная
масса белка.Ранее нуклеотидная последо¬
вательность гена, кодирующего
белок гес(24-41), была опреде¬
лена по Сэнгеру. Нуклеотидная
последовательность гена одно¬
значно определяет первич¬
ную структуру соответству¬
ющего кодируемого белка.Следовательно, для идентифи¬
кации белка не требуется пол¬
ный аминокислотный анализ, а
требуется лишь подтверждение
молекулярной массы и опреде¬
ление N-кoнueвыx аминокислот,что и было выполнено. Дополнительно были определены некоторые
летучие пептиды из внутренней последовательности белка.Выше (см. рис. 113) приведена аминокислотная последователь¬
ность белка гес(24-41), определенная по нуклеотидной последова¬
тельности.Теоретическая масса белка, рассчитанная по аминокислотной
последовательности, составляет 34,950 кД. Молекулярная масса
образцов белка гес(24-41), определенная на основании спектров
молекулярного иона, находилась в ряду 34,800-35,200, Определение
молекулярной массы трех экспериментальных серий белка, дало
следующие результаты. Для серии 160801 — 35,015 кД, для серии 141000 —
34,950 кД и для серии 150601 — 34,920 кД. Спектры молекулярного
иона трех серий белка представлены на рисунке 122. Таким образом,
молекулярная масса всех трех образцов, определенная на основании
спектров молекулярного иона, соответствовала ожидаемой.Для подтверждения аминокислотного состава рекомбинантный
белок гидролизовали трипсином и гидролизат анализировали с помо¬
щью масс-спектроскопии. На рисунке 123 приведены спектры МАТОЇ
трех экспериментальных серий, представленных для контроля в
462Глава 10. Конъюгированные полимер-субъединичные вакциныСерия 15 06 01|| || I л» ы <11и32000 340М 3«0М Э«М>0 40600 т/г1п1«а1зов20«10»36В5Серия 16 08 0132М0|<1>||||1>Н^|^ зтмо42И0ш/гРис. 122. Определение молекулярной массы трех серий белка гес(24-41) по
спектрам молекулярного иона
¡0.1. Экспериментальные вакцины: от конъюгированных...463ГИСК, а в таблице 51 — структура ожидаемых пептидов, получаемых
в результате исчерпывающего триптического гидролиза, и их молеку¬
лярная масса (МН+).Как видно из рисунка 123 и таблицы 51, на спектрах присутству¬
ют ионы всех ожидаемых пептидов с молекулярной массой выше
800, уровень шума на спектрах минимален. Исходя из этих спектров,1вав400» вЛ2М»40МРис. 123. Спектры МАЬО! триптического гидролизата трех серий белка
гес(24-41)
464Глава 10. Конъюгированные полимер-субъединичные вакциныТаблица 51Результат анализа трипсинового гидролизата трех экслериментальных серий
белка гес(24~41) (14 10 00,15 16 01 и 16 08 О!) с помощью МАЬВХ
(масс-спектрометрии)№От—доМН+ПоследовательностьПредставлен/не представ¬
лен на масс-спектре (+/—)Серия №14 10 0015 16 0116 08 0111-161768.85088НННННН88СтЬУРК+++217-453287.61GSHMLEDPQNYPIVQNТООдМУНОАТЗРК+++346-52831.47+++453-57603.34УУЕЕК---558-974233.05АР5РЕУ1РМР8АЬ8ЕСАТРОВЬКТМЬНТУООНдААМрМЕК+++698-1091462.65ETINEEAAEWDR++4-7110-1241566.83УНРУНАСРТАРОдМК+++8125-127401.21ЕРК---.9128-1583317.64О5О1АСТТ8ТЕ0Е0ЮWMTNNPPIPVGETYK+++10159-159175.12К---11160-167956.59WTILGLNK+++12168-170387.271УК---13171-1811295.67МУ$РТ81ЬОТК++-Н14182-185429.25ООРК---15186-189548.28ЕРЕК---16190-19466731ОУУОК---17195-197457.25РУК---18198-200389.25ТЕК---19201-209989.49аеоазоеук+++20210-2261975.91NWMTETLLУQNANРОСК+++21227-230474.33Т1ЕК---
10.1. Экспериментальные вакцины: от конъюгированных...465Окончание табл. 51От-доМН+ПоследовательностьПредставлен/не представ¬
лен на масс-спектре (+/■")Серия №14 10 0015 16 0116 08 0122231-2542325.09АЪОРААТЬЕЕММТАСОСУООРОНК+++255-256246.16АК257-2752048.97УЬАЕАМЗОиГОЬОТООООК+25276-2841004.52АМАТЗОЬОК285-290743.44291-293423.26294-3061403.69307-3151032.50иСТТАЕР\¥структура белка полностью доказана. Сравнение масс-спектров пока¬
зывает хорошую воспроизводимость белка от серии к серии.Результаты, представленные в этом разделе, свидетельствуют о
гомогенности и чистоте препарата и о том, что структура белка соот¬
ветствует теоретически заявленной и полностью подтверждена, что
доказывает подлинность белка гес(24—41),Контроль очищенного препарата белка гес(24—41)
на содержание примесей бактериальной ДНКИспользование белка гес(24-41) в качестве субстанции кандидатной
анти-ВИЧ/СПИД вакцины потребовало проведения контроля на
содержание бактериальной ДНК. Контроль проводили методом
молекулярной гибридизации с радиоактивной пробой согласно
указаниям [69]. Удельная радиоактивность ДНК-зонда составляла
4x10* сргп/мкг ДНК. Разведения стандартов очищенной бактериаль¬
ной ДНК наносили на нитроцеллюлозньгй фильтр в ко1щентрациях от
31,25 нг до 2 пг в точку. Результаты контроля трех экспериментальных
серий белка гес(24-41) на содержание примесей ДНК приведены
на рисунке 124. Содержание белка в дозе вакцины «ВИЧРЕПОЛ»
466Глава 10, Конъюгированные полимер-субъединичные вакциныДНК Стандарт
в пробе ь ДНКОбразец Белок в пробе Серия №
Г0С (24-41) , для экстракции6,26 йг ф ф
ф ф250 пг
50 пг
10 пг
2пг50050500505005014 10 0015 06 0116 08 01О пгРис. 124. Результаты контроля субстанции вакцины «ВИЧРЕПОЛ«> —
гес(24—41) на содержание примеси бактериальной ДНК методом молекуляр¬
ной гибридизации.Бактериальная ДНК ие определяется ни в одном из препаратов белка, как эквива¬
лентных одной дозе антигена гес(24—41) в вакцине (50 мкг), так и эквивалентных
десятикратной дозе антигена (500 мкг)составляет 50 мкг, В связи с этим ДНК выделяли из 50 мкг белка, что
соответствует дозе вакцины, и из 500 мкг белка, что в 10 раз превыша¬
ет содержание белка в дозе вакцины. Как видно из рисунка 124, ДНК
не определяется ни в одном из препаратов белка гес(24-41) (№ 14 10
00, 15 06 01 и 16 08 01), как в препаратах, соответствующих одной дозе
вакцины, так и в препаратах, соответствующих десятикратной дозе
вакцины. Иначе говоря, содержание бактериальной ДНК во всех трех
сериях рекомбинантного белка гес(24—41) меньше 2 пт на десятикрат¬
ную дозу препарата (500 мкг).
10 J. Экспериментальные вакцины: от конъюгированных,,. 467Рефолдинг белка гес(24-41)Методы генной инженерии позволяют получать промышленные
количества белков требуемой специфичности. Однако белки, проду¬
цируемые в Е. соИ, не подвергаются посттрансляционным изменени¬
ям, которые присущи белкам ВИЧ, образующимся в ходе естествен¬
ной инфекции, и, таким образом, иммунологические характеристики
рекомбинантных белков могут несколько отличаться от свойс гв вирус¬
ных белков, в связи с этим целью данной части работы явилось полу¬
чение экспрессируемых в Е. coli рекомбинантных антигенов (особенно
кодируемых геном gag), растворимых в физиологических условиях в
водных растворах. Для этого очищенный белок подвергали рефол-
дингу. Для проведения рефолдинга к раствору белка добавляли цис-
теин до конечной концентрации 10 мМ, инкубировали 72 ч при 4 °С и
диализовали ступенчато против 6 М — 1 М мочевины, а затем против
10 мМ NaHC03 [152].Таким образом, содержание бактериальной ДНК составляет мень¬
ше 2 пг на дозу препарата, что соответствует требованиям ВОЗ.Изучение иммуногенных свойств и специфической активности белка
гес(24-41) с помощью твердофазного иммунофермемтною анализа и
иммуноблоттингаДля изучения иммуногенных свойств и специфической активнос¬
ти белка гес{24—41) проводили две серии экспериментов. В первой
серии животных иммунизировали белком гсс(24—4!) и исследовали
иммунный ответ на сам белок и его составляющие, а также на культу¬
ральный ВИЧ-1. Во второй серии исследовали взаимодействие с бел¬
ком гес(24—41) антител, образующихся у людей, зараженных ВИЧ-1.Анализ иммуногенности белка гес(24—41) с помощью ИФА
и иммуноблотаМышей — гибридов (CBAxC57BL/6)F, массой 16—18 г — иммунизи¬
ровали дважды внутрибрюшинно с интервалом в 28 дней различными
дозами белка. Каждую дозу испытывали в группе из 20 мышей. Кровь
собирали через 7 дней после второй иммунизации. Контрольную
группу составили 20 неиммунизированных мышей того же поступле¬
ния. Сыворотки крови от мышей каждой группы объединяли и опре¬
деляли титр в ИФА, используя для твердой фазы антиген гес(24—41) в
468Глава 10. Конъюгированные полимер-субъединичные вакцины250 ООО150 000-%I 200 000-CQІ
sнX
<0^100 ООО -
50 000-
0>200 ООО>200 ОООгес (24-41) гвсдр41 геср24
Антиген на твердой фазеРис. 125. Химерный рекомбинантный антиген гсс(24—41) индуцирует образо¬
вание высоких титров антител на обе его составляющие — р24 и gp41концентрации 10 мкг/мл и для дегекции антител -- конъюгат перок-
сидазы с антителами против IgG мыши.Исследования показали, что химерный рекомбинантный белок
гес(24—41) индуцирует образование высоких титров антител как на
целый антиген, так и на обе его составляющие — р24 и gp41 (рис. 125)
[95, 153].Следующей задачей было определение специфической активиости
антител, индуцируемых белком гсс(24-41) по отношению к ВИЧ-1.
Для этого использовали нитроцеллюлозные стрипы из набора «New
Lav Blot» («Віо-Rad»), па которых сорбированы белки культурального
ВИЧ-1. В качестве детектирующсі о реагента использовали конъюгат
пероксидазы с антителами против IgG мыши. Результат типично¬
го эксперимента приведен на рисунке 126. Как видно из рисунка,
антитела из сывороток мышей, иммунизированных вакциной,
распознают в иммуноблоте белки культурального ВИЧ1 — gp41, р24 и
р55 (предшественник р24). Это свидетельствует о сохранности обоих
ВИЧ-специфических антигенных участков — р24 и gp41 и о том, что
рекомбинантный химерный белок гес(24—41) обладает той же специ¬
фичностью, что и вирусный прототип.
iO.l, Экспериментальные вакцины: от конъюгированных...46913т Iдр41 iр24др160
др120
р55*$^4 р34I Р241 2 3 4Рис. 126. Рекомбинантный антиген гес(24-41) индуцирует у животных обра¬
зование антител, специфически узнающих белки культурального ВИЧ-1 в
иммуноблоте:/ — сыворотка мыши, иммунизированной белком гес(24—41); 2 — сыворотка неим-
мунизированной мыши (отрицательный контроль); 3 — сыворотка ВИЧ-инфици-
рованного человека (положительный контроль); 4 — сыворотка ВИЧ-негативного
человека (отрицательный контроль). Окрашенная полоска в нижней части стрипов 3
и 4 указывает на правильность выполнения теста при анализе сывороток человекаВзаимодействие сывороточных антител людей,
инфицированных ВИЧ-1, с рекомбинантным белком гес(24-41)
в ИФА и иммуноблотеДля исследования в ИФА очищенный белок сорбировали в лунках
пол истироловых планшетов фирмы «Greiner». Постановку иммунофер-
меитного анализа црокодили согласно И.Г. Сидоровичу и соавт. [1551.
В качестве проявляющего реагента использовали конъюгат монокло¬
470Глава 10. Конъюгированные полимер-субъединичные вакцинынальных антител против lgG человека с пероксидазой хрена. Конъюгат
получали методом периодатного окисления но Накане [631]. Коллекция
позитивных сывороток включала панель отраслевой стандарт ОСО 42-
28-212-93 (16 образцов), панель Института иммунологии (20 образцов),
Греческую национальную панель (42 образца), панель Иранского инс¬
титута Пастера и Иранского института переливания крови (293 образ¬
ца), всего 371 сыворотку. Коллекция негативных образцов включала
панель отраслевой стандарт ОСО 42-28-214-94 (20 образцов), коллекцию
Института (1900 образцов), Греческую национальную панель (17 образ¬
цов) и сыворотки Иранского института Пастера и Иранского института
переливания крови (423 образца), все1о 2356 сывороток. Результаты
исследования приведены в таблице 52.Таблица 52Результаты определения антител к ВИЧ-1 в ИФА на основе гес(24-41)Позитивные образцыНегативные образцыИсточникЧисло образцовИсточникЧисло образцовОСО16ОСО20ИнститутИнститутиммунологии20иммунологии1900Греческая панслъ42Греческая панель17Иранская панель293Иранская панель423Всего371Всего2360Число позитив¬Число негатив¬ных результатов371ных результатов2356Чувствитель¬Специфичность99,83 %ность100%Как видно из таблицы, 371 из 371 позитивных (содержащих анти¬
тела к ВИЧ-1) образцов был определен как позитивный, а 2356 из 2360
негативных (не содержащих антител к ВИЧ) образцов были определе¬
ны как негативные, т.е. чувствительность (аккуратность) и специфич¬
ность определения составили 100 и 99,83% соответственно.Для исследования в иммуноблоте очишенный препарат белка
подвергали электрофорезу в полиакриламидном геле в денатурирующих
условиях (РААС-805) и переносили на нитроцеллюлозу. Полученный
блот выдерживали с сывороткой ВИЧ-инфицированного человека,
контрольный блот выдерживали с сывороткой здорового донора.
10,1. Экспериментальные вакцины: от конъюгированных...471В качестве детектирующего реагента использовали конъюгат моно¬
клональных антител против IgG человека с пероксидазой хрена, для
окрашивания применяли субстрат пероксидазы — перекись водорода
и хромоген 4-хлор-1-нафтол. Результат типичного эксперимента при¬
веден на рисунке 127.Таким образом, белок гес(24-41) индуцирует у животных образова¬
ние антител как против целого антигена, так и против обеих его состав¬
ляющих — р24 и gp4i. Эти антитела распознают соответствующие белки
культурального вируса в иммуноблоте. С другой стороны, антитела про¬
тив ВИЧ-1, образующиеся у людей, зараженных ВИЧ-1, специфически
взаимодействуют с белком гес(24-41) в ИФА и иммуноблоте.Димеры гес(24-41)Мономеры гес(24-41)1 2 ; 'Рис. 127. Антитела человека, инфицированного ВИЧ-1, специфически рас¬
познают химерный рекомбинантный белок гес(24—41) в иммуноблоте;/ — сыворотка ВИЧ-негативного человека; 2 — сыворотка ВИЧ-инфитрованпого
человека
Рис. 128. Схема строения вакцины «ВИЧРЕПОЛ».Показан участок связывания белка гес(24—41) с полиоксидониемИммунный ответ на белок гес(24—41) и конъюгат гес(24-41)
с полиоксидониемПолиоксидоний представляет собой иммуномодулятор, разре¬
шенный для клинического применения. Безопасность полиоксидо-
ния была показана в многочисленных исследованиях. Применение
полиоксидония позволяет усилить иммунный ответ и сократить дозу
вакцинного антигена. Была приготовлена серия конъюгатов белка
гес(24—41) с полиоксидонием и проведены сравнительные испытания
иммуногенности конъюгата и чистого белка [151, 153, 156]. Строение
конъюгата белка гес(24—41) с полиоксидонием показано на рисунке 128.
Установлено, что при низких дозах — 10 мкг белка гес(24-41) на
животное — иммунизация антигеном в составе конъюгата с поли¬
оксидонием обеспечивает получение титров антител, десятикратно
превышающих титры антител, индуцированные чистым антигеном
[150, 151, 156]. Результаты типичного опыта приведены на рисунке 129.
Было подобрано оптимальное соотношение белка гес(24-41) и поли¬
оксидония (1:10 по весу) и приготовлен препарат, получивший назва¬
ние «ВИЧРЕПОЛ».Таким образом, вакцина «ВИЧРЕПОЛ» представляет собой
генно-инженерный белок гес (24—41), копирующий аминокис¬
лотные последовательности фрагмента внутреннего белка р17,
IO.l. Экспериментальные вакцины: от конъюгированных...47350 000-I 40,000-
<а§ 30 000-
І^ 20 000-
10 000-50 ОООчистыи антиген
гес (24^1)
конъюгат
гес (24-41 )-П0гес (24-41)Антиген на твердой фазеРис. 129. Полиоксидоний усиливает иммунный ответ при низкой дозе антигена.
По оси ординат — титры антител в сыворотках мышей, иммунизированных анти¬
геном гес(24-41) или его конъюгатом с полиоксидонием — гес(24-41)-ПО в дозе
10 мкг антигена па животное, вторичный ответполноразмерного внутреннего белка р24 и иммунореактивно¬
го фрагмента трансмембранного белка §р41 ВИЧ-1, полученный
рекомбинантным методом, выделенный из трансформированно¬
го штамма кишечной палочки и высокоочишенный с гюмош;ью
аффинной и ионообменной хроматографии, в виде комплекса
с водорастворимым высокомолекулярным иммуностимулятором
Ы-оксидированным производным поли-1,4-этиленпиперазина
(субстанцией Полиоксидония) [146, 153].Оценка лимфопролиферативного ответа на белок гес(24—41)
и вакцину «ВИЧРЕПОЛ»Мышей — самок гибридов (СВАхС57ВЬ/6) ?! массой 16-18 г
иммунизировали гес(24-41) в полном адъюванте Фрейнда или вак¬
циной «ВИЧРЕПОЛ» подкожно дозой 50 мкг антигена на животное.
Через 30 дней мышам вводили внутрибрюшинно 500 мкг антигена в
физиологическом растворе. Через 48 ч и 72 ч после второй иммуниза-
474Глава 10. Конъюгированные полимер-субъединичные вакциныиии выделяли клетки селезенки и лимфатических узлов. Определяли
их пролиферативную активность по включению Ш-тимидина и
визуально, по образованию бластов в культуре клеток, с помощью
инвертируемого микроскопа. Негативным контролем служили неим-
мунизированные мыши. Клетки культивировали в 24-луночных
планшетах с плотностью культуры 5x10^ клеток на лунку в ростовой
среде (ОМЕМ с 20% РС8) и ^Н-тимидином 12 ч при 37 "С в 5% СО2
в трех параллелях. По завершении инкубации клетки переносили в
и-образные лунки 96-луночного планшета с плотностью культуры
1x10^ клеток, а оттуда на харвестер. Включение ^Н-тимидина считали
на р-счетчике в толуоловом сцинтилляторе. У животных развивался
сильный пролиферативный ответ как на белок гес(24-41), так и на
вакцину «ВИЧРЕПОЛ*>.Результаты определения антигенспецифической пролиферации
лимфоцитов приведены в таблице 53.Таблица 53Пролиферация клеток в ответ на введение вакцины «ВИЧРЕПОЛ»КлеткиВключение ^Н-тимидина
имп/мин/10^ клетокИндекспролифера¬цииСпонтанная про¬
лиферацияРБТ на
«ВИЧРЕПОЛ»Селезенка1 000+5010 000+30010,0Лимфатические узлы600±1005 000±1008,3Примечание. Включение ^Н-тимидина определяли через 48 ч после второй иммуниза¬
ции in vivo и через 12 ч культивирования in vitro; 2 мыши на группу; 2 лунки на клетки
селезенки + 2 лунки на клетки лимфатических узлов.Как видно из таблицы, индекс антигенспецифический проли¬
ферации составил 10 для клеток селезенки и более 8 — для клеток
лимфатических узлов. Следовательно, иммунизированные животные
в ответ на введение вакцины развивали сильный лимфопролифера-
тивный ответ.Оценка нейтрализующей активности вакцины «ВИЧРЕПОЛ»Для получения иммунных сывороток по 20 мышей — гибридов
(СВАхС57ВЕ/6)Р, массой 16-18 г иммунизировали дважды внутри-
ÍOJ. Экспериментальные вакцины: от конъюгированных... 475брюшинно с интервалом в 28 дней препаратом гес(24—41) или вакци¬
ной «ВИЧРЕПОЛ» [150, 153, 154]. Иммунизирующая доза составила
50 мкг антигена на животное. Кровь собирали через 7 дней после
второй иммунизации и получали сыворотки. Контрольную группу
составили 20 неиммунизированных мышей того же поступления.
Сыворотки крови от мышей каждой группы объединяли и определя¬
ли in vitro их нейтрализующую активность на модели острой инфск-
тши лимфобластных клеток МТ4 референс — штаммом ВИЧ-1/П1В
[150, 153, 154].Вирусные стоки для эксперимента получали в результате острой
инфекции клеток линии МТ4 вируссодержащей жидкостью, про¬
дукцию вируса оценивали по содержанию антихсна в культуральной
надосадочной жидкости методом ИФА. По достижении максималь¬
ной продукции антигена (поданным ИФА) вирус содержащую культу¬
ральную жидкость освобождали от клеток центрифугированием при1 тыс. об/мин 10 мин, собирали и хранили при температуре —70 'С.
Биологическую активность вирусных стоков оценивали путем титро¬
вания TCÎDjo (Tissue Culture Infectious Dose—50).Сыворотку (в разведениях 1:10, 1:50) и вируссодержащую жид¬
кость (100 ТСШ50) вносили одновременно в культуру клеток МТ4
(300 тыс. клеток на лунку). Эксперимент проводили в 24-луноч-
ной панели («Costar», США) в ростовой среде следующего состава:
RPMT1640 («Sigma», США), 10% фетальной телячьей сыворотки
(«Sigma», США), 2 шМ L-глутамина («Sigma», США). После 18-4асо-
вой инкубации (37“ С, 5% СО2) клетки отмывали путем низкоско¬
ростного центрифугирования (1100 об/мин х 7 мин), осадок клеток
ресуспендировали в 1 мл в свежей ростовой среды. За развитием
инфекции наблюдали в течение 5 сут, оценивая цитопатический
эффект (цитолиз, синцитиеобразование) и концентрацию вирусного
антигена р24 ВИЧ-1 с помощью иммуноферментного анализа (ИФА)
(«Tnnogenetics», Бельгия).Сыворотки иммунных мышей инкубировал и совместно с вирусом.
Нейтрализующую активность определяли по снижению концент¬
рации вирусного белка р24 в тех лунках, где вирус инкубировался
совместно с иммунными сыворотками, по сравнению с лунками,
где была сыворотка неиммунных мышей. В качестве позитивного
контроля использовали сыворотки инфицированных ВИЧ-1 людей,
имеющие сильную нейтрализующую активность. Концентрацию
476Глава 10. Конъюгированные полимер-субъединичные ващинывирусного белка р24 определяли методом ИФА с применением набора
«Tnnogenetics». Нейтрализацию оценивали на 3-и сутки после начала
инкубации. Индекс нейтрализации (1N) рассчитывали гю формулеODnegSer - QDTestScr
ODnegSer - ODcellControl ’где ODnegSer — средняя оптическая плотность по трем параллелям
контроля с негативной сывороткой в ИФА; ODTestSer — средняя опти¬
ческая плотность образца по трем параллелям в ИФА; ODcellControl —
средняя оптическая плотность контроля клеток без вируса по трем
параллелям в ИФА.Результаты определения нейтрализующей активности иммунных
сывороток приведены в таблице 54 и на рисунке 130. Полученные
данные показывают, что иммунизация вызывает у животных обра¬
зование антител, нейтрализующих ВИЧ-1 in vitro, причем индекс
нейтрализации сыворотки, разведенной в 50 раз, составляет 54^9%
[150, 640[.ИммуннаяHIV1 IIIBЛимфобластнаясыворотка100 ТСЮбоклеточная линия МТ41:50{300 ООО клеток/лунку)ИнкубацияИндекс нейтрализации 55%Рис. 130. Сыворотки животных, иммунизированттых белком гес(24-41) или
вакциной «ВИЧРЕПОЛ», нейтрализуют вирус ш vitro
10.1. Экспериментальные вакцины: от конъюгированных... 477Таблица 54Нейтрализующая активность сывороток мышей, иммунизированных вакциной,
и сыворотки инфицированного ВИЧ-1 человекаПараметрысыворотокИммуннаямышьИнфицированный
ВИЧ-1 человекаРазведение сыворотки1:501:10Индекс нейтрализации, %54,981,7Таким образом, было показано, что вакцина против ВИЧ/СПИДа
«ВИЧРЕПОЛ» вызывает у животных сильный лимфопролифератив-
ный (индекс 10) и гуморальный ответ в форме общих антител против
входящего в нее антигена (титры в ИФА >200 тыс.) и нейтрализую¬
щих антител (IN=54,7% для разведения сыворотки 1:50). Антитела из
сывороток иммунизированных животных взаимодействуют с вирус¬
ными белками вр41 и р24 ВИЧ1 в иммуноблоте; антитела из сыворо¬
ток ВИЧ-инфицированных лиц взаимодействуют с вакциной в ИФА.
В отдельной серии экспериментов было показано, что вакцина сте¬
рильна, апирогенна и нетоксична.Была разработана программа доклинических испытаний вак¬
цины «ВИЧРЕПОЛ», которые были проведены совместно с Г ИСК
им. Л.А. Тарасевича. В ходе доклинических испытаний были под¬
тверждены данные по иммуногенности, специфической активности,
безопасности и стандартности препарата. Для испытаний были под¬
готовлены три серии препарата. Результаты испытаний приведены в
статьях И.Г. Сидоровича и соавт. |153, 154]. Наряду с вакциной испы¬
тывалась ее субстанция — белок гес(24—41).Результаты доклинических испытаний вакцины «ВИЧРЕПОЛ»Контроль субстанции вакцины — белка гес(24—41). Исследованы
три серии белка гес(24-41). Чистоту препарата оценивали по резуль¬
татам анали1 и ческой хроматографии на колонках с О-сефарозой и
5ирегёсх-200, по электрофорезу в РАА0-808 [971 и по спектру УФ-
поглощения. Первичную структуру белка гес(24—41) подтверждали
с помощью масс-спектрометрии. Контроль на содержание примссей
бактериальной ДНК выполняли методом молекулярной гибридизации
согласно МУК 4.1,/4.2.588-96 [69]. Методы исследования и результаты
описаны выше, результаты приведены в таблице 51 и на рисунках П8-
124. Как видно из рисунков, испытания подтвердили молекулярную
478 Глава JO. Конъюгированные полимер-субъединичные вакцинымассу и первичную структуру белка и продемонстрировали чистоту и
стандартность препарата от серии к серии.Оценка безопасности вакцины. Доклинические испытания пока¬
зали, что вакцина «ВИЧРЕПОЛ» является апирогенным препа¬
ратом, не вызывающим у животных воспалительных реакций на
месте введения, морфологических изменений внутренних органов.
Вакцина не оказывает влияния на состояние ЦНС, клеточные эле¬
менты крови, обезвреживающую функцию печени, биохимические
показатели крови, отражающие состояние белкового, углеводного,
жирового обменов, ферментов печени и на уровень кальция в крови.
Проведенные иммунологические исследования свидетельствую! о
том, что вакцина является высокойммуноактивным препаратом,
стимулирующим гуморальный иммунный ответ и индукцию аллер¬
гических реакций немедленного и замедленного типов. Выявленный
на животных эффект является результатом естественного развития
сенсибилизации на белковый антиген, что характерно для многих
вакцинных препаратов. Эти результаты приняли во внима11ие при
разработке протокола клинических испытаний. Было решено начи¬
нать иммунизацию с малых доз (2,5 мкг по белку) и переходить к
испытаниям более высоких доз лищь после того, как будет доказана
безопасность более низкой дозы. Контроль стерильности, токсич¬
ности и пирогенности серий вакцины «ВИЧРЕПОЛ» проводили
согласно методикам, изложенным в проекте ФСП на препарат. Было
показано, что все три серии вакцины стерильны, нетоксичны и апи~
рогенны.Изучение специфической активности вакцины «ВИЧРЕПОЛ»
и иммунореактивности иммунных сывороток мышейСпецифическую активность вакцины «ВИЧРЕПОЛ» и иммуно-
реактивность иммунных сывороток мышей изучали в ИФА и имму¬
ноблоте согласно проекту ФСП.Определение специфического взаимодействия антигена гес(24-
41), входящего в состав вакцины «ВИЧРЕПОЛ», с антителами к ВИЧ,
содержащимися в сыворотках крови инфицированных ВИЧ-1 людей,
проводили с помощью ИФА [154], Вакцину сорбировали на твердую
фазу (полистироловыепланшеты «Greiner», Германия) в концентрации
10 мкг/мл в расчете на антиген. В качестве ВИЧ-позитивных образцов
применяли панель сывороток ОСО 42-28-212-02 П серии 10 (образцы,
содержащие антитела к ВИЧ-1). В качестве ВИ Ч-негативных образцов
10.i. Экспериментальные вакцины: от конъюгированных...479использовали сыворотки крови человека, не содержащих антите¬
ла к ВИЧ-1 (ОСО 42-28-214-02 П), серии 7. Все остальные реактивы
для проведения ИФА брали из набора «Пептоскрин-2» производства
«Амеркард*-. В качестве набора сравнения использовали тест-систему
«Пептоскрин-2», в которой анализировали те же образцы.Результаты определения специфической активности антигена,
входящего в состав вакцины, представлены в таблице 55. В качестве
препарата сравнения использована тест-система «Пептоскрин-2*>. Все
образцы, показавшие ОП>ОП Крит., считаются позитивными, все
образцы с ОП<ОП Крит, считаются негативными.Таблица 55Результаты исследования в ИФА сывороток крови человека, содержащих
и не содержащих антитела к ВИЧ-1 при использовании в качестве
антигена на твердой фазе вакцины «ВИЧРЕПОЛ»(приведены значения ОП492 в ИФА)*СывороткиАнтиген на твердой (>азе№ серии вакцины «ВИЧРЕПОЛ»«Пентоскрин- 2»1112 0112 12 0113 12 01К-0,1310,1520,1560,113ОСО№10(ВИЧ+)11,1951,1471,1421,35421,0520,9871,1521,12930,7520,6730,8220,82740,8690,9310,8550,930160,5020,4410,5910,433ОСО №7 (ВИЧ-)10,1280,1470,1400,09020,1180,1360,1270,10130,1600,1860,2040,16440,1590,1780,1700,12150,1280,1430,2300,08560,1190,1320,1510,11370,1620,1800,2300,153ОП Крит.0,3810,4020,4060,350* Значения ОП представляют собой среднее арифметическое двух пардл-чельных опре¬
делений.
480 Глава 10, Конъюгированные полимер-субъединичные вакциныКак видно из таблицы 55, при использовании всех трех серий вак¬
цины позитивные образцы были определены как позитивные, а нега¬
тивные — как негативные, что свидетельствует об антигенной актив¬
ности вакцины. Для всех серий были получены близкие результаты,
что свидетельствует о стандартности препарата вакцины.Таким образом, было показано, ^гго антиген гес(24—41) в составе вакци¬
ны «ВИЧРЕПОЛ» специфически взаимодействует с антителами к ВИЧ-1,
содержащимися в сыворотках крови ВИЧ-инфицированных людей.С целью исследования иммуногенных свойств вакцины
«ВИЧРЕПОЛ» (специфичности иммунного ответа) мышей — гибридов
(CBAxC57BL/6)Fj массой 16—18 г иммунизировали дважды внутри¬
брюшинно с интервалом в 28 дней, Иммунизирующая доза составила
50 мкг антигена/0,5 мл на животное. Кровь собирали через 7 дней после
второй иммунизации и получали сыворотки. Для испытания каждой
из трех серий вакцины иммунизировали группу 20 мышей (т.е. всего
три группы по 20 мышей в каждой). Четвертую, контрольную группу
составили 20 неиммунизированных мышей того же поступления.Анализ иммуногенности вакцины «ВИЧРЕПОЛ» с помощью ИФАСыворотки крови от мышей каждой группы объединяли и опреде¬
ляли титр в ИФА, используя для твердой фазы антиген гес(24—41) в кон¬
центрации 10 мкг/мл или планшеты-иммуносорбенты коммерческих
систем ИФА для определения антител к ВИЧ. В последнем случае для
выявления специфических мышиных антител вместо поставляемого в
тест-системах конъюгата пероксидазы с антителами против IgG человека
использовали конъюгат пероксидазы с антителами против IgG мыши.Результаты изучения взаимодействияиммунных сывороток мышей
с антигеном гес(24-41), входяищм в состав вакцины «ВИЧРЕПОЛ»,
приведены в таблице 56.Таблица 56Титры в ИФЛ антител сывороток мышей после второй иммунизации вакциной
«ВИЧРЕПОЛ». На твердой фазе сорбирован антиген гес(24-41)№ серии вакцины «ВИЧРЕПОЛ»Титр антител в ИФА*11 12 01500012 12 0110 ООО13 120110 000* В каждой серии тич'ровали объединенные сыворотки 20 иммунизированных живот¬
ных, каждую объединенную сыворотку титровали двукратно.
10.1. Экспериментальные вакцины: от конъюгированных...481Как видно из таблицы 56, все три серии вакцины индуциронали у
иммунизированных животных образование высоких титров антител. Эти
результаты указывают также на стандартность препаратов вакцины.
Результаты изучения сывороток мышей, иммунизированных вак¬
циной «ВИЧРЕПОЛ», в ИФА с использованием планшетов-иммуно¬
сорбентов коммерческих тест-систем для выявления антител к ВИЧ
представлены в таблице 57.Таблица 57Иммунореактивность сывороток мышей, иммунизированных
вакциной «ВИЧРЕПОЛ» (по результатам ИФА с использованием планшетов
из коммерческих тест-систем)Планшеты из
тест-системыАнтигены на твердой
фазе тест-системТитр антител в сыворотках мышей”№ серии вакцииы «ВИЧРЕПОЛИ 12 0112 12 011312 01«ИФА-АНТИ-ВИЧ-УНИФ»gpl60, gpl20, gp41 (env
ВИЧ-l), pl7, pl5, p24
(gag ВИЧ-1), gp 120,
gp41(env ВИЧ-1 группы
О), pi7, pi5, p24 (gag
ВИЧ-1 группы О), gp 40,
gp 38 (env ВИЧ-2)1:6401:12801:1280«Рекомби-Бест-анти-ВИЧ-1+2»P24, gpl20 ВИЧ-1 ир32
ВИЧ-21:3201:3201:640* В каждой серии титровали объединенные сыворотки 20 иммунизированных живот¬
ных, каждую объединенную сыворотку титровали двукрач но.Как видно из таблицы, антитела в сыворотках мышей, иммунизи¬
рованных любой из трех серий вакцины «ВИЧРЕПОЛ», взаимодей¬
ствуют с рекомбинантными антигенами ВИЧ, представленными на
иммуносорбентах коммерческих тест-систем, предназначенных для
выявления антител к ВИЧ.Анализ иммуногенности вакцины «ВИЧРЕПОЛ» с помощью
нммуноблотаСпецифическую активность сывороток мышей, иммунизирован¬
ных вакциной «ВИЧРЕПОЛ», изучали в иммуноблоте, как описано
4S2 Глава 10. Конъюгированные полимер-субъединичные вакцинывыше. Использовали нитроцеллюлозные стрипы из коммерческого
набора «New Lav Blot» («Bio-Rad»), на которые нанесены индивидуаль¬
ные белки культурального ВИЧ-1. Для определения мышиных анти¬
тел использовали конъюгат пероксидазы с антителами против IgG
мыши. Для идентификации специфических полос, соответствующих
белкам ВИЧ, использовали положительный контроль из набора «New
Lav Blot», в качестве отрицательного контроля использовали ВИЧ-
негативную сыворотку из набора «New Lav Blot» (в обоих этих случаях
для детекции использовали конъюгат пероксидазы с антителами про¬
тив IgG человека). Для постановки еще одного негативного контроля
стрип из набора «New Lav Blot» обрабатывали сывороткой неимму-
низированной мыши с использованием в качестве детектирующего
реагента конъюгата пероксидазы с антителами против IgG мыши.Сыворотки мышей, иммунизированных вакциной «ВИЧРЕПОЛ»,
распознавали белки культурального ВИЧ-1: gp41, р24, р55 (предшест¬
венника р24) в иммуноблоте, что указывает на сходство антигенных
детерминант входящего в вакцину рекомбинантного антигена гес(24—
41) с детерминантами соответствующих вирусных белков. Таким
образом, химерный белок гес(24—41) в составе вакцины обладает той
же специфичностью, что и вирусный прототип.Оценка активности вакцины «ВИЧРЕПОЛ» с помощью
нейтрализации ВИЧ-1 in vitroОценку нейтрализующей активности сывороток мышей, иммуни¬
зированных вакциной «ВИЧРЕПОЛ», проводили, как описано выше.
Сыворотки, полученные от мышей, иммунизированных каждой из
трех серий вакцины «ВИЧРЕПОЛ» (П 12 01, 12 12 01 и 13 12 01), раз¬
веденные 1:20, обеспечивали более чем 50%-ное угнетение накопле¬
ния вирусного р24 в культуре (индекс нейтрализации составил более
50%) [60, 205].Итак, доклинические испытания показали, что в ответ на введе¬
ние вакцины «ВИЧРЕПОЛ» у животных образуются высокие титры
антител как к белку гес(24—41), так и к его составляющим, причем
эти антитела специфически взаимодействуют с белками ВИЧ-1 в
иммуноблоте; вакцина индуцирует у животных образование вирус-
нейтрализующих антител и антигенспецифическую пролиферацию.
Специфическая активность вакцины доказана также с помощью
реакции с антителами, содержащимися в крови ВИЧ-инфицирован¬
ных лиц.
I10.1. Экспериментальные вакцины: от конъюгированных... 483Следовательно, вакцина «ВИЧ РЕПОЛ» вызывает у животных выра¬
женный гуморальный и лимфопролиферативный ответ. Вакцина
стерильна, апирогенна, нетоксична, хорошо переносится лаборатор¬
ными животными.Доклиническое испытание трех экспериментальных серий в ГИСК
показало воспроизводимость результатов всех проведенных тестов,
что свидетельствует о выполнении одного из важных требований к
медико-биологическим препаратам и вакцинам вообще и вакцинам
против ВИЧ в частности — воспроизводимости и стандартности пре¬
парата.Изучение субстанции вакцины «ВИЧРЕПОЛ» — химерного реком¬
бинантного белка гес(24—41) — показало, что указанный белок также
представляет собой стандартный воспроизводимый от серии к серии
препарат. Чистота и ] омогенность белка была подтверждена результа¬
тами аналитической хроматографии и электрофореза, теоретически
рассчитанная на основании аминокислотной последовательности
молекулярная масса белка была подтверждена с помощью электрофо¬
реза и масс-спектроскопии \22, 154].Таким образом, кандидатная вакцина против ВИЧ/СПИДа
«ВИЧРЕПОЛ» первой в России успешно прошла доклинические
исследования [22, 60].Это позволило перейти к подготовке клинических испытаний
вакцины.Клинические испытания вакцины «ВИЧРЕПОЛ»Для проведения 1 фазы клинических испытаний вакцины
«ВИЧРЕПОЛ» в соответствии со стандартами ССР (Качественная
клиническая практика) был разработан комплект документации,
включающий в себя Протокол клинических испытаний. Брошюру
исследователя, Информацию для добровольца, Форму информирован¬
ного согласия. Индивидуальную карту испытуемого. Документы были
одобрены ГИСК им. Л.А. Тарасевича и Комитетом по МИБП, после
чего переданы на экспертизу в Комитет по этике при Федеральном
органе контроля качества лекарственных средств. Документы успеш¬
но прошли экспертизу и были признаны соответствующими стандар¬
там ОСР. Федеральная служба по надзору в сфере здравоохранения и
социального развития Министерства здравоохранения и социального
развития Российской Федерации выдала Институту иммунологии
разрешение на проведение I фазы клинических испытаний.
484 Глава Ю> Конъюгированные полимер-субъединичные вакциныКлинические испытания вакцины «ВИЧРЕПОЛ» начались в 2005 г.
[42, 146, 641].Цель I фазы клинических испытаний — изучение безопасности и
реактогенности (выбор безопасной дозы), а также антигенной актив¬
ности вакцины «ВИЧРЕПОЛ». В задачи исследования входят:1) оценка безопасности и реактогенности различных доз вакцины
«ВИЧРЕПОЛ» у здоровых неинфицированных ВИЧ лиц с помо¬
щью комплекса клинических и лабораторно-инструментальных
методов для уточнения прививочной дозы;2) анализ антигенной активности (иммуногенности) вакцины
«ВИЧРЕПОЛ» по серологическим изменениям и лимфопроли-
феративиому ответу у вакцинированных,В испытаниях используется серия вакцины «ВИЧРЕПОЛ», предва¬
рительно проконтролированная в ГИСК им. Л.А. Тарасевича на соот¬
ветствие требованиям проекта ФСП. Стерильность, подлинность и
специфическая активность серии вакцины «ВИЧРЕПОЛ» подтверж¬
дены в доклинических испытаниях.Различные дозы вакцины «ВИЧРЕПОЛ» (от 2,5 до 50 мкг по белку)
проверяются на безопасность и реактогенность, а также антигенную
активность начиная с низких доз (2,5 мкг по белку). Каждая доза
испытывается на трех здоровых добровольцах, серонегативных по
антителам к ВИЧ. При отсутствии связанных с вакциной неблаго¬
приятных явлений в течение 72 ч после второй иммунизации можно
переходить к испытанию более высоких доз (5, 10, 25, 50 мкг по белку).
Схема иммунизации приведена в таблице 58 [146].Оценка безопасности и реактогенности различных доз вакцины
«ВИЧРЕПОЛ» у здоровых ВИЧ-неинфицированных лиц проводится с
помощью комплекса клинических и лабораторно-инструментальных
методов для уточнения прививочной дозы.Безопасная доза вакцины определяется на основании регистрации
неблагоприятных явлений и отклонений лабораторных показателей
от нормы. Участники испытаний находятся под наблюдением в тече¬
ние 1 ч после иммунизации для выявления немедленных местных
и системных реакций. Кроме того, участники испытаний получают
соответствующие инструкции относительно наблюдения за местны¬
ми и системными реакциями в течение 7 дней после иммунизации.
При сообщении о существенных симптомах участники должны быть
осмотрены врачом-исследователем. Проводится оценка стандартных
гематологических показателей, биохимических показателей и общий
анализ мочи.
10.1. Экспериментальные вакцины: от конъюгированных...485Таблица 58Схема иммунизации вакциной «ВИЧРЕПОЛ» на этане I фазы клиническихиспытанийГруппаЧислоиспытуе¬мыхМесяцыО12,5 мкг по
белку2,5 МК1 110
белку2,5 мкг по
белку2,5 мкг по
белку5 мкг по
белку5 мкг по
белку5 мкг по
белку5 мкг по
белку10 мкг побелку10 мкг по
белку10 мкг по
белку10 мкг по
белку25 мкг по
белку25 мкг по
белку25 мкг по
белку25 мкг по
белку50 мкг по
белку50 мкг по
белку50 мкг по
белку50 мкг по
белкуОпенка антигенной активности (иммуногенности) вакцины
«ВИЧРЕПОЛ» осуществляется по серологическим изменениям и
лимфопролиферативному ответу.В качестве показателей гуморального иммунного ответа опреде¬
ляются:• антитела, связывающиеся с белком гес(24-41), белком гес24 и
гес41 в ИФА;• антитела, связывающиеся с твердой фазой (планшетом с сорбиро¬
ванными антигенами ВИЧ) лицензирован ного в России теста для
определения антител к ВИЧ в ИФА;• антитела, связывающиеся с белками культурального ВИЧ-1 —
gp41, р24 и р55 (предшественником р24) в иммуноблоте;• нейтрализующие антитела против ВИЧ-1, культивируемого в
трансформированных клеточных линиях.Для оценки клеточного иммунного ответа определяются:• лимфопролиферативный ответ на белки гес(24-41), гес24 и гес41;• абсолютное количество С04- и С08-Т-лимфоцитов и соотноше¬
ние СВ4/С08;• продукция интерферона-у Т-клетками.Абсолютное количество С04- и С08-Т-лимфоцитов и соотноше¬
ние С04/С08 являются международно признанными стандартны¬
ми параметрами, которые отражают состояние иммунной системы
486 Глава 10. Конъюгированные полимер-субъединичные вакцинычеловека. Их определяют при лабораторном исследовании действия
ВИЧ-инфекции на иммунную систему. Следует, однако, отметить,
что значимые отклонения этих показателей от нормы наблюдаются
только на поздних стадиях ВИЧ-инфекции (СПИД). Определение
других субпопуляций лимфоцитов не является информативным
для оценки эффекта вакцины и в данном исследовании нецелесо¬
образно.Предварительная оценка безопасности и реактогенности выпол¬
няется после второй и третьей иммунизации. Предварительная оцен¬
ка антигенной активности (иммуногенности) выполняется после тре¬
тьей и четвертой иммунизации. Итоговый анализ проводится после
завершения исследования.К декабрю 2006 г. завершены испытания трех доз вакцины —- 2,5; 5 и
10 мкг по белку. После вакцинации не было отмечено отрицательных
изменений клинических или биохимических показателей крови и
мочи. Вакцина хорошо переносится и апирогенна, В месте введения
не зарегистрировано воспалительных реакций. Добровольцы также
сообшили о хорошей переносимости препарата. У части добровольцев
после второй иммунизации наблюдалось образование антител
против gp41 и р24 ВИЧ-1. В соответствии с протоколом испытаний
образцы крови этих лиц были проверены с помощью полимеразной
цепной реакции (ПЦР) на содержание генома ВИЧ. Результаты
этого теста оказались отрицательными. По завершении всего
цикла иммунизаций в соответствии с программой исследований
наблюдение за испытуемыми было продолжено. Было показано, что
титры антител со временем снизились. Следовательно, образование
антител у испытуемых стало результатом вакцинации препаратом
«ВИЧРЕПОЛ», а не заражением ВИЧ-1.Предварительные результаты испытаний позволяют сделать вывод
о безопасности и иммуногенности вакцины «ВИЧРЕПОЛ». В настоя¬
щее время начаты испытания следующих доз вакцины — 25 и 50 мкг
по белку.РАЗРАБОТКА ДНК-ВАКЦИНЫОптимизация нуклеотидной последовательности плазмиды
р(24—41) («гуманизация» плазмиды) |157]Следующей задачей является создание ДИК-вакцины для исполь¬
зования по схеме прайм-буст. Предполагается, что ДИК-вакцина
ÍO,L Экспериментальные вакцины: от конъюгированных... 487может быть использована как для профилактической, так и для тера¬
певтической вакцинации.В состав разрабатываемой ДНК-вакцины входит участок гена
gag, кодирующий внутренний белок ВИЧ-1 р24. Иммунизация
такой ДНК-вакциной может обеспечить индукцию цитотокси¬
ческих лимфоцитов (CTL) против консервативного белка р24,
что важно для получения препарата широкого спектра действия.
Однако на практике для того, чтобы сделать ДНК-вакцину имму¬
ногенной, необходимо обеспечить ее эффективную экспрессию.
Известно [603], что для экспрессии гена gag в клетках млекопита¬
ющих в состав ДНК-вектора должны входи гь также регуляторные
элементы ВИЧ-1, например Rev и RRE. Но даже в присутствии
Rev и RRE экспрессия гена gag в клетках мыши остается низ¬
кой. В эффективно экспрессируемых генах человека содержание
G/C-нуклеотидов превышает количество A/U-нуклеотидов [240].
Известно, что в нуклеотидной последовательности гена gag содер¬
жится повышенное количество A/U-нуклеотидов и дестабили¬
зирующих мРНК последовательностей (AUUUA и им подобные
мотивы). Повышенное содержание A/U-нуклеотидов (56%) в мРНК
человека приводит к ее нестабильности, увеличению числа обры¬
вов трансляции и низкому уровню экспрессии [425]. И наконец,
в геноме ВИЧ-1 содержатся неоптимальные кодоны аминокислот.
В связи с этим для эффективной экспрессии в клетках млекопи¬
тающих гена gag в составе ДНК-вакцин необходима модификация
(«гуманизация») плазмиды.Как указано выше, ранее авторами исследования на основе ком¬
мерческого вектора pDNA-3 была приготовлена плазмида р(24—41),
содержащая химерный ген, кодирующий полноразмерный белок р24
и иммунодоминантный эпитоп gp41.В этой плазмиде с целью повышения экспрессии белков ВИЧ-1
был осуществлен сайт-направленный мутагенез для удаления деста¬
билизирующих последовательностей (система GeneEditor, Promega,
США). Были также заменены наименее оптимальные кодоны.
Последовательности использованных олигонуклеотидов-мутагенов
приведены в таблице 59. Наличие нуклеотидных замен проверили
секвенированием ДНК. Для дальнейшего увеличения эффективности
трансляции была модифицирована 5’-концевая последовательность
гена с использованием консенсусной последовательности инициации
трансляции GCCACCATGG [425].
488Глава 10. Конъюгированные полимер-субъединичные вакциныПоследовательности олигонуклеотидов-мутагеновТа&шца 59ПоследовательностькДНКолигонуклеотида-мутагенаРасшифровкамутацииСАТТСТПТТСАТТАТСААОССТСООАССТСАТССССТОЗамена колоновСАААТОТТАААААСАСССАООАТСССТСАСОСАСЗамена кодоновОАААТТТАТААААОАТСаС СТССТСТОССАТССАТССУдаление Ш5СТАТТТААААОСАТГССОСОАССССАТСОАС САСССРабота по модификации плазмиды и созданию ДНК-вакцины про¬
должается.ЗАКЛЮЧЕНИЕВ целом разработана кандидатная вакцина против ВИЧ/СПИДа
«ВИЧРЕПОЛ». Вакцина представляет собой генно-инженерный
белок гес(24—41), копирующий аминокислотные последовательнос¬
ти фрагмента внутреннего белка р17, полноразмерного внутреннего
белка р24 и иммунореактивного фрагмента трансмембранного белка
ір41 ВИЧ-1, полученный рекомбинантным методом, выделенный из
трансформированного штамма кишечной палочки и высокоочищен-
ный с помощью аффинной и ионообменной хроматографии в виде
комплекса с водорастворимым высокомолекулярным иммуностиму¬
лятором К-оксидированным производным поли-1,4-этиленпипера-
зина (субстанцией полиоксидония).Рекомбинантный белок гес(24—41) представляет собой химерный
полипептид, содержащий аминокислотную последовательность кон¬
сервативного внутреннего белка р24 ВИЧ-1 и иммунореактивный
фрагмент трансмембранного белка ВИЧ1 — £р41. В связи с консерва¬
тивностью входящих в его состав антигенов ожидается, что он сможет
индуцировать антитела к ВИ4-1 широкого спектра действия.В опытах на животных белок гес(24—41) показал способность
индуцировать высокие титры специфических антител к ВИЧ-1 как
против целого химерного белка, так и против обеих частей (р24 и вр41)
(титры в ИФА более 64 тыс. и более 200 тыс. соответственно), вызывать
активную антигенспецифическую пролиферацию клеток селезенки и
лимфатических узлов (индексы пролиферации 10 и 6 соответственно).
Антитела к гес(24—41) и его конъюгату с полиоксидонием — вакцине
IO.L Экспериментальные вакцины: от конъюгированных... 489«ВИЧРЕПОЛ» — способны нейтрализовать ВИЧ в культуре ш vitro
(индекс нейтрализации составил 54,9% при разведении сыворотки
1:50). Показано, что при низких дозах антигена полиоксидоний уси¬
ливает гуморальный ответ, что позволяет снизить дозу антигена.Доклинические испытания показали иммуногенность, безопас¬
ность и стандартность препарата «ВИЧРЕПОЛ» и его субстанции —
белка гес(24—41).Создание безопасной, эффективной и доступной вакцины против
ВИЧ/СПИДа представляет собой очень сложную задачу. Важнейшая
роль в ее решении принадлежит клиническим испытаниям. В связи с
тем что отсутствует адекватная модель ВИЧ-инфекции на животных,
клинические испытания с участием добровольцев представляют собой
неоценимый источник информации. Формирование когорт доброволь¬
цев является наиболее важной, трудоемкой и дорогостоящей частью
клинических испытаний вакцины против ВИЧ/СПИДа. Именно поэто¬
му нами были разработаны подходы к формированию когорт доброволь¬
цев для клинических испытаний анти-ВИЧ/СП И Д-вакцин (Хаитов P.M.
и др. [44, 197J), накоплен опыт работы в этом направлении (Хаитов P.M.
и др. [43, 198]). Препарат «ВИЧРЕПОЛ» первой из отечественных канди¬
датных вакцин против ВИЧ/СПИДа был допущен к клиническим испы¬
таниям (Хаитов RM. и др. [199]), Целью 1 фазы клинических испытаний
было изучение безопасности и реактогенности (выбор безопасной дозы),
а также антигенной активности вакцины «ВИЧРЕПОЛ». К настоящему
времени завершены испытания трех доз вакцины (2,5; 5 и Ю мкг по
белку) и начаты испытания следующих доз — 25 и 50 мкг. Результаты
испытаний позволяют сделать вывод о безопасности и иммуногенности
вакцины «ВИЧРЕПОЛ». Клинические испытания продолжаются.На базе плазмиды р(24-41) начата разработка ДНК-вакци¬
ны. Проводится оптими;?ация нуклеотидной последовательности
плазмиды («гуманизация» плазмиды) для увеличения экспрессии в
клетках экспериментальных животных и человека.10.1,5. ВАКЦИНЫ ПРОТИВ РАКАРаковые (опухолеассоциированные) антигены, как известно, отно¬
сятся к числу неиммуногенных или слабоиммуногенных: организм
не способен обеспечить развитие эффективной иммунной реакции
против растущей опухоли. Однако опухолевые клетки — экспрессиру¬
490 Глава 10. Конъюгированные полимер-субъединичные вакциныющие специфические антигены — могут быть мишенями для антител
или сенсибилизированных киллерных клеток, если их индуцировать.
Поэтому не исключено, что комплексирование раковых антигенов с
синтетическими иммунопотенциаторами позволит создать вакцины
против некоторых форм рака.10.1.5.1. Опухолеассоциироваиные антигеныОсновой для постановки этой задачи служит то, что некоторые
опухолеассоциироваиные антигены уже выделены, получены в чистом
виде и используются для иммунодиагностики [1]. к их числу относятся,
в частности, АФП, ассоциированный с первичной карциномой печени,
карциноэмбриональный антиген, появляющийся при аденокарцино¬
мах кишечника, желудка, пищевода и поджелудочной железы, и др.Помимо иммунохимического изолирования этих антигенов, осу¬
ществлен синтез их фрагментов. Так, например, синтезирован [226]
пептид, воспроизводящий последовательность 11 аминокислотных
остатков КНг-концевого участка молекулы раково-эмбриопального
антигена (гликопротеида с ММ около 200 тыс. Д). Конъюгаты этого
пептида с полиаминокислотным носителем и с БСА индуцировали
синтез антипептидных антител, перекрестно реагирующих с интакт-
ной молекулой раково-эмбрионального антигена.Успехи в изучении антигенов опухолей характеризуются идентифика¬
цией значительного их количества. Исследованы и описаны опухолевые
антигены разных классов — белки, гликопротеины [769], гликолипиды,
углеводы [265]. Кроме раково-эмбриональных (онкофстальных), опре¬
делено большое количество ассоциированных антигенов других групп:
раково-тестикулярных, тканеспецифических дифферепцировочпых,
опухолеассоциированных специфических и других антигенов [16, 24,
70]. Кроме антигенов опухолей, определяемых на клеточной мембране,
идентифицированы молекулярные цитоплазматические структуры. При
этом охарактеризованы эпитопы многих антигенов, выделены пептидные
молекулы из антигенов опухолей разной локализации, определены пред¬
ставляющие их антигены главіюго комплекса гистосовместимости [18,
19, 24, 53, 664, 770]. Проводимый большой спектр работ по определению
клинической значимости выявляемых антигенов обеспечил применение
М1ЮГИХ из изученных антигенов в клинической практике с целью диа¬
гностики злокачественных новообразований и их прогнозирования [94].
Поскольку считается, что все опухолевые клетки содержат опухолеассо¬
W.L Экспериментальные вакцины: от конъюгированных... 491циированные антигены, ведутся поиски путей использования аутологич¬
ных опухолевых клеток в качестве источника опухолеассоциированных
антигенов для создания вакцин с целью вакцинотерапии больных с дис¬
семинированными солидными опухолями [17,87]. Накапливается и опыт
[фименения ксеногенной полиантигенной клеточной вакцины [66]. Для
усиления иммуногенности антигенов клеточных вакцин используются
адъюванты. В первом случае — BCG, во втором — ронколейкин.Таким образом, является очевидным, что в распоряжении иссле¬
дователей имеются опухолевые антигены, с помощью которых могут
быть сделаны попытки индукции противоопухолевого ответа. При
этом рассматриваются два основных приема вакцинации — превен¬
тивная, направленная на продукцию противоопухолевых антител с
целью профилактики образования опухолевого роста, и терапевти¬
ческая, обеспечивающая индукцию образования цитотоксических
Т-лимфоцитов, действующих на опухолевые клетки [769].Поскольку, как отмечалось выше, опухолеассоциироваиные антиге¬
ны являются слабыми иммуногенами, конструирование эффективных
вакцинирующих препаратов гребует разработки методов повышения
их активности. Малоиммуногенными являются и антигены, создава¬
емые с помощью генно-инженерных методов, а также антигены, полу¬
чаемые в результате применения метода обратной вакпинологии ~
«reverse vaccinology» (см. ниже). Именно поэтому проблема поиска и
создания новых эффективных и безопасных адъювантов чрсзвычаЙ1Ю
важна в вакцинологии. Малая иммуногенность получаемых антигенов
объясняется применением высоких технологий для их выделения и
очистки, вследствие чего антигены лишаются примесей, активирую¬
щих реакции врожденного иммунитета, в частности молекул РАМР.
Как отмечалось выше, базовой основой адаптивного иммунитета явля¬
ется врожденный иммунитет, в процессе развития которого антиген-
представляющие клегки (АПК) распознают антигены РАМР микробов,
эндоцитируют их, фрагментируют и представляют Т-клеткам для фор¬
мирования высокоспецифического ответа (см. главу 1).10.1,5.2. АдъювантыСо времени применения первых адъювантов в виде фосфата и гид¬
роокиси алюминия испытано и используется большое количество пре¬
паратов разных классов. Применяемые адъюванты, как правило, функ¬
ционируют по одному из характерных для них механизмов действия.
Так, например, гидроокись алюминия депонирует антиген в месте ее
492 Глава 19, Конъюгированные полимер-субъединичные вакцинывведения, индуцируя приток клеток иммунной системы к образован¬
ному воспалительному очагу. Адъюванты типа «масло-в-воде» также
депонируют антиген, но медленно его высвобождают и предохраняют
от быстрой элиминации. Это существенным образом пролонгирует
взаимодействие антигена с клетками иммунной системы в очаге воспа¬
ления. Адъюванты микробного происхождения или на базе цитокинов
обеспечивают эффективную доставку антигена непосредственно к
иммуноцитам, минуя формирование тяжелого воспалительного очага.
Выбор адъюванта с целью усиления иммуногенности опухолеассоци¬
ированных антигенов при конструировании противораковых вакцин
ЯВЛЯЄ! ся одним из важнейших этапов этого процесса.Нами проведена специальная работа по созданию универсального
иммуііостимулятора — синтетического полимера, отвечающеіо доста¬
точно жестким требованиям к фармакологическим препаратам, с целью
его возможного применения не только в качестве лечебного препарата,
но и использования в качестве одного из компонентов конструируе¬
мых вакцин. Помимо высокой иммуностимулирующей активности, от
других полиэлектролитов такой препарат должен отличаться безвред¬
ностью, способностью к деструкции и выведению из организма. При
создании препарата было важным также сохранить способность поли¬
мера к многоточечным кооперативным взаимодействиям, с которой и
связана иммуностимулирующая активность полиэлектролитов. В 1990 г.А.В. Некрасовым и соавт. был синтезирован биодеструктируемый поли¬
мер, отвечающий указанным выше требованиям. Это сополимер N-oкиcи
1,4-этиленпиперазина и (М-карбоксиэтил)-1,4-этилпиперазоний броми¬
да, впоследствии названный «Полиоксидоний» (ПО) (рис. 131).ПО запатентован с приоритетом 1990 г. [91]. Степень полимерности
ПО соответствует длине полимерной цепи, необходимой для осуществ¬
ления ключевого события — кластеризации белков в мембране клеток
системы иммунитета. Множество повторяющихся дипольных групп
N0 обеспечивает высокую способность к многоточечным кооператив¬
ным взаимодействиям. Карбоксиэтильные группы привносят допол¬
нительные адсорбционные свойства, а главное, служат универсальны¬
ми сайтами для химического присоединения к любому антигену.ПО подвергается в оріанизме деструкции биологическими сис¬
темами утилизации N-oкиceй третичных полиаминов. Окисление
третичных аминов через образование N-oкcидoв — основной путь
метаболизма азотистых соединений в живой природе. Изучены меха¬
низмы деструкции ПО, определены кинетические и термодинамиче-
Рис. 131. Структурное строение полиоксидонияские константы этого процесса. Установлено, что ПО деструктирует
вследствие разрывов N-С-связи, что характерно для алифатических
N-окисей. Детально изучена фармакокинетика ^Н- и ^'^С-меченного
ПО в организме экспериментальных животных. Показано, что ПО
эффективно выводится из организма, определены периоды полурас-
Пределения и пол у выведен ИЯ, время удержания, клиренс и другие
важные фармакокинетические показатели.Иммуностимулирующие свойства ПО сравнимы с таковыми свой¬
ствами рассмотренных выше полиэлектролитов. Под влиянием ПО
значительно активируются функции фагоцитов, повышается интен¬
сивное! ь антителообразования в ответ на чужеродные антигены.Ковалентное соединение ПО с белковыми или полисахаридными
антигенами приводит к усилению иммуногенности конъюгированных
антигенов. ПО в качестве носителя повышает иммуногенность и про-
тективные свойства антигенов, выделенных из возбудителей гриппа,
бруцеллеза, брюшного тифа, гепатита А, туберкулеза и других бактери¬
альных и вирусных инфекций (Петров Р.В., Хаитов RM., Некрасов A.B.
и др. [191, 488, 489, 678, 681]). Высокая эффективность полиоксидония
и безопасность его применения обусловили использование полиэлек¬
тролита при конструировании вакцин для применения в клинической
практике — аллерготропинов, вакцины против ВИЧ/СПИДа, против
гриппозной инфекции (см. разделы 10,1,3, 10.1.4, 10.2).Разрабатывая подходы к конструированию вакцин нового поко¬
ления, в том числе против вируса папилломы человека, ассоцииро¬
ванного с раком шейки матки, М.Р Хаитов использовал конъюгаты
вирусных пептидов с полиоксидонием [164]. Для этого этилпиперази-
пийбромидньте звенья полиэлекгролита превращали в реактивную,
азидную, форму и затем азидное производное вводили в реакцию
с пептидами. Степень конденсации контролировали по убыли сво-
494 Глава 10. Конъюгированные полимер-субъединичные вакциныбедного пептида из реакционной смеси путем ФЭЖХ. Конъюгаты
подвергали диализу и полученный диализат лиофильно высушивали.
Полученные конъюгаты проявляли высокие показатели иммуноген¬
ности, однако конъюгаты тех же самых пептидов с гемоциангином
фиссурелли (KLH) индуцировали наибольшие титры антител.Понимание значимости эффективности и безопасности иммуно¬
стимулирующего потенциатора для создания вакцинируюших препара¬
тов против непобежденных инфекций, включая раковые заболевания,
обусловило ведение широкого поиска адъювантов в ряду соединений
многих разных классов. Р.И. Атауллаханов и соавт. для конъюгации с
антигенами разного происхождения применили выделенный из расте¬
ний иммуностимулирующий препарат «Иммуномакс» (водораствори¬
мый кислый псптидогликан с молекулярной массой 1200—40 ООО кД).
Иммуногенность конъюгированных с пептидогликаном белков воз¬
росла примерно в 10 раз [14]. В качестве модификаторов иммунного
ответа в виде составных компонентов вакцин, в частности ДИК-вак-
цин, используют цитокины — ИНФ, ИЛ-2, ИЛ-4, ИЛ-12, ГМ-КСФ и др.
Эффективным оказалось также использование плазмиды, кодирующей
продукцию отдельных цитокинов (ИЛ-2, И Л-12 или ИНФа) [70], или
усиление иммуногенности опухолевых клеток путем их генной моди¬
фикации — трансфекции в опухолевые клетки генов цитокинов [66].
в качестве адъювантов используются также CpG-олигонуклеотиды
бактериальной ДНК, флагеллины, гемоцианин, липид А (MPL) в виде
очищенного производного ЛПС, мурамилдипептиды, белки теплового
шока, липотейхоевые кислоты и др. Для усиления иммуногенности
вакцин используется адъювант AS02A, представляющий собой водно¬
масляную эмульсию с монофосфорил-липидом А и производным
сапонина QS21 (Хаитов P.M. и др. [199]). С целью профилактики рака
шейки матки использовалась вакцина против вируса папилломы чело¬
века типов 16 и 18 с адъювантом AS04, содержащим смесь гидроокиси
алюминия и монофосфорил-липида А [72]. В поиске эффективных и
нетоксичных адъювантов все большее внимание уделяется структу¬
рам, в частности микробного происхождения, являющимся лигандами
для молекул РАМР, в частности для ТоП-подобных рецепторов (TLR)
эффекторов врожденного иммунитета, определяющих эффективность
индуцируемых реакций адаптивного иммунитета.В нашем отделе был конъюгирован очищенный АФП человека с гете-
роцепным иммуностимулирующим полиэлектролитом класса полибе¬
таинов (ПА), достоинством которого является отсутствие токсичности
ÍO.l. Экспериментальные вакцины: от конъюгированных...495И способность к выведению и биодеструкции в организме (Петров Р.В.
и др. [119]), [31]. При исследовании кинетики антителообразования у
мышей было показано, что при первичном введении конъюгат АФП-ПА
(без адъюванта Фрейнда) вызывает примерно в 100 раз более интенсив¬
ное образование специфических антител против АФП по сравнению с
чистым неконъюгированным антигеном (рис. 132). ПА в простой смеси с
АФП обладает не столь выраженной иммуноадъювантной активностью.Таким образом, с помощью соединения слабоиммуногенных моле¬
кул с нетоксичными иммуностимуляторами — полиэлектролитами,
видимо, можно получать конъюгированные антигены, вызывающие
выраженный иммунный ответ на опухолевые антигены, и на их осно¬
ве конструировать противораковые вакцины.Важность начальных этапов врожденного иммунитета (поглощение
антигена, его переваривание, комплексирование пептидов фрагмен¬
тированного антигена с антигенами главного комплекса гистосовмес¬
тимости, представление комплекса антигенраспознающим клеткам и
др.) в индукции адаптивного иммунитета определяет задачу не только
поиска эффективного и безопасного носителя для выделяемых опухо-
леассоциированных антигенов, но и создания средств доставки антиге¬
нов и генно-инженерных продуктов антигенпредставляющим клеткам.Время, сутРис. 132. Иммунный ответ против АФП, конъюгированного с полиионом (ПИ):
1—3 — антителообразование при иммунизации мышей раствором чистого АФП (1),
смесью АФП и ПИ (2), конъюгатом АФП и ПИ (3). Доза по белку — 50 мкг, доза
полимера — 300мкг. По оси абсцисс — время после иммунизации. По оси ординат —
количество специфичных анти-ЛФП-антител (~1о$2 титра)
496 Глава 10. Конъюгированные полимер-субъединичные вакциныТакая задача решается с использованием специальных конструкций,
включающих виросомы, липосомы, комплексы 18С0М и др.18С0М представляет собой комплекс, состоящий из жировых
частиц, образованных холестерином, с включенными в него произ¬
водными сапонина и антигенами клеточных мембран. Другая адъю¬
вантная структура представляет собой вирусную оболочку, несущую
функциональные особенности вирусной частицы, но которая лишена,
например, нуклеиновой кислоты и нуклсокапсида. Такие комплексы
характеризуются перспективностью разработки различного рода вак¬
цин, включая противораковые, в том числе против опухолей, ассо¬
циированных с вирусной инфекцией. Комплексы Т8СОМ, например,
используются при разработке вакцины против опухоли яичек или
против индуцированного вирусом папилломы человека рака шейки
матки. По-видимому, для целей адресной доставки опухолеассоци-
крованных антигенов и различных создаваемых генно-инженерных
продуктов могут использоваться и другрю приемы и реагенты, раз¬
работанные для целевой фармакотерапии новообразований (Петров
Р.В., Северин Е.С. и др. [10, 112, 125, 147, 159]) [5, 748].10.1.5.3. Противоопухолевые вакциныУспехи в развитии молекулярно-генетической и клеточной имму¬
нологии оказали заметное стимулирующее действие на проведение
работ, направленных на создание вакцинирующих препаратов профи¬
лактической и терапевтической значимости против ряда заболеваний,
опасных для человеческой жизни и не поддающихся методам принятой
профилактики и терапии. Одно из них связано с образованием опухо¬
лей, спонтанным или индуцированным вирусной или бактериальной
инфекцией, При этом особое внимание уделяется терапии с помощью
противораковых вакцин метастазирующих опухолей [6201.Проблемы вакцинотерапии спонтанных опухолей решаются в течение
ряда лет, однако сущестенные достижения в этом направлении отсутс¬
твуют, Одно из существующих мнений предполагает неэффективность
создаваемых вакцин против таких опухолей вследствие регистрируемого
подавления растворимыми продуктами опухоли функций клеток иммун¬
ной системы опухоленосителя и формирования периферической толеран¬
тности к опухолеассоциированным антигенам [291]. Однако в последние
годы накапливаются данные, кторые могут быть полезными в разработ¬
ке этой проблемы. Одни из них демонстрируют создание в результате
химического синтеза лекарственных препаратов, восстанавливающих
ÎO.L Экспериментальные вакцины: от конъюгированных... 497активность иммуноцитов, в частности Т-клеток, подавленную в организ¬
ме опухоленосителя. Примером этих препаратов служат миелопептиды
костномозгового происхождения. Один из них — это миелопептид-2 и
разработанный на его осіюве лекарственный препарат «Бивален» с про¬
тивоопухолевой активностью. Другие созданные препараты активируют
функции антигенпредставляющих клеток. Так, например, миелопептид-3
и синтезированный на его основе лекарственный препарат «Серамил»
стимулируют функции фагоцитов — эндоцитоз, антигенпредставляю-
щую и цитотоксическую активность (Петров Р.В., Михайлова А.А. и др.
[85, 86,110]). Сходное действие на макрофаги оказывают и другие лекарс¬
твенные средства — «Ликопид» (полусинтетическое производное мура-
милдипептидов), указанный выше синтетический полиэлектролит —
«Полиоксидоний» и др. (Хаитов P.M., Пинегин Б.В. [193]). Наконец, важію
отметить существенное усиление иммуногенности антигенов различ¬
ной природы, включая опухолеассоциироваиные, под влиянием опи¬
санных выше полиэлектролитов или адъювантов. Мы демонстрировали
выше значимость конъюгации антигенов и отдельных их эпитопов с
иммуностимулирующими молекулами для повышения эффективности
конструируемых вакцинирующих препаратов. Целесообразность включе¬
ния в создаваемые противоопухолевые вакцины иммуностимулирующих
средств новой направленности может оказаться высоко значимой.Значительно большей эффективностью характеризуется созда¬
ние вакцин против новообразований, индуцируемых инфектами
вирусной или бактериальной природы. К таким новообразованиям
относят назофарингиальный рак и лимфому Беркитта, индуцируе¬
мые вирусом Эпштейна-Барр; саркому Капоши, ассоциированную с
вирусом простого герпеса; первичную гепатокарциному, обусловлен¬
ную инфицированием вирусами гепатита В или С, или Т-клеточный
лейкоз взрослых — Т-лимфотропным вирусом типов 1 и П; аденокар¬
циному и лимфому желудка, связанные с инфекцией Н. pylori', В-кле-
точную лимфому, развивающуюся ири инфицировании ВИ4-1, или
злокачественные опухоли полового тракта и плоскоклеточный рак,
ассоциированные с вирусом папилломы, и др.При разработке проблемы папилломавирусной инфекции и возмож¬
ности ее специфической профилактики было установлено, что вирус
папилломы человека является этиологическим агеїітом в 100% случаев
рака шейки матки, 90% анального рака, 70% рака наружных половых
органов у женшин (вульвы, влагалища), 40% рака полового члена у
мужчин, 12% рака ротовой полости и гортани и 3% изолированного
498 Глава 10. Конъюгированные полимер-субъединичные вакцинырака ротовой полости. Из более чем 100 известных типов вируса папил¬
ломы человека 13 типов оказались генотипами высокого онкогенного
риска, наиболее часто встречающимися генотипами вируса являются
16 и 18. Наиболее распространенными генотипами вируса невысокого
риска являются 6 и 9. Доказано, что рак шейки матки сокращает про¬
должительность жизни примерно на 24 года (Намазова-Баранова Л.С.,
Хаитов М.Р., 2009). С целью создания вакцины для профилактики рака
шейки матки использовали полученные генно-инженерным способом
наиболее иммуногенные белки вирусов типов 16 и 18. В использо¬
ванных системах такие белки на основе самосборки превращаются в
«вирусоподобные частицы» (VLP, от — Virus-like particles). Они не содер¬
жат вирусной ДНК, являются неинфекционными и неонкогенными
[430, 5111. Показано, что двухвалентная вакцина против типов 16 и 18
вируса способна профилактировать 70,7% случаев заболевания. Более
эффективной была тетравалентная вакцина против типов 16,18, 31 и 45
(профилактика около 80% заболеваний раком). Включение в вакцину
вирусных белков большего числа типов вируса существенного прироста
эффективности вакцины не обеспечивает [72].К настоящему времени клиническое применение нашли квадри-
валентная вакцина «Гардасил» (MSD) против вируса папилломы чело¬
века типов 6, 11, 16 и 18 и двухвалентная вакцина «Церварикс» (GSK.)
против вируса папилломы человека типов 16 и 18.Существенным вкладом в борьбу с папилломавирусной инфекци¬
ей и в разработку базовых принципов создания новых эффективных
и безвредных вакцин для профилактики и терапии рака шейки матки
являются недавние исследования, проведенные М.Р. Хаитовым в
ГНЦ «Институте иммунологии ФМБА России» [164J. В процессе экс¬
периментальных исследований автором получены рекомбинантные
молекулы вируса папилломы человека серотипов 16 и 18, выделены,
охарактеризованы и определены иммуногенные свойства ряда белков,
идентифицированы иммунодоминантные эпитопы белков L1 и Е7
этого вируса. Как известно, эти белки являются консервативными,
белок Е7 относится к наиболее важным с точки зрения онкогенных
потенций вируса, L1 представляет собой основной поздний капсид-
ный белок [63]. Синтезированы также, очищены и отобраны пептиды,
имитирующие иммунодоминантные эпитопы выделенных белков,
в опытах на мышах отобранные пептиды в сочетании с адъювантами
(полиоксидоний, мурапилдипептид, гемоцианин фиссурелли) прояв¬
ляли способность индуцировать продукцию специфических антител
ÎO.l. Экспериментальные вакцины: от конъюгированных... 499и формирование антигенспецифических Т-клеток. Полученные све¬
дения явились значимой базой для ведущихся разработок комбиниро¬
ванной вакцины против вируса папилломы человека серотипов 16, 18
и 31 с использованием рекомбинантного белка L1 указанных сероти¬
пов, синтетических пептидов белков L1 и Е7 и встроенного в вакцину
иммуномодулятора стимулирующего типа [118].Другое направление конструирования вакцины против вируса папил¬
ломы человека — это создание ДНК-вакцины, включающей неспособ¬
ную к репликации ДНК, но содержащую целевой ген и регуляторные
элементы, необходимые для его экспрессии. Важной особенностью
ДНК-вакцины является содержание CpG-олигонуклеотидов бактери¬
альной нуклеиновой кислоты, т.е. структуры, распознаваемой эффек¬
торами врожденного иммунитета, значимыми для формирования адап¬
тивного иммунитета. Такая вакцина находится в стадии разработок.Привлекательность такой вакцины заключается и в том, что ее при¬
менение сопровождается развитием ТЫ-ответа, тогда как при обычной
вакцинации развивается ответ клеток Th2, По сути дела ДНК-вак¬
цины представляют собой пример «обратной вакцинологии» (Reverse
vaccinology), т.е. создание вакцины обеспечивается на восходящем
(от генома к его продуктам), но не на нисходящем (от целого микроба
к его составляющим) пути. Знание нуклеотидной последовательности
ДНК микроба и транскрипционной активности его генов ~ сущест¬
венный этап в разработке эффективного вакцинного препарата.Перспективный прием создания противораковых вакцин заключается
в разработке дендритных вакцин [372]. Для этих целей применяют раз¬
личные методы — слияние опухолевых и дендритных клеток, обработку
дендритных клеток опухолеассоциированными антигенами или мРНК.
При этом все большее применение находит методология использования
препаратов, стимулирующих созревание этих клеток, наряду с их обра¬
боткой опухолевыми антигенами (пептиды, белки, РНК опухолей и др.)
или в процессе слияния, например с клетками миеломы. Это объясняется
тем, что незрелые дендритные клетки обладают способ^ьюстью эндоцити-
ровать антиген и удерживать его молекулы, но их антигенпредставляю-
щая способность невелика. Зрелые дендритные клетки, наоборот, обла¬
дают способностью представлять пептиды фрагментированного антигена
Т-лимфоцитам, однако их способность захватывать и переваривать анти¬
ген снижается [238, 375]. Характерным примером современных подходов к
созданию такого рола противораковых вакцин может служить работа [429].
Была получена гибридома DC/J558cd40i ^ результате слияния дендритных
500 Глава 10. Конъюгированные полимер-субъединичные вакциныклеток (DC) и модифицированных клеток миеломы, экспрессирующих
лиганд CD40L—J558eD40L- Как известно, рецептор CD40R для лиганда
CD40L относится к семейству фактора некроза опухоли, экспрессируется
на антигенпредставляющих клетках, включая дендритные. Более того,
взаимодействие CD40R—CD40L способствует созреванию дендритных кле¬
ток, индуцирует образование цитокинов, способствующих образованию
Thl, и стимултфует взаимодействие костимулирующих молекул В7-1 и
молекул межклеточной адгезии (1САМ-1), обеспечивающее запуск ответа
цитотоксических Т-клеток фенотипа CD8. Проведенный анализ показал,
что противоопухолевая вакцина на основе гибридных клеток DC/J558cD4m.
по сравнению с гибридными клетками DC/J558 более эффективно инду¬
цировала образование цитотоксических Т-лимфоцитов и оказывала более
выраженный протективный ответ против опухолевых клеток J558. При
исгюльзовании созданной экспериментальной вакцины противоопухоле¬
вый иммунный ответ преимущественно опосредовался Т-лимфоцитами
фенотипов CD4 и CD8, но не естественными киллерами.Наряду с этим рассматривается и возможность применения зрелых
дендритных клеток в связи с их меньшей способностью по сравнению с
незрелыми дедритными клетками индуцировать состояние толерант¬
ности к опухолеассоциированным антигенам [523]. Поскольку анти-
генпредставляющими, помимо дендритных клеток, являются макро¬
фаги и В-лимфоциты, представление антигена может осуществляться и
этими клетками. Однако в настоящее время эти подходы рассматрива¬
ются скорее с фундаментальной точки зрения, нежели с практической.Создаются противоопухолевые вакцины на основе белков тепло¬
вого шока Î94, 620], показана возможность вакцины против гепатита В
предупреждать формирование гепатокарциномы. Считается, что при¬
менение вакцин против вируса папилломы человека или против
вируса гепатита В является эффективным приемом защиты особи от
ассоциированных опухолей [565, 877].Одним из важнейших направлений в иммунотерапии опухолей явля¬
ется разработка вакцин против гематологических злокачественных
новообразований. Для решения этой проблемы ведутся поиски под¬
ходов для конструирования пептидных и ДНК-вакцин, адаптивной
иммунотерапии с помощью Т-лимфоцитов (Heslop Н.Е., Stevenson F.K.,
Moldrem J.J., 2003). Как и во многих других областях создания про¬
тивораковых вакцин, в этом направлении получены впечатляющие
результаты, однако в подавляющем числе случаев они характеризуют¬
ся фундаментальной направленностью.
10.2. Вакцина «Гриппол» 501В связи с высокой степенью перспективности конструирования
полимер-субъединичных конъюгированных вакцин с применением
синтетических полиэлектролитов и принципиальной возможностью
применения таких подходов для создания противоопухолевых вакцин
существенную значимость для решения этой задачи приобретают про¬
блемы выделения специфических опухолевых антигенов и синтеза их
фрагментов, выявления микробов онкогспного риска, ассоциирован¬
ных с опухолями различной локализации и выделения их фрагментов,
наиболее эффективно формирующих протективные реакции гумо¬
рального и (или) клеточного типов, дальнейший поиск эффективных
и безопасных носителей для опухолевых или микробных фрагментов,
обеспечивающих повышение их иммуногенной активности.10.2. ВАКЦИНА «ГРИППОЛ»Создание вакцины «Гриппол» коллективом авторов (Петров Р.В.,
Кабанов В.А., Хаитов P.M., Некрасов A.B., Пучкова Н.Г., Иванова A.C.,
Атауллаханов Р.И.) фактически явилось завершающи м этапом многолет¬
них исследований, направленных на осмысливание молекул ярно-гене¬
тических основ функционирования системы иммунитета, формули¬
рования теоретически обоснованных подходов к созданию безопасных
вакцин нового поколения с повышенными иммунизирующими свойс¬
твами и иммунобиотехнологических задач, обеспечивающих реше¬
ние этой проблемы, экспериментальную проверку принятых решений.
Обоснование проблемы фенотипической коррекции генного контроля
иммунитета и ее экспериментальное peineiine явились базовой основой
для конструирования такой вакцины, состоящей, по нашим представ¬
лениям, из выделенных и очищенных протективных эпитопов патогена
актуальных штаммов, конъюгированных с иммуностимулирующими
молекулами синтетического полиэлектролита. Как отмечалось в преды¬
дущих разделах этой книги, конъюгирование антигенов разного проис¬
хождения с такими иммуностимулирующими молекулами приводило к
наибольшей иммуногенности используемых антигенных детерминант.
В качестве патогена было решено использовать вирус гриппа.Один из первых этапов, непосредственно связанных с созданием про¬
тивогриппозной вакцины, датируется 1984 г. Были проведены первые экс¬
перименты с поверхностными антигенами, выделенными из вируса грип¬
502 Глава 10. Конъюгированные полимер-субъединичные вакциныпа человеческого происхождения. До этого периода времени создавались
предпосылки для создания конъюгатов разных антигенов, в том числе
микробных, с полиэлектролитами и конструирования на их основе экс-
периме*1тальных вакцин. Было показано, что мыши, вакцинированные
конъюгатом нейраминидазы и гемагглютинина вируса ipnnna с полииона¬
ми, проявляли полную невосприимчивость к патогенному варианту виру¬
са, тог да как среди животных, иммунизированных неконъюгированными
антигенами, выживаемость составляла всего лишь 11—14% (см. рис. 88).
Эти модельные варианты вакцины были крайне важными, они позволили
перейти к созданию вакцршы, пригодной для введения человеку. Однако
даш этого был необходим полиэлектролитный носитель с рядом заданных
свойств, обеспечивающий существенное увеличение иммуногенности
григшозных антигенов. Помимо выраженной иммуностимулирующей
активности, носитель не должен характеризоваться токсическими свойс¬
твами и быть безвредным (не вызывать побочных нежелательных явле¬
ний), биодеградируемым в организме, неспособным изменять специфич¬
ность антигена в результате конъюгации и специфичность конъюгата при
взаимодействии с иммунокомпетентными клетками, экспрессирующими
антигенраспознающие рецепторы для используемого антигена. Такой
носитель был синтезирован в Институте иммунологии (ныне ГНЦ —
Институт иммунологии Федерального медико-биолопггеского агентс¬
тва) A.B. Некрасовым, назван «Полиоксидонием» и запатентован в 1990 г.
(см. раздел 10.1.5.2 «Адъюванты») [91].Испытание «Полиоксидония» в различных модельных системах
продемонстрировало его высокую иммуномодулируюшую активность.
«Полиоксидоний» в широком диапазоне доз активирует дендритные
клетки и макрофаги, гуморальный иммунный ответ, в том числе у особей
с врожденной аплазией тимуса (мыши nude) или у В-мышей с тяжелым
Т-иммунодефицитом, стимулирует синтез провоспалительных цитоки¬
нов, обладает антиинфекционной и противоопухолевой активностью,
мембраностабилизирующим действием. Препарат характеризуе тся высо¬
кой детоксицирующей способностью в отношении многих токсических
соединений, в том числе фармакологических препаратов, а также спо¬
собностью выводить их из организма. Аналоги «Полиоксидония» в мире
отсутствуют (Петров Р.В., Хаитов Р.М и др. [81, 130, 131, 195]).На основании результатов проведенных испытаний «Полиок¬
сидоний» был зарегистрирован Минздравом России (1966) в качестве
лекарственного средства и разрешен для медицинского применения
и промышленного выпуска. Было разрешено также использование
iO.2, Вакцина «Гриппол» 503«Полиоксидония» в качестве встроенного иммуномодулятора в соста-
ве вакцинных препаратов.Благодаря уникальным свойствам иммуномодулятора, его деток¬
сицирующей и антиоксидантной активности «Полиоксидоний» как
медицинский препарат нашел широкое применение в различных
областях практической медицины. Он нормализует как гипо-, так и
гиперфункции иммунной системы [139], применяется при леченирт
аллергий и аутоиммунных патологий (Петров Р.В., Хаитов P.M. и др.
[132, 141J), для коррекции иммунодефицитных состояний (Петров Р.В.
и др. 129]), эффективен у детей и лиц пожилого возраста [82, 140]. При
этом препарат не оказывает влияния на иммунологические показате¬
ли, находящиеся в пределах физиологической нормы и нормализует
исходно измененные. Важной особенностью «Полиоксидония» явля¬
ется его способность стимулировать продукцию всех классов протек¬
тивных антител кроме иммуноглобулинов класса Е (IgE).Благодаря жесткости полимерной цепи полиоксидония сущест¬
венно увеличивается стабильность молекул антигена, пролонгиро¬
ван ность их действия, многоточечность связывания с соответствую¬
щими мишенями. Наглядным примером является иммобилизация
на «Полиоксидонии» широко применяемого в медицине фермен¬
та гиалуронидазы (лидазы). Ковалентное связывание фермента с
«Полиоксидонием» в сотни раз повысило его устойчивость к денату¬
рирующим и ингибирующим воздействиям и позволило впервые
получить инъекционный препарат «Лонгидазу» для лечения соеди¬
нительной ткани [92]. Аналогичные эффекты регистрируются при
конъюгации с полиоксидонием протективных антигенов различных
патогенов, включая вирус гриппа (Petrov R.V. et al. [674]). Все вместе
взятое определило выбор «Полиоксидония» в качестве носителя для
молекул антигена при создании вакцин медицинского назначения.Первой вакциной, созданной на основе сформулированного,
теоретически обоснованного и экспериментально подтвержденно¬
го принципа создания конъюгированных полимер-субъединичных
иммуногенов и вакцин путем присоединения антигенов к полиэлек¬
тролитным иммуностимуляторам, была противогриппозная вакцина
«Грипгюл». В процессе ее создания была разработана технология
выделения главных, локализованных на мембране, субъединиц виру¬
са гриппа — гемагглютинина и нейраминидазы из расщепленного с
помощью детергента вируса, которая позволила получить высоко-
очищенный, специфически активный гемагглютинин, пригодный
504 Глава 10. Конъюгированные полимер-субъединичные вакциныдля дальнейшей работы по созданию вакцинирующего препарата на
основе его конъюгатов с полиоксидонием. Большой этап работы был
посвящен разработке методик синтеза, изучению влияния хими¬
ческой структуры и свойств носителя, условий синтеза конъюгатов,
количества и характера связей, состава конъюгата на иммунобиологи¬
ческие характеристики получаемых искусственных иммуногенов.Принципиально важным было рассматривать белковый антиген
как макромолскулярный компонент реакции, для чего было необхо¬
димо исследовать его презентацию, т.е, структурно-морфологическую
доступность, степень очистки, повышение его конформационной
стабильности, сохранение его нативной структуры и специфической
активности.В результате проведенной разработки методов получения, выделе¬
ния и анализа конъюгатов белковых антигенов с «Полиоксидонием»
наш коллектив определил оптимальные условия синтеза, разработал
методы анализа состава конъюгатов, включая ряд оригинальных
информативных методик (электрофорез в ПААГ, электронная микро¬
скопия, методы кругового дихроизма и флуоресцентной спектроско¬
пии), что позволило доказать факт ковалентного связывания белка с
носителем и количественно оценить степень связывания, качественно
определить локализацию связи и, что достаточно важно, — подтвер¬
дить конформационную стабильность белка в составе конъюгата.Выполненные работы определили состав вакцины. Как уже отме¬
чалось, она включает выделенные и очищенные поверхностные
протективные белковые антигены в виде субъединиц гемагглюти¬
нина и нейраминидазы каждого их трех актуальных эпидемиче¬
ских штаммов вируса гриппа типов А и В, ежегодно рекомендуемых
ВОЗ, соединенных с высокомолекулярным носителем — иммуно¬
адъювантом «Полиоксидонием». Благодаря уникальным свойствам
«Полиоксидония» вакцина «Гриппол» по сравнению с другими извест¬
ны ми противогриппозными вакцинами, содержит в прививочной
дозе (0,5 мл) в 3 раза меньше гемагглютинина — 5 мкг по сравне¬
нию с 15 мкг, содержащимися в обычных субъединичных вакцинах
(в сумме 15 и 45 мкг соответственно) при сравнимой эффективности.
Количество полиоксидония в прививочной дозе вакцины — 500 мкг.Изучение безопасности вакцины «Гриппол» у здоровых лиц и у
детей и взрослых с разными патологическими состояниями, в том
числе с сахарным диабетом или аллергиями, установило, что регис¬
трируемая иммуноадъювантность не определяется поликлональным
ÍO.2. Вакцина «Гриппол» 505действием вакцины. Вакцинация не оказывает негативного дей¬
ствия на исходные иммунологические показатели, не увеличивает
спектр и содержание аутоантител, не индуцирует синтез антител
класса IgE. Наоборот, вакцинация таких лиц приводит к увеличению
периода ремиссии основного заболевания, снижению количества
обострений и случаев госпитализаций, уменьшению заболеваемости
другими ОРВИ в 2 раза и более. Защитные титры антител к вакцин¬
ным штаммам уже определялись спустя 10—12 дней и сохранялись в
течение года. Продолжительность иммунитета наблюдалась также
у такого контингента, как пожилые и долгожители [28, 51, 68, 100,
148]. Различные испытания, и основные из них — Государственные
клинические [52, 133], доказали эффективность и безопасность вак¬
цины. В 1996 г. вакцина «Гриппол» зарегистрирована Минздравом
России и разрешена к медицинскому применению и промышленно¬
му выпуску. С 1997 г. промышленный выпуск вакцины «Гриппол»
по лицензионным соглашениям с Группой Компаний «Петровакс»
осуществляется Уфимским НПО «Иммунопрепарат» (в настоящее
время — филиал НПО «Микроген»), с 2009 г. также СПбНИИВС
ФМБА России. В 1998 г. вакцина «Гриппол» награждена меда¬
лью ВВЦ и дипломом 1 степени, а также медалью Международной
выставки «Инновации-99. Технологии живых систем». С 1999 г. вакци¬
на «Гриппол» включена в перечень вакцин для обязательной вакци-
нопрофилактики, с 2006 г. — в Национальный календарь профилак¬
тических прививок. Авторский коллектив проекта «Конъюгированные
полимер-субъединичные иммуногены и вакцины», включающего
в том числе создание вакцины «Гриппол», в составе Р.П. Петрова,В.А. Кабанова, P.M. Хаитова, A.B. Некрасова и Р,И. Атауллаханова
удостоен Государственной премии Российской Федерации в области
науки и техники за 2002 г.В целом вакцина «Гриппол» характеризуется выраженной имму¬
ногенной активностью, высоким уровнем безопасности и профилак¬
тической эффективности. Вакцина применяется у людей без огра¬
ничения возраста начиная с первых 6 месяцев жизни. Хроническая
соматическая патология у детей или аллергозаболевания детей и
взрослых не являются препятствием для вакцинации препаратом
«Гриппол».Усовершенствованными аналогами вакцины «Гриппол» являются
вакцины «Гриппол плюс» и «Гриппол Нео». Клинические испытания
и опыт применения вакцин продемонстрировали их эффективность
506 Глава 10. Конъюгированные полимер-субъединичные вакциныи полную безвредность, сравнимые с исходной вакциной «Гриппол».
Вакцины «Гриппол плюс» и «Гриппол Нео» не содержат консерванта,
изготовляются или изготавливаются в шприц-дозе в современной
удобной и стерильной упаковке со специальной атравматической
иглой для безболезненной вакцинации. Вакцины производятся на
современном предприятии в Московской области по стандартам
ОМР, в помещениях с барьерной технологией (ограниченный доступ
к продукту, автоматизированные линии розлива и упаковки, конт¬
роль качества на всех стадиях производства). Производство вакцины
«Гриппол Нео» не отличается от производства вакцины «Гриппол
плюс» за исключением того, что выращивание вируса для вакцины
«Гриппол Нео» осуществляется не на куриных эмбрионах, а в биоре¬
акторах на клеточных культурах в бессывороточной среде. С 2009 г.
вакцина «Гриппол Нео» зарегистрирована и разрешена к применению
в Российской Федерации.Отличительной характеристикой вакцины «Гриппол Нео» явля¬
ется получение антигенов путем выращивания вируса гриппа не на
куриных эмбрионах, а на культуре клеток МОСК. Данный субстрат
хорошо изучен, «клеточная» технология выращивания вакцинного
вируса соответствует всем международным требованиям безопас¬
ности, делает процесс производства закрытым, контролируемым,
независимым от внешних источников и в настоящее время широко
используется ведущими производителями вакцин. Новая технология
выращивания вируса позволяет производить еще более безопасную
вакцину, поскольку культура клеток не контаминирована никакими
другими микроорганизмами. Отказ от использования в качестве суб¬
страта куриных эмбрионов позволил полностью исключить из соста¬
ва готового продукта следы антибиотиков (добавляются к куриным
эмбрионам для предотвращения роста других микроорганизмов при
выращивании вируса гриппа). Благодаря новой технологии впервые
в России стала возможной вакцинация новых контингентов — лиц,
страдающих аллергией на белок куриного яйца.«Гриппол плюс» и «Гриппол Нео» применяются для вакцинации
детей с Зх лет, подростков и взрослых без ограничения возраста. В
настоящее время проводятся клинические исследования с целью сни¬
жения возраста применения.С 2009 г. вакцина «Гриппол плюс» применяется в рамках нацио¬
нального проекта «Здоровье» для иммунизации детей.
Глава 11НАНОБИОТЕХНОЛОГИЯ, НАНОВАКЦИНЫ,
НАНОАНТИТЕЛАДостижения генетики, цитологии, иммунологии и молекулярной
биологии XX в. явились базисом необычайных успехов биотехнологии,
выразившихся в птироком промышлеином внедрении культивирова¬
ния клеток микроорганизмов, растений и животных с нормальным
или модифицирован! 1ы м в желаемом направлении геномом. Сочетание
клеточного культивирования и генетической инженерии обеспечило
образование рынка новых диагностических, вакципируюпщх, лекар¬
ственных, пищевых и иных продуктов, включая энергетические, изме¬
ряемых на сегодняшний день триллионами американских долларов.
В свою очередь биотехнология обеспечила мощный толчок для разви¬
тия фундаментальной биологии и связанных с нею отраслей знаний, в
том числе иммунологии с иммунобиотехнологией.В XXI в. будущее биотехнологии и самой биологии связано с перехо¬
дом на новый уровень развития науки — на уровень нанотехнологий.Научный совет по нанотехнологии Российской академии наук,
возглавляемый лауреатом Нобелевской премии Ж,И. Алферовым,
выделяет пять основных разделов нанотехнологии — физика нано¬
структур, наноматериалы, наноэлектроника, нанодетекция и нано¬
биотехнология.Чтобы осмыслить, почему нанобиотехнология выделена в самостоя¬
тельную отрасль, необходимо сделать небольшой экскурс в историю.
Биология — одна из самых древних естественных наук, она начиналась с
описания, систематики объектов макромира, разделилась на ботанику и
зoo^югию, но все равно оставалась биологией. С изобретением микроско¬
па исследователям открылся мир, в котором действуют микросущества —
так появилась микробиология. Следующим этапом было доказательство
клеточного строения живых существ. Возникла клеточная биология.
Наука эволюционировала, и оказалось, что есть молекулы, которые
несут и передают всю информацию обо всем живом — пришла очередь
молекулярной биологии. Последовательность была именно такой: мик¬
робиология, клеточная биология, молекулярная биология.В наши дни приступили к исследованию мира на уровне нано¬
структур. В основе функционирования всех живых систем, будь
то вирусы, одноклеточные или многоклеточные организмы, лежит
sos Глава 11. Нанобиотехнология, нановакцины, наноантителаработа наноструктур — информационные единицы ДНК, клеточные
рибосомы, рецепторы, лиганды и широкий спектр трансмиттеров,
представленных разнообразным спектром цитокинов и других моле¬
кул. Фактически вся жизнь протекает на уровне наноструктур! Тем
не менее науку не назвали нанобиологией. Почему? Потому что тогда
НС возникает, образно говоря, нового лица, ведь «напо» — это всего
лишь обозначение размера. Нанометр — это одна тысячная микрона.
Назвать нанобиологией изучение биологических наноструктур —
значит никак не назвать новый этап науки: получилось бы, что мы
просто занимаемся нормальной молекулярной биологией.Основа нанобиотехнологии — наноконструирование из естествен¬
ных или воспроизведенных синтетических или генно-инженерных
наноструктур живых объектов разных биологических типов — от
вирусов до млекопитающих и человека. А основные цели биологи¬
ческого наноконструирования — создание наноструктур с искомыми
свойствами высшей эффективности. Так что нанобиотехнология —
это прежде всего конструирование, вот что отличает ее в первую оче¬
редь, Именно этот критерий отсекает то, что кнанобио- не относится.
Надо четко уяснить, что ученый, увидевший в микроскоп ту или иную
наноструктуру, еще не нанобиотехнолог, поскольку он не является
конструктором чего-то нового.Наноконструирование открывает неограниченные возможности и
новый этап развития и применения биотехнологии. Совершенно очевид¬
но, что на этом этапе на передний план выходит междисциплинарный
принцип исследований и разработок. Скажем, соединение биологи¬
ческих сенсорных молекул (биология) с неорганическими магнитными
наночастицами (химия) и введение таких наноструктур в кровоток обес¬
печивают возможность тестирования различных дефектов в организме с
помощью внешнего аналитического устройства типа ЯМР (физика).Иначе говоря, главными задачами нанобиотехнологии являются не
столько изучение или воспроизведение биологически значимых нано¬
структур, сколько конструирование неизвестных или принципиально
новых наноструктур для их научного и практического применения.Важнейшей особенностью биологических систем, придающей им
уникальность, является их природная способность к узнаванию (ком¬
плементарные цепи ДНК, рецептор-лиганд, антитело-антиген), само¬
сборке (укладка белков, самосборка мембранных структур, микро-
трубочек, вирусных частиц) и амплификация (амплификация ДНК,
размножение вирусов).
Глава 11. Нанобиотехнология, нановакцины, наноантитела 509Важное преимущество биологических систем — широкое природ¬
ное разнообразие, которое позволяет осуществлять выбор систем,
адекватных для разнообразных применений: от создания новых мате¬
риалов, систем для преобразования энергии и систем для использо¬
вания в медицине, сельском хозяйстве, пищевой промышленности и
экологии до создания бионанороботов для различных целей.в настоящее время фундаментальные и прикладные работы
бионанотехнологического профиля уже являются составной час¬
тью научно-исследовательской деятельности академических инс¬
титутов и связанных с ними государственных научных и произ¬
водственных учреждений, а также негосударственных компаний.
Бионанотехнологическая секция научного совета РАН по нанотех¬
нологии подготовила базу данных развивающихся или планируемых
проектов по нанобиотехнологии в системе институтов РАН и связан¬
ных с ними учреждений, в базе данных более 100 проектов, которые
классифицированы в виде пяти стратегических разделов.1. Нанокоиструирование биологических узнающих систем (нано-
диагностика и нанодетекция).2. Наноконструирование новых лечебных препаратов (нанолекарства).3. Наноконструирование новых иммуногенов, антител, вакцин
(нановакпины).4. Трансгенное наноконструирование (нанотрансгснез).5. Наноконструирование замещаюпшх систем и регуляторных
компонентов тела (нанобионика).I. Нанодиагностика и нанодетекция— Разработка наноструктурных систем детекции биоорганических
субстанций, бактерий, вирусов для использования в молекуляр¬
ной биологии, медицине, экологии, криминалистике и др.— Создание нанобиосенсоров для генодиагностики, наркодиаг¬
ностики, диагностики виремии и токсинемии, мониторинга
лекарств и пр.— Создание нанокомплексов, пригодных для внутривенного вве¬
дения и состоящих из биосенсоров с наночастицами, регистри¬
руемыми физическими приборами, расположенными вне тела
(ядерно-магнитный резонанс, ультразвук и др.).— Наноэтика: разработка систем гигиенического и экологиче¬
ского надзора биоопасности нанотехнологического производ¬
ства и нанопродукции.
510 Глава 11. Нанобиотехнология, нановакцины, наноантителаII, Нанолекарства— Векторные лекарства для клеток-мишеней и клеточных нано¬
структур, включая генотерапию.— Адресное преодоление клеточных мембран, гсматоэнцефали¬
ческого, воспалительного и других биологических барьеров.— Новые противоопухолевые, кардиотропные и психотропные
средства, новые антибиотики.— Новые иммуномодуляторы, аллерготропины и наноантитела
для лечения иммунодефицитов, аллергий, опухолей и аутоим¬
мунных заболеваний.Я/. Нановакцины— Конъюгированные полимер-субъединичные и субъединич-
но-адъювантные вакцины против новых и возвращающихся
социально значимых инфекций.— ДНК-вакцины и вакцины на базе генно-модифицированных
вирусов против актуальных вирусных инфекций.— Противоопухолевые вакцины на основе опухоль-спсцифи-
ческих на1юструктур, включая вирусы, и опухолевых клеток,
модифицированных генами, обеспечивающими противоопу¬
холевую защиту— Новые иммуномодуляторы и адъюванты на основе искусствен¬
ных или природных наноструктур, стимулирующих иммуни¬
тет (стресс-белки, клеточные лиганды, синтетические поли¬
меры, фуллерены и др.).IV. Нанотрансгенез— Трансгенез бактерий и вирусов, создание новых многокомпо¬
нентных плазмид и других векторных наноконструктов.— Трансгснез растений, включая создание продуцентов препа¬
ратов сельскохозяйственного и промышленного назначения
(гормо1юв, вакцин и др.).~ Трансгенез животных, включая создание продуцентов меди¬
цинского, сельскохозяйственного и промышленного назначе¬
ния (новые 1юроды, материалы и др.).— Создание нанотранспортеров для доставки генетических конс¬
труктов в геном, трансгенез соматических клеток животных и
человека, векторный трансгенез стволовых клеток.
Глава 11. Нанобиотехнология, нановакцины, наноантитела 511V. Нанобионика— Создание нанокомпонентов для новых кровезаменителей,
наногубок и нанотрубок для депонирования в тканях биоак¬
тивных субстанций, безаллергенных биоматериалов.— Создание энерготрансформирующих наносистем и нанороботов.— Разработка новых систем внеклеточного синтеза биооргани-
ческих субстанций, включая промышленно значимые матери¬
алы на основе биологических матриц.— Создание модельных живых клеток и искусственных вирусов.три вышеуказанные способности, работающие внутри и на поверх¬
ности клеток естественных наноструктур, делают их уникально удобны¬
ми для нанобиотехнологии. Эти способности — узнавание соответству¬
ющих им нанострую ур, самосборка (или саморазборка) при соответс¬
твующих условиях и самовоспроизведение. Последней способностью
обладает единственный в природе материал. Это ДНК, являющаяся
генетическим материалом и обеспечивающая благодаря конварианпюй
редубликдпии бесконечность и развиваемость всех жизненных форм на
Земле. В существующих и создаваемых в наши дни нановакцинах исполь¬
зованы вышеуказанные способности наноструктур или их конструкции
с син 1е гическими хюлиэлектролитами адъювантного действия.Одна из таких вакцин, как уже упоминалось выше, — вакцина
«Церварикс». Она выведена на рынок в ряде стран в 2007 г. В России
в 2008 г. проведены первые клинические испытания. Вакцина пост¬
роена на основе поверхностных белковых субъединиц вируса папил¬
ломы шейки матки Международной компанией «ГлаксоСмитКляйн».
Поверхностные белковые субъединицы вируса нарабатываются в необ¬
ходимых (неограниченных) количествах генно-инженерным путем.
Эти белки, как и поверхностные субъединицы М1ЮГИХ вирусов, обла¬
дают способностью к самоорганизации. При определенных условиях их
самоорганизация заканчивается построением цельной вирусной час¬
тицы, но без информационной начинки. Возникает вирусная частица,
несущая поверхностные антигены в их естественной комбинации, не
способная размножаться и вызывать болезнь, но способная стимулиро¬
вать иммунитет. Авторами выбраны типы вирусов 16 и 18 папилломы,
которые наиболее часто вызывают рак шейки матки. На рисунке 133
представлена наноструктура вакцины «Церварикс».«Гардасил (Мерк)» — это рекомбинантная квадривалентная вакци¬
на, состоящая из вирусоподобных частиц (ВП4) (Virus-like particle --
512Глава JL Нанобиотехнология, нановакцины, наноантителаРис. 133. Наноструктура вакцины
ЦервариксVLP) 6, 11, 16 И 18 типов вируса
папилломы человека. VLP полу¬
чены путем экспрессии вирусных
капсидных белков L1 в дрожжевых
клетках Saccharomyces cerevisiae,
очищены и адсорбированы в алю¬
миниевом адъюванте. «Гардасил» —
первая в мире вакцина против
вируса папилломы человека —
зарегистрирована в июне 2006 г.
Управлением но контролю за
продуктами питания и лекар¬
ственными средствами США.Вакцина «Гардасил» предна¬
значена для профилактики забо¬
леваний, вызываемых вирусом
папилломы человека типов 6, 11,16, 18;— рака шейки матки, влагалища и вульвы;~ генитальных кондилом;— цервикальной интраэнителиальной неоплазии I степени
(CIN1);— цервикальной интраэнителиальной неоплазии II и III степени
(CIN2/3);— аденокарциномы шейки матки in situ (AIS);— интраэнителиальной неоплазии вульвы II и Ш степени (VIN 2/3);— интраэнителиальной неоплазии влагалища IÍ и III степени
(ValN 2/3).Каждая доза вакцины (0,5 мл) содержит 20 мкг белка L1 вируса
папилломы человека типа 6, 40 мкг белка L1 этого же вируса типа 11,
4 мкг белка L1 вируса типа 16, 20 мкг белка L1 вируса типа 18,
225 мкг алюминиевого адъюванта и буферный раствор [798].Работы первостепенного значения в области самоорганизации
поверхностных белковых субъединиц вируса табачной мозаики
(ВТМ) проводятся академиком И.Г. Атабековым. Вирус вызывает
болезнь у табака и, как подавляющее большинство вирусов растений,
соверщенно не патогенен для человека. Поэтому создавать у людей
иммунитет против ВТМ лишено смысла. Но в работах И.Г. Ата¬
бекова показано, что на базе вирусного генома можно сконструи-
Глава и. Нанобиотехнология, нановакцины, наноантитела513ГЕНЭПИТОПНативныйвирусСтоп-крдонХимёрйый
вирус -
вакцинеРис. 134, Создание вирусных частиц из химерных субъединиц БО, слитых с
эпитопом вакцинного белкаровать нановакцину против необходимого патогена, вакцину против
которого до сих пор не удается создать. Рисунок 134 демонстрирует
принцип создания такой вакцины. Изображенные на рисунке пира¬
мидальные структуры — это белковые субъединицы ВТМ, которые
в соответствии с вирусным геномом (молекула РНК) уложены в виде
белковой спирали. Для получения химерного вируса к белковым
субъединицам вируса необходимо присоединить эпитоп соответ¬
ствующего антигена. Получается вирусная частица, собранная в
виде структуры, во много раз более иммуногенной по сравнению с
отдельными эпитопами или изолированным белковым антигеном
с данным эпитопом. Сборка вирусоподобных частиц из химерных
субъединиц вирусного белка (правая часть рис. 134) — один из путей
создания нановакцин.Помимо самосборки белковых субъединиц, вирусные частицы
оказываются перспективны для генно-инженерного конструирова¬
ния нановакцин профилактического или лечебного типа.В Институте им. Н,Ф. Гамалеи РАМН разработана весьма перспек¬
тивная универсальная «платформа» для создания ДНКовых нановак¬
514Глава 11. Нанобиотехнология, нановакцины, наноантителацин на основе конструирования
вирусного генома (Логунов Д.Ю.
и др.) [163, 562]. Используются
аденовирусы (рис. 135 а, б), у
которых «вырезана» часть генома.
Этот дефектный вирус способен
встраиваться в клетку, но не раз¬
множаться. В силу своей дефект¬
ности вирус не может вызвать
болезнь в целостном организме
млекопитающих и человека, т.е.
это безопасный наноноситель,
который от природы обладает
способностью эффективно при¬
нимать и переносить в определен¬
ные типы клеток содержащуюся
в нем генетическую информа¬
цию (гены). Если вместо «выре¬
занной» части генома вставить
участок генома того вируса, про¬
тив которого необходимо создать
иммунитет, то получится нано¬
вакцина, сконструированная на
основе «платформы» аденовиру¬
са, но вырабатывающая субъеди¬
ницы, иммунизирующие против
искомой вирусной инфекции.
Иначе говоря, рекомбинантные
псевдовирусные наночастицы (РПАН) представляют собой наибо¬
лее перспективный вектор для доставки чужеродной генетической
информации в клетки человека и животных.В качестве перспективной платформы для создания биологически
активных наноструктур применяются и другие вирусы (не только
адено) [379, 613, 719].Аденовирусные наночастипы представляют собой капсид размером
70—90 нм. Его наружная оболочка состоит из двух основных структур¬
ных белков — гексона и фибера. Внутри капсида локализуется двух¬
цепочечная ДНК размером 35—44 тыс. нуклеотидных пар (рис. 136).Рис. 135. Электронная фотография
аденопируса {а, б)
Глава //. Нанобиотехяология, нановакцины, наноантитела5/5'SiXоО)Iоh-ГенчужеродногоантигенаРис. 136. Структурная организация рекомбинантной псевдоаденовирус и ой
наиочастицы (РПАН)Рекомбинантная псевдоаденовирусная наночастида характеризуется
следующими особенностями:- содержит делегированный геном, неспособна к размножению
in vitro и in vivo',- является физической самособирающейся наночастицей;— обеспечивает доставку и экспрессию чужеродного генетиче*
ского материала к клетке.Получают РПАН в процессе выполнения следуютдих основных
этапов:— удаление из генома аденовируса области, ответственной за его
размножение в пермиссивных клетках;
516Глава П. Нанобиотехнология, нановакцины, наноантителаДНК аденовирусаОбласть А(Область, ответственная
за размножение
аденовируса)Удаление
Этап \ "Ч^обйаети АКлетки линии 293,
содержащие .
область А генома
аденовируса, вставка
. Цвлевогр гена\ВС1
Этап2\адВведение лстучвнной
энструкции в клеткиРекомбинантнаяаденовируснаянаночдстицаРис. 137. Схема получеттия рекомбинантных псевдоаденовирусных наночас¬
тиц (РПАМ)— встраивание в геном аденовируса кассеты, несущей целевой ген;— трансфекция клеток линии 293 (единственная линия, под¬
держивающая репликацию РПАН, получена с применением
генно-инженерных технологий) сконструированным генно-
инженерным продуктом. Схема получения РПАН показана на
рисунке 137.Получаемые по описанной выше технологии РПАН лишены спо¬
собности к размножению во всех нормальных клетках человека и
животных вследствие делеции протяженного участка генома. Такая
деледия изменяет и физические (количество ДНК), и биологические
(потеря способности реплицироваться) свойства наночастицы.Накопление РПАН обеспечивают клетки линии 293, в которых
синтезируются капсидные белки и собираются рекомбинантные аде¬
новирусные частицы, несущие вставку целевого гена. Затем наночас¬
тицы выходят из клетки.
Глава //. Нанобиотехнология, нановакцины, наноантитела 517Таким образом, в РПАН могут встраиваться гены, кодирующие
протективные антигены разных патогенов, факторы роста, опухоле-
супрессирующие молекулы и т.п. в РПАН могут встраиваться также
гены белков, выработка которых в прокариотических или дрожжевых
системах невозможна или невыгодна.В зависимости от типа целевого гена, встраиваемого в РПАН,
наночастицы могут использоваться для решения различных медико-
биологических задач;— для вакцинации (в РПАН встраиваются гены, кодирующие
протективные антигены разных патогенов);— для терапии (в РПАН встраиваются гены факторов роста,
супрессоров опухолей, одноцепочечных антител, т.е, структур,
необходимых для проведения терапии);— для продукции рекомбинантных белков (в РПАН встраи¬
ваются гены белков, продукция которых невозможна или
неэффективна в прокариотических или дрожжевых системах
экспрессии).Такие модифицированные аденовирусные наночастицы могут
использоваться для специфической доставки (в зависимости от встро¬
енного лиганда) трансгенов в определенные типы тканей. Схема
модификации тропизма РПАН показана на рисунке 138.В настоящее время проходят лабораторные испытания двух препа¬
ратов. Один из них исследуется на способность индуцировать протек-
тивный иммунитет у цыплят, иммунизированных псевдовирусными
наночастицами, несущими ген гемагглютинина вируса птичьего
гриппа H5N1. Другой препарат, представленный псевдоаденовирус-
пыми паночастицами, несущими ген гликопротеина вируса бешен¬
ства, испытывается на иммуногенносгь прогив бешенства.В течение многих лет используется, по сути дела, нанотехнологиче¬
ский принцип повышения иммуношнности слабых антигенов путем их
присоединения к белковым или полисахаридным молекулам органиче¬
ского происхождения, скажем к столбнячному анатоксину или гемоци¬
анину улитки (KLH) (рис. 139). Получаемые наноконструкции нередко
используются в лабораторных целях и на путях их клинического приме¬
нения. Это направление перспективно для разработки нового типа про¬
тивоопухолевых вакцин. Примером поиска варианта вакцины на основе
ранее не использованных ганглиозидов служит работа Р.Н. Степаненко и
соавт. [160, 161, 202] в Институте иммунологии ФМБА России.
518Глава 11. Нанобиотехнология, нановакцины, наноантителаАденовирусная каночастица
ФибврПвнтон-^ ,ГекоонТримергаксонаГенетическаямсяификамия’ [вна гвксонаГетероґіогичная ГеномГен гексіона ^ последоаатепькюстъ, аденовируса
коди^ющая лигандМодифициртанная
аденовирусная наночастицаРис. 138. Схема модификации тропизма рекомбинантных псевдоаденовирус-
ных наночастиц (РПАН)Гвмоцианин моллюска
Megathura crenulata
(keyhole limpet
hemocyanin, KLH)
MW - 8 ООО KDМорфолотческаяединицаБелковая
су<Ь>единица
MW-400 KDРис. 139. Четвертичная структура белка носителя (KLH)
Глава 11. Нанобиотехнология, нановакцины, наноантитела519KLHТиолированимй KLHРис. 140, Получение конъюгата трисахарида GM3 с KLHГанглиозиды относятся к сиалосодержашим гликосфинголипи-
дам, количество которых значительно увеличивается на поверхности
клеточной мембраны при малигнизации клеток при меланоме и дру¬
гих опухолях нейроэктодермического происхождения. Повышенная
экспрессия ганглиозида GM3 на мышиных и человеческих мела¬
номах и его важная роль в развитии опухолей позволяют рассмат¬
ривать этот собственный антиген как потенциальную мишень для
иммунотерапии этих новообразований. Авторы синтезировали оли-
госахаридные цепи природного GM3, конъюгировали их с белком —
гемоцианином (KLH) (рис. 140) и получили иммуногенную нано¬
конструкцию (рис, 141),Об иммуногенности «вакцины» судили по величине титров спе¬
цифических антител в сыворотке мышей линии C57BL/6 к нативному
GM3, синтетическим полисахаридным цепям GM3 и к GMЗ-пoлoжи-
тельным клеткам меланомы В-16, «Вакцину» вводили внутрибрюшин¬
но 2 раза с 14-дневным интервалом и затем спустя 3 мес после начала
иммунизации. На 7-й день после последней иммунизации у животных
520Глава 11. Нанобиотехнология, нановакцины, наноантитела; Конъюгат содержит ~ 300"
остатков трисахарида GM3,!
Г1рис0ейиненных к КШРис. 141. Структура синтезированной нановакциныбрали кровь и в сыворотке определяли титры антигенспецифических
антител методом ELISA и непрямым иммупопероксидазным окра¬
шиванием клеток меланомы В-16 (клеточная ELISA). Иммунизация
мышей созданной наноконструкцией индуцировала выраженную
иммунную реакцию против ганглиозида GM3 с образованием анти¬
тел разных изотипов (ígM, IgG, IgGl и igG3) и приводила к индукции
иммунологической памяти. Иммунная сыворотка также распознавала
ганглиозид GM3 на поверхности клеток меланомы В-16.Так же как и во всех разделах нанобиотехнологии, раздел
Нановакцины имеет дело не просто с изучением структур нанораз-
мерной величины, не просто с их обнаружением в клетках или их изо¬
лированием и молекулярным исследованием, но с конструированием
из них необходимых для заданных целей структур высшей эффектив¬
ности. Конструкция первой нановакцины, выпущенной на рынок в
2000 г. и доказавшей свое превосходство, детально описана в данной
монографии в главе 10. Она получила название «Гриппол». Динамика
ее использования демонстрируется количеством успешно провакци-
нированных людей: 2000—2002 гг. — 2 млн человек, 2003-2005 гг. —
24 млн, 2006—2009 гг. — 85 млн человек. В 2009 г. на территории РФ
в рамках национального проекта «Здоровье» также использовалась
Глава 11. Нанобиотехнология, нановакцины, наноантитела521Мапоаффе1стивмы
В ьшокореактоген ны
к1ммуногвнная доза
; 100 мкг :Убитая или живаяСплит-вакцины. .. .
Эффективны
; Мш10701^чнь>
Имриуногеннан доза■15мкг-“' 'г%ВаксигрипСубъединичныевакциныЭффв1ствны
Нет<жсичны
Иммуноганная доза
. . : 15 мкгИнфлювакУ—Полимер-
субъединичные
нано вакцины6 ЫСОКОЯ|}фвКТИ ЁНЫ; Нетс«сичны
Иммуногенная доза
бшгГриппол,
Гриппоп плюс,
Гриппол НеоРис. 142. Эволюция гриппозных вакцинвакцина «Гриппол плюс» (усовершенствованный аналог вакцины
«Гриппол») — 6,6 млн доз.На примере эволюции совершенствования гриппозных вакцин
удобно проиллюстрировать, что отличает нанобиотехнологию от
молекулярной биологии, клеточной инженерии и других ветвей био¬
логической науки (рис. 142).Первый этап, как и вообще первый этап создания вакцин, — это
использование убитых или ослабленных вирусов — убитой или живой
противогриппозных вакцин. Вирус гриппа выращивается на зара¬
женных куриных эмбрионах. Из аллантоисной жидкости путем цен¬
трифугирования выделяются вирусные частицы. Это и есть вакцина.
В случае убитой вакцины вирусную массу инактивируют прогрева¬
нием. В случае живой вакцины используют аттенуированный штамм
вируса. Иммунитет возникает за счет выработки антител против
поверхностных белковых антигенов - гемагглютинина и нейрами¬
нидазы. Это основные компоненты агрессивности вируса, которые
вместе с другими токсическими компонентами вируса обеспечивают
высокую степень поствакцинальных осложнений при весьма слабой
иммуногенности. Вакцины высокореактогенны и малоэффективны.
Совершенно очевидно, что никакой нанотехнологии в процессе изго¬
товления живых или убитых вакцин нет. Это пример клеточной био¬
логии с выращиванием вирусов в клетках куриного эмбриона.Второе поколение противогриппозных вакцин связано с разра¬
боткой так называемых расщепленных, или сплит-вакцин. Такие
вакцины, в отличие от цельновирионных, характеризуются высо¬
522 Глава 1Г Нанобиотехнология, нановакцины, наноантителакой степенью специфической безопасности, малотоксичны, имму-
погенны. Вакцины создаются на базе вирусного лизата, содержащего
микробные антигена и обычно получаемого с помощью детергента.
Однако, несмотря на высокую степень очистки, вакцины, как прави¬
ло, содержат различные примеси или органических соединений, или
комплексов, включающих липиды, белки, полисахариды.Третье поколение противогриппозных вакцин — это субъединич-
ные вакцины, разработанные более 20 лет тому назад. Они состоят не
из всего вируса, а только из структур его поверхности, т.е. из вирусных
субъединиц — молекул гемагглютинина и нейраминидазы. Препарат
избавился от ряда токсических комгюнентов вируса. Вакцина стала
нетоксичной. Повышенное количество поверхностных структур обес¬
печило повышение иммуногенности. Совместное введение с адъю¬
вантами усиливает эффективность вакцины. Вместе с тем, выделе¬
ние, очистка и концентрирование двух поверхностных белков вируса
относится к классической биохимии или, если хотите, к молекуляр¬
ной биологии, но никак не к нанобиотехнологии.Четвёртое поколение вакцины получило название конъюгирован¬
ных полимерсубъединичных. Их представителями являются вакци¬
ны «Гриппол», «Гриппол плюс», «Гриппол Нео», подробно описанные
в главах 8 и 10 данной книги. Данные вакцины построены по при¬
нципу наноконструирования. Ответственные за развитие иммунного
ответа поверхностные субъединицы (гемагглютинин и нейраминида-
за) соединяют с несущей полимерной молекулой — полиоксидонием
(ПО). Возникающие новые наноструктуры — пары гемагглютинин-
ПО и нейраминидаза*ПО — обладают повышенной иммуногеннос-
тью. Иммунизирующая доза в вакцинах группы «Гриппол» сниже¬
на в 3 раза. Благодаря этому токсические эффекты и вероятность
прививочных осложнений многократно снижаются. 2000 год, когда
были начаты массовые противогриппозные вакцинации, может быть
назван годом выхода на рынок первой нановакцины.Стольже приоритетное значение имеетразработкаивнедренисвпрак-
тику аллерготропинов (см. главу 10). Объектами наноконструирования
явились субъединицы растительного происхождения, конъюгирован¬
ное с полиоксидонием. Первыми препаратами явились аллерготропи-
ны «Тимпол» и «Берпол», используемые для предотвращения аллергии
к пыльце тимофеевки и березы — наиболее распространенной сезонной
аллергии в средней полосе России, Аллерготропины идут на смену аллер¬
говакцинам. Полимерный носитель субъединиц аллерге!юв стимули-
Глава 11. Нанобиотехнология, нановакцины, наноантитела 523руст выработку иммуноглобулинов класса IgG (блокирующие антитела)
и тем самым переводит аллергический тип иммунного реагирования —
выработку IgE-антител — в защитный. Аллергия к данному аллергену
предотвращается. Набор аллергенотропииов расширяется.В последнее десятилетие в науку вошли два термина, имеющие
отношение к биотехнологии и нанобиотехнологии. Речь идет о мини¬
антителах и наноантителах. Миниантителом называют часть молекулы
иммунопюбулина (антитела), состоящего из пары его пептидных цепей —
L и Н, несущих специфический и формирующих распознающий учас¬
ток. Пара Н-цепей отрезана как несущественная для распознавания
антигена. Миниантитела дают возможность создавать гуманизирован¬
ные антитела, «посадив» их на пару Н-депей человеческого иммуногло¬
булина, а также исгюльзовать в качестве вектора для противоопухолевых
иди иных лекарственных средств, требующих адресной доставки. Вместе
с тем они не могут работать как обычные антитела, поскольку имеют
только один центр узнавания и связывания с антигеном, С помощью
моноклональных миниантител создан широкий спектр препаратов пос¬
редством химического или генно-инженерного синтеза [47],В нескольких публикациях, использовавших термин «наноанти¬
тела», речь идет о строении иммуноглобулинов (антител) верблюдов,
В отличие от других млекопитающих, распознающие центры анти¬
тел верблюдов построены без легких цепей. Сама молекула имму¬
ноглобулина оказывается меньше обычной и по молекулярной массс,
и по размеру. При ее описании был использован термин «наноан¬
титело». Очевидно, 4Т0 эта ситуация не имеет отношения ни к био¬
технологии, ни к нанобиотехнологии. Верблюжьи антитела — это
природный субстрат. Его выделение и исследование относятся к имму-
1ЮЛОГИИ, биохимии или молекулярной биологии, поскольку не несут
элементов технологического конструирования. Что касается минианти¬
тел, используемых для создания гуманизированных или векторных
ко^ютрукций, то они имеют прямое отношение к нанобиотехнологии.
Если распознающие цепи верблюжьих антител будут использованы как
миниантишла для создания наноконструкций с искомыми качествами,
тогда те и другие конструкции получат общее название «наноантитела».Примером создания наноантител являются работы лабораторииС.М. Деева в Институте биоорганической химии им. М.М. Шемякина
и Ю.А. Овчинникова Российской академии наук.Опыт использования рекомбинантных миниантител для наце¬
ливания на раковые клетки показал, что такие антитела из-за моно¬
524 Глава 11. Нанобиотехнология, нановакцины, наноантителавалентности связывания с мишенью быстро выводятся из кровяного
русла и характеризуются невысоким временем задержки на антигене.
Поэтому для многих задач, как диапюстических, так и терапевтичес¬
ких, необходимо при конструировании наноантител вернуться к харак¬
терному свойству природных иммуноглобулинов — двухвалентности,
соединяя моновалентные фрагменты в мультивалентные молекулы.
Перевод миниантител в мультивалентный формат позволяет увеличить
их функциональную эффективность (авидность), уменьшить диссоци¬
ацию с клеточной поверхности и оптимизировать биораспределение.Для создания гетеромультимерных наноантител предложена новая
стратегия, основанная на рибонуклеазе барназе и природном инги¬
биторе барстаре (рис. 143). Эти два белка образуют исключительно
прочный комплекс с константой диссоциации Kd сравнимойпо аффинности со стрептавидин/биотиновой системой, Барназа и
барстар обладают небольшими размерами (ПО и 89 аминокислотных
остатков), стабильны, хорошо растворимы и устойчивы к протеазам.
N- и С-концевые части обоих белков локализованы вне области вза¬
имодействия барназы и барстара и могут поэтому быть использованы
для слияния с узнающими цепями антител. Сконцентрированные
таким образом моновалентные блоки, scFv-шарнир-барназа (или
scFv-шарнир-дибарназа) и scFv-шарнир-барстар далее объединяются
благодаря практически необратимому связыванию лигандов (барназы
и барстара) в очень прочный и стабильный димер (или тример) [342].Модуль барназа-барстар использован также для создания дивалент¬
ных биспецифических наноантител; гетеродимерное наноантитело
425scFv-6apcTap/4D5scFv-6apHa3a-His5 получено из двух комплемен¬
тарных мономерных блоков, включающих одноцепочечньте наноан¬
титела, специфичные к онкомаркерам HERI и HER2/neu и слитые с
барназой и барстаром [747].Предложенная технология получения на основе модуля барна¬
за—барстар конструкций (наноантител) и присоединенных к ним
необходимых в зависимос'т от задачи наносубъединиц является
универсальной платформой для конструирования нового поколе¬
ния наноантител, нагруженных широким спектром наночастиц —
золотых, магнитных, флуоресцентных (квантовых точек), предна¬
значенных для диагностических и терапевтических приложений.
Возможности представленных на рисунке 143 наноконструкций
изложены в публикациях С.М. Дсева, Р.В. Петрова и соавт. [48, 73,
360,411,747].
Глава 11. Нанобиотехнология, нановакцины, наноантитела525мшРис. 143. Ди- и три меры мини-антител, связанные с помощью модуля барна-
за—барстар:а — одноцетчечные антитела (5сГу), состоящие из доменов Уь " Ун, связанных пеп¬
тидным линкером; б — димер всРу (диантите/ю); в — биспецифическое диантитело;
гид-ди-и тримеры мини-антител, связанные с помощью людуля барназа—барстар
Глава 12НОВАЯ ВАКЦИНОЛОГИЯ И ВАКЦИНЫ
БУДУЩЕГОРазвитие вакцинологии обычно рассматривается в ключе совер¬
шенствования методов получения безопасных, высокоэффективных,
удобных в использовании, недорогостоящих вакцин. Говоря о вакци¬
нах будущего, учитывают потребности в создании вакцин, защищаю¬
щих от той или иной инфекции, а в последнее время терапевтических
вакцин и вакцин против соматических болезней. Между тем развитие
иммунологии показало, что конструкция вакцины, способ ее введения,
схема вакцинации должны подчиняться в первую очередь необходи¬
мости активации тех или иных звеньев протективного иммунитета.
В предыдущих разделах неоднократно подчеркивалось, что важнейшим
требованием к создаваемым вакцинам является способность активиро¬
вать как адаптивный, так и врожденный иммунитет. Для реализации
этой задачи в конструкцию вакцины включают адъюванты с известным
механизмом действия (такие, как полиоксидоний и другие адъюванты
с контролируемой структурой и свойствами) или специально разра¬
ботанные адъюванты, усиливающие иммуногенность нестандартных
вакцин (таких, как вирусоподобные частицы). Однако без стимуляции
дендритных клеток вакцинным препаратом маловероятна продукция
ИНФу и ИЛ-12, активирующих ТЫ-иммунный ответ. Это означает,
что при создании вакцин будет учитываться и способ введения анти¬
гена — внутрикожный, энтеральный, и форма вакпины — наночас¬
тицы, самодеградирующиеся частицы, металлосодержащие частицы.
Разработка и совершенствование энтеральных вакцин обусловлены
не только простотой введения, но и возможностью активировать как
«мукозальный иммунитет», так и Thl- или ТК2-ответ. Реализация дан¬
ных задач является будущим вакцинологии, однако уже в настоящее
время достигнуты определенные успехи в создании вакцин, которым
наряду с нановакцинами и будет принадлежать будущее, это;1) ДНК- и другие генетические вакцины;2) «обрати ьте вакцины» (reverse vaccines);3) растительные рекомбинантные вакцины (съедобные вакцины);4) терапевтические вакцины;5) вакцины против соматических (неинфекционных) болезней.
12 J, ДНК-вакцины и другие генетические вакцины 52712Л. ДНК-ВАКЦИНЫ И ДРУГИЕ ГЕНЕТИЧЕСКИЕ
ВАКЦИНЫПоследние достижения в стратегии вакцинологии и создания кон¬
кретных вакцин не исключают ситуаций, при которых иммунизация
организма живыми или убитыми вакцинами может быть неэффек¬
тивна или опасна для здоровья пациента. Определенные опасения
вызывает и реверсия живого вакцинного штамма в вирулентный
при длительной циркуляции в популяции, в процессе которой он к
тому же может обрести лекарственную устойчивость, в связи с этим
особое значение приобретает разработка вакцин, при вакцинации
которыми отсутствует циркуляция инфекционного агента в популя¬
ции. Наибольшее развитие получили так называемые ДНК- и гене¬
тические вакцины, базирующиеся на вирусных, бактериальных или
растительных векторах.Развитие этого направления в вакцинологии связано с фактом,
свидетельствующим о том, что введение чужеродной ДНК в организм
животного способствует формированию иммунитета (Bloom B.R.,
Lambert Р.-Н., 2003) [84].Получение ДНК-вакцин основано на способности плазмид — коль¬
цевых молекул двухцепочечной ДНК к репликации в бактериальной
клетке и обычно включает следующие этапы: синтез целевого гена,
его амплификацию с помощью полимеразной цепной реакции, вклю¬
чение в конструкцию регуляторных генов, при этом ген, кодирующий
синтез целевого антигена, и регуляторные гены, определяющие экс¬
прессию генов целевого антигена, встраивают в бактериальную плаз¬
миду. Далее очищенную плазмидную ДНК со встроенными генами,
кодирующими синтез целевых антигенов, используют для индукции
иммунного ответа к целевым белкам. Очевидно, что ДНК-вакци¬
ны можно комбинировать. Это дает определенные преимущества в
индукции иммунного ответа к патогенам с ра:жообразным антиген¬
ным профилем или к нескольким инфекционным агентам.Введение ДНК-вакцин проводят парентерально — внутрикожно
или внутримышечно, уровень переноса гена лабораторным живот¬
ным бывает очень низким, но интернализованная плазмида персис-
тирует в клетках организма и экспрессируется в течение длительного
времени. Необходимо отметить, что плазмидная ДНК, содержащая
соответствующий ген, не встраивается в ДНК хромосом иммунизи¬
руемого организма [62J.
528 Глава 12. Новая вакцинология и вакцины будущегоПри иммунизации ДНК-вакцинами используют новые методы
введения вакцинирующего материала, одновременно отвечающие
всем требованиям, предъявляемым к вакцинам: быстрое достижение
высокого уровня защиты, сохранение напряженности иммунитета в
течение длительного времени, видоспецифичность иммунного отве¬
та, минимальный побочный эффект. Используются не только сами
ДНК-вакцины, но и ДНК-содержащие наночастицы. Это па1ючас-
тицы фосфата кальция, который является адъювантом и носителем
для ДНК-вакцин (Joyappa D.H. ct al., 2009). Это нахючастицы на
основе джинсонамида (джиносомы) (Song X. et al., 2009). Это ранее
описанные самодеградирующиеся полимерные частицы или части¬
цы из золота [62, 84]. Смысл введения ДНК-вакцин столь «новатор¬
ским» способом заключается, во-первых, в повышении интенсивности
иммунного ответа, во-вторых, в активации как Т-, так и В-клеточного
ответа, В-третьих, в одновременном введении нескольких вакцинных
препаратов и, наконец, в одновременном введении ДНК-вакцин и
разнообразных цитокинов (Joyappa D.H. ct al., 2009; SongX. et al., 2009)
[62, 316].В главе 1 подробно обсуждался механизм активации врожденного
иммунитета внеядерной ДНК, фактически являющейся иниции¬
рующим сигналом активации ТЫ-иммупного ответа (Хаитов P.M.
и др. [196]). Однако значимый ТЫ-ответ наблюдается при активации
дендритных клеток, продуцирующих ИНФу и активирующих синтез
ИЛ-12 (Хаитов P.M. и др. [196]). Поэтому при введении ДНК-вакцин
широко используют внутрикожные методы — инъекционные «ген¬
ные» пистолеты (Bloom В.R., Lambert Р.-Н,, 2003) [84], при которых
наблюдается максимальная активация дендритных клеток.Эффективность ДНК-вакцинапии была показана в эксперимен¬
тальных моделях при заражении лабораторныхживотных как разно¬
образными вирусами, так и бактериями и паразитами (Bloom В.R.,
Lambert Р.~Н., 2003). При этом подчеркивалась активация как
ТЫ, так и Th2 иммунного ответа. В этой связи особое внимание
привлекают данные о высокой протективной активности вакцины
«МРТ-51/CpG DNA», защищающей лабораторных животных от
микобактериальной инфекции (Silva B.D. et al., 2009). Ген mpt-51
был найден при расшифровке полного генома М. tuberculosis. Он
ответствен за синтез белков, определяющих присоединение к клет¬
кам макроорганизма, и, по-видимому, относится к генам вирулент¬
Í2.1. ДНК-вакцины и другие генетические вакцины 529ности. Введение вакцины «МРТ-51/CpG DNA» приводило к форми¬
рованию у лабораторных животных ИНФуТ'-лимфоцитов. Новое
направление в профилактике туберкулеза связано с разработкой
вакцины, в основе которой лежит одиночный антиген Mycohacíerium
tuberculosis, белок теплового шока HSP65. В доклинических испы¬
таниях этот белок обнаружил высокий уровень зашиты клеток,
эквивалентный получаемому при вакцинации аттенуированной
живой вакциной [62]. ДНК-вакцины могут быть использованы для
лечения заболеваний, вызванных вирусом Эпштейна-Барр и виру¬
сом гепатита С [62].Безусловным достижением данного направления является созда¬
ние ДНК-вакцины к высокопатогенному вирусу птичьего гриппа
AH7/N1. Принципы получения данной вакцины предполагается реа¬
лизовывать для получения ДНК-вакцин к циркулирующим штаммам
(Szecsi J. ct al., 2009). Также заслуживают внимание с практической
точки зрения, вакцины, в которых гены, кодирующие синтез ней¬
раминидазы и гемагглютинина вируса гриппа, соединены с генами,
регулирующими их экспрессию (см. главу 6).В настоящее время нашла практическую реализацию идея комби¬
нации иммуногенного компонента ДНК-вакцин с генами, контроли¬
рующими синтез цитокинов. Такая вакцина с высоким протек гивным
эффектом была получена против вируса японского энцефалита [870].Интенсивная разработка новых ДНК-вакцин связана с сущест¬
венным преимуществом перед вакцинами предыдущих поколений.
Прежде всего, введение ДНК-вакцин, как правило, приводит к синте¬
зу клетками вирусных антигенов в их нативной форме и, следователь¬
но, к развитию иммунного ответа к нативным антигенам.Во-вторых, ДНК-вакцины индуцируют как гуморальный, так и
клеточный имму1П1ый ответ. Активация цитотоксических Т-клеток
без введения инфекционного агента является важнейшей отличи¬
тельной чертой ДНК-вакцин.В третьих, ДНК-вакцины могут избирательно стимулировать
иммунный ответ к определенным структурам Т-клеток и таким обра¬
зом их инактивировать. Это нашло отражение в разработке новых
подходов в лечении аутоиммунных заболеваний (Хи L. et al, 2009)
[400]. Принцип индукции иммунного ответа к определенным клеточ¬
ным популяциям с помощью соответствующих ДНК-вакцин перс¬
пективен и для лечения аллергических болезней [84].
530 Глава 12. Новая вакцинология и вакцины будущегоБезусловным достоинством ДНК-вакцин является снижение
стоимости их применения за счет уменьшения кратности имму¬
низаций, формирования длительного иммунитета, возможность
стандартизации и упрощение требований к условиям их хранения
и транспортировки.Как и ДНК-вакцины, «генетические» вакцины также способ¬
ны индуцировать клеточный и гуморальный иммунный ответ. Их
можно использовать не только для профилактики инфекционных
заболеваний, но и в перспективе, по-видимому, для лечения ауто¬
иммунных и аллергических заболеваний. Возможность индукции с
помощью генетических вакцин клеточного иммунного ответа или
антителообразования позволила разработать двухэтапную стратегию
вакцинации (так называемую prime-boost иммунизацию), при кото¬
рой наблюдается максимальный протективный эффект. На первом,
prime-этапе активируется Thl-ответ, на втором, boost — интенсивное
антителообразование.Стратегия prime-boost была использована для усиления иммун¬
ного ответа, индуцированного разнообразными ДНК-вакцинами.
Иммунизирующий режим (ДНК-вакцина на первом этапе, внрусньтй
вектор — на втором) с успехом был апробирован при получении анти¬
тел к вакцинному вирусу [354, 589], аденовирусам [496], вирусу птичь¬
его гриппа 1728, 766] и ретровирусам [341].Во втором варианте использования «генетических» вакцин на
первом этапе иммунизацию проводят ДНК-вакцинами, а повторно
используют рекомбинантные белки. Данный режим апробирован при
индукции иммунного ответа к ВИЧ [289, 487], гепатиту С [353, 552],
сибирской язве [393], Mycobacteria [758, 794], Streptococcus pneumoniae [617].Указанные схемы вакцинации активируют различные механиз¬
мы иммунного ответа. ДНК-вакцины активируют разнообразные
субпопуляции Т-лимфоцитов, играющих ключевую роль в развитии
Т-зависимого антителообразования [554]. При иммунизации ДНК-
вакцинами наблюдается предактивация В-клеток памяти, в то время
как при иммунизации рекомбинантными вакцинами превалирует
антителообразование и сразу формирование антителообразующих
клеток, обусловливающих высокий титр антител [566],Наиболее перспективными в создании генетических вакцин счи¬
таются генетические конструкции, в которых в качестве вектора
используют вирусы герпеса [62, 863] и аденовирусы (Lasaro М.О.,
Ertl Н.С„ 2009) [62].
/2.2. «Обратные вакцины» (reverse vacclnes) 53112.2. «ОБРАТНЫЕ ВАКЦИНЫ» (REVERSE VACCINES)Развитие геномики и расшифровка генома возбудителей боль¬
шинства особо опасных и социально значимых инфекций породили
новые пути создания вакцин. В 2000 г. была опубликована статья
R. Rappuoli «Обратная вакцинология» [692J. В ней был описан новый
принцип в создании вакцин. В отличие от традиционных подходов, при
которых неизбежным этапом является культивирование инфекцион¬
ного агента и имеется целый ряд ограничений [294], обратная вакцино¬
логия подразумевает получение вакцин, минуя этап культивирования
патогенов [294]. Она основана на новейших достижениях геномики,
транскриптомики, протеомики и включает установление полной геном¬
ной последовательности патогена, компьютерное моделирование поверх¬
ностных структур и синтез будущего вак[^инного препарата. Данная
методология, основанная на принципе последовательность-структу¬
ра—функция, получила название «функциональной генетики».Впервые полная расшифровка генома бактерии (Я influenza) была
проведена в 1995 г. (Bloom B.R., Lamber! Р.-Н., 2003). В настоящее
время число расшифрованных геномов патогенов достигло 140 [749,
762]. С помощью нового подхода были получены вакцинные препара¬
ты к Neisseria menengitídis В, Síreptococcus pneumonía, Porfiromonas gingivaiis
(Bloom B.R., Lambert R-H., 2003).Методология обратной вакцинологии использована при получении
вакцин к вирусам, в частности РНК-содержашим вирусам [749]. В основе
этих разработок лежит обратная транскрипция генов РНК циркулиру¬
ющих вирусов в ДНК. Сейчас получены ДНК-плазмиды, кодирующие
антигены вируса гриппа. Они используются для трансфекции клеток,
которые в результате начинают синтезировать вирусные антигены. Этот
подход является многообещающей альтернативой сложному и неэф¬
фективному процессу создания разнородной популяции вирусов путем
инфицирования яиц или клеток. Ускорение процесса производства
противогришюзньтх вакцин за счет использования клеточных культур и
методов обратной генетики особенно важно, учитывая постоянно появ¬
ляющиеся новые штаммы гриппа, в том числе штаммы вируса птичьего
гриппа H5N1, способного вызывать заболевание у людей. Кроме того,
достоинством данной методологии является сокращение времени между
идентификацией вируса и созданием вакцины [684].Дан ные, подтверждающие роль иммунных механ измов врезистент-
ности к некоторым паразитам, явились основанием для апробации
532 Глава Í2. Новая вакцинология и вакцины будущегообратной вакцины к Schistosoma. Эта вакцина по своей эффективнос¬
ти превосходила вакцину к церкариям, полученную облучением, и у
животных, и в человеческой популяции (Feng X.G. et al,, 2007).Необходимо отмстить, что, несмотря на явные успехи в создании
обратных вакцин, поиск и отбор антигенов, обладающих протектив¬
ной активностью, не во вссх случаях эффективен. Обратная вакцина,
полученная к Spirochaete brachyspira hyodysenteriae -- анаэробу, вызыва¬
ющему серозно-геморрагический колит свиней, была эффективной
только у пяти из девяти животных, несмотря па тщательный отбор
кандидатов вакцин. В то же время все 19 вакцинных препаратов у
мыщей вызывали интенсивное антителообразование [762|.Сложность отбора обратных вакцин, основанного на анализе
геномной последовательности, демонстрируют данные, полученньге
при создании вакцины к Streptococcus suis serotype 2, зоопатогена,
вызывающего тяжелейшие заболевания и даже смерть как у свиней,
так и у человека. При создании вакцины к этой инфекции на основа¬
нии данных геномного анализа и биоинформативиого компьютерного
анализа было отобрано 153 гена, кодирующих кандидаты в вакцины.
На основании экспериментальных данных значимость для создания
вакцин была подтверждена у 10. Восемь из полученных генов были
успешно экспрессированы в Е. coli Rosetta. Полученными рекомби¬
нантными, субъединичными антигенами иммунизировали мышей.
Из 8 антигенов только 4 — экзотоксин А (RfcA), поверхностный анти¬
ген (ESA), иммуноглобулин G (1§С)-связывающий протеин (IBP) и
суилизин (SLY) — обладали протективной активностью и защищали
мыщей от инфекции. RfeA, ESA, IBP индуцировали антителообра-
зование, а суилизин — и антителообразование и клеточный иммун¬
ный ответ [559]. Учитывая стратегию prime-boost для генных вакцин,
убедительно доказавшую преимущество индукции сочетанного Thl-
ответа и антителообразования, из 153 начальных кандидатов реально,
для практического использования, можно было отобрать 1,12.3. РАСТИТЕЛЬНЫЕ РЕКОМБИНАНТНЫЕ ВАКЦИНЫ
(СЪЕДОБНЫЕ ВАКЦИНЫ)Традиционно для получения рекомбинантных вакцин исполь¬
зуются клетки бактерий или дрожжей (Bloom B.R., Lambert Р.-Н.,
12.3. Растительные рекомбинантные вакцины (съедобные вакцины) 5332003) [62, 84]. Однако использование бактерий не всегда оправдано,
поскольку в них не происходит посттрансляционной модификации
и пространственной ориентации поли пептидных цепей эукариоти¬
ческих белков [62J. Использование дрожжей в качестве штаммов-про-
дуцентов ограничивает высокая себестоимость данного подхода [62],
Развитие генно-инженерного подхода в создании вакцин определило
использование в качестве продуцентов различных растений. Это
направление начало развиваться с созданием трансгенных растений
[288]. Его сразу начали рассматривать как дешевый способ производ¬
ства безопасных вакцин, поскольку культивирование растений не гре¬
бует дорогостоящего оборудования, а сельскохозяйственные масшта¬
бы продукции гарантируют доступность рекомбинантного препарата
в количествах, достаточных для клинических испытаний и широкого
терапевтического использования. Более того, создание растительных
вакцин с самого начала подразумевало получение разнообразных съе¬
добных вакцин, обеспечивающих зашиту от различных инфекций —
гепатита В [583], бешенства [611], цигомегаловируса [783], холеры [223],
токсигенных штаммов Е. соИ [7851,В настоящее время для получения вакцин используют различные
сельскохозяйственные культуры — фасоль, кукурузу, рис, пшеницу и
картофель [784]. Если в начале эры растительных вакцин в качестве
векторов служили бактерии Agrobacterium tumefaciens, содержащие
неонкогенные Ti-плазмиды и обладающие высокой вирулентностью,
и вирусы — вирус табачной мозаики (ВТМ), вирус мозаики коровьего
гороха (ВМКГ) и вирус Norwalk [62, 784], то в настоящее время для
генно-инженерных конструкций используются специально синтези¬
руемые векторы [414, 505]. Данные векторы определяют стабильность
наследования, высокую экспрессию и постгеномную модификацию, а
также продукцию целевого препарата в водорастворимых формах, что
особенно важно при создании съедобных вакцин [414, 505]. Последнее
обстоятельство существенным образом сказывается на стоимости
вакцин, поскольку не требуется выделения конечного продукта.Использование «векторной технологии» переноса целевого гена
существенным образом ограничивало круг растений-продуцентов.
Это стимулировало поиск новых способов переноса фрагментов экзо¬
генной ДНК в геном растений. Были разработаны методы прямой
доставки чужеродных генов в растительный геном, такие как микро-
инъекции, электропорация. Кроме того, в настоящее время использу¬
ют прямой перенос ДНК целевого антигена. Данная технология осно¬
534 Глава 12. Новая вакцинология и вакцины будущегована на обстреле ткани микрочастицами золота (или других тяжелых
металлов), покрытыми раствором ДНК [62]. Однако при получении
трансгенных растений, а именно интеграции гетерологичных генов в
ядерный геном растений, высока вероятность подавления экспрессии
целевого гена в последующих поколениях. Вероятность этого события
существенно возрастает при одновременном переносе нескольких
целевых генов или при нескольких вставках одного гена. Поэтому при
создании трансгенных растений-биопродуцентов рекомбинантных
белков среди трансформантов отбирают растения, содержащие толь¬
ко одну встройку чужеродного гена [784].В настоящее время широко используется еще один вариант пере¬
носа генетической информации в растения — с помощью PH К-содер¬
жащих вирусов, обладающих естественной способностью проникать в
клетки растений и размножаться в них. Генетические РНК-конструк-
ции на основе РНК-содержащих вирусов являются не только векто¬
ром доставки, но и матрицей для последующей трансляции целевых
белков. Для заражения растительных тканей используются реком¬
бинантные (+)РНК-содержащис вирусы растений, несущие в составе
своего генома транскрипт чужеродного гена. Скорость мультипли¬
кации вирусной РНК в растениях чрезвычайно высока, за счет чего
достигается высокая копийность транскриптов чужеродных генов в
цитоплазме зараженных клеток. Поэтому продуктивность вирусной
системы экспрессии в среднем на два порядка выше по сравнению со
стабильной трансформацией растений [410].Использование для переноса генетической информации векто¬
ров приводит к стабильному встраиванию в геном целевого гена с
сохранением в последующих поколениях. В случае создания расти¬
тельных вакцин с помощью вирусов происходит только временная
экспрессия. Накопление соответствующих белковых продуктов будет
определяться периодом вегетации зараженного растения-хозяина.
С другой стороны, преимуществом вирусного пути накопления бел¬
ков в растениях является короткий период размножения вирусных
частиц, простота инфицирования растений, а также широкий диапа¬
зон различных видов растений, которые могли бы быть использованы
для этих целей [410].Основным ограничением повсеместного использования раститель¬
ных вакцин является низкий выход целевого продукта. Связано это со
следующими причинами. Во-первых, с низким уровнем экспрессии целе¬
вых генов, даже при использовании адекватных промотеров, во-вторых.
12.3. Растительные рекомбинантные вакцины (съедобные вакцины) 535с высоким уровнем биодеградации чужеродных белков, а при использо¬
вании РНК-содержащих вирусов с активацией специальных механизмов
элиминации вирусной РНК [823J. Кроме того, при интеграции гетеро¬
логичных генов в ядерный геном растений существует опасность утечки
трансгена в окружающую среду (выход из-под контроля) в результате
переопыления с близкородственными дикорастущими видами.Это ограничение было с успехом преодолено, и в настоящее время
трансген экспрессируют в хлоропластах. Хлоропласты относятся к
органеллам, известным как пластиды, они располагаются в клетках
листьев. Их называют биорсакторами, поскольку они обладают своей
ферментативной системой, в них происходит поглощение световой
энергии и осуществляются фотохимические реакции, происходит
поглощение углекислого газа и выделение кислорода, синтез клетчат¬
ки, аминокислот, жирных кислот, пигментов и происходит метабо¬
лизм азота [306].Обычно геном хлоропластов состоит из 110—120 генов, и они никог¬
да не диссеминируют в пыльцу, что делает «нластидную» генную
инженерию безопасной с точки зрения неконтролируемого распро¬
странения генетически модифицированных растений. Производство
генно-инженерных биофармацевтических продуктов и вакцин в плас¬
тидах привлекательно и с точки зрения безопасности, поскольку при
данной технологии не используются ни патогены человека, ни бакте¬
риальные или вирусные векторы млекопитающих. В одной раститель¬
ной клетке в среднем содержится от 5 до 10 тыс. копий хлоропластной
ДНК, за счет чего уровень экспрессии чужеродных белков достигает
значений, сравнимых с уровнем экспрессии в Е. соИ [306]. Содержание
конечного продукта в пластидах по сравнению с переносом в геном
может превышать в 500 раз (Rigano М.М. et al., 2009).Хлоропласт — идеальный носитель для экспрессии трансгена.
Интеграция трансгена в геном хлоропласта происходит при рекомби¬
нации гомологичных фланговых последовательностей, используемых
в векторах хлоропласта. Для поддержания максимальной экспрессии
трансгена в генетическую конструкцию вектора вводят регуляторные
гены. Кроме того, для создания трансгснов используются специально
разработанные стандартные векторы (табл. 60) [823]. В этой таблице
наглядно демонстрируется применение для большинства генетиче¬
ских конструкций унифицированного промотера, и только для столб¬
нячного и холерного токсинов, а также гена, кодирующего боррелии
(болезнь Лайма), использовались нестандартные решения.
536Глава Í2, Новая вакцинология и вакцины будущегоТаблица 60Стандартные лромотсры для пластидных генетических конструкцийНазвание продукта,
инфекционного агента
или заболеванияТрансгенПромотерИнсулиноподобный
ростовой фактор
ИНФа2ЬСывороточный альбу¬
мин человека
ГТарвовирус собак
Сибирская язва
Амебиоз
Чума
Ротавирус
Гепатит Сigf-in igf-is
ifna2bhsalctb-2121 gfp-2121
Pag
lecA
CaFl-LcrV
VP6
NS3Prrn/PpsbA/TpsbAБолезттъ Лайма
ИНФуosp-a osp-t
gus-IFN-yPpsbA/TpsbAХолерный токсинctx-bPrrn/ggagg/TpsbAСтолбнячный токсинtet-c бактериальныйPrrn/T7gene 10/TrbcLСтолбнячный токсинtet-c синтетическийatpB/TrbcLВ настоящее время в качестве носителей векторов используется
цветная капуста {Brassica oleráceo), капуста {Brassica capitata), салат
{Lactuca sativa), масляничные культуры {Brassica napus), петуния
{Petunia híbrida), тополь {Populous spp.), картофель {Paslen tuberosum).,
табак {Nicotiana tabacum), томаты {Pasten lycopersium), морковь {Dacus
carota), хлопок {Gossypium hirsutun), рис {Oriza sativa) и соя {Gdcin
max), С помощью пластидной технологии получены в промышлен¬
ных масштабах биофармацевтические белки — инсулин, интерферо-
ны, соматотропин; вакцины, защищающие от холеры, токсигенной
Е. соИ, столбняка, дифтерии, коклюша, сибирской язвы, чумы, болез¬
ни Лайма, ортопоксовируса, натуральной оспы, собачьего парвови-
руса, ротавируса, вируса папилломы человека 16 типа, протозойного
амебиаза, шистозомоза. Данные вакцины вызывали развитие иммун¬
ного ответа и интенсивную продукцию антител у лабораторных
животных и защищали их от инфицирования или действия токсинов
(Rigano М.М. et al., 2009) [225, 305, 306, 543, 710, 823, 824].
пл. Терапевтические вакцины 537В заключение этого раздела необходимо еще раз подчеркнуть,
что пластидные вакпины, с одной стороны, являются источником
для производства субъединичных вакцин и, с другой стороны, уже
сейчас некоторые из них используются как съедобные вакцины. При
этом вследствие высокой экспрессии гена и стабильности продукта в
пластиде возможно масштабное получение вакцинных препаратов.
В настоящее время при получении трансгенных растений разрабаты¬
ваются и в ближайшее время будут внедрены новейшие технологии
максимальной и стабильной экспрессии целевого гена и съедобные
вакцины для большинства инфекций [306, 824],12.4. ТЕРАПЕВТИЧЕСКИЕ ВАКЦИНЫВозможность активации антителообразования или клеточного
иммунного ответа к инфекционным агентам привела к возрожде¬
нию «забытого» направления вакцинологии — созданию терапевти¬
ческих вакцин. Первоначально термин «терапевтические вакцины»
использовался для обозначения антигенсодержащих вакцинных
препаратов, стимулирующих протективный (обычно клеточный)
иммунный ответ, направленный на подавление и удаление инфек¬
ционного агента и устранение клинических проявлений инфекци¬
онного процесса. Однако позднее терапевтические вакцины рас¬
сматривали как антигенсодержашие препараты, стимулирующие
специфический противоопухолевый иммунитет 184] (см, главу 10),
В обоих случаях у пациентов с хронической вирусной инфекцией [61]
или опухолевым процессом с помощью соответствующих антигенсо¬
держащих препаратов стимулировали клеточный иммунный ответ
[340]. Данная идеология была реализована при получении тера¬
певтических вакцин к инфекционным заболеваниям, вызванным
Helicobacter pylori, Candida, вирусами герпеса, вирусом папилломы
человека [84], и апробирована при лечении больных туберкулезом
легких. В последнем случае гюсле вакцинации больных туберку¬
лезом легких новой вакциной, содержащей протективный антиген
85А, наблюдалось улучшение как клинической, так и рентгеноло¬
гической картины, а при лабораторных исследованиях в течение
52 нед наблюдался синтез ИНФу и ИЛ-12 клетками, полученными из
очагов поражения [726|.
538 Глава 12. Новая вакцинология и вакцины будущегоНа современном этапе разработка терапевтических вакцин данного
типа обычно основана на всестороннем тщательном отборе эпитопов,
стимулирующих клеточный иммунный ответ, получении плазмид,
содержащих гены, кодирующие соответствующие Т-эпитопы, включе¬
нии в вакцинный препарат гена, кодирующего универсальный pan-DR-
эпитоп (PADRE), и доказательстве эффективности вакцин в prime-boost
стратегии. Данный подход был назван «рациональной стратегией созда¬
ния терапевтических вакцин». Сложность проблемы наглядно демонс¬
трирует дизайн кандидатной терапевтической вакцины. В частности,
терапевтическая вакцина против гепатита В включает 30 эпитопов,
распознаваемых цитотоксическими лимфоцитами, 16 эпитопов, сти¬
мулирующих антителообразование, и универсальный PADRE-эпитоп,
распознаваемый Т-клетками человека (Depla Е. et al., 2008).Терапевтические вакцины в соответствующих случаях могут быть
использованы и для лечения инфекций, протективный иммунитет
к которым определяется антителами или механизмами врожденного
иммунитета. Воспалительный процесс, вызванный уропатогенной
Е. соН, полностью купируется живым аттенуированным штаммом
Е. соН, стимулирующим антителообразование и продукцию цитоки¬
нов макрофагами урогенитального тракта [263].Будущее терапевтических вакцин связывают с усилением экспрес¬
сии генов, кодирующих Т- или В-эпитопы. Для этих целей использу¬
ются различные мутантные щтаммы Listeria monocytogenes. В насто¬
ящее время создано более 60 мутантных векторов на основе Listeria
monocytogenes, экспрессирующих семь индивидуальных вирусных или
бактериальных антигенов [861].12.5. ВАКЦИНЫ ПРОТИВ СОМАТИЧЕСКИХ
(НЕИНФЕКЦИОННЫХ) БОЛЕЗНЕЙВ вакцинопрофилактике соматических болезней есть несколько аспек¬
тов. Во-первых, снижение соматической заболеваемости, подъем кото¬
рой наблюдается во время эпидемий различных инфекций, во-вторых,
профилактика заболеваний, тесно ассоциированных с инфекционными
процессами, в-третьих, заболеваний, которые определяются иммуноло¬
гическими механизмами, и, наконец, заболеваний, для лечения которых
используются методы индукции специфического иммунного ответа.
12.5. Вакцины против соматических (неинфекционных) болезней 539Все указанные аспекты рассмотрены в сборнике статей под общим
названием «Вакцинопрофилактика неинфскдионных заболеваний».
В нем был представлен комплекс иммунологических подходов в про¬
филактике (снижение заболеваемости) или лечении неинфекционной
патологии. Наиболее значимые результаты использования соответ¬
ствующих вакцин были получены при лечении болезни Альцгеймера,
аллергии и опухолевых процессов [29]. Аллерготропинам и вакцинам
против рака посвящена предыдущая глава. В данной главе будут при¬
ведены новые данные по лечению вакцинными препаратами аллер¬
гических и аутоиммунных заболеваний и дана характеристика новых
вакцин для лечения болезни Альцгеймера.12.5.1. ВАКЦИННЫЕ ДИК-КОНСТРУКЦИИ, СТИМУЛИРУЮЩИЕ
ТЫ-ОТВЕТ, В ЛЕЧЕНИИ АЛЛЕРГИЧЕСКИХ ЗАБОЛЕВАНИЙВ настоящее время иммунотерапия аллергических заболеваний,
обусловленных IgE-антителами, эксплоатирует идею подавления
Th2-0TBeTa и оппозитную активацию Th 1-типа. Оказалось, что для
реализации этого подхода можно использовать не только специфиче¬
ские аллергены или соответствующие аллерготропины (см. главу 10),
но и неспецифическую стимуляцию. Сейчас считается твердо уста¬
новленным, что наблюдаемый при аллергической бронхиальной астме
дисбаланс Thl/Th2 играет ключевую роль в ее патогенезе. В модели
аэрогенной бронхиальной астмы, сопровождающейся эозинофилией
и аллергическим бронхитом, была установлена профилактическая
и терапевтическая роль ДНК-вакцины, экспрессирующей протек¬
тивный антиген А85В, защищающей мышей от развития инфекции
М. tuberculosis и индуцирующей доминантный ТЫ-ответ. При инт-
раназальном введении вакцины устранялись воспаление, вызванное
аэрогенным введением аллергена, и эозинофильная инфильтрация
слизистой бронхов подопытных животных. Эффект Аг85В-ДНК-вак-
цины не только проявлялся местно, но и приводил к доминированию
клеток, продуцирующих ИНФу [856].В параллельно опубликованной работе было показано, что ДНК-
вакцины, кодирующие Ag85B, подавляют ТЬ2-индуцированный
аллергический ответ. При этом ДНК-вакцины активируют сигналь¬
ный путь (ТВК1) «TANK-связываюшей киназы-1» — TBK1/IRF-3/
STAT-1 [318, 541], приводящий к продукции ИНФу,р.
540 Глава 12, Новая вакцинология и вакцины будущегоАктивация сигнального пути ТВК1 рассматривается как современная
стратегия повышения иммуногенности ДНК-вакцин и индукции Thl-
ответа [541], а ДНК-вакцины — как перспективные препараты в лечении
аллергических заболеваний [789]. Это положение хорошо иллюстрируют
данные, показывающие, что аэрогенная сенсибилизация мышей яич¬
ным альбумином (Я А) может быть подавлена ЯА-липосомальным-ДНК-
содержащим комплексом, активирующим Thl-ответ,ДНК-содержащая вакциноіюдобпая конструкпия, экспрессиру¬
ющая вектор трансформирующего ростового фактора-бста (ТФРр),
вызывала у мышей снижение симптоматики пищевой аллергии [549].12,5.2. ВАКЦИНЫ, ПОДАВЛЯЮЩИЕ АУТОИММУННЫЕ РЕАКЦИИВ первом издании книги «Вакцинология» Н.В. Медуницин пред¬
полагал, что будут созданы вакцины, подавляющие аутоиммунные
реакции |841. Действительно, в настоящее время в эксперименталь¬
ных моделях дли лечения аутоиммуипых заболеваний применяют
«вакциноподобные конструкции». В частности, в патогенезе ревма¬
тоидного артрита центральную роль играют артритогенные Т-лим¬
фоциты с общим Т-клеточным рецептором (TCR) — V-beta клоно-
типы. При коллагеновом ревматоидном артрите крыс повреждение
суставов обусловлено TCR Vbeta 5.2 и TCR Vbeta 8.2. Рекомбинантные
ДНК-вакцины, кодирующие TCR Vbeta 5.2 и TCR Vbeta 8,2, инду¬
цировали иммунный ответ против Т-клеток, формирующихся при
«модельном ревматоидном артрите» и имеющих общий Т-клеточный
рецептор Vbeta 5.2 и Vbeta 8,2, что приводило к инактивации данных
клонотипов и устранению проявлений ревматоидного артрита [400].
ДНК-вакцины с успехом использовали при индукции иммунного
ответа геном, кодирующим синтез экстрацеллюлярного домена CD25
(рецептор к ИЛ-2), Полученные антитела подавляли в эксперименте
КонА-иидуцированный аутоиммунный гепатит (Xu L. et al., 2009).12.5.3. ВАКЦИНОТЕРАПИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРАБолезнь Альцгеймера (АБ) — прогрессирующее нейродегенератив-
ное расстройство, приводящее к деменции. В основе ее лежит пора¬
жение так называемых нейроваскулярных единиц — участков мозга,
12.5. Вакцины против соматических (неинфекционных) болезней 541включающих периваскулярные нейроны, перициты, астроциты и
конечные питающие сосуды [213]. Это поражение обусловлено образо¬
ванием пептидных бляшек с ам и лоидр (Абета) как в нейроваскулярной
единице, так и в сосудах, что приводит к церебральной амилоидной
ангиопатии. Модель АБ была получена и у мышей. Многочисленные
попытки предотвращения образования Абета или их рассасывания
у мышей показали перспективность использования антител к Абета.
Их введение приводило к рассасыванию бляшек и восстановлению
функции пораженных участков мозга. Это послужило основанием
для разработки вакцин для лечения болезни Альцгеймера на осно¬
ве амилоидр-пептидов, исключающих формирование Т-клеточного
иммунного ответа (Rossi М. et al., 2009).В настоящее время проводят клинические испытания первой вак¬
цины для лечения болезни Альцгеймера у человека AN1792. Данная
вакцина представляет собой мультикомпонентную систему фраг¬
ментов коротких пептидов (AF1T0PE), имитирующих нативную
последовательность Абета. Для индукции высокого уровня антител
в качестве адъюванта в этой вакцине используется гидроокись алю¬
миния. Сочетание пептидов в данной вакцине также исключает
формирование аутореактивных Т-клеток [739]. Сложность получения
высокоэффективной вакцины для лечения болезни Альцгеймера
обусловлена усилением при использовании цельной молекулы Абета
в пораженных сосудах геморрагического васкулита [848J. Однако
использование для вакцинации пептидов, по-видимому, позволит
обойти это обстоятельство. Кроме того, вакцина AN1792 может быть
использована исключительно как профилактическое средство [739].
список ЛИТЕРАТУРЫ1. Абелев Г,И. Иммунология злокачественных опухолей // Вести. АМН
СССР. - 1974. - № 2. - С. 23-29.2. Аксенова В.А. Современные подходы к вакцинации противтуберкулёза//
Вакцинация. — 2002. — Т. 19. — № 1. — С. 6—7.3. Аксенова В.А. Противотуберкулезная вакцинация в современных усло¬
виях // Биопрепараты. - 2004. - Т. 13. - № 1. - С. 2-5.4. Алексеев Л.П., Дедов И.И., Болдырева М.Н., Зилов A.B., Хаитов P.M.
HLA-гсны — маркеры инсулин-зависимого сахарного диабета, этниче¬
ские аспекты // Иммунология. — 2003. — Т. 24. - № 5. — С. 308-311.5. Алексеев Л.П., Долбин А.Г., Топтыгин А.Ю., Прокофьев С.А., Коренько-
ва Е.В., Сечкин A.B., Смирнов В.П., Мойсюк Я.Г., Тоневицкий А.Г.,
Шумаков В.И., Хаитов P.M. Клиническое использование моноклональ¬
ных антител и иммунотоксинов // В кн.: Современные проблемы аллер¬
гологии, клинической иммунологии и иммунофармакологии. Труды
2-го Национального конгресса Российской ассоциации аллергологов и
клинических иммунологов. - М., 1998. - С. 325.6. Алексеев Л.П., Федорова О.Е,, Зарецкая Ю.М., Сластен О.П. Изучение
роли HLA-D и CD антигенов при беременности в норме и патологии //
Терапевт, арх. — 1980. - № 6. - С. 8-15.7. Алексеев Л.П., Федорова O.E., Сластен О.П. Активация Т-клеток эффекто¬
ров в период родоразрешения // Иммунология. — 1984. - № 2. — С.69-^72.8. Алексеев Л.П., Яздовский В.В., Хаитов P.M. Межэтнические различия
в генетическом контроле иммунного статуса человека // Рос. физиол,
журн, им. И.М. Сеченова. - 2000. - Т. 86. - № 3. - С. 280—284.9. Алексеева Н.Ю., Насыров A.A., Хаитов P.M. Генетический контроль
иммунного ответа на антигены Salmonella typhimurium. Влияние генотипа на
иммунный ответ к 0-антигену // Иммунология. - 1981. - № 1. - С, 64-67.10. Аллахов В.Ю., Аржаков С.А., Василенко О.В., Волощук С.Г,, Глазкова-
Степанеико И.С., Дувакин И.А., Ишков А.Г., Кабанов A.B., Каба¬
нов В.А., Клинский Е.Ю., Кравцова Т.Н., Петров Р.В., Свешников П.Г.,
Северин Е.С. Новый при1щиг1 создания иммунотерапевтических соеди¬
нений направленного действия. Физиологически активные вещества,
обратимо экранированные мишень-узнающими микромолекулами //
ДАН СССР - 1988. - Т. 303. - № 6. - С. 1494-1497.И. Андронова Т.М. Биологические свойства синтетических бактериаль¬
ных гликопептидов // Труды V Всесоюзного биохимического съезда. -
М., 1985. - С. 171-172.12. Априкян B.C., Михайлова A.A., Петров Р.В. Повышение под влияни¬
ем миелопсптида-3 антигенпредставляюшей функции макрофагов //
Иммунология. - 2000. - № 2. - С. 21—23.
544 Список литературы13. Атауллаханов Р.И., Петров Р.В,, Хаитов Р.М, и др. Активация ионтранспорти-
руюших АТФаз плазматической мембраны лимфоцитов под дейстпмем мито¬
генных доз полиионов //Докл. АН СССР. - 1984. - Т, 274. - № 2. - С 479-482.14. Атауллаханов Р.И., Пичугин A.B., Мельникова Т,М., Хаитов P.M.
Повышение иммуногенности белковых антигенов путем конъюгации с
иммуномаксом // Иммунология. - 2008. - Т. 29. - № 6. - С. 334-337.15. Атауллаханов Р.И., Хаитов P.M., Петров Р.В. и др. Взаимодействие моле¬
кул полииона с плазматической мембраной лимфоцитов, различаютцих-
ся плотностью заряженных групп на клеточной поверхности // Бюлл.
эксперим. биологии и медицины. - 1984. - № 5. - С. 588-590.16. Балдуева И.А. Противоопухо.тевыс вакцины // Практическая онкология. —2003. - № 3-4. - С. 157-166.17. Балдуева И.А., Моисеенко В.М, Вакцинотерапия злокачественных опу¬
холей (молекулярно-генетические аспекты) // Труды IX Российского
онкологического конгресса. - 2005, — С. 14-16,18. Барышников А.Б, Моноклональные антитела в изучении антигенов лей¬
коза человека. (Иммунология опухолей). — М., 1984. — С, 243-286 (Итоги
науки и техники. Сер. Онкология; Т. 13).19. Барышников Л.Ю, Принципы и практика вакцинотерапии рака //
Бюллетень СО РАМН. - 2004. - Т 112. - X« 2. - С. 59-63.20. Бектимиров ТА. Побочное действие вакцин // Вакцинация 2000. - Т 2. -
№ 8. - С. 6-8.21. Бектимиров Т.А. Стратегия контроля над полиомиелитом в постэради-
кационном периоде // Вакцинация. - 2002. - Т. 24. - № 6. - С. 6-7,22. Бектимиров Т.А., Воробьева М.С., Расщепкина М,Н., Чеканова ТА., Сидо-
рович И.Г, Николаева И.А., Коробова С.В,, Гудима Г.О., Игнатьева ГА. Докли¬
ническое изучение кандидат-вакцины против ВИЧ/СПИД «ВИЧРЕПОЛ» //
Аллергия, астма и клин, иммунол. — 2003. - № 9. — С. 130—134.23. Белевская Р.Г., Михайлова A.A., Луценко Г,В. и др. Влияние миелонеп-
тида-3 на функциональную активность макрофагов //Иммунология. -
2000, - № 2. - С. 23-26.24. Бережная И.М., Чехун В,Ф. Иммунология злокачественного роста. —
Киев: Наукова думка, 2005. - 781 с.25. Болдырева М.H., Хаитов Р.М,, Барцева О,Б. и др. Исследование роли
HLA-DR81-генов при невынашивании беременности ¡геясного генеза //
ИммyнoJюгия. - 2004. - Т. 25. - № 1, - С. 4-8.26. Будихина A.C., Пинегин Б.В. Роль HNP и НВО при заболеваниях дыха¬
тельной системы // Физиол. и патол. иммунной системы. — 2008. — Т. 12,—
№ 5. - С. 3-8.
Список литературы 54527. Букринская А.Г. Матриксный белок вируса гриппа: свойства, функции и
роль п диагностике гриппа//Вопр. вирусологии. - 1985.-№ 1.-С. 16-21.28. Бурцева Е.И., Слепушкин А.H., Беляева А.Л. и др. «Гриппол» — эффек¬
тивный препарат для иммунизации лиц пожилого возраста против
гриппа // Иммунология. - 2000. - № 2. — С. 39-42.29. Вакцинация. Вакцинопрофилактика неинфекционных заболеваний, —2004. - № 4.30. Вакцинопрофилактика (справочник для врачей) / под ред, В.К. Тато-
ченко, H.A. Озерецковского. — М., 2000. - 174 с.31. Виноградов И В. Иммуногенность альфа-фетопротеина и го.мологич-
ных ему белков, соединенных с синтетическими полиэлектролитами:
аптореф. канд. дис. - М,, 1983. - 24 с.32. Виноградов И.В., Кабанов В.А., Мустафаев М.И. и др. Комплексы белков
с неприродными полиэлектролитами — тимуснезависимые антигены //
Докл. АН СССР. - 1982.- Т. 263. - № 1. - С. 228-230.33. Вольпина О.М., Суровой А.Ю., Снеткова Е.В. и др. Синтетическая анти¬
генная детерминанта поверхностного белка VP, вируса ящура: Тезисы
докл. 16-й конференции ФЕБО. — М., 1984. — С. 369.34. Воробьев A.A., Васильев H.H. Адъюванты. — М.; Медицина, 1969. - 206 с.35. Галавит. Клиническое использование и механизмы действия / под ред.
A.A. Подколзина, Т.И. Гришиной. — М.: Внешторгиздат. — 2002. - 103 с.36. Голощапова Е.Н., Голощапов Н.М,, Заварзин А.А. Изофон. Новый бифунк¬
циональный иммуномодулятор. - М.: Принт-Экспресс. — 2002, — 210 с.37. Гольдштейн A.B., Семенов Б.Ф. Проблема «птичьего гриппа» и пандемия
гриппа в человеческой популяции // Ремедиум. - 2005, Март. - С. 40-43.38. Горбачева Л.Д. Взаимодействие макрофагов с лимфоцитами in vitro:
генетический контроль и влияние синтетических полиэлектролитоп:
автореф. дис. канд. биол. наук. — М., 1981. — 25 с.39. Гордон Ада. Вакцины и вакцинация (обзорная статья) //Международный
мед. журн. - 2002. - № 1. - С. 1-13.40. Горностаева Ю,А., Латышева ТВ., Манько К.С., Пинегин Б.В., Сетдико-
ва Н.Х. Применение синтетических аналогов эндогенных иммунорегу-
лягорных пептидов в терапии больных хроническим рецидивирующим
фурункулезом //Иммунология. - 2006. - № 5. - С. 307-312.4L Грачев В.П.,ЕвреиноваЕ.Э., КаргановаГ.Г., Румянцев A.A. Молекулярно¬
генетические методы контроля живой (оральной) полиомиелитной вак¬
цины //Биопрепараты. - 2001. - № 1. - С. 17-21.42. Гудима Г.О., Игнатьева Г.А., Николаева И.А., Сидорович И.Г., Хаи¬
тов P.M. Пандемия ВИЧ/СПИД: контроль, анти-ВИЧ-вакцины, совре-
546 Список литературыменнос состояние проблемы и перспективы в России // Физиол. и патол.
иммунной системы. — 2004. — № 1. - С. 30-35.43. Гудима Г.О., Николаева И.А., Сидорович И.Г., Коробова С.В., Игнать¬
ева Г.А., Ольховик Е.И., Воробьева М.С., Чеканова Т.А., Хаитов P.M. Фор¬
мирование единой системы испытаний иммуногенов и вакцинирую¬
щих препаратов против ВИЧ/СПИД и разработка программы I фазы
клинических испытаний анти-ВИЧ/СПИД-вакцины ВИЧРЕПОЛ //
Физиол. и патол. иммунной системы. — 2005. — № 8. — С. 117—121.44. Гудима ГО., Сидорович И.Г., Карамов Э.В., Решетников A.B., Хаи¬
тов P.M. Клинические испытания и их вклад в совершеттствование анти-
ВИЧ-/СПИД-вакиин // Физиол. и патол. иммунной системы. — 2007. —
Т. 11.-№ 12.-С. 3-19.45. Гущин И.С. Ключевые звенья аллергического процесса, уязвимые для
фармакологического воздействия // Физиол. и патол. иммунной систе¬
мы. - 2004. - Т. 8. - № 1. - С. 36-43.46. Дедов И.И., Кураева Т.Л., Петеркова В.А., Носиков В.Б., Сергеев A.C.,
Титович Е.В., Колесникова ГС. Генетические факторы в развитии сахар¬
ного диабета I типа в России // Молек. мед. - 2003. - № 1. - С. 31-41.47. Деев С.М., Поляновский О.Л. Моноклональные антитела для диагнос¬
тики и терапии // Биотехнология. - 2008. — № 2. — С. 3-13.48. Деев С.М., Стремовский O.A., Лукаш С В., Карпенко Д.В., Полянов¬
ский О.Л., Петров Р.В, Продукция рекомбинантных противораковых
антител клетками НЕК-293 // Биохимия, биофизика, молекул, биоло¬
гия. - 2006. - Т. 406. - № 6. - С. 1-3.49. Демина A.A., Спирихина Л.В. HlV-инфекция: меры борьбы и профилак¬
тики // Эпидемиол. и инфекционные болезни. — 2001. — № 3. - С. 52—56.50. Евдаков В.П., Кабанов В.А., Кожинова Е.В. и др. Влияние синтетиче¬
ских полиамфолитов на взаимодействие Т- и В-лимфоцитов // Докл.
АН СССР. - 1975. - Т. 224. - № 2. - С. 464-467.51. Егорова Н.Б., Семенов Б.Ф., Курбатова Е.А., Ястребова Н.Е. Динамика
аутоатгтител у пожилых людей в процессе вакцинации грип полом и
поликомпоненттгой вакциной ВП-4 // Журн. микробиологии. - 2002. -
№ 5. - С. 29-35.52. Ельшина Г.А., Масалин Ю.М., Шерварли В.И. и др. Изучение гриппоз¬
ной тривалентной полимер-субъединичной вакцины Гриппол в услови¬
ях контролируемого эпидемиологического опыта // Военно-мед. журн. -
1996, - Т. 318. - № 8. - С. 57-60.53. Зильбер Л.А., Абелев Г.И. Вирусология и иммунология рака. — М.: Гос.
издат. мед. литературы, 1962. - 458 с.
Список литературы 54754. Зильбер Л,А., Ирлин И.С., Киселев Ф.Л. Эволюция вирусо-геттетической
теории возникновения опухолей. — М.: Наука, 1975. - 344 с.55. Кабанов В.А., Мустафаев М.И., Некрасов A.B. и др. Критический харак¬
тер влияния степени полимеризации по.'сиэлектролитов на их иммунос¬
тимулирующие свойства // Докл. АН СССР. — 1984. - Т. 274, - № 4. -
С. 998-1001.56. Кабанов В.А., Мустафаев М.И., Норимов А.Ш. и др. Иммуногенность
комплекса бычьего сывороточного альбу.мина с поли катионом, нагру¬
женным гидрофобными боковыми группами // Докл. АН СССР. —
1978. - Т. 243. - № 5. - С. 1130-1133.57. Кабанов В.А., Петров Р.В., Хаитов Р,М, Новый принцип создания искус¬
ственных иммуногенов // ЖВХО им, Д.И. Менделеева. - 1982. - Т. 27, -
№ 4. - С. 417-428.58. Канлина Э.Н., Вайнберг Ю.П. Деринат. Природный иммуттомодулятор
для детей и взрослых. — м.: Научная книга, 2007. - 240 с.59. Карамов Э.В., Гарманова A.B., Хаитов P.M. Мукозный иммунитет и его
особенности // Иммунология. — 2Ü08. — Т. 29. - № 6. - С. 377-384.60. Карамов Э.В,, Павлова Т.В,, Корниласва Г.В., Сидорович И.Г., Ба¬
жан С.И. Канлидатиые анти-ВИЧ-вакцины индуцируют сильный ней-
трализационный ответ // Аллергия, астма и клин, иммунол. - 2003. -
№9.-С. 144-151.61. Карамов Э.В., Сидорович И.Г., Хаитов P.M. Новая вакцинология.
Вакцины против ВИЧ/СПИДа. - М.; МИА, 2008. - 366 с,62. Киселев В.И. Генотерапия; состояние и перспективы развития.
В кн.; Введение в молекулярную медицину. - М.: Медицина, 2004. —
С. 237-271,63. Киселев В.И., Киселев О.И. Вирусы папилломы человека в развитии рака
шейки матки. — СПб.: Роза мира, 2003. - 92 с.64. Клаг У.С., Каммингс М. Основы генетики. - Техносфера, 2007. - С. 896.65. Ковальчук Л,В. Антигенные маркеры клеток иммунной системы челове¬
ка. CD (Cluster Differentiation) система. - М.: РГМУ М3 РФ, 2003. - 76 с.66. Козлов В.А., Черных Е.Р. Современные проблемы иммунотерапии в
онкологии // Бюллетень СО РАМН. — 2004. — Т. 112. — № 2. — С. 13—19-67. Кокряков В.Н. Очерки о врожденном иммунитете. - СПб.: Наука,
2006. - 261 с.68. Кондратьева Е.И., Шемякина ТА. Экстренная неспецифическая про¬
филактика ОРВИ вакциной «Гриппол» у детей дошкольного возраста с
бронхиальной астмой // Аллергология и иммунология. — 2004. — Т. 2. -
№ 3. - С. 34-35.
548 Список литературы69. Контроль содержания примесей клеточных ДНК в биотехнологических
препаратах. Методы контроля медицинских иммунобиологических пре¬
паратов, вводимых людям. — Методич. указания. МУК4.1/4.2.588-96. -
М.: Минздрав России, 1998. - С. 15-25.70. Коростелев С.А. Противоопухолевые вакцины //Соврсметгная онколо¬
гия. - 2003. - Т. 5. - № 4. - С. 3-21.71. Кочетков H.A., Дмитриев Б.А., Черняк А.Я. и др. Новый тип углсвод-
содержащих искусстве1[ных антигенов. Синтез и иммунохимические
свойства углеводсодержащего сополимера со специфичностью фактора
0:3 бактерии Salmonella серологической группы Е // Докл. АН СССР. —1982. - Т. 263. - № 5. - С. 1277-1280.72. Кулаков В.И., Паавонен Й., Прилепская В.Н. и др. Профилактика рака
шейки матки. - М.; МЕДпресс-информ, 2007. - 55 с.73. Лебеденко Е.Н., Баландин Т.Г., Эдельвейс Э.Ф., Георгиев О., Моисе¬
ева Е.С., Петров Р.В., Деев С, М. Визуализация раковых клеток с помо¬
щью флуоресцентного белка EGFP-барназа. // Биохимия, биофизика,
Молекул, биология. - 2007. - Т. 414. - № 3. - С. 1-4.74. Ликопид в комплексном лечении и профилактике иммунодефицитных
состояний. (Сборник статей). - М.; Пептек, 2005. - 236 с.75. Маниатис Т., Фриг Э., Сэмбрук Дж. Молекулярное клонирование. -
М.; Мир, 1984. - 479 с.76. Манько В.М., Петров Р.В., Хаитов P.M. Иммуномодуляция: исто¬
рия, тенденции развития, современное состояние и перспективы //
Иммунология. - 2002. - Т. 23. - № 3. - С. 132-138.77. Манько В.М., Руднева Т.Б., Разваляева H.A. Генетические аспекты имму¬
номодуляции: влияние полиакриловой кислоты и высокомолекулярного
иммуномодулятора МБ-ЮО на накопление продуцентов антител в селе¬
зенке мышей разных линий. // Иммунология. — 1995. — № 6. - С. 41-46.78. Манько В.М., Руднева Т.Б., Разваляева H.A. Генетические аспекты
иммуномодуляции; влияние полиакриловой кислоты и высокомоле¬
кулярного иммуномодулятора МБ-ШО на проявление гиисрчувстви-
тельности зa.мcдлeFIнoгo типа у мышей разных инбредных линий //
Иммунология, - 1996. - № 2. - С, 18-21.79. Манько В.М., Руднева Т.Б., Разваляева H.A., Пучкова Н.Г., Хаитов P.M.
Фенотипическая коррекция генного контроля иммунного ответа на
гриппозную вакцину // Иммунология, - 1977. — № 4. — С. 36—39.80. Маркова Т.П., Лусс Л.В., Хорошилова Н.В. Практическое пособие по
клинической иммунологии и аллергологии / Под ред. P.M. Хаитова. —
М.: ТОРУС ПРЕСС, 2005. - 175 с.
Список литературы 54981. МастернакТ.Б., Малкина Е.Ю., Алексеева Н.Ю. и др. Влияние иолиоксидо-
ния иа рсзистснтность животных к бактериальным инфекциям в экспери¬
менте // Аллергия, астма и клин, иммунология. - 2000. - № 9. - С. 8-13.82. Мастерцак Ю.А., Лусс Л.В. Влияние полиоксидония на показатели
иммунною статуса лиц пожилого возраста // Иммунология. - 2002. —
№6. - С. 343-345.83. Мая иск Ий А.Н. Питокины и медиаторттые функции уроэпителия п вос¬
палительных реакциях мочевыводящей системы // Цитокины и воспа¬
ление. - 2003. - Т. 2. - N9 4. - С. 3-9.84. Медуницын Н.В. Вакцинология. - М. — Триада-Х, 2004. — 272 с.85. Михайлова A.A. Регуляторные пептиды костного мозга - иммуномодуляторьт
нового поколения. // Аллергол. и иммунол. - 2001. — Т. 2. — №1. — С. 46-52.86. Михайлова A.A., Кирилина Е.А., Белевская Р,Г,, Борисова В.H., Петров Р.В.
Совместное использование вакцины против гепатита В и иммуномодуля¬
тора серамил для эффектиптгой вакцинации лиц с ослабленным иммуни¬
тетом. // Аллергия, астма и клин, иммунол. - 2001. — № 1. — С. 78-80.87. Моисеенко В.М.> Балдуева И.А., Щекина Л.А. и др. 1-11 фаза клиниче¬
ской оценки эффективности вакцинотерапии на основе аутологичных
опухолевых клеток в сочетании с адъювантом BCG у больных с диссе¬
минированными солидными опухолями // Российский биотерапевтич.
журн. - 2005. - Т. 4. - №3. - С. 122-130.88. Морозов И.А. Болезни печени и желчного пузыря // Патология.
Руководство / под ред. Пальцева М.А., Паукова B.C., Улумбекова Э.Г. —
М.: ГЭОТАР-МЕД, 2002. - С. 366-383.89. Нажмитдинов А.М., Хаитов P.M., Норимов А.Ш. и др. Влияние сополи¬
меров N-винилпирролидона и акриловой кислоты на отдельные этапы
иммуногенеза // Журн, микробиологии. - 1979. - № 9, — С, 14—18.90. Намазова Л.С., Геворкян А,К., Галеева Е.А. Является ли коклюш
проблемой современной педиатрии и можем ли мы его побелить? //
Педиатрическая фармакология. — 2006. - Т. 3. - № 4. — С. 6-9.91. Некрасов A.B., Пучкова Н.Г., Атауллаханов Р.И, и др. Производные поли-1,4-этиленпинеразина, обладающие иммуномодулирующей противови¬
русной и антимикробной активностью // Патент № 2073031 (Российская
Фeдepaт^ия). Приоритет: август 1990 г.92. Некрасов A.B., Пучкова Н.Г., Карапутадзе Н.Т, Физико-химические прин¬
ципы создания лонгидазы // Иммунология. - 2006. - Т. 27. — № 2. — С. 1-5.93. Несмеянов В.А,, Бомфорд Р., Козлов И.Г, Андронова Т.М. Современные
представления о молекулярном механизме действия глюкозаминилму-
рамилдипептида (ГМДП). - М.: Нептек, 2006. — 37 с.
550 Список литературы94. Никитин К.Д., Барышников А.Ю. Противоопухолевые вакцины на
основе белков теплового шока // Российский биотерапевтич. журн. —
2007. - Т. 6. - № 2. - С. 3-12.95. Николаева И.Л., Шевалье А.Ф., Игнатьева Г.А., Коробова СВ., Алек¬
сеев Т.А., Вазыхова Ф.Г., Сидорович И.Г. Использование рекомбинант-
ных атттигенов ВИЧ, экспрессируемых в Е. coli, для создания вакцинных
препаратов // Русский журн. ВИЧ/СПИД и родственные проблемы. —
2001.-Т. 5.-№ 1.-С. 15.96. Онищенко Г. Основная работа по биобезопасности у нас еще впереди //
Ремедиум. - 2005, Март. - С. 24-28.97. Определение электрофоретической чистоты и молекулярных масс
генно-инженерных препаратов. Методы контроля медицинских имму¬
нобиологических препаратов, вводимых людям. — Методич. указания.
МУК 4.1/4.2.588-96. - М.; Минздрав России, 1998. - С. 8-15.98. Па.тьцев М.А. Фундаментальные науки и развитие молекулярной меди¬
цины // Молек. мед. — 2003. — №1. — С. 4—11.99. Пальцев М.А., Иванов A.A., Северин С.Е. Межклеточные взаимодей¬
ствия. — М.: Медицина, 2003. — 287 с.100. Панфилова Л.В., Лусе Л.В., Иванова A.C. и др. Результаты вакгщнации лиц
пожилого и старческого возраста гриппозной трехвалентной полимср-
субъединичной жидкой вакциной Гриппол // Аллергология. - 1999. -
№4.-С 19-21.101. Петров Р.В. Иммунология острого лучевого поражения. —
М.; Госатомиздат, 1962. — 267 с.102. Петров Р.В. Формы взаимодействия генетически различающихся клеток
лимфоидных тканей (трехклеточная система иммуногенеза) // Успехи
соврем, биол. - 1970. - Т. 69. - №2. - С. 261-271103. Петров Р.В. Иммунология и иммуногенетика. — М.: Мединина,
1976. - 338 с.104. Петров Р.В,, Евдаков В.П., Хашов P.M. и др. Антигенные свойства пикратов
полиосЕговапий // Докл. АН СССР. - 1977. - Т. 236. ~ № 5. - С. 1260-1263.105. Петров Р.В., Жданов В.М., Кабанов В.А. и др. Вакцинирующий эффект конъ¬
югатов поверхностных антигенов вируса гриппа с синтетическим пролиме-
ром-носитслсм //Докл. АН СССР. — 1984. — Т. 227. — № 3. — С. 752—755.106. Петров Р.В., Жданов В.М., Кабанов В.А., Хаитов P.M., Харитонен-
ков И.Г., Норимов А.Ш., Подчерняепа Р.Я., Некрасов A.B., Синяков М.С.,
Щипанова М.В. Использование конъюгатов вирусных белков с синтети¬
ческими полимерами в качестве вакцинирующих комплексов для защиты
от гриппозной инфекции // Иммунология. — 1984. — №4. — С. 50—52.
Список литературы 55Í107. Петров Р.В., Жданов В.М., Хаитов P.M. Антителостимулирующий и про¬
тективный эффект конъюгата М-белка вируса гриппа с сишетичсским
полимером //Докл. АН СССР - 1984. - Т. 277. - № 3. - С. 720-722.108. Петров Р.В., Кабаков Е.Н. С-реактивный протеин (СРП) // Клин, меди¬
цина. - 1959. - № 5. - С. 28-32,109. Петров Р.В., Кабанов В.А., Хаитов P.M. и др. Протективная эффектив¬
ность конъюгатов бактериального антигена с синтетическими поли¬
электролитами // ДАН СССР - 1983. - Т. 270. - № 5. - С. 1257-1259.ПО. Петров Р.В., Михайлова A.A., Фонипа Л,А., Степаненко Р.Н. Миело-
пситиды. - М., Наука, 2000. — 182 с.111. Петров Р.В., Петрова A.C., Шиходыроп В.В, С-реактивный протеин в
крови обезьян, облученных гамма-лучами //ДАН СССР. — 1959. — Т. 29, —
№5. - С. 1190-1192.112. Петров Р.В , Сотниченко А.И., Посыпанова Г.А., Москалева Е.Ю., Фельд¬
ман Н.Б., Григорьев М.И,, Северин Е.С,, Северин С.Е. Разработка конс¬
трукций для направленной доставки противолейкемических средств с
помошьюа-фетопротеина человека//Аллергия, астмаиклин.иммунол.-1999. -№ 9.-С. 10-11.113. Петров Р.В., Хаитов P.M. Генетический контроль иммунноіо ответа:
клеточные основы и фенотипическая коррекция // Мед. РЖ. Разд. 21. -1976. - № 5. - С. 25-42.114. Петров Р.В., Хаитов P.M. Искусственные полиэлектролиты — новые
биологически активные соединения, влияющие на иммуногенез //Мед.
РЖ. Разд. 21. - 1977. - № 7. - С. 18-27.115. Петров Р.В., Хаитов P.M. Иммунный ответ к искусственным антигенам. //
Успехи соврем, биологии. - 1979. - Т. 88. — № 3. — С. 307-321.116. Петров Р.В., Хаитов P.M. Искусственные антигены и вакцины. -
М.; Медицина, 1988. - 288 с.117. Петров Р.В., Хаитов P.M. Новая отечественная тривалентная конъюги¬
рованная полимерсубъединичная вакцина «Грипиол» //Вакцинация. —1999. - № 5. - С. 6-7.118. Петров Р.В., Хаитов М.Р., Андреев С.М., Беневоленский СВ., Смирнова О.В.
Иммуногенные свойства рекомбинантных и синтетических пептидов вируса
папилломы человека //Докл. РАН. — 2008. — Т, 421. — № 2. — С. 267—273.119. Петров Р.В., Хаитов P.M., Атауллаханов Р.И. Иммуногенетика и искусст¬
венные антигены. - М.: Медицина, 1983. — 256 с.120. Петров Р.В., Хаитов P.M., Атауллаханов Р.И. Молекулярные механизмы
активации лимфоцитов полиионами. 1. Модификация трансмембранного
переноса катионов // Биол. мембраны. - 1984. - Т. 1. - №6. - С. 599-604.
552 Список литературы121. Петров Р.В., Хаитов P.M., Атауллаханов Р.И., Сидорович И.Г. Супрессия
антителогенеза костномозговыми В-лимфоцитами в культуре клеток
селезенки мышей разных генотипов //Докл. АН СССР. - 1977. - Т. 233. -
№ 4. - С. 745-748.122. Петров Р.В., Хаитов P.M., Букринская А.Г. и др. Получение гипериммун¬
ных сывороток и иммунных асцитических жидкостей к белку М вируса
грипиа при иммунизации котгъюгатом белка с полиэлектролитом //
Вопр. вирусологии, — 1984. — № 3. — С, 271—272.123. Петров Р.В,, Хаитов P.M., Гущин И.С. и др. Аллергенные свойства конъ¬
югата овальбумина с сополимером акриловой кислоты и N-вин ил пир-
родона//Докл. АН СССР. - 1985. - Т. 285. - № 6. - С. 1513-1516,124. Петров Р.В., Хаитов Р.М,, Ильина Н.И и др. Аллерготропины - препа¬
раты нового поколения для аллергенспецифической и.ммунотерапии //
Российский аллсргологичсский журн. - 2004. — №2, — С. 13-19.125. Петров Р.В., Хаитов P.M., Катлипский A.B., Москалева Е.Ю,, Севе¬
рин Е.С., Сотниченко А.И., Северин С.Е. Направленный транспорт про¬
тивоопухолевых и антибактериальных препаратов // Аллергия и имму¬
нология, - 2003. - Т. 24. - № 3. - С. 91-96,126. HeipoB Р.В., Хаитов P.M., Кожинова Е.В., Евдаков В.П. Замещение функции
Т-клеток поли-4-винилпиридином при формировании первичного и вторич¬
ного иммунного ответа // Цитология. — 1975, — Т. 17. — № 10. - С. 1172-1176.127. Петров Р.В., Хаитов P.M., Лиознер А.Л. и др. Индукция антител к виру¬
сам гриппа си11тетическими пеитидполиэлектролитными комплексами
со специфичностью константной части молекулы гемагглютинина //
Иммунология. — 1985. - № 5. — С. 24-27.128. Петров Р,В., Хаитов P.M., Манько В.М., Михайлова A.A. Контроль и
регуляция иммунного ответа. — Л.: Медицина, 1981. - 311 с.129. Петров Р.В., Хаитов P.M., Мастернак Т.Б. Коррекция иммунодефи¬
цит ных состояний с помощью иммуномодулятора полиоксидония //
Аллергия, астма и клин, иммунол. - 2000. — № 9. - С. 3-7.130. Петров Р.В,, Хаитов P.M., Некрасов A.B. и др. Полиоксидоний - иммуно¬
модулятор последнего поколения: итоги трехлетнего клинического при¬
менения //Аллергия, астма и клин, иммунол. - 1999. - № 3. - С. 3-6.131. Петров Р.В., Хаитов P.M., Некрасов A.B. и др. Полиоксидоний - препарат
1ГОВ0Г0 поколения иммуномодуляторов с известной структурой и меха¬
низмом действия // Иммунология. — 2000. — № 5. - С. 24—28.132. Петров Р.В., Хаитов P.M., Некрасов A.B. и др. Полиоксидоний: механизм
действия и клиническое применение // Мед. иммунология. — 2000. -
т. 2.-№3.-с. 271-278.
Список литературы 553133. Петров Р.В., Хаитов P.M., Некрасов A.B. Иванова A.C., Пучкова Н.Г.
Гриппозная вакцина нового поколения — Гриппол // Физиол. и патол,
иммунной системы. — 2004, — Т, 8. — № !. — С. 10—26.134. Петров Р.В., Хаитов P.M., Некрасов A.B., Федосеева В.Н. Конверсия
аллергического отпета в иммунный аллерготропинами // Докл. АН
СССР. - 2004. - Т. 398. - № 6. - С. 828-831.135. Петров Р.В., Хаитов P.M., Норимов А.Ш. и др. Искусственные антигены
со сниженной иммуногснностью — комплексы белков с карбоцеппыми
линейными полиамфолитами // Иммунология. - 1982. - № 6. - С. 52-54,136. Петров Р.В., Хаитов P.M., Норимов А.Ul., Корякитг С.А. Влияние синте¬
тических полиэлсктролитов на кооперацию Т- и В-клеток при иммуни¬
зации мышей разных генотипов искусственным антигеном (Т, Г)-А-Л //
Бюлл. эксперим. биологии и медицины. — 1981. — № 5. — с. 590.137. Петров Р.В., Хаитов P.M., Федосеева В.Н., и др. Разработка пыльцевых
аллерговакцин (аллерготропинов)//Аллергия, астма и клин, иммунол. -
2003. - Т. 7. - № 9. - С. 9-14.138. Петров Р.В,, Хаитов Р,М., ФонинаЛ.А. и др. Синтетические пептиды env и
gag распознаются антителами к LAV/HTLV-in //И.ммунология. — 1986. —
№5.-С. 80-81.139. Пинегин Б.В. Современные представления о стимуляции антиинфек-
ционного иммунитета с помощью иммуЕюмодулирующих препаратов //
Антибиотики и химиотерапия. - 2000. — № 12. - С. 3-8.140. Пинегин Б.В., Некрасов A.B., Хаитов P.M. Полиоксидоний: механизм дей¬
ствия и клиническое применение // Фарматека. — 2004. — № 7. — С. 16—21.141. Пинегин Б.В., Некрасов A.B., Хаитов P.M. Полиоксидоний: механизмы
действия и аспекты клинического применения // Цитокины и воспале¬
ние. - 2004. - Т. 3. - № 3, - С. 451-457.142. Покровский В.В. Можно ли иммунизировать больных СПИДом? //
Вакцинация. - 2001. - № 2 (14). - С. 6-7.143. Покровский В.В., Трегуб A.B., Тендетник Ю.Я. и др. Иммунобиологические
свойства искусственных антигенов - сополимеров синтетической 0-дстер-
минантыс акриламилом // Иммунология. — 1986. - Na 1. — С, 46—50,144. Полевщиков A.B., Назаров П.Г. С-реактивный белок и сывороточный
амилоид Р; роль в иммунорегуляции // Иммунология. — 1998. — № 4. —
С. 4-11.145. Потенциальное использование новых полиомиелитньтх вакцин:
Меморандум совещания ВОЗ // Бюлл. ВОЗ, — 1990. — № 5. — С. 12—15,146. Протокол ограниченных клинических испытаний препарата
«ВИЧРЕПОЛ», вакцины ВИЧ/СПИД полимер-белковой рекомбинант¬
554 Список литературыной конъюгированной жидкой (1 фаза), Москва. — 2004 (храїтится в
Федеральной службе по надзору в сфере здравоохранения и социального
обеспечения Российской Федерации).147. Северин С.Е., Муйжнек Е.Л., Северин Е.С. Наїїравленная достав¬
ка противоопухолевых препаратов с помощью белковых векторов //
Им.мунология. - 1999. - №4. - С. 20-24,148. Сенцова Т.Б., Балаболкин И.И., Булгакова В.А., Короткова Т.Н. Острые
респираторные вирусные инфекции и их профилактика у детей с ато¬
пическими болезнями // Вопр, современной педиатрии. - 2003. - Т. 2. —
№3.-С. 8-15.149. Сидорович И.Г., Лиознер А.Л., Игнатьева Г.А., Иващенко М.Е. Искус¬
ственные антигены в биотехнологии: получение гибридом к М-белку
вируса гриппа // Иммунология. - 1986. - № I. - С. 51-53.150. Сидорович И.Г., Николаева И.А., Карамов Э.В. Перспективы создания
анти-ВИЧ вакцины // Современные проблемы аллергологии, иммуноло¬
гии и иммунофармакологии: Тр. 5-го Конгресса Российской ассоциации
аллергологов и клинических иммунологов. — М., 2002. - Т. 1. - С. 420-431.151. Сидорович И.Г, Николаева И.А., Шевалье А.Ф., Игнатьева Г.А., Алексе¬
ев Т.А., Ефремов Е.Е., Вазыхова Ф.Г., Коробова С.В., Николаев А.Н,,
Апрятин С.А., Сеславина Л.С, Новый потенциальгтый вакцинный пре¬
парат против инфекции ВИЧ/СПИДА на основе рекомбинантного
химерного водорастворимого полипептида, содержащего фрагменты
структурных белков ВИЧ1 в нативной конформации // Иммунология. -
2001.-№6.-С. 25-26.152. Сидорович И.Г., Николаева И.А., Шевалье А.Ф., Игнатьева ГА,, Коро¬
бова С.В., Алексеев ТА,, Петров Р.В., Хаитов P.M. Иммуногенная ком¬
позиция, содержащая химерішй полипептид ВИЧ, полипептиды и
тест-система для обнаружения антител к ВИЧ // Патент Российской
Федерации № 2214274 от 20.10.2003 г., приоритет от 16.08.2001.153. Сидорович И.Г., Николаева И.А., Шевалье А.Ф., Коробова С.В., Игнать¬
ева Г.А., Карамов Э.В., Корниласва Г.В., Павлова ТВ., Апрятин С.А.,
Некрасов A.B., Пучкова Н.Г., Савинова И.В., Иванова A.C., Гудима Г.О.,
Воробьева М.С. Разработка конъюгированных вакиин против ВИЧ/
СПИД на основе специфических антигенов ВИЧ и иммуномодуляторов
известного состава // Аллергия, астма и клин, иммунол. - 2003. — № 9. —
С. 107-П2.154. Сидорович И.Г, Николаева И.А., Шевалье А.Ф., Коробова С.В., Игнать¬
ева ГА., Карамов Э.В., Корнилаепа Г,В., Павлова ТВ., Апрятин С.А.,
Некрасов A.B., Пучкова Н.Г., Савинова И.В, Иванова A.C., Гудима Г.О.,
Список литературы 555Воробьева М.С. Перспективы контроля эпидемии ВИЧ/СПИДа в Росси и.
Первая отечественная пакцина против ВИЧ/СПИД «ВИЧРЕПОЛ» гото¬
ва для проведения 1 фазы клинических испытаний // Физиол. и патол.
иммунной системы. — 20Ü4. — № 2. — С. 74—84,155. Сидоропич И.Г., Шевалье А.Ф., АлексеевТ.А., Вазыхова Ф.Г., Коробова С.В.,
Николаева И.А. Новая усовсршеЕГСтвованная ИФА тест-система для диа¬
гностики ВИЧ-инфекции на основе улучшенных рекомбинантныханти1е-
нов//Аллергия, астма и клин, иммунол. - 1999. — № 9. - С. 139-141.156. Сидорович И.Г., Шевалье А.Ф., Игнатьева Г.А., Алексеев Т.А., Вазыхо¬
ва Ф.Г., Коробова С В., Николаев А.Н., Апрятин С.А., Ссславина Л.С.,
Николаева И.А. Возможность форсификации с помощью полиоксидония
кацдидатной анти-ВИЧ вакцины на ochorc новых рекомбинантных рас¬
творимых антигенов ВИЧ // Иммунология. - 2001. - № 2, — С. 15—17.157. Сидорович И.Г., Шевалье А.Ф., Коробова С.В.,. Гудима ГО, Никола¬
ева И.А., Гасанов В,А., Киселев A.B., Игнатьева Г.А., Скляров Л.Ю.,
Некрасов A.B., Пучкова Н.Г, Иванова A.C., Истамов Х.И., Кара-
моп Э.В,, Корнилаева Г.В., Павлова Т.В., Воробьева М.С., Хаитов P.M.
Пути повытпения иммуногенности вакцин против ВИЧ/СПИДа //
Физиол. и патол.иммунной спсте.мы. - 2005. — № 9. — С. 17-23.158. Соколов Б.П. Белки вирусов гриппа А //Успехи соврем, биологии. -
19«4. - Т. 97. - № 1. - С. 13Í-145.159. Сотпиченко А.И., Северин С.Е., Фельдман Н.Б., Заболотиев Д.В.,
Северин С.Е., Петров Р.В. Изучение противоопухолевой активности
водораствори.мого комплекса 2,3,7,8'тетрахлордибснзо-р-диоксина с
а-фстопротеином человека in vivo // Аллергия, астма и клин, иммунол. —2001.-м 1.-С. 8-11.160. Степаненко Р.Н., Власенко Р.Я., Цветков Ю.Е., Хатунисва Е.А., Новико¬
ва Е.М., Нифантьев Н.Э., Петров Р.В. Терапевтическая противоопухоле¬
вая вакцина на основе GM3 // Биотехнология; состояние и перспективы
развития: Материалы 5-го Московского международного конгресса. —
М., 2009. - С. 457.161. Степаненко PH., Цветков Ю.Е., Хатунцева Е.А., Львов В.Л., Власен¬
ко Р.Я., Нифантьев Н.Э., Петров Р.В. Конъюгат олигосахаридного фраг¬
мента опухольассоциированного антигена ганглиозидттой природы с
гемоцианином — ирототип противоопухолевой вакцины //Докл. РАН. —
2007. - Т. 415. - № 3. - С. 425-429.162. Таточенко В.К, Федоров А.М,, Озерецковский Н.А Профилактика и
мониторинг поствакцинальных осложнений // пособие для врачей. -
М., 2004.- 127 с.
556 Список литературы163. Тутыхина И Л,, Безбородова О.А., Верховская Л.В. и др. Рекомбинантная
псевдоаденовирусная наноструктура с геном лактоферрина человека: полу¬
чение, изучение эксирсссии и свойств лактоферрина ири ее применении
in vivo Ц Молек. генетика, микробиол. и вирусол. - 2009. - № 1. - С. 6-15.164. Хаитов М.Р, Новые иммунобиотехнологичсские методы для профилак¬
тики и лечения вирус-ассоциированных заболеваний; авгореф. дис. докт
мед. наук: 14.00.36- аллергология и иммунология. — М., 2008. - 47 с.165. Хаитов РМ. Циркуляция гемопоэтических стволовых клеток в организ¬
ме // Успехи совр. биол. — 1973. - Т. 75. - № 1. — С. 86-103.166. Хаитов P.M. Воздействие на отдельные этапы становления и взаимо¬
действия Т- и В-клеток // Т- и В- системы иммунитета. — М.: ВИНИТИ
АН СССР, 1976. - С, Ш1-123. - (Итоги науки и техники. Сер. Общие
вопросы патологии; Т 4).167. Хаитов P.M. Итоги и перспективы исследований по созданию искусст¬
венных вакцин // Иммунология. - 1982, - № 6. - С. 35-40.168. Хаитов Р.М, Инфекционные болезни иммунной системы //Иммуно¬
логия. - 1985. - № 5. - С, 7-11.169. Хаитов P.M. В-клеточная регуляция иммунной системы // Иммунология. —
1987-№3,-С. 10-13.170. Хаитов P.M. Взаимодействие клеток иммунной системы: физиологи¬
ческие и мсдит^инские аспекты иммунитета // Аллергия, астма и клин,
иммунол. - 1999. - № 1. — С. 6 20.171. Хаитов P.M. Физиология иммунитета // Аллергия, астма и клин, имму¬
нол. - 2000. - № 2. - С. 3-16.172. Хаитов P.M. Физиология иммунной системы // Рос. физиол. журнал
им. И.М. Сеченова. -2000. - Т. 86. - 3. - С. 252-276.173. Хаитов P.M. Физиология иммутшой системы. — М: ВИНИТИ РАН. -
2005, - 428 с.174. Хаитов P.M., Алексеев Л.П. Генетика иммунною ответа // Иммуноло¬
гия. - 1988. -№ 5. - С. 11-15.175. Хаитов P.M., Алексеев Л,П. Физиология генов иммунною ответа // Рос.
физиол. журн. им. И.М. Сеченова, - 2003. - Т. 89. - № 3. - С. 313-328.176. Хаитов P.M., Алексеев Л.П. Геномика HLA; новые возможности молеку¬
лярной генетики человека в диагностике и терапии // Молекул, мед. -
2003.-№ 1.-С, 17-31,177. Хаитов P.M., Алексеев Л.П. Предназначение иммуніюй системы: выпол¬
нение физиологических функций, обеспечивающих генетическое по¬
стоянство внутренней среды организма // Физиол. и натол. иммунной
системы. - 2004. - Т. 8С. № 8. - С. 3-21.
Список литературы 557178. Хаитов P.M., Алексеев Л.П. HLA и врожденный (естественный) имму¬
нитет — целесообразность пересмотра известного // Физиол. и патол.
иммунной системы. — 2004. ~ Т. 8. — № 1. — С. 27—29.179. Хаитов P.M., Алексеев Л.П., Василов Р.Г. Молекулярно-генетические
подходы к изучению системы HLA: новые возможности фундаменталь¬
ных и прикладных исследоватгий // Бюл. эксиерим, биологии и медици¬
ны. - 1994. - № 10. - С. 436-439.180. Хаитов P.M., Алексеева Н.Ю., Мотиатпили И.Я. и др. Генетический
контроль иммунного ответа на антигены Salmonella typhimurium; фено¬
типическая коррекция антительного ответа па О- и Н-антигены с помо¬
щью синтетических неприродных полиэлсктролитов //Иммунология. —1982. ~№ 5.-С. 41-44.181. Хаитов P.M., Атауллаханов Р.И. Мембранозависимые медиаторы, регули¬
рующие метаболизм, пролиферацию и дифференцировку иммуЕюцитов.-
М., 1981. - С. 144-201. (Итоги науки и техники. Сер. Иммунология; Т. 9).182. Хаитов P.M., Атауллаханов P.M., Сидорова Е.В, Механизмы стимули¬
рующего действия полиакриловой кислоты на антителогенез ш vitro.
Изучение дифференцировки поликлональных антителопродуцен¬
тов и клеток, секретирующих неснецифические иммуноглобулины //
Иммунология. - 1982, - № 5. — С. 31-34.183. Хаитов P.M., Батырбеков A.A. Коррекция иммунного ответа к эритро¬
цитам барана у мышей разных линий с помощью полиэлектролитов //
Бюлл. экспсрим. биологии и мединипы. — 1976. — № 5. — С, 582—584.184. Хаитов P.M., Игнатьева Г.А., Сидорович И.Г. Иммунология. -
М.: Медицина, 2002. - 534 с.185. Хаитов P.M., Маджидов A.B., Некрасов А.В. Усиление активности естест¬
венных киллеров синтетическими полиэлектролитами // ИммyнoJЮГИЯ. —1984.-№2.-С 18-21,186. Хаитов P.M., Манько В.М., Ярилин А.А, Внутриклеточные сигнальные
пути при активации, торможении функций и апоптозе клеток системы
иммунитета // Физиол. и патол. иммунной системы. — 2005. - Т. 9. - № 1, -
С, 3-48,187. Хаитов P.M., Манько В.М., Ярилин A.A. Внутриклеточные сигнальные
цуги, активирующие или ингибирующие функции клеток иммунной
системы. 1. Молекулярные механизмы формирования активирующих
сигнальных путей фагоцитов, опосредованные через Fc- и TLR-pcucn-
торы // Успехи соврсм. биOJЮГии. - 2005. - Т. 125. - № 4. - С. 348-359.188. Хаитов P.M., Манько В.М., Ярилин A.A. Внутриклеточные сигнальные
пути, активирующие или ингибирующие функции клеток иммунной
558 Список литературысистемы. 2. Си1 налпроводящие активирующие и ингибирующие рецеп¬
торы естественных клеток-киллеров//Успехи соврем. биологии. — 2005. —
Т. 125. - №5. - С. 435-445.189. Хаитов P.M., Манько В.М., Ярилин A.A. Вттутриклсточные сигнальные
пути, активирующие или ингибирующие функции клеток иммунной сис¬
темы. 3. Формирование и регуляция сигнальных путей, индуцируемых
активацией антигенраспознающих рецепторных структур Т- и В-лимфо-
ц;итоп // Успехи соврем, биологии. — 2005. — Т, 125. — № 6. - С. 544—554.190. Хаитов P.M., Манько В.М., Ярилин A.A. Внутриклеточные сигнальные
пути, активирующие или ингибирующие функции клеток иммунной
системы. 4. Внутриклеточные сигнальные пути при апоптозе. // Успехи
соврем, биологии. - 2006. - Т. 126. - № 1. - С. 3-9.191. Хаитов P.M., Некрасов A.B. Синтез искусственных иммуногенов//Журн.
микробиологии, эпидемиологии и имупобиологии. — 1988. — № 3. —
С. 3-8.192. Хаитов P.M., Норимов А.Ш., Завгородний С.Г. Отмена иммунологиче¬
ской толерантности и эффекта Т-супрессоров синтетическими иолиэ-
лектролитами // Иммунология. — 1980. - № 2. — С. 47—50.193. Хаитов P.M., Пинегин Б.В. Современные иммуномодуляторы; основные
принципы их применения // Иммунология. — 2000. - № 5, - С. 4—7.194. Хаитов P.M., Пинегин Б.В. Иммуномодуляторы: механизм действия
и клиническое применение //Иммунология. - 2003. — Т. 24. — № 4. -
С. 196-203.195. Хаитов P.M., Пинегин Б.В, Современные предстапления о механизме дейс¬
твия полиоксидония // Иммунология. - 2005. - Т. 26. - № 4. - С. 197.196. Хаитов P.M., Пинегин Б.В,, Ярилин A.A. Руководство по клиниче¬
ской иммунологии. Диагностика заболеваний иммунной системы:
Руководство для врачей. — М.: ГЭОТАР-Медиа, 2009. - 350 с.197. Хаитов P.M., Решетников A.B., Гудима Г.О., Сидорович И.Г., Кара¬
мов Э.В. Анализ проведения клинических испытаний вакцин против
ВИЧ-инфекции, СПИДА в зарубежныхстранах и в России//Социология
медицины, - 2008. — № 1 (12). - С. 31-44.198. Хаитов P.M., Рещетников A.B., Сидорович И.Г, Карамов Э.В., Гуди¬
ма ГО. Подготовка когорт добровольцев для клинических испытаний
анти-ВИЧ/СПИД-пакцин: настоящее и будущее // Физиол. и патол.
иммунной системы. - 2007,- Т. 11, — № 11. — С. 3-16.199. Хаитов P.M., Рещетников A.B., Сидорович И.Г, Карамов Э.В., Гуди¬
ма Г.О. Клинические испытания первой отечественной анти-ВИЧ/
СПИД-вакцины. - М.: ГЭОТАР-Медиа. - 2009. - 671 с.
Список литературы 559200. Хаитов P.M., Федосеева В.Н., Некрасов A.B. и др, Создание аллерговак¬
цин на основе аллергоидов из пыльцы тимофеевки, березы, полыни и
иммуномодулятора полиоксидония // Аллергия, астма и клин, иммуно¬
логия. - 1999. - № 9. - С. 22-24.201. Харит С.М., Лакоткина Е.А., Черняева Т.Н. и др. Клинико-лабораторные
критерии диагностики, терапии и профилактики поствакцинальных
осложнений (Пособис для врачей). — СПб., 2001. — 40 с.202. Хатунцева Е.А., Цветков Ю.В., Степаненко Р.Н., Власенко Р.Я., Пет¬
ров Р.В., Нифантьев Н.Э. Синтез бета-2-аминоэтилгликозида N-глико-
нейраменил-З-лактозы и неогликоконъюгатов на его основе — прототипа
онкоспецифической вакцины и искусственных антигенов для конт¬
роля иммунного ответа // Известия РАН, Сер. химическая. - 2009. —
№ 2. - С. 441-447.203. Хрущов Н.Г, Старостин В.И., Домарацкая Е.И., Мичурина Т.В., Зо-
тин A.A. Стволовые клетки крови. - М.:ВИНИТИ АН СССР, 1988. — 205 с.
(Итоги науки и техники. Сер. Морфолог ия человека и животных. Т. 13).204. Хутуева С.Х., Федосеева В.Н. Аллерген-специфическая иммунотерапия
бронхиальной аст.мы. - М.: Экон., 2000. — С. 120—127.205. Чеканова Т.А., Карпенко Л.И., Некрасова H.A., Плясунова O.A.,
Николаева И.А., Коробова С.В., Сидорович И.Г., Гудима ГО., Юди¬
на О.С., Воробьева М.С., Расшепкина М.H., Ильичев A.A. Анализ спе¬
цифических показателей иммуногенности отечественных кандидат-
вакцин против ВИЧ/СПИД // Цитокины и воспаление. - 2005. - Т. 3. -
№ 4. - С. 148.206. Чон-вук-Ли ВОЗ готова противостоять пандемии гриппа // Ремедиум. —2005, Март. - С. 38-39.207. Шумаков В.И, Трансплантация. Руководство.- М.: Медицина, 1998. —
391 с.208. Яздовский В.В., Алексеев Л.П., Зсмсков В.М. Связь параметров иммун¬
ного ответа с HLA-фенотипом у здоровых лиц русской национальности//
Иммунология. — 1998. - № 3. - С. 20—24.209. Яздовский В.В., Дмитриева Н.Г., Алексеев Л.П. Динамика пролифера-
тивного ответа лимфоцитов на митогснные лектины и анти-СОЗ-анти-
тсла в культурах цельной крови и выделенных клеток у здоровых людей //
Иммунология. - 1994. - № 5. - С. 21-24.210. Яздовский В.В., Дмитриева Н.Г, Бачурин П.С. и др. Генетический
контроль активности естественных клеток-киллеров у человека //
Современные методы иммунотерапии: Материалы конференции. -
Ташкент, 1984. - С. 265-266.
560 Список литературы211. Ярилин А.А. Апоптоз. Природа феномена и его роль п целостном
организме. //Патол. физиология и экспсрим. терапия. - 1998. - № 2. -
С. 38-48.212. Ярилин А.А. Основы иммунологии. - М.: Медицина, 1999. - 607 с.213. Abbott M.J. Astrocyte-endothelial Interactions and blood-brain barrier perme¬
ability. //J. Anat. - 2002. - Vol.200, №6. - P.629-638.214. Abenslra-Amar O., Jolivet М., Audibert F. ct al. Ability of a synthetic streptococ¬
cal peptide to elicit immunological memory in the absence of detectable antibody
production. //Int. J. immunopharmacol. - 1985. - Vol.7. - P.397-403.215. Ada G.L. Vaccination against influenza virus. //New approaches lo vaccine
development: Proc. of a meeting WHO (Geneva 17-20 Oct. 1983), /Bell R.
Torrigiani (Eds) - Basel, 1984. - P197-217.216. Akira S., Sato S. Toll-like reccptors and their signaling mechanisms. //Scand. J.
Infect. Dis. - 2003. - Vol.35. - R555-562.217. Akiyama K., Yokota K., Kagawa S. et al, cDNA cloning and interferon gamma
dow^n-regulation of proteasomal subunits X and Y. //Science. — 1994. — Vol.265, —
P1231-1234.218. Altboum Z,, Levine M.M., Galen J.E. Genetic characterization and immu-
nogenicity of coli surface antigen 4 from enterotoxigenic E.coli when it is
expressed in Shigella livc-vector streine, //Infect. Immun.— 2003. — Vol.71. -
PI 352-1360.219. Amer A., Singh G., Darke C., Dolby A.E. Impaired lymphocyte responsive¬
ness lo phytohaemagglutinin associated with the possession of HLA-B8/Dr3. //
Tissue antigens. - 1986. - Vol.28. - P.193-198.220. Anders H.J., Banas B., Schlondorff D. Signaling danger: Toll-like receptors and
their potential roles in kidney disease. //J. Am. Soc. Nephrol. — 2004. - Vol. 15. -
P 854-867.221. Anonymous. Disseminated Mycobacterium bovis infection from BCG vaccina¬
tion of a patient with Acquired Immunodeficiency Syndrome.// MMWR. —1985. - Vol.34, - R227-228,222. Arai K., Lee F., Miyajima F. et al. Cytokines; coordinators of immune and
inflammatory responses. //Ann. Rev. Immunol. — 1990. — Vol.59. — P.783-802.223. Arakawa T, Chong D.K.X., Langridge W.H.R.. Efficacy of a food plant-based
oral cholera toxin В subunit vaccine. //Nat. Biotechnol. - 1998. -Vol. 16. -
P292-297224. Ariizumi K., Shcn G. L., Shikano S., Xu S., Ritter R., Kumamoto T, Edel-
baum D., Morita A., Bcrgstresser P, R., Takashima A. Identification of a novel,
dendritic cell-associated molecule, dectin-1, by subtractive cDNA cloning. //
J. Biol. Chem. - 2000. - Vol.275. - P20157-20I67.
Список литературы 56/225. Arien Р.А., Singleton М., Adamovicz J.J. et al. Effective plague vaccination via
oral delivery of plant cells expressing Fl-V antigens in chloroplasls.// Infect.
Immun. - 2Ü08. - Vol.76, №8. - P.3640-3650.226. Arnon R., Bustin М., Calcf E. ct al. Immunological cross-reactivity of antibod¬
ies to a synthetic undecapeptide analogous to the amino terminal segment of
carcinoembryonic antigen, with the intact protein and human sera. //Proc. Nat.
Acad. Sci. USA. - 1976.- Vol.73. - P2123-2127.227. Arnon R., Jacob C.O., Sbapira M Synthetic vaccines. /Prog, Immunol.; 5^*^
Intern. Congr. of Immunol. —J. Yamamura, T. Tada (Eds) — London-Tokyo,
1984.- P1327-1341.228. Arnon R,, Sela M. Antibodies to a unique region in lysozyme provoked by a
synthetic antigen conjugate. //Proc. Nat. Acad. Sci. USA. - 1969. - Vol.62. -
R163-17I.229. Arnon R., Sela М., Parant М., Chedid L. Antiviral response elicited by a
completely synthetic antigen with built-in adjuvantichy. //Proc. Nat, Acad. Sci.
USA. - 1980, - Vol.77. - R6769-1772,230. Arnon R., ShapiraM,, Jacob C.O. Synthetic vaccines.//!. Immunol. Methods. —1983.-Vol.61.-R261-273.231. Atassi M.Z., Webster R.C. Localization, synthesis and activity of an antigcnic
site on influenza virus hemagglutinin. //Proc. Nat. Acad. Sci. USA. - 1983. -
Vol.80, - P.840-844.232. Audibert F. Utilization des muramyl dipeptides dans des modelés de vaccines
synthétiques, //Bull. Inst. Sieroter. Milan. - 1985. — Vol.64. - P.95-102.233. Audibert F., Jolivet М., Chedid L. et al. Active antitoxic immunization by
a diphtheria toxin synthetic oligopeptide. //Nature. - 1981. - Vol.289, -
R593-594.234. Audibert F, Jolivet М., Chedid L. et al. Successful immunization with a
totally synthetic diphtheria vaccine. //Proc. Nat. Acad. Sci. USA. — 1982. —
Vol.79. - P5042-5046.235. Auger I,, Lepecuchel L,, Mugnier B., Roudicr J, HLA-DRBl motifs and
heat shock proteins. //Proc. 14^^ European Histocompatibility Conference,
Montpellier, France. - 2000. - P.35.236. Bach F,, KupermanO., Soilinger O. ctal. Cellular immunogenetics and LD-CD
collaboration. //Transplant. Proc. - 1977, - Vol,9. - P859-863.237. Bagchi A., Herrup E. A., Warren H. S., Trigilio J., Shin H. S., Valentine C.,
Heilman J. MyD88-dependcnt and MyD88-independent pathways in synergy,
priming, and tolerance between TLR agonists.//J. Immunol. — 2007. - Vol.178. -
R1164-1171.
562 Список литературы238. Banchereau J., Bricre F., Caux С., Davnust J., Lcbecque S., Liu Y. J., Pulendran
B., Palucka K. Immunobiology of dendritic cells. //Anna. Rev. Immunol. -
2000.-VoI.18.-P767-811.239. Banchcreau J., Steinman R.M. Dendritic cells and the control of immunity. //
Nature. - 1998. - Vol.392. - R245-252.240. Barnett S., Liu M. DNA vaccines coming of age. //Annu. Rep. Med. Chem. —1999. - Vol.34, №1. - P149-158.241. Barrat F.J., Meeker Т., Gregorio J. et al. Nucf leic acids of mammalian origin can
act as endogenous ligands for Toll-like rcceptors and may promote systemic lupus
erythematosus. //J. Exp. Med. - 2005. - Vol.202. - P.113I-1139.242. Barry E.M., AJlboum Z., Losonsky G. et al. Immune responses elicited against
multiple entcrotoxigenic Escherichia coli fimbriae and mutant LT expressed in
attenuated Shigella vaccine strains. //Vaccine. - 2003. - Vol. 21. - P.333-340.243. Barlen R., Torkar М., Haude A., Trowsdale J., Wilson M.J. Divergent and
covergent evolution of N K-cell receptors. //Trends Immunol. - 2001. - Vol.22. —
P 52-57.244. Barton G.M., Kagan J.C., Medzhitov R. Intracellular localization of Toll-like
receptor 9 prevents recognition of self DNA but facilitates access to viral DNA. //
Nat. Immunol. — 2006. - Vol.7. — P.49-56.245. Bauer S., Groh V., Wu J. el al. Activation of NK cells and T cells by N KG2D, a
receptor for stress-inducible MICA. //Science. - 1999. - Vol.285. - P.727-729.246. Bauer S., Groh V., Wu J., Steinle A., Phikkips J.H., Lanier L.L,, Spies T.
Activation of NK cells and T cells by NKG2D, a receptor for stress-induciblc
MICA. //Science. - 1999. - Vol285. - P.727-729.247. Beachey E.H., Seyer J.M., Dale J.B. et al. Type-specific protective immunity
evoked by synthetic peptide of Streptococcus pyogenes M protein. //Nature, —
1981. - Vol. 292. - P457-459.248. Bccht H., Gruschkau H., Rott R. The M protein of influenza viruses has
no immunizing effect. //Med. Microbiol. Immunol. - 1979. - Vol.167. -
P285-288.249. Becht H., Huang R.TC., Fleischer B. et al. Immunogenic properties of the small
chain HA2ofthe haemagglutinin of influenza viruses. //J. Gen. Virol. — 1984. -
Vol.65, Pt.l. -R173-183.250. Bell J.K., Askins J., Hall P.R. et al. The dsRNA binding site of human Toll-like
receptor 3. //Proc. Natl. Acad. Sci. USA. - 2006. - Vol.103. - P.8792-8797.251. Bell J.K., Botos I,, Hall P.R., Askins J., Shiloach J., Segal D.M., Davies D.R.
The molecular structure of the Toll-like receptor 3 ligand-binding domain. //
Proc. Natl. Acad. Sci. USA. - 2005. - Vol. 102. - P10976-10980.
Список литературы 563252. Bell J.K., Mullen G.E., Leifer C.A., Mazzoni A., Davies D.R., Segal D.M.
Leucine-rich repeats and pathogen recognition in Toll-like receptors. // Trends
Immunol. - 2003. - Vol,24. - P.528-533.253. Bellcr D.L, Farr A.G., Unanue E.R. Regulation of lymphocyte proliferation and
differentiation by macrophages. //Fed. Proc. —1978. - Vol.37. - P.91-96.254. Bellini W, J., Rora J.S., Greer RW. ct. al Measles vaccination death in a child with
severe combined immunodeficiency; report of a ease. //Lab Investig. — 1992.
Vol.66. -P.91A.255. Bellon N., Heredia A.B., Llano М., Mingúela A., Rodriguez A., Lopez-Bo-
tet М., Aparicio P. Triggering of effector functions on a CD8+ T cell done upon
the aggregation ofanactivatory CD94/kp39helcrodirner. //J, Immunol. - 1999. -
Vol. 162. - R3996-4002.256. Bcn-Sasson S.L., Lipscomb M.F., Tucker T.F., Uhr J,W. Specific finding
of T lymphocytes to macrophages. 3. Spontaneous dissociation of T cells
from antigen-pulsed macrophages. //J. Immunol, - 1978. - Vol. 120. -
PI 902-1908.257. Bernasconi N.L., Onai N., Lanzavecchia A. A role for Toll-like receptors in
acquired immunity; up-regulation of TLR9 by BCR triggering in nanve В cells
and constitutive expression in memory В cells. //Blood. - 2003. -Vol.lOl. —
P.4500-4504258. Bernasconi N.L., Traggiai E., Lanzavecchia A. Maintenance of serological
memory by polyclonal activation of human memory В cells. //Science. - 2002. -
Vol.298. - P2199-2202,259. Bertho N., Drenou B., Laupeze В et al. HLA-DR mediated apoptosus
susceptibility discri minales differentiation stages of dendritic/monocytic APC. //
In; Human Immunology. Proc. 14^^^ European Histocompatibility Conference. -2000. - Vol.61, SuppM. - PI29.260. Bossier W.C., Suhr B., Baring H.J. et al. Specific antibodies clicited by antigen
covalently linked to a synthetic adjuvant. //Immunobiology. - 1985. - Vol.170. -
P239-244.261. Bethcll D.B., Hien TT. 2003. Diphtheria. In; Oxford Textbook of Medicine. /
Warrel D.A., Weatherall D.J., Cox T,M., Firth J.D, (Eds), 4 edn.- Oxford;
Oxford University Pres, 2003, - P.453-456.262. Bhatnagar P.K., Papas E., Blum H.E. et al. Immune response to synthetic
peptide analogues of hepatitis В surface antigen specific for the determinant. //
Proc, Nat. Acad. Sci USA. - 1982. - Vol.79. - P4400-4404.263. Billips B.K., Yaggie R.E., Cashy J,P, Alive-attenuated vaccine for the treatment
of urinary trad infection by uropathogenic Escherichia coli. // J. Infect. Dis. —
2009, - Vol.200, №2. - P263-272.
564 Список литературы264. Billie J.L., Houghten R.A., Alexander Н, et al. Protection against foot-and-
mouth disease by immunization with a chemically synthesized peptide predicted
from the viral nucleotide sequence.//Naturc. - 1982. - Vol.298. - P.30-33.265. Bitton R.J., Guthmann M.D., Gabri M.R., Carnero A.J.. Alonso D.F., Fain-
boim L., Gomez D.E, Cancer vaccincs. An update with special focus on ganglio-
side antigens. //Oncol. Rep. — 2002. - Vol.9. - P.267-276.266. Bjorkman P.J., Saper M.A., Samraoui B. etal. Structure of the human class T his¬
tocompatibility antigen, HLA-A2.//Nature. — 1987. — Vol. 329. — P.506-512.267. Bjorkman P.J., Sapcr M.A., Samraoui B. et al. The foreign antigen binding site
andT cell recognition of class 1 histocompatibility antigens, //Naiure. - 1987. -
Vol.329.-P.512-518.268. Bleck Clostridium telani (Tetanus). In: Princ. Pract. Inf. Dis., Mandell G.L.,
Bennett J.E. (Eds), б'” edn, - 2005. - R2817-2822.269. Bloksma N., Rcuvcr M.J. de, Willers J.M.N. Jnfluencc on macrophage function
as a possible basis of immunomodification by polyanions. //Ann. Immunol. -
1980.-Vol.131.- P.255-265.270. Bodmer J.G., Marsh S.G., Albert E.D. et al. Nomenclature for factors of the
HLA system, 1996. //Tissue fnligens. — 1996. — Vol.49. — P.297-32I.271. Bodmer W. HLA: what’s in a name? A complementary on HLA nomenclature
development over years. //Tissue antigens. - 1997. - Vol,46, - P.193-296.272. Bodmer W. HLA polymorphism: origin and maintenance. //Tn: HLA 1997. Eds.
Terasaki P., Gjertson D. - 1998. - P.I-7.273. Bodmer W., Bodmer J.G. Evolution and function of the HLA system, //Bril.
Med. Bull. - 1978. - Vol.34. ~ P309-316.274. Boldyreva M.N., Chromova N.A., Yankevich ТЕ,, Bogatova O.V., Gous-
kova I,A., Philippova E.V., Alexeev L.P. HLA-DRBl homozygous in spontaneous
abortions of uncertain genesis. In; Abstracts of 17'*' European Histocompatibility
Conference (Baden-Baden, Germany). - 2003. - P.70.275. Boldyreva M.N., Gouzov T.I., Bartseva O.V., Jankevich T.E., Bogatova O.V.,
Gouskova T.A. et al. HLA-DRBl genes possibly involved in spontaneous abor¬
tions of uncertain genesis. //J. Reprod, Immunol. — 2003. - Vol,58, №2. —
P.102,276. Boquct P., Alouf J.E., Duflot E. et al. Characteristics of guinea pig immune sera
elicited by a synthetic diphtheria toxin oligopeptide. //Mol. Immunol. - 1982. -
Vol.l9.-P 1541-1549.277. Borkowsky W., Krasinski K., Pollack H, et al. Early diagnosis of human immu¬
nodeficiency virus infection in children <6 months of age: comparison of
polymerase chain reaction, culture, and plasma antigen capture techniques. //
J. Infect. Dis. - 1992. - Vol.166. - P.616-619.
Список литературы 565278. Borrego F,, Kabat J., Kim D.-K., Lieto L,, Maasho K., Pena J., Solona R.,
Coligan J.E. Stucture and function of major histocompatibility complex (MHC)
class I specific receptors expressed on human natural killer (NK) cells. //Molec.
Immunol. - 2001. - Vol.38. - P.637-660.279. Boydcn E. D., Dictrich W. F. Nalplb controls mouse macrophage susceptibility
to anthrax lethal toxin. //Nat. Genet. — 2006. - Vol.38. — P.240-244,280. Bradley J.R., Pobeer J.S. Tumor necrosis factor receptor-associated factors
(TRAFs). //Oncogenc. - 2001. - Voi.20. - R6482-6491.281. Brennan P., Babbage J.W., Burgering B.JM., Groner B., Reif K., Cantrell D.A.
Phosphatidylinositol 3-kinase couples the interleukin-2 receptor to the cell cycle
regulator E2F. //Immunity. — 1997. — Vol.7. — P.679-689.282. Bresnahan P. A., Barber L.D., Brodsky F.M. Localization of class I histocompat¬
ibility molcculc assembly by subfraction of the early secretory pathway. //Human
Immunol. - 1997. - Vol.53, №2. - P129-139.283. Brodsky F.M., Lem L., Bresnahan P.A. Antigen processing and presentation. //
Tissue antigens. - 1966. - Vol.47, №6. - P.464-471.284. Brodsky F.M., Lem L., Solache A., Bennett E.M. Human pathogen subversion
of antigen presentation. //Immunol. Rev. — 1999. — Vol. 168. — P. 199-215.285. Brown G. D. Dectin-1: a signalling non-TLR pattern-recognition receptor. //
Nat. Rev. Immunol. - 2006. - Vol.6. -P.33-43.286. Brown J.H., Jaredtzky T, Gorga J.C. et al. Three dimensional structure of the
human class П histocompatibility antigen HKA-DRl. //Nature. - 1993. -
Vol.364. - P.33-39.287. Brown M.A., Jones W.K. N F-kappaB action in sepsis: the innate immune system
and the heart. //Front Biosci. - 2004. - VoL9. - P.1201-1217.288. Budar F, Thia-Toong, Van Montagu M, Agrobacterium-mediated gene transfer
results mainly in transgenic plants trans-mitting T-DNA as a single Mendelian
factor. // Gcnctics. - 1986. - Vol.l 14. - P303-313.289. Buonaguro L., Devito C., rornesello M.L. et al. DNA-VLP prime-boost intra¬
nasal immunization induces cellular and humoral anti-HTV-l systemic and
mucosal immunity with cross-clade neutralizing activity. //Vaccine. — 2007. -
Vol.25. - P5968-5977.290. Burshtyn D.N., Lam A.S., Weston М., Gupta N., Warmerdam P.A.,
Long E.O. Conserved residues aminoterminal of cytoplasmic tyrosines contrib¬
ute to the SHP-1-mediated inhibitory function of killer cell Ig-like receptors. //
J. Immunol. - 1999, - Vol.162. - R897-902.291. Cancer Immunotherapy: Suppression and Tumor Growth. /Ed. PrendergastG.C., Jaffec E.M. — London: Elsevier, 2007. — 412 p.
566 Список литературы292. Cano Е., Mahadevan L.C. Parallel signal processing among mammalian
MAPKs. //Trends Biochem. Sci. -1995. - Vol.20. - P.117-122.293. Cantrell D. T ccll antigen receptor signal transduction pathways. //Ann. Rev.
Immunol. - 1996. - Vol.12. - P259-274.294. Capecchi B., Serruto D., Adu-Bbie J. The Genome Revolution in Vaccine
Research. //Mol. Biol. - 2004. - Vol.6. - R17-28.295. Capra J.D. Germinal centers. //Immunologist. - 1996. - Vol.4. - R84-86.296. Caputo A., Gavioli R., Ensoli B. Recent advances in the development of HTV-1
Tat-based vaccines. //Curr. HIV Res.- 2004. — Vol.2, JM94. - R357-376.297. Carrington М., Nelson G.W., Martin M.P. et al. HLA HIV-1: hetcrozygote
advantage B*35-Cw*04 disadvantage. //Science. - 1999. - Vol.283. - P.1748-1752.298. Carswell M. BCG immunization in the children of HIV-positive mothers. //
AIDS. - 1987. - Vol.l. - P.258.299. Casrouge A., Zhang S. Y., EidenschenkC. etal. Herpes simplex virus encephalitis
in human UNC-93B deficiency. //Science. - 2006. - Vol.314. - P.308-312.300. с DC, Diphtheria. Tetanus. Pertussis In: Epidemiology and Prevention of
Vaccine-Preventable Disease: 8 edn. - Atlanta: US Centers for Disease Control
and Prevention, 2005. — P.55-88.30!. CcpilliniR., FrumentoG., FerreraG.B.ctal. Bindingoflabcled influenza matrix
peptide to HLA-DR in living lymphoid cclls. //Nature. - 1989. — Vol.33. —
R392-394.302. Cerundelo V, Alexander J., Andtrson K. et al, Presentation of viral antigen
controlled by a gene in the Major Histocompatibility Complex. //Nature. -
1990. -Vol.345. - R449-452.303. Chambers C.A., Allison J.P. Co-stimulation in T cell responses. //Curr. Opin,
Immunol. - 1997. - Vol.9. - R396-404.304. Chan A.C,, Shaw A.S. Regulation of antigen receptor signal transduction by
protein tyrosine kinases. //Curr. Opin. Immunol, - 1995. - Vol.8. — P.394-40L305. Chcbolu S., Daniell H. Stable expression of Gal/GalNAc Icctin of Entamoeba
histolytica in transgenic chloroplasts and immunogenicity in mice towards vac¬
cine development for amoebiasis. //Plant Biotechnol. J. — 2007, — Vol.5, №2. —
R230-239.306. Chebolu S., Daniell H. Chloroplast-derived vaccinean antigens and biophar¬
maceuticals; expression, folding, assembly and functionality. //Curr. Top.
Microbiol. Immunol. - 2009. - Vol.332. - P.33-54.307. Chedid L., Audibert F., Johnson A.G. Biological activities of muramyl dipeptide,
a synthetic glycopeptides analogous to bacterial immunoregulating agents. //
Prog. Allergy. - 1978. - Vol.25. - P.63-105.
Список литературы 567308. Chedid L., Jolivet М., Audibert F. et al. Antibody responses elicited by a polyva¬
lent vaccine containing synthetic diphtheric, streptococcal and hepatitis peptides
coupled to the same carrier. //Biocem. Biophys, Res. Commun. — 1983. -
Vol.ll7.-P.908-915.309. Chedid L., Jolivet М., Morin A. et al. Production of biologically active anti¬
peptide antibodies in human volunteers immunized with a synthetic peptide of
Streptococcus pyogenes type 24M protein. //Int. J. Immunopharmacol. — 1985. -
Vol.7. - P.39S.310. Chedid L., Ledcrer E. Past, present and future of the synthetic immunoadjuvant
MDP and its analogs. //Biochem. Pharmacol. - 1978. - Vol.27. - P.2183-2186.311. Chen B.P., Parham P. Direct binding of influenza peptides to class 1 HLA mol¬
ecules. //Nature. - 1989. - Vol.337. ~ P.743-745.312. Chen H.L., Gabrilovich D., Tampc R. et al. A functionally defective al lele of TAP 1
results in loss of мне class 1 antigen presentation in a human lung canccr. //
Nature Genet. - 1996. - Vol. 13. - R210-213.313. Cheng E.H., Wei M.C., Weiler S., Flavell R.A., Mak T.W., Lindsten Т.,
Korsmeyer S. J. BCL-2, BCK-Xl sequester BH3 domain-only molecules prevent¬
ing BAX- and BAK-mediated mitochondrial apoptosis. //Mol. Cell. - 1998. -
Vol.8, - P.705-711.314. Choe J., Kelker M.S., Wilson I. A. Crystal structure of human toll-like receptor3 (TLR3) ectodomain. // Science. — 2005. - Vol.309. — P.581-585.315. Chou P.Y., Fasman G.D. Prediction of protein conformation. //Biochemistry, -
1974.-Vol.l3.-P222-253.316. Choudary S., Ravikumar P.,Ashok K. Enhanced immune response of DNA
vaccine (VPl -pCDNA) adsorbed on cationic PLG for fool and mouth disease in
guinea pigs. //Virus Genes. - 2008. - Vol.37, №1. - R81-87.317. Chow L.M.L., Veillettc A. The Src and Csk families of tyrosine kinases in hemo¬
poietic cells. //Semin. Immunol. - 1995. - Vol.7. - R207-226.318. Chua K.Y., Kuo I.C., Huang C.H. et al. DNA vaccines for the prevention and
treatment of allergy. //Curr. Opin. Allergy Clin, Immunol. - 2009. - Vol.9, №1. -
R50-54.319. Claman H.N., Chaperon E.A., Triplett R.F, Immunocompetence of trans¬
ferred thymus-marrow cell combinations. //J. Immunol. — 1966. - Vol.97. -
R828-832.320. Clemen.s J.D., Chuong J.J.H., Feinstein A.R. The BCG controverversy. //
JAMA. - 1983. - Vol.249. - R2362-2369.321. Cohen J. Public health. AIDS vaccine trial produces disappointment and confu¬
sion. //Science. - 2003. - VoL299, №5611, - C.1290-1291.
568 Список литературы322. Cohn J., Martin G.B. Pathogen recognition and signal transduction in plant
immunity. /In; Innate immunity; Ezenkowitz R.A.B., Hoffmann J.A. (Eds). -
Totova, New Jersey; Human Press, 2003. - P.3-26.323. Colonna М., Bresnahan М., Bahram S. et al. Allelic variants of the human puta¬
tive peptide transporter involved in antigen processing. //Proc. Natl. Acad. Sci.
USA. -1992. - Vol.S9. - R3932-3936.324. Cone R.E., Johnson A.G. Regulation of the immune system by synthetic polynu¬
cleotides. 4. Amplification of proliferation ofthymus-infiuenced lymphocytes. //
Cell, Immunol. - 1972. - Vol.3. - P.283*291.325. Cosman D., Mullberg J., Sutherland C.L., Chin W., Armitage R., Fanslow W.,
Kubin М., Chalupny N.J. ULBPs, novel MHC class I-related molecules, bind to
CMV glycoprotein UL16 and stimulate NK cytotoxicity through the NKG2D
reccptor, //Immunity. - 2001. - Vol. 14. - P.123-133.326. Cristiansen O.B. The possible role of classical human leukocyte antigens in
recurrent miscarriage. //Am. J. Rcprod. Immunol. - 1999. - Vol.42, №2, —
Р.110-П5.327. Crouch E.C., Whitsctt J.A, Diverse roles of lung collectins in pulmonary innate
immunity. In; Ezenkowitz R.A.B., Hoffmann J.A. (Eds): Totowa, New Jersey:
Human Press. - 2003. - P205-229.328. Cryns V,, Yuan J. Proteases to die for. //Genes Dev. - 1998. - Vol. 12. -
P1551-1570.329. CuHen М., Erlich H., Klitz W., Carrington M. Molecular mapping of a recom¬
bination hotspot located in the second intron of the human TAP2 locus. //Am. J.
Hum. Genet. - 1965. - Vol.56. - P.1350-1358.330. Cumano P., Kce B.L., Ramsden D.E. et al. Development of В-lymphocytes from
lymphoid committed and uncommitted progenitore. //Immunol. Rev, — 1994. —
Vol. 137. - P.5-33.331. Cuvillier O., Andrieu-Abadie N., Scgui B., Malagarie-Cazenave S., Tardy C.,
Bonhourc E., Levade T. Sphingolipid-mediated apoptotic signaling pathways. //
J. Soc. Biol. - 2003. - Vol.197. - P217-221.332. Dale J.B., Beachcy E.H. Chemically synthesized peptide vaccine against group
A streptococci. //Int. J. Immunopharmacol. - 1985. - Vol.7. - P.399.333. Dale J.B., Sever J.M., Beachey E.H. Type-specific immunogeniclty of a chemi¬
cally synthesized peptide fragment of type 5 streptococcal M protein. //J. Exp.
Med. - 1983. - Vol.158. - P1727-I732.334. Darcissac E.C., Bahr G.M., Parant M.A. et al. Selective induction of CDI la,b,c/
CD18 and CD54 expression at the cell surface of human leukocytes by muramyl
peptides. //Cell. Immunol. - 1996. - Vol.169. - P.294-301.
Список литературы 569335. Davis L.E., Bodian D., Price D. ct al. Chronic progressive poliomyelitis second¬
ary to vaccination of an immunodeficient child. //N. Engl. J. Med. - 1977. -
Voi.297. - P.241-245.336. Davis R.J. Signal transduction by the JNK group of MAP kinases. //Cell. -2000. - Vol.103. - P.239-252.337. De la Salle H., Donato L., Zimmer J. et al. HLA class I deficiencies. //In:
Primary immunodeficiency diseases: a molecular and gcnctic approach. OchsH.D., Smith C.LE., Puck J.M. (Eds): New York: Oxford University Press, 1999. -
R18I-1S8.338. De la Salle Y., Hanau D., Fricker D., Urlacher A. Homozygous human TAP
peptide transporter mutation in HLA class 1 deficiency. //Science. - 1994. —
Vol.265. - P237-24I.339. Deng G.Y., Muir A., Maclaren N.K. She J-X. Association of LMP2 and LMP7
genes within the Major Histocompatibility Complex with insulin-dependent
diabetes mellitus: population and family studies. //Am. J. Hum. Genet. - 1995. -
Vol.56. - P528-533.340. Denis F., Ploy M.C. Research and development strategies, examples among new
vaccines. //Ann. Pharm. Fr. - 2009. - Vol.67, №3. - P.198-202.341. Desjardins D., Huret C., Dalba C. et al. Rccombinant retrovirus-like par¬
ticle forming DNA vaccines in prime-boost immunization and their use for
hepatitis С virus vaccine development. //J. Gene Med. - 2009. - Vol. 11, №4. -
R313-325.342. Deyev S.М., Waibel R., Lebedenko E.N., Schubiger A.P., Plbckthun A. Design
of multivalent complexes using the barnase-barstar module. // Nature biotech¬
nology - 2003. - VoL21, №12. - P.1486-1492.343. Dhanasekaran N., Premkumar R.E. Signaling by dual specificity kinases. //
Onkogcne. - 1998. - Vol.l7. - P1447-1455.344. Diamanstein T, Vogt W., Rihl H., Bochcrt G. Stimulation of DNA synthesis in
mouse lymphocyte cells by polyanions in vitro. I. Target cclls and possible mode
of action. //Eur. J. Immunol. - 1973. - Vol.3. ~ P.488-493.345. Diamanstein Т., Wagner Б. The use of polyanions to break immunological toler¬
ance.//Nature. - 1973. -Vol.241. -P117-119.346. Diebold S.S., Kaisho T, Hcmmi H. et al. Innate antiviral responses by means
of TLER7-mediated recognition of single-stranded RNA. //Science. — 2004. -
VoL303.- P.1529-1531.347. Doan L.X., Li М., Chen C,, Yao Q. Virus-likc perticles as HTV-1 vaccines. //
Rev. Med.Virol. - 2005. - Vol.15, №2. - P 75-88.348. Downward J. Mechanisms and conscquences of activation of protein kinase
B/Akt. //Curr. Opin, Cell. Biol. - 1998. - Vol. 10. - P262-267.
570 CnüCOK литературы349. Dreesman G.R., Sánchez Y., lonescu-Matin I. et al. Antibody to hepatitis В sur¬
face antigen after a single inoculation of uncoupled synthetic HBsAg peptide. //
Nature. - 1982. - Vol.295. - P.15B.350. Driscoll J., Brown M.G., Finley D., Monaco J.J. MHC-linked LMP gene prod¬
ucts specially alter peptidase activities of the proteasomc. //Nature. - 1993. -
Vol.365. - P262-264.351. Du C., Fang M, Li Y., Li L., Wang X. Smac, a mitochondrial protein that promote
cytochrome c-dependem caspase activation by eliminating lAP inhibition. //
Cell.- 2000.-Vol. 100,-P 33-42.352. Dudarev М., Andrews L., Gilbent S.C. Prevalence of scrum neutralizing anti¬
bodies against chimpanzee adenovirus 63 and human adenovirus 5 in Kenyan
Children, in the context of vaccine vector efficacy. //Vaccine. -- 2009. - Vol.27,
№27, - P.3501-3504.353. Dueñas-Carrera S. DNA vaccination against hepatitis C. //Curr. Opin. Mol.
Ther. - 2004. - VoL6. - P.146-150.354. Dunachie S.J., Walther М., Epstein J.E. et al. A DNA prime-modified vaccinia
virus ankara boost vaccine encoding thrombospond in-related adhesion protein
but not circumsporozoite protein partially protects healthy malaria-naive adults
against Plasmodium falciparum sporozoite challenge. //Infect, immun. - 2006. -
Vol.74. - R5933-5942.355. Dupont B., Kettering S. Natural killer cell receptors with ligand specificity for
HLA class 1 molecules. //Proc. W** European Histocompatibility Conference. -
Montpelier, France, 2000. - R33.356. Dutton R.W., SwainS.L. BcellandT cell growth factors.//J. Immunol. - 1985. -
Vol. 132. - R2451-2456.357. Duvall E., Wyllie A.H., Morris R.G. Macrophage recognition of cells under¬
going programmed cell death (apoptosis). //Imn\unology. - 1985. - Vol.56. -
R35I-358.358. Dvorak H.F., Dvorak A.M. Cutaneous basophil hypersensitivity. //Progr.
Immunol. - 1974. - Vol,3. - R171-181,359. Ebihara H., Theriault S., Neumann G. et al. In vitro and in vivo characterization
of rccombinant Ebola viruses expressing enhanced green fluorescent protein. //J.
Infect. Dis. ^ 2007. - Vol.196, Suppl.2. - R313-322,360. Edelweiss E., Balandin T.G., Ivanova J.L., Lutsenko G.V., Leonova O.G., Popen-
ko V.I., Sapozhnikov A.M., Deyev S.M. Barnase as a new therapeutic agent trigger¬
ing apoptosis in human cancer cells.//PLi)S ONE. - 2008. - Vol.3, №6. - P.1-13.361. Eisenbarth S.C., Colegio O.R., O'Connor W. ct al Crucial role for the Nalp3
inflammasome in the immunostimulatory properties of aluminium adjuvants, //
Nature. - 2008. - Vol.453. №7198. - R1122-И26.
Список литературы 571362. Eisensteir Т, Evidence Гот О-antigens as the antigenic determinants in “ribo-
somal” vaccines prepared from Salmonella. //Infect, and Immun. - 1975. -
Vol.12. -P.364-377.363. Ellis S.A., Palmer M.S„ McMichael A.J. Human trophoblast and the choriocar¬
cinoma cell line be Wo express a truncated HLA class I molecule. //J. Immunol. -
1990.-Vol.l44.-P.73i-735.364. Elouz F., Adam A., Ciorbaru R„ Ledcrer E. Minimal structural requirements
for adjuvant activity of bacterial peptidoglycan derivatives. //Biochem. Biophys.
Res. Commun. - 1974. - Vol.59. - R1317-1325.365. Em ini E.A., Jameson B.A, Wimmer E. Priming for an induction of anti>poliovi-
rus neutralizing antibodies by synthetic peptides. //Nature. - 1983. - Vol.304. -
P699-703.366. Enkhbayar P., Kamiya М., Osaki М., MatsumotoT., Matsushima N. Structural
principles of leucine-rich repeat (LRR) proteins. //Proteins, — 2004. — Vol.54. —
R394-403.367. Ensoli B. Racional vaccine strategies against AIDS: background and rationale. //
Microbes infect. - 2005, - Vol.7, №14. - P. 1445-1452.368. Erlich H., Stctler D., Sheng-Dong R. et al. Analysis by molecular cloning of
human class 11 genes. //Fed. Proc. - 1984. - Vol.43. - P.3025-3030.369. Esterley J.R., Stumer W.Q. Disseminated BCG in two boys with chronic granu¬
lomatous diseases of chilhood // Pediatr. - 1971,-Vol. 48 - P. 141-148.370. European Collaborative Study Group. CD4 T cell count as predictor of
Pncumocystis carinii pneumonia in children born to mothers infected with HIV. //
Bf. Med. J. - 1994. - Vol.308. - P.437-440.371. Falk K., Rotzschke O., Takiguchi M. et al. Peptide motifs of HLA-Al, -All, -
A31, and -A33 molecules. //Immunogenetics. — 1994. - Vol.40. - P.238-241.372. Farkas A., Conrad C., Toncl G,, Kemeny L., Dobozy A., Nestle F.O. Current
state and perspectives of dendritic vaccination in cancer immunotherapy. //Skin
pharmacol. Physiol. - 2006. - Vol.19. - P.124-13L373. Faustin B., Lartigue L., Bruey J. М., Luciano F., Sergienko E., Bailly-Maitre B.,
Volkmann N.. Hanein D., Rouiller L, Reed J.C. Reconstituted NALP) inf 1am-
masome reveals two-step mcchanism of caspase-1 activation. // Mol. Ceil. —
2007. - Vol.25. - P713-724.374. Fehling H.J., Swat W., Laplace C. ct al. MHC class 1 expression in mice lacking
the proteasome subunit LMP-7. //Science. - 1994. - Vol.265. - P. 1234-1237,375. Felzmann Т., Gadner H., Holler W. Dendritic cells as adjuvants in antitumor
immune therapy. //Onkologie. — 2002. - Vol.25. - P.456-464.376. Fevrier М., Birrien J.L., Leclerc C. etai. The macrophage, target cell of the synthetic
adjuvant, muramyl dipeptide. //Eur. J. Immunol. - 1978. - Vol.8. — P.558-567.
572 Список литературы377. Fischer H., Yamamoto M., Akira S., Beutler В., Svanborg C. Mechanism of
pathogen-specific TLR4 activation in the mucosa: fimbriae, recognition recep¬
tors and adaptor protein selection. //Eur. J. Immunol. - 2006. - Vol,36. -
P. 267-277.378. Fischer U., Janickc R.U., Schulze-Osthoff K. Many cuts to ruin; a comprehen¬
sive update of caspase substrates. //Cell. - 2003. - Vol. 10. - P.76-100.379. Fisch lechner M ., Donath E. Viruses as bui Iding blocks for materials and devices. //
Angew. Chem. Int. Ed. - 2007. - Vol.46. - P3184-3193.380. Fitzgerald K.A., Pallson-Mc-Dermott E.M., Bowie A.G., Jefferrics C.A.,
Mansell A.S. el al. Mai (MyD88-adapter-like) is required for Toll-like receptor-4 signal transduction. //Nature. - 2001. - Vol.413. - P.78-83,381. Filzsimons H.L., Bland R.J., During M.J. Promoters and regulatory elemems
that improve adeno-associated virus transgene expression in the brain. //
Methods. - 2002. - Vol.28. - P.227-236.382. Foster S.L., Hargreaves D,C., Medzhitov R. Gene-specific control of inflamma¬
tion by TLR-induced chromatin modifications. //Nature. - 2007. - Vol.447, -
P972-978.383. Franchi L., Amer A., Body-Malapel M., Kanneganii T. D., Ozoren N., Jagir-
dar R., Inohara N., Vandenabeele P., Berlin J., Coyle A., Grant E. P., Nu¬
nez G. Cytosolic flagellin requires Ipaffor activation of caspase-1 and interleukin
Ibeta in salmonella-infected macrophages. // Nat. Immunol. - 2006. - Vol.7. —
P576-582.384. Franchi L., Warner N., Viani K. et al Function of Nod-like receptors in
microbial recognition and host defense. //Immunol. Rev. - 2009. - Vol.227. -
P106-134.385. Friedberger E. Uber die IntensitAt der Choleramboreccptorenbildung beim
Kaninchen unter dem eiflussender Alkoholisierung und der Mischung. //Berl.
Klin. Wschr. - 1904. - Bd 41. - S.242-247.386. Fritz J H., Ferrcro R.L., Philpott D. J et.al. Nod-like proteins in inflammaty and
disease. // Nature Immunology. - 2006. - Vol.7, №12. - P.1250-1257.387. Fritz J.H., Girardin S.E., Fitting C., Werts C., Mengin-Lecreulx D., Car-
off M., Cavaillon J.M., Philpott D.J., Adib-Conquy M. Synergistic stimu¬
lation of human monocytes and dendritic cells by Toll-like receptor 4 and
NODI - and N0D2-activating agonists. //Eur. J. Immunol. - 2005. — Vol.35. —
P2459-2470.388. Fritz J.H,, Le Bourhis L., Selige G., Magalhaes J.G., Fsihi H., Küfer T.A.,
Collins C., Viala J., Ferrero R.L., Girardin S.E., Phiipott D.J. Nodl-mediated
innate immune recognition of peptidoglycan contributes to the onset of adaptive
immunity. //Immunity. — 2007. - Vol.26. - P.445-459.
Список литературы 573389. Froehlich C.J., Dixit V.M., Yang X, Lymphocyte granule-mediated apoptosis:
matters of viml mimicry and deady proteases. //ImmunoL Today. - 1998. —
VoL19. - P.30-36.390. Fukuishi N., Metcalfe D., Kulka M. Sounding the alarm in infection. Mast
cells counter-attack. //J. World Allergy Organization. - 2004. - Vol.16, №2. -
P.70-74.391. Fux B.B., Petrov R.V., Khaitov R.M. et al. Bone marrow suppressor В cells in
vitro. //Immunology. - 1978. - Vol.35. - P.600-612.392. Gadjeva М., Verschoor A., Carroll M.C. The role of complement in innate and
adaptive immunity. /In: Innate immunity. Ezenkowitz R.A.B., Hoffmann J,A.
(Lds): Totowa, New Jersey; Human Press. - 2003. - P.305-319.393. Galloway D.R., Bail He L. DNA vaccines against anthrax. //Expert. Opin. Biol.
Ther. - 2004. - Vol.4. - P1661-1667.394. Gallucci S., Lolkema М., Matzinger P. Natural adjuvants; endogenous activators
dendritic cells. //Nat. Med. -1999. — Vol.5. — P.1249-1255.395. GanzT. Dcfensins; antimicrobial peptides of innate immunity. // Immunology. -
2003. - Vol.3. - P710-720.396. Garcon N. Development and evaluation of AS04, a novel and improved adjuvant
system containing MPL and aluminum salt. //In; Immunopotentiators in mod¬
ern vaccines. Schijns V, O’Hagan D. (Eds): London; Academic Press. - 2005. —
P.161-178.397. Garrett T.P.J., Sapcr M.A., Bjorkman P. J et al. Specificity pockets for side chains
of peptide antigen in HLA-Aw68. //Nature. - 1989. - Vol.342. - R692-695.398. Gaszynska М., Rock K.L., Goldberg A.L. Gamma-interferon and expression
of мне genes regulate peptide hydrolysis by proteasomes. //Nature. - 1993. -
Vol.365. - P264-267.399. Gautier G., Humbert М., Deauvieau F., Scuillcr М., Hiscott J., Bates E.E.,
Trinchicri G., Caux C., Garrorie P. A type I interferon autocrine-paracrinc loop
is involved in Toll-like receptor-induced interleukin-12p70 secretion by dendritic
cells. //J. Exp. Med. - 2005. - Vol.201. - P1435-1446.400. Ge P.L., Ma L.P., Wang W., Li Y. Inhibition of collagen-induced arthritis by
DNA vaccines encoding TCR Vbcta5.2 and TCR Vbeta8.2, //Clin. Med. J. —
2009. - Vol.122, №9. - R1039-1048.401. George A.J.T., Ritter M.A. Thymic involution with aging. //Immunol. Today. -
1996. -Vol.l7. -P.267-271.402. Gergely P. New immunological aspects of rheumatoid arthritis. //Allergol. and
Clin. Immunol. Internat. - 2000. - Vol.12, №2. - P.77-81.403. Germain R.N. The ins and outs of antigen processing and presentation. //
Nature. - 1986. - Vol.322, - P687-689.
574 Список литературы404. Germain R.N., Castelüno R, Han R. ct al. Processing and presentation of
endocytically acquired protein antigens by M HC class II and class I molecules. //
Immunol. Rev. - 1996. - Vol.151. - R5-30.405 Gerosa F., Baldani-Guerra B., Lyakh L. A., Batoni G., Esin S., Winkler-Pic-
kett R. Т., Con sol aro M. R., De March! М., Giachino D., Robbiano A., Astegia-
no М., Sambataro A., Kastelein R. A., Carra G., Trinchieri G. Differential
regulation of interleukin 12 and interleukin 23 production in human dendritic
cells. //J. Exp. Med. - 2008. - Vol..205. - P1447-1461.406. Gibb D., Spoulou V., Giacomclli A. ct al. Antibody responses to Hemophilus
influenzae type b and Streptococcus pneumoniae vaccines in children with human
immunodeficiency virus infection. //Pediatr. Infcct. Dis. J. - 1995. - Vol. 14. -
PI 29-135.407. Gill T.J., Doty P. Studies on synthetic polypeptide antigens. VIL The immu-
nogenicity of an aggregate of poly-glutamic acid and poly-L-lysine. //Biocbim.
Biopys. Acta, - 1962. - Vol.60. - R450.408. Glrardin S.E., Boneca Í.G., Carneiro L.A., Antignac A., Jehanno М., Viala J., Te-
din K., Taba M.K., Labignc A., Zahringcr U., Coyle A.J., DiStefano P.S., Bertin .Т.,
Sansonetti PI, Pbilpott D.J. Nodi detects a unique muropcptide from gram-nega¬
tive bacterial peptidoglycan. //Science. - 2003. - Vol.300. - PI584-1587409. Girardin S.E., Travassos L.H., Herve М., Blanot D., Boneca I.G., Philpott D.J.,
Sansonetti PJ., Mengin-Lecreulx D, Peptidoglycan molecular requirements
allowing detection by Nodi and Nod2, //J. Biol. Chem. — 2003. — Vol.278. —
R41702-41708.410. Gleba Y., Klimyuk V., Marillonnet S. Viral vectors for the expression of proteins
in plants. //Curr, Opin. Biotechnol. - 2007, - Vol. 18, №2, - P134-141.411. Glinka E.M., Edelweiss E,F, Sapozhnikov A,M,, Dcycv S.M. A new vector for
controllable expression of an anti-HER2/neu mini-antibody-barnase fusion
protein in HEK 293T cells. //Gene. - 2006. - Vol.366. -97-103.412. Glynne R., Powis S.H., Beck S et al. A proteasomc-rclated gene between the two
ABC transporter loci in the class II region of the human MHC. //Nature. - 1991. -
Vol.353. - R357-360.413. Godson G.N., Ellis J., Svcc P. et al. Identification and chemical synthesis of a
tandemly repeated immunogenic region of Plasmodium knowlesi circumsporo-
zoite protein. //Nature. - 1983, - Vol.305. - P.29-33.414. Golovkin М., Spitsin S., Andrianov, V. el al. Smallpox subunit vaccine produced
in planta confers protection in mice. //Proc. Natl, Acad. Sci. USA. - 2007. —
Vol. 104, №16. - P.6864-6869.415. Golstein P. Cell death; TRAIL and its receptors. //Curr. Biol. - 1997, - Vol.7.-
P750-753.
Список литературы 575416. Gordon S., Taylor P. R. Monocyte and macrophage heterogeneity. //Nat, Rev.
Immunol. - 2005. - Vol.5. - P953-964.417. Green N., Alexander H., Olson A. et al. Immunogenic structure of the influenza
hemagglutinin. //Cell. ~ 1982. - Vol.28. - P477-487.418. Griffiths G,M. The cell biology ofCTL killing,//Curr. Opin, Immunol. -1995. -
Vol7. - P343-349.419. Grode L., Seiler P., Baumann S. et al. Increased vaccine efficacy against tuber¬
culosis of recombinant Mycobacterium bovis bacille Calmette-Guerin mutants
that secrete listeriolysin. //J. Chn. Invest. - 2005. - Vol. 115, - P.2472-2479.420. Gruen J.R., Weissman S.M. Evolving views of the Major Histocompatibility
Cjmplex. //Blood. -1997. - Voi.90. - P4252-4265.421. Grzywacz М., Gorski B., Jakubowska A., Ronin-Walknowska E., Lubinski J.
Association between HLA-G*01018 allele pregnancy complications. //J. Reprod.
Immunol. - 2003. - Vol.58, №2, - P162.422. Guargliardi L.E., Koppebnan B., Blum J.S. et al. Co-localization of molecules
involved in antigen processing in an early endocytic compartment. //Nature. -1990, -Vol.343.- P133-139.423. Guerena-Burgueno R, Hall £.R., Taylor D.N. Safety and immunogenicity of
a prototype enterotoxigenic Escherichia coli vaccine administered transcutane-
ously. //infect. Immun. - 2002, - Vol,70. - P.1874-1880.424. Gulbins E. Regulation of death rcceptor signaling and apoptosis by ceramide. //
Pharmacol. Res. - 2003. - Vol.47. ~ P393-399.425. Gustafsson C., Govindarajan S., Minshull J. Codon bias and heterologous pro¬
tein expression. //Trends Biotechnol. — 2004. — Vol.22, №7. - P.346-353.426. Gyzin J., Barnwell J.W., Schlesinger D.H. ct al. Neutralization of the infectivity
of sporozoites of Plasmodium knowlesi by antibodies to a synthetic peptide. //J.
exp. Med, - 1984. -Vol. 160. - R935-940.427. Hagemann C., Blank J.L. The ups and down of MEK kinase interactions, //
Cellular Signaling. - 2001. - Vol.l3, №12. - R863-875,428. Hanna J.N. The epidemiology of invasive Haemophilus influenzae infection in
children under five years of age in Nortern Territory: a three-year study.// Med.
J. Aust. - 1990, - Vol.152. - R234-240.429. Hao S., Bi X., Xu S., Wei Y.,Wu X., Guo X., Carlsen S,, Xiang J. Enhanced atitu-
mor immunity derived from a novel vaccine of fusion hybrid between dendritic and
engineered myeloma cells. //Exp. Oncol. — 2004. - Vol.26, №4. - P.300-306.430. Harper D., Franco E,, Wheeler C. et al. Sustained efficacy up to 4,5 years of
a bivalent LI virus-like particle vaccine against human papillomavirus types
16 and 18: follow-up from a randomised controlled trial. //Lancct. - 2006. —
Vol.367. - R1247-12.55.
576 Список литературы431. Harris SX, Levine A.J. The p53 pathway; positive and negative feedback loops. //
Oncogene. - 2005. - Vol.24. - P.2899-2908.432. Hasan U., Chaffois C., Gaillard C. et aL Human TLRIO is a functional receptor,
expressed by В cells and plasmacytoid dendritic cclls, which activates gene tran¬
scription through MyD88. //J. Immunol. - 2005. - Vol. 174. - P,2942-2950.433. Haynes B.F., Fleming J., St.Clair W.E., Katinger H., Stieger G. etal. Cardiolipin
polyspecific auto reactivity in two broadly neutralizing HIV-1 antibodies. //
Science. - 2005. -Vol.308. - R1906-1908.434. Heil F, Hemmi H., Hochrein H. et al. Species-specific recognition of single-
stranded RNA via Toll-like receptor 7 and 8. //Science. - 2004. - Vol.303. -
P. 1526-1529.435. Hess J,, JVliko D., Catic A. ct al. Mycobacterium bovis Bacille Calmelte-Guerin
strains secreting listeriolysin of Listeria monocytogenes. //Proc. Natl. Acad. Sci.
USA. - 1998. - Vol.95. - P.5299-5304.436. Hewlett E.L. Bordetella species. / in; Principles and practice of infectious dis¬
eases.; Mandell G.L., Bennett J.E., DoMn R. (Eds). — Philadelphia: Churchill
Livingstone, 2005. - P.2701-2708.437. Higashi Y., Tanae A., Inoue H.H. et al. Evidence for frequent gene conversion
in the steroid 21-hydroxylase P-450 gene (C21) gene: implications for steroid 21
hydroxylase deficiency. //Am. J. Genet. -1988. - Vol.42. - P. 17-25.438. Hill A.V.S., Allsopp C.E., Kwiatkowski D. et al. Common West African HLA
antigens are associated with protection from severe malaria. //Nature. - 1991. -
Vol.352. - P.595-600.439. Hofselh L.J., Hussain S.P., Harris C.C. p53; 25 years after its discovery. //Trends
Pharmacol. Sci. - 2004. - Vol.25. - R177-18L440. Hollinger F.B., Dreesman G.R., Sparrow J., Melnick J.L. Synthetic peptide
vaccine for hepatitis B. //Rev. Biol. Stand. - 1983. - Vol.54. - P.113-116.441. Hopp TP. Immunogenicity of a synthetic HBsAg peptide; enhancement by
conjugation to a fatty acid carrier. //Molcc. Immunol. — 1984. — Vol.2l. —
R13-16.442. Hopp T.P., Woods K.R. Prediction of antigenic determinants from amino acid
sequences. //Proc. Nat. Acad. Aci. USA. - 1981. - Vol.78, — P.3824-3828.443. Horng T, Barton G.M., Medzhitov R. ТІ RAP: an adapter molecule! n the Toll
signaling pathway. //Nat. Immunol. - 2001. - Vol.2. - R835-841.444. Hornung V, Ellegast J., Kim S., Brzozka K., Jung A., Kato H., Poeck H., Aki¬
ra S., Conzelmann K. K., Schlee М., Endres S., Hartmann G. 5’-Triphosphate
RNA is the ligand for RIG-I. //Science. - 2006. - Vol.314. - R994-997.445. Horwitz M.A. Recombinant BCG expressing Mycobacterium tuberculosis major
extracellularproteins. //Microbes Infect. - 2005. - Vol.7. - P.947-954.
Список литературы 577446. Horwitz М.A., Harth G. A new vaccine against tuberculosis affords greater
survival afterchallenge than the current vaccine in the guinea pig model of
pulmonary tuberculosis. //Infect. Immun. — 2003. — Vol.71. — P.1672-1679.447. Huang D.C.S., Strasser A. BH3-only proteins - essential initiators of apoptotic
ccll death, //Cell. - 2000. - Vol. 103. - P.839-842.448. Huczko E.L., Bodnar W.M., Benjamin D, et al. Characteristics of endogenous
peptides eluted from the class I MHC moleculc HLA-B7 determined by mass
spectrometry and computer modeling. //J. Immunol. - 1993. - Vol.151. -
P2572-2587.449. Itoh N., Nagata S. A novel protein domain reqircd for apoptosis. Mutual analysis
of human Fas antigen. //J. Biol. Chem. - 1993. - Vol. 1993. - P. 10932-10937.450. Jackson D.G., Capra J.D. TAPI alleles in insulin-dcpcndcnt diabetes mellitus: a
newly defined centromeric boundary of disease susceptibility, //Proc. Nat. Acad.
Sci. USA. - 1990. - Vol.90. - P. 11079-11083.451. Jacob C.O., Sela М., Arnon R. Antibodies against synthetic peptides of the В
subunit of cholera toxin; crossreaction and neutralization of the toxin, //Proc.
Nat. Acad. Sci. USA. - 1983. - Vol.80. - P7611-7615.452. Janeway C.A., Jr. Approaching the asymptote? Evolution end revolution in
immunology. //Cold Spring Harb. Symp. Quant. Biol. — 1989. — Vol.54, Pt 1. —
Pl-13.453. Janeway C. A., Jr. The immune system evolved to discriminate infectious nonself
from noninfectious self. //Immunol. Today. — 1992. — VoI.13. — P.11-16,454. Janeway C, A. The T cell receptor as a multicomponent signaling machine: CD4/
CD8 coreccptors and CD45 in T cell activation. //Ann. Rev. Immunol. — 1992. —
Vol. 10. - P645-674.455. Janeway C.A. Functions of the MHC: Presentation of antigens to T ccils. //
Plenary report at ASHÍ 23'^ Annual Meeting. ~ Atlanta, Georgia, 1997. —
P27-42.456. Janssens S., Beyaert R. Functional diversity and regulation of different
intcrleukin-1 receptor-associated kinase (IRAK) family members. // Molec.
Cell. - 2003. - Vol.l 1, №2. - P293-302.457. Jeffreys A.J,, Rilchie A., Neumann R. High resolution analysis of haplotype
diversity and meiotic crossover in the human TAP2 recombination hotspot. //
Hum. Molec. Genet. - 2000. - Vol.9. - P725-733.458. Jemmerson R., Paterson Y. Mapping antigcnic sites on proteins; implications
for the design of synthetic vaccines. //Biotechniques. — 1986. - Vol.4, №1. -
P18-3I.459. Jenssen H., Hamill P., Hancock R.E.W. Peptide antimicrobial agents.//Clin.
Microbiol. Rev. - 2006. - Vol.l9, №3. - P491-51I.
578 Список литературы460. Jin M.S., Kim S.E., Нео J.Y. et al. Crystal structure of the TLR1-TLR2
heterodimer induced by binding of a tri-acylated lipopeptide. //Cell. - 2007, -
VoL130.-R1071-I082.461. Jolivet М., Audibert F., Tartar A. et al. Antibody response and protective activity
with a new synthetic polyvalent vaccine. //Int. J. Immunopharmacol. - 1985. -
Vol.7, - R398.462. Jones W.K., Brown М., Ren X., He S., McGuinness M. NF-kappaB as an
integrator of diverse signaling pathways: the heart of myocardial signaling? //
Cardiovasc. Toxicol. - 2003. - Vol.3, №3. - R229-254.463. Jonulcit H., Schmitt E., Stassen М., Tuettenberg A., Knop J., Enk A. H.
Identification and functional characterization of human CD4(+)CD25(+) T
cells with regulatory properties isolated from peripheral blood. //J. Exp. Med. -2001. - Vol.193. - R1285-1294.464. Jung G. Synthesis and perspectives of new adjuvants and carrier systems for
potential application for synthetic vaccines. - Synthetic antigens. //Ann. Sclavo. —
1984.-№2.-R191-208.465. Kabanov VA,, Retrov R.V., Khaitov R.M. Artificial antigens and vaccines based
on non-natural polyelectrolytes. //Sov. Sci. Rev., Ser.D. Physiochem. Biol. —1984. - Vol.5. - R277-322.466. Kabelitz D. Expression and function of Toll-like receptors in T lymphocytes. //
Curr. Opin. Immunol. - 2007. - Vol. 19. - P.39-45.467. Kadowaki N., Ho S., Antonenko S., Malefyt R. W., Kastelein R. A., Bazan F.,
Liu Y. J. Subsets of human dendritic ccll precursors express difterent toll-like
receptors and respond to different microbial antigens. //J. Exp. Med. — 2001. —
Vol. 194. - R863-869.468. Kagan J. C., Su Т., Horng T, Chow A., Akira S., Medzhitov R. TRAM couples
endocytosis of Toll-like receptor 4 to the induction of interferon-beta. //Nat.
Immunol. - 2008. - Vol.9. - R361-368.469. Kaisho T, Akira S. Toll-like receptors. //In: innate immunity; Ezenkowitz
R.A.B., Hoffman J.A. (Eds). - Totowa, New Jersey: Human Press, 2003. —
R177-189.470. Kalvakolanu D.V, Alternate interferon signaling pathway, //Pharmacol, and
Therapeutics. - 2003. - Vol. 100, №1, - Rl-29.471. Kane L.R, Lin J., Weiss A. Signal transduction by the TCR for antigen. //Curr,
Opin. Immunol. - 2000. -Vol.12. - R242-249.472. Kanneganti T.D., Lamkanfi М., Nunez G. Intracellular NOD-like receptors in
host defense and disease. //Immunity. - 2007. - Vol.27. - R549-559.473. Karin M,, Dclhase M. The I kappa В kinase (IKK) and NF-kappa B: key elements
of proinflammatory signaling. //Semin. Immunol. - 2000. - Vol.12. - P.85-98.J
Список литературы 579474. Каггс К. Natural killer recognition of missing self. //Nat. Immunol. - 2008. —
Vol.9. - P.477-480.475. Kato H., Sato S., Yoneyama М., Yamamoto М., Ucmatsu S., Matsui K,,
Tsujimura Т., Takeda K., Fujita Т., Takcuchi O., Akira S. Cell typc-specific
involvement of RlG-I in antiviral response. //Immunity. - 2005. - Vol.23. —
P. 19-28.476. Kato H., Takeuchi O., Mikam^o-Satoh E., Hirai R., Kawai Т., Matsushita K.,
Hiiragi A., Dermody T. S., Fujita Т., Akira S. Length-dependent recognition of
double-stranded ribonucleic acids by retinoic acid-inducible gene-1 and melanoma
differentiation-associatcd gene 5. //J. Exp. Med. — 2008. — Vol.205. — P. 1601-1610.477. Kato H., Takeuchi O., Sato S., Yoneyama М., Yamamoto М., Matsui K.,
Uematsu S., Jung A., Kaw^ai T, Ishii K. J., Yamaguchi O., Otsu K., Tsujimura
Т., Koh C. S., Reis e Sousa C., Matsuura Y., Fujita T, Akira S. Differential roles
of MDA5 and RIG-I helicases in the recognition of RNA viruses. //Nature. -2006.-Vol.441.-R101-105.478. Katz D.H. Prospects for the clinical control of IgE synthesis. //Prog. Clin.
Immunol. - New York, 1980. - Vol.4. - R127-150.479. Kaufmann S.H. Envisioning future strategies for vaccination against tuber¬
culosis. //Nat. Rev. Immunol. — 2006. — Vol.6. - P.699-704.480. Kawane K., Fukuyama H., Yoshida H., Nagase H., Ohsawa Y., Uchiyama Y.,
Okada K., lida T, Nagata S. Impaired thymic development in mouse embryos
deficient in apoptotic DNA degradation, //Nat. Immunol. - 2003, - Vol.4. —
R138-144.481. Kayagaki N., Phung 0 , Chan S,, Chaudhari R., Quan C., O’Rourke K. М.,
Eby М., Pietras E., Cheng G., Bazan J, F., Zhang Z., Arnott D., Dixit V. M.
DUBA: a deubiquitinase that regulates type I interferon production. //
Science. - 2007. ~ Vol.318. - R1628-1632.482. Kehrl J.H., Alvarez-Mon М., Delsing G.A. et al, Lymphotoxin is an important
T cell-derived growth factor for human В cclls. //Science. - 1987, - Vol,238. -
R1144-1146.483. Kellie S. Protein tyrosine phosphatases: potential roles in disease. //Cell
transmissions. — 2003. - Vol. 19. - P.3-8,484. Kelly A., Powis S.H., Glynne R. ct al. Second proteasome-rclated gene in the
human MHC class II region. //Nature. — 1991. - Vol.353. - P.667-668.485. Kempf K.E., Rubin A.S.J. Transient suppression of the humoral immune
response mediated be a factor derived from specifically activated double primed
lymphoid cells. //J. Immunol. - 1977. - Vol.. 119. - P.517-523.486. Kendall M.D. Functional anatomy of the thymus. //J. Anat. — 1991. ~ Vol.177. -
Rl-29.
580 Список литературы487. Kennedy J.S., Со М,, Green S., Longtine К. et al. The safety and tolerability
of an HlV-1 DNA prime-protein boost vaccinc (DP6-00!) in healthy adult
volunteers. //Vaccine. - 2008. - Vol.26. -- P.4420-4424.488. Khaitov R.M. Vaccincs based on synthetic polyions and pcptides.//Ann. N.Y.Acad. Sci. - 1993. - Vol.685. - P.788-802.489. Khailov R.M. Molecular bases for the construction of artificial immunogens
and vaccines based on synthetic polyions. //Allergy Proc. - 1995. - Vol.16. -
P 255-260.490. Khaitov R.M., Petrov R.V., Moroz B.B., Bezin G.i. The factors controlling stem
cel] recirculation. I. Migration of hemopoietic stem cells in adrenalectomizcd I
mice. //Blood. - 1975. - Vol.46. - P73-78. |491. Khanna A., Campbell R.D. Characterization of a novel gene G13 in the class III |
region of human MHC. //In: HLA 1991; Tsuji K., Aizawa М., Sasazuki T (Eds). — |
Oxford: Oxford University Press, 1992. - P.198-202. ^492. Khoor A., Gray M.E., Hull W.M., Whitsett J.A., Stahlman M.T. Developmental |
expression of SP-A and SP-D mRNA in the proximal and distal respiratory I
epithelium in the human fetus and newborn. //J. Histochem. Cy tochem. - 1993. - *
Vol.4l.-P1311-I319. I493. Khor C. C., Chapman S. J., Vannberg F. O. et al. A Mai functional variant is •
associated with protection against invasive pncumococcal disease, bacteremia, J
malaria and tuberculosis. //Nat. Genet. — 2007. - Vol..39. - P.523-528. I494. Khoury S., Waaga A., Chen W, Class IIMHC allopcptide-specific Thl cell done
recognizes single epitopic difference and transfers delayed type hypersensitivity
responses in vivo. /УРгос. XVI internat. Congress of the Transplant. Society - |
Barcelona, 1966. — P33.495. Khubchandani K.R., Snyder J.M. Surlactant protein A (SP-A); the alveolus and
beyond. //FASEB J. - 2001. - Vol.l5. - P.59-69.496. Kim H.D., Jin J.J., Maxwell J.A. Enhancing Th2 immune responses against
amyloid protein by a DNA prime-adenovirus boost regimen for Alzheimer’s .1
disease. ^Immunol. Lett. - 2007. - Vbl.H2. - P30-38. i497. Kim H.M., Park B.S., Kim II. et al. Crystal structure of the TLR4-MD-2 |
complex with bound endotoxin amagonist Eritoran. //Cell. - 2007. - Vol.l 30. - |
P906-917.498. King A., Allan D.S., Bowen M. el al. HLA-E expressed on trophoblast and inter¬
acts with CD94/NKG2 receptors on decidual NK cells. //Eur. J. Immunol. —2000.-Vol.30. - R1623-1631.499. Kipstein F.A., Engcrt R.F., Clements J.D., Houghtcn R.A. Vaccine for entero¬
toxigenic Escherichia coli based on synthetic heat-stable toxin cross-1 inked to the |
В subunit of heat-labile toxin. // J. Infect. Dis. — 1983. — Vol.147. — P.318-326. II'
Список литературы 581500. Kirkitadze M.D., Barlow P.N. Structure and flexibility of the multipledomain
proteins that regulate complement activation. //Immunol. Rev. -2001. -
Vol.180.-R 146-161.501. Kischkel RC., Hellbardt S., Behrmann L, Germer М., Pawlita М., Kramrner
P.H., Peter M.E. Cytotoxity-dependent APO-1 (Fas/CD95)-associated proteins
form a death-inducing signaling complex (DISC) with the receptor.//EM BO J.. —1995. - Vol.l4. - R5579-5588.502. Kishimoto Т., Hirari Y., Nakanishi K. et al. Regulation of antibody response in
different immunoglobulin classes. VI. Selective suppression of IgG response by
administration of antigen-conjugated muramilpeptidcs. //J. Immunol. - 1979. -
Vol.123.-R2709-27I5.503. Kisielow P., Von Boehmer H. Development and selection of T cells: facts and
puzzles. //Adv. ImmunoL - 1995. - Vol.5S. - P.87-209.504. Kobinger G.P., Feldmann H., Zhi Y. et al. Chimpanzee adenovirus vaccine pro¬
tects against Zaire Ebola virus. //Virology. — 2006. — Vol.346. — P.394—401.505. Kohl T, Hitzcroth L, Cristensen N.D. ct al. Expression of HPV-il LI protein
in transgenic Arabidopsis thaliana and Nicotiana tabacum. //BMC Biotechnol. -2007. - №7. - R56.506. Kolesnick R., Fuks Z. Radiation and ccramide-induced apoptosis. //Oncogene. -2003. - Vol.22. - R5S97-5906.507. Kolh W. Meaningful relationships: the regulation of the Ras/Raf/MEK/ERK
pathway by protein interactions. //Biochem. J. — 2000. — Vol.35l. — P.289-305.508. Koller B.H., Geraghty D.E., deMars R. et al. Chromosomal organization of ihe
human Major Histocompatibility Complex class I gene family. //J. Exp, Med,. —1989. -Vol. 169. - R469-480.509. Komatsu-Wakui М., Tokunaga K., IshikawaY. et al. MIC-A polymorphism in
Japoncse and a MIC-A-MIC-B null haplotype. //Immunogenetics. - 1999. -
Vol.49. - R620-628.510. Kool М., Piiirilli V. De Smedt T. ct al. Cutting edge; alum adjuvant stimulates
inflammatory dendritic cclls through activation of the NALP3 inflammasome. //
J. Immunol. - 2008. - Vol.181, №6. - R3755-3759.511. Koutsky L,, Ault K., Wheeler C. ct al. A controlled trial of a human papilloma¬
virus type 16 vaccinc. //N. Engl. J. Med. — 2002. - Vol.347. — R1645-1651.512. Kovats S., Main E., Librach C. HLA-G expressed in human trophoblast. //
Scicnce. - 1990, - Vol.248. - R220-223.513. Koyania S., Ishii K. J., Kumar H., TanimotoT., Coban C., Uematsu S., Kawai T,,
Akira S. Differential role of TLR- and RLR-signaling in the immune responses
to influenza A virus infection and vaccination. //J. Immunol. - 2007. -
Vol.l79. -P.4711-4720.
582 Список литературы514. Krammer PH. CD95 (APO-l/Fas)-mcdiated apoptosis: live and let die. Adv. //
ImmunoJ. - 1999. - Vol.71. - P163-210.515. Krieg A.M. CpG motifs in bacterial DNA and their immune cffects. //Annu.
Rev. Immunol. - 2002. - VoL20. - P.709-760.516. Kroemer G., Cuendc E., Maertincz C. Compartmentalization of the peripheral
immune system. //Adv. Immunol. - 1993. - Vol.53. - P. 157-216.517. Kubo R.T., Sette A., Grey H.M. et al. Definition of specific peptide motifs for
four major HLA-A alleles. //J. Immunol. - 1994. - Vol.152. - P.3913-3924.518. Kuikcn C-, Foley B., Hahn B. ct al. IV Sequence Compendum 2001. /Los Alamos
National Laboratory. - Los Alamos, New Mexico. - http://hiv-web.lanl.gov519. Kumagai Y., Takeuchi O., Kato H,, Kumar H., Matsui K., Morii E., Aozasa K.,
Kawai Т., Akira S. Alveolar macrophages are the primary interferon-alpha pro¬
ducer in pulmonary infection with RNA viruses. //Immunity. - 2007. - Vol.27. -
R240-252.520. Kummer J.A., Broekhuizen R., Everett H, et al. Inflammasome components
NALPI and 3 distinct but separate expression profiles in humane tissuses
suggesting a site-spccific role in the inflammatory response. // J. Histochem.
Cytochem. - 2007. - Vol.55, №5. - P443-452.521. Kurosaki T. Functional dissection of BCR signaling pathways. //Curr. Opin.
Immunol. - 2000. - Vol.12. - P276-281.522. Kyte J., Doolittle R.A. A simple method for displaying the hydropathic character
of a protein. //J. Mol. Biol. - 1982. - Vol. 157. - P105-132.523. Labeur M.S., Roters B., Pcrs B. et al. Generation of tumor immunity by bone
marrow-derived dendritic cells correlates with dendritic ccll maturation stage. //
J. Immunol. - 1999. - Vol.162. - P168-175.524. Lai C.Y. The chemistry and biology of cholera toxin. //CRC Crit. Rev. Biochem. -
1980. - Vol.9, №3. - P171-206.525. Lamb R.A., Lai C.-J. Conservation of the influenza virus membrane protein
(M,) amino acid sequence and open reading frame of RNA segment 7 cncodind
a second protein (М2) in HlNl and H3N2 strains. //Virology. - Vol.112, №2. -
P746-751.526. Lando Z., Teitelbaum D., Arnon R. Effect of cyclophosphamide on sup¬
pressor cell activity in micc unresponsive to EAE. //J. Immunol. - 1979. -
Vol.123. - P.2156-2160.527. Landsteiner K. The specificity of serological reactions. - Cambridge: Harvard
Univ. Press, 1946. - 310 p.528. Langbeheim H., Arnon R., Sela M. Antiviral effect on MS-2 coliphage obtained
with a synthetic antigen. // Proc. Nat. Acad. Sci. USA. - 1976. — Vol.73. -
P4636-4640.
Список литературы 583529. Langenkarap А., Messi М., Lanzavecchia А., Sallusto F. Kinetics of dendritic
cell activation: impact on priming of THl, TH2 and nonpolarized T cells. //Nat.
Immunol. - 2000. - Vol.l. - R311-316.530. Langermans J.A., Doherty T.M., Vervenne R.A. el al. Protection of macaques
against Mycobacterium tuberculosis infection by a subunit vaccine based on a
fusion protein of antigen 85B and ESAT-6. // Vaccine. — 2005. — Vol.23. —
P.2740-2750.531. Lanier L.L. Face off — the interplay between activating and inhibitory immune
receptors. // Curr. Opin. Immunol. - 2001. — Vol.l3. - P.326-331.532. Lanier L.L., Corliss B.C., Wu J., Leong C., Phillips J.H. Immunoreceptor
DAP12 bearing a tyrosine-based activation motif is involved in activating NK
cells. // Nature. - 1998. - Vol391. - P.703-707.533. Lapierre L. A., Fiers W., Pober J.S. Three distinct classes of regulatory cytokines
control endothelial cell MHC antigen expression. Interactions with immune
gamma interferon difTerenciate the effects of human necrosis factor and lym-
phoioxin from those of leucocytc alpha and fibroblast beta interferons. //J. Exp.
Med. - 1988. - Vol.167. - P794-804.534. Lasetic S., Chang C., Houchins J.P., Lanier L.L., Phillips J.H. Human natural
killer cell receptors involved in MHC class 1 recognition are disulfide-linked
heterodimers of CD94 and NKG2 subunits. //J. Immunol. — 1996. - Vol.157. -
R474b4745.535. Latour S., Veillettc A. Proximal protein tyrosine kinases in immunoreceptor
signaling. //Curr. Opin. Immunol. - 200L - Vol.l3. — P.299-306.536. Latz E., Verma A., Visintin A. et al. Ligand-induced conformational changes
allosterically activate Toll-like receptor 9. //Nat. Immunol. - 2007. - Vol.8. —
P772-779.537. Lau C.M., Broughton C., Tabor A.S. et al. RNA-associated autoantigens activate
В cclls by combined В cell antigen receptor/ToIl-like rcceptor 7 engagement. //J.
Exp. Med. - 2005. - Vol.202. - P.1171-1177.538. Laver W.G., Webster R.G. Preparation and immunogenicity of an influenza
virus hemagglutinin and neuraminidase subunit vaccine. //Virology. — 1976. —
Vol.69. - P511-522.539. Le Boutciller P., Piazzato N., Solier C., Barakonyi A., Agcrre-Girr М., Lenfant
F. HLA-G control of placental local immunity and angiogenesis. //J. Reprod.
Immunol, - 2003. - Vol.58, №2. - P. 115.540. Lee J., Chuang Т.Н., Redecke V. et al. Molecular basis for the immunostimula¬
tory activutyof guanine nucleoside analogs: activation of Toll-like receptor 7. //
Proc. Natl. Acad. Sci. USA, - 2003. - Vol.lOO. - R6646-6651.
584 Список литературы541. Lee S.H., Kim J.S., Jun Н.К. The major outer membrane protein of a periodon-
topathogen induces IFN-bcta and IFN-stimulated genes in monocytes via hpid
raft and TANK-binding kinase 1/IFN regulatory factor-3. //Immunology. —
2009. - Vol. 182, №9. - P.5823-5835.542. Lcnshaw D.J., Walunas TL. CD28/B7 system of T cell costimulation. //Ann.
Rev. Immunol. - 1996. - VoI.14. - P.233-258.543. Lenzi P, Scotti TM, Alagna F, et al. Translational fusion of chloroplast-expressed
human papillomavirus type 16 LI capsid protein enhances antigen accumula¬
tion in transplastomic tobacco. //Transgenic Res, — 2008. - Vol.17, №6. -
P1091-1102.544. Lerner R.A. Tapping the immunological repertoire to produce antibodies of
predetermined specificity, //Nature. - 1982. - Vol.299. - P,593-596.545. Lerner R.A., Green N., Alexander H. et al. Chemically synthesized peptides pre¬
dicted from nucleotide sequence of the hepatitis В virus genome elicit antibodies
reactive w'ith the native envelope protein of Dane particles. //Proc. Nat. Acad.
Sci. USA. - 1981. - Vol.78. - P3403-3407,546. Letai A., Bassik M.C., Walcnsky L.D,, Sorcinelli M.D., Weiler S., Korsmeyer
S.J. Distinct BH3-domains either sensitize or activate mitochondrial apoptosis,
serving as prototype canccr therapeutics.//Cancer Cell. - 2002. - Vol.2. -
P183-192.547. Lewis C.М., Broussard С., Czar M.J., Schwartzberg P.L, Tec kinases: modulators
of lymphocyte signaling and development. //Curr. Ohin. Immunol. - 2001. -
Vol.13.- R317-325.548. Lex A., Weismbller K.H., Jung G., Bessler W.G. A synthetic analogue of
Escherichia coli lipoprotein, tripalmitoylpentapcptide, constitutes a potent
immune adjuvant.//J. Immunol. - 1986. - Vol.137, №8. - P.1421-1426.549. Li F., Wang L., Jin X.M. et al. The immunologic effcct of TGF^-bctal chito-
san nanoparticle plasmids on ovalbumin-induced allergic BALB/c mice. //
Immunobiology. — 2009. - Vol.214, №2. — P.87-99.550. Li H., Willingham S.B., Ting J.P., Re F. Cutting edge; inflammasome activation
by alum and alum’s adjuvant effcct are mediated by NLRP3. //J. Immunol. —2008. - Vol.l8i, №1. - P17-21.551. Li X., Stark G.R. NFKB-dependent signaling pathways. //Exp, Hematol. —2002. - Vol.30, №4. - P285-296.552. Li Y.P., Kang H.N., Babiuk L.A., Liu 0- Elicitation of strong immune responses
by a DNA vaccine expressing a secreted form of hepatitis С virus envelope protein
E2 in murine and porcine animal models. //World J. Gastroenterol. - 2006. -
Vol.12. - P.7126-7135.
Список литературы 58$553. Lian Y., Srivastava I., Gomez-Roman V.R., Zur Megede J., Sun Y., Kan E. et
al. Evaluation of envelope vaccincs derived from the South African subtype С
human immunodeficiency virus type 1 TVl strain. //J. Virol. - 2005. - Vol.79,
№21. ~R 13338-13349.554. Liang R., van den Hurk J.V., Zheng C. et al. Immunization with plasmid DNA
encoding a truncated, secreted form of the bovine viral diarrhea virus E2 protein
elicits strong humoral and cellular immune responses. //Vaccine. — 2005, —
Vol. 23. - R5252-5262.555. Liew F.Y., Xu D,, Brint E.K., O’Neill L.A, Negative regulation of toll¬
like receptor-mediated immune responses. //Nat, Rev. Immunol. — 2005. -
V0I..5. - R446-458.556. Linnemann C,C., Jr. Pertussis. In; Oxford Textbook of Medicine, 4 edn./
Warrell D.A,, Weatherall D.J., Cox T.M., Firth J.D, (Eds). - Oxford: Oxford
University Pres, 2003. — P.525-527.557. Linsey P.S., Ledbetter J.A. The role of the CD28 receptor during T-cell respons¬
es to antigen. //Ann. Rev. Immmunol. - 1993. — Vol.lL - P.191-221.558. Lipsky P.E,, Rosenthal A.S. Macrophage-lymphocyte interaction. L
Characteristics of the antigen-independent-binding of guinea pig thymocytcs
and lymphocytes to syngeneic macrophages.//J. Exp. Med. - 1973. - Vol.138. —
P.900-924.559. Liu L-, Cheng G., Wang C. et al. Identification and experimental verification
of protective antigens against Streptococcus suis serotype 2 based on genome
sequence analysis. //Curr. Microbiol. — 2009, — Vol.58, №1. — P.11-17.560. Liu X,, Kim C.N., Jang J,, Jemmerson R,, Wang X. Induction of apoptotic
program in cell-frce extracts; requirement for aATP and cytochrom c, //Cell. -1996. - V0I.86, - P147-157,561. Locklcy R.M., Killeen N., Lenardo M.J. The TNF and TNF receptor superfam-
ilics; integrating mammalian biology. //Cell. - 2001, - Vol,104.- P.487-501.562. Logunov D,Y,, Zubkova 0,V., Karyagina-Zhulina A,S. et al. Identification of
HI-Like loop in CELO adenovirus fiber for incorporation of receptor bindibg
motifs. //J, Virol, - 2007. - V0I.8I, №18. - P.9641-9652.563. Lopez-Botet M,, Bellon T. Natural killer cell activation and inhibition by
rcceptors for MHC class 1. //Curr. Opin. Immunol. - 1999. — Vol.IL -
P 301-307.564. Lopez-Botet М., LlanoM., Navarro F., Bellon T, NK ccll recognition of non-
classical HLA class 1 molecules. //Semin. Immunol. — 2000. - Vol.126, №3. -
Р109-И9.565. Lowy D.R., Schiller J.T. Prophylactic human papillomavirus vaccines, //J. Clin.
Invest. - 2006. - Vol. 116. - P11676-1173.
586 Список литературы566. Lu S. Immunogenicity of DNA vaccines in humans: it takes two to tango.//
Hum. Vaccin. - 2008. - Vol. 4. - P,449-452.567. Lupcr M.L., Jr, Rao N., Eck M.J., Band H. The Cbl protooncoprotein: a negative
regulator of immune receptor signal transduction. //Immunol. Today. - 1999. -
Vol.20. - P.375-382.568. Mach B., Steimle V, Martinez-Soria E. ct al. Regulation of MHC class II genes:
lessons from a disease. //Ann. Rev. Immunol. - 1996. - Vol.14. - Р.302-ЗШ.569. Madden D.R. The three-dimensional structure of peptidc-MHC complexes. //
Ann. Rev. Immunol. - 1995. - Vol. 13. - P587-622,570. Madden D.R., Gorga J.C., Stroniingcr J.L. et al. The structure of HLA'B27
reveals nonamer self-pcptides bound in an axtcnded confirmation. //Nature. —1991. - Vol. 353.-R 321-325.571. Madsen J., Kliem A., Tornoe I. et al. Localization of lung surfactant protein D
(SP-D) on mucosal surfaces in human tissues. //J. Immunol. - 2000. — Vol. 164. -
P5866-5870.572. Makhatadzc N., Sanchez-Llamozas P., Frajo M.T., Layrisse Z. et al. Strong
association between Major Histocompatibility Complex class 1 antigens and
immune aberrations among healthy Venezuelans. //Hum. immunol, - 1995. -
Vol.42.-P189-194.573. Malathi K., Dong B., Gale М., Jr., Silverman R. H. Small self-RNA generated
by RNase L amplifies antiviral innate immunity. //Nature. - 2007. - Vol.448. —
R816-819.574. Mantrovani A., Bussolino F., Introna M. Cytokine regulation of endothelial cell
function: from molccular level to bedside. //Immunol, Today. - 1997. - Vol, 18. -
p.231-240.575. Mardscn V.S., Strasser A. Control of apoptosis in the immune system: BcI-2,
BH3-only proteins and more. //Ann. Rev. Immunol, — 2003. — Vol 2J. —
P.71-105.576. Marin R., Mendez R., Pcdrinaci S,, Ruiz-Cabello F., Geraghty G., Garrido F.
HLA-E expression in tumor cell lines. //Eur. J. Immunogcnet. - 2002. - Vol.29,
№2, - R145.577. Marsh S., Bodmer J., Albert Т., Bodmer W., Dupont Bo et al. Nomenclature for
factors of the HLA system, 2000. //Human Immunol. - 2001. - Vol,62, №4. —
R419-468.578. Marshak-Rothstein A. Toll-like receptors in systemic autoimmune disease. //
Nat. Rev Immunol. - 2006. - Vol.6. - R823-835.579. Marshall C.J, Specificity of receptor tyrosine kinase signaling: transient versus
sustained extracellular signal-regulated kinase activation. //Cell. - 1995. -
Vol.80.-R179-185.
Список литературы 587580. Martinez-Zapico R., de-Jose М.I., Garcia-Migue) M.J., Fernandcz-Calle R,
Sobcjano L., Garcia-Hortelano J. Hepatitis В virus in HTV-infected children. /
In: Proc. VH1 International Conference on AIDS; Amsterdam, 1992, - Abstract
PuB 7341.581. Martinon F., Petrilli V., Mayor A., Tardivel A., Tschopp J. Gout-associatcd uric
acid crystals activate the NALP3 inflammasome. //Nature. — 2006. — Vol.440. —
R237-241.582. Mascarcll L,, Fayolle C., Bauch e C,, Ladant D., Led ere C. Induction of
neutralizing antibodies and Thl-polarized and CD4-indcpendent CD8+ T
cell responses following delivery of human immunodeficiency virus type 1 Tat
protein by recombinant adenylate cyclase of Bordetella pertussis. //J. Virol. -
2005. - Vol.79, №15. - R9872-9884.583. Mason H.S., Lam D.M-K., Arntzen C.J. Expression of hepatitis В surface
antigen in transgenic plants. //Proc. Natl. Acad. Sci. USA. — 1992. - Vol.89,
R11745-11749.584. Matsushima N., Tanaka T, Enkhbayar P., Mikami T, Taga М., Yamada K.,
Kuroki Y. Comparative sequence analysis of Icucine-rich repeats (LRRs) within
vertebrate toll-like receptors. // BMC Genomics, — 2007, — Vol.8 — P. 124.585. Maurer P.H. Antigenicity of polypeptides (poly-a-amino-acids). //J. Immunol. —
1962, - Vol.88. - R330-338.586. Maurer RH. Antigenicity of polypeptides (poly-a-amino-acids). XVII.
Immunologic studies in humans with polymers containing L or D and L-a-
amino acids. //J. Immunol. - 1965. - Vol.95. - P. 1095-1099.587. McCombs C.C., Michalski J.P. Lymphocyte abnormality associated with HLA-
B8 in healthy young and adults. //J. Exp. Med. - 1982. - Vol.156. — P.936-941.588. McCombs C.C., Michalski J,R, De-Shazo R. et al. Immune abnormalities
associated w'ith HLA-B8: lymphocyte subsets and functional correlation. //Clin.
Immunol. Tmmunopathol. — 1986. — Vol.39. — P.l 120-120.589. McConkey S.J., Recce W.H., Moorthy VS. ct al. Enhanced T-cell immunoge¬
nicity of plasmid DNA vaccines boosted by rccombinant modified vaccinia
virus Ankara in humans. //Nat. Med. ~ 2003. — Vol.9. — R 729-735.590. McConnell M. J., Imperiale J.M. Biology of adenovirus and its use as a vector for
gene therapy, //Hum. Gene. Ther. - 2004. - Vol.15. - P.1022-1033.591. McDevitt H.O. Genetic control of the antibody response. III. Qualitative and
quantitative characterization of the antibody response to (T,G) - A - L in CBA
and C57 mice, //J. Immunol. - 1968. - Vol.lOO. - R485-492.592. McDevitt H.O., Sela M. Genetic control of the antibody response. //J. Exp. Med. -
1965.-Vol,122,-R517-53l,
588 Список литературы593. McGcachy М. J., Cua D. J. Th 17 cell diiTercntiation; the long and winding road. //
Immunity. - 2008. - VoL28. - P.445-453.594. McGreal E.P., Martinez-Pomares L., Gordon S. Divergent roles for C-type
lectins expressed by cells of the innate immune system. //Mol. Immunol. -2004.-Vol.41.-Pi 109-1121.595. Mcllroy D., Tanaka М., Sakahira H,, Fukuyama H., Suzuki М., Yamamu-
ra K., Ohsawa Y, Uchiyama Y., Nagata S. An auxiliary mode of apoptotic
DNA fragmentation provided by phagocytes. //Genes Dev. — 2000. - Vol. 14. -
P549-558.596. McNeil J.G., JohnstonM.l., Birx D.L., Tramont E.C. Policy rebuttal. HiV
vaccine trial justified. //Science. - 2004. - Vol.303, №5660. - P.961.597. McNeill ТА. The cffect of synthetic double-stranded polyribonucleotides on
haemopoietic cotony-forming cclls in vitro, //immunology. ~ 1971. - Vol.21. —
P741-750.598. McShane H., Pathan A.A., Sander C.R. et al. Rccombinant modified vaccinia
virus Ankara expressing antigen 85A boosts BCG-primed and naturally acquired
anti mycobacterial immunhy in humans. //Nat. Med. — 2004. - Vol. 10. -
P1240-1244.599. Meacock P.A., Cotien S.N . Partitioning of bacterial plasmids during cell
division; a cis-acting locus that accomplishes stable plasmid inheritance. //
Cell. - 1980. - Vol20, - P529-542.600. Mcdzhitov R. Recognition of microorganisms and activation of the immune
response. //Nature. - 2007. - Vol. 449. - P.819-826.601. Medzhitov R., Preston-Hurlburt P., Janeway C.A., Jr. A human homologie of
the Drosophila Toll protein signals activation of adaptive immunity. //Nature. —1997. - Vol.388.. - P394-397.602. Meek D.W. The p53 response to DNA damage. //DNA Repair (Amst). - 2004. -
Vol.3.-P1049-1056,603. Megede J., Chen М., Barnett S. Increased expression and immunogcnicity
of sequence-modified HIV 1 gag gene.Hi. Virol. - 2000. - Vol.74, № 6. -
P2628-2635.604. Michaelis L. Weitcre IJntersuchungcn ъЬег EiweissprAzipitine. //Dtsch. Med.
Wschr. - 1904. - Vol.30. - P1240-1241.605. Middleton D., Williams RA. A history of DNA typing for HLA. //In: HLA 1997;
Terasaki P., Gjertson D. (Eds) — Oxford: University Precc, 1997. — P. 1-7,606. Miller J.RA.P, Mitchell G,F. Cell to cell interaction in the immune response. 1.
Hemolysin-forming cells in neonatally thymectomized mice reconstituted virith
thymus of thoracic duct lymphocytes. //J. E.xp. Med. - 1968. - Vol. 128. - P801-820.
Список литературы 589607. Miller J.F.A.P., Mitchell G.F. Thymus and antigen-reactive cells. //Transplant.
Rev.- 1969.-V01.1.-R3-42.608. Milner C.M., Campbell R.D. Polymorphic analysis of the three MHC-linked
//5P7Í?genes, //in: HLA 1991; Tsuji K., Aizava М., Sasazuki T. (Eds) - Oxford:
University Prccc, 1992. — P.l 57-161.609. Mitchell G.F., Miller J.F.A.R Cell to ceil interaction in the immune response.II. The source of Hemolysin-forming cells in irradiated mice given bone marrow
and thymus or thoracic duct lymphocytes. //J. Exp, Med. — 1968. - Vol.128. —
R 821-837.610. Mizuki N., Ota M,, Kimura M, et al. Triplet repeat polymorphism in the
transmembrane region of the MICA gene: strong association of six GCT
repetitions with Behcet disease. //Proc. Natl. Acad. Sci. USA. — 1997. - Vol.94. -
R1298-1303.611. Modelska A., Dietzschold B., Sleysh N. et al. Immunization against rabies
with plant-derived antigen. //Proc. Nat. Acad, Sci. USA. — 1998. — Vol.95.
R2481-2485.612. Módica M.A., Cammarat G,, Caruso C. HLA-B8,DR3 phenotype and
lymphocyte responses to phytohaemagglutinin. //J. Immunogenet. - 1990. —
Vol.l7.-R101-107.613. Mok H., Won Park Ji, Gwan Park T Enhanced intracellular delivery of quantum
dot and adenovirus nanoparticles triggered by acidic pH via surfacc charge
reversal. //Bioconjugate chemistry. — 2008. - Vol.l9, №4. — P.797-801.614. Muller G. The B-ceil antigen receptor complex. //Immunol, Rev. - 1993. -
Vol.132.- R1-206,615. Muller G., Siuberg O. Effect of antigenic competition on antigen-sensitive cells
and onadoptlvely transferred immunocompetent cells,//Cell. Immunol. —1970. —
Vol.l.-R110-121.616. Moody r>.B, CDI-restrictedT-cells. //In: Innate immunity; Ezenkow/itz R.A.B.,
Hoffmann J.A. (Eds). -Totowa, New Jersey: Human Press, 2003. - R387-402.617. Moore Q.C., Bosarge J.R., Quin L,R., McDaniel L.S. Enhanced protective
immunity against pneumococcal infection with PspA DNA and protein. //
Vaccine. - 2006. - Vol.24. - R5755-5761.618. MorcttaA., BottinoC., Biassoni R. The natural cytotoxicity receptors that trigger
human NK cell-mediated functions. //Proc. I4^^ European Histocompatibility
Conference. - Montpelier, France, 2000. — P.34.619. Moretta L., Biassoni R., Bottino C., Mingari M.C., Moretta A. Human NK-cell
receptors, //Immunol. Today. — 2000. — Vol.21. — R420-422.620. Morris L.F., Ribas A. Therapeutic cancer vaccines. //Surgical Oncology Clinics
of North America. - 2007. - Vol,16, №4. - R8I9-831.
590 Список литературы621- Morris P., Shaman J., Attaya M. et ai. An essential role for HLA-DM in antigen
presentation by class II Major Histocompatibilily Molecules. //Nature. — 1994. -
Vol.368. - P551-554,622. Mosmann T.R., Coffman R.L. TH 1 and TH2 cells: different patterns of cytokine
secretion lead to different functional properties, //Ann. Rev. Immunol. - 1989. -
Vol.?. - PJ45-173.623. Mosmann T.R., Sad S. The expanding universe of T cell subsets; Thl, Th2 and
more, //Immunol. Today. — 1996. — Vol.17. - P, 138-146.624. Mowat A.M., Vincy J.L. The anatomical basis of intestinal immimity. //
Immunol. Rev. - 1997. - Vol.156. -P.145-166.625. Mozes E., Sela М., Chedid L. Efficient genetically controlled formation of
antibody to a synthetic antigen fpoly(L-Tyr, L-Gly)-poly(D,L-Ala)-poly(L-
Lys)l covalently bound to a synthetic adjuvant (N-acetylmuramyl-L-alanyl-D-
isoglutaminc), //Proc. Nat. Acad. Sci. USA. - 1980. - Vol.77. - P.4933-4937.626. Muesing M,A., Smith D.H., Cabradilla C.D., Benton C.V., Lasky L.A., Ca¬
pon D.J. Nucleic acid structure and expression of the human AIDS/
lymphadenopathy retrovirus. //Nature. - 1985. - Vol.313. - P.450- 458.627. Muller G.M., Shapira М., Arnon R. Anti-influenza response achieved by
immunization with a synthetic conjugate. //Proc. Nat. Acad. Sci. USA. - 1982, —
Vol.79. - P569-573,628. Muruve D,A„ Pctrilli V., Zaiss A.K., While L.R., Clark S.A., Ross PJ,,
Parks R.J., Tschopp J. The inflammasome recognizes cytosolic microbial
and host DNA and triggers an innate immune response. //Nature. - 2008, —
Vol.452. -P103-107.629. Nagase S, LNA degradation in development and programmed cell death, //
Annu. Rev, Immunol, - 2005. - Vol.23. - P.853-875.630. Nakajima H., Samaridis J., Angman L., Colonna M. Human myeloid cells
express an activating ILT receptor (ILTl) that associates with Fc receptor
Y-chain. //J. Immunol. - 1999. - Vol.162, - P5-8.631. Nakane P.K., Kawaoi A. A new method of conjugation peroxidase-labelled
antibody. //J. Histochem. Cytochem. - 1974. - Vol.22, - P. 1084 - 1090.632. Napolitani G,, Rinaldi A,, Bertoni F, Sallusto R, Lanzavecchia A. Selected
Toll-like receptor agonist combinations syncrgistically trigger a T helper type
1-polarizing program in dendritic cells, //Nat, Immunol. - 2005. — Vol.6. -
P769-776.633. Nazir S.A., Metcalf J.P, Innate immune response to adenovirus. //J, Investig,
Med. - 2005, - Vol.53. - P292-304.634. Ndiritu М., Cougill K.D., Ismail A. immunization coverage and risk factors for
failure to immunize within the expanded programme on immunization in Kenya
Список литературы 59tafter introduction of new Haemophilus influenzae type b and hepatitis b virus
antigens. //BMC Public Health. - 2006. — Vol.6. — P.132.635. Neeijcs J.J., Momburg K, Hammerling G.J, Selectve and ATP-dependent
translocacion of peptides by the MHC-encoded transporter. //Science. - 1993. —
Vol.261.-P.769-771.636. Nestorowicz A., Treager G.W., Southwell C.N. et al. Antibodies elicited by
influenza virus hemagglutinin fail to bind to synthetic peptides representing
putative antigenic sites. // Molec. Immunol. — 1985. - Vol.22. — P. 145-154,637. Neurath A.R., Kent S.B.H., Strick N. Specificity of antibodies elicited by a
synthetic peptide having a sequence in common with a fragment of a virus
protein, the hepatitis В surface antigen. //Proc. Nat. Acad, Sci, USA. - 1982. -
Vol.79. - P.7871-7875..638. Nicholson D.W. Caspase structure, proteolytic suslrates, and function during
apoptotic cell death. //Ceil. Death Differ, — 1999. — Vol.6. — P, 1028-1042.639. Nickolson L.B., Kichroo V.K. T cell recognition of self and altered self anti¬
gens. //Crit. Rev. Immunol. - 1997. - Vol. 17. - P.449-462.640. Nikolaeva I, Chevalier A, Korobova S, Ignatjeva G, Karamov E, Nekrasov A,
Khaitov R,, Sidorovich I. Novel HIV immunogen: HIV Gag-Env chimerical
protein conjugated with potent immunomodulator Polyoxidonium. // 9 th
Conference on Retroviruses and Opportunistic Infections. — Seattle: WA,
February 24-28,2002. Program and Abstracts Book, 2002. - AbstractNo.308-W.;
P. 173.641. Nikolaeva I., Korobova S., Chevalier A., Ignatjeva G., Karamov E., Kornilaeva G.,
Pavlova T., Vorobjova M., Savinova I., Nekrasov A., Ivanova A., Gudima G.,
Khaitov R., Sidorovich 1. HIV Epidemic Profile in Russia and Preparing
for Clinical Trials of the First Russian HIV Vaccine “VICHREPOL”. // XV
International AIDS Conference. — Bangkok: Thailand, July 11-16, 2004;
Medimond International Proceedings. - 2004. - Vol,3. - P157-160,642. Nishiya T.., DeFranco A.L. Ligand-regulated chimeric receptor approach
reveals distinctive subcellular localization and signaling properties of the Toll¬
like receptors. //J. Biol. Chem. — 2004. — Vol.279. — РЛ9008-19017.643. Niwa H., Yamamura K., Miyazaki J. Efficient selection for high-expression
transfectants with a novel eukaryotic vector. //Gene. — 1991. — Vol. 108. —
P. 193-199.644. Noelle R. B-cell differentiation and antibody production. //Immunologist. -
1995. - Vol,3.-P219-220.645. Ntrivalas E., Gilman-Sachs A,, Kwak-Kim J., Beaman K., Mantou-
valos H,, Beer A. NK cell activity. //J. Reprod. Immunol. - 2003. - Vol.58,
№2.-P,105.
592 Список литературы646. Nyman Т., Stenmark P., Flodin S., Johansson 1., Hammarstrom W., Nordlund
P. The crystal structure of the human toll-like receptor 10 cytoplasmic domain
reveals a putative signaling dimer. // J, Biol. Chem. — 2008. - Vol.283, -
P11861-11865.647. Obeid L.M,, Linardic C.M., Karolak L. A., Hannun Y.A. Programmed cell death
induced by ceramide. //Science. — 1993. - Vol.259. - P1769-1771.648. Ohara N., Matsuoka M,, Nomaguchi H. ct al. Protective responses against
experimental Mycobacterium leprae infection in mice induced by recombinant
Bacillus Calmette-Guirrin over-producing three putative protective antigen
candidates. //Vaccine. - 2001. - Vol.19, №15-16. -P1906-1910.649. Olavson M.G., Thomson W., Cheng J. ct al, Characterization of a novel gene G1
in the human MHC class III region. /In: LA 1991; Tsuji K., Sasuki A. A. (Eds). —
Oxford: University Precc, 1992. - P.190-192.650. O’Neill L.A., Bowie A.G. The family of five: TIR-domain-containing adaptors in
Toll-like receptor signaling. //Nat. Rev. Immunol. — 2007. - Vol.7. — P.353-364.651. Opferman JX, Korsmeyer S.J. Apoptosis in the development and maintenance
of the immune system. //Nat. Immunol. - 2003. - Vol.4. - P.4I0-415.652. Orr H.T HLAclassI gene family characterization of genes encoding non-HLA-
A, B, С proteins. /In: immunobiology of HLA; Dupont B. (Ed). - New York:
Springer-Verlag, 1989. - Vol.II. - P.33-39.653. Ouyang W., Kolls J. K., Zheng Y, The biological functions of T helper 17
ccll effector cytokines in inflammation. //Immunity. — 2008. — Vol.28. —
P454-467.654. Ozinsky A., Underhill D.M., Fontenot J.D. et al. The repertoire for pattern
recognition of pathogens by the innate immune system is defined by cooperation
between TolLlike receptors. //Proc. Natl. Acad. Sci. USA. — 2000. — Vol.97. -
P13766-13771.655. Pabst M.J., Johnston R.B. Increased production of superoxide anion by
macrophages exposed in vitro to muramyl dipeptide or lypopolysaccharide. //
J. Exp. Med. - 1980. - Vol.151. - PlOl-l 14.656. Palsson-McDermott E. М., O’Neill L, A. Building an immune system from nine
domains. //Biochem. Soc. Trans. - 2007. - Vol.35. - P. 1437-1444,657. Paluska E., Cinatl J., Korcakova L. et al. Immunosuppressive effect of a synthetic
polymer poly N-(2-m droxypropyl) methacrylamide (Duxon). //Folia Biol, -
1980,-Vol.26.- Р.304-ЗП.658. Pangault C., Leke F.S., Caulet-Maugendrc S., Lena H., Amiot L., Gouilloux
V., Fauchet S. Expression of HLA-G molecules in pulmonary diseases. //
Eur. J. Immunogenet, — 2002. — Vol.29, №2. — P.144.
Список литературы 593659. Parham P. Antigen processing. Transporters of delight. //Nature. —1990. -
Vol.348. - P674-675.660. Parham P., Lomen C.E., Lawlor D.A. et al. The nature of polymorphism in
HLA-A, -B, -C molecules. //Proc. Natl. Acad. Sci. USA. - 1988. - Vol.85. -
P4005-4009.661. Parker D.C. T cell dependent B-cell activation. //Ann. Rev. Immunol. - 1993. -
Vol.ll. - P.331-340.662. Pasarc C., Medzhitov R. Toll pathway-dependent blockade of CD4+CD25+ T cell-
mediated suppression by dendritic cells. //Science. - 2003. — Vol.299. — P. 1033-1036.663. Pasare C., Medzhitov R. Control of B-cell responses by Toll-like rcceptors. //
Nature. - 2005. - Vol.438. - P.364-368.664. Pasternak G. Tumorviren und spezifische antigene virusinduzierter. /In:
Transplantations— und Tumorimmunologie. - Jena: VEB Gustav Fischer
Verlag, 1973. - P221-256.665. Paul W.E., Seder R.A. Lymphocyte responses and cytokines. //Cell. -1994, —
Vol.76. - P.241-251.666. Paulnode D.M. Macrophage activation by T cclls. //Curr. Opin. Immunol. -
1992. - Vol.4. - R344-349.667. Pazmany L., Mandelboim O., Vales-Gomes М., Davis D.M., Becker T.C.,
Reyburn H.T, el al. Human leukocyte antigen-G and its recognition by natural
killer cells. //J. Reprod. Immunol. — 1999. - Vol.43. — Р.І27-137.668. PcacockJ.S,, BushJ.,Jr.,KrakauerH.etal.Thymus-independentimmunogenicity
in vitro of the divalent antigen DNP-polyethylene oxide. //Cell. Immunol. —1983. -Vol.79. - R220-231.669. Pellegrini М., Strasser A. A portrait of the Bcl-2 protein family: life, death, and
the whole picture. //J, Clin. Immunol. - 1999. - Vol.l9. - P.365-377.670. Pcrmuller D.H., Dinarello C.A., Punsal P.L et al. Cachectin/tumor necrosis
factor regulates hepatic acute-phase gene expression. //J. Clin. Invest. — 1986. -
Vol,78.- R1349-1354.671. Pertussis vaccines -- WHO position paper. // Weekly cpidemiological record. —2005.- V80, №4. - R 31-39.672. Petrilli V, Dostert C., Muruve D.A., Tschopp J. The inflammasome: a danger
sensing com lex triggering innate immunity. //Cur. Opin. Immunol. — 2007. -
Vol. 19. - R615-622.673. Petrilli V., Kool М., De Smedt T, Alum adjuvant stimulates inflammatory den¬
dritic cells. //J. Immunol. - 2008. - Vol.181, №6. - R3760-3767.674. Petrov R.V., Kabanov V.A., Khaitov R.M., Nekrasov A.V., Ataullakhanov R.L
Conjugated polymer-subunit immunogens and vaccincs. //Allergy and Clin.
Immunol. Internat. - 2003. - Vol.l5, ]№2. - P.56-61.
594 Список литературы675. Pelrov R,V., Khaitov R.M. В cell suppression of antibody response to sheep red
blood cells in mice of high- and low-responding genotypes. //Cell. Immunol. -1977. - Vol.28., №2. - P.298-306.676. Petrov R.V., Khaitov R.M., Babakhin A.A,, Popov A.N. IgE-responsc to aller¬
gen-polyelcctrolytc complexes. //Allergy and Clin. Immunol. News. - 1992. -
Vol.4, №3. - P. 87-91.677. Petrov R., Khaitov R., Fedoseeva V., Nekrasov A., Illuna N. Conjugated aller-
gen-polymer vaccines (pollen allergotropins of new generation) in allergen spe¬
cific immunotherapy. //Internat. Rev. Allergol. and Immunol.- 2001. - Vol.7,
№4.- R137-143.678. Petrov R.V., Khaitov R.M., Kabanov V.A. Artificial antigens and vaccines based
on nonnatural polyelectroletes.//Sov. Sci. Rev. J. Physicochem. Biol. - 1984. —
Vol.5. - P277-322.679. Petrov R.V., Khaitov R.M., Pinegin B.V. Suppressor В lymphocytes. // Chur;
Harwood acad. publ. GmbH, 1988. — 208 p.680. Petrov R.V., Khaitov R.M., Semenov B.F. Artificial vaccines against salmonella
infection. /New approaches to vaccine development: Proc. a Meeting WHO,
Geneva: 1983; Bell R., Torrigiani G. (Eds). - Basel, 1984. — P.390~402.681. Petrov R.V., Khaitov R.M., Zhdanov V.M. Influenza virus antigens conjugated
with a synthetic polyelectrolyte: a novel model of vaccines. //Vaccine. - 1985. -
Vol.3. - R392-400.682. Picker L.J., Butcher E.G. Physiological and molecular mcchanisms of lympho¬
cyte homing. //Ann. Rev, Immunol. - 1993. - Vol.10. - P.561-591.683. Plas D.R., Rathmell J.C., Thompson C.B. Homeostatic control of lymphocytc
survival: potential origins and implications. //Nat. Immunol. - 2002. - VoL3. -
P515-521.684. Plotkin S.A. New vaccination strategies. //Bull. Acad. Natl. Med. - 2008. -
Vol.l92,№3. - P511-518.685. Pluddemann A., Mukhopadhyay S., Gordon S. The interaction of macrophage
receptors with bacterial ligands, //Expert Rev. Mol. Med. - 2006. - Vol.8. -
P.1-25.686. Pohlmann Т., Schaumann A., Fitzgerald J.S., Le Boutciller P., Markert U.R.
Intlucnce of soluble HLA-G 1 on natural killer cells isolated from the human
decidua. //J. Reprod, Immunol. - 2003. - Vol.58, №2. - P.146.687. Prillman K.R., Jackson K.W,, Lindsey M. et al. HLA-B15 peptide ligands are
preferentially anchored at their С termini. //J. Immunol. — 1999. - Vol. 162, -
R7277-7284.688. Prince A.M., Ikram H., Hopp T.P. Hepatitis В virus vaccine: identification of
HBsAg/a and HBsAg/d but not HBsAg/subtypc antigenic determinants on a
Список литературы 595synthetic immunogenic peptide, //Proc. Nat. Acad. Sci. USA. - 1982. - Vol.79. —
P579-582,689. Pym A.S., Brodin P, Majlessi L. et al. Recombinant BCG exporting ESAT-6
confers enhanced protection against tuberculosis. //Nat. Med, — 2003. - Vol.9. -
P533-539.690. Quintana F.J., Cohen T.R. Heat shok proteins as endogenous adjuvants in
sterile and septic inflammation. //J. Immunol. - 2005. -Vol.175. -
R2777-2782.691. Rakoff-Nahoum S., Paglino J., Eslami-Varzaneh R, Edberg S., Medzhitov R.
Recognition of commensal microflora by tol (-like reccptors is required for intes-
tinal homeostasis.// Cell. — 2004. — V.118 — P.229-24I.692. Rappuoli R. Reverse vaccinology. //Curr. Opin. Microbiol. - 2000. - №3. -
P445-450.693. Rathmell J.C., Thompson C,B. The central effectors of cell death in the immune
system. //Ann. Rev, Immunol. - 1999. - Vol.17. - P.781-828.694. Ratner L., Haseltine W., Patarca R. et al. Complete nucleotide sequence of the
AIDS virus HTLV-m. //Nature. - 1985. - Vol.313, №600. - P277-284.695. Ravetch J.V., Lanier L.L. Immune inhibitory receptors. //Science, - 2000. -
Vol.290, №5489. - P84-89.696. Reid R., Hooper C., Richards R et al. Synthetic 30-50 peptide fragment
of cholera toxin p-chain is a possible carrier for peptide antigens. //Int. J.
Immunopharmacol. - 1985. - Vol.7, - P.399.697. Reiner S.I., Seder R.A. T helper ccll differentiation in immune response. //Curr.
Opin. Immunol. - 1995. - Vol.7. - P360-366.698. Res P., Spits H. Developmental stages of the human thymus. //Sem. Immunol. -
1999.-Vol.ll.-R39-46.699. Rhodes G., Carson D., Valbracht J, et al. Human immune responses to syn¬
thetic peptides from the Epstein-Barr nuclear antigen. //J. Immunol, — 1985. —
Vol.134.-P.211-216.700. Richter A.W., Eby R. Studies on artificial oligosaccharide-proLcin antigens:
induction of precipitating antibodies to defined epitopes on natural and synthetic
dextrans and mannans. //Molcc. Immunol. — 1985. — Vol,22. — P29-36.701. Roach J.C., Glusman G., Rowen L. et al. The evolution of vertebrate Toll-like
receptors, //Proc. Natl, Acad. Sci. USA. - 2005, - Vol,102. - P.9577-9582.702. Rochc P., Cress well P. High affinity binding of an influenza haemagglutinin
derived peptide to purified HLA-DR. //J. Immunol, -1990. - Vol,144, -
P1849-1856,703. Rodewald H.R, Pathways from hcmatopoietic stem cells to thymocytcs. //Curr.
Opin. Immunol. — 1995. - Vol.7. - P.176-187.
596 Список литературы704. Rocíen D-, van Bree F., van Beelen E. et al, Regulatory functions of human
€04"^ T-cclls recognizing HLA peptides presented by self-HLA-DR. //In:
Human Immunology; Proc.l4‘*^ European Histocompatibility Conference. —
Montpellier: France, 2000. - Vol.61. - P.l.705. Rogers N., Lechler R,I. Allorccognition. //Am. J. Transplant. - 2001. -Vol,l. -
P.97-102.706. Roitt 1.» Brostoff J., Male D. Immunology. - London: Harcourt Publishers
Limited, 2001. - 480 p.707. Rolink A., Karasuyama H., Haasner D. et al. Two pathways of B-lymphocyte
development in mouse bone marrow and the role of surrogate L chain in this
development. //Immunol. Rev, - 1994. - Vol.137. - P185-201.708. Romagnani S. The Thl/Th2 paradigm. //Immunol. Today, - 1997, -Vol, 18. -
R263-266.709. Romani L., Bistoni F., Puccetti P. Fungi, dcndritic cells and receptors: a host per¬
spective of fungal virulence. //Trends Microbiol. - 2002, - Vol.10. - P.508-514.710. Rosalcs-Mendoza S,, Alpuche-Solis A.G,, Soria-Gucrra R.E. et al. Expression
of an Escherichia coli antigenic fusion protein comprising the heat labile toxin
В subunit and the heat stable toxin, and its assembly as a functional oligomer in
transplastomic tobacco plants. //Plant J. - 2009. - Vol.57, №1. — P.45-54.711. Rosenthal A.S., Thomas J,W,, Schroer J.T., Blake J.T. The role of macrophagcs
in genetic control of the immune response.//Prog, Immunol. - London, 19Я0. -
P458-477.712. Rotzschke O., Falk K., Stevanovic S. et al. Peptide motifs of closely related
H LA class I molecules encompass substantial differences. //Eur, J. Immunol. -1992. - Vol.22. - P.2453-2456.713. Royet J., Meister М., Fcrrandon D. Humoral and cellular responses in Drosophila
innate immunity, // In: Innate immunity; Ezenkowitz R.A.B., Hoffmann J.A.
(Eds). -Totova, New Jersey: Human Press, 2003, - P.137-153.714. Rudd C.E., Schneider H. Lymphocyte signaling: Cbl sets the threshold for auto-
immunity. //Curr. Biol. -2000. - Vol. 10. - P344-347.715. Ruddy S. Complement deficiencies. 3, The second component.//Prog. Allergy. —1986.-Vol,39.- P250-266.716 Ruder R.W., Oxtoby M.J,, Mvula M. et al. Safety and immunogenecity of bacille
Calmette-Guerin, diphthcria-tetanus-pcrtussis, and oral polio vaccines in new¬
born children in Zaire infected with human immunodeficiency virus type 1, //J.
Pediatr, - 1993. - Vol.122. - R697-702,717. Rudy B.J., Rutstein R.M,, Punto-Martin J. Responses to measles immunization
in children infected with human immunodetlciency virus. //J. Pediatr. - 1994. -
Vol. 125. - P.72-74.
Список литературы 597718. Rynes R,l. Inherited compíetnent deficiency stales and SLE. //Clin. Rheum.
Dis.- 1982. - Vol.8. - R29-47.719. Saini V, Zharov V.P., Brazel C.S. et al. Combination of viral biology
and nanotechnology: new/ applications in nanomedicine. // Nanomedicine:
Nanotcchnology, Biology and Medicine. - 2006. - Vol.2. - P.20Ü-206.720. Saito Т., Hirai R., Loo Y. М., Owen D., Johnson C. L., Sin ha S. C., AJcira S.,
Fujita Т., Gale М., Jr. Regulation of innate antiviral defenses through a shared
repressor domain in RIG-I and LGP2. //Proc. Natl. Acad. Sci. USA. — 2007. —
Vol.104.- P582-587.721. Saito T,, Owen D. М., Jiang F, Marcotrigiano J., Gale M. Innate immu¬
nity induced by composition-dependent RIG-1 recognition of hepatitis С virus
RNA. // Nature. - 2008. - Vol.454. - P.523-.527,722. Sakahira H., Enari М., Nagata S. Cleavage of CAD inhibitor in CAD activation
and DNA degradation during apoptosis. //Nature. — 1998. — Vol.391. — P96-99.723. Salomon B., Bluestone J.A. Complexities of CD28/B7: CTLA-4 costimulatory
pathways in autoimmunity and transplantation. //Annu. Rev. Immunol. - 2001.
Vol.19. - R225-252.724. Sanchez A., Geisbcrt T.W., Feldmann H. Fields virology. /In: Marburg and
Ebola viruses; Knipe D., Howlcy P.M. (Eds). - Philadelphia: Wolters Kluwer/
Lippincott Williams and Wilkins, 2007, — P.1409—1448.725. Sanchez-Pescador R., Power M.D., Barr P.J. et al. Nuclcotide sequence and
expression of an AIDS-associated retrovirus (ARV-2). //Science. - 1985. —
Vol.227, №4686. - P.484-492.726. Sander C.R., Pathan A. A., Beveridge N.E. Safety and immunogenicity of a new
tuberculosis vaccine, MVA85A, in Mycobacterium tuberculosis-mítcxeú individu¬
als. //Am. J, Respir. Crit. Care. Med. — 2009. - Vol,179, №8. ~ P.724-733.727. Santangelo M.P, McIntosh D,, Bigi F et al. Mycobacterium bovis BCG as a
deliverysystem for the RAP-1 antigen from Babesia bovis. //Vaccine. — 2007. —
Vol.25, -R1104-1113.728. Santra S., Sun Y., Parvani J.G., Philippon V. et al. Heterologous prime/boost
immunization of rhesus monkeys by using diverse poxvirus vectors. //J. Virol. -
2007. - Vol.81. - P8563-8570.729. Sargent C.A,, Dunham Í., Trowsdale J, et al. Human Major Histocompatibility
Complex contains genes for the major heat shock protein HSP70. //Proc. Natl.
Acad. Sci. USA. - 1989. - Vol.86. - R1968-1972.730. Sarngadharan M,G., Popovic М., Brbch L. et al. Antibodies reactive with human
T-lymphotropic retroviruses (HTLV-III) in the serum of patients with acquired
AIDS, //Science. - 1984. - Vol.224. - P.506-508.
598 Список литературы731. Sathiamurthy М., Hickman H.D., Cavelt J.W., Zahoor А,, Prilliman К., Met¬
calf S., Fernandez-Vina M.A., Hildebrand W.H. Population of the HLA ligand
database. //Tissue Antigens. - 2003. — Vol.61. ~ PI2-19.732. Savill J,, Fadok V., Henson P., Haslett C. Phagocytc recognition of cells under¬
going apoptosis. //Immunol. Today. - 1993. - Vol.14. - P.I31-136.733. Savrda J. Synthesis and biologicalk assays of peptides from a luberculin-activc
protein, //infect, and Immun. -1983. - Vol.40. - P.l 163-1169.734. Saxinger W.C., Gallo R.C. Application of the indirect en/yme-linked
immunosorbent assay microtest to the detection and surveillance of human
T ceil Icukemia-lymphoma virus. //Lab. Invest, - 1983. — Vol.49. —
P 371-377.735. Scaffidi C., Fulda S., Srinivasan A., Friesen C., Li F, Tomasclli K.J., Debatin
K.M., Krammer PH., Peter M.E, Two CD95 (APO-l/Fas) signaling pathways. //
EMBO J. - 1998. - Vol.17 ~ P1675-1687.736. Scheid M.P., Hoffman M.K., Komuro K. etal. Differentiation ofT cclls induced
by preparations from thymus and by non-thymic agents. //J. Exp. Med. - 1973. -
Vol. 138.-R1027-1032.737. Schell PL. Uptake of polynucleotides by intact mammalian cells, //Biochem.
Biophys, Res. Commun. - 1971. - Vol. 262. - P.467-475.738. Schmidt C., Orr H. Maternal fetal interactions: the role of the MHC class I
molecule HLA-G. //Crit. Rev. Immunol. - 1994. - Vol.l 3. - P207-224.739. Schnccberger A,, Mandler М., Otawa O. et al. Development of affitope vaccines
for Alzheimer’s disease (AD) - from concept to clinical testing. //J. Nutr. Health
Aging. - 2009. - Vol. 13, №3. - P264-267.740. Scott P. Selective differentiation of CD4-t- T helper cell subsets. //Cur. Opin.
Immunol. - 1993. - Vol.5. - P391-397,741. Seder R.A., Paul W.E. Aquisition of lympokine producing phenotype by CD4'^ T
cells. //Ann. Rev. Immunol. - 1994. — Vol.12. - P.635-673.742. Schon A,H. Down regulation of IgE antibodies by supressogenic conjugates. //
Progr. Immunol. V; Proc. 5 Interm. Congr. Immunol; Yamamura J., Tada T.
(Eds). — London-Tokyo, 1984, — P.483-491.743. Sela M. From synthetic antigens to synthetic vaccines. //Biopolymers. — 1983. —
Vol,22. - R415-424.744. Sela M,, Arnon R. Specific synthetic polypeptide antigen. //Biochim. Biophys.
Acta. - 1960. - Vol.40, P382-391,745. Sela М., Fuchs S. The preparation of synthetic antigens. — Handbook of experi¬
mental immunology, Immunochcmistry; Weir D.M. (Ed). — Oxford-London,
1973.-Vol. 1 - PI-10.
Список литературы 599746. Selvakumar А., Steffens U., Dupont В. NK cell receptor gene of the KIR fam¬
ily with two Ig domains but highest homology to KIR receptors with three Ig
domains. //Tissue Antigens, - 1996, — Vol.48. - R285-294.747. Semenyuk E.G,, Strcmovskiy O.A., Edelweiss E.F,, Shirshikova O.V., Balandin
T.G., Buryanov Y.L, Deyev S.M. Expression of single-chain antibody-barstar
fusion in plants. //Biochimie. — 2007. - Vol.89. — R31-38.748. Senter RD. Activation of prodrugs by antibody-enzyme conjugates: a new
approach to cancer therapy, //FASEB Journal. - 1990, - V.4. - R188-193.749. Serruto D., Serino L., Masignani V, Genome-based approaches to develop
vaccines against bacterial pathogens. //Vaccine. - 2009. — Vol.27, №25-26. -
R3245-3250.750. Servenious B,, Gustafsson K., Widmark E. et al. Molecular map of the human
HLA-SB (HLA-DP) region and sequence of an SB-alpha (DP-alpha) pseudo¬
gene. //EMBO J. - 1984. - Vol.3. - R3209-3214.751. Shapira М., Misulovin Z., Arnon R. Specificity and cross-reactivity of syn¬
thetic peptides derived from a major antigenic site of influenza hemagglutinin. //
Molec. Immunol. - 1985. - Vol.22. - R23-28.752. Sherman L.A., Cattopadhyan S. The molccular basis of allorecognition. //Ann.
Rev, Immunol. - 1992. - Vol.ll, P.385-402.753. Shevach E. M. Certified professionals: CD4(+)CD25(+) suppressor T cells. //J.
Exp, Med. - 2001. - V. 193, - RF41-46.754. Shin nick TM., Sutcliffe J.G., Green N., Lerner R.A, Synthetic peptide immu¬
nogens as vaccines. //Ann. Rev. Microbiol, - 1983. - Vol.37. - R425-446.755. Shopper K., Matter L., Brunner C. et al. BCG osteomyelitis.Casc report and
review // Helv, Pediatrics Acta. - 1982. -Vol.37. - P.73-81756. Sidney J., Del Gucrcio M.F., Southwood S, et al. Several HLA alleles share over¬
lapping peptide specificities. //J. Immunol. — 1995. - Vol.154, — R247-249.757. Sivori S., Falco М., Della Chiesa М., Carlomagno S., Vitale М., Moretta L.,
Moretta A, CpG and double-stranded RNA trigger human NK cells by Toll-like
receptors: induction of cytokine release and cytotoxicity against tumors and den¬
dritic cells. //Proc. Natl. Acad. Sci. USA. - 2004. - Vol. 101. - R10116-10121.758. Skeiky Y.A., Sadoff J.C, Advances in tuberculosis vaccine strategies,// Nat, Rev.
Microbiol. - 2006. - Vol.4. - R469-476,759. Snippe H., van Dam J.E.C., van Houte A.J. et al. Preparation of a scmisynthetic
vaccine to Streptococcus pneumoniae type 3. //Infect, and Immun. — 1983. —
Vol.42.-R842-844.760. So R. Structure and assembly of class I and class II molecules. /In: HLA and
disease. — Academic Press, 1994, — P.5-45.
600 Список литературы761. Sokolovska А., Hem S.L., Hogcn E.H. Activation of dendritic cells and induction
of CD4(+) T cell differcmiation by aluminum-containing adjuvants. //Vaccine, —
2007 - Vol.25, №23. - P.4575-4585.762. Song Y., La Т., Phillips N.D., Bcllgard M.l. A reverse vaccinology approach
to swine dysentery vaccinc development. //Vet. Microbiol. - 2009. - Vol.l37,
№1-2.-Pill-119.763. Spies Т., Morton C.C., Nedospasov S.A. et al. Genes for the tumor necrosis fac¬
tors alpha and beta linked to the human Major Histocompatibility Complex. //
Proc. Natl. Acad. Sci, USA. - 1986. - Vol.83. - P8699-8702.764. Sprent J. T and В memory cells, //Cell. — 1994. - Vol.76. - P.315-322.765. Srivastava 1.К., Stamatatos L., Kan E. et al. Purification, characterization, and
immunogeniclty of a soluble trimeric envelope protein containing a partial dele¬
tion of the V2 loop derived from SF162, an R5-tropic human ininiunodeficicncy
virus type 1 isolate. //J, Vrol. - 2003. - Vol.77, №20. - PI 1244-11259.766. Steensels М., Bublot М., Van B,S. et al. Prime-boosl vaccination with a fowlpox
vcctor and an inactivated avian influenza vaccine is highly immunogenic in
Pekin ducks challenged whh Asian H5N1 HPAl, //Vaccine. - 2009. - Vol.27. -
P.646-654.767. Stehlc Т., Larvie M. Structures of complement control proteins, /in; Innate
Immunity; Ezenkowitz R.A.B., Hoffmann J.A, (Eds), - Totowa, New Jersey;
Human Press, 2003. — P231-253,768. Stetson D,B., Medzhitov R. Recognition of cytosolic DNA activates an 1RF3-
dependent innate immune response. //Immunity. - 2006. - Vol.24. - P.93-103.769. Stevenson F., Di Gcnjva G., Otlensmeier C., Savelyeva N. Cancer Vaccines. //
In: Cáncer Immunotherapy; Suppression and Tumor Growth; Prendergast G.C.,
Jaffee E.M. (Eds); London: Elsevier, 2007. — P. 183-204.770. Stevenson F.K., Rice J., Zhu D. Tumor vaccines. //Adv. Immunol. - 2004, -
Vol.82, - P.49-103.771. Stout R., Sutiles J. The many roles of CD40L in cell-mediated inflammatory
responses. //Immunol. Today. - 1996, - Vol.17, - P,487-492.772. Subramaniam S., Stansberg C., Cunningham C. The interleukin 1 receptor
family. //Develoop, Compar. Immunol. -2004. -Vol.28, №5, - P,415-428.773. Sullivan N.J., Geisbert T.W., Geisbert J.B. ct al, Acceleratcd vaccination for
Ebola virus haemorrhagic fever in non-human primates, //Nature. — 2003, —
Vol.424. - P681-684.774. Sullivan N.J., Sanchez A., Rollin P.E., Yang Z.Y., Nabel G,J„ Development of
a preventive vaccine for Ebola virus infection in primates, //Nature. — 2000, —
Vol.408, - P605-609.
Список литературы 601775. Sunder-Plassmann R., Lialios F., Madsen М., Koyasu S., Reinherz E.L.
Functional analysis of immunoreceptor tyrosine-based activation motif
{lTAM)-mediated signal transduction: the two YxxL segments within a single
CD3zeta-ITAM are functionally distinct. //Eur. J. Immunol. - 1997. - Vol.27. -
R2001-2009.776. Susin S.A., Daugas E., Ravagnan L., Samejima K., Zamzami N., Loeffler М.,
Costantini P., Ferri K.F., Trinopoulou Т., Prcvost M.C., Brothers G., Mak T.W.,
Penningcr J., Earnshaw W.C., Kroemer G. Two distinct pathways leading to
nuclear apoptosis. //J. Exp. Med. - 2000. - Vol. 192. - P.571-580.777. Sutmuller R. P., den Brok M. H., Kramer М., Bennink E. J., Toonen L. W.,
KuIlbergB. J., Joosten L. A., Akira S., NeteaM . G., Adema G. J. Toll-like recep¬
tor 2 controls expansion and function of regulatory T cells. //J. Clin. Invest. —2006. - Vol.l 16. - P485-494.778. Suzuki N., Suzuki S., YehW.-C. IRAK-4 as the central TIR signaling mediator in
innate immunity. //Trends in Immunol. - 2002. -VoL23, №10. - P5093-506.779. Svenson S.B., Lindberg A.A. Artificial Salmonella vaccines. Salmonella
typhimurium O-antigcn-specific oligosaccharide protein conjugates clicit pro¬
tective antibodies in rabbits and mice. //Infect. And Immun. — 1981. -
Vol.32. - P,490-496.780. Svenson S.B., Lindberg A.A. Artificial salmonella vaccines. //Prog. Allergy. -1983. - Vol.33. - R120-143.781. Swain S.L., Dutton R.W. T cell factors that promote proliferation and differen¬
tiation. //Contemp. Topics molcc. Biol. - 1985. - VoLlO. - P.219-229.782. Szereday L., Barakonyi A., Miko C., Varga P., Szekeres-Bartho J. Gamma/delta
T cell subsets, NKG2A expression and apoptosis of Vdclta2+ T cells in pregnant
women with or without risk for premature pregnancy termination. //J. Reprod.
Immunol. - 2003. - Vol.58, №2. - RI71.783. Tackabcrry E.S., Dudani A.K., Prior F. et al. Development of biopharmaceuti¬
cals in plant expression systems: cloning, expression and immunological reac¬
tivity of human cytomegalovirus glycoprotein В (UL55) in seeds of transgcnic
tobacco. //Vaccine. — 1999. — Vol.ll - R3020—3029.784. Tacket C.O. Garden-varicty vaccines: antigens derived from transgenic plants. //
Expert. Rev. Vaccines. - 2004. — Vol.3, №5. — P.529-531.785. Tacket C.O. Plant-based vaccines against diarrheal diseases. //Trans. Am. Clin,
Climatol. Assoc. - 2007. - Vol.l 18. - R79-87.786. Tainer J.A., Getzoff E.D., Alexander H. et al. The reactivity of antipeptide anti¬
bodies is a function ofthcatomii mobility of sites in aprotein. //Nature. - 1984. -
Vol.312. - PI27-133.
Ь02 Список литературы787. Tainer J.A., Getzoff E.D., Paterson Y. et al. The atomic mobility component of
protein antigenicity, //Ann. Rev, Immunol. - 1985. - Vol.3. - P.501-535.788. Takaoka A., Wang Z., Choi M.K. et al. DAI (DLM-1/ZBPl) is a cytosolic DNA
sensorand an activator of innate immune response. //Nature. — 2007. — Vol.448. —
P501-505.789. Takeda K., Dow S.W., Miyahara N. Vaccine-induced CD8^ T celi-dependent
suppression of airway hyperresponsiveness and inflammation. // immunol. -2009, - Vol. 183, №1. - R 181-190.790. Takcuchi O., Akira S. Recognition of viruses by innate immunity. //Immunol.
Rev, - 2007. -Vol.220. - R214-224.791. Takeuchi O., Akira S. MDA5/RIG-T and virus recognition.//Curr, Opin.
immunol. - 2008. - Vol.20. - R17-22.792. Tamura K., Sudo Т., Senftleben U., Dadak A.M., Jouhson R., Rarin M.
Requirement for p38 in erythropoietin expression: a role for stress kinases in
erythropoiesis. //Cell. - 2000. - Vol.102, №2. - R221-231.793. Tanaka H., Demeure C, E,, Rubio M,, Delespesse G., Sarfati M. Human mono¬
cyte-derived dendritic cells inducc naive T cell differentiation into T helper cell
type 2 (Th2) or Th1/Th2 effectors. Role of stimulator/responder ratio. //J, Exp.
Med. - 2000, - Vol, 192. - R405-412,794. Tanghe A., Dangy J.P., Pluschke G., Huygen K, Improved protective efficacy
of a species-specific DNA vaccine encoding mycolyl-transferase Ag85A from
Mycobacterium ulcerans by homologous protein boosting. //PLoS Negl. Trop,
Dis.- 2008.-Vol.2.-el99.795. Tattoli 1., Travassos L.H., Carneiro L.A. et al. The nodosomc: Nodi and Nod2
controlbacterialinfectionsandinflammation.//Semin. Immunopathol. -2007. ~
VoL29, №3. - R289-301.796. Taussig M.J, Antigenic competition. /The immune system.; Hobart M.J.,
McConell I. (Eds). - Oxford, 1978. - R167-178.797. Taussig M.J., Mozes E., Shearer G.M., Sela M. Antigenic competition and
genetic control of the immune response. A hypothesis for intramolecular compe¬
tition. //Cell. Immunol. - 1973. - Vol.8. - R299-310.798. The FUTURE II Study Group, Quadrivalent vaccine against human papilloma
virus to prevent high-grade cervical lesions.//N. Engl. J. Med. — Vol.356, №19. -
R1915-1927,799. Thien C.B., Langdon W,Y. Cbl: many adaptations to regulate protein tyrosine
kinases. //Nat. Rev. Mol. Cell. Biol. - 2001. - Vol.2. - R294-307.800. Thomas M.L., Brown E. J. Positive and negative regulation of Src-family mem¬
brane kinases by CD45, //Immunol, Today. - 1999. - Vol.20. - Р.406-4И.
Список литературы 603801. Thornbcrry М.А., Lazebnik Y. Caspases; enemies within. //Science. - 1998. —
Vol.281.-P.1312-1316.802. Till J.E,, McCulloch E.A. Early repair processes in marrow cclls irradiated and
proliferating in vivo. //Radiat. Res. - 1963. - Vol. 18. - P.96-101.803. Tokunaga K., Omoto K., Yukiyama Y. ct al. Further study or a Bf silent allele. //
Hum. Genet. - 1984, - VoL 67. - R449-451.804. Touber A., Dulphy N., Tieng V, Tamousa R., Charron D. Receptcurs des
lymphocytes Natural Killer et responses au stress. //Transfusion Clinique et
biologique. - 2003. ~ Vol.lO, №3. - R109-112.805. Toullet F., Audibert F., Voisin G.A., Chedid L. Production d’une orchiepididy-
mitc aspermatogenetiquc autoimmune chez le cobaye a l’aide de différents adju¬
vants hydrosolubles. //Ann. Immunol. - 1977. — Vol. 128. - R267-276.806. Trauth B.C., Klas C., Peters A,M. Monoclonal antibody-mediared tumor
regression by induction of apoptosis. //Science. — 1989, - Vol.245, —
R301-305.807. Trinchicri G., Sher A. Cooperation of Toll-like receptor signals in innate
immune defence. //Nat. Rev. Immunol. - 2007, - Vol.?. - P. 179-190.808. Tritto E., Mosca F., De Gregorio E. Mcchanism of action of licensed vaccine
adjuvant. //Vaccine. — 2009. - Vol.27, №25-26, - P3331-3334.809. Trowsdale J. Genetics and polymorphism: class II antigens. //Br. Med, Bull. -1987.-Vol.43. -P15-36.810. Trowsdale J., Hanson 1., Mockridge I. et al. Sequences cncoded in the class II
region of the MHC related to the ‘ABC’ supcrfamily of transporters. //Nature. -1990, - Vol.348. - P741-744.811. Turner A.K., Beavis J.C., Stephens J.C, et al. Construction and phase 1 clini¬
cal evaluation of the salely and immunogenicity of a candidate enterotoxigenic
Escherichia coli vaccine strain expressing colonization factor antigen CFA. //
Infect. Immun. - 2006. - Vol.74, №2. - P1062-1071.812. Unanue E.R. The regulation of lymphocyte functions by the macrophage. //
Immunol. Rev. - 1978. - Vol.40. - P227-255.813. Underhill D.M. Innate immune signaling during phagocytosis. In: Innate
immunity; Ezenkowitz R.A.B., Hoffmann J.A. (Eds), — Totowa, New Jersey;
Human Press, 2003. - P.341-359.814. Vales-Gomez М., Reyburn H.T, Erskine R.A., Lopez-Botet М., Strominger J.L.
Kinetics and peptide dependency of the binding of the inhibitory NK receptor
CD94/NKG2-A and the activating receptor CD94/NKG2-C to HLA-E. //
EMBO J. - 1999. - Vol.l8. - P4250-4260.815. VandcrVen K. HLA-G polymorphism and pregnancy, //J. Reprod. Immunol, -
2003. - Vol.58, №2. - P118.
604 Список литературы816. Van der Ven К., Pfeiffer К., Skrablin S. HLA-G polymorphisms and molecule
function-questions and more questions. //Placenta. - 2000. - Vol.2l (Suppl.). -
P86-92.817. Van Engeland М., Nieland L.J.W., Ramaekers F.C.S., Schutte B., Rcuelingsper-
ger C.P.M. Annexin V^affinity assay: a review on an apoptosis detection system
based on phosphatidylserine exposure. //Cytometry. - 1998. - Vol.31, — P.1-9,818. Van Kaer L., Ashton-Rickardt P.G., Eichelberger M. et, al. Altered peptidase
and viral-sped tic T cell response in LMP2 mutant mice. //Immunity. - 1994. -
Vol.l, -P.533-541.819. Van Oers N.S., Weiss A. The Syk/Zap-70 protein tyrosine kinase conncction
to antigen receptor signaling processes. //Semin. Immunol. — 1995. — Vol.7. —
R227-236.820. Van Sevcnter G.A., Simuzi Y., Shaw S. Roles of multiple acccssory molecules in
T cell activation. //Curr. Opin. Immunol, - 1991. - Vol.3. - P.294-303.821. Van Vonakis H., Kaplan J., Lehrer H., Levine L. Immunogcnicity of polylisine
and polyvinithine when complcxed to phosphorylated bovine serum albumin, //
Immunochemistry. - 1966. ~ Vol.3. - P.393-402,822. Veillettc A., Latour S., Davidson D. Negative regulation of immunoreceptor
signaling. //Annu. Rev. Immunol. - 2002. - Vol.20. - P.669-707.823. Verma D., Daniell H. С hloroplast vector systems for biotechnology applications.//
Plant, physiol. - 2007. - VoL145, №4. - P.1129-1143.824. Verma D,, Samson N,P, Koya V, el al. A protocol for expression of foreign genes
in chloroplasts. //Nat, Protoc. — 2008,— Vol.3, №4. — P739-758.825- Vivier E., Morin P., O’Brien C., Druker B,, Schlossman S,F,, Anderson P.
Tyrosine phosphorylastion of the Fc gamma K.11I (CD 16); zeta complex in
human natural killer cells. Induction by antibody-dependent cytotoxicity but not
by natural killing. //J. Tmmunol, - 1991. - Vol. 146. - P206-210.826. Voller A., Bidwell D,E., Bartlett A, The enzyme linked immunosorbent assay
(ELISA). - London, 1979. - VoLl. - 124 p.; 1980. - Vol.2 - 126 p.827. Von Boehmer H, The developmental biology of T lymphocytes. //Ann. Rev.
Immunol. - 1993, - Vol.6, - P309-326,828. Voss G., Manson K., Montefiori D,, Watkins D.I., Heency J., Wyand M. ct al.
Prevention of disease induced by a partially heterologous AIDS virus in rhesus
monkeys by using an adjuvanted multicomponent protein vaccine. //J. Virol. —2003. - Vol.77, m. - P1049-1058.829. Wabuke-Bunoti M.A.N., Taku A., Garman R., Fan D.P. Stimulation of anti¬
influenza cytolytic T lymphocytes by a synthetic peptide of the influenza hem¬
agglutinin can be modulated by at least three independent helper factors. //J.
Immunol. - 1984. - Vol.l33. - P2186-2201.
Список литературы 605830. Wagshal А.В., Jegasothy D.V., Waksman В.А. Regulatory substances produced
by lymphocytes. VI. Cell cyclc specificity of inhibitor of DNA synthesis action in
L cells. //J. Exp. Med. - 1978. - Vol.147. - RI71-181.831. Wahl S.М., Wahl L.M., McCarthy J.B. et al. Macrophage activation by
mycobacterial v^^ater-soluble compounds and synthetic muramyl dipcptide. //
J. Immunol. - 1979. - Vol.122. - R2226-2231.832. Wain-Hobson S., Sonigo R, Danos O. et al. Nucleotidc aequence of the AIDS
virus, LAV. //Cell. - 1985. - Vol.40. - R9-17.833. Waiant H., Henkler F., Scheurich R The TN F-receptor-associated factor family:
scaffold molecules for cytokine receptors, kinases and their regulators. //Cellular
signaling. - 2001. - Vol. 13. - R389-400.834. Waksman B.H. Adjuvant and immune regulation by lymphoid cells. //Springer
Semin. Immunopathol. - 1979. - Vol.2. — R5-33.835. Wallach D., Kovalenko A.V., Varfoloveev E.E., Boldin M.R Death-inducing
functions of ligands of the TNF family. //Cum Opin. Immunol. - 1998. -
Vol.lO. - R279-288.836. Wallich S., Clailin J.L., Brilcs D.E. Resistance to Streptococcus pneumoniae
is induced by a Phosphocholine-protein conjugate. //J, Immunol. — 1983. —
Vol.l30. -R2871-2875.837. Wang J., Shao Y., Bennett T.A. et al. The functional effects of physical interac¬
tions among Toll-like receptors 7,8 and 9. //J. Biol. Chem. - 2006. - VoL28l. -
R37427-37434.838. Wang S., El-Deity W.S. TRAIL and apoptosis induction by TNF-family death
receptors. //Oncogene. - 2003. - Vol.22. - R8628-8633.839. Wang T, Town T, Alcxopoulou L., Anderson J. F, Fikrig £., Flavell R. A.
Toll-like reccptor 3 mediates West Nile virus entry into the brain causing lethal
encephalitis. //Nat. Med. ~ 2004. - Vol.lO. - R1366-1373.840. WangX. The expanding role of mitochondria in apoptosis. //Gene.s Dev. — 2001. —
Vol.15.-R2922-2933.841. Wang Z., Choi M. K., Ban T, Yanai H., Negishi H., Lu Y,, Tamura Т., Takao¬
ka A., Nishikura K., Taniguchi T. Regulation of innate immune responses by
DAI (DLM-l/ZBPl) and other DNA-sensing molccules. //Proc. Natl. Acad.
Sci. USA- - 2008. - Vol.105. - R5477-5482.842. Wassmuth R. Molecular analysis of HLA-polymorphism and relevance for trans¬
plantation. //Biotest Bui. - 1997. - Vol.5- - R539-551.843. Watanabe T, Kitani A,, Murray P. J., Strober W. NOD2 i.s a negative regulator
of Toll-like receptor 2-mediatcd T helper type 1 responses. //Nat. Immunol. -2004. - Vol.5 - R 800-808.
606 Список литературы844. Watson J.C., Hadler S.C., Dykewicz C.A. ct al. Measles, mumps and rubella —
vaccine use and strategies for elimination of measles rubella and congenital
rubella syndrome and control of mumps: recommendations of the Advisory
Committee on Immunisation Practices (ACIP). //MMWP Recomm, Rep. —1998. - Vol.47. - Pl-57.845. Weber D.A., Evavold B.D., Jensen P.E. Enhanced dissociation of HLA-DR-
bound peptides in the presence of HLA-DM. //Science. — 1996. - Vol.274. —
P618-620.846. Weiss A., Littman D.R. Signal transduction by lymphocyte antigen receptors. //
Cell. - 1994. - Vol.76. - P.263-274.847. Werts C., Girardin S. E., Philpott D. L TIR, CARD and PYRTN; three domains
for an antimicrobial triad. // Ccll Death Differ. — 2006. — Vol. 13. - P.798-815.848. Wilcock D. М., Colton C.A. Immunotherapy, vascular pathology, and microhe-
morrhages in transgenic mice. //CNS Neurol. Disord. Drug Targets. - 2009. -
Vol.8, №l.-P50-64.849. Willmenl J.A., Brown G.D. C-type lectin receptors in antifungal immunity, //
Trends Microbiol. - 2008. — Vol,l6. - P.27-32.850. Wilson LA., Haft D.H., Getzoff E.D. et al. Identical short peptide sequences
in unrelated proteins can be have different conformations: a testing ground for
theories of immune recognition. //Proc. Nat. Acad. Sci. LFSA. ~ 1985, - Vol.82,
P5255-5259.851. Wilson M.J., Torkar М., Milne S., Jones Т., Sheer D., Beck S., Trowsdale J.
Plasticity in the organization and sequences of human KIR/ILT gene families. //
Proc. Natl. Acad. Sci. USA, - 2000. - Vol.97. - P4778-4783.852. Woo E.-J., Kim Y.-G., Kim M.-S., Han W.D., Shin S., Robinson H,, Park S.Y.,
Oh B.H. Structural mechanism for inactivation and activation of CAD/DFF40
in the apoptotic pathway. //Mol. Cell. - 2004, - Vol.14. — P.531-539.853. Woo М., Hakem R., Soengas M.S., Duncan G.S., Shahinian A., Kagi D., Па¬
кет A., McCurrach М., Khoo W,, Kaufman S.A., Scnaldi G., Howard T,
Lowe S.W., Mak T.W. Essential contribution of caspase 3/CPP32 to apoptosis and
its associated nuclear changes. // Genes Dev. - 1998. - Vol.12. - P.806-819.854. Wortis N., Strcbel P.M., Wharton M. et al. Pertussis deaths: report of 23 cases in
the United States, 1992 and 1993. //Pediatrics. — 1996. - Vol.97. P.607-612.855. Wu J., Song Y., Bakkcr A.B., Bauer S., Apies T, Lanier L.L., Phillips J.H. An
activating immunoreceptor complcx formed by N KG2Dand DAPIO. //Science. -1999. - Vol.285. - P.730-732.856. Wu J., Xu J., Cai C. et al. Ag85B DNA vaccine suppresses airway inflammation
in a murine model of asthma. //Respir. Res. — 2009. — Vol.lO, №1. - P.51.
Список литературы 607857. WuX.,DengY.BaxandBH3-domain-onlyprotcinsinp53-mediatedapoptosis.//
Front. Biosci. - 2002. - Vol.7. - РЛ51-156.858. Xu Y., TaoX., Shen B., Horng Т., Medzhitov R., Manley J. L., Tong L. Structural
basis for signal transduction by the Toll/interleukin-1 receptor domains. //
Nature. - 2000. - Vol.408. - R111-115.859. Yamamoto М., Sato S., Hemmi H., Sanjo H., Uematsu S. et al. Essential role of
TIRAP/Mal for activation of the signaling cascade shared by TLR2 and TLR4. //
Nature. - 2002, - Vol.420. - R324-329.860. Yamamoto T,, Takahashi Y., Kase N., Mori H, Proportion of CD56^CD16'^ T
cells in decidual and peripheral lymphocytes of normal prcgnancy and sponta¬
neous abortion with and without history of recurrent abortion. //Am. J. Reprod,
Immunol. - 1999. - Vol.42, - R355-360.861. Yan L., Qiu J., Chen J. Selected prfA* mutations in recombinant attenuated
Listeria monocytogenes strains augment expression of foreign immunogens and
enhance vaccine-clicited humoral and cellular immune responses. //Infect.
Immun. - 2008. - Vol.76, №8. - R3439-3450.862. Yang W.C., Collette Y., Nunes J.A., Olive D. Tec kinases; a family with multiple
roOles in immunity. //Immunity. — 2000. — Vol.12. — R372-382,863. Yao W., Liu S., Qu X. Enhanced immune response and protection efficacy of a
DNA vaccine constructed by linkage of the Mycobacterium tuberculosis Ag85B-
encoding gene with the BVP22-encoding gene, //J. Med. Microbiol. - 2009. -
Vol.58, Pt 4.-R462-468.864. Yarovinsky R, Zhang D., Andersen J,F. et al. TLRl 1 activation of dendritic cells
by a protozoan profiling-like protein. //Science. — 2005. — Vol,308. — P. 1626-
1629.865. Yasuda K., Rutz М., Schlatter J, et al. CpG motif-independent activation of
TLR9 upon endosomal translocation of «natural» phosphodiester DNA. //Eur.
J. Immunol. - 2006. - Vol.36. - R431-436.866. Yonehara S., Ashii A., Yonehara M. A cell-killing monoclonal antibody (anti-
Fas) to a cell surface antigen co-downregulated with the rcceptor of tumor
necrosis factor//J.Exp.Med. - 1989. - Vol. 1989. - R1747-1756.867. Yoneyama M,, Kikuchi М., Natsukawa T. et al. The RNA hclicase RIG-I has an
essential function in double-stranded RNA-induced innate antiviral responses. //
Nat. Immunol. - 2004. - Vol.5. - R730-737.868. Zavala F, Cochrane A.H., iSlardin E.H. et al. Circumsporozoite proteins of
malaria parasites contain a single immunodominant region with two or more
identical epitopes. //J. exp. Med. - 1983. — Vol.157. - P, 1947-1957.869. Zelensky A. N., Gready J. E. The C-type lectin-like domain superfamily. //
FEBS J. - 2005- - Vol.272. - R6179-6217.
608 Список литературы870. Zhai Y.Z., Li Х.М., Zhou У. et al. Intramu.scular Immunization with a Plasmid
DNA Vaccinc Encoding prM-E Protein from Japanese Encephalitis Virus:
Enhanced Immunogenicity by Co-Administration of GM-CSF Gene and
Genetic Fusions of prM-E Protein and GM-CSF. //Intervirology. — 2009. -
Vol.52,№3. -P152-163.871. Zhang D., Zhang G., Hayden M.S. et al, A Toll-like receptor that prevents infec¬
tion by Liropathogcnic bacteria. //Sciencc. — 2004. —Vol.303. — P. 1522-1526.872. Ziegler A., Dohr G., Kentcnich H., Volz A., Lfchanska-Ziegler B. MHC, olfac¬
tory receptor genes and mate selection. //Immunol. Letters. ~ Vol.87. - №1-3
(Special issue: Abstracts of the 15‘*’ European Immunol, Congress. ~ EFTS
2003).-P12.873. Zimmermann S., Moelling K. Phosphorylation and regulation of Raf by Akt
(Protein kinase B). //Science. - 1999. - Vol,286. - P. 1741-1744,874. Zinkernagel R.M., Bachmann M.F., Klindig TM. et al. On immunological
memory. //Ann. Rev. Immunol. -1996. - Vol.14. - P.333-367.875. Zinkernagel R.M., Doherty PC. The discovery of MHC restriction. //Immunol.
Today. - 1997. - Vol.18. - R14-17.876. Zou H., Henzel W.J., Liu X., Lutschg A,, Wang X. Apaf-1, a human protein
homologous to CED-4, participates in cytochrome c-dependent activation of
Caspase 3. //Cell. - 1997. - Vol. 90. - R405-413.877. Zuckerman J.N. Protective efficacy, immunotherapeutic potential, and safety of
hepatitis В vaccines.//J. Med. Virol. —2006. — Vol.78. — P.169-177.Петров Рэм Викторович
Хаитов Рахим МусаевичИММУН01ЕНЫ И ВАКЦИНЫ НОВОГО ПОКОЛЕНИЯВыпускающий редактор О.С. Шевченко
Корректоры Л.В. Ким, П. В. А'ашва
Компьютержж верстка И.Я КияимникПодписано в печать 10.08.10. Формат 60x901/16.EyMaj a офсетная. Печать офсетная. Печ. л. 38.Тираж 1000 эки. .Заказ Ке 7173Иадательская группа «ГЭ0'1АР-Мелиа».119021, Москва, ул. Россолимо, 4.
тел.; (495) 921-39-07, факс: (499) 246-39-47.Электронный адрес; inio@geolar.ru, www.geotar.ruв типографии:SsPAUDAПр. Лайсвес 60.LT-05120 Вильнюс. Литвз
Р.В. Петров, P.M. ХаитовИммуногены и вакцины
нового поколенияПетров Рэм ВикторовичВедущий иммунолог и иммуногенетик России, академик Российской академии
наук, Российской академии медицинских наук и Российской академии сельскохо¬
зяйственных наук, профессор, Герой Социалистического Труда, действительный
член Всемирной академии искусств и науки, Вашингтонской и Норвежской акаде¬
мий наук, лауреат Государственной премии и премии Правительства РФ, золотой
медали им. И.И. Мечникова АН СССР и золотой медали Международного общества
трансплантологов. Член Правления Международного союза иммунологических об¬
ществ (IUIS), вице-председатель постоянного комитета ЮНЕСКО по молекулярной
и клеточной биологии, председатель Комитета по биотехнологии и сопредседатель
Комитета по биоэтике при Комиссии РФ по делам ЮНЕСКО. Почетный председа¬
тель Всероссийского научного общества иммунологов. Автор более 400 научных
работ и 16 монографий, в т.н. первого в стране учебника «Иммунология». Более 60
научных трудов, включая 8 монографий, опубликованы в США, Англии, Франции,
Японии и в других странах.Хаитов Рахим МусаевичИзвестный иммунолог, академик Российской академии наук и Российской ака¬
демии медицинских наук, действительный член Всемирной академии искусств
и науки. Вашингтонской и Международной академий наук, профессор, заслужен¬
ный деятель науки Российской Федерации, лауреат Государственной премии РФ,
дважды лауреат премии Правительства РФ, лауреат премии Ленинского комсомо¬
ла, премий им. И.И. Мечникова РАН и им. А.А. Богомольца РАМН, директор ГНЦ
«Институт иммунологии» ФМБА России, заведующий кафедрами иммунологии
и аллергологии Института повышения квалификации ФМБА России и Московского
медико-стоматологического университета, президент Российской ассоциации ал¬
лергологов и иммунологов. Автор более 500 научных трудов, включая 20 моногра¬
фий, руководств и учебников по иммунологии, опубликованных в России, Англии,
США, Германии и в других странах.www.geotar.ruwww.rnedknigaservis.ru