Автор: Бурместер Г.-Р. Пецутто А.
Теги: физиология сравнительная физиология общая патология медицина
ISBN: 978-5-9963-1731-8
Год: 2014
Текст
COLOR ATLAS
OF IMMUNOLOGY
Gerd-Rudiger Burmester, M. D.
Professor of Medicine Charite University Hospital Humboldt University of Berlin Berlin, Germany
Antonio Pezzutto, M. D.
Professor of Hematology and Oncology Charite University Hospital Humboldt University of Berlin Berlin, Germany
With contributions by
Timo Ulrichs and Alexandra Aicher
131 color plates by Jurgen Wirth
13 tables
Thieme
Stuttgart • New York
НАГЛЯДНАЯ МЕДИЦИНА
Г.-Р. Бурместер, А. Пецутто с участием Т. Улрихса и А. Айхер
НАГЛЯДНАЯ ИММУНОЛОГИЯ
3-е издание
Перевод с английского канд. хим. наук Т. П. Мосоловой
под редакцией профессора, д-ра биол. наук Л. В. Козлова
Москва
БИНОМ. Лаборатория знаний
УДК 612.017
ББК 52.54
Б91
Серия основана в 2006 г.
Бурместер Г.-Р.
Б91 Наглядная иммунология / Г.-Р. Бурместер, А. Пецутто ; пер. с англ.-3-е изд. — М. : БИНОМ. Лаборатория знаний, 2014.— 320 с. : ил. — (Наглядная медицина).
ISBN 978-5-9963-1731-8
В справочном издании, написанном немецкими специалистами, в наглядной форме излагаются основы иммунологии, методы лабораторной диагностики и основы клинической иммунологии (объясняется связь теоретических принципов и клинических аспектов; рассмотрены все известные заболевания, имеющие иммунную природу). Книга построена как атлас, где на каждом развороте помещена иллюстрация, необходимые для темы объяснения, определения, понятия. Несмотря на краткость изложения, наиболее трудные для понимания вопросы изложены детально и четко. В приложении представлены критерии для диагностики иммунных заболеваний, приведен полный перечень известных кластеров дифференцировки, а также список наиболее важных для иммунологии цитокинов. В кратком словаре разъясняются основные иммунологические термины. Имеется предметный указатель.
Для студентов и преподавателей, а также для специалистов.
УДК 612.017
ББК 52.54
Справочное издание
Серия: «Наглядная медицина»
Бурместер Герд-Рюдигер
Пецутто Антонио
НАГЛЯДНАЯ ИММУНОЛОГИЯ
Ведущий редактор канд. хим. наук Т. И. Почкаева. Редактор канд. биол. наук В. В. Гейдебрехт
Художник С. Инфантэ
Технический редактор Е. В. Денюкова
Компьютерная верстка: Т. Э. Внуковой
Подписано в печать 14.04.14. Формат 70x100/16.
Усл. печ. л. 26,00. Тираж 1500 экз. Заказ
Издательство «БИНОМ. Лаборатория знаний»
125167, Москва, проезд Аэропорта, д. 3
Телефон: (499)157-5272, e-mail: binom@Lbz.ru, http://www.Lbz.ru
ISBN 978-5-9963-1731-8
© 2003 Georg Thieme Verlag, Riidigerstrasse 14, D-70469, Stuttgart, Germany
© Перевод на русский язык, оформление. БИНОМ. Лаборатория знаний, 2014
Об авторах
Герд-Рюдигер Бурместер
Антонио Пецутто
Йюрген Вирт
Герд-Рюдигер Бурместер родился в Ганновере (Германия) в 1953 г. С 1972 по 1978 г. обучался на медицинском факультете Университета Ганновера, выполнил диссертационную работу под руководством проф. Иоахима Р. Кальдена. Будучи студентом, активно интересовался клинической иммунологией и ревматологией, продолжил исследования во время работы в лабораториях проф. Генри Кункеля и проф. Роберта Винчестера в Рокфеллеровском университете в Нью-Йорке, получив стипендию фонда Немецкого общества естествознания. Позднее преподавал на медицинском факультете университета г. Эрлангена. В 1989 г. за научно-исследовательскую работу присвоено звание профессора. С 1990 г работает сначала в должности доцента, а затем заведующего кафедрой в Отделении ревматологии и клинической иммунологии клиники Шарите при Университете им. Гумбольта в Берлине. Научные интересы: клиническая и экспериментальная ревматология и клиническая иммунология. Ведет занятия со студентами, руководит аспирантами. Женат, имеет двоих детей.
В составление этого справочника большой вклад внес доктор Тимо Улрихс, сотрудник факультета микробиологии Свободного университета Берлина, преподаватель Отделения ревматологии клиники Шарите при Университете им. Гумбольта в Берлине. Получил образование в Марбурге, диссертационная работа посвящена иммунологии. В
настоящее время занимается исследованиями в области иммунологии туберкулеза и созданием вакцин.
Антонио Пецутто родился в Мирано вблизи Венеции в 1953 г. С 1972 по 1978 г. изучал медицину в Университете г. Падуи; диссертационная работа посвящена иммунологии опухолей; дипломированный специалист в области клинической и экспериментальной гематологии. В течение 10 лет (с 1984 г.) работал в клинической лаборатории и поликлинике при Университете Гейдельберга, где на него оказали огромное влияние исключительный профессиональный опыт и личность проф. Вернера Хунштейна. Имеет звание профессора в области гематологии и клинической иммунологии. С 1994 г. — профессор в Отделении гематологии, онкологии и иммунологии опухолей клиники Шарите при Университете им. Гумбольта в Берлине. Возглавляет рабочую группу по молекулярной иммунотерапии в Центре молекулярной медицины Макса Делбрюка в Бухе (Берлин). Научные интересы: иммунология опухолей. Жена — из Великобритании, ученый. У них двое детей.
На Александру Айхер легла основная работа по выверке текста и иллюстраций (с тем, чтобы добиться соответствия между ними). Айхер получила степень доктора медицины в 1995 г., а затем два года работала в Центре Макса Делбрюка/клинике Роберта Рессле в Берлине и два года специализировалась в области иммунологии и микробиологии
Об авторах
в Университете Вашингтона в Сиэтле (США). В настоящее время работает в области молекулярной кардиологии в Франкфуртском университете (Германия), специализируясь на изучении роли дендритных клеток и макрофагов в развитии атеросклероза, а также кроветворных стволовых клеток в неоваскуляризации.
Йюрген Вирт получил начальные навыки по графическому дизайну в Школе прикладного искусства г. Оффенбаха, продолжил образование в Университете графических искусств в Берлине, где специализировался в области свободной графики и иллю
страций, и в дизайнерском колледже г. Оффенбаха. Будучи членом дизайнерской группы при реконструкции музея Зенкенберга во Франкфурте-на-Май-не, развивал новаторскую концепцию организации выставок. Сотрудничал с несколькими издательствами, создавая иллюстрации к школьным учебникам, научным книгам и публикациям. Был неоднократно награжден за художественное оформление книг. В 1978 г. получил должность профессора в Школе дизайна в Швабиш Гмюнд а с 1986 г. ведет занятия по дизайну и визуализации в Университете прикладных наук в Дармштадте.
Благодарности
Авторы выражают благодарность проф. Фальку Хие-пу, д-ру Сюзанне Прием, Бруно Штулмюллеру и Бернарду Тьеле из Отделения ревматологии и клинической иммунологии клиники Шарите за помощь в подготовке раздела, посвященного лабораторным методам. Особую благодарность мы выражаем проф Хансу-Эберхарду Волкеру и Херрманну Крастелю из Отделения офтальмологии Университета Гейдельберга за полезные советы и предоставление слайдов для раздела, посвященного глазным болезням, а также директору Института патологии в Бухе (Берлин) проф. Вольфгангу Шнейдеру за конструктивные комментарии и предоставление ряда фотографий для раздела иммунонефрологии.
Ценные фотографии и слайды были также предоставлены д-ром Андреасом Брейтбартом из Отделения гематологии Ульмского университета, д-ром Уве Плейером из Отделения офтальмологии клиники Шарите, проф. Хей-друном Моллем из Исследовательского центра инфекционных болезней Университета Вюрцбурга, директором Института патологии Ульмского университета проф. Петером Мёллером, проф. Михелем Хюфнером из медицинского факультета (и поликлиники) Гёттингенского университета, директором Института патологии Университета Гейдельберга проф. Хервартом Отто, д-ром Хансом Р. Гельдербломом из Института Роберта Коха в Берлине, проф. Хансом-Михелем Мейнком из Отделения нейрологии Университета Гейдельберга и fl-ром Томасом Вольфенсбергером из госпиталя Жюля Тонина в Лозанне.
6
Предисловие
Иммунология является динамической дисциплиной, не имеющей себе равных по быстроте развития научных исследований, за исключением, пожалуй, только нейрологии. Эти исследования поставляют ценнейшие новые данные для медицины и биологии. Иммунология, включая фундаментальные принципы и клинические приложения, представляет собой увлекательнейшую область науки.
Люди в современном мире доживают до зрелого и пожилого возраста, несмотря на враждебные атаки несметного числа патогенных организмов. В защите от них особую роль играют иммунные механизмы с их высокой специфичностью и чувствительностью. Настоящая книга, задуманная как иллюстрированный атлас, предлагает графическое изображение данных механизмов; основная задача — объяснить многочисленные связи между фундаментальными принципами иммунологии и ее лабораторными и клиническими приложениями и тем самым создать ясную и всеобъемлющую картину. В основном книга предназначена для студентов-медиков, биологов и студентов других смежных специальностей. Однако она может быть интересна также практикующим врачам и исследователям, специализирующимся в соответствующих областях.
Иллюстрированный атлас, по определению, должен в графической форме представлять материал, описание которого ограничено кратким пояснительным текстом. Иллюстрации (особенно в иммунологии) отражают процессы и их изменения во времени, разные стадии процессов, а также взаимодействия между различными веществами и элементами. Для четкого отражения событий с участием этих «действующих лиц» графический дизайнер должен создавать типич
ные модели и умело использовать цвет, что обеспечивало бы доходчивость и целостное восприятие излагаемого материала Важное значение мы придавали унификации цветовых иллюстраций в различных разделах. Необходимо было избежать перегруженности модельных элементов внутренними структурами и достичь соединения отдельных элементов в целостную картину. Иногда для этой цели приходилось жертвовать красотой, а иногда происходила неизбежная потеря некоторых анатомических деталей.
В связи с ограниченным объемом книги, а также из-за акцента на медицинские аспекты иммунологии в данном атласе в основном рассматриваются вопросы иммунологии человека; нехватка места не позволила нам представить читателю необъятную область иммунологии во всей полноте. Опубликовано несколько превосходных учебников по иммунологии. Некоторые наши коллеги оказывают предпочтение более развернутому изложению материала. Мытак-же не должны забывать об огромных успехах в развитии иммунологии, об открытиях новых данных и о том, что неясные сегодня вопросы скоро могут быть нами поняты. Происходит постоянная смена теорий, особенно это касается вопросов толерантности и аутоиммунных процессов. Настоящее издание не в состоянии полностью отразить эту новую информацию. Мы надеемся, что последующие издания этой книги позволят нам пересматривать ее содержание и находиться на уровне передовых исследований. Мы с благодарностью воспримем любые предложения, добавления и замечания читателей.
Весна 2003 г. Герд-Рюдигер Бурместер, Берлин Антонио Пецутто, Берлин Йюрген Вирт, Дармштадт
7
Введение
Данный атлас предназначен для студентов медицинских и биологических специальностей, а также врачей и специалистов в различных областях биологии. Как было сказано в предисловии, книга в основном рассматривает проблемы иммунологии человека. Вся информация отражена в 131 иллюстрации, каждая из которых сопровождается комментарием, расположенным на соседней странице.
В атласе три раздела. Первый посвящен фундаментальным принципам иммунологии человека; во втором изложены важнейшие лабораторные методы, используемые в иммунологии; в третьем (заключительном) разделе обсуждаются клинические аспекты иммунных заболеваний В приложении имеются словарь важных иммунологических терминов, а также таблицы: номенклатура кластеров дифференцировки важных (с иммунологической точки зрения) молекул; критерии классификации ревматических заболеваний; обзор наиболее важных цитокинов и факторов роста; диапазоны важных иммунологических показателей. Эта книга не только введение во все разделы современной иммунологии, но также хороший справочник по многим вопросам клинической медицины и лабораторной практики.
Раздел «Фундаментальные принципы» открывается описанием органов иммунной системы, за которым следует перечень клеток иммунной системы и объяснение механизмов, обеспечивающих высо
кую специфичность Т- и В-лимфоцитов. Отдавая дань огромной роли, которую во многих публикациях по иммунологии отводят молекулам клеточной поверхности, мы также представили их детальное описание. Затем следует описание вспомогательных клеток и естественных клеток-киллеров. Далее анализируется система человеческих лимфоцитарных антигенов, принципы процессинга антигенов и реакции гиперчувствительности. В конце этого раздела обсуждаются проблемы аутоиммунных реакций и толерантности.
В разделе «Лабораторные методы» рассматриваются наиболее важные для иммунологии тестовые системы. Традиционные методы преципитации, агглютинации и фиксации комплемента соседствуют с такими новыми методами анализа как иммуноблоттинг и молекулярно-биологические методы, позволяющие следить в том числе и за экспрессией генов.
В разделе «Клиническая иммунология» рассматривается проблема иммунодефицита и наиболее важные аспекты некоторых заболеваний иммунной системы. Основное внимание сосредоточено на вопросах ревматологии и гематологии.
Для обозначения различных клеточных систем, рецепторов и продуктов используются однотипные символы. Расшифровка этих символов дана на внутренних сторонах обложки.
Принятые сокращения
Ab (antibody) антитело
Ag (antigen) антиген
BALT (bronchus-associated lymphoid tissue) ассоциирован-
ная с бронхами лимфоидная ткань
BCR (В-cell receptor) В-клеточный рецептор
CALLA (common acute lymphoblastic leukaemia-associated
antigen) общий антиген для ОЛП
CD (cluster of differentiation) кластер дифференцировки
CDR (complementarity determining region) область, отве-
чающая за комплементарность
Cn (complement factor n) компонент n комплемента
CR (complement receptor) рецептор комплемента
CRP (C-reactive protein) С-реактивный белок
CTLA (cytotoxic T-lymphocytes antigen) антиген цитотокси-
ческих Т-лимфоцитов
cyt/ц цитоплазматический
DAF (decay acceleration factor) фактор ускорения рас-
пада
del (deletion) делеция (хромосомы)
ELISA (enzyme-linked immunosorbent assay) твердофазный
иммуноферментный метод анализа
ENA (extractable nuclear antigens) экстрагируемые ядер-
ные антигены
EVB (Epstein-Barr virus) вирус Эпштейна-Барр
FACS (fluorescence-activating cell sorter) активируемый
флуоресценцией сортировщик клеток
Fc(y-e)R Fc-рецепторы для у, а, 6, pi и е иммуноглобулинов
FISH (fluorescence in situ hybridization) флуоресцентная гибридизация in situ
GALT (gut-associated lymphoid tissue) ассоциированная c
пищеварительным каналом лимфоидная ткань
GP (glycosylated phosphatidylinositol) гликозилфосфати-
дилинозитол
HAMA (human antimurine antibody) человеческие антимы-шиные антитела
HCV (hepatitis C virus) вирус гепатита С
HEV (high endothelial venules) высокие эндотелиальные венулы
HLA (human leukocyte antigen) человеческий лейкоцитарный антиген
hsp (heat-shock protein) белок теплового шока
HSV (herpes simplex virus) вирус простого герпеса
HZV (herpes zoster virus) вирус опоясывающего герпе-
са
HTLV (human T-lymphotropic virus) вирус человеческого Т-клеточного лейкоза
ICAM (intercellular adhesion molecule) молекула межклеточной адгезии
ICE (interleukin-1 р converting enzyme) интерлейкин-1 р-конвертирующий фермент
ICOS (inducible T-cell co-stimulator) индуцибельный Т-кле-точный костимулятор
lg (immunoglobulin) иммуноглобулин
ILT (lg-like transcript) lg-подобный рецептор
inv (inversion) инверсия (хромосомы)
IRAK (IL-1 receptor-associated kinase) киназа, ассоцииро-
ванная с рецептором ИЛ-1
IRBP
ITAM
ITIM
KIR
L
LFA
LIR
LKM
LTR МАЬ MALT
МБР МСР
МНС
MIF
MIRL
NFAT
PDGF
PMR REAL
Rh SAA SAP
S t(n:n)
TAP
TBII
TCR TIL
TSA
TSBA
VCAM
VLA
(interphotoreceptor retinoid-binding protein) интерфоторецепторный ретиноид-связывающий белок (immunoreceptor tyrosine-based activation motif) рецепторный активирующий мотив
(immunoreceptor tyrosine-based inhibiting motif) рецепторный ингибирующий мотив
(killer cell lg-like receptor) lg-подобный рецептор клетки-киллера
(ligand) лиганд
(lymphocyte function-associated antigen) лимфоци-тассоциированный антиген
(leukocyte lg-like receptor) lg-подобный рецептор лейкоцита
(liver-kidney microsomal antibody) антитела к печеночно-почечным микросомам
(long terminal repeats) длинные концевые повторы (monoclonal antibody) моноклональное антитело (mucosa-associated lymphoid tissue) ассоциированная co слизистой лимфоидная ткань (major basic protein) главный основный белок (monocyte chemoattractant protein) моноцитарный хемотаксический белок
(major histocompatibility complex) главный комплекс гистосовместимости
(migration inhibition factor) фактор ингибирования миграции
(membrane inhibitor of reactive lysis) мембранный ингибитор реактивного лизиса
(nuclear factor of activated T cells) ядерный фактор активированных Т-клеток
(platelet-derived growth factor) фактор роста, полученный из тромбоцитов
(polymyalgia rheumatica) ревматическая полимиалгия (revised European-American lymphoma classification) пересмотренная европейско-американская классификация лимфом (rhesus) резус
сывороточный амилоид А
сывороточный амилоид Р
(Svedberg) единица Сведберга
хромосомная транслокация из положения п в положение п
(transporter associated with presentation) транспортер, связанный с процессингом антигена
(TSH-binding inhibiting immunoglobulin) антитела ингибирующие связывание ПГ
(T-cell receptor) Т-клеточный рецептор
(tumor-infiltrating lymphocyte) опухольинфильтрую-щие лимфоциты
thyroid-stimulating antibodies) тиреостимулирующие антитела
(thyroid stimulation blocking antibodies) ПГ-блокиру-ющие антитела
(vascular cell adhesion molecule) молекула адгезии сосудистых клеток
(very late antigen) очень поздний антиген
Клиническая иммунология
АГА аутоиммунная гемолитическая анемия
АЗКЦ антителозависимая клеточная цитотоксичность
АК аминокислота
АКЛ анапластическая крупноклеточная лимфома
АЛТ аланинаминотрансфераза
АМА антимитохондриальные антитела
АНЦА антинеитрофильные цитоплазматические антитела
АПК антигенпрезентирующая клетка
АПФ ангиотензин-превращающий фермент
ACT аспартатаминотрансфераза
АХ ацетилхолин
АХЭ ацетилхолинэстераза
АЯА антиядерные антитела
БАЛ бронхоальвеолярный лаваж
БГЛ большой гранулярный лимфоцит
БПГН быстро прогрессирующий гломерулонефрит
БТПХ болезнь трансплантант против хозяина
БТЦ болезнь тяжелых цепей
БХ болезнь Ходжкина
БЦЖ бацилла Кальметта-Герена
ЕЗВИГ внутривенное введение иммуноглобулинов
ВИЧ вирус иммунодефицита человека
ГАД глутаматдекарбоксилаза
ГБМ гломерулярная базальная мембрана
ГЗТ гиперчувствительность замедленного типа
Г-КСФ колониестимулирующий фактор для гранулоцитов
ГМ-КСФ колониестимулирующий фактор для гранулоцитов и макрофагов
ГН гломерулонефрит
Да дальтон
ДК дендритная клетка
ДКЗЦ дендритная клетка зародышевого центра
ДС вакцина против дифтерии и столбняка
ЖКТ желудочно-кишечный тракт
ИК интердигитальная клетка
ИЗСД инсулинзависимыи сахарный диабет
ИК иммунный комплекс
ИЛ интерлейкин
ИНФ интерферон
ИТП идиопатическая тромбоцитопеническая пурпура
кДа килодальтон
КДС коклюш, дифтерия, столбняк
КЛ клетка Лангерганса
КОЕ колониеобразующая единица
КСФ колониестимулирующий фактор
ЛАМ липоарабиноманнан
ЛЛ лимфобластная лимфома
ЛПС липополисахарид
ЛТ лейкотриен
МАГ миелин-ассоциированный гликопротеин
МГНЗ моноклональная гаммопатия неустановленного зна-
чения
М-КСФ колониестимулирующий фактор для моноцитов
МОГ миелиновый олигодендроцитный гликопротеин
МПГН мембранопролиферативный гломерулонефрит
МПО миелопероксидаза
НК натуральный (естественный) киллер (клетка-киллер)
НПВП нестероидные противовоспалительные препараты
НХЛ неходжкинская лимфома
ОВИ общий вариабельный иммунодефицит
ОЛП острый лимфобластный лейкоз
ОМЛ острый миелоидный лейкоз
ОР относительный риск
СФМ система фагоцитирующих мононуклеаров
ПАЛО периартериальная лимфоцитарная оболочка
ПБЦ первичный билиарный цирроз
ПГ простагландин
ПИБФ прогестерон-индуцированный блокирующий фактор ПЛБ протеолипидный белок
ПМЯЛ полиморфноядерный лейкоцит (нейтрофильный гранулоцит)
ПО пероксидаза
поли-lgR рецептор полимерных иммуноглобулинов
ПСХ первичный склерозирующий холангит
ПЦР полимеразная цепная реакция
ПЭГ полиэтиленгликоль
РА ревматоидный артрит
РИА радиоиммунный анализ
РИД радиальная иммунодиффузия
РСК реакция связывания комплемента
РФ ревматоидный фактор
РШ Рида-Штернберга (клетка)
СКВ системная красная волчанка
СОЗ скорость оседания эритроцитов
СПИД синдром приобретенного иммунодефицита
ССК СПИД-связанный комплекс
ССТБ смешанная соединительнотканная болезнь
Т3 трииодтиронин
Т4 тетраиодтиронин
ТГ тиреоглобулин
ТДТ терминальная дезоксирибонуклеотрансфераза
ТКИД тяжелый комбинированный иммунодефицит
ТПЛ трансплантат против лейкоза (эффект)
ТПО тиреопероксидаза
ПГ тиреотропный (тиреостимулирующий) гормон
ТФР трансформирующий фактор роста
ФАТ фактор активации тромбоцитов
ФДК фолликулярная дендритная клетка
ФИТЦ флуоресцеин изотиоцианат
ФИО фактор некроза опухоли
ФРН фактор роста нервов
ФРФ фактор роста фибробластов
ФСК фактор стволовых клеток
ФЭ фикоэритрин
ХЛЛ хронический лимфолейкоз
ЦМВ цитомегаловирус
ЦОГ циклооксигеназа
ЦТЛ цитотоксический Т-лимфоцит
ЩФ щелочная фосфатаза
ЭАУ экспериментальный аутоиммунный увеоретинит
ЭАЭ экспериментальный аллергический энцефаломи-
елит
ЭК эндотелиальная клетка
ЭКП эозинофильный катионный протеин
ЭМА эпителиальный мембранный антиген
ЭР эндоплазматический ретикулум
ЭФР эпителиальный фактор роста
ЮРА ювенильный ревматоидный артрит
ЮХА ювенильный хронический артрит
ЯФ ядерный фактор
10
Фундаментальные принципы
Иммунная система
Превращение иммунной системы в комплекс сложных адаптируемых защитных механизмов, каковой она является сейчас, происходило на протяжении 400 миллионов лет. Основной задачей иммунной системы является защита нашего организма от посторонних и вредных веществ, микроорганизмов, токсинов и злокачественных клеток. Только постоянное развитие иммунной системы обеспечивает защиту живого организма от бесконечных воздействий опасных внутренних и внешних факторов. В процессе своей эволюции иммунная система научилась подавлять деструктивный ответ на эндогенные вещества и не оказывать пагубного воздействия на собственные ткани. Большинство иммунологических реакций краткосрочны и контролируются регуляторными механизмами, предотвращающими слишком сильный ответ.
Иммунная система должна уметь различать вредное и безопасное Например, проникновение микроорганизмов или бактериальных токсинов вредно для организма, а вдыхание пыльцы или попадание пищевых антигенов из желудка в кровоток безопасно. Положительным действием является разрушение злокачественных клеток или постороннего клеточного материала (например, при инвазии паразитами), однако прямая атака на ткани организма-хозяина является негативным действием (например, при аутоиммунном заболевании). Комплекс механизмов, при помощи которых иммунная система избегает деструктивных, направленных против собственного организма реакций, носит общее название толерантности. Подавляющее большинство лимфоцитов, присутствующих во всех первичных лимфоидных органах и направленных против собственных антигенов организма, разрушаются под действием механизмов центральной толерантности. Механизм периферической толерантности реализуется в других эндогенных структурах или только в отдельных участках организма.
ные системы, а также неспецифические медиаторы (интерфероны и интерлейкины). В этих механизмах задействованы гранулоциты, система моноцитов/ма-крофагов, а также клетки-киллеры. Последние осуществляют связь между специфическим и неспецифическим иммунным ответом.
Воспалительный ответ способствует концентрации защитных сил организма на пораженном участке, что достигается путем сложного взаимодействия растворимых и клеточных компонентов; в этом заключается важный неспецифический механизм защиты. Первой стадией при реализации данного механизма является высвобождение медиаторов, расширяющих кровеносные сосуды и способствующих лучшей проницаемости стенок капилляров. Затем в пораженный участок проникают гранулоциты, которые позднее заменяются макрофагами. Гранулоциты представляют собой «первую линию защиты», в результате действия которой большинство патогенов погибает. Оставшиеся патогены и продукты распада клеток подвергаются фагоцитозу макрофагами.
Специфический иммунный ответ
Описанный выше механизм создает почву для развития специфического иммунного ответа. В зависимости от цитокинового окружения организм выбирает между применением гуморального или клеточного механизма защиты. Миграция антигенпрезентирующих клеток (АПК) в лимфоидные органы сначала вызывает системный иммунный ответ, а затем вторичный иммунный ответ. За это отвечает специфический иммунитет, основанный на действии Т- и В-лимфоцитов. Эти клеточные системы способствуют протеканию высокоспецифичных реакций на определенные антигены и претерпевают клональную экспансию, довершая тем самым эффективный иммунный ответ и запоминая данные антигены
Неспецифический иммунный ответ
Более древние врожденные защитные механизмы называют неспецифическими, поскольку они активируются вне зависимости от природы патогена; их также называют неклональными защитными механизмами, поскольку для их проявления не требуется особого клона клеток. В качестве примеров можно назвать кислый слой кожи, интактный эпидермис, систему комплемента, антимикробные ферментатив-
Фундаментальные принципы
Клетки иммунной системы
Фундаментальные принципы
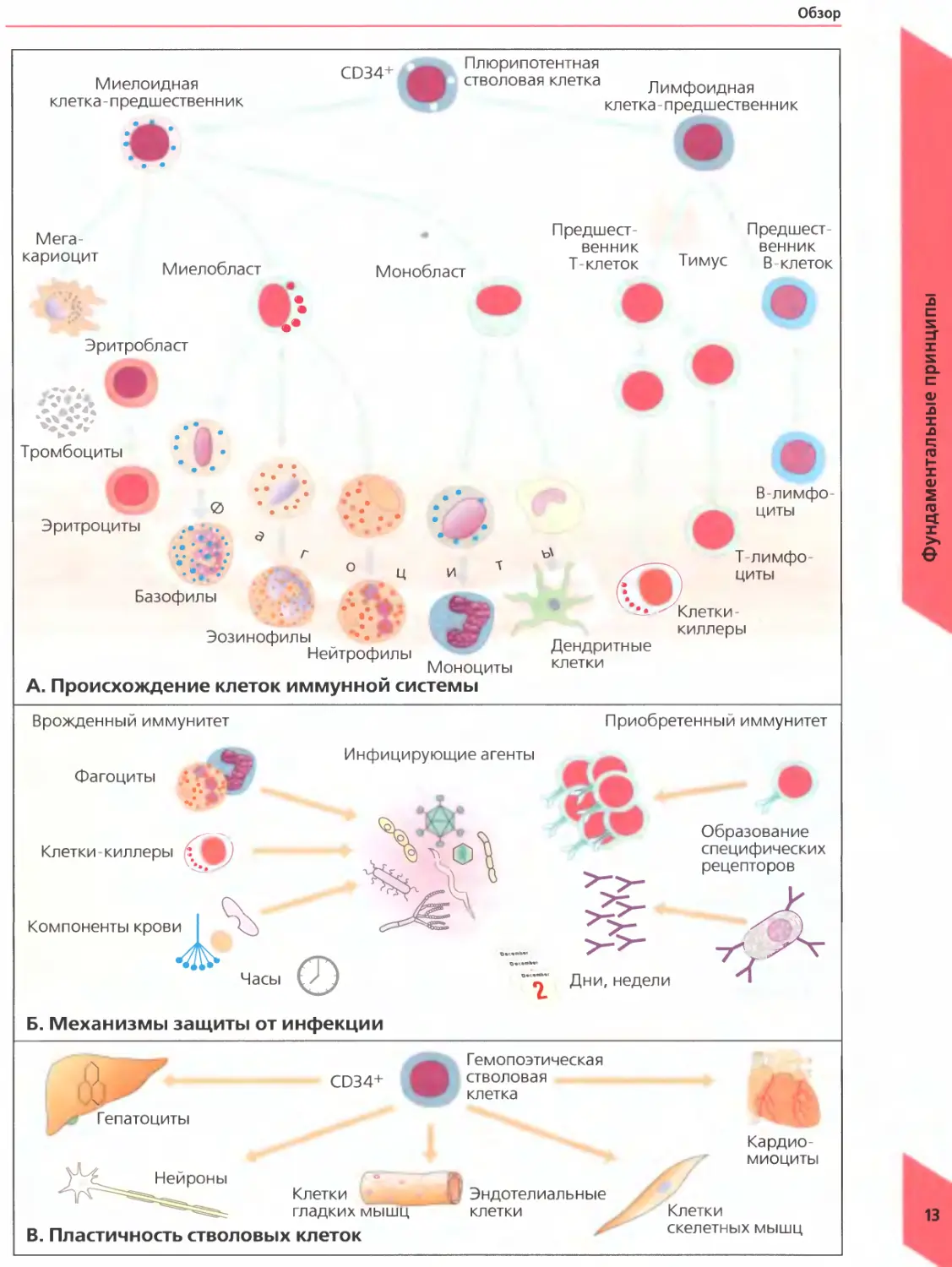
А. Происхождение клеток иммунной системы
Все компоненты крови, в том числе и клетки иммунной системы, происходят от плюрипотентных кроветворных стволовых клеток костного мозга. Под действием растворимых медиаторов (цитокинов) и контактных сигналов, подаваемых стромальными клетками, эти абсолютно недифференцированные клетки-предшественники превращаются в различные клетки крови (рис. А). Плюрипотентные кроветворные стволовые клетки являются одними из немногих клеток организма, способных к самовоспроизведению, то есть могут делиться, не подвергаясь дифференцировке и обеспечивая тем самым бесконечный источник клеток крови. Костный мозг производит в день 1,75 • 1011 эритроцитов (красных кровяных клеток) и 7 • 1010 лейкоцитов (белых кровяных клеток) и в случае необходимости может увеличить это число в несколько раз. Такие клетки-предшественники могут давать начало колониям дифференцированных клеток in vitro. Миелоидные клетки-предшественники последовательно превращаются в следующие типы клеток: мегакариоциты (очень крупные многоядерные клетки, при фрагментации которых образуются тромбоциты), эритробласты (эти клетки делятся дальше и превращаются в циркулирующие эритроциты), миелобласты (могут превращаться в нейтрофилы, эозинофилы и базофилы, имеющие сегментированное ядро и называемые полиморфноядерными лейкоцитами в отличие от других одноядерных клеток), монобласты (предшественники моноцитов) и дендритные клетки. Гранулоциты, моноциты и дендритные клетки обладают способностью поглощать частицы, микроорганизмы и жидкости и поэтому называются фагоцитами («фаго» от греч есть).
При действии растворимых медиаторов, называемых хемокинами, лейкоциты мигрируют из кровотока в ткани, где восстанавливают поврежденный участок и удаляют бактерий, паразитов и мертвые клетки, которые вызвали воспаление. После миграции в ткани моноциты крови превращаются в макрофаги.
Наиболее важными клетками иммунной системы являются лимфоциты, берущие начало от общих клеток-предшественников в костном мозге. Различают два типа лимфоцитов: Т-лимфоциты, ответственные за клеточный иммунный ответ, и В-лимфоциты, про
дуцирующие антитела и ответственные за гуморальный иммунный ответ. Существуют клетки третьего типа — естественные клетки-киллеры, также являющиеся частью лимфатической системы. Эти клетки родственны Т-лимфоцитам, однако их происхождение все еще остается предметом дискуссии, поскольку они также имеют некоторые черты миелоидных клеток.
Б. Механизм защиты от инфекции
Основной функцией иммунной системы является защита организма от инфекции. Врожденный иммунитет представляет собой наиболее древний способ защиты, имеющий значительное сходство у организмов разных видов. Его основными элементами являются фагоцитирующие клетки, белки крови и естественные клетки-киллеры Принципы действия данной системы основаны на узнавании типичных молекулярных структур, общих для различных патогенов. Врожденный иммунитет срабатывает практически сразу после воздействия патогена — обычно этот процесс развивается за несколько часов.
Приобретенный иммунитет с филогенетической точки зрения представляет собой более молодой механизм; он основан на существовании рецепторов, высокоспецифичных к определенным областям (эпитопам) патогенов. Эти рецепторы могут быть связаны с клеткой (на Т-лимфоцитах и некоторых В-лимфоцитах) или находиться в секретированной форме (антитела, продуцируемые В-лимфоцитами). Единственный Т- или В-лимфоцит пролиферирует и образует огромное число идентичных дочерних клеток (клональная экспансия). Этот специфический ответ развивается на протяжении нескольких дней или недель.
В. Пластичность стволовых клеток
Находясь в специализированной ткани, гемопоэтическая клетка-предшественник может дифференцированно превращаться в различные клетки крови или тканеспецифичные клетки: гепатоциты, нейроны, клетки мышц или эндотелия. Сигналы, управляющие законами дифференцировки в специализированные клетки, в значительной степени остаются неизученными Небольшое число гемопоэтических стволовых клеток циркулирует в периферической крови. По морфологическим признакам они не отличаются от небольших лимфоцитов.
Обзор
Миелоидная клетка-предшественник
Плюрипотентная стволовая клетка Лимфоидная клетка-предшественник
Мегакариоцит
Предшест- Предшественник венник
Т-клеток Тимус В-клеток
Миелобласт
Монобласт
Эритробласт
моноциты
В-лимфо-
киллеры Дендритные клетки
А. Происхождение клеток иммунной системы
Врожденный иммунитет
Приобретенный иммунитет
Образование специфических рецепторов
Б. Механизмы защиты от инфекции
Гепатоциты
Г емопоэтическая
стволовая клетка
Кардио-миоциты
гладких мышц
Эндотелиальные клетки
В. Пластичность стволовых клеток
Клетки скелетных мышц
Фундаментальные принципы
Органы лимфатической системы
фундаментальные принципы
А. Структура лимфатической системы
Все клетки крови происходят от общего предшественника — плюрипотентной стволовой клетки костного мозга. Такие клетки можно обнаружить в печени плода, обладающей кроветворными свойствами, в период от восьмой недели после зачатия почти до момента родов. Стволовые клетки дают начало клеткам-предшественникам лимфатического и миелопоэтического ряда. Эритроциты, гранулоциты и тромбоциты имеют общие стадии развития (общие клетки-предшественники), в то время как клетки лимфатической системы уже на ранних этапах дифференцируют в особые клеточные линии. Начиная с 13-й недели после зачатия, некоторые стволовые клетки перемещаются в тимус и костный мозг, которые называют первичными лимфоидными органами Здесь продолжается пролиферация и дифференцировка клеток. Т-лимфоциты обязательно проходят стадию созревания в тимусе, а В-лимфо-циты полностью завершают свое созревание в костном мозге (аналог фабрициевой сумки (bursa of Fabricius) у птиц).
На поверхности Т- и В-лимфоцитов локализованы специализированные рецепторы (рецепторы антигенов, состоящие из двух гликопротеиновых цепей). Структура рецепторов на различных клетках различна. Каждый рецептор узнает и связывает только один специфический антиген по принципу «ключ-замок». В отличие от Т-лимфоцитов, В-лимфоциты могут созревать до плазматических клеток, образуя большие количества модифицированных рецепторов, и попадать в кровоток в виде циркулирующих антител.
Незрелые Т-лимфоциты осуществляют контакт со специализированными эпителиальными клетками, дендритными клетками и макрофагами в тимусе, что обеспечивает возможность селекции и дифференцировки Т-клеток, необходимых иммунной системе. Цитокины (растворимые регуляторные факторы или мессенджеры) типа интерлейкинов 1, 2, 6 и 7 также играют важную роль. Большое количество лимфоцитов, особенно узнающих компоненты собственного организма, разрушаются в процессе селекции.
В-лимфоциты образуются из стволовых клеток костного мозга приблизительно на 14-й неделе внутриутробного развития. Для дифференцировки В-клеток необходим контакт со стромальными клетками костного мозга и цитокинами. Наиболее важную роль в этом процессе играют интерлейкины 1, 6 и 7. В-лимфоциты образуются в костном мозге на протяжении всей жизни организма.
Созревшие Т- и В-лимфоциты покидают участки, где проходила их дифференцировка, и перемещаются к периферическим или вторичным лимфоидным органам (например, к селезенке, лимфатическим узлам, а
также к ассоциированным со слизистой оболочкой лимфоидным тканям).
Ассоциированная со слизистой оболочкой лимфоидная ткань (MALT) представляет собой скопление лимфатических клеток в подслизистой желудочно-кишечного тракта (ЖКТ), бронхиальных и мочевыводящих путей и слезных желез. Здесь можно обнаружить организованную лимфоидную ткань (например, миндалины или пейеровы бляшки) и большое количество лимфатических клеток, свободно распределенных в тканях вокруг капилляров и эндотелия.
Б. Циркуляция лимфоцитов
Клетки лимфатической системы постоянно циркулируют и достигают всех участков тела за редкими исключениями (стекловидного тела глаза, головного мозга, яичек). Клетки проникают в лимфатические узлы, кожу и кишечник через специализированный эндотелий посткапиллярных венул — так называемые высокие эндотелиальные венулы (HEV). Такие эндотелиальные клетки гораздо крупнее обычных. Для них характерен высокий уровень экспрессии адгезивных молекул, служащих хоминг-рецепторами лимфоцитов. В результате действия некоторых хемотаксических факторов лимфоциты начинают мигрировать в расположенные ниже ткани (диапедез). Лимфатические клетки вновь попадают в циркулирующий поток через выводящие лимфатические сосуды, соединяющиеся в грудной лимфатический проток. Лимфоциты проникают в селезенку через артериолы и синусы, а выходят оттуда через селезеночную вену.
14
Обзор
Онтогенез
Первичные лимфоидные органы
Медуллярный • эпителий слои , *- • •• • » е Дендрит- —► • ные клетки 1 Кора Макрофаги^ Клетка-предшественник ИЛ-1 , ИЛ-2 г ИЛ-6 ИЛ-7 | • Т-лимфоциты
Вторичные лимфоидные органы
Селезенка
I
Миелоидный предшественник Плюрипотентная стволовая клетка
Лимфоидный предшественник
Лимфатические узлы
А. Структура лимфатической системы
Ассоциированная со слизистой лимфоидная ткань
Фундаментальные принципы
Органы лимфатической системы
Фундаментальные принципы
Тимус (вилочковая железа) является главным органом, где происходит дифференцировка и функциональное созревание Т-лимфоцитов. Тимус, костный мозг и фа-брициеву сумку (у птиц) относят к первичным лимфоидным органам в отличие от вторичных лимфоидных органов, к которым относят селезенку, лимфатические узлы и ассоциированную со слизистой оболочкой лимфоидную ткань.
А. Анатомия и развитие тимуса
1. Тимус образуется из третьего глоточного кармана, а затем перемещается через переднее средостение к своему обычному местонахождению между грудиной и главными артериальными стволами. Тимус состоит из двух долей, удерживаемых соединительной тканью, которые иногда распространяются до щитовидной железы.
2. Размер тимуса меняется с возрастом человека: он достигает максимальной массы (около 40 г) приблизительно к 10 годам жизни, а затем подвергается постепенным регрессивным изменениям В результате у пожилого человека паренхима Тимура почти полностью состоит из жировой и фиброзной ткани. Лишь несколько участков паренхимы и лимфоциты остаются без изменений (см. также пункты 3 и 4). Во многих случаях не представляется возможным различить регрессирующий орган и окружающий его медиастинальный жир макроскопическими методами.
3, 4. Каждая доля тимуса разделяется соединительнотканными перегородками (трабекулами) на более мелкие части, каждая из которых состоит из внешнего слоя (коры или коркового вещества) и внутреннего слоя (медуллярного слоя или мозгового вещества). Кора содержит плотное скопление лимфоцитов; большое количество митозов указывает на усиленную пролиферацию. Напротив, медуллярный слой содержит гораздо меньше лимфоцитов. Там содержатся структуры, называемые тельцами Гассаля, образованные плотно упакованными рядами клеток. Эти структуры, возможно, являются остатками выродившихся эпителиальных клеток. Барьер внутри тимуса, аналогичный барьеру, существующему между кровотоком и головным мозгом, отделяет кору от циркулирующей крови. В костном мозге подобного барьера не существует.
Лимфоциты, созревающие до Т-клеток в тимусе, по функциональным и анатомическим причинам называют тимоцитами. Специфическая комбинация важных поверхностных маркеров позволяет путем иммунофе-нотипирования различить тимоциты и зрелые Т-клет-ки. На ранних этапах развития тимоциты чрезвычайно чувствительны к кортизону, но по мере дифференцировки становятся все более устойчивыми к нему; эта особенность используется для определения степени
зрелости тимоцитов. Чувствительные к кортизону незрелые тимоциты в основном сосредоточены в коре, а устойчивые к кортизону — в основном в медуллярном слое.
5. Кроме лимфоцитов и телец Гассаля в тимусе содержатся эпителиальные клетки с обильной цитоплазмой, а также дендритные клетки и макрофаги (данные группы клеток не показаны на рисунке). Более того, в тимусе имеется много кровеносных сосудов и эфферентные лимфоидные ткани, осуществляющие отток в медиастинальные лимфатические узлы.
16
Тимус
Щитовидная__
железа
Главные________
артерии
Легкое
Сердце
40
Диафрагма—
1. Расположение тимуса
30
20
10
0
I
Жировая и соединительная ткань
|Медуллярный слой|
0 5 10 10
Возраст (мес.)
20 30 40 90
Возраст (годы)
2. Кривая роста
Тельца Гассаля
Соединительнотканные _ перегородки внутри долей тимуса
Кора
Медуллярный слой
4. Тимус взрослого
Фундаментальные принципы
3. Тимус новорожденного
-Тимоциты
Тимоциты.
. * е . . • . о v ?
Кора €/ Медуллярный слой
ал™’™’ •"
“ . •
[A e * ® • t r
O’— &
Соединительнотканные перегородки
5. Гистология
А. Анатомия и развитие тимуса
Тельца
Гассаля
Гассаля
17
Органы лимфатической системы
Фундаментальные принципы
А. Структура селезенки
Селезенка — самый крупный лимфоидный орган (примерно 12 х 7 х 4 см, масса около 200 г). Селезенка состоит из тканей двух типов: красной и белой пульпы. Белая пульпа содержит лимфоциты, а красная пульпа напоминает губку, состоящую из эритроцитов. Именно здесь происходит уничтожение старых или поврежденных эритроцитов. Селезенка заключена в капсулу из коллагеновых волокон. Коллагеновые перегородки (трабекулы) с прилежащими артериолами расходятся лучами от капсулы в паренхиму селезенки, где расположена белая пульпа. Т-лимфоциты в основном сосредоточены в периартериальной области, образуя периартериальные лимфатические оболочки. Они окружены В-лимфоцитами, образующими так называемую маргинальную зону. Небольшие скопления В-лим-фоцитов [первичные фолликулы] всегда обнаруживаются в маргинальной зоне периартериальной оболочки. В процессе иммунного ответа первичные фолликулы превращаются в истинные [вторичные] фолликулы с зародышевым центром и кортикальной зоной.
В-клетки выходят из кровотока в богатую Т-клетка-ми периартериальную область и попадают в фолликул. Затем они проходят сквозь маргинальную зону и венозные синусы в области белой пульпы, откуда вновь возвращаются в циркуляцию (циркуляция В-лимфоци-тов; см. также с. 32 и 34).
Б. Структура лимфатического узла
Лимфатические узлы располагаются по ходу лимфатических сосудов. Они образуют сложную сеть, охватывающую кожу и внутренние органы. Также как селезенка, лимфатические узлы заключены в капсулу из коллагеновых волокон. Нормальные лимфатические узлы имеют округлую почковидную форму и диаметр 1-15 мм. Лимфатические сосуды проникают внутрь капсулы и образуют маргинальные (краевые) синусы в субкапсулярной зоне и промежуточные синусы в более глубоких зонах ближе к центру лимфоузла. В центре узла синусы сливаются, образуя центральные синусы медуллярного (мозгового) слоя. Лимфа покидает лимфатический узел через единственный эфферентный (выносящий) лимфатический сосуд, проходящий вдоль кровеносных сосудов.
Внешний корковый слой лимфоузла в основном состоит из В-лимфоцитов, а Т-лимфоциты сосредоточены в лежащей под ним паракортикальной зоне. При воздействии антигена несвязанные кластеры В-клеток в корковом слое [первичные фолликулы] образуют вторичные фолликулы, которые содержат зародышевые центры (центры размножения), состоящие из бластов
(центроцитов и центробластов), и мантийную зону, состоящую из мелких лимфоцитов.
В. Ассоциированная со слизистой оболочкой лимфоидная ткань (MALT)
Некапсулированные лимфоидные ткани с небольшими агрегатами из Т- и В-лимфоцитов, а также плазматических клеток (в основном типа IgA), локализованы в подслизистой ЖКТ, дыхательных путей, слезных желез и мочевыводящих путей.
В организме также имеются такие сложные структуры, как миндалины и пейеровы бляшки. Структура миндалин напоминает структуру лимфатического узла.
Пейеровы бляшки в терминальном отделе подвздошной кишки состоят из фолликулов с зародышевыми центрами и мантийными зонами. Большое количество антигенпрезентирующих клеток можно обнаружить в области между фолликулом и связанным с фолликулом эпителием кишечника (область «купола»). Эпителий купола характеризуется наличием так называемых микроскладчатых клеток (М-клеток), имеющих многочисленные микроскладки (не микроворсинки) на эпителиальной поверхности и специализирующихся на транспортировке антигенов. Апикальная поверхность этих клеток вместо обычного гликокалик-са содержит специфические олигосахариды. М-клетки могут захватывать лимфоциты и моноциты, которые способны поглощать антигены, даже находясь внутри М-клеток.
Т-лимфоциты в основном свободно распределены в межфолликулярной ткани: иногда они обнаруживаются и внутри эпителия. В процессе воспаления число эпителиальных лимфоцитов и плазматических клеток значительно возрастает.
18
Периферические органы
1. Анатомическое строение
2. Поперечный срез артериолы и фолликула; показаны пути циркуляции лимфоцитов
А. Структура селезенки
Фундаментальные принципы
Б. Структура лимфатического узла
М-клетки Ассоциированные
це с фолликулом
фолликула \ / эпителиальные
ж 3 клетки
Мантийная Область
зона \ «купола»
Т-клеточная зона
Посткапиллярная венула
I Эфферентный
Слизистая оболочка лимфатический сосуд
1. GALT (gut-associated lymphoid tissue): ассоциированная с пищеварительным каналом лимфоидная ткань
В. Ассоциированная со слизистой оболочкой лимфоидная ткань
Развитие и дифференцировка Т-лимфоцитов
Фундаментальные принципы
А. Созревание Т-клеток
Претимоциты являются предшественниками Т-лимфоцитов (Т-клеток) Они созревают в костном мозге и печени плода. В процессе эмбрионального развития тимус образуется из третьего глоточного кармана и поступающих клеток-предшественников. Глоточный карман формирует эпителиальный компонент, а клетки-предшественники — лимфатический компонент тимуса. Эпителиальные клетки тимуса вырабатывают гормоны, необходимые для развития претимоцитов В тимусе клетки-предшественники созревают до тимоцитов и в конце концов попадают в кровоток в виде зрелых Т-лимфоцитов.
Б. Фазы развития тимоцитов
Претимоциты развиваются в печени и костном мозге плода, где также происходит перестройка Т-клеточных рецепторов (TCR) и изменение генетической информации, необходимое для образования гамма-цепей. Клетки-предшественники характеризуются наличием фермента терминальной дезоксинуклеотидилтрансферазы (ТдТ). По мере проникновения в тимус эти клетки превращаются в ранние тимоциты, отличающиеся экспрессией поверхностных антигенов CD2 и CD7 (первая стадия дифференцировки Т-лимфоцитов). В тимусе также происходит транскрипция p-цепи Т-клеточного рецептора и перестройка у-цепи. Образующиеся клетки описаны как дважды отрицательные, поскольку они не несут антигенов CD4 и CD8.
На следующей стадии созревания (вторая стадия дифференцировки) общий тимоцит имеет характерные антигены CD1, а также поверхностные антигены CD4 и CD8 (дважды положительные). Экспрессия TCR на клеточной поверхности связана с образованием а- и (3-цепей. Также на поверхности клеток возникают молекулы антигенного комплекса СОЗ.
Наступает время завершающей стадии созревания Т-клеток (третья стадия дифференцировки). Антиген CD1 перестает вырабатываться, и Т-клетки образуют две популяции, несущие либо антиген CD4, либо CD8. Антиген CD4 характерен для популяции Т-хелперов (Тн-клеток), a CD8 — для популяции цитотоксических Т-клеток (Тс, CTL). Образующиеся клетки называют единожды положительными. Свыше 99% всех зрелых Т-лимфоцитов имеют на поверхности TCRa/p, а оставшаяся часть несет TCRy/d. Т-клеточные рецепторы различаются функционально по своей способности распознавать антигены.
В. Развитие зрелых Т-лимфоцитов
Начинающие циркулировать зрелые Т-лимфоциты подвергаются дальнейшей дифференцировке в кровотоке и лимфатической системе. Такие наивные Т-лимфоциты циркулируют до контакта с антигеном вне лимфоидных органов. Эти клетки несут поверхностный антиген CD45RA. Контакт с данным антигеном приводит к образованию Т-клеток памяти, характеризующихся наличием антигенов CD45R0 и CD29. Антиген CD45R0 является вариантом общего лейкоцитарного антигена (см. также с. 27) — фосфатазы клеточной поверхности. Антиген CD29 является рецептором фибронектина и играет важную роль в адгезии Т-клеток и их миграции в ткани.
20
Развитие Т-клеток
Претимоциты костного мозга и печени плода Тимоциты Зрелые Т-клетки
А. Созревание Т-клеток
s к Печень плода го Костный мозг * го Тимус
Клетка 1 3i п "О ф л о Раннии тимоцит CD2 4 CD7 (CD1) Общий тимоцит CD4 CD8 / TCR , CD3 CD1-^| — CD7 CD2 CD5 Зрелый тимоцит CD4 № TCR >rD2 ' CD3 CD5 CD7 -CD8 TCR * CD2 , , \ CD3 CD5 CD7
Перегруппировка TCRy и 1— Транскрипция TCRy, перегруппировка TCRP Экспрессия TCRy,а, р на поверхности клетки В основном экспрессируются TCRa.P
Фермент ТдТ О) ы го 2 ТдТ, CD2, CD7 (CD1) Двойные отрицательные ТдТ, CD1, CD2, CD3, CD5, CD4 и CD8 Двойные положительные Тн: CD2, CD5, CD7, CD3, CD4 Тс: CD2, CD5, CD7, CD3, CD8 Одинарные позитивы
Б. Фазы развития тимоцитов
CD3
CD8
•Цитотоксическая Т- клетка
CD2, 5, 7, TCRa,P
• CD3
CD4
CD45RA
CD2, 5,7, TCRa,p
Наивная Т-клетка
Тимус (см. Б)
Т-хелпер CD2, 5, 7, TCRa,p
CD3
• CD4 CD45RO CD29 CD2, 5,7, TCRa,P
Т-клетка памяти
Зрелые Т-клетки в крови и в лимфатической системе
В. Развитие зрелых Т-клеток
Фундаментальные принципы
Развитие и дифференцировка Т-лимфоцитов
Фундаментальные принципы
Созревание в тимусе обеспечивает способность большинства циркулирующих Т-лимфоцитов действовать согласованно с соответствующими генами главного комплекса гистосовместимости (МНС) иммунной системы организма и не воспринимать эндогенные вещества в качестве чужеродных.
А. Механизмы селекции Т-лимфоцитов
в тимусе
Проникая в тимус, претимоциты вступают в контакт с эпителиальными клетками тимуса; происходит развитие Т-клеточных рецепторов и их взаимодействие с молекулами МНС на эпителиальных клетках. В данном процессе может иметь место одно из следующих событий.
Тимоциты могут быть не способны связывать молекулы МНС посредством TCR (случай А). Однако это необходимо для разрушения инфицированных вирусом клеток, осуществляющих презентацию вирусного антигена Т-клеткам на соответствующих молекулах МНС. Если Т-клетка, являющаяся «партнером» инфицированной клетки, не в состоянии образовать необходимую связь, то она не сможет распознать антиген, и в результате инфицированная клетка не будет уничтожена. Такие «неправильно запрограммированные» Т-клетки оказываются бесполезными для иммунной системы и немедленно уничтожаются. Эта процедура выполняется не путем прямого уничтожения клеток, а в результате действия эндогенного механизма программированной клеточной смерти (апоптоза). Такие клетки не получают положительного спасительного сигнала, останавливающего программированную клеточную смерть (см. также с. 75).
Т-лимфоциты могут взаимодействовать с соответствующей молекулой МНС. В таком случае Т-клеточ-ный рецептор может связываться с эпителиальной клеткой тимуса посредством молекулы МНС, в результате чего Т-лимфоцит получает сигнал прекратить реализацию программы самоуничтожения и тем самым спасает свою жизнь. Такая клетка продолжает созревать и в конце концов начинает циркулировать в организме. Этот процесс контролируется другим защитным механизмом. Если связь между Т-клеточным рецептором и молекулой МНС слишком сильна, то может возникнуть цитотоксическая реакция собственных антигенпрезентирующих клеток организма. В подобном случае Т-клетка тоже будет уничтожена (случай В).
Возможна ситуация, при которой Т-клеточный рецептор и антиген МНС способны взаимодействовать, но рецептор узнает эндогенный антиген. Реакция таких «аутоиммунных» Т-клеток может в конце концов навредить организму. Однако такие клетки также выбраковываются, возможно, при участии дендритных клеток,
перемещающихся в тимус Дендритные клетки несут большинство из известных поверхностных аутоантигенов. Т-клетка, реагирующая с одним из этих аутоантигенов, не получит спасительного сигнала и будет уничтожена (случай С).
Только те клетки, которые узнают соответствующую молекулу МНС, образуют с ней умеренно прочную связь и не реагируют с аутоантигенами могут продолжить созревание и превратиться в полностью функциональные циркулирующие Т-лимфоциты (случай D).
В результате такого строгого отбора около 90% тимоцитов, попадающих в тимус, погибают. Кроме данного механизма существуют некоторые дополнительные способы защиты от аутоагрессивных Т-лимфоцитов, обеспечивающие дополнительную степень безопасности на тот случай, если аутоиммунные клетки не были уничтожены действием основного механизма отбора (см. также с. 67, Б).
22
Селекция Т-клеток
Фундаментальные принципы
23
Развитие и дифференцировка Т-лимфоцитов
Фундаментальные принципы
А. Семейства генов
Т-клеточных рецепторов
Наиболее часто экспрессируются гены а- и р-цепей TCR. Рецепторы TCRy/б встречаются на незрелых Т-клетках и на незначительном числе Т-клеток периферической крови. Гены а- и p-цепей локализованы на хромосоме 14, а гены 6- и у-цепей — на хромосоме 7. Как и в случае иммуноглобулинов, вариабельные области Т-клеточных рецепторов локализованы в разных экзонах, которые в конце концов сшиваются с константными областями рецепторов в результате сплайсинга. Этот механизм обеспечивает широчайшее многообразие рецепторов, которое еще более увеличивается за счет вариабельной селекции J-элементов (а- и p-цепи) и D-областей (р-цепи).
Б. Перестройка генов Т-клеточных рецепторов Рекомбинация, происходящая в момент формирования информации, необходимой для образования цепи Т-клеточного рецептора, приводит к перестройке генов — процессу, при котором некоторые элементы генов могут быть удалены или изменены путем несбалансированного хромосомного обмена. Процесс инверсии заключается в образовании петли, последующем расщеплении хромосомы и ее воссоздании в инвертированном виде. Другими словами, порядок транскрипции исходной генетической информации оказывается обращенным.
В. Конфигурация Т-клеточных рецепторов
Альфа-цепь Т-клеточного рецептора представляет собой гликопротеин массой 40-60 кДа, а бета-цепь имеет молекулярную массу 40-50 кДа. Как и цепи иммуноглобулинов, цепи Т-клеточных рецепторов имеют вариабельные (V) и константные (С) области. С-конце-вой участок V области p-цепи (связывающий области V и С) кодируется J и D генами. Вариабельные области а- и p-цепей состоят из 102-119 аминокислот и в том числе содержат два остатка цистеина, участвующих в образовании дисульфидных мостиков.
Константные области сх- и p-цепей состоят из 138-179 аминокислот и имеют четыре функциональных домена, которые в норме кодируются различными экзонами.
N-Концевой участок константной области содержит два остатка цистеина, образующих дисульфидные мостики внутри цепи, в результате чего третичная структура этого участка, по-видимому, соответствует структуре константной области молекулы иммуноглобулина. Трансмембранный домен состоит из 20-24 главным образом гидрофобных аминокислотных остатков.
В отличие от а- и p-цепей, у- и 6-цепи локализованы только на тех Т-лимфоцитах, которые экс
прессируют СОЗ, но не экспрессируют а/p рецепторы. Структура у- и 6-цепей аналогична структуре а- и p-цепей Аминокислотная последовательность у-цепи очень напоминает последовательность р-цепи, в свою очередь 6- и a-цепи также имеют сходные последовательности.
Г. Возможная вариабельность
Т-клеточных рецепторов
Как и в случае иммуноглобулинов, всевозможные комбинации V, D и J генов, а также другие механизмы создают огромное многообразие Т-клеточных рецепторов (их возможное число составляет 1015).
Д. Распределение Т-клеток, содержащих а/p и у/6-рецепторы
Подавляющее большинство зрелых Т-лимфоцитов в кровотоке (и по всей видимости в тканях) экспрессируют TCRcx/p, в их числе 66% CD4+ и 33% CD8+ Т-лимфоцитов (усредненные цифры). Клетки, экспрессирующие TCRot/p, редко являются дважды положительными или дважды отрицательными (см. с. 19. Б). Напротив, большинство клеток, экспрессирующих TCRy/б, являются дважды отрицательными, некоторые — дважды положительными, и лишь немногие экспрессируют CD4 антиген.
Функции клеток, экспрессирующих TCRy/б, до сих пор остаются неизвестными. Считается, что они играют важную роль в защите от микобактерий и в ответе на суперантигены.
24
Т-клеточные рецепторы
a, 6 (Хромосома 14)
Vai Va2 Van
V5n D5 J5 Q
V
Ja сегменты
б ос
P (Хромосома 7q)
vpi VP2 VP3
VP.
DP1
JP1 CP1 D02
СР2
Vpl4
у (Хромосома 7p)
Vy n/ZOVA V1.5 V14
Vyii Vy||| VyV Jp1 J Jt Cy]
Vi 1 3
V1.2
V1 6 V1 8 VA
V1.5P V1.7
Псевдоген
Vb Ч|
◄---(Транскрипция
в обратном направлении)
А. Семейства генов Т-клеточных рецепторов
Неравный хромосомный обмен
Делеция
Инверсия
Б. Перестройка генов Т-клеточных рецепторов
Внеклеточная область
Трансмембранная область
Цитоплазматическая область
<х(6)
• P(Y)
S
сно
а-цепь = V-J-C р-цепь = V-D-J-C 6-цепь = V-D-J-C у-цепь = V-J-C
В. Конфигурация Т-клеточного рецептора
Генные сегменты а-цепь р-цепь
V 100 100
D 0 2
J 100 13
VxDxJ-комбинации 104 2x103
N-концевые последовательности 104 104
Общее возможное число a/p-комбинаций Ю15 Г. Возможная вариабельность Т-клеточного рецептора (а/Р)
a/р у/8 Всего — г *' 95% 5%
Маркер: CD4+ CD8 66% <1% CD4- CD8+ 33% 25% CD4- CD8- <1% 70% CD4+ CD8+ <1% <12% Д. Распределение Т-клеток с a/р и у/З-рецепторами
Фундаментальные принципы
Развитие и дифференцировка Т-лимфоцитов
Фундаментальные принципы
Для развития, дифференцировки, активации Т-клеток и узнавания ими антигенов кроме Т-клеточных рецепторов необходимо участие многочисленных вспомогательных молекул, играющих важную роль в связывании Т-клеток с антигенпрезентирующими клетками. Некоторые из этих молекул, такие как СОЗ, существуют исключительно на клетках линии Т-лимфоцитов, в то время как другие встречаются на В-клетках и вспомогательных клетках. Такие молекулы можно распознать и проанализировать при помощи моноклональных антител. Этот метод не только значительно повысил уровень понимания функций лимфатической клетки, но и явился одним из наиболее перспективных достижений в иммунодиагностике. Именно этот метод используется для определения иммунного статуса и категорий злокачественных заболеваний лимфатической системы. В соответствии с принятыми международными правилами антигены, идентифицированные с помощью моноклональных антител, получали (и будут получать) номера соответствующих кластеров дифференцировки (CD).
А. Молекулы дифференцировки
Т-клеток человека
Антиген CD1 имеет пять изоформ (a, b, с, d и е) и экспрессируется на кортикальных тимоцитах и дендритных клетках. Молекулы CD1 по структуре напоминают антигены МНС класса I. Подобно антигенам МНС, они образуют комплексы с 02-микроглобули-ном. Считается, что антигены CD1 участвуют в презентации липидсодержащих антигенов Т-клетке. Презентация липидных антигенов микобактерий также осуществляется при участии CD1
Молекула CD2 служит рецептором антигена CD58 (лимфоцитассоциированного антигена 3 (LFA-3)). CD2 является важным фактором при альтернативной активации Т-лимфоцитов. Он является ранним Т-клеточ-ным маркером всех Т-лимфоцитов и естественных киллеров (НК-клеток).
Кластер СОЗ состоит из нескольких важных мембранных молекул, тесно связанных с Т-клеточными рецепторами. Эти молекулы, особенно их дзета- (ф и эта- (т|) цепи, необходимы для передачи сигнала после установления контакта с молекулой МНС. Молекулы МНС непосредственно отвечают за активацию Т-лимфоцитов (см. с. 27).
Молекула CD4 характерна для Т-хелперных клеток, кроме того она экспрессируется незрелыми тимоцитами, а также вспомогательными клетками и эозинофилами. Эта молекула играет важную роль в связывании молекул МНС класса II и взаимодействует с тирозинкиназой p56lck. Она также служит для связывания вируса иммунодефицита человека
(ВИЧ). Антиген CD4 соответствует молекуле CD8, состоящей из двух цепей и характерной для цитотоксических Т-клеток. CD8 также экспрессируется на незрелых тимоцитах и редко — на клетках-киллерах. CD8 отвечает за связывание молекул МНС класса I и взаимодействует с тирозинкиназой р56|ск.
Антигены CD5 и CD7 также характерны для Т-лим-фоцитов. CD5 участвует в передаче сигнала и в межклеточных взаимодействиях. Антиген CD7 является наиболее ранним Т-клеточным маркером; его способ действия до сих пор изучен слабо. Антиген CD5 экспрессируется на субпопуляции В-лимфоцитов.
Молекулы CD28 и CD152 (CTLA-4) взаимодействуют с молекулами CD80 и CD86 на антигенпрезентирующих клетках. Взаимодействие между CD28 и CD80/CD86 вызывает важный костимулирующий сигнал активации и пролиферации Т-клеток. С другой стороны, связывание CTLA-4 с этой молекулой является для Т-клеток негативным сигналом
26
Т-клеточные антигены
Молекула Мол. масса, кДа Хромосомный локус Экспрессия Функция
5 « х ( 1_/Р bW CD1a p2m b,c,d,e 43-49 1q22-23 Тимоциты, дендритные клетки, иногда В-клетки (CDIc) Презентация антигенов (гликолипидов)
осшшхххю О С} CD2 50 1р13 Тимоциты, все Т-клетки, НК-клетки Рецептор CD58 (LFA-1), активация Т-клеток
\jjKB у хюо .СJ 6 я 02002020000 Г /п йшватх Ь/ ч \_n oomoom А С j Ot(6) Р(у) J £ CD3/TCR CD3g25 CD3d20 CD3e20 £-цепь 16 rj-цепь 22 11q23 11q23 11q23 1q22 1q22 Созревающие тимоциты, Т-клетки Передача сигнала после контакта MHC/TCR
: | CD4 55 12p12 Тимоциты, Т-хелперы, моноциты/макрофаги, дендритные клетки, эозинофилы Связывание с молекулами МНС класса II
о с \jlomooom (^Г^С^Г") А , CD5 67 11q13 Тимоциты, все созревающие Т-клетки, иногда В-клетки Передача сигнала
CD7 40 17q25 Все клетки ряда Т-лимфоцитов Неизвестна
а гаи Р CD8 CD8a33 CD8p33 2p12 2p1 Тимоциты, цитотоксические Т-клетки, НК-клетки (слабо, CD8a) Связывание с молекулами МНС класса I
тгохшшхху-— CD154 (CD4OL) 33 Xq26.3-27.1 Активированные CD4+ Т-клетки, субпопуляция CD8+ Т-клеток, базофилы Связывание с CD40, активация В-клеток и дендритных клеток
< ° OOQOQODOOQQQ С\ О 0ОК ТО CD28 40 2q33 Тимоциты, субпопуляции CD4+ и CD8+ Т-клеток Лиганд CD80, CD86 (сигнал костимуляции)
Q 2 т(ШШюооОо Г Г CD152 (CTLA-4) 33 2q33 Активированные Т-клетки Лиганд CD80, CD86 (негативная регуляция Т-клеточной активации)
А. Молекулы дифференцировки Т-клеток человека
Фундаментальные принципы
Развитие и дифференцировка Т-лимфоцитов
Фундаментальные принципы
А. Активация Т-клеток и передача сигнала Антигенный пептид, связанный сайр молекулами МНС (см. с. 61), представляется специфической Т-клетке, которая прежде всего связывается с а- и [3-цепями с образованием тримолекулярного комплекса (см. с. 45). Эта связь стабилизируется молекулой CD4/CD8. В конечном итоге осуществляется передача сигнала, главным образом посредством и т] молекул комплекса СОЗ. В передаче сигнала с участием тирозинкиназы p56lck участвуют позитивные по CD4 и CD8 (a-цепь) клетки, однако антиген CD45 также играет чрезвычайно важную роль. Этот антиген существует в виде нескольких изомеров и обладает внутриклеточной тирозинфосфатазной активностью. Таким образом, появление фосфорилирующей активности является первым этапом активации Т-клеток после связывания лиганда и молекулы TCR. Этот процесс позволяет другим белкам со специфической способностью связывать тирозин взаимодействовать с фосфорилированными белками. Такие связывающие мотивы с консервативной структурой называют 8гс<омологичными-2-доменами (ЭН2-доменами), поскольку впервые они были идентифицированы в белке Src.
Фосфорилирование остатка тирозина в цитоплазматическом домене мембраносвязанного белка приводит к связыванию в этом участке ЭН2-содержащих белков. Кроме CD45, p59fyn и р56|ск, на этом этапе важную роль играют также дзета-ассоциированный белок (70 кДа) и его киназа (ZAP-киназа).
В процессе активации происходит стимуляция фосфолипазы С (ФПС) и фосфатидилинозитол фосфолипазы (ФИФ) и запускается каскад процессов, в конечном итоге приводящих к повышению концентрации инозитолтрифосфата (IP3) и диацилглицерина (ДАГ) в цитоплазме. Это в свою очередь вызывает значительное увеличение содержания кальция в клетке путем мобилизации внутриклеточных мембраносвязанных источников кальция. Приток ДАГ и кальция прежде всего активирует протеинкиназу С (ПКС), серин-треонин-фо-сфокиназу, а затем продукт протоонкогена Ras. На этой стадии инициируется специфический каскад передачи сигнала, приводящий к активации таких транскрипционных факторов как АР1 (см. ниже). В данном процессе также задействованы кальмодулин и кальциневрин.
Все перечисленные события в конечном итоге приводят к активации генов и регуляции транскрипции. Ключевым фактором активации Т-клеток является инициация транскрипции гена интерлейкина 2 (ИЛ-2). Решающую роль в данном процессе играет трансформация ядерного фактора активированных Т-клеток (NFAT) в активированную форму путем фосфорилирования Фактор NFAT переносится в ядро, связывается со спе
цифической премоторной областью гена ИЛ-2 и вместе с другим ядерным связывающим фактором (АР1 комплексом) начинает транскрипцию гена ИЛ-2 при участии РНК-полимеразы II.
Б. Активация Т-клеток: временная зависимость экспрессии гена
Следует различать процессы немедленной, ранней и поздней активации Т-клеток. Протоонкогены [c-fos и с-тус), ядерные связывающие белки (см. раздел А) и гены цитокинов последовательно вовлекаются в эти процессы. Повышение уровня экспрессии детерминант МНС (в некоторых клеточных системах) и адгезионных молекул происходит лишь несколько дней спустя.
28
Активация Т-клеток
АПК МНС
В 00000....7 -
а р (Ж? CD3 Ад
CD45 е У ар
£ ^(П) £ ?
Фундаментальные принципы
А. Активация Т-клеток: передача сигнала
Немедленная
Протоонкогены c-fos Ядерные связывающие белки NFAT-1 с-тус NFkB
Минуты 15 30
Ранняя
Цитокины у-ИНФТФР-р ИЛ-2 ИЛ-3 ИЛ-4 ИЛ-5 ИЛ-6 ГМ-КСФ
Рецепторы Активирующие агенты Ферменты, внутриклеточные белки Инсулин-R ИЛ-2R CD69 Орнитин-Д К Актин Трансферрин-R Циклин Трансферрин Гистоны
Часы 1 2 3 4 5 6 12 18 24 48
Поздняя
МНС Цитокины Адгезионные молекулы HLA-DR Rantes VLA-4 J VLA-1
| Дни ; 1 4 ( з ; 3 ю
Б. Активация Т-клеток: временная зависимость экспрессии генов
Развитие и дифференцировка Т-лимфоцитов
Фундаментальные принципы
А. Дифференцировка в клетки Тн1 и Тн2 Периферические Т-клетки могут дифференцировать в наивные Т-клетки и Т-клетки памяти (см. с. 21, В). Далее. после контакта с антигеном они образуют две различимые субпопуляции, называемые Тц1 и Тн2.
После первичного контакта с различными антигенами (бактериями, грибами, простейшими, цветочной пыльцой) большинство Тн-клеток (Т-хелперов) сталкиваются с элементами неспецифической иммунной системы, особенно макрофагами, естественными клетками-киллерами и тучными клетками. Установление подобного контакта и соответствующий ответ на антиген определяют генетическую восприимчивость (предрасположенность) хозяина, определяемую компонентами МНС, Т-клеточными рецепторами и другими еще не известными факторами.
Процессирование антигена неспецифическими защитными клетками формирует цитокиновое окружение, оказывающее решающее действие на дальнейший ход иммунного ответа. Интерлейкин 12, секретируемый макрофагами, также принимает активное участие в процессе. Последующая презентация антигена осуществляется специализированными антигенпрезентирующими клетками (главным образом, дендритными клетками). Важную роль здесь играет тримолекуляр-ный комплекс TCR-антигенный пептид-МНС, а также связь между молекулами В7-1 (CD80) и CD28. Благодаря доминирующему цитокиновому окружению и различным способам презентации антигена, исходные Т-хелперные клетки ТцО трансформируются либо в Тн1. либо в Тн2.
Клетки типа ТН1 в основном секретируют ИЛ-2, у-ИНФ, ФНО-р и ГМ-КСФ. Путем активации макрофагов они усиливают воспалительный процесс, что также способствует уничтожению внутриклеточных патогенов.
Клетки типа Тц2 в основном образуют ИЛ-4 и ИЛ-5 (а также ИЛ-3, ИЛ-6, ИЛ-7, ИЛ-8, ИЛ-9, ИЛ-10 и ИЛ-14) и стимулируют В-лимфоциты к образованию антител.
Было проведено экспериментальное исследование этого процесса при заражении мышей лейшманией. Различные линии мышей по-разному реагируют на попадание инфекции в зависимости от типа цитокинов. Цитокины, приводящие к образованию клеток Тц1, обеспечивают выживание лабораторных животных после контакта с патогеном, в то время как преимущественное накопление клеток типа Тн2 приводит к летальному исходу инфекционного заболевания.
Т-хелперные клетки каждого типа способны ингибировать активацию Т-хелперов другого типа, используя свои собственные цитокины. Так, у-ИНФ ингибирует клетки Тц2, а ИЛ-10 препятствует активации
макрофагов и приводит к заметной иммуносупрессии. С другой стороны, характерные цитокины оказывают позитивное, активирующее действие на «свою» субпопуляцию Т-хелперов. ИЛ-2, например, воздействует на клетки Тн1, а ИЛ-4 — на клетки Тн2. Однако следует подчеркнуть, что в защитной системе человека часто не происходит строгого разграничения между этими субпопуляциями. Напротив, между ними может наблюдаться плавный патоген-зависимый переход.
Б. Регуляция синтеза IgE
Клетки Тц2 играют важнейшую роль в регуляции синтеза IgE. Активация В-лимфоцитов протекает главным образом с участием системы 0040/лиганд 0040. При этом выделяются ИЛ-4, ИЛ-13 и(или) растворимые рецепторы ИЛ-4 (ИЛ-4Ш, также вносящие вклад в продукцию IgE ИЛ-4 способствует дифференцировке В-клеток в плазматические клетки, синтезирующие lgG1 и IgE, а ИЛ-13 индуцирует образование антител lgG4 и IgE.
В. Регуляторные Т-клетки
Регуляторные Т-клетки несут супрессорную функцию. Они представляют собой небольшую субпопуляцию С04+ Т-клеток, которые также экспрессируют 0025 даже без активации. Было показано, что С04+ 0025+ регуляторные Т-клетки отвечают за аутоиммунные реакции, поскольку их исчерпание приводит к развитию различных аутоиммунных заболеваний у мышей. Возможно, они также играют роль в нарушении иммунологического контроля у больных раком (см. с. 162).
30
Клетки Тн1 и Тн2
ТнО
Уничтожение внутри клетки
Макрофаг
у-ИНФ
ИЛ-2 у ИНФ ФНО-Р
Тн2
Антитело
ИЛ-4
В-клетка
Тн1
£ИНф
А. Дифференцировка клеток ТН1 и Тн2
Б. Регуляция образования IgE
Фундаментальные принципы
Развитие и дифференцировка В-лимфоцитов
Фундаментальные принципы
А. Развитие В-лимфоцитов
В-лимфоциты развиваются в костном мозге из плюрипотентных стволовых клеток в ответ на сигнал стромальных клеток (растворимые цитокины, межклеточный контакт].
Первыми распознаваемыми предшественниками В-клеток являются про-В-клетки, представляющие собой самовозобновляющиеся клетки, экспрессирующие антигены, свойственные стволовым клеткам (CD34 и CD117), а также антигены CD19 и CD22, специфичные для линии В-клеток (последний экспрессируется только в цитоплазме)
На следующей стадии развития В-клеток начинается синтез иммуноглобулинов. Тяжелая цепь иммуноглобулина IgM (ц-цепь) детектируется в цитоплазме пре-В-клеток. Клетки на следующей стадии дифференцировки называются «наивными В-клетками», поскольку они еще не встретили чужеродных антигенов. На поверхности наивных клеток экспрессируются полные молекулы иммуноглобулина М. Следующие этапы дифференцировки определяются антигенами. Незрелые В-клетки подлежат уничтожению (апоптозу), если их иммуноглобулины связаны с аутоантигенами, предварительно представленными им стромальными клетками костного мозга (клональная делеция/клональная анэргия). Другие клетки на этой стадии покидают костный мозг и перемещаются в Т-клеточно-богатые зоны периферических лимфоидных органов, где вновь происходит процесс селекции. Все В-клетки, не получившие от Т-клеток «спасительного» сигнала, подвергаются апоптозу. Оставшиеся В-клетки перемещаются в лимфатические фолликулы. На их поверхности экспрессируются IgD, а также антигены клеточной дифференцировки CD21, CD22, CD23 и CD37. Зти В-клетки постоянно циркулируют между костным мозгом и вторичными лимфоидными органами до тех пор, пока не встретят подходящий антиген. Обычно это происходит в Т-клеточно-богатой зоне лимфатического узла или в ассоциированной со слизистой лимфоидной ткани, где В-клетки превращаются в синтезирующие IgM плазматические клетки (первичный В-клеточный ответ). Образующиеся антитела IgM имеют относительно невысокое сродство к антигену. Для образования антител с «лучшими характеристиками» В-клетки проходят специальные стадии развития в лимфатических фолликулах (реакция в зародышевом центре; см. с. 34), где они встречаются с иммунными комплексами, связанными с фолликулярными дендритными клетками. Реакция в зародышевом центре позволяет В-клеткам перейти к синтезу антител других классов (переключение класса иммуноглобулинов) с более высокой аффинностью. Заключительный этап превращения В-клеток в плазматические клетки происходит в костном мозге или слизистой ЖКТ.
Некоторые стимулированные антигеном В-клетки перемещаются в маргинальную зону периферических лимфатических органов и превращаются в IgD-отрицательные, СО23-отрицательные и СОЗЭ-положитель-ные клетки (экстрафолликулярные В-клетки). В противоположность многим другим В-клеткам эти клетки могут также реагировать на углеводные антигены (Т-клеточно-зависимый ответ), но производят только низкоаффинный IgM.
Б. CD5+ В-клетки
Небольшая доля В-клеток отличается экспрессией антигена дифференцировки Т-клеток CD5 (1у1 антиген у мыши). Считается, что эти В-клетки (фракция В1+) принадлежат к субпопуляции, выделившейся из линии нормальных В-клеток на ранних этапах онтогенеза и заселяющей плевральные и перитонеальные полости. Однако существование данного типа клеток экспериментально подтверждено только у мышей. CD5+ В-клетки являются долгоживущими самовозобновляющимися клетками, секретирующими низкоаффинные полиреактивные аутоантитела класса IgM. Их дифференцировка в плевральной и перитонеальной полости может объяснить их аутореактивный характер (отсутствие клональной делеции, вызываемой контактом со стромальными клетками костного мозга).
32
Онтогенез В-клеток
CD38
CD117
CD22 CD10
Про-В-клетка
Про-В-клетка
Фолликул
Про-ПК
Подслизистая кишечника
Циркулирующая фолликулярная В-клетка
Апоптоз
Наивная В-клетка
CD34 CD19
Плазматическая клетка (ПК)
CD19 CD20 CD38
CD10
Про-ПК
Маргинальная зона
U Плазматическая клетка (ПК)
Антиге
Циркулирующая фолликулярна! В-клетка
-клеточная зона
Я
Экстра фолликулярная В-клетка
Фундаментальные принципы
Пре-В-клетка
Костный мозг: первичное образование В-клеток
Периферическая кровь Вторичные лимфатические органы: индуцированная антигеном пролиферация В-клеток
CD2° CD22
CD19
cyt-ц
Пре-В-клетка
CD20 CD21
CD19 / CD22
slgM
Наивная В-клетка
CD20 CD21 CD19 CD22
CD23 CD37
* Р-slgM slgD Циркулирующая фолликулярная В-клетка
CD20 CD21
CD19 CD22
-CD39
slgM
Экстра- CD11c фолликулярная В-клетка
А. Развитие В-лимфоцитов
slgM+
CD5+
Плевральная полость
Д)
CD45R
CD20
CD11a
Раннии онтогенез
slgM
Перитонеальная полость
Костный мозг
CD5+
CD5+ В-клетки
— Т-независимые
— секретируют низкоаффинные IgM-аутоантитела
— самовоспроизводящиеся
— без гипермутации
Б. CD5+ В-клетки
Развитие и дифференцировка В-лимфоцитов
Фундаментальные принципы
А. Активация В-клеток и реакция в зародышевом центре
Нестимулированные покоящиеся лимфатические фолликулы, такие как фолликулы лимфатических узлов плода, состоят из сети фолликулярных дендритных клеток (ФДК), находящихся в неплотном контакте с мелкими фолликулярными В-клетками, на поверхности которых экспрессируются молекулы IgM и IgD. После контакта с антигеном начинают образовываться вторичные фолликулы с выраженными зародышевыми центрами. Экспоненциальный рост числа В-клеток происходит в зародышевом центре фолликула только через 3-4 дня после контакта с антигеном. В-клетки сначала превращаются в крупные клетки с обильной цитоплазмой (первичные В-бласты) и мелкие «покоящиеся» клетки, расположенные по краям фолликула. Спустя несколько дней бласты концентрируются главным образом в более темной нижней части фолликула, где разветвляющиеся цитоплазматические отростки ФДК образуют тонкую неплотную сеть. Время удвоения бластов (цент-робластов) составляет около семи часов. Однако их число не увеличивается, поскольку они быстро превращаются в мелкие клетки с дольчатыми ядрами (центроциты] и покидают темную зону зародышевого центра. Затем центроциты формируют так называемую светлую зону, где окружаются плотной сетью, образованной дендритными клетками. Значительная часть центроцитов погибает в результате апоптоза, особенно на границе темной и светлой зон, где расположено множество макрофагов с фагоцитированными ядрами разрушенных клеток [окрашивающимися тельцами]. Реакция в зародышевом центре длится около трех недель. Спустя 2-3 месяца в центре «отработанного» фолликула можно обнаружить лишь единичные В-бласты (вторичные В-бласты).
Б. Образование антигенов
В-клетками в процессе реакции в зародышевом центре
Центробласты и центроциты характеризуются высоким уровнем экспрессии CD38. В отличие от фолликулярных и экстрафолликулярных В-клеток, они утеряли способность экспрессировать антигены CD23 и CD39. Кроме того, для центробластов также характерен высокий уровень экспрессии CD77.
В связи с тем, что в процессе «соматической гипермутации» в центробластах транскрипция генов иммуноглобулинов временно прекращается, центробласты являются lg-негативными. В центроцитах экспрессия иммуноглобулинов возобновляется, и поэтому они способны реагировать с антигенами, представляемыми ФДК. Центроциты могут вновь превра
титься в центробласты, но могут также превратиться в клетки памяти или плазмобласты, которые затем дифференцируют в плазматические клетки в костном мозге или в слизистой ЖКТ.
В. Селекция высокоаффинных антител в результате гипермутации в зародышевом центре
В центробластах с невероятно высокой скоростью происходят мутации генов иммуноглобулинов (соматическая гипермутация], необходимые для образования антител с различной аффинностью. Являясь центроцитами, центробласты перемещаются в светлую зону зародышевого центра. Прибыв туда, они могут спастись от апоптоза только при наличии прочной связи с антигенпрезентирующей дендритной клеткой. Следующий спасительный сигнал центроциты получают через CD4O от находящихся в светлой зоне Т-лимфоцитов, несущих лиганд CD40. Затем клетки мигрируют обратно в темную зону и начинают следующий цикл деления как центробласты. Сродство поверхностных иммуноглобулинов к антигенам может возрастать в результате точечных мутаций. Например, замена одной аминокислоты может в десять раз увеличить сродство иммуноглобулина. Этот механизм способствует селекции В-клеток, синтезирующих высокоаффинные, специфические к конкретному антигену антитела. Выживаемость В-клеток и синтез ими антител с определенным сродством и специфичностью определяется потребностью в таких антителах.
34
Реакции в зародышевом центре
Фаза 3 (месяцы)
Первичный лимфоидный фолликул
Мантия фолликула ГВторичные IВ-бласты
= Фолликулярные дендритные клетки (ФДК)
Центроциты ФДК Т-хелперы Макрофаги
Мантия ---у
фолликула
Первичные В-бласты j
Фаза 1 (3-4 дня)
Мантия — ч
фолликула ▼
Светлая
| Центробласты^ "'темная / зона
Фаза 2 (3 недели)
А. Активация В-клеток: реакция в зародышевом центре
Фолликулярная В-клетка - ► — Первичный В-бласт —► Центробла» т Центроцит
Антигены -CD19 -CD20 -CD21 -CD22 -CD23 -CD39 -CD40 -CD7 -slgM/D -CD19 -CD20 -CD22 -CD40 - slgM -CD19 -CD20 -CD22 -CD38 -CD77 -CD40 -slg± -CD10 -CD19 -CD20 -CD22 -CD37 -CD38 -CD40 - slgM/ZyG/E Циркулирующая клетка памяти 5 Плазм» Плазматическая клетка слизистой кишечника г Апоптоз облает Плазматическая клетка костного мозга
Б. Образование антигенов В-клетками в процессе реакции в зародышевом центре
Антиген-специфичная ФДК
Темная зона зародышевого центра
Повторяющиеся циклы
_____________________)
Светлая зона зародышевого центра
Пролиферация Точечные мутации в V-области H/L-цепей
Более высокоаффинные иммуноглобулины после гипермутации связываются с антигенпрезентирующей ФДК и выживают
AAC TG С
Т TGACG
ААС С G С
I I i i i
TTG G С G
Замена одной = 10-кратное увеличение аминокислоты “ аффинности
В. Селекция высокоаффинных антител в результате гипермутации в зародышевом центре
Фундаментальные принципы
35
Фундаментальные принципы
Развитие и дифференцировка В-лимфоцитов
А. Структура иммуноглобулинов
Иммуноглобулины, экспрессирующиеся на поверхности зрелых В-лимфоцитов, являются рецепторами В-клеточных антигенов. Рецепторы синтезируются окончательно дифференцированными В-клетками (плазматическими клетками) и секретируются в кровь как антитела. Иммуноглобулины представляют собой гликопротеины, состоящие из двух одинаковых тяжелых цепей (Н) и двух одинаковых легких цепей (L) с молекулярными массами 50-70 кДа и 25 кДа соответственно. Существует два типа легких цепей иммуноглобулинов: каппа (к) и лямбда (X).
Остатки цистеина формируют мостики между отдельными цепями молекулы иммуноглобулина. Фермент папаин гидролизует молекулу с образованием двух идентичных антиген-связывающих Fab-фрагментов и одного не связывающего антиген Fc-фрагмента (кристаллизующегося фрагмента). На Fc-фрагменте расположены участки связывания фрагмента комплемента С1 q (см. с. 68).
Легкие цепи состоят из двух протяженных областей почти равного размера. Константная область (С[) приблизительно одинакова во всех иммуноглобулинах. Напротив, аминокислотная последовательность вариабельной области (VL) чрезвычайно изменчива. Обе области состоят приблизительно из 110 аминокислот. Тяжелые цепи иммуноглобулинов состоят из одной вариабельной области (VH), содержащей около 110 аминокислот, и трех константных областей (Он), за исключением IgM и IgE, которые имеют по четыре константные области. Отдельные домены молекулы иммуноглобулина характеризуются сходной глобулярной структурой, образованной множеством p-слоев и дисульфидных мостиков
Б. Суперсемейство иммуноглобулинов
Наличие глобулярных доменов со сходной структурой является характерной чертой всех молекул иммунной системы, объединенных в суперсемейство иммуноглобулинов. К этому суперсемейству относятся иммуноглобулины, Т-клеточные рецепторы (TCR), молекулы главного комплекса гистосовместимости (МНС) класса I и класса II, большое число МНС-распознающих антигенов клеток-киллеров, молекулы, ответственные за межклеточные взаимодействия (например, антигены CD4, CD8, CD19 и CD22), молекулы адгезии (например, CD56), а также рецепторы полимерных иммуноглобулинов (поли-1д-рецепторы). Поли-1д-рецептор необходим для прохождения IgA и IgM сквозь эпителиальные клетки. В суперсемейство входят и другие многочисленные антигены, чьи функции на сегодняшний день еще не выяснены.
В. Антигенная специфичность определяется гипервариабельными областями
Вариабельные области тяжелых и легких цепей иммуноглобулинов содержат участки с особенно изменчивой аминокислотной последовательностью. Их называют гипервариабельными областями.
Гипервариабельные области состоят из 6-8 аминокислот около положений 30, 50 и 93 легкой цепи и около положений 32, 55 и 98 в тяжелой цепи. Они определяют специфичность связывания антител и называются областями, определяющими комплементар-ность к антигену (CDR) (см. разд. А). Замена единственной аминокислоты в этой области критическим образом сказывается на связывании определенного антигена.
Эффекторная функция иммуноглобулина определяется его константной областью. Иными словами, константная область определяет степень связывания комплемента, взаимодействие со специфическими рецепторами (Fc-рецепторами) различных клеток и перенос через плаценту.
Иммуноглобулины представляют собой белки, и их аминокислотная последовательность может быть иммуногенной для разных индивидов и разных видов, т. е. они могут действовать как антигены. Действительно, сами иммуноглобулины могут выступать в роли антигенов — они имеют изотипические, ал-лотипические и идиотипические детерминанты. Изотипические детерминанты ответственны за разницу между различными классами и подклассами иммуноглобулинов, а также между тяжелыми и легкими цепями. Аллотипические детерминанты определяют вариации константной области иммуноглобулинов одного изотипа, связанные с аллельными вариациями генов, обнаруженными у разных индивидов одного вида. Идиотипические детерминанты отвечают за вариабельность CDR-области определенной молекулы иммуноглобулина.
36
Иммуноглобулины
Варна- Константный
Домен
Участок связывания C1q
Связывание антигена
Эффекторная функция
связывания антигена
CDR = область, определяющая комплементарность Fab = антиген-связывающий фрагмент Fc = кристаллизующийся фрагмент
А. Структура иммуноглобулинов
VH = вариабельный домен тяжелой цепи
VL = вариабельный домен легкой цепи
Ch/l = константный домен тяжелой/легкой цепи
СС СС С СС ССС С С С С
IgR TCRI/II МНС МНС CD4 CD8 Поли-lgR CD19 CD22 N-CAM/ класса I класса II CD56
Фундаментальные принципы
Б. Суперсемейство иммуноглобулинов
Вариабельный домен легкой цепи с тремя гипервариабельными областями
В. Антигенная специфичность определяется гипервариабельными областями
Фундаментальные принципы
Развитие и дифференцировка В-лимфоцитов
А. Электрофорез белков
В электрическом поле белки сыворотки крови разделяются на фракции, содержащие альбумин, а>|-, сх2". |3- и у-глобулины. Иммуноглобулины IgG мигрируют во фракции у-глобулинов, тогда как другие иммуноглобулины, в частности IgM и IgD, имеют более слабую электрофоретическую подвижность и поэтому в основном обнаруживаются во фракции р-глобулинов и даже а?-глобулинов
Б. Различные типы иммуноглобулинов
Циркулирующие антитела образуются и секретируются плазматическими клетками в костном мозге, в ассоциированной со слизистой лимфоидной ткани и в лимфоузлах. Иммуноглобулин IgA преобладает в слюне, бронхиальных секретах и секретах мочевыводящих путей, слезной жидкости, молозиве и грудном молоке, где обеспечивает защиту от бактерий.
Иммуноглобулины экспрессируются также на поверхности зрелых В-лимфоцитов и служат рецепторами антигенов. Некоторые эндогенные иммуноглобулины связываются с другими клетками (гранулоцитами, тучными клетками, моноцитами/макрофагами, эпителиальными клетками) обычно с помощью Fc-pe-цепторов.
В. Структура и свойства иммуноглобулинов Основную часть сывороточных иммуноглобулинов составляют IgG, подразделяемые на четыре подкласса: lgG1, lgG2, lgG3 и lgG4. Они различаются своими у-це-пями, обозначаемыми индексами Y1“V4- Тяжелые цепи имеют одну вариабельную область и три константные области. Молекулярная масса IgG в целом составляет около 150 кДа. Масса легких цепей (212 аминокислот) — около 23 кДа, а тяжелых (450 аминокислот) — от 50 до 70 кДа в зависимости от подкласса. Наибольшей массой в данном классе иммуноглобулинов обладает lgG3, поскольку он содержит ряд дисульфидных мостиков в так называемой шарнирной области. Он особенно хорошо связывает комплемент. Все IgG существуют в виде мономеров.
Сывороточные IgA обычно также существуют в виде мономеров, но могут присутствовать в виде димеров (около 15%), а изредка — ив виде полимеров. Димерные молекулы IgA удерживаются за счет J-цепи. Существует два подкласса IgA — 1дА1 и lgA2 — различающиеся дисульфидными мостиками в шарнирной области. Молекулы IgA содержат много углеводных участков и не связывают комплемент.
Молекула IgM обычно существует в пентамерной форме (молекулярная масса около 900 кДа), изредка — в виде других полимерных комплексов и весьма редко — как мономер. Молекулы IgM представляют
собой классические поверхностные иммуноглобулины, связанные с клеточной мембраной зрелых В-лимфоцитов. Они имеют четыре консервативных домена. Пентамерные молекулы IgM, также как молекулы IgA, удерживаются с помощью J-цепей. Иммуноглобулин М имеет высокое сродство к комплементу.
Иммуноглобулин D, подобно IgM, является одним из наиболее распространенных мембранных иммуноглобулинов в В-клетках человека. Его функции в сыворотке не известны.
Свободный IgE обнаруживается в сыворотке лишь в очень незначительных количествах. Обычно он связан с базофилами и тучными клетками, а в случае аллергии — с эпителиальными клетками слизистой бронхов и желудочно-кишечного тракта. Иммуноглобулин Е играет важную роль в защите от паразитов и реакциях гиперчувствительности немедленного типа (см. с. 76).
Г. Транспорт IgG
сквозь кишечный эпителий
Новорожденные не обладают полной иммунокомпетентностью, поскольку синтез иммуноглобулинов начинается только в шестимесячном возрасте. Кроме материнских антител, присутствующих в крови новорожденного (IgG проникает сквозь плаценту), хорошим источником антител в первые месяцы жизни является грудное молоко. Молекулы IgG из грудного молока всасываются специализированными эпителиальными клетками кишечника ребенка и проникают в кровь благодаря градиенту pH.
Д. Секреция IgA
Секретируемые молекулы IgA существуют в виде димеров с дополнительным секреторным компонентом (около 70 кДа) Этот секреторный компонент содержит некоторую часть мембранного рецептора, связывающего IgA на внешней стороне эпителиальной клетки. Рецептор подвергается расщеплению и та часть, которая связана с IgA, высвобождается вместе с иммуноглобулином.
38
Классы иммуноглобулинов
Альбумин у Г рудное
Глобулины к / / , , молоко N 7^ 1 f ф.
Д «1 а2 р у \ z
Ы Р ИЙ и
® Wilw / *—< Fc-pe-
। «г<цепторы
Г I г 1. Циркули- 2. Мембране- 3. Секрети- 4 . Связанные
IgM IgD IgA IgG рующие lg связанные Ig руемые Ig с клеткой Ig
А. Электрофорез
иммуноглобулинов Б. Различные типы иммуноглобулинов
Л |дс Л Л lgG1 Ч 65% IgA Сывороточный мономерный IgA V IgM Сывороточный IgM IgD Сывороточный IgD й IgE L
lgG2 23% Г ss Шар- у нирная it область р Секретируемый димер IgA ' V Л । Л Мембраносвязанный IgM Мембраносвязанный IgD р
А lgG3 8% с । ф Д ZT Рй • •
А Зрелый В-лимфоцит Зрелый В-лимфоцит Базофил
lgG4 4%
Сывороточные 1д 80% 13% 6% 0.1% 0.002%
Время полураспада 23 6 5 3 2.5 дня
В. Структура и свойства иммуноглобулинов
Просвет FcyR /- Й3™е0 WWpA^^^AATpAAM^ Ce=f„"^ Прос.„ vmnuwy? t . 1 .
pH 7,4 v Высвобождение Г. Транспорт IgG при рН 7,4 сквозь кишечный эпителий и >^< - J-цепь Д. Секреция IgA
Фундаментальные принципы
Развитие и дифференцировка В-лимфоцитов
фундаментальные принципы
В организме человека может образовываться по меньшей мере 1011 различных антител. Зто многообразие в первую очередь обеспечивается большим числом генов, кодирующих вариабельные области иммуноглобулинов.
А. Организация и перегруппировка генов тяжелых цепей иммуноглобулинов
Гены, кодирующие тяжелые (Н) цепи иммуноглобулинов, расположены на хромосоме 14. При зародышевой организации генов иммуноглобулинов в незрелой клетке эти гены локализованы в четырех областях: вариабельной (V), отвечающей за разнообразие (DJ, соединительной (JJ и константной (С]. Около 50 функционально активных V-генов кодируют аминокислоты 1-95 в вариабельной области, 10-30 D-генов кодируют аминокислоты 96-101 в области, отвечающей за разнообразие, а шесть J-генов кодируют аминокислоты 102-110 в соединительной области. Кроме того, константная область тяжелой цепи кодируется девятью С-генами: ц для IgM, у1 для IgG 1, у2 для lgG2 и т.д. Перед каждым V-геном расположена лидирующая последовательность (L) В процессе созревания D-гены смыкаются с J-генами (D-J перегруппировка) в результате удаления разделяющей их ДНК. Молекула мРНК транскрибируется с DJ-последовательности и гена константной области (Си) молекулы IgM, в результате чего синтезируется белок-предшественник Ш-Си (см. с. 42). В ходе дальнейшего созревания последовательности V-генов перестраиваются таким образом, что V-гены и соответствующие L-последовательности смыкаются с перегруппированными DJ-генами (V-DJ перегруппировка). С этой последовательности транскрибируется мРНК VDJ-Сц и синтезируется белок VDJ-Сц. Отщепление L-последовательности приводит к образованию тяжелой ц-цепи иммуноглобулина. Если учесть наличие 50 V-генов, 10-30 D-генов и шести J-генов, то рекомбинационный потенциал составит от 3 • 103 до 9 • 103 аминокислотных последовательностей вариабельных областей тяжелых цепей Данный процесс получил название соматической рекомбинации.
Б. Организация генов легкой к-цепи
Гены легкой к-цепи расположены на хромосоме 2. Около 35-40 функционально активных V-генов (вместе с соответствующими L-генами) кодируют аминокислоты 1-95 вариабельной области легкой к-цепи, а пять J-генов кодируют аминокислоты 96-110. В результате перегруппировки ДНК V-гены смыкаются с J-генами и мРНК транскрибируется с образующейся ^-последовательности вместе с последовательностью, соответ
ствующей константной области легкой к-цепи (Ск). Затем из белка выщепляется L-последовательность Наличие 35-40 V-генов и пяти J-генов приводит к синтезу 175-200 различных последовательностей легкой к-цепи.
В. Организация генов легкой к-цепи
Организация генов легкой k-цепи на хромосоме 22 известна не полностью. Здесь расположен ряд генов константной области, и непосредственно перед ними расположены гены J-области. Предполагается, что число генов легкой k-цепи примерно равно числу генов к-цепи.
Каждая тяжелая цепь соединена либо с к-, либо с k-цепью, поэтому теоретически возможно существование от 5,2-Ю5 (175- 3 - 103) до 1,8-106 (200 • 9 • 103) различных антител с к-цепью. Расчет дает приблизительно такое же количество возможных иммуноглобулинов с k-цепью Однако реальное число молекул антител гораздо выше. Объяснить этот факт можно несколькими причинами: 1) мутациями ДНК в процессе онтогенеза; 2) ошибками в ходе делеций и рекомбинаций V, D и J-генов, в результате которых происходит транскрипция нуклеотидов, которые в норме не должны были бы считываться; 3) точечными мутациями при реакциях в зародышевом центре, приводящими к замене аминокислот и образованию иммуноглобулинов с более высоким сродством (см. с. 34).
Г. Переключение
класса иммуноглобулинов
В процессе иммунного ответа происходит синтез иммуноглобулинов разных классов. Прежде всего, зрелые В-клетки синтезируют IgM. С течением времени перегруппировавшиеся VDJ-последовательности смыкаются с другими С-генами константной области. Перед каждым С-геном расположена так называемая переключающая S-последовательность (от англ, switching), контролирующая процесс перегруппировки путем рекомбинации с другими S-последовательностями, обладающими высоким уровнем гомологии. В результате происходит делеция последовательностей Си, расположенных между VDJ-последовательностями и новыми С-генами.
40
Организация генов иммуноглобулинов
п = ~50 Хромосома 14
VH1 VH2 VH3 Vn X
Ц L2 L3 Ln Dt D2D3,D4 Dn J2 J3 J4 J5 Je Сц Q Cy3 Су, Са1 Cy4 Ce Ca2
DJ-перегруппировка Делеция Зародышевая организация ДНК
VH1 VH2 VH3 Vn
5’4ЫМНЖНННИЧН _«>*_ з-Li L2 L3 Ln D| b2b3Jfe J6 Gy Cg Cy3 Cyi Cal Cy2 Cy4 Ce Ca2
Делеция Транскрипция
VDJ-перегруппировка W* мРНК DJ-Сц—► Белок DJ-Сц
А. Организация и перегруппировка генов тяжелых цепей иммуноглобулинов
Фундаментальные принципы
п = ~35
VK1 VK2 VK3 VKn
МННОЧНЮ---------
L, 1г L3 L„
JK1 ^K2 -ta Jk4 -ta Ck
Хромосома 2
Б. Организация генов легкой к-цепи
VX1 VXx VXn
-НЧЧСИМ]-
L, Lx VpreB Ln
JX2CX2 JX4CX4 JXxCXx
Хромосома 22
В. Организация генов легкой Z-цепи
I
IgM -экспрессирующие В-клетки
I lgGI-экспрессирующие В-клетки
Г. Переключение класса иммуноглобулинов
Развитие и дифференцировка В-лимфоцитов
Фундаментальные принципы
А. Схема дифференцировки В-клеток
Стадии дифференцировки В-клеток можно определить с помощью антител, направленных против поверхностных антигенов. Наиболее ранними специфическими В-клеточными маркерами являются антигены CD19 и 0022. Сначала 0022 экспрессируется только в цитоплазме, но по мере созревания клетки он начинает экспрессироваться и на клеточной поверхности. Предшественники В-клеток также экспрессируют антигены, свойственные стволовым клеткам: 0034, CD117 (с-kit/рецептор фактора стволовых клеток) и СОЮ. Поскольку CD10 впервые был обнаружен в клетках пациентов, больных лейкозом, его называют общим антигеном, ассоциированным с острым лимфобластным лейкозом (CALLA). Зрелые циркулирующие клетки являются CD10-отрицательными, тем не менее, СОЮ экспрессируется на клетках зародышевого центра. Экспрессия CD20 начинается приблизительно на стадии пре-В-клеток.
Низкоаффинный Fc-lgE-рецептор (CD23) и CD21 являются маркерами зрелых В-клеток. CD21 также является рецептором вируса Эпштейна-Барр и СЗб-фраг-мента комплемента.
Б. Модуляция экспрессии иммуноглобулинов в процессе дифференцировки В-клеток
Иммуноглобулины экспрессируются на поверхности зрелых В-лимфоцитов и в больших количествах секретируются плазматическими клетками. Аминокислотные последовательности различных частей целой молекулы иммуноглобулина детектируются в клетках-предшественниках в ходе В-клеточного онтогенеза.
В предшественниках В-клеток все еще немодифи-цированная ДНК обнаруживается в локусах тяжелых и легких цепей в так называемой зародышевой организации. Кроме генов легкой Х-цепи, на хромосоме 22 также расположены два других гена (Vpre-B и Х5), которые кодируют белки, напоминающие легкую цепь иммуноглобулина (суррогатные легкие цепи). Суррогатные легкие цепи сначала экспрессируются на поверхности клетки вместе с гликопротеиновым комплексом с массой 130 кДа. Считается, что они связывают ассоциированные с клеткой и растворимые лиганды и передают внутрь клетки сигналы, необходимые для дальнейшего развития В-клеток.
В более дифференцированных поздних пре-В-клетках перегруппированные гены Он и Jh сосредоточены в Н локусе хромосомы 14. В процессе транскрипции мРНК DJ-Сц кодируется белок DJ-Сц (см. с. 40). Его появление служит негативным сигналом обратной связи для прекращения дальнейшего синтеза белков DJ-Сц. Цепи Vpre-B и Х5 могут связываться
как с гликопротеинами р130, так и с белками DJ-CM на клеточной мембране.
В пре-В-клетках уже произошла перегруппировка Vh-Dh-Jh и синтезируется белок VDJ-Сц, соответствующий полной ^-цепи. Эта тяжелая цепь (Ни) экспрессируется на клеточной мембране вместе с суррогатной легкой цепью Vpre-B/X5, что служит сигналом начала перегруппировки в легкой цепи. В незрелых В-клетках наблюдается экспрессия тяжелой ^i-цепи в сочетании с суррогатными цепями Vpre-B/X5 (Hp/Vpre-B) и с нормальными к- или Х-цепями (образуются полные молекулы иммуноглобулинов IgM/к [Hp/Lp] или IgM/X 1Нр/1и1). Если перегруппировка в локусе легкой цепи прошла успешно и легкая цепь синтезируется, то дальнейшая перегруппировка в L-локусах будет прекращена. Если в клетке продуктивная перегруппировка произошла, например, в локусе к, то перегруппировка в локусе X будет подавлена, и наоборот. Однако перестройка в локусе X по-прежнему возможна, если прекратилась перегруппировка в локусе к. Данный механизм обеспечивает образование В-клеткой только одного типа легкой цепи [рестрикция легкой цепи).
42
Экспрессия генов иммуноглобулинов
HLA класса II
Ранние Поздние m
про-В про-В пРеВ
Незрелые
Зрелые Плазматические
I
CD34 I........=□
CD10 На поверхности
Ig-a/lg-P
На поверхности VpreB/X5 I..........'......'....................... । . ,
cyt-ц slgM/slgD
Иммуноглобулины CD22 I.............................:................... ' '
CD19 I ' ---------------- -----------
CD20
CD21
CD23 I I
А. Схема дифференцировки В-клеток в цитоплазме
Транскрипция
Фундаментальные принципы
Х/^ь-перегруппировка
Ни/!_к (slgM)
Незрелые В-клетки
CD19
CD22cyt
CD10
{ШИ-
— или
ЛГЦТЦ1-ииши
Hg/Lx(slgM)
Нц/\/ргеВ/Х5
Б. Модуляция экспрессии иммуноглобулинов в процессе дифференцировки В-клеток
Зрелые slgM+ В-клетки
Развитие и дифференцировка В-лимфоцитов
Фундаментальные принципы
Связывание антигена с поверхностными иммуноглобулинами запускает каскад биохимических сигналов в В-клетке. Поскольку иммуноглобулины имеют очень короткий цитоплазматический хвост, они зависят от вспомогательных молекул, сходных с комплексом СОЗ Т-клеточного рецептора. Данную функцию берут на себя цепи lg-а (0079а) и lg-(3 (0079b). Эти цепи по структуре напоминают у-, б- и е-цепи TOR и вместе с иммуноглобулинами образуют комплекс В-клеточного рецептора (BCR).
СОЮ называют общим антигеном, ассоциированным с острым лимфобластным лейкозом (общий антиген ОЛП, или CALLA), поскольку он впервые был обнаружен на лимфобластах пациентов с общим вариантом острого лимфобластного лейкоза. СОЮ представляет собой внеклеточную цинк-связывающую металлопротеиназу, способную катализировать расщепление самых разных пептидов, таких как вещество Р, эндотелии, окситоцин, брадикинин, ангиотензины I и II. Он экспрессируется на стромальных клетках, незрелых Т- и В-клет-ках в костном мозге, а также на клетках зародышевого центра во вторичных лимфоидных органах.
CD19 экспрессируется на мембранах всех В-лимфоцитов, в связи с чем является маркером всей серии В-клеток. СОЮ вместе с 0021, CD81 и Leu-13 образует корецептор, модулирующий сигналы, передаваемые комплексом BCR. Это особенно важно для незрелых В-клеток.
CD20 является «пан-маркером» В-клеток, экспрессирующимся на всех В-клетках за исключением предшественников В-клеток, и по структуре напоминает ионный канал. Его трансмембранный участок пересекает клеточную мембрану четыре раза и, по всей видимости, связан с цитоскелетом.
CD21 является низкоаффинным рецептором для продуктов расщепления комплемента — iC3b и 03d. Он также служит рецептором вируса Эпштейна-Барр. Молекулы 0021, СОЮ, CD81 и Leu-13 функционально связаны с В-клеточным рецептором.
Для CD22, подобно СОЗ на Т-клетках, характерно два варианта экспрессии: CD22 экспрессируется на клеточной мембране только зрелых В-клеток, но обнаруживается в цитоплазме всех В-клеток. Он действует как молекула адгезии, взаимодействующая с сиалиро-ванными гликопротеинами. Связывание CD22 модулирует передачу сигнала BCR-комплексом, приводя к ингибирующему эффекту.
CD23 является В-клеточно-ассоциированным рецептором Fc-фрагмента IgE. Связывание CD23 с IgE или с IgE-содержащими иммунными комплексами дает сигнал обратной связи, вызывающий ингибирование синтеза IgE. Продуктом расщепления CD23 является аутокринный/паракринный фактор роста В-клеток.
CD4O в основном экспрессируется В-клетками, но также дендритными клетками (ДК), фолликулярными дендритными клетками (ФДК), гемопоэтическими клетками-предшественниками, эпителиальными и опухолевыми клетками. Молекула CD40 является членом семейства рецепторов ФИО. Связанный с ФИО гликопротеин, в основном экспрессирующийся на активированных 004^ Т-клетках (лиганд CD40, CD154), обеспечивает важный сигнал для выживания В-клеток. При нарушении взаимодействия CD40 с лигандом CD40 зародышевые центры не могут полноценно развиваться. В результате блокировки переключения класса иммуноглобулина единственным иммуноглобулином, синтезируемым В-клеткой, является IgM (синдром гипериммуноглобулина М).
CD72 подобно CD23 является членом семейства асиалогликопротеиновых рецепторов. Как и CD19, он является маркером всех В-клеток, но его функции еще до конца не ясны. Гипотеза о том, что CD72 является лигандом CD5, пока не подтвердилась.
CD80 и CD86 не являются специфичными для В-клеток. Они экспрессируются на других антигенпрезентирующих клетках, например, моноцитах и дендритных клетках. Взаимодействие CD80/CD86 с их лигандами на Т-клетках (0028 и CTLA-4) играет решающую роль для полной активации или инактивации Т-клеток (см. с. 46).
44
Важные В-клеточные антигены
Молекула Мол. масса, кДа Хромосомный локус Экспрессия Функция
- sig СЭ О О 150-900 14 (Н-цепи) 2(к-цепь) 22 (Х-цепь) Зрелые В-клетки Антигенсвязывающий участок BCR
,jvl *ГЕ lg-«(CD79a) 34 19q132 Пре-В-клетки. slg-ассоциированные
lg-P(CD79b) 39 17q23 зрелые В-клетки молекулы, передающий сигнал участок BCR
Ai.< I AMW z X CDIO(CALLA) 100 3q21-q27 Пре-В-клетки, В-клетки зародышевого центра, гранулоциты Нейтральная эндопептидаза
ц. Т-Л-, r 8 U; ° CD19 95 16р11 2 Все В-клетки, включая про-В Вместе с CD21-, CD81-, Leu-13 служит корецептором BCR
Ц ri ° £ ° | CD20 35-37 11q—q13 Пре-В-клетки, зрелые В-клетки Субъединица ионного канала
Q h CD21 140 1q32 Зрелые В-клетки, ФДК C3d/EBV-рецептор (CR2) связь с BCR, передача сигнала
HOOD c )C~ . '~'QC кг- ХЯ T n r S c NJ 135 19q13.1 Все В-клетки (в цитоплазме), зрелые В-клетки (на поверхности) В-клеточная молекула адгезии (В-В и В-Т взаимодействия), модулятор BCR
z J II CD23 45 19q13.1 Зрелые В-клетки, ФДК, активированные моноциты, эозинофилы Низкоаффинный Fee-рецептор (FceRII), продукт расщепления = В-клеточный фактор роста
n о CD40 48 20q12-q13.2 Пре-В-клетки, зрелые В-клетки, ДК Взаимодействие с CD40L (на Т-клетках), антиапоптотический сигнал
z_li z\_ ZE CD72 43-39 9p Все клетки В-клеточной линии, макрофаги Молекула адгезии
9" 8 Г, - _nr> о x „ n CD80/86 60 3q21 В-клетки, активированные моноциты, ДК Взаимодействие Т /АПК (лиганды CD28/CTLA-4)
А. Важные В-клеточные антигены
Фундаментальные принципы
45
Межклеточные взаимодействия
Фундаментальные принципы
А. Молекулы, участвующие во взаимодействии Т-клеток с антигенпрезентирующими клетками
Некоторые молекулы адгезии и вспомогательные молекулы способствуют взаимодействию Т-клеток с антигенпрезентирующими клетками (АПК), такими как 8-клетки, дендритные клетки (ДК) и моноциты.
Повсеместно распространенный лимфоцитассоции-рованный антиген 1 (LFA-1) связывается с молекулой межклеточной адгезии 1 (ICAM-1). CD2 связывается с гликопротеином LFA-3, который в основном экспрессируется на эндотелиальных клетках, эпителиальных клетках и клетках соединительной ткани. Взаимодействие CD40 с лигандом CD40 служит спасительным сигналом для В-клеток зародышевого центра и провоцирует созревание ДК и синтез ими больших количеств ИЛ-12. Адгезия В- и Т-клеток еще больше стабилизируется за счет взаимодействия антигена CD106, иначе называемого молекулой адгезии сосудистых клеток 1 (VCAM-1), который также экспрессируется на эндотелиальных клетках, с антигеном CD49d. иначе называемым очень поздним антигеном 4 (VLA-4), на активированных Т-клетках. Взаимодействие Т-клеточной молекулы CD28 с CD80/CD86 на АПК оказывает стимулирующий эффект, в то время как взаимодействие CD152, иначе называемого антигеном цитотоксических Т-лимфоцитов 4 (CTLA-4), с теми же антигенами оказывает ингибирующее действие.
Б. Для активации Т-клеток требуется несколько сигналов
Узнавание антигена Т-клеточным рецептором обеспечивает первый сигнал активации Т-клеток, но его недостаточно для достижения полной активации. Без следующего сигнала клетки остаются толерантными или энергичными. Второй сигнал подается при взаимодействии антигена CD28, конститутивно экспрессирующегося на покоящихся Т-клетках, с костимуля-торной молекулой В7.1 (CD80) или В7.2 (CD86) на АПК. Наличие двух активирующих сигналов обеспечивает надежную регуляцию антигена CTLA-4 (CD152) в Т-клетках в течение 24-48 ч. Антиген CTLA-4 является наиболее высокоаффинным рецептором для CD80/CD86; он конкурирует с CD28 и ингибирует развитие клеточного цикла. Этот негативный сигнал, подаваемый CTLA-4, возможно, служит для прекращения активации Т-клеток с целью предотвращения слишком сильного иммунного ответа. Еще один ингибирующий рецептор является продуктом гена программируемой клеточной гибели 1 (programmed death-1, PD-1); он может взаимодействовать с двумя членами семейства В7: PD-L1 (B7-HI) и PD-L2 (B7-DC).
В ответ на взаимодействие CD40 с CD40L терминально дифференцированные ДК могут производить большое количество ИЛ-12, индуцируя выработку у-ИНФ и превращение CD4^ клеток в клетки типа Тц1. Интерлейкин 12, кроме того, является прямым и мощным стимулятором цитотоксических Т-лимфоцитов (ЦТЛ) и естественных клеток-киллеров. Гамма-ИНФ способствует антимикробной и провоспалительной активности макрофагов и усиливает активацию ЦТЛ.
В. Роль ICOS в активации Т-клеток
В отличие от CD28, гомологичный ему индуцибель-ный Т-клеточный костимулятор ICOS не экспрессируется конститутивно на покоящихся Т-клетках, но только после активации с участием TCR/СОЗ-комплекса. Привлечение ICOS, так же как и CD28, может опосредовать мощную костимуляцию Т-клеток и способствовать их пролиферации. Последние исследования показывают, что стимуляция с помощью ICOS может индуцировать дифференцировку и Тц1 и Тн2. ICOS взаимодействует со своим лигандом ICOSL, также известным как B7h, B7RP-1 и В7-Н2. Лиганд ICOS конститутивно экспрессируется на В-клетках, дендритных клетках, макрофагах и эндотелиальных клетках; ФНО-а или воспалительные стимулы способствуют повышению уровня его экспрессии.
Г. Стимуляция суперантигенами
Суперантигены в основном представляют собой продукты метаболизма бактерий (например, энтеротоксины стафилококка) или вирусные белки, вызывающие неспецифическую активацию Т-клеток. Ответ Т-клеток на суперантигены не является клональным — активируется большое количество разных Т-лимфоцитов. В то время как высокоспецифичное взаимодействие процессированного пептида, находящегося в комплексе МНС с а- и p-цепью TCR, является обязательным при антиген-специфичной активации Т-клеток, суперантигены не подвергаются внутриклеточному процессингу. Они в виде целых белковых молекул связываются с внешней стороной Vp-области некоторых TCR. Число Т-клеток, взаимодействующих с суперантигеном, приблизительно в 100 раз превосходит число Т-клеток, взаимодействующих с обычным антигеном Некоторые суперантигены вызывают активацию 10% Т-клеток периферической крови. При активации суперантигеном С04+ Т-клетки выделяют большое количество цитокинов, способных оказать токсическое действие на организм хозяина
46
Взаимодействия между Т-клетками и антигенпрезентирующими клетками
CD11a/18 (LFA-1) CD2 CD3 S 8 TCR CD4 или CD8 ' ICOS CD28/CTLA-4 CD40LF 1 1 £ II & ! -Жн!- /CD54 Ц1САМ-1) CD58 a: (LFA-3) 5 (X 05 MHC £ (класса I g- или II) J 8: II B7h/IC0SL CD80/CD86 < (B7.1/B7.2) >|CD40
1 ( J 1 1 ив
CD40 CD54 I CD58 05 Ф 5 МНС m (класса I II или II) EZ < IC0SL/B7h CD80/CD86 (В7.1/В7.2) CD106 (VCAM) —L pz ЯР- III * _!l CD40L CD11a/18 CD2 CD4 или CD8 “I ]TCR S CD3 ICOS CD28/CTLA-4 CD49d
А. Молекулы, участвующие во взаимодействии Т-клеток с АПК
АПК
Не АПК
wvwuir
МНС I
Анергия/Толерантность
1. Только первый сигнал
АПК
Активация Т-клеток
2. Костимуляция через CD28
CD80/ 1
CD86I
CD28
Повышение уровня экспрессии CD152/CTLA-4
АПК
CD80/ I 1 CD80/
CD86 I I CD86
CD28 ч . f CD152
V/ 1
3. Самоограничение/снижение экспрессии
Б. Для активации Т-клеток требуется несколько сигналов
Повышение уровня экспрессии CD154/CD40L
4. Активация эффекторных клеток
CD28 TCR
АПК
CCD86 I МНС 11
LDob Д
Повышение экспрессии ICOS
В. Роль ICOS в активации Т-клеток
Г. Стимуляция суперантигенами
Фундаментальные принципы
Неспецифические защитные клетки
Фундаментальные принципы
Естественные клетки-киллеры (НК-клетки) составляют приблизительно до 10% всех лимфоцитов крови. В них не происходит перегруппировки генов, кодирующих рецепторы антигенов, как в Т- и В-лимфоцитах. Клетки-киллеры не атакуют клетки с нормальным уровнем экспрессии молекул МНС класса I, но убивают клетки с посторонними МНС, а также те. у которых снижена или отсутствует экспрессия МНС класса I. Это часто наблюдается при вирусной инфекции и раке. НК-клетки в периферической крови можно идентифицировать как крупные лимфоциты с азурофильными (красного цвета) гранулами (большие гранулярные лимфоциты).
А. Развитие клеток-киллеров
Общие предшественники НК- и Т-клеток, экспрессирующие CD7, CD2 и иногда CD5, обнаруживаются в костном мозге, печени плода и в тимусе. Интерлейкин 15, в большом количестве синтезируемый стромальными клетками костного мозга, чрезвычайно важен для дифференцировки НК-клеток; ИЛ-2 и ИЛ-8 способствуют их дальнейшему созреванию.
Типичными маркерами клеток-киллеров являются низкоаффинный рецептор Fc-фрагмента IgG (CD16) и молекула адгезии CD56.
Б. Узнавание мишени клетками-киллерами Большинство активирующих и ингибирующих рецепторов клеток-киллеров кодируется генами хромосомы 19. Активирующие рецепторы, например, NKp46, NKp30 и NKp44 (natural cytotoxicity receptor, NCR) позволяют НК-клетке состыковаться с клеткой-мишенью. Эти молекулы относятся к суперсемейству иммуноглобулинов и характеризуются наличием короткого цитоплазматического хвоста. Поэтому для активации клеток-киллеров им необходимо дополнительно связаться с такими полипептидами, как ^-цепь, FceRly или DAP12. Лиганды этих молекул до сих пор не известны. Четвертым запускающим активацию рецептором является NKG2D, пектиновый гомодимер С-типа, связывающийся с полипептидом DAP10 Рецептор NKG2D взаимодействует с белками MICA и MICB, родственными молекулам МНС класса I, которые обычно слабо экспрессируются на нормальных клетках, но в стрессированных и опухолевых клетках уровень их экспрессии повышается. Эти белки похожи на классические молекулы МНС класса I, но они не связывают пептиды и не ассоциируют с Р2-микроглобулином.
В. Ингибирующие рецепторы НК-клеток
В распознавании классических молекул МНС задействовано множество рецепторов. В отличие от рецепторов антиген-специфичных Т-клеток, эти рецепторы обычно распознают целую группу различных аллелей
HLA класса I, но не комплекс пептид/МНС. Данные рецепторы можно сгруппировать в два больших семейства: lg-подобные рецепторы KIR и lg-подобные транскрипты ILT (также известны как lg-подобные рецепторы лейкоцитов LIR). Рецепторы KIR экспрессируются только на клетках-киллерах и субпопуляции Т-клеток, а рецепторы ILT (LIR) также экспрессируются на моноцитах, дендритных клетках и В-клетках. Эти рецепторы могут способствовать как активации, так и ингибированию, что определяется в основном структурой их цитоплазматического хвоста В большинстве случаев длинный цитоплазматический хвост указывает на наличие рецепторного богатого тирозином ингибирующего мотива ITIM. Мотив ITIM запускает действие специфической фосфатазы, которая блокирует в клетке передачу сигнала от активирующих рецепторов. Рецепторы с коротким цитоплазматическим хвостом не имеют мотива ITIM и для передачи сигнала активации связываются с полипептидами типа адаптерных молекул DAP12 или FcyR, содержащими рецепторный богатый тирозином активйрующий мотив НАМ. Известно больше дюжины различных рецепторов, относящихся к семействам LIR и KIR. Третий класс НК-клеточных рецепторов относится к семейству лектиноподобных рецепторов С-типа (например, упоминавшийся ранее активирующий NKG2D-peuenTop). Хотя большинство рецепторов клеток-киллеров существует как в виде активирующих, так и в виде ингибирующих изоформ, по всей видимости сигналы ингибирования, посылаемые ITIM-содержащими рецепторами, значительно сильнее активирующих сигналов. Некоторые ингибирующие молекулы и соответствующие им лиганды показаны на рисунке В.
Г. Механизм цитотоксического действия клеток-киллеров
Секреции клетками-киллерами литических ферментов не происходит, если клетка-мишень имеет рецепторы апоптоза типа антигена CD95 (другое название Fas или АРО-1) (И), запускающего механизм «самоубийства» клетки, называемый программированной клеточной смертью, или апоптозом (см. с. 84).
Наиболее распространенным механизмом лизиса под действием клеток-киллеров является выделение литических гранул (Г2). Эти гранулы содержат перфорин (белок, создающий поры в мембране клетки-хозяина) и гран-зимы (набор различных протеиназ). В присутствии перфорина гранзим В достигает клеточного ядра, где активирует каспазы (белки, способствующие апоптозу) и индуцирует гибель клетки. Клетки-киллеры могут уничтожать клетки, покрытые антителами. Связывание антител с Fc-рецептором на НК-клетке (CD16) активирует программу антителозависимой клеточной цитотоксичности, индуцируя выделение протеолитических ферментов (ГЗ).
Естественные клетки-киллеры
Тимус
Перегруппировка TCR
Т-клетка- CD34+ предшественник CD33-CD2+ CD7+ -CD5+ CD1+ CytCD3+
Дальнейшее развитие Т-клетки
CD34
1 CD33
ИЛ-7
Т /НК-предшественник
Костный мозг
I CD2+/- \
CD5+/- ил_5
CytCD3
Печень плода
CD7 НК-предшественник
CD34-CD33-CD7+ CD2+/-CD5-CD1" CD16-CD56-
Зрелая НК-клетка CD34-CD7+ CD2+/-CD5-CD1-CD16+/’ CD56+
А. Развитие клеток-киллеров
Б. Узнавание мишени клетками-киллерами
НК-клетка
Клетка-мишень
АРО-1/ Fas-
CD95 лиганд
NKR-P1
Апоптоз
Фрагментация ДНК
1. Несекреторный лизис
Клетка- Образование пор Дегрануляция мишень <Гранзимы • е / * >Перфоринв®
>
Фрагментация ДНК
Апоптоз + некроз
2. Секреторный лизис
Клетка-мишени
Фрагментация ДНК
Перфорин • Гранзим^
АЬ против Ад-мишени
Апоптоз + некроз
НК-клетка
Fc-рецептор
3. Антителозависимая клеточная цитотоксичность
Г. Механизмы цитотоксического действия клеток-киллеров
Фундаментальные принципы
Фундаментальные принципы
Моноциты и дендритные клетки
А. Фагоцитирующие клетки
Гранулоциты, моноциты и дендритные клетки (ДК) обладают способностью к фагоцитозу («фаго» от греч. есть). Все эти клетки происходят от кроветворных клеток-предшественников: колониестимулирующий фактор гранулоцитов (Г-КСФ) способствует дифференцировке клеток в гранулоциты, а колониестимулирующий фактор гранулоцитов/макрофагов (ГМ-КСФ), ИЛ-4 и фактор некроза опухолей а (ФНО-а) способствуют дифференцировке моноцитов и ДК. В норме циркулирующие в крови моноциты неизбежно превращаются в тканевые фагоциты (время полужизни моноцитов в крови всего несколько часов) Макрофаги продолжают существовать в тканях до конца своей жизни (до нескольких лет). Моноциты являются более крупными клетками, чем лимфоциты. Они имеют подковообразное или странной формы ядро, окруженное широкой полосой цитоплазмы с гранулами, содержащими ферменты (пероксидазу и гидролазы). ДК представляют собой крупные, подвижные клетки с длинными цитоплазматическими выростами (некоторые превышают 10 мкм). ДК редко обнаруживаются в крови. Их предки мигрируют в кожу, где образуют эпидермальные клетки Лангерганса и дермальные ДК, или в лимфатические узлы, где дают начало интердигитальным дендритным клеткам (ИДК) в Т-клеточной зоне и дендритным клеткам зародышевого центра (ДКЗЦ). Другая линия ДК, называемых лимфоидными ДК или ДК второго типа, образуются из клеток-предшественников под действием ИЛ-3 и цитокина FH3L. Они локализуются в паракортикальной зоне лимфатического узла. Предполагается, что они составляют популяцию ДК тимуса.
Б. Механизмы эндоцитоза
Захват мелких частиц жидкости (пиноцитоз, от греч. pinein — пить) начинается с образования углублений в мембране, осуществляемого при участии белкового комплекса, называемого клатрином. Покрытые клатрином частицы или частицы в покрытых клатрином ямках сливаются с лизосомами, где происходит разрушение антигенов. В случае макропино-цитоза клетка может проглатывать крупные капли размером до 0,5 мкм. Затем вода выталкивается сквозь каналы, называемые аквапоринами. Для образования более крупных фагоцитирующих частиц требуется полимеризация цитоскелетного белка актина. Клетки Лангерганса в коже для фагоцитоза используют гранулы Бирбека (мелкие частицы в форме теннисных ракеток). Некоторые бактерии (например, Legionella pneumophilia) интернализуются путем «спирального» фагоцитоза, при котором выросты цитоплазмы, называемые псевдоподиями, за
кручиваются вокруг бактерии, образуя «спиралевидную» фагосому Затем мембраны псевдоподий сливаются, и патоген оказывается внутри цитоплазмы
В. Fc-опосредованный фагоцитоз
Некоторые рецепторы могут связывать Fc-фраг-мент иммуноглобулинов (см. с. 53). Рецепторы IgG, IgA и IgE называют соответственно FcyR, FcaR и FceR. Эти рецепторы передают сигналы с помощью рецепторных богатых тирозином активирующих мотивов (НАМ), представляющих собой цитоплазматические домены, содержащие два остатка тирозина (Y), разделенных 9-12 аминокислотными остатками. В результате связывания остатки тирозина в ГГАМ-доменах фосфорилируются, что приводит к задействованию Syk-тирозинкиназы, запускающей каскад различных внутриклеточных сигналов, вызывающих активацию транскрипции, перестройку цитоскелета и высвобождение медиаторов воспаления. Рецептор FcyRII-A имеет свой собственный мотив НАМ во внутриклеточной части, а в цитоплазматических доменах FcyRI и FcyRIII ITAM-мотива нет. Для передачи сигнала им приходится реагировать соответственно с у- и ^-белка-ми, содержащими ПАМ.
Г. Маннозный рецептор
Макрофаги и ДК могут распознавать сахара — маннозу и фукозу — на поверхности различных патогенов с помощью маннозного рецептора. Эта молекула имеет длинный внеклеточный участок, состоящий из нескольких (по крайней мере восьми) лектиноподобных доменов. Связывание маннозного рецептора приводит к высвобождению цитокинов: ИЛ-1 р, ИЛ-6, ГМ-КСФ, ФНО-а и ИЛ-12.
Д. Фагоцитоз, опосредованный рецепторами комплемента
Белки комплемента покрывают (опсонизируют) измененные эритроциты или клетки бактерий. На моноцитах и макрофагах есть рецепторы комплемента CR1, CR3 и CR4. Рецептор CR1 связывается с фрагментами комплемента СЗЬ, С4Ь и C3bi. Рецепторы CR3 и CR4 (см. с. 53) специфически связывают СЗЫ Покрытые комплементом частицы (старые эритроциты) напрямую погружаются в клетку фагоцита, практически без образования псевдоподий. В этом процессе задействованы белки винкулин, паксиллин и F-актин. При этом провоспалительные цитокины не образуются.
50
Система фагоцитов
Стволовая Flt3L
клетка ИЛ-3 *
ФСК
ДК тимуса
ДК в лимфоузлах
Гранулоциты .
М-ФСК
ИЛ-3 ▼ Промиелоцит
ИДК
ДК-пред- . шественник
Моноцит
Клетки Лангерганса в коже/слизистой
М-КСФ ИЛ-3
ГМ-КСФ ИЛ-4
ДКЗЦ
Клетки Купфера
Тканевые макрофаги
Альвеолярные макрофаги
Моноциты лимфоузлов/ селезенки
Мезэмглаль- Микро-ные клетки глия
Дермальные/ интерстициальные ДК
г
Макрофаги серозной оболочки кишечника
А. Система фагоцитов
Фундаментальные принципы
Покрытые клатрином ямки/ частицы
0,5 мкм
зация актина
1. Пиноцитоз
Б. Механизмы эндоцитоза
FcyRIIA
2. Фагоцитоз
3. «Спиральный» фагоцитоз
IgG-опсонизированная частица
А V м У
Перестройка цитоскелета
Выделение воспалительных медиаторов
В. Fc-опосредованный фагоцитоз
Манноза или фукоза
Актин
Миозин
ИЛ-12?
ИЛ-1В?
ИЛ-6? ФНО-а?
Г. Маннозный рецептор
Интернализация
Актин, винкулин, паксиллин Воспалительные медиаторы не выделяются
Д. Фагоцитоз, опосредованный рецепторами комплемента
Фундаментальные принципы
Моноциты и дендритные клетки
А. Действие моноцитов и макрофагов
Моноциты и макрофаги являются важными вспомогательными клетками для формирования специфичного иммунного ответа в системе приобретенного иммунитета, но, кроме того, играют ключевую роль в качестве медиаторов в системе врожденного иммунитета. Они также могут активироваться при действии цитокинов (например, у-интерферона), вырабатываемых Т-клетками. Активация моноцитов и макрофагов приводит к секреции различных цитокинов, таких как ИЛ-1, ФНО-а и ИЛ-6, ответственных за системное (генерализованное) действие. В уничтожении бактерий путем фагоцитоза и образовании цитокинов принимает участие окись азота (NO) — продукт клеточного метаболизма, обладающий широким спектром действия. Цитокины ИЛ-1, ФНО-а и ИЛ-6 заставляют печень вырабатывать белки острой фазы, такие как С-реактивный белок и маннан-связывающий лектин, опсонизирующие патогены и облегчающие их уничтожение. Эти же цитокины действуют и на гипоталамус, вызывая жар и приводя к перемещению нейтрофилов из костного мозга в кровь (лейкоцитоз). Цитокины ИЛ-1 и ФНО-а повышают проницаемость сосудов, облегчая миграцию клеток в ткани. ИЛ-8 опосредует хемотаксис, что вместе с повышенной сосудистой проницаемостью способствует привлечению гранулоцитов и вызывает воспаление в тканях. Гранулоциты и макрофаги кооперируются при фагоцитозе патогенов и удалении поврежденных тканей (функция мусорщиков), осуществляя протеолитическое расщепление и последующее восстановление ткани, облегчаемое образованием новых сосудов (ангиогенез). Действуя в синергизме, ФНО-а и у-ИНФ индуцируют синтез реактивного азотсодержащего метаболита NO, ответственного за некоторые эффекторные функции моноцитов и макрофагов, в частности, уничтожение внутриклеточных бактерий и опухолевых клеток. В этом процессе участвуют и другие активные продукты (радикалы NO, NO- и NO+), а также протеазы. Моноциты играют важную роль в презентации антигена Т-клетке (см. с. 46). Выделяя цитокины ИЛ-10 и ИЛ-12, они действуют как ключевые регуляторы Т-клеточного ответа в модуляции ответов Тц1 против Тн2.
Б. Антигены моноцитов и дендритных клеток
Моноциты имеют три важных рецептора адгезии: лим-фоцитассоциированный антиген 1 (LFA-1) и рецепторы комплемента 3 и 4 (CR3 и CR4). Данные антигены являются членами семейства интегринов — большого семейства молекул, состоящих из двух нековалентно связанных полипептидных субъединиц (а- и р-цепей). Антигены LFA-1, CR3 и CR4 имеют одинаковую 95-кДа р-цепь, распознаваемую анти-С018 антителами. Соответствующие a-цепи представляют собой большие по
размеру молекулы: 180 кДа (СО11а), 170 кДа (СОНЬ) и 150 кДа (CDIIc)
Генетическое нарушение, связанное с отсутствием синтеза p-цепи, приводит к дефекту адгезии лейкоцитов, проявляющемуся в чрезвычайно высокой чувствительности к инфекциям.
CD14 экспрессируется на моноцитах в периферической крови, а CD68 — на тканевых макрофагах. CD14 является рецептором комплекса липополисахаридов (ЛПС) и ЛПС-связывающих белков. Бактериальные ЛПС представляют собой сильные митогены, приводящие к повышенному синтезу медиаторов воспаления и повышенной бактерицидной активности. CD68 является лизосомальным/эндосомальным гликопротеином.
На моноцитах экспрессируются рецепторы для Гс-фрагмента IgG. Существует три типа рецепторов, характеризующихся высокой (FcyRI = CD64), средней (FcyRII = CD32) и низкой аффинностью (FcyRIII = CD16) CD64 преимущественно экспрессируется моноцитами, CD32 — гранулоцитами, a CD16 — клетками-киллерами. Гранулоциты также экспрессируют изоформу молекулы CD16, заякоренную на мембране гликозилфосфатидилинозитолом (GPI). Иммуноглобулины lgG1 и lgG3 очень прочно связываются с Fc-pe-цепторами, в то время как связь, образованная lgG2 и lgG4, довольно слабая. Мышиные антитела также могут связываться с человеческими Fc-рецепторами: lgG2a и lgG3 связываются очень хорошо, a lgG1 — слабо.
Антигены CD46, CD86 и CD86 являются костиму-ляторными молекулами при презентации антигена (см. с. 46). Они экспрессируются на В-лимфоцитах, моноцитах и дендритных клетках.
Антиген CD83 полезен для определения стадии созревания дендритных клеток, поскольку только зрелые ДК являются СО83-положительными. Этот антиген обнаруживается также на некоторых В-клетках зародышевого центра и на активированных Т-клетках. Возможно, он играет роль в адгезии клеток.
Антиген CD266 (маннозный рецептор) представляет собой лектин С-типа (лектин, связанный с углеводом), экспрессирующийся на макрофагах и дендритных клетках. Он проявляет высокое сродство к остаткам маннозы на поверхности многих патогенов (бактерий и вирусов). Похожая молекула CD265, обнаруженная на дендритных клетках, служит в качестве рецептора при захвате антигена.
Антиген СО1а представляет собой молекулу, напоминающую молекулы МНС класса I, и используется для презентации липидных антигенов; обычно экспрессируется на незрелых ДК и клетках Лангерганса.
Функционирование моноцитов и их антигены
Белки острой фазы
2. Хемотаксис, тканевое воспаление ИЛ-8
--ГМ-КСФ \
ИЛ 12
ТН2
ФНО-а
1. Активация
Бактерии, ЛПС ФНО-а
► ИЛ-1 ИЛ-6
У1Л-1
3. Фагоцитоз, функция мусорщика, репарация ткани
Эластаза Коллагеназа
* фиброгенный фактор ангиогенные факторы
н
6. Иммуномодуляция 5. Презентация антигена
А. Действие моноцитов и макрофагов
NO
** Н2О2
Лизоцим
Гидролаза Токсические факторы ФНО-протеиназы
4. Эффекторная функция
Молекула Мол. масса, кДа Хромосомный локус Экспрессия Функция
CD11a ж--ИЛЛ —CD18 LFA-1 CD11a: 180 CD18. 95 16p11-13.1 21q22.3 Моноциты, макрофаги, T- и В-лимфоциты, гранулоциты Адгезия между клетками и клеткой и матриксом, _лиганд ICAM-1, ICAM-2
CD11b CD18_ CR3 CD11b: 170 CD18. 95 16p11-13.1 21q22.3 Миелоидные клетки, НК-клетки Адгезия между клетками и клеткой и матриксом, лиганд iC3b, C4b, ICAM-1
CD11c' дарцдл CD18 , CR4 CD11c: 150 CD18: 95 16p11-13.1 21q22.3 Макрофаги, миелоидные клетки Адгезия между клетками, лиганд iC3b, C4b, ICAM-1, ЛПС, фибриногена
£ J ЛАААЛ CD14 55 5q31 Моноциты, макрофаги гранулоциты, (В-клетки) , Рецептор ЛПС и комплекса ЛПС/ЛПБ
% или CD16 (FcRIII) _ 50-80 1q23 Моноциты, макрофаги, НК-клетки, гранулоциты (GPI) Низкоаффинный Fc-рецептор IgG
4^ (FCRH) 40 1q23-24 Фагоциты, В-клетки, тромбоциты Fc-рецептор IgG с промежуточной аффинностью
(FcRI) 72 1q21 Моноциты, макрофаги Высокоаффинный Fc-рецептор IgG
S'*—<X>>O ° .. 8 CD4° 48 20q12-q13.2 Пре-В и зрелые В-клетки, ДК Взаимодействие с CD40L на Т-клетках, антиапоп-тотический сигнал
g ЛЛ fid CD80/86 О ZE 60 3q21 В-клетки, активированные макрофаги, ДК Взаимодействие Т/АПК (лиганд CD28/CTLA-4)
CD83 45 6p23 Зрелые ДК, некоторые Т-и В-клетки Адгезионный рецептор
Q........j WvWAMA Маннозные рецепторы 180 10pl3 Фагоциты, лимфати чески й эндотелий Узнавание патогенов
CD1a 43-49 1q22-23 Тимоциты, ДК Презентация антигенов (гликолипидов)
/VVVb CD68 110 17p13 Моноциты, макрофаги, пэанулоциты, базофилы, БГЛ Лизосомальный и эндосомальный гликопротеин
Б. Антигены моноцитов и дендритных клеток
Фундаментальные принципы
53
Моноциты и дендритные клетки
Фундаментальные принципы
Дендритные клетки (ДК) составляют менее 0,5% всех одноядерных клеток крови, но присутствуют во всех органах. ДК имеют длинные цитоплазматические выросты, всего несколько внутриклеточных органелл, но весьма большое количество митохондрий. Они довольно подвижны. Только ДК могут примировать наивные Т-клетки.
А. Популяции дендритных клеток
Дендритные клетки принадлежат к миелоидному ряду Они образуются из кроветворных клеток-предшественников в ответ на действие ФНО-ос, ИЛ-4 и ГМ-КСФ. В коже ДК обнаруживаются как в эпидермисе (клетки Лангерганса, КЛ), так и в дерме. Клетки Лангерганса имеют характерные включения (гранулы Бирбека), возможно являющиеся эндосомами, участвующими в захвате антигена. После захвата антигена в коже и в ответ на выделение воспалительных цитокинов, таких как ФНО-ос, КЛ начинают созревать и перемещаются в Т-клеточную область лимфоузла, где активируют антиген-специфичные Т-лимфоциты. Зрелые моноциты способны к дифференцировке в интерстициальные ДК в различных органах, причем ключевым моментом в этом процессе является взаимодействие с адгезионными молекулами и хемоки-нами эндотелиальных клеток при перемещении сквозь эндотелий. Образовавшиеся из моноцитов ДК и интерстициальные ДК преимущественно перемещаются в зародышевые центры лимфоузлов, где могут активировать Т- и В-клетки. Зрелые ДК редко встречаются в периферической крови, однако небольшая часть (0,1-0,5%) одноядерных клеток в кровотоке имеет морфологические и иммунологические черты незрелых ДК, а именно, небольшие цитоплазматические выросты, низкий уровень содержания молекул МНС и костимулирующих молекул, а также характерный для ДК антиген CD83. Эти клетки, называемые предшественниками дендритных клеток типа 1 (пре-ДК-1), экспрессируют миелоидные антигены CD13, CD11 с и CD1 с, а также ВОСА-3. В условиях in vitro в ответ на сигнал ИЛ-4, ГМ-КСФ и ФНО-ос они превращаются в типичные ДК. Эти клетки секретируют большое количество ИЛ-12 (ДК первого типа или ДК-1).
Некоторые редкие одноядерные клетки крови реагируют на образование ИЛ-3 и Flt3L, давая начало клеточной популяции, теряющей миелоидные антигены CD13 и CD33, но экспрессирующей некоторые Т-клеточные антигены (CD2, CD5 и CD7), недавно описанные антигены ВОСА-2 и ВОСА-4, а также Toll-подобный рецептор 9 (TLR9). Эти клетки мигрируют в паракортикальную область лимфоузла, входя в непосредственный контакт с высокими эндотелиальными венулами. Учитывая морфологию этих клеток и выработку ими Т-клеточных антигенов, их первоначально назвали «плазмацитоидными Т-клетками», а затем «плазмацитоидными моноцитами».
Теперь их называют предшественниками дендритных клеток типа 2 (пре-ДК-2), поскольку в ответ на ИЛ-3 и на связывание CD40 они приобретают типичные морфологические признаки ДК и секретируют большие количества альфа-интерферона и ИЛ-10 (ДК второго типа, ДК-2, или интерферонпродуцирующие клетки, ИПК).
Б. Жизненный цикл дендритных клеток
Захваченные в коже антигены процессируются клетками Лангерганса, которые затем перемещаются в эфферентный лимфатический сосуд в виде вуалевидных клеток, перенося антиген к региональным лимфатическим узлам. Здесь они примируют и активируют CD4+ Т-клетки. Активированные Т-клетки вырабатывают большое количество лиганда CD40 (CD154), который связывается с CD40 на ДК. Последующая костимуляция осуществляется при помощи CD28, который взаимодействует с CD80/CD86. Активированные Т-клетки достигают участка проникновения антигена. Они секретируют цитокины ИЛ-2 и у-ИНФ, способствующие пролиферации Т-клеток и дальнейшему привлечению клеток, что в конечном итоге приводит к накоплению Т-лимфоцитов, макрофагов и других воспалительных клеток. Данная реакция (гиперчувствительность замедленного типа) может наблюдаться примерно через 48 часов после проникновения антигена и проявляется в образовании красноватых папул на коже (см. с. 76 и 101).
В. Рекрутирование предшественников дендритных клеток и миграция дендритных клеток
Эпителий миндалин и пищеварительного канала секретирует хемокин MIP-Зос, являющийся лигандом хемокино-вого рецептора CCR6 на незрелых ДК (а также на Т-клет-ках, проникающих в эпителий пищеварительного канала). Синтез MIP-Зос индуцируется при воспалительном процессе; он способствует хемотаксису незрелых ДК и клеток Лангерганса. При созревании ДК перестают экспрессировать CCR6; они избегают локального действия MIP-Зсх и обзаводятся хемокиновым рецептором CCR7. В результате зрелые ДК начинают реагировать на хемокины MIP-Зр и SLC (хемокин вторичных лимфоидных тканей), которые выделяются и связываются лимфатическими сосудами, эндотелиальными клетками и стромальными клетками лимфоузлов. Под действием данного хемокино-вого градиента Т-клетки также перемещаются в лимфатические узлы. В Т-зоне лимфоузла ДК могут взаимодействовать с антиген-специфичными Т-клетками. Собственные ДК лимфоузла сами производят SLC и MIP-Зр, что способствует дополнительному рекрутированию Т-клеток и дендритных клеток, приводящему к усилению иммунного ответа (рис. В2).
54
Популяции дендритных клеток
CD1a+
ФНО-а
Пре-ДК1
Клетка Лангерганса
Миграция сквозь эндотелий
CD11C+ CD13+
CD33+ CD14+ CD1c+
Моноцит
CD34+ клетки
Flt3L, ИЛ-3
м ХГМ-КСФ
М-КСФ \ иЛ-4
ГМ-КСФ \
ФНО-а \
CD1c+ BDCA3+ CD11c+ CD13+
ЛПС 1 связывание CD40
ИЛ-3
Пре-ДК2
ДК тимуса
Захват антигена
Интерстициаль-ИДК ная ДК
HEV
«Миелоидная»
ДКЗЦ ДК-1
ЛПС Бактериальные продукты
А. Популяции дендритных клеток
CD83+
Б. Жизненный цикл дендритных клеток
Эпителий
(миндалины, пищеварительный канал)
MlP-За ^-MlP-3a
Лимфатический сосудТ.$|_с
1. Миграция в воспаленные ткани и из них
CD11c+ CD123+ CD2/5/7<+> BDCA2+ BDCA2+ /BDCA4+
TLR9+ Связывание CD40 вирусная инфекция
«Лимфоидная» ДК-2
Интердигитальная ДК
Активированная Т-клетка
2. Хоминг ДК в лимфоузел
В. Рекрутирование предшественников ДК и миграция ДК
Фундаментальные принципы
Фундаментальные принципы
Моноциты и дендритные клетки
А. Созревание дендритных клеток: изменение фенотипа и функций
Фенотип дендритных клеток изменяется по мере их созревания. Незрелые ДК экспрессируют большое количество миелоидных антигенов CD13 и CD33, хемокиновых рецепторов CCR1, CCR5 и CCR6, а также Fc-рецепторов. Они вырабатывают немного костимулирующих молекул 0040, CD80 и CD86 и не экспрессируют антиген CD83 и мембранный белок лизосом LAMP. Некоторые незрелые ДК, в частности клетки Лангерганса в коже, характеризуются высоким уровнем экспрессии антигена CD1 а. Содержание молекул МНС класса I и класса II низкое, поскольку они с высокими скоростями возвращаются с поверхности клетки в лизосомы. В этой связи презентируемые пептиды доступны для узнавания Т-клетками лишь короткое время. Незрелые ДК обладают высокой фагоцитирующей активностью и способностью связывать антиген, однако из-за низкого уровня содержания костимуля-торных молекул их антигенпрезентирующая способность невелика. Воспалительные стимулы (ФНО-ct, ИЛ-1, ИЛ-6, ЛПС, бактерии и вирусы) способствуют созреванию ДК. Оборот молекул МНС класса II сокращается в 10-100 раз. В результате процессированные пептиды, образовавшиеся из захваченных антигенов, становятся доступными для узнавания Т-клетками на протяжении нескольких часов. Благодаря повышению уровня экспрессии костимулирующих молекул, ДК эффективно стимулируют Т-клетки. Повышение уровня экспрессии адгезионных молекул типа ДК-SIGN (лектин С-типа, взаимодействующий с ICAM-3 на наивных Т-клетках) вносит дополнительный вклад в стимуляцию Т-лимфоцитов. Окончательное созревание индуцируется связыванием CD40, заставляющим ДК вырабатывать большие количества ИЛ-12.
Б. Регуляция дендритными клетками Т-хелперного ответа: двойственность линии против пластичности
ДК являются важными регуляторами иммунного ответа. Они могут направлять развитие иммунного ответа по пути образования клеток типа Тц1 или Тн2. В присутствии большого количества ИЛ-12 Т-клетки превращаются в клетки типа ТН1, секретирующие у-ИНФ и ИЛ-2 и способствующие преимущественному развитию Т-клеточно-го воспалительного ответа. Напротив, низкое содержание ИЛ-12 приводит к образованию клеток типа Тн2, секретирующих ИЛ-4 и ИЛ-10 и способствующих дифференцировке В-клеток в плазматические клетки, секретирующие IgM, lgG2 и lgG4. До сих пор не ясно, является ли высокий уровень секреции ИЛ-12 «конститутивной» характеристикой дендритных клеток миелоидного типа (ДК-1) в отличие от дендритных клеток лимфоидного типа (ДК-2), образующихся в ответ на сигнал лиганда Flt3 и ИЛ-3 (верхняя часть рис. Б). Возможно
также, что оба типа ДК способны производить разное количество ИЛ-12 в зависимости от стимула: бактериальные продукты типа ЛПС и неметилированные CpG олигонуклеотиды, связывание CD40 и высокое значение отношения ДКД-клетки заставляют ДК секретировать большие количества ИЛ-12. Напротив, в присутствии ИЛ-10, ФНО-р, простагландина Е2 и низком значении отношения ДКЛ-клетки ДК секретируют мало ИЛ-12 и иммунный ответ направляется по пути образования клеток типа Тц2 (нижняя часть рис. Б).
Обычно ДК-1 экспрессируют антиген ВОСА-3, маннозные рецепторы, CD1, а также Toll-подобные рецепторы TLR2 и TLR4 Клетки типа ДК-2 или «лимфоидные» ДК экспрессируют антигены CD123 (альфа-цепь рецептора ИЛ-3), ВОСА-2 и ВОСА-4, а также TLR7 и TLR9. Клетки типа ДК-2 характеризуются слабой фагоцитирующей способностью, секретируют интерфероны типа I (а- и р-ИФН) и иначе называются интерферон-продуцирующими клетками (ИПК). Окончательное созревание ДК-2 индуцируется действием вирусного антигена в присутствии ИЛ-3, в то время как для созревания ДК-1 важным стимулом является наличие ЛПС и бактериального антигена. Связывание CD40 важно для развития обоих типов клеток.
В. Обратная связь в регуляции
образования ДК-1 и ДК-2
Дифференцировка Т-клеток в клетки типа Т|_|2 индуцирует секрецию ИЛ-4. Этот цитокин важен для образования ДК-1, но ингибирует образование ДК-2 из клеток-предшественников. Таким образом, вне зависимости от исходного стимула в организме поддерживается определенный баланс между Т|_|1 - и Тц2-клеточным ответом.
Г. Толерогенный потенциал незрелых дендритных клеток
Захват антигена незрелыми ДК в коже, слизистой и даже в опухоли может приводить к развитию антиген-специфичной толерантности, а не активации Т-клеток, если отсутствуют вещества, необходимые для их дальнейшего созревания (например, ФИО или ЛПС). В подобных условиях не происходит повышения уровня экспрессии костимуляторных молекул; вместо ИЛ-12 образуется ИЛ-10. По-видимому, при презентации антигенов в данных условиях клетки останутся толерантными. Этот механизм важен для предотвращения аутоиммунного процесса, но он также помогает раковым антигенам избежать иммунного ответа, поскольку они индуцируют толерантность.
56
Созревание дендритных клеток: изменение фенотипа и функций
Незрелые Зрелые Покоящиеся ДК: низкий Активированные ДК: высо-
уровень содержания кий уровень содержания
ДК ДК молекул МНС, высокий оборот молекул МНС, увеличение времени жизни
CD13, CD33, CD14 ++ (+) Чужеродный Антиген + ЛПС,
CD40, CD80, CD86 CD83 (+) +++ антиген ф
LAMP CCR1, CCR5, CCR6 ++ ++ z| 4 t t Рецикл 1 V I V Jb
CCR7 Фагоцитоз +++ + (+) А
Презентация Ад + +++
Секреция ИЛ-12 + ++++
А. Созревание дендритных клеток: изменение фенотипа и функций
Миелоидный предшественник
Фундаментальные принципы
CD34+
CD11c+ CD13/33/14+
ГМ-КСФ I —ФНО
ИЛ-4
CD34+
CD11C" CD2/7/5<+> TCRa+
Лимфоидный предшественник
BDCA3+
Ппр Маннозный рецептор* А дк-i
TLR4+ CD40L
I ЛПС
ДК-1
Высокая фагоцитирующая активность Высокий уровень секреции ИЛ-12 Активная кости мул я ци я
CD123+
BDCA2+
BDCA4+
TLR7+
ИЛ-3 , TLR9*
CD40L Вирусная инфекция
Низкая rhami imtm
Пре-ДК-2
ЦТЛ
Много ИЛ-12
Много ИЛ-12
у-ИНФ
Неметилированные CpG Связывание CD40L ЛПС у-ИНФ Высокое значение ДК/Т
I
Мало ИЛ-12
Мало ИЛ-12
ИЛ-10 ФНО-р ПГЕ2 Вовлечение Ox40L
Низкая фагоцитирующая активность
Низкии уровень секреции ИЛ-12 Секреция а/р-ИФН (ИПК)
ДК-2
у-И НФ
ДК-1 и ДК-2
Б. Регуляция Т-хелперного ответа: двойственность и пластичность линии
у-ИНФ
слабая кости мул я ция г-гп.и-. слабая секреция ИЛ-12
Слизистая секреция ил Ю
Пре-ДК-2
ДК-2
Опухоли
Незрелые ДК
Пре-ДК-1
ДК-1
Кожа —
Антиген -специфичная Т-кле-точная толерантность
В. Обратная связь в регуляции образования ДК-1 и ДК-2
Г. Толерогенный потенциал незрелых дендритных клеток
Система HLA (система МНС)
Фундаментальные принципы
А. Геномная организация HLA-комплекса
Изучение последствий трансплантации у экспериментальных животных показывает, что трансплантат от генетически неидентичного организма отторгается. Это явление связывают с антигенами главного комплекса гистосовместимости (МНС). У человека соответствующая система антигенов была открыта в 1950-х гг. Человеческие антигены МНС названы человеческими лейкоцитарными антигенами (HLA), поскольку у человека после трансплантации в первую очередь детектировались антитела против лейкоцитов. На сегодняшний день эти антигены обнаружены практически во всех клетках, имеющих ядро. Система HLA характеризуется чрезвычайно высоким уровнем полиморфизма, т. е. содержит гены, которые проявляются более чем в одной фенотипической форме и наследуются в соответствии с законами Менделя. Этот полиморфизм приводит к существованию необычайно сложной системы презентации антигена. У человека гены МНС расположены на коротком плече хромосомы 6.
Антигены HLA подразделяются на две группы: антигены класса I и класса II. Номера классов отражают хронологический порядок их открытия, а не расположение на хромосоме. Антигены класса I образуют комплексы антигенов, расположенных в трех смежных локусах (HLA-A, HLA-B, HLA-С). Эти антигены впервые были обнаружены с помощью серологических тестов. Напротив, антигены HLA-D были открыты в клеточных исследованиях на смешанных культурах лейкоцитов. Антигены HLA-D организованы в комплексы, содержащие антигены HLA-DR (D-родственный), HLA-DQ и HLA-DP.
В отличие от антигенов класса I, у которых тяжелые цепи связаны с одной и той же легкой цепью (Р2‘ микроглобулин, не кодирующийся на хромосоме 6), у антигенов класса II различные локусы кодируют как ос-цепь (DRA, DQA, DPA), так и p-цепь (DRB, DQB, DPB). Число и структура этих локусов различна у разных индивидов в зависимости от HLA гаплотипа. Например, комбинация различных p-цепей антигенов DR формирует разные группы (рис. 4). Другие структурно связанные с ними гены, расположенные вблизи генов DP, DQ и DR (рис. 3), в большинстве своем являются нетранслируемыми псевдогенами с неизвестными функциями.
Реальная структура гена содержит несколько экзонов, формирующих различные домены. Гены, кодирующие компоненты комплемента С2, С4 и Bf, расположены между генами молекул МНС класса I и класса II (рис. 2). Продукты экспрессии этих генов ранее называли антигенами класса III (рис. 1). Для них также характерен широкий полиморфизм, который еще более усложняется из-за дупликации и (или) вариации длины
генов С4. В пределах комплекса HLA расположены и другие важные гены, кодирующие, например, ФНО-а и ФН0-|3, родственный им лимфотоксин LTB, а также ферменты CYP21 а и CYP21Ь. На рисунках не показаны гены транспортных белков ТАР1 и ТАР2, расположенные между DP и DQ. Продукты их экспрессии играют важную роль в транспорте антигенных пептидов к молекуле HLA.
58
Геномная организация HLA-комплекса
Хромосома 6
Фундаментальные принципы
5. Экзон 1 Экзон 2 Экзон 3 Экзоны 4, 5, 6
I 11_._ , и, 1 IIH | Ген DRB1
II I I I I 11 | | | Первый домен
14 9 13 25 38 57 60 „ полипептида 67 74 94 DRB1
Аминокислоты
А. Геномная организация HLA-комплекса
Фундаментальные принципы
Система HLA (система МНС)
А. Структура молекул HLA
Каждая молекула HLA класса I состоит из тяжелой цепи (44 кДа) и легкой цепи (12 кДа), известной как р2-микроглобулин. Альфа-цепь представляет собой трансмембранный белок, состоящий из трех доменов («1, «2 и схз> каждый из которых состоит из 90 аминокислотных остатков), а также трансмембранного фрагмента (25 аминокислот) и внутриклеточного фрагмента (30 аминокислот). Альфа-цепи образуют нековалентные связи с внеклеточным р2-микроглобулином.
Каждая молекула HLA класса II состоит из двух цепей: ос-цепи (33-35 кДа) и р-цепи (26-28 кДа). Обе цепи имеют по два внеклеточных домена массой 90-100 кДа каждый (обозначаются а>|, ос2 и Ръ Р2^> соединенных с трансмембранным фрагментом (20-25 аминокислот) и внутриклеточным фрагментом (8-15 аминокислот). Домены ос2 1/1 Рг консервативны, а домены а>| и Pi высокополиморфны. Эти последние домены состоят из «базисного слоя», образованного р-слоями, к которому крепятся ос-спирали. Целиком эта молекула напоминает по структуре корзинку, в которой может разместиться антиген (см. также Б).
Б. Структура молекул HLA класса I
Пространственная структура антигенов HLA может быть определена с помощью рентгеноструктурного анализа, как это показано на рисунке для молекулы класса I. Каждый из а^- и а2‘Доменов состоит из четырех антипараллельных бета-слоев, С-концы которых связаны с альфа-спиралями. Это создает структуру антигенсвязывающей щели, соответствующей по форме антигенному пептиду. T-Клеточный рецептор может распознать подходящий антиген HLA (МНС-ре-цептор) и пептид, находящийся в щели (тримолеку-лярный комплекс). Связь между антиген-содержащей клеткой и Т-клеткой стабилизируется с помощью вспомогательных молекул (CD8 в случае цитотоксических Т-клеток).
В. Аллели HLA класса I
Антигены HLA традиционно именовали в соответствии с порядком их открытия как А, В и С (класс I) и D-антигены, а также внутри каждой группы обозначали номером. В результате обозначения стали слишком неединообразны. После определения точной структуры генов молекулярно-биологическими методами была введена единая международная номенклатура. Новые обозначения для молекул HLA класса I состоят из кода, описывающего область гена, и идентификационного номера, разделенных звездочкой Все известные на сегодняшний день аллели и их прежние названия перечислены в таблице
Аллели DR, DQ и DP системы HLA (табл, на с. 62-63)
В данной таблице содержится аналогичная классификация для антигенов класса II. Их номенклатура довольно сложна, что связано с полиморфизмом а-и p-цепей. Например, участок HLA-DR содержит ген ос-цепи (DRA1) и гены нескольких p-цепей (DRB1, DRB2, DRB3, DRB4, DRB5, DRB6 и DRB9), не все из которых существуют одновременно. Участок HLA-DP содержит кодирующие гены DPA1 и DPB1, а участок HLA-DQ — кодирующие гены DQA1 и DQB1. Далее в обозначении конкретного гена или участка ставится звездочка, а за ней следует номер аллеля и номер подтипа. Таким образом, обозначение HLA-DRBV0101 подразумевает локус DRB1 (кодирует р-цепь 1), аллель 01, подтип 01. В таблице на с. 62 приводится также прежняя номенклатура (например, DR4) и коды для HLA-типирования.
60
Структура молекул HLA и аллели класса I
соон
А. Структура молекул HLA (схема)
Т-клеточный рецептор
Цитозоль
Б. Структура молекул HLA класса I
HLA-A HLA-В HLA-C
Новая номенклатура Старая номенклатура Новая номенклатура Старая номенклатура Новая номенклатура Старая номенклатура
А*0101 А1 B*0701 В7, В7.1 Cw*0101 Cw1
А*0201 А2, А2.1 В*0702 В7, В7.2 Cw*0201 Cw2, Cw2.1
А*0202 А2, A2.2F В*0801 В8 Cw*02021 Cw2, Cw2.2
А*0203 А2, А2.3 В*1301 В13, В13.1 Cw*02022 Cw2, Cw2.2
А*0204 А2 В*1302 В13, В13.2 Cw*0301 Cw3
А*0205 А2, A2.2Y В*1401 В14 Cw*0501 Cw5
А*0206 А2, А2.4а В*1402 Bw65(14) Cw*0601 Cw6
А*0207 А2, А2.4Ь В*1501 Bw62(15) Cw*0701 Cw7
А*0208 А2, А2.4с В*1801 В18 Cw*0702 Cw7, jY328
А*0209 А2, A2-ZB В*2701 В27, 27f Cw*1101 Cw11
А*0210 А2, A2-LEE В*2702 В27, 27е, 27К, В27.2 Cw*1201 Cx52
А*0301 АЗ, А3.1 В*2703 В27, 27d, 27j Cw*1202 Cb-2
А*0302 АЗ, А3.2 В*2704 B27, 27b, 27C, B27.3 Cw*1301 CwBL18
А*1101 А11, А11Е В*2705 B27, 27a, 27W, B27.1 Cw*1401 Cb-1
А*1102 А11, А11К В*2706 B27, 27D, B27.4
А*2401 А24(9) В*3501 B35
А*2501 А25(10) В*3502 B35
А*2601 А2б(10) В*3701 B37
А*2901 A29(w19) В*3801 B38(16), B16.1
А*3001 A30(w19), АЗО.З В*3802 B39(16), B16.2
А*3101 A31(w19) В*4001 Bw60(40)
А*3201 A32(w19) В*4002 B40, B40*
А*3301 Aw333(w19), Aw33.1 В*4101 Bw41
А*6801 Aw68(28), Aw68.1 В*4201 Bw42
А*6802 Aw68(28), Aw68.2 В*4401 B44(12), B44.1
А*6901 Aw69(28) В*4402 B44(12), B44.2
В*4601 Bw46
В *4701 Bw47
В*4901 B49(21)
В*5101 B51(5)
В*5201 Bw52(5)
В*5301 Bw53
В*5701 Bw57(17)
В*5801 Bw58(17)
В*7801 B'SNA’
Фундаментальные принципы
В. Аллели HLA класса I
Молекулы HLA: аллели класса II
Фундаментальные принципы
Новая номенклатура Старая номенклатура Новая номенклатура Старая номенклатура
DRBI-аллели DRBI-аллели
DRB1*O1O1 DR1, Dw1 DRB1*1304 DRw6, DRw13
DRB1*0102 DR1, Dw20 DRB1*1305 DRw6, DRw13
DRB1*0103 DR’BR’, Dw'BON' DRB1*1401 DRW6, DRw14, Dw9, DRw6b
DRB1*15O1 DR2, DRw15, Dw2 DRB1*1402 DRw6, DRw14, Dw16
DRB1*15O2 DR2, DRw15, Dw12 DRB1*1403 DRw6, DRw14
DRB1*1601 DR2, DRw16, Dw21 DRB1*1404 DRw6, DRw6b.2
DRB1*1602 DR2, DRw16, Dw22 DRB1*1405 DRw6, DRw14
DRB1*O3O1 DR3, DRw17, Dw3 DRB1*0701 DR7, Dw17
DRB1*O3O2 DR3, DRw18 DRB1*0702 DR7, Dw'DBT
DRB1*0401 DR4, Dw4 DRB1*0801 DRw8, Dw8.1
DRB1*0402 DR4, Dw10 DRB1*08021 DRw8, Dw8.2
DRB1*0403 DR4, Dw13,13 1 DRB1*08022 DRw8, Dw8.2
DRB1*0404 DR4, Dw14,14.1 DRB1*08031 DRw8, Dw8.3
DRB1*0405 DR4, Dw15 DRB1*08032 DRw8, Dw8.3
DRB1*0406 DR4, Dw'KTZ DRB1*0804 DRw8
DRB1*0407 DR4, Dw13,13.2 DRB1*09011 DR9, Dw23
DRB1*0408 DR4, Dw14, Dw14.2 DRB1*09012 DR9, Dw23
DRB1*0409 DR4 DRB1*1001 DRw10
DRB1*0410 DR4
DRB1*0411 DR4
DRB1*1101 DR5, DRw11, Dw5, DRw11.1 Другие DRB-аллели
DRB1*11O2 DR5, DRw11, DRW11.2 DRB3*0101 DRw52a, Dw24
DRB1*1103 DR5, DRw11, DRw11.3 DRB3*0201 DRw52b, Dw25
DRB1*1104 DR5, DRw11 DRB3*0202 DRw52b, Dw25
DRB1*12O1 DR5, DRw12, Dw'DB6' DRB3*0301 DRw52c, Dw26
DRB1*1202 DR5, DRw12, DRw12b DRB4*0101 DRw53
DRB1*1301 DRw6, DRw13, Dw18, DRw6a DRB5*0101 DR2, DRw15, Dw2
DRB1*13O2 DRw6, DRw13, Dw19, DRw6c DRB5*0102 DR2, DRw15, Dw12
DRB1*13O3 DRW6, DRw13, Dw'HAG' DRB5*O2O1 DR2, DRw16, Dw21
DRB1*1304 DRw6, DRw13 DRB5*0202 DR2, DRw16, Dw22
А. Аллели DR, DQ и DP системы HLA (аллели класса II)
62
Молекулы HLA: аллели класса II
Новая номенклатура Старая номенклатура Новая номенклатура Старая номенклатура
DQAI-аллели DPAI-аллели
DQA1*0101 DQA1.1,1.9 DPA1*0101 LB14/LB24, DPA1
DQA1*0102 DQA1.2,1.19,1.AZH DPA1*0102 pSBa-318
DQA1*0103 DQA1.3,1.18, DRw8-Dqw1 DPA1*0103 DPw4a1
DQA1*0201 DQA2, 3.7 DPA1*0201 DPA2, pDAa13B
DQA1*03011 DQA3, 3.1, 3.2
DQA1*03012 DQA3, 3.1, 3.2, DR9-DQw3 DPBI-аллели
DQA1*0302 DQA3, 3.1, 3.2, DR9-DQW3 DPB1*O1O1 DPw1, DPB1, DPwla
DQA1*0401 DQA4.2, 3.8 DPB1*O2O1 DPw2, DPB2.1
DQA1*0501 DQA4.1, 2 DPB1*O2O11 DPw2, DPB2.1
DQA1*05011 DQA4.1, 2 DPB1*O2O12 DPw2, DPB2.1
DQA1*05012 DQA4.1, 2 DPB1*O2O2 DPw2, DPB2.2
DQA1*05013 DQA4.1, 2 DPB1*O3O1 DPw3, DPB3
DQA1*0601 DQA4.3 DPB1*0401 DPw4, DPB4.1, DPw4a
DPB1*0402 DPw4, DPB4.2, DPw4b
DQBI-аллели DPB1*O5O1 DPw5, DPB5
DQB1*0501 DQw5(w1), DQB1.1, DRw10-DQw1.1 DPB1*0601 DPw6, DPB6
DQB1*0502 DQw5(w1), DQB1.2J.21 DPB1*0801 DPB8
DQB1*05031 DQw5(w1), DQB1.3,1.9,13.1 DPB1*0901 DPB9
DQB1*05032 DQw5(w1), DQB1.3J.9,13.2 DPB1*1OO1 DPB1O
DQB1*0504 DQB1.9 DPB1*11O1 DPB11
DQB1*0601 DQw6(w1), DQB1.4,1.12 DPB1*1301 DPB13
DQB1*0602 DQw6(w1), DQB1.5,1.2 DPB1*1401 DPB14
DQB1*0603 DQw6(w1), DQB1.6,1.18 DPB1*15O1 DPB15
DQB1*0604 DQw6(w1), DQB1.7,1.19 DPB1*1601 DPB16
DQB1*0605 DQw6(w1), DQB1.8,1.19b DPB1*17O1 DPB17
DPB1*1801 DPB18
DQB1*0201 DQw2, DQB2
DPB1*1901 DPB19
DQB1*0301 DQw7(w3), DQB3.1
DQB1*0302 DQw8(w3), DQB3.2 DW4 DRB1*0401
DQB1*03031 DQw9(w3), DQB3.3 Z -DW10 DRB1*0402
h -DW13 — DRB1*0403
DQB1*03032 DQw9(w3), DQB3.3 Z DRB1*0407
DR4 v D\A/1ZL
DQB1*1401 DQw4, DQB4.1, Wa L>VV I4- Ur\DI U4-U4 DRB1*0408
DQB1*0402 DQw4, DQB4.2, Wa - DW15 DRB1*0405
DW"KT2" DRB1*0406
Б. Аллели DRf DQ и DP системы HLA (продолжение)
Фундаментальные принципы
63
Система HLA (система МНС)
Фундаментальные принципы
А. Процессирование антигена с участием МНС класса II
До того как антигенспецифичная С04+ Т-клетка сможет узнать экзогенные антигены, в том числе чужеродные молекулы или микроорганизмы, они должны быть подвергнуты интернализации, расщеплению на пептидные фрагменты и связаны с пептидсвязываю-щей щелью молекулы МНС. В процессе опосредованного рецепторами эндоцитоза или фагоцитоза (см. с. 50) экзогенные антигены переправляются в эндосомальные частицы. Эти частицы образуются из части интернализированной клеточной мембраны и имеют нейтральный pH, так что кислые протеазы там не работают. Через несколько часов pH внутри эндосомы падает и интернализованные белки расщепляются цистеиновыми протеазами, называемыми катепсинами. Затем эндосомы сливаются с частицами, содержащими молекулы МНС класса II. Вновь синтезированные трансмембранные белки, такие как молекулы МНС, перемещаются из цитозоля к эндоплазматическому ретикулуму (ЭР), где происходит их окончательная сборка и укладка Сначала молекулы МНС существуют в виде димеров, состоящих из а- и p-цепей. Третья цепь — у или инвариантная цепь (li-цепь) — нековалентно связывается с а/р-гетероди-мерной молекулой МНС класса II, блокируя ее сайт связывания. Это предотвращает связывание эндогенных пептидов, которые в изобилии присутствуют в ЭР (см. также с. 66). Часть инвариантной цепи, блокирующая антигенсвязывающую щель а/р-гете-родимера, называется класс Н-ассоциированным пептидом инвариантной цепи (class-ll associated invariant chain peptide, CLIP). Белок калнексин удерживает комплекс внутри ЭР до окончания сборки, затем отсоединяется и позволяет комплексу МНС ll/li покинуть ЭР в виде мелких связанных с коатомером частиц После диссоциации связанного с коатомером белка эти комплексы попадают в аппарат Гольджи. Инвариантная цепь способствует переносу МНС-комплексов сквозь транс-сеть Гольджи и их выходу в виде вакуолей по направлению к эндосомам. Затем инвариантная цепь отщепляется, оставляя лишь маленький фрагмент СИР связанным с сайтом связывания гетеродимера МНС II. Слияние вакуолей с эндосомами происходит в клеточном компартменте, называемом компартментом МНС класса II (МНС). Молекула HLA-DM, напоминающая молекулу МНС класса II, индуцирует высвобождение СНР-пептида из пептидсвязывающей щели МНС и стабилизирует пустой МНС II гетеродимер до связывания подходящего экзогенного пептида. В конечном итоге HLA-DM диссоциирует и комплекс пептида и МНС класса II в составе секреторной вакуоли перемещается к кле
точной мембране. Пептиды, не способные связаться с молекулами МНС, разрушаются в лизосомах.
Б. Якорные аминокислоты
в пептидах МНС класса II
Пептидсвязывающая щель в молекуле МНС класса II открыта с двух сторон, так что размер связываемого пептида может варьировать в пределах от 12 до 24 аминокислотных остатков. Обе цепи молекулы МНС класса II взаимодействуют с боковыми цепями пептида и определяют его связывающую способность. Каждая аллель класса II имеет свои характерные контактные участки цепи, так что в правильной (якорной) позиции может закрепиться только пептид с определенной аминокислотной структурой. В якорной позиции со стороны NН£-конца (позиция 1) может находиться только ароматическая или крупная алифатическая аминокислота, и это крайне важно для высокоаффинного связывания пептида. Другими важными, но менее критичными якорными позициями, являются положения 4, 6 и 9 в аминокислотной последовательности пептида Боковые цепи некоторых аминокислот могут препятствовать связыванию пептида (ингибирующие аминокислоты). Якорные позиции представляют собой наиболее важные участки контакта пептида и молекулы МНС класса II, так что не удивительно, что те же позиции играют принципиальную роль и в ингибировании связывания. На рис. В показаны аминокислоты, способствующие и мешающие связыванию пептида и молекулы HLA-DRB1 *0401. Пептид СИР инвариантной цепи может связываться с различными аллелями МНС класса II: он содержит метионин в позиции 1, а боковые цепи аминокислот в позициях 2-9 удовлетворяют условиям связывания со всеми аллелями DR. Компьютерное моделирование может предсказать структуру связывающих участков для конкретных аллелей HLA-DR на основании белковой последовательности.
Г. Активация Т-клеток
с участием МНС класса II
Комплекс пептида и молекулы МНС класса II может активировать CD4+ Т-клетки, индуцировать их пролиферацию и секрецию различных цитокинов. В этом процессе важную роль играет фактор некроза опухолей альфа (ФНО-а), выделяемый антигенпрезентирующими клетками. Он приводит к образованию радикалов кислорода, способных уничтожать внутриклеточные микроорганизмы Более того, активированные С04+ Т-клетки могут стимулировать образование антител В-клетками. Оба механизма направлены на уничтожение внеклеточных патогенов.
64
Презентация антигена, зависимая от МНС класса II
фф
Внеклеточные белки
А. Процессирование антигена с участием МНС класса II
Б. Якорные аминокислоты в пептидах МНС класса II
Якорные АК Ингибирующие АК
Р1 Phe, ile, Leu, Met, Vai, Trp, Tyr
Р4 Asp, Met, Gin, Ser Gly, Lys, Pro, Arg, Trp, Tyr
Р6 Ser, Thr, Vai Gin, Phe, Gly, His, Lys, Leu, Met, Tyr
Р9 Ser Asp, Gin, Leu, Asn, Pro
В. Аллель-специфичные мотивы в ОЯВ1*0401-связывающих пептидах
Г. Активация Т-клеток с участием МНС класса II
Фундаментальные принципы
Фундаментальные принципы
Система HLA (система МНС)
А. Процессирование и презентация эндогенных антигенов
Пептиды, презентация которых осуществляется при помощи молекул МНС класса I, происходят из белков цитоплазмы. Этот механизм позволяет иммунной системе распознавать клетки, инфицированные вирусом или бактериями. Теоретически, это также позволяет распознавать мутантные белки или опухолевые клетки.
Для сохранения жизнеспособности клетки необходимо уничтожать поврежденные, денатурированные, несформированные или неправильно сформированные белки. Нормальные белки также постоянно должны уничтожаться и заменяться новыми (периоды полураспада белков варьируют от нескольких минут до нескольких дней или недель). Маркировка уничтожаемых белков осуществляется при помощи белка убиквитина. Полиубиквитированные белки узнаются протеасомой — крупным комплексом протеаз с мол. массой 2000 кДа. Этот комплекс имеет форму бочонка и состоит из ядра 20S (650 кДа) и двух дополнительных внешних колец 19S (каждый по 700 кДа). Четыре кольца центрального ядра протеасомы представляют собой p-структуры (внутри) и «-структуры (по краям), каждая из которых в свою очередь состоит из семи разных субъединиц, окружающих центральную камеру, в которой происходит протеолиз.
Большинство белков, процессированных в протеа-соме, быстро разлагаются до отдельных аминокислот под действием цитозольных или ядерных ферментов. Лишь незначительное число пептидов (обычно состоящих из 8-10 аминокислотных остатков) транспортируются в эндоплазматический ретикулум (ЭР) гетеродимерным транспортным комплексом ТАР (transporter associated with antigen processing). В ЭР пептиды связываются с пептидсвязывающей щелью в «-цепи молекулы МНС класса I, если позволяет структура боковых цепей в их аминокислотной последовательности. Сначала с «-цепью связываются белки-шапероны (кал-нексин, кал ретикулин, Егр57), которые контролируют связывание белка. Тапасин формирует мостик, связывающий «-цепь с ТАР. Два или три кармана на каждой молекуле МНС вмещают в себя только определенные аминокислотные остатки (алифатические, основные, и т.д.), называемые якорными. Они различаются для разных аллельных форм молекул МНС класса I, поскольку аллели различаются последовательностью «-цепи. В большинстве случаев принципиальное значение имеют остатки в положениях 2 и 9. На рис. Б показаны якорные остатки пептидов, имеющих высокое сродство к трем распространенным аллелям HLA. Пептиды, имеющие в этих положениях другие аминокислотные остатки, возможно, смогут связаться, но с меньшим сродством.
Жесткие требования, предъявляемые к якорным аминокислотным остаткам, приводят к тому, что из целого белка только небольшое число пептидов с высоким сродством связывается с конкретным аллелем HLA (рис. В). Однако, поскольку каждый индивид может иметь до шести различных аллелей HLA (материнские и отцовские аллели HLA-A, -В и -С), то это расширяет спектр связывающихся пептидов. Компьютерные программы, доступные через Интернет, могут предсказать эпитопы для связывания в данном белке для наиболее распространенных HLA-гаплотипов.
Лимфоидные ткани и клетки, подвергшиеся воздействию у-ИНФ, имеют несколько отличающийся про-теасомный комплекс, в котором некоторые из р-субъ-единиц заменены субъединицами с другой субстратной специфичностью, например, LMP2, LMP7 и МЕСИ (иммунопротеасома, рис. П. Протеолитическая активность иммунопротеасомы по всей видимости выше, чем активность обычной протеасомы, что вполне согласуется с более высокими требованиями к процессированию антигена со стороны антигенпрезентирующих клеток и инфицированных вирусом клеток, подвергшихся воздействию у-ИНФ. Белки, процессированные в иммунопротеасоме, образуют совершенно иной набор пептидов.
Существуют механизмы, позволяющие антигенам избежать узнавания Т-клетками (рис. Д). Дефекты, например мутации в последовательностях белков ТАР, могут нарушить транспортировку пептидов к ЭР, что приводит к образованию пустых молекул МНС класса I, которые нестабильны и быстро диссоциируют с клеточной мембраны. Вирусные белки, такие как белки вируса герпеса US2 и US11, могут активизировать удаление молекул МНС из ЭР, предотвращая связывание вирусных пептидов молекулами МНС. Действительно, при вирусных инфекциях часто наблюдается низкое содержание молекул МНС класса I.
Поскольку многие «собственные» эндогенные пептиды представляются Т-клеткам молекулами МНС класса I, то существует два основных механизма предотвращения аутореактивности. В тимусе презентация собственных антигенов клетками эпителия тимуса или дендритными клетками может приводить к клональной делеции антиген-специфичных Т-клеток (центральная толерантность путем уничтожения тимусных клеток, рис. Е и с. 22). В периферических областях узнавание собственных антигенов антиген-специфич-ными Т-клетками, пережившими отбор в тимусе, приводит к преждевременной активации апоптоза из-за отсутствия костимулирующих молекул (периферическая толерантность, рис. Ж).
66
Презентация антигена, зависимая от МНС класса I
А. Процессирование и презентация эндогенных антигенов
HI_A-A*0201: Р2 = лейцин Р9 = валин, тирозин
в а-цеп и MHCI
HLA-A3: Р2 = лейцин
HLA-B7: Р2 = лейцин
Р9 = лизин
Р9 = пролин
Б. Участки связывания
MAPPQVLAFGLLLAAATATFAAAQEECVLENY KLAVNCFVNNNRQCQCTSVGAQNTVICSKL AAAKCLVMKAEMNGSKLGRRAKPEGALQNND GLYDPDCDESGLFKAKQCNGTSTCWCVNTA GVRRTDKDTEITCSERVRTYWIIIELKHKAREK PYDSKSLRTALQKEITTRYGLDPKFITSILYENN VITIDLVQNSQQKTQNDVDIADVAYYVEKDV KGESLFSHKKMDLTVNGEQLDLDPGQTLIYY VDEKAPEFSMQGLKAGVIAVIVVVVIAVVAGI VVLVISRKKRMAKIEKAEIKEMGEMHRELNA
В. Н1_А-А2-связывающие эпитопы белка из 314 АК
••TGSTA VPYGSFKHV DTRLQ • • •
Не АПК
KHVDTRLQ
Инфицированные вирусом клетки опухолевые клетки
Отсутствие презентации
АПК, клетки после воздействия у-И НФ
US2
US11
Г. Иммунопротеасома
Д. Механизмы, позволяющие избежать иммунного ответа
ДК медуллярного
уничтожение
Не АПК
Е. Центральная толерантность к собственным антигенам
Отсутствие Апоптоз/
костимуляции анергия
Ж. Периферическая толерантность к собственным антигенам
Система комплемента
Фундаментальные принципы
А. Активация комплемента
Для лизиса клеток или бактерий при помощи антител требуется «комплементарная» активность сыворотки. За эту активность сыворотки отвечает определенный набор протеаз, называемых компонентами комплемента Исторически сложилось, что белки этой системы обозначаются латинской буквой «С» (от англ, complement) и номером. Большинство компонентов комплемента являются зимогенами, т. е. неактивными проферментами, активируемыми путем протеолиза. Продукты протеолиза обозначаются дополнительными строчными буквами.
Белок СЗ, присутствующий в плазме крови в концентрации 1 г/л, играет в работе системы комплемента центральную роль. Существуют два пути активации комплемента — классический и альтернативный1. Оба приводят к образованию протеолитического комплекса, называемого С5-конвертазой.
Классический путь активации комплемента является антителозависимым. Собранные в кластеры иммуноглобулины (например, в иммунных комплексах) обладают высоким сродством к субкомпоненту С1 q белка С1. Связывание С1 q приводит к конформационным изменениям в С1 и к активации субкомпонентов С1 г и С1 s, в результате чего происходит протеолиз сывороточного белка 04 с образованием двух фрагментов С4а и С4Ь. Более крупный фрагмент С4Ь связывается с компонентом комплемента 02, который затем под действием С1 s распадается на С2а и С2Ь. Фрагмент С2а остается связанным с С4Ь, образуя СЗ конвертазу С4Ь2а. Эта конвертаза катализирует протеолиз СЗ с образованием СЗа и чрезвычайно активного фрагмента СЗЬ. С5 Конвертаза С4Ь2аЗЬ синтезируется как конечный продукт классического пути активации комплемента.
Небольшие количества СЗ постоянно гидролизуются в плазме до СЗа и СЗЬ. Альтернативный путь активации комплемента может активироваться при связывании СЗЬ с поверхностью микроорганизма. Благодаря взаимодействию с СЗЬ, плазменный фактор D катализирует расщепление плазменного фактора В на Ва и ВЬ. Вместе с СЗЬ фактор ВЬ образует комплекс СЗЬВЬ — альтернативную СЗ конвертазу. Связывание с пропердином (фактором Р) стабилизирует комплекс СЗЬВЬ Стабилизированный комплекс катализирует продолжение протеолиза СЗ (амплификация за счет вновь образующихся активированных фрагментов
1 Существует также третий путь — пектиновый (см. с. 72), в котором роль субкомпонента С1 q играет манно-зо-связывающий лектин, узнающий полисахариды, а роль субкомпонентов С1 г и С1 s — ассоциированная протеиназа, активирующая компоненты С4 и 02. — Прим. ред.
СЗЬ). Комплекс СЗЬВЬ связывает новые фрагменты СЗЬ, в результате чего образуется комплекс СЗЬВЬЗЬ — 05 конвертаза альтернативного пути активации комплемента.
Б. Заключительные стадии лизиса
Две протеолитические С5 конвертазы являются конечными продуктами классического и альтернативного путей активации комплемента. В обоих путях СЗЬ служит участком связывания сывороточного белка 05, который в результате протеолиза распадается на С5а и С5Ь. Фрагмент С5Ь способен связывать компоненты комплемента СВ и С7. Образующийся комплекс С5Ь67 является гидрофобным тримолекулярным комплексом, который легко связывается с двойным липидным слоем клеточной мембраны Компоненты комплемента 08 и 09 могут связываться с С5Ь67, образуя С5Ь6789, иначе называемый С5Ь-С9 комплексом. Компонент 09 образует полимерные комплексы, содержащие до 14 мономерных звеньев 09. Целый комплекс носит название комплекса, атакующего мембрану [membrane attack complex, МАС). Он проделывает поры в мембране клетки. Эндогенные клетки организма снабжены поверхностными белками, защищающими их от лизиса под действием МАС Например, CD59 связан с клеточной мембраной с помощью гликозил-фосфатидилинозитола (GPI). Поскольку GPI-заяко-ренные молекулы остаются «растворенными» в липидной мембране клетки, у них сохраняется высокая «латеральная подвижность». Молекулы CD59 ингибируют внедрение и полимеризацию 09. Нарушение функций GPI-заякоренных белков может привести к повышенной подверженности эритроцитов лизису под действием системы комплемента, как, например, при пароксизмальной ночной гемоглобинурии
68
Активация и эффекторы
С4Ь2а
(СЗ-конвертаза классического пути)
СЗа
С4Ь2аЗЬ (С5-конвертаза классического пути)
1. Классический путь
А. Активация комплемента
Спонтанный Контакт с микро-
2. Альтернативный путь
(до 14 молекул)
МАС-ингибитор CD59 ингибирует стабильное связывание С9
Нестабильное связывание С9
Стабильное связывание С9
Поли-С9, мембрано-1-----
атакующий комплекс (МАС)
Б. Заключительные стадии лизиса
Фундаментальные принципы
Система комплемента
Фундаментальные принципы
А. Защита аутологичных клеток путем регуляции активности системы комплемента
В сыворотке содержатся несколько регуляторных белков, предотвращающих атаку комплемента на нормальные клетки. Одним из этих белков является ингибитор протеазы С1, инактивирующий 01 г и C1s. Врожденная недостаточность ингибитора протеиназы С1 приводит к хронической и спонтанной активации комплемента, проявляющейся как тяжелые хронические отеки (ангионевротический отек).
Существует ряд других контролирующих активность комплемента белков, например, фактор ускорения распада (DAF) и рецептор комплемента первого типа (CR1). Фактор DAF ингибирует связывание С2 с С4Ь (рис. 1) и провоцирует диссоциацию существующих комплексов С4Ь2а (рис. 2). Рецептор комплемента CR1 оказывает похожее действие, а также способствует расщеплению С4Ь при помощи ферментативного фактора I (FI, рис. 3). Фактор I катализирует расщепление СЗЬ во многих местах. Сначала образуется промежуточный продукт iC3b, а затем фрагменты СЗс и C3dg. Фрагмент C3dg остается связанным с мембраной. Для выполнения своих функций фактору I требуется помощь CR1.
Б. Биологическая активность фрагментов комплемента: воспалительное действие
Расщепление СЗ и С5 приводит к образованию мелких фрагментов СЗа и С5а, вызывающих дегрануляцию базофилов и тучных клеток. Эти продукты расщепления называют анафилатоксинами. Активность С5а примерно в 100 раз превышает активность СЗа. Напротив, С4а обладает гораздо меньшей анафилактической активностью, которая приблизительно в 10 раз ниже активности СЗа. Активность анафи-латоксинов опосредована действием рецепторов, вызывающих сокращение гладких мышц, повышенную проницаемость сосудов, а также дегрануляцию базофилов и тучных клеток. Эта активность приводит также к хемотаксису и активации гранулоцитов, что стимулирует образование протеолитических ферментов и свободных радикалов.
В. Биологическая активность комплемента: иммунное действие
На заключительных этапах действия системы комплемента происходит направленный лизис бактерий путем образования клеточных пор (рис. 1). Покрытие клеток микроорганизмов компонентами комплемента [опсонизация] приводит к усилению фагоцитоза. Эта активность также предотвращает накопление опасного для организма избытка иммунных комплексов.
Существует четыре типа рецепторов комплемента:
• CR1 (или CD35) главным образом экспрессируется эритроцитами, нейтрофилами, моноцитами и макрофагами. Он связывает СЗЬ, С4Ь и iC3b и способствует фагоцитозу. Рецепторы CR1 на эритроцитах играют важную роль в удалении из циркуляции иммунных комплексов (рис. 2). Иммунные комплексы транспортируются в печень и в селезенку, где макрофаги, имеющие CR1 и Fc-рецепторы, могут удалить их с поверхности эритроцитов.
• CR2 (или CD21) в первую очередь экспрессируется на В-лимфоцитах, но также на некоторых Т-клетках и эпителиальных клетках. Он связывает C3d, iC3b и C3dg В В-клетках CR2 является частью В-клеточного корецепторного комплекса. Также является рецептором вируса Эпштейна-Барр.
• CR3 (CD18/CD11Ь) и CR4 (CD18/CD11с) являются членами семейства интегринов. Оба эти рецептора комплемента экспрессируются на клетках миелоидного ряда, в том числе на моноцитах, макрофагах, дендритных клетках и гранулоцитах, и оба связывают iC3b.
Иммунные комплексы, содержащие фрагменты комплемента, эффективно удаляются из циркуляции, главным образом за счет фагоцитоза, индуцируемого клетками, несущими рецепторы комплемента. Рецепторы комплемента и компоненты комплемента на клеточной мембране способствуют межклеточному взаимодействию (рис. 3). Взаимодействие между В-клетками и фолликулярными дендритными клетками посредством рецепторов комплемента и Fc-рецепто-ров играет важную роль в возникновении В-клеток памяти (рис. 4).
70
Регуляция и действие системы комплемента
Блокирование Усиление диссоциации
связывания С2а и С4Ь с помощью
Расщепление С4Ь и СЗЬ с помощью CR1/FI
DAF или CR1
А. Регуляция активности комплемента: защита аутологичных клеток
V/ V V v Сокращение гладких мышц ГII Повышение проницаемости кровеносных сосудов • • • • Дегрануляция базофилов Jр» » V* Хемотаксис, высвобождение Ог-радикалов и лизосомальных ферментов
СЗа + + + -
С4а (+) (+) (+) -
С5а ++++ ++++ + ++++
Б. Биологическая активность фрагментов комплемента: воспалительное действие
1. Антимикробное действие
2. Клиренс иммунных комплексов
Т-клетка
3. Адгезия клеток
В. Биологическая активность комплемента: иммунологическое действие
Фундаментальные принципы
Фундаментальные принципы
Врожденный иммунитет
А. Молекулярные структуры патогенов и узнающие их рецепторы
Эволюционно наиболее древняя система врожденного иммунитета основана на узнавании молекулярных структур патогенов, которые являются высококонсервативными среди микроорганизмов, но не экспрессируются в тканях хозяина. Узнавание осуществляют специфические рецепторы. которые экспрессируются в основном на фагоцитах.
Типичным примером молекулярной структуры патогена является бактериальная ДНК, для которой характерно большое количество неметилированных пар динуклеотидов цито-зин/гуанин (CpG). Эти олигонуклеотиды узнаются То11-подоб-ным рецептором 9 (TLR9). Идентифицировано по меньшей мере десять членов семейства Toll-рецепторов. Теперь известно, что TLR4 является рецептором липополисахарида (ЛПС) — основного компонента клеточной стенки грамотри-цательных бактерий. ЛПС-связывающий белок (ЛПБ) выступает в качестве опсонина (т. е. помечает молекулу), a CD14 является опсониновым рецептором для комплексов ЛПС и ЛПБ. Если конценцентрация ЛПС превышает физиологический уровень, то ЛПС может быть подвергнут эндоцитозу при участии рецепторов-мусорщиков. У грамположительных бактерий на поверхности клетки обычно присутствуют пептидогликаны, распознаваемые TLR2. Другими лигандами TLR2 являются липопротеины, липопептиды, пептидогликаны и ли-поарабиноманнан. Последний представляет собой гликолипид, характерный для микобактерий; с помощью молекул CD1 он может быть представлен Т-клеткам. Компоненты клеточной стенки дрожжей — зимозан и маннан — связываются с маннозным рецептором и подвергаются фагоцитозу. В этом процессе задействован также маннозосвязывающий белок, или лектин, действующий как опсонин.
Б. Рецепторы, распознающие патоген Выделяют три группы рецепторов, распознающих патогены: секретируемые, рецепторы эндоцитоза и сигнальные рецепторы.
Секретируемые патоген-распознающие молекулы представляют собой опсонины, которые связываются с клеточной стенкой микроорганизма, тем самым помечая их для последующей деградации системой комплемента или для фагоцитоза (рис. Б1). Наиболее изученным рецептором этого класса является маннозосвязывающий лектин — белок острой фазы, секретируемый печенью. Он распознает углеводы на поверхности бактерий, дрожжей, некоторых паразитических организмов и вирусов. Маннозосвязывающий лектин содержит две ассоциированные протеиназы MASP 1 и 2, соответствующие субкомпонентам С1 г и С1 s классического пути активации комплемента. При их активации происходит расщепление
компонента комплемента СЗ1, что запускает каскад активации комплемента (с. 68) — так называемый лектино-вый путь активации комплемента.
Рецепторы эндоцитоза экспрессируются на поверхности фагоцитов и способствуют захвату патогена и его доставке в лизосомы (рис. Б2). После деградации в лизосоме и процессирования антигена микробные пептиды могут быть представлены Т-клеткам при посредничестве молекул МНС класса II (приобретенный иммунитет). К данному классу рецепторов относятся маннозный рецептор и рецепторы-мусорщики. Маннозный рецептор узнает распространенный маннозный мотив на поверхности микробных клеток, а рецепторы-мусорщики связываются с клеточной стенкой бактерий, удаляя их из циркуляции.
В группу сигнальных патоген-распознающих рецепторов входят члены семейства Toll-подобных рецепторов (рис. БЗ). Наиболее изучен путь с участием рецептора TLR4, узнающего ЛПС. Молекула MD-2, необходимая для передачи сигнала этим рецептором, связывается с его внеклеточным доменом. Рецептор TLR4 имеет цитоплазматический домен, напоминающий аналогичный домен рецептора ИЛ-1 Можно выделить следующие стадии передачи сигнала: связывание адаптерной молекулы MyD88, активация киназы IRAK (киназа, связанная с рецептором ИЛ-1) и адаптерной молекулы TRAF6 (фактор 6, связанный с рецептором ФИО), вовлечение митоген-активируемых протеинкиназ МАРК и, наконец, высвобождение транскрипционного фактора NFkB из ингибиторного комплекса 1кВ, что индуцирует транскрипцию генов иммунного ответа.
В. Дендритные клетки как связь между врожденным и приобретенным иммунитетом
Дендритные клетки (ДК) экспрессируют сигнальные патоген-распознающие рецепторы типа TLR, а также рецепторы эндоцитоза типа рецепторов-мусорщиков. Рецепторы TLR воспринимают ЛПС как часть клеточной стенки гра-мотрицательных бактерий и опосредуют проведение сигнала, приводящего к секреции провоспалительных цитокинов и хемокинов. Врожденный иммунитет активируется за несколько часов. Рецепторы-мусорщики участвуют в фагоцитозе и уничтожении бактерий. Кроме того, TLR стимулируют созревание ДК и способствуют повышению уровня экспрессии костимуляторных молекул типа CD80/CD86, что стимулирует презентацию микробных пептидов. Спустя 3-5 дней стимуляция дендритными клетками приводит к клональной экспансии антиген-спе-цифических эффекторных Т-клеток и Т-хелперов, являющихся элементами системы приобретенного иммунитета.
1 СЗ конвертазой, образующейся в результате расщепления С4 и С2. — Прим. ред.
72
Молекулярные структуры патогенов и узнающие их рецепторы
Бактериальная ДНК ХХХХХХХХ
Микобактерии
Дрожжи
Г рам положительные бактерии
Г рам отрицательные бактерии
Молекулы патогенов Клеточные рецепторы
CpG —► Toll-подобный рецептор 9
___ Рецепторы-мусорщики,
ЛПС —► ЛПБ, CD14, TLR-4
Липопротеины —► Toll-подобный рецептор 2
Пептидогликаны —CD14, TLR-2
Липоарабиноманнан —► CD1, TLR-2 м __ Маннозный рецептор,
маннан маннозосвязывающий белок
Зимозан
Маннозный рецептор, рецепторы Р-глюкана, TLR-2
А. Молекулярные структуры патогенов и узнающие их рецепторы
MASP1 MASP2
Маннозосвязывающий лектин
комплемента СЗа
1. Секретируемые патоген-распознающие рецепторы Маннозный
Рецептор-мусорщик
МНС II
Презентация
2. Патоген-распознающие рецепторы эндоцитоза
—MD-2
Бактериальный липополисахарид
2CD14
Адаптерные белки 1KAF6
МАРК
1кВ
NFkB
3. Сигнальные патоген-распознающие рецепторы
Б. Рецепторы, распознающие патоген
ИЛ-1, ИЛ-12
Toll-подобный рецептор
МНС II
Рецептор эндоцитоза
CD80/86 CD28
1 рованная Т-клетка
В. Дендритные клетки как связь между врожденным и приобретенным иммунитетом
2>0<0<0<>0<Z>0<
Ядро
Активация генов, участвующих в воспалительном и иммунном ответе
Клональная экспансия
Фундаментальные принципы
Фундаментальные принципы
Миграция лейкоцитов
А. Адгезия лейкоцитов и экстравазация
Лимфоциты могут выйти из циркуляции, пройдя сквозь слой эндотелия. Специализированный эндотелий посткапиллярных венул лимфоузлов и пейеровых бляшек состоит из необычайно крупных клеток, называемых высокими эндотелиальными венулами (HEV); он способствует миграции лейкоцитов. В воспаленных тканях миграция активизируется. На первой стадии этого процесса циркуляция лейкоцитов замедляется благодаря действию молекул адгезии. Этот процесс осуществляется при помощи селектинов: лейкоциты экспрессируют L-селектин, а эндотелиальные клетки экспрессируют Е-селектин и Р-селектин (также обнаружены на тромбоцитах). Все типы селектинов связывают сиаломуцин-подобные гликопротеины типа сиа-лил-Льюисх, например PSGL-1 (P-selectin glycoprotein ligand-1) — наиболее важный лиганд для Р-селекти-на, но также и для Е- и L-селектинов. Кроме того, L-селектин связывается с аддрессинами типа PNAd (peripheral node addressin), характерными для периферических лимфоузлов, и MAdCAM-1 (mucosal addressin cell adhesion molecule-1), характерными для пейеровых бляшек. Из-за низкой аффинности такие адгезионные связи легко разрываются и вновь образуются все дальше и дальше, способствуя медленному перекатыванию лейкоцитов Торможению и перекатыванию лейкоцитов также способствуют а-интегрины типа (хдр'] (другое название VLA-4) и адРу. Однако образованных селектинами связей недостаточно для остановки лейкоцитов. Эндотелиальные клетки секретируют хемокины, которые связывают специфические хемокиновые рецепторы катящихся лейкоцитов, имеющие семь трансмембранных доменов (7TMR). В результате быстрой активации р2-интегринов, например cxLp2 (LFA-1, CD11a/CD18) или схмр2 (Мас-1, CD11b/CD18), а также оц-интегринов, происходит связывание некоторых молекул адгезии, принадлежащих к суперсемейству иммуноглобулинов, например, ICAM-1 (CD54), ICAM-2 (CD1O2), VCAM-1 (CD106) и MAdCAM-1. Это способствует более прочному связыванию лейкоцитов, которые, наконец, останавливаются и мигрируют в эндотелий.
Б. Миграция Т-клеток
Для обнаружения антигенов Т-лимфоциты периодически мигрируют ко вторичным лимфоидным органам. После активации опосредованной селектинами адгезии Т-лимфоциты начинают перекатываться по эндотелию и на высоких эндотелиальных венулах (HEV) встречаются с хемокином вторичных лимфоидных тканей (secondary lymphoid tissue chemokine, SLC). Хемо-кин SCL образуется клетками HEV и стромальными клетками в Т-клеточной зоне вторичных лимфоидных
органов. Т-клетки экспрессируют хемокиновый рецептор CCR7, являющийся рецептором для SLC и ELC (Epstein-Barr virus-induced receptor ligand chemokine, другое название MIP-Зр (macrophage inflammatory protein-Зр)). Передвижение Т-клеток осуществляется под действием SLC, образуемого стромальными клетками, и ELC, образуемого дендритными клетками и макрофагами в Т-клеточной зоне лимфоузла. Т-клетки памяти экспрессируют меньше CCR7, чем наивные Т-клетки, поэтому они менее способны проходить сквозь лимфатические узлы. При повторной стимуляции антигеном они вновь быстро реагируют с SLC и ELC. Клетки типа Тн2 также характеризуются низким уровнем экспрессии CCR7, в связи с чем они не мигрируют в Т-клеточную зону, а обнаруживаются в основном на границе В-клеточной зоны лимфоузла, где оказывают помощь В-клеткам.
В. Миграция В-клеток
В-клетки могут встретиться с антигенами в кровотоке, лимфатических узлах или селезенке. Они также могут распознать антиген на поверхности антигенпрезентирующих клеток или фолликулярных дендритных клеток (ФДК) внутри фолликулов. В-Лимфоциты привлекаются в лимфоузлы хемоаттрактантом В-лим-фоцитов (B-lymphocyte chemoattractant, BLC), образуемым ФДК и стромальными клетками. Соответствующим рецептором для BLC на В-лимфоцитах является хемокиновый рецептор CXCR5.
Г. Миграция дендритных клеток в воспаленные ткани
В местах воспаления микробные антигены захватываются эпидермальными клетками Лангерганса (КП). Микробные компоненты типа липополисахарида (ЛПС) инициируют созревание КЛ, которые затем перемещаются в дермальные лимфатические сосуды. ЛПС индуцирует секрецию воспалительных цитокинов типа ФНО-а и хемокинов М1Р-1а, МСР-1, ИЛ-8 и RANTES дермальными ДК и макрофагами. Это привлекает незрелые ДК, экспрессирующие соответствующие хемокиновые рецепторы CCR1, CCR2, CCR5, CCR6 и CXCR1. В процессе созревания происходит снижение уровня экспрессии перечисленных рецепторов, и в результате ДК могут покинуть участок воспаления В это же время повышается уровень экспрессии хемокиновых рецепторов CCR7 и CXCR4. Зрелые ДК, экспрессирующие CCR7, привлекаются эндотелиальными клетками дермальных лимфатических сосудов, экспрессирующими лиганд CCR7 (SLC), а затем перемещаются в субкапсулярные синусы региональных лимфатических узлов. Здесь под действием градиентов ELC и SLC они продвигаются в Т-клеточные зоны.
Адгезия и миграция лейкоцитов
А. Адгезия лейкоцитов и экстравазация
♦активированный
Фундаментальные принципы
CCR1 CCR2 CCR5 (CCR6)
Незрелая ДК
Миграция в лимфатический узел
Г. Миграция дендритных клеток в воспаленные ткани
Патологии иммунитета и толерантность
Фундаментальные принципы
Слишком сильные реакции на чужеродные антигены могут привести к повреждению тканей организма. Подобные реакции называют реакциями гиперчувствительности и подразделяют на четыре типа. Реакции типа I-III протекают с участием антител, а реакции типа IV опосредованы действием Т-клеток.
А. Типы реакций гиперчувствительности
Тип I: реакция гиперчувствительности немедленного типа. Некоторые антигены (аллергены), например, яды насекомых, пищевые продукты, пыльца и пылевой клещ могут способствовать образованию IgE у индивидов, имеющих определенную предрасположенность (атопия; см. также с. 216). Антитела IgE посредством Fc-рецепторов связываются с тучными клетками (сенсибилизация). Если индивид подвергается повторному воздействию аллергена, то происходит перекрестное сшивание мембраносвязанного IgE. Это приводит к немедленному высвобождению медиаторов (гистамин, кининоген), способствующих расширению кровеносных сосудов, сокращению гладких мышц, выделению слизи, отекам и появлению волдырей на коже Большинство аллергенов представляют собой небольшие белки, способные легко диффундировать сквозь слой кожи или слизистой оболочки. Они часто обладают протеазной активностью и активны в очень низких дозах. Интерлейкин 4 способствует дифференцировке клеток типа Тн2. Точный механизм, заставляющий В-клетки продуцировать IgE, остается неизвестным.
Тип II: опосредованная антителами цитотоксическая реакция. Характерным примером реакции этого типа является иммунизация антигенами эритроцитов в процессе беременности (см. также с. 128). Ребенок, унаследовавший от отца антиген эритроцита RhD, может вызвать иммунную реакцию против этого антигена у RhD- матери. Сенсибилизация обычно происходит в процессе родов, когда кровь плода приходит в контакт с элементами иммунной системы матери. В последующих беременностях материнские анти-RhD антитела (тип IgG) могут проходить сквозь плаценту и вызывать тяжелый гемолиз RhD 4- эритроцитов плода.
Другие примеры. Лекарства (пенициллин) могут пассивно связываться с эритроцитами. Антитела, направленные против пенициллина, могут приводить к лизису эритроцитов (см. также с. 136). При воспалительных процессах в почках может происходить образование антигенов против гломерулярной базальной мембраны (ГБМ) (см. также с. 238). В результате перекрестной реакции данных антител с базальной мембраной легкого может возникнуть повреждение легкого, сопровождаемое легочным кровотечением и
почечным воспалением (гломерулонефрит) (синдром Гудпасчура).
Тип III: реакция, опосредованная иммунными комплексами. В процессе иммунного ответа могут образовываться комплексы антиген-антитело (иммунные комплексы). Иммунные комплексы способны осаждаться на стенках сосудов, на базальной мембране легкого и почек, а также в суставах (синовии). В этих участках иммунные комплексы могут индуцировать воспалительный процесс через фрагменты компонентов комплемента СЗа и С5а (анафилатоксины).
Особым случаем реакций этого типа является феномен Артюса: при проникновении антигена в кожу человека, у которого уже выработались антитела IgG, иммунные комплексы связываются с Fc-рецепторами большинства клеток, вызывая их дегрануляцию; происходит рекрутирование воспалительных клеток и активация комплемента, в результате высвобождается С5а и наблюдается локальное воспаление, накопление тромбоцитов и в конечном итоге закупорка сосуда и некроз.
Тип IV: реакция гиперчувствительности замедленного типа. Гаптены — это молекулы с очень малой мол. массой (часто менее 1 кДа). Они слишком малы, чтобы самостоятельно являться антигенами, но они способны проникать в эпидермис и связываться с некоторыми белками кожи (носителями). Комплексы гаптенов и белков-носителей связываются антигенпрезентирующими клетками в коже (клетками Лангерганса) и переносятся в региональные лимфатические узлы (см. также с. 57). Затем в лимфоузлах происходит стимуляция Т-клеток. Так называемая фаза сенсибилизации длится около 10-14 дней Если индивид ранее уже подвергался воздействию гаптена, то антиген-спе-цифичные Т-клетки мигрируют в кожу, где происходит их накопление и пролиферация. Они также вызывают отеки и локальные воспаления при участии цитокинов. Типичными веществами, вызывающими реакции гиперчувствительности замедленного типа, являются никель и хром, а также химические вещества в составе резины (см. также с. 214).
76
Реакции гиперчувствительности
Антиген
Яды насекомых
Пища Пыльца Пылевой клещ
Секреция слизи
Второй контакт с Ад
4
Антиген
Повышение к проницаемости 2
IgE - ->
I Крапивница
Базофилы/ тучные клетки
Тип I: реакция гиперчувствительности немедленного типа
Дегрануляция, высвобождение медиаторов
Антиген
Комплемент
После родов
Мать (RhD)
Плод (RhD+)
2-я беременность
Нефрит
Лизис
Выделение ферментов, повреждение клеток
Пенициллин
1-я беременность
Анти-ГБМ антитела
Легочное кровотечение
Иммунные комплексы
Отложения иммунных комплексов
Фундаментальные принципы
Тип II: опосредованная антителами цитотоксическая реакция
Тип III: реакция, опосредованная иммунными комплексами
Гаптен
Лимфатический узел
Дермис
Лимфатическая система
Эпидермис
Повторная встреча с гаптеном/антигеном
Клетка Лангерганса
| Комплекс
I гаптен/ носитель
Образование антиген-специфических Т-клеток
Тип IV: реакция гиперчувствительности замедленного типа
А. Типы реакций гиперчувствительности
Патологии иммунитета и толерантность
Фундаментальные принципы
А. Индукция Т-клеточной толерантности антигенпрезентирующими дендритными клетками
Индукцию центральной толерантности мы продемонстрируем на экспериментальной модели. Из срезов тканей селезенки, взятой от взрослой мыши линии А, были приготовлены образцы, содержащие дендритные клетки. Эти клетки инкубировали со зрелыми Т-клетками, взятыми от мыши линии В Как и ожидалось, это привело к активации и реакции клеток мыши линии В. Однако этого не происходило, когда образцы чужеродных клеток линии А инкубировали с незрелыми тимусными клетками линии В. В данном случае наблюдалось специфическое отсутствие реакции — толерантность. По всей видимости, толерантность явилась результатом дородового контакта с чужеродными дендритными клетками. Таким образом, предродовая фаза развития и послеродовой период играют чрезвычайно важную роль в развитии толерантности, т. е. в предотвращении развития аутоиммунных реакций в будущем (см. также с. 68).
Б. Индукция периферической толерантности
Дородовые и послеродовые механизмы селекции работают в том случае, если потенциальный аутоантиген попадает в тимус до рождения. Без презентации антигена аутореактивные Т-клетки избегают отрицательной селекции в тимусе. Они, однако, могут быть уничтожены периферическими механизмами толерантности, например, под действием регуляторных клеток (см. также с. 84). Пока работает данный механизм, иммунные реакции невозможны.
Кроме активных механизмов супрессии, также важно, что потенциально аутореактивные Т-клетки не способны узнавать свои антигены, если они «спрятаны» (во внесосудистом или внутрисосудистом пространстве) или не представлены соответствующим образом специализированными антиген-презентирующими клетками (антигены «избегают узнавания», см. также с. 82) Также важно, что клетки большинства органов не несут вспомогательных молекул, участвующих в активации Т-клеток. Поэтому иммунный ответ не может развиваться, даже если клетка связана с помощью Т-клеточного рецептора.
С другой стороны, контакт с аутоантигенами может привести к исчерпанию реактивных клеток, модуляции TCR и, наконец, к анергии.
В. Трансгенные мыши
Важные теории относительно причин возникновения и предупреждения толерантности были выдвинуты в результате экспериментов с трансгенными мышами и крысами. Один или более чужеродных генов вводили в зародышевые клетки животных (микроинъекция ДНК соответствующих генов в пронуклеус оплодотворенной яйцеклетки). Яйцеклетки затем имплантировались суррогатным матерям. Детеныш, развившийся из такого зародыша, был «трансгенным». Другими словами. чужеродные гены были внедрены в гены зародыша и передались потомству. Такая экспериментальная система имеет одно решающее преимущество перед предыдущими моделями: продукт гена с данным толерогенным свойством существует в развивающемся организме от самого момента рождения. Нет необходимости искусственно вводить его позднее.
78
Индукция и предотвращение толерантности
А. Индукция Т-клеточной толерантности антигенпрезентирующими ДК
Аутоантиген/ отсутствие презентации
у Зрелая Т-клетка
4. Д»
Чужеродный/ узнаваемый антиген
Т-клеточный рецептор
Корецептор
Отсутствие Удаление, узнавания уничтожение
Анергия
TCR/ корецеп-торные модуляции
Регуляторные клетки
Б. Механизмы индукции периферической толерантности
Фундаментальные принципы
Патологии иммунитета и толерантность
Фундаментальные принципы
А. Индукция аутоиммунного ответа посредством активированных вирусом Т-клеток
Аутореактивные Т-клетки не могут активироваться клетками-мишенями в отсутствие костимулирующего сигнала (см. также с. 78). Т-клеточная активация и разрушение клетки-мишени может происходить только после того, как антиген был представлен Т-клетке специализированными антигенпрезентирующими клетками (АПК), например, при инфекции.
В описанном выше эксперименте были получены трансгенные по двум генам мыши с Т-клетками, несущими один и тот же Т-клеточный рецептор, направленный против белка вируса лимфоцитарного хорио-менингита (LCMV). Кроме того, ген вирусного белка был связан с промотором гена инсулина и введен животным той же линии. Таким образом, все островковые клетки экспрессировали данный белок через свои молекулы МНС. Теоретически, островковые клетки должны были быть быстро уничтожены поскольку все они несли молекулу, распознаваемую цитотоксическими Т-клетками. Однако на практике дородовая толерантность не развилась, поскольку трансгенный продукт, по всей видимости, не попадал в тимус. Не произошло Т-клеточной реакции, и у животных не развился сахарный диабет. С другой стороны, прямое инфицирование животных вирусом лимфоцитарного хо-риоменингита привело к активации Т-лимфоцитов и разрушению островковых клеток. Только в этом случае цитотоксические Т-лимфоциты получили костиму-лирующий сигнал через антигенпрезентирующие клетки и активировали Т-хелперы.
Б. Индукция синтеза антител
с помощью Т-клеток
после опосредованной аутоантителами презентации антигена
Аутореактивные В-клетки не могут активироваться и синтезировать антитела без помощи Т-клеток. Однако при участии их клеточных иммуноглобулинов они способны узнать, связать, процессировать и представить молекулы, содержащие эндогенные (аутоантигены) и чужеродные антигены. После процессирования таких антигенов В-клетки представляют чужеродный компонент антигена Т-клетке с помощью молекулы МНС. Затем Т-клетка передает сигналы помощи В-клетке. В таком случае В-клетки распознают аутоантиген и секретируют соответствующие аутоантитела.
В. Индукция аутоиммунного ответа посредством молекулярной мимикрии
В соответствии с теорией молекулярной мимикрии некоторые антигены, например антигены вирусов или бактерий, имеют значительное сходство с эндогенными структурами. Из-за этого сходства при проникновении антигена клетки организма атакуют как чужеродные, так и эндогенные молекулы.
Г. Индукция аутоиммунного ответа в результате вирусной инфекции посредством аномальных антигенов МНС класса II
При многих аутоиммунных заболеваниях антигены HLA класса II обнаруживаются на клетках-мишенях, причем у здоровых индивидов соответствующие клеточные системы отсутствуют. Возможным участником такой аномальной экспрессии антигенов класса II может выступать у-ИНФ. Вирус инфицирует определенную группу клеток, и его поверхностные молекулы воспринимаются как чужеродные специфическими Т-лимфоцитами. В процессе защитной реакции Т-лимфоциты секретируют у-ИНФ, способствующий индукции антигенов класса II в ранее не вовлеченных в процесс клетках. Эта аномальная экспрессия антигенов класса II, не экспрессируемых в нормальных условиях, может заставить аутореактивные Т-клетки воспринять аутоантигены на клеточной поверхности как чужеродные и в конце концов разрушить эндогенные клетки.
80
Механизмы аутоиммунных реакций (I)
А. Индукция аутоиммунного ответа Т-клетками, активированными вирусом
Антиген
I Чужеродная часть
Аутоанти
I генная часть
Процессинг
В-клетка
Поверхностный иммуноглобулин
Т-клеточный рецептор
Презентация антигена HLA класса II
Аутоантитела
Помощь
Аутологичная клетка
Т-клетка
Фундаментальные принципы
В. Индукция аутоиммунного ответа посредством молекулярной мимикрии
Клетка-мишень Т-клетка,
и вирус узнающая
Вирусный вирусный Ад
Т-клетка, узнающая ауто-Ад клетки
антиген
Т-клетка
Б. Индукция синтеза антител после опосредованной аутоантителами презентации антигена
Повреждение
Г. Индукция аутоиммунного ответа в результате вирусной инфекции посредством аномальных антигенов МНС класса II
Фундаментальные принципы
Патологии иммунитета и толерантность
А. Индукция аутоиммунного ответа в результате нарушения регуляторных механизмов
Периферические регуляторные механизмы сохраняются даже после инактивации клонов аутореактивных Т-клеток в тимусе (см. с. 23). Регуляторной функцией могут обладать как CD8+, так и CD4+ Т-клетки. После потери этих регуляторных клеток может развиться аутоиммунная реакция.
Кроме клеточных механизмов, для предотвращения толерантности существуют также гуморальные механизмы. Антиидиотипические антитела, направленные против детерминант гипервариабельных областей других антител, образуют антиидиотипическую сеть (согласно N. Jerne), вносящую вклад в развитие толерантности. Нарушения в работе этой сети, вызванные потерей антиидиотипических антител или преобладанием патогенных аутоантител, приводят к отмене толерантности. Искусственное введение, например, нормальных иммуноглобулинов может восстановить баланс сети.
Б. Органоспецифические
и неспецифические аутоиммунные заболевания
Аутоиммунные заболевания могут быть направлены против специфических органов или тканевых структур (системное аутоиммунное заболевание).
В. Изолированные антигены
Концепция изолированых антигенов сложилась в результате исследований, показавших, что, например, после повреждения глаза в здоровом глазу внезапно развиваются симптомы симпатической офтальмии. Таким образом, некоторые отделы организма не доступны для действия иммунной системы, т. е. являются «изолированными». Это касается не только белков хрусталика глаза, но также хрящевой и тестикулярной ткани. Как только подобная изоляция нарушается, например, в результате повреждения или серьезного воспаления, иммунная система получает доступ к ткани и воспринимает ее как «чужеродную».
Г. Связь между заболеваниями и системой HLA
Для развития аутоиммунного заболевания необходимо наличие двух факторов: генетического и фактора окружающей среды (факторы реализации). При наличии генетической основы (предрасположенности) факторы окружающей среды могут способствовать развитию аутоиммунного заболевания. Поскольку определенный набор HLA связан с предрасположенностью к некоторым заболеваниям, то система HLA (с. 60-69) является важным детерминантом генетического фактора. Некоторые антигены HLA часто ассоциированы со специфическими проявлениями аутоиммунных заболеваний (в таблице для простоты использована старая номенклатура). Например, спондилоартрит ассоциирован с наличием антигена HLA-B27, поэтому диагностика данного заболевания значительно упрощается при обнаружении данного антигена. Некоторые наиболее важные ассоциации перечислены ниже.
• Ассоциации I класса: серонегативный спондилоартрит и HLA-B27;
• Ассоциации II класса: ревматоидный артрит (хронический полиартрит) и HLA-DR4 и HLA-DR1; сахарный диабет первого типа и HLA-DR3 и HLA-DR4; нарколепсия и HLA-DR2.
Нарколепсия настолько часто связана с наличием HLA-DR2, что относительный риск не может быть рассчитан по формуле: относительный риск = (число пациентов с антигеном HLA х число контрольных пациентов без антигена HLA)/ (число пациентов без антигена HLA х число контрольных пациентов с антигеном HLA).
82
Механизмы аутоиммунных реакций (II)
Презентация ауто-Ад
Аутоагрессивные эффекторные функции
Орган-специфические Не орган-специфические заболевания заболевания
А. Индукция аутоииммунного ответа
в результате нарушения регуляторных механизмов
____
Спрятанные л антигены
----
Яички
Мозг PC Головной мозг СКВ
Хрящи Нос
Полихондрит Щитовидная железа Зоб Хашимото, Гранулематоз Вегенера
первичная микседема Легкое
тиреотоксикоз Склеродермия,
(болезнь Грейвса) MCTD, гранулематоз
Желудок Пернициозная анемия — Вегенера Мышцы/
Печень кожа
ПБЦ, аутоиммунный Дерматомиозит
гепатит Почки
г. СКВ,
Поджелудочная \ ' гранулематоз
железа Вегенера
Ювенильный диабет
Кишечник Суставы
Болезнь Крона, Ревматоидный
язвенный колит 1 / артрит
Костный мозг
Аутоиммунная Кожа
гемолитическая анемия Склеродермия,
ИТП Кожа Пемфигоид СКВ
Фундаментальные принципы
В. Изоляция антигенов
Б. Орган-специфические и неспецифические аутоиммунные заболевания
Болезнь Аллель* Частота встречаемости (%)
Пациенты Контроль Относительный риск
Болезнь Бехчета В5 41 10 6,3
Анкилозирующий спондилоартрит В27 90 9 87,4
Синдром Рейтера В27 79 9 37,0
Острый передний увеит В27 52 9 10 4
Подострый тироидит В35 70 15 13,7
Псориаз Cw6 87 33 13,3
Герпетиформный дерматит DR3 85 26 15,4
Целиакия DR3 79 26 10,8
Болезнь Грейвса DR3 56 26 3,7
Сахарный диабет первого типа DR3 и(или) DR4 91 57 7,9
Миастения гравис DR3 50 26 2,5
Системная красная волчанка DR3 70 26 5,8
Идиопатическая мембранозная нефропатия DR3 75 26 12,0
Нарколепсия DR2 100 25 н.о.
Рассеянный склероз DR2 59 25 4,1
Ревматоидный артрит DR4 50 19 4,2
Зоб Хашимото DR5 19 6 3,2
Пернициозная анемия DR5 25 6 5,4
Ювенильный хронический артрит DRw8 23 8 3,6
Г. Связь между заболеваниями и системой HLA («старая номенклатура)
Апоптоз
Фундаментальные принципы
Для нормального развития организма и поддержания баланса между образующимися и отмирающими клетками [гомеостаза) клетки должны постоянно умирать. Этот процесс регулируется программируемой клеточной смертью (своеобразным «самоубийством» клеток), морфологическим проявлением которой является апоптоз Апоптоз играет важную роль в правильном функционировании иммунной системы.
А. Различие между некрозом и апоптозом Клеточный некроз возникает в результате серьезных повреждений, например, ожога, кислородной недостаточности (сердечный приступ) или травмы При некрозе клеточные мембраны теряют свою целостность. В результате клетки разбухают и их содержимое вместе с определенными токсическими веществами попадает в окружающие ткани, вызывая воспалительную реакцию.
Напротив, апоптоз является весьма утонченным процессом. Первыми признаками апоптоза служат конденсация хроматина и сжатие клетки. Затем клеточная мембрана формирует небольшие пузыри. Процесс этот называется блеббингом. Клетка начинает выталкивать свое содержимое внутрь везикул, в некоторые из которых попадают части фрагментированного и конденсированного (пикнотичного) ядра Везикулы далее поглощаются и разрушаются макрофагами Поскольку цитоплазматические ферменты и токсичные метаболиты все время остаются окруженными мембраной, никакой воспалительной реакции не происходит.
Б. Регуляция апоптоза
Апоптоз является генетически регулируемым процессом, для которого требуется запас энергии и синтез определенных белков. Фрагментация клеток при апоптозе может стимулироваться набором сигналов, в том числе и физиологическими стимулами, например, связыванием антигена. Это происходит, например, в тех случаях, когда стимулы не подкрепляются вспомогательными сигналами (см. с. 48).
Поверхностные молекулы типа CD95 (АРО-1 или Fas-антиген) являются важными медиаторами апоптоза. Молекула CD95 принадлежит к рецепторным белкам семейства ФНО/ФРН (фактор роста нервов). При активации АРО-1/Fas-лигандами CD95 посылает в ряд клеток сигнал апоптоза. Апоптоз может запускаться при нарушении межклеточных контактов [аноикис), удалении ростовых факторов глюкокортикоидами гипертермии или действии гранзимов (см. с. 50). Общим внутриклеточным медиатором может быть окислительный стресс, который вызывает активацию нуклеаз, расщепляющих ДНК на фрагменты При электрофорезе подобной ДНК обнаруживается лестница из
фрагментов, являющаяся типичной для апоптоза картиной (рис. В).
Апоптоз сопровождается активацией ряда генов. Одним из наиболее важных является ген интерлейкин-1 р-конвертирующего фермента (interleukin-1 р converting enzyme, ICE). Для начальной фазы апоптоза также характерно повышение уровня экспрессии генов с-тус, р53 и пиг77. С другой стороны, ген bcl-2 кодирует белок, предотвращающий апоптоз. Высокий титр этого белка обнаруживается в клетках кортикальной зоны фолликулов, успешно осуществивших перестройку генов иммуноглобулинов, однако он не обнаруживается в зародышевых центрах, где скорость апоптоза очень велика. Продукты генов Ьах и bad являются антагонистами продукта гена bcl-2, поэтому активация данных продуктов способствует апоптозу. Ген Ьах образует комплекс с белком bcl-2, тем самым инактивируя его. Белок bcl-X, родственный белку bcl-2, существует в двух формах: антиапоптотический длинный сплайсинговый вариант ЬЫ-Xl и проапоптотический короткий сплайсинговый вариант Ьс1-Хд. Снижение уровня экспрессии Ьах и других способствующих апоптозу генов может играть роль в развитии новообразований.
В. Активация каспаз митохондриями Индукторы апоптоза, такие как церамид, оксиданты, Ьах, кальций и активированные каспазы, могут способствовать выработке митохондриями цитохрома с. Каспазы (цистеин/аспартат-протеиназы) расщепляют клеточные белки и способствуют гибели клеток. После выхода в цитозоль цитохром с связывается с адапторной молекулой Apaf-1, активирующей прокаспазу-9. Данный комплекс называется апоптосомой. Каспаза 9 в свою очередь активирует каспазы 3 и 7, что приводит к фрагментации ДНК и апоптозу. Действие каспаз ингибируется белками-ингибиторами IAP (inhibitors of apoptosis proteins).
Г. Фагоцитоз апоптозных клеток
В процессе апоптоза на поверхности клетки появляется фосфатидилсерин (ФС). Рецепторы-мусорщики А и рецептор эндотоксина CD14 могут связываться с ФС Рецептор витронектина взаимодействует с рецептором тромбоспондина (TSP) CD36 для связывания TSP Действие этих рецепторов индуцирует перестройку актина, что приводит к интернализации апоптотиче-ских клеток. Уровень экспрессии провоспалительных цитокинов и хемокинов снижается.
84
Апоптоз
Ишемия Гипертермия Гипотермия Физическое или химическое повреждение Травма
Конденсация хроматина
Сжатие клетки, образование
пузырьков мембраны
Изоляция Сегментация ядра, хроматина фрагментация ДНК
Апоптоти-ческие везикулы
Фагоцитоз: отсутствие воспаления
А. Различие между некрозом и апоптозом
Apo-l/Fas-антиген (CD95) Рецептор
Т/В-клеточных антигенов
Гены
Рецептор глюкокортикоида
Потеря межклеточных контактов
О7, Н2О2 ОН NO
Повреждение ДНК (УФ, радиация)
Выживание
Апоптоз
о ° о о Высвобождение о о°о ° ° цитохрома с
Гипертермия
апоптоз
- bcl-2
- bcl-xL Rb
Б. Регуляция апоптоза
Гранзимы
Потеря факторов роста
Эффекторные гены
- пиг77
- с-тус g
-ICE
Гены, вызывающие апоптоз
- Ьах Й
- bad g
- bcl-xs
(ГГТТТТИ Арам
Про-каспаза 9
V
Активацйядругих каспаз, апоптоз
В. Активация каспаз митохондриями
Апоптотическая клетка
Актин
Противовоспалительный ответ
ФНО-а^ ИЛ-1|ЗФ MCP-U ИЛ-8>Ь
Г. Фагоцитоз апоптотических клеток
Фундаментальные принципы
Лабораторные методы
Взаимодействие антиген — антитело
Лабораторные методы
А. Кривая преципитации
(кривая Гейдельбергера)
Методы осаждения (преципитации) используют для определения концентрации антигенов или антител. Реакции проводят в твердой фазе (радиальная иммунодиффузия, иммуноэлектрофорез) или в жидкости (турбидиметрия, нефелометрия).
Кривую преципитации Гейдельбергера можно объяснить следующим образом. Растворимые иммунные комплексы образуются в зоне избытка антител (низкое значение соотношения Ag/Ab). При этом количество образующихся комплексов пропорционально концентрации антигенов. По мере добавления антигена приближается зона эквивалентных концентраций антигенов и антител. Здесь образуется видимыи осадок нерастворимых иммунных комплексов. Далее, в зоне избытка антигенов присутствуют главным образом растворимые иммунные комплексы. Концентрация растворимых комплексов возрастает по мере роста концентрации антигенов, т.е. ситуация сходна с той, что наблюдается при очень низкой концентрации антигенов. Поэтому тестовый образец следует разводить до такой концентрации антигена, которая соответствует восходящей ветви кривой, где результат пропорционален концентрации антигена.
Б. Преципитация и агглютинация
Реакции преципитации. Иммунные комплексы образуются в результате взаимодействия антитела и молекулярных антигенов. При иммунопреципитации антиген вводят в образец с известной концентрацией антител до момента появления осадка, когда соотношение ан-тиген/антитело достигает зоны эквивалентности.
Реакции агглютинации. Иммунные комплексы образуются в результате взаимодействия антитела и антигенных частиц. Существуют методы прямой агглютинации (например, тест на гемагглютинацию для определения типа крови и реакция Видаля при бактериальной инфекции), а также непрямой агглютинации (например, латексная агглютинация и реакция Бойдена на пассивную гемагглютинацию).
В. Реакции преципитации в жидкой фазе Турбидиметрия. Образцы, содержащие антиген, помещают в кювету, где они реагируют с избытком антисыворотки, содержащей соответствующие антитела. Образуются растворимые иммунные комплексы. Из
менение мутности в кювете определяют фотометрически. Увеличение поглощения через определенный промежуток времени может служить мерой концентрации антигена.
Нефелометрия. Этот метод также основан на принципе образования иммунных комплексов в реакции антигенов и антител. Сквозь кювету пропускают лазерный луч, который рассеивается при встрече с иммунными комплексами Рассеянный свет с помощью линз направляют на фотометр. Концентрацию антигена определяют, сопоставляя полученный сигнал с калибровочной кривой.
Г. Простая радиальная иммунодиффузия (метод Манчини)
В данном методе используют пластинку из агара, покрытую ровным слоем геля, содержащего подходящие антитела. Образцы антигена помещают в лунки на пластинке. Антиген диффундирует по радиусу внутрь геля, и при этом происходит его разведение. В зонах эквивалентности образуется осадок иммунных комплексов. В методе Манчини принимают, что концентрация антигена пропорциональна квадрату диаметра (d2) кольца преципитата. Неизвестную концентрацию антигена (С) определяют по калибровочной кривой, построенной с помощью образцов с известной концентрацией антигена.
86
Основные определения и методы преципитации
Избыток Ад Зона эквивалентности Избыток АЬ
Образование иммунных комплексов с молекулами антигенов
Образование иммунных комплексов с антигенными частицами (эритроциты, латекс)
Агглютинация
Б. Преципитация и агглютинация
Лабораторные методы
В. Реакции преципитации в жидкой фазе
d
с неизвестной концентрацией
Гель с антителами
преципитата
(зоны эквивалентности)
Соотношение между диаметром кольца преципитата d и концентрацией антигена С
Г. Простая радиальная иммунодиффузия (метод Манчини)
87
Взаимодействия антиген-антитело
Лабораторные методы
А. Двойная радиальная иммунодиффузия (метод Ухтерлони)
В данном тесте как антигены, так и антитела диффундируют в радиальных направлениях в приготовленном на воде агарозном геле. Видимые полосы преципитации образуются в местах встречи антигенов и антител. Этот метод очень эффективен для идентификации неизвестных антигенов по форме линий преципитации. Слияние двух полос преципитации в единую линию означает идентичность двух антисывороток по отношению к неизвестному антигену. При неидентичности антисывороток полосы пересекаются, а при частичном сходстве образуется так называемая «шпора».
Б. Электроиммунодиффузия (противоточный электрофорез)
При заданном значении pH, например, 8.2 для экстрагируемых ядерных антигенов ENA антиген и антитело движутся в геле в противоположных направлениях, поскольку имеют разные заряды Если в сыворотке пациента содержатся соответствующие антитела, то при встрече движущихся образцов образуются иммунные комплексы, которые можно увидеть при окрашивании геля
В. Иммуноэлектрофорез
Иммуноэлектрофорез представляет собой комбинацию методов белкового электрофореза и иммунопреципитации. Сначала тестовые и контрольные образцы разделяют электрофоретически. Затем антисыворотка диффундирует перпендикулярно направлению разделения. В результате образования осадка иммунных комплексов в зонах эквивалентности видны четкие линии. Белки можно идентифицировать по интенсивности, форме и положению участков преципитации.
Метод иммуноэлектрофореза применяется для диагностики моноклональной и поликлональной гаммапатии. После проведения электрофореза поликлональные иммуноглобулины равномерно распределяются в у-глобулиновой фракции. Моноклональные иммуноглобулины образуют локальный градиент в у-глобулино-вой фракции (М-градиент), что выражается в появлении отчетливых зубцов на электрофоретической картине.
Г. Ракетный иммуноэлектрофорез (электрофорез в геле1 содержащем антитела)
В данном методе антигены движутся по направлению к аноду в геле, содержащем антитела. Это приводит к образованию длинных ракетоподобных участков осаждения, которые можно увидеть при окрашивании геля. Этот метод позволяет провести количественное определение концентрации антигена, сравнивая тестовые и контрольные образцы, одновременно подвергшиеся электрофорезу.
88
Электрофорез
Варианты линий преципитации анти-а, Р антител со смесью антигенов а и р в лунках х и у Анти-а,р । ч О z ] Анти-а, Р \ U ©л Анти-а. Р
©J
Антиген или или X а аР р У а аР р х У а Р X р У аР
Идентичность х = у Различие х ^у Частичное сходство х е у
А. Двойная радиальная иммунодиффузия (метод Ухтерлони)
Анод
Принцип
АЬ Ад
(анти-ENA) (ENA)
Катод
Анти-ENA
ENA
Лабораторные методы
Б. Электроиммунодиффузия (противоточный электрофорез)
В. Иммуноэлектрофорез
е ©
Катод
Анод
Линия преципитации
Г. Ракетный иммуноэлектрофорез (электрофорез в геле, содержащем антитела)
89
Лабораторные методы
Взаимодействия антиген-антитело
А. Методы агглютинации
1. Гемагглютинация: определение агглютинирующих антител в образце сыворотки. Полные антитела представляют собой иммуноглобулины класса IgM. Они связываются с антигенными детерминантами красных кровяных клеток в виде пентамеров и индуцируют агглютинацию антигенов. Их называют полными (или естественными) антителами, поскольку благодаря своей пентамерной структуре они способны вызывать агглютинацию. Антитела против антигенов групп крови являются одним из видов полных антител.
Существуют также неполные антитела (антитела IgG). Эти антитела связываются с антигенными детерминантами красных кровяных клеток, но не способны вызвать агглютинацию. Гемагглютинация происходит тогда, когда расстояние между красными кровяными клетками сокращается Это достигается при добавлении альбумина или раствора с низкой ионной силой, в результате чего антитела IgG образуют мостиковые структуры между клетками. Примером, иллюстрирующим данную ситуацию, является образование антител против Rh+ эритроцитов у Rh-отрицательных пациентов, например, в результате переливания Rh-несовме-стимой крови.
2. Латексная агглютинация: частицы латекса реагируют с неизвестными антителами. В проиллюстрированном примере (обнаружение ревматоидного фактора) молекулы IgG связываются с частицей латекса. Агглютинация частиц латекса происходит в том случае, если в образце сыворотки присутствует ревматоидный фактор (IgM против IgG: наблюдается положительная реакция).
Агглютинация бактериальных клеток (не показано на рисунке). Метод детекции антител (реакция Видаля): суспензию бактериальных клеток инкубируют с сывороткой крови пациента, взятой в серийном разведении. Агглютинация происходит в том случае, если в сыворотке пациента присутствуют антитела, соответствующие антигену (бактериальным клеткам). Метод детекции антигенов (метод Грубера): бактериальные культуры инкубируют с класс-специфическими и тип-специфическими антителами. Этот метод используют для определения типа бактерии.
Б. Реакция связывания (фиксации) комплемента
В данном методе для определения антител в сыворотке или спиномозговой жидкости используется связывание и активация комплемента комплексами антиген/антитело. К образцу сыворотки с инактивированным комплементом добавляют антиген, соответствующий искомым антителам, и комплемент. Комплемент будет связываться в том случае, если в сыворотке присутствуют антитела, образующие комплексы с добавленным антигеном. В качестве индикаторной системы используются эритроциты, покрытые антителами к их поверхностным антигенам (иммунные комплексы). В положительном тесте не происходит опосредованного комплементом гемолиза, поскольку комплемент связан. В отрицательном тесте существует свободный комплемент, способный вызывать лизис эритроцитов индикаторной системы.
Одним из недостатков данного метода является возможность ложноположительного результата, связанного, например, с самоингибированием сыворотки из-за наличия ревматоидных факторов, иммунных комплексов и др. Это приводит к положительной реакции контрольного образца (сыворотка пациента без добавления антигена).
Антиген может быть загрязнен другими веществами, способными образовывать иммунные комплексы с антителами в сыворотке пациента, индуцируя связывание комплемента. В результате также наблюдается ложноположительная реакция на антиген
90
Методы агглютинации/Реакция связывания комплемента
Агглютинация несущих антигены тестовых эритроцитов при наличии в сыворотке пациента специфических антител
1. Гемагглютинация
До проведения реакции: химическое связывание
Эритроциты барана
А. Методы агглютинации
Принцип: конкуренция между тестовой системой (Ag + Ab) и индикаторной системой (эритроциты с тестовыми АЬ) за связывание комплемента
Лабораторные методы
Индикаторная система (тестовые эритроциты с тестовыми АЬ)
Ф Комплемент
Ад (экзогенный)
"Т***АЬ (сыворотка пациента)
Положительный результат (связывание комплемента комплексом Ад-АЬ)
Нет гемолиза
Отрицательный результат (комплемент (
не связан и доступен 4
для лизиса тестовых эритроцитов) ' /
Гемолиз
Тестовая система (без специфических АЬ)
Индикаторная система
Б. Реакция связывания комплемента
91
Взаимодействия антиген-антитело
Лабораторные методы
А. Твердофазный иммуноферментный анализ (ELISA)
Иммуноферментный анализ представляет собой метод количественного определения, при котором один из реагентов (антиген или антитело) содержит ферментативную метку.
В иллюстрируемом примере лунки подложки (обычно используется планшет для микротитрования) покрыты антигеном, соответствующим искомому антителу. Если данное антитело присутствует в тестируемом образце (сыворотке), то оно будет связываться с антигеном. На следующем этапе реакции происходит связывание искомых антител с конъюгированными с ферментом вторичными антителами (например, Fab-фрагменты антител барана против IgG человека). Далее добавляют субстрат и проводят реакцию окрашивания: в присутствии фермента окраска субстрата изменяется. Концентрацию антител в тестируемом образце можно определить из сравнения концентрации окрашенного продукта со стандартом с известной концентрацией.
Сэндвич-метод иммуноферментного анализа используется для определения антигена. Антитела для искомого антигена нанесены на твердую подложку. Количество связанного антигена из образца определяют, добавляя вторичные конъюгированные с ферментом антитела. Вторичные антитела связываются с антигеном, образуя «сэндвич»-комплексы
Б. Твердофазный иммуноферментный
анализ с C1q
В данном методе субкомпонент С1 q комплемента ковалентно связан с химически активированными поли-стирольными стрипами микропланшета. Иммунные комплексы из образца (сыворотки) связываются с 01 q. Для детекции иммунных комплексов используют антитела против человеческого IgG, содержащие ферментативную метку. После добавления соответствующего субстрата осуществляют цветную реакцию. Интенсивность окрашивания пропорциональна концентрации растворимых иммунных комплексов в образце.
В. Радиоиммуноанализ (классический вариант)
Классический радиоиммуноанализ (РИА) основан на принципе конкурентного связывания. В иллюстрируемом примере антиген, соответствующий искомому антителу, иммобилизован на твердой подложке (в лунках планшета для микротитрования). Немеченые антитела в образце сыворотки и радиоактивно меченые антитела конкурируют за связывание с антигеном. Оставшиеся в растворе несвязанные антитела отмывают. Чем больше антител содержится в сыворотке, тем меньше меченых антител связывается с антигеном. Следовательно, измеряемая радиоактивность понижается с повышением титра сывороточных антител, и наоборот.
Г. Иммуноблоттинг (Вестерн блот)
Прежде всего белки разделяют в соответствии с их молекулярными массами методом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) В среде с SDS все белки приобретают отрицательный заряд. Добавление 2-меркаптоэ-танола способствует разрыву дисульфидных мостиков. В результате белки теряют свой характерный заряд и форму и разделяются только в соответствии с молекулярными массами.
Затем осуществляют блоттинг, т.е. перенос белков из геля на нитроцеллюлозную мембрану, где проводят реакцию со специфическими антителами. В данном примере использованы антитела против Borrelia burgdorferi. Одним из основных достоинств метода является возможность идентифицировать специфические антитела после разделения белков.
92
ИФА (ELISA), РИА и иммуноблоттинг
Индикатор Индикатор-Н
(бесцветный) + (окрашен) + субстрат Н2О
Детекция специфических антител против антигена с помощью меченых ферментом вторичных антител (конъюгатов)
Сэндвич-ELISA для чувствительной детекции антигена (напр., цитокинов)
Антимыши-ные Ab
Моноклональный 1g
Антиген
Поликлональный 1g (напр., кролика против ху)
у^Антитело
А Антиген РВторичные антитела и /\ с ферментативной меткой
А. Твердофазный иммуноферментный анализ (ELISA)
Связывание с антителами против 1g человека с последующей цветной реакцией
Б. Твердофазный иммуноферментный анализ с C1q
Мышиные Ab против lg человека
Высокий титр/низкая радиоактивность
Низкий титр/высокая радиоактивность
Антиген на твердой подложке
Принцип: антитела из сыворотки пациента конкурируют с мечеными антителами
В. Радиоиммуноанализ (классический вариант)
Перенос
Окрашивание
АР
Человеческие Ab против
В. burgdorferi
Г. Иммуноблоттинг (Вестерн блоттинг)
Щелочная фосфатаза Белки В. burgdorferi
Лабораторные методы
93
Лабораторные методы
Взаимодействия антиген-антитело
А. Флуоресцентное излучение
Некоторые вещества способны поглощать энергию при облучении светом определенной длины волны. Испускаемый ими затем свет имеет более низкую энергию и, следовательно, другой цвет. Испускание света называется флуоресценцией. Флуоресцеинизотиоцианат (ФИТЦ) является наиболее широко используемым флуоресцентным красителем. ФИТЦ возбуждается синим светом (450-500 нм) и излучает зеленовато-желтый (500-550 нм).
Фильтр флуоресцентного микроскопа позволяет проходить лучам определенной длины волны (например 470 нм). Свет, прошедший через фильтр, подается на флуоресцирующий образец. Флуоресцентное излучение с длиной волны 520-550 нм проходит через дихроичное зеркало и полосно-пропускающии фильтр, в результате чего становится видимым под микроскопом.
Б. Иммунофлуоресценция
В прямом иммунофлуоресцентном методе используется конъюгат антител с флуоресцентной меткой. В непрямом иммунофлуоресцентном методе после стадии связывания антиген-специфических первичных антител используют вторичные антитела, содержащие молекулу флуорохрома. В прямом иммунофлуоресцентном методе можно одновременно определять два или более различных антигенов. Непрямой иммуно-флуоресцентный метод позволяет определять слабо экспрессирующиеся антигены, поскольку с первичными антителами может связаться несколько молекул вторичных меченых антител. Образец можно зафиксировать таким образом, чтобы клеточная мембрана стала достаточно проницаемой для идентификации цитоплазматических антигенов. Это также эффективный способ окрашивания клеток в суспензии, срезах тканей или образцах, полученных цитоцентрифугированием (рис. Б2).
В. Проточная цитометрия
При проточной цитометрии суспензия клеток подается в вибрирующую проточную камеру с форсункой, выбрасывающей капли жидкости, в каждой из которых содержится единственная клетка. Капли проходят сквозь лазерный пучок и рассеивают свет. Светорассеяние измеряется с помощью фотоумножителя. Прямое светорассеяние коррелирует с размером клеток. Боковое светорассеяние (рассеяние света под углом 90° по отношению к оси пучка) коррелирует с гранулярностью клетки и с ядерно-цито-плазматическим отношением. Этот метод позволяет отличить крупные клетки с низким ядерно-цитоплаз-матическим отношением и гранулами в цитоплазме
(гранулоциты) от мелких клеток с крупными ядрами (лимфоциты). Для моноцитов характерны промежуточные свойства (рис. В2).
Г. Гистограммы в проточной цитометрии Сортированные клетки можно проанализировать и по другим параметрам, например изучить их флуоресценцию. Иммунофлуоресценцию лимфоцитов и моноцитов в одном образце можно проанализировать раздельно. Интенсивность флуоресценции коррелирует с плотностью антигенов на клеточной поверхности, а количественно ее можно измерить с помощью фотоумножителя (рис. И).
Одновременно можно проводить анализ ряда антител, направленных против различных антигенов и конъюгированных с различными флуоресцентными метками. Наиболее широко в качестве флуоресцентных красителей применяются флуоресцеин изотиоцианат (ФИТЦ) и фикоэритрин (ФЭ). Оба красителя возбуждаются светом с длиной волны 448 нм, но излучают при разных длинах волн: пик излучения ФИТЦ расположен в зеленой области, а ФЭ — в красной. Если следует обнаружить два разных антигена, то флуоресцентные красители позволяют идентифицировать ан-тиген-положительные клеточные популяции, экспрессирующие оба антигена (излучают в красном и зеленом диапазоне) или только один антиген (излучают либо в красном, либо в зеленом диапазоне), а также антиген-отрицательные клеточные популяции, не экспрессирующие ни одного из этих антигенов (нет флуоресценции) (рис Г2) В данном примере продемонстрировано двойное окрашивание по CD3 и CD4. Таким способом можно идентифицировать четыре клеточные популяции CD4 Т-клетки (Т-хелперы), CD4 Т-клетки (большинство из них CD8+ Т-лимфоциты), CD4+ CDS клетки (большинство из них моноциты), а также двойные отрицательные клетки, в числе которых В-лимфоциты, клетки-киллеры и некоторые моноциты.
94
Иммунофлуоресценция
365-
400
Понижение
Е 500
S’ 555
600
700
энергетического уровня
Зеленый свет (видимый)
Флуоресцирующий субстрат
Флуоресценция
фильтр возбуждающего света
I 450-\490 нм
t f 560 нм Полосно-
1. Возбуждение
А. Флуоресценция
2. Спектр поглощения/ испускания ФИТЦ
Свет
пропус-кающий фильтр
4а> Дихроичное
зеркало > 510 нм
3. Флуоресцентный микроскоп
Флуоресцирующее ^антитело
1. Прямая иммунофлуоресценция
Первичное антитело (мыши против человека)
ФИТЦ Конъюгат 7 АЬ с ФЭ
If------у
2. Двойная флуоресценция
Флуоресцирующее Ab (против Ig мыши)
4. Флуоресценция в цитоплазме
Лабораторные методы
3. Непрямая иммунофлуоресценция
Б. Иммунофлуоресценция
Клеточная суспензия
530-550 нм (зеленый)
Боковое светорассеяние
Фотоум ножител ь
Светочувствительный
Диод
Прямое светорассеяние
1. Принцип
560-580 нм (красный)
Прямое светорассеяние
2. Разделение клеточных фракций
В. Проточная цитометрия
о со
о
Отрицательный контроль Нет флуоресцирующих клеток
Интенсивность
флуоресценции
5
Интенсивность флуоресценции
75% положительных клеток
2. Дот-анализ с двумя красителями
1. Гистограммы
Г. Проточная цитометрия: гистограммы
95
Лабораторные методы
Взаимодействия антиген-антитело
А. Иммуногистологическое окрашивание
Обычно образцы тканей для гистологического анализа фиксируют в формалине. Поскольку фиксация формалином может изменить антигенные детерминанты многих клеточных структур, то применяют быструю заморозку образцов, позволяющую получить криосрезы, более подходящие для иммуногистохимического окрашивания. Сохраненные в замороженном виде срезы инкубируют с антителами против искомых антигенов в течение 20-30 мин при +4 С. Наиболее часто используют мышиные моноклональные антитела. Затем образцы отмывают и добавляют вторичные антитела против мышиных иммуноглобулинов. Часто применяют биотинилированные вторичные антитела, т.е. антитела, конъюгированные с биотином — витамином, имеющим чрезвычайно высокое сродство к белку стрептавидину. Для окрашивания используют комплекс стрептавидина и пероксидазы. Пероксидаза оказывается в непосредственной близости от искомого антигена. Добавление хромогенного субстрата (диаминобензидина (ДАБ) или аминоэтилкарбазола (АЗК)) приводит к цветной реакции, отражающей распределение искомого антигена в образце ткани.
Другим распространенным методом иммуногистохимического окрашивания является метод с использованием щелочной фосфатазы/антищелочной фосфатазы (alkaline phosphatase/anti-alkaline phosphatase) — АРААР-метод. Первичные антитела (обычно мышиные) связываются с исследуемым антигеном. Затем добавляют антитела против иммуноглобулинов мыши («мостиковые» антитела) и комплекс, состоящий из щелочной фосфатазы (АР) и моноклональных мышиных антител против щелочной фосфатазы (анти-АР-анти-тела, ААР). Комплекс АР-ААР связывается с исследуемым антигеном через мостиковые антитела. Последующая ферментативная реакция с хромогенным субстратом приводит к антиген-зависимому осаждению красителя в образце. Чувствительность АРААР-метода можно увеличить, повторяя реакции образования мостиков. Примеры использования данного метода представлены на рис. 4 и 5. На рис. 4 показана единственная опухолевая клетка, обнаруженная среди клеток костного мозга при помощи антител против эпителиальных клеток. На рис. 5 показано, как с помощью антител CD22 произведено окрашивание В-лимфоци-тов в мантийной зоне фолликула, в результате которого стала видна структура зародышевого центра.
Б. Флуоресцентная гибридизация
in situ (FISH)
Метод флуоресцентной гибридизации in situ (FISH, от fruorescence in situ hybridization) используется для идентификации молекулярных структур на уровне ДНК
и РНК. Двойная спираль ДНК разрывается при действии на образец тепла, химических веществ или растворов со щелочным значением pH Используются ДНК-зонды, сконструированные специально для обнаружения определенных последовательностей ДНК. ДНК-зонды представляют собой последовательности ДНК, комплементарные исследуемым последовательностям и содержащие маркерные молекулы. Эти зонды гибридизуются с ДНК образцов, а маркерные молекулы делают их видимыми.
Существуют также специфические РНК-зонды. Они позволяют идентифицировать РНК специфических клеточных продуктов, например цитокинов, на уровне одной клетки. Наиболее популярными маркерными веществами являются флуоресцеин и биотин, но также используются и другие иммунные комплексы (например, система дигоксигенин/антитела против дигоксигенина).
В. Пример: применение метода FISH для обнаружения транслокации 8:21
С помощью ДНК-зондов, меченных соответственно ФМТЦ или ФЭ, в нормальной клетке в интерфазе можно обнаружить ген ЕГО на хромосоме 8 и ген ABL-1 на хромосоме 21.
Транслокация небольшого участка хромосомы 21 на хромосому 8 и наоборот наблюдается в некоторых случаях острого миелоидного лейкоза (см. с. 140). Участок меченного ФИТЦ гена ABL-1 оказывается по соседству с меченным ФЭ геном ЕГО. Образование химерного гена можно обнаружить по сближению участков красной и зеленой флуоресценции.
96
Иммуногистология
Образец хир^ удаленной ткани ^(лимфоузел, селезенка, —опухолевая ткань)
ргически
n2
Быстрое замораживание
Нагревание Формамидаза Щелочная среда
Разрыв Н-Н связей, однонитевая ДНК
Тонкие срезы (4-8 мкм) на предметных стеклах
Криосрезы
Гибридизация
1. Подготовка образца
3 Стрептавидин/пероксидаза Биотинили-рованное антитело (кролика против мыши)
1 Антитело (мыши)
Хромогенный субстрат (ДАБ)
S РОХ
Срез с антигеном
2. Окрашивание в системе биотин-авидин/пероксидаза
Щелочная фосфатаза АР
^Комплекс АР-ААР \/ (мышиныеТЬ)
Г) Первичное-^ антитело I (мыши) /\
Хромогенный
(.2 Мостиковое Ab (кролика
3. АРААР-метод
1. С ДНК-зондами
Комплементарный ДНК-зонд с флуоресцентной меткой
4. Детекция опухолевых клеток в костном мозге
5. Окрашивание мантии фолликула антителами против CD22
А. Иммуногистологическое окрашивание
Мягкие условия фиксации
+ Меченный дигоксиге-нином комплементарный РНК-зонд
Гибридизация
РНК-специфичная флуоресценция
I X
Меченные ФИТЦ антитела против дигокси генина
2. С РНК-зондами
Б. Флуоресцентная гибридизация in situ (FISH)
Хромосома 8
Хромосома Sq-
Хромосома 21q+
Хромосома 21
Нормальная клетка Клетка
с транслокацией t(8:21)
Интерфазная цитогенетика
В. Пример: применение метода FISH для обнаружения транслокации 8:21
Лабораторные методы
97
Клеточный иммунитет
Лабораторные методы
А. Выделение одноядерных клеток из периферической крови
Одноядерные клетки могут быть отделены от других клеток периферической крови с помощью центрифугирования в градиенте плотности. В пробирку помещают раствор фиколл-гипак (плотность 1,077 г/л), сверху наслаивают разбавленный образец гепаринизированной крови и центрифугируют. Клетки с низкой плотностью (лимфоциты и моноциты) оказываются в верхней части раствора, а все другие компоненты крови образуют осадок на дне пробирки. Одноядерные клетки могут быть удалены с поверхности раздела фиколл/плаз-ма с помощью пипетки. В результате инкубации клеточного материала в пластиковых флаконах моноциты оказываются прикрепленными к стенкам, и становится возможным отобрать отдельно лимфоциты.
Б. Разделение Т- и В-лимфоцитов (образование розеток)
Т-лимфоциты экспрессируют молекулы адгезии, например, молекулы CD2, которые взаимодействуют с LFA-3 (CD58) на поверхности эритроцитов барана. После обработки ферментом нейраминидазой или 2-ами-ноэтилизотиоуронил бромидом (АЕТ) молекулы адгезии на поверхности эритроцитов взаимодействуют с Т-лимфоцитами еще более активно. К одной Т-клетке может прикрепляться несколько эритроцитов барана, образуя своеобразные розетки. Розеткообразующие клетки можно отделить центрифугированием в градиенте плотности, используя фиколл. Фракцию Т-лим-фоцитов приблизительно 95% чистоты можно получить после гипотонического лизиса эритроцитов.
Клетки, не образующие розеток, плавают на поверхности раствора фиколла и также могут быть отделены. Эта фракция главным образом состоит из В-клеток и других клеток, отличных от Т-лимфоцитов.
В. Разделение клеточных фракций с помощью антител
Сосуды для культивирования или пластиковые чашки при щелочном значении pH можно покрыть антителами (пэннинг). При инкубации смеси клеток в таком сосуде клетки, экспрессирующие соответствующий антиген, будут прикрепляться к стенкам. Не экспрессирующие данный антиген клетки легко удаляются декантированием.
Антиген-положительные клетки можно отделить механическим способом или с помощью ферментативного расщепления.
Покрывая антителами мелкие железные шарики (выпускаются шарики различных размеров), можно связывать как антиген-положительные, так и анти-ген-отрицательные клетки. Данный метод получил
название иммуномагнитного разделения. Для отделения антиген-положительных клеток используют магнит, притягивающий налипшие на металлические частицы клетки Это очень эффективный способ удаления из раствора ненужных клеток. Методом иммуномагнитного разделения удается отделить единственную опухолевую клетку от 1000 нормальных клеток. Другими словами, можно достичь степени очистки в 103—104 раз.
Г. Разделение клеток
методом проточной цитометрии
Метод проточной цитометрии был описан на с. 94. В проточном сортировщике клеток (активируемом флуоресценцией анализаторе клеток FACS) капли жидкости, содержащие клетки, имеют электрический заряд, что контролируется компьютерной программой Капли с флуоресцирующими клетками заряжены положительно, а с нефлуоресцирующими клетками (не несущими антиген) заряжены отрицательно. Поток клеток проходит сквозь электрическое поле, в котором происходит разделение содержащих и не содержащих антиген клеток Чистота клеточных фракций, разделенных с помощью FACS, достигает 99%.
98
Методы выделения клеток
Э»®
Ч®
Разбавленная кровь
Фиколл (плотность 1,077)
Центрифугирование
А. Выделение одноядерных клеток из периферической крови
Эритроциты барана
Одноядерные клетки
Центрифугирование
В-клетки, моноциты (Т-клеток нет)
Т-лимфоциты, эритроциты барана
Связывание эритроцитов барана с Т-клетками: образование розеток
Б. Разделение Т- и В-лимфоцитов (образование розеток)
Пластиковая подложка, покрытая антителами
IYYYYYYYYYYJ
Антитела, прикрепленные к железным шарикам
Лабораторные методы
Прикрепление антиген-несущих клеток
------------Антиген-ft ft’ftft клетки16
Антиген -положительные клетки притягиваются магнитом
лз
2
Антиген -отрицательные клетки
1. Пэннинг
2. Иммуномагнитное разделение
В. Разделение клеточных фракций с помощью антител
Лазер
Суспензия клеток в вибрирующей кювете
Фотоум ножител ь для анализа бокового светорассеяния
Переднее светорассеяние
Отрицательно заряженные клетки
Положительно заряженные клетки
Фотоумножитель (560-580 нм, красный свет)
Фотоумножитель (530-550 нм, зеленый свет)
Светочувствительный фотодиод
Дихроичное Полосно-пропус-зеркало кающий фильтр
Г. Разделение клеток методом проточной цитометрии
99
Клеточный иммунитет
А. Тесты на активацию клеток
Активация и пролиферация Т-клеток происходит в результате контакта со специфическими антигенами. В периферической крови лишь крайне малая часть Т-клеток (одна из 10 тыс. клеток или меньше) реагируют со специфическими антителами. В этой связи при исследовании действия Т-клеток in vitro используют вещества, стимулирующие все Т-клетки, вне зависимости от антиген-специфических рецепторов. Данные вещества называют поликлональными активаторами (например, фитогемагглютинин и конканавалин А).
Антитела против комплекса TCR/CD3 могут вызывать перекрестное сшивание молекул CD3. Этот процесс имитирует физиологическое связывание антигена, стимулирующее большинство Т-клеток. В качестве показателя активации Т-клеток измеряют концентрацию цитокинов в супернатанте (ГМ-КСФ, ИЛ-2, ИЛ-4, у-ИНФ). Очень ранним показателем активации является концентрация йонов кальция в цитоплазме, которую можно оценить уже через несколько секунд после реакции перекрестного сшивания рецепторов антигена Для определения концентрации йонов кальция в цитоплазме клетки используют специальные красители, изменяющие спектр флуоресценции при связывании кальция (например, индо-1). Сдвиг флуоресцентного излучения можно точно измерить с помощью проточного цитометра (см. с. 94).
Методом проточной цитометрии можно также определять экспрессию поверхностных антигенов, зависимую от активации. Через несколько часов после активации повышается уровень экспрессии молекул CD69 или рецептора трансферрина CD71 на клеточной мембране. Повышение уровня экспрессии других молекул, таких как CD25 или МНС, наблюдается только через 1-3 дня.
Анализ клеточного цикла представляет собой еще один путь наблюдения за активацией клеток. Этот метод позволяет точно подсчитать число покоящихся, активированных и пролиферирующих клеток.
Б. Тесты на пролиферацию клеток
Способность клеток к пролиферации часто используется как параметр, характеризующий функциональность Т-клеток [метод стимуляции лимфоцитов или реакция бласт-трансформации).
Клетки инкубируют в среде 5% СО? при 37Т на протяжении 72-96 ч, применяя различные стимулирующие факторы. Процесс деления клеток, сопряженный с удвоением ДНК, начинается приблизительно через 48 ч. Если в состав инкубационной среды добавить тимидин, содержащий радиоактивную метку (в молекуле вместо изотопа 1Н содержится изотоп трития 3Н), то он будет встраиваться в ДНК делящихся клеток.
Спустя еще 16-24 ч, клетки собирают с помощью автоматического оборудования: их вымывают из лунок планшетов и пропускают через стеклянный фильтр. Клетки осаждаются на фильтре, а несвязанный тимидин из культуральной среды вымывается. Далее с помощью бета-счетчика определяют радиоактивность клеток на фильтре, коррелирующую с уровнем репликации ДНК и пролиферацией клеток.
В. Функционирование Т-клеток in vivo: мультитест фирмы Merieux
Фирменный мультитест Merieux представляет собой специальное устройство с восемью иглами, в которых содержатся желатиновые растворы различных бактериальных или вирусных антигенов. Большинство людей когда-либо подвергались воздействию этих антигенов. Иглы прокалывают кожу и содержащиеся в них вещества вводятся под кожу. Примерно через 48 ч кожу осматривают для определения реакций гиперчувствительности замедленного типа (см. с. 77). Считается, что реакция положительна, если затвердение на коже в месте укола превышает в диаметре 2 мм.
Тесты на функционирование Т-клеток
Стимул
—►ГМ-КСФ
—► ИЛ-2, ИЛ-4
—►у-ИНФ
1. Определение цитокинов (ELISA)
А. Тесты на активацию клеток
3. Экспрессия активирующих антигенов
48 ч ------► 37°С, 5%СО2
Стеклянный фильтр задерживает клетки
16 ч, 37°С, 5%СО2
Деление клеток: при синтезе ДНК3Н-тимидин включается в новые цепи
Одноядерные клетки Стимул (лектины, антигены) Факторы роста
Слив
к
Смытые с фильтра радиоактивные клетки
Р-счетчик т
Б. Тесты на пролиферацию клеток
имп/мин
Проксимальная область
Proteus 8 (Щ) (S) 1
Столбняк
Trichophyton 7 (Щ) («?) 2 Дифтерия
В. Функционирование Т-клеток in vivo: мультитест фирмы Мёпеих
Лабораторные методы
101
Клеточный иммунитет
А. Образование клонов антиген-специфических Т-клеток
Несмотря на весьма незначительное количество антиген-специфических Т-клеток в периферической крови (обычно от 1/10000 до 1/100000), их можно выделить и размножить in vitro. Для этого их культивируют в присутствии исследуемого антигена, ИЛ-2 и облученных аутологичных одноядерных клеток в качестве питающих клеток. В данном случае одноядерные клетки выступают в качестве антигенпрезентирующих клеток. Антиген и антигенпрезентирующие клетки добавляют еще раз приблизительно через семь дней. Такую стимуляцию повторяют несколько раз с недельными интервалами. При этом немногочисленные антиген-специфичные Т-лимфоциты, исходно присутствовавшие в культуре, начинают пролиферировать, но все еще находятся среди подавляющего большинства неспецифических Т-клеток. Поэтому культуру с видимым клеточным ростом (некоторые пролиферирующие клетки образуют огромные клеточные агрегаты) подвергают последовательному разбавлению. В результате в некоторых лунках планшета содержится одна единственная Т-клетка. Клональная экспансия антиген-специфических Т-клеток в таких лунках достигается добавлением ИЛ-2 и исследуемого антигена.
Б. Тест на цитотоксичность с радиоактивным хромом
Антиген-специфичные цитотоксические Т-лимфоциты (ЦТЛ) способны убивать клетки, представляющие соответствующий антиген с помощью молекул HLA. С другой стороны, клетки-киллеры убивают те клетки, которые либо не экспрессируют молекул МНС, либо экспрессируют чужеродные или аномальные молекулы МНС (см. с. 48). Классическим тестом для изучения функционирования клеток-киллеров и ЦТЛ является определение концентрации выделившегося радиоактивного хрома. Исследуемые клетки метят радиоактивным хромом (51Сг), который связывается с цитоплазматическими белками. Спонтанное выделение радиоактивности клетками невелико (спонтанный или фоновый лизис). К исследуемым клеткам на 4-6 ч добавляют эффекторные клетки в различных концентрациях, что вызывает лизис исследуемых клеток. Разрыв клеточной мембраны, индуцируемый перфоринами и гранзимами (с. 49. Г), приводит к высвобождению радиоактивного хрома, который и измеряется. Чем эффективнее идет лизис, тем больше радиоактивного хрома оказывается в супернатанте. Максимальное высвобождение хрома достигается при лизисе всех клеток под действием соответствующего детергента (например, тритона). Эффективность лизиса до некоторой степени зависит от соотношения эффекторных и исследуемых клеток и может быть рассчитана по неслож
ной формуле. Недостатком метода является невозможность корректного определения числа клеток, погибающих в результате апоптоза (см. ниже).
В. Тест на цитотоксичность: jam-тест
При использовании метода с радиоактивным хромом эффективность эффекторных клеток часто бывает недооценена. Некоторые клетки погибают не от лизиса, а от апоптоза, но их число не учитывается, поскольку апоптозные частицы сохраняют интактные клеточные мембраны и, следовательно, не происходит высвобождения 51 Сг.
В так называемом jam-тесте (от англ, just another method) исследуемые клетки сначала культивируют в присутствии меченного тритием тимидина, который включается в ДНК клеток. При гибели клеток от апоптоза (см. с. 85) их ДНК подвергается фрагментации на мельчайшие частицы. Выращенные клетки собирают в автоматическом режиме. При прохождении через фильтр высокомолекулярная ДНК интактных клеток остается на фильтре, а низкомолекулярные фрагменты ДНК апоптозных клеток уходят с промывающим раствором. Число лизировавших клеток можно рассчитать по простой формуле.
Антиген-специфичные тесты
+ Облученные аутологичные ОК
+ Антиген
► Последовательное Рост клеток
(\т г « 4-7 дней
Одноядерные клетки (ОК) Антиген
+ ИЛ-2
се < е \
V *** ,
Г 3-4-кратное у повторение
7 дней 37°С 5%СО2
Человеческая сыворотка
А. Образование клонов антиген-специфических Т-клеток
Связывание с внутриклеточными белками
Отмывка
мишень = 5:1
Эффектор/ мишень = 20:1
Максимальный лизис
Фон (нет эффекторных клеток)
Эффектор/ мишень = 1:1
разбавление 1000/лунку 100/лунку
10/лунку
1/лунку 0,3/лунку
+ Антиген
+ ИЛ-2
имп/минпробь, - имп/минфона * 100
имп/минмакс - ИМП/МИНфона
Б. Тест на цитотоксичность с радиоактивным хромом
Клетка-мишень + 3Н-тимидин
Эффекторные
Апоптоз
► клетки-мишени
Фрагментация ДНК
Р-счетчик
Только интактная ДНК остается на фильтре
В. Тест на цитотоксичность: JAM-тест
Лизис, %
ИМП/МИН5ез эфф.клеток имп/минпробы х -jqq имп/минбезэфф .клеток
3
Лабораторные методы
Клеточный иммунитет
A. ELISPOT с у-интерфероном
Иммуноферментный спот-анализ ELISPOT (enzyme-linked immunosorbent spot assay) используется для определения числа антиген-специфичных Т-клеток в культуре клеток. Для определения степени специфичности антигена измеряют количество цитокинов, образовавшихся в результате стимуляции клеток антигеном. В лунку планшета для микротитрования, покрытую антителами против данного цитокина (например, у-ИНФ), помещают антиген, антигенпрезентирующие клетки и Т-лимфоциты, а затем инкубируют от 24 до 48 ч. Клетки, стимулированные антигеном, образуют у-ИНФ, связывающийся с иммобилизованными антителами. После инкубации клетки вымывают, а в планшет добавляют биотинилированные вторичные антитела против у-ИНФ. На следующем этапе добавляют стрептавидин, который связывается с биотином. Фермент, находящийся в конъюгате со стрептавидином, активирует хромогенный субстрат, который окрашивает ту зону, в которой стимулированные Т-лимфоциты производили у-ИНФ. Число таких зон указывает на число цитокин-образующих клеток, которое выражают как число цитокин-образующих клеток на 100 тыс. клеток.
Б. Окрашивание
внутриклеточных цитокинов
В отличие от иммуноферментного спот-анализа, который показывает только число цитокин-образующих Т-лимфоцитов, метод окрашивания внутриклеточных цитокинов позволяет еще и идентифицировать тип активированных клеток После стимуляции антигеном культуру клеток инкубируют с брефелдином А, ингибирующим выход внутриклеточного цитокина. Это приводит к накоплению большого количества секретируемого цитокина внутри клетки. Осуществляют окрашивание поверхности клетки (например, окрашивание на CD4 или CD8), а затем клетку фиксируют параформальдегидом (ПФА). В результате последующей обработки детергентом сапонином клеточная мембрана становится проницаемой для антител, связывающихся с внутриклеточными цитокинами. Использование двух меченых антител (ФИТЦ-меченые антитела против у-ИНФ и ФЭ-меченые антитела против ИЛ-4) позволяет различить клетки, образующие у-ИНФ и ИЛ-4. Мечение поверхностных клеточных маркеров осуществляется с помощью нескольких флуорохромов, излучающих в красной области и различимых при помощи FACS (например, перидин-хло-рофилл протеин (РегСР, 675 нм) для CD4 и аллофикоцианин (АФЦ, 660 нм) для CD8). Это позволяет одновременно обнаружить четыре типа флуоресцентного излучения и идентифицировать CD4+ или CD8+ Т-лимфоциты и образуемые ими цитокины.
В. Анализ секреции цитокинов
С помощью биспецифических антител (захватывающий реагент, Miltenyi) можно связывать цитокины, секретируемые активированными Т-клетками, непосредственно на клеточной поверхности Сначала антитела связываются с CD45 — широко распространенным маркером клеточной поверхности. Секретируемый цитокин (например, у-ИНФ) связывается с клеточной поверхностью, где его узнают вторичные антитела, несущие флуоресцентную метку. Окрашенные таким образом Т-клетки можно затем отделить на приборе FACS или в магнитном поле (метод MACS) с помощью конъюгированных с железными частицами антител. Преимущество данного метода по сравнению с окрашиванием внутриклеточных цитокинов состоит в том, что клетки остаются интактными и могут анализироваться далее.
Г. Окрашивание тетрамера
Окрашивание тетрамера используется для прямого окрашивания антиген-специфичных Т-лимфоцитов. Сначала тяжелые цепи молекул МНС класса I (например, HLA-A2) связываются в тетрамер, меченный флуорохромом (ФЭ). Затем в связывающие карманы молекул МНС класса I помещают синтетический пептид. Этот метод можно использовать для окрашивания только тех Т-клеток (С08+), которые узнают соответствующий пептид в комплексе с HLA-A2. Меченые клетки затем можно отделить с помощью FACS для получения антиген-специфичных Т-клеточных линий.
104
Методы характеристики антиген-специфичных Т-клеток
Покрытие уА- В течение ночи антителами
АПК, антиген, Т-клетки
IYYYYYYYYYYJ
24-28 ч
^YYYYYYYY;
Отмывка
Л XV IyYWyyyyyyJ
Отмывка
LyWyyyyyyyJ
Отмывка
Хромогенный субстрат
yftYYYYYYY^
A. ELISPOT с у-интерфероном
Внутриклеточные
анти-CD4-РегСР
анти-CD8-АФЦ
Окрашивание
цитокины
Отмывка + фиксация ПФА
поверхности
Обработка
анти-\/ х/анти-
ИЛ-4- Y Т у-ИНФ-ФЭф £)ФИТЦ
Внутриклеточное^ окрашивание
С08-АФЦ •
ИЛ-4-ФЭ
CD4-PerCP
• •
у-ИНФ-ФИТЦ
Б. Окрашивание внутриклеточных цитокинов
В. Анализ секреции цитокинов
Повторная стимуляция, синтез у-ИНФ (45 мин)
Разделение с помощью FACS <
Разделение с помощью MACS
Лабораторные методы
105
Гуморальный иммунитет
А. Активация В-клеток
Количественное определение иммуноглобулинов полезно для характеристики функционирования В-клеток in vivo. Однако при недостаточности антител необходимо провести функциональные тесты.
Связывание антител, направленных против поверхностных иммуноглобулинов, приводит к перекрестному сшиванию молекул иммуноглобулинов, что имитирует физиологическую стимуляцию антигеном. Поскольку связывание иммуноглобулинов с Fc-рецептором оказывает ингибирующее действие, то используют Fab-фрагменты из анти-IgM антител. Лиофилизованные клетки бактерии Staphylococcus aureus штамм Cowan С (SAC) являются очень активным индуктором реакции перекрестного сшивания. Как и в Т-клетках, связывание антигена приводит к заметному росту концентрации кальция в цитоплазме в течение нескольких секунд, а также к гиперэкспрессии антигенов CD69 и CD71 (рецептор трансферрина) в течение нескольких часов. За 2-3 дня повышается уровень экспрессии антигенов CD25 и CD23 на клеточной поверхности.
Б. Пролиферация В-клеток
После активации, вызванной перекрестным сшиванием иммуноглобулинов, В-клеткам необходим сигнал пролиферации. Стимулом могут быть цитокины (ИЛ-2, ИЛ-6, фактор роста В-клеток ИЛ-14), растворимые рецепторы (например, растворимые продукты расщепления поверхностного антигена CD23) или связывание антигена CD40 со своим лигандом. Аналогично тому, как это описано в разделе, посвященном Т-клеткам (с 101, Б), в качестве характеристики пролиферации В-лимфоцитов используют количество включенного в клетки за 72 ч меченного тритием тимидина.
При особенно высокой эффективности перекрестного сшивания иммуноглобулинов (например, при использовании бактерий SAC) В-клетки иногда образуют аутокринные факторы роста, что снимает необходимость использования дальнейших экзогенных стимулов.
В. Дифференцировка В-клеток: секреция антител
В культуре клеток В-лимфоциты могут через 5-7 дней превратиться в плазматические клетки. Методы ИФА или РИА можно использовать для количественного определения антител в супернатанте, однако этими методами нельзя определить реальное число В-клеток, производящих антитела. Для нахождения данного параметра используют различные тесты локального гемолиза
1. Обратный метод локального гемолиза. Эритроциты барана конъюгируют с антителами барана или кролика против иммуноглобулинов человека и инкубируют с В-клетками на агарозном геле Терминально дифференцированные В-клетки секретируют иммуноглобулины, которые диффундируют в гель и образуют иммунные комплексы с антителами против иммуноглобулинов человека на поверхности находящихся рядом эритроцитов. Добавляют комплемент и в результате происходит лизис эритроцитов, находящихся поблизости от секретирующих антитела клеток. Число зон лизиса соответствует числу терминально дифференцированных В-клеток.
Этот метод можно использовать для изучения субпопуляций клеток, образующих антитела. Используя эритроциты барана, несущие анти-IgM, можно быть уверенным, что обнаружены будут только те В-клетки, которые секретируют IgM. Если провести реакцию связывания антигенов и эритроцитов барана, то можно определить число В-клеток, образующих антитела против специфических антигенов.
2. Иммуноферментный спот-анализ (EUSPOT). В данном методе В-клетки помещают в чашки, покрытые подходящим антигеном. Специфические антитела, образуемые В-клетками, связываются с антигеном. Свободные антитела и клетки отмывают Потом добавляют связанные с ферментом антитела против иммуноглобулинов, а затем покрывают поверхность чашек гелем, содержащим хромоген. Цветная реакция имеет место там, где произошло связывание специфических антител. В результате образуются цветные пятна, число которых соответствует числу клеток, секретирующих антитела.
Тесты на функционирование В-клеток
Антиген
Анти- Перекрестное Активи-
IgM АЬ, сшивание рованная
SAC sig В-клетка
концентрации внутриклеточного Са
активирующего антигена
А. Активация В-клеток
ИЛ-2
ИЛ-14
ИЛ-4
- SCD23
Активиро- CD40L, ванная В-клетка анти-С040
АЬ
Б. Пролиферация В-клеток
Лабораторные методы
Эритроциты барана,
Зоны гемолиза
1. Обратный метод локального гемолиза
107
Молекулярно-биологические методы
А. Саузерн-блоттинг
В данном методе фрагменты ДНК разделяют с помощью гель-электрофореза под действием капиллярных сил или электрического поля, а затем переносят на мембрану. Фрагменты на мембране гибридизуют со специфическими зондами. Интересующие фрагменты ДНК вырезают из геномной ДНК с помощью ферментов рестрикции или получают с помощью полимеразной цепной реакции (см. В). Детекция ДНК осуществляется с помощью зондов, содержащих радиоактивные или нерадиоактивные метки, и гибридизующихся с комплементарной последовательностью ДНК за счет образования водородных связей Детекция метки производится с помощью ауторадиографии или ферментативной реакции.
Б. Нозерн-блоттинг
Нозерн-блоттинг используется для детекции фрагментов РНК. В данном методе размер и число специфических молекул мРНК определяют в препаратах тотальной или полиаденилированной РНК Молекулы РНК разделяют электрофорезом и переносят на мембрану. Интересующую последовательность РНК детектируют по гибридизации с меченым зондом.
В. Полимеразная
цепная реакция (ПЦР)
Полимеразная цепная реакция используется для амплификации специфических нуклеотидных последовательностей. Процедура состоит в повторении определенного цикла реакций, каждая стадия которого осуществляется при строго определенной температуре.
Участок двунитевой ДНК (или кДНК после обратной транскрипции РНК) денатурируют с образованием однонитевых фрагментов. В процессе отжига праймеры (олигонуклеотиды, специфические для данной нуклеотидной последовательности) прикрепляются к нити ДНК. На следующей стадии [элонгация) З'-конец праймера достраивается в соответствии с матрицей под действием термостабильной полимеразы (например, Taq полимеразы). Цикл, состоящий из стадий денатурации, отжига и элонгации, повторяют около 30 раз. Амплификация нуклеотидной последовательности происходит экспоненциально, поскольку каждая нить ДНК, синтезированная полимеразой в данном цикле, служит новой матрицей в последующих циклах. Продукты полимеразной цепной реакции можно разделить электрофоретически и наблюдать в ультрафиолетовом свете после окрашивания бромистым этидием.
Г. Секвенирование ДНК (по Сэнгеру)
Наиболее распространенным методом секвенирования фрагментов ДНК является ферментативный синтез фрагментов, основанный на реакции обрыва цепи. Сейчас существует несколько вариантов автоматических систем, использующих меченные флуоресцентными красителями праймеры или «терминаторы» (дидезоксинуклеотиды), при встраивании которых реакция полимеризации обрывается. В данных системах используют четыре красителя, излучающих свет разной длины волны. Аргоновый лазер возбуждает красители, а детектор регистрирует их специфическое излучение по мере прохождения фрагментов в геле. Данные анализируются с помощью компьютера.
Одним из новых методов является секвенирование однонитевой ДНК с помощью биотинилированных праймеров. В примере, показанном на рисунке, специфическая последовательность встроена в ДНК фага (X-gt II). Биотинилированный праймер [прямой праймер) содержит специфическую последовательность и 5'-последовательность, идентичную универсальному праймеру. Небиотинилированный [обратный) праймер содержит З'-последовательность и 5'-последователь-ность, комплементарную универсальному праймеру После амплификации методом ПЦР в присутствии необходимого количества дидезоксинуклеотидов специфические биотинилированные ПЦР-продукты могут связываться с покрытыми стрептавидином магнитными частицами и элюироваться в щелочной среде. Частицы могут быть затем использованы для твердофазного секвенирования.
Аналитические методы
Агарозный гель после электрофореза (75 В, 60 мА)
А. Саузерн-блот-анализ
после электрофореза (75 В, 60 мА)
Б. Нозерн-блот-анализ
Перенос ДНК на мембрану, гибридизация с меченым зондом
/ ь
Перенос РНК на мембрану, гибридизация с меченым кДНК-зондом
V------J
Амплифицируемая область
—Денатурация с получением однонитевой ДНК
г □ Гибридизация со специфическими праймерами
X-gt-11 левое плечо
Второй цикл тепловой денатурации, гибридизации с праймерами и синтеза комплементарной нити
Цикл ПЦР повторяют
Праймер 25-30 раз
L .......... j—
Миллионы копий ПЦР-продукта
В. Полимеразная цепная реакция (ПЦР)
с
Ауторадиография или ферментативная цветная реакция
с
Ауторадиография или ферментативная цветная реакция
X-gt-11 правое плечо
Q—Вставка
( Ь-Y.....
Покрытая стрептавидином частица
О___Биотинилирован-
u ный праймер ____Небиотинилиро-ваный праймер
Разделение нитей с помощью связанных v со стрептавидином V * магнитных частиц А С G Т
| 3'ddTACGG AGCTG АТТА... .' 3'dd ACGG AGCTG ATTA...
j 3'ddCGG AGCTG ATTA...
3'ddGGAGCTGATTA...
g 3'ddG AGCTG ATTA...
g 3'dd AGCTG ATTA...
“ 3'ddGCTGATTA...
& 3'ddCTGATTA...
Ш 3’ddTGATTA...
Г. Секвенирование ДНК
Лабораторные методы
109
Клиническая иммунология
Иммунодефициты
Клиническая иммунология
А. Х-сцепленная агаммаглобулинемия
Х-сцепленная агаммаглобулинемия, иначе называемая агаммаглобулинемией Брутона, является сцепленным с хромосомой X и наследуемым по рецессивному механизму нарушением, вызванным генетической мутацией тирозинкиназы, специфичной для В-клеток. Нарушение ведет к аномальному созреванию В-клеток с остановкой созревания на уровне пре-В-клеток, что приводит к дефициту IgG. Наиболее распространенными клиническими проявлениями данного заболевания являются частые инфекции дыхательных путей. Больной также может страдать от менингита, пиодермии и сепсиса. Эти инфекции вызываются капсулообразующими пиогенны-ми бактериями типа стафиллококков, пневмококков и стрептококков. Треть случаев заболеваний сопровождаются серонегативным олигоартритом. Пациенты с Х-сцепленной агаммаглобулинемией обычно хорошо реагируют на внутривенное введение IgG.
Б. Дисгаммаглобулинемия
Селективный дефицит IgA. Наиболее распространенной формой гуморального иммунодефицита является аномально низкая концентрация IgA в секретах организма. Заболевание это может быть как спорадическим, гак и наследственным. Селективный дефицит IgA обычно сопряжен с предрасположенностью к атопии (повышенное содержание IgE) и наличием HLA-типов В8 и DR3. У 50% пациентов заболевание протекает бессимптомно. Дефицит IgA проявляется чаще всего в виде хронических инфекций дыхательных путей, но также может протекать как аутоиммунное заболевание подобное системной красной волчанке (СКВ) или спру.
Селективный дефицит подклассов IgG (рис. Б1).
Дефицит определенного подкласса IgG может приводить к гуморальному иммунодефициту разной степени тяжести. Так, дефицит lgG2 способствует развитию тяжелых инфекционных заболеваний, вызванных патогенами Haemophilus influenzae, Meningococcus и Pneumococcus. Пациентам с хроническими инфекциями дыхательных путей необходимо провести количественный анализ подклассов IgG.
Селективный дефицит антител при нормальном уровне сывороточных иммуноглобулинов. У некоторых индивидов с нормальным уровнем иммуноглобулинов тем не менее возникают рецидивирующие ин
фекции дыхательных путей, вызванные некоторыми патогенами. Иммунная система не может распознать определенный антиген и не защищает от него организм. Таким пациентам вводят вакцины, содержащие соответствующие антигены и адъюванты.
Синдром гипериммуноглобулина М (гипер-IgM) (рис. Б2). Синдром характеризуется остановкой развития В-лимфоцитов на уровне клеток, синтезирующих IgM [дефект переключения классов]. В организме такого индивида циркулирует множество ц+ и д' В-клеток, но практически отсутствуют и al В-клетки. Данный дефект сцеплен с хромосомой X и наследуется по рецессивному механизму. Поскольку имеет место мутация гена лиганда CD40, то 0040 не способен участвовать в переключении классов иммуноглобулинов в В-клетках. Наиболее распространенными клиническими проявлениями дефицита IgG и IgA являются рецидивирующие инфекции дыхательных путей. Кроме указанной особенности В-клеток, могут также наблюдаться тромбоцитопения и нейтропения. Методом лечения может быть введение IgG и прием антибиотиков.
В. Общий вариабельный иммунодефицит
Общий вариабельный иммунодефицит (ОВИ) представляет собой гетерогенную группу заболеваний, связанных с неадекватным образованием иммуноглобулинов. Как и системная красная волчанка, ОВИ часто связан с наличием HLA антигенов А1, В8 и DR3. Некоторые наиболее распространенные случаи, связанные с недостаточным уровнем синтеза иммуноглобулинов, перечислены ниже.
• Остановка развития В-клеток на стадии пре-В-клеток; в результате — отсутствие плазматических клеток.
• Нарушение В-клеточной регуляции Т-хелперами
• Узнавание созревающих В-клеток аутоантителами.
• Нарушение секреции иммуноглобулинов из-за аномального гликозилирования.
ОВИ обычно детектируется на поздних стадиях, когда хронические бронхолегочные инфекции уже привели к бронхоэктазу
110
Дефициты гуморального иммунитета
Пиодермия
Ч- Xq21
Менингит
Х-сцепленный рецессивный признак
А. Х-сцепленная агаммаглобулинемия
Инфекция верхних и нижних дыхательных путей — Сепсис
Альбумин
Электрофорез сывороточных белков
а1 а2 ₽ Отсутствие у-фракции
Бактерия Моноцит
Fey-рецептор
IgGI + lgG3
-► Опсонизация, фагоцитоз, антителоопосредованная клеточная цитотоксичность Отсутствие -►повышенная подверженность бактериальным инфекциям
5. pneumoniae, Н. influenzae,
lgG2
Образуется на 2-м году жизни; антитела против бактериальных / полисахаридов, тейхоевои кислоты
Отсутствие -►повышенная подверженность бактериальным инфекциям
Не активирует комплемент
lgG4
Каскад комплемента
Опасно в случае отсутствия других подклассов IgG
lgG3
Время полураспада (t1/2) lgG1 = 23 дня
Опасно при отсутствии lgG1 из-за малого значения t-| 2 для lgG3
1. Селективный дефицит и свойства подклассов IgG
Мутации гена CD40L
— Xq26
CD40L
CD40
2. Синдром гипериммуноглобулина М
Б. Дисгаммаглобулинемия
Наивная В Ауто-АЬ
Про-В Пре-В
Остановка на пре-В- фазе
Циркулирующие В-клетки
Дефект гликозилирования Ig
Дефект Тн-регуляции
Связь CHLA-A1, В8, DR3; см. связь с СКВ
Плазматическая клетка
Рецидивы воспаления легких
Бронхоэктаз
В. Общий вариабельный иммунодефицит: возможные причины
Симптомы вЖКТ: целиакия-спру, диарея, мальабсорбция
Иммунодефициты
А. Тяжелый комбинированный иммунодефицит
Синдром тяжелого комбинированного иммунодефицита (ТКИД) представляет собой гетерогенную группу заболеваний, связанных с дефектами Т-клеточной системы. У детей с данным синдромом первые признаки заболевания проявляются в 3-6-месячном возрасте, когда снижается уровень защиты материнскими антителами. Основные признаки ТКИД у младенцев — это слабый рост и рецидивирующие инфекции. Наиболее часто отмечаются инфекции дыхательных путей (в основном вызванные Pneumocystis carinn и Candida) и ЖКТ (ротавирусные инфекции), а также экземы. У пациентов могут отсутствовать тимус, лимфоузлы и миндалины, а в крови не детектируются СОЗ+ клетки.
Существует несколько причин, вызывающих ТКИД, например:
• наследуемый по аутосомно-рецессивному механизму дефект гена рекомбиназы, приводящий к аномальной стыковке V, D и J-генов TCR и иммуноглобулинов;
• точечные мутации гена у-цепи рецептора ИЛ-2, приводящие к ингибированию активности рецептора.
ТКИД может быть также связан с различными нарушениями метаболизма пуринов, например:
• нарушение деления клеток, особенно Т-клеток, в результате ингибирования тимидилатсинтетазы, вызванного повышением концентрации дезоксиаденозина в отсутствие аденозиндезаминазы;
• повреждения Т-клеток, вызванные образованием токсических метаболитов инозина, связанным с нарушением превращения инозина в гипоксантин в отсутствие пуриннуклеозид-фосфорилазы.
Предпочтительным методом лечения ТКИД сейчас является аллогенная трансплантация костного мозга. Из-за нарушения активности Т-клеток введение эндогенных Т-клеток не приводит к отторжению.
Б. Синдром Ди Джордже
Синдром Ди Джордже связан с аномальным развитием у плода 3-го и 4-го глоточных карманов. Все органы, развивающиеся из этих структур, имеют серьезные функциональные нарушения. Первичный гипопаратиреоз проявляется в виде гипокальцемической тетании. Примерно в 20% случаев гипоплазия тимуса сопровождается хроническими инфекциями, связанными с Т-кле-точной недостаточностью. У пациентов также наблюдается лицевой дисморфизм, аномальное развитие дуги аорты, гипотиреоз и атрезия пищевода. Показано главным образом симптоматическое лечение, состоящее в приеме препаратов кальция и витамина D.
В. Атаксия-телеангиэктазия
Атаксия-телеангиэктазия или синдром Луи-Бар характеризуется клинической триадой симптомов: прогрессирующим иммунодефицитом, церебральной атаксией и телеангиэктазией с поражением кожи вокруг глаз. Синдром представляет собой гетерогенную группу заболеваний, наследуемых по аутосомно-рецессивному механизму и характеризующихся хромосомной нестабильностью. Разрыв и транслокация хромосом, особенно хромосомы 14, приводят к нарушениям в локусе генов Т-клеточного рецептора и иммуноглобулинов. Поскольку у таких пациентов также нарушен и механизм репарации ДНК, они чрезвычайно чувствительны к ионизирующему излучению. В этой связи таких пациентов не следует подвергать рентгенологическим исследованиям, за исключением случаев крайней необходимости. Кроме типичных клинических симптомов, данное нарушение характеризуется повышенным уровнем альфа-фетопротеина и сильно пониженным уровнем IgA и IgE. Прогрессирующий иммунодефицит приводит к тяжелым обострениям синусита и легочным инфекциям (так называемый «синопульмонарный» синдром). Показана симптоматическая терапия
Г. Синдром Вискотта-Олдрича
Синдром Вискотта-Олдрича представляет собой наследственное заболевание, характеризующееся тромбоцитопенической пурпурой, хроническими инфекциями и экземой. Болезнь передается по сцепленному с хромосомой X рецессивному механизму. Синдром Вискотта-Олдрича вызван изменением характера экспрессии CD43 — гликопротеина, являющегося важным элементом цитоскелета Методом электронной микроскопии можно обнаружить аномальное образование пучков актина в Т-клетках и тромбоцитах.
Дефициты клеточного иммунитета
V + D + J + С VDJ + Су
Рекомбиназа —
Л +
▼ Is тяжелая
Р-цепьТСР reHbiRAGI.ll | цепь IgG
А. Формы ТКИД
Точечная мутация Xq13
Х-сцепленный рецессивный признак
22q11
Нарушение эмбрионального развития (3-го и 4-го глоточных карманов)
1 . -► Евстахиева труба г Глоточные 2 миндалины » Тимус — 3 . \| Пара- n п —► Нижние щито- 4 ./2Л. видные 5 X !“► Верхние железы О >4 Ультимо- / бранхиаль- / ные тельца ' Продольный срез глотки Г Клиническая картина Аномалии лица Гипоплазия \ I тимуса Гипопара- 1 ТИРГ3 / Частые ▼ инфекции Т */г\ cCa^cPiT | Аномалия дуги аорты ипокальцемия
Б. Синдром Ди Джордже
Аутосом но-рецессивная, гетерогенная группа
Телеангиэктазия с поражением кожи вокруг глаз
Ионизирующее — излучение
ос, ₽, у, X Z
Невозмож-
Хромосомная нестабильность ;
Поломки и транслокации в локусах TCR и lg на хромосоме 14
Дисмор-физм
Церебральная атаксия
Клиническая триада
В. Атаксия-телеангиэктазия
Г. Синдром Вискотта-Олдрича
Тимидиновый димер
ность репарации ДНК
Осторожность при радиодиагностике!
Частые инфекции
Экзема
Тромбоцитопеническая пурпура: носовое кровотечение, петехия, мелена
Клиническая триада
Иммунодефициты
А. Детский септический гранулематоз
Септический гранулематоз характеризуется дефектом уничтожения внутриклеточных бактерий бактерицидными кислородными радикалами при нормальном связывании бактерий и фагоцитозе. Это нарушение вызвано остутствием в фагосомальной мембране гранулоцитов цитохрома Ь558. Молекула НАДФН не способна переносить электроны, необходимые для образования радикалов кислорода, через мембрану и передавать их молекуле О2. Недостаток цитохрома 655g представляет собой наследуемое по рецессивному механизму Х-сцепленное заболевание. НАДФН-оксидаза играет ключевую роль в указанной окислительно-восстановительной реакции. Глюкозо-6-фосфатдегидроге-наза обеспечивает наличие НАДФН в цитоплазме после его удаления из гексозомонофосфатного пути. Дефект НАДФН-оксидазы и отсутствие глюкозо-6-фо-сфатдегидрогеназы приводят к неспособности гранулоцитов уничтожать фагоцитированные бактерии. Клиническими проявлениями дефекта гранулоцитов являются лимфаденит, пиодермия с поражением носоглотки и колонизация легких, кишечника, костей и печени бактериями, вызывающими сепсис. К наиболее распространенным патогенам относятся штаммы Staphylococcus, Serratia, Klebsiella и Aspergillus. Каталазонегативные штаммы Streptococcus и Haemophilus influenzae уничтожаются внутри клеток, поскольку образуют Н2О2, которую гранулоциты могут использовать в качестве бактерицидного агента.
Терапия состоит в симптоматическом лечении антибиотиками и хирургическом удалении септических очагов.
Б. Синдром Чедиака-Хигаси
Это наследуемое по аутосомно-рецессивному механизму заболевание наиболее распространено среди евреев. Синдром характеризуется нарушением хемотаксиса и уничтожения бактерий внутри клетки. При микроскопическом исследовании в клетках обнаруживаются аномальные гигантские гранулы. Отсутствие дегрануляции связывают с дисфункцией микротрубочек. Кроме изменения функций гранулоцитов также может происходить нарушение активности клеток-киллеров и снижение антителозависимой клеточной цитотоксичности. Основным клиническим проявлением синдрома является частичный альбинизм, сопровождающийся светобоязнью и различными неврологическими симптомами. Пациенты с данным заболеванием особенно чувствительны к инфекциям, вызываемым каталазонегативными бактериями. Терапевтическое действие оказывают холинергические агенты, поскольку они способствуют репарации микротрубочек путем повышения содержания цГМФ в клетке.
В. Дефект адгезии лейкоцитов
Существует два основных типа дефектов адгезии лейкоцитов. При дефекте первого типа адгезия, хемотаксис и фагоцитоз нарушены из-за сниженного уровня экспрессии CD18, p-цепи адгезионного белка LFA-1, рецептора комплемента 3 и рецептора C3dg. Второй тип характеризуется нарушением взаимодействия гранулоцитов и эндотелиальных клеток, что мешает перекатыванию гранулоцитов по стенкам сосудов и проникновению к очагам воспаления. Данный процесс обычно опосредован селектинами и их рецепторами. Сиалогликопротеин Sgp50 является рецептором L-селектина в лейкоцитах, а сиалил-Лыоисх-олигосахарид — рецептором Е-селектина в эндотелиальных клетках. Углеводные цепи каждой из этих молекул содержат молекулы фукозы, которые в связи с дефектностью фермента образованы не из маннозы.
Г. Дефицит миелопероксидазы
Миелопероксидаза (МПО) превращает Н2О2 и хлорид в OCI", запасаемый в специальных гранулах. Дефицит МПО возникает в результате значительного уменьшения числа гранул в гранулоцитах и моноцитах В этой связи ослабевает внутриклеточная бактерицидная активность, хотя не исчезает полностью. Тем не менее, без миелопероксидазы не уничтожаются клетки Candida albicans.
Дефициты гранулоцитов
Гексозомонофосфатный путь
Глюкозо-6-фосфатдегидрогеназа
Рибулозо-6-фосфат 4- СО2?
Гл кжозо - 6 - фосфат
NADP+
NADPH+H+
Хр21
NADPH-оксидаза
Дефект
Цитохром b
Staphylo-г I coccus, / Klebsiella, Ser rat ia
О2 (радикал)
Абсцесс в легких, кишечнике, костях, печени
Назальная пиодермия
Абсцесс в лимфатических узлах
А. Детский септический гранулематоз
Клиническая иммунология
Streptococcus, Pneumococcus,. Н influenzae
Хемотаксис |
Б. Синдром Чедиака-Хигаси
Внутриклеточное бактерицидное действие (дегрануляция)|
Неврологические x I симптомы
Частичный альбинизм вокруг глаз
Экспрессия CD18|
CD18 CD11a CD18 CDIIb
CR-3
Cl Гомология с факторами WF и FB /
LFA-1
Тип 1
В. Дефект адгезии лейкоцитов
Манноза —Фукоза
Транс-
C3dg-R
Поверхность гранулоцита
CD18 CD11c
Тип 2
Е-селектин
Адгезия
Перекатывание
Эндотелий
ранулоцит
Sgp5O
L-селектин
Льюисх-лиганд
17q21
Г. Дефицит миелопероксидазы
115
Иммунодефициты
Нарушение функций белков системы комплемента оказывает примерно такое же действие, как и дефицит иммуноглобулинов. Пациенты с такими нарушениями страдают от часто повторяющихся тяжелых бактериальных инфекций. В здоровой иммунной системе распространение подобных инфекций контролируется процессами опсонизации и комплемент-опосредованного лизиса. В некоторых случаях признаки и симптомы напоминают таковые при системной красной волчанке и васкулитах (см. таблицу).
А. Дефицит ингибитора С1
Низкая концентрация сывороточного ингибитора С1 приводит к хроническим ангионевротическим отекам кожи и слизистой. При отеках ротоглоточной области может произойти острая обструкция верхних дыхательных путей Существует два типа дефицита ингибитора С1: наследственный аутосомно-доминантный и приобретенный. В обоих случаях ингибитор С1 разрушается с более высокой скоростью, чем образуется. Неконтролируемая протеазная активность приводит к высвобождению медиаторов воспаления, что повышает локальную проницаемость сосудов и способствует образованию отека. Для лечения данных состояний применяют производные андрогена. Например, дана-зол повышает уровень выработки ингибитора С1, заставляя работать ген в клетках печени пациентов с наследственной формой заболевания.
Б. Пароксизмальная
ночная гемоглобинурия (ПНГ)
Пароксизмальная ночная гемоглобинурия (ПНГ) возникает из-за дефекта поверхностных белков, регулирующих активность комплемента. В данном процессе задействованы молекулы клеточной поверхности, заякоренные на мембране посредством гликозилфос-фатидилинозитола (GPI). Примерами являются фактор ускорения распада (DAF), ацетилхолинестераза эритроцитов и LFA-3. ПНГ характеризуется пролиферацией кроветворных стволовых клеток с дефицитом мембра
носвязанных белков. Повышенная восприимчивость образующихся эритроцитов к СЗЬ способствует запуску альтернативного пути активации комплемента. Лизис наступает более быстро и более часто после образования мембраноатакующего комплекса. Пациенты страдают от рецидивирующих кризов внутри- и внесо-судистого гемолиза, клиническим проявлением которого является гемоглобинурия.
В. Дисфункция положительной обратной связи
У здоровых людей ингибирующие факторы Н и I эффективно контролируют активацию СЗ. При дефиците этих регуляторных белков в результате действия положительной обратной связи для образования комплекса СЗЬВЬ (СЗ-конвертазы) весь имеющийся нативный компонент СЗ потребляется непродуктивно. Кроме того, некоторые аутоантитела также могут связываться с комплексом СЗЬВЬ. Это не позволяет молекуле диссоциировать на фрагменты СЗЬ и ВЬ по реакции с участием фактора Н. Как и в случае первичной недостаточности СЗ, эти регуляторные нарушения клинически проявляются в виде диффузной липодистрофии и ме-зангиокапиллярного гломерулонефрита Наблюдаются и рецидивы пиогенных инфекций, обусловленные ослаблением опсонизации и клеточного лизиса в результате отсутствия СЗ.
Дефицит рецепторов комплемента
При этом редком наследственном заболевании происходит значительное ослабление опосредованной нейтрофилами адгезии, хемотаксиса и фагоцитоза чужеродных веществ, опсонизированных iC3b. Фактически не происходит инфильтрации нейтрофилами участков воспаления. У пациентов развивается сепсис, угрожающий их жизни. Тяжесть заболевания зависит от степени нарушения экспрессии рецепторов комплемента CR3 и CR4, а также LFA-1. Другие клинические проявления данного синдрома иммунодефицита перечислены в таблице.
Дефицит компонентов системы комплемента
Белки комплемента Клинические проявления дефицита
С1-С4 СКВ, пиогенные инфекции (например, пневмококковый сепсис)
СЗ, FH, F1 Пиогенные инфекции, гломерулонефрит
С8 Инфекции, особенно вызванные Neisseria spp (гонококки, менингококки); склеродактилия
CR3, CR4, LFA-1 Гингивит, позднее отхождение пупочного канатика, хронический сепсис
Дефициты и дефекты системы комплемента
Локальное усиление проницаемости сосудов, отек
А. Дефицит ингибитора С1
Плазминоген
Б. Пароксизмальная ночная гемоглобинурия (ПНГ)
В. Нарушение положительной обратной связи
Иммунодефициты
Ранее неизвестный синдром иммунодефицита, от которого преимущественно страдали мужчины-гомосексуалисты, впервые был описан в 1981 г. Этот синдром сопровождался такими угрожающими жизни заболеваниями, как пневмония, вызванная Pneumocystis carninii, и саркома Капоши, которые ранее встречались редко. Похожие случаи синдрома приобретенного иммунодефицита (СПИДа) позднее наблюдались у больных гемофилией, которым переливали фактор свертывания крови VIII, а также у других реципиентов крови или препаратов крови. Стало понятно, что вещество, вызывающее СПИД, переносится инфекционно, при сексуальных контактах и через кровь. В результате активнейшего поиска причин СПИДа в 1983 г. в группе под руководством Люка Монтанье был открыт новый вирус, который позднее был назван вирусом иммунодефицита человека (ВИЧ).
А. Структура генома и вириона
ВИЧ представляет собой ретровирус, относящийся к подсемейству лентивирусов. Все ретровирусы содержат обратную транскриптазу— фермент, транскрибирующий однонитевую геномную РНК в ДНК. Геном ВИЧ составляет приблизительно 10 т.п.н. Кодирующие гены gag (группоспецифический антиген), pol (обратная транскриптаза и другие белки) и env (интегральные мембранные белки для липидной мембранной оболочки) имеются и у других ретровирусов (например, HTLV). Геном ВИЧ содержит еще и другие регуляторные гены, необходимые для транскрипции и организации поздних стадий репли-кационного цикла: vif (фактор инфекционности вириона), rev (регулятор экспрессии белков вириона) и nef (фактор негативной регуляции). Эти гены перекрываются, т.е. на одном и том же участке РНК содержится несколько генов. Дифференциальная транскрипция под действием системы биосинтеза хозяина приводит к образованию продуктов разных генов.
Вирион ВИЧ имеет диаметр около 100 нм. На его внешней липидной оболочке расположено 72 шипа, образованных гликопротеином др120. Шипы связаны с мембраной трансмембранным белком др41. Липидная мембрана делает вирус особенно чувствительным к действию липофильных агентов, например, спирта.
Б. Связывание с клеткой хозяина
Прикрепление вирусной частицы к поверхности клетки-хозяина протекает в два этапа: 1) связывание др120 с одним из доменов молекулы CD4; 2) связывание с хемокиновым рецептором после конформационных изменений.
В. Цикл репликации в клетке хозяина
После слияния двух липидных мембран содержимое вириона входит в цитоплазму клетки. Сразу после этого обратная транскриптаза начинает транскрибировать РНК вируса в двунитевую ДНК. Длинные концевые повторы ретровируса (LTR) и фермент интеграза позволяют встроить геном вируса в геном клетки-хозяина, где он хранится как провирус. Синтез вирусного белка, осуществляемый синтетическим механизмом клетки-хозяина, может быть инициирован регуляторными последовательностями LTR, а также генами rev, tat и vpr.
Г. Клетки, чувствительные к ВИЧ-инфекции ВИЧ атакует CD4+ Т-лимфоциты и другие иммунные клетки, в том числе клетки моноцитарной системы (моноциты, тканевые макрофаги, клетки Лангерганса). До сих пор не известно, может ли ВИЧ инфицировать плюрипотентные стволовые клетки. Могут быть инфицированы клетки ЖКТ и центральной нервной системы. Наиболее часто ВИЧ атакует такие участки и клетки ЦНС, как микроглия (макрофаги), астроциты, олигодендроциты и эндотелиальные клетки церебральных кровеносных сосудов. Могут ли быть инфицированы нейроны — неизвестно.
Структура и репликация ВИЧ
Белки Усиливает Способ-
нуклео- инфек- ствует
капсида ционность почкованию
gag~]
LTR
pol
vor
/ 'обратная
Длинные •транскриптаза концевые Протеаза повторы Дрибонуклеаза транскрипции
Слабый и сильный активатор
] Структурные белки
] Ферменты
] Регуляторные белки
] Другие белки
vpu
Белки поверхности вируса опосредуют связывание CD4 и слияние мембран
tat rev
Регулятор экспрессии структурных белков
др120-др41
РНК р7-нуклеокапсид Липидная мембрана р24-капсид р17-матрикс
А. Структура генома и вириона
(др41.
ВИЧ
Б. Связывание с клеткой хозяина
Клиническая иммунология
Обратная ДНК вируса транскриптаза превращает 4 \ ,.
РНК в ДНК 7 \ Интеграция
' в геном
клетки
ВИЧ
Образование вирусной ДНК белков /о
Связывание CD4, слияние мембран
Высвобождение содержимого вириона в клетку
Отпочко-вывание вирионов
Образование интегральных мембранных белков (др41, др12О)
Протеаза
В. Цикл репликации в клетке хозяина
119
Иммунодефициты
А. Течение ВИЧ-инфекции
Латентный период развития ВИЧ-инфекции до появления тяжелых симптомов иммунодефицита (СПИДа) составляет около 10 лет. В этот период иммунная система ухитряется удерживать распространение инфекции под контролем. В начальной фазе заболевания вирус пролиферирует, практически не получая никакого отпора. Число свободных вирусных частиц резко возрастает. Прежде чем умереть, инфицированные Т-хелпе-ры и макрофаги производят тысячи новых вирионов. Но только около 30% ВИЧ-инфицированных на этой стадии ощущают симптомы болезни (жар, озноб, лимфаденопатия).
Б. Иммунный ответ
При помощи молекул МНС класса I инфицированные клетки осуществляют презентацию вирусных эпитопов, тем самым активируя цитотоксический иммунный ответ. Т-клеточная активация, опосредованная молекулами МНС класса II, приводит к образованию интерлейкинов, активации В-клеток и синтезу антител. Антитела связывают свободные вирусные частицы, способствуя их уничтожению макрофагами. Суммарная вирусная популяция резко сокращается. В условиях такого строгого контроля при репликации ВИЧ постоянно происходят новые мутации. Обратная транскриптаза ретровируса делает примерно одну ошибку на 2000 нуклеотидов, что способствует образованию мутантных форм. Новые мутанты пролиферируют без проверки иммунной системой хозяина до тех пор, пока она не воспримет новые эпитопы. Постоянное образование новых вирусных мутантов делает популяцию настолько разнородной, что иммунная система в конце концов «запутывается» и становится неспособной эффективно контролировать развитие инфекции Координированная атака против вируса становится невозможной. Скорость образования и деструкции вирусных частиц составляет 109 вирионов в день, причем каждое поколение ВИЧ-час-тиц проживает примерно 2,6 дня. Таким образом, за год образуется около 140 поколений вируса. К концу латентного периода иммунной системе противостоит образование 10 млн ВИЧ-вариантов в день. Точный механизм разрушения иммунной системы до сих пор не выяснен
В. СПИД
Проявлению СПИДа во всей полноте предшествует персистирующая генерализованная лимфаденопатия (ПГЛ). Лимфаденопатический синдром (ЛАС) обычно длится более трех месяцев и характеризуется вовлечением аномально расположенных лимфоузлов.
Коллапс иммунной системы приводит к проявлению множества симптомов. Число Т-хелперов в сыворотке крови падает ниже критической отметки 400 клеток/мкл. Кроме того, возрастает концентрация сывороточного IgG, содержащего главным образом «бессмысленные» глобулины, что связано со стимуляцией неспецифических поликлональных В-клеток К другим клиническим проявлениям относятся потеря массы тела, жар, ночная потливость. Этот комплекс симптомов называют СПИД-связанным комплексом (СОК).
Наступление СПИДа сопровождается развитием инфекционных заболеваний, вызванных условно-патогенными микроорганизмами, такими как Pneumocystis carninii (пневмония) и Candida (эзофагит), а также оральной волосатой лейкоплакии (вирус Эпштейна-Барр). СПИД сопровождается некоторыми злокачественными новообразованиями. Например, возникновение саркомы Капоши обусловлено хронически повышенным уровнем воспалительных цитокинов и ангиогенных факторов роста. Сопутствующая инфекция, вызванная человеческим вирусом герпеса 8 (HHV-8), также является важным фактором. Злокачественные лимфомы поражают примерно 10% ВИЧ-инфицированных. На поздних стадиях развития СПИДа проявляются признаки поражения ЦНС. Следует различать первичные энцефалопатии, вызванные нейротропным ВИЧ, и вторичные энцефалопатии типа церебрального токсоплазмоза, ЦМВ энцефалита и менингитов различного происхождения.
Течение ВИЧ-инфекции
Иммунодефициты
А. Диагностика ВИЧ-инфекции
ВИЧ-инфекцию обычно диагностируют с помощью твердофазного иммуноанализа (ELISA) непрямым методом детекции специфических сывороточных антител к ВИЧ. Тест осуществляют в три стадии.
1. Антитела к ВИЧ связываются с ВИЧ-антигеном, покрывающим лунки планшета.
2. Связанные антитела метят конъюгированными с ферментом антителами против иммуноглобулинов человека.
3. Добавленный субстрат под действием фермента превращается в окрашенный продукт реакции в присутствии антител к ВИЧ.
Положительный результат данного теста всегда следует подтвердить еще хотя бы одним способом, например, с помощью иммуноблоттинга или специфического иммунофлуоресцентного метода (см. с. 92—95).
Поддержание вирусной культуры обходится довольно дорого, поэтому в рутинной практике ее не используют для ВИЧ-диагностики. Часто для скрининга используют методы амплификации генов, такие как полимеразная цепная реакция (ПЦР) или ПЦР с обратной транскриптазой (ОТ-ПЦР). ПЦР используют для детекции провирусной ДНК, а с помощью ОТ-ПЦР определяют вирусную РНК (см. с. 109, В).
Б. Стратегии лечения
Противовирусные препараты (1). Аналоги нуклеозидов (модифицированные нуклеозиды) ингибируют обратную транскриптазу и при встраивании в ДНК вируса вызывают обрыв цепи. Азидотимидин (АЗТ) был первым ингибитором обратной транскриптазы, разработанным для борьбы с ВИЧ-инфекцией, однако вирус довольно быстро приобретает устойчивость к этому препарату (6). Встраивание «фальшивых» нуклеозидов также блокирует полимеразу клетки, что приводит к побочным явлениям, сходным с теми, что наблюдаются при приеме цитостатических препаратов.
Другая группа веществ связывается с каталитическим центром обратной транскриптазы, инактивируя ее (а). Относительно новые препараты этого класса остаются эффективными после многих мутаций гена pol. Эффективность данных препаратов, измеряемая как снижение вирусной нагрузки, можно еще повысить, комбинируя их с другими статическими препаратами. Особенно эффективно сочетание с новой группой ингибиторов протеаз (в). Ингибиторы блокируют каталитический центр вирусной протеазы, поскольку имеют структурное сходство с вирусным белком-предшественником.
Вакцины (2). Использование ослабленного живого вируса для вакцинации людей слишком рискованно, поскольку развитие иммунитета, наблюдавшееся в экспериментах на животных (обезьянах) нельзя гарантированно экстраполировать на человека. Новые возможности открываются в связи с развитием методов гибридных вирусов. Ген ВИЧ др120 может быть перенесен в безвредный для человека вирус, например, вирус коровьей оспы. Это позволяет использовать функционально ослабленный, но все еще высокоиммуногенный вирус в качестве живой вакцины. Другой подход заключается в использовании в качестве вакцины очищенной ДНК. Поскольку вводимая ДНК включается в геном клетки, она может имитировать внедрение вирусной инфекции, но в отсутствие вирулентности.
Интерлейкины (3). Активированные CD8+ Т-клетки образуют ИЛ-16 (лимфоцитарный хемотаксический фактор), ингибирующий репликацию вируса. В то же время он индуцирует перекрестное сшивание молекул CD4 на поверхности CD44 Т-клеток. Синтез вирусных частиц инфицированными CD44 Т-клетками снижается в 10 раз. Хемокины RANTES, М1Р-1а и MIP-1 р оказывают на Т-клетки похожий эффект, поскольку блокируют хемокиновые рецепторы, необходимые для связывания ВИЧ. Рекомбинантный «-интерферон и ИЛ-12 ингибируют некоторые стадии цикла репликации. При экспериментальной разработке медикаментозной терапии их часто используют в сочетании с ингибиторами обратной транскриптазы в случаях бессимптомного протекания ВИЧ-инфекции.
Диагностика и лечение ВИЧ-инфекции
Лунки покрыты ВИЧ-антигеном
у\ Антитела против хЗ\1д человека хх + фермент
Ферментативная реакция с субстратом
Фотометрический анализ
А. Диагностика ВИЧ-инфекции методом ELISA
Клиническая иммунология
Антиген, митоген
Инфицированная CD4+ Т-клетка
Передача сигнала
Снижение продукции вируса
Активированная CD8+ Т-клетка
3. Интерлейкины
Б. Стратегии лечения
Хемокиновый рецептор
CD4
Отсутствие инфицирования
123
Гемолитические заболевания и цитопении
А. Система групп крови АВО
Система групп крови АВО была открыта Карлом Ланд-штайнером в 1901 г. и является наиболее важной системой типирования групп крови. Она основана на существовании естественных антител (изоагглютининов) против антигенов групп крови А и В, экспрессирующихся на эритроцитах. Антитела вырабатываются только против антигенов, не экспрессируемых на эритроцитах хозяина. Люди, относящиеся к типу А (около 42% жителей центральной Европы, 41% белого населения Америки, а также 27% афроамериканцев и мексиканцев). имеют антитела против антигена группы крови В. Эти антитела способствуют агглютинации и лизису эритроцитов, несущих антигены В; их называют анти-В антителами Если такие эритроциты перелить индивиду с группой крови А, то они немедленно подвергнутся лизису. Люди, относящиеся к типу В (около 14% европейцев, 20% афроамериканцев, 13% мексиканцев, а также 25% азиатов), имеют природные анти-А антитела. Существуют люди типа АВ (около 6% всего населения), на эритроцитах которых экспрессируются как А, так и В антигены, а в сыворотке нет ни анти-А, ни анти-В антител. У людей с группой крови 0 (около 38% европейцев, 45% белого населения Америки, 49% афроамериканцев и 56% мексиканцев) на эритроцитах нет ни А, ни В антигенов, а в сыворотке присутствуют как анти-А, так и анти-В антитела. Антигены А подразделяются на подтипы А1 (80%) и А2 (20%). Анти-А1 антитела изредко встречаются у людей с типом А2. Антигены А и В экспрессируются главным образом на эритроцитах, но слабая экспрессия наблюдается также на тромбоцитах и эндотелиальных клетках.
Б. Образование антител А и В
У новорожденных анти-А и анти-В антитела развиваются при контакте с повсеместно встречающимися антигенами. Бактерии и пыльца несут особенно много антигенов А и В. Если эти антигены экспрессируются на эритроцитах хозяина, то клоны клеток, образующих антитела против них, уничтожаются.
В. Образование антигенов системы АВО
Гены АВ и 0 расположены на длинном плече хромосомы 9. Они кодируют гликозилтрансферазы, переносящие различные группы сахаров к веществам-предшественникам. Перенос L-фукозы к цепи предшественника осуществляется продуктом так называемого Н-гена у 99,9% людей. Это приводит к образованию антигена Н, экспрессирующегося на эритроцитах и состоящего из остатков глюкозы, галактозы, N-ацетилглюкозамина, галактозы и фукозы. Активный ген А (у людей с типом крови А) кодирует специфическую N-ацетил-галактозаминилтранс-
феразу, присоединяющую к антигену Н молекулу N-ацетилгалактозамина с образованием антигена А. Если активен ген В, то вместо этого синтезируется молекула галактозилтрансферазы. Иными словами, у людей с группой крови В к антигену Н присоединяется молекула галактозы. У людей с активными генами А и В на эритроцитах происходит экспрессия обоих антигенов. У людей с активным молчащим геном О антиген Н остается немодифицированным, что соответствует группе крови 0.
Гены АВ и 0 наследуются в соответствии с законами Менделя. Следовательно, люди типа А могут иметь генотип АА или АО, а люди типа В — ВВ или ВО. Индивиды типа АВ имеют генотип АВ, а индивиды типа О — генотип 00. Естественные анти-А и анти-В антитела представляют собой главным образом иммуноглобулины класса IgM. Однако у индивидов с группой крови О против А и В антигенов вырабатываются также антитела класса IgG.
Поскольку анти-А и анти-В изоагглютинины присутствуют в организме от природы, то однократное переливание АВО-несовместимых эритроцитов может привести к тяжелой форме гемолиза. После первичной встречи с антигенами кроме природных антител может начаться выработка новых иммуноглобулинов.
Система групп крови АВО
4 эуппа кр A>Y L СИСЛ юви А: ~ 42% Антитела против В Антиген А ема групп кр Г ЮЕ руппа к СК 00 Гр (И АВО зови В: ~ 14% Антитела против А i Антиген В эуппа кр о юви АВ: ~ 6% Нет антител против А и В Антиген А Антиген В Гг эуппа кр go 91 юви 0: ~ 38% Антитела против А и В Нет антигенов АиВ
Бактерия пыльца \fa
Много А и В антигенов
Антитела IgM
Новорожденный против А, В и АВ
Делеция клонов, синтезирующих антитела против собственных антигенов эритроцитов
Б. Образование антител А и В
Эритроцит
в
Церамид Glu Gal GIcNAc Gal \ \ “
Вещество-предшественник
GDP 1-фукоза,
L-фукозилтрансфераза (Н-ген активен у 99 9% населения)
Хромосома 9
Церамид ।
Gal GIcNAc
Антиген Н
А
О
Ген О (молчащий аллель)
Активный ген А (N - а цетилга л а ктоз -аминилтрансфераза)
Активен ген В (гала ктозилтра нс-фераза)
Активны оба гена А и В
Немодифици-рованный антиген Н
Галактоза
Антиген А + антиген В
N-ацетил-галактозамин
Группа крови О
Группа крови В
Группа крови АВ
Группа крови А
В. Образование антигенов системы АВО
Гемолитические заболевания и цитопении
На эритроцитах экспрессируются антигены более 20 различных систем групп крови С клинической точки зрения наиболее важны системы АВО, резус, Келл и Даффи.
А. Система резус
Система резус (Rh) сложна как генетически, так и фенотипически. Антигены этой системы обозначаются DdCcEe и кодируются соответствующими генами. Компонент d представляет собой молчащий аллель, наличие которого не приводит к экспрессии антигена. В соответствии с упрощенной моделью экспрессия антигенов данной группы крови контролируется двумя соседними локусами генов на хромосоме 1. В локусе 1 активным может быть молчащий ген d или ген D, кодирующий антиген D. В соседнем локусе расположены четыре аллеля: СЕ, Се, сЕ и се. Гены двух локусов являются кодоминантными. Другими словами, продукт гена из первого локуса экспрессируется вместе с геном из второго локуса. В результате возможны следующие комбинации: DCE, DCe, DcE, Dee, dCE, dCe, dcE, dee. Поскольку каждый человек наследует один аллель от отца, а другой от матери, то разнообразие генотипов достаточно велико. Тип людей, у которых происходит экспрессия продукта гена D, называют резус-положительным (Rh+), а тип людей с генотипами, в которых антиген D потерян (активен молчащий аллель d), называют резус-отрицательны-ми (Rh—). Наиболее распространенные генотипы показаны на рис. А. Антиген D по иммуногенности намного превосходит другие антигены.
Б. Аллоиммунизация
против антигенов группы резус
Аллоиммунизация против резусных антигенов происходит при попадании в кровь несовместимых эритроцитов. Например, это может случиться при переливании резус-отрицательному пациенту резус-положительных эритроцитов. Всего лишь 1 мл Rh+ крови в 15% случаев приводит к выработке анти-D антител класса IgM; у 80% Rh-отрицательных индивидов выработка анти-D антител происходит после введения 250 мл Rh+ эритроцитов. Повторное введение даже очень малых количеств Rh+ эритроцитов может вызвать быстрое образование антител IgG против антигена D. Важным клиническим примером служит гемолитическая болезнь новорожденных (ГБН) (рис. Б2). После родов резус-негативной матерью резус-положительного ребенка в ее организме начинают вырабатываться анти-D антитела (IgM), что связано с соприкосновением эритроцитов плода с кровеносной системой матери (обычно в момент родов) При следующей беременности контакт даже с малыми количествами эритроцитов
плода активирует выработку антител IgG, проникающих сквозь плаценту. Плод может погибнуть в утробе матери в результате тяжелой гемолитической анемии (эритробластоз плода). Продукты расщепления гемоглобина могут попадать в головной мозг, особенно в мозговой ствол (ядерная желтуха). Для предотвращения иммунизации резус-негативным матерям в течение 72 ч после родов, амниоцентеза, выкидыша или аборта следует ввести анти-D иммуноглобулины. Введение этих антител немедленно удалит любые эритроциты плода, которые могли попасть к матери, и тем самым предотвратит стимуляцию материнской иммунной системы и синтез антител.
В. Другие антигены эритроцитов
Важное значение системы групп крови Келл объясняется высокой иммуногенностью антигена К (обычно коррелирует с наличием антигена D системы резус). Антиген К обнаруживается лишь у 9% людей. Передача К-положительных эритроцитов при беременности или переливании крови приводит к образованию анти-К антител, что необходимо учитывать при следующих переливаниях. Бактериальные антигены также могут провоцировать образование анти-К антител.
Поскольку антигены системы Даффи (Fya и Fyb) обладают слабой иммуногенностью, то анти-Fy антитела встречаются редко. Оба антигена отсутствуют у 68% афроамериканцев. Этот факт связывают с естественным отбором, поскольку гликопротеин Fy служит рецептором патогена Plasmodium vivax, вызывающего малярию. Поэтому отсутствие антигенов Fy приводит к устойчивости к малярии. Недавние исследования показали, что антиген Даффи является хемокиновым рецептором (DARC, Duffy antigen receptor for chemokines), который присутствует также на эндотелиальных клетках и посткапиллярных венулах. Он является рецептором многих СХС и СС-хемокинов (см табл 9 в приложении).
Система резус и другие системы групп крови
Хромосома 1
Локус 1 Локус 2
Возможны 2 аллеля: D и d (неактивен) Возможны 4 аллеля: Се, сЕ, СЕ и се
Наиболее распространенные генотипы Встречаемость Фенотип Иммуногенность
DCe/DCe 18%
DCe/dce 35%
DCe/DcE 13% Rh+ c
DcE/dce 12% E I
DcE/DcE 2% c \l
Dce/dce 2%
dce/dce 15% Rh- e (+)
А. Система резус
1-й контакт
Иммуногенный антиген D
Повторный контакт с Rh+ эритроцитами (< 0,5 мл)
1-я беременность Rh+ плод
Rh
1 мл Rh+ эритроцитов
У 15% синтезируется анти-D IgM
Немедленное образование IgG
Rh- мать Попадание Rh+ эритроцитов при родах
Мать синтезирует анти-D IgM
2-я беременность ©Rh+ плод
/ Достаточно незначительного - количества
Лизис Rh+эритроцитов эритро- I цитов Синтез
плода анти-D IgG
I__________J
2. Гемолитическая болезнь новорожденных
250 мл Rh+ эритроцитов
У 80% синтезируется анти-D IgM
1. Иммунный ответ на антиген D
Rh+ плод Rh- мать
после родов ввести анти-D lg
эритроцитов: нет иммунной стимуляции
3. Профилактика путем Rh-иммунизации
Б. Аллоиммунизация против антигенов группы резус
Система Келл (Кик)
Фенотип Встречаемость
К- k+ 91%
К+ k+ 8.8%
К+ к- 0.2%
Путь передачи: беременность инфекция переливание крови
Система Даффи (Fya и Fyb)
Фенотип Встречаемость (США)
Белые Черные
Руа+Ь- 17% 9%
Fya+b+ 49% 1%
Fya-b+ 34% 22%
Fya-b- <1% 68%
В. Другие антигены эритроцитов
Клиническая иммунология
127
Гемолитические заболевания и цитопении
Антитела против эритроцитов могут вызывать их лизис вне зависимости от того, возникли ли они в организме в результате физиологической реакции на переливание несовместимых эритроцитов или из-за нарушения работы иммунной системы (аутоиммунный гемолиз).
А. Механизмы гемолиза
Гемолиз может быть внутрисосудистым и внесосудис-тым. Прикрепление антител IgM к эритроцитам может приводить к связыванию комплемента в кровотоке и образованию пор в эритроцитах после активации литической последовательности (1). Данный тип внутрисосудистого гемолиза приводит к высвобождению большого количества гемоглобина, который связывается гемоглобин-связывающим белком (гаптоглобином) в сыворотке. При исчерпании связывающей емкости гаптоглобина свободный гемоглобин выводится через почки (гемоглобинурия). Поскольку молекулы гемоглобина осаждаются в кислой среде, происходит повреждение почечных канальцев. Ситуация усугубляется осаждением иммунных комплексов антигенов и антител из мембран поврежденных эритроцитов. Кроме того, иммунные комплексы и свободный гемоглобин активируют каскад свертывания крови. Это в свою очередь приводит к диссеминированному внутрисосудистому свертыванию (ДВС), сопровождающемуся микротромбозом в почках, легких, головном мозге и печени.
Внесосудистый гемолиз имеет место в том случае, когда не происходит прямого связывания комплемента антителами, т.е. когда литическая последовательность комплемента (С5-С9) в кровотоке не активирована. При участии Fc-рецепторов и рецепторов фрагментов комплемента (СЗЬ) эритроциты подвергаются фагоцитозу в ретикулоэндотелиальной системе (РЭС) и внутриклеточному расщеплению (2). Течение внесосудистого гемолиза менее тяжелое, чем внутрисосудистого.
Б. Антиглобулиновый тест (проба Кумбса)
Сыворотка Кумбса представляет собой полиспеци-фическую сыворотку, используемую для детекции эритроцитарных антител к человеческим IgG, IgM и компонентам комплемента (1). Поскольку обычно в сыворотке Кумбса отсутствуют анти-IgA антитела, то IgA-аутоантитела часто не детектируются.
Прямая проба Кумбса используется для детекции антител, связанных с эритроцитами или с комплементом. При наличии антител сыворотка Кумбса вызывает перекрестное сшивание антител и агглютинацию клеток (2).
Непрямая проба Кумбса используется для детекции антиэритроцитарных антител в сыворотке (3). Сыворотку пациента инкубируют с различными тестовыми эритроцитами с известным антигенным профилем. Если сыворотка содержит антитела к одному из тестовых антигенов, то антитела связываются с эритроцитами, которые при добавлении сыворотки Кумбса будут агглютинировать. Проба Кумбса используется для детекции антител к антигенам эритроцитов перед переливанием крови и при подозрении на гемолиз при беременности.
В. Детекция полных и неполных антител на поверхности эритроцита
Антитела IgM способствуют агглютинации эритроцитов в изотоническом солевом растворе; поэтому их называют полными антителами. Напротив, антитела IgG являются моновалентными молекулами и не способны перекрыть расстояние между двумя эритроцитами. Молекулы IgG могут связываться с эритроцитом, но агглютинации не происходит, поэтому IgG называют неполными антителами. Наличие на поверхности эритроцита неполных антител и фрагментов комплемента детектируется при помощи сыворотки Кумбса.
Г. Гемолиз и аффинность антител
Одной из функций ретикулоэндотелиальной системы является лизис старых эритроцитов (продолжительность жизни эритроцита около 120 дней). Степень гемолиза обычно коррелирует с числом молекул антител, связанных с каждым эритроцитом. В редких случаях тяжелый гемолиз может индуцироваться небольшой концентрацией высокоаффинных антител Например, время жизни эритроцита может сократиться до трех дней в присутствии всего 10 анти-Rh антител В данном случае проба Кумбса может быть отрицательной или лишь слабо положительной, поскольку нижний предел обнаружения для большинства реагентов Кумбса составляет 300-500 антител на эритроцит. Такие компоненты комплемента, как СЗЬ, могут существенно повысить скорость гемолиза.
Механизмы гемолиза и детекции антител
Связывание комплемента с Ab (IgM)
Свободный гемоглобин
Иммунные комплексы
две Нефропатия Гемоглобинурия
2, Внесосудистый гемолиз
1. Внутрисосудистый гемолиз
А. Механизмы гемолиза
Полиспецифическая сыворотка Кумбса: анти-IgG, анти-IgM, анти-комплементарные АЬ
2. Прямая проба Кумбса
Тестовые эритроциты с известным антигенным составом
< Y 4+ Сыворотка Y \~7^ пациента
>- Агглютинация
4- Сыворотка Кумбса
Клиническая иммунология
1. Получение сыворотки
3. Непрямая проба Кумбса
Б. Детекция эритроцитарных антител: антиглобулиновый тест (проба Кумбса)
Агглютинация в суспензии = полные антитела (IgM)
-??000
Нет агглютинации = неполные антитела (IgG) или только комплемент
+ Сыворотка Кумбса
Агглютинация посредством анти-СЗ АЬ
Агглютинация посредством анти-IgG АЬ
В. Полные и неполные антитела
Число молекул АЬ/эритроцит
Г. Гемолиз и аффинность антител
Гемолитические заболевания и цитопении
А. Патогенез аутоиммунной гемолитической анемии
Причины аутоиммунной гемолитической анемии (ЛИГА) не известны (идиопатический гемолиз) приблизительно в 50% случаев. В других 50% случаев она имеет различную этиологию, например, может быть вызвана инфекцией, стимулирующей образование аутоантител в результате перекрестной реакции бактериальных или вирусных антигенов с антигенами эритроцитов. Заболевания соединительной ткани, особенно системная красная волчанка (см. с. 194-197), кроме усиленного синтеза аутоантител характеризуются еще и повышенной активностью Т-хел-перов. Лимфопролиферативные заболевания Т- и В-клеточной природы, а также лимфомы могут мешать регуляторным функциям Т-клеток, тем самым способствуя повышенному уровню синтеза аутоантител. Гематологические заболевания такие как болезнь Ходжкина, неходжкинская лимфома или хронический лимфоцитарный лейкоз могут развиваться в результате злокачественной трансформации аутореактивных В-клеток, образующих аутоантитела, или могут нарушать ингибирующие механизмы, которые в норме предотвращают образование аутоантител. Еще один важный тип аутоиммунного гемолиза обусловлен приемом некоторых лекарств (см. с. 134).
Б. Тепловые антитела
Гемолитические анемии классифицируют в соответствии с температурной зависимостью активности соответствующих аутоантител. Холодовые антитела более эффективно связываются с эритроцитами при 4°С, в то время как тепловые антитела — при 37 С. Приблизительно 70% пациентов с АИГА имеют тепловые антитела, 15-20% — холодовые, а оставшаяся часть — и те и другие. Тепловые антитела обычно представляют собой иммуноглобулины класса IgG. Связывание комплемента такими антителами ослаблено, поскольку компонент комплемента 01 для активации должен подвергаться конформационным изменениям. Это происходит только тогда, когда С1 связывается с двумя близко расположенными молекулами иммуноглобулинов. Так всегда происходит в случае поливалентного IgM, существующего в виде пентамера, но в случае IgG это возможно только при высокой плотности антигенов на мембранах эритроцитов. Лизис IgG-несущих эритроцитов макрофагами обычно происходит вне сосудов. Этот гемолитический процесс относительно малоэффективен, поскольку циркулирующие иммуноглобулины блокируют Fc-рецепторы. Единственным местом, где процесс идет активно, является селезенка, поскольку эритроциты циркулируют там крайне медленно. Это снижает концентрацию сы
вороточных иммуноглобулинов по отношению к числу эритроцитов. Скорость гемолиза увеличивается при связывании СЗЬ с мембраной эритроцита.
В. Клинические признаки гемолиза
Аутоиммунный гемолиз проявляется в снижении концентрации гемоглобина в сочетании с выраженным анизоцитозом. В случае тепловых антител лизис эритроцитов имеет место в основном в РЭ системе. Концентрация гемоглобин-связывающего белка гаптоглобина падает только при тяжелых формах гемолиза. В результате повышенной скорости гемолиза в селезенке и печени может наблюдаться гепатоспленомегалия. Происходит высвобождение таких внутриклеточных ферментов, как лактатдегидрогеназа. В костном мозге происходит стимуляция эритропоэза, и повышается концентрация ретикулоцитов. Свободный гемоглобин превращается в билирубин, который связывается с глюкуроновой кислотой в печени и выводится с желчью. Часто наблюдается гипербилирубинемия, вызывающая пожелтение склеры и кожи (желтуха). Другой продукт деградации гемоглобина — уробилиноген — придает темный цвет моче.
Г. Лечение аутоиммунного гемолиза, опосредованного тепловыми антителами
В большинстве случаев таким пациентам прежде всего назначают лечение кортикостероидами. Эти препараты подавляют выработку антител, но также могут снизить эффективность и число Fc- и СЗ-рецепторов на макрофагах. Высокие дозы иммуноглобулинов тоже блокируют Fc-рецепторы. Кортикостероиды и иммуноглобулины обычно не приводят к долгосрочному улучшению состояния. Часто показана спленэктомия или облучение селезенки, поскольку захват покрытых агглютинином эритроцитов происходит главным образом в селезенке. Там же образуются большие количества IgG. В качестве последнего средства можно использовать иммуносупрессоры, такие как циклофосфамид, азатиоприн или циклоспорин. Недавно хорошие результаты были получены при использовании анти-С020 моноклональных антител (ритуксан). Эти антитела способствуют уничтожению В-лимфоцитов являющихся источником аутоантител
Аутоиммунный гемолиз, вызванный тепловыми антителами
А. Патогенез аутоиммунном гемолитической анемии
+ 20°С
D Fc-опосредованный фагоцитоз
Клиническая иммунология
Селезенка
Макрофаг
Тепловые антитела: IgG, редко IgM или IgA
Б. Тепловые антитела
Анемия
Желтуха
Гепатосплено-мегалия
Гиперплазия костного мозга, эритропоэз t
лдг!
Гаптоглобин ▼ Уробилиноген!
Насыщение Fc-рецепторов высокими внутривенными дозами 1g
Иммуносупрессорная терапия
Циклофосфамид
Азатиоприн
Циклоспорин
Ahth-CD20 АЬ
Преднизон: успех в 20% случаев
1. Снижение синтеза Ab
2. Ослабление фагоцитоза
В. Клинические признаки гемолиза
Г. Лечение аутоиммунного гемолиза, опосредованного тепловыми антителами
131
Гемолитические заболевания и цитопении
А. Аутоиммунный гемолиз, опосредованный холодовыми антителами
Чаще всего встречаются холодовые антитела, относящиеся к классу IgM, и лишь иногда — к классу IgG. Поэтому они могут вызывать агглютинацию эритроцитов и называются агглютининами Наиболее часто эти антитела возникают в результате инфекций, особенно вызванных микоплазмой, вирусом Эпштейна-Барр или цитомегаловирусом, но редко после бактериальных инфекций. Перечисленные инфекции обычно приводят к образованию поликлональных холодовых антител, более эффективно связывающихся с эритроцитами при пониженной температуре. В большинстве случаев холодовые антитела направлены против антигена I, в основном экспрессирующегося на зрелых эритроцитах, но также на некоторых патогенах. Некоторые злокачественные заболевания лимфатической системы могут приводить к секреции моноклональных агглютининов (см. с. 152). Моноклональные антитела могут быть направлены против антигенов I и I (на незрелых эритроцитах плода). Моноклональные холодовые агглютинины вызывают хроническую холодовую гемагглютининовую болезнь (ХХГБ) с пиком заболеваемости, приходящимся на возраст от 70 до 80 лет.
Тяжесть гемолиза, вызванного холодовыми агглютининами, зависит от температурного диапазона антител, определяемого как количество антител, связывающихся с эритроцитами при данной температуре. При понижении температуры связывание антител усиливается, но литическая активность комплемента снижается. В результате гемолиз происходит только в определенном диапазоне температур, обычно между 10 и 30°С (рис. А2). Если температурный диапазон широкий (достигает значений выше 30°0), то гемолиз происходит при температурах, реально достижимых в коже. Холодовые агглютинины часто обнаруживаются у пациентов случайно в результате агглютинации эритроцитов при обычном анализе крове (рис. АЗ). Автоматические анализаторы крови регистрируют слипшиеся клетки как одну крупную клетку. Это приводит к ошибочно завышенному показателю среднего объема эритроцита (СОК) и к ошибочно заниженному показателю числа эритроцитов у пациентов с нормальной концентрацией гемоглобина.
Поскольку температура в капиллярах кожи может опускаться ниже 30°С, холодовые агглютинины провоцируют слипание эритроцитов. Данный процесс внутрисосудистой агглютинации приводит к закупорке капилляров, проявляющейся в виде акроцианоза (посинение пальцев, ушей, кончика носа) или мраморной кожи (красно-голубое побледнение кожи) В тяжелых случаях могут иметь место трофические повреждения (язвы и некроз).
Б. Механизмы гемолиза
Холодовые антитела наиболее эффективно связываются с эритроцитами при +4°С и очень слабо при 37°С. Степень связывания при комнатной температуре может быть различной. Поскольку холодовые антитела в основном представлены иммуноглобулином М, то активация комплемента может приводить к прямому внутрисосудистому гемолизу с серьезными клиническими проявлениями, включая гемоглобинурию, почечную недостаточность и диссеминированное внутрисосудистое свертывание (см. также с. 128). К счастью, такие явления наблюдаются редко. В большинстве случаев гемолиз развивается постепенно. Присоединение к поверхности эритроцита молекулы СЗЬ способствует связыванию с рецептором комплемента на клетках Купфера в печени. Поскольку фагоциты не имеют Fc-pe-цепторов для IgM, то Fc-опосредованного фагоцитоза не происходит (в отличие от гемолиза, вызванного тепловыми антителами). Следовательно, для лечения гемолиза, вызванного холодовыми антителами, бессмысленно применять спленэктомию, высокие дозы иммуноглобулинов или стероидов.
В. Лечение
Небольшие количества холодовых агглютининов довольно часто детектируются в лабораторных тестах. Однако этот показатель обычно не имеет клинического значения, поскольку холодовые агглютинины чаще всего имеют небольшой температурный диапазон. Кроме того, у многих пациентов с холодовой гемагглютининовой болезнью наблюдается лишь слабый, постепенно прогрессирующий гемолиз, не требующий лечения Тем не менее в некоторых случаях при нахождении на холоде у человека может произойти тяжелый гемолитический криз. Переливание крови при данном заболевании не показано, за исключением критических для жизни ситуаций. При переливании кровь должна быть подогрета до 37°С. Специфического лечения данного заболевания не существует. Наиболее важной превентивной мерой является ношение теплой одежды. При особенно серьезных симптомах рекомендуется смена климата на более теплый. Удаление или облучение селезенки обычно не дают результата. Лечение цитостатиками или иммуносуппрессорами имеет смысл лишь в том случае, когда причиной болезни является лимфопролиферативное заболевание. Недавние исследования показали, что препарат ритуксан (моноклональные антитела, направленные против CD20) может контролировать гемолиз
Аутоиммунный гемолиз, вызванный холодовыми антителами
1. Специфичность холодовых антител
2. Температурный диапазон антител
Завышенное СОК
Заниженное число эритроцитов
Анемия
Акроцианоз
Мраморная кожа
Трофические повреждения
3. Изменения формулы крови
4. Клинические симптомы
А. Аутоиммунный гемолиз, опосредованный холодовыми антителами
Внутрисосудистый гемолиз
Антитела против CD20
Холодовые антитела: IgM, редко IgG
Фагоцитоз, опосредованный СЗ-рецептором
Клетка Купфера
Б. Механизмы гемолиза
В. Лечение
Клиническая иммунология
Гемолитические заболевания и цитопении
А. Аутоиммунный гемолиз, вызванный приемом лекарств
Существует ряд иммунных механизмов гемолиза, спровоцированного действием лекарств.
1 При гемолизе, вызванном пенициллином, лекарство действует как гаптен. В данном случае образующиеся специфические антитела направлены непосредственно против антибиотика. Строго говоря, они не являются истинными аутоантителами. Гемолиз имеет место в том случае, если лекарство прочно прикрепляется к мембране эритроцита. Пенициллин способен даже образовывать ковалентные связи с белками мембраны. Высокий титр антител обычно наблюдается у пациентов, получавших высокие дозы препарата. Образующиеся антитела обычно представляют собой тепловые антитела класса IgG, и гемолиз связан с Fc-опосредованным фагоцитозом. У пациентов, принимавших цефалоспорины, часто наблюдается положительная проба Кумбса, но гемолиз происходит редко.
2 Такие препараты, как хинидин или стибофен, сначала образуют иммунные комплексы с антителами IgG или IgM, направленными против лекарства, а потом эти комплексы связываются с поверхностью эритроцитов. Это активирует каскад активации комплемента, приводящий в конце концов к лизису даже не вовлеченных в процесс эритроцитов. Иногда этот механизм гемолиза называют механизмом «невинного свидетеля». На сегодняшний день многие исследователи считают, что по крайней мере часть антител направлена против антигенов эритроцитов, и что лекарства, вызывающие данный тип гемолиза, действуют как гаптены. Другими словами, для стимуляции иммунного ответа они должны связаться с белками-носителями.
3 Некоторые препараты, например а-метилдопа. специфически ингибируют регуляторные Т-клет-ки, способствуя неконтролируемому синтезу аутоантител. Таков механизм истинной аутоиммунной гемолитической анемии. Образующиеся антитела в основном реагируют с резусными антигенами. Примерно у 15% пациентов, лечившихся а-метилдопой, происходит образование аутоантител (положительная проба Кумбса), но лишь у 1% наблюдается гемолиз.
Б. Реакции на переливание крови
Переливание крови может вызвать неблагоприятные последствия. Тяжелые гемолитические реакции обычно возникают при ошибочном переливании несовместимой крови. Наиболее часто в этих процессах задей
ствованы антигены А1, Келл и Даффи. Резусный антиген, являющийся сильным иммуногеном, редко становится причиной реакции на переливание, поскольку резусную несовместимость легко обнаружить.
Фебрильные, негемолитические реакции наблюдаются в результате 1% случаев переливания крови. Этот тип посттрансфузионных реакций представляет собой аллергическую реакцию, вызванную аллергенами или IgE из сыворотки донора. Аллергены стимулируют образование ИЛ-1 и гистамина Для предотвращения данного типа реакций следует использовать очищенную кровь или назначить реципиенту прием антигистаминных препаратов до переливания крови.
У пациентов, перенесших многочисленные переливания крови, а также у многократно рожавших женщин может произойти аллоиммунизация против чужеродных антигенов HLA (загрязненных лейкоцитов в продуктах крови) или против антигенов эритроцитов Е, D и С. Процесс аллоиммунизации является физиологической иммунной реакцией, которую можно свести к минимуму фильтрацией лейкоцитов и тщательным подбором доноров.
Болезнь трансплантат против хозяина (с 170) является редким осложнением после переливания крови. Болезнь вызывают жизнеспособные лимфоциты в переливаемой крови, атакующие нормальные ткани подверженного иммунным реакциям реципиента. Эту проблему можно предотвратить, используя фильтры для лейкоцитов или облучая кровь перед переливанием.
Использование загрязненных продуктов крови довольно редко является причиной инфекционных заражений. Из них чаще других отмечаются случаи передачи гепатита, цитомегаловируса и ВИЧ. В эндемичных регионах бывают случаи заражения малярией, болезнью Шагаса и филяриатозом. Такие бактерии, как Pseudomonas, Е coli и Yersinia, передаются с кровью редко.
У пациентов с дефицитом IgA (1/600 человек) после переливания крови могут развиться анафилактические реакции. Причина этого явления состоит в том, что переливаемые продукты часто содержат небольшие количества сывороточных иммуноглобулинов. Подготовка крови для таких пациентов должна проводиться особенно тщательно.
134
Гемолиз, вызванный приемом лекарств и переливанием крови
пенициллин
1. Лекарство - гаптен
ho-ch-r
хинидин, стибофен и др.
2. Эритроцит - «невинный свидетель»
3. ос-Метилдопа
В-клетка Синтез ауто-АЬ
А. Аутоиммунный гемолиз, вызванный приемом лекарств
«трансплантат против хозяина»
Анти-HLA Анти-С, D, Е
Аутоиммунизация
Б. Реакции на переливание крови
Клиническая иммунология
Гемолитические заболевания и цитопении
А. Аутоиммунная нейтропения
Нейтропения может быть вызвана активностью антител, цитокинов или прямым цитотоксическим действием Т- и НК-клеток. При аутоиммунной нейтропении часто наблюдается появление аутоантител против антигенов гранулоцитов NA1 и NA2. Эти антигены играют роль в иммунизации плода (нейтропения новорожденных). Они также обнаруживаются при системной красной волчанке (СКВ) и синдроме Фелти — особом типе ревматоидного артрита. Лейкоз больших гранулярных лимфоцитов Т-клеточного типа связан с клональным развитием Т-клеток, обладающих цитотоксической активностью против нейтрофилов. У пациентов с таким заболеванием очень часто наблюдаются аутоиммунные нарушения, в том числе тромбоцитопения, чистая красноклеточная аплазия, тиреоидит, СКВ и системная склеродермия. У трети пациентов развивается ревматоидный артрит.
Опухоли тимуса (тимомы) могут привести к развитию чистой красноклеточной аплазии при условии образования больших количеств Т-супрессорных клеток Эти клетки избирательно ингибируют образование гранулоцитов. У ВИЧ-инфицированных нейтропения обычно возникает из-за ингибирования образования нейтрофилов в костном мозге, связанного с прямым поражением данным вирусом, условно-патогенными инфекциями или побочным токсическим действием терапии. Иногда в развитии нейтропении задействованы анти-нейтрофильные антитела.
Б. Апластическая анемия
При апластической анемии нарушается весь процесс гемопоэза. Анализ крови выявляет панцитопению, т.е. анемию, лейкопению и тромбоцитопению одновременно. Клиническими признаками являются бледность кожных покровов и утомляемость, повышенная чувствительность к инфекциям, склонность к кровотечениям. Болезнь может быть вызвана инфекциями, токсическим воздействием или иметь аутоиммунную природу. При повышенном уровне содержания лимфатических клеток в костном мозге следует иметь в виду возможность аутоиммунного патогенеза. Эти Т-регу-ляторные клетки ингибируют плюрипотентные стволовые клетки либо напрямую, либо через стромальные клетки. В процессе по-видимому задействованы у-ИНФ, ФНО-а и ИЛ-2. Клетки, несущие CD34, уничтожаются путем Fas-индуциро-ванного апоптоза. Для лечения таких пациентов успешно применяют методы иммуносупрессии (стероиды, циклоспорин, трансплантация костного мозга).
В. Чистая красноклеточная аплазия
Чистая красноклеточная аплазия затрагивает исключительно эритропоэз, без нарушения развития лейкоцитов и тромбоцитов. Болезнь часто связана с наличием тимомы или вызвана парвовирусом В19. По всей видимости, происходит активация Т-регуляторных клеток, селективно ингибирующих эритропоэз. Обнаруживаются антитела против предшественников эритроцитов.
Г. Иммунная тромбоцитопения
Иммунная тромбоцитопения связана с образованием антитромбоцитарных антител (обычно IgG). Это заболевание может проявляться в результате заболеваний соединительной ткани (особенно СКВ), после приема некоторых лекарств или вирусной инфекции. Предшествующая вирусная инфекция, возможно, является причиной многих случаев иммунной тромбоцитопении с неясной этиологией (идиопатическая тромбоцитопеническая пурпура, ИТП). Антитела укорачивают срок жизни тромбоцитов. Несмотря на пролиферацию мегакариоцитов в костном мозге, число тромбоцитов в крови сокращается. У пациентов с тяжелой формой заболевания происходят кровотечения, обычно в виде петехии. Церебральные геморрагии, угрожающие жизни пациента, происходят редко даже при содержании тромбоцитов ниже 30 000/мл. Иммунные реакции затрагивают гликопротеиновые антигены тромбоцитов gpllla. gpllb (комплекс gpllla/gpllb) и gplb. Антитела детектируются в виде тромбоцит-ассоциированных иммуноглобулинов. В присутствии гепарина образуются комплексы антиген-антитело, прикрепленные к тромбоцитам через Fc-рецепторы. В результате лизируют или подвергаются фагоцитозу тромбоциты, оказавшиеся «невинными свидетелями». У детей ИТП обычно протекает в острой форме и с частыми спонтанными ремиссиями. У взрослых форма заболевания хроническая и плохо поддается лечению. Традиционные формы лечения включают назначение кортикостероидов, иммуносупрессоров, внутривенное введение высоких доз иммуноглобулинов и спленэктомию. Недавно хорошие результаты были получены при использовании моноклональных анти-С020 антител (ритуксан).
Аутоиммунные нейтропении и другие цитопении
Идиопатическая аутоиммунная нейтропения
Нейтропения новорожденных
СКВ, синдром Фелти
Лейкоз из больших гранулярных лимфоцитов
Тимома (аплазия белых клеток)
ВИЧ
CD8+ Т-клетка
Цитокины
А. Аутоиммунная нейтропения
Б. Апластическая анемия
Миелопоэз
Эритропоэз
Мегакарио-цитопоэз
В. Чистая красноклеточная аплазия
Идиопатическая тромбоцитопеническая пурпура
Вирусные инфекции
Лекарства. Осторожно с гепарином!!
СКВ
Переливание крови (посттрансфузионная пурпура)
Г. Иммунная тромбоцитопения
Клиническая иммунология
137
Гематологические заболевания
Острый лейкоз представляет собой опухолевое заболевание, при котором клетки-предшественники в костном мозге теряют способность дифференцировать, но сохраняют высокую пролиферирующую активность. Неконтролируемый рост опухолевых клеток подавляет нормальный гемопоэз. Без лечения острый лейкоз приведет к смерти больного в течение нескольких недель.
А. Гемопоэз и причины лейкоза
Многие типы лейкозов связаны с плюрипотентными стволовыми клетками. Этот недифференцированный тип лейкоза трудно классифицировать морфологически. Другие типы связаны с миелобластами и имеют соответствующую морфологию. Миеломоноцитарные лейкозы затрагивают общие клетки-предшественники гранулоцитарного и моноцитарного ряда. В соответствии с франко-американо-британской классификацией (ФАБ) острые миелоидные лейкозы (ОМЛ) подразделяют на восемь категорий (от МО до М7) в соответствии с морфологическими критериями и результатами цитохимических методов анализа (детекция специфического фермента, например миелопероксидазы).
Б. Фенотипические особенности острого миелоидного лейкоза
Лимфоидные и миелоидные лейкозы лечат по-разному. В тех случаях, когда невозможно определить тип лейкоза по морфологическим критериям, особенно важно провести иммунотипирование. Лейкозы из незрелых клеток (МО) характеризуются экспрессией лишь нескольких антигенов (например, CD117 или CD34) или слабой экспрессией ранних миелоидных антигенов (CD13 и CD33). Категории ОМЛ М1. М2 и М3 обычно легко идентифицировать с помощью световой микроскопии. Здесь нет корреляции с экспрессией специфических антигенов. При миеломоноцитарном лейкозе (М4) и моноцитарном лейкозе (М5) выявляется экспрессия CD14 и CD64 При категории МБ экспрессируется антиген эритроцитарного ряда гликофорин А. При категории М7 на тромбоцитах и мегакариоцитах обнаруживают интегрин CD61
В. Фенотипические особенности
острого лимфобластного лейкоза (ОЛЛ)
Недифференцируемые лейкозы, при которых не наблюдается экспрессии специфических антигенов, встречаются редко. В таких случаях обычно детектируют фермент терминальную дезоксинуклеотидилт-рансферазу (ТДТ). Выделяют несколько категорий лимфобластного лейкоза. Большинство случаев возникает в результате пролиферации В-клеток ранних стадий дифференцировки (про-В- и пре-В-клеточные
лейкозы). У детей экспрессия общего антигена ОЛЛ СОЮ коррелирует с благоприятным прогнозом. Однако у взрослых наличие СОЮ имеет слабую предсказательную силу. При В-клеточных лейкозах из зрелых клеток на клеточной мембране экспрессируются иммуноглобулины (sig), а при про-В- и пре-В-клеточных вариантах экспрессируется lg-ассоциированная а-цепь (С079а). Лейкозы из зрелых В-клеток имеют неблагоприятный прогноз и должны подвергаться активному лечению. При лейкозах, связанных с линией Т-кле-ток, в цитоплазме или на поверхности клеток обнаруживается СОЗ. Экспрессия CD1 а и CD2 наблюдается при различных вариантах лейкозов (из про-Т, пре-Т, кортикальных тимоцитов и зрелых Т-клеток), но не имеет большого клинического значения.
Г. Цитогенетические особенности острого миелоидного и лимфобластного лейкозов
Наиболее частыми причинами лейкоза являются мутации, хромосомные делеции (del) и транслокации (t), приводящие к дисфункции или ингибированию продуктов генов, имеющих важное значение для дифференцировки и деления клеток Эти биологические характеристики имеют важное прогностическое значение, но они редко коррелируют со специфическими морфологическими критериями. Промиелоцитарный лейкоз (М3), возникающий в результате транслокации 15:17, с морфологической точки зрения характеризуется наличием больших количеств азурофильных гранул. Лейкозы с инверсией или делецией в хромосоме 16 связаны с эозинофилией (М4Ео). Транслокации, затрагивающие хромосомы 8 и 21, часто наблюдаются при миелоидном лейкозе категории М2. Перечисленные три типа лейкоза имеют более благоприятный прогноз, чем большинство остальных типов, особенно тех, в которых наблюдаются сложные генетические аномалии. Транслокации или другие аномалии в локусе q23 хромосомы 11 часто обнаруживаются при миеломоноцитарном лейкозе и особенно при вторичных лейкозах, вызванных приемом некоторых лекарств. Используемые далее в книге прогностически значимые классификации лейкозов основаны на генетических особенностях Наиболее часто встречающиеся аномалии перечислены на рисунке.
Острые лейкозы
Хронический миелолейкоз (ХМЛ)
Острый миелоидный лейкоз (ОМЛ) МО = Недифференцированный ОМЛ М1 = ОМЛ без признаков созревания М2 = ОМЛ с признаками созревания М3 = Промиелоцитарный лейкоз М4 = Миеломоноцитарный лейкоз М5 = Монобластный/моноцитарный лейкоз Мб = Эритролейкоз
М7 = Мегакариобластный лейкоз у
Острый лимфобластный лейкоз (ОЛЛ) Недифференцированный ОЛЛ Т-ОЛЛ В-ОЛЛ
Плюрипотентная ▼ стволовая t клетка
КОЕ-Баз
КОЕ-Эоз
КОЕ-ГМ
КОЕ-ГЭММ
ВОЕ-Э i оо
А. Гемопоэз и причины лейкоза
МРО HLA-DR CD34 CD117 CD13 CD14 CD15 CD33 CD61 CD64
МО +/- +/- +/- 4- +/- - - +/- - -
М1 + +/- +/- +/- _ +/- . — — +/- — —
М2 + 4- V- +/- 4- — +/- +/- — —
_мз_ 4- — -/+ 4- 4- 4- — +/-
М4 4- 4- -/+ +/- 4- * +/- +/- 4- — 4-
М5 — 4- -/+ -/+ 4- +/- 4- 4- — 4-
М7 — +/- 17- — +/- 4-
Мб ’ = положителен по гликос Зорину А
Б. Фенотипические особенности острого миелоидного лейкоза
ТДТ CD1a CD2 cyCD3 mCD3 CD10 CD19 GD79OC cylg sig
Про-Т-ОЛЛ _ 4- - - 4- +/- - - - -
Пре-Т-ОЛЛ 4- - 4- 4- +/- — - - -
ОЛЛ из кортикальных тимоцитов + 4- 4- +/- +/- +/- — —
ОЛЛ из зрелых Т-клеток +/- - 4- 4- - - — - —
Про-В-ОЛЛ 4- - - - - 4- 4- - -
Пре-В-ОЛЛ4- 4- - - - +/- 4- 4- 4- -
ОЛЛ из зрелых В-клеток - - - - +/- 4- 4- - 4-
В. Фенотипические особенности острого лимфобластного лейкоза
Миелобластный лейкоз
t(8;21) М2
_invC16)± del(16q) _M2Eo
t(15;17) М3
t(11 ;17) МЗ-подобный
del(11)(q22-23) _M5, M4
t(9;11), t(11;19) M5, M4
моносомия/del 7 и 5 M1, М2, M5
t(9;22) t(4;11)
t(8;14), (2;8), (8;22)
t(11;14), (1;14)
t(1;19)
t(5;14)_________________
del 9, t(9;n...)________
Лимфобластный лейкоз
Ph+ ОЛЛ
ОЛЛ новорожденных или бифенотипический ОЛЛ
В-ОЛЛ
Т-ОЛЛ
пре-В-ОЛЛ__________________________
В-ОЛЛ
гиперлейкоцитоз, экстрамедулл. проявл.
Г. Цитогенетические особенности острого миелоидного и лимфобластного лейкозов
Гематологические заболевания
Клиническая иммунология
Обзор классификаций лимфом
Злокачественные лимфомы — это пролиферативные заболевания, возникающие в лимфатических узлах или в других лимфатических тканях. Существует несколько типов лимфом, соответствующих стадиям созревания и дифференцировки лимфатических клеток
Болезнь Ходжкина рассматривается как отдельное заболевание, поскольку имеет характерные морфологические и клинические признаки. Многие годы обсуждался источник опухолевых клеток при болезни Ходжкина. Возможно, в будущем исчезнет строгое разграничение между болезнью Ходжкина и другими видами лимфом, коллективно называемыми неходж-кинскими лимфомами.
В Европе несколько десятилетий назад была принята Кильская классификация лимфом. В ней пытались связать различные типы лимфом с иммунной природой опухолевых клеток. Классификация основывалась не только на морфологических критериях, но, что более важно, на иммунофенотипических особенностях клеток лимфомы, определенных с помощью иммуногистохимического окрашивания. Например,
центробластная и центроцитарная лимфомы рассматривались с физиологической точки зрения нормального зародышевого центра; также были определены различия между Т- и В-клеточными лимфомами. Клиническое значение Кильской классификации состоит в том, что она ввела разграничение между высокой и низкой степенью злокачественности лимфом.
Кильская классификация не нашла широкого применения на Американском континенте. В 1994 г. международная группа исследователей приняла пересмотренную европейско-американскую классификацию лимфом REAL. Создатели классификации REAL не ставили цели «биологической корректности», но просто составили список типов лимфом, определенных с помощью новейших морфологических, иммунологических, молекулярно-биологических и генетических методов анализа.
В таблице перечислены типы лимфом в соответствии с классификацией REAL и Кильской классификацией. Болезнь Ходжкина будет обсуждаться далее на с. 142-143, а другие (неходжкинские) лимфомы — на с. 144-151.
Кильская классификация злокачественных неходжкинских лимфом
В-клеточные лимфомы Т-клеточные лимфомы
Лимфомы низкой степени злокачественности
•Лимфоцитарные: В-ХЛЛ, В-ПЛЛ, волосатоклеточный лейкоз
• Плазмоцитоидная лимфоцитарная лимфома (иммуноцитома)
• Плазмоцитоидная лимфома, плазмоцитома
• Центробластная/центроцитарная лимфома (фолликулярная, фолликулярная + диффузная, диффузная)
• Лимфома Т-зоны
• Ангиоиммунобластная лимфома (иммунобластная лимфаденопатия, лимфогранулематоз X)
• Т-ХЛЛ, Т-пролимфоцитарный лейкоз (Т-ПЛЛ)
• Лейкоз из больших гранулярных лимфоцитов
• Грибовидный микоз, синдром Сезари
• Лимфоэпителиоидная лимфома
• Плеоморфная мелкоклеточная лимфома
Лимфомы промежуточной степени злокачественности
• Центроцитарная лимфома
Лимфомы высокой степени злокачественности
• Центробластная лимфома • Плеоморфная Т-клеточная лимфома
• Иммунобластная лимфома из средних/крупных клеток
• Лимфома Беркитта • Т-иммунобластная лимфома
• Крупноклеточная анапластическая • Т-лимфобластная лимфома
В-клеточная лимфома (CD30+) • Крупноклеточная анапластическая Т-клеточная лимфома (CD30+)
140
Обзор классификаций лимфом
В-клеточные лимфомы
I. Опухоли из предшественников В-клеток
Лимфобластный лейкоз/лимфома из В-клеток-предшественников
II. Опухоли из периферических В-клеток
1. В-ХЛЛ, В-ПЛЛ, мелкоклеточная лимфоцитарная лимфома
2. Лимфоплазмоцитоидная лимфома (иммуноцитома)
3. Лимфома из клеток мантийной зоны
4. Лимфома из клеток зародышевого центра, фолликулярная, степени I-III;
диффузная (в основном мелкоклеточная) (предварительная классификация)
5. Лимфома из В-клеток маргинальной зоны, экстранодальная
(MALT-типа, +/- моноцитоидные В-клетки), нодулярная (+/- моноцитоидные В-клетки)
6. Лимфома из клеток маргинальной зоны селезенки (предварительная классификация)
7. Волосатоклеточный лейкоз
8. Плазмоцитома/миелома
9. Диффузная В-крупноклеточная лимфома (подтип: первичная медиастинальная В-крупноклеточная лимфома)
10. Лимфома Беркитта
11. В-клеточная лимфома высокой степени злокачественности Беркиттовского типа
В-лимфобластная лимфома
В-лимфоцитарная лимфома
Лимфоплазмоцитарная иммуноцитома
Центроцитарная лимфома, Центроцитоидный вариант центробластной лимфомы Центробластная/центроцитарная лимфома;
Фолликулярная, диффузная
Моноцитоидная лимфома, включая лимфому из клеток маргинальной зоны
Волосатоклеточный лейкоз Плазмоцитарная лимфома Центробластная лимфома, В-иммунобластная лимфома, крупноклеточная анапластическая лимфома (КП+) Лимфома Беркитта
Центробластная, иммунобластная лимфома
Клиническая иммунология
Лимфомы из Т-клеток и клеток-киллеров
I. Опухоли из предшественников Т-клеток
Лимфобластный лейкоз/лимфома из Т-клеток-предшественников
II. Опухоли из периферических Т- и НК-клеток
1. Т-ХЛЛ/Т-ПЛЛ (пролимфоцитарный лейкоз)
2. Лейкоз из крупных гранулярных лимфоцитов (Т-клеточный тип и НК-клеточный тип)
3. Грибовидный микоз/синдром Сезари
4. Периферическая Т-клеточная лимфома, подкожная панникулитическая лимфома (предварительная классификация), печеночно-селезеночная у-6-лимфома (предварительная классификация)
5. Ангиоиммунобластная Т-клеточная лимфома
6. Ангиоцентрическая лимфома
7. Т-клеточная лимфома кишечника (+/- энтеропатия)
8. Т-клеточная лимфома/лейкоз взрослых (HTLV1+)
9. Анапластическая крупноклеточная лимфома (Т- и нуль-клеточного типа)
Т-лимфобластная лимфома
Т-лимфоцитарная лимфома, ХЛЛ-типа, ПЛЛ-типа
Т-лимфоцитарная лимфома, ХЛЛ-типа
Грибовидный микоз/синдром Сезари Лимфома из клеток Т-зоны, лимфоэпителиоидная лимфома, плеоморфная мелко/крупноклеточная лимфома, Т-иммунобластная лимфома
Ангиоиммунобластная лимфома (иммунобластная лимфаденопатия, лимфогранулематоз X)
Плеоморфная лимфома (HTLV1+)
Анапластическая крупноклеточная лимфома (КП+)
I. Лимфоидное преобладание
II. Нодулярный склероз
III. Смешанно-клеточный вариант
IV. Лимфоидное истощение
V. Классический вариант
Болезнь Ходжкина
Нодулярный склероз
Смешанно-клеточный вариант Лимфоидное истощение Лимфоидное преобладание
1. Классификация REAL
2. Кильская классификация
А. Список лимфом по классификации REAL и Кильской классификации
141
Гематологические заболевания
Клиническая иммунология
А. Модель патогенеза
Спустя 160 лет после первого описания болезни Ходжкина, ее патогенез остается до конца не понятым. Характерные для этого заболевания клетки Рида-Штернберга (РШ) или клетки Ходжкина (двуядерные или многоядерные клетки с крупным ядрышком и широкой яркой цитоплазмой) составляют лишь 1-2% от общей популяции клеток лимфатического узла. Остальную массу составляют разнообразные инфильтрующие клетки, в том числе лимфоциты, гистиоциты, эозинофилы, плазматические клетки и фибробласты. В ряде РШ-клеток была обнаружена клональная транслокация генов тяжелых цепей иммуноглобулинов. Это означает, что данные клетки имеют В-клеточную природу. В 50% случаев в РШ-клетках детектируется геном вируса Эпштейна-Барр, а также наблюдается активная экспрессия В-клеточных антигенов. Таким образом, нет сомнений, что болезнь Ходжкина с лимфоидным преобладанием является В-клеточной лимфомой. Тем не менее, некоторые немногочисленные РШ-клетки имеют черты активированных Т-клеток, а некоторые экспрессируют типичные антигены дендритных клеток, например, CD83 и р55. Клетки Ходжкина также несут все молекулы, необходимые для презентации антигена: молекулы МНС класса I и II, костимулирующие антигены CD80 и CD86, молекулы адгезии CD54 и CD58 Антиген CD30 взаимодействует с CD30L, экспрессирующимся на Т-лимфоцитах, моноцитах и макрофагах. Это, в свою очередь, стимулирует секрецию цитокинов РШ-клетками. Интерлейкин 5, и особенно эотаксин, ответственны за эозинофильную инфильтрацию. Интерлейкины 1, 6 и 9 действуют в качестве аутокринных и паракринных факторов роста. Аномальное повышение уровня экспрессии транскрипционного фактора NFkB является типичным признаком болезни и вносит свой вклад в повышение уровня экспрессии цитокинов. Интерлейкин 1 и ТФР-р вызывают еще один характерный признак болезни Ходжкина — фиброз.
Б. Классификация на основании гистологических особенностей
Нодулярный склероз — это наиболее распространенный вариант болезни Ходжкина. Он характеризуется наличием пучков коллагеновых волокон с разной степенью склеротических изменений. Прогноз при этом варианте болезни благоприятный. В варианте с лимфоидным преобладанием [парагранулема) детектируются лишь единичные клетки Рида-Штернберга. Этот тип болезни однозначно имеет В-клеточную природу, для него характерная низкая скорость прогрессирования и очень хороший прогноз. Лимфоидное истощение — это наименее изученный вариант болезни Ходжкина Эта форма заболевания по морфологическим признакам
напоминает анапластическую крупноклеточную лимфому (см. с. 145). Все другие варианты болезни Ходжкина, не попадающие под эти три типа, относят к смешанно-клеточному варианту.
В. Симптомы
Общим для всех вариантов болезни Ходжкина является безболезненное увеличение лимфатических узлов. К симптомам заболевания также относятся рецидивирующая лихорадка, ночная потливость и уменьшение массы тела (так называемые В-симптомы), наблюдаемые у 10-50% пациентов в зависимости от стадии заболевания При развитии болезни ее проявления становятся все более отчетливыми и распространяются за пределы лимфатических органов, поражая печень, костный мозг, кости, легкие и кожу.
Г. Лабораторная диагностика
Типичными признаками воспаления при болезни Ходжкина являются высокий показатель СОЭ, анемия, дефицит железа, повышенное содержание а2'глобУли-на, ферритина и меди Часто наблюдаются нейтрофилия или моноцитоз. Эозинофилия наблюдается редко, но может быть очень сильной. Лимфоци-топения наблюдается у 30% пациентов. Иногда в сыворотке обнаруживается растворимая форма антигена CD30 (sCD30). Повышение уровня sCD30 коррелирует со стадией заболевания и является неблагоприятным прогностическим фактором, как и наличие в сыворотке растворимого рецептора ИЛ-2 — sCD25.
Д.Лечение
Большинство пациентов с болезнью Ходжкина сегодня излечиваются. Прогноз зависит от стадии заболевания и факторов риска (большая опухоль средостения, вовлечение экстранодальных областей, массивное поражение селезенки, повышенный уровень СОЭ) Применение на ранних стадиях лечения радиотерапии приводит к ремиссии у 80% пациентов, не имеющих факторов риска. Обычно облучению подвергают зоны как затронутых болезнью, так и здоровых лимфатических узлов; используют протоколы для облучения мантиевидного и перевернутого Y-образного полей (рис. Д1). Химиотерапия с применением нескольких препаратов показана больным на более поздних стадиях заболевания или входящим в группу риска. При неудаче данного лечения применяют высокодозовую химиотерапию в сочетании с аутологичной трансплантацией стволовых клеток. В настоящее время новые методики лечения находятся в стадии испытания. Одна из них основана на применении биспецифических антител, доставляющих цитотоксические Т-клетки к С030+ клеткам Ходжкина (рис. ДЗ).
142
Болезнь Ходжкина
В-клетка
Активированная В-клетка
Моноцит/ дендритная ТВ клетка ЧР
А. Модель патогенеза
Гены
VH
Клетка
CD3OL ;'"i
CD30
CD15
CD25
CD71
HLA-DR -------►
(CD20) Секреция
(CD2) (CD3) (CD4)
Рида-Штернберга
цитокинов
Вариант с лимфоид- Нодулярный склероз Смешанно-клеточный
ным преобладанием (46%) вариант (31%)
(12%)
Лимфоидное истощение (10%)
Б. Классификация на основании гистологических особенностей
В-симптомы
Температура > 38°С Уменьшение массы тела > 10% Ночная потливость
Печень
Костный мозг/ кости
Анемия Лейкоцитоз Тромбоцитоз Эозинофилия
В. Симптомы
Прурит Зуд «Алкогольная болезнь»
Боль в костях
Легкие, плевра, перикард
Кожа
Э кстра нода л ь н ые проявления
Признаки воспаления
Увеличение СОЭ
Г. Лабораторная диагностика
i рГ.п Мантиевидное поле Перевернутое Y-образ-ное поле Ап Бп Ви Ди ^риамицин еомицин нбластин жарбазин Циклофосфамид Онковин (винкристин) Прокарбазин |Преднизон CD3 CD30 • т о Т-клетка Биспецифические антитела Клетка Ходжкина
"ВЁАСОРР | Е = этопозид
Высоко- Аутологичная дозовая 1 трансплантация химио- ' стволовых терапия клеток
1. Облучение 2. Комплексная химиотерапия 3. Экспериментальные подходы
Д.Лечение
Гематологические заболевания
А. Лимфобластный лейкоз/лимфома из Т-клеток-предшественников
Клетки лимфобластной лимфомы исходно образуются в лимфатических узлах, а затем заселяют костный мозг, в то время как клетки лимфобластного лейкоза возникают в костном мозге, а потом инфильтруют лимфоузлы Поскольку иногда бывает трудно провести границу между этими заболеваниями, диагноз лейкоз ставят в том случае, когда лимфатические клетки составляют более 25% популяции клеток костного мозга. На долю Т-клеточной лимфобластной лимфомы приходится 40% случаев лимфомы у детей Напротив, у взрослых она составляет лишь около 2% случаев неходжкинских лимфом и около 15% случаев острого лимфобластного лейкоза. Болезнь наиболее часто поражает молодых мужчин. При постановке диагноза у них уже наблюдается объемное образование средостения (возникающее из тимуса) и/или периферическая лимфаденопатия. Без лечения клетки лимфомы распространяются за пределы лимфатических узлов, болезнь быстро прогрессирует и наступает смерть. Лимфобласты образуются из тимоцитов, они имеют округлые ядра и небольшую цитоплазму. Опухолевые клетки экспрессируют CD7 и СОЗ, которые можно обнаружить как в цитоплазме, так и на поверхности клеток. Характер экспрессии других Т-клеточных маркеров (CD2 и CD5) может быть разным. В ядре обычно экспрессируется терминальная дезоксинуклеоти-дилтрансфераза. При условии активной химиотерапии заболевание излечимо.
Б. Периферические Т-клеточные опухоли
1. Хронический Т-клеточный лимфоцитарный лейкоз (Т-ХЛЛ) представляет собой редкий вариант не-ходжкинской лимфомы. В большинстве случаев Т-ХЛЛ опухолевые клетки отличаются неравномерной структурой ядра с выраженными ядрышками и довольно обильной цитоплазмой. Их классифицируют как пролимфоциты. Данное заболевание неотличимо от Т-клеточного пролимфоцитарного лейкоза (Т-ПЛЛ). Лимфоциты обычно инфильтруют костный мозг, селезенку, печень и лимфоузлы, но также может наблюдаться инфильтрация кожи и слизистой. Число лимфоцитов часто превышает 100 тыс/мм3. Лейкемические клетки экспрессируют Т-клеточные маркеры CD2, СОЗ, 005, 007, а также в 65% случаев CD4; иногда наблюдается сопутствующая экспрессия CD4 и 008. В 75% случаев происходит инверсия хромосомы 14 (q11 : q32), а иногда обнаруживается трисомия 8. Прогноз при данном заболевании неблагоприятный, гораздо хуже, чем при хроническом В-клеточном лимфоцитарном лейкозе.
2. Опухолевыми клетками при лейкозе из крупных гранулярных лейкоцитов являются циркулирующие С08+ Т-клетки или НК-клетки. Часто наблюдается умеренный лейкоцитоз (число лимфоцитов превышает 20 тыс/мм3) в сочетании с нейтропенией. При Т-клеточном типе заболевания часто имеет место анемия и спленомегалия. Течение болезни умеренно тяжелое, наиболее частой причиной возникновения симптомов является цитопения. Опухолевые клетки имеют эксцентрическое, круглое или овальное ядро и бледно-голубую цитоплазму, содержащую азу-рофильные гранулы. Фенотип при Т-клеточном варианте болезни соответствует цитотоксическим Т-клеткам (СОЗ +, CD8+, CD16+ и TCRap+). Фенотип НК-клеточного варианта иной (СОЗ , ТСРоф-, С056+/- С016+ и С08+/_).
3. Грибовидный микоз и его генерализованная форма синдром Сезари (кожная Т-клеточная лимфома) связаны с периферическими эпидермотропными С04+ Т-клетками. У пациентов развивается зудящая экзема, позже перерастающая в кожные бляшки или узлы. У пациентов с синдромом Сезари развивается диффузная эритродермия [синдром красного человека), иногда с невыносимым зудом. При синдроме Сезари в крови циркулирует много опухолевых клеток, а при грибовидном микозе — лишь отдельные клетки. При прогрессировании заболевания может развиться анапластическая крупноклеточная лимфома. В инфильтратах кожи и па-ракортикальной зоны лимфоузлов гистологический анализ выявляет наличие аномальных мелких лимфоцитов с петлистой структурой ядра. Опухолевые клетки экспрессируют CD2, СОЗ. CD5 и во многих случаях CD4.
4. Периферическая Т-клеточная лимфома может образоваться из периферических Т-клеток любой стадии созревания. Эти новообразования составляют около 10% всех неходжкинских лимфом. Данная группа лимфом является гетерогенной и пока классифицирована только предварительно. Опухолевые клетки часто имеют ядро неправильной формы и сильно различаются по размеру. Т-клеточные маркеры экспрессируются по-разному Большинство опухолевых клеток несут CD4. В некоторых случаях наблюдается высокий уровень эпителиоидных клеток (лимфома Леннерта или лимфоэпителиоидная лимфома). Гепатосплени-ческая у/6-лимфома характеризуется активной инфильтрацией печени и селезенки. В отличие от большинства других лимфом, клетки лимфомы в данном случае экспрессируют у/6-Т-клеточ-ные рецепторы.
Т-клеточные лимфомы
5. Другие виды периферических лимфом перечислены отдельно, поскольку они представляют собой клинически различимые и хорошо описанные типы заболеваний. Ангиоиммунобластная Т-клеточная лимфома проявляется в виде симптомов генерализованной лимфаденопатии в сочетании с лихорадкой, снижением массы тела, покраснениями кожи и поликлональной гипергаммаглобулинемией Это заболевание иначе называют ангиоиммунобластной лимфаденопатией с диспротеинемией. Структура лимфоузлов нарушается, синусы расширяются и инфильтрат проникает сквозь капсулу в жировую ткань Агрегаты фолликулярных дендритных клеток окружают пролиферирующие, ветвящиеся венулы. Для опухолевых клеток характерна транслокация, затрагивающая область генов Т-клеточного рецептора. Они экспрессируют Т-клеточные маркеры и обычно являются СО4-положительными. В некоторых случаях болезнь может перерастать в Т- и В-клеточные лимфомы высокой степени злокачественности.
6. Ангиоцентрические лимфомы, по всей видимости, возникают из Т-клеток или клеток-киллеров. Они поражают носовую полость, небо и кожу; могут быть как вялотекущими, так и агрессивными. Обычно наблюдается инфильтрация мелкими и атипичными лимфоцитами. Просвет протока закрывается, что приводит к ишемическому некрозу. Опухолевые клетки экспрессируют 002 и во многих случаях 007 и 005. Иногда они являются СОЗ- и 0056+.
7. Т-клеточная лимфома кишечника наиболее часто возникает у людей с глютенчувствительной энтеропатией. Ранее это заболевание именовали «злокачественным гистиоцитозом кишечника». У пациентов образуются множественные язвы тощей кишки, имеющие тенденцию к прободению. Опухолевые клетки имеют разный размер, экспрессируют СОЗ и CD7, а иногда 008. Они также могут экспрессировать антиген Т-лимфоцитов слизистой оболочки (СОЮЗ).
8. Причиной Т-клеточного лейкоза/лимфомы взрослых является Т-клеточный лимфотропный вирус человека HTLV-1. Это заболевание наиболее распространено в Японии и на Карибских островах, но изредка встречается и в Европе. Течение болезни обычно острое, сопровождающееся тяжелой формой лейкоцитоза, гепатоспленомегалией и остеолизом. Медиана выживаемости составляет менее одного года. В периферической крови обнаруживаются клетки с многодольчатыми ядрами, имеющими форму клевера. Клетки экспрессируют СОЗ, 002, CD4 и CD25 и являются 007-негативными. Хроническая форма характеризуется менее выраженным лейкоцитозом, от
сутствием гепатоспленомегалии и остеолиза и несколько более обнадеживающим прогнозом.
9. Опухолевыми клетками при анапластической крупноклеточной лимфоме (АКЛ) являются С030+ экстрафолликулярные бласты. Может возникать как первичное системное или кожное заболевание, а также развиваться как вторичное новообразование. Первичная кожная форма имеет гораздо более благоприятный прогноз. Опухолевые клетки представляют собой крупные бласты с обильной цитоплазмой, часто содержащие множественные ядра или ядра в форме подковы, каждое из которых содержит многочисленные ядрышки. Многоядерные клетки иногда напоминают клетки Рида-Штернберга. В большинстве случаев клетки имеют Т-клеточные маркеры (С03+/_, СО25+/-); перегруппировка Т-клеточного рецептора наблюдается более чем в 50% случаев. Наряду с CD30 опухолевые клетки экспрессируют также антиген эпителиальной мембраны. Первичная системная форма АКЛ часто ассоциирована с транслокацией 2:5, в результате которой ген белка NPM (ядрышкового белка-регулятора клеточного цикла) образует химерный ген NPM-ALK с киназой из семейства инсулиновых рецепторов (киназа анапластической лимфомы, ALK). Изменение киназной активности, по всей видимости, играет роль в развитии лимфомы.
Гематологические заболевания
Б. Периферические Т-клеточные опухоли
Т-клеточные лимфомы
2а) Лейкоз из крупных гранулярных лейкоцитов Т-типа (< 1%)
26) Лейкоз из крупных гранулярных лейкоцитов НК-типа (<1%)
3. Грибовидный микоз/ синдром Сезари (< 1%)
CD2+
CD3+
CD8+
CD16+
CD57+/-TCRab+
CD2+ CD8+/-CD16+ CD56+A CD57+/-
CD2+
CD3+
CD5+ CD7+(35%) CD4+(95%)
-1—
Периферические эпидермотропные CD4+ Т-клетки
Периферические Т-клетки на различных стадиях созревания
Гематологические заболевания
А. Опухоли из В-клеток-предшественников Клиническими проявлениями новообразований с участием предшественников В-клеток являются острый лимфобластный лейкоз с инфильтрацией костного мозга и лейкемической картиной крови. У детей заболевание часто характеризуется опуханием лимфатических узлов и кожной инфильтрацией; на более поздних стадиях заболевания может затрагиваться костный мозг. Опухолевые клетки экспрессируют специфические В-клеточные антигены (0019, цитоплазматический 0022 и С079а). Во многих случаях экспрессируется общий антиген ОЛЛ СОЮ. Эта группа заболеваний имеет довольно хороший прогноз у детей, но не у взрослых. Экспрессия поверхностных иммуноглобулинов клетками лейкоза/лимфомы является очень неблагоприятным прогностическим фактором. Кроме того, транслокации, затрагивающие хромосомы 1 и 19 и/или 9 и 22, а также изменения в хромосоме 11 q тоже указывают на крайне неблагоприятный прогноз.
Б. Периферические В-клеточные опухоли
1. Периферические В-клеточные опухоли составляют около 80% всех неходжкинских лимфом. При таких заболеваниях как хронический лимфоцитарный лейкоз (В-ХЛЛ) или пролимфоцитарный лейкоз (В-ППЛ) в периферической крови обычно обнаруживается высокий уровень лейкоцитов и наблюдается активная инфильтрация костного мозга Могут вовлекаться лимфоузлы, селезенка и печень. Большинство опухолевых клеток при В-ХЛЛ представляют собой мелкие лимфоциты с округлыми ядрами. При В-ПЛЛ опухолевые клетки крупнее и имеют выраженное центральное ядрышко. Пролимфоцитарный лейкоз сопровождается тяжелой спленомегалией и агрессивным развитием заболевания, а хронический лимфоцитарный лейкоз часто прогрессирует медленно и носит вялотекущий характер. Клетки В-ХЛЛ экспрессируют классические В-клеточные маркеры (CD19, CD20 и CD22), а также CD23 и Т-клеточный антиген CD5. Поверхностные иммуноглобулины экспрессируются слабо. В-ХЛЛ обычно диагностируют по мазку крови и/или цитологическому анализу костного мозга. Аналогичным по гистологическим признакам заболеванием с поражением лимфоузлов является лимфоцитарная лимфома. Примерно в 30% случаев наблюдается делеция хромосомы 13 или трисомия 12. Делеция 17р связана с плохим прогнозом.
2. Ппазмоцитоидная лимфоцитарная лимфома (иммуноцитома] развивается из мелких лимфоидных клеток, начавших дифференцировать в плазмати
ческие клетки. Во многих случаях клиническая картина напоминает макроглобулинемию Вальденст-рема (см. с. 153, Б). Аналогичным образом при этом заболевании часто обнаруживают наличие моноклонального парапротеина IgM. Большинство опухолевых клеток представляют собой мелкие лимфоциты с ярко выраженной базофильной цитоплазмой, но встречаются также и разнообразные плазматические клетки Такие лимфомы обычно связаны с наличием цитоплазматических иммуноглобулинов. Наиболее частыми хромосомными аномалиями являются делеции хромосом 11, 13 или 17. У некоторых пациентов обнаруживается транслокация t(9;14), затрагивающая ген рах-5.
3. Лимфома из клеток мантийной зоны во многом совпадает с центроцитарной лимфомой по Кильской классификации. Опухолевые клетки представляют собой мелкие или средние лимфоциты с зазубренными контурами ядра и иногда с крупными ядрышками. Эти клетки экспрессируют поверхностные иммуноглобулины и Т-клеточный антиген CD5. Гиперэкспрессия цикл ина 01 (белка, регулирующего клеточный цикл) возникает в результате транслокаций хромосом 11 и 14. Болезнь чаще поражает пожилых мужчин и к моменту постановки диагноза обычно находится в прогрессирующей форме. Прогноз неблагоприятный, среднее время выживаемости составляет от 3 до 5 лет
4. Четверть случаев неходжкинских лимфом относятся к лимфомам из клеток зародышевых центров. Опухолевыми клетками являются В-клетки зародышевого центра, центроциты и центробласты. Болезнь в равной степени поражает мужчин и женщин. Число центроцитов и центробластов варьирует, но центроциты обычно значительно преобладают. Диффузный характер распространения опухоли является неблагоприятным прогностическим фактором. Опухолевые клетки экспрессируют поверхностные иммуноглобулины и СОЮ. Анти-апоптозный ген bcl-2 активируется в результате транслокации 14:18, что приводит к накоплению долгоживущих центроцитов.
5. Лимфомы из клеток маргинальной зоны подразделяются на два подтипа: экстранодальные и узелковые При экстранодальном варианте лимфомы опухолевыми клетками являются В-клетки из ассоциированной со слизистой лимфоидной ткани (MALT). К этому варианту относятся около 50% всех лимфом желудка, 40% орбитальных лимфом и большинство лимфом легкого, щитовидной и слюнной железы Возникновение лимфомы желудка обычно связано с инфекцией Helicobacter pylori, образующей стимулирующие антигены, ответственные за пролиферацию лимфоцитов слизистой.
В-клеточные лимфомы
Назначение антибактериальных препаратов может привести к регрессии лимфомы. Узелковый вариант лимфомы связан с моноцитоидными В-клетками маргинальной зоны лимфоузла Вероятность заболевания выше у лиц с синдромом Шегрена (см. с. 200). Болезнь имеет вялотекущий характер. Опухолевые клетки по фенотипу напоминают клетки экстранодального варианта лимфомы.
6. Лимфома из клеток маргинальной зоны селезенки возникает из мелких В-клеток памяти, возможно, претерпевших злокачественную трансформацию в селезенке после дифференцировки в зародышевом центре. Клетки обычно инфильтруют костный мозг. В периферической крови опухолевые клетки циркулируют в виде ворсистых лимфоцитов. В большинстве случаев болезнь прогрессирует очень медленно. Продолжительная ремиссия может быть достигнута в результате спленэктомии.
7. Клетки волосатоклеточного лейкоза характеризуются наличием ворсинчатых отростков, овального ядра и широкой каемки цитоплазмы. Болезнь обычно сопровождается спленомегалией и панцитопенией. Почти всегда имеет место выраженный фиброз костного мозга, а лимфоузлы поражаются редко. В-клетки активно экспрессируют CD22 и поверхностные иммуноглобулины. Характерным признаком является экспрессия СОЮЗ. Болезнь очень хорошо поддается лечению аналогами пуринов и интерфероном.
8. В соответствии с классификацией REAL (см. с. 140) плазмоцитома и множественная миелома (с. 156) относятся к В-клеточным новообразованиям, поскольку они также могут образовываться как отдельные опухоли в лимфоидных тканях.
Э. Диффузные крупноклеточные лимфомы являются довольно распространенным заболеванием (около 30% всех неходжкинских лимфом). Болезнь главным образом поражает взрослых, но иногда встречается и у детей. Опухолевыми клетками являются периферические В-клетки на разных стадиях созревания. Диффузная крупноклеточная лимфома крайне агрессивна, но излечима при применении интенсивного курса химиотерапии. Часто имеют место экстранодальные проявления (в желудке, ЦНС, костях, почках, яичках). В 30% случаев отмечается транслокация гена bcl-2 и гена bcl-6, кодирующего репрессор транскрипции. Иногда отмечается транслокация гена с-тус.
10. Лимфома Беркитта возникает из В-лимфоцитов, ставших «бессмертными» после поражения вирусом Эпштейна-Барр. Опухолевые клетки представляют собой мономорфные клетки среднего
размера с круглым ядром и множественными ядрышками. Цитоплазма сильно базофильная. Инфильтрация макрофагами, фагоцитирующими апоптозные опухолевые клетки, приводит к образованию характерной гистологической картины «звездного неба». Лимфома Беркитта часто встречается у детей. У взрослых имеет тенденции} сопровождаться нарушениями иммунитета, в частности, ВИЧ-инфекцией. Лимфома Беркитта эндемична в Африке, для жителей которой характерно поражение нижнечелюстной области. При данной лимфоме часто происходит транслокация гена с-тус из хромосомы 8 в область генов тяжелой цепи на хромосоме 14. Реже встречается перенос гена с-тус в область генов легкой цепи (транслокации 2:8 или 8:22).
11. Пролиферация периферических В-клеток может вызвать высокозлокачественную лимфому беркиттовского типа. Морфологически и иммунотипически это заболевание напоминает лимфому Беркитта, однако в данном случае не происходит транслокаций гена с-тус. Вместо этого в 30% случаев наблюдается транслокация гена bcl-2
Гематологические заболевания
Клиническая иммунология
150
Б. Периферические В-клеточные опухоли
В-клеточные лимфомы
2 Плазмоцитоидная лимфоцитарная лимфома (иммуноцитома) (-2%)
3 Лимфома из клеток мантийной зоны (-6%)
4. Лимфома из клеток зародышевых центров (-25%)
CD19+
CD20+
CD22 cyt SlgM+ SlgD-/+ cyt lg+
CD19+ CD20+ CD22<+) CD5+ CD10+/-SlgM+
CD10+/-
CD19+
CD20+
-CD22 cyt
-SlgM, G, А+
t(9;14); делеции в хромосомах 13,11,17
Периферические В-клетки, дифференцирующие в плазматические клетки
t(11;14); перестройка гена bcl-1 (цикл ина)
CD5+ CD23- клетки мантии фолликула
t(8;14); гиперэкспрессия продуктов гена bcl-2
Клетки зародышевого центра
Клиническая иммунология
Периферические В-клетки на различных стадиях дифференцировки
Маргинальная зона лимфоузла
Маргинальная зона ассоциированной со слизистой лимфоидной ткани
Транслокация bd-2 (30%), bcl-6 (30%)
CD19+
CD20+
CD22+
CD10-/+ CD30-/+ Slg+/-
Антигенная стимуляция, на п р. Helicobacter pylori CD19+ CD20+ CD22+
9. Диффузная крупноклеточная лимфома (-30%)
CD19+ CD20+ CD22+ SlgM+
-cyt lg+/--CD43-/+
56) Лимфома из клеток маргинальной зоны, нодальная (моноцитоидная) (-2%)
5a) Лимфома из клеток маргинальной зоны, экстранодальная (MALT-типа) (-8%)
151
Гематологические заболевания
А. Пролиферация поликлональных и моноклональных гамма-глобулинов
Образование антител В-клетками контролируется Т-клетками. Основной задачей антител является защита организма от инфицирования бактериями, вирусами или другими паразитами. Поскольку каждый патогенный организм характеризуется целым набором антигенов, то при его попадании в организм хозяина всегда происходит поликлональная стимуляция В-клеток. Каждый клон В-клеток образует антитела, направленные против конкретного антигена. Более того, происходит образование различных антител, относящихся к различным классам иммуноглобулинов, в результате чего синтезируется целый набор иммуноглобулинов На электрофорезе это выражается в виде широкого спектра гамма-глобулинов. Злокачественное перерождение В-клеток или дефект регуляции Т-клетками может привести к неконтролируемой пролиферации отдельного клона В-клеток. Увеличение синтеза структурно гомогенных иммуноглобулинов может быть обнаружено при электрофоретическом анализе сыворотки по наличию так называемых миелома-ассоциированных или макроглобулинемия-ассоциированных (М) белковых компонентов, появляющихся в виде острого пика на денситограмме электрофореза гамма-глобулинов (моноклональная гаммапатия). Любое новообразование, в котором задействованы В-клетки, теоретически может приводить к моноклональной гаммапатии, которая часто не детектируется из-за низкого содержания иммуноглобулинов. М-белок обнаруживается у 3% людей старше 70 лет. Для этих пациентов невозможно предсказать, будет ли развиваться плазмоклеточное нарушение (например, множественная миелома, макроглобулинемия Вальденстре-ма или болезнь тяжелой цепи). Вот почему в таких случаях диагностируют моноклональную гаммапатию неустановленного значения (прежнее название «доброкачественная моноклональная гаммапатия»). У части этих людей, безусловно, будет развиваться плазмоклеточная дискразия, но многие из них умрут в пожилом возрасте до появления клинических признаков болезни.
Б. Макроглобулинемия Вальденстрема
Макроглобулинемия в основном является старческим заболеванием. Она бывает вызвана пролиферацией мелких плазмоцитоидных лимфоцитов при наличии более зрелых плазматических клеток. Сначала аномальные клетки инфильтруют костный мозг, а по мере прогрессирования болезни развивается гепатомегалия и лимфаденопатия. На более поздних стадиях происходит проникновение лейкемических
клеток в периферическую кровь. Клетки секретируют большие количества моноклонального IgM, который из-за своей структуры с пятью разветвлениями сильно повышает вязкость крови. В результате может развиться синдром гипервязкости в сочетании с нарушениями циркуляции крови. Следствием подобных нарушений может стать повреждение сетчатки глаза, ухудшение зрения или слепота, а также апоплексический удар, кома или повреждение коронарной артерии (ишемическая болезнь сердца, паралич сердца). Отложение белка М в миелиновой оболочке нервов может привести к полинейропатии. Могут также наблюдаться кровоизлияния, особенно в коже нижних конечностей. В результате отложений иммунных комплексов на стенках сосудов могут происходить сосудистые изменения.
В. Болезнь тяжелых цепей
Болезнь тяжелых цепей (БТЦ) — это редкое состояние, характеризующееся секрецией моноклональных белков, построенных из неполных тяжелых цепей иммуноглобулинов. Гамма-БТЦ связана с повышенным уровнем синтеза моноклональных у-цепей IgG. Этот тип болезни обычно сопровождается лимфаденопатией и иногда остеолизом. Альфа-БТЦ (средиземноморская лимфома) характеризуется паталогической секрецией IgA плазматическими клетками слизистой оболочки кишечника. Это вызывает синдром мальабсорбции в сочетании с диареей и болями в животе Течение болезни может сопровождаться непроходимостью или прободением кишечника. Болезнь чаще поражает детей и молодых людей. Мю-БТЦ сопровождается лимфопролиферативными заболеваниями, особенно В-ХЛЛ. Типичным признаком болезни является инфильтрация костного мозга содержащими вакуоли плазматическими клетками У пациентов с этим типом заболевания легкие цепи также синтезируются, что выражается в наличии в моче так называемого белка Бенс-Джонса.
Плазмоклеточная дискразия
Г ипергаммаглобулинемия
Бактерии, смесь антигенов
Поликлональная стимуляция В-клеток
Злокачественная трансформация
Нарушение Т-клеточной
регуляции
Моноклональная пролиферация В-клеток
Моноклональная гаммапатия
А. Пролиферация поликлональных и моноклональных гамма-глобулинов
Костный мозг
Гепатоспленомегал ия Лимфаденопатия
Кровь
Вязкость!
Плазмоцитоидные лимфоциты
Клиническая иммунология
Б. Макроглобулинемия Вальденстрема
у-цепь
Лимфаденопатия, редко остеолитические повреждения (болезнь Франклина)
В. Болезнь тяжелых цепей
ц-цепь
В случае ХЛЛ
153
Гематологические заболевания
Новообразования из плазматических клеток обычно проявляются в виде диссеминированных повреждений костного мозга {множественная миелома), но иногда — в виде единичных опухолей вне костного мозга, классифицируемых как плазмоцитомы или плазмоцитоидные лимфомы. Несмотря на это различие термины «множественная миелома» и «плазмоцитома» часто рассматриваются как синонимы. Плазматические клетки обычно секретируют IgG (60%) или IgA (20%), но редко IgD (1-2%). Миеломы Бенс-Джонса (15-20%) характеризуются секрецией только легких цепей Полное отсутствие синтеза или секреции иммуноглобулинов (несекретирующая миелома) встречается редко (менее 1% случаев)
А. Патогенез и механизмы множественной миеломы
Для роста плазматических клеток необходим ИЛ-6. Аутокринный механизм синтеза ИЛ-6 миеломными клетками возможен, но также ИЛ-6 и подобные ему молекулы могут синтезироваться стромальными клетками костного мозга. До сих пор неизвестно, какую роль в развитии множественной миеломы играет вирус герпеса 8, ассоциированный с саркомой Капоши.
Из-за наличия большого количества моноклонального белка повышается вязкость крови, а это приводит к развитию синдрома гипервязкости (см. с. 153, Б). Наиболее часто это происходит при миеломах с секрецией IgA, поскольку IgA образует полимерные структуры, удерживаемые дисульфидными мостиками. Миеломы Бенс-Джонса характеризуются наличием только легких цепей. Электрофорез не показывает наличия М-белков, поскольку легкие цепи выводятся с мочой. Однако белки, состоящие из легких цепей (белки Бенс-Джонса), обнаруживаются в моче 40% пациентов с классическим вариантом IgG или IgA плазмоцитомы. Эти белки накапливаются в почечных канальцах в виде гиалиновых телец, способствуя постепенному ухудшению работы почек.
У пациентов с миеломой наблюдается повышение концентрации иммуноглобулинов в крови, но поскольку все иммуноглобулины имеют одинаковую специфичность, то они не могут участвовать в защитных иммунных реакциях Концентрация нормальных иммуноглобулинов обычно снижена (вторичный иммунодефицит) из-за нарушения регуляции В- и Т-клеток. Цитотоксические Т-клетки и цитокины, секретируемые клетками миеломы, ингибируют эритропоэз в костном мозге, приводя к анемии. Картина множественной миеломы характеризуется наличием множества остеолитических повреждений, связанных с повышенной активностью остеокластов. Было показано, что ИЛ-113 и ФН0-а могут активировать остеокласты. Повышение
скорости деструкции костей приводит к потере кальция и гиперкальциемии.
Остеолитические повреждения обычно имеют очаговый характер и затрагивают различные участки, особенно повреждая кости с кроветворным мозгом: ребра, грудину, позвоночник, ключицы, череп, лопатки, кости таза, а также проксимальные отделы костей бедер и плеч (Б). На рентгеновском снимке они выглядят как «перфорированные» кости (Г). Пациенты испытывают боль в костях и подвержены частым переломам. Диффузная инвазия позвонков может имитировать картину остеопороза. Множественная миелома характеризуется пролиферацией плазматических клеток внутри костного мозга (В). Обычно содержание плазматических клеток в костном мозге состаляет 5-10%, но эта цифра может значительно вырасти при инфекции. Поэтому увеличение числа плазматических клеток в костном мозге не может интерпретироваться как результат развития множественной миеломы, за исключением тех случаев, когда у пациента обнаружены еще и моноклональные иммуноглобулины. Характер пролиферации плазматических клеток часто диффузный, и поэтому она может детектироваться путем аспирации костного мозга (цитологический анализ). Однако для диагностики очаговой инфильтрации костного мозга необходима биопсия (гистологический анализ). Внешний вид плазматических клеток может быть очень разным в зависимости от стадии их созревания и злокачественной трансформации Обычно морфологическая картина представлена доминирующими крупными, содержащими ядрышки плазмобластами на фоне слабо дифференцированных плазматических клеток.
Для лечения миеломы обычно применяют алкилирующие агенты (например, мелфалан) и кортикостероиды. Прогноз при данном заболевании неблагоприятный, и излечение традиционными методами химиотерапии невозможно Молодым пациентам может помочь пересадка костного мозга.
Множественная миелома
Вирусная инфекция
Г
Иммуноглобулины
Цитокины: ФНО ИЛ-1 (факторы, активирующие остеокласты)
♦
Большие количества моноклональных белков
L-1
Дисбаланс синтеза легкой цепи
Подавление синтеза нормального lg
Подавление гемопоэза
Активация остеокластов
Костный мозг
Остеолиз
Вязкость плазмы (особенно lgA)tt
I
Синдром гипервязкости
к/Х-цепи в моче (протеинурия Бенс-Джонса)
I
Нефропатия
Падение уровня нормальных Ab
I
Частые инфекционные заболевания
I
Цитопения
♦
Г иперкальциемия
А. Патогенез и механизмы множественной миеломы
Гистология
Цитология
Повреждение костей черепа
Остеолиз, декальцификация
Г. Рентгеновское
Б. Области остеолитических повреждений
В. Гистологический и цитологический анализ костного мозга
исследование
Гематологические заболевания
А. Патогенез криоглобулинемии
Криоглобулины — это сывороточные белки, растворимые при 37°С и выпадающие в осадок при более низких температурах Молекулярные основы криопреципитации еще не до конца изучены. Одной из возможных причин данного явления считают изменение углеводной компоненты белков, в частности уменьшение содержания сиаловой кислоты.
Б. Детекция криоглобулинов
Для обнаружения криоглобулинов в крови пользуются подогретыми шприцами. Образцы взятой крови немедленно центрифугируют при 37°С, чтобы предотвратить осаждение криоглобулинов вместе с клетками. Сыворотку быстро отделяют и выдерживают при +4°С по крайней мере 72 ч. При центрифугировании в капиллярных пробирках происходит отделение криоглобулинов, образующих криопреципитат.
В. Классификация
и клинические проявления
1. Криоглобулины типа I состоят из единственного моноклонального иммуноглобулинового компонента и обнаруживаются в 20% случаев криоглобулинемии. Их находят при множественной миеломе, макрогло-булинемии Вальденстрема, хроническом лимфоцитарном лейкозе (ХЛЛ) и других неходжкинских лимфомах (НХЛ). Криоглобулины чаще обнаруживаются при множественной миеломе, а при других перечисленных заболеваниях доминируют антитела IgM. При множественной миеломе и макроглобулинемии Вальденстрема около 10 и 20% белка М соответственно ведут себя как криоглобулины Симптомы заболевания в первую очередь связаны с ухудшением или полным отсутствием циркуляции крови в капиллярах кожи: низкая температура поверхности кожи способствует осаждению криоглобулинов в сосудах и повышает вязкость сыворотки. Это может привести к полной закупорке сосудов. Частыми явлениями при данном заболевании бывают болезнь Рейно (см. с. 198), а также некрозы конечностей, акроцианоз, сосудистая пурпура и полинейропатиче-ские боли и язвы в области лодыжек.
2. Криоглобулины типа II состоят из моноклональных иммуноглобулинов (обычно IgM, но иногда это могут быть IgA или IgG) и поликлонального IgG. К этому типу относится примерно 40% случаев криоглобулинемии. Моноклональный компонент проявляет активность в отношении к ГаЬ2-фрагменту поликлонального иммуноглобулина (ревматоидный фактор, см. с. 182). Моноклональные иммуноглобулины чаще содержат легкие к-цепи и реже — k-цепи. Примерно у трети пациентов, в крови которых обнару
жен данный тип криоглобулинов, причина заболевания остается неизвестной (эссенциальная смешанная криоглобулинемия). У таких пациентов часто возникает гепатит (обычно считают, что причиной заболевания является хроническая вирусная инфекция гепатита С); заболевания соединительной ткани, другие аутоиммунные нарушения и лимфопролиферативные заболевания встречаются редко.
3. Криоглобулины типа III состоят из поликлональных иммуноглобулинов (обычно IgM), направленных против поликлональных IgG и IgA (смешанные поликлональные криоглобуллины). К этой группе относятся примерно 40% всех криоглобулинов. Криоглобулины типа III обычно возникают в сочетании с различными инфекциями и аутоиммунными заболеваниями, но встречаются и при эссенциальной криоглобулинемии.
При смешанных криоглобулинемиях иммуноглобулиновые иммунные комплексы осаждаются на стенках сосудов, вызывая воспалительный ответ (васкулит). Наиболее выраженным симптомом является сосудистая пурпура (точечные или пятнистые кровоизлияния на нижних конечностях). Может происходить изъявление лодыжек. Моторная и сенсорная полинейропатии могут проявляться в виде пареза или парестезии. У 60-70% пациентов возникает артралгия, особенно в руках, коленях, лодыжках и локтях. Может происходить покраснение и опухание суставов, но деформации суставов не наблюдается. Через некоторое время у 50% пациентов развивается почечная недостаточность. Гистологическая картина обычно отражает развитие гломерулонефрита, вызванное отложением иммуноглобулинов и комплемента (см. с. 235 и 237).
Прогноз при криоглобулинемии зависит от тяжести вызвавшего ее заболевания. Больным следует избегать холода. В качестве средств лечения применяют кортикостероиды, иммуносупрессоры и «-интерферон. Именно «-интерферон хорошо зарекомендовал себя при лечении больных с криоглобулинемией, вызванной гепатитом, особенно в сочетании с антивирусными препаратами (например, рибавирином). При кризисных состояниях для быстрого удаления из циркуляции больших количеств криоглобулинов применяют криофильтрацию.
Криоглобулинемия
IgM, IgG —► или IgA, к, X
Пурпура
Полинейропатия
Трофические язвы
Нарушение циркуляции крови
Клиническая иммунология
1. Тип I (моноклональные иммуноглобулины)
Активность ревматоидного фактора
Поликлональные
IgG
IgG
Осаждение иммунных комплексов
Моноклональные
IgM IgA IgG
+ 4*1
IgG
IgG
Поликлональные
Васкулит
Полинейропатия
Артралгия
IgM IgM
Эссенциальная смешанная криоглобулинемия (гепатит СИ)
Соединительнотканные заболевания
Лимфопролиферативные заболевания
Нефрит
IgA
Инфекции
(гепатит С и В, ВИЧ, сифилис, боррелиоз)
Эссенциальные криоглобулины
Соединительнотканные заболевания
Пурпура
2. Тип II (смесь криоглобулинов, содержащая один моноклональный Ig)
З.Тип III (смесь поликлональных криоглобулинов)
В. Классификация и клинические проявления
157
Гематологические заболевания
А. Патогенез амилоидоза
Многие заболевания характеризуются инфильтрацией тканей гомогенным эозинофильным веществом, которое подобно крахмалу (amylon = крахмал) окрашивается иодом. Эта «амилоидная» субстанция состоит из фибриллярных белков, образованных при полимеризации пептидных фрагментов (легкие цепи иммуноглобулинов, амилоидный белок А, [^-микро-глобулин, транстиретин, пептид А4, цистатин, прокальцитонин и «-натрийуретический пептид). Антипараллельные амилоидные нити образуют переплетенные p-слои, которые после окрашивания Конго красным имеют зеленую окраску в поляризованном свете. Около 5-10% амилоидных отложений представлено нефибриллярным пентагональным белком острой фазы — сывороточным амилоидом Р (САР), образующимся в гепатоцитах.
Б. Амилоидоз с накоплением легких цепей (AL-амилоидоз)
Первичный ненаследственный AL-амилоидоз характеризуется отложением фибрилл, образованных фрагментами легких цепей иммуноглобулинов (белки Бенс-Джонса, см. с. 154). Этот тип амилоидоза встречается при плазмоклеточных нарушениях, особенно при множественной миеломе и макроглобулинемии Вальден-стрема Около 20% всех легких цепей участвуют в образовании амилоида; часто в этом задействован подкласс лямбда-цепей — Ху|. Синтезируемый гепатоцитами сывороточный амилоид Р неспецифически связывается с амилоидными фибриллами.
В. Амилоидоз с амилоидом А
(АА-Амилоидоз)
Вторичный или реактивный системный амилоидоз может возникать как осложнение хронического инфекционного заболевания (туберкулеза, бронхоэктаза, хронического остеомиелита), хронического воспалительного заболевания (ревматоидного артрита, болезни Крона), при злоупотреблениях лекарственными средствами или при раке. При АА-амилоидозе амилоидные фибриллы состоят из А-амилоида, образующегося в результате протеолитического расщепления белка острой фазы сывороточного амилоида A (SAA). Белок SAA образуется в гепатоцитах или макрофагах в процессе воспаления.
Г. Амилоидоз, вызванный гемодиализом
Бета-2-микроглобулин (р2т) по структуре напоминает легкую цепь иммуноглобулина и является белком-предшественником AL-амилоида. Основным источником циркулирующего |32т являются клетки иммунной системы и гепатоциты. Этот белок перерабатывается при
фильтрации в почечных клубочках и обратном всасывании в почечных канальцах. У пациентов с почечной недостаточностью уровень р2т в плазме возрастает в 40-60 раз. Поскольку молекулы р2т слишком велики, чтобы пройти сквозь большинство диализных мембран, то несмотря на гемодиализ, они продолжают накапливаться. Сегодня для удаления этого вещества разработан новый тип диализных мембран.
Д. Клинические признаки
Амилоидоз чаще всего сказывается на работе почек; симптомы могут варьировать от протеинурии до почечной недостаточности. Часто встречается адренокортикальная недостаточность. У 80-90% пациентов с AL-амилоидозом регистрируются нарушения работы сердца. Амилоидные отложения могут приводить к повышению ригидности миокарда, что вызывает сердечную недостаточность и аритмию. Несмотря на массивную гепатомегалию, функции печени обычно не нарушаются. Спленомегалия обычно протекает бессимптомно. Амилоидные отложения в связках запястья могут вызвать компрессию срединного нерва и парестезию рук. Нарушения в работе желудочно-кишечного тракта происходят при всех формах амилоидоза. Типичным является утолщение языка (макроглоссия) и нарушения моторики, сопровождающиеся непроходимостью, мальабсорбцией или диареей. Амилоидные отложения в трахеобронхиальном отделе могут вызывать симптомы бронхита.
При различных формах семейного амилоидоза наблюдается нарушение работы периферической нервной системы. Часто происходят мутации транстиретина — тироксин- и ретинол-связывающего белка. Клиническое исследование выявляет сенсорные нарушения, связанные с безболезненными язвами, или двигательные нарушения. Накопление амилоида в автономной нервной системе проявляется в дисгидрозе, недержании и импотенции. Поражения ЦНС проявляются в форме старческого амилоидоза. Этот тип заболевания связан с отложением пептида А4, кодируемого геном на хромосоме 21. При некоторых формах болезни Альцгеймера были обнаружены миссенс-му-тации гена, кодирующего амилоидный белок-предшественник. Этот аномальный пептид способен образовывать бляшки в головном мозге.
Диагностику амилоидоза осуществляют с помощью взятия биопсии из пораженного органа. Системный амилоидоз диагностируется по ректальной биопсии и аспирации внутрибрюшного жира.
Амилоидоз
Легкая цепь 1g Амилоидный белок А
р2-Микроглобулин
Транстиретин
Пептид А4 Цистатин Прокальцитонин «-Натрийуретический пептид >
Деградация белков или предшественников
10 нм
Амилоидные Полимеризованные
нити пептиды
А. Патогенез амилоидоза
Миелома, -----
дискразия плазматических клеток
Избыток моноклональной легкой цепи lg
Макроглобу-линемия Вальденстрема
Сывороточный амилоид Р
Амилоидные (AL) нити
Б. AL-Амилоидоз (первичный, ненаследственный)
Хронические инфекции
Хроническое воспаление
ИЛ-1, ИЛ-6, ФНО-а
Сывороточный амилоид А A = SAA
Амилоидные (АА) нити
В. АА-Амилоидоз (вторичный)
Гепатоциты
Всасывание в почечных канальцах
р2-Микро-гл обул ин
Клетки иммунной системы
Ухудшение фильтрации при хронической Нити ▲
почечной —► R м |
недостаточности
Г. АН-Амилоидоз (вызванный гемодиализом)
Накопление АА-нитей в тканях
Макроглоссия
Гепатомегалия
Недостаточность надпочечников
Кардиомегалия, застойная сердечная недостаточность
Спленомегалия
Деменция, васкулопатия
Бронхит, диффузная или узелковая инфильтрация легкого
Периферическая и автономная нейропатия: полинейропатия, недержание, импотенция
Повреждения клубочков, протеинурия, азотемия
Лучезапястный синдром
Расстройства моторики кишечника, мальабсорбция, обструкция
Д. Клинические признаки
Иммунология опухолей
Клиническая иммунология
Вопрос о том, существует ли на самом деле иммунный механизм контроля развития опухоли, до сих пор не имеет ответа. Бактерии и вирусы, узнаваемые и удаляемые иммунной системой с высокой эффективностью. несут на себе множество чужеродных для организма белков. В отличие от них опухолевые клетки лишь незначительно отличаются от нормальных клеток организма. Иногда в них содержатся укороченные или мутантные белки, но во всем остальном эти клетки следуют нормальным биохимическим закономерностям Даже если некоторые белки экспрессируются сильнее обычного или происходит экспрессия фетальных антигенов, это в большинстве случаев все те же нормальные клеточные белки. В большинстве случаев лишь единичные пептиды из мутантного белка воспринимаются как чужеродные. Целый ряд исследований показывает, что контроль развития опухоли не является первоочередной задачей иммунной системы. У пациентов с серьезными иммунным заболеваниями (например, ВИЧ) чаще возникают вирус-ассоциированные опухоли, однако они не становятся более предрасположенными к другим типам рака. Более того, у голых мышей, у которых отсутствуют функциональные Т-клетки, не возникает опухолей, но они чаще умирают от инфекционных заболеваний. И тем не менее результаты, полученные на экспериментальных животных, и клинические исследования позволяют надеяться, что именно новые методы иммуннотерапии позволят эффективно бороться с опухолевыми заболеваниями.
А. Узнавание опухолевых антигенов
С тех пор как около 20 лет назад были разработаны методы гибридомных технологий, ученые пытаются создать антитела, направленные против опухолевых клеток Методика заключается в иммунизации мышей опухолевыми клетками. После повторных иммунизаций у животного берут клетки селезенки и в присутствии полиэтиленгликоля (ПЭГ) проводят их слияние с иммортализованными миеломными клетками. При перенесении на селективную среду, содержащую гипоксантин, аминоптерин и тимидин (ГАТ-сре-да), обычные миеломные клетки погибают из-за отсутствия соответствующей ферментативной активности (рис. А1). Выживают только те клетки, которые унаследовали бессмертность от миеломных клеток и ГАТ-резистентность от клеток селезенки Кроме устойчивости к ГАТ, эти гибридомные клетки наследуют от клеток селезенки способность синтезировать специфические антитела. Гибридомные клетки, синтезирующие антитела против опухолевых клеток, подвергают последовательному разведению и повторно клонируют. При этом получают линию клеток (гибри-дому), происходящую из одной единственной клетки
и синтезирующую антитела строго определенной специфичности (моноклональные антитела).
С другой стороны, Т-клетки способны узнавать опухолевые антигены (рис. А2). После разрушения в клетке такие антигены (например, мутантные белки) могут быть представлены цитотоксическим CD8+ Т-клеткам в виде пептидов, связанных с молекулами МНС класса I. Т-клеточный ответ является HLA-зависимым, т.е. зависит от того, подходит ли мутантный опухолевый пептид к участку связывания антигена на молекуле HLA (см. с. 66). Опухолевые клетки осуществляют презентацию антигена с низкой эффективностью, поскольку лишены важных костимулирующих молекул (см. с. 36).
Б. Идентификация опухолевых антигенов Путем клонирования можно выделить клоны Т-клеток, способных лизировать специфические клетки-мишени (см. с. 102). Для идентификации последовательностей ДНК соответствующих опухолевых антигенов тотальную ДНК опухолевой клетки встраивают в векторы в виде множества мелких фрагментов (рис. Б1). Затем векторы со вставками вводят в клетки с таким же характером HLA-зависимости, как у опухолевых клеток. Только те клетки, которые содержат соответствующий фрагмент ДНК, осуществляют его презентацию с помощью молекул МНС, поэтому они распознаются и уничтожаются Т-клеточными клонами.
Альтернативным методом является элюирование пептида с поверхности опухолевой клетки. Для того чтобы узнать, какие из представленных клеткой пептидов являются специфичными для опухоли, все пептиды, связанные с молекулой МНС, предварительно растворяют в подкисленной среде (рис. Б2). Растворенные пептиды разделяют с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Затем отдельные пептидные фракции инкубируют с ТАР-дефицитными клетками (см. с. 163). В этих клетках не происходит связывания молекул МНС с пептидами. Не несущие пептида «пустые» молекулы МНС на поверхности клеточной мембраны нестабильны и быстро разрушаются. Добавление точно подходящих пептидов стабилизирует молекулы МНС и они могут осуществлять презентацию пептидов. Если один из добавленных пептидов является специфичным для опухолевых клеток, то соответствующая презентирующая клетка узнается и уничтожается опухоль-специфичным клоном Т-клеток. Дальнейшая характеристика пептидов, выделенных из молекул МНС, может быть проведена с помощью масс-спектрометрии
160
Обнаружение и идентификация опухолевых антигенов
Слияние (+ ПЭГ)
Клетки миеломы
Клетки селезенки
-► Клонирование
клетка
Клетки ГАТ-чувстви- Культивирование
миеломы тельный мутант на среде ГАТ
Тест на активность Гибридомные против опухолевых клоны клеток
1. Получение моноклональных антител против опухолевых антигенов
Опухоль-специфичный пептид
CD8
Опухоль специфичная Т-клетка
А. Узнавание опухолевых антигенов
Опухолевая клетка (напр., HLA-A2+)
TCR
Опухолевый пептид
CD8 ______
Клон
Т-клеток
MHCI
Экстракция ДНК
Фракционирование ДНК
Встраивание фрагментов ДНК в вектор
Введение в HLA-A2+
клетки
Т-клеточный клон лизирует только клетки, содержащие ДНК опухолевого антигена
Клон
Т-клеток
Опухолевая клетка
Связывание пептидов с «пустыми» молекулами МНС
Лизис под действием Т-клеток
2. Идентификация пептидов
CD8
Клон
Г-кле-ток
TCR
Опухолевый
пептид
Фракционирование (ВЭЖХ)
Элюирование МНС-связанных пептидов в кислой среде
1. Идентификация генов
Б. Идентификация опухолевых антигенов
Иммунология опухолей
А. Опухолевые антигены
В идеальном варианте для того чтобы быть узнанным иммунной системой в качестве чужеродного антигена, опухолевый антиген должен экспрессироваться только опухолевыми клетками, но не нормальными клетками организма. В реальной ситуации большинство опухолевых антигенов очень активно экспрессируется опухолевыми клетками, но в меньших количествах экспрессируется и нормальными клетками. Например, фермент тирозиназа экспрессируется всеми нормальными меланоцитами, но в клетках меланомы ее концентрация гораздо выше. Специфичные к тирозиназе Т-клетки, распознающие и уничтожающие клетки меланомы, обнаруживаются в крови некоторых пациентов с меланомой. Эти Т-клетки на самом деле ответственны за депигментацию кожи (витилиго) у некоторых пациентов. Наличие витилиго часто коррелирует с реакцией на терапию.
Онкофетальные антигены (например, альфа-фето-протеин или раково-эмбриональный антиген (РЭА)) присутствуют в опухолевых клетках печени и гонад, а также различных аденокарцином. Эти антигены активно экспрессируются в процессе развития плода, но в норме слабо экспрессируются во взрослом организме. Онкофетальные антигены циркулируют в крови больных раком в виде растворимых белков и поэтому могут использоваться как индикаторы прогрессии опухолей (опухолевые маркеры).
При В- и Т-клеточных лейкозах и лимфомах клон-специфичные детерминанты (идиотипы) иммуноглобулинов и Т-клеточных рецепторов представляют собой индивидуальные и специфичные опухолевые антигены. Следовательно, они не должны участвовать в реакциях в других тканях.
С другой стороны, мутантные белки, возникающие в результате хромосомных транслокаций или точечных мутаций, представляют собой совершенно новые антигены [неоантигены]. Например, при хроническом миелолейкозе имеет место транслокация t(9:22), приводящая к образованию химерного белка BCR-ABL. Пептиды с аминокислотными последовательностями, соответствующими обоим генам BCL и ABL, могут действовать как истинные опухолевые антигены. Точечные мутации, которые часто возникают в последовательности гена-супрессора опухоли р53 и в генах других белков-регуляторов клеточного цикла [р16 и р21), также приводят к образованию новых опухоль-специфичных пептидов, не существующих в нормальных клетках. Однако для того чтобы быть узнанными иммунной системой, эти пептиды должны соответствовать молекулам HLA в опухолевых клетках. Следовательно, могут существовать опухоли, в которых присутствуют такие специфические пептиды, но они не презентируются иммунной системе
индивидуальными молекулами МНС. Истинные вирусные белки, образуемые вирусом HTLV1 при Т-клеточ-ном лейкозе и вирусом Зпштейна-Барр при некоторых злокачественных лимфомах, ответственны за злокачественную трансформацию и синтезируются опухолевыми клетками. Очевидно, что такие вирусные белки могут успешно узнаваться иммунной системой. В отличие от белков с единичными мутациями, такие вирусные белки обычно содержат много потенциально иммуногенных пептидов, и поэтому существует большая вероятность, что некоторые из них будут связываться с молекулами МНС организма хозяина.
Б. Механизмы, позволяющие опухолевым клеткам избежать иммунной реакции
Существует ряд причин, объясняющих отсутствие эффективного иммунного ответа на опухолевые клетки. Каждый аутологичный белок разлагается внутри цитоплазмы с образованием пептидов, состоящих из 9-12 аминокислотных остатков. Зти пептиды препровождаются в эндоплазматический ретикулум (ЗР) специальными транспортными белками, называемыми транспортерами, связанными с процессингом антигена (ТАР). В ЭР пептиды связываются молекулами МНС класса I и презентируются CD8+ Т-лимфоцитам на поверхности клетки (см. с. 66).
В некоторых опухолях может не быть пептидов, соответствующих участкам связывания на молекулах МНС больного (рис. Б1). В опухолевых клетках с нарушением механизма процессинга антигена (например, с дефицитом ТАР) опухолевые пептиды не транспортируются в ЭР (рис. БЗ) и не происходит их презентации на поверхности клетки. Во многих случаях происходит потеря молекул МНС класса I на поверхности опухолевых клеток, связанная со снижением экспрессии генов МНС. В результате опухолевые антигены не распознаются цитотоксическими Т-клетками (рис Б2).
Опухолевые клетки не являются профессиональными антигенпрезентирующими клетками. У них нет костимулирующих молекул CD80 и CD86, необходимых для активации Т-клеток. Без костимуляции презентация пептида посредством комплекса МНСДСР приводит к анергии и толерантности Т-клеток (рис. Б4) Некоторые опухолевые клетки прекращают синтезировать опухолевые антигены, чтобы избежать иммунной реакции (рис. Б5). Кроме того, опухоль может производить иммуносупрессоры типа ИЛ-10 и трансфрмирующего фактора роста р (ТФР-р) (рис. ББ), а в некоторых случаях — и МНС l-подобные молекулы, которые взаимодействуют с ингибирующими лигандами на Т-клетках. Недавно было показано, что регуляторные Т-клетки (CD4+, CD25+) подавляют иммунный ответ у пациентов с солидными опухолями
Преодоление иммунологического надзора опухолевыми антигенами
Антигены дифференцировки с повышенным уровнем экспрессии в опухолевых клетках Продукты нормальных генов Антигены плода Клональные антигены Печень плода В-клетка Т-клетка П П JILMlg /У \TCR ос-Фетопоо- Раково-эмбрио-
/ \ Нормальный меланоцит Ч У
Тирозиназа (Туг) С£>г [Ур Туг У ст Клетка Уг ТУГ (^меланомы теин(АФП) нальный ' Клон антиген (РЭА) g кл лиг Рак печени/ яичек АФП+++ Рак кишеч- ника РЭА+++ и| 1альная пролиферация 1 1 еточная Т-клеточная ифома лимфома 1 1
диотипы Ig или TCR
Мутантные или аномальные белки Вирусные белки
Хромосомные транслокации 9 22 8Ы1 R 5 ZW -BCR"" ~ABL~~ Точечные мутации ((рУ) (Р5з) р1б HTLV1 Белки-регуляторы клеточного цикла I 1 * s' Инфицированная Ч/V W ; w Т’клетка Точечные мутации 1 . * А EL Г]л Т-клеточный
Химерный ген L
Белок BCR-ABL | Химерный пептид = опухоль-специфичный А. Опухолевые антигены лейкоз взрослых Ik Вирусный пептид
Но^^ный Й белок специфичный белок
► X 1. Опухолевый пептид не связывается с МНС Нормальные клетки экспрессируют молекулы MHCI 2. Ослабление экспресса Опухолевые клетки не экс-0 пресси ру ют/ слабо экспрессируют МНС 1 и молекул МНС
X. / _ Пустая молекула MHCI СОв . т_ Т-клеточная О TCR клетка ^”лееРрант- ^^2^ ность 4. Отсутствие костимуляторных молекул
Дефект ТАР 3. Дефект процессинга антигена
Опухолевый (~ч антиген ч_) —► несинтези- руется/ не экспрес-_ h й си руется 5. Модуляции антигенов Б. Механизмы, позволяющие опухолев —►ИЛ-10, ФНО-р, простагландины Т- Анергия/ О ’J|(^ клЛка —►апоптоз Т клеток Fas-лиганд pas 6. Ингибирующие молекулы, цитокины ым клеткам избежать иммунной реакции
Клиническая иммунология
163
Иммунология опухолей
Клиническая иммунология
А. Усиление неспецифического иммунитета
В конце XIX в. американский хирург Уильям Колей начал вводить раковым больным лизаты опухолевых клеток, которые были заражены бактериями из-за неразработанности методик стерильной работы. Удивительно, но у некоторых пациентов происходила регрессия опухоли. Позднее, уже в XX в. опыт с противоопухолевой вакцинацией был вновь повторен, однако использование только немодифицированных опухолевых клеток не приводило к возникновению ощутимого иммунного ответа. Вскоре в вакцину стали добавлять адъюванты. Сначала использовали ослабленные штаммы микобактерий: бациллу Кальметта-Герена (БЦЖ) и Corynebacterium parvum. В более поздних экспериментах для этой цели пытались использовать вирус ньюкастлской болезни. До сих пор ведутся некоторые клинические испытания, основанные на данной стратегии лечения. Стремительного успеха от этих исследований ожидать трудно, но некоторые положительные данные указывают на возможность применения усовершенствованных методов вакцинации в будущем.
В последние три-четыре года были проведены работы по генетической модификации опухолевых клеток с целью достичь селективной индукции Т-кле-точного иммунного ответа. Ставилась задача стимулировать локальный рост Т-клеток или дендритных клеток путем секреции цитокинов (ИЛ-2, ИЛ-4, ИЛ-7 и ГМ-КСФ) в надежде активировать специфичные к опухоли Т-клетки.
В терапевтических целях можно также использовать системное введение цитокинов. Однако на практике при отдельных видах опухолей используются только а-интерферон и ИЛ-2 (рис. А2). Кроме иммуностимулирующей активности, а-ИНФ обладает и прямым антипролиферативным действием, что может объяснять наблюдаемый терапевтический эффект. Лучше остальных видов опухолей на иммунотерапию реагируют почечные карциномы и злокачественные меланомы, однако причина этого явления не ясна При лечении пациентов с саркомами и меланомами при перфузии конечностей для усиления воздействия на опухолевые клетки используется также фактор некроза опухолей ФНО-а в сочетании с противоопухолевыми препаратами.
Б. Индукция специфического Т-клеточного ответа
У многих пациентов хирургическое вмешательство в момент постановки диагноза может успешно уничтожить первичную опухоль. Однако у некоторых из этих пациентов через какое-то время будут образовывать
ся отдаленные метастазы или произойдет повторное возникновение опухоли. Вот почему пациентам с определенными факторами риска (тип опухоли, степень злокачественности, глубина проникновения опухоли, вовлечение лимфатических узлов и др.) показано проведение адъювантной терапии. Тем не менее в большинстве случаев пока не удается индуцировать специфический Т-клеточный ответ на опухоль путем введения облученных аутологичных опухолевых клеток или лизатов опухолевых клеток (рис. Б1). Даже в идеальной ситуации, когда опухолевые клетки осуществляют презентацию опухолевого антигена Т-клеткам, сильный иммунный ответ не достигается из-за отсутствия у опухолевых клеток костимуляторных молекул типа В7 (CD80/CD86) (см. с. 46 и 163). Проведен целый ряд испытаний генетически модифицированных опухолевых клеток, экспрессировавших В7 для усиления иммуногенности (рис. Б2). Еще одним способом активизации иммунного ответа на слабоиммуногенные опухолевые клетки является презентация опухолевого антигена специализированными антигенпрезентирующими клетками (АПК) (рис. БЗ). Специализированные АПК экспрессируют все необходимые костимуляторные молекулы, необходимые для индукции эффективного Т-клеточного ответа Таким образом, вместе с лизатами опухолевых клеток, очищенными опухолевыми антигенами или специфическими опухолевыми пептидами можно ввести дендритные клетки, образованные ex vivo. На сегодняшний день в этой области исследований получен ряд обнадеживающих результатов.
Особой формой иммунотерапии является капельное введение вакцины БЦЖ после локальной резекции карциномы мочевого пузыря. БЦЖ в значительном числе случаев предотвращает повторное возникновение опухоли. Введение бациллы может запускать воспалительный процесс, в результате которого активированные антигенпрезентирующие клетки способны захватывать антигены оставшихся опухолевых клеток и эффективно осуществлять их презентацию
164
Иммунотерапевтические стратегии (I)
Постоперационное * введение (п/к)
ос-ИНФ:
ХМЛ
Плазмоцитома Лимфома Миелома Почечная карцинома
Встраивание генов цитокинов в опухолевые клетки (ретровирусы, аденовирусы, физические методы)
ИЛ-2
ИЛ-7
ИЛ-4 ГМ-КСФ
1. Вакцинация с адъювантами -цитокин-производящими клетками
ИЛ-2:
Почечная карцинома Меланома Лейкозы
ФНО-а: Местная перфузия при саркоме/ меланоме
2 Терапия с применением цитокинов
Клиническая иммунология
А. Усиление неспецифического иммунитета
1. Стратегия вакцинации
Б. Индукция специфического Т-клеточного ответа
I .*•
Толерант-
ность Активация
Т-клеток
2. Прямая презентация антигена
очищенного антигена, Активация
пептида Т-клеток
3. Непрямая презентация антигена
165
Иммунология опухолей
А. Генноинженерные опухоль-специфичные Т-клеточные рецепторы
Многие опухоли интенсивно инфильтруются лимфоцитами. Были предприняты попытки выделять инфильтрующие опухоль лимфоциты TIL из удаленных опухолей, особенно из меланом и почечных карцином, и вновь переливать их пациенту. Однако результаты оказались скорее обескураживающими. Теперь возможно определить последовательность ДНК вариабельных доменов а- и p-цепей Т-клеточных рецепторов TIL. С помощью вирусных векторов можно получить генетически измененные Т-лимфоциты, специфическим образом реагирующие с опухолевыми клетками Затем следует осуществить адоптивную терапию, вводя пациенту эти размноженные ex vivo клетки. В настоящее время наибольшую проблему представляет этап переноса генов в нормальные Т-клетки, однако постоянно ведется интенсивный поиск новых методов. Также необходимо обеспечить снижение экспрессии эндогенных Т-клеточных рецепторов.
Б. Терапия с применением антител
Моноклональные антитела (МАЬ) используются для лечения рака уже на протяжении более 20 лет. Большинство антител получают в мышах. Лечение мышиными антителами приводит к образованию человеческих анти-мышиных антител (НАМА), что снижает эффективность мышиных МАЬ. В связи с этим была разработана технология получения гуманизированных МАЬ (рис. Б1). В гуманизированных антителах большая часть молекулы имеет человеческую природу, и только Fab-фрагмент или вариабельный участок Fab-фрагмента взяты от мыши. Гуманизированные моноклональные антитела имеют гораздо большее время полувыведения из крови пациента и гораздо эффективнее активируют иммунную систему по сравнению с мышиными антителами. В последние несколько лет прекрасные результаты были получены при применении двух типов гуманизированных моноклональных антител: анти-С020 антитела ритуксимаб (препарат ритуксан) обладают активностью против В-клеточных лимфом, а антитела трастузумаб (препарат герсептин), направленные против рецептора человеческого эпидермального фактора роста 2 (HER2), обладают активностью при раке молочной железы. Получен ряд обнадеживающих результатов и с другими антителами. Еще одним новым подходом является использование биспецифических антител (рис. Б2). Биспецифические антитела образуются путем слияния двух гибридом, каждая из которых секретирует специфические моноклональные антитела. Такие гибри-домы одновременно связывают эпитопы опухолевых клеток и Т-клетки (СОЗ). Таким образом, Т-клетки вступают в контакт с опухолевыми клетками и активируют
ся при помощи СОЗ. Новшеством в данной стратегии стало использование синтетических антител, состоящих из одной цепи (рис. БЗ). Эти полученные генноинженерным способом антитела состоят только из легкой и тяжелой цепи вариабельной области (Fv) МАЬ. Единичные цепи от двух различных антител могут быть скреплены при помощи связывающего фрагмента (спейсера). В альтернативном варианте состоящие из одной цепи антитела, узнающие опухолевый эпитоп, могут быть связаны с дзета-цепью, играющей важную роль при передаче сигнала TCR. Можно осуществить трансфекцию Т-клеток такими конструкциями, в результате чего они смогут узнавать опухолевый антиген таким же образом, как это делают антитела, и передавать сигнал внутрь клетки при помощи дзета-цепи TCR. Антитела, направленные против опухолевых антигенов, можно связать с иммунотоксинами или радиоизотопами (рис. Б4). Токсический компонент иммунотоксина, блокирующий синтез РНК, высвобождается в результате интернализации антител. В случае меченных радиоактивными изотопами конъюгатов радиоактивное вещество (обычно радиоактивный иттрий или иод) вызывает лизис клетки-мишени, но при этом также страдают расположенные рядом клетки (эффект «невинного свидетеля»)
В. Механизмы терапевтического действия моноклональных антител
Моноклональные антитела могут имитировать или блокировать естественные лиганды рецепторов. Например, анти-СО95 антитела активируют рецептор Fas/APO-1 (CD95), запуская апоптоз (рис. Bl). С другой стороны, антитела могут активировать комплемент и индуцировать образование пор в клеточной мембране (рис. В2? При антителозависимой клеточной цитотоксичности клетки-киллеры, несущие Fc-рецепторы, узнают Fc-фрагмент связанных с клеткой антител, что приводит к высвобождению цитоплазматических гранул. содержащих цитотоксические перфорины и гран-зимы (рис. ВЗ, см. также с. 49).
Как уже говорилось, мышиные антитела могут индуцировать образование НАМА. Некоторые из этих анти-мышиных антител могут быть направлены против специфических идиотипических связывающих областей мышиных антител (рис. В4). В таком случае анти-идиотипические антитела имитируют опухолевые антигены и могут служить опухолевыми суррогатами в вакцинах. С другой стороны, они также могут приводить к образованию анти-анти-идиотипических моноклональных антител, которые узнают опухолевый антиген, подобно мышиным МАЬ. В результате реализации этого каскада действие мышиных моноклональных антител усиливается
Иммунотерапевтические стратегии (II)
Опухолевый пептид
МНС
/zyxwxww
Клонирование ДНК TCR из опухоль-инфильтрующих лимфоцитов
Перенос гена в лимфоциты, пролиферация
Т-клеток с опухоль-специфичным TCR
Экспрессия ДНК
Адоптивная терапия
А. Искусственное создание опухоль-специфичных Т-клеточных рецепторов
Челове- Мыши-
ческий Fc ный Fab
Человеческий Fc и часть Fab
Мышиные моноклональные антитела МАЬ
Гуманизированные АЬ
От мыши - только вариабельный участок
^Анти-АРО-1 /Fas
Апоптоз
АРО-1
Fas ---------►
Антитело имитирует природный лиганд молекулы: «действие агониста»
2. Моноспецифические антитела
Слияние гибридом (квадромы)
CD3
Опухолевый антиген
антитела
Биспецифические антитела
3- Fv-область DO
Только вариабельная часть антитела
Варна- Напр., Химерный TCR
бельная С-цепь
часть антитела
/жьоьоьа/жш
Тран сфе кция Т-клетки
Генноинженерные производные антител
Иммунотоксины -иммуноконъюгаты
Б. Терапия с применением антител
Образование пор
Активация каскада комплемента
Fc-рецептор
Некроз, k апоптоз
Перфорины, гранзимы
Антителозависимая клеточная цитотоксичность
3.
терапия
Мышиные МАЬ
Опухолевый антиген
Образование человеческих антимыши-ных антител (НАМА), имитирующих антиген
В. Механизмы действия МАЬ
Трансплантационная иммунология
Аутологичная трансплантация костного мозга и гемопоэтических стволовых клеток
Многие опухолевые заболевания, особенно лейкозы и лимфомы, могут быть излечены с помощью высокодо-зовой химиотерапии и радиотерапии. Лимитирующим фактором такого метода лечения является токсичность, связанная с необратимыми повреждениями кроветворного костного мозга (миелоабляция). Для восстановления системы кроветворения достаточно введения реципиенту 700-800 мл костного мозга от здорового донора (аллогенная трансплантация костного мозга, алогенная ТКМ). Функцию костного мозга можно также восстановить, вводя пациенту аутологичный костный мозг, взятый у него непосредственно перед аблативной терапией (аутологичная ТКМ).
А. Получение стволовых клеток
Отбор костного мозга пациента осуществляется при повторных пункциях из гребня подвздошной кости, проводимых под общим наркозом. За восстановление кроветворной функции в пунктате ответственны немногочисленные CD34+ стволовые клетки. Эти клетки присутствуют не только в костном мозге, но в небольшом количестве циркулируют и в периферической крови. Поэтому они могут быть отобраны методом лейкафереза — селективного центрифугирования крови, при котором отбирают одноядерные клетки, в том числе и стволовые. При этом от 8 до 15 л крови постоянно пропускают через сепаратор на протяжении 2-5 ч. Эта процедура позволяет получить около 350 мл крови, обогащенной стволовыми клетками, которые замораживают до дальнейшего использования. Минимальное количество CD34+ клеток, необходимое для успешного восстановления гемопоэтической системы, составляет 2 • 106 CD34 клеток/кг массы тела.
Б. Мобилизация гемопоэтических стволовых клеток и проведение трансплантации
Содержание CD34 стволовых клеток в периферической крови низкое, но его можно повысить, вводя рекомбинантные гемопоэтические факторы роста, такие как Г-КСФ или ГМ-КСФ. Затем осуществляют отбор костного мозга или лейкаферез. Отобранные клетки хранят в замороженном виде. Высокодозовая хи-мио/радиотерапия приводит к аплазии костного мозга (снижению числа эритроцитов, гранулоцитов и тромбоцитов), которая без переливания стволовых клеток была бы необратимой. Период аплазии длится не более 10-15 дней; при завершении курса химиотерапии пациенту вводят хранившиеся в замороженном виде
стволовые клетки. В результате происходит полное восстановление гемопоэза.
В. Показания к трансплантации
Трансплантация аутологичных кроветворных стволовых клеток или трансплантация костного мозга показаны при ряде гематологических заболеваний, а также при изолированных солидных опухолях, особенно эмбриональноклеточных опухолях. Процедуры с введением генетически измененных стволовых клеток показаны при лечении врожденных метаболических или иммунных нарушений. Недавно для лечения рефрактерных аутоиммунных заболеваний стали применять высокодозо-вую химиотерапию с последующим переливанием стволовых клеток. In vitro CD34+ клетки способны дифференцировать в дендритные клетки или иммунные эффекторные клетки. В таком случае трансплантация сочетается с иммунотерапией.
Г. Очистка аутотрансплантата
При аутологичной трансплантации существует риск загрязнения трансплантата опухолевыми клетками. Поэтому трансплантируемый материал подвергают процедуре очистки Поскольку антиген CD34 не экспрессируется на поверхности клеток солидных опухолей, можно провести позитивную селекцию CD34+ клеток. В присутствии биотинилированных анти-С034 антител CD34+ клетки связываются на колонке с авидином, а затем отделяются. Чистота полученных таким способом CD344 клеток составляет около 90% Дальнейшая очистка осуществляется путем негативной селекции. Для этой процедуры используют железные шарики, покрытые антителами против опухолевых антигенов Клетки, несущие опухолевые антигены, удаляют в магнитном поле.
До сих пор ведется обсуждение роли опухолевых клеток, загрязняющих аутотрансплантат, в рецидивах опухолей после проведения высокодозовой химиотерапии. По всей видимости, большая часть рецидивов связана с устойчивостью опухолевых клеток в организме, а не с их наличием в трансплантируемом материале.
Аутологичная трансплантация костного мозга и гемопоэтических стволовых клеток
Аспирация костного мозга (КМ)
~ 350 мл продукта лейкафереза
А. Получение стволовых клеток
Трансплантация стволовых клеток
Леикаферез
Клиническая иммунология
Б. Мобилизация гемопоэтических стволовых клеток и проведение трансплантации
Острый лейкоз
Болезнь Ходжкина
Неходжкинская лимфома
Рак молочной железы
Опухоли из клеток зародышевого центра
1. Усиление эффекта химиотерапии
Иммунодефициты
Гемофилия
Иммунная терапия рака
Генетическая модификация стволовых клеток
2. Генная и экспериментальная терапия
В. Показания к трансплантации
Авидин
клетка
Обогащение CD34+ клетками
90% чистота
Магнит Железный шарик
CD34+
Удаление примеси опухолевых клеток
Г. Очистка аутотрансплантата
169
Трансплантационная иммунология
А. Аллогенная трансплантация костного мозга и гемопоэтических стволовых клеток
Для проведения аллогенной трансплантации необходимо найти совместимого донора. Человека с идентичным набором антигенов HLA в первую очередь ищут среди ближайших родственников пациента. Вероятность существования полностью HLA-идентичного брата или сестры (совпадают все HLA-антигены) составляет 1:4. Если близкий или дальний родственник (дядя, тетя, двоюродный брат или сестра) не найден, то проводят поиск в международном банке данных. В качестве трансплантируемого материала используют костный мозг или кроветворные стволовые клетки периферической крови. Можно также использовать пуповинную кровь, в которой содержится много CD344 клеток и небольшое количество зрелых Т-клеток. Реципиента готовят к трансплантации, используя сочетание высоких доз алкилирующих агентов и тотальное облучение (10-14 Гр). Это разрушает опухолевые клетки и в достаточной степени подавляет иммунитет, что необходимо во избежание отторжения чужеродного костного мозга или стволовых клеток.
Б. Показания к трансплантации
В случае злокачественного заболевания трансплантацию можно проводить только при полной ремиссии, т.е. после того как большинство опухолевых клеток было удалено традиционными методами химиотерапии Трансплантация костного мозга является методом лечения хронического миелолейкоза. При остром миелоидном лейкозе (ОМЛ) и остром лимфобластном лейкозе (ОЛЛ) трансплантация показана только пациентам с высоким риском рецидива заболевания. Трансплантацию также проводят больным с тяжелой апластической анемией, пароксизмальной ночной гемоглобинурией, тяжелым комбинированным иммунодефицитом и талассемией. Роль аллогенной трансплантации костного мозга при солидных опухолях окончательно не ясна; положительные результаты были достигнуты при лечении рака почки.
В. Осложнения
Высокодозовая химиотерапия или радиотерапия могут вызвать повреждения разных органов (рис. В1). Возникают повреждения и изъязвления слизистой разных участков ЖКТ, а иногда тяжелая диарея. Облитерирующий эндофлебит является угрожающим жизни состоянием, симптомы которого варьируют от умеренных повреждений печеночных вен до печеночной недостаточности. Также иногда возникает интерстициальная пневмония. Почти во всех случаях неизбежно бесплодие, однако мужскую сперму можно
заморозить до проведения терапии. Побочным эффектом при приеме циклофосфамида является тяжелый геморрагический цистит. Позднее могут возникать вторичные новообразования. В период аплазии особенно большую угрозу представляют инфекционные заболевания, вызванные полирезистентны-ми штаммами стафилококка, псевдомонад и грибов (рис. В2). Наиболее опасным вирусным патогеном является цитомегаловирус (ЦМВ), приводящий к тяжелым легочным и желудочно-кишечным инфекциям. Поскольку переливание тромбоцитов иногда затруднено из-за аллоиммунизации, то существует риск кровотечений.
Одной из основных причин заболеваний и смертей после проведения аллотрансплантаций является болезнь трансплантат против хозяина (БТПХ). Она связана с атакой Т-лимфоцитов трансплантата различных тканей реципиента. В случае HLA-совместимой трансплантации реакция трансплантат против хозяина направлена против минорных антигенов гистосовместимости. По-видимому, антигенпрезентирующие клетки реципиента представляют антигены из чужеродных тканей донорским Т-лимфоцитам. Такое объяснение кажется вероятным в связи с тем, что активность АПК возрастает благодаря усилению активности цитокинов (ИЛ-1, ИЛ-6 и ФНО-а), вызванному химио/радиотерапией. БТПХ особенно поражает кожу (мелкопятнистая экзантема), печень (холестатический гепатит) и кишечник (диарея). Также могут наблюдаться сухость слизистой и соединительной ткани (синдром сухости) и миозит. Профилактика БТПХ состоит в иммуносупрессорной терапии с применением циклоспорина, при необходимости в сочетании с метотрексатом, микофенолат мофе-тилом, такролимусом и кортикостероидами.
Г. Исчерпание Т-клеток и эффект «трансплантат против лейкоза»
Риск БТПХ может быть снижен путем уменьшения содержания Т-лимфоцитов в трансплантате. Недостатком является повышение риска отторжения трансплантата и рецидива опухолевого заболевания, поскольку донорские Т-лимфоциты опосредуют благоприятный эффект «трансплантат против лейкоза». Для того чтобы сохранить эффект трансплантат против лейкоза, но снизить риск БТПХ, проводят частичное удаление Т-лимфоцитов из трансплантата, а затем постепенно по разработанной схеме вводят донорские лимфоциты реципиенту.
Аллогенная трансплантация костного мозга и гемопоэтических стволовых клеток
хмл
ОМЛ
Апластическая анемия
ТКИД
ПНГ
Анемия Фанкони
Талассемия
Агрессивные лимфомы?
Солидные опухоли?
Б. Показания к трансплантации
Кровотечения
1. Осложнения, связанные с химиотерапией
Вирус простого герпеса, ЦМВ
Aspergillus, Candida Coccus, Pseudomonas
2. Осложнения, вызванные аплазией
ФНО-а ИЛ-1 ИЛ-6
Хозяйская Лимфоциты Цитотоксические
АПК донора лимфоциты
А * ф
2 L у-ИНФ “ - ~
Молекулы *
адгезии tf, взаимодействие АПК с Т-клетками НК-клетка
3. Иммунологические осложнения (БТПХ)
В. Осложнения аллогенной трансплантации
Исчерпание Т-клеток
• Снижение риска БТПХ, повышение риска рецидива
КМ донора
гилейке-чески й эффект
Переливание Т/ЦК-клеток через 4,8,12 недель
Г. Исчерпание Т-клеток и эффект трансплантат против лейкоза
Трансплантационная иммунология
А. Типы трансплантации
Существует несколько типов пересадки органов. Аутологичные трансплантаты (например, кожу) переносят из одного участка тела в другой. Сингенные трансплантаты переносятся между однояйцовыми близнецами. Аллогенные трансплантаты переносятся между генетически отличными индивидами. Ксеногенные трансплантаты переносятся между организмами, относящимися к разным видам (например, от обезьяны человеку).
Б. Критерии для удаления органа
Главным необходимым условием изъятия органа является смерть головного мозга донора, которая определяется по отсутствию волн на энцефалограмме, остановке спонтанного дыхания и отсутствию рефлексов, а также ангиографически подтвержденному отсутствию мозгового кровотока. Донор и/или его семья должны быть согласны на передачу органа. Сразу после удаления органа устанавливают группу крови системы АВО и проводят HLA-типирование Необходимо исключить наличие ВИЧ и ЦМВ. Затем с помощью трансплантационного координационного центра (например, Евротрансплант) находят подходящего реципиента. Полное совпадение HLA-антигенов происходит только в 20% случаев. Приоритетность совпадения следующая: DR>B>A>C. Далее проводят перекрестное тестирование клеток донора и сыворотки реципиента; при наличии реакций пересадку не осуществляют.
После любых аллогенных трансплантаций органов пациентов подвергают иммуносупрессорной терапии, предотвращающей отторжение. Сверхострое отторжение может иметь место во временном диапазоне от нескольких минут до трех дней после пересадки. Этот тип отторжения связан с предшествующей сенсибилизацией реципиента и плохо поддается лечению. Острое отторжение может возникнуть через 4-5 дней после трансплантации, но наиболее часто наблюдается через 2-3 недели. Это критическое состояние, которое, однако, преодолимо при использовании надлежащей медикаментозной терапии. Хроническое отторжение, развивающееся на протяжении месяцев и лет, характеризуется серьезным поражением сосудов. Такие реакции отторжения плохо поддаются лечению высокими дозами иммуносупрессоров.
В. Примеры пересадки органов
При диализзависимой хронической почечной недостаточности показана пересадка почки (рис. В1). Основными осложнениями пересадки могут быть реактивация заболевания в пересаженной почке,
реактивация цитомегаловирусной инфекции и нейротоксический эффект некоторых иммуносупрессоров (циклоспорина).
Пересадка роговицы (кератопластика) может быть межслойной, когда переносят только эпителий и строму, а может быть сквозной, при которой также пересаживают задний эпителий (рис. В2). Трансплантат не будет отторгаться до тех пор, пока не произойдет васкуляризация («секвестрация антигенов», см. с. 82).
Г. Ксенотрансплантация
До сих пор одной из важнейших проблем транспланта-логии является нехватка органов. В этой связи ведется интенсивное исследование возможностей ксенотрансплантации (например, пересадка человеку органов свиньи). К основным проблемам ксенотрансплантации относятся реакции немедленного отторжения, связанного с наличием преформированных антител и системы комплемента, сомнительная функциональность суррогатного органа, возможность переноса патогенных для человека вирусов и этическая сторона вопроса.
Для предотвращения свехострого отторжения, связанного с активацией комплемента, исследователи пытаются создать трансгенных свиней, клетки которых не содержат антигенов к имеющимся антителам, но вместо этого экспрессируют регуляторы комплемента, ограничивающие вызываемый комплементом лизис. Такими регуляторами комплемента могут быть мембранный ингибитор реактивного лизиса MIRL (CD59), фактор ускорения распада DAF (CD55) и мембранный кофакторный белок MOP (CD46). Уже имеющиеся антитела могут быть удалены, по крайней мере частично, методом плазмафереза или путем введения растворимых ингибирующих факторов.
Клинические аспекты трансплантации органов
Аутологичная
Сингенная
Ксеногенная
А. Типы трансплантации
спонтанного дыхания
Письменное согласие донора
2. Условия
Согласие членов семьи
1. Смерть мозга
Двукратная ангиография: отсутствие мозгового кровотока
- - 30 мин--1
Группа крови АВО
HLA-типирование: DR>B>A>C Тест на перекрестную реактивность
Отсутствие ВИЧ, ЦМВ
3. Тестирование
Б. Критерии для трансплантации органа
Аорта
Мочеточник
Мочевой пузырь
Ламеллярная кератопластика
Сквозная кератопластика
2. Роговица
Цилиарное тело Радужная оболочка Хрусталик
Передняя камера глаза Эпителий Эндотелий Строма
В. Примеры пересадки органов
Регуляторы комплемента
«Нокаут»
Без антигенов
для преформированных антител
Плазмаферез
Растворимые ингибирующие факторы опосредованного комплементом лизиса - CD35
DAF (CD55) МСР (CD46) MIRL(CD59) /
ос-Галактозил -содержащие вещества
Трансгенная свинья
Реципиент
Г. Ксенотрансплантация
Трансплантационная иммунология
А. Иммуногенность трансплантата
Иммунологические реакции, направленные против трансплантата, запускаются его МНС-комплексами. Молекулы МНС класса I и представляемые ими пептиды могут восприниматься как чужеродные иммунной системой реципиента в результате генетического полиморфизма. Пептидные фрагменты, происходящие от цитоплазматических белков, образуются в ферментативном комплексе, называемом протеасомой, и доставляются транспортными белками ТАР в эндоплазматический ретикулум (ЭР), где они связываются с молекулами МНС класса I Узнавание лимфоцитами реципиента пептида, связанного с МНС класса I, запускает действие как клеточного, так и гуморального им-муннитета. Пептиды, происходящие из других клеточных компартментов, также транспортируются в ЭР, связываются с молекулами МНС класса I и презентируются на поверхности клетки Эти «не-МНС-антиге-ны» обычно вызывают гораздо более слабый иммунный ответ и активируют лишь ограниченное число Т-клеточных клонов. Еще одной причиной иммунных реакций против трансплантата является восприятие реципиентом антигенов групп крови трансплантата как чужеродных. Система АВО характеризуется наличием заранее сформированных антител, что может вызвать реакции сверхострого отторжения.
Б. Реакции отторжения
1. Гуморальный механизм отторжения. Опосредованное антителами отторжение трансплантата может играть весьма важную роль, особенно в случаях пресенсибилизации реципиента, например, в результате беременности или переливания крови. Имеющиеся антитела в первую очередь направлены против эндотелия трансплантата (донора). Наличие этих антител запускает активацию системы комплемента, тем самым способствуя комплемент-опосредованному повреждению эндотелия, агрегации тромбоцитов, гранулоцитов и моноцитов, а также внутрисосудистому свертыванию. связанному с высвобождением медиаторов. Антителозависимая клеточная цитотоксичность (АЗКЦ) играет важную роль в основном при хроническом отторжении трансплантата.
2. Ранняя стадия клеточного отторжения. В ранних реакциях отторжения принимают участие профессиональные антигенпрезентирующие клетки (АПК). АПК трансплантата могут мигрировать и напрямую активировать хозяйские Т-клетки, которые становятся специфичными к молекулам МНС трансплантата. Кроме того, антигены трансплантата могут подвергаться фагоцитозу и процессироваться антигенпрезентирующими клетками хозяина. Однако
презентация на собственных МНС активирует только Т-клетки, которые не узнают молекулы МНС трансплантата.
3. Центральная стадия клеточного отторжения. Активированные Т-клетки инфильтруют околососуди-стые ткани и участки вокруг антигенпрезентирующих клеток. Преимущественно в этом процессе задействована популяция клеток Тн1-типа. Высвобождение цитокинов оказывает прямое токсическое действие на окружающие ткани. Кроме того, цитокины индуцируют привлечение дополнительных Т- и В-клеток, макрофагов и гранулоцитов. Активированные эффекторные клетки выделяют прокоагуляционные факторы, кинины и эйкозаноиды. Под воздействием цитокинов происходит усиление экспрессии молекул адгезии и МНС в окружающих тканях.
Иммуномодулирующие процессы, происходящие в организме реципиента и приводящие к длительной толерантности, сложны и не до конца изучены. Если не приходит второй сигнал от костимулирующего лиганда, передаваемый посредством CD28, то активация наивных Т-клеток останется неполной. Такое состояние, называемое анергией, характеризуется отсутствием ИЛ-2 и деструктивных Т-клеточных реакций. В условиях толерантности аллогенные трансплантаты часто инфильтруются Тн2-клетками, что, возможно, ингибирует действие Тц1 -клеток. Более того их цитокины ИЛ-10 и ТФР-р снижают уровень экспрессии костимуляторных лигандов CD80 и CD86
Иммунологические аспекты трансплантации органов
Не МНС-антигены
о
9
1 MHCI
Аппарат Гольджи
А. Иммуногенность трансплантата
Система групп крови АВО
Толерантность
Клиническая иммунология
Отторжение
МНС II Кости мул я-торные лиганды
МНС II (Отсутствует . костимуля-Молекула'^^' торный адгезии сигнал
ИЛ-2, у-ИНФ, ФНО-а ИЛ-4, ИЛ-10
2. Ранняя стадия клеточного отторжения
Б. Реакции отторжения
Отсутствует ИЛ-2
Анергия
CD80
CD86 1
° О
ИЛ-10, ТФР-Р
Толерантность
3. Центральная стадия клеточного отторжения
175
Скелетно-мышечные заболевания
Ревматоидный артрит (РА. хронический полиартрит) является наиболее распространенным заболеванием суставов. Ему подвержено 1-2% всего населения. Критерии, необходимые для диагностирования данного заболевания, были разработаны Американской коллегией ревматологов (АКР). Для постановки диагноза РА должны выполняться по меньшей мере четыре из семи критериев (см. также таблицу 1 в приложении).
А. Клинические проявления ревматоидного артрита
РА представляет собой системное заболевание, часто имеющее внесуставные проявления. РА обычно развивается у людей старше 40 лет и чаще поражает женщин (соотношение с мужчинами 3:1) В большинстве случаев болезнь начинается скрыто, обычно носит многосуставной и симметричный характер, особенно поражая мелкие периферические суставы. Многие пациенты жалуются на общее недомогание Утолщение суставной капсулы и веретенообразный вид сустава наиболее часто наблюдаются в медиальных проксимальных межфаланговых суставах кистей рук, в запястьях, а также в плюснефаланговых суставах пальцев ног. Возможны болевые приступы по ночам, артралгия и тугоподвижность суставов по утрам. Распространение воспаления носит центрипетальный характер. Дистальные межфаланговые суставы пальцев рук обычно не затрагиваются.
На более поздних этапах развития болезни происходит необратимая деформация, ограничивающая подвижность суставов, особенно затрагивающая мелкие суставы. Характерная ульнарная девиация пальцев кисти и деформация пальцев в форме «шеи лебедя» или «бутоньерки» («петлицы») объясняется подвывихом сухожилия разгибателя или сгибателя в опухшем и поврежденном синовиальном влагалище сухожилия. Происходит также деструктивный процесс в кости, который начинается у места прикрепления суставной капсулы (на рентгеновском снимке выглядит как зона эрозии). Терминальная стадия заболевания характеризуется образованием фиброзных и костных сращений вокруг сустава. При рефрактерном характере заболевания на поздних стадиях часто наблюдается поражение шейного отдела позвоночника. Зто выражается в деструктивных изменениях атлантоаксиального сустава и повышает риск компрессии костного мозга.
Внесуставные проявления заболевания часто ассоциированы с наличием ревматоидных факторов (РФ). Одним из характерных проявлений является образование фиброзных узелков на конечностях на стороне разгибающей мышцы, особенно в предплечьях. Эти ревматоидные узелки состоят из некроти
ческой ткани, окруженной «палисадом» макрофагов. Висцеральные проявления связаны с васкулитом и последующим плевритом или перикардитом (клинически диагностируются редко). К другим редким вне-суставным проявлениям относятся кожный васкулит, легочный фиброз, недостаточность митрального клапана и миокардит. Характерными для РА являются заболевания глаз с такими проявлениями, как склерит или эписклерит, а также вторичный синдром Шегрена (см. с. 200).
К серологическим проявлениям РА относятся значительные изменения картины крови, наблюдающиеся при воспалении (СОЭ и концентрация С-реак-тивного белка), что может указывать на анемию и тромбоцитоз Такой ревматоидный фактор, как IgM, обнаруживается у 70% пациентов, а антиядерные антитела — у 30%.
Критерии АКР для классификации РА
Критерий
1 Тугоподвижность суставов по утрам
2 Артрит в области трех и более суставов
3 Артрит суставов рук: запястья, проксимальные межфаланговые суставы, пястно-фаланговые суставы
4 Симметричное опухание (артрит)
5 Ревматоидные узелки
6 Ревматоидные факторы в сыворотке
7 Радиологически подтвержденные изменения
Клинические проявления ревматоидного артрита
Суставные Внесуставные
Ступни
А. Клинические проявления ревматоидного артрита
Скелетно-мышечные заболевания
А. Клеточная структура синовиальной оболочки
Характерным признаком ревматоидного артрита является растяжение и ворсинчатое разрастание синовиальной оболочки, в норме имеющей гладкую поверхность. Наблюдается пролиферация клеток выстилки, представленных главным образом макрофагами и активированными синовиальными фибробластами, а также инфильтрация Т-лимфоцитами. В структурах, напоминающих лимфатические фолликулы, обнаруживаются в основном CD4+ клетки. Иногда эти клетки по характеристике сходны с клетками зародышевых центров. Напротив, в диффузной инфильтрации соединительной ткани участвуют CD8 Т-клетки. Еще одной характерной чертой синовита является активная васкуляризация синовиальной оболочки.
Б. Состав клеток в суставах при артрите
У пациентов с РА наблюдается вызванное синовитом расширение суставной капсулы и влагалища сухожилия (рис. Б1). Это может приводить к разрыву сухожилия и потере подвижности.
Типичным гистологическим признаком является активная инфильтрация лимфоцитами. Отдельные ворсинки состоят в основном из гипертрофированного выстилающего слоя, содержащего макрофаги (клетки типа А), фибробласты (клетки типа В) и инфильтрующие лимфоциты (круглые клетки) (рис. Б2). С помощью электронной микроскопии можно обнаружить активацию клеток, особенно макрофагов и синовиальных фибробластов (рис. БЗ). Это приводит к развитию паннуса (от лат. «слой ткани»), проникающего в кость, покрывающего хрящ и в конечном итоге разрушающего обе ткани.
В синовиальной оболочке находятся практически все клетки иммунной системы (рис. Б4). Таким образом, при воспалении синовиальная оболочка приобретает черты лимфоидного органа. Присутствующие там Т-клетки в основном относятся к Т-клеткам памяти
(CD45R0+). Клеточные агрегаты, напоминающие зародышевые центры, состоят из активированных В-кле-ток и фолликулярных дендритных клеток. Здесь также встречаются отдельные плазматические клетки, вырабатывающие ревматоидные факторы и поликлональные антитела различной специфичности. На границе между слоем паннуса и хрящем в основном находятся активированные синовиальные фибробласты, образующие большое количество ферментов деструкции, в частности металлопротеиназы (коллагеназу и стромелизин; см. Таблицу). Синовиальную оболочку в основном инфильтруют одноядерные клетки, а синовиальную жидкость активно инфильтруют нейтрофилы.
Вклад различных типов клеток в развитие ревматоидного артрита до сих пор обсуждается. Большинство исследователей придерживается той точки зрения, что за патогенез РА отвечают клетки иммунной системы. Однако по мнению других специалистов иммунологические проявления имеют лишь вторичную природу. Они считают, что эти проявления могут возникать в ответ на длительные воспалительные стимулы, вызываемые либо неизвестными инфекциями, либо аномальными синовиальными фибробластами, приводящими к активации деструктивных процессов. Для окончательного выяснения данного вопроса необходимы дальнейшие исследования
Важные протеолитические ферменты, вовлеченные в развитие РА
Семейство ферментов Представители
Матриксные металлопротеиназы ММП ММП 1,2,3 и9
Цистеиновые протеиназы Катепсины В, Н и L
Сериновые протеиназы Эластаза, активатор плазминогена, катепсин G
Аспартатные протеиназы Катепсин D
Синовиальные изменения при ревматоидном артрите
Синовиальная оболочка со структурами, напоминающими лимфоидные фолликулы
Клиническая иммунология
1. Синовит
Кость
Хрящ
В-клетки
Т-клетки
Эрозия
Паннус
2. РА: гистология
Слой выстилающих клеток
Синовиальная оболочка
Синовиальная жидкость
Эндотелиальные клетки
_ Дендритные клетки
3. Активированные макрофаги (электронная микрофотография)
- Клетки-киллеры
- Гранулоциты
Плазматические клетки /л
Макрофаги 3 и моноциты
4. Клеточный состав
Б. Состав клеток в суставах при артрите
179
Скелетно-мышечные заболевания
Клиническая иммунология
А. Подверженность ревматоидному артриту
Генетические факторы играют важную роль в развитии ревматоидного артрита, хотя среди однояйцовых близнецов только 15% одновременно страдают этим заболеванием. Это указывает на решающую роль внешних факторов в развитии РА, в частности на роль инфекционных заболеваний. При создании гипотезы «разделенных эпитопов» («shared epitope») интенсивно изучалась связь РА с антигенами HLA. Данная гипотеза постулирует, что болезнь связана не только с определенной HLA-DR-специфичностью, но и с общими эпитопами на различных молекулах DR (особенно DR4 и DR1). Показано также, что наличие DR4 связано с более тяжелым течением РА и сильным разрушением суставов, особенно в тех случаях, когда обе хромосомы содержат ген данной молекулы («двойная доза» гена).
На основании патогенетических исследований можно предположить, что неизвестные пока чужеродные антигены или аутоантигены, способствующие развитию заболевания, связываются с пептидсвязывающей щелью на молекуле HLA класса II. Взаимодействие между антигенпрезентирующей клеткой и Т-хелпером происходит через область третьего гипервариабельного участка антигена HLA класса II, имеющего спиральную структуру. Здесь расположены вариабельные аминокислотные остатки, закодированные в области первого домена гена HLA-DRB1. Из таблицы видно сходство между подтипами DR4, DR1 и DR6Dw16, также связанными с ревматоидным артритом. Замена нейтрального и(или) основного аминокислотного остатка на кислый остаток Asp или Glu в положениях 70, 71 и 74 в аллелях Dw10 и(или) Dw13 приводит к потере связи с РА. По всей видимости, эти молекулы НГАлибо не способны к высокоаффинному связыванию артритогенных пептидов, либо не распознаются «правильными» Т-кле-точными рецепторами.
Б. Патогенез ревматоидного артрита
Т- и В-лимфоциты мигрируют от посткапиллярных венул синовиальной оболочки к тканям по неизвестному на настоящий момент механизму (инфекция, травма?). Затем синовиальные клетки, несущие аномальные антигены HLA класса II и костимуляторные молекулы, представляют неизвестный артритогенный пептид Т-клеткам. После этого цитокины стимулируют активацию различных клеточных систем. В-клетки активируются по механизму поликлональной стимуляции. Эти активированные В-клетки синтезируют иммуноглобулины, в частности ревматоидные факторы, которые активируют систему комплемента через иммунные комплексы. Более того, провоспалительные цитокины,
особенно ФНО-а и ИЛ-1, приводят к усиленной пролиферации и активации фибробластов. Все это вызывает развитие синовита и образование паннуса, а как следствие — разрушение кости и сустава (эрозия и деформация на рентгеновском снимке).
В. Индукция ревматоидного артрита
Неизвестный на сегодняшний день антиген стимулирует активацию Т-лимфоцитов, которые в свою очередь активируют синовиальные макрофаги. Макрофаги секретируют важные цитокины ФНО-а и ИЛ-1, активирующие остеокласты и хондроциты. Такая двустадийная атака приводит к разрушению хряща и кости Хондроциты могут производить большие количества фактора роста фибробластов (ФРФ) и ГМ-КСФ, что дополняет губительный цикл, способный привести к реактивации макрофагов. Такая схема событий объясняет, почему заболевание иногда сохраняется в течение длительного времени, даже после уничтожения Т-клеток при лечении с использованием моноклональных антител. Данную концепцию учитывают при разработке новых терапевтических стратегий, основанных на применении моноклональных антител или на аналогичных моделях (см. с. 271).
180
Патогенез ревматоидного артрита (I)
Аминокислота
DRB1 57 69 67 70 71 74 86
DR4Dw4 Asp Glu Leu Gin Lys Ala Gly
DR4Dw10 — — lie Asp Glu — Vai
DR4DW13 — — — — Arg Glu Vai
DR4DW14 — — — — Arg — Vai
DR4Dw15 Ser • — — — Arg — —
DR1 lie — — - Arg — Ala
DR6Dw16 Leu - - - Arg - Ala
2. Вариабельность аминокислот в последовательности DR
А. Подверженность ревматоидному артриту
комплексы
Посткапиллярные венулы
синовиальных клеток
Образование паннуса
Цитокины
Активация комплемента
Повреждение костей и суставов
Б. Патогенез ревматоидного артрита
Неизвестный антиген
Паннус
Синовиальная ткань
Хондроциты
Остеокласты
В. Индукция ревматоидного артрита
Скелетно-мышечные заболевания
А. Активированные синовиальные макрофаги
Наряду с Т-лимфоцитами важную роль в разрушении сустава при РА играют активированные синовиальные макрофаги Эти клетки составляют около 30% клеток в воспаленной синовиальной оболочке. Они несут все важные молекулы: антиген CD14, полный набор антигенов HLA класса II (DR. QR, DP). Fc-рецепторы и антиген CD4. Синовиальные макрофаги характеризуются наличием внутриклеточного антигена CD68. Кроме мембраносвязанных молекул они также секретируют многочисленные медиаторы и цитокины, наиболее важными из которых являются ФНО-а и ИЛ-1. Синовиальные макрофаги при РА также образуют контррегуляторные цитокины ТФР-р и ИЛ-10, но их действие, по всей вероятности, не может противостоять активности провоспалительных цитокинов. В культурах тканей макрофаги очень активны, для них характерны усиленный фагоцитоз и хемотаксис
Б. Активированные клетки в синовиальной оболочке
Активированные синовиальные клетки показаны на иллюстрациях: синовиальные макрофаги, экспрессирующие антигены HLA класса II (рис. Б1), CD14+ гигантские клетки, встречающиеся в гранулемоподобных образованиях (рис. Б2), и типичные звездчатые клетки, соответствующие синовиальным фибробластам и несущие аномальные антигены HLA класса II (рис. БЗ). Звездчатые синовиоциты не следует путать с дендритными клетками, которые также встречаются в синовиальной оболочке у пациентов с ревматоидным артритом.
В. Ревматоидные факторы
(анти гл обул ины)
Ревматоидные факторы (РФ) представляют собой иммуноглобулины, направленные против Fc-фрагментов IgG. Они являются лучшим примером аутоиммунных элементов, поскольку представляют собой антитела, направленные против своего собственного вида («антиглобулины»). У здоровых людей могут встречаться небольшие количества ревматоидных факторов. Их роль, возможно, связана с неспецифическим усилением реакций антител при инфекциях, особенно на ранних этапах, когда синтез специфических иммуноглобулинов еще не налажен в полную силу То же происходит и при серьезных иммунных нарушениях, например при эндокардите. При ревматоидном артрите неизвестные механизмы вызывают аномальную пролиферацию ревматоидных факторов, относящихся к классу IgG, которые в норме не детектируются.
Ревматоидные факторы обнаруживаются и при других заболеваниях, но все же они являются наиболее важными факторами гуморального иммунитета при ревматоидном артрите. РФ класса IgM легко детектируются. Благодаря незанятым валентностям, они могут реагировать со свободными молекулами в тестовой системе (рис. В1). РФ класса IgG стимулируют образование крупных иммунных комплексов. В данном случае аутоантитела связываются друг с другом и их трудно выделить из этих комплексов. Поэтому такие ревматоидные факторы нельзя определить в классическом тесте (рис. В2).
Г. Нарушение В-клеточной регуляции
Не изученные до сих пор нарушения регуляции и презентации антигена приводят к тому, что В-клетки начинают синтезировать ревматоидные факторы, образующие крупные иммунные комплексы. Это активирует систему комплемента и приводит к высвобождению хемотаксических фрагментов комплемента, что способствует развитию васкулита. В результате цитокины и воспалительные медиаторы попадают в ткани. Эти молекулы привлекают гранулоциты и макрофаги, что также вносит вклад в разрушение ткани. По всей видимости, этот механизм играет решающую роль в развитии внесуставных, связанных с васкулитом повреждений, наблюдаемых при ревматоидном артрите.
Патогенез ревматоидного артрита (II)
пге2,
неоптерин
ТФР-Р, ФРФ, ИЛ 10
ФНО-а, ИЛ-1
Усиление фагоцитоза
Усиление хемотаксиса
А. Активированные синовиальные макрофаги
1. Синовиальный макрофаг
2. Гигантская клетка
3. Звездчатая синовиальная клетка
Б. Активированные клетки в синовиальной оболочке
1. Ревматоидный фактор IgM
2. Ревматоидный фактор IgG (а также IgA и IgE)
В. Ревматоидные факторы (антиглобулины)
Скелетно-мышечные заболевания
А. Классификация
Существует несколько видов ювенильного хронического артрита (ЮХА). Полиартикулярный ЮХА представляет собой серонегативный вариант (РФ-нега-тивный), который возникает в раннем детстве. Существует большая разница между полиартикуляр-ным ЮХА и взрослой формой заболевания, которая развивается в более зрелом возрасте и является РФ-позитивной. Олигоартикулярный ЮХА подразделяют на два подтипа: моноартикулярный артрит с ранним началом заболевания (тип 1) и моноартикулярный артрит с поздним началом заболевания (тип 2). Первый тип характеризуется наличием антиядерных антител, а второй — наличием антигена гистосовместимости HLA-B27. Кроме этих видов существует еще системный ювенильный хронический артрит (болезнь Стилла), характеризующийся серьезными поражениями органов.
Б. Системный ювенильный хронический артрит (болезнь Стилла)
Болезнь Стилла имеет тяжелую клиническую картину с разнообразными проявлениями. Она характеризуется частыми сыпями, высокой температурой (до 41°С), полисерозитом с плевральным и перикардиальным выпотом и во многих случаях гепатоспленомегалией. Если лабораторные тесты выявили значительный лейкоцитоз со сдвигом лейкоцитарной формулы влево у пациентов с частыми лимфаденопатиями, то данное состояние можно ошибочно принять за лейкоз. Болезнь Стилла обычно имеет характер симметричной периферической формы полиартрита с опуханием и ограничением подвижности суставов.
В. Многосуставные формы
Серонегативный полиартикулярный ЮХА обычно начинается в возрасте от 2 до 5 лет. Типичным проявлением заболевания является поражение височно-нижнечелюстного сустава (часто в сочетании с микрогнатией) и симметричным характером полиартрита. Осложнениями заболевания могут быть дисфункции эпифиза, приводящие к нарушениям роста и разной длине конечностей. Чаще заболеванию подвержены девочки. Лабораторные диагностические тесты разработаны слабо. Иногда при анализе обнаруживают антиядерные антитела. Во многих случаях данное состояние коррегируется при достижении половой зрелости.
Серопозитивный полиартикулярный ЮХА, который иначе называют ревматоидным артритом с ранним началом, обычно развивается у детей в 10-летнем возрасте. РФ-позитивная ювенильная форма не отличается от серопозитивного ревматоидного артрита
взрослых. В большинстве случаев болезнь носит тяжелый характер с симметричными поражениями, типичными для артроза. Лабораторные тесты выявляют ревматоидные фактроы и антиядерные антитела: обычно присутствует также антиген DR4.
Г. Олигоартрит с ранним началом заболевания
Болезнь чаще поражает детей Сам по себе артрит не является основной проблемой, поскольку болезнь имеет неострый характер. Серьезным осложнением болезни может быть хронический иридоциклит, способный привести к слепоте. Данная форма иридоциклита связана с наличием антиядерных антител. Болезнь в основном поражает девочек.
Д. Ювенильный спондилоартрит
Подобно РФ-позитивному полиартикулярному артриту. ювенильный спондилоартрит является детской формой спондилоартрита взрослых. Серонегативные спондилоартропатии обычно сопровождаются сакрои-леитом и поражают бедренные или другие крупные суставы. Ювенильному спондилоартриту больше подвержены мальчики. Для болезни характерно наличие антигенов HLA-B27 и отсутствие ревматоидных факторов и антиядерных антител. Прогноз неоднозначный: болезнь может либо полностью исчезнуть с наступлением половой зрелости, либо развиваться, приобретая типичную клиническую картину анкилозирующего спондилоартрита.
Ювенильный хронический артрит
Ювенильный хронический артрит (ЮХА)
А. Классификация
Экзантема
Температура до 4ГС .
Увеличение размера органов
жен:муж 2:3
Лимфаденопатия
Экзантема
Артрит (полпартикулярный)
|Лаб. показатели: СОЭШ, С-реактивный белок Ш, лейкоциты ttt (сдвиг влево), анемия
Б. Системный ювенильный хронический артрит (болезнь Стилла)
Хронический иридоциклит
Артрит (единичные суставы)
жен:муж 9:1
Иридоциклит
Г. Олигоартрит с ранним началом заболевания
Серонегативный (проявляется в возрасте 2-5 лет)
Поражение нижнечелюстного сустава (микрогнатия)
Симметричный полиартрит (нарушения роста эпифиза)
Серопозитивный (проявляется в возрасте > 10 лет)
Симметричный деструктивный артрит
жен : муж 4:1
Лаб.
показатели: неспецифические (АЯА+у25%)
Лаб. показатели: РФ+, АЯА+ у 75%, DR4+
В. Многосуставные формы ЮХА
Увеит
Сакроилеит
жен:муж 9:1
Лаб. показатели: HLA-,B27+, АЯА-, РФ~
Д. Ювенильный спондилоартрит
Скелетно-мышечные заболевания
Эти заболевания имеют между собой много общего. В частности, их связывает наличие предполагаемого патогенного фактора HLA-B27 и типичные клинические проявления. Термин спондилоартрит предполагает вовлечение в заболевание осевого скелета. Для классификации такого рода заболеваний пользуются критериями Европейской группы по исследованиям спондилоартрита (ESSG, см. таблицу).
А. Клинические проявления
К данной группе заболеваний относят анкилозирующий спондилоартрит (АС), реактивный артрит (реА), артрит, сопровождаемый хроническим воспалением кишечника (ХВК) и псориатический артрит.
Анкилозирующий спондилоартрит (болезнь Бехтерева) представляет собой системное воспалительное заболевание, поражающее в основном осевой скелет и суставы, но иногда и внутренние органы. Этой болезни больше подвержены мужчины в возрасте от 15 до 30 лет. Кроме суставов, могут затрагиваться структуры из волокнистой хрящевой ткани (синхондрозы и межпозвоночные диски). Патологические изменения чаще всего наблюдаются в местах прикрепления сухожилий и связок. Болезнь носит хронический прогрессирующий характер, всегда с вовлечением позвоночных и крестцово-подвздошных суставов. Периферические суставы поражаются в 25% случаев. Болезнь может иметь и внесуставные проявления, наиболее частым из которых является передний увеит (ирит) и уретрит; у мужчин часты случаи простатита.
Реактивный артрит часто является последствием кишечной инфекции или уретрита. При олигоартрите поражается от 2 до 4 крупных или мелких суставов, обычно после латентного периода от 10 до 30 дней. Почти всегда страдают суставы нижних конечностей, в основном колени и лодыжки. Для данного заболевания характерны кожные проявления (бленнорейная кератодермия, см. фото), конъюнктивит и иридоциклит (триада Рейтера: артрит, уретрит, конъюнктивит).
Псориатичесий артрит может развиваться из моноартрита, олигоартрита или полиартрита. У многих пациентов с длительной историей заболевания могут иметь место проявления полиартрита с характерным поражением дистальных межфаланговых суставов пальцев рук и ног, межфаланговых суставов больших пальцев рук. Могут вовлекаться крестцово-подвздошные и позвоночные суставы. Из заболеваний периферических суставов наиболее общим случаем является дактилит — воспаление всех суставов пальца ноги или руки.
Б. Патогенез
Спондилоартрит часто является последствием воспалительных заболеваний кишечника и(или) мочеполовой системы. У пациентов с воспалениями слизистых оболочек возможно проникновение в циркуляцию большого количества антигенного материала. При наличии генетической предрасположенности артрит проявляется после исчезновения вызвавшего его заболевания. Течение заболевания зависит от промоторных областей генов провоспалительных цитокинов (генов-модификаторов) и от типа лечения.
В. Наличие антигена HLA-B27
Антиген HLA-B27 обнаруживается у 90-95% больных анкилозирующим спондилоартритом по сравнению с 8-10% у населения в целом, в зависимости от этнического состава. Результаты некоторых исследований показывают, что у 20% лиц, имеющих антиген HLA-B27, на протяжении жизни разовьется анкилозирующий спондилоартрит или недифференцированный спондилоартрит.
Классификация спондилоартритов (ESSG)
Болевые ощущения воспалительной
природы в спине или
Синовит, асимметричный или преимущественно нижних конечностей.
а также хотя бы один из приведенных ниже признаков:
Случаи заболевания в роду
Псориаз
Воспалительное заболевание кишечника
Уретрит, цервицит или острая диарея
за 1 месяц до начала артрита
Боль в ягодицах, перемежающаяся между правой и левой ягодичными областями Энтезопатия
Сакроилеит
Клинические проявления спондилоартрита
Лечение
Клинический результат
Анкилозирующий спондилоартрит 95%
Синдром Рейтера (классический вариант) 80%
Недифференцированная спондилоартропатия 70%
Артрит + ХВК 25%
Псориатический артрит 25%
Реактивный артрит 20-80%
Нормальная популяция 8-10%
Б. Патогенез
В. Частота встречаемости антигена HLA-B27
Скелетно-мышечные заболевания
Для объяснения роли антигенов HLA-B27 в патогенезе анкилозирующего спондилоартрита используют три рассмотренные ниже модели.
А. Молекулярная мимикрия
В данной гипотезе, как и в теории толерантности, считается, что между полиморфными областями антигена HLA-B27 и антигенами бактериальных патогенов существует большое структурное сходство. При инфекции бактериальные патогены воспринимаются как чужеродные, и возникает адекватный Т-клеточный и гуморальный иммунный ответ. Из-за структурного сходства антиген HLA-B27 также воспринимается как чужеродный. В результате иммунная система начинает атаковать эндогенные структуры, что запускает не изученный до сих пор каскад реакций, приводящих в конце концов к спондилоартриту.
Б. Теория толерантности
Модель толерантности основана на похожих предположениях. Однако в данном случае считается, что сходство между HLA-B27 и микробными антигенами приводит не к аутоиммунным реакциям, а к аномальной толерантности бактериальных антигенов. В результате патогены продолжают существовать в пораженных суставах и не удаляются иммунной системой с должной эффективностью. Противостояние патогену приводит к воспалительному процессу, вызывающему артрит.
В. Гипотеза «неразборчивого» В27
В соответствии с этой недавно предложенной моделью антиген HLA-B27 не вовлечен напрямую в узнавание артритогенного пептида, а действует как аутоантиген, косвенным образом способствующий запуску воспалительного каскада по CD4-опосредованному механизму. При этом молекула HLA-B27 распадается внутри клетки на мелкие пептидные фрагменты. Эти фрагменты связываются с пептидсвязывающим участком антигена HLA-B27 и представляются артритогенной CD44 Т-клетке. Эти Т-хелперные клетки запускают процесс развития артрита.
Г. Индукция спондилоартрита
у трансгенных крыс
Непосредственное участие антигена HLA-B27 в развитии артрита было продемонстрировано в экспериментах на трансгенных крысах. Крысиные овоциты трансфецировали человеческим HLA-B27 в сочетании с Р2-микроглобулином и имплантировали самкам с ложной беременностью. У трансгенного потомства наблюдались проявления, характерные для
Н1А-В27-ассоциированного спондилоартрита у людей. Кроме продуктов собственных генов, у крыс обнаруживали человеческий антиген HLA-B27 и Р2-микроглобулин. У животных развивался артрит, псориаз, колиты, наблюдалось повреждение когтей. Интересно, что болезнь не развивалась у животных, выросших в стерильных условиях. Это подтверждает важную роль инфекционных заболеваний в патогенезе спондилоартрита.
Патогенез спондилоартрита
Перекрестнореактивные антитела или Т-клетки
Устойчивость патогенных бактерий
В. Гипотеза «неразборчивого» В27
Инъекция генов тяжелых цепей и Р^-микроглобулина в яйцеклетки крыс
Трансгенное потомство
Продукты собственных генов
Человеческий HLA-B27
Имплантация трансфецированных яйцеклеток сингенным крысам
Артрит
Псориаз
Колит
Г. Индукция спондилоартрита у трансгенных крыс
Скелетно-мышечные заболевания
А. Подагра
Первичная подагра связана с накоплением и отложением солей мочевой кислоты, что обусловлено генетической предрасположенностью и высоким содержанием пурина в потребляемых продуктах питания. Кристаллы урата натрия главным образом накапливаются в суставах, но также в хрящевой и соединительной ткани в результате системного распространения.
1. Пациенты, страдающие подагрой, имеют врожденный дефект экскреции урата. При нормальном уровне содержания урата состояние остается бессимптомным. Однако богатая пуринами диета приводит к его накоплению (гиперурикемия: свыше 7 мг/дл) и в конечном итоге — к осаждению солей мочевой кислоты. Вторичная подагра вызвана повышенным уровнем урата в сыворотке, связанным с усилением клеточного метаболизма (например, при истинной полицитемии, лейкозах, приеме цитостатиков и облучении), или ослаблением экскреции (дисфункция почечных канальцев или конкуренция со стороны лактата, кетонов или диуретиков).
2. Осаждение кристаллов чаще всего происходит в суставах нижних конечностей, где вызывает воспалительную реакцию. Болезнь может поражать плюснефаланговый сустав большого пальца ноги (подагра) или коленный сустав (подагрический гонит). Гранулоциты мигрируют в сустав и осуществляют фагоцитоз кристаллов, но не могут катализировать их разрушение в лизосомах. Кристаллы повреждают лизосомальную мембрану гранулоцитов, приводя к высвобождению ферментов и медиаторов воспаления. Подагрическая атака является самораспространяющимся состоянием. В связи с этим целью лечения при остром приступе является снятие воспаления. Приступы эффективно подавляются колхицином — алкалоидом, останавливающим деление клетки в метафазе путем разрыва митотического веретена. Этот препарат также связывается с контрактильными элементами гранулоцитов, препятствуя миграции гранулоцитов к местам воспаления.
Хроническая подагра характеризуется отложением кристаллов урата в мягких тканях (наружном ухе, пяточных шпорах), костях (особенно вблизи суставов) и почках (рис. А2). Профилактической мерой в борьбе с приступами подагры является снижение концентрации урата. Этого можно достичь с помощью диеты или лекарств. Аллопуринол является гипоурикемическим средством, ингибирующим ксантиноксидазу и снижающим тем самым скорость образования урата. Бензбро-марон — это урикозурический препарат, способствующий выведению урата через почки.
Б. Полихондрит
Полихондрит представляет собой воспалительное заболевание с неизвестной этиологией, поражающее различные хрящевые структуры, особенно уши, нос и трахею. Болезнь часто сопровождается системным васкулитом. Чаще всего болезнь начинает развиваться у людей в возрасте от 40 до 60 лет и носит хронический характер. Воспаление и опухание хрящевых структур приводит к деформациям типа седловидного носа или ушной раковины в виде «цветной капусты». Размягчение гиалиновых хрящей может привести к инспираторному стридору и разрыву стенки трахеи. Поражения артикулярного хряща аналогичны тем, что наблюдаются при неэрозивном полиартрите. Часто повреждаются глаза, что выражается в эписклерите, ирите и увеите. Васкулит основных кровеносных сосудов может привести к воспалению аорты и аортальной недостаточности. Анализ крови выявляет характерные признаки воспаления, но ядерные аутоантитела отсутствуют. При острых состояниях показано применение преднизолона; при приступах обычно используют азатиоприн, циклофосфамид или циклоспорин А.
В. Синдром Бехчета
Синдром Бехчета представляет собой системное воспаление мелких кровеносных сосудов, характеризующееся триадой симптомов: афтозный стоматит, язвенные изменения слизистой оболочки половых органов и увеит. Иногда возникают олигоартрит нижних конечностей, легочный васкулит и цереброваскулярные симптомы. Этиология болезни остается неизвестной. Была обнаружена связь с наличием HLA-B52. Афтозный стоматит следует отличать от обычных афт и тех, что связаны с иммунными васкулитами и болезнью Крона. Пациентам обычно назначают местную стероидную терапию или прием системных препаратов (циклоспорин А или циклофосфамид).
Питание
Аллопуринол
Усиление лизиса клеток
Вторичная v
Первичная (
Пищевые пурины
-АЛ
н н
Мочевая кислота
Бензбромарон
мг/дл
Ураты
Ослабленное выведение урата
Колхицин
г_ Кристаллы
урата £
Макрофаг *ЙЛ
Воспалительные реакции Гранулоцит
Хемотаксис ’
Фагоцитоз
1. Патогенез и лечение
А. Подагра
Увеит
Седло-видный нос
Разрыв стенки трахеи
Ушная раковина в форме «цветной капусты»
Подагра, полихондрит и синдром Бехчета
Подагрические отложения в хрящевой ткани
Подагрическая остеоартропатия
Подагрические отложения в мягких тканях кистей рук
Нарушение работы почек
- - Коленные суставы (подагрический гонит)
Бурсит локтевого отростка
Разрыв мембраны
Высвобождение ферментов и медиаторов
Первый плюсне-фаланговый сустав (подагра)
Клиническая иммунология
2. Проявления
Поражение ушного хряща
1. Увеит
Воспаление аорты
Системный васкулит мелких сосудов
ЦНС: васкулит
Перикардит
Легочный васкулит
Менингоэнцефалит
Узелковая эритема, пиодермия
2. Афтозный стоматит
Олигоартрит, особенно нижних конечностей
Связь сHLA-B52
3. Язвы гениталий
Клиническая триада
Другие признаки
Б. Полихондрит
В. Синдром Бехчета
Аутоантитела
Клиническая иммунология
А. Характер аутоантител
Некоторые аутоантитела при непрямых иммуноф-луоресцентных методах исследования (см. с. 95, Б) демонстрируют определенный характер окрашивания, свойственный системному аутоиммунному заболеванию. Во многих случаях по характеру окрашивания антител можно провести предварительную классификацию специфичности, а также определить тип заболевания. Заболевания соединительной ткани связаны с характерными аутоантителами. Такие болезни прежде называли коллагеновыми сосудистыми болезнями, поскольку считалось, что аутоиммунная атака направлена на коллагенсодержащие соединительные ткани. К этой группе заболеваний относятся системная красная волчанка (СКВ), синдром Шегрена, склеродермия, полимиозит/дерматомиозит и наследственная смешанная соединительнотканная болезнь (ССТБ). Большинство аутоантигенов, против которых направлена аутоиммунная реакция, являются компонентами ядра и цитоплазмы клетки, играющими определенную роль в процессировании генетической информации. Характер распределения ау
тоантител и связанные с ними заболевания перечислены в приложении в таблице 3 «Антиядерные антитела при ревматических заболеваниях» и таблице 4 «Значение аутоантител для диагностики аутоиммунных заболеваний».
192
Значение аутоантител для диагностики аутоиммунных заболеваний
Заболевание
Аутоантитело СКВ ССТБ Склеродермия Миозит Синдром Шегрена Ревматоидный артрит Первичный васкулит Анти-фосфо-липид-ный синдром
АЯА 4-4-4- 4-4-4- 4-4-4- 4- 4-4-4- 4- 4- 4-
dsDNA 4-4-4- - - - - - - -
SM -ы- - - - - - - -
U1RNP 4- 4-4-4- 4- 4- - - - -
Ribosomal Р 4-4- - - - - - - -
PNCA 4- - - - - - - -
Ro 4-4- 4- 4- - 4-4-4- 4- - -
La 4-4- 4- 4- - 4-4-4- 4- - -
RA33 4-4- 4-4- - - 4- 4-4- - -
Scl70 - - 4-4-4- - - - - -
Центромера - - 4-4-4- - - - - -
Jo-1 - - 4-4- - - - -
PM-Sd - - 4- 4- - - - -
Кардиолипин 4-4-4- 4- 4- - 4- 4- - 4-4-4-
АНЦА - - - - - - 4-4-4- -
Ревматоидный фактор 4-4- 4- 4- 4- 4-4-4- 4-4-4- 4- -
Примеры аутоантител
1. Анти-ДНК антитела: 2. Анти-ДНК антитела:
наличие ободка (х 150 раз) гомогенное окрашивание
(х435 раз)
3. Ядрышки
(напр., фибрилларин)
4. Крупные крапинки (U1RNP/SM)
5. Мелкие крапинки (Ro/La)
6. Антицентромерные антитела
7. PM-Scl
8. Антитела против митотического веретена
9. Антитела против койлина
10. Анти-PNCA антитела
11. Антимитохондриальные антитела
12. Анти-Jo-I антитела
А. Характер аутоантител
Заболевания соединительной ткани и васкулиты
Системная красная волчанка (СКВ) является хроническим интермиттирующим аутоиммунным воспалительным заболеванием, поражающим многие органы и характеризующимся наличием антиядерных антител. Женщины болеют в десять раз чаще мужчин. Начало заболевания приходится на возраст от 10 до 30 лет. Как и для других воспалительных ревматоидных заболеваний, Американская коллегия ревматологов (АКР) разработала критерии, необходимые для диагностирования СКВ (см. таблицу 5 в приложении)
А. Клинические проявления СКВ
Клиническая картина СКВ может сильно меняться в зависимости от типа пораженного органа. У 70% пациентов на ранних этапах заболевания наблюдаются кожные проявления. Другим общим признаком является характерная сыпь на скулах в форме бабочки (50% пациентов), а также дискоидное поражение кожи (20%). Также распространены случаи васкулита. Большинство больных СКВ страдают от суставной боли, однако серьезная деформация суставов происходит редко (артрит Жакку, см. фото). Этот тип деформирующего артрита обычно сопровождается подвывихами без повреждений кости. Угрожающими жизни пациента осложнениями СКВ являются поражения почек (волчаночный нефрит), ЦНС (эпилепсия или инсульт со вторичным ан-тифосфолипидным синдромом), а также плевроперикардит. Общие симптомы, такие как лихорадка и утомляемость, наблюдаются при обострении заболевания.
Иммунологическая диагностика. Определение антиядерных антител имеет важное значение, поскольку их наличие говорит о поражении органов. Наличие антител против двунитевой ДНК является патогномоничным признаком.
Методы лечения СКВ выбирают в зависимости от тяжести состояния и от того, какие органы и в какой степени поражены. При вялотекущей форме заболевания может быть достаточно назначения низких доз глюкокортикоидов и противомалярийных препаратов. Эти препараты особенно эффективны в борьбе с кожными проявлениями заболевания, они также снижают частоту приступов. Острые состояния требуют назначения высоких доз стероидной болюсной терапии. Внутривенное введение циклофосфамида показано при тяжелых симптомах повреждения органов, таких как диффузный гломерулонефрит, и при нейропсихиатрических симптомах Азатиоприн показан при состояниях средней тяжести, вызванных поражением органов, или по
сле проведния курса лечения циклофосфамидом. В настоящее время ведется разработка и испытание методов лечения, основанных на использовании моноклональных антител (например, анти-004) и аутологичной трансплантации стволовых клеток (см. с. 169, Б).
Критерии АКР для диагноза СКВ
Высыпания в скуловой области
Дискоидная сыпь
Повышенная светочувствительность
Изъязвления ротовой полости
Артрит
Серозит
Нарушения работы почек
Неврологические нарушения
Гематологические нарушения
Иммунологические нарушения
Антиядерные антитела
Наличие у пациента четырех или более
из одиннадцати перечисленных критериев одновременно или их возникновение последовательно в ходе наблюдения является основанием для диагноза СКВ.
Клинические проявления СКВ
Скуловая сыпь в форме крыльев бабочки (50%)
Дискоидное поражение кожи (20%)
(50%)
Общие симптомы: лихорадка, утомляемость (80%)
А. Клинические проявления системной красной волчанки (СКВ)
Заболевания соединительной ткани и васкулиты
Теории патогенеза СКВ различаются так же сильно, как и клинические проявления самого заболевания. Основным клиническим показателем служит появление многочисленных аутоантител, связанных с аутоиммунными клеточными нарушениями.
А. Патогенез системной красной волчанки
Механизмы, способствующие развитию болезни, в первую очередь проявляются в повреждении тканей. Причиной заболевания считают вирусные инфекции, но определенную роль может играть и ультрафиолетовое излучение. Цитокины (ФНО-а), выделяющиеся при повреждении тканей, приводят к аномальной экспрессии аутоантигенов на клеточной поверхности В результате ядерные антигены (например, антиген Ro) достигают поверхности клеток, таких как керати-ноциты. Апоптозные клетки, подвергшиеся какому-либо пагубному воздействию, выделяют апоптотиче-ские пузырьки, часто содержащие антигены из ядра или цитоплазмы. Далее срабатывает механизм презентации аутоантигенов Т-хелперным клеткам. По всей видимости, важную роль в этом процессе играют нарушения регуляторного механизма и как следствие — отсутствие периферической толерантности. В результате помощи В-клеткам они становятся способными представлять антигены аутореактивным Т-клеткам. В связи с этим происходит активация иммунного ответа в соответствии с механизмом «распространения эпитопов».1
В процессе поликлональной В-клеточной активации происходит синтез аутоантител против гемопоэтических клеток. Наиболее важными клиническими последствиями этого процесса являются лейкопения и тромбопения. Аутоантитела против фосфолипидов и р2-гликопротеина-1 обнаруживаются при вторичном антифосфолипидном синдроме, осложнениями которого могут быть тромбоз, выкидыш и инсульт.
Еще одним важным механизмом патогенеза является образование иммунных комплексов, в состав которых входят субклеточные антигены, особенно комплексы нативной двунитевой ДНК и анти-ДНК антител. В данном случае число образующихся иммунных комплексов слишком велико, чтобы эффективно захватываться в процессе фагоцитоза и уничтожаться системой фагоцитирующих мононуклеаров (СФМ).
Иммунные комплексы накапливаются в стенках сосудов, постепенно приводя к развитию васкулита. Вме
сте с активацией комплемента, агрегацией тромбоцитов и активацией лейкоцитов это приводит к закупорке сосудов и повреждениям органов. Накопление иммунных комплексов в различных отделах почечных клубочков (мезангиальном, субэндотелиальном, субэпителиальном) способствует развитию различных типов волчаночного нефрита (см. также с. 232).
1 Под распространением эпитопов понимают развитие иммунного ответа на эпитопы, отличные от доминантных. Антиген-специфический аутоиммунный ответ может распространяться на вторичные (часто скрытые) эпитопы на тех же молекулах или доминантные эпитопы на соседних молекулах. — Прим, перев.
Патогенез СКВ
Повреждение ткани
Цитокины, ФНО-а
Вредное воздействие: вирусы, УФ
Гистоны Антиген Sm
ДНК nRNP
Ядрышки La (SS-B)
Ro (SS-A) I
Ядерные антигены
Аутоантитела Jfi <3\
против
фосфолипидов
Тромбоз, Крове-
выкидыш. носный
инсульт сосуд
Апоптоз Аномальная
экспрессия аутоантигенов
Апоптозные
пузырьки
( Нуклеосомы J
Нити Ro (SS-A)
цитоскелета
Белок клеточной мембраны
Цитоплазматические антигены
Антитела против клеток м ц м Тромбо-пения Лейко-
Анемия пения
Поликлональная
В-клеточная активация
Фагоцитоз
предрасположенность
Нарушение регуляции
Помощь В-клеткам
Распространение эпитопа
Клиническая иммунология
Тканевое повреждение: высвобождение аутоантигенов
Антитела против субклеточных антигенов (ДНК, ЯМРидр.)
Иммунные комплексы
Отложение мелких иммунных комплексов
Крупные — иммунные комплексы
Эндотелиальные клетки
Эпителиальная клетка
Рецептор комплемента
Fc-рецептор
Агрегация
тромбоцитов
Перегрузка СФМ
Высвобождение ферментов
Фрагменты комплемента (анафила-токсины)
Гранулоцит
комплексы
Отложения в почках
ГБМ
Васкулит
Иммунные комплексы и гломерулонефрит
А. Патогенез системной красной волчанки
Заболевания соединительной ткани и васкулиты
А. Склеродермия
Склеродермия, или прогрессирующий системный склероз (ПСС), характеризуется фиброзом соединительной ткани с вовлечением кожи, сосудов, легких, плевры, миокарда, перикарда, пищевода и тонкой кишки. Причины этого мультисистемного заболевания неизвестны.
1. В пораженных тканях обнаруживают много CD4+ Т-клеток, образующих ИЛ-1 и ИЛ-2, которые дают фибробластам сигнал запуска синтеза коллагена. Усиленное отложение коллагена в межклеточном пространстве приводит к склерозу соединительной ткани. Отложения коллагена в сосудах повреждают эндотелий и способствуют закупорке сосудов из-за разрастания интимы. Это в конечном итоге приводит к уплотнению и отвердению кожи, нарушению функций внутренних органов и инфарктам, связанным с облитерацией сосуда
2. Ранним симптомом склеродермии является синдром Рейно — нарушение циркуляции крови, поражающее дистальные участки конечностей. Этот синдром может возникнуть за несколько лет до появления других симптомов. На более поздних стадиях болезни возникает безболезненная отечность пальцев рук (пальцы-сосиски), а затем происходит постепенное развитие склеродактилии (пальцы Мадонны) с акроостеолизом. При нарушении циркуляции может происходить изъязвление кончиков пальцев («крысиный укус»). Характерными чертами лица больных склеродермией является маленький рот (микростомия) и клювовидный нос. Часто встречаются случаи телеангиэктазии с поражением кожи и слизистой У 40% больных склеродермией наступает фиброз миокарда и двусторонний легочный фиброз. В сыворотке крови пациентов кроме типичных аутоантител обнаруживают два признака воспаления: повышенные показатели С-реактивного белка и СОЗ. Основным иммунологическим тестом является определение антицентромерных антител или антител против топоизомеразы I (анти-Эс1-70 антитела). Антиядерные антитела различной специфичности также иногда обнаруживаются, а вот антитела против двунитевой ДНК и антитела к антигену Смита (Sm-антитела) отсутствуют.
3. CREST-синдром (по первым буквам характерных симптомов: кальциноз (С), синдром Рейно (R), нарушение подвижности пищевода (Е), склеродакти-лия (S), телеангиэктазия (Т)) — это прежнее название лимитированной склеродермии. У 70% пациентов с этим синдромом обнаруживают антицентромерные антитела. Данное состояние часто сопровождается первичным билиарным циррозом (ПБЦ).
К иммуносупрессорной терапии стероидами или терапевтическими препаратами добавляется также симптоматическое лечение. При нарушении кровообращения, связанном с синдромом Рейно, используют антагонисты кальция, а при изъявлениях кожи показаны вливания простагландинов. В случае ангиопатии эффективным оказалось назначение простациклинов
Б. Смешанная
соединительнотканная болезнь
Смешанная соединительнотканная болезнь (ССТБ) характеризуется наличием симптомов различных заболеваний соединительной ткани (СКВ, склеродермии, ревматоидного артрита, полимиозита, дерматомиозита, синдрома Шегрена). Первым проявлением обычно бывает болезнь Рейно. К другим признакам ССТБ относятся (в порядке снижения частоты встречаемости): склеродактилия и отечность рук, полиартралгия, легочные симптомы, нарушение подвижности пищевода, миозит и кожные проявления. Типичным проявлением болезни является высокий титр аутоантител против рибонуклеазы Р (U1-RNP) Часто обнаруживаются антиядерные антитела и ревматоидные факторы, а аутоантитела против двунитевой ДНК, Scl-70, Sm, Ro, La и PM встречаются реже. Методы лечения ССТБ такие же, как для склеродермии и СКВ. Выбор терапевтического метода в каждом конкретном случае определяется характером и тяжестью основных симптомов.
Склеродермия и смешанная соединительнотканная болезнь
Активация
Синтез коллаген»
Склероз соединительной ткани
1. Патогенез
Активация фибробластов
Пролиферация интимы сосуда
Системный склероз соединительной ткани
Микростомия
уздечка языка
Фиброз -миокарда
Нарушение моторики пищевода
Интерстициальный легочный фиброз
Мальабсорбция, нарушение моторики
Против центромеры $ (CREST) АЯА
Против топоизомеразы I
2. Симптомы
Склеродактилия
Синдром Рейно
Телеангиэктазия
Склеродактилия
Кальциноз
Нарушение моторики пищевода
Антицентромерные АЬ
Связь с ПБЦ
3. Синдром CREST
А. Склеродермия
Закупорка кровеносных сосудов
Ранки на кончиках пальцев
Закупорка коронарных артерий
Инфаркт почки
СКВ
Поли- | миозит
Дерматомиозит
Склеродермия
ССТБ
Синдром Шегрена/РА
Болезнь Рейно
Отечность РУК, склеродактилия
Нарушение моторики пищевода
Поражение легких
Кожные проявления
Полиартралгия, полиартрит
Б. Смешанная соединительнотканная болезнь
Заболевания соединительной ткани и васкулиты
А. Клинические признаки синдрома Шегрена
Различают первичный и вторичный синдром Шегрена. Первичная форма представляет собой аутоиммунное заболевание экзокринных желез с вовлечением вне-железистых областей. Вторичная форма сопровождается проявлениями других аутоиммунных заболеваний, таких как ревматоидный артрит (50-60% случаев), болезни соединительной ткани (СКВ, склеродермия, полимиозит), васкулиты (узелковый полиартериит) и(или) первичный билиарный цирроз (50% случаев), зоб Хашимото и хронический активный гепатит. Синдром Шегрена является очень распространенным ревматическим воспалительным заболеванием, уступая по числу случаев только ревматоидному артриту. Женщины страдают от этой болезни в девять раз чаще мужчин. Болезнь обычно диагностируют у людей старше 40 лет. Наиболее частыми симптомами синдрома Шегрена являются сухость глаз (ксерофтальмия) и ротовой полости (ксеростомия). Причиной этих симптомов сухости является воспаление слюнных и слезных желез, за которым следует инфильтрация лимфоцитами и разрушение ткани желез. Полиартралгия (неэрозивный артрит), миалгия, синдром Рейно и лимфаденопатия являются внежелезистыми проявлениями синдрома Шегрена. Осложнения в области легких (интерстициальная пневмония), почек (интерстициальный нефрит, почечный канальцевый ацидоз) и печени (ПБЦ) встречаются редко.
Б. Патогенез
В развитии синдрома Шегрена, связанного с наличием антигенов HLA DR3, DQ1 и DQ2, задействован целый ряд факторов. Тот факт, что синдром поражает главным образом женщин, указывает на некоторую роль эстрогенов. Непосредственной причиной поражения желез считают вирусную инфекцию. Эпителиальные клетки в инфицированных железах осуществляют презентацию вирусных антигенов. Это привлекает Т-клет-ки, инфильтрующие ткани желез и вызывающие воспаление, которое в конечном итоге приводит к поражению тканей. Т-клетки активируют эпителий желез и, что более важно, В-клетки. Последнее событие приводит к активному, неконтролируемому росту В-клеток, проявляющемуся сначала как гипергаммагло-булинемия в сочетании с образованием иммунных комплексов. Анализ крови может выявить повышенный уровень С-реактивного белка и СОЭ, наличие антиядерных антител, ревматоидных факторов и аутоантител против антигена Ro (SS-A) и антигена La (SS-B). Поскольку данные аутоантитела обнаруживаются и при других аутоиммунных заболеваниях, то их диагностическая ценность невысока. В 10-15% случаев силь
ная поликлональная активация В-клеток в конечном итоге перерастает в неходжкинскую лимфому
В. Диагностика
Кроме перечисленных гематологических проявлений существуют другие патологические изменения, которые можно использовать для диагностических целей. Можно назвать тест Ширмера для определения уровня секреции слезной жидкости (определяют степень намокания полоски бумаги, помещенной на нижнее веко), тест Саксона на уровень саливации (пациента заставляют жевать промокательную бумагу), сиалографию, сцинтиграфию слюнных желез для визуализации протока (разрежение ткани железы и сужение просвета), а также биопсию губ для гистологического анализа (например, для обнаружения лимфоцитарной инфильтрации перидуктальной ткани). При постановке диагноза следует исключить синдром сухости, возникающий при амилоидозе и СПИДе, а также возможное влияние некоторых лекарственных препаратов (например, антидепрессантов).
Лечение
В начале развития заболевания используют симптоматическое лечение, ограниченное местным введением искусственной слезной (метилцеллюлоза) и слюнной жидкости. При умеренном поражении суставов применяют нестероидные противовоспалительные препараты и кортизон. Тяжелые внежелезистые проявления требуют назначения азатиоприна.
Синдром Шегрена
С поражением желез
Внежелезистые проявления
Артрит без эрозий
Ревматоидный артрит
1. Симптомы
Интерстициальная пневмония
Синдром Рейно
Поражение печени
Интерстициальный нефрит
Коллагеноз (СКВ, склеродермия)
Вторичный синдром Шегрена
Васкулит (узелковый полиартериит)
Первичный билиарный цирроз(ПБЦ)
Хронический активный
% Аутоиммунный тиреоидит
гепатит
А. Клинические признаки синдрома Шегрена
2. Вторичный синдром Шегрена
I
Вирусные антигены
В-клеточная
Лимфоцитарная активация инфильтрация
I
Сужение просвета _
Снижение
Разрежение активности ткани железы
1. Экзокринные железы Б. Патогенез
Эндогенные факторы
HLADR3, DQ1/DQ2
Экзогенные факторы Вирусы (герпес, ретровирусы)
Ткань железы
ИЛ-2
Симптомы сухости
2. Возможные механизмы патогенеза
Поликлональная активация В-клеток в экзокринных железах
3. Развитие лимфомы
. ИЛ-1>
мп - Активация
v J ’ Дэпителиальныхде
\* клеток ^*/у-ИНФ
Поли-, олиго- и моноклональная активация В-клеток при системных проявлениях
Сиалография
В. Диагностика
Поликлональная
В-клеточная активация
Внежелезистые ____ __
проявления •
Аутоантитела
Моноклональная активация В-клеток
Лимфома
АЯА, РФ: анти-Ro, анти-La антитела
Клиническая иммунология
201
Заболевания соединительной ткани и васкулиты
А. Полимиозит, дерматомиозит, миозит с включениями
Клинические проявления различных форм миозита очень разнообразны. Диагностические критерии приведены на рис. А4 Полимиозит (рис. А1) характеризуется слабостью проксимальных мышц, особенно плеч и бедер. Пациентам бывает трудно вставать со стула и подниматься по лестнице. Дерматомиозит (рис. А2) кроме того характеризуется кожными проявлениями, особенно в открытых для попадания света областях тела. Одно из наиболее частых проявлений — гелио-тропная сыпь (рис. А5). Характерные папулезные высыпания наблюдаются на костяшках пальцев (папулы Готтрона, рис. А6) У пациентов с дерматомиозитом старше 50 лет болезнь часто сопровождается наличием опухолевого заболевания. В связи с этим необходимо обследование по поводу наличия рака, особенно молочной железы, легкого и желудочно-кишечного тракта. Присутствие аутоантител не характерно; иногда определяют низкий титр антиядерных антител Стандартный анализ крови выявляет высокую концентрацию креатинкиназы (КК) и миоглобулина. Недавно было продемонстрировано наличие при данном заболевании антипротеасомных антител.
Антисинтетазный синдром (рис А2) представляет собой независимую форму заболевания, характеризующуюся наличием анти-Jo-l антител, направленных против гистидил-тРНК-синтетазы. Типичными клиническими проявлениями заболевания являются интерстициальная болезнь легких (ИБП), артрит, болезнь Рейно, кожные проявления, лихорадка и мышечная слабость.
Миозит с включениями (рис. АЗ) — это еще одна независимая форма болезни. В отличие от вышеупомянутых заболеваний в данном случае возможно поражение дистальных мышц. Характерных лабораторных признаков для диагностики этого заболевания не существует.
Б. Гистология при воспалительных миопатиях
Гистологические картины полимиозита и дерматомиозита сильно различаются. При полимиозите CD8 ’ Т-клетки напрямую инфильтруют отдельные клетки в мышечном волокне (см также рис. А7) Напротив, дерматомиозит характеризуется наличием васкулита и воспаления периваскулярной области, вызванных действием CD4+ Т-клеток В данном случае гибель миоцитов является вторичным событием при повреждении сосудов.
В. Патогенез
Патогенез полимиозита и дерматомиозита, как и их гистологические картины, сильно различаются. В развитии полимиозита важную роль играют механизмы с участием молекул МНС класса I. При полимиозите происходит аномальная экспрессия антигенов HLA класса I на поверхности мышечных клеток, которые в норме не экспрессируют молекул HLA (в организме существует небольшое число и других HLA-негатив-ных клеток). Эта аномальная экспрессия является следствием генетической предрасположенности или результатом действия неизвестного фактора (вирусного заболевания?) Цитотоксические клетки воспринимают такие измененные миоциты как чужеродные и разрушают их. Данный процесс является гистологическим механизмом упоминавшейся выше гибели клеток в мышцах. Полагают, что в основе развития миозита с включениями лежат те же патогенетические процессы. Механизм возникновения амилоидсодержащих клеточных включений при данном заболевании до сих пор не изучен.
При дерматомиозите воспаление возникает в сосудах прослойки перимизия. Следовательно, центральным событием в патогенезе заболевания является повреждение кровеносных сосудов. Происходящая в результате этого ишемия тканей приводит к гибели мышечных клеток, что обычно сопряжено с вовлечением перифасцикулярных пространств
Миозиты
1. Полимиозит/ дерматомиозит
2. Антисинтетазный синдром
Гелиотропная сыпь -
Опухоли (дерматомиозит)
Миозит с включениями
Лаб. показатели: неспецифические
Интерстициальная болезнь легких
Поражение дистальных мышц
Артрит, болезнь Рейно, растрескивание кожи кистей рук («руки механика»)
Слабость проксимальных мышц -----\
Лаб. показатели АЯА+, анти-протеасомные Ab+, KKftt , миоглобин!^
5. Гелиотропная сыпь
Температура Лаб. показатели:
Jo-1+
।
1
а) Типичные клинические показатели
б) Повышение активности креатинкиназы
в) Электронные микрофотографии: полифункциональные изменения
г) Результаты биопсии
д) Наличие характерных АЬ
4. Диагностические критерии
6. Паппулы Готтрона
7. Гистология полимиозита
А. Полимиозит, дерматомиозит, миозит с включениями
Т-клеточная
инфильтрация (CD8+)।
ПМ/ИБЛ
Мышечные клетки Кровеносный /— сосуд
Перимизий
Т-клеточная инфильтрация (CD4+)
У— Закупорка кровеносных сосудов
Некроз
Дермато- периваскулярных миозит мышечных волокон
Б. Гистология миозита
Клиническая иммунология
1. ПМ/ИБЛ
2. Дерматомиозит
В. Патогенез
203
Заболевания соединительной ткани и васкулиты
Клиническая иммунология
А. Классификация
системных васкулитов, принятая в Чепел Хилл
С патологической точки зрания васкулит представляет собой воспалительную инфильтрацию и некроз стенки кровеносного сосуда. Клинические симптомы заболевания сильно различаются в зависимости от локализации и степени поражения сосуда. В результате диагностика васкулита довольно сложна. Существует несколько классификаций типов данного заболевания, однако с клинической точки зрения полезной оказалась классификация, основанная на размере поврежденного сосуда. Эта классификация носит название местности, где проходила конференция, на которой она была принята — Чепел Хилл (см. Таблицу 6 в Приложении).
Б. Классификация васкулитов на основании механизма развития заболевания
В основе альтернативной системы классификации васкулитов лежит механизм развития заболевания, т.е. тип аутоантител, приведший к разрушению сосуда (васкулиты, связанные с антинейтрофильными цитоплазматическими антителами (АНЦА) и с антителами против эндотелиальных клеток (ЗК), см. с. 207). В патогенезе многих воспалительных заболеваний сосудов лежит образование циркулирующих иммунных комплексов. В зависимости от их состава, т.е. от типа и размера чужеродных антигенов или аутоантигенов и соответствующих антител, эти иммунные комплексы активируют различные механизмы воспалительного процесса в эндотелии (например, активация комплемента, моноцитов, лимфоцитов и тромбоцитов; образование цитокинов; хемотаксис гранулоцитов). В результате гистологическая картина демонстрирует инфильтрацию стенки сосуда и периваскулярной зоны, а также фибриноидный некроз стенки сосуда.
Симптомы васкулита могут проявляться практически при любом инфекционном заболевании и особенно характерны при заболеваниях, вызванных следующими патогенами: Streptococcus, Salmonella, Mycobacterium, Spirochaetales, вирус гепатита В, ВИЧ, вирус Эпштейна-Барр, Aspergillus, Leishmania и Filaria. При злокачественных заболеваниях (болезни Ходжкина и волосатоклеточном лейкозе) в первую очередь опасность представляют те патогены, которые поражают лимфоретикулярную систему. Потенциальной причиной заболеваний может быть использование многочисленных лекарственных препаратов, таких как антибиотики, изониазид, золото, D-пенициламин, иодид калия и бисульфан.
Классификация Чепел Хилл для системных васкулитов Васкулиты, затрагивающие крупные сосуды
• Гигантоклеточный (височный) артериит
• Артериит Такаясу
Васкулиты, затрагивающие сосуды среднего размера
• Узелковый полиартериит
• Болезнь Кавасаки
Васкулиты, затрагивающие мелкие сосуды
• Г ранулематоз Вегенера
• Синдром Чарга-Стросса
• Микроскопический полиангиит
• Пурпура Шенлейна-Геноха
• Эссенциальный криоглобулинемический васкулит
• Кожный лейкоцитокластический ангиит
204
Общая классификация васкулитов
Венулы
Вены
Пурпура Шенлейна-Геноха и эссенциальная криоглобулинемия
Микроскопический полиангиит
Гранулематоз Вегенера и синдром Чарга-Стросса
Капилляры
Артериолы
1Х Мелкие артерии
Крупные r г
и средние артерии
Аорта
Узелковый полиартериит и болезнь Кавасаки
Гигантоклеточный (височный) артериит и артериит Такаясу
А. Классификация системных васкулитов, принятая в Чепел Хилл
Иммунные:
с отсутствием иммунных реактантов («малоиммунные»), связанные с наличием аутоантител
АНЦА: Гранулематоз Вегенера, микроскопический полиангиит; антитела против эндотелиальных клеток (АЕСА): болезнь Кавасаки
Иммунокомплексные васкулиты:
индукция аутоантигенов (СКВ)
Связанные с инфекцией:
гепатит В (классический узелковый полиартериит), гепатит С
Гранулематозные васкулиты: гигантоклеточный (височный артериит и артериит Такаясу)
С инфекционной природой:
вирусы (ЦМВ), риккетсии, спирохеты
С опухолевой природой:
криоглобулинемия, лимфоматоидный гранулематоз, волосато клеточный лейкоз
Б. Классификация васкулитов на основании механизма развития заболевания
Заболевания соединительной ткани и васкулиты
А. Теория развития васкулита
на примере гранулематоза Вегенера
Основным медиатором в патогенезе гранулематоза Вегенера является протеиназа 3 (ПРЗ) — специфический антиген для антинейтрофильных цитоплазматических антител (ц-АНЦА). Протеиназа 3 в азуро-фильных гранулах не доступна для антител в случае покоящихся полиморфноядерных нейтрофильных гранулоцитов (ПМЯЛ) (рис. А1). Активация провоспали-тельными цитокинами приводит к образованию молекул адгезии на ПМЯЛ и эндотелиальных клетках (ЭК) и к перемещению цитоплазматической ПРЗ на клеточную мембрану (рис. А2) Затем происходит адгезия ПМЯЛ к эндотелиальным клеткам (рис. АЗ). ПМЯЛ активируются и начинается их дегрануляция, индуцированная связыванием АНЦА с мембраносвязанной ПРЗ. Находясь в непосредственной близости от эндотелиальных клеток, ПМЯЛ выделяют токсические медиаторы и лизосомальные белки, недоступные для ингибитора а-протеиназы. Это приводит к лизису эндотелиальных клеток и некротическому васкулиту (рис. А4)
Б. Гранулематоз Вегенера
Данное заболевание обычно затрагивает верхние и нижние дыхательные пути и почки, но дополнительные симптомы васкулита могут проявляться и в других органах. В большинстве случаев на начальном этапе болезнь проявляется как хроническое воспаление верхних дыхательных путей в сочетании с изъявлением слизистой, гнойным ринитом, синуситом или воспалением среднего уха, а также прогрессирующим разрушением и деформацией хрящевой части носовой перегородки. К легочным проявлениям относятся эрозии трахеобронхиальной области, пневмония и гранулемы, способные претерпевать кавернозную трансформацию Основными клиническими признаками болезни являются кашель и гемофтиз, а к системным проявлениям относятся лихорадочные состояния и уменьшение массы тела. В стадии генерализации часто наблюдается нарушение работы почек (протеинурия, гематурия, прогрессирующая почечная недостаточность), а также артралгия, пурпура, изъязвление кожных покровов и эписклерит. Реже поражаются сердце, периферические нервы и желудочно-кишечный тракт. Наличие сывороточных антител против протеиназы 3 (ц-АНЦА) является довольно специфическим показателем.
В. Синдром Чарга-Стросса
Синдром Чарга-Стросса представляет собой воспаление сосудов, в основе которого лежит аллергический диатез (перенесенные пациентом аллергический ри
нит, бронхиальная астма, хронический синусит или лекарственная аллергия). При постановке диагноза у больных часто наблюдается транзиторная эозинофильная легочная инфильтрация. При развитии заболевания проявляются симптомы, аналогичные тем, что встречаются при узелковом полиартериите, в сочетании с артралгией, пальпируемой пурпурой, болевыми ощущениями в желудочно-кишечном тракте и гипертензией. Почки поражаются редко. Основной причиной смерти таких больных является сердечная недостаточность, вызванная кардиомиопатией. Анализ крови выявляет неспецифические признаки воспаления и массивную эозинофилию (число клеток более 1500/мм3, что составляет до 80% лейкоцитарной формулы), высокий уровень общего IgE и иногда наличие ревматоидных факторов.
Г. Узелковый полиартериит
Узелковый полиартериит представляет собой некротическое заболевание, поражающее главным образом висцеральные сосуды среднего размера. Клиническая картина обычно включает в себя разнообразные, но неспецифические симптомы: общее недомогание, лихорадка, снижение массы тела и артралгия Вовлечение периферических нервов на ранних этапах заболевания может проявляться в виде множественного мононеврита (боли, парестезия или парез в зоне иннервации пораженных нервов), что связано с васкулитом vasa nervorum. Проявления со стороны центральной нервной системы, такие как апоплексический удар, конвульсии или психоз, наблюдаются реже Почки поражаются очень часто, особенно это проявляется в виде гломерулонефрита в сочетании с протеинурией и гематурией. Данное состояние может быстро перерастать в почечную недостаточность. У 50% пациентов детектируется антиген HBs.
Иммунный васкулит и узелковый полиартериит
Ау.АНЦА
। LFA~T| | LFA-1 |
а^антитрипсин
Комплекс
ПРЗ/АНЦА
ПРЗ-сс-]-антитрипсин
||САМ-1]
||САМ-11
Эндотелиальные клетки (ЭК)
1. Покоящиеся ПМЯЛ и ЭК
2. Преактивированные 3. Адгезия ПМЯЛ к ЭК 4. Активация ПМЯЛ ПМЯЛ и ЭК под действием АНЦА
А. Теория развития васкулита на примере гранулематоза Вегенера
О
° § , о о ц-АНЦА
Поражение буль барного отдела Отит
Синусит
Отек околоушных желез
Легочная инфильтрация Гранулемы ЦНС Эписклерит Ринит, язвы Подглоточный стеноз Трахеобронхиальный стеноз Гломерулонефрит Миалгия/миозит Артралгия Лейкоцитокластический васкулит Полинейропатия
Синусит
Аллергический ринит
Легочная инфильтрация
Астма
Кардит
Эозинофильный гастроэнтерит
Интерстициальный нефрит
Миалгия
Артралгия
Пурпура
Полинейропатия
Узелковые образования на коже
О
Диастолическое АД >90
Энцефаломаляция
Коронарная недостаточность
Язвы желудка и кишечника
1. Клинические черты
Б. Гранулематоз Вегенера
IgE
Эозинофилия
Некроз кожи
О О HBsAg
Тестикулярные боли
Мраморная кожа
Миалгия
Артралгия
Болезненные кожные узелки
Полинейропатия
В. Синдром Чарга-Стросса
Г. Узелковый полиартериит
Клиническая иммунология
207
Заболевания соединительной ткани и васкулиты
Выделяют два типа гигантоклеточного артериита: артериит Такаясу, поражающий аорту и ее ветви, и височный артериит, затрагивающий крупные артерии головы. Гистологическая картина обоих заболеваний выявляет массивное утолщение стенок артерий или выраженный артериальный стеноз (рис. А6), а также наличие гигантских полиядерных клеток (рис. А4) Патогенез болезни до сих пор обсуждается. В качестве основных гипотез выдвигается генетическая предрасположенность (HLA-DR4) и иммунные механизмы, опосредованные Т-хелперами и приводящие к образованию гранулемы, возможно запускаемые неизвестной инфекцией.
А. Гигантоклеточный артериит:
височный артериит и артериит Такаясу
Височный артериит, иначе называемый краниальным артериитом или болезнью Хортона, представляет собой довольно распространенное заболевание среди людей старше 50 лет (диагностические критерии представлены на рис. АЗ). Женщины болеют в два раза чаще мужчин. При данном типе заболевания в первую очередь поражаются артерии в области головы (височная артерия, артерия сетчатки, краниальные сосуды), но также и сосуды других отделов. Кроме общих симптомов лихорадки, состояния усталости и уменьшения массы тела, при данном заболевании также часты головные боли, гиперестезия в области головы и уплотнение височной артерии, обнаруживаемое при пальпации (рис. А7). Наиболее опасным осложнением является внезапная слепота, вызванная окклюзией артерии сетчатки. Такие симптомы как ухудшение зрения, боли в глазах или повышенная светочувствительность требуют внимательного исследования и терапевтического вмешательства. Офтальмоскопия позволяет обнаружить закупорку ветвей артерии сетчатки или папиллярный отек. Редким осложнением заболевания является изъязвление кожи в области скальпа, вызванное нарушением циркуляции (рис. А8).
Приблизительно у 20-30% больных с височным артериитом наблюдаются симптомы ревматической полимиалгии (диагностические критерии представлены на рис. А2). Основными симптомами болезни являются боли в мышцах проксимальных отделов плеч и бедер. Наблюдаются также и общие симптомы, такие как усталость, разбитость, депрессия и субфебрильная температура, обычно носящие выраженный характер.
Основным лабораторным показателем при обоих типах заболевания является очень высокое значение СОЗ, которое может превышать 100 мм/ч. Могут наблюдаться умеренно выраженная анемия и лейкоцитоз. Для постановки диагноза височный артериит тре
буется двусторонняя биопсия протяженного участка височной артерии с серийными гистологическими срезами. В некоторых случаях диагноз можно поставить на основании характерных эхографических изменений, обнаруженных методом допплеровской сонографии. Прогноз при данном заболевании благоприятный, но обычно для достижения долгосрочной ремиссии требуется лечение стероидами на протяжении одного или двух лет.
Артериит Такаясу (иначе называемый синдромом дуги аорты) — это сосудистое заболевание, поражающее главным образом молодых женщин. Васкулит затрагивает грудную аорту и ее ветви. Основные клинические признаки связаны со стенозом сосудов: хромота, отсутствие пульса, сосудистые шумы и(или) гипертензия. В начале воспалительной фазы могут наблюдаться лихорадка, потеря массы тела, миалгия и артралгия. Реже встречаются головные боли, головокружения. нарушения зрения, аортальная недостаточность и аневризма. Лабораторный анализ выявляет сильные изменения неспецифических параметров, свидетельствующих о течении воспалительного процесса. Артериит Такаясу хорошо поддается лечению стероидными препаратами, однако, если на момент постановки диагноза имеют место сильные повреждения сосудов, то прогноз значительно ухудшается (рис. А5).
Гигантоклеточный артериит
о
Головная боль
о
Височный артериит
Изъязвление кожи в области скальпа
Хромота челюсти
Легочный васкулит (редко)
Коронарная недостаточность (редко)
О и а Церебральный инфаркт с вовлечением внечерепных артерий (редко)
Поражения глаз: ухудшение зрения, парез глазных мышц
Двусторонняя (^реактивный полимиалгия
белок! в области таза/плеч
1. Клинические проявления височного артериита/ревматической полимиалгии
Двусторонние боли и(или) тугоподвижность плеч
Болезнь развивается в течение 2-х недель
СОЭ > 40 мм/ч
Тугоподвижность по утрам > 1 ч
«
Пациенты > 65 лет
Депрессия и(или) снижение массы тела
Болезненность при пальпации предплечий (двусторонняя)
2. Критерии для диагностики ревматической полимиалгии
Первые проявления в возрасте > 50 лет
Недавно появившаяся головная боль
Клинические признаки височного артериита: болезненность при пальпации, отсутствие пульса, высокий показатель СОЭ, результаты биопсии артерии
3. Критерии для диагностики височного артериита
Клиническая иммунология
4. Гистология при артериите Такаясу
5. Стеноз аорты и ее ветвей при артериите Такаясу
8. Изъязвления кожи головы
6. Гистология при закупорке 7. Височный артериит
височной артерии
А. Клинические признаки гигантоклеточного артериита: височный артериит и артериит Такаясу
209
Заболевания кожи
Крапивница — это заболевание, сопровождающееся появлением сыпи (волдырей) и отечности кожи, часто с сильным зудом. Сыпь проходит сама собой, не оставляя рубцов.
А. Патогенез
В патогенезе крапивницы ключевую роль играют тучные клетки кожи. После действия стимула тучные клетки выделяют имеющиеся (гистамин, гепарин, ферменты) и вновь синтезированные медиаторы воспаления (простагландины, лейкотриены), вызывающие появление отека Отечность кожи обычно наблюдается на протяжении 24 ч, сопровождается зудом и эритемой. Если сыпь не проходит через сутки, это может говорить о наличии у больного уртикарного васкулита (рис. Б4) — признака аутоиммунного заболевания. После активации и образования гранул тучные клетки остаются рефрактерными на протяжении нескольких часов или дней. Поэтому крапивница не может возникнуть в том же участке до окончания определенного латентного периода.
Б. Причины и типы заболевания
Крапивница может быть вызвана многими стимулами, причем все они приводят к развитию одной и той же клинической картины. Стимулы имеют физическую, иммунологическую или псевдоаллергическую природу. Крапивница также может быть следствием инфекционного заболевания (гепатита или паразитарной инфекции).
1. При физической крапивнице физический стимул приводит к образованию отеков или дегрануляции тучных клеток у пациентов с особенно чувствительной сосудистой системой. Реакция может быть вызвана перепадом давления, теплом, холодом, светом, радиацией, холинергическим стимулом (потение), адренергическим стимулом (стресс) и ак-вагенным стимулом. При контактной крапивнице образующийся отек ограничен участком контакта со стимулом (например, ядовитым плющом, укусом насекомого, ожогом медузы).
2. Острая иммунологическая крапивница представляет собой аллергическую IgE-зависимую реакцию первого типа, которая может вызвать анафилактический шок в течение нескольких минут. Типичными признаками заболевания являются спазм бронхов, отек языка и циркуляторные нарушения. Потенциальными стимулами, способными вызвать данное состояние, являются некоторые лекарства (антибиотики и снотворные), а также некоторые продукты питания.
3. Названные выше случаи заболевания отличаются от псевдоаллергических реакций на некоторые ве
щества (аспирин, консерванты, рентгенконтрастные препараты), которые могут вызывать крапивницу и анафилактоидные реакции без специфического иммунологического ответа.
4. Уртикарный васкулит характеризуется появлением на коже сильно пигментированных полос, не исчезающих за 24 ч. Причиной данного заболевания являются реакции гиперчувствительности типа III в сочетании с образованием иммунных комплексов и расходованием компонентов комплемента. Васкулит способствует высвобождению вазоактивных медиаторов, что и приводит к появлению крапивницы.
5. Пигментная крапивница (мастоцитоз) обычно поражает детей. Болезнь проявляется в виде множественных красно-коричневых пятен на коже, которые при расчесывании превращаются в волдыри. Являющаяся первопричиной заболевания мастоцитома обычно исчезает спонтанно.
В. Диагностика и лечение
О причине заболевания обычно можно узнать из истории болезни пациента. Следует также учесть возможную роль механических факторов (рис. Б1) и прием лекарственных средств. В установлении причины заболевания может помочь дневник пациента. У пациентов с хронической крапивницей следует учесть возможность первичного заболевания инфекционной или аутоиммунной природы. При лечении крапивницы прежде всего необходимо избегать воздействия вызвавшего ее стимула Для блокировки локального действия гистамина можно использовать сочетание антагонистов Н1 и Н2.
Крапивница
А. Патогенез
Б. Причины заболевания и его проявления
Клиническая иммунология
211
Заболевания кожи
Контактный дерматит представляет собой воспалительное заболевание кожи, вызванное непосредственным контактом с вредным веществом (ядом).
А. Классификация
Острый токсический дерматит является формой дерматита, возникающей после повреждения кожи, вызванного вредным воздействием, например, солнечным ожогом. Повторное воздействие даже слабых раздражителей (многократное мытье и дезинфециро-вание рук) может привести к кумулятивному повреждению кожи (кумулятивный токсический дерматит).
В отличие от этих форм дерматита, аллергический контактный дерматит не связан с действием ядовитого или вредного вещества Он вызван контактом с нетоксичным веществом, индуцирущим иммунологические реакции в местах контакта, что приводит к воспалению. Далее мы остановимся на описании аллергической контактной экземы (аллергического контактного дерматита).
Б. Контактные аллергены
Типичными источниками возникновения аллергического контактного дерматита являются примеси солей хрома в кожаных изделиях и никеля в одежде и ювелирных изделиях. Отеки эпидермиса возникают в местах контакта в результате разрыва межклеточных мостиков. Кроме того, происходит миграция в эпидермис лимфоцитов. Медиаторы воспаления приводят к вазодилатации сосудов дермиса и образованию отека.
Молекулы, инициирующие возникновение экземы, обычно имеют небольшой размер и действуют как гаптены, т.е. не могут самостоятельно вызвать иммунный ответ. Они должны образовать ковалентную связь с белками эпидермиса или внедриться в мембрану клетки. Такой гаптен-белковый комплекс обладает всей эффективностью антигена Небольшие молекулы могут также находиться в эпидермисе в виде «прогаптенов»; при воздействии света они способны превращаться в активные гаптены (фотоаллергический контактный дерматит).
В. Патогенез
В процессе сенсибилизации ключевую роль играют клетки Лангерганса, находящиеся в эпидермисе (рис. а) В экспериментах на животных было показано, что при удалении этих клеток из кожи сенсибилизации не происходит, и развивается толерантность к антигену. Клетки Лангерганса, действующие в качестве антигенпрезентирующих клеток, захватывают, процессируют и представляют аллерген Т-клеткам в лимфатическом узле. Сенсибилизированные Т-клетки привлекаются цитокинами, выделяемыми клетками Лангерганса и ке-
ратиноцитами, и инфильтруют поврежденный участок кожи.
Причиной внезапного начала аллергического контактного дерматита является повторное воздействие аллергического стимула (после сенсибилизации) (рис. б). Цитокины, образованные кератиноцитами, особенно ФНО-а и ИЛ-1, а также хемокины инициируют воспалительный ответ в эпидермисе. Сенсибилизированные Т-клетки и макрофаги мигрируют из дермальных кровеносных сосудов, эндотелий которых экспрессирует молекулы адгезии при стимуляции цитокинами Клетки Лангерганса, несущие особенно большое число комплексов, состоящих из поверхностных пептидов и молекул МНС, сенсибилизируют дополнительные Т-клетки, которые в свою очередь выделяют цитокины, способствуя тем самым накоплению воспалительных клеток в эпидермисе. В результате наблюдается клиническая картина аллергического контактного дерматита. Наиболее эффективным методом лечения данного заболевания является полное исключение контакта с аллергическим стимулом. Гипосенсибилизация не дает хорошего результата.
Контактные аллергии
Токсическое воздействие
УШ1М
Острый токсический дерматит: вызван сильным однократным воздействием (напр., солнечный ожог)
Кумулятивный токсический дерматит: вызван слабым повторяющимся воздействием (напр, многократное мытье и дезинфецированше рук)
Аллергический контактный дерматит:
не связан с токсическим воздействием;
сенсибилизация вызывает аллергическую реакцию IV типа (напр., реакция на никель)
А. Причины дерматита
Uv# Никель
Кожа (хроматы)
□ Краска
[ \ для волос
<j с р-фенилен-
'—' диамином
\ \ Антибиотики, \ \ неомицин
Б. Контактные аллергены
Вазодилатация и отек дермы
Сенси-билиза ция
а) Сенсибилизация
б) Возникновение экземы
В. Патогенез
Заболевания кожи
А. Атопический дерматит
Атопический дерматит (нейродерматит) — это хроническое заболевание, выражающееся в появлении зудящих отеков, часто в сочетании с аллергической астмой и аллергическим ринитом. Болезнь носит интермиттирующий характер и поражает главным образом кожу лица, шеи и суставных сгибов Воспаленные поверхности кожи подвергаются воздействию инфекций. Наиболее часто встречается пиодермия, вызванная стрептококком, и герпетическая экзема, вызванная простым вирусом герпеса В возникновении болезни свою роль играют как генетические, так и внешние факторы (пищевые аллергены, раздражения кожи, психогенный фактор). Иммунные механизмы, задействованные в развитии заболевания, до сих пор не изучены. Часто у пациентов обнаруживают высокий уровень IgE и иммунных комплексов, содержащих IgE (рис. А2) Может наблюдаться повышенный уровень экспрессии рецепторов IgE — FceRI и FceRII — на моноцитах и клетках Лангерганса. В иммунной реакции главным образом задействованы клетки типа Тн2. Интерлейкин 4 активирует синтез IgE и частично подавляет ТН1-клеточные реакции, что способствует развитию инфекционного процесса.
Каузальный подход к лечению атопической экземы пока не разработан. Пациентов лечат симптоматически, назначая им кортизон (местно) и препараты на основе дегтя для предотвращения воспаления и снятия зуда.
Б. Лейкоцитокластический васкулит
Лейкоцитокластический васкулит, иначе называемый аллергическим васкулитом или пурпурой Шонлейна-Геноха, представляет собой воспалительное заболевание мелких и средних сосудов кожи. Поражения кожи (кровоизлияния, некротические повреждения, уртикарные и папулезные высыпания) распределены симметрично. главным образом на нижних конечностях В патогенезе заболевания ключевую роль играет образование иммунных комплексов. Накопление иммунных комплексов в стенках сосудов, сопровождающееся активацией комплемента, в конечном итоге приводит к воспалительной реакции. Лихорадка, суставные боли и нарушения работы ЖКТ — это наиболее распространенные общие реакции; изредка встречаются случаи IgA-нефропатии. Для постановки диагноза используют гистологические методы. Легкие случаи поддаются лечению физическими средствами, но при системном заболевании требуется назначение иммуносупрессоров.
Диагноз лейкоцитокластический васкулит основывается на клинических показателях и гистологическом анализе. Для демонстрации отложений иммунных ком
плексов в стенках сосудов можно использовать имму-нофлуоресцентную микроскопию. Практически не представляется возможным идентифицировать антиген, ответственный за образование иммунных комплексов. В связи с этим следует обратить внимание на возможность первичного заболевания, ставшего причиной лейкоцитокластического васкулита (инфекционные, опухолевые, аутоиммунные заболевания, и особенно коллагеновые заболевания сосудов).
Атопический дерматит и лейкоцитокластический васкулит
Генетические факторы
Метаболические нарушения
Иммунологические нарушения
YY ЧЕ,
Иммунные комплексы с IgE
FceRII
на моноцитах
Аллергический ринит
Аллергическая аст/йа
Экзема со стороны сгибающих мышц
Внешние факторы Пища
FceR
Кожные раздражения
Психологические факторы
Частые инфекции
Высвобождение тучных клеток и базофилов!
1. Инициирующие факторы
2. Патогенез
А. Атопический дерматит (нейродерматит)
Изменения в кровеносных сосудах
Б. Лейкоцитокластический васкулит
Заболевания кожи
А. Псориаз
Псориаз (psoriasis vulgaris) — это наследственный дерматоз, характеризующийся образованием хорошо сформированных и очерченных очагов воспаления, покрытых серебристыми чешуйками. Псориаз чаще возникает у людей, в семьях которых уже были случаи заболевания, и связан с наличием HLA-DR7, HLA-Cw6 и HLA-B13.
1. Типы псориаза различают в зависимости от причины возникновения болезни, т.е. нарушений механизмов ороговения (гиперкератоз, паракератоз) и иммунологических механизмов. Т-клетки и гранулоциты мигрируют к участкам псориатических повреждений. Толчком к развитию болезни могут быть как экзогенные (повреждение, ультрафиолетовое излучение, холод), так и эндогенные факторы (инфекция, ВИЧ, лекарственные препараты, алкоголь, гипокальциемия, стресс). Длительность периода обострения и переход болезни в хроническую форму зависят от целого ряда эпидермальных и иммунологических факторов.
2. Псориатические повреждения (бляшки) чаще всего появляются на поверхности конечностей со стороны разгибающих мышц, подвздошно-крестцовой области и волосистой части головы. Сшелушива-ние псориатических бляшек приводит к образованию характерных поверхностных восковых чешуек (а), появлению серебристой кожицы в местах удаления чешуек (б), а при удалении этой кожицы — к образованию конусообразных углублений с точечными кровотечениями (в). Псориатический артрит— это особый вид заболевания, сопровожда ющийся моно- или полиартритом. При данном заболевании наиболее часто поражаются суставы пальцев ног и рук.
Б. Буллезные дерматозы
Обыкновенная (вульгарная) пузырчатка сопровождается образованием волдырей на коже. Болезнь вызвана действием аутоантител, направленных против десмог-леина — молекулы адгезии десмосомы, относящейся к группе кадгеринов. Десмоглеины представляют собой гликопротеины, обеспечивающие гомотипическую межклеточную адгезию в десмосоме Опосредованная антителами активация внеклеточных протеиназ разрушает эти контакты. Межклеточные цементирующие вещества в шиповатом слое (stratum spinosum) разрушаются, а отделившиеся кератиноциты принимают округлую форму (акантолиз). Все это приводит к расслоению эпидермиса с последующим образованием пузырей и эрозией. Сопровождающая этот процесс потеря жидкости, белков и электролитов может стать угрозой для жизни пациента.
Буллезный пемфигоид в основном развивается у пожилых людей. Болезнь характеризуется появлением крупных тугих волдырей, содержащих прозрачную или окрашенную кровью жидкость. В субэпидермальной области происходят разрывы базальной мембраны. Аутоантитела, являющиеся причиной возникновения буллезного пемфигоида, направлены против антигенов базальной мембраны ВР-1 и BP-II, расположенных в гемидесмосомах и lamina lucida базальной мембраны. Образование пузырей происходит при активации комплемента и выделении ферментов гранулоцитами.
Приобретенный буллезный эпидермолиз представляет собой невоспалительное заболевание кожи, возникающее в период полового созревания и характеризующееся образованием субэпидермальных пузырей. Пузыри появляются на коже в области суставов и могут быть последствиями обычной травмы. Болезнь носит хронический характер. Пузыри обычно покрывают кисти рук, ступни и нижнюю часть ног со стороны разгибающей мышцы. После заживления пузырей на их месте остаются рубцы и белые угри (милиум) Образуются аутоантитела, направленные против коллагена типа VII в lamina densa базальной мембраны.
Герпетиформный дерматит [болезнь Дюринга) является хроническим рецидивирующим заболеванием кожи, сопровождающимся очень сильным зудом. Болезнь характеризуется образованием папул и пузырьков и может быть следствием глютенчувствительной энтеропатии. К другим характерным чертам заболевания относятся наличие гранулярных отложений IgA в дермальных папулах и субэпидермальных пузырей. Болезнь связана с наличием антигенов HLA-B8 и HLA-DR3, а также аутоантител к ретикулину и эндомизию.
Псориаз и буллезные дерматозы
Генетическая предрасположенность: HLA-DR7, Cw6, В13
Q Участки возможного проявления симптомов
Нарушение кератинизации;
ИЛ-8, ЛТВ4, ЭФР.ТФР-а; >5 кератиноциты t
Нарушение иммунной регуляции; lgAt, АЯА
ИЛ-8°
Экзогенная
уф |
Латентная | “ фаза *
псориаза
га г i Провокация
I
*
Открытая форма псориаза
Эндогенная
Са2+ | С2Н5ОН
Разрастание эпидермиса
Воспаление
1. Патогенез
А. Псориаз
О Псориатический артрит
2. Симптомы
Акантолиз
Аутоантитела
Буллезный пемфигоид
BP-I, -II
Приобретенный буллезный эпидермолиз
Герпетиформный дерматит
2. Образование субэпидермальных пузырей
йЛаменты
Коллаген VII
Ретикулин
Ламин
Базальные клетки
Гемидесмосомы
Lamina lucida
Lamina densa
Соединительная ткань дермиса
Б. Буллезные дерматозы
Заболевания желудочно-кишечного тракта
А. Хронический атрофический гастрит (тип А)
Хронический атрофический гастрит (тип А) представляет собой аутоиммунное заболевание, связанное с образованием аутоантител против главных клеток слизистой оболочки желудка, париетальных клеток и внутреннего фактора. При данном заболевании в основном происходят изменения в области дна и тела желудка, вызывающие атрофию железистой ткани с последующей ахлоргидрией и снижением выработки внутреннего фактора. Гастрит типа А выражается в относительно небольшом количестве симптомов. При развитии болезни появляются признаки нарушения пищеварения и хронического дефицита витамина В12 (пернициозная анемия). К гематологическим проявлениям относятся гиперхромная макроцитарная анемия и гиперсегментация гранулоцитов. Неврологические осложнения включают в себя признаки фуникулярного миелоза, такие как ухудшение вибрационной чувствительности и атаксия, вызванные повреждением корешков спинного мозга. На поздних стадиях заболевания может возникнуть спастический парапарез ног, связанный с поражением пирамидального тракта. Ахлоргидрия быстро приводит к развитию гипергастринемии; тест на пентагастрин положительный.
Аутоантитела против главных клеток можно разделить на следующие группы:
• антитела против микросомального антигена (РМСА), которые также связаны с диабетом первого типа;
• антитела против поверхностного антигена (PMSA), фактически специфичные для аутоиммунного гастрита типа А.
Иногда гастрит типа А сопровождается другими эндокринными аутоиммунными заболеваниями, например, гипертиреозом или зобом Хашимото. Болезнь связана с наличием антигенов HLA: АЗ, В7, DR2 и DR4 Для лечения пернициозной анемии применяют парентеральное введение витамина Bq 2-
Б. Болезнь Виппля
Болезнь Виппля вызвана хронической инфекцией Tropheryma whippeli — грамположительным актиномицетом, способным выживать в фагосомах макрофагов в микрофлоре кишечника. Наличие патогена можно установить гистологическими методами по характерным PAS-положительным тельцам. Макрофаги в лимфатических сосудах и узлах раздуваются и блокируют опок лимфы. Это мешает всасыванию пищевых жиров и приводит к мальабсорбции и стеаторее. Системные проявления заболевания включают в себя артралгию и коричневую гиперпигментацию кожи Иммунные нарушения по всей видимости связаны с синдромом маль
абсорбции Для лечения болезни Виппля используют препараты типа тетрациклина; курс лечения длится 5-6 месяцев.
В. Глютенчувствительная энтеропатия
Глютенчувствительная энтеропатия (спру) характеризуется наличием у генетически предрасположенных индивидов аллергической реакции на глиадин — вещество, содержащееся в белках злаков. Болезнь связана с антигенами HLA DR3 и В8. Спру характеризуется аутоагрессивным воспалением, направленным против миоэпителиальных якорных фибрилл кишечника. К иммунологическим проявлениям относятся синтез аутоантител против эндомизия и ретикулина, а также анти-глиадиновых антител Происходит атрофия слизистой оболочки тонкой кишки (уплощение слизистой) и инфильтрация эпителия лимфоцитами. Клинические симптомы сглаживаются при переходе на диету, не содержащую глютенов Кроме мальабсорбции и стеатореи аутоантитела могут вызвать герпетиформный дерматит. У таких пациентов также повышается риск злокачественной лимфомы, возникающей из ассоциированной со слизистой лимфоидной ткани.
Патогенез. Глиадин из пищевых продуктов проникает между клетками эпителия в lamina propria, где связывается с АПК (HLA-DQ- или HLA-DQ8+) и Т-клетками. Тканевая трансглутаминаза способствует перекрестному сшиванию глиадина, что приводит к образованию даже более эффективных Т-клеточных эпитопов. Участие клеток Тн1-типа приводит к воспалительной реакции и структурным изменениям, в то время как цитокины клеток Тн2-типа активируют В-лимфоциты, которые начинают вырабатывать антитела против глиадина и аутоантитела против трансглутаминазы и комплекса глиадин-трансглутаминаза. Аутоантитела против трансглутаминазы способствуют развитию атрофии, поскольку ингибируют потенцирующее действие трансглутаминазы.
Атрофический гастрит, болезнь Виппля и спру
О О
О. , < о
Главные клетки |
Пепсиноген *
Атрофия слизистой
Тело
Внутренний фактор
Главная клетка
Париетальная клетка
Дно
Париетальные клетки |
Ахлоргидрия
Нарушение
— пищеварения/ мальабсорбция
I ВнУтРенний - ► Дефицит витамина В12 фактор | 12
Пира-
Задние канатики। мидаль-
Пернициозная анемия
Гиперхромная Гиперсегментация макроцитарная анемия гранулоцитов
А. Хронический атрофический гастрит (тип А)
Пищевые Макрофаги
жиры с PAS+ фагосомами
Просвет Эпителий Блокада Крове-кишечника кишечника оттока носный лимфы сосуд
Мальаб- , Уменьшение Стеаторея сорбция - массытела
Б.Болезнь Виппля
ныи тракт*
Фуникулярный миелоз
Заболевания желудочно-кишечного тракта
А. Болезнь Крона
Болезнь Крона представляет собой хроническое гранулематозное воспаление, при котором может быть поражен весь пищеварительный тракт, однако в большинстве случаев на начальных стадиях заболевания наблюдаются терминальный илеит или регионарный энтероколитит Воспалительный процесс охватывает все слои стенки кишки, но ограничивается разрозненными участками кишечника (так называемые «прыжки кенгуру»), способствует возникновению свищей, абсцесса и перфорации. Радиологическое исследование выявляет области утолщения, стеноза и нарушение моторики в пораженном участке кишечника (феномен «садового шланга»). Абсцесс и образование свищей в прилежащих органах (мочевой пузырь или кожа) способствуют развитию множественных опухолей. В результате наиболее распространенными осложнениями болезни Крона являются стеноз и непроходимость кишечника, мальабсорбция и образование свищей. Также повышается вероятность колоректальных опухолей и амилоидоза Болезнь Крона связана с наличием антигенов HLA DR1 и DQw5 Факторами риска развития данного заболевания являются курение, краткий период грудного вскармливания и(или) высокий уровень потребления рафинированных углеводов в продуктах питания.
Слизистая оболочка кишечника вырабатывает большое количество ИЛ-12. При стимуляции бактериями ИЛ-12 способствует превращению наивных Т-клеток в клетки типа Тц1. Действительно, активность этого типа клеток в слизистой у пациентов с болезнью Крона высокая что определяется по концентрации у-ИНФ, ФНО-а и ИЛ-2. При анализе состава IgG обнаруживают высокий уровень lgG2, который особенно эффективен в распознавании бактериальных углеводных антигенов Таким образом, основой патогенеза болезни Крона считают усиление иммунного ответа на экзогенные антигены, например, антигены фекалий (рис. Г).
При обострении болезни показан прием сульфасалазина, 5-аминосалицилатов и стероидных препаратов. В состоянии ремиссии пациентам назначают комбинацию из трех препаратов — азатиоприна, метотрексата и циклоспорина А. В рефрактерных случаях используют антагонисты ФНО, например инфликсимаб. Для предотвращения рецидивов заболевания следует продолжать прием низких доз препаратов. Хирургическое вмешательство с применением наименее инвазивных методов показано только в тех случаях, когда оно необходимо для устранения осложнений или при безрезультативности медикаментозной терапии.
Б. Язвенный колит
Язвенный колит представляет собой хроническое рецидивирующее заболевание толстой кишки, сопровождающееся диареей с выделениями крови и слизи. При язвенном колите происходит изъязвление поверхности слизистой оболочки, которое постепенно распространяется от прямой кишки к проксимальным отделам кишечника. Изъязвление приводит к уплощению эпителия слизистой между зонами повреждения и к исчерпанию бокаловидных клеток. Избыточная регенерация эпителия приводит к образованию псевдополипов. Исследование прямой кишки с двойным контрастированием выявляет потерю гаустрации и наличие атипичной зазубренной поверхности Наиболее опасными осложнениями заболевания являются токсический мегаколон и колоректальный рак. Язвенный колит может проявляться и в других участках организма; наиболее частыми проявлениями болезни вне области кишечника являются артрит и увеит. Кроме того, язвенный колит может быть связан с IgA-нефритом, аутоиммунным гепатитом и первичным билиарным циррозом В слизистой обнаруживаеся высокое содержание ИЛ-5, что подтверждает повышенную активность клеток Тн2. Анализ подклассов IgG выявляет высокий уровень содержания lgG1 и lgG3. Наличие антинейтрофильных цитоплазматических антител (АНЦА) и связь с некоторыми аутоиммунными заболеваниями говорит о возможной аутоиммунной природе язвенного колита (рис. Г).
При обострениях назначают прием сульфасалазина и 5-аминосалицилатов. Эти препараты ингибируют синтез простагландинов и лейкотриенов, но, как и при болезни Крона, они включаются в каскад воспалительных реакций только на поздних стадиях. Возможно хирургическое вмешательство (проктоколэктомия)
Хронические воспалительные заболевания кишечника
HLA-DR1 Короткий период
кормления
-DQw5 грудью
Связь Рафинированные
с курением углеводы
HLA-DR2 Первичный склерозирующий холангит
Связь с IgA- Аутоиммунный нефритом гепатит
Типичные участки поражения
Очаговое Дискретное поражение поражение
Образование множественных опухолей
Типичный характер
Язвы
Сплошное Поверх-
поражение * ностное
Типичные участки поражения
Уплощение с КРОВЬЮ
слизистой и слизью
Типичный характер
А. Болезнь Крона
Б. Язвенный колит
В. Воспаление стенки кишечника
Болезнь Крона
Г. Механизмы патогенеза
Заболевания желудочно-кишечного тракта
Клиническая иммунология
А. Аутоиммунный гепатит
Этиология аутоиммунного гепатита неизвестна. Поэтому для постановки диагноза требуется выполнение ряда критериев. Болезнь поражает главным образом женщин и связана с наличием антигенов HLA-DR3 и DR4. Гистологическая картина совпадает с таковой при хроническом гепатите, а серологические тесты указывают на наличие гипергаммаглобулинемии. Терапия с применением иммуносупрессоров приводит к сглаживанию симптомов. Аутоиммунный гепатит часто ассоциирован с другими аутоиммунными заболеваниями, такими как ревматоидный артрит, гломерулонефрит, язвенный колит, болезнь Крона и зоб Хашимото. У 50% больных наблюдаются признаки васкулита, криоглобулинемии и синдрома Шегрена. Встречаются также системные проявления: нарушение работы печени (желтуха), чесотка, тошнота, диарея, лихорадка и гепатоспленомегалия Повышается уровень аспартат-трансаминазы и аланинтрансаминазы (AST и ALT) и наблюдаются признаки холестаза.
С иммунологической точки зрения данное заболевание представляет собой иммунную реакцию на структуры тканей печени. Роль задействованных в данном заболевании аутоантител пока не выяснена. Антитела, направленные против структурных белков, называют антителами к печеночно-почечным микросомам (LKM). Антитела LKM-1 направлены против цитохрома P450IID6 — фермента, метаболизирующего некоторые лекарственные препараты (бета-блокаторы, противоаритмические препараты и антидепрессанты). Антитела LKM-1 часто встречаются вместе с антителами против вируса гепатита С. Это говорит о том, что аутоиммунный гепатит, возможно, индуцируется гепатотропным вирусом.
Диагноз ставится при обнаружении аутоантител. Для дифференциальной диагностики следует исключить вирусный гепатит, поражения печени, связанные с другими причинами, такими как алкоголь и лекарственные препараты, или генетические ферментативные нарушения (например, дефицит сх>|-антитрипсина, болезнь Вильсона). Всегда следует провести HLA-типи-рование. Иммуносупрессорная терапия состоит в использовании преднизолона или его сочетания с азатиоприном.
Б. Первичный билиарный цирроз
Первичный билиарный цирроз (ПБЦ) или негнойный деструктивный холангит — это воспалительное заболевание мелких внутрипеченочных желчных протоков, которое главным образом поражает женщин старше 40 лет. Кроме признаков холестаза может иметь место высокий уровень сывороточного холестерина. Повышенный уровень холестерина способствует разви
тию ксантомы. К другим возможным симптомам относятся желтуха, чесотка, пигментация кожи и гепатобилиарная недостаточность. Наличие внепеченочных проявлений характеризует ПБЦ как полисистемное заболевание. В некоторых случаях наблюдается поражение поджелудочной, слезных, а также слюнных желез (сухость во рту и синдром «сухих глаз»). В 50% случаев болезнь ассоциирована с синдромом Шегрена, а также с другими аутоиммунными заболеваниями. В сыворотке могут быть обнаружены антимитохондри-альные антитела (АМА). Эти антитела в первую очередь направлены против Е2 субъединицы пируватдеги-дрогеназного комплекса. Роль АМА в патогенезе ПБЦ пока не выяснена. Одна из гипотез предполагает наличие бактериальной индукции. Предпринимаемые попытки лечить данное заболевание с помощью иммуносупрессоров не дают положительного результата.
В. Первичный склерозирующий холангит
Первичный склерозирующий холангит (ПСХ) представляет собой хроническое фиброзное воспаление внутри- и внепеченочных желчных протоков Утолщение стенок протоков и стеноз в конечном итоге приводят к холестазу. ПСХ чаще встречается у мужчин и ассоциирован с наличием антигенов HLA-B8 и DR3. У 50% пациентов болезнь сопровождается язвенным колитом. Постановка диагноза осуществляется при обнаружении АНЦА и демонстрации изменений желчного протока. Как и в случае первичного билиарного цирроза, лечение симптоматическое.
222
Аутоиммунные заболевания печени
Критерии •
• $ • HLA-DR3,-DR4
• Связь с РА, гломерулонефритом, язвенным колитом, болезнью Крона зобом Ха ши мото
Клинические проявления:
Перипортальная область с артерией, перипортальной веной и желчным протоком
Центральная вена
Лимфоцитарная Доля печени инфильтрация
• Гистология: хронический гепатит
Лаб. показатели: гипергамма-
Воспалительная инфильтрация в перипортальной области
Тошнота
Желтуха
Зуд
Синдром Шегрена
Лихорадка
Диарея
Васкулит
1ИО-глобули-нем^я
А. Аутоиммунный гепатит
Трансаминазы GOT, GPTt холестаз: билирубин, гамма-ГТ, ЩФ|
• Аутоантитела
LKM1 - ► цитохром P450IID6 при аутоиммунном гепатите
. __► цитохром P450IIC9 при гепатите, вызванном
приемом лекарств
LKM3- ► УДФ-глюкуронилтрансфераза при хроническом гепатите D
дяд____асиалогликопротеиновый рецептор
в гладких мышцах
Связь с синдромом Шегрена (50%), склеродермией, CREST, РА, зобом Хашимото
Симптомы: меланин
I
Г иперпигментация
кожи
Б. Первичный билиарный цирроз
Холестаз, нарушение пищеварения
I
Желтуха - билирубин!, гамма-ГТ!, ЩФ!. холестерин в сыворотке!
Ксантома
Связь с HLA-B8, DR3, с язвенным колитом в 50%
Холестаз, нарушение пищеварения, билирубин!, гамма-ГТ!, ЩФ !
У Уплотнение и стеноз желчного протока
В. Первичный склерозирующий холангит
Респираторные заболевания
А. Генетическая предрасположенность к астме
Бронхиальная астма — это хроническое заболевание интермиттирующего характера, на начальном этапе с обратимой обструкцией дыхательных путей, воспалительными изменениями и бронхиальной гиперчувствительностью. В отличие от «эндогенной» или неаллергической астмы, «экзогенная» аллергическая (атопическая) астма характеризуется повышенным уровнем сывороточного IgE и связана с другими аллергическими проявлениями у пациента и его родственников. Однако граница между двумя видами заболевания условна, поскольку некоторые их клинические и патогенетические черты перекрываются.
Бронхиальная гиперчувствительность и тенденция к усиленному ИЛ-4-зависимому синтезу IgE обычно передаются по наследству с генами хромосомного локуса 5q31-q33 Распространенность заболевания составляет 5% у взрослых и 10% у детей. Атопическая астма встречается гораздо чаще, чем другая форма заболевания.
Б. Инициирующие факторы
Атопическая астма может быть вызвана контактом с шерстью животных, пылевым клещем, перьями птиц, пыльцой и плесенью. Напротив, бронхиальная гипер-чувтвительность при неаллергической астме может быть споровоцирована вдыханием химических веществ, таких как сернистый газ S02, озон О3 и табачный дым, а также вирусной инфекцией, холодным воздухом, нагрузкой или стрессом. Астматический приступ также может быть вызван приемом анальгетиков, в том числе аспирина.
В. Патогенез
Сенсибилизация к аллергенам может произойти в раннем детстве (рис. В1). Антигенпрезентирующие клетки в слизистой бронхов захватывают попавший с вдыхаемым воздухом аллерген и представляют его С04+ Т-клеткам, которые затем превращаются в клетки фенотипа Тн2. Эти клетки секретируют ИЛ-4, ИЛ-5, ИЛ-9, ИЛ-10 и ИЛ-13, которые способствуют переключению класса иммуноглобулинов, вырабатываемых В-лимфоцитами, заставляя их производить IgE. Кроме того, ИЛ-13 стимулирует активацию эозинофилов и базофилов, а также выделение хемокинов и протеолитических ферментов типа металлопротеиназ. Циркулирующие молекулы IgE могут связаться с высокоаффинными рецепторами на тучных клетках и базофилах (FceRI) и с низкоаффинными рецепторами на эозинофилах и макрофагах (FceRII, CD23). При повторном попадании в организм (рис. В2) аллерген быстро реагирует с молекулами IgE, связанными с по
верхностью клеток. Происходит выделение гистамина, протеаз, лейкотриенов, простагландинов и фактора активации тромбоцитов (ФАТ). Бронхоконстриктор-ная астматическая реакция происходит в два этапа. Функции легких быстро снижаются за первые 10-20 мин, а затем постепенно восстанавливаются на протяжении нескольких часов. Этот «ранний ответ» протекает с участием гистамина, простагландина-О2 (ПГ02), цистеинил-лейкотриенов (ЛТС4, ЛТ04, ЛТЕ4) и ФАТ. Цистеинил-лейкотриены индуцируют выделение протеаз: триптаза отщепляет 03а и брадикинин из белков-предшественников, что приводит к сокращению бронхиальных мышц и повышает проницаемость сосудов Химаза в свою очередь способствует секреции слизи. Бронхоспазм в сочетании с отеком слизистой и выделением слизи приводят к кашлю, одышке и свистящему дыханию. «Поздний ответ» начинается через 4-6 часов. ЛТВ4 и ФАТ привлекают эозинофилы, которые в свою очередь привлекают главный основный белок (МБР) и эозинофильный катионный протеин (ЭКП), оказывающие токсическое действие на эпителиальные клетки. На более поздних этапах происходит разрушение эпителия, а это в конечном итоге приводит к накоплению в просвете бронхов слизи, что объясняется увеличением числа бокаловидных клеток и гипертрофией слизистых желез в подслизистом слое. Может также наблюдаться гипертрофия гладких мышц. Многие из перечисленных эффектов вызваны активностью ИЛ-13 в STAT 6-сигнальном пути, поэтому одним из возможных терапевтических подходов является соответствующая фармакологическая блокада.
Г. Аллергический ринит
Аллергический ринит возникает при контакте аллергена со слизистой оболочкой носовой полости. В данном процессе также важен элемент пресенсибилизации, поскольку аллерген связывается с сенсибилизированными тучными клетками, несущими на поверхности IgE. Чихание и выделение слизи (ринорея) могут начаться спустя 30-60 с после вдыхания аллергена. Рефлекторная гиперсекреция имеет место не только на участке контакта с аллергеном, но и в другой ноздре. Реакция на аллергены может быть определена при тестировании, состоящем в интрадермальном введении растворенных антигенов При положительной реакции в течение 15-30 мин кожа вокруг места укола краснеет и образуется волдырь
Бронхиальная астма и аллергический ринит
Гиперчувствительность бронхов
Усиление синтеза igE
А. Генетическая
Пылевой клещ
Пыльца
Шерсть животных
Фекалии животных
Перья
Плесень
Никотин
Лекарства
Хим. вещества
so2
О3
Холодный воздух
Стресс
Физическая активность
предрасположенность к астме
1. Сенсибилизация
В. Патогенез
Травы
Злаки
Ольха
Орешник
Береза
Плесень
Клещи
Аллергены животного происхождения
Профессиональные аллергены
Б. Инициирующие факторы
Повторный контакт
Сокращение гладких мышц
Железы
2. Повторный контакт, ранний ответ
Г. Аллергический ринит
3. Поздний ответ
Отек слизистого эпителия
Назальный контакт с аллергеном
Тестирование
Клиническая иммунология
225 ’
Клиническая иммунология
Респираторные заболевания
А. Саркоидоз
Саркоидоз — это полисистемное заболевание, характеризующееся наличием в нескольких органах неказеозных гранулем. Считается, что болезнь возникает в результате вдыхания пока еще неидентифицированно-го антигена (рис. А1). Антигенпрезентирующие клетки вырабатывают ИЛ-1 ИЛ-15, у-ИНФ и ФНО-а. Они рекрутируют активированные С04+ клетки типа Тн1. что приводит к олигоклональному Т-клеточному альвеолиту. Происходящее далее выделение моноцитарного хемоаттрактантного белка 1 (МСР-1), макрофагального воспалительного белка 1а (MIP-1 а), CXCL10 и ИЛ-16 способствует миграции моноцитов и пролиферации Т-клеток. Моноциты синтезируют фибрин, фибронектин, ТФР-р, ИЛ-3, у-ИНФ и ФНО-а, а затем превращаются в эпителиоидные клетки. Некоторые из них объединяются, образуя гигантские поли-ядерные клетки и неказеозные (ненекротические) гранулемы из эпителиоидных клеток. Интерлейкины 4 и 6 способствуют поликлональной В-клеточной стимуляции, что выражается в гипергаммаглобулинемии.
Часто болезнь обнаруживают случайно по двустороннему увеличению медиастинальных лимфатических узлов (двусторонняя лимфаденопатия корней легких) на рентгеновском снимке грудной клетки (рис. А4). Острая форма заболевания (синдром Лефгрена) характеризуется двусторонней лимфаденопатией корней легких, лихорадкой, узелковой эритемой и острым артритом, особенно поражающим колени и лодыжки (рис. А2). Бронхоальвеолярный лаваж (БАЛ) обычно выявляет наличие С04+ Т-клеточного альвеолита (рис. АЗ). Лаважная жидкость часто содержит в 10 раз больше С04+ Т-лимфоцитов, чем периферическая кровь, что объясняется привлечением лимфоцитов из периферической крови и кожи (анергия к кожным антигенам) в легкие. У здоровых людей 90% и более клеток лаважной жидкости составляют макрофаги, а число лимфоцитов не превышает 106; при саркоидозе концентрация лимфоцитов оказывается в 10 или 20 раз выше. Также наблюдается снижение отношения CD4+/CD8+ Т-клеток в периферической крови. Увеличение концентрации ФИО, ИЛ-1 и ИЛ-6 в сыворотке способствует возникновению лихорадки и общего недомогания.
Наиболее распространенным поражением кожи при саркоидозе является узелковая эритема — негранулематозное воспаление подкожной ткани. Часто поражаются глаза, что выражается в симптомах промежуточного или заднего увеита (см. с. 254 и 256), осложнениями которых могут быть как практически безопасные конъюнктивные узелки, так и слепота. Гранулематозное воспаление, поражающее структуры головного мозга, может быть проявлени
ем нейросаркоидоза. Усиление всасывания кальция в кишечнике связано со способностью макрофагов гранулемы превращать 25-гидроксивитамин D в 1,25-дигидроксивитамин D. Остеолитические повреждения костей вносят свой вклад в развитие гиперкальциемии и гиперкальциурии. Возникновение гранулем в ткани миокарда может привести к венти-кулярной тахикардии. В печени часто обнаруживаются мелкие гранулемы в перипортальной области или Т-клеточная инфильтрация с различной степенью фиброза (рис. А5). Развитие гранулем в селезенке может привести к спленомегалии. Рост концентрации ангиотензинпревращающего фермента (АПФ) в сыворотке отражает его синтез тканью гранулемы.
Б. Идиопатический легочный фиброз
Легочный фиброз может развиваться при различных заболеваниях. Следовательно, диагноз идиопатический легочный фиброз (криптогенный фиброзирующий альвеолит) ставится после исключения остальных возможных заболеваний. Считается, что активация альвеолярных макрофагов происходит у генетически предрасположенных индивидов после контакта с неизвестным патогеном. Возможно, за это ответственны вирусы или иммунные комплексы. Также в процессе активации могут участвовать Т-клеточные цитокины. Альвеолярные макрофаги секретируют ИЛ-8 и лейкотриены, которые рекрутируют и активируют нейтрофилы. Нейтрофильный альвеолит является типичным проявлением идиопатического легочного фиброза, в то время как лимфоцитарный альвеолит возникает при саркоидозе. Альвеолярные макрофаги также секретируют факторы роста фибробластов, такие как ТФР-р, инсулиноподобный фактор роста (1/1ФР-1) и фактор роста, полученный из тромбоцитов (PDGF). Окислительные процессы помогают альвеолярным макрофагам и нейтрофилам разрушать пневмоциты I типа. Это вызывает компенсаторный рост числа пневмоцитов II типа, производящих хемотаксические и фиброгенные факторы. Происходит отложение внеклеточного матрикса, что в конечном итоге приводит к фиброзно-рубцовым изменениям с характерной рентгенологической и гистологической картиной (легкие в виде медовых сот). Для лечения данного заболевания использовались кортикостероиды, однако часто без положительного результата. К улучшению клинических показателей может привести использование сочетания кортикостероидов и у-ИНФ.
226
Саркоидоз и идиопатический легочный фиброз
Неизвестный патоген
Мико- J бактерии?
Вирусу
Т-клеточный (CD4+)
альвеолит
Хемотаксис ----------► и активация моноцитов
Не^азеозная гранулема
Распространение через кровь?
Вдыхание
патогена
1. Модель патогенеза
Лихорадка, общие симптомы
— Поражение ЦНС
О Увеит
Кальций!, АХЭ!, неоптерин!
Отношение CD4/CD8I, у-глобул ины!
Инфильтрация печени
Поражение кожи
Синдром Лефгрена: двусторонняя лимфаденопатия корней легких, лихорадка, узелковая эритема,
Нейропатия
Паротит
Медиастинальная лимфаденопатия
Поражение легких (90%)
Поражение сердца
Инфильтрация селезенки
3. БАЛ
грудной клетки
полиартрит
2. Клинические проявления
А. Саркоидоз
Узелковая эритема
Повреждение костей
Артрит
5. Т-клеточная инфильтрация печени
Хемотаксис
Иммунные
ТФР-Р.
PDGF
и активация моноцитов
И нтерсти циал ь на я
инфильтрация, фиброз
Т-клетки
Альвеолярный макрофаг
Пнев-мо-циты
I типа
Нейтрофильный альвеолит
Пнев-мо-циты
II типа
Фиброз легкого
ИЛ-8,
лейко- Хемотаксис
триены
гранулоцитов
Легкое в виде медовых сот
Б. Идиопатический легочный фиброз
Респираторные заболевания
А. Экзогенный аллергический альвеолит
1. Наиболее распространенные клинические симптомы. Экзогенный аллергический альвеолит (ЭАА) (гиперчувствительный пневмонит) возникает в результате сенсибилизации и повторного контакта с антигеном при вдыхании. Антигены вместе с пылью попадают в альвеолы, где запускают локальный иммунный ответ. Такие аллергены могут иметь бактериальную или грибковую природу, быть частью определенных химических веществ, продуктов животного или растительного происхождения. Развивающиеся реакции гиперчувствительности вне зависимости от вызвавшего их аллергена приводят к одной и той же клинической картине Если в данных реакциях участвуют бактерии или грибы, то их действие не инвазивно — они выступают в качестве антигенов Описано более 50 вариантов заболевания, связанных с родом деятельности людей и факторами окружающей среды. Многие названия болезни отражают тип контакта с аллергеном. Так, легкое фермера — это болезнь, вызванная термофильными актиномицетами, обитающими в заплесневевшем сене. Грибное легкое — болезнь, вызванная грибами, населяющими компост (например, Aspergillus]. Кондиционеры и увлажнители воздуха на производстве и в общественных заведениях, а также сауны создают идеальные условия для роста термофильных актиномицетов, амеб, микроорганизмов рода Klebsiella, Candida и Aureobasidium (вызывают болезнь легионеров). Болезнь любителей птиц встречается у тех, кто подвергается контакту с экскрементами голубей и других птиц. Изоцианаты и ангидриды являются основными веществами, вызывающими профессиональное заболевание работников химической промышленности. Эти вещества используются для производства пластмасс, красок и полиуретана. Несмотря на различную этиологию, лежащие в основе данных заболеваний патологические механизмы и клинические проявления идентичны.
2. Иммунопатогенез. Частицы, попадающие в организм при вдохе, могут способствовать осаждению антител IgG, образующих активирующие комплемент иммунные комплексы. Активация комплемента может произойти и без участия антител, поскольку вдыхаемая пыль способна напрямую активировать комплемент по альтернативному пути. Фрагменты комплемента оказывают хемотаксическое действие на нейтрофилы и способствуют их привлечению в альвеолы Активированные макрофаги выделяют различные монокины. Например, ИЛ-8 усиливает хемотаксис гранулоцитов. В результате через 4-6 ч после попадания антигена
развивается обширный нейтрофильный альвеолит. Другие монокины привлекают Т-клетки в альвеолярные септы и интерстициальные ткани или стимулируют образование аутокринных факторов. Спустя 48-72 ч в альвеолы поступают дополнительные Т-клетки, что обнаруживается при бронхоальвеолярном лаваже (БАЛ). В отличие от саркоидоза, который способствует развитию С04+ альвеолита, в данном случае Т-клетки в основном экспрессируют CD8. Они проявляют супрессорную активность и могут уничтожать НК-чувствительные мишени; они также экспрессируют CD56 и CD57. В лаважной жидкости часто обнаруживают макрофаги. Гистология выявляет инфильтрацию интерстициальной ткани одноядерными клетками и начало образования мелких гранулем. Характер альвеолита, определенный с помощью БАЛ, помогает при дифференцировке интерстициальных заболеваний легких различной этиологии. А именно, преобладание CD4+ Т-клеток характерно для саркоидоза, туберкулеза и бериллиоза, a CD8+ Т-клеточный альвеолит обнаруживают при гиперчувствительном пневмоните, силикозе, бластомикозе и интерстициальном заболевании легких (коллагенозе), ассоциированном с ВИЧ, коллагеновыми сосудистыми заболеваниями и болезнью трансплантат против хозяина.
3. Течение заболевания. Различают хроническую и острую формы заболевания. Острый ЭАА проявляется вскоре после воздействия антигена Такие симптомы, как лихорадка, озноб, кашель, удушье и миалгия, обычно возникают уже через 4-8 ч и наблюдаются на протяжении 18-24 ч, пока не начинают ослабевать (при отсутствии повторного контакта с антигеном) При каждом новом контакте симптомы возникают вновь. Рентгенологическое исследование может выявить узелковые интерстициальные инфильтраты в нижней доле легкого. В большинстве случаев особого лечения не требуется В тяжелых случаях для ослабления симптомов можно назначить прием стероидных препаратов. Хроническое воздействие аллергенов, т.е. возникающее через короткие промежутки времени, приводит к гораздо более тяжелым симптомам. Сначала в отсутствие лихорадки могут появиться общая слабость, анорексия, потеря массы тела. Постепенно развивается укороченное дыхание и одышка в состоянии покоя. При длительном хроническом повреждении легочной ткани болезнь может перерасти в легочный фиброз, который на рентгенограмме выражен как фиброзные интерстициальные изменения.
Экзогенный аллергический альвеолит
Сено
Животные
Кондиционеры воздуха
Компост
Полиуретан
Актиномицеты
Легкое фермера
Белки животного * происхождения
Болезнь любителей птиц
Актиномицеты Aureobasidium р.
Болезнь легионеров
R Изоцианаты
Грибное легкое
Болезнь работников химической промышленности
1. Наиболее распространенные клинические синдромы
Ранний нейтрофильный альвеолит
ИЛ-8, хемокины
СЗа
2. Иммунопатогенез
Альтернативный путь активации комплемента — 4-12 ч
Лимфоцитарный альвеолит (CD8+), интерстициальная инфильтрация одноядерными клетками, образование гранулем
Вдыхание
4^.8 ч _____ Лечение
стероидами
Лихорадка, кашель, диспноэ
12-24 ч
а) Острое течение
Регулярный
контакт
Слабость, анорексия, снижение Одышка массы тела в покое
Нарушение вентиляции легких
б) Хроническое течение
3. Клиническая картина
А. Экзогенный аллергический альвеолит
4. Рентгеноскопия грудной клетки
Клиническая иммунология
229
Респираторные заболевания
А. Туберкулез
1. Воздушно-капельная инфекция. При попадании в легкие микобактерии подвергаются фагоцитозу альвеолярными макрофагами. Фагоцитоз в основном идет с участеим рецепторов (2). Некоторые рецепторы, например Toll-подобные рецепторы (TLR). узнают определенный набор поверхностных антигенов, общий для всех прокариотов, тогда как другие специфичны к антигенам микобактерий (например, молекула CD14 специфична к липоарабиноманнану (LAM)). Антитела и компонент комплемента СЗ связываются с молекулами на поверхности патогена и распознаются соответствующими рецепторами. Поскольку альвеолярные макрофаги не могут эффективно уничтожать фагоцитированные микобактерии, то бактерии могут выжить внутри них и даже способны реплицироваться, блокируя созревание фагосомы. Миграция альвеолярных макрофагов к ближайшим лимфатическим узлам активирует Т-клеточный специфический иммунный ответ
3. Индукция специфического иммунного ответа. Mycobacterium tuberculosis секретирует белки внутрь фагосомы. Сначала это экспортные белки, затем — составляющие клеточной стенки, и наконец после автолиза — внутриклеточные белки. Презентация процессированных фрагментов из 10-20 аминокислот осуществляется с помощью молекул МНС класса II, а фрагментов из 8-10 аминокислот— с помощью молекул МНС класса I. Молекула CD1, являющаяся дальним родственником молекул МНС класса I, осуществляет презентацию бактериальных липоидов, что стимулирует главным образом двойные негативные (CD4~ CDS) Т-клет-ки. Кроме этого, антигены микобактерий, содержащие фосфатные группы, активируют у/6-Т-клетки. Молекула, ответственная за презентацию этих антигенов, пока не идентифицирована. Считается, что фосфорилированные лиганды представляются непосредственно на поверхности клетки.
4. Гранулема. Активированные CD4+ Т-клетки секретируют хемокины, которые привлекают моноциты из циркуляции к местам воспаления. Они также секретируют ФНО-а, ответственный за образование гранулемы. Полное уничтожение микобактерий в гранулеме может происходить за счет цитокин-опосредованной активации макрофагов. Однако в большинстве случаев патоген концентрируется в гранулеме, которая плотно закрыта от внешней среды. Причиной являются опосредованное действием ФНО-а утолщение и фиброз стенки гранулемы, а также индуцированное ИЛ-4 слияние макрофагов с образованием гигантских клеток (клетки Ланганса). В данном случае
организм хозяина инфицирован, но туберкулез не развивается, поскольку микобактерии и защитная система гранулемы находятся в равновесии. у-Ин-терферон может активировать туберкулостатические макрофаги, например, стимулируя синтез кальцитриола — вещества, активирующего действие микробицидных факторов. Активированные макрофаги выделяют кислородсодержащие продукты и протеазы, вызывая тем самым некроз центральной части гранулемы. Активированные CD8+ цитотоксические Т-клетки способствуют лизису макрофагов, в результате чего их содержимое выходит в некротическую зону гранулемы. Создавшиеся здесь условия менее благоприятны для роста микобактерий, что связано с низким давлением кислорода и наличием выделившихся ферментов.
В то же время неконтролируемое разрушение клеток способствует творожистому перерождению гранулемы, что приводит к обширному повреждению тканей. Теперь микобактерии могут попасть в циркуляцию и создать новые колонии практически во всех органах хозяина. Если разорванная гранулема получает доступ к бронхам, то микобактерии могут выдыхаться хозяином в окружающую среду, распространяя инфекцию (открытая форма туберкулеза).
5. Осложнения. Нарушение баланса между микобактериями и защитной системой гранулемы может привести к дальнейшему распространению инфекции. Типичными осложнениями являются туберкулез внутригрудных лимфоузлов, плевральная эффузия и повреждения верхушки легкого (апикальные очаги Симона). Генерализация инфекции, обусловленная распространением через кровоток, приводит к образованию тысяч мелких узелков в легких печени, селезенке и мозговых оболочках (милиарный туберкулез). Казеозная пневмония и туберкулезный сепсис (сепсис Ландузи) обычно заканчиваются летальным исходом.
Туберкулез
Первичный_ комплекс
Лимфоузлы
CR FcyR IgG Комплемент
CD14 LAM
Первичное поражение
Инкубационный период 4-12 недель
1. Инфицирование воздушно-капельным путем
Белки
Муреин □□ Полисахариды Фосфатные группы Гликолипиды Восковая оболочка
2. Фагоцитоз альвеолярными макрофагами
CD4+
Т-клетки
CD8+
Т-клетки
CD4-/CD8-Т-клетки
Y/S Т-клетки
а/p TCR
Y/STCR
a/PTCR
a/pTCR
класса II
МНС класса I
Фагосома
3. Индукция специфического иммунного ответа
CD1
Секретируемые белки
М. tuberculosis
Л
Распространение через кровь
Спинно- Д) мозговая
пункция
4. Гранулема
а)
Моноцит /) крови
Гигантская
°2f
Протеазы
Туберкулез Плевральная Минимальное Милиарный внутригрудных эффузия поражение туберкулез лимфоузлов
5. Осложнения
А.Туберкулез
— Слой фибрина
Кальцитриол
Открытая форма туберкулеза
Кровеносный
сосуд
рахео-
бронхиальная система
е)
ФНО-а
у-ИНФ
Цитотоксическая Т-клетка
Летальный исход через несколько дней
Сепсис Ландузи
Казеозная пневмония
Болезни почек
В основе многих болезней почек лежат иммунологические механизмы. В первую очередь, в развитии подобного рода заболеваний задействованы антитело-зависимые иммунные реакции, а клеточные механизмы не играют столь важной роли. При иммунологических заболеваниях почек поражаются главным образом почечные клубочки, что скорее всего связано с их функцией в качестве фильтров. Иммунологические механизмы, связанные с развитием васкулитов, в данном разделе не рассматривались, но они упомянуты в приложении (см. таблицу 6).
А. Иммунологические механизмы
Схематично анатомическое строение почечного клубочка представлено на рис. А1. Для выхода из циркуляции и попадания в уринарное пространство клубочка растворенному веществу необходимо пройти сквозь фенестрированный эндотелий капилляров и войти в гломерулярную базальную мембрану (ГБМ). Эта мембрана состоит из коллагена, ламинина, полианионных протеогликанов, фибронектина и других гликопротеинов. Следующий слой представлен висцеральными эпителиальными клетками (подоцитами) и их ножками (стопообразными отростками). Уринарное пространство расположено между висцеральным и париетальным эпителием капсулы Боумана. Весь клубочек удерживается мезангиальным матриксом, в котором распределены мезангиальные клетки. Эти подвижные фагоцитирующие клетки секретируют вещество матрикса, коллаген и ряд биологических медиаторов.
Развитие антителозависимых болезней почек индуцируется по трем механизмам (рис. А2). Циркулирующие, преформированные иммунные комплексы накапливаются в субэндотелиальной области на базальной мембране со стороны капилляра (рис. А2а) Кроме того, антитела могут реагировать с базальной мембраной in situ (рис. А2б) или с антигенами висцеральных клеток (так называемый нефрит Хейманна) (рис. А2в). Иммуноглобулины и комплемент можно обнаружить с использованием флуоресцентной антисыворотки. Преформированные иммунные комплексы и антитела к эпителиальным антигенам выглядят как гранулярные дискретные флуоресцентные структуры, тогда как антитела против базальной мембраны распределены равномерно.
Отложения антител могут оказывать прямое действие, повреждая эпителиальные или эндотелиальные клетки за счет активации комплемента и образования пор (рис. АЗ). С другой стороны, антитела также могут связываться с Fc-рецепторами моноцитов, макрофагов, гранулоцитов и тромбоцитов. Это приводит к активации или в случае тромбоцитов — к агрегации клеток. Фрагменты комплемента, особенно С5а, уси
ливают активационный процесс. В конечном итоге происходит выделение протеаз, цитокинов, эйкозаноидов, оксидантов и окиси азота. Цитокины могут привлекать и активировать Т-клетки.
Повреждение почечного клубочка может вызывать два различных комплекса симптомов: нефротический синдром (рис. Б) и нефритический синдром (рис. В). При нефротическом синдроме повреждение эндотелиальных клеток, базальной мембраны и/или висцерального эпителия приводит к усилению фильтрации белков в уринарное пространство. Это вызывает про-теинемию и связанную с ней потерю низкомолекулярных веществ (альбумина и иммуноглобулинов). В результате в сыворотке повышается относительное содержание «2" и р-глобулинов. Из-за гипоальбуми-немии падает осмотическое давление крови, что приводит к развитию генерализованного отека с плевральным выпотом и асцитом. В печени происходит реактивное повышение синтеза липопротеинов, приводящее к гиперлипидемии Компенсаторная секреция альдостерона вызывает удержание натрия и гипертензию. В осадке мочи могут детектироваться гиалиновые и гранулярные цилиндры. Причины нефротического синдрома у детей и взрослых различаются. Детская форма заболевания обычно характеризуется гломерулопатией с минимальными изменениями и доброкачественным течением, тогда как у взрослых болезнь обычно ассоциирована с системным заболеванием и имеет менее благоприятный прогноз
Нефритический синдром чаще возникает у детей. Наступление болезни обычно характеризуется внезапным появлением крови в моче и снижением выделения мочи, сопровождающимся острой почечной недостаточностью (олигурия) и гипертензией. Болезнь часто бывает вызвана постинфекционным или быстро прогрессирующим гломерулонефритом
Иммунологические механизмы
Иммунные комплексы в капиллярах
Париетальный эпителий
Эндотелиальные клетки
__Гломерулярная базальная мембрана (ГБМ)
Подоциты со стопообразными отростками
1. Анатомическое строение
2а. Отложение 26. Анти-ГБМ 2в. Антитела
антитела
иммунных комплексов
против эпителиальных клеток
Протеазы, эйкозаноиды, NO, цитокины, факторы роста
3. Медиаторы повреждения почечного клубочка
А. Иммунные механизмы
Отеки вокруг глаз
Гипертензия
Асцит
Протеинурия
Г иперлипидемия
Отек
Осадок мочи гиалиновые и гранулярные цилиндры
Гипоальбуми-немия
1. Клинические сймптоМы
Мембранозный гломерулонефрит
Липоидный нефроз (нефропатия с минимальными изменениями)
Дети Взрослые
5% 20%
60% 10%
Фокальный сегментарный гломерулосклероз 10%
Мембранопролиферативный гломерулонефрит 10%
Пролиферативный ГН (фокальный, IgA и др.) 10%
Системные заболевания 5%
(диабет, СКВ, амилоидоз и др.)
10%
5%
15%
40%
2. Причины нефротического синдрома
Б. Нефротический синдром
Отеки
вокруг • •
Гипертензия
1. Клинические симптомы
Протеинурия U
Олигурия С
Гематурия^
Появление крови в моче
Постинфекционный гломерулонефрит Быстро прогрессирующий ГН
IgA-нефропатия
2. Причины нефритического синдрома
В. Нефритический синдром
Болезни почек
А. Нефропатия
с минимальными изменениями
Нефропатия с минимальными изменениями (или липоидный нефроз) — это доброкачественное заболевание. Оно является наиболее частой причиной детского нефротического синдрома. При исследовании в световом микроскопе почечные клубочки кажутся нормальными, а электронная микроскопия выявляет потерю или слияние стопообразных отростков висцеральных эпителиальных клеток. В подоцитах можно обнаружить отложения иммунных комплексов (обозначены стрелкой на фото). Еще одной характерной особенностью является образование так называемых микроворсинок (буква М на фото). Причины возникновения нефропатии с минимальными изменениями остаются неизвестными. Считается, что за разрушение структуры подоцитов ответственны Т-клеточные цитокины. Нарушение функции подоцитов приводит к усилению фильтрации белка. Изменения, произошедшие в результате заболевания, являются полностью обратимыми. В 90% случаев хороший результат достигается при лечении кортикостероидами, хотя некоторым пациентам приходится назначать долгосрочную терапию. При лечении взрослых используют более высокие дозы кортикостероидов, а вероятность рецидива заболевания гораздо выше, чем у детей.
Б. Фокальный сегментарный гломерулосклероз
Фокальный сегментарный гломерулосклероз (ФСГС) характеризуется наличием склероза в нескольких отдельных клубочках или поражением только части (сегмента) клубочка (см. фото). Эти изменения связаны с ВИЧ-инфекцией, злоупотреблениями лекарственными препаратами и IgA-нефропатией, либо возникают как вторичное осложнение компенсаторной гипертрофии. Часто причина болезни неизвестна. Около 10% всех нефротических синдромов относят к этой категории. Данные изменения по всей видимости представляют собой более тяжелый вариант нефропатии с минимальными изменениями. Накопление липидов, фибрина, компонента комплемента СЗ и IgM приводит к мезангиальной пролиферации, ассоциированной с гиалинозом и склерозом. На гистологическом срезе явно виден сегментарный характер склеротических изменений (см. фото). ФСГС плохо поддается лечению кортикостероидами. Примерно у 50% пациентов за 10 лет развивается почечная недостаточность.
В. Мембранозный гломерулонефрит
Мембранозный гломерулонефрит характеризуется образованием иммунных комплексов на субэпителиальной поверхности базальной мембраны. Антитела реа
гируют in situ с эндогенными антигенами подоцитов или с антителами, которые были отфильтрованы и образовали отложения. Болезнь в 80% случаев идиопатическая; иногда она связана с наличием системного заболевания или с применением определенных препаратов, а также может быть вызвана воздействием токсических агентов Типичными признаками заболевания являются диффузное утолщение базальной мембраны и слияние стопообразных отростков. Неравномерное распределение отложений IgG и СЗ выражается в характерной зернистости образца при флуоресцентном исследовании (см. фото). На более поздних стадиях заболевания может развиваться гломерулярный склероз. С клинической точки зрения мембранозный гломерулонефрит является относительно легкой формой нефротического синдрома. Примерно у 40% больных постепенно развивается почечная недостаточность. Болезнь плохо поддается лечению кортикостероидами.
Г. Мембранопролиферативный гломерулонефрит
Мембранопролиферативный гломерулонефрит (МПГН) характеризуется изменениями в базальной мембране и пролиферацией мезангиальных и гломерулярных клеток. Выделяют два типа заболевания, различающиеся патологическими механизмами. Тип I (примерно две трети случаев) связан с СКВ, гепатитом В и С. Субэндотелиальная ткань содержит комплемент и иммуноглобулины, по всей видимости представляющие собой преформированные иммунные комплексы. Тип II (около одной трети случаев) связан с антителами против СЗ конвертазы, называемыми СЗ нефритическим фактором Антитела стабилизируют конвертазу, что приводит к постоянной активации компонента СЗ. Отложения СЗ и других веществ располагаются в гломерулярной базальной мембране. Электронная микроскопия выявляет наличие в базальной мембране характерных электронноплотных депозитов (см. фото). В результате накопления мезангиального матрикса между базальной мембраной и эндотелиальными клетками при обоих типах МПГН стенки капилляров выглядят как двойные линии (напоминают трамвайные рельсы). Данное заболевание, особенно тип II, имеет неблагоприятный прогноз. Только у 30% пациентов не развивается почечная недостаточность. Эффективного метода лечения болезни не существует. Результаты применения кортикостероидов противоречивы.
Гломерулонефрит (I)
и потеря стопообразных отростков
Потеря стопообразных отростков
Альбуминурия
I
Накопление липидов в тубулярных клетках
I
Нефротический синдром
А. Нефропатия с минимальными изменениями
Хорошо реагирует на кортикостероиды; благоприятный прогноз
Электронная микроскопия
ВИЧ-инфекция, героин
Осложнение других ГН
Осложнение компенсаторной гипертрофии
Идиопатический ГН
Отложения IgM, фибрина
отростков
Повреждение эпителиальных клеток
I
Отложения белков, липидов, фибрина
I
Пролиферация мезангиальных клеток
Плохо реагирует на кортикостероиды
Сегментарный склероз
Б. Фокальный сегментарный гломерулосклероз
Клиническая иммунология
Идиопатический
ГН >80% (генетическая предрасположенность)
Инфекции
Опухоли
СКВ
Лекарства
Золото, ртуть
Потеря 4 L стопообразных отростков
Утолщение базальной мембраны
I
Неселективная протеинурия
I
У 40% прогрессирует почечная недостаточность
Плохо реагирует на кортикостероиды
В. Мембранозный гломерулонефрит
Зернистые отложения IgG
Тип I
СКВ, гепатит В и С, инфекции?
• С
Нефротический синдром, острый нефрит
Су бэндотел иа л ь н ые отложения IgG, комплемента
Тип II
Антитела против СЗ-конвертазы I
Активация и расходование комплемента
Отложения СЗ в ГБМ
У 40% прогрессирует почечная недостаточность
У 30% развивается частичная почечная недостаточность
У 30% наблюдается стойкий нефротический синдром
Г. Мембранопролиферативный гломерулонефрит
Эффект «трамвайных путей»
Электронная микроскопия: плотные депозиты
235
Болезни почек
А. Постинфекционный
(диффузно пролиферирующий) гломерулонефрит
Типичным примером данного заболевания является острый постстрептококковый гломерулонефрит (ОСГН), хотя гломерулонефрит может также развиться при инфекционном заболевании, вызванном пневмококками, стафилококками и вирусами. В большинстве случаев через несколько недель после вызванного стрептококковой инфекцией фарингита или кожной инфекции возникает лихорадка и гематурия. Иммунные комплексы, содержащие IgG, и комплемент накапливаются в субэндотелиальном пространстве базальной мембраны. Окрашивание гистологических срезов выявляет обилие различных клеток, диффузную пролиферацию эндотелиальных и мезангиальных клеток, а также увеличение числа лейкоцитов в просвете капилляра. Прогноз благоприятный, особенно у детей; хроническая почечная недостаточность развивается редко. Однако среди взрослых пациентов примерно в 50% случаев наблюдается хроническое прогрессирование заболевания.
Б. Быстро прогрессирующий гломерулонефрит
Быстро прогрессирующий гломерулонефрит (БПГН) следует рассматривать скорее как синдром, а не как специфическое заболевание. Вне зависимости от этиологии, он характеризуется образованием серповидных структур внутри клубочков. Это явление связано с проникновением фибрина в уринар-ное пространство за счет пролиферации париетальных эпителиальных клеток капсулы Боуманна и инфильтрации моноцитами и макрофагами. Принято выделять три типа БПГН, имеющих иммунопатологические особенности
Тип I характеризуется наличием аутоантител против гломерулярной базальной мембраны (анти-ГБМ антитела). Эти антитела иногда участвуют в перекрестных реакциях с базальной мембраной легочных альвеол и вызывают синдром Гудпасчера, связанный с почечной недостаточностью и легочным кровотечением. Иммунопатологическая картина (см. фото) характеризуется равномерным диффузным отложением IgG и часто СЗ вдоль гломерулярной базальной мембраны.
Тип II характеризуется отложением иммунных комплексов. Этот тип БПГН наблюдается при тяжелой форме стрептококкового нефрита, IgA-нефропатии, СКВ и пурпуры Шенлейна-Геноха, а также может иметь неизвестную этиологию (идиопатическое заболевание)
При заболевании типа III («малоиммунный» ГН) не обнаруживают ни иммунных комплексов, ни анти-ГБМ антител. Этот тип часто сопровождается васкулитом,
связанным с наличием антигранулоцитарных антител (АНЦА, см. с. 194).
Клиническая картина БПГН представляет собой картину нефритического синдрома с олигурией и острой почечной недостаточностью. Прогноз зависит от количества пораженных клубочков. Иногда пациентов удается вылечить при помощи агрессивной иммуносупрессорной терапии. При наличии анти-ГБМ антител показан плазмаферез.
В. IgA-нефропатия
IgA-нефропатия — это наиболее распространенное заболевание почечных клубочков. У детей и подростков болезнь часто возникает как осложнение после гриппа. Возможно, существует генетическая предрасположенность к данному заболеванию. Характерной особенностью является отложение IgA в мезанглии (см. фото). Пурпура Шенлейна-Геноха тоже сопровождается отложением IgA в мезанглии, но также в ЖКТ, суставах и коже Мезанглиальные отложения иммунных комплексов IgA вызывают активацию комплемента по альтернативному пути и пролиферацию клеток. В зависимости от тяжести заболевания в почечных клубочках могут наблюдаться либо очаговые сегментарные изменения, либо серповидные структуры, характерные для БПГН. У детей прогноз благоприятный. У взрослых болезнь носит хронический прогрессирующий характер. Более чем у 50% больных развивается почечная недостаточность.
Г. Тубулоинтерстициальный нефрит
Воспалительные изменения в интерстициальных тканях могут происходить в результате инфекции или воздействия определенных препаратов, а также возникать по неизвестной причине. Клиническое исследование выявляет общие симптомы, олигурию и острую почечную недостаточность. Клиническая картина может отягощаться обезвоживанием. Морфологические исследования демонстрируют наличие инфильтрации интерстициальных тканей одноядерными клетками, гранулоцитами и эозинофилами (см. фото). При длительном употреблении лекарств могут возникать гранулемы. Возможно, здесь играют роль реакции гиперчувствительности замедленного типа. Тот факт, что у некоторых пациентов повышен уровень IgE, позволяет считать, что в некоторых случаях наблюдаются реакции гиперчувствительности I типа. Отмена приема вызвавших заболевание препаратов приводит к полной нормализации состояния.
Гломерулонефрит (II) и интерстициальный нефрит
Общие симптомы, гематурия
Клеточная пролиферация во всех клубочках
I i
Дети Взрослые
♦ +
> 80% ~ 50%
излечиваются
Специфическое лечение отсутствует
Клеточная пролиферация
А. Постинфекционный (диффузно пролиферирующий) гломерулонефрит
Тип I: Анти-ГБМ антитела
X с/без легочным кровотечением
Тип II: Иммунные комплексы; идиопатический ГН, осложнение системного, постинфекционного
заболевания или пурпуры Шонлейна-Геноха
Тип III: «малоиммунный»; идиопатический ГН,
I
Почечная недостаточность у 90%
Серповидные образования в клубочках
—гранулематоз Вегенера, узелковый полиартериит
Б. Быстро прогрессирующий гломерулонефрит
Генетическая
предрасполо-
женность, инфекции
Активация
синтеза
IgA
Иммунные комплексы IgA
мезангиальные отложения IgA, пролиферация
мезангиальных клеток
Инфекция дыхательных путей
Гематурия, почечные боли
I I
Дети Взрослые
I I
Излечение Болезнь в боль- медленно
шинстве прогрес-
случаев сирует
В. Иммунные комплексы IgA
Идиопатический ?
Инфекции
Лекарства
Интерстициальные отложения
Интерстициальный е t ... .... отек, увеличение размера почки Образование гранулемы
Лекарства I Лихорадка, эозинофилия, экзантема (25%)
I
Поражение почек (гематурия, протеинурия, лейкоцитурия)
I
Почечная недостаточность (избегать обезвоживания)
Г. Тубулоинтерстициальный нефрит
! а
Агрессивная иммуносупрессорная терапия: высокие дозы стероидов, циклофосфамид
Равномерное отложение IgG
Специфическое лечение отсутствует
Отложения IgA
Регидратация Стероиды??
инфильтрация
Клиническая иммунология
237
Метаболические нарушения
А. Аутоантигены щитовидной железы
Передняя доля гипофиза синтезирует тиреотропный гормон (ТТГ), связывающийся с рецепторами ТТГ на клетках щитовидной железы. Йодид окисляется до молекулярного иода и связывается с тирозином. Монои-одтирозин и дииодтирозин взаимодействуют с тирог-лобулином (Тг) и под действием тиропероксидазы (ТПО) превращаются в трииодтиронин Т3 и тетраиодти-ронин Тд. После отщепления тироглобулина Т3 и Тд попадают в циркуляцию. Перечисленные белки могут являться иммуногенными мишенями, антитела к которым обнаруживаются в крови пациентов с заболеваниями щитовидной железы.
Б. Наиболее важные аутоантитела
В патогенезе наиболее важными аутоантителами являются те, что направлены против рецепторов ТТГ. Они могут имитировать нормальную работу ТТГ (тиреостимулирующие антитела (TSA)), приводя к повышению активности щитовидной железы (гипертиреоз), или полностью блокировать стимуляцию ПГ (ПГ-блокиру-ющие антитела (TSBAJ), ингибируя активность щитовидной железы (гипотиреоз). Третья группа антител (антитела, ингибирующие связывание ТТГ (TBID) способны стимулировать рецепторы ТТГ, но при этом одновременно блокируют связывание ТТГ. Такая ситуация может привести к развитию как гипертиреоза, так и гипотиреоза.
В. Базедова болезнь (болезнь Грейвса)
Базедова болезнь является типичным примером иммуногенного гипертиреоза. Она поражает главным образом женщин и связана с гаплотипами HLA-DR3 и HLA-B8. Основной особенностью заболевания является диффузное увеличение щитовидной железы (зоб). К другим характерным проявлениям заболевания относятся выпячивание глазного яблока (экзофтальм) и ограниченная микседема кожи (уплотнение кожи в результате накопления мукополисахаридов). Повышенный уровень синтеза гормонов Т3 и Тд усиливает чувствительность пациента к катехоламинам, что приводит к развитию нервозности, потливости, непереносимости жары, к уменьшению массы тела, диарее, тремору и тахикардии.
Синтез аутоантител против рецепторов ТТГ предположительно провоцируется вирусными антигенами с высоким уровнем гомологии с рецептором (рис. В2). Клетки типа Тн2 способствуют дифференцировке плазматических клеток и образованию антител при участии ИЛ-4 и ИЛ-6. Аутоантитела, действующие как агонисты (TSA), связываются с рецептором ТТГ, стимулируя синтез гормонов более настойчиво, чем это делает естественный ТТГ. У пациентов с болезнью Грейвса так
же обнаруживают антитела TBII. Эти иммуноглобулины блокируют связывание ТТГ вдоль всего внеклеточного домена рецептора ТТГ. В зависимости от степени развития этого процесса у пациента может наблюдаться гипертиреоз, эутиреоз или гипотиреоз.
Эндокринная орбитопатия (рис. ВЗ) чаще всего наблюдается при болезни Грейвса, но может быть и независимым заболеванием. Экзофтальм (см. фото) связан с отеком глазных мышц (КТ-сканирование), пролиферацией ретроорбитальной клетчатки и инфильтрацией лейкоцитами. Возможно, имеет место перекрестная реактивность эпитопов глазных мышц и ТТГ. Фибробласты ретроорбитальной области по всей видимости секретируют молекулы, сходные с рецепторами ТТГ, и молекулы адгезии, что делает их рецептивными к аутоантителам против рецепторов ТТГ.
Г. Тиреоидит Хашимото
Разрушение щитовидной железы в результате образования зоба Хашимото — это обычная причина возникновения гипотиреоза.Типичными симптомами заболевания являются хроническая усталость, боязнь холода, брадикардия и увеличение массы тела (рис. Д). Микседема — генерализованный отек кожи, чаще всего на лице (см. фото) — связана с накоплением в коже мукополисахаридов. Причина, лежащая в основе возникновения зоба Хашимото, судя по всему, состоит в образовании ФИО, ИЛ-2 и у-ИНФ клетками типа Тц1, что стимулирует СП8^ Т-клетки, ответственные за разрушение ткани щитовидной железы. Опосредованное Т-клетками повреждение ткани щитовидной железы, по-видимому, приводит к высвобождению антигенов и последующему образованию аутоантител, специфичных к ТПО или тироглобулину. В ткани щитовидной железы можно обнаружить картину инфильтрации лимфоцитами и иногда образование целых лимфатических фолликулов (см. фото). Зоб Хашимото связан с наличием антигенов HLA-DR3 и HLA-DR5 и возникает в основном у женщин. Болезнь часто протекает бессимптомно на протяжении многих лет, а клинические симптомы гипотиреоза появляются лишь при значительном разрушении фолликулов щитовидной железы.
Аутоиммунные заболевания щитовидной железы
А. Аутоантигены щитовидной железы
Экзофтальм
Диарея
Тремор
Снижение массы тела
HLADR3+
HLAB8+
Непереносимость жары
Учащенный пульс, тахикардия
1. Клинические Проявления
Мишень АЬ Действие антител
Тироглобулин (Тг) Тг-
Анти-тела
Микросомальный ТПО-антиген, тиро- Анти-пероксидаза (ТПО) тела
Снижение уровня иодирования Тг
TSA
TBII
TSBA
Тиреостимулирующие антитела: гипертиреоз (Базедова болезнь)
Антитела, ингибирующие связывание ТТГ:
гипер- или гипотиреоз
ТТГ-блокирующие антитела: гипотиреоз
Б. Наиболее важные аутоантитела
АПК
Тн2
ИЛ-4, ИЛ-6
В-клетка
В. Базедова болезнь (болезнь Грейвса)
T3,T4tt ттг; 4
2. Иммунопатогенез
®'7Рецептор
Гомология вирусных антигенов и рецептора
▼
Активация CD4+ клеток
HLADR5ft HLADR3t
у-ИНФ г а
*ФНО- ► • CD8 ИЛ-2
Повреждение клеток щитовидной железы
Высвобождение
Тонкие волосы
Брадикардия
Зоб (часто небольшой)
Макроглоссия
Хриплый голос
Непереносимость золота
Гипо-рефлек-
( сия
Д. Клинические проявления гипотиреоза
Метаболические нарушения
Метаболический гормон инсулин регулирует поступление глюкозы из крови в клетки. Сахарный диабет может быть результатом дефицита инсулина (диабет I типа, инсулинзависимый диабет (ИЗСД)) или результатом невосприимчивости тканей к инсулину (диабет II типа). Диабет I типа чаще всего связан с патологическими аутоиммунными реакциями
А. Клинические проявления
Диабет I типа чаще развивается у молодых людей. Невозможность передавать глюкозу клетке вызывает увеличение содержания глюкозы в крови и повышение осмотического давления плазмы. Это в свою очередь приводит к осмотическому диурезу с повышенной частотой мочеиспускания (полиурия), жажде и усиленному потреблению жидкости (полидипсия). У пациентов повышается аппетит (полифагия), но они худеют, поскольку организм не может утилизировать глюкозу. Жирные кислоты высвобождаются из жировых тканей и метаболизируются в печени с образованием кетонов, что приводит к метаболическому ацидозу. Повреждение сосудов (диабетическая микроангиопатия) связано с накоплением гликозилированных белков и полипептидов в стенках сосудов. Гликозилированные продукты вызывают перекрестное сшивание полипептидов, захват липопротеинов и активацию клеток, что способствует развитию атеросклероза. Это одно из основных осложнений диабета на поздних стадиях развития болезни; атеросклероз может привести к инсульту, почечной недостаточности, слепоте и сердечной недостаточности.
Б. Генетическая предрасположенность к ИЗСД
Наличие аллелей HLA-DQ и HLA-DR с серином, аланином или валином в положении 57 p-цепи повышает риск развития диабета I типа (см. с. 64). Наличие остатка аспарагиновой кислоты в данном положении связано со снижением риска ИЗСД. Так называемые «диабетогенные» аллели по-видимому связывают пептиды с отрицательным зарядом в положении 9, а определяющие «устойчивость» к диабету аллели с остатком аспарагиновой кислоты в положении 57 связывают пептиды, имеющие в положении 9 остатки серина, глицина или аланина. Пептиды с положительным зарядом в позиции 9 судя по всему направляют иммунный ответ по пути образования клеток типа Тц2, а пептиды с отрицательным зарядом индуцируют цитотоксический иммунный ответ с участием клеток типа Тц1.
В. Концепции патогенеза
В сыворотке крови пациентов с диабетом I типа содержатся аутоантитела к различным аутоантигенам островковых клеток, например инсулину, белку теплового шока 60 (hsp60) и, что наиболее важно, к глутаматдекарбоксилазе 65 (ГДК-65). Поскольку белки вируса Коксаки имеют высокий уровень гомологии с антигеном ГДК-65, то возможно образование антител с перекрестной специфичностью. Антитела вызывают воспалительную реакцию вокруг р-клеток панкреатического островка, что приводит к привлечению антигенпрезентирующих клеток (инсулит). АПК могут захватывать антигены из поврежденных клеток островка и вызывать Т-клеточный ответ в р-клетках внутри островка. У людей с предрасположенностью к диабету I типа (наличие соответствующих аллелей HLA) превалирует цитотоксический ответ, опосредованный клетками Тн 1. После первичного инфекционного заражения может пройти несколько лет, прежде чем болезнь проявится во всей полноте поскольку для предотвращения симптомов заболевания достаточно небольших количеств инсулина.
Г. Плюригландулярный синдром (ПС)
Плюригландулярный синдром возникает в результате множественных генетических нарушений, проявляющихся одновременно, или в результате иммунного ответа, направленного против антигенов, экспрессируемых различными эндокринными органами. Выделяют три типа заболевания. Тип I чаще возникает у подростков и проявляется в виде адренокортикальной недостаточности (иммунный ответ на 21-гидроксилазу (21-ОН)), гипопаратиреоза (аутоантитела к Са2+-рецептору паращитовидной железы CAS) и хронического кандидоза кожи и слизистых. Иногда наблюдается гипогонадизм, связанный с образованием антител к ферменту, отщепляющему боковые цепи р450 (p450scc), и к ферменту 17а-0Н ПС иногда ассоциирован с хроническим активным гепатитом (аутоантитела к антигенам микросом печени и почек). При наличии аутоантител к внутреннему фактору может возникать пернициозная анемия.
Не зависящий от возраста тип II характеризуется сочетанием адренокортикальной недостаточности и аутоиммунного тиреоидита. В 50% случаев этот тип заболевания ассоциирован с ИЗСД. Тип III характеризуется сочетанием аутоиммунного тиреоидита с другими аутоиммунными заболеваниями (кроме адренокортикальной недостаточности)
Сахарный диабет и аутоиммунный плюригландулярный синдром
Микроангиопатия
Инсульт
„ Ретинопатия Vj Катаракта, глаукома Гипертензия Ишемическая кардиопатия
DRB1-0405
DQB1-0201
DQB1-0302
DQB1 0502
Повышенный риск
Р11
Р1
Связывание пептидов ------
с отрицательным
TCR
Ser/Ala в позиции57
зарядом в позиции 9 (Asp/Glu)
/у-ИНФ / ФНО-а ТН1 ИЛ-12
Полидипсия
Полифагия
Полиурия
1. Ранние симптомы
Гломерулосклероз
Снижение риска
Автономная нейропатия
Периферическая ангиопатия
Гангрена
2. Осложнения на поздних стадиях
DRB1 0403=-
DQB1-0301
DQB1-0602
Р11
Связывание пептидов с положительным
TCR
А. Клинические проявления
Инфильтрация ткани вокруг островка
:=: —
Инфекция, Молеку-^Иммун-
напр., лярная ный ответ
вирус мимикрия против
Коксаки ГДК ГДК
В. Концепции патогенеза
Asp в позиции 57
зарядом в позиции 9 (Ser/Gly/Ala)
/ИЛ-4
/ ИЛ-10
Б. Генетическая предрасположенность
Инфильтрация островка
Локальный иммунный ответ
Г оды с момента появления заболевания
_ -►Высвобож-
___дение других
* аутоантигенов (напр., инсулина)
Генети наруи ческие иения ' 1 Ауто-—антитела Кора над- 21-ОН почечников Паращитовид- / на я железа д Рецептор уровня Са2+ Интерстици-альные клетки О Лейдига 17а-ОН/ p450scc Печень j Цитохром
с мно-_^/^жествен-
ной * реактивностью
Молек\ мими 'лярная 1крия f p450IID6 Париетальные 0 0 j ВнуТренний клетки желудка № фактор Антигены в клетках, синтезирующих стероиды
Тип I (ювенильная форма): Адренокортикальная нед остаточ ность, гипопаратиреоз, кандидоз
Гипогонадизм, хронический гепатит, реже пернициозная анемия
Тип II:
Адренокортикальная нед остаточ ность, аутоиммунный тиреоидит
Тип III:
Аутоиммунный тиреоидит, гипогонадизм, недостаточность яичников
Г. Плюригландулярный синдром (ПС)
Клиническая иммунология
241
Болезни сердца
А. Ревматическая атака
Ревматическая атака (РА) — это воспалительное заболевание затрагивающее сердце, суставы, кожу и центральную нервную систему (рис. А1). Обычно болезнь наступает спустя 1-3 недели после тонзиллярной инфекции, вызванной стрептококками группы А. Острые симптомы, которые могут наблюдаться на протяжении нескольких недель или даже месяцев, иногда приводят к необратимым изменениям в организме. Например, фиброз створок митрального клапана — это одна из наиболее распространенных причин приобретенных болезней сердца у детей и подростков. К наиболее частым клиническим проявлениям относятся кардиты и полиартриты Кардит может затронуть эндокард (клапаны), миокард и перикард; типичным является поражение митрального клапана. Поражение суставов проявляется в виде мигрирующего полиартрита с вовлечением в основном крупных суставов. У 20% пациентов происходят инволюционные изменения мышечной координации (малая ревматическая хорея). К другим наименее частым проявлениям относится ревматоидная эритема — не сопровождающаяся зудом, быстро исчезающая сыпь, образующая красные пятна с округлыми краями и бледной центральной частью, а также подкожные узелки в области сустава на стороне разгибающей мыщцы. Данные проявления представляют собой основные критерии для диагностики ревматической атаки (критерии Джонса). Дополнительными критериями являются лихорадка, повышенные показатели СОЗ и концентрации С-реактивного белка, а также увеличенный интервал PR (ЭКГ).
Ревматической атаке всегда предшествует фаринготонзиллит, вызванный инфекцией р-гемолитическо-го стрептококка группы А (рис. А4). Однако только 3% нелеченных стрептококковых фарингитов приводит к РА, а стрептококковые инфекции кожи — никогда. Только вирулентные, капсулированные штаммы, вызывающие сильную иммунную реакцию на стрептококковые антигены, способны привести к развитию РА (рис. А2). Это главным образом штаммы стрептококка типа М1, 3, 5, 6 и 18. Стрептококковые антигены участвуют в перекрестных реакциях с кардиальными тканями человека, особенно с белками сарколеммы и кардиальным миозином, а также с антигенными структурами суставов и головного мозга. Эпидемиологические исследования показали, что существует наследственная предрасположенность к заболеванию, связанная с наличием HLA-гаплотипов DR1, DR2, DR3 и DR4.
Гранулемы, возникающие при РА, называют гранулемами Ашоффа-Талалаева. Обычно они развиваются около мелких сосудов сердца (рис. АЗ). Эти гранулемы характеризуются наличием центральной зоны фиб
риноидного некроза (результат разрушения коллагена) и пучков мышечных волокон, окруженных одноядерными клетками и фиброгистиоцитарными ашоффскими клетками, а иногда и полиядерными гигантскими ашоффскими клетками. Гранулемы Ашоффа-Талалаева возникают в результате непосредственного повреждения клетки и осаждения иммунных комплексов, содержащих антитела, быстро образующиеся в ответ на различные перекрестно-реактивные стрептококковые антигены. Стимуляция такого иммунного ответа происходит локально в лимфатической ткани при фаринги-те/тонзиллите (рис. А4).
Б. Миокардит
Миокардит возникает в результате инфекционных заболеваний, вызванных различными патогенами В странах Запада наиболее частой причиной миокардита является вирус Коксаки. В Южной Америке болезнь обычно является следствием паразитарной инфекции (болезнь Шагаса, вызванная Trypanosoma cruzi). В начальной стадии репликация патогена в миоцитах приводит к лизису клеток и мионекрозу. На миоцитах экспрессируются молекулы МНС и молекулы адгезии, особенно ICAM-1. В результате презентации вирусных антигенов происходит стимуляцмя гуморального и клеточного иммунного ответа. ФНО способствует образованию цитотоксических Т-клеток, а антитела с перекрестной специфичностью усиливают повреждение клеток Разрушение ткани миокарда приводит к высвобождению внутриклеточных белков таких как миозин, с которыми иммунная система прежде не была знакома.
В. Синдром Дресслера
и постперикардиотомический синдром
Постинфарктный синдром [синдром Дресслера) представляет собой острое заболевание, сопровождающееся лихорадкой, перикардитом и плевритом, которое начинается в большинстве случаев через промежуток времени от 1-2 недель до нескольких месяцев после перенесенного острого инфаркта миокарда. Постперикардиотомический синдром имеет те же симптомы, но развивается в течение двух недель после операции на сердце Оба заболевания связаны с образованием антимиокардных антител, вызывающих лихорадку и воспаление перикарда. Из-за отсутствия сильных воспалительных стимулов этот аутоиммунный процесс является самокупирую-щимся. Лечение состоит в основном в обеспечении постельного режима и назначении нестероидных противовоспалительных препаратов.
Ревматическая атака, миокардит и постинфарктный синдром
Первые признаки
Основные проявления
Температура
coat
(Пан-)кардит
Ревматоидная эритема
С-реак-. тивный белок!
Хорея
PR-интервал!
Подкожные узелки
Артрит
1. Первичные симптомы
+ Капсула
Клеточная стенка
М-белок
Перекрестная реактивность: миозин, тропомиозин, синовия, хрящи, гол. мозг
Лимфоузлы/ миндалины
Стрептококковый фарингит
Группо------► специфические углеводы
Мукопептид
Клапаны
Цитоплазматическая - * мембрана
2. Стрептококковые антигены
Нейроны субталамического и хвостатого ядра
Вегетации клапана
Гранулемы Фибринозный
Ашоффа- перикардит
Талалаева
А. Ревматическая атака
4. Патогенез
Бактерии
Цитотоксические реакции
Паразиты
Риккетсии
к •
\ Г-ч Грибы*
Ж
ВИРУСЫ :
Спирохеты
CD4
Инфекция Экспрессия микробных антигенов, молекул адгезии !
CD8
Антитела у5, с перекрестной реактивностью
Б. Миокардит
1 неделя - После
4 месяца хирургической
после инфаркта операции миокарда . , на сердце
Высвобождение антигенов 0 миокарда
Антитела против сарколеммы ^Антитела N ПРОТИВ миозина
В. Синдром Дресслера
Неврологические заболевания
Клиническая иммунология
Рассеянный (или множественный) склероз (PC) — это заболевание центральной нервной системы с неизвестной этиологией. Болезнь характеризуется наличием множественных очагов демиелинизации, которые постепенно превращаются в склеротические бляшки.
А. Морфологические
и гистопатологические черты
В зонах демиелинизации происходит деградация богатого липидами изоляционного слоя вокруг аксонов, образованного олигодендроцитами. Первичные повреждения проявляются как околососудистые области лимфоплазматической инфильтрации с демиелинизацией отдельных аксонов (рис. А1). Более поздние повреждения характеризуются поражением множества аксонов (рис. А2). Обнаруживаются глиальные филаменты и пенистые клетки — макрофаги и микроглиоциты (макрофаги ЦНС), содержащие в фагосомах миелин. Очаги демиелинизации можно увидеть с помощью метода магнитного резонанса; с течением времени их локализация постоянно меняется (рис АЗ)
Б. Экспериментальный аутоиммунный энцефаломиелит (ЭАЭ)
У животных экспериментальный PC можно вызвать, иммунизируя крыс или мышей очищенными миелиновыми белками, такими как основной белок миелина (ОБМ), протеолипидный белок (ПЛБ), миелиновый олигодендроцитный гликопротеин (МОГ) и миелин-ас-социированный гликопротеин (МАГ). Активированные Т-клетки от иммунизированных животных могут передавать болезнь здоровым особям.
В. Механизмы иммунопатогенеза
Генетическая предрасположенность (наличие HLA DR15/DQ6) в сочетании с внешними факторами (возможно, вирусная инфекция, например человеческий вирус герпеса 6) могут способствовать миграции аутореактивных Т-клеток сквозь барьер, разделяющий головной мозг и кровоток, в ЦНС. Этот механизм опосредован молекулами адгезии лимфоцитов и эндотелиальных клеток. Микроглиальные клетки представляют миелиновые пептиды активированным Т-клеткам, которые подвергаются локальной дифференцировке в клетки типа ТН1 или Тн2. Клетки Тн2 индуцируют активацию В-клеток и синтез аутоантител против миелина, способствующих разложению миелина и стимулирующих дополнительное образование антигенов. Это приводит к образованию олигоклонально-го у-глобулина в цереброспинальной жидкости. Клетки Тн1 активируют астроциты, микроглиальные клетки и макрофаги, которые в свою очередь выделяют ИЛ-1,
ФНО-а, NO, Н2О2 и свободные радикалы. Эти вещества индуцируют апоптоз олигодендроцитов и способствуют их фагоцитозу микроглиальными клетками и макрофагами.
Г. Клинические проявления
Демиелинизация аксонов может ослаблять или усиливать передачу сигнала нервами, в зависимости от того, поражен ли активирующий или ингибирующий нейрон. Если поражены активирующие нейроны, то возможно развитие слабости в конечностях, ухудшение зрения и атаксия. Усиление сигнала, связанное с повреждением ингибирующих нейронов, приводит к мышечным сокращениям, парестезии и симптомам Лермитта (ощущение покалывания, распространяющееся от шеи к ногам при наклоне головы). Болезнь протекает с острыми приступами, чередующимися с периодами частичной ремиссии (рецидивно-ремитти-рующий PC), но в 10-15% случаев носит хронический прогрессирующий характер. У 25% пациентов симптомы имеют относительно легкий характер.
Д. Терапевтические подходы
Наилучшим средством для лечения рецидивно-ремит-тирующего рассеянного склероза являются кортикостероиды (рис. Д1). От одной трети до половины всех пациентов хорошо реагируют на р-ИНФ, хотя механизм действия препарата пока не выяснен. Комбинации синтетических полипептидов (копаксон (глатира-мера ацетат)) имитируют структуру антигенов против основного белка миелина (ОБМ) и восстанавливают толерантность. Пуриновый аналог азатиоприн ингибирует как синтез антител, так и клеточный иммунный ответ. Положительный эффект может оказывать внутривенное введение высоких доз иммуноглобулинов Недавно было продемонстрировано положительное действие моноклональных антител к ад-интегрину.
Лечение хронического прогрессирующего рассеянного склероза требует применения более сильных иммуносупрессоров, таких как метотрексат, циклофосфамид и циклоспорин. В некоторых случаях положительное действие оказывает р-ИНФ (рис. Д2). Экспериментальные стратегии лечения, в том числе с использованием антицитокиновых антител или миелиновых пептидов. приводящих к анергии Т-клеток, атакующих миелин, не дали положительных результатов, а иногда даже усугубляли состояние пациентов. В частности, из-за ухудшения симптомов были остановлены клинические испытания ФНО-блокирующих антител.
244
Рассеянный склероз
1. Первичные повреждения 2. Поздние повреждения
А. Морфологические и гистопатологические черты
3. Применение метода магнитного резонанса
Миелиновые белки:
ОБМ
ПЛБ
МОГ
МАГ
Перенос Т-клеток
Животное заболевает
Б. Экспериментальный аллергический энцефаломиелит (ЭАЭ)
Генетическая
Снижение
синтеза миелина, апоптоз
предрасположенность (DR15, DR6)+ болезнетворные агенты (вирусы? мимикрия?)
Макрофаг Астроцит
CD4
Высвобождение миелиновых антигенов
ИЛ-2 ФНО-а у-ИНФ
ИЛ-4_^
ИЛ-10 1
Диапедез аутореактивных Т-клеток
ИЛ-1, ФНО-а, NO, Н2О2
Микроглия
Активация
В. Иммунопатогенные механизмы
Фагоцитоз
Ауто-АЬ на миелин
Ослабление передачи сигнала
Активирующий нейрон
Нарушение зрения
Парез Атаксия
Г. Клинические проявления
Усиление передачи сигнала
1. Лечение рецидивно-ремиттирующего PC
Корти костерои д ы, Р-ИНФ, полипептиды (глатирамера ацетат), азатиоприн, ВВИГ
2. Лечение первичного прогрессирующего PC
Метотрексат циклофосфамид, (Р-ИНФ), циклоспорин
Д.Терапевтические подходы
Клиническая иммунология
Неврологические заболевания
А. Синдром Гийена—Барре
Синдром Гийена—Барре, или острый первичный идиопатический полирадикулоневрит, представляет собой острое воспаление периферических нервов, вызванное демиелинизацией и характеризующееся восходящим симметричным моторным параличом мыщц ног, глаз, лица и дыхательных путей (рис. А1). Прогноз при данном заболевании благоприятный. Если не возникает серьезных патологий дыхательной системы, то большинство пациентов полностью выздоравливают. Уровень смертности составляет около 5%. Более двух третей пациентов указывают на перенесенную прежде инфекционную болезнь, обычно вызванную Campylobacter jejuni, реже цитомегаловирусную или вызванную вирусом Эпштейна-Барр. Это говорит о возможной роли механизма молекулярной мимикрии в развитии заболевания (рис. А2). Хирургические операции, вызывающие высвобождение антигенов нейронов, могут ускорить болезнь, так же как и лимфома, способствующая пролиферации аутореактивных Т-клеток. Считается, что в патогенезе в качестве аутоантигенов выступают белки миелина (РО, Р1, Р2) и ганглиозиды. Активированные антигенпрезентирующие клетки представляют аутоантигены и вызывают иммунный ответ с участием клеток типа Т|_|1 и Тн2. Активированные макрофаги фагоцитируют миелин и выделяют провоспалительные цитокины, реактивные радикалы кислорода, NO и протеазы. Плазматические клетки, стимулированные Тн2, синтезируют аутоантитела против миелина. Поскольку аутоантитела играют важную роль в патогенезе заболевания, не удивительно, что хороший результат при лечении дает проведение плазмафереза (рис. АЗ). Еще более эффективным оказывается внутривенное введение высоких доз иммуноглобулинов. Эти препараты содержат естественные анти-идиотипические антитела, которые, по-видимому, ингибируют связывание миелин-специфичных аутоантител. Иммуноглобулины также насыщают Fc-рецепторы на макрофагах, ингибируя фагоцитоз покрытых аутоантителами периферических нервных клеток.
Б. Энцефалит Расмуссена
Энцефалит Расмуссена — это детское заболевание, сопровождающееся тяжелыми, неподдающимися лечению эпилептическими приступами, слабоумием и очаговым воспалением головного мозга. У некоторых пациентов обнаруживают аутоантитела к третьей субъединице глутаматного рецептора (GluR3). Глутамат является возбуждающим нейротрансмиттером, способствующим деполяризации центральных нейронов. Ahth-GIuR3 аутоантитела выступают в качестве
агонистов рецептора, связываясь с ним более прочно, чем глутамат. В результате стимуляция рецептора агонистом оказывается более длительной, чем нормальная физиологическая реакция и, следовательно, приводит к массивному эпилептическому возбуждению, как показывает кривая деполяризации мембраны, снятая в присутствии аутоантител.
В. Паранеопластические неврологические синдромы
Паранеопластические неврологические синдромы (ПНС) обычно развиваются в качестве иммунного ответа на антигены, экспрессируемые опухолевыми клетками, но которые также существуют в нервной системе в здоровом организме. Неврологические симптомы часто предшествуют диагностированию опухолевого заболевания. Среди данных антигенов наиболее известен антиген Ни — ядерный белок, присутствующий во всех центральных и периферических нейронах. Белки Ни экспрессируются при мелкоклеточном раке легкого и нейробластоме. Анти-Ни антитела связаны с сенсорной нейропатией и энцефаломиелитом. У больных с мелкоклеточным раком легкого с низким титром анти-Hu антител без признаков ПНС образуются более мелкие опухоли; такие пациенты лучше поддаются лечению и живут дольше, что говорит о возможной роли этих антител в эффективной противоопухолевой реакции.
В отличие от белка Ни, нейрональный ядерный белок Ri существует только в центральной нервной системе. Было показано, что белок Ri является мишенью для аутоантител у пациентов с гинекологическими опухолями и раком молочной железы, сопровождающимся нарушениями подвижности глаз (опсоклонус).
Белки Уо экспрессируются в цитоплазме клеток Пуркинье (нейроны коры мозжечка), а также в клетках некоторых гинекологических опухолей и рака молочной железы. В результате реакций антител против антигенов Уо многие пациенты страдают от паранеопластической дегенерации мозжечка. Большинству пациентов с паранеопластическими синдромами с вовлечением ЦНС не помогают плазмаферез и иммуносупрессорная терапия. Удаление опухоли или ремиссия, вызванная действием лекарств или облучением, может привести к сглаживанию симптомов.
246
Болезни, вызванные аутоантителами
Восходящая симметричная слабость мыщц
Дисфагия
о о
Респираторные и вегетативные нарушения
Хирургическое вмешательство
Высвобождение антигенов
Campylobacter jejuni, ЦМВ, вирус Эпштейна-Барр
I
Молекулярная мимикрия
Опухоли (злокачественные лимфомы)
I
Ауто-реактивные .Т-клетки
1. Клинические черты
б) Высокие дозы ВВИГ
Л1|К
CD4+ W
Т-клетка >
а) Плазмаферез
3.Терапия
2. Патогенез
Клиническая иммунология
А. Синдром Гийена-Барре
Неконтролируемые эпилептические припадки
АЬ против рецептора глутамата
Б. Энцефалит Расмуссена
Центральный нейрон
Антигены Ни и Ri
Нейробластома
Рак легкого
Периферический нейрон
Антиген Ни^>—
Клетка
Пуркинье А _
Антиген Yo^>—
Рак яичников
В. Паранеопластические неврологические синдромы
Неврологические заболевания
А. Миастения гравис
1. Клинические проявления. Миастения гравис (МП — это опосредованное аутоантителами прогрессирующее. провоцируемое нагрузкой заболевание, характеризующееся слабостью и быстрой утомляемостью произвольных мышц. Обычно болезнь в первую очередь поражает глазные мышцы Характерными признаками являются опущение века (птоз) и двоение изображения (диплопия). Когда пациент поднимает глаза вверх, глазное веко начинает опускаться (см. фото). В 20% случаев болезнь поражает только мышцы глаз, но в остальных случаях распространяется дальше (рис. 16). Пациентам бывает трудно жевать, глотать, говорить. МГ может распространиться на конечности и даже на дыхательные пути. Электрофизиологическое исследование демонстрирует характерное снижение мышечного потенциала при повторных стимуляциях (рис. 1в). От первого до пятого стимула мышечный ответ снижается более чем на 10%. При назначении ингибитора ацетилхо-линэстеразы (АХЭ) мышечный потенциал остается на постоянном уровне и птоз может исчезнуть.
2. Патогенез. Распространение потенциала действия до отдаленного конца аксона индуцирует выделение ацетилхолина (АХ) в синаптическую щель, где он связывается с ацетилхолиновым рецептором. Активация рецептора АХ приводит к деполяризации мембран клеток (рис. 2а).
Деполяризация завершается гидролизом АХ при участии ацетилхолинэстеразы Пациенты с миастенией гравис демонстрируют сниженную нервно-мышечную активность, что связано с наличием антител против рецептора АХ. Эти антитела ингибируют деятельность рецептора, вызывая опосредованный комплементом лизис в постсинаптической мембране (рис. 26). Аутоантитела против рецептора АХ также могут блокировать сайты связывания АХ Более того, скорость деградации рецептора АХ повышается после его интернализации при образовании комплекса с аутоантителами. Концентрацию АХ в синаптической щели можно поддерживать на более высоком уровне с помощью ингибиторов холинэстеразы, что приводит к временному улучшению состояния Кроме АХ-рецептора, в качестве аутоантигенов могут выступать белки поперечно-полосатых мышц (актин, миозин, титин).
Примерно в 30% случаев у больных миастенией гравис возникают мелкие, обычно доброкачественные эпителиальные тимомы (рис. 2в). Для этих опухолей характерна аномальная экспрессия нейрофиламентов с такими же эпитопами, как у рецептора АХ и титина. В результате действия механизма молекулярной мимикрии Т-клетки, специфичные к ре
цептору АХ и титину, подвергаются положительной селекции в тимусе и активируются по выходе из тимуса, способствуя образованию аутоантител.
У 70% пациентов с миастенией гравис наблюдается лимфофолликулярная гиперплазия вилочковой железы (рис. 2г). Инфильтрующие В-клетки образуют зародышевые центры (см. фото) МГ часто ассоциирована с наличием аллелей HLA-B8 и HLA-DR3. В тимусе обнаруживают клетки, несущие АХ-рецеп-тор, которые напоминают клетки мышц (миоидные клетки). Миоидные клетки образуют в тимусе агрегаты с дендритными клетками, которые, по всей видимости, способны представлять антигенные АХ-рецепторы CD4+ Т-клеткам, в результате чего непосредственно в тимусе начинают образовываться антитела, специфичные к АХ-рецептору. Эта гипотеза подтверждается тем фактом, что аутоантитела, обнаруженные у пациентов с миастенией, сопровождающейся поражением тимуса, специфически узнают эмбриональную форму АХ-рецептора, обнаруживаемую в постнатальном периоде только в тимусе и мышцах глаз.
Б. Синдром Ламберта-Итона
Миастенический синдром Ламберта-Итона напоминает миастению гравис, однако в данном случае в первую очередь страдают не мышцы лица, а мышцы таза. В отличие от МГ данный синдром характеризуется автономными симптомами, например, сухостью ротовой полости и нарушением мочеиспускания. В пресинапти-ческой мембране у пациентов с миастеническим синдромом обнаруживаются антитела против кальциевых каналов, ингибирующие выделение АХ. Это затрудняет передачу стимулирующего сигнала постсинаптической мембране. После серии стимуляций пресинаптический блок временно преодолевается, и ацетилхолин может поступать в более высоких концентрациях, что приводит к повышению амплитуды потенциала действия по сравнению с начальным уровнем. Впервые данный синдром был описан как паранеопластический синдром, связанный с определенным видом рака, особенно с мелкоклеточным раком легкого. Иногда появление этого синдрома предшествует диагностике ракового заболевания Существуют доказательства, что некоторые антитела могут участвовать в перекрестных реакциях с опухолевыми клетками.
Миастения гравис и синдром Ламберта-Итона
а) С поражением глазных мышц
Диплопия
Т рудности при жевании
Ослабление дыхательных мышц
б) Генерализованная форма
1. Клинические признаки миастении гравис
бооос ооооо ментом
а) Нейромышечная активность
2. Патогенез
А. Миастения гравис
Синтез антител
Лизис, опосредованный компле-
Уменьшение числа АХ-рецепторов б) Изменения при МГ
Сухость во рту
Рак легкого
Слабость мышц плеч и таза
Нарушение мочеиспускания
Б. Синдром Ламберта-Итона
Гнусавость
Дисфагия
на стимулы
Улучшение после приема ингибитора АХЭ в) Электрофизиологическое
исследование
Дефект Т-клеточных ^взаимодействий
Экспрессия рецептора жАХ/титина в опухолевой ткани в) МГ при тимоме
Миоидные клетки в тимусе
АПК CD4
Снижение синтеза АХ
Перекрестная реактивность опухолевых клеток с пресинаптическими кальциевыми каналами
Болезни глаз
Клиническая иммунология
А. Защитные механизмы
Веко представляет собой механический барьер, защищающий глазное яблоко. Веко содержит сальные, потовые и слезные железы. Регулярный мигательный рефлекс обеспечивает влажность конъюнктивы. Слезная жидкость постоянно смывает с поверхности глаза микробы и частицы пыли. Слезы обладают антимикробным действием, поскольку содержат антитела IgA, лизоцим, лактоферрин и комплемент, а также клетки моноцитов и гранулоцитов. Таким образом, слезная жидкость служит первичным, неспецифическим барьером против инфекций и антигенов. В конъюнктиве также содержатся антиген-презентирующие клетки.
Б. Конъюнктивит
Конъюнктивит может быть вызван действием бактерий, вирусов, грибов, паразитов, а также химических и физических агентов (кислоты, ультрафиолет). Начало болезни характеризуется усилением притока крови (гиперемия), зудом и светобоязнью (фотофобией). У людей с пониженным уровнем образования слезной жидкости болезнь носит более серьезный характер. Например, при синдроме Шегрена наблюдается сильное снижение выработки слезной жидкости и изменение ее состава (см фото и с. 200)
В. Аллергический конъюнктивит
Пыльца и молодые побеги являются обычными причинами сезонного аллергического конъюнктивита, а пыль, перья птиц, домашний пылевой клещ и шерсть животных вызывают хронический, не зависящий от сезона конъюнктивит. Обе формы заболевания представляют собой анафилактические реакции гиперчувствительности I типа (см. с. 77), при которых происходит дегрануляция тучных клеток и базофилов. Повышается уровень IgE в сыворотке и слезной жидкости. У многих людей происходит повышенное выделение секрета слизистой оболочки носа (ринорея). Сочетание аллергического конъюнктивита и атопического дерматита называют атопическим кератоконъюнктивитом.
Весенний конъюнктивит представляет собой двустороннее рецидивирующее воспалительное заболевание, характеризующееся гипертрофией сосочков верхнего века (см. фото). Такая картина чаще наблюдается у детей, страдающих экземой или астмой Наличие в сосочках тучных клеток, эозинофилов и CD4+ Т-клеток говорит о том, что после реакции гиперчувствительности I типа наблюдается реакция гиперчувствительности замедленного типа (тип IV) Гигантский папиллярный конъюнктивит имеет такие же проявления, как и весенний конъюнктивит, но его
причиной является повышенная чувствительность к контактным линзам
Г. Патология роговицы
Роговица представляет собой кристально прозрачную структуру, которая вместе со склерой формирует наиболее важную защитную оболочку глаза. Воспаление роговицы называется кератитом и может привести к образованию рубцов и слепоте Наиболее распространенной причиной кератита является инфекционное заболевание, вызванное вирусом простого герпеса (HSV) Вирус HSV типа 1 содержит белки, напоминающие по структуре белки роговицы. Недав но был выделен кератогенный пептид. Локальная инфекция, вызванная HSV, способствует образованию новых сосудов и повышает вероятность перекрестных иммунных реакций на этот пептид. Возникновение сосуда в роговице, в норме не содержащей сосудов, приводит к поступлению туда лимфоцитов и воспалительных клеток. Выделение цитокинов способствует повреждению эпителия. Могут также возникать язвы роговицы (см. фото).
Д. Патологии склеры
Склера представляет собой белок глаза Она составляет внешний слой глазного яблока и придает ему прочность. Склеру пересекают несколько кровеносных сосудов, но ее собственное кровоснабжение довольно ограниченное. Зписклерит — это воспаление внешней поверхности склеры, а склеритом называют воспаление более глубоких слоев. Воспаление часто бывает вызвано инфекцией, но во многих случаях трудно отделить эффект, вызванный прямым воздействием патогена, от эффекта, оказываемого патологическими иммунными реакциями. Воспаление склеры часто сопровождает системные заболевания, такие как ревматоидный артрит, соединительнотканные дисплазии или васкулиты. Внутри кровеносных сосудов и вокруг них может происходить накопление иммунных комплексов, что способствует активации комплемента хемотаксису гранулоцитов и в конечном итоге приводить к некрозу (см. фото). Наиболее серьезным осложнением воспалительного заболевания является перфорация глазного яблока.
252
Воспаления внешних структур глаза
Слезная железа Механическая защита
А. Защитные механизмы
Секреция IgA
Лизоцим
Гранулоциты----
Моноциты
Антимикробная активность
Клетки Лангерганса в конъюнктиве
1. Причины
Б. Конъюнктивит
3. Синдром Шегрена
Пыльца, грава, цветы
IgE-связанные антигены
Связывание тучных клеток
Высвобождение гистамина
Сезонный конъюнктивит
В. Аллергический конъюнктивит
Пленка слезной Вирусы (HSV), жидкости бактерии, паразиты
. Идиопатическая
Роговица форма, БТПХ
Ревматоидный артрит, синдром Шегрена, панартериит, СКВ, । > гранулематоз
Вегенера
1. Нормальная 2. Этиология роговица
3. Неоваскуляризация
4. Повреждение 5. Язва роговицы эпителия
Г. Патология роговицы
Сетчатка
гриоы, паразиты
)<ориоидея Идиопатическая
форма в 50%
Склера
Ревматоидный артрит, синдром Шегрена, панартериит, СКВ, гранулематоз
Эписклера Вегенера
1. Нормальная 2. Этиология
склера
Д. Патологии склеры
3. Эписклерит
4. Склерит 5. Некроз склеры
Болезни глаз
Увеит представляет собой воспалительное заболевание увеального тракта — богатой сосудами части глаза, состоящей из радужной оболочки, ресничного тела и собственно сосудистой оболочки глаза. Воспалительные процессы в сетчатке (ретинит) и стекловидном теле (витрит) также можно назвать увеитом. Из дидактических соображении мы будем использовать анатомическую классификацию увеитов.
А. Передний увеит
К переднему увеиту относятся воспаления радужной оболочки (ирит), ресничного тела (циклит) или оба одновременно (иридоциклит). Передний увеит может сопровождаться Н1_А-В27-ассоциированной спондилоартропатией (см. с. 186), инфекционными или системными заболеваниями. Обычные «идиопатические» формы переднего увеита связаны с наличием HLA-B27. Гетерохромный увеит (болезнь Фукса) — это подтип заболевания, характеризующийся депигментацией и выцветанием радужной оболочки и минимальным воспалительным ответом. По всей видимости, механизм молекулярной мимикрии способствует образованию антител с перекрестной специфичностью, которые накапливаются в виде иммунных комплексов и индуцируют дальнейшее разрушение ткани. Основными клиническими проявлениями являются отек, депигментация и выцветание радужной оболочки, а также сужение зрачка (миоз). При иридоциклите также наблюдается помутнение стекловидного тела. Может происходить сращение радужной оболочки с передней капсулой хрусталика, что связано с эксудацией секрета в переднюю камеру. Эти секреты обычно имеют желатиновую консистенцию, иногда с кровью.
Б. Промежуточный увеит
Воспаления стекловидного тела (витрит), плоской части ресничного тела или передних участков сетчатки (периферический ретинит) обычно имеют идиопатическую природу (в 70-80% случаев). Изредка их причиной бывает саркоидоз, рассеянный склероз и болезнь Лайма. Болезнь развивается в результате миграции лейкоцитов в стекловидное тело, где они агрегируют, образуя «снежные шары». Это приводит к помутнению стекловидного тела. Глиальные клетки на плоской части пролиферируют, вызывая образование так называемых «снежных заносов». На более поздних этапах болезни стекловидное тело может сокращаться и отслаиваться от сетчатки; возникает отек макулы. Считается, что активированные Т-клетки, секретирующие у-интерферон, индуцируют образование так называемых высоких эндотелиальных венул (HEV, см. с. 74). Эти активированные эндотелиальные клетки отличаются высоким уровнем экспрессии молекул адгезии и молекул МНС
класса II, в результате чего они могут осуществлять презентацию антигенов Т-лимфоцитам, вызывая тем самым иммунный ответ. Более того, HEV могут участвовать в локальном привлечении Т-клеток.
В-Ж. Задний увеит: причины, связь с другими заболеваниями, клинические черты
Наиболее распространенной формой заднего увеита является хориоретинит; отдельно хориоидит встречается редко. Эти воспаления вызываются бактериальными, вирусными, паразитарными или грибковыми инфекциями. системными заболеваниями (васкулит) и гранулематозными заболеваниями, особенно саркоидозом. Причины некоторых форм болезни, например хориоре-тинопатии birdshot, острой задней многоочаговой пла-коидной пигментной эпителиопатии (ОЗМППЭ) и серпигинозного хориоидита до сих пор не известны. Ниже перечислены некоторые важные типы заболевания.
Токсоплазмоз (рис. Г) является одной из наиболее распространенных причин увеита у иммунокомпетентных пациентов. Болезнь может иметь полисистемный характер, если была передана плоду через плаценту, или выражаться в хориоретините, если приобретена во взрослом возрасте. Обычно заболеванию сопутствует витрит, а также ретинит с отеком макулы и сегментарным васкулитом Необходимо проводить лечение антибиотиками, особенно в том случае, когда наблюдаются повреждения задней камеры, а также при лечении иммунокомпромиссных пациентов.
При саркоидозе (рис. Д) гранулемы могут образовываться в любой части глаза, вызывая конъюнктивит, кератит, иридоциклит, васкулит сетчатки, а также па-пиллит, способствующий разрушению нервных волокон сосочков. Может происходить поражение сетчатки в сочетании с вовлечением в заболевание ЦНС.
При гистоплазмозе (рис. Е) гиперчувствительность к антигенам Histoplasma capsulation приводит к хроническому иммунному ответу с субретинальной пролиферацией. В макулярной, перипапиллярной и периферической областях сосудистой оболочки глаза могут образовываться рубцы.
Существует строгая зависимость между наличием HLA-A29 и хориоретинопатией birdshot — редким заболеванием людей среднего возраста, не страдающих никакими другими заболеваниями (рис. Ж). У людей, имеющих аллель HLA-A29, риск заболевания возрастает в 224 раза. По-видимому, иммунная реакция на белки сетчатки ответственна за гранулематозные изменения внутри сетчатки и под ней, проявляющиеся в виде пятен цвета кофе с молоком на глазном дне. Предполагается, что здесь имеет место очаговая депигментация меланоцитов хориоидеи, по аналогии с витилиго на коже
Увеит (I)
Радужная Циклит оболочка
Идиопатический (50%) — «~4Д|
Связь с HLA-B27 Молекулярная
гмимикрия HLA-B27
Связь со спондило- г
артропатией Поли-
Иридоциклит
А. Передний увеит
Герпес, иерсиниоз, боррелиоз
Гетерохромный увеит (болезнь Фукса)
Болезнь Бехчета, ЮРА, саркоидоз
клональная В-клеточная
Отложение иммунных комплексов
Задний Периферичес-циклит кий ретинит
Витрит;*
«Снежные заносы»
L «Снежны^
/С шары»
Кистозный отек
Идиопатический (70%)
Саркоидоз
Болезнь Лайма
Множественный склероз
Антиген?
Активация Т-клеток
у-ИНФ Эндо- I телий I HEV
Презентация^ антигена *
макулы
Б. Промежуточный увеит
Стекловидное тело
Пролиферация Т-клеток
Сифилис ЦМВ Гистоплазмоз Узелковый Ретинопатия birdshot
Туберкулез EBV полиартериит
Боррелиоз HSV - — Болезнь Бехчета ОЗМППЭ
Проказа HZV Токсоплазмоз — —
Болезнь Виппля ВИЧ ф Саркоидоз Серпигинозный
Бруцеллез хориоидит
В. Задний увеит: причины, связь с другими заболеваниями, клинические черты
Врожденный/ приобретенный
Витрит Ретинит/папиллит Воспаление передней камеры глаза
Инфильтрация сетчатки + пигментные рубцы
Г. Токсоплазмоз
Рубцевание сетчатки
Васкулит сетчатки
Гранулематозный папиллит
4
Разрушение нервного волокна
Инфильтрация хориоидеи
Д.Саркоидоз
Г иперчувствительность к Ад гистоплазмы
Субретинальная пролиферация, кровотечение
Рубцы в периферической и перипапиллярной зонах
Е. Гистоплазмоз
Повреждение в области макулы
HLA-A29: ОР = 224!!
Связывание S-антигенных пептидов?
Гранулематозное воспаление в/под сетчаткой
Пигментные пятна
Ж. Хориоретинопатия birdshot
Болезни глаз
А. Панувеит: причины и связь с другими заболеваниями
Панувеит — это воспалительное заболевание, при котором поражается весь увеальный тракт. Обычно заболевание бывает вызвано бактериальными инфекциями, особенно спирохетами (боррелиоз Лайма и сифилис), вирусными инфекциями (особенно ЦМВ и ВИЧ), аутоиммунными заболеваниями, связанными с аутоантигенами глаза, хроническим гранулематозным заболеванием и васкулитом.
Б. Увеит и болезнь Бехчета
Болезнь Бехчета (см. с. 190) — одна из наиболее частых причин возникновения слепоты в странах Среднего Востока и в Японии. Болезнь связана с наличием гаплотипа HLA-B5; у людей с таким гаплотипом риск развития заболевания повышен в семь раз. Поражение глаз отмечается у 80-90% больных с синдромом Бехчета. Типичным проявлением болезни являются рецидивы стерильного гипопиона, представляющего собой отложения асептического гноя в передней камере глаза (см. фото). Исследование глазного дна выявляет наличие васкулита с периваскулярной эксудацией, затрагивающей как артерии, так и вены, которые расширяются и становятся извилистыми. Постепенно в результате локального накопления иммунных комплексов и комплемента, а также вызванного ИЛ-8 локального привлечения нейтрофилов происходит развитие некротизирующего лейкоцитокластического васкулита.
В. Синдром Фогта-Коянаги-Харады
Синдром Фогта-Коянаги-Харады характеризуется экспрессией молекул МНС класса II меланоцитами, что, возможно, является результатом вирусной инфекции. Экспрессия молекул МНС класса II способствует презентации аутоантигенов Т-клеткам. У лиц, имеющих антигены HLA-DR4 и HLAw53, риск заболеть выше соответственно в 16 и 34 раза. Увеит начинается с симптомов двусторонней гиперемии и отека задней части сосудистой оболочки. Затем происходит накопление субретинальной жидкости. На более поздних этапах заболевания может развиваться ирит и отек в области ресничного тела. Типичными симптомами в ЦНС являются менингизм и головные боли, которые могут сопровождаться потерей слуха, шумом в ушах и головокружениями. Может также иметь место фрагментарная депигментация кожи (витилиго) и бровей (седина) и облысение (алопеция).
Г. Многоочаговый хориоидит и панувеит
Причина болезни неизвестна. Данное состояние пред-ставялет собой вариант хориоретинита, характеризующийся наличием множественных новых повреждений
и фиброзных изменений. Часто сопровождается вит-ритом. Возможно, причиной заболевания является вирус Эпштейна-Барр.
Д. Симпатическая офтальмия
Симпатическая офтальмия — это двустороннее гранулематозное воспаление увеального тракта, которое может привести к слепоте. Существуют генетические факторы, предрасполагающие к возникновению заболевания. Непосредственной причиной болезни обычно является проникающее ранение глаза или (редко) хирургическая операция на глазу Воспаление развивается на протяжении промежутка времени от двух недель до трех месяцев. Предполагается, что аутоантигены представляются CD4+ Т-клеткам эпителиальными клетками сетчатки и клетками Мюллера. Позже на всей протяженности увеального тракта появляются множественные гранулемы, причем они возникают как в поврежденном, так и в здоровом «сочувствующем» глазу. При этом преобладающим типом клеток являются цитотоксические Т-клетки. Типичное проявление заболевания — наличие узелков Далена-Фукса, состоящих из гистиоцитов и депигментированных клеток пигментного эпителия сетчатки. Хотя применение иммуносупрессоров может замедлить распространение болезни, единственным способом предотвращения симпатической офтальмии является ранняя энуклеация поврежденного глаза.
Факогенный увеит представляет собой аутоиммунную реакцию, вызванную появлением антигенов хрусталика в стекловидном теле после удаления катаракты. С усовершенствованием методов хирургии глаз это заболевание становится все более редким.
Е. Офтальмологические осложнения системных заболеваний
Офтальмологические осложнения сопровождают целый ряд системных заболеваний, таких как ревматоидный артрит (РА), спондилоартропатия (СПА), системная красная волчанка (СКВ), синдром Шегрена (СШ), ювенильный ревматоидный артрит (ЮРА), гранулематоз Вегенера (ГВ), узелковый полиартериит (УПА), болезнь Бехчета (ББ) и саркоидоз (см. Таблицу).
Увеит (II) и глазные проявления системных заболеваний
Сифилис Иерсиниоз Боррелиоз
ЦМВ Симпатическая
Эпштейна- офтальмия
Барр
ВИЧ Факогенный увеит
Болезнь Бехчета rQ
Саркоидоз * « ♦
Синдром
Фогта-Коянаги-Харады
Многоочаговый хориоидит и панувеит
А. Панувеит: причины и связь с другими заболеваниями
Облитерирующий васкулит сетчатки
Б. Увеит и болезнь Бехчета
Гипопион Неврит,
сопровождающийся васкулитом
Двусторонний панувеит
ВЦНС:
Менингизм Головные боли Плеоцитоз
Потеря слуха, шум в ушах
Витилиго, алопеция
Отслоение сетчатки
от хориоида
В. Синдром Фогта-Коянаги-Харады
CD4
-ФИО
Клетки Мюллера
Повреждение
хориоида
Эпштейна-Барр??
Витрит
Хориоретинит
Рубцевание в области макулы
Переход в хроническую форму
Г. Многоочаговый хориоидит и панувеит
HLA-A11 Проникающее ранение
Правый глаз: рубец
Левый глаз: развитие ирита
Д. Симпатическая офтальмия
РА СПА СКВ сш ЮРА ГВ
Сухость конъюнктивы + + ++ +
Кератит, язвы роговицы ++ + + + + +
Эписклерит, склерит ++ 4- + 4-
Передний увеит + + + + ++
Васкулит + + + 4-
Хориоидит, панувеит +
УПА
ББ
саркоидоз
Е. Офтальмологические осложнения системных заболеваний
Клиническая иммунология
Иммунология репродукции
А. Иммунное бесплодие
Мужское бесплодие может быть обусловлено образованием аутоантител против акросомальных белков сперматозоидов или антигенов мембранных пептидов, которые иммобилизуют сперму (рис. А1). Женское бесплодие может быть связано с изоантителами к сперме или аутоантителами к антигенам блестящей оболочки яйцеклетки, которые ингибируют накопление спермы и ее проникновение в яйцеклетку (рис. А2). Возможным подходом к лечению является снижение концентрации антител путем предотвращения воздействия антигенов или путем иммуносупрессии (рис. АЗ). Альтернативой является внутриматочное оплодотворение Наилучшие результаты достигаются при оплодотворении in vitro. Введение сперматозоида непосредственно в цитоплазму позволяет полностью преодолеть иммунологические барьеры.
Б. Иммунные взаимоотношения матери и плода
Для организма матери плод представляет собой нечто вроде аллогенного трансплантата, иммунный ответ против которого необходимо подавлять. При нормальной беременности превалирует гуморальный иммунитет, связанный с повышенным уровнем цитокинов клеток типа Тн2. Гуморальный иммунный ответ варьирует от образования цитотоксических антител lgG2 (индуцированного клетками Тн1) до образования нецитотоксических антител lgG1 (индуцированного клетками Тн2). Преобладание ТН1-клеточного ответа связано с повышенным риском выкидыша. Кроме того, прогестерон стимулирует образование лимфоцитами прогестерон-индуцированного блокирующего фактора (ПИБФ). Этот фактор подавляет пролиферацию лимфоцитов, активацию клеток-киллеров и образование ФИО. У женщин, перенесших многочисленные выкидыши, только небольшое количество лимфоцитов секретируют ПИБФ. Кроме того, прогестерон и ПИБФ способствуют Тн2-клеточному иммунному ответу.
Трофобласты тоже вырабатывают иммуносупрессорный фактор. Антиабортивное действие ИЛ-10, продемонстрированное в экспериментах на животных, возможно, говорит о важной роли этого цитокина при беременности. Кроме того, человеческая плацента не имеет классических антигенов HLA класса I (А, В и С). Это предотвращает узнавание отцовских антигенов, представляемых в плаценте материнскими Т-клетка-ми, но делает ткани плаценты мишенью для клеток-киллеров, которые могут распознавать клетки без молекул HLA класса I. Однако на материнской стороне плаценты экспрессируется неклассическая молекула HLA-G, относящаяся к HLA класса lb, которая взаимодействует с ингибирующими рецепторами на НК-клет
ках, защищая плаценту от НК-опосредованной цитотоксичности. Еще один защитный механизм состоит в экспрессии Fas-лиганда на трофобластах. Это обеспечивает удаление экспрессирующих Fas-активированных Т-лимфоцитов матери через апоптоз.
В. Аутоиммунные синдромы новорожденных
Материнские аутоантитела могут проходить сквозь плаценту и попадать в плод. При иммунной тромбоцитопенической пурпуре (ИТП, см. с. 136) аутоантитела против гликопротеинов тромбоцитов попадают в плод, где могут вызвать геморрагические симптомы от слабого кровотечения до внутричерепного кровоизлияния. Часто это случается вскоре после родов. Иммуноглобулины, ингибирующие связывание ТТГ (TBII), могут вызвать транзиторный врожденный гипотиреоз у детей, рожденных от матерей с аутоиммунным тиреоидитом (см. с. 238). Тиреостимулирующие антитела (TSA), характерные для болезни Грейвса, могут вызывать гипертиреоз у новорожденных. Транзиторная миастения новорожденных (см. с. 248) может развиваться в результате прохождения через плаценту аутоантител против ацетилхолинового рецептора.
Аутоантитела против кардиолипина повышают риск тромбоза, который может привести к транзитор-ному нарушению мозгового кровообращения или инсульту. Еще одним возможным осложнением является инфаркт плаценты, связанный с повышенной вероятностью выкидышей у больных волчанкой. Наличие у беременной женщины аутоантител против кардиолипина часто сопряжено с тромбоцитопенией. У детей, рож^нных матерью с СКВ или синдромом Шегрена, может иметь место волчанка новорожденных (см. с. 198, 200), что объясняется проникновением сквозь плаценту аутоантител SS-A (анти-Ro) и SS-B (анти-La) Волчанка новорожденных характеризуется транзиторной сыпью, аналогичной той, что наблюдается при дискоидной волчанке, цитопенией, а также врожденной атриовентрикулярной блокадой с брадикардией.
258
Иммунология репродукции
„ Бесплодие
<3 (аутоантитела)
Бесплодие У (аутоанти-' тела или
изоантитела, т.е. антитела
Яйцеклетка
Антигены блестящей оболочки яйцеклетки
1. Антигены
А. Иммунное бесплодие
2. Ауто- и изоиммунность
Предотвращение контакта со спермой на 6-12 мес
Внутриматочное оплодотворение
Иммуносупрессоры
Оплодотворение in vitro (введение сперматозоида в цитоплазму)
3. Лечение бесплодия
АПК Трофобласт
сигнал
FAS-L FAS
Трофо- Т-клетка бласт
Апопто-тическая
клетка
Б. Иммунологические взаимоотношения матери и плода
Транзиторный гипертиреоз
Транзиторный гипотиреоз
Транзиторная миастения В 20%
беременностей у матерей
Затруднения с миастенией при глотании и дыхании
ИТП
На 1-7-й день после рождения
Транзиторная волчанка новорожденных
В. Аутоиммунные синдромы новорожденных
Вакцинация
Хорошая вакцина должна удовлетворять целому ряду требований Вообще целью иммунизации является защита реципиента от конкретного заболевания при обеспечении минимально возможного риска и побочных явлений Защитное действие вакцины в идеале должно быть полным и длительным (рассчитанным на несколько лет или на всю жизнь). Цена производимых вакцин должна быть приемлемой для большей части населения. Кроме того, вакцина должна быть широко доступна и иметь длительный срок годности. Потребность в вакцинах зависит от текущей эпидемиологической ситуации и цели иммунизации: для индивидуальной защиты, выработки иммунитета у населения (некоторые патогены не становятся эндемичными, если иммунизирована хотя бы часть населения) или полного искоренения патогена, как это произошло с прививкой против вируса оспы. Вакцины для активной иммунизации можно разделить на четыре группы: анатоксины (токсоиды), расщепленные вирусные вакцины, инактивированные и живые вакцины.
Анатоксины. В том случае, когда иммунный ответ направлен против определенного продукта жизнедеятельности патогена, например, против токсинов Corynebacterium diphtheriae или Clostridium tetam, возможно создать вакцину на основе только той части токсина, которая ответственна за нейтрализацию антигена. Анатоксины обычно вводят в организм вместе с дополнительными веществами (адъювантами), необходимыми для усиления иммунного ответа.
Расщепленные вирусные вакцины — это вакцины на основании очищенных субъединиц вируса, обычно его оболочки. Однако при использовании бактерий, образующих углеводную капсулу, такой иммунизации недостаточно, особенно для детей.
Инактивированные вакцины готовятся из инактивированных бактерий и эффективны против внеклеточных организмов. Они индуцируют адекватный иммунный ответ, например, в случае холеры. Защитный эффект такой вакцинации имеет ограниченный срок действия, следовательно, необходимо периодическое введение бустер-дозы.
Живые вакцины оказывают наибольшее количество побочных явлений и связаны с наибольшим риском развития заболеваний. Однако они являются наиболее эффективными в стимуляции адекватной защитной реакции, особенно в тех случаях, когда иммунный ответ на действие патогена опосредован Т-клетками.
А. Порядок вакцинации детей
В Германии рекомендованная схема вакцинации начинается с самого раннего возраста и следует определенному порядку, адаптируемому в соответствии с новейшими медицинскими данными. Эта схема
включает вакцинацию против столбняка, дифтерии, полиомиелита, Haemophilus influenzae, кори, свинки, краснухи и гепатита В. Тот факт, что эти прививки рекомендованы системой здравоохранения, обеспечивает их покрытие страховкой и компенсацию в случаях возникновения заболеваний, связанных с проведением вакцинации. В Германии вакцинация против коклюша и введение БЦЖ рекомендованы только при наличии высокого риска, т.е. их рассматривают в качестве необязательных и рекомендуют только в случае необходимости.
Проведение вакцинации противопоказано при следующих обстоятельствах: острое инфекционное заболевание, болезни крови, врожденные и приобретенные нарушения иммунитета, гиперчувствительность к каким-либо ингредиентам вакцины. Использование любых живых вакцин, за исключением живой оральной вакцины против полиомиелита, строго противопоказано при беременности. Инактивированные вакцины, такие как вакцина против холеры, также могут вызвать сильный иммунный ответ. Живые вакцины следует вводить по очереди с перерывами не менее четырех недель.
Обзор
Введение бустер-дозы
Основная вакцинация
Туберкулез
Краснуха -для девочек
Корь Свинка Краснуха
Полиомиелит
Полиомиелит -оральная вакцина
До сих пор в некоторых странах
Н. Influenzae, столбняк, дифтерия, коклюш
Л6
п/к
Рождение 3
11-14
14
Возраст (мес)
Возраст (годы)
Тест ППД (туберкулин)
Определение титра антител
А. Порядок вакцинации детей
Патоген Показания Побочные эффекты Противопоказания
Гепатит В: рекомбинантная вакцина HbsAg Работники больниц Пациенты на диализе Члены семей носителей гепатита В Проститутки Гомосексуалисты Наркоманы Путешествующие в эндемичные районы Краткосрочная лихорадочная реакция Беременность Наличие аллергии
Г рипп: инактивированная вакцина Тяжело больные Люди старше 60 лет Аллергические реакции (редко) Острые заболевания Аллергия на яичный белок
Бешенство: инактивированная вакцина После укуса животного До укусов: ветеринарам, лесничим, охотникам и др. Лихорадка, опухание лимфоузлов До укусов: аллергия на неомицин и тетрациклин в вакцине
Пневмококк: инактивированная вакцина (капсульные полисахариды 14 серотипов) Спленэктомия Серповидно-клеточная анемия Местное воспаление Текущая пневмококковая инфекция, хроническое гнойное заболевание
Клиническая иммунология
Перед путешествием в эндемичные районы
Холера: инактивированная вакцина
Слабая лихорадка
Аллергия
Желтая лихорадка:
живая ослабленная вакцина (D17)
Тифоидная лихорадка: живая вакцина
Б. Факультативная вакцинация
Слабая лихорадка
Нет
Беременность Аллергия на яичный белок
Для пациентов из групп риска использовать инактивированную вакцину
261
Вакцинация
Благодаря созданным на сегодняшний день вакцинам многие инфекционные заболевания удалось в большой степени предотвратить или полностью искоренить во многих частях света Тем не менее ощущается нехватка вакцин, обеспечивающих длительную защиту от множества патогенов, использующих разнообразные механизмы подавления иммунной системы хозяина. Наиболее важными примерами являются микобактериальные инфекции (например, туберкулез) и паразитарные заболевания (малярия, лейшманиоз). Сегодня на помощь создателям вакцин приходят методы генетической инженерии.
А. Синтетические пептиды
Синтетические пептиды для вакцинации содержат только эпитопы протективных антигенов и не содержат других частей белка, оказывающих негативное (подавляющее) действие на иммунный ответ, обладающих токсической активностью или способных к перекрестным реакциям с эндогенными пептидами. Большинство пептидов стимулируют развитие гуморального иммунного ответа, сила которого зависит от соответствующего типа HLA. Таким образом, оптимальный уровень защиты достигается только у части населения.
Б. Рекомбинантные белки
Рекомбинантные белки можно производить в больших количествах. Основным их достоинством является то, что в отличие от классических вакцин они не содержат тех структур патогенов, которые могли бы оказывать побочное действие. Генноинженерные вакцины можно создавать и в том случае, когда сам патогенный организм трудно или невозможно культивировать (как в случае вирусов). Однако технология получения рекомбинантных белков требует разработки подходящей системы экспрессии (например, Е. coli) и простого способа отделения вакцины от клеток, в которых она произведена.
В. Рекомбинантные вакцины
Если рекомбинантный белок не может вызвать адекватного иммунного ответа, особенно Т-клеточного, то возможным выходом из положения является клонирование его гена в подходящем бактериальном носителе (например, в БЦЖ). Вместе с антигенами носителя рекомбинантный белок вызовет более сильную защитную иммунную реакцию.
Г. Делеционные мутанты
Делеция генов, важных для вирулентности или выживаемости патогена в организме хозяина, может лишить патоген болезнетворной активности. Однако сокращен
ное время жизни патогена должно быть все же достаточным для того, чтобы вызвать защитную реакцию организма.
Очищенная ДНК
Препараты очищенной ДНК, использующиеся для вакцинации, содержат ген, кодирующий антиген патогенного организма, и подходящий промотор. После интеграции в клетку хозяина происходит транскрипция ДНК вакцины, обеспечивающая синтез антигена. Антиген вызывает В-клеточный ответ (при условии, что данный ген содержит последовательность сигнального пептида). Некоторые антигены могут быть процессированы внутри клетки и представлены на ее поверхности при участии молекул МНС класса I, что стимулирует Т-кле-точный ответ. Тестирование таких вакцин на животных дает обнадеживающие результаты. Этот метод был недавно предложен для вакцинации против СПИДа (см. с. 123. Б). Однако прежде чем такие вакцины можно будет использовать в медицине, следует получить ответы на ряд вопросов. Основной вопрос заключается в дальнейшей судьбе этой ДНК в организме хозяина, а именно, вероятность ее трансформации в вирулентную ДНК, время ее существования в геноме хозяина и способность реплицироваться в организме хозяина
Новые вакцины
пептид
А. Синтетические пептиды
П роцесси рсува н ие с участием АПК
Сильный В-клеточный и слабый Т-клеточный
ответ
Отбор клеток
Е. coli на среде с антибиотиком / ,, синтез и секреция генноинженерного продукта
Плазмида, содержащая ген белка для вакцины и гены устойчивости к антибиотикам
Центрифуги- Рекомби-
рование нантная
и очистка вакцина
Б. Рекомбинантные белки
Вакцинация
Сама рекомбинантная вакцина не эффективна
Клонирование в подходящем носителе
Т-клеточная защита1
В. Рекомбинантные вакцины
Высоковирулентный Выделение
вирус дикого типа генома
Лигаза
Нуклеаза S1, специфичная к однонитевой ДНК
Сниженная репликация, но сильная иммуногенность
вирулентность
Г. Делеционные мутанты
Иммунофармакология
Клиническая иммунология
А. Нестероидные противовоспалительные препараты (НПВП)
НПВП вмешиваются в метаболизм простагландинов, ингибируя циклооксигеназу. Фосфолипаза А2 индуцирует выделение из фосфолипидов клеточной мембраны арахидоновой кислоты. Арахидоновая кислота служит субстратом для синтеза эйкозаноидов, лейкотриенов, тромбоксана, простациклина и простагландинов. Наиболее важной стадией синтеза простагландинов является образование простагландина Н2 при участии циклооксигеназы. Идентифицировано две изоформы этого фермента — ЦОИ и ЦОГ2.
ЦОИ отвечает за образование простагландинов с физиологическими функциями, а именно:
• регуляция периферической резистентности, почечного кровотока и удаления натрия;
• цитопротекция слизистой желудка путем стимуляции выделения слизи и ингибирования секреции кислоты;
• усиление чувствительности болевых рецепторов;
• бронходилатация.
Образование Ц0Г2 в моноцитах, макрофагах, эндотелиальных клетках и синовиоцитах происходит в результате воспалительного стимула, например, эндотоксинов или ИЛ-1. Этот фермент усиливает синтез простагландинов при воспалительном ответе.
Таким образом, ингибирование циклооксигеназ под действием НПВП оказывает противовоспалительный эффект и блокирует физиологическое действие простагландинов, опосредованное ЦОГ1. Противовоспалительное действие этих ферментов используется в терапевтических целях при острых и хронических воспалениях суставов. Ингибирование ЦОГ1-опосредованных реакций является причиной большинства побочных эффектов, возникающих при использовании НПВП, в том числе повреждения и изъязвления стенок желудка. Кроме того, ингибирование фермента может привести к почечной недостаточности и изменению уровня кровяного давления у некоторых пациентов.
Б. Глюкокортикоиды
Противовоспалительное действие глюкокортикоидов активно используется при лечении ревматоидных заболеваний. Действие этих препаратов является дозозависимым и влияет на процессы в различных клеточных компартментах. Основной эффект препаратов связан с их влиянием на процесс транскрипции. После связывания рецепторов с глюкокортикоидами в цитозоле рецепторы диссоциируют из комплексов с белком теплового шока (hsp) и получают возможность связаться с определенными участками геномной ДНК в клеточном ядре (с так называемыми гормон-респон-
сивными элементами). Это приводит к активации некоторых генов, продукты которых ингибируют воспалительный процесс. Кроме того, взаимодействие NFkB и других транскрипционных факторов с ДНК приводит к ингибированию синтеза белков, усиливающих воспаление (например, ферментов метаболизма простагландинов)
При использовании более высоких концентраций глюкокортикоидов через короткий промежуток времени в некоторых клетках наблюдаются эффекты, которые нельзя приписать действию препаратов на уровне генов. В связи с этим было постулировано существование мембраносвязанных быстро активирующихся рецепторов кортикостероидов.
При очень высоких концентрациях препаратов происходит встраивание значительного числа молекул глюкокортикоидов в клеточную мембрану, что вызывает неспецифические изменения физических свойств мембраны (текучесть, проницаемость). Ослабевает трансмембранный перенос катионов и снижается общая способность клетки к активации.
Глюкокортикоиды вмешиваются в ход воспалительного процесса и клеточного иммунного ответа по нескольким механизмам. Например, они ингибируют миграцию лейкоцитов к участкам воспаления, модулируют различные функции эффекторных клеток, а также снижают уровень синтеза воспалительных медиаторов.
264
Нестероидные противовоспалительные препараты и глюкокортикоиды
Физиологический
Воспалительный
Тромбоксан А2
ПГ
Периферическая резистентность Защита желудка Усиление функции почек Гипералгезия Бронходилатация
1. Механизмы
Воспаление:
Вазодилатация Медиаторы * Протеазы*
Язвенная Нарушение
болезнь гемопоэза
Бронхиальная Беременность,
астма кормление грудью
2. Противопоказания
А. Нестероидные противовоспалительные препараты (НПВП)
сн?он
Миелопоэз!
МНС класса II!
Fc-рецепторы!
ИЛ-1, ИЛ-6, ФНО-а,!
ПГ!
Содержание лимфоцитов! (перераспределение), синтез ИЛ-2! действие ИЛ-2!
О о -4Г ИЛ-2 о
сн2он
1°он
NFkB
посредники Катионный транспорту
Свободные радикалы!
Стабильность мембран !
4
Активационная способность!
Адгезия к эндотелию! эозинофилы! базофилы! нейтрофилы!
Проницаемость кровеносных сосудов ! молекулы адгезии !
ИЛ-1т
ПГ!
мРНК V АХЭ, липокортин, эндонуклеазы
мРНК
д Фосфолипаза А2,
I ЦОГ2
| цитокины
1. Механизмы
Б. Глюкокортикоиды
Пролиферация фибробластов! фибронектин, ЦОГ1! ►ПГ!
2. Влияние на иммунную систему
Иммунофармакология
А. Антиметаболиты
Метотрексат выступает в качестве антиметаболита, нарушающего метаболизм фолиевой кислоты. Связываясь с дигидрофолатредуктазой. он ингибирует внутриклеточное восстановление фолата до тетрагидрофолата, тем самым ингибируя метаболизм С1, необходимый для биосинтеза тимидина и пуринов. Снижение уровня синтеза ДНК и РНК приводит к функциональному дефициту и гибели клеток (главным образом В-клеток). Метотрексат также ингибирует клеточный рост в быстро пролиферирующих тканях, например, кроветворном костном мозге, половых железах, слизистой выстилке, опухолях и псориатической коже. Высокие дозы метотрексата оказывают в первую очередь цитотоксический эффект, а низкие дозы (от одной пятой до одной десятой иммуносупрессорной дозы) имеют противовоспалительное действие, связанное с ингибированием молекул адгезии и цитокинов. Кроме побочных эффектов, проявляющихся в быстро пролиферирующих тканях, препарат может оказывать токсическое действие на печень и легкие.
Азатиоприн особенно эффективен в ингибировании роста Т-клеток После всасывания в тонкой кишке азатиоприн превращается в 6-меркаптопурин — серосодержащий аденин, который ингибирует биосинтез пуринов, действуя в качестве «неправильного» конечного продукта, подающего отрицательный сигнал обратной связи. Кроме того, он встраивается в ДНК и РНК, тем самым повреждая эти молекулы. Аллопуринол, применяющийся при лечении подагры, ингибирует ксантинок-сидазу. Тем самым он ингибирует метаболизм и снижает эффективность 6-меркаптопурина, но повышает его токсичность. В качестве побочных эффектов могут наблюдаться нарушения со стороны ЖКТ и обратимая панцитопения.
Б. Циклофосфамид
Циклофосфамид является цитостатическим препаратом и одним из наиболее мощных иммуносупрессоров. В печени он превращается в активную форму 4-гидроксициклофосфамид и может алкилировать различные клеточные структуры, тем самым приводя к их инактивации. Алкилирование оснований ДНК и РНК приводит к образованию связей между парами оснований и в конечном итоге — к гибели клетки. Ингибирование функциональной активности и снижение численности касается в равной степени В- и Т-клеток Наиболее важным побочным действием циклофосфамида является геморрагический цистит, риск возникновения которого можно снизить при одновременном приеме 2-меркаптоэтансульфоновой кислоты.
В. Сульфасалазин
Сульфасалазин является одним из плохо всасывающихся сульфонамидных препаратов. Он используется при лечении язвенного колита и болезни Крона. Этот препарат связывается с коллагеновыми и эластиновыми волокнами субэпителиальной ткани в местах повреждения слизистой в глубоких слоях стенки тонкой кишки. При помощи кишечных бактерий, расщепляющих азо-связь в молекуле сульфасалазина, препарат превращается в активные компоненты сульфапиридин и 5-аминосалицилат (5-АСК). Эти активные компоненты ингибируют воспалительный ответ в стенках кишечника. Последующее всасывание сульфапиридина ответственно за некоторые побочные эффекты от приема препарата (головокружение, тошнота, лихорадка, артралгия) Компоненты препарата ацетилируются и выводятся с мочой. Побочное действие наиболее сильно проявляется у пациентов, для которых характерено так называемое «медленное ацетилирование».
Г. Золото
Препараты, содержащие золото, используются в комплексной терапии при ревматоидном артрите. Механизм действия препаратов до конца не ясен. По одной из гипотез, их иммуномодулирующее действие связано с химической модификацией пептидов, представляемых молекулами МНС. По другой теории макрофаги оказывают стабилизирующее действие, возможно, связанное с ингибированием медиатора и процесса выделения ферментов С побочным действием препаратов золота (дерматит, стоматит, тромбоцитопения и агранулоцитоз) связана необходимость регулярного проведения анализа крови и мочи.
Антиметаболиты, циклофосфамид, сульфасалазин и золото
Фолат -----► FH2
FH4 (тетрагидрофолат)
А. Антиметаболиты
Циклофосфамид
Печень
С1-СН2-СН2
С1-СН2-СН2
Я . -► Иммуномодуляция
Структура
___Перекрестное____Гибель сшивание___________клеток
Клиническая иммунология
Б. Циклофосфамид
Сульфапиридин
5-АСК
Ингибирование
Побочное действие:
Головная боль Головокружение Лихорадка Аллергия
Т-клетки НК-клетки
Хемотаксис!
Воспалительные медиаторы!
Ферменты |
В. Сульфасалазин
267
Иммунофармакология
А. Циклоспорин А
Циклоспорин А — это циклический белок, синтезируемый почвенным грибом Tolypocladium inflatum. Его молекула состоит из 11 аминокислотных остатков. Иммуносупрессорное действие циклоспорина А связано с ингибированием образования цитокинов, особенно ИЛ-2, на раннем этапе активации Т-клеток. Недавно был предложен молекулярный механизм действия лекарства. Циклоспорин А связывается с цитоплазматическим рецептором циклофилином. Комплекс циклоспорина А с циклофилином ингибирует кальциневрин, являющийся фосфопротеин фосфатазой, ответственной за активацию ядерного фактора активированных Т-лимфоцитов NFAT Отсутствие дефосфорилирования ингибирует миграцию активного NFAT в клеточное ядро и транскрипцию гена ИЛ-2. Циклоспорин А также нарушает передачу сигнала через TCR Он ингибирует протеинкиназу Ср (ПКСр) и тем самым блокирует индукцию ядерных компонентов NFAT.
Циклоспорин А в меньшей степени ингибирует образование других цитокинов (ИЛ-1 в макрофагах, а также ИЛ-3, ИЛ-4, ИЛ-8 и у-ИНФ). Таким образом, этот препарат в первую очередь влияет на клеточный иммунитет.
Такролимус (FK506), относящийся к антибиотикам класса макролидов, также используется для подавления клеточного иммунитета. Механизм его действия очень похож на механизм действия циклоспорина А. Комплекс, образующийся в результате связывания та-кролимуса с цитоплазматическим рецептором FK-свя-зывающим белком, ингибирует кальциневрин и тем самым косвенно ингибирует образование цитокинов.
Рапамицин, еще один антибиотик класса макролидов, тормозит ИЛ-2-зависимые процессы в клетках-мишенях после связывания с цитоплазматическим рецептором. Таким образом, этот препарат нарушает последовательность активации Т-клеток на несколько более поздних этапах, чем циклоспорин А и такролимус, действуя с ними в синергизме.
Б. Микофенолат
Микофенолат — это новый иммуносупрессорный препарат, показавший хорошие результаты при лечении отторжения трансплантатов. Он прошел клинические испытания на пациентах с ревматоидным артритом и псориазом. При внутривенном введении пролекарст-венная форма микофенолат мофетил быстро превращается в микофенолат. Он обратимо ингибирует инозинмонофосфат дегидрогеназу (IMP-DH), и, следовательно, биосинтез пуриновых оснований de novo Поскольку лимфоциты особенно зависимы от синтеза de novo, наблюдается резкое падение концент
рации гуанин-нуклеотида Повреждение лимфоцитов достигается несколькими путями. Дефицит dGTP приводит к снижению уровня синтеза ДНК и РНК. Кроме того, отсутствует GDP-фукоза, необходимая для N-гли-козилирования гликопротеинов (например, молекул адгезии). Дефицит СТР-циклогидролазы-1 вызывает недостаток тетрагидробиоптерина, а это в свою очередь сокращает число восстановительных реакций в клетке, в частности ингибирует образование NO.
В. Лефлуномид
Лефлуномид — это еще один новый иммуносупрессор, наиболее сильно влияющий на лимфоциты. Механизм его действия напоминает механизм действия ми-кофенолата. Ингибируя дигидрооротат дегидрогеназу (DHO-DH), он на ранних этапах нарушает биосинтез пиримидинов de novo. Лекарство в равной степени действует на Т- и В-клетки. Покоящиеся лимфоциты имеют небольшой запас пиримидинов. При низком уровне синтеза пиримидинов, связанном с ингибированием дигидрооротат дегидрогеназы, образуется меньше ДНК и РНК Также снижается уровень синтеза молекул адгезии.
Циклоспорин А, микофенолат и лефлуномид
Ген ИЛ-2
Ядро
ИЛ-1
ИЛ-3
О ИЛ-4
Рапамицин
Такролимус
Циклоспорин А
А. Циклоспорин A/FK506
Влияние на клеточный иммунитет
IMP |
Микофенолат - IMP-DH NAD+ -►NADH
1 ХМР |
GMP-синтаза I - Glu + ADP -►Gin + ATP
GDP-фукоза 1 ▼ GTP-циклогидролаза 1
1 GTP, dGTP I
i /\/-гликозилирование гликопротеинов 1 1 f Синтез ДНК/РНК! । V Тетра гид ро-биоптерин I
▼ Молекулы адгезии! 1 * ▼ Восстановительные реакции!
Б. Микофенолат
Gin, НСО§, АТР
Дигидро
Лефлуномид оротат
DHO-DH — FMNH2 «•FMN
Молекулы адгезии!
Оротат
!
UMP -Пул!
Синтез
ДНК/РНК1
В. Лефлуномид
Иммунофармакология
А. Моноклональные антитела
Метод производства больших количеств антител заданной специфичности путем слияния В-клеток с клетками миеломы используется очень широко, особенно в диагностических целях. Однако мышиные моноклональные антитела (МАЬ) в организме человека воспринимаются как чужеродные антигены. Организм начинает синтезировать антитела для их нейтрализации. Это ограничивает использование моноклональных антител в терапевтических целях. Поскольку человеческие моноклональные антитела получить гораздо сложнее, исследователи пытаются понизить антигенность мышиных моноклональных антител. Один из подходов состоит в гуманизации антител путем связывания ан-тиген-специфических мышиных Fab-фрагментов с человеческим Fc-фрагментом. Другой подход заключается во внедрении в человеческие антитела только тех участков мышиных Fab-фрагментов, которые важны для распознавания антигена (области, ответственные за комплементарность, COR).
Одним из примеров таких химерных антител, состоящих из мышиных и человеческих фрагментов, являются анти-ФНО антитела. Они содержат мышиный Fab-фрагмент, обладающий высоким сродством к человеческому ФИО, и человеческий Fc-фрагмент. В другом химерном белке ФНО-R-Fc Fab-фрагмент заменен рекомбинантным человеческим растворимым рецептором ФИО Этот рецептор в норме присутствует в сыворотке крови и связывает ФНО-а. Оба типа генноинженерных ФНО-блокаторов прошли клинические испытания и показали хорошие результаты при лечении ревматоидного артрита, псориатического артрита и анкилозирующего спондилоартрита. Анти-ФНО антитела ингибируют стимуляцию воспалительного процесса под действием ФНО-а, который может поражать кровеносные сосуды, влиять на миграцию клеток иммунной системы, воспаление синовии и хрящевой ткани, а также метаболизм костной ткани. Одним из возможных побочных эффектов от использования анти-ФНО-а является активация латентной формы туберкулеза (см. с. 231).
Другим важным клиническим приложением моноклональных антител является ингибирование 004 клеток для ослабления иммунного ответа в аутоиммунных заболеваниях. Анти-004 МАЬ направлены против внеклеточного домена молекулы 004. Связавшись с ним, антитела модулируют активационную способность Т-клеток или вызывают апоптоз Возможными проявлениями цитотоксической активности моноклональных антител также являются активация комплемента, приводящая к лизису клеток, фагоцитоз клеток-мишеней макрофагами и антителозависимая клеточная цитотоксичность с участием CD8+ клеток-киллеров Клетки-
мишени могут отщеплять или «ошелушивать» какую-то часть молекул CD4 с прикрепленными антителами или интернализовать их, тем самым снижая уровень повреждения. За последние несколько лет в клиническую практику вошло несколько типов моноклональных антител: специфичные для В-клеток антитела против CD20 (ритуксимаб) активно используются для лечения болезни Ходжкина, а анти-НЕВ-2/пеи антитела (трастузумаб) успешно применяются в борьбе с раком молочной железы.
Еще одним возможным способом ингибирования воспалительного процесса и активации клеток иммунной системы является блокада молекул адгезии. Моноклональные антитела, направленные против ICAM-1 (CD54), мешают молекулам адгезии связаться с LFA-1 (CD11a/CD1 В), тем самым предотвращая их прикрепление к эндотелиальным клеткам и активацию Т-клеток. Сейчас проводятся клинические испытания, целью которых является оценить эффективность подобных антител для лечения аутоиммунных заболеваний.
Б. Поликлональные антитела
Поликлональные антитела могут несколькими путями препятствовать возникновению иммунного ответа. Они могут снизить иммунный ответ у пациентов с аутоиммунным заболеванием, мешая антигенпрезентирующим клеткам захватывать и представлять антиген Т-клеткам. Они могут также затруднять фагоцитоз антигенов макрофагами и ингибировать активацию В-клеток. Еще одной очень важной функцией поликлональных антител является перехват патогенных аутоантител.
Пептиды для вакцинации
Новый подход к решению проблемы ингибирования клеточного иммунного ответа при аутоиммунных заболеваниях основан на вмешательстве во взаимодействие между молекулами МНС и Т-клеточными рецепторами. В моделях in vitro и в экспериментах на животных анти-МНС, анти-TCR и анти-С04 антитела успешно использовались для ингибирования активации Т-клеток путем предотвращения узнавания МНС.
Вакцинация в данном случае основана на использовании пептидов, специфичных для Т-клеточных клонов, участвующих в развитии заболевания. Эти пептиды конкурируют с патогенными пептидами за связывание с молекулами МНС. В экспериментах на животных показано, что использование таких пептидов ослабляет болезнетворный процесс
Моноклональные и поликлональные антитела
Синтез антител с определенной _ специфичностью
Слияние /
В-клетка
Гибридома
Клетка миеломы (несекретирующие)
Часть АЬ человека
Антиген
Часть Ab мыши —
1. Образование
2. Снижение антигенности
ФНО-а
Анти-ФНО АЬ
ФНО а
Синовит
Миграция
пролиферация, усиление адгезии
активация, хемотаксис, синтез ИЛ-8
деградация, активация, репарация
пролиферация, активация, образование паннуса
Т-клетка
rhs-TNF-R: Химерный белок ФНО-R-Fc
Кровеносные сосуды
Хрящ/кость
Изменения в суставах при РА
а) Ингибирование действия ФНО-а с помощью анти-ФНО антител (например, при РА)
Сшелушивзние а И TCR CD4
Модуляция Апоптоз
Анти-1САМ1 антитела
сС^Лизис с участием комплемента, антителозависимая клеточная цитотоксичность, фагоцитоз
LFA-1
LFA-1
ICAM 1
Адгезия |
Костимуляция!
в) Анти-1САМ1 антитела
б) Ahth-CD4 антитела
А. Моноклональные антитела
Перегрузка СФМ
Презентация антигенов;
Активность В-клеток4
Фагоцитоз антигенов!
Нейтрализация патогенных
Фагоцитоз +
Б. Поликлональные антитела
Поликлональные антитела
Приложение
Таблица 1: Критерии АКР для классификации РА (сокращенный вариант)
Критерий Краткое описание
' Тугоподвижность суставов по утрам Тугоподвижность суставов по утрам (не менее 1 ч)
2 Артрит в области трех и более суставов Вовлечение по крайней мере трех суставных областей с выпотом или отеком мягких тканей
3 Артрит суставов рук: запястья, проксимальные межфаланговые суставы, пястно- фаланговые суставы Отек мягких тканей или выпот по крайней мере в трех из этих областей
4. Симметричное опухание (артрит) Двустороннее (симметричное) поражение суставов
5 Ревматоидные узелки Подкожные узелки на выпуклых частях тела, со стороны разгибающей мышцы или в других близких к суставам областях
6 Ревматоидные факторы в сыворотке Аномально высокие концентрации ревматоидных факторов в сыворотке
7 Радиологически подтвержденные изменения Обнаружение в области суставов типичных изменений’ эрозии и декальцификации
Таблица 2: Классификация спондилоартритов (ESSG)
Болевые ощущения воспалительной природы в спине или
Синовит,
асимметричный или
преимущественно нижних конечностей
а также хотя бы один из приведенных ниже признаков:
Случаи заболевания в роду
Псориаз
Воспалительное заболевание кишечника
Уретрит, цервицит или острая диарея за 1 месяц до начала артрита
Боль в ягодицах, перемежающаяся между правой и левой ягодичными областями Энтезопатия
Сакроилеит
Приложение
Таблица 3: Антиядерные антитела при ревматических заболеваниях
Специфичность Характер окрашивания (клетки НЕР-2) Распространенность заболевания
Нуклеиновые кислоты
• Двунитевая ДНК (dsDNA), Гомогенные, Детектируются
антигенные детерминанты dsDNA и ssDNA идентичны округлые у 60-70% больных СКВ (диагностический маркер СКВ)
• Однонитевая ДНК (ssDNA), Гомогенные, Детектируются
антигенные детерминанты относятся к пуринам и пиримидинам Гистоны округлые у 95% больных СКВ; также наблюдается при других (и не ревматических) заболеваниях
• Антигенные детерминанты Гомогенные, Детектируются у 30-70%
на Н1, Н2а, Н2Ь, НЗ, Н4 или комплексах Н2а-Н2Ь, НЗ Н4 Ядерные белки округлые больных СКВ, 5-20% больных РА и у 95% больных СКВ, вызванной приемом лекарств
• Антиген SM; комплексы антигенных детерминант с малой ядерной РНК (мяРНК) Г рубая зернистость Детектируются у 25-35% пациентов с СКВ; специфический маркер СКВ
• U1-RNP; комплексы антигенных детерминант с U1 РНК Г рубая зернистость Высокий титр детектируется у 95% пациентов с ССТБ и у 35-45% больных СКВ; низкий титр обнаруживается у больных с прогрессирующим системным склерозом, дискоидной СКВ и синдромом Шегрена
•SS-A(Ro); Мелкие гранулы + Детектируются у 30-40%
антигенные детерминанты на двух белках (61 и 52 кДа) цитоплазма больных СКВ и у 60-70% больных синдромом Шегрена; наличие антител при СКВ новорожденных связано с врожденной блокадой сердца
•SS-B(La); Мелкие гранулы + Детектируются у 15% больных СКВ
антигенная детерминанта связана с белком (43 кДа), образующим комплекс с РНК цитоплазма и у 40-60% больных синдромом Шегрена; наличие антител при СКВ новорожденных связано с врожденной блокадой сердца
• PCNA (ядерный антиген Флуоресценция Детектируются
пролиферирующих клеток); антигенная детерминанта связана с 33-кДа белком ядра с разной интенсивностью у 3% больных СКВ
• Scl 70 (топоизомераза 1) Гомогенные ядра + окрашенные ядрышки Детектируются у 30% больных с прогрессирующим системным склерозом
•Jo-1 Гранулы Детектируются у 5% больных
(гистидил-тРНК-синтетаза) в цитоплазме дерматомиозитом и 30% больных пол и миозитом
• Центромера (кинетохор) Пятнистый характер Детектируются у 70% пациентов с ограниченной формой склеродермии
Приложение
273
Приложение
Таблица 4: Значение аутоантител для диагностики аутоиммунных заболеваний
Заболевание
Аутоантитело СКВ ССТБ Склеродермия Миозит Синдром Шегрена Ревмато- Первич-идный ный артрит васкулит Анти-фосфо-липид-ный синдром
АЯА +++ 4-4-4- 4-4-4- 4- 4-4-4- 4- 4- 4-
dsDNA +++ - - - - - - -
SM 4-4- - - - - - - -
U1RNP + 4-4-4- 4- 4- - - - -
Ribosomal Р ++ - - - - - - -
I PNCA 4- - - - - - - -
Ro ++ 4- 4- - 4-4-4- 4- - -
La ++ 4- 4- - 4-4-4- 4- - -
RA33 4-4- 4-4- - - 4- 4-4- - -
Sd7O - - 4-4-4- - - - - -
Центромера - - 4-4-4- - - - - -
Jo-1 - - 4— - - -
PM-Scl - - 4- 4- - - - -
Кардиолипин +++ 4- 4- - 4- 4- - 4-4-4-
АНЦА - - - - - - 4-4-4- -
Ревматоидный фактор ++ 4- 4- 4- 4-4-4- 4-4-4- 4- -
Приложение
Таблица 5: Критерии АКР для классификации СКВ (сокращенный вариант)
Критерий*
Высыпания в скуловой области
Дискоидная сыпь
Повышенная светочувствительность
Изъязвления ротовой полости
Артрит
Серозит
Нарушения работы почек
Неврологические нарушения
Гематологические нарушения
Иммунологические нарушения
Антиядерные антитела
Краткое описание
Пятнистая или папулезная сыпь на обеих щеках и переносице
Эритематозные выпуклые пятна с участками кератоза и атрофическими рубцами, возникающие прежде всего на открытых участках кожи
Сыпь, которая быстро появляется при воздействии солнечных лучей (или наличие данного признака у кого-либо из родственников)
Безболезненные язвы ротовой полости или носоглотки, обнаруженные при медицинском осмотре
Артрит (без эрозии) более чем в двух периферических суставах (тугоподвижность, отечность, выпот)
Документально подтвержденные плевриты или перикардиты
Устойчивая протеинурия (> 0,5 г/сут) или цилиндрурия (гиалиновые цилиндры, зернистые и эритроцитарные конгломераты) Судороги или психозы, не связанные с метаболическими причинами или действием лекарств
Иммуногемолитическая анемия (ретикулоцитоз, положительная проба Кумбса или лейкопения < 4000/м3 или лимфопения < 1500/мм3 или тромбоцитопения < 100 000/мм3)
Положительный результат теста на LE-клетки
или наличие анти-dsDNA антител или анти-Sm антител или ложно-позитивная реакция на сифилис
Аномально высокий титр АЯА у пациента, не принимавшего лекарств, способных вызвать СКВ
Приложение
* Наличие у пациента четырех из одиннадцати перечисленных критериев одновременно или их возникновение последовательно в ходе наблюдения является основанием для диагностирования СКВ
275
Приложение
Таблица 6: Классификация Чепел Хилл для системных васкулитов
Васкулиты, затрагивающие крупные сосуды
Гигантоклеточный (височный) артериит Гранулематозный артериит, поражающий аорту и ее главные ветви; могут затрагиваться ветви наружной сонной артерии; обычно поражается височная артерия (пациенты > 40 лет); часто связан с ревматической полимиалгией.
Артериит Такаясу Гранулематозное воспаление аорты и ее главных ветвей (пациенты > 40 лет).
Васкулиты, затрагивающие сосуды среднего размера
Узелковый полиартериит Некротическое заболевание средних и мелких артерий, не сопряженное с гломерулонефритом и не затрагивающее артериолы, капилляры и венулы.
Болезнь Кавасаки Воспаление крупных, средних и мелких артерий; обычно сопровождается воспалением лимфатических узлов; часто затрагиваются коронарные артерии; аорта и вены чаще поражаются у детей.
Васкулиты, затрагивающие мелкие сосуды
Гранулематоз Вегенера Гранулематозное воспаление дыхательных путей и некротический васкулит мелких и средних кровеносных сосудов; некротический гломерулонефрит.
Синдром Чарга-Стросса Эозинофилия и гранулематозное воспаление дыхательных путей с некротическим васкулитом мелких и средних кровеносных сосудов; сопровождается астмой.
Микроскопический полиангиит Некротическое воспаление мелких сосудов с минимальными отложениями иммунных комплексов (или без них); может наблюдаться некротический васкулит мелких и средних кровеносных сосудов; некротический гломерулонефрит, поражение капилляров легких.
Пурпура Шенлейна-Геноха Васкулит, сопровождающийся отложением в мелких сосудах иммунных комплексов, в основном состоящих из IgA; характеризуется поражением кожи, ЖКТ и почечных клубочков а также артралгией и (или) артитом.
Эссенциальный криоглобулинемический васкулит Васкулит, затрагивающий мелкие сосуды и связанный с отложением иммунных комплексов и появлением криоглобулинов в сыворотке; часто поражаются почечные клубочки.
Кожный лейкоцитокластический ангиит Лейкоцитокластический ангиит кожи, не сопряженный с системным васкулитом или гломерулонефритом.
Приложение
Таблица 7: Основные лабораторные показатели
Принятые единицы измерения Единицы СИ
Скорость оседания эритроцитов (СОЭ) М: 3-8 мм (1 ч), 5-18 мм (2 ч) Ж: 6-11 мм (1 ч), 6-20 мм (2 ч)
Клетки крови
Лейкоциты 4,3-10,0-103/мкл 4,3-10,0 г/л
Тромбоциты 150-350-103/л 150-350 г/л
Гемоглобин (НЬ) Эритроциты Лейкоцитарная формула Гранулоциты • Сегментоядерные нейтрофилы • Палочкоядерные нейтрофилы • Эозинофилы • Базофилы Лимфоциты Моноциты Плазматические клетки М: 13-18 г/дл Ж: 12-16 г/дл М: 4,5-6,9-10б/мкл Ж: 4,0-5,2-10б/мкл 57 ± 10% 5 ± 3% 3 ± 2% <1% 30 ± 10% 6 ± 4% < 0,1% 8,1-11,2 ммоль/л 7,4-9,9 ммоль/л
Субпопуляция лейкоцитов
Т-клетки: CD4+ CD8 47% 610-1400/мкл
CD8+ СПД- 31% 400-930/мкл
уд CD4 CDS- 1-5% <1% 26-60/мкл
В-клетки Электрофорез < 20% 260-600/мкл
Альбумин 54-65% 0,54-0,65
оц-Глобулины 2-5% 0,02-0,05
а2- Глобулины 7-10% 0,07-0,10
р-Глобулины 9-12% 0,09-0,12
Белки плазмы 6,6-8,5 г/дл 66-85 г/л
Общий белок 20-30 мг/дл 200-300 мг/л
Альбумин 3,6-5,0 г/дл 36-50 г/л
oq-Антитрипсин 90-200 мг/дл 0,9-2,0 г/л
а2-Макроглобулин 130-300 мг/дл 1,3-3,0 г/л
р2-Микроглобулин (р2м) 8,0-24 мг/дл 0,8-2,4 мг/л
Миоглобулин < 70 мкг/л < 70 мкг/л
Ферритин 30-300 мкг/л 30-300 мкг/л
Трансферрин 200-360 мг/дл 2-3,6 г/л
Гаптоглобин 70-380 мг/дл 0,7-3,8 г/л
Церулоплазмин 15-60 мг/дл 0,15-0,6 г/л
С-реактивный белок Иммуноглобулины < 0,8 мг/л < 0,008 г/л
IgA Подклассы IgA 70-400 мг/дл 0,7-4,0 г/л
IgA, 57-321 мг/дл 0,57-3,21 г/л
1дА2 4,7-82 мг/дл 0,047-0,82 г/л
Приложение
Таблица 7: Основные лабораторные показатели (продолжение)
Принятые единицы измерения Единицы СИ
IgG 700-1600 мг/дл 7-16 г/л
Подклассы IgG
igGn 422-1292 мг/дл 4,22-12,92 г/л
lgG2 117-747 мг/дл 1,17-7,47 г/л
lgG3 41-129 мг/дл 4,1-1,29 г/л
lgG4 < 291 мг/дл < 2,91 г/л
IgG в моче 10 мг/л 10 мг/л
IgM 40-230 мг/дл 0,4-2,3 г/л
IgE < 24 мг/дл или < 0,24 г/л или
10-120 ед/мл 10-120 ед/мл
C1q 180 мкг/мл
C1 ингибитор 60-140% 60-140%
СЗ компонент комплемента 55-120 мг/дл 0,55-1,2 г/л
С4 компонент комплемента 20-50 мг/дл 0,2-0,5 г/л
Рецептор ИЛ-2 200-1000 ед/мл
ИЛ-8 < 70 нг/л
Ферменты
АПФ 15-80 ед/л
Щелочная фосфатаза 60-180 ед/л
Креатинкиназа <80 ед/л
Свертывание крови
Тромбопластиновое время (время Квика) 70-130% 0,9-1,15 INR*
Частичное тромбопластиновое время (ЧТВ) 23-35 с
Фибриноген 200-400 мг/дл 5,88-11,76 мкмоль/л
Опухолевые маркеры
cq-Фетопротеин (АФП) < 10 мкг/л < 10 мкг/л
РЭА < 5 мкг/л < 5 мкг/л
СА 125 <35 ед/мл
СА15-3 < 28 ед/мл
СА19-9 < 37 ед/мл
СА 72-4 <6,0 ед/мл
Цереброспинальная жидкость (ЦСЖ)
Клетки < 5 в 1 мкл
Альбумин 11-35 мг/дл 110-350 мг л
IgA < 6 мг/л < 6 мг/л
IgG 0,9-2,6 мг/дл 9-26 мг/л
IgM 0,09-0,25 мг/дл 0,9-2,5 мг/л
Кортизон
Утро 171-800 нмоль/л 171-800 нмоль/л
Вечер 82,8-477 нмоль/л 82,8-477 нмоль/л
Антитела: здесь не приведены показатели для таких антител, как АЯА или анти-ДНК, поскольку резуль таты измерения их концентрации различаются при использовании большого числа разнообразных методов. Лаборатория, выполняющая анализ, должна указывать нормальный диапазон показателей.
INR - международный нормализованный коэффициент = плазма пациента (по Квику)/пул плазмы (по Квику)
Приложение
Таблица 8: Список кластеров дифференцировки (CD)*
С использованием моноклональных антител стало возможным провести количественный анализ популяций клеток крови и классифицировать их в соответствии с наличием поверхностных антигенов. Комитет по стандартизации лейкоцитарных антигенов дифференцировки ВОЗ рассмотрел различные варианты номенклатуры, использующиеся для обозначения моноклональных антител и их антигенов, и предложил упрощенную международную терминологию. Моно-
клональные антитела с фактически идентичной специфичностью к данному мембранному антигену были сгруппированы и обозначены соответствующим номером кластера дифференцировки (CD). Таблица 8 представляет собой обзор известных на сегодняшний день моноклональных антител и их антигенов. Сюда включены недавно описанные кластеры и их подклассы, обсуждавшиеся на 7-м Международном симпозиуме HLDA7 (Харрогит, Великобритания, 2000 г).
Номер CD Другие обозначения и функции молекулы/амтигена Клеточная экспрессия
CD1a Презентация липидов микобактерии Тимоциты, КЛ, ДК
CD1b то же Тимоциты, ДК
CD1c то же Тимоциты, КЛ, ДК, В
CD1d Конститутивная экспрессия, М. Т
взаимодействие с НК/Т-клетками
CD2 Т11, Тр5О, рецептор эритроцитов барана, Т, НК
рецептор CD48, CD58, CD59
CD2R Эпитоп CD2 на активированных Т-клетках Т, НК
CD3 CD3 комплекс Т-клетки
CD4 Т4, рецептор МНС класса II, ВИЧ Т-клетки, М
CD5 Тр67, рецептор CD72 т, В
CD6 Т12 т, В
CD7 Fc-рецептор IgM Т, НК
CD8 Т8, рецептор МНС класса I Т, НК
CD8b Т8, рецептор МНС класса I Т, НК
CD9 р24 пре-В, М, Тр, Эо
CD1O Нейтральная эндопептидаза, дрЮО, ОЛЛ, В-клетки
общий антиген ОЛЛ (CALLA) зародышевого центра
CD11a Лимфоцитассоциированный антиген-1 (LFA-1) Лейкоциты
CD11b Рецептор C3bi (CR3), Мас-1, Мо-1 М, Г, НК
CD11c Рецептор C3bi (CR3), C3dgR, CR4 М, Г, НК, В
CDw12 Функция неизвестна М, Г, Тр
CD13 Аминопептидаза N, др 150, рецептор коронавируса М, Г
CD14 Рецептор ЛПС/ЛСБ, др55 М, Г, ДК, В
CD15 Льюис (Le-x), 3-FAL, х-гаптен,
лакто-М-фукопентатоза III, SSEA Г, М, Р-Ш
CD15s Сиалил-Льюис (sLe-x), лиганд CD62e Лейкоциты. ЭК
CD15u Сульфатированная форма CD15
CD16 FcRIIIa для IgG, gp50-65 НК, Г, МФ
CD16b РсРШЬдля IgG (с GPI-якорем) Г
CDw17 Лактозилцерамид Г, М, Тр
CD18 Цепь р2-интегрина с CD11a, b и с Лейкоциты
CD19 Вдр95, семейство Sig В
CD2O В1, Вр35, Са2+ каналы В
CD21 Рецептор C2d (CD2), др140, рецептор EVB и CD23 Зрелые В, ФДК
CD22 Вдр135, рецептор CD45RO В
CD23 Низкоаффинный Fc-рецептор IgE (FceRII), Зрелые В, М, ФДК, Эо
др50-45, рецептор CD21
Приложение
# Принятые сокращение. Актив. = активированный; БГЛ = большие гранулярные лимфоциты, В = В-клетки, Г = гранулоциты, ДК = дендритные клетки, ИЛ = интерлейкин, КЛ = клетки Лангерганса, М = моноциты, МФ = макрофаги, НК = клетки-киллеры, ОЛЛ = острый лимфобластный лейкоз, R = рецептор, Р-Ш = клетки Рида-Штернберга, Т = Т-клетки, Тр = тромбоциты, ФДК = фолликулярные дендритные клетки ЭК = эндотелиальные клетки, Эо = эозинофилы.
279
Приложение
Таблица 8: Список кластеров дифференцировки (CD)
Номер CD Другие обозначения и функции молекулы/антигена Клеточная экспрессия
CD24 Гомолог термостабильного антигена (HSA) в, г
CD25 «-Цепь рецептора ИЛ-2, антиген Тас Актив. Т, В, М
CD26 Дипептидилпептидаза IV, др120, Та1 Актив. Т, В, МФ
CD27 Рецептор CD70, ФНО-Р-подобный белок Т, тимоциты, НК, В
CD28 Гр44, рецептор CD80 и CD86 Т, актив. В
CD29 Цепь ^-интегрина, gplla тромбоцитов Лейкоциты
CD30 Антиген Ki-1, ФНО-Р-подобный белок Актив. В и Т, Р-Ш
CD31 РЕСАМ-1, gplla тромбоцитов, endoCAM Тр, М, Г, В, Т
CD32 FcRII для IgG, gp4O М, Г, В, Эо
CD33 Му9, функции неизвестны М, миелоидные предшественники
CD34 МуЮ Гемопоэтические
предшественники, Эо
CD35 Рецептор C3b/C4b(CR1) Эр, Г, М, В (Т, НК, ФДК)
CD36 gpIV тромбоцитов (gplllb), рецептор тромбоспондина, М,Тр, ЭК
рецептор коллагена типа I/III
CD37 др40-45 В, (Т), миелоидные клетки
CD38 Т10, др45 (НАД-гликогидролаза и ADP-рибозилциклаза) ПК, ранние В и Т, актив. Т
CD39 др80 В, НК, ЭК, М, ДК
CD40 др50, рецептор CD40L, семейство ФНО-рецепторов В, М, ДК, базальные ЭК
CD40L др39, TRAP-1, лиганд CD40 Т
CD41 Рецептор фибриногена и фактора Виллебранда Тр, мегакариоциты
CD42a Тромбоцитарный gpIX Тр, мегакариоциты
CD42b Тромбоцитарный gplb-a Тр, мегакариоциты
CD42c Тромбоцитарный gplb-p Тр, мегакариоциты
CD42d Гликопротеин V тромбоцитов Тр
CD43 Лейкосиалин, др95, сиалофорин, др115, Лейкоциты,
лейкоцитарный сиалогликопротеин за искл. покоящихся В
CD44 Рдр-1, др80-95, рецептор гиалуроната, Н-САМ Т, В, Г, М, Эр
CD44R Укороченный CD44 Эр
CD45 Т200, общий лейкоцитарный антиген (LCA), Все гемопоэтические
тирозинфосфатаза клетки
CD45RO Укороченный Т200, др180, рецептор CD22 Субпопуляции Т и В, М
CD45RA Укороченный Т200, др22О, изоформа LCA Субпопуляция Т; В, М
CD45RB Укороченный Т200, изоформа LCA Субпопуляция Т; В, Г, М
CD46 Мембранный кофакторный белок (МСР), Лейкоциты
др45-70, рецептор вируса кори
CD47 Интегрин-связанный белок, ОАЗ, 1D8 Все клетки
CD48 др41, возможный рецептор CD244 Лейкоциты
CD49a «гЦепь VLA (VLA-1), рецептор ламинина и коллагена Актив Т и В; М
CD49b «2-Цепь VLA (VLA-2), тромбоцитарный gpla, Тр, культив Т
рецептор ламинина и коллагена
CD49c «з-Цепь VLA (VLA-3), рецептор ламинина, В
коллагена и фибронектина
CD49d «4-Цепь VLA (VLA-4), рецептор фибронектина и VCAM М,Т, ВТр
CD49e «5-Цепь VLA (VLA-5), рецептор фибронектина Т-клетки памяти, М, Тр
CD49f «6-Цепь VLA (VLA-6), рецептор ламинина Тр.Т
CD50 Молекула межклеточной адгезии 3 (ICAM-3), Во многих клетках.
рецептор CD11a/CD18 (LFA-1) но не ЭК
CD51 «-Цепь рецептора витронектина (VNR) (Тр), ЭК, фибробласты
CD52 Campath-1, др21-28 Лейкоциты
CD53 МЕМ 53 Только на лейкоцитах,
но не на Тр
Приложение
Таблица 8: Список кластеров дифференцировки (CD)
Номер CD Другие обозначения и функции молекулы/антигена Клеточная экспрессия
CD54 Молекула межклеточной адгезии 1 (ICAM-1), рецептор CD11a/CD18 (LFA-1), лиганд МАС-1 Во многих клетках
CD55 Фактор ускорения распада (ФУР) Во многих клетках
CD56 NKH1, изоформа нейтральной молекулы клеточной адгезии (NCAM) НК
CD57 HNK1, др11О, функции неизвестны НК, В, субпопуляция Т, гол. мозг
CD58 Лимфоцитассоциированный антиген 3 (LFA-3), рецептор CD2 Лейкоциты, эпителий
CD59 др18-20 сходство с Ly-б, гомологичный рестрикционный фактор 20 (HRF-20), рецептор CD2, протектин Во многих клетках
CD60a Ганглиозид GD3 Т, Тр
CD60b 9-О-ацетил-С03 Т,Тр
CD60c 7-О-ацетил-СЭЗ Т,Тр
CD61 р2-Цепь интегрина (gpllla) Тр, мегакариоциты
CD62E Е-селектин, ELAM-1 Актив. ЭК
CD62L L-селектин, LAM-1, Leu-8, TQ1, MEL14 Во многих клетках
CD62P Р-селектин, gmp140, PADGEM Актив. ЭК; Тр
CD63 Антиген активации тромбоцитов (53 кДа), LIMP Актив. Тр; М, (Г, Т, В)
CD64 Высокоаффинный Fc-рецептор для IgG М
CD65 Антиген VIМ2, церамид додекасахарид 4с Г, (моноциты)
CD66a Антиген желчных капилляров 1 (BGP1) Г
CD66abce АЬ к BGP, NCA95, NCA90 Г
CD66acd АЬ к BGP, NCA90, CGM1 Г
CD66acde АЬ к BGP, NCA90, CGM1, РЭА Г
CD66ace АЬ к BGP, NCA90, РЭА Г
CD66ade АЬ к BGP, CGM1, РЭА Г
CD66ae АЬ к BGP, РЭА Г
CD66b CD67, рЮО, CGM6, неспецифический перекрестно-реагирующий антиген (NCA) 95 Г
CD66be АЬ к NCA95, РЭА Г
CD66c NCA90 Г
CD66ce АЬ к NCA90, РЭА Г
CD66d CGM1 Г
CD66de АЬ к CGM1, РЭА Г
CD66e Раковоэмбриональный антиген (РЭА) Эпителий прямой кишки
CD67 Теперь CD66b
CD68 gp110, макросиалин М, нейтрофилы, базофилы
CD69 Индуктор активации (AIM), ЕА1, MLR, Leu23 Ранние актив. Т, В, МФ, НК
CD70 Рецептор CD27, Ki-24 Т, В (EBV), пре-ВЛЛ, Р-Ш
CD71 Рецептор трансферрина, антиген T9 Актив. Тг В, пролиф. клетки
CD72 Lyb-2, рецептор CD5 В, но не плазматические клетки
CD73 Экто-5'-нуклеотидаза в,т
CD74 Инвариантная цепь шаперона, специфичного к МНС класса II В, М
CD75 Лактозамины, возможный лиганд CD22 Зрелые В-клетки, субпопуляция Т-клеток
CD76 а-2,6-Сиалированные лактозамины В, т, ЭК
CD77 Глоботриаозил-церамид (Gb3), В-клетки зародышевого
антиген лимфомы Беркитта (BLA) центра, лимфома Беркитта
CD79a mb-1, lg-a В
CD790 В29, lg-p В
Приложение
281
Приложение
Таблица 8: Список кластеров дифференцировки (CD)
Номер CD Другие обозначения и функции молекулы/антигена Клеточная экспрессия
CD80 В7/ВВ1, рецептор CD28 и CTLA-4 субпопуляция В-клеток
CD81 Мишень антипролиферативных антител (ТАРА-1), М38 Лимфоциты
CD82 R2, 4F9, СЗЗ, IA4 М, актив. В, Т, БГЛ
CD83 НВ15 КЛ, ДК, Эр
CDw84 р75, 2G7, функции неизвестны В, Т, М, Тр
CD85 Семейство ILT/LIR ДК
CD86 FUN-1, BU-бЗ, В7-2; лиганд CD28 и CTLA-4 В, М, ДК
CD87 Рецептор активатора плазминогена урокиназного типа (uPAR) М, Г, эндотелиальные клетки
CD88 Рецептор С5а, GR10 Г, М, клетки гладких мышц
CD89 Fc-рецептор IgA г, м, В, Т
CD90 Thy-1 Клетки-предшественники, гол. мозг
CD91 Рецептор а2-макроглобулина (a2MR) М
CD92 р70, VIM15, функции неизвестны Г, М,ЭК
CD93 р120, GR11, функции неизвестны М, Г, ЭК
CD94 КР43 НК, Т
CD95 АРО-1, Fas Актив. Т, МФ
CD96 TACTILE Актив. Т, НК
CD97 р74/80/89, семейство ФНО-рецепторов, GR1, связывает CD55 Г, М, Т, В
CD98 4F2 Т, В, НК, Тр
CD99 Е2, MIC2 Во многих клетках
CD99R Укороченный CD99 Во многих клетках
CD100 р150 Во многих клетках
CD101 р140 Г, М,Т, ДК
CD102 Молекула межклеточной адгезии-2 (ICAM-2) Во многих клетках, включая ЭК и М
CD103 HML1, аЕ|37-интегрин Лимфоциты кишечного эпителия, ворсинчатые клетки
CD104 Цепь р4-интегрина Тимоциты
CD105 Эндоглин; рецептор ТФР-fy и -р3 ЭК, актив. М
CD106 VCAM-1, INCAM110, рецептор VLA-4 Актив. ЭК
CD107a LAMP1 Актив. ЭК, Тр, Т
CD107b LAMP2 Актив. ЭК, Тр, Т
CD108 GPI-gp80 (с GPI-якорем) Эр, циркулирующие лимфоциты
CD109 GPI-заякоренная молекула ЭК, Т, Тр
CD110 MPL, рецептор тромбопоэтина Тр
CD111 РРР1/Нектин1 Миелоидные клетки
CD112 PRR2 Миелоидные клетки
CD114 Рецептор Г-КСФ Г, М
CD115 Рецептор-1 Г-КСФ, рецептор М-КСФ М, МФ
CD116 Рецептор ГМ-КСФ М, Г
CD117 Рецептор стволового фактора, с-kit Тучные клетки, миелоидные предшественники
CD118 Рецептор р- и а-ИНФ Во многих клетках
CD119 Рецептор у-ИНФ М, Г, В, НК
CD120a 55-кДа рецептор ФНОтипа I (TNFRI) Во многих клетках
CD120b 75-кДа рецептор ФНО типа II (TNFRII) Во многих клетках
CD121a Рецептор ИЛ-1 типа I (IL1RI) Т, тимоциты
CDw121b Рецептор ИЛ-1 типа II (IL1RII) Г, М, В, МФ
Приложение
Таблица 8: Список кластеров дифференцировки (CD)
Номер CD Другие обозначения и функции молекулы/антигена Клеточная экспрессия
CD122 р-Цепь рецептора ИЛ-2 Актив. Т, культ. НК; М
CD123 др70, a-цепь рецептора ИЛ-3 Миелоидные предшественники
CD124 а-Цепь рецепторов ИЛ-3 и ИЛ-4 Зрелые Т и В; М, гемопоэтические предшественники
CD125 дрбО, рецептор ИЛ-5 Миелоидные предшественники
CD126 а-Цепь рецептора ИЛ-6 Актив. В, плазмоциты, ЭК
CD127 а-Цепь рецептора ИЛ-7 Лимфоидные предшественники, про-В
CDw128 др58-67, рецептор ИЛ-8 Г, Т, М, кератиноциты
CD129 Неизвестен, номер зарезервирован для рецептора ИЛ-9 —
CD130 др13О, p-цепь рецептора ИЛ-6 Во многих клетках
CDw131 др95-120. передающая p-цепь рецептора ИЛ-3 М, Г, Эо
CD132 у-Цепь рецепторов ИЛ-2, ИЛ-4, ИЛ-7, ИЛ-9 и ИЛ-15 Т, В, лимфоидные предшественники
CD133 АС133 Стволовые клетки/ предшественники
CD134 0X40, семейство ФИО-рецепторов Актив Т
CD135 Ftl3/Flk2, тирозинкиназа семейства Ig Ранние лимфоидные предшественники
CDw136 др180, протоонкоген с-ron, рецептор фактора стимуляции макрофагов Во многих клетках
CDw137 дрЗО, 4-1ВВ, семейство ФНО-рецепторов Т
CD138 Syndecan-1, гепарин-сульфат протеогликан рецептор внеклеточного матрикса В
CD139 др209-228, функции неизвестны В, ФДК
CD140a а-Цепь рецептора тромбоцитарного фактора роста PDGF Во многих клетках
CD140b р-Цепь рецептора тромбоцитарного фактора роста PDGF ЭК, строма, мезангий
CD141 Тромбомодулин ЭК, клетки гладких мышц
CD142 Тканевой фактор, инициирует свертывание крови, ЭК, эпителий, М,
связывает фактор Vila кератиноциты
CD143 Ангиотензинпревращающий фермент (АПФ), пептидилдипептидаза ЭК, эпителий, МФ
CD144 VE-кадгерин ЭК
CDw145 рд25-90-110, пан-маркер ЭК, также экспрессируется на базальной мембране —
CD146 MUC18, S-эндо ЭК
CD147 Нейротелин, базигин, индуктор металлопротеиназ ЭК, миелоидные
внеклеточного матрикса EMMPRIN, TCSF, Мб и лимфоидные предшественники
CD148 Н РТР-eta фосфотирозин-фосфатаза Экспрессируется повсеместно; не экспрессируется опухолевыми клетками при раке молочной железы, мочевого пузыря и гепатоклеточной карциноме
CD150 Суперсемейство Ig сигнальная молекула активации лимфоцитов (SLAM) В, Т, тимоциты
Приложение
Таблица 8: Список кластеров дифференцировки (CD)
Номер CD Другие обозначения и функции молекулы/антигена Клеточная экспрессия
CD151 РЕТА-3, тетраспанин Тр, ЭК, эпителий, Г
CD152 CTLA-4, член суперсемейства Ig, лиганд CD80 и CD86 Актив. Т
CD153 Лиганд CD30, член семейства ФНО Т
CD154 Лиганд CD30, др39, член семейства ФНО Актив. CD4+ Т
CD155 Рецептор полиовируса (PVR) суперсемейство Ig Во многих клетках
CD156a Семейство ЭФР, ADAM8 М, Г
(дезинтегрин и металлопротеиназа)
CD156b ФНО-конвертирующий фермент TACE/ADAM17, Во многих тканях
молекула адгезии
CD157 Антиген стромы костного мозга 1 (BST-1) Строма КМ, Г, М, ЭК, ФДК
CD158 Семейство KIR НК
CD159a NKG2A НК
CD160 BY55 Т
CD161 NKRP1A семейство С-лектинов НК,Т
CD162 Лиганд Р-селектина (PSGL-1), лиганд CD62P М, П, Т(В)
CD162R PEN5 НК
CD163 М130, рецептор-мусорщик RI/II. функции неизвестны (М, МФ)
CD164 Муциноподобный гомодимерный гликопротеин MGC-24 М, Г,Т(В)
CD165 AD2 Тр, Т, НК, тимоциты
CD166 ALCAM, лиганд CD6, суперсемейство Ig ЭК, М
CD167a Молекула адгезии, DDR1 ЭК
CD168 Молекула адгезии, RHAMM Тимоциты, клетки рака
молочной железы
CD169 Молекула адгезии, сиалоадгезин Субпопуляция МФ
CD170 Молекула адгезии, siglec-5 Нейтрофилы
CD171 Молекула адгезии, L1-CAM Во многих клетках
CD172a Молекула адгезии, SIR Ра Во многих клетках
CD173 Углевод, антиген группы крови Н. тип 2 Эритроидные клетки, Тр
CD174 Углевод, антиген у группы крови системы Льюис Эритроидные клетки, Тр
CD175 Углевод, Тп антиген Субпопуляция
стволовых клеток
CD175S Углевод, антиген сиалил-Тп Эритробласты
CD176 Углевод, TF антиген Субпопуляция
стволовых клеток
CD177 NB1 Миелоидные клетки
CD178 Fas-лиганд Актив. Т
CD179a Vpre-B Ранние предшественники
В-клеток
CD179b Лямбда 5 В
CD180 RP1O5 В
CD183 Хемокиновый рецептор CXCR3 Во многих клетках
CD184 Хемокиновый рецептор CXCR4 Во многих клетках
CD195 Хемокиновый рецептор CCR5 Во многих клетках
CDw197 Хемокиновый рецептор CCR7 Во многих клетках
CD200 0X2 Во многих клетках
CD201 Рецептор эндотелиального белка С (EPCR) ЭК
CD202b Тирозинкиназа Tie2 (Тек) ЭК
CD203c NPP3/PDNP3 Миелоидные клетки
CD204 Рецептор макрофагов-мусорщиков Миелоидные клетки
CD205 DEC205 ДК
CD206 Маннозный рецептор макрофагов МФ. ЭК
CD207 Лангерин ДК
Приложение
Таблица 8: Список кластеров дифференцировки (CD)
Номер CD Другие обозначения и функции молекулы/антигена Клеточная экспрессия
CD208 DC-LAMP ДК
CD209 DC-SIGN ДК
CDw210 Рецептор ИЛ-10 Во многих клетках
CD212 Рецептор ИЛ-12 Актив. CD4+, CD8+ Т
CD213a1 а-1 Рецептор ИЛ-13 В, М, ЭК, фибробласты
CD213a2 а-2 Рецептор ИЛ-13 В, М, ЭК, фибробласты
CDw217 Рецептор ИЛ-17 Актив. Т-клетки памяти
CD220 Рецептор инсулина Во многих клетках
CD221 Рецептор IGF1 Во многих клетках
CD222 Рецептор маннозо-6-фосфата/1СЕ2 Во многих клетках
CD223 LAG-3 Актив. Т, НК
CD224 у- Глута м илтра нсфераза Во многих клетках
CD225 Leu13 Во многих клетках
CD226 DNAM 1, РТА1 Субпопуляция Т; НК, М, Тр
CD227 MUC 1 Во многих клетках
CD228 Меланотрансферрин Во многих клетках,
клетках меланомы
CD229 Ly9 Лимфоциты
CD230 Прион Во многих клетках
CD231 TALLA-1/A15 Во многих клетках
CD232 Рецептор VESP Во многих клетках
CD233 Полоса 3 Эритроидные клетки
CD234 Fy-гликопротеин, антиген системы Даффи (DARC) Эритроидные клетки
CD235a Гликофорин А Эритроидные клетки
CD235b Гликофорин В Эритроидные клетки
CD235ab Гликофорин АВ Эритроидные клетки
CD236 C/D Гликофорин C/D Эритроидные клетки
CD236R Гликофорин С Эритроидные клетки
CD238 Антиген системы Келл Эритроидные клетки
CD239 Молекула адгезии В-САМ Эритроидные клетки
CD240CE Антиген системы резус Rh30CE Эритроидные клетки
CD240D Rh30D Эритроидные клетки
CD240DCE Rh30D/CE (перекрестная реактивность) Эритроидные клетки
CD241 Антиген Rh Эритроидные клетки
CD242 ICAM-4 Эритроидные клетки
CD243 MDR-1 Стволовые клетки/
предшественники
CD244 2В4 НК
CD245 Р220/240, NPAT Т
CD246 Киназа анапластической лимфомы Во многих клетках
CD247 Дзета-цепь TCR Т. НК
Приложение
285
Приложение
Таблица 9: Наиболее важные цитокины и хемокины
Принятые сокращение: ак = аминокислота, АПК = антигенпрезентирующая клетка, актив. = активированный, ДК = дендритные клетки, ИЛ = интерлейкин, кДа = килодальтон, КМ костный мозг, ЭК = эндотелиальные клетки.
Цитокин Другие обозначения ИЛ-1 Лимфоцитактивирующий фактор, эндогенный пироген, эндогенный медиатор лейкоцитов, катаболин ИЛ-2 Фактор роста Т-клеток (TcGF) ИЛ-3 Мульти-КСФ, фактор роста тучных клеток, КСФ эозинофилов, фактор роста гемопоэтических клеток, взрывообразующая активность (ВРА) ИЛ-4 Фактор стимуляции В-клеток-1 (BSF1) ИЛ-5 Фактор дифференцировки эозинофилов/КСФ эозинофилов, В-клеточный ростовой фактор II (BCGFII), активатор синтеза IgM В-клетками (BCDFp,), фактор генерации цитотоксических Т-клеток (TRF) ИЛ-6 ИНФ-02, фактор стимуляции В-клеток-2 (BSF2), фактор роста плазмоцитомы, фактор стимуляции гепатоцитов (HSF), индуктор моноцитов/гранулоцитов-2 (MGI-2) ИЛ-7 Лимфопоэтин 1 (LP-1), фактор роста пре-В-клеток И Л - 8 см. Хемокины ИЛ-9 Р40, активатор роста тучных клеток, Т-клеточный ростовой фактор III Хромосомный Структура локус 2q12-q21 Состоит из двух молекул с некоторой гомологией: ИЛ-1а (271 ак) и ИЛ-10 (269 ак), связывающихся с одним рецептором, с которым также связывается агонист рецептора ИЛ-1 (IL-1Ra) и отменяет действие ИЛ-1 4q26-q27 133 ак, 15 кДа 5q23-q31 152 ак, 15 кДа 5q31 Глобулярная структура с гидрофобным ядром; 129 ак, 15 кДа 5q23-q31 Гомодимер; 115 ак, 13 кДа 7р21-р14 183 ак, 26 кДа 8q21-q13 152 ак, 20-28 кДа 5q31.1 126 ак, 32-39 кДа
Приложение
Источник Клетки-мишени Биологическая активность Рецепторы
Моноциты, Т, в, ЭК, Активация лимфоцитов Рецептор типа 1:
макрофаги, гепатоциты, и макрофагов, усиление CD121a (80 кДа),
ДК, астроциты, НК, В-клетки, эк, фибробласты костные клетки клеточной адгезии; ;ри lg-подобных домена; лихорадочные состояния, рецептор типа 2: потеря массы тела, гипотензия, CD121 b (60 кДа). реакции острой фазы три lg-подобных домена; растворимый рецептор может связывать ИЛ-1р
Т-клетки Т, НК, В-клетки, Пролиферация Три цепи: а-цепь (р55), Г
моноциты, макрофаги, олиго-
дендроциты
и дифференцировка
Т и В-клеток, активация моноцитов
CD25; р-цепь (р75) CD122; у-цепь (р64); у-цепь общая с рецепторами ИЛ-4, ИЛ-7, ИЛ-9, ИЛ13 и ИЛ-15; а/у и р/у гетеродимеры образуют рецепторы промежуточной аффинности; а/р/у-гетеродимеры образуют высокоаффинные рецепторы
Актив. Все клетки- Фактор роста клеток- Две субъединицы: а-цепь
Т-клетки, тучные клетки, эозинофилы Тучные клетки, Т-клетки, стромальные клетки КМ Тучные клетки, Т-клетки, эозинофилы предшественники костного мозга Т, В-клетки, моноциты, ЭК, фибробласты Эозинофилы предшественников КМ, (CD123) и р-цепь образуют В-клеток и моноцитов высокоаффинный рецептор ИЛ-3; р-цепь общая с рецепторами ИЛ-5 и ГМ-КСФ Изотипическое переключение, Две цепи: а-цепь (р140, CD124) секреция lgG4 (lgG1) и IgE обеспечивает высокоаффинное В-клетками связывание ИЛ-4; общая у-цепь (р64) повышает аффинность Индукция дифференцировки Две цепи: эозинофилов, роста а-цепь (CD125) обеспечивает и дифференцировки В-клеток низкоаффинное связывание ИЛ-5; (только в мышах) р-цепь общая с рецепторами ИЛ-4 и ГМ-КСФ
Т, В-клетки, В-клетки, макрофаги, плазматические стромальные клетки, клетки КМ, гепатоциты, фибробласты, клетки КМ ЭК Клетки КМ, Т, В-клетки стромальные клетки тимуса, клетки селезенки Рост и дифференцировка Две цепи: а-цепь (CD126) В-клеток, пролиферация обеспечивает низкоаффинное Т-клеток, реакции острой фазы связывание ИЛ-6; р-цепь (др130) связывается с комплексом а -цепь/ИЛ-б Пролиферация и созревание Две цепи: а-цепь (CD127) Т-и В-клеточных связывает ИЛ-7; у-цепь предшественников общая с рецепторами ИЛ-4, ИЛ-9, ИЛ-13 и ИЛ-15
Тн2-клетки Клетки Ходжкина, Т-клетки, тучные клетки, мегакариоциты, эритроидные предшественники Пролиферация Т-клеток и базофилов Рецептор ИЛ-9 связывается с общей у-цепью
Приложение
Таблица 9: Наиболее важные цитокины и хемокины (продолжение)
Цитокин Другие обозначения Хромосомный локус Структура
ИЛ-10 Ингибитор синтеза цитокинов 1 160 ак, 35-40 кДа (CSIF)
ИЛ-11 Ингибитор адипогенеза 19q13.3-13.4 179 ак, 23 кДа
ИЛ-12 Фактор стимуляции натуральных 7 Гетеродимер, состоящий
ИЛ-13 клеток-киллеров (NKSF), фактор созревания цитотоксических лимфоцитов (CLMF) Р600 5q31 из двух цепей (р35 и р40). 196 ак (30-33 кДа) и 306 ак (35-44 кДа) соответственно 112 ак, 9/17 кДа
ИЛ 14 Высокомолекулярный фактор роста В-клеток (HMW-BCGF) 7 483 ак, 60 кДа
ИЛ-15 Фактор роста Т-клеток 4q31 Сходство с ИЛ-2; 114 ак, 14 кДа
ИЛ-16 Хемоаттрактант лимфоцитов (LCF) 7 130 ак, 40 кДа (предшественник: 632 ак)
ИЛ-17 Антиген цитотоксических лимфоцитов (CTLA-8) 7 132 ак, 20 кДа
ИЛ-18 у-ИНФ индуцирующии фактор (IGIF) ИЛ-19 (гомолог ИЛ-10) ИЛ-20 (гомолог ИЛ-10) ИЛ-21 (родственен ИЛ-2 и ИЛ-15) 7 1q32.2 1q32.2 157 а к, 18 кДа, имеет сходство сИЛ-10 152 ак, 17,6 кДа
ИЛ-22 (гомолог ИЛ-10) Т-клеточный индуцибельный фактор (IL-TIF) 12q15 147 ак, 16,8 кДа
Приложение
Источник Клетки-мишени Биологическая активность Рецепторы
Т^О и В-клетки, Активация и пролиферация Одна цепь, гомологичная
Тн2-клетки, CD4" и CD8+ Т-клетки, моноциты, макрофаги, ДК тимоциты, Тн1-клетки, моноциты, НК В-клеток, тимоцитов, тучных клеток рецептору у-ИНФ и ар-И НФ
Фибробласты стромальные клетки КМ Гемопоэтические предшественники, клетки плазмоцитомы, адипоциты Фактор роста гемопоэтических предшественников, ингибитор адипоцитов 7
ДК, моноциты, макрофаги, В-клетки Т, НК-клетки Синтез у-ИНФ в Т и НК-клетках; активация и дифференцировка Тн1-клеток Один большой рецептор, по структуре сходный с рецептором Г-КСФ
Актив Т-клетки В-клетки, моноциты Пролиферация и дифференцировка В-клеток, секреция IgE 7
Т, В-клетки Актив. В-клетки Пролиферация актив. В-клеток, ингибирование синтеза иммуноглобулинов Уникальный рецептор
Периферические моно-нуклеары, плацента, скелетные мышцы, почки, легкое, сердце Т-клетки, лимфокин-активированные клетки-киллеры Фактор роста Т-клеток Общие с рецептором ИЛ-2 р- и у-цепи; одна вариабельная а-цепь
CD8 Т-клетки Эозинофилы. CD4r Т-клетки. моноциты Хемотаксис 7
CD4 Стромальные Провоспалительное действие Нет гомологии с другими
Т-клетки клетки, фибробласты аналогичное действию ФНО и лимфотоксина рецепторами
Клетки Купфера, кератиноциты, остеокласты Кератиноциты Т-клетки Т, НК-клетки Моноциты Кератиноциты (аутокринный фактор), моноциты Т, НК, В-клетки Индукция у-ИНФ Образование ИЛ-6 и ФНО-а; индукция апоптоза и выделения активных кислородных молекул Играет роль в функционировании эпидермиса и развитии псориаза; индукция пролиферации Т-клеточная костимуляция, экспансия НК-клеток, пролиферация В-клеток; синтез Ig Индукция реактантов острой фазы в печени и поджелудочной железе Одна часть рецептора общая с рецептором ИЛ-1 i Рецептор ИЛ-21. а также имеет общую у-цепь с интерлейкинами 2, 4,7, 9 и 15 Рецептор ИЛ-22, р-цепь рецептора ИЛ-10
Приложение
Приложение
Таблица 9: Наиболее важные цитокины и хемокины (продолжение)
Цитокин Другие обозначения Хромосомный Структура
локус
ИЛ-23 12q1313
ИЛ-24 Ген дифференцировки меланомы-7 1q32 (гомолог (MDA-7), mob-5, IL-17F
ИЛ-10)
23 кДа
ИЛ-25 SF20
(член семейства ИЛ 17) ИЛ-26 (гомолог ИЛ-10) АК155 12q15
а-ИНФ а-Интерферон, интерферон 1 типа, лейкоцитарный интерферон, интерферон светлого слоя кровяного сгустка 9 а - Интерфероны - это семейство белков, являющихся продуктами как минимум 24 генов; «1-интерферон: 166 ак, 16-27 кДа,
И НФ |3-Интерферон, интерферон 1 типа, интерферон фибробластов 9р22 166 ак, 20 кДа
у ИНФ у-Интерферон, иммунный интерферон 2 типа, Т- клеточ н ы й и нтерферон 12q24 1 143 ак, 40-70 кДа; мономеры 20-25 кДа образуют димеры или мультимеры
ФНО а
ФНО-р
ТФР-а
Фактор некроза опухолей, кахектин, 6р21 3 некрозин, геморрагический фактор цитотоксин макрофагов
Фактор некроза опухолей, 6р21
лимфотоксин, цитотоксин
Трансформирующий 2
фактор роста-a (TGF-a), фактор роста саркомы
157 ак, 52 кДа
(исходная форма 17, 4 кДа)
35% гомологии с ФНО а; 171 ак, 25 кДа
50 ак, 6 кДа, высокий уровень гомологии с IgF
290
Приложение
Источник
Клетки-мишени
Биологическая активность
Актив ДК
Т-клетки памяти
Секреция ИЛ 17
Остановившиеся в росте и терминально дифференцированные клетки меланомы, актив, моноциты и Т-клетки Стромальные клетки КМ
Супрессор опухоли;
стимулирует рост Т-клеток и ингибирует ангиогенез, побуждает ЭК синтезировать ИЛ-2, ТФР-р и МСР-1
Рецепторы
Рецептор ИЛ-23, р1 цепь рецептора ИЛ-12;
гетеродимеры, состоящие из субъединицы р40 ИЛ-12 и другой субъединицы, родственной р35 ИЛ-12, называют р19
Рецепторы ИЛ-22-1, 2;
ИЛ-20-1,2
Т-клетки
Лимфоциты, моноциты, макрофаги
Большинство клеток организма
Способствует Тн2-подобному ответу
Общий тимусный антиген-1 (TSA-1)
Приложение
Фибробласты, эпителиальные клетки CD8+ и CD4+ Т-клетки, НК клетки
Актив моноциты и макрофаги, ДК, В, Т-клетки, фибробласты Актив Т и В-клетки
Моноциты, кератиноциты, различные ткани
Практически все клетки организма
Гемопоэтические клетки, эпителиальные и эндотелиаль ные клетки, многие опухо левые клетки Практически все клетки организма
Практически все клетки организма Практически все клетки организма
Повышает сопротивляемость вирусным инфекциям, ингибирует пролиферацию клеток, регулирует экспрессию молекул МНС класса II Аналогичен а-И НФ
Активация, рост и дифференцировка Г, В клеток, макрофагов, НК, ЭК; усиливает противовирусное действие а и р-ИНФ
Провоспалительный цитокин, фактор роста и дифференцировки для многих клеток; цитотоксичен для многих трансформированных клеток Рост и дифференцировка многих клеток
Рост и дифференцировка многих клеток
По крайней мере два разных рецептора, один из которых связываетаир ИНФ; гомологичны рецепторам у-ИНФ и ИЛ 10 Общий рецептор с а-ИНФ
Две цепи одна (CD119) имеет высокое сродство ку-ИНФ; р цепь -вспомогательная цепь для передачи сигнала
Рецептор 1 типа (CD120A), 2 типа (CD120B);
оба связывают ФНО-а и р; растворимые рецепторы детектируются в сыворотке и моче Общий рецептор с ФНО-а
Общий рецептор с ЭФР (известен как с-егЬВ)
291
Приложение
Приложение
Таблица 9: Наиболее важные цитокины и хемокины (продолжение)
Цитокин ТФР-₽ Другие обозначения Трансформирующий фактор роста-р (TGF-p), фактор ингибирования дифференцировки Хромосомный локус 9q13, 1q41, 14q24 Структура Три родственных белка: TGF-pi, II и III из 112 ак, 25 кДа
ЭФР Эпидермальный фактор роста, р-урогастрон 4q25 Продукт протеолиза мембранного белка, 53 ак, 6 кДа
Г-КСФ Колониестимулирующий фактор гранулоцитов 17q21-22 17 ак, 21 кДа
ГМ-КСФ Колониестимулирующий фактор гранулоцитов и макрофагов. КСФ-а 5q21q32 127 ак, 22 кДа
М-КСФ Колониестимулирующий фактор макрофагов 5q33 1 224,406, 522 ак, 45-90 кДа; гомодимерная структура; существует 3 варианта мРНК
ФСК Фактор стволовых клеток, фактор роста тучных клеток, kit-лиганд (KL), стальной фактор (SLF) 12q22-24 Продукт протеолитического расщепления трансмембранных белков: 222 ак и 248 ак, 36 кДа
Flt3L fms-подобная тирозинкиназа-3, киназа печени плода-2 (fIk-2) 19q13.3-13.3 353 ак
ЭП Эритропоэтин (ЕРО)
ТП Тромбопоэтин (ТРО)
7pter-q22 166 ак. 36 кДа
3q27 322 ак. 60 кДа
292
Приложение
Источник Клетки-мишени Биологическая активность Рецепторы
Практически Практически Ингибирование роста клеток, Три рецептора
все ядросодержащие клетки, многие опухолевые клетки все клетки организма организация тканей с разной активностью
Все эктодермаль- Практически ные клетки, все клетки моноциты, организма клетки почек железы Рост эпителиальных клеток, заживление ран Общий рецептор с ТФР-а
Макрофаги, Гранулоциты Рост, дифференцировка Две формы рецептора.
фибробласты, и миелоидные и активация гранулоцитов различающиеся
ЭК, предшественники, и миелоидных цитоплазматическими
стромальные клетки КМ ЭК, тромбоциты и предшест венники предшественников; пролиферация и миграция ЭК участками
Т-клетки, Гранулоциты, Фактор роста гемопоэтических Две цепи: низкоаффинная
макрофаги. моноциты и предшественников, фактор a-цепь (CD116) и общая
фибробласты, предшественники, дифференцировки и активации с рецепторами ИЛ-3 и ИЛ-5
ЭК ЭК, фибробласты. КЛ, ДК гранулоцитов и моноцитов, фактор роста ЭК p-цепь связываются между собой, образуя высокоаффинный рецептор
Лимфоциты, Макрофаги Рост, дифференцировка М-КСФ (CD115) кодируется
моноциты, фибробласты, эпителиальные клетки, ЭК и предшественники и активация макрофагов и предшественников протоонкогеном c-fms
Стромальные клетки, гол. мозг, печень, почки, легкое, фибробласты, овоциты Практически все гемопоэти ческие предшественники, за исключением В-клеток Фактор роста гемопоэтических клеток Протоонкоген с-kit (CD117)
Т-клеточные Гемопоэтические Мобилизация стволовых клеток Flt3R, 993 ак, 5 lg-подобных
линии предшественники в периферической крови, ex vivo экспансия стволовых клеток, ex vivo и in vivo экспансия ДК, противоопухолевая активность in vitro внеклеточных доменов
Печень, почки Эритроидные предшественники, ЭК Фактор роста и дифференцировки предшественников эритроцитов и кровеносных сосудов Одна цепь, 484 ак
Печень, почки, Мегакариоциты скелетные мышцы Фактор роста и дифференцировки мегакариоцитов Одна а-цепь и общая с рецепторами ИЛ-3. ИЛ-5 и ГМ КСФ р цепь
Приложение
Таблица 9: Наиболее важные цитокины (продолжение)
Система- Наиболее Другие обозначения тическое употребимое название название
Хемокины
Гермин «хемокин» происходит от словосочетания «хемотаксические цитокины» и относится к суперсемейству мелких провоспалительных ин-дуцибельных молекул, способствующих хемотаксису (миграции) различных типов клеток Мо пекулярная масса этих гомологичных между собой молекул составляет 8-10 кДа; все они име-
Хромосомный локус, название гена
ют несколько консервативных остатков цистеина. Описано два больших семейства хемокинов: 4q хемокины кодируются генами локусов SCYB (small inducible cytokine subfamily member В) на хромосоме 4q12-21. Хемокины этого семейства имеют два цистеиновых остатка (С), разделенных одной аминокислотой (X). поэтому их называют
СХС-хемокины: два остатка цистеина (С) разделены другой аминокислотой (X)
CXCL1 GROcx Связанный с ростом онкоген GROcx, фактор роста меланомы-сх (MGSAcx), нейтрофилактивирующий белок 3 (NAP-3) 4q12-13, член индуцибельного семейства цитокинов В1 (SCYB1)
CXCL2 GROp Связанный с ростом онкоген GROp, фактор роста меланомы-р (MGSAp) воспалительный белок макрофагов 2-сх (М1Р-2сх) 4q12-13, SCYB2
CXCL3 GROy Связанный с ростом онкоген GROy, 4q12 13.
фактор роста меланомы-у (MGSAy) SCYB3
воспалительный белок макрофагов 2-р (М1Р-2р)
CXCL4 PF4
Тромбоцитарный фактор 4 (PF4), онкостатин А
4q12-13, SCYB4
CXCL5 ENA-78 Эпителиальный аттрактант нейтрофилов 78 (ENA-78) 4q12-13,
SCYB5
CXCL6 GCP-2 Хемотаксический фактор гранулоцитов 2 (GCP-2), 4q12-13,
ЛПС-индуцируемый СХС (LIX) SCYB6
CXCL7 NAP-2 Нейтрофилактивирующий белок-2 (NAP-2), 4q12 13,
белок-активатор соединительной ткани 3 (СТАР-3), SCYB7
низкоаффинный фактор тромбоцитов 3 (LA PF4), основной белок тромбоцитов (РВР), р-тромбоглобулин
Приложение
Структура Источник
Клетки-мишени Биологическое действие
Рецепторы
СХС-хемокинами. Члены другого большого семейства 17q хемокинов имеют два соседних цистеиновых остатка (СС-хемокины) и кодируются в хромосомном локусе 17q11 -32 (SCYA). Еще одна группа хемокинов характеризуется наличием единственного дисульфидного мостика и цитоплазматического С-конца, необходимого для
передачи сигнала (С-хемокины) Наконец, существует группа хемокинов, имеющих два остат ка цистеина, разделенных тремя аминокислотами (СХ^С-хемокины). До настоящего времени охарактеризовано лишь несколько хемокинов, относящихся к двум последним группам
73 ак, Актив, моноциты, Нейтрофилы, ЭК Хемотаксис и дегрануляция CXCR2 >
7,9 кДа фибробласты, ЭК, эпителиальные клетки, синовиальные клетки нейтрофилов; рост фибробластов, меланомы и предшественников олигодендроцитов CXCR1
73 ак, 7,9 кДа Актив моноциты, фибробласты, ЭК, эпителиальные клетки, синовиальные клетки Нейтрофилы, ЭК Хемотаксис и дегрануляция нейтрофилов; рост фибробластов, меланомы и предшественников олигодендроцитов CXCR2
73 ак, 7,9 кДа Актив моноциты, фибробласты, ЭК, эпителиальные клетки, синовиальные клетки Нейтрофилы, ЭК Хемотаксис и дегрануляция нейтрофилов; рост фибробластов, меланомы и предшественников олигодендроцитов CXCR2
70 ак, Мегакариоциты Моноциты Хемотаксис моноцитов активация Неизвестен
7,8 кДа и тромбоциты тучные клетки, ЭК пупочной вены нейтрофилы и дегрануляция нейтрофилов, ингибирование ангиогенеза (хондроитин-сульфат нейтрофилов)
78 ак, 8,4 кДа Эпителиальные клетки Нейтрофилы Хемотаксис и активация нейтрофилов CXCR2
75 ак, 8 кДа Фибробласты, эпителиальные клетки Нейтрофилы Хемотаксис нейтрофилов CXCR1, CXCR2
69-85 ак, Макрофаги, Моноциты, Хемотаксис фибробластов, CXCR2
6-7,5 кДа тромбоциты, нейтрофилы, нейтрофилов и моноцитов;
(усеченные эпителиальные формы пред- клетки, ЭК шественника -лейкоцитарного фактора роста фибробласты митоген для фибробластов; способствует выделению гиалуроновой кислоты, гликозаминогликанов, активатора плазминогена и ПГЕ2; способствует
LDGF); делеция 2 ак от NAP-2 приводит к образованию тромбосидина-1 образованию гистамина базофилами
Приложение
Приложение
Таблица 9: Наиболее важные цитокины (продолжение)
Систематическое название Наиболее употребимое название Другие обозначения Хромосомный локус, название гена
CXCL8 ИЛ 8 Нейтрофилактивирующий белок-1 (NAP-1), фактор активации нейтрофилов (NAF), ингибитор адгезии лейкоцитов (LAI) хемотаксический белок гранулоцитов (GCP), нейтрофилактивирующий белок эндотелиальных клеток (ENAP-p) 4q12-13, SCYB8
CXCL9 Mig у-ИНФ-индуцированный монокин (mig), ген цитокин-респонсивный-10 (CRG-10) 4q21.21, SCYB9
CXCL10 IP-10 ИНФ-индуцибельный белок-10 или иммунный белок-10 (IP-10), цитокин респонсивный ген-2 (CRG-2) 4q21.21, SCYB10
CXCL11 l-TAC ИНФ-индуцибельный Т-клеточный а-хемоаттрактант (I-TAC), ИНФ-у-индуцибельный белок-9 (IP-9) 4q21.21, SCYB11
CXCL12 SDF-1a/p Стромальный фактор-1 (SDF-1), фактор стимуляции роста пре-В-клеток (PBSF) 10q11.1, SCYB12
CXCL13 BCL/BCA-1 В-лимфоцитарный хемоаттрактант (BCL), В-клеточный аттрактантный хемокин-1 (ВСА-1) 4q21, SCYB13
CXCL14 BRAK СХС хемокин молочной железы и почек (BRAK), фактор активации В-клеток и моноцитов (ВМАС) 5q31, SCYB14
CXCL15 (до сих пор идентифицирован только в мышах)
Хемокин Weird (WECHE)
Лангкин (lungkine)
Мышиная хр.
5.51.5, SCYB15
296
Приложение
Структура Источник Клетки-мишени Биологическое действие Рецепторы
72 ак, 8 кДа, Актив. ЭК Все клетки Хемотаксис всех мигрирующих CXCR1,
образуется при процессинге и моноциты иммунной фибробласты, системы, иммунных клеток, активирует нейтрофилы, ингибирует выброс CXCR2
предшественника из 99 ак; существуют более длинные и более короткие формы кератиноциты, эритроциты, ЭК, меланоциты, некоторые гепатоциты, эпителиальные хондроциты, клетки ряд опухолевых клеток гистамиц^ базофилами, регулирует синтез IgE В-клетками, способствует ангиогенезу
103 ак, 11,7 кДа Макрофаги, Актив эпителий нейтрофилы, бронхов ЭК, опухолевые клетки - после стимуляции у ИНФ Хемотаксис моноцитов, модуляция роста клеток и активация при воспалении CXCR3
98 ак Лимфоциты, Лимфоциты, моноциты, моноциты, кератиноциты, нейтрофилы, ЭК, нейтрофилы ЭК Регуляция роста незрелых гемопоэтических предшественников, ингибирование ангиогенеза, индукция пролиферации мезангиальных клеток CXCR3
73 ак, 8,3 кДа Актив астроциты, ИЛ 2-активиро-актив моноциты ванные Т-клетки Мощный хемоаттрактант для ИЛ 2-активированных Т клеток CXCR3
89 и 93 ак Экспрессируется В основном Хемотаксис одноядерных клеток, CXCR4, рецеп-
(4 доп. ак bSDF-10), 32 кДа повсеместно, лимфоциты но не в клетках и моноциты крови включая предшественников КМ тор пре-В-кле точного хемо-кина (PB-CRK)
109 ак, 13,2 кДа Фолликулы Клетки экспрес- селезенки, сирующие рецеп лимфоузлы, тор лимфомы Пейеровы бляшки Беркитта 1 (Ыг 1) Активация и усиление хемотаксиса В лимфоцитов CXCR5, Ыг 1
88 ак 17 кДа Повсеместно Актив моноциты экспрессируется в нормальных тканях, образуется фибробластами, кератиноцитами, клетками lamina propria Высокий уровень Клетки КМ мыши экспрессии в легком, печени плода и желточном мешке (мыши) Селективный хемотаксис актив. моноцитов в воспаленных тканях Ингибирует рост эритроидных предшественников, способствует миграции клеток КМ Неизвестен
Приложение
297
Приложение
Таблица 9: Наиболее важные цитокины (продолжение)
Систематическое название Наиболее употребимое название Другие обозначения Хромосомный локус, название гена
С-хемокины
XCL1 Лимфотактин (Ltn, Lptn) SCM-1a, АТАС 1q23
XCL2 SCM-1₽ SCM-10 1q23
СХзС-хемокины
CX3CL1 Фракталкин (FK, FKN)
16q13
СС-хемокины
CCL1 1-309 Р500, ТСА-3 (мышиный гомолог I-309) 17q11.2, SCYA1
CCL2 MCP-1/MCAF Хемоаттрактантный белок моноцитов-1 (МСР-1), хемоаттрактантный и активирующий фактор моноцитов (MCAF), хемотаксический фактор клеток глиомы (GDCF), ФНО-стимулированная последовател ь ность - 8 17q11.2-q21.1, ген JE в локусе SCYA2
CCL3
MIP-1 cx/LD78a
Макрофагальный воспалительный белок-1а (MIP-1-сх), ген переключения G0/G1 (GOS-19)
17q11.2, SCYA3
CCL4 MIP-1-р Ген иммунной активации-2 (АСТ-2), макрофагальный воспалительный белок-1р (MIP-1-J3) 17q11 2, SCYA4
CCL5 RANTES
RANTES (Regulated upon activation, normal T-cell 17q11.2, SCYA5
expressed and secreted), малый индуцибельный секретируемый хемокин-дельта (SIS-6). эозинофильный хемотаксический полипептид-1 (ЕоСР-1)
CCL6 СЮ, белок-1, связанный с макрофагальным
(только воспалительным белком (MRP-1)
у мышей)
? SCYA6
Приложение
Структура Источник
Клетки-мишени Биологическое действие
Рецепторы
93 ак, 2 Актив. Т, НК, В-клетки, Хемотаксис лимфоцитов, XCR1
различные структурные конформации про-Т-клетки, тимоциты, CD8+ Т-клетки нейтрофилы НК и нейтрофилов
Отличается от XCL1 только на 2 ак Аналогичен XCL1? Аналогичен XCL1? Аналогичен XCL1? XCR1
397 ак, хемокино- ЭК, эпителиальные Моноциты, подобный домен клетки, нейроны Т, НК-клетки расположен
над муциновым
и трансмембран-
ным доменом
Мембраносвязанная форма CX3CR1 индуцирует связывание и адгезию CX3CR1+ клеток, растворимая форма индуцирует активацию и миграцию CX3CR1+ клеток
72 ак, 15-16 кДа 76 ак, неглико-зилированный: 6-7 кДа, гликозилированный: до 30 кДа
Актив. Т-клетки Моноциты, макрофаги, фибробласты, ЭК, кератиноциты, клетки гладких
Моноциты Моноциты, Т-клетки, базофилы и эозинофилы
Хемотаксис и активация моноцитов CCR8 Хемотаксис моноцитов, активация CCR2 моноцитов и базофилов (индуцирует выделение гистамина)
Приложение
69 ак,
7,8 кДа
Высокий уровень гомологии cMIP-1-а
8 кДа
мышц, астроциты, различные опухолевые клетки Моноциты и макрофаги (при стимуляции бактериальными эндотоксинами), Т-клетки памяти (при активации) Моноциты и макрофаги (при стимуляции бактериальными эндотоксинами), Т-клетки памяти (при активации) Т-клетки
(индуцированные филы, базофилы, воспаления, индуцирует ФНО-а и ИЛ-1а)
Гранулоциты, Т-клетки, гемопоэтические предшественники
Гранулоциты, Т-клетки, гемопоэтические предшественники Т-клеток к ЭК
Т-клетки, эозино-
Гомолог
MIP-1-6?
Ингибирование гемопоэза, индукция миграции Т-клеток. усиление адгезии моноцитов к ЭК
Способствует росту гемопоэтических предшественников, активирует НК-клетки, способствует адгезии
При вл екает клетки к местам
Гемопоэтические клетки, фибробласты
моноциты, синовиальные фибробласты Моноциты, Т-клетки
высвобождение гранул эозинофилами, активирует НК-клетки
Участвует в миграции моноцитов и макрофагов при повреждении тканей
CCR1, CCR5
CCR5
CCR1 CCR3, CCR5
Неизвестен
299
Приложение
Таблица 9: Наиболее важные цитокины (продолжение)
Система- Наиболее Другие обозначения
тическое употребимое
название название
CCL7 МСР-3 Хемоаттрактантный белок моноцитов-3 (МСР-3),
хемокин, связанный с активацией тучных клеток (MARC), NC28
CCL8 МСР-2 Хемоаттрактантный белок моноцитов-2 (МСР-2)
Хромосомный локус, название гена
17q11.2 (вблизи локуса егЬВ2), SCYA7
17q11.2, SCYA8
CCL9 (только у мышей)
Макрофагальный воспалительный белок-1у (MIP-1-у), CCF18
Мышиная хр. 11, CSYA9
Приложение
CCL10 (только у мышей) CCL11
Эотаксин
Связан с человеческим CCL15?
SCYA10
17q21.1-21.2.
SCYA11
CCL12 Мышиный МСР-5 Хемоаттрактантный белок моноцитов-5 (МСР-5)
CCL13 МСР 4 Хемоаттрактантный белок моноцитов-4 (МСР-4)
Мышиная хр. 11, SCYA12
17q11.2, SCYA13
CCL14 НСС-1 СС-хемокин гемофильтрата-1 (НСС-1), фактор ингибирования колоний макрофагов (M-CIF)
17q11.2, SCYA14
CCL15 MIP-1-6 Макрофагальный воспалительный белок-5 (MIP-5), СС-хемокин гемофильтрата-2 (НСС-2), NCC-3, лейкотактин-1
17q11.2, SCYA15
CCL16 LEC
Хемокин печени (LEC), монотактин-1, новый СС-хемокин-4 (NCC-4), СС-хемокин гемофильтрата-4 (НСС-4)
17q11.2, SCYA16
300
Приложение
Структура Источник Клетки-мишени Биологическое действие Рецепторы
97 ак. Эпителиальные Моноциты, Хемотаксис моноцитов CCR1,
8-18 кДа и ЭК, моно-нуклеары крови при активации Т-клетки, эозинофилы и эозинофилов; индукция секреции протеаз макрофагами CCR3, CCR5, CCR10?
76 ак, 8-18 кДа Фибробласты, эпителиальные и ЭК, моно-нуклеары крови Моноциты, Т-клетки, эозинофилы Хемотаксис моноцитов CCR1, CCR2B, CCR5
100 ак Мышиные макрофаги Гемопоэтические клетки КМ, Т-клетки Подавление колониеобразования в стимулированном КМ; индуцирует высвобождение кальция нейтрофилами, активирует и рекрутирует Т-клетки Неизвестен Неизвестен
97 ак Эпителиальные клетки, макрофаги, Т-клетки, фибробласты Эозинофилы Хемотаксис эозинофилов, активация и высвобождение кальция CCR3
82 ак, 9,3 кДа Лимфоузлы, повышение уровня экспрессии в актив, моноцитах Моноциты, макрофаги Сильный хемоаттрактант моноцитов и макрофагов CCR2
75 ак Эпителиальные и ЭК (при стимуляции ФНО-а и ИЛ-1), макрофаги Моноциты, Т-клетки Мощный хемоаттрактант моноцитов и Т-клеток CCR2, CCR3
74 ак, 8,6 кДа Селезенка, Моноциты, печень, скелетные миелоидные и сердечные предшественники мышцы, ЖКТ, КМ; растворимая форма присутствует в крови Слабый аттрактант моноцитов; индукция пролиферации CD34+ миелоидных клеток, ингибирование колониеобразования под действием М-КСФ CCR1
92 ак, 6 вместо 4 коне. Cys остатков, сходство с мышиным СЮ Лейкоциты в печени, кишечнике, легком i Моноциты, незрелые ДК Т и В-клетки, эозинофилы Аттрактант для моноцитов, ДК, лимфоцитов, эозинофилов; ингибирует образование колоний клеток-предшественников CCR1, CCR3
100 ак, 11,2 кДа, Гепатоциты, Моноциты, Способствует клеточной адгезии, CCR1,
существует актив, моноциты лимфоциты, рекрутирует АПК к опухолевым CCR2,
предшественник (повышение из 120 ак уровня экспрессии ИЛ-10), некоторые НК, у/6-Т-клетки ДК клеткам CCR5, CCR8
Приложение
301
Приложение
Таблица 9: Наиболее важные цитокины (продолжение)
Система- Наиболее тическое употребимое название название
Другие обозначения
CCL17 TARC
Тимусный активируемый цитокин (TARC), ABCD-2
Хромосомный локус, название гена
16q13, SCYA17
CCL18 DC-CK1 Легочный активируемый хемокин (PARC), АМАС-1, хемокин дендритных клеток-1 (DC-CK1) 17q11.2 SCYA18
CCL19
MIP-3-p/ELC
EBI-1-лиганд (ELC) exodus-3
9р13, SCYA19
CCL2O
MIP-3-a/LARC Активируемый хемокин печени (LARC), exodus-1
2q33-q37, SCYA20
CCL21
6Ckine/SCL Хемокин с 6 цистеинами (6Ckine), хемокин вторичных лимфоилных тканей (SCL), exodus-2
9р13, SCYA21
CCL22 MDC Макрофагальный хемокин (MDC), STCP-1, DC/B-CK 16q13, SCYA22
CCL23 MPIF-1 Ингибирующий фактор миелоидных предшественников-1 (MPIF-1), хемокин-р-8 17q11.2, SCYA23
CCL24
MPIF-2/ Ингибирующий фактор миелоидных
эотаксин-2 предшественников-2 (MPIF-2), хемокин-р-6
7q11.23, SCYA24
CCL25 ТЕСК Тимусный хемокин (ТЕСК) 19р13.2, SCYA25
CCL26 Эотаксин-3 Макрофагальный воспалительный белок-4а (MIP-4-а), хемокин стромы тимуса-1 (TSC-1) 7q11.23, SCYA26
CCL27 CTACK/ILC Кожный Т-клеточный аттрактант (СТАСК), хемокин локуса IL-11Rcc (ILC), ALP, skinkine, ESkine, MILC 9р13, SCYA27
CCL28 МЕС Хемокин мукозоассоциированного эпителия (МЕС) 5, SCYA28
Приложение
Структура Источник Клетки-мишени Биологическое действие Рецепторы
94 ак, 8 кДа Тимоциты, ИЛ-13- Т-клетки активированные макрофаги, эпителий бронхов, кератиноциты Аттрактант для Тн2-клеток CCR4, CCR8
69 ак, 7,8 кДа ДК зародышевых Покоящиеся центров Т-клетки и Т-клеточных зон лимфоузлов, альвеолярные макрофаги, актив, моноциты Хемоаттрактант, привлекающий Т-клетки к участкам презентации антигена Неизвестен
98 ак Тимус,лимфоузлы, Т, В-клетки макрофаги Хемоаттрактант для CD34+ клеток, актив. Т и В-клеток CCR7
96 ак Печень, Незрелые ДК, фибробласты, Т-клетки ЛПС-стимули-рованные лейкоциты Хемоаттрактант для лимфоцитов, слабый хемоаттрактант для гранулоцитов CCR6
111 ак имеет 30-ак С-концевой домен с 2 доп. Cys остатками HEV лимфоидных Лимфоциты, органов, актив. Т-клетки лимфатический эндотелий различных органов Адгезия и миграция Т-клеток, в частности наивных Т-клеток CCR7
69 ак, 8,1 кДа Макрофаги, Актив. Т-лимфо ДК, В-клетки Т-лимфоциты и моноциты Привлечение актив. Т-клеток к взаимодействию с АПК CCR4
99 ак Разные ткани Моноциты, ДК, покоящиеся Т-клетки Хемоаттрактант для моноцитов, ДК, покоящихся Т-клеток предшественников остеокластов; ингибирование образования колоний миелоидных п ред шествен ников CCR1
93 ак, 10,6 кДа Актив моноциты Покоящиеся Т-клетки. эозинофилы, базофилы, гемопоэтические предшественники Хемотаксис покоящихся Т-клеток. эозинофилов и базофилов; высвобождение гистамина и ЛТ; ингибирование образования колоний стволовых клеток CCR3
127 ак ДК тимуса, Лимфоциты эпителиальные кишечного клетки тонкой эпителия кишки Хемоаттрактант для IgA-секретирующих клеток CCR9
71 ак ЭК, Эозинофилы эпителиальные клетки различных тканей Активация фибробластов и эозинофилов, хемотаксис эозинофилов и базофилов CCR3
95 ак, 10,9 кДа Кератиноциты Т-клетки памяти Селективный аттрактант Т-клеток кожи CCR10
108 ак, Эпителиальные Покоящиеся CD4" Аттрактант для покоящихся CCR10,
12,3 кДа клетки (особенно и CD8+ Т-клетки, слизистой) эозинофилы Т-клеток, эозинофилов CCR3
Приложение
303
Словарь терминов
Авидность Суммарный потенциал связывания антитела с антигеном, зависит от сродства эпитопов и паратопов а также от валентности антитела и антигена.
Агретоп Участок антигена или антигенного фрагмента, взаимодействующий с молекулой МНС.
Аллель Аллергия Вариант данного гена у особей определенного вида. Исходно этим термином называли реакцию организма при вторичном контакте с антигеном; сегодня под аллергией главным образом понимают реакции гиперчувствительности типа 1 или IV.
Аллогенный Аллогенные вариации представляют собой генетические различия между представителями одного и того же вида.
Аллотип Белковый продукт аллели, воспринимаемый в качестве антигена другим представителем данного вида
Анафилаксия Антиген-специфичная IgE-опосредованная иммунная реакция, сопровождающаяся вазодилатацией и сокращением гладких мышц и бронхов; может привести к летальному исходу.
Анафилатоксины Фрагменты комплемента (СЗа и С5а), индуцирующие дегрануляцию тучных клеток и сокращение гладких мышц
Антиген (Ад) Любое вещество способное вызвать специфический иммунный ответ или реагировать с участниками уже возникшего иммунного ответа (например, участвовать в перекрестных реакциях с антителами). Антигенами в основном являются белки и другие вещества с большой молекулярной массой. Некоторые низкомолекулярные вещества, которые сами не могут вызвать иммунный ответ (гаптены), способны связываться с эндогенными белками (носителями) и в виде таких комплексов оказывать полноценное антигенное воздействие.
Антигенпрезентирующая Макрофаги, дендритные клетки и клетки Лангерганса, способные поглощать
клетка (АПК) и процессировать антигены (например, из микроорганизмов, связанных на их поверхности), а также представлять их в комплексе с молекулами МНС Т-лимфоцитам. Правильная презентация крайне важна для развития эффективного иммунного ответа.
Антитело (АЬ) Молекула, образующаяся в ответ на контакт организма с антигеном и способная специфическим образом связывать его.
Апоптоз Атопия Программированная клеточная смерть (самоуничтожение клеток) Клинические проявления реакций гиперчувствительности 1 типа: экзема, астма, ринит.
Аутологичный Происходящий от того же индивида.
Вторичный ответ Иммунный ответ, возникающий при второй и последующих встречах со специфическим антигеном.
Гаплотип Гаптен Набор генетических детерминант на одной хромосоме Небольшая молекула, несущая антигенную детерминанту, но не способная самостоятельно вызывать иммунный ответ.
Геном Гетерологичный Весь генетический материал клетки. Принадлежащий другому виду.
Словарь терминов
Гетероядерная РНК (гяРНК)
Гибридома
Г истосовместимость
Гомологичный
Дезетоп
(desetope: determinant selection + tope)
Дендритная клетка
Идиотип
Идиотоп Изологичный Изотип
Иммунный комплекс
Интерлейкины (ИЛ)
Интерфероны (ИНФ)
Интрон
Кинины
Кластер дифференцировки (CD)
Клеточная линия
Клеточный цикл
Клон
Колониеобразующая единица (КОЕ)
Фракция ядерной РНК представляющая собой первичные непроцессированные ДНК-транскрипты, еще не превратившиеся в матричную РНК.
Гибридная линия клеток, образованная in vitro из двух типов клеток (обычно лимфоцитов), один из которых происходит от опухолевых клеток.
Способность приживления трансплантата, взятого от другого организма Относящийся к тому же виду.
Часть молекулы МНС, связывающаяся с антигеном или процессированным антигеном.
Антигенпрезентирующая клетка; в коже — это клетка Лангерганса, в лимфатических узлах — фолликулярная или интердигитальная клетка, в крови и лимфе — вуалевидная клетка.
Общий набор идиотопов антитела, имеющего также антигенные свойства. Существуют антиидиотипические антитела, идентичные эпитопу исходного антигена
Антигенная детерминанта на вариабельном участке антитела.
Характеризующийся идентичным генетическим составом.
Среди нескольких возможных вариантов специфических пептидов или белков изотипические варианты идентичны у всех особей данного вида (например, классы иммуноглобулинов).
Продукт взаимодействия антигена и антитела: может содержать компоненты системы комплемента.
Группа молекул, передающих сигналы между клетками иммунной системы. На сегодняшний день идентифицировано по меньшей мере 17 интерлейкинов. Сейчас стало возможным получать эти вещества в больших количествах с помощью генноинженерных методов, что позволяет использовать их в терапевтических целях.
Вещества, синтезируемые клетками различных типов, в частности, Т-лимфоцитами Играют важную роль в неспецифической защите организма от вирусных инфекций и участвуют в лизисе инфицированных клеток, предотвращающем дальнейшую репликацию вируса.
Участок гена между двумя экзонами, который не кодирует белковой последовательности.
Группа вазоактивных медиаторов выделяющихся при повреждении тканей. Международная номенклатура антигенов клеточной поверхности. Популяции клеток можно различить, используя моноклональные антитела, направленные против этих молекул.
Клетки, выведенные in vitro в определенной клеточной культуре. Клеточные линии обычно содержат потомство нескольких индивидуальных клонов.
Процесс деления клетки, в котором выделяют четыре фазы: Gq, S, G2 и М. Репликация ДНК происходит в S-фазе, а деление клетки — в М-фазе (фазе митоза).
Клетки или организмы с идентичной генетической конфигурацией.
Стволовые клетки костного мозга, которые в результате дальнейшей дифференцировки превращаются в зрелые клетки крови
Словарь терминов
Колониестимулирующий фактор (КСФ) (или фактор роста) Компоненты комплемента С1-С9 Конъюгат Ксеногенный Полипептид, образованный, например, Т-лимфоцитом, стимулирующий пролиферацию и дифференцировку стволовых гемопоэтических клеток Компоненты классического и альтернативного путей активации комплемента, задействованные в воспалительных реакциях, опсонизации частиц и лизисе клеточных мембран. Реагент, образованный при ковалентном связывании двух молекул например, флуоресцеина и молекулы иммунной системы. Относящийся к антигенным различиям между организмами разных вицов.
Лиганд Лимфокин-активированная клетка-киллер (ЛАК) Локус Молекула, опосредующая связывание. При инкубации с интерлейкинами лимфоидные клетки-предшественники могут дифференцировать в зрелые эффекторные клетки с высоким цитотоксическим потенциалом, например, против опухолевых клеток Положение специфического гена на хромосоме.
р2-Микроглобулин Митоген Митоген лаконоса Полипептид в составе молекул HLA класса I (легкая цепь) Вещество, индуцирующее трансформацию и деление клеток (главным образом лимфоцитов). Лектин Phytolacca Americana; в экспериментальной иммунологии этот митоген используется для стимуляции лимфоцитов и макрофагов.
Носитель Иммуногенная молекула (часть молекулы), узнаваемая Т-клеткой в ходе развития иммунного ответа.
Область, определяющая комплементарность (CDR) Опсонизация Гипервариабельный участок антител или Т-клеточных рецепторов, отвечающий за связывание с антигеном Изменение поверхности патогена или других частиц (например, под действием антител или СЗЬ), облегчающее фагоцитоз антигена.
Паратоп Патоген Первичный ответ Пиноцитоз Примирование Процессирование антигена Псевдоаллели Псевдогены Часть молекулы антитела, за счет которой происходит контакт с антигенной детерминантой. Болезнетворный организм. Иммунный ответ (клеточный или гуморальный), возникающий в результате первичного контакта со специфическим антигеном. Процесс захвата клеткой жидкости или очень мелких твердых частиц Первичная активация наивной клетки специфическим антигеном. Превращение антигена в узнаваемый лимфоцитами пептид Тандемные варианты гена, занимающие негомологичные позиции на хромосоме (например, 04). Гены, имеющие структурную гомологию с другими генами, но не экспрессирующиеся.
Регуляторная Т-клетка Супрессорная Т-клетка, оказывающая регуляторное действие на ход гуморального и клеточного иммунного ответа; играет важную роль в предотвращении аллергических реакций и аутоиммунных заболеваний.
Секреторный компонент Часть секретируемого IgA, облегчающая транспорт иммуноглобулина сквозь кишечный эпителий и защищающая его от протеолитического расщепления ферментами.
Словарь терминов
Сильная иммунореактивность Сингенный
Система фагоцитирующих мононуклеаров
Слабая иммунореактивность Созревание сродства
Соматическая гипермутация Сродство (аффинность)
Структурные FR-области
Сумка Фабрициуса
Толерантность
Т-хелпер
Фактор ингибирования миграции (MIF)
Хемокинез
Хемотаксис
Химеризм
Цитокин
Экзон
Энхансмент
Эпитоп (антигенная детерминанта)
Эффекторные клетки
Способность индивида или породы животного сформировать сильный иммунный ответ.
Особи одной инбредной линии, все аутосомные пары которых идентичны.
Этим термином обозначают морфологическую и функциональную единицу, которую ранее называли ретикулоэндотелиальной системой. Эти цитогенетически однородные клетки способны дифференцировать в промоноциты, гистиоциты, клетки Купфера (звездчатые клетки), альвеолярные макрофаги, эндотелиальные клетки синуса селезенки, макрофаг^ лимфоузла, эндотелиальные клетки синуса костного мозга, перитонеальные макрофаги или остеокласты.
Способность индивида или породы животного формировать слабым иммунный ответ на один или несколько антигенов.
Повышение аффинности антител в процессе формирования вторичного иммунного ответа.
Перегруппировка генов иммуноглобулинов происходящая при созревании В-клеток; обеспечивает многообразие специфических антител.
Мера связывания антигенных детерминант (эпитопов) с участками связывания антител (паратопов).
Участки вариабельных областей антител, расположенные между гипервариабельными участками.
Лимфоэпителиальный орган, расположенный в клоаке у птиц; место активного созревания В-клеток.
Состояние специфической иммунологической неотвечаемости.
Т-лимфоцит, несущий антигенные маркеры подкласса CD4; играет ключевую роль в инициации и поддержании иммунного ответа Т-хелперы распознают антиген только в комплексе с молекулой МНС класса II.
Пептиды, выделяемые лимфоцитами; ингибируют миграцию макрофагов.
Усиленная (ненаправленная) миграционная активность клеток.
Направленное движение клеток вдоль градиента концентрации определенного хемотаксического фактора.
Наличие у данного индивида клеток от генетически различных индивидов.
Общий термин, которым обозначают растворимые медиаторы межклеточного взаимодействия.
Кодирующий участок гена.
Увеличение времени жизни трансплантата с помощью антител, прикрепляющихся и маскирующих аллоантигены ткани донора
Участок антигена, с которым связывается паратоп антитела
Функциональное обозначение лимфоцитов и фагоцитов, оказывающих решающее действие на иммунный ответ.
Приложение
307
Предметный указатель
Campylobacter jejuni 246, 247
CD1 20, 21,26, 27,280
CD1a 52, 280
CD2 20, 21,26, 27,279
CD3 20, 21,26, 27,279
- активация Т-клеток 26, 29
- биспецифические антитела 166, 167
- проточная цитометрия 94, 95
CD4 24-27, 36, 37, 279
- активация Т-клеток 26, 29
- окрашивание 104,105
- проточная цитометрия 94, 95
CD5 26, 27, 280
CD5 + В-клетки 32, 33
CD7 20,21,26, 27,279
CD8 20,21,24, 25,36, 37,279
- активация Т-клеток 28, 29, 46
- окрашивание 104,105
- структура 26, 27
- функции 26, 27
- хелперная молекула 60, 61
СОЮ 42-45, 279
CD11 52, 53, 279
CD14 52, 53, 279
- микобактериальные
антигены 230, 231
0016 52,53, 279
CD18 52, 53, 279
CD19 32, 33, 36, 37,42, 43, 279
- экспрессия 44, 45
CD20 280 (см также анти-С020 моноклональные антитела)
CD21 32, 33, 42, 43, 279
- экспрессия 44, 45
CD22 32, 33, 36, 37, 42, 43, 279
- антитела 96, 97
- экспрессия 44, 45
CD23 32-35, 42, 43, 279
- экспрессия 44, 45, 106, 107
0025 30,106,107,280
0028 26, 27,30, 31,280
- CD80/CD86 взаимодействие
44-47
0029 20, 21,280
0032 52, 53, 280
0034 32, 33, 42, 43, 280
СО34+ стволовые клетки 168-170
0036 84, 85, 280
CD37 32, 33, 280
CD38 34, 35, 280 0039 32-35, 280 0040 44, 45, 52, 53, 280 CD40/CD40 лиганд 30, 31, 34, 35, 44, 45, 280
- В-клеточная пролиферация 106, 107
- взаимодействие Т-клеток с АПК 46, 47
CD45RA 20, 21,280
- Т-клеточная активация 28, 29 CD45R0 20, 21, 178, 280 0046 172,173, 280 CD49d 46, 47, 280 0054 270, 280
CD55 172, 173, 281
CD56 36, 37, 281 0058 26, 27, 281 CD59 172, 173, 281 CD64 52, 53. 281 CD68 52, 53, 281 0069 106,107,281
CD71 106,107,281
CD72 44, 45, 281
CD77 34, 35, 282 0080 30. 31,282 - презентация антигена 52, 53 0083 52, 53, 282 0086 44. 45. 282 - презентация антигена
52, 53
-Т-клеточная активация 164 0095 84, 85,166, 282 CD106 46, 47,282 00117 32, 33, 42, 43, 282 CD152 26, 27,46, 47,284 CD205 52, 284
CD206 285 (см. также маннозный рецептор)
CDR-области 36, 37, 306 Clostridium tetani 260 Corynebacterium diphtheriae 260
HLA комплекс
- аллели DP 60, 63
- аллели DQ 60, 63
- аллели DR 58-60, 62
- геномная организация 58, 59
- класс I 60, 61
- класс II, аллели 60, 61
- аномальные антигены 80, 81
- ревматиодный артрит 180 181
- связь с заболеваниями 82, 83
HLA совместимость 170, 171, 180,
181
HLA-A3 218
HLA-A29 254, 255
HLA-B5 256
HLA-B7 218
HLA-B8 216, 218, 222,223
- болезнь Грейвса 238, 239
- миастения гравис 248 249
HLA-B13 216, 217
HLA-B27 82, 184, 185
-распространение 186, 187
-спондилоартропатия 186-189
- увеит 254, 255
HLA-B52 190, 191
HLA-Cw6 216, 217
HLA-D3 248, 249
HLA-D6Q 244, 245
HLA-DQ1 200, 201
HLA-DQ2 200, 201
HLA-DQW5 220, 221
HLA-DR1 220, 221
HLA-DR2 218
HLA-DR3 200, 201.216, 218, 222,
223
- болезнь Грейвса 238, 239
- зоб Хашимото 238, 239
HLA-DR4 208, 218, 256
HLA-DR5 238, 239
HLA-DR7 216, 217
HLA-DR15 244, 245
HLA-G 258, 259
HLAw53+ 256
HLA-типирование 172 173
Leishmania 30
Mycobacterium tuberculosis
230
Mycoplasma 132, 133
Pneumocystis carinii 118,120,121
Streptococcus 236 242
Tropheryma whippeli 218 219
Trypanosoma cruzi 242, 243
308
Предметный указатель
Антиген 124,125
А1 антиген 134,135
Авидин 168,169
АВО система 124,125
- иммуногенность трансплантата 174, 175
-типирование органов 172,173
Агаммаглобулинемия Брутона 110, 111
Агаммаглобулинемия, Х-сцепленная 110,111
Агглютинация
- бактериальных клеток 90
- методы 90, 91
- реакции 86, 87
Адгезионных молекул блокада 270, 271
Адгезия лейкоцитов, нарушение 114, 115
Аддрессины 74, 75
- периферических узлов 74, 75
Адренокортикальная недостаточность 240, 241
Азатиоприн 266, 267
Азидотимидин 122,123
Аквапорины 50
Активируемый флуоресценцией анализатор клеток (FACS) 98, 99
Актин 50, 51
Актиномицеты термофильные 228.
229
Аллергены 76, 77
-контактные 212, 213
- конъюнктивит 252, 253
Аллергический альвеолит, экзогенный 228, 229
Аллергический ринит 224,
225
Аллергия 310
- крапивница 210
- на никель 76, 213
- на резину 76, 213
- нахром 76, 213
Аллоиммунизация 134,135
Альвеолит криптогенный фиброзирующий 226, 227
- нейтрофильный 226-229
- экзогенный аллергический 228, 229
Альдостерон 232, 233
Альфа-фетопротеин 162,163
Амилоид А, сывороточный 158,
159
Амилоидоз 158,159
- с амилоидом А158,159
- связанный с гемодиализом 158, 159
- связанный с легкой цепью 158, 159
- синдром Шегрена, дифференциальная диагностика 200
- старческий 158
Анатоксины 260
Анафилаксия 310
-крапивница 210
Анафилатоксины 70, 71,76
Ангидриды 228
Ангиоиммунобластная лимфаденопатия с диспротеинемией 145
Ангионевротический отек 70,116,
117
Анемия
-апластическая 136,137,170,171
- аутоиммунная гемолитическая 130, 131
- пернициозная 218, 219, 240, 241
Анергия 174,175
Анизоцитоз 130
Анкилозирующий спондилоартрит
184,186,187
Анти-С04 моноклональные антитела
270, 271
Анти-С020 моноклональные антитела
130-133,136
- противоопухолевая терапия 166
Анти-С095 моноклональные антитела
166
Анти-1САМ-1 моноклональные антите-
ла 270, 271
Антибиотики
- аллергия 213
- макролиды 268, 269
Антиген Н 124
Антиген Ни 246, 247
Антиген Ri 246, 247
Антиген SM 273
Антиген Уо 246, 247
Антигенпрезентирующие клетки (АПК)
11,304
- - аллергическая астма 224, 225
- - аллогенная трансплантация 170, 171
- - взаимодействие с Т-клетками 46, 47
- - контактный дерматит 212, 213
- - отторжение трансплантата 174, 175
-------профессиональные 30, 80,
174,175
-------индукция Т-клеточного ответа
164,165
- - саркоидоз 226
Антигены 11
- грибные 228, 229
-Даффи 134,135
- детекция 90
- DR 58-60, 62, 82, 83 (см. также
отдельные HLA-DR)
-Келл 134,135
- кривая преципитации Гейдельберге-ра 86, 87
- презентация 66, 67
- опосредованная аутоантителами 80, 81
- моноцитами 52, 53
- процессирование 30, 66, 67, 304 -связывание 14
- секвестрированные 82, 83,172
- глаза 250, 251
- фагоцитоз 270, 271
Антиглобул иновый тест 128 129 Антиидиотипическая сеть 82, 83 Антиметаболиты 266, 267 Антисинтетазный синдром 202, 203 Антитела (см. также моноклональные антитела)
-анти-А124
- анти-В 124
-анти-ДНК 196,197
- анти-Jo-l 202, 203
- анти-La 200, 201
- анти-МНС 270
- анти-Ro 200, 201,258, 259, 273
- анти-TCR 270
-анти-ФНО270, 271
- антикардиолипиновые 258, 259
- антимиокардиальные 242, 243
- антимитохондриальные (АМА) 222 223
- антинейтрофильные цитоплазматические (ц-АНЦА) 206, 207, 220, 236
- антицентромерные 198,199 -антиядерные (АЯА) 176,194, 200 - ревматические заболевания 273 - склеродермия 198,199 -биспецифические 142,143,166.
167
- детекция 90
- к почечно-печеночным микросомам 222
- полные/неполные 90,128,129
- против гломерулярной базальной мембраны 236
- против рибонуклеазы Р 198,199, 273
- селективный дефицит 110 -сродство 128,129 -тепловые 130,131
-холодовые 130,132,133
- человеческие антимышиные (HAMA) 166,167
Антителозависимая клеточная цитотоксичность 48, 49, 76, 77,166, 167
-----моноклональные антитела 270, 271
-----отторжение трансплантата 174. 175
Антифосфолипидный синдром 194, 274
Апоптоз 22, 23, 32, 33, 84, 85
- материнские Т-лимфоциты
- определение 304
- реакция в зародышевом центре 34, 35
309
Предметный указатель
зю
- регуляция 84, 85
- тест на цитотоксичность 102 103
- центроциты 34, 35
- цитолитический механизм в клетках-киллерах 48, 49
Апоптотические рецепторы 48
Артериит Такаясу 208, 209, 276
Артрит (см. также олигоартрит; псориатический артрит; ревматоидный артрит; спондилоартропатия)
- реактивный 178,179
- суставы 178,179
Асиалогликопротеиновый рецептор 44, 45
Ассоциированная с бронхами лимфоидная ткань (BALT) 19
Ассоциированная с пищеварительным каналом лимфоидная ткань (GALT) 19
Ассоциированная со слизистой лимфоидная ткань (MALT) 14-16,18, 19
Астма бронхиальная 224, 225
Астроциты 244, 245
Атаксия телеангиэктазия 112,113
Атопия, астма 224, 225
-дерматит214, 215
- кератоконъюнктивит 252
Аутоантигены 80, 81
- островковых клеток 240, 241
- щитовидной железы 238 239
Аутоантитела 192,193
- SS-A и SS-B 200,201,258,259,273
- глютенчувствительная энтеропатия 218, 219
- нейтрализация антител патогенов 270, 271
- против рецептора ТТГ 238, 239
- системная красная волчанка 196,197
- системный васкулит 204, 205
Аутоиммунная гемолитическая анемия 130,131
Аутоиммунное заболевание 82, 83
-аутоантитела 192,193
- диагностические 274
- новорожденных 258, 259
Аутоиммунные синдромы новорожденных 258, 259
Аутоиммунный гемолиз
- - вызванный действием лекарств 134,135
- - холодовые антитела 132,133
Аутоиммунный ответ 80, 81
- - индукция 82, 83
Аутотрансплантата отмывка 168,169
Ацетилхолин 248, 249
Ацетилхолиновый рецептор 248 249
Ашоффа гранулема 242, 243
Бацилла Кальметта-Герена (БЦЖ) -----вакцина 260, 261 -----иммунотерапия 164
Белки
- плазмы 267
- рекомбинантные для вакцин 262
263
Белок
-STAT6 224
-ZAP-70 28
-Бенс-Джонса 152,154,155,158
Бесплодие, иммунное 258, 259
Билиарный цирроз, первичный 220, 222, 223
Биопсия губ 200, 201
Бирбека гранулы 50, 54
Бласты, В-бласты 34, 35
Болезнь Альцгеймера 158
-Бехчета 190,191
- увеит 256, 257
- Виппля 218, 219
- Грейвса 238, 239
-Дюринга 216, 217
- Кавасаки 276
- Крона 220, 221
- аутоиммунный гепатит 222, 223
- Лайма, панувеит 256, 257
- - увеит 254, 255
- любителей птиц 228, 229
-Рейно 198-201
- Стилла 184,185
-тяжелой цепи 152,153
- Фукса 254, 255
- химиков профессиональная 228, 229
-Ходжкина 130,131,140-143
- - ритуксимаб 270
- Хортона 208
-Шагаса 242, 243
Большие гранулярные лимфоциты 48
Боумана капсула 232, 236
Бронхиальная гиперчувствительность
224, 225
Бронхоальвеолярный лаваж (БАЛ)
226, 228
Буллезный пемфигоид 216,
217
Буллезный эпидермолиз, приобретенный 216, 217
Вакцина на основе делеционных мутантов 262, 263
- на основе рекомбинантных штаммов 262, 263
- против Haemophilus influenzae 260, 261
- против дифтерии 260, 261
- против коклюша 260, 261
- против кори 260, 261
- против краснухи 260, 261
- против полиомиелита 260, 261
- против свинки 260, 261
- против столбняка 260, 261
- против холеры 260, 261
Вакцинация 260-263
- детей 260, 261
- пептиды 270
Васкулит (см также системный васкулит) аллергический 214, 215
- аутоиммунный гепатит 222
- диагностические антитела 274
- крупных сосудов 276
- мелких сосудов 276
- некротизирующий лейкоцитокластический 256, 257
- панувеит 256
- склерит 252, 253
- средних сосудов 276
-уртикарный 210, 211 Вестерн-блоттинг 92, 93
Видаля реакция 90
Винкулин 50, 51
Вирус HTLV-1 145,162,163
- Коксаки 240-243
- простого герпеса, кератит 252, 253 - человеческого герпеса 8 120,154 -Эпштейна-Барр 120,121,132,133
- вирусные белки 162
- рецептор 42
- синдром Гийена-Барре 246, 247 Вирусные антигены 238. 239, 242, 243
Вирусные белки 162,163
Височный артериит 208, 209
Витрит 254, 255 ВИЧ/ВИЧ-инфекции (см. также
СПИД) 118,119
- аллогенная трансплантация 172,173 -вакцины 122,123
- восприимчивые клетки 118,119
-диагностика 122,123
- иммунный ответ 120,121
-лечение 122,123
- панувеит 256, 257
- связывание с клетками хозяина 118,119
- структура вириона 118,119
- структура генома 118,119
-течение 120,121
- фокальный сегментарный гломерулосклероз 234, 235
- цикл репликации 118,119 Внугритимусный барьер 16 Волчанка новорожденного 258, 259 Волчаночный нефрит 194-197 Воспаление кишечника хроническое
186,187
Воспаление стенки кишечника 221 Воспалительный ответ 11, 264, 265
Вторичный ответ 11
Высокие эндотелиальные венулы 14 74, 254, 255
Гамма-глобул инов пролиферация, моноклональных/поликлональных 152,153
Предметный указатель
Гаптены 76, 77,134, 212, 312 Гаптоглобин 128,130,131
Гассаля тельца 16,17
Гастрит, хронический атрофический 218, 219
Гемагглютинация 90, 91
Гематологические заболевания 138-159
Гемоглобин-связывающий белок 128, 130,131
Гемолиз аутоиммунный 132-135 - клинические признаки 130,131 - механизм «невинного свидетеля» 134,135
-механизмы 128,129
Гемолитическая анемия, аутоиммунная 130,131
Гемолитическая болезнь 124-137
-новорожденного 126,127
Ген АМЫ 96, 97
-ВАХ84, 85
-BCL-2 84, 85
-ЕГО 96, 97
-NPM145
- программированной смерти-1 46, 47
Генетические заболевания соединительной ткани 192
Гены, инверсия/перегруппировка 24, 25
Гепатит аутоиммунный 220-223
- плюригландулярный синдром 240 241
- крапивница 210
Гепатит В мембранопролиферативный гломерулонефрит 234 235
- вакцина 260, 261
Гепатит С 156,157
- мембранопролиферативный гломерулонефрит 234, 235
Гетерохромный увеит 254, 255
Гибридома 160,161, 312
Гигантоклеточный артериит 208, 209, 276
Гигантские клетки 182,183 Гипергаммаглобулинемия 226 Гиперлипидемия 232, 233 Гипертиреоз 218, 238, 239 - новорожденных 258, 259 Гиперчувствительности реакции 76, 77
- весенний конъюнктивит 252
- типы 76, 77
- тубулоинтерстициальный нефрит 236
- экзогенный аллергический альвеолит 228
Гипоальбуминемия 232, 233
Гипокальцемическая тетания 112, 113
Гипопаратиреоз 240, 241
Гипопион 256 257
Гипотеза «неразборчивого» В27 188 189
Гипотиреоз 238, 239
Гистоны 273
Гистоплазмоз 254, 255
Главный комплекс гистосовместимости (МНС) 22, 26, 27, 30, 31 (см.
также HLA комплекс)
- вытеснение патогенных пептидов 270
- иммуногенность трансплантата 174, 175
- класс I 36, 37
- - ВИЧ инфекция 120
- класс II 36, 37
- - аномальные антигены 80, 81
- - якорные аминокислотные остатки 64. 65
- - процессинг антигена 64, 65
- - ВИЧ инфекция 120
- - активация Т-клеток 64, 65
- - синдром Фогта-Коянаги-
Харады 256
- рецепторы 48
Глаз 250, 251 (см. также заболевания глаз; увеит)
- защитные механизмы 250-253
- кератопластика 172,173
- проявления системных заболеваний 256, 257
- симпатическая офтальмия 82, 256, 257
Глиадин 218, 219
Гломерулонефрит «pauci-immune»
236,237
- аутоиммунный гепатит 222, 223
- быстро прогрессирующий 232, 233, 236, 237
- мембранозный 234, 235
- мембранопролиферативный 234, 235
- постинфекционный 236, 237
- с минимальными измененями 232
Гломерулосклероз фокальный сегментарный 234, 235
Гломерулярная базальная мембрана
76, 232, 233
Глугаматдекарбоксилаза-65 240, 241
Глутаматный рецептор 246,
247
Глюкозилфосфатидилинозитол 68, 116,117
Глюкокортикоиды 264, 265
Глютенчувствительная энтеропатия 218, 219
Гомеостаз клеточный 84
Гормонореспонсивные элементы 264
Гранзимы 102,166,167
Гранулематоз Вегенера 206, 207, 276
- - с поражением глаз 256, 257
Гранулоциты 11, 50, 51
- активация 70
- в слезной жидкости 252, 253
- тубулоинтерстициальный нефрит 236
Грибное легкое 228, 229
Грибовидный микоз 144,147
Грубера метод 90
Грудное молоко 38, 39
Далена-Фукса узелки 256, 257
Дегрануляция базофилов 70, 71 Демиелинизация нервных клеток 244, 245
Дендритные клетки 12, 22, 23, 50, 51,54, 55
- - антигенпрезентирующие 78, 79 - - взаимодействие Т-клеток с АПК 46, 47
- - жизненный цикл 54, 55
— зародышевого центра 50, 51
- - интердигитальные 50, 51
- - интерстициальные 54, 55
--лимфоидные 50, 51
— миграция 54, 55. 74. 75
--моноцитарного происхождения 54, 55
--регулирование Th-клеточного баланса 56, 57
- - связь врожденного и приобретенного иммунитета 72, 73
--созревание 56, 57
- - типа 1 и 2 56, 57
- - толерантность 56, 57
- - экспрессия CD40 44, 45
- - экспрессия антигенов 52, 53
Деполяризация мембраны 248, 249
Дерматит атопический 214, 215 - герпетиформный 216-218 -контактный 212, 213 -токсический 212, 213 Дерматомиозит 192, 202, 203 Десмоглеины 216
Детский септический гранулематоз 114,115
Дефицит витамина В12 218, 219
Дефицит миелопероксидазы 114 115
Диабет сахарный 82, 83, 240, 241
Диацилглицерин 28, 29
Дигидрооротат дегидрогеназа 268, 269
Дисгаммаглобулинемия 110,111
Диссеминированное внутрисосудистое свертывание 128
ДНК двунитевая 196,197, 273
- однонитевая 273
- очищенная для вакцин 262 -секвенирование 108,109 - синтез 268, 269
ДНК-зонды 96, 97
Предметный указатель
Естественные киллеры (НК-клетки) 11,12, 26, 48, 49
- - в плаценте 258, 259
Заболевания глаз 82, 226, 227, 250-257
- желудочно-кишечного тракта 218-223
-кожи 210-217
--буллезные 216, 217
- неврологические 244-249
- почек 232-237
- респираторные 224-231
- сердца 242, 243
- скелетно-мышечные 176-191
- соединительной ткани 194-209
- щитовидной железы (см. также гипертиреоз; гипотиреоз)
- - аутоиммунные 240, 241
Зародышевый центр 32, 34, 35
Защитные механизмы, неклональные 11
Зимогены 68
Злоупотребление лекарствами 234, 235
Зоб Хашимото 218, 238, 239
- - аутоиммунный гепатит 222 223
Золото, применение в терапии 266,
267
Изоцианаты 228, 229
Иммунитет врожденныи/приобретен-ный 12
Иммунная система 11
- - неспецифическая 11
- - ответ на ВИЧ-инфекцию 120 121
- - происхождение клеток 12,13
- - специфическая 11
Иммунные комплексы 307
- - лейкоцитокластический васкулит 214 215
- -системная красная волчанка 196, 197
Иммунный ответ
- - независимый от Т-клеток 32, 33
- - опосредованный Т-клетками 164, 165
- - при туберкулезе 230, 231
Иммуноблоттинг 92, 93
Иммуногистологическое окрашивание 96, 97
Иммуноглобулиновые Fc-рецепторы 38, 39, 50, 51
Иммуноглобулино-подобные транскрипты 48
Иммуноглобулины (см. также ревматоидные факторы)
- A (IgA) 215 (см. также IgA-нефропатия)
- - в слезной жидкости 252, 253
--дефицит 134
- - секреция 38, 39
- - селективный дефицит 110
- - структура 38, 39
- D (IgD) 32, 33
- - структура 38, 39
- Е (IgE)
- - аллергическая астма 224, 225
- - аллергический конъюнктивит 252, 253
- - аллергический ринит 224, 225
- - немедленная гиперчувствительность 76, 77
- - регуляция образования 30, 31
- - структура 38, 39
- - тубулоинтерстициальный нефрит 236
-G(lgG)
- - быстро прогрессирующий гломерулонефрит 236,237
- - селективный дефицит 110,111
- - структура 38, 39
- - транспорт сквозь эпителий кишечника 38, 39
- М (IgM) 32, 33 (см. также синдром гипер-IgM)
- -агглютинация эритроцитов 128, 129
- - структура 38, 39
- аллотипические детерминанты 36
- внутривенное введение 246, 247
- гены легкой к-цепи 40, 41
- гены легкой Х-цепи 40. 41
- идиотипические детерминанты 36
- изотипические 36
- моноклональные 156.157
- нормальный диапазон 278
- область CDR 36, 37
- организация/перегруппировка гена Н 40, 41
- переключающая последовательность 40, 41
- переключение класса 40, 41
- поликлональные 156,157
- последовательности VDJ 40, 41
- свойства 38, 39
- синтез 32, 33
- специфичность антигена/ тпервариабельные области 36, 37
- структура 36-39
- суперсемейство 36, 37
- типы 38, 39
- тяжелые цепи 40, 41 Иммунодефицит 110-123 - тяжелый комбинированный 112, 113,170,171
Иммунодиффузия 86-89 - двойная радиальная 88, 89 - простая радиальная 86 87 Иммуноконъюгаты с радиоактивной меткой 166,167
-----усиление неспецифического иммунитета 164,165
Иммуномагнитное разделение 98 99
Иммунопротеасома 66 67 Иммуносупрессия 130,131 - аллогенная трансплантация 172, 173
- бесплодие 258, 259
- препараты 268, 269
- трансплантат против хозяина 170, 171
Иммунотоксины 166,167 Иммуноферментный спот-анализ
(ELISPOT) 104-107
- - с у-интерфероном 104,105 Иммунофлуоресценция 94, 95 Иммуноэлектрофорез 88, 89 Индуцибельный Т-клеточный костиму-
лятор (ICOS) 46, 47 Инозитолтрифосфат 28, 29 Инсулин 240, 241
Интердигитальные дендритные клетки 50, 51
Интерлейкины 286-290, 307
- ИЛ-1-превращающий фермент 84, 85
-ИЛ-2 28, 30, 31,286-287 - - созревание НК-клеток 48 --системное введение 164,165
-ИЛ-4 30. 31,50. 51.286-287 - - аллергическая астма 224, 225 -ИЛ-5 30, 31,286-287
-ИЛ-8 226, 227
- - синдром Бехсета 256, 257 -ИЛ-10 258, 259, 288-289
-ИЛ-12 30, 31.288-289
- - болезнь Крона 220
- - образование дендритных клеток 46
- - экспериментальный аутоиммунный увеоретинит 250, 251
- - лечение ВИЧ-инфекции 122 -ИЛ-13 30, 31,290, 291
- - астма 224, 225
-ИЛ-15 48, 288-289
-ИЛ-18 48, 288-289 Интерфероны 313 -ИНФ-а122, 290-291 --системное введение 164,165 -ИНФ-уЗО, 31,290-291 Инфекция бактериальная 116 - болезнь Виппля 218, 219 -крапивница 210
- механизмы защиты 12,13
- осложнения химиотерапии 170, 171
- острый стрептококковый гломерулонефрит 236, 237
- при переливании крови 134 135
- системный васкулит 204, 205 Иридоциклит 254, 255
Ирит 254, 255
312
Предметный указатель
- синдром Фогта-Коянаги- Харады 256
Калнексин 64 65
Кальмодулин 28
Кальциневрин 28
Кандидоз 240, 241
Кандидозный эзофагит 120, 121
Карцинома, экспрессия CD40 44, 45
Каспаза, активация митохондриями 84. 85
Кератит 252, 253
Кератоконъюнктивит, атопический 252
Кератопластика 172,173
Киназа анапластической лимфомы (ген) 145
Киназа ZAP 28
Кишечный эпителий
- - область «купола» 18,19
- -транспорт IgG 38, 39
Кластер дифференцировки (CD) 22, 23, 26 (см. отдельные CD)
- - определение 305
- - номенклатура 279-285
Клатрин 50, 51
Клетки бокаловидные 224 -Лангерганса 76, 77, 212, 213
- - фагоцитоз 50, 51
- Пуркинье 246, 247
Клеточного цикла анализ 100
Клеточные фракции, разделение с помощью антител 98, 99
Клональная экспансия 11
Коллаген VII типа 216
Колониестимулирующий фактор --гранулоцитов 50, 51, 288-289 -----рекомбинантный гемопоэтический 168,169
- - гранулоцитов/макрофагов 30, 31, 50,51, 288-289
-----рекомбинантный гемопоэтический 168,169
-----при ревматоидном артирите 180,181
Колоректальный рак 220
Комплекс, атакующий мембрану 68, 69,116
Комплемент активация 68, 69, 252, 253
- - альтернативный путь 68, 69
- воспалительное действие 70, 71
- иммунологическое действие 70, 71
- каскад активации 166,167
- классический путь 68, 69
- компоненты 305
- - С1 ингибитор 70
-----дефицит 116,117
- - СЗ белок 68, 69, 70, 71
-----регуляция 116
- - СЗ-конвертаза 234, 235
- -СЗа 76, 77
- -С5 белок 70, 71
- - С5-конвертаза 68, 69
- -С5а 76, 77, 232, 233
- отложение фрагментов 232, 233
- реакция связывания 90 91
- регуляция активности 70, 71
- рецептор C3d фрагмента 42
- рецепторы 50, 51, 52, 53
- - дефицит 116 *
- -типы 1-3 70, 71
- слезная жидкость 252, 253 Конъюнктивит 252, 253
Кортизол нормальные показатели 278
Костный мозг 12,14
- - множественная миелома 154
- - пересадка
-----аллогенная 170,171
-----аутологичная 168,169 Краниальный артериит 208 Крапивница 210, 211
Краска для волос 213
Красные кровяные клетки 130 -----агглютинация 128,129 -----антигены групп крови 124 -----лизис 128
Криоглобулинемия 156,157 - аутоиммунный гепатит 222 - эссенциальный васкулит 276 Криоглобулины 156,157 Криптогенный фиброзирующий альвеолит 226, 227
Кровь, нормальные показатели 277 - осмотическое давление 232, 233 -переливание 132 -пуповинная 170
-типирование 124,125,126,127
(см. также АВО система; резус) Ксантома кожная 222, 223 Ксенотрансплантация 172,173 Ксеростомия 200, 201 Ксерофтальмия 200, 201 Кумбса проба 128,129
Лактоферрин 252, 253 Латексная агглютинация 90, 91 Легкие (см. также заболевания респираторные), аллергические заболевания 228, 229
- фермера 228, 229
Легочный фиброз, идиопатический 226, 227
Лейкоз 138,139 -волосатоклеточный 149,150 - из крупных гранулярных лимфоцитов 136,137,144
- из предшественников Т-лимфоцитов 134,146
- острый лимфобластный 138,139, 170,171
- острый миелоидный 138,139, 170,171
- пролимфоцитарный 148,150
- хронический лимфоцитарный 130, 131,148,150
- - криоглобулины 156,157
-хронический миелоидный 162, 170,171
- хронический Т-лимфоцитарный 144,146
Лейкоз/лимфома, из предшественников В-клеток 148,150
- из предшественников Т-клеток 144, 146
Лейкотриены 226, 227
Лейкоцитарная формула 277
Лейкоцитокластический васкулит 214, 215,276
Лейкоциты 12, 74, 75
Лефлуномид 268, 269
Лиганд Р-селектина 1 74 75
Лизоцим 252, 253
Лимфаденопатия 200
- ангиоиммунобластная с диспротеи-немией 145
- корней легких 226, 227
Лимфатическая система, структура 14,15
Лимфатический узел 14,15,16 - - высокие эндотелиальные венулы 74
--синусы 18,19
--структура 18,19
Лимфатический фолликул 18, 32
Лимфоидные органы 14,15,16 Лимфома, В-клеточная 141,166 -Т-клеточная 141
- анапластическая крупноклеточная 144,145,146
- ангиоиммунобластная Т-клеточная 144,145,146
- ангиоцентрическая 145,147
-Беркитта 149,150
- глютенчувствительная энтеропатия 218
- диффузная крупноклеточная 149
- из клеток зародышевого центра 148,151
- из клеток мантийной зоны 148,151 - из клеток маргинальной зоны 148, 149,150
- из клеток маргинальной зоны селезенки 149
- из клеток-киллеров 141
- Кильская классификация 140,141
- кишечника Т-клеточная 145
- классификация REAL 140,141, 149
- лимфоцитарная плазмоцитоидная 148,151
- неходжкинская 130,131,144, 148,149,150,151
313
Предметный указатель
--криоглобулины 156,157
- - прогрессия синдрома Шегрена 200, 201
- периферическая Т-клеточная 144
- средиземноморская 152
Лимфофолликулярная гиперплазия вилочковой железы 258, 259
Лимфоцитассоциированный антиген 1
(LFA-1) 46, 47, 52, 53
Лимфоциты 11,12
- В-лимфоциты 11,12
- - В-клеточный рецепторный ком-
плекс (BCR) 44, 45
- -MALT 18
--активация34, 35,106,107
- - вышедшие из зародышевого центра 32
- - дифференцировка
-----детекция 106,107
-----схема 42, 43
- - иммуноглобулины
-----экспрессия 38, 39
-----изменения в процессе дифференцировки 42, 43
--ингибирование лефлуномидом 268
- - лимфатический узел 18
- - миграция 74, 75
— отделение 98, 99
— память 34, 70, 71
- - предшественники 42, 43
--пролиферация 106,107
--развитие 14, 32, 33
- - реакции в зародышевом центре 34 35
--ревматоидный артрит 178-181
-----нарушение регуляции 182,183
--селезенка 18
--синтез иммуноглобулинов 32, 33
— созревание 14
- - к/Х-специфическая рестрикция 42
-----Т-клеточное взаимодействие с
АПК 46, 47
-----циркуляция 18
--подавление микофенолатом 268
- - распределение субпопуляций 277
- - тест на стимуляцию 100
- Т-лимфоциты 11,12 (см. также Т-лимфоциты CD4+, CD8+)
--MALT 18
--активация 26, 27, 28, 29, 80, 81
-----анализ 100,101
-----молекулы 46, 47
-----МНС класса II 64, 65
-----отторжение трансплантата
174,175
-----сигналы 46, 47
-----аномально запрограммированные 22
-----взаимодействие с АПК 46, 47
-----дифференцировка 16
-----ингибирование лефлуномидом 268
-----индукция ответа 164,165
-----исчерпание 170 171
-----лимфоузлы 18
-----миграция 74, 75
-----молекулы дифференцировки
26, 27
-----наивные 30
-----образование антиген-специфи-ческих клонов 102,103
-----образование антител 80 81
-----памяти 30,178
-----пролиферация 26
-----разделение 98, 99
-----ревматиодный артрит 178, 179,180,181
-----регуляторные 30. 315
-----саркоидоз 226
-----селезенка 18
-----селекция 22, 23
-----созревание 14,16, 20, 21
-----тимусные 16, 20, 21
-----толерантность 78, 79
-----увеит 254, 255
-----узнавание опухолевых антигенов 160,161
-----функционирование in vivo 100, 101
- Т-лимфоциты CD4+ 30
- - активация 64, 65
- - аллергическая астма 224, 225
- - весенний конъюнктивит 252
— ВИЧ-инфекция 118,119,122, 123
- - дерматомиозит 202, 203
--идентификация 104,105
- - ингибирование 270, 271
- - миастения гравис 248, 249
- - регуляторные функции 82
- - саркоидоз 226
--синовиальная оболочка 178,179
- - склеродермия 198,199
- - туберкулезная гранулема 230, 231
- - экзогенный аллергический альвеолит 228
- Т-лимфоциты CD8+
--ВИЧ-инфекция 122,123
- - зоб Хашимото 238, 239
- - идентификация 104,105
- - полимиозит 202, 203
- - презентация опухолевых антигенов 160,161
- - регуляторные функции 82
- - симпатическая офтальмия 256, 257
- - соединительная ткань 178
--туберкулез 230, 231
- - экзогенный аллергический альвеолит 228, 229
Липоарабиноманнан 230
Липополисахарид 52, 53, 72
- воспалительные цитокины 74
М-клетки 18,19
Макроглобулинемия Вальденстрема 148,152,153
- - амилоидоз, связанный с легкой цепью 158
- - криоглобулины 156,157
Макрофагальный воспалительный белок
-----1 (MIP-1J122
-----За (М1Р-За) 54, 55
-----3₽ (MIP-Зр) 74
Макрофаги 30, 31
- Fc-рецепторы 246, 247
- активация 52, 53
-альвеолярные 226, 227, 230, 231
- быстро прогрессирующий гломерулонефрит 236
- при туберкулезе 230, 231
-ревматоидный артрит 180,181, 182,183
- синдром Гийена—Барре 246 247
-синовиальные 180,182,183
- функции 52, 53
- функция мусорщика 52, 53
- эффекторная функция 52, 53
Маннозный рецептор 50, 51, 52
- - связывание 72, 73
Маннозосвязывающий лектин 72, 73
Манчини метод 86, 87
Мегакариоциты 12
Меланома злокачественная 164,165
Мелфалан 154
Мембранный ингибитор реактивного лизиса (MIRL) 172,173
Мембранный кофактор 172,
173
2-Меркаптоэтансульфоновая кислота 266
Метаболические заболевания 238-241
Металлопротеиназы 178
- а-метилдопа 134,135
Метотрексат 266, 267
Миастения гравис 248, 249
Миастения новорожденных, транзиторная 258, 259
Миелин 244, 245, 246, 247
Миелобласты 12
Микобактерии (см также туберкулез)
- защита 24
Микофенолат 268, 269
Микроворсинки 234, 235
Микроглия 244, 245 р2-Микроглобулин 58,158,159, 307
Микроскопический полиангиит 276
Микседема ограниченная 238, 239
Милиарный туберкулез 230, 231
Миндалины 18
314
Предметный указатель
Миозин 242
Миозит 274
Миозит с включениями 202
203
Миокардит 242, 243
Множественная миелома 154,155
- - амилоидоз, связанный с легкой цепью 158
- - криоглобулины 156
Множественный склероз 244, 245
- увеит 254, 255
Молекула адгезии сосудистых клеток
1 (VCAM-1) 46, 47
Молекулы межклеточной адгезии
(ICAM), блокада 270, 271
Молекулярная мимикрия 80, 81, 188,189
- - синдром Гийена-Барре 246, 247
- - увеит 254, 255
Монобласты 12
Моноклональные антитела 26, 270, 271
--анти-С04 270, 271
- -анти-С020 130,131,132,133, 136
--анти-С095 166
- - анти-1САМ-1 270, 271
- - против опухолевых антигенов 160,161
--противоопухолевая терапия 166, 167
--ревматоидные артриты 180
Моноциты 50, 51
- активация 50, 51
- быстро прогрессирующий гломерулонефрит 236
- взаимодействие Т-клеток с АПК 46, 47
- дендритные клетки 54, 55
- саркоидоз 226
- слезная жидкость 252, 253
- функции 52, 53
- функции мусорщиков 52, 53
- эффекторные функции 52, 53
Мотив рецепторный НАМ 48, 50, 51
-ITIM48
Мультитест Merieux 100,101
НАДФН 114,115
Нарколепсия 82
Невирапин 123
Нейродерматит 214, 215
Нейросаркоидоз 226. 227
Нейтропения аутоиммунная 136,137
Некроз 84, 85
Неоантигены 162,163
Нестероидные противовоспалитель-
ные препараты 264, 265
Нефелометрия 86, 87
Нефрит Хейманна 232
Нефрит тубулоинтерстициальный
236, 237
Нефритический синдром 232, 233, 236
Нефропатия с минимальными изме-ненями 234, 235
Нефротический синдром 232, 233 Новообразования из периферических
Т-клеток 144,145,146,147 Нозерн-блоттинг 108,109 Нуклеозидные аналоги 122
Облитерирующий эндофлебит 170, 171
Обратной транскриптазы ингибиторы 122,123
Обратный метод локального гемолиза 106,107
Общий антиген CALLA см. СОЮ Общий вариабельный иммунодефицит
110,111
Общий лейкоцитарный антиген 20 Одноядерные клетки, выделение 98, 99
- - ревматоидный артрит 178,179 - - тубулоинтерстициальный нефрит
236,237
Окрашивание пептидного тетрамера 104
Окрашивающиеся тельца 34 Оксид азота 246, 247
Олигоартрит, синдром Бехсета 190, 191
- раннее начало заболевания 184,185 Онкофетальные антигены 162,163 Операции на сердце 242, 243 Опсонизация 70, 72, 306 Опухолевые антигены 162,163 -идентификация 160,161
- маркеры 278
-неоантигены 162,163
-узнавание 160,161
Опухолевые клетки в трансплантируемой ткани 168,169
- - визуализация 96, 97
- - лизаты 164,165
- - механизмы преодоления иммунной защиты 162,163
--облученные аутологичные 164, 165
--распознавание опухолевых антигенов 160,161
Опухолей иммунология 160-167 Опухоль-инфильтрующие лимфоциты
166
Оральная волосатая лейкоплакия 120 Орбитопатия эндокринная 238, 239 Остеолиз, множественная миелома 154,155
- саркоидоз 226, 227
Острый постстрептококковый гломерулонефрит 236, 237
Очень поздний антиген 4 (VLA-4) см CD49d
Паксиллин 50, 51
Панувеит 256, 257
Паппулы Готтрона 202, 203
Паранеопластические неврологические синдромы 246, 247
Пароксизмальная ночная гемоглобинурия 68,116,117,170,171
Патогены, молекулярные структуры 72, 73
Пейеровы бляшки 18, 74
Пенициллин
-гемолиз 134,135
- цитотоксическая реакция 76
Пептиды для вакцинации 270
--синтетические 262, 263
Переливание крови 132
--реакция организма 134,135
Периартериальная лимфатическая оболочка 18
Перфорация глазного яблока 252, 253
Перфорин 48, 49,102
- цитотоксичность 166,167
Пиноцитоз 50, 51, 306
Плазмаферез 246, 247
Плазмацитома 154
Плацента 258, 259
Плевроперикардит 194,195
Плюригландулярный синдром 240, 241
Пневмонит гиперчувствительный 228
Пневмония казеозная 230, 231
Пневмоциты, тип II 226, 227
Подагра 190,191
Поджелудочная железа 240, 241
Подоциты 232, 233, 234, 235
Полиангиит микроскопический 276
Полиартралгия 200
Поликлональные активаторы 100
Поликлональные антитела 270, 271
Полимеразная цепная реакция 108, 109
-----диагностика ВИЧ-инфекции 122
-----с обратной транскриптазой 122
Поли-Ig рецепторы 36, 37
Полимиозит/дерматомиозит 192, 202, 203
Полиморфноядерные нейтрофильные гранулоциты 206, 207
Полихондрит 190,191
Почек заболевания, IgA-нефропатия 214, 220, 221,236,237
-----фокальный сегментарный гломерулосклероз 234, 235
- - волчаночный нефрит 194,195, 196,197
--карцинома 164,165
--трансплантация 172,173
- - узелковый полиартериит 206
Пре-B-I и пре-В-Н-клетки 42, 43
Предметный указатель
Преодоление иммунологического надзора 66, 67
Претимоциты 20, 21, 22, 23
- миграция 22, 23
Преципитация 86, 87
- кривая Гейдельбергера 86, 87
Прогестерон-индуцированный блокирующий фактор 258, 259
Программированная клеточная смерть 12 (см. также апоптоз)
Пролиферация, тесты 100,101
Протеиназа 3 206, 207
Протеиназы 246, 247
- ингибиторы 122
Протеинкиназа С 28, 29
Протививирусные препараты 122
123
Противовоспалительные препараты 264, 265
Протоонкоген c-fos 28, 29
Протоонкоген с-тус 28, 29
Проточная цитометрия 94 95
- - разделение клеток 98, 99
Псориаз 216, 217
Псориатический артрит 186,187,
216,217
Пузырчатка обыкновенная 216, 217
Пурины, биосинтез 268
Пурпура идиопатическая тромбоцитопеническая 136,137
- иммунная тромбоцитопеническая 258,259
- Шенлейна-Геноха 214, 215, 276
Пэннинг 98, 99
Радиоиммуноанализ 92, 93
Радиотерапия, повреждение органов 170,171
Рак (см. также химиотерапия; лейкоз; лимфома; опухолевые клетки; опухолей иммунология)
- антитела для терапии 166,167
-груди 166, 270
- иммунологический контроль 30
- колоректальный 220
- легкого 248, 249
- паранеопластические неврологические синдромы 246, 247
-почек 164,165
- системный васкулит 204 205
Раково-эмбриональный антиген 162,
163
Рапамицин 268, 269
Реактивные радикалы кислорода 246, 247
Реактивный артритид 186,187
Ревматическая атака 242, 243
Ревматическая полимиалгия 208
Ревматические заболевания, антиядерные антитела 273
Ревматоидные факторы 176,182,
183
- - синдром Шегрена 200
- - скрининг 90, 91
Ревматоидный артрит 82,83,176,177
- - аутоиммунный гепатит 222, 223
- - диагностические антитела 274
— индукция 180,181
- - клетки в пораженном суставе 178,179
- - критерии АКР 272
--макрофаги 180,181,182,183
- - нарушение В-клеточной регуляции 182,183
--патогенез 180,181
- - подверженность 180,181
- - поражение глаз 256, 257
- -синовиальная оболочка 182,183
--склерит252, 253
Репродуктивная иммунология 258
259
Ресничное тело 254, 255
Респираторные заболевания
224-231
Ретикулин 216, 217, 218
Ретикулоэндотелиальная система
128,129
Ретинит 254, 255
Рецепторы KIR 48, 49
Рецепторы Toll-подобные 72, 73, 230
Рецепторы, распознающие патогенов 72, 73
Ритуксимаб 270
РНК синтез 268, 269
РНК-зонды 96 97
Роговица, патологии 252, 253
-пересадка 172,173
- язва 252, 253
Розеткообразующие клетки 98, 99
Саквинавир 123
Саркоидоз 226, 227
- поражение глаз 256, 257
- увеит 254, 255
Саркома Калоши 118,120,121
Саузерн-блоттинг 108,109
Свертывание крови, нормальные показатели 278
Селезенка 14,15,16
- структура 18
Селектины 114
Сепсис Ландузи 230, 231
Сиалирование 44
Сиалография 200, 201
Симпатическая офтальмия 82, 256, 257
Симптомы Лермитта 244, 245
Синдром CREST 198,199
- Вискотта-Оддрича 112,113
- Гийена—Барре 246, 247
-гипер-IgM 110,111
- Гудпасчура 76, 236
- Ди Джордже 112,113
- Дресслера 242, 243
- Ламберта-Итона 248, 249
- Лефгрена 226, 227
- лимфаденопатии 120
-Луи-Бар 112,113
- посткардиотомный 242, 243
- Рейно 198
-Сезари 144,147
- сухости 200, 201
-Фелти 136,137
- Фогта-Коянаги-Харады 256, 257
- Чарга-Стросса 206, 207, 276
- Чедиака-Хигаси 114,115
- Шегрена 192
Синовиальная оболочка 178,179
- - при ревматоидном заболевании 182,183
Синовиоциты, звездчатые 182,183
Система фагоцитирующих мононукле-аров (СФМ) 196,197
Системы групп крови
-----АВ0124,125
-----Даффи 126,127
-----Келл 126,127
-----резус 76. 77.126.127
-----аллоиммунизация против Rh-антигенов 126,127
-----образование антител 90
Системная красная волчанка 136, 137,192
-----быстро прогрессирующий гломерулонефрит 236, 237
-----волчанка новорожденного 258 259
-----выкидыши 258, 259
-----диагностические аутоантитела 274
-----клинические проявления 194, 195
-----критерии АКР 275
-----лечение 194
-----мембранопролиферативный гломерулонефрит 234, 235
-----СЗ нефритный фактор 234, 235
--патогенез 196,197
- - поражение глаз 256, 257
Системные заболевания с поражением глаз 256, 257
Системный васкулит 204, 205
- - ассоциированный с АЕСА 204, 205
- - ассоциированный с ANCA 204, 205
- - определение Чепел Хилл 204, 205, 276
--теория развития 206, 207
Сифилис 256, 257
Скелетно-мышечные заболевания 176-191
Склерит 252, 253
Склеродермия 192,198,199
- диагностические антитела 274
316
Предметный указатель
Склерозирующий холангит, первичный 221,222, 223
Склеры патологии 252, 253
Скорость оседания эритроцитов (СОЭ) 277
Слезная жидкость 252, 253
Слизистых желез гипертрофия 224
Слюнных желез сцинтиграфия 200
Смерть мозга 172,173
Смешанная соединительнотканная болезнь 198,199
-----диагностические антитела 274
Собственные антигены, толерантность 66, 67
Соединительная ткань, С08+
Т-клетки 178
--заболевания 194-209
Соматическая гипермутация 34, 35, 307
СПИД 118,120,121 (см. также ВИЧ/ВИЧ-инфекция)
- дифференциальная диагностика синдрома Шегрена 200
- вакцина 262
Спленэктомия/облучение селезенки 130,131
Спондилоартрит 82 Спондилоартропатия 186,187 -HLA-B27 186,187,188,189 - индукция у трансгенных мышей
188,189
- классификация ESSG 272
- поражения глаз 256, 257
-ювенильная 184,185
Спру 218, 219
Стволовые гемопоэтические клетки 12
-----аллогенная трансплантация 170,171
-----аутологичная трансплантация 142,143
-----клоны 116
-----мобилизация 168,169
-----пластичность 12,13
-----получение 168,169 -----трансплантация 168,169
-----экспрессия CD40 44, 45
Стибофен 134,135
Сульфасалазин 266, 267
Суперантигены 46, 47
Такролимус 268, 269
Талассемия 170,171
Тапасин 66, 67
Твердофазный иммуноферментный анализ (ELISA) 92, 93
-----диагностика ВИЧ-инфекции 122,123
-----с C1q 92, 93
Тетрайодтиронин (Т4) 238, 239
Тимома 248, 249
Тимоциты 16
- развитие 20, 21
-Т-клеточная селекция 22, 23 Тимус 14,15,16
-анатомия 16,17
-гипоплазия 112,113
- лимфоциты 16
- развитие 16,17
- Т-клетки
--созревание 20, 21
- - селекция 22, 23
- у взрослого 17
- у новорожденного 17
Тиреоидит, см. зоб Хашимото Тиреостимулирующие антитела 238, 239, 238, 239
Тиреотропный гормон (ПГ) 238, 239 ПГ-блокирующие антитела 238, 239, 258, 259
Тирозинкиназа, p56fyn 28. 29
- p56lck 28, 29
Тканевое воспаление 52, 53
- миграция дендритных клеток 74.
75
Т-клеточные рецепторы 20, 21, 22, 23
- - активация Т-клеток 27, 29 --генно-инженерные 166,167 --дзета-цепь 166,167
- - комбинационный потенциал 24, 25
- - конфигурация 24, 25
- - модуляции 78, 79
- - перегруппировка 24, 25
- - распределение сх/р и у/6 20, 21, 24, 25
- - семейства генов 24, 25
- - суперсемейство иммуноглобулинов 36, 37
- - узнавание антигена 46, 47 Т-клеточный лейкоз/лимфома взрослых 145,162,163
Токсический мегаколон 220 Токсоплазмоз 254, 255 Толерантность 11, 307
- HLA-B27 в спондилоартропатии 188,189
- периферическая 11
- Т-клеток 78, 79
- центральная 11
Трансгенные мыши 78, 79 Транслокация BCR-ABL162,163 Трансплантат, против лейкоза 170, 171
- против хозяина 134,135 Трансплантация (см. также костный мозг; стволовые клетки)
-аллогенная 172,173 -аутологичная 172,173 - иммуногенность 174,175
- иммунология 168-175
- критерии удаления органов 172, 174
-отторжение 172,174,175
-почек 172,173
-сингенная 172,173
-типы 172,173
Транспортные белки ТАР 66, 67,162, 163
- - иммуногенность трансплантата 174,175
- - узнавание опухолевого антигена 160,161
Трастузумаб 166, 270
Трийодтиронин (ТЗ) 238, 239
Тромбоспондин 84, 85
Тромбоцитопения иммунная 136,137, 258 259
Трофобласт 258, 259
- экспрессия Fas-лигандов 258, 259
Туберкулез 230, 231
- вакцина 260, 261
- гранулема 230
- иммунный ответ 230, 231
Туберкулезный сепсис 230 231
Турбидиметрия 86, 87
Тучные клетки
- - аллергический ренит 224, 225
- - весенний конъюнктивит 252
--дегрануляция 70, 71
--краснуха 210, 211
Т-хелперы 20, 307
- аллергическая астма 224
- атопический дерматит 214, 215
- глютенчувствительная энтеропатия 218
- дифференцировка Ту1Д|_|2 30. 31
- зоб Хашимото 238, 239
- множественный склероз 244, 245
- отторжение трансплантата 174, 175
- регуляция дендритными клетками 56, 57
- регуляция моноцитами 52, 53
- сахарный диабет 240, 241
- толерантность матери/плода 258 259
- экспрессия CD4 26, 27
Увеальный тракт 250, 251
Увеит 226, 227, 254, 255
- задний 254, 255
- передний 254, 255
- промежуточный 254, 255
- синдром Бехсета 256, 257
- синдром Фогта-Коянаги-Харады 256
- факогенный 256
Узелковый полиартериит 206, 207,
256. 257, 276
Урата кристаллы 190,191
Ухтерлони метод 88, 89
Фагосома «спиральная» 50
Фагоцитоз 12, 52, 53
Предметный указатель
- альвеолярные макрофаги 230, 231 -антигены 270, 271
- апоптозные клетки 84, 85
- клетки Лангерганса 50, 51
- миелин 244, 245, 246, 247
- опосредованный Fc-рецептором 50, 51
- опосредованный комплементом 50, 51
- системная красная волчанка 196 197
- спиральный 50, 51
-эритроцитов 128 Фагоциты 12. 50. 51
Фактор некроза опухолей а (ФНО-а) 50, 51, 290-291
- системное введение 164.165
-туберкулез 230, 231
Фактор некроза опухолей р (ФНО-р) 30, 31,290-291
Фактор роста фибробластов 180,181 Фактор ускорения распада 70,172, 173
Фаринготонзиллит 242 Фармакология иммунная 264-271 л-Фенилендиамин 213
Ферменты, нормальные показатели 278
Фибронектина рецептор 20 Флуоресцеин изотиоцианат 94, 95 Флуоресцентная гибридизация in situ
(FISH) 96, 97
Флуоресцентное излучение 94, 95 Фолликулярные дендритные клетки 34, 35
- миграция В-клеток 74, 75
- экспрессия CD40 44, 45 Фосфатидилинозитол фосфолипаза
28, 29
Фосфатидилсерин 84, 85
Хемокиновые рецепторы 74, 75,122, 123
- антиген Даффи 126,127 Хемокины 12, 74, 75, 290-304
- контактный дерматит 212 -лечение ВИЧ-инфекции 122 Хемотаксис 52, 53, 70, 71, 311 Хемотаксические факторы 14 Химиотерапия
- болезнь Ходжкина 142,143
- переливание стволовых клеток 168, 169
- повреждение органов 170,171
Хинидин 134,135
Холестерин 222
Холодовая гемагглютининовая болезнь, хроническая идиопатическая 132,133
Хорея малая ревматическая 242, 243
Хориоидит многоочаговый 256, 257
Хориоретинит 254, 255, 256, 257
Хориоретинопатия birdshot 254, 255
Хром радиоактивный, тест на цитотоксичность 102
Хромосома 17. 24. 25
Хромосомная транслокация (8:22)
96, 97
Центробласты 18, 34, 35
Центроциты 18, 34, 35
Цереброспинальная жидкость, нормальные показатели 279
Циклит 254, 255
Циклооксигеназа 1 и 2 264, 265
Циклооксигеназы ингибиторы 264, 265
Циклоспорин А 268, 269
Циклофосфамид 266, 267
Цитокиновое окружение 30, 31
Цитокины 11,12,104,105, 286-295, 307
- внутриклеточное окрашивание 104, 105
- воспалительные 74, 246, 247
- гены 28, 29
- кератит 252
- контактный дерматит 212, 213
Цитомегаловирус (ЦМВ) 120,121, 132,133
- аллогенная трансплантация 172, 173
- осложнения химиотерапии 170 171
- панувеит 256, 257
- синдром Гийена-Барре 246, 247
Цитопения 124-137
Цитотоксические реакции с участием антител 76, 77
Цитотоксические Т-лимфоциты (см также CD8)
-антиген-специфичные 102
Цитотоксичность, тест 102,103
-JAM тест 102,103
Цитохрома Ь558 дефицит 114,115
Человеческие лейкоцитарные антигены см. HLA комплекс
Чистая красноклеточная аплазия 136, 137
Шапероны 66
Ширмера тест 200
Щелочная фосфатаза 96, 97
Экзема 212, 213
Экзофтальм 238, 239
Экспериментальный аутоиммунный
увеоретинит 250, 251
Экспериментальный аллергический энцефаломиелит 244, 245
Электроиммунодиффузия 88, 89
Электрофорез белков 38. 39
-----нормальный диапазон 277
- методы 88, 89
- противоточный 88, 89
- ракетный 88, 89
Эндомизий 216, 217
Эндоцитоз 50, 51
Энтеротоксины стафилококковые
46
Энцефалит Расмуссена 246, 247
Эозинофилы, весенний конъюнктивит 252
- тубулоинтерстициальный нефрит 236
Эписклерит 252, 253
Эпителиальные клетки, экспрессия
CD40 44, 45
Эпитоп 307
-распространение 196,197
Эритема ревматоидная 242, 243
- узелковая 226, 227
Эритробласты 12
Эритроциты 12
-фагоцитоз 128
Ювенильный хронический артрит
184,185
-полиартикулярный 184,185
- поражение глаз 256, 257
-системный 184 185
Ядерные связывающие белки
28, 29
-----АР-1 комплекс 28
Ядерный фактор активированных
Т-клеток (NFAT) 28, 29, 268, 269
Язвенный колит 220-223
318
Содержание
Об авторах .. 5
Благодарности .................................. 6
Предисловие........................................7
Фундаментальные принципы
Иммунная система .......................11
Клетки иммунной системы (обзор) .............12
Органы лимфатической системы (обзор).........14
Тимус...................................... 16
Периферические органы........................18
Развитие и дифференцировка Т-лимфоцитов . . .. 20
Развитие Т-клеток........................... 20
Селекция Т-клеток........................... . 22
Т-клеточные рецепторы ... ..24
Т-клеточные антигены . . 26
Активация Т-клеток .. 28
Клетки Т|-|1 и Т|-|2 ..........................30
Развитие и дифференцировка В-лимфоцитов .......32
Онтогенез В-клеток.............................32
Реакции в зародышевом центре ... 34
Иммуноглобулины . . 36
Классы иммуноглобулинов .......................38
Организация генов иммуноглобулинов.............40
Экспрессия генов иммуноглобулинов .............42
Важные В-клеточные антигены......... ..........44
Межклеточные взаимодействия 46
Взаимодействия между Т клетками и антигенпрезентирующими клетками .............46
Неспецифические защитные клетки .............. 48
Естественные клетки-киллеры .48
Моноциты и дендритные клетки ..................50
Система фагоцитов .............................50
Введение ........ . 8
Принятые сокращения ............................ 9
Функционирование моноцитов и их антигены ......52
Популяции дендритных клеток .....................54
Созревание дендритных клеток: изменение фенотипа и функций 56
Система HLA (система МНС) .......................58
Геномная организация HLA-комплекса ........... ..58
Структура молекул HLA и аллели класса I ........ 60
Молекулы HLA: аллели класса II...................62
Презентация антигена, зависимая от МНС класса II .............................. 64
Презентация антигена, зависимая от МНС класса I.................................66
Система комплемента ... 68
Активация и эффекторы . . 68
Регуляция и действие системы комплемента . 70
Врожденный иммунитет 72
Молекулярные структуры патогенов
и узнающие их рецепторы .... 72
Миграция лейкоцитов ... 74
Адгезия и миграция лейкоцитов ... 74
Патологии иммунитета и толерантность 76
Реакции гиперчувствительности .... 76
Индукция и предотвращение толерантности.........78
Механизмы аутоиммунных реакций (I) . .. 80
Механизмы аутоиммунных реакций (II) ............82
Апоптоз ... ..... 84
Апоптоз ........................................84
Лабораторные методы 86
Взаимодействия антиген-антитело ............... 86
Основные определения и методы преципитации......86
Электрофорез ...................................88
Методы агглютинации/ Реакция связывания комплемента .................90
ИФА (ELISA), РИА и иммуноблоттинг 92
Иммунофлуоресценция.......................... ..94
Иммуногистология............................. 96
Клеточный иммунитет.............................98
Клиническая иммунология
Иммунодефициты ... 110
Дефициты гуморального иммунитета ... 110
Дефициты клеточного иммунитета ................112
Дефициты гранулоцитов .........................114
Дефициты и дефекты системы комплемента.........116
Структура и репликация ВИЧ .................. 118
Течение ВИЧ-инфекции ..........................120
Диагностика и лечение ВИЧ-инфекции..........122
Методы выделения клеток ...................... 98
Тесты на функционирование Т-клеток............100
Антиген-специфичные тесты..... ..102
Методы характеристики антиген-специфичных Т-клеток .................104
Гуморальный иммунитет 106
Тесты на функционирование В-клеток ...........106
Молекулярно-биологические методы .108
Аналитические методы..........................108
110
Гемолитические заболевания и цитопении .... 124
Система групп крови АВО ......................124
Система резус и другие системы групп крови...126
Механизмы гемолиза и детекции антител........ 128
Аутоиммунный гемолиз, вызванный тепловыми антителами..........................130
Аутоиммунный гемолиз, вызванный холодовыми антителами.........................132
319
Клиническая иммунология
Гемолиз, вызванный приемом лекарств и переливанием крови...............................134
Аутоиммунные нейтропении и другие цитопении.....136
Гематологические заболевания ......................138
Острые лейкозы.....................................138
Обзор классификации лимфом.........................140
Болезнь Ходжкина 142
Т-клеточные лимфомы 144
В-клеточные лимфомы............................... 148
Плазмоклеточная дискразия........... ..............152
Множественная миелома .............................154
Криоглобулинемия ................................ 156
Амилоидоз..........................................158
Иммунология опухолей 160
Обнаружение и идентификация опухолевых антигенов 160
Преодоление иммунологического надзора опухолевыми антигенами.....................162
Иммунотерапевтические стратегии (I)................164
Иммунотерапевтические стратегии (II) .... 166
Трансплантационная иммунология ................... 168
Аутологичная трансплантация костного мозга и гемопоэтических стволовых клеток ................168
Аллогенная трансплантация костного мозга и гемопоэтических стволовых клеток.................170
Клинические аспекты трансплантации органов........ 172
Иммунологические аспекты трансплантации органов .. 174
Скелетно-мышечные заболевания .................... 176
Клинические проявления ревматоидного артрита.......176
Синовиальные изменения при ревматоидном артрите ..178
Патогенез ревматоидного артрита (I) ...............180
Патогенез ревматоидного артрита (II) ..............182
Ювенильный хронический артрит .....................184
Клинические проявления спондилоартрита ............186
Патогенез спондилоартрита ....................... 188
Подагра, полихондрит и синдром Бехчета ............190
Аутоантитела .... 192
Примеры аутоантител .............................. 192
Заболевания соединительной ткани и васкулиты . 194
Клинические проявления СКВ....... .194
Патогенез СКВ .....................................196
Склеродермия и смешанная соединительнотканная болезнь ......................198
Синдром Шегрена .................................. 200
Миозиты . . 202
Общая классификация васкулитов ....................204
Иммунный васкулит и узелковый полиартериит.........206
Гигантоклеточный артериит .. . 208
Заболевания кожи ..................................210
Крапивница ....................................... 210
Контактные аллергии............................212
Атопический дерматит и лейкоцитокластический васкулит ..............214
Псориаз и буллезные дерматозы..................216
Заболевания желудочно-кишечного тракта ........218
Атрофический гастрит, болезнь Виппля и спру .. .. 218
Хронические воспалительные заболевания кишечника .....................................220
Аутоиммунные заболевания печени ...............222
Респираторные заболевания .....................224
Бронхиальная астма и аллергический ринит.......224
Саркоидоз и идиопатический легочный фиброз ....226
Экзогенный аллергический альвеолит ............228
Туберкулез.....................................230
Болезни почек .................................232
Иммунологические механизмы ....................232
Гломерулонефрит (I) ...........................234
Гломерулонефрит (II) и интерстициальный нефрит .. . 236
Метаболические нарушения ......................238
Аутоиммунные заболевания щитовидной железы ....238
Сахарный диабет и аутоиммунный плюригландулярный синдром......................240
Болезни сердца 242
Ревматическая атака, миокардит и постинфарктный синдром................ . . . 242
Неврологические заболевания ...................244
Рассеянный склероз............................ 244
Болезни, вызванные аутоантителами....... 246
Миастения гравис и синдром Ламберта Итона .. 248
Болезни глаз ................................. 250
Анатомия и патогенез.......................... 250
Воспаления внешних структур глаза..............252
Увеит (I) .....................................254
Увеит (II) и глазные проявления системных заболевании .........................256
Иммунология репродукции .......................258
Иммунология репродукции........................258
Вакцинация ................................... 260
Обзор ........................................ 260
Новые вакцины .................................262
Иммунофармакология ........................... 264
Нестероидные противовоспалительные препараты и глюкокортикоиды ...................264
Антиметаболиты, циклофосфамид, сульфасалазин и золото.........................266
Циклоспорин А, микофенолат и лефлуномид .......268
Моноклональные и поликлональные антитела..... 270
Приложение .................................. 272
Словарь терминов .......................... 304
Предметный указатель........................ 308
320