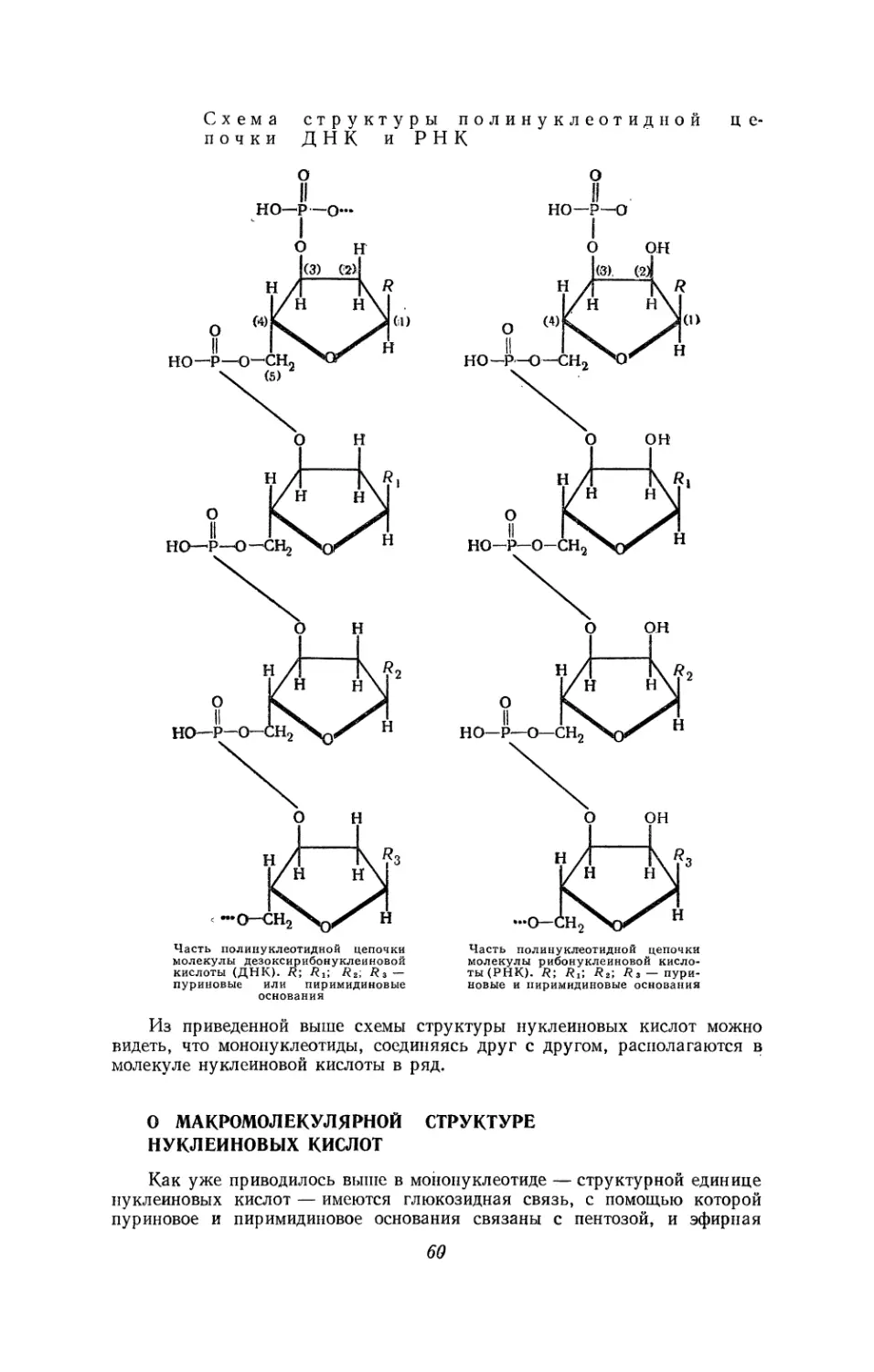
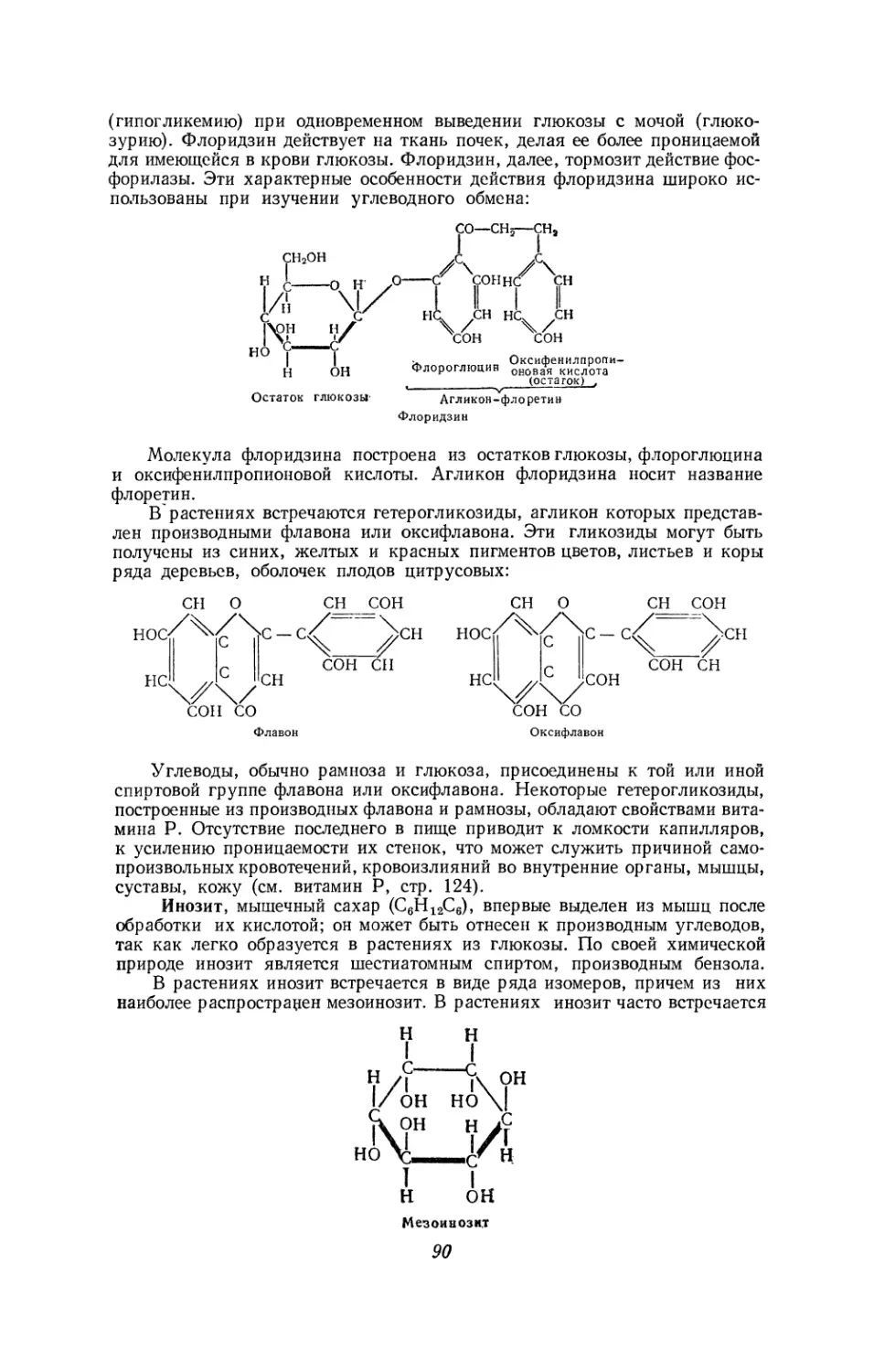
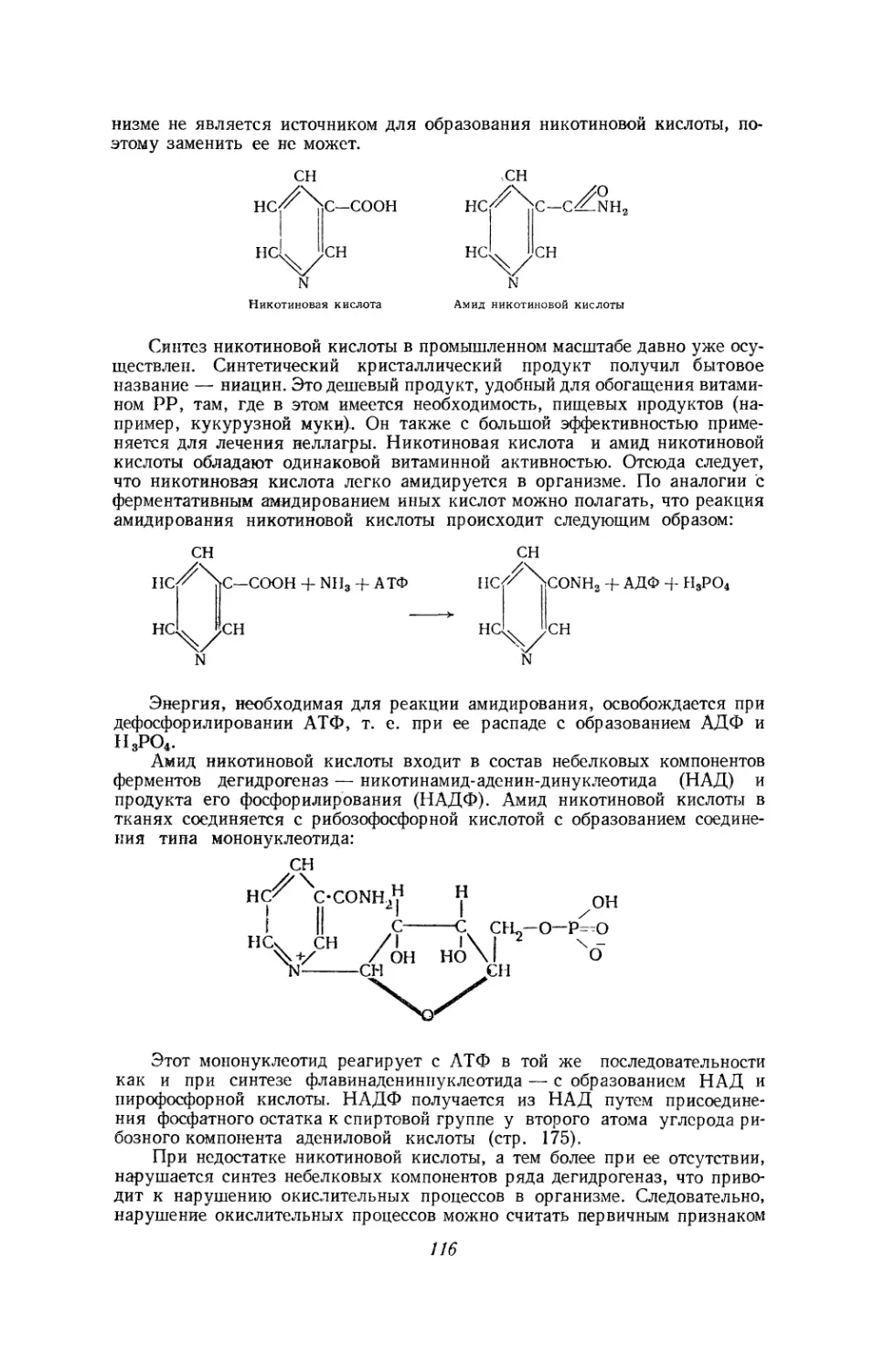
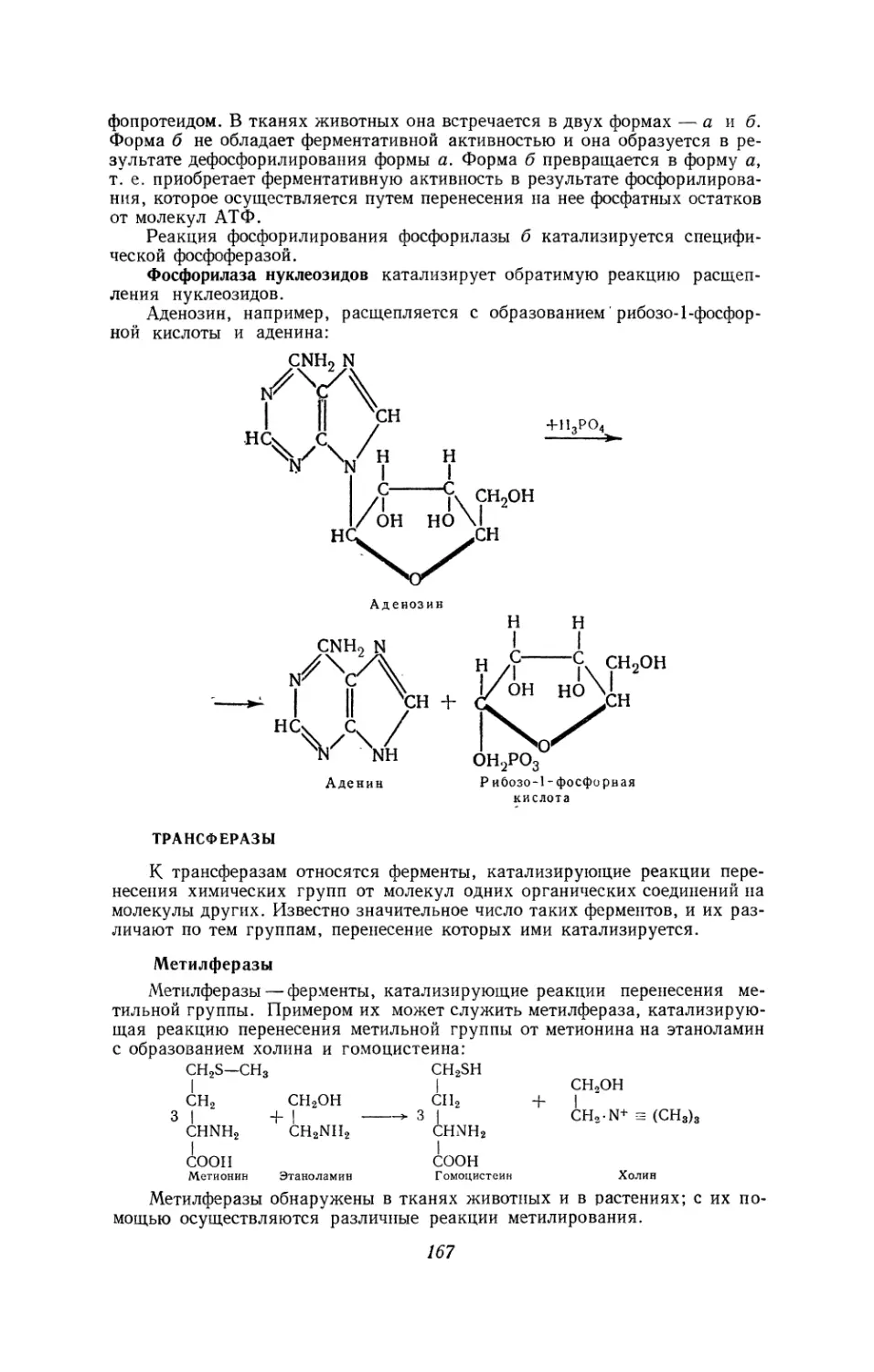
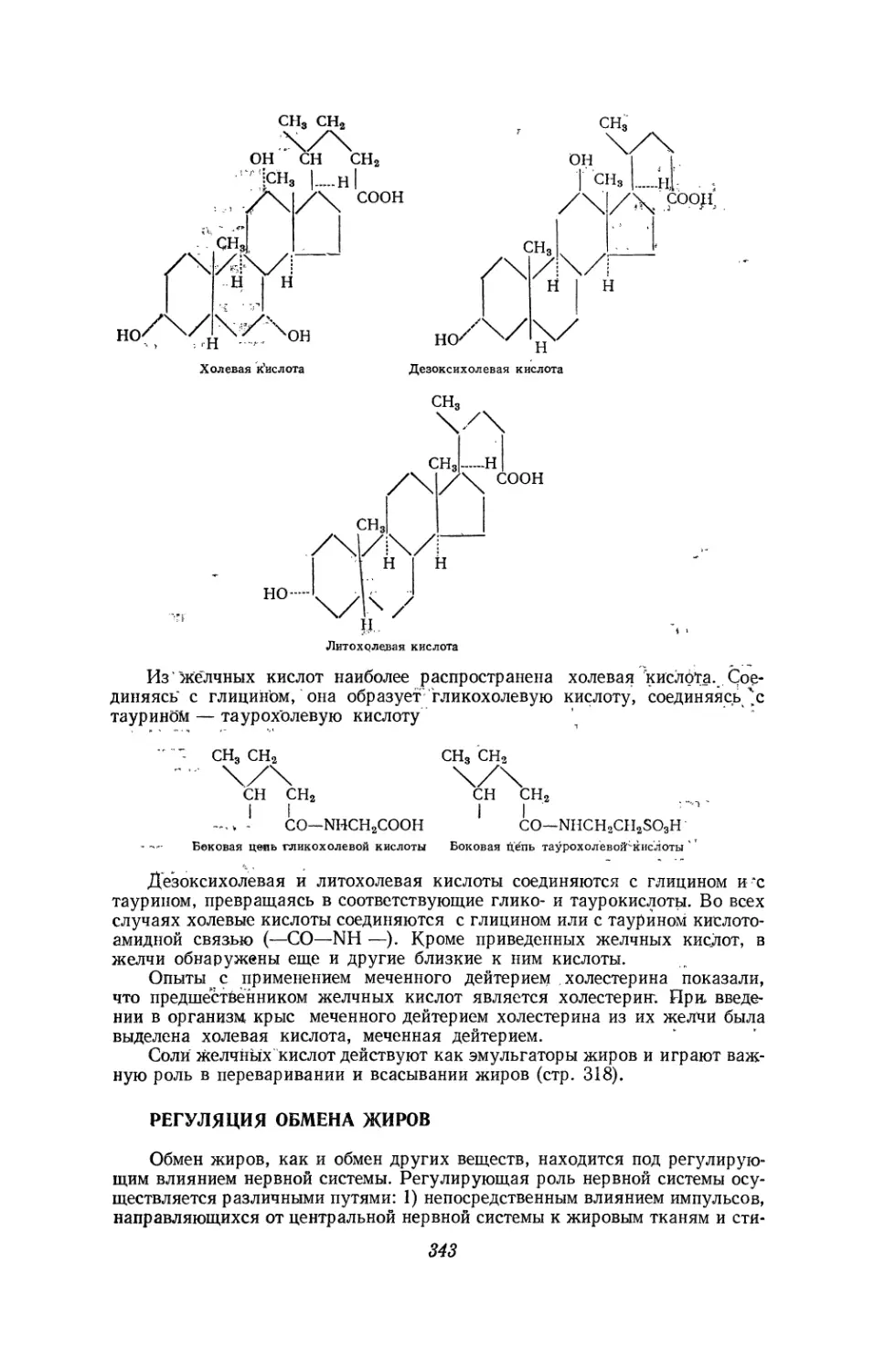
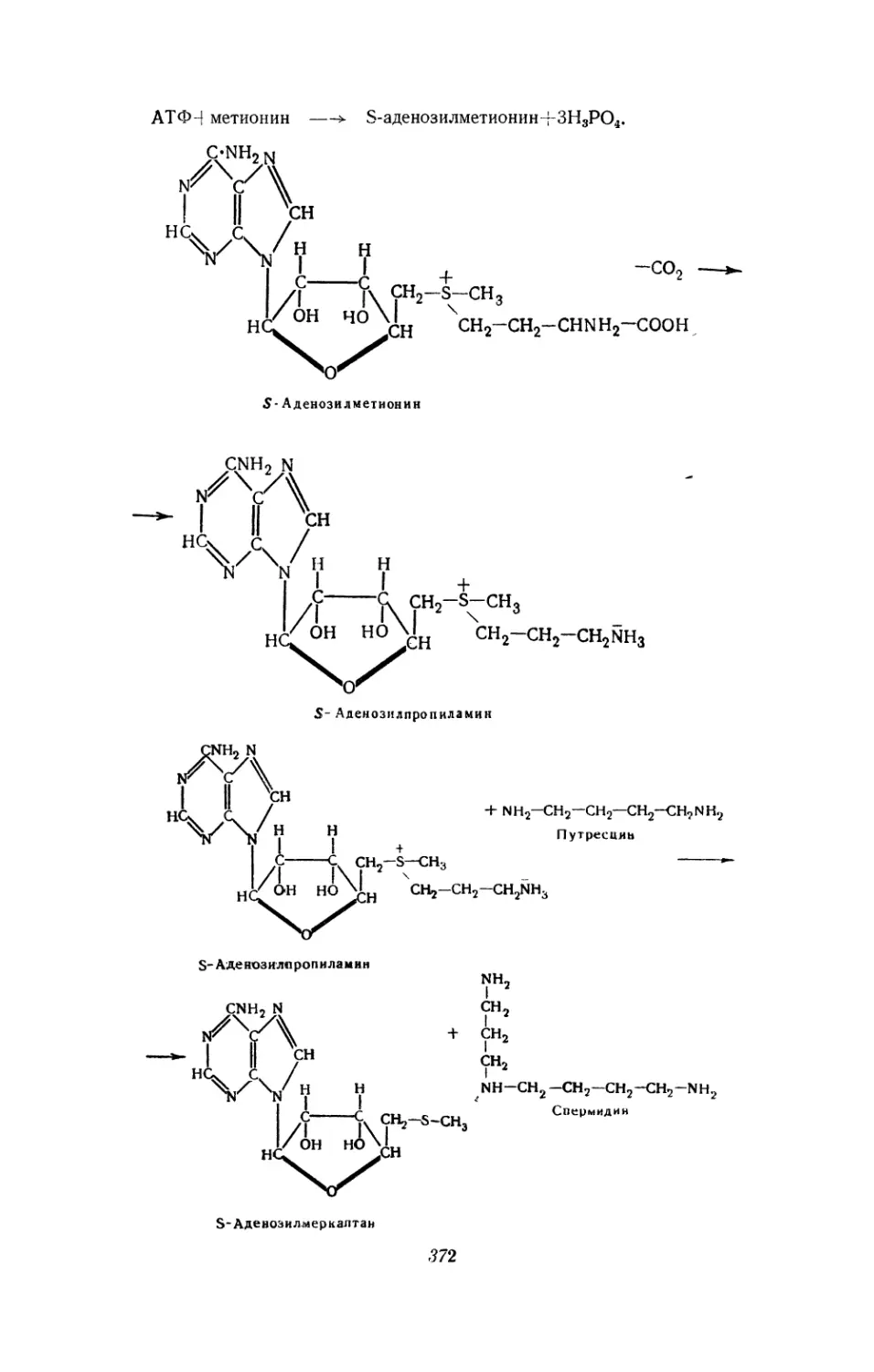
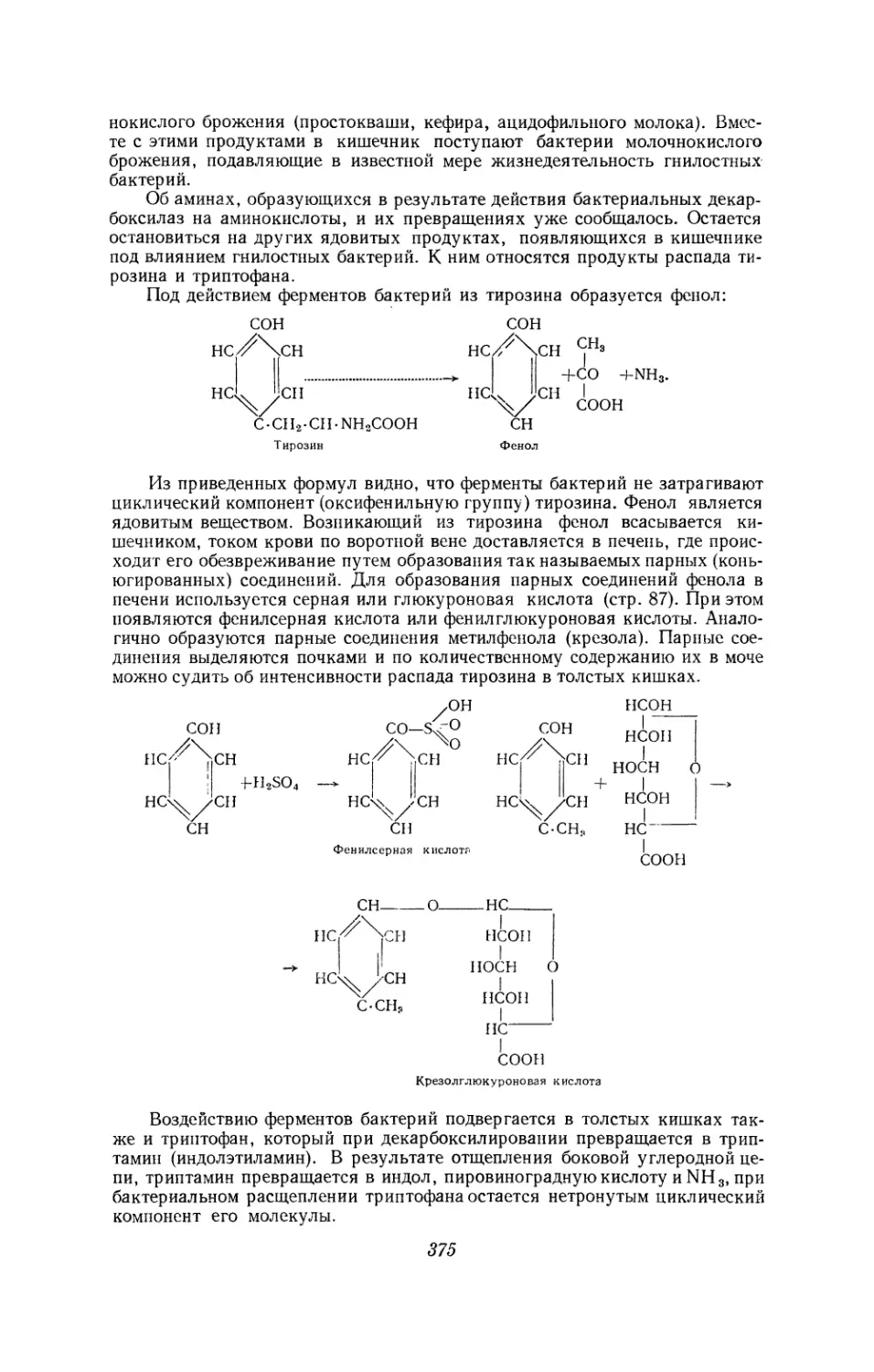
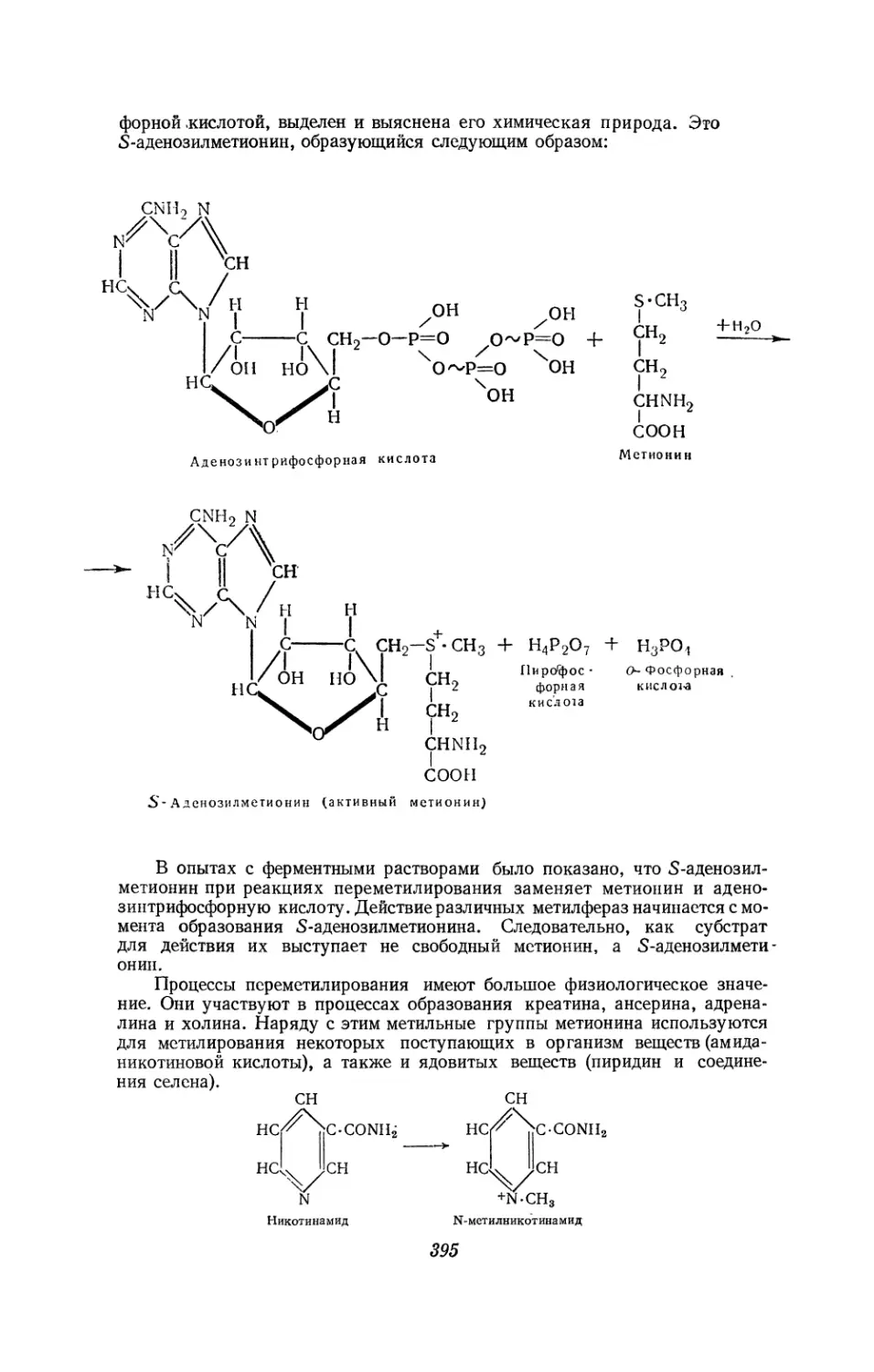
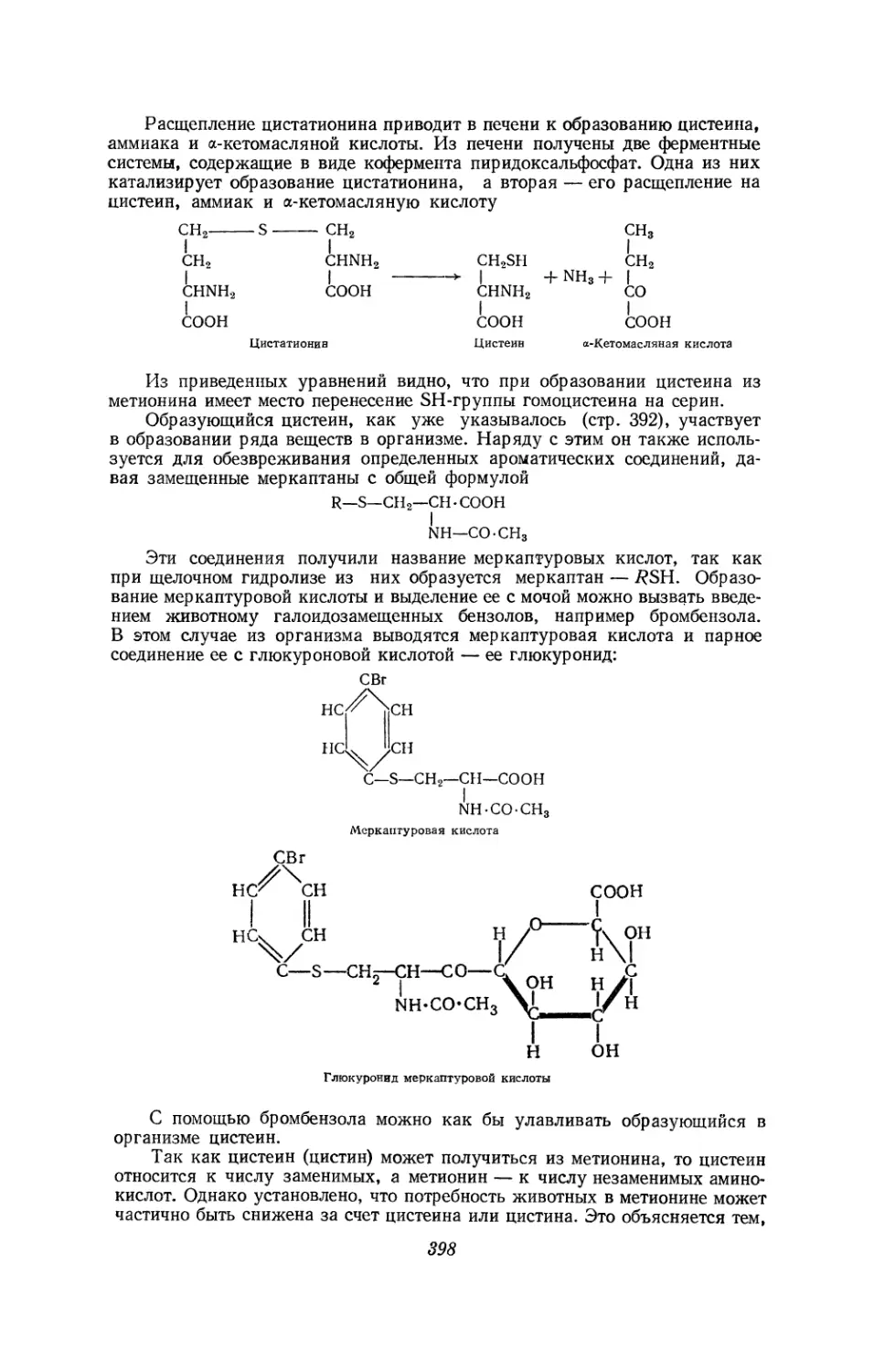
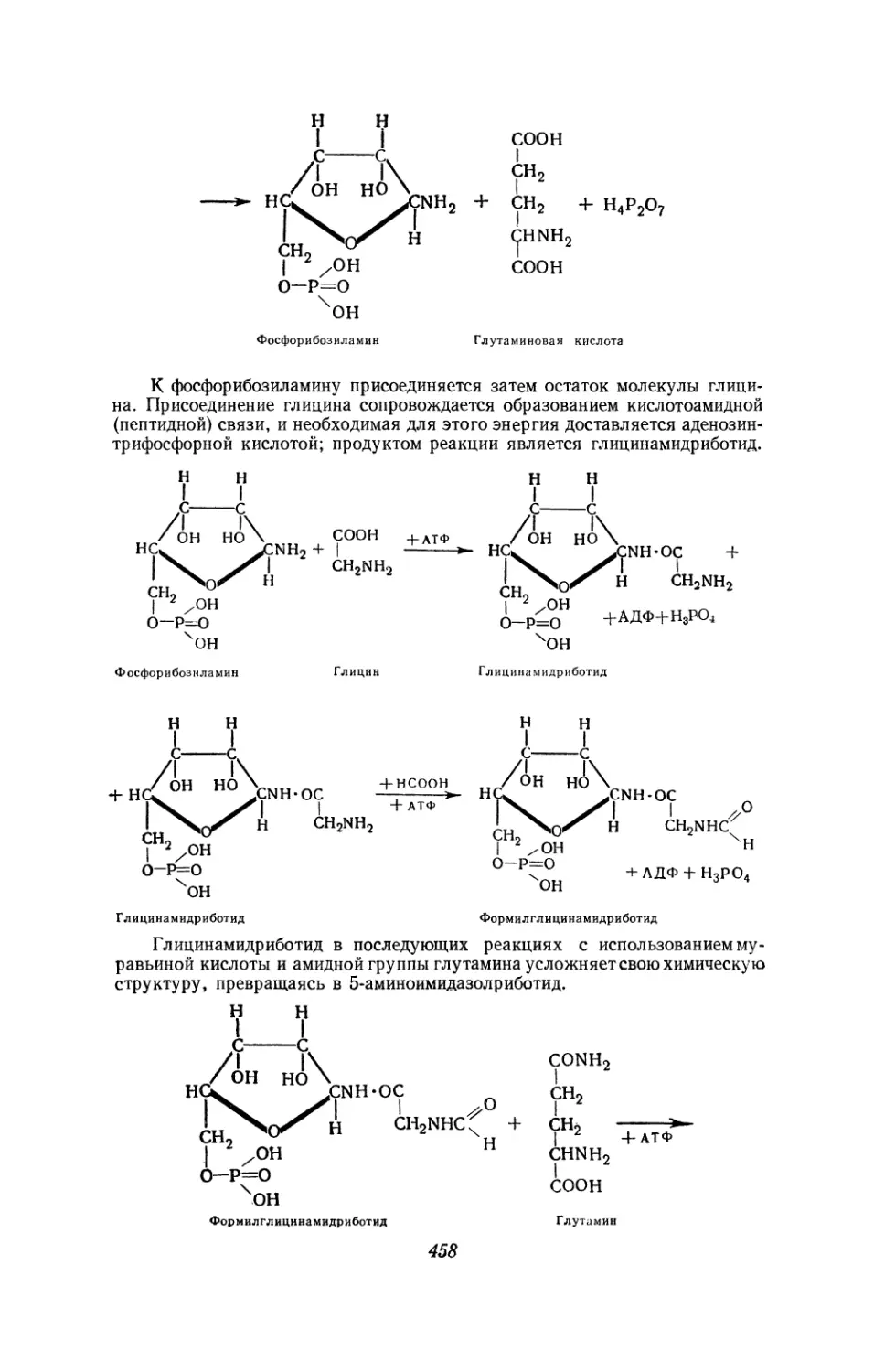
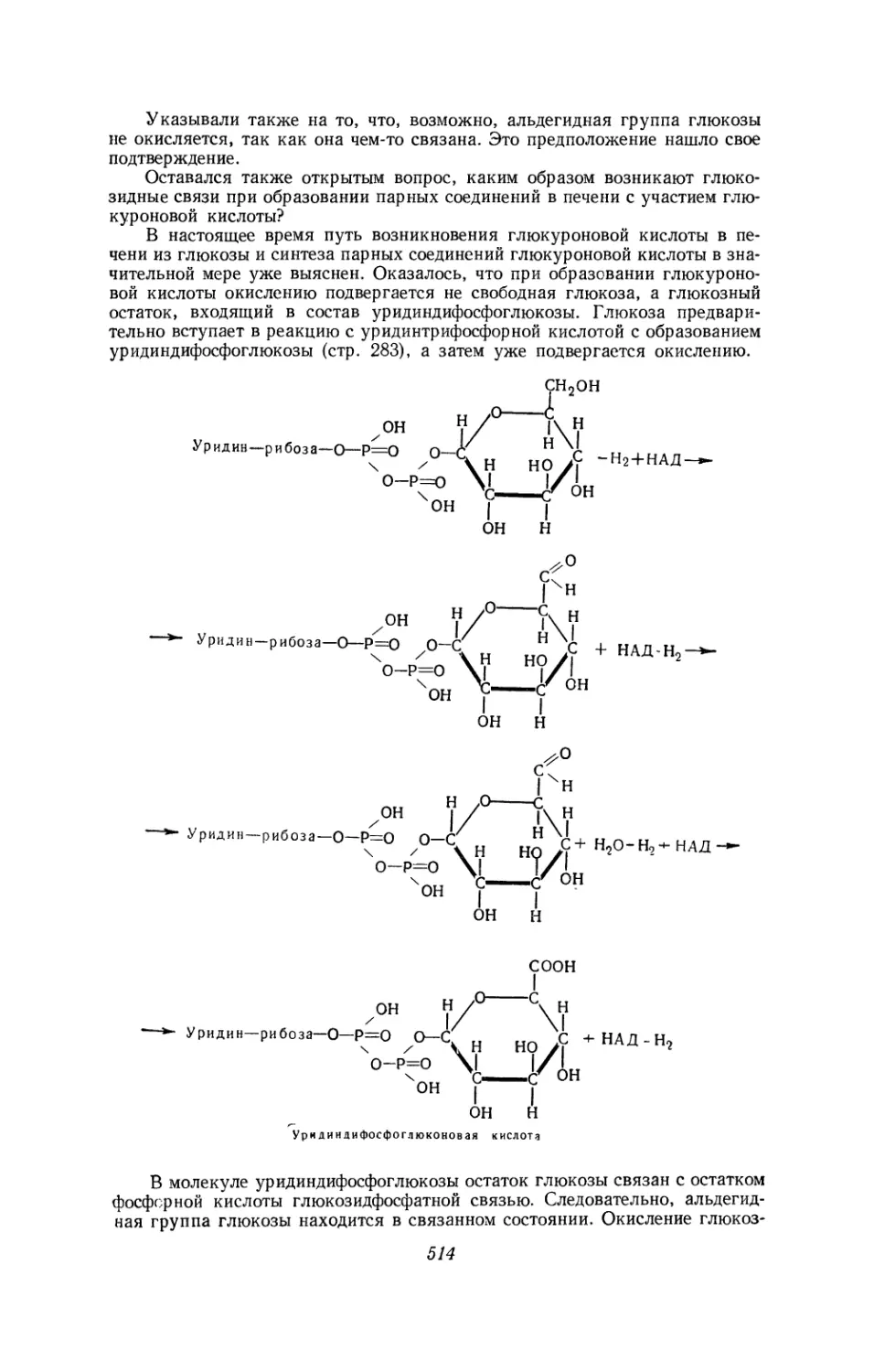
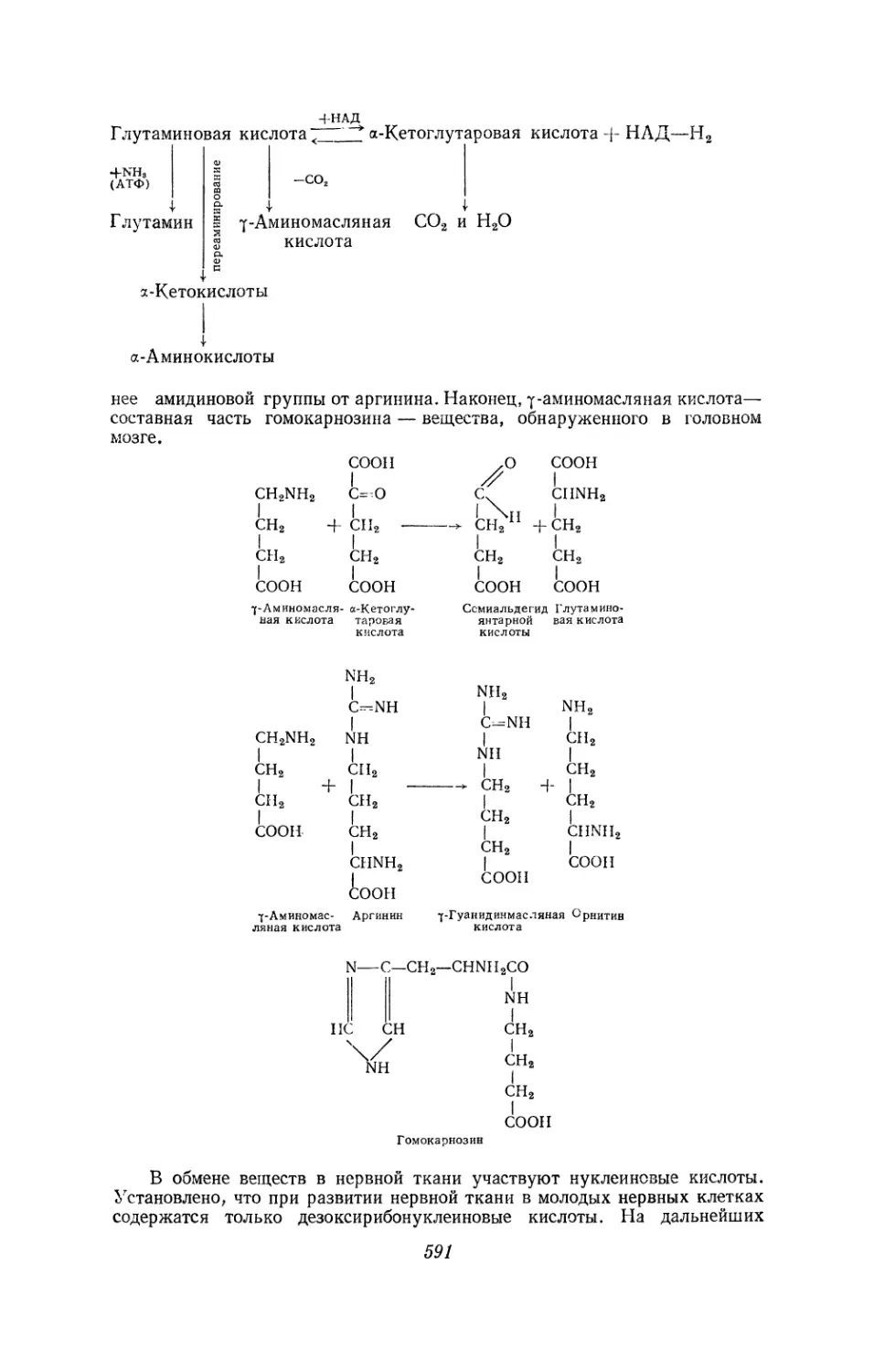
Текст
Член-корр. АН СССР
БИОХИМИЯ
ИЗДАНИЕ ТРЕТЬЕ
ПЕРЕРАБОТАННОЕ И ДОПОЛНЕННОЕ
Допущено
Министерством высшего и среднего специального обра-
зования СССР в качестве учебника для государственных
университетов СССР
ИЗДАТЕЛЬСТВО «ВЫСШАЯ ШКОЛА»
МОСКВА—19 66
2—10—2
БЗ—46/21—66
ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ
Задача предлагаемой вниманию читателей книги
состоит в том, чтобы дать современное представление
о биохимической науке и ее содержании, преимуще-
ственно о биохимических превращениях и химиче-
ском составе организмов животных. Она рассчитана,
в основном, на студентов биологических факультетов
университетов, но может представить интерес также
для студентов других высших школ, где ведется пре-
подавание биохимии, а также для молодых научных
работников, использующих знания по биохимии в
своей исследовательской работе.
За короткий срок, прошедший после выхода из
печати второго издания настоящего учебника, поя-
вились многочисленные работы по наиболее важным
проблемам биохимии. Многие взгляды, казавшиеся
до этого гипотетическими, прочно заняли свое место
в науке и становятся достоянием широких кругов
научных работников. Исключительно быстрое раз-
витие биохимии приносит все новые и новые факты,
намечает новые проблемы, требующие своего осве-
щения в учебнике.
За последние три года появились изменения в био-
химической терминологии. Это особенно касается
ферментов.
Все вышесказанное, по возможности, учтено ав-
тором при подготовке к печати настоящего третьего
издания.
Некоторые главы первого издания «Биохимии»
были критически просмотрены А. Е. Браунштейном,
С. Я. Капланским, В. Л. Кретовичем и А. М. Утев-
ским.
Второе издание было прорецензировано коллек-
тивом преподавателей и научных работников кафед-
ры биохимии МГУ и настоящее — третье издание —
коллективом преподавателей и научных работников
кафедры биохимии ЛГУ.
Автор считает своим приятным долгом искренне
поблагодарить товарищей за ценные замечания, ис-
пользованные им для улучшения учебника, и с бла-
годарностью примет критические замечания и поже-
лания читателей третьего издания «Биохимии».
Д. ФЕРДМАН
ВВЕДЕНИЕ
Биологическая химия, или биохимия — сравнительно недавно офор-
мившаяся научная дисциплина. Начало становления биохимии относят ко
второй половине прошлого столетия, а иногда даже к началу нашего сто-
летия.
Основными задачами биохимии являются: 1) изучение химического
состава живых организмов и 2) изучение химических процессов, т. е. про-
цессов обмена веществ, лежащих в основе их жизнедеятельности.
Изучение химического состава живых организмов, выделение из тка-
ней индивидуальных веществ и выяснение их химической структуры сбли-
жают биохимию с органической химией. Это направление в биохимии при-
нято называть статическим. Изучение биохимической статики привело к
ряду крупнейших открытий, без которых немыслимо было бы развитие не-
которых направлений в биохимии. В самом деле, изучение химических
превращений веществ, входящих в состав клеток и тканей, а также веществ,
поступающих в организм извне и ассимилируемых клетками, требует де-
тальных знаний химической природы этих веществ.
Изучение процессов обмена веществ и связанное с ним изучение хими-
ческой природы продуктов, образующихся в организме, составляет пред-
мет динамической биохимии.
Биохимия изучает процессы обмена веществ, включающие многооб-
разные химические реакции, обеспечивающие синтез различных органиче-
ских веществ — составных частей клеток и тканей (процессы ассимиля-
ции), а также реакции, приводящие к распаду органических веществ, со-
провождающиеся использованием организмом их потенциальной энергии
(процессы диссимиляции).
Процессы ассимиляции и процессы диссимиляции взаимосвязаны и
часто трудно бывает их разграничить. Совокупность процессов ассимиля-
ции и диссимиляции составляет обмен веществ между организмами и внеш-
ней средой, являющийся одним из самых характерных особенностей прояв-
ления жизни. Обмен веществ лежит в основе проявления самых разнообраз-
ных функций живых существ, и поэтому биохимия является важнейшей
биологической дисциплиной.
Биохимия теснейшим образом связана с физиологией — дисциплиной,
изучающей функции органов и организма в целом. Следует, однако, под-
черкнуть, что задачи, стоящие перед физиологией, и методы, применяющие-
ся для их разрешения, отличаются от задач и методов биохимии. Физиоло-
гия изучает закономерности проявления функций органов и организма и
пользуется для этой цели преимущественно методами физики. Биохимия же
изучает химические закономерности, лежащие в основе функциональной
активности органов или тканей, и для этой цели пользуется преимущест-
венно методами химии, включая методы физической химии.
Тесная связь биохимии и физиологии создала определенное направле-
ние в биохимии, известное под названием функциональной биохимии. За-
дача функциональной биохимии сводится к изучению химических законо-
мерностей превращения веществ, лежащих в основе проявления функций
органов и организма в целом.
5
БИОХИМИЧЕСКАЯ СТАТИКА
В XIX столетии, в связи с интенсивным развитием органической химии,
создались возможности для выделения и изучения химических свойств
соединений, широко распространенных в живых организмах,— углеводов,
жиров и белков. Разработка методов количественного элементарного ана-
лиза Берцелиусом, а затем Либихом, позволила подойти к изучению эле-
ментарного состава веществ, выделенных из живых организмов. При ана-
лизе многих веществ, входящих в состав тканей животных и растений,
исследователями первой половины прошлого столетия было выявлено нали-
чие в них углерода. Все больше расширялись знания об углеродсодержа-
щих веществах живых организмов, получивших название органических
веществ. Позже к классу органических веществ стали относить и углерод-
содержащие вещества, полученные путем синтеза.
В первой половине XIX столетия стало развиваться синтетическое
направление в химии, которое призвано было удовлетворить потребности
химической промышленности. На первых порах при разработке приемов
синтеза ученые встречались с большими затруднениями, особенно при син-
тезе углеродсодержащих соединений. В науке того времени сложилось
представление, что составные части организмов, а также продукты их выде-
ления, независимо от степени их сложности, не могут быть получены синте-
тическим путем, что они поддаются лишь аналитическому изучению. Счи-
талось общепринятым, что с помощью химических методов можно разру-
шить органические соединения и изучить образующиеся при этом продукты,
но что нельзя синтезировать вещества, входящие в состав организмов,
из более простых соединений вне организма лабораторным путем. Объяс-
нение неудач при синтезе органических соединений лабораторным путем
стали искать в том, что эти соединения создаются в живых организмах
особым путем, с помощью «жизненной силы». Подобное виталистическое
представление о синтезе органических соединений укоренилось в науке
того времени, и оно поддерживалось крупными научными авторитетами.
Выдающийся шведский химик Берцелиус (1779—1848), например, стоял
на виталистических позициях и совершенно не признавал возможности ла-
бораторного синтеза органических соединений; он считал, что химия не
способна овладеть «жизненной силой», создающей различные органические
вещества в живых организмах. Так была создана пропасть между вещест-
вами неорганическими, синтез которых считался доступным человеку, и
органическими, синтезирующимися якобы только в живых организмах.
Вполне понятно, что виталистическое представление о синтезе органи-
ческих соединений не могло способствовать развитию химической науки.
Оно ограничивало научную мысль и препятствовало прогрессу научных
знаний, поискам новых путей для разрешения проблем, выдвигаемых прак-
тической деятельностью человека.
Виталистические представления о синтезе органических веществ потер-
пели крушение в 1828 г., когда Вёлером, учеником Берцелиуса, была син-
тезирована из неорганического соединения (циановокислого аммония)
мочевина — соединение, образующееся в организмах человека, млекопи-
тающих, амфибий и рыб и выделяющееся с мочой. Синтез мочевины лабора-
торным путем оказался настолько простым, что он совершенно не уклады-
вался в представления об участии в нем «жизненной силы».
В своем письме к Берцелиусу Вёлер писал: «Я должен Вам заявить,
что могу делать мочевину, не нуждаясь при этом в почках и вообще в живот-
ном, будь это человек или собака».
В том же 1828 г. С. Я. Нечаев в диссертации, защищенной в Медико-
хирургической академии в Петербурге («Диссертация о животной теплоте»),
пришел к заключению, что химические и физические процессы, совершаю-
щиеся в живом организме, подчиняются тем же законам, которые справед-
ливы для неорганической химии.
6
Еще задолго до этого сокрушительный удар по виталистическим пред-
ставлениям в естествознании был нанесен М. В. Ломоносовым (1746) и
Лавуазье (1770), открывшими закон сохранения материи и движения. От-
крытие закона положило начало новому этапу в развитии естественных наук
и, особенно, в развитии химии. Гениальный естествоиспытатель М. В. Ло-
моносов сознавал качественные отличия живого от неживого, но считал, что
это отличие не может препятствовать изучению и познанию явлений, ха-
рактерных для живого. Явления жизни, полагал он, подчиняются тем же
закономерностям и так же познаваемы, как и явления неживой природы,
и химия призвана сыграть большую роль в познании как неживой, так и
живой природы.
После лабораторного синтеза мочевины вскоре были осуществлены мно-
гочисленные синтезы других органических соединений. Органическая химия
была освобождена от связывавших ее пут витализма, и для ее развития от-
крылись новые горизонты. Многие вещества, вошедшие в обиход человека,
которые получали раньше из живых организмов, стало возможным синте-
зировать не только в лабораториях, но и для производственных нужд.
Были созданы новые отрасли химической промышленности, например про-
изводство синтетических красок (индиго, ализарин и др.), фармацевтиче-
ских (применяемых в медицине) веществ, витаминов, гормонов, которые до
этого добывались путем выделения из тканей растительных или животных
организмов. Особенно крупные успехи были достигнуты в синтезе органи-
ческих соединений во второй половине XIX столетия, а затем в XX столе-
тии. К достижениям XIX столетия относится осуществление синтеза угле-
водов А. М. Бутлеровым и Э. Фишером, синтеза жиров М. Бертло и первые
попытки проникнуть в тайны химической структуры наиболее сложных из
известных в химии веществ — белков.
В 1838 г. Мульдер впервые попытался дать представление о химиче-
ской природе белков. Белкам он дал название протеины. Этим термином
стали пользоваться, чтобы подчеркнуть особенно важное значение белков
(protos — по-гречески первый, главный). Согласно этому представлению,
основным веществом всех живых организмов является единое химическое
вещество — протеин с эмпирической формулой C40H30N5O12. Все разнооб-
разие белков в природе Мульдер объяснял тем, что каждый белок состоит
из различных количеств молекул протеина с добавлением к ним, в виде при-
меси, некоторого количества молекул (различного для разных белков) серы
и фосфора. Представление Мульдера о химической природе белков в тече-
ние некоторого времени имело свое признание, однако вскоре оно было по-
колеблено исследованиями Н. Лясковского, которому не удалось путем
эксперимента подтвердить данные Мульдера о протеине как единой состав-
ной основе всех белков. Благодаря исследованиям Н. Лясковского,
П. Н. Ильенкова, Н. Н. Любавина, нашедшим поддержку со стороны круп-
нейших химиков того времени — Либиха и Берцелиуса,— метафизическое
представление Мульдера о структуре белков было окончательно опроверг-
нуто, и в науке упрочилось представление о большом разнообразии белков
в живой природе.
В XIX столетии стали появляться данные о том, что при обработке бел-
ков кислотами (гидролиз) при температуре 100—105°С они расщепляются
с образованием относительно простых низкомолекулярных азотсодержащих
соединений — аминокислот. К настоящему времени из гидролизатов раз-
личных белков выделено более 20 различных а-аминокислот. Естественно,
возник вопрос о том, каким образом отдельные аминокислоты связываются
друг с другом при образовании белковых молекул. В 1891 г. А. Я. Данилев-
ский впервые высказал мнение о форме связи отдельных аминокислот в
белковой молекуле. Согласно этому мнению, аминокислоты связываются
друг с другом за счет аминных и карбоксильных групп с образованием
кислотоамидных связей (/?—СО—NH—7?х). Позже представление А. Я. Да-
нилевского о структуре белков получило экспериментальное подтверждение
7
в исследованиях Гоффмейстсра и особенно Э. Фишера, и в настоящее вре-
мя наличие кислотоамидной, или, как ее еще называют, пептидной связи
аминокислот в белковых молекулах пользуется всеобщим признанием.
Однако для более полного представления о структуре белковых молекул
чрезвычайно важно знать, в какой последовательности соединяются от-
дельные молекулы друг с другом при синтезе белков. В зависимости от по-
следовательности расположения аминокислотных остатков, естественно,
строятся различные белковые молекулы. Известны различные по своим свой-
ствам белки, имеющие один и тот же аминокислотный состав.
Современные методы изучения химической структуры белков позволяют
выявить последовательность расположения остатков аминокислот в бел-
ковых молекулах. Для некоторых, правда еще очень немногих белков, эта
последовательность уже детально изучена.
Успехи, достигнутые в области химии белков, приближают нас к пол-
ной разгадке их химической структуры и намечают пути, которые должны
будут привести к их синтезу.
Выяснение химической структуры белков имеет принципиально важ-
ное значение. Во второй половине прошлого столетия Ф. Энгельс, обобщая
известные к тому времени данные о роли белков, дал краткое и яркое пред-
ставление о белковых веществах как о носителях жизни. «Жизнь,— писал
Ф. Энгельс,— это способ существования белковых тел, существенным момен-
том которого является постоянный обмен веществ с окружающей их внеш-
ней природой, причем с прекращением этого обмена веществ прекращается
и жизнь, что приводит к разложению белка»1. Следовательно, материальная
основа жизни — это белковые вещества, и с помощью белков осущест-
вляется постоянное взаимодействие живых организмов с окружающей их
внешней средой.
Раскрытие химической структуры белковых веществ, осуществление
их синтеза из более простых соединений является важным моментом в деле
понимания их биологических особенностей.
Наряду с белками, жирами и углеводами в составе живых организмов
содержатся также другие многочисленные органические вещества.
Конец XIX столетия и последующие десятилетия характеризуются боль-
шими достижениями в выделении из организмов веществ, встречающихся
в очень малых количествах, но играющих важную роль в жизнедеятельно-
сти живых существ. К ним относятся витамины, без которых не могут обой-
тись организм человека и животных, гормоны — вещества, образующиеся
в железах внутренней секреции и участвующие в регуляции функций ор-
ганизма, небелковые компоненты биологических катализаторов — фермен-
тов, антибиотики и другие. Химическая природа многих из этих веществ
изучена настолько полно, что удалось осуществить их синтез. Это явилось
предпосылкой к организации новых отраслей химической промышленно-
сти — витаминной, эндокринной (производство гормонов и гормональных
препаратов), производства антибиотиков и многих иных медицинских пре-
паратов.
Наряду с органическими веществами, в состав живых организмов вхо-
дят также многочисленные неорганические (минеральные) вещества. Одни
из них содержатся в организмах в сравнительно больших количествах
(кальций, фосфор, натрий, калий), иные в малых количествах (микроэле-
менты— магний, железо, марганец). Элементы, встречающиеся в очень
малых количествах, относятся к ультрамикроэлементам (медь, цинк, фтор).
Фундаментальные исследования по изучению роли минеральных ве-
ществ в организме животных принадлежат профессору Юрьевского (ныне
Тартуского) университета Г. А. Бунге (1844—1920). В более позднее время
было установлено наличие в клетках минеральных веществ, составляющих
1 Ф. Энгельс. Диалектика природы. Госполитиздат, 1955, стр. 244.
8
группу ультрамикроэлементов. Эти минеральные вещества (например,
кобальт, цинк, медь и др.) содержатся в ничтожно малых количествах, од-
нако физиологическое значение каждого из них велико и недостаток их в
пище вызывает тяжелые расстройства функций организма.
БИОХИМИЧЕСКАЯ ДИНАМИКА.
ФУНКЦИОНАЛЬНАЯ БИОХИМИЯ
Наиболее важной задачей биохимии является изучение динамики хи-
мических превращений в живых организмах. К концу XIX столетия были
проведены многочисленные исследования по изучению балансов превра-
щений различных веществ в организме человека. Эти исследования каса-
лись начальных продуктов, поступающих в организм, и конечных продук-
тов, выделяющихся из него, затем подводился баланс между количествами
первых и вторых. Таким образом, был окончательно установлен замеча-
тельный факт, что взрослый организм при нормальных условиях питания
находится в состоянии азотистого равновесия, т. е. что количество азота,
входящего в состав белков, поступающих с пищей (приход азота), равня-
ется количеству азота, содержащегося в выделяющихся из организма с
мочой азотистых веществах, главным образом в мочевине (расход азота).
Известно было также, что углеводы и жиры подвергаются в организме рас-
паду с образованием воды и углекислого газа, причем чем больше углево-
дов и жиров подвергается распаду, тем больше образуется и выделяется из
организма углекислого газа и воды.
Установление балансов превращения веществ в организме оказалось
совершенно недостаточным для выяснения, каким образом, по каким путям
происходит распад веществ в организме, в какой мере и каким образом ис-
пользуются они для синтеза составных частей тканей. В XIX столетии
представители биохимической науки отдавали себе ясный отчет в том, что
между начальными и конечными продуктами превращений сложных орга-
нических веществ должны стоять промежуточные вещества, что белки, на-
пример, не сразу дают начало образованию мочевины, точно так же, как
углеводы и жиры не сразу превращаются в углекислый газ и воду. Выска-
зывались, однако, соображения, что над промежуточными этапами прев-
ращения органических веществ в организмах «висит завеса неизвестности»
(Шонбейн), что они не поддаются изучению. Между тем необходимость
выявить пути превращения сложных органических веществ, входящих в
состав тканей, а также судьбу поступающих в организм пищевых веществ
становилась все более насущной.
Основоположник отечественной физиологии И. М. Сеченов в 1884 г.
в «Физиологических очерках» писал: «Проследить судьбу внешнего вещест-
ва при его странствовании по телу — значит описать всю историю жизни».
Эта «история жизни», с биохимической точки зрения, может быть вскрыта
выявлением промежуточных этапов превращения сложных органических
веществ в организме.
Разработка проблемы промежуточного обмена веществ, начавшаяся в
нашем столетии, увенчалась замечательными достижениями, благодаря ко-
торым был открыт новый, невиданный раньше мир химических реакций в
живых организмах.
Изучение промежуточных этапов превращения органических веществ
в организме связано с большими трудностями. Объясняется это тем, что
химические реакции в клетках и тканях протекают с большой, а иногда да-
же с неимоверной быстротой. Возникающие на том или ином этапе превра-
щения промежуточные продукты не накопляются в тканях, а подвергаются,
по мере своего возникновения, дальнейшим превращениям. В связи с этим
для изучения промежуточных этапов превращения веществ требуется раз-
9
работка специальных методов. Основным путем здесь является изолиро-
ванное изучение того или иного биохимического процесса вне клеток или
тканей организма. В виде примера можно привести изучение процесса спир-
тового брожения, т. е. распада под влиянием ферментов дрожжевых клеток
глюкозы с образованием этилового спирта и углекислого газа. Уравнение
спиртового брожения было сформулировано Гей-Люссаком (1778—1850), и
оно дает представление о количественных соотношениях между подверга-
ющейся распаду глюкозой и образующимися продуктами этого распада:
С6Н12О6 - 2СН 3СН 2ОН -|-2СО2.
Это уравнение является балансовым, и оно не выявляет, каким образом и
через какие промежуточные продукты протекает распад глюкозы с образо-
ванием спирта и углекислого газа. Химизм спиртового брожения оставался
невыясненным в течение многих десятков лет, однако это положение резко
изменилось, начиная с XX столетия, когда спиртовое брожение стали изу-
чать в бесклеточном дрожжевом соке. Пользуясь этим объектом исследо-
вания, удалось в сравнительно короткий срок расшифровать до последних
деталей весь сложный и длинный путь распада глюкозы с образованием
спирта и углекислого газа. Подобных примеров успешного изучения био-
химических процессов с использованием бесклеточных материалов (соков,
экстрактов), получаемых из клеток и тканей, можно было бы привести очень
много.
Современная техника биохимических исследований позволяет не толь-
ко изолированно (вне организма) изучать превращения отдельных веществ,
но и произвольно расчленять эти превращения, останавливая процесс
превращения на том или ином этапе. В последнем случае происходит на-
копление промежуточных продуктов обмена веществ, неуловимых при ис-
следованиях, проводимых в целом организме.
Много ценных результатов было получено при изучении химических
процессов, протекающих в отдельных морфологических элементах клеток—
ядрах, митохондриях, микросомах, пластидах. Они позволяют проникнуть
в интимные химические процессы, характерные для отдельных частей клет-
ки, и приблизиться к пониманию их интеграции.
До тридцатых годов XX столетия механизмы биохимических реакций
оставались во многом неясными. Это положение резко изменилось с тех пор,
когда в биохимии стали использоваться принципы термодинамики (энерге-
тики). Это позволило в значительной мере расшифровать имеющиеся в живых
организмах ферментативные механизмы, посредством которых осуществля-
ется использование химической энергии в клетке и превращение химиче-
ской энергии в иные виды энергии, необходимые для ее жизнедеятель-
ности.
Динамическая биохимия ставит своей задачей изучить химические за-
кономерности, лежащие в основе процессов обмена веществ между живыми
организмами и окружающей их средой. С этой точки зрения усилия дина-
мической биохимии направлены к разрешению главнейшей проблемы био-
химии — химической стороны обмена веществ. Обмен веществ, возникший
на определенном этапе эволюции материи, является основой жизни. В жи-
вые организмы непрерывно поступают вещества из внешней среды (орга-
нические вещества, минеральные соли, вода, кислород). Эти вещества под-
вергаются различным химическим превращениям, в результате чего они ис-
пользуются для замены распавшихся составных частей клеток и тканей.
При распаде органических составных частей пищи, а также органических
веществ клеток и тканей освобождается энергия, необходимая для жизне-
деятельности организма. Из организмов также непрерывно в окружающую
среду выделяются продукты распада, низкомолекулярные вещества, преи-
мущественно полностью окисленные (СО2 и Н2О). Следовательно, в орга-
низме постоянно идут процессы распада и синтеза; организм беспрерывно
10
обновляет свой состав, сохраняя одновременно его постоянство. Подобное
состояние живых организмов принято называть динамическим состоянием,
и оно является характерной особенностью всего живого.
Идея о главенствующей роли обмена веществ нашла свое отражение
в трудах классиков марксизма, а также выдающихся естествоиспытателей
XIX и XX веков. Ф. Энгельс писал: «Растение, животное, каждая клетка
в каждое мгновение своей жизни тождественны с собою и тем не менее от-
личаются от самих себя благодаря усвоению и выделению веществ, благо-
даря дыханию, образованию и отмиранию клеток, благодаря происходяще-
му процессу циркуляции — словом, благодаря сумме непрерывных моле-
кулярных изменений, которые составляют жизнь...»1.
К. А. Тимирязев в своих трудах подчеркивает, что развитие всего жи-
вого, изменчивость и наследственность обусловливаются единством между
противоположными сторонами обмена веществ. Представление К. А. Тими-
рязева нашло свое преломление и дальнейшее развитие в работах И. В. Ми-
чурина. И. П. Павлов рассматривал обмен веществ как основу физиологи-
ческих функций организма.
Изучение процессов обмена веществ представляет особый интерес с точ-
ки зрения медицины. Различные заболевания человека сопровождаются
сдвигами в процессах обмена веществ, поэтому существенно важно выяс-
нить причины этих сдвигов и возможности их устранения. Это привело к
возникновению специальной отрасли медицинской науки — медицинской
химии, пользующейся биохимическими методами исследования. Большое
значение имеет изучение обмена веществ для ветеринарии и животновод-
ства.
При разработке проблем динамической биохимии и обмена веществ,
как правило, сталкиваются с действием биологических катализаторов —
ферментов. Высокая скорость течения химических процессов в живых ор-
ганизмах является характерной особенностью процесса обмена веществ
между ними и окружающей их средой. Высокомолекулярные органические
составные части тканей и органов точно так же, как составные части пищи,
подвергаются многочисленным превращениям в организме с помощью фер-
ментов. Материалистический подход к оценке ферментов, к изучению их
действия и их химической природы, наметившийся уже в конце XVIII в.,
отбросил фантастическое представление о сущности действия ферментов.
Существовавшее идеалистическое представление о ферментах как о «бо-
жественном начале» было опровергнуто ходом развития биохимии. В борьбе
между виталистическим и материалистическим представлениями о фермен-
тах к концу XIX в. восторжествовало материалистическое представление.
Ферменты стали рассматривать как вещества белковой природы, обладаю-
щие свойствами катализаторов. Их стали выделять из живых организмов,
изучать механизм их действия, а также пути возникновения их в организ-
мах.
В 1811 г. член Петербургской Академии наук К. С. Кирхгоф открыл
превращение крахмала в сахар при нагревании его в присутствии разбав-
ленных кислот. В 1814 г. в проросших зернах ячменя он открыл фермент
амилазу, с помощью которого происходит осахаривание крахмала.
В 1863 г. А. Я. Данилевский впервые разработал метод адсорбционного
разделения и очистки ферментов поджелудочной железы. Этот метод нашел
позже широкое применение в исследованиях Вильштегтера и его учеников
по выделению ферментов и изучению их химии.
Дальнейшее развитие исследований по очистке ферментов привело к
получению большого количества очищенных и кристаллических ферментов.
Первый фермент (уреаза) был получен в кристаллическом виде из бобов
сои Самнером в 1927 г.
1 Ф. Энгельс. Диалектика природы. Госполитиздат, 1955, стр. 168.
И
В процессах обмена веществ большое место занимают окислительные
реакции. Органические вещества подвергаются в живых организмах окисле-
нию, сопровождающемуся освобождением энергии. Окисление органических
веществ катализируется многочисленными окислительными ферментами.
Выдающиеся исследования А. Н. Баха и В. И. Палладина по изуче-
нию процессов биологического окисления позволили им выяснить фер-
ментативные процессы, лежащие в основе окисления органических веществ
и использования при этом кислорода. Представления А. Н. Баха и В. И.
Палладина о механизме окислительных процессов получили широкое при-
знание и были развиты в обширных исследованиях Варбурга, Виланда, Кей-
лина и др. Они создали основу для современных теоретических обобщений,
касающихся механизма биологического окисления и путей использования
в организмах химической энергии.
Последние 25 лет характеризуются широким применением в биохимии
метода меченых атомов. Благодаря достижениям физики биохимия обога-
тилась новым методом исследования, позволяющим проследить за превра-
щением веществ в организме, за процессами синтеза и распада органиче-
ских соединений. Искусственно радиоактивные, а также природные ста-
бильные изотопы, будучи введены в состав молекул тех или иных соедине-
ний, метят эти соединения, придавая им радиоактивность или же (в слу-
чае стабильных изотопов) большую плотность. По этим признакам можно
следить за превращением веществ в организме, за использованием их для
синтеза сложных соединений, а также за их распадом. Применение метода
меченых атомов позволило выяснить пути синтеза многих органических
веществ в организме (красящей части гемоглобина, производных пурина,
креатина и многих иных веществ). Замечательно, что применение метода
меченых атомов в биохимии позволяет проследить за скоростью обновле-
ния составных частей клеток и тканей организмов, за продолжительностью
«жизни» отдельных химических соединений в организме.
В результате применения метода меченых атомов выявлена исключи-
тельная динамичность белковых веществ. Белки, больше чем какие-либо
иные вещества, подвергаются в организме обновлению, распаду и синтезу.
Далее было установлено, что постоянному обновлению в известной мере
подвергаются составные части таких, казалось бы, инертных образований,
как сухожилия, связки, зубная эмаль и др. Все эти данные в значительной
мере расширили наши представления об обмене веществ между организмами
и окружающей их средой и поставили перед исследователями ряд новых
проблем.
Метод меченых атомов позволяет часто изучать процессы обмена ве-
ществ в целом организме, не прибегая к нарушению его целостности, един-
ства, что имеет особенно большую ценность. Многие факты, установленные
динамической биохимией при использовании бесклеточных соков, отдель-
ных клеточных элементов (микросом, митохондрий, ядер), были подтверж-
дены изучением химических процессов в целом организме с помощью мето-
да меченых атомов.
Метод меченых атомов чрезвычайно важен при разрешении вопросов
функциональной биохимии. В основе проявления функций отдельных орга-
нов лежат процессы обмена веществ. Одна из основных задач биохимии
состоит в выявлении особенностей химических процессов, связанных не-
посредственно с проявлением функции того или иного органа. Подобный под-
ход к изучению процессов обмена веществ явно определился еще в биохими-
ческих исследованиях прошлого столетия. Примером могут служить иссле-
дования по изучению биохимических процессов, лежащих в основе разных
сторон функций печени, мышц и некоторых других органов.
Достижения динамической биохимии, применение новых методов ис-
следований и, особенно метода меченых атомов, позволяют в наше время
более глубоко разобраться в особенностях биохимических превращений в
функционально различных тканях и органах.
12
Функциональная биохимия сближает биохимическую науку с физио-
логией и выдвигает к разрешению общие для обеих дисциплин проблемы.
В этом отношении очень важной является координированная работа био-
химиков и физиологов. Как пример такой работы могут рассматриваться
исследования великого физиолога И. П. Павлова по изучению роли печени
в азотистом обмене, проведенные совместно с известным биохимиком
М. В. Ненцким. Исследования И. П. Павлова и его сотрудников внесли
много ценного в учение о ферментах. Было установлено влияние внешних
факторов, особенно условий питания на интенсивность образования фер-
ментов в пищеварительных железах и на их выделение с соками этих желез.
Исследования И. П. Павлова по изучению физиологии центральной
нервной системы, особенно коры головного мозга, выявили, каким образом
осуществляется связь организма человека и высокоорганизованных жи-
вотных с внешней средой. Выдающиеся открытия этого ученого служат ос-
новой для биохимических исследований по изучению влияния нервной сис-
темы на процессы обмена веществ между организмами и окружающей их
средой.
Развитие биохимии и использование ее достижений в различных отрас-
лях медицины, сельского хозяйства и промышленности в последние годы
привело к тому, что некоторые ее разделы вырастают в самостоятельные
научные дисциплины.
По признаку объекта исследования биохимия подразделяется на био-
химию животных, биохимию растений и биохимию микробов. Каждая из
перечисленных дисциплин теснейшим образом связана друг с другом, но,
вместе с этим, имеет свои специфические особенности. Биохимия растений
все больше отделяется от физиологии растений подобно тому, как биохимия
микробов выходит за рамки общей микробиологии.
Широкое развитие биохимии, как и других научных дисциплин, нача-
лось в нашей стране после Великой Октябрьской социалистической рево-
люции. До 1917 г. в России существовали биохимические лаборатории, в
которых проводилась научно-исследовательская работа. Ряд русских иссле-
дователей прошлого и начала нашего столетий обогатили биохимию открыти-
ями первостепенного значения. Такие ученые, как А. Я. Данилевский,
М. В. Ненцкий, А. Н. Бах, В. И. Палладии, К. А. Тимирязев, С. П. Косты-
чев, Д. Н. Прянишников, создали свои оригинальные направления в био-
химии животных и в биохимии растений и свои школы. Однако в дорево-
люционное время ученые располагали ограниченными возможностями для
ведения работы. Биохимические лаборатории, немногочисленные и очень
скромно оборудованные, имелись только в некоторых университетах
страны.
В первые послеоктябрьские годы в нашей стране были созданы совет-
ские биохимические школы известного биохимика и общественного деятеля
академика А. Н. Баха и академика А. В. Палладина. В 1921 г. под руковод-
ством А. Н. Баха был организован биохимический институт Народного ко-
миссариата здравоохранения (ныне Институт биохимии им. А. Н. Баха
Академии наук СССР). Несколько позже, в 1925 г., под руководством вы-
дающегося современного биохимика и общественного деятеля А. В. Пал-
ладина был создан Украинский биохимический институт, ныне Институт
биохимии Академии наук Украинской ССР. В 1944 г. был создан Институт
биологической и медицинской химии Академии медицинских наук СССР.
В 1960 г. был организован Институт радиационной и физико-химической
биологии Академии наук СССР (ныне Институт молекулярной биологии).
Наряду со специальными биохимическими институтами в СССР имеются
многочисленные биохимические лаборатории в научно-исследовательских
институтах, в университетах, медицинских и ветеринарных институтах и т. д.
Эти биохимические учреждения работают в направлении разрешения
проблем, имеющих первостепенное теоретическое и практическое значение.
13
ЛИТЕРАТУРА
Буланки н И. Н. А. Я. Данилевский — основоположник отечественной
биохимии. Изд. Харьковского гос. университета им. А. М. Горького, 1950.
Владимиров Г. Е. Основоположники отечественной биохимии. Изд. Все-
союзн. общества по распространению политических и научных знаний. Ленинградское
отделение, 1950.
Збарский Б. И., Иванов И. И. иМардашевС. Р. Биологическая
химия. Изд. 4-е, Медицина, 1965.
Кретович В. Л. Основы биохимии растений. Изд. 4-е, «Высшая школа»,
1964.
О п а р и н А. И. Возникновение жизни на Земле. Изд. 3-е, Изд. АН СССР, 1957.
О п а р и н А. И. А. Н. Б а х — основоположник советской энзимологии. Юби-
лейный сборник, посвященный 30-летию Великой Октябрьской социалистической ре-
волюции, ч. 2, Изд. АН СССР, 1947.
П а л л а д и и А. В. Биохимия. Изд. 12-е, Медгиз, 1946.
Рапопорт С. Медицинская биохимия (перевод с немецк.) Изд. Медицина,
М., 1966
Штрауб Б. Биохимия. Будапешт, 1962*
Раздел первый
ХИМИЧЕСКИЙ
СОСТАВ
ОРГАНИЗМОВ
Глава первая
БЕЛКИ. ПРОТЕИНЫ, ИЛИ ПРОСТЫЕ БЕЛКИ
Из органических веществ, входящих в состав живых организмов, наи-
более важными в биологическом отношении и наиболее сложными по своей
химической структуре являются белки. Белки составляют основу прото-
плазмы, и с ними мы встречаемся всюду, где имеет место проявление жизни.
Представление о содержании белков в тканях и органах животных дает
следующая таблица:
Ткань или орган
Мышцы ............
Сердце ...........
Печень............
Почки.............
Легкие............
Содержание
белка в сухой
ткани
в %
Ткань или орган
Содержание
белка в сухой
ткани
тэ О/
в /о
80 Головной мозг .... 45*
60 Селезенка 84
57 Пищеварительный тракт 63
72 Кожа 63
82 Кости 28
Зубы 24
* Сравнительно невысокое содержание белка в головном мозгу связано с большим
содержанием в нем липидов.
Белки составляют 45% сухого веса организма животных. Содержание
белков в растительных организмах значительно ниже, что объясняется на-
личием в них большого количества клетчатки, из которой построены обо-
лочки клеток. Протоплазма же клеток растений также богата белками.
Исключительно важная роль белков в живых организмах отмечалась
уже в прошлом столетии. В 1838 г. Мульдер предложил для них название
протеины1. Название же «белки» возникло впервые в связи с обнаружением
в тканях животных и растений веществ, похожих по некоторым своим приз-
накам на яичный белок. Как и яичный белок, они, например, при нагрева-
нии свертываются.
После Мульдера многие ученые также подчеркивали биологическое
значение белков, однако решающее значение белка как основы жизни оп-
ределил Ф. Энгельс в своих классических трудах «Диалектика природы»
и «Анти-Дюринг», где он подчеркнул, что с белками связаны такие прояв-
ления жизни, как пищеварение, раздражимость, сократимость, способность
1 В первой половине прошлого столетия существовало представление, что в
основе химического строения всех белков лежит какое-то вещество, повторяющееся
много раз в белковой молекуле. Это вещество и было названо Мульдером «протеин».
Представление это оказалось ошибочным, но термин «протеин» удержался в науке,
и им подчеркивается важное биологическое значение белков.
В настоящее время оба названия (белки и протеины) удерживаются в нау-
ке, хотя ни одно из них не выражает роли белковых веществ в проявлении жизни.
17
к росту и размножению, движение. Современное развитие биохимии бле-
стяще подтвердило представление Ф.Энгельса о биологической роли белков.
При изучении различных клеток и органов мы неминуемо приходим к бел-
кам различного состава и строения, биохимическая активность которых ле-
жит в основе их биологических (физиологических)функций. Так, например,
при изучении процессов пищеварения мы сталкиваемся с белками — фер-
ментами, ускоряющими расщепление молекул сложных органических
веществ, входящих в состав пищи; при изучении сокращения мышц мы встре-
чаемся с актомиозином, белковым комплексом, обладающим сократитель-
ными свойствами. Способность к росту и размножению связана со свойст-
вами сложных белков — нуклеопротеидов и т. д.
Биологическая роль белков настолько велика, что биохимия прежде
всего является биологической химией белковых веществ. С химической
точки зрения, белки относятся к особенно реактивным веществам. Они лег-
ко реагируют друг с другом, с липидами — органическими веществами,
нерастворимыми в воде и растворимыми в органических растворителях,
с полисахаридами и с другими органическими веществами, образуя много-
численные комплексы, входящие в состав протоплазмы. Подобная химиче-
ская реактивность белковых веществ определяет многие их биологические
свойства.
Белки — высокомолекулярные азотсодержащие вещества, находящие-
ся в клетках преимущественно в коллоидном состоянии. Это физико-хими-
ческое состояние белковых веществ, характеризующееся неустойчивостью,
зависимостью от изменений условий среды, также связано с проявлением
ряда их биологических особенностей.
По своему элементарному составу белки характеризуются наличием
в них наряду с углеродом, кислородом и водородом еще азота, серы и часто
фосфора.
Процентное содержание отдельных элементов в белковых
веществах
С —50,6—54,5 %; 0—21.5—23,5%; Н —6,5—7.3%;
N—15,0—17,6 %; S —0,3—2.5 %.
Эти цифры показывают, что содержание углерода, кислорода, водорода
и азота в различных белках колеблется в сравнительно небольших преде-
лах. Обычно среднее содержание азота в белке принимают равным 16%.
Что касается серы, то содержание ее в одних белках сравнительно невелико,
в других же достигает больших размеров (от 0,3 до 2,5%).
Элементарный состав белков не дает представления об их химической
структуре. Структура белковых веществ изучается сложными приемами и
методами, в частности методом гидролиза.
ПРОДУКТЫ ГИДРОЛИТИЧЕСКОГО РАСЩЕПЛЕНИЯ
БЕЛКОВ
С давних пор химическая структура белков изучается путем гидро-
лиза. Выделенные из органов и тканей белки гидролизуются в 5—10 объе-
мах кислоты (6—12 н. H2SO4 или НО в течение 6—20 ч при 100—110°С).
При этих условиях белки распадаются с образованием различных а-амино-
кислот. При кислотном гидролизе, однако, разрушается триптофан и час-
тично серин и треонин. Для предохранения этих аминокислот от разруше-
ния прибегают к гидролизу белков в 2 н. щелочи при 100—110° С. Щелоч-
ной гидролиз приводит к разрушению ряда аминокислот (аргинина, цистина,
цистеина, серина и треонина), а также к рацемизации (потере оптиче-
ской активности) аминокислот. Гидролиз белков с образованием аминокис-
лот производят также с помощью протеолитических ферментов. Аминокис-
лоты выделяют из гидролизатов в кристаллическом виде или в виде солей.
18
Из гидролизатов различных белков получено свыше 20 различных а-ами-
нокислот. Имеются веские основания считать, что простые белки построены
исключительно из а-аминокислот. Следовательно, а-аминокислоты являются
компонентами белковых молекул.
Аминокислотный состав (приблизит.) белков (грамм аминокислот в 100 г белка)*
Белок
Аминокислота яичный белок казеин фибри- ноген миозин — глиадин пшеницы зеин ку- курузы
Аланин Аргинин Аспарагиновая кислота Цистин Глутаминовая кислота Глицин Г истидин Оксипролин Изолейцин .... Лейцин Лизин Метионин Фенилаланин Пролин . . . Серин .... Треонин . . Тирозин .... Триптофан Валин ... 6,7 5,7 9,3 1,9 16 5 3,1 2,4 7,0 9,2 6,3 5,2 7,7 3,6 8.2 4,0 3,7 3,7 7.1 3,5 4,0 7,2 0,3 22,0 1,9 3,2 2,3 7,6 10,3 8,2 3,1 5,5 11,6 5,9 4,5 6,1 6,1 7,2 3,7 7,8 13,1 2,7 14,5 5,6 2,6 4.8 I 7,1 / 9.2 2,6 4,6 5,7 7,0 6,1 5,5 5,5 4.1 6,5 7.4 8,9 1,4 22,1 -1,9 2,4 15,6 11,9 3,4 4,3 1,9 4,3 5.1 3,4 3,4 2,6 2,1 2,7 1,3 2,6 45,7 1,8 11,9 0,7 1,7 6,4 13,4 4,9 2,1 3,2 3,2 2.7 10,5 1,7 4,6 0,8 26,9 0,0 1,3 22,5 0,0 2,4 5,4 10,5 7,1 3,5 3,5 5,3 3,5
Общее содержание . 108 115,6 103,2 104,5 108,4 109,5
* Образование из 100 г сухого белка свыше 100 г аминокислот объясняется тем, что гидролиз
сопровождается присоединением воды.
Ъ-АМИНОКИСЛО ТЫ
Изучение химической природы аминокислот приближает нас к понима-
нию химической структуры белков.
Все выделенные из белковых гидролизатов аминокислоты могут быть
разделены на две группы: ациклические (жирного ряда) и циклические (аро-
матического ряда). По наличию в молекулах аминокислот аминогрупп и
карбоксильных групп они разделяются на: 1) моноаминомонокарбоновые
кислоты — в молекуле каждой из них имеется одна амино- и одна карбок-
сильная группа; 2) моноаминодикарбоновые кислоты — наличие одной ами-
ногруппы и двух карбоксильных групп и 3) диаминомонокарбоновые кис-
лоты — наличие двух аминогрупп и одной карбоксильной группы.
ОБЩИЕ СВОЙСТВА а-АМИНОКИСЛОТ
За исключением аминокислоты глицина, все остальные а-аминокисло-
ты — оптически активные вещества, так как в их молекулах имеется асим-
метрический атом углерода. Аминокислоты, входящие в состав всех бел-
ков, а также встречающиеся в живых организмах в свободном виде (природ-
ные аминокислоты), относятся к L-ряду. Одни из этих аминокислот
являются правовращающими, другие — левовращающими. В оптические
антиподы природных аминокислот L-ряда входят аминокислоты О-ряда.
19
Эти аминокислоты получаются путем синтеза, в природе же они встреча-
ются редко. Они не входят в белки и очень редко встречаются в свободном
состоянии в организмах. Для правильной ориентировки в оптических свой-
ствах естественных аминокислот обычно к букве L добавляют знак «+»
для обозначения правого вращения и знак «—» для левого вращения.
Аминокислоты относятся к амфотерным электролитам и обладают
свойствами кислот и оснований, что обусловлено их химической структу-
рой. Общая структура для всех моноаминомонокарбоновых кислот может
быть представлена формулой
Я—СН-СООН или /?—СН-СОО-
I I
nh2 nh;
В водном растворе карбоксильная группа отщепляет ионы водорода, и ами-
нокислота начинает функционировать как кислота. В том же растворе груп-
па NH2 является источником гидроксильных ионов, что определяет щелоч-
ные свойства аминокислоты.
Аминокислоты могут реагировать как с основаниями, так и с кислотами
с образованием различных солей:
Я—CH. СООН Я—CH. COO. Na
| 4- NaOH > |
NH2 NHe.
Я—СН «СООН
I +НС1
NH
Я—CH. СООН
I
NH3C1
Водные растворы моноаминомонокарбоновых кислот имеют нейтральную
реакцию, так как в каждой молекуле моноаминомонокарбоновой кислоты
на одну кислотную группу (—СООН) приходится одна основная группа
(—NH2). Водные растворы моноаминодикарбоновых кислот обладают кис-
лой реакцией, так как у них на одну основную группу приходятся две кис-
лотные группы. Щелочной реакцией обладают водные растворы диамино-
монокарбоновых кислот.
Реакции на аминокислоты
Существуют химические реакции, общие для всех аминокислот. Эти
реакции обычно используются как для качественного, так и для количест-
венного их определения. Сюда относятся реакции: с азотистой кислотой,
с формальдегидом, с нингидрином.
С азотистой кислотой реагируют аминогруппы (реакция Ван-Сляйка)-
Я-СН-СООН Ч- hno2 /?.сн.соон 4- n2 4- Н2О
I I
NHo ОН
По количеству выделившегося азота судят о количестве аминогрупп аминокислот. -
С формальдегидом также реагируют аминогруппы аминокислот (реакция Сёрен-
сена):
Я-СН-СООН
I
NHo
/?.СН.СООНЧ-Н2О
----> I
n=ch2
Путем титрования щелочью определяют количество карбоксильных групп.
20
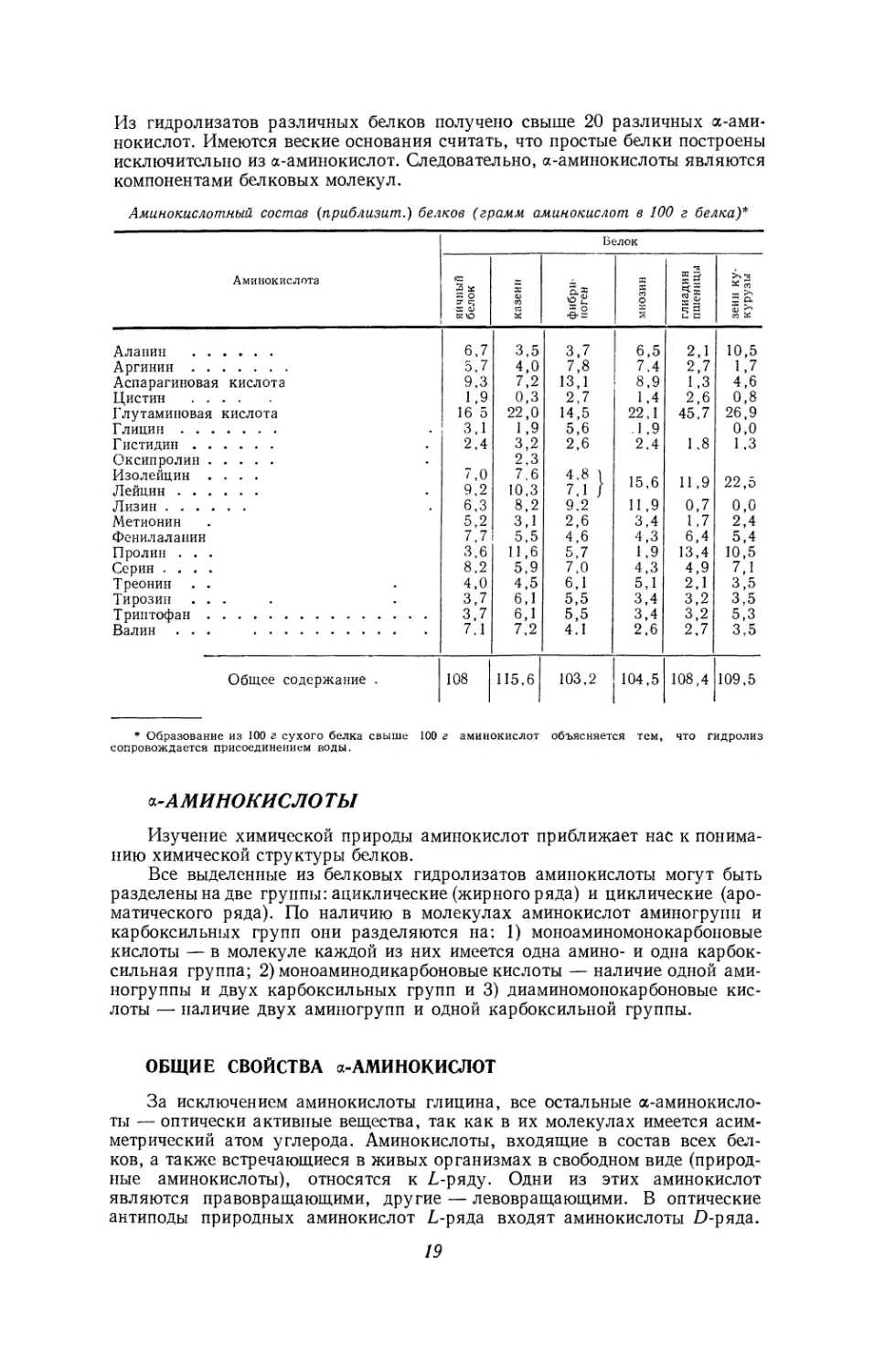
Почти все а-аминокислоты, реагируя с нингидрином при pH ниже 5, образуют
аммиак, углекислый газ и альдегиды, содержащие на один углеродный атом меньше,
чем исходные аминокислоты..
NH
СНОН -Ь
СН
НС
НС
СН
Нингидрин
Аминокислота
+ яс
+ NH3 + со2.
Альдегид
При pH выше 5 реакция протекает с образованием углекислого газа, альдегида
и соединения, окрашенного в синий цвет:
СН С=О СН с=о
СН С==О СН с=о
Нингидрин Аминокислота
О
II
С СН
СН
Реакция с нингидрином применяется для определения аминокислот по интен-
сивности окраски и по выделению углекислого газа.
АЦИКЛИЧЕСКИЕ АМИНОКИСЛОТЫ
Моноаминомонокарбоновые кислоты
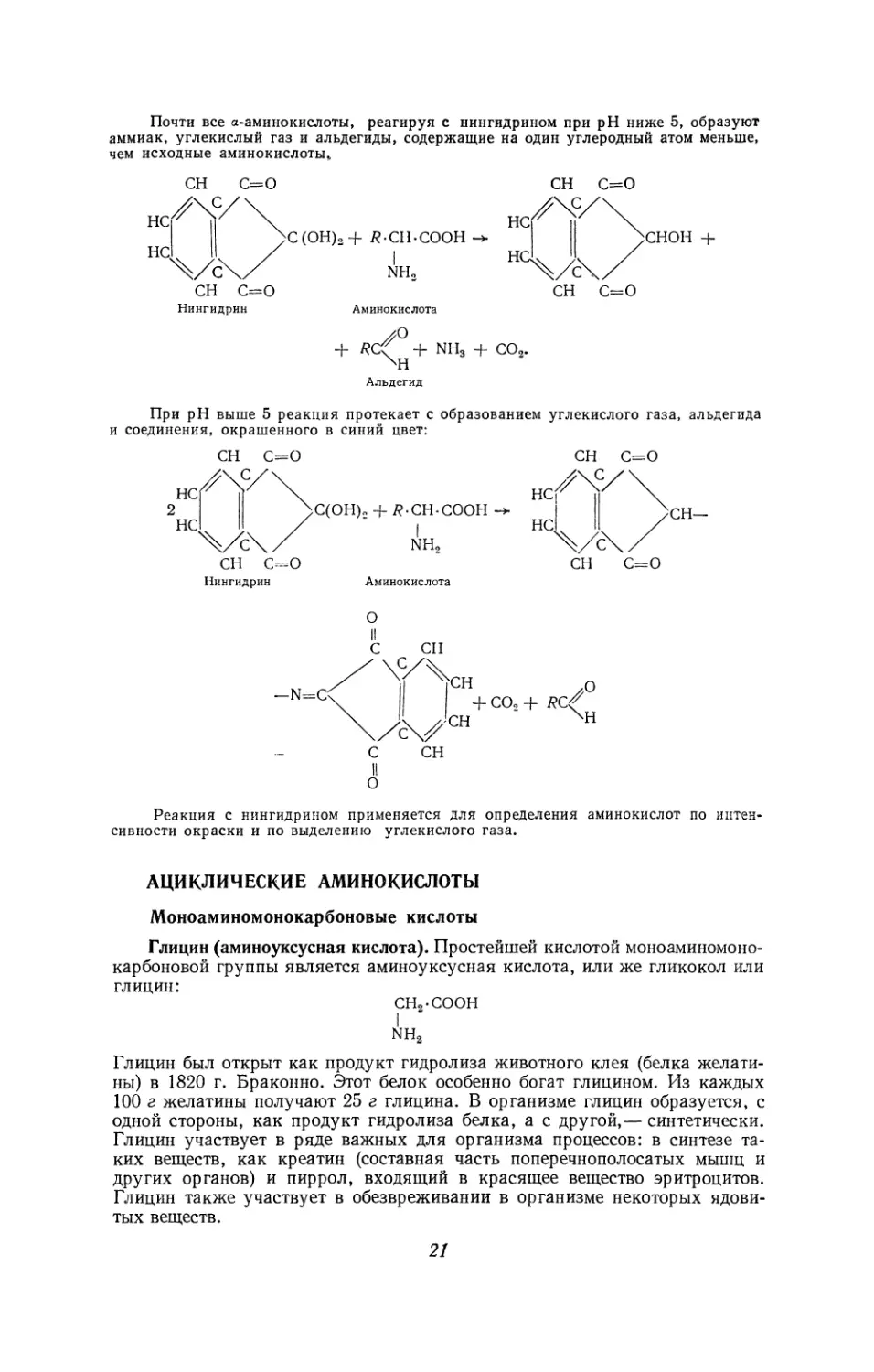
Глицин (аминоуксусная кислота). Простейшей кислотой моноаминомоно-
карбоновой группы является аминоуксусная кислота, или же гликокол или
глицин:
сн2-соон
I
nh2
Глицин был открыт как продукт гидролиза животного клея (белка желати-
ны) в 1820 г. Браконно. Этот белок особенно богат глицином. Из каждых
100 г желатины получают 25 г глицина. В организме глицин образуется, с
одной стороны, как продукт гидролиза белка, а с другой,— синтетически.
Глицин участвует в ряде важных для организма процессов: в синтезе та-
ких веществ, как креатин (составная часть поперечнополосатых мышц и
других органов) и пиррол, входящий в красящее вещество эритроцитов.
Глицин также участвует в обезвреживании в организме некоторых ядови-
тых веществ.
21
Глицин имеет сладкий вкус. Температура плавления 240°С (с разложением).
В 100 г воды при 25°С растворяется 25,0 г глицина.
L-Аланин — а-аминопропионовая кислота:
СН3
I
chnh2
I
СООН
Аланин
Впервые выделен из щелочного гидролизата шелка в 1888 г. Задолго до
этого (в 1850 г.) аланин был получен путем синтеза. Аланин широко рас-
пространен и входит в состав всех белков. Некоторые из них особенно бо-
гаты аланином. Из гидролизата 100 г шелка можно получить 30 г аланина.
Многие аминокислоты могут рассматриваться как производные аланина.
Температура плавления аланина 297°С (с разложением). Удельное вращение его
в ледяной уксусной кислоте [a] -J-33,0°. В 100 г воды при 25°С растворяется 16,6 г
аланина.
В организме животных аланин образуется при гидролитическом рас-
паде белков, а также синтезируется заново из других соединений.
L-Серин — а-амино-р-оксипропионовая кислота — может рассматри-
ваться как производное аланина:
₽ СНоОН
a CI INI 12
СООН
а CHNH.3
р СН2О. Р
СООН
Серин
Фосфосерин
Впервые серин был выделен в 1856 г. из гидролизата фиброина шелка.
В фосфорсодержащих белках (казеин молока, вителлин яичного желтка
и др.) к спиртовой группе серина присоединена фосфорная кислота. Серин
освобождается в организме при гидролитическом распаде белка и синте-
зируется из более простых веществ.
Удельное вращение серина в 5 н. НС) [а]+ 15,1°. В 100 г воды при 25°С раство-
ряется 5 г серина.
L-Треонин1— а-амино-^-оксимасляная кислота — гомолог серина. Вы-
делен впервые в 1935 г. из гидролизата фибрина:
СН3
₽ IICOH
aCHNH2
СООН
Треонин
Очень часто, но сравнительно в небольших количествах, треонин встреча-
ется в других белках, освобождается при гидролитическом распаде белков.
Организм животных не способен его синтезировать из других веществ.
1 В молекуле треонина имеются два асимметрических атома углерода — один
в положении а, второй в положении Отсюда возможны четыре изомера. Конфигура-
ция ^-углеродного атома изомера треонина, встречающегося в белках, такая же, как
у D-молочной кислоты, т. е. D-ряда, и это отражено в приведенной формуле. Вто-
рой изомер L-аллотреонин в белках не встречается.
22
Удельное вращение треонина в ледяной уксусной кислоте [а] —30,0°. В 100 г
воды при 25°С растворяется 20,5 г треонина.
L-Валин—а-аминоизовалериановая кислота—выделен в 1879 г.
из гидролизата белков; может рассматриваться как продукт метилирования
аланина:
сн3 сн3
Vcbf
aCHNH2
СООН
Валин
Валин содержится в белках в небольших количествах. Валин не син-
тезируется в животном организме, а освобождается лишь при гидролити-
ческом распаде белков.
Температура плавления валина 298°С (с разложением). Удельное вращение его
в ледяной уксусной кислоте [а]4-62,0°. В 100 г воды при 25°С растворяется 8,8 г ва-
лина.
L-Лейцин — а-аминоизокапроновая кислота — получен в 1839 г. из
щелочного гидролизата мышц и шерсти. Структурная формула его установ-
лена только в 1891 г. Обнаружен в составе всех белков и в значительных
количествах. Лейцин в организме животных не синтезируется:
СН3 СН3
?сн
I
₽СНо
I
aClINH,
I
СООН
Лейцин
СН„ СН,—СН*
рсн
I
a CHNH2
I
СООН
Изолейцин
СН3
I
СН.2
I
сн3
сн2
a CHNH,
I
СООН
Норлейцин
Температура плавления лейцина 295°С. Удельное вращение его в ледяной ук-
сусной кислоте [а] +22,5°. В 100 г воды при 25°С растворяется 2,2 г лейцина.
L-Изолейцин — а-амино-^-этил- p-метилпропионовая кислота — содер-
жится в белках в незначительном количестве. В организме животных изо-
лейцин не синтезируется.
Температура плавления изолейцина 280°С (с разложением). Удельное вращение
его в ледяной уксусной кислоте [а] +49,0°. В 100 г воды при 25°С растворяется 4,1 г
изолейцина.
L-Норлейцин — а-амино-я-капроновая кислота — обнаружен при гид-
ролизе белков животного происхождения.
Лейцин, изолейцин и норлейцип освобождаются в организме животных
при распаде белков, но не синтезируются в тканях организма заново.
Серусодержащие аминокислоты
Среди моноаминомонокарбоновых кислот встречаются серусодержащие
аминокислоты: цистеин, цистин, метионин. Имеющаяся в составе белков
сера принадлежит этим аминокислотам.
1 В молекуле изолейцина имеются два асимметрических атома углерода — один
в положении а, второй в положении 3. Отсюда возможны четыре изомера. Второй
изомер L-аллоизолейцин в белках не встречается.
23
L-Цистеин—а-амино-р-меркаптопропионовая кислота—по своей струк-
туре близок к серину:
₽ CH2SH CH2-S- S-CH2
a CHNH2 chnh2 chnh2
СООН 1 СООН СООН
Цистеин Цистин
Цистеин с трудом получают из гидролизатов белков. Легче получается
близкая к ней аминокислота цистин, состоящая из двух, соединенных друг
с другом, остатков молекул цистеина.
Цистеин очень легко растворим в воде. Удельное вращение его в ледяной уксус-
ной кислоте [а]4-13°.
Цистин — р, ^-дитиоди-а-аминопропионовая кислота — единственная
диаминодикарбоновая кислота, встречающаяся в составе белков. В моле-
куле цистина сера представлена в виде дисульфидной группы (—S—S—),
в цистеине же—в виде сульфгидрильной группы (—SH). Окисление сульф-
гидрильной группы в двух молекулах цистеина (отщепление 2Н) приводит
к образованию молекулы цистина. С другой стороны, восстановление моле-
кулы цистина (присоединение 2Н) приводит к образованию двух молекул
цистеина.
Цистин выделен впервые в 1810 г. из нерастворимого в моче осадка —
мочевого песка (отмытый мочевой песок состоит из цистина), и только
лишь в 1899 г. он был получен из продуктов гидролиза белка — кератина
волос, отличающегося высоким содержанием цистина.
Удельное вращение цистина в 5 н. НС1 [а] —23,2°. В 100 г воды при 25°С раст-
воряется 0,01 г цистина.
Цистеин и цистин освобождаются при распаде белков в организме жи-
вотных. Они могут образовываться так же, как продукты превращения
аминокислоты — метионина.
£-Метионин — а-амипо-у-метилтиомасляная кислота — был открыт
как продукт гидролиза казеина в 1922 г.:
CH., . S . СН3 CHoSH
I I
сн2 сн2
I I
CHNH2 CHNHo
I I
СООН СООН
Метионин Гомоцистеин
Метионин широко распространен в белках, но встречается в них в не-
больших количествах. Он обладает очень важной биологической особен-
ностью: лабильная, подвижная метильная группа метионина широко ис-
пользуется в организме для метилирования различных соединений. Мети-
онин является источником метильных групп в организмах. В результате
потери метильной группы метионин превращается в гомоцистеин. Послед-
ний в составе белков не встречается. Метионин освобождается в животном
организме при распаде белков, но не синтезируется.
Удельное вращение метионина в ледяной уксусной кислоте [а]4-20,0°. В 100 г
воды при 25°С растворяется 3,4 а метионина.
Моноаминодикарбоновые кислоты
К моноаминодикарбоновым кислотам относятся аспарагиновая кислота,
глутаминовая кислота и ^-оксиглутаминовая кислота.
Аспарагиновая кислота — аминоянтарная кислота — впервые была
выделена в 1868 г. из гидролизата белка растительного происхождения.
24
Задолго до этого был известен амид аспарагиновой кислоты (аспарагин),
изолированный из сока спаржи:
т СООН г CONH,
I I
₽ сна р сн2
I I
aCHNH2 aCHNH2
I I
СООН СООН
Аспарагиновая Аспарагин
кислота
Аспарагиновая кислота в значительных количествах входит в состав
белков растительного, а также животного происхождения. В животном
организме аспарагиновая кислота является продуктом распада белка, а так-
же синтезируется из других веществ. Продуктом амидирования аспараги-
новой кислоты является встречающийся в растениях в значительных коли-
чествах в свободном состоянии аспарагин. Он входит также в состав бел-
ков, особенно растительных. В тканях животных аспарагин обнаружен в
очень малых количествах.
Температура плавления аспарагиновой кислоты 270°С. Удельное вращение ее
в 5 н. НС1 [а] +25,4°. В 100 а воды при 25°С растворяется 0,5 г аспарагиновой кислоты.
Удельное вращение аспарагина в 3,4 н. НС1 [а] 4^34,3°. В 100 г воды при 25°С
растворяется 2,5 г аспарагина.
L-Глутаминовая кислота — а-аминоглутаровая кислота — гомолог ас-
парагиновой кислоты. Впервые открыта в гидролизате растительных бел-
ков в 1866 г., содержится в больших количествах в белках растений, а так-
же и в белках животного происхождения. Несколько позже (в 1875 г.) был
выделен из сока растений s-амид глутаминовой кислоты—глутамин:
СООН eCONH2 СООН
тСН. 7СН0 ?сн2
₽сн2 ?сн2 рснон
aCHNH2 aCHNHo aCHNHo & А
СООН Глутаминовая кислота । । СООН СООН 3*Окс иглу та ми нова я кислота
Глутаминовая кислота образуется в организме как продукт гидролиза
белков, а также синтезируется из других веществ.
Глутамин получается в результате амидирования глутаминовой кисло-
ты и, подобно аспарагину, встречается в растениях и тканях животных в
свободном состоянии. Он входит также в состав белков, особенно раститель-
ного происхождения. Глутамин в свободном состоянии встречается во всех
тканях животных.
Температура плавления глутаминовой кислоты 206°С (с разложением). Удельное
вращение в 5 н. НС1 [а]4-31,8°. В 100 г воды при 25°С растворяется 0,9 г глутамино-
вой кислоты.
Удельное вращение глутамина в воде [а] 4^6,1°. В 100 г воды при 25°С растворя-
ется 4,2 г глутамина.
Аспарагиновая и глутаминовая кислоты играют важную роль в процес-
сах обмена веществ.
Диаминомонокарбоновые кислоты
К диаминомонокарбоновым кислотам относятся лизин, оксилизин, ар-
гинин и орнитин. Первые три аминокислоты входят в состав белков; орни-
тин — продукт превращения аргинина и в состав белков не входит.
25
L-Лизин — а,з-диаминокапроновая кислота — впервые выделен в
1889 г. из гидролизата казеина. Лизин входит в состав многих белков. Осо-
бенно много содержится его в белках молок рыб, но вместе с этим известны
белки, которые практически не включают лизина, например:
е СН • NH2
I
ьсн2
I
сн2
I
сн2
a CHNHo
СООН
Лизин
е СН2 • nh2
I
ь снон
I
сн2
I
сн2
I
a CHNH2
I
СООН
Оксилизин
Лизин в организме животных освобождается лишь при распаде белков,
но не синтезируется. Организм животных очень чувствителен к недостатку
лизина в составе белков пищи.
Температура плавления кристаллического пикрината лизина 252°С (с разложе-
нием). Удельное вращение его в 5 н. НС1 [а]+25,9°. Лизин очень легко растворим в
воде.
Оксилизин — а,г-диамипо-о-оксикапроновая кислота — обнаружен в
1938 г. в гидролизате коллагена и желатины. Содержание его в белках очень
незначительно.
£-Аргинин —а-амино-З-гуанидил-я-валериановая кислота — впервые
выделен в 1886 г. из проростков люпина. Установлено (1896 г.), что гидро-
лизаты так называемых щелочных белков (протамины и гистоны) содержат
значительные количества аргинина. Встречается аргинин также и в других
белках. Аргинином богаты белки ядер клеток, а также белки растущих
тканей (эмбриональная ткань, опухоли):
NH2
C=NH
NH NH
ЬСН2
CH2
СН2
a CHNIL,
СООН
Аргинин
сн2
СНо
сн2
chnh2
СООН
Аргининфосфорная кислота
В мышцах беспозвоночных животных содержится в свободном состоя-
нии продукт фосфорилирования аргинина — аргининфосфорная кислота.
Температура плавления аргинина 207°С. Удельное вращение его в ледяной уксус-
ной кислоте [а]+29,4°. В 100 г воды при 25°С растворяется 15 г аргинина.
I
В молекуле аргинина имеется амидиновая группа (H2N—C=NH), легко
отщепляющаяся при гидролизе в избытке Ва(ОН)2 при 100°С, а также под
воздействием фермента аргиназы, с образованием мочевины и орнитина (а,
3-диаминовалерьяновая кислота). При обработке аргинина эквимолеку-
лярным количеством водного раствора Ва(ОН)2 от амидиновой группы ар-
26
гинина отщепляется аммиак с образованием цитруллина (а-амино-о-уреид-
валерьяновая кислота).
Орнитин и цитруллин являются диаминомонокарбоновыми кислотами:
nh2
NH, 1
с=о
С—NH 1
। nh2
Nil Ч -Н2О-> +
1 nh2
сн2 1
1 ьсн.
сн2
1 сн2
сн2
1 сн2
CHNIIjs
1 i a CHNH
СООН 1 СООН
Аргинин Орнитин
NH2 nh2
I I
C—NH C=O
NH + H?O NH 4- NH3
I I
CH, dcn2
I ~ I
CH2 CHo
I I
CH2 CH2
I I
CHNIL ;
| aCIINH2
COOH I
COOH
Аргинин Цитруллин
Аргинин играет важную роль в процессе образования мочевины (стр.
431). Орнитин в организме птиц обезвреживает бензойную кислоту, соеди-
няясь с ней и переводя ее таким образом в орнитуровую кислоту.
ЦИКЛИЧЕСКИЕ а-АМИНОКИСЛ ОТЫ
К циклическим аминокислотам относятся фенилаланин, тирозин (го-
моциклические), триптофан, гистидин, пролин и оксипролин (гетероцикли-
ческие).
L-Фенилаланин — а-амино-р-фенилпропионовая кислота — впервые
выделен в 1879 г. из проростков люпина; установлено его наличие, правда
в небольших количествах, в гидролизатах различных белков. Фенилаланин
в организме животных не синтезируется, образуется только лишь в резуль-
тате распада белков.
К фенилаланину близка аминокислота — тирозин.
Температура плавления фенилаланина 283°С (с разложением). Удельное вращение
его в ледяной уксусной кислоте [а] — 7,5°. В 100 г воды при 25°С растворяется 3,0 г
фенилаланина.
£-Тирозин — а-амино-р-оксифенилпропионовая кислота — открыт в
1846 г. в щелочном гидролизате казеина:
СН
/\
НС СН
НС СН
\>СН2 • СН • СООН
I
NH,
Фенилаланин
сон
НС СН
НС СН
^С^СН2 • СН . СООН
I
nh2
Тирозин
Тирозин встречается в составе многих белков. В организме животных
он освобождается при распаде белков, может также образоваться из фе-
нилаланина как продукт его окисления.
Температура плавления тирозина 314—318°С (с разложением). Удельное враще-
ние его в 5 н. НС1 [а] — 10°. В 100 г воды при 25°С растворяется 0,05 г тирозина.
В ткани щитовидной железы содержится продукт йодирования тиро-
зина (дийодтирозин). Гормон щитовидной железы (тироксин) синтезиру-
27
ется из двух молекул дийодтирозина. Гормон мозгового вещества надпо-
чечников (адреналин) является производным тирозина.
£-Триптофан — а-амино-р-индолилпропионовая кислота. Впервые об-
наружен в 1901 г. в гидролизате казеина, полученном при действии на по-
следний соком поджелудочной железы. Выше (стр. 18) указывалось, что
триптофан разрушается при кислотном гидролизе белков:
СН
НС^^С С—СНо
НС С СН
НС NH
СН—СООН
I
nh2
Триптофан в организме животных не синтезируется заново, а освобож-
дается в результате распада белков.
Температура плавления триптофана 289°С. Удельное вращение его в ледяной
уксусной кислоте [а] —34,0% В 100 г воды при 25°С растворяется 1,1а триптофана.
£-Гистидин — а-амино-^-имидазолилпропионовая кислота — открыт
в 1896 г. среди продуктов, образующихся при гидролизе белков — прота-
минов и казеина. В дальнейшем оказалось, что гистидин часто встречается
в составе различных белков.
N---СН N---------СН
Имидазол
NH
ИС ССИ, • СН • СООН
NH2
Гистидин
В 1911 г. гистидин был получен путем синтеза. В организме живот-
ных гистидин образуется как продукт распада белков.
Температура плавления гистидина 251—252°С. Удельное вращение его в ледя-
ной уксусной кислоте [а] 4^7,5°. В 100 г воды при 25°С растворяется 4,19 г гистидина.
Аминокислоты — гистидин, лизин и аргинин — имеют в составе своих
молекул по шести атомов углерода и содержат на одну карбоксильную груп-
пу основные группы — NH2 n=NH. Благодаря этому они обладают ще-
лочными свойствами.
Гистидин, лизин и аргинин были впервые выделены из продуктов гид-
ролиза белка в виде фракции, получившей название лизатин. После разде-
ления л изатина на составные части гистидин, лизин и аргинин получили
название гексоновых (шесть атомов С) оснований.
£-Пролин — пирролидин-2-карбоновая кислота и оксипролин — 4-ок-
сипирролидин-2-карбоновая кислота по своей химической структуре отно-
сятся к иминокислотам:
СН2—СН2 НОСН—СН2
NH
Пролин
СН .СООН
Оксипролин
Пролин впервые выделен в 1901 г. из гидролизата казеина. Он широко
представлен в белках, особенно много его в белках злаков и в желатине.
Оксипролин изолирован из гидролизата казеина в 1904 г. Большие ко-
личества его имеются в желатине, в других белках его сравнительно мало.
28
Иминокислоты пролин и оксипролин могут в организме переходить в
а-аминокислоты. В этом случае происходит разрыв пирролидинового кольца.
Удельное вращение пролина в ледяной уксусной кислоте [я] —80,0°. Пролин
очень хорошо растворим в воде.
Удельное вращение оксипролина в ледяной уксусной кислоте [я] —77,0°.
В 100 г воды при 25°С растворяется 36,1 г оксипролина.
Итак, мы привели краткие данные об а-аминокислотах, образующихся
при гидролизе белков.
Что же дает применение метода гидролиза белков для понимания их
химической структуры? На поставленный вопрос можно дать следующий
ответ: в результате применения этого метода установлено, что простые бел-
ки (протеины) построены исключительно из а-аминокислот и что различные
белки отличаются друг от друга по своему аминокислотному составу (по
набору аминокислот и по их количественному содержанию).
Применение метода гидролиза не позволяет выяснить, каким образом
и в какой последовательности отдельные аминокислоты соединены друг с
другом. Таким образом, применение метода гидролиза не позволяет выяс-
нить все особенности химической структуры белковых веществ. Для этого
необходимы иные пути, иные подходы.
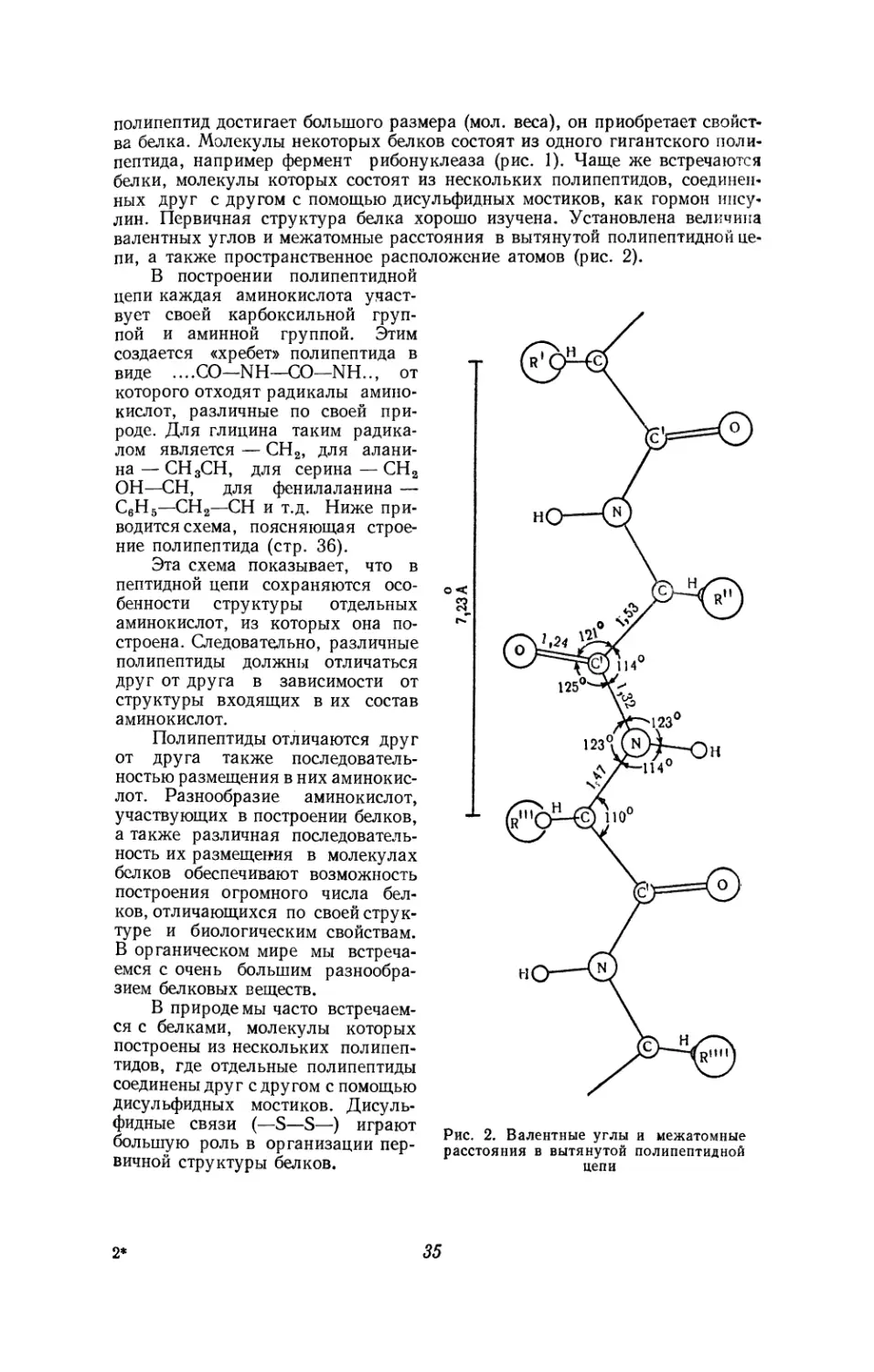
ФОРМЫ СВЯЗИ АМИНОКИСЛОТ В БЕЛКОВОЙ МОЛЕКУЛЕ
Пептидные связи
Еще в прошлом столетии возник вопрос о том, каким образом соедине-
ны друг с другом аминокислоты в белковой молекуле? Первые положитель-
ные результаты в изучении этого вопроса были получены А. Я. Данилев-
ским в 1888 г.
Для изучения структуры белка А. Я. Данилевский применил биурето-
вую реакцию. При добавлении к щелочному раствору биурета (NH2—СО—
—NH—СО—NH2) несколько капель разбавленного раствора CuSO4 появ-
ляется фиолетовое или красно-фиолетовое окрашивание. Такое же окра-
шивание, кроме биурета, дают оксамид (H2N—СО—СО—NH2) и малонамид
(NH2—СО—СН2—СО—NH2). Аминокислоты и другие соединения, в моле-
кулах которых отсутствует группировка —СО—NH—, дают отрицательную
биуретовую реакцию. Между тем при добавлении к щелочному раствору
любого белка разведенного раствора CuSO4 получают также фиолетовое
окрашивание. Если раствор белка подвергнуть гидролизу, а затем к под-
щелоченному гидролизату прибавить раствор CuSO4, окрашивания не насту-
пает. Отсюда ясно, что положительная биуретовая реакция белков обуслов-
ливается особенностями связей аминокислот друг с другом. На основании
изучения биуретовой реакции А. Я. Данилевский высказал предполо-
жение, что в молекуле белка характерным типом связи аминокислот меж-
ду собою является связь—СО—NH—, т. е. та группировка, которая дает
положительную биуретовую реакцию. Группировка —СО—NH— может
возникнуть в результате присоединения к карбоксильной группе одной
аминокислоты аминной группы другой аминокислоты:
R Ъ R
I I I
СН—СООН+НООС—СН—NH2----> СН—СООН 7?! + Н2О
I I I
NH3 NH— СО—СН —NH2
Аминокислота Аминокислота Дипептид
Предположение А. Я. Данилевского о типе связи между собою отдель-
ных аминокислот в молекуле белка получило блестящее подтверждение в
исследованиях Э. Фишера, который разработал метод связывания аминокис-
лот друг с другом. Получающиеся при этом продукты были названы поли-
29
пептидами. Сложность структуры полипептидов определяется количеством
вошедших в их состав аминокислот. В зависимости от количества амино-
кислот, из которых они состоят, эти соединения получили названия: дипеп-
тиды, трипептиды, тетрапептиды и т. д. При наличии в их молекулах боль-
шого количества остатков аминокислот они называются полипептидами.
Существуют различные приемы синтеза полипептидов. Приведем один из них.
Для синтеза берется какая-либо аминокислота (например, аланин) и хлорангид-
рид какой-либо хлорзамещенной жирной кислоты, например уксусной. При взаимо-
действии в щелочном растворе этих двух веществ образуется соединение, близкое к
дипептиду:
CHoCl
I
COCI
Хлорангидрид
уксусной
кислоты
сн3
I
chnh2
I
СООН
Аланин
СН2С1 сн3
I I
> СО—NH—СН + НС1
I
сосн
Хлорацетилаланин
При обработке хлорацетилаланина аммиаком получают дипептид глицил-ала-
нин:
СН2С1 сн3 ch2nh, сн9
I 1'1'
СО—NH—СН + 2NHS СО—NH—СН + NH«C1
I I
СООН СООН
Глицил-аланин
Для получения трипептида к дипептиду таким же путем присоединяют новую
молекулу хлорангидрида хлорзамещенной кислоты с последующей обработкой полу-
ченного продукта аммиаком. Трипептид можно превратить в тетрапептид и т. д.
Существует определенная номенклатура для полипептидов. В основу
ее положены названия аминокислот, входящих в состав полипептидов, при-
чем аминокислоты, за исключением последней, меняют последнюю букву сво-
его названия «н» на «л» (например, глицил-аланин, аланил-аланил-глицин
и т. д.).
Связь между собою аминокислот в полипептидах (и в белках) носит
название пептидной связи.
Э. Фишер осуществил синтез многочисленных полипептидов. Наиболее
сложный синтезированный им полипептид состоял из 18 остатков аминокис-
лот: 15-ти глицина и 3-х лейцина. Даже этот наиболее сложный синтезиро-
ванный Э. Фишером полипептид по своим свойствам отличался от белков.
Его молекулярный вес —1354 — во много раз ниже, чем у белков; в проти-
воположность белкам он не выпадал в осадок при кипячении, а также под
влиянием некоторых белковых осадителей; не обладал он и биологиче-
скими свойствами белков. Между тем синтетические полипептиды, подобно
белкам, давали положительную биуретовую реакцию и, что особенно важ-
но, расщеплялись с образованием аминокислот при воздействии на них фер-
ментов кишечного сока. Как известно, действием ферментов кишечного сока
заканчивается в пищеварительном тракте расщепление белков с образова-
нием аминокислот.
Ферменты обладают специфичностью действия и каждый из них ката-
лизирует течение определенной реакции. Следовательно, расщепление син-
тетических полипептидов с образованием аминокислот под влиянием фер-
ментов является прямым доказательством наличия в них, как в белках, пеп-
тидных связей.
Легко понять, что при использовании известного количества различных
аминокислот для синтеза полипептида можно получить, в зависимости от
последовательности присоединения друг к другу, ряд изомеров. Так, на-
30
пример, при использовании трех различных аминокислот (обозначим их
буквами А, Б, В) можно получить следующие трипептиды: 1) А—Б—В;
2) А—В—Б; 3) Б—А—В; 4) Б—В—А; 5) В—А—Б и 6) В—Б—А. Из че-
тырех аминокислот можно построить 24 изомера, из пяти — 120 изомеров,
из шести — 720 изомеров и т.д. Достаточно сказать, что из 20 аминокислот
мыслимо построение изомеров в количестве 2 432 902 008 176 640 000 (де-
вятнадцатизначное число!).
При постепенном гидролизе белков из них образуются продукты, ко-
торые по своей химической природе более просты, чем белки, но более слож-
ны, чем аминокислоты. Эти продукты получили название пептонов, а также
альбумоз. Более современное их название — полипептиды.
Пептоны могут быть получены при гидролизе белков кислотой. В этом
случае проводят гидролиз белков в разбавленной водой соляной кислоте,
причем белки не доводятся до полного расщепления, т. е. до образования
лишь свободных аминокислот. Легче получить полипептиды при воздейст-
вии на белки ферментов — пепсина и трипсина. Белки под влиянием пеп-
сина и трипсина распадаются, превращаясь в смесь различных по сложно-
сти полипептидов. Изолированные полипептиды по своим свойствам подоб-
ны синтетическим: остатки аминокислот у них соединены друг с другом
пептидными связями.
Приведенные исследования показали, что основной формой соединения
между аминокислотами в белках является прочная (ковалентная) пептидная
связь.
Как уже указывалось, полипептиды, синтезированные Э. Фишером в
начале XX в., обладали невысоким молекулярным весом. В настоящее вре-
мя разработаны методы, позволяющие синтезировать полипептиды с высо-
ким молекулярным весом. Их получают путем конденсирования карбоксиан-
гидридов аминокислот.
Карбоксиангидриды образуются при воздействии фосгена на аминокис-
лоты:
- НС1 - НС1
R—СН—СООН + СОС12 > R—СН • СООН
NFU
NH—COCI NH—ССИ
Карбоксиангидрид аминокислоты
Конденсация молекул карбоксиангидридаминокислоты приводит к об-
разованию высокомолекулярных полипептидов:
п R—СН—ССХ Я
^>О—> NH—СН—СО—NH—СН—СО—NH + п СО2
NH—СО'
В зависимости от исходной аминокислоты образуется тот или иной вы-
сокомолекулярный полипептид, или полиаминокислота, например полигли-
цин, полиглутаминовая кислота и т.д., так называемые «монотонные поли-
пептиды». Молекулярный вес их достигает 300000 и выше.
В настоящее время получены монотонные полипептиды, построенные
из остатков молекул не одной, а двух и даже больше аминокислот, они дают
положительную биуретовую реакцию и обладают рядом физических особен-
ностей, свойственных белкам. Это весьма удобные модели для изучения фи-
зических свойств и особенностей структуры белков.
Монотонные полипептиды, построенные из остатков молекул одной или
из ограниченного числа аминокислот, несмотря на их высокий молекуляр-
ный вес, не обладают биологическими свойствами белков.
31
Дисульфидные связи
В молекулах белка имеются ковалентные дисульфидные связи, или ди-
сульфидные мостики. Эти связи стабильны при гидролизе белков кислота-
ми, но разрушаются при присоединении к ним водорода, т. е. в результате
восстановления. Дисульфидные связи определяются наличием в составе
белков остатков молекул цистина. Дисульфидная связь (—S—S—), при-
соединяя к себе два атома водорода, переходит в сульфгидрильную (2SH—).
С другой стороны, сульфгидрильные группы, теряя водород, образуют ди-
сульфидные связи:
I I “н* I I
SH+SH----> S—S
С помощью сульфгидрильных групп остатков молекул цистеина при отщеп-
лении от них водорода в белковых молекулах появляются дисульфидные
связи остатков молекул цистина, с помощью которых связываются между
собой отдельные полипептиды. Ниже приводится схема связывания между
собой полипептидов дисульфидными связями (мостиками):
• СН • СО • NH • СН • СО • NH • СН • СО • NH • СН • СО • NH • СО. . .
I I I
NHo Я, R3 СН2 • S
I
сн2. S
7?! • СН • СО • NH • СН • СО • NH • СН ♦ СО • NH . СН • СО • NH • СН • СО . ..
Ill I
NH2 R2 R3 R&
Наличие дисульфидных связей в белках доказывается следующим об-
разом. Белки подвергаются окислению надмуравьиной кислотой. При этом
образуются полипептиды, в молекулах которых обнаруживается цистеино-
вая кислота:
I 4- 5НОСООН 4- Н2О
CHNH2 chnh2
NH—
СН2—S—S—CHo /
CO
---> 2CHNHo
1
СН2—S^o
юн
4- 5НСООН
По количеству цистеиновой кислоты, возникающей при гидролизе об-
разовавшихся полипептидов, судят о том, какое количество полипептидных
’цепей входит в состав белковой молекулы.
Водородные связи
Наряду с прочными ковалентными связями (пептидными и дисульфид-
ными) в белковых молекулах имеются многочисленные лабильные водород-
ные связи. Эти связи, идущие от кислорода группы СО к водороду группы
NH, обозначены пунктирами на приведенной ниже схеме. Благодаря им в
полипептидах возникают водородные мостики между атомами кислорода и
азота. Такие же мостики возникают между атомами кислорода одного поли-
32
пептида и атомами азота расположенного рядом другого полипептида. Во-
дородные связи как бы сшивают между собой отдельные участки полипепти-
да, а также отдельные полипептиды между собой:
...... водородная связь.
Водородные связи создают спиральную структуру полипептидов.
Лабильность структуры белков часто объясняется тем, что под влия-
нием тех или иных факторов (нагревания, химических реактивов) разры-
ваются водородные мостики, причем ковалентные связи могут оставаться без
изменения.
Иные формы связи
В белковых молекулах остаются свободными в остатках моноаминоди-
карбоновых кислот (аспарагиновой, глутаминовой) по одной карбоксиль-
ной группе (другая же используется для образования пептидной связи) и
по одной аминной группе диаминомонокарбоновых кислот (лизина, аргини-
на). При физиологической концентрации водородных ионов, благодаря дис-
социации этих групп, между ними возникают электростатические силы стя-
гивания, ионные связи.
Наличие ионных связей объясняет изменения в свойствах белков, на-
ступающие уже при небольших изменениях pH, когда ковалентные связи
остаются незатронутыми.
Между неполярными остатками различных аминокислот действуют си-
лы Ван-дер-Ваальса. В том случае, когда эти остатки аминокислот располо-
жены близко друг к другу, они стягиваются. Подобное стягивание имеет
место между метильной группой аланина и той же группой разветвленных
аминокислот (валина, лейцина, изолейцина и остатками фенилаланина и
триптофана).
Различные формы связи определяют различные уровни организации
структуры белковых молекул.
УРОВНИ ОРГАНИЗАЦИИ СТРУКТУРЫ БЕЛКОВ
Первичная структура белковой молекулы
Ковалентные пептидные связи создают первичную структуру белковой
молекулы. Благодаря этим связям аминокислоты связываются друг с дру-
гом с образованием полипептидной цепи, каждое звено которой представлено
остатком молекулы какой-либо одной аминокислоты. В том случае, когда
2 Заказ № 581 33
ала - ала - лиз - фен - глу - арг - сер- тре - сер- сер - асп - гис - мет - глу - ала - ала - сер - сер
г—nh2 "" / р' -ДЛЛУ " ГЛУ ~ сер-тир-сер-тре-мет - сер \глук х^асп __—IV j вал) TCnH, r~NH2 rNHj ’ ГЛУ^ вал) ( ала, вал, сер, глу , цис)-л из--асп,/ . ( X^nNH2 г-NH2 rNH2 J / * глу - асп - тре-тре-лиз-тир-цис-ала-асп - про - тир - лиз - гли - сер - тре - сер / ала>-— vn ’ \Л1? \ VIII \гис r-NH2-i 4 хДвал, илей2)( §сп, глу, про, гли, цис, ала)-тир-(вал2, про, гис)-фен- асп-ала-сер- ал-СОО тре । асп L ЦИсИ । г арг] •лу / н
Рис. 1. Структура рибонуклеазы
полипептид достигает большого размера (мол. веса), он приобретает свойст-
ва белка. Молекулы некоторых белков состоят из одного гигантского поли-
пептида, например фермент рибонуклеаза (рис. 1). Чаще же встречаются
белки, молекулы которых состоят из нескольких полипептидов, соединен-
ных друг с другом с помощью дисульфидных мостиков, как гормон инсу-
лин. Первичная структура белка хорошо изучена. Установлена величина
валентных углов и межатомные расстояния в вытянутой полипептидной це-
пи, а также пространственное расположение атомов (рис. 2).
В построении полипептидной
цепи каждая аминокислота участ-
вует своей карбоксильной груп-
пой и аминной группой. Этим
создается «хребет» полипептида в
виде ....СО—NH—СО—NH.., от
которого отходят радикалы амино-
кислот, различные по своей при-
роде. Для глицина таким радика-
лом является — СН2, для алани-
на — СН3СН, для серина — СН2
ОН—СН, для фенилаланина —
СбН5—СН2—СН и т.д. Ниже при-
водится схема, поясняющая строе-
ние полипептида (стр. 36).
Эта схема показывает, что в
пептидной цепи сохраняются осо-
бенности структуры отдельных
аминокислот, из которых она по-
строена. Следовательно, различные
полипептиды должны отличаться
друг от друга в зависимости от
структуры входящих в их состав
аминокислот.
Полипептиды отличаются друг
от друга также последователь-
ностью размещения в них аминокис-
лот. Разнообразие аминокислот,
участвующих в построении белков,
а также различная последователь-
ность их размещения в молекулах
белков обеспечивают возможность
построения огромного числа бел-
ков, отличающихся по своей струк-
туре и биологическим свойствам.
В органическом мире мы встреча-
емся с очень большим разнообра-
зием белковых веществ.
В природе мы часто встречаем-
ся с белками, молекулы которых
построены из нескольких полипеп-
тидов, где отдельные полипептиды
соединены друг с другом с помощью
дисульфидных мостиков. Дисуль-
фидные связи (—S—S—) играют
большую роль в организации пер-
вичной структуры белков.
Рис. 2. Валентные углы и межатомные
расстояния в вытянутой полипептидной
цепи
2*
35
NH3
CH, он
। * /S
CH, HC-NH^
I II )CH I J
CH2 OH C—NH Xf/
CH2 CH2 CH2 CH2
CH CO NH CH CO NH CH CO NH CH CO
COO*
CH2
CH2
NH CH CO
CO NH CH CO NH CH CO NH CH CO NH CH CO NH
CH2 CH2 ch2 CH3
CH SH yk
CH3 CH3 I
Вторичная структура белковой молекулы
Благодаря водородным связям полипептидные цепи скручиваются и
приобретают пространственную спиральную форму. Пространственная ор-
ганизация полипептидных цепей лежит в основе вторичной структуры бел-
ков.
По общепринятому представлению Полинга и Кори, в молекулах бел-
ков имеются многократно повторяющиеся структурные пептидные единицы
со спиральной конфигурацией, получившие название а-спиралей (рис. 3).
Схема свидетельствует о том, что отдельные витки спирали полипептида сое-
динены водородными связями. Спиральные полипептидные цепи «плотно
упакованы» в белковых молекулах, что и создает внутреннюю структуру
этих молекул. От конфигурации полипептидов и внутренней структуры бел-
ковой молекулы зависят многие свойства белков.
Третичная структура белковой молекулы
Спиральная структура пептидных цепей на определенных участках пре-
терпевает нарушения и прерывается с образованием аморфных участков.
Зависит это от ряда причин, среди которых особенно важным является на-
личие в белках дисульфидных (ковалентных) связей, а также аминокислот
пролина и оксипролина. Направление спирали в местах расположения в
пептидной цепи пролина или оксипролина, благодаря особенностям их
структуры, должно поворачиваться (угол в 130°).
Укладкой спиральных и аморфных участков пептидных цепей создает-
ся третичная структура белков, где большое значение имеют вандервааль-
совские силы, существующие между боковыми радикалами аминокислот.
Пространственная структура белков изучается методами рентгенострук-
турного анализа. Эта структура зависит от строения аминокислот и после-
довательности размещения их в полипептидных цепях, от количества этих
цепей, от водородных связей, возникающих в белковых молекулах и сши-
вающих между собой отдельные звенья пептидных цепей и др.
36 '
Рис. 4. Схема пространственного
расположения полипептидной цепи
миоглобина (по Кендрью). Черным
диском обозначен гем
Пространственная структура миоглобина и
гемоглобина изучена настолько полно, что
известно расположение в пространстве каждого
из атомов, составляющих их молекулы. Приве-
дем пространственную структуру миоглобина —
белка, играющего важную роль в потребле-
нии мышцами кислорода (рис. 4..)
Четвертичная структура белковой
молекулы
Ассоциация двух или большего числа белков
с образованием комплекса создает четвертичную
структуру белков. Такие белковые комп-
лексы часто обладают важными биологическими
свойствами. В виде примера можно привести
ассоциацию миозина и актина с образованием
актомиозина, являющегося сократительным бел-
ковым комплексом мышц, ассоциацию молекул
фибриноген-мономера с образованием фибрина,
что имеет большое значение в процессе свер-
тывания крови и т.д.
Молекула гемоглобина состоит из четырех
субъединиц (полипептидов с молекулярным ве-
сом 17 000), одинаковых в функциональном от-
ношении.
ИЗУ Ч ЕНИ Е ПОСЛЕДОВАТЕЛЬНОСТИ
РАЗМЕЩЕНИЯ АМИНОКИСЛОТ
В БЕЛКОВОЙ МОЛЕКУЛЕ
Выше указывалось, что первичная струк-
тура белков, в основе которой лежат ковалент-
ные связи — пептидные и дисульфидные, зави-
Рис. 3. Схема спиралевидной a-структуры пептидной цепи (по Полингу и Кори)
37
сит от того, какие аминокислоты входят в состав полипептидных
цепей, и от последовательности их размещения.
В связи с этим важно разобраться в методах, позволяющих изучить
аминокислотный состав белков и последовательность соединения их друг
с другом.
Для выяснения аминокислотного состава белок подвергается полному
гидролитическому расщеплению (стр. 18) и затем из гидролизата изолиру-
ются отдельные аминокислоты. Применение метода распределительной хро-
матографии позволяет сравнительно легко изолировать отдельные амино-
кислоты, что необходимо для их дальнейшего химического определения.
Химическими методами устанавливается природа каждой аминокислоты
и ее количественное содержание в подвергшемся гидролитическому рас-
щеплению белке.
Молекулы белка, как нам уже известно, в одних случаях состоят из
одной пептидной цепи, в других — они построены из нескольких, соединен-
ных друг с другом. При обработке белка надмуравьиной кислотой (стр. 32)
разрушаются дисульфидные мостики и расчленяются пептидные цепи. За-
тем осуществляется их разделение.
В каждой пептидной цепи, независимо от ее величины, имеются остат-
ки двух концевых аминокислот. Они образуют концевые звенья пептидной
цепи; называются концевыми аминокислотами. В одной концевой аминокис-
лоте свободной остается аминогруппа, а в другой — карбоксильная группа.
Существуют методы, позволяющие установить природу концевой ами-
нокислоты со свободной аминогруппой и природу концевой аминокислоты
со свободной карбоксильной группой.
Для определения концевой аминокислоты со свободной аминогруппой
(JV-концевую) применяется реакция с динитрофторбензолом и реакция с
фен ил изотиоцианатом.
При обработке раствора белка (или полипептида) раствором 2,4-дини-
трофторбензола последний реагирует со свободными аминогруппами белка
с образованием производных соединений ярко-желтого цвета:
2, 4-Динитрофторбензол
h2n . Я-
Аминокислота
2, 4-Динитробен-
золаминокислота
HF
В реакцию вступает аминогруппа остатка аминокислоты, находяще-
гося с краю пептидной цепи. Если с конца молекулы белка (или полипепти-
да) будет находиться диаминомонокарбоновая кислота, например лизин,
то к ней присоединяются две молекулы динитробензола. Связь амино-
группы аминокислоты с 2,4-динитробензолом оказывается более стабильной,
чем обычная кислотоамидная (пептидная) связь. Поэтому при гидролизе,
после разрушения пептидных связей, остается нерасщепленным производ-
ное — 2,4-динитробензол-аминокислота. Соединение это выделяется и за-
тем устанавливается химическая природа входящей в его состав амино-
кислоты.
При обработке раствора белка фенилизотиоцианатом также происходит
связывание JV-концевой аминокислоты:
Я Ri
I I
CeH5—N=C=S + HoN—CH—СО—NH—CH . —>
Фенилизотиоцианат Полипептид
s R Ri
Il I I
—» C4H6—NH—C—NH—CH—CO—NH—CH. ..
Фенилгидантоин
38
При дальнейшей обработке соляной кислотой образуется фен ил гидантоин
аминокислоты, занимавшей в пептидной цепи TV-концевое положение:
R—СН---СО
c=s
Фенилгидантоин аминокислоты
В фенилгидантоине аминокислоты определяют природу входящего в его
состав остатка аминокислоты.
Для определения концевой аминокислоты со свободной карбоксильной
группой (С-концевой) пользуются кристаллическим препаратом фермента
карбоксипептидазы из поджелудочной железы. При кратковременном дей-
ствии этого фермента от полипептида отщепляется С-концевая аминокисло-
та, которую выделяют и идентифицируют.
С-концевую аминокислоту можно определить также с помощью гидра-
зинового метода. Гидразин (H2N—NH2) реагирует со всеми аминокисло-
тами, связанными друг с другом пептидной связью. С-концевая аминокисло-
та с гидразином не реагирует и ее можно идентифицировать.
После установления природы N- и С-концевых аминокислот полипеп-
тид подвергают постепенному гидролизу с образованием низкомолекуляр-
ных полипептидов. Последние изолируются, и в каждом из них устанавли-
вают природу N- и С-концевых групп. В результате изучения концевых
аминокислот в различных низкомолекулярных полипептидах, образую-
щихся при гидролизе полипептида, выявляют последовательность разме-
щения в нем аминокислот.
При изучении различных полипептидов и белков установлено, что по-
следовательность размещения аминокислот в их молекулах неодинакова.
Однако эта последовательность не носит случайного характера. Оказалось,
что ряд специфических свойств белков, например способность некоторых
белков (ферментов), ускорять течение химических реакций, способность
связывать антигены (стр. 44), гормональная активность и другие зависят
от размещения аминокислот в полипептидных цепях и от их пространствен-
ной структуры.
В ряде случаев специфическая активность тех или иных белков зависит
от размещения аминокислот не на всем протяжении полипептидной цепи,
а на определенном ее участке, который может неоднократно повторяться
в белковой молекуле. В этих случаях говорят о «реактивном центре» бел-
ковой молекулы.
Применение новых методов исследования белков позволило установить
количество пептидных цепей и размещение аминокислот в ряде белковых
молекул.
На рис. 1 приведена структура рибонуклеазы — белка, построенного
из одной пептидной цепи, состоящей из 126 остатков аминокислот, и после-
довательность размещения аминокислот в молекуле рибонуклеазы. Пеп-
тидная цепь имеет несколько витков, так как в отдельных ее местах пары
остатков цистеина (их четыре и они на рисунке подчеркнуты) соединены
друг с другом дисульфидными связями.
На стр. 198 приведена структура белка инсулина с наличием двух
пептидных цепей, причем в каждой из этих цепей установлена последова-
тельность размещения аминокислот.
Удалось также установить последовательность размещения аминокис-
лот в адренокортикотропном гормоне — полипептиде, бедке вируса табач-
ной мозаики и в некоторых других.
39
Выяснение первичной структуры белков имеет большое значение, так
как позволяет разобраться в химической структуре и свойствах белков и
намечает пути осуществления химического синтеза белков.
В зависимости от первичной структуры спонтанно (самопроизволь-
но) возникает вторичная и третичная структуры белков.
ВЫДЕЛЕНИЕ БЕЛКОВ ИЗ ТКАНЕЙ
Для изучения химической структуры и биологических особенностей
белковых веществ весьма важно получить их в чистом, т. е. свободном от
примесей, виде. Между тем получение отдельных белков или, как это при-
нято говорить, индивидуальных белков в чистом виде является задачей не-
легкой. Объясняется это тем, что белки легко связываются друг с другом,
а также и с иными веществами с образованием комплексных соединений.
Расчленить эти комплексы трудно.
Всякое выделение белков из тканей начинается с их экстрагирования.
Для экстрагирования применяется вода, растворы нейтральных солей,
разбавленный водой спирт, слабые растворы кислот и щелочей и др.
С помощью различных растворителей удается получить из тканей фрак-
ции, содержащие различные белки и иные вещества. Из этих фракций пы-
таются изолировать отдельные белки, по возможности в кристаллическом
виде.
В 1889 г. впервые был выделен в кристаллическом виде альбумин из
яичного белка. Удалось также без больших трудностей изолировать в кри-
сталлическом виде гемоглобин. Следует, однако, указать, что после выделе-
ния указанных двух белков животного происхождения прошло свыше 40
лет до разработки новых приемов, позволивших получить в кристалличе-
ском виде значительное количество белковых веществ. Большую роль
здесь сыграло применение сернокислого аммония. Пользуясь различными
концентрациями сернокислого аммония, можно фракцию водорастворимых
белков, извлеченную из той или иной ткани, расчленить на отдельные части
и из них при дальнейшей обработке получить белки в кристаллическом
виде.
Получение белков в кристаллическом виде не всегда еще гарантирует
выделение индивидуальных белков, так как иногда несколько близких
друг к другу по своим свойствам белковых веществ кристаллизуются вместе
с образованием кристаллов общей для них формы. В этих случаях крис-
таллические белки представляют собой смеси или комплексы, состоящие из
нескольких индивидуальных белков. Так, например, установлено, что кри-
сталлический мио ген, выделенный из мышц, включает несколько индиви-
дуальных белков. Неоднородными по своему химическому составу оказа-
лись кристаллический ^-глобулин молока и некоторые иные препараты
кристаллических белков. Неоднородность состава препаратов кристалли-
ческих белков устанавливается физико-химическими методами (например,
методом электрофореза, ультрацентрифугированием), а также изучением
их биологических особенностей. Так, например, установлено, что кристал-
лический миоген обладает активностью нескольких ферментов. Учитывая
специфичность действия ферментов, следует считать, что кристаллы мио-
гена представлены не одним, а несколькими индивидуальными бел-
ками.
Несмотря на это, все же получение белков в кристаллическом виде яв-
ляется известным критерием их чистоты и часто их однородности.
Для разделения белков и их выделения из растворов часто пользуются методами
электрофореза и хроматографии.
Метод электрофореза основан на том, что молекулы белка, находясь в растворен-
ном состоянии, имеют электрический заряд. В электрическом поле они передвигаются
к противоположно заряженному полюсу. Это явление носит название электрофорез а &
40
В специально сконструированных приборах при строго определенных условиях
в электрическом поле происходит передвижение белковых частичек, которое регист-
рируется с помощью специальных оптических устройств на фотопластинке. Скорость
движения белка при электрофорезе выражается расстоянием, пройденным частичками
белка за единицу времени при падении потенциала на 1 в при определенном значении
pH и ионной силе раствора и различна для различных белков. Этим свойством поль-
зуются для разделения белков и их выделения.
На этом же принципе базируется широко применяемый метод электрофореза на
фильтровальной бумаге, позволяющий работать с малыми количествами белка и не
требующий сложной аппаратуры.
Хроматографическое разделение и выделение белков проводится пропусканием
раствора белков через колонку, наполненную тем или иным адсорбентом. На различ-
ных участках адсорбента в колонке адсорбируются различные белки.
Осаждение белков из растворов с сохранением их нативных свойств
может быть осуществлено “также осаждением при температуре от 3 до —5°C
некоторыми органическими жидкостями (ацетоном, спиртом).
Изолированные белки подвергают лиофильной сушке. При этом вода
удаляется из замороженных белковых препаратов в вакууме. Лиофильная
сушка широко применяется для получения в сухом виде медицинских пре-
паратов — сывороток и вакцин.
Изолирование химически чистых, индивидуальных белков долгое вре-
мя встречало большие трудности. В XIX и в начале XX столетий исследо-
ватели при изучении белков вынуждены были пользоваться препаратами,
состоящими из смеси различных белков и иных веществ. Это затрудняло
изучение химической структуры и биологических особенностей отдельных
белков. Появились сомнения, являются ли белки индивидуальными ве-
ществами, или же это сложная смесь близких, но неотделимых друг от дру-
га веществ.
Современные методы фракционирования белков и дальнейшей их очист-
ки дают возможность получать отдельные белки в химически чистом виде,
что позволяет изучать химическую структуру и свойства индивидуальных
белков. Существовавший термин «живой белок» потерял свое значение, так
как каждый индивидуальный белок, взятый в отдельности, не обладает
свойствами живых существ.
Неверным оказалось также представление о том, что при изолирова-
нии индивидуальных белков они теряют свойства, присущие им в живых
организмах. Мы знаем, например, что изолированные отдельные гормоны,
являющиеся белковыми веществами (инсулин, глюкагон, адренокортикот-
ропин и др.), будучи введенными в организм, оказывают такое же действие,
как гормоны, выделяемые железами внутренней секреции в организме.
Изолированные в чистом виде ферменты (они являются белками) про-
являют свое каталитическое действие как в клетках, где они находятся в
сложной смеси с иными веществами, так и вне их.
Подобных примеров, свидетельствующих о том, что белки являются
химическими индивидуумами, можно было бы привести много.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
Глобулярные и фибриллярные белки
В зависимости от укладки пептидных цепей в молекулах различают
белки глобулярные и фибриллярные. Белки, имеющие округлую, или эл-
липсоидную, форму, носят название глобулярных белков (лат. globulus—
шарик). Глобулярные белки встречаются в физиологических жидкостях
(сыворотке крови, молоке, пищеварительных жидкостях) и в тканях орга-
низма, растворимы в воде и в слабых солевых растворах.
Белки, имеющие форму тончайших нитей — волоконец, носят назва-
ние фибриллярных белков (лат. fibrilla — волокно). Они встречаются в
сухожилиях, коже, мышцах, волосах, рогах. В большинстве случаев они
41
нерастворимы в воде. Следует указать, что между глобулярными и фибрил-
лярными белками существуют белки промежуточных форм. Так, например,
глобулы некоторых белков (например, зеина) имеют продолговатую форму
и тем самым близки к фибриллярным белкам. С другой стороны, некоторые
типичные фибриллярные белки — миозин, актин, фиброин шелка — при
известных условиях могут находиться в глобулярном состоянии. В природе
нет резкой границы между глобулярными и фибриллярными белками.
Молекулярный вес белков
Молекулярный вес белков устанавливают различными методами (по
осмотическому давлению, по скорости седиментации в ультрацентрифуге,
рентгеноструктурным анализом и др.). Все они дают близкие между собой
результаты и показывают, что белки являются высокомолекулярными ве-
ществами.
Белок Молекуляр-
ный вес
Яичный альбумин......................... 44 000
р-Лактоглобулин......................... 38 000
Химотрипсин ............................ 41 000
Э дестин ............................. 310 000
Альбумин сыворотки крови лошади . . 70 000
Гемоглобин эритроцитов . . . 70 000
Каталаза печени . 225 000
Гемоцианин........................... 6 500 000
Оптические свойства белков
Белки, как и высокомолекулярные полипептиды, обладают способно-
стью вращать плоскость поляризованного луча. Это свойство обусловлено
оптическими свойствами входящими в их состав аминокислот, а также спи-
ральной структурой пептидных цепей, которая, как указывалось (стр. 37),
создается водородными связями. Факторы, разрушающие водородные свя-
зи, например концентрированные растворы мочевины и гуанина, изме-
няют оптические свойства белков.
КОЛЛОИДНЫЕ СВОЙСТВА БЕЛКОВ
Белки благодаря своему большому молекулярному весу находятся в
коллоидном состоянии. Белковые молекулы содержат некоторое количе-
ство свободных карбоксильных и аминных групп, и поэтому белки относятся
к амфотерным электролитам. В щелочной среде белок диссоциирует как
кислота, в кислом растворе — как щелочь. Отсюда следует, что в щелоч-
ном растворе молекулы белка заряжены отрицательно, а в кислом — поло-
жительно. При прохождении постоянного электрического тока через щелоч-
ной раствор белка молекулы его движутся к аноду, а через кислый раствор
белка — к катоду. При определенной для каждого белка концентрации во-
дородных ионов количество положительных и отрицательных зарядов в
молекуле белка становится одинаковым, и белки перестают передвигаться
в электрическом поле. Концентрация водородных ионов (реакция среды),
при которой в молекуле белка устанавливается равенство положительных
и отрицательных ионов, носит название изоэлектрической точки данного
белка. Изоэлектрическая точка для различных белков оказывается неоди-
наковой. Так, например, для казеина изоэлектрическая точка находится
при pH 4,7, для яичного альбумина — при pH 4,8, сывороточного глобу-
лина — при pH 5,4, для эдестина из семян конопли — при pH 5,5, для зеи-
на кукурузного зерна — при pH 6,2 и т. д.
42
В изоэлектрической точке белки в наименьшей степени гидратированы,
и они легко выпадают в осадок, особенно при прибавлении к ним водоотни-
мающих реактивов (спирта, ацетона).
Белки являются гидрофильными коллоидами. При растворении белка
вокруг каждой его молекулы образуются водные оболочки, состоящие из
определенным образом ориентированных в пространстве молекул воды.
Вещества, разрушающие водные оболочки растворенных белков, вызывают
выпадение их в осадок. К разрушающим водные оболочки растворенных бел-
ков относятся такие обезвоживающие (дегидратирующие) вещества, как
спирт, ацетон, растворы нейтральных солей щелочных металлов, растворы
сернокислого аммония, используемые для этой цели в биохимической прак-
тике.
Одним из важнейших свойств белков как лиофильных коллоидов яв-
ляется их способность образовывать гели. При этом коллоидальные частич-
ки склеиваются друг с другом в своеобразный каркас, в ячейки которого
включается значительное количество молекул воды. Если гель высушить,
а затем поместить в воду, то он сильно набухает, т. е. впитывает воду, что
зависит от концентрации водородных ионов и от присутствия в растворе со-
лей. Наименьшее набухание наблюдается при изоэлектрической точке дан-
ного белка.
Отделение воды от геля носит название синерезиса. Следовательно,
синерезис — явление, обратное набуханию. При синерезисе гель умень-
шается в объеме и сморщивается.
Высаливание белков. При воздействии на белковые растворы водоот-
нимающих веществ (нейтральных солей) белки выпадают в осадок или,
как принято говорить, высаливаются. Осадки белков после удаления во-
доотнимающих веществ при прибавлении к ним воды вновь растворяются.
Различные нейтральные соли осаждают белки с различной интенсивностью
и это зависит от характера их катионов и анионов. Катионы и анионы по
их осаждающей способности располагаются в два ряда:
Катионы: Cs, Rb, К, Na, Li, Ba, Sr, Ca, Mg.
Анионы: SO4, Cl, Br, NO3, I, CNS.
Эти ряды получили название лиотропных рядов.
Денатурация белков. Ряд факторов, влияя на структуру белков, из-
меняет их физико-химические особенности и, как принято говорить, де-
натурирует их. Изменения, наступающие при денатурации, сводятся к то-
му, что белки теряют способность растворяться в воде и в солевых раство-
рах. Высушенные денатурированные белки набухают в воде. Изменяются
оптические свойства белков, в них усиливается реактивность сульфгид-
рильных групп и т.д. Процесс денатурации весьма сложен и детально еще
не изучен.
Первый этап денатурационного процесса не вызывает глубоких изме-
нений в структуре белковых молекул и является обратимым. Однако при
дальнейшем своем развитии денатурационный процесс приводит к необра-
тимым изменениям. К денатурирующим факторам относится повышение тем-
пературы (нагревание до 70—100°С) белкового раствора, действие на белок
сильных кислот и щелочей, тяжелых металлов и ряда химических реакти-
вов (так называемых алкалоидных осадителей). Под влиянием перечислен-
ных факторов белки теряют свои гидрофильные и приобретают гидрофоб-
ные свойства. При денатурации белки обычно выпадают в осадок.
При денатурации значительно повышается вязкость глобулярных бел-
ков, объясняется это тем, что глобулы выпрямляются и приобретают ните-
видную форму, достигая больших размеров.
Денатурация фибриллярных белков вызывает уменьшение их вязко-
сти, что связано со скручиванием пептидных цепей и частичным уничтоже-
нием фибрилл.
Реакции на белки. Существует ряд приемов, с помощью которых можно
установить наличие в растворах белковых веществ. Так, например, для об-
43
наружения белков широко пользуются способностью их денатурироваться
и выпадать в осадок. При нагревании до кипения белки, особенно при сла-
бокислой реакции, свертываются с образованием хлопьев. Выпадают в
осадок белки при прибавлении к их растворам солей тяжелых металлов
(ртути, меди, серебра), пикриновой, вольфрамовой, фосфорновольфрамо-
вой, фосфорномолибденовой, трихлоруксусной кислот и других так назы-
ваемых белковых осадителей.
Для обнаружения белков используются также цветные реакции. Би-
уретовая реакция (стр. 29), выявляющая наличие в белках пептидных (кис-
лотоамидных) связей, используется как для установления присутствия бел-
ков, так и для количественного их определения. К весьма чувствительной
нингидриновой реакции (стр. 21) прибегают для определения белка, содер-
жащегося в очень малых концентрациях. Проба Миллона на тирозин, ксан-
топротеиновая проба на циклические аминокислоты, проба Адамкевича
на триптофан и некоторые другие используются для обнаружения белков
и для выявления в их составе тех или иных аминокислот.
РАЗНООБРАЗИЕ БЕЛКОВ. СЕРОЛОГИЧЕСКАЯ
СПЕЦИФИЧНОСТЬ БЕЛКОВ
Изучение химической природы белков показывает, что количество
белков в природе очевидно чрезвычайно велико. Выше (стр. 31) указыва-
лось, что из сравнительно небольшого числа различных аминокислот мож-
но построить большое количество полипептидов (изомеров), отличающихся
друг от друга последовательностью расположения в них остатков амино-
кислот. Из двадцати различных аминокислот мыслимо построение такого
количества различных изомеров полипептидов, которое выражается девят-
надцатизначным числом. Это количество изомеров значительно уменьшится,
если в построении полипептида из двадцати аминокислот будут участвовать
не одни только молекулы различных аминокислот, т. е. если молекулы
отдельных аминокислот будут повторяться в полипептиде. Все же и в этом
случае число возможных изомеров останется очень большим. Следует учесть,
что количество остатков аминокислот в белках составляет сотни, и при до-
пущении только одной пептидной формы связи между ними количество воз-
можных изомеров белков должно быть очень и очень большим, даже при
частом повторении одноименных аминокислот в белковых молекулах.
Можно поэтому утверждать, что разнообразие встречающихся в белках
аминокислот и способ связывания их друг с другом говорит о неимоверно
большом количестве белковых веществ. Встает вопрос о том, действительно
ли существует в органическом мире разнообразие белковых веществ? На
поставленный вопрос следует дать положительный ответ. Изучение биоло-
гических особенностей белков различных организмов приводит к заклю-
чению, что белки обладают видовой, а также тканевой специфичностью.
Если учесть многообразие живых существ и количество различных тканей
у многоклеточных животных, то становится ясным, что белки чрезвычайно
разнообразно представлены в органическом мире. Это подтверждается ре-
зультатами серологических исследований.
Химическая индивидуальность, или видовая специфичность белков
легко выявляется серологическим путем. Если животному, например кро-
лику, ввести в кровь чужеродный ему белок (антиген), то в организме вы-
рабатываются специфические антитела, являющиеся белками глобулино-
вой природы и находящиеся, главным образом, в у-глобулиновой фракции
белков сыворотки крови. Антигены и антитела взаимодействуют друг с
другом с образованием осадков (преципитата), что можно наблюдать при
добавлении к сыворотке крови животного, которому ввели в кровяное русло
чужеродный белок («иммунизированного» животного), того же белка (анти-
гена). Образование осадка носит название «реакции преципитации». Эта
реакция весьма тонкая и позволяет выявить свойства белков, неуловимые
44
при их химическом изучении. Так, например, тщательное химическое изу-
чение гемоглобина крови лошади, овцы и собаки не выявляет каких-либо
особенностей в их химической структуре. Между тем при введении этих
гемоглобинов в кровь кролика образуются специфические для каждого из
них антитела. Известны, однако, некоторые белки, почти не вызывающие
образования антител. Гормоны белковой природы (инсулин, некоторые гор-
моны гипофиза и др.), изолированные из желез внутренней секреции круп-
ного рогатого скота, при введении их в кровь человека (а также животных)
практически не вызывают образования антител. Надо полагать, что мша-
ческие различия в структуре белков-гормонов животных и белков-гормонов
человека настолько малы, что они не всегда выявляются серологически.
Это обстоятельство имеет большое практическое значение, так как оно поз-
воляет широко применять в медицинской практике белки-гормоны без опа-
сения вызвать при повторном введении их в организм человека реакцию
преципитации.
КЛАССИФИКАЦИЯ БЕЛКОВ
Для того чтобы разобраться в разнообразии белков, принято пользо-
ваться их классификацией. Следует, однако, отметить, что существующая
классификация белковых веществ далека от того, чтобы дать истинное пред-
ставление об их разнообразии, кроме того, она не охватывает все известные
белки.
В основу классификации простых белков положены некоторые физико-
химические, а также химические их особенности. К простым белкам отно-
сятся: альбумины, глобулины, гистоны, протамины, протеиноиды, прола-
мины, глютелины и др.
Альбумины — группа весьма распространенных белков, встречающих-
ся в тканях животных и растений, а также в жидкостях организмов (в сыво-
ротке крови, спинномозговой жидкости и др.). К альбуминам относятся
белки, растворимые в воде и нерастворимые в насыщенных растворах серно-
кислого аммония. Альбумины содержатся в яичном белке (овальбумины),
в сыворотке крови (сывороточные альбумины,), в сыворотке молока (лак-
тальбумины), в зеленых частях растений, в зернах злаков (в зародышах),
в семенах бобовых растений и т. д. Многие альбумины получены в кристал-
лическом виде. Различные альбумины могут отличаться друг от друга по
способности высаливаться при различных концентрациях нейтральной соли
(сернокислого аммония).
Глобулины, подобно альбуминам, широко представлены в организмах.
Отличаются они от альбуминов тем, что нерастворимы в воде, но раство-
римы в водных растворах различных солей. Эти признаки используются
для разделения альбуминов и глобулинов. Глобулины отличаются от альбу-
минов и тем, что в отличие от альбуминов или вовсе не содержат глицина,
или же содержат эту аминокислоту в незначительных количествах.
Гистоны — группа белков, в состав молекул которых входит от 20
до 30% диаминомонокарбоновых кислот (лизина, аргинина) и циклической
основной аминокислоты — гистидина. Эти белки обладают щелочными
свойствами, так как из двух аминогрупп диаминомонокарбоновых кислот
при построении белковой молекулы только одна (а-аминогруппа) исполь-
зуется для образования пептидной связи. Вторая же аминогруппа (в гис-
тидине иминогруппа) остается в белковой молекуле свободной, и это обус-
ловливает щелочное свойство гистонов. Гистоны встречаются в значитель-
ных количествах в белках эритроцитов и зобной железы.
Протамины — группа белков, отличающиеся особенно высоким со-
держанием диаминомонокарбоновых кислот — до 80%. Отсюда понятно,
почему протамины обладают еще более ярко выраженной щелочностью, чем
гистоны. В большом количестве протамины содержатся в сперме и икре рыб,
45
а также в тканях, богатых клетками с ядрами. Протамины, а также и гис-
тоны составляют белковую часть сложных белков нуклеопротеидов и с
этой точки зрения представляют значительный биологический интерес.
Протамины построены из очень ограниченного числа аминокислот.
В составе их отсутствуют серусодержащие аминокислоты. Молекулярный
вес протаминов не превышает 10 000. Все это позволяет считать протамины
наиболее просто построенными белками.
Протеиноиды — группа белков, содержащихся в опорных тканях орга-
низма, животных — в костной ткани, хрящах, сухожилиях, волосах и шер-
сти. Протеиноиды нерастворимы ни в воде, ни в солевых растворах, ни в
разведенных кислотах и щелочах, т.е. они находятся в денатурированном
состоянии. Они не гидролизируются пищеварительными ферментами (не
перевариваются) и поэтому не могут быть использованы как продукты пита-
ния. Протеиноиды по своей структуре являются волокнистыми (фибрилляр-
ными) белками. К протеиноидам относится белок соединительной ткани кол-
лаген (его биологический предшественник — белок проколлаген — выделен
в кристаллическом виде и изучен В. Н. Ореховичем), оссеин — белок кост-
ной ткани, кератины — белки волос, шерсти, эпидермиса, рогов. Эти белки
богаты цистином. Протеиноидом является также фиброин, образующийся
в так называемых прядильных железах насекомых (гусениц бабочек-шелко-
прядов, пауков). Из фиброина шелкопрядов изготавливаются шелковые
нити.
Проламины — группа белков растительного происхождения — встре-
чаются в семенах злаков. Отличительную черту проламинов составляет
хорошая растворимость в 60—80-процентном этиловом спирте (другие бел-
ки под влиянием спирта денатурируются и выпадают в осадок). Проламины
слабо растворяются в воде. При гидролизе они образуют большое коли-
чество пролина (отсюда название «проламины») и глутаминовой кислоты.
Проламины почти не содержат лизина. К проламинам относятся глиадин
из семян пшеницы и ржи, гордеин из семян ячменя, авенин из семян
овса и др.
Глютелины — группа белков растительного происхождения — обна-
руживаются в семенах злаков и в зеленых частях растений. Отличительной
их чертой является растворимость только в растворах щелочей.
ЛИТЕРАТУРА
Б е л и цер В. А. О структуре белков. «Успехи современной биологии», 1960,
т. 50, стр. 3.
Б е л и ц е р В., А. Денатурация и связанные с нею изменения белков. «Успехи
биологической химии», т. I, стр. 53.
Аминокислоты и белки. Сб. под ред. А. Г. Пасынского, ИЛ, М., 1952.
Белки в промышленности и сельском хозяйстве. Конференции по белку. Изд.
АН СССР, 1955.
Белки, их специфические свойства. Труды совещания по проблеме белка. Изд.
АН Укр. ССР, 1955.
Белки, т. I. Химия белковых веществ, под ред. Г. Нейрата и К- Бейли. ИЛ, М.,
1956; т. II. Физико-химия белковых веществ. ИЛ, М., 1956; т. III, ч. I и II. Биохимия
белковых веществ. ИЛ, М.
БраунштейнА. Е. Представления Ф. Энгельса о белке как основе жизни в
свете данных современной биохимии. «Успехи биологической химии», 1950, т. 1,
стр. 21.
БреслерС. Е. Введение в молекулярную биологию. Изд. АН СССР, 1963.
Г ауровитц Ф. Химия и биология белков. ИЛ, М., 1953.
Орехович В. Н. Современные представления о строении белков. «Успехи
современной биологии», т. 35, 1953,,стр. 425.
ПолингЛ. и КориР. Конфигурация полипептидных цепей в белках. «Сов-
ременные проблемы биохимии». ИЛ, М., 1957, стр. 38.
Цыперович А. С. Денатурация глобулярных белков. «Успехи химии»,
1956, т. 25, стр. 1173#
Глава вторая
ПРОТЕИДЫ-СЛОЖНЫЕ БЕЛКИ
К сложным белкам относятся такие, в составе молекул которых, кроме
аминокислот, имеются также другие вещества небелковой природы. Эти
небелковые компоненты сложных белков в одних случаях легко от них от-
делимы, в иных—отделяются с трудом и выявляются при гидролизе белка,
а также под влиянием агентов, денатурирующих белки. Небелковые ком-
поненты сложных белков, часто называющиеся простетическими группами
(греч. prostheto — присоединяю, прибавляю), имеют различную химичес-
кую структуру, начиная от простых неорганических веществ и кончая раз-
личными органическими соединениями, имеющими сложные структуры.
Классификация сложных белков базируется на химических особен-
ностях их небелковых компонентов. Исходя из этого, они разделяются на:
1) фосфопротеиды, 2) гликопротеиды, 3) хромопротеиды, 4) нуклеопротеиды.
Все сложные белки — весьма важные в биологическом отношении
вещества.
ФОСФОПРОТЕИДЫ
Фосфопротеиды содержат много фосфорной кислоты, которая освобож-
дается при гидролизе наряду с аминокислотами. К фосфопротеидам относят-
ся казеиноген молока, вителлин, вителленин и витин из яичных желтков
и ихтулин — белок рыбьей икры и др. Все они с химической точки зрения
характеризуются эфирной связью фосфорной кислоты в белковых моле-
кулах, а с биологической точки зрения тем, что являются питательным ма-
териалом для растущих организмов. Вместе с необходимыми для развития
молодых организмов аминокислотами, фосфопротеиды доставляют также и
необходимую организмам фосфорную кислоту. Фосфорная кислота осо-
бенно важна для развития скелета.
Наряду с приведенными, давно известными белками, в последнее время
в составе различных тканей и органов животных обнаружены новые фос-
фопротеиды. Особенности химической структуры этих фосфопротеидов ос-
таются еще во многом невыясненными, что же касается их физиологическо-
го значения, то установлено, что в тканях они активно превращаются,
интенсивно отщепляя и присоединяя к себе снова фосфорную кислоту. Неко-
торые ферменты (фосфоглюкомутаза, пепсин, фосфорилаза) являются фос-
фопротеидами.
Эфирная связь в молекулах фосфопротеидов осуществляется благодаря
присоединению фосфорного остатка к оксигруппе остатков серина и трео-
нина. Из всех оксиаминокислот, входящих в состав белков (серин, треонин,
47
тирозин, оксипролин), только серин и треонин связывают фосфорную кис-
лоту с образованием серинфосфорной и треонинфосфорной кислот:
,ОН
СН2 • О • Р=О
U, Х°И
СООН
Серинфосфорная кислота
СН3
СН—О—Р
chnh2
СООН
Треонинфосфорная кислота
Обе эти фосфоаминокислоты выделены из гидролизатов фосфопротеидов
(казеина). Применение более совершенных методов исследования позво-
лило выявить наличие в фосфопротеидах пирофосфатных и фосфодиэфирных
остатков:
0 0 О
II II II
—О—Р—О—Р—ОН —О—Р—о—
I I I
он он он
Наличие фосфодиэфирных остатков указывает на то, что пептидные цепи в
молекулах фосфопротеидов соединены друг с другом не только дисульфид-
ными мостиками, как это имеет место у различных белков, но и с помощью
остатков фосфорной кислоты.
ГЛИКОПРОТЕИДЫ
К гликопротеидам относятся сложные белки, имеющие в своем составе
кроме аминокислот, углеводы, производные углеводов (глюкуроновую кис-
лоту, гексозамины), нередко серную кислоту и уксусную кислоту. Эти уг-
леводные вещества встречаются в различных комбинациях в составе ряда
гликопротеидов, освобождаясь при гидролизе последних.
Имеются основания полагать, что простетическими группами глико-
протеидов являются полисахариды, распадающиеся при гидролизе на моно-
сахариды.
Главными представителями гликопротеидов, встречающимися в раз-
личных тканях, особенно в хрящах, костной ткани, роговице глаза, а также
в составе пищеварительных жидкостей, являются муцины и мукоиды. Вы-
сокая вязкость слюны зависит от наличия в ней муцина. Пищевой комок,
покрытый слюной, благодаря муцину, легче проскальзывает через пищевод
в желудок. Муцины трудно поддаются воздействию протеолитических фер-
ментов (ферментов, катализирующих расщепление белков). Обволакивая
слизистую оболочку желудка и кишечника, муцины предохраняют ее от
воздействия протеолитических ферментов, имеющихся в пищеварительных
жидкостях (в желудочном и в кишечном соках).
ХРОМОПРОТЕИДЫ
Хромопротеиды — это сложные белки, включающие окрашенные
(греч. chroma — краска) простетические группы. Сюда относятся белки,
простетические группы которых содержат в одних случаях железо, а в дру-
гих медь, а также белки, простетические группы которых окрашены, но не
содержат металла. Одни из этих белков играют важную роль в связывании
48
атмосферного кислорода и доставке его тканям (гемоглобины, гемоцианины),
другие служат ферментами, участвующими в окислительных процессах
(каталаза, пероксидаза, желтые окислительные ферменты). Из сказанного
ясно, что хромопротеиды являются функционально важными веществами.
ЖЕЛЕЗОСОДЕРЖАЩИЕ ХРОМОПРОТЕИДЫ
Гемоглобин
Среди металлсодержащих хромопротеидов особо важное место занимает
красящее вещество (пигмент) крови гемоглобин.
Гемоглобин крови позвоночных животных и человека сосредоточен в
эритроцитах и появляется в плазме крови только в результате разрушения
их — гемолиза.
Гемоглобин легко разлагается уксусной кислотой и хлористым натрием
на две составные части: белковую — глобин и на красящее вещество —
гем.
Глобины гемоглобинов крови разных животных различны по составу
и расположению в их молекулах аминокислот. Различаются они также се-
рологически (стр. 44). Так, например, глобин человека не включает амино-
кислоты изолейцина, в то время как в глобине собаки его содержание со-
ставляет 1,36%. В глобине собаки и коровы содержатся различные коли-
чества метионина и т.д. Что же касается гема, то по своей химической струк-
туре он один и тот же у различных позвоночных животных. Отсюда ясно,
что видовая специфичность гемоглобинов обусловлена их белковыми ком-
понентами. Глобины по содержанию в них диаминомонокарбоновых кислот
относятся к гистонам. Молекулярный вес гемоглобина равен 67—70 тыся-
чам и в его молекуле содержатся четыре молекулы гема. Молекула гема
включает один атом железа.
Природа присоединения гема к глобину еще окончательно не выяс-
нена. Предполагают, что оно осуществляется ковалентной связью между
железом гема и гистидином глобина.
В изучении химической структуры гема большую роль сыграли иссле-
дования М. В. Ненцкого и, особенно, Г. Фишера, проведенные им в период
с 1920 по 1940 гг.
В результате этих исследований было установлено, что в основе струк-
туры гема лежат производные пиррола. В каждой молекуле имеются четыре
производных пиррола, связанные друг с другом метиковыми группами
(—СН—), и один атом двухвалентного железа. Скелет молекулы гема со-
ставляет порфин, в который входят четыре соединенных друг с другом через
метиновые мостики производных пиррола:
Порфин
Пиррол
Протопорфирин — соединение более сложное, чем порфин,— он имеет
отходящие от пирроловых ядер порфина боковые цепочки (метильные, ви-
49
нильные и пропионовокислые). По своей химической структуре протопор-
фирин является 1,3,5,8-тетраметил-2,4-дивинил-6,7-дипропионовокислым
порфином:
Протопорфирин
(1,3,5,8-тетраметил-2,4-ДИвинил-6,7-дипропионовокислый порфин)
При введении в молекулу протопорфирина атома двухвалентного железа по-
лучают молекулу гема. Ниже приводится схема структуры гемоглобина и
его производных (пунктирные линии в формуле гема обозначают добавочные
связи, идущие от атома железа к двум атомам азота пирролов):
СН2СН2СООН СН2СН2СООН
Гем
При отщеплении гема обработкой гемоглобина уксусной кислотой и
хлористым натрием он окисляется с образованием гемина.
N4 ZN
Глобин....’’: ре/
N' N
N4 yN N4 >N
Глобин...J: Рет—О2 Глобин-A Fey—011
N/ NZ 4N
Гемоглобин
Оксигемоглобин
Метгемоглобин
N\ ZN
Глобин"**';. Fe—- CO
NZ XN
Карбоксигемоглобин
Самая интересная биологическая особенность гема заключается в его
способности соединяться с газами (кислородом, окисью углерода и др.).
При присоединении к гемоглобину (Нв) кислорода образуется оксигемо-
глобин (НвО2); О2 присоединяется к железу за счет дополнительных свя-
зей. НвО2 настолько нестоек, что уже при уменьшении парциального дав-
ления кислорода он распадается (диссоциирует) с образованием Нв и 02.
Присоединение 02 к Нв крови происходит в легких, распад же НвО2 на
50
Нв и О2 имеет место в крови, притекающей к тканям, что весьма важно для
снабжения тканей кислородом.
К гемоглобину (к имеющемуся в его составе железу) легко присоеди-
няется окись углерода (угарный газ) с образованием карбоксигемоглобина
(НвСО). При вдыхании воздуха, в котором содержится СО, последний вы-
тесняет О2 из НвО2, занимая его место. В результате нарушается доставка
кислорода от легких к тканям.
Важным производным гемоглобина является метгемоглобин, в молекуле
которого атом железа трехвалентен. Метгемоглобин образуется из НвО2
при воздействии на него окислителей K3Fe(CN)6, окислов азота, метилено-
вой сини и т.д.). Образование инертного, прочно связывающего кислород
метгемоглобина в крови уменьшает количество в ней функционально важ-
ного НвО2, нарушает доставку О2 к тканям, что ведет к тяжелым патологи-
ческим последствиям.
Миоглобин
Веществом, близким к гемоглобину, является хромопротеид мышц—
миоглобин, или мышечный гемоглобин. Миоглобин близок к гемоглобину
крови, но не идентичен с ним. Он образует такие же производные, как и
гемоглобин крови (оксимиоглобин, карбоксимиоглобин и метмиоглобин).
Миоглобин и гемоглобин очень близки по своему элементарному составу.
Одинаковыми оказались и простетические группы миоглобина и гемогло-
бина. Следовательно, различия в этих двух соединениях следует отнести
за счет их белковых компонентов. Миоглобин выделен из мышц ряда живот-
ных в кристаллическом виде. По своей форме кристаллы миоглобина раз-
личных животных отличаются друг от друга. Молекулярный вес белкового
компонента миоглобина, имеющего кристаллический вид, равен 17 000.
В каждой его молекуле содержится одна молекула гема. Миоглобин рас-
сматривают как дыхательный пигмент, обеспечивающий в мышцах кратко-
временный резерв кислорода, используемый мышечными волокнами. Срод-
ство к кислороду у миоглобина более выражено, чем у гемоглобина.
Особенно важна роль миоглобина в жизни водных животных. Так, на-
пример, содержание миоглобина в мышцах тюленя настолько велико, что
они имеют сине-черную окраску. Количество кислорода, связываемого мио-
глобином, у тюленя составляет почти половину общего количества кисло-
рода в организме. Тюлень может оставаться долго под водой, так как
необходимый ему в это время кислород обеспечивается распадом (диссоциа-
цией) оксимиоглобина. Очень важна также роль миоглобина у морских жи-
вотных — обитателей приливно-отливной зоны. Эти животные во время от-
лива покрывают свою потребность в кислороде за счет оксимиоглобина.
У человека при общем запасе кислорода, равном 2450 мл, 345 мл
(т.е. 14%), находится в форме оксимиоглобина. Миоглобин, обеспечивая ре-
зерв кислорода в мышцах, предохраняет органы животных от временного
кислородного голодания. Особо большое значение в этом отношении должен
иметь миоглобин сердечной мышцы.
Иные железосодержащие хромопротеиды
Хромопротеиды, содержащие железопорфирин (гем), представлены в
природе не только гемоглобинами и миоглобинами. Очень распространен
в тканях животных и некоторых бактерий фермент каталаза, имеющий в
составе своей молекулы четыре гема. Из некоторых тканей организма жи-
вотных выделены кристаллические препараты каталазы, молекулярный
вес их достигает 225 000; они содержат в каждой молекуле четыре молеку-
лы гема. В растительных организмах широко распространен другой гемсо-
держащий фермент — пероксидаза. Встречается этот фермент также и в
тканях животных. Из радужной оболочки глаза лошади пероксидаза полу-
57
чена в кристаллическом виде. Молекулярный вес ее равен 44 000, и она со-
держит одну молекулу гема. Из молока выделена в кристаллическом виде
лактпероксидаза с молекулярным весом 92 000, также с одним гемом в
молекуле. Пероксидаза, обнаруженная в лейкоцитах^ получила название
вердопероксидазы. Каталаза и пероксидаза относятся к числу окислитель-
ных ферментов.
Гем содержится также в других веществах хромопротеидной природы—
цитохромах. Последние встречаются во всех клетках, потребляющих кис-
лород, и, следовательно, широко распространены в органическом мире.
Цитохромы участвуют в процессах, ведущих к использованию клетками
кислорода. Среди выделенных из клеток цитохромов («а», «&» и «с») наиболее
изучен цитохром «с», полученный в кристаллическом виде (молекулярный
вес 13 000, одна молекула гема). Гем связан с белковым компонентом цито-
хрома «с» одной основной связью, идущей от железа к гистидину, и двумя
ковалентными связями между винильными группами гема и остатками цис-
теина глобина.
При изучении железосодержащих хромопротеидов обращает на себя
внимание весьма широкое использование в природе структуры протопорфи-
рина для образования биологически важных веществ. Протопорфирин мы
находим также в составе хлорофилла, являющегося одним из самых важных
органических соединений растений. Химическая природа и свойства хлоро-
филла (существуют два хлорофилла: хлорофилл a—C55H72O5N4Mg и хло-
рофилл б — C55H70O6N4Mg) особенно полно изучены благодаря исследова-
ниям М. В. Ненцкого, К. А. Тимирязева, М. С. Цвета, Р. Вильштеттера и
Г. Фишера. В молекуле хлорофилла, как и в молекуле гема, имеются четы-
ре соединенных друг с другом пирроловых ядра, которые двумя основными
и двумя дополнительными валентностями связывают атом магния. Хлоро-
филл наряду с этим представляет собой сложный эфир двухосновной кис-
лоты и двух спиртов — метилового и фитола (высокомолекулярного нена-
сыщенного спирта):
!
20п39
сн3 СН—сн2
СН3ООС—НС
СН,
сн2сн3
Хлорофилл а
I
*
N
МЕДЬСОДЕРЖАЩИЕ ХРОМОПРОТЕИДЫ
В крови и в гемолимфе беспозвоночных животных (головоногие мол*
люски, ракообразные) имеются медьсодержащие хромопротеиды-гемоциа-
нины (греч. kyanas — темно-голубое вещество). Гемоцианины выполняют
функцию связывания и переноса к тканям беспозвоночных животных кис-
лорода. Гемоцианины с присоединенным кислородом (они могли бы быть
названы оксигемоцианинами) окрашены в голубой цвет. После отдачи кис-
52
лорода они теряют окраску. Гемоцианины различного происхождения име-
ют молекулярный вес от 350 000 до 6 500 000. Форма включения меди в мо-
лекулу гемоцианина остается еще неясной. Отсутствуют также данные, ука-
зывающие на наличие в гемоцианинах простетических медьсодержащих
групп, как это имеет место в случае гемоглобина, где железо входит в состав
гема.
Флавопротеиды
К флавопротеидам относятся белки, окрашенные в желтый цвет. Ок-
раска зависит от наличия в них в качестве простетической группы флавин-
адениннуклеотида (стр. 113). Флавопротеиды широко распространены и
они играют роль ферментов (желтые окислительные ферменты, стр. 177).
Нуклеопротеиды
Нуклеопротеиды открыты в 1869 г. Ф. Мишером в ядрах клеток. От-
сюда и название протеиды ядер. Мишер же показал, что нуклеопротеиды
состоят из белка и простетической группы, которую он назвал нуклеином.
Позже она получила название нуклеиновой кислоты. Мишер и ряд других
исследователей обнаружили нуклеопротеиды в различных клетках, со-
держащих ядра, а также в тканях, богатых клетками с ядрами (содержащие
ядра клеточные элементы крови птиц, сперма, ткани желез внутренней и
внешней секреции и т. д.). Отсюда сложилось представление, что нуклео-
протеиды входят лишь в состав клеточных ядер. Однако более детальное
изучение распространения нуклеопротеидов с помощью, главным образом,
гистохимических методов исследования показало, что нуклеопротеиды
встречаются также и вне клеточных ядер в митохондриях, рибосомах и в
гиалоплазме. Однако основная масса нуклеопротеидов содержится в яд-
рах клеток. Так как нуклеопротеиды имеются не только в ядрах клеток,
названия «нуклеопротеиды» и «нуклеиновые кислоты» устарели, хотя они
применяются и в настоящее время.
Нуклеопротеиды относятся к числу наиболее важных в биологичес-
ком отношении белковых веществ. Входя в состав ядер клеток, они благо-
даря своим простетическим группам тесно связаны с процессами деления
клеток и с передачей наследственных признаков. Далее установлено, что
нуклеиновые кислоты участвуют в процессах биосинтеза белков. Из нукле-
опротеидов построены фильтрующиеся вирусы — возбудители многих
болезней человека, животных и растений. Попадая в организм человека,
животных и растений, вирусы, взаимодействуя с их клетками, приобретают
способность к размножению, следовательно, к самовоспроизведению.
Со времени открытия их Мишером и по настоящее время нуклеопроте-
иды привлекают к себе пристальное внимание многих исследователей.
Белки, входящие в состав нуклеопротеидов, чаще всего являются гис-
тонами и протаминами. Эти щелочные белки образуют с нуклеиновыми кис-
лотами солеобразные соединения.
Белковая часть нуклеопротеидов иногда бывает представлена белками
с относительно невысоким содержанием диаминомонокарбоновых кислот^
т. е. не гистонами и не протаминами.
Липопротеиды
К липопротеидам относятся комплексы, состоящие из белков и липи-
дов (холестерина, фосфатидов, жиров). В отличие от липидов, липопротеи-
ды растворимы в воде и нерастворимы в органических растворителях (эфи-
ре, бензоле, хлороформе и др.).
53
Липопротеиды чрезвычайно распространены. Они встречаются в со-
ставе различных тканей, являясь важнейшим компонентом протоплазмы
клеток; они обнаруживаются в форменных элементах и в плазме крови,
яичном желтке, молоке и т.д.
Различные белки, выделенные из организма, содержат в большем или
меньшем количестве липиды, и, следовательно, они могут быть отнесены к
числу липопротеидов.
Прочность связи белков с липидами в липопротеидах неодинакова.
Часто эта связь носит адсорбционный характер. Содержание липидов в ли-
попротеидах непостоянно и поэтому химическая характеристика их за-
труднена.
Особенно богата липопротеидами нервная ткань.
ЛИТЕРАТУРА
ВерболовичП. А. Миоглобин и его роль в физиологии и патологии живот-
ных и человека. Медгиз, М., 1961.
Коржуев П. А. Гемоглобин. Изд-во «Наука», М., 1965.
Лисовская Н. Н. и Ливанова Н. Б. Фосфопротеины. Изд. АН СССР,
М., 1960.
Глава третья
НУКЛЕИНОВЫЕ КИСЛОТЫ
Нуклеиновые кислоты были открыты в 1869 г. Мишером из ядер гной-
ных клеток и отсюда они получили свое название (nucleos — ядро).
Это широко распространенные вещества, содержащиеся в ядрах клеток
животного происхождения. Несколько позже была получена из дрожжей
нуклеиновая кислота, которая по своим свойствам несколько отличалась
от нуклеиновой кислоты, полученной из клеток животных, и это послужи-
ло поводом считать, что в природе существуют две нуклеиновые кислоты —
одна—характерная для животных (ее стали называть тимонуклеиновой кис-
лотой и этим подчеркивалось, что она была получена из зобной железы),
другая — для растений.
Дальнейшее изучение нуклеиновых кислот показало, что существуют
два типа нуклеиновых кислот, отличных друг от друга по своим свойствам,
а не по своему происхождению.
Химическая природа нуклеиновых кислот изучалась многими исследо-
вателями, причем очень важные результаты были получены в первой чет-
верти нашего века Левиным и его сотрудниками, а в последнее время Тоод-
дом.
Со времени открытия нуклеиновых кислот прошло 97 лет, однако толь-
ко в течение последних 10—15 лет они привлекают к себе пристальное вни-
мание не только биохимиков, но и других исследователей. Благодаря раз-
витию новых методов исследования удалось разобраться в особенностях
химической структуры нуклеиновых кислот и показать, что они являются
веществами, особенно важными в биологическом отношении.
Нуклеиновые кислоты —это высокомолекулярные вещества, и для изу-
чения их химической природы прежде всего был применен метод гидролиза.
В результате гидролиза нуклеиновые кислоты расщепляются с образова-
нием ряда низкомолекулярных веществ.
ПРОДУКТЫ ГИДРОЛИЗА НУКЛЕИНОВЫХ кислот
Для понимания химической природы нуклеиновых кислот, молекуляр-
ный вес которых составляет от десятков тысяч до нескольких миллионов,
важно прежде всего познакомиться с химической структурой их состав-
ных частей.
При полном гидролизе нуклеиновых кислот образуются производные
пурина, так называемые пуриновые основания, и производные пиримиди-
на — пиримидиновые основания, а также рибоза или дезоксирибоза (в за-
висимости от того, какая именно нуклеиновая кислота была взята для гид-
ролиза) и фосфорная кислота.
Из гидролизатов нуклеиновых кислот выделены следующие пуриновые
основания: аденин (6-аминопурин) и гуанин (2-амино-6-оксипурин), а так-
же пиримидиновые основания: цитозин (2-окси-6-аминопиримидин), урацил
(2,6-диоксипиримидин), тимин (2,6-диокси-5-метилпиримидин) и 5-метил-
урацил.
55
Пуриновые основания
С(6)’ NH(2)
или
Аденин
Аденин
Гуанин
Пиримидиновые основания
Цитозин
НОС(2) (4)СН
X(3)Z
N
Ци тозин
он
У рацил
,5- метилцитозин
Пентозы нуклеиновых кислот
D-Дезоксирибоза
О-Рибоза
56
Нуклеиновые кислоты по входящей в их состав пентозе разделяются на
две группы: рибонуклеиновые кислоты* (РНК) и дезоксирибонуклеиновые
кислоты (ДНК). Первые встречаются преимущественно в митохондриях,
рибозомах, гиалоплазме и в ядрышке клеток, вторые — главным образом
в ядрах клеток.
Продукты полного гидролиза ДНК и РНК приводятся ниже.
Дезокси рибон уклеиновые
кислоты (ДНК)
Аденин
Г уанин
Цитозин
Тимин
£)- Дезоксирибоза
Фосфорная кислота
Рибонуклеиновые кислоты (РНК)
Аденин
Гуанин
Цитозин
Урацил
Р-Рибоза
Фосфорная кислота
Из приведенных данных видно, что в состав ДНК входят: аденин, гу-
анин, цитозин, тимин, D-дезоксирибоза. В состав же РНК входят: D-рибо-
за, аденин, гуанин, цитозин и урацил.
В малых количествах в составе ДНК имеются 5-метилцитозин и в со-
ставе РНК — метилцитозин, метилгуанин и метиладенин.
Гидролиз нуклеиновых кислот можно вести не до конца. В этом случае
образуются продукты, изучение химической природы которых еще больше
приближает нас к пониманию их строения. Из гидролизатов нуклеиновых
кислот выделены нуклеозиды, пентозофосфорные кислоты и нуклеотиды
(мононуклеотиды).
Нуклеозиды являются продуктами неполного гидролиза нуклеиновых
кислот; они построены из двух компонентов: пуринового или пиримидино-
вого основания и рибозы или дезоксирибозы, причем основание присоеди-
нено к альдегидной группе пентозы. Нуклеозиды получают название по со-
держащимся в них основаниям и пентозам. Различают рибонуклеозиды и
дезоксирибонуклеозиды. Нуклеозид, имеющий в своем составе аденин,
носит название аденозин; при наличии в его составе гуанина — гуанозин,
цитозина — цитидин и т.д.
Аденозин
Цитидин
Пентозофосфорные кислоты, выделенные из гидролизатов нуклеино-
вых кислот, имеют в своем составе p-D-рибозу или {3-D-дезоксирибозу; фос-
форная кислота у них присоединена эфирной связью к спиртовой группе у
Пятого или же у третьего атома углерода.
57
Рибозо-5-фосфорная кислота
Дезоксирибозо-5-фосфорная кислота
Рибозо-З-фосфорная кислота
Дезоксирибозо-З-фосфорная кислота
Мононуклеотиды построены из трех компонентов: пуринового или пири-
мидинового основания, рибозы или дезоксирибозы и фосфорной кислоты.
Последовательность присоединения друг к другу этих слагаемых становится
ясной при изучении структуры нуклеозидов и пентозофосфорных кислот,
возникающих в результате гидролиза нуклеиновых кислот. Так как среди
продуктов постепенного гидролиза нуклеиновых кислот никогда не обна-
руживаются соединения пуриновых или пиримидиновых оснований с фос-
форной кислотой, а встречаются нуклеозиды и пентозофосфорные кислоты,
то можно с уверенностью говорить о том, что в молекулах мононуклеотидов
пентоза (рибоза или дезоксирибоза) занимает серединную позицию, при-
соединяя к себе с помощью глюкозидной связи пуриновое или пиримидино-
вое основание (с одного края) и через эфирную связь — фосфорную кислоту
(с другого края молекулы):
В зависимости от того, при каких условиях проводится гидролиз ну-
клеиновых кислот, из гидролизатов выделяются мононуклеотиды, у кото-
рых фосфатный остаток стоит у пятого или же у третьего углеродного атома
пентозы.
Причина этого станет ясной при рассмотрении структуры молекул
нуклеиновых кислот:
58
NHa
АдениН'Дезоксирибоза-З-фосфорная кислота
Химическая природа нуклеиновых кислот. Перейдем теперь к рассмот-
рению химической структуры нуклеиновых кислот (РНК и ДНК). Нуклеи-
новые кислоты могут рассматриваться как полимеры мононуклеотидов,
подобно тому, как полисахарид гликоген может рассматриваться как поли-
мер глюкозы. С этой точки зрения название «нуклеиновые кислоты» сле-
дует заменить названием «полинуклеотиды».
Как же соединены молекулы мононуклеотидов между собой в молекуле
полинуклеотида? Какое количество молекул мононуклеотидов участвует
в образовании молекулы нуклеиновой кислоты? Ответ на последний вопрос
дают данные по изучению молекулярного веса нуклеиновых кислот. Моле-
кулярный вес рибонуклеиновых кислот варьирует для водорастворимых
(низкомолекулярных) форм в пределах 20000—35000. Для других он дости-
гает 500000, для третьих — 1500000 — 2000000.
Молекулы последних построены из 5000—6000 отдельных мононуклеоти-
дов. Молекулярный вес дезоксирибонуклеиновых кислот достигает
4000000—8000000 и выше. Что касается формы химической связи отдельных
мононуклеотидов в молекулах полинуклеотидов, то до сих пор с досто-
верностью установлена только лишь одна форма связи, а именно диэфирная
связь, идущая от остатка фосфорной кислоты у пятого углеродного атома
пентозы одного мононуклеотида к спиртовой группе у третьего углерод-
ного атома пентозы другого мононуклеотида. Схематически строение
нуклеиновых кислот можно представить следующим образом:
Основание Основание Основание Основание Основание
Выше (стр. 58) указывалось, что в зависимости от условий гидролиза
полинуклеотида образуются мононуклеотиды, у которых фосфатный оста-
ток присоединен к пятому атому углерода пентозы, или же мононуклеотиды,
у которых этот остаток присоединен к третьему атому углерода. В одних
случаях при гидролизе разрыв эфирной связи идет в направлении, указан-
ном на схеме сплошной стрелкой, в других — в направлении пунктирной
стрелки. В первом варианте образуются нуклеотиды, у которых фосфатный
остаток стоит у третьего атома углерода, во втором — нуклеотиды с фосфат-
ным остатком у пятого атома углерода.
59
Схема структуры полинуклеотид ной це-
почки ДНК и РНК
Часть полинуклеотидной цепочки
молекулы дезоксирибонуклеиновой
кислоты (ДНК). Я; Rt; R2; Re —
пуриновые или пиримидиновые
основания
Часть полинуклеотидной цепочки
молекулы рибонуклеиновой кисло-
ты (РНК). R; RiZ R2; -Rs — пури-
новые и пиримидиновые основания
Из приведенной выше схемы структуры нуклеиновых кислот можно
видеть, что мононуклеотиды, соединяясь друг с другом, располагаются в
молекуле нуклеиновой кислоты в ряд.
О МАКРОМОЛЕКУЛЯРНОЙ СТРУКТУРЕ
НУКЛЕИНОВЫХ кислот
Как уже приводилось выше в мононуклеотиде — структурной единице
нуклеиновых кислот — имеются глюкозидная связь, с помощью которой
пуриновое и пиримидиновое основания связаны с пентозой, и эфирная
60
связь, соединяющая пентозу с фосфорной кислотой. Отдельные мононукле-
отиды в молекуле нуклеиновых кислот связаны друг с другом диэфирной
связью. Все эти связи прочные, ковалентные и они создают первичную стру-
ктуру нуклеиновых кислот. Наряду с ними в молекулах нуклеиновых кис-
лот имеются водородные связи, играющие важную роль в их макрострук-
туре.
Вопрос о значении водородных связей в структуре ДНК особенно
привлек к себе внимание начиная с 1953 г., когда Уотсон и Крик, исходя из
данных рентгеноструктурного
анализа, создали модель мак-
ромолекулярной структуры
ДНК. При создании этой мо-
дели ими были использованы
также данные о первичной струк-
туре ДНК, сообщавшиеся выше.
Эта модель сразу же стала
в центре внимания ученых и по-
будила их к постановке много-
численных исследований, ре-
зультаты которых позволили
глубоко изучить строение ДНК.
Молекула ДНК, согласно
этой модели, состоит из двух
спиралеобразных цепей, закру-
ченных правильными витками
вокруг общей для обеих цепей
оси (рис. 5). Каждая цепь пред-
ставляет собой полинуклеотид,
в котором обычным образом (ди-
эфирной связью) связаны друг
с другом мононуклеотиды. Вдоль
оси отдельной цепи на каждые
о
3,4 А приходится один моно-
нуклеотид. Угол между смеж-
ными мононуклеотидами в каж-
дой цепи равен 36°. Подобное
Рис. 5. Схема строения дезоксирибонук-
леиновой кислоты. Две ленты — две це-
пи; фосфато-дезоксирибозные горизонталь-
ные полоски — пары оснований, удержи-
вающие эти полоски цепи; вертикальная
линия — ось нити
расположение соединенных друг
с другом мононуклеотидов пов-
торяется в каждой цепи через
каждые 10 остатков. В цепи мо-
нонуклеотиды расположены та-
ким образом, что азотистые ос-
нования их находятся внутри,
а пентоза и фосфорная кислота—снаружи (рис. 5). Две параллельно
идущие цепи, обвитые вокруг общей для них оси, связаны друг с
другом своими азотистыми основаниями вдоль всей молекулы ДНК с по-
мощью водородных связей.
Как уже указывалось, промежуток между двумя цепями заполняется
азотистыми основаниями соединенных друг с другом мононуклеотидов.
Этот промежуток (3,4 А) позволяет попарно расположиться одному пурино-
вому основанию (состоит из двух ядер) и одному пиримидиновому основа-
нию (состоит из одного ядра). Каждое пуриновое и пиримидиновое основа-
ние соединяются друг с другом с помощью водородной связи.
Водородные связи направлены от МН2-аденина к ОН-тимина и от NH2-
гуанина к ОН-цитозина, а это означает, что последовательность расположе-
ния азотистых оснований в какой-либо одной из двух цепей может быть лю-
бая, но последовательность расположения азотистых оснований другой бу-
61
дет находиться в строгой зависимости от последовательности расположения
азотистых оснований первой цепи. Следовательно, аденину первой цепи
будет соответствовать тимин второй цепи, тимину первой цепи будет соот-
ветствовать аденин второй цепи, гуанину — цитозин, цитозину — гуанин.
Связывание между собой водородными связями азотистых оснований двух
цепей схематически представлено на рис. 5.
Исследованиями Чаргаффа установлено, что в ДНК различного проис-
хождения содержание аденина всегда равно содержанию тимина, точно
так же как содержание гуанина равно содержанию цитозина. Эти пары ос-
нований являются комплементарными (дополнительными) друг к другу. Из
этого следует, что макромолекула ДНК складывается из двух комплемен-
тарных друг к другу цепей.
Представление Уотссна и Крика о макромолекулярной структуре ДНК
получило свое подтверждение в ряде дальнейших исследований. Удалось
при определенных условиях (нагреванием ДНК до 80—90°С) разделить
Рис. 6. Схема строения рибонуклеиновой кис-
лоты. Длинная нить — соединенные между со-
бой нуклеотиды. В некоторых местах нить спи-
рально закручена
молекулы ДНК на отдельные цепи, а затем при медленном охлаждении их
снова соединить. Далее оказалось, что таким образом можно соединить
друг с другом две цепи, полученные из различных ДНК, и тем самым полу-
чить «гибридную» ДНК. При расчленении цепей ДНК теряет свои биологи-
ческие свойства. При соединении цепей друг с другом восстанавливаются
биологические свойства ДНК.
Модель макромолекулярной структуры ДНК сыграла большую роль
в деле выяснения генетической роли ДНК.
В макроструктуре РНК большую роль также играют водородные связи.
Однако чаще всего РНК не имеют двухцепочную структуру. Благодаря
водородным связям в молекулах РНК возникают по ходу полинуклеотид-
ной цепи отдельные витки (рис. 6). РНК принадлежит важная роль в про-
цессе биосинтеза белков (стр. 471).
К середине нашего века были разработаны новые методы исследования,
позволяющие с большой точностью определить содержание пуриновых и
пиримидиновых оснований в нуклеиновых кислотах. С помощью этих
методов Чаргаффом, А. Н. Белозерским и другими исследователями было
установлено, что препараты ДНК, изолированные из различных организ-
мов, характеризуются разным количественным соотношением в дих пури-
новых и пиримидиновых оснований. Это привело к заключению, что ну-
клеотидный состав ДНК различного происхождения не постоянен и что он
варьирует в зависимости от их происхождения, от принадлежности их к
той или иной систематической группе живых организмов. Совершенно оче-
видно, что ДНК имеют видовую специфичность. До этого считалось, что
видовой специфичностью обладают только лишь белки.
Были выявлены существующие закономерности соотношения нуклео-
тидов в различных ДНК, которые сводятся к следующему:
1. У всех ДНК сумма нуклеотидов, которые содержат производные
пурина, равна сумме нуклеотидов, содержащих производные пиримидина
(Пур=Пир, или
62
2. Содержание в ДНК аденина равно содержанию тимина (А -Т, или
3. Содержание в ДНК гуанина равно содержанию цитозина (Г-^Ц,
или ц-=1).
4. Количество аминогрупп (шесть), входящих в состав ДНК оснований
(А и Ц), равно количеству кетогрупп имеющихся там оснований (Г и Т),
Следовательно, Г+Т=А+Ц, или
Выше приведены закономерности соотношения нуклеотидов, характер-
ные для всех ДНК. Однако не они создают возможности существования
того большого разнообразия ДНК» с которым мы встречаемся в органичес-
ком мире. Это разнообразие создается в одних случаях тем, что в ДНК раз-
личного происхождения имеет место преобладание аденина над гуанином и
тимина над цитозином (А+Т>Г+Ц). В этом случае говорят о АТ-типе
ДНК. Этот тип ДНК характерен для всех животных.
В других случаях в ДНК гуанин и цитозин преобладают над аденином
и тимином (Г+Ц>А4 Т). Это так называемый ГЦ-тип ДНК. Подобные
ДНК встречаются у микроорганизмов, особенно у бактерий. У последних
содержание гуанина и цитозина резко преобладает над содержанием аде-
нина и тимина. В пределах каждого типа ДНК имеется бесконечное коли-
чество возможных вариаций по степени преобладания той или иной пары
оснований (Г+Ц и А+Т).
Следовательно, нуклеотидный состав различных ДНК может варьи-
микроорганизмов (водо-
ДНК варьирует в зна-
колеблется в пределах
ровать по величине отношения или -=-г’-й. У
г А~т~ 1 1 t «Д
рослей, грибов и бактерий) нуклеотидный состав
чительных пределах. У бактерий отношение
от 0,45 до 2,8, т.е. в шесть раз.
У высших растений и у животных нуклеотидный состав ДНК колеб-
лется в узких пределах (от 0,54 до 0,81 у животных и от 0,58 до 0,94 у рас-
тений). Это однако еще не означает, что у высших растений и у животных
ДНК представлены менее разнообразно, чем у микроорганизмов. Разно-
образие структуры ДНК и видовая их специфичность определяется не толь-
ко нуклеотидным составом ДНК, но и последовательностью размещения
нуклеотидов в молекулах ДНК.
При изучении структуры белков (стр. 44) было отмечено, что разно-
образие белковых веществ органического мира зависит как от содержания
аминокислот в молекулах белков, так и от последовательности их
щения.
Большое разнообразие химической структуры ДНК и видовая
цифичность говорят о их важном биологическом значении.
Детальному изучению подвергся также нуклеотидный состав
Оказалось, что нуклеотидный состав РНК различных живых существ варь-
ирует в гораздо меньших масштабах, чем нуклеотидный состав ДНК. Это,
однако, не дает оснований считать, что РНК не обладают видовой специфич-
ностью. Последняя может быть создана различной последовательностью
размещения нуклеотидов в их молекулах. В ряде случаев эта возможность
экспериментально доказана. Для всех изученных РНК установлена сле-
дующая закономерность: содержание гуанина и урацила равно содержа-
нию аденина и цитозина (Г+У=А+Ц), отсюда -Ргп" 1 •
разме-
их спе-
РНК.
Нуклеозидмоно-, ди- и трифосфаты
В различных тканях организма животных содержатся нуклеозидфос-
фаты, играющие важную роль в процессе обмена веществ и энергии. К ним
принадлежит адениловая кислота (аденозин-5-фосфорная кислота), обычно
63
встречающаяся в фосфорилированном состоянии в виде аденозинтрифосфор-
ной кислоты. При дефосфорилировании последней последовательно
образуются аденозиндифосфорная и адениловая кислоты. Образова-
ние адениловой кислоты из аденозинтрифосфорной кислоты может проис-
ходить также путем одноразового отщепления от нее двух остатков фосфор-
ной кислоты в виде пирофосфорной кислоты. Дефосфорилирование адено-
зинтрифосфорной кислоты сопровождается освобождением энергии, которая
широко используется в клетках для различных процессов синтеза; она так-
же превращается в механическую энергию при работе мышц и в иные виды
энергии.
Аденозиндифосфорная кислота за счет энергии, освобождающейся при
окислении органических веществ, фосфорилируется с образованием адено-
зинтрифосфорной кислоты.
3 клетках организма постоянно происходит процесс дефосфорилиро-
вания аденозинтрифосфорной кислоты и фосфорилирования аденозиндифос-
форной кислоты:
Содержание аденозинтрифосфорной кислоты в скелетных мышцах теп-
локровных животных достигает 0,33—0,4%. Несколько меньше аденозин-
трифосфорной кислоты в других тканях и органах.
В сравнительно малых количествах в тканях животных обнаружены
иные нуклеозидфосфаты: гуаниловая кислота, уридиновая кислота и цити-
диновая кислота. Подобно адениловой кислоте, они также дают фосфорили-
рованные продукты:
у а нозиндифосфорная
к ислота
Гуанозинтрифосфорна я кислота
64
Уридиловая кислота
Уридилдифосфорная кислота
Уридилтрифосфорная кислота
Гуаниловая кислота фосфорилируется с образованием гуанозиндифос-
фор ной, а затем гуанозинтрифосфорной кислоты. Уридиловая кислота —
с образованием уридилди- и уридилтрифосфорных кислот. Цитидиловая
кислота — с образованием цитидилди- и цитидилтрифосфорных кислот.
Все эти соединения обнаружены в тканях недавно, но теперь уже установ-
лена их важная роль в процессах обмена веществ в организме.
Фосфорилированные мононуклеотиды могут образоваться в организме
как продукты фосфоролиза (расщепления с помощью фосфорной кислоты)
нуклеиновых кислот, но они могут получаться также путем синтеза. Послед-
ний путь образования фосфорилированных мононуклеотидов представ-
ляет особый интерес, так как из них синтезируются нуклеиновые кислоты.
ЛИТЕРАТУРА
КотельниковаА. В. Новые данные о роли свободных рибонуклеотидов и
некоторых их производных. «Успехи современной биологии», 1957, т. 63, стр. 133.
«Нуклеиновые кислоты». Химия и биология. Под ред. Э. Чаргаффа и Дж. Дэвид-
сона. ИЛ, М., 1957 и 1962.
«Нуклеиновые кислоты». Под ред. Э. Чаргаффа и Дж. Дэвидсона. ИЛ, М., 1962.
«Нуклеиновые кислоты». Сб. статей. Изд-во «Мир». М., 1965.
С п и р и н А. С. Химия нуклеиновых кислот. Журнал Всесоюзного химического
общества им. Д. И, Менделеева, 1961, стр., 260,
3 Заказ № 58Т
65
Глава
четвертая
УГЛЕВОДЫ
Углеводы входят в состав клеток и тканей всех организмов, причем
количественно и качественно они особенно широко представлены у расте-
ний. Количество углеводов в сухом остатке различных частей растений
(листьях, стеблях, корнях, клубнях, семенах, плодах) составляет 70—80%.
Исключение составляют семена масличных растений, в которых содержа-
ние углеводов значительно ниже. Высокое содержание углеводов в расте-
ниях объясняется тем, что оболочка их клеток состоит преимущественно
из полисахарида целлюлозы, а также тем, что в клубнях, корнях, семенах
откладывается в виде запаса большое количество углеводов. Что же ка-
сается протоплазмы клеток растений, то она, как и протоплазма клеток
животных, состоит главным образом из белковых веществ, образующих
комплексы с липидами и иными соединениями.
Содержание углеводов у животных едва достигает 2% на сухой вес,
причем основная их масса находится в печени и в мышцах в виде поли-
сахарида гликогена.
Углеводы играют очень важную роль в питании человека и животных
как вещества, легко подвергающиеся распаду в тканях с освобождением
энергии. С этой точки зрения говорят об энергетическом значении угле-
водов. Известно, например, что при физической работе в организме потреб-
ляется много углеводов. Наряду с этим углеводы имеют большое промыш-
ленное значение. Они находят широкое применение в кондитерской, спир-
товой и в иных видах пищевой промышленности. Из древесины, состоящей
преимущественно из целлюлозы, производят мебель, строительные материа-
лы, бумагу, бумажные ткани, спирт и т. д.
Углеводы по своей химической природе являются альдегидами или
кетонами многоатомных спиртов или же продуктами их конденсации. Наз-
вание «углеводы» возникло в связи с тем, что на первых порах их изучения
считали, что все они имеют состав СпН2пОп или СП(Н2О)П. Иными словами,
что у них водород и кислород представлены в таких же соотношениях,
как и в воде (2 : 1). В дальнейшем было установлено, что имеются углеводы,
у которых соотношение между количествами водорода и кислорода иное.
С другой стороны, известны вещества с таким же соотношением между во-
дородом и кислородом, как в воде, но которые тем не менее не являются
углеводами, например уксусная кислота —С2Н4О2, молочная кислота —
С3Н6О3.
Все углеводы делятся на три класса: 1) моносахариды, 2) олигосахари-
ды (греч. oligos — немногий) и 3) полисахариды. Олигосахариды представ-
лены в природе главным образом в виде дисахаридов, образующихся при
конденсации двух (следовательно, немногих) молекул моносахаридов.
Совсем редко встречаются (в растениях) более сложные олигосахариды,
построенные из трех или четырех моносахаридов. Многие дисахариды обыч-
но называются сахарами; этим подчеркивается их вкусовая особенность —
66
сладость. Следует, однако, отметить, что сладким вкусом обладают не толь-
ко моносахариды и дисахариды. Сахарин, ничего общего не имеющий с
углеводами, во много раз слаще углеводов. Все это говорит о том, что от-
нести то или иное вещество к углеводам можно только основываясь на осо-
бенностях его химического строения, т. е. на том, является ли оно альдеги-
дом или же кетоном многоатомного спирта.
МОНОСАХАРИДЫ
Простейший моносахарид — гликолевый альдегид СН2ОН-
называют биозой, исходя из наличия в его молекуле двух атомов углерода.
Обычно к моносахаридам относят соединения, имеющие не меньше трех
атомов углерода в своих молекулах в виде неразветвленной цепи. В зави-
симости от числа атомов углерода их называют триозами, тетрозами, пен-
тозами, гексозами или гептозами. Моносахариды с более длинной цепью
атомов углерода в природе неизвестны. Один из атомов углерода в молекуле
моносахаридов представлен всегда в виде карбонильной группы (>С=О).
Если карбонильная группа находится на каком-либо одном конце молеку-
лы, т. е. занимает терминальное положение, моносахарид является альдеги-
доспиртом, и его называют альдозой. Если же карбонильная группа не за-
нимает краевого положения в молекуле, то она представлена кетонной груп-
пой, и такие моносахариды называются кетозами.
Триозы
В зависимости от места расположения карбонильной группы суще-
ствуют две триозы: альдотриоза и кетотриоза. Первая носит еще одно наз-
вание — глицериновый альдегид; вторая — диокси ацетон:
*СНОН
СН2ОН
Глицериновый альдегид
СН2ОН
с=о
I
СН2ОН
Диоксиацетон
Легко видеть, что из этих двух триоз одна, а именно глицериновый
альдегид, имеет один асимметричный атом углерода,-обозначенный звездоч-
кой. Следовательно, для него возможны стереоизомеры: правовращающий
(+) и левовращающий (—):
НО*СН
СН2ОН
(4-)-Глицериновый альдегид
СН2ОН
Ц—)-Глицериновый альдегид
Чем длиннее цепь атомов углерода в моносахариде, тем большее коли-
чество асимметричных атомов углерода в нем обнаруживается. Количество
возможных для него стереоизомеров определяется формулой Вант-Гоффа —
2Л, где п — количество асимметричных атомов углерода. Большинство
встречающихся в природе моносахаридов относятся к /^-моносахаридам,
так как они имеют при атоме С, ближайшем к первичной спиртовой группе
(СН2ОН), такое же пространственное расположение Н и ОН, как у О-глице-
3*
67
ринового альдегида. Эти моносахариды, независимо от направления враще-
ния поляризованного луча (вправо или влево), обозначаются символом D,
который, ставится перед названием моносахарида. Рядом с символом D
в скобках обозначают направление вращения + (вправо) или — (влево).
В виде поясняющего примера можно взять структуру двух гексоз: глю-
козы и фруктозы:
2 НСОН
3 носн
4 НСОН
5 НСОН
6 СН2ОН
DW- Глюкоза
СН2ОН
U
носн
неон
неон
I
СН2ОН
D(—)-Фруктоза
Как глюкоза, так и фруктоза имеют конфигурацию О-глицеринового
альдегида у пятого атома углерода, поэтому оба эти моносахарида обоз-
начаются символом D, Между тем глюкоза является правовращающим сое-
динением, фруктоза — левовращающим. Это отмечается знаками 4- и —
в скобках.
Триозы образуются при окислении трехатомного спирта глицерина.
В случае окисления первичной спиртовой группы образуется глицериновый
альдегид, в случае же окисления вторичной спиртовой группы — диокси-
ацетон:
НСОН
I
СН.ОН
Глицериновый альдегид
СН2ОН
СНОН
I
СН2ОН
Глицерин
СН2ОН
-1** с=о
I
СН2ОН
Диоксиацетов
Триозы — продукты распада углеводов в тканях. В фосфорилирован-
ном состоянии они образуются при расщеплении фруктозодифосфор ной
кислоты (стр. 295). При обычных условиях фосфотриозы подвергаются
дальнейшим превращениям, не накопляясь в тканях:
НСОН
СН2—О—Н,РО3
D(+)—Фосфоглицериновый
альдегид
СН2ОН
I
с=о
СН2—О—Н2РО3
Фосфолиоксиацетоп
Близость структуры обеих фосфотриоз объясняет их взаимопревращение
друг в друга, имеющее место в тканях под влиянием фермента изомеразы
фосфотриоз.
68
Гексозы
Из моносахаридов наиболее распространены в природе гексозы (С6Н12О6).
Альдогексозы имеют в своих молекулах 4 асимметричных атома углерода,
кетогексозы —3 атома:
/°
C<f CILOH
| I
*СНОН С—о
♦снон ♦снон
♦снон *снон
♦снон ♦снон
I I
СН2ОН СН2ОИ
Таким образом, возможно существование 24^16 стереоизомеров для
альдогексоз и 23=8 стереоизомеров для кетогексоз.
Гексозы, точно так же, как и пентозы и гептозы, образуют циклические
изомеры. В этих случаях карбонильная группа моносахарида связана с
гидроксильной группой той же молекулы с образованием циклического
полуацеталя:
*СНОН О
♦снон /
СН2ОН
*сон
*снон
♦снон о
♦снон
сн2он
♦сон
♦снон
СН2О
I
СН
*сн
♦снон
*сн
СНоОН
СН2ОН
Альдогексоза
пираноза
сн2
Пиран
Кетогексоза
пираноза
Кетогексоза
фураноза
Фуран
В молекулах альдогексоз циклический полуацеталь образуется связы-
ванием карбонильной группы с гидроксильной группой у пятого атома
углерода. По аналогии со структурой пирана эти формы альдогексоз по-
лучили название пираноз. Кетогексозы образуют полуацетали формы пира-
ноз и формы фураноз (при взаимодействии кетогруппы с гидроксильной
группой соответственно шестого или пятого углеродного атома углеродной
цепочки кетоге ксоз ы):
Альдогексоза-пираноза
Кетогексоза-пираноза
НОСН2 ЛХ СН2ОН
\н н А
н он
он он
Кетогексоза-фураноза
69
Молекулы циклических альдогексоз-пираноз и кетогексоз-пираноз
могут быть изображены в гексагональной форме и кетогексозы-фуранозы —
в пентагональной форме.
Циклические формы альдогексоз имеют в своих молекулах уже не
четыре, а пять асимметричных атомов углерода. Те же формы кетогексоз
содержат четыре асимметричных атома углерода. Число изомеров цикличе-
ских альдогексоз должно составлять 25^32, а число изомеров циклических
кето гексоз 24—16. Для альдогексоз известны 32 изомера, и это указывает,
что они находятся преимущественно в циклической форме.
В растворах устанавливается равновесие между циклическими и обыч-
ной альдегидной формами гексоз. Это можно видеть на примере D-глюкозы:
Н ОН
неон
I
носн о
I
неон
нс______
СНоОН
А.
а-О-Глюкоза
НОСН
неон
неон
I
СНоОН
D-Глюкоза
НО II
------------
неон
носн о
неон
нс----------
сн2он
p-D-Глюкоза
Из приведенных формул видно, что в молекуле ОН-группа у первого
атома углерода может меняться положением с атомом водорода. По-видимо-
му, D-глюкоза в альдегидной форме занимает промежуточное место при
взаимопревращении молекул а и [3-глюкоз.
Превращение а-глюкозы в [3-глюкозу и наоборот сопровождается яв-
лением мутаротации, т. е. изменением угла вращения поляризованного лу-
ча света. Мутаротацию можно наблюдать, например, при растворении D-
глюкозы в воде. .D-глюкоза обычно встречается в виде a-формы. Удельное
вращение ее [а]£>20°^ + 113°. При нейтральной реакции раствор а-глюкозы
медленно изменяет величину своего удельного вращения. Если же раствор
подщелочить, уже через несколько секунд удельное вращение становится
равным 52,5°. Объясняется это тем, что а-глюкоза частично переходит
в (3-глюкозу, имеющую удельное вращение +19°. Образующаяся смесь
содержит 36% а-глюкозы и 64% 9-глюкозы, и удельное вращение этой
смеси двух форм глюкозы равно 52,5°.
Среди 32 изомеров альдогексоз содержится 8 D- и 8 L-форм. Каждая
из этих 16 форм образует а- и р-альдогексозу при своей циклизации. Из 32
изомеров в природе в больших количествах встречаются в свободном виде
и в составе более сложных углеводов D-глюкоза, за нею следует D-манно-
за и в составе более сложных веществ D-галактоза. Кетогексозы имеют
24 изомера; из них в больших количествах в свободном виде и в составе
сложных углеводов встречается D-фруктоза.
D-Глюкоза, виноградный сахар, декстроза. D-глюкозы особенно много
в зрелом винограде, отсюда название ее — виноградный сахар. Раствор
D-глюкозы вращает поляризованный луч вправо, поэтому и возникло еще
одно название ее — декстроза.
Глюкоза является наиболее распространенным моносахаридом. Она
в больших или меньших количествах встречается в различных фруктах
и в ягодах. Из глюкозы построены полисахариды: крахмал, целлюлоза,
гликоген. Она входит в состав мальтозы, сахарозы, лактозы, раффинозы.
Глюкоза кристаллизуется из воды в виде пластинок С6Н12О6-Н2О. Глюко-
за входит как постоянная составная часть в кровь человека и животных.
70
Содержание глюкозы в крови человека колеблется в пределах 0,085—0,120%.
При одноразовом приеме с пищей большого количества глюкозы (например,
винограда, меда, картофельной патоки) содержание глюкозы в крови в те-
чение короткого срока возрастает, и глюкоза появляется в моче. При са-
харной болезни содержание глюкозы в крови всегда повышено, и она всегда
выделяется с мочой.
В медицинской и в ветеринарной практике находит применение препа-
рат чистой глюкозы для инъекций в кровь в виде 20- и 40-процентного раст-
воров. Глюкоза легко сбраживается дрожжами.
В качестве промежуточных продуктов распада углеводов в клетках и
в тканях глюкоза встречается в фосфорилированном виде. Известны три
фосфорилированные глюкозы: глюкозо-1-фосфорная кислота [а]о 20° — 4-120°;
глюкозо-6-фосфорная кислота [a[D20° =+25o и глюкозо-1,6-дифосфорная
кислота
НСОН
II он
^с—------
НСОН
носн о
НСОН
НСОН
НОСН О
неон
НС-----
сн.,он
D-Глюкозо-б-фосфорная
кислота
носн о
НСОН
нс____
>он
CH2-O-pZ=o
^Чэн
D-Глюкозо-1-фосфорная
кислота
D-Глюкозо-! ,6-дифосфорная
кислота
Из трех форм глюкозофосфорных кислот восстанавливающим свойством
обладает только одна — глюкозо-6-фосфорная кислота, у которой свободна
(вернее, находится в форме полуацеталя) альдегидная группа.
D-Манноза. D-Манноза встречается в составе различных сложных поли-
сахаридов — растительных слизей и гемицеллюлоз.
Маннозу получают путем кислотного гидролиза гемицеллюлоз, обра-
зующих скорлупу кокосовых орехов. Удельное вращение маннозы после
установления в растворе равновесия между а- и ^-формами (мутаротации)
равно -г 14,2°. Манноза сбраживается дрожжевыми клетками.
носн
I
НОСН О 7^
a-D-Манноза
НСОН
Г
НС-----
СН2ОН
носн
I
носн
I
НСОН
НСОН
СНоОН
kJ
но н
---------
носн
I
носн о
I
НСОН
НС----
СН2ОН
a-D-Манноза
71
D-Манноза
3-D-Манноза
D-Галактоза. D-Галактоза является составной частью молочного саха-
ра (лактозы), а также галактозидов (цереброзидов — составных частей
нервной ткани). В растениях галактоза входит в состав дисахарида мелибио-
зы и трисахарида раффинозы, полисахарида агар-агара, слизей и гемицел-
люлоз. В кристаллическом виде галактоза выделяется из плодов плюща:
неон
носн
носн
неон
сн2он
Галактоза
сн2он
а-Р-Галактоза
Галактозу можно получить из лактозы путем ее гидролиза. Она кри-
сталлизуется в спирте, образуя безводные шестигранные пластинки. Удель-
ное вращение водного раствора галактозы по окончании мутаротации рав-
но +80,2°.
Галактоза сбраживается только адаптированными к ней так называе-
мыми «лактозными» дрожжами.
Дезоксигексозы. В растениях в составе глюкозидов (стр. 88) и некото-
рых слизей встречаются гексозы с эмпирической формулой С6Н12О5—де-
зоксигексозы. Одной из таких дезоксигексоз является L-6-дезоксиманноза
(L-рамноза):
НСОН
НСОН
I
НОСН
НОСН
СН3
L-Рамноза
ОН он
Q-L - Рамноза
В свободном виде она встречается редко (в листьях сумаха — Rhus
toxicodendron). Получают ее при гидролизе глюкозидов.
К дезоксигексозам относится еще фукоза (D-6-дезоксигалактоза),
входящая в состав полисахаридов водорослей.
D-Фруктоза, плодовый сахар, левулёза. D-Фруктоза содержится в пло-
дах, в нектаре цветов. Отсюда ее название — плодовый сахар. Она вра-
щает поляризованный луч влево, и поэтому ее называют левулёзой. Фрук-
тоза входит в состав сахарозы и полифруктозидов (полисахаридов, образую-
щих при своем гидролизе фруктозу), встречающихся в растениях, особенно
из семейства сложноцветных (в клубнях земляной груши, в корнях кок-
72
сагыза, цикория). Полисахарид инулин построен из остатков молекул
D-фруктозы. В состав сложных углеводов фруктоза входит в виде О-фрук-
тофуранозы:
СН2ОН
I
с=о
I
носн
I
ИСОН
I
неон
I
сн2он
£)( — )-фруктоза
он н
а-О(— )-Фруктоза (фураноза)
Фруктозу получают при гидролизе инулина и сахарозы. Фруктоза
из водных растворов кристаллизуется в виде иголочек, имеющих состав
2СбН12О6‘Н2О, из спирта в виде безводных ромбических призм. Фруктоза
гораздо более сладка, чем иные углеводы. Удельное вращение водного рас-
твора D-фруктозы по окончании мутаротации равно —92,4°. Фруктоза лег-
ко сбраживается дрожжами.
Фруктоза встречается в фосфорилированном состоянии. Известны три
формы фруктозофосфорной кислоты: фруктозо-1-фосфорная кислота, фрук-
тозо-6-фосфорная кислота и фруктозо-1,6-дифосфорная кислота:
ОН
СН2—О—Р^О
^ОН
СОН
носн4^
I
неон о
сн----
сн2он
Фруктозе-1-фосфорная кислота
сн2он
носн
неон о
НС---- он
Фруктозо-6-фосфорная
кислота
ОН
СН.-О-Р^О
^он
сон
носн \
I
неон о
Фруктозо-1,6-дифосфорная
кислота
£-Сорбоза — кетогексоза, образующаяся при окислении шестиатом-
ного спирта — сорбита — некоторыми бактериями. Она является промежу-
точным продуктом при синтезе аскорбиновой кислоты (витамина С).
СНоОН
I
но—с—н
I
но—с—н
I
н—с—он
I
но—с—н
I
СН2ОН
Сорбит
н
он н
L-Сорбоза
73
Пентозы
Пентозы (С5Н10О5) входят в состав сложных веществ тканей животных
и растительных организмов. В малых количествах встречаются они в соке
созревших фруктов.
Молекулы альдопентоз имеют три асимметричных атома углерода,
кетопентозы — два атома. Исходя из этого, возможны 23=8 стереоизоме-
ров для альдопентоз и 22—4 для кетопентоз:
*снон
*снон
I
*снон
СН2ОН
СН2ОН
I
с=о
*снон
I
*снон
СН2ОН
Альдопентоза Кетопентоза
снон
I 0
снон
I
СН--------
I
СН2ОН
а-Альдопентоза
НО
Р-Альдопентоза
Циклические альдопентозы имеют в своих молекулах по четыре асим-
метричных атома углерода. Число изомеров циклических альдопентоз
должно равняться 24=16. Обычно встречаются три альдопентозы: L-араби-
ноза, D-ксилоза и D-рибоза и в виде их циклических форм (а- и р-форм):
НСОН
НСОН
НСОН
сн2
неон
неон
НОСН
НОСН
СН2ОН
L-Арабиноза
носн
пеон
СН2ОН
D-Ксилоза
НСОН
НСОН
I
СН2ОН
D-Рибоза
сн2он
D-Дезоксирибоза
D-Арабиноза часто встречается в растениях в составе слизей, гемицел-
люлозы и пектиновых веществ. Ее получают путем кислотного гидролиза
свекловичного жома и вишневого клея. Удельное ее вращение в водном
растворе по окончании мутаротации +104,5°. Арабиноза не сбраживается
дрожжами.
D-Ксилоза входит в состав растительных слизей и гемицеллюлозы.
Ее получают при кислотном гидролизе соломы, древесины, отрубей, куку-
рузных кочерыжек. Удельное вращение ксилозы в водных растворах по
окончании мутаротации +18,8°. Ксилоза используется в кондитерской про-
мышленности.
D-Рибоза входит в состав адениловой, гуаниловой, цитидиловой и ури-
диловой кислот и продуктов их фосфорилирования, в состав никотинамид-
аденин-динуклеотидов и нуклеиновых кислот, следовательно, веществ,
играющих очень важную роль в жизнедеятельности организма. Удельное
вращение D-рибозы в водном растворе по окончании мутаротации —23,7°.
D-Дезоксирибоза встречается в составе нуклеиновых кислот, входящих
в состав ядер клеток. D-рибоза и D-дезоксирибоза в фосфорилированном
74
виде являются продуктами распада нуклеиновых кислот и нуклеотидов,
а также образуются в пентозном цикле распада глюкозы (стр. 309):
НСОН
о
НСОН
н он
НСОН
с
НСОН
НС
НС
СН2ОН
D- Рибозо-1-фосфорная
кислота
£)-Рибозо-5-фосфорная
кислота
D-Дезоксирибозе-1 -фос-
форная кислота
II ОН
—
I
сн2
с
НСОН
I
НС-----
£)-Дезоксирибозо-5-фос-
форная кислота
Тетрозы
Тетрозы — моносахариды, имеющие в своих молекулах четыре атома
углерода. Среди них представляет интерес D-эритрозофосфорная кислота,
возникающая как промежуточный продукт при фотосинтезе, а также при
окислительном пентозном цикле распада углеводов (стр. 310):
НСОН
НСОН
СН2ОН
D-Эритроза
НСОН
НСОН
I /он
СН2О—Р=О
М>Н
D-Эритрозофосфорная
кислота
Гептозы
В природе известны две гептозы, встречающиеся в виде кетоформ —
D-гептулоза и D-манногептулоза.
Р-Гептулоза в фосфорилированном состоянии участвует в фотосинтезе.
Она также возникает как промежуточный продукт окислительного пентоз-
ного цикла распада углеводов в организме животных и растений.
СН2ОН
I
с=о
I
носн
I
НСОН
I
НСОН
I
НСОН
I
CILOH
D-Г люкозо-гептулоза
СН2ОН
I
с=о
I
носн
I
носн
I
НСОН
I
НСОН
СН.ОН
£)-Манногелтулоза
75
ОЛИГОСАХАРИДЫ
К олигосахаридам относятся углеводы, построенные из небольшого
количества моносахаридов; наиболее распространены из них дисахариды.
Дисахариды, как указывает название, построены из двух остатков
моносахаридов, соединенных друг с другом глюкозидной связью, т. е.
связью, идущей от редуцирующей (альдегидной или кетонной) группы
одного моносахарида к какой-либо группе другого моносахарида. В резуль-
тате соединения двух моносахаридов друг с другом выделяется молекула
воды. Обычно встречающиеся в природе дисахариды построены из молекул
гексоз, и эмпирическая формула их С12Н22ОП. Различаются дисахариды по
входящим в их состав моносахаридам и по форме их глюкозидных связей.
Так, например, мальтоза по своему строению является а-глюкозидо-1,4-
глюкозой. Это означает, что она состоит из двух остатков молекул а-глю-
козы, соединенных между собой глюкозидной связью, идущей от альде-
гидной группы одного остатка глюкозы к спиртовой группе в положении
4 второго остатка глюкозы. Целлобиоза — это р-глюкозидо-1,4-глюкоза.
Следовательно, она отличается от мальтозы тем, что построена из остатков
молекул р-глюкозы и а-глюкозы. Трегалоза является а-глюкозидо-1.1-
глюкозидом. Это означает, что она состоит из двух молекул а-глюкозы,
соединенных друг с другом связью, идущей от альдегидной группы одного
остатка глюкозы к альдегидной группе второго остатка глюкозы.
Приведем еще один пример. Сахароза — а-глюкозидо-1,2-р-фрукто-
зид — построена из остатка молекулы а-глюкозы и остатка молекулы
p-фруктозы, соединенных между собой связью, идущей от альдегидной
группы к кетонной группе фруктозы.
Из приведенных примеров видно, что дисахариды могут быть по-
строены из одного и того же моносахарида. Мальтоза, целлобиоза и трега-
лоза построены из глюкозы. Однако они по своим свойствам отличаются
друг от друга, что обусловлено их структурой; так, мальтоза построена
из двух остатков а-глюкозы, в то время как целлобиоза — из одного остат-
ка р-глюкозы и одного остатка а-глюкозы. Трегалоза состоит из двух остат-
ков а-глюкозы, как и мальтоза. Однако эти два дисахарида отличаются
друг от друга по форме своих глюкозидных связей. В молекуле трегалозы
имеется 1,1-глюкозидная связь, в молекуле же мальтозы глюкозидная
связь 1,4. Отличается также по своим свойствам от всех приведенных диса-
харидов сахароза, так как она построена из двух различных моносахари-
дов и имеет глюкозидную связь 1,2. Все дисахариды, за исключением сахаро-
зы, включают два моносахарида — пиранозы. Сахароза же построена из
глюко-пиранозы и фрукто-фуранозы.
Сахароза. Свекловичный сахар, тростниковый сахар
Сахароза — чрезвычайно широко распространенный дисахарид. Встре-
чается в стеблях, корнях, клубнях, в плодах и листьях растений: в корнях
сахарной свеклы до 27%, в стеблях сахарного тростника до 20%. Сахарная
свекла и тростник используются для промышленного получения сахарозы:
сн2он
н он он н
Сахароза
76
Сахароза легко растворима в воде. Кристаллизуется из воды в виде
больших моноклинических кристаллов. Удельное вращение водных рас-
творов +66,5°. Сахароза не обладает восстанавливающим свойством, так
как в ее молекуле редуцирующие группы (альдегидная и кетонная) связаны
друг с другом. Сахароза легко гидролизируется в разведенных кислотах
с образованием глюкозы и фруктозы. Глюкоза, как известно, вращает впра-
во (уд. вращение +52,5°). Фруктоза вращает влево (уд. вращение —92,4°).
Смесь фруктозы и глюкозы, образующаяся при гидролизе сахарозы, само
собой разумеется, вращает влево. Это смещение правовращения сахарозы
при ее гидролизе в левовращение носит название инверсии. Смесь глюкозы
и фруктозы получила название инвертного сахара. Интересно отметить,
что при кислотном гидролизе сахарозы имеет место переход фуранозной фор-
мы фруктозы, входящей в состав сахарозы, в пиранозную форму. Сахароза
подвергается гидролизу с помощью фермента сахаразы или инвертазы.
В этом случае образуется фуранозная форма фруктозы. Ферментативное
расщепление сахарозы происходит в кишечнике животных, а также в орга-
низме пчел при образовании меда. Пчелиный мед преимущественно состоит
из инвертного сахара. Сахароза — важный питательный продукт, имеющий
наряду с энергетическим также и вкусовое значение.
Мальтоза, солодовый сахар
Мальтоза образуется при ферментативном расщеплении крахмала
и гликогена, в свободном виде в природе не встречается. При хранении зерен
злаков во влажной и теплой атмосфере они образуют солод, богатый маль-
тозой (лат. maltum — солод). Мальтоза возникает в солоде как продукт
Мальтоза
ферментативного расщепления крахмала. Мальтоза образуется в пищева-
рительном тракте при воздействии на крахмал ферментов (амилазы слюны
и сока поджелудочной железы).
Мальтоза, как а-глюкозид-1,4-глюкоза, имеет в своей молекуле одну
свободную альдегидную группу и поэтому обладает восстанавливающими
свойствами. Удельное вращение мальтозы в водных растворах +130,4е.
При гидролизе мальтозы образуется а-О-глюкоза.
Трегалоза, грибной сахар
Трегалоза встречается в грибах, в рожках спорыньи, водорослях и в
некоторых высших растениях. Являясь а-глюкозидо-1,1 -а-глюкозид ом,
она не обладает восстанавливающими свойствами. При гидролизе трега-
лозы образуется a-D-глюкоза.
77
Трегалоза
Целлобиоза
Встречается в свободном виде в соке некоторых деревьев, образуется
она при гидролитическом расщеплении целлюлозы ферментом целлюлазой,
имеющейся у ряда микробов. Являясь р-глюкозидо-1,4-глюкозой, целло-
биоза обладает восстанавливающими свойствами.
Целлобиоза
Целлобиоза отличается от мальтозы тем, что в ее молекуле глюкоза,
потерявшая свой глюкозидный гидроксил, является р-глюкозой. Расщеп-
ление целлобиозы и мальтозы катализируется соответственно целлобиазой
и мальтазой.
Лактоза, молочный сахар
Лактоза содержится в молоке животных и человека и является един-
ственным углеводом пищи новорожденных млекопитающих животных и де-
тей. При гидролизе лактозы образуется глюкоза и галактоза.
D - Ла ктоза
Лактоза обладает восстанавливающими свойствами. Удельное вращение
лактозы +52,6®.
78
Раффиноза
Раффиноза (С18Н32О16) — трисахарид а-галактозидо-а-глюкозидо-+
фруктозид — встречается в семенах хлопчатника, сахарной свеклы, в манне
(засохшие выделения эвкалипта) и в других растениях:
Н ОН ОН Н
Раффиноза
При гидролизе раффинозы образуются галактоза, глюкоза и фруктоза.
Раффиноза не обладает редуцирующими свойствами. Удельное вращение
раффинозы в водном растворе +105,2°.
Сладкий вкус различных моносахаридов и олигосахаридов
Все моносахариды и олигосахариды обладают сладким вкусом, однако
сладость их неодинакова. Для характеристики степени сладости различных
углеводов обычно сладость сахарозы принимают за 100.
Сладость фруктозы составляет 173, инвертного сахара (смесь глюкозы
и фруктозы) —130, глюкозы —74, рамнозы —32, мальтозы —32, лактозы—
16 и ксилозы —40.
Из приведенных данных видно, что наибольшей сладостью обладает
фруктоза.
ПОЛИСАХАРИДЫ
Полисахариды — высокомолекулярные вещества, состоящие из боль-
шого количества (сотен и тысяч) остатков моносахаридов. Встречаются
полисахариды преимущественно в растениях как запасные вещества. Неко-
торые из них (целлюлоза, пектиновые вещества) играют в растениях опор-
ную роль. У животных полисахариды представлены гликогеном — запас-
ным веществом — и хитином, являющимся у насекомых структурным поли-
сахаридом.
Полисахариды по своему химическому строению могут быть разделены
на: гомополисахариды, построенные из остатков какого-либо одного моно-
сахарида (глюкозы, фруктозы, ксилозы и др.) и гетерополисахариды, по-
строенные из остатков различных моносахаридов и их производных. К важ-
нейшим гомополисахаридам относятся крахмал, целлюлоза, гликоген и
инулин.
Крахмал
Крахмал (С6Н12О5)Л является типичным резервным полисахаридом
растений. Откладывается он в виде зерен в клубнях и корнях, в зернах
злаков. Форма зерен крахмала различного происхождения неодинакова и
характерна для каждого вида растений. Содержание крахмала в зернах
пшеницы достигает 75%, кукурузы —72%, риса —80%. В клубнях карто-
феля содержание крахмала колеблется от 12 до 24%. Клубни картофеля —
наиболее дешевый материал для производственного получения крахмала.
79
Крахмал составляет главный углевод пищи человека. Из крахмала
путем гидролиза получают патоку, сладкий густой сироп, являющийся
неочищенной глюкозой, декстрины.
Крахмал имеет вид белого аморфного порошка, напоминающего пше-
ничную муку (картофельная мука). С раствором йода в водном растворе
йодистого калия (раствор Люголя) крахмал дает синее окрашивание, и этой
чрезвычайно чувствительной реакцией пользуются для его обнаружения.
Зерна крахмала состоят из двух близких друг к другу компонентов: амило-
пектина и амилозы. Крахмал при нагревании в воде до 60—80° клейстери-
зуется благодаря набуханию и клейстеризации амилопектина; амилоза же
в воде растворяется. Амилопектин и амилоза могут быть отделены друг
от друга. Оба они различно окрашиваются йодом: амилопектин с йодом
дает бурое окрашивание, амилоза — синее. При реакции крахмала с йодом
синее окрашивание амилозы перекрывает бурое окрашивание амилопек-
тина. Крахмал не обладает восстанавливающими свойствами.
Быстрое нагревание крахмала, содержащего обычно 10—20% воды,
приводит к некоторому его расщеплению с образованием декстринов.
Это явление носит название декстринизации крахмала. Слабо декстринизи-
рованный крахмал растворим в воде и называется растворимым крахмалом.
Под влиянием ферментов крахмал подвергается постепенному гидроли-
тическому расщеплению с образованием различных по своей сложности
декстринов, из которых в дальнейшем образуется мальтоза, а затем глюкоза.
Декстрины отличаются друг от друга по сложности своей структуры
и по своим свойствам. Одни из них близки по своей структуре к крахмалу
и окрашиваются йодом в синий или фиолетовый цвет (амилодекстрины).
Другие имеют меньший молекулярный вес и они, по мере упрощения струк-
туры, окрашиваются в темно-бурый и в красный цвет (эритро-декстрины).
Декстрины, не дающие окрашивания с йодом, носят названия ахродекст-
рины и мальтодекстрины.
Декстрины, особенно низкомолекулярные, обладают редуцирующими
свойствами
Глюкоза — конечный продукт ферментативного (а также кислотного)
гидролиза крахмала. Отсюда можно заключить, что как амилоза, так и
амилопектин построены из молекул а-глюкозы. Оба они имеют эмпириче-
скую формулу (С6Н10О&)л. Важно знать, как соединены между собой остат-
ки молекул глюкозы в амилозе и в амилопектине, иными словами, какова
их химическая структура.
Химическая структура амилозы и амилопектина. Химическая структура
амилозы и амилопектина может считаться выясненной. В молекуле амило-
зы остатки глюкозы связаны между собой глюкозидными связями, идущими
от первого атома углерода одного остатка глюкозы к четвертому атому угле-
рода другого остатка через кислородный мостик (глюкозидные связи 1,4).
Остатки глюкозы расположены в ряд, образуя длинную цепь. О длине
цепи можно получить представление, если учесть, что молекулярный вес
амилозы достигает 160000 и выше:
Рентгеноструктурные исследования выявили в молекуле амилозы не-
сколько параллельно идущих цепочек, соединенных друг с другом, причем
в каждой из цепочек остатки глюкозы расположены по спирали.
80
В молекуле амилопектина обнаружены глюкозидные связи 1,4 и 1,6.
Это обусловливает его разветвленную структуру. На 25 связей 1,4 в моле-
куле амилопектина приходится одна 1,6 связь:
Если каждый остаток глюкозы обозначить кружочком, то структу-
ру амилозы и амилопектина можно изобразить схематически (рис. 7).
Начало разветвлению в молекуле амилопектина дают 1,6-глюкозидные
связи. В ветвях амилопектина глюкозные остатки соединены друг с другом
1,4-глюкозидными связями. Молекулярный вес амилопектина достигает
400000 и выше.
Содержание амилозы и амилопектина в крахмале различных растений
неодинаково, причем амилопектина всегда содержится значительно больше,
чем амилозы. В пределах одного и того же растения препараты крахмала,
полученные из листьев и клубней, различаются по содержанию в них ами-
лозы и амилопектина.
Соотношения между амилозой и амилопектином в крахмале зависят
от возраста растения, сорта и условий его прорастания. Состав крахмала
различных растений таков:
Амилоза, %
Амилопек-
тин %
Картофель......................... 19—22 78—81
Рис.................................16—17 83—84
Кукуруза.......................... 21—22 78—79
Пшеница ......................... 22—24 76—78
Рис. 7. Схема строения молекулы амилозы (Л) и амило-
пектина (5). Кружочки—остатки молекул глюкозы
81
Целлюлоза
Целлюлоза (С6Н10О5)л относится к структурным полисахаридам. Из
нее преимущественно построены оболочки клеток растений; древесина
на 50% состоит из целлюлозы. В более чистом виде целлюлоза встречается
в волокнах хлопка, где она составляет примерно 90%. Вата может считаться
почти чистой целлюлозой.
Целлюлоза имеет большое пищевое значение для животных, особенно
для жвачных. Она в известной мере (от 40 до 60%), в зависимости от состава
пищи, используется в организме человека.
Расщепляется целлюлоза в кишечнике под влиянием ферментов микро-
организмов.
Целлюлоза нерастворима в воде. При гидролизе в крепкой серной
кислоте она распадается с образованием глюкозы, при гидролизе в разбав-
ленной серной кислоте, а также под влиянием фермента — целлюлазы,
она распадается с образованием целлобиозы. Последнюю считают струк-
турным компонентом целлюлозы.
Молекула целлобиозы построена из остатка а-глюкозы и из остатка
Р-глюкозы, следовательно, из остатков тех же глюкоз построена молекула
целлюлозы. Остатки молекул целлобиозы связаны между собой 1,4-глюко-
зидными связями. Учитывая, что молекула целлобиозы состоит из двух
глюкозных остатков, соединенных между собой 1,4 глюкозидной связью,
можно считать, что в целлюлозе имеются только одни 1,4 глюкозидные
связи.
Остаток целлобиазы
Остаток целлобиозы
Молекулярный вес целлюлозы еще не установлен окончательно. По
имеющимся данным, молекула целлюлозы содержит до 10 000 глюкозных
остатков. Рентгеноструктурный анализ показывает, что молекулы целлю-
лозы имеют нитевидную структуру.
Нитевидные молекулы целлюлозы с помощью водородных связей сое-
диняются друг с другом с образованием пучков. Каждый пучок состоит из
60 молекул целлюлозы.
Лихенин
Лихенин (С6Н10О5)я — полисахарид, построенный из D-глюкозы, со-
держится в лишайниках. Остатки молекул глюкозы в лихенине связаны
друг с другом глюкозидными связями 1,4 (73%) и глюкозидными связями
1,3 (27%). Лихенин растворим в горячей воде и в разведенных водой ще-
лочах.
Лихенин является важным кормовым продуктом северных оленей.
В кишечнике оленей он расщепляется ферментами микроорганизмов.
Гликоген, животный крахмал
Гликоген (С6Н10О5)л является запасным углеводом организмов живот-
ных и человека. Значительные количества гликогена содержатся в печени,
в скелетных мышцах и в сердце. В меньших количествах гликоген входит
в состав головного мозга и гладких мышц. Содержание гликогена в печени
82
и в мышцах зависит от степени упитанности животного. В печени оно колеб-
лется в пределах от 2 до 10%, в скелетных мышцах — от 0,2 до 2%. При го-
лодании содержание гликогена в мышцах и в печени сильно снижается (в
печени до десятых долей процента). Гликоген используется при работе мышц.
В утомленных мышцах содержание гликогена очень невелико.
Гликоген обнаружен в грибах и в дрожжах.
Гликоген растворяется в горячей воде с образованием опалесцирую-
щего раствора. Он окрашивается йодом в красно-бурый цвет, близкий к цве-
ту окрашенного йодом амилопектина. Гли-
коген не обладает восстанавливающими
свойствами. При гидролизе гликогена раз-
бавленной минеральной кислотой, а также
при расщеплении его ферментами образу-
ется а-/)-глюкоза. Остатки молекул глю-
козы в молекулах гликогена соединены
друг с другом глюкозидными связями 1,4
и 1,6. Таким образом, подобно амилопек-
Рис. 8. Схема строения молекулы
гликогена. Кружочки — остатки
молекул глюкозы
тину, молекула гликогена имеет ветвис-
тую структуру, при этом в ней большее
количество 1,6 глюкозидных связей (на 12
связей 1,4 приходится одна 1,6 связь), чем
в молекуле амилопектина, и, следовательно, она более разветвлена и бо-
лее компактна (рис. 8).
Молекулярный вес различных гликогенов колеблется от 400 000 до
4 000 000, что соответствует наличию в их молекулах от 2400 до 24 000
глюкозных остатков.
Инулин
Инулин (С6Н10О5)л встречается в растениях реже, чем крахмал. Содер-
жится он в больших количествах в клубнях земляной груши, георгин,
в корнях кок-сагыза, в артишоках. Инулин растворим в воде и при гидро-
лизе при кислой реакции расщепляется с образованием фруктозы. Удельное
вращение инулина —39°. В молекуле инулина фруктоза представлена в виде
фуранозы. Остатки молекул фруктозы в количестве 28 соединены друг с
другом глюкозидными связями 1,2:
одним из полифруктозидов, встречающихся в расте-
Инулин является
НИЯХ.
Декстран
Полисахарид декстран (С6Н10О5)л образуется в результате деятельности
микроорганизма Leuconostoc mesenteroides. Построен он из молекул a-Z)-глю-
козы, соединенных друг с другом 1,6 и 1,4 глюкозидными связями, причем
благодаря 1,6 глюкозидным связям получается цепь из глюкозных остатков,
глюкозидные же связи 1,4 стоят на местах разветвления цепи. Этим струк-
тура декстрана отличается от структуры амилопектина и гликогена. Вод-
ные растворы декстрана вводятся в кровяное русло при кровопотерях в
83
качестве временных заменителей плазмы крови, так как они обладают вяз-
костью, близкой к вязкости крови, и создают необходимое онкотическое
давление (стр. 223).
Пектиновые вещества
Пектиновые вещества содержатся в плодах (яблоки, груши, цитрусо-
вые, виноград), в мясистых корнях (свекла, морковь) и в соках растений;
с сахарозой и кислотами они дают студни. В основе структуры пектиновых
веществ лежит цепь из остатков D-галактуроновой кислоты, соединенных
друг с другом 1,4-глюкозидными связями. Карбоксильные группы остатков
галактуроновой кислоты в большей или меньшей мере этерифицировапы
метиловым спиртом:
соон
с/0
H(LhH
I
ИОСИ
носн
I
неон
I
соон
н он
D-Г алактуронозая
кислота
Пектиновые вещества в растениях обычно сопровождаются полисаха-
ридами галактонами, построенными из остатков молекул галактозы, и ара-
банами (пентозанами), состоящими из остатков молекул арабинозы. Пек-
тиновые вещества находят применение в кондитерской промышленности.
Гемицеллюлозы
Гемицеллюлозы относятся к гетерополисахаридам, так как они по-
строены из различных моносахаридов. Гемицеллюлозы в растениях сопро-
вождают целлюлозу, но они легче, чем целлюлоза, подвергаются гидролизу.
Существовало предположение, что гемицеллюлозы являются промежуточ-
ными продуктами образования в растениях целлюлозы. Изучение химиче-
ской природы гемицеллюлоз показало неправильность этого предполо-
жения.
При гидролизе гемицеллюлоз образуются £)-галактоза, £)-ксилоза,
D-арабиноза, уроновые кислоты (продукты окисления первичной спирто-
вой группы моносахаридов) и иногда/)-манноза и£)-глюкоза. В зависимости
от входящего в их состав моносахарида гемицеллюлозы носят название ма-
нанов, галактанов или петозанов — ксиланов и арабанов. Во всех случаях
приходится говорить о преобладании в той или иной гемицеллюлозе опре-
деленного моносахарида, так как при гидролизе всегда образуется смесь
различных моносахаридов. Гемицеллюлозы извлекаются из растительных
материалов разведенными растворами щелочей. Мицеллы плесневых грибов
рода Penicillium выделяют в питательную среду водорастворимые гемицел-
люлозы, манан и галактан.
Агар-агар
Агар-агар содержится в красных морских водорослях. При гидролизе
агар-агара образуется D-галактоза и серная кислота. Остатки молекул га-
лактозы соединены друг с другом глюкозидными связями. Основной струк-
84
турной единицей агар-агара является цепочка, состоящая из шести соединен-
ных Друг с другом глюкозидными связями остатков галактозы; к первич-
ной спиртовой группе галактозного остатка присоединен остаток серной
кислоты £>-галактозидо-£)-галактозидо-£)-галактозидо-1)-галактозидо-£)- га-
лактозидо-£)-галактоза-6-сульфат.
Молекула агар-агара возникает в результате конденсации большого
количества структурных единиц (до 140).
Агар-агар не растворим в холодной, но растворяется в горячей воде.
При охлаждении водных растворов агар-агара образуется студень. Агар-
агар применяется в бактериологической ^практике для изготовления твер-
дых питательных сред, а также в кондитерской промышленности для изго-
товления мармелада, пастилы и желе.
Слизи и гумми
Слизи и гумми — продукты растительного происхождения, раствори-
мые в воде. По своему составу они являются полисахаридами. К гумми
относится клей, выделяющийся в местах повреждений ветвей и стволов кос-
точковых плодовых деревьев (вишен, слив, миндаля). При гидролизе полиса-
харидов вишневого клея образуются галактоза, манноза, арабиноза, глю-
куроновая кислота и в малом количестве ксилоза. Слизи богаты пентозанами.
Мукополисахариды
Растворы мукополисахаридов и их белковых комплексов (лат. mucor —
слизь) имеют слизистый характер. Они входят в состав межклеточного веще-
ства соединительной ткани и ряда слизистых жидкостей. К мукополисаха-
ридам относятся гиалуроновая кислота, хондроитинсерная кислота и ге-
парин. По содержанию в них остатков кислот (серной, глюкуроновой)
они входят в группу кислых мукополисахаридов. Наряду с ними имеется
группа нейтральных мукополисахаридов. В их составе отсутствуют серная
и глюкуроновая кислоты. Все они являются гетерополисахаридами.
Гиалуроновая кислота — наиболее изученное соединение из крупномо-
лекулярных мукополисахаридов (молекулярный вес 200 000—500 000).
Она встречается в стекловидном теле глаза, в жидкости суставных сумок
(синовиальная жидкость), в пупочном канатике, оболочке яйцеклетки,
злокачественных опухолях, в капсулах некоторых бактерий и др. При
гидролизе гиалуроновой кислоты образуются эквимолекулярные количе-
ства глюкозамина (стр. 88), глюкуроновой кислоты (стр. 88) и уксусной
кислоты. При ферментативном гидролизе (фермент гиалуронидаза) гиалу-
роновая кислота расщепляется с образованием глюкуроновой кислоты и
TV-ацетилглюкозамина. Структурной единицей гиалуроновой кислоты яв-
ляется дисахарид гиалобиуроновая кислота (3[р-£)-глюкуронозидо-(1,5)]-
2У-ацетил-£)-глюкозамин). При растворении в воде гиалуроновая кислота и
ее соли образуют коллоидальные растворы очень высокой вязкости (гели):
Н HNCOCH3 Н ОН
3 [р-£)-глюкуронозидо-(1,5]-М-ацетил-Р-глюкозамин
85
Гиалуроновая кислота играет важную роль в организме. Вследствие
высокой вязкости она влияет на проницаемость оболочек клеток и препят-
ствует проникновению в ткани микробов. В бактериях, отличающихся вы-
сокой инвазионностью (инвазия — вторжение), в пчелином и змеином яде,
в сперме, в быстро растущих опухолях и в некоторых других тканях со-
держится гиалуронидаза (комплекс ферментов), катализирующая посте-
пенный гидролиз гиалуроновой кислоты с образованием ацетилглюкозамина
и глюкуроновой кислоты. Расщепление гиалуроновой кислоты, цементи-
рующей фолликулярные клетки вокруг яйцеклетки, гиалуронидазой спер-
мы имеет большое значение в процессе оплодотворения яйца.
Гиалуроновая кислота входит в состав основного вещества соединитель-
ной ткани.
Хондроитинсерная кислота, подобно гиалуроновой кислоте, содержится
в большом количестве в основном веществе соединительной ткани, особен-
но ее много в хрящах. Соединяясь с белками, она образует хондро-
мукоиды.
Хондроитинсерная кислота при полном гидролизе образует прибли-
зительно эквимолекулярные количества 2-дезокси-2-амино-£)-галактозы
(хондрозамина или галактозамина, стр. 88), глюкуроновой кислоты, сер-
ной кислоты и уксусной кислоты. При частичном ее гидролизе образуется
хондрозин (3-[p-D-глюкуронозидо-(1,5) ]-7У-ацетил-1)-галактозамин), кото-
рый, по-видимому, является структурной единицей хондроитинсерной
кислоты.
Остатки серной кислоты в молекуле хондроитинсерной кислоты при-
соединяются к первичным спиртовым группам галактозамина.
Гепарин (лат. hepar — печень). Гепарин широко представлен в тканях
животных и в значительных количествах содержится в печени, сердце,
мышцах, легких. Гепарин выделен из тканей в кристаллическом виде.
При гидролизе он образует глюкозамин (см. стр. 88), глюкуроновую кислоту,
серную кислоту и уксусную кислоту. Гепарин содержит больше серной
кислоты, чем хондроитинсерная кислота. Полагают, что структурной еди-
ницей гепарина является тетрасахарид, построенный из глюкозамина и
глюкуроновой кислоты и этерифицированный пятью или шестью остатками
серной кислоты.
Гепарин уже в ничтожно малых количествах задерживает свертывание
крови, связывая участвующую в этом процессе тромбокиназу. Он является
мощным природным антикоагулянтом. Гепарин получил применение в
медицинской практике. Его используют как средство для предотвращения
тромбозов, а также в качестве стабилизатора крови при переливании крови
(стр. 552).
Хитин
Хитин широко распространен в природе. Из него построена внешняя
оболочка (кутикула) ряда беспозвоночных животных. У насекомых, раков
и крабов хитин составляет 0,25—0,5% их сухого веса. Вместе с минераль-
ными веществами и белками хитин образует защитный панцирь этих жи-
вотных.
Хитин нерастворим в обычных растворителях и устойчив к щелочному
гидролизу. Он расщепляется при длительном гидролизе в сильной кислоте
с образованием глюкозамина и уксусной кислоты. Молекула хитина по-
строена из остатков Д^-ацетил-О-глюкозамина, соединенных между собой
1,4-глюкозидными связями. Эти остатки, числом в несколько сот, распо-
ложены в цепочку.
86
Бактериальные полисахариды
Среди полисахаридов, встречающихся в бактериях, особый интерес
представляют иммуноспецифические полисахариды. Все они имеют в своем
составе ацетилированные и неацетилированные аминогексозы, глюкуроно-
вую кислоту и отличаются друг от друга по содержанию азота, количеству
ацетильных групп, оптической активностью, вязкостью и т. д. При введе-
нии в организм животного в составе бактериальных антигенов или в виде
искусственных комплексов с белковыми веществами они вызывают образо-
вание специфических для каждого из них антител (стр. 44).
Специфические полисахариды бактерий определяют серологическую
специфичность бактериальных антигенов, откуда и их название — специфи-
ческие полисахариды.
ПОЛИСАХАРИДЫ ГРУПП КРОВИ
Из эритроцитов крови, из тканей человека и животных получены поли-
сахариды, определяющие групповую специфичность крови человека и
животных (группы крови А, В, О). Эти полисахариды содержат глюкоз-
амин, галактозу и маннозу и связаны в эритроцитах и тканях с белками.
ПРОИЗВОДНЫЕ УГЛЕВОДОВ
Моносахариды можно рассматривать как продукты окисления много-
атомных спиртов. При окислении сорбита образуется D-глюкоза, при окис-
лении маннита — манноза и т. д. С другой стороны, моносахариды, окис-
ляясь, превращаются в соответствующие кислоты:
СН2ОН
ЫСОН
НОСН
неон
неон
сн2он
Сорбит
СООН соон
неон
4Н2О
НОСН Zc*
неон
неон
СНоОН
Глюкоза
неон
нс2он
СН2ОН
Глюконовая
кислота
неон
носн
неон
I
неон
соон
Сахарная
кислота
Каждая альдогексоза может дать начало образованию трех кислот.
Так, например, из глюкозы образуются глюконовая, сахарная и глюкуро-
новая кислоты, из галактозы — галактоновая, слизевая и галактуроновая
кислоты и т. д.
Гексуроновые кислоты
Кислоты, образующиеся из альдогексоз при окислении первичной спир-
товой группы, носят название гексуроновых кислот. Глюкуроновая и
галактуроновая кислоты входят в состав различных гетерополисахаридов
(стр. 88):
87
COOH
COOH
a-D-Глюкуроновая кислота
a-D-Галактуроновая кислота
Глюкуроновая и галактуроновая кислоты обладают восстанавливаю-
щими свойствами. Они способны реагировать с другими веществами с обра-
зованием глюкозидных связей.
Глюкуроновая кислота в организме человека и животных связывается
с некоторыми ядовитыми веществами, давая так называемые парные соеди-
нения, не обладающие ядовитыми свойствами. Парные соединения глюкуро-
новой кислоты выделяются с мочой (подробнее о глюкуроновой кислоте
см. стр. 514).
Аминогексозы
К производным углеводов относятся аминосахара (аминогексозы).
Эти вещества входят в состав различных гетерополисахаридов. Они инте-
ресны тем, что по своей химической природе напоминают а-аминокислоты>
компоненты белковых молекул:
IICNFL
hcnh2
НОСН
НСОН
НСОН
СН2ОН
Глюкоза мин
НОСН
НОСН
НСОН
сььон
Галактозамин
Гетерогликозиды
Большую группу веществ — производных углеводов — составляют ге-
терогликозиды. В олигосахаридах и в полисахаридах моносахариды соеди-
нены друг с другом глюкозидной связью. В гетерогликозидах также имеет-
ся глюкозидная связь, но она направлена от альдегидной или кетонной
группы к соединению неуглеводной природы. Неуглеводная часть гетеро-
гликозида носит название агликона.
Гетерогликозиды содержатся в растениях. Некоторые гетерогликозиды
находят применение в медицинской практике. К наиболее простым по свое-
му строению гетерогликозидам относятся а- и £-мети л гликозиды. Аглико-
ном у них является остаток метилового спирта:
88
сн2он
а-Метилгликозид
сн?он
₽-Метилгликозид
В листьях и косточках плодов многих растений из семейства розо-
цветных (вишня, слива, абрикос, персик, миндаль, рябина, яблоня) содер-
жится гетерогликозид амигдалин. Особенно много амигдалина в горьком
миндале. Одной из составных частей агликона амигдалина является синиль-
ная кислота. Отравление, наступающее при большом потреблении горького
миндаля, вызывается действием синильной кислоты, освобождающей-
ся при распаде амигдалина. Распад амигдалина катализируется имеющим-
ся в горьком миндале и вырабатываемым некоторыми кишечными бакте-
риями ферментом эмульсином.
Амигдалин состоит из дисахарида гентиобиозы (построенного из двух
остатков (3-глюкозы), соединенного глюкозидной связью с агликоном, по-
строенным из бензойного альдегида и синильной кислоты:
Остаток дисахарида Агликон
Амигдалин
В наперстянке, ландыше, семенах строфанта содержатся гетерогли-
козиды — дигиталин, строфантин, применяемые при лечении расстройств
сердечно-сосудистой системы. Агликонами у этих гликозидов являются
производные фенантрена.
В ботве, клубнях и особенно в ростках картофеля имеется гетерогли-
козид — соланин, обладающий ядовитым действием. Обычно соланин
находится на поверхности клубней и удаляется при чистке картофеля. Он
разрушается также при варке картофеля. Углеводная часть соланина со-
стоит из трисахарида, построенного из остатков рамнозы, галактозы и глю-
козы. Гетерогликозиды, аглюконами которых являются производные фе-
нантрена, составляют группу сапонинов. Эти вещества хорошо растворимы
в воде и обладают ядовитыми свойствами. При попадании в кровь они вы-
зывают разрушение эритроцитов — гемолиз. Углеводная часть сапонинов —
гетерополисахарид, построенный из глюкозы, галактозы, арабинозы и ме-
тилпентозы.
В корнях яблонь, груш, вишен и других деревьев содержится глико-
зид, известный под названием флоридзина. Флоридзин при введении его
в организм животных вызывает снижение содержания глюкозы в крови
89
(гипогликемию) при одновременном выведении глюкозы с мочой (глюко-
зурию). Флоридзин действует на ткань почек, делая ее более проницаемой
для имеющейся в крови глюкозы. Флоридзин, далее, тормозит действие фос-
форилазы. Эти характерные особенности действия флоридзина широко ис-
пользованы при изучении углеводного обмена:
Остаток глюкозы
СО—СН5—СНа
/с\ /с\
-С СОН НС СН
НС. ,ЗН нсх .СН
Л / ч/
сон сон
Оксифенилпропи-
Флороглюцин ОНОвая кислота
_________(остаток) t
Агликон-фло ретин
Флоридзин
Молекула флоридзина построена из остатков глюкозы, флороглюцина
и оксифенилпропионовой кислоты. Агликон флоридзина носит название
флоретин.
В растениях встречаются гетерогликозиды, агликон которых представ-
лен производными флавона или оксифлавона. Эти гликозиды могут быть
получены из синих, желтых и красных пигментов цветов, листьев и коры
ряда деревьев, оболочек плодов цитрусовых:
СН О СН сон
\у\/
сон со
СОН СН
СН О СН СОН
сон со
Флавон
нос
НС
Оксифлавон
Углеводы, обычно рамноза и глюкоза, присоединены к той или иной
спиртовой группе флавона или оксифлавона. Некоторые гетерогликозиды,
построенные из производных флавона и рамнозы, обладают свойствами вита-
мина Р. Отсутствие последнего в пище приводит к ломкости капилляров,
к усилению проницаемости их стенок, что может служить причиной само-
произвольных кровотечений, кровоизлияний во внутренние органы, мышцы,
суставы, кожу (см. витамин Р, стр. 124).
Инозит, мышечный сахар (СбН12С6), впервые выделен из мышц после
обработки их кислотой; он может быть отнесен к производным углеводов,
так как легко образуется в растениях из глюкозы. По своей химической
природе инозит является шестиатомным спиртом, производным бензола.
В растениях инозит встречается в виде ряда изомеров, причем из них
наиболее распространен мезоинозит. В растениях инозит часто встречается
Мезоинознт
90
в виде эфира с фосфорной кислотой, известного под названием фитина.
Фосфорилированный инозит — фитин применяется в медицинской практике.
Инозит входит в состав некоторых фосфатидов (стр. 125). Он также является
фактором роста для некоторых микробов, и его поэтому относят к числу
витаминов (стр. 125).
Изучение углеводов приводит к заключению, что химическая природа
их разнообразна, что они чрезвычайно распространены в органическом мире,
где играют важную физиологическую роль.
ЛИТЕРАТУРА
Бычков С. М. Мукополисахариды и мукопротеиды глаза. Успехи совр. биол.,
т. 41, 1956.
Степаненко Б. Н. Современные представления о строении полисахаридов
крахмала. Успехи биологической химии, т. 5, 1963.
Трустановский А. А. Мукоидные вещества тканей животных. Успехи
современной биологии, т. 54, 1962.
Глава пятая
ЛИПИДЫ
К липидам относятся различные по своей химической природе веще-
ства, обладающие одним общим физическим свойством, — они не раствори-
мы в воде и растворяются в органических растворителях (эфире, хлороформе,
бензоле, толуоле, спиртах, ацетоне и т. д.). Различные липиды не одинаково
легко растворимы во всех органических растворителях: одни из них хоро-
шо растворимы в эфире, но плохо растворимы в ацетоне, иные растворимы
в бензоле, но нерастворимы в спирте и т. д. Этим пользуются для их разде
ления.
Липиды по своей химической природе делятся на следующие группы.
1. Жиры.
2. Высокомолекулярные жирные кислоты.
3. Воска.
4. Фосфолипиды.
5. Цереброзиды.
6. Стерины и стериды.
7. Каротины и близкие к ним вещества.
8. Прочие липиды.
В клетках и тканях живых существ одновременно встречаются раз-
личные липиды. Одни из них — жиры, фосфолипиды, стериды, являющиеся
сложными эфирами, при нагревании со щелочью гидролизуются (омыляют-
ся). иные — стерины, каротины — при этом не подвергаются изменениям.
Пользуясь методом гидролиза в щелочи, можно липиды, входящие в состав
тканей, расчленить на две фракции: омыляемую и неомыляемую. Омыляе-
мая фракция состоит преимущественно из жиров, фосфолипидов и стеридов.
ЖИРЫ, ТРИГЛИЦЕРИДЫ
Жиры относятся к числу очень распространенных в органическом ми-
ре веществ. Количество жиров в организмах человека и животных сильно
варьирует. В известных случаях (при сильном ожирении) содержание жира
в организме человека составляет до 50% его веса. До 50% веса составляет
жир в организме зимнеспящих животных перед их залеганием в спячку
осенью. Высокого уровня достигает содержание жира у сельскохозяй-
ственных животных (свиней, рогатого скота и птиц) при специальной от-
кормке их. У животных различают жиры запасные и жиры протоплазмати-
ческие. Первые откладываются в подкожной жировой клетчатке и в саль-
никах в виде капелек жира. Вторые входят в состав протоплазмы, образуя
комплексы с белками, и количество их не зависит от степени упитанности
организма. При голодании, а также при недостаточном питании в организме
исчезает запасной жир, процентное содержание же протоплазматического
жира остается без явных изменений в тканях, даже в случаях крайнего ис-
тощения организма. Запасной жир легко извлекается из жировой ткани ор-
92
ганическими растворителями (например, эфиром). Протоплазматический
жир удается извлечь только лишь после предварительной обработки тканей,
приводящей к денатурированию белков. При денатурировании белков про-
топлазмы распадаются комплексы белков с жирами и другими липидами,
и они становятся растворимыми в эфире и в иных растворителях.
Различное поведение запасных и протоплазматических жиров
указывает на их различную роль. Запасные жиры составляют в ор-
ганизме энергетический резерв, используемый по мере надобности. Прото-
плазматический же жир является структурным компонентом протоплазмы.
Жиры содержатся в растениях в сравнительно небольших количествах.
Исключение составляют масличные растения, семена которых отличаются
высоким содержанием жира. Растительные жиры носят название масел.
Жиры относятся к числу важных в биологическом отношении веществ.
Они играют прежде всего энергетическую роль как вещества, входящие в
состав пищи и освобождающие большое количество энергии при своем
распаде с образованием конечных продуктов — СО2 и Н2О (при распаде
одного грамма жира освобождается 9,3 килокалорий, в то время как при
распаде одного грамма углеводов —4,2 килокалорий).
Жиры участвуют в процессах теплорегуляции организма. Находясь
в подкожной жировой клетчатке, жиры как плохие проводники тепла
предохраняют внутренние органы от охлаждения. В этом отношении особен-
но большое значение имеют жиры млекопитающих животных, обитателей
водоемов — морей, океанов, озер и рек.
Поверхностный слой жира, кроме того, охраняет организм от травм.
Важное значение имеют жиры как смазочные вещества. Выделяясь
кожными железами, они придают коже эластичность и охраняют ее от вы-
сыхания. Водоплавающие птицы смазывают жиром (выделение кобчиковой
железы) перья, что делает их несмачиваемыми водой.
Жиры широко применяются как сырье для изготовления различных
сортов мыла, в лакокрасочной промышленности, при производстве смазок
и т. д.
Жиры являются сложными эфирами глицерина и жирных кислот.
Их называют также триглицеридами, или нейтральными жирами. Природ-
ные жиры — смеси различных триглицеридов:
CH2O-OCR
CHO-OCRj
I
CII2O-OCR2
ХИМИЯ ЖИРОВ
В состав жиров входят различные жирные кислоты. Все они имеют
неразветвленную цепь из атомов углерода. Число атомов углерода, как
правило, четное. Жирные кислоты, входящие в состав жиров, могут быть
насыщенными и ненасыщенными. Из насыщенных жирных кислот в составе
жиров часто встречаются стеариновая кислота СН3(СН2)16СООН и пальми-
тиновая кислота СН3(СН2)34СООН. Обе эти жирные кислоты при комнатной
температуре твердые, плавятся при нагревании. Из ненасыщенных жирных
кислот в жиры чаще всего входит олеиновая кислота СН3(СН2)7СН=
=СН(СН2) 7СООН. Олеиновая кислота имеет в своей молекуле одну двой-
ную связь. В составе жиров реже встречаются другие ненасыщенные жир-
ные кислоты: линолевая, линоленовая и арахидоновая.
СН3(СН2)4СН^СНСН9СН^СН(СН2) 7СООП — линолевая кислота,
СН3СН2СН=СНСН2СН=-СНСНоСН-СН(СН.,)7С00Н — линоленовая кис-
лота , СН 3(СН2)4СН—СНСН 2СН =-СНСН 2СН=СНСН 2СН=СН(СН2) 3соон—
арахидоновая кислота.
93
Молекула первой жирной кислоты имеет цепь из 18 атомов углерода
и две двойные связи. В молекуле второй жирной кислоты цепь также из
18 атомов углерода, но она более не насыщена, так как у нее три двойные
связи. Молекула третьей жирной кислоты имеет четыре двойные связи при
наличии цепи из 20 атомов углерода.
Линолевая, линоленовая и арахидоновая кислоты представляют очень
большой интерес. Они, в отличие от иных жирных кислот, не синтезируются
в организмах человека и животных и должны доставляться с пищей. При
недостатке в пище жиров, имеющих в своем составе линолевую, линолено-
вую и арахидоновую кислоты, наблюдаются патологические явления, на-
рушаются процессы обмена веществ. Физиологическая роль этих жирных
кислот остается еще далеко не выясненной.
Линолевая и линоленовая кислоты содержатся в составе жиров льня-
ного и подсолнечного масла.
СВОЙСТВА жиров
Ненасыщенные жирные кислоты при комнатной температуре находятся
в жидком состоянии. Подобно иным ненасыщенным соединениям, ненасы-
щенные жирные кислоты существуют в цис- или в транс-форме. Природная
олеиновая кислота является ^w-изомером. При обработке ее азотной кисло-
той она переходит в транс-форму, которая носит название элаидиновой
кислоты.
СН3(СН2)7-СН
НООС(СН2)7СН
Олеиновая кислота
СН3(СН2)7-СН
НС(СН2)7СООН
Элаидиновая кислота
Температура плавления жиров зависит от входящих в их состав жир-
ных кислот. Чем выше содержание ненасыщенных жирных кислот, тем
ниже температура плавления жиров. Растительные жиры (масла) затверде-
вают при температурах ниже 0°. Температура плавления жиров неодинако-
ва у животных одного и того же вида. Жир подкожной жировой клетчатки
имеет более высокую точку плавления, чем жир внутренний — сальников.
Жир
Говяжий жир
Свиное сало .
Бараний жир
Гусиный жир
Куриный жир
Температура
плавления. °C
25—30
36—45
44—50
25—35
33—40
Жир Температура
плавления. °C
Коровье масло .... 28—33
Подсолнечное мас-
ло ................ —21
Хлопковое масло . . —34
Конопляное масло . . —17
Льняное масло . . . —17
Жиры различного происхождения отличаются друг от друга по составу
входящих в них жирных кислот. Как правило, в организмах животных и
растений встречается смесь различных жиров. Естественно, что при извле-
чении жира из жировых тканей (вытапливанием или прессованием) полу-
чают смесь жиров — триглицеридов. В этих смесях жиров преобладают те
или иные жирные кислоты.
Жиры получают названия по входящим в их состав жирным кислотам.
Так, например, различают жир тристеарид, имеющий в своем составе три
остатка стеариновой кислоты, триолеид — с тремя остатками олеиновой
кислоты, стеародипальмитид — с одним остатком стеариновой кислоты
и двумя остатками пальмитиновой кислоты и т. д.
Жиры при гидролизе расщепляются с образованием глицерина и жир-
ных кислот. Гидролиз жира может быть осуществлен с помощью перегретого
94
Кислота Содержание жирных кислот, %
говя- жий жир бара- ний жир коро- вье масло олив- ковое масло
Масляная (С4) - . — 4,2
Капроновая (Св) — — 1,3 - *
Октановая (С8) — — 0,5 —
Дециловая (Сю) — —
Лауриновая (Сю) 3,0 •
Миристиновая (С44) 6 2 7 0,5
Пальмитиновая (Сю) 33 25 26 10
Стеариновая (Сю) 28 26 16 3,5
Пальмитолеиновая (Сю» ненасыщ.) 2 — 1,0
Олеиновая (С18, ненасыщ.) 29 42 35 76
Линолевая (Сю, ненасыщ.) 1,5 5 2,0 9
Арахидоновая (С2о, ненасыщ.) 0,5 -- - 3,2
пара, минеральных кислот и щелочей. В присутствии щелочи получающиеся
при расщеплении жиров жирные кислоты нейтрализуются с образованием
солей. Соли высокомолекулярных жирных кислот носят название мыл.
Свойства мыл зависят от входящих в их состав катионов. Натронное мыло
(хозяйственное, туалетное мыло) — твердое, растворимое в воде.
Калийное мыло (так называемое зеленое мыло) — жидкое и растворимо
в воде. Мыла щелочноземельных и тяжелых металлов в воде не растворимы.
Из нерастворимых в воде мыл имеет применение свинцовое мыло (свинцо-
вый пластырь).
Жиры различного происхождения, как уже указывалось, неоднородны,
представляют собой смеси различных триглицеридов, к которым примеша-
ны также свободные жирные кислоты.
Естественные жиры характеризуются некоторыми химическими пока-
зателями. к ним относятся:
1) кислотное число — количество миллиграммов КОН, не-
обходимое для нейтрализации одного грамма жира. Оно указывает на ко-
личество имеющихся в жире свободных жирных кислот; 2) ч и с л о омы-
ления выражается количеством миллиграммов КОН, необходимым для
омыления одного грамма жира. Так как один грамм жирных кислот с низ-
ким молекулярным весом требует больше КОН для своей нейтрализации,
чем один грамм высокомолекулярных жирных кислот, число омыления за-
висит от молекулярного веса жирных кислот, входящих в состав триглице-
ридов и освобождающихся при гидролизе; 3) йодное число выражает-
ся количеством граммов йода, которое связывается 100 граммами жира или
масла. Так как йод присоединяется к жирным кислотам по месту их двой-
ных связей, то естественно, что йодное число характеризует степень нена-
сыщенности жирных кислот в триглицеридах.
Жиры при хранении прогоркают. Прогоркание жира зависит от появ-
ления продуктов превращения жирных кислот, главным образом альдеги-
дов. Чем больше ненасыщенных жирных кислот в составе жиров, тем легче
они взаимодействуют с кислородом и быстрее прогоркают. Растительные
жиры (масла) с высоким содержанием ненасыщенных жирных кислот про-
горкают быстрее, чем твердые жиры животного происхождения. Для пре-
дохранения жиров от прогоркания (порчи) ограничивают доступ к ним кис-
лорода.
Жиры способны присоединять к себе при известных условиях водород,
т. е. гидрогенизироваться. Водород присоединяется по месту двойных связей
ненасыщенных жирных кислот. Жидкие при комнатной температуре жиры
(масла), гидрогенизируясь в присутствии катализаторов, превращаются
в твердые жиры. Гидрогенизация предохраняет жиры от прогоркания.
К гидрогенизированным жирам относится маргарин — пищевой продукт,
95
не уступающий по своей калорийной ценности коровьему маслу и иным
жирам. При гидрогенизации жира разрушаются витамины, поэтому для
повышения пищевых качеств маргарина его обогащают витаминами или
продуктами с высоким содержанием витаминов (например, яичным желтком).
Одной из интересных особенностей жиров является способность их
к эмульгированию. При взбалтывании жидкого жира с водой образуется
эмульсия — взвесь мельчайших капелек жира в воде. При стоянии эмуль-
сии капельки жира сливаются и всплывают над слоем воды. Наряду с такой
нестойкой эмульсией жиров бывают эмульсии стойкие. Стойкие эмульсии
жиров получаются с помощью эмульгаторов — веществ, легко адсорбирую-
щихся на поверхности раздела двух фаз. Эмульгатор адсорбируется на по-
верхности капелек жира, образует тончайшую пленку, которая препятствует
их слиянию. Эмульгаторы понижают поверхностное натяжение и создают
условия для образования стойких эмульсий. Важными в физиологическом
отношении эмульгаторами жиров являются соли желчных кислот. Взаимо-
действуя в тонком кишечнике с жирами, они благоприятствуют образованию
стойких эмульсий, что ускоряет процесс переваривания жиров в кишечнике.
ФОСФОЛИПИДЫ (ФОСФАТИДЫ)
Фосфолипиды, или фосфатиды, представляют собой очень важную
в биологическом отношении группу липидов. Фосфатиды встречаются в со-
ставе клеток всех живых существ, где они включаются в белково-липидные
комплексы. Вместе с другими липидами фосфатиды образуют перифериче-
ский слой клетки, ее липидную оболочку.
Изучение фосфатидов ведет свое начало с первой четверти XIX в., когда Вакелен
открыл наличие фосфора в составе жироподобных веществ мозга. В середине того же
века фосфатиды были изолированы из яичного желтка, икры рыб, мозга, крови,
желчи и т.д. Однако химическая природа фосфатидов оставалась долго неизвестной.
Предполагалось, что фосфатиды во всех тканях представлены одним жироподобным ве-
ществом — лецитином (так был назван первый фосфатид, полученный из яичного жел-
тка). Применение метода гидролиза позволило установить компоненты, из которых
построен лецитин. Оказалось, что он состоит из глицерина жирных кислот, фосфор-
ной кислоты и азотистого вещества — холина. В начале XX столетия полагали, что
все фосфатиды представлены в тканях лецитинами, отличающимися друг от друга
химической природой своих жирных кислот. Это представление было оставлено с вы-
делением из головного мозга фосфатидов, в составе которых оказался не только холин,
но и иные азотистые вещества. В дальнейшем выяснилось, что фосфатиды представля-
ют собой группу липидов, имеющих различную структуру^
ХИМИЯ ФОСФАТИДОВ
Различные фосфатиды отличаются друг от друга прежде всего содержа-
щимися в их составе спиртами и азотистыми веществами. В тех случаях,
когда в состав фосфатидов входят одинаковые по своей структуре спирты
и азотистые вещества, они все же могут различаться, так как у них могут
оказаться различные жирные кислоты.
Все фосфатиды являются сложными эфирами, они делятся на глицериды
и неглицериды. Различные фосфатиды-глицериды отличаются друг от друга
по входящим в их состав азотистым веществам; подобным образом отличают-
ся друг от друга фосфатиды-неглицериды.
К фосфатидам-глицеридам относятся: лецитины (фосфатидилхолины),
кефалины (фосфатидилэтаноламины) и фосфатидил сер ины.
Фосфатиды-неглицериды включают сфингомиэлины, имеющие в своем
составе спирт сфингозин и линозитолы, содержащие шестиатомный цикли-
ческий спирт инозит. К фосфатидам тесно примыкает группа сопутствую-
щих им веществ — ацетальфосфатиды. Эти вещества характеризуются
наличием в их составе альдегидов вместо жирных кислот.
96
Фосфатиды-глицериды
В состав фосфатидов-глицеридов входят следующие близкие друг к дру-
гу по своей химической природе азотистые соединения: серин, этаноламин
и холин:
СНоОН сн2он СН2ОН
CHNH, 1 CH2NI12 1 CH2-NUCH8)g
। СООН
Серин Этаноламин Холин
Из серина декарбоксилированием получается этаноламин. Из этанол-
амина путем метилирования образуется холин.
В составе лецитинов содержится холин.
СН2О-ОСЯ
СНО-ОС7?!
СН2О—Р==О
O-CH2-CH2N+ = (CH3)?
Лецитин (фосфатидилхолин)
Различные лецитины отличаются друг от друга по остаткам своих жир-
ных кислот. Они могут также отличаться друг от друга положением в моле-
куле остатка фосфорной кислоты, а отсюда и положением жирных кислот. В
приведенной формуле остаток фосфорной кислоты присоединен к первичной
спиртовой группе остатка глицерина. Такие лецитины, независимо от струк-
туры входящих в их состав жирных кислот, должны быть оптически ак-
тивными, подобно тому, как оптически активной является а-глицерин-фос-
форная кислота.
СН2ОН
неон
I /0Н
СН2О— Р=О
\он
сн,он
HCO —Р
сн.2он
а-Глицеринфосфорная
кислота
(З-Глицеринфосфорная
кислота
В случае же присоединения фосфатного остатка к вторичной спиртовой
группе лецитины оказываются оптически активными только лишь при нали-
чии у них в молекуле остатков двух различных жирных кислот. Имеющиеся
данные по изучению химической структуры лецитинов дают основание
считать, что у них остаток фосфорной кислоты присоединен к первичной
спиртовой группе остатка глицерина.
Фосфатидилэтаноламин, известный также под названием кефалина,
и фосфатид и л сер ин построены подобно лецитинам.
СН2О-ОС/?
СНО-ОС/?!
/ОН
СН2О-----Р=О
\dCH2-CH2NH2
Фосфатидилэтаноламин
СН2О-ОСЯ
Фосфатидилсерин
4 Заказ № 581
При отщеплении от молекул фосфатидов-глицеридов азотистых компо-
нентов образуются безазотистые соединения — фосфатидные кислоты.
Последние встречаются в составе растений, например листьев капусты.
От фосфатидов-глицеридов могут отщепляться остатки жирных кислот.
Под влиянием фермента, содержащегося в змеином яде, от лецитина отще-
пляется молекула жирной кислоты с образованием лизолецитина. Лизоле-
цитины относятся к числу гемолизинов — веществ, разрушающих красные
кровяные тельца.
Фосфатиды-неглицери ды
К фосфатидам-неглицеридам относятся сфингомиэлины и липозитолы.
Последние правильнее было бы, по входящему в их состав спирту — ино-
зиту, называть инозитидами.
Сфингомиэлины впервые были выделёны из нервной ткани. Позже было
выяснено, что они встречаются также в составе иных тканей. Сфингомиэлины
построены из остатка двухатомного ненасыщенного аминоспирта — сфин-
гозина, остатков жирной кислоты, фосфорной кислоты и холина.
СН3—(СН2)12—СН=СН—СН—СН—СН2ОН
он nh2
Сфингозин
В молекуле сфингомиэлина жирная кислота соединена не со спиртовой
группой, т. е. не сложноэфирной связью, а с аминогруппой, следовательно,
кислотоамидной связью.
Сфингозин
ai3—(сн2)12—ci I = сн—сн—сн—сн,—о
I I
ОН NII—СО-7?
+
O-CH2-CH2-N ls (СН3)з
Холин
Жирная
кислота
Сфивгомиэлин
Сфингомиэлины отличаются друг от друга по входящим в их состав
жирным кислотам.
Фосфатидилинозиты представляют собой группу фосфатидов, в состав
которых входит спирт инозит. К шестиатомному спирту инозиту присоеди-
нен ряд компонентов: фосфорная кислота, две жирные кислоты, галактоза,
этаноламин и тартроновая кислота.
снон
нонс/^снон
н3РО4
Я-СООН
7^1 СООН
НОНСЧ /СНОН
снон
Инозит
НСОН
НСОН
НОСН о
НОСН
НС----
СН2ОН
Галактоза
CH2OH-CH2NH2
Этаноламин
СООН
снон
СООН
Тартроновая
кислота
Последовательность присоединения отдельных компонентов к моле-
куле инозита окончательно еще не выяснена.
Фосфатидилинозиты выделены из головного мозга, из некоторых микро-
бов, бобов сои и т. д. Они, по-видимому, встречаются в различных тканях
животных и в растениях.
98
АЦЕТАЛЬФОСФАТИДЫ
Ацетальфосфатиды в клетках и тканях организмов обычно сопутствуют
фосфатидам, резко уступая им в количественном отношении. По своей хими-
ческой природе они близки к фосфатидам-глицеридам и отличаются от них
тем, что в построении их молекул участвует наряду с высокомолекулярной
жирной кислотой еще и альдегид высокомолекулярной жирной кислоты.
Ниже приводится формула пальмитальфосфатида:
СН2—О—СН—С15Н31
I О
СН—О—ОС—R
СН2—СН2—О—Р-----
'^о—сн2—сн2—nh2
Эта формула показывает, что альдегид пальмитиновой кислоты присое-
динен к глицерину и фосфорной кислоте с образованием ацеталя. Ацеталь-
фосфатиды отличаются друг от друга по входящему в их состав альдегиду
высокомолекулярной жирной кислоты (встречаются, например, стеараль-
фосфатиды), а также по азотистому компоненту.
СТЕРИНЫ И СТЕРИДЫ
Стеринами называются высокомолекулярные циклические спирты,
производные циклопентанпергидрофенантрена. Стериды являются слож-
ными эфирами, в состав которых входят стерины (холестерин и др.) и вы-
сокомолекулярные жирные кислоты, чаще всего пальмитиновая кислота.
Холестериды широко представлены в тканях животных. Очищенный жир
овечьей шерсти — ланолин отличается высоким содержанием холестеридов.
Циклопентанпергидрофенантрен можно рассматривать как продукт
конденсации циклопентана с гидрированным фенантреном.
Циклопентан
/\/ч/
Фенантрен
Циклопентанпергидрофенантрен
Для того чтобы легче ориентироваться в структуре стеринов, принято
отдельные кольца циклопентанпергидрофенантрена обозначать буквами
алфавита (А, Б, В и Г), а атомы углерода колец — цифрами. Легко видеть,
что циклический компонент стеринов построен из 17 атомов углерода.
Одним из наиболее распространенных стеринов является холестерин,
впервые открытый Конради в XVIII столетии при исследовании желчных
камней. Желчные камни на 90% состоят из холестерина. Холестерин в сво-
бодном виде и в виде сложных эфиров входит в состав клеток и тканей,
образуя с белками холестеринбелковые комплексы. Особенно богато холе-
стерином белое вещество головного мозга.
4* 99
Холестерин (С27Ы46О) — вторичный высокомолекулярный цикличе-
ский спирт — производное циклопентанпергидрофенантрена, от семнадца-
того атома которого отходит боковая цепь. В циклическом компоненте холе-
стерина в кольце Б имеется двойная связь, идущая от пятого атома углерода
к шестому. Спиртовая группа находится у третьего атома углерода. Холесте-
рин, в отличие от иных липидов (жиров, фосфатидов, восков), — вещество
кристаллическое. Кристаллы холестерина имеют вид пластинок с жирным
блеском. Сложные эфиры холестерина — холестериды — образуются при
присоединении к спиртовой группе жирной кислоты. Чаще всего в эфирах
холестерина встречаются пальмитиновая, стеариновая и олеиновая кислоты
СН3 СН3 СН3
Холестерин
Продуктом дегидрирования холестерина является 7-дегидрохолесте-
рин — провитамин D3 (стр. 132).
CHS СН3 СН8
7-Д еги д ро холестерин
При облучении 7-дегидрохолестерина ультрафиолетовыми лучами раз-
рывается связь между девятым и десятым атомами углерода, в результате
чего образуется витамин D3.
Наряду с холестерином, в тканях животных в небольших количествах
содержатся близкие к нему вещества — оксихолестерин, дегидрохолесте-
рин и 7-дигидрохолестерин. Холестерин выделяется с желчью в кишечник.
Там он под влиянием микробов кишечной флоры превращается в копросте-
рин — г{ш?-изомер дегидрохолестерина. Копростерин выделяется с калом.
Из холестерина в организме образуются очень важные в биологическом
отношении вещества (стероидные гормоны, желчные кислоты).
Холестерин — представитель стеринов, встречающихся в тканях живот-
ных (зоостерины). В растениях содержатся стерины, несколько отличаю-
щиеся по своим химическим особенностяхМ от холестерина. Они объединяют-
ся под названием фитостеринов. В дрожжах, грибах содержится эргостерин—
100
более ненасыщенное, чем холестерин, соединение. При облучении ультра-
фиолетовыми лучами эргостерин превращается в витамин D2 (стр. 132).
сн3 сн3 сн3 сн3
I I I
Н2С сн—сн—сн-сн—сн—сн—сн3
Эргостерин
К фитостеринам относятся
в растительных маслах
СН3
ситостерин и стигмастерин, содержащиеся
СН.
о
сн3
G
сн—сн—сн2—сн2—сн—сн—сн3
2
сн2
'2“5
н2с
снг
СН _____
/'Ч /СН
СН
Ситостерин
Стигмастерин
ВОСКА
Воска составляют группу липидов, построенных из высокомолекуляр-
ных одноатомных спиртов, обычно жирного ряда, и высокомолекулярных
жирных кислот. Встречаются воска в организмах животных и растений.
Природные воска содержат некоторое количество свободных кислот и спир-
тов, а также углеводороды.
К воскам животного происхождения относятся спермацет (имеется
в черепной полости кашалота), пчелиный воск, ланолин.
101
Спермацет является сложным эфиром цетилового спирта и пальмити-
новой кислоты
С1бН3з-О-С-С15Н31Ч-Н2О------->С15Нз1СООН4-С16Н33ОН
II
О
Цетиловый спирт
Пчелиный воск построен из мирицилового спирта и пальмитиновой
кислоты
СзоНбз—®—С—C15H3i >С15Н31СООН^С3011бзОН
II
О
Мирициловый спирт
Ланолин состоит из смеси сложных эфиров и свободных спиртов, вклю-
чающей цериловый и ланолиновый спирты, холестерин и др.
Ланолин и спермацет применяются в медицинской практике при из-
готовлении мазей, а также в парфюмерии для производства различных кос-
метических средств.
В растениях воска покрывают тонким слоем листья, стебли и плоды;
восковой налет на плодах предохраняет их от смачивания водой, высыхания
и проникновения микробов. Воска растений построены из различных высо-
комолекулярных одноатомных спиртов (цетиловый С15Н31СН2ОН, /г-три-
аконтовый —С29Н61СН2ОН и др.) и жирных кислот, имеющих от 16 до 29
и больше атомов углерода в цепи.
ЦЕРЕБРОЗИДЫ
Цереброзиды входят в состав мозга и по своим физическим свойствам
относятся к липидам. Их называют еще галактозидами, так как они часто
содержат галактозу. При гидролизе из них образуются сфингозин, галактоза
и различные жирные кислоты
Сфингозин
СН3(СН2)
он
Галактоза
В молекуле цереброзида остаток галактозы связан глюкозидной связью
с одной из спиртовых групп сфингозина. Остаток же жирной кислоты,
как и в сфингомиэлине (стр. 98), присоединен к аминогруппе сфингозина
путем образования кислотоамидной связи. В составе различных церебро-
зидов преимущественно встречаются лигноцериновая, нервоновая и цереб-
роновая кислоты:
102
сн3
СН3
I
(сн2)22
I
соон
I
CH
II
CH
I
(СН2)Ъ
I
COOH
Лигноцериновая Нервоновая
кислота кислота
сн3
I
(CH2)2i
I
снон
I
соон
Цереброновая
кислота
Цереброзиды получают название в зависимости от входящих в их состав
жирных кислот: нервон — в случае наличия в нем нервоновой кислоты,
цереброн — в случае наличия цереброновой кислоты. Керазином назвали
цереброзид, в составе которого имеется лигноцериновая кислота.
ЛИТЕРАТУРА
Зиновьев А. А. Химия жиров. Пищепромиздат, 1952.
Тирфельдер Г. и К л е н к Е. Химия цереброзидов и фосфатидов. Пище-
промиздат, 1937.
Трусов В. И. Фосфатиды. Успехи совр. биол., т. 45, 1958.
Ф е р д м а н Д. Л. Новые данные о фосфатидах. «Украинский биохимический
журнал», 1949, т. 18, стр. 123.
ФизерЛ. иФизерМ. Химия природных соединений фенантренового ряда.
Госхимиздат, 1953.
Глава шестая
ВИТАМИНЫ
Витамины представляют собой группу органических веществ различной
химической структуры, синтезирующихся, как правило, в растениях и вхо-
дящих в состав тканей животных обычно в малых количествах. Организм
человека, а также животных нуждается в поступлении витаминов с пищей.
При отсутствии витаминов наступают глубокие нарушения в процессах
обмена веществ, ведущие к тяжелым заболеваниям, заканчивающимся ги-
белью организма. Эти заболевания носят название авитаминозов и по своим
проявлениям отличаются друг от друга, в зависимости от природы витамина,
недостающего в пище.
ИЗ ИСТОРИИ ИЗУЧЕНИЯ ВИТАМИНОВ
Многочисленные наблюдения врачей еще в прошлом столетии указывали на за-
висимость состояния организма человека от состава пищевых рационов. Цинга как тя-
желая болезнь была известна мореплавателям, которые в далеких путешествиях не
имели возможности пользоваться в течение длительного времени овощами, фруктами
и свежим мясом. Цинга нередко вспыхивала среди населения городов при длительных
их осадах во время войн.
В Восточной Азии, на Филиппинских островах, на п-ове Индокитай и в Японии
более тысячи лет назад было известно заболевание бери-бери, возникавшее в связи с
тем, что население питалось почти исключительно рисом. Это заболевание особенно
широко распространилось при введении машинной обработки риса, практически пол-
ностью освобождавшей зерна от оболочки, полируя их. Связь заболевания бери-бери
с питанием преимущественно рисом отмечалась неоднократно. В прошлом столетии от
бери-бери страдали моряки японского флота. В 1882 г. главный санитарный инспек-
тор японского флота Такаки заменил в пищевом рационе японских моряков рис сме-
шанной пищей, и с этого времени заболевание бери-бери практически прекратилось.
Такаки полагал, что бери-бери вызывается недостатком белков в пище и что замена
риса, богатого углеводами, пищевыми продуктами, содержащими много белка, предо-
храняет людей от заболевания бери-бери. Однако он ошибался, так как бери-бери вы-
зывается не недостатком белков, а отсутствием определенного витамина в пище.
В результате недостаточности питания возникает рахит—заболевание, особенно
широко распространенное в прошлом столетии среди бедных слоев населения городов
Англии.
Больные цингой, бери-бери, рахитом излечивались при введении в их пищевой
рацион разнообразных продуктов. Следует, однако, отметить, что наблюдения врачей,
несмотря на то что им удалось установить способы борьбы с цингой, бери-бери и ра-
хитом, не привели к открытию витаминов. Основную роль в открытии витаминов сы-
грали экспериментальные исследования.
В прошлом столетии сложилось представление, что углеводы, жиры, белки, ми-
неральные вещества (соли) и вода удовлетворяют потребность организма человека и
животных в пище. Все внимание уделялось количеству этих веществ в пищевых про-
дуктах. Однако попытки кормления животных пищей, составленной из чистых угле-
водов, жиров, белков, минеральных веществ и воды, не увенчались успехом: животные,
получавшие такую пищу, погибали. Опыты, поставленные в 1816 г. Маженди, приве-
ли его к заключению, что молодые животные не могут остаться .здоровыми при кормле-
нии их пищей, состоящей только из углеводов, жиров и белков.
Экспериментальные исследования, впервые указавшие на необходимость при-
сутствия в пище, кроме углеводов, белков, жиров, минеральных веществ и воды еще
104
каких-то веществ, были проведены в 1880 г. Н. И. Луниным. В своих опытах он кор-
мил одну группу мышей пищей, состоявшей из казеина, жира и сахара с добавкой
золы (солей) молока, а другую —молоком. Мыши первой группы погибали, мыши же
второй группы оставались здоровыми. На основании результатов своих исследований
Н. И. Лунин пришел к выводу, что «...очевидно, в естественной пище, такой как молоко»
должны присутствовать в малых количествах, кроме известных главных пищевых ин-
гредиентов, еще и неизвестные вещества, необходимые для жизни». Этот вывод не полу-
чил сразу признания. Больше того, результаты исследований Н. И. Лунина стали
оспаривать, указывая, например, что причиной гибели мышей в его опытах явилась
невкусная пища. Однако с течением времени накапливались данные, подтверждавшие
результаты его исследований. Через 10 лет, пользуясь несколько иным вариантом ис-
кусственно составленной пищи, К. А. Сосин экспериментально подтвердил выводы
Н. И. Лунина о том, что в пище, кроме углеводов, жиров, белков, минеральных веществ
и солей, должны иметься еще какие-то иные вещества.
В 1905 г. датский ученый Пекельхаринг подтвердил результаты исследований
этих ученых, показав, что пища, составленная из казеина, яичного альбумина, рисо-
вой муки, лярда, неорганических солей и воды, непригодна для кормления мышей.
В 1909—1912 гг. немецкий ученый Штепп экстрагировал хлеб и молоко спиртом и
эфиром и кормил ими мышей, при этом мыши погибали. При прибавлении же к экст-
рагированной спиртом и эфиром пище незначительных количеств экстракта мыши
развивались нормально. Штепп пришел к заключению, что молоко и хлеб содержат
какие-то извлекаемые спиртом и эфиром вещества, необходимые для поддержания жиз-
ни животных. Несколько миллиграммов этих веществ предохраняли мышей от гибели.
В 1912 г. английский ученый Гопкинс провел тщательные исследования на крысах и
пришел к выводам, аналогичным выводам Н. И. Лунина, показав, что для нормального
развития крыс недостаточно кормить их пищей, составленной из казеина, крахмала,
лярда, минеральных солей и воды. Добавка к подобной пище незначительных коли-
честв молока или экстракта из молока или дрожжей делала ее полноценной. Так
постепенно утверждалось представление о веществах, имеющихся в незначительных ко-
личествах в составе пищевых продуктов и необходимых для жизни человека и живот-
ных. Этим веществам было вначале дано название дополнительных веществ—«добавоч-
ных факторов питания».
Важное значение в изучении «добавочных факторов питания» сыграли исследова-
ния Эйкмана, работавшего тюремным врачом на острове Ява. Эйкман провел обшир-
ные наблюдения над заключенными в тюрьмах, среди которых свирепствовало забо-
левание бери-бери. Он установил, что причиной заболевания являлась пища, состояв-
шая почти исключительно из полированного риса. Он далее подметил, что куры,
питавшиеся остатками пищи заключенных (полированным рисом), заболевали, причем
у них появлялись признаки, напоминавшие бери-бери у людей. В специально постав-
ленных исследованиях Эйкман вызвал у кур, кормя их полированным рисом, забо-
левание, которое излечивалось экстрактами из рисовых отрубей. Стало ясным, что
в рисовых отрубях содержится ’ какое-то вещество, предохраняющее от заболевания
бери-бери. В 1911 г. К. Функу удалось выделить из рисовых отрубей в кристалличе-
ском виде вещество, предохраняющее от заболевания бери-бери. Анализ обнаружил
наличие в этом веществе азота. В 1912 г. была опубликована монография Функа, под-
ытоживавшая имевшиеся к тому времени результаты исследований но изучению доба-
вочных факторов питания и данные о заболеваниях, причиной которых являлась не-
достаточность питания. Функ ввел в науку термин «витамины», считая, что добавочные
факторы питания содержат азот в виде аминогруппы и что они необходимы для жизни
(vita — amine).
Впоследствии изучение химической природы различных витаминов показало,
что многие из них не содержат азота. Тем не менее термин «витамины» оказался на-
столько широко распространенным среди ученых и широких слоев населения, что ме-
нять его на химические обозначения не представляется целесообразным. Отсюда, под
витаминами подразумевается группа органических как азотистых, так и безазотистых
веществ, содержащихся в незначительных количествах в пищевых продуктах и необ-
ходимых для нормальной жизнедеятельности организма человека и животных. Вита-
мины образуются в растениях, в малых количествах они входят в состав тканей орга-
низма человека и животных и играют важную роль в процессах обмена веществ.
КЛАССИФИКАЦИЯ ВИТАМИНОВ
Витамины очень часто носят буквенные обозначения. Причина этого
становится понятной, если учесть, что химическая природа витаминов оста-
валась некоторое время невыясненной и что даже теперь проходит срок
между открытием нового витамина и выяснением его химической природы.
Между тем буквенные обозначения создают неудобства, так как число из-
вестных уже сейчас витаминов велико, и открытие новых витаминов может
создать положение, когда количество букв алфавита окажется недостаточ-
105
ным. Неудивительно поэтому, что некоторые витамины сейчас уже получают
иные названия, часто при этом исходят из химических особенностей витами-
нов. Некоторые витамины, удерживая свои буквенные обозначения, приоб-
рели химические названия (например, витамин С — аскорбиновая кислота,
витамин Вх — тиамин и т. д.).
Прежде чем перейти к приемам классификации витаминов интересно разобрать-
ся в вопросе о том, каким образом, с помощью каких методов открываются новые ви-
тамины. Витамины выявляются в опытах на животных и на микробах. В первом слу-
чае животных переводят на искусственный пищевой рацион, состоящий из нужного
количества белков, жиров, углеводов, минеральных солей с добавлением всех извест-
ных витаминов. Если подобный пищевой рацион оказывается неполноценным, и жи-
вотные заболевают (у молодых животных прежде всего останавливается рост), прихо-
дится считать, что в нем отсутствует какой-то неизвестный еще витамин. Для выявле-
ния его наличия в пищевых продуктах к оказавшемуся неполноценным пищевому ра-
циону начинают добавлять тот или иной продукт. Если добавление данного продукта
предохраняет животное от заболевания (авитаминоза), то в нем должен содержаться
недостающий в искусственно составленном пищевом рационе витамин.
Дальнейшие исследования проводятся в направлении изучения свойств нового
витамина, выделения его в чистом виде и установления его химической структуры.
Завершаются подобные исследования синтезом витамина.
Большое значение в постановках исследований по выявлению новых витаминов
имеет правильный подбор подопытных животных. Различные животные в неодинако-
вой степени чувствительны к недостатку витаминов в пище. Это объясняется тем, что
некоторые виды животных обладают способностью синтезировать тот или иной вита-
мин в таком объеме, что могут обойтись без наличия его в пище.
Удобным объектом исследований для обнаружения новых витаминов являются
микробы. Оказалось, что многие микробы нуждаются для своего развития в наличии
незначительных количеств веществ роста. При отсутствии того или иного из этих ве-
ществ наступают расстройства роста и размножения — авитаминозы у микробов. До-
бавление к питательной среде, оказавшейся недостаточной для нормального развития
того или иного микроба, продукта, восстанавливающего рост и размножение его, дает
основание для дальнейших исследований, направленных к выявлению нового вита-
мина. Как правило, витамины, обнаруженные в опытах на микробах, оказываются
важными для человека и животных. Опыты на микробах имеют то преимущество, что
авитаминозы у этих организмов возникают быстро, и они легко обнаруживаются по
прекращению размножения микробов.
С давних пор витамины по их растворимости делятся на растворимые
в воде и растворимые в органических растворителях (эфире, хлороформе,
бензоле и др.). В тканях организмов последняя группа витаминов растворена
в жирах, и поэтому их называют жирорастворимыми витаминами.
ВОДОРАСТВОРИМЫЕ ВИТАМИНЫ
К водорастворимым относится витамин С (аскорбиновая кислота) и ряд
витаминов, составляющих группу витаминов В. Витамины группы В обыч-
но сопровождают в пищевых продуктах друг друга, и они обладают одним
общим для них свойством — устойчивостью к нагреванию, или, как при-
нято говорить, термостабильностью. Что же касается витамина С, то он
легко разрушается при нагревании, особенно в присутствии кислорода и
ничтожно малых количеств тяжелых металлов, особенно меди.
ВИТАМИН С, АНТИЦИНГОТНЫЙ ФАКТОР,
L-АСКОРБИНОВАЯ КИСЛОТА
Отсутствие в пище витамина С (аскорбиновой кислоты — СбН8Об)
вызывает у человека тяжелое заболевание (авитаминоз С) — цингу, или
скорбут. Характерным признаком цинги является поражение кровеносных
сосудов, особенно капилляров, сопровождающееся ломкостью их стенок и
повышенной проницаемостью. Этим объясняются наблюдающиеся при цин:
ге кровоизлияния, кровоточивость, поражения десен. Кровоточивость ка-
пилляров приводит к появлению на коже кровоизлияний (петехий), что
106
особенно характерно для цинги. Ломкость более крупных кровеносных со-
судов, а также повышение их проницаемости приводит к кровоизлияниям в
суставах, в сердечную сумку и т. д.
Характерным признаком цинги является также заболевание зубов.
Последние разрушаются, расшатываются и выпадают.
При цинге наблюдаются также изменения в костях, связанные с нару-
шением образования белка-коллагена, количество которого в костях умень-
шается, и кости становятся более хрупкими. Эти патологические явления
усугубляются сопутствующим Р-авитаминозом (стр. 124).
Цингу легко можно вызвать у морских свинок кормлением их пищей,
не содержащей аскорбиновой кислоты. Экспериментальная цинга у свинок
по своим признакам (кровоизлияния в суставах и в деснах, расшатывание
зубов) сходна с цингой у человека.
Цинга в средние века была страшным заболеванием, она уносила еже-
годно в могилу большое количество людей, преимущественно жителей го-
родов. В наше время цинга встречается очень редко. Объясняется это тем,
что причина цинги выяснена и что соответствующим набором пищевых про-
дуктов можно обеспечить организм человека необходимым количеством аскор-
биновой кислоты. Аскорбиновая кислота является единственнььм и мощным
фактором при лечении цинги. Применение ее даже в последней стадии раз-
вития болезни приводит к выздоровлению человека. Устраняется также лег-
ко и экспериментальная цинга путем введения аскорбиновой кислоты в ор-
ганизм больных морских свинок.
Недостаток (а не отсутствие) аскорбиновой кислоты в пище вызывает
у людей состояние, носящее название гиповитаминоза С. Оно характери-
зуется понижение?*! устойчивости организма к различным инфекционным
заболеваниям, легкой утомляемостью, головными болями, потерей аппетита.
Гиповитаминоз С наблюдается в конце зимы и весной, когда содержание
аскорбиновой кислоты в пище становится недостаточным.
Химическая структура L-аскорбиноеой кислоты
Химическая структура аскорбиновой кислоты выяснена. Этому пред-
шествовали многочисленные исследования при получении ее из продуктов
растительного происхождения, в которых содержание ее нередко оказы-
вается значительным. Следует, однако, отметить, что в кристаллическом
виде аскорбиновая кислота была выделена из надпочечников — единствен-
ного органа животных, в котором она содержится в значительном количе-
стве (0,12—0,15%). Из надпочечников аскорбиновая кислота была впервые
выделена Сцент-Диордьи, им же была установлена ее химическая структура.
Вскоре после выяснения химической структуры аскорбиновой кислоты был
осуществлен ее синтез. Сейчас аскорбиновую кислоту получают в больших
количествах на химических предприятиях.
НОС О
НС—I
носн
СН2ОН
L-Аскорбиновая
кислота
О--С о
нс—
носн
сн2он
Дегидроаскорбиновая
кислота
107
Аскорбиновая кислота (С6Н8О6) — белое кристаллическое вещество,
по своей химической природе близка к углеводам, гексозам. Это диенол фу-
ранозы лактон гексоновой кислоты.
Подобно другим диенолам, аскорбиновая кислота легко подвергается
окислению. Продукт ее окисления — дегидроаскорбиновая кислота — вос-
станавливаясь (присоединяя к себе два водорода), превращается в аскорби-
новую кислоту.
Аскорбиновая кислота легко растворима в воде и благодаря диссоциа-
ции енольных групп освобождает водородные ионы. Этим объясняется кислая
реакция водных растворов аскорбиновой кислоты.
При рН-7 дегидроаскорбиновая кислота неустойчива и необратимо
превращается в Л-дикетогулоновую кислоту.
Подобное превращение дегидроаскорбиновой кислоты имеет место и в
организме. Дикетогулоновая кислота не обладает свойствами витамина С.
I/
НС
носн
CILOH
сХ
I^OH
с-о
с=о
I
неон
носн
сн2он
соон
соон
Щавелевая
кислота
окисление соон
-------> I
неон
носн
СН2ОН
L-Дикетогулоновая
кислота
L-Треоновая
кислота
Следовательно, разрыв лактонной связи лишает дегидроаскорбиновую
кислоту свойств витамина.
При дальнейшем распаде А-дикетогулоновой кислоты образуется щаве-
левая кислота, выделяющаяся из организма с мочой, и А-треоновая кислота.
При введении человеку или животному большого количества аскорбиновой
кислоты она быстро выделяется в значительном количестве с мочой. Установ-
лено, что при недостатке аскорбиновой кислоты организм удерживает зна-
чительную часть введенной извне аскорбиновой кислоты. Этим пользуются
для установления степени насыщения организма аскорбиновой кислотой.
Аскорбиновая кислота, введенная в организм, быстро поглощается печенью,
селезенкой, надпочечниками и кожей. В тканях животных и растений аскор-
биновая кислота встречается как в свободном, так и в связанном (с белками)
виде. Связанная аскорбиновая кислота — аскорбиноген обладает боль-
шей устойчивостью к окислителям, чем свободная аскорбиновая
кислота.
Аскорбиновая кислота легко окисляется как в щелочной, так и в кислой
среде. Это позволяет установить наличие аскорбиновой кислоты в присут-
ствии редуцирующих углеводов, окисляющихся только при щелочной реак-
ции. Подкисленные растворы AgNO3 и некоторые кислые красители (2,4-
динитрофенилгидразин или дихлорфенолиндофенол) восстанавливаются ас-
корбиновой кислотой. Этими красителями пользуются для ее количествен-
ного определения.
У животных аскорбиновая кислота может играть некоторую роль в окис-
лительных процессах как переносчик водорода. В последнее время установ-
лено, что аскорбиновая кислота участвует в превращении аминокислот —
тирозина и фенилаланина. При недостатке аскорбиновой кислоты нарушают-
ся процессы распада этих аминокислот, в результате чего с мочой выделяет-
108
ся промежуточный продукт — гомогентизиновая кислота, отсутствующая
обычно в моче.
Несмотря на то, что изучению роли аскорбиновой кислоты посвящено
очень большое количество исследований, до сих пор остается еще неизвест-
ным, в каких именно процессах обмена веществ проявляет она свое действие.
Нарушение физиологических функций организма при скорбуте, ломкость
кровеносных сосудов являются отдаленным следствием первичных наруше-
ний процессов обмена веществ, вызываемых отсутствием аскорбиновой
кислоты в организме.
Распространение аскорбиновой кислоты.
Потребность в ней человека
Аскорбиновая кислота широко встречается в продуктах растительного
происхождения — в овощах и фруктах.
Содержание аскорбиновой кислоты в овощах, фруктах и ягодах (в мг на 100 г
продукта)
Брюква..................25—40
Дыня..................• . . 20
Капуста белокочанная .... 30
Картофель ...............• 7—10
Редис и редька........... 20
Томат ........................ 40
«Пук зеленый (перо)...... 60
Лук репчатый............. 10
Укроп....................... 150
Хрен (корень)............... 200
Перец красный............... 250
Шпинат....................... 50
Вишня ....................... 15
Земляника лесная.................. 20
Клубника.......................... 60
Черная смородина ............... 300
Крыжовник......................... 50
Малина............................ 30
Апельсины........................ 40
Лимоны........................... 40
Мандарины......................... 30
Яблоки.................... 10—30
Плоды шиповника сухие (в за-
висимости от сорта) .... 1000—5000
Хвоя зимой................ 220—275
» летом................. 70—150
Из приведенных данных видно, что аскорбиновая кислота в разных
продуктах растительного происхождения содержится в различных количе-
ствах. Зимой и весной важнейшими источниками аскорбиновой кислоты
являются картофель и капуста.
Продукты животного происхождения, за исключением печени, бедны
аскорбиновой кислотой.
В овощах и фруктах при сушке аскорбиновая кислота распадается под
действием фермента аскорбиноксидазы. Предохранить аскорбиновую кис-
лоту при сушке можно предварительным окуриванием овощей и фруктов
сернистым газом, который разрушает аскорбиноксидазу.
Аскорбиновая кислота легко разрушается при нагревании в присут-
ствии кислорода. Это следует учитывать при изготовлении овощных кон-
сервов и варенья.
Консервы и варенье, изготовленные при малом доступе кислорода и
при возможно коротком нагревании (варке), содержат аскорбиновую кисло-
ту. При обычной варке овощей основная масса аскорбиновой кислоты, имею-
щейся в них, сохраняется.
Аскорбиновая кислота разрушается при стоянии приготовленной пищи
и повторных ее нагреваниях.
Потребность человека в аскорбиновой кислоте исчисляется 50 мг в
сутки. В поступлении аскорбиновой кислоты с пищей нуждаются обезьяны
и морские свинки. Организмы большинства животных обладают способ-
ностью синтезировать аскорбиновую кислоту из углеводов и не нуждаются
в доставке ее с пищей, т. е. для большинства животных она не является ви-
тамином.
109
ВИТАМИНЫ ГРУППЫ в
Витамин В17 антибериберийный фактор, антиполинев-
ритный фактор, анейрин, тиамин (C12H17N4CO HC1)
Название тиамин этот витамин получил благодаря наличию в его моле-
куле азота и серы. Отсутствие в пище витамина Вх вызывает тяжелое забо-
левание— бери-бери, или полиневрит (воспаление нервных стволов), что
приводит к параличам. Авитаминоз Вх ведет также к нарушению сердечной
деятельности, к отекам, вызываемым нарушением обмена воды, к расстрой-
ствам функций желудочно-кишечного тракта, к понижению секреции пище-
варительных соков.
Бери-бери (полиневрит) — довольно распространенное заболевание в
Восточной Азии, на Филиппинских островах, на п-ове Индокитай и в Япо-
нии, где основным продуктом питания широких масс населения является
полированный рис. Очень редко бери-бери встречается в европейских стра-
нах, где в основном потребляется хлеб и картофель.
Химическая структура витамина Вх
Первые исследования по изучению химической структуры витамина
Вх принадлежат К. Функу. Окончательно химическая природа витамина Вг
была установлена в 1937 г. главным образом исследованиями Уильямса.
Молекула витамина Вх содержит остатки двух компонентов — про-
изводного пиримидина (2-метил, 5-оксиметил, 6-аминопиримидин) и произ-
водного тиазола (4-метил, 5-оксиэтилтиазол)
=c(6)nh,
С(5)СН2ОН
N(3)—С(4)В
-СНз
—СН2СН2ОН
(1)
N=C—NH2
11зс—С С---CI I2—N+—С—СН3
N— СИ НС С—СН2СН2ОН
Тиамин
Химическая структура тиамина окончательно подтверждена была его
синтезом. Он представляет собой белые кристаллы, хорошо растворимые
в воде. Тиамин устойчив к температуре и при кислой реакции (рН=3,0)
выдерживает нагревание до 140°С без потери витаминной активности. Тиа-
мин легко распадается на компоненты при нагревании, при нейтральной
и особенно при щелочной реакции. Под действием окислителей тиамин
превращается в тиохром (тиохромная реакция), обладающий синей флуо-
ресценцией, интенсивность которой пропорциональна концентрации тиами-
на. Тиохромная реакция используется для количественного определения
тиамина.
Тиамин синтезируется в растениях. Он является фактором роста ряда
бактерий. Организмы человека, обезьян и птиц неспособны синтезировать
тиамин и нуждаются в доставке его с пищей.
Тиамин в организме подвергается разрушению. После введения жи-
вотному тиамина часть его выделяется без изменения, часть же в виде пи-
110
рамина (2-метил-6-амино-5-оксиметил пиримидин). Отсюда следует, что в
организме животных тиамин распадается на составные части (производное
пиримидина и производное тиазола). Фермент, катализирующий расщеп-
ление тиамина, — тиаминаза впервые был обнаружен в тканях рыб при
следующих обстоятельствах. При введении в пищевой рацион лисиц (на
зверофермах) свежей рыбы они заболевали полиневритом. Причину заболе-
вания лисиц удалось выяснить. Оказалось, что внутренние органы свежей
рыбы (особенно породы карповых) содержат тиаминазу, под действием кото-
рой происходит расщепление в кишечнике тиамина.
Тиамин в тканях животных представлен главным образом в виде своего
пирофосфатного производного. Тиамин пищи всасывается из кишечника в
кровь и в тканях подвергается фосфорилированию при участии фосфофе-
разы, катализирующей перенесение на него фосфатных остатков от адено-
зинтрифосфорной кислоты:
Я—СН2—СН2ОП+2АТФ
СН2СН2—О—Р—О—Р—ОН+2АДФ
ОН ОН
Тиамин
Т иаминпирофосфат
Тиаминпирофосфат является небелковым компонентом (коферментом)
ферментов декарбоксилирования а-кетокислот (пировиноградной и а-кето-
глутаровой кислоты). В процессе окислительного декарбоксилирования
этих кислот наряду с тиаминпирофосфатом участвует еще одно вещество,
необходимое для развития некоторых микробов и встречающееся в тканях
животных — липоевая кислота:
СН2—СН9—СН(СН2)4—СООН
I I
S--------S
Липоевая кислота
СН3
N—CH
С=С—СН2СН2О—Р—О—Р—ОН
3
С—СН,—N+
£л
он он
NH—СО(СН2)4—СН—СН2СН2
Липотиамидпирофосфорная кислота
Липоевая кислота соединяется с тиаминпирофосфатом с образованием
липотиамидпирофосфата.
Нарушение процессов обмена веществ при ^-авитаминозе
Так как из тиамина образуется кофермент декарбоксилазы, то, оче-
видно, при недостатке тиамина в тканях организма процессы декарбоксили-
рования кетокислот должны быть нарушены. Это, прежде всего, относится к
декарбоксилированию пировиноградной кислоты — одного из важнейших
промежуточных продуктов обмена углеводов.
Уже давно было замечено, что при полиневрите у людей и при экспе-
риментальном полиневрите у птиц нарушены процессы углеводного обмена.
111
Далее было установлено, что обогащение пищи углеводами вызывает более
тяжелое течение Bi-авитаминоза. При экспериментальном Вравитами-
нозе и при полиневрите у людей имеет место накопление пировиноградной
кислоты, прежде всего, в мозгу, а также в иных тканях и в крови. Это
объясняется тем, что пировиноградная кислота в меньшем объеме подвер-
гается декарбоксилированию и в результате накопляется в тканях. Нервная
ткань особенно чувствительна к нарушению углеводного обмена, поэтому
при Bi-авитаминозе нарушается функция центральной и периферической
нервной системы.
Распространение тиамина. Потребность в нем организма
Суточная потребность организма человека в тиамине в среднем соста-
вляет 2—3 мг. Интересно при этом отметить, что при преимущественно уг-
леводном питании потребность организма в тиамине выше, чем при потреб-
лении пищи, богатой жирами.
Содержание тиамина в продуктах растительного проис-
хождения (в мг на 100 г продукта)
V Гречневая крупа........... 0,5
Овсяная крупа............... 0,3
Ячневая крупа............... 0,2
Соя ....................... 0,6
Фасоль ..................... 0,3
Горох .................... 0,1
к / Дрожжи сухие пекарские . 2
Хлеб пшеничный из муки
грубого помола........... 0,3
Хлеб высшего сорта . . . следы
Хлеб ржаной............ 0,3
Картофель.................. 0,1
Капуста.................... 0,2
Морковь.................. 0,15
Дрожжи сухие пивные . . 5
Некоторые бактерии способны синтезировать тиамин. Микрофлора
пищеварительного тракта жвачных (коровы) синтезирует тиамин в количе-
стве, достаточном для обеспечения потребности животных. Наряду с этим
имеются микробы, неспособные синтезировать тиамин. Для них тиамин
является фактором роста и размножения.
Тиамин не разрушается при варке пищи и при выпечке хлеба. Не.со-л
^дещждт^ тиамина корка — периферическая часть jG/ie6a,'^ которая подверг
гается в’“печи~особо сильному нагреву. При выпечке хлёЗных изделий на
^химических разрыхлителях (бикарбонате натрия и др.) тиамин в муке раз-
рушается благодаря воздействию щелочной среды.
Витамин В2, рибофлавин (C17H20N4O6)
В опытах на молодых крысах было установлено, что для их роста необ-
ходимо вещество, имеющееся в сыворотке молока. В дальнейших исследо-
ваниях это вещество было выделено из сыворотки молока, а затем из сырого
яичного белка и получило название витамина В2.
Химическая структура витамина В2
Изучение химической структуры витамина В2 по времени совпало с ис-
следованиями по изучению химической природы небелкового компонента
желтого окислительного фермента. Оба эти вещества оказались близкими
друг другу. Оба они окрашены в желто-зеленый цвет и флуоресцируют.
Такие вещества носят название флавинов. Витамин В2 по своей химической
природе является рибофлавином, так как в нем содержится остаток пяти-
112
атомного спирта — риботола. Как второй компонент в витамин В2 входит
метилированное производное изоаллоксазина:
Н СН2—(CHOI 1)3—СН2ОН
N N
Ч/с\А\/
С N С
N—Н
Н О
Рибофлавин
Химическая структура витамина В2 была окончательно выяснена Ку-
ном и Каррером, осуществившими его синтез.
Рибофлавин — желтое кристаллическое вещество, хорошо раствори-
мое в воде. Разрушается он при облучении его растворов ультрафиолетовы-
ми лучами с образованием при щелочной реакции люмифлавина и при кис-
лой реакции люмихрома. Продукты расщепления рибофлавина не обладают
витаминными свойствами. Рибофлавин устойчив к нагреванию и не разру-
шается при варке пищи.
Основным признакохМ недостаточности рибофлавина у молодых живот-
ных является остановка роста. У домашних птиц недостаток рибофлавина
в пище приводит к снижению яйценоскости. При длительном отсутствии
рибофлавина в пище (В2-авитаминозе) у птиц наблюдаются параличи и ги-
бель. Необходимость в доставке с пищей рибофлавина установлена для
человека, обезьян, собак, крыс, свиней и птиц. У человека В2-авитаминоз
сопровождается заболеванием глаз, легкой их утомляемостью, а затем вос-
палением глазного яблока с развитием катаракты. При В2-авитаминозе
часто развивается анемия.
Авитаминоз-В2 легко излечивается путем ежедневного введения в ор-
ганизм человека 5—10 мг рибофлавина.
В тканях животных рибофлавин подвергается фосфорилированию при
участии АТФ:
/ОН
СН2ОН+АТФ----СН2О—Р=О 4-АДФ.
Образующаяся при этом рибофлавинфосфорная кислота в свою очередь
реагирует с АТФ, превращаясь в флавинадениндинуклеотид. Путь образова-
ния последнего выяснен благодаря исследованиям Корнберга и заключается
в следующем:
ОН
СН2—(СНОН)з—СН2О—Р=О
Х)Н
Н3С—с
н,с"с'Ч/с\/с\/
NH
СН N СО
Флавинфосфорная кислота
113
^Аде нозинтрифосфорная кислота
ОН
I
снг-(снон)3сн2-о — Р=О
СН N N
н3с-с/ с/ чу \о о
Н3С-С\/\^С\ ZNH НО Р—о
СН N СО
он
/°—рс0
4- НО—Р=О ОН
ч0н
Пи рофосфорная
кислота
Флавин адениндинуклеотид
Флавинадениндинуклеотид является небелковым компонентом ряда
окислительных ферментов, окрашенных в желтый цвет (желтые окисли-
тельные ферменты). Важно отметить, что флавинадениндинуклеотид осу-
ществляет свою коферментную функцию путем присоединения к изоаллокса-
зиновому компоненту водорода от подвергающихся окислению веществ
(стр. 176) с последующей его отдачей кислороду. Остальная часть молекулы,
особенно фосфатные группы, обеспечивают присоединение флавинаденин-
динуклеотида к различным белкам — апоферментам, с образованием двух-
компонентных ферментов.
Роль витамина В2 (рибофлавина) в организме заключается в том, что
он используется как материал для построения небелкового компонента
ряда окислительных ферментов. При недостатке его в организме умень-
шается количество желтых окислительных ферментов, нарушаются процес-
сы окисления органических веществ. Все остальные признаки В2-авитами-
ноза (остановка роста, параличи у птиц и др.) относятся к вторичным прояв-
лениям отсутствия рибофлавина в тканях организма.
Распространение витамина В2. Потребность в нем
организма
Рибофлавин широко распространен в тканях животных, где он пред-
ставлен в виде флавинадениндинуклеотида, входящего в состав окислитель-
ных ферментов. Особенно богаты рибофлавином дрожжи (3—4 мг в 100 г
сухих дрожжей). Мясные продукты (печень, мышцы, почки, мозг), рыбные
114
продукты, яйца, молоко являются основными источниками рибофлавина
в пище человека. Рибофлавин в меньших количествах содержится также
в овощах.
Потребность организма человека в рибофлавине составляет 2—3 мг
в сутки.
Витамин РР, антипеллагрический фактор,
никотиновая кислота, ниацин (C6H5O2N)
Отсутствие витамина РР в пище приводит к тяжелому заболеванию —
пеллагре. Это заболевание человека известно с давних пор и свое название
оно получило от итальянских слов pelle agra — что означает шершавая
кожа. Болезнь продолжается в течение длительного времени и сопровож-
дается расстройством деятельности желудочно-кишечного тракта (частые
поносы), воспалением слизистой оболочки ротовой полости и языка, воспа-
лением кожи (дерматитом) и в особенно тяжелых случаях — расстройством
нервной деятельности (потеря памяти, бред, слабоумие). Особенно харак-
терным признаком пеллагры является дерматит. Он обычно развивается
симметрично на кистях рук, на щеках и вообще на открытых (незащищен-
ных платьем) местах кожи.
Заболевание, напоминающее пеллагру, удалось вызвать у собак специ-
ально составленным пищевым рационом. Оно получило название «черный
язык» вследствие появления темных некротических участков на языке.
Изменение пищевого рациона приводило к выздоровлению собак. Отсюда
стало ясным, что собаки нуждаются в каком-то витамине, предохраняющем
их от заболевания пеллагрой. Этот витамин получил название антипеллагри-
ческого витамина РР. Пеллагра довольно часто встречается в южных райо-
нах США, в Италии, в Испании, в Южной Африке среди бедных слоев насе-
ления, питающихся преимущественно кукурузной мукой и свиным салом.
В XIX веке пеллагра была широко распространенным заболеванием не
только в США, но и во многих странах Европы. Причиной пеллагры нельзя
считать отсутствие в пище только одного витамина РР. Большое значение
для развития пеллагры имеет также недостаточность белкового питания и
особенно малое содержание в белках пищи аминокислоты — триптофана.
Белки кукурузы бедны триптофаном.
Это объясняет причину распространения пеллагры среди населения,
питающегося преимущественно кукурузной мукой.
Установлено, что проявления у собак признаков авитаминоза РР ослаб-
ляются при введении им в организм триптофана. Однако одним введением
триптофана вылечить собак не удается. Для этого необходимо дать больным
собакам еще витамин РР. Связь между триптофаном и витамином РР стала
понятной, когда выяснилось, что триптофан в животном организме может
превращаться в витамин РР (никотиновую кислоту, стр. 405).
Химическая структура витамина РР
По своей химической структуре витамин РР является никотиновой кис-
лотой или ее производным — амидом никотиновой кислоты. Интересно ука-
зать, что никотиновая кислота была известна в органической химии еще
в прошлом столетии, но о биологическом значении этого сравнительно
несложного по своему строению вещества в течение многих десятков лет
не было известно. Никотиновая кислота, как указывает уже само название,
имеет определенное отношение к никотину. Она легко образуется из нико-
тина при его окислении в лабораторных условиях. Никотин, однако, в орга-
115
низме не является источником для образования никотиновой кислоты, по-
этому заменить ее не может.
СН
С—СООН
НС^^/СН
N
Никотиновая кислота
Амид никотиновой кислоты
Синтез никотиновой кислоты в промышленном масштабе давно уже осу-
ществлен. Синтетический кристаллический продукт получил бытовое
название — ниацин. Это дешевый продукт, удобный для обогащения витами-
ном РР, там, где в этом имеется необходимость, пищевых продуктов (на-
пример, кукурузной муки).. Он также с большой эффективностью приме-
няется для лечения пеллагры. Никотиновая кислота и амид никотиновой
кислоты обладают одинаковой витаминной активностью. Отсюда следует,
что никотиновая кислота легко амидируется в организме. По аналогии с
ферментативным амидированием иных кислот можно полагать, что реакция
амидирования никотиновой кислоты происходит следующим образом:
СН
НС^\с—СООН + NH3 + АТФ
СН
CONH2 + АДФ + Н3РО4
Энергия, необходимая для реакции амидирования, освобождается при
дефосфорилировании АТФ, т. е. при ее распаде с образованием АДФ и
Н3РО4.
Амид никотиновой кислоты входит в состав небелковых компонентов
ферментов дегидрогеназ — никотинамид-аденин-динуклеотида (НАД) и
продукта его фосфорилирования (НАДФ). Амид никотиновой кислоты в
тканях соединяется с рибозофосфорной кислотой с образованием соедине-
ния типа мононуклеотида:
СН
Этот мононуклеотид реагирует с АТФ в той же последовательности
как и при синтезе флавинадениннуклеотида — с образованием НАД и
пирофосфорной кислоты. НАДФ получается из НАД путем присоедине-
ния фосфатного остатка к спиртовой группе у второго атома углерода ри-
бозного компонента адениловой кислоты (стр. 175).
При недостатке никотиновой кислоты, а тем более при ее отсутствии,
нарушается синтез небелковых компонентов ряда дегидрогеназ, что приво-
дит к нарушению окислительных процессов в организме. Следовательно,
нарушение окислительных процессов можно считать первичным признаком
116
проявления РР-авитаминоза. Остальные же признаки пеллагры являются
следствием нарушения окислительных процессов в организме.
Никотиновая кислота устойчива к воздействию температуры и ряда
иных факторов.
Распространение никотиновой кислоты.
Потребность в ней организма
Никотиновая, кислота широко распространена в продуктах питания как
растительного, так и животного происхождения. Хлеб (особенно из муки
грубого помола), гречневая крупа, рис, картофель, морковь, мясо и рыба
являются основными продуктами питания, содержащими никотиновую кис-
лоту. Суточная потребность человека в никотиновой кислоте исчисляется
в 15—25 мг и зависит от уровня белкового питания. Учитывая, что никоти-
новая кислота образуется в известной мере в организме из триптофана,
следует полагать, что 15—25 мг никотиновой кислоты, поступающих в орга-
низм с продуктами питания, удовлетворяют общую суточную потребность в
ней человека.
При избыточном введении в организмы человека и животных никоти-
новой кислоты с мочой выделяется Л^-метилникотинамид:
СН
НС
С—CONHo
НС
СН
сн3
ЛП -метил никотинамид
nh2
о=с
СН
сн3
Л^-метилпиридон
Л;1-метилникотинамид — основной продукт превращения никотиновой
кислоты (ее амида) в организме. Он не обладает витаминным действием
и не является источником необходимых организму метильных групп. При
образовании Л^-метилникотинамида используются метильные группы ме-
тионина и при систематически 1оргяни^_больших
никотиновоГкислоты в организме наступает недостаток в метионине и свя-
занные с этим нарушения процессбв^^бмста.вещеетвг——
- -Некоторая часть образовавшегося А/^метилникотинамида подвергается
в печени человека и животных окислению с образованием Д^-метилпиридо-
на. Это вещество не подвергается дальнейшим превращениям и выделяется
с мочЪиЗ.^.. Д”"”™ ” ~~~ " ~
----В то время как организмы человека и млекопитающих животных удов-
летворяют свою потребность в витамине РР за счет никотиновой кислоты
и никотинамида, некоторые бактерии для своего развития специально нуж-
даются в никотинамиде. Наряду с этим имеются бактерии, для развития
которых требуется никотинамид-рибозофосфорная кислота или НАД.
Витамин Вб, адермин, пиридоксин
При кормлении молодых крыс искусственно составленной пищей,
содержащей тиамин и рибофлавин, они заболевали с проявлением признаков
пеллагры (выпадение шерсти, дерматиты, воспаление кожи). Заболевание
получило название «пеллагра крыс». Недостающий фактор питания был
назван витамином Вб. В 1938 г. витамин В6 был выделен из печени и из
дрожжей и в том же году синтезирован. Добавление его к пищевому рациону
больных молодых крыс приводило к их выздоровлению. Витамин Вб полу-
чил название пиридоксина.
117
Химическая структура витамина В6
В продуктах питания встречаются два соединения, близкие к пиридок-
сину: пиридоксаль и пиридоксамин. Все эти вещества обладают одинаковым
витаминным действием в организме животных. Отсюда можно полагать,
что из пиридоксина в организме животных образуются пиридоксаль и пири-
доксамин. Некоторые бактерии, особенно бактерии молочнокислого броже-
ния, нуждаются для своего роста в пиридоксале и в пиридоксамине. Пи-
ридоксин же стимулирует их рост слабо. По-видимому, он у них слабо
превращается в пиридоксаль и в пиридоксамин:
С—СП2ОП
С—СН2ОН
НОС
Пиридоксин
Пиридоксаль
ch2nh2
НОС^ Х2 СН,ОН
Пиридоксамин
Пиридоксальфосфат
Первоначальное представление о том, что в пиридоксине нуждаются
только крысы, скоро было оставлено. Оказалось, что отсутствие пиридок-
сина в пище вызывает ряд тяжелых явлений у поросят и взрослых свиней.
У людей обнаруживаются дерматиты, не поддающиеся лечению никотино-
вой кислотой и напоминающие собой пеллагру. Подобные дерматиты под-
даются лечению пиридоксином. Возможно поэтому В6-авитаминоз характе-
рен и для человека.
В тканях животных пиридоксаль и пиридоксамин подвергаются фосфо-
рилированию с образованием пиридоксальфосфата и пиридоксаминфосфата.
Пиридоксальфосфат является небелковым компонентом ряда ферментов,
катализирующих превращение аминокислот (процессы переаминирования,
декарбоксилирования, распада триптофана и др.). Следовательно, при В6-
авитаминозе должны быть нарушены процессы превращения в организме ами-
нокислот.
Распространение пиридоксина. Потребность в нем
человека
Пиридоксин содержится в продуктах питания животного и раститель-
ного происхождения.
Содержание пиридоксина в пищевых продуктах
(в мг на 100 г продукта)
Печень .........0,7—1,0
Мясо.................0,5—0,7
Рыба.................0,5—1,0
Пшеница (цельная) . . 0,3—0,4
Отруби (пшеничные) . . 1,5—1,7
Горох................0,6—0,7
Фасоль ..................... 0,5
Картофель ........ 0,2
Капуста............. 0,1
Рис полированный .... 0,15
Морковь............. 0,1
Дрожжи хлебопекарные и
пивные (сухие)........... 3—5,5
118
Пиридоксин устойчив к нагреванию, не расщепляется щелочами и кис-
лотами, но легко поддается воздействию окисляющих веществ.
Суточная потребность организма человека в пиридоксине составляет
1,5 мг.
Витамин Н, биотин
Биотин (греч. bios — жизнь) открыт при изучении роста дрожжей.
Было установлено,что биотин излечивает заболевание, появляющееся у крыс,
кур и у человека при введении в организм больших количеств сырого яич-
ного белка. Заболевание сопровождается дерматитами. У крыс наблюдается
отек, воспаление кожи и выпадение шерсти. Причину этого заболевания уда-
лось выявить. Оказалось, что в составе яичного белка имеется гликопро-
теид— авидин, связывающий биотин с образованием нерастворимого в воде
комплекса (биотин-авидин). Этот комплекс не всасывается, и биотин пищи
теряется для организма. Нагревание до 100°С денатурирует авидин и лишает
его способности связывать биотин. Поэтому при наличии в пище варе-
ных яиц связывания в кишечнике биотина авидином не происходит.
Биотин выделен в 1936 г. Кеглем из сухого яичного желтка. Из 250 кг
этого материала было получено 1,1 мг кристаллического вещества, назван-
ного биотином.
Химическая структура биотина
Химическая структура биотина выяснена в 1940 г. В основе его строе-
ния лежит тиофеновое кольцо, к которому присоединен остаток мочевины.
К циклическому компоненту присоединен остаток валерьяновой кислоты:
со
НС—СН
НС СН
Тиофен
Hn/\nh
НС--СН
Биотин
СН—СН,—СН,—СН,—СН, -СООН
и С и L
Недостаток биотина у человека и животных, как указывалось выше,
можно вызвать введением с пищей больших количеств сырого яичного белка.
Авитаминоз можно вызвать у человека пищей, лишенной биотина. Кормле-
ние же животных пищей, бедной биотином, авитаминоза не дает; объясняет-
ся это тем, что биотин в этих случаях синтезируется кишечной флорой и вса-
сывается из кишечника в кровь. Установлено, что при наличии в суточном
пищевом рационе 0,025—0,050 мг биотина столько же выделяется из орга-
низма человека за сутки с мочой и калом.
В чем именно заключается роль биотина, еще остается невыясненным.
Имеются данные, показывающие, что биотин необходим для фиксации угле-
кислого газа бактериями и млекопитающими животными в реакции карбок-
силирования пировиноградной кислоты с превращением последней в щаве-
левоуксусную кислоту, играющую большую роль в обмене веществ.
со2 + СН3СОСООН---->НООССН2СОСООН.
Исключительно высока активность биотина как стимулятора роста
дрожжей. В разведении 1 : 300 -109 биотин еще стимулирует рост дрожжей;
это позволяет определить ничтожно малые количества биотина.
Биотин не разрушается при нагревании. Он устойчив в нормальных
растворах соляной и серной кислот. Разрушается при воздействии на него
сильной щелочи.
119
Распространение биотина. Потребность в нем человека
Биотин содержится в продуктах питания в очень малых количествах
Содержание биотина в продуктах питания (в мг на 100 г продукта)
Печень .................
Мясо....................
Яйца ...................
Молоко .................
0.1 Картофель.................. 0,0006
0,003 Лук......................... 0,003
0,009 Томат....................... 0,004
0,005 Шпинат ..................... 0,006
Суточная потребность организма человека в биотине составляет 0,010—
0,025 жа.
Пантотеновая кислота
При изучении условий, необходимых для роста дрожжей и молочнокис-
лых бактерий, в 1933 г. было открыто в отрубях вещество, оказавшееся
водорастворимым фактором роста и названное пантотеновой кислотой (греч.
pantos — всюду, везде). Вслед за этим было установлено, что пантотеновая
кислота является необходимой составной частью пищи человека и животных.
Пантотеновая кислота выделена в 1940 г. в кристаллическом виде и в том
же году получена путем синтеза. Активным оказался правовращающий сте-
реоизомер пантотеновой кислоты.
Химическая структура пантотеновой кислоты
Пантотеновая кислота построена из двух компонентов: я-рдиокси-р-ди-
метилмасляной кислоты и р-аланина:
; СН3 ОН О: :
i I I li ; ;
: НО—СН2—С-----СН—С—N—СН,—СН»—СООН ;
i I н i
: СН3 pl i
Диметилдиоксимасляная £...........................
кислота
Отсутствие пантотеновой кислоты в пище вызывает ряд расстройств у
млекопитающих животных и у птиц. У них появляются дерматиты, проис-
ходит депигментация шерсти и перьев, задержка роста и нарушение функ-
ций внутренних органов. Эти далеко идущие в самых различных тканях
и органах изменения становятся понятными, если учесть, что пантотеновая
кислота в норме содержится во всех тканях организма животных. Панто-
теновая кислота входит в состав кофермента ацилирования^— КоА (стр. 174),
являющегося коферментом ряда ферментов, принимающих важное участие
в процессах обмена веществ.
При гидролизе в кислоте и в щелочи при 100°С пантотеновая кислота
расщепляется с потерей своей витаминной активности. При нейтральной
реакции она устойчива при нагревании до 100°С.
Распространение пантотеновой кислоты.
Потребность в ней организма
Пантотеновая кислота широко распространена в продуктах питания.
Продукты животного происхождения (мясо, яйца, молоко) содержат боль-
ше пантотеновой кислоты, чем продукты растительные. Тем не менее, овощи
(капуста, картофель, морковь) являются важным источником пантоте-
новой кислоты для человека и животных. Очень богаты пантотеновой кисло-
той дрожжи и отруби. Суточная потребность человека в пантотеновой кис-
лоте составляет 10 мг.
120
Пара-аминобензойная кислота
п-Аминобензойная кислота является одним из факторов роста микробов-
Она, оказалось, необходима также для человека и млекопитающих жи-
вотных.
Отсутствие n-аминобензойной кислоты в пище черных крыс приводит
к их поседению.
При введении п-аминобензойной кислоты млекопитающим животным
она выделяется из организма в виде А-ацетильного производного и, в мень-
шем количестве, в соединении с глюкуроновой кислотой.
n-Аминобензойная кислота входит в состав более сложного по своей
структуре витамина — фолиевой кислоты и в этом, по-видимому, заклю-
чается ее значение для животных.
п-Аминобензойная кислота в сравнительно больших количествах содер-
жится в печени (0,25 мг%), в дрожжах (0,4 мг%), в зародышах пшеницы
(0,18 мг %) и в меньших количествах в овощах.
Фолиевая кислота и близкие к ней соединения
Фолиевая кислота была выделена в 1941 г. Вильямсом из листьев шпи-
ната (лат. folium — лист) и из печени. До этого было установлено, что для
роста молочнокислых бактерий необходимо какое-то вещество, обладающее
свойством кислоты и имеющееся в зеленых листьях растений.
Химическая структура фолиевой кислоты
Изучение химической структуры фолиевой кислоты показало, что она
близка к птеринам. Птерины н их производные — птериды встречаются
в тканях живых организмов. В 1925 г. некоторые из них (ксантоптерин
и эритроптерин) были выделены из тканей насекомых. Желтая окраска
ряда бабочек зависит от наличия в их крыльях ксантоптерина, красное ок-
рашивание связано с наличием эритроптерина. Незначительное количество
ксантоптерина регулярно выделяется из организма с мочой
он
Фолиевая кислота построена из птеридина, n-аминобензойной кислоты
и глутаминовой кислоты. Синтез ее осуществлен в 1945 г., и этим была окон-
чательно установлена химическая структура фолиевой кислоты.
Птеридин
л-Аминобензойная
кислота
СН
С—CONH—CII—СН2—СН2—СООН
СООН
Глутаминовая кислота
Птероилглутаминовая (фолиевая) кислота
121
Фолиевая кислота является не только фактором роста для микробов.
Она также и витамин, необходимый для человека и некоторых животных.
Было показано, что заболевание обезьян, вызываемое рационом, бедным
фолиевой кислотой, хорошо излечивается введением в их пищевой рацион
дрожжей. Предполагаемый в дрожжах витамин получил название витамина
М. Оказалось, что в витамине М нуждаются также куры и крысы. В 1937 г.
было установлено, что анемия (малокровие), вызываемая у крыс при кормле-
нии их козьим молоком, излечивается ксантоптерином и что образование
эритроцитов в организме усиливается при даче животным птеринов.
Витамин М оказался идентичным с фолиевой кислотой. У людей наи-
более типичным признаком авитаминоза, вызываемого отсутствием в пище
фолиевой кислоты, является малокровие. Фолиевая кислота получила при-
менение в медицинской практике при лечении анемий.
После открытия фолиевой кислоты были выделены из различных био-
логических источников вещества, близкие к ней по своим химическим осо-
бенностям и по действию. К ним относится птероиновая кислота, из которой
в результате присоединения глутаминовой кислоты образуется фолиевая
кислота. Из продуктов жизнедеятельности дифтерийной палочки выделена
птероилтриглутаминовая кислота (соединение птероиновой кислоты с три-
пептидом глутаминовой кислоты). Из дрожжей выделена птероилгепта-
глутаминовая кислота (соединение птероиловой кислоты с гептапептидом
ОН
Птероиновая кислота
глутаминовой кислоты). Из продуктов жизнедеятельности Leuconostoc
citrovorum изолирована в кристаллическом виде формил-тетрагидроптеро-
илглутаминовая кислота, получившая название фолиновой кислоты, и цит-
роворум-фактор. Все эти вещества являются производными фолиевой кис-
лоты.
СН
/С—CONH—СН—СН2—СН2—СООН
СН СООН
Фолиевая кислота
(5-формил-5-, 6, 7, 8,-тетрагидроптероилглутаминовая кислота)
Фолиевая кислота и ее производные участвуют в организме в процес-
сах обмена Cj-соединений (муравьиной кислоты, метильного радикала при
переметилировании). Имеются данные, указывающие, что фолиевая кислота
участвует в превращении в организме тирозина, а также нуклеозидов. Фолие-
вая кислота встречается в продуктах питания животного и растительного
происхождения. Наиболее богата ею печень, затем мясо, рыба, бобы, шпи-
нат, картофель, капуста.
Суточная потребность человека в фолиевой кислоте составляет0,2 —
0,5 мг.
122
Витамин B12> цианкобаламин, антианемический
витамин
В 1927 г. было установлено, что пернициозная (злокачественная)
анемия человека успешно лечится введением в рацион больных больших
количеств печени. Как и другие анемии, пернициозная анемия характери-
зуется уменьшением в крови количества эритроцитов. Однако в отличие
от иных видов анемий, при которых количество гемоглобина в эритроцитах
снижено, при пернициозной анемии содержание гемоглобина в эритро-
цитах нормальное и даже несколько повышенное. Развитие пернициозной
анемии ведет к все большему уменьшению количества эритроцитов в крови
и к смерти больного. Симптомы болезни смягчаются и даже исчезают, если
больной постоянно получает с пищей печень как в сыром, так и в вареном
виде. Отсюда ясно, что антианемическое вещество, имеющееся в печени, не
разрушается при нагревании. Это вещество выделено в 1948 г. и получило
название витамина В12.
Химическая структура витамина В12
Химическая структура витамина В12 выяснена в 1955 г. Его молекула
состоит из двух частей: кобальтсодержащей порфиринподобной (хромофор-
ной) и нуклеотидной, содержащей 5,6-диметилбензимидазол.
Хромофорная часть молекулы витамина В12, характерной особен-
ностью которой является наличие атома кобальта и цианогруппы, образую-
щих координационный комплекс, имеет большое сходство с порфиринами
(уропорфирин Ш, протопорфирин IX, хлорофиллы, гем). Так же, как и
порфирины, хромофорная часть молекулы витамина В12 состоит из четырех
азотистых гетероциклов типа пиррола. В нее входит металл (кобальт). У
обоих типов соединений имеются одинаковые заместители — боковые цепи
(—СН3 и —СН2—СН2—COOH-группы). Но вместе с тем хромофорная часть
молекулы витамина В12 отличается рядом особенностей от известных порфи-
ринов, будучи более насыщенной метильными остатками (две дополнитель-
ные СНз-группы у двух метеновых мостиков и четыре дополнительных
СНо-группы у колец в ^-положении) и более восстановленной по сравнению
с порфиринами (вместо пиррольных колец более восстановленные произ-
водные пиррола — одно тетрагидропиррольное или пирролидиновое и
три дигидропиррольных или пирролиновых кольца). Кроме того, пирро-
лидиновое и одно из пирролиновых колец соединены не через метеновый
(—С~) мостик, а непосредственно; ^-заменителями в хромофорной группе
витаминов являются не просто остатки уксусной и пропионовой кислот, а
их амиды.
Цианкобаламин оказывает на человека действие в очень малых количе-
ствах (0,01 мг вдень) при парентеральном (внутримышечном) введении. При
введении же в организм per os (через рот) он почти полностью теряет свою
активность. Лечебный эффект цианкобаламин оказывает при даче его боль-
ным пернициозной анемией per os вместе с желудочным соком здорового
человека. Желудочный сок здоровых людей содержит особый белок (апо-
эритеин), образующий комплексное соединение с кобаламином (эритеин).
Образование комплекса предохраняет цианкобаламин от воздействия на
него микробов кишечника, потребляющих его в свободном состоянии. В же-
лудочном соке больных пернициозной анемией апоэритеин отсутствует.
Поступающий с пищей цианкобаламин у них используется кишечными мик-
робами, что приводит к недостатку цианкобаламина в тканях организма.
Цианкобаламин является витамином, в доставке которого с пищей нуж-
дается не только человек, но и различные животные. Он служит также фак-
тором роста для ряда микроорганизмов.
Цианкобаламин участвует в процессах переметилирования (использо-
вания метильной группы метионина), синтеза пуриновых и пиримидино-
123
NH2 NH2
CO NH2 oo
CH2 CO CH2
CH3 CH2 CH2 CH2
хромофорная
часть
нуклеоти дная
часть
вых оснований и нуклеозидов. Имеются данные о том, что цианкобаламин
принимает участие в биосинтезе белков.
Суточная потребность человека в витамине В12 составляет 10—20 рг.
Витамин Р (цитрин, флавон)
В 1936 г. А. Сцент-Диордьи сообщил, что в экстрактах из венгерского
красного перца и из лимонного сока, как известно, богатых аскорбиновой
кислотой, содержится вещество, предохраняющее от ломкости кровеносные
сосуды и от повышенной проницаемости кровеносные капилляры. Вещество
это получило название цитрин и витамин Р (permeability vitamin). В даль-
нейшем было установлено, что препараты витамина Р при введении их в ор-
ганизм морских свинок, получавших пищу, лишенную аскорбиновой кис-
лоты, смягчают у них явления геморрагии и удлиняют жизнь. Высказыва-
лось мнение, что явления, наблюдающиеся у морских свинок при скорбуте,
вызываются отсутствием в пище как аскорбиновой кислоты, так и витами-
на Р. Изучение химической природы витамина Р (цитрина) показало, что
он является флавоном. Свойствами витамина Р обладают близкие друг к
другу по своей химической природе флавоны и полифенолы.
124
К веществам, обладающим свойствами витамина Р, относятся геспери-
дии — глюкозид метилового эфира эриодиктиола; рутин, обнаруженный
Гесперидии (R — остаток углевода)
Эпикатехин
С—ОН
он
в спарже, в листьях гречихи и в эвкалипте; пирокатехины, встречающиеся
в чае и в различных растениях, и др.
Вещества, обладающие свойствами витамина Р, встречаются в продук-
тах растительного происхождения, особенно в плодах цитрусовых, и сопут-
ствуют аскорбиновой кислоте.
Инозит, гексагидрогексаоксибензол, инозитол
К витаминам комплекса В относят инозит — гексагидрогексаоксибен-
зол (С6Н12О6) — вещество давно уже известное как составная часть тканей
животных и растений. Химическая структура инозита допускает возмож-
ность существования семи оптически неактивных форм и одной пары опти-
чески активных изомеров. Только одна из этих форм — мезоинозит — обла-
дает витаминной активностью:
125
В опытах на молодых мышах было установлено, что искусственно соста-
вленная диета, при наличии в ней многих витаминов, вызывает у подопыт-
ных животных остановку роста и выпадение шерсти. Выздоровление мышей
наступает при прибавлении к диете экстракта из печени. Дальнейшие ис-
следования показали, что в искусственно составленной диете мышей отсут-
ствовал инозит.
Инозит широко распространен в тканях животных, растений и у микро-
бов. В тканях животных он содержится преимущественно в некоторых фос-
фатидах (стр. 98), в растениях представлен, главным образом, в фосфорили-
рованном состоянии в виде фитина.
До сих пор еще остается неясным, необходима ли доставка инозита
с пищей только мышам и крысам, или же инозит является витамином и для
других видов животных.
*
Холин
Вопрос о том, является ли холин витамином, остается пока спорным.
Отсутствие холина вызывает характерные расстройства жирового обмена
только в тех случаях, когда пища животных бедна белками. При достаточ-
ном количестве метионина в составе белков пищи животные не зависят от
наличия в ней холина:
,СНоСН2ОН
+ /
N-^(CH8)3
Холин
Холин может синтезироваться в организме животных, и входящие в
его состав метильные группы доставляются метионином.
Витамин В15, пангамовая кислота
В 1951 г. Кребс с сотрудниками выделили из семян очень многих расте-
ний, из оболочек семян риса, из дрожжей, печени лошади и др. кристалличе-
ского вида вещество, названное пангамовой кислотой (витамин В15).
Витамин В15 является октаметилированным азотистым производным
сложного эфира — D-глюконовой и уксусной кислот — глюконо-D-CV-
диизопропиламино)-уксусной кислотой:
СООН
I
НСОН
I
НОСН
НСОН
НСОН
уСН(СН3)2
N\
СНоОСОСН СН(СН3)2
\ /СН(СН3)2
СН(СН3)2
126
Витамин В15 — активнейший донор метильных групп, что свидетель-
ствует о его важной роли в обмене веществ. Пангамовая кислота в настоя-
щее время применяется в клинической практике при лечении заболеваний
печени, сердечно-сосудистых заболеваний склеротического характера, сосу-
дисто-склеротических поражений мозга и т. д.
Витамин Вт, карнитин
При изучении потребности в пище мучного червя Tertebrio molitor
было установлено, что в отсутствие какого-то пищевого фактора личинки
этого насекомого погибают. Это вещество, растворимое в воде, было назва-
но витамином Вт (его выделили в свое время Гулевич с сотрудниками из
мышц и назвали карнитином), оно представляет собой бетаин — производ-
ное у-аминоф-оксимасляной кислоты.
/СН3
-----nZ_ch3
|\сн3
сн2
сноп
сн2
----со
Карнитин
Зависимость организма от наличия в пище витамина Вт показана до
сих пор только для трех видов насекомых. Нуждаются ли в нем позвоноч-
ные г животные — не установлено. Исходя из того, что карнитин имеется
в сравнительно больших количествах в мышцах, можно полагать, что позво-
ночные животные способны синтезировать карнитин и не нуждаются в
введении его с пищей.
ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ
К жирорастворимым витаминам относятся: 1) витамины группы А,
2) витамины группы D, 3) витамины группы Е и 4) витамины группы К.
ВИТАМИНЫ ГРУППЫ А
Витамин А, антиксерофтальмический витамин
В начале XX столетия было установлено, что пища, экстрагирован-
ная эфиром, неполноценна для животных. Прибавление к ней эфирного
экстракта восстанавливает ее полноценность. Отсюда возникло предположе-
ние, что в пищевых продуктах содержатся какие-то необходимые для орга-
низма животных вещества, растворимые в эфире. Это предположение полу-
чило свое обоснование в дальнейших исследованиях с кормлением крыс ис-
кусственно составленным пищевым рационом, в котором жиры были пред-
ставлены в виде свиного смальца или оливкового масла. При подобном
кормлении рост молодых крыс прекращался и они погибали. Замена смаль-
ца или оливкового масла коровьим маслом, рыбьим жиром или яичным
желтком делала пищевой рацион полноценным. Необходимое для организма
вещество, отсутствовавшее в искусственно составленном пищевом рационе,
получило название витамина А.
127
Отсутствие витамина А в пище — А-авитаминоз сопровождается рядом
симптомов. Молодые животные быстро прекращают свой рост. Отсюда вита-
мин А получил название витамина роста. Это название, однако, оказалось
неудачным, так как остановка роста не является признаком, характерным
только для А-авитаминоза. Рост молодых животных останавливается и в
случае иных авитаминозов, а также в случаях неполноценного белкового
питания и др. Наиболее характерный признак авитаминоза А — заболева-
ние глаз, расстройство сумеречного зрения.
Авитаминоз А сопровождается также изменениями в коже и в слизистых
оболочках. Появляется сухость кожи и слизистых оболочек, благоприят-
ствующая проникновению микробов и возникновению инфекций. Наряду
с этим А-авитаминоз понижает сопротивляемость организма к инфекциям.
Особенно страдает при А-авитаминозе роговая оболочка глаз. Насту-
пает высыхание ее эпителия — ксерофтальмия (греч. xeros — сухой, ophtal-
nios — глаз). Вслед за этим наступает размягчение и некротический распад
роговицы — кератомаляция (греч. keras — рог, malatia — размягчение).
При дальнейшем прогрессировании авитаминоза наступает слепота. Симп-
томы А-авитаминоза как у человека, так и у животных исчезают с наступ-
лением полного выздоровления при введении в организм витамина А.
• Более ранняя стадия А-авитаминоза проявляется в том, что глаз те-
ряет способность приспосабливаться (адаптироваться) к свету различной
интенсивности. При переходе из освещенного помещения в темное человек
плохо различает предметы, медленно приспосабливается к видению в тем-
ноте. В медицинской практике пользуются специальным прибором — адап-
тометром, позволяющим определить, насколько быстро человек адаптирует
свое зрение при перемене освещения. С помощью адаптометра устанавли-
ваются первичные изменения, связанные с недостатком (а не с отсутствием)
витамина А в организме, с гиповитаминозом А. Оказывается, что гипови-
таминоз А нередкое явление, особенно среди детей. Гиповитаминоз, если
не принять соответствующих мер, может перейти в авитаминоз, который
сопровождается более серьезными заболеваниями глаз и более серьезными
расстройствами зрения. Одним из важнейших первичных симптомов А-ави-
таминоза — гемералопия — известен в народе под названием куриной сле-
поты. Заболевание это проявляется в том, что человек, нормально видящий
при обычном освещении, плохо видит с наступлением сумерек. Глаза боль-
ного плохо (медленно) адаптируются к перемене освещения. Больной при
перемене освещения через более поздний срок, чем обычно, начинает разли-
чать предметы.
Следует отметить, что при развитии А-авитаминоза куриная слепота
появляется вне зависимости от развития ксерофтальмии. Ксерофтальмия,
как уже указывалось, является следствием засыхания эпителия роговой
оболочки, куриная же слепота — следствием изменений в сетчатке глаза,
в содержащемся в ней зрительном пурпуре. Витамин А осуществляет свою
функцию, входя в состав важного в физиологическом отношении вещества —
зрительного пурпура.
Зрительный пурпур, или как его еще называют, родопсин, представляет
собой соединение белка опсина с альдегидным производным витамина А.
Родопсин содержится в воспринимающих концевых аппаратах зрительного
нерва, в его палочках, занимающих периферическую часть сетчатки глаза.
Родопсин очень чувствителен к действию света и играет роль фотохимиче-
ского сенсибилизатора. От концентрации родопсина в палочках зритель-
ного нерва зависит восприимчивость глаза к свету. Под влиянием освещения
родопсин распадается с образованием через ряд промежуточных продуктов
пигмента ретинена (альдегида витамина А) и опсина. При длительном воз-
действии света ретинен восстанавливается с образованием витамина А.
В темноте, а также при ослаблении освещения, распавшийся родопсин реге-
нерирует за счет продуктов своего распада. Чем яоче освещение, тем боль-
ше распадается родопсина и чувствительность сетчатки глаза к восприя-
128
тию света понижается. Наоборот, в темноте в результате регенерации род-
опсина, чувствительность сетчатки глаза повышается к восприятию слабо-
го освещения.
Представление о превращении родопсина на свету и в темноте дает
следующая схема:
Родопсин (зрительный пурпур)
и
(D
(Т>
Опсин
Ретиненч--——^Витамин А
-н2
____ Ретинен редуктаза
Давно уже было установлено, что сетчатка глаза по сравнению с дру-
гими тканями богата витамином А. Однако если исследовать сетчатку гла-
за, взятую у животных, находящихся в темноте, то содержание в ней вита-
мина оказывается ничтожно малым. Значительное количество витамина А
можно обнаружить только в подвергшейся яркому освещению сетчатке.
Следовательно, при восприятии сетчаткой яркого освещения родопсин
распадается с освобождением альдегида витамина А, который затем восста-
навливается в витамин А. В темноте, при слабом освещении, витамин А
превращается в свой альдегид (ретинен), который, связываясь с опсином,
дает родопсин (зрительный пурпур).
При недостатке витамина А в организме количество родопсина в сет-
чатке уменьшается, так как ощущается недостаток в материале для образо-
вания ретинена. Синтез распавшегося на свету родопсина в темноте замед-
ляется, световые раздражения в темноте и при слабом освещении воспри-
нимаются сетчаткой плохо. Этим и объясняется причина возникновения
куриной слепоты при недостатке витамина А в организме.
Роль витамина А в организме человека и животных не исчерпывается
тем, что он, вернее его альдегид, являясь составной частью родопсина,
участвует в акте восприятия сетчаткой глаза света. Как уже указывалось,
А-авитаминоз сопровождается не только расстройством процесса светового
восприятия, но и такими симптомами, как засыхание эпителия слизистых
оболочек органов. В чем заключается роль витамина А в предохранении
эпителия слизистых оболочек от засыхания, сказать сейчас еще не предста-
вляется возможным.
Дальнейшее изучение роли витамина А в обмене веществ должно будет
вскрыть биохимические процессы, в которых непосредственно участвует
витамин А.
Химическая структура витамина А
При изучении распространения витамина А было замечено, что содер-
жание его в продуктах питания находится в определенной зависимости от
степени их окраски в желтый цвет. Так, например, летнее желтое коровье
масло оказывается богаче витамином А, чем масло зимнее, белое. Яичный
желток содержит много витамина А. Столовые сорта моркови, окрашенные
в оранжевый цвет, являются источником витамина А, в то время как кормо-
вая белая морковь этим свойством не обладает. Желтые краски, раствори-
мые в жирах, носят название каротинов. Одно время предполагали, что они
и являются витамином А. Позже, однако, было обращено внимание на то
обстоятельство, что некоторые продукты, богатые витамином А (жиры печени
рыб и некоторых млекопитающих животных), окрашены слабо. Это навело на
5 Заказ № 581
129
мысль о том, что должно иметься какое-то иное, чем каротины вещество, об-
ладающее свойствами витамина А. Существование связи между содержа-
нием в продуктах каротинов и витаминной их активностью было взято под
сомнение.
Определенный сдвиг в деле изучения химической природы витамина А
был сделан в 1929 г. Муром, установившим, что добавление к пище, лишен-
ной витамина А, p-каротина не только предохраняет крыс от А-авитаминоза,
но приводит к накоплению у них в печени неокрашенного вещества, обла-
дающего свойствами витамина А. Это позволило сделать вывод, что вита-
мин А образуется в организме животных из каротина, что каротин является
провитамином А.
Для того чтобы разобраться в химической структуре витамина А, необ-
ходимо прежде всего остановиться на химическом строении каротинов.
Каротины впервые были выделены из столовой моркови, а затем и из
иных растений. Различают три вида каротинов: а-, р- и у-каротины, не-
сколько отличающиеся друг от друга по химической структуре. Все они —
циклические углеводороды, но структура колец у различных каротинов
неодинакова:
СН3 СН3
СНз
СН3
сн3
,с—сн=снс=снсн=снс=снсн=снсн=ссн=
С—СН3
сн2
СН, СН,
сн3
=снсн=ссн=снсн сн2
а-Каротин
сн, СН,
X СН, СН, СН,
/ \ I I г
Н.С ССН=СНС=СНСН=СНС=СНСН=СНСН=ССН=
6»
СНз СН3
СНз
=СНСН=ССН=СНС сн2
СН3С
сн2
сщ
?-Каротин
130
CH3 СН3
СН,
о
сн3
сн3
ссн=снс=снсн-снс=снсн=снсн==ссн=
н2с
ССН3
сн2
СН3 СН3
СН3
-снсн=ссн=снсн СН
II
СН3С сн2
сн2
7-Каротин
Все три вида каротинов являются провитаминами А и все они имеют
в своем составе кольца р-ионона. В молекуле p-каротина два кольца р-ионо-
на, и они расположены у обоих концов молекулы. Между обоими кольцами
находится цепь из 18 атомов углерода с отходящими от нее четырьмя ме-
тильными группами. При внимательном рассмотрении формулы р-каро-
тина можно видеть, что структура p-каротина симметрична и что молекулу
его можно было бы расщепить на две равные половины. Подобное окисли-
тельное расщепление молекулы p-каротина происходит в печени под
влиянием содержащегося в ней фермента каротиназы. Структура образую-
щихся при расщеплении p-каротина двух молекул одинакова и идентична
со структурой витамина А.
Следовательно, из каждой молекулы p-каротина в печени (и в слизистой
оболочке тонких кишок ряда млекопитающих животных) образуются две
молекулы витамина А.
В молекуле а-каротина имеется одно кольцо р-ионона и одно кольцо
а-ионона и цепь из 18 атомов углерода с отходящими от нее четырьмя метиль-
ными группами (изопреновые группировки). Так как замыкающие углерод-
ную цепь кольца отличаются друг от друга по своей структуре, то при раз-
рыве углеродной цепи должны возникнуть две также отличающиеся по своей
структуре молекулы, и только одна из них должна оказаться идентичной
по своему построению с витамином А. То же самое можно сказать и в отно-
шении у-каротина, молекула которого содержит одно кольцо р-ионона и
остаток псевдоионона.
Из всех трех каротинов наиболее активен как предшественник витамина
p-каротин. Некоторые другие каротины, например криптоксантин, имеющие
в своей структуре по одному р-иононовому кольцу, также являются прови-
таминами А. Из каждого из них под влиянием каротиназы в печени обра-
зуется витамин А, причем из каждой молекулы этих каротиноидов
Н3С СН3
сн3
СН3
Н2С ССН=СНС=СНСН^СНС=СНСН2ОН
сн3
сн3
Витамин А
/3/
возникает по одной молекуле витамина А. Благодаря наличию в печени
каротиназы каротины в ней подвергаются окислительному расщеплению
с образованием витамина А, который в больших количествах содержится
в печени морских рыб, например трески.
В печени пресноводных рыб имеется витамин А, несколько отличаю-
щийся по своей структуре от витамина А, образующегося из каротина. Этот
витамин получил название витамина А2 и он в р-иононовом кольце имеет
не одну, а две двойные связи.
Н3С^^СН3
с сн3 сн3
/ \ I I
Н2С ССН=СНС=СНСН=СНС=СНСН2ОН
НС ссн3
сн
Витамин А2
Витамин А, находящийся в ткани печени морских рыб и образующийся
там из каротинов, получил название витамина Аг.
Для витамина А2 провитамин неизвестен. Можно поэтому полагать,
что он образуется как продукт превращения витамина АР
Распространение витамина А. Потребность в нем человека
Провитамины А — каротины встречаются в растениях, витамины же Ах
и А2 содержатся только в некоторых продуктах животного происхождения.
Богаты витамином Ах жиры печени ряда рыб (трески, палтуса, морского
окуня). Жир печени палтуса содержит 1,5—2,5% витамина Ап в жире пе-
чени морского окуня витамина Ах до 35%. Содержание витамина Ах и А2
в печени рыб, а также в печени других животных зависит от условий их
питания. Чем больше в пище каротинов, тем больше витамина А оказы-
вается в печени.
Потребность человека в витамине А обеспечивается как за счет каро-
тинов, так и за счет витамина А пищевых продуктов. Подсчеты показывают,
что примерно 2/3 общей потребности организма в витамине А обеспечивается
каротинами растительной пищи и х/з ;— витамином А из пищи животного
происхождения. Если не считать рыбий жир, не являющийся пищевым
продуктом (его потребляют как медицинский препарат), то витамин А в
небольших количествах доставляется в организм с коровьим маслом, цель-
ным молоком, сливками, сметаной, яичным желтком и с печенью крупного
рогатого скота и свиней.
У детей чувствительность к недостатку витамина А значительно выше,
чем у взрослых. Объясняется это сравнительно большим запасом витамина А
в печени взрослых.
Даже временный недостаток витамина А в пище вызывает у детей явле-
ния гипо- и авитаминоза А. У взрослых же гиповитаминоз и тем более
авитаминоз А встречается очень редко.
При обеспечении организма витамином А приходится учитывать, что
каротины всасываются кишечником значительно хуже, чем витамин А.
Для всасывания каротинов кишечником исключительно большое значение
имеют желчные кислоты. При закупорках желчного протока всасывание
каротинов кишечником происходит в крайне незначительном объеме. В
этих случаях каротин или витамин А полезно вводить в организм паренте-
рально, т. е. не через рот, а инъицировать, например, под кожу.
Суточная потребность организма в витамине А составляет 1—2 мг.
Такое количество витамина А может образоваться в печени из 1—2 мг р-ка-
132
ротина. Введение больших количеств витамина А (а не каротинов) в орга-
низм приводит к ряду отрицательных явлений — гипервитаминозу А.
Витамин А разрушается при гидрогенизации, и поэтому он отсутствует
в продукте гидрогенизации жиров — маргарине. Для повышения качества
маргарина его обогащают каротинами.
ВИТАМИНЫ ГРУППЫ D, АНТИРАХИТИЧЕСКИЕ ВИТАМИНЫ,
ВИТАМИН D
Открытие витаминов D тесно связано с изучением тяжелого заболевания
детей — рахита (греч. rachis — позвоночник). Рахит известен в Европе
с давних пор, причем особенно широко он распространен в Англии. Отсюда
рахит называют еще английской болезнью. Рахит широко встречается там,
где живут дети в плохих жилищах, при недостатке свежего воздуха и осо-
бенно солнечного света. Плохое, недостаточное питание детей также является
причиной рахита.
Рахит удалось вызвать у молодых животных (крыс, собак) кормлением
их неполноценной пищей. Животные, как было показано, выздоравливают
при прибавлении к неполноценному корму рыбьего жира. Отсюда стало
ясным, что в рыбьем жире имеется какой-то компонент, предохраняющий
животных от заболевания рахитом. Это вещество оказалось отличным от
антиксерофтальмического фактора (витамина А). Последний разрушается
при аэрации рыбьего жира при 100°С, в то время как антирахитический ком-
понент при этих условиях остается без изменений. Антирахитическое веще-
ство получило название витамина D.
Химическая структура витамина D
Выяснению химической структуры витамина D предшествовали много-
численные исследования. Хульдчинский, исходя из того, что рахитом болеют
дети, лишенные в значительной степени солнечного света, применил в 1919 г.
облучение больных рахитом детей ультрафиолетовым светом. Он установил,
что облучение ультрафиолетовыми лучами оказывает лечебное действие.
Несколько позже было показано, что при облучении ряда пищевых продук-
тов ультрафиолетовыми лучами они приобретают антирахитическое свой-
ство. Ультрафиолетовые лучи, оказалось, действуют на липиды пищевых
продуктов, вернее на два из них — эргостерин и на 7-дегидрохолестерин.
В то время как продукт, образующийся при облучении 7-дегидрохолестери-
на, обладает одинаковой активностью при лечении больных рахитом кур
и крыс, продукт облучения эргостерина оказывается менее эффективным при
лечении птиц, чем при лечении крыс. Отсюда можно было сделать вывод,
что продукты, возникающие при облучении ультрафиолетовыми лучами
7-дегидрохолестерина и эргостерина, несколько отличаются друг от друга.
Облучение эргостерина приводит к образованию ряда изомеров, стеринов,
один из которых — кальциферол — обладает значительным антирахити-
ческим действием.
Кальциферол получил название витамина D2. (Витамином Dx был наз-
ван препарат недостаточно очищенного кальциферола. Сейчас название Di
не применяется).
Приводим схему превращения эргостерина при облучении его ультра-
фиолетовыми лучами:
Эта схема показывает, что среди продуктов, образующихся из эрго-
стерина при облучении его ультрафиолетовыми лучами, центральное место
занимает превитамин (стерин, близкий по своим свойствам к эргостерину и
к витамину D2). Превращение превитамина в витамин D2 происходит под
влиянием тепловой энергии, при температуре 80°С. Это обстоятельство за-
ставляет предполагать наличие в коже, где под влиянием ультрафиолетовых
133
Эргостерин
4
Тепловая энергия
D2 t—.__> Превитамин <---Тахистерин
(Кальцеферол) t
I_Люмистерин
лучей эргостерин превращается в витамин D2, фермента, катализирующего
превращение превитамина в витамин D2.
При облучении ультрафиолетовыми лучами 7-дегидрохолестерина по
приведенной выше схеме возникает биологически активный продукт, по-
лучивший название витамина D2.
При продолжительном облучении ультрафиолетовыми лучами витамин
D2 теряет свою витаминную активность с образованием веществ, токсически
действующих на организм (токсистерина, супрастерина I и супрастерина II).
Получение из эргостерина и 7-дегидрохолестерина антирахитических
витаминов D2 и D3 объяснило, почему именно дети, лишенные солнечного
света, болеют рахитом и почему облучение ультрафиолетовыми лучами
больных рахитом детей оказывает лечебное действие. Под действием ультра-
фиолетовых лучей эргостерин и 7-дегидрохолестерин подкожной жировой
клетчатки превращаются в витамины D2 и D3.
Эргостерин и 7-дегидрохолестерин получили название провитаминов
D2 и Е)3. Необходимо, однако, учитывать, что в организме животных отсут-
ствуют ферменты, превращающие эргостерин и 7-дегидрохолестерин в ви-
тамины D2 и D3. Этим провитамины D2 и D3 отличаются от провитамина А
(каротина), который под влиянием каротиназы превращается в печени в
витамин А.
Поэтому провитамины D2 и D3 не могут заменить в организме витаминов
D2 и D3 без действия ультрафиолетовых лучей.
В естественных продуктах (рыбий жир, коровье масло и др.) встре-
чается витамин D3
СН3 СН3 СН3
I I I
СН—сн=сн—сн—сн—сн3
Эргостерин
сн3 сн3 снэ
I I I
СН3 —СН—СН—СН—сн—сн—сн3
но
Витамин D2
134
сн,
СП,
CH, —сн—снг—сн2—сн2—сн—сн.
V<£13
z\z\z
сн
HO/w
7-Дегидрохолестерин
сн,
сн,
□
сн3__сн—сн2—сн2—сн2-сн—сн3
сн2
но
Витамин D
Действие витаминов D2 и D3* Практическое
их применение
Основным признаком рахита является нарушение кальциевого и фос-
форного обмена и связанного с ним процесса костеобразования. В костях
больных рахитом уменьшается содержание солей кальция и фосфорной
кислоты, главным образом фосфорнокислого кальция. Кости становятся
мягкими, и под влиянием веса туловища деформируются кости ног. Наруше-
ние костеобразования приводит к изменению формы черепа. Голова стано-
вится непомерно большой. У детей, больных рахитом, замедляется развитие
зубов.
Рентгеноскопически удается легко видеть недостаточное обызвествле-
ние концов трубчатых костей (эпифизов). Хрящевая прослойка между эпи-
физом и диафизом трубчатых костей увеличивается.
Нарушения обмена кальция и фосфора сопровождаются уменьшением
содержания этих веществ в сыворотке крови. Особенно это относится к фос-
фору. В сыворотке крови здоровых детей содержание фосфора неорганиче-
ских фосфатов равно 5 мг%; при рахите, в зависимости от степени заболева-
ния, количество фосфора снижается до 3 и даже 2 мг%. Определение содер-
жания неорганического фосфора в сыворотке крови позволяет судить о
тяжести рахитического процесса.
Рахит эффективно лечится введением в организм препаратов вита-
мина D2 (кальциферола) и витамина D3, а также обогащением пищевого
рациона продуктами с высоким содержанием витамина D3. Большое значе-
ние имеет применение препаратов витаминов D2 и D3 для предупреждения
заболевания рахитом.
Витамины D2 и D3 получили также применение в зоотехнической прак-
тике. Ими пользуются для предупреждения, а также и для лечения рахита
у цыплят, поросят, телят. В зоотехнической практике обычно прибегают
к облучению ультрафиолетовыми лучами дрожжей. Дрожжи богаты эрго-
стерином и после облучения содержат много витамина D2; их и добавляют
к корму животных. Витамин D3 в значительных количествах имеется в
135
коровьем масле и в желтках яиц, в печени. Овощи, фрукты и мучные про-
дукты витамина D не содержат. Суточная потребность детей и взрослых
в витамине D исчисляется в 25 [лг.
Избыточное введение в организм витамина D приводит к отрицатель-
ным явлениям — к гипервитаминозу D.
ВИТАМИНЫ ГРУППЫ Е, АНТИСТЕРИЛЬНЫЕ ВИТАМИНЫ,
ТОКОФЕРОЛЫ
В 1920 г. было сделано наблюдение, приведшее затем к открытию вита-
мина Е. Было установлено, что взрослые крысы, кормившиеся продолжи-
тельное время одним молоком, теряли способность размножаться. Молоко,
являющееся полноценным продуктом питания для молодых животных,
по-видимому, не может удовлетворить потребности взрослого организма.
Оказалось также, что продолжительное кормление крыс искусственно
составленным пищевым рационом, содержащим различные витамины,
также приводит к их бесплодию. Так была установлена связь между пита-
нием и способностью животных к размножению.
Витамин Е
Активный фактор, необходимый для размножения животных, получил
название витамина Е. Богаты витамином Е растительные масла, особенно
масло из зародышей пшеницы. В 1936 г. витамин Е был выделен из масла
зародышей и получил название токоферол (греч. tocos — рождение детей,
fero — несу). Это название нельзя считать удачным, так как отсутствие
витамина Е в пище вызывает не только прекращение размножения живот-
ных, но и нарушение ряда других функций организма.
Химическая структура витамина Е
Токоферол получен из масла зародышей пшеницы в виде маслянистой
жидкости. В кристаллическом виде получен его эфир с аллофановой кисло-
той (NH2 — СО — NH — СООН). В продуктах питания установлено нали-
чие трех близких друг к другу по химической структуре токоферолов: а-,
р- и у-токоферолов, обладающих витаминной активностью и отличающихся
друг от друга по количеству и расположению в их циклическом компоненте
метильных групп:
СН3
сн2
НО—С
СН
СНз
сн3
снэ
о сн9
С—(СН2)3—СН(СН2)з—СН(СН2)з—СН—СНз
Фитол
снэ
а-Токоферол
НО—С
СН.
л 0
сн2
СН сн2
сн2
но—с
сн2
3
О СН3
СНз
₽-Токоферол
СНз
v-Токоферол
* R — боковая цепь, одинаковая у
всех токоферолов — фитол.
136
а-Токоферол состоит из циклического компонента — триметилгидро-
хинона и спирта-фитола (фитол входит также в состав хлорофилла). Он очень
устойчив к воздействию кислот, не разрушается при высоких температурах
(выдерживает нагревание до 170° С).
Авитаминоз Е
Е-Витаминной активностью обладает ряд производных гидрохинона
и хинонов, однако по активности эти соединения значительно уступают
токоферолам.
Из а-, р- и у-токоферолов наибольшей активностью обладает а-токо-
ферол.
Е-авитаминоз, экспериментально вызванный у крыс, оказывает различ-
ное влияние на органы воспроизведения у самцов и у самок. У самцов раз-
вивается атрофия зародышевого эпителия и постепенно прекращается спер-
мообразование. Форма сперматозоидов дегенеративно изменяется, исчезают
жгутики, и сперматозоиды теряют подвижность. Все это приводит к тому,
что способность сперматозоидов к оплодотворению резко снижается. На-
ряду с этим у самцов прекращается образование половых гормонов, угасает
половой инстинкт и деградируют вторичные половые признаки.
У самок при Е-авитаминозе в течение длительного периода не отмечает-
ся особых изменений, кроме потери способности к деторождению. Оплодо-
творение яйца и начальное развитие эмбриона у Е-авитаминозных самок
происходит без отклонения от нормы. Но вскоре развитие эмбриона при-
останавливается, плод рассасывается и беременность прекращается. Если
зачатие имело место в начале авитаминоза, беременность протекает нормаль-
но, но самки оказываются неспособными вырастить потомство.
Стерильность животных (потеря способности к размножению) не отно-
сится к первичным признакам Е-авитаминоза; она является результатом
целого ряда изменений в организме, вызываемых отсутствием в пище вита-
мина Е. К ним следует отнести прежде всего изменения, наблюдающиеся
в поперечнополосатых мышцах. Уже в первые дни кормления молодых
кроликов Е-авитаминозной пищей наблюдаются гистологические изменения
в мышцах. Мышцы теряют свою поперечнополосатую исчерченность, а затем
наступают более глубокие изменения, ведущие к перерождению мышечных
волокон. Мышечные волокна истончаются и затем распадаются, некротизи-
руются. Одновременно с уменьшением массы мышечных волокон в мышцах
возрастает количество соединительной ткани. Все эти изменения наступают
в результате нарушения нормального питания мышц, дистрофии. К концу
Е-авитаминоза масса мышечной ткани у животных значительно уменьшается,
подвижность животных резко снижается, и они погибают при явлениях
паралича.
Морфологические изменения в мышцах сопровождаются изменениями
в обмене веществ.
В мышцах снижается содержание гликогена, увеличивается количество
липидов, изменяется содержание различных минеральных веществ (увели-
чивается содержание хлористого натрия, уменьшается содержание калия,
магния, фосфора). Изменяется также белковый состав мышц, причем резко
уменьшается количество сократительного белка — миозина. В мышцах
снижается содержание креатина. Изменения, наступающие в мышцах при
Е-авитаминозе, носят название мышечной дистрофии. Последняя изучена
у крыс, кроликов, хомяков, морских свинок и собак. Мышечная дистро-
фия в незапущенных случаях излечивается обогащением пищи токофе-
ролами.
От недостатка витамина Е в пище страдают также и сельскохозяйствен-
ные животные. У кур снижается яйценоскость и вылупляемость при инку-
бировании яиц. У животных уменьшается масса мускулатуры. Несмотря
на то, что токоферолы широко распространены и Е-авитаминоз обычно не
137
встречается, все же следует учитывать, что потребность в них организма
не всегда одинакова. При беременности, при некоторых инфекционных
заболеваниях, особенно при бруцеллезе, потребность организма в витами-
не Е возрастает. В этих случаях следует заботиться об увеличенной доставке
витамина Е в организм.
Е-авитаминоз отличается еще одной интересной особенностью; больные
животные, а также изолированная их мышечная ткань, усиленно потреб-
ляют кислород. Интенсивность дыхания животных возрастает в 2—3 раза.
Введение в организм витамина Е снижает потребление кислорода и при-
водит интенсивность дыхания к норме. Отсюда можно заключить, что токо-
феролы каким-то образом действуют на ферменты дыхания, снижая их
активность. Выяснить, на какие именно ферменты действуют токоферолы,
трудно, так как они нерастворимы в воде, и поэтому изучить их взаимодей-
ствие с ферментами в водной среде вне организма не представляется воз-
можным.
В определенной связи с усиленным потреблением кислорода при Е-ави-
таминозе находятся установленные факты резкого повышения интенсив-
ности обновления белков и ряда иных важных составных частей (нуклеино-
вых кислот, гликогена, фосфорных соединений) тканей животных. В этом
отношении Е-авитаминоз отличается от всех иных изученных авитаминозов.
Некоторые особенности биологической активности токоферолов свя-
заны с их действием как антиоксидантов, т. е. веществ, предохраняющих
от окисления другие вещества. В этом отношении интересно, что токофе-
ролы предохраняют от окисления каротины и витамин А и тем самым создают
более благоприятные условия для их использования в организме. Однако
действие токоферолов как антиоксидантов нельзя считать специфическим,
так как другие соединения обладают тем же действием.
Распространение токоферолов
Токоферолы широко встречаются как в продуктах животного (мясо,
яйца, молоко, коровье масло), так и в продуктах растительного происхож-
дения (зеленые овощи, горох, фасоль, хлеб из муки грубого помола, льня-
ное и хлопковое масла).
В организме животных, в его тканях, всегда имеется некоторый запас
токоферолов. В значительных количествах они содержатся в плаценте,
в гипофизе, обнаруживаются в мышцах, в печени и в иных органах. Этим
объясняется причина медленного развития авитаминоза при кормлении
животных пищей, в которой отсутствуют токоферолы. Зимой и весной запас
токоферолов в организме животных уменьшен и Е-авитаминоз у них вы-
зывается легче и быстрее.
ВИТАМИНЫ ГРУППЫ к, АНТИГЕМОРРАГИЧЕСКИЕ
ВИТАМИНЫ, КОАГУЛЯЦИОННЫЙ ФАКТОР
Витамин К
В 1929 г. в опытах с кормлением цыплят искусственно составленной
пищей было открыто вещество, отсутствие которого в пище замедляет про-
цесс свертывания крови. В 1934 г. Дам назвал это вещество витамином К.
При отсутствии витамина К в пище, а также при нарушении его всасывания
кишечником, например при недостаточном поступлении желчи в кишечник,
наступает К-авитаминоз, характеризующийся понижением содержания
в крови протромбина — одного из важных компонентов ферментной системы
свертывания крови, прекращением синтеза ряда иных белков, необходимых
для свертывания крови, замедлением образования кровяного сгустка (за-
138
медление свертывания крови) и подкожными и внутримышечными кровоиз-
лияниями (геморрагии).
Введение в организм авитаминозных животных витамина К повышает
у них содержание протромбина в крови до нормального уровня и устраняет
явления авитаминоза.
Химическая структура витамина К
Витамин К выделен в 1939 г. из люцерны, и в том же году была уста-
новлена его химическая структура. Молекула витамина К построена из
циклического компонента — 2-метил-1,4-нафтохинона и из фитола. Из гни-
ющей рыбной муки было выделено вещество, аналогичное по действию ви-
тамину К и несколько отличающееся от него по своим химическим и физи-
ческим свойствам.
Витамин, выделенный из люцерны, получил название витамина Кх;
витамин же, изолированный из рыбной муки, — витамина К2.
Витамин К2 отличается от витамина Ki структурой своей боковой цепи,
которая содержит шесть двойных связей
и 30 атомов углерода:
НС
С—СН3 СН3
сн3
сн3
НС
С—СН2—СН=С—(СН2)з^СН—(СН2)з—СН—сн3
Витамин Kt
НС
-сн3
СНз
сн3
НС С С—СН2—[СН-С—СН2 -CH*]6CH-C—CI13
Витамин Кг
Витаминная активность К2 примерно в два раза ниже активности КР
Образуется витамин К2 в рыбной муке при действии на нее микробов.
Активность витаминов Ki и К2 определяется наличием в их составе
молекул циклического компонента —2-метил-1,4-нафтохинона. Сам 2-ме-
тил-1,4-нафтохинон обладает при расчете на грамм-молекулу такой же ак-
тивностью, как и витамин Кх. В медицинской практике получили применение
как 2-метил-1,4-нафтохинон, так и его водорастворимые фосфатное и би-
сульфитное производные
НО NaSO3 НО Н2РО4
С=О
с
\/\/
II
о
139
Бисульфитное производное 2-метил-1,4-нафтохинона —викасол —ста-
ло широко применяться в медицинской, особенно в хирургической практике
после того, как А.В. Палладии установил; что введение в организм аналогов
витамина К ускоряет свертывание крови не только при сниженном содер-
жании протромбина в крови, но и при норме.
Распространение витамина К. Потребность в нем
организма
Витамин Ki доставляется в организм человека и животных с пищей.
Некоторое количество витамина К2 синтезируется кишечной флорой и вса-
сывается из кишечника. Наличие кишечной флоры, синтезирующей вита-
мин К2, уменьшает потребность в доставке витамина К в организм с пище-
выми продуктами.
Применение сульфамидных препаратов, ограничивающее развитие
микрофлоры, уменьшает объем синтеза витамина К2 в кишечнике. У ново-
рожденных детей вследствие отсутствия кишечной флоры и запаса витамина
К в тканях наблюдаются иногда геморрагии, которые легко устраняются
путем введения в организм витамина К] и его аналогов.
Витамин Ki встречается, главным образом, в продуктах питания рас-
тительного происхождения, особенно в зеленых частях растений. Шпинат,
крапива, капуста богаты витамином Кх.
НЕНАСЫЩЕННЫЕ ЖИРНЫЕ КИСЛОТЫ, ОБЛАДАЮЩИЕ
СВОЙСТВАМИ ВИТАМИНОВ
Ненасыщенные жирные кислоты с несколькими двойными связями
(цисизомеры) — линолевая, линоленовая и арахидоновая (стр. 93) не син-
тезируются у животных и у человека и могут быть отнесены к числу ви-
таминов.
В опытах на млекопитающих животных установлены патологические
изменения при кормлении их продуктами, в которых отсутствуют указанные
ненасыщенные жирные кислоты. Добавление этих жирных кислот к ави-
таминозному корму предохраняет животных от заболевания.
Незаменимые ненасыщенные жирные кислоты входят в состав расти-
тельных масел. Потребность в них организма человека составляет около
1 г в сутки.
АНТИВИТАМИНЫ
При изучении витаминов в ряде случаев можно было наблюдать, что
витамины (Вх, В2, В6, РР) являются веществами, из которых в организме
образуются небелковые компоненты ферментов. В этих случаях явления
авитаминозов вызываются недостатком в ферментах, нарушениями фермен-
тативных процессов в организме. В других случаях механизм действия
витаминов остается еще не выясненным, хотя и здесь авитаминозы сопровож-
даются нарушениями процессов обмена веществ.
Авитаминозы могут быть вызваны у животных и у микробов не только
отсутствием в пище витаминов. Оказалось, что авитаминозы вызываются
также веществами, являющимися по своему действию антагонистами ви-
таминов. Эти вещества принято называть антивитаминами. Антивитамины
близки по своей химической природе к соответствующим им витаминам.
Однако они не только не обладают в организме свойствами витаминов,
но препятствуют проявлению действия витаминов, занимая благодаря хи-
мической близости их место в биохимических системах.
140
Антивитамины вытесняют из биохимических систем витамины, но не
способны выполнять их биологические функции. Антивитамины — как бы
ложные заменители витаминов.
В 1940 г. Вуд установил, что сульфаниламиды тормозят рост бактерий,
конкурируя с n-аминобензойной кислотой, являющейся витамином (стр. 121).
Сравнение химических структур сульфаниламида и п-аминобензойной
кислоты выявляет их близость:
СН СН
H.NC^^CH H,NC^\cH
С—СООН
С—SO2NH2
n-Аминобензойная кислота
Сульфаниламид
n-Аминобензойная кислота входит в структуру фолиевой кислоты
(стр. 121). Сульфаниламиды, конкурируя с n-аминобензойной кислотой,
препятствуют использованию ее при синтезе фолиевой кислоты.
Введение животным дезоксипиридоксина быстро вызывает у них В6-
авитаминоз:
ССН2ОН
С—СН2ОН
НОС
Пиридоксин
Дезоксипиридоксин
Дезоксипиридоксин является антивитамином для пиридоксина. Пири-
дин-3-сульфокислота — антивитамин для никотиновой кислоты. Она угне-
тает рост некоторых бактерий
С—СООН
СН
НС
Никотиновая кислота
НС СН
Пиридин-З-сульфокислота
Явления авитаминоза Bj (полиневрит) можно вызвать у крыс кормлением
их небольшими количествами пиритамина. Эти явления могут быть ликви-
дированы введением в организм тиамина. Пиритамин — антивитамин для
тиамина
Тиамин
141
Глюкоаскорбиновая кислота близка по своей структуре к аскорбиновой
кислоте и является ее антивитамином
!
С—он
II о
с—он
I
НС-----
I
носн
I
сн2он
II
с—он
— сн
I
неон
I
НСОН
I
СНоОН
to
Аскорбиновая кислота
Глюкоаскорбиновая кислота
Антивитамины, конкурируя с витаминами, в ряде случаев вытесняют
их из небелковых компонентов ферментов (например, дезоксипиридоксин
вытесняет пиридоксин из ферментов, катализирующих обмен аминокислот).
Занимая их место, они образуют «недеятельные ферменты». В результате
этого обмен веществ нарушается, что может привести к гибели организма.
Действие поступивших в организм антивитаминов можно снять путем
введения в организм соответствующих количеств витаминов.
АНТИБИОТИКИ
Рост и развитие микроорганизмов можно прекратить не только анти-
витаминами, но и веществами, известными под названием антибиотиков.
Эти вещества, обладающие антимикробным действием, образуются в плесе-
нях, дрожжах, бактериях, а также в организмах растений и животных.
Для них характерна некоторая специфичность действия, и образование их
может рассматриваться как явление «химической» защиты одних живых
существ от воздействия на них других. Антибиотики получили широкое при-
менение в медицинской и ветеринарной практике при лечении инфекцион-
ных заболеваний.
Механизмы действия антибиотиков на микроорганизмы разнообразны.
В большинстве случаев они избирательно влияют на те или иные ферменты,
ослабляя или даже прекращая их действие. Для лечебных целей подби-
раются такие антибиотики, которые оказывают в организме человека и жи-
вотных бактериостатическое действие и минимально при этом влияют на
их ткани.
Далеко не во всех случаях выяснено, каким образом взаимодействуют
антибиотики с ферментами микробов. Известно, что иногда бактериостати-
ческий эффект антибиотика обусловлен продуктом, образующимся в ре-
зультате действия антибиотика. Из плесени Penicillium notatum выделено
вещество нотатин, оказавшееся желтым окислительным ферментом, ката-
лизирующим реакцию окисления глюкозы.
нотатин
Глюкоза + О2-------> лактон глюконовой кислоты 4- Н2О2
глюконовая кислота
Нотатин — фермент, обладающий антибиотическим действием в при-
сутствии глюкозы; этому он обязан образующейся в результате окисления
глюкозы перекиси водорода. Возникающая перекись водорода оказывает
бактериостатическое действие.
142
Химическая природа ряда антибиотиков выяснена. Ниже приводятся
формулы часто применяющихся в медицинской практике антибиотиков пе-
нициллина, стрептомицина и ауреомицина и данные о лизоцимах и интер-
фероне:
Пенициллин
С1 Н3С ОН N(CH3)2
он о он о
Ауреомицин
NH
,СН3
--''Н
Н3с- N—СН
неон
I
носн
I
-------СН
I
СН2ОН
Стрептидин
Стрептоза ЛЛМетил-Л-глюкозамин
Стрептобиозамин
Стрептомицин
Лизоцимы обнаружены у животных, растений и у микробов. Они яв-
ляются белковыми веществами. Молекулярный вес лизоцима, изолирован-
ного из яичного белка в кристаллическом виде, равен 14800. Этот полипеп-
тид построен из 130 остатков аминокислот. W-концевой его аминокислотой
является лизин; С-концевой—лейцин.
143
Лизоцимы по своему действию являются ферментами, расщепляющими
у чувствительных к их действию микроорганизмов, мукополисахариды;
Интерферен также белковое вещество. Он обнаружен в инфицирован-
ных вирусом клетках. Интерферен препятствует размножению различных
видов вирусов.
АНТИМЕТАБОЛИТЫ
Наряду с антивитаминами существуют вещества, специфически влияю-
щие на течение ферментативных процессов. Они носят название антиме-
таболитов.
Антиметаболиты блокируют процессы использования естественно воз-
никающих в тканях организма промежуточных продуктов обмена вещества —
метаболитов. Будучи близки по своим химическим свойствам к метаболитам
и обладая химическим сродством к ферментам, они связываются с фермен-
тами с образованием комплексов, неспособных к дальнейшим превращениям.
Этим они выключают ферменты и нарушают биохимические процессы в
организме. Ниже даны примеры действия некоторых антиметаболитов.
Одним из важных ферментов, участвующих в цикле окисления органи-
ческих веществ, является дегидрогеназа янтарной кислоты — сукциндеги-
дрогеназа. Она катализирует окисление янтарной кислоты с образованием
фумаровой кислоты:
СООН СООН СООН
I I I
сн2 сн сн2
I -н* II I
СН2 —* СН СООН
I I
СООН СООН
Малоновая кислота
Антиметаболит — малоновая кислота, блокирующий в опытах in
vitro окисление янтарной кислоты, связывается с сукциндегидрогеназой и
тем самым делает невозможным окисление янтарной кислоты.
Антиметаболитом 6-аминопурина (адениьа) является 2,6-диаминопурин:
CNH, N
N NH
6-Аминопурин
2,6-Диаминопурин
2-6-Диаминопурин, введенный в организм, в ферментативных реакциях
замещает аденин, исключая возможность его использования.
Антиметаболитом фенилаланина является [3-2-тиэнилаланин:
СН
S
с—сн2—chnh2cooh
сн
C-CH2.CHNH2COOH
3-2-T иэнилаланин
144
Связывая ферменты, катализирующие превращение фенилаланина,
р-2-тиэнилаланин препятствует использованию его в тканях.
Антиметаболитом метионина является его сульфоксимин:
I I3C—S—(СН2)2—СН—СООН
о nh2
Метионин
о
II
Н3С—S—(СН2),—СН—СООН
I
ын2
Сульфоксимин
метионина
Выключением метионина из процессов обмена веществ сульфоксимин
приводит к ряду расстройств в организме. У собак он вызывает судорожные
приладки, известные под названием «собачьей истерии». Токсическое дей-
ствие сульфоксимина устраняется введением в организм метионина.
Антиметаболиты относятся к веществам, чуждым для организма. Бла-
годаря близости их химической структуры к структуре образующихся в
организме тех или иных промежуточных продуктов обмена веществ они
становятся на место последних и нарушают нормальное течение фермента-
тивных реакций в клетках.
Антиметаболиты используются в случаях, когда возникает необходи-
мость снизить активность течения того или иного ферментативного процесса
в тканях организма и тем самым препятствовать росту ткани (например,
для прекращения роста опухолей).
ЛИТЕРАТУРА
Андреева Н. А. Участие фолиевой кислоты в превращениях одноуглероди-
стых соединений. «Успехи биологической химии», 1963, т. 5.
Березовский В. М. Химия флавинов. «Успехи химии», 1949, т. 18, вып. 6.
Березовский В. М. Химия витаминов группы В. «Успехи химии», 1952,
т. 21.
Букин В. Н., Арешкина Л. Я. и Куцева Л. С. Химия и биохимия
витамина В12. «Успехи современной биологии», 1955, т. 40.
Б у к и н В. Н. Витамины. Пищепромиздат, 1940.
В ул л и Д. Учение об антиметаболитах. ИЛ, 1954.
ДевятининВ. А. Витамины. Пищепромиздат, 1948.
Кудряшов Б. А. Биологические основы учения о витаминах. «Советская
наука», 1948.
Леутский К. М. Витамин А. Изд. Львовского гос. ун-та, 1959.
Леутский К. М. Витамины (комплекс Вг). Изд. Львовского гос. ун-та, 1949.
Натансон А. О. Витамин А и А-витаминная недостаточность. Медгиз, 1961.
Сборники «Витаминные ресурсы и их использование», 1951—1961, № 1—5. Изд.
АН СССР.
Сборники «Витамины», 1953—1958, № 1—4. Изд. АН УССР.
Труфанов А. В. Биохимия и физиология витаминов и антивитаминов. Сель-
хозгиз, 1959.
Глава седьмая
ФЕРМЕНТЫ
К ферментам относятся белковые вещества, биологическая функция
которых состоит в ускорении (катализе) течения химических реакций в
организмах.
Одно из поразительных проявлений жизни — неимоверная скорость
течения химических процессов. Вещества, устойчивые, т. е. практически
не изменяющиеся при обычных температурных условиях, становятся не-
устойчивыми и легко распадаются при поступлении их в организм. Сложные
углеводы (например, крахмал), жиры и белки могут храниться без заметных
изменений при температуре 37°С. Попадая же в пищеварительный тракт,
они под влиянием пищеварительных соков быстро подвергаются гидролити-
ческому распаду с образованием более простых веществ. Подобных примеров
можно было бы привести очень много. Чем же можно объяснить это явление?
Объяснение тут одно: в организмах имеются вещества — катализаторы,
ускоряющие течение химических реакций. Вещества эти получили название
ферментов, или энзимов, и они, как это установлено, являются
белками.
С действием ферментов человек знаком уже с незапамятных времен.
Свертывание молока при изготовлении сыра, сбраживание углеводов при
получении спирта, хлебопечение, пивоварение и целый ряд других техно-
логических процессов имеют в своей основе действие ферментов.
Катализаторы, в том числе и ферменты, не способны вызывать реакции,
невозможные по термодинамическим условиям. Они только лишь ускоряют
обычно медленно идущие реакции. Ферменты в клетках живых существ
направляют течение реакций по определенным путям, что объясняется сле-
дующим образом. В состав клеток входят разнообразные соединения, спо-
собные подвергаться превращениям и реагировать друг с другом. Между
тем химические реакции в клетках не происходят хаотически. Из всех тер-
модинамически возможных реакций в клетках преимущественно осущест-
вляются только лишь те, которые благодаря действию ферментов протека-
ют с большой скоростью. По И. П. Павлову, ферменты «есть возбуди-
тели всех химических превращений у живых существ».
ФЕРМЕНТЫ КАК КАТАЛИЗАТОРЫ
БИОЛОГИЧЕСКОЙ ПРИРОДЫ
Первые представления о ферментах и их действии носили виталисти-
ческий характер. Принималось, что быстрое превращение стабильных при
обычных условиях веществ осуществляется особой «жизненной» силой.
Еще во второй половине XIX столетия существовало представление, что
скорость течения химических процессов в организмах является результатом
их жизнедеятельности, а не действия веществ-катализаторов. Однако со
146
временем исследователям все больше удавалось проникать в сущность дей-
ствия ферментов и приблизиться к выявлению их химической природы.
В 1811 г. Кирхгоф сообщил, что крахмал при воздействии на него раз-
веденной соляной кислоты превращается в глюкозу, причем соляная кис-
лота остается в этом процессе без изменения. Несколько позже (в 1814 г.)
Кирхгоф установил, что подобный распад крахмала происходит под влия-
нием экстракта из проросших зерен злаков. Кирхгоф первым описал явле-
ние ускорения течения химической реакции (расщепления крахмала)
под влиянием веществ, не принимающих видимого участия в ней. После
Кирхгофа, в первой четверти XIX столетия, было установлено, что некото-
рые химические реакции ускоряются в присутствии металлов. В 1836 г.
Берцелиус обобщил установленные факты ускорения течения химических
реакций, назвав это явление катализом, а вещества, присутствие которых
вызывает это явление, — катализаторами. Естественно, возникает вопрос,
каким образом действуют катализаторы, как объяснить ускорение течения
реакций их присутствием?
Как известно, скорость течения химической реакции зависит от частоты
столкновения молекул реагирующих веществ. Повышение температуры
усиливает движение молекул, что увеличивает частоту их столкновений.
Понятно поэтому, что повышение температуры должно ускорить течение
реакции. Важное значение для скорости течения реакции имеет концентра-
ция реагирующих веществ. Чем выше концентрация молекул в растворе,
тем больше возможность при движении столкновения молекул друг с дру-
гом. В приведенных случаях ускорение течения реакций не связано с нали-
чием катализаторов, а обусловлено температурой и концентрацией реаги-
рующих между собой веществ. Добавление катализатора повышает скорость
течения реакции при данных условиях температуры и концентрации реа-
гирующих между собой веществ. Для большей ясности остановимся на кон-
кретном примере.
Часто применяемым катализатором является губчатая платина. Послед-
няя, будучи прибавленной к смеси водорода и кислорода, катализирует
реакцию образования воды. В этом случае мы имеем дело с гетерогенным
катализом, и сущность действия губчатой платины заключается, в значи-
тельной мере, в концентрировании молекул водорода и кислорода на ее
поверхности, что облегчает столкновение их друг с другом. Но как объяс-
нить катализ, при котором химическая реакция протекает в растворе или
в газовой среде, т. е. в одной фазе (гомогенный катализ)? В данном случае
катализатор не концентрирует на своей поверхности молекулы реагирую-
щих веществ; он также не влияет на температуру среды, в которой проте-
кает реакция. В чем же в этом случае заключается действие катализатора?
Чтобы ответить на этот вопрос, полезно привлечь известные в физической
химии данные о кинетике химических реакций. Эти данные говорят, что
в химическое взаимодействие вступают молекулы веществ, находящиеся
как бы в возбужденном, иначе говоря, в активном состоянии. Энергия,
необходимая для возбуждения молекул, носит название энергии активации.
Следовательно, температура и концентрация реагирующих между
собой веществ не являются единственными моментами, влияющими на ско-
рость течения химических реакций, они только лишь влияют на частоту
столкновения (встречи друг с другом) молекул и, в том числе, что особенно
важно, активных молекул. Действие катализатора заключается в том, что
он снижает энергию активации, необходимую для осуществления данной
реакции. Осуществляется это установлением временной связи катализатора
с реагирующими веществами, в результате возникают промежуточные реак-
ции, требующие значительно меньшей энергии активации. Представим себе
реакцию, протекающую между двумя веществами А и Б при определенной
энергии активации их молекул: А+Б->АБ. В присутствии катализатора
(К) реакция произойдет несколько обходным путем. Катализатор войдет во
временную связь с одним из реагирующих веществ: А+К->АК, а затем
147
уже АК будет реагировать с Б : АК+Б~>АБ-|-К. Эти реакции будут прои-
сходить при меньшей энергии активации, чем реакция А+Б->АБ.
При действии ферментов мы имеем дело с гомогенным катализом, для
которого во многих случаях изучена степень снижения энергии активации.
Приведем два примера:
1) Реакция гидролиза сахарозы: С^Н^Оц+ЩО-^
->2С6Н12О6. Энергия активации для осуществления этой реакции без уча-
стия фермента составляет 32 калории на моль. В присутствии фермента
сахаразы энергия активации снижается до 9,4 калорий на моль.
2) Перекись водорода разлагается на воду и кисло-
род. В отсутствии катализатора эта реакция требует энергии активации,
равной 18 калориям на моль. Введение фермента каталазы снижает энергию
активации до 5,5 калорий. Интересно отметить, что под влиянием ферментов
энергия активации молекул снижается значительно больше, чем в случае
действия неорганических катализаторов.
Катализаторы, снижая энергию активации, ускоряют течение хими-
ческих реакций.
ИЗ ИСТОРИИ ИЗУЧЕНИЯ ФЕРМЕНТОВ
Современные представления о ферментах как о белковых веществах — катали-
заторах — сложились в результате многочисленных исследований, проведенных в те-
чение полутора столетий. Первое вполне научное описание действия фермента было
дано в 1814 г. Кирхгофом, которому удалось показать, что водные вытяжки из солода
способны при обычной температуре расщеплять крахмал с образованием сахара
и декстрина. Через десять лет после открытия Кирхгофа был обнаружен новый фермент
в горьком миндале (эмульсин), способствующий гидролизу амигдалина, и описано
действие известных уже в то время ферментов — амилазы слюны и пепсина желудоч-
ного сока. В 1833 г. Пайен и Персо провели исследования, сыгравшие важную роль
в деле дальнейшего изучения ферментов. Из полученных экстрактов солода, обладаю-
щих способностью расщеплять крахмал с образованием сахара, им удалось осаждени-
ем спиртом получить осадок, который, подобно экстракту, вызывал расщепление крах-
мала. Осадок этот не представлял собой фермент (амилазу) в чистом виде, однако сам
факт отделения фермента солода от многих сопутствующих ему веществ произвел в то
время большое впечатление. Он указывал на материальную основу ферментов и нахо-
дился в противоречии с виталистическими представлениями о действии ферментов, как
о проявлении «жизненной силы». Результаты исследований первой половины XIX в.
были предпосылкой к разрешению важных проблем во второй половине того же века.
Среди исследований этого времени особое по своей значимости место занимают работы
А. Я. Данилевского.
Сок поджелудочной железы так же, как водный экстракт из этой железы, обла-
дает способностью расщеплять белки, жиры и крахмал. В 1862 г. Данилевский сооб-
щил, что ему удалось соответствующей обработкой экстракта поджелудочной железы
отделить трипсин от амилазы. Он впервые применил метод адсорбции (связывание на
поверхности) ферментов с последующей их элюцией (освобождение с поверхности).
Метод адсорбции и элюции широко использовался Вильштеттером в первой четверти
нашего столетия в его работах по очистке ферментов.
Исследования Данилевского по разделению ферментов в экстрактах из поджелу-
дочной железы явились дальнейшим подтверждением взгляда о материальной основе
ферментов.
Несколько позже, в 1871 г. Л. Пастер, исходя из результатов своих замечатель-
ных исследований, показавших, что для спиртового брожения необходимы живые
дрожжи, высказал предположение, что спиртовое брожение (распад глюкозы с обра-
зованием спирта и углекислого газа) является результатом жизнедеятельности дрож-
жевых клеток, а не действия ферментов. Пастер считал, что существуют ферменты
организованные и ферменты неорганизованные. Первые неотделимы от клеток, вторые
же от клеток отделимы.
К неорганизованным Пастер относил ферменты пищеварительных соков, инвер-
тазу дрожжей и др. Взгляд Пастера, что действие «организованных ферментов» следует
рассматривать как результат жизнедеятельности клеток, по существу своему был вита-
листическим, и тормозил дальнейшее развитие изучения ферментов. Против этого воз-
зрения выступал Либих, высказывавший мысль о том, что все, без исключения, фер-
менты являются определенными веществами, которые в одних случаях проявляют
свое действие в клетках, а в других случаях — вне их. В дискуссии между Пастером
и Либихом приняли участие многие исследователи того времени. На сторону Либиха
стала М. Манасеина, пришедшая на основании результатов своих исследований к за-
ключению, что спиртовое брожение может происходить в присутствии разрушенных
148
растиранием в ступке с кварцевым песком дрожжевых клеток. Спор между Пастером
и Либихом был окончательно разрешен в пользу Либиха к концу XIX столетия, когда
братья Бухнер показали, что бесклеточный дрожжевой сок способен сбраживать
глюкозу.
Открытие бесклеточного спиртового брожения явилось важным этапом в изуче-
нии ферментов. К семидесятым годам накопилось уже немало данных о действии пище-
варительных ферментов, а также о некоторых ферментах, легко отделимых от клеток
(сахаразы дрожжей, эмульсина горького миндаля и Др.). Все эти ферменты ускоряют
реакции расщепления органических веществ с помощью воды (реакции гидролиза).
Что же касается ферментов, катализирующих глубокое расщепление органических
веществ с образованием из них более простых соединений, в том числе углекислого га-
за и воды, то о них мало что было известно. Представление Пастера об «организован-
ных ферментах», удерживавшееся в течение 30 лет, естественно, не могло стимулиро-
вать исследования по изолированию из клеток ферментов и их изучению. Отделение
ферментов спиртового брожения от дрожжевых клеток сразу же указало па новые
перспективы в изучении внутриклеточных ферментов.
Большую роль в этом отношении сыграл разработанный А. Н. Лебедевым про-
стой и изящный метод получения из дрожжей бесклеточного сока путем мацерации
клеток. «Мацерационный сок Лебедева» и в наше время используется для получения
растворов ферментов из дрожжей и других клеток. В нашем столетии из дрожжевого
сока, водных экстрактов мышц и других тканей были выделены многочисленные фер-
менты.
В XIX в. было открыто одно из замечательных свойств ферментов — специфич-
ность их действия. В 1858 г. Л. Пастер обнаружил, что зеленая плесень (Penicilliutn
glaucum), помещенная в раствор рацемической винной кислоты, расщепляет только
ее правый изомер, оставляя незатронутым левый. Позже, в 1894 г., Э. Фишер в ряде
своих исследований показал специфичность действия различных ферментов, ускоряю-
щих гидролиз углеводов и белков.
Исследования по изучению окислительных ферментов привели уже в первой чет-
верти нашего столетия к созданию основ теории окислительных процессов А. Н. Ба-
ха и В. И. Палладина. Эти исследования нашли свое развитие в работах О. Варбурга,
О. Вилланда и др.
Особенно крупные успехи в изучении ферментов достигнуты начиная со второй
четверти нашего столетия. В 1926 г. Самнером был получен из бобов канавалии первый
кристаллический фермент — уреаза. Несколько позже, в 1930 и 1931 гг., Нортроп с
сотрудниками выделили в кристаллическом виде пепсин и трипсин. Количество выде-
ленных в кристаллическом виде ферментов с течением времени все больше и больше
увеличивалось благодаря усовершенствованию приемов их получения и очистки.
В двадцатых годах нашего столетия благодаря работам Вильштеттера оконча-
тельно сложилось представление о двухкомпонентной структуре ферментов, оказав-
шееся, однако, правильным не во всех, а лишь во многих случаях. По представлениям
Вильштеттера, ферменты состоят из двух компонентов: одного, находящегося в колло-
идном состоянии (так называемый носитель — ферон), и другого, активного компо-
нента— агона. Вильштеттер не сумел правильно оценить значение «носителей», ока-
завшихся во всех случаях белковыми веществами. Последующие исследования пока-
зали ведущее значение белковых компонентов в проявлении действия ферментов, они
привели к выяснению во многих случаях химической природы и механизма действия
небелковых компонентов ферментов.
Большой вклад в изучение пищеварительных ферментов внес И. П. Павлов и его
сотрудники. Ими были разработаны физиологические методы, позволяющие получать
чистые пищеварительные соки и изучать в них активность ферментов. Далее они иссле-
довали условия, влияющие на образование ферментов в пищеварительных железах
животных. В лаборатории Павлова были разработаны методы количественного опреде-
ления некоторых ферментов. И. П. Павлов впервые указал на белковую природу фер-
ментов.
Учение о ферментах обособилось в отдельную интенсивно развивающуюся от-
расль биохимической науки — ферментологию (энзимологию).
ХИМИЧЕСКАЯ ПРИРОДА ФЕРМЕНТОВ
Как уже указывалось, ферменты — белковые вещества. Об этом сви-
детельствует ряд фактов. Установлено, что ферменты находятся в коллои-
дальном состоянии и, следовательно, неспособны проходить через полупро-
ницаемые мембраны. При нагревании растворов заключающиеся в них фер-
менты инактивируются. При ультракентрифугировании ферменты оседают
с такой же скоростью, как белки. Ферменты — амфотерные электролиты,
т. е. существуют в растворах в форме катионов и анионов. Ферменты выса-
149
ливаются при прибавлении к их растворам нейтральных солей, особенно
сернокислого аммония; они инактивируются при прибавлении к ним солей
тяжелых металлов и других осадителей белков. Все эти факты подтверж-
дают, что ферменты по своей химической природе являются белковыми ве-
ществами: во всех приведенных выше случаях они ведут себя, как белки.
Главное доказательство белковой природы ферментов — потеря ими
активности при воздействии на них протеолитических ферментов. На какой
бы фермент мы ни воздействовали пепсином или трипсином, он, в резуль-
тате переваривания, теряет активность.
В настоящее время получено в очищенном виде значительное количе-
ство ферментов, и все они в одних случаях простые белки, в других — слож-
ные белки. Ферменты — простые белки — носят название однокомпонент-
ных ферментов. При гидролизе их обнаруживаются только аминокислоты.
Ферменты— сложные белки — называются двухкомпонентными фер-
ментами. Небелковые компоненты этих ферментов — коферменты — в од-
них случаях легко отделимы от белка и устранимы при диализе. В других
случаях небелковые компоненты тесно связаны с белками и отделяются при
воздействии факторов, денатурирующих белки. Независимо от того, имеем
ли мы дело с одно- или же с двухкомпонентным ферментом, всегда специфи-
ческие свойства фермента определяются белком.
Что же касается двухкомпонентных ферментов, то о них известно сле-
дующее. Каждый компонент двухкомпонентного фермента в отдельности не
обладает ферментативным действием. Для проявления этого действия оба
компонента должны быть взаимно связаны. Отсюда ясна важность обоих
компонентов в проявлении активности фермента.
ИЗОФЕРМЕНТЫ (ИЗОЭНЗИМЫ)
Одноименные ферменты—это ферменты, катализирующие одни и те
же реакции. Изолированные из тканей различных животных, они отличаются
друг от друга иммунохимически, а также и по ряду физико-химических
свойств (подвижностью в электрическом поле, растворимостью и др.). Ока-
залось также, что некоторые ферменты, изолированные из органа одного и
того же животного, например лактикодегидрогеназа из сердца, могут быть
разделены на близкие друг к другу белковые вещества, обладающие одина-
ковым каталитическим действием, но отличающиеся друг от друга по неко-
торым физико-химическим свойствам. Подобные ферменты получили назва-
ние «изофер ментов».
СВОЙСТВА ФЕРМЕНТОВ
Температурные условия действия ферментов
Ферменты термолабильны. Это означает, что при нагревании они те-
ряют активность. Обычно нагревание до 80эС необратимо разрушает фер-
менты. Исключение составляют отдельные ферменты, не разрушающиеся
при нагревании до 80 и даже 100э С. При низких температурах (ниже нуля)
ферменты прекращают свое действие, но не разрушаются. Существует тем-
пературный оптимум для действия ферментов. Оптимум действия большин-
ства ферментов животного происхождения находится при 40—50э С. Чув-
ствительность к температуре — характерное свойство ферментов и объяс-
няется их белковой природой. Белки, как известно, при нагревании
денатурируются.
150
Влияние pH на действие ферментов
В 1909 г. Сервисен установил, что действие ферментов зависит от кон*
центрации водородных ионов в растворах. Это открытие сыграло важную
роль в изучении ферментов. До 1909 г. существовали большие противоречия
в данных, полученных различными учеными при изучении действия одних
и тех же ферментов. Объяснить причину этих противоречий нельзя было до
тех пор, пока не было установлено, что здесь сказывается концентрация
водородных ионов, на что обычно не обращалось внимания. Оказалось
дальше, что каждый фермент проявляет максимальное действие при опре-
деленной для него концентрации водородных ионов, при определенном зна-
чении pH, получившем название pH-оптимума. Ниже приводится рН-оп-
тимум действия ряда ферментов. Незначительные сдвиги значения pH за-
медляют действие ферментов и даже вовсе его прекращают.
Оптимум pH для действия ферментов
Фермент pH
Амилаза поджелуд. железы . 6,7—7,2
» солода . . 4 4—4,5
» » слюны . . 6,8
Сахараза дрожжевая .... 4,6—5,0
Мальтаза » ... 6,7—7,2
кишечная .... 6,1
Фермент
Липаза................
У реаза ..............
Аргиназа..............
Трипсин ..............
Пепсин ...............
Каталаза..............
pH
7,0—7,5
7,0
9,8
7,0-7,3
1,5—2,0
7,0
Явно выраженная чувствительность ферментов к концентрации водородных
ионов является одним из характерных их свойств.
Специфичность действия ферментов
Одним из замечательных свойств ферментов является специфичность
их действия. Это свойство отличает ферменты от других катализаторов.
Установлено, что каждый фермент действует на определенное вещество
(субстрат) или на несколько близких по своей химической структуре веществ.
По специфичности действия различают следующие типы ферментов: стерео-
химический, абсолютный, абсолютно групповой и относительно групповой.
Стереохимическая специфичность
Первые сведения о стереоспецифичности действия ферментов были
получены в 1858 г. Пастером при изучении воздействия зеленой плесени на
рацемическую винную кислоту. Оказалось, что из двух изомеров этой кис-
лоты расщеплению подвергается только ее правый изомер. Значительно поз-
же, в 1894 г., вопросу стереохимической специфичности действия ферментов
были посвящены исследования Э. Фишера. Расщепление а- и р-метилглико-
зидов, как было им показано, катализируется не одним, а двумя фермен-
тами: а-метилгликозидазой и р-метилгликозидазой (см. стр. 152).
Э. Фишер пришел к заключению о строгой специфичности действия
ферментов. Строгую специфичность стали понимать так, что каждый фер-
мент соответствует субстрату, как «ключ к отпираемому замку».
Стереохимическая специфичность действия ферментов проявляется не
только в реакциях расщепления, но и в реакциях синтеза. Ферментативные
синтезы всегда приводят к образованию определенных стереоизомеров, а не
смесей разных изомеров (рацематов). Примеров подобного действия фермен-
тов можно привести очень много. Из углекислого газа и воды (при фото-
синтезе) образуется D-глюкоза. Та же глюкоза синтезируется из молочной
151
сн2он
а-Метилгликозид
н он
₽-Метилгликозид
кислоты в организме животных. В растениях синтезируются аминокислоты
Л-ряда. У животных из а-кетокислот и аммиака синтезируются также ами-
нокислоты Л-ряда и т. д. Все это позволяет говорить о том, что фермента-
тивные синтезы относятся к асимметрическим и приводят к образованию
определенных стереоизомеров.
Абсолютная специфичность
Известны ферменты, катализирующие только одну реакцию превраще-
ния определенного вещества. Уже небольшие изменения в структуре ве-
щества делают его недоступным для действия фермента. Например, фермент
уреаза катализирует реакцию гидролитического расщепления мочевины,
но совершенно не действует на метилмочевину:
Мочевина
> СО2 -t- 2NH3
/NHCH3
СО
Метил мочевина
Фермент аргиназа катализирует реакцию гидролитического расщепления
аргинина с образованием орнитина и мочевины, но совершенно не действует
на продукт его декарбоксилирования — агматин и на метиларгинин.
Дипептид аргинил-аргинин подвергается воздействию аргиназы, но
при этом мочевина отщепляется не от обоих остатков аргинина, а только от
одного. Надо полагать, что для действия аргиназы необходимо наличие кар-
боксильной группы аргинина:
NH,
I
C-NH
NH
I 4- Н2О
СН,
I
сн2
1
сн,
I
CHNIh
I
СООН
Аргинин
-> NIL, NH2
С-0 + СН2
NH2 СН2
Мочевина I
сн2
I
chnh2
I
СООН
nh2
I
С—NH
I
NH
I
сн2
I
сн2
I
сн2
chnh2 •
coo—сн3
Метиларгинин
nh2
C=NH
I
NH
I
CH2
I
CH2
I
CH2
I
ch2nh2
Агматин
Орнитин
nh2
I
C=NH
NH2 nh2
I I
NHOC—CH—CH2—CH2—CH2—NH—C=NH
I I
NH—CH2—CH2—CH2—CH—COOH
Аргинил-аргинин
152
Абсолютная групповая специфичность
Существуют ферменты, субстратами для которых являются несколько
химических соединений, построенных по одному типу. Действие этих фер-
ментов адаптировано к типу химической реакции.
В виде примера этих ферментов можно взять дегидрогеназы. Все они
катализируют одну и ту же реакцию отщепления водорода (окисление), но в
зависимости от субстрата проявляется специфичность действия отдельных
дегидрогеназ. Так, например, отщепление водорода от молекулы молочной
кислоты катализируется ферментом лактикодегидрогеназой, яблочной ки-
слоты — маликодегидрогеназой, янтарной кислоты — сукциндегидроге-
назой и т. д.
Пример групповой специфичности действия ферментов — некоторые
ферменты из группы гидролаз. Фермент мальтаза катализирует гидролиз не
только дисахарида мальтозы, в молекуле которой имеется а-глюкозидная
связь, но и ряда а-гликозидов. С другой стороны, мальтаза не действует
на расщепление дисахаридов, в которых а-глюкозидная связь образована
за счет галактозы и маннозы.
Относительная групповая специфичность
Существуют ферменты, специфичность которых заключается в том, что
они действуют на определенные связи, с помощью которых соединены от-
дельные части молекул. Такими связями являются эфирная, гликозидная
и др. Химическая же структура молекул для действия этих ферментов роли
не играет.
Специфичность действия ферментов настолько разнообразна, что она
не исчерпывается приведенными выше материалами. При описании действия
отдельных ферментов мы встретимся и с иными примерами проявления спе-
цифичности их действия.
Обратимость действия ферментов
Ферменты как катализаторы способны ускорять течение химических
реакций в обоих направлениях, т. е. как в сторону распада, так и в сторону
синтеза.
Для того чтобы уяснить себе особенности течения какой-либо реакции,
рассмотрим реакцию распада и синтеза какого-либо сложного эфира в при-
сутствии неорганического катализатора.
Сложный эфир при взаимодействии с водой расщепляется на состав-
ные части: кислоту и спирт. Реакция расщепления катализируется кисло-
тами, вернее, Н-ионами:
Сложный эфир + вода ~ * спирт -J- кислота
Реакция может идти в двух направлениях в сторону распада и в сто-
рону синтеза сложного эфира. В обоих случаях течение реакции ускоряется
катализатором (Н-ионами). Следовательно, катализатор влияет на ско-
рость течения реакции, а не на ее направленность.
В случае действия ферментов можно установить такую же закономер-
ность. В зависимости от условий наблюдается обратимость химических
реакций, катализируемых ферментами.
В 1886 г. А. Я. Данилевский впервые доказал обратимость действия пеп-
сина в опытах с прибавлением к концентрированным растворам пептонов
вытяжек из слизистой оболочки желудка. Продукты синтеза были названы
пластеинами и они по своим свойствам хотя и отличались от белков, но все
же оказались более сложными веществами, чем пептоны. Позже была до-
казана обратимость действия мальтазы (Крафт-Хилл, 1898), липазы,
эмульсина.
153
В пищеварительных соках содержится очень много воды, и реакции,
катализирующиеся гидролитическими ферментами, всегда там направлены
в сторону гидролиза. Такие же условия имеются для действия гидролити-
ческих ферментов в тканях организма. Это еще не означает, что из продук-
тов гидролиза органических веществ в тканях не синтезируются те же ве-
щества. Синтез этот, однако, часто происходит более сложным путем, при
участии иных ферментов. Так, например, при ферментативном гидролизе
в печени с помощью амилазы и мальтазы из гликогена образуется глюкоза.
Из глюкозы в печени синтезируется гликоген, но этот синтез не является
следствием обратимости реакций гидролиза. При синтезе гликогена глюкоза
при участии одного фермента присоединяет к себе фосфорную кислоту, а
затем уже при участии другого фермента превращается в гликоген. Под-
робнее о синтезе гликогена см. на стр. 286).
С обратимостью действия ферментов стали часто встречаться при изуче-
нии внутриклеточных процессов обмена веществ. В процессе распада гли-
когена с образованием молочной кислоты участвует большое количество
(свыше десяти) ферментов. Каждый из этих ферментов последовательно
катализирует определенную промежуточную реакцию распада гликогена
и, в конечном счете, из него образуется молочная кислота. С другой стороны,
давно уже известно, что из молочной кислоты в тканях (например, в мыш-
цах, в печени) может образоваться гликоген. Изучение отдельных реакций
распада гликогена показало обратимость действия катализирующих их
ферментов. Известны также многочисленные случаи обратимости действия
ферментов, катализирующих реакции перенесения химических радикалов
от молекул одних органических веществ на молекулы других веществ.
Одним словом, с обратимостью действия ферментов встречаются часто, и
она не вызывает сомнения.
Факторы, влияющие на активность ферментов
На активность ферментов влияет ряд факторов. На некоторые из них
указывалось раньше. Приводились данные о влиянии температуры и кон-
центрации водородных ионов на активность действия ферментов. Большое
значение для действия ферментов имеет также концентрация веществ, на
превращение которых действуют ферменты. При малых концентрациях
вещества не только неблагоприятны условия для столкновения между собой
молекул, но, кроме того, в реакции при этом не может действовать все
имеющееся количество фермента, и реакция протекает с малой скоростью.
С увеличением концентрации вещества и при сохранении без изменений
других условий скорость течения реакции увеличивается, и при определен-
ной концентрации вещества наступают оптимальные условия для проявле-
ния действия фермента. Дальнейшее увеличение концентрации вещества
приводит к замедлению действия фермента.
Немаловажное значение для скорости течения реакции имеет концент-
рация фермента. При оптимальной концентрации вещества скорость реак-
ции прямо пропорциональна концентрации фермента.
На активность ферментов влияет присутствие в растворах ряда хими-
ческих веществ. Одни из них повышают активность ферментов и называются
активаторами, другие понижают активность ферментов и называются инги-
биторами (парализаторами). Активаторами в ряде случаев являются двух-
валентные катионы (Са2+, Mn2+, Mg2+, Со2+ и др.). Иногда активаторами
выступают анионы. Например, амилаза слюны и амилаза поджелудочной
железы активируются анионами С1".
Активаторами ферментов могут служить также органические вещества.
Так, например, действие липазы поджелудочной железы активируется
желчными кислотами. Известны случаи, когда активность ферментов повы-
шается при прибавлении к растворам, в которых они действуют, малых
количеств белков, не обладающих свойствами ферментов.
154
Ингибиторами ферментов часто являются вещества, связывающие хи-
мически так называемые активные группировки ферментов или входящие
в их состав атомы металлов. Так, например, соли тяжелых металлов в ма-
лых концентрациях, не вызывающих денатурацию белков, связывают сульф-
гидрильные группы (—SH) ферментов и этим тормозят их активность.
Подобным действием обладает монойодуксусная кислота, люизит и некоторые
иные вещества. Синильная кислота и ее соли связывают железо в гемсодер-
жащих ферментах (каталаза, пероксидаза) и тем самым парализуют их дей-
ствие, такое же влияние оказывают ионы фтора, связывая содержащийся
в некоторых ферментах магний.
Во всех приведенных случаях ингибиторами ферментов выступают
вещества, которые обычно в клетках и тканях либо отсутствуют, либо
содержатся в ничтожно малых концентрациях, и их действие можно наблю-
дать в опытах in vitro (вне организма) путем прибавления к их растворам
ферментов. Между тем ингибиторы ферментов встречаются также в тканях
организма. В поджелудочной железе обнаружено вещество белковой при-
роды, тормозящее действие трипсина. Известно также вещество белковой
природы, тормозящее действие пепсина, и некоторые иные вещества с по-
добным действием на ферменты. Часто эти вещества называются антифер-
ментами.
Действие ингибиторов ферментов в некоторых случаях носит обратимый
характер. Это относится в первую очередь к антиферментам, которые,
связывая молекулы фермента, тормозят его действие. При известных усло-
виях антиферменты легко отделяются от ферментов и этим самым дей-
ствие ферментов возобновляется.
И. П. Павлов впервые обнаружил, что из пищеварительных желез
некоторые ферменты выделяются в неактивном или же в малоактивном
виде. В таком же виде находятся многие ферменты в тканях. Ферменты
в неактивном виде получили название проферментов или зимогенов. Каким
путем проферменты переходят в состояние активных ферментов — известно
далеко не во всех случаях. Для пепсина это может произойти в результате
отделения от них парализаторов. Проферменты могут перейти в состояние
ферментов при воздействии на них веществ, содержащих SH-группы и являю-
щихся восстановителями. Отсюда можно заключить, что некоторые фермен-
ты проявляют свою активность при их восстановлении.
МЕТОДЫ ИЗУЧЕНИЯ АКТИВНОСТИ ФЕРМЕНТОВ И МЕТОДЫ
ПОЛУЧЕНИЯ ЧИСТЫХ ФЕРМЕНТОВ
О наличии ферментов судят по их действию. Если течение реакции пре-
вращения (распада или синтеза) какого-либо вещества в растворе уско-
ряется при прибавлении к нему какой-либо физиологической жидкости
(например, пищеварительного сока) или измельченной ткани, или экстрак-
та из нее, говорят о наличии в данном объекте катализатора — фермента.
Об активности фермента, которая, с одной стороны, зависит от его
свойств, а с другой стороны, от его концентрации, принято судить по интен-
сивности его действия, т. е. по количеству вещества, подвергшегося пре-
вращению. Понятно, что при таких исследованиях следует придерживаться
определенных условий (температуры, pH, концентрации вещества, времени,
в течение которого действует фермент), влияющих на активность фер-
ментов.
О количестве подвергшегося превращению вещества следует судить
или по уменьшению его содержания, по его убыли, или же по количеству
возникающих продуктов превращения. Например, об активности липазы —
фермента, катализирующего гидролиз жира, судят или по убыли количест-
ва жира, или же по количеству освобождающихся при распаде жира жир-
ных кислот. В тех случаях, когда имеются данные о молекулярном весе дан-
155
кого фермента, активность фермента выражается так называемым «числом
перехода», которое говорит о числе молекул вещества, подвергшихся пре-
вращению под влиянием одной молекулы фермента в течение, единицы вре-
мени (минуты). Понятно, чем более активен фермент, тем выше его число
перехода. Число перехода различных ферментов, т. е. активность их, ко-
леблется в очень широких пределах.
Число «переходов» в минуту для некоторых чистых
ферментов
Фермент Субстрат реакции Число переходов
Каталаза из печени лошади . . . Холинэстераза из сыворотки крови Уреаза из бобов сои Амилаза из солода Дегидрогеназа молочной кислоты из мышц Пепсин из желудка Фосфорилаза картофеля Н2О2 Ацетилхолин Мочевина Крахмал Молочная кис- лота Казеин Крахмал 5 000 000 90 000 46 000 19 000 31 000 1 000 40 000
Активность ферментов, содержащихся в плазме крови, в пищеваритель-
ных соках, изучается путем непосредственного прибавления известного
объема плазмы крови или сока к веществу, находящемуся в буферном раст-
воре. Несколько сложнее изучение какого-либо фермента, имеющегося
в составе ткани. В этом случае ткань тщательно измельчают и активность
фермента исследуют прибавлением известного количества измельченной
ткани к веществу, подвергающемуся превращению и находящемуся в бу-
ферном растворе. Часто при определении активности ферментов, имеющихся
в тканях, их предварительно извлекают. Для извлечения ферментов ткань
тщательно измельчают, а затем обрабатывают водой или каким-нибудь
иным растворителем, например глицерином. Можно, кроме того, извлекать
ферменты из тканей и клеток путем выдавливания из них сока, а также путем
разрушения клеток мацерированием.
Извлечение ферментов из тканей является важным этапом работы и с
него начинают при очистке ферментов от сопутствующих (балластных)
веществ. При дальнейшей работе для удаления сопутствующих веществ
прибегают к различным приемам. Низкомолекулярные вещества могут
быть удалены из экстрактов путем диализа. Этот прием пригоден для всех
однокомпонентных ферментов и для тех двухкомпонентных ферментов,
у которых оба составляющих (белковый и небелковый) крепко связаны
друг с другом и не расчленяются при диализе.
Удаление низкомолекулярных веществ еще не приводит к окончатель-
ной очистке ферментов. Более радикальным приемом является осаждение
ферментов этиловым спиртом определенной концентрации, ацетоном и дру-
гими водоотнимающими реактивами с последующим извлечением их из
осадков водой. Во всех приемах очистки ферментов критерием степени чи-
стоты является активность их действия. Активность фермента в весовой
части исходного материала принимается за единицу. Чем больше очищен
фермент, тем больше его активность на единицу веса его препарата. В от-
дельных случаях можно было повысить активность ферментов в 2000 раз и
больше по сравнению с активностью исходного материала. К эффективным
приемам очистки ферментов относится связывание их на поверхности раздроб-
ленных частичек твердых веществ (адсорбция) с последующим освобожде-
нием (элюирование), а также отделение их от других веществ методом хро-
матографии. Следует, однако, указать, что эти приемы очистки ферментов
обычно не приводят к их кристаллизации и они используются только при
156
предварительной очистке ферментов. Весьма ценным в очистке ферментов
оказался метод высаливания их нейтральными солями щелочных металлов
особенно сернокислым аммонием. Метод высаливания позволил получить
целый ряд ферментов в кристаллическом виде. Часто для очистки ферментов
приходится прибегать к различным приемам, и заключительным звеном
работы является их высаливание.
Изучение свойств ферментов, разработка методов определения актив-
ности ферментов и, наконец, получение ферментов в чистом виде оконча-
тельно опровергли виталистические представления о ферментах, что созда-
ло широкие перспективы для развития ферментологии. Вместе с этим уда-
лось выявить специфические особенности ферментов как биологических
катализаторов, отличающие их от обычных катализаторов, являющихся чаще
всего неорганическими веществами и иногда несложными по своей струк-
туре органическими соединениями. Специфические особенности ферментов
определяются их белковой природой. Коллоидальное состояние, большая
чувствительность к изменениям температуры и разрушение при 80°и выше,
строгая зависимость активности ферментов от концентрации водородных
ионов отличают ферменты от обычных катализаторов, не относящихся к
белкам. Однако самыми замечательными свойствами, характерными для
биологических катализаторов — ферментов, является специфичность их
действия и чрезвычайно высокая активность. Эти свойства позволяют счи-
тать ферменты идеальными катализаторами, играющими важную роль в
процессах обмена веществ, лежащих в основе жизнедеятельности живых
существ.
Как идеальные катализаторы ферменты получили широкое применение
в различных областях пищевой и других отраслях промышленности. Препа-
раты очищенных и кристаллически чистых ферментов для промышленных и
медицинских целей изолируются из биологических материалов (микробов,
пищеварительных соков, органов животных, растений) на предприятиях
ферментной индустрии.
КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
Учитывая специфичность действия ферментов и разнообразие химиче-
ских процессов в организмах, можно предположить наличие очень боль-
шого количества ферментов. Экспериментальные данные показывают, что
количество ферментов в любом организме, начиная от одноклеточного,
действительно велико. У высокоорганизованных беспозвоночных и, особенно,
у позвоночных животных, мы встречаемся со специализированными орга-
нами, приспособленными к выработке и выделению ферментов (пищева-
рительные железы). В отношении этих органов можно говорить, что дей-
ствие ферментов происходит за пределами клеток, в которых они образуются.
Образование ферментов в пищеварительных железах и выделение их в со-
ставе пищеварительных соков зависит от факторов внешней среды (напри-
мер, состава пищи) и регулируется нервной системой. Особенно убедительно
это доказано классическими исследованиями И. П. Павлова и его школы.
Ферменты неравномерно распределены в тканях и органах, и образова-
ние их связано с функцией последних. В виде примера можно привести сле-
дующие данные. Фермент аргиназа, катализирующий гидролиз аргинина
с образованием орнитина и мочевины, встречается у человека и у млекопи-
тающих животных в печени и практически отсутствует в иных органах.
Ферменты, расщепляющие мочевую кислоту (уриколитические ферменты),
отсутствуют у человека и высших обезьян и имеются у ряда других предста-
вителей млекопитающих животных.
Ферменты, катализирующие окислительный распад высокомолекуляр-
ных жирных кислот с образованием уксусной кислоты, встречаются, глав-
ным образом, в печени, мало их в мышцах и в ряде иных органов. Ферменты,
157
катализирующие синтез органических веществ из неорганических веществ
(СО2, Н2О) с использованием солнечной энергии, обнаруживаются
у зеленых растений и отсутствуют у животных. Таких примеров можно
привести очень много, и все они свидетельствуют о том, что образование и
действие ферментов в различных тканях тесно связаны с типом обмена ве-
ществ, с особенностями существования организмов. Отсюда становится
важной в биологическом отношении задача воздействия на процессы f обра-
зования ферментов в организмах, которое могло бы сказаться на направ-
ленности процессов обмена веществ. Имеются многочисленные данные,
указывающие на зависимость процессов, ведущих к образованию фермен-
тов, от условий внешней среды. С особой яркостью это наблюдается у микро-
бов, легко адаптирующихся (приспособляющихся) к условиям питания.
При изменении питательной среды у них постепенно появляются ферменты,
катализирующие реакции, приводящие к использованию органических
веществ, обычно для них непривычных.
Ферменты образуются в любых клетках живых существ. В каждой
клетке имеется «набор» различных ферментов, а общее количество их весьма
велико. В связи с этим можно с уверенностью говорить о том, что ферменты
составляют значительную часть белков клеток.
Для того чтобы легче ориентироваться в массе ферментов, встречающихся
в живых организмах, прибегают к их классификации. Название фер-
ментам дается по веществам, на превращение которых они действуют.
При этом к латинскому корню названия вещества добавляется окончание
«аза». Ферменты, катализирующие гидролитический распад белков, крах-
мала, мочевины, соответственно носят название протеиназы, амилазы
(amylum — крахмал), уреазы (urea — мочевина) и т. д. Наряду с этим фер-
менты получают также названия по химическим процессам, в которых они
участвуют. Нередки, однако, случаи, когда применяют сложившиеся
исторически, часто случайно возникшие названия ферментов, например,
пепсин, трипсин, каталаза и др. Ферменты делятся на шесть основных
групп. Каждая группа в свою очередь делится на подгруппы; подгруппы
делятся на классы, которые охватывают ряд отдельных ферментов.
ГИДРОЛАЗЫ
К группе гидролазы относятся ферменты, катализирующие процессы
расщепления (а в специальных условиях и синтеза) сложных органических
веществ с помощью воды. Протекающие в этих случаях реакции можно
схематически представить следующим образом:
R — R' + Н2О---> /ЮН -J- /?'Н
Группа гидролаз расчленяется на подгруппы в зависимости от веществ,
на которые они действуют.
Карбогидразы
Карбогидразы катализируют гидролиз углеводов. Карбогидразы, дей-
ствующие на полисахариды (крахмал, гликоген, инулин и др.), составляют
класс полисахараз или полиаз, карбогидразы, действующие на дисахари-
ды, — дисахараз или олигаз.
Олигазы делятся на а-гликозидазы и р-гликозидазы в зависимости от
того, катализируют ли они гидролиз а-гликозидной или же р-гликозидной
связи. Как пример действия а-гликозидазы, можно взять фермент маль-
тазу, под влиянием которого происходит гидролиз мальтозы с образованием
двух молекул а-£)-глюкозы:
158
сн,он
I “
СН2ОН
Мальтоза
сн2он
Глюкоза
Отдельные а-гликозидазы с различной интенсивностью катализируют
гидролиз различных соединений, имеющих а-гликозидные связи (мальтозу,
сахарозу, трегалозу, а-метил-глиКозид и др.). Мальтаза содержится в ки-
шечном соке, в соке поджелудочной железы, в крови и в тканях животных и
растений, а также в дрожжах, в плесневых грибах и в бактериях. Особенно
богаты мальтазой проросшие зерна проса. К р-гликозидазам относится саха-
раза или же инвертаза, катализирующая гидролиз сахарозы с образованием
глюкозы и фруктозы. Гидролиз сахарозы, как указывалось, катализируется
также а-гликозидазой. Однако имеется различие в действии а-гликози-
дазы и р-гликозидазы (сахаразы) на молекулу сахарозы. Первая дейст-
вует на а-гликозидную связь, идущую от остатка глюкозы, в то время как
сахараза действует на ^-гликозидную связь, идущую от остатка фруктозы:
’Место действия
а-гликозидазы
Место действия
(3-гликозидазы
Сахараза содержится в кишечном соке, в секрете слюнных желез пчел,
ее особенно много в дрожжах.
К р-гликозидазам можно отнести лактазу, катализирующую гидролиз
лактозы (молочного сахара), являющейся по своему строению р-галактози-
до-а-глюкозой. Она содержится в кишечном соке и в соке поджелудочной
железы.
Полиазы. К полиазам относятся а-амилаза, р-амилаза, целлюлаза, ину-
каза и некоторые другие ферменты. Из них наиболее важны амилазы,
катализирующие гидролиз крахмала и гликогена (животного крахмала);
а- и ^-амилазы отличаются друг от друга по своим свойствам, способу дей-
ствия на крахмал и гликоген и по распространению. а-Амилаза содержится
в слюне, в соке поджелудочной железы, в крови и в тканях животных (в пе-
чени, мозге, мышцах молодых животных), а также в проросших зернах
злаков и в плесневых грибах. Ее называют декстрогенной амилазой, так
как в результате ее действия получается мало мальтозы и много декстринов.
Что же касается р-амилазы, то она катализирует расщепление крахмала с
образованием, главным образом, мальтозы и небольшого количества декст-
ринов. Как а-, так и р-амилаза катализируют гидролиз только 1,4 глюко-
зидных связей. В связи с этим расщепление амилопектина в результате их
действия сопровождается образованием некоторого количества декстринов,
159
имеющих в своей структуре 1,4 и 1,6 глюкозидные связи. Эти декстрины
носят название пограничных декстринов.
а- и р-Амилазы отличаются друг от друга по ряду свойств. а-Амилаза
более чувствительна к воздействию кислоты, чем р-амилаза, она более
устойчива при нагревании.
P-Амилаза встречается преимущественно в растениях. При прорастании
семян некоторых растений (пшеница, рожь, ячмень) появляется а-ами-
лаза. Бобы сои как проросшие, так и не проросшие содержат только одну
Р-амилазу.
Как а-, так и р-амилаза получены в кристаллическом виде.
Целлюлаза встречается преимущественно у микробов. Под ее влия-
нием происходит гидролиз целлюлозы с образованием дисахарида целло-
биозы. В пищеварительных соках позвоночных животных целлюлоза рас-
щепляется с помощью целлюлазы кишечных микробов.
Инулаза, катализирующая гидролиз инулина с образованием фруктозы,
встречается у некоторых растений, в клубнях и в корневищах которых
накапливается инулин.
Эстеразы
К эстеразам относятся ферменты, катализирующие гидролиз сложных
эфиров, — это липазы, фосфатазы, сульфатазы и др.
Специфически действующей эстеразой является холинэстераза, ката-
лизирующая гидролиз ацетилхолина:
/СН2 - СН2О • ОС • СН3 /CHaCI 12ОН
N ef. (СН3)з -|- Н2О >N г (СН3)3 4- СН3СООН
Встречается холинэстераза в мозгу, в нервах и в других органах и тканях.
Липазы катализируют гидролиз жиров с образованием глицерина и жир-
ных кислот. Следовательно, действие липаз направлено на сложноэфирную
связь между глицерином и жирными кислотами. Содержатся липазы в соке
поджелудочной железы, сыворотке крови, в печени, а также в семенах расте-
ний (особенно их много в клещевине) и в некоторых микроорганизмах.
Широко распространены фосфатазы, катализирующие гидролиз слож-
ных эфиров, состоящих из спиртов и фосфорной кислоты. Среди фосфатаз
различают специфически и неспецифически действующие. Специфически
действующие фосфатазы катализируют гидролитическое расщепление опре-
деленных фосфорных эфиров. Например, фруктозодифосфатаза катализи-
рует отщепление фосфорной кислоты от фруктозодифосфор ной кислоты,
нуклеотидаза — фосфорной кислоты от нуклеотидов. Неспецифически дей-
ствующие фосфатазы катализируют отщепление фосфорной кислоты от раз-
личных фосфорных эфиров независимо от химической природы входящих
в их состав спиртов. Неспецифические фосфатазы разделяются на так назы-
ваемые «кислые» и «щелочные». Оптимум действия первых — при pH 4,5—•
5,0, вторых — при pH 8,5—9,0.
К фосфатазам относятся также ферменты, катализирующие гидролиз
полинуклеотидов (рибонуклеиновых и дезоксирибонуклеиновых кислот),—
рибонуклеаза и дезоксирибонуклеаза. Оба эти фермента выделены из тканей
животных в кристаллическом виде. При их действии происходит гидролиз
полинуклеотидов с разрывом диэфирных связей, идущих от остатков
фосфорной кислоты к спиртовым группам рибозы или же дезоксирибозы.
Рибо- и дезоксирибонуклеазы, иначе они еще называются нуклеин-
ацидазами, встречаются в различных тканях организмов, а также в составе
кишечного сока.
Среди фосфатаз различают фосфомоноэстеразы, катализирующие гид-
ролиз моноэфиров фосфорной кислоты (глицерофосфата, гексозофосфатов,
нуклеотидов и др.), и дифосфоэстеразы, катализирующие гидролиз диэфи-
ров фосфорной кислоты, например диглицеринфосфорного эфира.
160
К фосфатазам относятся также ферменты, катализирующие гидролиз
ангидридфосфатных связей в срганических и неорганических полифосфатах.
Сульфатазы катализируют гидролиз сложных эфиров, содержащих
серную кислоту. Примерами сульфатаз могут явиться миросульфатаза,
под действием которой от синигрина (глюкозид семян черной горчицы) от-
щепляется серная кислота, и хондросульфатаза, под влиянием которой
отщепляется серная кислота от хондроитинсерной кислоты.
Если обратиться к химизму реакций, течение которых ускоряют карбо-
гидразы и эстеразы, то можно видеть, что действие этих ферментов направ-
лено на разрыв химических связей, идущих от атома углерода к атому ки-
слорода:
Протеазы (протеолитические ферменты)
К протеазам относятся ферменты, ускоряющие гидролиз белков и про-
дуктов их распада — полипептидов. В обоих случаях протеазы катализи-
руют гидролиз пептидной связи (—СО—NH—). Протеазы часто разделяют
на протеиназы — ферменты, катализирующие гидролиз белков, и на пеп-
тидазы, катализирующие гидролиз полипептидов. Однако это разделение
следует считать условным, так как установлено, что такая типичная проте-
иназа, как, например, пепсин, катализирует гидролиз пептидных связей
не только в белках, но и в полипептидах, в тех случаях, когда в составе их
молекул имеются пептидные связи, в образовании которых участвуют амин-
ные группы тирозина или фенилаланина. К протеазам относятся такие фер-
менты, как пепсин, химозин, трипсин, химотрипсин, катепсин, папаин.
Пепсин в виде профермента (пепсиногена) образуется в клетках пред-
пилорической и пилорической частей слизистой оболочки желудка (в глав-
ных клетках) млекопитающих животных. Пепсиноген активируется (пре-
вращается в пепсин) под влиянием соляной кислоты, образующейся в об-
кладочных клетках пилорической части слизистой оболочки желудка, а
также при воздействии на него пепсина. Пепсин был выделен в кристалли-
ческом виде Нортропом в 1930 г.
Пепсин катализирует гидролиз большинства известных белков. Ис-
ключением являются протамины, кератины волос и шерсти, белок губок —
спонгин. Пепсин более интенсивно катализирует расщепление денатуриро-
ванных белков. Кислая среда, при которой в желудочном соке происходит
действие пепсина, способствует денатурации белков, а тем самым действию
пепсина, которое направлено на разрыв пептидной связи, где участвует
аминогруппа тирозина или фенилаланина. Наиболее интенсивно катали-
зируется пепсином разрыв пептидной связи между двумя циклическими
аминокислотами. Помимо этих пептидных связей при действии его расщеп-
ляются также и некоторые другие пептидные связи (между аланином и лей-
цином, лейцином и валином и др.).
При pH 5,0 пепсин вызывает створаживание молока (превращение
казеиногена в казеин).
Под влиянием действия пепсина начинается переваривание белков в
желудке. При продолжительном действии пепсина расщепляется до 30%
всех имеющихся в белках пептидных связей. В результате действия на бел-
ки пепсина образуются различные по своей сложности полипептиды и не-
большое количество аминокислот.
Химозин, или сычужный фермент, вырабатывается в слизистой же-
лудка молодых млекопитающих (телят) и вызывает свертывание молока.
Действие его заключается в том, что он превращает растворимый в воде
(молоке) казеиноген в нерастворимый казеин. Химозин получен в кристал-
лическом виде. Значение химозина заключается в том, что образующийся
при его действии на казеиноген нерастворимый казеин дольше задерживает-
6 Заказ № 581
161
ся в желудке и подвергается вследствие этого более длительному воздейст-
вию пепсина. Подобным действием обладает также пепсин, однако образую-
щийся под его влиянием казеин подвергается дальнейшему расщеплению.
Трипсин образуется в поджелудочной железе как профермент трипси-
ноген и в таком виде выделяется с соком этой железы. Как трипсин, так и
трипсиноген получены в кристаллическом виде. Трипсиноген активируется
энтерокиназой — ферментом, вырабатываемым в слизистой тонких кишок.
Он был открыт в лаборатории Павлова Шеповальниковым. Трипсиноген
активируется также ничтожно малыми количествами трипсина. Под влияни-
ем трипсина белки расщепляются на полипептиды и аминокислоты. Трипсин
катализирует гидролиз в белках и в полипептидах пептидных связей, в
образовании которых участвует карбоксильная группа аргинина или
лизина.
Химотрипсин образуется в виде химотрипсиногена (профермента) в
поджелудочной железе и выделяется с ее соком. В отличие от трипсиногена,
химотрипсиноген не активируется энтерокиназой. Он превращается в химо-
трипсин под влиянием ничтожно малых количеств трипсина. Химотрипсин
энергично действует на казеиноген молока, превращая его в казеин. Химо-
трипсин также катализирует гидролиз различных белков и полипептидов.
Он катализирует разрыв пептидных связей, идущих от карбоксильных групп
фенилаланина и тирозина. Установлено, что трипсин и химотрипсин ката-
лизируют не только гидролиз пептидных связей, но и гидролиз сложно-
эфирных связей. Они также катализируют реакции перенесения амино-
кислотных остатков от одних полипептидов на другие.
Катепсин является протеиназой тканей животных. В значительных
количествах он содержится в печени, почках и селезенке. Катепсин катали-
зирует гидролиз белков с образованием полипептидов. Оптимум его дей-
ствия при pH 4—5. При нейтральной реакции он неактивен. Действие
катепсина в тканях особенно проявляется после смерти животного, когда
концентрация водородных ионов в них повышается в результате образова-
ния молочной кислоты.
Папаин содержится в млечном соке и в семенах некоторых растений.
Активируется восстановителями (цистеином и др.). Полагают, что папаин
встречается в окисленной и восстановленной формах, причем активной яв-
ляется восстановленная форма.
В зависимости от характера белка, подвергающегося гидролизу, папаин
оптимально действует при слабокислой, нейтральной или слабощелочной
реакции (pH 5—7,5). Папаин получен в виде кристаллов; молекулярный
вес папаина 27 000.
Пептидазы катализируют гидролиз белков и полипептидов с образо-
ванием аминокислот. Пептидазы образуются в слизистой оболочке тонких
кишок и выделяются с кишечным соком. Раньше считалось, что в кишечном
соке имеется один фермент, катализирующий гидролиз различных полипеп-
тидов, — эрепсин. В дальнейшем же оказалось, что кишечный сок, а также
сок поджелудочной железы, содержат смесь различных пептидаз — карбо-
ксипептидазу, аминопептидазу, пролиназу и дипептидазу. Название эреп-
син сейчас потеряло свое значение.
Пептидазы обладают большой специфичностью действия, которая зави-
сит от расположения в полипептиде определенных химических группиро-
вок: наличия в них групп — NH2, —СООН и др.
Карбоксипептидаза содержится в кишечном соке и в соке поджелудоч-
ной железы. Она катализирует расщепление белков и полипептидов, имею-
щих свободную карбоксильную группу
/СООН
R—СО—NH—СН
А Ч
Место действия карбоксипептидазы
162
Аминопептидаза образуется в слизистой оболочке кишечника. Она
катализирует гидролиз полипептидов, которые имеют аминогруппу по
месту пептидной связи, находящуюся у конца пептида.
II2N. СН • СО—NH • СН • СО • NH • СН • СО • NHCH—СООН
Г 1 *1 1 1
Место действия аминопептидазы
Пролиназа обнаружена в почках, легких, в слизистой оболочке кишеч-
ника и в дрожжах. Она катализирует гидролиз пептидов, у которых в обра-
зовании пептидной связи участвует карбоксильная группа пролина и у кото-
рых отсутствует свободная аминогруппа.
НоС — СНо
I I Ч12о
I I2C СНСО • NH • СН2 • СО • NH • СН2 • СООН->
а-Пролин-глицил-глицин
НоС — сн2
'I I
Н2О Н2С СН.СООН +
---
NH
а-Пролин
I
nh2 . СН2СО • NH • СН2СООН
Глицил-глицин
Пролидаза образуется в слизистой оболочке кишок. Она катализирует
гидролиз полипептидов, у которых пролин своей иминогруппой создает
пептидную связь с карбоксильной группой других аминокислот
Н2С — СН2
I I
Н2С СН—СООН
Н2С — сн2
+н2о | |
---->Н2С СН—СООН + HOOC—CH2xNH2
N—OCCH2NH2
Дипептидаза широко распространена в тканях растений, животных и в
микроорганизмах. Содержится в слизистой кишечника, почках, лейкоцитах.
Она катализирует гидролиз дипептидов с образованием двух аминокислот:
H2N—СН2—СО—NH—СН—СООН-> H2N—СН2—СООН NH2—СН—соон
В результате последовательного действия протеиназ и пептидаз слож-
ные по своему строению молекулы белка распадаются до аминокислот.
Амидазы
К амидазам относятся ферменты, катализирующие гидролиз амидов с
образованием аммиака и кислоты:
Я—CONH24-H2O -> /?—COOH+NH3
Различают уреазу, аспарагиназу, глутаминазу, аргиназу, канаваназу.
Уреаза катализирует реакцию гидролитического расщепления моче-
вины (амида аминомуравьиной кислоты):
/NH2
со
^nh2
Уреаза широко распространена среди бактерий (уробактерий), встре-
чается в растениях, особенно в семенах бобовых и в грибах.
6*
163
/NH2
4-Н2О->СО
\nh2
Мочевина
nh2
Аспарагиназа катализирует реакцию гидролитического отщепления
амидной группы от аспарагина:
H2N—СО—СН2—CH(NH2)COOH-f-H2O -> NH34-HOOC—СН2—CHNH2COOH
Находится в тканях животных, растениях и в микробах. В очищенном
виде она получена из дрожжей.
Глутаминаза катализирует реакцию гидролитического отщепления
амидной группы от глутамина:
HoN—СО—СН 2—СН2—CH(NHo)COOH+H2O->
-> NH34-H00C—СН2—СН2—CHNH2—СООН
Обнаружена она в тканях животных, высших растений и у многих бак-
терий. Наибольшей глутаминазной активностью обладают почки, затем
головной мозг, печень и мышцы.
Аргиназа катализирует гидролитическое расщепление аргинина с обра-
зованием орнитина и мочевины.
NH,
I
C=NH NH,
NH—СН2—СН2—СН2—СН— (
Аргинии
+nh2—сн2—сн2—СН2—СН —СООН
Орнитин
Аргиназа в значительных количествах содержится в печени и в малых—
в почках и селезенке млекопитающих животных. В печени птиц и рептилий,
где мочевина не образуется, аргиназа отсутствует. Аргиназа имеет важное
значение для процесса образования мочевины в печени млекопитающих.
Канаваназа катализирует гидролиз канаванина, выделенного из сои и
канавалии, с образованием канавалина и мочевины:
СООН
I +Н2о
CH(NIk)—СН2—СН2—О—NH—C-NH+IIoO->
I
NH2
Канаванин
СООН /NH2
-> CH(NH2)— сн2—сн2—о—nh2+co
^NHjj
Канавалии Мочевина
Канаваназа встречается в печени млекопитающих животных. По своему
действию она не отличается от аргиназы. Обе эти дезамидазы катализируют
гидролитическое отщепление от веществ, на которые они действуют, амиди-
новой группы NH2—С—NH.
Дезаминазы пуриновых оснований
К дезаминазам относятся ферменты, катализирующие гидролитическое
отщепление аммиака от пуриновых оснований (аденина и гуанина) как сво-
бодных, так и входящих в состав более сложных веществ (нуклеозидов и ну-
клеотидов). Одна из дезаминаз, катализирующая дезаминирование адени-
на,— аденаза, редко встречается в тканях животных и не обнаружена в
растениях. Другая — гуапаза. катализирующая дезаминирование гуани-
на, встречается чаще, а третья — дезаминаза адениловой кислоты — очень
часто.
164
Особенно активна дезаминаза адениловой кислоты в скелетных мыш-
цах. Источником аммиака в мышцах при их работе является подвергаю-
щаяся там дезаминированию адениловая кислота:
Инозиновая кислота
При действии протеиназ, пептидаз, дезамидаз и дезаминаз ускоряются
реакции гидролиза, при которых происходит разрыв химической связи,
идущей от атома углерода к атому азота (—С—i—NH). Учитывая, что карбо-
гидразы и эстеразы катализируют реакции гидролиза, характеризующиеся
разрывом химической связи, идущей от атома углерода к атому кислорода
(—С——О—7?), гидролазами могут быть названы ферменты, катализирую-
щие реакции, при которых происходит разрыв химических связей, направ-
ленных от атома углерода к атому азота или же от атома углерода к атому
кислорода.
ФОСФОРИЛАЗЫ
Сравнительно недавно открыта группа ферментов, катализирующих
расщепление органических веществ с помощью фосфорной кислоты (реакции
фосфоролиза), получившая название фосфорилаз. При этом происходит
разрыв глюкозидных связей. Фосфоролизу подвергаются некоторые поли-
сахариды (крахмал, гликоген, сахароза), а также нуклеозиды.
Фосфорилаза сахарозы катализирует обратимую реакцию расщепления
сахарозы с образованием глюкозо-1-фосфорной кислоты и фруктозы.
Фосфорилазы широко распространены и встречаются в тканях живот-
ных, растений и в микроорганизмах. В условиях, имеющихся в клетках
(низкая концентрация неорганической фосфорной кислоты), действие фос-
форилаз обратимо. Следовательно, с их по.мощью осуществляются как
165
СНоОН
+ Н2РО3‘ОН
Са хароза
Фруктоза
реакции расщепления сложных органических веществ, так и реакции их
синтеза.
Фосфорилаза крахмала и гликогена катализирует расщепление послед-
них с образованием глюкозо-1-фосфорной кислоты:
сн2он СН2ОН СН2ОН
Как и в случае фосфоролиза сахарозы, фосфоролиз гликогена и крахмала яв-
ляется обратимой реакцией, т. е. из глюкозо-1-фосфорной кислоты с помощью
фосфорилазы этих полисахаридов может синтезироваться при известных
условиях гликоген и крахмал. Одним из этих условий является наличие
ничтожного количества «затравки» (полисахарида или начальных про-
дуктов его распада).
Фосфорилаза гликогена и крахмала изолирована в кристаллическом
виде из мышц и из печени. По своей химической природе она является фос-
166
фопротеидом. В тканях животных она встречается в двух формах — а и б.
Форма б не обладает ферментативной активностью и она образуется в ре-
зультате дефосфорилирования формы а. Форма б превращается в форму а,
т. е. приобретает ферментативную активность в результате фосфорилирова-
ния, которое осуществляется путем перенесения на нее фосфатных остатков
от молекул АТФ.
Реакция фосфорилирования фосфорилазы б катализируется специфи-
ческой фосфоферазой.
Фосфорилаза нуклеозидов катализирует обратимую реакцию расщеп-
ления нуклеозидов.
Аденозин, например, расщепляется с образованием ’ рибозо-1-фосфор-
ной кислоты и аденина:
Аденин Р ибозо-1 - фосфо рная
кислота
ТРАНСФЕРАЗЫ
К трансферазам относятся ферменты, катализирующие реакции пере-
несения химических групп от молекул одних органических соединений на
молекулы других. Известно значительное число таких ферментов, и их раз-
личают по тем группам, перенесение которых ими катализируется.
Метилферазы
Метилферазы — ферменты, катализирующие реакции перенесения ме-
тильной группы. Примером их может служить метилфераза, катализирую-
щая реакцию перенесения метильной группы от метионина на этаноламин
с образованием холина и гомоцистеина:
CH2S—СН3 CH2SH
| | СНоОН
сн2 сн2он сн2 + I
3 I + I -----> 3 I CH2-N+ ее (СН3)3
chnh2 ch2nii2 chnh2
I I
соон соон
Метионин Этаноламин Гомоцистеин Холин
Метилферазы обнаружены в тканях животных и в растениях; с их по-
мощью осуществляются различные реакции метилирования.
167
Аминоферазы
Лминоферазы открыты А. Е. Браунштейном и М. Г. Крицман. Они ка-
тализируют реакции перенесения аминогруппы от а-аминокислот на а-кето-
кислоты. В реакциях перенесения аминогрупп (переаминирования) всегда
участвует моноаминодикарбоновая кислота (глутаминовая или соответствую-
щая ей дикарбоновая а.-кетокислота-а-кетоглутаровая) либо как донор,
либо как акцептор NH2-rpynn.
Примером аминоферазы может служить аминофераза глутаминовой —
пировиноградной кислот — глутамикопирувикоаминофераза, катализирую-
щая реакцию обратимого перенесения аминогруппы от глутаминовой ки-
слоты на пировиноградную кислоту:
СООН
CHNH2
I
СНо
I
сн2
I
СООН
+ СН3ч>-
I
с-о
СООН
СООН
I
со
I
сн2 + сн3
I I
сн9 chnh2
I “ I
СООН СООН
Другие глутамикоаминоферазы катализируют реакцию обратимого
перенесения аминогруппы на различные а-кетокислоты. Аспартикоамино-
фераза катализирует реакцию обратимого перенесения аминогруппы от
аспарагиновой кислоты на а-кетоглутаровую. Небелковым компонентом
аминофераз является пиридоксальфосфат. Участие его в реакциях переами-
нирования можно представить следующим образом:
СООН
I
CHNIL
I
СООН
С—С\
/й\ Н
ИОС/У ХССН2О .Н2РО3«Ь
Пиридоксальфосфат
СООН
сн—N = СН—С
Глутаминовая
кислота
СООН
I
СН—N = СН
сн2
I
сн2
I
СООН
НОС/^ \сСН2ОН2РОз
СООН
I
со
I
сн2+
I
сн2
СООН
I
(2) СН2
СН2
I
СООН
с—ch2nh2
НОС^^С—СН,С Н2РО3
а-Кетоглутаровая Фосфопиридоксамин
кислота
168
c—ch2nh2
НОС^^С—СН2ОН2Р 03
Фосфопиридокса мин
сн3
+ <5о
I
СООН
Пировиноградная
кислота
сн3
chnii2
I
СООН
Пиридоксальфосфат
Аланин
Аминоферазы распространены чрезвычайно широко. Они встречаются
в различных тканях животных, в растениях и микроорганизмах.
ФОСФОФЕРАЗЫ (ФОСФОКИНАЗЫ)
Фосфоферазы—ферменты, катализирующие перенесение фосфатных
остатков от одних соединений на другие. В этих реакциях обычно участ-
вует в качестве вещества, отдающего фосфатный остаток, аденозинтрифос-
форная кислота (АТФ) и иногда другие фосфорилированные мононуклеотиды
(стр. 65). Веществами, к которым присоединяются фосфатные остатки, яв-
ляются креатин, аденозиндифосфорная кислота (АДФ), моносахариды,
глицерин и др. Одни фосфоферазы катализируют обратимые реакции, дру-
гие — необратимые. Зависит это от того, происходит ли реакция перенесе-
ния фосфатного остатка с изменением или без изменения свободной энергии
системы. Чтобы детальней разобраться в этом, необходимо остановиться
на некоторых свойствах АТФ
Аденозинтрифосфорная кислота (АТФ)
Из трех остатков фосфорной кислоты, имеющихся в молекуле АТФ,
один присоединен эфирной связью к молекуле аденозина (/), второй — так
называемой, ангидридной (пирофосфатной) связью к фосфатному остатку (2)
и третий — той же связью к фосфатному остатку (5). В каждой ангидридной
фосфорной связи сосредоточена энергия (при физиологических условиях
8000—10 000 калорий на грамм-молекулу); она освобождается при разрыве
связи. Что касается эфирофосфорной связи, то количество сосредоточенной
в ней энергии невелико (около 2500 калорий на грамм-молекулу). Принято
химические связи, в которых сосредоточено большое количество энергии,
называть макроэргическими и обозначать волнистой черточкой (~).
Легко понять, что от АТФ при феразной реакции отрывается фосфат-
169
ный остаток, возбужденный энергией
Р — ОН . Судьба этого фосфатного
\он/
остатка может быть двоякой: он может быть перенесен на молекулу другого
вещества с сохранением макроэргической связи или утратой ее. В послед-
нем случае освобождается энергия макроэргической связи, происходит
изменение свободной энергии системы. Фосфоферазные реакции обратимы
только в том случае, когда свободная энергия системы в результате перенесе-
ния фосфатного остатка от АТФ остается почти без изменения. Как пример
обратимой фосфоферазной реакции можно привести реакцию фосфорилиро-
вания креатина:
/ОН
NH2 HN ~ Р - О
С = NH С = NH0H
АТФ I । “ АДФ --J- |
А1ф+ы-СН3 N—СН3
I I
сн2—соон сн2—соон
Креатин Креатинфосфорная кислота
Принимающий участие в этой реакции фермент носит название АТФ—
креатинфосфоферазы.
В этом случае макроэргическая связь фосфатного остатка АТФ сохра-
няется в аминофосфатной связи.
Существуют 'многочисленные фосфоферазы, катализирующие необра-
тимые реакции перенесения фосфатного остатка от АТФ на спиртовые груп-
пы моносахаридов, а также и на спирты. Фосфоферазы, катализирующие
перенесение фосфатных остатков на моносахариды, получили название
киназ (глюкозокиназа, фруктозокиназа, фосфоглюкозокиназа, фосфофрук-
тозокиназа, рибозокиназа и т. д.). При этих фосфоферазных реакциях обра-
зуются фосфюэфирные связи и изменяется свободная энергия системы, что
понятно, так как фосфоэфирная связь уже не является макроэргической.
В виде примера приведем действие глюкозокиназы:
Глюкоза
ОН
СН2-О-Р=О
1 л 0Н
cf u М АДФ (+ энергия)
|\9Н ?/|
ИО XI I/он
I I
н он
Глюкозо-6-фосфорная кислота
Фосфоферазные реакции играют важную роль в процессах обмена ве-
ществ и освобождения энергии.
Возникает вопрос, каким путем протекают фосфоферазные реакции?
Как осуществляется перенесение фосфатных остатков от одних веществ
на другие вещества?
Перенесение фосфатных остатков с помощью фосфофераз может проис-
ходить следующим образом. Фосфофераза временно связывает молекулы
реагирующих веществ (например, АТФ и глюкозу). Затем происходит вну-
тримолекулярная перегруппировка образовавшегося комплекса, после чего
170
он распадается с освобождением продуктов реакции (АДФ и глюкозо-6-фос-
форной кислоты).
Другой возможный путь перенесения фосфатного остатка от АТФ на
иные соединения сводится к тому, что молекула фермента реагирует с АТФ
путем отнятия от него фосфатного остатка.
Фермент + АТФ ~ ; * Фермент ~ Н3РО4 АДФ
Затем этот фосфатный остаток переносится на молекулу того или иного
соединения: фермент ~Н3РО4+А-> фермент +А ~Н3РО4. В этом урав-
нении под А подразумевается молекула соединения, на которую переносится
остаток фосфорной кислоты. Особый интерес представляют фосфокиназы,
катализирующие реакции перенесения фосфатного остатка от молекулы
одного нуклеозидфосфата на молекулы другого. К ним относится адени-
латкиназа, катализирующая реакцию
АТФ + АМФт—~~АДФ + АДФ
и ферменты, катализирующие перенесение фосфатного остатка от АТФ на
нуклеозиддифосфорные кислоты (ГДФ, УДФ, ЦДФ) с образованием
соответствующих нуклеозидтрифосфатов (ГТФ, УТФ, ЦТФ). Действие
этих фосфокиназ не сопровождается изменением свободной энергии системы
и они обратимы. Эти ферменты получили название нуклеозиддифосфокиназ.
ДРУГИЕ ФЕРАЗЫ
Кроме метил-, амино- и фосфофераз, существует ряд других фераз.
Имидинфераза катализирует реакцию перенесения имидиновой группы
аргинина на глицин с образованием гуанидинуксусной кислоты:
NH2
H2N—С = NH (!н. ->
I I
Nil—CH2—CH2—CH2—CHNH3—COOH + COOH
Аргинин Глицин
NHo
I
C = NH
I
NH
I
CH2COOH
+ nh2—ch2—ch2—CH2—CHNH2—COOH
Орнитин
Гуанидинуксусная
кислота
Тиофераза катализирует перенесение тиогруппы от гомоцистеина на
серин:
CH2SH СН2ОН
। j । —НгО
CH2CIINH2—СООН CHNH2—СООН *
Гомоцистеин Серин
СН., — S—СН2—CHNH,— СОО. I
I ---»
СН2—CHNH3COOH +Н2°
Цистотионин
СН2ОН
-> ch2chnh2cooh +
Гомосерин
CH2SH
chnh2
СООН
Цистеин
171
Известны феразы, катализирующие реакции перенесения остатков
аминокислот. Установлено, что папаин и химотрипсин (стр. 162) не только
ускоряют реакции гидролиза полипептидов, но и катализируют реакции
перенесения остатков аминокислот (транспептидирование). Существуют фе-
разы, катализирующие перенесение остатков моносахаридов (реакции пере-
глюкозидирования или трансглюкозидирования). Этим путем, например,
в молекуле сахарозы может быть заменен остаток фруктозы на остаток сор-
бозы.
Глюкозидо-фруктозид (сакароза) -|- сорбоза"
глюкозидосорбозид + фруктоза
Большое значение имеют трансглюкозидазы, катализирующие реакции
перенесения гексоз при синтезе полисахаридов. Коферментом этих ферментов
является уридиндифосфогексоза, возникающая в результате реакции
между уридиптрифосфатом (УТФ) и той или иной гексозомонофосфорпой
кислотой:
УТФ -|- глюкозо-1-фосфорная кислота-> УДФ-глюкоза -J- Н4Р2О7.
От УДФ-глюкозы глюкозный остаток переносится на декстрины с
образованием гликогена. Тот же остаток глюкозы утилизируется для
синтеза целлюлозы и других соединений. В последнее время обнаружен
фермент, катализирующий перенесение глюкозных остатков от одних
декстринов на другие, а также и на мальтозу. * Этот фермент получил
название трансглюкозилазы.
Число обнаруженных фераз с каждым годом все увеличивается и вместе
с этим расширяются наши знания о важном значении этих ферментов.
Лиазы
К лиазам относятся ферменты, катализирующие реакции негидроли-
тического расщепления молекул. При этом имеет место разрыв хими-
ческой связи между атомами: С—С, С—S, а также обратимое отщепле-
ние от молекул Н2О (гидролиазы или С—О-лиазы).
С—С-лиазами являются различные альдолазы. Ниже приводится дей-
ствие альдолазы, которая катализирует обратимое расщепление фруктозо-
1,6-дифосфорной кислоты с образованием фосфодиоксиацетона и фосфо-
гл и цер и н а л ь дегида :
СН2О—Н2РО3
I
СО
I
носы
I
НСОН
I
НСОН
СН2О—Н2РО3
СН2О—Н2РО3
I
СО
I
СН2ОН
Диоксиацетонфосфорная кислота
неон
I
СН2О-Н2РО3
Фруктозо-1,6-дифосфорная
кислота
Гли церинальдеги дфосфорная
кислота
Альдолазной активностью обладает миоген, полученный из скелетных
мышц в кристаллическом виде. К лиазам относятся также ферменты, ката-
лизирующие декарбоксилирование (отщепление СО2) ряда органических
кислот. Декарбоксилаза пировиноградной кислоты катализирует отщепле-
ние СО2 от этой кислоты:
СН3
I
с=о
I
СООН
-нсо2
Декарбоксилированию подвергаются и более сложные, чем пировино-
градная кислота, а-кетокислоты.
Декарбоксилазы аминокислот катализируют реакции отщепления СО2
от различных аминокислот с выделением аминов:
R—CHNH2—СООН-^ R—CH2NH2+CO2
Легко видеть, что образование СО2 из кислот не требует участия кислорода.
Декарбоксилазы встречаются в тканях животных, растений, а также у
микробов.
К декарбоксилазам относят фермент — угольную ангидразу (карбо-
ангидразу), катализирующую образование угольной кислоты из углекислого
газа и воды и разложение угольной кислоты на углекислый газ и воду:
CO2-j-H2O Н2СО3.
Освобождение углекислого газа можно рассматривать как реакцию
декарбоксилирования угольной кислоты:
/ /ои\
\ НО— С=О ).
Угольная ангидраза встречается в эритроцитах. Она содержится также
в слизистой оболочке желудка.
К С—О лиазам относятся ферменты, катализирующие реакции обра-
тимого отщепления воды от яблочной, 2-фосфоглицериновой, лимонной
кислот и других соединений (гидратазы)
СООН
I
сн2
I
снон
I
соон
соон
I
-н,о СН
—1
сн
соон
СН2ОН
I
СНО—Н2РО3
СООН
-4-Н2О
сн2
СО-Н2РО3
СООН
2-Фосфоглице-
^блочная
кислота
Фумаровая
кислота
риновая кислота
ФоссЬопировино-
градная кислота
Н2С—СООН
I —ню
НОС—СООН
I -гН2о
Н2С—СООН
Лимонная кислота
Н2С—СООН
I
с—соон
I
НС—СООН
Z/мс-аконитовая
кислота
Все эти ферменты содержатся в различных тканях животных, в расте-
ниях и микробах и играют важную роль в превращениях органических
веществ.
Изомеразы
К изомеразам относятся ферменты, катализирующие обратимое превра-
щение некоторых органических веществ в их изомеры, например глюкозо-
фосфорную кислоту в фруктозофосфорную кислоту, фосфодиоксиацетон
в фосфоглицеринальдегид:
СН2О-Н2РО3
СНОН
Фосфоглицеринальдегид
СН2О—Н2РО3
I
с=о
I
сн2он
Фосфодиоксиацетон
173
Близко к изомеразам стоят ферменты — мутазы, катализирующие как
бы передвижение химических радикалов внутри молекул органических
соединений.
Из мутаз хорошо изучены фосфоглицеромутаза и фосфоглюкомутаза
(подробнее о них см. стр. 180).
Лигазы
К лигазам относятся ферменты, катализирующие реакции, сопровождаю-
щиеся возникновением химических связей между атомами: С—С и С—S.
Лигазы катализируют реакции присоединения отдельных аминокислот
к тем или иным транспортным (адапторным) РНК (см. стр. 472). Они также
катализируют реакции присоединения ацильных остатков к коферменту А
(КоА), который входит в состав ряда ферментов. К лигазам относятся фер-
менты, катализирующие реакции конденсации молекул органических со-
единений. Механизм подобных реакций удалось выяснить после открытия
химической природы кофермента ацетилирования, или, вернее, кофермента
ацилирования (кофермент А или КоА), поскольку этот кофермент катали-
зирует реакции конденсации не только ацетила-радикала уксусной кислоты
(СН3СО), но и вообще ацилов — одновалентных кислотных остатков
(остаток молекулы кислоты без гидроксила) других жирных кислот (стр.
328). Кофермент ацилирования, как оказалось, входит в состав ряда фер-
ментов в качестве их небелкового компонента. Эти ферменты катализируют
реакции конденсации между собой двух молекул уксусной кислоты с обра-
зованием ацетоуксусной, уксусной кислоты с холином — с образованием
ацетилхолина (фермент холин-ацетилаза), уксусной кислоты с щавелево-
уксусной — с образованием лимонной кислоты и многие другие реакции,
в которых конденсирующимися компонентами являются более сложные
органические кислоты. Уксусная кислота (или другие кислоты), прежде
чем вступить в реакции конденсации, соединяется с коферментом ацилиро-
вания, образуя с ним ацетильное (или, соответственно, ацильное) соединение:
Меркаптоэти ламин
NH—СН2—СН2—SH
N
НС
CNHo N
СН
ОН
сн2
он
сн
А д е н о з и н-3-фосфорная кислота
сн3
СН2 р-Аланин
сн2
NH
он
—О-гР—о—Р 4-ОСН 2—С—СН он—С—О
ОН он
•.Пиро фосфорная
к ислота
сн3
2,4 - Диокс и -3,3-ди метилмасляная
кислота
Кофермент А
Активным началом сложной по своей химической структуре молекулы
кофермента ацилирования служит группа SH, поэтому его обычно обозна-
чают символом Ко ASH. Ацетильное производное кофермента ацилирования
обозначают:
KoAS~OCCH3.
Это соединение входит в реакцию конденсации со второй молекулой
уксусной кислоты, в результате чего образуется ацетоуксусная кислота:
КоА—S~ ОССН3+СН3СООН CH3COCH2COOII+KoASII.
174
В случае ацетилирования холина (действие холинацетилферазы) реак-
ция происходит следующим образом:
* КоА—S^OCCH3+HOCH2CH2—N+ = (СН3)3->
СН3СООСН2СН2—N+ - (CH3)3+KoASH.
При реакции конденсации уксусной кислоты с щавелевоуксусной
(действие конденсирующего фермента) образуется лимонная кислота:
KoAS^OCCH3-HCOOH СН2СООН
I -------* I
со »+н2о HOCCOOH+KoASH
I I
сы2 снхоон
I
СООН
Оксидоредуктазы
Многочисленные ферменты, участвующие в реакциях биологического
окисления (стр. 259), составляют группу оксидоредуктаз.
Среди этой группы различают дегидрогеназы, катализирующие реак-
ции отщепления водорода от подвергающихся окислению молекул органи-
ческих веществ, и оксидазы, катализирующие реакцию соединения водорода
с кислородом. К окислительным ферментам относятся также каталаза, ка-
тализирующая реакцию разложения перекиси водорода с образованием воды
и кислорода, и пероксидаза, катализирующая реакции разложения переки-
си водорода с использованием освобождающегося кислорода для окисления
некоторых веществ. Эти ферменты, а также цитохромы, участвующие в про-
цессах окисления, и фермент, катализирующий окисление цитохрома с по-
мощью кислорода, являются железосодержащими белками.
Дегидрогеназы
Дегидрогеназами называются ферменты, воздействующие на опреде-
ленные атомы водорода в молекулах органических веществ и тем самым
способствующие переходу их на молекулы других веществ, акцептирующих
атомы водорода. Отсюда ясно, что в результате действия дегидрогеназ одни
вещества теряют водород, т. е. окисляются, а другие присоединяют его и
восстанавливаются.
Отщепление водорода от молекул веществ носит название дегидроге-
низации, а ферменты, катализирующие отщепление водорода, получили
название дегидрогеназ. Дегидрогеназы обладают специфичностью действия
по отношению к веществам, подвергающимся дегидрогенизации, а также к
веществам, к которым присоединяется отщепленный водород (акцепторам
водорода).
Дегидрогеназы, катализирующие реакции дегидрогенизации с перене-
сением водорода на молекулы органических веществ, носят название
анаэробных дегидрогеназ. Дегидрогеназы же, катализирующие реакции де-
гидрогенизации с перенесением водорода на кислород и действующие, следо-
вательно, только в аэробных условиях, получили название аэробных деги-
дрогеназ. Анаэробные дегидрогеназы относятся к двухкомпонентным фер-
ментам, причем небелковыми компонентами их в одних случаях является
никотинамид-аденин-динуклеотид (НАД), а в других — продукт его фосфо-
рилирования — НАДФ:
175
jD-рибоза О
D- ри боза
Н и коти нам ид-аден ин-дину клеотид (НАД)
ОН
Никотинамид-аденин-динуклеотидфосфат (НАДФ)
Активной группировкой кодегидрогеназы, т. е. группировкой, присоеди-
няющей к себе два атома водорода, отщепляющихся от подвергающейся
окислению молекулы органического вещества, является остаток амида нико-
тиновой кислоты. Восстановленный кофермент дегидрогеназы в результате
присоединения водорода окисляется, т. е. отдает водород иным веществам,
но не кислороду.
К дегидрогеназам относятся также двухкомпонентные ферменты с
коферментом флавинадениндинуклеотидом (ФАД). Активной группировкой
176
ФАД является остаток изоаллоксазина. К нему присоединяются два атома
водорода от подвергающихся окислению молекул субстрата. ФАД имеет
желтый цвет и содержащие ФАД дегидрогеназы окрашены также в желтый
цвет. По этой причине их называют желтыми окислительными ферментами
(флавиновыми ферментами). Восстановленный ФАД бесцветен.
Адениловая кислота
Остатки
фосфорной
ки слоты
Изоаллоксазин
Флавинадениндинуклеотид (ФАД)
о
I
снон—сн2~ор=о
он
Флавиновые ферменты акцептируют водород от восстановленных НАД-
и НАДФ-дегидрогеназ, т. е. окисляют их. Некоторые флавиновые ферменты
являются аэробными дегидрогеназами (оксидазами). Они катализируют
перенос водорода от молекул окисляющихся веществ непосредственно на
кислород.
К оксидазам относится полифенол-оксидаза, катализирующая реак-
цию окисления, то есть отдачу электронов и протонов от фенолов (гидрохи-
нона, пирокатехина, пирогаллола) на кислород. В результате окисления
полифенолов образуются хиноновые соединения и другие темноокрашенные
вещества. Полифенолоксидаза широко распространена в растениях. Дей-
ствие ее можно наблюдать на поверхности разрезов клубней картофеля,
яблок и др. На поверхности разреза полифенолы и полифенолоксидаза
приходят в соприкосновение с кислородом воздуха. В результате действия
гюлифенолоксидазы полифенолы окисляются с образованием темноокрашен-
ных продуктов, и срезы картофеля и яблок темнеют. Потемнение плодов и
овощей при сушке также связано с действием полифенолоксидазы.
Полифенолоксидаза играет важную роль в дыхании растений. В расте-
ниях обратимое окисление полифенолов в хиноны (полифенол хи-
нон) является промежуточной системой перенесения водорода (Н+ и е~) от
окисляющегося вещества к кислороду.
Тирозиназа катализирует окисление тирозина, адреналина и ряда
фенолов в соответствующие хиноны, из которых при дальнейшем окислении
образуются темноокрашенные вещества — меланины. Тирозиназа широко
распространена в организмах растений и животных.
Гемсодержащие ферменты
Гемсодержащие ферменты и цитохромы характеризуются наличием в
их составе в качестве небелкового компонента (кофермента) гема, являюще-
гося железосодержащим порфирином (стр. 50). Все они участвуют в окис-
лительных процессах. Активность гемсодержащих ферментов угнетается
цианидами. К ним относятся следующие ферменты:
Пероксидаза, катализирующая окисление многих фенолов и аромати-
ческих аминов за счет кислорода перекиси водорода. Встречается, главным
образом, в растениях.
Пероксидазы обнаружены в эритроцитах (вердопероксидаза) и в
молоке (лактоперсксидаза).
Каталаза, катализирующая реакцию разложения перекиси водорода
с освобождением молекулярного кислорода:
2Н2О2 —2112О-т О2
Каталаза широко представлена в тканях, а также в эритроцитах, пре-
дохраняя их от возможности накопления перекиси водорода.
Цитохромоксидаза, имеющая еще название «дыхательный фермент
Варбурга», катализирует окисление восстановленного цитохрома «с» ки-
слородом воздуха.
Существующую классификацию ферментов нельзя считать совершенной,
так как она не охватывает все известные в настоящее время ферменты.
Несомненно, что эта классификация будет в дальнейшем совершенствоваться
и стимулом к этому послужит дальнейшее изучение химической природы и
биологических особенностей ферментов, а также открытие новых, пока еще
неизвестных, ферментов.
ХИМИЧЕСКАЯ ПРИРОДА КОФЕРМЕНТОВ
И ИХ ДЕЙСТВИЕ
Для понимания особенности действия двухкомпонентных ферментов
большое значение имеет выяснение химической природы коферментов.
Выше уже говорилось (стр. 149), что белковый компонент является функ-
ционально важной частью двухкомпонентного фермента. С его участием
осуществляется временная связь фермента с подвергающимся химическому
превращению веществом. Специфичность действия ферментов определяется
его белковым компонентом. В чем заключается роль кофермента? В тех
случаях, когда химическая природа коферментов выяснена, имеется воз-
можность разобраться в их роли.
При рассмотрении классификации ферментов указывалось, что деги-
дрогеназы являются динуклеотидами, содержащими никотинамид (НАД и
НАДФ). Химическая структура этих соединений полностью установлена
(стр. 175). Схематично присоединение водорода к коферменту можно пред-
ставить следующим образом:
—CONH2
СН
О
Окисленная форма
кофермента
Восстановленная форма
кофермента
178
Роль НАД и НАДФ при осуществлении действия дегидрогеназ заклю-
чается в том, что они присоединяют к себе водород, отщепляющийся от под-
вергающихся окислению веществ. Этот водород в дальнейшем используется
для восстановления других соединений. Легко видеть, что кофермент ана-
эробных дегидрогеназ играет роль переносчика водорода. С подобным явле-
нием встречаются и при действии дегидрогеназ, коферментом которых яв-
ляется флавинадениндинуклеотид. И в данном случае водород присоеди-
няется к определенной части молекулы кофермента — к нзоаллоксазину,
а затем соединяется с другими веществами.
Открыты ферменты, содержащие небелковый компонент, известный
под названием кофермента ацилирования (КоА). По своей химической при-
роде КоА—довольно сложное соединение (стр. 173), построенное из ряда
компонентов. Из них действующим началом является остаток меркапто-
этиламина, вернее, его сульфгидрильная группа. Отсюда кофермент аци-
лирования обозначают KoA-SH. Схематически его структуру можно пред-
ставить следующим образом: SH
СН2
I
сн2
I
I
NH
R
Ферменты с небелковым компонентом KoA-SH участвуют в различных
реакциях, в частности в реакциях окисления альдегидов и кетокислот.
Возникающая кислота оказывается связанной с KoA-SH. В том случае,
когда образуется уксусная кислота, она дает с KoA-SH соединение KoA-S
—ОССН3. Ацетильная группа (—ОССН3) от KoA-S —ОССН3 переносится
на другие вещества, и получаются более сложные соединения. Ацетильная
группа, в частности, используется для реакций ацетилирования (отсюда и
возникло название «кофермент ацетилирования»).
Своеобразная форма участия коферментов в ферментативных реакциях
встречается у мутаз. Одна из них — фосфоглюкомутаза катализирует реак-
цию обратимого превращения глюкозо-1-фосфорной кислоты в глюкозо-6-
фосфорную кислоту:
Глюкозо - 1 - фосфорная
кис лота
Глюкозо-6 - фосфорная
кислота
н он
Глюкозо-1,6-дифосфорна я кислота
179
Коферментом фосфоглюкомутазы является глюкозо-1,6-дифосфорная
кислота. Участие ее в ферментативной реакции и заключается в следу-
ющем: она отдает свой фосфатный остаток в положении 1 глюкозо-1- фосфор-
ной кислоте с образованием из нее глюкозо-1,6-дифосфорной кислоты:
Гл-1-ф {-гл-1,6-диф гл-1, 6-диф-}-гл-6-ф.
Отсюда следует, что в этой реакции молекула кофермента фосфоглюко-
мутазы превращается в продукт реакции (гл-1, 6-диф в гл-6-ф), а молекула
подвергшегося превращению вещества (гл-1-ф) — в небелковый компонент
фосфоглюкомутазы (гл-1, 6-диф). Подобное явление наблюдается в случае
действия фосфоглицеромутазы. Этот фермент катализирует обратимое пре-
вращение 3-фосфоглицериновой кислоты в 2-фосфоглицериновую кислоту:
СН2О—Н2РО3
I
НСОН
СООН
3-фосфоглицериновая
кислота
СН2ОН
I
СНО—НоРО-5
I
СООН
2-фосфоглицери-
новая кислота
СН2О—Н2РО3
СНО—Н2РО3
СООН
2,3-дифосфоглицериновая
кислота (косЬермент)
Коферментом фосфоглицеромутазы является 2,3-дифосфоглицериновая
кислота. Участие ее в реакциях заключается в том, что она дает свой фосфат-
ный остаток в 3-м положении 3-фосфоглицериновой кислоте:
3-ф-гл. к.-{-2,3-ф-гл. к. 2,3-ф-гл. к.+2-ф-гл. к.
глюк.-6-Р (продукт
реакции)
З-Р-глиц.к (продукт
v реакции)
глюк.-l -Р
(субстрат)
глюк. - 1,6-Р
( кофермент)
2-Р-глиц.к.
(субстрат)
2,3-Р-глиц. к.
(кофермент)
Рис.
9.
Схема действий фосфоглюкомутазы и
фосфоглицеромутазы
Из приведенных примеров видно, насколько разнообразно проявляется
роль коферментов различных ферментов. Коферменты можно рассматривать
как своеобразные вещества, реагирующие с субстратами, которые подвергают-
ся каталитическому воздействию белковых компонентов ферментов.
ОСОБЕННОСТИ СТРУКТУРЫ ФЕРМЕНТОВ. АКТИВНЫЕ
ЦЕНТРЫ ФЕРМЕНТОВ
Ферменты, как уже указывалось (стр. 149), являются белковыми вещест-
вами. Это относится как к однокомпонентным ферментам, так и к двух-
компонентным. В связи с этим следовало бы ожидать, что уровни организа-
ции их структуры как белков (стр. 33) должны быть связаны с проявлением
каталитической активности.
Имеющийся фактический материал показывает, что все уровни орга-
низации структуры ферментов являются очень важными для осуществления
их действия.
Первичная структура, в основе которой лежит аминокислотный состав
и последовательность размещения аминокислот в белковой молекуле,
имеет очень важное значение для проявления ферментативных свойств.
Ферменты при своем действии связываются с субстратами и, следовательно,
обладают химическим сродством к ним. Это сродство осуществляется нали-
чием в молекулах ферментов тех или иных остатков аминокислот при том
180
или ином сочетании. Не только каталитические свойства ферментов, но й
специфичность их действия неразрывно связаны с их первичной структурой.
Большое значение для проявления действия ферментов имеют их вто-
ричная и третичная структуры. Установлено, что высокие концентрации
мочевины, гуанина, разрушающие водородные связи и нарушающие спи-
ралеобразную структуру пептидных цепей, инактивируют ферменты. Вы-
зывает также инактивирование ферментов разрушение их третичной струк-
туры, что имеет место при воздействии агентов, разрывающих дисульфид-
ные связи, а также изменяющих ионные силы в молекулах ферментов.
Для проявления действия ферментов их вторичная и третичная структу-
ры не менее важны, чем первичная.
Имеются данные, указывающие на значение четвертичной структуры
ферментов для проявления их активности. Так, например, установлено,
что дегидрогеназа фосфоглицеринальдегида теряет свою активность при
разделении ее ассоциированной глобулы на две части, составляющие ее.
Большой интерес представляет вопрос о том, зависит ли каталитиче-
ская активность фермента от структуры всей его молекулы, или же части ее.
Для выяснения этого вопроса давно уже предпринимались поиски активных
участков (центров) в молекулах ферментов. Для ряда ферментов было уста-
новлено, что воздействие химических реактивов, которые связывают сульф-
гидрильные группы (—SH), вызывает инактивирование ферментов. Для
железосодержащих ферментов (каталаза, пероксидаза) было показано, что
они инактивируются под влиянием реактивов, связывающих железо. Для
магнийсодержащих ферментов было установлено, что удаление магния или
же связывание его фтористыми солями приводит к их инактивированию.
Все это свидетельствовало о том, что в молекулах ферментов имеются какие
то участки, ответственные за их каталитическую активность.
Дальнейшие исследования по изучению активных центров в молеку-
лах ферментов стали возможными благодаря тому, что окончательно была
установлена их белковая природа. Совершенствование методов препара-
тивной белковой химии и широкое применение их при изучении ферментов
привело в настоящее время к тому, что около 200 ферментов изолировано в
химически чистом виде (кристаллическом или аморфном). Химически
чистые ферменты явились объектами для изучения активных центров. О на-
личии подобных центров говорило прежде всего сопоставление молекуляр-
ных весов ферментов и субстратов (веществ), превращение которых они ка-
тализируют.
Молекулярный вес фермента во всех случаях в сотни и тысячи раз
больше молекулярного веса субстрата. Следовательно, молекула субстрата
при ферментативной реакции связывается не со всей молекулой фермента,
а с той или иной его частью.
Экспериментально установлено, что некоторые ферменты сохраняют
свою каталитическую активность после отщепления от них даже значитель-
ной части молекулы. Так, например, установлено, что можно отщепить от
рибонуклеазы (формулу см. стр. 34), начиная от TV-концевой аминокислоты
(лизина), полипептид, состоящий из 20 аминокислот с сохранением ее ак-
тивности.
Ферменты, катализирующие гидролиз сложных эфиров — холинэсте-
раза, трипсин, химотрипсин и другие, теряют свою активность при воздей-
ствии на них диизопропилфторфосфата, являющегося очень сильным ядом.
(СН3)2—СН-Оч ,0
(СН3)2—СН-СК
Это говорит о том, что эти ферменты имеют какой-то общий активный центр.
Установлено, что диизопропилфторфосфат связывает у ферментов-эстераз
входящий в их состав остаток серина. Следовательно, эта аминокислота
181
входит в состав активного центра эстераз. Имеются указания на то, что в
этот центр входит также гистидин и моноаминодикарбоновая кислота.
Изучение активных центров в молекулах ферментов далеко еще не за-
кончено и это является нелегкой задачей. Активный центр не всегда распо-
ложен в одной пептидной цепи молекулы фермента. Далее на проявление
его активности влияет не только первичная, но вторичная и третичная
структуры молекулы фермента, а также аминокислотные остатки, располо-
женные в пептидных цепях вблизи от активного центра.
Еще более сложной является задача выявления активных центров в
двухкомпонентных ферментах, где наряду с изучением активных центров
белкового компонента фермента, от которого зависит взаимодействие его с
субстратом, необходимо еще выяснить, с какой частью белковой молекулы
взаимодействует небелковый компонент (простетическая группа) фермента.
Изучение активных центров ферментов является новой и многообе-
щающей проблемой биохимии и в ее разработке достигнуты уже известные
успехи.
ДЕЙСТВИЕ ФЕРМЕНТОВ В КЛЕТКЕ.
«АНСАМБЛИ» ФЕРМЕНТОВ
Ферменты, являясь катализаторами, образуют при своем действии
временные соединения с субстратами, но не входят в состав конечных про-
дуктов реакций. Следовательно, можно было бы заключить, что они в клет-
ках не подвергаются изменениям. Однако это не так. Как составные части
клетки ферменты находятся в динамическом состоянии, т. е. подвергаются
распаду и синтезу. Благодаря этому в клетке постоянно наблюдается обнов-
ление ферментов.
Имеющиеся экспериментальные данные показывают, что в клетках
происходит интенсивное образование ферментов. Особенно это относится к
клеткам железистой ткани пищеварительных желез (слюнным железам,
слизистым оболочкам желудка и тонких кишок, поджелудочной железе),
которые интенсивно продуцируют ферменты.
Механизм синтеза ферментов, по-видимому, не отличается от меха-
низма синтеза белков вообще и он осуществляется в клетке сложным путем
(см. стр. 471). Большой интерес представляет изучение факторов, направляю-
щих синтез ферментов и проявление их активности.
Нервная система и химические агенты — гормоны, регулирующие
процессы обмена веществ, влияют на интенсивность образования ферментов
и на проявление их активности. Важное значение имеют также и факторы
внешней среды, особенно доставка в клетки питательных веществ. Установ-
лено, что при недостатке белков в пище снижается активность в клетках
ряда ферментов. В этом случае оказывает свое влияние недостаточный при-
ток к клеткам незаменимых аминокислот.
Для синтеза двухкомпонентных ферментов имеет большое значение при-
ток к клетке не только аминокислот, но и веществ, входящих в состав про-
статических групп. МатериалОлМ для синтеза последних часто являются
витамины (Вр В2, В6, РР, биотин). При недостатке витаминов в пище на-
рушается синтез простетических групп ферментов. Для синтеза ферментов
в клетках пищеварительных желез имеет значение состав пищи. При корм-
лении травоядных животных пищей, бедной углеводами, значительно
уменьшается содержание в соке пищеварительных желез амилазы.
Для синтеза ферментов важное значение имеют генетические факторы.
Известны случаи, когда в организме наблюдаются дефекты в синтезе белков,
передающиеся по наследству и сопровождающиеся тем, что тот или иной
фермент совсем не синтезируется. В этих случаях имеют место глубокие на-
рушения процессов обмена веществ.
182
В любой живой клетке, независимо от уровня ее эволюционного разви-
тия, одновременно проявляет свое действие очень большое количество фер-
ментов. Каждый фермент, благодаря специфичности своего действия, ката-
лизирует течение, или одной, или ограниченного числа реакций. Проявле-
ние активности действия ферментов в клетке происходит упорядоченно.
Это осуществляется тем, что в клетках имеет место последовательность
действия ферментов, их «ансамблей». С участием «ансамблей» ферментов
в чрезвычайно важных биохимических процессах мы будем часто встречаться
в дальнейшем. Для примера укажем, что окисление органических веществ
катализируется в клетке специальным «ансамблем» ферментов. В распаде
углеводов с образованием молочной кислоты участвует свой «ансамбль»
ферментов и т. д.
Упорядоченность действия ферментов является сложным биологиче-
ским явлением, которое подвергается всестороннему изучению. В последнее
время установлено, что ферменты не равномерно распределены в клетке, а
различно сосредоточены в структурных ее элементах (ядре, митохондриях,
микросомах и бесструктурной внутриклеточной жидкости). Это обсто-
ятельство имеет важное значение для упорядоченного действия ферментов
и для процессов обмена веществ в клетке.
ЛИТЕРАТУРА
БраунштейнА. Е. Современные представления о природе активных цент-
ров ферментов. «Актуальные вопросы современной биохимии», Медгиз, 1962.
В л а д и м и р о в Г. Е. и Л ы з л о в а С. Н. Энзимология. Изд. ЛГУ, 1962.
Диксон М. иУэббЭ. Ферменты. ИЛ, 1962.
Лисовская Н. П. Серин как элемент активного центра некоторых фермен-
тов. «Успехи современной биологии», 1962, т. 54.
М ю л ь б е р г А. А. Структура и биологические функции коэнзима фосфорили-
рования. «Успехи современной биологии», 1962, т. 53.
Н е й л а н д с Дж. и Ш т у м п ф П. Очерки по химии ферментов. ИЛ, 1958.
Нортроп Д. Кристаллические ферменты. ИЛ, 1950.
ПронинС. И. Амилолитические ферменты и их роль в пищевой промышлен-
ности. Гизлегпищепром, 1953.
Самнер Д. иСомерс Г. Химия ферментов и методы их исследования. ИЛ,
1948.
Ферменты. Сборник статей под ред. А. Н. Баха и В. А. Энгельгардта. Изд. АН
СССР, 1940.
II ы п е р о в и ч А. С. Ферменты в народном хозяйстве. Изд. «Техника», Киев,
1965.
Черников М. П. и Евтихина 3. Ф. Протеиназы животных тканей.
«Успехи современной биологии», 1964, т. 57.
Глава
восьмая
ГОРМОНЫ
Химические реакции, происходящие в клетках и тканях, как известно,
ускоряются ферментами. Несмотря на разнообразие и многочисленность,
свойственные живым организмам, химические реакции протекают согласо-
ванно друг с другом, слаженно, а не хаотически. Эта особенность течения
химических процессов в живых организмах является характерной чертой
проявления жизни. Нарушение этой слаженности наступает при гибели
организма. В этом случае имеет место бесперебойное хаотическое действие
ферментов, что приводит к расщеплению составных частей клеток и тканей,
к их самоперевариванию (автолизу).
Взаимодействие и согласованность течения химических процессов
в живых организмах обеспечиваются регуляторными механизмами. У низко-
организованных животных и растений регуляция ферментативных процес-
сов обеспечивается специально образующимися у них веществами (химиче-
ские регуляторы), у высших животных и у человека ведущая роль в этом
отношении принадлежит центральной нервной системе. Следует, однако,
указать, что у высших животных и у человека также существует регуляция
течения ферментативных процессов химическими веществами. Больше того,
в результате эволюционного развития у них появились специальные орга-
ны, в которых образуются вещества, поступающие в кровь и доставляемые
кровью в различные ткани и органы, где они проявляют свое регуляторное
действие. Эти вещества, получившие название гормонов, образуются в желе-
зах, обычно не имеющих выводных протоков,— в железах внутренней секре-
ции. Гормоны этих желез поступают непосредственно в кровь.
Деятельность желез внутренней секреции, образование и выделение
в кровь гормонов, регулируются, в свою очередь, центральной нервной
системой. Железы внутренней секреции снабжены нервами, образующими
в них сеть нервных окончаний. От центральной нервной системы, коры го-
ловного мозга по нервам направляются в железы импульсы, усиливающие
или ослабляющие их деятельность. В ряде случаев гормоны осуществляют
регуляторную роль, воздействуя в органах на нервные окончания. Отсюда
понятна тесная связь, существующая между центральной нервной системой
и железами внутренней секреции при осуществлении ими регуляции хими-
ческих процессов, процессов обмена веществ у человека и у животных. Де-
ятельность желез внутренней секреции (эндокринных желез), а также регу-
ляция гормонами функции органов и организма в целом, изучается специ-
альной отраслью физиологии — эндокринологией. В ее задачу входит
также изучение изменений, наступающих в результате нарушения функций
эндокринных желез. Биохимия призвана заниматься вопросами выяснения
химической структуры гормонов, изучения обмена веществ в эндокринных
железах, приводящего к образованию в них гормонов, и механизма дейст-
вия гормонов. Если в изучении химической природы гормонов достигнуты
большие успехи, то пути образования гормонов, и особенно механизм их
184
действия, еще мало известны. Между тем нельзя понять нарушения функции
эндокринных желез и связанные с ними заболевания без знания процессов,
ведущих к образованию гормонов, и механизма их действия.
Успехи, достигнутые в выделении гормонов из эндокринных желез,
а также в деле синтеза ряда гормонов, позволяют широко применять так
называемую заместительную терапию — лечение эндокринных заболеваний
путем введения в организм недостающих в нем гормонов.
ЩИТОВИДНАЯ ЖЕЛЕЗА
Вес щитовидной железы взрослого человека составляет 20—30 г. Железа рас-
положена на шее в виде бугорка впереди верхней части дыхательного горла под гор-
танью. Она исключительно обильно снабжается кровью. Через кровеносные сосуды
щитовидной железы в течение часа проходит вся масса крови организма человека.
Железа состоит из фолликулов — полостей, ограниченных слоем кубических эпите-
лиальных клеток. Фолликулы заполнены полужидкой вязкой массой, получившей
название «коллоид» и отделены друг от друга прослойками из соединительной ткани.
В состав коллоида входит белок-глобулин, содержащий йод (йодтиреоглобулин).
Функция щитовидной железы оставалась невыясненной до последней четверти
прошлого столетия, пока не была установлена связь между атрофией железы и заболе-
ваниями, которые характеризуются недостаточностью ее функции. В 1840 г. Базедов
дал полное описание болезни, возникающей в результате гиперфункции щитовидной
железы, получившей название базедовой болезни. В конце прошлого столетия впервые
был применен экстракт щитовидной железы для лечения больных с недостаточностью
функции щитовидной железы. Лечебный эффект был достигнут как при инъекциях
экстракта, так и при введении его через рот.
Химическая природа гормонов щитовидной железы
В 1895 г. Магнус-Леви показал, что экстракты из щитовидной железы
при введении их в организм повышают интенсивность процессов обмена
веществ. Они повышают потребление кислорода у больных микседемой,
у которых понижена функция щитовидной железы, а также у здоровых лю-
дей. Исследования с удалением щитовидной железы у животных и опыты
с пересадкой железы оперированным животным дали прямые указания на
то, что в щитовидной железе образуется активное вещество — гормон, не-
обходимый для нормальной жизнедеятельности человека и животных. Воз-
ник вопрос о химической природе этого гормона.
В конце прошлого столетия в составе щитовидной железы был открыт
йод. Далее оказалось, что йод находится в железе в составе органических
соединений. Полученные из ткани железы препараты тиреоглобулина со-
держат от 0,5 до 1 % йода. Наряду с тиреоглобулином из щитовидной желе-
зы, вернее из ее щелочных гидролизатов, было выделено йодсодержащее кри-
сталлическое вещество — тироксин. В 1929 г. была установлена химиче-
ская структура тироксина, подтвержденная затем синтезом. Йод тироксина
составляет 20—25% всего йода щитовидной железы.
СН CJ СН
Тироксин (тетрайодтиронин)
Веществом, близким к тироксину, в молекуле которого имеются три
атома йода, является трийодтиронин.
СН
^>С—СН2^СН—СООН
сн nh2
Трийодтиронин
185
Трийодтиронин выделен сравнительно недавно из гидролизатов ткани
щитовидной железы и из плазмы крови. Он оказался в опытах на мышах
и при лечении больных значительно активнее тироксина. Установлено, что
трийодтиронин имеется в больших количествах, чем тироксин, во фракции
йодсодержащих белков плазмы крови. Отсюда возникло предположение,
что истинным гормоном щитовидной железы является не тироксин, а три-
йодтиронин. Из гидролизатов щитовидной железы выделены еще два йод-
содержащих вещества: монойод- и дийодтирозин. Около 70% йода щито-
видной железы представлено в виде дийодтирозина:
СН
%С—СН2—СН—соон
СН NH,
Моной одтирозин
CJ СН
у>С—СН2—СН—соон
СН nh2
Дийодтирозин
Легко заметить, что все четыре йодсодержащие вещества, полученные
из гидролизатов ткани щитовидной железы, являются производным тиро-
зина. Итак, тирозин — предшественник йодсодержащих веществ щитовид-
ной железы.
Тирозин монойодтирозин —* дийодтирозин —> тироксин
(тетрайодтиронин)
Трийодтиронин
Трийодтиронин синтезируется из монойод- и из дийодтирозина или
же возникает из тироксина при отщеплении от него йода.
В пользу предположения, что дийодтирозин является предшествен-
ником тироксина, свидетельствуют следующие факты: дийодтирозин при
рН-7 в присутствии кислорода вне организма превращается в тироксин,
далее он в сравнительно большом количестве имеется в щитовидной железе;
физиологическое действие его невелико и он, следовательно, не может счи-
таться гормоном щитовидной железы.
Несмотря на то, что химическая природа йодсодержащих веществ щи-
товидной железы изучена, процессы, обеспечивающие йодирование тиро-
зина и синтез тироксина и трийодтиронина, остаются еще не выясненными.
Несомненно одно, что щитовидная железа обладает способностью извле-
кать йод из притекающей к ней крови и интенсивно его включать в состав
тирозина и его производных.
Применение в экспериментах радиоактивного йода дало возможность
выявить новые моменты, касающиеся синтеза йодсодержащих веществ в
щитовидной железе. Прежде всего была установлена связь между функцио-
нальным состоянием щитовидной железы и ее способностью поглощать из
крови (концентрировать) поступающий в организм йод. При пониженной
функции железы йод в ней концентрируется медленнее, наоборот, при по-
вышенной функции йод концентрируется интенсивнее, чем обычно. Это об-
стоятельство используется в клинических исследованиях для диагностики
функционального состояния железы.
Поступивший в щитовидную железу йод быстро переходит в органиче-
скую форму. Он обнаруживается сначала в дийодтирозине, а затем в тиро-
186
ксине тиреоглобулина. Интересно отметить, что введенный в организм дий-
одтирозин не поглощается щитовидной железой и выводится из организма
с мочой.
Срезы ткани щитовидной железы способны синтезировать дийодтиро-
зин и тироксин. Обязательным условием для этого является потребление
ими кислорода, т. е. дыхание. Факторы, прекращающие дыхание срезов
ткани железы, приостанавливают синтез дийодтирозина и тироксина. Эти
данные указывают, что синтез гормона щитовидной железы связан с происхо-
дящими в ней процессами обмена веществ.
Большой интерес представляет вопрос, какое из йодированных ве-
ществ, образующихся в щитовидной железе, обладает гормональной актив-
ностью. Принято считать, что этой активностью обладают тироксин и трий-
одтиронин, которые поступают из щитовидной железы в кровь, связываются
белками сыворотки крови, а затем доставляются к различным органам и
тканям. Следует, однако, учитывать, что гормоны щитовидной железы под-
вергаются расщеплению с образованием промежуточных продуктов. Эти
продукты могут обладать той или иной активностью. Установлено, чтотрий-
одтируксусная кислота и трийодтирамин, возникающие из трийодтиронина,
усиливают дыхание, причем действуют более эффективно, чем трийод-
тиронин.
Гормоны щитовидной железы обладают разносторонним действием и
это, по всей вероятности, связано с тем, что из них образуются различные
вещества, каждое из которых обладает определенным гормональным дей-
ствием.
Установлено, что дийодтирозин тормозит образование в передней доле
гипофиза тиреотропного гормона, активирующего деятельность щитовид-
ной железы. В связи с этим дийодтирозин получил применение при заболе-
ваниях, вызываемых гиперфункцией щитовидной железы.
Образование тироксина при йодировании белков
Белки вне организма легко подвергаются йодированию. Йодирование
происходит при слабощелочной реакции и при температуре 40 и 70° С. Свя-
зывание йода белками происходит за счет йодирования входящих в их со-
став остатков молекул тирозина. При щелочном гидролизе йодированных
белков (казеина и иных) образуется дийодтирозин и тироксин. Следует,
однако, отметить, что искусственное йодирование белков происходит мед-
леннее, чем связывание йода тканью щитовидной железы. Это снова под-
черкивает, что синтез гормона щитовидной железы является ферментатив-
ным процессом.
Действие гормонов щитовидной железы
Врожденная гипофункция щитовидной железы (гипотиреоидизм, гипотиреоз) вы-
зывает у детей задержку роста, изменяет строение тела и задерживает умственное раз-
витие. Все эти явления известны под названием кретинизма.
Атрофия щитовидной железы в зрелом возрасте сопровождается слизистым оте-
ком— микседемой (греч. глуха — слизь, odema — отек). В тканях организма больного
задерживается вода, наблюдается ожирение и общая вялость организма.
Гипофункция щитовидной железы известна у людей в горных местностях, где
почва крайне бедна йодом. Вода и растения содержат там настолько мало йода, что
они не могут обеспечить потребность в нем организма. Щитовидная железа пере'рожда-
ется и увеличивается в размерах за счет разрастания соединительной ткани. Способ-
ность ее к синтезу тироксина снижается. Болезнь получила название «эндемический
зоб».
Гипофункция щитовидной железы у животных вызывается полным или частичным
удалением ее из организма. Во всех случаях гипофункции щитовидной железы наблю-
дается понижение основного обмена (стр. 487), расстройство обмена веществ, уменьше-
ние содержания в крови йодсодержащих соединений (тироксина).
Введение в организм тироксина, а также добавление к пище сырой или же вы-
сушенной щитовидной железы, устраняют явления гипотиреоидизма.
Гиперфункция щитовидной железы вызывает у человека базедову болезнь, которая
характеризуется повышением основного обмена, усиленным распадом белковых ве-
187
шеств тканей. У больных нарушается функция сердечной мышцы, увеличивается размер
щитовидной железы, наблюдается пучеглазие.
Явление гиперфункции щитовидной железы вызывается экспериментально у жи-
вотных путем кормления их щитовидной железой, а также, путем введения в организм
тироксина.
Избыточное образование (а также введение) тироксина отрицательно влияет на
организм, вызывает тиреотоксикоз.
Антитиреоидные вещества
Вещества, тормозящие функцию щитовидной железы, носят название
антитиреоидных веществ. По своей химической природе эти вещества могут
быть разделены на две группы. Одни из них имеют тиокарбонамидную
группировку, вторые — аминобензольную группировку. К первым отно-
сятся тиомочевина, тиоурацил, метилтиоурацил; ко вторым — диамино-
дифенилметан и диаминобензол:
Диаминодифенилметан
HN = СО
I I
s=c сн
HN---СН
Тиоурацил
HN—СО
I I
s=c сн
HN—С-СЫз
Метилтиоурацил
Эти вещества, будучи введенными в организм, тормозят синтез тирок-
сина в щитовидной железе, но не влияют на ее способность поглощать йод
из крови.
Антитиреоидные вещества применяются в медицинской практике для
лечения базедовой болезни. Пригодны в этом отношении те антитиреоид-
ные вещества, которые избирательно действуют на образование гормона
в щитовидной железе и не обладают явно выраженным действием на иные
органы и ткани.
ПАРАЩИТОВИДНЫЕ ЖЕЛЕЗЫ
Паращитовидные железы человека (их две пары) расположены на зад-
ней поверхности боковой доли щитовидной железы. Они представляют
собой овальные образования, состоящие из широких клеток, напоминаю-
щих клетки щитовидной железы. Общий вес всех паращитовидных желез
человека всего 0,1—0,15 г. Паращитовидные железы обильно снабжаются
кровеносными сосудами и нервами.
Несмотря на свои незначительные размеры, паращитовидные железы
имеют большое физиологическое значение. Удаление или разрушение их
приводит к быстрой гибели большинства видов животных. Только крысы
оказываются более выносливыми к операции разрушения паращитовидных
желез, но и они погибают через 4—6 недель после операции.
Удаление паращитовидных желез вызывает у животных понижение
содержания кальция в крови с 9—11 до 5—7 мг%, повышенную возбуди-
мость нервной системы и повторяющиеся судороги, ведущие к гибели жи-
вотных.
Гормон паращитовидных желез
В 1926 г. из паращитовидных желез быка был получен экстракт, кото-
рый при введении в кровь собакам вызывал у них повышение содержания
кальция в крови. При введении его в кровь собакам, перенесшим операцию
188
удаления паращитовидных желез, жизнь собак удлинялась и судороги у них
не появлялись. Содержание у них кальция в крови повышалось до нормаль-
ного уровня.
Дальнейшие исследования по изучению активного начала экстрактов
из паращитовидных желез привели к выделению белкового вещества, спо-
собного снижать содержание кальция в крови и удлинять жизнь опериро-
ванных собак. Была установлена белковая природа гормона паращито-
видных желез и что в построении его молекулы участвуют около 75 амино-
кислот. Молекулярный вес ее достигает 8500.
При воздействии на гормон протеолитических ферментов, а также при
гидролизе в кислоте и в щелочи он терял свою активность. Неактивным он
оказывается также при введении его оперированным животным через пище-
варительный тракт.
Гормон паращитовидных желез получил название паратгормона.
Заболевание, связанное с недостаточностью функции паращитовидных
желез, иногда наблюдается у детей и успешно излечивается инъекциями
паратгормона.
НАДПОЧЕЧНЫЕ ЖЕЛЕЗЫ
Каждая надпочечная железа у млекопитающих состоит из двух различных частей,
анатомически связанных друг с другом. Наружная, или корковая, часть железы часто
при эмбриологическом развитии возникает из мезодермы и по своему происхождению
близка к почкам и к половым железам. Интересно в связи с этим отметить, что в ней
наряду с другими гормонами образуются также и половые гормоны. Внутренняя, или
мозговая, часть железы имеет иное происхождение. Она возникает из симпатического
ганглия и остается связанной с брюшными симпатическими нервами. В каждом надпо-
чечнике, следовательно, заключены два гистологически различных образования и каж-
дое из них обладает специфической для него функцией.
МОЗГОВОЙ СЛОЙ НАДПОЧЕЧНИКОВ. АДРЕНАЛИН, НОРАДРЕНАЛИН
Мозговой слой надпочечников функционирует как железа внутренней секреции.
Она состоит из групп полиэдральных клеток, содержащих хромаффиновые гранулы.
Группы клеток разделены кровяными синусами, впадающими в центральую вену. Моз-
говой слой надпочечников обильно снабжается кровью. В течение одной минуты к нему
доставляется количество крови, превышающее его вес в 6--7 раз.
Адреналин, норадреналин
В мозговом (адреналовом) слое надпочечников образуются гормоны — адреналин
и норадреналин.
Изучению химической природы адреналина предшествовали следующие наблюде-
ния. В 1856 г. было обнаружено, что мозговой слой надпочечников окрашивается раство-
ром FeCls в изумрудно-зеленый цвет. Такое же, но слабое, окрашивание давала и кровь,
оттекающая от надпочечников. Этим было показано, что в надпочечниках имеется ка-
кое-то вещество, поступающее в кровь. Раствором FeCh в изумрудно-зеленый цвет
скрашивается пирокатехин (ортодиоксибензол). Отсюда возникло мнение, что в адре-
наловом слое надпочечников образуется вещество, близкое к пирокатехину и поступаю-
щее в кровь.
Первое указание на то, что образующееся в мозговом слое надпочечни-
ков вещество обладает физиологической активностью, было получено в
1895 г. Оказалось, что при внутривенном введении водных экстрактов из
адреналового слоя надпочечников у животных повышается кровяное давле-
ние (прессорное действие). Вещество, обладающее прессорным действием,
было выделено в кристаллическом виде из водных экстрактов мозгового слоя
надпочечников в 1899 г. Абелем и в 1901 г. — Такамине. Абель назвал его
эпинефрином, а Такамине — адреналином. Адреналин явился первым гор-
моном, выделенным в кристаллического виде. Изучение химических осо-
189
бенностей адреналина позволило выяснить его строение. Оказалось, что
он является метиламиноэтанолпирокатехином:
СН
НОС
ССНОН—СН2—NH—СН3
нос
СН
В 1904 г. адреналин был получен путем синтеза. Из двух его стереоизо-
меров активным оказался L- изомер.
Образование адреналина
Выяснение химической структуры адреналина послужило предпосыл-
кой к постановке исследований по изучению его образования в адреналовом
слое надпочечников. Исходя из близости структур адреналина и тирозина,
было высказано предположение, что предшественником адреналина является
тирозин или же фенилаланин, образующий при своем окислении тирозин.
Это предположение получило подтверждение в проведенных опытах с при-
менением фенилаланина, меченного радиоактивным углеродом (С14). Было
установлено, что как циклический компонент, так и боковая цепь адрена-
лина возникает из фенилаланина. Далее было установлено, что источником
метильной группы, имеющейся в боковой цепи адреналина, является ме-
тионин. Следовательно, в процессе синтеза адреналина участвуют две
аминокислоты: фенилаланин (или тирозин) и метионин.
Фенилаланин, прежде чем дать начало образованию адреналина, дол-
жен подвергнуться определенным превращениям: окислению, декарбокси-
лированию и метилированию.
СООН
I
H2N—СН
I
сн2
СН
Фенилаланин
------>
(окисл,)
соон
I
H2N—СН
I
СН2
сон
соон
-со2
Диоксифенилаланин
nh2 nh2
сн2 сн2
I !
сн2 носн
I I
сон сон
---------------->
(метилирование)
Окситирамин Норадреналин
Адреналин
Естественно возникает вопрос, сосредоточены ли все этапы превраще-
ния в адреналовом слое надпочечников? Опыты с прибавлением фенила-
190
ланина и тирозина к мозговому слою надпочечников, а также опыты с про-
пусканием через изолированные надпочечники питательной жидкости,
в которой имелись эти аминокислоты показали, что образование адреналина
в этом случае происходит в небольшом объеме. Отсюда возникло предполо-
жение, что в синтезе адреналина в организме участвуют не только ферменты
адреналового слоя надпочечников, но ферменты и иных органов. Это пред-
положение находит свое подтверждение в том, что фермент, катализирую-
щий декарбоксилирование диоксифенилаланина с образованием оксити-
рамина, отсутствует в адреналовом слое надпочечников, но имеется в
почках и в печени. По-видимому, некоторые промежуточные этапы превра-
щения фенилаланина в адреналин происходят вне адреналового слоя надпо-
чечников. Промежуточные, продукты доставляются в адреналовый слой
надпочечников и там они подвергаются дальнейшему превращению с обра-
зованием адреналина.
Действие адреналина
Как уже упоминалось выше, адреналин обладает прессорным действием.
Это объясняется тем, что он, влияя на нервные окончания в стенках крове-
носных сосудов, вызывает сужение их просветов. Далее, адреналин вызы-
вает распад гликогена в печени с образованием глюкозы, которая поступает
из печени в кровь. Введение адреналина приводит к гипергликемии (по-
вышенное содержание глюкозы в крови). Опыты с введением адреналина в
организм животных и человека показали, что чем богаче печень гликогеном,
тем больше происходит его распад и тем выше становится содержание глю-
козы в крови.
Начальный этап превращения гликогена катализируется ферментом
фосфорилазой. Этот фермент находится в тканях в двух формах — фосфо-
рилированной, активной (фосфорилаза а) и в дефосфорилироваиной, не-
активной (фосфорилаза б). Обе эти формы взаимопревращаемые. Устано-
влено, что адреналин усиливает переход фосфорилазы а в фосфорилазу б.
Происходит это следующим образом. Образование фосфорилазы а из фос-
форилазы б происходит путем фосфорилирования последней. Фермент, ка-
тализирующий эту реакцию, активируется 3,5-адениловой кислотой, возни-
кающей в результате ферментативной реакции из аденозинтрифосфорной
кислоты. Адреналин усиливает ферментативное образование 3,5-аденило-
вой кислоты (стр. 510).
Изложенное иллюстрируется следующей схемой:
фосфорилаза а
фосфорилаза б
3’,5’-адениловая
кислота
л действие
--------
адреналина
аденозинтрифосфор пая
кислота
Рис. 10. Схема действия адреналина
Адреналин также влияет на гликоген мышц, усиливая его распад с на-
коплением молочной кислоты, которая затем подвергается дальнейшим
превращениям. Адреналин мобилизует запасы гликогена в печени и в мыш-
191
цах и благоприятствует их использованию. Это положение находит свое
подтверждение в том, что введение адреналина усиливает также потребле-
ние организмом кислорода и выделение углекислого газа. (Подробнее о роли
адреналина в регуляции обмена углеводов см. на стр. 289).
Адреналин оказывает свое действие в организме в очень малых коли-
чествах (0,0001—0,00001 мг на 1 кг веса тела).
Продукты превращения адреналина
Адреналин подвергается в тканях организма превращениям с образо-
ванием физиологически активных, а также и неактивных веществ. При-
бавленный к крови и к тканям адреналин быстро окисляется и теряет свою
активность. Глутатион (стр. 422), аскорбиновая кислота предохраняют адре-
налин от быстрого окисления.
Большой интерес представляет норадреналин, отличающийся от адре-
налина отсутствием в его молекуле метильной группы. Норадреналин
обладает физиологическим действием, несколько отличающимся от действия
адреналина. Так, например, он в значительно меньшем объеме вызывает
распад гликогена в печени и не приводит к гипергликемии. Он не повышает
потребление организмом кислорода. Подобно адреналину, норадреналин
обладает прессорным действием.
СН
нос^^с —снон
сн сн2
I
nh2
Норадреналин
Норадреналин обнаружен в экстрактах из адреналового слоя надпо-
чечников. Прессорная активность экстрактов из адреналового слоя надпо-
чечников до 30 % обусловлена наличием в них норадреналина. У некоторых
животных (например, у кошек) содержание норадреналина в экстрактах
из адреналового слоя надпочечников еще выше. У китов активность этих
экстрактов на 90—100% зависит от наличия в них норадреналина.
Норадреналин имеется также в экстрактах из сердца, печени, мозга,
селезенки и в крови. Все это дает основание считать норадреналин вторым
гормоном адреналового слоя надпочечников. Вместе с этим норадреналин
можно считать предшественником адреналина. Установлено, что он в адре-
наловом слое надпочечников подвергается метилированию с образованием
адреналина.
Адреналин претерпевает в организме превращения с образованием ве-
ществ с иной биологической активностью. На первом этапе окисления адре-
налина образуется дегидроадреналин.
Адреналин
Дегидроадреналин
Благодаря обратимому превращению адреналина в дегидроадреналин
возникает окислительно-восстановительная система. Дегидроадреналин не
обладает физиологическими свойствами адреналина. Продуктом окисления
дегидроадреналина является адренохром, который, в свою очередь, окис-
192
ляясь, дает оксоадренохром. Восстанавливаясь, адренохром обратимо пре-
вращается в лейкоадренохром.:
СН
СН N-CH3
Адренохром
Лейкоадренохром
Адренохром и лейкоадренохром не могут превращаться в адреналин.
Они составляют окислительно-восстановительную систему, участвующую
в окислительных процессах. Оксоадренохром, возникающий как продукт
необратимого окисления адренохрома, обладает физиологическим дейст-
вием, противоположным адреналину (вызывает расширение кровеносных
сосудов).
СН
У\/сщ
СН N-CH3
Оксоадренохром
Изучению роли адреналина и продуктов его превращения в организме
посвящены обширные исследования А. М. Утевского. На основании полу-
ченных результатов А. М. Утевский пришел к заключению, что физиоло-
гическая роль адреналина определяется как непосредственно, так и рядом
образующихся из него продуктов.
Адреналин и продукты его превращения по своей химической природе
стоят близко к симпатинам — веществам, освобождающимся на концевых
аппаратах симпатических нервов при их возбуждении. Симпатины являются
химическими медиаторами симпатической нервной системы, так как с их
помощью передаются импульсы от симпатических нервов к органам.
Наряду с приведенным выше путем превращения адреналина существует
еще один путь, которвтй сопровождается образованием физиологически не-
активного вещества — 3,4-диоксиминдального альдегида. Образование по-
следнего происходит окислительным путем и катализируется ферментом
аминоксидазой. От молекулы адреналина отщепляется метилаланин, а от
молекулы норадреналина аммиак:
СН
НОС
НОС
Адреналин
С—СНОН
I
сн2
СН I
NHCH3
Норадреналин
3,4-Диокси миндальный
альдегид
Адреналин, норадреналин и близкие к ним амины, содержащие в своей
структуре катехол, получили название катехоламины.
7 Заказ № 581
193
Корковый слой надпочечников
Вес корковой части надпочечников составляет 2/з общего веса надпочечников.
Корковая часть надпочечников очень богата липидами, особенно холестерином и его
эфирами. Обнаружено там также значительное количество стероидов. Холестерин и его
эоиры составляют 5% от веса надпочечников. Богаты также надпочечники аскорбино-
вой кислотой — 120—150 мг% в сыром веществе.
Интерес к изучению надпочечников и особенно его корковой части усилился
с 1855 г., когда Аддисон описал картину тяжелого заболевания человека, неминуемо
кончающегося смертью больного,—бронзовой болезни (она так названа по пигмента-
ции кожи). Аддисон высказал мнение, что причиной бронзовой болезни является раз-
рушение надпочечников. В дальнейшем было доказано, что при бронзовой болезни раз-
рушается, обычно в результате туберкулезного процесса, корковая часть надпочечников.
В 1856 г. была впервые произведена у животных операция удаления надпочечни-
ков. Операция привела к гибели животных. Хирургическая техника в те годы не позво-
ляла удалять из организма раздельно адреналовую и корковую часть надпочечников.
По этой причине нельзя было выяснить, погибают ли животные от удаления всей желе-
зы или же какой-либо одной ее части. В настоящее время известно, что животные
чувствительны к удалению корковой части надпочечников.
ПОСЛЕДСТВИЯ УДАЛЕНИЯ НАДПОЧЕЧНИКОВ
Обычно, как уже указывалось, удаление надпочечников приводит к
гибели животных. Крысы легче переносят удаление надпочечников, но и они
погибают через более отдаленный срок после операции. Наиболее характер-
ными расстройствами, возникающими после операции, являются мышечная
слабость, неуверенность в движениях (мышечная адинамия), падение темпе-
ратуры тела, рвоты и поносы. Животные погибают при явлениях сердечной
слабости. Более детальные исследования оперированных животных пока-
зали, что удаление надпочечников вызывает уменьшение содержания глю-
козы в крови и гликогена в мышцах и в печени, т. е. нарушение углевод-
ного обмена. В крови повышается содержание мочевины. Изменяется
минеральный состав крови: увеличивается количество ионов калия и умень-
шается количество ионов натрия. Нарушается обмен воды. Эти изменения
особенно характерны в период развития болезни. Установлено, что введе-
ние в организм оперированного животного хлористого натрия и уменьшение
в пище содержания солей калия улучшают состояние животного и удли-
няют его жизнь. Для больных бронзовой болезнью нарушения аналогичны
установленным у животных при удалении у них надпочечников.
КОРТИ КОСТЕРОИДН Ы Е ГОРМОН Ы
В 1930 г. впервые было установлено, что путем экстрагирования тка-
ней надпочечников органическими растворителями удается получить пре-
параты (экстракты), которые, будучи введенными в организм собак после
удаления надпочечников, предохраняют от их развития заболевания и
гибели.
В 1936 г. из экстрактов надпочечников было выделено активное веще-
ство, оказавшееся по своей химической природе стероидом. Начиная с этого
года, стали интенсивно проводиться исследования по выделению активных
веществ из корковой части надпочечников, по изучению их химической
природы и осуществлению их синтеза. Выделенные в кристаллическом виде
вещества (их теперь получено свыше тридцати) являются стероидами, и зна-
чительное количество из них оказалось биологически активными вещества-
ми — гормонами.
Некоторые гормоны корковой части надпочечников по своему дейст-
вию и по своей химической природе идентичны гормонам, образующимся
в половых железах (стр. 200). Другие гормоны оказались по своему дейст-
вию специфичными для функции корковой части надпочечников и получили
название кортикостероидных гормонов. Химическая природа этих гормонов
установлена, осуществлен их синтез.
194
СН2ОН
СН2ОН
С-0
СН3 |
С-О
Кортикостерон
11-Дезоксикортикостерон
СНоОН
I
с=о
/\^\/
о
17-Оксикортикостерон (кортизол)
СН2ОН
I
с=о
СН3 |—ол
°ч/\ /\
сн3
Х\/\/---------
11-Дегидрокортикостерон
СН2ОН
н |
| С—О
НО О:- С I
Альдостерон
17-Окси-11-дегндрокортикостерон (кортизон)
Все стероидные гормоны обладают общей для них химической особен-
ностью: в структуре их имеется циклический компонент в виде пергидро-
фенантренциклопентана. Предшественником их является холестерин, вклю-
чающий такой же циклический компонент (подробнее о холестерине стр. 99).
При изучении стероидных гормонов корковой части надпочечников
прежде всего возникает вопрос, обладают ли они все одинаковой актив-
ностью? Активность этих гормонов устанавливается в опытах на животных
с удаленными надпочечниками. О степени активности их судят по способ-
ности поддерживать жизнь оперированных животных, по нормализации
углеводного обмена, минерального обмена, устранению адинамии. В таб-
лице приводятся результаты испытания активности стероидных гормонов
коры надпочечников на мышах и крысах с удаленными надпочечниками
(активность 11-дегидро, 17-оксикортикостерона принята за 100).
Из приведенных данных видно, что различные стероидные гормоны
с различной степенью активности восстанавливают отдельные нарушения
в организме, вызванные удалением надпочечников. Альдостерон, например,
7*
195
Активность стероидных гормонов коры надпочечников
Название гормона Поддержание жизни опери- рованных животных Отложение гликогена в печени и в мышцах Восстановле- ние уровня натрия в кро- ви Восстановле- ние способ- ности к мы- шечной работе
11-дегидро-17-оксикортикостерон . . . 100 100 100 100
Кортикостерон 75 54 255 46
11-дегидрокортикостерон 58 48 — 32
17-оксикортикостерон 100 155 150 160
Дезоксикортикостерон 400 Неак- тивен 1 500 5
Альдостерон — — 120 000
Примечание. Использованы данные, приведенные в Principles of Biochemistry
A. White и др. 1945, стр. 945.
оказывается в 1200 раз более активным в восстановлении нормального со-
держания ионов натрия в крови, чем 17-дегидр о-11-оксикортикостерон.
Перечисленные в таблице гормоны не в одинаковом количестве обра-
зуются в корковой части надпочечников и поступают в кровь. Из общего
количества всех стероидных кортикальных гормонов около 80% приходится
на долю 17-оксикортикостерона, кортикостерона и альдостерона. Эти три
гормона способны обеспечить все основные функции коры надпочечников.
Кортикальные стероидные гормоны, поступающие из корковой части
надпочечников в кровь, подвергаются в организме превращениям и затем
выделяются с калом щ с мочой.
У человека продукты превращения этих гормонов выделяются преи-
мущественно с мочой, у некоторых животных (собака, крыса) они в основ-
ной своей массе выделяются с калом. Эти продукты уже не обладают гормо-
нальной активностью. Наряду с ними выделяется некоторое количество
неизмененных или малоизмененных кортикостероидов (17-оксикортикостерон
и близкий к нему 11-дегидро-17-оксикортикостерон, получивший название
кортизон и др.). Количество стероидов в моче человека увеличивается при
травмах, при хирургических операциях, а также при некоторых физиологи-
ческих состояниях организма.
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА И ЕЕ ГОРМОНЫ
Поджелудочная железа обладает двоякой функцией. С одной стороны, она яв-
ляется пищеварительной железой, сок которой через выводной проток поступает в
двенадцатиперстную кишку, с другой стороны, в ней образуются активные вещества,
поступающие непосредственно в кровь. Соответственно этому в поджелудочной железе
обнаруживают секреторную часть (основная масса железы) и особые образования, в
которых вырабатываются рормоны. Эти образования были описаны впервые в 1869 г.
Лангергансом и носят название островков Лангерганса, или островковой ткани. Ост-
ровковая ткань диффузно распространена в поджелудочной железе и в общей своей
массе составляет меньше одного процента всей массы железы. В островковой ткани
гистологически различают четыре вида клеток: а-, 9., Q. и £>-клетки. з-Клетки состав-
ляют около 75% всей массы клеток.
До исследований Меринга и Минковского (1889 г.) поджелудочную железу рас-
сматривали только как пищеварительный орган. В 1889 г. Меринг и Минковский осу-
ществили операцию удаления поджелудочной железы у собак (депанкреатизацию).
Совершенно неожиданным оказалось появление у собак после операции расстройства
углеводного обмена (повышение содержания глюкозы в крови — гипергликемия и
выделение глюкозы с мочой — глюкозурия). Дальнейшие наблюдения показали, что
депанкреатизация вызывает у животных явления, характерные для людей, больных
сахарной болезнью (сахарным диабетом). Отсюда стало ясным, что поджелудочная
железа не только пищеварительный орган, но обладает еще какой-то важной функци-
ей, предохраняющей организм от расстройства углеводного обмена.
196
Инсулин
Попытки получения активных экстрактов из поджелудочной железы,
с помощью которых можно было бы лечить людей, больных сахарным диа-
бетом, а также предохранить от заболевания животных после удаления
поджелудочной железы, долго не давали положительных результатов.
В 1902 г. Л. Соболев на основании исследований морфологических осо-
бенностей поджелудочной железы пришел к заключению, что активное
вещество, предохраняющее организм от сахарной болезни, образуется не
по всей железе, а только в островковой ткани. Далее он указал на то, что
неудачи в получении активного вещества из островковой ткани объясня-
ются разрушением этого активного вещества протеолитическим фермен-
том железистой ткани поджелудочной железы: При экстрагировании
всей поджелудочной железы в экстракт переходят как ферменты желе-
зистой ткани, так и активное вещество из островковой ткани. Соболев
предложил метод, позволяющий вызвать перерождение железистой тка-
ни с сохранением островковой ткани. Это достигается путем перевязки
протока поджелудочной железы. В перерожденной железистой ткани
прекращается образование ферментов, разрушающих при получении
экстрактов активное вещество островковой ткани. Далее Соболев указал,
что материалом для получения активного вещества из островковой тка-
ни могли бы явиться поджелудочные железы новорожденных животных
и эмбрионы, так как у них железистая ткань слабо развита, в то время
как островковая ткань развита хорошо.
Перевязка выводного протока, а также заполнение его парафином,
выключает пищеварительную функцию железы, но не вызывает у живот-
ных признаков сахарного диабета.
Сравнительно недавно был предложен способ, вызывающий перерожде-
ние островковой ткани поджелудочной железы при сохранении функции
железистой ткани. Это достигается введением в организм животного аллок-
сана:
HN-C-0
I I
о-с с=о
I
HN-C-0
Аллоксан
В результате перерождения островковой ткани наступает заболевание
животных, получившее название аллоксанового диабета (в результате
удаления поджелудочной железы наступает панкреатический диабет). Ал-
локсановый диабет можно рассматривать как модель сахарной болезни че-
ловека и им широко пользуются для изучения особенностей нарушения об-
мена веществ при сахарной болезни.
Еще до получения активного вещества из островковой ткани в 1909 г.
а затем в 1916 г. для него было предложено название инсулин (insula—
остров).
В 1921 г. Бантинг и Бест, использовав операцию перевязки протока,
получили из поджелудочной железы собаки активные экстракты, которые,
будучи введенными в кровь, снижали у животных содержание в ней глю-
козы. В результате разработки приемов очистки экстрактов в 1926 г. инсу-
лин был получен в кристаллическом виде.
Инсулин оказался белковым веществом, и отсюда стали понятными не-
удачи исследователей, пытавшихся получить активные экстракты из под-
желудочной железы: белок-инсулин расщеплялся трипсином железистой
ткани железы и инактивировался. Для получения инсулина в производ-
ственных масштабах стали применять экстракцию измельченных поджелу-
дочных желез крупного рогатого скота подкисленным спиртом. При кислой
реакции действие трипсина и химотрипсина поджелудочной железы пре-
кращается.
197
В настоящее время благодаря исследованиям Сангера выяснена хими-
ческая природа инсулина. Макромолекула инсулина построена из мономе-
ров. Каждый мономер в свою очередь построен из двух полипептидов. Один
из них состоит из 21 аминокислотного остатка (цепь А), а другой из 30.
В полипептиде А аминокислоты в цепи расположены так: Глиц-Изо-
Лейц-Вал-Глут-Цист-Цист-Алан-Сер-Вал-Цист-Сер - Лейц - Тир - Глут-Лейц -
Глут-Глут-Асп-Тир-Цист-Аспарагин. Af-концевой аминокислотой в этом
полипептиде является глицин. С-концевой аминокислотой — аспарагин.
В полипептиде В расположение аминокислот в цепи такое: Фен-Вал-
Асп-Глут-Гист-Лейц-Цист-Глиц-Сер-Гист-Лейц-Вал-Глут- Алан - Лейц - Тир-
Лейц-Вал-Цист-Глиц-Глут-Арг-Глиц-Фен-Фен-Тир-Треон - Прол-Лиз - Алан.
Всего 30 остатков аминокислот.
TV-концевой аминокислотой в этом полипептиде является фенилаланин.
С-концевой аминокислотой — аланин. Молекулярный вес мономера инсу-
лина равен 6000.
В инсулине полипептиды соединены друг с другом через дисуль-
фидные мостики. Схематически соединение их может быть представлено
следующим образом:
(7) (20) (21)
Полипептид A. II2N глиц..................цист.........цист........цист........цист......................acn-NH2
S S
I I
S S
I (7) | (19) (30)
Полипептид В. H2N фен------------------....................цист...............цист..........-......алан-СООН
Известно, что препараты инсулина, изолированные из островковой тка-
ни поджелудочной железы, содержат цинк (около 0,3%). Долго оставалось
неизвестным, какое положение занимает цинк в молекуле инсулина. В на-
стоящее время установлено, что с помощью цинка соединяются друг с
другом два мономера инсулина с образованием димера с молекулярным ве-
сом — 12000. Два димера с помощью электростатических и вандерваальсов-
ских сил соединяются друг с другом с образованием молекулы весом 24000.
Соединение трех димеров дает молекулу с весом в 36000 и, наконец, соеди-
нение четырех димеров образует молекулу весом 48000. Эти макромолеку-
лы инсулина (весом в 12000, 24000, 36000 и 48000) находятся в организме
в состоянии подвижного равновесия. Физиологической активностью обла-
дают мономер, димер, соединение двух, трех и четырех димеров инсулина.
Препараты инсулина, полученные из поджелудочной железы различ-
ных видов животных, несколько отличаются друг от друга по своему ами-
нокислотному составу. В пептидной цепи В различных по своему проис-
хождению инсулинсв аминокислоты в положении 8, 9 и 10 представлены
следующим образом:
Инсулин быка
8 Глут
9 Сер
10 Гист
Инсулин свиньи
8 Треон
9 Сер
10 Изолейц
Инсулин овцы
8 Алан
9 Глиц
10 Вал
Инсулин лошади
8 Треон
9 Глиц
10 Изолейц
Инсулин оказался первым белком, химическое строение которого вы-
яснено до конца. В 1964 г. удалось осуществить синтез инсулина из отдель-
ных аминокислот.
Установление химической структуры инсулина и осуществление его
синтеза является выдающимся достижением биохимии.
Инсулин получил широкое применение в клинике при лечении сахар-
ного диабета. Его применяют также при лечении некоторых других заболе-
ваний. Инсулин вводят подкожно; при введении через рот он разрушается
198
протеолитическими ферментами. Инсулин легко соединяется с щелочными
белками (протаминами) с образованием стойких комплексов. Эти комплексы
обладают более продолжительным действием в организме, чем свободный
инсулин (депо-препараты).
Инсулин вызывает снижение содержания глюкозы в крови и усиливает
синтез гликогена в печени и в мышцах. Инсулин, создавая благоприятные
условия для проявления активности фосфоферазы, активирующей реакцию
перенесения фосфатного остатка от аденозинтрифосфорной кислоты на глю-
козу, усиливает процессы потребления глюкозы тканями организма. Инсу-
лин, по-видимому, действует также и на окислительную фазу превращения
органических веществ. Наряду с этим инсулин усиливает проницаемость
тканей по отношению к глюкозе.
Глюкагон
Наряду с инсулином, обладающим способностью снижать содержание
глюкозы в крови (вызывать гипогликемию) и стимулировать синтез глико-
гена в печени, в островковой ткани образуется гормон, вызывающий повы-
шение содержания глюкозы в крови (гипергликемию) и распад гликогена
в печени. Гормон вначале получил название гипергликемический-гликоге-
нолитический фактор, а затем глюкагон.
Гормон глюкагон был открыт недавно и предпосылкой к этому послужили сле-
дующие наблюдения.
В ряде случаев было замечено, что введение в организм инсулина вызывает в
первые 10—30 минут гипергликемию, а затем уже гипогликемию. Отсюда возникло
предположение, что препараты инсулина содержат какое-то вещество, вызывающее
до начала действия инсулина гипергликемию, которая, оказалось, сопровождается рас-
падом гликогена в печени. Отсюда возникло название — гипергликемический глико-
генолитический фактор. В пользу предположения об образовании подобного фактора
в поджелудочной железе свидетельствовали также и следующие данные. Аллоксан при
введении его в организм животного (например, собаки) вызывает у него так называе-
мый аллоксановый диабет в результате перерождения В-клеток островковой ткани под-
желудочной железы. Гипергликемию при аллоксановом диабете можно устранить пу-
тем инъекций в организм животного инсулина. В опытах на собаках было установле-
но, что для устранения гипергликемии при аллоксановом диабете приходится вводить
в организм больше инсулина, чем в том случае, когда у тех же собак с аллоксановым
диабетом удаляется поджелудочная железа. Приведенные факты указывали на то, что
в поджелудочной железе, кроме инсулина, образуется еще какое-то активное вещест-
во. Его удалось получить в кристаллическом виде из препаратов инсулина и из экст-
рактов поджелудочной железы, и оно получило название глюкагон.
Глюкагон образуется в а-клетках островковой ткани поджелудочной
железы и является полипептидом.
Молекула глюкагона построена из 29 аминокислот.
Леконцевой аминокислотой этого полипептида является гистидин,
С-концевой группой — треонин. Последовательность размещения амино-
кислот в молекуле глюкагона следующая:
nh2
I
Гис-Сер-Глу-Глиц-Тре-Фен-Тре-Сер-Асп-Тир-Сер-Лиз-Тир-Изолейц-Асп-Сер-Арг-Арг-
Ала-Глу-Асп-Фен-Вал-Глу-Тир-Лей-Мет-Асп-Тре
NH2 nh2 nh2 nh2
Глюкагон по своему физиологическому действию во многом схож с дейст-
вием адреналина на углеводный обмен.
Открытие глюкагона представляет большой интерес. Оно заставляет
пересмотреть сложившееся представление о причине возникновения сахар-
ного диабета у людей.
Не исключена возможность, что причиной сахарного диабета является
не только уменьшение объема образования инсулина в р-клетках остров-
ковой ткани поджелудочной железы, но и увеличение образования
199
в а-клетках той же ткани глюкагона. Установлено, что введение в
организм некоторых сульфамидных препаратов (например, Мрсульфанил-Мя-
h-бутилкарбамида) ограничивает образование глюкагона и устраняет гипер-
гликемию в случаях средней по тяжести формы сахарного диабета. Эти
препараты получают применение в медицинской практике при лечении
сахарного диабета.
ПОЛОВЫЕ ГОРМОНЫ
Половые гормоны образуются в половых железах, а также в корковой части над-
почечников (стр. 194) и в плаценте. Центром образования половых гормонов в мужском
организме являются семенные железы (testes), а в женском организме — яичники
(ovaria). Следует, однако, подчеркнуть, что в семенных железах, наряду с преимуще-
ственным образованием мужских половых гормонов, образуются в некотором коли-
честве и женские половые гормоны. Точно так же, как в яичниках, вырабатывающих
преимущественно женские половые гормоны, образуются в некотором количестве и
мужские половые гормоны. Следовательно, в мужском организме обнаруживаются
как мужские, так и женские половые гормоны, но преобладают в нем мужские поло-
вые гормоны; в женском организме, при наличии мужских половых гормонов, преоб-
ладают женские половые гормоны. Интересно отметить, что при известной патологии —
гермафродитизме—в организме имеются сдвиги в соотношении образования мужских
и женских гормонов. У гермафродитов мужчин увеличена продукция женских поло-
вых гормонов, у гермафродитов женщин усилена продукция мужских половых гор-
монов.
На ранних стадиях эмбриогенеза различить пол по строению половых желез не-
возможно: зачаток половой железы оказывается бисексуальным. Позже появляются
эпителиальные тяжи — зачатки семенных канальцев (развитие мужских особей).
Семенные железы. Мужские половые гормоны
В семенных железах, в извитых канальцах, имеются спермогенные клетки, в
которых образуются сперматозоиды. В семенных железах образуются также гормо-
ны, и они, следовательно, являются железами внутренней секреции. С давних пор из-
вестно, что кастрация (удаление семенных желез) у животных, а также у человека
вызывает глубокие .изменения в их поведении. Пересадка семенной железы кастриро-
ванным животным предохраняет их от последствий кастрации. Эти данные, с одной
стороны, указывают на то, что в семенных железах образуются активные вещества, а
с другой стороны, что железы являются основным органом, в котором продуцируются
мужские половые гормоны. Мужские половые гормоны носят название андрогенных
гормонов (греч. andros — мужчина).
Существуют биологические тесты, позволяющие обнаружить андрогены в тех
или иных материалах. К ним относится тест на рост гребня у кастрированных пе-
тушков. Кастрация приводит к резкому уменьшению гребня и его кровенаполнения.
Введение андрогенов кастрированным петушкам вызывает рост и кровенаполнение
гребня. Установлена прямая зависимость между количеством введенного гормона и
интенсивностью роста гребня. Это позволяет не только выявлять наличие андрогенов,
но и судить об их количестве.
Другим биологическим тестом является проба на кастрированной рыбке горчаке.
У горчака в период спаривания появляется красивый брачный наряд. После кастрации
этого не наблюдается. Прибавление к воде аквариума, в котором плавают кастриро-
ванные горчаки, материала, содержащего андрогены, уже через несколько часов ска-
зывается в появлении у рыбок брачного наряда.
Андрогенные гормоны нерастворимы в воде, а растворимы В' органиче-
ских растворителях. Следовательно, они относятся к липидам (стр. 92).
Прообразом их может служить полициклический углеводород андростан.
Андростан
ОН
Тестостерон
200
о
СН, ||
Андростерон
Из семенных желез быка и жеребца выделен гормон, получивший наз-
вание тестостерон. Химическая структура тестостерона была установлена
путем его синтеза из холестерина.
Из корковой части надпочечников выделены четыре вещества, обладаю-
щие андрогенными свойствами: андростерон; 3,17-андростендион; 3, 11,
17-андростендиол и 17-оксипрогестерон.
Андрогены выделяются из организма с мочой. Еще до изолирования
(1935 г.) тестостерона из семенных желез, из мочи мужчин были получены
(1927 г.) в кристаллическом виде андростерон и дегидроизоандростерон.
Синтетический андроген — мети л тестостерон — получил широкое при-
менение в медицинской практике.
Дегидроандростерон
\/
о
Метилтестостерон
Метилтестостерон при введении его в организм в шесть раз активнее
тестостерона. Андрогенные гормоны, как и экстракты, полученные из се-
менных желез, при введении их в организм кастрированных самцов пре-
дохраняют их от явлений кастраций. Андростероны влияют на процессы
обмена веществ. У растущих организмов они сказываются на азотистом об-
мене, усиливая задержку организмом (ретенцию) азота (использование бел-
ков пищи для увеличения массы белков тканей).
Обмен андрогенных гормонов
Выделение из семенных желез корковой части надпочечников и из мо-
чи мужских и женских особей андрогенных гормонов поставило к разреше-
нию вопрос об их образовании и о взаимосвязи между ними.
При инкубации ткани семенных железе меченным по углероду ацетатом
было установлено образование меченного радиоактивным углеродом тесто-
стерона. Известно (стр. 340), что уксусная кислота в организме животных
используется для синтеза холестерина, в составе которого имеется такой же
циклический компонент — пергидрофенантренциклопентан, как и в тесто-
стероне. Возникает вопрос, образуется ли из уксусной кислоты в семенных
железах холестерин, а затем из него — тестостерон? Иными словами, стоит
ли холестерин на пути образования тестостерона из уксусной кислоты? Име-
ющиеся экспериментальные данные говорят о том, что синтез тестостерона
201
из уксусной кислоты происходит без промежуточного образования холес-
терина.
Наиболее активен из природных андрогенных гормонов тестостерон.
Из него, по-видимому, образуются иные андрогенные гормоны. Установлено
превращение тестостерона в андростерон и в дегидроизоандростерон—
вещества, обнаруживаемые в моче мужских и женских особей. В моче
имеются еще два андростерона, образующиеся из тестостерона: изоандро-
стерон и этиохоланолон.
Тестостерон в организме может дать начало образованию иных андро-
генных гормонов не только в семенных железах. Превращение тестосте-
рона в андростерон наблюдали при введении его в кастрированный организм,
а также в организм женщин. В этих опытах из мочи был выделен этиохо-
ланолон.
В превращении и в выделении андрогенных гормонов из организма
участвует печень. При введении собаке с фистулой желчного пузыря тесто-
стерона и андростерона можно наблюдать выделение с желчью андроген-
ных гормонов. Далее, при инкубировании ткани печени с прибавлением к
ней тестостерона происходит его исчезновение с образованием продуктов
превращения — андрогенных гормонов. Происходит ли в организме глу-
бокий распад андрогенных гормонов — сказать пока еще трудно. Опыты с
введением мышам меченного радиоактивным углеродом тестостерона пока-
зали, что приблизительно 5% его радиоактивности обнаруживается в выды-
хаемом углекислом газе.
Андрогенные гормоны выделяются с мочой в неактивном состоянии в
виде эфиров серной кислоты. Эти эфиры растворимы в воде; при гидролизе
их в кислоте образуются активные, нерастворимые в воде андрогенные
гормоны.
яичники
Основным органом, в котором образуются женские половые гормоны, являются
яичники (ovaria). В яичнике различают наружный, или корковый, слой и расположен-
ный под ним мозговой слой. Тяжи эпителиальных клеток проникают вглубь яичника
и образуют в нем маленькие гнезда. Некоторые из них впоследствии развиваются в
фолликулы с яйцеклеткой внутри. С момента рождения до момента полового созре-
вания фолликулы медленно увеличиваются в размере. К половому созреванию фол-
ликулы резко увеличиваются и наиболее зрелый из них лопается, освобождая заклю-
ченное в нем яйцо; наступает овуляция. Затем место разрыва смыкается, полость фол-
ликула заполняется кровью и впоследствии прорастает соединительной тканью. Эпи-
телий фолликула разрастается, в клетках его откладываются липиды, окрашенные в
желтый цвет. Возникающее образование получило название «желтое тело» (у многих
видов животных — крысы, мыши — «желтое тело» не имеет окраски).
Если освободившееся яйцо не оплодотворилось, через некоторое время наступа-
ет инволюция (обратное развитие) желтого тела. В случае же оплодотворения яйца и
укрепления зародыша в матке желтое тело продолжает расти, достигает размера око-
ло трети всего яичника и существует в течение всей беременности. Одновременно с
первой овуляцией наступает первый половой цикл, у животных — первая течка.
Удаление яичников — кастрация — приводит к ряду изменений в организме.
При кастрации недоразвиваются внутренние половые органы (яйцеводы, матка, вла-
галище), атрофируются молочные железы, не наступает половая зрелость, отсутству-
ет половой инстинкт. Пересадка яичников кастрированным самкам устраняет у них
явления кастрации. Отсюда следует, что яичники являются органом внутренней сек-
реции.
Гормоны образуются в фолликулах яичника и в желтом теле.
Химия эстрогенов
Женские половые гормоны получили название эстрогены (греч. estrus —
течка). В деле их изучения большое значение имела разработка методов их
определения с помощью биологических тестов.
202
С помощью биологических тестов было установлено наличие эстрогенов
в экстрактах из яичников и из плаценты, в крови и в моче (особенно много
эстрогенов в моче беременных женщин и самок). В кристаллическом виде
получены следующие эстрогены: 1) фолликулин или эстрон (из яичников,
плаценты и из мочи беременных, а также из экстрактов корковой части над-
почечников), 2) эстриол (из мочи беременных) и 3) эстрадиол (из мочи бере-
менных и синтетически). Все они имеют в своих молекулах циклический
компонент в виде дегидрофенантренциклопентана и прототипом их может
явиться циклический углеводород эстран. Этот углеводород отличается от
андростана тем, что у него в молекуле есть только одна метильная группа
у 13-го углеродного атома:
ОН
Эстриол
Из всех эстрогенов, формулы которых здесь приведены, наиболее ак-
тивным является эстрадиол, образующийся в фолликулах яичников. Эст-
рон и эстриол есть производные эстрадиола.
Интересно отметить, что в семенных железах жеребцов обнаружен
эстрон. Моча жеребцов — наиболее богатый источник для получения
эстрона.
Эстрогены выделяются с мочой, главным образом в виде эфиров серной
кислоты и соединений с глюкуроновой кислотой. Соединения эти раствори-
203
мы в воде, в то время как свободные эстрогены в воде нерастворимы. Связы-
вание эстрогенов с серной кислотой и с глюкуроновой кислотой происходит
в печени.
Эстрон- сульфат
нс=
I
НСОН
I
носн
I
НСОН
I
нс----
I
СООН
ОН
Эстриол-глюкуронид
В превращениях эстрогенов, ведущих к их инактивированию, а также
к выделению их из организма, большую роль играет печень. Поражения
печени сопровождаются повышением содержания эстрогенов в крови.
Эстрогены (эстрон и эстрадиол) образуются из холестерина.
Вещества, обладающие эстрогенным действием. Известны нестероид-
ные вещества, обладающие эстрогенным действием. К ним относится диок-
сидиэтилстильбен, известный под названием стильбэстрола. Он значительно
(в 3—5 раз) активнее эстрона и его можно вводить в организм без потери
активности через рот. Эстрогены приходится вводить парентерально.
С2Н5 С2Н5
Стильбэстрол
Гормон желтого тела, прогестерон
В желтом теле образуется гормон, получивший название гормона бе-
ременности, или прогестерона. В опытах на кроликах было установлено,
что разрушение желтого тела через несколько дней после полового акта
приводит к тому, что беременность несмотря на наличие оплодотворенных
яйцеклеток не продолжается. В 1929 г. из желтого тела были приготовлены
экстракты, способные поддерживать течение беременности у крольчих при
удалении у них яичников. Гормон получен из экстрактов в кристалличе-
ском виде и установлена его химическая структура.
Прогестерон влияет на матку, подготавливая ее слизистую и мышеч-
ную оболочку к возможной беременности. Далее он тормозит во время бе-
ременности овуляцию и стимулирует развитие молочных желез.
204
СНз
I
с=о
Прогестерон
Прогестерон образуется также в плаценте и в корковой части надпочеч-
ников. Материалом для образования прогестерона является холестерин.
Прогестерон подвергается в печени превращениям, ведущим к его ина-
ктивированию. В печени продукт восстановления прогестерона — прегнан-
диол — связывается с глюкуроновой кислотой и в связанном виде выделя-
ется с мочой.
ГИПОФИЗ
Гипофиз, или придаток мозга,— важнейшая железа внутренней секре-
ции. В ней образуется ряд гормонов, среди которых большой интерес пред-
ставляют гормоны, влияющие на функцию (гормонообразование) иных
желез внутренней секреции. Вес гипофиза человека составляет 0,5—0,7 г.
Он состоит из передней и задней доли, отличающихся друг от друга эмбрио-
логически, гистологически и по своим функциям.
В передней доле гипофиза образуется не меньше шести различных по
своей функции гормонов. Каждый из них получен в чистом или в очищенном
виде. При введении одного из гормонов в организм животного с удаленным
гипофизом восстанавливается определенная функция гипофиза. В задней
доле гипофиза вырабатывается не меньше двух гормонов. Оба они получе-
ны в чистом виде.
Все гормоны гипофиза являются или белками, или белковоподобными
веществами (полипептидами). Операция удаления гипофиза— гипофизэк-
томия — вызывает ряд изменений в организме, но не приводит к смерти.
После операции у молодых животных прекращается рост. Особые измене-
ния наблюдаются у гипофизэктомированных животных (молодых и полово-
зрелых) в общем виде и в функции половых желез, надпочечников и щитовид-
ной железы. У половозрелых животных гипофизэктомия вызывает атрофию
половых желез с потерей вторичных половых признаков. У молодых особей
гипофизэктомия прекращает развитие половых признаков и приводит к
стерильности.
Большие изменения наблюдаются после гипофизэктомия в надпочеч-
никах. Они атрофируются, причем особенно сильно уменьшается размер их
корковой части. В организме наблюдаются почти все явления, возникающие
в результате удаления надпочечников (нарушение углеводного обмена,
адинамия мышц, изменения азотистого обмена и др.). Почти не нарушается
у гипофизэктомированных животных обмен натрия, калия и воды. Эта
функция корковой части надпочечников сохраняется при значительной их
атрофии.
Гипофизэктомия приводит к гипофункции щитовидной железы. В ней
уменьшается образование тироксина. Клинические наблюдения показыва-
ют, что расстройства функции гипофиза у человека отражаются на функции
половых желез, надпочечников и щитовидной железы.
205
Гормоны передней доли гипофиза
Известны следующие гормоны, образующиеся в передней доле гипофиза:
1) гормон роста, 2) адренокортикотропный гормон, 3) тиреотропный гормон,
4) лютеинизирующий гормон, стимулирующий образование прогестерона
в желтом теле яичников, 5) фолликулостимулирующий гормон, 6) пролак-
тин, стимулирующий секрецию молока.
Гормон роста
Давно уже было отмечено, что гипоизэфктомия вызывает у молодых
животных замедление и даже прекращение роста. С другой стороны, клини-
ческие исследования привели к заключению, что непомерный рост людей—
гигантизм и акромегалия — связаны с расстройством функции гипофиза.
В 1921 г. из гипофиза был получен экстракт, инъекции которого крысам и
собакам приводили к усилению их роста. Активное вещество экстрактов
гипофиза получило название гормона роста. Первые исследования свойств
гормона роста указали на его белковую природу. Оказалось, что гормон
влияет на организм только при парентеральном его введении. При введении
через рот этот гормон подвергается в пищеварительном тракте переварива-
нию с полной потерей активности.
В 1944 г. гормон роста был получен из экстракта гипофиза в очищенном
виде. В 1948 г. его выделили в кристаллическом виде и изучили его амино-
кислотный состав и свойства.
Молекула гормона роста содержит 396 остатков аминокислот. Кратко-
временное воздействие на него химотрипсина и трипсина (переваривание
гормона на 25—30%) не приводит к потере активности. Более интенсивное
переваривание приводит к инактивированию гормона.
Имеются данные, указывающие на то, что гормон роста различных ви-
дов животных, а также человека имеет свои особенности в химической
структуре, обладает специфичностью действия. Гормон роста, изолирован-
ный из гипофиза рыб, не действует на организм других животных. Гормоны
роста обезьян и человека близки по своей химической структуре и отли-
чаются от того же гормона крупного рогатого скота.
О степени активности гормона роста судят по интенсивности роста ги-
пофизэктомированных крыс или по увеличению ширины проксимального
конца большеберцовой кости. Последний тест особенно чувствителен. Еже-
дневная инъекция молодой гипофизэктомированной крысе 0,01 мг гормона
роста в течение десяти дней приводит к увеличению веса животного на 10 г.
При инъекции такого же количества гормона ежедневно в течение четырех
дней увеличивается на 50% ширина некальцифицированной части про-
ксимального эпифизального хряща по сравнению с контрольной (у гипо-
физэктомированного животного).
Инъекция гормона роста увеличивает рост не только молодых, но и
взрослых крыс. Гормон роста влияет на процессы образования хрящевой
и костной тканей, усиливает отложение кальция в костях.
Гормон роста влияет на процессы обмена веществ. Он усиливает синтез
белков в тканях, что обеспечивает увеличение объема тканей, их рост.
Инъекции гормона вызывают у животных гипергликемию и глюкозурию,
что, по-видимому, связано с действием его на а-клетки островковой ткани
поджелудочной железы, усиливающим выделение ими в кровь глюкагона.
После выделения гормона роста усиливается также процесс мобилизации
жиров из жировой ткани и доставки их в печень.
Увеличенное образование гормона роста вызывает у человека усилен-
ный рост костей рук, ног и черепа. Обычно это связано с развитием аденомы
гипофиза. У взрослых аденома гипофиза вызывает акромегалию (греч.
акгоп — конечность, megas — большой), характеризующуюся непропор-
206
циональным ростом, увеличением нижней челюсти, носа, надбровных дуг,
костей рук, ступней ног. У детей аденома гипофиза приводит к пропорцио-
нальному усиленному росту костей, к гигантизму.
Заболевания гипофиза, снижающие образование гормона роста, при-
водят к развитию карликового роста.
Адренокортикотропный гормон (кортикотропин)
Одним из важнейших гормонов передней доли гипофиза является ад-
ренокортикотропный гормон, сокращенно АКТГ, получивший широкое при-
менение в медицинской практике и в физиологическом эксперименте. Как
указывает название, АКТГ влияет на функции надпочечников и, как это
установлено, на их кору. Гипофизэктомия вызывает у животных резкое
уменьшение размера надпочечников за счет уменьшения их корковой части.
Инъекции АКТГ предохраняют гипофизэктомированных животных от
уменьшения корковой части надпочечников и связанных с этим рас-
стройств.
АКТГ выделен в чистом виде из гипофиза свиней и овец. По своей хими-
ческой природе он является белковым веществом с молекулярным весом —
20 000. При кратковременном воздействии на АКТГ пепсина, а также н-со-
ляной кислоты он расщепляется без потери активности с образованием по-
липептидов. Из смеси полипептидов был изолирован один из них, обладаю-
щий полной активностью АКТГ. Этот полипептид получил название кор-
тикотропин В.
Кортикотропин В построен из 39 аминокислот, размещенных в следу-
ющей последовательности:
Сер-Тир-Сер-Мет-Глу-Гис-Фен-Арг-Три-Гли-Лиз-Про-Вал-Гли-Л из-Лиз- Арг
Арг-Про-Вал-Лиз-Вал-Тир-Про-Асп-Гли-Ала-Глу- Асп - Глу-Лей - Ала - Глу-
Ала-Фен-Про-Лей-Глу-Фен.
Леконцевой аминокислотой является серин, а С-концевой — фенила-
ланин.
Установлено, что можно действием карбоксипептидазы и пепсина по-
степенно, начиная с С-конца, отщепить 15 аминокислот с получением по-
липептида, построенного из 24 аминокислотных остатков, полностью сох-
раняющего активность АКТГ. Подобный полипептид удалось синтезиро-
вать.
Активность кортикотропина В тесно связана с наличием в его молекуле
Л^-концевого серина. При его отщеплении активность исчезает.
АКТГ влияет на образование и выделение кортикостеронов — гормо-
нов корковой части надпочечников. Введение его в организм приводит к
увеличению содержания в крови кортикостероидов. Очевидно, АКТГ
усиливает синтез гормонов в корковой части надпочечников. Длительное
введение в организм АКТГ усиливает синтез кортизона в корковой части
надпочечников. АКТГ выделяется передней долей гипофиза при различ-
ных воздействиях, приводящих организм в состояние напряжения (травмы,
в том числе операционные, ионизирующие излучения, низкая и высокая
температура окружающей среды, асфиксия, отравления и др.).
Выделение АКТГ регулируется гипоталамусом, его задней частью и
особенно серединным возвышением. Обнаружить нервные волокна, идущие
от гипоталамуса к передней доле гипофиза, до сих пор не удалось. Считают,
что в гипоталамусе образуются какие-то вещества, поступающие в кровь
и стимулирующие функцию передней доли гипофиза. Химическая при-
рода этих веществ остается пока не известной.
Применяется АКТГ в тех случаях, когда желательно увеличить образо-
вание и выделение в кровь гормонов, образующихся в корковом слое над-
почечников, особенно кортизона.
207
Тиреотропный гормон (тиреотропин)
Гипофизэктомия вызывает у животных уменьшение размера щитовид-
ной железы с проявлением недостаточности ее функции — понижением
обмена веществ (стр. 185). Оставшаяся ткань щитовидной железы в меньшем
объеме поглощает из крови йод и в меньшем объеме включает его в состав
органических соединений. Введение экстрактов гипофиза приводит у гипо-
физэктомированных животных к увеличению размера щитовидной железы
и к восстановлению ее функций.
Тиреотропный гормон получен из экстрактов гипофиза рогатого скота
в очищенном, но не в химически чистом виде. Исследование химической
природы полученных препаратов выявило его белковую природу. При воз-
действии на них протеолитических ферментов эти препараты инактивиру-
ются.
Применение метода меченых атомов, введение в организм радиоактив-
ного йода и последующее изучение радиоактивности йодсодержащих соеди-
нений в щитовидной железе и в крови нормальных и гипофизэктомирован-
ных животных позволило разобраться в механизме действия тиреотроп-
ного гормона на функцию щитовидной железы. Как уже указывалось,
гипофизэктомия приводит к уменьшению размера щитовидной железы.
Изучение содержания тироксина в плазме крови показало, что количество его
уже через четыре дня после гипофизэктомия снижается на 50%. Отсюда
можно заключить, что в отсутствие тиреотропного гормона в щитовидной
железе образуется меньше тироксина и одновременно с этим снижается
количество тироксина, выделяемого в кровь. Далее оказалось, что посту-
пающий в щитовидную железу гипофизэктомированных животных йод бы-
стро превращается в ней в дийодтирозин, но образование тироксина про-
исходит в малом объеме. Отсюда можно заключить, что тиреотропный гор-
мон необходим для нормального поглощения щитовидной железой йода из
крови, превращения его в тироксин и для поступления тироксина из щито-
видной железы в кровь.
Гипофизэктомия приводит к явлениям, характерным для гипофунк-
ции щитовидной железы.
Гонадотропные гормоны (гонадотропины)
Гонадами называют органы, образующие половые продукты,— спер-
матозоиды и яйцеклетки: семенные железы и яичники. Гормоны передней
доли гипофиза, воздействующие на развитие и функцию семенных желез
и яичников, получили название гонадотропных гормонов.
Давно уже известно, что гипофизэктомия оказывает тормозящее дей-
ствие на сексуальные (половые) функции животных. Точно так же клини-
ческие наблюдения показали, что при некоторых заболеваниях гипофиза
(при акромегалии, карликовом росте) имеет место атрофия половых желез.
В 1922 г. было установлено, что при введении экстрактов из гипофиза кры-
сам у самок увеличивается размер яичников с образованием желтых тел.
Позднее оказалось, что у гипофизэктомированных самок при введении в ор-
ганизм экстрактов из гипофиза восстанавливается угасшая функция яич-
ников.
В экстрактах гипофиза были обнаружены два гонадотропных гормона.
Один из них стимулирует рост фолликулов яичника у женских особей и
сперматогенез в семенных железах мужских особей. Второй гормон стиму-
лирует созревание фолликул, их разрыв с последующим образованием
желтых тел. У самцов он стимулирует развитие интерстициальных клеток
семенных желез. Первый гормон получил название фолликулостимулирую-
щего гормона, или сокращенно ФСГ, второй — лютеинизирующего гор-
мона.
Фолликулостимулирующий гормон (ФСГ). Фолликулостимулирующий
гормон получен в весьма очищенном виде из гипофизов овец. При введении
208
в организм гипофизэктомированных крыс он вызывает у них развитие фол-
ликулов в яичниках, но не устраняет иные явления, наблюдающиеся в ре-
зультате гипофизэктомии. По своей химической природе ФСГ оказался
сложным белком — гликопротеидом с молекулярным весом 67 000. При
переваривании трипсином он расщепляется с потерей активности. При воз-
действии пепсином при pH-4,0 ФСГ расщепляется, образуя полипептиды,
сохраняющие еще в значительной мере гормональную активность. Из ги-
пофизов свиней был получен фолликулостимулирующий гормон, также
оказавшийся белковым веществом, но несколько отличавшийся своими
физическими свойствами от того же гормона, выделенного из гипофиза
овец.
Введение самкам в период размножения фолликулостимулирующего
гормона вызывает развитие у них в яичниках большого числа фолликулов,
что приводит к многоплодию. На этом принципе М. М. Завадовский разра-
ботал метод стимуляции многоплодия у некоторых сельскохозяйственных
животных.
Фолликулостимулирующий гормон получил применение в практике
искусственного рыборазведения как средство, стимулирующее икромета-
ние.
Гонадотропный гормон в значительных количествах выделяется из
организма с мочой при беременности. Повышается также при беременности
содержание его в крови. Моча и сыворотка крови жеребых кобыл являются
источником для получения фолликулостимулирующего гормона. Препараты
его известны также под названием пролана А.
Лютеинизирующий гормон. Активность лютеинизирующего гормона
можно наблюдать при введении его гипофизэктомированным и неполово-
зрелым животным одновременно с фолликулостимулирующим гормоном.
Это становится понятным, если учесть, что он влияет на финальную фазу
развития фолликула.
Лютеинизирующий гормон выделен в чистом виде; он по своей химиче-
ской природе является белковым веществом. Интересно при этом отметить,
что лютеинизирующие гормоны, выделенные из гипофизов овец и из гипо-
физов свиней, оказались неодинаковыми по своим молекулярным весам и
по содержанию в них аминокислот. Молекулярный вес гормона из гипофи-
зов овец равен 40 000, в то время как молекулярный вес гормона из гипо-
физов свиней — 100 000. Содержание триптофана в первом составляет 1%,
во втором — 3,8%. Оба гормона оказались гликопротеидами, отличающи-
мися друг от друга также серологически.
Препараты лютеинизирующего гормона известны под названием про-
лана В.
Гонадотропный гормон образуется также во время беременности в
плаценте. Его называют гонадотропным гормоном хориона, в отличие от
того же гормона передней доли гипофиза. По своей химической природе —
это белковое вещество, несколько отличающееся по аминокислотному со-
ставу от гонадотропного и лютеинизирующего гормонов гипофиза. Гона-
дотропный гормон плаценты выделяется с мочой на ранней стадии бере-
менности.
Лактогенный гормон (пролактин)
В экстрактах из гипофиза был обнаружен гормон, стимулирующий лак-
тацию у млекопитающих животных. Этот гормон, получивший название
лактогенный гормон, а позже — пролактин, усиливает также функцию
желтого тела яичников.
Интересно отметить, что пролактин стимулирует образование «молоч-
ка» в зобе голубей.
Пролактин получен в кристаллическом виде в 1937 г.— это белковое
вещество с молекулярным весом 25 000.
209
Меланофорстимулирующий гормон (МСГ)
В средней доле гипофиза, явно выраженной морфологически у многих
животных, образуется гормон, получивший название меланофорстимули-
рующий (МСГ). Этот гормон образуется и в гипофизе человека, где средняя
доля гипофиза морфологически отсутствует.
МСГ изолирован из гипофиза различных видов животных. Он являет-
ся белковоподобным веществом. Последовательность размещения амино-
кислот в молекуле МСГ различных животных более или менее одина-
кова.
МСГ свиньи обладает в 10 раз большей активностью, чем МСГ круп-
ного рогатого скота. Это связано с тем, что МСГ свиньи — серин, имеющий-
ся в МСГ крупного рогатого скота, замещен глутаминовой кислотой. Из
средней доли гипофиза свиньи выделены два меланофорстимулирующие
гормона — а-МСГ и {3-МСГ, отличающиеся составом и количеством амино-
кислот, из которых построены их молекулы.
Интересно отметить, что действием МСГ обладает АКТГ. В молекуле
АКТГ и в молекуле МСГ последовательность размещения первых 13 ами-
нокислот оказывается одинаковой.
МСГ действует на размещение пигмента в меланофорах. Он влияет
на равномерное распределение пигмента в меланинсодержащих клетках
кожи. Удаление гипофиза вызывает у лягушки посветление кожи, бла-
годаря концентрированию пигмента в центре меланофоров.
ГОРМОНЫ ЗАДНЕЙ ДОЛИ ГИПОФИЗА
В задней доле гипофиза образуются гормоны: вазопрессин и окситоцин.
Вазопрессин
В 1894 г. было установлено, что при инъекции собакам экстрактов из
гипофиза у них повышается кровяное давление. Вещество, обладающее
подобным действием, образуется в задней доле гипофиза. Оно было названо
вазопрессином. Вазопрессин вызывает более стойкое повышение кровяного
давления, чем адреналин, и одновременно с этим он резко уменьшает диу-
рез (мочеотделение).
Вазопрессин выделен в чистом виде из задней доли гипофиза. Дю-
Виньо детально изучил его химическую природу. Вазопрессин оказался
полипептидом, состоящим из восьми аминокислот, с молекулярным весом
1025. Установлена последовательность расположения аминокислот в вазо-
прессине и этим выяснена его структура (см. стр. 211).
Вазопрессин, полученный из задней доли гипофиза коров, и вазопрес-
син из задней доли гипофиза свиней отличаются друг от друга тем, что в
составе первого имеется аргинин, в составе же второго аргинин заме-
нен лизином — оба они обладают одинаковой гормональной актив-
ностью.
Действие вазопрессина обусловлено тем, что он суживает сосуды арте-
риол и капилляров. Вазопрессин при инъекциях в очень малых дозах ока-
зывает антидиуретическое действие. Максимальное действие отмечено при
введении человеку 0,0001 мг вазопрессина. Выделяющаяся при этом из
организма моча оказывается концентрированной. В ней увеличена концен-
трация хлоридов, фосфатов и азотистых веществ (мочевины, креатинина
и др.).
При нарушении процесса образования вазопрессина в задней доле гипо-
физа и выделения его в кровь у человека возникает заболевание — неса-
харный диабет, характеризующийся выделением из организма больших
210
количеств мочи (4—5 и больше литров за сутки). Известны случаи тяжелого
несахарного диабета, когда из организма больного выделялось до 20 л
мочи за сутки. Больные очень много пьют, их мучает жажда. Моча их на-
столько разведена водой, что она оказывается почти неокрашенной. Удель-
ный вес такой мочи низкий (1,002—1,005), что также указывает на сильное
ее разведение водой. Химический анализ мочи не выявляет наличия в ней
каких-либо патологических составных частей. Отсюда следует, что моча
больных несахарным диабетом отличается от мочи здоровых людей только
содержанием воды.
Возникновение несахарного диабета связано обычно с патологическими
процессами в гипоталамусе, следовательно, гормональная функция задней
доли гипофиза регулируется центральной нервной системой. В пользу это-
го говорит также хорошо известный факт, что нервные переживания (на-
пряжение нервной системы) часто сопровождаются увеличенным выделени-
ем мочи (частыми мочеиспусканиями).
Окситоцин
Окситоцин повышает тонус гладких мышц, особенно матки. Чистые пре-
параты окситоцина вызывают сокращение изолированной матки в разведе-
нии 1:2 - ЮS * * * 9. Окситоцин получил применение в акушерской практике. Его
с успехом применяют при затянувшихся родах, когда необходимо усилить
сокращение матки.
Окситоцин выделен из задней доли гипофиза в чистом виде и по своей
химической природе является полипептидом. Дю-Виньо выяснил амино-
кислотный состав и химическую структуру окситоцина. Молекула
окситоцина построена из восьми аминокислот и является октапеп-
тидом.
Дю-Виньо получил окситоцин путем синтеза и тем самым окончательно
подтвердил его структуру.
Аминокислотные остатки в молекуле окситоцина расположены в сле-
дующей последовательности: Л-цистин, L-тирозин, Л-изолейцин, L-глута-
мин, L-аспарагин, L-пролин, L-лейцин и амид глицина. Он является цисте-
ил-тирозил-изолейцил-глутамил-аспарагил- цистеинил- пролил- лейцил- гли-
цин-амидом.
Цистин
Тирозин
Изолейцин
NIL, СН,—С6Н4ОН С4Н,
СН,—СН—СО——NH—СН СО------NH—СН
I ' I
S со
S СН,—CONH,
I I
СН2—СН—NH—СО—СН—NH------СО
Аспарагин
I
NH
I
с н—сн2—сн2—со nh2
Глутамин
I
N—СН—СО—NH—СН—СО—NH—СН2—CONH2
4Нэ
2V> ^119
Пролин
Лейцин
Глицинамид
Окситоцин
211
Интересно сравнить аминокислотный состав окситоцина и вазопрес-
сина.
Аминокислоты (в октапептидах)
Тирозин ......................
Пролин .......................
Глутаминовая кислота .........
Аспарагиновая кислота ........
Глицин .......................
Цистин........................
Лейцин........................
Изолейцин ....................
Финилаланин ..................
Аргинин.......................
Окситоцин Вазопрессин
1 1
1 1
1 1
1 1
1 1
1 1
1 О
1 О
О 1
О 1
Из приведенных данных очевидно, что в окситоцине отсутствуют фе-
нилаланин и аргинин, имеющиеся в вазопрессине. С другой стороны, в
вазопрессине нет лейцина и изолейцина, содержащихся в окситоцине.
Экстракты из задней доли гипофиза, обладающие прессорным и антиди-
уретическим действием и вызывающие сокращение матки, носят название
питуитрина.
ГОРМОНЫ БЕСПОЗВОНОЧНЫХ животных
Вещества, регулирующие процессы обмена веществ, обнаружены и у
низших животных.
У беспозвоночных животных отсутствует система желез с внутренней
секрецией. У насекомых обнаружены некоторые железистые образования,
в которых образуются гормоны, регулирующие метаморфоз и рост насеко-
мых, линьку, обмен веществ. У кольчатых червей существует зачаток адре-
наловой системы, у асцидий имеются аналоги щитовидной железы и гипо-
физа. В этих железистых образованиях вырабатываются гормоны, поступа-
ющие в кровь.
Система желез внутренней секреции с определенными физиологиче-
скими функциями достигает полного развития у высших животных (позво-
ночных) и у человека.
ТКАНЕВЫЕ ГОРМОНЫ (ГОРМОНОПОДОБНЫЕ ВЕЩЕСТВА)
Наряду с физиологически активными веществами, образующимися в
железах внутренней секреции (гормоны), в различных тканях возникают
вещества, действующие подобно гормонам. К ним относятся соединения,
образующиеся в пищеварительных органах и в почках, а также продукты
превращения некоторых аминокислот.
Гормоноподобные вещества органов пищеварения
В слизистой оболочке двенадцатиперстной кишки образуется вещество,
влияющее на секреторную функцию поджелудочной железы. Оно получило
название «секретин». По своей химической природе секретин является по-
липептидом. Выделение секретина в кровь стимулируется соляной кисло-
той, попадающей в двенадцатиперстную кишку с желудочным соком. Сек-
ретин не влияет на интенсивность образования ферментов в поджелудочной
железе, а только вызывает увеличение объема сокоотделения железой.
В слизистой оболочке тонких кишок образуются также и другие ве-
щества, поступающие в кровь и влияющие на функцию органов, например
панкреозимин, который усиливает образование (и выделение) пищевари-
тельных ферментов в поджелудочной железе.
В слизистой оболочке пилорической части желудка образуется гаст-
рин, усиливающий секрецию соляной кислоты. Другое вещество — энтеро-
212
гастрон образуется в слизистой оболочке тонких кишок и в противополож-
ность гастрину тормозит секрецию соляной кислоты железами слизистой
оболочки желудка.
В слизистой оболочке тонких кишок также образуется и выделяется в
кровь холецистокинон, усиливающий выделение желчи.
Приведенные выше гормоноподобные вещества еще мало изучены.
Гормоноподобное вещество почек (ренин)
Гормоноподобное вещество, имеющееся в почках и получившее назва-
ние ренин, действует подобно ферменту. Под влиянием ренина отщепляется
от р2‘гл°булина сыворотки крови полипептид — ангиотензин, повышаю-
щий кровяное давление.
Ангиотензин расщепляется под влиянием протеолитических ферментов
и тем самым инактивируется.
Гормоноподобные вещества, возникающие из аминокислот
Гистамин образуется из гистидина в результате его декарбоксилиро-
вания с помощью специфической декарбоксилазы:
N—С • CHoCHCOOH N—С • CI L>—СН,
I! II I — СО2 || ||
нс сн nh2------------> нс сн nh2
^NH 'nH
Гистидин Гистамин
С помощью гистамина передаются нервные импульсы к стенкам кровеносных
сосудов. Это вызывает расширение их просветов и падение кровяного дав-
ления.
Гистамин в тканях и в крови находится в очень малых количествах и
преимущественно в связанном с белком состоянии. Активность его прояв-
ляется в свободном состоянии. При воспалительных процессах и при трав-
мах имеет место появление свободного гистамина и его действие на те или
иные функции организма.
Наряду с образованием в тканях гистамина имеют место процессы, вы-
зывающие его инактивацию. Гистамин подвергается дезаминированию с
образованием имидазолацетилальдегида, который подвергается дальней-
шему распаду. Гистамин в организме метилируется и ацетилируется с об-
разованием соответственно метил- и ацетил гистидина. Эти вещества не об-
ладают физиологической активностью.
5-0кситриптамин (серотонин) — продукт окисления и декарбоксили-
рования триптофана — был изолирован из сыворотки крови быка. Серо-
тонин находится в тромбоцитах и поступает в сыворотку крови при ее свер-
тывании. Давно уже было известно, что сыворотка крови обладает сосудо-
суживающим действием. В результате исследований этого явления было
изолировано вещество серотонин и установлена его химическая структура:
СН NH
С—СН2—СН—СООН
I
nh2
СН
Триптофан
5-Окситриптамин (серотонин)
Серотонин является физиологически активным веществом. При введении его
в кровь он вызывает мгновенное повышение артериального давления, ко-
213
торое затем снижается до нормального уровня. Действует он на гладкую
мускулатуру (кровеносных сосудов, бронхов, матку). Особенное значение
имеет действие серотонина на функцию нервной системы. В малых дозах он
угнетает функцию центральной нервной системы; в больших дозах, наобо-
рот, стимулирует ее функцию и вызывает галлюцинации.
Серотонин, возникающий в малых количествах из триптофана, содер-
жится в различных клетках, в том числе и в нервных, главным образом в
связанном с белками состоянии. Серотонин же оказывает свое действие в
свободном состоянии. Под влиянием фермента моноаминооксидазы серото-
нин дезаминируется с образованием 5-оксииндолуксусного альдегида, не
обладающего физиологической активностью серотонина.
у-Аминомасляная кислота является продуктом декарбоксилирования
глутаминовой кислоты:
у-Аминомасляная кислота угнетает возбудимость нервных клеток,
подавляя проведение нервных импульсов. Она непосредственно действует на
нейроны.
СООН CHoNH2
I I
chnh2 сн2
I _(2Q I
CHo сн.
I - I
сн2 соон
I
соон
Глутаминовая кислота 7-Аминомасляная кислота
у-Аминомасляная кислота подвергается дезаминированию и дальней-
шему окислению с образованием янтарной кислоты. При этом она теряет
свою физиологическую активность.
Характерной особенностью гормоноподобных веществ, образующихся
из а-аминокислот, является их чрезвычайно высокая активность. Они обна-
руживаются в клетках в ничтожно малых количествах и главным образом
в связанном с белками состоянии. Физиологическая активность их прояв-
ляется в свободном состоянии, при освобождении от связывающих их
белков.
ГОРМОНЫ РАСТЕНИЙ. ФИТОГОРМОНЫ
Гормонами растений, фитогормонами, называются вещества, актив-
ные в очень малых количествах за пределами тканей, в которых они об-
разуются. Фитогормоны обнаружены у ряда растений. Они стимулируют
рост отдельных частей растений (листьев, стебля, корня). Эти стимулирую-
щие рост растений гормоны носят название ауксинов. Известны и иные фи-
тогормоны, например гормоны раневые. Наиболее изучены ауксины. Из
семян злаков выделены два близких друг к другу фитогормона —ауксин
«а» и ауксин «б»:
8 f р а
НС---с—снон— сн2—снон—снон—соон
СН3—СН2—СН—СН СН—СН—СН2—СН
СН. СН2 СН3
3
Ауксин «а»
214
о 7 р а
НС----С—СНОН—СН»—СО—СН,—СООН
I I
сн3—сн2—сн—сн сн—сн—сн,—сн3
сн8 сн2 сн3
Ауксин «б»
Из культур грибов Rhizopus suinus выделен гормон роста, оказавший-
ся индолил-3-уксусной кислотой:
>-------CHjCOOH
Ч/\/
NH
Индолил-З-уксусная кислота
Ауксины выделены из мочи человека; они, по-видимому, попадают в
организм человека с растительной пищей и выделяются затем из него с
мочой.
На месте ранений у взрослых растений происходит деление клеток,
разрастание ткани, образование так называемой мозоли (каллуса). Этот про-
цесс стимулируется «раневым гормоном». Подобный фитогормон выделен из
сока стручков бобов, он оказался ненасыщенной С12-дикарбоновой кисло-
той (травматиновой кислотой):
НООССН - СН (СН 2)8СООН.
Гормон цветения остается еще пока гипотетическим. Получить из рас
тений экстракты, которые воздействовали бы на цветение, до сих пор не
удалось.
ЛИТЕРАТУРА
Берзин. Биохимия гормонов. М., 1964.
Камерон А. Т. Достижения современной эндокринологии. ИЛ, 1948.
УтевскийА. М. Биохимия адреналина. Изд. Украинского института экспе-
риментальной медицины. Харьков, 1939.
УтевскийА. М. Данные и перспективы изучения обмена адреналина в экс-
перименте и в клинике. «Успехи биологической химии», 1950, т. 1, стр. 423.
Холодный Н. Г. Фитогормоны. Избр. тр. 1956, т. 2. Изд. АН СССР..
Юдаев Н. А. Биохимия стероидных гормонов коры надпочечников. Медгиз,
1956.
Руководство по клинической эндокринологии под ред. Е. А. Васюковой. Мед-
гиз, 1958.,
Глава девятая
МИНЕРАЛЬНЫЕ ВЕЩЕСТВА
Наряду с органическими веществами — белками, углеводами, липи-
дами, ферментами, витаминами и гормонами — в клетках содержатся сое-
динения, составляющие обширную группу минеральных веществ. К ним от-
носятся: вода, различные катионы и анионы. Соли минеральных кислот на-
ходятся обычно в растворенном состоянии и диссоциируют с образованием
ионов. Соли минеральных кислот содержатся в организмах также и в не-
растворенном состоянии, например фосфорнокислый кальций в костной
ткани, углекислый кальций в створках раковин моллюсков и т.д. Часто не-
органические вещества входят в состав сложных органических веществ —
металлопротеидов, например железо — в состав гемоглобина; магний, мар-
ганец, медь и др.— в состав ряда ферментов.
Содержание воды в том или ином биологическом материале устанавливают пу-
тем высушивания в сушильном шкафу при Ю5°С. При более высокой температуре на-
ряду с водой удаляются и летучие органические вещества. Разница в весе до и после
высушивания указывает на количество воды в исследуемом материале.
Общее содержание минеральных веществ, за исключением воды, определяют пу-
тем сжигания исследуемого материала в тигле. В результате сжигания образуется
зола, в состав которой входят различные анионы и катионы. По количеству золы, об-
разовавшейся при сжигании, судят о содержании в исследуемом материале минераль-
ных веществ. Анализ золы дает представление о содержании в исследуемом материале
отдельных минеральных веществ, следовательно, различных элементов.
В начале XX в. считалось, что для нормального существования живых
организмов необходимо регулярное снабжение их так называемыми органо-
генами, к которым относили атомы углерода, водорода, кислорода, азота
и зольные элементы: фосфор, калий, кальций, магний, натрий, сера, железо
и йод. Остальные химические элементы, в тех случаях, когда они обнаружи-
вались в золе, считали случайными, засоряющими организм, бесполезными
для него и попадающими с водой или продуктами питания. Однако с тече-
нием времени в связи с разработкой и применением новых методов анализа,
позволяющих обнаружить и количественно определить ничтожно малые
количества элехментов, накоплялось все больше данных о наличии и важной
биологической роли различных минеральных веществ. Оказалось, что круг
биогенных элементов не ограничивается теми, которые встречаются в орга-
низмах в значительных количествах. Многие элементы, обнаруживаемые
в минимальных количествах, как было выяснено, играют существенную
роль, входя в состав таких важных для жизнедеятельности организмов ве-
ществ, как ферменты, гормоны и др. Вместе с этим было показано, что не-
достаток тех или иных минеральных веществ в пище вызывает глубокие рас-
стройства в жизнедеятельности животных, в развитии растений.
Почти все элементы, известные в химии, встречаются в живых организ-
мах. Однако количества их далеко не одинаковы. Элементы, встречающиеся
в малых количествах (от 10~12 до 10~3%), относятся к числу ультрамикро-
элементов. Необходимо, однако, учесть, что отнесенный к числу микроэле-
216
ментов тот или инси элемент на основании количественного содержания его
в составе золы, полученной при сжигании всего организма, может оказаться
макроэлементом при анализе золы, полученной при сжигании какого-либо
определенного органа и тем более определенного изолированного из орга-
низма органического вещества. Так, например, йод в очень малых количе-
ствах содержится в зольном остатке всего животного, в больших количе-
ствах он обнаруживается в золе щитовидной железы и в значительном ко-
личестве в гормоне тироксине. Цинка в золе цельного организма ничтожно
мало, но в значительном количестве он обнаруживается в составе гормона
инсулина и фермента карбоангидразы и т.д. Эти данные свидетельствуют о
том, что те или иные элементы концентрируются в определенных органах и
в определенных веществах.
Изучение содержания и роли минеральных веществ в организме — важ-
ная задача биохимии.
ВОДА
Вода — важнейшая составная часть всех организмов. Она выступает
в роли растворителя различных веществ; в водной среде происходят раз-
личные химические реакции, с участием воды идут реакции гидролиза
сложных органических веществ, вода образуется как продукт реакций
окисления органических веществ. Большинство химических превращений,
лежащих в основе жизнедеятельности организма, в той или иной мере
связано с участием воды. Отсюда понятно, что жизнь без воды невозможна.
Организм взрослого человека на 65% состоит из воды. Еще больше воды
содержится в сочных частях растений и в микроорганизмах.
У позвоночных животных содержание воды в различных органах и тка-
нях неодинаково. Особенно много воды в наиболее активно функционирую-
щих органах.
Содержание воды в %
В организме взрослого человека .................. 65
в сером веществе мозга........................... 84
» белом » ».......... ................. 72
в печени................. ... .......... 75
в мышцах .... . ............ 75
» сердце . . . .............. . . 78
» почках .... 81
» жировой ткани . . .... 25
в костях..................................... ... 20—40
в крови (цельной)................................... 80
в плазме крови ...................................... 92
» эритроцитах ...................................... 65
в эмбрионах человека, 2-месячных .... 97
» » » 3 » 94
в в в 4 в 92
в в в 5 в . . 87
в организме новорожденных . . .............. 70—74
Животные, если их лишить воды, через короткий срок погибают. Хо-
рошо упитанная собака может выдержать голодание при условии снаб-
жения ее водой до 100 дней; но без воды она погибает через десять дней.
Состояние воды в тканях
Большой интерес представляет вопрос о состоянии воды в тканях.
Несмотря на то, что ткани животных и растений содержат много воды, она
не вытекает при рассечении органов. Отсюда можно заключить, что вода
как-то связана в тканях. Вода связывается гидратационно составными
217
частями клеток, главным образом белками, и в еще большей степени она
замкнута между фибриллярными молекулами и мембранами. Большинство
белков тканей способно связать при гидратации около 50 г воды на 100 г
белков.
Электрохимическое состояние ионов натрия, калия, хлора и иных ио-
нов показывает, что они в водных растворах существуют в форме гидратов,
например в виде [Na(H2O)J~ или [С1(Н2О)у]“. Этим путем также связы-
вается некоторое количество воды в тканях.
Гидратационная вода по своим свойствам несколько отличается от
обычной. Она не замерзает при понижении температуры до нуля градусов
и даже ниже. Она не действует как растворитель на обычно растворимые
в воде вещества. Известно, что семена и споры бактерий выносят низкие
температуры без повреждений. Это объясняется тем, что вода в них нахо-
дится в гидратационном состоянии и не образует кристаллов льда, способ-
ных механически повредить структуру клеток.
Гидратационная вода составляет только лишь небольшую часть общего
количества воды тканей организма, и это показывает следующий расчет.
В 100 г мышц содержится 20 г белковых веществ и 75 г воды. Такое коли-
чество белков способно связать 10 г воды. Следовательно, 65 г воды не свя-
заны белками. Эта часть воды заключена между молекулами волокнистой
структуры, микроскопическими волокнами и мембранами; она не может
вытечь при разрезе мышцы даже при ее тщательном измельчении. Эта часть
воды иммобильна. Иммобильная вода по своим свойствам отличается от
гидратационной воды: она замерзает при температуре несколько ниже 0°С
и может растворять соли и иные вещества.
Наряду с водой гидратационной и водей иммобильной различают еще
воду свободную. Жидкости организма: плазма крови, лимфа, спинномозго-
вая жидкость, пищеварительные соки, моча содержат свободную воду.
Свободная вода содержится и в межклеточных пространствах тканей (меж-
клеточная вода), но количество ее настолько невелико, что она не вытекает
при разрезе ткани: вода удерживается между клетками силами капилляр-
ности. Количество межклеточной воды значительно возрастает при пато-
логических условиях, особенно, при болезнях почек, когда почки оказы-
ваются неспособными удалять избыток воды из организма. В этих случаях
вода накапливается в подкожной клетчатке, в мышцах и в иных органах,
что вызывает явление, именуемое отеком. Накопление свободной воды (оте-
ки) имеет место также при глубоких нарушениях функции сердечно-сосу-
дистой системы. При отеках в организме человека накопляется много литров
свободной воды. Из отечной мышцы вода вытекает при погружении в нее
тонкой металлической трубки. Отечные органы теряют свою эластичность,
становятся мягкими, тестообразными. При надавливании пальцами на отеч-
ную кожу остается углубление, которое медленно расходится.
Суммируя, можно заключить, что вода, составляющая две трети веса
организма, находится в различных состояниях. Часть воды тесно связана
с составными частями тканей организма, главным образом с белками (гид-
ратационная вода). Она обусловливает набухание коллоидов при образо-
вании гелей. Отдача гидратационной воды коллоидами носит название си-
нерезиса.
В тканях происходят процессы гидратации и дегидратации, в резуль-
тате чего количество гидратационной воды в них остается без особых изме-
нений. Только с возрастом организма количество гидратационной воды в
тканях уменьшается, и в результате они сморщиваются.
Вода, заключенная между волокнистыми молекулами, волокнистыми
структурами, мембранами клеток, отличается по своим свойствам от гидра-
тационной воды и она легче вовлекается в общий круговорот воды.
Наконец, вода, как уже указывалось, находится и в свободном состоя-
нии. Это вода плазмы крови, лимфы и других жидкостей организма и меж-
клеточная вода. С помощью свободной воды к тканям и клеткам доставля-
218
ются питательные вещества, и из клеток и тканей оттекают конечные
продукты обмена веществ.
Вполне понятно, что различные состояния воды в организме теснейшим
образом связаны друг с другом. Изменения в содержании гидратационной
воды влияют на содержание иммобильной воды, точно так же иммобильная
вода находится во взаимосвязи со свободной водой.
Потребление и выделение воды
Выше указывалось, что животные (в равной мере это относится и к
растениям) не могут обходиться без постоянного потребления воды. Воз-
никает вопрос, какое количество воды потребляется организмом в течение
суток? Ответ на этот вопрос дают исследования как выделения воды, так
и ее потребления. Организм взрослого человека ежесуточно выделяет и
потребляет в среднем следующие количества воды:
Выделение воды, мл Потребление воды, мл
С мочой ....... 1500 Питьевая вода...................................... 900
С калом....................... 150 Вода в жидких блюдах (молоко, суп,
Испарение через кожу .... 600 кофе)................................ 650
Вода (пары), выдыхаемая с Вода в пищевых продуктах (твердых) 700
воздухом ................... 350 Эндогенная вода (вода, образующая-
ся при окислении органических
веществ в клетках организма) . . 350
Всего ... 2600 2600
Вода выделяется из организма главным образом почками, с мочой, в
небольшом количестве ее выделяют стенки кишечника, затем потовые же-
лезы (через кожу) и легкие с выдыхаемым воздухом. Количество
воды, выделяемой почками, не постоянно. При сильном потении
с потом выделяется пять и больше литров воды. В этом случае количество
воды, выделяемой почками, уменьшается, моча сгущается. Уменьшается вы-
деление мочи при ограничении питья. Однако сгущение мочи возможно до
определенного предела, и при дальнейшем ограничении питья задержива-
ется выведение конечных продуктов азотистого обмена и минеральных ве-
ществ, что отрицательно отражается на жизнедеятельности организма. При
обильном поступлении воды в организм выделение мочи увеличивается.
Из организма выделяется всегда несколько больше воды (примерно на
350 мл), чем в него поступает, объясняется это образованием воды за счет
окисления органических веществ (эндогенная вода).
Потеря воды организмом компенсируется ее поступлением. Поступает
вода в организм с питьевой водой (вода, чай, кофе, молоко и т. д.); с жид-
кими блюдами (супы и др.) и твердой пищей (хлеб, овощи, мясо, фрукты),
всегда содержащей известное количество воды.
Человек и плотоядные животные не могут обходиться тем количеством
воды, которая имеется в твердой пище, и они страдают при отсутствии пи-
тьевой воды. Травоядные животные, питающиеся сочными кормами, могут
обходиться без питьевой воды. Нуждаются в питьевой воде сельскохозяй-
ственные животные, например коровы, выделяющие большое количество
воды с секретом молочной железы — молоком,— лошади, теряющие боль-
шое количество воды с потом. Животные, обитатели морей и океанов, имеют
в своем распоряжении только соленую воду. У них кишечник обладает спо-
собностью задерживать соли морской воды и отдавать в кровь пресную воду.
Мелкие грызуны (мыши, крысы), питающиеся сухими продуктами, мо-
гут обходиться без питьевой воды. Для них большое значение приобретает
эндогенная вода, образующаяся при окислении органических веществ пи-
219
щи1. Роль эндогенной воды в организме еще окончательно не выяснена.
Предполагают, что она, возникая внутри клеток, имеет несколько иное зна-
чение, чем вода, поступающая в организм извне (экзогенная вода).
Суточная потребность организма человека в воде составляет около 40 г
воды на один килограмм веса. У детей грудного возраста потребность в воде
на 1 кг веса в три-четыре раза выше, чем у взрослых.
Вода у живых существ не только выполняет транспортную функцию в
смысле доставки к тканям и клеткам питательных веществ и к выделитель-
ным органам конечных продуктов обмена веществ. Вода, кроме того, в
известной мере используется в процессах обмена, в результате чего она появ-
ляется в органических веществах — составных частях организма. Вклю-
чение воды в органические вещества в большом масштабе имеет место у зе-
леных растений, у которых при использовании солнечной энергии из воды,
углекислого газа и минеральных азотистых веществ синтезируются углево-
ды, белки, липиды и иные органические вещества. Для выяснения степени
участия воды в синтезе органических веществ у человека и у животных не-
достаточно изучения водного баланса, т.е. соотношения количества воды, по-
поступающей в организм, и количества воды, из него выделяющейся. Для
этого необходимы иные подходы. Одним из таких подходов является вве-
дение в организм наряду с обычной водой небольшого количества тяжелой
воды D2O (D — дейтерий, тяжелый водород). Введенная тяжелая вода
быстро перемешивается со свободной межклеточной водой и водой жидко-
стей организма. Одновременно с этим значительная часть дейтерия тяжелой
воды появляется в составе сложных органических веществ, например в вы-
сокомолекулярных жирных кислотах и иных веществах.
Регуляция водного обмена
Поступающая в организм вода всасывается в кровь через стенку тон-
ких кишок. Чем больше поступает воды, тем больше ее всасывается в кровь
и тем больше воды выделяется почками с мочой или через кожу при поте-
нии. Удаление избыточного количества воды требует усиленной работы
сердца, и поэтому в жаркое время и при походах рекомендуют строго при-
держиваться питьевого режима.
Поступление воды в организм регулируется чувством жажды. Уже при
первых признаках сгущения крови в результате рефлекторного возбужде-
ния определенных участков коры головного мозга возникает жажда —
стремление к питью. При потреблении даже большого количества воды, на-
пример одновременно 1,5 л, кровь не обогащается водой, не разжижается.
Объясняется это тем, что вода из крови быстро поступает в межклеточные
пространства и увеличивается количество межклеточной воды. Всосав-
шаяся в кровь и отчасти в лимфу из кишечника вода в значительной части
поступает в кожу и на некоторое время там задерживается. С этой точки
зрения, кожу следует рассматривать как временное депо воды в организме.
В печени также удерживается некоторое количество поступившей в орга-
НИЗлМ воды.
На поступление воды и выделение ее известным образом влияют соли,
вернее катионы. Общеизвестно, что усиленное поступление в организм с пи-
щей хлористого натрия вызывает жажду. Соли натрия способствуют задер-
жке воды в тканях, наоборот соли калия и кальция стимулируют отдачу
воды.
Как уже указывалось, вода удаляется из организма главным образом
почками. Мочеотделительная функция почек регулируется нервной систе-
мой, а также гормонами. Важнейшим гормоном, участвующим в регуляции
1 Различные органические вещества при своем окислении образуют различное
количество воды. Чем богаче молекула органического вещества водородом, тем больше
образуется при окислении воды. При окислении 100 г жира образуется 107 мл воды,
100 г углеводов — 55 мл воды и 100 а белков — 41 мл воды.
220
мочеотделительной функции, является вазопрессин (он же и антидиурети-
ческий гормон), образующийся в задней доле гипофиза. Вазопрессин повы-
шает обратное всасывание воды в почечных канальцах и тем самым умень-
шает диурез (выделение мочи). Недостаточное образование вазопрессина
приводит к увеличению диуреза, к заболеванию несахарным диабетом
(стр. 210).
БУФЕРА ТКАНЕЙ И ОРГАНОВ И РЕГУЛЯЦИЯ pH
В многократно перегнанной в кварцевой посуде воде почти все ее молекулы на-
ходятся в недиссоциированном виде. Только весьма малая часть их диссоциирована на
ионы водорода [Н+] и гидроксильные ионы [ОН-].
Диссоциация слабых электролитов подчиняется следующему уравнению:
[А-]х[В+] тг
[АВ] -
где [А-] —молярная концентрация анионов, [В4] —молярная концентрация ка-
тионов, [АВ] —молярная концентрация недиссоциированных молекул и К —кон-
станта диссоциации. Это уравнение в применении к диссоциации воды принимает та-
кой вид:
[Н+]Х[ОН-] _
[Н2О] -к-
Так как число диссоциированных молекул воды ничтожно мало по сравнению
с числом недиссоциированных молекул, концентрация недиссоциированных молекул
(Н2О) практически не изменяется. Заменяя КХ[НгО] константой Kw, получают урав-
нение [ Н4 ] X[OH"]=/CW. При округлении/Сцу оказывается равным 10"14. Так как ко-
личество Н+ и ОН“ одинаково, то из этого следует, что в одном литре чистой воды со-
держится 10“7 грамм-эквивалентов Н+ и 17-10"7 грамм-эквивалентов ОН". Из фор-
мулы [Н4] Х[ОН"] = Ю"14 следует, что уменьшение [ Н+] влечет за собой увеличение
[ОН"] и наоборот. Отрицательный логарифм этих величин получил название водо-
родного показателя (pH). Следовательно, [ Н+] X [ОН-] — 10"14может быть представ-
лено так — (lg[H+]-Mg[OH-])=14. При нейтральной реакции рН=7.
Измерение pH в крови и в тканях показало, что он изменяется в очень
незначительных пределах и что реакция крови и тканей слабощелочная
(pH равно 7,3—7,4). Между тем, изучение процессов обмена веществ позво-
ляет сделать вывод, что в организме беспрестанно возникают кислоты. При
распаде углеводов образуется ряд промежуточных продуктов — кислот
(фосфоглицериновые кислоты, фосфопировиноградная и молочная кислоты
ди- и трикарбоновые кислоты). Распад жиров начинается с процесса их гид-
ролиза, который завершается появлением наряду с глицерином жирных
кислот. К промежуточным продуктам распада глицерина относятся те же
кислоты, которые возникают и при распаде углеводов. Обмен жирных кис-
лот приводит к образованию уксусной, ацетоуксусной и оксимасляной кис-
лот. Распад аминокислот сопровождается возникновением а-кетокислот и
аммиака. Из всех перечисленных промежуточных веществ щелочными свой-
ствами обладает только один аммиак. Да и в отношении аммиака следует
указать, что известная часть его не освобождается из аминокислот в свобод-
ном состоянии, а переносится на другие вещества (на а-кетокислоты) амино-
феразами с образованием в конечном счете нейтрального вещества — моче-
вины. Все это говорит о том, что в организме образуется больше кислых
продуктов обмена веществ, чем щелочных. Если даже учесть, что проме-
жуточные продукты обмена веществ не накапливаются в тканях, а подвер-
гаются дальнейшим превращениям, то все же факт преобладания кислот
в организме остается бесспорным. Чем же объяснить, что реакция среды
в тканях и жидкостях организма сохраняется без явных изменений? Объ-
яснение следует искать в регуляторных механизмах, удерживающих слабо
щелочную реакцию в крови и в тканях. Эти механизмы основаны на дейст-
вии буферных систем и на функции выделительных систем.
В тканях и в жидкостях содержатся слабые кислоты и их соли, обра-
зующие буферные системы. Буферами принято называть вещества, способ-
22/
ные обратимо связывать ионы водорода и тем самым устранять их из раст-
вора с высокой кислотностью и освобождать их в растворе с низкой кислот-
ностью. В организмах имеются следующие три главные буфера: 1) фосфат-
ный, 2) бикарбонатный и 3) белковый.
Фосфатный буфер состоит из вторичного фосфата (Na2HPO4), диссоци-
ирующего с образованием двух ионов натрия (Na+) и иона вторичного фос-
фата (НРО2"4). Вторичные ионы фосфата связывают ионы водорода и дают
первичные фосфатные ионы (Н2РО4“) : HPO2"-j-H+^H2PO4“.
Ион Н2РО4_ , подобно кислоте, диссоциирует на ион водорода и анион
НРО42-. Первичные фосфатные ионы можно рассматривать как слабую кис-
лоту, вторичные фосфатные ионы — как слабую щелочь.
Концентрация фосфатных ионов в тканях, и особенно в крови, незна-
чительна и поэтому буферная емкость их невелика. Следует, однако, учесть,
что с мочой выделяется довольно значительное количество фосфатов (пер-
вичных и вторичных) и они составляют главный буфер мочи; pH мочи варь-
ирует в больших пределах и в норме колеблется между 5 и 7. При образо-
вании избыточного количества кислот в организме с мочой выделяются пре-
имущественно первичные фосфаты. Наоборот, при избытке щелочи с мочой
выводятся вторичные и даже третичные фосфаты.
Выделение кислых и щелочных фосфатов зависит от состава пищи. В
корме травоядных животных количество катионов преобладает над коли-
чеством анионов1. Моча этих животных всегда щелочная, моча плотоядных
животных и моча человека обычно кислая.
При «кислой» пище с мочой выделяются аммиачные соли. Следователь-
но, аммиак в организме используется в некоторой части для нейтрализации
кислот. При «щелочной» пище аммиачные соли с мочой практически не вы-
деляются.
Бикарбонатный буфер имеет важное значение в жидкостях организма
и в первую очередь в крови. Карбонатный ион связывается с ионом водорода
согласно уравнению
НСО3- + Н+ СО2 4- Н2О(Н2СО3).
Свободная угольная кислота (Н2СО3) очень неустойчива и распадается
на воду и углекислый газ. Бикарбонатные ионы действуют, как буфер, уст-
раняя ионы водорода органических кислот, например молочной.
Na+ + НСОГ + СН3СНОНСОО- + 11+ -> Na+ + СН3СНОНСОО- + Н2О + СО3.
Бикарбонат Молочная кислота
В крови основная часть углекислого газа находится в виде бикарбо-
натных ионов и только незначительное количество СО2 содержится в раст-
воренном состоянии. Отношение [НСО"3]:[СО2]—20. Бикарбонатный
буфер предохраняет организм человека и животных от сдвига реакции в кис-
лую сторону образующимися в тканях органическими кислотами. В резуль-
тате связывания водородных ионов из бикарбонатных ионов получается
СО2 и Н2О. Однако СО2 не накопляется в плазме крови. Едва уловимое
изменение в концентрации водородных ионов, вызываемое образованием
угольной кислоты из бикарбонатных ионов, действует на дыхательный
центр в головном мозгу, следствием чего является усиление дыхания и
выделение избытка углекислого газа из организма.
Буферная емкость бикарбонатного буфера крови и иных жидкостей
организма велика, но все же она не безгранична. В тех случаях, когда много
бикарбоната превращается в углекислый газ, емкость буфера истощается
и концентрация водородных ионов может быть сдвинута в кислую сторону
1 В золе растительных продуктов (кроме мучных) катионов содержится больше’
чем анионов. Анионы органических кислот сгорают при образовании золы. В золе
продуктов животного происхождения анионов больше, чем катионов. Растительная
пища условно называется «щелочной», пища животного происхождения — «кислой»,
222
до pH 7,0 и даже ниже. Организмы человека и высших животных очень
чувствительны к изменению обычной для него концентрации водородных
ионов, и уже при pH 6,8 наступает смерть. Буферная емкость крови на
х/4—х/3 обеспечивается бикарбонатами.
Буферные свойства белков играют очень важную роль в поддержании
постоянства pH крови и тканей организма. Кровь и ткани, если исключить
воду, состоят преимущественно из белковых веществ. Белковые молекулы
имеют известное количество не связанных между собой карбоксильных
и аминных групп и являются поэтому амфотерными электролитами (стр.
42). Они способны связывать как водородные, так и гидроксильные ионы.
В кислых растворах белки связывают водородные ионы, в щелочных раст-
ворах — гидроксильные ионы.
Большое значение для сохранения постоянства pH крови и тканей име-
ют выделительные системы организма, функция которых регулируется
центральной нервной системой. Выше уже указывалось на значение уда-
ления углекислого газа при дыхании. Следовательно, выделительная
функция легких играет роль в удалении излишка углекислого газа из плаз-
мы крови, а отсюда — в сохранении емкости бикарбонатного буфера. Еще
более важная роль принадлежит выделительной функции почек. Почки вы-
деляют с мочой различные вещества. При избыточном образовании и накоп-
лении в организме органических кислот, последние выделяются частично
в свободном состоянии, но главным образом в виде аммонийных солей.
В виде аммонийной соли выделяется также с мочой серная кислота. Инте-
ресно при этом отметить, что в почках происходит нейтрализация кислот,
доставляемых к ним кровью, аммиаком, отщепляющимся от глутамина
(подробнее см. стр. 518).
В случае введения в организм щелочи (например, питьевой соды) из-
быток щелочи быстро выделяется из организма с мочой.
По анализу мочи можно получить представление о том, насколько ин-
тенсивно образуются в организме кислоты. На избыточное образование
кислот указывает pH мочи. Чем ниже этот показатель, тем больше образу-
ется кислот. Далее, чем больше щелочи требуется для нейтрализации мочи,
а отсюда, чем больше потенциальная кислотность мочи, благодаря избыточ-
ному выделению первичных фосфатов, тем больше выводится из организма
кислот.
Избыточное образование (и выделение из организма) кислот носит на-
звание ацидоза. Чаще всего встречается компенсированный ацидоз, при ко-
тором, благодаря буферным системам и функции выделительных систем,
pH крови и тканей остается без явных изменений, т.е. остается равным
7,3—7,4. При некомпенсированном ацидозе, наблюдаемом очень редко,
образование кислот происходит настолько интенсивно, что буферных систем
и почек с их выделительной функцией оказывается недостаточно для устра-
нения этих кислот, pH крови и тканей сдвигается в кислую сторону, и это
приводит к гибели организма.
Жизнедеятельность организма человека и теплокровных животных мо-
жет протекать только в узких рамках изменений концентрации водородных
ионов в пределах колебаний от 7,4 до 7,0.
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ
Минеральные вещества, растворенные в плазме крови, межклеточной
жидкости и в других жидкостях организма, создают определенное осмоти-
ческое давление. Осмотическое давление жидкости зависит от молярной
концентрации растворенных в ней веществ. Так, например, осмотическое
давление молярного раствора глюкозы и молярного раствора мочевины
одинаково. Соли повышают осмотическое давление в большей степени,
223
чем неэлектролиты (глюкоза, мочевина и др.) при той же молярной концент-
рации, так как соли диссоциируют с образованием ионов, и величина осмо-
тического давления зависит от суммарного количества недиссоциированных
молекул и ионов.
Осмотическое давление в жидкостях организмов — важный физиологи-
ческий фактор, влияющий на распределение в тканях воды и растворенных
веществ. У растений разность осмотического давления клеточного сока и
тургорного напряжения растянутой оболочки клетки, препятствующего
проникновению воды в клетку, определяет «сосущую» силу клетки и отсюда
интенсивность поступления в нее воды и питательных веществ. Величина
осмотического давления у различных растений неодинакова и зависит от
условий их существования: освещенности, температуры, почвы, влажности
воздуха, времени года и т.д. У пресноводных водорослей осмотическое дав-
ление клеточного сока эпидермиса колеблется в пределах от 1 до 3 атмос-
фер, у полевых растений оно составляет 5—10 атмосфер, у солончаковых и
пустынных растений оно во много раз выше и достигает 80 и даже 100 ат-
мосфер. Величина осмотического давления в тканях растений зависит от
содержания в клеточном соке моносахаридов, органических кислот и ми-
неральных веществ, главным образом хлористого натрия. Повышение осмо-
тического давления клеточного сока сверх определенного предела угнетает
ферментативные процессы в клетках растений. Сильное понижение осмоти-
ческого давления уменьшает «сосущую» силу клеток, уменьшает приток к
ним питательных веществ. Для различных видов растений существуют оп-
ределенные физиологически допустимые пределы изменений осмотического
давления (у картофеля, например, от 5 до 8 атмосфер).
Более чувствительны к изменениям осмотического давления животные.
Осмотическое давление крови, лимфы и межклеточной жидкости позвоноч-
ных животных зависит от растворенных в них минеральных веществ, глав-
ным образом хлористого натрия. У животных в процессе их эволюцион-
ного развития выработались приспособления, обеспечивающие постоянство
осмотического давления плазмы крови, лимфы, внеклеточной жидкости (так
называемой внутренней среды организма). У низших беспозвоночных —
обитателей морей осмотическое давление жидкостей зависит от осмотичес-
кого давления окружающей их морской воды. При разведении морской воды
пресной осмотическое давление жидкостей этих животных понижается. У
высших же животных осмотическое давление постоянно и его очень трудно
сдвинуть в ту или иную сторону. У различных млекопитающих оно состав-
ляет 7,5—9,0 атмосфер. Осмотическое давление плазмы крови человека
колеблется в пределах 7,7—8,1 атмосфер. Понижение точки замерзания
плазмы крови (А°) составляет 0,56°.
Осмотическое давление крови и лимфы зависит не только от растворен-
ных в них низкомолекулярных веществ (главным образом, хлористого нат-
рия), но и от осмотического давления белков, или онкотического давления.
Осмотическое давление веществ, находящихся в коллоидальном состоянии
(следовательно, и белков), очень незначительно, поэтому несмотря на то,
что плазма крови является белковой жидкостью (содержание белков* в ней
достигает 8%), онкотическое давление составляет очень малую часть (0,5%)
общего осмотического давления плазмы.
Постоянство осмотического давления внутренней среды (жидкостей),
омывающей клетки и ткани, обеспечивается в организме регуляторной сис-
темой. Особенно большая роль в этом отношении принадлежит функции
выделительных органов, главным образом почкам и отчасти потовым же-
лезам.
Осмотическое давление мочи человека и животных непостоянно и ко-
леблется в значительных пределах. У человека, например, понижение тем-
пературы замерзания мочи (А°) колеблется в пределах от 0,9 до 2,7°С и за-
висит от концентрации солей, главным образом хлористого натрия. При
нормальной функции почек А° мочи всегда выше А° крови, которое, как
224
уже указывалось, в крови остается постоянным. Следовательно, с мочой из
организма удаляется избыток солей (хлористого натрия). Только лишь при
тяжелом нарушении функции почек осмотическое давление мочи снижается.
Осмотическое давление пота также непостоянно, но всегда ниже осмо-
тического давления крови. Следовательно, с потом удаляется много воды и
мало минеральных веществ (NaCI).
Устранение избыточного количества солей почками происходит на-
столько интенсивно, что в опытах с введением в кровь животных даже зна-
чительных количеств солей, осмотическое давление плазмы изменяется мало
и уже через короткий срок возвращается к норме. Введение в кровь мине-
ральной соли приводит к поступлению в кровь межклеточной воды, что сни-
жает в ней концентрацию соли. Затем избыток воды и соли удаляется поч-
ками. Снижение содержания в тканях воды, рефлекторно действуя на нерв-
ные центры, вызывает жажду, усиливается поступление в организм воды
в виде питья, и водносолевой баланс организма восстанавливается до обыч-
ного уровня. Подобное явление имеет место при потреблении с пищей боль-
шого количества поваренной соли.
ФИЗИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ ИОНОВ
Растворенные в плазме крови минеральные вещества диссоциируют с об-
разованием ионов, обладающих физиологическим действием на органы и,
прежде всего, на функцию нервной системы.
Ионы влияют на физико-химическое состояние белков. От них зависит
степень гидратации и растворимость белков тканей. При этом оказывается,
что различные ионы обладают неодинаковым действием. Физиологическое
действие ионов зависит от их химической природы. Часто встречаются с
антагонизмом действия ионов. Так, например, ионы кальция понижают воз-
будимость коры головного мозга, в то время как ионы натрия обладают про-
тивоположным действием. Специфическое действие различных ионов обычно
наблюдают в исследованиях с изолированными из организма органами и
тканями. Изолированные ткани и органы могут сохранять в течение из-
вестного времени свою жизнедеятельность в питательных растворах, со-
держащих глюкозу, минеральные соли и кислород. Питательная жидкость
должна иметь слабощелочную реакцию (pH 7,3) и осмотическое давление,
равное осмотическому давлению крови. Осмотическое давление для тканей
млекопитающих животных и человека создается 0,9%-ным, для птиц —
1,1%-ным и для холоднокровных—0,7 %-ным раствором хлористого натрия;
0,9%-, 1,1 %- и 0,7%-ные растворы хлористого натрия носят название фи-
зиологических растворов, соответственно для человека и млекопитающих
животных, для птиц и для холоднокровных животных. Однако следует под-
черкнуть, что название «физиологический раствор» неправильно, так как
раствор хлористого натрия, значительно отличающийся от сложного ион-
ного состава крови, способен обеспечить только лишь нормальное для тка-
ней осмотическое давление. Физиологический раствор изоосмотичен крови и
им пользуются при хирургических операциях, когда бывает необходимо при
кровопотерях восстановить объем циркулирующей крови без изменения
ее осмотического давления.
В опытах с изолированными органами выявилось, что для сохранения
в течение известного времени их жизнедеятельности необходимо пользо-
ваться раствором нескольких солей, который соответствовал бы по своему
составу минеральному составу крови. Подобный раствор получил название
эквилибрированного раствора по той причине, что в нем уравновешено ан-
тагонистическое действие различных ионов. Обычно принято пользоваться
солевым раствором, предложенным Рингером, следующего состава в грам-
мах па 1 литр дистиллированной воды.
8 Заказ № 581
225
Для млекопитаю- щих Для птиц Для холод- нокровных
NaCI . . .... 9,0 11,0 7,0
КС! . . . .... 0,2 0,2 0.1
СаСЬ . . .... 0,2 0,2 0,1
NaHCO3 .... 0,1 о,1 0,2
В качестве питательного вещества в одном литре раствора Рингера раст-
воряют 1 г глюкозы (раствор Рингер—Лскка).
СОДЕРЖАНИЕ МИНЕРАЛЬНЫХ ВЕЩЕСТВ
В ТКАНЯХ И ОРГАНАХ
В золе, образующейся при сжигании тканей позвоночных животных,
содержится большое количество кальция (в виде окиси), а также аниона
фосфорной кислоты.
Содержание минеральных веществ в золе, полученной от сжигания от-
дельных органов или тканей, оказывается различным.
Содержание отдельных минеральных веществ (в мг % на сырую ткань)
Ткань или орган К Na Са Mg С1 F р
Костная ткань 61 180 11 000 105 190 5 050
Зубы (сухая, обезжиренная ткань) . 50 250 36 000 400 300 111 17 000
Мышцы 360 72 7 23 66 0,16 220
Сердце 250 185 10 17 135 0,08 270
Мозг 330 170 12 16 150 0,25 380
Печень 215 175 12 22 160 0,48 210
Почки 175 80 20 21 220 — 140
Плазма крови 20 335 10 2 370 — 15
Весь организм человека 265 335 109 36 160 0,9 1 160
Из приведенных в таблице данных видно, что кальций и фосфор сосре-
доточены преимущественно в костной ткани и в зубах. Фтор встречается
в большом количестве в зубах. В «мягких» тканях в некоторых количествах
содержатся все перечисленные в таблице вещества, причем калия больше,
чем натрия. Только в плазме крови содержание натрия примерно в 20 раз
выше содержания калия. В эритроцитах много калия (460 мг%) и сравни-
тельно мало натрия (20 мг%). Магний входит во все органы и ткани, но осо-
бенно много его в костях. В костной ткани минеральные вещества находятся
в нерастворимом состоянии, составляя их минеральный остов. Однако при
недостатке в организме кальция и фосфора они могут быть извлечены из
костной ткани. Активны в процессах обмена веществ минеральные вещества,
растворимые в воде, а также входящие в состав органических соединений
тканей и органов.
ПОТРЕБНОСТЬ ОРГАНИЗМА В МИНЕРАЛЬНЫХ ВЕЩЕСТВАХ
Организмы животных, а также растений очень чувствительны к недо-
статку, а тем более к отсутствию в пище тех или иных минеральных веществ.
Эю относится как к макроэлементам, так и к микроэлементам. Потребность
в минеральных веществах зависит от ряда физиологических моментов.
226
Растущий организм нуждается в усиленной доставке с пищей солей каль-
ция и фосфатов. При этом чрезвычайно важно не только достаточное коли-
чество этих веществ, но и определенное соотношение между ними в пище.
Соотношение между количеством кальция и количеством фосфора в пище
приблизительно должно составлять 1 : 2. При изменении этого соотношения
нарушается обмен кальция и фосфора, что вызывает в растущем организме
явления рахита.
При недостатке в пище железа уменьшается количество гемоглобина
крови. Чувствителен также организм к недостатку и иных минеральных ве-
ществ (йода, фтора, марганца, кобальта и др.). Минеральные вещества до-
ставляются с пищей, и только одно вещество — хлористый натрий — спе-
циально добавляется к пищевым продуктам. Недостаток поваренной соли
в пищевом рационе, «солевой голод», очень тяжело переносится человеком.
Взрослый человек ежесуточно потребляет до 15 г поваренной соли и столько
же выделяет ее из организма. Это количество значительно превышает физио-
логически необходимое, и оно определяется прежде всего вкусовым качест-
вом хлористого натра, привычкой к соленой пище. Несоленая, пресная
пища невкусна. Количество хлористого натрия в пище можно без ущерба
для человека снизить до 5 г в сутки.
На выделение хлористого натрия из организма, а отсюда и на потреб-
ность в нем влияют соли калия. Растительная пища, особенно картофель,
богата калием и она вызывает увеличенное выделение с мочой хлористого
натрия. Хищные животные довольствуются количеством хлористого натрия,
содержащимся в пожираемых ими животных, и не нуждаются в доставке
хлористого натрия извне.
Суточная потребность человека в различных минеральных веществах,
не считая микроэлементов, такова (в граммах):
Кальций........... 0,7—0,8
Фосфор ........... 1,5—2
Калий............. 2—3
Натрий............ 4—6
Железо............ 0,008—0,010
Хлор ............. 6,0—9
РОЛЬ ОТДЕЛЬНЫХ МИНЕРАЛЬНЫХ ВЕЩЕСТВ
Натрий и калий
Хлористый натрий, составляя значительную часть минеральных ве-
ществ крови, играет важную роль в создании осмотического давления.
Около 90% осмотического давления плазмы крови зависит от наличия в ней
хлористого натрия. Наряду с этим хлористый натрий играет важную роль
в регуляции водного обмена организма. С мочой и, особенно, с потом вы-
деляется значительное количество хлористого натрия. При усиленном по-
треблении жидкости человек в течение рабочего дня при высокой темпера-
туре выделяет от 3 до 5 л пота. Пот на 99,5% состоит из воды. В состав
сухого остатка пота входят некоторые органические вещества, главным об-
разом мочевина, и минеральные вещества, преимущественно хлористый нат-
рий. При обильном потоотделении организм теряет значительное количество
хлористого натрия, он как бы обессоливается. Потеря хлористого натрия
плохо отражается на состоянии организма, снижает его работоспособность.
По этой причине рекомендуют при работе в горячих цехах и при продол-
жительных походах пить не обычную (чем больше человек при этих ус-
ловиях пьет, тем больше он потеет и теряет хлористый натрий), а подсолен-
ную воду.
Хлористый натрий, создавая осмотическое давление, играет также важ-
ную роль в процессах внутренней циркуляции воды в организме. С пищева-
8*
227
ригельными соками выделяется значительное количество воды. В течение
суток со слюной выделяется до полутора литров воды. До двух литров воды
выделяется с желудочным соком. Такое же количество воды выделяется с
соком поджелудочной железы, с желчью и кишечным соком. Все это коли-
чество воды, составляющее около восьми литров, не теряется, так как оно
всасывается через стенку кишечника и поступает в кровь и в лимфу. Выде-
ляющаяся с пищеварительными соками вода способствует процессам пище-
варения и всасыванию переваренных продуктов. Эта вода при исследова-
нии водного баланса организма не выявляется, так как она не учитывается,
хотя физиологическое значение ее велико. В обмене этой воды, т.е. в ее вы-
делении в пищеварительный тракт и всасывании через стенку кишечника,
важная роль принадлежит осмотическому давлению жидкостей организма,
концентрации в них хлористого натрия.
Натрий и калий находятся у животных и растений только в виде ионов
Na+ и Кг, а не в виде комплексных соединений. Ионы натрия и ионы калия
обладают специфическим для них действием. Сокращаемость и раздражи-
мость изолированной сердечной мышцы прекращается, если в пропускае-
мой через нее питательной жидкости имеется только один хлористый нат-
рий, сердечная мышца расслабляется и остается в расслабленном состоянии.
Соли калия в малых количествах уменьшают число сердечных сокращений,
а в повышенных дозах вызывают состояние крайнего расслабления, так на-
зываемое «калиевое торможение».
Нормальный ритм сердечной деятельности, т.е. чередующееся сокраще-
ние и расслабление сердца, зависят от наличия в должном количестве в пи-
тательной жидкости солей натрия, калия, а также и кальция. Естествен-
ная радиоактивность организма (у-излучение) в значительной мере зависит
от наличия радиоактивного изотопа калия (К40).
Магний и кальций
Большая часть магния находится в составе костной ткани, следователь-
но, в нерастворенном состоянии. В плазме крови, в эритроцитах и в «мяг-
ких» тканях магний в основном содержится в ионном состоянии, а некото-
рое его количество связано с белками. При кормлении животных пищей,
лишенной солей магния, у них развивается расстройство сердечной дея-
тельности. Животные погибают в результате частых судорог.
Введение в кровь больших количеств солей магния вызывает у живот-
ных депрессию и сон (магнезиальный наркоз). Тормозящее действие ионов
магния на функцию нервной системы устраняется путем введения в кровь
соли кальция.
Магний необходим для действия некоторых ферментов, катализирую-
щих распад углеводов, а также и для действия фосфатаз и фосфофераз. Маг-
ний входит в состав хлорофилла.
Около 99?^о кальция в организме содержится в костной и зубной тка-
нях. Остальной кальций входит в состав крови и тканей как в форме ионов,
так и в связанном с белками состоянии. Кальций в плазме крови составляет
9—11 мг%. В эритроцитах кальций отсутствует. Около 60% кальция в
плазме крови находится в ионном состоянии, остальное количество свя-
зано с белками. Понижение содержания кальция в плазме крови сопровож-
дается повышением возбудимости центральной нервной системы, следстви-
ем чего являются судороги. Содержание кальция в крови регулируется гор-
моном паращитовидных желез — паратгормоном (стр. 188).
Фосфор. Процессы костеобразования
Фосфор широко распространен в органическом мире в виде своего выс-
шего окисла (Р2О5). У позвоночных животных основная масса фосфора
(фосфорной кислоты) содержится в костной ткани (фосфорнокислый каль-
228
ций). Остальная, значительно меныпая часть фосфора, входит в состав
«мягких» тканей и жидкостей. Эта часть фосфора представлена либо солями
ортофосфорной кислоты (небольшая доля), либо различными органиче-
скими фосфорными соединениями (основная масса). Соли о-фосфорной кис-
лоты содержатся в плазме крови в виде первичных фосфатов Н2РО4“ и в
виде вторичных фосфатов НРО4” в соотношении 4:1. Содержание о-фос-
фатов в плазме крови детей в расчете на фосфор составляет 4—5 жг%; в
плазме крови взрослых — 2,5—3 мг%.
Минеральная часть костной ткани состоит преимущественно из фос-
форнокислого кальция и из незначительного количества углекислого каль-
ция, фтористого кальция и гидроокиси кальция. Кроме перечисленных каль-
циевых солей, в костях содержатся соли магния, натрия и калия и некото-
рые микроэлементы. Фосфорнокислый кальций в костной ткани находится
в нерастворимом состоянии и по форме кристаллов относится к группе апа-
титсв состава [Са(ОН)-Са4(РО4)3]2. Изучение размеров этих кристаллов
показывает, что 1 г их имеет поверхность 100 м2. Следовательно, костная
ткань представляет большую поверхность, на которой могут адсорбиро-
ваться различные вещества. При введении в организм животного фосфата,
меченного Р32, а также хлористого кальция, меченного радиоактивным
кальцием, можно наблюдать появление значительной радиоактивности в
костях.
По объему минеральные вещества составляют одну четверть объема
костной ткани, а по весу — половину ее. Органические вещества — основа
костной ткани, ее матрица (3/4 объема), в значительной мере представлены
фибриллярным белком соединительной ткани — коллагеном и другими це-
ментирующими веществами, главным образом, хондроитинсерной кисло-
той (стр. 85). Остеобласты являются костеформирующими клетками кост-
ной ткани и характеризуются высокой фосфатазной активностью. Благо-
даря действию фосфатазы остеобластов расщепляются доставляемые кровью
к костной ткани органические фосфорные соединения (гексозофосфаты, гли-
церофосфат), чем создается концентрация неорганического фосфата, благо-
приятная для отложения в костях фосфорнокислого кальция. Цементи-
рующие вещества костной ткани связывают кальций в местах образования
кристаллов фосфорнокислого кальция. Из изложенного следует, что отло-
жение в костях минеральных веществ нельзя рассматривать как реакцию
образования фосфорнокислого кальция, оно является результатом жизне-
деятельности костной ткани, в котором участвуют остеобласты, остеоклас-
ты (клетки, разрушающие костную ткань) и органические составные части
костной ткани, главным образом белки.
На процессы обмена веществ, ведущие к костеобразованию, влияет
ряд факторов. Недостаток витамина D в организме детей и молодых млеко-
питающих и птиц вызывает рахит, характеризующийся нарушением обмена
фосфора и кальция, в результате которого замедляется рост и развитие
костей (стр. 135). На обмен фосфора и кальция в костях влияет также гор-
мон паращитовидных желез. Избыток этого гормона тормозит обратное
всасывание фосфатов в извитых канальцах почек, что приводит к сниже-
нию содержания неорганического фосфора в плазме крови, а это отрица-
тельно отражается на процессе костеобразования. Наряду с этим в костях
деполимеризуются мукопротеиды, что нарушает нормальное отложение
фосфорнокислого кальция в костной ткани.
Нарушения обмена веществ в костях, ведущие к изменению процессов
минерализации органического состава кости, носят название остеомаляции.
В детском возрасте при остеомаляции (например, при рахите) образование
органического остова кости происходит нормально, отложение же в нем
фосфорнокислого кальция уменьшено. Продолжающийся рост хряща без его
минерализации приводит к деформации костей. Остеомаляция иногда встре-
чается и у взрослых. Она сопровождается уменьшением плотности костной
ткани, ломкостью костей, но не их деформацией, так как рост костей уже
229
закончен. Остеомаляция сопровождается повышением активности остеоб-
ластов и увеличением активности фосфатаз в плазме крови.
Недостаточное образование органического остова кости приводит к
остеопорозу — заболеванию, при котором изменяются структура и физио-
логические свойства костной ткани.
Костная ткань адсорбирует на своей поверхности тяжелые металлы —
свинец, радий, уран и тяжелые элементы, возникающие при расщеплении
урана и обладающие радиоактивностью. Накопление радиоактивных ве-
ществ в костях нарушает кроветворную функцию костного мозга.
Фосфорные соединения
В тканях человека и животных, за исключением костной, а также в
растениях и в микроорганизмах фосфорная кислота входит в состав, глав-
ным образом, органических соединений. Содержание солей неорганиче-
ской фосфорной кислоты сравнительно невелико.
В организмах содержатся соли о-фосфорной кислоты (Н3РО4) и конден-
сированных фосфорных кислот, образующиеся в результате процессов
обмена веществ. К полифосфорным относятся пирофосфорная кислота
(Н4Р2О7), существующая только в виде солей и возникающая как продукт
превращения аденозинтрифосфорной кислоты (стр. 64), трифосфорная и ме-
тафосфорная кислоты.
ОН
НО—Р^О ОН
^Ъ—р=о
'он
он
НО—Р^О он
'Ъ—Р^О он
^Ь—рС=о
'Ън
Пирофосфорная кислота
Трифосфорная кислота
Конденсированные полифосфорные кислоты, встречающиеся в дрожжах,
плесневых грибах и в ряде других микроорганизмов, делятся на 2 группы:
линейные и циклические. Простейший представитель линейных полифсс-
форных кислот — пирофосфат.
Он состоит из двух остатков о-фосфорной кислоты. Следующим по
сложности продуктом является трифосфорная кислота, построенная из трех
остатков о-фосфорной кислоты. Чем более сложна структура линейной по-
лифосфорной кислоты, тем больше в ней остатков молекул о-фосфорной кис-
лоты.
Простейшими циклическими полифосфорными кислотами являются
три- и тетраметафосфорные кислоты:
Триметафосфорная кислота
о о
II II
НО—Р—О—Р—он
I I
о о
I I
НО—Р—О— Р—он
Тетраметафосфорная кислота
Различные циклические полифосфорные кислоты — продукты конден-
сации большого количества молекул три-, или же тетраметафосфорной
кислот.
230
В составе органических фосфорных соединений содержатся остатки
о-фосфорной, пирофосфорной и трифосфорной кислот.
Существуют следующие типы органических фосфорных соединений.
1) Эф и р о фос фа тн ы е соединения с общей формулой
—сн—о
Соединения этого типа широко распространены в живых организмах.
К ним относятся глицеринфосфюрная кислота, входящая в состав фосфати-
дов (стр. 97), триозо- и гексозо-фосфорные кислоты (стр. 294), являющиеся
промежуточными продуктами распада углеводов, серинфосфорная кислота,
содержащаяся в фосфопротеидах (стр. 47) и в некоторых фосфатидах (стр. 97),
и др. При гидролизе фосфорных эфиров освобождается небольшое количе-
ство энергии (2500—3000 калорий на моль расщепленного эфира).
2) Глюкозидфосфатные соединения, у которых име-
ется глюкозидная связь, направленная к остатку фосфорной кислоты. К ним
относится глюкозо-1-фосфорная кислота, образующаяся при фосфоролизе
гликогена.
сн2он
I I ОН
н он
Глюкозо-1-фосфорная кислота
3) Енолфосфатные соединения — фосфорилированные
третичные спирты (енолы). Это, например, енолфосфопировиноградная кис-
лота, промежуточный продукт распада углеводов
СНо УОН
и “ Z
СО-Р-О
cooh'Nmi
Характерной особенностью енолфосфатных соединений является нали-
чие у них макроэргической фосфатной связи.
4) Карбоксилфосфатные соединения общей хими-
ческой формулы
К ним относятся 1,3-дифосфоглицериновая кислота и другие фосфорилиро-
ванные по карбоксилу органические кислоты.
231
он
СН2О—Р-0
снон
1, 3-Дифосфо глицериновая кислота
В молекуле 1,3-дифосфоглицериновой кислоты имеются одна эфиро-
фосфатная и одна карбоксилфосфатная связь. Последняя связь является
макроэргической связью. При ее разрыве освобождается 12500 калорий на
моль.
5)Аминофосфатные соединения общей формулы
ОН
К ним относятся содержащаяся в мышцах и в некоторых других тка-
нях позвоночных животных креатинфосфорная кислота и содержащаяся в
мышцах беспозвоночных животных аргининфосфорная кислота.
NH—Р—О
C=NH
NH
I
сн2
I
сн2
I
сн2
I
chnh2
I
соон
С—NH
I
N • СН3
I
сн2
I
соон
Креатинфосфорная кислота
Аргининфосфорная кислота
Аминофосфатная связь является макроэргической связью. При ее раз-
рыве освобождается 12000—13000 калорий на моль.
6) Ангидридофосфатные соединения, прототипом
которых служит пирофосфорная кислота, образующаяся из Двух молекул
о-фосфорной кислоты при отщеплении от них молекулы воды:
Н3РО4 + Н3РО4 — Н2О -> Н4Р2О7.
К ним относятся аденозинтрифосфорная кислота и другие фосфорили-
рованные нуклеотиды, содержащие остатки молекул пирофосфорной кис-
лоты (стр. 64). Ангидридфосфатная связь является макроэргическойфос-
фатной связью.
Органические фосфорные соединения образуются в живых организмах
при использовании неорганических фосфатов в результате химических
232
превращений. Продукты питания содержат неорганические фосфаты и орга-
нические фосфорные соединения. Последние в кишечнике в значительной
мере подвергаются расщеплению с освобождением неорганического фосфата.
Всасываются кишечником преимущественно неорганические фосфаты.
Опыты с введением неорганического фосфата, меченного радиоактивным
фосфором (Р32), показали, что поступающий в организм неорганический
фосфат скоро обнаруживается в составе различных органических фосфор-
ных соединений тканей.
Центральное место в процессах обмена веществ и в обмене энергии за-
нимает аденозинтрифосфорная кислота. Энергия ее макроэргических связей
используется в организме для самых разнообразных синтезов органических
соединений (при синтезе пептидных связей белковых молекул, фосфорных
эфиров, при реакциях ацилирования, метилирования, синтеза мочевины
и т.д.). С другой стороны, образующиеся при реакциях окисления макро-
эр гические фосфорные соединения (карбоксилфосфаты) идут на фосфори-
лирование аденозиндифосфорной кислоты, т.е. на образование макроэрги-
ческих связей аденозинтрифосфорной кислоты. Энергия макроэргических
связей аденозинтрифосфорной кислоты используется в мышцах при их де-
ятельности. В этом случае химическая энергия каким-то пока еще неиз-
вестным путем превращается в энергию механическую.
Из организма человека и животных соли фосфорной кислоты выделя-
ются преимущественно почками (с мочой) и в некотором количестве через
стенку толстого кишечника. Поступающие ежесуточно с пищей 1—1,5 г
фосфора всасываются в кровь в виде неорганических фосфатов и проходят
длинный путь превращений, во время которого возникают различные орга-
нические фосфорные соединения. Этот путь заканчивается образованием
из органических фосфорных соединений неорганических фосфатов, выделя-
ющихся из организма.
Опыт с введением животным фосфатов, меченных радиоактивным фос-
фором (Р32), показал, что наиболее интенсивно происходит обмен фосфорных
соединений в активно функционирующих органах (мозгу, печени, мышцах).
Введенный радиоактивный фосфат быстро появляется в составе органиче-
ских фосфорных соединений тканей и в первую очередь в составе аденозин-
трифосфорной кислоты.
ГАЛОИДЫ
В организмах человека и животных содержатся в различных количе-
ствах фтор, хлор, бром и йод. Из них хлор встречается в сравнительно боль-
ших количествах, остальные же относятся к числу микроэлементов. Хлор
находится в ионизированном виде, в виде аниона солей натрия, калия
кальция, магния, марганца. Анионы хлора вместе с ионами натрия играют
важную роль в создании осмотического давления плазмы крови и других
жидкостей. Хлор в виде соляной кислоты является важной составной ча-
стью желудочного сока.
Бром — постоянная составная часть различных тканей организмов
животных. В тканях млекопитающих содержание брома различно и колеб-
лется в пределах от 0,1 до 0,7 мг%. Значительно выше (15—30 мг%) содер-
жание брома в гипофизе.
В организм человека бром поступает главным образом с продуктами
растительного происхождения и небольшое количество его вводится с по-
варенной солью, содержащей 0,1% брома. Введение в организм бромистых
солей усиливает выделение хлоридов.
У некоторых беспозвоночных животных (губки, моллюски и др.) бром
входит в состав органических соединений, однако биологическое значение
этих соединений остается невыясненным. Неизвестной также остается роль
брома в гипофизе.
233
Озли брома получили широкое применение в медицине благодаря тому,
что они усиливают процессы торможения в центральной нервной системе,
действуют успокаивающим образом на организм.
Фтор в небольших количествах содержится во всех тканях организма
человека и животных. В крови человека содержание фтора колеблется в
пределах 0,03—0,07 мг%, Значительно больше его в костях (10—30л*г%)
и особенно много в зубах (в эмали 120—150 мг%, в дентине — 50 мг%).
В костях и в зубах фтор находится в нерастворимом состоянии в виде фтор-
кальциевой соли фосфорной кислоты и фторапатита Cajo(p°4)eF2- Фтор
поступает в организм преимущественно с питьевой водой. Оптимальное со-
держание фтора в воде колеблется в пределах 0,5—1,0 мг в одном литре.
В местностях, где содержание фтора в воде ниже 0,5—1,0 мг в литре и где
пищевые продукты бедны фтором, у людей часто встречается заболевание—
кариес зубов. Вредным оказывается и избыточное содержание фтора в
питьевой воде и в продуктах питания. В почву, воду и атмосферу фтор пере-
ходит из вулканических масс и газов. В районах действующих вулканов
впервые было обнаружено неблагоприятное действие избытка фтора на че-
ловека и животных, проявляющееся в заболевании зубов — пятнистой эма-
ли. Избыток фтора, кроме того, вызывает у людей и животных флуороз,
встречающийся не только в районах действующих и потухших вулканов,
а также и в местностях, почва которых содержит фторапатиты (США, Ар-
гентина, Италия, Испания, Япония и другие страны), что сказывается на
составе питьевой воды (свыше 1,5 мг фтора в 1 л воды) и соответственно
пищевых продуктов.
Ионы фтора реагируют с ионами магния с образованием нерастворимого
в воде фтористого магния. В опытах с прибавлением к тканям или к фермент-
ным растворам фтористого натрия или калия можно наблюдать прекраще-
ние действия ферментов, являющихся Mg-протеидами (фосфатаз и других).
Фторорганические соединения очень ядовиты и применяются для борь-
бы с вредителями сельского хозяйства.
Йод встречается в различных органах и тканях человека и животных,
причем основное его количество содержится в щитовидной железе, в составе
ее гормонов — трийодтиронина и тироксина. Содержание йода в щитовид-
ной железе человека составляет 20—40л<г%, превышая в 2000—4000 раз со-
держание йода в крови. Потребность человека в йоде исчисляется 0,1 мг
в сутки. Соли йода, подобно солям других галоидов, хорошо растворимы
в воде и мало адсорбируются почвой. Из почвы йод вымывается дождями
и уносится в моря. Организмы морских животных и растений более богаты
йодом, чем организмы наземных животных и растений. Некоторые морские
водоросли концентрируют в себе йод и являются промышленным сырьем
для получения металлического йода.
В противоположность другим галоидам, йод встречается у животных и
растений главным образом в составе органических соединений, производ-
ных тирозина. Дийодтирозин был давно получен как продукт гидролиза
белков коралла Gorgonia и носит название йодгортоновой кислоты: дийод-
тирозин составляет значительную часть структурных белков коралла.
Йодированные производные тирозина содержатся также в белках ряда
губок.
Недостаток йода в пищевых продуктах вызывает расстройство функции
щитовидной железы, сопровождающееся ее разрастанием. С подобным
явлением встречаются в горных местностях, где почва, а отсюда и пищевые
продукты бедны йодом. Заболевание это сопровождается гипофункцией
щитовидной железы и известно под названием эндемического зоба. Пре-
дохранить людей от этого заболевания удается путем дополнительного вве-
дения йода в организм, что достигается добавлением его к поваренной соли.
Чувствительными к недостатку йода в кормах оказываются сельско-
хозяйственные животные. Недостаток йода в кормах вызывает заболевания
у свиней, особенно у молодняка.
234
Хлор в организме находится преимущественно в ионизированном со-
стоянии в виде аниона, главным образом, натрия и в меньшей мере калия,
кальция й магния, а также соляной кислоты (в составе желудочного сока).
Анионы хлора (вместе с катионами натрия) играют важную роль в соз-
дании осмотического давления плазмы крови, спинномозговой жидкости и
содержимого клеток.
Сера. У животных и растений сера встречается преимущественно в вос-
становленной форме, в виде остатка сероводорода (сульфидная сера) в составе
серусодержащих аминокислот, трипептида глутатиона (стр. 422), кофермен-
та ацилирования (стр. 174), витамина Вх (стр. НО) и др. В окисленном со-
стоянии, в виде серной кислоты, сера встречается в мукополисахаридах
(стр. 85), таурине (стр. 393) и эфиросерных соединениях.
Сульфидная сера подвергается окислению с образованием серной кис-
лоты, которая выделяется с мочой. В крови и в моче содержатся эфиросер-
ные соединения — сложные эфиры серной кислоты и циклических спиртов
(фенолов, индоксила, скатоксила). Эфиросерные соединения образуются в
печени как продукты обезвреживания ряда ядовитых веществ.
ТЯЖЕЛЫЕ МЕТАЛЛЫ
ЖЕЛЕЗО
Большинство тяжелых металлов встречается у животных и растений
в чрезвычайно малых количествах. Исключением является железо, которого
у животных, особенно у позвоночных, довольно много.
Железо в виде неорганических соединений широко распространено в
природе. Источником железа для человека и животных являются растения,
получающие его из почвы. Ежесуточно с пищей в организм взрослого чело-
века поступает около 15 мг железа, преимущественно в составе органиче-
ских соединений. Благодаря кислотности желудочного сока поступающие
в организм нерастворимые основные соединения железа превращаются в
растворимые ферри- и ферро-ионы. Ионы железа, в противоположность
комплексам железа с органическими веществами, легко всасываются ки-
шечником. Железо гемоглобина, поступающее в пищеварительный тракт с
пищей, всасывается в незначительных количествах.
У человека и животных железо входит в состав чрезвычайно важных
в биологическом отношении органических соединений (гемоглобина крови,
миоглобина, каталазы, цитохромов). Около 70% всего железа организма
человека содержится в крови, вернее в гемоглобине эритроцитов.
Дети рождаются со значительным запасом железа. У новорожденных
концентрация гемоглобина в эритроцитах и количество эритроцитов в кро-
ви значительно выше, чем в последующие периоды жизни. Спустя несколь-
ко недель после рождения скорость разрушения эритроцитов в организме
ребенка превосходит скорость их образования, однако излишек железа из
организма при этом не выделяется. Способность организма ребенка удер-
живать избыток железа имеет важное значение, так как в молоке железа
содержится явно недостаточное количество. Запас железа у ребенка делает
его независимым, примерно в течение года, от наличия железа в составе
молока. Подобное явление наблюдается и у новорожденных млекопитаю-
щих животных. Исключение составляют морские свинки, которые рожда-
ются без запаса железа, и уже через несколько дней после рождения начи-
нают кормиться, кроме молока, обычным для взрослых животных кормом
и тем самым обеспечивают потребность своего организма в железе.
Известный запас железа у человека и животных имеется в белке — фер-
ритине, содержащемся в тканях селезенки, печени и слизистой оболочки ки-
235
шечника. В ферритине железо составляет 22%. Белковая часть ферритина
носит название апоферритин. Апоферритин связан с комплексным соеди-
нением гидроокиси железа с фосфорной кислотой [(FeOOH)8(FeO—
ОРО3Н2)]; последнее соединение по весу составляет половину ферритина.
Ферритин слизистой оболочки кишечника играет роль в процессе вса-
сывания железа. В слизистой оболочке кишечника голодной морской свин-
ки содержание апоферритина незначительно. Через несколько часов после
введения соединений железа количество ферритина в слизистой возрастает
в 20—50 раз. Следовательно, в слизистой оболочке при всасывании железа
происходит интенсивный синтез апоферритина. Всасывание железа лими-
тируется способностью апоферритина связывать железо и переходить в
ферритин. При интенсивном введении в пищеварительный тракт соединений
железа количество апоферритина оказывается недостаточным для их свя-
зывания, в силу чего не происходит всасывание избыточных количеств же-
леза. Следовательно, слизистая оболочка кишечника регулирует всасывание
железа в кишечнике.
Значительный запас железа в виде ферритина создается в печени.
В печени взрослого человека в виде ферритина содержится 700 мг железа,
которое тратится по мере надобности. При недостатке железа в пище со-
держание ферритина в печени снижается. При продолжительном введении
в организм железа после насыщения печени ферритином избыток железа
накопляется в печени в коллоидальной форме окиси железа, получившей
название гемосидерина. Гемосидерин вредно действует на клетки печени,
вызывает их разрушение. Следует полагать, что организм человека и жи-
вотных не обладает достаточной способностью удалять избыток железа пу-
тем его выделения. Отсюда становится понятным физиологическое значение
способности слизистой оболочки кишечника регулировать объем всасывания
поступающего извне железа.
МЕДЬ
Медь играет важную роль у животных и растений. У ряда беспозво-
ночных животных медь входит в состав гемоцианинов, являющихся, подоб-
но гемоглобину в организме позвоночных, переносчиками кислорода. Медь
включают и некоторые ферменты — оксидазы (тирозиназа, аскорбинокси-
даза, лакказа). Установлено значение меди для процессов кроветворения,
синтеза гемоглобина и цитохромов.
Содержание меди в различных тканях позвоночных животных невелико
и достигает десятых долей мг%. Исключение составляет печень, в которой
содержание меди достигает 3—5 мг%. Из печени выделен медьсодержащий
белок — гепатокупреин. Содержание меди в плазме крови человека сос-
тавляет 0,1 мг%.
Ежесуточно в организм человека с пищей поступает около 2 мг меди.
Недостаток меди в пище вызывает ряд расстройств и прежде всего наруше-
ние процессов кровообразования и синтеза гемоглобина.
При недостатке меди в почве ткани растений беднеют медью, в силу
чего растения недостаточно обеспечивают животных этим элементом. Жи-
вотные заболевают «лизухой» — медной недостаточностью. У больных жи-
вотных появляется анемия, расстройство пищеварения, потеря аппетита,
заболевание сердца и т. д.
Молоко — продукт с очень низким содержанием меди. У новорожден-
ных детей и млекопитающих животных в печени имеется запас меди, бла-
годаря чему они в течение многих месяцев не зависят от поступления меди
с пищей (молоком).
236
КОБАЛЬТ
Кобальт — широко распространенный в природе элемент. У животных
и растений он обнаруживается в чрезвычайно малых количествах. Внима-
ние к кобальту, как к важному для человека и животных элементу, при-
влекли два момента. Во-первых, оказалось, что в некоторых местностях,
где почва бедна кобальтом и его соответственно мало в корме, овцы и круп-
ный рогатый скот страдают «кобальтовой» недостаточностью, которая
приводит животных к истощению и смерти. Добавка к кормам незначитель-
ных количеств кобальта предохраняет животных от заболевания. Во-вто-
рых, кобальт, как оказалось, является составной частью витамина В12.
Следует отметить, что кобальт предохраняет животных от заболеваний при
введении его в организм вместе с кормом, но введение его в кровь не дает
эффекта. По-видимому, микроорганизмы пищеварительного тракта живот-
ных синтезируют при использовании поступающего с кормом кобальта ви-
тамин В12. Биологическая роль кобальта в значительной мере связана с
проявлением активности витамина В12 (стр. 123).
СТРОНЦИЙ И ЦЕЗИЙ
Стронций обнаружен как составная часть скелета человека и животных.
Он содержится также у беспозвоночных животных. Пища, богатая строн-
цием, вызывает расстройство процессов оссификации, известное под назва-
нием стронциевого рахита. Последний по своим признакам напоминает обыч-
ный рахит, но он не излечивается витамином D. Стронциевый рахит был
описан у сельскохозяйственных животных в местностях, где почва содер-
жит много стронция.
Стронций привлекает к себе внимание как радиоактивный продукт
распада атомного ядра, появляющийся после атомных взрывов. Радиоак-
тивный изотоп стронция — стронций-90, попадая в почву, поглощается
растениями, а затем с кормом попадает в организм животных. Вместе с мо-
локом и мясом он поступает в организм человека и животных и фиксиру-
ется в костях. Радиоактивный стронций испускает [3-частицы, вызывающие
патологические изменения в костях и в костном мозгу.
Цезий входит в состав животных и растений в очень незначительных
количествах. Вопрос о биологическом значении цезия остается еще откры-
тым. В последнее время он стал привлекать к себе внимание как радиоактив-
ный продукт распада атомного ядра. В результате испытаний ядерного ору-
жия отмечалось повышение у-излучения на земной поверхности и появление
этого излучения в продуктах питания. у-Излучение почвы и продуктов пи-
тания вызывает цезий-137. у-Лучи оказывают вредное влияние на организм.
На примере цезия можно видеть, как элемент, не имеющий, по-видимому,
существенного биологического значения, в случае приобретения им радио-
активности может стать очень опасным для человека и животных.
ПРОЧИЕ МИКРОЭЛЕМЕНТЫ, ВСТРЕЧАЮЩИЕСЯ
В ОРГАНИЗМАХ
У живых существ содержатся, кроме приведенных выше минеральных
веществ, также различные микроэлементы. Биологическая роль некоторых
из них уже установлена, значение же других остается еще не выясненным.
Марганец входит в состав некоторых ферментов и усиливает их актив-
ность. Без марганца не могут обходиться живые существа. Внесение мар-
ганца в почву в качестве удобрения повышает урожайность культурных
растений.
237
Молибден в крайне незначительных количествах имеет значение для
фиксации атмосферного азота азотфиксирующими бактериями: он входит в
состав фермента ксантиноксидазы.
Цинк содержится в ферменте карбангидразе, а также в гормоне инсу-
лине.
ЛИТЕРАТУРА
В ой н а р А. О. Биологическая роль микроэлементов в организме животных и
человека. «Высшая школа», 1960.
КапланскийС. Я. ^Минеральный обмен. Медгиз, 1938.
Ньюман У. и Ньюман М. Минеральный обмен кости. ИЛ, 1961.
С т а й л с В. Микроэлементы в жизни растений и животных. ИЛ, 1949.
ЧаговецР. В. Состояние, содержание и распределение воды у человека.
В1сник АН Укр. РСР, 1951, № 9, стр. 34.
Раздел второй
ОБМЕН
ВЕЩЕСТВ
Глава десятая
ПРЕДСТАВЛЕНИЕ ОБ ОБМЕНЕ ВЕЩЕСТВ
Обмен веществ создает то единство, которое существует между живыми
организмами и окружающей их средой. Марксистско-ленинская философия
рассматривает жизнь как особую форму движения материи, форму сущест-
вования белковых веществ, характерной особенностью которых является
обмен веществ с окружающей их средой. Изучение обмена веществ состав-
ляет одну из важнейших задач биохимии.
Ф. Энгельс дал обобщающее представление об обмене веществ, считая,
что он лежит в основе проявления жизни: «Жизнь — это способ существова-
ния белковых тел, существенным моментом которого является постоянный
обмен веществ с окружающей их внешней природой, причем с прекращением
этого обмена веществ прекращается и жизнь, что приводит к разложению
белка»1. Обмен веществ, указывает Ф. Энгельс, свойствен также и телам не-
органической природы. Однако существует важная особенность, отличаю-
щая обмен веществ неживых тел от обмена веществ живых существ. В ре-
зультате обмена веществ неживые тела разрушаются, в то время как обмен
веществ живых существ с окружающей средой является условием их суще-
ствования. В живые организмы в течение всей их жизни поступают пита-
тельные вещества. Живые организмы усваивают или, как говорят, ассимили-
руют их, т.е. превращают в составные части своих клеток и тканей. Одно-
временно с этим в организмах происходит разрушение веществ, входящих в
состав их клеток и тканей, а также распад питательных веществ или, как
говорят, процессы диссимиляции. Продукты диссимиляции выделяются из
организмов в окружающую их среду. Совокупность тесно связанных между
собой процессов ассимиляции и диссимиляции составляет обмен веществ,
характерную особенность всех без исключения живых существ.
Выдающиеся биологи-материалисты прошлого и настоящего веков под-
черкивали роль обмена веществ для проявления жизни и придавали боль-
шое значение его изучению. Основоположник отечественной физиологии
И. М. Сеченов в 1884 г. в «Физиологических очерках» писал: «Проследить
судьбы внешнего вещества при его странствовании по телу — значит опи-
сать всю историю жизни». К. А. Тимирязев в своих работах последователь-
но проводил взгляд о том, что развитие всего живого, изменчивость и
наследственность обусловливаются единством между противоположными сто-
ронами обмена веществ, т.е. ассимиляцией и диссимиляцией. И. В. Мичу-
рин неоднократно подчеркивал значение обмена веществ и направленного
воздействия окружающей среды для развития и формирования особенно-
стей растений. И. П. Павлов рассматривал обмен веществ как основу фи-
зиологических функций организма. В трудах И. П. Павлова нашло свое
развитие и экспериментальное подтверждение представления Ф. Энгельса,
что «...из обмена веществ посредством питания и выделения —обмена, со-
ставляющего существенную функцию белка,— и из свойственной белку
1 Ф. Энгельс. Диалектика природы. Госполитиздат, 1955, стр. 244.
241
пластичности вытекают все прочие простейшие факторы жизни: раздражи-
мость ... сокращаемость ... способность к росту ... внутреннее движение,
без которого невозможно ни поглощение, ни ассимилирование пищи»1.
При изучении химических процессов, лежащих в основе обмена ве-
ществ, прежде всего сталкиваются с тем, что многочисленные химические
реакции протекают в определенной последовательности и теснейшим обра-
зом связаны друг с другом. У человека и у животных течение химических
процессов регулируется нервной системой. В этой регуляции участвуют
гормоны, образующиеся в железах внутренней секреции.
ПУТИ ИЗУЧЕНИЯ ОБМЕНА ВЕЩЕСТВ
Объектами изучения обмена веществ являются: человек, животные,
растения, микроорганизмы, изолированные органы и ткани, субклеточные
элементы (ядра, митохондрии, микросомы). Принято говорить об изучении
обмена веществ организма, органа, ткани, клетки, субклеточных элементов.
В тех случаях, когда изучается значение химических превращений молекул
отдельных биологически важных веществ (белков, нуклеиновых кислот и
др.), говорят о молекулярном уровне изучения обмена веществ.
Изучение химических процессов на различных уровнях преследует од-
ну общую цель — выяснить общие закономерности процессов обмена ве-
ществ, лежащих в основе жизнедеятельности живых существ.
Существуют различные методы изучения обмена веществ.
Одним из них и наиболее старым является метод изучения балансов,
заключающийся в том, что изучают количество поступающего в организм ве-
щества и количество образующихся конечных продуктов его превращения,
обычно выделяющихся из организма. Примерами применения такого метода
изучения обмена веществ могут служить следующие.
1. Изучение обмена углеводов в дрожжевых
клетках, при котором исходным продуктом является глюкоза и конеч-
ными продуктами распада — этиловый спирт и углекислый газ. Учет ко-
личеств распавшейся глюкозы и образовавшихся спирта и углекислого газа
позволил дать следующее уравнение для спиртового брожения:
С6Н12Об -> 2СН3СН2ОН 4- 2СО2
Вполне понятно, что приведенное уравнение не вскрывает пути распада
глюкозы и того, какие промежуточные вещества возникают из глюкозы при
ее превращении в этиловый спирт и углекислый газ.
2. Изучение превращения белковых веществ
у человека и животных с образованием ряда азотистых веществ, среди ко-
торых больше всего мочевины. Изучая количество азота, поступающего в
организм с белками, и количество азота, выделяющегося с мочой конечных
продуктов азотистого обмена, можно установить баланс азота. Этот баланс
указывает на состояние азотистого равновесия организма в случаях, когда
количество азота, поступающего в организм в виде белков, равняется ко-
личеству азота, выделяющегося из него в виде азотистых веществ. Понят-
но, что и в данном случае изучение азотистого баланса не может дать пред-
ставления о превращениях белков в организме, т.е. об их распаде с образо-
ванием аминокислот и о многочисленных реакциях их распада и синтеза из
них азотистых продуктов.
Таких примеров можно привести много и все они показывают, что изу-
чение балансов не может вскрыть многообразие лежащих в основе обмена
веществ химических явлений. Этот метод также не выявляет степени учас-
тия различных органов в превращении тех или иных веществ.
1 Ф. Энгельс. Анти-Дюринг. Госполитиздат, 1957, стр. 78.
242
Изучение балансов дает количественное представление об обмене тех
или иных веществ, и только в этом заключается его значение.
Другим подходом к изучению обмена веществ является метод использо-
вания изолированных из организма органов, так называемых пережива-
ющих органов. Изолированные органы сохраняют в течение некоторого
времени свою жизненную активность, а также способность использовать
питательные вещества, пропускаемые через кровеносные сосуды, их прони-
зывающие. В опытах над переживающими органами удается выяснить ин-
тенсивность превращения в них тех или иных веществ. Так, например,
опыты, поставленные на переживающей печени, позволили выяснить, что
источниками образования в ней гликогена является не только глюкоза, но
и такие вещества, как молочная, пировиноградная кислоты, глицерин и др.
Следует, однако, отметить существенный недостаток, с которым встреча-
ются при работе с изолированными органами. Он заключается в том, что
изолированный орган теряет связь с иными органами, на него перестает
распространяться регулирующее воздействие центральной нервной системы,
действие гормонов. Вполне понятно поэтому, что химические превращения,
свойственные органам в организме, in situ, могут несколько отличаться от
превращений, совершающихся в них вне организма, фактически при их мед-
ленном отмирании. Имеется еще один недостаток в работе с переживающими
органами. Он заключается в трудности снабжения их кислородом. Послед-
ний недостаток устраняется при работе с тонкими срезами, получаемыми
из органов. Варбург ввел в практику изучения обмена веществ применение
тонких срезов тканей, которые удобны при изучении аэробного окисления
органических веществ и возникающих при этом продуктов.
В последнее время для изучения процессов обмена веществ стали широ-
ко пользоваться тонко измельченными тканями, так называемыми гомогена-
тами тканей и клеток. С помощью скоростных центрифуг гомогенаты разде-
ляются на фракции частичек различной величины. Этим путем можно изо-
лировать фракции митохондрий, микросом, ядер, т.е. отдельных органоидов
клеток, и изучить распределение и действие в них ферментов.
Наконец, при изучении химических превращений прибегают к получе-
нию из тканей, а также из клеток, бесклеточного материала в виде отжатых
из них соков, водных и иных экстрактов. Этот прием позволяет еще ближе
подойти к изучению химических превращений, устраняя часто осложняющий
опыты с тканями и клетками вопрос о проницаемости тканей и клеток для
веществ, подвергающихся превращениям.
Бесклеточные экстракты стали применяться для изучения процессов
обмена веществ в начале XX века, когда было показано, что спиртовое
брожение может происходить в дрожжевом соке, лишенном клеток. В даль-
нейшем оказалось, что в отжатом из мышц соке, а также в экстрактах из
мышц происходит распад гликогена с образованием молочной кислоты.
Бесклеточные экстракты из тканей были удачно использованы для изуче-
ния отдельных этапов превращения углеводов и иных веществ.
При изучении химических превращений веществ в гомогенатах, в со-
ках и в экстрактах биохимические процессы выводятся за пределы биологи-
ческих объектов; их изучают вне клеток и тканей, вне организма.
Между тем, основной задачей, стоящей перед биохимией, является изу-
чение процессов обмена веществ между организмами и окружающей их сре-
дой. Вполне понятно, что изучение превращений веществ в упрощенных
объектах (соках, экстрактах, гомогенатах) может дать только лишь схема-
тическое представление о процессах, протекающих в целом организме.
Поэтому факты, устанавливаемые с помощью упрощенных методов исследо-
вания, всегда нуждаются в проверке при постановке опытов на целом ор-
ганизме. Чрезвычайно ценным методом, позволяющим следить за превра-
щением различных веществ, является метод меченых атомов, или изотоп-
ный метод.
243
При использовании органических и неорганических веществ, молекулы
которых мечены изотопами с искусственной радиоактивностью или стабиль-
ными изотопами, можно, введя их в организм, проследить за их передви-
жением, за путями их распада, а также за участием их в процессах синтеза
в организме.
Многие химические процессы, не поддающиеся изучению при приме-
нении обычных методов химического исследования, становятся доступными
для исследования с применением метода меченых атомов. Так, например,
метод меченых атомов позволил выяснить, с какой интенсивностью обнов-
ляются составные части различных тканей и органов, из каких предшест-
венников образуются в тканях производные пурина, пиримидина, креатин
и др. Неудивительно, поэтому, что метод меченых атомов получает все
большее и большее применение в биохимических исследованиях.
БИОХИМИЧЕСКИЕ ПРОЦЕССЫ В СУБКЛЕТОЧНЫХ
ЭЛЕМЕНТАХ
Применение скоростных рефрижераторных центрифуг позволяет полу-
чить из измельченных (гомогенизированных) клеток и тканей структурные
элементы клеток. К ним относятся ядра, митохондрии (размером в 0,5—
2,0 ммк\ микросомы (размером в 0,02 ммк). После выделения этих элемен-
тов остается бесструктурная часть протоплазмы. Изучение химического со-
става отдельных элементов клеток и активность в них ферментов показало
следующее: клеточные элементы отличаются друг от друга по своему хими-
ческому составу. Так, например, ядра клеток богаты содержанием нуклео-
протеидов, в которых представлены дезоксирибонуклеиновые кислоты.
Митохондрии богаты содержанием белков и липидов, образующих белково-
липидные комплексы. Микросомы содержат наряду с белками много рибо-
нуклеиновых кислот. Бесструктурная часть протоплазмы богата водой и
содержит много растворимых в воде белков.
Различно представлены в разных элементах клетки-ферменты. В мито-
хондриях сосредоточены ферменты, катализирующие процессы окисления
органических веществ и связанные с ними процессы фосфорилирования.
Эти процессы играют чрезвычайно важную роль в обмене веществ и в ис-
пользовании энергии.клеткой. В микросомах сосредоточены ферменты, ката-
лизирующие процессы синтеза, особенно белковых веществ. В бесструк-
турной части протоплазмы сосредоточены преимущественно ферменты, ка-
тализирующие реакции гликолиза, но в ней отсутствуют окислительные
ферменты и ферменты окислительного фосфорилирования.
Преимущественная локализация тех или иных ферментов в клеточных
элементах имеет большое значение для направленного течения процессов
обмена веществ.
При изучении процессов обмена веществ обычно встречаются с процессами син-
теза и разрушения органических молекул. Исходя из этого, прежде чем перейти к изу-
чению превращения отдельных групп веществ в организме (углеводов, липидов, бел-
ков), полезно будет познакомиться с процессами биосинтеза органических веществ,
а также с процессами окисления, приводящими к распаду органических веществ с
образованием воды и углекислого газа*
ЛИТЕРАТУРА
Сисакян Н. М. Биохимия обмена веществ. Изд. АН СССР, 1954.
X е в е ш и Г. Радиоактивные индикаторы. ИЛ, 1950.
X е с и н Р. В. Биохимия цитоплазмы. Изд. АН СССР, 1960*
Глава одиннадцатая
БИОСИНТЕЗ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
Живые существа построены из различных органических и неорганиче-
ских соединений. Если отбросить воду и скелет у позвоночных животных,
а у беспозвоночных животных воду и внешние оболочки (раковины, створ-
ки, панцирь), то остающаяся масса состоит преимущественно из разнооб-
разных органических соединений, среди которых особое место по своему
биологическому значению занимают белки и нуклеиновые кислоты.
Человек и животные используют в качестве продуктов питания органи-
ческие вещества, синтезирующиеся в растениях из минеральных веществ.
Питательные вещества (углеводы, жиры, белки) подвергаются глубокому
распаду с образованием углекислого газа, воды и мочевины (последняя рас-
щепляется уробактериями с образованием аммиака и углекислого газа),
т.е. веществ, из которых в зеленых растениях синтезируются органические
вещества.
В широком масштабе зеленые растения используют световую энергию
при синтезе органических веществ из углекислого газа и воды.
ФОТОСИНТЕЗ
Синтез органических веществ в зеленых растениях из углекислого газа
и воды с использованием световой энергии носит название фотосинтеза.
Процесс фотосинтеза является основным источником образования органи-
ческих веществ на нашей планете и, с этой точки зрения, вполне объясним
интерес, который проявляют к нему представители различных отраслей
естествознания (биологи, химики, физики). Благодаря исследованиям
М. Непцкого, К. Тимирязева, Р. Вилыптеттера, Г. Фишера, М. Цвета и
других изучена химическая природа хлорофилла, играющего роль фотосен-
сибилизатора. Хлорофилл, нерастворимый в воде зеленый пигмент, в зеле-
ных растениях находится в особых образованиях — хлоропластах. Хлоро-
пласты содержат до 75% воды. Сухое вещество хлоропластов состоит из
белковой основы (стромы), хлорофилла, фосфатидов, каротиноидов, мине-
ральных веществ, углеводов и т.д. Хлорофилл в хлоропластах содержится
в отдельных гранулах в сочетании с белками и липидами.
К. Тимирязев внес большой вклад в дело изучения роли хлорофилла.
Им впервые было выдвинуто представление о тем, что хлорофилл в зеленых
частях растений играет роль фотосенсибилизатсра, т.е. вещества, способ-
ного поглощать световые лучи с использованием затем поглощенной свето-
вой энергии для фотохимических реакций, не протекающих в отсутствие
фотосенсибилизатора. Это представление получило всеобщее признание.
Хлорофилл, поглощая энергию квантов света, претерпевает некоторые струк-
турно-химические изменения. Затем в хлоропласте происходит миграция
энергии к участвующим в реакции фотосинтеза соединениям, и хлорофилл
возвращается в исходное состояние. Далее, Тимирязевым было установле-
но, что наиболее интенсивно процесс фотосинтеза происходит в красной час-
ти спектра, лучи которой усиленно поглощаются хлорофиллом. Этим было
показано, что процесс фотосинтеза подчиняется общему закону фотохимии,
245
согласно которому световая энергия должна быть поглощена, чтобы в даль-
нейшем быть использованной для той или иной реакции. Тимирязев также
установил, что интенсивность фотосинтеза находится в прямой зависимости
от количества поглощенной световой энергии, и это общее положение для
всех фотохимических реакций.
Легкоуловимым продуктом фотосинтеза является крахмал. При осве-
щении зеленой пластинки листа, пользуясь чувствительной реакцией на
крахмал (окрашивание в синий цвет раствором йода в йодистом калии),
можно установить появление в нем крахмала. Учитывая, что крахмал по-
строен из молекул глюкозы, суммарную реакцию фотосинтеза представляют
себе следующим уравнением:
световая энергия
6СО2 + 12Н2О-------------> С6Н12Об + 6Н2О + 6О2.
хлорофилл
Это уравнение показывает, что наряду с глюкозой в результате фотосинтеза
образуется также и кислород, что имеет важное значение, так как фотосин-
тез является единственным источником газообразного кислорода на Земле.
Убыль кислорода в атмосфере в результате дыхания живых организмов
пополняется кислородом, выделяющимся в атмосферу растениями при фо-
тосинтезе.
Приведенное уравнение фотосинтеза не вскрывает его интимные меха-
низмы. Оно, прежде всего, не выявляет того, освобождается ли кислород
из углекислого газа, или же из воды. До последнего времени предполага-
лось, что источником освобождающегося при фотосинтезе кислорода явля-
ется углекислый газ. Однако опыты с применением изотопа кислорода О18
в молекулах воды (Н2О18) показали, что кислород образуется не из углекис-
лого газа, а из воды. Следовательно, реакция фотосинтеза может быть пред-
ставлена уравнением
световая энергия
6СО* -ь- 12Н2О18-----------> С6н12о16 + 6H2O1S + 60 *8.
хлорофилл 2
Это уравнение показывает, что при фотосинтезе происходит фотолити-
ческое расщепление воды, причем образующийся из воды водород восста-
навливает углекислый газ. В свое время К. Тимирязевым и А. Бахом было
высказано мнение о том, что в основе фотосинтеза лежит цепь окислительно
восстановительных реакций. Известно, что водород в момент выделения вос-
станавливает хлорофилл. Восстановленный хлорофилл слабо окрашен. При
воздействии на него кислородом он окисляется и превращается в обычный
хлорофилл зеленого цвета. В хлоропластах обнаружены окислительно-
восстановительные ферменты, участвующие в процессе фотосинтеза. Экспе-
риментальные данные показывают, что восстановление углекислого газа
при фотосинтезе является весьма сложным процессом, причем восстанавли-
вается несвободный углекислый газ, а предварительно связанный с какими-
то веществами, имеющимися в хлоропластах.
Весьма важным для расшифровки механизма процесса фотосинтеза
оказались исследования Блекмэна, проведенные в 1905 г. и показавшие,
что при определенных условиях фотосинтез не может быть усилен повыше-
нием интенсивности освещения. Отсюда возникло предположение, что в про-
цессе фотосинтеза участвует какая-то еще нефотохимическая реакция, по-
лучившая название «темновой реакции». Дальнейшим доказательством в
пользу существования темновой реакции явились результаты исследований,
показавшие, что прерывистое освещение растения приводит к образованию
большего количества кислорода, чем это имеет место при беспрерывном
освещении той же интенсивности. Наконец, окончательно существование
темновой реакции было подтверждено результатами исследований с приме-
нением меченного радиоактивным углеродом углекислого газа. Оказалось,
что зеленые растения связывают углекислый газ и в отсутствие света,
в темноте, т. е. что какая-то составная часть зеленого растения без участия
246
света связывает углекислый газ, и получающееся при этом вещество под-
вергается восстановлению фотохимическим путем при участии хлорофилла.
Следовательно, энергия освещения оказывается необходимой для восстанов-
ления продукта фиксации углекислого газа. Применение меченных радио-
активным углеродом (С14) молекул углекислого газа (С14О2) позволило бо-
лее глубоко вникнуть в химизм процесса фотосинтеза. Вместе с этим были
подобраны удачные объекты для изучения фотосинтеза — зеленые водорос-
ли Chlorella и Scenedesmus. Эти водоросли получали углекислый газ, содер-
жащий радиоактивный углерод (С14О2), и подвергались очень непродолжи-
тельному освещению, исключавшему, по возможности, вовлечение первич-
ного продукта фотосинтеза в другие химические процессы. После освещения
водоросли обрабатывались, из них извлекались входящие в их состав ве-
щества и устанавливалось наличие в них радиоактивного углерода. Основ-
ное количество радиоактивного углерода обнаруживалось в 3-фосфоглице-
риновой кислоте, меньшее — в фосфопировиноградной кислоте и совсем
мало С14 оказалось в яблочной кислоте. При освещении водоросли в течение
пяти секунд 87% поглощенного ею углерода С14О2 обнаруживалось в 3-фос-
фоглицериновой кислоте, 10%—в фосфопировиноградной кислоте и 3% —
в яблочной кислоте
СООН
I
СООН СООН снон
I I I
СНОН СО • Н2РО3 сн2
I II I
СН20НоР03 СН2 СООН
З-Фосфоглицериновая
кислота
Енолфосфопировино-
градная кислота
Яблочная кислота
Из полученных экспериментальных данных можно заключить, что пер-
вичным улавливаемым продуктом фотосинтеза является фосфоглицерино-
вая кислота. Из нее, по-видимому, образуется фосфопировиноградная кис-
лота. Оба эти вещества известны как промежуточные продукты распада
углеводов (стр. 296), которые под воздействием соответствующего фермента
легко превращаются друг в друга. Известно также, что фосфоглицериновая
и фосфопировиноградная кислоты могут дать начало образованию уг-
леводов.
При освещении водоросли в течение минуты радиоактивный углерод
обнаруживается в углеводах, в органических кислотах, в аминокислотах
и в белках.
Возникает вопрос, как образуется 3-фосфоглицериновая кислота в зе-
леных растениях при использовании ими углекислого газа? На этот вопрос
дают ответ результаты исследований Кальвина.
Кальвином установлено, что образование 3-фосфоглицериновой кисло-
ты происходит в результате присоединения углекислого газа к рибулозо-1,5-
фосфорной кислоте. Последняя возникает из гептулозо-7-фосфорной кис-
лоты — промежуточного продукта пентозного цикла превращения углево-
дов (стр. 310).
СНоОН
I
СО
I
носы
I
НСОН ---------
I
НСОН
I
НСОН
I
СН2О • Н2РО3
Гептулозо-7-фосфор-
ная кислота
СНоОН
> НСОН +
I
НСОН
I
НСОН
I
CI12О • Н2РО3
Рибозо-5-фосфорная
кислота
ХН
Гликолевый
альдегид
247
с< СН2ОН
I ХН I
неон со
"* неон * неон
неон неон
I I
СН2О • Н2РО3 СН2О • Н2РО3
Рибулозо-5-фосфорная
кислота
СН.,0 • Н,РО3
I
со
+АТФ |
* неон
I
неон
I
СН2ОН2РО3
Рибулозо-1, 5-дифосфор-
ная кислота
+ АДФ
Присоединение СО2 к рибулозо-1,5-фосфорной кислоте с образованием
3-фосфоглицериновой кислоты происходит следующим образом:
СН2О • Н2РО3
I
СО
I
неон
I
неон
I
СН2О • Н2РО3
(+ АТФ)
- СН2О • Н2РО3~
I
со
I
неон
| /СООН
_ СН2ОН Н2РО3_
+ Н,О
Гипотетический
промежуточный
продукт
СН2О . Н2РО3
неон
I
соон
З-Фосфоглицерино-
вая кислота
соон
I
неон
I
СН2О • Н2РО3
З-Фосфоглицсриновая
кислота
(+ АДФ + Н3РО4)
Возникающие две молекулы 3-фосфоглицериновой кислоты подвергаются
затем восстановлению за счет двух молекул водорода, образующегося при
реакции разложения воды при участии хлорофилла с использованием све-
товой энергии: 2Н2О (хлорофилл, световая энергия)-^О2+2Н2. Кислород
выделяется в атмосферу, а водород акцептируется фосфорилированным ни-
котинамид-аденин-динуклеотидом (НАДФ) с образованием его восстанов-
ленной формы (стр. 176):
2НАДФ + 2Н2----> 2НАДФ-Н2
Реакция восстановления 3-фосфоглицериновой кислоты приводит к об-
разованию 3-фосфоглицеринальдегида:
СООН
I
2НСОН
СН2О • Н2РО3
З-фосфоглицериновая
кислота
,0
?\н
4- 2НАДФ - Н2----у 2НС0Н + 2НАДФ + 2Н3О,
СН2О • Н2РО3
3-фосфоглицериновый
альдегид
248
З-Фосфоглицериновый альдегид подвергается воздействию изомеразы с об-
разованием диоксиацетонфосфорной кислоты:
с^°
1хн
НСОН 4-------
I
СН2О • Н2РО3
СН2ОН
I
со
I
СН2О • Н2РО3
Диоксиацетонфосфорная кислота
В результате действия фермента альдолазы происходит реакция кон-
денсации с образованием фруктозо-1,6-дифосфорной кислоты
Н2РО3
СН2О •
I
СО
I
СН2ОН
НСОН
I
СН2О • Н2РО3
СН2О . Н2РО3
I
СО
I
НОСН
I
НСОН
I
НСОН
СН2О . Н2РО3
Фруктозо-1, 6-дифосфорная кислота
Из гексозных остатков молекул фруктозо-1,6-дифосфорной кислоты обра-
зуются различные гексозы, из которых синтезируются различные олиго-
и полисахариды (сахароза, крахмал и др.).
Из приведенных данных видно, что утилизация СО2 (в темновой реак-
ции) происходит с использованием энергии АТФ. Установлено, что при све-
товой, фотохимической реакции происходит фосфорилирование АДФ с об-
разованием АТФ. Энергия макроэргических связей АТФ используется в ре-
акции фиксации СО2.
Из листьев шпината изолированы ферменты, катализирующие вне клет-
ки фиксацию углекислого газа с образованием из рибулозо-1,5-дифосфорной
кислоты 3-фосфоглицериновой кислоты. Изолированы также ферменты, с
помощью которых при участии НАДФ-Н2 как восстановительного фактора,
из 3-фосфоглицериновой кислоты образуется 3-фосфоглицериновый альде-
гид, а из него гексозы, олиго- и полисахариды.
Изучение процесса фотосинтеза представляет исключительно большой
интерес. Подсчитано, что растениями используется около 1% солнечной
энергии, достигающей поверхности нашей планеты. Остальная масса (99%)
солнечной энергии, достигающей поверхности Земли, остается неиспользо-
ванной. Годовая продукция органических соединений, возникающих в ре-
зультате фотосинтеза, оценивается примерно в 2-1011 т, и она обеспечивает
потребность людей и животных в пище. Легко понять, что повышение эф-
фективности использования световой энергии солнца должно привести к
колоссальному повышению синтеза органических веществ в растениях, к
повышению урожайности сельскохозяйственных культур.
СИНТЕЗ УГЛЕВОДОВ И ДРУГИХ ВЕЩЕСТВ В РАСТЕНИЯХ
В растениях широко представлены различные углеводы. Как уже
указывалось, в листьях растений при освещении быстро появляется
крахмал. Отсюда следует, что из фосфоглицериновой кислоты, возникаю-
щей при фотосинтезе, образуется глюкоза, которая используется как ма-
териал для синтеза крахмала.
249
n-глюкозофосфорная кислота —» крахмал+ ПН3РО4-
Из глюкозы синтезируется также целлюлоза.
Глюкоза перед тем, как быть использованной для синтеза крахмала и
целлюлозы, фосфорилируется, а затем входит в соединение с уридил-
трифосфорной кислотой с образованием уридиндифосфоглюкозы. Ури-
дилфосфоглюкоза дает начало образованию целлюлозы:
Уридилдифосфорглюкоза—> крахмал (целлюлоза) + уридилдифос-
форная кислота.
Распространенным среди растений дисахаридом является сахароза.
Синтез сахарозы происходит из фосфорилированной глюкозы и из
фруктозы:
Уридилдифосфоглюкоза + фруктоза—>сахароза + уридилдифосфор-
ная кислота
В тех случаях, когда исходным продуктом для синтеза сахарозы явля-
ется глюкоза, она предварительно подвергается фосфорилированию, а за-
тем реагирует с уридилтрифосфорной кислотой.
Глюкоза+АТФ->глюкозо-6-фосфорная кислота 4~ АДФ.
Глюкозо-6-фосфорная кисл ота^=± глюкозо-1 -фосфорная кислота.
Глюкозо-1-фосфорная кислота+уридилтрифосфорная кислота-^ури-
дил дифосфо гл юкоза+Н4Р 2О7.
Биологический смысл предварительного фосфорилирования глюкозы
заключается в том, что для образования глюкозидных связей при синтезе
ди- и полисахаридов необходимы глюкозидфосфатные связи молекул глю-
козофосфорной кислоты.
Из продуктов превращения углеводов в растениях синтезируются жи-
ры, различные спирты, циклические и гетероциклические соединения, а-ке-
токислоты и многие другие соединения. Особенно важен синтез в растениях
а-кетокислот, из которых в результате аминирования возникают различ-
ные а-аминокислоты — компоненты белковых молекул. Синтез а-амино-
кислот в растениях в основном происходит следующим образом. Дикар-
боновая а-кетокислота — а-кето глутаровая кислота, получающаяся из
продуктов обмена углеводов, подвергается восстановительному аминиро-
ванию с образованием глутаминовой кислоты.
СООН • СН2 • СН2 • СО • СООН + 2Н2 + NH3 ->
а-Кетоглутаровая кислота
СООН • СН2 . СН2 • CHNH2COOH + н2О.
Глутаминовая кислота
Глутаминовая кислота, включаясь в реакции переаминирования, отда-
ет свои аминогруппы различным а-кетокислотам с образованием соответ-
ствующих а-аминокислот.
СООН • СН2 • СН2 * CHNH2 • СООН + Я • СО • СООН
-> СООН • СН2 . СН2 . СО • СООН 4- R • CHNH2 • СООН.
Имеющиеся экспериментальные данные показывают, что в зеленых рас-
тениях осуществляются процессы синтеза разнообразных органических
веществ с использованием в качестве первичных продуктов углекислого
газа, воды и аммиака.
250
СИНТЕЗ ОРГАНИЧЕСКИХ ВЕЩЕСТВ У ЧЕЛОВЕКА
И животных
У человека и у животных происходят процессы синтеза различных ор-
ганических веществ. Следует, однако, отметить, что процессы синтеза у
них не столь разнообразны, как в зеленых растениях, и известным образом
ограничены. Прежде всего животные не способны использовать энергию
солнечных лучей для синтеза органических соединений с употреблением
неорганических соединений. Из этого отнюдь не вытекает, что в животном
организме не используется для синтеза углекислый газ, вода и аммиак.
Уже с давних пор известно, что выделяющаяся у человека, млекопитаю-
щих животных, амфибий и рыб мочевина синтезируется из углекислого га-
за, воды и аммиака; применение метода меченых атомов позволило выявить
участие воды, углекислого газа и аммиака в процессах синтеза органиче-
ских веществ — составных частей организма. Введение животным карбо-
натов, меченных С14, позволяет проследить, как различные органические
вещества приобретают радиоактивность, благодаря включению в их состав
углекислого газа. После введения животным тяжелой воды, меченной дей-
терием, последний появляется в составе различных органических соединений.
При введении животным аммонийных солей, меченных стабильным изото-
пом азота (N15), N15 появляется в составе белков и других азотистых соеди-
нений. Все эти данные с несомненностью показывают, что у животных для
синтеза органических соединений используются минеральные вещества—уг-
лекислый газ, вода и аммиак. Было бы, однако, ошибочным считать, что у жи-
вотных и у зеленых растений отсутствуют различия в использовании ми-
неральных веществ для синтетических целей. Различия эти прежде всего
количественного характера. Объем использования углекислого газа, воды
и аммиака для синтеза органических веществ у животных по сравнению с
зелеными растениями незначителен. Далее обращают на себя внима-
ние и различия качественного характера', ряд веществ, синтезирующихся в
растениях, вовсе не синтезируются у человека и у животных, и эти вещест-
ва должны доставляться им в готовом виде с продуктами питания. Так, ор-
ганизмы человека и животных не способны синтезировать ряд аминокислот,
входящих в состав белков, они не могут синтезировать различные витами-
ны и т.д. Отсутствие этих веществ в пище приводит к их гибели.
Животный организм способен синтезировать большое количество соеди-
нений как жирного ряда, так и ароматического ряда. Для синтеза углеводов
в организме легко используются органические молекулы, имеющие в своем
составе три атома углерода — молекулы молочной кислоты, пировиноград-
ной кислоты, глицерина и др. Эти вещества получили название гликогено-
образователей, так как в печени они легко используются для синтеза глико-
гена. Из продуктов превращения углеводов образуются жиры. Широко
известным фактом является превращение в организме углеводов в жиры:
потребление пищи, богатой углеводами, приводит к отложению жира. Из
промежуточных продуктов распада углеводов и жиров синтезируются не-
которые а-кетокислоты: щавелевоуксусная, а-кето глютаровая, пировино-
градная кислоты и некоторые другие; а-кетокислоты, присоединяя к себе
аммиак, превращаются в соответствующие а-аминокислоты. Однако синтез-
а-аминокислот в организме животных не столь разнообразен как в расте-
ниях.
Полный набор аминокислот, необходимый для образования белков,
синтезируется только лишь в зеленых растениях.
Животные способны к синтезу ряда, по далеко не всех, встречающихся
в них циклических соединений. Так, например, животное легко синтези-
рует холестерин, имеющий в своей основе молекулы пергидрафенаптрен-
циклопентана (стр. 99). Применение метода меченых молекул позволило
выявить, что главным материалом, из которого строится молекула холе-
стерина, является уксусная кислота. Пользуясь уксусной кислотой, ме-
251
ценной радиоактивным углеродом (С14) в метильной группе (С14Н3СООН),
и уксусной кислотой, меченной тем же углеродом в карбоксильной группе
(СН3С14ООН), удалось выяснить, как используются атомы углерода уксус-
ной кислоты в синтезе холестерина.
В схематически показанной структуре молекулы холестерина кружоч-
ками обозначены атомы углерода, возникающие из углерода карбоксиль-
ных групп молекул уксусной кислоты, и точками — атомы углерода, об-
разующиеся из углерода метильных групп молекул уксусной кислоты. Из
приведенной схемы легко видеть, что из углерода уксусной кислоты строит-
ся как циклический компонент (пергидрофенантренциклопентан), так и бо-
ковая цепь молекулы холестерина. Приведенная схема показывает, как рас-
полагаются в молекуле холестерина атомы углерода метильных групп и кар-
боксильных групп молекул уксусной кислоты, использованных для синтеза
холестерина.
В деле изучения синтеза холестерина в организме достигнуты большие
успехи. Невыясненным окончательно остается еще вопрос, каким образом
с участием каких ферментов осуществляется этот синтез.
Углеродные атомы холестерина
•—образующиеся из метильных
групп ацетата
о—образующиеся из карбоксиль-
ных групп ацетата
Человек и животные, обладающие способностью синтезировать слож-
ную циклическую структуру холестерина, неспособны к синтезу значи-
тельно менее сложной структуры бензольного ядра. Аминокислота фенила-
ланин, имеющая в своей молекуле бензольное ядро, у них не синтезируется
и должна поступать в организм с белками пищи.
Животное оказывается неспособным осуществлять синтез некоторых
гетероциклических соединений. Так, например, у животных не синтезиру-
ется ядро индола, входящее в состав триптофана, ядро имидазола, входящее
в состав гистидина, и ядро пиридина, входящее в состав никотиновой кис-
лоты и ее производных.
Ядро имидазола
Ядро пиридина
Между тем человек и животные легко синтезируют гетероциклические
соединения — производные пурина и пиримидина, а также производные
пиррола. Особенно легко осуществляется синтез производных пурина у
птиц и рептилий, у которых конечным продуктом азотистого обмена явля-
ется триоксипурин — мочевая кислота. Исследования с применением ме-
252
ченных изотопами молекул позволили выявить вещества, из которых син-
тезируются в организме ядра пурина, пиримидина и пиррола.
Ядро пиримидина
Ядро пиррола
Оказалось, что источником четвертого, пятого и седьмого атомов ядра
пурина является молекула глицина. Источником шестого атома служит уг-
лекислый газ. Второй и восьмой атомы возникают из молекул муравьиной
кислоты. Атомы азота — первый получается из аспарагиновой кислоты,
третий и девятый получаются из амидной группы глутамина. Следователь-
но, в синтезе пуринового ядра участвует несколько веществ. В последнее
время выяснено, в какой последовательности используются при синтезе
вещества, из которых оно строится, и какие при этом образуются проме-
жуточные продукты (стр. 456).
Имеются экспериментальные данные, выявляющие вещества, из кото-
рых синтезируются в организме ядро пиримидина и ядро пиррола. Оказы-
вается, что в синтезе ядра пиримидина участвует карбаминовая и янтарная
кислоты (стр. 545), а в синтезе ядра пиррола — глико кол. Этот синтез
представляет особый интерес, так как пирроловые ядра являются основой
структуры пигмента гемоглобина — гема (стр. 464).
Из приведенных примеров видно, что у животных осуществляется
синтез самых разнообразных веществ. Тем не менее, по своим синтети-
ческим способностям животные уступают зеленым растениям, у которых
осуществляются более разнообразные процессы синтеза.
ЛИТЕРАТУРА
Бриллиант В. А. Фотосинтез как процесс жизнедеятельности растений.
Изд. АН СССР, 1949.
Краснове кий А. А. Фотосинтез растений (биохимические представления).
«Успехи биологической химии», 1950, т. 1, стр. 473.
Кальвин М. Получение и передача энергии при фотосинтезе. Современные
проблемы биофизики, т. I, 1961, ИЛ., М., стр. 191.
Рабинович Е. Фотосинтез, т. 1 и 2, ИЛ., 1951.
Степаненко Б. Н. Работы М. Ненцкого в области химии пирроловых пиг-
ментов. «Успехи биологической химии», т. 2, 1954, стр. 7.
Тимирязев К. А. Избранные работы по хлорофиллу. Изд. АН СССР, 1948.
Глава двенадцатая
ОКИСЛИТЕЛЬНЫЕ ПРОЦЕССЫ
Процессы окисления органических веществ происходят у всех живых
существ. В результате окисления освобождается энергия, необходимая
для их жизнедеятельности. Неудивительно поэтому, что процессы окисления
органических веществ с давних пор привлекают к себе внимание исследова-
телей. Открытие кислорода явилось важным моментом, определившим ход
исследований по изучению процессов окисления органических веществ как
в неорганической, так и органической природе.
В 1756 г. М. В. Ломоносов показал, что металлы при прокаливании уве-
личивают свой вес за счет присоединения к себе каких-то элементов из воз-
духа. Этим был нанесен решительный удар по теории флогистона, господст-
вовавшей в науке в течение продолжительного времени. Согласно этой тео-
рии, все способные к горению вещества содержат «флогистон», улетучиваю-
щийся при горении. Позже, в 1774 г., в результате опытов, проведенных с
большой точностью, Лавуазье пришел к выводу о том, что вещества, под-
вергающиеся горению, присоединяют к себе кислород воздуха. Вследствие
присоединения кислорода к органическим веществам они сгорают с образо-
ванием углекислого газа и воды и с освобождением тепла.
Лавуазье провел ряд исследований по изучению газообмена (потребле-
ния кислорода и выделения углекислого газа) и образованию тепла у живот-
ных. Учитывая, что как при сгорании органических веществ вне организма,
так и при дыхании возникают одни и те же продукты (углекислый газ и вода)
и что в обоих случаях освобождается тепло, Лавуазье пришел к заключе-
нию, что при дыхании и при горении происходит один и тот же процесс сое-
динения кислорода воздуха с углеродом и водородом органических веществ.
Различия в процессах горения органических веществ вне организма
и «горения» их в живых организмах были установлены позже. Прежде все-
го было обращено внимание на то, что «сгорание» органических веществ
вне организма сопровождается большим повышением температуры, возник-
новением пламени, в то время как сгорание органических веществ у живых
существ происходит при более низких температурах и практически не по-
вышает температуру их тела. Вместе с этим привлекало к себе внимание то
обстоятельство, что «горение» органических веществ в организме происхо-
дит в присутствии воды (организмы животных на 65 и выше процентов со-
стоят из воды), хотя вода, как известно, вне организма препятствует горе-
нию органических веществ.
При окислении одного моля глюкозы с образованием углекислого газа
и воды освобождается 686 калорий:
C6Hi2O6 4- 6О2 6СО2 + 6Н2О (+ энергия).
Если бы энергия окисления глюкозы освобождалась в организме
как при горении вне его мгновенно, то окисление даже незначительного ко-
личества молекул было бы достаточным для разрушения структуры клеток.
254
Существует также принципиальное различие в использовании энергии,
освобождающейся при окислении органических веществ. Энергия освобож-
дается при горении органических веществ вне организма, рассеивается в
виде тепловой энергии. Тепловую энергию можно использовать, трансфор-
мируя ее в энергию механическую (энергию движения). Энергия тепловая
может быть использована в паровой машине, в основе работы которой ле-
жит разность температуры. Второй закон термодинамики, в применении
к паровой машине, утверждает, что максимум производимой машиной ра-
боты является функцией разности температуры в системе:
где W — работа; Q — использованное тепло; 7\ и Т2— соответственно вы-
сокая и низкая температуры в системе.
Из приведенного уравнения следует, что если Т2 будет равно Tlt ра-
бота не будет производиться. Так как температура тела теплокровных жи-
вотных постоянна, то освобождающееся тепло не может быть использовано
для работы, не может трансформироваться в энергию механическую. У жи-
вых существ энергия, освобождающаяся при окислении органических ве-
ществ, аккумулируется в макроэргических связях аденозинтрифосфорной
кислоты, а затем используется при синтезах различных веществ, для рабо-
ты мышц, сердца и иных органов. Аккумулирование энергии, освобождаю-
щейся при окислении органических веществ, в макроэргических связях
аденозинтрифосфорной кислоты является процессом, имеющим общебиоло-
гическое значение. Клетки и ткани приспособлены к использованию именно
этого вида химической энергии для покрытия своих энергетических затрат.
Своеобразие окислительных процессов в живых организмах создается
наличием ряда ферментов, катализирующих отдельные этапы окислитель-
ного распада органических веществ.
РЕАКЦИИ ОКИСЛЕНИЯ И ВОССТАНОВЛЕНИЯ
Окисление раньше рассматривалось как процесс присоединения к ве-
ществу кислорода. Так как при горении некоторых веществ образуются
ангидриды кислот (SO2, SO3, Р2О3, Р2О5 и др.), то горение рассматривали
как процесс окисления, и все химические реакции, сопровождающиеся обо-
гащением веществ кислородом, стали относить к окислительным реакциям.
Как пример реакции окисления органического вещества можно привести
окисление альдегидов:
R • + О -> Я • C<f
^Н Х)Н
Однако по мере изучения реакций окисления выяснилось, что они чаще
всего сопровождаются отдачей органическими молекулами водорода. В слу-
чае окисления альдегидов эта отдача водорода заключается в том, что к мо-
лекуле альдегида присоединяется молекула воды, а затем отдается молеку-
ла водорода. Иными словами, окисление альдегидной группы происходит
за счет кислорода воды.
4" Н2О — Н2->- R • С<
\)Н
В случае спиртов и оксикислот окисление возможно при непосредствен-
ной отдаче их молекулами водорода:
✓О
R • СН2ОН — FL, -> R • С< .
\Н
255
Далее было обращено внимание на реакции окисления, в которых нет
ни отдачи водорода, ни присоединения кислорода. Примером такой реакции
окисления может служить следующая:
2KJ + 2FeCl3 2КС1 + 2FeCl2 + J2.
В этой реакции отрицательно заряженные ионы хлора и положительно
заряженные ионы калия не изменяются и они поэтому могут быть опущены,
и уравнение реакции окисления можно представить следующим образом:
2J- + 2Fe3+ J2 + 2Fe2+.
Это уравнение показывает, что окисление осуществляется путем пере-
несения электронов (е") от ионов йода на ионы железа (ферри). В результа-
те этого происходит окисление йодида в йод: 2J~—2е-> J2 и восстановление
ферри-иона в ферро-ион: 2Fe3++2e~->2Fe2+.
Следовательно, окисление сопровождается потерей одними молекулами
электронов, а восстановление — присоединением к другим молекулам элек-
тронов.
В случаях биологического окисления (это имело место и при окислении
йода) электроны не появляются в свободном виде, а переносятся на другие
молекулы. Поэтому окисление одного какого-либо вещества (потеря им
электронов) сопровождается восстановлением (присоединением электро-
нов) другого вещества. Иными словами, реакции окисления в организме со-
провождаются реакциями восстановления. С этим фактом всегда встреча-
ются при изучении окислительных процессов в живых организмах. Отсюда
и возникло название оксидоредукция, которое, между прочим, применимо
не только к процессам окисления, протекающим в организмах, но и к окис-
лительным процессам, протекающим и вне их.
У живых существ обычно (исключением являются некоторые бактерии,
окисляющие аммиак, сероводород и железо) окислению подвергаются орга-
нические вещества. Как в этих случаях осуществляется окисление путем
отдачи электронов и восстановление путем присоединения электронов?
Как уже указывалось выше, при окислении органических молекул ими
отдается водород; отщепленные атомы водорода присоединяются к дру-
гим веществам, восстанавливая последние. Так как атом водорода построен
из одного протона (Н+) и одного электрона (е~), перенесение атомов водоро-
да включает в себя отдачу протонов и перенесение электронов. Так, на-
пример, реакцию окисления спиртов и альдегидов можно представить себе
таким образом:
,0
R • СН2ОН — 2Н+ — 2е“ -> R • ;
R‘C? + Н20 — 2IP — 2е*-> R •
^ОН
Приведенные уравнения показывают, что перенесение атомов водорода
сопровождается перенесением электронов и отдачей протонов и катализи-
руется в организмах ферментами — дегидрогеназами (стр. 175). При их
участии водород многократно переносится от одного вещества на другое,
пока не достигнет своего окончательного акцептора, подвергающегося вос-
становлению. У организмов, жизнедеятельность которых невозможна в от-
сутствие кислорода, основным акцептором водорода (электрона и протона)
является кислород. В перенесении электронов от дегидрогеназ к кислороду
участвуют цитохромы, причем конечная реакция присоединения электро-
нов и протонов к кислороду, в результате которой образуется вода, катали-
зируется ферментом цитохромоксидазой.
Вне организма присоединение водорода к кислороду является резко
выраженной экзотермической реакцией, сопровождающейся освобождением
256
около 68 килокалорий на моль образовавшейся воды. Окисление органиче-
ских веществ сопровождается значительным повышением температуры.
Между тем окисление органических веществ (углеводов, жиров, белков и
др.) в живых организмах происходит без повышения температуры и не тре-
бует предварительного нагрева. Важным моментом в действии окислитель-
ных ферментов является то, что они катализируют реакции окисления и
восстановления при низких температурах, свойственных живым организ-
мам.
Суммируя, можно заключить, что окисление различных по своей хими-
ческой природе органических веществ у живых существ сводится к фермен-
тативному перенесению электронов и отдаче протонов от молекул веществ,
подвергающихся окислению, к молекулам веществ, подвергающихся вос-
становлению. В результате перенесения водорода от одних веществ к дру-
гим освобождается потенциальная энергия окисляющихся веществ. Наи-
большим энергетическим эффектом сопровождается перенесение водорода к
кислороду, когда кислород является конечным акцептором водорода.
ТЕОРИИ ОКИСЛИТЕЛЬНЫХ ПРОЦЕССОВ
Современные представления о процессе биологического окисления (см.
схему на стр. 261) сложились не сразу. Начиная с 60-х годов прошлого сто-
летия неоднократно появлялись теории, пытавшиеся вскрыть сущность про-
цессов окисления органических соединений у животных и растений.
Среди этих теорий особое место принадлежит теориям А. Н. Баха и
В. И. Палладина.
Теория, выдвинутая А. Н. Бахом в 1897 г., касается пути включения
атмосферного кислорода в окислительные процессы, происходящие в орга-
низмах. Она разъясняет, каким путем атмосферный кислород, инертный
вне организма, становится активным в окислении органических веществ в
организме.
Согласно этой теории, кислород воздуха О—О реагирует с легко окисляемыми
веществами с образованием перекисей. Эти вещества были обозначены буквой А. Ре-
акция их с кислородом происходит следующим образом:
/О
А + О = О -> А< |
^О
Образующиеся перекиси отдают свой кислород трудно окисляемым веществам
/О
А<^ | + органическое вещество -> продукт окисления 4- А.
^О
Бах считал, что активирование кислорода является ферментативным процессом.
Легкоокисляемые вещества клеток (А) он назвал оксигеназами. Освобождение кисло-
рода из перекисей и окисление им трудно окисляемых веществ происходит с по-
мощью ферментов пероксидаз.
Таким образом, путь использования кислорода в клетках лежит через образова-
ние перекисей. Отсюда теория Баха получила название «перекисной теории окисле-
ния». Эта теория основное- значение в процессе биологического окисления придает
механизму активирования кислорода.
Теория А. II. Баха получила свое дальнейшее развитие в исследованиях О. Вар-
бурга, а затем Кейлина, выявивших наличие в тканях цитохромоксидазы (Варбург)
и цитохромов (Кейлин), участвующих в процессах использования кислорода в организ-
мах, жизнедеятельность которых протекает в аэробных условиях.
Теория, выдвинутая в 1908—1912 гг. В. И. Палладиным, в процессах
биологического окисления особое значение приписывает водороду.
Согласно этой теории, в окислении органических веществ участвуют вещества,
широко распространенные в растениях — пигменты (хромогены). Пигменты во время
окисления легко обесцвечиваются благодаря присоединению к ним водорода, а затем
при отщеплении от них водорода снова окрашиваются. Эти пигменты были названы
9 Заказ № 581 257
Палладиным «дыхательными хромогенами». Исходя из теории Палладина, процессы
окисления органических веществ могут протекать в отсутствие кислорода. В этом слу-
чае отщепляющийся водород акцептируется пигментами, а с них переносится на другие
вещества, подвергающиеся восстановлению (при спиртовом брожении, например, на
уксусный альдегид с образованием этилового спирта). При отсутствии акцепторов
водорода восстановленные пигменты остаются обесцвеченными. В присутствии кислоро-
да и при наличии соответствующих ферментов водород от восстановленных пигмен-
тов акцептируется кислородом. Следовательно, по теории Палладина, атмосферный
кислород при окислении органических веществ не взаимодействует непосредственно
с ними, а окисляет отщепляющийся от них водород.
Исследования В. И. Палладина показали, что вещества, окисляющиеся
в растениях в присутствии кислорода, могут подвергнуться окислению
также и в отсутствие кислорода, если к среде, в которой происходит окисле-
ние, добавить раствор определенных красителей, акцептирующих водород,
например раствор метиленовой сини. Окисление веществ происходит до тех
пор, пока метиленовая синь, в результате присоединения к ней водорода,
полностью не обесцветится.
Основное содержание теории В. И. Палладина вытекает из предложен-
ных им двух уравнений окисления глюкозы:
(1) С6Н12О6 + 127? ± 6Н2О -> 6СО2 + 127?Н2 и
(2) 127?Н2 + 6О2-^ 127? + 12Н2О.
Из первого уравнения следует, что окисление глюкозы может проте-
кать при наличии акцепторов водорода (7?) в отсутствие кислорода, т.е. в
анаэробных условиях. Кислород, необходимый для образования углекис-
лого газа из подвергающейся окислению глюкозы, берется из воды. Про-
цессы анаэробного окисления глюкозы катализируются дегидрогеназами.
В присутствии кислорода, т.е. в аэробных условиях, кислород исполь-
зуется для окисления восстановленных акцепторов водорода, как это пока-
зывает второе уравнение. Следовательно, аэробному окислению подверга-
ется водород.
Теория Палладина приложима к процессам окисления органических
веществ не только с участием пигментов в растениях, но и в организмах
животных. Там в качестве акцепторов водорода выступают не пигменты,
а другие соединения, возникающие в результате процессов обмена ве-
ществ. Точно так же и в растениях акцепторами водорода могут служить и
не пигменты.
Теория Палладина получила в дальнейшем свое подтверждение в рабо-
тах ряда исследователей, особенно в работах Виланда, установившего воз-
можность анаэробного окисления вне организма спиртов с образованием
альдегидов и альдегидов с образованием кислот.
Вскоре после опубликования В. И. Палладиным основных взглядов, ознамено-
вавших, по его выражению, «водородный период в изучении биохимии дыхания»,
Виланд выступил со своей теорией значения водорода в процессах окисления органи-
ческих веществ. В этой теории нашло свое дальнейшее развитие представление Пал-
ладина о механизме биологического окисления. Следует, однако, отметить, что Виланд
в течение продолжительного времени считал, что биологическое окисление осуще-
ствляется действием одного только фермента дегидрогеназы, под влиянием которого от
субстрата, подвергающегося окислению, отщепляется водород. Этот водород, полагал
он, может затем восстанавливать любое вещество, в том числе и молекулярный кисло-
род. Промежуточные акцепторы водорода в биологическом окислении, а также про-
цесс активирования молекулярного кислорода теорией Виланда не были предусмот-
рены.
Как пример реакции окисления, укладывающегося в рамки окисли-
тельной теории Палладина, можно привести окисление янтарной кислоты с
образованием фумаровой кислоты.
Янтарная кислота, весьма устойчивая к окислению вне организма,
легко окисляется в тканях благодаря наличию в них фермента сукциндеги-
дрогеназы. Это окисление может происходить в тканях при отсутствии кис-
255
лорода, при добавлении к ним раствора метиленовой сини (МС). Метиле-
новая синь при этом акцептирует водород и обесцвечивается.
СООН СООН
сн2 + МС 1 сн
1 > II
сн2 — 2На — 2е- сн
СООН 1 СООН
ч- мсн2.
В присутствии кислорода окисление янтарной кислоты протекает сле-
дующим путем:
СООН СООН
I I
СН2 —2Н+ - 2е СН
|--------------> II + Н2О.,
СН2 +V2o2 СН
I
СООН СООН
Янтарная кислота Фумаровая кислота
Теория В. И. Палладина объясняет хорошо известное в органическом
мире явление: жизнь многих микроорганизмов без потребления кислорода,
так называемых анаэробов. Энергия, необходимая для жизнедеятельности
анаэробов, освобождается при окислении органических веществ. Акцепто-
рами водорода при окислении являются у них те или иные органические
соединения, возникающие при реакциях распада органических веществ пи-
щи. При окислении питательных веществ у анаэробов, естественно, не об-
разуется вода, а восстанавливаются органические молекулы, акцептирую-
щие водород (в результате акцептирования водорода пировиноградная кис-
лота превращается в молочную кислоту у бактерий молочно-кислого бро-
жения, уксусный альдегид превращается в этиловый спирт у дрожжей и
т. д.).
ФЕРМЕНТЫ ДЫХАНИЯ
Различные клетки и ткани способны потреблять кислород и выделять
углекислый газ, т.е. способны дышать. При дыхании в клетках и тканях
окисляются питательные вещества с образованием конечных, полностью
окисленных, соединений — воды и углекислого газа. Процессы окисления
органических веществ в клетках и тканях катализируются многочислен-
ными ферментами. В седьмой главе (стр. 175—178) приведены данные о хи-
мической природе ряда окислительных ферментов, являющихся по своей
структуре двухкомпонентными ферментами. Для того чтобы ясно предста-
вить себе окислительные процессы в клетках и тканях, необходимо разоб-
раться в механизме и последовательности действия этих ферментов.
Начальный этап окисления органических веществ в клетке начинается
с действия дегидрогеназ, у которых коферментом являются никотинамид-
аденин-динуклеотиды (НАД и НАДФ). К ним присоединяется водород (элек-
троны и протоны) от подвергающихся окислению веществ:
Молекула окисляющегося
вещества
— 2Н+ + 2е + НАД (или НАДФ)
—> Молекула окисленного вещества + НАД-Н2 (или НАДФ-Н2),
От НАД-Н2 (или НАДФ-Н2) водород переносится на флавин-аденин-ди-
нуклеотид (ФАД) — кофермент желтых окислительных ферментов:
НАД-Н2 + ФАД НАД + ФАД-Н2.
Затем водород от ФАД-Н2 переносится на другие соединения (акцепто-
ры водорода) и на конечном этапе он акцептируется кислородом.
9*
259
При действии оксидаз (стр. 177) водород от окисляющихся веществ не-
посредственно переносится на кислород.
В перенесении водорода к кислороду участвуют цитохромы (стр. 261) и
цитохромоксидаза — геминсодержащий фермент, открытый Варбургом и
названный им «дыхательным ферментом».
При действии цитохромоксидазы от двух молекул восстановленного
цитохрома «а» переносятся на молекулу кислорода 4 электрона и отдаются
4 протона:
цитох ромо ксид я за
2 цитохром — Fe3+-------------2 цитохром — Fe2+ 4- 2Н2О.
— 4Н+ — 4е4- О?
СХЕМА АНАЭРОБНЫХ И АЭРОБНЫХ ОКИСЛИТЕЛЬНЫХ
ПРОЦЕССОВ
Из изложенного выше видно, как происходит окисление органических
веществ в клетках и тканях. Окисление органических веществ в клетках
обычно начинается с действия анаэробных дегидрогеназ. К коферменту де-
гидрогеназы присоединяются отщепляющиеся от окисляющегося вещества
электроны и протоны. Кофермент при этом восстанавливается. Затем от не-
го электроны и протоны переносятся на иное вещество — акцептор. Этот
акцептор водорода может оказаться временным, промежуточным, и в этом
случае от него электроны и протоны будут переноситься дальше на новое
вещество. Странствование электронов и протонов от одного вещества к дру-
гому совершается до тех пор, пока они не достигнут конечного акцептора
водорода.
Путь передвижения водорода при анаэробном окислении может иметь
различную длину, по независимо от длины он заканчивается присоедине-
нием двух электронов и двух протонов к конечному акцептору. При спир-
товом брожении конечным акцептором водорода является уксусный аль-
дегид, восстанавливающийся в этиловый спирт. Этиловый спирт в анаэроб-
ных условиях в дрожжах дальше не окисляется и выделяется из клеток в
окружающую среду. То же самое можно сказать о молочнокислом броже-
нии. где конечный акцептор водорода — пировиноградная кислота — вос-
станавливается в молочную кислоту и т.д.
Новым моментом, характерным для аэробного окисления, является
участие в нем, кроме анаэробных дегидрогеназ, еще и флавиновых фермен-
тов, цитохромов и цитохромоксидазы. В этом случае путь странствования
водорода (электронов и протонов) к конечному акцептору (к кислороду)
становится более длинным.
При аэробном окислении водород от восстановленных коферментов
(НАД-Н2 и НАДФ-Н2) в виде электронов и протонов переносится на осо-
бый флавиновый фермент, получивший название диафоразы, и при этом его
флавиновый кофермент (ФАД) восстанавливает цитохромную систему, ко-
торая является посредником между восстановленными коферментами фла-
виновых ферментов и кислородом.
Обратимое окисление и восстановление цитохромов осуществляется из-
менением валентности железа, входящего в состав их небелкового компо-
нента — гемина. В окисленных цитохромах железо трехвалентно (Fe3+),
в восстановленных цитохромах оно двухвалентно (Fe2+). Присоединяя элек-
трон, Fe3+ переходит в F2+ и. наоборот, Fe2+, теряя электрон, переходит в
Fe3+. Интересно указать, что изменение валентности железа в цитохромах
не сопровождается одновременным присоединением или отщеплением про-
тона. Поэтому цитохромы являются переносчиками электронов, но не пере-
носчиками водорода, т.е. электрона и протона (Н+). В результате действия
цитохромоксидазы происходит окисление цитохромной системы при одно-
временном восстановлении кофермента цитохромоксидазы. Сущность этой
реакции заключается в том, что активированный водород, т.е. водород без
260
электрона, соединяется с активирован-
ным цитохромоксидазой кислородом, име-
ющим отрицательный заряд за счет
электрона окисляемого вещества. Этот
электрон проходит большой путь через
сложную систему, включающую дегидроге-
назу, систему цитохромов и цитохромокси-
дазы. При этом имеет место конечная, за-
вершающая реакция — окисление восстанов-
ленного кофермента цитохромоксидазы
кислородом с образованием воды. Таков пол-
ный путь странствования водорода от подвер-
гающихся окислению веществ к главному
акцептору водорода в клетках и тканях аэро-
бов — кислороду.
Этот путь можно представить следую-
щей схемой (рис. 11). Приведенная схема
показывает, как, исходя из современных
данных, сочетаются между собой теория
В. И. Палладина, согласно которой главен-
ствующее значение в процессах окисления
принадлежит водороду, и теория А. Н. Ба-
ха, придающая главное значение в процес-
сах окисления кислороду.
Аэробное окисление органических ве-
ществ может происходить без участия ана-
эробных дегидрогеназ, системы цитохромов
и цитохромоксидазы (с помощью аэробных
дегидрогеназ). В этих случаях от окисля-
ющихся веществ электроны и протоны пере-
носятся на кофермент флавиновых фермен-
тов, а от восстановленного кофермента они
переносятся на кислород с образованием пе-
рекиси водорода. Путь странствования водо-
рода здесь короткий.
В тканях животных, растений и микро-
организмов обнаружена еще одна окисли-
тельно-восстановительная система, участву-
ющая в системе перенесения водорода к
кислороду. Активным компонентом этой сис-
темы является нерастворимое в воде хино-
идной структуры вещество (липид), получив-
шее название убихинона. Химическая струк-
тура его следующая:
ССН3
С(СН2—СН = С—СН2)ЛН
СОН
Рис. 11. Схема передвижения водорода к кислороду
СОН
261
Боковая цепь молекулы убихинона состоит из изопреноидных единиц,
количество их варьирует в зависимости от биологического объекта. В тка-
нях животных убихинон имеет в своем составе 10 изопреноидных единиц.
Окислительно-восстановительная система с убихиноном активна в пе-
реносе электронов на одном из финальных этапов окисления водорода кис-
лородом.
Интересно сопоставить между собой объем аэробного окисления ор-
ганических веществ в организме животных при участии оксидаз, цито-
хромов и цитохромоксидазы и без их участия*. Экспериментальные данные
показывают, что свыше 90% потребляемого тканями кислорода восстанав-
ливается с образованием воды при участии цитохромов и цитохромоксидазы
и только лишь 5—7% кислорода восстанавливается без их участия с обра-
зованием перекиси водорода.
Возникающая в клетках и в тканях организма перекись водорода, под-
вергаясь воздействию каталазы, расщепляется на воду и молекулярный
кислород:
2Н2О2 2Н2О + О2.
ОБРАЗОВАНИЕ УГЛЕКИСЛОГО ГАЗА
Начиная с работ Лавуазье, некоторое время было широко распростра-
нено мнение о том, что углекислый газ образуется в результате присоедине-
ния вдыхаемого кислорода к атомам углерода, подвергающихся окислению
органических веществ. Однако более детальное изучение окислительных
процессов в живых организмах опровергло это мнение. Прежде всего было
обращено внимание на то, что при спиртовом брожении, при котором проис-
ходит анаэробный распад глюкозы, наряду со спиртом получается и выде-
ляется углекислый газ. В этом случае говорить об образовании углекислого
газа за счет присоединения кислорода к углероду глюкозы совершенно не
приходится. Оказалось далее, что и при аэробном распаде органических
веществ образование углекислого газа происходит без присоединения к их
углероду кислорода.
Образование углекислого газа происходит в результате отщепления
от органических кислот карбоксильных групп, или, как принято говорить,
их декарбоксилирования. Декарбоксилирование кислот катализируется
ферментами декарбоксилазами.
При спиртовом брожении образование углекислого газа происходит
в результате декарбоксилирования пировиноградной кислоты
сн3 • СО • СООН—со2 -> сн3 • С<
хн
которое катализируется декарбоксилазой, открытой Нейбергом. Сущест-
вуют декарбоксилазы, катализирующие выделение углекислого газа из
аминокислот с образованием аминов:
R—CHNH2COOH—СО2 -> R~CH2NH2.
Образование углекислого газа из аминокислот животных происходит в
ограниченном объеме, более широко оно известно у бактерий.
В тканях животных в большом объеме декарбоксилируются кетокисло-
ты, возникающие как промежуточные продукты распада различных орга-
нических веществ. Декарбоксилирование а-кетокислот обычно там протека-
ет окислительным путем с образованием углекислого газа и соответствую-
щая
щих кислот. Схематически подобное декарбоксилирование можно предста-
вить следующим уравнением:
Я—СО-СООН + н2о—н2 -> я-соон + со2.
Изложенные выше данные приводят к заключению, что образование
углекислого газа является результатом декарбоксилирования кислот. Меж-
ду тем изучение дыхания животных, а также растений показывает, что меж-
ду поглощением кислорода и выделением углекислого газа существует пря-
мая зависимость: чем больше организм поглощает кислорода, тем больше
он выделяет углекислого газа.
Объясняется это тем, что а-кетокислоты образуются из органических
веществ пищи — углеводов, жиров и аминокислот, в результате их окисле-
ния. Так как главным акцептором водорода при окислении этих веществ
является кислород воздуха, то понятно, что без потребления кислорода не
могут получаться а-кетокислоты, служащие материалом для образования
углекислого газа.
АКТИВНОСТЬ ДЫХАНИЯ ТКАНЕЙ И ОРГАНОВ
Активность дыхания организма измеряется количеством потребленного
кислорода воздуха и выделенного в воздух углекислого газа. Так как меж-
ду потреблением организмом кислорода и выделением углекислого газа су-
ществует прямая зависимость, то об интенсивности дыхания можно судить
по количеству потребленного организмом кислорода.
Интенсивность дыхания организма зависит от ряда условий. Известно,
например, что при работе организм потребляет больше кислорода, чем при
покое. При понижении температуры воздуха увеличивается потребление
организмом кислорода. Гормон щитовидной железы, тироксин, повышает
интенсивность потребления кислорода и т.д.
Поступающий через легкие кислород доставляется кровью к различ-
ным органам и тканям — к местам его потребления. Об интенсивности по-
требления кислорода тем или иным органом можно судить по содержанию
кислорода в крови, притекающей (артериальной) к данному органу, и в кро-
ви, оттекающей (венозной) от него. Учитывая разность в содержании кис-
лорода в артериальной и венозной крови, так называемую артериовенозную
разницу содержания кислорода, а также скорость кровообращения в тече-
ние известного промежутка времени для данного органа, можно получить
представление о количестве потребленного им кислорода, следовательно, об
интенсивности его дыхания.
Интенсивность потребления тканями кислорода можно изучать вне ор-
ганизма, в опытах in vitro. С этой целью из органов и тканей готовятся тон-
кие срезы, которые с добавлением питательной жидкости помещаются в ре-
акционные сосудики манометрического прибора (аппарата Варбурга). Об
объеме дыхания в таких опытах судят по показаниям манометров аппарата.
В них находится О2, который при поглощении его тканью приводит к изме-
нению уровня слоя жидкости. Выделяющийся при дыхании углекислый газ
поглощается раствором щелочи, поэтому объем газов в сосудиках при ды-
хании уменьшается. Техника работы по изучению дыхания тканей, по Вар-
бургу, описывается в практических руководствах по биохимии.
Экспериментальные данные показывают, что интенсивность дыхания
различных тканей неодинакова. Обычно мерилом интенсивности дыхания
служит Qo2, который равняется миллилитрам О2, потребленным одним мил-
лиграммом ткани (на сухой вес) в течение определенного времени, напри-
мер одного часа. Ниже приводятся величины Qo2 для срезов различных тка-
ней, помещенных в питательную среду (рингер-фосфатный раствор+глю-
коза).
263
Т кань Qq2
Сетчатка глаза ........... 31
Почки .................... 21
Печень . . ............... 17
Слизистая тонкого кишеч-
ника .................... 15
Щитовидная железа . . . . 13
Семенные железы........... 12
Гипофиз................... 12
Кора мозга................ 12
Селезенка................. 12
Надпочечники ............. 10
Эритроидный костный мозг 9
Легкие .................... 8
ТканЬ QOg
Плацента............... 7
Миэлоидный костный мозг . 6
Зобная железа.......... 6
Поджелудочная железа . . 6
Диафрагма ................... 6
Сердце ...................... 5
Лимфатические узлы . . 4
Скелетные мышцы .... 3
Роговица глаз ............... 2
Кожа ....................... 0,8
Линза глаза........... 0,5
Изучение дыхания тканей в опытах, проводимых вне организма, позво-
ляет выявить, какие именно вещества потребляются, т. е. окисляются в тка-
нях, и какие условия необходимы для их окисления. В подобных опытах,
в частности, можно доказать значение цитохромов и цитохромоксидазы для
дыхания тканей.
Синильная кислота и ее соли (цианиды) в самых незначительных коли-
чествах интенсивно тормозят потребление кислорода тканями. Объясняется
это тем, что цианиды связывают атомы железа в геминовых молекулах ци-
тохромов и этим прекращают перенесение электронов на кислород, исклю-
чая возможность использования его тканями как акцептора электронов и
протонов. В силу этого цианиды являются сильнейшим ядом для человека
и животных. Ткани, отравленные цианидами, потребляют незначительное
количество кислорода (5—7% обычного) благодаря активности некоторых
аэробных дегидрогеназ, катализирующих перенесение электронов и про-
тонов на кислород, минуя цитохромы и цитохромоксидазу. Подобное по-
требление кислорода носит название цианрезистентного дыхания.
ЛИТЕРАТУРА
Б а х А. Н. Химизм процессов дыхания. 3-е Тимирязевское чтение. Киргосиздат,
1942.
'Л а р д и Г. Дыхательные ферменты. ИЛ, 1952.
Л ь в о в С. Д. Основные направления в историческом развитии учения о дыха-
нии растений. 8-е Тимирязевское чтение. Изд. АН СССР, 1950.
М и х л и н Д. М. Биохимия клеточного дыхания. Изд. АН СССР, 1960,
Глава тринадцатая
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
Как уже указывалось, энергия, освобождающаяся при окислении орга-
нических веществ, не сразу используется клетками и тканями организма,
а резервируется в макроэргических связях аденозинтрифосфорной кислоты.
Известны многочисленные факты, подтверждающие существование свя-
зи между процессами окисления и процессами связывания неорганического
фосфата, т.е. фосфорилирования органических молекул. В опытах по изу-
чению дыхания изолированных из организма тканей установлено, что
интенсивность дыхания может быть усилена прибавлением к питательной
среде неорганического фосфата и аденозиндифосфорной кислоты. Одновре-
менно с усилением дыхания наблюдается устранение неорганического фос-
фата и синтез аденозинтрифосфорной кислоты. Усиливается потребление
кислорода тканями при прибавлении к питательной среде неорганического
фосфата, минимального количества аденозиндифосфорной кислоты и боль-
шего количества креатина. В этом случае усиление дыхания сопровожда-
ется образованием креатинфосфорной кислоты. Роль креатина заключается
в том, что он акцептирует фосфорную кислоту от синтезирующейся при ды-
хании аденозинтрифосфорной кислоты. Акцепторами фосфата аденозинтри-
фосфорной кислоты могут служить и другие вещества (например глюкоза,
глицерин).
Во всех случаях из аденозинтрифосфорной кислоты возникает адено-
зиндифосфорная кислота, которая снова затем включается в процесс окис-
лительного фосфорилирования, присоединяя к себе фосфорную кислоту.
В некоторых случаях связь между фосфорилированием и окислением
детально выяснена. Это можно видеть на примере окисления промежуточ-
ного продукта распада углеводов фосфоглицеринальдегида. Несколько схе-
матизируя (более подробно о пути окисления фосфоглицеринальдегида ска-
зано на стр. 296), окисление фосфоглицеринальдегида можно представить
себе следующим образом:
I ХН
НСОН 4-
I
CIkO-H2POs
С-О-Н9РО3
I
НО-НоРОз—Ik ->нсон
I
СН2О-ЩРО3
Окисление здесь происходит с участием фосфорной кислоты: фосфогли-
церинальдегид превращается в 1,3-дифосфоглицериновую кислоту, причем
энергия окисления появляется в макроэргической карбоксилфосфатной
связи 1,3-дифосфоглицериновой кислоты.
265
От 1,3-дифосфоглице-
р и новой кислоты, с помо-
щью фермента фосфофе-
разы, фосфатный остаток
переносится на аденозин-
дифосфорную кислоту:
С~О-Н2РО3
НСОН
I
СН2О-Н2РО3
+ АДФ->
сч
| ХОН 4- АТФ
НСОН
СН2О-Н2РО3
В этом случае говорят
об окислительном фосфо-
рилировании на субст-
ратном уровне, так как
известен субстрат (1,3-фос-
фоглицериновая кислота),
от которого фосфатный ос-
таток с помощью фосфофе-
разы переносится на аде-
нозиндифосфорную кис-
лоту.
Наряду с фосфори-
лированием на субстрат-
ном уровне различают
фосфорилирование адено-
зиндифосфорной кислоты,
сопряженное с аэробным
окислением органических
веществ, точнее, с процес-
сом перенесения водорода
(электронов) от подверга-
ющихся окислению моле-
кул органических веществ
на кислород с образовани-
ем воды. Процесс аэробно-
го окислительного фосфо-
рилирования, играющий
особенно важную роль в
энергетических явлениях,
происходящих в клетке,
был открыт В. А. Энгель-
гардтом и В. А. Белице-
ром и изучен ими и други-
ми исследователями.
При изучении процессов биологического окисления (стр. 261) указы-
валось, что электроны, попарно отщепляющиеся от органических веществ
при их окислении, переносятся на кислород не сразу, а через ряд промежу-
точных этапов. На каждом этапе перенесения пары электронов освобожда-
ется некоторое количество энергии. В настоящее время установлено, что
266
на трех определенных этапах пути перенесения пары электронов к кисло-
роду освобождающаяся энергия используется для фосфорилирования адено-
зиндифосфор ной кислоты с образованием аденозинтрифосфорной кислоты.
Иными словами, при использовании одного атома кислорода в реакциях
аэробного окисления (2е+2Н++О->Н2О) фосфорилируются три молеку-
лы аденозиндифосфорной кислоты (ЗАДФ+ЗН3РО4~>ЗАТФ). Эти этапы
отмечены стрелками на приведенной схеме (рис. 12).
Большой интерес представляет вопрос, в каком объеме энергия, осво-
бождающаяся при аэробном окислении органических веществ, аккумули-
руется в макроэргических связях аденозинтрифосфорной кислоты? Чтобы
разобраться в этом вопросе, возьмем в виде примера аэробное окисление
глюкозы: СбН2Об+6О2~>6СО2+6Н2О. Из приведенного уравнения видно,
что при окислении моля глюкозы (180 г) потребляется 12 грамм-атомов кис-
лорода. Использование одного грамм-атома кислорода (акцептирование им
электронов и протонов) сопровождается фосфорилированием трех молей
аденозиндифосфорной кислоты с образованием трех молей аденозинтри-
фосфорной кислоты. Отсюда при использовании 12 грамм-атомов кислорода
фосфорилируются 36 молей аденозиндифосфорной кислоты с образованием
36 молей аденозинтрифосфорной кислоты, т. е. возникает 36 эквивалентов
макроэргических фосфатных связей.
В каждом эквиваленте макроэргической фосфатной связи сосредоточе-
но, примерно, 10 килокалорий1. В 36 эквивалентах—360 килокалорий.
Энергетическая ценность моля глюкозы составляет 720 килокалорий
(180x4—720). Из них 360 килокалорий, т. е. 50%, используются для образо-
вания макроэргических фосфатных связей. Энергия этих связей использу-
ется в процессах жизнедеятельности клетки. Она превращается в клетке
в иные виды энергии (механическую, электрическую), она используется для
различных синтетических процессов.
Процессы окисления и фосфорилирования можно экспериментальным
путем разобщить. Отравление изолированных из организма тканей или от-
равление всего организма животного динитрофенолом, азидом натрия, а
также введение в организм больших доз тироксина и некоторых других
веществ приводит к тому, что аэробное окисление органических веществ
в них происходит в полном объеме, а иногда даже повышается, в то время
как процессы фосфорилирования подавляются. В этих случаях при окис-
лении органических веществ, например углеводов, при использовании од-
ного грамм-мол я кислорода образуется не три макроэргических связи, а
значительно меньше. Основная масса освобождающейся при окислении
энергии рассеивается в виде тепловой энергии и, следовательно, ускользает
от рационального использования тканями организма.
ФАКТОРЫ, РЕГУЛИРУЮЩИЕ ОКИСЛЕНИЕ ВЕЩЕСТВ
В ОРГАНИЗМЕ
Изучение окислительного фосфорилирования указало на наличие ряда
факторов, регулирующих интенсивность клеточного дыхания, т. е. потреб-
ления клеткой кислорода.
Мы видели, что использование клеткой кислорода находится в тесной
связи с реакцией фосфорилирования аденозиндифосфорной кислоты
(АДФ гН3РО4->АТФ). Установлено, что добавление к митохондриям (в
них сосредоточены окислительные ферменты и ферменты окислительного
фосфорилирования) АДФ и Н3РО4 усиливает окисление в них органиче-
ских веществ (кетоглютаровой кислоты и др.). Следовательно, необходимым
1 Макроэргическая фосфатная связь по данным различных авторов при своем
разрыве освобождает от 8000 до 12500 кал.
267
моментом, регулирующим дыхание клетки, является наличие в ней адф
и Н3РО4. Можно полагать, что избыточное фосфорилирование АДФ при
недостаточном дефосфорилировании АТФ автоматически выключает клеточ-
ное дыхание.
Снижается активность клеточного дыхания в случае разобщения про-
цессов окисления и фосфорилирования. Тироксин в больших концентраци-
ях разобщает процессы дыхания и фосфорилирования и тем самым наруша-
ет процесс эффективного использования клеткой кислорода. Дикумарин
(стр. 266) также разобщает процессы окисления и фосфорилирования, причем
витамин К предохраняет клетку от подобного действия дикумарина.
Клеточное дыхание зависит от снабжения клетки питательными веще-
ствами и кислородом, а также от удаления из нее конечных продуктов об-
мена веществ. Состояние проницаемости клеточных мембран играет в этом
отношении очень важную роль.
Из приведенного вытекает, что клеточное дыхание регулируется многи-
ми факторами.
ПРОЦЕССЫ АКТИВИРОВАНИЯ ВЕЩЕСТВ В ОРГАНИЗМЕ
Изучение превращения органических, а также и некоторых неорганиче-
ских веществ показало, что, прежде чем быть использованными, эти вещест-
ва подвергаются в клетках определенным изменениям. Оказалось, что глю-
коза, являющаяся важным питательным веществом, используется клетка-
ми и тканями после предварительного ее фосфорилирования. Изменениям
подвергаются также жирные кислоты и другие соединения. В результате
этих изменений вещества в клетках активируются, приобретают более вы-
сокий энергетический потенциал, становятся доступными воздействию фер-
ментов.
В настоящее время выяснены механизмы, обеспечивающие активиро-
вание молекул органических и некоторых неорганических веществ. К ним
относятся процессы фосфорилирования и образования производных кофер-
мента ацилирования (KoA-SH).
В клетках и в тканях содержатся ферменты гексокиназы (фосфофера-
зы), катализирующие реакции фосфорилирования гексоз (глюкозы, фрук-
тозы, галактозы). Фосфорилирование гексоз можно представить одной
общей для них реакцией:
гексоза + АТФ гексозофосфорная кислота + АДФ.
Эта реакция показывает, что в активировании гексоз участвует аденозин-
трифосфорная кислота.
Образующаяся из глюкозы в результате фосфорилирования глюкозо-
фосфорная кислота используется для синтеза гликогена, она также может
подвергнуться распаду с образованием конечных продуктов — углекислого
газа и воды. Фосфорилированные гексозы в клетках способны взаимопре-
вращаться. Так, например, фруктозофосфорная кислота может с участием
фермента превратиться в глюкозофосфорную кислоту и, наоборот, глюкозо-
фосфорная кислота — в фруктозофосфорную кислоту; галактозофосфорная
кислота может также ферментативно превратиться в глюкозофосфорную
кислоту и наоборот. Свободные, т. е. нефосфорилированные, гексозы в орга-
низме не подвергаются взаимопревращению.
Роль аденозинтрифосфорной кислоты в активировании молекул орга-
нических веществ можно видеть также на примере использования в клет-
ках и тканях аминокислот для синтеза белков. Свободные молекулы амино-
кислот, оказывается, не используются для синтеза белков. Они предвари-
тельно реагируют с молекулами аденозинтрифосфорной кислоты с обра-
268
зованием смешанных ангидридов — аденилатов аминокислот, которые за-
тем синтезируются в белковые молекулы.
/ОН
Аденозин — О — Р=О ,ОН
_р=~ О /ОН
\0 —Р=О 4- tfCHNILCOOH
\он
/ОН
Аденозин — О — Р^=О
\о- OCCHNH,
Н4Р2О7.
Аденилат аминокислоты
Органические кислоты активируются, вступая в соединения с кофер-
ментом ацилирования с образованием соединений типа
/°
S-KoA.
Установлено, например, что жирные кислоты, появляющиеся в тка-
нях при гидролизе жиров, прежде чем подвергнуться окислительному рас-
паду, связываются с KoA-SH. Синтез сложных зфиров (жиров и др.) про-
исходит в клетках и в тканях в результате взаимодействия спиртов с акти-
вированными жирными кислотами, т. е. жирными кислотами, у которых к
карбоксильной группе присоединен кофермент ацилирования. Активиро-
вание жирных кислот происходит следующим образом: KoASH взаи-
модействует с АТФ с образованием своего пирофосфатного производного и
адениловой кислоты:
KoASH 4- Аденозин — О—Р^--0
\эн
Аде нозин—О—Р
/ОН
-> KoAS~P=O
он
он
KoAS — пирофосфат и реагирует с жирной кислотой, активируя ее.
У некоторых микробов установлен процесс активирования аммиака,
заключающийся в том, что он, реагируя с АТФ, дает начало образованию
аминофосфоаденозина и Н4Р2О7.
Аденозин — О — Р
NH3
/ОН
Аденозин — О — Р=О 4- Н4Р2О7.
nh2
269
Аминогруппа образовавшегося аминофосфоаденозина утилизируется
для аминирования а-кетокислот.
Установлено, что при синтезе в тканях сложных эфиров серной кисло-
ты серная кислота предварительно подвергается активированию с помощью
фосфоаденозинтрифосфорной кислоты в результате образования фосфоаде-
нилата серной кислоты
/°
H2POS О ~s=°
Аденозин — О—Р=О ОН
Х)Н
Фосфоаденилат серной кислоты
Точно так Же угольная кислота, которая в известном объеме исполь-
зуется тканями организмов животных, предварительно активируется аде-
нозинтрифосфорной кислотой. Это активирование происходит следующим
образом. АТФ реагирует с биотинсодержащим ферментом путем перенесе-
ния на него остатка АДФ:
АТФ + биотип-фермент АДФ — биотин-фермент + Н3РО4
Затем АДФ-биотин-фермент, получивший от АТФ макроэргическую связь,
вступает в реакцию с СО2:
АДФ ~ биотин-фермент + СО2 АДФ СО2 ~ биотин-фермент.
От СО2 биотин-фермента — СОО" переносится на молекулы соединений,
подвергающиеся карбоксилированию.
Приведенные данные показывают, что в химических превращениях
важное место занимают процессы активирования молекул органических и
неорганических веществ, благодаря которым они становятся доступными
для использования клетками и тканями организма.
Активирование химических соединений, приобретение ими более вы-
сокого энергетического потенциала протекает с использованием энергии
макроэргических фосфатных связей АТФ, возникающих в результате про-
цесса окислительного фосфорилирования.
ЛИТЕРАТУРА
Ленингер А. Преобразование энергии дыхания. Современные проблемы
биофизики. 1961, т. 1, стр. 177.
Сборник статей «Окислительное фосфорилирование и функция». Л., 1961.
Скулачов В. П. Соотношение окисления и фосфорилирования в дыхатель-
ной цепи. Изд. АН СССР, 1962.
Ш а п о т В. С. Взаимосвязи процессов окисления, сопряженного фосфорили-
рования и биосинтезов в клетках. «Успехи современной биологии», 1954, т. 37, стр.255,
Глава четырнадцатая
АЭРОБНЫЙ ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ
В предыдущих главах было изложено, как происходят процессы окис-
ления органических веществ и как эти процессы сочетаются с фосфорилиро-
ванием, приводящим к образованию макроэргических фосфатных связей.
Одним из выдающихся достижений современной биохимии является откры-
тие так называемых метаболических циклов, с помощью которых в одних
случаях осуществляется в организме полный распад сравнительно неслож-
ных по своей структуре соединений («метаболитов»), возникающих в ре-
зультате химических превращений питательных веществ, а в других — син-
тез тех или иных соединений. Подобные метаболические циклы мы рас-
смотрим в следующих главах, здесь же мы остановимся на особенно важном
цикле, прочно вошедшем в биохимическую науку под названием окисли-
тельного цикла трикарбоновых кислот.
Одним из промежуточных продуктов обмена веществ в клетках и тка-
нях организма, образующихся при аэробном распаде углеводов, жиров
(глицерина и жирных кислот), а также ряда аминокислот, является уксус-
ная кислота. Для того чтобы представить себе количество образующейся
уксусной кислоты в организме взрослого человека, приведем следующие
расчеты. Ежесуточно в организм человека с пищей поступает примерно
400 г углеводов. При распаде углеводов до этапа образования уксусной кис-
лоты (в виде ацетильного производного кофермента А) одна третья часть
углерода углеводов выделяется в виде углекислого газа. Следовательно,
две трети углерода проходят через этап образования уксусной кислоты
(из 400 г углеводов образуется 267 г уксусной кислоты). То же самое имеет
место при окислительном распаде глицерина. Что же касается жирных
кислот, то при окислительном распаде их углерод полностью проходит
через этап образования уксусной кислоты. Не меньше двух третей углерода
ряда аминокислот при их окислительном распаде также проходит через
этап образования уксусной кислоты. Ежесуточно в пище человека содер-
жится примерно 70 г жиров и 100 г белка. Из них на известном этапе рас-
пада, как показывают подсчеты, которые для краткости изложения здесь
не приводятся, должно образоваться не меньше 100 г уксусной кислоты. От-
сюда видно, что ежесуточно в организме человека возникает около 370 г
уксусной кислоты. С ферментативными процессами, приводящими к обра-
зованию в виде промежуточного продукта уксусной кислоты из более слож-
ных молекул органических веществ — углеводов, жиров и некоторых ами-
нокислот, мы познакомимся в других главах, тут же укажем на два сле-
дующих обстоятельства:
1) уксусная кислота возникает не в виде свободных молекул
(СН3СООН), а в соединении с коферментом ацилирования, в виде его аце-
тильного производного, KoAS~COCH3.
2) несмотря на исключительно интенсивное образование ацетильного
производного кофермента ацилирования в тканях обнаруживают его в край-
не незначительных количествах.
271
Отсюда можно заключить, что уксусная кислота (в виде ацетильного
производного KoAS~CO-CH3) не накопляется в тканях, а по мере своего
образования подвергается дальнейшему превращению. Каков же путь этого
превращения?
Конечными продуктами распада уксусной кислоты являются вода и
углекислый газ: СН3• СООН+2О2->2СО24 2Н2О.
Между тем химическая структура уксусной кислоты не предопределяет
ни возможности ее окисления путем отщепления от нее водорода (электрона
и протона), ни возможности ее декарбоксилирования (декарбоксилирова-
нию в тканях подвергаются, как известно, а-кетокислоты и в незначитель-
ной степени а-аминокислоты, уксусная же кислота не относится к этим
группам соединений). Распад уксусной кислоты с образованием углекислого
газа и воды осуществляется с помощью окислительного цикла трикарбоно-
вых кислот.
Катализируется цикл трикарбоновых кислот рядом последовательно
действующих ферментов, сосредоточенных в митохондриях:
1. Конденсирующим ферментом.
2. Дш>аконитазой.
3. Дегидрогеназой изолимонной кислоты.
4. Декарбоксилазой щавелевоянтарной кислоты.
5. Оксидазой а-кетоглутаровой кислоты.
6. Дегидрогеназой янтарной кислоты.
7. Фумаразой.
8. Дегидрогеназой яблочной кислоты.
Начальнойи поэтому особенно важной реакцией окислительного
цикла трикарбоновых кислот является реакция конденсации уксусной кис-
лоты с щавелевоуксусной кислотой. Щавелевоуксусная кислота образу-
ется в тканях организма, с одной стороны, как продукт дезаминирования
аспарагиновой кислоты, с другой стороны, в результате карбоксилирования
(присоединения углекислого газа) к пировиноградной кислоте:
СООН
I
ciinh2
I
сн
I
СООН
Аспарагиновая
кислота
СООН СООН 1
1 со СН. 1 сн,
1 - NHS; 1 1
сн, СО 4~СО 2—> со
СООН СООН СООН
Щавелевоуксус- Пировиноградная
ная кислота кислота
Щавелевоуксусная
кислота
В реакции конденсации участвует ацетильный остаток в виде KoAS—
~СО-СН3 и щавелевоуксусная кислота. Катализируется реакция так на-
зываемым конденсирующим ферментом, выделенным в кристаллическом
виде из сердечной мышцы. Фермент этот содержится в различных тканях
животных, в растениях и в микроорганизмах. В результате конденсации
получается лимонная кислота:
СООН
I
с=о
| 4- СН3—CO-S-KoA 4 Н2О
СН2
I
СООН
Щавелевоуксусная
кислота
СООН
I
НОС—СН?—СООН
> | 4 HS-KoA
сн.?
I
СООН (1-я реакция)
Лимонная
кислота
Второй реакцией цикла является превращение лимонной кислоты
в ^uc-аконитовую кислоту, катализируемое ферментом ^&с-аконитазой.
272
coon соон
I I
нос—сн2—соон _H o C—CH2COOH
i -----> li
CH2 CH
I I
СООН СООН (2-я реакция)
Z/мс-аконитовая кислота
Третья реакция приводит к образованию из ^uc-аконитовой кислоты
изо-лимонной кислоты:
СООН СООН
I I
С—СН2СООН СН—СН2СООН
II + н2о ->
сн неон
I I
СООН СООН (3-я реакция)
#зо-лимонная кислота
Четвертая реакция является окислительной реакцией, катализи-
рующейся дегидрогеназой изо-лимонной кислоты. В результате окисления
изо-лимопной кислоты образуется щавелевоянтарная кислота.
СООН СООН
I I
сн—СН2СООН сн—СН9СООН
I -Н2 |
снон -------------> со
I I
СООН СООН (4-я реакция)
Щавелевоянтарная кислота
Во всех приведенных четырех реакциях фигурировали кислоты, в со-
став молекул которых входит по три карбоксильные группы. От этих кис-
лот и возникло название «цикл трикарбоновых кислот».
Пятая реакция — декарбоксилирование щавелевоянтарной кислоты
с образованием а-кетоглутаровой кислоты.
Эта реакция катализируется специфической для щавелевоянтарной
кислоты декарбоксилазой
СООН
I
СН—СН.СООН СН2—СНоСООН
I -СО2 I
со со
I I
СООН СООН (5-я реакция)
а-Кетоглутаровая кислота
Шестая реакция — реакция окислительного декарбоксилирования
а-кетоглутаровой кислоты. Эта реакция катализируется специфической кар-
боксилазой, небелковым компонентом которой является фосфорилирован-
ный витамин Bj—тиаминпирофосфат. Реакция приводит к образованию
из а-кетоглутаровой кислоты янтарной кислоты.
СООН
I
сн2 соон
I +Н2О I
сн2 --------> сн2
I -н2 I +со2
со сн2
I I
СООН СООН (6-я реакция)
Янтарная кислота
273
Отщепляющиеся здесь два атома водорода, как и в реакции четвертой,
окисляются кислородом с образованием воды.
Седьмая реакция приводит к окислению янтарной кислоты с об-
разованием фумаровой кислоты. Катализируется реакция ферментом сук-
циндегидрогеназой, с помощью которой отщепляющиеся от янтарной кис-
лоты два атома водорода через систему цитохромов и с участием цитохромо-
ксидазы переносятся на кислород с выделением воды.
СООН
I
сп2 -
I —
СНо
I
СООН
СООН
I
сн
1 ;Н2+О->Н2О
СН
I
СООН (7-я реакция)
Фумаровая кислота
Восьмая реакция дает из фумаровой кислоты яблочную кислоту.
Реакция катализируется широко распространенным ферментом фумаразой,
выделенным в кристаллическом виде.
СООН СООН
I I
СН +Н2О снон
II —> I
сн сн2
I I
СООН СООН (8-я реакция)
Яблочная кислота
Девятая, заключительная, реакция приводит к окислению яблоч-
ной кислоты с образованием из нее щавелевоуксусной кислоты. Реакция ка-
тализируется специфической для яблочной кислоты дегидрогеназой —
маликодегидрогеназой (acidum malicum — яблочная кислота) с образова-
нием щавелевоуксусной кислоты.
СООН СООН
I I
снон — н2 со
I —> I
сн2 сн2
I I
СООН СООН (9-я реакция)
Водород с помощью переносчиков переходит к кислороду и окисляется
с образованием воды.
Суммируя все приведенные реакции, можно видеть, что включение ук-
сусной кислоты (ацетильного производного кофермента ацилирования
KoAS —СО-СН3) в цикл трикарбоновых кислот приводит к ее окислитель-
ному распаду с образованием углекислого газа и воды. В самом деле, в пер-
вой реакции цикла уксусная кислота конденсируется с щавелевоуксусной
кислотой с образованием лимонной кислоты. В результате восьми последую-
щих реакций лимонная кислота снова дает начало образованию щавелево-
уксусной кислоты. Что же касается участвовавшей в первой реакции моле-
кулы уксусной кислоты, то она по ходу реакций цикла превратилась в две
молекулы углекислого газа и две молекулы воды: СН3СООН+2О2->2СО2+
+2Н2О. Освободившаяся в результате окисления уксусной кислоты
энергия в значительной мере сосредоточивается в макроэргических фосфат-
ных связях аденозинтрифосфорной кислоты.
Цикл трикарбоновых кислот иллюстрирует схема, показывающая, что
окисление ацетильного остатка сопровождается четырьмя реакциями деги-
дрирования (отщеплением 4Н2) и образованием 2СО2. Отщепленный во-
274
дород подвергается окислению с образованием 4 молекул воды. Учиты-
вая использование двух молекул воды при реакциях гидратирования,
валовое уравнение цикла трикарбоновых кислот можно представить сле-
дующим образом:
С2Н4О2 — 4Н2 + 2О2 -> 2СО2 + 2Н2О.
Рис. 13. Схема цикла трикарбоновых кислот
Цикл трикарбоновых кислот, по которому происходит аэробное окис-
ление ацетильного остатка KoAS-COCH3, занимает важное место в процес-
сах обмена веществ еще и по той причине, что один из его членов, а именно,
а-кетоглутаровая кислота легко подвергается в тканях организма аминиро-
ванию с образованием глутаминовой кислоты. Последняя же является до-
нором аминогруппы а-кетокислотам при реакциях переаминирования,
приводящих к образованию из а-кетокислот а-аминокислот. Благодаря
этому осуществляется связь между реакциями цикла трикарбоновых кислот
и синтезом аминокислот.
Представление о цикле трикарбоновых кислот сложилось на основании
результатов многочисленных экспериментальных исследований, среди кото-
рых особо важное место занимают исследования Кребса. Кребс впервые
сформулировал цикл трикарбоновых кислот и поэтому этот цикл часто на-
зывают циклом Кребса.
К циклу трикарбоновых кислот оказался близким обнаруженный у некоторых
бактерий глиоксилатный цикл. В этом цикле изолимонная кислота подвергается дей-
ствию фермента изоцитразы, а не дегидрогеназы изолимонной кислоты, как это имело
место при ее превращении в цикле трикарбоновых кислот. В результате действия изо-
цитразы изолимонная кислота расщепляется с образованием янтарной и глиоксилевой
кислот:
СООН СООН
I
СНСН2СООН
СНОП!
СООН
I
сн
I
сн2
I
СООН
СООН
Изолимонная
Янтарная
Глиоксилевая
кислота
кислота
кислота
275
Глиоксилевая кислота реагирует с ацетильным остатком KoAS^OCCHa с об-
разованием яблочной кислоты:
СООН
/Я снон
С" -Ь KoAS ~ ОССНз + Н2О I + KoASH.
| ХН СНо
СООН |
СООН
Благодаря приведенным выше двум реакциям цикл трикарбоновых кислот ви-
доизменяется и приобретает следующую форму:
KoASH
Углеводы
Рис. 14. Схема глиоксилатного цикла
Благодаря реакции образования глиоксилевой кислоты, приведенный цикл получил
название глиоксилатного цикла.
Побочный продукт этого цикла — янтарная кислота — может подвергнуться
ряду превращений с образованием углеводов.
Легко видеть, что в глиоксилатном цикле используется два ацетильных остатка
KoAS-ОССНз, которые не подвергаются окислению с образованием СОг. Предпола-
гается, что глиоксилатный цикл играет роль в превращении жирных кислот (образую-
щихся из них ацетильных остатков) в углеводы.
ЛИТЕРАТУРА
Г у л ы й М. Ф. Модифицированный трикарбоновый или глиоксилатный цикл
и его физиологическое значение. Украинский биохимический журнал, 1959, т. 31,
№ 3.
Клейн цел лер Э. О цикле лимонной кислоты при обмене веществ. «Чехосло-
вацкая физиология», 1954, т. III, 444.
Глава пятнадцатая
ОБМЕН УГЛЕВОДОВ
Под обменом углеводов принято понимать поступление углеводов
в организм с пищей, переваривание сложных углеводов в пищеваритель-
ном тракте, всасывание моносахаридов в кишечнике, транспорт всосав-
шихся моносахаридов к тканям и органам, потребление моносахаридов тка-
нями, образование в организме из углеводов других веществ, распад угле-
водов в тканях и выделение из организма продуктов распада углеводов.
Обмен углеводов включает целый ряд последовательно протекающих про-
цессов.
ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ УГЛЕВОДОВ
Вместе с пищей в организм человека и животного поступает большое
количество углеводов. В ежесуточном пищевом рационе взрослого человека
содержится 350—450 г углеводов, что составляет на килограмм веса тела
5—7 г. Энергетические потребности человек на 60% покрывает энергией
поступающих в него углеводов. Еще более богат углеводами корм траво-
ядных и особенно жвачных животных. В пищевом рационе человека угле-
воды представлены преимущественно крахмалом. В некотором количестве
в пище содержатся целлюлоза, гемицеллюлоза, пентозаны, сахароза и
лактоза. В кормах травоядных животных много целлюлозы и сопровождаю-
щей ее гемицеллюлозы. Большое количество целлюлозы и гемицеллюлозы
содержится в так называемых грубых кормах жвачных животных.
Сложные углеводы подвергаются в пищеварительном тракте гидроли-
тическому расщеплению, перевариванию, в результате которого возникают
простые углеводы, моносахариды, всасывающиеся кишечником.
В переваривании сложных углеводов участвует ряд ферментов — кар-
богидразы, поступающие в пищеварительный тракт с пищеварительными
соками. К ним относятся амилаза, образующаяся в слюнных железах и
в поджелудочной железе и выделяющаяся с секретами этих желез; мальтаза,
сахараза и лактаза, вырабатываемые в железах слизистой оболочки тонких
кишок и выделяющиеся с кишечным соком. Целлюлоза у человека и жи-
вотных расщепляется в пищеварительном тракте под влиянием ферментов
целлюлозорасщепляющих микробов. Здесь имеет место явление симбиоза,
заключающееся в том, что животные предоставляют микробам в качестве
пищи целлюлозу, микробы же расщепляют целлюлозу с образованием
продуктов, используемых животными.
Расщепление крахмала начинается в ротовой полости под влиянием
амилазы слюны, обволакивающей измельченную пищу. Амилаза способ-
ствует гидролитическому распаду крахмала с образованием декстринов,
которые в свою очередь распадаются на мальтозу. Действие амилазы про-
исходит при нейтральной и слабощелочной реакции и усиливается ионами
хлора. В ротовой полости имеются необходимые условия для действия
277
амилазы, однако гидролиз крахмала в ней происходит в небольшомобъеме,
поскольку пищевой комок задерживается в ротовой полости лишь на корот-
кое время.
Интересно указать, что содержание амилазы в слюне различных живот-
ных неодинаково, например в слюне кошек и собак мало амилазы, в слюне
хищных животных она практически отсутствует. В слюне людей, пища
которых богата углеводами, содержится амилазы больше, чем в слюне
людей, потребляющих малоуглеводную пищу. Эти данные показывают, что
фактор внешней среды — состав пищи — влияет на образование фермента
в пищеварительной железе.
Из ротовой полости пищевой комок через пищевод поступает в желудок.
В желудке отсутствуют условия для действия амилазы. Попавшая в желу-
док вместе с пищевым комком амилаза слюны благодаря кислой реакции
желудочного сока прекращает свое действие на крахмал. Переваривание
крахмала возобновляется в двенадцатиперстной кишке и в дальнейших
отрезках тонких кишок под влиянием амилазы, поступающей в двенадцати-
перстную кишку с соком поджелудочной железы. Основная масса крахмала
пищи переваривается в тонких кишках с образованием мальтозы и некото-
рого количества глюкозы. Мальтоза в свою очередь гидролизуется там же
под влиянием мальтазы, выделяющейся с кишечным соком.
Образующаяся в результате воздействия на крахмал амилазы и на
мальтозу — мальтазы глюкоза не задерживается в тонких кишках, а быстро
по мере своего образования всасывается в кровь. Это подтверждается тем,
что у животных, убитых в разгар переваривания крахмала, в содержимом
тонких кишок оказывается очень мало глюкозы.
Расщепление целлюлозы происходит в кишечнике, как на это указы-
валось выше, при участии ферментов микробов. Расщепляющие целлюлозу
микробы выделяют целлюлазу, под влиянием которой происходит гидролиз
нерастворимой в воде целлюлозы, с образованием растворимого в воде ди-
сахарида целлобиозы. Целлобиоза подвергается дальнейшему гидролизу
под влиянием целлобиазы микробов с образованием глюкозы. Целлюлоза
является питательным веществом для микробов, продуцирующих целлюлазу
и целлобиазу.
Отсутствие ферментов, расщепляющих целлюлозу с образованием глюкозы в
секретах пищеварительных желез животных, весьма поразительно, если учесть, что
внешние факторы — наличие в составе пищи тех или иных веществ — влияют на об-
разование в организме адаптированных к ним ферментов. Исключение в этом отноше-
нии составляет целлюлоза, которая, являясь постоянной составной частью пищи че-
ловека и травоядных животных, не подвергается расщеплению образующимися у них
ферментами.
Объем переваривания в кишечнике ферментами микробов целлюлозы
зависит от характера пищевых продуктов. Целлюлоза ранних овощей
и фруктов расщепляется в кишечнике человека в большей степени, чем
целлюлоза поздних овощей; одеревеневшая целлюлоза совершенно не рас-
щепляется в кишечнике человека. У жвачных животных целлюлоза грубых
кормов расщепляется в значительном объеме, благодаря особенностям
пищеварения, создающим условия для длительного воздействия на нее фер-
ментов микробов.
В результате действия ферментов микробов в кишечнике при расщеп-
лении возникающей из целлюлозы глюкозы образуются также и другие ор-
ганические вещества, среди которых особое место по своему количеству за-
нимает уксусная кислота. У жвачных животных основным продуктом, по-
лучающимся в пищеварительном тракте из целлюлозы и подвергающимся
всасыванию кишечником является уксусная кислота. В меньших количе-
ствах в результате действия микробов в пищеварительном тракте образуют-
ся другие органические кислоты (масляная, молочная, пропионовая, янтар-
ная). Все эти кислоты — продукты превращения углеводов микробами пи-
щеварительного тракта; они подвергаются всасыванию. Не всасываются,
278
а выделяются из кишечника газообразные продукты брожения углеводов—
углекислый газ, метан, водород.
В кишечнике человека, в зависимости от состава растительной пищи,
подвергается расщеплению от 40 до 60% целлюлозы. Остальное же коли-
чество целлюлозы не расщепляется и выводится с калом. Действие целлю-
лазы, выделяющейся микробами, приводит к тому, что оболочки расти-
тельных клеток разрушаются, благодаря чему заключенные в клетках
растений питательные вещества освобождаются и могут быть использованы
организмом. Без расщепления целлюлозных оболочек растительных клеток
растительная пища не могла бы в значительных размерах усваиваться
человеком.
Пищевое значение целлюлозы определяется не только объемом расщеп-
ления ее в кишечнике и всасыванием кишечником в кровь образующихся
из нее продуктов. Кроме этого, целлюлозе как пищевому веществу, принад-
лежит еще иная роль: она имеет значение как механический раздражитель
стенки кишечника, усиливающий перистальтику кишок и связанное с этим
передвижение пищевой массы. Эта физиологическая особенность целлюлозы
объясняется тем, что она, в противоположность другим составным частям
пищевых продуктов, нерастворима в воде, и, следовательно, в кишечнике
находится в виде твердых частичек. Наконец, целлюлоза играет роль в
формировании кала: вокруг нерасщепленной в кишечнике части целлюлозы
формируется в толстых кишках кал.
Важное значение целлюлозы как составной части пищи с особой нагляд-
ностью выявлено в опытах с кормлением животных пищей, не содержащей
целлюлозу. Оказалось, что животные (исключением являются хищные)
не могут обходиться без целлюлозы; в этих случаях у них наблюдается рас-
стройство пищеварения, развивается атония кишечника. При длительном
кормлении животных нищей, не содержащей целлюлозы, они погибают.
Употребление овощей и хлеба из муки грубого помола создает благо-
приятные условия для пищеварения у человека.
Расщепление дисахаридов — сахарозы, лактозы, мальтозы — проис-
ходит в тонких кишках. Из перечисленных трех дисахаридов первые два
(сахароза и лактоза) поступают в организм с пищей. Что же касается маль-
тозы, то она появляется в ротовой полости и в тонких кишках как продукт
переваривания крахмала.
Сахароза, или, как обычно ее называют, сахар, наряду с энергетиче-
ским значением, общим для всех углеводов, важна также как вещество,
обладающее сладким вкусом. Расщепление сахарозы с образованием глю-
козы и фруктозы происходит в тонких кишках под влиянием сахаразы
кишечного сока. Сахароза расщепляется в кишечнике быстрее, чем крахмал,
и поэтому быстрее усваивается.
Молочный сахар, или лактоза, поступает в организм с молоком. Перева-
ривание лактозы происходит под влиянием лактазы кишечного сока с обра-
зованием глюкозы и галактозы. Переваривание лактозы имеет особое зна-
чение у детей и у молодых млекопитающих в период, когда лактоза является
единственным углеводом пищи.
В кишечнике в результате переваривания пентозанов образуется неко-
торое количество пентоз. В случае наличия в пищевых продуктах инулина,
в пищеварительном тракте происходит его расщепление с образованием
фруктозы.
Суммируя, следует указать, что при переваривании углеводов в кишеч-
нике образуется преимущественно глюкоза. В сравнительно небольшом
количестве появляются фруктоза (из сахарозы) и галактоза (из лактозы).
Все образующиеся при переваривании сложных углеводов моносахариды
всасываются кишечной стенкой и поступают в кровь.
Всасывание моносахаридов. Многочисленные исследования были посвя-
щены изучению скорости всасывания отдельных моносахаридов. Оказалось,
что моносахариды всасываются кишечной стенкой с неодинаковой скоростью.
279
Если принять скорость всасывания глюкозы за 100, то сравнительную ско-
рость всасывания различных гексоз и пентоз можно представить следую-
щими данными:
Моносахариды
Скорость
всасывания
D-Глюкоза ................ 100
D-Галактоза................ ПО
D-Фруктоза ................ 43
D-Манноза.................. 19
L-Ксилоза.................. 15
L-Арабиноза................. 9
Приведенные цифры показывают, что различные гексозы, имеющие
одинаковый молекулярный вес, всасываются с различной скоростью. Так,
например, манноза всасывается примерно в пять раз медленнее глюкозы.
Еще более поразительным является медленное всасывание пентоз, моле-
кулярный вес которых ниже молекулярного веса гексоз.
Все это указывает на то, что всасывание моносахаридов не является
простым проникновением молекул через полупроницаемую стенку, а актив-
ным физиологическим процессом. Следует учесть, что моносахариды, как
и другие продукты переваривания пищи, проходят через слизистую оболоч-
ку по направлению от кишечных ворсинок к наружной стенке кишки против
действия осмотических сил: ворсинки при этом производят значительную
«работу». Отсюда следует, что в кишечных ворсинках при всасывании про-
дуктов переваривания должны интенсифицироваться процессы обмена
веществ, ведущие к освобождению энергии, необходимой для «работы»
кишечных ворсинок.
Высказывалось мнение (Верцар) о том, что при всасывании моносаха-
риды подвергаются в слизистой оболочке тонких кишок фосфорилированию
и что скорость всасывания различных моносахаридов находится в прямой
зависимости от интенсивности их фосфорилирования при прохождении через
кишечную стенку. В подтверждение этого мнения приводились результаты
исследований, показавшие, что содержание гексозофосфорных кислот в сли-
зистой тонких кишок повышается во время всасывания моносахаридов,
введение в кишечник фосфатов ускоряет всасывание моносахаридов,
отравление организма монойодуксусной кислотой, веществом, нарушаю-
щим превращение углеводов, замедляет всасывание моносахаридов и др.
Однако все эти доказательства оказались недостаточно убедительными и для
них найдено иное толкование. В самом деле, если принять во внимание, что
во время всасывания усиливаются в слизистой оболочке тонких кишок
процессы обмена веществ, то следует ожидать, что факторы, благоприят-
ствующие использованию энергетических веществ (преимущественно угле-
водов) в слизистой кишечника, будут ускорять процессы всасывания и на-
оборот.
Фосфаты благоприятствуют процессам распада углеводов в тканях
организма и неудивительно, что введение фосфатов в кишечник ускоряет
всасывание моносахаридов.
Повышение содержания гексозофосфорных кислот в слизистой кишеч-
ника при всасывании моносахаридов может явиться указанием на усиление
процессов в ней углеводного обмена. Торможение всасывания моносахари-
дов при отравлении организма монойодуксусной кислотой объяснимо тем,
что это отравление блокирует процессы обмена углеводов в различных тка-
нях в том числе и в слизистой оболочке кишечника.
Особенно показательны результаты исследований по изучению всасы-
вания моносахаридов, проведенных на изолированной петле тонкой кишки.
Оказалось, в частности, что понижение температуры окружающей среды
280
замедляет всасывание стенкой изолированной петли кишки различных
моносахаридов, причем различия в скорости их всасывания сглаживаются.
Все это показывает, что всасывание моносахаридов является сложным фи-
зиологическим явлением, в основе которого лежат процессы обмена веществ,
совершающиеся в слизистой оболочке кишечника.
ВЗАИМОПРЕВРАЩЕНИЕ ОТДЕЛЬНЫХ МОНОСАХАРИДОВ
Как уже указывалось, при переваривании полисахаридов в кишечнике
образуются, главным образом, глюкоза, а также некоторое количество
фруктозы и галактозы. Эти три моносахарида оказываются в тканях орга-
низма взаимопревращаемыми; накопленные экспериментальные данные
позволяют разобраться в путях их взаимопревращений. Обратимое превра-
щение D-фруктозы и D-глюкозы связано с участием фосфорной кислоты
и является ферментативным процессом. D-Фруктоза под влиянием фермента
фруктокиназы — специфической для фруктозы фосфоферазы (фермента,
переносящего фосфатный остаток от аденозинтрифосфорной кислоты) —
фосфорилируется с образованием фруктозо-6-фосфорной кислоты.
Фруктоза
z0H
О—Р—О он
Аденозин—О—Р=О О—Р~О
хон Чон
Аденозин три фосфорная
кислота
Фру кто зо-6- фосфорная
кислота
Фруктозо-6-фосфорная кислота с участием фермента фруктозо-6-фосфоизо-
меразы обратимо превращается в глюкозо-6-фосфорную кислоту (стр. 282).
При дефосфорилировании фруктозо-6-фосфорной и глюкозо-6-фосфор-
ной кислот образуются фруктоза и глюкоза.
Фруктозо-6-фосфорная и глюкозо-6-фосфорная кислоты являются про-
межуточными продуктами распада гликогена в тканях и клетках (стр. 295).
Взаимопревращение фруктозы в глюкозу объясняет известный факт
быстрого использования введенной человеку и животным фруктозы, а также
281
Фруктозо-6-фосфорная кислота
Глюкозо-6-фосфорная кислота
синтез из нее гликогена в печени. Более сложно взаимопревращение £>-га-
лактозы и О-глюкозы — гексоз, отличающихся по своей химической струк-
туре больше, чем фруктоза и глюкоза. В этом превращении участвуют фер-
менты и среди них фосфогалактозоизомераза, катализирующая Вальден-
скую инверсию, включающую реакцию:
Галактозо-1 -фосфорная кислота^глюкозо-1 -фосфорная кислота.
Эта реакция протекает с участием фермента (вальденазы), коферментом
которого служит уридиндифосфоглюкоза.
Последовательное течение процессов взаимопревращения галактозы
и глюкозы сводится к следующему. Галактоза с участием фермента галакто-
зокиназы, являющегося специфической для галактозы фосфоферазой, и
АТФ превращается в галактозо-6-фосфорную кислоту (см. стр. 168), которая
затем ферментативно превращается в галактозо-1-фосфорную кислоту.
Г алактоза
хон
о—Р=О
о—Р—О 4 он
Аденозин—О—Р=О ОН ----
хон
ОН
СНоО—Р=О
Н ОН
Г алактозо-6-фосфорнан
кислота
ОН
О—Р"-О
Аденозин—О—Р=О ОН
х'он
282
Галактозе-1-Фосфорная кислота
Галактозо-6-фосфорная кислота
Интимный механизм вальденовского обращения остается еще невыяс-
ненным, что же касается превращения галактозо-1-фосфата в глюкозо-1-
фосфат (действие фосфогалактозоизомер азы), то оно сводится к следующей
реакции:
хон
^о—Р=О
Уридин—О—Р=О
он 0
н он н он
Г ала ктозо- 1 - фосфорная
кисл о та
Уридиндифосфоглюкоза
Уридиндифосфо галактоза
Г люкозо-1 -фосфорная
кислота
Обратимое превращение галактозы в глюкозу важно в том отношении,
что галактоза, всосавшаяся кишечником в кровь, может затем исполь-
зоваться тканями организма. Особенно важно превращение глюкозы в га-
лактозу в молочной железе, в которой синтезируется лактоза. Кровью к
283
молочной железе доставляется глюкоза, превращаемая в ней в галактозу.
Синтез лактозы протекает с использованием галактозы и глюкозы.
С нарушением использования галактозы встречаются у детей при одном
из заболеваний, передающемся по наследству. Это заболевание сопровож-
дается галактоземией и галактозурией (появление галактозы в крови и вы-
деление ее с мочой) при накоплении ее в тканях. Кормление больных детей
молочной пищей вызывает глубокое расстройство их жизнедеятельности,
которое может привести к смерти. В основе этих расстройств лежит отрав-
ление галактозой, возникающей из лактозы молока и поступающей из ки-
шечника в кровь. У больных детей отсутствуют ферменты, катализирующие
превращение галактозы в глюкозу, что приводит к накоплению галактозы.
Выключение молока из диеты больных детей устраняет накопление у
них галактозы, и это приводит к их выздоровлению.
СОДЕРЖАНИЕ ГЛЮКОЗЫ В КРОВИ. ОБРАЗОВАНИЕ
И РАСПАД ГЛИКОГЕНА В ПЕЧЕНИ
Образующиеся в тонких кишках при переваривании полисахаридов
моносахариды (преимущественно глюкоза) всасываются через капилляры
кишечных ворсинок в кровь сосудов системы воротной вены и током крови
доставляются к печени. Глюкоза является постоянной составной частью
крови. Однако содержание глюкозы в крови, взятой из различных сосудов,
оказывается неодинаковым.
Содержание глюкозы в крови воротной вены и печеночных вен во время
переваривания пищи различно: оно выше в крови воротной вены. Это ука-
зывает на то, что глюкоза из кишечника поступает в кровь воротной вены
и что печень поглощает из крови глюкозу.
Содержание глюкозы в крови человека, взятой натощак, колеблется в
пределах от 0,085 до 0,120% (или 85—120 мг%) и в среднем равно 100 мг%.
Содержание глюкозы в крови различных животных оказывается различным.
У холоднокровных животных (рыб, амфибий и рептилий) глюкозы в крови
содержится меньше, чем у теплокровных животных, и составляет 40—
60 мг%. Существует определенная зависимость между содержанием глю-
козы в крови животных и степенью их подвижности, а также условиями
превращения углеводов в пищеварительном тракте. Содержание глюкозы
в крови, например, у донных, малоподвижных рыб ниже, чем у подвижных
рыб горных ручьев и быстротекущих рек. Содержание глюкозы в крови
птиц выше, чем в крови млекопитающих животных. В крови жвачных, у
которых углеводы кормов в основной массе превращаются в пищеваритель-
ном тракте в уксусную кислоту под влиянием микробов, содержание глюко-
зы в крови значительно ниже, чем у других теплокровных животных, и
достигает всего 60 мг%. У жвачных животных из кишечника в кровь по-
ступает преимущественно уксусная кислота, а не глюкоза.
Часть поступающей с кровью воротной вены в печень глюкозы прев-
ращается в гликоген. Образование гликогена в печени имеет большое зна-
чение, так как оно предохраняет организм от насыщения крови глюкозой.
Гликоген откладывается в печени в виде глыбок и, находясь в коллоид-
ном состоянии, не изменяет осмотическое давление в клетках печени. От-
ложившийся в печени гликоген в дальнейшем постепенно расщепляется с
образованием глюкозы, равномерно поступающей в кровь.
Способность печени поглощать глюкозу и синтезировать из нее глико-
ген и расщеплять гликоген с выделением в кровь глюкозы носит название
гликогенной функции печени. Как же осуществляется гликогенная функция
печени?
Глюкоза, поступающая из крови в печень, прежде чем превратиться в
гликоген, подвергается фосфорилированию.
Фосфорилирование глюкозы происходит с помощью фермента глюкозо-
киназы (фосфоферазы), катализирующего реакцию перенесения фосфатного
284
остатка от аденозинтрифосфорной кислоты на глюкозу с образованием глю-
козо-6-фосфорной кислоты.
Глюкоза
ОН
СНэО—Р=О
н он
Глюкозо-6-фосфорная кислота
В печени содержание аденозинтрифосфорной кислоты не столь велико,
чтобы обеспечить фосфорилирование поступающей из крови воротной вены
глюкозы. Это становится возможным благодаря процессу аэробного фос-
форилирования в печени аденозиндифосфорной кислоты, приводящему
к образованию аденозинтрифосфорной кислоты.
Из приведенной схемы видно, что образование глюкозо-6-фосфорной
кислоты из глюкозы связано с процессом окислительного фосфорилирова-
ния с участием аденозинтрифо-
сфорной кислоты. Так как гли-
коген синтезируется не из глю-
козы, а из глюкозофосфорной
кислоты, то понятно, что син-
тез должен зависеть от проис-
ходящих в печени окислитель-
ных процессов, что наблюдается
в действительности. В опытах с
применением тонких срезов пе-
чени было показано, что синтез
Рис. 15. Схема образования глюкозо-
6-фосфорной кислоты
гликогена из глюкозы происхо-
дит только в аэробных условиях
с поглощением тканью печени
кислорода. Результаты этих ис-
следований, полученные еще
фосфорилирования глюкозы при
ными сейчас, когда известно, что
задолго до установления процесса
синтезе гликогена, становятся понят-
глюкоза может быть использована для
синтеза гликогена только после предварительного ее фосфорилирования.
Непосредственным веществом, из которого синтезируется гликоген,
однако, является не глюкозо-6-фосфорная кислота, а глюкозо-1-фосфорная
кислота. Превращение глюкозо-6-фосфорной кислоты в глюкозо-1-фос-
форную кислоту катализируется ферментом фосфоглюкомутазой:
СН2ОН
Глюкозо-1-фосфорная кислота
285
Синтез гликогена из глюкозо-1-фосфорной кислоты катализируется пре-
имущественно трансглюкозилазой при участии уридинтрифосфорной кислоты
(УТФ). Последняя взаимодействует с глюкозо-1-фосфорной кислотой с об-
разованием уридиндифосфоглюкозы (УДФ-глюкоза) и Н4Р2О7:
^ОН
/О~Р=О хон
Уридин - О—Р=О х О— Р = О + Глшзо -1-фосфорная кислота^
х он '"он
Уридиндифосфоглшза + Н4Р2О7
Глюкозные остатки молекул УДФ-глюкозы используются для син-
теза 1,4-глюкозидных связей гликогена. Синтез этих связей может также
осуществляться из глюкозо-1-фосфорной кислоты в результате обратимости
фосфоролиза гликогена. Однако объем синтеза гликогена с помощью фос-
форилазы ограничен.
Приведенная схема дает наглядное представление о пути синтеза гли-
когена из глюкозо-1-фосфорной кислоты:
Глюкозо-1 -фосфорная кислота
Рис. 16. Схема синтеза гликогена из глюкозо-
1-фосфорной кислоты
В молекуле гликогена, как известно, наряду с 1,4-глюкозидными свя-
зями имеются также 1,6-глюкозидные связи, благодаря чему молекула
гликогена имеет ветвистую структуру. Трансглюкозидаза катализирует
286
перенесение глюкозных остатков в молекуле амилозы из положения 1,4 в
положение 1,6.
В синтезе гликогена из глюкозы, следовательно, участвуют следующие
ферменты: 1) глюкозокиназа, 2) фосфоглюкомутаза, 3) трансглюкозил аза и
4) трансглюкозидаза.
В печени наряду с синтезом гликогена происходит также его распад с
образованием глюкозы. Распад гликогена идет двумя путями. С одной
стороны, гликоген распадается, хотя и в ограниченном объеме, гидролити-
ческим путем с участием ферментов амилазы и мальтазы.
1. (СбН10О5)л + х/2 пН2О -> х/2/г мальтоза.
2. х/п Мальтоза + Х/ЛН2О -> п глюкоза.
С другой стороны, распад гликогена совершается с участием фосфори-
лазы. Этот фосфорилитический распад гликогена, являющийся основным,
приводит к образованию глюкозо-1-фосфорной кислоты, которая под влия-
нием фосфоглюкомутазы превращается в глюкозо-6-фосфорную кислоту.
Обе глюкозо-фосфорные кислоты в печени подвергаются воздействию спе-
цифической для них фосфатазы с образованием глюкозы и фосфорной
кислоты.
Распад гликогена с участием фосфорилазы и фосфатазы можно пред-
ставить следующими уравнениями:
I. Гликоген (C6H10O5)rt+nH3PO4^Ti глюкозо-1-фосфорная кислота.
II. п Глюкозо-1-фосфорпая кислота (а также глюкозо-6-фосфорная
кислота) +пН2О-^пглюкоза ) /гН 3РО4.
III. Гликоген пН2О глюкоза.
Суммирование уравнений I и II дает уравнение III, которое показывает,
что суммарное действие фосфорилазы и фосфатазы приводит к распаду
гликогена с выделением глюкозы. Подобный ход распада гликогена был
открыт в 1935 г. Парнасом. До этого времени считалось, что распад гликоге-
на в печени происходит амилолитическим, т. е. гидролитическим путем.
Содержание гликогена в печени зависит от степени упитанности орга-
низма, от количества углеводов в пище. При обильном содержании углеводов
в пище в печени человека может отлагаться до 150 г гликогена. Гликоген
в печени человека и животных может составлять 5—7%. При голодании
содержание гликогена в печени резко уменьшается и доходит до 0,1% и
меньше.
Углеводы в организме легко превращаются в жиры. Опыты с кормле-
нием животных глюкозой, меченной радиоактивным углеродом (С14), пока-
зали, что уже через короткий срок после ее введения в организм жиры в нем
приобретают радиоактивность. Способность организма легко превращать
углеводы в жиры используется в зоотехнической практике. При откорме
животных на жир корм их обогащают углеводами.
Людям, склонным к ожирению, рекомендуют пищу с низким содержа-
нием углеводов.
Изучение содержания глюкозы в крови до к после приема пищи пока-
зывает, что поступающая в кровь из кишечника глюкоза не полностью пре-
вращается в печени в гликоген. В период всасывания содержание глюкозы
повышается не только в крови системы воротной вены, но и в крови других
кровеносных сосудов.
Способность печени откладывать гликоген ограничена, и при одновре-
менном поступлении из кишечника большого количества глюкозы, а также
и других моносахаридов, которые, прежде чем дать начало образованию
гликогена, должны превратиться в глюкозу, печень не в состоянии в корот-
кий срок их усвоить. Содержание глюкозы в крови возрастает, наступает,
как принято говорить, алиментарная (пищевая) гипергликемия. При гипер-
гликемии содержание глюкозы в крови переходит за пределы верхней гра-
ницы нормы (120 мг%) и может достигнуть 200 мг% и более. Алиментарная
287
гипергликемия, в противоположность патологической (стр. 314), непродол-
жительна и с прекращением приема с пищей избыточного количества угле-
водов исчезает.
Гипергликемию обычно сопровождает выделение глюкозы с мочой —
глюкозурия. Следовательно, алиментарная гипергликемия сопровождается
алиментарной глюкозурией. Обычно выделение глюкозы с мочой начинается
тогда, когда содержание глюкозы в крови достигает 160 мг%. В этом случае
почки становятся проницаемы для глюкозы и избыточное ее количество уда-
ляется из крови с мочой. Алиментарная глюкозурия, как и алиментарная
гипергликемия, непродолжительны.
СВЯЗЬ МЕЖДУ СОДЕРЖАНИЕМ ГЛИКОГЕНА В ПЕЧЕНИ,
ГЛЮКОЗЫ В КРОВИ И ПОТРЕБЛЕНИЕМ УГЛЕВОДОВ
В МЫШЦАХ
Синтез гликогена из глюкозы происходит не только в печени, но и в
других органах и тканях. Об этом говорит уже сам факт наличия гликогена
в различных тканях и органах. Значительным содержанием гликогена отли-
чаются мышцы. Содержание гликогена в мышцах колеблется в значитель-
ных размерах и зависит прежде всего от упитанности организма. Обычно
оно составляет от 0,3 до 0,5% на сырой вес. При кормлении животных
большим количеством углеводов содержание гликогена в мышцах дости-
гает 2%. Работа мышц при явлениях утомления сопровождается снижением
содержания в них гликогена. Отдых стимулирует повышение содержания
гликогена в мышцах, которое вскоре достигает обычного уровня. Отсюда
можно заключить, что при работе мышцы потребляют гликоген, а при от-
дыхе его синтезируют.
Материалом для синтеза гликогена в мышцах и в других органах слу-
жит доставляемая к ним с кровью глюкоза. Синтез гликогена в мышцах
и в иных тканях происходит таким же путем, как и в печени. Глюкоза
подвергается фосфорилированию с образованием глюкозо-6-фосфорной кис-
лоты, которая затем превращается в глюкозо-1-фосфорную кислоту. Из
глюкозо-1-фосфорной кислоты синтезируется гликоген. Если синтез глико-
гена в различных органах происходит по одному и тому же пути, то распад
гликогена в мышцах и в других органах отличается от распада его в печени.
В то время как распад гликогена в печени приводит к образованию глюкозы,
которая поступает в кровь и доставляется к местам ее потребления (мышцам,
сердцу, почкам, мозгу и др.), распад гликогена в мышцах и в других тка-
нях, минуя стадию образования глюкозы, приводит в конечном счете к
образованию углекислого газа и воды. В качестве промежуточного про-
дукта распада гликогена можно обнаружить молочную кислоту. При распа-
де гликогена в мышцах оттекающая от них кровь не обогащается глюкозой;
здесь, как и при распаде гликогена в печени, возникают глюкозо-1- и" глю-
козо-6-фосфорные кислоты, однако в мышцах отсутствует фосфатаза, ката-
лизирующая их гидролиз с выделением глюкозы, как это имеет место в пе-
чени, где фосфатаза содержится, и поэтому в мышцах эти кислоты не могут
явиться материалом для образования глюкозы.
Мышцы являются местом усиленного потребления углеводов (содержа-
щегося в них гликогена и глюкозы, доставляемой к ним кровью). Резко
повышается потребление углеводов в мышцах при их работе. Изучение
содержания гликогена в печени, глюкозы в крови и гликогена в мышцах
животных в состоянии покоя и интенсивной мышечной работы показало
следующее.
В начальной фазе работы в мышцах усиленно потребляется гликоген,
и содержание его резко снижается. В крови в начальной фазе работы мышц
несколько снижается содержание глюкозы. Это означает, что при работе
288
в мышцы поступает из крови больше глюкозы, чем при покое. Работа мышц
сопровождается усиленным распадом гликогена в печени. Снижение содер-
жания глюкозы в крови в начальной фазе работы является стимулом к уси-
лению распада гликогена в печени. Усиливается поступление в кровь глю-
козы из печени и при дальнейшей работе усиливается доставка глюкозы
к мышцам. При утомительной работе исчезает гликоген как в печени, так
и в мышцах. Из изложенного вытекает, что содержание глюкозы в крови
является связующим звеном, обеспечивающим использование резервного
гликогена печени работающими мышцами.
РЕГУЛЯЦИЯ ГЛИКОГЕННОЙ ФУНКЦИИ ПЕЧЕНИ
И СОДЕРЖАНИЯ ГЛЮКОЗЫ В КРОВИ
Гликогенная функция печени подвергается регулирующим воздействиям
со стороны центральной нервной системы и гормонов, особенно мозгового
слоя надпочечников — адреналина и норадреналина и островковой ткани
поджелудочной железы — инсулина и глюкагона. Впервые влияние цен-
тральной нервной системы на гликогенную функцию печени было показано
в прошлом столетии Клодом Бернаром в опытах с механическим раздраже-
нием продолговатого мозга (дна четвертого желудочка мозга). При погруже-
нии острия ножа в дно четвертого желудочка головного мозга Клод Бернар
наблюдал явление гипергликемии и глюкозурии при понижении содержания
гликогена в печени.
Глюкозурия начиналась через 1—2 часа после укола и прекращалась
через 5—6 часов. Этот опыт Клода Бернара получил название сахарного
укола.
Сахарный укол приводит к гипергликемии и к глюкозурии только
у сытых животных. У голодных же животных, у которых содержание гли-
когена в печени доведено до минимума, сахарный укол не приводит к ги-
пергликемии. Результаты исследований Клода Бернара, следовательно,
показали, что раздражение определенного участка продолговатого мозга
вызывает интенсивный распад гликогена в печени и повышение содержания
глюкозы в крови. Дальнейшее изучение показало, что возбуждение, выз-
ванное уколом определенного участка продолговатого мозга, передается
из центральной нервной системы к печени по нервным путям. В этой пере-
даче возбуждения участвует гормон мозгового слоя надпочечников —
адреналин. Импульсы, идущие от центральной нервной системы к надпо-
чечникам, вызывают при сахарном уколе усиленное выделение адреналина
в кровь. С током крови адреналин доставляется в печень, где он стимули-
рует резкое повышение распада гликогена с образованием глюкозы, посту-
пающей в кровь. Быстрый распад гликогена в печени с интенсивным поступ-
лением глюкозы в кровь носит название «мобилизация гликогена печени».
То, что в мобилизации гликогена печени важная роль принадлежит адрена-
лину, видно из следующего. При сахарном уколе повышается содержание
адреналина в крови. Далее, пользуясь адреналином, можно при введении
его в кровь вызвать явление сахарного укола, т. е. гипергликемию, глюко-
зурию и распад гликогена в печени.
Обычно, без сахарного укола, импульсы, идущие из центральной нерв-
ной системы по нервным путям к надпочечникам, поддерживают на опре-
деленном уровне выделение адреналина в кровь. Механическое раздра-
жение определенного участка продолговатого мозга вызывает возбуждение
центральной нервной системы, и импульсы с большой скоростью направ-
ляются к надпочечникам и усиливают поступление адреналина в кровь.
Естественно возникает вопрос, нельзя ли вызвать усиление выделения адре-
налина из надпочечников в кровь естественным путем, влияя теми или иными
физиологическими раздражителями на кору головного мозга? Имеющиеся
экспериментальные данные дают положительный ответ на поставленный
10 Заказ № 581
289
вопрос. Оказывается, что определенные психические факторы, эмоциональ-
ные переживания вызывают усиленное выделение адреналина из надпочеч-
ников в кровь и связанную с этим мобилизацию гликогена печени. Так,
например, внезапный испуг вызывает как у человека, так и у животных,
гипергликемию и глюкозурию при повышенном содержании адреналина
в крови. С подобным явлением встречаются у людей (спортсменов) перед
началом состязаний, у студентов перед сдачей экзаменов и т. д. Все это
с несомненностью указывает на то, что гликогенная функция печени и свя-
занное с нею содержание глюкозы в крови подвергается сложной регуляции
и что в этой регуляции основную роль играет центральная нервная система.
В регуляции гликогенной функции печени и содержания на нормаль-
ном уровне глюкозы в крови, кроме адреналина, участвуют и другие гормо-
ны. Большое влияние на различные стороны углеводного обмена оказывает
гормон, образующийся в [3-клетках островковой ткани поджелудочной же-
лезы, инсулин (стр. 196). По своему влиянию на распад гликогена в печени
и на содержание глюкозы в крови инсулин является антагонистом адрена-
лина. Под влиянием инсулина в печени усиливается синтез гликогена и сни-
жается содержание глюкозы в крови. Снижение нормального содержания
глюкозы в крови (ниже 80 мг%) носит название гипогликемии. Путем вве-
дения в организм инсулина (в кровь, или под кожу) содержание глюкозы
в крови можно снизить до таких пределов (до 40 мг% и ниже), когда снаб-
жение органов и тканей глюкозой становится совершенно недостаточным.
В этих случаях благодаря недостаточному подвозу глюкозы к мозгу, наблю-
дается углеводное голодание, вызывающее нарушение функций мозга.
Углеводное голодание органов, и в первую очередь головного мозга, вызы-
вает сильные судороги (гипогликемические судороги), и, если не принять
срочных мер (введение в организм большого количества глюкозы, инъекция
адреналина), наступает гибель организма. С явлениями гипогликемии
встречаются у больных сахарной болезнью при передозировке инсулина.
Появляющаяся у больных так называемая гипогликемическая кома устра-
няется введением в организм легко усвояемых углеводов (сахарозы, глю-
козы).
На гликогенную функцию печени и на содержание глюкозы в крови
влияет также гормон а-клеток островковой ткани поджелудочной железы
— глюкагон (стр. 199). Действие глюкагона на гликогенную функцию пе-
чени противоположно действию инсулина. Глюкагон стимулирует распад
гликогена в печени и вызывает гипергликемию. В этом отношении действие
глюкагона сходно с действием адреналина.
На содержание глюкозы в крови, кроме адреналина, инсулина и глю-
кагона, влияют также и некоторые другие гормоны. Так, например, уста-
новлено, что гормон коры надпочечников, кортикостерон при введении его
в организм вызывает гипергликемию. Подобным же образом действует
гормон щитовидной железы тироксин. Следует, однако, отметить, что корти-
костерон, в отличие от адреналина и глюкагона, не стимулирует распад
гликогена в печени, а вызывает гипергликемию, усиливая образование глю-
козы в организме из других веществ (из продуктов дезаминирования амино-
кислот и возможно из глицерина и жирных кислот). На содержание глю-
козы в крови и гликогена в печени влияют и гормоны передней доли ги-
пофиза. Действие их, однако, не прямое, а косвенное. В передней доле
гипофиза образуются адренокортикотропный (стр. 207) и тиреотропный гор-
моны. Первый из них стимулирует образование в корковой части надпочеч-
ников гормонов (кортизона), второй — образование в щитовидной железе
тироксина. Как кортизон, так и тироксин повышают содержание глюкозы
в крови.
Гормоны, образующиеся в передней доле гипофиза, влияют на углевод-
ный обмен, следовательно, и на содержание гликогена в печени и глюкозы
в крови, противоположно инсулину. Об этом говорят результаты следую-
щих исследований. При удалении поджелудочной железы у собак возни-
230
кает сахарный диабет и содержание глюкозы в крови у них резко возрас-
тает. Введение инсулина оперированным животным снижает содержание у
них в крови глюкозы. Удается добиться у оперированных животных сниже-
ния глюкозы в крови и иным путем, а именно, удалением у них гипофиза. В
нормальном организме гормоны передней доли гипофиза стимулируют распад
гликогена, однако их действие уравновешивается действием инсулина,
который стимулирует синтез гликогена. При удалении поджелудочной
железы, благодаря отсутствию инсулина, распад гликогена под влиянием
гормонов передней доли гипофиза происходит в большем объеме.
В деле регуляции содержания глюкозы в крови большое значение имеет
интенсивность использования углеводов в различных органах, а также
процессы превращения углеводов в жиры. Превращение углеводов в жиры
происходит у человека и животных не только при избыточном употреблении
углеводов, ведущем к ожирению. Образование жиров из углеводов и про-
дуктов их превращения (молочной, пировиноградной и уксусной кислот)
имеет место и при нормальном содержании углеводов в пище, когда вес
взрослого человека и животных остается без изменения. Опыты с введе-
нием в организм животных меченных С14 глюкозы, фруктозы, лактозы,
молочной кислоты, пировиноградной кислоты и уксусной кислоты пока-
зали, что уже через короткий срок радиоактивный углерод в довольно боль-
шой концентрации появляется в составе жиров организма. При введении
этих же веществ голодающему животному (на ранней стадии голодания,
когда запасы жиров в организме еще не истощены) радиоактивный углерод
появляется в жирах в малой концентрации. Интересно отметить, что инсу-
лин усиливает процесс превращения углеводов в жиры. Имеется достаточно
оснований считать, что у человека и животных потребляется больше жиров,
чем их поступает с пищей, так как из части углеводов пищи образуются
жиры. Что касается жиров, то хотя возможность их превращения в углеводы
у животных доказана, однако объем этого превращения ограничен. (Под-
робнее о взаимопревращении углеводов и жиров см. в главе девятнадцатой.)
Использование углеводов для синтеза жиров уменьшает запасы гликогена
в печени, снижает содержание глюкозы в крови.
Подводя итоги изложенного, можно заключить, что распад и синтез
гликогена в печени, уровень содержания глюкозы в крови и использование
углеводов в тканях подвергаются в организме весьма сложной регуляции.
Главная роль в регуляции углеводного обмена, как и вообще обмена веществ,
принадлежит центральной нервной системе. Нервная система оказывает
свое регуляторное действие на обмен углеводов через железы внутренней
секреции, влияя на образование в них гормонов и выделение их в кровь.
Центральная нервная система, регулируя функции органов, может тем
самым оказывать непосредственное воздействие на интенсивность и на на-
правленность обмена веществ, в том числе и углеводов.
ИСПОЛЬЗОВАНИЕ УГЛЕВОДОВ В КЛЕТКАХ
И ТКАНЯХ ОРГАНИЗМА
Глюкоза, поступающая из крови в органы, подвергается в них пре-
вращениям, приводящим ее к распаду с освобождением потенциальной
энергии. Превращения глюкозы в тканях, независимо от того, происходят
ли они после предварительного образования из нее гликогена или же без
этого, начинаются с процесса ее фосфорилирования, приводящего к обра-
зованию глюкозо-6-фосфорной кислоты. Глюкозо-6-фосфорная кислота,
а не глюкоза является исходным материалом для дальнейших превраще-
ний углеводов в клетках и в тканях организма. Химическое превращение
глюкозы, начиная с процесса ее фосфорилирования и кончая образованием
конечных продуктов распада — углекислого газа и воды, носит название
тканевого, а также внутриклеточного обмена углеводов. Так как этот обмен
10*
291
включает образование многочисленных промежуточных продуктов, его
называют также еще промежуточным обменом углеводов.
С давних пор известно, что распад углеводов может происходить не
только в аэробных, но и в анаэробных условиях. Распад глюкозы в дрож-
жевых клетках не требует участия кислорода и приводит к образованию
этилового спирта и углекислого газа. Бактерии молочнокислого брожения
без участия кислорода вызывают расщепление углеводов с выделением
молочной кислоты (С6Н12О6->2СН3СНОНСООН). Не участвует также кис-
лород при маслянокислом брожении, когда глюкоза сбраживается микро-
бами с образованием масляной кислоты, углекислого газа и водорода
(С6Н12О6->СН3СН2-СН2СООН+2СО2Ч-2Н2). Также без участия кислорода
происходит ацетоновое, изобутиловое, изопропиловое и некоторые другие
виды брожения.
Распад углеводов без участия кислорода имеет место и в тканях чело-
века и животных, причем он сопровождается образованием молочной кис-
лоты. Очень давно уже известно, что при работе мышц образуется молочная
кислота при одновременном распаде гликогена. При отмирании тканей ор-
ганизма в них накопляется молочная кислота.
Распад углеводов без участия кислорода получил название анаэробного
распада. Если начальным продуктом анаэробного распада углеводов в тка-
нях и в клетках является гликоген, говорят о процессе гликогенолиза, В
том случае, когда начальным продуктом распада является глюкоза, говорят
о гликолизе. Часто под названием «гликолиз» понимают анаэробный ряспад
углеводов, независимо от того, начинается ли он от распада гликогена или
глюкозы.
В тканях и клетках организма происходят также процессы аэробного
распада углеводов. Аэробному распаду подвергаются продукты, образую-
щиеся при анаэробном распаде углеводов (молочная кислота, этиловый
спирт). Аэробный распад в определенных клетках и тканях может начинать-
ся и с окисления фосфорилированной глюкозы. При распаде углеводов в
тканях принято различать этапы: анаэробный и аэробный.
АНАЭРОБНЫЙ РАСПАД УГЛЕВОДОВ (АНАЭРОБНЫЙ
ГЛИКОЛИЗ)
Один из видов анаэробного распада углеводов — спиртовое брожение,
известен человеку с незапамятных времен. Однако причина спиртового
брожения была установлена после 1860 г. исследованиями Л. Пастера. Уже
в глубокой древности спиртовым брожением пользовались при изготовле-
нии вина, пива, при хлебопечении. Неудивительно поэтому, что процесс
спиртового брожения с давних пор изучается биохимиками. В первом
периоде изучения спиртового брожения интересовались главным образом
количественной стороной дела и вопросом о том. насколько полно исполь-
зуется углерод глюкозы для образования этилового спирта и углекислого
газа. Исследования этого периода привели к балансовому уравнению спир-
тового брожения—С6Н12Об-^2СН3СН2ОН+2СО2. Однако это балансовое
уравнение спиртового брожения не вскрывает химические превращения,
которым подвергается глюкоза при образовании из нее спирта и углекислого
газа. Чрезвычайно важным моментом в изучении химизма спиртового бро-
жения явилось открытие бесклеточного спиртового брожения. Первые ука-
зания на возможность бесклеточного спиртового брожения были сделаны
в 1871 г. М. Манасеиной (стр. 148). Окончательно эта возможность была
доказана в 1897 г. братьями Бухнер.
Интересны обстоятельства, при которых братья Бухнер открыли бесклеточное
спиртовое брожение. С давних пор дрожжи получили применение в медицине как про-
дукт, усиливающий процессы обмена веществ в организме человека. Однако живые
дрожжи не могут употребляться человеком в больших количествах, так как они вызы-
292
вают усиленное брожение в кишечнике. В связи с этим предпринимались попытки по-
лучения препаратов из дрожжей, в которых отсутствовали бы живые клетки (зими-
нов). Братья Бухнер предприняли попытку получить для медицинских целей препарат
из дрожжевого сока, свободного от живых клеток. Работая в этом направлении, они
обратили внимание на тот факт, что дрожжевой сок, свободный от клеток, сбраживает
прибавленную к нему сахарозу. Дальнейшие исследования привели их к заключению
о том, что спиртовое брожение может осуществляться ферментами дрожжевых клеток
в отсутствие самих клеток,
Выведение процесса спиртового брожения за пределы дрожжевых кле-
ток позволило в дальнейшем более детально приступить к его изучению.
Дрожжевой бесклеточный сок с начала нашего столетия стал объектом
всестороннего изучения.
Позже, в 1918 г., Мейергоф показал, что бесклеточные экстракты из
мышц способны образовывать из углеводов молочную кислоту. Это об-
стоятельство позволило подойти к более детальному изучению анаэробного
распада углеводов в мышечной ткани.
История изучения анаэробного гликолиза
В 1905 г. Л. А. Иванов установил, что прибавление неорганического фосфата
к дрожжевому соку ускоряет процесс сбраживания глюкозы, причем оказалось, что
прибавленный фосфат исчезает из сока. Дальнейшие исследования показали, что ис-
чезновение неорганического фосфата сопровождается накоплением органического
фосфорного соединения — гексозофосфорной кислоты. Почти одновременно с Ивано-
вым подобные исследования были проведены Гарденом и Йонгом, которые выделили
из дрожжевого сока гексозодифосфорную кислоту и изучили ее химическую структу-
ру. Гарден и Ионг изучили также количественные соотношения между неорганическим
фосфатом, исчезающим в дрожжевом соке, накоплением гексозофосфата и образова-
нием этилового спирта. Исходя из полученных при этом данных, они вывели уравне-
ние спиртового брожения в дрожжевом соке, получившее название «реакции Гар-
дена — Ионга»:
2С6Н12Об + 2Н3РО4 -> 2СН3СН2ОН + 2СО2 + (Н2РО4)2
Глюкоза Этиловый Гексозодифосфорная
спирт кислота
Приведенное уравнение показывает, что из двух молекул глюкозы в дрожжевом
соке одна сбраживается с образованием двух молекул этилового спирта и двух моле-
кул углекислого газа, а одна остается в соке в виде гексозодифосфор ной кислоты. Сле-
дует указать, что в дрожжевых клетках спиртовое брожение не сопровождается на-
коплением гексозофосфорных кислот и что оно происходит значительно интенсивнее,
чем в дрожжевом соке.
Реакция Гардена — Ионга оставалась загадочной в течение долгого времени.
Ответить на вопросы, почему именно спиртовое брожение в дрожжевом соке сопровож-
дается накоплением гексозодифосфорной кислоты (позже оказалось, что наряду с ней
накопляются также и гексозомонофосфорные кислоты), почему оно происходит более
медленно, чем в дрожжевых клетках, удалось только лишь спустя 40 лет после обна-
ружения этих фактов (расшифровка уравнения Гардена — Ионга приводится на
стр. 300).
Благодаря исследованиям Л. Иванова, Гардена и Ионга и несколько позже
А. Лебедева, разработавшего простой и удобный метод получения бесклеточного дрож-
жевого сока и изучавшего гексозофосфорные кислоты, образующиеся при спиртовом
брожении, в начале XX в. сложилось представление об участии неорганических фос-
фатов в процессе анаэробного распада углеводов и об образовании в виде промежуточ-
ных продуктов распада фосфорилированных гексоз.
Позже (в 1921 —1927 гг.) Г. Эмбден обнаружил, что при распаде гликогена в соке
мышц исчезает неорганический фосфат и образуются гексозофосфорные кислоты. Этим
было показано, что гексозофосфорные кислоты образуются при распаде углеводов так-
же и в мышцах.
Большой шаг вперед в деле изучения анаэробного гликолиза был сделан Эмб-
деном в 1932 г., показавшим, что при распаде углеводов в мышцах в виде промежуточ-
ных продуктов образуются фосфоглицериновая и глицеринфосфорная кислоты. Об-
наружение этих продуктов позволило Эмбдену предложить схему анаэробного распа-
да углеводов, которая была значительно расширена и дополнена исследованиями
293
Мейергофа и его сотрудников и Я. Парнаса. Эта схема общепризнана и в настоящее
время.
Наряду с изучением промежуточных продуктов анаэробного гликолиза шло
изучение ферментов, катализирующих отдельные его этапы. Открытие бесклеточного
спиртового брожения дало возможность подойти к изучению ферментов дрожжевых
клеток. Комплекс ферментов, катализирующий распад глюкозы с образованием эти-
лового спирта и углекислого газа, получил название дрожжевой зимазы. Вначале
предполагалось, что зимаза является однородным ферментом; Однако ошибочность это-
го предположения вскоре была установлена.
Исследования Гардена и Ионга, проведенные в 1904 г., показали, что дрожжевой
сок в результате диализа теряет способность сбраживать глюкозу. Эту способность он
снова приобретает, если к нему прибавить диализат. Диализат оказался устойчивым
к нагреванию, и активное его начало получило название козимазы.
Соответственно этому ферменты сака и экстрактов из мышц, способные расщеп-
лять гликоген с образованием молочной кислоты, получили название животной зи-
мазы. Зимаза оказалась комплексом ферментов, причем некоторые из них оказались
двухкомпонентными.
Анаэробный гликолиз изучен детально. Выделено большое количество промежу-
точных продуктов, образующихся как в дрожжевых клетках, так и в тканях животных.
Установлено, что в образовании этих промежуточных продуктов участвуют многочис-
ленные ферменты. Названия «зимаза» и «козимаза» сейчас оставлены и ими редко поль-
зуются.
Изучение распада углеводов в дрожжевом соке и в соке и в экстрактах из мышц
позволило глубоко проникнуть в сущность химических процессов, лежащих в основе
анаэробной фазы обмена углеводов в клетках и в тканях организма.,
ПРОМЕЖУТОЧНЫЕ ЭТАПЫ РАСПАДА УГЛЕВОДОВ
В ДРОЖЖЕВЫХ КЛЕТКАХ
Дрожжевые клетки неспособны расщеплять прибавленные к ним крах-
мал и гликоген. Гликоген же, содержащийся в дрожжах, легко распадает-
ся с образованием этилового спирта и углекислого газа. Объясняется
это тем, что коллоидальные полисахариды не проникают в дрожжевые клет-
ки и ферменты, катализирующие их распад, не выделяются дрожжевыми
клетками в окружающую их среду. Крахмал (картофеля, злаков) предва-
рительно расщепляют, или, как говорят, осахаривают. Осахаривание крах-
мала, распад его с образованием мальтозы, осуществляют с помощью ами-
лазы, содержащейся в проросших зернах ячменя (в солоде). Распад маль-
тозы с образованием глюкозы происходит с помощью фермента дрожжей
мальтазы. Сахароза, подобно мальтозе, непосредственно используется
дрожжами, так как они богаты сахаразой. Спиртовое брожение начинается
с процесса фосфорилирования глюкозы.
Дрожжевые клетки содержат активную глюкозокиназу, катализирую-
щую первый этап спиртового брожения — фосфорилирование глюкозы.
I этап:
Глюкоза
СН2О-Н2РО3
н он
Глюкозо-6-фосфорная кислота
На II этапе выделившаяся глюкозо-6-фосфорная кислота превращается
под влиянием фосфоглюкоизомеразы в фруктозо-6-фосфорную кислоту.
294
II этап:
Глюкозо—6 - фосфорная»
кислота
Фруктозо -6 - фосфорная
кислота
На третьем этапе происходит фосфорилирование фруктозо-6-фосфорной
кислоты в результате перенесения фосфорного остатка от АТФ на нее.
Катализируется эта реакция ферментом фосфофруктокиназой.
III эта п:
Фруктозо-6-фосфорная кислота
Фруктозо-1,6-дифосфорная кислота
Четвертый этап характеризуется разрывом шестиуглеродной цепи
фруктозе-1,6-дифосфорной кислоты с образованием 3-фосфоглицериналь-
дегида и фосфодиоксиацетона. Эта реакция катализируется ферментом
альдолазой. При прибавлении ее к раствору фруктозо-1,6-дифосфорной
кислоты получается смесь 3-фосфоглицерипальдегида и фосфодиоксиацето-
на (триозофосфорные кислоты). Образование их можно наблюдать при
сбраживании глюкозы в дрожжевом соке, если прибавить к нему раствор
монойодуксусной кислоты, являющейся одним из гликолитических ядов.
Монойодуксусная кислота блокирует спиртовое брожение на стадии об-
разования триозофосфорных кислот. В дрожжевом соке в этом случае
накопляется смесь из гексозодифосфорной и триозофосфорных кислот.
IV э т а п:
СН2О-Н2РОа
0-Н2Р03
СН, /°\ СН2О-Н2РО3
\|н |/
н\_____/он
н он
носн
I
НСОН ------------>
I ч---
НСОН
I
СН2-Н2РО3
СН2О'Н2РО3
I
с=о
I
СН2ОН
Фосфодиоксиацетон
/О
НСОН н
СН2О-Н2РО3
Фруктозо-1,6-дифосфорная кислота
3-фосфоглицеринальдегид
Из двух триозофосфорных кислот дальнейшему окислительному прев-
ращению подвергается только одна — фосфоглицеринальдегид. Фосфодиок-
295
сиацетон, однако, не теряется для брожения, так как он под влиянием фер-
мента изомеразы фосфотриоз превращается в фосфоглицеринальдегид.
V этап:
СН2ОН
с=о
I
СН2О-Н2РО3
Фосфодиоксиа цетон
/°
С<у
----" |\
* нсонн
I
СН2О-Н2РО3
Фосфогли перинальдегид
Между обеими фосфотриозами устанавливается равновесие, но так как
в дальнейшем превращениям подвергается фосфоглицеринальдегид, то во
время брожения реакция сдвигается в правую сторону, и фосфодиокси ацетон
превращается в фосфоглицеринальдегид. В дальнейшем будет видно, что
при особых условиях фосфодиоксиацетон может восстановиться с образо-
ванием фосфоглицерина (см. стр. 302).
На шестом этапе фосфоглицеринальдегид подвергается окислению. Эта
окислительная реакция катализируется дегидрогеназой коферментом кото-
рой является никотинамид-аденин-динуклеотид (НАД). В окислении уча-
ствует фосфорная кислота. Реакции протекают следующим образом:
VI этап:
C-S—фермент
I ХН |
2НСОЫ IIS-дегидрогеназа + 2НАД------>2НСОН + НАД-Н2
СН2О • Н2РО3 СН2О • Н2РО3
НАД восстанавливается в НАД-Н2, а к ферменту присоединяется с по-
мощью макроэргической связи 3-фосфоглицериновая кислота. Образует-
ся нестойкое соединение фермента с 3-фосфоглицериновой кислотой, кото-
рое взаимодействует с Н3РО4 с образованием 1,3-дифосфоглицериновой
кислоты.
Z Z
С—S—фермент
2НСОН +2НО-НоРО3 2НСОН°‘Н2Р°3 + HS —фермент
I ------2---> I
СН2-Н2РО3 СН2О-Н2РО3
Шестой этап гликолиза — окисление фосфоглицеринальдегида, сле-
довательно, сопровождается образованием 1,3-дифосфоглицериновой кис-
лоты.
На седьмом этапе гликолиза фосфатный остаток, имеющий макроэрги-
ческую связь, переносится с участием фосфоферазы на аденозиндифосфор-
ную кислоту, образуя 3-фосфоглицериновую кислоту и АТФ.
VII этап:
Z
С~О-Н.>РО8 соон
I I
2 НСОН + 2 АДФ 2 НСОН + 2 АТФ
I I
СН2О-Н2РО3 СН2О-Н2РО3
1,3-дифосфоглицериновая кислота 3-фосфоглицериновая кислота
Восьмой этап гликолиза приводит к превращению 3-фосфоглицерино-
вой кислоты в 2-фосфоглицериновую кислоту. Эта реакция катализируется
ферментом фосфоглицеромутазой.
296
VIII этап:
СООН
I
2 НСОН
I
СН2О-Н2РО3
3-фосфоглицериновая
кислота
СООН
I
2 НСО’Н2РО3
СН2ОН
2-фосфоглицериновая
кислота
На девятом этапе 2-фосфоглицериновая кислота в результате отщепле-
ния воды превращается в енолфосфопировиноградную кислоту. Эта реак-
ция катализируется фосфопируватгидратазой.
IX этап:
СООН
СООН ZOH
2 СНО-Н2РО3 —J^O^
I <--------------
СН2ОН
2 СО~Р- О
сн2
он
2-фосфоглицериновая
кислота
Енолфосфопировиноградная
кислота
Реакция образования енолфосфопировиноградной кислоты интересна в
энергетическом отношении. В молекуле 2-фосфоглицериновой кислоты фос-
фатный остаток присоединен эфирной связью. В молекуле же енолфосфопи-
ровиноградной кислоты фосфатный остаток присоединен к третичной спир-
товой группе макроэргической связью. Следовательно, в результате этой
реакции эфирофосфатная связь, бедная энергией, превращается в фос-
фатную связь, богатую энергией. Это превращение осуществляется без
какого-либо использования энергии извне. Реакция дегидратирования,
имеющая место при образовании енолфосфопировиноградной кислоты из
2-фосфоглицериновой кислоты приводит к перераспределению внутренней
энергии молекулы, в связи с чем возникает макроэргическая связь.
Десятый этап гликолиза сводится к фосфоферазной реакции — пере-
несению фосфатного остатка с макроэргической связью от фосфопировино-
градной кислоты на аденозиндифосфорную кислоту.
X этап:
+ 2 АДФ
Енолфосфопировиноградная
кислота
СООН
I
2 СОН 4-2 АТФ;
сн2
СООН СООН
I
СОН -> СО
I! I
сн2 сн3
Енолпировиноградная
П ировиноградная
кислота
кислота
Одиннадцатый этап гликолиза состоит в декарбоксилировании пиро-
виноградной кислоты с образованием уксусного альдегида и углекислого
газа. Реакция катализируется декарбоксилазой.
XI этап:
Пировиноградная Уксусный альдегид
кислота
Двенадцатый этап завершает спиртовое брожение. Он приводит к вос-
становлению уксусного альдегида. Отсюда этот этап получил название вос-
становительного этапа гликолиза. Водород, необходимый для восстановле-
ния уксусного альдегида, доставляется НАД-Н2, возникающим на VI этапе
при окислении фосфоглицеринальдегида.
297
XII этап:
zO СН2ОН
2 С<^ + 2НАД-Н2-> 2 + 2НАД
СН3 Н СН8
Уксусный альдегид Этиловый спирт
Следовательно, реакция приводит к восстановлению уксусного альде-
гида и к окислению восстановленного кофермента дегидрогеназы фосфогли-
церинальдегида НАД-Н2 с образованием НАД.
Окислительная и восстановительная реакции брожения теснейшим
образом связаны друг с другом и обусловливают друг друга: без окисления
фосфоглицеринальдегида, ведущего к восстановлению НАД в НАД-Н2, не
может быть реакции восстановления уксусного альдегида, в результате ко-
торой окисляется НАД-Н2 и образуется НАД, являющийся переносчиком во-
дорода от подвергающегося окислению фосфоглицеринальдегида на вос-
станавливающийся уксусный альдегид.
Последовательность промежуточных этапов спиртового брожения мож-
но представить схематически (см. стр. 299).
Приведенная схема спиртового брожения подтверждена большим фак-
тическим материалом. Прежде всего выделены все приведенные в ней про-
межуточные продукты; химическая структура их установлена синтезом.
Каждый из этих продуктов, будучи прибавленным к дрожжевому соку,
сбраживается, т. е. превращается в этиловый спирт. Так, например, прибав-
ление к дрожжевому соку фосфоглицеринальдегида и неорганического фос-
фата приводит к интенсивному образованию этилового спирта и углекислого
газа. Этот факт объясняет усиление сбраживания глюкозы при прибавлении
к дрожжевому соку неорганических фосфатов, впервые установленное
Л. Ивановым и Гарденом и Йонгом.
Схема подтверждена также тем, что зимазу дрожжей удалось расчле-
нить на ряд ферментов, каждый из которых катализирует определенный
этап гликолиза. Из этих ферментов одни выделены в кристаллическом виде,
другие — в очищенном состоянии. Некоторые ферменты оказались двух-
компонентными; изучена химическая природа их коферментов.
Прошло свыше 30 лет с того времени, как Г. Эмбден предложил новую
в то время схему гликолиза. Эта схема не включала тогда многочисленных
ныне известных промежуточных продуктов гликолиза. Схема Эмбдена дала
правильную ориентировку исследователям, и благодаря их усилиям она
была расширена и дополнена. Нет никаких сомнений в том, что опа объек-
тивно отражает путь анаэробного гликолиза как в дрожжевых клетках,
так, как мы увидим дальше, и в тканях животных.
Схема анаэробного гликолиза показывает участие в нем аденозинтри-
фосфорной и аденозиндифосфорной кислот. Из этой схемы легко видеть,
что при спиртовом брожении, при распаде каждой молекулы глюкозы с об-
разованием двух молекул этилового спирта и двух молекул углекислого га-
за, фосфорилируются две молекулы аденозиндифосфорной кислоты. Учи-
тывая это, валовое уравнение спиртового брожения, которое с давних пор
изображается в видеС6Н12О6->2СН3СН2ОН+2СО2, может быть представлено
следующим образом:
С6Н12О6 + 2II3PO4 + 2АДФ -> 2СН3СН2ОН + 2СО2 Ч-2АТФ.
Фосфорилирование двух молекул АДФ при распаде одной молекулы
глюкозы показывает, что спиртовое брожение сопровождается появлением
макроэргических фосфатных связей; это представляет большой интерес при
энергетической оценке процесса гликолиза.
Сравнение между собой калорийной ценности одной грамм-молекулы
глюкозы и двух грамм-молекул этилового спирта приводит к заключению,
298
Схема спиртового брожения
Глюкоза АТФ АДФ
___________________ (глюкозокиназа)
Глюкозо-6-фосфорпая кислота
I (фосфоглюкомутаза)
Фруктозо-6-фосфорная кислота
(фосфоф р уктокиназа)
АТФ
АДФ
Фруктозо-1,6-дифосфорная кислота
(альдолаза)
Диоксиацетонфосфорная
кислота
Глицеринальдегидфосфорная
кислота
(фосфотриозиозомераза)
(дегидрогеназа фосфоглицеринальдегида)
2 молекулы 1,3-дифосфоглицериновой кислоты +
2 молекулы АДФ------
2 молекулы АТФ-<----
2 молекулы
2 молекулы
2 молекулы
+ 2Н3РО4 +
2НАД-Н2
2НАД i
(киназа 3-фосфоглицериновой
кислоты)
3-фосфоглицериновой кислоты
(фосфоглицером у таза)
V I
2-фосфоглицериновой кислоты
I (енолаза)
фосфоенолпировиноградной кислоты
2 молекулы АДФ--------
2 молекулы АТФ<-------
2 молекулы
(декарбоксилаза)
(киназа пировиноградной
кислоты)
пировиноградной кислоты
2
молекулы уксусного альдегида
Д
2 молекулы этилового спирта
2НАД-Н2
2НАД
что анаэробный гликолиз сопровождается уменьшением свободной энергии,
причем это уменьшение составляет около 50 000 калорий на грамм-молекулу
сброженной глюкозы. Если учесть, что при сбраживании грамм-молекулы
глюкозы образуются за счет фосфорилирования АДФ две грамм-молекулы
АТФ и что при образовании каждой грамм-молекулы АТФ (макроэргиче-
ских фосфатных связей) используется 10000 калорий, то легко видеть, что
значительная часть энергии, возникающая при сбраживании глюкозы, ока-
299
зывается в макроэргических связях АТФ. При гидролизе АТФ с помощью
аденозинтрифосфатазы, а также при использовании фосфатного остат-
ка АТФ в ряде фосфоферазных реакций освобождается энергия, доступная
для использования клеткой.
Биологический смысл сложного пути спиртового брожения, надо по-
лагать, заключается в том, что он приводит к образованию макроэргических
связей, обеспечивающих энергетические нужды клеток.
Значительная часть энергии, освобождающейся при брожении глюкозы,
рассеивается в виде тепловой энергии. В пользу этого говорит тот факт,
что при брожении повышается температура бродящей жидкости. Так как
рост и размножение дрожжей усиливаются при повышении (до известного
предела) температуры, то, возможно, что рассеивание известного количества
энергии брожения в виде тепловой энергии является фактором, благоприят-
ным для дрожжевых клеток.
Сбраживание глюкозы в дрожжевых клетках
и в бесклеточном дрожжевом соке
Дрожжевой сок, как уже было отмечено,— удобный объект для изучения спир-
тового брожения. Благодаря его использованию удалось разобраться в ферментатив-
ных механизмах, приводящих к сбраживанию глюкозы. Следует, однако, отметить, что
распад глюкозы в дрожжевых клетках в известной мере отличается от распада глюкозы
в бесклеточном дрожжевом соке. Прежде всего обращает на себя внимание факт, что
в дрожжах спиртовое брожение происходит во много раз быстрее, чем в дрожжевом
соке, т. е., очевидно, действие ферментов гликолиза в дрожжевых клетках более эф-
фективно, более слаженно, чем в бесклеточном соке. Далее, установлено, что в дрож-
жевом соке сбраживание глюкозы происходит до тех пор, пока в нем содержится неор-
ганический фосфат. По мере сбраживания глюкозы в дрожжевом соке уменьшается
запас неорганического фосфата, интенсивность брожения замедляется и доходит до
низкого уровня. Сбраживание глюкозы в дрожжевом соке сопровождается накопле-
нием гексозофосфатов и особенно фруктозо-1,6-дифосфата. Выше (стр. 293) уже указы-
валось, что Гарден и Ионг установили количественное соотношение между образова-
нием из глюкозы спирта и углекислого газа и накоплением гексозофосфорных кислот
(«реакция Гардена-Ионга»). Накопление гексозофосфорных кислот объясняет причи-
ну убыли в дрожжевом соке неорганического фосфата. Было бы ошибочным считать,
что спиртовое брожение в дрожжевых клетках происходит без участия неорганичес-
кого фосфата. Мы видели, что окислительная реакция спиртового брожения (VI этап)
сопровождается связыванием неорганического фосфата, образованием из фосфогли-
церинальдегида 1,3-дифосфоглицериновой кислоты. Однако в дрожжевых клетках при
спиртовом брожении неорганический фосфат, связавшись при окислительной реакции,
затем переносится на АДФ с образованием АТФ. От АТФ неорганический фосфат от-
щепляется в результате действия аденозинтрифосфатазы. В дрожжевых клетках при
гликолизе происходит кругооборот неорганического фосфата, и небольшого его коли-
чества, имеющегося в дрожжевых клетках, оказывается достаточно, чтобы обеспечить
на должном уровне интенсивность распада глюкозы с образованием спирта и углекис-
лого газа. Наблюдающееся постоянство в содержании неорганического фосфата в
дрожжевых клетках до и во время сбраживания глюкозы не говорит о том, что гли-
колиз в них происходит без участия неорганического фосфата.
Чем же все-таки можно объяснить причину медленного сбраживания глюкозы в
дрожжевом соке и накопление в нем гексозофосфатов? Ответ на этот вопрос дали ре-
зультаты исследований по изучению активности аденозинтрифосфатазы в дрожжевом
соке. Оказалось, что активность ее там незначительна. Аденозинтрифосфатаза раз-
рушается при получении сока из дрожжей. Недостаточная активность аденозинтри-
фосфатазы и даже отсутствие ее в дрожжевом соке приводит к тому, что образующаяся
при гликолизе АТФ (при фосфорилировании АДФ) расщепляется медленно, или же
вовсе не подвергается гидролизу. В дрожжевом соке остается только один путь дефос-
форилирования АТФ с помощью фосфофераз. С их помощью возникает из АТФ необ-
ходимая для течения гликолиза АДФ. Фосфатные остатки от АТФ при спиртовом бро-
жении в дрожжевом соке переносятся на глюкозу и гексозомонофосфаты.
Спиртовое брожение в бесклеточном дрожжевом соке протекает согласно следую-
щим двум уравнениям:
СбЫ12О6 + 2АДФ + 2Н3РО4 -> 2СН3СН2ОН + 2СО, -f- 2АТФ (1)
С6Н12О6 + 2АТФ -> С6Н10О4 (Н2РО4)2 + 2АДФ. (2)
Суммирование уравнений 1 и 2 дает уравнение 3, т. е. уравнение Гарден — Ионга:
2С6Н12О6 -+ 2СН3СН2ОН + 2СО2 + С6Н10О4 (Н2РО4)2. (3)
300
Если приведенные выше соображения верны, то следует ожидать, что добавление
препарата адснозинтрифосфатазы к дрожжевому соку (его можно получить, например,
из клубней картофеля) должно привести к тому, что сбраживание глюкозы в нем будет
происходить без накопления гексозодифосфата и более интенсивно, так как оно не будет
лимитировано медленным образованием АДФ из АТФ. Экспериментальные данные
показали, что добавление к дрожжевому соку препарата аденозинтрифосфатазы дей-
ствительно ускоряет сбраживание в нем глюкозы и при этом без накопления гексозо-
фосфатов.
Физиологическое значение спиртового брожения
В 1860 г. Л. Пастер с полной убедительностью показал, что при различ-
ных видах брожения происходит рост и размножение микробов. При спир-
товом брожении растут и размножаются дрожжи. Брожение, следовательно,
является физиологическим процессом. Позже, в 1875 г., Пастер показал,
что брожение может происходить при полном отсутствии кислорода.
Анаэробное брожение было названо Пастером «жизнь без кислорода».
При спиртовом брожении глюкоза используется дрожжевыми клетками
как питательное вещество. Распад глюкозы с образованием этилового спирта
сопровождается освобождением энергии, используемой дрожжевыми клет-
ками. Следует указать, что с энергетической точки зрения анаэробный
распад глюкозы малоэкономичен. Возникающий при распаде глюкозы
этиловый спирт сохраняет еще в себе много потенциальной энергии, и этот
спирт в отсутствие кислорода не подвергается дальнейшему распаду.
Установлено, что при полном сгорании грамм-молекулы глюкозы с обра-
зованием углекислого газа и воды изменение свободной энергии (—А/7)
достигает 686 000 калорий. При сбраживании же грамм-молекулы глюкозы
уменьшение свободной энергии составляет всего около 50 000 калорий.
Легко сосчитать, что при сбраживании глюкозы в дрожжевой клетке мак-
симально может быть использовано только примерно 7% всей энергии глю-
козы. Дрожжевые клетки покрывают свои энергетические затраты за счет
сбраживания большого количества глюкозы. Это обстоятельство широко
используется человеком для изготовления спирта (в спиртовой промышлен-
ности) и при изготовлении алкогольных напитков.
С неэкономным использованием питательных веществ мы встречаемся
у различных, так называемых строгих (облигатных) анаэробов — немногих
групп микробов, совершенно неспособных использовать кислород, и у фа^
культативных микробов, чрезвычайно широко распространенных в при-
роде, использующих кислород для окисления питательных веществ, когда
он им доступен, но которые могут существовать и в отсутствие кислорода,
расщепляя те же питательные вещества с образованием сложных органиче-
ских веществ, сохраняющих еще значительное количество потенциальной
энергии. К факультативным анаэробам относятся и дрожжи.
Управление процессом спиртового брожения
Процесс спиртового брожения настолько хорошо изучен, что можно
в него вмешиваться и направленно его изменять. Нормальный ход брожения,
при котором образуются этиловый спирт и углекислый газ, можно напра-
вить таким образом, чтобы вместо этилового спирта получить глицерин.
Такой распад глюкозы в дрожжах получил название второй формы брожения
и он осуществляется следующим образом.
К раствору подвергающейся сбраживанию дрожжами глюкозы добав-
ляют гидросульфит натрия, который связывает уксусный альдегид:
zO ZOIISOg
СН3С<^ 4- NaHSO3-----> СН3сДн
ХН \Na
Этим самым образующийся при декарбоксилировании пировиноград-
ной кислоты уксусный альдегид выключается из процесса гликолиза и не
301
восстанавливается НАД-Н2. Вместо уксусного альдегида акцептором водо-
рода от НАД-Н2 в этом случае становится фосфодиоксиацетон, восста-
навливающийся в фосфоглицерин:
СН2ОН СН2ОН
С-0 + НАД-Н2-> СНОН + НАД
I I
СН2О • Н2РО3 СН2О • Н2РО3
Фосфоглицерин затем под влиянием фосфатазы подвергается гидролизу,
превращаясь в глицерин и фосфорную кислоту. Каждая молекула глюкозы
при второй форме брожения дает по одной молекуле глицерина, соедине-
ния уксусного альдегида с бисульфитом и углекислого газа. Вторая форма
брожения была разработана и предложена для производственного получения
глицерина из углеводов К. Нейбергом.
Наряду со второй формой существует еще и третья форма спиртового брожения,
при которой получается, кроме этилового спирта, и уксусная кислота. Третья форма
брожения имеет место в том случае, когда распад глюкозы дрожжевыми клетками про-
исходит при щелочной реакции, создаваемой добавлением к бродящей смеси соды.
В щелочной среде возникающий при декарбоксилировании щировиноградной кислоты,
уксусный альдегид не восстанавливается обычным путем в спирт, т. е. за счет водоро-
да, освобождающегося при окислении фосфоглицеринальдегида. Уксусный альдегид в
этом случае подвергается дисмутации, т. е. одна его молекула восстанавливается с об-
разованием спирта, а другая окисляется в уксусную кислоту.
Схематически третью форму брожения можно представить следующими урав-
нениями;
СООН
1) С6Н12Ов ----------> 2 СНОН Г— 2Н2":;
СН2О-Н2РО9
СООН
2 СНОН ----------> 2 СН3С^ + 2СО2
I ХН
СН2О-Н3РО3
2)
./О
сс СН2ОН
I ХН I
С9Н12О6-—> снон + с=о
I I
СН2О-Н2РО3 СН2О-Н2РО3
с<°
I ХН
снон
I
СН2О-Н2РО3
сн2он
I
с=о
I
СН2О-Н2РОг
СНоОН
I
----> 2 СНОН
I
СН2О-Н2РО3
3)
----> СН3СН2ОН + СН3СООН
4)
СН2ОН СН2ОН
I I
2 СНОН + 2Н2О----------> СНОН + 2Н3РО4
I I
СН2ОН2РО3 СН2ОН
Поскольку продуктом брожения является наряду с этиловым спиртом и глице-
рином уксусная кислота, для осуществления третьей формы спиртового брожения
приходится прибавлением соды все время поддерживать в бродящей смеси слабощелоч-
ную реакцию. В противном случае при появлении слабокислой реакции восстанавли-
вается обычная форма брожения, при которой образуется только один этиловый спирт
и углекислый газ.
Третья форма спиртового брожения интересна тем, что здесь дрожжевые клетки
способны при воздействии на них щелочи несколько изменять гликолиз, в результате
чего образуется уксусная кислота, нейтрализующая эту щелочь.
302
АНАЭРОБНЫЙ РАСПАД УГЛЕВОДОВ
В ТКАНЯХ животных
Объектом для изучения анаэробного гликолиза уже с давних пор, на-
ряду с дрожжевыми клетками, служит мышца. Оказалось, что гликолиз
в мышцах и спиртовое брожение в дрожжевых клетках происходят по
одному и тому же пути, следовательно, с образованием одинаковых про-
межуточных продуктов. Различия имеются только лишь па этапе превра-
щения пировиноградной кислоты, которая в мышцах при анаэробном гли-
колизе не подвергается декарбоксилированию, а восстанавливается с обра-
зованием молочной кислоты. Отсюда конечным продуктом анаэробного
гликолиза в мышцах является молочная кислота, в то время как в дрожже-
вых клетках — этиловый спирт и углекислый газ. Необходимо отметить,
что анаэробный распад углеводов с выделением молочной кислоты специфи-
чен не только для мышц. Установлено, что подобный процесс происходит
и в других тканях организма человека и животных. Он имеет место также
у микроорганизмов (бактерий молочнокислого брожения), у которых ана-
эробный распад углеводов заканчивается образованием молочной кис-
лоты.
В мышцах наблюдается как гликогенолиз, так и гликолиз. Гликоге-
нолиз характерен также и для дрожжевых клеток, сравнительно богатых
гликогеном. Однако при брожении, когда дрожжевая клетка перераба-
тывает очень большое количество глюкозы, в ней распад глюкозы происхо-
дит без предварительного образования гликогена.
Как бы ни шел анаэробный распад углеводов в клетках, начинается ли
он с распада гликогена (гликогенолиз) или же с распада глюкозы (гликолиз),
дальнейший путь его, начиная с этапа образования глюкозо-6-фосфорной
кислоты, всегда один и тот же.
Распад гликогена в мышцах происходит преимущественно фосфори-
литическим путем. Не исключена, однако, возможность незначительного
по своему объему распада гликогена в мышцах гидролитическим путем
с помощью амилазы, которая катализирует этот распад с образованием дек-
стринов, расщепляющихся до мальтозы, и мальтазы, катализирующей
гидролиз мальтозы с выделением глюкозы. В мышцах (особенно молодых
животных) содержится небольшое количество амилазы и мальтазы. Фосфо-
рилитический распад гликогена осуществляется двумя ферментами и при-
водит к образованию глюкозо-1-фосфорной кислоты. Один из ферментов —
фосфорилаза — катализирует расщепление с участием фосфорной кислоты
1,4-глюкозидных связей, но не затрагивает 1,6-глюкозидные связи. В ре-
зультате действия фосфорилазы наряду с глюкозо-1-фосфорной кислотой
образуются еще так называемые пограничные декстрины, имеющие в своих
молекулах 1,6-глюкозидные связи. Распад этих декстринов начинается
с действия трансглюкозидазы (стр. 172), катализирующей расщепление
1,6-глюкозидных связей. В результате действия фосфорилазы и трансглюко-
зидазы вся молекула гликогена распадается с образованием глюкозо-1-
фосфорной кислоты.
Глюкозо-1-фосфорная кислота
303
Образующаяся при фосфоролизе гликогена глюкозо-1-фосфорная кис-
лота подвергается дальнейшему превращению в тканях. Что же касается
глюкозы, появляющейся при гидролизе гликогена, то прежде чем подверг-
нуться дальнейшему превращению, она должна фосфорилироваться. Фосфо-
рилирование глюкозы происходит с помощью глюкозокиназы, катализирую-
щей перенесение на нее фосфатного остатка от аденозинтрифосфорной кис-
лоты (стр. 170).
Глюкозо-1-фосфорная кислота с участием фермента фосфоглюкомутазы
превращается в глюкозо-6-фосфорную кислоту. На этапе образования глю-
козо-6-фосфорной кислоты сливаются между собой гликогенолиз и гликолиз.
4
(гликогенолиз)
глюкозо-1-фосфорная кислота
глюкоза + АТФ
ф (гликолиз)
АДФ
глюкозо-6-фосфорная кислота
Схематически путь гликогенолиза в мышцах можно представить сле-
дующим образом:
Гликоген [1/п(С6Н10О5)п] + Н3РО4
Глюкозо-1-фосфорная кислота
Глюкозо-6-фосфорная кислота
Фруктозо-6-фосфорная кислота + АТФ
Фруктозе-1,6-дифосфорная кислота+АДФ
fl
Фосфоглицеринальдегид + фосфодиоксиацетон
2 молекулы фосфоглицеринальдегида 4-
2НАД ' J +2Н3РО4
2 молекулы 1,3-дифосфоглицериновой кислоты + •’ 2НАД-Н2 * 4- 2АДФ
2 молекулы 3-фосфоглицериновой кислоты 4- 2АТФ
Г
2 молекулы 2-фосфоглицериновой кислоты
2 молекулы фосфоенолпировиноградной кислоты 4- 2АДФ
2 молекулы пировиноградной кислоты 4- 2АТФ
2 молекулы пировиноградной кислоты 4- 2НАД-Н2
2 молекулы молочной кислоты + i 2 НАД
Из приведенной схемы видно, что валовое уравнение гликогенолиза
можно представить следующим образом:
l/n(CeHi0O5)n 4- ЗАДФ 4- ЗН3РО4 -> 2С3НбО3 4- ЗАТФ.
Изменение свободной энергии при полном окислении двух грамм-мо-
лекул молочной кислоты (при образовании из нее воды и углекислого
газа) составляет 650 000 калорий. Учитывая, что уменьшение свободной
энергии при полном окислении грамм-молекулы глюкозы равняется 686 000
304
калориям, можно подсчитать, что уменьшение свободной энергии при гли-
когенолизе составляет 36 000 калорий на 1 грамм-молекулу глюкозы. Однако
это количество энергии не освобождается при гликогенолизе, так как обра-
зование двух грамм-молекул молочной кислоты, как показывает приведен-
ное выше уравнение, сопровождается фосфорилированием трех грамм-
молекул аденозиндифосфорной кислоты с выделением трех грамм-молекул
АТФ. Если считать, что образование макроэргических фосфатных связей
при фосфорилировании одной грамм-молекулы аденозиндифосфорной кис-
лоты требует около 10 000 калорий (следовательно, трех грамм-молекул—
30 000 калорий), можно заключить, что 80% энергии гликогенолиза об-
наруживается в макроэргических фосфатных связях АТФ, т. е. в таком
виде, в каком она в дальнейшем используется клетками для удовлетворения
их энергетических затрат. В мышцах эта энергия превращается в механиче-
скую, когда происходит гидролиз АТФ с помощью аденозинтрифосфатазы.
Следует подчеркнуть, что с энергетической точки зрения гликогено-
лиз, как и гликолиз, мало эффективен. Из всей потенциальной энергии
глюкозного остатка молекулы гликогена только лишь 1/20 часть стано-
вится доступной для использования клеткой при образовании из этого остат-
ка двух молекул молочной кислоты. Остальное количество энергии (19 из
20 частей) остается в молекулах молочной кислоты. Однако, несмотря на
малую энергетическую эффективность гликогенолиза, физиологическое
значение его велико, особенно в тех случаях, когда в тканях организма
ощущается недостаток кислорода. Так, например, в начальной фазе мы-
шечной работы, когда доставка кислорода к мышце не соответствует потреб-
ности в нем, наблюдается усиленный распад гликогена с образованием
молочной кислоты.
Гликогенолиз в начальной фазе работы в известной мере обеспечивает
энергетические затраты мышц.
Обратимость гликогенолиза
Изолированная мышца способна работать, т. е. сокращаться и расслаб-
ляться, в анаэробных условиях, например в камере, заполненной газо-
образным азотом. Работа мышцы в анаэробных условиях сопровождается
распадом в ней гликогена и накоплением молочной кислоты. В отсутствие
кислорода работа мышцы непродолжительна, и мышца через некоторое
время перестает отвечать на электрическое раздражение сокращением.
Образовавшаяся в изолированной мышце при работе ее в анаэробных усло-
виях молочная кислота не исчезает, если не переместить мышцу в атмосферу
кислорода, или в газовую смесь, в которой имеется кислород. В атмосфере
кислорода не только исчезает молочная кислота, но из определенной ее
части синтезируется гликоген.
Результаты подобных исследований приводят к заключению, что в
анаэробных условиях гликогенолиз необратим и что обратимость его можно
наблюдать в аэробных условиях.
Изучение отдельных этапов гликогенолиза показало, что подавляю-
щее число их обратимо. Так, при использовании соответствующих фермен-
тов удается легко синтезировать гликоген из глюкозо-6-фосфата, получить
из фэсфоенолпировиноградной кислоты 2-фосфоглицериновую, из триозо-
фосфорных кислот — фруктозодифосфорную кислоту и т. д. Необратимым
оказался только лишь этап дефосфорилирования фруктозо-1,6-дифосфорной
кислоты (т. е. получения фруктозо-6-фосфорной кислоты), однако образо-
вание в мышцах фруктозо-6-фосфорной кислоты из фруктозе-1,6-дифос-
форной, как можно полагать, вполне возможно, поскольку в мышцах
содержится фосфатаза, под влиянием которой от фруктозо-1,6-фосфорной
кислоты отщепляется фосфорный остаток в положении 1. Следовательно,
в мышечной ткани имеется набор ферментов, способный обеспечить обрати-
мость гликогенолиза, т. е. образование гликогена из молочной кислоты.
305
Исходя из того, что гликогенолиз сопровождается уменьшением сво-
бодной энергии (36 000 калорий на грамм-молекулу глюкозы), следует
ожидать, что обратимость гликогенолиза возможна только при наличии
источника энергии. С этой точки зрения, объяснимо отсутствие устранения
молочной кислоты и синтеза гликогена в мышцах в аэробных условиях.
В аэробных условиях в мышцах часть образовавшейся молочной кислоты
подвергается окислению и дает воду и углекислый газ. Освобождающаяся
при этом энергия (через макроэргические фосфатные связи АТФ) обеспечи-
вает обратимость этапов гликогенолиза, т. е. синтеза из молочной кислоты
гликогена.
АЭРОБНЫЙ РАСПАД ПРОДУКТОВ ГЛИКОЛИТИЧЕСКОГО
РАСЩЕПЛЕНИЯ УГЛЕВОДОВ
Молочная кислота в тканях организма подвергается аэробному окис-
лению с образованием полностью окисленных продуктов — углекислого
газа и воды. При этом освобождается вся ее потенциальная энергия. Отли-
чительная черта обмена углеводов у аэробов заключается в том, что конеч-
ный продукт анаэробного распада углеводов — молочная кислота — при
наличии кислорода подвергается аэробному распаду.
Валовое уравнение аэробного распада молочной кислоты следующее:
С3НбО3 + ЗО2 -> ЗСО2 4- ЗН2О (+ энергия).
Приведенное уравнение не вскрывает промежуточных этапов распада
молочной кислоты, катализируемых рядом ферментов.
Первым этапом аэробного распада молочной кислоты является ее окис-
ление с помощью лактикодегидрогеназы. На кофермент лактикодегидроге-
назы переносятся от молочной кислоты два электрона и два протона, в ре-
зультате чего молочная окисляется до пировиноградной кислоты, а кофер-
мент восстанавливается:
СН3 СН3
I I
СНОН—2е“—2Н+ + НАДч> С-=О+НАД-Н2
I I
СООН СООН
От восстановленного кофермента электроны переносятся на коферменты
других окислительных ферментов и через систему цитохромов с помощью
цитохромоксидазы на кислород.
Из сказанного видно, что пировиноградная кислота образуется и как
промежуточный продукт анаэробного распада углеводов и при аэробном
окислении молочной кислоты. В первом случае она восстанавливается с
образованием молочной кислоты, во втором же — подвергается дальнейшему
окислению. Пировиноградная кислота занимает одно из центральных мест
в обмене углеводов и других веществ. Она участвует в многочисленных
реакциях, важных для процессов тканевого обмена веществ. Из реакций
превращения пировиноградной кислоты наибольшее значение имеют сле-
дующие:
1) аэробное декарбоксилирование, приводящее к образованию так на-
зываемой «активной уксусной кислоты». На этой реакции подробнее оста-
новимся ниже;
2) аминирование, ведущее к образованию аминокислоты аланина:
СН3СОСООН + NH3 + Н2 -> CH3CHNH2COOH + Н2О;
3) карбоксилирование, ведущее к образованию щавелевоуксусной
кислоты:
СО2 + СН3СО-СООННООССН2-СО-СООН.
306
Аэробное декарбоксилирование пировиноградной кислоты является
сложным процессом, в котором участвует декарбоксилаза пировиноградной
кислоты; коферментом ее служит фосфорилированный витамин Вх — дифос-
фотиамин и липоевая кислота, дегидрогеназа и кофермент ацилирования.
Пировиноградная кислота взаимодействует с тиаминпирофосфатом с обра-
зованием способной к декарбоксилированию формы:1
Затем вступает в действие липоевая кислота:
СН2 • СН2 • СН(СН2)4СООН
S-------S
Липоевая кислота
В заключительной реакции участвуют никотинамид-аденин-динуклео-
тид (НАД) и кофермент ацилирования (KoASH):
СН3
,0 + НАД 4- KoASH S4 „
c£s -----> СН3СО - SKoA 4- НАД-Н2 4- ^>л
Н$/Л
Подобным путем происходит также аэробное декарбоксилирование
а-кетоглутаровой кислоты.
Мы видим, таким образом, что при аэробном декарбоксилировании
пировиноградной кислоты образуется не уксусная кислота, а ацетильное
производное кофермента ацилирования (CH3C~SKoA). Установление
этого факта имело принципиальное значение, разрешив вопрос об «актив-
ной» уксусной кислоте. В течение продолжительного времени считалось,
что окислительное декарбоксилирование пировиноградной кислоты при-
водит к образованию углекислого газа и уксусной кислоты:
СН3
I
СО
I
соон
сн3
I /ОН
4- Н2о -> С<
| Х)Н
соон
сн3
\он.
4-
со2
Между тем результаты экспериментальных исследований показывали,
что при добавлении уксусной кислоты к срезам ткани она используется в
незначительном объеме. Отсюда возникло допущение, что при окислительном
декарбоксилировании пировиноградной кислоты образуется какая-то ак-
1 Формула тиаминпирофосфата дана схематически. Полная формула на стр. ПО.
307
тивная форма уксусной кислоты. Природа этой формы уксусной кислоты
оставалась невыясненной до открытия кофермента ацилирования, выясне-
ния его химической природы и роли в процессах обмена веществ. Ацетиль-
ное производное кофермента ацилирования участвует в многочисленных хи-
мических реакциях, ведущих к использованию в организме остатка уксусной
кислоты. Перечислим некоторые из них: 1) остаток уксусной кислоты
(СН3—С ) используется в синтезе холестерина, 2) в ацетилировании
аминов, 3) в синтезе ацетоуксусной кислоты, 4) подвергается в главной
своей массе окислительному распаду с образованием углекислого газа
и воды.
Об использовании уксусной кислоты в синтезе холестерина мы уже го-
ворили (стр. 252). Ацетилирование аминов происходит в большом объеме
при введении в организм сульфамидных препаратов и его можно представить
следующим уравнением:
Я • NH2 + СН3С - SKoA -> 7? ♦ NH • СО • СН3 + KoASH.
Из этого уравнения видно, что образование кислотоамидной связи
(/?NHCOCH3) сопровождается использованием макроэргической связи
(~S) ацетильного остатка в коэнзиме А. Этот факт интересен в том отно-
шении, что он объясняет, почему именно свободная уксусная кислота не
потребляется в организме для процессов ацетилирования аминов.
Синтез ацетоуксусной кислоты, имеющий место в тканях организма,
и особенно в печени, происходит по следующему уравнению:
СН3
I
С-0
СН2 4- Ко А • SH.
О
SKoA
Из этого уравнения следует, что конденсация ацетильных остатков
при синтезе ацетоуксусной кислоты связана с использованием макроэрги-
ческой связи (~S). В результате конденсации образуется, как это видно из
приведенного уравнения, ацетоацетил ~SKoA. Это производное в различ-
ных тканях включается в различные химические превращения, приводя-
щие, с одной стороны, к его окислительному распаду, а с другой — к синте-
зу высокомолекулярных жирных кислот. В печени ацетоацетил — SKoA
превращается в ацетоуксусную кислоту и KoASH:
СН3 • СО • СН2 • С - S • КоА + Н2О -> СН3СОСН2СООН + KoASH.
Окислительный распад ацетил ~SoKoA происходит путем включения
его в цикл трикарбоновых кислот. В результате ряда ферментативных реак-
ций (см. стр. 271) уксусная кислота подвергается полному окислению с
образованием углекислого газа и воды.
Превращение молочной кислоты в пировиноградную кислоту, аэробное
декарбоксилирование последней с образованием ацетил ~SKoA и включе-
ние его в цикл трикарбоновых кислот, в результате которого он подвер-
гается разрушению с превращением в углекислый газ и воду, составляют
аэробную фазу распада углеводов, освобождающая всю их потенциальную
энергию.
308
ПЕНТОЗНЫЙ ЦИКЛ АЭРОБНОГО РАСПАДА
В течение многих лет принималось, что аэробная фаза распада углево-
дов начинается после анаэробного распада их с образованием молочной
кислоты в тканях животных или спирта в дрожжевых клетках и в расте-
ниях. Между тем накапливались факты, указывающие на то, что глюкоза
может подвергнуться аэробному окислению без предварительного расщеп-
ления на С3-соединения. Важным стимулом к изучению возможного окисле-
ния глюкозы без ее предварительного расщепления послужили результаты
исследований Варбурга, показавшие, что в эритроцитах имеется фермент,
катализирующий окисление альдегидной группы глюкозо-6-фосфорной
кислоты. Последняя, как известно, образуется в клетках как промежуточный
продукт гликогенолиза (стр. 299) или же в результате реакции перенесения
на глюкозу остатка фосфорной кислоты от АТФ на глюкозу (глюкоза+
АТФ->глюкозо-6-фосфорная кислота+АДФ). Окисление глюкозо-6-фос-
форной кислоты катализируется специфической для нее аэробной дегид-
рогеназой. Продуктом окисления является 6-фосфоглюконолактон.
Н\/ОН
С-----------
Н(Г0Н + НАДФ
НОСН 0 *
I
НСОН
I
НС------------
I
СНзО • Н2РО8
Глюкозо-6-фосфорная кислота
I
НСОН
НОСН с
I
НСОН
I
нс-----------
I
СН2О • Н2РО8
6-Фосфоглюконолактон
+ НАДФ-Н,
(i>
6-фосфоглюконолактон затем окисляется с помощью глюконолактоназы
с образованаем З-кето-6-фосфоглюконовой кислоты.
zO
1 НСОН СООН 1 НСОН
носн °' р НАДФ L_n + НАДФ-Н2 (2) Чи
НСОН НСОН
1 нс НСОН
1 СН2О • Н2РО8 СН2О • Н2РО8 З-кето-6-фосфоглюконовая кислота
З-кето-6-фосфоглюконовая кислота декарбоксилируется с помощью де-
карбоксилазы с образованием рибулозо-5-фосфорной кислоты.
СООН 1 НСОН СН2ОН 1 с=о
1 с=о > 1 НСОН 1 НСОН 1 НСОН , ГГ1 I + (3) НСОН СН2О • Н2РО8
I
СН2О . Н2РО3
Рибулозо-5-фосфорная кислота
309
Рибулозо-5-фосфорная кислота изомеризуется с образованием рибозо-
5-фосфорной кислоты и ксилулозо-5-фосфорной кислоты. Реакция обратима,
и эти соединения взадмопревращаемы.
СЫ2ОН
I
с=о
I
НСОН
НСОН
I
СН2О • Н2РО3
с^°
\н
неон
I
НСОН
I
НСОН
I
СН9О . Н2РО3
Рибозо-5-фосфорная кислота
СН2ОН
I
с=о
носн
I
НСОН
СН2О • Н2РО3
Ксилулозо-5-фосфорная кислота
Приведенные реакции охватывают первую часть пентозного цикла.
Они приводят к укорочению цепи атомов углерода глюкозы на один атом
(отщепление СО2). Вторая часть цикла характеризуется образованием ряда
промежуточных соединений без возникновения углекислого газа.
Реакции второй части цикла следующие:
Ксилулозо-5-фосфорная кислота реагирует с рибозо-5-фосфорной кис-
лотой (оба эти соединения будут в наличии, если исходить из окислитель-
ного превращения одновременно двух молекул глюкозо-6-фосфорной кис-
лоты). В результате этой реакции образуется гептулозо-7-фосфорная кис-
лота и фосфоглицеринальдегид. *
Реакция катализируется ферментом транскетолазой, получившей свое
название благодаря тому, что здесь имеет место перенесение остатка
СН2ОН ксилулозо-5-фосфата на ксилулозо-5-фосфорную кислоту.
(3=0
СН2ОН
I
со
I
нос— н
I -------
НСОН
I
СН2О . Н2РО3
Ксилулозо-5-фосфорная
кислота
неон
носн “*
I
НСОН
I
СН2О • Н2РО3
Рибозо-5-фосфорная кислота
СН2ОН
I
со
I
НОСН , п
I + с^°
НСОН Т\н (5)
НСОН НСОН
НСОН СН2О • Н2РО3
I
СН2О • Н2РО3
Г ептулозо-7-фосфорная Фосфоглицерин-
кислота альдегид
Гептулозо-7-фосфорная кислота реагирует с помощью фермента транс-
альдолазы с фосфоглицеринальдегидом, в результате чего образуются фрук-
тозо-6-фосфорная кислота и эритрозо-4-фосфорная кислота.
СН2ОН
I
СО
I
НОСН
I
НСОН 4
I
НСОН
I
НСОН
I
СН2О • Н2РО3
нс=о
I
НСОН
I
СН2О • Н2РО3
Фосфоглицерин-
альдегид
СН2ОН
I
носн 4- 9\н
НСОН НСОН
I I
НСОН НСОН
СН2О • Н2РО3 СН2О • Н2РО3
Гептулозо-5-фосфорная кислота
Фруктозо-6-фосфорная Эритрозо-4-фосфарная
кислота кислота
310
Фруктозо-6-фосфорная кислота изомеризуется с образованием глюкозо-
6-фосфорной кислоты, которая в результате окисления и декарбоксилиро-
вания дает начало образованию рибулозо-5-фосфорной кислоте.
СН2ОН
I
СО
I
носн
I
НСОН
I
НСОН
I
СН2О • Н2РО3
Фруктозо-6-фосфорная
кислота
I
носн
I .
НСОН
I
НСОН
I
СН2О • Н2РОз
Глюкозо-6-фосфорная
кислота
СН2ОН
I
С—° + Со2 (7)
НСОН
I
НСОН
I
СН2О • Н2РО8
Ксилулозо-6-фосфорная
кислота
Ксилулозо-5-фосфорная кислота с помощью фермента транскетолазы
реагирует с эритрозо-4-фосфорной кислотой с образованием фруктозо-6-фос-
форной кислоты и фосфоглицеринового альдегида.
СН2ОН
I
СО ---------
нос— н 4-
I —
НСОН
I
СН2О • Н2РО8
Ксилулозо-5-фосфорная
кислота
г\
НСОН
I
НСОН
СН2О . Н2РО3
Эритрозо-4- фосфор-
ная кислота
СН2ОН
I
со
I
носн
I 1
НСОН 4
НСОН
СН2О • Н2РО3
Фруктозо-6-фосфорная
кислота
НСОН
СН2О . Н2РО3
Фосфоглицерин-
альдегид
(8)
Фруктозо-6-фосфорная кислота включается в реакции, приведенные на
этапе (7), и дает начало образованию ксилулозо-5-фосфорной кисло-
те и СО2.
Схематически реакции второй части пентозного цикла можно предста-
вить следующим образом:1
Ксил-5-фосф. к. + риб-5-фосф. к. ->глиц-3-фосф. к. + гепт-7-фосф. к. (54-5)=(34-7)
Глиц-З-фосф к. + гепт-7-фосф к.->фрукт-6-фосф к. + эрит-4-фосф к. (34-7)—(6-j-4)
Кси-5-фосф к. 4- эрит-4-фосф к. —>фрукт-6-фосф к. + глиц-3-фосф к. (54-4)=(6-|-3)
3 пентозо-5-фосфорная кислота-> 2 фруктозо-6-фосфорная кислота 4- 1 глицерин-3-
-фосфорная кислота
В результате всех реакций пентозного цикла шесть молекул глюкозо-
6-фосфорной кислоты дадут начало образованию трем молекулам фруктозо-
6-фосфорной кислоты и двум молекулам глицеринальдегид-3-фосфорной
кислоты. Из них в результате обратимости реакций могут возникнуть пять
молекул глюкозо-6-фосфорной кислоты. Следовательно, одна шестая часть
подвергшейся превращению глюкозо-6-фосфорной кислоты распадется с об-
разованием шести молекул СО2 и Н3РО4.
При многократном повторении цикла весь углерод подвергшейся окис-
лению глюкозо-6-фосфорной кислоты превратится в углекислый газ.
Приведенный выше путь аэробного окисления глюкозы получил назва-
ние «пентозного цикла». Этот цикл имеет в виде промежуточных продуктов
рибулозо-5-фосфорную кислоту — соединение, играющее исключительно
важную роль в ассимиляции СО2 зелеными растениями (стр. 245), и рибозо-
5-фосфорную кислоту, являющуюся составной частью рибонуклеиновых
1 См. Ф. Б. Шт а у б. Биохимия, 1963.
311
кислот. В мышцах, где интенсивно происходит анаэробный гликогенолиз,
аэробная фаза превращения углеводов начинается с окисления молочной
кислоты. Нет оснований считать, что в мышцах аэробная фаза начинается с
окисления глюкозофосфорной кислоты. В печени же, а также у некоторых
растений и микроорганизмов, аэробное окисление глюкозофосфорной кис-
лоты подтверждено рядом экспериментальных данных; конечно, не исклю-
чается возможность аэробного распада углеводов у них, начиная и с этапа
образования молочной кислоты.
Физиологическое значение аэробного окисления углеводов заклю-
чается в том, что в результате его происходит полный распад их с осво-
бождением их потенциальной энергии. Выше (стр. 305) приводились
данные, показывающие, что значительная часть энергии окисления угле-
водов аккумулируется в макроэргических фосфатных связях аденозин-
трифосфорной кислоты, которая затем используется для различных
целей в клетках.
Связь между анаэробным и аэробным распадом углеводов
Реакция Пастера
Между гликолизом и аэробным окислением углеводов существует
тесная связь. Эта связь заключается прежде всего в том, что первые стадии
гликолиза и аэробного окисления углеводов одинаковы. Расхождение
путей анаэробного и аэробного распада начинается на стадии дальней-
шего превращения пировиноградной кислоты, которая в отсутствие кис-
лорода восстанавливается за счет водорода восстановленного кофермента
(НАД-Н2) с образованием молочной кислоты; в присутствии же кислорода
она подвергается окислительному декарбоксилированию. При аэробном
окислении углеводов по пентозному циклу расхождение путей начинается
на стадии образования глюкозо-6-фосфорной кислоты.
В большинстве тканей животных углеводы при аэробных условиях
полностью окисляются, превращаясь в воду и углекислый газ, в то время
как в отсутствие кислорода образуется молочная кислота. Л. Пастер впервые
обратил внимание на тот факт, что гликолиз тормозится кислородом. Это
явление вошло в науку под названием «реакции Пастера». Значительно
позже О. Варбург показал, что в эмбриональных тканях и тканях злокаче-
ственных опухолей гликолиз не снижается и в присутствии кислорода.
Образование молочной кислоты в присутствии кислорода получило название
«аэробного гликолиза».
Физиологический эффект реакции Пастера легко понять, если учесть,
что при аэробном выключении процесса образования молочной кислоты рас-
пад углеводов происходит до конца, т. е. с выделением углекислого газа
и воды. Клетки и ткани способны покрыть свои энергетические затраты при
аэробном распаде углеводов за счет значительно меньшего количества глю-
козы, чем при анаэробном распаде. Отсюда понятно, что аэробный распад
сберегает в клетках и тканях запас углеводов.
Что же касается механизма реакции Пастера, то он остается еще недо-
статочно выясненным, хотя для его объяснения существует ряд гипотез.
Одна из этих гипотез указывает на то, что прекращение гликолиза при
аэробных условиях является скорее кажущимся, чем действительным.
В присутствии кислорода в некоторых тканях, например в мышечной,
часть образующейся при гликолизе молочной кислоты окисляется до угле-
кислого газа и воды с освобождением энергии, которая используется час-
тично для ресинтеза из оставшейся части молочной кислоты гликогена.
Следовательно, в этом случае в тканях образование молочной кислоты
не прекращается в присутствии кислорода. Сбережение запасов гликогена
достигается тем, что некоторая, и при этом большая часть образовавшейся
молочной кислоты в присутствии кислорода снова превращается в глико-
ген. Другие гипотезы объясняют реакцию Пастера тем, что кислород пре-
312
кращает гликолиз, воздействуя на ферменты, катализирующие тот или
иной этап гликолиза, прекращая или тормозя их действие. Некоторые
ферменты гликолиза содержат важные для проявления их действия сульф-
гидрильные группы (—SH). Среди этих ферментов находится и дегидрогена-
за фосфоглицеринальдегида. Кислород окислением сульфгидрильных групп
ферментов может приостановить гликолиз.
Существует мнение (В. А. Энгельгардт), что в присутствии кислорода
тормозится активность фосфоферазы, катализирующей перенесение фосфат-
ного остатка от аденозинтрифосфорной кислоты на фруктозо-6-фосфорную
кислоту и это замедляет течение гликолиза. Другая гипотеза (Э. Сорени)
исходит из того, что в присутствии кислорода тормозится активность
фосфорилазы и поэтому замедляется распад гликогена и т. д. Наличие боль-
шого количества гипотез для объяснения механизма реакции Пастера пока-
зывает, что этот механизм остается еще до конца невыясненным. Не исклю-
чена возможность, что существует не один, а несколько механизмов торможе-
ния гликолиза в присутствии кислорода и что в клетках, в зависимости от
ситуации, используется то один, то другой механизм.
Торможение гликолиза связано с переключением обмена веществ в клет-
ках и тканях на аэробный путь, в котором могут быть использованы как
углеводы, так и другие органические вещества.
НАРУШЕНИЯ УГЛЕВОДНОГО ОБМЕНА
Гипергликемия. Сахарный диабет
Одним из важных моментов, обеспечивающих нормальное использо-
вание углеводов тканями организма, является регулярная доставка к ним
глюкозы кровью. Выше (стр. 289) подробно изложены вопросы содержания
глюкозы в крови, гликогенной функции печени и регуляторных механиз-
мов, поддерживающих на нормальном уровне содержание глюкозы в крови.
Указывалось, что гипергликемия сопровождается глюкозурией, а распад
и синтез гликогена в печени регулируются центральной нервной системой
и гормонами, в первую очередь адреналином и инсулином. Приводился
также путь превращения углеводов в мышцах и в других тканях, проте-
кающий без участия кислорода с образованием молочной кислоты, а при
участии кислорода — с образованием углекислого газа и воды. В виде
дополнения к изложенному следует указать, что при интенсивной мышеч-
ной работе образующаяся в мышцах молочная кислота, в известной своей
части, поступает в кровь и доставляется в печень, где из нее синтезируется
гликоген. Следовательно, источником для синтеза гликогена в печени
является как всасывающаяся кишечником глюкоза, так и образующаяся
из гликогена в мышцах при интенсивной их работе молочная кислота. Вза-
имосвязь отдельных звеньев общей цепи превращений углеводов в организме
можно представить следующим образом:
Глюкоза крови-----------
_____t
Гликоген печени Гликоген мышц СО2 и Н2О
Почки ----Молочная кислота крови---
Моча
Глюкоза, всасываю-
щаяся кишечником
В норме в моче нет глюкозы: глюкоза появляется в моче тогда, когда
содержание ее в крови выше 150—160 мг%. Почки в этих случаях становят-
ся проницаемыми для глюкозы (порог проницаемости почек). Гипергликемия
313
и глюкозурия может быть результатом приема с пищей большого количества
глюкозы или другого легко усвояемого сахара (фруктозы, галактозы, саха-
розы). В этих случаях способность печени синтезировать гликоген оказы-
вается недостаточной, и содержание глюкозы в крови может превысить
порог проницаемости почек.
Гипергликемия и глюкозурия, вызванные обильным поступлением
сахара с пищей, непродолжительны и через несколько часов после приема
пищи исчезают.
Постоянные, не прекращающиеся в течение жизни гипергликемия и
глюкозурия встречаются у больных сахарной болезнью, или сахарным диа-
бетом (diabetes mellitus). Сахарный диабет известен как тяжелое заболевание
человека уже с давних времен. В VI в. впервые был описан один из призна-
ков сахарного диабета — сладкий вкус мочи. Причина заболевания оста-
валась долго совершенно неясной. В 1890 г. явления сахарной болезни
впервые были воспроизведены в эксперименте на собаках Мерингом и
Минковским. Эти авторы разработали приемы операции удаления поджелу-
дочной железы с сохранением жизни животных. Было обращено внимание
на то, что у оперированных животных появляется гипеогликемия и глюко-
зурия и исчезает гликоген из печени и из мышц, появляется неукротимая
жажда и ненасытный голод. Они несмотря на поедание большого количества
корма худеют и нередко погибают от истощения.
Гипергликемия, глюкозурия, жажда, похудение, упадок сил — харак-
терные признаки сахарного диабета у людей. Заболевание собак, вызван-
ное удалением поджелудочной железы, получило название панкреатического
диабета (pancreas — поджелудочная железа). Панкреатический диабет
удалось вызвать у различных млекопитающих, птиц, пресмыкающихся
и рыб.
Вначале казалось, что расстройства, появляющиеся у животных после удаления
поджелудочной железы, являются следствием прекращения выделения ее сока, играю-
щего большую роль в процессах пищеварения. Однако от подобного допущения сразу
же отказались, так как было установлено, что перевязка протока поджелудочной же-
лезы и связанное с этим прекращение оттока из нее сока не вызывает явления сахар-
ного диабета. Отсюда можно было сделать вывод, что поджелудочная железа отдает
в кровь какое-то вещество, предохраняющее организм от сахарной болезни. Инкре-
торная функция поджелудочной железы была подтверждена в 1892 г. Гедоном в опы-
тах с приживанием ее под кожей. Через разрез в стенке брюшной полости собаке была
подведена и пришита под кожу поджелудочная железа вместе с кровеносными сосуда-
ми. Сахарный диабет у оперированного животного не наступал. При наложении
зажима на отходящие от железы кровеносные сосуды у собаки появлялись гиперглике-
мия и глюкозурия. Снятие зажима устраняло признаки сахарного диабета. Инкре-
торная функция поджелудочной железы была подтверждена также в опытах с парабио-
зом. Соединение кровеносных сосудов двух собак: одной — с удаленной поджелудоч-
ной железой и другой — нормальной — снимало у первой признаки сахарной
болезни.
Явление «естественного парабиоза» наблюдается между матерью и растущим пло-
дом. В опытах на животных установлено, что удаление поджелудочной железы не
прерывает беременность и не вызывает сахарную болезнь. Объясняется это инкретор-
ной функцией поджелудочной железы растущего плода. После родов оперированное
животное сразу же заболевало сахарной болезнью.
Открытие инкреторной функции поджелудочной железы, гистологи-
ческое изучение, при котором в поджелудочной железе наряду с железистой
тканью была обнаружена еще и островковая ткань, и, наконец, открытие
панкреатического диабета создали предпосылки к выяснению причины са-
харной болезни у человека и определили пути лечения сахарного диабета.
На стр. 197 приведены результаты исследований, проведенных Соболе-
вым и указавших на возможные пути выделения гормона поджелудочной
железы, а также Бантинга и Беста, впервые получивших гормон поджелу-
дочной железы — инсулин.
В начале 40-х годов XX столетия удалось найти новый подход к изу-
чению сахарного диабета. Оказалось, что у животных сахарный диабет мож-
но вызвать не только путем удаления поджелудочной железы, но и введе-
314
нием в их организм аллоксана (стр. 197), специфически действующего на
островковую ткань поджелудочной железы, вызывая ее отмирание. Подобная
форма сахарной болезни у животного получила название аллоксанового
диабета. При аллоксановом диабете мало затрагивается секреторная функ-
ция поджелудочной железы, т. е. образование в ней пищеварительного сока
и выделения его в двенадцатиперстную кишку.
Сахарный диабет является следствием перерождения [3-клеток остров-
ковой ткани поджелудочной железы, в которых образуется инсулин. С от-
крытием инкреторной функции а-клеток островковой ткани, вырабатываю-
щих глюкагон (стр. 199), приходится считаться с тем, что сахарный диабет
может также вызываться усилением функции а-клеток, избыточным обра-
зованием в них глюкагона. Глюкагон стимулирует распад гликогена в пе-
чени и вызывает гипергликемию*
Как уже указывалось, одним из основных (но не единственным) прояв-
лений сахарного диабета является гипергликемия и глюкозурия. Это прояв-
ление диабета может быть ослаблено уменьшением количества углеводов
в пище больного, но оно не устраняется, если даже полностью изъять угле-
воды из пищи, а также при голодании. Выделение глюкозы с мочой в зави-
симости от тяжести заболевания колеблется в значительных размерах
(от 0,5 до 10%). Если принять во внимание, что больные диабетом пьют
много воды и выделяют увеличенное количество мочи (до 3 и даже до 10 л),
то легко видеть, что организм больного за сутки теряет много десятков, а
в тяжелых случаях сотни граммов глюкозы.
Действие инсулина в организме заключается не только в том, что он
стимулирует синтез гликогена в печени; оно многогранно. Эксперименталь-
ные данные показывают, что при недостатке инсулина снижается прони-
цаемость клеток по отношению к глюкозе. Ткани и органы в результате
недостатка инсулина меньше поглощают глюкозы из крови, и это в извест-
ной мере приводит к гипергликемии и глюкозурии. Имеются также данные,
указывающие, что инсулин устраняет тормозящее действие некоторых ве-
ществ (p-липопротеидов) на активность глюкозокиназы, фермента, катали-
зирующего реакцию фосфорилирования глюкозы. Таким образом, при не-
достатке инсулина интенсивность процесса фосфорилирования глюкозы в
тканях организма понижена. Так как использование глюкозы в тканях
и органах начинается с момента ее фосфорилирования, то при сахарном
диабете условия для использования глюкозы оказываются неблагоприят-
ными.
Однако гипергликемия и глюкозурия вызываются не только этим явле-
нием. При сахарном диабете в тканях происходит избыточный синтез глю-
козы из других веществ — промежуточных продуктов распада жиров и ряда
аминокислот. Этим и объясняется, почему именно при отсутствии углеводов
в пище из организма, больного диабетом, выделяется с мочой глюкоза.
Сахарный диабет следует рассматривать как заболевание, сопровож-
дающееся серьезным расстройством обмена веществ. Неудивительно по-
этому, что наряду с гипергликемией и глюкозурией при сахарном диабете
наблюдаются еще и другие изменения в химическом составе крови и мочи.
При тяжелых случаях диабета в крови значительно увеличивается содер-
жание так называемых кетоновых веществ (кетонемия) и выделяются
значительные количества кетоновых тел с мочой (кетонурия). К кетоновым
телам относятся следующие соединения: ацетоуксусная кислота, р-окси-
масляная кислота и ацетон
СНЧ СН3 СН3
I I I
СО снон со
I I ; I
сн2 сн2 сн3
I I
соон соон
315
Ацетоуксусная кислота образуется в печени главным образом как про-
дукт конденсации двух молекул уксусной кислоты (стр. 328). Ацетоуксусная
кислота легко подвергается декарбоксилированию (даже без участия фер-
мента) с образованием ацетона. Восстанавливаясь, она превращается в
Р-оксимасляную кислоту. Неудивительно поэтому, что все эти три соедине-
ния, близкие генетически друг к другу, обычно встречаются вместе. Ацето-
уксусная и р-оксимасляная кислоты при накоплении их в крови и в тканях
создают угрозу для сдвига реакции среды в кислую сторону. В случаях,
когда эта угроза реализуется, наступает диабетическая кома, при которой,
если не принять срочных мер, организм погибает. Введение больному би-
карбоната натрия (щелочи) на некоторое время устраняет явление диабети-
ческой комы. Более радикально введение больному инсулина.
Со времени получения из поджелудочной железы активных экстрактов
(1921 г.) единственным эффективным средством при лечении сахарного диа-
бета является инсулин. Неоднократные попытки применения других веществ
для лечения диабета оказались безуспешными. Лишь совсем недавно в ме-
дицине стали применять некоторые сульфамидные препараты (например,
А1-сульфанилил-А2-бутилкарбамид), снижающие при введении их в орга-
низм содержание глюкозы в крови. Эти препараты действуют на а-клетки
островковой ткани, уменьшая интенсивность образования в них глюкагона.
Возможно также, что они предохраняют инсулин в органах (в печени) от
ферментативного расщепления, тормозя активность фермента — инсули-
назы.
Применение инсулина требует известной осторожности. Передозировка вызывает
гипогликемию, при которой нарушается доставка глюкозы тканям и нормальное ее
использование. При значительном снижении содержания глюкозы в крови наступает
гипогликемическая кома, которая может привести к гибели организма. Гипоглике-
мия, вызванная избыточным введением инсулина, легко устраняется путем одноразо-
вого приема большого количества легкоусвояемого сахара (глюкозы, сахарозы).
Гипогликемия
Снижение нормального содержания глюкозы в крови носит название
гипогликемии. Гипогликемия наблюдается при микседеме (гипофункция
щитовидной железы), при бронзовой болезни (гипофункция надпочечников),
при гипофункции передней доли гипофиза. Во всех этих случаях содержа-
ние глюкозы в крови ниже 80 мг%. Сопровождаемая глюкозурией гипогли-
кемия наблюдается при нарушении функции почек (почечная глюкозурия).
Подобное явление наблюдается у женщин в последней стадии беременности.
Ренальную глюкозурию можно вызвать путем введения в организм живот-
ных глюкозида флоридзина (стр. 89). Флоридзин нарушает процесс обра-
тного всасывания глюкозы в почечных канальцах.
ЛИТЕРАТУРА
Курсанов А. Л. Биологический синтез дисахаридов. «Успехи биологиче-
ской химии», 1954, т. 2, стр. 220.
Энгельгардт В. А. О взаимоотношении дыхания и брожения. «Успехи
современной биологии», 1944, т. 17, стр. 237*
Глава шестнадцатая
ОБМЕН ЛИПИДОВ
Липиды представляют собой большую группу органических веществ,
различных по химической структуре и обладающих одним общим для них
свойством — нерастворимостью в воде и растворимостью в различных
органических растворителях. Вполне понятно, что путь превращения раз-
личных по своей структуре липидов, их распад и синтез не могут быть
одинаковыми. Различной должна быть и роль их в организме. Ниже мы
остановимся на обмене жиров, фосфатидов и стеридов.
ОБМЕН ЖИРОВ
Вместе с пищей в организм взрослого человека ежесуточно поступает
50—70 г жиров животного и растительного происхождения. Все они отно-
сятся преимущественно к триглицеридам. Жиры являются наиболее кон-
центрированным источником энергии для организма: калорийная ценность
жира составляет 9,5 килокалорий, в то время как калорийная ценность уг-
леводов —4,2, а белков —5,6 килокалорий на 1 г.
ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ ЖИРОВ
Переваривание жиров, гидролитическое их расщепление, катализи-
руется ферментами — липазами. Липазы катализируют распад жиров с
образованием глицерина и жирных кислот.
СН2ООСЯ
СН2ОН
сноося + ЗН2О -> 3/? . СООН + снон
СН2ООСЯ
СН2ОН
В ротовой полости переваривания жиров не происходит, так как в слю-
не липаза отсутствует. В желудочном соке содержится липаза, однако зна-
чение ее в переваривании жиров пищи незначительно. Объясняется это тем,
что желудочная липаза катализирует распад жиров, находящихся в эмуль-
гированном состоянии. В желудке отсутствуют условия, необходимые для
эмульгирования жиров, и поэтому желудочная липаза может воздейство-
вать на жир, поступающий в организм в виде готовой эмульсии. Подобным
жиром является жир молока. Так как удельный вес жира молока среди
иных жиров в пище взрослого человека невелик, то переваривание жиров
в желудке особенного значения не имеет. Иначе обстоит дело с перевари-
ванием жиров в желудке ребенка и молодых млекопитающих животных.
В раннем возрасте жир молока служит для них единственным жиром пищи,
317
и переваривание его в желудке имеет определенное значение. Следует,
однако, иметь в виду, что под влиянием пепсина и кислотности желудоч-
ного сока жировая эмульсия молока разрушается и поэтому из желудка
ребенка и молодых млекопитающих значительная часть жира молока про-
ходит в кишечник в нерзацепленном виде.
В основном переваривание жиров происходит в тонких кишках. В две-
надцатиперстную кишку поступают две физиологически важные жидкости:
сок поджелудочной железы и желчь. В соке поджелудочной железы, наряду
с иными ферментами, содержится липаза, в желчи — желчные кислоты,
играющие существенную роль в процессе переваривания жиров. В соке
тонких кишок также есть липаза. Липаза, поступающая в двенадцати-
перстную кишку с соком поджелудочной железы, малоактивна и является
проферментом (стр. 155). Профермент липазы переходит в активный фермент
под влиянием солей желчных кислот. Соли желчных кислот играют также
важную роль как эмульгаторы жиров. Некоторая, правда еще мало изучен-
ная, роль в переваривании жиров принадлежит липазе, выделяющейся с
соком тонких кишок. Известно, что после полного удаления из организма
поджелудочной железы переваривание жиров происходит в известном объе-
ме благодаря действию кишечной липазы.
В двенадцатиперстную кишку вместе с пищевой массой заносится не-
которое количество желудочного сока, содержащего соляную кислоту.
Соляная кислота нейтрализуется бикарбонатом сока поджелудочной железы,
желчи и кишечного сока. Выделяющийся при нейтрализации соляной кис-
лоты углекислый газ разрыхляет пищевую кашицу и способствует переме-
шиванию ее с пищеварительными соками и имеющимися в них ферментами.
В двенадцатиперстной кишке и в других участках тонких кишок происхо-
дит эмульгирование жиров. Соли желчных кислот—холевой, литохолевой
и дезоксихолевой, образующиеся в печени из холестерина (стр. 343), адсор-
бируются в присутствии жирных кислот на поверхности капелек жира тон-
чайшей пленкой, препятствующей слиянию между собой этих капелек.
Соли желчных кислот, кроме того, уменьшают поверхностное натяжение на
поверхности раздела двух фаз — воды и жира и способствуют расчленению
больших капелек жира на меньшие. Благодаря солям желчных кислот в
тонких кишках создаются условия для образования тонкой и устойчивой
эмульсии жиров с диаметром частиц 0,5 мк и меньше.
Эмульгирование жиров приводит к чрезвычайно большому увеличе-
нию их поверхности, а это создает благоприятные условия для соприкосно-
вения жира с липазой, что ускоряет его гидролиз.
Значение сока поджелудочной железы и желчи в переваривании жиров
пищи и использовании их в организме можно видеть из следующего. В опы-
тах на животных с перевязкой протока поджелудочной железы установлено,
что при прекращении поступления сока поджелудочной железы перевари-
вание жиров происходит в меньшем объеме, и часть жира пищи не усваи-
вается и выделяется с калом. То же самое можно наблюдать при закупорке
желчного протока (при желтухе). Для нормального переваривания жиров
необходимо одновременное наличие сока поджелудочной железы и желчи.
У кроликов места вливания сока поджелудочной железы и желчи в две-
надцатиперстную кишку отдалены друг от друга на несколько сантиметров.
В этом пространстве двенадцатиперстной кишки жиры не перевариваются.
В тонких кишках после переваривания пищи, богатой жирами, можно
обнаружить жирные кислоты, их соли (мыла) и смесь моно-, ди- и тригли-
церидов в виде тонкой эмульсии. Глицерин, образующийся при перевари-
вании жиров, как вещество, хорошо растворимое в воде, может всасываться
стенкой кишок. Всасывание жирных кислот, нерастворимых в воде, про-
исходит с участием желчных кислот. Желчные кислоты соединяются с высо-
комолекулярными жирными кислотами, образуя растворимые в воде ком-
плексы, — холеиновые кислоты. X олеиновые кислоты поступают в стенку
кишок и в эпителиальных клетках кишечных ворсинок вновь распадаются
318
на желчные и жирные кислоты. В клетках кишечного эпителия из глицерина
и жирных кислот синтезируются жиры. Некоторое количество жира в виде
капелек диаметром меньше чем 0,5 мк может всосаться стенкой кишок без
предварительного переваривания. Эмульсии моноглицеридов значительно
более устойчивы, чем эмульсии жирных кислот, поэтому было высказано
мнение, что триглицериды не подвергаются полному перевариванию, а обра-
зуют смесь из моно- и диглицеридов и жирных кислот. Это мнение получило
подтверждение в опытах с введением в кишечник триглицеридов, содержа-
щих СВ * * * * * 14 глицерин. Было установлено, что несколько меньше половины три-
глицеридов подвергается полному перевариванию, остальное'же коли-
чество переваривается с образованием моноглицеридов.
Синтезировавшиеся в эпителии кишок из глицерина и жирных кислот
и из моноглицеридов и жирных кислот нейтральные жиры (триглицериды),
а также капельки жиров, не подвергшиеся перевариванию, проходя через
кишечную стенку, поступают в центральную лимфатическую полость вор-
синки, а затем в сосуды лимфатической системы. При всасывании жиров
лимфатические сосуды заполняются капельками жира и содержимое их
становится мутным. Через грудной лимфатический проток содержимое лим-
фатических сосудов поступает в кровоток.
Раньше предполагалось, что жир из тонких кишок поступает исключи-
тельно в сосуды лимфатической системы. Однако более детальное изучение
этого вопроса показало, что 20—30% жира поступает из кишечника непо-
средственно в кровь капилляров воротной вены печени. Следовательно,
из тонких кишок жир поступает в кровь через сосуды лимфатической систе-
мы (большая часть), а также непосредственно в кровь (меньшая часть).
Обнаруживаемые в крови капельки нейтральных жиров носят название
хиломикронов. Определенная часть их разрушается под влиянием так назы-
ваемого фактора просветления. Внутривенное введение гепарина (стр. 86).
уменьшает количество хиломикронов и снижает содержание жира в крови.
Гепарин, по-видимому, — кофермент специфического фермента, действую-
щего на хиломикроны.
Высказывалось мнение, что жиры, проходя через стенку тонких кишок,
подвергаются там фосфорилированию с образованием фосфолипидов и что
в виде фосфолипидов они всасываются кишечной стенкой. Это мнение полу-
чило подтверждение в опытах с введением в кишечник триглицеридов, со-
держащих или меченые жирные кислоты или меченый глицерин: меченые
жирные кислоты и меченый глицерин обнаруживались в составе фосфоли-
пидов лимфы. Результаты этих опытов, однако, не говорят о том, что жиры
при всасывании в кишечной стенке полностью превращаются в фосфолипи-
ды. Они указывают лишь, что процесс всасывания жиров сопровождается в
какой-то мере синтезом фосфолипидов, поступающих вместе с жиром в лим-
фатическую систему, а затем в кровь.
ТРАНСПОРТ И ОТЛОЖЕНИЕ ЖИРОВ
В кишечной стенке для синтеза жиров используются преимущественно
продукты гидролиза жиров пищи. Большее или меньшее постоянство соста-
ва жиров, содержащихся в виде запаса в жировой ткани различных живот-
ных, зависит от относительного единообразия пищи для каждого вида жи-
вотных. Сказанное подтверждается результатами опытов с кормлением
животных необычными для них жирами. При скармливании животным, на-
пример собакам, предварительно голодавшим (при голодании жир из жи-
ровых тканей исчезает), большого количества сурепного масла это масло
откладывается в жировой ткани. Такие же данные были получены в анало-
гичных опытах с применением льняного масла, верблюжьего жира и других
жиров. Следует, однако, указать, что в жировой ткани откладываются в
составе жиров только высокомолекулярные жирные кислоты (С16 и выше).
319
Низкомолекулярные же жирные кислоты (масляная кислота и др.) не от-
кладываются, а подвергаются при введении их в организм окислению. Более
прямые доказательства в пользу отложения жирных кислот жиров пищи
были получены в опытах с применением меченых жирных кислот. При корм-
лении крыс в течение восьми дней пальмитиновой кислотой, меченной дей-
терием, в жирах жировой ткани обнаруживается меченая пальмитиновая
кислота. Еще до использования в биохимических исследованиях изотопов
было установлено, что при введении с пищей жирных кислот в лимфатиче-
ские сосуды из кишечника поступают нейтральные жиры. Это объясняется
тем, что с кровью к эпителию кишечной стенки может доставляться глице-
рин для синтеза триглицеридов. В опытах с меченной дейтерием пальмити-
новой кислотой последняя вводилась в виде этилового эфира. В тонких
кишках этиловый эфир под влиянием эстераз гидролизовался и пальмити-
новая кислота в кишечной стенке использовалась для синтеза триглице-
ридов.
Поступающие из лимфатических сосудов в кровь жиры, а также жиры,
всасывающиеся в кровь непосредственно из кишечника, в основной своей
массе откладываются в подкожной жировой клетчатке и в сальниках. Опыты
с кормлением животных мечеными жирными кислотами показали, что эти
кислоты быстро появляются в жирах жировых тканей. Это имеет место так-
же при кормлении мечеными жирными кислотами голодающих животных.
Следовательно, даже в том случае, когда запасы жира в организме практи-
чески отсутствуют, поступающие с пищей жиры не используются непосред-
ственно, а предварительно откладываются в жировой ткани. В жировой
ткани откладываются также жиры, синтезирующиеся в организме из про-
межуточных продуктов распада углеводов и некоторых аминокислот.
Из жировой ткани жиры, по мере надобности, поступают в кровь и ею
доставляются к местам их использования. Следовательно, жиры в крови
появляются в результате всасывания кишками и в результате поступления
из жировых тканей (жировых депо). В крови содержание триглицеридов
и жирных кислот составляет обычно около 0,5%, оно возрастает после при-
ема богатой жиром пищи до 1%. В этом случае говорят об алиментарной,
или пищевой липемии. Пищевая липемия непродолжительна и исчезает
через несколько часов. С липемией встречаются также в случаях интенсив-
ного использования отложенных в виде запаса жиров, а также в тех слу-
чаях, когда доставляемые к органам, главным образом к печени, жиры
медленно используются. Липемия наблюдается при голодании и при заболе-
ваниях, приводящих к истощению организма. Особенно явно выражена
липемия у зимнеспящих животных в период спячки. Как известно, в период
спячки используется запасной жир.
ОКИСЛИТЕЛЬНЫЙ РАСПАД ЖИРОВ
Распад жиров в организме происходит с образованием конечных про-
дуктов — углекислого газа и воды. Эмпирическую формулу, среднюю для
различных жиров С55Н104О6, и валовое уравнение полного окислительного
распада жира можно представить следующим образом:
C55H10406 + 78О2->55СО2 + 52Н2О.
Из приведенного уравнения можно видеть, что для полного окисления
жира тратится много кислорода. Это не вызывает удивления, если принять
во внимание, что жиры являются веществами, содержащими мало кисло-
рода и, следовательно, малоокисленными. Объемное отношение между коли-
чеством образовавшегося углекислого газа и использованного для окисле-
ния жира кислорода (СО2 : О2), дыхательный коэффициент (RQ) равен 0,71;
при окислении углеводов дыхательный коэффициент составляет 1. Приве-
денное валовое уравнение не дает представления о пути распада жира, о про-
320
межуточных продуктах, образующихся на отдельных этапах процесса его
распада.
Распад жиров начинается с их гидролиза. В тканях, особенно в пече-
ни, эта реакция катализируется тканевыми липазами. Продукты гидро-
лиза жиров — глицерин и высокомолекулярные жирные кислоты — зна-
чительно отличаются друг от друга по своей химической природе, и пути
распада их различны. Распад глицерина, в основном, повторяет путь
распада глюкозы. О тесной связи глицерина с обменом углеводов говорит
хотя бы тот факт, что в дрожжах при распаде глюкозы в присутствии
бисульфита натрия (вторая форма спиртного брожения, стр. 30 L) обра-
зуется глицерин. Опыты, проведенные на животных, в пище которых
углеводы были заменены глицерином, показали, что из глицерина в ор-
ганизме образуется гликоген. Вместе с этим глицерин может подвергать-
ся непосредственному окислительному распаду.
Превращения глицерина начинаются с его фосфорилирования. Эта
реакция происходит с участием специфической фосфоферазы, катализирую-
щей перенесение фосфатного остатка от АТФ на глицерин.
СН2ОН СН2ОН
I I
СНОН -И АТФ -> СНОН +АДФ.
СН2ОН СН2О-Н2РО3
Глицеринфосфорная кислота
подвергается затем окислению с образо-
ванием фосфоглицеринальдегида
СН2ОН
СНОН
СН2О.Н2РО3
—2е-2Н+
> СНОН
СН2О.Н2РО3
Начиная от образования фосфоглицеринальдегида, благодаря обра-
тимости отдельных звеньев гликогенолиза, можно легко себе представить
возможность синтеза из глицерина гликогена, а также его распад до молоч-
ной кислоты с последующим ее аэробным окислением с получением углекис-
лого газа и воды. По иному пути протекают превращения в организме высо-
комолекулярных жирных кислот.
Теория р-окисления жирных кислот
В начале нашего столетия Кнооп провел исследования по изучению пути
окисления жирных кислот у собак, результаты которых легли в основу
теории р-окисления жирных кислот. Эта теория получила широкое приз-
нание и была подтверждена исследованиями последних десятилетий.
Для изучения превращения жирных кислот Кнооп пользовался со-фе-
нилзамещенными жирными кислотами. Молекула жирной кислоты мети-
лась путем введения в нее фенильного остатка и благодаря этому станови-
лась более доступной для изучения ее превращения в организме. Кнооп в
своих исследованиях пользовался синтетическими о-фенилзамещенными
жирными кислотами с углеродной цепью различной длины (не больше С5).
Жирные кислоты, входящие в состав жиров, имеют значительно более
длинные цепи атомов углерода. Следовательно, Кнооп, по сути дела, изучал
превращение о-фенилзамещенных низкомолекулярных жирных кислот.
<о-Фенилзамещенные жирные кислоты вводились животным, а затем в
моче этих животных изучались продукты их превращения.
11 Заказ № 581
321
. п Ддя..дцщщи, результатов исследований.полезно остановиться на дан-
ных, полученных во второй половине XIX века по изучению превращений
бензойной и фенил уксусной кислот, введенных млекопитающим животным.
Обе. эти .кислоты обладают некоторой токсичностью и в организме подвер-
гаются,.обезвреживанию путем связывания с глицином. Продукты связыва-
ния — гщпиуровая и фенацетуровая кислоты — выделяются с мочой.
'1»'
С-ЙОСИ I NH2 C-CONH-CH2COOH
НС^^СН СН2 HcZ\CH
П--, J- ’ - ’ '
’ *" * венгзоиййй ’кислота Г л ицин
Гиппуровая кислота
• ССН.СООН
сн
nh2
I'
сн2
СООН
CCH2CONH-CH2CO0H ‘
HC/zSqH
- Л'
Фенилуксусная кислота Фенацетуровая кислота
При введении животным (о-фенилзамещенных жирных кислот с угле-
родной цепочкой различной длины оказалось, что только определенные
да них стимулируют выделение с мочой гиппуровой кислоты. Так, при вве-
дении (о-фенилвалерьяновой кислоты (C6H5CH2CH2CH2GH2GOOH) ' На-
блюдалось выделение гиппуровой кислоты. (о-Фенилмасляная кислота
(СбН5СН2СН2СН2СООН) оказалась в этом смысле неэффективной, оз-фе-
нилпропионовая кислота (СбН5СН2СН2СООН) —эффективной, фенилук-
сусная кислота (С6Н5СН2СООН) — нёэффективной. Исходя из приведенных
данных, Кнооп пришел к выводу, что жирные кислоты в организме подвер-
гаются превращениям, в результате которых углеродная цепь их последова-
тельно укорачивается на два атома углерода. Окислению (дегидрогенизации)
в этом случае подвергается радикал СН2, находящийся в p-положении по
отношению к 'карбоксйлу. В результате от углеродной цепи жирной кислоты
отщепляется С2-фрагменТ, который рассматривался как уксусная кислота.
Представление о процессе [3-окисления жирных кислот дает следующая
схема: ‘
я
сн2 сн2
?-CH2 СН
, ф-СН2 СН
Ч ’Г ' >|
^ОООН СООН
а 1 я я '*ri
сн2 сн2 сн2
СНОН. -н, 10 +НОН СООН
сн2 сн2 СНзСООН
СООН СООН
.. -г(
Образодавщаяся молекула жирной кислоты /?СН2СООН снова подвер-
гается окислению.
Процесс -^-окисления жирных кислот предусматривает последователь-
ное их окисление с; образованием С2-фрагментов (уксусной кислоты). Ко-
личество образующихся молекул уксусной кислоты зависит от длины угле-
родной цепи жирной кислоты, подвергшейся окислению. Для стеариновой
кислоты (С17Н35СООН) оно будет равняться девяти, для пальмитиновой
£С15Нз1СООН)—восьми и т. д. Интересно указать, что для всех природ-
ных жирных кислот обычно характерно наличие в их молекулах четного
322
числа атомов углерода. Следовательно, в результате процесса ^-окисления
каждая из них должна дать то или иное количество молекул уксусной”
кислоты. !
Жирные кислоты с нечетным числом атомов углерода встречаются
редко и в небольших количествах. В результате окисления их. молекулы-
наряду с тем или иным количеством молекул уксусной кислоты должна*
образоваться одна молекула пропионовой кислоты.
Так как естественные жирные кислоты содержат в своих молекулах
четное число атомов углерода, то все они на определенном этапе своего пре-
вращения должны дать начало образованию С4-жирной кислоты мае-*
ляной кислоты. Последняя, следовательно, должна явиться промежуточ-
ным продуктом окисления высокомолекулярных жирных кислот. В свою
очередь, масляная кислота подвергается также р-окислению.
сн3 1 сн3 1 СН3 1 сн, 0 1 СН9
1 сн2 н 1 н= сн +н°п (1нон -н. со +нон 1 СООН
1 II 1 -U
сн2 сн 1 сн2 сн2 сн, 0
СООН 1 СООН СООН СООН СООН
Масляная Кротоновая ₽-Оксимасляная Ацетоуксусная Уксусная
кислота кислота кислота кислота кислота
При окислении масляной кислоты последовательно образуются крото-
новая, р-оксимасляная, ацетоуксусная и уксусная кислоты. Каждая моле-'
кула высокомолекулярной жирной кислоты на определенном этапе своего
распада должна дать начало образованию одной молекулы ацетоуксусной
кислоты.
Ацетоуксусная кислота может образоваться путем синтеза из двух
молекул уксусной кислоты, она же может быть и промежуточным продуктом
р-окисления масляной кислоты.
При критическом подходе к оценке результатов исследований Кноопа
обращают на себя внимание два следующих момента: 1) Кнооп пользовался
в своих исследованиях со-фенилзамещенными жирными кислотами; естест-
венно возникает вопрос, происходит ли их превращение в организме по-
добно превращению жирных кислот, образующихся при гидролизе жиров?
2) Кнооп изучал превращение ш-фенилзамещенных низкомолекулярных
жирных кислот; возникает вопрос, можно ли результаты исследований,
полученные при изучении превращений низкомолекулярных жирных кис-
лот, переносить без соответствующей проверки на высокомолекулярные
жирные кислоты? Понятно поэтому, что исследования Кноопа, несмотря
на их большую ценность, не разъяснили окончательно процесс распада
высокомолекулярных жирных кислот животных. Необходимы -были даль-’
нейшие исследования.
В 1908 г. Эмбден и Маркс изучали процесс распада жирных жислот,
пользуясь изолированной печенью. В опытах с пропусканием через *изоли-
рованную печень питательной жидкости с прибавлением к ней различных
жирных кислот они наблюдали появления в оттекающей от печени жидко-
сти ацетоуксусной кислоты. Результаты их исследованйй приводятся нйже;
появление в оттекающей от печени питательной жидкости ацетоуксусной
кислоты обозначено плюсом, а отсутствие ее — минусом.
СНз(СН2)2СООН (масляная кислота)
СНз(СН2)зСООН (валерьяновая кислота)
СНз(СН2)4СООН (капроновая* кислота)
СНз(СН2)бСООН (гептановая кислота)
СНз(СН2)бСООН (октановая .кислота)
СНз(СН2)7СООН (нонановая кислота)
СНз (СН2)8СООН (декановая кислота)
СНз(СН2)9СООН (ундекановая'кислота)
СН3(СН2)юСООН (лауриновая, кислота).
11*
323
Таким образом, ацетоуксусная кислота появлялась в оттекающей пита-
тельной жидкости в тех случаях, когда через печень пропускали жирные
кислоты с четным числом атомов углерода в их молекулах.
Результаты этих исследований оценивались как доказательство в поль-
зу р-окисления жирных кислот. Считали, что в случае р-окисления жирных
кислот с четным числом атомов углерода на определенном этапе должна
появиться ацетоуксусная кислота. В случае же окисления жирных кислот
с нечетным числом атомов углерода, ацетоуксусная кислота как проме-
жуточный продукт не должна появляться, так как окисление их должно
на последнем этапе привести к образованию С3-кислоты — пропионовой
(СН3-СН2СООН).
Вскоре после исследований Эмбдена и Маркса было установлено, что
при пропускании через изолированную печень питательной жидкости
с прибавлением к ней уксусной кислоты в оттекающей жидкости появляется
ацетоуксусная кислота, следовательно, в печени ацетоуксусная кислота
синтезируется из уксусной кислоты. Это обстоятельство в известной мере
снижает убедительность выводов, вытекающих из исследований Эмбдена
и А^аркса. Ведь какая бы жирная кислота не подвергалась р-окислению,
из нее должны образоваться молекулы уксусной кислоты. В этом отношении
поведение жирных кислот с четным и нечетным числом атомов углерода в
молекулах должно быть одинаковым. В действительности же этого не
наблюдается.
Если результаты исследований с жирными кислотами с четным числом
атомов углерода подтверждают существование процесса р-окисления жир-
ных кислот, то отрицательные результаты, полученные для жирных кислот
с нечетным числом атомов углерода, требуют объяснения.
Исследования, проведенные в более позднее время по изучению окис-
ления синтетических жирных кислот с нечетным числом атомов углерода,
показали, что они окисляются в тканях организма медленнее, чем жирные
кислоты с четным числом атомов углерода. По-видимому, по этой причине
не наблюдалось образования в количестве, доступном для определения аце-
тоуксусной кислоты из жирных кислот с нечетным числом атомов углерода
при пропускании их через печень.
Дальнейшее изучение окисления жирных кислот проводилось с приме-
нением срезов печени, мелко измельченной ткани печени (гомогенатов пе-
чени) и метода меченых молекул.
Все это позволило ближе подойти к познанию пути превращения жир-
ных кислот в организме.
В 1935 г. на основании изучения окисления жирных кислот в срезах
печени и образования при этом ацетоуксусной кислоты Джоветт и Квостл
выдвинули гипотезу так называемого многократно перемежающегося окис-
ления жирных кислот. Эти авторы на основании результатов, полученных
ими при исследовании интенсивности образования ацетоуксусной кислоты
при окислении в срезах печени различных по длине углеродной цепи жир-
ных кислот, пришли к заключению, что ацетоуксусная кислота является
единственной кетокислотой, возникающей в значительных количествах при
окислении жирных кислот. Из каждой молекулы, подвергшейся окислению
жирной кислоты, при этом образуется не одна молекула ацетоуксусной кис-
лоты, а несколько. Такое интенсивное образование ацетоуксусной кислоты
в срезах печени потребовало внесения изменений в схему р-окисления
жирных кислот.
Еще до исследований Джоветта и Квостла при изучении выделения аце-
тоновых веществ из организма людей, больных сахарным диабетом, было
обращено внимание на то, что при тяжелых формах диабета выделение
ацетоновых веществ с мочой настолько велико, что объяснить это образова-
нием из каждой молекулы жирной кислоты только лишь одной молекулы
ацетоуксусной кислоты не представляется возможным.
Гипотеза многократно перемежающегося окисления жирных кислот
324
предусматривает окисление, идущее по всей углеродной цепи, подвергаю-
щейся окислению жирной кислоты. В результате этого окисления появляют-
ся карбонильные группы, чередующиеся через один атом углерода (СН2),
а жирная кислота превращается в жирную поликетокислоту.
СН3.СН2-СН2.СН2-СН2-СН2.СН2-СН2-СН2-СН2.СН2‘СООН->СНз-СО‘СН2СО-
+ЗН2О
♦ СН2-СО-СН2.СО-СН2-СО-СН2-СООН------► ЗСН3СО-СН2СООН
Гипотеза многократно перемежающегося окисления жирных кислот
предусматривает образование из каждой молекулы высокомолекулярной
кислоты нескольких молекул ацетоуксусной кислоты. Так, например, окис-
лительный распад молекулы пальмитиновой кислоты должен привести к
образованию четырех молекул ацетоуксусной кислоты (С16 : 4=^4С4). Окис-
лительный же распад каждой молекулы стеариновой или же олеиновой
кислоты должен привести к образованию четырех молекул ацетоуксусной
кислоты и одной молекулы уксусной кислоты (С18 : 4=4С44 1С2). Гипо-
теза многократно-перемежающегося окисления жирных кислот не преду-
сматривает возможности образования ацетоуксусной кислоты за счет кон-
денсации молекул уксусной кислоты, и в этом сказалась ее несостоятель-
ность.
Первым серьезным возражением против этой гипотезы явились резуль-
таты исследований, полученные при изучении в срезах печени окисления
капроновой кислоты (С6). Оказалось, что при окислительном распаде этой
кислоты в срезах печени образуется на каждую молекулу больше одной
молекулы ацетоуксусной кислоты. Согласно же гипотезе многократно-
перемежающегося окисления, следовало бы ожидать образования на каж-
дую молекулу подвергшейся окислению капроновой кислоты не больше
одной молекулы ацетоуксусной кислоты (С6 : 4-1С441С2).
Дальнейшее изучение окисления жирных кислот в срезах печени с при-
менением меченых молекул, проведенное Вейнхаузом, полностью опроверг-
ло представление о многократно перемежающемся окислении жирных кис-
лот. На результатах этого изучения интересно остановиться более под-
робно.
Опыты проводились с октановой кислотой, меченной в карбоксиле
тяжелым изотопом углерода — С13. При окислении этой кислоты в срезах
шло образование ацетоуксусной кислоты, в молекулах которой тяжелый
углерод был равномерно распределен между карбоксильной и карбониль-
ной группами. Это с несомненностью показывает, что ацетоуксусная кис-
лота образуется в результате конденсации молекул уксусной кислоты,
появляющихся при окислении октановой кислоты. Если бы образование
ацетоуксусной кислоты шло бы по пути многократно перемежающегося
окисления, то тяжелый углерод оказался бы только в карбоксильной группе
одной из двух молекул образовавшейся ацетоуксусной кислоты.
СН3-СН2-СН2-СН2-СН2-СН2-СН2-С13ООН-^СН3СО-СН2-СО.
•СН2СО-СН2С13ООН -> СН3СОСН2СООН + СН3СО-СН2С13ООН
Так как С13 оказывается равномерно распределенным между карбо-
ксильной и карбонильной группами, то следует считать, что при окислении
октановой кислоты образуется уксусная кислота, молекулы которой под-
вергаются конденсации с появлением ацетоуксусной кислоты.
СН3<СЫ3.СН2.СН2.СН2-СН2.СНоС13ООН-> СН3С13ООН 4- СН3СООН 4 СН3СООН4
4СН3СООН4СН3СООН4СН3СООН
Образовавшаяся уксусная кислота оказывается меченой только в кар-
боксиле. Понятно, что концентрация меток в карбоксильной группе моле-
кул уксусной кислоты будет в четыре раза ниже, чем в карбоксильной груп-
пе молекул октановой кислоты. Затем, при конденсации молекул уксусной
325
кислоты тяжелый углерод окажется равномерно распределенным между
карбоксильной и карбонильной группами образовавшейся ацетоуксусной
кислоты.
СП3 СНз
1 13СООН 13СО
СНз * сн2
13СООН 13СООН
Применение меченых молекул позволило разобраться еще в одном
вопросе. В течение долгого времени считали, что появление ацетоуксусной
кислоты связано с ее образованием на определенном этапе окислительного
распада высокомолекулярных жирных кислот. Предполагалось, что ацето-
уксусная кислота накапливается в организме, если по какой-либо причине
ее распад с появлением уксусной кислоты тормозится. Опыты с применением
меченной в карбоксиле тяжелым углеродом масляной кислоты опровергли
это мнение.
В этих опытах, проведенных на срезах печени, было установлено, что
при окислении масляной кислоты накапливается ацетоуксусная кислота,
в которой тяжелый углерод равномерно распределен в карбоксильной и в
карбонильной группах. Это возможно только в том случае, если масляная
кислота окисляется с образованием уксусной кислоты, а из уксусной кислоты
конденсируется ацетоуксусная кислота
СНз СН, СНз
1 1 1
СН2 -н2 СН 4-НОН СНОН
1 -* • II -* 1
сн2 сн сн2
1 1 1
13СООН 13СООН 13СООН
сн3
I
13СООН
4-
сн3
I
13СООН
СНз СНз
-н2 1 с=- о _ > соон
СНз 1 13С^О > 1 сн2 1 ,3СООН + СН, 1 13СООН
СНо
I
13СООН
Результаты всех этих исследований приводят к заключению, что при
окислительном распаде высокомолекулярных жирных кислот образуются
молекулы уксусной кислоты. Это является подтверждением теории [3-окис-
ления жирных кислот, в последнее время дополненной благодаря изучению
ферментов, катализирующих отдельные этапы окислительного распада
жирных кислот. Новый момент заключается здесь в том, что р-окисление
жирных кислот приводит к образованию не свободной уксусной кислоты,
а ацетильного производного кофермента ацилирования (KoASH).
Экспериментальные данные, полученные в течение ряда лет, не только
подтвердили предложенную в начале нашего столетия Кноопом теорию
р-окисления жирных кислот, но определенным образом ее расширили.
Прежде всего было показано, что жирные кислоты до процесса [3-окисления
актйвируются. Реакция активирования заключается в образовании карбок-
сильными группами жирных кислот с участием аденозинтрифосфорной кис-
лоты и кофермента ацилирования (KoASH) ацил-тиопроизводных соеди-
нений.
KoASH 4- АТФч>КоАЭ~ Р==
,ОН
О-Р=°
О ^ОН + адениловая кислота (1)
ОН
326
ОН” ''
1ЧЧ м \
Г» ’ i
^CCtoH+KbAS-Pf^D’5 ч°н
-1 - * ’ll'
’ Х)Н
> fl£~SK?A+H4₽2Qj.(?)
Дальнейшему превращению подвергается ацил— SKoA. ' ’
Превращение активированной ^жирной кйс’лоть! катализируется следую-
щими ферментами: 1) р-ацйлдегвдрогеназой; являющейся флавиновым фер-
ментом, катализирующим реакцию дегидрирований активированной жир-
ной кислоты;? 2) р-енол гидратазой/ которая катализирует присоединение
молекулы воды к молекуле нс^аоыщенней-активированной жирной кислоты;
3) [З-оксиацилдегидрогеназощ катализирующей бкНсйение Активированной
оксикислоты; 4) р-кетотиолазой—ферментом, катализирующим^отщепление
от активированной кетокислоты С2-фрагмента в виде ацетильного произ-
водного кофермента А.
Путь превращения активированной жирной кцслрты следующий:
СН2
сн2 иНг ,
I ₽-Ацилдегидрогеназа
СНз
^О- -
C~SKoA
R
I
сн2
'СН
II
сн
+нон
3- Енолгидратаза
R
I
СН2
I
СНОН
I
сн2
IZ
G-SKoA
. *
-н2
(З-Оксиацилдегидрогеназа
I
СНз
1
СО
I
СНз +
C-SKoA
KoASH /7 от_ А
_________C—SKoA
Р-Кетотиолаза I
СН3
. . . > .. . . ч , А . , ; _ . / /- <
Коферментом p-ацилдегидрогеназы является ^фладинаденицдинуклсртид
(ФАД), который восстанавливается, присоединяя к себе водород от окисляю-
щейся жирной кислоты, в ФАД-Н2.
Коферментом p-оксиацилдегидрогеназы является никотинамид-аденин-
динуклеотид (НАД), который от подвергающейсяюкиелению р-оксикислоты
присоединяет к себе водород.
В результате-последовательного действия четырех ферментов от акти-
вированной жирной кислоты отщепляется ацетильное производное кофер-
мента А и углеродная ее цепь укорачивается на два атома углерода. Обра-
зовавшаяся при этом жирная кислота с меньщим числом атомов в углерод-
ной цепи снова подвергается р-окисленйю. Легко понять, что в результате
процесса р-окисления жирная кислота распадается с образованием молекул
ацетил ~S Ко А.
РОЛЬ ПЕЧЕНИ В ОБМЕНЕ^ЖИРОВ
В процессах превращения жиров.большая роль принадлежит печени.
В печени жиры подвергаются гидролизу с образованием глицерина и жир-
ныд дислот. При нарушениях .обмена, веществ, например при углеврдном
голодании,fв клетках паренхимы Лечен и накапливается жир/ С подобным
явлением встречаются при отравлении организма фбс^ором^ четыреххло-
рйстым у глеродом'и др. Печень,‘обогащённая ‘жиром, получила "название
327
«жировой печени». Ожирение печени вызывается тем, что доставляемый
кровью жир утилизируется не полностью. Изучение окисления жирных
кислот в срезах различных тканей и органов показало, что только в срезах
печени интенсивно происходит окисление жирных кислот. Считается обще-
принятым, что основная масса жирных кислот подвергается р-окислению в
печени. В остальных же тканях р-окисление жирных кислот происходит в
ограниченном объеме.
Незначительная часть образующегося в результате р-окисления в пе-
чени ацетил^—SKoA подвергается там дальнейшему распаду, основная же
его масса конденсируется и превращается в ацетоацетил—SKoA. Из пос-
леднего ацетоуксусная кислота образуется двумя путями. Первый путь —
гидролитическое отщепление KoASH с образованием ацетоуксусной кислоты.
Другой путь более сложный. В печени Линеном установлено наличие двух
ферментов, катализирующих отщепление KoASH от его ацетоацетильного
производного. Эти ферменты катализируют следующие две реакции:
СН3-С—SKoA +
Ацетил—SKoA
СООН
I
снг
I
Н3С-СОН+KoASH
I
сн2
и
C~SKoA
Ацетоацетил—SKoA
р-Метил-(з-оксиглутарил~5КоА
СООН
сн2
I
Н3С-СОН
I
сн2
IZ
С-SKoA
СООН
I +CH3-C-SKoA
СО Ацетил~5КоА
I
сня
Ацетоуксусная
кислота
Из приведенных уравнений следует, что в процессе отщепления KoASH
от ацетоацетил —SKoA участвует ацетильное производное кофермента А
и этот процесс протекает по циклу.
Ферменты, катализирующие отщепление KoASH от ацетоацетил—SKoAr
обнаружены в печени, но они отсутствуют в иных тканях, например в мыш-
цах. Наличие их в печени имеет физиологическое значение. Если в печени
328
не происходило бы отщепления остатка KoASH отацетоацетильного произ-
водного KoASH и оно бы поступало в кровь, в печени обнаруживался бы
дефицит в KoASH. Это, несомненно, должно было бы отрицательно отра-
зиться на течении процесса р-окисления жирных кислот, в котором, как мы
видели, участвует KoASH.
ПОТРЕБЛЕНИЕ АЦЕТОУКСУСНОЙ КИСЛОТЫ ТКАНЯМИ
Ацетоуксусная кислота, доставляемая кровью к различным тканям
и органам, подвергается там распаду с образованием конечных продуктов —
углекислого газа и воды. Начальным этапом ее превращения является обра-
зование ацетоацетильного производного KoASH. Затем оно с помощью
кетотиолазы подвергается расщеплению с образованием двух молекул
ацетил—SKoA.
CH3-C-O-CH2-C~SKoA+HSKoA->CH3C~SKoA+CH3C-SKoA
Молекулы ацетил—SKoA включаются в окислительный цикл трикарбо-
новых кислот и подвергаются полному распаду до углекислого газа и воды.
Потребление ацетоуксусной кислоты различными тканями и органами
было установлено в опытах на срезах тканей (in vitro) и в опытах на целом
организме (in vivo). В первом случае можно было видеть аэробное окисле-
ние ацетоуксусной кислоты, прибавленной к питательной жидкости. Во
втором случае о потреблении ацетоуксусной кислоты можно было судить по
содержанию ее в крови, притекающей (артериальной) и оттекающей (веноз-
ной) от различных органов (мышц, головного мозга, почек, молочной железы
коров). В артериальной крови содержание ацетоуксусной кислоты оказалось
выше, чем в венозной. Артерио-венозная разница в содержании ацето-
уксусной кислоты больше при работе мышц, при активной функции молоч-
ной железы. Отсюда следует, что в мышцах при их работе, а также в молоч-
ной железе при лактации, повышается потребление ацетоуксусной кислоты.
Обмен жиров схематически можно представить следующим образом:
Жиры
------> Глицерин + Жирные кислоты
| [3-окисление
транспорт
жиров к тка-
ням кровью
различные
ткани
СО2 + Н2О
ацетил — SKoA
ацетоуксусная кислота
k печень
транспорт к тканям кровью
ацетоуксусная кислота
ацетил — SKoA
через цикл трикарбоновых кислот
ПРЕВРАЩЕНИЕ НЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
До сих пор излагались данные об окислительном распаде насыщенных
жирных кислот. Естественно возникает вопрос, как окисляются ненасыщен-
ные жирные кислоты. На первый взгляд может показаться, что этот вопрос
разрешается просто. Ведь известно, что при р-окислении, уже на первом
его этапе, при дегидрогенизации, образуется из насыщенной кислоты ненасы-
щенная, поэтому можно предположить, что ненасыщенные жирные кислоты
являются промежуточными продуктами окисления насыщенных жирных
329
кислот. Этому,.рднако,чпротиЁоречат следующие обстоятельства/Во-первых,
при p-окисленци возникает ненасыщенная связь между атомами углерода
в положении а- и р- по отношению к карбоксилу. Между тем< как в жирах,
так и в фосфатидах встречаются жирные кислоты, имеющйе'не одну/а не-
сколько ненасыщенных связей. Даже в случае одной ненасыщенной связи,
например, в олеиновой кислоте, она расположена далеко от карбоксила —
между 9-м и 10-м атомами углерода. Во-вторых, некоторые жирные кислоты
с несколькими'ненасыщенными связями (линолевая, линоленовая и арахи-
доновая) не могут образоваться в организме животных из других веществ
и должны доставляться с пищей. Эти жирные кислоты содержатся 'в расти-
тельных жирах и поэтому эти жиры биологически более ценны, чем жиры
животного, происхождения. г».. . - и
Вопрос О; том, как синтезируются ненасыщенные жирные кислоты,'встре-
чающееся в состдве, /жиров и фосфатидов^: остается еще невыясненным.
Также еще мало известно о пути их распада. Некоторым исключением-яв-
ляется олеиновая кислота, путь превращения которой изучен более полно.
Опыты с введением животным олеиновой кислоты, меченной тяжелым изо-
топом водорода (дейтерием), показали, что она превращается в стеариновую
кислоту (т._е. гидрогенизируется), которая затем подвер?аётся ^-окислению.
Превращение олеиновой > кислоты (СН3(СН2)7СН=СН—(СН2)7СООН)
в стеариновую^ биохимически оправдано тем, что р-окисление олеиновой
кислоты должно прекратиться после отщепления от ее молекулы трех моле-
кул уксусной кислоты, так как жирная кислота СН3(СН2)7СН—СН—
—СН2СООН не может уже подвергаться обычному р-окислению.
* а
СИНТЕЗ ЖИРНЫХ КИСЛОТ В ОРГАНИЗМЕ
Жирные кислоты могут синтезироваться у животных из - продуктов
превращения углеводов и ряда аминокислот. Превращение углеводов в
жиры происходит в значительных размерах при откорме животных, особен-
но свиней и гусей. В больших количествах синтезируются жирные кислоты
(жиры) во время лактации у коров. У коров углеводы пищи в основной'своей
массе превращаются в пищеварительном теракте в уксусную кислоту, кото-
рая служит у них4 материалом как для синтеза жиров, так и для синтеза уг-
леводов.
Успехи, достигнутые в области изучения внутриклеточного обмена
углеводов и жиров, объясняют, каким образом, через какие промежуточные
продукты осуществляется, синтез высокомолекулярных жирных кислот.
Центральное место в биосинтезе жирных кислот занимает ацетил—/SKoA,
т. е. ацетильное производное кофермента ацилирования. Как известно,
оно является промежуточным продуктом окислительного распада как угле-
водов (стр. 307), так и жирных кислот. Обратимость действия ферментов,
катализирующих реакции р-окисления жирных кислот, обеспечивает воз-
можность синтеза жирных кислот из ацетильного производного KoASH
независимо от того, образовалось ли оно из углеводов или из жирных кис-
лот. Синтез ацетоуксусной кислоты, правильнее, ацетоацетильного произ-
водного кофермента А, из ацетильного производного KoASH, происходящий
в различных тканях и особенно интенсивно в печени, является первым эта-
пом дальнейшего удлинения углеродной цепи жирной кислоты.'
Синтез низкомолекулярных жирных кислот благодаря обратимости
промежуточных этапов процесса окисления жирных кислот удалось осуще-
ствить^ опытах in vitro при использовании препаратов очищенных фермен-
тов. Поскольку два этапа процесса окисления жирных кислот сопровож-
даются реакциями окисления (дегидрогенизации окисленной жирной кис-
лоты с образованием ненасыщенной кислоты и окислением ф-оксикислоты с
образованием р-кетокислоты), то понятно, что при- обращении процесса
р-окцеления, т. е., при синтезе жирной кислоты, должны происходить реакции
330
восстановления ненасыщенной жирной кислоты и р-кетокислоты. Эти
реакции восстановления осуществляются с помощью фермента, в состав
которого входит НАДФ-Н2 при восстановлении р-кетокислоты в р-окси-
кислоту и фермента, в состав которого входит ФАД-Н2, при восстановле-
нии ненасыщенной жирной кислоты. НАДФ-Н2 и ФАД-Н2 при этом
окисляются в НАДФ и ФАД. С другой стороны, в результате окисления
различных органических веществ в тканях НАДФ и ФАД восстанавли-
ваются с образованием НАДФ-Н2 и ФАД-Н2. Иначе говоря, синтез
жирных кислот происходит при обязательном окислении иных веществ.
Наряду с синтезом низкомолекулярных жирных кислот путем обрати-
мости реакций р-окисления обнаружен путь синтеза высокомолекулярных
жирных кислот.
Этот путь интересен в том отношении, что в нем, кроме СН3СО—SKoA,
участвует углекислый газ с образованием в качестве промежуточного про-
дукта — малонил—SKoA:
СООН
I/0 I
С-SKoA + СО2+АТФ-»СН2
+ АДФ+-Н3РО4 (1)
Ацетил—SKoA
C~SKoA
Малонил—SKoA
Энергия, необходимая для активирования СО2, доставляется АТФ.
На втором этапе синтеза происходит реакция новой молекулы ацетильного
производного кофермента А и образовавшейся малонил — SKoA.
СН3 |/° - С-SKoA СООН СООН Н 1 СН2 СН3СО—СН + HS-KoA (2) IZ „ 1/> С—SKoA С—SKoA
Ацетил—SKoA Малонил—SKoA
Ацет ил м ал он ил—S К о А
Возникший ацетилмалонил ~ SKoA подвергается на третьем этапе восста-
новлению.
СООН СООН
I . I
СН3—СО—СН +НАДФ-Н2-»СН3—СНОН—СН4-НАДФ (3)
U0 \//0
С—SKoA С-SKoA
Ацетилмалонил—SKoA Оксиэтилмалонил—SKoA
На четвертом этапе происходит реакция дегидратирования:
СООН
I
СН3—СНОН—СН —112О -> CI13—сн
|у°
С - SKoA
СООН
I
С (4)
/°
C~SKoA
На пятом этапе снова происходит реакция восстановления:
331
На шестом этапе имеет место декарбоксилирование с образованием бу-
тир ил ~SKoA:
СН3
СООН СН2
I I (6)
СНз—сн2—сн —со2 -> сн2
V/° 1/°
C~SKoA C~SKoA
Этилмалонил^БКоА Бутирил~8КоА
Следовательно, в результате приведенных реакций из двух молекул
ацетил —SKoA синтезируется молекула бутирил ~SKoA. Последняя, пов-
торив цикл приведенных реакций, превращается в капронил —SKoA. Кап-
ронил —SKoA дает начало образованию октил -—SKoA и так в дальнейшем
будет продолжаться удлинение цепи атома углерода в молекулах каждый
раз на два атома.
Этот путь синтеза высокомолекулярных жирных кислот установлен
исследованиями Вейкила.
О МЕСТЕ АЦЕТОУКСУСНОЙ КИСЛОТЫ
В ПРОМЕЖУТОЧНОМ ОБМЕНЕ
Мы видели, что ацетильное производное KoASH, образующееся в пе-
чени в результате [3-окисления жирных кислот, превращается там же в аце-
тоуксусную кислоту. Основная масса жирных кислот окисляется в печени,
и возникающая там ацетоуксусная кислота поступает в кровь и ею достав-
ляется к различным тканям организма, • где она используется. Подобно
тому как за счет расщепления гликогена печень снабжает ткани организма
глюкозой, она снабжает ткани ацетоуксусной кислотой за счет окислитель-
ного расщепления высокомолекулярных жирных кислот и конденсации
молекул ацетильного производного KoASH. Следует, однако, отметить отли-
чительные моменты в снабжении печенью тканей организма глюкозой и в
снабжении ацетоуксусной кислотой. Они заключаются в том, что глюкоза в
печени образуется из имеющегося в ней запаса гликогена, в то время как в
печени значительный запас жиров и тем более жирных кислот отсутствует.
Запасы жира сосредоточены в брыжейке (сальниках), в подкожной жиро-
вой клетчатке, образование же из жирных кислот ацетоуксусной кислоты
происходит в печени.
Ацетоуксусная кислота образуется не только в печени, но и в других
органах, однако, во всех органах, за исключением печени, ацетоуксусная
кислота образуется за счет ацетильного производного KoASH, возникаю-
щего, главным образом, в результате окислительного распада углеводов и
некоторых аминокислот.
Ацетоуксусная кислота, возникающая в тканях из углеводов, а также
поступающая в ткани из печени, при нормальных условиях подвергается
окислительному распаду с образованием углекислого газа и воды. Содер-
жание ее в тканях и в крови незначительно. Незначительно также содержа-
ние в них веществ, легко образующихся из ацетоуксусной кислоты —
р-оксимасляной кислоты и ацетона. При нарушении обмена веществ про-
исходит накопление ацетоуксусной кислоты в тканях и в крови. С подобным
явлением встречаются в случаях голодания и истощения организма. Накоп-
ление ацетоуксусной кислоты в этих случаях, по-видимому, связано с тем,
что в организме интенсивно используются запасные жиры, и образующаяся
в печени ацетоуксусная кислота, в связи с общим снижением обмена веществ,
используется в организме не столь интенсивно, как обычно.
У больных сахарным диабетом накопление ацетоуксусной кислоты,
р-оксимасляной кислоты и ацетона объясняется тем, что у них, с одной сто-
332
роны, происходит избыточное образование ацетоуксусной кислоты — сое-
динения, стоящего на пути синтеза углеводов (при диабете усилен синтез
углеводов из иных веществ), а с другой стороны, — потребление ацето-
уксусной кислоты, ее окислительный распад снижен.
ОБМЕН ФОСФАТИДОВ
Обмен фосфатидов тесным образом связан с обменом жиров. Фосфатиды
участвуют в процессах всасывания жиров, в транспорте их в организме.
При кормлении животных жиром, в который входят жирные кислоты с
высоким йодным числом (стр. 95), например рыбьим жиром, эти жирные
кислоты появляются в составе фосфатидов слизистой оболочки тонких
кишок. Еще более показательны результаты исследований с прибавлением
к корму кошек синтетического жира, состоящего из глицерина и элаидино-
вой кислоты (изомер олеиновой кислоты). В этом случае в составе фосфати-
дов слизистой оболочки тонких кишок обнаруживается элаидиновая кис-
лота, чего обычно не наблюдается. Так как при всасывании жиров количе-
ство фосфатидов в слизистой оболочке не увеличивается, следует полагать,
что при всасывании жиры взаимодействуют с фосфатидами слизистой кишеч-
ника, обмениваясь с ними жирными кислотами.
Фосфаты, как известно, ускоряют процесс всасывания жиров. По-
этому существовало мнение, что жиры при всасывании подвергаются фос-
форилированию, проходя стадию образования фосфатидов. В этом случае
молекула нейтрального жира должна заменить один остаток жирной кислоты
на фосфорную кислоту с образованием фосфатидной кислоты. Присоедине-
ние к остатку фосфорной кислоты в фосфатидной кислоте азотистого компо-
нента (холина, этаноламина) должно привести к синтезу соответствующего
фосфатида. В пользу этого мнения приводили данные, указывающие на
то, что при введении в организм животного веществ (например, монойодук-
сусной кислоты), нарушающих процессы фосфорилирования, всасывание
жиров замедляется. Следует, однако, подчеркнуть, что прямых доказатель-
ств в пользу синтеза фосфатидов в слизистой оболочке из жиров при их вса-
сывании нет. Замедление всасывания жиров при нарушении процессов фос-
форилирования можно трактовать в том смысле, что всасывание является
активным физиологическим процессом, сопровождающимся усилением про-
цессов обмена веществ в слизистой оболочке, в которых участвует фосфор-
ная кислота.
Об участии фосфатидов в транспорте жиров говорят следующие факты.
Обогащение жирами и жирными кислотами плазмы крови при всасывании
жиров сопровождается увеличением содержания в ней фосфатидов (фосфа-
тидемией). Фосфатидемия наблюдается также при усиленной мобилизации
жиров из мест их отложения в организме, что происходит в первый период
голодания и при заболеваниях, ведущих к истощению организма.
Велико значение фосфатидов и в процессе использования жиров.
При недостатке фосфатидов (оно может быть вызвано недостатком
холина или же метионина, необходимого для его синтеза) замедляются
процессы превращения жиров в печени. Доставляемые в печень с кровью
жиры накапливаются, причем содержание их в печени может дойти до 50%.
Участие холинсодержащих фосфатидов (лецитинов) в обмене жиров
наглядно видно из результатов исследований над животными, у которых
вызывали ожирение печени («жировую печень») кормлением их пищей,
богатой жирами и бедной белками. По мере накопления жира в печени
в ней уменьшается содержание фосфатидов. Установлено, что введение
животным лецитина или холина предохраняет их от накопления жира в пе-
чени. Подобное действие лецитина и холина носит название липотропного
действия. Липотропным действием обладает не только холин, но и его
предшественники в организме — метионин и серин. При кормлении жи-
333
котныхпм.щей, бедной белками, ощущается недостаток метионина и син-
тез холина замедляется. Выраженным липотропным действием обладают
.белки с. высоким содержанием метионина.
Холин не только восстанавливает до нормы содержание фосфатидов
в «жировой печени», но усиливает синтез фосфатидов и отдачу их из пе*
чени в кровь и доставку их к другим тканям и органам.
При наличии компонентов, входящих в состав различных фосфати-
дов, в тканях может осуществиться их синтез. В ряде случаев у живот-
ных образуются путем синтеза компоненты, необходимые для синтеза
фосфатидов например, для синтеза лецитинов, кефалинов, серин-фосфа-
тидов. Ограничен синтез инозитолсодержащих фосфатидов и очевидно
.некоторых, других.
Возможность синтеза фосфатидов у животных впервые была установ-
лена в 1885 г. А. Тихомировым в опытах над шелкопрядом. Оказалось, что
при развитии из грены (яиц) шелкопряда личинок происходит увеличение
содержания фосфатидов. Личинки содержат почти вдвое больше фосфатидов,
.чем грены, хотя при развитии последней фосфатиды извне не поступают.
Возможность синтеза фосфатидов у животных была установлена так-
же в опытах на .птицах. Изучая поступление фосфатидов с пищей и выве-
дение их при кладке яиц, можно наблюдать, что из организма выводится
фосфатидов значительно больше, чем в него поступает. Так как наблюде-
ния проводились в течение продолжительного времени, можно прийти к
заключению, что у птиц происходит синтез фосфатидов. Однако эти ис-
следования не дали ответа на вопросы, в каких именно органах синтези-
руются фосфатиды и как осуществляется этот синтез.
Оказалось, что печень играет важную роль в синтезе фосфатидов.
Первые исследования по изучению обмена фосфатидов, проведенные в
щрощлом столетии Дроздовым, показали, что кровь, притекающая к пе-
рчена, содержит меньше фосфатидов, чем кровь оттекающая. Отсюда сле-
дует вцвод, что в печени синтезируются фосфатиды, которые из нее по-
ступают в кровь. Этот вывод нашел свое подтверждение в дальнейших
доследованиях, особенно с применением радиоактивных изотопов.
Так, было показано, что у кур фосфатиды синтезируются в печени,
.оттуда они током крови доставляются в яичник и накапливаются в фор-
мирующихся желтках яиц.
Печень не единственный орган, в котором происходит синтез фосфа-
_т-идов. Синтез фосфатидов в значительном объеме наблюдается в слизи-
стой оболочке тонких кишок. В этом случае синтезирующиеся фосфати-
ды также поступают в кровь.
. Синтез фосфатидов происходит и в тканях почек, в нервной ткани,
в мышцах, но из них фосфатиды в кровь не поступают.
В синтезе фосфатидов особое место занимает молочная железа.
>В ней при лактации образуется значительное количество фосфатидов, но
они не остаются в организме, а выводятся с молоком.
Фосфатиды играют важную роль в органах размножения (репродук-
ции) — семенниках, яичниках, желтом теле—и при развитии зародыша.
,В этих органах содержится много фосфатидов. С наступлением беремен-
ности содержание фосфатидов в яичниках увеличивается и достигает
максимума к концу первого периода беременности (у кролика к 16—
18^му дню). Затем начинается понижение содержания фосфатидов, ко-
торое происходит постепенно до конца беременности.
Наибольшее содержание фосфатидов в желтом теле совпадает с фа-
.зой его наивысшей активности.
Имеются интересные данные, касающиеся использования фосфатидов
яичного жедтка при развитии куриного зародыша. Содержание фосфатидов
,в яйцах при их инкубировании почти не изменяется до 14-го дня. Затем
^содержание фосфатидов быстро уменьшается и одновременно появляется
значительное количество неорганического фосфата. Последняя неделя инку-
334
бацйй характеризуется ” интенсивным потреблением7 фосфа тйдбв^ резни даю-
щимся эмбрион ом. Причем интересно, что в последний периОдЖйдйвйдуаЛь-'
ного развития> эародышй потребляют фосфатиды- интёйёйВйёе, .чем жиры
и белки. ’ уцчятл- / ж „л
После вылуплейия- до десятидневного возраста -у щыпля^ ^содержание
фосфатидов* увеличивается, а затем снижается.- t; н
ПриМёнёниё в исследованиях радиоактйвнЪгб фбсфатй лтбзёолНло ‘белее
Глубоко йьыснить соотношение между фосфатидами яичного Желтка* й’фос-'
фатйдаМй ’рйзвйвйкяЦегося -куриного* заредвийа:' ©iibiW*Ставились таким
образом/1 ’йгсЯ* й яйца до инкубаций" ввоДЙлёя раствор фосфата, ’меченного
Р32, а затем на различных стадиях инкубации определяли радиоактивность
фосфМтйДбё-Желтка й фосфатидов эмбрйбна.’ Оказалось, Что при инкубации
яиц фбсфатВДЬГШёЛтка не приобреталйфадиоактивнбстй, фбсфатиды же за-'
рбдьнйей rfa-всех стадиях развитий пЪказырали высокую радиоактивность.
Отсюда м^жй^^^йклтОД^в^ч'То^фбеф^тиДьГжелЛ'^ подвергаются расщеп--
в развивающихся тканях эмбриона
синтезируются фосфатиды.
Потребление фосфатидов при эмбриогенезе происходит у человека и у
млекопитающих животных. Плодом по мере развития потребляются фосфа-
тиды, доставляемые ему с кровью матери. Содержание фосфатидов в крови
пупочных артерий оказывается в течение всего периода эмбриогенеза выше,
чем в крови пупочных вен. Более детальные исследования показали, что
фосфатиды, доставляемые к плоду с,крбвью матери, подвергаются там рас-
паду, а из продуктов распада синтезируются фосфатиды тканей плода.
Фосфатиды в тканях подвергаются постоянному обновлению, т. е.
находятся в динамическом состоянии, (Подробнее о динамическом состоянии
фосфатидов см. на стр. 487.) Здесь же укажем, что жирные кислоты, входя-
щие в состав фосфатидов подвергаются без предварительного отщепления
реакциям Дегидрогенизаций. Об*'этом Свидетельствуют следующие факты.
В составе фосфатидов органов обычно встречаются высокомолекулярные
ненасыщенные жирнее жйсЛоть/. Степень ненасыщенности их, 6 которой
можно судить п с? величине йб дно го Числа, оказывается* нёпостдяйной. Так/
например, йодное число жирйых1 кислот фбефатйдов печени*сбб*ак при голо-
дании выше., чем-при кормлений обычной для них й'ищей. При” кормлении
собдк пищей/ боГатой Жир'аМи о высоким -йодным числом; фосфатиды ’ п'ё-
ченй содержат жирнее жислбты ’ также с высоким йодньгм'числбм? Через
еутки^ после кормления подобной .пищейг’ величина йоднбгофйсла жирных'
кислот фосфатидов печени снижается и доходит до обычного'уровня; Все
эти факты говорят о том, что жирные кислоты в составе фосфатидов подвер-
гаются химическим изменениям.
Объем этих изменений мй"‘ физиологическое*' их значение остаются еще
невыясненными.
ФЕРМЕНТЫ, УЧАСТВУЮЩИЕ В ПРЕВРАЩЕНИЯХ
»ФОСФАТИДОВ f „ , . < — ~ В
В превращениях фрсфатидов^ в их. расрадег и..синтезе, участвует, .ряд
ферментов.. Исходя, из то гр,,.что фосфатиды отличаются/друг от друга по
составу своих компонентов, следует полагадь, чдов, превращения^ их уча-
ствуют различные" „специфические для, них,-ферменты., Наиболее . изурецы,
ферменты, активирующие ра,спад. холинфосфатцдрв (ледитицрв) д ^ацола-
минфосфатидов (кефалинов). ’ ”л4 **
Гидролиз фосфатидов - осуществляется с'пёмбщьюГ^рЯда ферментов:
лецитиназа А, катализирует отщепление от молекулы лецитина (кефалина)
одного остатка жирной кислоты. Образующийся прй<это]ц продукт носит
название лизоледитина (ЛиЗбкефалЙна). ~ Лецитиназа А обнаружена в зме-
ином яде, а также в тканях животных.
. **
335
Лизолецитин относится к числу гемолизинов, т. е. веществ, вызываю-
щих разрушение эритроцитов (гемолиз). Накопление л изолецитина в орга-
низме не происходит, так как на него действует второй фермент — леци-
тиназа В, катализирующий отщепление от него второго остатка жирной
кислоты. Лецитиназа В находится в составе различных тканей животных.
Лецитиназы А и В являются эстеразами. В расщеплении фосфатидов уча-
ствуют также фосфатазы, под влиянием которых расщепляются фосфсрно-
эфирные связи. При отщеплении от молекулы лецитина (кефалина) азоти-
стого компонента (холина или этаноламина) образуется фосфатидная кисло-
та, или же глицеринфосфорная кислота, если предварительно с помещыо
лецитиназ были отщеплены два остатка жирных кислот.
Под действием фосфатазы от молекулы лецитина может отщепиться
холинфосфорная кислота, а от кефалина — этаноламинофосфорная кислота.
Глицеринфосфорная, холинфосфорная и этаноламинфосфорная кислоты
распадаются на составные части также с помощью фосфатаз.
Гидролитический распад лецитина можно представить схематически!
СН2—О-4-ОСЯ
I
СН—О
I
сн2—о
4-ос/?
-ЖГ
| \,н
4----- ОН
О—СН2 • СН, • N = (СН3)8
Прерывистые линии в формуле указывают на места разрыва связей
при гидролизе.
Современная биохимия располагает рядом фактов, выявляющих путь
синтеза фосфатидов в тканях организма. Синтез фосфатидов осуществляется
с помощью ряда ферментов. В случае синтеза глицеринсодержащих фос-
фатидов отдельные компоненты, входящие в состав их молекулы, соеди-
няются между собой следующим образом. Глицерин подвергается фосфори-
лированию с помощью фосфоферазы, катализирующей перенесение на него
фосфатного остатка от аденозинтрифосфорной кислоты с образованием гли-
церинфосфорной кислоты.
СН2ОН СН2ОН
I I
СНОН+АТФ -> СНОН .ОН+АДФ.
• । /п
СН2ОН СН2О.Р=О
Х)Н
Более сложным путем происходит присоединение к глицеринфосфорной
кислоте остатков жирных кислот. Высокомолекулярные жирные кислоты,
появляющиеся в организме при гидролизе жиров, а также синтезированные
заново, не способны непосредственно реагировать со спиртовыми группами
глицерина. Эту способность они приобретают в результате активирования
своих карбоксильных групп с помощью кофермента ацилирования и АТФ.
Происходит это в результате следующих реакций:
KoASH+АТФ KoAS* Н3Р2Ов4-адениловая кислота
zO у0
R-C<^ +KoAS.H8P8Oe^^C~SKoA+H4P2O7.
NOH
336
Из приведенных уравнений видно, что к карбоксилу жирных кислот
присоединяется остаток молекулы кофермента ацилирования. В случае»
например, стеариновой кислоты образуется СН3(СН2)16С—SKoA. Глице-
ринфосфорная кислота с участием фермента реагирует с двумя молекула-
ми активированной жирной кислоты с образованием фосфатидной кислоты.
СН2ОН
1 /°
СНОН ,ОН+2СН8(СН2)И С-SKoA
СН2-О-Р==О
х>н
СН2—О—ОС(СН2)1вСН,
CHO-OC(CH2)leCHa +2KOASH.
.ОН
6н2о-р=о
Х)Н
Дистеарилфосфатидная кислота
Биосинтез дистеарилфосфатидной кислоты был осуществлен путем ин-
кубирования водного экстракта печени (в экстракте содержались необходи-
мые ферменты) с добавленными к нему стеариновой кислотой, АТФ и KoASH.
Сложнее происходит процесс присоединения к фосфатидной кислоте
холина. В этом процессе участвует цитидилтрифосфорная кислота (ЦТФ)
и аденозинтрифосфорная кислота.
Холин с помощью фосфоферазы фосфорилируется при перенесении на
него фосфатного остатка от АТФ.
он
^/СН2«СН2ОН
N=(CH3)8
(I)
он
Образующийся фосфохолин реагирует с цитидилтрифосфорной кисло-
той с выделением цитидилдифосфохолина (ЦДФ) и пирофосфата:
ЦТФ+фосфохолин —ЩДФ-холин + Н4Р2О7 (II)
Цитидилдифосфохолин может реагировать или с фосфатидной кислотой
или же с диглицеридом. В первом случае образуется цитидилдифосфорная
кислота и лецитин, во втором случае — цитидилмонофосфорная кислота
(ЦМФ) и лецитин:
ЦДФ-холин 4- фосфатидная кислота —ДДДФ 4- лецитин (III)
ЦДФ-холин 4- диглицерид -^ЦМФ 4- лецитин (IV)
Экспериментально наиболее доказана реакция (IV), т. е. перенесение
фосфохолина на диглицерид. В более расшифрованном виде реакцию (IV)
можно представить таким образом (см. стр. 338).
Приведенные выше реакции катализируются соответствующими фер-
ментами, обнаруженными в ткани печени.
Установлено, что подобным же путем образуются этаноламинсо-
держащие фосфатиды (кефалины). В этом случае вместо холина в реак-
циях участвует этаноламин (H2N-CH2-CH2OH).
ЦДФ-холин и ЦДФ-этаноламин выделены из печени млекопитающих,
птиц и из дрожжей. В печени несущихся кур эти соединения содержатся
в значительно больших количествах, чем в печени кур ненесущихся. Это
находится в соответствии с выводом о том, что синтез фосфатидов желтков
яиц происходит в печени.
337
СН2О-О-С(СН2)!6СН3
+ СНО-О-С(СН2)16СН3 —
СН2ОН
СН2О-О-С(СН2)16СН3 "
4- СНО-О-.С(СН2)16.СН3 г.г .
СН2О-Р=О . -.^-д^ОН „
4O-CH<,.CH2-N=(CHJ4
ЩИ ТИН w ..' * * L
Следует полагать; что приведеннь1ё‘фёрмейтати№ыереаВДй^гЖляк)тся
общими для биосинтеза всех -фосфатидов,* т.^е^фосфатадсй/ТОШ^а^щиЙе^
друг от другагпр входящим,в их_состав азотдртыод,компонентам и спиртам.
Еще до выяснения пути синтеза фосфат вдов в тканях организма было уста-
новлено,, что-осуществление его, вгерезахтткадей требуёт^'кроме: Федёств,
входящих в их состав, еще, 0пределедныхуслювдй^а.щ]^ешюлп.рИ£утетвия
кислорода и соединений,_под^ргающихся£ окислешпо,л например ягексоз**
В свете современных данных, легко понять, почему именно, синтез фосфат
тидов зависит от аэробных^реакций окисления гексоз,., или иных веществ.
Из приведённых уравтенйисийтёз^фоёфатаДЬв^ы ЪиДелй, что в нем
участвует аденозинтрифорфорнаяу кдслота^- фдефорилирцванде ?глицерина
и холина, активирование высокомолекулярных жирных кислот происходят
с использованием энергии-ма^ро^рТйЧёски^ ’ёвявёй АТФ. Эти свяйй, как
известно, -возникают^ главным образ ом,* в-^результате аэробны# процессов,’*
приводящих к фосфорилфованйю аденоЗ^нДйфосфорной ‘кислоты (стрг 265);
Холин, -возййКййщййтйжпрйфаёйаде^осфатиДов/т^к и пу^ём'синте-
за из серина и метионина, в нейотФрЪй ёйоей Части подвергается ацЬтилй^
рованию с'ОбразОВй’нйёМацетилхолина, играющего важную р‘бл£ в Передаче
нервных жпульсов (стр593). < ; '* ’ ъ
В растениях встречается прЪдуй^ близкий к холину, — бетайн. '
_ •£ Т | IrF4!1'. ' т
’ (CH^sN+^CHoCi^O-OCCtts; (CH3j3N+.tH2CdO-.*
Г,?*. jryry-*-' • *• ’ u ** r ' "
X i .CIXu-i;. Бетаин
338
ОБМЕН СТЕРИНОВ (ХОЛЕСТЕРИНА)
Стерины, и особенно холестерин, играют важную роль в организме
человека и животных. Из холестерина образуются биологически активные
вещества — гормоны коры надпочечников (кортикальные гормоны), поло-
вые гормоны, желчные кислоты.
Вещество, близкое к холестерину , дегидрохолестерин, является прови-
тамином D3.
Различные стерины, встречающиеся в составе пищи человека и высших
животных, всасываются кишечником в разной степени. Из стеринов живот-
ного происхождения легко всасывается холестерин, но практически не вса-
сываются близкие к нему продукты — холестенон и копростерин. Из сте-
ринов растительного происхождения всасывается лишь эргостерин. При
всасывании в слизистой оболочке тонких кишок значительная часть холе-
стерина связывается жирной кислотой, преимущественно пальмитиновой с
образованием сложного эфира. В плазме крови содержатся эфиры холесте-
рина и жирных кислот и свободный холестерин, причем количество холесте-
рина, входящего в состав эфиров, в два раза выше количества свободного
холестерина.
Холестерин выделяется, главным образом, с желчью, а также поступает
непосредственно в толстые кишки, проходя через их стенки. Следовательно,
органами выделения холестерина являются печень и стенки толстых кишок.
В кале, однако, обнаруживается не холестерин, а близкий к нему продукт —•
копростерин (греч. kopros — кал.). Копростерин — продукт гидрогениза-
ции холестерина, т. е. насыщенный высокомолекулярный циклический
спирт.
Гидрогенизация холестерина в кишечнике происходит под влиянием
кишечной микрофлоры.
Биосинтез холестерина
Холестерин синтезируется у человека и животных, и поэтому они не
зависят от наличия его в пище. Только некоторые низшие животные (ли-
чинки насекомых) нуждаются в присутствии холестерина в пище.
Возможность синтеза холестерина в животном организме уже давно
установлена исследованиями, показавшими, что при ограничении содер-
жания холестерина в пище содержание его в желчи и в органах остается
на обычном уровне. Однако вопрос о том, из каких веществ синтезирует-
ся в организме холестерин, оставался невыясненным до применения в
биохимии метода меченых атомов. С помощью этого метода прежде все-
го было показано, что при синтезе холестерина используется в известной
мере водород воды. При введении животным тяжелой воды (D2O) в хо-
лестерине тканей появляется дейтерий. Далее было установлено, что для
синтеза холестерина используется уксусная кислота. Опыты с введением
в организм уксусной кислоты, меченной радиоактивным углеродом в кар-
боксиле и в метильной группе, показали, что оба атома углерода ее мо-
лекулы используются при синтезе холестерина.
Синтез холестерина с использованием уксусной кислоты происходит
не только в организме (in vivo), но и в срезах печени и в ее экст-
рактах.
В опытах in vitro было установлено, что уксусная кислота более ин-
тенсивно используется для синтеза холестерина, чем для синтеза жирных
кислот.
Для синтеза холестерина используется не только уксусная кислота, а
также и ацетоуксусная кислота, возникающая как продукт конденсации
уксусной кислоты, промежуточные продукты превращения лейцина,
339
p-изовалерьяновая кислота
ацилпроизводные KoA-SH).
и р-метил-,р-оксимасляная
кислота (вернее
СН3 СН3
сн3 сн3
СОН
сн2
Изовалерьяновая
кислота
C-SKoA
Сенециоилсвая
кислота
C-SKoA
р-Метил, 0-оксимасляная
кислота
р-Метил, р-оксимасляная кислота карбоксилируется с образованием
р-окси-, p-метилглутаровой кислоты. В этой реакции участвует фермент,
имеющий в качестве кофермента биотин. р-Окси, p-метилглутаровая кисло-
та восстанавливается с образованием мевалоновой кислоты.
СООН
I
сн2
I
СО2(+АТФ)НОС.СН3(+АДФ+НзРО4);
” сн2
С-SKoA
g'Метил, р-оксимасляная
кислота
р-Окси-, р-метилглутаровая
кислота
СООН
I
сн2
I +2Н2
НОС-СН,---->
I —н2о
сн2
С—SKoA
СН2ОН
СН2
>НОС-СН3
СН2
С—SKoA
Мевалоновая
кислота
р-Окси-, p-метилглутаровая кислота подвергается фосфорилированию с
образованием пирофосфатного производного. Эта реакция катализируется
специфической фосфокиназой.
Мевалоновая кислота является промежуточным продуктом, возникаю-
щим при синтезе холестерина.
Эта кислота подвергается фосфорилированию с образованием пиро-
фосфатного производного. Эта реакция катализируется специфической фос-
фокиназой.
СН2ОН
I
сн2
I
НОССН3-|-2АТФ
I
СН2
I
СООН
сн2—о
I
сн2
I
>носсн3
I
сн2
I
СООН
Мевалоновая кислота Пирофосфат мевалоновой кислоты
340
Отщепление СО2 от пирофосфата мевалоновой кислоты приводит к
разеванию изопентилпирофосфорной кислоты:
об-
он
СН2—о—Р=О он
I \ /
сн2 хо—р4^о
ссн3 \он
|| +(АДФ+Н3РО4)
сн2
НОССНз
L —СО2 (-(-АТФ)
СН2
I -Н2О
СООН
Изопентилпирофосфорная кислота
Изопентилпирофосфорная кислота в результате конденсации трех ее
молекул превращается в фарнезин, из двух молекул которого возникает
сквален:
СН3 СН3
I I
СН3—С=СН—СН2—СН2—С=СН—СНо—С=СН—СНо—СН2ОН—>
СН3
Фарнезин
>сн3—с=сн—сн2—(сн2—с=сн—сн2)4—сн2—с=сн—сн3
I I I
сн3 сн3 сн3
Сквален
Сквален (С30) впервые выделен в 1916 г. из жира печени акулы. По
химической природе это дегидротритерпен. Из всех приведенных проме-
жуточных продуктов он стоит ближе всего к холестерину.
СН3
I
Молекула сквалена построена из шести изопреновых единиц —СН2—С=
=СН—СН2—. Сквален на своем пути превращения в холестерин подвер-
гается циклизации с образованием ланостерина. Последний через ряд про-
межуточных продуктов дает начало образованию холестерина.
Ниже приводятся схематические формулы сквалена, ланостерина и
холестерина.
НО Холестерин
341
Распад холестерина
Особый интерес представляет вопрос о разрушении холестерина в орга-
низме. Как уже отмечалось выше, у животных легко осуществляется синтез
холестерина. Между тем распад холестерина (его циклического компонента)
весьма ограничен. Имеется основание полагать, что основная масса холесте-
рина распадается в организме с образованием желчных кислот. В этом
случае количество углерода в боковой цепи холестерина уменьшается на
пять атомов, циклический же компонент молекулы — фенантренциклопен-
тан остается без изменения.
Когда холестерин является материалом для образования стероидных
гормонов, укорочение боковой цепи его молекулы происходит более ин-
тенсивно, но и здесь циклический компонент не подвергается разрушению.
Применение метода меченых атомов подтвердило представление об
устойчивости в организме циклического компонента холестерина. Иссле-
дования проводились с синтетическим холестерином, в молекуле которого
в одном случае содержался радиоактивный углерод в положении 26 (т. е.
с края боковой цепи), а в другом случае — в положении 4 (т. е. в первом
кольце фенантренциклопентана).
При введении в организм холестерина, меченного радиоактивным угле-
родом в положении 26, около 20% имевшегося в холестерине радиоактив-
ного углерода выделялось в течение 24 часов в виде углекислого газа с вы-
дыхаемым воздухом. При введении же холестерина, меченного радиоактив-
ным углеродом в положении 4, в выдыхаемом воздухе углекислый газ, ме-
ченный радиоактивным углеродом, не обнаруживался в течение 24 и даже
84 часов. Эти данные указывают на исключительную устойчивость в ор-
ганизме циклического компонента холестерина.
Для выяснения вопроса, в каких именно органах наиболее интенсивно
происходит разрушение молекулы холестерина, проводились исследования
по изучению окислительного распада меченного радиоактивным углеродом
холестерина в опытах in vitro. Из организма после введения холестерина,
в одних случаях меченного радиоактивным углеродом в положении 26,
а в других случаях — в положении 4, изолировались органы, в которых
после измельчения изучалось образование и выделение углекислого газа.
Изучалось образование меченных радиоактивным углеродом молекул СО2.
Результаты этих исследований показали, что при дыхании исследованных
органов в опытах с введением в организм холестерина, меченного в положе-
нии 4, выделившийся углекислый газ не содержал радиоактивного углерода.
В опытах же с введением холестерина, меченного в положении 26, при
дыхании органов выделялся углекислый газ, содержащий радиоактивный
атом углерода. Результаты этих исследований находятся в полном соответ-
ствии с результатами исследований по изучению выделения меченных радио-
активным углеродом молекул углекислого газа из организма после введения
в него меченного радиоактивным углеродом холестерина. Как в исследо-
ваниях in vivo, так и в исследованиях in vitro циклический компонент холе-
стерина оказался устойчивым. Опыты in vitro показали, что укорочение бо-
ковой цепи холестерина наиболее интенсивно происходит в печени, т. е. в
органе, где образуются желчные кислоты. Чрезвычайно медленно укорачи-
вается боковая цепь холестерина в головном мозге, хотя ткани его очень
богаты холестерином.
ЖЕЛЧНЫЕ КИСЛОТЫ
К числу желчных кислот относятся холевая, дезоксихолевая и литохо-
левая кислоты, входящие в состав желчи высших животных, соединяясь
с глицином таурином. Все перечисленные кислоты имеют в своих молекулах
в виде циклического компонента фенантренциклопентан и являются про-
изводными холестерина.
342
сн3 сн2 ОН ^СИ[ сн2 PJ3 1 н| СООН и X х / X Гц - сн4 _ / но^^ХХ / чон •• у . 1'Г1 Холевая кислота сн3 /х/х н , сн; ОН . сн« --и . . /\ /X C00R * s 1 СН3 ‘ //'Хч /НЧ н /X / X / Н(У X/ Дезоксихолевая кислота сн3 СН3 --Н 'Ч СООН н
i >
Н
Литохрлевая кислота
Из'желчных кислот наиболее распространена
диняясь с глицином, она образует гликохолевую
тауринбМ — таурохолевую кислоту
холевая
кислоту,
1
кислота. Сое-
соединяясь \
СН3 СН2
CH3 CH3
СН СН2
I I
- со—nhch2cooh
Боковая цеяь гликохолевой кислоты
Дезоксихолевая и литохолевая
СН
Боковая
СН2
I
со—nhch2ch2so3h
цепь таурохолевой'-кислоты '
кислоты соединяются с глицином и-с
таурином, превращаясь в соответствующие глико- и таурокислоты. Во всех
случаях холевые кислоты соединяются с глицином или с таурином кислото-
амидной связью (—СО—NH —). Кроме приведенных желчных кислот, в
желчи обнаружены еще и другие близкие к ним кислоты.
Опыты с применением меченного дейтерием холестерина показали,
что предшественником желчных кислот является холестерин; При. введе-
нии в организм крыс меченного дейтерием холестерина из их желчи была
выделена холевая кислота, меченная дейтерием.
Соли желчных кислот действуют как эмульгаторы жиров и играют важ-
ную роль в переваривании и всасывании жиров (стр. 318).
РЕГУЛЯЦИЯ ОБМЕНА ЖИРОВ
Обмен жиров, как и обмен других веществ, находится под регулирую-
щим влиянием нервной системы. Регулирующая роль нервной системы осу-
ществляется различными путями: 1) непосредственным влиянием импульсов,
направляющихся от центральной нервной системы к жировым тканям и сти-
343
мулирующих мобилизацию отложенных в них жиров и вовлечение их в об-
щую циркуляцию и доставку кровью к местам потребления, главным обра-
зом к печени, 2) влиянием импульсов, идущих по нервам к различным желе-
зам внутренней секреции. Гормоны, образующиеся в некоторых железах
внутренней секрекции (гипофиз, корковый слой надпочечников, половые
железы, щитовидная железа), приносятся кровью к различным тканям и
органам и там оказывают свое влияние на обмен веществ, включая и жиры.
Немаловажное значение в регуляции обмена жиров принадлежит фак-
торам внешней среды — веществам, поступающим в организм с пищей.
Общеизвестен факт обильного отложения жира, ожирения организма,
при избыточном потреблении пищи, особенно пищи, богатой жирами и угле-
водами. Наличие в пище фосфатидов или веществ, входящих в их состав
(холина, инозитола), а также метионина, метильные группы которого ис-
пользуются для синтеза холина, создают условия для нормального потреб-
ления жиров в печени, предохраняет от накопления в ней жиров, от обра-
зования «жировой печени».
Большое значение в обмене жиров имеет процесс отложения запасного
жира в жировой ткани и его мобилизация. Нарушение этого процесса часто
приводит к ожирению организма, к накоплению жира в жировой ткани,
вокруг скелетных мышц, сердца и т. д. Отложение жира в жировой ткани
является физиологически активным процессом. В жировой ткани обнару-
жены различные ферменты, катализирующие превращение углеводов и
других веществ. При введении в организм промежуточных продуктов обме-
на веществ, меченных радиоактивным углеродом (например, радиоактивной
уксусной кислоты), в жировой ткани обнаруживаются радиоактивные жиры.
Жировая ткань иннервируется, следовательно, в нее поступают им-
пульсы, направляющиеся от нервных центров. Повреждением гипоталами-
ческой области мозга можно вызвать у животных ожирение.
Как уже указывалось, в регуляции жирового обмена участвуют железы
внутренней секреции. Удаление половых желез (кастрация) вызывает у
животных избыточное отложение запасного жира. Этот прием получил при-
менение в зоотехнической практике при откорме животных на жир. Рас-
стройство функции гипофиза в одних случаях приводит к значительному
отложению жира в организме человека (гипофизарное ожирение), в других —
к исчезновению запасного жира и истощению организма (кахексия). Ги-
перфункция щитовидной железы сопровождается похудением, исчезновением
запасного жира организма. Удаление поджелудочной железы вызывает
обогащение печени жиром. В этой железе обнаружено вещество, введение
которого^ организм усиливает превращение жиров в печени и, следователь-
но, устраняет явление «жировой печени». Оно получило название «липокаи-
ческое вещество».
ЛИТЕРАТУРА
Г у л ы й М. Ф. Биохимия обмена жиров. Изд. АН Украинский ССР, 1961.
Л е й т е с С. М. Липотропные и липогенные пищевые факторы. «Успехи совре-
менной биологии», 1948, т. 22, стр 231.
Л е й т е с С. М. Обмен веществ в жировой ткани и его регуляция. «Успехи
современной биологии», 1952, т. 34, стр. 8.
Прохорова М. И. и Туманова С. Ю. Биосинтез холестерина в живот-
ном организме. «Успехи современной биологии», 1963, т. 55, стр. 355.
Фердман Д. Л. Новые данные о фосфатидах «Украинский биохимический
журнал» 1946, т. 18, стр. 123.
Фердман Д. Л. Данные о внутриклеточном обмене жиров. «Украинский
биохимический журнал», 1947, тэ 19, стр 102.,
Глава семнадцатая
ОБМЕН БЕЛКОВ
Обмен белков в организме — их распад и синтез — представляет осо-
бенно большой интерес. В тканях происходит непрекращающийся синтез
и распад белков клеток. В результате распада белков возникают аминокис-
лоты, претерпевающие затем дальнейшие превращения. Для синтеза белков
необходимы аминокислоты, источником которых являются белки пищи.
Человек и животные нуждаются в постоянном поступлении аминокислот
извне с белками пищи, так как не все аминокислоты могут возникать у них
из других веществ. При недостатке аминокислот распад белков в клетках
не компенсируется их синтезом. Наступает белковое голодание, приводящее
неминуемо к гибели организма.
Белки поступают в организм с пищевыми продуктами. Одни из них
богаты белками (мясо, рыба, творог, сыр, яйца, горох, фасоль, соя), другие
(овощи, фрукты) содержат белки в незначительных количествах. Среднее
место по содержанию белков занимают хлеб и мучные продукты.
Представление о содержании белков в продуктах питания дает приво-
димая ниже таблица.
Содержание воды, белков, жиров и углеводов в некоторых пищевых
продуктах (%)
Продукт
Вода
Белки
Жиры,
липиды
Угле-
воды
Говядина ср. жирности............
Яйцо куриное.............................
Карп ..................................
Лещ....................................
Икра зернистая.........................
Творог.................................
Сыр тощий.......................... .
Хлеб пшеничный белый ,............. . . .
Хлеб ржаной .... .................
Г орох ..................................
Картофель................................
Капуста..................................
Яблоки ..................................
Груши....................................
72,5 20,6 5,4 —
73,7 12,6 12,1 —-
77,3 20,4 1,5
78,7 16,2 4,1
53,2 26.0 16,3 —
80,6 14,6 0,6 1,2
43,1 35,6 12,5 4,2
34,7 10,7 0,3 52,4
43,6 7.8 0,7 43,7
11,3 25,8 3,8 53,0
76,1 2,1 0,2 19,6
90,1 1.8 0,2 5,0
84,4 0,4 12,1
83.8 0,35 — 9.2
ПЕРЕВАРИВАНИЕ БЕЛКОВ
Переваривание белков, ферментативный гидролиз их с образованием
полипептидов, а затем аминокислот, происходит в желудке и в тонких киш-
ках. В секрете слюнных желез, в слюне, отсутствуют протеолитические
ферменты, и поэтому белки в ротовой полости не перевариваются. В же-
лудке на измельченную в ротовой полости пищу воздействует желудочный
345
сок и имеющиеся в ней белковые вещества подвергаются начальным изме-
нениям.
Для понимания значения переваривания белков в желудке необходимо
познакомиться с составом желудочного сока и с процессом его выделе-
ния.
СОСТАВ ЖЕЛУДОЧНОГО СОКА
Детальное изучение химического состава желудочного сока стало воз-
можным после выдающихся работ И. П. Павлова и его учеников в области
процессов пищеварения.
Разработанная ими операция фистулы желудка и эзофаготомии дала возмож-
ность получать чистый, не загрязненный примесями пищи и слюны желудочный сок..
Операция гастрогэзофаготрмии позволяет ставить опыты с мнимым кормлением, когда
пища, измельченная в ротовой полости, не попадает в желудок, а выбрасывается из
пищевода наружу, так как пищевод перерезается и перерезанные концы его вп/иваются
в кожу. Получается отверстие, через которое измельченная в ротовой полости пища
по мере прохождения по пищеводу вываливается наружу, не попадая в желудок.
При мнимо^ кормлении выделяется желудочный сок, свободный от остатков пищи
и слюны, который собирается через фистулу желудка.
Желудочный сок — сложная по составу физиологическая жидкость,
состоящая из различных неорганических и органических веществ, среди
которых?особое место занимают соляная кислота и белки-ферменты/Желу-
дочный сок здоровых людей и животных — очень кислая жидкость, содер-
жащая около 0,5*% соляной кислоты. Все составные части желудочного сока
сильно разведены водой. Вода в желудочном соке составляет до 99,2%.
Ниже приводятся данные химического состава чистого желудочного сока.
Химический состав желудочного сока человека
Г ‘ 4 ? Ч
Суточное количество........................... 2 литра*
Удельный вес ................................. 1,006—1,009
pH ........................................... f,5—2,0
Вода.......................................... 99,0—99,2%
СуХби остаток . . ,‘7Т. ............... ЛГ,8—1,0%
Органические вещества......................... 0,4—0,5%
Хлориды (соляная кислота и ее соли)........... 0,5—0,65%
Соляная кислота:
___общая........................ . .......... 0,45—0,6%
свободная .................................... 0,4—0,5%
Общий азот ................................... 50—75 мг %
Белок................................................ 0,4%-' *
Азот аминокислот ............................. 3—10 мг%
Азот мочевины................................. 5—7 мг %
Мочевая кислота............................... 1—5 мг %
Аммиак . ;.................................... 2—8 мг-<%
Желудочный сок выделяется железами, находящимися в слизистой оболочке
желудка: фундальными (дна), пилорическими (привратника) и кардиальными (входной
части желудка). Эти железы отличаются друг от друга по гистологическому строению
и по химическому составу их секретов. В фундальных железах различают три рода
клеток: обкладочные, добавочные и главные.
Обкладочные клетки выделяют соляную кислоту, добавочные — секрет, содер-
жащий мукоид, и главные — пепсиноген.
Пилорические железы не содержат обкладочных клеток, и в их секрет не входит
соляная кислота, больше того, он имеет даже слабощелочную реакцию. Эти железы не
имеют существенного значения в формировании желудочного сока, так как количе-
ство их сравнительно невелико (10% общего количества желез). Кардиальных же-
лез еще меньше, чем пилорических.
В кардиальных железах содержатся преимущественно главные клетки и иногда
обкладочные клетки, соответственно секрет этих желез состоит преимущественно из
пепсиногена-. «
Изучению образованйя и выделения соляной кислоты обкладочными
клетками желез слизистой оболочки желудка посвящено много йсследо-
ваний?* Установлено;* что материалом для образования соляной КисЛбты
346
является хлористый натрий, доставляемый к железам кровью. При кормле-
нии животных пищей, бедной хлористым натрием, уменьшается количе-
ство соляной кислоты в желудочном соке. При замене в пище хлористого
натрия бромистым натрием или йодистым натрием в желудочном соке умень-
шается содержание ёоляной кислоты и вместо нее появляется бромистово-
дородная или йодистоводородная кислота. Следует, однако, указать, что
как происходит замена в галоидных солях металла на водород, остается еще
далеко не изученным. Наличие в слизистой оболочке желудка весьма ак-
тивной карбоангидразы говорит о том, что с образованием соляной кислоты
связан процесс разложения углекислоты (бикарбоната). Наиболее вероят-
но допущение, что ионы водорода, необходимые для образования соляной
кислоты, получаются в результате реакции: СО2+Н2О->Н++НСО3. Энер-
гия, необходимая для перенесения водородных ионов против градиента
концентрации жидкостей организма в желудочный сок, по всей вероятно-
сти, доставляется макроэргическими связями аденозинтрифосфорной кис-
лоты.
Наиболее важными ферментами желудочного сока являются пепсин
и химозин.
Некоторое значение имеет также липаза желудочного сока, катали-
зирующая расщепление эмульгированного жира (стр. 318).
Желудочный сок обладает бактерицидным действием. Большое коли-
чество бактерий, попадающих с пищей в желудок, подвергаются разруше-
нию под влиянием желудочного сока. С этой точки зрения, желудочный сок
является как бы барьером, препятствующим проникновению бактерий в
кишечник.
Только та часть микроорганизмов, которая проходит через этот
барьер, может дальше размножаться в кишечнике и участвовать в создании
кишечной микрофлоры, играющей важную физиологическую роль, особенно
у жвачных животных.
СЕКРЕЦИЯ ЖЕЛУДОЧНОГО СОКА
Для изучения секреции желудочного сока и влияния на нее различных факторов
И. П. Павловым была разработана операция изолирования «малого желудка». Сущ-
ность этой операции заключается в следующем. Оперативным путем изолируется с
сохранением иннервации и кровеносных сосудов некоторая, примерно 1/10 часть же-
лудка в виде «малого желудка». На эту изолированную часть желудка накладывают
фистулу. Оставшаяся большая часть желудка («большой желудок») продолжает функ-
ционировать. Через пищевод в нее поступает измельченная в ротовой полости пища.
Там она подвергается воздействию желудочного сока, а затем поступает в двенадцати-
перстную кишку. Пища, поступающая в «большой желудок», вызывает секрецию же-
лудочного сока всей слизистой желудка, исключая ту ее часть, которая заключена в
«малом желудочке».
С помощью фистулы собирают сок из «малого желудочка» и по его количеству и
химическому составу судят о влиянии рода пищи, ее количества и иных факторов на
секрецию желудочного сока.
Исследования И. П. Павлова и его учеников показали, что железы
слизистой оболочки желудка действуют не непрерывно, а под влиянием
особых раздражителей. При отсутствии их содержимое желудка благодаря
присутствию слизи имеет слабо щелочную реакцию. Работа желез слизистой
оболочки желудка, т. е. образование и выделение сока, вызывается раздра-
жителями, связанными с актом приема пищи (раздражение рецепторов по-
лости рта и рецепторов, возбуждаемых условными раздражителями — видом
пищи, ее запахом и др.). Опыты на собаках с мнимым кормлением (эзофаго-
томированных собаках) показывают, что акт еды, независимо от поступле-
ния пищи в желудок, вызывает секрецию железистой оболочки желудка.
Эти опыты также показывают, что секреция желудочного сока начинается
спустя 5—6 минут после дачи еды (латентный период). То же имеет место
при обычном съедании пищи. Начавшееся после этого срока сокоотделение
347
быстро усиливается и достигает максимума через 15—30 минут и прекращает-
ся через 6—10 часов. Оказалось, что каждому виду пищи соответствует свой
ход сокоотделения и свой латентный период. Мясо вызывает выделение
большего количества сока, чем хлеб, хлеб — большего, чем молоко и т. д.
Интересно, что состав сока, его кислотность и способность переваривать
белки также зависят от сорта пищи, от пищевого раздражителя. Количе-
ство сока, отделяющееся на весь период секреции, при одном и том же сор-
те пищи прямо пропорционально количеству съеденной пищи.
Приведенные данные интересны в том отношении, что они устанавли-
вают связь между факторами внешней среды (состав пищи) и образованием
и составом секрета желез слизистой оболочки желудка.
На интенсивность сокоотделения влияют, кроме механического раздра-
жения, также химические вещества, входящие в состав того или иного пище-
вого продукта, и вещества, образующиеся при переваривании пищи. Эти
вещества поступают в кровь и действуют на нервный аппарат желез слизи-
стой оболочки желудка. Сокоотделение под влиянием химических агентов
И. П. Павлов назвал нервно-химической фазой секреции сока. Мясные и
рыбные отвары (бульон, уха) вызывают обильное сокоотделение благодаря
наличию в них азотистых экстрактивных веществ. Подобным образом вли-
яют также соки из овощей и из фруктов. Гистамин при введении его в кровь
уже в очень малых количествах (1—1,5 мг человеку) вызывает сильную
секрецию желудочного сока. Жиры (жирная пища) угнетают секрецию же-
лудочного сока.
Состав желудочного сока, содержание в нем соляной кислоты и пепсина
изменяется при нарушении функции пищеварительного тракта. Процент
соляной кислоты в желудочном соке увеличивается" при язве желудка и
гиперацидном гастрите (гипер хлор гидр ия). Часты случаи пониженного
содержания соляной кислоты в желудочном соке (гипохлоргидрия). Обычно
гипохлоргидрия сопровождается уменьшением количества пепсина в же-
лудочном соке. При тяжелых расстройствах пищеварения в желудочном
соке могут отсутствовать и соляная кислота и пепсин. Это явление носит
название ахилии. При гипохлоргидрия и ахилии больным рекомендуют при-
нимать ’ раствор соляной кислоты, препарат пепсина или желудочный
сок. Последний получают путем экстракции из слизистой оболочки желудка
свиней (искусственный желудочный сок) или же у эзофаготомированных
животных с фистулой желудка (естественный желудочный сок). Естествен-
ный желудочный сок как медицинский препарат обладает известными преи-
муществами перед искусственным желудочным соком.
ПЕРЕВАРИВАНИЕ БЕЛКОВ В ЖЕЛУДКЕ
Белки пищи подвергаются в желудке воздействию желудочного сока,
особенно его составных частей: соляной кислоты и пепсина. В главных клет-
ках желез слизистой оболочки желудка образуется пепсиноген, переходящий
под влиянием соляной кислоты в пепсин. Превращение пепсиногена в пеп-
син сопровождается отщеплением от него «ингибитора», являющегося поли-
пептидом (стр. 155). Одновременно с этим наблюдаются изменения в кон-
цевом аминокислотном остатке пепсиногена. В пепсине он представлен изо-
лейцином, в пепсиногене же — лейцином. Наряду с этим соляная кислота,
концентрация которой в желудочном соке достигает 0,5%, способствует
набуханию белков, увеличивает их объем и делает их более доступными для
действия пепсина. Это имеет особое значение для переваривания таких бел-
ков, как коллаген и эластин, трудно поддающихся воздействию протеолити-
ческих ферментов.
Благодаря наличию соляной кислоты pH желудочного сока достигает
1,5—2,0, что создает оптимальные условия для действия пепсина. Содержа-
348
ние пепсина в желудочном соке человека составляет примерно 1 мг в 1 мл.
Если принять суточную секрецию сока равной 2 л, то ежесуточно главными
клетками желез слизистой оболочки желудка будет образовываться и выде-
ляться 2 г пепсиногена. Этого количества профермента после превращения
его в активный пепсин оказывается достаточно для переваривания в течение
двух часов 100 кг яичного белка, т. е. переваривающая активность желудоч-
ного сока весьма велика.
При действии пепсина происходит разрыв внутренних пептидных свя-
зей белковой молекулы. Об этом свидетельствует тот факт, что среди про-
дуктов переваривания белков пепсином обнаруживается много полипепти-
дов, построенных из 4—8 аминокислотных остатков. Наряду с ними обра-
зуются также полипептиды с более высоким молекулярным весом и неболь-
шое количество аминокислот.
При воздействии пепсина на белок происходит разрыв (гидролиз)
пептидной связи между аминогруппой ароматической аминокислоты и кар-
боксильной группой моноаминодикарбоновой кислоты (аспарагиновой, глю-
таминовой). Действует пепсин также и на некоторые иные пептидные связи.
Продукты расщепления белковых молекул получили название аль-
бумоз и пептонов. Ошибочно считалось, что альбумозы построены более
сложно, чем пептоны и что они, следовательно, близки по структуре к бел-
кам. В настоящее время продукты гидролиза белка все чаще называют поли-
пептидами (по аналогии с продуктами, получающимися при синтезе из ами-
нокислот и близких к ним).
После воздействия на белок пепсином получается смесь полипептидов
(пептонов), причем из каждого белка образуется характерная для него
смесь продуктов, называемая «пептоном» данного белка. Так, например,
говорят о мясном пептоне, имея в виду полипептиды, появляющиеся при
переваривании пепсином белков мяса, о яичном пептоне — смеси полипеп-
тидов, образующихся при переваривании яичного белка, и т. д. «Пептоны»
всегда содержат некоторое количество аминокислот.
Атакуемость белков пепсином, или, иными словами, интенсивность воз-
действия на различные белки пепсина, неодинакова. Одни белки легко под-
вергаются воздействию пепсина и, следовательно, легко перевариваются в
желудке, другие перевариваются медленнее, третьи совсем не поддаются
воздействию пепсина. Атакуемость белков пепсином зависит от особенностей
их химической структуры и физических свойств.
Легко подвергаются перевариванию в желудке водорастворимые белки
мышц, миозин, актин, а также яичный белок, альбумины и глобулины жи-
вотного и растительного происхождения. Медленно поддаются воздействию
пепсина белки соединительной ткани — коллаген, эластин. Совершенно не
перевариваются в желудке кератины волос и шерсти. Не расщепляются пеп-
сином сравнительно несложные по своей химической структуре и богатые
диаминомонокарбоновыми кислотами белки — протамины.
Под влиянием желудочного сока легко подвергается превращению белок
молока казеиноген. Растворимый в молоке казеиноген ферментативно пере-
ходит в нерастворимый в присутствии ионов кальция казеин. Молоко при
этом створаживается. Превращение казеиногена в казеин имеет существен-
ное значение для переваривания его в желудке, особенно у детей и молодых
млекопитающих животных, когда молоко является единственным продуктом
их питания. Створоженное молоко задерживается в желудке и подвергается
более длительному воздействию пепсина. В желудочном соке детей и моло-
дых млекопитающих, например телят, содержится фермент химозин (рен-
нин), катализирующий превращение казеиногена в казеин. Под влиянием
химозина казеиноген в незначительной степени гидролизуется и образую-
щийся при этом казеин в присутствии кальция дает нерастворимый в воде
казеинат кальция. В желудочном соке взрослых животных, как это установ-
лено И. П. Павловым, химозин отсутствует, и створаживание молока в же-
лудке у них происходит под влиянием пепсина. На первом этапе воздей-
349
ствия пепсина на казеиноген из него получается казеин, который затем под-
вергается дальнейшему гидролитическому расщеплению. Следовательно,
различие в действии химозина и пепсина на казеиноген заключается в том,
что первый, т. е. химозин, вызывает незначительный по своему объему гид-
ролиз казеиногена с образованием казеина и на этом его функция заканчи-
вается, в то время как пепсин вызывает более глубокий гидролиз казеино-
гена, оканчивающийся на первом этапе образованием из него казеина.
Створаживание молока с помощью химозина, а также пепсина широко
используется в сыроварении.
Образующиеся в желудке продукты переваривания белков — полипеп-
тиды и незначительное количество аминокислот, а также белки, не успев-
шие подвергнуться воздействию пепсина, поступают в кишечник. Прежде
чем перейти к изучению переваривания полипептидов и белков в кишеч-
нике, интересно остановиться на вопросе об устойчивости белков стенки же-
лудка к воздействию пепсина.
Действие желудочного сока на белки можно наблюдать как при пере-
варивании белков пищи в желудке, так и в опытах in vitro, когда к желудоч-
ному соку в пробирке прибавляются белки. Кусочек мяса под влиянием
прибавленного к нему желудочного сока постепенно растворяется в нем бла-
годаря расщеплению входящих в его состав белков. Химический анализ пока-
зывает, что в этом случае из белков образуются главным образом поли-
пептиды. Подобным образом действует желудочный сок на различные
белки.
Если в пробирку поместить кусочек зиолированной слизистой оболоч-
ки желудка и облить его желудочным соком, можно также наблюдать по-
степенное его растворение, сопровождающееся расщеплением белков с
образованием полипептидов. Естественно возникает вопрос, почему сли-
зистая оболочка желудка, находящаяся в постоянном контакте с желудоч-
ным соком, не разрушается в желудке. Чем объяснить ее устойчивость к
воздействию пепсина? — Устойчивость слизистой оболочки желудка к
воздействию желудочного сока объясняется рядом причин. Прежде всего
следует указать на защитную роль слизи, обволакивающей стенку же-
лудка. Мукопротеиды слизи не поддаются воздействию пепсина и, обво-
лакивая слизистую оболочку, предохраняют ее от контакта с желудочным
соком.
Во-вторых, пепсин проявляет свое действие при кислой реакции, а при
слабощелочной реакции, характерной для клеток тканей, он неактивен.
Действию пепсина в клетках слизистой оболочки желудка препятствует
циркулирующая в железах кровь, имеющая слабощелочную реакцию
(pH—7,3). Соляная кислота, в случае ее проникновения в клетки, нейтра-
лизовалась бы в известной мере буферными системами клеток и крови.
Известное значение может иметь то обстоятельство, что соляная кислота,
попадая на поверхностный слой протоплазмы клеток слизистой оболочки,
богатый липидами, подвергается в нем меньшей диссоциации, чем в воде,
что должно снизить ее кислотность. Устойчивость стенки желудка к воз-
действию пепсина желудочного сока, возможно, связана с наличием в клет-
ках антипепсина, парализующего действие пепсина. Устойчивость клеток
тканей к воздействию различных внешних факторов — сложное биологи-
ческое явление, эволюционно возникшее в результате взаимодействия кле-
ток и тканей и условий внешней среды. Очевидно большое значение имеют
нервно-трофические импульсы.
Объяснить какой-либо одной причиной устойчивость стенки желудка
по отношению к желудочному соку не представляется возможным. Изуче-
ние устойчивости слизистой оболочки желудка представляет большой не
только научный, но и практический интерес. Оно должно вскрыть причину
язвенной болезни, которая возникает у человека, когда в результате нару-
шения нормальной деятельности слизистой оболочки отдельные участки ее
подвергаются воздействию пепсина и изъязвляются.
350
ПЕРЕВАРИВАНИЕ БЕЛКОВ И ПОЛИПЕПТИДОВ1
В КИШЕЧНИКЕ 11 г *
Полипептиды, образующиеся' при переваривании беДков в' желудке,
построены из значительного количества аминокислот и1 подвергаются в ки-
шечнике дальнейшему расщепДенйю.' В’ кишечнике также перевариваются
и белкй, не подвергшиеся воздействию пепсина. В перевариваний белков и
полипептидов в кишечнике участвуют две пищеварительные жидкости:
сок поджелудочной железы и кишечный сок.
СОСТАВ СОКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
' ’ * • ' '' *
Как известно (стр. 196), поджелудочная железа обладает как секретор-
ной, так и инкреторной деятельностью. В железистой ткани,' составляющей
примерно 99% веса всей железы, образуется пищеварительный сок, посту-
пающий через выводной проток железы в двенадцатиперстную кишку.
Около одного процента железы составляет островковая ткань, в которой
образуются гормоны, направляющиеся непосредственно в кровь (инсулин,
глюкагон). Сок поджелудочной железы имеет сложный химический состав
и представляет собой слабощелочную жидкость благодаря содержанию
бикарбоната натрия.
Химический состав сока поджелудочной железы человека
СуТЙЧное количество..........‘..................... 1500—2000 мл
Удельный вес ................; .................'. 1,007—1,009
pH ......................................... ч i" 7,3—8,7
Вода , ......................„.. ............... . 98,7%
Сухой остаток...............................................1,3%
Органические вещества............................./ 0,6%
Неорганические'’вещества........................... . *0,7%
Белки . . . .г,г у . . . . г........................... >0;2%
Na .....................................................- 0.3%
К..................................................... .,0,03%
Са.................................. !.................... 0,18%
' лЧ
Сок поджелудочной железы боГат ферментами. В нем' содержатся фер-
менты, катализирующие гидролиз белков й полипептидов’(трипсин, химо-
трипсин, протаминаза, карбоксиполйпептидазы), гидролиз 'Углеводов (ами-
лаза, лактаза, мальтаза), гидролиз жиров (липаза), гидролиз’нуклеиновых
кислот (нуклеинацидаза). .
Детальное изучение секреции поджелудочной железы и состава ее
сока стало возможным после разработки И. П. Павловым’операции, позво-
ляющей получать чистый сок железы в хроническом'опыте.
Чистый сок поджелудочной железы представляет собой бесцветную
прозрачную жидкость, содержащую сравнительйо много бикарбоната нат-
рия и белков — ферментов и Незначительное количество слизи. Ферменты
сока поджелудочной железы катализйруют глубокое расщепление белков
и полипептидов с образованием низкомолекулярных полипептидов и амино-
кислот. Сок, собранный у собаки непосредственно из протока железы через
хроническую фистулу, содержит трипсин ц неактивном, состоянии, в виде
трипсиногена. В активное состояние трипсиноген переходит подгвлиянием
энтерокиназы, имеющейся в кишечном соке. Энтерокиназа, открытая в ла-
боратории И. П. Павлова Шеповальниковым, была названа ферментом
фермента (трипсиногейа). Оказалось, что для активирования трипсиногена,
т. е. превращения ёгЗ'в'трипсин, достаточно ничтожно малого количества
энтерокиназы. Активирование его происходит сразу же при соприкоснове-
нии сока поджелудочной жёлезы со стенкой двенадцатиперстной кишки,
в месте впадения протока жёлезы. Превращение трипсиногена в трипсин
351
связано с некоторыми изменениями в его химической структуре. В его
молекуле происходит разрыв связи между лизином и изолейцином, что при-
водит к отщеплению от него полипептида.
Вместе с соком поджелудочной железы в двенадцатиперстную кишку
поступает значительное количество трипсиногена, и переваривание белков
в тонких кишках может достигнуть значительных размеров. Особенно это
имеет место в случаях оперативного удаления части желудка или всего
желудка (при операциях язвы желудка, рака желудка), когда перевари-
вание белков в желудке сводится к минимуму.
Было бы, однако, неправильно недооценивать значение процесса гид-
ролиза белков в желудке под влиянием пепсина. Распад белков с образова-
нием полипептидов в желудке приводит к тому, что общее количество
молекул, расщепление которых происходит под влиянием ферментов сока
поджелудочной железы в кишечнике, значительно возрастает. Это ускоряет
дальнейшее их переваривание.
Применение метода хронической фистулы протока поджелудочной желе-
зы позволило И. П. Павлову и его ученикам изучить влияние различных
факторов на секрецию сока и на его состав. Оказалось, что в отсутствие спе-
циальных раздражителей, связанных с едой, сок поджелудочной железой
не выделяется. Обильное выделение сока начинается через две-три минуты
после начала приема пищи, затем оно на время затихает и через несколько
минут снова увеличивается. На каждый род пищи поджелудочная железа
реагирует выделением определенного количества сока. Наибольшее коли-
чество сока выделяется при приеме углеводной пищи, мясная пища вызы-
вает меньшее выделение сока и еще меньшее пища, богатая жиром. Род
пищи влияет не только на интенсивность выделения сока поджелудочной
железы, но и на активность содержащихся в нем ферментов. Так, например,
по данным И. П. Павлова, при продолжительном кормлении собаки мясом
способность сока переваривать мясо все больше возрастает, а способность
его переваривать крахмал падает. При кормлении преимущественно моло-
ком в соке усиливается активность липазы, при кормлении хлебом — ак-
тивность амилазы.
Приведенные данные показывают, что, как и в случае секреции желу-
дочного сока, фактор внешней среды — пища — влияет, как на количе-
ство выделяемого поджелудочной железой сока, так и на его состав.
Исследованиями И. П. Павлова и его школы установлено, что деятель-
ность поджелудочной железы регулируется нервной системой. Раздражение
периферического конца перерезанного блуждающего нерва, по данным
И. П. Павлова, усиливает деятельность поджелудочной железы, вызывает
выделение сока. Отделение сока после приема пищи — процесс рефлектор-
ный.
Наряду с нервным механизмом в отделении сока поджелудочной железой
важную роль играет химический, гуморальный фактор. Установлено,
что в слизистой оболочке тонких кишок образуется особое вещество —
секретин, который поступает в кровь и, доставляясь затем к поджелудочной
железе, усиливает ее деятельность (повышает секрецию воды и бикарбо-
ната). Секретин можно рассматривать как гормон, влияющий на функцию
поджелудочной железы.
ДЕЙСТВИЕ ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ
В КИШЕЧНИКЕ
В соке поджелудочной железы содержится трипсиноген, который под
влиянием энтерокиназы кишечного сока превращается в активный протео-
литический фермент — трипсин. pH-Оптимум действия трипсина равен 7,8
и соответствует pH сока поджелудочной железы и кишечного сока. В ки-
шечнике под влиянием трипсина расщепляются белки и высокомолекуляр-
352
ные полипептиды, в результате чего образуются низкомолекулярные поли-
пептиды и некоторое количество аминокислот.
Свое действие на белки и полипептиды оказывает и химотрипсин. Этот
фермент содержится в соке поджелудочной железы в неактивном состоянии
в виде химотрипсиногена. Последний превращается в химотрипсин под
влиянием трипсина.
Изучение химической структуры химотрипсиногена показало, что в
молекуле его отсутствуют концевые аминогруппы и что он, следовательно,
является циклопептидом. Под влиянием трипсина происходит разрыв
циклопептидной структуры химотрипсиногена с появлением аминогрупп.
В этом заключается процесс активирования химотрипсиногена, превращения
его в активный фермент химотрипсин.
Химотрипсин, подобно трипсину, катализирует гидролиз белков и
высокомолекулярных полипептидов. Следует, однако, отметить различие
в действии трипсина и химотрипсина на белки и полипептиды. Под влия-
нием трипсина легко происходит разрыв пептидной связи между карбок-
сильной группой аргинина или лизина и аминогруппой какой-либо амино-
кислоты. Под влиянием же химотрипсина гидролизуются пептидные связи,
образованные с участием карбоксильной группы ароматических аминокислот
(тирозина, фенилаланина).
Если на белок (казеин) воздействовать трипсином, а затем по окончании
действия трипсина к продуктам переваривания добавить химотрипсин,
переваривание возобновляется. То же самое можно наблюдать в случае
воздействия на белок химотрипсина, а затем трипсина.
В результате совместного действия в кишечнике на белки и высокомо-
лекулярные полипептиды трипсина и химотрипсина происходит их распад с
образованием низкомолекулярных полипептидов. Одновременно с этим
появляется небольшое количество аминокислот.
Дальнейший распад полипептидов, возникших под влиянием пепсина,
трипсина и химотрипсина, осуществляется под влиянием карбоксиполипеп-
тидазы сока поджелудочной железы и аминополипептидазы и дипептидаз,
содержащихся в кишечном соке. Карбоксиполипептидаза катализирует
расщепление полипептидов с конца полипептидной цепи, на которой поме-
щается свободная карбоксильная группа. Аминополипептидаза действует
на полипептиды с противоположного конца цепи, где имеется свободная
а-аминогруппа. Дипептидазы катализируют гидролиз различных дипепти-
дов с образованием аминокислот.
Ферменты кишечного сока раньше рассматривались как один фермент
эрепсин, катализирующий гидролиз низкомолекулярных полипептидов.
В действительности, эрепсин является смесью различных ферментов.
В кишечнике под влиянием ферментов сока поджелудочной железы и
кишечного сока заканчивается начавшееся в желудке под влиянием фер-
мента желудочного сока гидролитическое расщепление белков пищи.
Последовательное действие всех этих протеолитических ферментов при-
водит к тому, что белки пищи подвергаются полному гидролизу с образо-
ванием смеси различных аминокислот.
ВСАСЫВАНИЕ ПРОДУКТОВ ПЕРЕВАРИВАНИЯ БЕЛКОВ
Процесс всасывания продуктов гидролиза белков в пищеварительном
тракте в течение многих лет привлекал к себе внимание исследователей.
Могло бы казаться, что изучение содержимого кишечника во время пере-
варивания белков пищи даст ответ на вопрос, насколько полно расщепляют-
ся белки с образованием аминокислот. Однако исследование содержания
белков и продуктов их гидролиза в пищеварительном тракте оказалось
недостаточным, чтобы дать прямой ответ на поставленный вопрос. Выясни-
лось, что в содержимом кишечника, взятом в разгар переваривания бога-
12 Заказ № 581
353
той белками пищи, не обнаруживаются в больших количествах ни полипеп-
тиды, ни аминокислоты. Отсюда можно было бы заключить, что объем
гидролиза белков в пищеварительном тракте невелик, что всасыванию могут
подвергаться белки без предварительного расщепления. Возможен тут,
однако, и иной вывод. Не исключено, что продукты гидролиза белка —
полипептиды и аминокислоты, по мере своего образования из белков, не
задерживаются в кишечнике, а всасываются в кровь. В этом случае коли-
чество продуктов распада в содержимом кишечника будет зависеть от ин-
тенсивности их всасывания.
О невозможности непосредственного всасывания белков пищи в кровь
говорят результаты многочисленных опытов с парэнтеральным (минуя
пищеварительный тракт) введением чужеродных для организма белков.
Парэнтеральное введение белков вызывает появление в крови специфиче-
ских для каждого из них антител (стр. 44). При повторном парэнтеральном
введении белков у животных и у человека развиваются тяжелые анафилак-
тические явления, которые обычно заканчиваются состоянием шока и ги-
белью. Так как подобные явления отсутствуют при обычном, повседневном
питании белковой пищей, то можно считать, что из пищеварительного трак-
та белки в кровь не поступают и что они подвергаются предварительному
перевариванию. Продукты переваривания белков — аминокислоты — при
парэнтеральном введении их не вызывают образования антител и явлений
анафилактического шока. Оказалось, однако, что в отдельных случаях
белки пищи в некотором количестве могут из кишечника поступить в кровь
без предварительного распада. После приема большого количества сырого
яичного белка в моче появляется яичный белок и вместе с этим наступают
явления отравления организма. Этот факт, с одной стороны, указывает на
возможность непосредственного всасывания белков кишечником, с другой
же стороны, подтверждает, что всасывание в кровь несвойственных для
организма белков является моментом ненормальным и вредным для него.
Следовательно, только в специальном случае избыточного поступления в
организм яичного белка некоторая небольшая часть чужеродного белка
может поступить непосредственно в кровь. Все имеющиеся эксперименталь-
ные данные неопровержимо показывают, что при обычных условиях пи-
тания белки пищи кишечником не всасываются, а перевариваются в нем.
Непереварившаяся часть белка пищи (около 5%) выделяется с калом.
Остается еще разобраться в вопросе, какие продукты переваривания
белков всасываются — полипептиды или же аминокислоты. Ряд опытов,
в которых изучалось содержание аминокислот в крови, взятой у животных
из воротной вены натощак и во время переваривания белковой пищи, пока-
зали, что содержание аминокислот, определяемое по азоту аминогрупп
(стр. 21), в крови невелико и колеблется в пределах5—8мг% азота в кро-
ви, взятой натощак. В крови же, взятой во время переваривания белков
в кишечнике, содержание азота аминокислот возрастает до 10—12 мг%.
Эти данные указывают, что аминокислоты всасываются в кровь кишечником.
Для правильной оценки данных о нарастании количества аминокислот в
крови при переваривании белков следует учесть, что аминокислоты быстро
исчезают из крови, поглощаются органами и тканями. Опыты с введением
в кровь аминокислот показали, что основная масса их уже через 10—30 мин
исчезает из кровяного русла. Таким образом, стабильное повышение содер-
жания азота аминокислот, даже на 4—5 мг% в период переваривания бел-
ковой пищи, является прямым и веским доказательством в пользу всасыва-
ния аминокислот кишечником.
Следующим веским доказательством в пользу всасывания кишечником
аминокислот были результаты исследований с заменой белков в питании
продуктами глубокого их расщепления, а также смесью аминокислот.
При кормлении собак белками, предварительно обработанными вне организ-
ма протеолитическими ферментами оказалось, что смесь аминокислот,
образующаяся при гидролизе белков, способна заменить собой белки пищи^
354
Животные, получавшие пищу, в которой белки заменялись смесью амино-
кислот, не только нормально себя вели, но даже прибавляли в весе. В одном
из опытов собака в результате предварительного голодания потеряла 7 кг
веса. После этого ее кормили смесью аминокислот, полученной при фер-
ментативном переваривании мяса. Через 100 дней после кормления такой
пищей вес собаки увеличился на 10 кг. Результаты этого опыта особенно ин-
тересны в следующем смысле. При голодании организм теряет запасы жира
и гликогена, объем тканей уменьшается также за счет распада белков.
Восстановление и даже увеличение веса собаки при кормлении ее после
голодания смесью аминокислот с особой наглядностью показывает, что син-
тез белков, входящих в состав тканей организма, осуществляется за счет
аминокислот, образующихся при распаде белков. Это убедительно под-
тверждают результаты исследований с заменой у молодых, а также и бере-
менных животных белков пищи смесями аминокислот. Молодые животные
в этих опытах нормально росли, беременные собаки рождали нормальных
щенят.
Учитывая, что аминокислоты способны заменить собой белки пищи,
что при переваривании белков повышается содержание аминокислот в кро-
ви, оттекающей от кишечника (кровь воротной вены печени), а также что
аминокислоты, введенные парэнтерально, легко усваиваются организмом,
можно заключить, что в пищеварительном тракте в результате последо-
вательного действия протеолитических ферментов белки распадаются с
образованием аминокислот, которые кишечником всасываются в кровь. Что
же касается более сложных, чем аминокислоты, продуктов переваривания
белков, то возможность всасывания низкомолекулярных полипептидов
в кишечнике допустима , но объем его сравнительно невелик, и этот процесс
не имеет существенного значения.
Переваривание белков пищи с образованием аминокислот и их всасы-
вание кишечником весьма важны в биологическом отношении. Аминокислоты
в противоположность белкам имеют небольшой молекулярный вес и дают в
воде истинные растворы. Следовательно, в результате переваривания в
кишечнике белки, являющиеся высокомолекулярными веществами и нахо-
дящиеся в коллоидальном состоянии, дают начало образованию низкомоле-
кулярных веществ — аминокислот. Это обстоятельство имеет существенное
значение для всасывания. Низкомолекулярные вещества всасываются ки-
шечником значительно быстрее, чем высокомолекулярные. Еще более важен
следующий момент. Как уже указывалось, человек и животные отрицатель-
но реагируют на парэнтеральное введение чужеродных белков. Чувствитель-
ность их настолько велика, что повторное парэнтеральное введение незна-
чительного количества чужеродного белка вызывает анафилактический шок
и даже приводит к гибели. Чувствительность к чужеродному белку является
чертой, общей для всех видов животных. Между тем пища человека и жи-
вотных содержит чужеродные для них белки, так как белки различных
животных и растений отличаются друг от друга и каждый из них обладает
видовой специфичностью. Что же касается аминокислот, то они видовой спе-
цифичностью не обладают, так как одноименные аминокислоты, независимо
от их происхождения, имеют одинаковую химическую структуру. Отсюда
можно сделать заключение, что расщепление белков с образованием амино-
кислот в кишечнике лишает белки пищи их видовой специфичности. Из
всосавшихся кишечником аминокислот строятся специфические для каж-
дого вида животных белки.
ПРЕВРАЩЕНИЕ АМИНОКИСЛОТ В ОРГАНИЗМЕ
Ежесуточно в кровь взрослого человека поступает из кишечника 100 г
и более различных аминокислот, образующихся при переваривании белков
пищи. В результате распада белков тканей у взрослого человека освобож-
даются ежесуточно минимально 20 г аминокислот. Какова же судьба в ор-
12*
355
ганизме аминокислот? Аминокислоты имеют различные пути превращения:
они являются материалом для синтеза белков, образования биологически
важных веществ — ряда гормонов, азотистых небелковых составных частей
клеток и тканей, а также для образования конечных продуктов азотистого
обмена.
Синтез белков из аминокислот и других азотистых соединений, входя-
щих в состав тканей, определяет пластическую роль последних. За счет
аминокислот в организме взрослых восстанавливаются белки, распавшиеся
в тканях в результате их жизнедеятельности. В молодых растущих орга-
низмах аминокислоты используются не только для синтеза подвергшихся
распаду белков тканей, но и для увеличения массы белков органов в связи
с их ростом. Синтез белков — важнейших составных частей клеток и тка-
ней — является очень важным биологическим процессом, детали которого
в значительной мере выяснены. Современные достижения биохимии позво-
ляют разобраться в процессах биосинтеза белков и нуждаются в специаль-
ном освещении (стр. 471). Здесь же укажем, что у человека и животных био-
синтез белка начинается с использования аминокислот. Так как при распа-
де белков тканей и белков пищи образуются аминокислоты, из которых не
только синтезируются белки тканей, но они претерпевают и иные превраще-
ния, чаще всего ведущие к глубокому их распаду с образованием более
простых веществ, можно утверждать, что аминокислоты являются централь-
ным звеном обмена белков у животных и человека. Сказанное подтверждает-
ся тем, что при недостатке той или иной незаменимой аминокислоты (т. е.
аминокислоты, не синтезирующейся в организме из других веществ) нару-
шаются процессы обмена белков, что прежде всего проявляется в потере бел-
ков, входящих в состав его тканей. В организме животных из аммиака и
других веществ синтезируются только некоторые аминокислоты, получившие
название заменимых аминокислот.
Существуют микроорганизмы, способные синтезировать белки при обязательном
добавлении к питательной среде, кроме аммонийной соли, еще какой-либо аминокис-
лоты. Подобные микроорганизмы не могут синтезировать из аммиака и других веществ
определенной в каждом отдельном случае аминокислоты.
Аммиак не является единственным неорганическим азотистым соединением, ко-
торое у ряда микроорганизмов используется как единственный источник для синтеза
всех аминокислот, входящих в состав белков. Высшие растения легко используют
для синтеза аминокислот поступающие в них через корневую систему из почвы нитра-
ты. В 1890 г. Виноградский изолировал из почвы микроорганизмы, быстро окисля-
ющие аммиак в нитрит (N itrosomonas) и нитрит в нитрат (Nitrobacter). Эти автотрофные
нитрофицирующие бактерии не нуждаются в органических веществах для своего рос-
та. Органические вещества у них синтезируются из углекислого газа и воды с исполь-
зованием энергии окисления аммиака.
Нитраты, поступающие в растения, восстанавливаются с образованием аммиака.
Аммиак используется для синтеза аминокислот и других органических азотистых сое-
динений. Аммиак в растениях образуется также при распаде белков. Следовательно,
у высших растений при нитратном питании основным звеном обмена азотистых веществ
(белков) является аммиак. Д. Н. Прянишников, желая подчеркнуть важное значение
аммиака в процессах азотистого обмена, назвал аммиак «альфой и омегой» азотистого
обмена. Превращением аммиака начинается азотистый обмен в растениях, образова-
нием аммиака заканчивается распад белков в них.
Атмосферный азот используется (фиксируется) некоторыми бактериями рода
Azotobacter и другими аэробами, свободно живущими в почве. Эти микроорганизмы мо-
гут жить при полном отсутствии соединений азота при снабжении их соединениями
углерода и атмосферным азотом. Фиксация атмосферного азота этими бактериями про-
исходит весьма интенсивно. Установлено, что на каждый миллимоль потребленного
ими кислорода фиксируется одна десятая миллимоля атмосферного азота. Азотфикси-
рующие бактерии нуждаются для своей жизнедеятельности в присутствии ничтожно
малых количеств молибдена и ванадия.
Установлено, что при фиксации бактериями (Azotobacter} азота на определенном
этапе в виде промежуточного продукта образуется аммиак. Это доказано опытами, в
которых штаммы Azotobacter размножались в среде, содержащей стабильный изотоп
азота (№5), обнаруживаемый затем в аммиаке и в органических азотистых соединениях.
Особенно убедительными оказались результаты опытов, проведенных на азотфиксиру-
ющем анаэробном микроорганизме Clostridium pasteurianum, который в противопо-
ложность азотфиксирующим аэробным бактериям выделяет в культуральную среду
356
значительные количества аммиака и других азотистых соединений. При выращивании
Clostridium pasteurianum з присутствии тяжелого изотопа азота было установлено,
что выделяющийся в культуральную среду аммиак содержит значительное количество
стабильного изотопа азота. Изучение содержания изотопа азота в других азотистых
(органических) соединениях привело к заключению, что при фиксации азота Clostri-
dium pasteurianum возникает аммиак, который затем уже используется для синтеза
органических азотистых соединений.
При фиксации азота бактериями — симбионтами клубеньковых растений —
аммиак в виде промежуточного продукта в свободном виде не возникает, в то время
как у Clostridium pasteurianum это основной промежуточный продукт фиксации атмо-
сферного азота. Аммиак, как указывалось, образуется при фиксации атмосферного
азота бактериями рода Azotobacter. Надо полагать, что условия симбиоза определен-
ным образом повлияли на химизм фиксации атмосферного азота у бактерий Rhizobium,
устранив в нем этап появления из гидроксиламина свободного аммиака.
Суммируя, следует подчеркнуть, что атмосферный азот (N2) используется для
синтеза азотистых соединений только лишь азотфиксирующими микроорганизмами.
Все же остальные живые организмы, независимо от сложности их организаиии, не
способны использовать для синтеза азотистых соединений атмосферный азот, и у них
азотистый обмен начинается с использования аммиака или аминокислот. У высших
растений, как мы видели, поступающие из почвы нитраты восстанавливаются с обра-
зованием аммиака. В составе аминокислот, белков и других азотистых соединений,
встречающихся в живых организмах, азот находится в восстановленнОхМ состоянии
в виде остатка аммиака.
ХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ АМИНОКИСЛОТ
Аминокислоты, не использованные для синтеза белков или других
азотистых соединений, входящих в состав тканей, не накапливаются в орга-
низме. Изучение азотистого состава тканей различных органов, а также
крови и физиологических жидкостей (спинномозговой жидкости, лимфы
и др.) показало, что концентрация свободных, т. е. не входящих в состав
других соединений, аминокислот невелика. Аминокислоты в организме
претерпевают различные ферментативные превращения, в результате ко-
торых неиспользованная для синтеза белков и других веществ часть их
подвергается глубокому распаду с образованием конечных продуктов —
аммиака, углекислого газа и воды и освобождением потенциальной энергии.
Глубокий распад аминокислот, их диссимиляция, имеет место не толь-
ко при нормальном питании, когда они образуются в результате перевари-
вания белков. Распад аминокислот, правда в меньшем объеме, происходит
также при низком содержании и даже при отсутствии белков в пище. Изве-
стно, что при безбелковом питании из организма с мочой выделяются конеч-
ные продукты азотистого обмена, освобождающиеся в результате превраще-
ний аминокислот. Следует также учесть, что часть аминокислот, образую-
щаяся при распаде тканевых белков, используется для синтеза ряда азо-
тистых соединений, входящих в состав тканей. Так, например, для синтеза
креатина (стр. 416) используются глицин, аргинин и метионин (последние
две аминокислоты относятся к числу незаменимых аминокислот); карнозин
и ансерин синтезируются (стр. 421) из незаменимой аминокислоты гисти-
дина. Аминокислоты используются также для синтеза гормонов белковой
природы (инсулина, глюкагона, гормонов гипофиза и др.). Адреналин
и тироксин синтезируются из незаменимой аминокислоты фенилаланина.
Следовательно, некоторая часть аминокислот, образующаяся в результате
распада белков тканей в организме при недостатке или отсутствии белков
в пище, расходуется на синтез различных биологически важных веществ.
Часть незаменимых аминокислот постоянно расходуется как при нормаль-
ном питании, так и при белковом голодании. В последнем случае, т. е.
при белковом голодании (само собой разумеется, что и при полном голо-
дании) должен ощущаться недостаток в незаменимых аминокислотах.
Между тем для синтеза подвергающихся распаду тканевых белков необхо-
димо наличие полного набора всех аминокислот в соответствующих количе-
ствах. При недостатке, а тем более при отсутствии тех или иных незаменимых
аминокислот синтез белков тканей уменьшается или вовсе прекращается.
357
Следовательно, аминокислоты, образующиеся в процессе распада тканевых
белков при голодании, если не полностью, то в значительной мере, не могут
быть использованы для синтеза белков и подвергаются распаду с освобож-
дением конечных продуктов: аммиака, углекислого газа и воды. При нали-
чии белков в пище избыточное количество аминокислот, всасывающееся
кишечником, подвергается распаду. Химическая структура различных
аминокислот различна. Отсюда понятно, что путь распада различных ами-
нокислот не одинаков. Однако существуют некоторые общие для многих
аминокислот процессы превращения. К ним относятся реакции дезамини-
рования, переаминирования и декарбоксилирования аминокислот.
ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
После приема с пищей белков, а также после введения в организм
аминокислот, весь входящий в их состав азот выделяется у млекопитающих
главным образом в виде мочевины. Этот факт указывает на то, что амино-
кислоты подвергаются расщеплению и за счет их аминогрупп, затем обра-
зуется мочевина. Естественно, возникает вопрос, каким образом происходит
дезаминирование аминокислот? Здесь напрашиваются следующие три пути:
1) дезаминирование восстановительным путем:
R • СН • NH 2 • СООН — R • СН2СООН -- NHS
в этом случае из аминокислоты образуются кислота и аммиак;
2) дезаминирование путем гидролиза:
R-CHNH2’COOH-'-H2O R-CHOH-COOH-rNH3
т. е. аминокислота, присоединяя воду, образует а-оксикислоту и аммиак;
3) дезаминирование окислительным путем с образованием в виде про-
межуточного продукта иминокислоты:
R • СН • NH2 • СООН—Н2 R • С - NII • СООН
R-C- -NH COOH+H3O R-C - О-СООН j-NH3
здесь при дезаминировании образуется а-кетокислота и аммиак.
Какой же из этих трех теоретически возможных путей дезаминирова-
ния аминокислот реализуется в организме? В 1909 г. Нейбауэр пришел
к заключению, что дезаминирование аминокислот у животных происходит
окислительным путем. При этом он исходил из следующих эксперимен-
тальных данных. Вводя собакам фениламиноуксусную кислоту (вещество
синтетическое, не входящее в состав белков), он в моче собаки обнаруживал
фенилглиоксилевую и миндальную кислоты, которые обычно в моче отсут-
ствуют.
СН сн
С • CHNHo • СООН С. СО • СООН
Фениламиноуксусная кислота
СН
С-СНОП-СООН
Фенилглиоксилевая кислота Миндальная кислота
Выделение с мочой как фенилглиоксилевой, так и миндальной кислот
указывает на возможность и окислительного и гидролитического дезами-
нирования аминокислот. Нейбауэр пришел к заключению об окислитель-
ном пути дезаминирования. При этом он исходил также из данных, получен-
ных им при изучении превращения фенилаланина и тирозина у людей,
у которых наблюдается патологическое отклонение в обмене этих амино-
кислот, известное под названием «алкаптонурия» (стр. 410).
358
Следует, однако, указать, что результаты исследований Нейбауэра
не исчерпывающи. Данные, полученные при изучении дезаминирования в
организме неприродной фениламиноуксусной кислоты и превращения фе-
нилаланина и тирозина при алкаптонурии, не дали ответа на вопросы,
дезаминируются ли все аминокислоты окислительным путем, в каких орга-
нах они преимущественно дезаминируются, какими особенностями обла-
дают ферменты дезаминирования аминокислот. В связи с этим понадоби-
лось дальнейшее изучение дезаминирования аминокислот. Между тем вос-
произвести процесс дезаминирования аминокислот вне организмов с по-
мощью экстрактов из тканей или с помощью ферментов, выделенных из них,
не удавалось. Дезаминирование аминокислот в лучшем случае удавалось
наблюдать при пропускании питательной жидкости через изолированную из
организма печень, или же в дрожжевых клетках. Сложилось и существовало
до 1932 года представление о том, что процесс дезаминирования аминокислот
тесно связан с жизнедеятельностью клеток и неотделим от них.
В 1932 г. Кребс использовал методику работы со срезами тканей и тех-
нику манометрических исследований, позволивших ему глубоко вникнуть
в изучение ферментов окислительного дезаминирования аминокислот.
Благодаря исследованиям Кребса, Грина и других стало известно, что в
тканях (печени, почек, мозга) животных, у растений, плесеней, бактерий и
в змеином яде содержатся различные ферменты, катализирующие окисли-
тельное дезаминирование как L-, так и D- аминокислот. Все они носят наз-
вание оксидаз аминокислот.
Оксидазы аминокислот обладают абсолютной стереоспецифичностью.
Одни из них катализируют дезаминирование природных аминокислот
(L-ряда), другие — неприродных аминокислот (О-ряда). Первые получили
название оксидаз L-аминокислот, вторые — оксидаз /^-аминокислот.
Обнаружение оксидаз /^-аминокислот, для которых субстратами яв-
ляются неприродные, т. е. практически не встречающиеся в организме
животных и у растений аминокислоты, представляет особый интерес (см.
стр. 360). Некоторые оксидазы аминокислот катализируют дезаминирование
только определенных аминокислот.
Все оксидазы аминокислот классифицируются по их стереоспецифич-
ности, по месту их обнаружения и по специфичности их действия (действие
на определенные аминокислоты).
Оксидаза L-аминокислот
Оксидаза L-аминокислот получена в очищенном виде из почек и из
печени и по своей природе является флавинсодержащим белком (стр. 177).
Этот фермент катализирует отщепление водорода от большого числа раз-
личных аминокислот, причем водород от восстановленного флавопротеида
(в нем флавин представлен, по-видимому, в виде флавинофосфорной кислоты)
переносится на молекулярный кислород с образованием перекиси водорода.
В результате действия фермента молекула L-аминокислоты превращается в
а-кетокислоту и* в аммиак.
R—СН—СООН—Н2-Ьфлавопротеид->
nh2 (1)
-----> R—С—СООН-]-фла<вопротеид-Н2
II
NH
Я—С—СООН
| 4-Н2О-> Я—С—COOH+NH3(2)
NH ||
О
флавопротеид-Н2 + О2—> флавопротеид 4- Н2О2 (3)
ЩО.^ЩО+^Л (4)
359
Реакция (2) происходит без участия фермента, так как иминокислоты
очень неустойчивы в водном растворе и расщепляются с образованием
а-кетокислот и аммиака. Перекись водорода, получающаяся в реакции
(3), в тканях распадается на воду и на кислород под влиянием каталазы.
Суммирование реакций (1—3) дает уравнение
R—СН—СООН R—С—COOI1
I -Р/2о2 !| ; NH*
nh2 О
В присутствии оксидазы L-аминокислот дезаминированию подвергают-
ся все моноамино-монокарбоновые кислоты, за исключением глицина.
Не дезаминируются также диамино-монокарбоновые и моноамино-дикар-
боновые кислоты. Их дезаминирование катализируется специфическими для
них ферментами. Долго не удавалось выделить оксидазу L-аминокислот,
так как она оказалась слабо активной. После больших усилий Грин и его
сотрудники из 50 кг замороженных почек крыс выделили и очистили этот
фермент.
Оксидаза L-аминокислот, как оказалось, катализирует окислительное
дезаминирование 13 L-аминокислот.
Неправильно было бы, однако, считать, что оксидаза L-аминокислот
играет существенную роль в дезаминировании L-аминокислот в организме.
Против этого говорят следующие факты: 1) активность этого фермента в
почках и в печени (в органах, где интенсивно происходит дезаминирование
аминокислот) сравнительно незначительна; 2) L-аминооксидаза практиче-
ски не катализирует дезаминирование глутаминовой и аспарагиновой кис-
лот, образующихся в больших количествах как при гидролизе белков, так
и синтетически; 3) оксидаза L-аминокислот обнаружена только лишь в
почках и в печени, в иных же органах и тканях она отсутствует.
Трудно себе представить, что оксидаза L-аминокислот, обнаруженная
только лишь в почках, и в печени и обладающая слабой активностью,
может играть существенную роль в дезаминировании аминокислот в ор-
ганизме.
Оксидаза D-аминокислот
Оксидаза D-аминокислот обнаружена в почках и в печени и она ката-
лизирует окислительное дезаминирование большого числа различных
D-аминокислот. Очищенные препараты этой оксидазы оказываются значи-
тельно более активными, чем препараты оксидазы L-аминокислот. По своей
химической природе оксидаза D-аминокислот является флавопротеидом,
причем флавин в ней представлен флавинадениндинуклеотидом. Способ
действия оксидазы D-аминокислот такой же, как и оксидазы L-аминокислот
(см. выше). Оксидаза D-аминокислот обнаружена в почках и в печени раз-
личных позвоночных животных, бактериях и плесенях.
Оксидаза L-аминокислот отличается от оксидазы D-аминокислот не
только по химической структуре входящих в их состав" коферментов, но
и чувствительностью к синильной кислоте и к октиловому спирту. Первая
оксидаза чувствительна к синильной кислоте и к октиловому спирту и их
присутствие сильно тормозит окислительное дезаминирование L-амино-
кислот, вторая оксидаза к этим веществам нечувствительна.
В чем именно заключается значение оксидазы D-аминокислот, катали-
зирующей окислительное дезаминирование неприродных аминокислот?
Прежде всего необходимо выяснить, встречаются ли в организмах в свобод-
ном виде или в составе более сложных веществ D-аминокислоты, на которые
могла бы воздействовать оксидаза D-аминокислот.
Некоторые D-аминокислоты иногда встречаются в составе природных
продуктов. Так, например, D-пролин обнаружен в некоторых алкалоидах,
капсулярное вещество бактерий группы Mesentericus содержит D-глу-
360
таминовую кислоту. D-аминокислоты встречаются в составе некоторых ан-
тибиотиков (производное D-цистеина в пенициллине, D-лейцин — в гра-
мицидине).
Понятно, однако, что значение этих продуктов как возможных источни-
ков D-аминокислот для человека или животных не может быть сколько-
нибудь значительным.
Рацемирования аминокислот в тканях животных, по-видимому, не
происходит. D-аминокислоты могут поступить в кровь, а оттуда в ткани
организма из кишечника, где они могут образовываться из L-аминокислот
при действии рацемазы микроорганизмов.
Имеется предположение, что роль оксидаз D-аминокислот заключается
в их способности предохранять своим действием организм от возможного
появления в его тканях D-аминокислот. Последние, в случае их появления
и использования для синтеза белков тканей, могли бы привести к возник-
новению не свойственных для организма белков. Этот взгляд нашел поддерж-
ку, когда было установлено, что некоторые L-аминокислоты, образующиеся
в кишечнике при превращении белков, могут рацемизироваться под влия-
нием ферментов кишечных бактерий. Появляющиеся при этом D-аминокис-
лоты могут всосаться кишечником и поступить в кровь.
Трудно, однако, допустить, что всасывание D-аминокислот кишечником
могло бы достигнуть размеров, которые соответствовали бы активности ок-
сидаз D-аминокислот в печени и в почках. Роль оксидазы D-аминокислот в
организме требует еще дальнейшего выяснения.
Иные пути дезаминирования L-аминокислот
Дезаминирование аминокислот может происходить окислительным пу-
тем. Это, однако, не означает, что вся масса подвергающихся превращению
аминокислот дезаминируется окислительным путем, иными словами, что
каждая молекула аминокислоты превращается в т-кетокислоту и аммиак.
В растениях и у некоторых микроорганизмов возможно происходит
гидролитическое дезаминирование аминокислот с образованием а-оксикис-
лот и аммиака:
R • СН • NH3 ‘ СООН 4-Н.,О->Я • СН • ОН • COOf I 1 NH;|
У некоторых анаэробов и факультативных аэробов наблюдается восстановитель-
ное дезаминирование аминокислот:
/? CH NH2-COOH + H2 -> /? СН2-СООН 4 NH3
У микроорганизмов — строгих анаэробов (например, у Clostridium sporogenes
и С. botulinum) дезаминирование аминокислот происходит особым образом в резуль-
тате реакций оксидоредукции между двумя аминокислотами (реакция Стикленда):
/?-СН NH2COOH 4- Н2О -Н £'CHNH2COOH-> Я-СО COOH 4- /?CH2COOH-}-2NHo
Из приведенного уравнения видно, что молекулы одной аминокислоты дезамини-
руются окислительным путем за счет кислородг! воды, а молекула другой аминокисло-
ты дезаминируется восстановительным путем за счет водорода через НАДН2. Амино-
кислоты L-ряда можно разделить на две группы по их отношению к" реакции
Стикленда. Аминокислоты первой группы окисляются, и одновременно с этим восстанав-
ливаются другие аминокислоты. Эти аминокислоты действуют как восстановитель-
ные агенты. Аминокислоты второй группы восстанавливаются и окисляют другие
аминокислоты. Они действуют как окислительные агенты.
К аминокислотам, являющимся в реакции Стикленда восстановительными аген-
тами (первая группа), относятся: аланин, валин, цистеин, гистидин, глутаминовая
кислота, лейцин, фенилаланин, серин и аспарагиновая кислота. К аминокислотам,
выступающим в реакции Стикленда как окислительные агенты (вторая группа), отно-
сятся: глицин, пролин, оксипролин, орнитин и аргинин.
Ферментативный механизм дезаминирования аминокислот по реакции Стикленда
остается еще во многом невыясненным.
361
Ферменты, катализирующие дезаминирование некоторых
L-аминокислот
Дезаминирование L-глутаминовой кислоты катализируется широко рас-
пространенной в тканях животных, а также в растениях и микроорганизмах
дегидрогеназой L- глутаминовой кислоты; фермент детально изучен, и уста-
новлено, что его небелковым компонентом являются пикотинамид-аде-
ниндинуклеотиды (НАД и НАДФ). Как и в случае дезаминирования
других аминокислот оксидазой L-аминокислот, глутаминовая кислота деза-
минируется с образованием кетокислоты и аммиака.
СООН СООН СООН
сн2 сн2 сн2
| -НН-НАДч *1 4 НАД-Н, |
сн2 сн2 СН.,
CHNH, £ 1 C=NH 1 C-NH
СООН । СООН СООН
СООН
I
СНо
4 НоО+> | +NH3
СН2
I
СО
сооо
Глутаминовая кислота Иминоглутаровая
кислота
а-Кетоглутаровая кислота
Наличие широко распространенной в тканях животных, в растениях
и среди микроорганизмов специфической для L-глутаминовой кислоты
дегидрогеназы представляет особый интерес. Глутаминовой кислоте принад-
лежит важная роль в процессах азотистого обмена. Реакция дезаминирова-
ния глутаминовой кислоты, катализируемая дегидрогеназой L-глутамино-
вой кислоты, легко обратима, и при физиологических условиях pH равнове-
сие реакции благоприятствует синтезу глутаминовой кислоты из аммиака
и а-кетоглутаровой кислоты. а-Кетоглутаровая- кислота образуется в тка-
нях из продуктов распада углеводов. Благодаря обратимости реакции, ката-
лизируемой дегидрогеназой L-глутаминовой кислоты, в тканях организма
легко синтезируется глутаминовая кислота. Синтез а-кетоглутаровой кис-
лоты, а отсюда, следовательно, и L-глутаминовой кислоты тесно связан с
реакциями цикла трикарбоновых кислот (стр. 271).
L-Аспарагиновая кислота под влиянием специфического для нее фермен-
та — аспартазы дезаминируется без появления а-кетокислоты. Действие ас-
партазы изучено у бактерий, например у Escherichia coli. Под влиянием
аспартазы аспарагиновая кислота дезаминируется следующим образом:
СООН СООН
1 мн I
СНо ~NH3 СН
I " <—~!|
CHNH2 4?nh,CH
I ' I
СООН СООН
Аспарагиновая Фумаровая
кислота кислота
Образующаяся фумаровая кислота является одним из членов цикла
трикарбоновых кислот и возникает так же, как промежуточный продукт
превращения углеводов.
Аспартаза найдена у некоторых растений. В тканях животных ее об-
наружить не удается; там дезаминирование L-аспарагиновой кислоты про-
исходит иным путем, с участием иных ферментов.
Дезаминирование цистеина катализируется ферментом десульфгидра-
зой. Реакция сопровождается образованием из цистеина сероводорода и
аминоакриловой кислоты, которая легко превращается в иминопропионо-
вую кислоту. Из последней в результате присоединения воды получается
пировиноградная кислота и аммиак.
362
CH2SH CHNH., СН2 сн3 сн3 ~H;S CNH., C~NH С -O+NH3
СООН соон соон соон
Цистеин а-Амнноакриловая Иминопроиионо- Пировиноградная кислота вая кислота кислота
Десульфгидраза цистеина содержится в тканях животных, главным об-
разом в печени, а также в дрожжах и многих бактериях.
L-Серин дезаминируется с помощью фермента, катализирующего от-
щепление от него молекулы воды (гидратазы). В результате реакции обра-
зуется а-аминоакриловая кислота, путь дальнейшего распада которой та-
кой же, как в случае превращения цистеина.
сн,он 1 CHNH, сн, CNH, сн3 C=NH . сн3 ±НЛ C=O4-NH3
। соон соон соон 1 соон
Серин
9-Аминоакрпловая Иминопропионовая Пировиноградная
кислота кислота кислота
Серингидратаза содержится в различных тканях животных, в дрожжах
и бактериях.
Подобно L-серину дезаминируется L-треонин. Под влиянием гидра-
тазы от него отщепляется молекула воды, а затем из возникшей иминокис-
лоты образуется а-кетомасляная кислота и аммиак.
сн3 сн3 сн3 сн3 1
снон —н2о СН СИ, 1 +н,о СН,
1 , н > 1 1 KTLJ
CHNH, || (Unh
* CNH, С--О
1 1 1 1
соон соон соон соон
Треонин а-Кетомасляная кислота
Как и в случае дезаминирования цистеина, в реакции дегидратиро-
вания серина и треонина участвует пиридоксальфосфат.
L-Метионин дезаминируется с помощью у-тионазы с образованием
метилмеркаптана, аммиака и а-кетомасляной кислоты.
CH2S*CH? СН3
СН, СН2
| ' 4-H,O-^CH3SH4-NH34- I
CHNH, СО
' I I
СООН соон
Метионин а-Кетомасляная кислота
Дезаминированию L-гистидина способствует специфическая дезами-
наза (а-кетокислота не образуется). В тканях животных и у микроорганиз-
мов имеется фермент гистидин-а-дезаминаза, катализирующий реакцию
дезаминирования L-гистидина с освобождением аммиака и уроканиновой
кислоты (эта кислота впервые выделена из мочи собаки, canis — собака —
отсюда ее название).
С—СН2—CH-NH,COOH
II
сн
N — С—СН=СН—СООН
N —
II
НС
+NH3.
Гистидин
Уроканиновая кислота
363
Более сложным путем происходит дезаминирование (вернее отщепле-
ние иминогруппы) L-пролина и близкой к нему аминокислоты L-оксипролина
(иминокислоты). Пролин подвергается дегидрированию и дальнейшему пре-
вращению с образованием глутаминовой кислоты, которая затем дезами-
нируется обычным для нее путем с помощью специфической дегидрогеназы.
В превращении пролина в глутаминовую кислоту участвует не один,
а несколько ферментов, которые получили название «оксидазы пролина».
Схематически превращение пролина можно представить следующим об-
разом:
Н2С — СН2
Н2С СНСООН
Н2С — СН2
I I
НС снсоон
Н2С — сн2
Z22L. нс снсоон
+н2о
1 -Пролин(пирролидин-
а~карбоновая кислота)
Гипотетическ ий
продукт
дегидрирования
6-Альдегид-а-аминовалсрьяногая
кислота (семиальдегид глута-
миновой кислот)
+Н±О
----)
-Н,
Н2С — СН2
I I
НОС снсоон.
Глутаминовая кислота
Сложным путем происходит также дезаминирование оксипролина.
Здесь в виде промежуточных продуктов появляются кетопролин, полуаль-
дегид оксиглутаминовой кислоты и глутаминовая кислота.
Оксипролин
Кетопролин
НОНС — СНп
л*
> НС снсоон
Полуальдегид
оксиглутаминовой кислоты
Н2С — сн2
I I
нос снсоон
Глутаминовая кислота
Данные о путях дезаминирования фенилаланина, тирозина и трипто-
фана приведены ниже (стр. 402—412).
Аминокислоты, имеющие в своих молекулах аминогруппы в ш-поло-
жении, т.е. в противоположном по отношению к карбоксилу конце молеку-
лы, дезаминируются с участием специфических для них ферментов. К по-
добным аминокислотам относятся лизин и орнитин, образующийся из ар-
гинина.
Глицин также дезаминируется с помощью специфической для него ок-
сидазы (глициноксидазы). По своей химической природе эта оксидаза яв-
ляется флавопротеидом. Химизм дезаминирования глицина аналогичен
химизму окислительного дезаминирования многих других аминокислот.
NH2 NH
1 11
СН2—Н2-|- флавопротеид —>СН-г флавопротеид-Н2
I I
СООН СООН
Глицин Иминоглицин
(I)
364
NH
з
CH+H2O->
(2)
COOH
COOH
Глиоксилевая
кислота
флавопротеид-Н24~О2----► флавойротеид +Н2О2-
(3)
Образующаяся глиоксилевая кислота окисляется с образованием ща-
велевой кислоты:
COOH
COOH
COOH
Щавелевая
кислота
Подобным же образом подвергается превращению метилглицин, сар-
козин:
NH-CH3
N.CH3
СН2 —Н2+фл а во протеид —> СН 4- флавопротеид-Н21
СООН
Саркозин
СООН
Метилиминоглицив
NCH3
CH
> | Vl+NH2CH3
СООН
COOH
Глиоксилевый альдегид
Глициноксидаза содержится в печени и в почках животных. В почках
крыс она не обнаружена.
L-Орнитин в организме превращается в L-глутаминовую кислоту.
Путем переаминирования (см. ниже) он превращается в полуальдегид глу-
таминовой кислоты, а затем
NH2
в глутаминовую кислоту.
CH2
СН2
СН2
|\он
сн2
СН2
сн2
chnh2
chnh2
chnh2
COOH
COOH
> СН2
СООН
Орнитин
Полуальдегид глу-
таминовой кислоты
Глутаминовая кислота
L-Лизин дезаминируется
ется в а-аминоадипиновую
NH2
подобно
кислоту.
орнитину, окисляясь, он превраща-
соон
СН2
СН2
СН2
сн2
сн2
СН2
СН2
сн2
СН2
СН2
chnh2
chnh2
chnh2
СООН
СООН
СООН
Лизин
а-Аминоадипиновая кислота
365
В случаях орнитина и лизина приводились данные о дезаминировании
(«-аминогруппы. Что касается а-аминогрупп этих кислот, то они, естест-
венно, могут дезаминироваться обычным путем (переаминированием, окис-
лительным путем). Дезаминирование ^-аминогруппы аминокислот имеет
много общего с дезаминированием аминов, возникающих в результате де-
карбоксилирования аминокислот (стр. 369).
ПРОЦЕСС ПЕРЕАМИНИРОВАНИЯ АМИНОКИСЛОТ
Переаминирование является процессом, охватывающим превращение
всех аминокислот. Оно было открыто А. Е. Браунштейном и М.Г. Крицман.
Реакции переаминирования заключаются в обратимом перемещении
группы NH2 от одной аминокислоты к той или иной а-кетокислоте, без про-
межуточного образования аммиака.
R
I .....
С : HNH 2
I '....
СООН
Яг
I ......
4- С : HNH2
I :....
СООН
При более детальном рассмотрении реакции переаминирования можно
видеть, что участвующая в ней аминокислота (донор аминогруппы) пре-
вращается в а-кетокислоту, а а-кетокислота (акцептор аминогруппы) под-
вергается восстановительному аминированию. Реакции переаминирования
катализируются ферментами-аминоферазами, механизм действия которых
может считаться в значительной мере выясненным. Аминоферазы содержат-
ся в различных тканях животных, в растениях и в различных микроорга-
низмах. Небелковым компонентом аминофераз является пиридоксальфос-
фат, играющий роль промежуточного переносчика аминогрупп от амино-
кислот на а-кетокислоты. Аминоферазы широко распространены, т. е.
процесс переаминирования аминокислот является общим для всех живых
организмов, и он должен играть важную роль в обмене веществ.
В реакциях переаминирования участвуют L-аминокислоты, причем на
а-кетокислоты переносятся не только аминогруппы, находящиеся в а-поло-
жении, но и аминогруппы, расположенные у атомов углерода в противопо-
ложных по отношению к карбоксилам концах молекулы, т. е. расположен-
ные в а)-положении (в орнитине, р-аланине, у-аминомасляной кислоте). О ме-
ханизме реакции переаминирования см. стр. 367.
В результате переаминирования аминогрупп в (D-положении образу-
ются альдегидокислоты, как это имеет место в случаях окислительного
дезаминирования аминогрупп в (D-положении (стр. 365).
Реакциям переаминирования подвергаются также амиды аминокислот—
глутамин и аспарагин. Эти реакции катализируются специфическими для
них аминоферазами.
CONH2 R
I I
сн2 с=о
I + I
chnh2 соон
I
соон
CONHo
I
сн2
I
с=о
соон
R
I
chnh2
I
соон
Аспарагин
Амид щавелевоуксусной
кислоты
Аминоферазы обладают явно выраженной специфичностью, и каждая
из них катализирует реакцию перенесения аминогруппы от определенной
аминокислоты. Однако, активность различных аминофераз в тканях и клет-
ках оказывается неодинаковой. Наиболее активна глутамикоаланиновая
фераза, катализирующая обратимое перенесение аминогруппы от глутами-
366
новой кислоты на пировиноградную, и глутамико-аспарагиновая фераза,
катализирующая обратимое перенесение аминогруппы от глутаминовой
кислоты на щавелевоуксусную кислоту (аминофераза глутаминовой — ща-
велевоуксусной кислот). Коферментом аминофераз является пиридоксаль-
фосфат, и действие заключается в следующем:
СООН
I
chnh2
I
сн2
I
сн2
I
СООН
Пиридоксалфосфорная
кислота
СООН
I
со
I
>сн2 +
сн2
I
СООН
с—ch2nh2
^'\з-СН2О-Н2РО3
Фосфопиридоксамин
c-ch2nh2
СНз
НОС
С-СН2ОН2РО3
СООН
сн
сн3
НОС
-> chnh2
С-СН2ОН2РО3
СООН
Н3СС^
N
сн
N
В приведенных выше реакциях имело место перенесение аминогруппы
глутаминовой кислоты на пировиноградную кислоту. Аналогичные реак-
ции имеют место и в других случаях переаминирования.
При рассмотрении дезаминирования аспарагиновой кислоты под вли-
янием аспартазы (стр. 362) указывалось, что продуктом дезаминирования ас-
парагиновой кислоты в организме может явиться фумаровая кислота, пре-
вращающаяся в щавелевоуксусную кислоту. Приведенная выше реакция
показывает, что аспарагиновая кислота может превратиться в щавелево-
уксусную кислоту в результате реакции переаминирования (направле-
ние реакции справа налево). Важно подчеркнуть, что особенно активно дей-
ствующие аминоферазы (глутамикоаланиновая фераза и глутамикоаспара-
гиновая фераза), катализируют превращение в соответствующие им
аминокислоты трех а-кетокислот (а-кетоглутаровой, щавелевоуксусной и пи-
ровиноградной кислоты), из которых первые две являются членами цикла
трикарбоновых кислот, а третья — пировиноградная кислота — предшест-
венником ацетил —SKoA, включающегося в этот цикл.
567
Биологическое значение реакций переаминирования
На первый взгляд может казаться, что реакции переаминирования не
сопровождаются каким-либо существенным изменением в превращении
аминокислот в организме. В самом деле, общее количество аминокислот в
результате реакций переаминирования не изменяется. Аминогруппы от
аминокислот переносятся на а-кетокислоты; возникают новые молекулы
аминокислот, которые в свою очередь могут отдавать свои аминогруппы
а-кетокислотам. Процесс переаминирования происходит как бы по замкну-
тому кругу, без физиологического эффекта. Дело, однако, обстоит не так.
Экспериментальные данные, полученные при изучении роли процесса
переаминирования аминокислот А. Е. Браунштейном и его сотрудниками,
а также рядом других исследователей, позволяют иначе подойти к оценке
роли переаминирования и характеризовать его как важнейшее звено в
процессах обмена веществ в организме.
Реакции переаминирования играют важную роль в процессах биосин-
теза аминокислот у растений. Поступающие в растения из почвы нитраты
восстанавливаются с образованием аммиака (стр. 356). Этот аммиак связы-
вается ферментативно с а-кетоглутаровой кислотой, которая легко возни-
кает из углеводов при превращении продуктов их распада по окислитель-
ному циклу трикарбоновых кислот. Аминирование а-кетоглутаровой кис-
лоты специфической дегидрогеназой приводит к появлению глутаминовой
кислоты. Аминогруппа этой аминокислоты в результате реакций переамини-
рования переносится на различные а-кетокислоты (пути синтеза этих кето-
кислот в растениях весьма разнообразны) с образованием различных ами-
нокислот, из которых строятся белковые молекулы. а-Кетоглутаровая
кислота в растениях является, по выражению Д. Н. Прянишникова, как
бы «воротами», проходя через которые аммиак используется для синтеза
различных аминокислот.
Глутаминовая кислота наряду с этим участвует в растениях также в
синтезе других азотистых веществ путем перенесения аминогрупп на не-
которые безазотистые соединения, акцептирующие их.
Большое значение имеют также реакции переаминирования, проис-
ходящие у животных. Синтез а-кетокислот у них не столь разнообразен,
как в растениях. Отсюда понятно, что в тканях животного возможен син-
тез ограниченного числа аминокислот из других веществ (из возникающих
путем синтеза а-кетокислот и из аммиака). Легко синтезируются из про-
дуктов превращения, главным образом углеводов, а также и других ве-
ществ, в организме а-кетоглутаровая и щавелевоуксусная кислоты (члены
цикла трикарбоновых кислот) и пировиноградная кислота. Эти а-кетокис-
лоты, особенно а-кетоглутаровая кислота, являются теми «воротами» через
которые и в организме животных аммиак вовлекается в процессы обмена
веществ. Следует, однако, указать на различные в процессе использования
аммиака у животных и высших растений. У высших растений из почвы че-
рез корневую систему поступают нитраты и нитриты, которые восстанавли-
ваются с образованием аммиака. Некоторое количество аммиака поступает
в растения непосредственно из почвы. Следовательно, синтез аминокислот
и других азотистых веществ в растениях начинается с использования ам-
миака. В организмы животных нитриты с пищей не поступают. Количество
аммиака в виде аммонийных солей в пищевых продуктах весьма незначи-
тельно, поэтому можно считать, что аммиак у животных образуется за счет
дезаминирования аминокислот, поступающих в кровь из кишечника и воз-
никающих при распаде тканевых белков. Дезаминированию подвергаются
в тканях также и другие вещества, среди которых особое место в этом отно-
шении занимает адениловая кислота (стр. 358). В устранении появляюще-
гося в тканях аммиака первостепенную роль играет а-кетоглютаровая
кислота, которая под влиянием специфической дегидрогеназы обратимо ами-
нируется с образованием глутаминовой кислоты. В тканях животных те-
368
чение реакции сдвинуто влево,т.е. в сторону аминирования а-кетоглутаро-
вой кислоты. От синтезирующейся глутаминовой кислоты с помощью ами-
нофераз аминогруппы переносятся на щавелевоуксусную, пировиноград-
ную и на другие а-кетокислоты с образованием соответствующих им а-ами
нокислот.
Из организмов человека и млекопитающих животных выделяется в
виде конечного продукта обмена белков и других азотистых веществ моче-
вина. Данные о механизме образования мочевины изложены на стр. 428;
здесь же укажем, что в синтезе мочевины участвуют глутаминовая и аспа-
рагиновая кислоты. Один из двух атомов азота, входящих в состав молеку-
лы мочевины — CO(NH2)2, доставляется аспарагиновой кислотой, которая
в свою очередь образуется путем перенесения аминогруппы от глутамино-
вой кислоты на щавелевоуксусную кислоту. При синтезе мочевины амино-
группа аспарагиновой кислоты используется без промежуточного выделе-
ния аммиака. Это обстоятельство дает основание предполагать, что при син-
тезе мочевины в определенном объеме (до 50%) используется не свободный
аммиак., а аминогруппа глутаминовой кислоты. В этом процессе снова про-
является значение реакций переаминирования аминокислот.
Оксидазы L-аминокислот, как известно, катализируют реакции окисли-
тельного дезаминирования аминокислот с образованием а-кетокислот и ам-
миака. Аминоферазы же катализируют реакции перенесения аминогрупп от
аминокислот на а-кетокислоты. Исследования А. Е. Браунштейна показы-
вают, что окислительное дезаминирование аминокислот может происходить
путем сопряженной реакции катализируемой аминоферазой и дегидрогена-
зой глутаминовой кислоты
(аминофераза)
(1) а-аминокислота 4- а-кетоглутаровая кислота------------>
глутаминовая кислота-{-а-кетокислота
Дегидрогенеза глутаминовой кислоты
(2) глутаминовая кислота---------------------------------->-
а-кетоглутаровая кислота4-1^Н3
(3) a-а м инокис л ота->а-кетокис лота+NH3
Уравнение (3) является результатом суммирования уравнений (1) и
(2).
Таким образом, окислительное дезаминирование аминокислот в орга-
низме может протекать не только в результате действия оксидаз амино-
кислот, но в результате действия аминофераз и дегидрогеназы L-глутами-
новой кислоты. Учитывая это обстоятельство, а также то, что при синтезе
мочевины (и некоторых других азотистых соединений) используются ами-
ногруппа аспарагиновой кислоты без промежуточного образования ам-
миака, можно заключить, что реакции переаминирования аминокислот иг-
рают очень важную роль в процессах азотистого обмена.
ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ. ОБРАЗОВАНИЕ
ПРЭТЕИНОГЕННЫХ АМИНОВ
Общим для многих аминокислот является процесс их декарбоксилиро-
вания. В результате этого процесса различные аминокислоты теряют свою
карбоксильную группу и превращаются в соответствующие им амины, по-
лучившие название протеиногенных аминов:
R • СН • NH2 • СООН—CO2-*R • СН2 • NH2
Изучено около пятнадцати различных декарбоксилаз, каждая из ко-
торых катализирует декарбоксилирование какой-либо одной а-аминокис-
369
лоты. Отличаются они друг от друга по своим белковым компонентам, имея
общий для всех небелковый компонент в виде пиридоксальфосфата.
Реакции декарбоксилирования аминокислот часто обнаруживаются у
микроорганизмов, они наблюдаются также у животных и растений. Первые
протеиногенные амины были получены в результате воздействия на белки
бактерий гниения. В 1876 г. М. В. Ненцкий выделил из гниющей желатины
фенилэтиламин, являющийся продуктом декарбоксилирования фенилала-
нина:
CcH5CH2CHNH2COOH---->C6H5CH2CH2NH24 со2
Фенилаланин Фенилэтиламин
Позже, в первой четверти нашего века, были выделены тетраметилен-
диамин — продукт декарбоксилирования орнитина — и пентаметилендиа-
мин — продукт декарбоксилирования лизина. Первый известен под на-
званием путресцина, а второй — кадаверина.
H2NCH2CH2CH2CH2NH2;
Путресцин
h2n • сн2 • сн2 • сн2 • сн2 • сн2 • nh2
Кадаверин
Путресцин и кадаверин входят в состав трупного яда.
При воздействии на соответствующие аминокислоты бактериальных
ферментов были выделены протеиногенные амины: гистамин и раминомас-
ляная кислота — продукты декарбоксилирования соответственно гистиди-
на и глутаминовой кислоты, ^-аланин1 и агматин — продукты декарбокси-
лирования соответственно аспарагиновой кислоты и аргинина, тирамин и
изоамиламин — продукты декарбоксилирования тирозина и лейцина.
Химическая структура некоторых аминов такова:
N — C-CH2CH2NH2
CH2
I
СНо
NHo
I
C=NH
I
NH
Гистамин
СОН
HCx^/zCH
C-CH2CH2.NH2
Тирамин
I
СНо
I
CHoNH2
Агматин
СООН СООН
I I
сн, сн2
I I
CH2 ch2nh2
I
ch2nh,
v-Аминомасляная кислота З-Аланин
Различные ткани животных, особенно ткани печени и почек, содержат
декарбоксилазы, которые способны декарбоксилировать ряд аминокислот.
В противоположность бактериям в тканях животных отсутствуют декарбо-
ксилазы, отщепляющие углекислый газ от карбоксильных групп лизина
1 -'-Аминомасляная кислота и ^-аланин условно могут быть отнесены к аминам.
370
и орнитина. Образование протеиногенных аминов в тканях организма жи-
вотных происходит в ограниченном объеме. Исключением в этом отноше-
нии являются высокоактивные декарбоксилазы диоксифенилаланина и
цистеиновой кислоты. Декарбоксилирование цистеиновой кислоты приводит
к образованию таурина, входящего в состав таурохолевых кислот.
CH.’HSO3
( —со2 CH2-HSO3
CHNH.--------> |
| ch2nh2
СООН
Цистеиновая кислота Таур-ин
Протеиногенные амины, образующиеся из циклических аминокислот
(фенилаланина, тирозина, триптофана, гистидина), относятся к физиологи-
чески высокоактивным веществам. В очень малых концентрациях они ока-
зывают влияние на функцию различных органов. Так, например, гистамин
вызывает усиленную секрецию пищеварительных и других желез внеш-
ней секреции. Он также вызывает понижение кровяного давления. Ядови-
тостью обладают диамины, возникающие при декарбоксилировании диамино-
монокарбоновых кислот (лизина и орнитина).
Образующийся в результате декарбоксилирования орнитина протеино-
генный амин путресцин превращается в тканях в два близких друг к другу
по своей структуре физиологически активных соединения — спермидин и
спермин. Оба эти соединения обнаружены в различных тканях животных,
а также и в микроорганизмах. Спермидин и спермин являются полиаминами
(они содержат в своих молекулах больше, чем по одной аминогруппе), они
токсически влияют на функцию почек.
NH.
I
СН.
I
сн2
I
сн2
| Остаток путресцина >
NH • сн2 • сн2 • сн2 • CH2NH2
NH, NH3
I I
CH2 CH2
CH, CH.
I I
CH. CH.
to
NH • CH2CH2-CH2-CH2—NH
Спермидин
Спермин
Удалось установить предшественников спермидина и спермина и фер-
ментативный механизм их синтеза. Было показано, что синтез спермидина
и спермина требует наличия наряду с путресцином также метионина и аде-
нозинтрифосфорной кислоты. В присутствии меченного тяжелым изотопом
азота и радиоактивным углеродом путресцина, синтезирующиеся сперми-
дин и спермин содержат в своих молекулах остатки меченого путресцина.
Участие метионина в синтезе спермидина и спермина доказано в опытах с
применением меченного радиоактивным углеродом метионина. В этом слу-
чае оба синтезирующиеся соединения оказываются радиоактивными. От-
сюда следует, что для синтеза спермидина и спермина используется как
путресцин, так и метионин.
Имеющиеся экспериментальные данные позволяют считать, что метио-
нин, прежде чем быть использованным для синтеза спермидина и спермина,
входит в соединение с аденозинтрифосфорной кислотой с образованием
S-аденозилметионина, а из него образуется S-аденозилпропиламин, от
которого остаток пропил амина переносится на путресцин.
371
АТФЧ метионин------> 5-аденозилметионин+ЗН3РО4.
c-nh2 n 1 1 \ 1 СН 1СХ с. / т/ V Y |* Л f\ 9 н2~5 ыг/ он но\1 у HCv .СН S-Аденозилметионин -СО2 — -сн3 сн2-сн2-сны н2-соон
CNH, ы /х,А 1 сн НЧ /с\ / V V у у /1 f\ нс£ ОН НО CH2-S-CH3 СН2 CHj CH2NH3
S- Аденозилпропиламин
Ал
I I с*
hvA
Н
Путресцин
ch«-s—СН:
нс/онно\1.н S-Аденозилпропиламин CNH, N ГА- н .С С. CI НС/ОННО^ S* Аденозилмеркалтан CHj-CH,— ch2nh3 nh2 сн2 + сн2 сн2 nh-ch2 —сн2—ch2-ch2-nh2 „ Спермидин Н,-5-СН3 Н
372
Образующийся S-аденозилметионин подвергается декарбоксилирова-
нию, а затем остаток метионина —СН2—СН2—СН2—NH2 переносится
на путресцин. В случае перенесения одного остатка образуется сперми-
дин, в случае перенесения двух остатков—спермин.
Широкое распространение спермидина в тканях животных указы-
вает на его роль в процессах обмена веществ.
ПРЕВРАЩЕНИЕ ПРОТЕИНОГЕННЫХ АМИНОВ
В ОРГАНИЗМЕ
У человека и животных в результате действия декарбоксилаз образует-
ся небольшое количество протеиногенных аминов, причем некоторые из
них (8-аланин, у-аминомасляная кислота, таурин) не обладают ядовитым
действием. В организм протеиногенные амины могут поступать извне с пи-
щевыми продуктами, подвергшимися гниению (при пищевых отравлениях),
они могут также образоваться в кишечнике в большем, чем обычно, объеме
под влиянием гнилостных бактерий (при расстройствах пищеварения).
Протеиногенные амины устраняются: 1) выведением их почками—при
пищевых отравлениях протеиногенные амины выделяются с мочой; 2) свя-
зыванием аминогруппы. Амины в организме ацетилируются и также выде-
ляются с мочой. Ацетильные производные не обладают физиологической ак-
тивностью; 3) амины подвергаются в организме распаду. Распад аминов
начинается с процесса их дезаминирования, происходящего под действием
оксидаз аминов. Эти ферменты разделяются на две группы. Одна объеди-
няет ферменты, катализирующие окислительное дезаминирование диами-
нов (гистамина, путресцина, кадаверина), другая — дезаминирование моно-
аминов (оксидазы диаминов и оксидазы моноаминов). Оксидазы аминов
особенно активны в слизистой оболочке кишечника. Отсюда можно пола-
гать, что протеиногенные амины, образующиеся при бактериальном рас-
щеплении аминокислот в кишечнике, а также попадающие в кишечник с
подвергшимися гниению пищевыми продуктами, могут дезаминироваться в
слизистой оболочке кишечника вовремя всасывания.Оксидаза моноаминов
обнаружена в различных тканях позвоночных и беспозвоночных животных.
Чаще всего у животных наиболее активна оксидаза моноаминов печени и
почек, за ними следует слизистая оболочка кишечника, мозг, сердечная и
скелетные мышцы, железы внутренней секреции.
Оксидазы моноаминов катализируют реакции окислительного деза-
минирования моноаминов с образованием альдегидов и аммиака:
R • CH2NH2—• СН=NH
,0
/?CH=NHH-H2O->/?C<f 4-NH4
Промежуточными продуктами дезаминирования аминов являются ими-
ны. Следовательно, дезаминирование аминов происходит по тому же пути,
что и окислительное дезаминирование аминокислот. В тех случаях, когда
дезаминирование моноаминов происходит с участием оксидаз вне организма,
удается выделить продукты реакции — альдегиды и аммиак. Оксидазы мо-
ноаминов не катализируют дезаминирование ди- и полиаминов.
Дезаминирование диаминов катализируется оксидазой диаминов, встре-
чающейся в тканях (особенно в почках) различных животных, в растениях
и у бактерий. Оксидаза диаминов катализирует также окислительное де-
заминирование гистамина. Она оказалась идентичной с гистаминазой. кото-
рая считалась ферментом, специфическим для гистамина.
Оксидаза диаминов катализирует реакцию отщепления от аминов од-
ной аминогруппы:
NH2CH2(CH2)nCH2NH2—Ho->NH2CH2(CH2)nCH=NH
NH2CH2(CH2)nCH-NH4-H2O->NH2CH2(CH2)ZIC<f 4-NH3
373
Образующийся моноамин подвергается в дальнейшем воздействию ок-
сидазы моноаминов и отщепляет от себя аминогруппу с образованием ам-
миака и диальдегида.
Альдегиды, образующиеся в результате действия оксидаз на амины,
окисляются в кислоты: монокарбоновые — в случае превращения моноами-
нов и дикарбоновые — в случае превращения диаминов.
Бактериальное расщепление аминокислот в кишечнике
Выше указывалось, что протеиногенные амины, как и ряд других ве-
ществ, часть из которых обладает ядовитым действием, образуются в ки-
шечнике из аминокислот под влиянием бактерий.
Различные микроорганизмы составляют так называемую микрофлору
пищеварительного тракта человека и животных. Распределение микроорга-
низмов в различных частях пищеварительного тракта неодинаково. Обильна
и чрезвычайно разнообразна микрофлора в ротовой полости. Однако здесь
ввиду краткости процесса жевания пища не подвергается значительным из-
менениям. В желудке микрофлора очень ограничена благодаря антибак-
териальному действию желудочного сока. Немногочисленна микробная
флора в тонких кишках. Сок слизистой оболочки тонких кишок также
обладает антибактериальным действием. Микроорганизмы, прошедшие без
повреждения через желудочный, а затем кишечный сок, находят в толстых
кишках весьма благоприятные условия для размножения. В толстых киш-
ках флора особенно богата и разнообразна по своему составу. При повреж-
дении пилорической части желудка и при заболевании тонких кишок мик-
робы перемещаются из нижних отделов кишечника в верхние и в желудок.
О многочисленности флоры толстых кишок можно судить по такому
примеру: в 1 г кала в среднем насчитывается до 15 миллиардов микробов.
В кишечной флоре встречаются различные микробы — В, coll, Str, fecalis,
В. putrificus и многие другие. В. putrificus вызывают гниение белков, по-
ступающих в кишечник из желудка.
Кишечная флора играет известную положительную роль в организме.
При описании переваривания клетчатки (стр. 278) мы указывали на важную
роль кишечной флоры, особенно для жвачных животных. Расщепление
клетчатки сопровождается образованием в кишечнике уксусной, молочной,
янтарной и других кислот, которые всасываются кишечником в кровь и ис-
пользуются в тканях организма. Наряду с этим, под влиянием микробов
в кишечнике образуются газы — метан, водород, углекислый газ, а из серу-
содержащих аминокислот — сероводород. Под влиянием определенных
бактерий в толстых кишках расщепляются тирозин, триптофан, цистеин,
аргинин, лизин, гистидин с образованием протеипогенных аминов и других
веществ. Следует подчеркнуть, что с количественной стороны бактериальное
расщепление аминокислот в толстых кишках сравнительно незначительно
и охватывает лишь ничтожную долю аминокислот, появляющихся в кишеч-
нике при переваривании белков, так как аминокислоты по мере своего об-
разования всасываются. Учитывая, однако, высокую ядовитость некоторых
продуктов гниения аминокислот в толстых кишках, приходится считаться
с возможностью отрицательного влияния на организм кишечной флоры, осо-
бенно в тех случаях, когда имеют место сдвиги в ее качественном и коли-
чественном составе.
Образование ядовитых веществ — продуктов бактериального расщеп-
ления некоторых аминокислот в толстых кишках — и всасывание их в
кровь может вызвать отравление организма.
И. И. Мечников считал, что постоянное всасывание из толстых кишок
ядовитых веществ и воздействие их на клетки и ткани является главной
причиной старения организма.
Состав микрофлоры кишечника не постоянен. Он изменяется в зависи-
мости от условий питания, а также при введении с пищей продуктов молоч-
374
нокислого брожения (простокваши, кефира, ацидофильного молока). Вмес-
те с этими продуктами в кишечник поступают бактерии молочнокислого
брожения, подавляющие в известной мере жизнедеятельность гнилостных
бактерий.
Об аминах, образующихся в результате действия бактериальных декар-
боксилаз на аминокислоты, и их превращениях уже сообщалось. Остается
остановиться на других ядовитых продуктах, появляющихся в кишечнике
под влиянием гнилостных бактерий. К ним относятся продукты распада ти-
розина и триптофана.
Под действием ферментов бактерий из тирозина образуется фенол:
Тирозин
Фенол
Из приведенных формул видно, что ферменты бактерий не затрагивают
циклический компонент (оксифенильную группу) тирозина. Фенол является
ядовитым веществом. Возникающий из тирозина фенол всасывается ки-
шечником, током крови по воротной вене доставляется в печень, где проис-
ходит его обезвреживание путем образования так называемых парных (конь-
югированных) соединений. Для образования парных соединений фенола в
печени используется серная или глюкуроновая кислота (стр. 87). При этом
появляются фенилсерная кислота или фенилглюкуроновая кислоты. Анало-
гично образуются парные соединения метилфенола (крезола). Парные сое-
динения выделяются почками и по количественному содержанию их в моче
можно судить об интенсивности распада тирозина в толстых кишках.
СОН
I-H2SO4
Фенилсерная кислота
I —
НСОН
I
носн
I
НСОН
I
НС —
неон
I
СООН
с-сн3
СН-----о______НС______
I
НСОН
I
носн о
I
НСОН
I
НС-----
I
СООН
Крезолглюкуроновая кислота
Воздействию ферментов бактерий подвергается в толстых кишках так-
же и триптофан, который при декарбоксилировании превращается в трип-
тамин (индолэтиламин). В результате отщепления боковой углеродной це-
пи, триптамин превращается в индол, пировиноградную кислоту и NH3, при
бактериальном расщеплении триптофана остается нетронутым циклический
компонент его молекулы.
375
Индол ядовит, обладает неприятным запахом, который в значительной
мере обусловливает запах кала. В кишечнике индол всасывается в кровь
и обезвреживание его происходит в печени, где он предварительно окисля-
ется с образованием индоксила и дает затем парные соединения с серной,
а также с глюкуроновой кислотой. То же самое происходит со скатолом (ме-
тилиндолом).
Индоксил
СО—SOaH
Индоксилсерная кислота
Скатол
ССН3
СОН
Скатоксил
4-H2SO4
ССН3
CO-SO3H
Скатоксилсерная кислота
Калиевая (натриевая) соль индоксилсерной кислоты получила назва-
ние мочевого индикана.
Парные соединения индоксила и скатоксила выделяются из организма
с мочой. В клинических лабораториях часто прибегают к определению инди-
кана, так как по количеству его в моче можно судить об объеме образова-
ния индола в толстых кишках, а отсюда — об интенсивности распада трип-
тофана в результате гниения.
Кроме фенола, крезола, индола и скатола при гниении белков в толс-
тых кишках образуется еще ряд других веществ, среди которых имеются и
продукты превращения фенилаланина и тирозина. Из фенилаланина воз-
никают фенилпировиноградная и фенилуксусная кислоты.
СН
СН
C-CH2-CH-NHo.COOH
Фенилаланин
С-СН2-СО-СООН
Фенилпировиноградная кислота
376
сн
с-сн2-соон
Фенилуксусная кислота
Соответственно из тирозина образуются оксифенилпировиноградная
и оксифен илу ксу сна я кислоты.
Из фенилаланина в результате дезаминирования и укорочения угле-
родной цепи под влиянием ферментов микроорганизмов возникает бензой-
ная кислота, которая после всасывания кишечником образует в печени
и в почках парное соединение с глицином — гиппуровую кислоту.
CCONH-CH2COOH
С-СООН
h-nh?-ch2-cooh
4-Н2О
Гиппуровая кислота
Бензойная кислота
Гиппуровая кислота была впервые обнаружена в моче лошадей (отсюда
и название). При введении человеку и млекопитающим животным бензойной
кислоты из организма выделяется с мочой гиппуровая кислота. В клини-
ческой практике для изучения способности человека обезвреживать ядо-
витые вещества вводят бензойную кислоту и определяют количество выде-
ленной с мочой гиппуровой кислоты (проба Квика на детоксицирующую
функцию печени). При нарушении функций печени синтез гиппуровой кис-
лоты в организме снижен и выделение ее с мочой после введения бензойной
кислоты уменьшено.
У птиц бензойная кислота дает парное соединение с орнитином— ор-
нитуровую кислоту.
СН2. NH2
I
сн2
I
СН2 4-2СвН5СООН ->
I
CH-NHe
СООН
Орнитин
CH.NH-СОСвН5
I
сн?
I
сн.
I
CH-NHCOCeH5
I
соон
Орнитуровая кислота
В заключение изложения данных о продуктах, образующихся при гни-
ении белков в толстых кишках еще раз подчеркивается, что количество
аминокислот, подвергающихся в толстых кишках воздействию гнилостных
бактерий, невелико и составляет очень малую часть аминокислот, возника-
ющих в кишечнике при переваривании белков пищи.
ПРЕВРАЩЕНИЯ ОТДЕЛЬНЫХ АМИНОКИСЛОТ
Реакции дезаминирования, переаминирования и декарбоксилирования,
как уже указывалось, общие для всех аминокислот. Однако этими реакция-
ми не исчерпываются процессы превращения аминокислот в организме.
Различные аминокислоты отличаются друг от друга по своей химической
природе, и пути использования их в организме не могут быть одинаковы-
377
ми. С этой точки зрения можно говорить об обмене индивидуальных ами-
нокислот.
Переходим к ознакомлению с данными по изучению химических пре-
вращений отдельных аминокислот, а также взаимопревращения некоторых
из них.
ОБМЕН ГЛИЦИНА
Применение изотопного метода позволило выявить различные стороны
превращения глицина в организме. Оказалось, что глицин участвует в про-
цессах обезвреживания бензойной кислоты путем синтеза гиппуровой кис-
лоты (стр. 377) и в образовании парных соединений с желчными кислотами
(стр. 341). Он может дать начало образованию ряда соединений: муравьиной
и уксусной кислотам, этаноламину, серину, производным пурина и пор-
фиринам. Благодаря этому глицин связан с обменом углеводов и жиров
(через уксусную кислоту), с обменом серина, нуклеотидов и нуклеиновых
кислот (участвуя в синтезе производных пурина) и с обменом гемоглобина
(как предшественник протопорфирина). Кроме этого, глицин участвует в
синтезе важных в физиологическом отношении веществ — креатина и
глутатиона.
Продуктом дезаминирования глицина является глиоксилевая кислота
Глицин
CHoNI 12СООН+1/2О2->С
COOH+NH3+H2O
Глиоксилевая кислота
Глиоксилевая кислота занимает важное место в превращениях глицина.
Следует прежде всего отметить, что из глиоксилевой кислоты в организме
легко синтезируется глицин. Введение в организм глиоксилевой кислоты
приводит к быстрому образованию глицина. Синтез глицина из глиоксиле-
вой кислоты может осуществиться благодаря реакции переаминирования:
c<f • соон+соон • СН2• СН2• CHNI12СООН^
хн
Глиоксилевая Глутаминовая кислота
кислота
5>CH2NH2COOH+HOOC • СН2 • СН2СО • СООН
Глицин а-Кетоглутаровая кислота
Глиоксилевая кислота может образоваться не только как продукт де-
заминирования глицина, но и из гликолевого альдегида — промежуточного
продукта превращения пентоз.
Гликолевый Гликолевая кислота Глиоксилевая
альдегид кислота
Глиоксилевая кислота, декарбоксилируясь, может дать начало образо-
ванию муравьиной кислоты, которая участвует в ряде процессов обмена
веществ
zO .О +н2о-н2 zO
COOII-Ccf — CO2->HC<f-------->HC<f
^ОН
Муравьиный
альдегид
Муравьиная
кислота
Глицин в тканях входит во взаимодействие с другими аминокислотами,
в результате чего образуются вещества, имеющие важное физиологическое
значение. При взаимодействии с аргинином с помощью амидинферазы на
378
глицин переносится амидиновая группа аргинина с образованием гуанидин-
уксусной кислоты — предшественника креатина:
nh2
I
C=NH
I
NH
I
CH2
I
CH,
I
CH,
I
CHNH,
I
COOH
Аргинин
nh2
I
CH2
NH2 +
I
сн2
I
СООН
Глицин
nh2 сн2
-> 1 1
C--NH сн2
। NH chnh2
। сн2 СООН
СООН Орнитин
Гуанидинуксусная
кислота
Продуктом, близким к глицину, является саркозин (N-метилглицин). Обра-
зование саркозина происходит из холина следующим путем:
/СНз-СНзОН , /СН2СОО-
/ окисление \/
N = (CH3)3 -------> N-(CH3)3
-СН3
Холин
Бетаин
СН2СООН СН2СООН
-сн3 / -сн3 /
------>N-4CH3)2 -------> NH—СН3
Диметилглицин
Саркозин
Физиологическая роль саркозина еще не выяснена.
Глицин образуется в организме как продукт распада белков, а также
путем синтеза. Синтез глицина достигает больших размеров при введении
млекопитающим животным бензойной кислоты. В этом случае наблюда-
ется прямая зависимость между количеством введенной бензойной кислоты
и выделенной с мочой гиппуровой кислоты. Так как гиппуровая кислота
построена из бензойной кислоты и из глицина, то по количеству ее в моче
можно судить об интенсивности образования глицина. При введении мле-
копитающим животным бензойной кислоты и меченных изотопами веществ—
предполагаемых предшественников глицина — можно по появлению изо-
топов в гиппуровой кислоте безошибочно судить, какие из введенных ве-
ществ действительно дают начало образованию глицина. Подобными иссле-
дованиями установлено, что важным источником образования глицина у
животных является аминокислота серин. При введении бензойной кислоты
и меченных N15 и С14 серина с мочой выделяется гиппуровая кислота,
остаток глицина в которой оказывается меченным N15 и С14. Превращение
серина в глицин может происходить следующим путем:
сн2он ено
I -Н2 I +Н2О
NH2—СН—СООН-------> NH2—СН—СООН-------->hcooh+nh2-ch2cooh
Серин Формилглицин Муравьиная Глицин
кислота
Превращение в организме серина в глицин — процесс обратимый. Уста-
новлено, что при введении животным меченной С14 муравьиной кислоты
и меченного стабильным изотопом углерода С13 в карбоксиле глицина в
тканях появляется серин с двойной меткой:
С14Н2ОН
HC14OOH+NH2CH2C13OOH->NH2—сн—с13оон.
Муравьиная Глицин Серин
кислота
<379
Для синтеза глицина используются два атома углерода (карбоксильной
и карбонильной групп) пировиноградной кислоты. Пировиноградная кис-
лота, как известно, является промежуточным продуктом обмена углеводов.
Поэтому можно заключить, что для построения углеродного скелета моле-
кулы глицина используется углерод углеводов.
Возможность синтеза глицина у человека и животных из различных ве-
ществ объясняет давно уже известный факт независимости их от поступления
глицина с белками пищи. Из всех изученных высших животных только
цыплята нуждаются в доставке глицина с пищей. Однако и они могут об-
ходиться без глицина, если доставлять им вещества, из которых он синте-
зируется. Все же при обычных условиях кормления у птиц синтез глицина
ограничен. Для обезврежения бензойной кислоты (стр. 377) у них исполь-
зуется не глицин, как у млекопитающих животных, а орнитин, т.е., очевид-
но, у птиц глицин — физиологически более дефицитная аминокислота,
чем орнитин, который образуется из аргинина.
ОБМЕН АЛАНИНА
У человека и животных аланин легко синтезируется из пировиноград-
ной кислоты в результате реакции переаминирования — перенесения ами-
ногруппы от глутаминовой кислоты на пировиноградную кислоту. Таким
образом, животные могут обеспечить свою потребность в аланине путем
синтеза и не нуждаются в доставке его с белками пищи. Это относится так-
же и к микроорганизмам, подавляющее большинство которых может обхо-
диться без аланина. Аланин и углеводы в одинаковой мере используются
микроорганизмами как источники энергии, а также как источники углеро-
да, необходимого для их роста и размножения.
Аланину некоторых бактерий, например у Streptococcus fecalis и Lacto-
bacillus easel, содержится в виде L- и D-изомера. У этих бактерий имеется
фермент рапемаза, обратимо превращающий L-аланин в D-аланин. Эта ра-
цемаза действует только на аланин и не затрагивает другие аминокислоты.
Физиологическое значение рацемазы аланина для бактерий не выяснено.
У животных действие рацемазы бактерий в кишечнике создает возможность
для образования и всасывания D-аланина. Как известно (стр. 360), в печени
и в почках содержится оксидаза D-аминокислот, интенсивно дезаминирую-
щая различные D-аминокислоты, в том числе и D-аланин.
Так как в результате дезаминирования аланина в животном организме
образуется пировиноградная кислота, обмен его тесно связан с превраще-
нием углеводов.
Аланин относится к числу аминокислот, из которых возникают углево-
ды (гликоген). Превращения аланина, его связь с другими аминокислотами
и углеводами иллюстрируются следующей схемой:
Аспарагиновая-> | Аланин | <-Кинуренин<~Трйптофан
кислота |
Пировиноградная—>Углеводы
кислота
I
Серин, глицин,
цистеин
ОБМЕН СЕРИНА
Серин (а-амино-Р-оксипропионовая кислота), как уже сообщалось, в
организме легко превращается в глицин. Обмен серина, поэтому во многом
сводится к обмену глицина. Следует, однако, указать, что обмен серина име-
380
ет самостоятельное значение. Он связан с биосинтезом серу содержащих
аминокислот, а также фосфатидов, углеводов и жирных кислот.
Серин входит в состав серинсодержащих фосфатидов (стр. 97), он также
является исходным веществом для образования этаноламина и холина, сос-
тавной части фосфатидов. При введении животным серина, меченного изо-
топом азота, можно наблюдать появление этого изотопа в этаноламине фос-
фатидов. Этаноламин появляется в результате декарбоксилирования
серина
СН2ОН СН2ОН
I I
chnh2------> ch2nh2+co2
Этаноламин
СООН
Серин
Дезаминирование серина приводит к образованию пировиноградной
кислоты, что устанавливает связь между превращениями серина и алани-
на, так как пировиноградная кислота в тканях легко аминируется с образо-
ванием аланина. С другой стороны, через пировиноградную кислоту уста-
навливается связь обмена серина с обменом углеводов и жирных кислот.
Серин относится к числу аминокислот, из которых в организме образуются
углеводы. Серин легко синтезируется у животных. О связи превращений
серина с обменом серусодержащих аминокислот см. стр. 392.
ОБМЕН ТРЕОНИНА
Организм животных зависит от поступления треонина извне, с белками
пищи. Треонин при участии фермента — альдолазы треонина — превраща-
ется в глицин и в уксусный альдегид. В этом превращении участвует пири-
доксальфосфат
СООН
Треонин Глицин
Установлено, что треонин косвенным путем участвует в ряде превра-
щений, свойственных глицину. Он используется для синтеза пирроловых
ядер протопорфирина, синтеза холестерина, жирных кислот, углеводов.
ОБМЕН ВАЛИНА, ЛЕЙЦИНА И ИЗОЛЕЙЦИНА
Валин, лейцин и изолейцин —аминокислоты, имеющие в своих молеку-
лах разветвленные цепи атомов углерода. В процессах превращений они те-
ряют разветвленность, что является общей чертой их обмена.
L-Валин относится к числу незаменимых аминокислот, т.е. аминокис-
лот, не синтезирующихся у животных из других веществ. Валин легко об-
разуется только из а-кетоизовалерьяновой кислоты, что указывает на обра-
тимость его дезаминирования. а-Кетоизовалерьяновая кислота способна
заменить валин, отсутствующий в пище. Промежуточный продукт обмена
валина имеет в своей молекуле три атома углерода и используется для син-
теза гликогена.
381
При введении в организм Л-валина, меченного радиоактивным угле-
родом в метильных группах, в выдыхаемом воздухе обнаруживается радио-
активный углекислый газ. Радиоактивный углерод при этом появляется
также в гликогене. Это указывает, что метильные группы 'валина исполь-
зуются в организме. Каким же образом отщепляется метильная группа ва-
лина, какова химическая природа образующегося из него вещества, имею-
щего в своей молекуле три атома углерода? На эти вопросы дают ответ ре-
зультаты исследований, выявившие следующий путь превращения валина:
СН
СН
34
>СН—СН—СООН
3 I.
nh2
Валин
снзч
>СН—С—СООН
сн/ II
о
а-Кетоизовалерьяновая кислота
4-KoASH
—С02—Н2
Н—C-SKoA
II
О
Изобутил ~ SKoA
И ~н--
СН,-= С —C^SKoA
I II
СН3 О
Метакрнлил ~ SKoA
11 +н2о
СН,—СН—С ~ SKoA
I I II
ОН СН3 О
p-Оксиизобутирил ~ SKoA
НС—СН—CO~SKoA-------
II I
О СНз
Полуальдегид метилмалоновой кислоты
HOC—СН—CO-SKoA
* II I
О сн3
Метилмалоновая кислота
4-NH,
СН2—СН—СООН
I I
NH, СНз
З-Аминоизо.масляная
кислота
Ч-0-С02
CH3CH,C~ SKoA
II
О
Пропионил — SKoA
Приведенная схема показывает, что одна из двух метильных групп мо-
лекулы валина подвергается последовательному окислению с образованием
из нее карбоксильной группы, которая отщепляется в виде СО2.
Образование метилмалоновой кислоты в виде промежуточного продукта
превращения нашло свое подтверждение в опытах с содержанием крыс на
рационе, богатом валином. Подобный корм вызывал у крыс некроз печени,
сопровождавшийся усиленным выделением с мочой метил малоновой кис-
лоты. Надо полагать, что при некрозе печени превращение валина в орга-
низме крыс тормозится на стадии образования метилмалоновой кислоты.
/Аетилмалоновая кислота, как показывает схема, превращается в про-
382
пионовую кислоту. Превращение последней у животных представляет
большой интерес.
Валин — не единственный источник образования пропионовой кисло-
ты. Она может возникнуть также из изолейцина (стр. 384) и в результате
3-окисления жирных кислот с нечетным числом атомов углерода (стр. 385).
У жвачных животных пропионовая кислота образуется в рубце как про-
дукт брожения углеводов; она в значительных количествах поступает в
кровь.
В тканях животных широко распространен фермент — метилмалонин-
изомераза, катализирующий реакцию перенесения карбоксильной группы
от метилмалоновой кислоты на пропионовую кислоту с образованием ян-
тарной кислоты и пропионовой кислоты.
IIOOC • СН3 СН3 СН3 :СООН!
.....\/ I I "|............
СН 4- СН2 -----------> СН2 + сн2
I I I I
CO^SKoA СООН СООН сн2
Метилизомалонил ~ Пропионовая кислота |
~ SKoA СООН
Янтарная
кислота
Образовавшаяся янтарная кислота является одним из членов окисли-
тельного цикла трикарбоновых кислот (стр. 271), и она подвергается окис-
лительному распаду. Из приведенного видно, что распад пропионовой кис-
лоты проходит через стадию образования янтарной кислоты.
L-Лейцин. Подобно L-валину, Л-лейцин не синтезируется у животных.
'Молодые крысы могут нормально развиваться при замене L-лейцина в пи-
ще а-кетоизокапроновой кислоты. Отсюда можно заключить, что у живот-
ных происходит аминирование а-кетоизокапроновой кислоты, что может
быть обеспечено реакцией переаминирования (перенесения аминогруппы от
глутаминовой кислоты). L-Лейцин — незаменимая аминокислота для
многих микроорганизмов. В этом случае лейцин также без ущерба для раз-
вития и размножения может быть заменен в питательных средах а-кетоизо-
капроновой кислотой.
Путь распада лейцина у животных в значительной мере выяснен. Уже
давно было установлено, что лейцин обладает сильно выраженным кетоген-
ным свойством, т. е., что эта аминокислота в организме дает начало образо-
ванию ацетоуксусной кислоты, из которой путем восстановления возникает
р-оксимасляная кислота, а при декарбоксилировании—ацетон. Образова-
ние ацетоуксусной кислоты из лейцина можно легко наблюдать при следую-
щей постановке опытов. Крысам (или другим животным) при голодании
систематически вводится флоридзин. Этим у животных вызывается глюко-
зурия, и ткани их обедневают гликогеном. В моче животных появляются
кетоновые соединения (ацетоуксусная, р-оксимасляная кислота и ацетон).
Если таким голодающим «флоридзиновым» крысам ввести лейцин, выделе-
ние кетоновых веществ резко возрастает.
Превращение лейцина с образованием кетоновых соединений можно
также наблюдать в опытах со срезами печени. Подобные опыты показали,
что из каждой молекулы лейцина образуются 1,5 молекулы ацетоуксусной
кислоты. Если учесть, что молекула лейцина содержит шесть атомов угле-
рода, а молекула ацетоуксусной кислоты—четыре атома, можно заклю-
чить, что при известных условиях весь углерод лейцина используется для
образования ацетоуксусной кислоты. Опыты с применением меченного С14
в p-положении молекулы лейцина показали, что при введении его голод-
ным «флоридзиновым» крысам выделяющаяся ацетоуксусная кислота ока-
зывается, как и следовало ожидать, радиоактивной. При этом С14 в равной
мере обнаруживается в метильной и в метиленовой группах ацетоуксусной
кислоты. Эти данные позволяют сделать безошибочный вывод, что два ато-
383
ма углерода молекулы лейцина, находящиеся в а- и p-положении, исполь-
зуются для синтеза ацетоуксусной кислоты. Один фрагмент молекулы лей-
цина дает начало ацетоуксусной кислоте, другой — уксусной кислоте, из
двух молекул которой синтезируется ацетоуксусная кислота.
Путь превращения L-лейцина в организме следующий:
СН3
I
СН3—СН—СНо—СН— СООН
I
nh2
Лейцин
и
СН3
I
СН3—СН—СН2—С—СООН
II
о
а-Кетойзокапроновая кислота
+KoASH
СН3
СН3—СН—СН3—С - SKoA
II
О
Изовалерил—SKoA
И-нг
СН,
СН3— С=-СН—С—SKoA
!1
О
Сенецеил — SKoA
Л 4-Н2О
СН,
СН,—С—СН3—C-SKoA
I II
ОН о
fi-Окси изовалерил — SKoA
j | -ЬСОД+АТФ)
CH,
I
HOOC—CH»—С—CH3—С-SKoA
I II
ОН о
0-Окси-З-метилглутарил — SKoA
1 t
i
НООС—СО СН2—СН3 + СНз—С —SKoA
>1
О
Ацетоуксусная кислота Ацетил ~ SKoA
2СГ,—C-SKoA > СН,—С—СН.,—С-SKoA
II II II
О 0 0
Ацетоацетил -- SKoA
Подобный путь превращения лейцина приводит к использованию всех
его углеродных атомов для образования ацетоуксусной кислоты.
Изолейцин. Подобно лейцину и валину, изолейцин — незаменимая
аминокислота для животных и многих микроорганизмов. Соответствующая
384
ему а-кето-^-метилвалерьяновая кислота способна заменить собой изолей-
цин в пище. Отсюда можно заключить, что дезаминирование изолейцина
у животных и у микроорганизмов — процесс обратимый.
Установлено, что при превращении изолейцина образуются как гли-
коген, так и кетоновые соединения. В последние годы удалось более
детально разобраться в пути его распада:
СН3—СН2—СН—СН—СООН
I I
СНз NH2
Изолейцин
сн3—сн2—сн—со—соон
I
СНз
я-Кето-З-метилвалерьяновая кислота
| 4-KoA-SH—СО2—Н2
СН3—СН2—СН—С—SKoA
I II
СНз О
а-Метилбутирил — SKoA
И ~Н2
СНз—СН=С — С -SKoA
I II
СНз О
Тиглил — SKoA
If +Н2О
СНз—СН — СН — C~SKoA
I I II
ОН СНз О
а-Метил-З-оксибутирил — SKoA
И-Н2
СНз—С—СН—C~SKoA
II I II
О СНз О
«-Метилацетоацетил — SKoA
И 4-KoASH
СН3—С—SKoA 4- СН3—СН2—С—SKoA
II II
О о
Ацетил — SKoA
Пропионил — SKoA
2СН3—С—SKoA
Ацетил — SKoA
СНз
I
со
-> I 4- KoASH
сн2
CO—SKoA
Ацетоацетил—SKoA
ОБМЕН ПРОЛИНА, ОКСИПРОЛИНА И ОРНИТИНА
Пролин и оксипролин относятся к числу аминокислот, которые обра-
зуются у животных и человека путем синтеза, а поэтому они не нуждаются
в присутствии этих аминокислот в белках пищи.
13 Заказ № 581 335
Опыты с введением пролина, меченного одновременно дейтерием и N15,
показали, что из него у животных образуется оксипролин (выделенный из
белков тканей оксипролин содержал дейтерий и тяжелый азот). Образова-
ние оксипролина из пролина — процесс необратимый. При введении в ор-
ганизм меченого оксипролина не наблюдалось появления в белках тканей
меченого пролина. Следует указать, что введенный оксипролин вообще мало
используется для синтеза белков тканей. Введенный меченый оксипролин
обнаруживается в очень малых концентрациях в белках тканей. При вве-
дении же меченого пролина в белках тканей обнаруживается большая
концентрация меченого оксипролина, чем при введении меченого оксипро-
лина. Эти данные указывают, что оксипролин тканевых белков возникает
из пролина. В гидроксилировании пролина в белках участвует аскорбино-
вая кислота. При недостатке последней (при цинге) нарушается образование
проколлагена— белка с высоким содержанием оксипролина. Об особом
поведении оксипролина у животных легко судить по результатам исследо-
ваний с кормлением животных различными аминокислотами. В то время
как различные аминокислоты, введенные в организм с пищей, легко ими ус-
ваиваются, при введении оксипролина имеет место его выделение в значи-
тельных количествах в неизменном виде.
Обмен пролина связан с обменом орнитина. При введении крысам орни-
тина, меченного дейтерием, было обнаружено наличие в белках тканей ме-
ченных дейтерием пролина и глутаминовой кислоты. Как уже указывалось
(стр. 365), орнитин при окислительном отщеплении o-аминогруппы прев-
ращается в полу альдегид глутаминовой кислоты, а затем в глутаминовую
кислоту. Полуальдегид глутаминовой кислоты может превратиться в про-
лин. В этом случае происходит циклизация структуры полуальдегида глу-
таминовой кислоты. С другой стороны, оксидаза пролина (стр. 364) катали-
зирует расщепление пролина с образованием глутаминовой кислоты. Отсюда
следует, что обмен пролина, оксипролина, орнитина и глутаминовой кисло-
ты тесно связан друг с другом. Представление об этой связи дает следую-
щая схема:
Н2С — СН2
сн-соон
Пролин
А
окисление
--------->
ноне---сн2
Н2С—-СНо
сн-соон
сн-соон
Полуальдегид
глутаминовой кислоты
Д-Пирролидин-5-карбоновая
кислота
ch2nh2
сн2
сн2
I
chnh2
I
СООН
Орнитин
СООН
I
сн2
сн2
I
chnh2
I
СООН
Глутаминовая
кислота
ОБМЕН ЛИЗИНА
L-Лизин является незаменимой аминокислотой для всех животных
и единственной диаминомонокарбоновой кислотой (если не считать аргинин,
который обычно относят к числу диаминомонокарбоновых кислот), входя-
386
щей в состав белков. Обмен лизина отличается от обмена других аминокис*
лот тем, что его а-аминогруппа слабо участвует в реакции переаминиро-
вания с а-кетоглутаровой кислотой. Опыты с введением лизина, меченного
тяжелым изотопом азота в аминогруппах и дейтерием в углеродной цепи,
показали, что лизин пищи включается в белки тканей, не подвергаясь ка-
ким-либо предварительным воздействиям.
Путь превращения лизина, по-видимому, следующий:
лО
CH2-NH2 С< СООН СООН СООН
I I хн I I I
сн2 сн2 сн2 сн2 сн2.
I —NH3 I +н2о | —NH3 I -СО2 I
сн2 -»- сн2 -> сн2 -> сн2 ---> сн2
| -t-о | —н2 I 4-0 | 4-Н2О—н2 |
сн2 сн2 сн2 сн2 сн5
I 1111
chnh2 chnh2 chnh2 СО СООН
I III
СООН СООН СООН СООН
Лизин
Альдегид а-амино-
адипиновой кислоты
а-Аминоадипиновая а-Кетоадипиновая Глутаровая
кислота кислота кислота
Опыты с введением в организм лизина, меченного радиоактивным угле-
родом в положении о, показали, что углерод лизина появляется в глутами-
новой кислоте белков тканей, а также, что глутаровая кислота может пре-
вратиться в глутаминовую кислоту. В этом случае она должна предвари-
тельно окислиться с образованием а-кетоглутаровой кислоты, которая мо-
жет обратимо аминироваться с помощью дегидрогеназы глутаминовой
кислоты (стр. 362). Следует, однако, указать, что путь превращения
глутаровой кислоты в а-кетоглутаровую остается еще совершенно не вы-
ясненным.
ОБМЕН АРГИНИНА
Характерной химической особенностью аргинина является наличие
в его молекуле наряду с а-аминогруппой еще и амидиновой группы (NH2—
—C=NH), расположенной у 5-аминогруппы. Амидиновой группе принад-
лежит важная роль в обмене азотистых веществ в организме человека и жи-
вотных. Амидиновая группа аргинина подвижна и с помощью амидинфераз
переносится на другие вещества. Она отщепляется также путем гидролиза
с образованием молекулы мочевины. Участвующий в этой реакции фермент
известен под названием аргиназы. При перенесении амидиновой группы на
глицин появляется гуанидинуксусная кислота — предшественник креати-
на. При перенесении амидиновой группы, а также при гидролитическом ее
отщеплении аргинин превращается в орнитин:
nh2 nh2
C=NH nh2 1 C=NH
NH +Нао 1 сн2 1 NH
1 сн9 -> 1 СНа 4- CO(NH2)2; 1 сн2
1 Мочевина
сн2 сн2 сн2
1 1 1
сн2 chnh2 1 СНз
1 chnh2 СООН chnh2
1 СООН СООН
Аргинин Орн-итин Аргинин
nh2
I
сн2
I
СООН
Глицин
13*
387
nh2
сн2
I
сн2
I
сн2
I
chnh2
I
COOH
Орнитин
nh2
I
C=NH
I
NH
I
CH2
I
COOH
Гуанидин-
уксусная кислота
Орнитин, в результате переаминирования 3-аминогруппы, дает полу-
альдегид глутаминовой кислоты, который окисляется с образованием глу-
таминовой кислоты.
Орнитин наряду с этим может явиться источником образования проли-
на (стр. 386).
Перенесение амидиновой группы от аргинина — процесс необратимый,
тем не менее из орнитина в организме образуется аргинин. Происходит это
в результате превращения его в цитруллин, а затем цитруллина в аргинин.
Превращение аргинина может начаться (установлено для печени индюка)
с процесса его окислительного дезаминирования. В этом случае из аргинина
получается а-кето-В-гуанидинвалерьяновая кислота.
У млекопитающих животных аргинин предварительно гидролизуется
с образованием орнитина, который затем уже подвергается дальнейшим
превращениям.
Продуктами превращения орнитина могут быть пролин и глутамино-
вая кислота (стр. 386).
Синтез аргинина у животных, хотя и возможен, но он ограничен. Это
подтверждается следующим примером. При кормлении молодых животных
пищей, в белках которых отсутствует какая-либо незаменимая аминокисло-
та, они теряют в весе и обычно погибают. Если же кормить молодых живот-
ных пищей, не содержащей аргинина, наблюдается замедление роста, но
животные не погибают.
Эти данные показывают, что у животных аргинин синтезируется, но
размеры этого синтеза недостаточны для того, чтобы обеспечить интенсив-
ный синтез белков (при наличии других аминокислот), имеющий место во
время роста молодого организма.
Благодаря синтезу орнитина из пролина аргинин, в известной мере,
заменим. Чем интенсивнее синтез орнитина, тем меньше организм зависит
от поступления аргинина с белками пищи. У птиц синтез орнитина проис-
ходит более интенсивно, чем у млекопитающих. У птиц орнитин ис-
пользуется не только для синтеза аргинина, но и для обезвреживания бен-
зойной кислоты путем образования орнитуровой кислоты.
ОБМЕН АСПАРАГИНОВОЙ И ГЛУТАМИНОВОЙ КИСЛОТ
Аспарагиновая и глутаминовая кислоты играют исключительно важную
роль в азотистом обмене. Эти две аминокислоты связывают между собой
обмен белков и обмен углеводов. Обращает также на себя внимание высокое
содержание аспарагиновой и глутаминовой кислот в составе белков тканей
различных организмов. Особенно богаты этими аминокислотами белки рас-
тительного происхождения; содержание аспарагиновой и глутаминовой
кислот в растительных белках составляют 25% и более и достигает в от-
дельных случаях 70—80%.
Аспарагиновая и глутаминовая кислоты образуются у животных раз-
личными путями. Они освобождаются как продукты распада белков, а
388
также синтезируются из продуктов обмена углеводов. Соответствующие
им а-кетокислоты — щавелевоуксусная и а-кетоглутаровая—являются ком-
понентами цикла трикарбоновых кислот (стр. 271).
Глутаминовая кислотаможет синтезироваться в различных тканях жи-
вотных, благодаря универсальности цикла трикарбоновых кислот и широте
распространения в тканях дегидрогеназы глутаминовой кислоты, обратимо
катализирующей реакцию:
—NH3
НООС-CH2-CH2-CHNH2-СООН <------* НООС.СН2.СН2-СО‘СООН
+NH,
Два обстоятельства благоприятствуют восстановительному аминиро-
ванию а-кетоглутаровой кислоты: 1) условия, существующие в тданях,
благоприятствуют течению реакции, катализируемой дегидрогеназой глута-
миновой кислоты, в сторону аминирования а-кетоглутаровой кислоты и
2) для восстановительного аминирования а-кетоглутаровой кислоты может
быть использован водород, возникающий в тканях организма при окисле-
нии различных органических веществ.
Возможность широкого синтеза глутаминовой кислоты в тканях, в свою
очередь, создает условия для образования аспарагиновой кислоты: амино-
группа глутаминовой кислоты переносится на щавелевоуксусную кислоту
и дает аспарагиновую кислоту:
НООС • СН2 ♦ СН2 • CHNH2 • СООН + НООС • СН2 • СО - СООН НООС • СН2.
•сн2-со-соон + HOOC-CH2<HNH2COOH
Образование глутаминовой и аспарагиновой кислот из углеводов мо-
жет быть показано схематически:
углеводы
жирные кислоты
Ацетил-SKoA
углеводы
СО-
аспарагиновая
кислота
пировиноградная
кислота
фумаровая
кислота
глутаминовая
кислота
яблочная
кислота
ш, авелевоуксусная
кислота
лимонная
кислота
янтарная
кислота
. <£-кетоглутаровая
в г кислота
цис-аконитовая
кислота
изолимонная
кислота
ui, авелевоянтарная
кислота
Рис. 18. Схема образования глутаминовой и аспарагиновой кислоты из углеводов
а-Кетоглутаровая кислота (стр. 368) и есть те «ворота», через которые
включается в обмен веществ и используется в организме для синтеза азо-
359
тистых веществ аммиак. Это относится как к растениям, так и к животным.
У растений синтезируются различные а-кетокислоты — предшественники
всех аминокислот, из которых строятся белки. Глутаминовая кислота, легко
синтезирующаяся из а-кетоглутаровой кислоты и аммиака, является доно-
ром аминогрупп, необходимых для синтеза аминокислот из различных
а-кетокислот.
У животных синтезируется ограниченное число а-кетокислот, из ко-
торых также образуются аминокислоты путем перенесения аминогрупп
от глутаминовой кислоты.
Как у растений, так и у животных глутаминовая и аспарагиновая кис-
лоты являются донорами азота (аминогрупп) не только для а-кетокислот, но
и для других безазотистых веществ.
Отсюда вытекает, что эти две аминокислоты играют очень важную роль
в процессах обмена веществ.
Источником для образования глутаминовой кислоты являются не толь-
ко продукты превращения углеводов и жирных кислот, но и некоторые ами-
нокислоты (пролин, аргинин — через орнитин, гистидин).
Глутаминовая кислота под влиянием специфической для нее декарбок-
силазы подвергается декарбоксилированию с образованием у-аминомасля-
ной кислоты. При этом отщепляется углекислый газ от карбоксильной груп-
пы, смежной с а-углеродом.
рАминомасляная кислота встречается в головном мозге, она обнару-
живается и в иных тканях.
СООН
I
chnh2 ch2nh2
I -СО2 I
сн2 ----------> сн2
I I
сн2 сн2
I I
СООН СООН
Глутаминовая f-Аминомасляная
кислота кислота
Подобно глутаминовой кислоте, декарбоксилированию подвергается
аспарагиновая кислота. Углекислый газ также отщепляется от ее карбок-
сильной группы, смежной с ^-углеродом, с образованием р-аланина. Подоб-
ный процесс имеет место у бактерий, у животных р-аланин возникает при
распаде пиримидиновых оснований (стр. 454).
Образующийся р-аланин входит в состав физиологически важных ве-
ществ — карнозина, кофермента ацилирования, пантотеновой кислоты.
Глутаминовая и аспарагиновая кислоты встречаются не только в сво-
бодном состоянии, но и в виде своих амидов — глутамина и аспарагина.
Эти амиды с давних пор обнаружены в растениях. Некоторые растения со-
держат преимущественно аспарагин, например этиолированные проростки
бобовых, другие — глутамин (корни свеклы), третьи — аспарагин и глу-
тамин (клубни картофеля). В тканях животного глутамин был обнаружен
значительно позже (Д. Л. Фердман). Затем было установлено наличие в
тканях позвоночных животных аспарагина (С. Р. Мардашев). Содержание
аспарагина в тканях животных очень невелико — в десять раз меньше, чем
глутамина.
Глутамин и аспарагин возникают в растительных и животных тканях
при устранении аммиака. О физиологическом значении синтеза глутамина
и аспарагина см. на стр. 423.
Глутаминовая кислота и ее амид—глутамин в довольно значительных
количествах встречаются в свободном виде в тканях и жидкостях живот-
ных.
390
Синтез глутамина из глутаминовой кислоты, т. е. амидирование глута-
миновой кислоты, происходит с использованием энергии макроэргических
фосфатных связей аденозинтрифосфорной кислоты.
СООН
I
CHNH2
I
СН2 + NH3 + АТФ
I
СН2
I
СООН
Глутаминовая
кислота
СООН
chnh2
I
> СН2 + АДФ+Н3РО4
I
сн,
I
conii2
Глутамин
Подобный механизм амидирования характерен и для синтеза аспараги-
на; он одинаков для животных и растений.
Амидный азот глутамина используется в тканях организмов для синте-
за ряда азотистых соединений, без промежуточного образования ам-
миака, с помощью ферментов, катализирующих перенесение их амидных
групп на те или иные соединения.
В настоящее время установлено, что амидный азот глутамина непосред-
ственно используется для: 1) синтеза пуринового ядра (стр. 455); 2) амини-
рования ксантозинфосфорной кислоты с образованием гуаниловой кислоты;
3) аминирования глюкозы с образованием глюкозамина — вещества, вхо-
дящего в состав мукопротеидов (стр. 540). В организме человека и челове-
коподобных обезьян глутамин используется для синтеза фенилацетилглута-
мина — вещества, выделяющегося с мочой при введении в организм фенил-
уксусной кислоты.
ZO
|\н
НСОН conh2
I I
носн + сн2
I I
НСОН сн2
I I
НСОН chnh2
I I
СН2ОН СООН
HCNH, СООН
I ' I
-------> НОСН ч- сн2
I I
НСОН сн,
I I
НСОН chnh2
I I
СН2ОН СООН
Глюкоза
Глутамин
Глюкоза мин
Глутаминовая
кислота
С-СНо-СООН
сн
Фенилуксусная
кислота
conh2
сн2
I
сн2
I
chnh2
I
СООН
Глутамин
с-сн2-со
Фенилацетилглута мин
conh2
I
сн2
I
сн2
сн
СООН
391
Представление об участии глутамина в биохимических процессах с пе-
ренесением от него амидной группы дает следующая схема:
Синтез гуаниловой Синтез пуринов Синтез глюкозамина
кислоты
Ксантозинфосфор- '
ная кислота +
Глутамин
+Глюкоза
Мукопротеиды
Глутаминовая кислота
Наряду с этим в тканях животных и растений содержатся ферменты,
катализирующие реакции гидролитического отщепления аммиака от глу-
тамина (глутаминаза) и от аспарагина (аспарагиназа). Наибольшей глута-
миназной активностью обладает ткань почек, затем ткани головного мозга,
печени, мышц.
ОБМЕН СЕРУСОДЕРЖАЩИХ АМИНОКИСЛОТ
Цистеин, цистин и метионин — три аминокислоты, содержащие в сво-
их молекулах серу, являются источниками серной кислоты у животных.
Обмен этих аминокислот имеет некоторые общие черты, особенно это от-
носится к обмену цистеина и цистина, которые легко превращаются друг в
друга
S -S SH
1 1 1
сн2 СН2 +Н2 • „сн*
1 1 < - 2 |
chnh2 CHNH2 -н, chnh2
1 1 1
СООН СООН СООН
Цистин Цистеин
С реакции восстановления цистина, ведущей к образованию из него цис-
теина, начинаются превращения цистина в организме. Превращение же ци-
стеина, независимо от того, возник ли он из цистина, или же иным путем,
может начаться в организме с окисления группы SH (тиоловой или сульф-
гидрильной группы), с отщепления аминогруппы или же с декарбоксили-
рования. В зависимости от этого появляются различные продукты распада
цистеина.
Окисление тиоловой группы цистеина приводит к образованию цисте-
иновой кислоты. При дезаминировании последней возникает р-сульфопи-
ровиноградная кислота. С другой стороны, цистеиновая кислота подвер-
гается декарбоксилированию с освобождением таурина
CH2SH
I
chnh2
I
СООН
Цистеин
zO
сн2—Sx=O
\он ’
chnh2
I
СООН
Цистеиновая кислота
^О
CH2sCo
" Lox°H
।
СООН
|3-Сульфопировиноградная
кислота
392
CH2S=O
\эн
chnh2
I
соон
-co2
z^°
СН2—S==O
\он
ch2nh2
Цистеиновая
кислота
Таурин
Окисление тиоловой группы цистеина происходит постепенно с образо-
ванием промежуточных продуктов. В печени млекопитающих содержится
ферментная система, катализирующая окисление цистеина в цистеинсуль-
феновую кислоту и последнюю — в цистеинсульфиновую, а затем в цистеи-
новую кислоту.
CH2SH
I
chnh2
I
соон
Цистеин
CH2S—он
* I
chnh2
I
соон
Цистеинсульфеновая
кислота
chnh2
I
соон
Цистеинсульфиновая
кислота
У5
CH2-S=O
\эн
chnh2
I
соон
Цистеиновая
кислота
Цистеинсульфиновая кислота под влиянием ферментов печени может
претерпевать различные превращения: декарбоксилирование с образованием
гипотаурина, из которого путем окисления образуется таурин, переамини-
рование с появлением p-сульфинилпировиноградной кислоты. При отщеп-
лении от p-сульфинилпировиноградной кислоты остатка сернистой кислоты
образуется пировиноградная кислота, которая в результате переаминиро-
вания с глутаминовой кислотой превращается в аланин. Пировиноградная
кислота наряду с этим может также дать начало образованию гликогена.
Этим путем устанавливается связь между превращением метионина и об-
меном углеводов:
Цистеинсульфиновая
кислота
-H2SO3
З-Сульфинилпировиноградная
кислота
СН3 _ гликоген СН3
I ..-••• I
СО /•' chnh2
—h2so3 I -------------> I
-------> СООН * соон
Пировиноградная Аланин
кислота
Возникающая из p-сульфинилпировиноградной кислоты сернистая кис-
лота в печени окисляется в серную кислоту.
Цистеин в организме подвергается декарбоксилированию с образова-
нием меркаптоэтиламина, входящего в состав кофермента ацилирования.
CH2SH
I
chnh2
I
соон
Цистеин
_ CH2SH
—со2 ।
” ch2nh2
Меркаптоэтиламин
3S>3
Большой интерес представляет превращение метионина» Он, как и
другие аминокислоты, подвергается реакциям переаминирования, но на-
ряду с этим участвует во многих процессах благодаря наличию метильной
группы. В организме имеются ферменты метилферазы, катализирующие
перенесение метильной группы от метионина на другие вещества. Отщепле-
ние метильной группы от метионина сопровождается образованием гомо-
цистеина (гомолог цистеина, имеющий на одну СН2-группу больше, чем
цистеин)»
CH2S. СНз
I
СНо
I
chnh2
I
СООН
Л!етионнн
CH2SH
I
сн2
I
ciinh2
I
СООН
Гомоцистеин
Метильная группа переносится на то или иное вещество (например
на гуанидинуксусную кислоту), становясь на место одного из его атомов
водорода. Образование гомоцистеина in vivo подтверждено в опытах, по-
ставленных на растущих крысах, содержащихся на диете, бедной метио-
нином. Добавление гомоцистеина и холина предохраняло молодых живот-
ных от остановки роста и гибели. В этих опытах холин служил источником
метильных групп для превращения гомоцистеина в метионин. Опыты с
введением в организм холина, меченного в метильных группах дейтерием,
и гомоцистеина показали, что гомоцистеин превращается в метиошшпри
использовании метильных групп холина. Выделенный из белков тканей
в этих опытах, метионин имел меченную дейтерием метильную группу. С
другой стороны, при введении в организм метионина, меченного дейтерием
в метильной группе, можно было выделить из тканей организма холин (вер-
нее холинсодержащие вещества — лецитин и др.), метильные группы ко-
торого были мечены дейтерием. Дю Виньо, изучая процессы метилирования
ряда веществ, пришел к заключению о существовании подвижных метиль-
ных групп, способных переходить в организме от одного соединения на
Другое.
Реакции перенесения метильных групп, катализируемые метилфера-
зами, получили название реакций переметилирования.
Метионин — основной донор метильных групп в организме. Что же
касается других веществ — источников метильных групп, то их СН3-груп-
пы используются для метилирования гомоцистеина с образованием метио-
нина. Метионин же является универсальным донором СН3-групн, ис-
пользуемых для метилирования различных соединений (этаноламина,
карнозина, гуанидинуксусной кислоты, норадреналина, никотинами-
да и др.).
Изучение процессов метилирования в изолированных тканях (печени)
позволило подойти к выяснению механизма перенесения метильной группы
от метионина на другие вещества. Прежде всего было установлено, что в
процессе метилирования участвует аденозинтрифосфорная кислота, которая
при этом дефосфорилируется, теряя все свои три остатка фосфорной кислоты.
Более детальное изучение взаимодействия аденозинтрифосфорной кис-
лоты с метионином показало, что прежде, чем подвергнуться деметили-
рованию, метионин активируется. Активирование метионина — фермента-
тивный процесс, протекающий в печени. Активирующий метионин фермент
обнаружен в печени различных животных. Его удалось получить в виде
водорастворимого, свободного от клеток препарата. Активный метионин,
образующийся в результате взаимодействия метионина с аденозинтрифос-
394
форной .кислотой, выделен и выяснена его химическая природа. Это
S-аденозилметионин, образующийся следующим образом:
S-CH3
сн2
сн,
I 2
CHNH;
СООН
Аденозинтрифосфорная кислота
4-Н2О
Метионин
ГМЫ NT
СООН
+ Н4р2о7
Пиро'фос -
формая
кислота
S-А денозилметионин (активный метионин)
+ Н3РО4
О Фосфорная
кислот-а
В опытах с ферментными растворами было показано, что S-аденозил-
метионин при реакциях переметилирования заменяет метионин и адено-
зинтрифосфорную кислоту. Действие различных метилфераз начинается с мо-
мента образования S-аденозилметионина. Следовательно, как субстрат
для действия их выступает не свободный метионин, а S-аденозилмети-
онип.
Процессы переметилирования имеют большое физиологическое значе-
ние. Они участвуют в процессах образования креатина, ансерина, адрена-
лина и холина. Наряду с этим метильные группы метионина используются
для метилирования некоторых поступающих в организм веществ (амида-
никотиновой кислоты), а также и ядовитых веществ (пиридин и соедине-
ния селена).
СН СН
HO^^C-CONHa НС|^\з-СОНН2
Никотинамид
N-метилникотинамид
395
сн
Пиридин
N-метилпиридин
Диметилселен
Эти метилированные вещества выделяются с мочой.
Наряду с участием в реакциях переметилирования метильные группы
метионина и некоторых других веществ подвергаются в организме окисле-
нию. Так, например, при кормлении крыс метионином, меченным в метиль-
ной группе С14, в выдыхаемом ими воздухе обнаруживается радиоактивный
углекислый газ. То же самое можно наблюдать при кормлении крыс холи-
ном, бетаином, диметилтетином, саркозином, меченными С14 в метильных
группах. Естественно, встает вопрос, какие именно соединения образуются
при окислении подвижных (способных к переметилированию) метильных
групп. Ответ на этот вопрос дают следующие экспериментальные данные.
Установлено, что при введении крысам меченного С14 в метильной группе
холина, С14 обнаруживается не только в выдыхаемом углекислом газе, но и
в p-углероде серина. Это указывает, что метильная группа, по-видимому,
окисляется с образованием формальдегида. Как известно, серин может воз-
никнуть из глицина и формальдегида (стр. 378). При введении крысам ме-
ченного С14 в метильных группах саркозина и бетаина в моче появляются
радиоактивные формальдегид и муравьиная кислота. Следовательно, ме-
тильные группы окисляются, и продуктами их окисления являются фор-
мальдегид, муравьиная кислота и углекислый газ. Первые два вещества
используются для синтеза других соединений (например, серина из глицина).
Окисление подвижных метильных групп ряда соединений с использованием
их углерода для синтеза серина установлено также в опытах in vitro, где
эти соединения, меченные в метильной группе радиоактивным углеродом,
добавлялись к измельченной ткани печени и почек.
Окисление метильных групп метионина, по-видимому, является про-
цессом, поддерживающим на определенном уровне содержание метионина
в тканях. Это подтверждается тем фактом, что чем больше поступает в ор-
ганизм метионина, тем большее количество его метильных групп оказыва-
ется в виде углекислого газа в выдыхаемом воздухе.
Наряду с окислением подвижных метильных групп, входящих в со-
став ряда соединений, в организме происходит и их синтез. Установлено,
что предшественниками подвижных метильных групп могут явиться му-
равьиная кислота, формальдегид, метиловый спирт, ацетон, глицерин, се-
рин и гистидин. За исключением муравьиной кислоты и ее альдегида, все
остальные упомянутые соединения должны подвергнуться превращениям,
приводящим к образованию вещества, содержащего один атом углерода в
своей молекуле (Сгсоединение). Этим соединением, как установлено, яв-
ляется не углекислый газ, а, по-видимому, формальдегид, находящийся
в активированном состоянии (оксиметиленовый остаток в соединении с вос-
становленной фолиевой кислотой).
Оксиметиленовый остаток восстановленной фолиевой кислоты восста-
навливается с образованием метильной группы. Следует, однако, указать,
что при нормальных условиях питания основная масса подвижных метиль-
ных групп поступает в организм с метионином пищи, затем метионин акти-
вируется (образование S-аденозилметионина) и с помощью метилфераз
СН з-группа от него переносится на другие соединения.
Превращения метионина иллюстрирует схема (см. стр. 397).
S-метил метионин может подвергнуться декарбоксилированию с образо-
ванием S-аденозилпропиламина, аминопроциловый остаток которого исполь-
зуется при синтезе спермидина и спермина (стр. 371).
396
Серин
Холин
д
Адреналин
Гомоцистеин
N-Метилни-
котинамид
Цистатионин
Гомосерин
Спермин
Пировиноградная
кислотам------
Цистеин
-^Креатин
->Ансерин
^Спермидин
Цистин
Образование цистеина из метионина
Учитывая, что при наличии метионина в пище цистеин становится заме-
нимой аминокислотой в организме, уже давно высказывалось мнение, что
цистеин может образовываться из метионина. Это мнение нашло свое под-
тверждение. Первым этапом превращения метионина в цистеин является
деметилирование метионина с образованием гомоцистеина (а-амино-у-тио-
масляная кислота). Гомоцистеин реагирует с серином с образованием диа-
мино-дикарбоновой серусодержащей аминокислоты — цистатионина. Ци-
статионин является промежуточным продуктом превращения метионина в
цистеин и не входит в состав белков. Участие серина в синтезе цистеина
установлено в опытах in vivo. В опытах со срезами печени крыс было по-
казано, что при наличии метионина или гомоцистеина добавление серина
приводит к образованию цистатионина. Оказалось также, что при введении
в организм М15-серина в белках тканей обнаруживается №5-цистеин.
Образование цистатионина из метионина и серина происходит в два
этапа:
CH2S-CH3
I
сн2
I
chnh2
I
соон
Метионин
CH2SH
I
сн2
--------> I
chnh2
соон
Гомоцистеин
(1)
CH2SH 1 сн2 - S —сн2
1 сн2 СН2ОН сн2 1 CHNH
1 chnh2 1 chnh2 " ' Ml _ chnh2 соон
1 соон 1 соон соон
Серин Цистатионин
2
(2)
397
Расщепление цистатионина приводит в печени к образованию цистеина,
аммиака и а-кетомасляной кислоты. Из печени получены две ферментные
системы, содержащие в виде кофермента пиридоксальфосфат. Одна из них
катализирует образование цистатионина, а вторая — его расщепление на
цистеин, аммиак и а-кетомасляную кислоту
сн2 1 сн2 -S — сн2 1 CHNH, CH2SH сн3 1 сн2
1 chnh2 1 — СООН 1 chnh2 4-NH3+ I СО
СООН 1 СООН 1 СООН
Цистатионин Цистеин а-Кетомасляная кислота
Из приведенных уравнений видно, что при образовании цистеина из
метионина имеет место перенесение SH-группы гомоцистеина на серин.
Образующийся цистеин, как уже указывалось (стр. 392), участвует
в образовании ряда веществ в организме. Наряду с этим он также исполь-
зуется для обезвреживания определенных ароматических соединений, да-
вая замещенные меркаптаны с общей формулой
R—S—СН2—СН. СООН
I
NH—СО-СН3
Эти соединения получили название меркаптуровых кислот, так как
при щелочном гидролизе из них образуется меркаптан — Z?SH. Образо-
вание меркаптуровой кислоты и выделение ее с мочой можно вызвать введе-
нием животному галоидозамещенных бензолов, например бромбензола.
В этом случае из организма выводятся меркаптуровая кислота и парное
соединение ее с глюкуроновой кислотой — ее глюкуронид:
СВг
hc/^44сн
С—S—СН2—СН—СООН
I
NH-CO-CH3
/Меркаптуровая кислота
СВг
С помощью бромбензола можно как бы улавливать образующийся в
организме цистеин.
Так как цистеин (цистин) может получиться из метионина, то цистеин
относится к числу заменимых, а метионин — к числу незаменимых амино-
кислот. Однако установлено, что потребность животных в метионине может
частично быть снижена за счет цистеина или цистина. Это объясняется тем,
398
что при наличии цистеина (цистина) в составе белков пищи потребность в нем
организма покрывается за счет притока его извне, и объем превращения ме-
тионина в цистеин уменьшается. Следовательно, наличие в пище цистеина
(цистина) сокращает расход метионина в организме.
При обработке белков, содержащих метионин, трихлорамином («аге-
ном») образуются так называемые агенизированные белки, при гидролизе
которых среди аминокислот вместо метионина обнаруживается вещество,
близкое к нему — метионинсульфоксимин:
СН3
I
O=S=NH
I
сн2
I
сн2
I
CHNH3
СООН
Метионинсульфоксимин
Кормление собак агенизированными белками, или введение им метио-
нинсульфоксимина, вызывает судорожные припадки. Метионинсульфокси-
мин тормозит рост многих бактерий.
Продукты окисления серы, входящей в состав цистеина,
цистина и метионина
Одним из конечных продуктов обмена серусодержащих аминокислот
является серная кислота. В виде сульфатов серная кислота выделяется с
мочой. Сульфаты содержатся также и в крови. Наряду с солями серной кис-
лоты и ее эфирами (эфиросерными, или парными сернщми кислотами) в
моче имеется некоторое количество неокисленной до конца серы — так назы-
ваемой нейтральной серы. Нейтральная сера обнаруживается и в безбелко-
вом фильтрате крови. При минерализации мочи, а также безбелкового экс-
тракта крови, все входящие в их состав недоокисленные соединения серы
превращаются в сульфаты. Сульфаты легко осаждаются ионами бария, а
также образуют нерастворимые соединения с бензидином и могут быть оп-
ределены количественно. Общее количество серы составляет так называе-
мую общую серу. Общая сера состоит из неорганических сульфатов (при-
мерно на 80%), эфирной серы (сульфатов, входящих в состав эфиров общей
формулы 7?—О—SO3H). К ним относятся фенолсерная кислота, индикан.
Количество эфирной серы составляет 6—8% общей серы. Остальное
количество, 12—14%, общей серы приходится на долю нейтральной, т. е.
неокисленной серы, входящей в состав органических серусодержащих
веществ.
Источниками серы в моче наряду с цистеином, цистином и метионином
могут явиться и другие вещества, например витамины — тиамин, биотин.
Однако количество этой серы очень невелико и его можно не принимать в
расчет. По количеству общей серы мочи судят об объеме распавшихся в ор-
ганизме серусодержащих аминокислот, а отсюда и о количестве распав-
шихся белков.
Цистинурия
Одним из расстройств азотистого обмена является выделение цистина
с мочой, т. е. цистинурия, редко встречающаяся у людей. Количество цис-
тина, выводимого из организма человека при тяжелых случаях цистину-
рии, составляет 2 грамма в сутки. Цистин плохо растворим в воде и при
выделении его он может выпадать из раствора в почках, мочевом пузыре
399
и мочеточниках и создавать условия для образования цистиновых камней.
Выпадает в виде осадка цистин и в моче.
Цистин был открыт при исследовании камней, отложенных в мочеточ-
никах, около 150 лет тому назад, когда о наличии его в белках еще не было
известно. Цистин не является единственной аминокислотой, содержащейся
в моче при цистинурии. Установлено, что наряду с ней в моче есть такие
аминокислоты, как лизин, аргинин, орнитин, а также амины — кадаверин
и путресцин. Содержание аргинина и особенно лизина в моче больных цис-
тинурией часто бывает выше, чем содержание цистина. Отсюда можно за-
ключить, что при цистинурии выделяются с мочой различные аминокисло-
ты, в том числе и цистин. Выделение аминокислот с мочой носит название
аминоацидурии. Аминоацидурия может быть вызвана экспериментальным
путем, например аноксемией (недостаток кислорода в крови) и асфиксией
(удушение).
Наблюдается аминоацидурия и при беременности. Однако в этом слу-
чае она непродолжительна, в то время как цистинурия, раз начавшаяся,
не прекращается у человека в течение всей его жизни.
С биохимической точки зрения представляет интерес выяснить, какие
именно изменения в обмене серусодержащих аминокислот приводят к вы-
делению цистина с мочой? Из серусодержащих аминокислот, встречаю-
щихся в составе пищи, больше всего цистина и метионина. Можно было бы
допустить, что цистин, поступающий в организм с белками, не подвергается
в должном объеме расщеплению и выделяется с мочой. Это допущение, од-
нако, не находится в соответствии с установленным фактом, показывающим,
что при цистинурии в моче наряду с цистином содержатся в достаточно боль-
шом количестве сульфаты, которые, как известно, образуются в виде конеч-
ных продуктов распада серусодержащих аминокислот, в том числе цистина.
Далее показано, что введение человеку, страдающему цистинурией, белков,
богатых цистином, не приводит к усилению выделения цистина с мочой.
Отсюда следует, что источником цистина в моче при цистинурии является
не пищевой цистин, а цистин, образующийся из других серусодержащих
аминокислот,— цистеина или метионина. Введение в организм при цисти-
нурии каждой из этих двух аминокислот приводит к усилению выделения
цистина. Цистин, выделяющийся с мочой при цистинурии, образуется из
метионина, а также из промежуточного продукта превращения метионина
в цистеин — цистатионина (стр. 397). Оба эти вещества, меченные радиоак-
тивной серой, вводились человеку, страдающему цистинурией, а затем изу-
чалось содержание радиоактивной серы в цистине.
Цистин мочи оказался при этом интенсивно метенным радиоактивной
серой. Цистинурия — заболевание, связанное с изменениями в обмене ме-
тионина и цистеина.
Как указывалось, при цистинурии наряду с цистином в моче обнару-
живаются в значительных количествах аргинин и лизин. Причина появле-
ния в моче цистина и других аминокислот остается еще невыясненной.
Предполагают, что их выделение связано с замедленным обратным всасы-
ванием их в извитых канальцах почек.
Цистинурия — наследственное заболевание; она встречается не только
у людей, но и у животных (собаки).
ОБМЕН ГИСТИДИНА
Гистидин — единственная аминокислота, встречающаяся в белках и
имеющая в своем составе имидазольное ядро. Гистидин относится к неза-
менимым для животных аминокислотам. Однако взрослый человек может1
обходиться без доставки ему гистидина с пищей. Отсюда возникает пред-
положение, что у человека гистидин образуется путем синтеза из других
веществ. В этом случае следовало бы допустить, что организм человека
400
способен синтезировать имидазольное ядро. Справедливость этого допу-
щения не исключена, но оно, тем не менее, остается недоказанным прямыми
опытами. Способность взрослого человека обходиться без гистидина в пище
может быть связана с тем, что гистидин синтезируется у него в кишечнике
микроорганизмами и оттуда всасывается в кровь. Возможно, что организм
взрослого человека обходится очень малыми количествами гистидина и об-
разование его микрофлорой кишечника достаточно для удовлетворения его
потребности.
Имидазольное ядро гистидина в организме животных расщепляется.
Установлено, что в печени содержатся ферменты, объединенные под назва-
нием гистидаза, способные расщеплять имидазольное ядро гистидина с об-
разованием молекулы глутаминовой кислоты, молекулы муравьиного альде-
гида и двух молекул аммиака.
В выяснении пути расщепления в организме гистидина выдающуюся
роль сыграли опыты с применением изотопов. Гистидин в этих опытах ме-
тился в различных частях своей молекулы С14 и N15. Меченые молекулы
гистидина вводились в организм, а затем изучалось появление изотопов в
предполагаемых промежуточных продуктах распада гистидина. Резуль-
таты этих опытов показали, что начальной реакцией превращения гисти-
дина является его дезаминирование при участии фермента гистидиндеза-
миназы с образованием уроканиновой кислоты и аммиака.
N---С • СН2 • СН • NH2 • СООН
Гистидин
—NH3
N--С—СН=СН-СООН
НС^/СН
NH
Уроканиновая кислота
Уроканиновая кислота под влиянием уроканиназы подвергается даль-
нейшему расщеплению с выделением формамидглутаминовой кислоты.
СООН
N — С—СН=СН-СООН
НС^/СН + 2Н2О --
NH
CH-NHCH=NH
I +н2о
СН2 ------>
| —NH3
сн2
СООН
Уроканиновая кислота
Формамидглутаминовая
кислота
СООН
I /£>
CH-NH-C^
> сн2
I
сн2 --------->
I
СООН
Фор м илглу там инова я
кислота
СООН
I
сн—nh2
I
СН2 +НСООН
I Муравьиная
I , кислота
сн2
I
СООН
Глутаминовая
кислота
Формилглутаминовая кислота расщепляется с образованием глутами-
новой и муравьиной кислот.
Образование глутаминовой кислоты сближает обмен гистидина с об-
меном углеводов в организме (стр. 389), а образование муравьиной кислоты—
401
с обменом глицина и серина (стр. 378). У двустворчатых моллюсков превра-
щение гистидина происходит без промежуточного образования уроканино-
вой кислоты. У них гистидин теряет а-аминогруппу с образованием ими-
дазолпировиноградной кислоты, которая, декарбоксилируясь, превращает-
ся в имвдазо л уксусную кислоту и в иные имид азол содержащие соеди-
нения.
В организмах встречаются производные гистидина, имеющие в своем
составе имидазольное ядро. Среди них особенно интересен гистамин, обра-
зующийся при декарбоксилировании гистидина микроорганизмами, а так-
же ферментами ряда тканей животных. Гистамин в очень малых количест-
вах обнаружен в связанном состоянии в различных тканях (легких, печени,
слизистой оболочке желудка и др.). Гистамин освобождается из связанной
формы в плазмоцитах (тучных клетках) при анафилактическом шоке и с
действием его, в известной мере, связано проявление шока. Гистамин по-
нижает кровяное давление, стимулирует функции желез внешней секреции
(усиливает секрецию желудочного и иных соков). Гистамин в организме
подвергается окислительному дезаминированию (стр. 363), а также ацетили-
рованию. В моче можно обнаружить ацетил производное гистамина.
У грибов, а также в семенной жидкости и в эритроцитах крови млеко-
питающих содержится производное гистамина — эрготионеин, являющийся
триметилбетаином гистидина
N— С—СН2 • СН—СООН
I
№(СН3)з
Эрготионеин
Содержание эрготионеина в семенной жидкости составляет около
75 мг%, в цельной крови — 30 мг%. Физиологическое значение эрготионе-
ина не выяснено.
Гистидин входит в состав дипептидов карнозина и ансерина, содержа-
щихся в мышцах и в очень малых количествах в других тканях (стр. 421).
ОБМЕН ТРИПТОФАНА
Обмен триптофана — аминокислоты, имеющей в своей структуре ядро
индола, является сложным процессом, сопровождающимся образованием
ряда промежуточных продуктов. Триптофан не синтезируется у животных.
При его дезаминировании образуется индолпировиноградная кислота и
только она одна может заменить собой триптофан в пище. Это означает,
что дезаминирование в организме триптофана путем переаминирования яв-
ляется обратимым процессом.
Начало изучению обмена триптофана было положено свыше ста лет
тому назад Либихом, обнаружившим в составе мочи собаки азотистое ве-
щество, названное им кинуреновой кислотой, которая, как впоследствии
было установлено, является 4-оксихинолин-2-карбоновой кислотой. Зна-
чительно позже, через пятьдесят лет после обнаружения кинуреновой кис-
лоты в моче собак, была установлена связь между ее выделением и прев-
ращением триптофана в организме. Было показано, что введение животным
(собакам, кроликам, крысам) триптофана приводит к выделению с мочой
кинуреновой кислоты.
Кинуреновая кислота оказалась первым изученным промежуточным
продуктом превращения триптофана в организме. Позднее был обнаружен
еще один промежуточный продукт превращения триптофана, получивший
название благодаря своей желтой окраске ксантуреновой кислоты. Ксанту-
402
реновая кислота оказалась близкой по своей химической природе к кинуре-
новой кислоте — продуктом ее окисления — 4,8-диоксихинолин-2-карбоно-
вой кислотой
Н<Ч/с\Х
СН N
С-СООН
СН СОН
HOC N
С СООН
Ксантуреновая кислота
Кинуреновая кислота
Ксантуреновая кислота выделяется животными, получающими бога-
тую белками пищу. Образование ксантуреновой кислоты из триптофана бы-
ло доказано следующим образом. При кормлении крыс пищей, не содержа-
щей пиридоксаля (витамина В6), они при введении триптофана выделяли
с мочой ксантуреновую кислоту. Если же пища этих крыс не содержала
триптофана, ксантуреновая кислота не выделялась. Этот факт показывает,
что ксантуреновая кислота образуется из триптофана, что в превращении
триптофана в ксантуреновую кислоту участвует витамин В6.
Несмотря на близость ксантуреновой и кинуреновой кислот первая в
норме не образуется. Установлено, что ксантуреновая и кинуреновая кис-
лоты в организме образуются из общего для них предшественника — кину-
ренина, впервые обнаруженного в составе мочи кроликов при кормлении
их триптофаном. Как было установлено, формилкинуренин образуется из
триптофана
СН
нс х: • со • сн2 • chnh2cooh
2
Кинуренин
НС
НС
С • СО ’ СН2. chnh2cooh
СН
Формилкинуренин
При введении кроликам кинуренина, как и при введении триптофана,
увеличивается выделение с мочой кинуреновой кислоты.
Еще одним продуктом превращения триптофана в организме, по-види-
мому, является хинолиновая кислота, выделяющаяся в малых количест-
вах у крыс с мочой при введении им триптофана:
С СООН
НС
с-соон
СН
НС^\
Хинолиновая кислота
Ценные данные получены при изучении превращения триптофана в
опытах in vitro. Добавляя триптофан к срезам печени или к растворимым
в воде ферментам печени, можно наблюдать образование из него формилки-
нуренина, который подвергается гидролизу с образованием кинуренина и
муравьиной кислоты. В срезах печени и в водных экстрактах из ткани печени
можно также наблюдать образование из триптофана 3-оксиантраниловой
кислоты и аланина. Ферментная система, катализирующая образование из
кинуренина антраниловой кислоты и аланина, получила название кину-
рениназы. Кинурениназа является в организме животных ферментом пре-
вращения триптофана, в действии которого участвует пиридоксальфосфат
403
Кинурениназа катализирует превращение кинуренина в антраниловую кис-
лоту и 3-оксиантраниловую кислоту.
НС
СН
ссосн2
сн-соон
НС
НС
nh2
NH
НС
СН
С-СООН
nh2
сн3
HNH,
СООН
сон
СОН
З-оксикинуренин
3-оксиантраниловая кислота Аланин
Так одно за другим выявлялись вещества, возникающие в результате
превращения триптофана.
Рассмотренные реакции превращения триптофана иллюстрируются схе-
мой, приведенной ниже.
Данные схемы подтверждаются также результатами исследований
с применением изотопов. Установлено, что при инъекции животным (кры-
сам и кроликам) триптофана, меченного в индоловом компоненте N15, с
мочой выделяются кинуренин, кинуреновая кислота и ксантуреновая кис-
лота, содержащие N15 в такой же концентрации, в какой он имелся в вве-
денном триптофане. Далее, при введении в организм триптофана, меченного
в бензольном ядре индола дейтерием и в пирольном компоненте — N15,
азот пирольного компонента триптофана обнаруживался в бензольном
ядре кинуренина и в тех же ядрах антраниловой и 3-оксиантраниловой
кислот. Этот азот также обнаруживался в кинуреновой, ксантуреновой и
хинолиновой кислотах. В этих же соединениях был и дейтерий. Все это
указывает на то, что приведенные в схеме соединения действительно воз-
никают в организме как продукты превращения триптофана.
В приводимой дальше схеме фигурирует никотиновая кислота — анти-
пеллагрический витамин, возникающая из хинолиновой кислоты. Первые
указания на возможность образования никотиновой кислоты из триптофана
были получены в опытах на молодых животных, получавших корм, не со-
держащий никотиновой кислоты, но богатый триптофаном. Животные на
таком корме продолжали нормально расти, между тем известно, что корм,
не содержащий никотиновой кислоты и с обычным количеством триптофана,
не обеспечивает рост молодых животных. Дальнейшие исследования пока-
зали, что введение крысам триптофана приводит к выделению с мочой ни-
котиновой кислоты и N-метилникотинамида. Превращение триптофана в
никотиновую кислоту установлено также в опытах с микроорганизмами.
Схема превращений триптофана
5-Оксииндолилуксусная кислота
Индол + пировиноградная |
кислота + NH3 |
5-окситриптамин
(серотонин)
Индолилуксусная
кислота
5-окситриптофан
Триптамин
ТРИПТОФАН
404
Кинуреновая
кислота
Формилкинуренин'
3-оксиантраниловая «
кислота Аланин
> Кинуренин---Антраниловая
кислота +
> > + Аланин
—3-оксикинуренин
Никотиновая
кислота
Ксантуреновая
кислота
Хинолиновая
кислота
Приведенная схема не охватывает все возможные пути превращения трип-
тофана. Известно, что при расщеплении триптофана бактериями образуется
индол (стр. 376). Экстракты из Escherichia coli и других микробов содержат
пиридоксалевый фермент, катализирующий расщепление триптофана с вы-
делением индола, пировиноградной кислоты и аммиака
СН
НС ^/Х^С----С • СН2 • CI INH3COOH
СН NH
Триптофан
+ СН3СОСООН + NH3
Пировиноградная кислота
Индол
У высших растений превращение триптофана приводит к возникнове-
нию индолилуксусной кислоты, являющейся гормоном роста растений.
Исследования Бутенандта указывают на участие кинуренина в обра-
зовании черного пигмента глаза плодовой мушки (Drosophila). Яркокрас-
ный («киноварный») мутант дрозофилы не способен образовывать 3-оксикину-
ренин из триптофана. «Красноглазый» мутант накапливает триптофан, так
как он также не способен превращать триптофан в кинуренин. Мутанты
дрозофилы с черным пигментом содержат ферменты, катализирующие пре-
вращения триптофана.
Кинуренин, как оказалось, также необходим для образования пигмен-
та глаза мучного червя (Ephestid).
Обнаружение в организме 5-окситриптамина (серотонина) указало на
наличие еще одного пути превращения триптофана в организме. 5-Окси-
триптамин является физиологически активным веществом (нейрогумораль-
ным фактором). В малых концентрациях он вызывает сужение просвета
кровеносных сосудов. В крови позвоночных животных 5-окситриптамин
405
содержится в кровяных пластинках (тромбоцитах) и освобождается из них
при свертывании крови. При введении в организм животного меченного ра-
диоактивным углеродом триптофана в тромбоцитах появляется радиоактив-
ный 5-окситриптамин. Это позволяет заключить, что предшественником
5-окситриптамина является триптофан.
Изучение скорости появления в тромбоцитах радиоактивного 5-окси-
триптамина после введения в организм С14 -триптофана показало, что 5-ок-
ситриптамин образуется во время формирования пластинок и исчезает из
них после их разрушения. Половина жизни кровяных пластинок равна
приблизительно 2,5 дням и этому сроку соответствует период полупревраще-
ния в них 5-окситриптамина. Освобождающийся в плазму крови 5-окси-
триптамин быстро теряет свою активность.
5-Окситриптамин содержится также в различных тканях и органах.
Распространение его в головном мозге повторяет распространение в мозге
норадреналина.
Из мочи человека и многих животных выделен продукт превращения
5-окситриптамина — 5-оксииндолилуксусная кислота. В организмах встре-
чаются и другие 5-оксииндолиловые соединения.
Имеющиеся данные позволяют представить путь превращения трипто-
фана с образованием в виде промежуточных продуктов 5-оксииндолиловых
соединений. Первым этапом этого пути является окисление триптофана в
индоловом кольце с выделением 5-окситриптофана. Последний подверга-
ется декарбоксилированию с образованием 5-окситриптамина. В печени и
в других тканях обнаружен фермент, катализирующий отщепление СО2
от карбоксильной группы 5-окситриптофана. Этот фермент специфически
действует на 5-окситриптофан, но не оказывает влияния на триптофан.
Таким образом, триптофан в тканях сначала подвергается окислению (с об-
разованием 5-окситриптофана), а затем превращается в 5-окситриптамин.
В опытах с прибавлением к измельченной ткани печени и почек 5-окси-
триптамина показано, что он превращается в 5-оксииндолилуксусный аль-
дегид, а затем в 5-оксииндолилуксусную кислоту. Из этого вытекает, что
5-окситриптамин подвергается в тканях окислительному дезаминированию
(о дезаминировании аминов см. стр. 373) с образованием соответствующего
альдегида, который дальше окисляется до кислоты.
Путь превращения триптофана с образованием 5-оксииндолиловых сое-
динений можно представить следующим образом:
СН
СН
С-СНо-СН-СООН
СН Г\1Н2
окисление
Триптофан
HOCZ
с-сн2-сн-соон
декарбоксилирование
НС
СН NIL,
сн
NH
5-окситриптофан
сн
нос
с-сн2-сн2
дезаминирование
НС
сн nh2
сн
NH
б-окситриптамин (серотонин)
406
5-оксииндолилуксусный альдегид
с-сщ-соон
5-оксииндолилуксусная кислота
Остается еще выяснить, как происходит распад 5-оксииндолилуксусной
кислоты, которым завершается превращение триптофана в организме жи-
вотных, каков объем распада триптофана с образованием 5-оксииндолиловых
соединений?
Опыты с введением в организм 5-окситриптофана и 5-окситриптамина
(серотонин) с учетом выделения 5-оксииндоловых соединений с мочой при-
вели к выводу, что около 3% триптофана, поступающего в организм с бел-
ками пищи, превращается, давая в виде промежуточного продукта 5-окси-
триптамин.
У бактерий Chromobacterium violaceum превращение триптофана происходит пре-
имущественно по пути образования оксииндолиловых соединений. У этих микроорга-
низмов имеется пигмент виолацеин, являющийся соединением, в котором имеется ос-
таток окситриптофана.
НС----СОН
О NH СН
Виолацеин
У жаб и у беспозвоночных животных и у некоторых растений обнаружены про-
дукты метилирования 5-окситриптамина — буфотенин и продукты, близкие к нему:
Буфотенин
Некоторые бактерии обладают способностью расщеплять индол с образованием
индоксила, индиго и индирубина. Эти вещества обнаруживаются в моче человека, и
они, по-видимому, выделяются почками как продукты, образующиеся кишечной фло-
рой и всасывающиеся кишечником»
407
Приведенные данные показывают, что превращения триптофана при-
водят к образованию многочисленных продуктов, имеющих циклическую
структуру.
Как происходит их дальнейший распад, остается еще невыясненным.
Для одного из продуктов превращения триптофана — антраниловой кис-
лоты — известно, что он распадается с образованием муконовой кислоты.
С нарушением обмена триптофана встречаются у детей и молодых лю-
дей, страдающих наследственным заболеванием, сопровождающимся пси-
хозами (болезнь Гартнупа). У больных в моче появляются индол-3-уксус-
ная кислота и индикан, что свидетельствует о нарушении обмена трипто-
фана. Больные оказываются очень чувствительными к недостатку в пище
никотиновой кислоты. Это, по-видимому, связано с тем, что превращения
триптофана у них не приводит к образованию в виде промежуточного про-
дукта никотиновой кислоты.
ОБМЕН ФЕНИЛАЛАНИНА И ТИРОЗИНА
Фенилаланин и тирозин очень близки друг к Другу по своей химиче-
ской природе. Уже давно установлено, что при пропускании (перфузии)
через изолированную печень вместе с питательной жидкостью фенилаланина
он превращается в тирозин. В опытах с введением животным фенилаланина,
меченного в бензольном ядре дейтерием, было установлено, что бензольное
ядро фенилаланина превращается в фенольное ядро тирозина.
СН
НС^/СН
С—СН2—CHNH2—СООН
Фенилаланин
СОН
нс^^сн
С—СН2—CHNI12СООН
Тирозин
Превращение фенилаланина в тирозин — процесс необратимый. В ор-
ганизме из тирозина фенилаланин не образуется. Окисление в бензольном
кольце фенилаланина катализируется ферментом, небелковым компонен-
том которого является никотинамид-адениндинуклеотид. Действие его в ор-
ганизме необратимо. Эти данные находятся в соответствии с давно установ-
ленным фактом, что фенилаланин относится к незаменимым аминокислотам,
в то время как при наличии фенилаланина в пище тирозин может синтези-
роваться.
У человека обнаруживаются отклонения и нарушения в обмене фени-
лаланина и тирозина. Изучение этих отклонений позволило во многом ра-
зобраться в обмене двух названных аминокислот. Одним из таких наруше-
ний является фенилкетонурия — характернейший симптом психического
заболевания — олигофрении (oligophrenia phenylpyruvica). При фенил-
кетонурии с мочой, особенно при высоком содержании фенилаланина в бел-
ках пищи, выделяются фенилаланин, фенилпировиноградная, фенилмолоч-
ная и фенилуксусная кислоты. При фенилкетонурии человек не способен в
должном объеме превращать фенилаланин в тирозин, и образующаяся при
переаминировании фенилаланина фенилпировиноградная кислота выделя-
ется с мочой. Следовательно, фенилаланин нормально до переаминирова-
ния окисляется в тирозин, который затем подвергается дальнейшим прев-
ращениям. Фенилпировиноградная кислота у больных олигофренией час-
тично выделяется в неизменном состоянии, частично же превращается в
фенилмолочную и фенилуксусную кислоты, которые также выделяются с
мочой.
408
При введении здоровому человеку фенилпировиноградной и фенилмолоч-
ной кислот они используются и с мочой не выделяются. Очевидно, нормаль-
ное использование фенилпировиноградной и фенилмолочной кислот проис-
ходит благодаря их превращению в фенилаланин и окислению его в тиро-
зин.
с-сн2снон-соон
с-сн2-со-соон
Фенилпировиноградная кислота
Фенилмолочная кислота
C-CH2CHNH2COOH
Фенилаланин
Фенилуксусная кислота возникает из фенилпировиноградной кислоты
путем ее декарбоксилирования, причем этот процесс необратим; понятно,
что она превратиться в фенилаланин, а затем в тирозин не может.
Фенилуксусная кислота в здоровом организме не образуется. При вве-
дении ее животным она образует парное соединение с глицином — фенил-
ацетуровую кислоту (стр. 322). При введении человеку фенилуксусной кис-
лоты она обезвреживается, соединяясь с глутамином. В этом случае обра-
зуется фенилацетилглутамин
СН
С-СН?СООН
CONH2
I
сш
I
+ сн2
I
CHNH.
I
СООН
сн
conh2
I
сн2
I
сн., + Н2О
C-CH2-CONH—сн
I
соон
Фенилуксусная кислота Глутамин
Фенилацетилглутамин
Возможно, что нарушения, наблюдаемые при олигофрении, связаны
с нарушением обмена фенилаланина. Для выяснения пути превращения в
организме фенилаланина и тирозина большую роль сыграло изучение еще
одного отклонения в обмене веществ у человека, известное под названием
алкаптонурии (окрашивание мочи при щелочной реакции). Моча при алкап-
тонурии, в отличие от нормальной мочи, окрашивается в темный цвет при
добавлении к ней щелочи. Моча постепенно окрашивается и без добавления
щелочи благодаря бактериальному процессу разложения мочевины с обра-
зованием аммиака и углекислого газа. Аммиак подщелачивает мочу.
Установлено, что при алкаптонурии моча окрашивается вследствие
образования при щелочной реакции темных пигментов из гомогентизиновой
кислоты (2,5-диоксифенилуксусной кислоты). Эта кислота в моче здоровых
людей отсутствует. Будучи введенной здоровому человеку извне, 2,5-дио-
ксифенилуксусная кислота подвергается превращениям и с мочой почти не
выделяется. Иная картина наблюдается при введении гомогентизиновой
кислоты в организм при алкаптонурии. В этом случае она не подвергается
изменениям и выделяется с мочой. Образование гомогентизиновой кислоты
409
как промежуточного продукта обмена финилаланина и тирозина происходит
согласно следующей схеме:
НС
C-CH2-CHNH2.COOH
C-CHa-CHNHo-COOH
Фенилаланин
сон
Тирозин
сн
с-сн2.со-снон
НО СН2.СО«СООН
77-Оксифенилпировиноградная кислота
Гипотетический хиноидный продукт
сон
НСхч^/С • СН2 • СО • СООН
сон
2,5-диоксифенилпировиноградная кислота
СОН
нсХ \сн
ССН..СООН
СОН
Гомогентизиновая кислота
В пользу этой схемы, предложенной в 1913 г. Нейбауэром, свидетель-
ствуют следующие экспериментальные данные. Оказалось, что веществами,
вызывающими при введении людям с алкаптонурией усиление выделения
с мочой гомогентизиновой кислоты, являются фенилаланин, тирозин и /7-ок-
сифенилпировиноградная кислота. Это указывает, что фенилаланин окис-
ляется в бензольном кольце, превращаясь в тирозин, который затем под-
вергается переаминированию с образованием /7-оксифенилпировиноградной
кислоты.
Введение больному алкаптонурией тир амина или параоксифенилэта-
ноламина не приводит к усилению выделения из организма гомогентизино-
вой кислоты.
Все это подтверждает, что первым этапом превращения тирозина в ор-
ганизме является его дезаминирование.
/7-Оксифенилпировиноградная кислота и гомогентизиновая кислота
были выявлены как промежуточные продукты превращения тирозина не
только при изучении отклонений в обмене тирозина у больных людей. Обра-
зование этих веществ было доказано также в экспериментах, проведенных
на животных.
Образование гомогентизиновой кислоты, сопровождающееся окисле-
нием /7-оксифенилпировиноградной кислоты (появлением второй оксигруп-
пы у бензольного кольца и укорочением боковой цепи на один атом углерода
и ее перемещением), доказано в опытах с применением изотопного метода.
При введении крысам, отравленных флоридзином, меченных фенилалани-
на, тирозина, а также гомогентизиновой кислоты, наблюдалось окисление
этих веществ с образованием меченой ацетоуксусной кислоты. Это позво-
ляет заключить, что продуктом распада фенилаланина и тирозина являет-
ся ацетоуксусная кислота и что распад этих аминокислот проходит через
этап возникновения гомогентизиновой кислоты. Подобные результаты были
410
получены в опытах с прибавлением фенилаланина, тирозина и гомогенти*
зиновой кислоты к срезам печени нормальных крыс.
Понятно, что образование ацетоуксусной кислоты из гомогентизино-
вой возможно только в результате разрыва ее диоксифенильного компонен-
та. Опыты с применением изотопов позволили выяснить путь окислитель-
ного распада фенилаланина и тирозина с расщеплением их циклического
компонента. Распад их происходит по следующей схеме:
СН
(V О
НС\ЛН «
С—СН2—CHNHa • СООН
СОН
С—СН2—CHNH2 • СООН
Фенилаланин
сон
сон
Тирозин
₽ а
С—СН2СООН
Н СООН
Малеилацетоуксусная кислота
Гомогентизиновая кислота
5 4 ₽ а
1 6 5 4 3 2 (За СНСООН СН2СООН
—> НООС. СН = СН. СО • СН2. СО—СЩСООН —> II + I
16 2 3
снсоон со-сн3
Фумарилацетоуксусная кислота Фумаровая Ацетоуксусная
кислота кислота
Из ткани печени получены препараты ферментов, катализирующие
окислительное расщепление диоксифенильного компонента гомогентизи-
новой кислоты с образованием фумар и л ацетоуксусной кислоты, которая
дальше подвергается ферментативному гидролизу до фумаровой и ацето-
уксусной кислоты.
В превращениях фенилаланина и тирозина в организме принимают уча-
стие аскорбиновая кислота, а также глутатион. Морские свинки при кор-
млении их пищей, не содержащей аскорбиновой кислоты, выделяют с мо-
чой гомогентизиновую кислоту, п-оксифенилпировиноградную и п-оксифе-
нилуксусную кислоты. Подобное явление наблюдалось у людей, получав-
ших пищу с низким содержанием аскорбиновой кислоты. Обогащение пищи
аскорбиновой кислотой устраняло у морских свинок и у людей нарушение
обмена фенилаланина и тирозина.
Нарушения обмена тирозина наблюдаются и у недоношенных детей.
Эти нарушения также устраняются введением в организм аскорбиновой
кислоты.
Аскорбиновая кислота каким-то, пока еще не выясненным путем стиму-
лирует окислительный распад тирозина.
У человека и животных тирозин — предшественник гормонов адрена-
лина, норадреналина (стр. 188), тироксина и трийодтиронина (стр. 185). При
образовании адреналина и норадреналина происходит окисление одного из
атомов углерода циклического компонента молекулы тирозина, декарбок-
силирование и, наконец, метилирование аминной группы в случае образо-
вания адреналина. Считают, что одним из промежуточных продуктов
превращения тирозина в адреналин является 3,4-диоксифенилаланин, сокра-
411
щенно называемый «Дофа». При декарбоксилировании 3,4-диоксифенил-
аланина образуется 3,4-диоксифенилэтиламин, превращающийся в резуль-
тате окисления и метилирования в адреналин.
НС
НС
сон
сн
сн
сон
НС
НС
сон
сн
-со2
---->
С-СНо—CHNH2COOH
Тирозин
C-CH2‘CHNH2-COOH
3, 4-диоксифенилаланин
(Дофа)
НС
сон
сон
НС
сн
c-ch2-ch2nh2
3, 4-диоксифенилэтиламин
сон
сон
НС
сон
НС
сон
НС
сн
НС
сн
C-CHOH-CH2NH2
Норадреналин
C-CHOIbCHo-NH-CHo
Адреналин
Легко видеть, что образование адреналина происходит по особому пути
превращения тирозина.
Интересно отметить, что 3,4-диоксифенилэтиламин обнаружен в слюн-
ной железе головоногих моллюсков. Слюна одного из их представителей
(Octopus macropus) отличается очень высоким содержанием тирозина (0,7%
в сухом остатке слюны).
Рассмотренные превращения фенилаланина и тирозина у человека и
животных можно представить следующей схемой:
Схема превращения тирозина и фенилаланина
Адреналин
Норадреналин
Трийодтиронин
А
Меланины
а
3,4-диоксифенилэтиламин Тироксин
А А
3,4-диоксифенилаланин Дийодтирози н
(Дофа) |
А
(Фенилкетонурия)
Фенилаланин
-> Тирозин
412
Фенилпировиноградная п -Оксифенилпировиноградная
кислота кислота
(Фенилкетонурия)
Фенилуксусная Гемогентизиновая кислота (Алкаптонурия)
кислота
Бензойная
кислота
Малеилацетоуксусная
кислота
Гиппуровая Фенацетуровая Фенилацетил
кислота кислота глутамин
Фумарилацетоуксусная
кислота
Фумаровая кислота 4-
+ ацетоуксусная кислота
Превращение тирозина у животных, растений и микробов происходит
еще и путем образования из него темных пигментов, получивших название
меланинов. Меланины распространены у животных, образуются они и в
растениях, и в ряде бактерий. При повышенном образовании меланинов
они выделяются с мочой (меланурия). Меланины отсутствуют у альбиносов.
СИНТЕЗ АЗОТИСТЫХ НЕБЕЛКОВЫХ ВЕЩЕСТВ
ИЗ АМИНОКИСЛОТ
В предыдущих главах основное внимание было уделено изучению про-
цессов, приводящих к распаду аминокислот, их дезаминированию, окисли-
тельному декарбоксилированию образующихся при дезаминировании а-кето-
кислот, разрушению циклических компонентов и т. д. Наряду с этим встреча-
ются вещества, образующиеся из аминокислот, содержащие азот и играющие
часто важную роль в процессах обмена веществ. К ним относятся гор-
моны — тироксин, трийодтиронин, норадреналин и адреналин, источника-
ми образования которых являются фенилаланин и тирозин; этаноламин —
производное серина; холин, возникающий из серина и метионина; таурин —
продукт превращения цистеина; протеиногенные амины и др. Ниже приво-
дятся данные о некоторых азотистых небелковых веществах, входящих в
состав тканей и образующихся в результате превращений аминокислот.
К ним относятся креатин и продукт его ангидризации — креатинин, кар-
нитин, карнозин и продукт его метилирования ансерин, глутатион и не-
которые другие вещества.
КРЕАТИН И ЕГО ОБМЕН
Креатин с давних пор известен как составная часть мышечной ткани
человека и позвоночных животных. Встречается креатин и в составе других
тканей позвоночных, и в некоторых физиологических жидкостях (плаз-
ма крови). Креатин содержится в выделяемой моче.
413
Ангидрид креатина — креатинин является постоянной составной час-
тью мочи и в тканях организмов практически отсутствует. В небольших
концентрациях креатинин обнаруживается в плазме крови позвоночных
животных. Ткани и жидкости беспозвоночных животных или вовсе не со-
держат креатина и креатинина, или же содержат креатин в минимальном
количестве.
NH,
I
C=NH
I
N-CH3 — H2O—>
I
сн2
I
СООН
Креатин
Nil--------
I
C=NH
I
N-CH3
CH2
I
CO---------
Креатинин
Из приведенных формул видно, что креатин — это метилгуанидинук-
сусная кислота. Креатинин же может образовываться из креатина путем
его ангидризации. Содержание креатина особенно велико в поперечнополо-
сатых мышцах. Оно неодинаково в различных мышцах (быстро сокращаю-
щихся и медленно сокращающихся) одного и того же вида животного (соот-
ветственно 2,5% и 1,6% в сухом остатке мышц). Мышцы теплокровных
животных содержат больше креатина, чем мышцы холоднокровных. Сердеч-
ная мышца беднее креатином, чем скелетные мышцы, но она содержит боль-
ше креатина, чем гладкая мускулатура. Довольно богат креатином голов-
ной мозг. Содержание креатина в печени, селезенке, железах внутренней
и внешней секреции незначительно. Приведенная ниже таблица дает пред-
ставление о содержании креатина в различных тканях. Следует отметить,
что креатин в мышцах, а также и в некоторых других тканях, в основном
находится не в свободном, а в связанном с фосфорной кислотой состоя-
нии —в виде креатинфосфорной кислоты.
Животное Содержание креатина в % сырого вещества Органы Содержание креатина в % сырого вещества
Кролик Сердце 0,250
Белые мышцы Красные мышцы 0,570 0,380 Головной мозг Мозжечок Печень 0,130 0,180 0,05
Петух Селезенка Гладкие мышцы 0,05 0,05
Белые мышцы (груд- 0,500
ные) Красные мышцы 0,330
(лап)
Каким же путем, из каких веществ образуется у животных креатин? Этому воп-
росу было посвящено много исследований. Время от времени выдвигались различные
гипотезы и теории происхождения креатина. Наиболее обоснованной считалась так
называемая аргининовая теория образования креатина потому, что аргинин и креа-
тин имеют общие черты в своей химической структуре и что с биохимической точки
зрения допустимо возникновение гуанидинуксусной кислоты — непосредственного
предшественника креатина — из аргинина.
414
nh2 1 C=NH NH. 1 C=NH nh2 1 С—NH
NH 1 сн. Дезамини- NH 1 сн2 Окислительное NH 1 СН2 Р-Окисление
сн2 рование сн2 декарбоксилирование сн3
СНо 1 CHNH. СООН Аргинин СН. сн2 1 ~ 1 с=о соон 1 соон Гуанидинкетовалерьяновая Гуанидинмасляная
кислота
кислота
nh2
I
С—NH
I
р-Окисление NH 4
CH2
I
COOH
Г уани динуксусная
кислота
сн3
I
соон
Уксусная
кислота
Образующаяся гуанидинуксусная кислота в результате метилирования должна прев-
ратиться в креатин.
Аргининовая теория образования креатина получила свою поддержку в иссле-
дованиях А. В. Палладина по образованию и выделению из организма креатина, по-
казавших, что при инкубировании мышечной ткани с прибавлением к ней гуанидин-
масляной и гуанидинуксусной кислот содержание креатина в ней несколько увели-
чивается. Возможность образования креатина из аргинина по приведенной выше схе-
ме не опровергнута окончательно и в настоящее время.
В пользу аргининовой теории образования креатина свидетельствуют и данные
сравнительной биохимии. Как указывалось выше, креатин постоянно обнаружива-
ется у всех позвоночных животных и только иногда у беспозвоночных животных. У
последних место креатина занимает аргинин. Наличие аргинина у беспозвоночных
животных объясняли тем, что процессы обмена веществ у них происходят менее ин-
тенсивно, чем у позвоночных животных, и поэтому аргинин не подвергается окисли-
тельному превращению с образованием гуанидинуксусной кислоты.
Наличие в организме беспозвоночных животных аргинина при отсутствии у них
креатина, с нашей точки зрения, было бы более правильным объяснить тем, что у бес-
позвоночных отсутствует фермент, катализирующий перенесение амидиновой группы
аргинина на глицин с образованием гуанидинуксусной кислоты.
Аргининовая теория образования креатина, казалось, снова получила поддерж-
ку в связи с обнаружением в мышцах позвоночных животных креатинфосфорной
кислоты и в мышцах беспозвоночных—аргининфосфорной кислоты и выяснения иден-
тичности их физиологической функции. Оба эти вещества оказались источником энер-
гии при работе мышц (стр. 417).
В пользу теории образования креатина из аргинина говорит обнаружение в тка-
нях и в моче гуанидинмасляной кислоты.
Установлено образование гуанидинмасляной кислоты путем перенесения амиди-
новой группы от аргинина на у-масляную кислоту (стр. 591).
Однако эта теория имеет сейчас больше исторический интерес.
Применение в исследованиях по изучению происхождения креатина
в организме метода изотопов позволило выяснить основной путь его обра-
зования. Оказалось, что в синтезе креатина участвуют три аминокислоты:
аргинин, глицин и метионин. Аргинин в этом синтезе участвует амидиновой
группой, глицин — всей молекулой и метионин — метильной группой.
С помощью фермента амидинферазы от аргинина переносится амидиновая
группа на глицин с образованием гуанидинуксусной кислоты, и с помощью
метилферазы метильная группа переносится от S-аденозилметионина на
гуанидинуксусную кислоту. Следовательно, синтез креатина, в котором
участвуют три аминокислоты, происходит в два этапа.
415
Первый этап синтеза:
NH,
I
C=NH
I....
NH
I
СН2
I
CH2
I
CH2
chnh2
I
COOH
Аргинин
nh2
I
CH2
I
COOH
Глицин
nh2
1 nh9
сн2 1 1 C=NH
(Амидинфераза) > СН2 I 4 1 - NH
сн2 1 1 сн2
chnh2 1 1 СООН
СООН Орнитин Гу ани динуксусная
кислота
I
chnh2
I
COOH
NH,
I
C=NH
I
NH
I
CH2
COOH
CH2SH nh2
(Метилфераза) 1 СН., ь C=NH
1 chnh2 N-CH3
1 СООН । сн2
1 СООН
Гомоцистеин
Креатин
Метионин Гуанидинуксусная
кислота
В пользу приведенного пути синтеза креатина указывают следующие
экспериментальные данные: 1) при введении в организм животного арги-
нина, меченного в амидиновой группе N15, этот азот обнаруживается в ами-
диновой группе креатина; 2) при введении в организм глицина, меченного
азотом N15, последний оказывается в креатине. Точно так же при введении
С14-глицин С14 обнаруживается в креатине. Наконец, при введении метио-
нина, меченного дейтерием в метильной группе, дейтерий оказывается в
метильной группе креатина.
Удалось также выяснить, в каких именно органах происходит синтез
креатина. Оказалось, что первый этап синтеза креатина — образование гу-
анидинуксусной кислоты — происходит в почках. Срезы почек при до-
бавлении к ним глицина и аргинина синтезируют гуанидинуксусную кис-
лоту. Второй этап синтеза происходит в печени. При добавлении к срезам
печени гуанидинуксусной кислоты и метионина синтезируется креатин.
Следовательно, в синтезе креатина участвуют два органа — почки и пе-
чень, кстати сказать, органы с весьма низким его содержанием.
В мышцах, где креатина особенно много, а также в мозгу и в других
органах креатин накапливается за счет доставки его с кровью. В пользу
этого положения говорят следующие факты. При введении в организм жи-
вотного небольших количеств креатина он в первое время не выделяется
с мочой, а накапливается в мышцах. Только после известного повышения
содержания креатина в мышцах при дальнейшем его введении в организм
он начинает выделяться с мочой.
При ампутации конечностей, когда масса мышц в организме уменьша-
ется, образование креатина в организме не уменьшается. Избыточное коли-
чество его в этом случае выделяется из организма с мочой. Если сопоста-
вить эти данные с установленным фактом участия в синтезе креатина почек
и печени, то можно заключить, что в мышцы креатин с кровью доставляется
из печени, т.е. из органа, где осуществляется второй этап его синтеза.
Креатин и аргинин — не единственные соединения животного организма, содер-
жащие остаток гуанидина. В губках Geodia gigas и в тканях некоторых представите-
ле
лей головоногих моллюсков, в ядовитом выделении — «слюне»— осьминога содержит-
ся октопин, обладающий ядовитым действием. Октопин обнаружен также у некоторых
пластинчатожаберных моллюсков.
/NH2
C^-NH
NH
CH
CH2
CH2
CH3
CH—NH—CH
COOH COOH
Октопин
Октопин можно рассматривать как продукт конденсации аргинина и молочной
кислоты. Из тканей пластинчатожаберного моллюска Area выделено гуанидинсодер-
жащее соединение аркаин.
NbL
I
C=NH
I
NH N=(CH3)»
I I
CHo C=NH
I I
CH2 NH
I I
CH2 CH,
I I
NH CH2-SO3H
C^NH Астерубин
I
nh2
Аркаин
Астерубин, в молекулу которого входит остаток диметилгуанидина и остаток сер-
ной кислоты, выделен из тканей двух видов морских звезд. У позвоночных и беспозво-
ночных животных обнаружены продукты метилирования гуанидина—моно-, ди- и
триметил гуанидины и др.
Физиологическое значение креатина в мышцах позвоночных и аргини-
на и некоторых других гуанидинсодержащих веществ в мышцах беспоз-
воночных стало выясняться с тех пор, как было обнаружено, что эти
соединения содержатся в мышцах в фосфорилированном состоянии (1927—
1928 гг.).
/ОН
HN~P=O
С„ NH°«
/ОН
HN~P<=0
C=NHOH
I
N-CH3
I
CH2
I
COOH
Креати нфосфорная
кислота
NH
I
CH.
I
CH2
I
CH,
I
chnh2
I
COOH
Аргининфосфорная
кислота
14 Заказ № 581
417
При работе мышц позвоночных животных содержание креатинфосфор-
ной кислоты снижается с образованием креатина и фосфорной кислоты
и с освобождением энергии.
При отдыхе мышц увеличивается содержание креатинфосфорной кис-
лоты при одновременном устранении креатина и фосфорной кислоты.
Энергия, необходимая для синтеза креатинфосфорной кислоты,
доставляется в результате окисления органических соединений во время
отдыха мышц (стр. 578). Тоже самое происходит при работе и отдыхе
мышц беспозвоночных животных с аргининфосфорной кислотой. При раз-
рядке электрического органа скатов имеет место интенсивный распад креа-
тинфосфорной кислоты. Все это показывает, что креатинфосфорная кислота
у позвоночных и аргининфосфорная кислота у беспозвоночных животных
участвуют в энергетических процессах в организме.
Открытие креатинфосфорной и аргининфосфорной кислот явилось сти-
мулом к изучению распространения этих веществ в тканях представителей
животного мира.
Креатинфосфорная кислота обнаружена у всех обследованных позво-
ночных животных, аргининфосфорной кислоты у них нет или по крайней
мере достоверных сведений о ее наличии не имеется.
Аргининфосфорная кислота встречается только у беспозвоночных
животных. Известны, однако, случаи когда в тканях некоторых беспозво-
ночных обнаруживается креатин. У морских ежей (Echinodermatd) и кишеч-
нодышащих (Enteropneusta) содержится, наряду с аргининфосфорной кис-
лотой, также и креатинфосфорная кислота. У иглокожих (офиур) встречает-
ся только креатинфосфорная кислота. У простейших и у губок отсутствуют
и креатинфосфорная и аргининфосфорная кислоты. Представление о
распространении среди животных аргининфосфорной и креатинфосфорной
кислот дает приводимая ниже таблица.
Тип животных Класс животных Аргинин- фосфорная кислота Креатин- фосфорная кислота
Простейшие губки Кишечнополостные Ленточные черви Нем ер тины Моллюски Кольчатые черви Г афиреи Фо ро НИДЫ Членистоногие Иглокожие Хордовые Г Сцифоидные < Коралловые ( Гребневики ( Боконервные Пластинчатожаберные 4 Брюхоногие Головоногие J Многощетинковые ( Малощетинковые Ракообразные Насекомые Паукообразные Морские лилии Морские звезды 4 Офиуры Голотурии Морские ежи , Оболочники 1 Кишечнодышащие | Бесчерепные 1 1 ++++++++ ++++++++ 1 ++ ++ 1 + 11 т 1 + 1 1 1 1 1 1 1 1 1 1 и 1 1 1 1 1 1
418
Тип животных Класс животных Аргининфос- форная кислота Креати нфос- форная кислота
Позвоночные Рыбы Земноводные Рептилии Птицы Млекопитающие 1 1 1 1 1 +++++
Примечание. Данные взяты из книги Э. Болдуина «Основы динамической био-
химии». ИЛ, 1949-
У беспозвоночных животных (Arenicola marina, Nereis di versicolor и
Lumbricus terrestris) обнаружены фосфорилированные гуанидинсодержа-
щие вещества — гликоциаминфосфорная кислота, тауроциаминфосфорная
кислота и ломбрицинфосфорная кислота
/ОН
HN—Р=о
C=NH 011
I
NH
I
СН,
I
СООН
HN
NH
сн2
ОН
ОН
CH2-HSO3
HN
NH
СН
он
ОН
СН2—О—Р—О—СН2 • CHNH2. СООН
Гликоциаминфосфорная
кислота
Тауроциаминфосфорная
кислота
ОН
Ломбрицинфосфорная
кислота
Эти соединения у перечисленных беспозвоночных животных, по-видимому,
имеют такое же значение, какое имеет аргининфосфорная кислота у иных
беспозвоночных животных и креатинфосфорная кислота у позвоночных жи-
вотных. Наличие различных фосфорилированных гуанидиновых соединений
у разных животных является результатом особенностей процессов обмена
веществ, связанных с эволюционным их развитием и образом жизни.
Выделение креатина и креатинина из организма
Из организмов взрослого человека и взрослых животных при отсутст-
вии креатина в пище (мяса, рыбы) с мочой выделяется только креатинин.
Можно поэтому полагать, что реакцией ангидризации заканчивается обмен
креатина и что креатинин является конечным продуктом этого обмена. Еже-
суточно у взрослого человека с мочою выделяется около 1,5 г креатинина
и такое же количество креатина (вернее, около 1,7 г, так как молекулярный
вес креатина—131, выше, чем молекулярный вес креатинина—113)
ежесуточно синтезируется в организме.
При наличии мясных и рыбных продуктов в пище наряду с креатини-
ном выделяется некоторое количество креатина: примерно 0,15—0,25 г.
Выделение креатина с мочой носит название креатинурии.
При наличии креатина в пище говорят об алиментарной креатину-
рии. Креатинурия у людей, а также у половозрелых животных бывает и
иного происхождения. Креатин с мочой выделяется в результате углевод-
ного голодания, а также различных расстройств, приводящих к истощению
организма. Это — патологическая креатинурия. У детей и у молодых мле-
копитающих животных с мочой, независимо от состава пищи наряду с
креатинином всегда выделяется креатин; тогда говорят о детской креатину-
рии. Установлено, что значительное обогащение пищи детей углеводами
уменьшает и даже полностью прекращает у них креатинурию. Детскую
креатинурию, поскольку обычно она встречается у всех детей и молодых
животных, нельзя считать патологическим явлением.
14*
419
Креатинин в организме образуется из креатина. Это окончательно уста-
новлено опытами с введением креатина, меченного в гуанидиновой группе
N15: при введении меченого креатина с мочой выделяется меченный в гуа-
нидиновой группе креатинин.
Образование креатинина из креатина, надо полагать, происходит без
участия фермента. Фермент, который ускорял бы ангидридизацию креати-
на в организме, не обнаружен. Известно, что в водном растворе креатин
превращается в креатинин. Исходя из того, что основная масса креатина
в мышцах и в других тканях находится в фосфорилированном состоянии,
в виде креатинфосфорной кислоты, напрашивается предположение, что
последняя является предшественником креатинина. В этом случае креати-
нин должен образоваться при отщеплении от креатинфосфорной кислоты
молекулы фосфорной кислоты. Возникновение креатинина из креатинфосфор-
ной кислоты не исключает, однако, возможности его образования из креа-
тина.
В пользу образования креатинина из креатинфосфорной кислоты,
а не из креатина, говорят следующие факты. В водном растворе из креатин-
фосфорной кислоты значительно легче (быстрее) образуется креатинин, чем
из креатина.
В случаях нарушения процесса фосфорилирования, когда уменьшается
содержание в мышцах креатинфосфорной кислоты и увеличивается содер-
жание креатина, выделяется с мочой меньше креатинина.
NH-----
C=NH
N-CH3
СН2
со-----
Креатинин
Креати нфосфорная
кислота
NH----
Н3РО4 -> c=NH
N-CH3
СН2
СО----
Креатинин
Можно предполагать, что креатинурия, вызванная углеводным голо-
данием и истощением организма, обусловлена тем, что в мышцах и в иных
тканях уменьшается содержание креатинфосфорной кислоты и увеличива-
ется содержание креатина.
БЕТАИНЫ ЖИВОТНОГО ПРОИСХОЖДЕНИЯ
Простейшим бетаином, встречающимся в мышцах многих беспозвоноч-
ных животных, является глицинбетаин. Глицинбетаин также широко рас-
пространен в растениях. У позвоночных животных он не обнаружен, и
при введении его с пищей кроликам и другим млекопитающим выделяется
с мочой.
Более сложны по своей структуре у-бутиробетаин, кротонбетаин и кар-
нитин.
N = (CH3)3
I
сн2—соо-
Бетаин
+Nh(CH3)3
I
сн2
I
сн2
I
сн2
I
соо-
f-Бутиробетаин
+N = (CH3)3
I
сн,
I
сн
II
сн
соо-
7-Кротонбетаин
+N-(CH3)3
I
сн2
I
снон
I
сн2
I
соо-
Карнитин
420
Физиологическое значение бетаинов еще не выяснено. Бетаины могут
образоваться из холина и явиться источниками метильных групп. Из них
могут образоваться саркозин и холин (стр. 379). Карнитин, открытый в мыш-
цах В. С. Гулевичем и сотрудниками, предположительно является неза-
менимой составной частью пищи некоторых насекомых и получил название
витамина Вт.
МЕТИЛИРОВАННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
У низших животных обнаружены некоторые гетероциклические метили-
рованные соединения. К ним относится гомарин, являющийся продуктом
метилирования пиколиновой кислоты.
К гомарину оказывается близким по структуре тригонеллин — веще-
ство, выделяющееся в виде амида с мочой человека и млекопитающих жи-
вотных как продукт превращения антипеллагрического витамина РР
(никотиновой кислоты). При введении в организм большого количества
никотиновой кислоты, часть ее выделяется в неизмененном виде, часть в виде
парного соединения с глицином (никотинуровая кислота), а остальное
количество — в виде амида тригонеллина.
Гомарин
нс^^усн
+N-CH3
Тригонеллин
CCO-NH
I
сн2
I
СООН
Никотинуровая кислота
сн2—сн3
сн2 сн-соо-
Стахидрин
Из тканей пластинчатожаберного двустворчатого моллюска Area было
выделено гетероциклическое метилированное соединение — стахидрин. Ста-
хидрин встречается также у растений.
КАРНОЗИН И АНСЕРИН
Карнозин и ансерин по структуре очень близкие друг к другу дипепти-
ды. Они обнаружены в мышцах и впервые выделены в чистом видеВ. С. Гу-
левичем и его сотрудниками.
N—С—СН2—СН—СООН N—С—СН2—СН—СООН
НС СН . HN—CO-CHa-CH2NH2 НС СН HN—со—сн2—ch2nh2
'nh Vch3
Карнозин Ансерин
Из приведенных формул видно, что карнозин и ансерин являются ди-
пептидами, построенными из гистидина и р-аланина. Ансерин— это метили-
рованный карнозин, образуется из последнего путем перенесения метильной
группы от S-аденозилметионина (стр. 395).
Полагали, что карнозин служит составной частью поперечнополосатых
мышц млекопитающих, а ансерин — птиц (название ансерин возникло пото-
42/
му, что он был выделен впервые из мышц гуся). Позже, однако, выясни-
лось, что карнозин и ансерин содержатся в различных количественных соот-
ношениях в мышцах млекопитающих и птиц. Оказалось также, что карно-
зин, которым наиболее богаты мышцы, встречается также и в других тка-
нях и органах (С. Е. Северин, Н. А. Юдаев).
Физиологическое значение карнозина и ансерина остается еще во
многом неизвестным.
По данным С. Е. Северина и его сотрудников, карнозин и ансерин —
вещества, имеющие определенное значение в химизме мышц.
Карнозин и ансерин образуются путем биосинтеза, а не как продук-
ты распада белков. Об этом свидетельствуют особенности их структуры,
а именно, наличие в их молекулах р-аланина, аминокислоты, отсутствую-
щей в белках.
ГЛУТАТИОН
Глутатион (G-SH), выделенный Гопкинсом из мышц, печени и
дрожжей, является трипептидом, у-А-глутамил-£-цистинилглицином.
СО—NH—СН—CONH—СНо—СООН
I I
СН CH9SH
I
сн2
I
chnh2
СООН
Глутатион
Глутатион широко распространен в тканях организмов и встречает-
ся как в виде трипептида (О-5Н),такив виде соединенных друг с другом
G-SH (G-S—S-G); G-SH носит название восстановленного глутатиона,
G-S—S-G — окисленного глутатиона.
Глутатион образуется в организме путем синтеза. В белковых моле-
кулах у-карбоксильная группа глутаминовой кислоты, по-видимому, не
образует пептидных связей с аминокислотами. Синтез глутатиона осуще-
ствлен в срезах тканей печени, причем установлено, что энергия, необхо-
димая для этого синтеза, доставляется макроэргическими связями адено-
зинтрифосфорной кислоты.
Физиологическое значение глутатиона определяется наличием в его
молекуле SH-группы. Глутамилтрипептид, G-SH, легко окисляется, пере-
ходя в дисульфид G-S—S-G, и, наоборот, G-S—S-G легко восстанавливает-
ся, переходя в G-SH
2G-SH^G-S—S-G.
Этим создается окислительно-восстановительная система в тканях, играю-
щая существенную роль в поддержании на известном уровне соотношения
между сульфгидрильными (—SH) и дисульфидными (—S—S—) группами в
белках и особенно в белках-ферментах. Известно, например, что G-SH
активирует действие ряда протеолитических ферментов.
ОБРАЗОВАНИЕ И УСТРАНЕНИЕ АММИАКА
В ОРГАНИЗМЕ
Аминокислоты в организме подвергаются распаду до конечных про-
дуктов — аммиака, углекислого газа и воды. После отщепления от амино-
кислот аммиака образуются безазотистые соединения, обычно а-кетокисло-
ты, которые декарбоксилируются окислительным путем. Химическая струк-
тура кислот, образующихся при декарбоксилировании а-кетокислот,
определяет дальнейший путь их превращения. В одних случаях они окисля-
422
ются по пути р-окисления, а в других — распад их идет по пути превраще-
ния углеводов. Циклические аминокислоты распадаются с разрывом цик-
лических ядер, а затем дальнейший распад их приводит к образованию угле-
кислого газа и воды. Подробно эти вопросы изложены в соответствующем
разделе, касающемся обмена отдельных аминокислот. Остановимся здесь на
превращениях аммиака.
Ежесуточно в организме человека распадается около 100 г белка.
Как известно, среднее содержание азота в белках составляет 16%, атом-
ный вес азота равен четырнадцати, а молекулярный вес аммиака семнад-
цати, поэтому легко вычислить, что ежесуточно у взрослого человека дол-
жно освободиться 19,4 г аммиака. Между тем установлено, что содержание
аммиака в тканях и жидкостях очень невелико. Незначительно также вы-
деление аммиачных солей с мочой. Оно составляет при расчете на аммиак
ежесуточно 0,3—0,5 г. Основная масса азотистых веществ выделяется у че-
ловека и животных в виде мочевины (исключение составляют птицы, реп-
тилии и насекомые, у которых выделяется мочевая кислота).
До открытия А. Е. Браунштейном процесса переаминирования счита-
лось общепринятым, что в процессах превращения аминокислот входящие
в их состав аминогруппы освобождаются в виде аммиака, который затем
уже используется для синтеза других веществ и, главным образом, мочеви-
ны. Данные, полученные в течение последних 15—25 лет, показывают, что
использование аминных групп аминокислот может происходить и без об-
разования аммиака путем перенесения их от аминокислот на другие сое-
динения. В настоящее время нет еще возможности определить, какая часть
аминогрупп аминокислот используется в организме с помощью реакции
их перенесения на другие вещества и какая освобождается в виде аммиака,
который подвергается дальнейшему превращению. Однако несомненно, что
в живых организмах существует мощный ферментативный механизм, обес-
печивающий устранение аммиака как возникающего в результате дезами-
нирования азотистых веществ, так и поступающего в них извне в случаях
введения аммонийных солей.
Окислительное дезаминирование аминокислот относится к числу мед-
ленно протекающих ферментативных процессов, и оно происходит отнюдь
не во всех органах, а в печени, почках и в некоторой степени в головном
мозге. Наряду с этим медленно протекающим процессом образования ам-
миака во всех тканях и органах имеется также и иной источник образова-
ния аммиака — это гидролитическое дезаминирование адениловой кислоты,
возникающей при дефосфорилировании аденозинтрифосфорной кислоты.
Образование аммиака происходит в мышцах при их работе, при возбужде-
нии коры головного мозга, раздражении спинного мозга и периферических
нервов ит.д. Травматическое повреждение мышц, головного мозга и пери-
ферической нервной системы, печени, почек и т. д. сопровождается интен-
сивным образованием аммиака за счет дезаминирования адениловой кис-
лоты и возможно еще некоторых других азотистых соединений.
Быстрое образование аммиака, в котором не участвуют аминокислоты,
связано с проявлением функции органов и тканей и имеет физиологическое
значение. По-видимому, аммиак, вернее, ионы аммония, являются физиоло-
гическим раздражителем и в малых концентрациях играют роль в проявле-
нии функции органов.
В больших концентрациях ионы аммония токсичны и вызывают ги-
бель организма.
Токсическое действие ионов аммония можно наблюдать в различных
объектах как растительного, так и животного происхождения. Известно,
например, что многие растения, выращенные на водных средах, гибнут при
наличии в этих средах сравнительно небольших количеств аммиачной соли.
Очень чувствительны к ионам аммония животные, особенно теплокровные.
При введении животным аммонийных солей через рот наблюдается ряд рас-
стройств, приводящих к гибели организма. Еще более чувствительны жи-
423
вотные к введению аммонийных солей в кровь. Уже при введении в кровь
50—70 мг соли на 1 кг веса тела можно наблюдать гибель животного.
Исследования, проведенные в конце прошлого, и, главным образом,
в первой четверти нашего столетия Д. Н. Прянишниковым, выявили путь
обезвреживания в растениях ионов аммония как поступающих извне, так
и образующихся в результате процесса обмена веществ. Установлено, что
ионы аммония в растениях устраняются путем синтеза амидов — аспара-
гина и глутамина (стр. 25). Аспарагин и глутамин обнаруживаются в раз-
личных растениях, причем в случаях усиленного аммиакообразования (на-
пример, в этиолированных проростках лупина и других растений при рас-
паде белков) а также при поступлении ионов аммония через корневую
систему, содержание аспарагина и глутамина в них резко возрастает.
До недавних пор считалось, что основным путем устранения ионов
аммония у животных является синтез мочевины (у человека, млекопитаю-
щих, амфибий, рыб) и мочевой кислоты (у птиц, рептилий). Синтез мочеви-
ны, как известно, происходит в печени. Отсюда принималось, что ионы ам-
мония, образующиеся в различных тканях и органах при дезаминирова-
нии аминокислот и адениловой кислоты, поступают в кровь и доставляются
в печень, где используются для синтеза мочевины. Это представление, одна-
ко, противоречило известному факту — практически почти полному отсут-
ствию аммиака в крови (содержание аммиака в крови составляет сотые доли
миллиграмм-процента, причем нет уверенности в том, что некоторое количе-
ство аммиака не образуется в крови во время его определения).
Представления о механизмах, приводящих к устранению аммиака у
животных, изменились в связи с обнаружением амидов, главным образом,
глутамина, в тканях и жидкостях животных. Оказалось, что глутамин, и в.
меньших количествах аспарагин, являются постоянными составными час-
тями тканей животных. Глутамин также содержится в крови (в плазме и
форменных элементах) и в спинномозговой жидкости. Представление о со-
держании глутамина у животных дает таблица (см. стр. 425).
Установлено, что в различных тканях животных происходит синтез
глутамина. Инкубируя измельченные ткани в аэробных условиях с при-
бавлением к ним аммонийной соли, можно наблюдать устранение ионов
аммония при одновременном синтезе глутамина. Точно так же при введе-
нии животным в кровь малых количеств аммонийной соли можно наблю-
дать быстрое устранение ионов аммония из крови, появление и устранение
их в различных тканях при одновременном увеличении содержания в них
глутамина. Введение аммонийной соли вызывает значительное увеличение
содержания глутамина в крови (до 30—40 мг%) и тканях, наблюдаемое в те-
чение определенного времени. Введенная в организм аммонийная соль через
несколько часов выделяется с мочой в виде мочевины. Имеющиеся экспе-
риментальные данные позволяют считать, что аммиак, возникающий в про-
цессах обмена веществ у животных, обезвреживается путем синтеза в тка-
нях глутамина. Иными словами, устранение аммиака происходит там, где
он возникает. Из тканей глутамин поступает в кровь и с кровью подводит-
ся к различным органам, где он и используется.
Д. Н. Прянишников считал, что амиды (глутамин и аспарагин) явля-
ются транспортной формой обезвреженного аммиака в растениях. Эта точка
зрения приложима также к оценке роли глутамина и у животных.
В тканях животных обнаружен еще один ферментативный механизм
обезвреживания аммиака — связывание его путем амидирования карбо-
ксильных групп белков тканей (Д. Л. Фердман и С. Ф. Эпштейн). Белки со-
держат некоторое количество так называемого амидного азота. Этот азот
сравнительно легко отщепляется при гидролизе белков; он принадлежит к
амидным группам остатков глутамина и аспарагина, имеющихся в белковых
молекулах. Установлено, что при введении в организм аммиачной соли со-
держание амидного азота в белках мышечной ткани увеличивается, а за-
тем возвращается к норме.
424
Объект исследования
Содержание
глутамина
в мг %
на влажное
вещество
Человек,
Спинномозговая жидкость .............
Кровь ...............................
Собака
Сердечная мышца......................
Головной мозг .......................
Печень....................... ....
Скелетные мышцы . ....
Почки................ ...............
Кровь................................
Кролик
Сердечная мышца.........
Головной мозг ..........
Печень................
Скелетные мышцы . . .
Почки ................
Голубь
Сердечная мышца......................
Головной мозг .......................
Печень...............................
Г рудная мышца .... ....
Кровь ...............................
Речной рак
Мышцы клешней и шейки................
Дубовый шелкопряд
Г усеницы ...........................
Куколки .............................
Г рена ..............................
7—8
9—10
200—250
100—110
80—85
100—110
30—40
9—11
90—105
70—85
60—70
45—50
25—30
60—70
80—100
50—60
40—50
12—15
90—95
70—140
60—70
25—30
Крайне малое содержание аммиака (ионов аммония) в тканях живот-
ных объясняется тем, что он, по мере своего образования, устраняется путем
синтеза амидов, и в первую очередь глутамина, а также путем восстанови-
тельного аминирования а-кетоглутаровой кислоты. Синтез амидов предо-
храняет организм от ядовитого действия ионов аммония. Надо полагать,
что и реакции переаминирования, ограничивающие процесс образования
свободного аммиака в тканях организма, одновременно служат механиз-
мом, предохраняющим ткани от ядовитого действия ионов аммония.
Синтез мочевины в печени человека, млекопитающих животных, амфи-
бий и рыб, а также синтез мочевой кислоты у птиц и рептилий является
заключительным этапом процесса устранения аммиака. Для этого синтеза,
как мы увидим ниже, используется не только, как считали раньше, свобод-
ный аммиак, но и аминогруппы, входящие в состав органических соедине-
ний без предварительного образования аммиака.
Способность к обезвреживанию аммиака путем синтеза амидов и моче-
вины появилась у животных на определенной ступени их эволюционного
развития. У некоторых животных главным конечным продуктом азотистого
обмена является аммиак, который и выделяется в виде аммонийных солей
с мочой. Эти животные названы аммониотелическими. Многие беспозвоноч-
ные, особенно обитатели водоемов, относятся к аммониотелическим живот-
ным и у них больше половины (у некоторых до 80%) азотистых веществ,
выделяющихся с мочой, представлены аммонийными солями.
У низших позвоночных, у ряда костистых рыб (морской черт, морской
язык, морской конек) содержание аммиака среди продуктов выделения из
425
организма также велико и составляет от 40 до 60% азота всех азотистых ве-
ществ. У более высокоорганизованных позвоночных аммонийных солей в
моче всего несколько процентов от азота, входящего в состав всех азоти-
стых веществ мочи.
Образование мочевины
Главный конечный азотистый продукт, выделяющийся с мочой у чело-
века, млекопитающих, амфибий и рыб,— это мочевина, причем у них на-
блюдается определенная зависимость между выделением мочевины и аммо-
нийных солей. Эта особенность позволила назвать такие организмы урео-
телическими. В тех случаях, когда в организме усилено образование кислот
(ацидоз, стр. 223), увеличивается выделение аммонийных солей с мочой и
соответственно уменьшается выделение мочевины. То же самое наблюда-
ется при введении неорганических кислот (органические кислоты, введен-
ные в организм, окисляются и в расчет не принимаются). Следовательно,
аммиак частично используется у животных для нейтрализации кислот.
Необходимо отметить, что нейтрализация кислот аммиаком не приводит к
его обезвреживанию, так как образующиеся аммонийные соли диссоци-
ируют, давая ионы аммония, обладающие ядовитым действием. Нейтрали-
зация кислот происходит главным образом в почках, и при этом использу-
ется не свободный аммиак, а амидные группы глутамина.
Образование мочевины у уреотелических видов сосредоточено в печени.
Этот факт установлен многочисленными исследованиями по изучению син-
теза мочевины в различных органах и тканях. Из всех изученных органов
только изолированная печень при пропускании через нее питательной жид-
кости с прибавлением к ней аммонийной соли образует мочевину. Химиче-
ская структура мочевины—CO(NH2)2 показывает, что для ее синтеза мо-
гут использоваться аммиак и углекислота.
В последней четверти прошлого столетия благодаря исследованиям
Шмидеберга и Ненцкого возникла так называемая ангидридная теория
образования мочевины. Согласно этой теории синтез мочевины происходит
из углекислого аммония путем двуактного отщепления от него молекул
воды. Углекислый же аммоний образуется в результате нейтрализации
аммиаком угольной кислоты
/ОН /О-МЩ
С=О + 2NH3 —> С~О
ОН ^O-NH*
o-nh4
O-NH4
Карба м иновоки слый
аммоний
Мочевина
Углекислый
аммоний
В начале XX столетия (1904 г.) Коссель и Дэкин открыли в ткани пе-
чени фермент — аргиназу, катализирующий гидролиз аргинина с образо-
ванием мочевины и орнитина (стр. 164).
Сложилось представление, что образование мочевины происходит дву-
мя путями: синтетическим — из угольной кислоты и аммиака и гидролити-
ческим — из аргинина.
Аргиназу в заметных количествах в других тканях, помимо ткани
печени, обнаружить не удалось.
В 1932 г. Кребс и Хензелейт показали, что синтез мочевины может про-
исходить в переживающих срезах печени. При прибавлении к срезам пе-
чени, инкубируемым в аэробных условиях, аммонийной соли можно наблю-
дать синтез мочевины. В опытах с заменой аммонийной соли различными
аминокислотами было установлено, что только добавление аргинина при-
426
водит в срезах печени к усиленному образованию мочевины. Этот факт объ-
ясняли тем, что аргинин в срезах печени подвергается действию аргиназы
с отщеплением мочевины и орнитина. Далее, однако, оказалось, что и при-
бавление малых количеств орнитина, цитруллина и аргинина, при нали-
чии аммонийной соли, приводит к усиленному образованию мочевины. Из
результатов этих опытов вытекало, что аргинин, орнитин и цитруллин ка-
тализируют процесс синтеза мочевины, а не являются материалами для ее
образования. Отсюда возникла новая теория образования мочевины, из-
вестная как теория образования мочевины по циклу Кребса. Важно под-
черкнуть, что образование мочевины по циклу Кребса в срезах печени про-
исходит в присутствии кислорода и веществ, подвергающихся окислению,
например молочной кислоты. При этих условиях наличия уже самых малых
доз орнитина оказывается достаточным для превращения значительного
количества аммонийной соли в мочевину.
Схематически образование мочевины по циклу Кребса можно предста-
вить следующим образом:
NH2
I
C=NII
।
NH
I
CH,
I
CH2
I
CH2
I
CHNH.
I
COOH
Аргинин
_27_H2O
аргиназа
NH2 •
I •:
C-O:
I i
NH2 ;
4-
NH2
CH2
I
CH2
I
CH2
I
chnh2
I
COOH
Орнитин
+ NH3 + CO2
- H2O
nh2
I
c=o
I
NH
I
CH,
I
CH2
I
CH,
I
CHNH2
COOH
-INHs
-HjO-*"
NH,
I
C=-NII
I
NH
CH2
I
CH,
I
CH,
I
CHNH,
I
COOH
Цитруллин
Аргинин
Суммирование реакций цикла образования мочевины приводит к сле-
дующему уравнению:
2NH3 + СО2---> CO(NII2)2 + Н2О.
Это уравнение не отличается от уравнения реакций образования мочевины
по теории Шмидеберга — Ненцкого. Значение цикла Кребса заключается
в том, что он частично выявляет механизмы образования мочевины и ве-
ществ (аргинин, орнитин и цитруллин), участвующих в этом процессе.
Образование мочевины по указанному циклу получило свое подтверж-
дение в многочисленных исследованиях и является общепринятым. Сле-
дует, однако, указать, что цикл впоследствии подвергся существенной дета-
лизации. Из приведенных выше реакций можно видеть, что в образовании
мочевины участвует свободный аммиак (ионы аммония) и углекислый газ.
Между тем известно, что ионы аммония, по мере своего образования в тка-
нях, устраняются с образованием глутамина. Далее известно, что реакции
переаминирования. которые активно происходят в различных тканях, при-
водят к тому, что аминогруппы подвергающихся распаду аминокислот не
освобождаются в виде аммиака. Естественно, возникает вопрос, откуда
же берется в печени аммиак, необходимый для синтеза мочевины? Ответ
на этот вопрос дают проведенные в последнее время исследования Ратнер
с сотрудниками, показывающие, что в синтезе мочевины участвуют амино-
группы, входящие в состав аминокислот, без предварительного отщепле-
ния их в виде аммиака. Еще задолго до исследований Ратнер, Салазкин
на основании результатов своих исследований по изучению образования мо-
чевины в изолированной печени при пропускании через нее питательной
427
жидкости с прибавлением аминокислот, пришел к выводу, что мочевина в
печени образуется непосредственно из аминокислот. Этот вывод, в извест-
ной мере, опередил развитие взглядов того времени на механизм синтеза
мочевины. Исследования Ратнер с применением современных методов ис-
следования показали, каким путем используются аминогруппы аминокис-
лот для синтеза мочевины.
В опытах с применением водных экстрактов из печени было показано,
что образование аргинина из цитруллина происходит не при участии амми-
ака, как это предусмотрено циклом Кребса, а с использованием аминогруп-
пы аспарагиновой кислоты. Аспарагиновая кислота в синтезе аргинина не
может быть заменена другой аминокислотой. Установлено, что синтез ар-
гинина из цитруллина происходит в два этапа. На первом этапе имеет место
конденсация цитруллина и аспарагиновой кислоты с образованием арги-
нинянтарной кислоты. Эта реакция происходит с использованием энергии
макроэргических связей аденозинтрифосфорной кислоты. Аргининянтарная
кислота затем расщепляется на аргинин и фумаровую кислоту.
NH2
I
с=о
I
NH
1
СНо
I
сн2
I
сн2
ciinh2
I
СООН
NH
н
сон
I
NH
I
СНо
I
сн2
I
СНо
I "
chnh2
I
СООН
СООН
I
h2nch
I
СНо
I
СООН
Аспарагиновая
кислота
(+АТФ)
----->
Цитруллин Енольная форма
цитруллина
NH СООН
II I
С—Nil—СН
I I
NH СН2
I I
-------> СН2 СООН( + АДФ + Н3РО4)
I
СН,
I
сн2
I
chnh2
I
СООН
Аргининянтарная
кислота
NH2
I
C=NH
I
NH
I
> CH3
I
CH2
I
CH2
I
chnh2
I
COOH
COOH
I
CH
II
CH
I
COOH
Фумаровая
кислота
Аргинин
Приведенные реакции показывают, что при синтезе аргинина из цит-
руллина используется аминогруппа аспарагиновой кислоты. Фумаровая
кислота затем превращается в щавелевоуксусную кислоту, из которой в
результате реакций переаминирования образуется аспарагиновая кислота.
Иными словами, аминогруппы различных аминокислот в результате реак-
ций переаминирования переносятся (с промежуточным возникновением
глутаминовой кислоты) на щавелевоуксусную кислоту с образованием
аспарагиновой кислоты, аминогруппа которой используется для синтеза
аргинина из цитруллина.
Синтез цитруллина из орнитина также происходит более сложно, чем
это можно предположить, исходя из цикла Кребса. Дальнейшие исследо-
вания показали, что в синтезе цитруллина из орнитина, при котором ис-
пользуется энергия макроэргических связей аденозинтрифосфорной кис-
лоты, участвует ацетил-глутаминовая кислота.
428
Ацетил-глутаминовая кислота ускоряет синтез цитруллина из орни-
тина. В образовании цитруллина из орнитина участвует карбамилфосфор-
ная кислота, и ее возникновение из NH3, СО2 и Н3РО4 обеспечивается учас-
тием ацетил-глутаминовой кислоты, как предполагают, в результате сле-
дующих реакций:
СООН
I
О сн2
II I
Н3С—с сн2
I I
HN—СН
\зоон
АТФ П
I
АДФ + Н3РО4_
СООН
I
О сн2
II I
Н3С—с сн2
I I
N—СН
4- АТФ
Ацетил-глутаминовая
кислота
СООН
-I-АТФ
СООН
I
О СН2 - Н3РО4
II I -------------’
Н3С-С сн2
I I
N-CH
о=с хюон
^О-Н2РО3
СООН
+ АДФ
Н3С — с сн2
N—СН
о=с WOH
\)-Н2РО3
соон
I
СН2 +NH3
сн2
I
сн
соон
I
о сн2
II I
Н3С—с сн2
I I
HN—СН
+ Н3РО4
------>
СООН
I
о сн2
II I
* н3с— с сн2
I I
HN— СН
О • Н2РО3
соон
Ацетил-гл ута м иновая
кислота
Карбамилфосфорная
кислота
nh2 NH3
сн2 С-0
СН3 з =± NH +Н3РО4
сн2 сн2
CHNH, сн2
СООН сн2
Орнитин chnh2
СООН
Цитруллин
429
Синтез мочевины может быть представлен следующим образом:
1. МН3-|-Н2СОз-|-АТФ—> карбаминовая кислота АДФ+Н3РО4.
2. Карбаминовая кислота+АТФ^карбамилфосфорная кислота+АДФ
3. Карбамилфосфорная кислота+орпитин^цитруллин +Н 3РО4.
4. Цитруллин-^ аспарагиновая кислота+АТФ—^аргининянтарная
кислота+АДФ+Н 3РО4.
5. Аргининянтарная кислота^аргинин+фумаровая кислота.
6. Аргинин+Н2О—>орнитин+мочевина.
Баланс уравнений синтеза мочевины (суммирование уравнений 1, 2,
3, 4, 5 и 6) дает следующее уравнение:
СООН
NH3 + СО2 + СН | NH2
СН2
I
СООН
+ ЗАТФ + Н
Мочевина
Аспарагиновая кислота
СООН
I
сн
II + 2АДФ + 2Н3РО4
СН
СООН
Фумаровая кислота
При синтезе одной молекулы мочевины используется энергия трех макро-
эргических связей АТФ.
Из приведенных уравнений можно заключить, что одна группа NH2
молекулы мочевины образуется из аммиака, а другая — из аминогруппы
аспарагиновой кислоты. Отсюда напрашивается вывод, что аминогруппы
50% аминокислот, подвергающихся в организме превращению путем пере-
аминирования (через глутаминовую кислоту), включаются в щавелевоук-
сусную кислоту с образованием аспарагиновой кислоты. Аминогруппа
аспарагиновой кислоты, как мы видели, непосредственно используется для
синтеза мочевины. Использование азота (аминогрупп) аминокислот для син-
теза мочевины видно из схемы (стр. 431), показывающей связь между син-
тезом мочевины и циклом трикарбоновых кислот.
Как уже указывалось, у уреотелических животных среди различных
азотистых веществ, выделяющихся с мочой, главное место занимает моче-
вина. Количество выделяемой из организма мочевины находится в зависи-
мости от количества белков в пище и у взрослого человека при нормальном
белковом питании составляет 25—35 г в сутки. Устранение ионов аммония
в тканях путем синтеза глутамина и синтеза мочевины в печени является
процессом, общим для всех уреотелических организмов. Синтез мочевины
имеет место и у некоторых растений (грибов). Синтез амидов (глутамина
и аспарагина) настолько широко распространен, что он встречается у всех
живых организмов. У некоторых классов позвоночных, как уже упомина-
лось, в печени в виде конечного продукта азотистого обмена образуется не
мочевина, а мочевая кислота. И в этом случае аммиак предварительно уст-
раняется в тканях путем синтеза глутамина.
Д. Н. Прянишников выдвинул представление о биологическом един-
стве процессов устранения аммиака в организмах животных и растений. При
этом он исходил из некоторых общих черт структуры мочевины и амидов
дикарбоновых аминокислот (аспарагина и глутамина).
Мочевина может рассматриваться как амид аминомуравьиной кислоты:
ОН NH2
(Н—С=О—муравьиная кислота, NH2—L=O—амид аминомуравьиной кислоты —мо-
чевина). Отсюда, полагал Д. Н. Прянишников, обезвреживание аммиака и у растений
и у животных сопровождается синтезом амидов, у растений — аспарагина и глутами-
на, у животных (а также и у грибов) — мочевины. Заключение об общности процессов
устранения аммиака в организмах растений и животных Д. Н. Прянишников сделал
до обнаружения глутамина и аспарагина и изучения их образования в тканях жи-
вотных.
430
Рис. 19. Схема превращения веществ, приводящих к синтезу мочевины
Исходя из фактов, известных в наше время, проблема общности про-
цесса устранения аммиака у животных и растений может быть представлена
более широко. Общность этого процесса заключается в том, что у растений
ядовитое действие аммиака устраняется путем синтеза амидов — глутамина
и аспарагина, у высших животных — путем синтеза глутамина. Аммиак,
связанный в виде амидных групп глутамина, как у растений, так и у жи-
вотных (у первых — передвижением соков, у вторых — током крови) до-
ставляется к различным тканям и органам, где он используется для син-
теза различных азотистых соединений. Общим для растений, микробов и
животных является также и первичное образование а-аминогрупп при ами-
нировании а-кетоглутаровой кислоты с помощью глутамикодегидрогеназы.
У растений амидный азот широко используется для синтеза аминокислот;
у животных — для синтеза различных соединений и в том числе моче-
вины. которая как конечный продукт азотистого обмена выделяется
с мочой.
431
Свойства мочевины
Мочевина кристаллизируется в виде длинных, ромбических, бесцветных призм.
Она хорошо растворима в воде и в спирте, но не растворима в эфире. Растворы моче-
вины нейтральны. Мочевина под действием щелочей и сильных кислот гидролизуется
с образованием аммиака и углекислого газа. В почве выделяющаяся из организма с
мочой мочевина разлагается под влиянием фермента уреобактерий — уреазы. Благо-
даря этому в природе не образуется больших скоплений мочевины. Возникающий
в почве при разложении мочевины аммиак подвергается воздействию нитрофицирую-
щих бактерий, и образующаяся азотная кислота (нитраты) используется растениями.
При сплавлении кристаллов мочевины выделяется аммиак и образуется биурет—
соединение, легко растворимое в воде и дающее с окисью меди при щелочной реакции
фиолетовое окрашивание (биуретовая реакция). Биуретовую реакцию дают также и
белки. Это послужило А. Я. Данилевскому основанием для предположения о наличии
пептидных связей в молекулах белка (стр. 29).
NH2
СО^
^>NH 4-NH3
СО
NH2
Биурет
Для количественного определения мочевины может быть использована реакция
ее разрушения бромноватокислым натрием (NaBrO).
/NH2
СО + 3NaBrO Н- 2NaOH -> 3NaBr + ЗН2О + N2 -f- Na2CO3
\nh2
По количеству образовавшегося азота судят о количестве мочевины; реакция
не вполне специфична — ее дают также аммиак и амины.
О количестве мочевины судят также по количеству аммиака или СОг, образую-
щихся из мочевины под влиянием уреазы.
Для количественного определения мочевины пользуются также ксантгидролом,
специфически реагирующим с мочевиной с образованием не растворимого в воде осад-
ка. О количестве мочевины судят по весу осадка или же по количеству раствора пер-
манганата, необходимого для его окисления.
(НО)НС
Ксантгидрол
Диксантгидролмочевина
Синтез мочевой кислоты
В экскрементах птиц и рептилий основное азотистое соединение — моче-
вая кислота — 2,6,8-триоксипурин. Птиц и рептилий по этому признаку
относят к урикотелическим животным; у них мочевая кислота занимает
такое же место в азотистом обмене, какое занимает мочевина в азотистом
обмене уреотелических животных. Экспериментально это подтверждается
тем, что удаление печени вызывает как у птиц, так и млекопитающих на-
копление в крови аминокислот и аммиачное отравление. Следует, однако,
подчеркнуть, что синтез мочевой кислоты происходит не только у урико-
телических животных. Уреотелические животные также способны синтези-
ровать мочевую кислоту, но не в столь больших количествах, как урикоте-
лические животные.
Большой интерес представляет вопрос о пути синтеза мочевой кислоты
у человека и животных. Установлено, что в этом случае при синтезе возни-
432
кает не мочевая кислота, а гипоксантин (6-оксипурин), который затем
уже под влиянием фермента ксантиноксидазы окисляется в мочевую
кислоту.
Синтез гипоксантина и дальнейшее его окисление в мочевую кислоту
легко проследить у голубей, в печени которых, в отличие от других птиц,
отсутствует ксантиноксидаза. Синтез гипоксантина у голубей, как и у дру-
гих птиц, имеет место в печени, но окисление его происходит в почках, со-
держащих ксантиноксидазу. В опытах in vitro было показано, что ткань
печени и ткань почек голубей в отдельности способны к образованию лишь
незначительных количеств мочевой кислоты, взятые же вместе они интен-
сивно ее образуют.
Применение в исследованиях метода изотопов позволило установить,
какие именно вещества участвуют в синтезе мочевой кислоты у птиц. Ока-
залось, что предшественниками гипоксантина являются глицин, муравьиная
кислота, аспарагиновая кислота и глутамин (стр. 431). Интересно отме-
тить, что в синтезе конечного продукта азотистого обмена у урикотеличе-
ских животных — мочевой кислоты — используется азот, входящий в со-
став органических соединений. Образование мочевой кислоты из гипоксан-
тина под действием ксантиноксидазы происходит следующим образом:
Г ипоксантин
СОН N
Ксантин
СОН
Мочевая кислота
(кетоформа)
Мочевая кислота
У урикотелических, а также у уреотелических животных мочевая кис-
лота образуется за счет дезаминирования и окисления пуринсодержащих
соединений, поступающих с пищей, а также и из производных пурина, воз-
никающих при распаде нуклеиновых кислот и нуклеотидов тканей и гипок-
сантина, образующегося синтетически.
Изучение конечных продуктов азотистого обмена у животных различ-
ных типов и классов представляет общебиологический интерес. Полученные
в этом направлении данные показывают, что образование и выделение ко-
нечных продуктов азотистого обмена зависит как от уровня эволюционного
развития животных, так и от условий их жизни и влияния внешней среды.
У беспозвоночных животных выделяется с мочой значительное коли-
чество аминокислот. Около одной четверти азотистых веществ (белков),
поступающих в организм беспозвоночных животных с пищей, выводится в
виде аминокислот. Это обстоятельство позволяет предполагать, что обмен
азотистых веществ у беспозвоночных недостаточно развит и что благодаря
этому они неспособны в достаточной мере использовать поступающие извне
белки.
По характеру выделения азотистых веществ, т. е. по преобладанию
у них того или иного конечного продукта азотистого обмена, все животные,
433
как известно, могут быть разделены на три группы: 1) аммониотелические,
2) уреотелические и 3) урикотелические. Тип азотистого обмена, по-види-
мому, зависит от условий существования животных, от степени обогащения
организма водой. Чем лучше снабжается организм водой, тем легче из него
удаляются конечные продукты азотистого обмена. Большая часть беспоз-
воночных относится к аммониотелическим животным. Беспозвоночные оби-
татели водоемов выделяют в виде конечного продукта аммиак, который
настолько разводится водой, что его ядовитое действие практически сво-
дится к нулю. Организмы вследствие этого не подвергаются опасности быть
отравленными продуктами их выделения.
Среди беспозвоночных животных встречаются и урикотелические.
Обычно это обитатели суши, приток воды к которым ограничен. Образую-
щийся в их тканях в результате азотистого обмена аммиак не может выде-
ляться из организма ввиду недостатка воды. У этих животных ядовитое
действие аммиака устраняется путем его химического связывания—синтезом
мочевой кислоты, обладающей небольшой растворимостью в воде и являющей-
ся поэтому относительно безвредным продуктом. Подобное явление наблю-
дается и у позвоночных животных. В зависимости от условий существова-
ния среди них встречаются аммонио-, урео- и урикотелические формы.
У пресноводных костных рыб образующийся аммиак сильно разво-
дится и быстро выводится с мочой. Приток пресной воды в организм рыб мог
бы привести к разведению солей крови и тканей, к изменению их осмотиче-
ского давления. Этого не происходит, так как избыточная вода удаляется
выделительными органами (почками). Система химического связывания ам-
миака у этих рыб развита слабо. Они являются животными в значительной
мере аммониотелическими.
К аммониотелическим животным в известной степени относятся также костистые
рыбы морей и океанов. У них выделяется много аммонийных солей (40—60% азота всех
азотистых соединений мочи) и значительное количество окиси триметиламина N = (СН3)3
Образование триметиламина, очевидно, связано с окислением холина
в бетаин (стр. 338) и расщеплением последнегос выделением триметиламина,
который далее окисляется до окиси триметиламина. Окись триметиламина
не ядовитое вещество, и образование ее следует рассматривать как процесс
обезвреживания аммиака. Наличие подобного процесса обезвреживания
аммиака у морских костистых рыб представляет интерес по той причине,
что обитатели морей ощущают недостаток в пресной воде. Окружающая их
морская вода, прежде чем она может быть использована, должна потерять
свои соли. Физиологические механизмы «опреснения» морской воды у мор-
ских рыб, а также других морских животных, еще мало изучены.
Хрящевые рыбы — уреотелические животные. Главный конечный про-
дукт их азотистого обмена — мочевина, причем мочевина задерживается
в организме в таких больших количествах, что содержание ее в крови со-
ставляет 2—2,5%.
Когда количество мочевины становится еще более высоким, она начи-
нает выделяться из организма. Благодаря высокому содержанию мочевины
осмотическое давление в тканях и в крови морских хрящевых рыб даже
несколько выше осмотического давления морской воды, что имеет значение
для притока в организм воды извне.
Пресноводные хрящевые рыбы — также уреотелические животные.
Содержание мочевины в крови у них достигает 1 %.
У хрящевых рыб, как и у костистых, происходит выделение окиси три-
метиламина.
Интересный пример зависимости обмена азотистых веществ от условий
жизни дают двоякодышащие рыбы — обитатели тропических водоемов.
В течение жаркого периода года эти животные укрываются в специальных
гнездах в иле. В период недостатка воды у них выделяется мочевина, и они,
434
следовательно, являются уреотелическими животными. В период тропиче-
ских дождей, когда реки заполняются водой, двоякодышащие рыбы осво-
бождаются от избытка мочевины, накопившейся во время засухи, и начи-
нают, подобно другим рыбам, выделять аммонийные соли. Следовательно,
двоякодышащие рыбы, в зависимости от условий жизни, могут быть то урео-
телическими, то аммониотелическими животными.
Большой интерес представляют данные по изучению выделения азоти-
стых веществ земноводными животными, которые в течение своего индиви-
дуального развития один период времени живут в воде, другой — нахо-
дятся вне воды. Изучение выделения конечных продуктов азотистого обме-
на у представителей земноводных (лягушек) показало, что живущий в воде
головастик выделяет в виде главного азотистого продукта аммонийные соли,
являясь, следовательно, аммониотелическим животным. После метаморфоза
взрослые лягушки выделяют уже не аммонийные соли, а мочевину. Сле-
довательно, взрослые формы земноводных, оставляя воду как постоянную
среду обитания, становятся уреотелическими животными.
Шпорцевая лягушка (представитель земноводных) в течение всей своей
жизни живет в воде и не проходит стадию метаморфоза. Она является аммо-
ниотелическим животным.
Эволюционное развитие, начиная от земноводных, шло по двум линиям.
Одна из них привела к появлению и развитию млекопитающих, другая—
к развитию пресмыкающихся и птиц. Млекопитающие обладают мощными
ферментативными механизмами устранения из организма аммиака и отно-
сятся к уреотелическим животным. Рептилии и птицы также обладают по-
добными механизмами, но конечный продукт их азотистого обмена — моче-
вая кислота; следовательно, они урикотелические животные. Образование
мочевой кислоты в виде конечного продукта азотистого обмена у рептилий
и у птиц находится в связи с условиями их эмбрионального развития. Раз-
витие зародыша у них протекает в замкнутом пространстве, в яйцах,
окруженных оболочками, непроницаемыми для воды. Количество воды,
имеющееся в яйце и образующееся в нем при распаде питательных веществ,
невелико, и ее едва хватает для развивающегося эмбриона. Образование
аммонийных солей во время эмбриогенеза неминуемо должно было бы при-
вести эмбрион к гибели, а появление продукта обезвреживания аммиака —
мочевины имело бы своим следствием значительное повышение осмотиче-
ского давления в среде, окружающей эмбрион, что должно было бы отрица-
тельно влиять на его развитие. Иное дело образование мочевой кислоты,
являющейся веществом, мало растворимым в воде. Ее возникновение при
развитии зародыша не может значительно влиять на осмотические свойства
жидкости в яйце. Мочевая кислота, выделяясь из эмбриона в окружающую
его жидкость, выпадает в осадок и этим выключается из обменных процес-
сов, протекающих при эмбриогенезе. Изучение конечных продуктов азотис-
того обмена у эмбриона цыпленка показало, что в первый период развития
эмбрион выделяет в окружающую среду аммонийные соли, следова-
тельно, ведет себя как аммониотелический организм. Затем эмбрион начи-
нает выделять мочевину как животное уреотелическое, и, наконец, наступа-
ет последний период развития, когда эмбрион выделяет мочевую кислоту,
т.е. ведет себя, как урикотелический организм. Этот урикотелический тип
обмена веществ сохраняется у птиц и у рептилий в течение всего постэмб-
рионального развития.
У млекопитающих животных уреотелический тип обмена веществ уста-
навливается уже во время эмбриогенеза. Эмбриональное развитие у них
происходит в условиях тесного контакта эмбриона с кровообращением
матери. С кровью матери через плаценту к зародышу доставляются питатель-
ные вещества. Через плаценту в кровь матери поступают и конечные про-
дукты обмена веществ. Развивающиеся эмбрионы млекопитающих не испы-
тывают недостатка в воде. Образующаяся у них мочевина поступает в кровь
матери и затем почками удаляется из организма.
435
КОЛИЧЕСТВЕННАЯ СТОРОНА ОБМЕНА БЕЛКОВ
Белки, как указывалось, занимают особое место в процессах обмена
веществ. В противоположность углеводам и жирам, они у человека и у жи-
вотных не могут синтезироваться из органических веществ и из аммиака.
В организме синтез аминокислот возможен в том случае, если имеются
соответствующие а-кетокислоты. Некоторые а-кетокислоты возникают в виде
промежуточных продуктов обмена углеводов и жиров. Аминируясь, эти
а-кетокислоты превращаются в аминокислоты. Появляющиеся подобным
образом аминокислоты носят название заменимых аминокислот. Синтез
заменимых аминокислот у животных происходит в большом масштабе и
совершенно не зависит от поступления их с белками пищи. Однако как бы
интенсивно ни шел синтез заменимых аминокислот, эти аминокислоты не мо-
гут обеспечить потребность организма в белках. Для синтеза белков необ-
ходим полный набор аминокислот, их составляющих. Кроме аминокислот,
синтезирующихся в организме, для синтеза белков необходимы еще амино-
кислоты, которые не могут образоваться путем синтеза заново, необходимы
еще незаменимые аминокислоты. При отсутствии, а также недостатке ка-
кой-либо незаменимой аминокислоты в пище, животное не может сущест-
вовать и раньше или позже наступает его гибель.
Белки, в отличие от углеводов и жиров, практически не откладываются
в виде запаса у животных. Чем больше в организм поступает белков с пи-
щей, тем больше выделяется из него продуктов азотистого обмена с мочой:
мочевины — у уреотелических животных, мочевой кислоты — у урикоте-
лических. На эту особенность обмена белков в организме указал Ю. Либих,
и она нашла свое подтверждение в исследованиях К- Шмидта и других
ученых. Особенно убедительны в этом отношении результаты исследований
К. Фойта. Приведем, как пример, результаты одного из его опытов. Фойт
в течение 25 дней скормил взрослой собаке 29 кг мяса.
Экспериментально было установлено количество белков, вернее, коли-
чество азота, входящего в белки, содержащееся в мясе. Далее в течение опы-
та, т.е. в течение 25 дней, собирались продукты выделения собаки — моча
и кал — и определялось содержание в них азота, входящего в состав азоти-
стых веществ. Результаты исследований таковы:
СкорхМлено 29 кг мяса, содержащего . . 989,0 г азота
Выделилось с мочой ...................... 943,7 г »
Выделилось с калом ....................... 39,1 г »
Общее количество выделенного азота . . 982,8 г »
Анализ приведенных данных позволяет сделать следующие важные
выводы: 1) весь азот белков, поступивший с пищей в организм взрослого
животного, выделяется в виде азотистых веществ, 2) азотистые вещества вы-
деляются преимущественно с мочой (в моче здоровых животных белки отсут-
ствуют). Азотистые вещества, выделяющиеся с калом, составляют незначи-
тельную часть поступившего в организм азота белков, и они в расчет обыч-
но не принимаются. Эти азотистые вещества принадлежат микроорганизмам
кала, остаткам пищеварительных соков и непереваренным остаткам
пищи.
Уже в последней четверти прошлого столетия сложилось представление
об азотистом равновесии организма. Под азотистым равновесием подразу-
мевается такое состояние, при котором приход азота в виде белков равня-
ется его расходу в виде азотистых соединений, выделяющихся с мочой,
главным образом в виде мочевины у уреотелических животных и мочевой
кислоты у урикотелических животных.
Состояние азотистого равновесия характерно для взрослых людей и
взрослых животных и является для них нормальным явлением. Бывают,
однако, случаи, когда азотистый баланс сдвигается в ту или иную сторону.
Так, например, при голодании, а также при недостаке белков в пище вы-
436
деляется азотистых веществ с мочой больше, чем поступает азота с белками
пищи. В этих случаях приход азота с белками оказывается меньшим, чем
его расход, иными словами, наблюдается отрицательный азотистый баланс.
Отрицательный азотистый баланс свидетельствует о потере организмом бел-
ков тканей. Организм не может продолжительное время находиться в со-
стоянии отрицательного азотистого баланса, и наступает момент, когда
дальнейшая потеря белков тканей приводит его к гибели.
Организм находится в состоянии отрицательного азотистого баланса
также в том случае, когда белки пищи не содержат необходимого для син-
теза белков набора аминокислот, когда в них отсутствует одна или большее
число незаменимых аминокислот. В этом случае распад белков тканей не
может компенсироваться их синтезом.
Белки пищи делятся на две категории: на белки полноценные и на бел-
ки неполноценные. Первые содержат все необходимые для организма ами-
нокислоты (незаменимые аминокислоты). Во вторых же (неполноценных)
белках отсутствует или находится в недостаточном количестве та или иная
незаменимая аминокислота. Как ни велико было бы содержание неполно-
ценных белков в пище, человек и животные будут находиться в состоянии
отрицательного азотистого баланса. Это отнюдь не означает, что в составе
пищи имеются только лишь одни полноценные белки, что неполноценные
белки непригодны для организма. Для нормального питания необходимо,
чтобы различные белки пищи содержали бы все аминокислоты, необходи-
мые для организма, и при этом в нужном соотношении. Более подробно воп-
росы белкового питания освещаются в главе «Биохимия питания» (стр. 489).
Взрослый человек и взрослые животные могут оказаться в состоянии
положительного азотистого баланса, когда количество азота поступающих
в организм белков с пищей оказывается более высоким, чем количество вы-
деляющихся почками с мочой азотистых веществ. Положительный азотис-
тый баланс наблюдается после голодания и истощения организма в резуль-
тате болезней. В период «поправки» восстанавливается масса тканей, и
аминокислоты белков пищи интенсивно используются для синтеза белков
тканей.
У детей и у молодых животных положительный азотистый баланс —
нормальное явление и наблюдается у них постоянно до периода прекраще-
ния роста. Это понятно, так как рост сопровождается увеличением массы
тканей, а отсюда и количества белков. Состояние азотистого равновесия у
молодого организма означает прекращение роста, что является физиологи-
чески ненормальным процессом.
Для установления состояния белкового питания организма, что часто
является практически важной задачей, прибегают к следующему приему.
Путем анализа определяют количество азота, входящего в состав суточного
пищевого рациона. В составе пищевых продуктов азот содержится преиму-
щественно в белках, количество азотистых небелковых веществ невелико
и поэтому без большой погрешности их не определяют отдельно. Результаты
анализа дают представление о приходе азота. Одновременно у человека
или у животного количественно собирают в течение нескольких суток мочу
и ежедневно из общего количества мочи (суточная моча) берут пробу, в ко-
торой определяют содержание азота, входящего в состав всех азотистых ве-
ществ мочи. Этим путем определяют так называемый общий азот мочи. По
количеству общего азота мочи судят о расходе азота.
Для определения азота, входящего в состав белков пищи, производится анализ
пищевых продуктов. Весовая часть того или иного продукта сжигается в колбе в при-
сутствии серной кислоты. Белки гидролизуются, и отщепляющиеся от аминокислот
(и иных веществ) аминогруппы в виде аммиака связываются серной кислотой. Затем
определяют количество сернокислого аммония, по которому судят о количестве азота
белков. Обычно для установления прихода азота учитывают количество отдельных пи-
щевых продуктов в пищевом рационе и по готовым таблицам устанавливают содержа-
ние в них азота белков.
437
Общий азот мочи определяют аналогичным образом. Отдельную пробу суточного
количества мочи сжигают с серной кислотой и устанавливают количество образовав-
шегося сернокислого аммония.
Белки пищи, кроме пластического и иного значения, имеют также и
энергетическое значение. При сгорании одного грамма белка в калоримет-
рической бомбе освобождается 5,6 больших калорий. В организме, однако,
используется не вся энергия белков. Объясняется это тем, что образую-
щийся в результате превращения белков (аминокислот) аммиак выделяется
из организма в очень малом количестве. В моче как уреотелических, так и
урикотелических животных содержатся азотистые вещества, обладающие еще
известной теплотой сгорания. Установлено, что из каждого грамма белка
образуется количество азотистых веществ (мочевины, мочевой кислоты,
креатинина и др.), дающее при сгорании 1,3 больших калорий. Следова-
тельно, физиологическая калорийная ценность одного грамма белков со-
ставляет 4,3 больших калорий (5,6—1,3—4,3).
БИОСИНТЕЗ БЕЛКОВ
Одна из самых интересных проблем белкового обмена — проблема био-
синтеза белков. Этот вопрос с давних пор привлекает к себе внимание ис-
следователей. Белки, как известно, построены из отдельных аминокислот.
Различные белки отличаются друг от друга по составу аминокислот и по
расположению их в полипептидных цепях. Каким образом соединяются ами-
нокислоты друг с другом? Какие ферментативные механизмы обеспечивают
расположение всегда по строгому плану отдельных аминокислот в полипеп-
тидных цепях? Без выяснения этих вопросов проблема биосинтеза белков
не может быть разрешена.
Пионером в деле изучения синтеза белков был А. Я. Данилевский, ко-
торый впервые попытался из продуктов ферментативного переваривания
белков синтезировать белки. Данилевский и его сотрудники при этом ис-
ходили из принципа обратимости действия протеолитических ферментов.
Данилевскому действительно удалось подобрать условия, при которых из
продуктов гидролиза белков происходил синтез сложных веществ, полу-
чивших название пластеинов. Пластеины, однако, оказались веществами
лишь близкими к белкам и не соответствовали белкам, из которых были фер-
ментативным путем получены продукты гидролиза. Исследования Данилев-
ского не разрешили проблему биосинтеза белков.
В клетках и тканях синтез белков начинается с использования амино-
кислот. У зеленых растений образуются все аминокислоты, из которых
синтезируются белки. У животных из кишечника поступают в кровь ами-
нокислоты, из которых в тканях синтезируются белки. В первом и во втором
случае из аминокислот синтезируются определенные, свойственные данным
организмам, белковые вещества. Как же осуществляется этот синтез? До
последнего времени на поставленный вопрос нельзя было дать какой-либо
удовлетворяющий ответ. Результаты исследований последнего времени по-
зволяют разобраться в сложных процессах, приводящих к синтезу белков в
клетках и тканях организмов.
Синтез белков в клетках и тканях может начаться с использования
аминокислот. В этом случае говорят о синтезе белков заново. Он может так-
же осуществляться с использованием и более сложных веществ типа поли-
пептидов, без полного расщепления их до аминокислот (реакция перепеп-
тидации). Наконец, в тканях организма в белковых молекулах происходит
замена аминокислот на одноименные аминокислоты без предварительного
полного распада молекул. Если оставить реакции перепептидации, которые
протекают без явных сдвигов в содержании свободной энергии среды и на
которых мы остановимся несколько позже, остальные процессы использо-
вания аминокислот для синтеза пептидных (кислотоамидпых) связей нуж-
438
даются в притоке энергии извне, так как они являются эндотермическими.
Аминокислоты, прежде чем быть использованными в синтезе белков и более
простых соединений, имеющих пептидные связи, должны активироваться,
стать реакционноспособными. Многочисленные исследования были направ-
лены на выяснение, каким образом аминокислоты, не реагирующие друг
с другом в водной среде с образованием пептидных связей, приобретают спо-
собность к образованию пептидных связей в организме.
Ряд исследователей пытались создать условия, при которых из амино-
кислот можно было бы получить полипептиды чисто химическим путем, без
участия катализаторов, вне организма. Для этого применялись производ-
ные аминокислот с реакционноспособной карбоксильной группой. Было
показано, что фосфорилированные молекулы аминокислот обладают спо-
собностью реагировать друг с другом, причем фосфорилированию должна
подвергнуться карбоксильная группа аминокислот. Синтез подобных фос-
форилированных продуктов (ацилфосфатов аминокислот) удалось осу-
ществить. Эти соединения оказались очень неустойчивыми в водной среде,
но способными реагировать друг с другом с образованием пептидных свя-
зей.
Rt
I
/?i R2 Ri HCNH3
I I II
CHNH2 + CHNH2 —* CHNH—CO +H3PO4
Возможности синтеза пептидных связей в водном растворе из ацилфос-
фатов аминокислот ограничены, причиной этого является их неустойчи-
вость. Они легко отщепляют фосфатную группу и теряют способность к
реакции.
Осуществление синтеза пептидных связей вне организма в результате
реагирования между собой ацилфосфатов аминокислот представляет инте-
рес, так как в ацилофосфатных (карбоксилфосфатных) связях сосредото-
чена энергия (стр. 230), иными словами, эти связи являются макроэргиче-
скими. Отсюда можно заключить, что для синтеза пептидных связей ис-
пользуется энергия макроэргических фосфатных связей. Это заключение
базируется на результатах исследований, проведенных вне организма и без
участия ферментов. Естественно, в связи с этим возникает вопрос, прило-
жим ли этот вывод к процессу синтеза пептидных связей в организме?
В результате многочисленных исследований по синтезу соединений,
имеющих в своих молекулах пептидные связи, и условий, необходимых для
этого синтеза, имеется возможность разобраться в этом сложном процессе,
играющем первостепенную роль в биосинтезе белков.
Изучение условий, необходимых для синтеза пептидных связей, прово-
дилось при синтезе соединений, несложных по своей химической природе.
К таким соединениям относится глутамин, гиппуровая кислота, глутатион
и др. Все они имеют в своих молекулах пептидные, кислотоамидные связи.
Синтез этих соединений удалось осуществить в срезах печени и других
тканей, а также в тонкоизмельченных тканях (гомогенатах) и в фермент-
ных экстрактах из них. Прежде всего привлек к себе внимание тот факт,
что синтез глутамина из глутаминовой кислоты и аммиака, синтез гиппуро-
вой кислоты из бензойной кислоты и глицина, точно так же как синтез глу-
татиона из глутаминовой кислоты, цистеина и глицина, происходит в при-
сутствии кислорода, при окислении в ткани органических веществ. Синтез
этих соединений можно осуществить и в отсутствие кислорода, но в этом слу-
чае необходимо добавить к среде, в которой осуществляется их синтез, аде-
459
нозинтрифосфорную кислоту. Удалось показать, что при синтезе каждой
молекулы глутамина из глутаминовой кислоты и аммиака происходит от-
щепление одной молекулы фосфорной кислоты от аденозинтрифосфорной
кислоты. Следовательно, при синтезе одной пептидной связи используется
энергия одной макроэргической связи аденозинтрифосфорной кислоты.
Подобное соотношение установлено также между образованием пеп-
тидных связей при синтезе гиппуровой кислоты и глутатиона и дефосфори-
лированием аденозинтрифосфорной кислоты. На каждую возникающую пеп-
тидную связь приходится одна молекула фосфорной кислоты, освобождаю-
щаяся от аденозинтрифосфорной кислоты.
Синтез белков в организме происходит в аэробных условиях. Амино-
кислоты, прежде чем быть использованными, активируются, причем в ак-
тивации участвует аденозинтрифосфорная кислота. Активация аминокис-
лот происходит в тканях ферментативно по следующему пути. Молекула
аминокислоты реагирует с молекулой аденозинтрифосфорной кислоты с об-
разованием смешанного ангидрида — аденилата аминокислоты (ациладени-
лата) и пирофосфорной кислоты.
Аденозинтрифосфорная кислота
Аденилат аминокислоты
При образовании ациладенилата аминокислоты используется энергия
макроэргической связи аденозинтрифосфорной кислоты. Эта энергия, одна-
ко, не рассеивается, а оказывается в макроэргической карбоксилфосфатной
связи аденилата аминокислоты (в формуле эта связь обозначена волнистой
черточкой).
Образование ациладенилатов аминокислот удалось наблюдать при
осуществлении с помощью ферментов взаимодействия между аминокислота-
ми и аденозинтрифосфорной кислотой. Аденилаты аминокислот получены
также и путем химического синтеза; они используются в опытах с изолиро-
ванными тканями для синтеза белков. При синтезе белков в опытах вне
организма (в срезах тканей, в ферментных растворах) добавление аденила-
тов аминокислот дает тот же эффект, что и совместное добавление амино-
кислот и аденозинтрифосфорной кислоты.
Сравнение свойств карбоксилфосфатов аминокислот и аденилатов ами-
нокислот показывает, что последние обладают известным преимуществом
по сравнению с первыми. Они более устойчивы в водном растворе и не так
быстро подвергаются расщеплению. Из двух возможных путей активирова-
ния аминокислот в живых организмах имеет место один наиболее эффектив-
ный — путь образования аденилатов аминокислот.
440
В свете изложенного выше становится понятным, почему именно для
осуществления биосинтеза белков требуется окисление органических ве-
ществ (использование кислорода) или же наличие аденозинтрифосфорной
кислоты. Аденозинтрифосфорная кислота необходима для образования аде-
нилатов аминокислот. Энергия макроэргических связей аденозинтрифос-
форной кислоты переходит в энергию карбоксилфосфатной связи аденила-
тов аминокислот. Эта энергия оказывается необходимой для образования
затем пептидных связей. Окисление органических веществ дает энергию
для образования макроэргических связей при фосфорилировании аденозин-
дифосфорной кислоты. Отсюда можно заключить, что для синтеза аденила-
тов аминокислот необходима энергия окисления органических веществ, аде-
нозинтрифосфорная же кислота — как бы посредник при использовании
этой энергии.
Активация аминокислот — образование аденилатов — важный этап
биосинтеза белков. Это, однако, не объясняет, почему именно активирован-
ные аминокислоты дальше соединяются друг с другом не хаотически, а в
строго определенном порядке. Этот строгий порядок сочетания аминокислот
при синтезе белков — одно из самых замечательных явлений, которое встре-
чается у всех живых организмов. Биологическое значение этого явления
очень велико. Благодаря ему в организме каждого вида животных и расте-
ний, а также микроорганизмов всегда синтезируются специфические для
него белковые вещества. Современная биологическая химия в настоящее
время дает ответ на вопрос, как осуществляется синтез белковых ве-
ществ, с помощью каких ферментов происходит отбор, всегда в строгом
порядке, различных аминокислот при конструировании белков, специфич-
ных для различных живых существ. Биохимики сумели стать на путь
точного эксперимента для разрешения поставленных вопросов.
Установлено, что в биосинтезе белков исключительно важную роль
играют нуклеиновые кислоты, входящие в состав ядер и цитоплазмы кле-
ток. Содержание нуклеиновых кислот (нуклеопротеидов) в различных клет-
ках и тканях оказывается неодинаковым. В тех клетках, где происходит
активный синтез белков, например в железах (пищеварительные железы),
в быстрорастущих клетках эмбриональных тканей и т. д., всегда содержится
большое количество нуклеопротеидов. Одновременно с этим установлено,
что нуклеиновые кислоты в этих клетках находятся в состоянии активного
обмена, подвергаясь интенсивному распаду и ресинтезу. Интенсивное об-
новление нуклеиновых кислот в клетках, физиологически приспособленных
к интенсивному синтезу белков, установлено в исследованиях с применени-
ем изотопов. Оказалось, что синтез белков в клетке осуществляется про-
странственно неравномерно, он локализован в отдельных структурных
элементах клеток — в секреторных гранулах, в микросомах, ядрышке. Пере-
численные структурные элементы клеток особенно богаты рибонуклеиновы-
ми кислотами, в них особенно интенсивно происходит обновление рибону-
клеиновых кислот во время синтеза белков.
Существует ряд веществ (к ним относятся некоторые антибиотики),
тормозящие синтез нуклеиновых кислот в клетках. Эти же вещества подав-
ляют синтез белков в клетках. Следует отметить, что благодаря участию
нуклеиновых кислот аминокислоты при синтезе белков соединяются
друг с другом в строго определенном порядке. Подробнее о роли ну-
клеиновых кислот см. стр. 471.
Изложенные представления о биосинтезе белков в равной мере отно-
сятся также к синтезу полипептидов из аминокислот. И в случае синтеза
полипептидов (некоторых гормонов и антибиотиков) всегда встречаются с
набором аминокислот, расположенных в их молекулах в строго определен-
ном порядке. Возможно, что в процессе биосинтеза белков возникают поли-
пептиды, из которых затем уже синтезируются белки. В пользу этого пред-
положения говорит наличие ферментов транспептидаз, катализирующих
реакции, при которых в пептидной связи на место остатка одной или нес-
441
кольких аминокислот становится остаток другого пептида или аминокисло-
ты. В результате реакций транспептидации общее количество пептидных
связей (—СО—NH—) в системе реагирующих веществ остается без измене-
ния, количество же этих связей у одних компонентов реакции увеличива-
ется, а у других уменьшается по сравнению с исходными. Для большей яс-
ности приводится пример реакции транспептидации, в которой участвуют
два дипептида (в реакциях транспептидации участвуют и более сложные
полипептиды).
H2NCH#iCO—NHCH-/?2-COOH 4- H2N-CH£3CO—NH-CH£4-COOH^
(первый дипептид) (второй дипептид)
^2 H2N-СНТ?!• CONII-CH£2-CONH-CH£3COOH + £4CHNH2COOH.
В приведенном случае реакция транспептидации привела к образова-
нию из двух дипептидов одного трипептида. В других случаях в резуль-
тате реакций транспептидации может переноситься от одного полипептида
(для примера возьмем гексапептид) часть его молекулы (например, состоя-
щую из четырех остатков аминокислот) на гептапептид; в результате этой
реакции образуются дипептид и пептид, состоящий из одиннадцати остатков
аминокислот. Интересно, что реакции транспептидации протекают без су-
щественных изменений свободной энергии. Следовательно, если при синтезе
пептидных связей используется энергия макроэргических связей аденозин-
трифосфорной кислоты, то перекомбинирование остатков аминокислот в
полипептидах, которое осуществляется с помощью транспептидаз, может
происходить без изменения свободной энергии системы.
Установлено, что реакции транспептидации катализируются протеоли-
тическими ферментами. Насколько эти реакции важны для биосинтеза бел-
ков, должны показать дальнейшие исследования.
С проблемой биосинтеза белков теснейшим образом связана проблема
их обновления. Применение метода меченых атомов позволило установить,
что, помимо полного распада и полного синтеза белковых молекул, в клет-
ках происходят еще процессы замещения в белках отдельных аминокислот-
ных остатков, или небольших участков полипептидных цепей, идентичными
аминокислотами, или соответствующими низкомолекулярными полипепти-
дами. В этих случаях происходит частичное обновление химического со-
става белков клеток без их полного распада с образованием аминокислот и
последующего затем синтеза. Подобное обновление белков тканей установ-
лено в опытах с введением в организм аминокислот меченных N15 или С14.
В ряде опытов были использованы аминокислоты, меченные и стабильным
изотопом азота и радиоактивным углеродом. В результате этих опытов было
установлено, что аминокислотный состав белков тканей подвергается не
только образованию заново, но и постепенному обновлению. Введенные в
организм меченые молекулы отдельных аминокислот, появлялись в составе
белков еще до их полного распада. Подобное обновление аминокислотного
состава белков связано с их динамическим состоянием.
Вопросам динамического состояния белков и других составных частей
клеток посвящена специальная глава (стр. 483). Здесь же следует отметить,
что использование в исследованиях наряду с радиоактивными и стабиль-
ными изотопами также отдельных элементов клеток: гранул, митохондрий,
микросом и ферментных экстрактов из клеток — позволило весьма деталь-
но разобраться в ферментативных процессах, обеспечивающих обнов-;
ление аминокислотного состава белков тканей. Установлено, что обновле-
ние аминокислотного состава белков происходит при определенных усло-
виях. Аминокислоты, участвующие в этом процессе, как это имеет место в
случае синтеза белковых молекул, подвергаются активированию. Активиро-
вание аминокислот происходит в присутствии кислорода, или же при добав-
лении к среде аденозинтрифосфорной кислоты. Продуктами активирова-
442
ния являются аденилаты аминокислот. Ферментативные процессы активи-
рования аминокислот сосредоточены преимущественно в митохондриях,
обновление же белков интенсивно происходит в микросомах клеток. В про-
цессах обновления аминокислотного состава белков участвуют нуклеиновые
кислоты. Из приведенного следует, что обновление аминокислотного состава
белков, как и биосинтез белков, является сложным процессом, теснейшим
образом связанным с обменом веществ.
Этот процесс (обновление аминокислотного состава) вероятно представ-
ляет одну из промежуточных фаз реакций синтеза белков заново. Вне обме-
на веществ нет ни синтеза, ни обновления белков клеток. Между тем иногда
на основании результатов опытов с добавлением к отдельным выделенным
из организма белкам, а также к препаратам денатурированных белков мече-
ных аминокислот приходят к выводу, что обновление аминокислотного
состава свойственно индивидуальным белкам, находящимся вне биологиче-
ской системы. При этом смешивают процессы химического и физико-химиче-
ского характера — реакции адсорбции, конденсации и другие реакции хи-
мического взаимодействия между белками и аминокислотами с процессами
включения и выключения отдельных аминокислот в белковые молекулы, яв-
ляющимися процессами биологического характера. Биохимической осно-
вой обновления белков являются ферментативные процессы, обеспечиваю-
щие активирование аминокислот и распад и синтез пептидных связей.
ОБМЕН БЕЛКАМИ МЕЖДУ КРОВЬЮ И ТКАНЯМИ
Аминокислоты, необходимые для синтеза белков, доставляются к тка-
ням кровью. Этим, однако, не исчерпывается участие крови в синтезе бел-
ков в организме. Большое значение в процессах обмена белков тканей име-
ют белки плазмы крови, альбумины и глобулины. У человека и животных
постоянно и интенсивно происходит взаимопревращение белков плазмы кро-
ви и белков тканей. Это взаимопревращение приводит к тому, что между
количеством белков (плазмы) в крови и содержанием белков в тканях уста-
навливается определенное равновесие. При голодании, кровопотерях (бел-
ковое голодание) это равновесие нарушается. Нормальное количественное
соотношение между белками плазмы крови и белками тканей в этих случаях
в организме легко восстанавливается при введении в кровь извне кровяной
плазмы, или гетерогенной кровяной сыворотки. Подобное введение белков
в кровь носит название парентерального белкового питания.
Установлено, что с помощью парентерального питания можно в тече-
ние продолжительного времени при отсутствии белков в пище поддержи-
вать состояние азотистого равновесия в организме и даже создать условия
для положительного азотистого баланса. При этом содержание белков в
плазме крови сохраняется на обычном уровне. Опыты с парентеральным
введением человеку и животным белков, меченных радиоактивной серой
(S35), радиоактивным йодом (J131) и другими изотопами (для получения
меченых белков в организм вводят те или иные меченые аминокислоты,
а затем выделяют белки; для получения меченных йодом белков плазму
крови йодируют в присутствии J131), показали, что после внутривенного
введения белков они через 3—4 дня оставляют кровяное русло, переходя
в печень и в другие органы, где и превращаются в специфические белки
указанных органов.
Естественно, встает вопрос, как превращаются белки плазмы крови в
специфические белки тканей? Подвергаются ли они предварительно рас-
щеплению с помощью протеолитических ферментов тканей, а затем из обра-
зовавшихся аминокислот синтезируются белки тканей, или же структура
их подвергается перестройке без полного распада? Исчерпывающий ответ
дать на поставленные вопросы еще не представляется возможным. Учиты-
вая, однако, что парентерально введенные белки лучше усваиваются, чем
парентерально введенная смесь аминокислот, полученная при расщеплении
443
белков ( о чем судят по данным изучения азотистого баланса), можно пола-
гать, что белки плазмы крови превращаются в белки органов, не подверга-
ясь полному расщеплению.
Белки плазмы крови образуются в различных органах, главным образом
в печени, а также в незрелых клеточных элементах кроветворных органов
(в плазмоцитах, гистиоцитах и др.). Этим путем возмещается расход белков
плазмы крови и осуществляется их обновление. О важной роли печени в син-
тезе белков плазмы крови свидетельствуют результаты исследований с вы-
ключением печени из кровообращения путем наложения экковской фистулы.
В этом случае содержание белков в плазме крови значительно снижается
и обновление их прекращается. Различные заболевания печени, сопровож-
дающиеся поражением ее паренхимы, сопровождаются нарушением синтеза
белков плазмы и отсюда уменьшением их содержания. Определение содер-
жания различных белков плазмы крови имеет диагностическое значение и к
нему часто прибегают в клинической практике.
Белки поступают в кровь непрерывно не только из печени, но и из дру-
гих органов. В плазме крови содержатся различные ферменты, гормоны бел-
ковой природы (паратиреоидный гормон, инсулин, гормоны гипофиза),
поступающие в кровь из различных тканей и органов. При многих заболе-
ваниях изменяется активность ферментов в плазме крови, а также содержа-
ние в ней гормонов.
ФАКТОРЫ, РЕГУЛИРУЮЩИЕ АЗОТИСТЫЙ ОБМЕН
Обмен белков, превращения аминокислот и других азотистых веществ
регулируются у животных и человека рядом факторов. К ним относятся
биологически активные вещества — витамины, поступающие в организм
извне, и гормоны, образующиеся в железах внутренней секреции. Главное
же место в регуляции обмена азотистых, как и других, веществ занимает
центральная нервная система.
Процессы биосинтеза белка, образование пептидных связей, как мы
видели (стр. 440), связано с окислительными процессами, которые обеспечи-
вают фосфорилирование аденозиндифосфорной кислоты, образование мак-
роэргических связей. Энергия этих связей используется для активирования
аминокислот, для образования их аденилатов. Процессы использования
энергии в организме регулируются нервной системой.
Процессы распада аминокислот, их дезаминирование, переаминирова-
ние, декарбоксилирование, расщепление безазотистых продуктов, образую-
щихся из аминокислот и др., катализируются различными ферментами.
Отсюда понятно, что различные витамины, входящие в состав ферментов
(флавин, пиридоксаль, тиамин, никотиновая кислота и др.) и тем самым
участвующие в многочисленных ферментативных реакциях обмена веществ
в организме, прямым и косвенным образом участвуют также в обмене бел-
ков и образующихся из них аминокислот.
При недостатке витаминов у животных нарушаются процессы обмена
веществ, нарушаются также превращения и азотистых веществ. При раз-
личных авитаминозах животные, несмотря на наличие в пищевых рационах
достаточного количества полноценных белков, находятся в состоянии отри-
цательного азотистого баланса. Распад белков в тканях авитаминозных
животных происходит в большей степени, чем их синтез.
Некоторым витаминам принадлежит особо важная роль в азотистом
обмене. Подвергаясь в организме фосфорилированию, а в некоторых слу-
чаях более сложным превращениям, они дают начало образованию небел-
ковых компонентов ферментов, катализирующих реакции превращения
аминокислот.
Витамин В2 (флавин) является составной частью кофермента оксидазы
D- и L-аминокислот и аминооксидаз. Пантотеновая кислота входит в состав
444
кофермента ацилирования, играющего важную роль в обмене безазотистых
соединений, образующихся из аминокислот (а-кетокислот и др.) и ряда азо-
тистых веществ. Фолиевая кислота и ее производные участвуют в процес-
сах, приводящих к использованию метильных групп метионина, формиль-
ных, оксиметильных групп (остатков муравьиной кислоты и формальдегида),
возникающих при превращении ряда аминокислот (серина, глицина, гисти-
дина, триптофана).
Особо важное место в азотистом обмене занимает витамин В6 (пиридок-
саль). В виде своего фосфорного эфира витамин В6 служит коферментом
ряда ферментов, участвующих в превращениях аминокислот. В частности,
ферменты, катализирующие переаминирование аминокислот, содержат
в виде кофермента пиридоксальфосфат. Авитаминоз В6 сопровождается, осо-
бенно у микроорганизмов, ослаблением и даже прекращением реакций пере-
аминирования. Пиридоксальфосфат является также коферментом декарбо-
ксилаз аминокислот. Вместе с этим пиридоксальфосфат входит (в виде ко-
фермента) в состав ряда других ферментов, участвующих в превращениях
определенных аминокислот (триптофана, серина, серусодержащих амино-
кислот). При недостатке витамина В6 в организме нарушается обмен этих
аминокислот.
В азотистом обмене участвует также никотиновая кислота (витамин
РР). Амид никотиновой кислоты входит в состав кофермента ряда дегидро-
геназ, в том числе дегидрогеназы глутаминовой кислоты, катализирующей
обратимое дезаминирование глутаминовой кислоты. С помощью этого фер-
мента при аминировании а-кетоглутаровой кислоты вовлекается в процес-
сы азотистого обмена аммиак. От образующейся глутаминовой кислоты ами-
ногруппы переносятся с помощью аминофераз на различные а-кетокислоты
с образованием соответствующих аминокислот.
Витамин С — аскорбиновая кислота — участвует в одной из реакций
окисления фенольного ядра тирозина. Авитаминоз С сопровождается выде-
лением из организма гомогентизиновой кислоты, промежуточного продукта
превращения тирозина. Витамин С необходим для биосинтеза белков соеди-
нительной ткани (коллагенов); предполагают, что он участвует в образо-
вании оксипролина — аминокислоты — важной в структуре колла-
гена.
Витамин В12 принимает участие в процессах биосинтеза белков.
Витамины относятся к числу факторов внешней среды, участвующих
в обмене веществ вообще и в обмене белков и других азотистых соединений,
в частности. К факторам внутренней среды, влияющим и, следовательно,
регулирующим процессы обмена веществ, в том числе белков и азотистых
веществ, относятся гормоны. Некоторые гормоны, например, тироксин
и близкий к нему трийодтиронин, а также некоторые другие гормоны, осо-
бенно явно влияют на обмен белков. Тироксин и трийодтиронин усиливают
процессы распада белков и способствуют течению процессов обновления
аминокислотного состава белков.
Гормон островковой ткани поджелудочной железы — инсулин косвен-
ным образом (подобно другим гормонам) влияет на азотистый обмен, способ-
ствуя синтезу белка в тканях. При диабете усилены процессы образования
углеводов из аминокислот и одновременно с этим усилен также распад бел-
ков в организме.
На обмен белков влияют также некоторые гормоны гипофиза. Особую
роль в этом отношении играет гормон роста, под влиянием которого увели-
чивается масса тканей и, следовательно, синтез белков тканей организма.
В азотистом обмене участвуют также гормоны коры надпочечников и поло-
вые гормоны.
В большинстве случаев гормоны действуют на азотистый обмен косвен-
ным путем. Влияя на углеводный и жировой обмен, на окислительные про-
цессы и на процессы фосфорилирования, гормоны, в том или ином направ-
лении, воздействуют также на обмен белков и азотистых веществ.
445
Обмен веществ, включая обмен белков и азотистых веществ, у человека
и у высших животных, регулируется центральной нервной системой и осо-
бенно высшими ее отделами — корой больших полушарий головного мозга
и подкорковыми центрами головного мозга. Регуляторные функции фак-
торов внешней среды (витаминов) и внутренней среды (гормонов) подчине-
ны регуляторной функции высшей нервной системы и вместе с нею состав-
ляют единую систему регуляции обмена веществ и координации многооб-
разных функций организма.
Нервная регуляция белкового обмена начинается уже с момента пере-
варивания белков, а затем всасывания продуктов переваривания кишечни-
ком в кровь. Образование протеолитических ферментов в пищеварительных
железах, выделение пищеварительных соков регулируется нервной систе-
мой. Регулируются и координируются нервной системой и другие звенья
обмена. От коры больших полушарий головного мозга и от подкорковых
центров к периферии направляются импульсы, под влиянием которых про-
цессы азотистого обмена приспосабливаются к условиям внешней и внут-
ренней среды организма. Регуляторные воздействия центральной нервной
системы на обмен веществ осуществляются также рефлекторнььм путем,
в ответ на безусловные раздражители, поступающие в различные отделы
центральной нервной системы через экстеро- и интерорецепторы.
При поражениях тех или иных отделов центральной нервной системы,
повреждениях периферических нервов наблюдаются значительные измене-
ния белкового обмена в различных органах, сопровождающиеся изменения-
ми в активности и в образовании белков — ферментов, а также умень-
шением общего содержания белков. Известно, например, что денервация
мышц вызывает расстройство их питания, атрофию, при которой резко
уменьшается масса мышцы — содержание белков, входящих в состав мы-
шечных волокон.
Еще большее значение, чем прямая иннервация периферических орга-
нов, в регуляции азотистого обмена и обмена других веществ имеет нервная
регуляция функции желез внутренней секреции. Образование гормонов
и выделение их в кровь происходит под контролем центральной нервной
системы. Следовательно, воздействие гормонов на обмен белков и азотистых
веществ регулируется нервной системой.
Перед биологической химией стоит чрезвычайно важная и очень слож-
ная задача выяснения химических механизмов, с помощью которых осу-
ществляется нервная регуляция обмена веществ, и в частности обмена
белков.
КРУГОВОРОТ АЗОТА В ПРИРОДЕ
Изучение азотистого обмена у живых существ выявило одно из звеньев
круговорота азота в природе. Основная масса азота находится в свободном,
т.е. молекулярном виде, в составе земной атмосферы. Количество азота,
окружающее в газообразном состоянии Землю, неимоверно велико. Под-
счеты показывают, что над каждым квадратным метром земной поверхности
находится около восьми тонн азота. В связанном состоянии, т.е. в составе
химических соединений, азот встречается в почве и в воде. Там он представ-
лен органическими и неорганическими веществами. Запасы азота в виде
солей азотной кислоты (селитры) имеются в Чили, Египте, Бенгалии.
В составе органических соединений азот встречается в живых организ-
мах. Белковые вещества, являющиеся основой жизни, состоят в среднем на
16% из азота. В почве имеются органические соединения азота — продукты
выделения животных, а также продукты бактериального распада остатков
животных и растений. Эти соединения в почве минерализуются под влия-
нием микроорганизмов и служат источником образования аммиака. Со-
держание аммиачных солей в почве, однако, невелико, так как под влияни-
ем нитрофицирующих бактерий они превращаются в соли азотистой и
446
азотной кислот. Минеральные соединения азота составляют около процента
общего количества азотистых веществ почвы. Из почвы минеральные соеди-
нения азота (нитраты, нитриты, аммиак) поступают в организмы растений.
Нитраты и нитриты восстанавливаются с образованием аммиака, который
используется для синтеза аминокислот и других азотистых органических
веществ. Из аминокислот синтезируются белки.
Животные с пищей получают белки, синтезированные зелеными расте-
ниями, при этом травоядные животные — непосредственно, плотоядные—
пожирая свои жертвы. Белковые вещества у животных претерпевают цикл
сложных превращений, в результате которых образуются конечные про-
дукты азотистого обмена — мочевина, мочевая кислота и другие соеди-
нения, которые, выделяясь из организма, поступают в почву. В почве эти
вещества подвергаются воздействию микроорганизмов. Из них вновь
образуются аммиак, нитриты и нит-
раты, являющиеся продуктами азо-
тистого питания растений.
Почвенные микроорганизмы иг-
рают очень важную роль в кругово-
роте азота в органическом мире.
Разлагая органические азотистые со-
единения, минерализуя их, они по-
требляют некоторое количество азота.
Окисляя аммиак, нитрифицируя его,
они используют энергию его окис-
ления. Главная же масса нитратов
используется в качестве продуктов
азотистого питания растениями
(стр. 356).
Рис. 20. Схема круговорота азота
Наряду с процессом нитрифика-
ции в почве в сравнительно неболь-
шом объеме происходит обратный про-
цесс — денитрификации, осуществля-
емый рядом бактерий почвы. В результате этого процесса из некоторого ко
личества нитратов образуется свободный азот. Денитрифицирующие бакте
рии высвобождают незначительное количество азота из его соединений, ис-
пользуемых животными и растениями. Однако это компенсируется жизне-
деятельностью микроорганизмов, фиксирующих азот, превращающих моле-
кулярный азот в азот органических сединений. Среди этих организмов
особое значение имеют клубеньковые бактерии, живущие в симбиозе с бо-
бовыми растениями, они проникают в корни бобовых растений, образуя клу-
беньки. Клубеньковые бактерии пользуются органическими соединениями
растений и в свою очередь снабжают растения азотистыми веществами,
вырабатываемыми ими в результате фиксации атмосферного азота.
Круговорот азота в органической природе, в который вовлечена ма-
лая доля всего азота атмосферы Земли, можно представить в виде схемы
(рис. 20).
Фиксация азота, т. е. его использование для синтеза азотистых соеди-
нений, характерно только лишь для небольшой определенной группы
бактерий. Все остальные организмы не способны использовать атмосферный
азот. Это неопровержимый факт.
ЛИТЕРАТУРА
БраунштейнА. Е. Биохимия аминокислотного обмена. Изд. АМН СССР,
1949.
БраунштейнА. Е. Главные пути ассимиляции и диссимиляции азота у
животных. XII Баховское чтение. Изд. АН СССР, 1957.
БраунштейнА. Е. Некоторые черты интеграции процессов азотистого об-
мена. Доклад на IV Международном биохимическом конгрессе, 1958.
447
Г у л ы й М. Ф. О биологическом синтезе белка. «Укр. биохимический журнал»,
1961, т. 33, стр. 876.
Капланский С. Я- Некоторые проблемы патологии обмена аминокислот.
В кн. «Химические основы процессов жизнедеятельности». М., 1962, стр. 253.
Ко н никова А. С. и Крицман М. Г. Некоторые данные о механизме
синтеза белка, полученные при использовании аналогов аминокислот. «Успехи совре-
менной биологии», 1963, т. 55, стр. 339.
Майстер А. Биохимия аминокислот, 1961.
М а р д а ш е в С. Р. Амиды аминокислот, их обмен и физиологическая роль в
животном организме. «Успехи современной биологии», 1955, т. 40, стр. 8.
Медведев Ж- А. Биосинтез белков и проблемы онтогенеза. Медгиз, 1963.
Прянишников Д. Н. Азот в жизни растений и в земледелии. Изд.
АН СССР, 1945.
С и н и цы н а А. Л. Обмен глутатиона и его биохимические функции. «Успехи
современной биологии», 1953, т. 35, стр. 313.
ФердманД. Л. О процессах образования и устранения аммиака в живот-
ном организме. «Успехи биологической химии», 1950, т. 1, стр. 216.
Глава восемнадцатая
ОБМЕН НУКЛЕИНОВЫХ КИСЛОТ
Нуклеиновые кислоты относятся к числу особенно важных составных
частей клеток. Химическое строение предопределяет большое их разнооб-
разие и возможность многочисленных реакций превращения. Интересно
проследить за ходом превращения нуклеиновых кислот в организме: за
их распадом, за судьбой возникающих при их распаде продуктов, за процес-
сами, приводящими к синтезу нуклеиновых кислот.
РАСПАД НУКЛЕИНОВЫХ КИСЛОТ
Нуклеиновые кислоты, как составные части нуклеопротеидов, входят
в состав пищевых продуктов. Более богаты нуклеиновыми кислотами про-
дукты животного происхождения.
В желудке нуклеопротеиды пищи подвергаются воздействию пепсина
и соляной кислоты, в результате чего от них отщепляется часть белка.
В кишечнике под влиянием трипсина от нуклеопротеидов отщепляется
оставшийся белок с образованием нуклеиновых кислот. Последние фермен-
тами, содержащимися в соке поджелудочной железы, деполимеризуются
в кишечнике и расщепляются на мононуклеотиды. Образующиеся в тонких
кишках мононуклеотиды подвергаются воздействию кишечной фосфатазы,
в результате чего получается фосфорная кислота и нуклеозиды.
Кишечником всасываются мононуклеотиды, нуклеозиды и азотистые
основания.
В различных тканях организма содержатся ферменты нуклеотидазы
(фосфатазы), катализирующие гидролитическое отщепление от мононукле-
отидов фосфорной кислоты, и нуклеозидазы (нуклеозидфосфорилазы), ка-
тализирующие распад нуклеозидов с образованием углевода и азотистых
веществ (производных пурина и пиримидина). Следовательно, начавшийся
распад нуклеиновых кислот в пищеварительном тракте может завершиться
в тканях организма. Одновременно с этим в тканях может происходить
распад нуклеиновых кислот. В тканях широко распространены деполи-
меразы рибо- и дезоксирибонуклеиновых кислот, с помощью которых ну-
клеиновые кислоты деполимеризуются.
В результате полного гидролиза нуклеиновых кислот образуются:
производные пурина и пиримидина, пентозы (рибоза и дезоксирибоза)
и фосфорная кислота. Конечным продуктом обмена производных пурина
у человека и приматов (человекообразных обезьян) служит мочевая ки-
слота. Часть мочевой кислоты, выделяющейся у человека с мочой, появ-
ляется в результате превращений производных пурина, поступающих с
пищей преимущественно в составе нуклеиновых кислот, часть же образует-
ся при превращении производных пурина, синтезирующихся в организме.
У большинства млекопитающих животных мочевая кислота превращается
15 Заказ № 581 449
большей частью или почти целиком в аллантоин, а у холоднокровных жи-
вотных аллантоин в дальнейшем расщепляется с образованием глиокси-
левой кислоты и мочевины. Расщепление мочевой кислоты носит название
уриколиза (acidum uricum — мочевая кислота, lysis — расщепление)
(стр. 452).
ОБРАЗОВАНИЕ МОЧЕВОЙ КИСЛОТЫ
Мочевая кислота—продукт окисления гипоксантина и ксантина, об-
разующихся в результате дезаминирования аденина и гуанина. В составе
нуклеиновых кислот производные пурина представлены аденином и гуа-
нином.
В тканях животных содержатся ферменты аденаза и гуаназа, катализи-
рующие гидролитическое дезаминирование аденина с образованием гипо-
ксантина и дезаминирование гуанина с образованием ксантина. Однако
активность этих ферментов, особенно аденазы, невелика.
CNHo N
Гипоксантин
Аденин
Ксантин
Наряду с аденазой и гуаназой в тканях животных установлено наличие
дезаминаз, субстратами для которых являются мононуклеотиды —адени-
ловая и гуаниловая кислота — и нуклеозиды — аденозин и гуанозин. Осо-
бенно активна в тканях дезаминаза адениловой кислоты. Таким образом,
дезаминирование аденина и гуанина может происходить и до отщепления
их от нуклеотидов и нуклеозидов.
Окисление гипоксантина и ксантина с помощью ксантиноксидазы в
печени приводит к образованию мочевой кислоты
Гипоксантин
Мочевая кислота
ВЫДЕЛЕНИЕ МОЧЕВОЙ КИСЛОТЫ
Мочевая кислота постоянно обнаруживается в моче. Выделение ее
главным образом в виде натриевой соли при диэте, не содержащей производ-
ных пурина, зависит от объема превращений в организме производных
пурина.
450
Человек, а также животные могут обходиться без наличия производных
пурина в пище, причем количество нуклеиновых кислот и других веществ,
содержащих пуриновые производные в тканях, не уменьшается. Количе-
ство мочевой кислоты, выделяющееся у человека, а также человекообраз-
ных обезьян, получающих пищу, свободную от производных пурина,
может служить мерилом интенсивности обмена нуклеиновых кислот и дру-
гих веществ, включающих пуриновые производные. У различных млеко-
питающих животных этим мерилом является количество выделяющегося
аллантоина — продукта расщепления мочевой кислоты.
При наличии производных пурина в пище выделение мочевой кислоты
у человека и аллантоина у большинства млекопитающих увеличивается.
Следовательно, мочевая кислота, выделяющаяся с мочой, является, с од-
ной стороны, продуктом дезаминирования и окисления производных пури-
на, синтезирующихся в организме, а с другой — поступающих в организм
с нищей.
Выделение производных пурина из организма с мочой, в %:
Аллантоин Мочевая Пуриновые
кислота основания
Человек ......................... 2 90 8
Обезьяны (за исключением ан-
тропоидных) . 66 8 26
Собака.......................... 97 2 1
Овца............................ 65 16 19
Мочевая кислота, в виде мононатриевой соли, содержится в плазме
крови (3—5 мг %). Это количество значительно повышается при подагре,
которой часто болеют пожилые люди, и при лейкозах. При подагре моче-
вая кислота и ее малорастворимая натриевая соль откладываются в хрящах
и сухожилиях. Отложение мочевой кислоты и ее солей (уратов) в виде кам-
ней происходит также в почках, вызывая их повреждения. Мужчины болеют
подагрой значительно чаще, чем женщины.
Образование и выделение мочевой кислоты у человека с давних пор
является объектом изучения как биохимиков, так и клиницистов. В послед-
нее время, благодаря применению метода изотопов, удалось уточнить ряд
ранее полученных данных и продвинуть вперед исследование обмена произ-
водных пурина, образование и выделение мочевой кислоты у человека.
Введение меченной тяжелым изотопом азота мочевой кислоты и последующее
определение N15 в мочевой кислоте во взятой пробе крови и во внеклеточной
жидкости позволили установить распределение мочевой кислоты в жид-
костях организма. Оказалось, что у здорового человека содержится около
1,1 г мочевой кислоты, из них около 0,2 г содержится в крови, остальное
количество — во внеклеточной жидкости. Далее было обнаружено, что от
половины до трех четвертей имеющейся в организме мочевой кислоты под-
вергается ежедневно обновлению. Эти данные интересны в том отношении,
что они уточняют ранее установленные факты об интенсивности образования
и выделения мочевой кислоты.
Установлено, что у человека, больного подагрой, общее количество мо-
чевой кислоты в крови и в жидкостях в несколько раз больше, чем у здо-
рового человека. Значительно повышенным оказывается содержание мо-
чевой кислоты в крови больных, особенно во время приступов подагры.
Указанное явление зависит от двух причин: увеличения образования моче-
вой кислоты или от задержки ее выделения.
Для выяснения причин, обусловливающих повышение содержания мо-
чевой кислоты у больных подагрой, были поставлены следующие опыты.
Здоровым людям и людям, больным подагрой, вводился глицин, меченный
N15. Исследователи исходили из того, что глицин подвергается в организме
15*
451
различным превращениям (стр. 378), и в частности используется для синтеза
пуринов. Введенный в организм азот глицина обычно выделяется в виде
азота мочевины, а также в виде азота креатина, мочевой кислоты и других
азотистых соединений. У здоровых людей, как это было установлено в опы-
тах с введением меченого глицина, в течение десяти дней около 0,15%
введенного азота глицина выделяется в виде мочевой кислоты. У некоторых
больных подагрой за это же время в виде мочевой кислоты выделяется при-
мерно 0,5% введенного глицина. Эти данные показывают, что образование
производных пурина, их дезаминирование и окисление, приводящие к об-
разованию мочевой кислоты, у больных подагрой происходит интенсивнее,
чем обычно у здоровых людей. Это, однако, не исключает возможности
нарушения выделения из организма мочевой кислоты. Известно, что перед
приступами подагры выделение мочевой кислоты уменьшается, а затем,
после прекращения приступа, увеличивается. Усиление образования моче-
вой кислоты и нарушение ее выделения при подагре приводит к отложению
мочевой кислоты и ее солей в хрящах, в сухожилиях и в суставных сум-
ках больных.
В возникновении подагры большое значение имеет употребление в пищу боль*
шого количества мяса и мясных продуктов. В Индии, где люди питаются преимущест-
венно вегетарианской пищей, подагра встречается чрезвычайно редко. В тех же пример-
но климатических условиях население Ирана, питающееся мясной пищей, страдает
от подагры. У жителей Англии, потребляющих в значительных количествах мяс-
ную пищу, подагра встречается довольно часто. С сокращением потребления мяса в
Англии заболевание подагрой снизилось. Мясная пища с высоким содержанием про-
изводных пурина — предшественников мочевой кислоты, противопоказана больным
подагрой. Одним из приемов лечения подагры является ограничение в пищевом рацио-
не мяса и мясных продуктов и замена их овощами, хлебом и мучными продуктами,
яйцами, сыром и фруктами — продуктами, бедными производными пурина.
Наряду с диетическим лечением подагры, прибегают также к приемам лечения,
направленным к усилению выделения мочевой кислоты у больных и к удалению отло-
женных в организме мочевой кислоты и ее солей. С этой целью рекомендуют вводить
в организм соли лития для замещения в уратах натрия на литий. Литиевая соль моче-
вой кислоты обладает большей растворимостью, чем натриевая. Введение в организм
щелочей (бикарбонатов) также создает благоприятные условия для растворения и вы-
деления уратов с мочой. В медицине наряду с этим применяются органические веще-
ства (например, атофан), которые способствуют растворению уратов и выделению их
из организма больных.
Мочевая кислота малорастворима в воде и нерастворима в спирте и в эфире.
Кристаллизуется она в виде ромбических пластинок. Она ведет себя как двуосновная
кислота. Два атома водорода мочевой кислоты, находящиеся у атомов азота (в ее кето-
форме), замещаются металлами. Соли мочевой кислоты также плохо растворимы в
воде. Особенно это относится к аммонийной соли, а также к солям щелочноземельных
и тяжелых металлов.
РАСПАД МОЧЕВОЙ КИСЛОТЫ. УРИКОЛИЗ
Мочевая кислота, как уже указывалось, является конечным продуктом
обмена производных пурина у человека и у человекообразных обезьян.
При введении человеку мочевой кислоты или ее непосредственных пред-
шественников — соединений, содержащих аденин, гуанин, гипоксантин и
ксантин — усиливается выделение мочевой кислоты. Причем основная
масса (иногда до 100%) введенной мочевой кислоты, или образовавшейся из
ее предшественников, выделяется с мочой в неизмененном виде. Ферментов,
катализирующих расщепление мочевой кислоты в тканях организма че-
ловека и человекоподобных обезьян, не обнаружено. То же самое имеет
место у урикотелических животных (птиц, рептилий), у которых основная
масса (95% общего азота мочи) мочевой кислоты образуется путем синтеза
в виде конечного продукта азотистого обмена и некоторое количество
(5%) за счет дезаминирования и окисления производных пурина, посту-
пающих извне.
Иное мы видим у большинства млекопитающих, у амфибий, рыб и ряда
беспозвоночных. У перечисленных животных мочевая кислота подвергается
452
расщеплению, и из организма выделяются продукты ее распада. Первым
этапом расщепления мочевой кислоты (уриколиза) является окисление
мочевой кислоты под влиянием урикооксидазы с образованием аллантоина.
У млекопитающих животных расщепление мочевой кислоты на этом останав-
ливается и у них из организма вместо мочевой кислоты выделяется аллан-
тоин.
Мочевая кислота
В организме большинства животных возникающий из мочевой кислоты
аллантоин подвергается дальнейшему расщеплению с образованием аллан-
тоиновой кислоты, мочевины, глиоксилевой кислоты и в случаях наличия
уреазы — аммиака и углекислого газа. Однако не у всех видов животных
имеются все ферменты, необходимые для полного расщепления мочевой
кислоты. У млекопитающих, за исключением приматов, у насекомых (Dip-
terd) и у брюхоногих моллюсков расщепление мочевой кислоты идет до об-
разования аллантоина. У некоторых костистых рыб — до образования ал-
лантоиновой кислоты. У остальных рыб, амфибий и у пресноводных пластин-
чатожаберных моллюсков — до образования мочевины и глиоксилевой
кислоты. У морских пластинчатожаберных моллюсков и ракообразных —
до аммиака и углекислого газа:
ZNH2
со
xnh2
Мочевина
СН СО
СООН NH2
NH NH
NH?
2СО
XNH^
Мочевина
О
H(f - соон
Глиоксалевая
кислота
Аллантоиновая
кислота
Н20
2NH3 + СОз
Распад мочевой кислоты с образованием мочевины и глиоксилевой
кислоты катализируется рядом ферментов, из которых не все еще изучены.
С помощью урикооксидазы, которая, по-видимому, представлена не одним,
а большим количеством ферментов, мочевая кислота превращается в аллан-
тоин. Из аллантоина под действием аллантоиназы возникает аллантоино-
вая кислота, из которой с помощью аллантоиказы образуется глиоксиловая
кислота и мочевина. При наличии уреазы мочевина гидролизуется, распада-
ясь на аммиак и углекислый газ.
С эволюционной точки зрения интересно отметить, что по мере услож-
нения форм животных у них исчезают отдельные ферменты уриколиза.
У человека и у человекоподобных обезьян эти ферменты вовсе отсутствуют.
РАСПАД ПРОИЗВОДНЫХ ПИРИМИДИНА
Путь превращения производных пиримидина — цитозина, урацила и
тимина, освобождающихся при распаде нуклеиновых кислот, остается еще
во многом неизученным. Установлено, что цитидин с помощью цитидиндеза-
миназы, содержащейся в тканях животных, дезаминируется с образованием
уридина. Дезаминируется как рибо-, так и дезоксирибоцитидин. Азот про-
453
изводных пиримидина превращается в мочевину. Из этого следует, что пи-
римидиновое ядро в организме подвергается расщеплению. Расщепление
пиримидинового ядра в тимине приводит к образованию р-аминоизомасля-
ной кислоты, а в урациле — р-аланина. При кормлении крыс дезоксири-
бонуклеиновой кислотой (в ее состав входит тимин), дигидротимином или
тимином наблюдается выделение с мочой {3-аминоизомасляной кислоты.
Последняя обнаружена также в моче человека. Как известно, р-аминоизо-
масляная кислота не является продуктом распада белков и не возникает
при обмене аминокислот. Путь распада тимина таков:
СОН
СНСН3
Дигидротимин
СООН
I
СНСНз
I
nh2-ch2
(Э-Уреидоизомасляная
кислота
Р-Аминоизомас-
ляная кислота
Образование ^-уреидоизомасляной кислоты и р-аминоизомасляной кис-
лоты установлено в срезах печени при инкубации их с тимином. Подобно
тимину происходит расщепление урацила. В печени крыс обнаружены фер-
менты, катализирующие расщепление урацила:
СООН
сн2
I
ch2nh2
Урацил Дигидроурацил З-Уреидпропионовая (З-Аланин
кислота
₽-Аланин в организме животных образуется преимущественно как про-
дукт расщепления урацила.
БИОСИНТЕЗ НУКЛЕИНОВЫХ КИСЛОТ И БЛИЗКИХ ИМ
СОЕДИНЕНИЙ
Проблема биосинтеза нуклеиновых кислот и близких им соединений
(фосфорилированных мононуклеотидов и динуклеотидов) давно уже разра-
батывается биохимиками. Классическими исследованиями Мишера, изучав-
шим молоки рейнского лосося, было установлено, что лосось синтезирует
нуклеиновые кислоты из веществ, входящих в состав его тканей. Лосось, на-
правляясь из моря вверх по течению во время нереста, не принимает пи-
щи. Длительное время рыба голодает и при этом расходует, главным обра-
зом, белки своих мышц, за исключением сердечной и плавниковых мышц.
Между тем во время нереста в организме самцов синтезируется большое ко-
личество нуклеиновых кислот: сперматозоиды, как известно, отличаются
высоким содержанием нуклеопротеидов. Не остается сомнения в том, что
в зависимости от физиологических условий происходит усиленный синтез
нуклеиновых кислот. Для этого синтеза необходимы производные пурина и
пиримидина, пентозы (преимущественно дезоксирибоза) и фосфорная кис-
лота.
454
Фосфорная кислота входит в состав различных соединений тканей, при-
чем особенно много ее в костях. Пентоза образуется в организме из глюкозы
(стр. 309). Фосфорная кислота, рибоза и дезоксирибоза могут в организме
быть использованы для синтеза нуклеиновых кислот. Что же касается про-
изводных пурина и пиримидина, то у лосося они должны синтезироваться
из азотистых веществ и, как вначале принималось, из аминокислот мышеч-
ных белков.
Синтез производных пурина был установлен А. Тихомировым при раз-
витии личинок шелкопряда из яичек (грены). Им было показано, что содер-
жание производных пурина в развивающихся личинках шелкопряда выше,
чем в яичках. Синтез производных пурина был также установлен исследова-
телями в опытах по изучению их содержания в развивающемся курином
эмбрионе и в тканях животных, получавших пищу, свободную от производ-
ных пурина. В курином зародыше при развитии увеличивается содержание
производных пурина, входящих в состав нуклеиновых кислот. В тканях
животных, получавших беспуриновую пищу, содержание нуклеиновых
кислот (следовательно, производных пурина) не уменьшалось, хотя из орга-
низма с мочой выделялась мочевая кислота.
На возможность синтеза производных пурина указывают также данные
клинических исследований. Люди могут обходиться без поступления в ор-
ганизм с пищей производных пурина. Выделение мочевой кислоты при бес-
пуриновой пище уменьшается, а затем удерживается на определенном уров-
не (0,3—0,4 г в сутки).
Что касается возможности синтеза производных пиримидина, то рань-
ше на этот счет прямых доказательств не было, и по аналогии с производ-
ными пурина допускалось, что и они могут образовываться путем синтеза.
Из приведенных данных видно, что вопрос о синтезе нуклеиновых кис-
лот сводился к выяснению способности организма человека и животных
(имеется в виду уреотелических) синтезировать производные пурина. Этот
вопрос был в положительном смысле разрешен исследованиями, проведен-
ными в конце прошлого и в начале нашего столетия. Что же касается пути
синтеза из отдельных компонентов нуклеиновых кислот, то он, по сути де-
ла, оставался невыясненным до самого последнего времени.
Применение в биохимии новых методов исследований, метода меченых
атомов, хроматографического анализа, позволило глубоко вникнуть в про-
цессы обмена нуклеиновых кислот, моно- и динуклеотидов и разобраться
в ходе синтеза их азотистых компонентов и их молекул в целом.
Приведенная ниже схема показывает, какие вещества используются
при синтезе ядра пурина.
Аспарагиновая-----> Nx----
Муравьиная кислота
Глутамин
455
СИНТЕЗ ПРОИЗВОДНЫХ ПУРИНА
Изучение обмена мочевой кислоты, продукта дезаминирования и окис-
ления производных пурина показало, что у птиц, у которых образование
мочевой кислоты происходит в больших количествах, у млекопитающих
и у многих микроорганизмов производные пурина синтезируются из гли-
цина, углекислого газа, муравьиной кислоты, аспарагиновой кислоты и из
глутамина. На первый взгляд может казаться, что приведенная выше схе-
ма если не до конца, то, по крайней мере, очень глубоко выявляет пути син-
теза производных пурина. Однако это не так. Выявление веществ, участ-
вующих в синтезе производных пурина, не объясняет еще, каким образом
они из них синтезируются. Понадобились еще многочисленные исследова-
ния по изучению синтеза производных пурина, и в этой области достигнуты
большие успехи. Можно считать установленным, что при синтезе пуриновых
производных прежде всего возникает гипоксантин. Из гипоксантина (из
инозиновой кислоты, в состав которой он входит) образуется путем амини-
рования аденин (адениловая кислота). При окислении гипоксантина появ-
ляется ксантин, аминирование которого приводит к образованию гуанина.
Трудно представить себе, что гипоксантин является непосредственным
продуктом синтеза производных пурина, так как он имеет слишком слож-
ную химическую структуру. Отсюда понятны попытки обнаружить менее
сложные, чем гипоксантин, продукты, стоящие на пути его образования.
В этом отношении был достигнут крупный успех при изучении обмена ве-
ществ у бактерий. Установлено, что у некоторых штаммов Escherichia coli
при торможении их роста сульфатиазолом (сульфамидный препарат) в пи-
тательной среде накопляется вещество, оказавшееся 4-аминоимидазол-5-
карбоксамидом. Далее оказалось, что глицин, являющийся, как известно,
одним из веществ, из которых синтезируется гипоксантин, усиливает на-
копление в питательной среде Escherichia coli 4-аминоимидазол-5-карбокса-
мида (сокращенно 5-карбоксамида) при добавлении сульфатиазола. Кроме
того, 5-карбоксамид является источником производных пурина, необходи-
мых для роста ряда микробов. Таким образом, 5-карбоксамид — один из
промежуточных продуктов, образующихся при синтезе производных пурина
у бактерий. В дальнейшем оказалось, что сульфатиазол тормозит рост бак-
терий, так как он тормозит у них синтез фолиевой кислоты. Что же каса-
ется 5-карбоксамида, то он накопляется благодаря тому, что в отсутствие
фолиевой кислоты дальнейшее его превращение останавливается.
4- Аминоимидазол
-5-карбоксамид
4-Формамидоимидазол
- 5-карбоксамид
—Н2О
•---->-
N NH
Гипоксантин
Из приведенных формул видно, что для превращения 5-карбоксамида
в гипоксантин необходима фолиевая кислота (или ее производные), которая,
присоединяя к себе муравьиную кислоту, отдает ее затем 5-карбоксамиду с
образованием из него гипоксантина. В отсутствие фолиевой кислоты синтез
гипоксантина останавливается на стадии образования 5-карбоксамида.
Осталось выяснить, является ли 5-карбоксамид также промежуточным про-
456
дуктом синтеза гипоксантина в тканях животных. Оказалось, что в печени
животных (голубей и крыс) 5-карбоксамид в свободном состоянии не явля-
ется промежуточным продуктом синтеза гипоксантина. Прежде чем быть
использованным при добавлении его к измельченной ткани печени, он дол-
жен предварительно связаться с рибозофосфорной кислотой с образованием
риботида. Дальнейшее изучение промежуточных продуктов синтеза гипо-
ксантина привело к результатам, показавшим, что у животных в синтезе
уже на начальном его этапе участвует рибозо-5-фосфорная кислота (дезок-
сирибозофосфорная кислота). К альдегидной группе рибозо-5-фосфорной
кислоты, вследствие ряда идущих друг за другом ферментативных реакций,
надстраивается остаток молекулы гипоксантина. Следовательно, при син-
тезе производных пурина образуется не свободный гипоксантин, а инози-
новая кислота, в состав которой входит гипоксантин.
Все основные промежуточные этапы синтеза гипоксантина сейчас уже
выявлены и сводятся они к следующему. Альдегидная группа молекулы ри-
бозофосфорной кислоты, прежде чем вступить в реакции, ведущие к синтезу
гипоксантина, взаимодействует с аденозинтрифосфорной кислотой, в ре-
зультате чего образуется фосфорибозилпирофосфорная кислота:
Рибозофосфорная кислота
•4* Адениловая
кислота
Р—О^р—ОН
хон хон
Фосфорибозилпирофосфорная кислота
Из этой реакции вытекает, что альдегидная группа рибозофосфорной
кислоты фосфорилируется (образуется глюкозидфосфорная связь), а необ-
ходимая для этого энергия доставляется макроэргической связью аденозин-
трифосфорной кислоты.
Фосфорибозилпирофосфорная кислота реагирует с глутамином, при-
чем его амидная группа замещает остаток пирофосфорной кислоты. Реак-
ция протекает без какого-либо изменения свободной энергии, так как глю-
козидфэсфорная и амидная связи в энергетическом отношении близки друг
к другу. В результате реакции образуется фосфорибозил амин, и этим как
бы закладывается первый «кирпич» в построение гипоксантина, в котором
участвует амидная группа глутамина
ОН
Фосфорибозилпирофосфорная кислота
457
co-nh2
I
chnh2
СООН
Глутамин
Фосфорибозила мин
СООН
I
сн2
сн,
I
chnh2
СООН
+ Н4Р2О7
Глутаминовая кислота
К фосфорибозиламину присоединяется затем остаток молекулы глици-
на. Присоединение глицина сопровождается образованием кислотоамидной
(пептидной) связи, и необходимая для этого энергия доставляется аденозин-
трифосфорной кислотой; продуктом реакции является глицинамидриботид.
Фосфорибозила мин
Глицин
Глицинамидриботид
Глицинамидриботид
Формилглицинамидриботид
Глицинамидриботид в последующих реакциях с использованием му-
равьиной кислоты и амидной группы глутамина усложняет свою химическую
структуру, превращаясь в 5-аминоимидазолриботид.
Формилглицинамидриботид
CONH
I
сн2
CHj
CHNH
I
СООН
4-АТФ
Глутамин
458
Глутаминовая кислота
хон
5-аминоимидазолриботид
Установлено, что 5-аминоимидазолриботид подвергается карбоксилиро-
ванию путем присоединения СО2 с образованием нового промежуточного
продукта — 5-амино-4-имидазолкарбоксилриботида
5-аминоимидазолриботид
ОН
5-аминоимидазол-4-карбоксилриботид
5-аминоимидазол-4-карбоксилриботид дальше реагирует своей карбо-
ксильной группой с аминной группой аспарагиновой кислоты с образова-
нием амидной связи. Энергия, необходимая для образования этой связи,
доставляется аденозинтрифосфорной кислотой. В результате реакции обра-
зуется 5-амино-4-имидазол-сукцинкарбоксамидриботид. Отщепление от
5-амино-4-имидазол-М-сукцинкарбоксилриботида фумаровой кислоты при-
водит к появлению 5-карбоксамидриботида
СООН
НС—N—СО
о—Р=о
хон
СН2 С---N,
I
соон
H2N—С---N
соон
I
сн
сн
соон
Фу маровая
кислота
5-АМ£но-4-нмндазол-М-сукцинкарбокса
мидриботид
459
h2n—co
5-КарбоксаМидриботид
5-карбоксамидриботид взаимодействует с муравьиной кислотой с обра-
зованием1 инозиновой кислоты: ‘
ОН
Так шаг за шагом вскрываются отдельные этапы синтеза производных
пурина и возникающие при этом промежуточные продукты.
,460
Из приведенных выше данных видно, что молекула гипоксантина фор-
мируется у альдегидной группы молекулы рибозофосфорной кислоты. Из
инозиновой кислоты образуются другие нуклеотиды.
Условия, при которых остаток гипоксантина в молекуле инозиновой
кислоты превращается в другие пуриновые производные, выяснены. В част-
ности, это относится к образованию адениловой кислоты из инозиновой.
Адениловая кислота в тканях легко дезаминируется гидролитическим пу-
тем с образованием инозиновой кислоты и аммиака. Эта реакция катализи-
руется специфической дезаминазой, и действие ее в условиях, имеющихся в
тканях, необратимо. Исследования, направленные на изучение аминиро-
вания инозиновой кислоты, выявили участие в нем аспарагиновой кислоты.
Из дрожжевых клеток выделен ферментный препарат, катализирующий
реакцию аминирования инозиновой кислоты с образованием в виде проме-
жуточного продукта аденилянтарной кислоты.
СООН
I
chnh2 +
сн2
СООН
А с параги новая
кислота
С-ОН N
Инозиновая кислота
Лденилянтарная кислота
ОН
ОН
4- АЛФ + Н3РО4
Аденилянтарная кислота дальше расщепляется на адениловую и фумаро-
вую кислоты:
СООН
Аденилянтарная кислота
461
Адениловая кислота
Также происходит аминирование инозиновой кислоты и в тканях животных.
Аминирование остатка ксантина в молекуле ксантозинфосфорной кисло-
ты приводит к образованию гуаниловой кислоты. В этой реакции исполь-
зуется амидная группа глутамина и энергия макроэргической связи АТФ.
Инозиновая кислота — исходное вещество для образования ксантозин-
фосфорной кислоты. В этом случае имеет место окисление остатка гипоксан-
тина в положении 2 с образованием остатка ксантина.
conh2
сн2
+ сн2 + АТФ
CHNH,
I
СООН
Гл у тамин
Ксантозинфосфорная кислота
Г уани ловая
СООН
к ислота
V СН2
I I 2
сн20-н2Р03 + сн2 +
CHNH,
I
СООН
Г лугами новая
АДФ + Н3РО4
кислота
Приводим схему образования пуринсодержащих мононуклеотидов:
адениловая кислота + фумаровая кислота
+ аспара-
гиновая
кислота
Инозиновая кислота
окисление
^ксантозиновая кислота
+ глутамин
+ АТФ
Гуаниловая кислота + глутами-
новая кислота + АДФ + Н3РО4
Рибозофосфорная ки-
слота + 2 глутамин +
’ + глицин+2НСООН+
+ СО2+ аспарагиновая
кислота (6 АТФ)
2 глутаминовая кислота ч- фума-
ровая кислота 6 АДФ 4-
+ 6Н3РО4
462
Итак, мы познакомились с синтезом производных пурина (гипоксанти-
на, аденина, ксантина и гуанина), который сопровождается синтезом нукле-
отидов, имеющих в своих молекулах рибозу. Между тем дезоксирибозону к-
леиновые кислоты состоят из остатков нуклеотидов, содержащих дезоксири-
бозу. Как же образуются эти нуклеотиды? Исходным продуктом для синтеза
их, возможно, является дезоксирибозофосфорная кислота, у альдегид-
ной группы которой конструируется остаток гипоксантина, подобно тому
как это происходит у альдегидной группы рибозы. Не исключена возмож-
ность, что дезоксирибонуклеотиды образуются из рибонуклеотидов путем
их восстановления.
Следует полагать, что основным источником образования свободных
производных пурина служат нуклеотиды и возникающие из них нуклео-
зиды. Содержание свободных производных пурина в тканях невелико. Они
превращаются в мочевую кислоту, они могут также быть использованы и
для синтеза нуклеотидов.
Вопрос о возможности использования свободных пуриновых основа-
ний (пищевых) для синтеза нуклеиновой кислоты разрешался исследова-
ниями с применением метода меченых атомов. Животным вводили в одних
случаях гуанин, а в других аденин, меченные в пуриновом ядре N15, а за-
тем из нуклеиновых кислот тканей выделяли производные пурина (аденин
и гуанин), в которых изучалось наличие тяжелого изотопа азота. Было
установлено, что введенный в организм гуанин в очень небольшой степени
используется для синтеза нуклеиновых кислот. Основная масса его выде-
ляется в виде мочевой кислоты. В случае введения N15 гуанина он не об-
наруживался в заметных количествах ни в составе гуанина, ни в составе
аденина нуклеиновых кислот тканей. Иные результаты получены при вве-
дении животным аденина, меченного N15 в пуриновом ядре. В этих опытах
оказалось, что тяжелый изотоп азота появляется как в составе аденина, так
и в составе гуанина нуклеиновых кислот тканей; кроме того, выяснилось,
что использование введенного аденина в организме происходит в печени.
Аденин и гуанин, выделенные из нуклеиновых кислот печени, содержали
большее количество тяжелого изотопа азота, чем аденин и гуанин, изолиро-
ванные из нуклеиновых кислот других тканей.
Естественно возник вопрос, каким образом аденин превращается в
тканях в гуанин? Прежде всего оказалось, что превращение аденина в
гуанин происходит без расщепления пуринового ядра. При введении в
организм аденина, меченного тяжелым изотопом азота в положении 1 и 3
пуринового ядра, в выделенном из нуклеиновых кислот гуанине тяжелый
изотоп азота оказывается также в положении 1 и 3. Возможным промежу-
точным продуктом превращения аденина в гуанин является 2,6-диаминопу-
рин. Это вещество, будучи введенным в организм, интенсивно превращается
в гуанин и в виде гуанина появляется в нуклеиновых кислотах тканей.
Другое вещество, близкое к аденину,— изогуанин (2-окси-6-аминопу-
рин) не является промежуточным продуктом превращения аденина в гуа-
нин, так как, будучи введенным животным, оно не превращается в гуанин.
и аминопурин
Изогуанин
Прямых доказательств в пользу образования из аденина 2,6-диамино-
пурина пока нет, и поэтому вопрос о превращении аденина в гуанин пока
неясен.
463
При изучении синтеза нуклеиновых кислот из производных пурина
у микроорганизмов выяснилось, что дрожжевые клетки способны использо-
вать для синтеза нуклеиновых кислот как свободный аденин, так и свобод-
ный гуанин. В опытах с аденином, меченным в положении 8 радиоактивным
углеродом, было установлено, что у дрожжей радиоактивность обнаружи-
вается как в аденине, так и в гуанине рибонуклеиновых кислот. Что же ка-
сается гуанина, то он в дрожжах используется для синтеза рибонуклеино-
вых кислот, как таковой, и из него аденин не образуется.
Адениловая и гуаниловая кислоты и соответствующие им нуклеозиды
в очень малой мере используются в дрожжах для синтеза нуклеиновых
кислот.
У микроорганизмов установлены случаи взаимопревращения гуанина
в аденин. Lactobacillus casei в одинаковой мере удовлетворяет свою потреб-
ность в производных пурина как за счет аденина, так и за счет гуанина.
У протозоа Tetrahymena galii гуанин является предшественником аденина.
СИНТЕЗ ПРОИЗВОДНЫХ ПИРИМИДИНА
Производные пиримидина, подобно производным пурина, синтезиру-
ются в организме животных. При введении животным аммонийной соли, ме-
ченной тяжелым изотопом азота, в производных пиримидина в составе нук-
леиновых кислот тканей появляется этот изотоп. В опытах с введением ме-
ченных тяжелым изотопом азота цитозина, урацила и тимина установлено,
что они не используются для синтеза нуклеиновых кислот тканей. Отсюда
можно заключить, что производные пиримидина не участвуют в свободном
состоянии в синтезе нуклеиновых кислот.
Ядро пурина
Ядро пиримидина
Гетероциклическое ядро производных пиримидина по своему строению
аналогично с шестичленным ядром гетероциклического ядра производных
пурина. Однако пути синтеза этих двух групп соединений неодинаковы.
Образование производных пиримидина, вернее, синтез пиримидинового
ядра, долгое время оставалось невыясненным. Применение метода изотопов
дало возможность выяснить происхождение отдельных звеньев пиримиди-
нового ядра. Незадолго до этого было установлено, что некоторые штаммы
Neurospora способны синтезировать урацил, используя щавелевоуксусную
кислоту. Оказалось также, что эти организмы способны образовывать ура-
цил из оротовой кислоты, являющейся по своей структуре 4-карбоксиура-
цилом (оротовая кислота обнаружена в составе молозива коровы).
В опытах с Lactobacillus bulgaricus показано, что оротовая кислота у
них является источником образования цитозина и урацила, но не аденина
и гуанина. При добавлении к питательной среде, меченной радиоактивным
углеродом в положении 2 оротовой кислоты, радиоактивность появляется
в производных пиримидина, но не в производных пурина нуклеиновых
кислот.
Дальнейшие исследования показали, что оротовая кислота использует-
ся для синтеза производных пиримидина не только у микробов, но и у жи-
вотных. Введение в организм животных оротовой. кислоты, меченной тяже-
лым изотопом азота, приводит к появлению этого изотопа в производных
464
пиримидина нуклеиновых кислот тканей. В производных же пурина он не
появляется. Синтез оротовой кислоты и из нее производных пиримидина
происходит из карбамилфосфорной кислоты и аспарагиновой кислоты.
СООН
H2N—С-О.Н2РО3+ сн2
О chnii2
СООН
Нгс/ NHsi
СООН
+ H3PO4
СООН
Аспарагиновая Карбамил-А-аспарагиновая
кислота кислота
Карбамилфосфоряая
кислота
СООН со
NH NH
СООН СООН
L-Дигидрооротовая
кислота
СООН
Оротовая
кислота
Оротовая кислота реагирует с 5-фосфорибозилпирофосфорной кисло-
той с образованием оротидин-5-фосфорной кислоты и пирофосфорной
кислоты.
Оротидилфосфорная кислота
От оротидил-5-фосфорной кислоты отщепляется СО2 с образованием
уридиловой кислоты.
465
on
он
Уридиловая кислота
Из уридиловой кислоты путем аминирования должна образоваться
цитидиловая кислота, а путем метилирования — тимидиловая кислота.
Установлено, что метильная группа тимина нуклеиновых кислот возникает
или из муравьиной кислоты, или а-углерода глицина, или p-углерода се-
рина. Из этих веществ может образоваться метильная группа метионина,
являющегося источником метильных групп для метилирования различных
веществ в организме.
СИНТЕЗ РИБОЗЫ И ДЕЗОКСИРИБОЗЫ
Источником для образования рибозы является глюкоза. Возникает ри-
боза как промежуточный продукт пентозного цикла превращения глюкозы
(стр. 309). Несколько сложнее обстоит дело с образованием дезоксирибозы.
Можно было бы допустить, что она образуется из рибозы в результате ее
восстановления, однако экспериментальных данных в пользу этого нет.
Возможен иной путь образования дезоксирибозы: из уксусного альдегида
и из 3-фосфоглицеринальдегида. У микробов и в печени обнаружен фермент
альдолаза, катализирующий синтез дезоксирибозы из этих двух соедине-
ний:
СН3 НСОН
I
СН2О*Н2РО3
I
сн2
НСОН
I
НСОН
СН2О.Ц2РО3
СИНТЕЗ МОНОНУКЛЕОТИДОВ
Синтез мононуклеотидов, входящих в состав нуклеиновых кислот, а
также и фосфорилированных, встречающихся в свободном состоянии,
можно представить себе следующим образом. Рибоза, а таже и дезоксири-
боза с помощью соответствующих фосфофераз (стр. 168) фосфорилируются
путем перенесения фосфатных остатков от аденозинтри(}юсфорной кислоты.
К альдегидной группе рибозо- или же дезоксирибозо-5-фосфорной кислоты
начинают затем «пристраиваться» отдельные компоненты, входящие в со-
став производных пурина, или же к ней присоединяется то или иное про-
изводное пиримидина.
В тех случаях, когда для синтеза мононуклеотидов используются сво-
бодные производные пурина (аденин в организме животных и аденин и гу-
466
анин—у некоторых микроорганизмов), сначала возникают нуклеозиды,
которые затем, фосфорилируясь, превращаются в неклеотиды. Синтез
нуклеозидов обеспечивается специальной фосфорилазой, катализирующей
обратимый фосфоролиз нуклеозидов:
Рибозо -1-
Аденозин
Аденози н
Адениловая кислота
СИНТЕЗ ДИНУКЛЕОТИДОВ
В клетках и тканях наряду со свободными, не входящими в состав ну-
клеиновых кислот мононуклеотидами — продуктами фосфорилирования
адениловой, гуаниловой, цитидиловой и уридиловой кислот, содержатся
также динуклеотиды. К ним относятся флавин-аденин-динуклеотид и ни-
котинамид-аденин-динуклеотиды (стр. 177). Механизм синтеза динуклео-
тидов выяснен исследованиями А. Корнберга.
467
В молекулах динуклеотидов всегда содержится остаток адениловой
кислоты и источником его является, как оказалось, аденозинтрифосфорная
кислота. Так, например, синтез никотинамидаденин-динуклеотида проис-
ходит следующим образом:
^ОН
Никотинамид-рибоза—О—Р=О 4~
^ОН
ОН
О
ОН —*
+ аденин-рибоза —О—О
^ОН
Аденозинтрифосфосная кислота
^/он
Никотинамид-рибоза—О—Рг^О
+Н4Р2О7
Аденин-рибоза—О—Р\— О
^ОН
Дифосфопиридиннуклеотид
При синтезе фосфорилированного никотинамид-аденин-динуклеотида
к одному из остатков рибозы никотинамид-аденин-динуклеотида присоеди-
няется остаток фосфорной кислоты.
В молекулах динуклеотидов остатки мононуклеотидов соединены пирофосфат-
ной связью, и энергия, необходимая для образования этой связи, доставляется мак-
роэргической связью аденозинтрифосфорной кислоты.
Динуклеотиды подвергаются в тканях организма расщеплению. Они фермента-
тивно расщепляются с помощью пирофосфорной кислоты (пирофосфоролиз) с образо-
ванием молекулы мононуклеотидов; структура которых зависит от подвергающегося
пирофосфоролизу динуклеотида, причем одним из них всегда является адениловая
кислота. Наряду с этим имеется еще и второй путь расщепления динуклеотидов —
гидролиз, осуществляемый с помощью фермента нуклеотидпирофосфатазы. В этом
случае происходит гидролиз пирофосфатной связи с образованием двух мононуклео-
тидов, один из которых адениловая кислота. Динуклеотиды являются коферментами
различных окислительных ферментов. При расщеплении на мононуклеотиды они те-
ряют свои коферментные свойства.
СИНТЕЗ НУКЛЕИНОВЫХ КИСЛОТ (ДНК и РНК)
Синтез ДНК (каждой входящей, в состав макромолекулы ДНК поли-
нуклеотидной цепи) осуществляется при участии специфического фермента,
открытого А. Корнбергом и названного им полимеразой ДНК. Субстратами
для синтеза ДНК являются нуклеозидтрифосфаты, содержащие в своих
молекулах дезоксирибозу (аденин-цитозин-гуанин-тимин-дезоксирибозотри-
фосфаты). Фермент этот носит еще название пирофосфорилазы, действие
его обратимо.
Схематически синтез и распад ДНК происходит следующим образом:
Дезоксирибозонуклеозидтрифосфатыч±ДНК+Н4Р2О7.
При изучении действия полимеразы ДНК были установлены следую-
щие факты: 1) синтез ДНК происходит при обязательном наличии всех че-
тырех нуклеозидтрифосфатов и 2) при наличии всех четырех нуклеозидтри-
фосфатов для осуществления синтеза необходимо наличие в виде «затравки»
небольшого количества той или иной высокомолекулярной ДНК.
Характер синтезирующейся ДНК зависит от взятой «затравки». Так,
например, если «затравкой» служит ДНК, полученная из зобной железы,
468
то продуктом синтеза явится ДНК, идентичная ДНК зобной железы. Если
«затравкой» явится ДНК из эритроцитов голубя, то продуктом синтеза явит-
ся та же ДНК и т. д.
Синтез РНК осуществляется при участии специфических для них
ферментов. Очоа выделен фермент, катализирующий синтез и распад РНК.
Фермент этот получил название фосфорилазы или полимеразы РНК. Суб-
стратами для действия этого фермента служат рибозосодержащие нуклеозид-
дифосфаты. Продуктами реакции являются РНК и Н3РО4: нуклеозиддифос-
фаты^РНК+Н3РО4. Изучение активности фосфорилазы РНК показало, что
для проявления ее действия необходимо наличие в виде «затравки» неболь-
ших количеств продуктов деполимеризации РНК (ди-три-тетрануклеоти-
дов). Далее обнаружилось, что в зависимости от имеющихся в наличии ну-
клеозиддифосфатов и концентрации каждого из них фермент катализирует
синтез различных по своему нуклеотидному составу высокомолекулярных
РНК. В том случае, когда имеется какой-либо один нуклеозиддифосфат,
например аденозиндифосфат, в результате действия фермента синтезируется
РНК, построенная из одних только остатков молекул аденозинмонофосфо р-
ной кислоты.
При наличии в должном соотношении всех четырех нуклеозиддифос-
фатов (аденин-цитозин-гуанин и урацилрибозодифосфата) синтезируются
РНК, не отличающиеся по своей химической структуре и свойствам от РНК,
с которыми встречаются в клетке.
Установлено наличие в клетках особой ферментной системы, катализи-
рующей синтез особой РНК с молекулярным весом 300—500 тыс. и полу-
чивших название РНК — посредников, или информационных РНК. Эта
ферментная система находится в ядрах клеток. Действие ее строго специ-
фично и субстратами для нее служат рибозосодержащие нуклеозидтрифос-
фаты. Кроме наличия субстратов для действия фермента необходимо в виде
«затравки» наличие неболыпиих количеств высокомолекулярной (ядер-
ной) ДНК. В зависимости от происхождения ДНК, взятой для «затравки»,
синтезируется специфическая РНК. Так как ДНК обладают видовой спе-
цифичностью, то понятно, что РНК — посредники также обладают видовой
специфичностью.
Изложенные данные о синтезе ДНК и РНК очень важны для понима-
ния их биологической роли.
ЛОКАЛИЗАЦИЯ В КЛЕТКЕ НУКЛЕИНОВЫХ КИСЛОТ
Различные нуклеиновые кислоты отличаются друг от друга по своей
химической структуре, степени полимеризации, локализации в клетке и по
своей биологической роли. Нуклеиновые кислоты входят в состав всех суб-
клеточных элементов (органоидов) клетки. ДНК сосредоточена в ядрах,
где в незначительном количестве обнаруживается и РНК. Это указывает
на роль ДНК в процессах деления ядра клетки и передаче наследственных
признаков.
РНК различной степени полимеризации сосредоточены в микросомах
(рибосомах), где интенсивно протекают процессы синтеза белков. Содержа-
ние РНК в микросомах достигает 50%. Отсюда можно заключить, что РНК
играют роль в синтезе особенно важных в биологическом отношении ве-
ществ — белков.
В незначительных количествах нуклеиновые кислоты имеются в мито-
хондриях, где сосредоточены окислительные (энергетические) процессы.
Богато содержанием РНК ядрышко.
Бесструктурная жидкость клетки (гиалоплазма) содержит низкомоле-
кулярные РНК (растворимые, или транспортные РНК), роль которых за-
ключается в связывании и транспортировке аминокислот к микросомам,
где они используются для синтеза белков.
469
Из приведенного видно, что нуклеиновые кислоты встречаются во всех
составных частях клеток с преимущественной локализацией ДНК в ядрах,
а РНК в микросомах.
ГЕНЕТИЧЕСКАЯ РОЛЬ ДНК
Роль ДНК в передаче наследственных признаков к потомству
в настоящее время считается общепризнанной. Хромосомы состоят
преимущественно из дезоксирибонуклеопротеидов. При делении клеточного
ядра макромолекулы ДНК переходят из двухцепочного состояния (см.
стр. 61) в одноцепочное. Дочерняя клетка получает одноцепочную ДНК,
полностью соответствующую той, которая остается в материнской клетке.
Как в материнской, так и в дочерней клетке синтезируются затем новые
комплементарные, молекулы ДНК и образуются двухцепочные макромо-
лекулы ДНК.
Рис. 21. Пары оснований в нуклеиновых кислотах
Генетическая роль ДНК доказана рядом экспериментов. Например,
А. С. Спирин установил, что при экспериментальной изменчивости кишеч-
ной палочки и тифозной бактерии, возникающие из них новые формы с за-
крепленной наследственностью (нейтральные и щелочные формы) содер-
470
жат ДНК, отличные по своей химической структуре от ДНК исходных форм.
Приведем соотношения между суммарным содержанием гуанина и цитозина.
Г LL
и суммарным содержанием аденина и тимина =:):
исходная форма кишечной палочки............................ 1,09
нейтральная форма кишечной палочки......................... 0,71
щелочеобразующая форма кишечной палочки ................... 2,04
исходная форма дизентерийной бактерии...................... 1,15
щелочеобразующая форма дизентерийной бактерии.............. 1,94
Веские доказательства генетической роли ДНК были получены при
изучении бактериальных трансформаций, происходящих под влиянием
ДНК.
При прибавлении к питательной среде одного штамма бактерий ДНК,
изолированной из другого штамма, у первого штамма появляются особен-
ности, характерные для штамма бактерий, из которого была изолирована
ДНК. Эти признаки передаются по наследству в последующих поколениях.
Подобных трансформаций бактерий под влиянием ДНК изучено уже боль-
ше чем в тридцати случаях.
Генетическая роль ДНК доказана также исследованиями, проведенными
с бактериальными вирусами-бактериофагами. Бактериофаги состоят в ос-
новном из ДНК-протеида. При заражении бактериальной клетки бактерио-
фагом внутрь клетки проникает ДНК. В зараженной клетке происходит
репродукция ДНК-протеида (бактериофага). Многочисленные факты, об-
наруженные при постановке различных исследований, убедительно доказы-
вают, что ДНК играют генетическую роль и являются носителями генетиче-
ской' информации.
Передача генетической информации ДНК сводится к синтезу специфи-
ческих в видовом отношении белковых веществ. Отсюда следует ожидать,
что ДНК направляет синтез белков, что приводит к образованию белков,
специфических в видовом отношении. Иначе говоря, видовая специфичность
ДНК определяет видовую специфичность белков. Как это осуществляется?
Оказывается, что в синтезе белков непосредственно участвуют не ДНК, а
РНК. Здесь имеет место передача информации ДНК на РНК, действующими
же агентами являются РНК.
РОЛЬ РНК в БИОСИНТЕЗЕ БЕЛКОВ
Синтез белка в клетке (биосинтез) является сложным процессом, в
котором участвуют различные РНК и многочисленные ферменты.
Свыше 30 лет назад было обращено внимание на существующую
связь между интенсивностью синтеза белков в клетке и содержанием в ней
РНК. Было показано, что в больших количествах РНК обнаруживается в
быстрорастущих эмбриональных тканях, в секреторных органах (пищева-
рительных железах и др.), продуцирующих богатые содержанием белков
секреты. Содержание РНК в интенсивно растущих и размножающихся клет-
ках всегда велико. Наоборот, замедление роста, прекращение размножения
характеризуются значительным снижением содержания в клетках РНК.
В активно функционирующих органах (сердце, мышцы), в которых
синтез белков незначителен, содержание РНК оказывается низким.
Синтез белков активно происходит в рибосомах — клеточных образо-
ваниях, особенно богатых содержанием РНК.
Фермент рибонуклеаза катализирует реакцию расщепления (деполиме-
ризацию) РНК. Исследованиями Браше установлено, что обработка рибо-
нуклеазой кончиков корней, дрожжевых клеток, яиц лягушек приостанав-
ливает у них синтез белков.
Важным шагом вперед в деле изучения роли РНК в биосинтезе белков
явились результаты исследований, проведенные в 1956 г. Френкель-Кон-
471
ратом и Шраммом, которыми было показано, что РНК не только участвуют в
биосинтезе белков, но направляют этот синтез таким образом, что возникают
специфические для того или иного объекта белки. Им удалось разделить ви-
рус табачной мозаики, являющийся РНК-протеидом, на его составные
части: РНК и белок. При этом оказалось, что инфекционностью обладает
РНК, а не белок. Высокополимерная РНК, полученная из вируса табачной
мозаики, введенная в лист табачного растения, приводила к накоплению в
нем вируса — комплекса РНК сю специфическим белком. Следовательно,
специфическая РНК приводила к синтезу в растении — хозяине специфиче-
ского вирусного белка, который сам по себе не обладает инфекционностью.
Эти исследования и многие другие с несомненностью показали, что
РНК не только участвуют в синтезе белков в клетке, но что благодаря им
синтезируются специфические белки.
Рис. 22. Активирование аминокислот. Ф —мо-
лекула ферментов, Ад — аденозин, R—боковая
цепь аминокислоты
В чем же заключается участие РНК в биосинтезе белков. Синтез белков
является многоступенчатым процессом и в нем участвуют различные по своей
природе и степени полимеризации РНК и ферменты. Белки синтезируются из
аминокислот. Однако аминокислоты, прежде чем выйти во взаимодействие
друг с другом, а также с другими веществами, должны пройти стадию
активирования. Активирование аминокислот осуществляется в результате
присоединения к их карбоксильной группе остатка адениловой кислоты
от АТФ с образованием смешанных ангидридов-аденилатов аминокислот
(см. стр. 440). Активирование аминокислот происходит в бесструктурной
части протоплазмы клетки — в гиалоплазме. Из последней путем осаж-
дения спиртом при слабокислой реакции (рН-5) получена фракция (рН-5-
фракция), содержащая ферменты, катализирующие реакцию активиро-
вания аминокислот. Подобная фракция получена из тканей животных, из
растений и микроорганизмов.
472
Активирование аминокислот является первым этапом пути синтеза бел*
ков и в нем, как мы видели, РНК не участвуют. Схема активирования, пред-
ставленная на рисунке, показывает, что активированная аминокислота свя-
зывается ферментом. Каждая аминокислота активируется специальным для
нее ферментом.
Второй этап заключается во взаимодействии активированных аминокис-
лот с низкомолекулярными РНК, содержащимися в гиалоплазме («раствори-
мые РНК»). Эти РНК носят название «транспортных», так как их роль заклю-
чается в том, что они отнимают аминокислоты, возбужденные химической
энергией от активирующего фермента и транспортируют их в микросомы,
где происходит синтез белка.
В перенесении каждой аминокислоты участвует специальная для нее
растворимая РНК- Если учесть, что в синтезе различных белков участвует
20 аминокислот, то в гиалоплазме должно быть 20 различных РНК. Эти,
выполняющие одну и ту же функцию РНК, по своей структуре отличаются
друг от друга по нуклеотидному составу и по последовательности размеще-
ния в их молекулах нуклеотидов.
Третий этап биосинтеза белков наиболее сложный. В нем участвует
фракция РНК, получившая название информационной РНК, обладающая
видовой специфичностью. Выше (стр. 469) уже приводилось, что информа-
ционная РНК синтезируется из рибозонуклеозидтрифосфатов в присутствии
служащей «затравкой» ДНК и что специфичность структуры этой РНК
определяется структурой ДНК. Другими словами, информационная РНК
является своего рода посредником между ДНК ядра клетки и рибосомами,
где происходит синтез белков.
Информационная РНК образуется следующим образом. Двухцепочная
спиральная макромолекула ДНК в ядре клетки раскручивается с освобож-
дением двух цепей и каждая одиночная цепь ДНК начинает присоединять к
себе рибонуклеотиды из окружающей среды. Это присоединение рибонукле-
отидов происходит комплементарно. При этом к аденину ДНК будет присое-
диняться не тимин, а урацил — азотистое основание, характерное для РНК.
Образуется молекула нуклеиновой кислоты, макромолекула которой состо-
ит из двух спиралеобразных комплементарных цепей — одной цепи ДНК
и одной цепи РНК. Обе цепи затем разделяются с образованием цепи ДНК
и цепи РНК.
Синтез специфической РНК (информационной), в которой последова-
тельность размещения нуклеотидов полностью соответствует последо-
вательности размещения нуклеотидов в ДНК, осуществляется с помощью
специального фермента — полимеразы РНК. Активность этого фермента,
как это и следовало ожидать, требует обязательного присутствия ДНК.
Синтезировавшаяся в ядре клетки информационная РНК поступает в
цитоплазму и проникает в рибосомы. В рибосомах эта РНК проявляет свою
роль в синтезе белка со строго определенной последовательностью разме-
щения аминокислот (специфического белка). Аминокислоты в пептидной цепи
белка располагаются в соответствии с последовательностью размещения нук-
леотидов в молекуле информационной РНК.
С 1961 г. интенсивно проводятся исследования, благодаря которым выяс-
няется, к каким частям цепи молекулы информационной РНК присоединяют-
ся те или иные аминокислоты, прежде чем соединиться друг с другом с обра-
зованием пептидных связей. Эти исследования очень важны, так как они
направлены к тому, чтобы выяснить как в микросомах происходит «сборка»
аминокислот, обеспечивающая синтез белков, в молекулах которых амино-
кислоты размещены не хаотично, а в строго определенной последователь-
ности. Оказалось, что последовательность размещения аминокислот в моле-
куле белка зашифрована особенностями размещения нуклеотидов в молекуле
информационной РНК.
Принято говорить о наличии кода. В чем же он заключается и как он
был обнаружен?
473
В 1961 г. Ниренберг синтезировал РНК, состоящею из одних молекул
уридиловой кислоты (полиуридиловую кислоту). Добавляя ее к смеси фер-
ментов, катализирующих синтез белков из различных аминокислот, Нирен-
берг наблюдал синтез полипептида, построенного из одних остатков молекул
фенилаланина (полифенилаланин). В дальнейшем оказалось, что иные син-
тетические полинуклеотиды, состоящие из остатков молекул одного только-
мононуклеотида (адениловой, гуаниловой, цитидиловой кислот) фермент-
ных систем, обеспечивающих синтез белков, приводят к синтезу полипеп-
тидной цепи, построенной из остатков, в каждом случае только одной оп-
ределенной аминокислоты.
В опытах с использованием синтетических РНК, содержащих в своих
молекулах в том или ином соотношении два или три мононуклеотида для син-
теза полипептидов, использовалось ограниченное количество аминокислот.
Напрашивалось предположение, что в информационной РНК, по-
строенной из четырех мононуклеотидов, остатки молекул которых размещены
в определенной последовательности, закодирована специфическая последо-
вательность аминокислот белков. Это предположение нашло свое эксперимен-
тальное подтверждение в исследованиях Крика и Очоа, в результате чего
были выявлены структурные участки цепи информационной РНК (коды),
Аминокислоты.
Рис. 23. Этапы синтеза белка
от которых зависит включение в состав белковой молекулы при ее синтезе
определенной аминокислоты. Было установлено, что такие структурные
участки цепи состоят из трех в определенном сочетании нуклеотидов (три-
плетный код).
Ниже приводятся данные о нуклеотидном составе триплетных кодов
РНК.
Аминокислоты Нуклеотидный состав триплетов Аминокислоты Нуклеотидный состав триплетов
Фенилаланин У У У1 Цистеин у у Г
Аланин у цг Глицин угг
Аргинин у цг Г истидин у а ц
Изолейцин у у а Метионин у а г
Лейцин у у ц, У у г, у у а Пролин у цц, ццц
Лизин У аа Серин У У Ц
Аспарагиновая кислота . у а г Треонин у ац, у цц
Аспарагин у а а, цац Триптофан угг
Глутаминовая кислота . У аг Тирозин у у а
Глутамин у цг Валин у у Р
’ У — уридиловый, ц — цитидиловый, а — адениловый и г — гуаниловый нуклеотиды.
Из приведенных данных видно, что иногда один и тот же триплет яв-
ляется кодом больше чем для одной аминокислоты. Это, по-видимому, объяс-
няется тем, что последовательность размещения нуклеотидов в триплете,
которая остается пока еще не изученной, различна.
474
Выяснение основных механизмов биосинтеза белков и роли нуклеиновых
кислот является одним из важнейших достижений биохимии. Мы видели,
что нуклеиновые кислоты, подобно белкам, обладают видовой специфич-
ностью. В ДНК материализуется передача наследственных признаков
к потомству (генетическая роль). РНК играет важную роль в синтезе
белков. Химическая структура ДНК определяет структуру информацион-
ной РНК (передача информации от ДНК к РНК).
Специфическая структура РНК определяет специфическую структуру
белков (передача информации от РНК к белкам). С другой стороны синтез
ДНК и РНК осуществляется в клетке специфически действующими фермен-
тами, являющимися белками.
Следовательно, нуклеиновые кислоты и белки взаимно связаны друг с
другом. Вместе взятые они создают важнейшую систему, определяющую био-
логические свойства всего живого.
ЛИТЕРАТУРА
БелозерскийА. Н. Нуклеиновые кислоты и их биологическое значение.
Изд. «Знание», 1963.
Габерман. Изучение нуклеотидной последовательности рибонуклеиновых
кислот. «Успехи современной биологии», 1963, т. 55, стр. 9.
Дэвидсон Д. Биохимия нуклеиновых кислот. ИЛ, 1952.
Ефим очкина Е. Ф. и Поз н анская А. А. Биологический синтез
пуриновых и пиримидиновых оснований. «Вопросы медицинской химии», 1957. т. III,
стр. 243.
Збарский И. Б. О нуклеотидном коде и регуляции синтеза белков в клет-
ке. «Успехи современной биологии», 1962, т. 54, стр. 265.
Кор откор у ч к а В. П. Обмен пуринов в тканях здоровых и пораженных
опухолями животных. Изд. АН УССР, 1959.
Спирин А. С., Двор кЗи н Л. Л., Киселев Л. Л. и Смир-
нов В. Н. Некоторые проблемы биосинтеза белков. «Успехи биологической химии»,
1963, т. 5, стр. 3.
ФилиповичЮ. Б. Механизм биосинтеза фиброина шелка. «Успехи совре-
менной биологии», 1964, т. 57, стр. 192.
X е с и н Р. Б. О механизме биологического синтеза нуклеиновых кислот. Журн.
Всесоюзн. химического общества им. Д. И. Менделеева, 1961, т. 3, стр. 254.
Глава девятнадцатая
ВЗАИМОСВЯЗЬ ПРЕВРАЩЕНИЙ УГЛЕВОДОВ,
ЖИРОВ И БЕЛКОВ
Превращения углеводов, жиров и белков, их распад и синтез в орга-
низме теснейшим образом связаны друг с другом. Нельзя представить себе
изолированно превращение отдельных органических, а также и неорганиче-
ских веществ в организме. Только как исключение можно наблюдать преиму-
щественный синтез углеводов (у зеленых растений на свету), распад углево-
дов с образованием этилового спирта и углекислого газа (в дрожжевых клет-
ках при спиртовом брожении) и молочной кислоты (при работе мышц),
синтез жиров (при откорме животных), синтез белков (при усиленном рос-
те). Но даже и в этих случаях обмен веществ не сводится к превращениям
только одной какой-либо группы веществ. Обмен веществ между любым
живым существом и окружающей его средой является чрезвычайно сложным
процессом, в который вовлекаются химические составные части организма
и вещества, поступающие в него извне (пищевые вещества, включая кисло-
род и воду). Обмен веществ у человека и животных регулируется централь-
ной нервной системой. При изучении превращений углеводов, жиров и бел-
ков приводились данные о регуляторной деятельности центральной нервной
системы. Было бы ошибочным полагать существование в центральной
нервной системе отдельных механизмов, регулирующих превращения от-
дельных групп веществ. Процесс обмена веществ между организмом и внеш-
ней средой, лежащей в основе проявления жизни, — единый биологический
процесс и если его расчленяют на процессы превращения отдельных веществ,
то это делают только с целью более глубокого его познания и изучения.
С биохимической точки зрения, взаимопревращения углеводов, жиров
и белков в организме обеспечивается тем, что эти, отличающиеся по своей
химической структуре друг от друга вещества, при распаде их образуют
часто близкие, а иногда одинаковые промежуточные продукты. На опреде-
ленных этапах превращения углеводы, жиры и белки (аминокислоты)
теряют характерные для них химические особенности. Они дают начало
образованию новых по своей структуре веществ со своими путями превра-
щения. Из этих веществ могут синтезироваться углеводы, жиры и некоторые
аминокислоты.
Взаимосвязь между превращением углеводов, жиров и белков внешне
проявляется в том, что из углеводов пищи образуются и откладываются жи-
ры, что при недостатке углеводов нарушается обмен жиров, что потребность
организма в белках определяется не только количеством поступающих с пи-
щей белков, но и количеством углеводов. При недостатке углеводов потреб-
ность организма в белках увеличивается.
Рассмотрим биохимические основы взаимосвязи между превращениями
в организме органических веществ — углеводов, жиров и белков.
476
СИНТЕЗ ЖИРОВ ИЗ УГЛЕВОДОВ
Превращение углеводов пищи в жиры установлено многочисленными
исследованиями над животными. Оно хорошо известно из практики откарм-
ливания животных. Однако строгие подсчеты объема углеводов, использую-
щихся для образования и отложения жира, проводились не часто. При под-
счете количества углеводов, жиров и белков в корме свиньи было установ-
лено, что из отложенных в течение трех месяцев ее откармливания 22 кг
жира только небольшая часть его могла быть доставлена с кормом,
остальная же масса жира в основном должна была образоваться из
углеводов.
Установлено, что жир, синтезирующийся у животного из углеводов,
имеет более низкое йодное число и, следовательно, более тверд, чем жир,
откладываемый в организме при потреблении обычного корма, когда обра-
зование жиров из углеводов ограничено.
Углеводы значительно богаче кислородом, чем жиры. Можно было бы
поэтому ожидать, что при интенсивном образовании в организме жиров из
углеводов будет выделяться кислород, или же образующийся кислород
будет использоваться в тканях и этим уменьшится потребление кислорода
при дыхании. В первом и во втором случае дыхательный коэффициент (т. е.
отношение объема выделяемого углекислого газа к объему потребленного
кислорода) будет повышен.
Исследования в этом направлении показали, что если животное заста-
вить голодать, а затем давать ему корм, богатый углеводами, то величина
дыхательного коэффициента у него резко возрастет, достигая двух, чего
обычно не наблюдается у животных. Как известно, дыхательный коэффи-
циент в случае полного окислительного распада одних только углеводов в
организме равен единице. Обычно же он ниже единицы (0,85—0,90), так как
в организме наряду с окислительным распадом углеводов происходит также
окислительный распад жиров и белков, сопровождаемый более низким дыха-
тельным коэффициентом.
Данные по изучению распада углеводов позволяют понять фермента-
тивные процессы, приводящие к образованию жира из углеводов.
Молекула жира построена из глицерина и из высокомолекулярных
жирных кислот. Синтез глицерина из углеводов несложен. Промежуточные
продукты анаэробного распада углеводов — фосфоглицеринальдегид и фос-
фодиоксиацетон в результате реакции восстановления должны превратиться
в фосфоглицерин. Гидролиз фосфоглицерина с помощью фосфатазы приво-
дит к возникновению глицерина. Образование глицерина легко осуществ-
ляется ферментами дрожжей (вторая форма спиртового брожения), оно
возможно и у животных. Сложнее проходит синтез высокомолекулярных
жирных кислот. Здесь следует обратить внимание на два обстоятельства:
первое — молекулы высокомолекулярных жирных кислот, входящих в
состав жиров, обычно имеют четное число атомов углевода, и второе — от-
дельные ферментативные этапы распада высокомолекулярных жирных кис-
лот (^-окисление их, см. стр. 330) обратимы. Так как р-окисление жирных
кислот приводит к образованию ацетил ~SKoA, то, естественно, напраши-
вается допущение, что из него синтезируются высокомолекулярные жирные
кислоты. Ацетил-SKoA образуется не только как промежуточный продукт
окисления жирных кислот. Он также промежуточный продукт аэробного
распада углеводов. Следовательно, путь синтеза высокомолекулярных
жирных кислот из углеводов может осуществляться через ацетил —SKoA*
Это допущение нашло свое полное подтверждение в исследованиях с приме-
нением изотопного метода. Оказал ось,г что при введении в организм животных
уксусной кислоты, меченной радиоактивным углеродом (С14), радиоактивны-
ми становятся ацетоуксусная кислота, являющаяся продуктом конденсации
двух молекул ацетил —SKoA, и высокомолекулярные жирные кислоты — со-
ставные части жиров.
477
Далее оказалось, что при введении в организм уксусной кислоты, ме-
ченной радиоактивным углеродом в карбоксильной группе и дейтерием —
в метильной группе, в жирных кислотах, входящих в состав жиров, обна-
руживается радиоактивный углерод в карбоксильной группе и дейтерий —
в метиленовой группе, находящейся в а-положении, причем дальше в угле-
родной цепи радиоактивный углерод и дейтерий последовательно чередуются
в метиленовых группах. Результаты опытов с применением уксусной кисло-
ты с двойной меткой убедительно показывают, что вся молекула уксусной
кислоты, не расщепляясь на (^-фрагменты, используется для синтеза жир-
ных кислот.
Образование значительного количества жиров (глицерина и жирных
кислот) из уксусной кислоты происходит у лактирующих коров. Корм коров
исключительно богат углеводами. В пищеварительном тракте коров углево-
ды корма подвергаются воздействию микроорганизмов, в результате чего
они расщепляются с образованием преимущественно уксусной кислоты
(до 70% углеводов корма всасывается в пищеварительном тракте в кровь
в виде уксусной кислоты). Всосавшаяся уксусная кислота активируется —
из нее образуется ацетил ~SKoA, а в дальнейшем она используется как
материал для синтеза жиров и углеводов молока. Из нее у коров также син-
тезируются и запасные жиры.
С биохимической точки зрения, представляет интерес процесс образова-
ния эфирных связей при взаимодействии глицерина с жирными кислотами.
Липаза, катализирующая гидролиз жиров, действует в условиях, когда об-
ратимость реакции гидролиза, т. е. синтез жира из продуктов его распада,
не имеет места. Синтез жира в организме осуществляется иначе, и в нем, на-
до полагать, участвует кофермент ацилирования и аденозинтрифосфор-
ная кислота. Синтез жира из глицерина и жирных кислот можно предста-
вить следующим образом:
ОН
3KoASH + ЗАТФ^ЗКоАЗ^Р^О
\он
он
+3 адениловая кислота
(1>
KoAS-пирофосфорная кислота
ЗЯСООН + 3KoAS~P
?.37?C~SKoA + ЗН4Р2О,
(2)
Жирная кислота
Ацил-5-КоА-пирофосфорная кислота
СН2ОН /О СНгООСЯ
I /7 I
СНОН +3J?C~SKoA--------> СНООС7? + 3KoASH
I I
CH2OH CH2OOCP
Глицерин Триглицерид
Суммирование трех приведенных реакций дает уравнение (4)
(3)
СН2ОН zO СН2ООСЯ
СНОН +3/?с—ОН + ЗАТФ----------> сноося + ЗН4Р2О7+
СН2ОН СН2ООСК
Глицерин Жирная кислота Триглицерид-ЬПирофосфорная кислота
+3 адениловая кислота
478
Из уравнения (4) следует, что энергия, необходимая для образования
эфирных связей при синтезе жиров, доставляется макроэргической связью
аденозинтрифосфорной кислоты при отщеплении от нее пирофосфор ной
кислоты.
СИНТЕЗ УГЛЕВОДОВ ИЗ ЖИРОВ
Вопрос о возможности синтеза углеводов из жиров считался долгое
время спорным. Существовали на этот счет две противоположные точки
зрения. Одни исследователи придерживались взгляда, что жиры, вернее,
высокомолекулярные жирные кислоты, животных совершенно не превра-
щаются в углеводы. Другие, наоборот, полагали, что жирные кислоты
используются в организме при обязательном превращении их в углеводы.
При этом исходили из сложившегося в двадцатых годах нашего столетия
представления (оказавшегося позже неправильным), что работа мышц
совершается только лишь за счет потребления ими углеводов. Отсюда
приходили к выводу, что энергетические затраты организма при физиче-
ской работе могут быть покрыты за счет жиров после предварительного их
превращения в углеводы.
Исследователи, считавшие, что жирные кислоты не превращаются у жи-
вотных в углеводы, исходили из того соображения, что возникновения угле-
водов из жиров обычно в организме не наблюдается, в то время как обра-
зование жиров из углеводов встречается часто. Разрешить спор путем выяс-
нения химической природы промежуточных продуктов распада жиров,
которые могли бы рассматриваться как предшественники углеводов в
организме, не представлялось возможным. Биохимическая наука в те годы
не располагала еще достаточными сведениями относительно внутриклеточ-
ного превращения веществ.
Сторонники возможности превращения жиров в углеводы исходили из
следующих экспериментальных данных. При прорастании семян маслич-
ных растений в отсутствие света наблюдается увеличение количества угле-
водов, которое нельзя объяснить образованием их путем фотосинтеза. Угле-
воды в этом случае должны получаться из веществ, имеющихся в готовом
виде в семенах. Определение в прорастающих семенах содержания жиров
выявило их убыль. Следовательно, при прорастании семян имеет место
убыль в содержании жиров при одновременном увеличении количества угле-
водов. Эти данные, однако, еще не убеждают в том, что углеводы образуются
из жирных кислот. Не исключена возможность возникновения углеводов
за счет глицерина, входящего в состав жиров. Далее, в семенах растений
всегда содержатся белки. Поэтому нельзя исключить возможность образо-
вания при прорастании семян углеводов из белков. Возникшие сомнения
были разрешены данными, полученными при изучении газового обмена
семян масличных растений при их прорастании в темноте.
Изучение потребления кислорода и выделения углекислого газа семе-
нами показало, что дыхательный коэффициент у них очень низкий (около
0,3) и приближается к тому, который по расчетам должен существовать в
случае превращения всей молекулы жира (глицерина и жирных кислот)
в углеводы.
Превращение жиров в углеводы имеет место у зимнеспящих животных.
Эти животные к осени, прежде чем впасть в состояние спячки, накапливают
в организме большое количество жиров, до 50% веса организма. К началу
весны, к моменту перехода животных в бодрствующее состояние, количе-
ство жира у них доходит до минимума. В период спячки резко замедляются,
но не прекращаются физиологические функции организма животных (кро-
вообращение, дыхание и др.). Энергетические затраты у животных крайне
снижены, но все же они имеют место и в течение периода спячки (она про-
должается до полугода). Энергетические затраты покрываются за счет рас-
479
пада жиров, из которых в этот период образуются углеводы. Об этом гово-
рят следующие факты. Во время зимней спячки животные просыпаются на
короткие сроки (это у них совпадает обычно с актом мочеиспускания),
а затем снова засыпают. В эти промежутки времени у них усиливаются
процессы обмена веществ, причем в основном тратятся запасы гликогена
печени и мышц. Зимнеспящие животные могут быть выведены из состояния
спячки искусственно, например, помещением их в термостат при 30-40°.
Гликоген из печени и мышц (это впервые было установлено Клодом Берна-
ром) у пробужденных животных почти полностью исчезает. Между тем в
промежутках между пробуждениями содержание гликогена в печени, в
мышцах и в других органах оказывается достаточно большим. Весною, к
концу спячки животных, гликоген в довольно значительных количествах
оказывается в мышцах, в печени и в других органах. Все это указывает
на то, что во время спячки животных у них в организме синтезируются угле-
воды. Если учесть, что белковые вещества тканей тратятся в период спячки
очень ограниченно, а жиры в значительных количествах, то уже это одно
указывает на возможность синтеза углеводов из жиров. Дополнительным
доказательством в пользу превращения жиров в углеводы у зимнеспящих
животных явились данные, полученные при изучении газового обмена.
Потребление кислорода и выделение углекислого газа у животных в пе-
риод спячки значительно уменьшены. Одновременно с этим у них оказывает-
ся значительно сниженным дыхательный коэффициент. В зависимости от
глубины сна величина дыхательного коэффициента у них колеблется в
пределах 0,4—0,6. Наличие такого низкого дыхательного коэффициента
доказывает, что не только глицерин, но и жирные кислоты являются мате-
риалом для синтеза углеводов у животных, находящихся в состоянии
спячки.
Для изучения возможности превращения жиров в углеводы были ис-
пользованы животные с экспериментальным диабетом. У подобных живот-
ных, как известно,, с мочой выделяется глюкоза. Выделение глюкозы, кото-
рое не прекращается даже при голодании, можно усилить введением в
организм адреналина. Опыты ставились таким образом, что животных с
диабетом лишали пищи и вводили им для усиления глюкозурии адрена-
лин. В моче животных при этом определяли количество глюкозы и содер-
жание общего азота (по нему судили об объеме распада белков тканей).
Полученные данные показали, что количество выделенной из организма
глюкозы настолько велико, что нельзя объяснить образование ее из белков,
а также из глицерина, входящего в состав жиров. Отсюда напрашивался
вывод, что у животных, больных диабетом, глюкоза образуется из жирных
кислот.
Возможность синтеза углеводов из жиров получила подтверждение в
результате изучения промежуточных продуктов обмена углеводов и жи-
ров в организме животных, а также ферментов, катализирующих их обра-
зование. Ацетильное производное кофермента А, как оказалось, является
общим промежуточным продуктом обмена как углеводов, так и жирных
кислот. Из ацетил—SKoA, возникающего при окислительном распаде
жирных кислот, могут в результате ряда ферментативных реакций синте-
зироваться углеводы.
Опыты с применением уксусной кислоты, меченной радиоактивным
углеродом или дейтерием, показали, что при введении ее в организм радио-
активный углерод или дейтерий появляется как в углеводах, так и в жир-
ных кислотах.
Ошибочным оказался взгляд, что при использовании в организме жир-
ных кислот они проходят стадию образования углеводов. Образование из
них на определенном этапе превращения ацетил —SKoA вовсе не означает,
что он по мере своего образования превращается в углеводы точно так же,
как образующаяся при окислительном распаде углеводов ацетоуксусная
кислота не обязательно превращается в жиры. Превращения возникающего
480
в обмене веществ ацетил —SKoA осуществляется в организме различными
путями. Основная масса ацетил —SKoA окисляется в реакциях цикла три-
карбоновых кислот (стр. 271). В зависимости от условий в организме реали-
зуется тот или иной возможный путь превращения ацетил —SKoA. Однако
реализация определенного пути превращения, например образование из
него углеводов, еще не означает, что в результате этого должно иметь место
накопление и отложение в тканях углеводов. Возникающее путем синтеза
вещество вовлекается в свою очередь в цепь химических превращений,
приводящих к его расщеплению, или к выделению из организма (при-
мером здесь может служить холестерин, который синтезируется в организме
животных из ацетил —- SKoA и который, с одной стороны, используется для
образования гормонов и других веществ, а с другой — выделяется из орга-
низма).
Интенсивное накопление жира при кормлении животных пищей, бога-
той углеводами, а также ожирение, наступающее у человека при обильной
пище (алиментарное ожирение), и случаи патологического ожирения (на-
пример, гипофизарное ожирение) свидетельствуют о том, что ацетил —SKoA
легко используется для синтеза жиров, а не углеводов. Это имеет извест-
ный биологический смысл. Отложение в запас углеводов у животных огра-
ничено в то время как жир может откладываться в очень больших количе-
ствах. Отложение жира, если оно не выходит за физиологические пределы,
позволяет подвижному животному создавать энергетический резерв при
сравнительно небольшой массе отложенного вещества. Калорийная цен-
ность жиров в 2,3 раза выше калорийной ценности углеводов.
В малоподвижных организмах (растения) обычно основными запасными
веществами являются не жиры, а углеводы.
СИНТЕЗ УГЛЕВОДОВ ИЗ БЕЛКОВ
Белки в организме являются источником образования углеводов. Это
было установлено опытами над животными с экспериментальным сахарным
диабетом, наблюдениями над людьми, больными сахарным диабетом, а так-
же опытами над голодающими животными. При введении в организм при
сахарном диабете белков или некоторых аминокислот можно наблюдать
повышенное выделение глюкозы с мочой. При введении таких же веществ
голодающему животному увеличивается содержание гликогена в печени.
Образование в организме углеводов из иных веществ носит название
гликонеогенеза и хорошо известно у больных сахарным диабетом. Если не
принимать в расчет глицерин, образующийся при гидролизе жиров и легко
превращающийся в гликоген, гликонеогенез обеспечивается у них белками.
В опытах на собаках с экспериментальным диабетом по повышению
выделения глюкозы с мочой было установлено, в каком количестве образу-
ются углеводы из различных белков и аминокислот. Оказалось, что в зависи-
мости от аминокислотного состава белков из 100 г может образоваться
от 50 до 80 г глюкозы. Далее выяснилось, что глюкоза возникает из тех
аминокислот, которые при своем распаде в виде промежуточного продукта
образуют пировиноградную кислоту. Установлено, что из пяти атомов угле-
рода, входящих в состав глутаминовой кислоты, три используются для син-
теза глюкозы; из четырех атомов углерода аспарагиновой кислоты на син-
тез глюкозы идет также три атома углерода. Каждая молекула глутамино-
вой и аспарагиновой кислот при распаде образует в виде промежуточного
продукта по одной молекуле пировиноградной кислоты, имеющей в своем
составе три атома углерода.
Исследования, проведенные с различными аминокислотами, показали,
что они в различной степени стимулируют гликонеогенез. Наиболее актив-
ными в этом отношении являются следующие аминокислоты: аланин,
аспарагиновая и глутаминовая кислоты, серин, валин, орнитин, гистидин.
16 Заказ № 581
481
Слабо стимулируют гликонеогенез глицин, цистин, цистеин, изолейцин,
фенилаланин, тирозин и триптофан. Остальные аминокислоты вовсе не
влияют на гликонеогенез.
Аминокислоты, вызывающие увеличение выделения глюкозы из орга-
низма при сахарном диабете, повышают также отложение гликогена в пе-
чени голодающих животных.
Путь превращения аминокислот, образующих при распаде в виде про-
межуточного продукта пировиноградную кислоту, в углеводы становится
ясным, если учесть, что пировиноградная кислота появляется как при ана-
эробном, так и при аэробном распаде углеводов и что из пировиноград-
ной кислоты легко синтезируется гликоген.
Гликонеогенез из белков (аминокислот) легко наблюдать у больных
сахарным диабетом. В здоровом- организме гликонеогенез происходит в
небольшом объеме, так как распад аминокислот направлен преимуществен-
но в сторону образования конечных продуктов.
СИНТЕЗ ЖИРОВ ИЗ БЕЛКОВ
Многочисленные исследования, направленные к выяснению вопроса,
образуются ли жиры в результате превращения белков (аминокислот),
не привели к окончательным результатам. В тех случаях, когда можно бы-
ло проследить убыль в содержании белков при одновременном накоплении
жиров, не исключалась возможность участия в образовании жиров из угле-
водов. Наблюдающееся при некоторых патологических состояниях ожире-
ние органов обычно является следствием перемещения жира из жировой
ткани, а не результатом синтеза жира из белковых веществ.
По-видимому, у животных, а также и у других живых существ, жиры
образуются из белков не прямым путем, а через процессы синтеза из амино-
кислот углеводов (гликонеогенеза). В этом случае образование жиров из
белков проходит стадию возникновения углеводов, из которых затем уже
появляются жиры. Не исключена, однако, возможность образования жи-
ров непосредственно из некоторых аминокислот. При распаде оксипролина,
лейцина, фенилаланина, тирозина и отчасти изолейцина в тканях животных
образуется ацетоуксусная кислота, которая может превратиться в высоко-
молекулярные жирные кислоты.
СИНТЕЗ АМИНОКИСЛОТ ИЗ УГЛЕВОДОВ
Ряд аминокислот, входящих в состав белков, может синтезироваться
из углеводов. При распаде гликогена в тканях образуется пировиноград-
ная кислота, в результате аминирования которой возникает аланин. При
карбоксилировании пировиноградной кислоты образуется щавелевоуксус-
ная кислота, которая, аминируясь, превращается в аспарагиновую кислоту.
В цикле трикарбоновых кислот из продуктов превращения углеводов обра-
зуется а-кетоглутаровая кислота, которая, присоединяя к себе аммиак,
превращается в глутаминовую кислоту. Из углеводов получаются также и
некоторые другие (кроме пировиноградной, щавелевоуксусной и а-кетоглу-
таровой кислоты) а-кетокислоты — предшественники аминокислот. Ряд
заменимых аминокислот синтезируется в организме животных из продуктов
превращения углеводов и из аммиака.
Приведенные данные о взаимопревращениях углеводов, жиров и бел-
ков (аминокислот) показывают, что обмен различных веществ в организме
составляет единое целое. Неудивительно, поэтому, что нарушения превра-
щения углеводов в организме влекут за собой изменения в обмене жиров и
белков, что использование белков пищи в известной мере зависит от достав-
ки в организм углеводов и т. д. В клетках нет биохимических процессов,
которые протекали бы изолированно, вне связи друг с другом.
Глава двадцатая
ДИНАМИЧЕСКОЕ СОСТОЯНИЕ ХИМИЧЕСКИХ
СОСТАВНЫХ ЧАСТЕЙ ТКАНЕЙ ОРГАНИЗМА
Теснейшая связь, существующая между живыми организмами и окру-
жающей их средой, приводит к тому, что составные части клеток и тканей
находятся в особом, динамическом, состоянии. Любое вещество в составе
организма не может находиться в нем в стабильном состоянии. Органи-
ческие вещества в клетках и тканях подвергаются распаду и одновременно
с этим происходит их синтез за счет веществ, поступающих в организм
извне с пищей. Единство процессов ассимиляции и диссимиляции, лежа-
щее в основе процесса обмена веществ, предопределяет постоянное обновле-
ние в клетках и тканях их составных частей.
Применение в биологической химии метода меченых атомов позволило
выявить интенсивность обновления многих составных частей клеток, уста-
новить, как принято говорить, продолжительность «жизни» их в организме.
Интенсивность обновления составных частей различных тканей и орга-
нов неодинакова и зависит прежде всего от их жизнедеятельности. Неоди-
накова также интенсивность обновления различных составных частей одного
и того же органа. С различиями в скорости обновления химических состав-
ных частей тканей и органов встречаются также у различных животных.
Так, например, у теплокровных животных скорость обновления составных
частей тканей выше, чем у холоднокровных. У теплокровных и холодно-
кровных встречаются в этом отношении различия, зависящие от образа
жизни отдельных их групп и даже отдельных представителей в пределах
той или иной группы.
Имеющиеся экспериментальные данные свидетельствуют о том, что
в живых организмах нет таких образований, которые не подвергались бы
постоянному обновлению. Даже такие, казалось бы, инертные ткани, как
костная и соединительная, хрящи и сухожилия, не являются в этом отно-
шении исключением.
Динамическое состояние составных частей клеток и тканей — одна
из замечательных черт, характеризующих жизнь.
Ниже приводятся данные, касающиеся динамического состояния бел-
ковых веществ, составляющих основу протоплазмы клеток, нуклеиновых
кислот, а также липидов и углеводов, играющих важную роль в энергети-
ческих и иных процессах.
ДИНАМИЧЕСКОЕ СОСТОЯНИЕ БЕЛКОВ
До применения меченых атомов в биохимии представление об интен-
сивности обновления белков организма давали исследования по изучению
так называемого коэффициента изнашивания тканей. Величина этого коэф-
фициента устанавливалась следующим образом. У животных, содержащих-
16* 483
ся в течение некоторого времени на безбелковой пище, изучали выделение
с мочой азотистых веществ (общий азот мочи), и по количеству общего азота
судили об интенсивности распада белков в организме (стр. 437). Динами-
ческое состояние белков исследовалось у человека. Результаты этих иссле-
дований показали, что организм взрослого человека при безбелковом
питании ежесуточно теряет на 1 кг своего веса около 0,25 г белков, входя-
щих в его ткани. Эта величина и составляет «коэффициент изнашивания»
тканей организма. Если принять вес взрослого человека (мужчины) рав-
ным 70 кг, то величина коэффициента изнашивания его тканей показывает,
что он ежесуточно теряет 17,5 г белков своих тканей. При нормальном
питании человека (и животных) распад белков тканей компенсируется за
счет аминокислот, образующихся в организме при распаде белков пищи.
Приблизительные расчеты, базирующиеся на данных изучения химического
состава организма, позволяют считать, что у взрослого мужчины содержит-
ся не меньше 16 кг белков. Принимая во внимание, что в организме ежесу-
точно распадается 17,5 г белков тканей и что такое же количество ежесу-
точно вновь синтезируется, легко вычислить время, в течение которого все
белки организма подвергнутся обновлению. Оно будет равно 16 000 : 17,5—
^—910. Следовательно, полное обновление белков организма произойдет
за 910 суток, или приблизительно за 2,5 года.
Приведенные расчеты нельзя считать безупречными. Прежде всего нет
уверенности в том, что интенсивность распада белков в тканях организма
при безбелковом питании та же, как и при нормальном питании. Далее,
совершенно ясно, что изучение выделения общего азота с мочой может дать
представление о суммарном распаде белков при безбелковом питании, но
на его основании нельзя выявить, насколько интенсивно происходит этот
распад в различных органах, какие именно белки распадаются интенсивно
и какие распадаются медленно. Необходимо также учитывать, что даже при
отсутствии белков в пищевом рационе синтез их в тканях полностью не
прекращается, так как он может происходить в известной мере за счет ис-
пользования аминокислот, возникающих при распаде белков тканей. Сле-
довательно, изучение коэффициента изнашивания тканей не может дать
полного представления о динамическом состоянии белков в организме,
об интенсивности их обновления.
Применение метода меченых атомов позволило глубоко разобраться в
вопросах обновления белков в организме. При введении в организм какой-
либо аминокислоты, меченной радиоактивным углеродом, или же стабиль-
ным азотом, белки тканей приобретают метку. Интенсивность метки ока-
зывается различной в белках различных тканей и даже в различных белках
одной и той же ткани. По величине метки радиоактивности (определяемой
обычно по показаниям счетчика Гейгера-Мюллера), в случае введения в
организм аминокислот, меченных С14, и массы (определяемой на масспект-
рометре) — при введении аминокислот, меченных N15, появляющихся
в белках тканей, можно судить об интенсивности включения в них за данный
отрезок времени аминокислот. По истечении некоторого промежутка вре-
мени после введения в организм меченой аминокислоты появившаяся в бел-
ках метка исчезает. По интенсивности включения меченых молекул амино-
кислот в белки тканей и по интенсивности их выхода из белков можно судить
о степени обновления белков, об их динамическом состоянии.
Результаты исследований с применением меченых аминокислот пока-
зали, что белки находятся в тканях в состоянии непрекращающегося об-
новления, т. е. распада и синтеза. Обновление белков тканей происходит в
организме значительно интенсивнее, чем это можно было бы предположить,
исходя из данных изучения величины коэффициента изнашивания тканей
организма.
Р. Шёнгеймер, впервые применивший меченые аминокислоты для изу-
чения обмена белков в тканях, пришел к выводу, что включение аминокислот
в белки тканей может происходить двояким путем: 1) в результате полного
484
распада белков с образованием аминокислот и последующего синтеза бел-
ковых молекул из аминокислот; в этом случае говорят о включении тех или
иных аминокислот в белки за счет синтеза белков заново; 2) за счет частич-
ной замены в молекулах остатков различных аминокислот на одноименные
аминокислоты. В этом случае белковые молекулы не подвергаются полному
распаду с образованием аминокислот и обновление аминокислот происхо-
дит внутри белковой молекулы. Каждая белковая молекула, исходя из
представлений Р. Шёнгеймера, получивших широкий отклик среди биохи-
миков, имеет свой срок «жизни» в организме не только потому, что она
подвергается полному распаду, а затем синтезу, а главным образом по той
причине, что в различных участках белковой молекулы происходит размы-
кание пептидных (кислотоамидных) связей, благодаря чему те или иные
аминокислотные остатки оказываются вне молекулы и заменяются другими
остатками одноименных аминокислот.
Представление Р. Шёнгеймера о динамическом состоянии белковых
молекул в организме стало известно более 25 лет тому назад. Оно получило
свое признание, хотя до сих пор нет еще окончательных доказательств
в пользу того, что в тканях организма происходит размыкание пептидных
связей в белках с заменой одних остатков аминокислот на другие одноимен-
ные. Объясняется это тем, что опыты, проводимые с применением меченых
аминокислот, выявляют конечный результат имевших место реакций (в дан-
ном случае наличие или отсутствие меченой аминокислоты в молекуле
белка), но не показывают, каким образом достигнут этот результат. Суще-
ствует еще одно важное обстоятельство, затрудняющее путь исследователя.
Дело в том, что проблема биосинтеза белка (стр. 471) еще не может считать-
ся разрешенной, хотя в изучении ее достигнуты уже крупные успехи. Дан-
ные, которыми располагает биохимическая наука, позволяют в настоящее
время считаться со следующими возможными путями обновления белков
в тканях организма.
Первый возможный путь обновления заключается в том, что белки под-
вергаются в организме интенсивному распаду с образованием аминокислот
и синтезу заново из аминокислот. При оценке возможности этого пути
приходится учитывать, что интенсивность протеолиза в тканях организма
невелика и что нет соответствия между активностью протеолитических фер-
ментов в различных тканях и интенсивностью обновления входящих в их
состав белковых веществ. Сторонники взгляда, что обновление аминокислот-
ного состава белков тканей происходит преимущественно в результате их
распада и синтеза заново, в недостаточной мере учитывают эти моменты.
Второй возможный путь обновления белков тканей заключается в том,
что они синтезируются не только из отдельных аминокислот, но и из поли-
пептидов. В этом случае из аминокислот синтезируются большей или мень-
шей сложности полипептиды, из которых затем строятся белковые молеку-
лы. Интенсивность включения той или иной аминокислоты в различные
части белковой молекулы зависит от степени участия различных полипеп-
тидов в построении белковой молекулы. Наконец, третий возможный путь
обновления белков тканей заключается в замене аминокислотных остатков
без полного расщепления белковых молекул. Дальнейшие исследова-
ния должны выявить значение каждого из приведенных возможных путей
обновления белков тканей организма. Однако сравнение между собой
данных, полученных при изучении интенсивности обновления белков орга-
низма в опытах с установлением коэффициента изнашивания тканей, с дан-
ными, полученными с применением изотопного метода, уже сейчас показы-
вает, что динамическое состояние белков в тканях зависит не только от про-
цессов их полного распада и синтеза заново, но и от процессов, приводящих
к обновлению частей белковых молекул. Если бы динамическое состояние
белков в тканях организма объяснялось лишь процессом их распада и
синтеза заново, то следовало бы ожидать, что обновление всего белкового
состава организма происходило бы в течение длительного срока. Между
485
тем результаты изучения интенсивности обновления белков различных тка-
ней и организма в целом, полученные с помощью метода меченых атомов,
показывают, что это обновление происходит значительно более интенсивно
и исчисляется сроками в десятки дней. Важно также отметить, что обновле-
ние белков тканей не прекращается при голодании, когда синтез белков или
вовсе не происходит, или же крайне ограничен. При голодании, как из-
вестно, имеет место убыль в содержании белков в тканях.
Выявление биохимических процессов, приводящих к обновлению бел-
ков, оказалось весьма трудным, так как белки имеют чрезвычайно сложную
структуру, и превращения их в организме весьма разнообразны. Лучше
удалось выявить процессы, обусловливающие динамическое состояние в
тканях организма сравнительно более простого вещества, с более очерченной
физиологической ролью — гликогена.
ДИНАМИЧЕСКОЕ СОСТОЯНИЕ ГЛИКОГЕНА
В молекуле гликогена, как известно, остатки глюкозы соединены друг
с другом с помощью глюкозидных связей 1,4 и 1,6. Благодаря этому моле-
кула гликогена имеет ветвистую структуру, в которой различаются остатки
молекул глюкозы, расположенные на периферии, и остатки молекул глю-
козы, расположенные в глубине молекулы гликогена, за пределами глю-
козидных связей 1,6, т. е. к центру молекулы гликогена.
До последнего времени считалось общепринятым, что обмен углеводов
в тканях организма — в печени и в мышцах — сопровождается в одних
случаях образованием гликогена из молекул глюкозо-1-фосфорной кислоты
(синтез гликогена заново), а в других — полным распадом молекул гликоге-
на с дальнейшим использованием в тканях образовавшихся молекул глюко-
зы. Иными словами, считалось, что молекула гликогена в метаболическом
отношении однородна и что срок «жизни» молекулы гликогена в той или
иной ткани определяется интенсивностью процессов, приводящих к ее син-
тезу и к ее распаду.
Применение метода меченых атомов позволило выявить метаболическую
неоднородность структурных единиц гликогена, выражающуюся в том, что
степень участия глюкозных остатков, находящихся на периферии молекулы
и внутри ее, в углеводном обмене неодинакова. В опытах с введением в орга-
низм животного глюкозы, меченной радиоактивным углеродом, было уста-
новлено, что введенная глюкоза с различной скоростью появляется в пери-
ферической и во внутренней части молекулы гликогена печени и мышц.
Расположенные в периферической части молекулы глюкозные остатки об-
новляются интенсивнее, чем остатки глюкозы, находящиеся внутри, ближе
к центру, молекулы гликогена. Различие в интенсивности обновления «пе-
риферических» и «внутренних» остатков глюкозы в гликогене печени оказы-
вается более ярко выраженным, чем в гликогене мышц. Это неудивительно,
если учесть, что в печени обмен гликогена, его распад и синтез происходит
более интенсивно, чем в мышцах.
Приведенные данные показывают, что обновление гликогена в тканях
не является простым замещением предшествующих молекул его на вновь
образовавшиеся. Молекула гликогена подвергается постепенному обновле-
нию, а не только одноразовому обновлению, благодаря ее синтезу и распаду.
Из этого следует, что молекулы гликогена в тканях находятся в динамиче-
ском состоянии и что в течение «жизни» молекулы в ней происходит обно-
вление глюкозных остатков.
Метаболическая неоднородность наблюдается и в молекулах фосфа-
тидов.
486
ДИНАМИЧЕСКОЕ СОСТОЯНИЕ ФОСФАТИДОВ
Применение изотопного метода позволило выявить динамическое со-
стояние фосфатидов в тканях организма. Прежде всего было показано, что
при введении в организм радиоактивного фосфата (Р32) фосфатиды приобре-
тают радиоактивность, причем величина этой радиоактивности оказывается
неодинаковой в фосфатидах различных тканей. Особенно интенсивно обнов-
ляются фосфатиды печени. Уже в результате старых исследований было уста-
новлено, что в составе молекул фосфатидов встречаются различные жирные
кислоты (преимущественно ненасыщенные), в зависимости от жирных кис-
лот, входящих в состав жиров пищи, а также и от физиологического состоя-
ния организма. Так, например, при голодании изменяется степень ненасы-
щенности жирных кислот фосфатидов тканей.
Исследования последнего времени выявили механизм ферментативного
синтеза фосфатидов (лецитинов) и вместе с этим показали, что молекулы их
метаболитически неоднородны. Оказалось, что обновление фосфатного ос-
татка в молекуле лецитина происходит более интенсивно, чем это имеет
место в случае синтеза молекулы лецитина из отдельных ее компонентов
заново. Эти данные позволяют считать, что молекула лецитина отщепляет
от себя остаток фосфохолина, или же остаток холина и остаток фосфорной
кислоты, не подвергаясь полному распаду, а затем к образовавшейся молеку-
ле фосфатидной кислоты снова присоединяется фосфорная кислота и холин.
Подобное обновление фрагментов молекул оказалось характерным не
только для лецитинов, но и для других тканевых фосфатидов. Все эти дан-
ные приводят к заключению, что срок «жизни* фосфатидов в тканях опре-
деляется не только интенсивностью их распада и синтеза заново, но и ин-
тенсивностью обновления отдельных компонентов их молекул.
ДИНАМИЧЕСКОЕ СОСТОЯНИЕ ПУРИНСОДЕРЖАЩИХ
ВЕЩЕСТВ
К пуринсодержащим веществам относятся нуклеиновые кислоты и ряд
нуклеотидов — веществ, играющих особенно важную роль в живых орга-
низмах. Вопрос о динамическом состоянии этих веществ представляет боль-
шой интерес.
Молекулы нуклеиновых кислот, особенно дезоксирибонуклеиновых
кислот, имеют очень большой молекулярный вес и построены из большого
числа мононуклеотидов. Каждый мононуклеотид в свою очередь состоит
из трех компонентов: азотистого вещества (производного пурина или пири-
мидина), моносахарида (рибозы или дезоксирибозы) и фосфорной кислоты.
Можно полагать, что динамическое состояние нуклеиновых кислот зависит
от интенсивности распада и синтеза их молекул, а также от интенсивности
обновления входящих в их состав мононуклеотидов и компонентов, из кото-
рых они построены. Между тем экспериментальных данных относительно
динамического состояния нуклеиновых кислот в клетках пока очень еще
мало, и они преимущественно основываются на интенсивности обновления
входящей в их состав фосфорной кислоты.
Большой интерес представляют имеющиеся данные о динамическом
состоянии производных пурина, входящих в состав нуклеиновых кислот
и нуклеотидов. Эти данные показывают, что наряду с синтезом ядра пурина
заново из его предшественников (глицина, муравьиной кислоты, амидного
азота глутамина, аспарагиновой кислоты и углекислого газа, см. стр. 455)
происходит постоянное обновление углеродного атома пуринового ядра в
позиции 2 (за счет включения и выключения муравьиной кислоты в 5-кар-
боксамидриботид, см. стр. 459). Эти данные говорят о метаболической неод-
нородности атомов, входящих в состав производных пурина нуклеиновых
кислот и нуклеотидов.
487
Изучение динамического состояния аденозинтрифосфорной кислоты
выявило метаболическую неоднородность остатков фосфорной кислоты,
входящих в состав ее молекулы. Оказалось, что из имеющихся в молекуле
АТФ трех остатков фосфорной кислоты интенсивно обновляются два остатка
(третий и второй), первый же остаток фосфорной кислоты, связанный эфир-
ной связью с рибозой, обновляется медленнее.
Обновлению подвергается в молекуле АТФ также остаток аденина и
остаток рибозы. Следовательно, динамическое состояние молекулы АТФ
в клетке заключается в обновлении всех ее компонентов.
Оказалось, что интенсивность обновления отдельных компонентов моле-
кулы АТФ, как и молекулы АТФ в целом, зависит от физиологического
состояния органов, от интенсивности процессов обмена веществ в них.
Так, например, установлено, что интенсивность обновления компонентов
молекулы АТФ в скелетной мышце ниже, чем в сердечной мышце (в послед-
ней обмен веществ происходит более интенсивно, чем в первой). То же
самое обнаружено при сравнении интенсивности обновления компонентов
молекулы АТФ в мышце бедра кролика и в грудной мышце голубя, характе-
ризующейся интенсивным обменом веществ. При голодании интенсивность
обновления АТФ в мышцах значительно ниже, чем в норме.
Изучение динамического состояния химических составных частей кле-
ток и тканей организмов является новой проблемой современной биологиче-
ской химии. Уже на нынешнем этапе разработки этой проблемы полу-
чены данные, показывающие, что обмен высокомолекулярных составных
частей клеток и тканей (белков, нуклеиновых кислот, гликогена, фосфати-
дов) заключается не только в том, что эти вещества подвергаются полному
распаду, а затем синтезу. Высокомолекулярные вещества в организме на-
ходятся в динамическом состоянии, обновляя отдельные компоненты своих
молекул.
Перед биологической химией встает новая задача — выявить значение
динамического состояния сложных органических веществ, составных частей
клеток и тканей в процессах жизнедеятельности организмов.
Глава двадцать первая
БИОХИМИЯ ПИТАНИЯ
В основе жизнедеятельности живых существ, как известно, лежат про-
цессы обмена веществ. Из внешней среды к ним поступают органические
и неорганические вещества, которые подвергаются различным химическим
превращениям. Конечные продукты обмена веществ выделяются во внеш-
нюю среду, где они, подвергаясь воздействию микроорганизмов, превра-
щаются в продукты питания растений. Углекислый газ, конечный продукт
расщепления всех органических веществ, выделяется из организма главным
образом при дыхании, и из него в зеленых растениях с помощью хлорофил-
ла и при использовании солнечной энергии синтезируются органические
вещества, необходимые для жизнедеятельности человека и животных.
Вещества, необходимые человеку и животным, доставляются с пищевы-
ми продуктами, имеющими весьма сложный химический состав. Наряду с
ними в организм поступают извне кислород и вода (помимо воды, имеющейся
в пищевых продуктах). Питательные вещества используются для обновле-
ния составных частей клеток тканей и органов, для роста организма, уве-
личения его массы, а также для энергетических целей. При окислительном
распаде органических веществ пищи освобождается химическая энергия,
которая превращается в механическую энергию при работе мышц, в тепло-
вую энергию, энергию секреции (выделение секретов железами), фильтра-
ции и концентрации веществ почками, электрическую энергию и др.
С практической точки зрения очень важно знать, какие именно вещества
и в каком количестве должны поступать в организм человека и животных с
пищей для удовлетворения их потребностей. Недостаток в пище, а также
отсутствие в ней той или иной составной части, приводит к потере веса
организма, его исхуданию и гибели.
Потребность в пище определяется физиологическим состоянием орга-
низма. Растущий организм нуждается в большем количестве пищи (на 1 кг
веса тела), чем организм взрослый. Для человека, занимающегося спортом,
физической работой, требуется большее количество пищи, чем для челове-
ка, ведущего малоподвижный образ жизни. Во время беременности и лакта-
ции организм нуждается в усиленной доставке пищевых продуктов.
Одной из важных задач биологической химии является изучение соста-
ва пищевых продуктов, роли отдельных составных частей пищи и потреб-
ности в них организмов при различных физиологических состояниях.
В конце прошлого столетия пища обычно оценивалась с энергетической
точки зрения. Предполагали, что роль пищи лишь в том, чтобы удовлетво-
рить энергетические потребности и рост молодых животных. Углеводы, жи-
ры и белки пищи, как считали, являются источниками энергии. Однако ско-
ро выяснилось, что физиологическое значение углеводов, жиров и белков
неодинаково, что организм человека и животных не могут обходиться без
белков, что замена белков углеводами и жирами недопустима, так как она
приводит к гибели организма. Оказалось также, что входящие в состав пи-
щи минеральные вещества, не играющие энергетической роли, абсолютно
489
необходимы живым существам. Наконец, были выявлены органические ве-
щества (витамины) и неорганические вещества (микроэлементы) в пищевых
продуктах, играющие чрезвычайно важную физиологическую роль. Они
оказались необходимыми для нормальной жизнедеятельности человека и
животных.
Ценность пищевых продуктов определяется содержанием в них различ-
ных веществ, необходимых для организма. Значение каждой составной части
пищевых продуктов определяется ее ролью.
ЭНЕРГЕТИЧЕСКИЕ ЗАТРАТЫ ОРГАНИЗМА
Энергетические затраты покрываются за счет энергии, освобождающей-
ся при распаде органических составных частей пищи — углеводов, жиров и
белков. При составлении пищевых рационов важно знать размеры энергети-
ческих затрат организма. Для этой цели в физиологии уже с давних пор раз-
работаны специальные методы исследования, которые сводятся к прямой и
непрямой калориметрии. В случаях прямой калориметрии учитывается ко-
личество тепла в килокалориях, которое освобождается в определенный
промежуток времени (сутки). Современные калориметры представляют собой
просторные камеры, в которых человек может совершать движения и выпол-
нять физическую работу. С их помощью можно установить, какое количе-
ство энергии тратит человек в покое и при выполнении работы различной
тяжести.
В случаях непрямой калориметрии об энергетических затратах судят
по количеству поглощаемого организмом кислорода и выделяемого угле-
кислого газа, следовательно, по данным газового обмена. Чем больше кис-
лорода поглощается организмом, тем интенсивнее происходит окисление
в нем органических веществ и тем больше выделяется углекислого газа.
При подсчете энергетических затрат на основании данных газового обмена
важно знать, какие именно вещества подверглись окислению. Представле-
ние об этом дает величина дыхательного коэффициента (СО2 : О2), которая
складывается из трех величин: дыхательных коэффициентов окисления угле-
водов (равен единице), жиров (равен 0,71) и белков (равен 0,80). Количество
белков, подвергшихся распаду в организме за сутки, устанавливают по ана-
лизу общего азота в суточном количестве мочи.
Исходя из среднего содержания азота в белках, равного 16%, можно
по количеству общего азота мочи судить о количестве распавшихся белков.
С этой целью пользуются коэффициентом 6,25 (16 г азота соответствует
100 г белка; 1 г азота соответствует 100 : 16 6,25 г белков). Содержание
углерода в белках в среднем составляет 22,5%. Отсюда, зная по определе-
нию общего азота мочи количество распавшихся белков, можно вычислить
объем ушедшего на это кислорода и выделенного углекислого газа. Разность
между общим количеством потребленного кислорода и количеством кисло-
рода, ушедшего на окисление белков, составляет количество кислорода,
затраченного на окисление углеводов и жиров. Разность между общим ко-
личеством выделенного углекислого газа и количеством углекислого газа,
образовавшегося при окислении белков, дает количество углекислого газа,
возникшего при окислении углеводов и жиров. Из двух величин: кис-
лорода, потребленного на окисление углеводов и жиров, и выделенного
углекислого газа при их окислении — вычисляют величину дыхательного
коэффициента, позволяющую судить о соотношении между количеством
окисленных углеводов и жиров.
Многочисленными исследованиями установлено, что из общего количе-
ства потребленного кислорода человеком в среднем 15% тратится на окисле-
ние белков и 85% на окисление углеводов и жиров. Исходя из этого, со-
ставлены таблицы, позволяющие по величине дыхательного коэффициента
судить о соотношении между количествами подвергшихся окислению угле-
водов и жиров.
490
Величина дыхательного коэффициента Процент потребленного кислорода, ушедшего на окисление
белков углеводов жиров
0,97 15 85 0
0,95 15 78 7
0,9 15 61 24
0,85 15 44 41
0,8 15 26 59
0,75 15 9 76
0,72 15 0 85
Приведенная таблица показывает, что по величине дыхательного коэф-
фициента можно судить о соотношениях между окисленными в организме
белками, углеводами и жирами. О количестве же распавшихся указанных
веществ судят по количеству потребленного организмом кислорода. Расчеты
при этом показывают, что на полное окисление 1 г углеводов потребляется
829 мл О2 и при этом выделяется 4,1 килокалорий, на полное окисление 1 г
жира потребляется 2019 мл О2 с освобождением 9Г3 килокалорий и на пол-
ное окисление 1 г белка —966 мл О2 с освобождением 4,2 килокалорий.
(В случае белков учитывается не только энергия, освобождающаяся при
их окислении, но и энергия, которая тратится на синтез мочевины, креати-
нина и других азотистых веществ, выделяющихся из организма с мочой.)
Метод непрямой калориметрии значительно менее сложен, чем метод
прямой калориметрии, и дает достаточно точные результаты, позволяющие
судить об энергетических затратах организма. Поэтому он получил широкое
применение в физиологических исследованиях. С помощью этого метода
установлены энергетические затраты организма в состоянии относительного
покоя, при ходьбе, беге, выполнении различных физических упражнений.
Оказалось, что энергетические затраты организма находятся в прямой за-
висимости от интенсивности произведенной им работы.
ЭНЕРГЕТИЧЕСКИЕ ЗАТРАТЫ ОРГАНИЗМА ПРИ
ОТНОСИТЕЛЬНОМ ПОКОЕ (ОСНОВНОЙ ОБМЕН)
Организм всегда тратит энергию. При покое продолжается деятельность
внутренних органов, работа сердца, обеспечивающая кровообращение,
работа дыхательных мышц и легких, обеспечивающая внешнее дыхание,
теплоотдача и др. На все это тратится энергия. Сюда еще следует отнести
энергию, которая тратится на деятельность различных желез и на деятель-
ность нервной системы (головного мозга, спинного мозга и периферических
нервов), регулирующих физиологические функции и во время покоя.
Энергетические затраты организма при относительном покое составля-
ют так называемый основной обмен. Под основным обменом принимают
то количество энергии, которое тратится организмом в состоянии наиболее
полного покоя, когда работа мышц сведена до минимума. Эти энергетические
затраты устанавливают у человека через 12—18 часов после приема пищи
(чем сводится до минимума затрата энергии органами пищеварения) и при
лежании его в постели при комнатной температуре. Изучается в течение
20 мин объем потребленного кислорода и выделенного углекислого газа
(обычно ограничиваются определением одного кислорода) и по этим данным
судят об энергетических затратах организма в килокалориях. При умноже-
нии числа калорий на 3 и на 24 выясняют энергетические затраты в сутки
при относительном его покое — основной обмен. Основной обмен — непо-
стоянная величина. Он зависит от ряда факторов: от возраста, пола, дея-
491
тельности желез внутренней секреции, особенно щитовидной, температуры
окружающей среды, барометрического давления и иных факторов.
Основной обмен у взрослого человека (мужчины) весом в 70 кг состав-
ляет 1700—1800 килокалорий в сутки, что соответствует примерно 25 кило-
калориям на 1 кг веса тела. Основной обмен на 1 кг веса тела у женщин не-
сколько ниже, чем у мужчин. У детей он выше, чем у взрослых. Основной
обмен повышен во время беременности.
Величина основного обмена изменяется при некоторых патологических
состояниях организма. Она понижена при гипофункции щитовидной железы
и повышена при ее гиперфункции. К определению величины основного об-
мена обычно прибегают в клиниках для выяснения функционального со-
стояния щитовидной железы. Основной обмен усилен при заболеваниях,
сопровождающихся лихорадочным состоянием.
Организм не может находиться продолжительное время в состоянии по-
коя. Уже незначительные движения, производимые даже в лежачем поло-
жении, сопровождаются усилением потребления кислорода и выделения
углекислого газа. В сидячем положении потребляется больше кислорода,
чем в лежачем, стоя — больше, чем сидя, при ходьбе — больше, чем стоя
и т. д. При средней интенсивности работы энергетические затраты человека
составляют около 2500 килокалорий. Следовательно, они превышают на
700—800 килокалорий основной обмен. При больших физических напря-
жениях (беге на большую дистанцию, гребле, прыжках и т. д., а также при
длительных тренировках) энергетические затраты значительно возрастают.
То же самое имеет место при напряженной физической работе, при которой
вовлекаются в работу большие группы мышц. При тяжелой физической
работе, например, дровосека, кузнеца, работающего вручную грузчика
энергетические затраты за сутки составляют 5000—6000 килокалорий, пре-
вышая основной обмен на 3300—4300 килокалорий. В связи с механизацией
трудоемких работ с такими большими энергетическими затратами практи-
чески не встречаются. Интересно отметить, что умственная работа также со-
провождается повышением потребления кислорода и выделения углекислого
газа. Однако это повышение сравнительно невелико.
Изучение энергетических затрат людей различных профессий и возрастов
имеет важное практическое значение для составления пищевых рационов.
Чем выше энергетические затраты организма, тем выше должна быть кало-
рийность пищевого рациона.
СПЕЦИФИКО-ДИНАМИЧЕСКОЕ ДЕЙСТВИЕ
ПИЩЕВЫХ ВЕЩЕСТВ
Прием пищи усиливает потребление организмом кислорода и выделение
углекислого газа. Это понятно, так как поступление пищи усиливает
активность пищеварительных органов, образование и выделение пищевари-
тельных соков, а также движения желудка и кишок. Оказалось, однако,
что энергетические затраты организма при пищеварении зависят от химиче-
ской природы пищевых веществ, подвергающихся перевариванию и всасы-
ванию в кишечнике. Проведенные исследования показали, что при перева-
ривании и всасывании жиров основной обмен увеличивается на 3%,
углеводов — на 6% и белков — на 16%. Способность пищевых веществ
усиливать основной обмен получила название специфико-динамического
действия. Из приведенных цифр видно, что наибольшим специфико-динами-
ческим действием обладают белки. Опыты показали, что аминокислоты
обладают таким же высоким специфико-динамическим действием, как и
белки.
Причина специфико-динамического действия различных пищевых ве-
ществ еще окончательно не выяснена. Установлено, что это действие являет-
ся результатом усиления процессов обмена веществ продуктами, поступаю-
492
1цими из кишечника в кровь. В этом смысле большой активностью обладают
аминокислоты. Продукты их превращения усиливают функцию желез внут-
ренней секреции, особенно функцию щитовидной железы, и этим повышают
интенсивность процессов обмена веществ в организме.
КАЛОРИЙНАЯ ЦЕННОСТЬ ОТДЕЛЬНЫХ ВЕЩЕСТВ
Калорийная ценность органических веществ зависит от их элементар-
ного состава, точно так же как освобождение энергии в результате окисления
отдельных элементов зависит от свойств этих элементов. Установлено, что
при сгорании 1 г углерода с образованием около 4 г углекислого газа осво-
бождается 8,08 килокалорий. При сгорании 1 г водорода с образованием
9 г воды освобождается 34,5 килокалорий. При сгорании углеводородов,
веществ, состоящих из атомов углерода и атомов водорода, количество
освобождающегося тепла оказывается близким к количеству тепла, которое
могло бы освободиться при раздельном сгорании соответствующих коли-
честв углерода и водорода.
Углеводы и жиры состоят из углерода, водорода и кислорода. Углерод
и водород их уже отчасти окислен кислородом. То же самое относится к бел-
кам, состоящим из углерода, водорода, кислорода, азота, серы и часто еще
и фосфора. Фосфор в белках полностью окислен кислородом, углерод и во-
дород частично окислены, сера же находится в восстановленном состоянии.
При сгорании углеводов, жиров и белков количество освобождающегося
тепла зависит от того, насколько они богаты кислородом, иными словами,
насколько они уже окислены.
Поясним это примером: 100 г глюкозы содержат 40 г углерода и 6,7 г
водорода. Остальное количество — 53,3 г приходится на долю кислорода.
При полном сгорании 100 г углеводов должно было бы освободиться
40x8,08=323 килокалории за'счет сгорания 40 г углерода и 231 килокало-
рия (6,7x34,5) за счет сгорания 6,7 г водорода. Общее количество соста-
вило бы (323+231)^554 килокалорий. Между тем при сгорании 100 г
глюкозы в калориметрической бомбе получают всего 375 килокалорий.
100 г жира содержат 77,2 г углерода, 12 г водорода и 10,8 г кислорода.
При полном сгорании 100 г жира должно было бы освободиться 77,2x8,08—
—624 килокалории за счет сгорания 77^2 г углерода и 12x34,5=414 кило-
калорий за счет сгорания 12 г водорода, т. е. всего 1038 килокалорий
(624+414). В действительности же при сгорании 100 г жира освобождается
945 килокалорий.
Из приведенных примеров можно сделать следующий вывод: содержа-
ние кислорода в молекуле органического вещества снижает его калорийную
ценность, причем это снижение тем более выражено, чем выше содержание в
органическом веществе кислорода.
При сгорании белков в калориметрической бомбе образуется углекис-
лый газ, вода, азот, незначительное количество азотной и серной кислот.
Если не считать небольшого количества тепла, которое освобождается за
счет образования азотной и серной кислот, то освобождение тепла будет
зависеть от окисления углерода и водорода, имеющихся в составе белков,
так как азот освобождается как таковой в виде газа. Калорийная ценность
белков определяется тем, насколько углерод и водород находятся в окис-
ленном состоянии, т. е. содержанием в белках кислорода.
Ниже в таблице приводятся данные, показывающие зависимость между
количеством тепла, освобождающегося при окислении различных веществ,
и их элементарным составом. Во всех приведенных случаях сгорание ве-
щества и определение количества тепла (в килокалориях) производилось
в калориметрической бомбе.
В организме углеводы и жиры окисляются с образованием тех же ко-
нечных продуктов (СО2 и Н2О), что и в калориметре. Отсюда следует, что
в организме освобождается вся потенциальная энергия углеводов и жиров.
493
Элементарный состав, в % Вещество Угле- род Водо- род Кисло- род Азот Сера Фос- фор Количество килокалорий при сгорании 1 г вещества
Глюкоза 40,0 6,7 53,5 3,75
Сахароза 42,1 6,4 51,5 —• — —• 3,96
Крахмал 44,4 6,2 49,4 — — — 4,22
Жир животный 76,5 12,0 11,5 — — — 9,60
Жир молока 75,0 11,7 13,3 — — —• 9,30
Эдестин 51,4 7,0 22,1 18,6 0,9 — 5,64
Легумин 51,7 7,0 22,9 18,0 0,4 — 5,62
Глиадин 52,7 6,9 21,7 17,7 1,0 — 5,74
Казеин 53,1 7,0 22,5 15,8 0,8 0.8 5,85
Альбумин 52,5 7,0 23,0 16,0 1,5 5,80
Креатинин 42,5 6,2 14,1 37,2 4,58
Мочевина 20,0 6,7 26,7 46,6 2,53
При распаде же белков и окислении аминокислот в организме не возникает
свободный азот. Азот выделяется в виде мочевины — главным образом у
уреотелических животных и мочевой кислоты — преимущественно у ури-
котелических животных. Наряду с ними выделяются, сравнительно в не-
больших количествах, иные органические азотистые соединения. Все эти
азотистые вещества содержат потенциальную энергию, количество которой
можно измерить при сжигании их в калориметрической бомбе. Подсчеты
показывают, что на каждый грамм распавшегося белка из организма выде-
ляются с мочой азотистые продукты, при сжигании которых освобождается
1,3 килокалории.
Калорийная ценность пищевых веществ, всосавшихся кишечником и
подвергшихся полному распаду в тканях на 1 а, такова:
углеводы в среднем дают . .
жиры » » » . . .
белки » » » . .
4,1 килокалорий
9,45 »
4,35 (5,65—1,3—4,35)
При учете калорийной ценности пищевых продуктов принимается
во внимание степень их усвояемости, которая определяется интенсивностью
их переваривания и всасывания. Непереваренные остатки пищи выделяются
с калом. Установлено, что при смешанной, включающей углеводы, жиры и
белки пище человеком усваивается 98% углеводов, 95% жиров и 92% белков.
Отсюда физиологическая ценность пищевых веществ составляет:
углеводов 4,1x0,98=4,0 килокалорий на 1 г
жиров 9,45x0,95=9,0 » » »
белков 4,35x0,92=4,0 » в »
Зная количество углеводов, жиров и белков в суточном пищевом ра-
ционе, легко вычислить его калорийную ценность. Обычно принято рассчи-
тывать калорийную ценность пищевых продуктов, исходя из того количества
продукта, которое дает 100 килокалорий. Так, например, калорийная
ценность молока исчисляется следующим образом. АГолоко (коровье) со-
держит 3,5% белков, 5% углеводов и 3,8% жира. Физиологическая калорий-
ная ценность 100 г молока будет равна 68,2 килокалориям.
3,5x4=14 килокалорий (распад белков)
5,0x4=20 » ( » углеводов)
3,8x9=34,2 в ( » жиров)
Итого: 68,2 килокалорий
Для того чтобы организм получил 100 килокалорий, необходимо дать
(округляя) 146 г молока (68 : 100-= 100 : х).
494
Другой пример. Яйца (куриные) имеют следующий состав: 12,8%
белков, 11,5% жиров (и жироподобных веществ) и 0,75% углеводов. Физи-
ологическая калорийная ценность 100 г яиц будет равна 158 килокалориям.
12.8x4—51,2 килокалорий (распад белков)
11,5x9=103,5 » ( » жиров)
0,75x4—3,0 » ( » углеводов)
Итого: 157,7 килокалорий
Для того чтобы организм получил 100 килокалорий, необходимо дать
63,3 г яиц (158 : 100-100 : х).
Физиологическая калорийная ценность ряда пищевых продуктов харак-
теризуется данными, сведенными в следующую таблицу:
Пищевой продукт (съедобная часть) Количество продуктов, дающее 100 килокало- рий, в г Распределение килокалорий в:
белках жирах углеводах
1 Хлеб (белый) 38 13,0 6,9 80,1
Масло (коровье) 14 0,3 99,5 0,2
Мясо (постное) . . . 66 52,3 47,7 « 1
Сало (бекон) 17 16,7 82,6 0.7
Семга 59 48,8 51,2
Бобы (фасоль, горох) сухие 29 25,2 3,9 70,9
Капуста 350 19,6 6,3 74,1
Морковь 224 10,7 6,0 83,3
Картофель 147 9,4 1,0 89,6
Томаты 441 17,6 11,9 70,5
Яблоки 156 1,9 5,6 92,5
Яйца 63 32,5 65,7 1.8
Молоко 146 20.4 50,1 28,5
ПРАВИЛО ИЗОДИНАМИИ РУБНЕРА
При составлении пищевого рациона можно заменять одни продукты
другими, не меняя его калорийную ценность. Из приведенных в таблице
данных можно видеть, например, что 38 г белого хлеба можно заменить
147 г картофеля, 17 г сала, 146 г молока и т. д. Рубнер в прошлом столетии
ввел термин изодинамии для пищевых продуктов. По Рубнеру, 38 г хлеба
изодинамичны (т. е. имеют одинаковую энергетическую ценность) 147 г
картофеля, 17 г сала и т. д. Из правила изодинамии Рубнера следует, что
можно широко заменять в пищевом рационе одни пищевые продукты други-
ми. Важно только это делать в известных пропорциях, не меняя общей ка-
лорийности всего пищевого рациона. Легко видеть, что правило изодинамии
односторонне оценивает физиологическую значимость пищевых веществ,
учитывая лишь их калорийность; в этом оказалась его несостоятельность.
Замена одних пищевых веществ другими физиологически возможна только
лишь в известных пределах, и с этим обстоятельством сразу же столкнулись
при попытках замены белков углеводами и жирами. Физиологическая
калорийная ценность белков и углеводов одинакова. Однако устранение
белков из пищи и замена их углеводами недопустима, так как необходимые
организму белки не могут синтезироваться из углеводов. Не могут также
белки синтезироваться из жиров. Поэтому замена белков эквивалентным в
калорийном отношении количеством жиров также недопустима.
495
РОЛЬ БЕЛКОВ В ПИТАНИИ
Белки пищи — источник аминокислот, необходимых для построения
белков тканей, для образования ряда гормонов и некоторых других важ-
ных для организма азотистых веществ (креатина, карнозина, глутатиона
и др.).
Не все аминокислоты, входящие в состав белков пищи, обладают оди-
наковой физиологической (пищевой) ценностью. Одни аминокислоты могут
синтезироваться в организме из аммиака и иных веществ и доставка их
не обязательна, другие не могут образоваться в организме и должны обяза-
тельно доставляться с белками пищи. Первые носят название заменимых,
вторые — незаменимых аминокислот.
Физиологическая ценность той или иной аминокислоты, заменимость
или незаменимость ее, обычно устанавливается в опытах на молодых кры-
сах. Животных кормят искусственно составленным пищевым рационом, в ко-
тором отсутствует испытуемая аминокислота. Если у крыс прекращается
рост, испытуемую аминокислоту относят к числу незаменимых. В резуль-
тате проведенных исследований можно классифицировать аминокислоты
следующим образом:
Незаменимые
аминокислоты
Заменимые
аминокислоты
Лизин
Триптофан
Г истидин
Фенилаланин
Лейцин
Изолейцин
Метионин
Валин
Треонин
Аргинин
Глицин
Аланин
Серин
Аспарагиновая кислота
Глутаминовая кислота
Пролин
Оксипролин
Цистин
Тирозин
Цистеин
Приведенная классификация • нуждается в некоторых пояснениях.
Аргинин в незначительных количествах может синтезироваться в организме
крыс. При отсутствии аргинина в пище молодых крыс рост их прекращается,
но они не погибают, как это имеет место при отсутствии в пище какой-либо
другой незаменимой аминокислоты. Отсюда можно заключить, что коли-
чество аргинина, синтезируемого в организме молодых крыс, недостаточно
для обеспечения их роста.
Глицин, являющийся заменимой аминокислотой для всех животных,
незаменим для цыплят. Цистеин — заменимая аминокислота только в том
случае, когда в пище имеется метионин. Точно так же тирозин может от-
сутствовать в пище, если в ней есть фенилаланин.
Отсутствие в пище той или иной незаменимой аминокислоты сказывает-
ся на азотистом балансе организма. В этом случае выделяется с мочой боль-
ше общего азота, чем поступает азота в составе белков пищи, азотистый ба-
ланс, следовательно, отрицательный. Организм нуждается в незаменимых
аминокислотах не в одинаковой мере. Это означает, что одна незаменимая
аминокислота может удовлетворить потребность в ней в .одном количестве,
другая — в ином и т. д. Систематические исследования Роуз и сотрудников
установили следующую потребность взрослого человека в незаменимых ами-
нокислотах в сутки (см. табл, на стр. 497).
Приведенные данные показывают, что только наличие незаменимых
аминокислот в составе белков пищи не является критерием для физиологи-
ческой оценки белков. Необходимо, чтобы незаменимые аминокислоты
имелись в достаточном количестве. Обычно человек (а также животные)
получают с пищей смесь различных белков, отличающихся друг от друга
496
Название аминокислоты Минимальное количество (г), при котором организм нахо- дится в состоянии азотистого равновесия Рекомен- дуемое ко- личе- ство (г), га- рантирую- щее под- держание азотистого равновесия
Триптофан 0,25 0,5
Фенилаланин 1,10 2,2
Лизин 0,80 1,6
Треонин 0,50 1,0
Валин 0,80 1,6
Метионин 1,10 2,2
Лейцин 1,10 2,2
Изолейцин 0,70 1.4
как по аминокислотному составу, так и по количественному содержанию
различных аминокислот. Среди них имеются неполноценные белки, в кото-
рых отсутствует та или иная (иногда несколько) незаменимая аминокислота.
В пищеварительном тракте белки подвергаются перевариванию с образова-
нием смеси аминокислот, которая может оказаться полноценной, т. е. в ней
могут присутствовать все незаменимые аминокислоты и в случае потребле-
ния неполноценных белков. Это происходит потому, что в каждом неполно-
ценном белке может отсутствовать какая-то одна (или несколько) опреде-
ленная для него незаменимая аминокислота, в смеси же нескольких непол-
ноценных белков могут оказаться, и обычно оказываются, все незаменимые
аминокислоты.
Характеристику белков пищи по содержанию в них отдельных амино-
кислот (набору аминокислот) нельзя считать достаточной. Важно учитывать
и количественное содержание в них незаменимых аминокислот. Допустим,
что в 100 г белков пищи имеются все незаменимые аминокислоты в достаточ-
ном количестве за исключением лизина, которого в два раза меньше, чем
требуется. Для того чтобы образовавшаяся смесь незаменимых аминокислот
стала полноценной в количественном отношении, необходимо увеличить
количество белков в пище вдвое (до 200 г). Оценку белкам дают по той
незаменимой аминокислоте, которая содержится в смеси аминокислот
в наименьшем количестве.
ПОТРЕБНОСТЬ ОРГАНИЗМА В БЕЛКАХ
Неприменимость правила изодинамии Рубнера прежде всего сказалась
при замене белка углеводами и жирами. Выключение белков из пищи при-
водит к гибели животного, и замена белков углеводами и жирами не дает
эффекта. Организм не выдерживает длительного белкового голодания, он
теряет белки тканей и неминуемо погибает. Из сказанного, однако, не выте-
кает, что белки пищи не могут частично быть заменены углеводами и жи-
рами. Количество белков, имеющееся в пище, может быть снижено, но до
определенного предела. Ниже этого предела начинается частичное белковое
голодание, при котором тратятся, хотя и медленно, белки тканей. Как при
полном, так и при частичном белковом голодании организм находится в со-
стоянии отрицательного азотистого баланса.
Практически важно выяснить, какое минимальное количество белков,
дающее при своем переваривании полноценную смесь аминокислот, может
удовлетворить потребности организма. Минимальное количество белков
в суточном пищевом рационе, при котором взрослый человек или животное
продолжительное время находится в состоянии азотистого равновесия, носит
497
название белкового минимума. Следовательно, при белковом минимуме удо-
влетворяются минимальные потребности организма в аминокислотах, при
нем нет убыли белков тканей.
Для установления белкового минимума прибегали к различным иссле-
дованиям. Изучалась, например, потеря белков тканей при голодании
животных. О потере белков судили по выделению общего азота с мочой. Ока-
залось, что в первые дни голодания выделение общего азота с мочой сохра-
няется еще на высоком уровне, затем снижается к сохраняется на снижен-
ном уровне в течение дальнейших нескольких дней. В течение этого времени
энергетические затраты покрываются преимущественно за счет распада
углеводов и, главным образом, жиров. Наконец, наступает последний период
голодания, который характеризуется предсмертным увеличением выделения
общего азота с мочой. В этот период запасы углеводов и жиров в организме
уже истощены, и энергетические потребности организма покрываются в
значительной мере за счет распада белков тканей.
Изучение выделения общего азота с мочой при голодании дает представ-
ление о трате белков тканей в различные периоды голодания, но оно не мо-
жет выяснить, какое количество белков тканей подвергается распаду при
нормальном питании организма. Несомненно, что по мере голодания энер-
гетические затраты организма все больше начинают покрываться за счет
распада белков тканей. Следовательно, при голодании распад белков тканей
оказывается повышенным.
В значительно большей мере дают представление об объеме распада бел-
ков тканей опыты с белковым, а не полным голоданием. В этих опытах энер-
гетические затраты организма покрываются главным образом за счет до-
ставляемых с пищей углеводов и жиров. По количеству выделяемого с мочой
общего азота можно получить приближенное представление об интенсивно-
сти распада белков тканей (приближенное по той причине, что нет уверен-
ности в том, что при белковом голодании распад белков тканей происходит
с такой же интенсивностью, как и при нормальном питании).
При белковом голодании распад белков тканей не компенсируется их
синтезом. Ткани, состоящие главным образом из белков, при белковом го-
лодании изнашиваются. О степени изнашивания тканей (коэффициенте изна-
шивания тканей) судят по выделению общего азота с мочой. Рядом исследо-
ваний было показано, что коэффициент изнашивания тканей организма взрос-
лого человека в среднем составляет за сутки 0,25 г белка на 1 кг веса тела.
Для взрослого человека весом в 70 кг коэффициент изнашивания тканей
выразится следующей цифрой: 0,25x70=-17,5; 17,5 г белков ежесуточно
тратит организм за счет изнашивания тканей. Вполне понятно, что в орга-
низм должно вводиться ежесуточно такое количество белков с пищей, которое
компенсировало бы своими аминокислотами распавшиеся в тканях белки.
Какое же это должно быть количество? На первый взгляд, казалось бы,
что оно должно равняться 17,5 г. Однако такое заключение неправильно
по следующим соображениям. Белки пищи усваиваются не полностью,
а в среднем на 92%. Следовательно, некоторая часть их (8%) не перевари-
вается и выделяется с калом. Оказалось, что перевариваемость различных
белков в пищеварительном тракте неодинакова. Перевариваемость белков
животного происхождения равна 97%, белков злаков—85%, белков бо-
бовых —78%, овощей и плодов —83—85%. В зависимости от преобладания
в пищевом рационе белков животного или растительного происхождения
процент усвоения их организмом то более, то менее высокий.
Приходится также учитывать, что некоторое, хотя и небольшое, коли-
чество аминокислот расщепляется в кишечнике человека микроорганиз-
мами. Все это указывает на то, что 17,5 г белка в суточном пищевом рационе
не может быть достаточным для того, чтобы возместить потерю белков при
изнашивании тканей.
Еще большее значение для удовлетворения потребности человека и
животных в белках имеет различная биологическая ценность белков пище-
498
вого продукта, которая определяется, как известно, наличием в их составе
незаменимых аминокислот и количественным их содержанием. Смеси из
аминокислот, образующиеся при переваривании белков пищевых продуктов,
могут в различной степени соответствовать аминокислотному составу бел-
ков тканей. Чем больше данная смесь аминокислот соответствует аминокис-
лотному составу белков тканей, тем лучше она используется в организме
для синтеза белков и тем выше ее физиологическая ценность.
Для приблизительного определения степени биологической ценности отдельных
пищевых продуктов прибегают к двум методам: биологическому и химическому. Био-
логический метод заключается в следующем. Животное, обычно крысу, в течение не-
скольких дней (до одной недели) кормят безбелковой пищей. За этот срок животное,
естественно, тратит известное количество белков тканей. Затем к корму животного
прибавляют испытуемый пищевой продукт. Чем полноценнее смесь аминокислот бел-
ков испытуемого продукта, тем быстрее восстанавливается потерянное при безбелко-
вом питании количество белков тканей. По количеству задержанного в организме бел-
кового азота (по состоянию положительного азотистого баланса) можно судить о сте-
пени биологической ценности испытуемого белка.
Химический метод определения ценности белков пищевого продукта сводится к
выяснению количественного содержания отдельных аминокислот в том или ином бел-
ке. Этот метод получил особое применение в последние годы в связи с использованием
хроматографического, а также микробиологического методов количественного опре-
деления аминокислот. По количественному содержанию отдельных незаменимых ами-
нокислот в белках данного пищевого продукта судят о его биологической ценности.
Следует отметить, что результаты биологического и химического метода исследо-
вания биологической ценности белков пищевых продуктов, или отдельных белков,
дают не всегда одинаковые результаты. Объясняется это тем, что интенсивность перева-
ривания различных белков, имеющих одинаковый аминокислотный состав, в кишеч-
нике не всегда одинакова. Для действия протеолитических ферментов важна после-
довательность соединения (чередования) отдельных аминокислот друг с другом, а также
и другие особенности структуры белковых молекул. Следовательно, интенсивность
переваривания белков в пищеварительном тракте зависит от их химической структуры,
а от этого, в свою очередь, зависит интенсивность доставки аминокислот к тканям, в
которых происходит синтез белков. В случае замедления доставки той или иной неза-
менимой аминокислоты, условия для синтеза белков ухудшаются, и распад белков
происходит в большем объеме, и в связи с этим биологическая ценность данного белка
низка.
Одновременное использование биологического и химического методов должно
дать более надежные результаты изучения биологической ценности белков пищевых
продуктов, а также отдельных белков.
В настоящее время изучена биологическая ценность белков, особенно
часто употребляемых человеком. В виде примера ниже приводятся некото-
рые результаты изучения потребности взрослых людей в различных пище-
вых продуктах для поддержания состояния азотистого равновесия. При
достаточной в калорийном отношении пище организм взрослого человека
находится в состоянии азотистого равновесия при потреблении белков (г):
Молоко.................. 24,5
Яйца.................... 19,9
Говядина........ 19,2—26,3
Пшеничная мука 38,4—42,0
Картофель............... 29,6
Легко заметить, что все приведенные цифры выше величины, характери-
зующей коэффициент изнашивания тканей взрослого человека (17,5). Од-
нако это еще не определяет минимального количества белков в пище, обе-
спечивающего состояние азотистого равновесия взрослого человека, так как
практически белки доставляются не одним каким-либо пищевым продуктом,
а смесью различных продуктов. Следует также считаться с тем, что потреб-
ность в белках неодинакова у людей различного возраста и различных про-
фессий. Известно, например, что коэффициент изнашивания тканей у лю-
дей, занимающихся физическим трудом, более высок, чем у людей, ведущих
малоподвижный образ жизни. У первых более интенсивно происходит рас-
пад и синтез белков тканей, и они нуждаются в большей доставке белков с
пищей. Все это свидетельствует о том, что белковый минимум не может быть
499
одним и тем же во всех случаях, а колеблется в известных пределах. При-
нято, что 40—50 г белков — минимальное количество, которое обеспечивает
азотистое равновесие организма взрослого человека в случае, если в этом
количестве содержатся в должном объеме все незаменимые аминокислоты.
Было бы, однако, с физиологической точки зрения, неправильным рекомен-
довать пользоваться минимальным количеством белков в пище. В этом
случае всякие возможные сдвиги физиологического состояния организма
(повышение температуры при простудах и иных заболеваниях, лихорадоч-
ное состояние и т. д.), при которых потребность в белках повышена, могут
нарушить азотистое равновесие, вызвать белковое голодание. С физиологи-
ческой точки зрения, неоправдано также и слишком большое потребление
белков. Как известно, белки обладают высоким специфико-динамическим
действием. Благодаря этому большие количества белков в пище могут вы-
звать нежелательный эффект увеличенного напряжения процессов обмена
веществ в органах. Усиленное белковое питание приводит к увеличенному
образованию мочевины и иных азотистых веществ, выделяющихся почками,
следовательно, — к перегрузке выделительной функции почек.
Исходя из изложенного, весьма важной задачей является установление
количества белков в пище, которое оптимально удовлетворило бы потреб-
ность человека в белках, т. е. белкового оптимума. Установление белкового
оптимума не менее сложная задача, чем установление белкового минимума.
Он также не может быть одинаковым для всех людей при всех физиологиче-
ских состояниях. Имеющиеся данные позволяют полагать, что взрослый че-
ловек ежесуточно должен получать с пищей 1,1—1,2 г белка на 1 кг веса
тела, т. е. 77—84 г белков при весе в 70 кг. Это количество белков не опти-
мум, больше того, оно становится недостаточным для женщин в период
беременности и лактации. В этом случае оно должно быть увеличено до
1,5—2 а на 1 кг веса; оно явно недостаточно, кроме того, для растущего орга-
низма, для детей. Растущий организм требует наличия дополнительного ко-
личества белков в пище для обеспечения нормального роста тканей. В за-
висимости от различных фаз интенсивности роста потребность в белках
ребенка определяется в 2—3,5 г на 1 кг веса тела.
Проблема белкового питания имеет также важное значение в зоотехни-
ческой практике при кормлении сельскохозяйственных животных. Недо-
статок белков в кормах снижает продуктивность сельскохозяйственных жи-
вотных.
Многочисленными исследованиями (С. М. Капланского и др.) установ-
лено, что при малом содержании белков в пище (малобелковая пища) сни-
жается активность ряда ферментов, катализирующих превращение пита-
тельных веществ в тканях организма.
ЭНЕРГЕТИЧЕСКАЯ ЦЕННОСТЬ ПИЩЕВЫХ ПРОДУКТОВ
Энергетическая ценность пищевого продукта определяется содержанием
в нем углеводов, жиров и белков. При расчетах обычно исходят из 100 г
съедобного продукта. Калорийная ценность мясных продуктов (свинины,
баранины, говядины, ветчины, колбасных изделий, птицы) зависит от со-
держания в них белков и жиров. Количество углеводов в них настолько
невелико, что оно может не учитываться. Калорийность жирных мясных про-
дуктов в значительной мере зависит от процентного содержания в них жи-
ров. Это становится понятным, если учесть, что калорийность жира в 2,3
раза выше калорийности углеводов и белков.
Изложенное в равной мере относится к рыбе и рыбным продуктам.
Калорийность молочных продуктов (молоко, кефир, простокваша)
зависит от содержания в них углеводов, жиров и белков. Калорийность
снятого молока зависит в основном от содержания в нем белков и углеводов.
В творог и различные сорта сыров почти не входят углеводы и их кало-
500
рийность обусловливается содержанием в них жиров и белков. Кало-
рийная ценность яиц (цельных) зависит от содержания в них жиров и жиро-
подобных веществ (фосфатидов), а также белков. Калорийность яичного
белка зависит от содержания только белков, так как в нем жиры и углеводы
практически отсутствуют. В яичном желтке много жиров и жироподобных
веществ и известное количество белков. Его калорийность зависит главным
образом от содержания жиров и жироподобных веществ.
Хлеб, мучные и зерновые продукты (крупы) богаты углеводами, коли-
чество жиров в них колеблется в пределах 0,5—1,5%, белков 4—11%
(в овсянке 16%), и их калорийная ценность определяется преимущественно
содержанием углеводов. То же самое относится к овощам (картофель, ка-
пуста, лук, морковь и т. д.).
Бобовые (горох, фасоль) богаты углеводами и белками, и калорийная
ценность их зависит от содержания в них указанных веществ.
В нижеследующей таблице приведены данные о зависимости калорий-
ности пищевых продуктов от содержания в них белков, жиров и углеводов
(калорийность вычислена на 100 г съедобного пищевого продукта). Содержа-
ние белков, жиров и углеводов приведено в процентах.
Продукты Кило- калории Белки Жиры Угле- воды
Мясо и мясные продукты Говядина тощая Баранина тощая Баранина жирная Свинина жирная Телятина Язык Колбаса 156 191 303 337 143 158 250 21,3 19,8 25,0 16,6 20,7 18,9 19,6 7,9 12,4 22,6 30,1 6,7 9,2 18,6 .“1 1 1 1 1 1 I
Рыба и рыбные продукты
Камбала 121 18,6 5,2
Лососина 203 22,0 12,8 —-
Осетрина 90 18,1 1,9 —
Треска 79 18,7 0,5 —*
Молоко и молочные продукты
Молоко цельное . . 69 3,3 4,0 5,0
» », сухое 512 26,9 28,7 36,5
Сливки жидкие 198 2,8 18,5 4,5
Сыр — творог 102 23,2 1,0
Сыр швейцарский .. 392 29,2 30,6 • “
Хлеб, мучные и зерновые продукты
Хлеб пшеничный из муки грубого помола .... 245 9,7 0,9 49,7
Хлеб пшеничный белый 261 9,2 1,3 53,1
Хлеб ржаной 254 9,0 0,6 53,2
Кукуруза свежая 108 3,7 1,2 20,5
» сухая 357 9,2 1,9 75,4
Овсянка 400 16,1 7,2 67,5
Крупа ячменная 355 8,5 1,1 77,8
Бобовые
Бобы сухие 345 22,5 1,8 59,6
Горох сухой 355 24,6 1,0 62,0
Овощи
Картофель 85 2,0 0,1 19,1
Капуста 29 1,4 0,2 5,3
Морковь . . . . • 45 1,2 0,3 9,3
Томаты 23 1,0 0,3 4,0
Огурцы 14 0,7 0,1 2,7
501
ОБЩАЯ ОЦЕНКА ПИЩЕВЫХ ПРОДУКТОВ. ПРОДУКТЫ
«КИСЛЫЕ» И «ЩЕЛОЧНЫЕ»
Ценность пищевых продуктов определяется не только содержанием
в них белков, углеводов и жиров. В пищевых продуктах содержатся еще
и другие органические вещества, а также минеральные вещества — соли.
Организмы человека и животных не могут обойтись без поступления извне
витаминов и минеральных веществ. При составлении пищевых рационов
очень важно учитывать наличие в пищевых продуктах этих веществ. Роли
витаминов в питании посвящена глава 6 (стр. 104), значению минеральных
веществ — глава 9 (стр. 216).
С пищей доставляются элементы, образующие кислоты и щелочи.
Этим определяется потенциальная кислотность или щелочность пищи.
Кислотообразующие элементы вводятся в организм с белками. К ним
относятся сера белков, подвергающаяся окислению с образованием серной
кислоты, фосфор, обычно встречающийся в составе белков в виде фосфорной
кислоты. Щелочеобразующие элементы имеются в составе пищевых продук-
тов в виде различных катионов. С поваренной солью (хлористый натрий)
доставляется в организм натрий (щелочь) и хлор (кислота), и она поэтому
не влияет ни на кислотность, ни на щелочность организма.
Продукты с преобладанием кислотообразующих элементов
Приблизительная потенциальная кис-
лотность (в мл нормальной кислоты)
Пища (съедобная часть)
на 100 г
на 100
килокалорий
Мясо (тощее) 12
Яйца 11
Овсянка 12
Рис 9
Пшеница цельная 12
Пшеничная мука 9
Хлеб (белый) 8
Продукты с преобладанием
10
7
3
2
3
2
2
щелочеобразующих элементов
Пища (съедобная часть) Приблизительная потенциальная щелочность (в мл нормальной щелочи)
на 100 г на 100 ки- локалорий
Яблоки 3 6
Дыня 7 18
Морковь 14 30
Апельсиновый сок . . 5 10
Г руши 4 5
Картофель 9 10
Помидоры 5 24
Арбуз 4 12
Содержание образующих кислоту и образующих щелочь элементов
в пищевых продуктах устанавливают по анализу золы, получаемой из них
при сжигании. В случае преобладания элементов, образующих кислоту,
над элементами, образующими щелочь, продукты относятся к числу «кис-
лых», в противном случае — к числу «щелочных». К кислым продуктам
относятся мясо, хлеб, мучные продукты и др. К щелочным —фрукты, ово-
502
щи, молоко. Продукты, кислые на вкус (цитрусовые, яблоки), относятся'
к числу «щелочных», а не «кислых». Объясняется это тем, что органические
кислоты, обусловливающие кислый вкус, в организме окисляются и поэтому
не создают кислой реакции.
В зависимости от подбора пищевых продуктов, пищевой рацион может
оказаться «кислым» или же «щелочным». В определенных случаях, когда
в организме намечаются сдвиги кислотно-щелочного равновесия в кислую
сторону, рекомендуют увеличивать в пищевом рационе овощи и фрукты,
относящиеся к числу «щелочных» продуктов.
ФОСФОР И КАЛЬЦИЙ В ПИЩЕВЫХ ПРОДУКТАХ
Фосфор, составляющий 0,11% массы земной коры, неравномерно рас-
пределен в природе. Естественные отложения фосфора — фосфориты —
устойчивы к выветриванию и очень медленно обогащают почву фосфатами.
Фосфор относится к элементам, которыми бедна почва, и внесение фосфат-
ного удобрения в почву увеличивает урожай. На почве с низким содержанием
фосфатов произрастают растения с пониженным содержанием фосфор-
ных соединений. У животных, питающихся растительным кормом с низким
содержанием фосфорных соединений, снижается содержание этих соедине-
ний в тканях.
Кальций — элемент, обмен которого в организме тесно связан с фос-
фором. В растениях кальций находится главным образом в листьях, фос-
фор же — в семенах и плодах. Пища, бедная зеленью и богатая зерновыми
продуктами (хлеб, крупы и Др.), приводит к недостатку кальция в орга-
низме.
Наличие должных количеств фосфора и кальция в пищевом рационе
особенно важно для растущего организма. Содержание фосфора в пищевых
продуктах оказывается достаточно большим, и обеспечение нужд в нем ор-
ганизма человека не составляет трудности. Иначе обстоит дело с кальцием.
Его в пищевых продуктах сравнительно мало, и вопрос обеспечения потреб-
ности в нем растущего организма и женщин в период беременности и лакта-
ции требует особого внимания.
Для разрешения вопроса, какие количества фосфора и кальция в пи-
щевых рационах могут обеспечить потребность в них человека, проводились
исследования по изучению балансов этих веществ, т. е. изучались количе-
ства фосфора и кальция, поступающие в организм с пищей и выделение
этих веществ из организма с мочой и с калом (кальций и фосфор выделяются
почками и стенкой толстых кишок). При этом учитывалось, что баланс
фосфора и кальция должен быть положительным у растущих организмов
и у женщин в период беременности и кормления.
Эти исследования позволили установить нормы потребления фосфора
и кальция. Вместе с этим было установлено, что во время роста и развития
потребность в кальции значительно выше потребности в других веществах,
необходимых для роста тканей организма. Особенно это характерно для
периода быстрого роста и развития. В детском возрасте и в переходный пе-
риод пища должна быть богата кальцием.
Считают, что у детей задерживается в организме 20% кальция, полу-
чаемого с пищей. Содержание кальция и фосфора в молоке настолько хоро-
шо сбалансировано, что оно удовлетворяет потребности в нем организма
ребенка и новорожденных млекопитающих в первый период их развития.
Суточная потребность в кальции и фосфоре
1-й год 2-й год 3-й год 4-й год 5-9 лет 10—15 лет
Са—0,220 0,235 0,286 0,246 0,230 0,190
Р — до 8 лет 1 а; от 9 до 12 лет 1,3 а
503
Для взрослых мужчин оптимальное количество кальция в суточном
пищевом рационе составляет 0,8—1 г, фосфора —0,5 г. Для женщин в за-
висимости от их физиологического состояния кальция—1—1,3 г, фосфо-
ра —1,2—1,5 г.
Содержание кальция и фосфора в некоторых пищевых продуктах сле-
дующее:
Продукты Кальций, % Фосфор, %
Продукты животного происхождения
Мясо....................................
Яйца ...................................
Молоко..................................
Сыр ....................................
Зерновые продукты
Белая мука.......................................
Белый хлеб (дрожжи богаты Са)....................
Овсянка .........................................
Овощи и фрукты
Картофель ...............
Цветная капуста (головки)
Яблоки ..................
Апельсины ...............
0,013
0,054
0,111
0,930
0,204
0,224
0,093
0,701
0,015 0,1
0,05 0,1
0,065 0,387
0,011 0,053
0,089 0,111
0,007 0,012
0,024 0,018
При составлении пищевого рациона необходимо учитывать содержание
кальция и фосфора в пищевых продуктах.
ЛИТЕРАТУРА
М о р е й н и с И. Я. Гигиена питания, Изд. 3-е, Медгиз, 1952.
П а л л а д и н А. В. Основы питания. М., 1927.
Покровский А. А. Беседы о питании. Журн. «Экономика», М., 1965.
Шерман Г. и Шерма н-Л е н ф о р д К. Основы питания. Пищепромиз-
дат, 1949.
Раздел третий
БИОХИМИЯ
СПЕЦИАЛИЗИРОВАННЫХ
ОРГАНОВ И ТКАНЕЙ
Глава двадцать вторая
БИОХИМИЯ ПЕЧЕНИ
Обмен веществ в различных органах координируется центральной нерв-
ной системой и представляет собой биологическую систему, с помощью ко-
торой осуществляется единство организма с окружающей средой. Различные
органы приспособлены в организме к выполнению характерных для них
функций, и естественно поэтому ожидать, что каждый из них обладает спе-
цифическими особенностями химического состава и биохимических превра-
щений веществ.
Печень — один из важнейших органов, играющих активную роль
в процессах обмена веществ. Продукты переваривания пищи, а также ве-
щества, возникающие в результате жизнедеятельности микрофлоры кишеч-
ника, всасываются в кровь и по системе воротной вены (vena porta hepatica)
доставляются в печень. В печени питательные вещества подвергаются
различным превращениям. В печени происходит синтез сложных органиче-
ских веществ: белков, гликогена, фосфатидов и других соединений. В ней
же сложные органические молекулы (гликоген, жирные кислоты) подвер-
гаются распаду с образованием сравнительно несложных по своей структу-
ре веществ, которые поступают в кровь и кровью доставляются к различ-
ным тканям и органам, где и используются.
В печени происходят различные процессы синтеза, приводящие к обез-
вреживанию ядовитых веществ, образующихся в результате воздействия
микроорганизмов кишечника на аминокислоты. В ней этим путем обезвре-
живаются также ядовитые вещества, попадающие в организм извне, а также
многие лекарственные вещества.
В печени вырабатывается важная в физиологическом отношении жид-
кость — желчь.
Представление об участии печени в процессах обмена веществ можно получить
при исследовании химического состава притекающей к ней и оттекающей от нее кро-
ви. В ворота печени входят крупные кровеносные сосуды — печеночная артерия и
воротная вена. Эти сосуды образуют обширную капиллярную сеть. По системе ворот-
ной вены оттекает кровь от органов брюшной полости и, что особенно важно, от кишеч-
ника. Следовательно, вещества, всасывающиеся кишечником, поступают через ворот-
ную вену в печень, а затем уже непосредственно, или же после определенной перера-
ботки, переходят в венозную кровь печени и распределяются по организму. Через
систему воротной вены проходит около 80% всей крови, поступающей в печень; у
человека это 100 л крови в час. Эта масса крови проходит через систему капилляров^
равную примерно 400 jw2.
ХИМИЧЕСКИЙ СОСТАВ ПЕЧЕНИ
Вес печени составляет 2—3% от веса организма (1,2—2 кг у взрослого
человека). 70% от веса приходится на воду и 30% на сухой остаток. Коли-
чество воды в печени не постоянно; оно изменяется в зависимости от состоя-
ния организма. При заболеваниях печени (острая атрофия, застойные яв-
507
ления) количество воды в печени увеличивается и достигает 80—82%.
При ожирении печени содержание воды в ней резко падает, составляя в
острых случаях 55—60%.
Благодаря участию печени в водном обмене содержание воды в ней ко-
леблется в известных пределах (68—72%). У зимнеспящих животных в пе-
риод спячки содержание воды в печени увеличивается (75%—у спящих,
70% — у бодрствующих сусликов). Интересно при этом отметить, что у
спящих сусликов содержание воды в мышцах уменьшено (72%) по срав-
нению с бодрствующими (76%). Так как животные во время спячки не
принимают пищи, можно полагать, что вода в период спячки перемещается
в определенной мере из мышц в печень.
Сухой остаток печени примерно наполовину состоит из белковых ве-
ществ. Эти белки в небольшой своей части (на 10%) извлекаются водой
(альбумины), а в основной массе они в воде нерастворимы. Нерастворимая
часть белков состоит главным образом из глобулинов, в меньшей степени
из нуклеопротеидов, а также из коллагена (соединительнотканных белков).
Особый интерес представляет наличие в печени железосодержащего белка —
ферритина.
В организме взрослого человека содержится около 4 г железа. Из этого
количества немного больше половины находится в эритроцитах (гемогло-
бин), 10% — в миоглобине, незначительная часть в железосодержащих фер-
ментах и в цитохромах, и остальное количество (около 35%) представляет
собой так называемое запасное железо. До 70% запасного железа в орга-
низме представлено железом, входящим в состав ферритина. Ферритин
состоит из белка (апоферритин) и из окиси железа, приблизительно следую-
щего состава [Fe(OOH)8-(FeO-PO3H2)]. Содержание железа в ферри-
тине непостоянно (максимум 23%). Ферритин получен в кристалличес-
ком виде. В таком виде получен и апоферритин с молекулярным ве-
сом 465 000.
Ферритин, содержащийся в печени, а также в селезенке, играет важную
роль в обмене железа, в использовании его для синтеза гема, составной части
гемоглобина. Использование железа пищи для синтеза гемоглобина проис-
ходит следующим путем. Трехвалентное железо (Fe3+) пищи в кишечнике
восстанавливается в двухвалентное (Fe2+). В слизистой оболочке кишечника
оно окисляется, а затем в виде Fe3+ включается в ферритин.
Fe34 сыворотки крови«±Ре2+ч^ферритин—Fe3+ (печень, селезенка)
--------костный мозг
Fe2+ гема-----> гемоглобин
+ глобин
Среди белков печени имеются многочисленные ферменты. Одни из них
характерны для всех органов, другие — сцецифичны для печени и катали-
зируют процессы, специфичные для нее. К последним относятся ферменты,
катализирующие синтез мочевины, метилирование гуанидинуксусной кис-
лоты, окисление высокомолекулярных жирных кислот, дефосфорилирова-
ние глюкозо-6-фосфорной кислоты и ряд других ферментов.
Печень богата липидами (жирами, фосфатидами и стер идами). Содержа-
ние нейтральных жиров в печени достигает 1,5—2%. Количество их значи-
тельно возрастает при ожирении печени. Содержание фосфатидов в печени
колеблется в пределах 1,5—3%; холестерина—0,3—0,5%. При ожирении
508
печени процент фосфатидов и холестерина в ней остается без существенных
изменений.
Печень богата гликогеном. В зависимости от состояния упитанности
организма, содержание гликогена в печени колеблется в значительных пре-
делах (2—10%). В печени взрослого человека количество гликогена может
достигнуть 150—200 г. Гликоген в клетках паренхимы печени откладывается
в виде глыбок как запасное вещество. Мобилизация гликогена, распад его
в печени с образованием глюкозы происходит чрезвычайно быстро под
влиянием нервных факторов. Быстрый распад гликогена сопровождается
гипергликемией без накопления глюкозы в печени.
В печени содержится много каротина (провитамина А) и витами-
нов группы А. В ней также содержатся витамин D3 и некоторые другие
витамины. Способность организма обходиться некоторое время без поступ-
ления жирорастворимых витаминов с пищей объясняется наличием за-
паса их в печени.
В печени содержатся различные минеральные вещества, причем про-
цент в ней железа (в составе ферритина) выше, чем в иных органах. В
печени содержится также больше, чем в других тканях, меди (микро-
элемент).
ГЛИКОГЕННАЯ ФУНКЦИЯ ПЕЧЕНИ. РОЛЬ ПЕЧЕНИ
В ОБМЕНЕ УГЛЕВОДОВ
Наличие в печени фосфатазы глюкозофосфорной кислоты — важный
момент в осуществлении ее гликогенной функции. Благодаря действию
этого фермента в печени происходит распад гексозофосфорной кислоты,
возникающей при фосфоролизе гликогена с освобождением глюкозы,
поступающей из печени в кровь.
В основе гликогенной функции печени лежит способность печени
синтезировать из глюкозы гликоген и расщеплять его с образованием
глюкозы. Эта функция регулируется центральной нервной системой,
гормонами, особенно адреналином, инсулином, глюкагоном; она играет
важную роль в снабжении тканей глюкозой, в поддержании в опреде-
ленных рамках концентрации глюкозы в крови.
Глюкогенная функция печени обеспечивается действием ряда фер-
ментов. Прежде всего глюкоза, доставляемая кровью в печень, подверга-
ется фосфорилированию с образованием глюкозо-6-фосфорной кислоты (дей-
ствие фосфоферазы-глюкозокиназы, катализирующей реакцию перенесения
на глюкозу фосфатного остатка от аденозинтрифосфорной кислоты). Глюко-
зо-6-фосфорная кислота затем при участии фермента фосфоглюкомутазы пре-
вращается в глюкозо-1-фосфорную кислоту, т. е. в материал для синтеза
гликогена.
Глюкозо-1-фосфорная кислота, однако, не превращается непосредствен-
но в гликоген. Она взаимодействует с уридинтрифосфор ной кислотой с об-
разованием уридиндифосфоглюкозы и Н4Р2О7. Для синтеза гликогена ис-
пользуется глюкозный остаток уридиндифосфоглюкозы; реакция катали-
зируется трансглюкоз ил азой (стр. 286). Важное значение для нее имеет ин-
сулин.
Распад гликогена в печени происходит, главным образом, благодаря
действию фосфорилазы. Амилолитический путь расщепления гликогена
ограничен.
Важное значение для фосфоролиза гликогена имеет адреналин. Уста-
новлено, что под влиянием адреналина в печени (и в других тканях) проис-
ходит образование из аденозинтрифосфорной кислоты циклической 3,5-
адениловой кислоты, усиливающей активность фосфорилазы.
509
Циклическая 3,5-адениловая кислота
Фосфоролиз гликогена приводит к образованию глюкозо-1-фосфорной
кислоты, которая превращается в глюкозо-6-фосфорную кислоту. Обе эти
кислоты под влиянием специфической фосфатазы, имеющейся только в пе-
чени, подвергаются гидролизу с образованием глюкозы и Н3РО4.
Основная масса глюкозы, всасывающейся кишечником в кровь, про-
ходя через печень, превращается в гликоген. Этим создается в печени
запас гликогена, который по мере надобности распадается с образованием
глюкозы. Последняя затем кровью транспортируется к местам ее потреб-
ления (к мышцам, головному мозгу, сердцу и т. д.).
Участие печени в углеводном обмене заключается, однако, не только
в том, что она превращает в гликоген глюкозу, доставляемую к ней кровью
портальной вены. Источниками образования гликогена в печени могут быть
и другие моносахариды — фруктоза, манноза, галактоза, а также проме-
жуточные продукты распада углеводов и ряда аминокислот. Вещества,
из которых возникает в печени гликоген, получили название гликогено-
обр азовате лей. Все они, прежде чем превратиться в гликоген, должны прой-
ти стадию образования глюкозы.
Одним из важных гликогенообразователей является молочная кислота»
конечный продукт анаэробного распада углеводов. Образующаяся в боль-
шом количестве при интенсивной работе мышц молочная кислота в значи-
тельной мере поступает из мышц в кровь, кровью доставляется к различ-
ным органам, причем в печени она превращается в гликоген. В результате
синтеза гликогена устраняется молочная кислота.
Превращение гликогена в печени можно представить схематически:
Глюкоза 4- АТФ--------> глюкозо-6-фосфорная кислота -j АДФ
другие гликогенообразователи
(фруктоза, молочная кислота
и др.)
глюкоза---> кровь
глюкозо-1-фосфорная кислота гликоген
I
>
Y
углекислый газ и вода
Пунктирной стрелкой в схеме обозначен распад углеводов в печени
с выделением конечных продуктов — углекислого газа и воды. Этим под-
черкивается, что в печени, как и в других тканях, углеводы служат пита-
тельными веществами. Однако количество углеводов, используемых в пе-
чени в качестве источника энергии, по сравнению с количеством глюкозы,
являющейся материалом для гликогенной функции печени, очень невелико.
Можно сказать, что печень благодаря своей гликогенной функции создает
благоприятные условия для потребления углеводов различными органами»
расходуя для своих нужд незначительное количество углеводов.
510
НЕНОРМАЛЬНОЕ ОТЛОЖЕНИЕ ГЛИКОГЕНА В ПЕЧЕНИ
И В ДРУГИХ ОРГАНАХ
У людей известно заболевание (болезнь Гирке), сопровождающееся
большим отложением гликогена в печени и в других органах (мышцах,
мозге, почках). Установлено, что непосредственной причиной этого заболе-
вания является отсутствие в органах фосфорилазы, приводящее к нарушению
соотношения между процессами синтеза и распада гликогена. Синтез глико-
гена происходит в обычном объеме, распад же его ограничен, так как он
может осуществляться только лишь одним амилолитическим путем. При
этом заболевании отсутствует в печени также фосфатаза глюкозо-6-фос-
форной кислоты.
РОЛЬ ПЕЧЕНИ В ОБМЕНЕ ЛИПИДОВ
Печень играет важную роль в обмене жиров. Жиры пищи в печени,
подвергаясь ряду превращений (удлинению или укорочению углеродных
цепей жирных кислот, дегидрированию), образуют жиры, характерные для
данного вида животных. Далее, в печени преимущественно сосредоточен про-
цесс ^-окисления жирных кислот, приводящий к появлению молекул аце-
тил —SKoA и конденсации их в молекулы ацетоуксусной кислоты, посту-
пающей в кровь. Распад жирных кислот начинается в печени и заканчивает-
ся в различных органах, где ацетоуксусная кислота превращается с обра-
зованием углекислого газа и воды. В печени используется только лишь
часть потенциальной энергии высших жирных кислот, другая же часть ос-
вобождается в различных органах при окислительном распаде ацетоуксус-
ной кислоты. Как и в случае превращения углеводов, в печени при превра-
щении жирных кислот образуется продукт (ацетоуксусная кислота), основ-
ная масса которого используется за ее пределами, в различных тканях и
органах.
В печени в значительном объеме происходит синтез фосфатидов. Еще в
конце прошлого столетия учеником Данилевского — Дроздовым было
установлено, что кровь, оттекающая от печени, богаче фосфатидами, чем
кровь, к ней притекающая. Этим было показано, что в печени синтезируются
фосфатиды, которые током крови подводятся к различным тканям и органам.
Использование фосфатидов, синтезирующихся в печени в больших количе-
ствах, происходит у кур при формировании яичного желтка и в молочной
железе млекопитающих в период лактации.
Печень участвует в обмене холестерина. В ней происходит синтез эфи-
ров холестерина, превращения холестерина с образованием холевых кислот,
составных частей 'желчи. Печень играет важную роль в выделении холесте-
рина из организма. Холестерин как составная часть желчи вместе с нею по-
ступает в кишечник.
Печень играет важную роль в обмене жирорастворимых витаминов.
В ней происходит превращение каротина (провитамина) в витамин А с
помощью фермента каротиназы. В печени создаются запасы жирораство-
римых витаминов, особенно витамина А и его предшественника — ка-
ротина.
РОЛЬ ПЕЧЕНИ В АЗОТИСТОМ ОБМЕНЕ
Печени принадлежит важная роль в процессах биосинтеза белков. В
пользу этого говорят также данные, показывающие, что при переваривании
белков пищи содержание аминокислот в печени резко возрастает. Некоторое
количество поступающих в печень аминокислот используется для синтеза
белков.
511
В печени образуется фибриноген и протромбин, играющие важную роль
в процессе свертывания крови. При заболевании печени снижается содержа-
ние белков в плазме крови, особенно фибриногена.
Особо важную роль играет печень в процессах обезвреживания ядови-
тых продуктов азотистого обмена, в первую очередь аммиака. В изучении
роли печени в азотистом обмене значительную роль сыграл метод выключе-
ния печени из общего кровотока, разработанный Экком и Павловым и
заключающийся в создании искусственного соустья (анастомоза) между
воротной и нижней полой венами таким образом, что кровь, оттекающая
от органов брюшной полости, попадает в общий кровоток, минуя
печень.
Исследования И. П. Павлова и М. В. Ненцкого с выключением печени
из общего кровотока, поставленные на собаках, показали, что в печени про-
исходит обезвреживание ядовитых веществ, всасывающихся кишечником
при переваривании белков. У оперированных собак при обильном кормле-
нии мясом обнаруживались признаки отравления, судороги, и при продол-
жении кормления мясом они погибали. При кормлении же собак пищей,
состоящей из углеводов и жиров, признаков отравления не наблюдалось.
При переваривании белков в кровь системы воротной вены поступает
аммиак, отщепляющийся от аминокислот в кишечнике микроорганизмами.
Отравление оперированных собак в этих опытах, в известной мере, про-
исходило вследствие действия аммиака. Применение операции фистулы
Экка — Павлова позволило показать, что в печени происходит устранение
аммиака путем синтеза мочевины. Синтез мочевины был затем также уста-
новлен опытами, проведенными на изолированной печени путем пропуска-
ния через нее питательной жидкости с прибавлением аммиачных солей,
а также аминокислот. Различные ткани организма обладают способностью
обезвреживать аммиак путем синтеза глутамина, образование же конечного
продукта азотистого обмена — мочевины, являющееся финальным этапом
устранения аммиака, происходит в печени.
ОБЕЗВРЕЖИВАЮЩАЯ ФУНКЦИЯ ПЕЧЕНИ
Как уже указывалось, в печени происходит обезвреживание аммиака
путем синтеза мочевины. Аммиак, однако, не является единственным ве-
ществом, обезвреживающимся в печени. В печени обезвреживаются и не-
которые другие, обладающие ядовитым действием вещества, образующиеся
в кишечнике и поступающие с кровью через воротную вену. В печени обез-
вреживаются и вещества с ядовитым действием, вводимые в организм извне
(многие лекарственные вещества).
Обезвреживание ядовитых веществ в печени происходит путем образо-
вания так называемых парных или конъюгированных соединений. Для
целей обезвреживания в печени используются глюкуроновая кислота, сер-
ная кислота, ацетил '—SKoA, метильные группы метионина, глицин, глу-
тамин. В случаях, когда ядовитое вещество неспособно непосредственно
реагировать с серной или же с глюкуроновой кислотой, оно подвергается
в печени некоторым изменениям. Так, например, индол, прежде чем под-
вергнуться обезвреживанию, окисляется с образованием индоксила.
Z
Хлоралгидрат (СС13С ) превращается в СС13СН2ОН (трихлорэтанол),
41
а затем связывается с глюкуроновой кислотой. Использование серной и
глюкуроновой кислот для обезвреживания ядовитых веществ в печени
представляет особый интерес, и на нем остановимся более подробно.
512
При обезвреживании ядовитых веществ с помощью серной кислоты
образуются сложные эфиры. В образовании эфиросерной связи участвует
аденозинтрифосфорная. кислота, фосфорилированная в положении 3 ри-
бозы. Серная кислота, образующаяся при окислении восстановленной
серы, входящей в состав белков, прежде чем вступить в реакцию со
спиртовой группой фенола и крезола или индоксила и скатоксила, пред-
варительно подвергается активированию. Благодаря этому она становится
способной к реакции образования сложных эфиров. Активирование сер-
ной кислоты — процесс ферментативный и сводится к следующей реакции:
Фосфоаденозинтрифосфорна я кислота
Серная кислота
Фосфоаденилат серной кислоты имеет макроэргическую связь и воз-
никает в результате отщепления пирофосфорной кислоты от аденозин-
трифосфорной кислоты.
От фосфоаденилат серной кислоты остаток кислоты переносится на
спиртовую группу фенола, индоксила и близким к ним продуктов — кре-
зола и скатоксила с образованием парных соединений.
При обезвреживании ядовитых веществ глюкуроновой кислоты обра-
зуются парные соединения типа глюкозидов. В этом случае происходит
связывание ядовитых веществ путем установления глюкозидных связей.
В изучении синтеза конъюгированных соединений с использованием
глюкуроновой кислоты оставались невыясненными следующие моменты:
как образуется глюкуроновая кислота в печени и каким образом возни-
кают глюкозидные связи при образовании парных соединений.
Образование глюкуроновой кислоты представляли себе как реакцию
окисления первичной спиртовой группы глюкозы при сохранении незатро-
нутой альдегидной группы. Естественно, возникал вопрос, каким образом
в печени остается при окислении глюкозы незатронутой легко окисляю-
щаяся альдегидная группа глюкозы при окислении более трудно окис-
ляющейся спиртовой группы с образованием карбоксила. С химической
точки зрения окисление глюкозы легче должно завершиться возникнове-
нием глюконовой, чем глюкуроновой кислоты. Объяснение искали в том,
что в печени должны существовать специфические ферменты, катализи-
рующие окисление спиртовой группы с образованием альдегидной груп-
пы, а затем окисление ее до карбоксильной. Однако эти ферменты оста-*
вались невыясненными, а осуществить ферментативный синтез глюку-
роновой кислоты вне организма не удавалось.
17 Заказ № 581
513
Указывали также на то, что, возможно, альдегидная группа глюкозы
не окисляется, так как она чем-то связана. Это предположение нашло свое
подтверждение.
Оставался также открытым вопрос, каким образом возникают глюко-
зидные связи при образовании парных соединений в печени с участием глю-
куроновой кислоты?
В настоящее время путь возникновения глюкуроновой кислоты в пе-
чени из глюкозы и синтеза парных соединений глюкуроновой кислоты в зна-
чительной мере уже выяснен. Оказалось, что при образовании глюкуроно-
вой кислоты окислению подвергается не свободная глюкоза, а глюкозный
остаток, входящий в состав уридиндифосфоглюкозы. Глюкоза предвари-
тельно вступает в реакцию с уридинтрифосфор ной кислотой с образованием
уридиндифосфоглюкозы (стр. 283), а затем уже подвергается окислению.
ОН Н
СООН
zOH н/° С\Н
Уридин—рибоза—О—Р=О О___С '
хо-р=о
хон
ОН Н
Н НО /9 + НАД н?
•i—Ин
Ури дин дифосфоглюконовая кислота
В молекуле уридиндифосфоглюкозы остаток глюкозы связан с остатком
фосфорной кислоты глюкозидфосфатной связью. Следовательно, альдегид-
ная группа глюкозы находится в связанном состоянии. Окисление глюкоз-
514
ного остатка происходит в молекуле уридиндифосфоглюкозы и приводит
к образованию уридиндифосфоглюкуроновой кислоты.
При синтезе парных соединений остаток глюкуроновой кислоты из мо-
лекулы уридиндифосфоглюкуроновой кислоты переносится на спиртовую
группу вещества, подвергающегося обезвреживанию. В этом случае глюко-
зидфосфатная связь переходит в эфирную связь.
Обезвреживание ядовитых веществ в печени возможно также путем
образования пептидных связей. Для обезвреживания некоторых ядовитых
веществ используются глицин (у человека и у млекопитающих), орнитин
(у птиц) и глутамин (у человека). Во всех этих случаях обезвреживанию
подвергаются вещества, имеющие в своем составе карбоксильную группу.
Энергия, необходимая для образования пептидных связей при обезврежи-
вании ядовитых веществ, доставляется макроэргическими связями адено-
зинтрифосфорной кислоты.
Глицин используется в печени человека и млекопитающих для обез-
вреживания бензойной кислоты (при этом образуется гиппуровая кислота)
и в печени млекопитающих для обезвреживания фенилуксусной кислоты
(образуется фенацетуровая кислота), орнитин — у птиц для обезврежива-
ния бензойной кислоты (образуется орнитуровая кислота) и глутамин — у
человека, для обезвреживания фенилуксусной кислоты (образуется фенил
ацетилглутамин).
ВЫДЕЛИТЕЛЬНАЯ ФУНКЦИЯ ПЕЧЕНИ. СОСТАВ ЖЕЛЧИ
В клетках печени образуется желчь, непрерывно поступающая через
систему небольших протоков в общий проток. Из общего протока желчь
попадает в желчный пузырь, где накапливается и сгущается. В период
пищеварения желчь поступает через желчный проток (ductus choleodochus)
в двенадцатиперстную кишку. Желчь, следовательно, — секрет печени.
При емкости желчного пузыря в 30—40 мл у взрослого человека в кишечник
поступает в сутки 500—800 мл желчи.
Желчь — сложная по своему составу жидкость. Поступающая из пе-
чени в желчный пузырь желчь содержит 97,5% воды и 2,5% сухого остатка.
В желчном пузыре она сгущается (содержание воды в ней составляет 86%,
сухого остатка —14%). Изучение химического состава желчи, выделяющей-
ся из печени, и желчи, сгустившейся в желчном пузыре, показало, что через
стенку желчного пузыря всасывается в кровь не только вода, но и неболь-
шое количество минеральных веществ: бикарбоната натрия и хлористого
натрия. Стенка желчного пузыря выделяет муцин и обогащает им желчь.
Наиболее важными составными частями желчи считаются желчные
кислоты, содержание которых обычно равно 0,6—0,7%, желчные пигменты,
холестерин (0,6% в желчи, взятой из пузыря). В желчи также содержатся
нейтральные жиры, жирные кислоты, фосфатиды, муцин, мочевина, моче-
вая кислота и минеральные вещества. Обращает на себя внимание высокое
содержание в желчи кальция и железа. Содержание холестерина, кальция
и железа в желчи выше, чем в плазме крови, из чего можно заключить, что
эти вещества концентрируются при образовании желчи и выделяются из
организма через печень.
Желчь — важная пищеварительная жидкость. Желчные кислоты иг-
рают большую роль в процессах переваривания жиров (стр. 318).
ИЗУЧЕНИЕ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ПЕЧЕНИ
При ряде заболеваний поражается печень, и в этих случаях нарушают-
ся ее обменные функции. Практически бывает важно установить степень из-
менений, наступающих в печени при тех или иных ее поражениях.
Функциональное состояние печени изучается двояким путем — уста-
новлением изменений в содержании в плазме крови веществ, образующихся
17* 515
в печени (фибриногена, протромбина, белков сыворотки крови, желчных
пигментов), и пробами на способность печени удалять введенные в орга-
низм вещества, например глюкозу путем синтеза гликогена, бензойную
кислоту путем образования гиппуровой кислоты и т. д.
Белковообразовательная функция печени устанавливается путем опре-
деления содержания в крови различных белков. По содержанию в плазме
крови фибриногена, протромбина, альбуминов и глобулинов получают
представление о способности печени синтезировать белки плазмы крови.
При поражениях паренхимы печени в плазме крови повышается содер-
жание свободного холестерина и уменьшается содержание эфиров холесте-
рина.
Определение содержания в крови билирубина (желчного пигмента)
позволяет выяснить способность печени выделять желчь (желчеобразова-
тельная функция печени). При затруднении оттока желчи (при закупорке
желчного протока) содержание билирубина в крови повышается.
Углеводная функция печени обычно изучается путем сахарной нагрузки.
В организм вводят натощак 100 г глюкозы, растворенной в воде, и через оп-
ределенные промежутки времени (15—30 мин) определяют содержание
глюкозы в крови. Это позволяет начертить сахарную кривую (на оси абс-
цисс откладывается время взятия проб крови после введения глюкозы,
на оси ординат — содержание глюкозы), которая показывает, насколько
быстро глюкоза в печени превращается в гликоген. При нарушении глико-
генной функции печени сахарная кривая принимает необычный вид.
Часто для выявления участия печени в углеводном обмене в организм
вводят 40 а галактозы в виде раствора. Галактоза в печени превращается
в глюкозу, а затем в гликоген. Часть галактозы, не успевшей превратиться
в глюкозу, выделяется с мочой. При введении здоровому взрослому челове-
ку 40 а галактозы с мочой выделяется 3—4 а галактозы в течение 4—5 ча-
сов; при нарушении функции печени с мочой выделяется большее количе-
ство галактозы.
Способность печени обезвреживать ядовитые вещества (защитная функ-
ция печени) устанавливается пробой на синтез гиппуровой кислоты (проба
Квика). В организм человека вводят бензойную кислоту — слабо ядовитое
соединение, — а затем в течение нескольких часов определяют в отдельных
порциях мочи содержание гиппуровой кислоты. При заболеваниях печени
объем и скорость выделения с мочой гиппуровой кислоты уменьшаются.
В клинической практике обычно для выяснения функционального со-
стояния печени прибегают не к одному, а к нескольким исследованиям. Это
дает более правильные результаты, так как некоторые сдвиги в процессах
обмена веществ в организме могут отразиться только на какой-либо одной
функции печени.
Глава двадцать третья.
ОБМЕН ВЕЩЕСТВ В ПОЧКАХ
Почки — преимущественно секреторный (выделительный) орган. Выде-
ляемая ими из организма жидкость (моча), в отличие от секретов других
органов, сильно варьирует по своему количеству и имеет чрезвычайно раз-
нообразный состав. Благодаря работе почек из крови удаляются конечные
продукты обмена веществ, чем поддерживается постоянство состава плазмы
крови, являющейся внутренней средой тканей организма.
Почки человека весят около 300 г. Каждая почка содержит около миллиона функ-
циональных единиц — нефронов. Около одной трети работы сердца затрачивается на
кровообращение в почках. Кровь поступает в почки через почечные артерии, перехо-
дящие в более мелкие сосуды, которые в свою очередь расчленяются в афферентные
артериолы. Последние входят в боуменову капсулу, и каждая из них делится прибли-
зительно на 50 неанастомозирующих капилляров клубочка, из которых возникает
эфферентная артериола, снабжающая кровью проксимальные и дистальные канальцы
прежде, чем кровь уходит из почки в почечную вену.
Обильное кровообращение в почках непосредственно связано с выде-
лительной функцией, т. е. образованием и выделением мочи. За сутки через
кровеносные сосуды почек человека протекает до 700 л крови. Следует
отметить, что обильное кровоснабжение почек обеспечивает не только их
выделительную функцию, но и интенсивность процессов обмена веществ
в них. Подсчеты показывают, что около 10% всей протекающей через почки
крови используется на снабжение почек питательными веществами и для
удаления из них конечных продуктов обмена веществ, а остальные 90% —
на выделительную функцию почек.
До 10% всего количества кислорода, поглощаемого человеком при ды-
хании, используется почками. Отсюда можно заключить, что в почках ин-
тенсивно происходят процессы окисления питательных веществ. Обмен ве-
ществ в почках непосредственно связан с активной их секреторной деятель-
ностью, образованием мочи. Образование мочи является результатом трех
процессов, происходящих в каждом нефроне: 1) фильтрации через капил-
ляры клубочков, 2) обратного всасывания воды и растворенных веществ
в проксимальных канальцах и 3) секреции в просвет дистальных канальцев.
При образовании мочи почки выполняют большую работу. Концентра-
ция осмотически активных веществ в моче намного превышает концентра-
цию этих веществ в плазме крови. Содержание мочевины, например, в плаз-
ме крови обычно равно 0,03%, в моче же оно достигает 2%. Концентрация
в моче фосфатов, хлористого натрия и ряда иных веществ выше, чем концен-
трация их в плазме крови. Отсюда понятно, что почки выполняют большую
работу против осмотических сил, приводящую к концентрированию ряда
составных частей плазмы крови.
517
БИОХИМИЧЕСКИЕ ПРОЦЕССЫ В ПОЧКАХ
Как уже указывалось, почки потребляют большое количество кисло-
рода, интенсивно дышат. Интенсивное дыхание почек можно наблюдать
в опытах по изучению содержания кислорода и углекислого газа в крови,
притекающей к почкам, и в крови, оттекающей от них. В оттекающей крови
содержание кислорода ниже, а содержание углекислого газа выше, чем в
крови, идущей к почкам. По величине артериовенозной разницы в содержа-
нии кислорода и углекислого газа и по объему протекающей через почки
крови судят об интенсивности дыхания почек.
Срезы почечной ткани интенсивно потребляют кислород и выделяют
углекислый газ, причем срезы из коркового слоя почек дышат более актив-
но, чем срезы из мозгового вещества.
Энергетические затраты почек в значительной мере покрываются за
счет окисления углеводов. Почки содержат ферменты, катализирующие
окислительный распад углеводов и фосфорилирование органических веществ.
Имеются основания предполагать, что аэробное фосфорилирование адено-
зиндифосфорной кислоты с последующим расщеплением аденозинтрифосфор-
ной кислоты играет важную роль в использовании химической энергии для
секреторной функции почек.
В почках наряду с углеводами также интенсивно потребляется ацето-
уксусная кислота. Содержание ацетоуксусной кислоты в крови, притекаю-
щей к почкам, выше, чем в крови оттекающей. Учитывая, что ацетоуксусная
кислота возникает в печени как продукт конденсации ацетил — SKoA,
образующегося при р-окислении жирных кислот, можно заключить, что
в почках при потреблении ими ацетоуксусной кислоты используется в
известной мере потенциальная энергия жиров.
В почках происходит интенсивное превращение азотистых веществ,
о чем можно судить по образованию в них аммиака. Изучение содержания
аммиака в крови, притекающей к почкам и оттекающей от почек (артерио-
венозная разница в содержании аммиака), показало, что из почек поступает
в оттекающую кровь аммиак. Этот давно уже установленный факт казался
странным, так как в почках происходит концентрирование аммиака и выде-
ление его в виде аммиачных солей с мочой. Содержание аммиака в крови,
притекающей к почкам, очень невелико, поэтому, естественно, возник во-
прос об источниках образования в почках аммиака, выделяющегося с мо-
чой, а также поступающего из почек в оттекающую кровь.
Источниками образования аммиака в почках могут быть: адениловая
кислота, аминокислоты и глутамин. В почках содержится дезаминаза,
катализирующая гидролитическое дезаминирование адениловой кислоты.
Однако дезаминирование адениловой кислоты не играет существенной роли
в аммиакообразовании в почках, так как содержание ее, а также аденозин-
трифосфорной кислоты, из которой она образуется, в почках невелико.
С кровью же адениловая кислота, надо полагать, к почкам не доставляется.
Внимание исследователей привлекли аминокислоты, как вещества,
из которых, возможно, образуется в почках аммиак. В крови содержатся
аминокислоты, доставляемые к различным органам, в том числе и к почкам.
В почках содержится оксидаза L-аминокислот, что указывает на возмож-
ность окислительного дезаминирования аминокислот в них. Образование
аммиака из аминокислот в почках не исключено, однако интенсивность это-
го процесса, как показали результаты исследований, недостаточна для
образования относительно больших количеств аммиака, выделяющегося
с мочой в виде аммонийных солей.
Интенсивным источником образования аммиака в почках служит до-
ставляемый с кровью к почкам глутамин. В почках содержится активная
глутаминаза, катализирующая отщепление амидной группы глутамина в
виде аммиака. Изучение артериовенозной разницы глутамина с учетом ин-
тенсивности кровообращения почек показало, что глутамин является ос-
518
новным источником образования аммиака, выделяющегося из организма с мо-
чой. Этот факт представляет особый интерес, так как он показывает, что
в почках не только концентрируются при образовании мочи вещества плаз-
мы крови, но в них также происходит образование вещества (аммиака),
которое выделяется с мочой.
Образование аммиака в почках из глутамина и выделение его в виде
аммиачных солей играет существенную роль в поддержании кислотно-
щелочного равновесия организма. Возникающий в почках аммиак нейтра-
лизует кислоты (серную кислоту и органические кислоты), появляющиеся
в результате процессов обмена веществ. Установлено, что при повышенном
образовании кислот, при ацидозах, дезаминирование глутамина в почках
повышено.
ФИЗИЧЕСКИЕ СВОЙСТВА МОЧИ
И ЕЕ ХИМИЧЕСКИЙ СОСТАВ
Моча — сложная по химическому составу жидкость. Образование мочи в поч-
ках начинается в мальпигиевых клубочках путем фильтрации через стенки капилляров
жидкой безбелковой части плазмы крови. Этот фильтрат носит название первичной
мочи. Первичная моча в норме не содержит белков, так как они не проникают через
стенки капилляров мальпигиевых клубочков и поэтому в боуменовых капсулах их
нет. Только при заболевании почек, когда изменяется проницаемость стенок капилля-
ров и морфологических элементов почек, белки плазмы крови, главным образом аль-
бумины, выделяются с мочой.
Первичная моча из полости боуменовых капсул, передвигаясь по направлению
к собирательным трубкам, отдает в извитых канальцах почек обратно в кровь часть
своих веществ. Обратному всасыванию в кровь подвергается в значительной степени
вода (сгущение первичной мочи), всасываются также и некоторые растворенные в
первичной моче вещества — сахар, аминокислоты, соли и др. Не подвергаются вса-
сыванию в кровь из канальцев почек конечные продукты обмена веществ (мочевина,
креатинин, мочевая кислота и др.), и концентрация их благодаря обратному всасы-
ванию воды возрастает. Из первичной мочи после всасывания воды и ряда растворен-
ных веществ образуется окончательная моча, которая поступает в собирательные труб-
ки, чашки, лоханки, а затем по мочеточникам в мочевой пузырь.
ФИЗИЧЕСКИЕ СВОЙСТВА МОЧИ
Моча представляет собой прозрачную жидкость, окрашенную в желтый
цвет (от соломенно-желтого до оранжевого). При стоянии в моче появляется
муть, оседающая на дно. Легкая муть зависит от попадания в мочу с поверх-
ности слизистых оболочек мочеполовых путей муцина и клеток эпителия.
Более сильная муть, легко оседающая на дно, зависит часто от выпадения
малорастворимых в воде солей мочевой кислоты (уратов). Выпадающий оса-
док адсорбирует на своей поверхности пигменты мочи (уроэритрин), бла-
годаря чему осадок бывает окрашен в розовый цвет. Мочевой осадок может
состоять из щавелевокислого кальция, цистина (в случаях цистинурии,
стр. 399), из третичных фосфатов кальция и магния, выпадающих при под-
щелачивании мочи. В патологических случаях моча бывает мутной от нали-
чия в ней белков, форменных элементов крови (при кровоизлияниях в поч-
ках, мочевом пузыре) и лейкоцитов (при воспалительных процессах).
Практически важно распознавание состава осадков, появляющихся
в моче. Наличие форменных элементов устанавливают микроскопическим
анализом. Этот же анализ позволяет в ряде случаев по форме кристаллов
судить о химическом составе осадков. В случае необходимости осадки ана-
лизируются химическим путем.
Реакция мочи. Реакция свежей мочи человека обычно слабокислая
(pH 5,6—6,2). Концентрация водородных ионов в моче зависит от характера
пищи: преобладания в ней кислых или щелочных элементов (стр. 502).При
преобладании в пище мяса моча становится более кислой, при преоблада-
519
нии овощей и фруктов — слабощелочной. У травоядных животных моча
щелочная, у хищных — кислая.
Концентрация водородных ионов мочи зависит от количества в моче
первичных и вторичных фосфатов (NaH2PO4 и Na2HPO4 или соответствую-
щих К-солей). В случае кислой реакции в моче преобладают первичные фос-
фаты, в случае щелочной — вторичные фосфаты. Щелочная реакция мочи
в известной мере обусловлена наличием в ней карбонатов калия и натрия.
Наряду с активной кислотностью или щелочностью мочи, различают
также потенциальную кислотность или щелочность, которые измеряются
количеством миллилитров децинормальной щелочи или децинормальной
кислоты, нейтрализующих 100 мл мочи. Потенциальная кислотность, или
щелочность, показывает степень забуференности мочи. Активная и потен-
циальная кислотность мочи увеличивается при избыточном образовании
кислот в организме человека, например при сахарном диабете.
При стоянии моча становится щелочной благодаря расщеплению моче-
вины уробактериями. Моча оказывается щелочной при некоторых заболе-
ваниях мочеполовых путей, когда мочевина разлагается в полости мочевого
пузыря на аммиак и углекислый газ под влиянием бактерий.
Цвет мочи. Окраска мочи зависит от содержания в ней пигментов —
урохрома, уробилина и др. Больше всего содержится в моче урохрома
(70—75 мг в суточной моче человека), от наличия которого зависит желтый
цвет мочи. Уробилин образуется в свежей моче из бесцветного вещества —
уробилиногена, возникающего в свою очередь в кишечнике из желчного
пигмента — билирубина — продукта распада гема. Уробилин выделяется
с мочой в небольшом количестве (несколько миллиграммов в сутки) и при-
дает моче оранжевый цвет. В моче в минимальных количествах (доли мил-
лиграмма в суточной моче) содержатся также и другие продукты превраще-
ния гема — копропорфирин и уропорфирин. В состав мочи в очень неболь-
ших количествах входит уроэритрин, придающий моче красноватый оттенок.
Содержание отдельных пигментов в моче изменяется при заболевании
печени. В этом случае моча принимает ненормальную окраску. При повы-
шенном содержании уробилина, моча получает темный, краснобурый цвет.
В моче при заболеваниях печени появляются желчные пигменты. Часто
повышается содержание в ней порфиринов (порфиринурия), в связи с не-
нормальным превращением гема, из которого нормально образуется били-
рубин. Определение пигментов мочи имеет диагностическое значение.
Суточное количество мочи и ее плотность
Из организма взрослого мужчины ежесуточно выделяется в среднем
1,5 л мочи, из организма женщины—1,2 л. Количество выделяемой мочи
варьирует в значительных пределах и зависит прежде всего от питьевого
режима. При ограниченном потреблении воды суточное количество мочи
достигает всего 0,5 л, и наоборот, при обильном потреблении воды коли-
чество мочи резко возрастает и может составить 2—3 л.
Уменьшается выделение мочи при потении. Потовые железы выделяют
на поверхность кожи жидкость (пот), состоящую на 97—98% из воды.
При потении количество воды, выделяющейся с мочой, уменьшается, и в
ней повышается концентрация растворенных веществ. Уменьшение суточ-
ного количества мочи носит название олигурии, а увеличение — полиурии.
Колебания в мочеотделении (диурезе), зависящие от потребления воды
и пищевых продуктов, богатых водой (овощей, фруктов), и от выделения
пота, имеют физиологический характер. При известных нарушениях диурез
может уменьшаться (олигурия), а иногда практически свестись к нулю
(анурия). Известны, с другой стороны, случаи полиурии, когда объем суточ-
ной мочи достигает 10 и больше литров. Длительная анурия обычно приво-
дит к гибели организма благодаря отравлению его конечными продуктами
обмена веществ. (Моча является ядовитой жидкостью. Введение кролику
520
под кожу 40—50 ли мочи вызывает гибель животного). Анурия возникает
при заболеваниях почек, при токсических нефритах.
Повышенный диурез, полиурия, может явиться следствием расстрой-
ства функции гипофиза (стр. 210). При несахарном диабете (diabetes insipi-
dus) нарушается обмен воды. Больные пьют много воды и выделяют боль-
шие количества мочи (до 15 л за сутки).
Объем выделяемой мочи зависит от количества функционирующих клу-
бочков почек, в которых образуется первичная моча. При нормальных усло-
виях функционируют не все клубочки, а только часть их. Чем большее
количество клубочков вовлечено в выделительную функцию почек, тем
больше выделяется мочи. Деятельность клубочков, выделительная функция
почек регулируется нервной системой, а также гормонами (гипофиза, коры
надпочечников и др.). На диурез влияют психические эмоции, болевые
раздражения. В известных случаях они вызывают анурию.
Количество выделяемой мочи уменьшается при образовании отеков;
в этих случаях в организме задерживается вода. Величина диуреза зависит
также от интенсивности обратного всасывания воды в почечных канальцах.
При замедлении обратного всасывания воды выделение мочи увеличивается,
и моча сильно разбавляется водой.
При увеличенном диурезе моча слабо окрашена и почти бесцветна;
при уменьшенном диурезе моча, наоборот, интенсивно окрашена. В первом
и во втором случае в суточной моче содержится одинаковое количество
пигментов, но разведение их водой оказывается различным.
Плотность мочи находится в прямой зависимости от суточного ее ко-
личества. Чем больше выделяется мочи, тем меньше ее плотность. Обычно
плотность суточной мочи человека колеблется в пределах 1,010—1,025.
Повышение плотности мочи при нормальном ее выделении, а также
при полиурии следует считать патологическим явлением, которое связано
с увеличением выделения каких-либо составных частей мочи, или же с по-
явлением в моче веществ, обычно в ней отсутствующих. Так, например,
при сахарном диабете (diabetes mellitus) количество выделяемой мочи зна-
чительно увеличивается (до 3 и больше литров), а плотность ее достигает
1,035. Объясняется это выделением с мочой большого количества глюкозы,
в норме отсутствующей в моче.
ХИМИЧЕСКИЙ СОСТАВ МОЧИ
В состав мочи входит большое количество разнообразных веществ
(свыше полутораста). Часть из них относится к неорганическим соедине-
ниям, часть — к органическим.
Неорганические составные части мочи
Ежесуточно из организма человека с мочой выделяется 15—25 г мине-
ральных веществ (солей).
Из неорганических солей с мочой в наибольшем количестве выделяется
хлористый натрий. Содержание его в суточной моче составляет 8—12 г
и зависит от количества поваренной соли, добавляемой к пищевому рациону.
Основная масса ионов натрия и хлора, появляющаяся в первичной моче
(клубочковом фильтрате), подвергается обратному всасыванию вместе с во-
дой в проксимальных канальцах. Установлено, что в течение суток в клу-
бочках почек фильтруется около 1 кг хлористого натрия и только около 1 %
его выделяется с мочой.
Хлористый натрий играет важную роль в создании осмотического дав-
ления плазмы крови и тканей, поэтому удаление избыточного количества
хлористого натрия с мочой имеет важное значение в сохранении постоянства
осмотического давления. Понижение температуры замерзания сыворотки
521
крови (депрессия) колеблется в очень узких пределах (—0,56 до —0,58° С)
и обеспечивается содержанием в ней хлористого натрия; понижение темпе-
ратуры замерзания мочи колеблется в широких пределах и достигает—2° С.
Депрессия мочи зависит от растворенных в ней различных веществ, среди
которых важное место занимает хлористый натрий.
Бикарбонаты натрия и кальция выделяются с мочой в очень незначи-
тельных количествах при кислой реакции мочи (pH 6 и ниже). Бикарбонаты
подвергаются обратному всасыванию в почечных канальцах в тех случаях,
когда содержание их в плазме крови ниже 0,25%. Когда содержание их
в плазме крови становится выше указанного, они выделяются с мочой. Сле-
дует, однако, отметить, что при нарушении дыхания выделение бикарбона-
тов может иметь место без повышения содержания их в плазме крови. При
дыхательном алкалозе содержание бикарбонатов в плазме крови понижено,
в то время как с мочой выделяется значительное их количество. Моча при
этом становится щелочной. Наоборот, при дыхательном ацидозе моча не
содержит карбонатов, хотя концентрация их в плазме крови повышена.
С мочой выделяются соли калия. Содержание калия в моче зависит от
пищевого рациона. Растительные продукты богаты калием, в мясных же
продуктах его меньше. В зависимости от преобладания в пище растительных
или мясных продуктов, содержание калия в моче бывает большим или мень-
шим. Ежесуточно с мочой выделяется 1,5—2 г калия, т. е. значительно
меньше, чем натрия. Между выделением калия и натрия из организма суще-
ствует определенная зависимость. Чем больше поступает в организм солей
калия, тем больше выделяется из организма хлористого натрия. Если при
этом не наблюдается недостатка натрия в организме, то это объясняется тем,
что с растительной пищей человек потребляет больше поваренной соли.
Наряду с калием и натрием с мочой выделяются также магний и каль-
ций. Количество каждого из них в суточной моче колеблется в пределах
0,1—0,3 г. В больших количествах магний и кальций выделяются слизистой
оболочкой толстого кишечника, поэтому по выделению их с мочой нельзя
судить о их балансе (т. е. поступлении и выделении).
Аммиак выводится из организма с мочой в виде аммонийных солей
(ионов аммония). Содержание аммонийных солей в суточной моче человека
составляет 0,4—0,6 г в расчете на азот, т. е. составляет 4—6% общего азота
мочи. Выделение аммонийных солей с мочой резко уменьшается при потреб-
лении пищи, в которой щелочные компоненты превалируют над кислыми
(«щелочная пища»). У травоядных животных содержание аммонийных солей
в моче крайне незначительно.
При ацидозах резко возрастает содержание аммонийных солей в моче.
В тяжелых случаях ацидоза с мочой из организма человека за сутки выде-
ляется до 5 а азота аммонийных солей, что составляет до 30% общего азота
мочи. Содержание аммонийных солей в моче находится в обратной зависи-
мости от содержания мочевины: чем выше содержание аммонийных солей,
тем ниже содержание мочевины.
Аммиак в организме используется для нейтрализации кислот, выводи-
мых с мочой.
С мочой выделяются анионы неорганических кислот — соляной, фос-
форной и серной. Больше всего выделяется с мочой хлора. Содержание его
в моче находится в прямой зависимости от содержания натрия.
Наиболее важным анионом мочи является анион фосфорной кислоты.
Соли фосфорной кислоты содержатся в небольшом количестве в плазме
крови. В почечных канальцах соли фосфорной кислоты концентрируются,
и в моче концентрация их в несколько десятков раз выше чем в плазме.
Следует при этом учесть, что фосфаты выделяются не только с мочой, но
и с калом (обычно 70% с мочой и 30% с калом).
Фосфорная кислота в моче содержится в виде первичных и вторичных
натриевых и калиевых солей. От соотношений между первичными и вторич-
ными фосфатами зависит кислотность мочи.
522
Выделение фосфатов с мочой повышается при ацидозах и алкалозах,
при гиперфункции щитовидной железы.
Источником анионов серной кислоты мочи являются белки. При окис-
лении серусодержащих аминокислот — цистина, цистеина и метионина,
образуется серная кислота, которая выделяется в виде солей. Общее коли-
чество сульфатов в суточной моче составляет 2—2,5 г. Наряду с сульфатами
в моче содержатся эфиры серной кислоты — продукты обезвреживания ядо-
витых веществ в организме и продукты неполного окисления серы.
ОРГАНИЧЕСКИЕ СОСТАВНЫЕ ЧАСТИ МОЧИ
В суточной моче человека содержится 35—45 г органических веществ,
главным образом мочевины. Азот мочевины составляет 85—90% общего
азота мочи. Содержание мочевины в моче человека за сутки колеблется в
пределах 25—35 г и зависит от количества белков в пище. При безбелковой
диете содержание мочевины в моче снижается до нескольких граммов. Ко-
личество мочевины в моче снижается при ацидозах, когда аммиак в организ-
ме используется для нейтрализации кислот. Снижено также количество мо-
чевины в моче при заболеваниях печени, когда нарушен синтез моче-
вины.
К числу важных азотистых составных частей мочи относится мочевая
кислота*, содержание мочевой кислоты в суточной моче человека 0,6—
0,7 г. Выделяется мочевая кислота с мочой преимущественно в виде моно-нат-
риевой соли. Количество мочевой кислоты в моче зависит от содержания про-
изводных пурина в пище, однако выделение ее при отсутствии этих веществ
в пищевом рационе не прекращается. Объясняется это тем, что в организме
происходит распад нуклеиновых кислот и других веществ, включающих
производные пурина. Этот распад при беспуриновой пище компенсируется
синтезом в организме производных пурина из других соединений (стр. 455).
Мочевая кислота, выделяющаяся из организма при беспуриновой пи-
ще, носит название эндогенной мочевой кислоты; в суточной моче содержа-
ние ее достигает 0,25—0,30 г.
Количество эндогенной мочевой кислоты в моче человека является в
известной мере показателем интенсивности распада нуклеиновых кислот
и других соединений, содержащих производные пурина. Мочевая кислота,
как известно, в организме человека не подвергается расщеплению и уда-
ляется с мочой. Наряду с мочевой кислотой в моче в небольших количествах
содержатся производные пурина — аденин, гуанин, гипоксантин и
ксантин.
Вместе с чаем, кофе и какао в организм поступают метилированные
пурины — теобромин (3,7-диметилксантин) и кофеин (1,3,7-триметилксан-
тин). Эти продукты в малых количествах появляются в моче. Метилирован-
ные пурины также обнаруживаются в моче при введении их в организм с не-
которыми лекарственными веществами.
Постоянной азотистой составной частью мочи является креатинин.
Количество креатинина в суточной моче находится в определенной связи
с массой мускулатуры и варьирует у разных людей, оставаясь более или
менее постоянным для данного человека. Чем более развита мускулатура,
тем больше креатинина выделяется из организма с мочой. Этот факт указы-
вает, что образование креатинина происходит в мышцах. Креатинин, как
известно, является ангидридом креатина, основная масса которого нахо-
дится в организме в виде креатинфосфорной кислоты. Ежесуточно из орга-
низма человека с мочой выделяется 1,3—1,7 г креатинина, что составляет
3—4% общего азота мочи.
Для оценки выделения креатинина с мочой часто пользуются так назы-
ваемым креатининовым коэффициентом, т. е. отношением миллиграммов
креатинина в суточной моче к килограмму веса тела. Чем более развита
523
мускулатура, тем выше креатининовый коэффициент; у мужчин он колеб-
лется в пределах 20—30, у женщин —10—25. Он примерно одинаков у
мужчин и женщин спортсменов.
В моче наряду с креатинином обнаруживается и его предшественник —
креатин. У взрослых людей и у взрослых животных креатин в моче обычно
отсутствует и появляется лишь при наличии в пищевом рационе мяса, ры-
бы — продуктов, содержащих креатин. Содержится креатин в моче детей
и молодых животных независимо от наличия его в составе пищи.
Выделение креатина с мочой носит название креатинурии. Креатину-
рия у взрослых наблюдается при различных расстройствах обмена веществ,
особенно при нарушении энергетических процессов в мышцах. Часто при
креатинурии уменьшается выделение с мочой креатинина. Объективное
суждение об изменениях в выделении креатина и креатинина из организма
дает так называемый креатиновый показатель — отношение суммы креати-
на и креатинина к креатинину (в мг). При отсутствии креатина в моче креа-
тиновый показатель равен единице.
В случае креатинурии креатиновый показатель выше единицы. При за-
болеваниях мышц: прогрессивной мышечной дистрофии, миотонии и др. —
креатиновый показатель мышц достигает трех и выше. При мышечной ди-
строфии, вызванной у животных отсутствием витамина Е в пище, креати-
новый показатель достигает в разгаре заболевания 5—6. По величине креа-
тинового показателя можно судить о степени дистрофического процесса
в мышцах.
В моче содержится некоторое количество аминокислот. Общее коли-
чество аминокислот в суточной моче человека составляет около 1 г. Приме-
нение метода хроматографического разделения аминокислот позволило
выявить, какие именно аминокислоты и в каких количествах содержатся
в моче. Установлено, что в моче встречаются почти все известные амино-
кислоты, но в различных количествах. Больше всего в моче глутаминовой
кислоты и глутамина (350 мг), гистидина (200 мг), аспарагиновой кислоты
(150 мг), остальные аминокислоты содержатся в суточной моче в количе-
ствах 20—50 мг. Содержание аминокислот в моче возрастает при нарушении
процессов, приводящих к их дезаминированию. В особых случаях наруше-
ний обмена аминокислот в организме увеличивается выделение аминокислот
с мочой с преобладанием какой-либо одной из них, например при цистину-
рии — цистина (стр. 399).
В моче содержится ряд веществ, являющихся продуктами обезврежи-
вания ядов в организме. К ним относятся эфиросерные кислоты, парные
соединения глюкуроновой кислоты, гиппуровая кислота.
В моче человека содержатся фенол и крезол и продукты их обезврежи-
вания — фенол- и крезолсерные кислоты, а также глюкурониды. По содер-
жанию этих веществ в моче можно судить о способности печени их обезвре-
живать, а также об интенсивности гниения в толстых кишках. В опытах
на животных введение фенола может быть использовано для изучения спо-
собности печени обезвреживать яды. Животным под кожу вводят фенол,
а затем в моче устанавливают количество связанного (серной или глюкуро-
новой кислотой) фенола. Чем больше выделяется связанного фенола, тем
активнее в печени происходит его обезвреживание.
В моче обнаруживается индоксилсерная кислота (индикан) — продукт
окисления индола и его обезвреживания. В суточной моче взрослого чело-
века содержится 20—30 мг индикана. Количество его в моче увеличивается
при усилении процессов гниения в кишечнике. Источником образования ин-
дола в кишечнике является триптофан.
В суточной моче человека обычно содержится около 0,7 г гиппуровой
кислоты. Она является продуктом обезвреживания бензойной кислоты, при-
сутствующей в пищевых продуктах, особенно в фруктах и ягодах. Обра-
зуется она также в результате разрушения некоторых ароматических сое-
динений, входящих в состав растительных продуктов.
524
Введенная в организм бензойная кислота полностью выделяется с
мочой как в свободном виде, так и в соединении с глицином, в виде гиппу-
ровой кислоты. По количеству выделенной с мочой гиппуровой кислоты
можно судить о способности организма обезвреживать бензойную кислоту.
Парные глюкуроновые кислоты составляют большую группу веществ,
выделяющихся из организма с мочой. К ним относятся продукты обезврежи-
вания ядовитых веществ, образующихся при гниении в кишечнике (фенола,
крезола, индола, скатола). В виде парных соединений глюкуроновой кисло-
ты выделяются с мочой лекарственные вещества — хлоралгидрат, ментол,
морфий, аспирин, камфора и др. В моче также содержатся парные соеди-
нения, состоящие из глюкуроновой кислоты и стероидных гормонов.
Кроме перечисленных, в моче содержатся еще многие другие вещества.
В ней обнаружен ряд микроэлементов (медь, цинк, кобальт, фтор, йод
и др.), а также в малых количествах витамин С (аскорбиновая кислота),
витамины группы В. Для витамина С установлено, что при введении его в
больших дозах он по мере насыщения им организма в значительных количе-
ствах выделяется с мочой.
В моче обнаружены некоторые гормоны (эстрон, эстрадиол, эстриол,
андростерон). Содержатся в моче также некоторые ферменты (протеаза,
липаза, амилаза). Активность амилазы в моче увеличивается при воспали-
тельном процессе в поджелудочной железе.
Количественное определение нормально встречающихся в составе мочи
соединений дает представление об интенсивности обмена веществ. Так,
например, по количеству выделенной мочевины можно судить об интенсив-
ности распада белков, по количеству мочевой кислоты — об обмене пурин-
содержащих веществ и т. д. Определение pH мочи, потенциальной кислот-
ности и количества аммонийных солей может дать представление о сдвигах
в кислотно-щелочном равновесии организма. Определение количества пар-
ных соединений — об интенсивности гниения в кишечнике и т. д. Часто при
расстройствах обмена веществ в моче появляются так называемые патологи-
ческие составные части; определение их представляет значительный интерес.
ПАТОЛОГИЧЕСКИЕ СОСТАВНЫЕ ЧАСТИ МОЧИ
К наиболее важным патологическим составным частям мочи относятся
глюкоза, белки, кетоновые вещества (ацетоуксусная, р-оксимасляная кисло-
та, ацетон), желчные и кровяные пигменты. Все эти вещества в нормальной
моче содержатся в столь малых количествах, что они могут быть выявлены
только с помощью чувствительных методов исследования. Поэтому считает-
ся, что они в моче практически отсутствуют.
Глюкозурия
Наличие в моче редуцирующих углеводов носит, вне зависимости от их
химической природы, название глюкозурии. При выявлении химической
природы углеводов в моче глюкозурия получает название по обнаружен-
ному углеводу: глюкозурия — в случае наличия глюкозы, пентозурия —
в случае пентозы, лактозурия — в случае лактозы и т. д.
Глюкозурия. В свежей моче содержится очень небольшое количество
глюкозы (0,01 до 0,02%), в 5—10 раз меньше, чем в плазме крови. Это
говорит о том, что при образовании мочи глюкоза подвергается обратному
всасыванию в почечных канальцах.
При глюкозурии содержание глюкозы настолько велико, что она легко
обнаруживается качественными пробами на восстановление. Глюкозурия
появляется у людей и у животных после анестезии, асфиксии, в результате
сильных психических эмоций, а также после одноразового введения в орга-
низм больших количеств глюкозы (100—150 г). Во всех этих случаях глю-
525
козурия непостоянна и через короткий срок после устранения вызвавшей ее
причины исчезает.
Стойкая, т. е. продолжительная глюкозурия, наблюдается при некото-
рых хронических заболеваниях. У 25% людей с тяжелым гипертиреозом
наблюдается глюкозурия. С постоянной, обычно резко выраженной, глюко-
зурией встречаются у больных сахарным диабетом. Содержание глюкозы
в моче у этих больных в зависимости от тяжести болезни колеблется в пре-
делах от 0,5 до 10 и даже 12%. Одновременно с этим у больных повышено
содержание глюкозы в крови. Обычно глюкозурия наступает при содержа-
нии глюкозы в крови равном 0,160—0,180% («сахарный порог» почек).
Начиная с этого уровня глюкозы в крови, интенсивность обратного всасы-
вания ее в канальцах почек уменьшается (или всасывание даже прекра-
щается), и глюкоза в повышенных количествах выделяется с мочой. Обычно
существует прямая зависимость между содержанием глюкозы в крови (сте-
пенью гипергликемии) и выделением глюкозы с мочой (степенью глюкозу-
рии).
Различают формы ренальной глюкозурии, связанной с повышенной
проницаемостью почек для глюкозы при отсутствии гипергликемии; встре-
чается она у женщин в последнем периоде беременности. Ренальная глюко-
зурия вызывается экспериментально у животных путем введения в организм
флоридзина (стр. 89).
Лактозурия встречается у женщин в последние дни беременности и при
кормлении грудью. Она не сопровождается гипергликемией. Наличие лак-
тозы в моче устанавливается по несбраживаемости ее некоторыми культура-
ми дрожжей и по специфической форме лактозазона.
Пентозурия. Пищевая пентозурия встречается при поедании очень
большого количества плодов и ягод или фруктовых соков с высоким содер-
жанием пентозанов. В моче появляется та пентоза, которая имелась в соста-
ве пентозанов употребленных фруктов (обычно арабиноза). Известна пенто-
зурия и непищевого происхождения, когда в моче содержится L-ксилулоза.
Эта пентозурия считается врожденной и продолжается в течение всей жиз-
ни. Причина ее остается неизвестной.
Галактозурия встречается у грудных детей при расстройствах пищева-
рения. Иногда у детей галактозурия сопровождается задержкой роста.
В этих случаях она является результатом нарушения процесса превращения
в печени галактозы в глюкозу. В крови больных детей содержится много
галактозы (отсюда и выделение ее с мочой) и мало глюкозы. Содержание
глюкозы в крови оказывается у них настолько низким, что в результате
углеводного голодания тканей наступают гипогликемические судороги
(стр. 290).
Фруктозурия. Пищевая фруктозурия появляется в результате употреб-
ления необычно большого количества плодов и ягод (черники.) Очень
редко встречается у людей фруктозурия, не связанная с наличием больших
количеств фруктозы в пище. В этом случае фруктозурия является результа-
том изменений, наступающих в обмене гексоз (глюкозы и фруктозы).
Наличие углеводов в моче устанавливают с помощью качественных
проб, основанных на способности редуцирующих углеводов восстанавливать
окиси металлов. Вполне понятно, что с помощью этих проб нельзя опреде-
лить, какой именно углевод содержится в моче. Для выяснения химической
природы углеводов прибегают к специфическим реакциям (проба на броже-
ние, получение озазона, проба Селиванова на фруктозу, получение и опре-
деление фурфурола при наличии пентоз).
Протеинурия (альбуминурия)
В моче в норме содержатся ничтожно малые количества белков —
сывороточного альбумина и муцина. Эти количества не обнаруживаются
с помощью обычных качественных проб на белок. При некоторых заболе-
526
ваниях в моче появляются белки (главным образом, сывороточный аль-
бумин). Протеинурия имеет место при воспалительных заболеваниях почек
(нефритах), при расстройствах сердечной деятельности, приводящих к за-
стою крови во внутренних органах. Протеинурия наступает также при ток-
сикозах беременности.
В моче людей при некоторых заболеваниях (остеомаляции, костных
саркомах), при которых разрушается органическое вещество кости, содер-
жится особый белок, получивший название по имени врача, впервые его
обнаружившего, белка Бенс-Джонса. Этот белок осаждается при комнатной
температуре при подкислении мочи и растворяется вновь при нагревании.
Выпадает он также в осадок при нагревании мочи до 60° С, растворяется
вновь при 80° С. При комнатной температуре белок Бенс-Джонса, выпадаю-
щий в осадок при нагревании мочи до 60° С, снова растворяется. Этим белок
Бенс-Джонса отличается от других белков (плазмы крови), появляющихся
в моче при нарушении функции почек. Источник белка Бенс-Джонса в моче
не выяснен.
Гематурия, гемоглобинурия. При повреждениях слизистой оболочки
мочеполовых путей, при прохождении через них мочевых камней с острыми
краями, при кровоизлияниях в почки в моче появляется кровь. Наличие
форменных элементов крови в моче носит название гематурии. При явно
выраженной гематурии моча непрозрачна и окрашена в темно-красный
цвет.
При интенсивном разрушении больших количеств эритроцитов (при
гемолизе), имеющем место при различных отравлениях организма, а также
при тяжелых инфекциях, в моче содержатся гемоглобин и метгемоглобин.
Содержание этих веществ в моче носит название гемоглобинурии. Моча
в этих случаях бывает окрашена в красный или бурый цвет. Как при гема-
турии, так и при гемоглобинурии наличие гемоглобина в моче легко обна-
ружить спектрометрическим анализом. Отличительная черта гематурии —
наличие форменных элементов крови (обнаруживаются микроскопически),
отсутствующих при гемоглобинурии. При гематурии и гемоглобинурии
в моче содержится белок.
Кетонурия
Выделение с мочой в значительных количествах ацетона, ацетоуксусной
и р-оксимасляной кислот носит название кетонурии (ацетонурии). В нор-
мальной суточной моче содержание ацетона колеблется в пределах 10—
30 мг, при тяжелом диабете выделение ацетона с мочой достигает 50 г за
сутки. В этих случаях резко повышено содержание ацетона в крови, и он
выделяется не только с мочой, но и с выдыхаемым воздухом, приобретаю-
щим характерный плодовый запах.
В небольших количествах содержатся в нормальной моче ацетоуксус-
ная и р-оксимасляная кислоты (несколько десятков миллиграммов в суточ-
ной моче). В больших количествах эти вещества появляются в моче при го-
лодании, недостатке углеводов в пище, при сахарном диабете. При тяже-
лых случаях диабета в суточной моче содержится 50 г и больше р-оксимас-
ляной кислоты и до 25 г ацетоуксусной кислоты.
Желчные пигменты (билирубин)
Билирубин появляется в моче в тех случаях, когда повышается содер-
жание его в крови. При закупорке желчного протока и при некоторых забо-
леваниях печени (желтуха) билирубин всасывается в кровь и частично
выделяется с мочой.
При заболеваниях печени, при которых печень теряет способность
задерживать всасывающийся из кишечника уробилиноген, содержание его
527
в моче значительно возрастает. Определение билирубина и уробилиногена
в моче имеет диагностическое значение
К патологическим составным частям мочи относятся также мочевые
осадки, мочевые сростки и мочевые камни. Часто они состоят преимущест-
венно из мочевой кислоты и ее солей, из оксалатов (щавелевокислого каль-
ция), в отдельных случаях — из фосфорнокислого кальция и из фосфорно-
кислой аммиакмагнезии (трипельфосфата).
Анализ патологических составных частей мочи имеет большое клини-
ческое значение.
ЛИТЕРАТУРА
Г у д ев ич В. С. Анализ мочи. Медгиз, 1945s
Глава двадцать четвертая
ХИМИЯ КРОВИ. ЛИМФА
Одноклеточные организмы получают питательные вещества непосред-
ственно из-окружающей их среды и выделяют в окружающую среду про-
дукты, образующиеся в результате их превращений. Такой непосредствен-
ный контакт одноклеточных с внешней средой создает для них известные
трудности в использовании пищевых веществ, их ассимиляции. Они вынуж-
дены захватывать высокомолекулярные вещества, неспособные дифундиро-
вать через их оболочки и внутри клетки подвергать их химической пере-
работке.
Конечные продукты обмена веществ одноклеточных, прежде чем быть
выделенными во внешнюю среду, задерживаются внутри клетки, что связа-
но с отсутствием специальных приспособлений, обеспечивающих быстрый
отток этих веществ из клетки.
С эволюцией животного мира в организмах появляются системы, обес-
печивающие отбор питательных веществ и переработку их до поступления
во внутреннюю среду клеток (переваривание в пищеварительном тракте
и всасывание кишечником), транспорт питательных веществ к клеткам,
выделение конечных продуктов обмена веществ из клеток.
Клетки и ткани приобретают внутреннюю для них среду. В организме
появляются системы циркуляции жидкостей, которые постоянно омывают
клетки и ткани, доставляя к ним питательные вещества, подвергшиеся
предварительной обработке в пищеварительном тракте, а затем в печени.
Из клеток в системы циркулирующих жидкостей легко поступают конечные
продукты обмена веществ, которые затем удаляются из организма. Системы
циркулирующих жидкостей играют чрезвычайно важную роль в обеспече-
нии связи между химическими превращениями веществ в различных тка-
нях и органах.
Системы циркулирующих жидкостей достигли большого совершенства
у высших животных. У них в развитой форме имеются системы интенсивно
циркулирующей в сосудах крови и более медленно циркулирующей в со-
судах лимфы.
Обе эти системы взаимосвязаны.
Кровь и лимфа отличаются друг от друга по своему составу. В крови
находится большое количество красных кровяных телец—эритроцитов,
у человека 4—4 5-Ю6 в 1 жж3, и поэтому она окрашена в красный цвет.
В лимфе эритроцитов очень мало, но имеется большое количество лимфо-
цитов — белых телец. Кровь и лимфа отличаются друг от друга не только
по содержанию в них клеток (морфологических элементов), но и по химиче-
скому составу.
ФИЗИОЛОГИЧЕСКИЕ ФУНКЦИИ КРОВИ
Количество крови составляет 1/13 часть от веса тела; у взрослого человека
это 5—6 л. Кровь состоит из белковой жидкости — плазмы и взвешенных
в ней форменных элементов — красных кровяных телец (эритроцитов), от
529
которых зависит цвет крови, белых кровяных телец (лейкоцитов) и кровя-
ных бляшек (тромбоцитов). Резко преобладают в крови эритроциты.
Основными функциями крови являются: питательная, экскреторная,
дыхательная, регуляторная и защитная.
Питательная функция. Продукты переваривания пищи, питательные
вещества, всасывающиеся кишечником, доставляются кровью к различным
тканям. Кровью также доставляются вещества, образующиеся в одних
органах к другим. Так например, глюкоза, образующаяся в печени при
распаде гликогена, кровью доставляется к мышцам и другим органам. Мо-
лочная кислота, образующаяся в мышцах из гликогена, частично поступает
в кровь и ею доставляется к сердечной мышце, где она окисляется до угле-
кислого газа и воды, и в печень, где она превращается в гликоген. В кровь
поступают образующиеся в железах внутренней секреции гормоны, достав-
ляемые ею к различным тканям и органам и т. д.
Экскреторная функция. Конечные продукты обмена веществ, образу-
ющиеся в клетках и тканях, поступают в кровь. Кровью транспортиру-
ются к выделительным органам (почкам, легким, потовым железам,
стенке толстых кишок) различные конечные продукты обмена веществ,
выделяющиеся из организма.
Освобождение клеток и тканей от ненужных им веществ — одна из
важнейших функций крови.
Дыхательная функция. Кровь (эритроциты) связывает кислород воз-
духа в легких и снабжает им органы и ткани организма. Доставка кисло-
рода к тканям — важнейшая функция крови. В осуществлении этой функ-
ции особо важная роль принадлежит гемоглобину. Кровь к легким транс-
портирует углекислый газ. Следовательно, кровь активно участвует в обме-
не газов: потреблении тканями организма кислорода и выделении конечного
продукта обмена веществ — углекислого газа.
Регуляторная функция. Регуляторная функция крови заключается
в том, что с ее помощью создается и поддерживается без резких изменений
состава внутренняя среда для клеток и тканей организма. Постоянство физи-
ко-химических условий внутри клеток и тканей, концентрация водородных
ионов, осмотическое давление в значительной мере определяются доставкой
кровью различных веществ к ним и отдачей в кровь избытка тех или иных
образующихся веществ.
С помощью крови поддерживается на определенном уровне содержа-
ние воды в тканях организма.
Распространением гормонов в организме, доставкой их в различные
части его, кровь участвует в регуляции процессов обмена веществ и функций
организма.
Защитная функция. Наличие в крови иммунных глобулинов и антител
предохраняет организм от ряда инфекций. Кроме того, в крови содержатся
белки и ферментативная система, предохраняющие организм от кровопо-
терь. При ранениях благодаря свертыванию крови образуется тромб, за-
крывающий просвет сосудов и останавливающий кровотечение.
* *
*
Перечисленные функции характеризуют кровь как чрезвычайно важ-
ную жидкость организма. Наличие в крови форменных элементов позволяет
считать кровь своеобразной по строению и функции тканью.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА КРОВИ
Плотность крови человека равна 1,050—1,060. Колебания плотности
крови зависят от количества содержащихся в ней белков. Содержание воды
в крови колеблется в пределах 75—85%.
530
Кровь имеет слабощелочную реакцию. pH крови (7,35) варьирует в
очень узких пределах. Постоянство концентрации водородных ионов
в крови имеет большое физиологическое значение и тонко регулируется.
В этой регуляции существенную роль играют буферные системы крови и
выделительные органы, деятельность которых находится под контролем
центральной нервной системы.
БУФЕРНЫЕ СИСТЕМЫ КРОВИ
Буферные системы крови предохраняют ее от резких сдвигов pH. Ос-
новными буферами крови являются: бикарбонатный, фосфатный белки
плазмы и гемоглобин эритроцитов.
В плазме крови содержатся угольная кислота (Н2СО3) и бикарбонаты
натрия или калия (NaHCO3), причем содержание бикарбоната примерно
в 20 раз выше содержания угольной кислоты. Эти два соединения создают
бикарбонатный буфер, емкость которого зависит от их концентрации. Обыч-
но соотношение между количествами Н2СО3 и NaHCO3 в крови следующее:
Н2СО3 1
NaHCO3 “ 20
При поступлении в кровь кислоты известная часть бикарбоната тратит-
ся на ее нейтрализацию с освобождением эквивалентного количества уголь-
ной кислоты. Однако сдвиг соотношения концентраций бикарбоната и уголь-
ной кислоты не влияет существенно на pH плазмы крови, так как угольная
кислота очень слабая и степень ее диссоциации весьма незначительна.
Далее, угольная кислота очень нестойка и разлагается по мере своего обра-
зования на углекислый газ и воду. Избыток СО2 удаляется через легкие.
Все это приводит к тому что соотношение концентраций Н2СО3 и NaHCO3
в плазме крови относительно постоянно. Из приведенного следует, что уда-
ление СО2 при дыхании — существенный момент в проявлении функции
бикарбонатного буфера. На примере бикарбонатного буфера легко просле-
дить регулирующую роль нервной системы в сохранении постоянства pH
крови. Ничтожно малые сдвиги концентрации водородных ионов в крови
вызывают раздражение дыхательного центра головного мозга, что усиливает
частоту дыхания, а отсюда и скорость удаления через легкие избытка угле-
кислого газа.
Фосфатный буфер крови создается наличием в плазме крови первично-
го и вторичного фосфатов (NaH2PO4 и Na2HPO4). Первичный фосфат обла-
дает свойствами слабой кислоты, а вторичный фосфат—слабой щелочи. Кон-
центрация фосфатов в плазме крови невелика, поэтому фосфатный буфер
Na нр0— имеет небольшую емкость. Между тем фосфатный буфер крови
играет существенную роль в сохранении постоянства концентрации водо-
родных ионов крови. Объясняется это тем, что фосфаты плазмы крови кон-
центрируются в почках и выделяются с мочой в довольно больших количе-
ствах. При поступлении в кровь кислоты известная часть Na2HPO4 исполь-
зуется для ее нейтрализации, с образованием эквивалентного количества
NaH2PO4. Избыточное количество NaH2PO4 концентрируется в почках и
удаляется с мочой. В результате этого соотношение концентраций NaH2PO4
и Na2HPO4 в крови остается без особых изменений Интересно подчеркнуть,
что величина pH мочи, которая зависит от содержания в ней фосфатного
буфера, низкая (5,5—6,2). Следовательно, из плазмы крови почками выде-
ляется первичного фосфата больше, чем вторичного.
Белки плазмы крови, являясь амфотерными электролитами, способны
связывать как кислоты, так и щелочи, т. е. они обладают свойствами буфера.
Большим буферным действием обладает гемоглобин — белок эритро-
цитов,—гемоглобин (НЬ) и оксигемоглобин (НЬО2). В кровеносных капил-
531
ля pax НЬО2 диссоциирует на кислород и НЬ. Диссоциация НЬО2 в ткане-
вых капиллярах с образованием НЬ создает благоприятные условия для
связывания угольной кислоты, в то время как образование НЬО2 в легких
способствует высвобождению угольной кислоты и удалению ее из организ-
ма при дыхании.
Система НЬО2^НЬ усиливает действие других буферов в крови, в чем
и заключается ее буферная роль. В крови имеется резерв щелочи, способный
связывать угольную и другие кислоты, возникающие в результате обмена
веществ. Он более или менее постоянен при нормальном состоянии организ-
ма, однако, может оказаться сниженным при избыточном образовании кис-
лот, при ацидозе. Если снижение щелочного резерва не влечет за собой из-
менения pH крови, то подобный ацидоз носит название компенсированного
ацидоза. При некомпенсированном ацидозе щелочной резерв истощается, и
концентрация водородных ионов в плазме крови повышается (pH снижается).
Некомпенсированный ацидоз наблюдается при особо тяжелых заболеваниях,
например при диабетической коме.
При избыточном поступлении в организм щелочных элементов с пищей
(щелочная пища) щелочной резерв плазмы крови увеличивается. Повышение
щелочного резерва плазмы крови носит название алкалоза.
Постоянство концентрации водородных ионов в крови, являющейся
внутренней средой для клеток и тканей организма, поддерживаемое буфер-
ными системами и функцией выделительных органов, играет очень важную
физиологическую роль. Нормальная жизнедеятельность клеток и тканей
происходит в очень узких пределах колебаний концентрации водородных
ионов.
ДЫХАТЕЛЬНАЯ ФУНКЦИЯ КРОВИ
Одна из наиболее замечательных функций крови — это снабжение тка-
ней организма кислородом и удаление из организма углекислого газа. Об-
мен веществ., расщепление питательных веществ в тканях с освобождением
энергии сопровождается потреблением кислорода и образованием углекис-
лого газа. У низших организмов потребность в кислороде удовлетворяется
путем его диффузии из воздуха во внутреннюю среду. Удаляется углекислый
газ у них также путем диффузии. У высших животных, для которых харак-
терен интенсивный обмен веществ, имеется специальный механизм обеспе-
чения их тканей достаточным количеством кислорода и удаления углекис-
лого газа. Значение крови в доставке кислорода и удалении углекислого га-
за станет понятным, если учесть, что взрослый человек при энергетических
затратах организма в 3000 килокалорий ежесуточно потребляет 600 л кисло-
рода и выделяет 480 л углекислого газа. Это количество кислорода достав-
ляется в ткани кровью. Если бы кислород находился в крови только в раство-
ренном виде, как это имеет место в воде, то для доставки в течение суток
600 л кислорода от легких, где кровь насыщается кислородом, к тканям не-
обходимо было бы пропускать через них ежечасно 8000 л крови. Между
тем в течение часа сердце способно протолкнуть через сосуды максимально
1500 л крови. Отсюда ясно, что перенесение больших количеств кислорода
от легких к тканям обеспечивается особыми свойствами крови, ее способ-
ностью связывать кислород. То же самое можно сказать и в отношении угле-
кислого газа, который также связывается кровью.
Газы крови
В крови обнаружены кислород, углекислый газ и азот. Представление
о поглощении кровью газов воздуха дают данные по изучению состава вды-
хаемого, альвеолярного и выдыхаемого воздуха.
532
Состав газов крови
(напряжение в мм рт. ст.)
Газ Вдыхаемый воздух Альвеолярный воздух Выдыхаемый воздух
о2 158,2 101,2 116,2
со2 0,3 40,0 28,5
n2 595,5 571,8 568,3
Н2О (пары) . . . 5,0 47,0 47.0
760,0 760,0 760,0
Фундаментальные исследования по изучению содержания газов в кро-
ви и дыхательной функции крови были проведены в прошлом столетии
И. М. Сеченовым.
Транспорт кислорода гемоглобином
Гемоглобин обладает способностью связывать большое количество
кислорода. В легочных капиллярах кровь насыщается кислородом благодаря
его связыванию гемоглобином. В тканевых капиллярах, где парциальное
давление кислорода значительно ниже, чем во вдыхаемом воздухе, происхо-
дит обратный процесс — отдача кислорода тканям. Способность крови
(гемоглобина) связывать кислород называется кислородной емкостью кро-
ви. Кислородная емкость крови зависит от содержания в ней эритроцитов
и гемоглобина в них. В 100 мл крови содержится 14—16 г гемоглобина: 1 г
гемоглобина способен связывать 1,34 мл кислорода. Отсюда кислородная
емкость крови при расчете на 100 мл соответствует 19—21,4 мл кислорода.
Кислородная емкость крови почти целиком обусловлена наличием гемогло-
бина. В 100 мл плазмы в растворенном виде содержится всего 0,3 мл кисло-
рода, т. е. в 60—70 раз меньше, чем в 100 мл цельной крови.
Гемоглобин (НЬ), соединяясь с кислородом, превращается в оксигемо-
глобин (НЬО2). Кислород (О2) присоединяется к гемоглобину через железо
с помощью добавочных связей. НЬО2 — очень нестойкое соединение и легко
диссоциирует на НЬ и О2 уже при уменьшении парциального давления кис-
лорода. Превращение НЬО2 в НЬ принято называть восстановлением НЬО2.
Однако это название, с химической точки зрения, неправильно, так как при
этом не происходит изменения валентности. Как в НЬО2, так и в НЬ железо
остается двухвалентным.
НЬО2 окрашивает кровь в ярко-красный цвет. Артериальная кровь,
богатая НЬО2, окрашена в ярко-красный (алый) цвет. Венозная же кровь,
содержащая меньше НЬО2, имеет более темную окраску.
Содержание НЬО2 в крови зависит от парциального давления кислорода.
Г ипоксия
При снижении парциального давления О2 в альвеолярном воздухе до
50—60 мм рт. ст. и ниже степень насыщения НЬ кислородом воздуха
настолько падает, что кровь оказывается уже неспособной снабдить в доста-
точной мере ткани организма кислородом. В этих случаях организм находит-
ся в состоянии гипоксемии. Гипоксемия наступает на больших высотах
(свыше 5000 м над уровнем моря).
Недостаточное снабжение кислородом тканей носит название гипок-
сии. Гипоксия сопровождается глубокими расстройствами функций орга-
низма и может привести его к гибели.
533
Гипоксия, вызванная низким парциальным давлением кислорода
в атмосфере, легко устраняется доставкой кислорода в организм (дыханием
из кислородного баллона). Гипоксия может наступить также в результате
иных причин — низкого содержания гемоглобина в эритроцитах, потери
крови при сильных ранениях и др. В этих случаях гипоксия устраняется
переливанием крови. При ряде отравлений организма (нитробензолом,
анилином и др.), сопровождающихся окислением НЬ с образованием метге-
моглобина, также наблюдается гипоксия. Метгемоглобин не способен свя-
зывать кислород и отдавать его тканям. В результате образования метгемо-
глобина теряется функция НЬ и наступает гипоксия. Метгемоглобин являет-
ся довольно стойким соединением и медленно переходит в НЬ. Ускорить
образование НЬ из метгемоглобина можно путем вдыхания чистого кис-
лорода.
Гипоксия вызывается также вдыханием угарного газа (СО). При этом
НЬ превращается в карбоксигемоглобин (НЬСО) — соединение, не обладаю-
щее свойством связывать кислород и отдавать его тканям.
Чрезвычайно сильным ядом, вызывающим гипоксию, является синиль-
ная кислота и ее соли (цианиды). Связывая прочно железо в НЬ, цианиды
лишают его способности связывать кислород и снабжать им ткани.
Хромопротеиды — переносчики кислорода
Кроме гемоглобина у человека и животных имеются и другие слож-
ные белки — пигменты, функционирующие как переносчики кислорода
к тканям. У более простых животных со слабым обменом веществ хромопро-
теиды — переносчики кислорода — находятся в жидкостях в растворен-
ном состоянии. У более развитых животных, имеющих замкнутую систему
циркуляции жидкостей, появляются хромопротеиды, растворенные в цир-
кулирующей плазме. У позвоночных животных хромопротеиды (гемогло-
бины) включены в специальные кровяные тельца — в эритроциты, поэтому
в их крови сосредотачивается большое количество гемоглобина (16% у че-
ловека и млекопитающих) без повышения вязкости и осмотического давле-
ния циркулирующей жидкости — крови.
У представителей животного мира встречаются различные по своим
свойствам хромопротеиды — переносчики кислорода. Особенно разнооб-
разны они у беспозвоночных животных, у которых они растворены в цирку-
лирующей плазме. Эти хромопротеиды имеют большой молекулярный вес
(400 000—6 500 000). У большинства червей — полихет, олигохет, аннелид—
в крови содержатся эритрокруорины, соединения с большим молекулярным
весом и похожие на гемоглобин. Кровь некоторых аннелид (Spirorgaphis)
содержит зеленые пигменты — хлорокруорины — с молекулярным весом
3 400 000. В крови большинства моллюсков и ракообразных имеются гемо-
цианины, окрашенные в голубой цвет. Гемоцианины медьсодержащие протеи-
ды (Cu-протеиды) с молекулярным весом, достигающим 6 500 000.
Эритрокруорины и хлорокруорины связывают кислород, подобно гемо-
глобину, железом (каждый атом железа связывает одну молекулу кислоро-
да). Гемоцианины связывают кислород медью (каждые два атома меди свя-
зывают одну молекулу кислорода).
Гемоглобины эритроцитов позвоночных животных отличаются друг от
друга своими белковыми компонентами. Каждый из них обладает специфи-
ческими иммунными свойствами, они кристаллизируются в виде различных
форм кристаллов и различаются по интенсивности связывания окиси угле-
рода.
Железосодержащим хромопротеидом, близким к гемоглобину, является
миоглобин (стр. 51), содержащийся в мышцах. Миоглобин связывает и
отдает кислород. Так как его нет в крови, миоггобин не участвует в достав-
ке кислорода к мышцам, а лишь создает в них запас кислорода. Содержа-
ние миоглобина в мышцах морских млекопитающих (дельфинов, тюленей)
534
составляет 3,5—7,5%, что позволяет им находиться продолжительное вре-
мя под водой. У животных, часто и продолжительно ныряющих, содержание
миоглобина в мышцах выше, чем у животных, ныряющих редко и непродол-
жительно. Функция миоглобина в мышцах дополняет в отношении доставки
кислорода к мышцам функцию гемоглобина.
При заболевании мышц у животных (лошадей, коров) с мочой выделяет-
ся миоглобин, который освобождается из мышц, поступает в кровь и поч-
ками удаляется из организма.
Токсичность кислорода
Кислород при большом напряжении (при давлении в 2—3 и выше
атмосфер) отрицательно действует на организм человека и животных. При
дыхании чистым кислородом при большом его давлении он растворяется
в плазме крови настолько, что оказывается почти достаточным для удовлет-
ворения в нем потребности организма. Связывание кислорода гемоглобином
и отдача его тканям при этих условиях теряет свое значение, а содержание
НЬО2 в артериальной и венозной крови почти одинаково и вследствие этого
буферное свойство гемоглобина (стр. 531) не проявляется. Это приводит
к сильному ацидозу, отрицательно влияющему на организм.
Дыхание кислородом при большом его давлении вызывает сильные
судороги. Это указывает на отрицательное действие его на функцию цент-
ральной нервной системы. Обмен веществ в головном мозгу, как показали
исследования, при этом нарушается.
Транспорт углекислого газа
Ежесуточно у взрослого человека в результате распада органических
веществ образуется около 500 л углекислого газа, дающего при реакции
с водой угольную кислоту. Кислотность этой массы угольной кислоты соот-
ветствует 2 л концентрированной соляной кислоты. Однако угольная кисло-
та не сдвигает в тканях организма реакцию в кислую сторону, так как она
в виде углекислого газа интенсивно удаляется при дыхании легкими.
Содержание углекислого газа в артериальной крови составляет 50 объ-
емных процентов, а в венозной крови 55—60. Эти цифры показывают, что
с кровью углекислый газ подводится к легким и удаляется в количестве
5—10 мл на 100 мл крови.
В организме человека и у животных имеются механизмы, обеспечиваю-
щие удаление углекислого газа. В крови углекислый газ представлен,
главным образом, в виде бикарбоната в плазме и в эритроцитах. Углекис-
лый газ из тканей дифундирует через стенки капилляров. В эритроцитах
происходит гидратирование углекислого газа, катализирующееся специаль-
ным ферментом карбоангидразой (стр. 173).Эта ферментная реакция обрати-
ма, и в условиях, существующих в эритроцитах, она сдвинута влево: СО2+
+Н2О^Н2СО3. При слабощелочной реакции, имеющейся в крови, основное
количество Н2СО3 находится в ионном состоянии (НСО3).
В легочных капиллярах благодаря обратимости действия карбоангид-
разы углекислый газ освобождается из карбонатов и удаляется вместе
с выдыхаемым воздухом.
Углекислый газ связывается также щелочными солями белков крови.
В результате взаимодействия солей белков с угольной кислотой образуются
в крови бикарбонаты (NaHCO3 в плазме и КНСО3 в эритроцитах. В плазме
преобладают ионы натрия, в эритроцитах — калия):
Н2СО3 + Na-белок NaHCO3 + Н-белок
Реакция связывания угольной кислоты натриевыми (калиевыми) солями
белков обратима, так как Н-белок (свободный белок) обладает свойствами
слабой кислоты.
535
В тканевых капиллярах, где парциальное давление углекислого газа
достаточно велико, реакция идет влево, т. е. в сторону образования бикар-
бонатов и свободного белка. В легочных капиллярах направление реакции
обратное, так как из легких удаляется углекислый газ и парциальное дав-
ление его уменьшается. Здесь свободный белок вытесняет углекислый газ
из бикарбонатов.
Большую роль в транспорте углекислого газа к легким играет гемо-
глобин.
Установлено, что в тканевых капиллярах углекислый газ связывается
не только с щелочными солями белков, но и с гемоглобином. Оказалось, что
гемоглобин с помощью свободных аминогрупп связывает углекислый газ
с образованием карбгемоглобина:
Hb—NH2 + ОН—С—ОН HbNH—С—ОН
II II
О о
Гемоглобин Угольная кислота Карбгемоглобин
Карбгемоглобин не стоек и в легочных капиллярах легко диссоциирует
с освобождением углекислого газа. В виде карбгемоглобина к легким
переносится около 20% возникающего в организме углекислого газа.
Вытеснение СО2 в результате перехода в капиллярах легких оксиге-
моглобина в гемоглобин, а также связывание СО2 гемоглобином с последую-
щим его освобождением приводит к тому, что свыше 90% всей массы обра-
зующегося в тканях углекислого газа доставляется к легким гемоглобином.
Еще в прошлом столетии И. М. Сеченов, на основании проведенных им иссле-
дований, пришел к заключению о важной роли гемоглобина в транспорте
углекислого газа.
ОСМОТИЧЕСКИЕ СВОЙСТВА КРОВИ
Осмотическое давление плазмы (сыворотки) крови человека колеблется
в пределах 7,7—8,1 атм при 37° С, что соответствует снижению температуры
ее замерзания на 0,56—0,58° С. Осмотическое давление крови изменяется
в очень небольших пределах и обусловлено оно содержанием главным обра-
зом хлористого натрия. Постоянство осмотического давления плазмы крови,
имеющее большое значение для нормального физиологического состояния
клеток и тканей организма, поддерживается главным образом деятельностью
выделительных органов — почек и, в известной мере, потовых желез. Поч-
ками и потовыми железами выделяется избыток воды; почками, кроме того,
удаляется также избыток осмотически активных веществ.
Растворы, имеющие осмотическое давление, равное осмотическому дав-
лению сыворотки крови, носят название изотонических. Изотоническим
сыворотке крови человека и млекопитающих животных будет 0,9-процент-
ный раствор NaCl, называемый также физиологическим раствором. Растворы
с более низким осмотическим давлением называются гипотоническими.
Соответственно, растворы с более высоким осмотическим давлением —
гипертоническими.
ХИМИЧЕСКИЙ СОСТАВ ПЛАЗМЫ КРОВИ
После удаления из крови форменных элементов остается белковая жид-
кость, носящая название плазмы крови. Плазма крови составляет около
55% объема всей крови и на 90% состоит из воды. В этой воде растворены
белки — около 7%, органические вещества — около 2% и неорганические
вещества — около 1 %.
536
Содержание различных веществ в плазме крови колеблется в известных
пределах и является результатом физиологических процессов, происходя-
щих в организме. Как известно, одна из функций крови заключается в до-
ставке клеткам питательных веществ. В кровь наряду с этим поступают раз-
личные вещества, образующиеся в клетках в результате обмена веществ.
Поэтому состав крови и содержание в ней отдельных веществ зависит от
интенсивности потребления питательных веществ клетками и тканями и от
поступления в плазму крови веществ из клеток.
Таким образом, количественное определение различных составных час-
тей плазмы крови может дать представление об интенсивности обмена веществ
в тканях организма, а также об изменениях, наступающих в них под влия-
нием тех или иных причин.
БЕЛКИ ПЛАЗМЫ КРОВИ
Белки — основная составная часть плазмы крови. Общее содержание
их колеблется в пределах 6,0—8,5% и зависит от содержания воды в плазме.
При больших потерях воды организмом (при несахарном диабете, поносе,
рвоте и др.) содержание воды в крови снижается, и вместе с этим в плазме
крови повышается содержание белков. Повышение содержания белков
в плазме крови носит название гиперпротеинемии. В ряде случаев (при
злокачественных новообразованиях, после кровопотерь) содержание бел-
ков в плазме понижается. Понижение содержания белков в плазме носит
название гипопротеинемии. Количественное определение содержания бел-
ков в плазме крови представляет клинический интерес.
В плазме крови содержатся различные по своим свойствам и физиоло-
гическому значению белки, например белок фибриноген, ферментативно
превращающийся в фибрин, что обусловливает свертывание крови. При
свертывании крови образуется сгусток, состоящий из фибрина и форменных
Альбумины а-Глобулины
^-Глобулины
Глобулины
Человек 55,2 5,3 8,7 30,8
Корова 41 13 8 38
Лошадь 32 14 24 30
Свинья 42 16 17 25
Овца 57 11 7 25
Кролик 60 7 12 21
Морская свинка . . 56 14,5 8 21,5
элементов крови и жидкости, окрашенной в желтый цвет, сыворотки крови.
В сыворотке крови содержатся альбумины и глобулины.
В приведенной выше таблице собраны данные о содержании белков
в сыворотке крови человека и различных животных. Общее содержание бел-
ков принято в расчетах за 100%.
Содержание белков в сыворотке крови у различных животных неодина-
ково; меньше всего альбуминов в сыворотке крови лошади, коровы и свиньи.
Сывороточные альбумины
Сывороточные альбумины составляют обычно свыше 50% всех белков
сыворотки крови человека. Молекулярный вес белков, входящих в фракцию
альбуминов сыворотки, равен 68—70 тысячам и он значительно ниже моле-
кулярного веса глобулинов сыворотки, достигающего 160—180 тысяч.
Альбумины сыворотки хорошо растворимы в воде и характеризуются по
сравнению с глобулинами, небольшой вязкостью, что имеет физиологическое
значение. Скорость движения крови в сосудах, как известно, зависит от
степени ее вязкости. Отсюда ясно, что работа, выполняемая сердцем, зави-
сит в значительной мере от степени вязкости крови.
537
Преобладание в крови альбуминов, характеризующихся относительно
низкой вязкостью, делает кровь более подвижной.
Сывороточным альбуминам принадлежит роль в транспорте малораство-
римых веществ в организме. Многие вещества, ограниченно растворимые,
в воде, легко растворяются при прибавлении их к плазме, или к сыворотке
крови, или же к раствору выделенных из сыворотки крови альбуминов.
К таким веществам, в частности, относятся жирные кислоты, билирубин,
сульфамидные препараты и др. Альбумины сыворотки крови играют важ-
ную роль в транспорте веществ малорастворимых в воде, а также лекар-
ственных веществ, вводимых в организм (например, сульфамидов).
Сывороточные глобулины
Общее содержание глобулинов в сыворотке крови несколько ниже
содержания альбуминов. Соотношение между содержанием в сыворотке
крови человека фракции альбуминов и глобулинов
альбумины
глобулины
(коэффи-
циент А/Г) непостоянно и колеблется в пределах 1,2—2,3. При инфекцион-
ных заболеваниях в крови увеличивается содержание сывороточных глобу-
линов, и соотношение между альбуминами и глобулинами уменьшается.
Увеличение содержания глобулинов в крови в этих случаях объясняется
реакцией организма на инфекцию — накоплением в крови антител, являю-
щихся по своей природе глобулинами.
Отношение фракции альбуминов к фракции глобулинов снижается
при некоторых заболеваниях за счет уменьшения содержания альбуминов.
Например, при заболеваниях почек (воспалительные процессы) альбумины
крови выделяются с мочой в большем количестве, чем глобулины, а отсюда
и содержание альбуминов в крови уменьшается в большей степени, чем
содержание глобулинов.
При воспалительных процессах в печени образование в ней альбуминов
снижается в большей степени, чем образование глобулинов, и отношение
между альбуминами и глобулинами в крови уменьшается.
Глобулины сыворотки крови делятся на три фракции: а-, р- и у-глобу-
лины. Каждая из этих фракций с различной скоростью перемещается при
электрофорезе к аноду; на этом принципе основано их раздельное получение.
С биологической точки зрения, особый интерес представляют у-глобулины.
у-Глобулины. К у-глобулинам относится фракция белков плазмы крови,
в которой преимущественно сосредоточены специфические белки — анти-
тела. Как известно, при введении в кровь человеку или животному чуждых
им белков (белковых антигенов) у них образуются антитела. Организм реа-
гирует также образованием антител при введении некоторых полисахари-
дов, входящих в состав капсул пневмококков и других патогенных ми-
кробов.
Антитела возникают также при поступлении в организм бактериальных
токсинов (например, дифтерийный токсин). Эти антитела носят название
антитоксинов. Образование антител у-глобулинов происходит главным
образом в ретикулоэндотелиальной системе организма.
Антитела обладают высокой специфичностью. Наличие их выявляется
с помощью реакции преципитации (оседания). При введении, например,
в кровь кролика яичного альбумина в плазме крови появляются антитела,
вызывающие осаждение только этого альбумина.
Образование антител — важнейшее биологическое приспособление,
появившееся у теплокровных животных в процессе эволюционного разви-
тия. С плазмой крови антитела доставляются к различным тканям, где они
обезвреживают антигены и токсины.
Человек и животные на протяжении жизни контактируют с различными,
часто патогенными, микробами, что приводит к выработке организмом раз-
личных антител.
538
Иммунитет к бактериям и вирусам определяется наличием в организме
антител, связывающих соответствующие антигены.
Активный иммунитет искусственно вызывается инъекцией в организм антигена
с ослабленным действием (убитая бактерия, или бактериальный токсин, обработан-
ный муравьиным альдегидом). В организме при этом образуются специфические ан-
титела, вследствие чего приобретается активный иммунитет против данной бактерии
или токсина. Временный, пассивный иммунитет получают при инъекции антител (сы-
воротки крови, или ее глобулиновой фракции) от организма, который приобрел ак-
тивный иммунитет, в другой организм. На этом принципе основано лечение иммунны-
ми сыворотками (например, антидифтерийной, антистолбнячной и др.) некоторых ин-
фекционных заболеваний.
Фракция у-глобулинов плазмы крови наряду с антителами содержит
также и иммуннонеактивные белки. Отделение антител от неактивных бел-
ков является сложной задачей, так как по электрофоретической подвиж-
ности различные белки фракции у-глобулинов близки друг к другу. Вы-
сокоочищенные антитела получают осаждением их специфическими антиге-
нами с последующим отделением от антигенов.
Очищенные у-глобулины (антитела) различных видов животных имеют
молекулярный вес 160—170 тысяч. Молекулярный вес некоторых антител
лошади и близких к ней Видов составляет 900 тысяч. Изоэлектрические точ-
ки различных антител находятся при pH 6,3—7,3. у-Глобулины содержат
некоторое количество (3,5—5%) гексоз и гексозамина, что позволяет от-
носить их к гликопротеидам.
У лошадей и у коров при сильном стимулировании образования анти-
тел они содержатся не только в фракции у-глобулинов крови, но и в фрак-
ции, электрофоретически занимающей среднее место между {3- и у-глобули-
нами. Эта фракция (Т-глобулины) особенно богата антителами.
Молекулы у-глобулинов (антитела) могут быть расщеплены с уменьше-
нием их молекулярного веса наполовину и даже больше протеолитическими
ферментами (пепсином, трипсином и др.) При этом их иммунные свойства
не теряются.
Новорожденные млекопитающие животные (а также дети) не обладают
способностью (или же эта способность у них слабо выявлена) к образова-
нию антител. Они появляются на свет с антителами, полученными от мате-
ри через плаценту. Большое значение для них имеет наличие у-глобулинов
в молозиве. Антитела молозива всасываются кишечником новорожденных
(по-видимому, благодаря большой проницаемости стенки кишечника).
У новорожденных, до появления у них способности образовывать соб-
ственные антитела, создается пассивный иммунитет.
В глобулиновой фракции белков сыворотки человека и животных
содержится особый белок — пропердин. Этот белок играет важную роль в
устойчивости организма по отношению к ряду заболеваний.
Другие белки плазмы крови
Наряду с альбуминами, глобулинами и фибриногеном в плазме крови
имеются и некоторые другие белки.
Липопротеиды. Большая часть липидов крови связана с белками в виде
белково-липидных комплексов. Один из этих комплексов, выделенный из
плазмы крови, {^-липопротеид состоит на 77% из липидов и на 23% из белков
(аминокислот). Липидная часть, в свою очередь, содержит 29% фосфатидов,
39% эфиров холестерина, 8% свободного холестерина и небольшое коли-
чество каротинов и стероидных гормонов. Молекулярный вес этого липопро-
теида 1 300 000. Несмотря на большое содержание в нем липидов, его раст-
воримость не отличается от растворимости белков. Физиологическая роль
липопротеидов заключается в том, что они обеспечивают передвижение в
организме липидов, веществ не растворимых в воде. Содержание ^-липопро-
теида составляет около 5% всех белков плазмы крови. При разделении бел-
539
ков плазмы с помощью электрофореза он оказывается во фракции ^-глобули-
нов.
Металлопротеиды. Из плазмы крови выделен ^-глобулин, способный
связывать железо (трансферрин). Содержание этого белка составляет
около 3% от общего содержания белков плазмы крови. Он не свя-
зан с липидами и включает углеводы (1,8%). Молекулярный вес его
около 90 000. Каждая молекула способна связать два атома железа. Связь
с железом непрочна и при рН7 железо отделяется от белка. Физиологиче-
ская роль металлопротеида заключается в транспорте железа.
Из плазмы крови выделен синий медьсодержащий белок с молекулярным
весом 150 000, содержащий 8 атомов меди на одну молекулу белка. В этом
белке обнаруживается почти вся медь плазмы крови.
Мукопротеиды — белки, характеризующиеся высоким содержанием
углеводов, отличаются по ряду свойств от обычных белков. Они не осаж-
даются такими осадителями белков как трихлоруксусная кислота и хлор-
ная кислота и не свертываются при кипячении.
В очищенных препаратах мукопротеидов гексоза составляет 16% и
гексозамин 12%.
Некоторое представление о содержании белков в плазме крови и их
роли дают данные, приводимые в таблице:
Белки плазмы крови Содержа- ние в % ко всему белку Молеку- лярный вес Изоэлек- трическая точка Физиологическая роль
Альбумины крови . . 52—55 69 000 4,9 Транспорт питатель- ных веществ
7-Глобулины .... 11 160 000 6,3—8,3 Защитная. Антитела
^-Глобулины .... Мукопротеиды . . . 3 0.5 6,3 4,9
[31 -Липопротеиды . . 5 1 300 000 5,5 Транспорт липоидов
Металлопротеиды . . 3 90 000 5,8 Транспорт железа
Фибриноген .... 4 400 000 5,3 Превращение в фиб- рин. Свертывание крови
Протромбин .... 0.1 68 000 Предшественник тромбина
Белки плазмы крови имеют широкое применение в медицине. Их ис-
пользуют в виде сухой плазмы, отдельных фракций белков и в качестве
кровезаменителей. Препараты у-глобулинов широко применяются для пас-
сивной иммунизации.
ФЕРМЕНТЫ ПЛАЗМЫ КРОВИ
Плазма крови содержит ряд ферментов. Обычно активность ферментов
плазмы невелика, за исключением тех, которые участвуют в свертывании
крови (стр. 549). Предполагают, что ферменты, имеющиеся в плазме крови,
образуются при распаде форменных элементов крови и тканей организма.
В пользу этого говорят следующие факты. При мышечной дистрофии, со-
провождающейся уменьшением массы мускулатуры, увеличивается актив-
ность в плазме крови некоторых гликолитических ферментов. Воспаления
поджелудочной железы (панкреатиты) сопровождаются увеличением в
плазме активности амилазы.
При ряде заболеваний изменяется активность тех или иных ферментов
в плазме крови. Так, например, при гипофункции щитовидной железы в
плазме уменьшается активность фосфатазы, при ряде заболеваний костной
ткани (рахите и др.) — активность фосфатазы увеличена и т. д. Определе-
ние активности ферментов плазмы крови имеет клиническое значение и к
нему часто прибегают в клинической практике.
540
АЗОТИСТЫЕ НЕБЕЛКОВЫЕ ВЕЩЕСТВА ПЛАЗМЫ
(СЫВОРОТКИ) КРОВИ
После удаления белков из плазмы или сыворотки крови получают
фильтрат, содержащий различные вещества, в том числе азотистые соеди-
нения. Азот, входящий в состав всех небелковых азотистых веществ крови,
носит название небелкового азота. Его содержание в плазме крови колеб-
лется, составляя в норме в среднем 30—40 мг %. Содержание небелкового
азота в плазме снижается (до 25 мг %) при малом количестве белков в пи-
ще и, таким образом, является показателем интенсивности обмена белков в
организме. При заболеваниях почек, когда нарушается процесс выделения
из организма конечных продуктов азотистого обмена, содержание небелко-
вого азота резко возрастает и достигает 80 мг % и более. В этих случаях
имеет место задержка в крови продуктов азотистого обмена.
Небелковый азот крови слагается из азота ряда веществ.
Мочевина. Около половины всего небелкового азота крови (в плазме,
сыворотке и форменных элементах содержится одинаковое его количество),
составляет азот мочевины. При изменениях белкового питания — уменьше-
ние или увеличение количества белков в пищевом рационе — изменяется,
уменьшается или увеличивается содержание мочевины в крови. Увеличи-
вается содержание мочевины в крови иногда в несколько раз при задержке
выделения ее и других веществ почками (уремия).
Полипептиды и аминокислоты. Содержание полипептидов в плазме
крови невелико, достигая 0,5—1 мг %, Значительно выше содержание в
плазме крови азота аминокислот: в среднем 5—6 мг % в крови, взятой нато-
щак; во время переваривания белков в кишечнике оно увеличивается. При-
менение метода хроматографического разделения аминокислот позволило
более подробно разобраться в содержании отдельных аминокислот в составе
плазмы крови. Оказалось, что содержание отдельных аминокислот в плазме
крови неодинаково.
Аминокислоты Содержание, Аминокислоты Содержание,
мг % мг %
Глицин 1,75 Фенилаланин .... 1,40
Аланин 3,95 Триптофан 1,00
Метионин .... 0,85 Аргинин 2,30
Валин 2,80 Гистидин 1.40
Лейцин 1,90 Лизин 3,00
Изолейцин .... 1,60 Глутаминовая кислота 3,40
Тирозин .... 1,50 Глутамин ...... 9,0
Из приведенных данных видно, что больше третьей части всех амино-
кислот приходится на долю глутаминовой кислоты и глутамина. Сравнитель-
но высоко содержание таких аминокислот, как лизин, аргинин, валин, ала-
нин, лейцин. Содержание аминокислот в плазме является показателем ин-
тенсивности обмена белков в организме.
Мочевая кислота обнаруживается в плазме крови в количестве 3—
4 мг %, и она, как известно, у человека является конечным продуктом
превращения производных пурина. Содержание мочевой кислоты увеличе-
но у больных подагрой, особенно перед приступами болей (до 7—10 мг %).
Креатин и креатинин. В плазме крови имеется небольшое количество
креатинина (1—2 мг %) и еще меньше в ней креатина; 1—1,5 мг % креати-
на содержится в форменных элементах крови. Содержание креатинина в
плазме крови увеличивается при заболеваниях почек.
Билирубин — продукт распада гемоглобина — содержится в плазме
крови в небольших количествах. Билирубин плазмы крови несколько отли-
чается от билирубина, образующегося при распаде гемоглобина в клетках
ретикуло-эндотелиальной системы. Он, в противоположность билирубину
плазмы крови, дает положительную реакцию с диазореактивом Эрлиха.
541
Билирубин, поступающий в кровь при закупорках желчного протока
и в иных случаях застоя желчи в печени, обнаруживается по окрашиванию
диазореактивом («прямая» реакция). Билирубин же, обычно циркулирую-
щий в крови, обнаруживается диазореактивом только после предваритель-
ной обработки плазмы крови спиртом («непрямая» реакция). В чем именно
заключаются химические различия обоих билирубинов, остается неиз-
вестным.
БЕЗАЗОТИСТЫЕ ОРГАНИЧЕСКИЕ СОСТАВНЫЕ
ЧАСТИ ПЛАЗМЫ
В плазме крови содержатся многочисленные безазотистые органические
вещества, образующиеся в тканях как промежуточные продукты обмена
веществ, а также питательные вещества, доставляемые кровью к различным
тканям и органам. Сюда относятся глюкоза, гексозофосфорные кислоты,
молочная кислота, пировиноградная кислота, лимонная кислота, С4-дикар-
боновые кислоты, жиры, жирные кислоты, ацетоуксусная и р-оксимасля-
ная кислоты, холестерин, его эфиры и другие вещества.
Представление о содержании в плазме крови человека различных орга-
нических веществ (азотистых и безазотистых, за исключением белков) дают
следующие данные:
Вещество Содержание, мг %
Небелковый азот . . 25—40
Мочевина (азот) . . 12—20
Аминокислоты (азот) 5—8
Глутамин ... 8—12
Мочевая кислота . . 2—4
Креатинин 1—2
Креатин 1—2
Глюкоза 85—110
Глюкозамин 65—75
Лимонная кислота . . . 1,5—3,0
а-Кетоглутаровая кислота 0,5—1,0
Яблочная кислота 0,2—0.9
Янтарная кислота ... 0,1—0,5
Ацетоуксусная кислота . . 0,5—2,0
Кетоновые вещества . . 0,8—5,0
Молочная кислота . . . 15—20
Пировиноградная кислота 0,5—2,0
Липиды 400—700
Нейтральные жиры . . 100—250
Жирные кислоты . . . 200—400
Холестерин свободный . 50—70
Эфиры холестерина 90—150
Фосфатиды (общие) 150—250
Лецитин 100—200
Кефалин .... 10—30
Сфингомиэлин 10—30
Билирубин . . . 0,2—1.4
МИНЕРАЛЬНЫЕ ВЕЩЕСТВА ПЛАЗМЫ КРОВИ
В плазме крови содержатся различные минеральные вещества. Особенно
много в плазме натрия, представленного, главным образом, в виде хлористо-
го натрия и отчасти в виде карбонатов. В плазме, наряду с другими мине-
ральными веществами, содержится кальций, имеющий важное значение
для процессов свертывания крови.
542
Ниже приводятся данные о содержании минеральных веществ в
плазме крови человека:
Вещество
Кальций . .
Магний . .
Калий ....
Натрий.....................
Бикарбонаты (в виде NaHCO3)
Хлориды (в виде хлора) . .
Фосфаты (в виде фосфора) . .
Сульфаты (в виде серы) . . .
Йод (общий)..................
Йод (связанный с белками) . . .
Содержание
мг %
9—11
2—2,7
1£—20
310—350
200—230
350—390
3,0—4,0
0,5—2,0
0,008—0,015
0,006—0,008
Содержание различных веществ в плазме (сыворотке) крови колеблется
в известных пределах и зависит от интенсивности процессов обмена веществ,
количества веществ, всасываемых кишечником, условий питания (пищевого
рациона). При нормальном состоянии организма содержание того или ино-
го вещества в плазме крови колеблется в известных пределах, сохраняясь
на определенном уровне. В этом смысле принято говорить о нормальном
содержании его в крови. При нарушениях процессов обмена веществ изме-
няется содержание тех или иных составных частей плазмы крови (при сахар-
ном диабете — глюкозы, подагре — мочевой кислоты), поэтому количе-
ственное определение составных частей крови представляет интерес для
клиники.
ХИМИЧЕСКИЙ СОСТАВ ЭРИТРОЦИТОВ
Химический состав форменных элементов крови, основную массу ко
торых составляют эритроциты, отличается от химического состава плазмы
крови. Главной составной частью эритроцитов является гемоглобин, что
соответствует выполняемой в организме эритроцитами функции транспорта
кислорода и углекислого газа. Весь гемоглобин крови сосредоточен в эрит-
роцитах. Содержание гемоглобина достигает 90% от сухого остатка эрит-
роцитов. Воды в эритроцитах 40%.
Эритроциты взрослого человека и млекопитающих не содержат ядер.
Обмен веществ в них, судя по слабому потреблению ими кислорода, невелик.
Эритроциты птиц, рептилий и амфибий содержат ядра. Обмен веществ у
них происходит более интенсивно.
Эритроциты возникают из ретикулярных клеток костного мозга. Каж-
дый эритроцит имеет свой жизненный цикл в организме, который заканчи-
вается его разрушением. Количество разрушившихся эритроцитов соответ-
ствует количеству вновь образовавшихся, и таким образом масса их в
крови не изменяется. Количество выделяемых за сутки желчных пигментов
(они образуются при распаде гемоглобина) дает представление о количестве
подвергшихся за этот период времени разрушению эритроцитов. Расчеты
показывают, что ежесуточно разрушается 0,85% всей массы эритроцитов
крови. Сроки жизни эритроцитов неодинаковы у различных видов живот-
ных. У человека этот срок—126 дней, у собаки—107 дней, у кошки и у
кролика—68 дней.
Представление о химическом составе эритроцитов дают следующие дан-
ные:
Вещество Содержание
Вода ..........
Сухой остаток
Гемоглобин . .
Небелковый азот
Глутамин . . .
Мочевина (N) . .
60—65 %
35—40 »
32—36 »
30—40 мг %
75—120 »
15—20 »
543
К реатин............................ 4—6
Креатинин .......................... 1—2
Аминокислоты (в виде азота)......... 7—8
Мочевая кислота..................... 2—3
Г люкоза............................ 60—70
Пировиноградная кислота .................. Следы
Лимонная кислота ........................... »
а-Кетоглутаровая кислота ................... »
Янтарная кислота ........................... »
Кетоновые вещества.......................... »
Жирные кислоты...................... 150—170
Холестерин (общий).................. 150
Лецитин............................. 350
Натрий ............................. 50—100
Калий ................................. 450—480
Кальций................................. Следы
Магний ..................................... 5
Железо ............................. 105—ПО
Медь................................ 1—1,5
Хлор................................... 180—200
Фосфор неорганич................ Следы
Фосфор органич...................... 50—60
Фосфор общий........................ 50—60
Бикарбонаты (НСО3")................. 200—210
Из приведенных данных видно, что химический состав эритроцитов
отличается от химического состава плазмы крови не только по содержанию
в них гемоглобина. Эритроциты беднее водой и богаче калием, глутатио-
ном и фосфором, чем плазма крови. В эритроцитах почти отсутствуют проме-
жуточные продукты распада органических веществ в тканях организма.
ГЕМОЛИЗ
Гемоглобин сосредоточен в эритроцитах и отсутствует в плазме крови.
При разрушении оболочек эритроцитов гемоглобин поступает в плазму,
образуется так называемая лаковая кровь. Разрушение эритроцитов вызы-
вается действием различных факторов (змеиного яда, лизолецитина, сапо-
нинов и др.). При выпускании крови в дистиллированную воду, а также в
гипотонический раствор наступает набухание эритроцитов и их разрушение
(гемолиз). Гемолиз наступает также при помещении эритроцитов в гипер-
тонический раствор — эритроциты сморщиваются, оболочки их разруша-
ются.
После гемолиза можно изолировать разрушенную клеточную оболочку
эритроцитов. Она богата липопротеидами.
ФЕРМЕНТАТИВНЫЕ ПРОЦЕССЫ В ЭРИТРОЦИТАХ
В ядросодержащих эритроцитах (птиц, рептилий, амфибий и рыб)
интенсивно протекают процессы обмена веществ. Такие эритроциты интен-
сивно дышат, у них имеет место аэробное окисление органических соедине-
ний и окислительное фосфорилирование.
Эритроциты человека и млекопитающих животных не содержат ядер.
Они формируются в костном мозге и в готовом виде поступают в кровь.
Такие эритроциты почти не дышат. У них наблюдается гликолиз, который
протекает в ограниченном объеме. Освобождающаяся при гликолизе энер-
гия появляется в макроэргических связях АТФ.
В эритроцитах содержится много ионов калия и мало ионов натрия.
В плазме наоборот, содержание ионов натрия значительно выше содержа-
ния ионов калия. Это неравномерное распределение ионов калия и натрия
в плазме и эритроцитах устанавливается при использовании энергии АТФ.
544
СИНТЕЗ ГЕМА. РАСПАД ГЕМОГЛОБИНА. ОБРАЗОВАНИЕ
ЖЕЛЧНЫХ ПИГМЕНТОВ
Синтез гема. Биосинтез красящего вещества крови — гема — изучен
Шеминым и его сотрудниками. Установлено, что исходными веществами
для синтеза гема являются глицин и сукцинил —SKoA. Известно, что в
основе структуры гема лежит порфирин (стр. 49), в состав которого входят
четыре пирроловых ядра. Более сложным соединением является протопор-
фирин (стр. 50), из которого путем введения в его молекулу атома железа
возникает гемоглобин. Шемин показал, что источником азота в составе всех
четырех пирроловых колец протопорфирина является глицин и что для
синтеза молекулы протопорфирина используются восемь атомов углерода,
входящих в состав метиленовых групп восьми молекул глицина. Из этих
восьми атомов углерода четыре (по одному для каждого пирролового ядра)
используются для построения пирроловых ядер и четыре — для метиновых
мостиков, соединяющих пирроловые ядра протопорфирина. Остальные атомы
углерода (двадцать шесть) протопорфирина возникают из сукцинил ~SKoA.
Установлено, что одним из промежуточных продуктов синтеза протопор-
фирина является 8-аминолевулиновая кислота, образующаяся в результате
декарбоксилирования а-амино-^-кетоадипиновой кислоты. Образование о-
аминолевулиновой кислоты, а из нее порфобилиногена происходит следую-
щим образом:
NH2
| + KoAS—ОС-СН2-СНо-СООН------>
сн2-соон
Глицин Сукцинил-SKoA
nh2
----” I
НООС— СН—СО—СН2—СН2—СООН 4- KoASH.
а-Амино-З-кетоадипиновая кислота
В этой реакции участвуют глицин и сукцинил ~SKoA.
Из а-амино-р-кетоадипиновой кислоты путем декарбоксилирования об-
разуется о-аминолевулиновая кислота
/NH2
НООС—СН—СО—СЫ2—СН2—СООН
/NH2^O
—+ СН2 — С—СН2—СН2—СООН 4- со2.
б-Аминолевулиыовая кислота
Из приведенных уравнений легко видеть, что при образовании 3-ами-
нолевулиновой кислоты используются четыре атома углерода янтарной
кислоты и один атом углерода (метиленовой группы) глицина.
Из двух молекул 3-аминолевулиновой кислоты синтезируется порфо-
билиноген — производное пиррола — путем отщепления двух молекул
воды:
СООН
I
сн2
I -ЗН8'
сн2 -----
с=о
19 Заказ № 581
545
—2Н2О
СООН
СООН сн2
I I
сн2 сн2 ----
I I
С--- с
II II
с сн
HsC^^NId
I
nh2
протопор-
фирин
Порфобилиноген
При синтезе пирролового ядра порфобилиногена из двух остатков гли-
цина, имеющихся в составе двух молекул В-аминолевулиновой кислоты, как
это явствует из уравнения, один входит в структуру пирролового ядра,
а другой находится за его пределами.
Из восьми атомов углерода двух остатков янтарной кислоты, входящих
в состав двух молекул o-аминолевулиновой кислоты, три атома использу-
ются для синтеза пирролового ядра и пять — для синтеза углеродных це-
почек, отходящих от пирролового ядра.
При синтезе гема из введенного в организм меченного радиоактивным
углеродом глицина, а также при синтезе гема из радиоактивного глицина
в эритроцитах птиц вне организма, в молекуле гема, состоящей из четырех
пирроловых ядер, обнаруживаются восемь радиоактивных атомов углерода,
из которых четыре приходится на четыре пирроловых ядра (по одному на
каждое пирроловое ядро) и четыре — на атомы углерода радикалов, соеди-
няющих друг с другом пирроловые ядра в молекуле протопорфирина.
СН3 сн--сн2
сн3_
сн2—
сн2
I
СООН
сн2 сн3
СН2СООН
Протопо рфирин
В приведенной формуле протопорфирина звездочками обозначены ра-
диоактивные атомы углерода.
Введение в протопорфирин атома железа приводит к образованию гема.
В состав молекулы гемоглобина входят четыре гема.
Типы гемоглобина. Гем при образовании гемоглобина связывается
с глобином. Глобин — белок, близкий по своим свойствам к альбуминам.
Связь между гемом и глобином осуществляется с помощью имидазольного
ядра гистидина, входящего в состав глобина.
Гемоглобин является главным протеидом эритроцитов. Он содержит
0,338% железа. Гемоглобин построен из четырех субъединиц, каждая из
546
которых является полипептидом. Каждые два полипептида по своей струк-
туре идентичны. Мол. вес субъединицы равен 16500, следовательно, моле-
кулярный вес гемоглобина равен 66000.
Каждая субъединица связана с одной молекулой гема и все четыре гема
находятся на поверхности общей молекулы. Связывание гемов субъедини-
цами глобина приводит, к стабилизации молекулы гемоглобина. Химиче-
ская структура гемоглобина, пространственное расположение в его моле-
куле атомов изучена практически до конца и это является большим дос-
тижением биохимии.
Гемоглобин человека и животных неоднороден. Различные гемогло-
бины отличаются по своей электрофоретической подвижности и это поз-
воляет их обнаружить и изолировать. Различия в гемоглобинах объясняются
тем, что у них в молекулах глобина последовательность размещения амино-
кислот неодинакова. Гем у всех гемоглобинов один и тот же.
У взрослого человека в эритроцитах имеется один основной гемогло-
бин, составляющий 90% всех гемоглобинов. Он получил название гемо-
глобина A (adultus по лат. взрослый).
В эритроцитах крови эмбрионов содержится главным образом другой
гемоглобин —HbF(no лат. fetus — плод). HbF обладает большим сродством
к кислороду, чем НЬА.
У людей обнаружены патологические типы гемоглобина. К ним отно-
сится так называемый серповидный гемоглобин (HbS — от англ, sickle —
серп). Серповидный гемоглобин встречается у людей, страдающих болезнью
крови — дрепаноцитозом. Эта болезнь внешне выражается в том, что эри-
троциты приобретают форму серпа или полулуния. HbS плохо раство-
рим и, выпадая из раствора, деформирует эритроциты, придавая им
серповидную форму.
Когда количество эритроцитов с HbS достигает 30—60% общего содер-
жания эритроцитов, наступает тяжелая гемолитическая анемия. Дрепано-
цитоз встречается среди некоторых африканских племен, он обнаружен так-
же среди населения побережья Средиземного моря; болезнь передается по
наследству.
Дрепаноцитоз обусловлен отклонениями в химической структуре гло-
бина. Детальное изучение аминокислотного состава глобинов, полученных
из обычного и из серповидного гемоглобинов, показало, что в одной точке
белковой цепи у него вместо глутаминовой кислоты стоит валин.
В связи с этой заменой глобин из серповидных эритроцитов имеет лиш-
ний положительный заряд по сравнению с глобином из нормальных эритро-
цитов.
Кроме приведенного заболевания крови, известны и иные, связанные с
теми или иными отклонениями в химической структуре глобина.
Распад гемоглобина. Эритроциты через 120—130 дней после своего
возникновения в костном мозге и появления в крови фагоцитируются клет-
ками ретикулоэндотелиальной системы (макрофагами). Макрофаги содер-
жатся, главным образом, в селезенке, печени и в костном мозге. В макро-
фагах происходит разрушение эритроцитов и распад их главной составной
части — гемоглобина. Разрываются в геме мостики, соединяющие пиролло-
вые ядра, в результате чего образуется вердогемоглобин, окрашенный в зе-
леный цвет. Вердогемоглобин затем распадается с освобождением глобина,
железа и биливердина. Из биливердина в результате восстановления обра-
зуется билирубин.
Освободившееся из гема железо связывается белком плазмы (Р-глобули-
ном) и им транспортируется в печень, где оно откладывается в виде фер-
ритина (стр. 508), или же доставляется в костный мозг, где используется
для синтеза гемоглобина новых эритроцитов.
Схематически путь распада гемоглобина таков:
19*
547
Аминокислоты
4
гемоглобин ->вердогемоглобин-^биливердин 4- железо + глобин
билирубин в плазму крови
в печень
в костный мозг
в печень
(ферритин)
В основе структуры желчных пигментов лежат четыре пирроловых ядра,
соединенные друг с другом в прямом ряду. В протопорфирине же пирроло-
вые ядра соединены друг с другом через углеродные мостики с образова-
нием циклического скелета (стр. 546). Следовательно, образование желчных
пигментов из протопорфирина должно сопровождаться разрывами его цик-
лического скелета.
Скелет порфирина Скелет желчного пигмента
Образующийся в ретикулоэндотелиальных клетках билирубин в виде
комплекса с белком доставляется кровью в печень. В печени этот комплекс
распадается, и освободившийся билирубин, поступает в желчные канальцы,
а затем через протоки в желчный пузырь. Из желчного пузыря билирубин,
в виде составной части желчи, поступает в двенадцатиперстную кишку.
В кишечнике, под влиянием кишечной флоры, билирубин восстанавли-
вается с образованием бесцветного мезобилирубиногена, из которого возни-
кают различные пигменты.
Билирубин
Мезобилирубиноген
г V
Уробилиноген Стеркобилиноген
-Н2
V
Уробилин
(правовращающий)
Стеркобилин
(левовращающий уробилин)
548
Некоторое количество стеркобилиногена, образовавшегося в кишечнике
из мезобилирубиногена, всасывается кишечником в кровь, которая достав-
ляет его в печень. Из печени часть стеркобилиногена вместе с желчью посту-
пает в кишечник, а остальная часть его с кровью доставляется к почкам
и выделяется с мочой.
Из изложенного видно, что в образовании желчных пигментов из гемог-
лобина и в выделении их из организма участвуют клетки ретикулоэндоте-
лиальной системы, печень, почки, микрофлора кишечника. Приводим схему
образования и обмена желчных пигментов.
Эритроциты----> ретикулоэндотелиальная система
в ней происходят превращения:
гемоглобин
I
ф
вердоглобин
I
биливердин
----------->печень
билирубин
желчи
билирубин
кишечник
билирубина
мезобилирубиноген
уробилиноген
—> почки
уробилин
стеркобилиноген
стеркобилин
в кал
Пигменты, химически близкие к желчным, обнаружены у некоторых
беспозвоночных, у которых гемоглобин отсутствует. Интересно, что эти
пигменты входят в состав хромопротеидов (фикоцианин, фикоэритрин) си-
них и красных водорослей, где они вместе с хлорофиллом служат в качестве
веществ, поглощающих свет.
БИОХИМИЯ СВЕРТЫВАНИЯ КРОВИ
У человека и животных существуют приспособления, предохраняющие
их в случаях ранения кровеносных сосудов от кровопотери; это—способность
образовывать сгусток крови, закрывающий дефект в кровеносном сосуде.
Второе приспособление заключается в сужении просвета кровеносных сосу-
дов и, следовательно, уменьшении кровотечения.
Кровь млекопитающих и человека, выпущенная из сосудов, при 37° С
свертывается в течение 3—5 мин. При этом фибриноген свертывается с обра-
зованием фибрина. Превращение фибриногена в фибрин — ферментатив-
ный процесс, катализируемый специальным ферментом — тромбином.
Тромбин сам по себе в крови отсутствует. Он образуется из своего неак-
тивного профермента — протромбина.
549
Для более глубокого понимания процессов, протекающих при сверты-
вании крови, необходимо более подробно остановиться на свойствах фиб-
риногена, протромбина, тромбина и тромбопластина.
Фибриноген
Фибриноген образуется в печени. Содержание его в плазме крови чело-
века составляет около 0,35%. При заболеваниях печени содержание фибри-
ногена в крови понижается (гипофибриногенемия). Фибриноген осаждается
из плазмы на холоду при добавлении к ней до полунасыщения хлористого
натрия или же до четверти насыщения сернокислого аммония и некоторыми
иными солями. Осаждается он также из плазмы при —3°—0° С 10-процент-
ным раствором этилового спирта. Молекулярный вес фибриногена человека
равен около 330 000. Фибриноген, как уже указывалось, под влиянием тром-
бина превращается в фибрин. Некоторые другие ферменты (протеолитиче-
ские), как папаин и ферменты змеиного яда, также вызывают превращение
фибриногена в фибрин.
В молекуле фибриногена обнаружены N-концевые остатки тирозина и
в зависимости от фибриногена видов животных другие N-концевые остатки.
В противоположность фибриногену, фибрин нерастворим в разбавлен-
ных солевых растворах. Под микроскопом фибрин представляет тонкую
сеть волокон, обладающих в поляризационном свете двойным прелом-
лением.
При образовании фибрина фибриноген подвергается определенным из-
менениям. Под влиянием тромбина от него отщепляются два полипептида
с образованием фибринмономера, подвергающегося полимеризации с обра-
зованием фибрина. Фибрин в противоположность фибриногену имеет
свободные аминогруппы глицина.
При расчете фибрина с молекулярным весом 450 000 в нем имеется шесть
открытых цепей с 2 N-концевыми остатками тирозина и с 4 N-остатками
глицина, независимо от вида животных.
Протромбин
Плазма крови человека содержит 10—20 мг% протромбина. Молеку-
лярный вес протромбина 68 000. Протромбин наряду с аминокислотами
содержит сахара (4—5%) и гексозамин. Следовательно, он является гли-
копротеидом. Протромбин образуется в печени, и в этом процессе участвует
витамин К (стр. 138). При заболеваниях печени содержание протромбина
в плазме крови уменьшается, и скорость свертывания крови снижается.
Из испорченного сена травы донника и из сладкого клевера выделено
вещество дикумарин, производное кумарина, вызывающее геморрагию
(кровоизлияние).
Дикумарин при введении его в организм животных и человека снижает
содержание в плазме крови протромбина. Действие дикумарина на образо-
вание протромбина в печени противоположно действию витамина К, и в
этом отношении дикумарин является антагонистом витамина К»
Кумарин
550
Дикумарин
Дикумарин получил применение в медицине; им пользуются в тех слу-
чаях, когда имеется необходимость снизить склонность организма к обра-
зованию тромбов крови в сосудах (тромбозы).
Тромбин, вызывающий превращение фибриногена в фибрин, в плазме
крови отсутствует. В незначительных количествах он появляется в циркули-
рующей крови при некоторых патологических состояниях организма.
Тромбопластин
Превращение протромбина в тромбин требует присутствия вещества,
имеющегося в тканях, — тромбопластина. Наибольшее содержание тром-
бопластина обнаружено в легких, мозге и плаценте.
Тромбопластин выделен в чистом виде; по химической природе это
липопротеид, содержащий 40—50% фосфатидов (по весу). Молекулярный
вес тромбопластина около 170 000. Удаление фосфатидов из тромбопластина
не изменяет его активность. Очищенный тромбопластин проявляет свою
активность (вызывает превращение протромбина в тромбин) уже в концент-
рации 0,008 мг/мл. В плазме крови тромбопластин отсутствует. Он образу-
ется при взаимодействии факторов плазмы и тромбоцитов.
Другие глобулины, участвующие в свертывании крови
В плазме крови человека содержатся, кроме приведенных выше, и дру-
гие белковые вещества, участвующие в процессах свертывания крови. Они
необходимы для превращения протромбина в тромбин. К этим белкам отно-
сятся антигемофилический глобулин, плазменный компонент тромбопласти-
на, тромбостропин, проакцелирин, проконвертин и др.
Недостаточность того или иного фактора приводит к заболеваниям, объе-
диненным под общим названием «гемофилия», характеризующимся медлен-
ным свертыванием крови. Наиболее часто встречается гемофилия «а», свя-
занная с отсутствием антигемофилического глобулина. Гемофилия «а» —
наследственное заболевание, встречающееся только у мужчин, но передаю-
щееся по наследству только женщинами.
При гемофилии «б» отсутствует плазменный компонент тромбопластина.
Оба вида гемофилии характеризуются нарушением процесса образования
тромбопластина крови. Гемофилия «б» также передается по наследству.
Роль тромбоцитов
В процессе свертывания крови участвуют тромбоциты. Распад тромбо-
цитов в начальный период свертывания крови приводит к освобождению
заключающихся в них в небольших количествах факторов, участвующих
в образовании тромбопластина и в иных этапах процесса свертывания
крови.
551
АНТИСВЕРТЫВАЮЩИЕ СВОЙСТВА КРОВИ
В печени обнаружено вещество, препятствующее свертыванию крови,—
гепарин. Гепарин обнаружен и в других органах и выделен в кристалличе-
ском виде из печени и из легких. По химической природе гепарин — суль-
фированный мукополисахарид (стр. 86). Он состоит из эквимолекулярных
количеств глюкозамина и глюкуроновой кислоты и содержит 10% серной
кислоты. Молекулярный вес гепарина 17 000. Гепарин удлиняет время свер-
тывания крови. Для проявления действия гепарина необходимо наличие
какого-то вещества, имеющегося в составе плазмы крови. В присутствии
плазмы гепарин задерживает превращение протромбина в тромбин. На очи-
щенный препарат протромбина гепарин не действует. Гепарин и вещество
плазмы, необходимое для проявления его действия, можно рассматривать
как антитромбин.
В альбуминовой фракции сыворотки крови содержатся также ве-
щества, связывающие тромбин — антитромбины. Наряду с этим тромбин
адсорбируется на образующемся при свертывании крови сгустке.
Из изложенного видно, что свертывание крови является сложным фер-
ментативным процессом, в котором наряду с фибриногеном участвуют про-
ферменты, превращающиеся в ферменты (протромбин-тромбин, тромбопла-
стин. специфические глобулины и иные факторы). Наличие многих факторов,
участвующих в превращении фибриногена в фибрин, указывает на слож-
ность процесса свертывания крови. Благодаря регуляторным механизмам
кровь свободно течет по сосудам и не подвергается свертыванию. Ранение
кровеносных сосудов приводит к Сдвигам в системах, прямо или косвенно
участвующих в свертывании крови. В результате этого образуется тромб,
препятствующий утечке крови из сосудов.
Схематически процесс свертывания крови можно представить следую-
щим образом:
/. Образование тромбина крови
Тромбоциты
Тромбоцитарный фактор
Антигемофильный глобулин.
Плазменный компонент тром-
бопластина.
Тромботропин.
Предшественник плазменного
тромбопластина.
Ионы кальция.
Тромбопластин крови
II. Превращение протромбина в тромбин
_ (Тромбопластин плазмы+Са)
Протромбин------------------------------> Тромбин
(Тромбопластин ткани4-конвертин-|-
Н-а к целер ин-j-Ca)
III. Превращение фибриногена в фибрин
' (Тромбин)
Фибриноген--------> Фибринпептид -|- Фибрин
552
ФИБРИНОЛИЗ (РАСТВОРЕНИЕ ФИБРИНА)
Образующийся при свертывании сгусток крови через несколько часов
или дней растворяется. Это не связано с действием микробов, так как
происходит и при стерильных условиях.
В сыворотке крови обнаружен профермент фибринолизиноген, прев-
ращающийся под влиянием ряда факторов в фермент фибринолизин.
Фибринолизин является протеолитическим ферментом, действующим на
фибрин. Под его влиянием фибрин подвергается некоторым изменениям,
благодаря которым он приобретает растворимость.
Фибринолизиноген превращается в фибринолизин и при обработке
сыворотки крови органическими растворителями (хлороформом и др.).
Это превращение наблюдается и при физиологических условиях, напри-
мер, при эмоциональном возбуждении, физических упражнениях, при вве-
дении в организм адреналина. У бактерий обнаружен фермент — стрепто-
киназа, активирующий превращение плазминогена в фибринолизин.
Расщепление фибрина — фибринолиз имеет физиологическое значе-
ние. Он приводит к устранению тромбов в сосудах после прекращения
кровоизлияний, а также тромбов, возникающих в сосудах при заболева-
ниях (тромбозах).
ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ БЕЛКОВ
ПЛАЗМЫ КРОВИ
Белки плазмы применяются в медицине. Они используются для па-
рэнтерального белкового питания, а также используются в хирургической
практике. Изделия из фибрина — кровеостанавливающие препараты,
фибриновые пленки, нити и другие — применяются при хирургических за-
болеваниях, а также для пластики дефектов твердой мозговой оболочки,
брюшины, кожи и т. д. Фибриновые нити используются для зашивания
хирургических ран.
Препараты тромбина применяются в хирургии как кровоостанавли-
вающие средства при паренхиматозных и капиллярных кровотечениях.
ЛИМФА
Между эндотелием кровяных капилляров и клетками находится меж-
клеточное вещество, отделяющее клетки от стенок капилляров. В межкле-
точном веществе имеются межклеточные щели, заполненные тканевой
жидкостью, которая находится в постоянном обмене с кровью. Лимфати-
ческие капилляры соединяются друг с другом, образуя сосуды. Из лим-
фатических сосудов жидкость собирается в грудной поток (ductus thora-
cicus) и из него поступает в яремную вену (vena jugularis).
Тканевая жидкость, проникая в лимфатические сосуды, медленным
потоком проходит через лимфатические узлы, где обогащается лимфо-
цитами. По пути своего передвижения тканевая жидкость меняет свой
химический состав и превращается в лимфу. Химический состав лимфы,
взятой из различных сосудов, неодинаков.
Лимфа является белковой жидкостью. Белковый состав лимфы близок
к составу белков плазмы крови. В лимфе имеются все факторы свертыва-
ния крови. Подобно крови, лимфа, выпущенная из сосудов, свертывается.
Лимфатические узлы участвуют в образовании иммунных веществ и
глобулинов. Эти вещества поступают в кровь вместе с лимфой. Количество
лимфы у человека составляет 1—2 л. На месте попадания лимфы в ярем-
ную вену содержание в ней белков достигает 5%. Отсюда можно заклю-
чить, что при попадании в кровь 1—2 л лимфы ею доставляется 50—100 г
белков.
i/4 18 Заказ № 581
553
Жиры пищи всасываются главным образом в лимфатические сосуды
(стр. 319). После приема пищи, особенно богатой жиром, содержание жиров в
лимфе (хилусе) оттекающей по сосудам от кишечника, достигает 4%. Жир в
лимфе находится в эмульгированном состоянии.
Ниже в таблице приводятся сравнительные данные химического состава
лимфы и плазмы крови.
вещество Лимфа шейного ствола Лимфа грудного протока Плазма
Вода (в %) 95 94 90
Белки (в %) 2 4 7
Фибриноген (в мг %) .... — 40 300
Глюкоза » ... 100 ПО 100
Натрий » ... 330 330 320
Калий » .... 23 24 20
Кальций » 10 11 10
Магний » 3 3 1,8
Хлор » 420 410 370
Неорг. фосфор » 3 4 3,7
ЛИТЕРАТУРА
Белик Я. В. и X од о р о в а Е. Л. Биохимия свертывания крови. Изд.
АН Украинской ССР, 1957.
Капланский С. Я. Функция белков крови в норме и при различных
патологических состояниях. В кн. «Химические основы процессов жизнедеятельности».
М., 1962, стр. 263.
КоржуевП. А. Эволюция дыхательной функции крови. Изд. АН СССР, 1949
Коржуев П. А. Гемоглобин. Изд. «Наука», М., 1965.
К р е п с Е. М. Дыхательный фермент — угольная ангидраза — и его значение
в физиологии и патологии. «Успехи современной биологии», 1944, т. 17, стр. 125.
Кудряшов Б. А. Проблемы свертывания крови. Изд. «Высшая школа», 1960.
Глава двадцать пятая
ОБМЕН ВЕЩЕСТВ В МОЛОЧНОЙ ЖЕЛЕЗЕ
ХИМИЧЕСКИЙ СОСТАВ МОЛОКА
Молочная железа — чрезвычайно важный орган; в ней образуется
молоко — единственный продукт питания млекопитающих на первом этапе
их постнатального развития. В молоке сбалансированы все питательные
вещества, необходимые для развития растущего организма.
Молочная железа является сложным органом, состоящим из желе-
зистой и соединительной тканей, и по своему происхождению относится
к группе кожных желез, эмбриологически близких к потовым
железам.
Молочная железа функционирует не постоянно, а во время так назы-
ваемого лактационного периода. Продолжительность лактационного периода
у различных видов млекопитающих различна, но у всех во время лакта-
ции физиологическая активность молочной железы высока. Между периода-
ми лактации молочная железа находится в состоянии покоя. Во время лак-
тации молочная железа функционирует беспрерывно, причем молоко
накапливается в альвеолах, протоках и специальных вместилищах молоч-
ной железы.
У коров лактационный период продолжается 300 дней, и за этот про-
межуток времени при обильном и рациональном кормлении у коровы обра-
зуется шесть и более тысяч литров молока. Количество плотных веществ,
выделяющихся за лактационный период высокоудойной коровы составляет
свыше 800 кг, что значительно превышает ее вес. Выделение такой массы
веществ лактирующей коровой связано не только с активными физиологиче-
скими процессами в самой молочной железе, где формируется ее секрет —
молоко, а с участием в процессе лактации других органов, особенно печени,
в которых происходит образование продуктов, предшественников составных
частей молока.
У женщин во время беременности, начиная Со второго месяца, молочная
(грудная) железа резко увеличивается, достигая полного развития после
родов, при кормлении ребенка. С возрастом железистая ткань постепенно
атрофируется и замещается соединительной тканью.
ПРЕДШЕСТВЕННИКИ СОСТАВНЫХ ЧАСТЕЙ МОЛОКА
К молочной железе с кровью притекают различные питательные вещест-
ва, из которых в ней формируется молоко. Молочная железа не только
«забирает» из крови те или иные вещества, но часто подвергает их коренной
переработке с образованием веществ, отличающихся по своей химической
структуре от доставляемых с кровью и присутствующих в кормах. От мо-
лочной железы с кровью оттекают вещества, не использованные для молоко-
18 Заказ № 581
555
образования, а также продукты, образовавшиеся в ней и не поступившие
в молоко. По изучению химического состава крови, притекающей к вымени
(артериальной) и крови оттекающей (венозной), можно получить представле-
ние о том, какие вещества используются для образования составных частей
молока. Если при этом изучить интенсивность кровообращения, т. е. ско-
рость притока артериальной крови и оттока венозной, то можно получить
представление о том, в каком объеме используются вещества, доставляемые
кровью к железе. Следовательно, при артерио-венозной разнице в содер-
жании различных веществ можно судить, чем снабжается молочная железа.
По химическому составу молока можно судить о переработке, которой под-
вергаются питательные вещества в ней.
Установлено, что примерно 10% энергии питательных веществ, погло-
щаемых молочной железой из крови, используется для ее «собственных»
нужд, т. е. для образования молока и его секреции. Как уже указывалось,
в функционирующей молочной железе молоко образуется беспрерывно и до
отдоя накапливается в альвеолах и специальных вместилищах железы.
Определенное количество энергии тратится на процесс секреции
молока.
Молочная железа поглощает из крови целый ряд веществ: белки и про-
дукты их распада (аминокислоты, полипептиды), глюкозу, липиды (жиры,
фосфатиды и др.), ацетоуксусную и оксимасляную кислоты и др. Одни из
поглощенных веществ подвергаются в железе коренной переработке, иные
(минеральные вещества, витамины) без изменения используются при обра-
зовании молока.
ПРЕДШЕСТВЕННИКИ БЕЛКОВ МОЛОКА
Установлено, что предшественниками белков молока являются достав-
ляемые к молочной железе с кровью аминокислоты, а также белки плазмы
крови, главным образом глобулины. Полагают, что 30—45% белков молока
синтезируются за счет доставляемых аминокислот, а остальное количество —
за счет белков крови, без предварительного полного распада их па аминокис-
лоты. Некоторое количество аминокислот подвергается в молочной железе
дезаминированию и образующиеся из них а-кетокислоты либо полностью
распадаются и в этом случае они используются для энергетических
целей, либо они превращаются в другие органические вещества (жиры,,
углеводы).
ПРЕДШЕСТВЕННИКИ ЛАКТОЗЫ
Молочная железа во время лактации поглощает из крови значительное
количество глюкозы. Главным, а возможно преимущественным, предшествен-
ником лактозы — единственного углевода молока, является глюкоза.
Установлено, что количество поглощенной из крови глюкозы достаточно
велико, чтобы обеспечить синтез лактозы, выделяемой с молоком. Отсюда
естественно предположение, что другие вещества, из которых теоретически
могла бы образоваться лактоза (промежуточные продукты распада углево-
дов и некоторых аминокислот), не играют в этом отношении существенной
роли.
Предполагалось, что для синтеза лактозы в молочной железе исполь-
зуется доставляемая к ней с кровью молочная кислота. Оказалось, однако,
что молочная кислота крови не поглощается молочной железой, и поэтому
она не может рассматриваться как предшественник лактозы.
Синтез лактозы удалось осуществить в опытах со срезами молочной
железы. В этих опытах было установлено, что лактоза легче всего синтези-
руется из глюкозы. Из молочной кислоты и из мальтозы лактоза не синте-
зируется.
556
Существенного значения, по-видимому, не имеют, как предшественники
лактозы, а-кетокислоты — продукты дезаминирования аминокислот, так
как дезаминирование аминокислот в молочной железе не достигает значи-
тельных размеров.
ПРЕДШЕСТВЕННИКИ ЖИРОВ
Основными источниками жира молока являются нейтральные жиры
плазмы крови. Молочная железа из притекающей к ней крови поглощает
значительные количества нейтральных жиров. Приблизительные расчеты
показывают, что 65% жира молока образуется из высокомолекулярных жир-
ных кислот, входящих в состав нейтральных жиров плазмы крови. Жирные
кислоты в составе фосфатидов, которые до недавнего времени считались
предшественниками жира молока, по современным данным существенной
роли в образовании молочного жира не играют.
Молочная железа поглощает из крови также ацетоуксусную, р-окси»
масляную и низкомолекулярные летучие кислоты, среди которых главное
место занимает уксусная кислота. Ацетоуксусная, р-оксимасляная и осо-
бенно уксусная кислоты также являются предшественниками жира молока.
Изучение артерио-венозной разницы для уксусной кислоты при одновре-
менном учете интенсивности кровоснабжения молочной железы, а также ко-
личества молока, показало, что молочная железа при образовании одного
литра молока поглощает из крови 7—8 г уксусной кислоты.
Возможность превращения уксусной кислоты, поглощаемой из крови,
а также образующейся из глюкозы, в жиры подтверждена опытами по изу-
чению дыхательного коэффициента лактирующей железы, а также ее.
срезов.
Дыхательный коэффициент лактирующей железы, вычисленный по ар-
терио-венозной разнице кислорода и углекислого газа, оказывается значи-
тельно выше единицы (от 1,3 и выше), в то время как дыхательный коэф-
фициент покоящейся молочной железы равен 0,81. При превращении уксус-
ной кислоты (С2Н4О2) и глюкозы (СбН12Об) в жирные кислоты (С18Н3бО2)
освобождается кислород, используемый в тканях как акцептор водорода
при окислении веществ. Соответственно уменьшается потребление кислорода
при дыхании. Дыхательный коэффициент , который вычисляется по
объему выделенного из организма углекислого газа и объему потребленного
кислорода, при наличии интенсивно идущего процесса образования жира
в молочной железе должен повышаться.
В опытах с добавлением к срезам лактирующей молочной железы раз-
личных видов животных глюкозы и уксусной кислоты также можно наблю-
дать, что дыхательный коэффициент у них выше единицы. Оказалось, что
срезы молочной железы кроликов используют (судя по величине дыхатель-
ного коэффициента) для образования жиров молока глюкозу и уксусную
кислоту, срезы же молочной железы крыс утилизируют для этой цели
преимущественно глюкозу; срезы желез жвачных животных интенсивно
используют уксусную кислоту.
Использование уксусной кислоты для синтеза жиров было показано
в опытах с введением в организм лактирующей коровы уксусной кисло-
ты, меченной радиоактивным углеродом. Оказалось, что различные жир-
ные кислоты, полученные из жира молока, обладали значительной ра-
диоактивностью.
Интенсивное использование уксусной кислоты для образования жира
молока у жвачных животных имеет большое биологическое значение.
В пищеварительном тракте (в рубце) жвачных животных основная масса
углеводов пищи подвергается воздействию микробов и сбраживается. При
этом основным продуктом брожения является уксусная кислота. Молочная
железа жвачных животных приспособлена к использованию для синтеза
жиров молока уксусной кислоты.
18*
557
БИОХИМИЧЕСКИЕ ПРОЦЕССЫ В МОЛОЧНОЙ ЖЕЛЕЗЕ
Изучение предшественников белков, углеводов и жиров молока еще не
дает представления о химических превращениях, которым они подвергаются
в молочной железе. Продукты, доставляемые кровью к молочной железе,
по своей химической природе отличаются от белков, углеводов и жиров
молока. Следовательно, они в молочной железе должны подвергнуться
переработке.
Синтез белков
Аминокислоты, поглощаемые молочной железой из крови, используют-
ся для синтеза белков молока — казеиногена, лактальбуминов и лактогло-
булинов. Как и в других случаях биосинтеза белков, следует полагать, что
аминокислоты, прежде чем соединиться друг с другом, активизируются
с образованием аденилатов аминокислот (стр. 440). Этот процесс происхо-
дит с использованием энергии макроэргической фосфатной связи аденозин-
трифосфорной кислоты. Затем активированные аминокислоты соединяются
друг с другом и дают пептидные связи. В молекуле казеиногена, так же как
в молекуле лактальбулинов и лактоглобулинов, остатки аминокислот рас-
положены всегда в определенном порядке. Как и в других случаях синтеза
белков, здесь возникает вопрос, каким образом комбинируются всегда в
определенном порядке активированные молекулы отдельных аминокислот
при синтезе белков веществ. По-видимому, в молочной железе, как и в
других органах, в синтезе белков участвуют нуклеиновые кислоты, и бла-
годаря этому аминокислоты реагируют друг с другом не хаотично, а в
определенной последовательности. (О биосинтезе белков см. стр. 471).
Следует отметить, что железистая ткань, вообще, и молочной железы,
в частности, богата нуклеиновыми кислотами.
Белки плазмы крови, поглощаемые молочной железой, прежде чем
превратиться в белки молока, должны подвергнуться значительной перера-
ботке. Главный по своему содержанию белок молока — казеиноген значи-
тельно отличается по строению от альбуминов и глобулинов плазмы крови.
Эта перестройка белков плазмы крови может заключаться в распаде их на
аминокислоты с последующим синтезом из них белков молока или же в
распаде их на полипептиды, которые путем транспептидации (стр. 442) мо-
гут быть использованы для синтеза белков молока.
Синтез лактозы
Лактоза — единственный углевод (дисахарид) молока; в составе дру-
гих физиологических жидкостей, а также в составе тканей организма она
не встречается. Следовательно, синтез лактозы происходит только в молоч-
ной железе. Предшественником лактозы является глюкоза, которая, как
известно, интенсивно поглощается из крови молочной железой. Лактоза
построена из остатка молекулы галактозы и из остатка молекулы глюкозы.
Отсюда следует считать, что часть поглощенной из крови глюкозы превра-
щается в молочной железе в галактозу, т. е. она подвергается внутримолеку-
лярной перестройке.
В молекулах глюкозы и галактозы атомы водорода и гидроксильные
группы пространственно расположены различно.
Синтез лактозы в молочной железе складывается из образования из
глюкозы галактозы и соединения молекулы галактозы с молекулой глюкозы
(образование глюкозидной связи).
Превращение глюкозы в галактозу — сложный ферментативный про-
цесс. Известна ферментная система, превращающая глюкозу в галактозу.
В этом превращении участвуют аденозинтрифосфорная кислота и уридин-
трифосфорная кислота (УТФ).
558
н он
D-Галактоза
D-Глюкоза
D-Лактоза
С участием фосфоглюкозокиназы происходит фосфорилирование глю-
козы согласно следующему уравнению:
Глюкоза + АТФ—глюкозофосфорная кислота +АДФ. (1).
Далее глюкозофосфорная кислота взаимодействует с УТФ с образова-
нием уридиндифосфоглюкозы:
Глюкозофосфорная кислота 4- УТФ—УДФ-глюкоза 4- Н4Р2О7. (2)
Затем УДФ-глюкоза превращается в УДФ-галактозу:
Уридил дифосфогалактоза
559
Происходит это следующим образом:
УДФ-галактоза+глюкозо-1-фосфорная кислота-*
—^лактозо-1 -фосфорная кислота+УДФ. (3)
Лактозо-1 -фосфорная кислота—^лактоза+Н 3РО4 (4)
УДФ -ЬАТФ->УТФ4 АДФ (5)
Реакция синтеза уридиндифосфоглюкозы (2) имеет особо важное значе-
ние для синтеза лактозы по следующим соображениям.
Образование уридиндифосфоглюкозы является этапом превращения
глюкозы в галактозу. Далее, в молекуле уридиндифосфоглюкозы имеется
глюкозидфосфорная связь, которая затем сохраняется в молекуле уридин-
дифосфогалактозы (галактозидфосфатная связь). Эта связь в дальнейшем
используется для образования глюкозидной связи при синтезе лактозы.
Таким образом, синтез лактозы сложный ферментативный процесс, при
котором имеет место перестройка глюкозы с образованием галактозы.
Синтез жира
Синтез жира в молочной железе — сложный процесс, в котором уча-
ствуют жиры плазмы крови, углеводы и низкомолекулярные соединения,
образующиеся при сбраживании углеводов в рубце, главным образом ук-
сусная кислота.
Жиры молока отличаются по своему составу от жиров пищи и от жиров
плазмы крови. В составе жиров молока имеются жирные кислоты с различ-
ными по своей длине цепями атомов углерода, начиная от масляной кислоты.
Для всех жирных кислот молочного жира характерно построение их из
четного числа атомов углерода.
Установлена связь между составом жирных кислот молочного жира и
жиром корма. Жирные кислоты некоторого количества жиров корма непо-
средственно, не подвергаясь изменениям, используются для синтеза жиров
молока. Наряду с этим жирные кислоты жиров корма, в также жирные кис-
лоты жиров крови в молочной железе подвергаются перестройке, заключаю-
щейся в укорочении цепи атомов углерода и в дегидрогенизации. Все это
приводит к образованию жирных кислот, входящих в состав молочного жи-
ра, имеющих углеродные цепи от 4 до 18 и выше атомов углерода и в из-
вестной мере являющихся ненасыщенными жирными кислотами.
Образующиеся в молочной железе в результате гидролиза доставляе-
мых с кровью жиров жирные кислоты в случаях укорочения или удлинения
углеродной цепи подвергаются процессу ^-окисления (стр. 321) с последова-
тельным отщеплением (в случае укорочения) или же присоединением (в слу-
чае удлинения) молекул ацетил ~SKoA.
Образующаяся в результате брожения углеводов в рубце масляная
кислота может в молочной железе использоваться непосредственно для син-
теза жира или же служить материалом для синтеза высокомолекулярных
жирных кислот. Точно так же доставляемая с кровью уксусная кислота
после взаимодействия с HSKoA и ацетил —SKoA, образующаяся в резуль-
тате распада глюкозы, в молочной железе является материалом для синте-
за жирных кислот.
Жирные кислоты независимо от сложности их структуры (длины угле-
родной цепи), прежде чем быть использованными, должны подвергнуться
активированию в карбоксильной группе путем образования ацильных про-
изводных кофермента А. Активированные жирные кислоты в дальнейшем в
одних случаях подвергаются {3-окислению, с укорочением или же удлине-
нием углеродной цепи, в других — дегидрогенизации с образованием нена-
сыщенных жирных кислот. Активированные жирные кислоты соединяются
с глицерином и образуют нейтральные жиры — составные части молока.
560
Другие физиологические процессы в молочной железе
Кроме процессов синтеза белков, лактозы и жиров, в молочной железе
при образовании молока происходит «отбор» из притекающей крови целого
ряда веществ, которые не подвергаются какой-либо переработке. Сюда
относятся минеральные вещества, витамины, ферменты, гормоны и др.
Отбор этих веществ при молэкообразовании является физиологически ак-
тивным процессом, а не фильтрованием их из крови. Правильность сказан-
ного подтверждается тем, что концентрация многих составных частей молока
оказывается выше концентрации их в плазме крови.
Следовательно, молочная железа обладает способностью концентриро-
вать вещества, доставляемые к ней с кровью. Это относится как к веществам,
подвергающимся в ней глубокой перестройке, так и к веществам, выделяю-
щимся без изменения с молоком.
РЕГУЛЯЦИЯ ПРОЦЕССОВ ОБРАЗОВАНИЯ И ОТДЕЛЕНИЯ
МОЛОКА
Образование молока и накопление его во вместилищах молочной желе-
зы является сложным физиологическим процессом, в который вовлекается
не только молочная железа, но и другие органы. Во время лактации, осо-
бенно это относится к лактации жвачных (коров), у которых этот процесс
имеет место продолжительное время (300 дней в году), происходит значитель-
ная перестройка физиологических и биохимических функций всего организ-
ма. Неудивительно поэтому, что функция молочной железы регулируется
нервной системой и находящимися под ее влиянием железами внутренней
секреции. Молочная железа обильно и разнообразно снабжена нервами,
причем нервные волокна вступают в непосредственный контакт с клетками
железистой ткани. Установлено, что денервация вымени приводит к рез-
кому снижению образования молока. Болевые раздражения также приводят
к уменьшению образования молока.
Влияние нервных центров на молокообразование хорошо известный
факт. Кормящая мать при душевных и эмоциональных переживаниях «теря-
ет» на время молоко. Установлено наличие рефлекторных механизмов лакта-
ции. Манипуляции, обычно предшествующие доению коров, усиливают
отделение молока.
На развитие молочных желез и на лактацию влияют гормоны. В гипо-
физе вырабатывается лактогенный гормон (стр. 209), стимулирующий про-
цесс образования молока, а также развитие молочной железы. На лактацию
прямым или косвенным путем действуют гормоны щитовидной железы,
надпочечников, паращитовидной железы.
В опытах на животных показано, например, что удаление щитовидной
железы приводит к значительному снижению лактации и изменению состава
молока (уменьшению содержания в нем лактозы, жира и др.).
ХИМИЧЕСКИЙ СОСТАВ МОЛОКА
Молоко содержит в себе многочисленные вещества в соотношениях
благоприятных для развития растущих организмов. Это ценнейший пище-
вой продукт, удовлетворяющий все потребности ребенка и новорожденных
млекопитающих. Молоко животных как прекрасный пищевой продукт
используется человеком во все периоды жизни. Из него готовят различные
молочные продукты (простоквашу, кефир, кумыс, сливки, сметану, сыр
и др.)
Молоко различных видов млекопитающих состоит из одних и тех же
составных частей, однако концентрация их оказывается неодинаковой в
молоке различных животных. Надо полагать, что состав молока, количест-
561
венное содержание в нем различных веществ приспособлено к потребностям
развития и роста тех или иных видов животных. Приведенная ниже табли-
ца показывает наличие связи между ростом новорожденных и содержанием
(концентрацией) в молоке белков и минеральных веществ.
Вид животных Время, в течение которого уд- ваивается вес новорожден- ного (в днях) Содержа- ние белка, % Содержа- ние мине- ральных веществ (золы), %
Лошадь 60 2,0 0,4
Корова 47 3,5 0,7
Коза 19 4,3 0,8
Свинья 18 5,9 0,8
Овца 10 6,5 0,8
Собака 8 7,1 10,4 1,3
Кролик 6 2,5
Молоко представляет собой непрозрачную белую жидкость, с реакцией,
близкой к нейтральной, обладающую характерным запахом и вкусом. За-
пах и вкус молока различны у разных животных и в известной мере зави-
сят от корма животных. В молоке эмульгированы капельки жира, покрытые
белковой оболочкой. Белый цвет молока обусловлен отражением света
эмульгированными капельками жира и белка.
Молоко при подкислении, а также под влиянием химозина (стр. 161)
свертывается вследствие выпадения казеина. После удаления сгустка полу-
чают жидкость зеленоватого цвета — сыворотку молока.
Молоко содержит в растворенном виде много веществ, удельный вес
которых выше единицы. Удельный вес молока различных животных колеб-
лется в пределах 1,028—1,036 при 15° С.
Белки молока
Важнейший белок молока казеиноген относится к числу сложных бел-
ков — протеидов. Небелковым компонентом казеиногена является фосфор-
ная кислота. Основное количество фосфорной кислоты в казеиногене свя-
зано эфирной связью с остатком серина. Казеиноген — типичный представи-
тель фосфопротеидов. Содержание фосфорной кислоты в казеиногене
составляет около 0,9%.
Казеиноген обладает явно выраженным свойством кислоты и в молоке
находится в виде анионов, растворимых в воде (кальцинат казеиногена).
Недиссоциированные молекулы казеиногена мало растворимы в воде.
Изоэлектрическая точка казеиногена находится при pH 4,7. Этим объяс-
няется то, что при подкислении до pH 4,7 молоко свертывается благодаря
выпадению в осадок казеиногена. Свертывание молока происходит также
вследствие образования молочной кислоты из лактозы под влиянием молоч-
нокислых бактерий. Молочная кислота сдвигает реакцию в кислую сторону,
что способствует выпадению в осадок казеиногена.
При ферментативном свертывании молока (действие химозина, пепсина)
казеиноген подвергается химическим изменениям с образованием из него
казеина. Кальциевая соль казеина, в противоположность кальциевой соли
казеиногена, нерастворима в воде. Превращением казеиногена в казеин
объясняется ферментативное свертывание молока.
В простокваше и в близких к ней молочных продуктах в свернутом
состоянии находится казеиноген, при ферментативном же свертывании моло-
ка — казеин. Свертывание молока пепсином или химозином используют в
сыроварении. При свертывании молока сгусток казеина захватывает часть
562
жира молока. Образующийся творог подвергается воздействию микробов,
и казеин претерпевает некоторые изменения. Период воздействия микро-
бов на казеин носит название «созревания» сыра. Вкусовые качества сыра
определяются скоростью ферментативного превращения казеиногена в
казеин и условиями созревания сыра, которые создаются подбором соот-
ветствующих микробов. Качество сыра зависит также от содержания в нем
жира, захваченного казеином при свертывании молока.
Казеиноген (казеин) — полноценный белок, так как при распаде его об-
разуются все незаменимые аминокислоты. Высокая пищевая ценность ка-
зеиногена, кроме этого, определяется еще входящей в его состав фосфорной
кислотой. Вместе с казеиногеном в организм ребенка и молодых животных
поступает необходимая для роста костей фосфорная кислота, которая
играет также роль и в процессах обмена веществ.
Значительная часть фосфора молока входит в состав казеиногена.
Казеиноген в молоке представлен кальциевой солью (казеинат кальция).
Следовательно, два важных минеральных вещества — фосфор и кальций —
доставляются в организм вместе с казеиногеном (казеином). В молоке раз-
личных видов животных содержание кальция и фосфора зависит от содер-
жания казеиногена: чем больше в молоке казеиногена, тем больше в нем
кальция и фосфора. Молоко включает эти два минеральных вещества в фи-
зиологически оптимальных соотношениях, и поэтому они хорошо усваива-
ются организмом.
Наряду с казеиногеном, в молоке содержатся еще и другие белки. После
удаления казеиногена из молока получают сыворотку, в состав которой
входят глобулины и альбумины. Главным белком сыворотки молока яв-
ляется р-лактглобулин. Он получен в виде кристаллов. Содержание Р-лакт-
глобулина в сыворотке молока составляет 60 % от общего количества белков
сыворотки. В сыворотке содержатся еще а-глобулины и ^-глобулины,
обладающие свойствами антител.
Казеиноген и р-лактглобулин являются важнейшими в пищевом отно-
шении белками молока, они содержат все незаменимые аминокислоты, но
в различных количественных соотношениях. Вместе взятые казеиноген и
р-лактглобулин обладают оптимальными количествами незаменимых ами-
нокислот.
р-Лактглобулин — белок, лучше других обеспечивающий рост молодых
животных.
у-Глобулины молока близки по своим свойствам к у-глобулинам сыво-
ротки крови. То же самое можно сказать об альбуминах молока.
Ниже приводятся данные о содержании аминокислот в казеиногене и в
р-лактглобулине коровьего молока.
Аминокислоты Содержание в Содержание в
казеиногене, % ^-лактглобу-
лине, %
Аланин 1,85 7,1
Г лицин 0,5 1,4
Серин 0,5 4,0
Треонин 4,9
Лейцин и изолейцин 9,7 21,4
Лизин 6,3 12,6
Аргинин 3,8 2,9
Цистин 0,31 3,4
Метионин 3,4 3,2
Валин . . 6,7 5,6
Аспарагиновая кислота .... 4,1 21,8 11,5
Глутаминовая кислота .... 19,1
Оксиглутаминовая кислота . . 10,5 ——
Гистидин 1,83 1,6
Фенилаланин 3,9 3,8
Тирозин 6,5 3,6
Триптофан 2,2 8,0 1,9
Пролин 5,1
563
Углеводы молока
Лактоза является единственным углеводом, входящим в состав молока.
Некоторые штаммы дрожжей, а также некоторые другие микроорганизмы,
вызывают спиртовое брожение лактозы.
Жиры молока
Жир молока имеет сложный состав, вернее, он является смесью раз-
личных жиров. При гидролизе жира молока получают наряду с глицерином
смесь различных по своей химической структуре жирных кислот. Данные
о содержании жирных кислот в жире молока коровы приводятся ниже.
Жирные кислоты Содержание. %
Масляная.................... 4,26
Капроновая.................. 1,64
Каприловая.................. 1,16
Капроновая.................. 1,19
Лауриновая.................. 5,01
Миристиновая............... 16,43
Пальмитиновая ............. 14,83
Стеариновая................. 3,40
Диоксистеариновая .... 0,38
Олеиновая ................. 44,42
Из этих данных видно, что в жире молока (смеси жиров) больше всего
олеиновой кислоты, затем миристиновой и пальмитиновой кислот. В значи-
тельном количестве в жире молока представлена масляная кислота.
В жире молока имеются жирные кислоты, начиная от масляной (С4)
и кончая стеариновой (С18). Триглицериды с низкомолекулярными жирны-
ми кислотами составляют около 10% от общего количества жира молока.
В жире молока женщины отсутствуют жирные кислоты, содержащие в своих
молекулах меньше чем 10 атомов углерода.
В молоке имеется небольшое количество фосфатидов и холестерина.
Другие органические вещества молока
В молоке содержится ряд ферментов (амилаза, фосфатаза, каталаза,
ксантиноксидаза, дегидрогеназы и др.) При кипячении молока ферменты
инактивируются. По способности молока обесцвечивать метиленовую синь в
присутствии альдегида (муравьиного, уксусного) можно различить свежее
и кипяченое молоко (проба Шардингера). Кипяченое молоко метиленовую
синь не обесцвечивает, так как в нем альдегид-дегидрогеназа (фермент,
катализирующий окисление альдегидов) разрушена.
В молоке содержатся некоторые витамины. Особенно богато молоко
витамином А и витамином В2. Первый имеется в липидной фракции молока,
а также в масле, второй — в сыворотке молока. Зеленоватая окраска сыво-
ротки молока зависит от наличия в ней витамина В2 (флавина). В молоке
содержатся также аскорбиновая кислота (витамин С) и витамины группы
В, но в меныпих количествах. Витаминов D и Е в молоке очень мало.
Содержание витаминов в молоке не постоянно и зависит от наличия их
в составе кормов. Летом и осенью коровье молоко более богато витаминами,
чем зимой и весной.
Различно содержание в молоке витамина С (аскорбиновой кислоты).
В коровьем молоке витамина С 1—2 мг%, в молоке кобылы —30—33мг%.
В женском молоке содержание витамина С составляет 3—6 мг%.
Учитывая невысокое содержание витаминов D и С в молоке, полезно
обогащать его при питании детей, добавлением препаратов этих витаминов.
564
Минеральные составные части молока
Молоко сравнительно богато кальцием, фосфором, калием, натрием,
магнием и хлором. В нем обнаруживаются и другие минеральные вещества,
но в малых количествах. Минеральных веществ в молоке достаточно для
удовлетворения в них потребности растущего организма, за исключением
железа и меди. Новорожденные содержат некоторый запас железа (воз-
можно также и меди), поэтому они не терпят недостатка в этих элементах.
Недостаток в железе и в меди ощущают растущие организмы в тех случаях,
когда молоко в течение продолжительного времени является у них един-
ственным источником питания.
Молоко, как уже указывалось, наилучший источник фосфора и каль-
ция для организма, особенно растущего.
Процентное содержание минеральных веществ в золе молока следую-
щее:
Зола женского молока .
Зола коровьего молока .
Са Mg Р
16,7 2,2 7,3
16,8 1,7 11,6
Na К С1
5,3 23,5 16,5
5,3 20,7 13,6
Коровье молоко содержит несколько больше фосфора и несколько мень-
ше магния, чем женское молоко.
ХИМИЧЕСКИЙ СОСТАВ И ПИЩЕВАЯ ЦЕННОСТЬ МОЛОКА
РАЗЛИЧНОГО ПРОИСХОЖДЕНИЯ
Качественный состав молока различных животных, а также женского
молока в основном один и тот же, различия обнаруживаются в количествен-
ном содержании отдельных составных частей в молоке различного проис-
хождения. Представление о среднем химическом составе молока различного
происхождения дают следующие данные:
Составные части молока Женское молоко Коровье молоко Козье молоко Кобылье молоко
Плотность 1,032 1,032 1,033 1,034
Вода 88,0 87,6 86,0 90,0
Сухой остаток 12,0 12,4 14,0 10,0
Белки (все) ... 2,3 3,8 3,1 1,7
Казеиноген 1,5 2,9 2,4 1,3
Глобулины и альбумины 1,0 0,8 0,7 0,4
Лактоза 6,5 4,6 4,8 6,5
Жир ... 4,Ь 3,8 4,3 2,0
Зола 0,3 0,7 0,8 0,3
Калий .... 0,050 0,140 0,142 0,08
Натрий 0,015 0,037 0,046 0,010
Кальций 0,030 0,140 0,142 0,083
Магний 0,004 0,012 0,009 0,007
Железо 0,00015 0,00006 — —
Фосфор 0,015 0,080 0,110 0,054
Хлор 0,050 0,100 0,100 0,300
Медь 0,00005 0,00003 —
Фтор 0.00005 0.00026 —-
Женское молоко содержит меньше белков и больше лактозы, чем коровье
молоко. В коровьем молоке значительно (в 2—2,5 раза) больше минераль-
ных веществ (золы), чем в женском молоке. Для приближения содержания
белков и углеводов коровьего молока к женскому, его разбавляют в 1,5—
2 раза водой и добавляют сахар.
565
Молоко — ценный пищевой продукт не только по своему химическому
составу. Переваривание и усвоение составных частей молока происходит
легко и без больших энергетических затрат. С этой точки зрения, молоко
выгодно отличается от других пищевых продуктов.
МОЛОЗИВО
В первые дни после родов молочная железа выделяет жидкость, отлич-
ную по своим физическим и биологическим свойствам от молока. Эта жид-
кость носит название молозива. Свежее молоко при кипячении не сворачи-
вается, что же касается молозива, то оно при кипячении образует большой
осадок. Это различие связано с белковым составом молока и молозива.
Коровье молоко содержит около 4% белков, состоящих преимущественно
(на 80%) из казеиногена. Белков в молозиве до 20%, причем около полови-
ны их составляют глобулины, обладающие иммунными свойствами. Эти
глобулины содержат все антитела, имеющиеся в крови матери, и создают
пассивный иммунитет новорожденного.
Переход от молозива к молоку, который происходит через несколько
дней после начала лактации, сопровождается уменьшением содержания
в нем иммунных глобулинов. Новорожденный получает антитела путем
всасывания глобулинов через стенку кишечника в течение первых дней пос-
ле рождения, но они могут быть обнаружены в его крови в течение несколь-
ких месяцев.
Женское молозиво в два-три раза богаче белками, чем молоко. Оно
также богато иммунными глобулинами.
Молозиво обычно окрашено в темно-желтый или оранжевый цвет, что
обусловлено высоким содержанием в нем каротина. Содержание каротина
в молозиве в 50—100 раз выше, чем в молоке. Молозиво богаче витаминами
чем молоко.
Молозиво, таким образом, важный пищевой продукт, снабжающий
организм новорожденного не только белками, жирами, углеводами, вита-
минами и минеральными веществами, но и антителами.
ЛИТЕРАТУРА
Ин и хов Г. С. Химия молока и молочных продуктов. Пищепромиздат, 1941.
Ко р ж у е в П. А. О биологических основах жиромолочности «Успехи совре-
менной биологии», 1956, т. 42, стр. 215.
Никитин В. Н. Биохимия лактации и процесса синтеза молочного жира.
«Успехи современной биологии», 1953, т. 35, стр. 57.
Никитин В. Н. и Каплан В. А. Источники и пути образования жира мо-
лока у жвачных животных. «Успехи современной биологии», 1954, т. 38, стр. 319.
Энгельгардт В. А. Ферментные системы, участвующие в молокообразо-
вании. «Успехи современной биологии», 1950, т. 29, стр. 60,
Глава двадцать шестая
БИОХИМИЯ МЫШЦ
Мышцы (поперечнополосатые, сердечная, гладкие) составляют более
40% веса человека и животных. Особенно развита и дифференцирована по-
перечнополосатая мускулатура, обеспечивающая произвольные движения,
передвижение и работу организма.
Чрезвычайно важна сердечная мышца, работа которой обеспечивает
кровообращение. Гладкие мышцы, расположенные вдоль стенок органов
пищеварительного тракта, в легких, в стенках крупных кровеносных сосу-
дов, выводных протоков пищеварительных желез и в других внутренних
органах, выполняют ряд важных физиологических функций (передвиже-
ние пищевой кашицы, выделение пищеварительных соков, поддержание
тонуса сосудов и др.).
Основная функция мышц — их сокращение и расслабление. Эту функ-
цию обычно называют сократительной.
Сократительная функция мышц связана с превращением химической
энергии в механическую. Работа мышц сопровождается резким усилением
процессов обмена веществ, усиленным использованием энергетических
ресурсов организма.
Мышцы с давних пор являются объектом биохимического изучения,
так как они не только выполняют важную функцию в организме, но и срав-
нительно легко доступны для изучения: они без особых повреждений изо-
лируются из организма (особенно амфибий), способны вне организма сокра-
щаться и расслабляться, следовательно, выполнять работу, причем объем
выполненной работы поддается строгому учету. Можно, например, пользу-
ясь изолированной из организма мышцей, установить, какие именно веще-
ства и в каком объеме являются источниками энергии для работы мышц,
а также обнаружить зависимость между тратой тех или иных веществ
и величиной выполненной мышцей работы. Все это привело к тому, что био-
химические процессы в мышцах изучены более детально, чем в других тка-
нях и органах. Многие закономерности обмена веществ, общие для всех
тканей и органов, впервые были установлены в мышечной ткани. Так, на-
пример, анаэробный гликолиз — постепенный распад углеводов с образова-
нием молочной кислоты, сопровождающийся образованием многочислен-
ных промежуточных продуктов, был прежде всего изучен в мышцах. Роль
фосфорных соединений, значение аденозинтрифосфорной кислоты в ис-
пользовании химической энергии в тканях были изучены в мышцах. Бла-
годаря этому современная биохимия располагает большим эксперименталь-
ным материалом, выяснившим химический состав мышц, ферментативные
процессы, протекающие в мышечной ткани, и биохимические процессы, ле-
жащие в основе деятельности мышц.
567
ХИМИЧЕСКИЙ СОСТАВ СКЕЛЕТНЫХ МЫШЦ
Структурная единица скелетной мышцы — мышечное волокно — много-
ядерная клетка длиной в несколько сантиметров, диаметром в 0,2—0,1 мм.
Внутри волокна, в саркоплазме, расположены в виде пучков нитей миофиб-
риллы — сократительные элементы мышечного волокна. Миофибриллы обла-
дают видимой под микроскопом поперечной исчерченностью, зависящей
от оптической неоднородности входящих в их состав белковых веществ.
Мышечное волокно покрыто соединительнотканной оболочкой — сарколем-
мой. Из мышечных волокон состоят мышечные пучки, содержащие некото-
рое количество соединительной ткани. Обычно химический состав мышцы
изучается не в отдельно взятых ее микроскопических элементах, а в общей
массе. Для полного представления о составных частях мышечных волокон
учитывают содержание в мышце белков соединительной ткани.
В скелетных мышцах теплокровных животных 75—80% воды и 20—
25% сухого остатка. Содержание воды в работающей до утомления в орга-
низме мышце значительно увеличивается и достигает 80—83%. В мышцах
холоднокровных животных воды обычно 80—82%.
Плотный остаток состоит в значительной мере из белков (до 85%)..
БЕЛКИ МЫШЦ
При экстрагировании охлажденных измельченных мышц холодной во-
дой получают фракцию белков, известную под названием миогена; миогено-
вая фракция белков детально изучена, и многие ее составные части выделены
в кристаллическом виде. Часть миогеновой фракции белков составляют
ферменты, катализирующие отдельные этапы процесса анаэробного'
гликолиза и превращение ряда других веществ.
При экстрагировании измельченных мышц 0,1 М раствором КО полу-
чают белковый раствор, из которого при диализе выпадает осадок белков,
получивший название глобулина X. Глобулин X представляет собой фрак-
цию, содержащую многие белки (до 20% всех белков мышц). Составные части
этой белковой фракции окончательно еще не изучены.
При экстрагировании измельченных мышц 0,6 М раствором КО и
при дальнейшем диализе экстракта выпадает в осадок белковая фракция,
получившая название миозина. Миозиновая фракция белков входит в состав
фибрилл мышечных волокон, являющихся сократительной структурой мышц,
поэтому миозин называют сократительным белком мышц (правильнее была
бы его назвать фракцией сократительных белков мышц). После извлечения
измельченных мышц 0,6 М раствором КО остается еще белковый осадок,
состоящий из белков мышечной стромы. Данные о содержании различных,
белковых фракций в мышцах высших животных приводятся ниже:
Белковая фракция Содержание в процентах
к общему количеству
белков мышц
Миогеновая......................... 20
Миозиновая........................ 40
Глобулин X......................... 20
Белки стромы.........• • 20
Миозиновая фракция. При многочасовом экстрагировании измельчен-
ных мышц 0,6 М раствором КО получают белковый раствор, обладающий
большой вязкостью и двойным лучепреломлением в потоке; при кратковре-
менном экстрагировании (20—30 мин) получают белковый раствор со слабой
вязкостью и с незначительным двойным преломлением в потоке. Оказалось,
что при длительном экстрагировании 0,6 М раствором КС1 в раствор пере-
ходит наряду с миозином еще один белок, входящий в состав стромы мышщ
Его назвали актином.
568
Миозин выделен в очищенном виде, частички его ориентированы в про-
странстве, не образуя истинных кристаллов. Молекулярный вес миозина
около 420 000. Миозин, поскольку он извлекается из мышц солевым раство-
ром (КС1), следовало бы отнести к глобулинам. Однако, в противополож-
ность истинным глобулинам, он растворяется в чистой, не содержащей
солей, воде.
Чистый миозин состоит из близких друг к другу по своим физическим
свойствам белков, которые удается в известной мере расчленить на состав-
ные части. Один из них с большим молекулярным весом — тяжелый меро-
миозин — получил название Н-меромиозина. Другой — с меньшим моле-
кулярным весом назван L-меромиозином. Молекулярное соотношение обоих
меромиозинов в миозине L : Н равно 2:1. Н-меромиозин обладает адено-
зинтрифосфатазной активностью и связывается с актином (см. ниже) с
образованием актомиозина. L-Меромиозин этими свойствами не обладает.
Н- и L-Меромиозины отличаются друг от друга по содержанию в них
аминокислот.
Миозин содержит большое количество глутаминовой кислоты, лейци-
на, лизина. Содержание аминокислот в очищенном миозине мышц кролика
следующее:
Аминокислоты Содержание
в миозине,
%
Аргинин........................................ 7,0
Гистидин..................................... 1,7
Лизин.................................. . 10,3
Глутаминовая кислота ......................... 22,1
Аспарагиновая кислота ......................... 8.9
Тирозин........................................ 3,4
Серин ........................................ 3,9
Треонин........................................ 4,9
Цистин ........................................ 1,4
Метионин ...................................... 3,4
Триптофан ... . ........................... 0,8
Глицин......................................... 1.9
Аланин ...................................... 6,3
Лейцин .................................. 15 6
Валин.......................................... 2,6
Фенилаланин.................................... 4,3
Пролин ........................................ 1,9
Актин, открытый Штраубом, легко экстрагируется из измельченных
мышц водой после удаления из них миозина извлечением 0,6 М раствором
КО и последующей обработкой ацетоном. Он является глобулярным белком с
молекулярным весом около 70 000. Актин может существовать в двух резко
отличающихся по своим физико-химическим свойствам формах: глобуляр-
ной и фибриллярной. Первая форма называется Г-актином, вторая — Ф-ак-
тином. Изучение этих двух форм актина с помощью электронного микроско-
па показало, что в результате ассоциации глобул Г-актина образуются фиб-
риллы полимеризованного актина (Ф-актин). Растворы Г-актина подвижны
и обладают незначительной вязкостью, растворы же Ф-актина обладают
большой вязкостью. Г-Актин легко переходит в Ф-актин и наоборот. Пере-
ход Г-актина в Ф-актин принято называть активацией Г-актина. Превра-
щение Г-актина в Ф-актин, т. е. активацию, можно вызвать добавлением
к раствору Г-актина хлористого калия или хлористого магния.
Содержание актина составляет около 3% веса мышц. В покоящейся
мышце он находится в фибриллярной форме. Предполагают, что при рабо-
те мышц Ф-актин превращается в Г-актин.
Актин легко соединяется с миозином с образованием комплекса — ак-
томиозина.
569
Актомиозин получают путем продолжительного экстрагирования из-
мельченных мышц 0,6 М раствором КС1. Его можно также получить, сме-
шивая растворы миозина и актина. Актомиозин обладает большой вяз-
костью. При понижении концентрации солей в растворе он образует гель.
При выдувании раствора актомиозина через тонкую трубочку в чистую воду
он застывает с образованием тонких нитей. Эти нити обладают способностью
укорачиваться (сжиматься) в присутствии аденозинтрифосфорной кислоты и
ионов магния и калия (0,001 М MgCl2 и 0,05 М КС1). При сжимании из ни-
тей (актомиозинового геля) выдавливается вода (синерезис коллоида) и об-
разуется компактный малогидратированный комочек белка.
При высоких концентрациях (0,6 М) хлористого калия раствор акто-
миозина при добавлении к нему аденозинтрифосфорной кислоты распадает-
ся на актин и миозин — с резким снижением вязкости. Сцент-Дьиордьи и
его сотрудники показали, что сократительным белком фибрилл мышеч-
ного волокна является миозин в комплексе с актином, т. е. акто-
миозин.
Изолированные мышечные волокна, вымоченные в течение нескольких
дней в дистиллированной воде (из них при этом удаляются растворимые
в воде составные части) и потерявшие возбудимость, сокращаются при взаи-
модействии их с раствором аденозинтрифосфорной кислоты.
Вымоченные (мацерированные) мышечные волокна, и тем более акто-
миозиновые нити, могут служить только лишь отдаленными моделями жи-
вых мышечных клеток, и данные, получаемые при их изучении, хотя и пред-
ставляют интерес, однако не могут без должной проверки переноситься на
мышечные волокна, на способность их сокращаться и расслабляться.
Сокращение мышечных волокон вызывается импульсами, идущими от
нервных окончаний. В ответ на раздражение нерва мышца реагирует быст-
рым сокращением, а затем расслаблением. Мацерированные же, безжизнен-
ные мышечные волокна при взаимодействии их с аденозинтрифосфорной
кислотой в водном растворе сокращаются медленно и не расслабляются да-
же после отмывания от них аденозинтрифосфорной кислоты. Все же следует
указать, что установленный факт изменения физико-химического состояния
актомиозиновых нитей и мацерированных мышечных волокон под влиянием
аденозинтрифосфорной кислоты представляет значительный интерес, так
как он расширяет наши представления о физиологической роли аденозин-
трифосфорной кислоты в мышцах (стр. 578).
Большой интерес представляют исследования Хаксли и Хенсона, по-
казавшие, что в покойных мышечных фибриллах актин и миозин лока-
лизированы в различных сегментах (саркомерах) и образуют две систе-
мы тончайших нитей различного диаметра. Эти миозиновые и актино-
вые нити в состоянии покоя только частично входят друг в друга. При
сокращении же миофибрилл миозиновые и актиновые нити проникают друг
в друга и это обусловливает мышечное сокращение.
Проникновение друг в друга нитей миозина и актина является при-
чиной, а, возможно, следствием сокращения миофибрилл.
Другие мышечные белки. Глобулин X, а также белки мышечной стромы,
за исключением актина, остаются еще мало изученными. Все еще неизвест-
на роль их в сокращении мышц.
Тропомиозин выделен из мышц в кристаллическом виде Бейли при
обработке мышц органическими растворителями. Тропомиозин в присут-
ствии солей дает разведенный водный раствор. При диализе сильно увели-
чивается вязкость, но тропомиозин не выпадает в осадок.
Содержание тропомиозина в мышцах составляет 1—3 %.
Из ядер мышечных волокон выделен нуклеопротеид.
Мышцы содержат соединительнотканные белки (коллаген), не входя-
щие в состав мышечных волокон, в количестве 15—20%. При заболеваниях
570
мышц, сопровождающихся убылью мышечных волокон (их истончением
и распадбм), процентное содержание соединительнотканных белков возра-
стает, а белков мышечных волокон снижается.
ЭКСТРАКТИВНЫЕ ВЕЩЕСТВА МЫШЦ
Вещества, экстрагирующиеся из мышц, составляют группу экстрактив-
ных веществ. Среди них имеются органические азотистые вещества, органи-
ческие безазотистые вещества и минеральные соли.
Азотистые экстрактивные вещества мышц
Скелетные мышцы богаты азотистыми небелковыми веществами, легко-
растворимыми в воде. Содержание небелкового азота, т. е. азота, входяще-
го в состав всех азотистых небелковых веществ мышц, составляет
300—350 мг%.
Основным по количественному содержанию и важным в физиологиче-
ском отношении азотистым веществом скелетных мышц является креатин.
Содержание креатина в мышцах различных видов животных различно, но
более или менее постоянно для данного вида; оно колеблется в пределах
от 350 до 600 мг%.
В синтезе креатина участвуют три аминокислоты: глицин, аргинин
и метионин. Из глицина и аргинина в почках синтезируется гуанидинуксус-
ная кислота; в печени на гуанидинуксусную кислоту переносятся метиль-
ные группы от метионина с образованием креатина. (Подробнее об образова-
нии креатина см. стр. 416).Следовательно, креатин, имеющийся в составе
мышц, образуется не в мышцах, а к ним доставляется извне кровью. Ске-
летные мышцы, в противоположность другим органам, способны удержи-
вать значительные количества креатина. Азот креатина составляет до
60% небелкового азота мышц. Значительная часть (больше половины) креа-
тина в мышцах находится в связанном с фосфорной кислотой состоянии —
в виде креатинфосфорной кислоты.
В мышцах беспозвоночных животных, за редкими исключениями, креа-
тин отсутствует и заменен аргинином. Значительная часть аргинина в мыш-
цах беспозвоночных находится в виде аргининфосфорной кислоты.
К азотистым экстрактивным веществам скелетных мышц относятся
карнозин (стр. 421), продукт его метилирования — ансерин и кар-
нитин (стр. 420). Эти вещества, открытые В. С. Гулевичем и его сотрудни-
ками, в сравнительно больших количествах содержатся только в скелетных
мышцах. Однако роль их в мышцах остается еще невыясненной.
К азотистым экстрактивным веществам мышц относятся глутамин
и глутаминовая кислота. Содержание глутамина в мышцах достигает 80—
100 мг%, примерно столько же в них глутаминовой кислоты. Другие ами-
нокислоты в свободном виде в мышцах обнаруживаются в минимальных
количествах (до 10 мг% по азоту). В мышцах имеется мочевина — 15 —
20 мг% (по азоту); таково же содержание мочевины и в крови. Мочевина
относится к числу веществ, равномерно распространенных в жидкостях
и тканях организма. Можно поэтому полагать, что мочевина — не специ-
фичное для мышц вещество, а конечный продукт азотистого обмена, кото-
рый, как известно, образуется в печени.
В незначительных количествах в мышцах содержится мочевая кислота,
аденин, гуанин и продукты их дезаминирования — гипоксантин и ксантин,
Безазотистые экстрактивные вещества мышц
К безазотистым экстрактивным веществам относится запасный угле-
вод — гликоген. Содержание его в скелетных мышцах колеблется в значи-
тельных пределах (от 0,2 до 2% и выше) и зависит от степени упитанности
организма и количества углеводов в пище. Гликоген легко используется
V4 18* 571
в мышцах при их деятельности. Уже при самой кратковременной работе
мышц (0,5—1 мин) содержание гликогена в них резко снижается.
В мышцах содержатся растворимые в воде промежуточные продукты
распада гликогена — глюкозо- и фруктозо-6-фосфорные кислоты, пиро-
виноградная и молочная кислоты.
ФОСФОРНЫЕ СОЕДИНЕНИЯ МЫШЦ
В состав скелетных мышц входят разнообразные фосфорные соеди-
нения. Общее содержание фосфорных соединений при расчете на фосфор
составляет 220—250 мг% (в мышцах теплокровных). Значительная часть
(до 80%) фосфорных соединений мышц растворима в воде и обычно
извлекается из измельченных мышц при осаждении мышечных белков
(например, раствором трихлоруксусной кислоты). Нерастворимы в воде
фосфатиды и нуклеиновые кислоты (нуклеопротеиды).
Среди фосфорных соединений, растворимых в воде, главное место
как по количественному содержанию, так и по физиологическому значе-
нию, занимают креатинфосфорная и аденозинтрифосфорпая кислоты; в
мышцах теплокровных^они составляют около 50% фосфора всех раство-
римых в воде фосфорных соединений. Оба эти соединения играют важ-
ную роль в энергетических процессах, протекающих в мышцах.
Из других фосфорных соединений сравнительно много (до 10% фос-
фора всех растворимых в воде фосфорных соединений) в скелетных
мышцах содержатся глюкозо- и фруктозо-6-фосфорные кислоты. В мыш-
цах всегда обнаруживается смесь гексозофосфорных кислот, 75% кото-
рых состоит из глюкозо-6-фосфорной кислоты и 25%—из фруктозо-6-
фосфорной кислоты. Гексозофосфорные кислоты являются промежуточ-
ными продуктами распада углеводов. Значение наличия их в мышцах
при почти полном отсутствии других фосфорилированных промежуточ-
ных продуктов распада углеводов остается невыясненным. Около 20%
фосфора, входящего в состав растворимых в воде фосфорных соедине-
ний мышц, приходится на долю ортофосфорной кислоты.
ЛИПИДЫ СКЕЛЕТНЫХ МЫШЦ
В мышцах (мышечных волокнах) обнаруживается до 1% жира.
При работе мышц, а также при голодании организма этот протоплаз-
матический жир не тратится.
Мышцы содержат фосфатиды, или, точнее, смесь насыщенных и нена-
сыщенных фосфатидов. Общее содержание их в расчете на фосфор состав-
ляет 20—25мг%. Значение фосфатидов в мышцах, роль их в процессах,
связанных с деятельностью мышц, пока не выяснены. Однако известно, что
мышцы диких животных богаче фосфатидами, чем мышцы домашних жи-
вотных (их сородичей). Далее установлено, что при тренировке мышц со-
держание фосфатидов в них увеличивается. Следовательно, существует
связь между работоспособностью мышц и содержанием в них фосфатидов.
Постоянной составной частью мышц является также и холестерин.
Содержание его в мышцах около 200 мг°/о. Физиологическое значение
мышечного холестерина не выяснено.
МИНЕРАЛЬНЫЕ ВЕЩЕСТВА СКЕЛЕТНЫХ МЫШЦ
При сжигании мышцы остается зола, состоящая из минеральных ве-
ществ. В золе содержатся анионы (главным образом фосфорной кислоты
и соляной кислоты) и катионы (калий, натрий, кальций, магний и др.).
Особенно богаты мышцы калием (0,3%). Содержание минеральных ве-
ществ составляет 1,0—1,5% веса мышц.
572
ХИМИЧЕСКИЙ СОСТАВ СЕРДЦА И ГЛАДКИХ МЫШЦ
Сердечная мышца богата водой (78—79%). Плотный остаток, составляю-
щий 21—22% веса сердца, на 80% состоит из белков, по своим свойствам
мало отличающихся от белков скелетных мышц. Отличия имеются в коли-
чественном содержании в сердечной мышце отдельных белков и белковых
фракций по сравнению со скелетными мышцами. В сердечной мышце мень-
ше, чем в скелетной креатина (примерно в два раза) и аденозинтрифосфорной
кислоты, а глутамина и глутаминовой кислоты в ней содержится больше,
чем в скелетных мышцах. Сравнительно богата она фосфатидами. Содержа-
ние гликогена в сердечной мышце составляет около 0,5% и не подвергается
большим колебаниям, как это имеет место в скелетных мышцах.
Еще мало изучен химический состав гладких мышц. Они, подобно
другим мышцам, богаты водой и белками. Содержание белковых фракций
у них отличается от скелетных мышц и сердца. Они богаты тропомиозином.
В гладких мышцах содержится мало гликогена и азотистых экстрактивных
веществ.
Мышцы, кроме рассмотренных выше веществ, содержание которых срав-
нительно велико, включают еще ряд веществ в небольших количествах. К
ним относятся витамины, ферменты, микроэлементы; все они играют важ-
ную роль в мышцах, участвуя в процессах обмена веществ.
Изучение химического состава мышц представляет большой интерес.
Без детального знания структуры и химического состава мышц нельзя
разобраться в химических процессах, лежащих в основе их деятельности.
ФЕРМЕНТАТИВНЫЕ ПРОЦЕССЫ В МЫШЦАХ
В скелетных мышцах интенсивно происходит распад гликогена с образо-
ванием молочной кислоты. В измельченной ножницами мышце при комнат-
ной температуре/ накопляется молочная кислота при одновременном ис-
чезновении гликогена. То же самое можно наблюдать в изолированной
из организма мышце, пролежавшей некоторое время. Особенно интенсивно
происходит распад гликогена с образованием молочной кислоты при работе
мышц. Все это свидетельствует о том, что мышцы содержат систему фермен-
тов гликогенолиза, обеспечивающую быстрый распад гликогена с образо-
ванием молочной кислоты.
Для предохранения гликогена, а также некоторых других веществ (креатинфос-
форной и аденозинтрифосфорной кислоты) от распада при определении их содержания
в мышцах необходимо приостановить действие ферментов. Это достигается погружени-
ем мышцы в сосуд с жидким воздухом (—160°С), где она быстро охлаждается, и дейст-
вие ферментов в ней прекращается. Мышца в замороженном виде затем растирается
в фарфоровой ступке (с прибавлением жидкого воздуха) в порошок, который без отта-
ивания погружается в растворы, используемые для проведения анализа. При оттаи-
вании растертой в жидком воздухе мышечной ткани в растворах кислоты или щелочи
ферменты не проявляют своего действия, они разрушаются.
Применение жидкого воздуха (а также жидкого кислорода или азота)
позволяет предохранить гликоген от распада и определить в мышцах истин-
ное содержание в них молочной кислоты. (Следует оговориться, что приме-
нение жидких газов в качестве охладителей не исключает действия фермен-
тов в течение весьма короткого срока при замораживании ткани, пока тем-
пература в ней не снизится до 0—2° С. Небольшой распад гликогена имеет
место в мышцах и при погружении их в жидкий воздух, поскольку актив-
ность гликолитических ферментов в мышцах весьма высока.)
При соблюдении необходимых мер для приостановки действия фермен-
тов обнаруживают в мышцах (покоящихся) теплокровных животных 30—
40 мг% молочной кислоты, в мышцах лягушки —15—20 мг% молочной
кислоты. Образование молочной кислоты в мышцах при их продолжитель-
ной работе происходит с использованием значительного количества имею-
щегося в них запаса гликогена.
573
Валовое уравнение гликогенолиза (стр. 304) следующее:
1 /п (С6Н10О5)л + ЗАДФ + ЗН3РО4 —> 2С3Н6О3 + ЗАТФ.
Из этого уравнения видно, что при распаде одной глюкозной единицы
гликогена образуются две молекулы молочной кислоты и фосфорилируются
три молекулы аденозиндифосфорной кислоты. Значительная часть энергии
гликогенолиза используется для синтеза аденозинтрифосфорной кислоты.
В мышцах также представлены ферменты, обеспечивающие аэробный
распад молочной кислоты с образованием конечных продуктов — угле-
кислого газа и воды. Особенно важную роль играют ферменты, катализи-
рующие распад ацетил—SKoA по циклу трикарбоновых кислот. Значитель-
ная часть энергии (60—70%), освобождающейся при аэробном распаде
углеводов, используется для фосфорилирования аденозиндифосфорной
кислоты (стр. 267).
В мышцах также содержатся ферменты, катализирующие аэробный
распад ацетоуксусной кислоты. На определенном этапе этого распада обра-
зуется ацетил~БКоА, окисляющийся по циклу трикарбоновых кислот с
образованием углекислого газа и воды. Значительная часть энергии, ос-
вобождающейся при аэробном окислении ацетоуксусной кислоты, идет
на фосфорилирование аденозиндифосфорной кислоты. Таким образом,
в мышцах, где интенсивно происходит анаэробный распад углеводов, а
также аэробный распад молочной кислоты и других веществ, фосфорили-
руются большие количества аденозиндифосфорной кислоты с образованием
аденозинтрифосфорной кислоты. Процессы окисления органических веществ
сопряжены, как известно, с процессами фосфорилирования аденозиндифос-
форной кислоты (стр. 265).
В мышцах содержание аденозиндифосфорной кислоты невелико, в них
обнаруживается главным образом аденозинтрифосфорная кислота, и это
понятно, так как процессы использования органических питательных
веществ в мышцах сопровождаются усиленным фосфорилированием адено-
зиндифосфорной кислоты.
Сопряженность процессов окисления и фосфорилирования, для чего
необходимо наличие в мышцах аденозиндифосфорной кислоты, становится
возможной, благодаря реакциям дефосфорилирования аденозинтрифосфор-
ной кислоты — перенесения от нее фосфатного остатка на молекулы орга-
нических веществ с помощью фосфофераз и реакции гидролитического от-
щепления остатка фосфорной кислоты с помощью аденозинтрифосфатазы
(АТФ-аза). Последняя реакция, катализирующаяся АТФ-азой и сопро-
вождающаяся освобождением энергии, происходит особенно интенсивно в
скелетных мышцах.
В скелетных мышцах меньшая часть АТФ-азы находится в растворимом
состоянии (она обнаруживается в фракции водорастворимых белков), а
другая, большая часть, — в миозиновой фракции. В 1939 г. В. А. Энгель-
гардт и М. Н. Любимова установили, что извлеченный из мышцы миозин
обладает АТФ-азной активностью, которая сохраняется при многократном
его переосаждепии. Изучение АТФ-азной активности актомиозина показало,
что она принадлежит миозину, а не актину и что различные факторы (тем-
пературное воздействие, действие тяжелых металлов, например, серебра),
инактивирующие АТФ-азу, одновременно с этим вызывают необратимые из-
менения физико-химических свойств миозина. Энгельгардт пришел к за-
ключению, что миозин является АТФ-азой. Дальнейшее изучение АТФ-аз-
ной активности миозиновой фракции подтвердило это заключение и показа-
ло, что один из белков этой фракции, обладающий способностью связывать
актин с образованием актомиозина, действительно является АТФ-азой.
Образующаяся при дефосфорилировании аденозитрифосфорной кис-
лоты аденозиндифосфорная кислота, как отмечалось выше, подвергается
в мышцах фосфорилированию, сопряженному с реакциями окисления орга-
нических веществ. Наряду с этим в мышцах обнаружена еще одна реакция
574
фосфорилирования аденозиндифосфорной кислоты, которая катализируется
ферментом, получившим название аденилаткиназы. Этот фермент, открытый
Калькаром, катализирует реакцию, протекающую между двумя молекулами
аденозиндифосфорной кислоты, в результате которой образуется одна моле-
кула аденозинтрифосфорной кислоты и одна молекула адениловой кислоты:
АДФ + АДФ АТФ + адениловая кислота.
Эта реакция показывает, что в мышцах может образоваться адениловая
кислота из аденозинтрифосфорной кислоты.
1) 2АТФ + 2Н2О 2АДФ + 2Н3РО4
2) 2АДФ 7"^ АТФ + адениловая кислота.
Первая реакция катализируется АТФ-азой, вторая — аденилаткиназой.
Адениловая кислота подвергается дезаминированию. В мышцах со-
держится активная дезаминаза, катализирующая гидролитическое отщеп-
ление аммиака от адениловой кислоты. Часть этой дезаминазы находится
в мышцах в растворимом виде (в водорастворимой фракции белков), другая
же часть — в миозиновой фракции белков, являясь одним из ее компонен-
тов. Дезаминаза адениловой кислоты образует комплекс с миозином (Д. Л.
Фердман и 3. Ю. Нечипоренко) и при соответствующей обработке может быть
отделена от миозина.
В результате последовательного действия АТФ-азы, миокиназы и деза-
миназы адениловой кислоты происходит распад аденозинтрифосфорной
кислоты с образованием инозиновой кислоты, аммиака и фосфорной кислоты:
1) 2АТФ + 2Н2О—^2АДФ + 2113РО4 (действие АТФ-азы)
2) АДФ АДФ —> АТФ + адениловая кислота (действие аденилаткиназы)
3) Адениловая кислота + Н2О —> инозиновая кислота + NH3 (действие дезаминазы)
4) АТФ + ЗН2О —> инозиновая кислота + 2Н3РО4 Д- NH3*.
Гидролитическое дезаминирование адениловой кислоты (реакция 3)
в условиях, имеющихся в мышцах, необратимо. Установлено, что образо-
вание адениловой кислоты из инозиновой в мышцах происходит в аэробных
условиях, что и при этом используется аминогруппа аспарагиновой кислоты.
В мышцах креатинфосфорная кислота расщепляется на креатин и фос-
форную кислоту. Однако попытки обнаружения в мышцах фермента, ката-
лизирующего это расщепление, не увенчались успехом. Оказалось, что
образование креатина и фосфорной кислоты из креатинфосфорной кислоты
не является результатом ее непосредственного гидролиза, а результатом
двух последовательно идущих ферментативных реакций: 1)фосфоферазной
(киназной) и 2) АТФ-азной. В результате первой реакции фосфатный оста-
ток от креатинфосфорной кислоты переносится на аденозиндифосфорную
кислоту с образованием креатина и аденозинтрифосфорной кислоты; в ре-
зультате второй аденозинтрифосфорная кислота отщепляет от себя молекулу
фосфорной кислоты с образованием аденозиндифосфорной кислоты.
1) Креатинфосфорная кислота АДФ креатин + АТФ (действие креатинкиназы)
2) АТФ + Н2О —> АДФ + Н3РО4 (действие АТФ-азы)
3) Креатинфосфорная кислота + Н2О —> креатин + Н3РО4.
Суммируя уравнения (1) и (2), получаем уравнение (3), которое имити-
рует гидролиз креатинфосфорной кислоты.
В мышцах происходит не только распад креатинфосфорной кислоты,
но и ее синтез, т. е. фосфорилирование креатина. Действие креатинфосфофе-
разы обратимо, и фосфорилирование креатина осуществляется путем пере-
несения фосфатного остатка от аденозинтрифосфорной кислоты на креатин.
* Уравнение (4) — результат суммирования первых трех уравнений.
575
АТФ + креатин
^Z± АДФ + креатинфосфорная кислота.
Фосфорилирование креатина приводит к образованию резерва макроэрги-
ческих связей в мышцах, использование энергии которых происходит не
прямым путем, а через аденозинтрифосфорную кислоту. Интересно, что
в мышцах беспозвоночных животных, в которых отсутствует креатинфосфор-
ная кислота, имеется аргининфосфорная кислота; распад последней проис-
ходит аналогичным путем. С помощью аргининфосфоферазы фосфатный
остаток переносится на аденозиндифосфорную кислоту с образованием ар-
гинина и аденозинтрифосфорной кислоты, которая отщепляет затем от себя
с помощью АТФ-азы молекулу фосфорной кислоты.
1) Аргининфосфорная кислота + АДФ^> аргинин 4- АТФ (действие аргининкиназы)
2) АТФ 4~ Н2О-> АДФ 4~ Н3РО4 (действие АТФ-азы)
3) Аргининфосфорная кислота 4~ Н2О~> аргинин 4- Н3РО4 ’
Реакции, в результате которых креатинфосфорная кислота или аргининфосфор-
ная кислота распадается с образованием креатина или аргинина и фосфорной кисло-
(I /°Н\
—N — р4=0 I ,
\он/
имеющаяся в молекуле креатинфосфорной кислоты, является макроэргической связью.
Однако энергия этой связи освобождается не в результате гидролиза, т. е. прямым
путем, а через реакцию гидролиза аденозинтрифосфорной кислоты. Отсюда следует
что энергия макроэргической связи креатинфосфорной кислоты прямым путем в мыш-
цах не может быть использована. Это относится также и к аргининфосфорной кис-
лоте.
Приведенные данные о ферментативных процессах в мышцах показы-
вают, что в мышцах без участия кислорода (в анаэробных условиях) могут
происходить: 1) распад гликогена с образованием молочной кислоты; осво-
бождающаяся при этом энергия накопляется в макроэргических связях
аденозинтрифосфорной кислоты; 2) распад (гидролиз) аденозинтрифосфор-
ной кислоты с помощью АТФ-азы с образованием аденозиндифосфорной
кислоты и фосфорной кислоты и 3) распад креатинфосфорной кислоты на
креатин и фосфорную кислоту, который осуществляется не прямым путем,
а через фосфоферазную реакцию с отщеплением фосфорной кислоты от аде-
нозинтрифосфорной кислоты с помощью АТФ-азы.
С участием кислорода (аэробно) в мышцах происходит окисление мо-
лочной кислоты и некоторых других органических соединений до углекисло-
го газа и воды. В этом случае освобождающаяся энергия в значительной
мере используется для фосфорилирования аденозиндифосфорной кислоты
с образованием аденозинтрифосфорной кислоты.
Отсюда можно заключить, что использование энергии в мышцах как
при анаэробных, так и при аэробных процессах, происходит путем гидро-
лиза аденозинтрифосфорной кислоты с помощью АТФ-азы. В этом и состоит
важная роль аденозинтрифосфорной кислоты в энергетических процессах
в мышцах.
ХИМИЧЕСКИЕ ПРОЦЕССЫ В РАБОТАЮЩЕЙ
ИЗОЛИРОВАННОЙ МЫШЦЕ
Химизм мышечной деятельности широко изучался на изолированной
мышце лягушки. При использовании этого объекта еще в прошлом столе-
тии было установлено, что мышца при раздражении ее электрическим
током через нерв (в этом случае мышца изолируется вместе с нервом) или же
прямым путем — приложением к ней электродов, способна в анаэробных
условиях (в атмосфере азота или водорода) сокращаться и расслабляться,
т. е. выполнять работу. Естественно, возник вопрос об источниках энергии
при работе мышц в анаэробных условиях. Еще до постановки исследований
по изучению химических процессов в работающей изолированной мышце
576
было обращено внимание на то, что в ряде случаев в мышцах образуется
какая-то кислота. Так, например, при окоченении мышцы приобретают
кислую реакцию. Если к разрезу окоченевшей мышцы приложить лакму-
совую бумажку, то она слегка краснеет. В свежей мышце кислая реакция
не обнаруживается. Образование кислоты в мышце было установлено так-
же и при ее работе до утомления.
В начале прошлого столетия Берцелиус предположил, что при работе
мышцы образуется молочная кислота. Это предположение нашло свое под-
тверждение в исследованиях Либиха, установившего наличие молочной
кислоты в автолизированных мышцах (в мясе). Во второй половине прош-
лого столетия был проведен ряд исследований по изучению образования
молочной кислоты в мышцах, однако до начала XX столетия вопрос о зна-
чении образования молочной кислоты в мышцах оставался открытым.
В 1907 г. Флетчер и Гопкинс впервые применили метод сильного охлаж-
дения мышцы при изучении ее химического состава. Ими было показано,
что содержание молочной кислоты в покоящихся мышцах очень невелико
и что она образуется при работе. Была также установлена прямая зависи-
мость между интенсивностью образования молочной кислоты и величиной
произведенной мышцей работы. При утомлении мышцы в ней обнаруживали
большое количество молочной кислоты. Было показано, что утомленная
мышца в присутствии кислорода постепенно восстанавливает свою работо-
способность, причем параллельно с этим в ней уменьшается содержание
молочной кислоты.
Результаты исследований Флетчера и Гопкинса, сыгравшие важную
роль в дальнейшем развитии работ по изучению химических процессов
в мышцах при их деятельности, оставили невыясненным вопрос об источнике
образования молочной кислоты в мышцах, об энергетическом значении
процесса ее образования.
Новым этапом в изучении энергетических процессов в мышцах явилось
исследование Мейергофом превращения углеводов при работе изолирован-
ной мышцы. Им было установлено, что источником образования молочной
кислоты в мышцах является гликоген. Было обращено внимание на то,
что образование молочной кислоты из гликогена сопровождается освобож-
дением энергии. (При образовании 1 г молочной кислоты из гликогена ос-
вобождается 180 кал.) Образованию молочной кислоты в мышцах стали при-
давать большое значение. Предполагалось, что образование ее во времени
совпадает с моментом сокращения мышцы и что оно обусловливает акт
сокращения.
Продолжительное время был известен только один процесс в мышцах,
не нуждающийся в присутствии кислорода и сопровождающийся освобож-
дением энергии — распад гликогена с образованием молочной кислоты.
Часть возникающей при работе в анаэробных условиях молочной кислоты
аэробно окисляется с образованием углекислого газа и воды, другая часть
ее идет на образование гликогена. Углеводы считались единственным источ-
ником энергии, обеспечивающим работу мышц.
В 1927 г. в связи с обнаружением в мышцах позвоночных животных
креатинфосфорной кислоты, образование молочной кислоты при работе
мышц в анаэробных условиях не могло уже считаться единственным источ-
ником энергии. Оказалось, что при работе мышц уменьшается содержание
в них креатинфосфорной кислоты и возрастает содержание креатина и фос-
форной кислоты. Распад креатинфосфорной кислоты, как было показано,
сопровождается освобождением энергии. Возник вопрос, какая из двух
энергетических реакций стоит ближе к акту мышечного сокращения —
образование молочной кислоты из гликогена, или же распад креатинфосфор-
ной кислоты с образованием креатина и фосфорной кислоты? Вопрос этот
получил неожиданное разрешение в 1930 г. в связи с исследованиями
Лундсгаарда, установившего возможность работы мышц без образования
молочной кислоты. Оказалось, что при отравлении лягушки галоидопроиз-
577
водными уксусной кислоты — монойодуксусной или монобромуксусной
кислотами — она погибает при явлениях окоченения мышц. Причем это
окоченение, в отличие от иных форм окоченений, не сопровождается накоп-
лением молочной кислоты. Если у отравленной лягушки незадолго до на-
ступления окоченения изолировать мышцу, то можно видеть, что мышца при
раздражении электрическим током способна работать (сокращаться и рас-
слабляться) без образования в ней молочной кислоты. При работе отравлен-
ной моноиодуксусной кислотой мышцы в ней наблюдается распад креатин-
фосфорной и аденозинтрифосфорной кислот. Работа мышцы происходит
за счет энергии, освобождающейся при распаде этих двух веществ, и обра-
зование молочной кислоты не является обязательным условием для работы
мышц. Представление о том, что углеводы служат единственным источником
энергии для работы мышц, оказалось несостоятельным. Выяснилось, что
в изолированной мышце при работе ее в анаэробных условиях происходит
распад гликогена с образованием молочной кислоты, аденозинтрифосфор-
ной кислоты с образованием аденозиндифосфорной кислоты и из последней
адениловой кислоты, а также распад креатинфосфорной кислоты с образо-
ванием креатина и фосфорной кислоты. Отравленная монойодуксусной кис-
лотой мышца может производить работу без образования молочной кислоты.
В нормальной мышце освобождающаяся при образовании молочной кислоты
энергия используется для фосфорилирования аденозиндифосфорной кислоты
с образованием АТФ и энергия макроэргических связей АТФ может быть
мышцей использована для выполнения работы. Распад креатинфосфорной
кислоты, как известно, происходит не путем гидролиза, а путем фосфори-
лирования аденозиндифосфорной кислоты с последующим распадом образо-
вавшейся АТФ. Отсюда понятно, что распад креатинфосфорной кислоты
не является непосредственным источником энергии для работы мышцы.
Это относится как к мышце нормальной, так и к мышце, отравленной
монойодуксусной кислотой.
Использование энергии при работе мышцы, исходя из известных в на-
стоящее время экспериментальных данных, происходит согласно следующей
схеме:
Гликоген----> молочная кислота
Анаэробно (без участия
кислорода)
Креатинфосфорная
к
S
о.
я
кислота —> креатин-|-НзРО4 энергия_^
АТФ
Аэробно
{Молочная
кислота-------> СО2+В2О-------
(органические вещества)
энергия работа
>мышцы
АДФ, адениловая
кислота, Н3РО4
Следовательно, для работы мышцы используется энергия, освобождаю-
щаяся при дефосфорилировании аденозинтрифосфорной кислоты, которое
как известно, катализируется АТФ-азой.
Интересно в связи с этим вернуться к важному факту, открытому
В. А. Энгельгардтом и М. Н. Любимовой, — наличию АТФ-азной активности
у миозина (стр. 574). Миозин в комплексе с актином (актомиозин) является
сократительным белковым комплексом мышечных фибрилл. Он обладает
способностью не только сокращаться, но и катализировать гидролитиче-
ское отщепление фосфорной кислоты от аденозинтрифосфорной кислоты
с освобождением энергии, используемой мышцей для ее работы.
Как уже указывалось (стр. 570), нити, полученные из актомиозина,
помещенные в раствор аденозинтрифосфорной кислоты, с добавлением
ионов магния и калия обладают способностью укорачиваться. При этом про-
исходит расщепление аденозинтрифосфорной кислоты. Это явление, установ-
578
ленное впервые В. А. Энгельгардтом, а также и А. Сцент-Дьиордьи, ука-
зывает, что распад аденозинтрифосфорной кислоты каким-то образом свя-
зан с изменением физико-химического состояния сократительного белка
мышц, т. е. что распад аденозинтрифосфорной кислоты является процессом,
непосредственно связанным с работой мышц. Аденозинтрифосфорной кислоте,
ее синтезу и распаду принадлежит особенно важная, если не главная,
роль в превращении химической энергии в механическую. Распад гликогена
с образованием молочной кислоты, как и дефосфорилирование креатинфос-
форной и аденозинтрифосфорной кислот не требуют участия кислорода,
и это объясняет, почему изолированная из организма мышца способна ра-
ботать в анаэробных условиях. В утомленной при работе в анаэробных
условиях мышце накопляются молочная кислота и продукты распада креа-
тинфосфорной и аденозинтрифосфорной кислот; в ней исчерпываются запасы
веществ, расщепление которых дает необходимую для работы энергию. При
помещении утомленной мышцы в среду, содержащую кислород, она начи-
нает его потреблять. Некоторая часть молочной кислоты, накопившейся в
мышце при работе, подвергается окислению с образованием углекислого га-
за и воды. Освобождающаяся энергия используется для ресинтеза глико-
гена, креатинфосфорной и аденозинтрифосфорной кислот из продуктов их
распада, и мышца снова приобретает способность к работе.
Несмотря на большие достижения в изучении химических процессов,
протекающих в работающих мышцах, все же нельзя считать, что обмен
веществ в мышцах выяснен до конца. Еще окончательно не установлено,
какие химические реакции обусловливают акт мышечного сокращения,
несмотря на то, что роль аденозинтрифосфорной кислоты в нем может счи-
таться вполне известной. Остается еще не совсем ясным, каким образом
осуществляется передача импульсов, идущих от нерва к мышце и усили-
вающих процессы обмена веществ в мышце. При раздражении нерва мышца
возбуждается, и интенсивность распада в ней гликогена и аденозинтрифос-
форной и креатинфосфорной кислот возрастает в десятки раз. Известно,
что передача нервных импульсов сопровождается освобождением нервными
окончаниями специальных веществ (медиаторов), усиливающих фермента-
тивные процессы в мышцах, однако механизм этого явления не выяснен.
Изучение химических процессов в изолированных из организма мыш-
цах позволило разобраться во многих явлениях, которые ускользают при
исследовании работы мышц в целом организме. Следует, однако, иметь
в виду, что для глубокого изучения процессов обмена веществ нельзя огра-
ничиваться исследованиями изолированных мышц. Условия работы мышц
в организме значительно более сложны, чем в изолированных мышцах.
В организме мышцы снабжаются питательными веществами, доставляемыми
к ним кровью. Из мышц в условиях интактного организма продукты распада
органических веществ поступают в кровь и поэтому накопляются в данном
случае в меньших количествах, чем в изолированных мышцах. В целом
организме на обмен веществ в мышцах влияют процессы, протекающие в
других органах. С этой точки зрения важно разобраться в химических про-
цессах, происходящих в мышцах при работе их в организме.
ОБМЕН ВЕЩЕСТВ В МЫШЦАХ ПРИ РАБОТЕ ОРГАНИЗМА
В организме работа мышц вызывается импульсами, направляющимися
к ним по двигательным нервам от центральной нервной системы. Усиленная
работа мышц приводит к их утомлению и накоплению молочной кислоты
и продуктов распада аденозинтрифосфорной и креатинфосфорной кислот.
Молочная кислота и аммиак легко диффундируют из мышц в кровь, и со-
держание их в крови при усиленной работе мышц значительно возрастает.
Одновременно с этим с кровью к мышцам доставляются питательные веще-
ства (глюкоза, ацетоуксусная кислота и др.), которые используются мыш-
цами. Неудивительно поэтому, что работа мышц в организме, которая про-
579
исходит при благоприятных условиях, более продолжительна и более эф-
фективна, чем работа изолированной мышцы. При правильном сочетании
периодов работы и отдыха мышцы могут работать продолжительное время
без накопления в них молочной кислоты, продуктов распада аденозинтри-
фосфорной и креатинфосфорной кислот, а также без признаков утомления.
Это объясняется тем, что в период отдыха интенсивно протекают окисли-
тельные процессы, сопровождающиеся синтезом гликогена из молочной
кислоты и аденозинтрифосфорной и креатинфосфорной кислот из продуктов
их распада. Только в тех случаях, когда распад энергетически важных
веществ в мышцах в период работы происходит более интенсивно, чем их
синтез в период отдыха, в мышцах накопляется молочная кислота, инози-
новая кислота (продукт дефосфорилирования и дезаминирования адено-
зинтрифосфорной кислоты), аммиак, креатин и фосфорная кислота. Мышцы
постепенно утомляются, и для восстановления их работоспособности в этих
случаях требуете Яг продолжительный период отдыха.
Экспериментальные данные показывают, что при обычных условиях
физической работы, а также при физических упражнениях, утомление
наступает не в результате истощения запасов энергетически важных веществ,
а от иных причин (недостаточно интенсивного снабжения мышц питательны-
ми веществами с кровью и удаления продуктов обмена веществ и др.).
В начальной стадии работы мышц (которую часто называют пусковым
периодом) наблюдается интенсивное использование имеющихся в них запа-
сов гликогена, креатинфосфорной и аденозинтрифосфорной кислот. Эта
стадия работы характеризуется преобладанием в мышцах процессов, не
требующих участия кислорода, следовательно, анаэробных процессов.
В последующих стадиях работы на первый план выступают аэробные про-
цессы, сопровождающиеся использованием питательных веществ, доставляе-
мых к мышцам с кровью.
БИОХИМИЧЕСКИЕ ПРОЦЕССЫ В МЫШЦАХ
ПРИ ТРЕНИРОВКЕ
Хорошо известно, что привычный к работе, тренированный организм,
обладает большой работоспособностью. В нем все органы работают сла-
женно. В результате этого мышцы лучше снабжаются питательными веще-
ствами, из них интенсивнее удаляются конечные продукты обмена веществ.
В тренированном организме процессы кровообращения и дыхания проте-
кают более слаженно, чем в нетренированном. Тренировка влияет также
непосредственно на мышцу, на ее химический состав и на интенсивность
процессов обмена веществ в ней. Установлено, что систематическая работа
мышц приводит к повышению содержания в них гликогена и к более быст-
рому устранению молочной кислоты и продуктов распада аденозинтрифос-
форной и креатинфосфорной кислот. Как показали исследования, главным
образом А. В. Палладина и сотрудников, а также Н. Н. Яковлева, трени-
ровка приводит к более интенсивному и вместе с тем к более экономному
использованию питательных веществ в мышцах. Это происходит по той
причине, что тренировка влияет не только на химический состав мышц,
но и на ферментативные процессы, обеспечивающие использование углево-
дов и других веществ, доставляемых к мышцам с кровью. Работа трениро-
ванных мышц сопровождается меньшим накоплением в них молочной кис-
лоты, а также более быстрой отдачей ее в кровь, чем работа нетренирован-
ных мышц.
Изменения, наступающие в химическом составе мышц и в интенсивно-
сти обмена веществ в них в результате тренировки, интересны также с об-
щебиологической точки зрения, так как они указывают на пластичность
обмена веществ, на приспособляемость организма в целом и мышц в част-
ности к изменению условий их деятельности.
580
БИОХИМИЧЕСКИЕ ИЗМЕНЕНИЯ В МЫШЦАХ
ПРИ ИХ ЗАБОЛЕВАНИЯХ
Повреждения двигательных нервов, перерезка сухожилий вызывают
атрофию мышц, сопровождающуюся уменьшением их веса и перерождением
мышечной ткани. В мышцах увеличивается содержание соединительной
ткани и уменьшается содержание белков, входящих в состав мышечных
волокон. Работоспособность мышц, по мере развития атрофии, снижается
благодаря наступающим изменениям в химическом составе мышц и в про-
цессах обмена веществ в них.
Подобные изменения в мышцах наблюдаются у человека при ранениях
двигательных нервов, а также при некоторых расстройствах функций нерв-
ной системы. К тяжелым мышечным заболеваниям человека относится также
прогрессивная мышечная дистрофия и ряд других функциональных рас-
стройств мышц. В эксперименте заболевание, близкое к прогрессивной мы-
шечной дистрофии, вызывается кормлением животных пищей, лишенной
витамина Е. Изучение биохимических изменений в мышцах, наступающих
при атрофии и дистрофии, показало, что нарушения физиологической функ-
ции мышц сопровождаются глубокими изменениями в обмене углеводов,
фосфорных соединений и азотистых веществ, включая белки. При заболе-
ваниях мышц уменьшается содержание гликогена в них, изменяется актив-
ность гликолитических и других ферментов, уменьшается содержание креа-
тинфосфорной и аденозинтрифосфорной кислот. Мышцы теряют способ-
ность нормально использовать питательные вещества, нарушается, как
принято говорить, их трофика (отсюда название «атрофия» и «дистрофия»).
Одной из важных задач биохимии является изучение непосредственных
причин, вызывающих расстройства обмена веществ в мышцах при их забо-
леваниях, а также разработка приемов активного воздействия на мышцы,
которые привели бы к нормализации процессов обмена веществ.
ОСОБЕННОСТИ ОБМЕНА ВЕЩЕСТВ В СЕРДЕЧНОЙ МЫШЦЕ
Сердечная мышца по содержанию в ней ряда веществ и по интенсивно-
сти течения некоторых биохимических процессов, а также и по своей функ-
ции, отличается от скелетных мышц. Сердечная мышца относится к числу
непрерывно функционирующих в организме органов, в то время как в ске-
летных мышцах перемежаются работа и отдых. Сердце ритмично работает в
течение всей жизни организма. Уже незначительные изменения ритма ра-
боты сердца вызывают нарушение кровообращения, что влечет за собой
нарушение кровоснабжения органов.
Для сердечной мышцы характерно аэробное превращение веществ.
Окислительному распаду в ней подвергаются глюкоза, жирные кислоты
и аминокислоты. Об этом свидетельствует наличие в сердечной мышце очень
активной системы ферментов, катализирующих реакции аэробного окисли-
тельного цикла трикарбоновых кислот. Высокое содержание в сердечной
мышце миоглобина обеспечивает известный запас в ней кислорода, исполь-
зуемый в случае повышения потребности в нем при усиленной работе серд-
ца. Вместе с этим, экспериментальные данные показывают, что активность
гликолитических ферментов, катализирующих анаэробный распад углево-
дов, в сердечной мышце сравнительно невелика (примерно в пять раз мень-
ше, чем в скелетных мышцах). В сердечной мышце содержится значительно
меньше аденозинтрифосфорной и креатинфосфорной кислот, чем в скелетных
мышцах. Энергия макроэргических связей этих соединений, как уже ука-
зывалось, интенсивно используется при работе скелетных мышц в анаэроб-
ных условиях (стр. 578).
Преобладание в сердечной мышце аэробных процессов над анаэроб-
ными приводит к тому, что в ней не накопляется молочная кислота при рас-
20 Заказ № 581
581
наде гликогена. Больше того, в сердечной мышце интенсивно используется
(окисляется) молочная кислота, доставляемая с кровью системой коронар-
ных сосудов. При усиленной работе скелетных мышц образующаяся в них
молочная кислота частично поступает в кровь. В печени она превращается
в гликоген, а в сердечной мышце она подвергается аэробному окислению.
При интенсивной мышечной работе усиливается доставка к сердечной мыш-
це молочной кислоты, образующейся в скелетных мышцах, следовательно,
создаются более благоприятные условия для питания сердца. Этот факт
интересен с физиологической точки зрения. Он является примером корре-
ляции функции органов. При усиленной работе мышц увеличивается интен-
сивность кровообращения. Объем работы сердца возрастает, и одновременно
с этим сердцу доставляется в увеличенном количестве молочная кислота
ОКОЧЕНЕНИЕ МЫШЦ
Мышца, изолированная из организма, через некоторое время впадает
в состояние окоченения: затвердевает и укорачивается (уменьшается в дли-
ну). Затем наступает расслабление окоченевшей мышцы, и она принимает
свой первоначальный размер. Известны несколько видов окоченения:
тепловое — при помещении мышцы в теплую воду, хлороформенное — при
воздействии на мышцу хлороформа и др. Окоченение мышцы наступает
в организме также после смерти (посмертное окоченение).
Во всех случаях окоченения, за исключением окоченения, вызванного
галоидопроизводными уксусной кислоты, в мышцах происходит расщепле-
ние гликогена с образованием молочной кислоты; чем интенсивнее этот про-
цесс, тем быстрее наступает окоченение мышц. В окоченевшей мышце
реакция сдвигается в кислую сторону вследствие накопления в ней молочной
кислоты.
Окоченение мышц во всех случаях сопровождается распадом в них
аденозинтрифосфорной и креатинфосфорной кислот.
Причина затвердевания мышц после смерти остается еще невыяснен-
ной. Предполагают, что мышцы окоченевают в результате расщепления в
них аденозинтрифосфорной кислоты без последующего ее синтеза. Мышеч-
ные волокна сохраняют свою эластичность только в присутствии достаточ-
ного количества в мышцах аденозинтрифосфорной кислоты. По мере умень-
шения содержания в мышцах аденозинтрифосфорной кислоты теряются
эластические свойства мышечных волокон, и под влиянием кислой реак-
ции, которая вызывается накоплением молочной кислоты, наступают изме-
нения физико-химического состояния белков, характерные для окоченения
мышц.
ЛИТЕРАТУРА
Владимиров Г. Е. и Н. С. Пантелеева. Функциональная биохимия.
Изд-во Ленинград, ун-та, 1965.
«Вопросы биохимии мышц». Сб. работ под редакцией Фердмана Д. Л. Изд. АН
Украинской ССР, 1954.
И в а н о в И. И. и Ю р ь е в В. А. Биохимия и патобиохимия мышц. Медгиз,
1961.
Иванов И. И. Химическая динамика мышц и подвижных клеток. Медгиз,
1950.
Фердман Д. Л. Биохимия заболеваний мышц. Изд. АН Украинской ССР,
1953.
ЭнгельгардтВ. А. Ферментативные и механические свойства белков мыш-
цы. «Успехи современной биологии», 1941, т. 14, стр. 177.
Яковлев Н. Н. Очерки по биохимии спорта. Изд. «Физкультура и спорт»,
1955.
Глава двадцать седьмая
БИОХИМИЯ НЕРВНОЙ ТКАНИ
В предыдущих главах неоднократно отмечалось, что нервной системе
принадлежит важная роль в координировании химических процессов
в организме — процессов обмена веществ. С помощью нервной системы
организм воспринимает изменения условий внешней среды и тем или иным
образом реагирует на них. С помощью нервной системы устанавливается
теснейшая связь между организмом и окружающей его внешней средой,
без которой немыслимо его существование.
В основе проявления функций нервной системы лежат химические
процессы, и важнейшая задача биологической химии — изучение особен-
ностей химического состава различных отделов нервной системы и про-
цессов обмена веществ, связанных с проявлением их функций. И. П. Пав-
лов подчеркнул важность изучения химических процессов в нервной ткани
для понимания ее функции, указав, что «едва ли можно оспаривать, что
настоящую теорию всех нервных явлений даст нам только изучение физико-
химического процесса, происходящего в нервной ткани, и фазы которого
дадут нам полное объяснение всех внешних проявлений нервной деятель-
ности, их последовательности и связи».
Следует подчеркнуть, что изучение как химического состава нервной
системы, и особенно высших ее отделов, так и протекающих в ней химиче-
ских процессов, сопряжено с большими трудностями.
Головной мозг, спинной мозг и в известной мере периферические нервы
расположены в организме таким образом, что изолировать их для биохими-
ческого анализа, не травмируя, чрезвычайно трудно. Между тем нервная
ткань больше чем какие-либо иные ткани реагирует на повреждение быст-
рым изменением своего химического состава, распадом лабильных соеди-
нений. Следует также подчеркнуть, что физиологические процессы в нерв-
ной ткани (возбуждение и торможение ее функций), особенно в коре боль-
ших полушарий, происходят чрезвычайно быстро и установить связанные
с ними сдвиги химического характера зачастую весьма трудно.
В изучении химических процессов в нервной ткани, как ив ряде иных
тканей, большую услугу оказывает исследователям изотопный метод.
Ряд вопросов, совершенно не поддававшихся изучению обычно принятыми
в биохимии методами исследования, получил свое разрешение благодаря
применению изотопного метода.
ХИМИЧЕСКИЙ СОСТАВ НЕРВНОЙ ТКАНИ
Химический состав нервной ткани очень сложен, к тому же он неоди-
наков в функционально различных отделах нервной системы (сером и белом
веществе полушарий головного мозга, мозжечке, продолговатом мозге,
спинном мозге, нервных узлах, периферических нервах). Нервная ткань
богата содержанием липидов. В сером веществе коры больших полушарий
20*
583
содержание липидов составляет около 25%, в белом веществе больших
полушарий оно достигает 40%, еще больше липидов в периферических нер-
вах. Благодаря высокому содержанию липидов, содержание белков (в %)
в нервной ткани ниже, чем в других тканях( мышцы, печень и др.). В нерв-
ной ткани имеются также азотистые и безазотистые экстрактивные вещест-
ва, незначительное количество гликогена и продуктов его превращения и
минеральные веществ а.
Пионером в деле изучения химического состава головного мозга был
И. Тудихум (1828—1901), плодотворно работавший в этом направлении
около 40 лет (с 1862 по 1901 г.). Этот исследователь имеет большие заслуги
в деле выделения и изучения липидов мозга. Следует, однако, отметить, что
Тудихум изучал химический состав головного мозга, взятого в целом.
Только в более позднее время (с 1922 г.) благодаря исследованиям А. В. Пал-
ладина и его сотрудников началось изучение химического состава функцио-
нально различных участков коры больших полушарий головного мозга,
подкорковых центров, белого вещества больших полушарий, мозжечка,
спинного мозга. Палладиным и его сотрудниками были установлены раз-
личия в химическом составе функционально различных частей центральной
нервной системы и показано, что, наряду с морфологической и функцио-
нальной топографией центральной нервной системы, существует также и
химическая топография..
Эти данные вызвали большой интерес и явились стимулом для даль-
нейших исследований не только в области изучения химической статики
центральной нервной системы, но и ее химической динамики.
БЕЛКИ НЕРВНОЙ ТКАНИ
В составе нервной ткани обнаружены различные белковые вещества.
Имеются основания предполагать, что в головном мозге (возможно также
и в других частях нервной системы) они главным образом связаны с липи-
дами, образуя белково-липидные комплексы. Белки головного мозга вклю-
чают ферменты, катализирующие различные этапы распада углеводов,
дезаминирование аминокислот, реакции переаминирования, окислительные
процессы и т. д. Белково-липидные комплексы головного мозга по своим
способностям растворяться в воде и в органических растворителях разде-
ляются на две группы: протеолипиды и липопротеиды. Первые не раство-
римы в воде и растворимы в органических растворителях, вторые, наоборот,
растворимы в воде и не растворимы в органических растворителях.
Из белого вещества мозга выделены три протеолипида. Один из них
оказался смесью нескольких протеолипидов, второй был получен в кристал-
лическом виде и состоял на 50% из белка и на 50% из липидов (фосфоли-
пидов и цереброзидов); третий же состоял на 75% из белка и на 25% из
липидов (главным образом фосфолипидов, содержащих глицерин). Протео-
липиды соответствующей обработкой удается разделить на белок и липиды.
Липопротеиды отделяют от себя липиды при воздействии веществ, де-
натурирующих белки. Липидная и белковая часть липопротеидов образуют
прочно связанные друг с другом комплексы, однородные при электро-
форезе и при ультрацентрифугировании. Существует ряд данных, указы-
вающих на важную роль липопротеидов. Считают, что они участвуют в соз-
дании тонкой структуры нервной ткани, особенно миэлиновой оболочки.
Химическая природа липопротеидных комплексов остается еще во
многом невыясненной.
В составе нервной ткани (мозга и периферических нервов) обнаружены
нуклеопротеиды, а также альбуминоид — нейрокератин — основная часть
опорной ткани нервной системы (нейроглии).
Нуклеопротеиды нервной ткани включают нуклеиновые кислоты двух
родов: содержащие рибозу и основания — аденин, гуанин, цитозин и ура-
584
цил (РНК) — и содержащие дезоксирибозу и основания — аденин, гуанин,
цитозин и тимин (ДНК).
Нейрокератин не растворим в воде. Он остается в нерастворенном виде
после обработки мозга органическими растворителями, разведенными кис-
лотами и щелочами и после воздействия пепсина и трипсина. По своему
аминокислотному составу нейрокератин отличается от обычного кератина
опорных тканей.
В головном мозге и в периферических *нервах содержится в небольшом
количестве коллаген. Как и в других тканях, в составе нервной ткани содер-
жатся фосфопротеиды.
Исследования Палладина и его сотрудников показали, что общее со-
держание белков в различных отделах нервной системы не одинаково и за-
висит от выполняемых ими функций. В функционально более активных
отделах нервной системы содержание белков выше, чем в функционально
менее активных отделах. Наименее богаты белками периферические нервы.
Проведенные исследования показали, что водорастворимые белки, извле-
ченные из головного мозга, мозжечка, нервных узлов, электрофоретически
отличаются друг от друга.
При изучении белков нервной ткани интересные данные получены в
результате применения изотопного метода. Установлено, что введенные
в организм меченые аминокислоты (535-метионин, Си-глицин и др.)< появ-
ляются в составе белков различных отделов нервной системы. Особенно
интенсивно включаются аминокислоты в белки головного и спинного мозга
в случаях субокципитального их введения и при введении их в спинно-
мозговую жидкость, т. е. в обход так называемых барьеров, препятствую-
щих проникновению тех или иных веществ в нервную ткань.
Опыты с введением в организм 535-метионина показали, что интенсив-
ность включения аминокислот в белки различных отделов нервной системы
неодинакова (Палладии). Наиболее интенсивно включаются аминокислоты
в белки функционально более сложных и филогенетически более молодых
отделов: в серое вещество больших полушарий и в мозжечок. Менее интен-
сивно включаются аминокислоты в белки белого вещества полушарий,
спинного мозга и периферических нервов.
Эти данные говорят о том, что функционально различные отделы нерв-
ной системы отличаются друг от друга не только по количественному содер-
жанию белков, но и но интенсивности их обмена, о котором можно судить
по интенсивности включения аминокислот.
С помощью радиоактивного фосфата (Р32) изучались нуклеиновые кис-
лоты нервной ткани, входящие в состав нуклеопротеидов. Установлено,
что при введении радиоактивного фосфата в спинномозговую жидкость он
быстро включается в состав нуклеиновых кислот. То же самое имеет место
при прибавлении радиоактивного фосфата к питательной среде, снабженной
кислородом, в которой помещены срезы головного мозга.
Установлено, что интенсивно включается радиоактивный фосфат в фос-
фопротеиды головного мозга (Де-Люка, Энгельгардт и др.).
НЕБЕЛКОВЫЕ АЗОТИСТЫЕ ЭКСТРАКТИВНЫЕ
ВЕЩЕСТВА
В нервной ткани содержатся многочисленные азотистые небелковые
соединения. По своей химической природе они, как правило, не отличаются
от азотистых экстрактивных веществ других тканей и органов. Здесь суще-
ствуют различия лишь количественного характера. Так, например, содер-
жание креатина, а отсюда и креатинфосфорной кислоты в головном мозге
ниже, чем в мышцах, но значительно выше, чем в почках или в печени.
Ниже также содержание в головном мозге аденозинтрифосфорной кислоты.
Еще меньше в спинном мозге и в периферических нервах креатинфосфорной
и аденозинтрифосфорной кислоты.
585
В головном мозге содержатся различные аминокислоты и близкие к
ним вещества. Ниже приводятся данные об их количественном содер-
жании.
Содержание аминосоединений в головном мозге (мг %)
Аминный азот................................ 38—42
Глутаминовая кислота........................ 120—140
Глутамин.................................... 70—90
7-Аминомасляная кислота..................... 32—35
Аспарагиновая кислота ...................... 40—42
N-Анетиласпарагиновая кислота............... 80—85
Треонин..................................... 8—10
Азот других аминокислот..................... 15—17
Таурин...................................... 63—67
Глутатион (общий) .......................... 90—100
Азот других полипептидов.................... 18—22
Из приведенных данных видно, что в головном мозге содержится много
глутаминовой кислоты и глутамина. Суммарное содержание их составляет
190—230 мг%. В головном мозге содержатся также значительные количества
аспарагиновой и д-аминомасляной кислоты.
Оценивая количество тех или иных веществ, находящихся в нервной
ткани, следует принимать во внимание высокое по сравнению с другими
тканями содержание липидов. Если исключить из нервной ткани липиды,
а также и воду, то в сухом остатке ее содержание ряда веществ оказывается
выше, чем в сухом остатке других тканей.
В различных в функциональном отношении отделах нервной системы
содержание некоторых экстрактивных азотистых веществ оказывается
неодинаковым. Так, например, креатина в мозжечке больше, чем в полуша-
риях головного мозга, в последних больше, чем в спинном мозге.
ЛИПИДЫ НЕРВНОЙ ТКАНИ
Нервная ткань особенно богата липидами. По своим химическим осо-
бенностям липиды нервной системы могут быть разделены на следующие
группы:
I. Фосфолипиды
1. Фосфатиды, содержащие глицерин (фосфоглицериды). К ним отно-
сятся фосфатидилхолины (лецитины), фосфатидилэтаноламины и фосфатидил-
серипы.
2. Фосфатиды, содержащие инозит.
3. Фосфатиды, содержащие сфингозин (сфингомиэлины).
4. Ацетальфосфатиды.
II. Гликолипиды
1. Цереброзиды (гликосфингозиды).
2. Ганглиозиды.
3. Страндин.
III. Сульфатиды
IV. С т е р и н ы
Количественное содержание липидов в нервной ткани у млекопитаю
щих животных в % влажного вещества приведено ниже:
586
Липиды
Серое Белое
вещество
вещество
Общие липиды........................................ 3,5—4,5
Фосфатидилхолин..................................... 1,0—1,5
Кефалин (фосфатидилсерин, фосфатидилэтаноламин) . . . 1,5—2,5
Сфингомиэлин ....................................... 0,5—0,9
Цереброзиды......................................... 0,5—1,5
Холестерин ......................................... 0;8—1,4
7,5—9,0
1,2—2,0
3,0-5,2
2,0—4,0
4,0—7,0
3,6—5,4
Воды в нервной ткани содержится в сером веществе 83—87%, в белом —
70—74%.
Из приведенных данных следует, что нервная ткань богата содержанием
различных липидов, причем количество липидов в белом веществе больших
полушарий (это относится также и к периферическим нервам) значительно
выше, чем в сером веществе.
В мозге содержание жиров (триглицеридов) незначительно. Выше со-
держание их в периферических нервах.
Остановимся на химическом строении гликолипидов и сульфатидов.
К ганглиозидам относятся гликопротеиды. Ганглиозид выделен из серого
вещества больших полушарий головного мозга. В состав его входят по од-
ному остатку молекул нейраминовой кислоты, сфингозина и стеариновой
кислоты и три остатка молекул гексозы.
Нейраминовая кислота, как полагают, является продуктом альдольной
конденсации маннозамина с пировиноградной кислотой:
ОН
СН
hc-nh2 сн2
он
НС с
СНОН О СООН
снон
I
СН2ОН
Нейраминовая кислота
Нейраминовая кислота широко распространена в животных тканях,
она почти постоянный компонент углеводсодержащих белков, включая бел-
ки сыворотки крови человека и гликолипиды (ганглиозиды). Л/'-ацетилней-
раминовая кислота является, по-видимому, одной из форм группы сходных
соединений, известных под общим названием сиаловых кислот. Сиаловые
кислоты относительно сильные кислоты, очень лабильные, с высокой реак-
ционной способностью. Интересна способность сиаловых кислот отщепляться
от гликопротеидов под действием вируса гриппа и некоторых бактериальных
ферментов (ферменты высокопатогенных бактерий — холерного вибриона
и бациллы Велша), что проливает некоторый свет на их биологическую роль
(иммунитет).
Сиаловые кислоты входят в состав ганглиозидов. При некоторых забо-
леваниях мозга отмечено увеличение содержания в нем ганглиозидов при
уменьшении содержания цереброзидов.
Из мозга выделен сложный по своему составу гликолипид — страндип.
Состоит страндин из жирной кислоты, сфингозина, или подобного ему ве-
щества, глюкозамина, моносахарида (по-видимому, галактозы), первичного
амина и неизвестного по своей природе, способного к окрашиванию веще-
ства. Страндин содержится в сером веществе головного мозга в большем
количестве, чем в белом веществе.
587
Сульфатиды впервые были обнаружены в мозге Тудихумом. Описан
липид, состоящий из цереброзида и из серной кислоты, получивший назва-
ние церебронсерной кислоты.
Как уже указывалось, липиды в нервной ткани образуют с белками
комплексы.
МИНЕРАЛЬНЫЕ ВЕЩЕСТВА НЕРВНОЙ ТКАНИ
В составе нервной ткани обнаруживаются различные минеральные
вещества, которые более или менее равномерно распределены в различных
отделах нервной системы. Ниже приводятся данные о содержании различ-
ных минеральных веществ в некоторых отделах нервной системы млеко-
питающих (в % влажного вещества).
Минеральное вещество Серое вещество головного мозга Белое вещество Спинной мозг Периферические нервы
Зола 1,0-2,2 0,7—0,25 1,2—1,9 1,0—1,1
Na 0,11—0,21 0,10—0,20 0,13—0,20 0,17—0,4
к 0,20—0,35 0,18—0,38 0,26—0,34 0,12—0,20
Са 0,01—0,013 0,010—0,013 0,018—0,032 " " "
Mg 0,02—0,023 0,026—0,040 0,038—0,048 —
С 0,11—0,22 0,09—0,18 0,12—0,15 0,17—0,28
N 0,056—0,08 0,09—0,015 0,08—0,10 0,07—0,12
Р 0,019—0.29 0,33—0,48 0,52—0,55 0,20—0,48
Н2О 83—87 70—74 66—75 60—70
Фосфор в нервной ткани представлен рядом фосфорных соединений:
неорганическим фосфатом и органическими фосфорными соединениями.
К последним относятся различные фосфолипиды, рибонуклеиновые кислоты,
дезоксирибонуклеиновые кислоты, фосфопротеиды, фосфорил холин, фос-
форилэтаноламин, креатинфосфорная кислота, аденозинтрифосфорная кисло-
та и продукты ее дефосфорилирования и др.
Фосфорное соединение
Серое вещест-
во головного
мозга
Р общий ....................
Р липидов ..................
Р растворимый в кислоте . .
Р неорган. фосфорной кислоты
Р креатинфосфорной кислоты
Р аденозинтрифосфорной кис-
лоты .......................
Р других растворимых в кис-
лоте фосфорных соединений
Р рибонуклеиновых кислот . .
Р дезоксирибонуклеиновых кис-
лот ................ . . . .
Р фосфопротеидов............
0,19—0,29
0,12—0.18
0,08—0,19
0,030—0,045
0,015—0,017
0,025—0,30
0,022—0,029
0,010—0.011
0,004—0,005
0,002—0,003
Белое
вещество
Спинной
мозг
Перифериче-
ские нервы
0,33—0,49 0,52—0,55 0,20—0,40
0,25—0,38 0,30—0,40 0,1—0,25
0,06—0,120 0.06—0,07 0,028—0.06
0,015—0,020 0,010—0.012
в сером и белом веществе полушарий
головного мозга
0,025—0,042 0,030—0.050 0,02—0,035
0,006—0,008 0,004—0,005
0,004—0,005 * — 0,003—0.004
0,002—0,003 ~ * 0,002—0,003
В таблице приводятся данные о содержании фосфорных соединений в
различных отделах нервной системы млекопитающих (в % влажного веще-
ства).
Кроме перечисленных в таблице неорганических веществ, в нервной
ткани содержатся также микроэлементы (Си, Со, Zn и др.).
588
ОБМЕН ВЕЩЕСТВ В НЕРВНОЙ ТКАНИ
В головном мозге обнаружены ферменты, катализирующие различные
этапы превращения углеводов, азотистых веществ, фосфорных соединений
и аэробного окисления продуктов распада углеводов, жиров, аминокислот.
Это обстоятельство позволяет считать, что в нервной ткани широко пред-
ставлены реакции превращения различных органических веществ, приводя-
щие к их использованию нервной тканью.
ОБМЕН УГЛЕВОДОВ
Головной мозг усиленно потребляет глюкозу, о чем можно судить по
содержанию глюкозы в притекающей к нему и оттекающей от него крови.
Если изучать одновременно с потреблением глюкозы головным мозгом пот-
ребление им кислорода, можно видеть, что количество потребленного кисло-
рода оказывается достаточным для окисления всей поглощенной мозгом
глюкозы. Давно уже установлено, что глюкоза — основное питательное
вещество головного мозга. Важное значение глюкозы для питания головно-
го мозга видно хотя бы из того, что снижение содержания ее в крови, при-
водящее к снижению потребления ее мозгом (при гипогликемии, вызванной
введением инсулина), вызывает нарушение обмена веществ в мозге, сопро-
вождающееся судорогами. Гликогена в головном мозге так мало (около
ОД %), что он не может обеспечить хотя бы в продолжении короткого вре-
мени потребности мозга в углеводах. Чрезвычайно чувствителен головной
мозг к факторам, нарушающим в организме углеводный обмен. Известно,
например, что нервная ткань чувствительна к недостатку в организме вита-
мина В} (тиамина), при котором имеет место нарушение превращений од-
ного из промежуточных продуктов обмена глюкозы — пировиноградной
кислоты.
При авитаминозе Вх в нервной ткани накопляется пировиноградная
кислота и одновременно с этим нарушается функция нервной системы, осо-
бенно периферических нервов.
Изучению превращения углеводов в головном мозге посвящены много-
численные исследования А. В. Палладина и его сотрудников. В результате
этих исследований установлено, что в головном мозге содержатся амилаза и
мальтаза, катализирующие гидролиз гликогена с образованием глюкозы,
фосфорилаза, катализирующая фосфоролиз гликогена с образованием глю-
козо-1-фосфорной кислоты. Синтез гликогена в головном мозге осуществляет-
ся с помощью трансглюкозилазы, катализирующей перенесение глюко-
зильного остатка от УДФ-глюкозы на продукты расщепления гликогена.
Использование глюкозы как образующейся при гидролизе гликогена в
мозге, так и поглощенной мозгом из крови, сопровождается ее фосфорили-
рованием с помощью глюкозокиназы с использованием фосфорной кислоты
АТФ:
глюкоза АТФ —» глюкозо-6-фосфорная кислота.
Образующаяся глюкозофосфорная кислота, с одной стороны, подвер-
гается в ткани мозга гликолизу, с другой — она может быть использована
для синтеза гликогена.
Значение синтеза гликогена в головном мозге убедительно доказано
исследованиями М. И. Прохоровой с применением глюкозы, меченной радио-
активным углеродом. Установлено, что при введении в организм глюкозы
(а также сахарозы), меченной радиоактивным углеродом, гликоген мозга
приобретает радиоактивность. Сравнение радиоактивности гликогена мозга
и гликогена печени после введения в организм радиоактивной глюкозы по-
казало, что скорость обновления гликогена мозга примерно равна, а в не-
которых случаях даже превышает скорость обновления гликогена в печени.
589
Таким образом, несмотря на низкое содержание гликогена в головном мозге,
он играет важную роль в углеводном обмене мозга. По-видимому, немалая
часть глюкозы, поглощаемой головным мозгом, прежде чем быть исполь-
зованной, проходит стадию превращения в гликоген.
Исследованиями Палладина, его сотрудников и других изучены в голов-
ном мозге отдельные ферменты анаэробного гликолиза. Можно считать
установленным, что распад углеводов с образованием молочной кислоты
(анаэробный гликолиз) в нервной системе происходит по тому же пути, как
и в других тканях. В ткани головного мозга имеет место также и аэробный
гликолиз (образование молочной кислоты в присутствии кислорода). Сле-
дует, однако, отметить, что энергия углеводов в основном используется в
результате их аэробного распада с образованием углекислого газа и воды.
Опыты со срезами головного мозга показали, что главными субстра-
тами дыхания головного мозга являются глюкоза и промежуточные продук-
ты ее распада — пировиноградная и молочная кислоты. Интенсивность ды-
хания срезов головного мозга быстро падает благодаря низкому содер-
жанию в них гликогена, но может поддерживаться на высоком уровне при
прибавлении к ним глюкозы.
Дыхательный коэффициент при этом оказывается близким к единице.
Дыхательный коэффициент ткани периферических нервов ниже единицы
(0,8—0,85), т. е. ткани головного мозга при дыхании потребляют почти
исключительно углеводы, а ткани нервов — наряду с углеводами еще и
другие вещества.
АЗОТИСТЫЙ ОБМЕН
В нервной ткани, особенно в головном мозге, имеет место превращение
азотистых веществ. В ней имеются ферменты переаминирования и деза-
минирования аминокислот, дезаминазы адениловой кислоты и глутаминовой
кислоты, декарбоксилаза глутаминовой кислоты и др.
В обмене веществ головного мозга особенно важная роль принадлежит
глутаминовой кислоте, являющейся важным субстратом питания нервной
ткани. При дезаминировании глутаминовой кислоты образуется а-кето-
глутаровая кислота — одно из веществ окислительного цикла трикарбоно-
вых кислот. Включаясь в этот цикл, она подвергается окислению с образо-
ванием конечных продуктов — углекислого газа и воды. Следует, однако,
отметить, что глутаминовая кислота в противоположность ее амиду — глу-
тамину — весьма трудно проникает из крови и из спинномозговой жидко-
сти в мозг. Возможно, что глутаминовая кислота, прежде чем быть исполь-
зованной головным мозгом, подвергается амидированию, а затем в виде
глутамина легко проникает в нервную ткань, где она подвергается превра-
щениям. Установлено, что глутамин может синтезироваться в ткани голов-
ного мозга. В том случае в нервной ткани устраняются и, следовательно,
обезвреживаются ионы аммония. В ткани головного мозга содержится глу-
таминаза, катализирующая реакцию дезамидирования глутамина с обра-
зованием глутаминовой кислоты и аммиака. Глутамин как доставляемый в
головной мозг с кровью, так и синтезирующийся в нем, может рассматри-
ваться в качестве источника аммиакообразования.
Ниже приводится схема превращения глутаминовой кислоты в голов-
ном мозге.
Образование в головном мозге у-аминомасляной кислоты из глутами-
новой кислоты имеет важное функциональное значение. Показано, что
у-аминомасляная кислота оказывает тормозящее влияние на возникнове-
ние возбуждения коры головного мозга. у-Аминомасляная кислота подвер-
гается в головном мозге ферментативным превращениям. Она включается
в процессы переаминирования, реагируя с а-кетоглутаровой кислотой,
превращается в гуанидинмасляную кислоту, в результате перенесения на
590
4-НАД
Глутаминовая кислота с а-Кетоглутаровая кислота 4- НАД—Н2
4-NH3
(АТФ)
Глутамин
5 СО2
п
S ’ г
® у-Аминомасляная СО2 и Н2О
5 кислота
а
о
С
а-Кетокислоты
а-Аминокислоты
нее амидиновой группы от аргинина. Наконец, у-аминомасляная кислота—
составная часть гомокарнозина — вещества, обнаруженного в головном
мозге.
CH2NH2
I
сн2
I
сн2
I
соон
соон
I
с= о
I
+ сн2
I
сн2
I
соон
I
сн2
I
соон
соон
I
chnh2
I
+ сн2
I
сн2
I
соон
7'Лминомасля- а-Кетоглу-
ная кислота таровая
кислота
nh2
I
С—NH
ch2nh2 NH
сн2 сн2
1 4 сн2 । сн2
1 соон сн2
chnh2 1 соон
f-Аминомас- Аргинин
ляная кислота
Ссмиальдегид Глутамино-
янтарной вая кислота
кислоты
nh2 1 nh2
С—NH 1
1 сн2
NH 1
1 сн2
сн2 + 1
1 сн2
сн2 1
CHNH
сн2 1
1 соон
соон
у-Гуанидинмасляная Орнитин
кислота
N—С—СН8—CHNI12СО
I
NH
I
сн2
I
сн2
I
сн2
I
соон
Гомокарнозин
В обмене веществ в нервной ткани участвуют нуклеиновые кислоты.
Установлено, что при развитии нервной ткани в молодых нервных клетках
содержатся только дезоксирибонуклеиновые кислоты. На дальнейших
591
ступенях роста и развития нервной клетки в ней появляются рибонуклеи-
новые кислоты. По мере повышения содержания рибонуклеиновой кислоты
в нервной клетке уменьшается содержание дезоксирибонуклеиновых кис-
лот. В нервной ткани, как и в иных тканях, нуклеиновые кислоты (особенно
рибонуклеиновые кислоты) участвуют в процессе биосинтеза белков(стр.471).
С помощью изотопного метода исследования установлено, что нуклеи-
новые кислоты в головном мозге так же, как и в других тканях подверга-
ются постоянному обновлению.
ОБМЕН ЛИПИДОВ
Имеющиеся экспериментальные данные позволяют считать, что в ткани
головного мозга превращение жиров (триглицеридов) существенной роли
не играет. Другие липиды (фосфолипиды, гликолипиды, стерины), зани-
мающие важное место в структуре нервной ткани, как показали исследо-
вания с применением меченых атомов, подвергаются обновлению, хотя
объем этого обновления сравнительно невелик. До сих пор остается еще
невыясненным вопрос о количестве фосфолипидов и некоторых других ли-
пидов, синтезируемых в ткани головного мозга, и о количестве липидов,
доставляемых в головной мозг с кровью. Более полно изучен в головном
мозге обмен холестерина. Установлено, что в притекающей к головному
мозгу крови (артериальной) содержание холестерина ниже, чем в оттекаю-
щей (венозной). Отсюда следует, что из мозга в кровь поступает холесте-
рин. По-видимому, в ткани мозга используется ацетил—SKoA для синтеза
холестерина. Повышение содержания холестерина в крови при некоторых
заболеваниях (менингоэнцефалитах и абсцессах мозга) связано с усиленным
поступлением холестерина из мозга в кровь.
ПРОЦЕССЫ ОКИСЛЕНИЯ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
И ФОСФОРИЛИРОВАНИЯ
Ткань головного мозга (опыты in vitro), как и головной мозг в организ-
ме (опыты in vivo), интенсивно потребляют кислород и выделяют угле-
кислый газ. В нервной ткани содержатся ферменты, катализирующие раз-
личные реакции окисления органических веществ, и в ней особо большую
роль играют процессы аэробного окисления. Это объясняет причину боль-
шой чувствительности головного мозга к недостатку, а тем более к отсут-
ствию кислорода. Установлено, что эволюция позвоночных животных
сопровождалась увеличением интенсивности дыхания головного мозга
и снижением интенсивности в нем анаэробного гликолиза, усилением ак-
тивности цитохромоксидазы и системы цитохромов.
Окислительные процессы в нервной ткани, как и в других тканях,
связаны с процессами фосфорилирования. По данным исследований
Е. М. Крепса и Н. А. Вержбинской, эволюция позвоночных животных со-
провождалась усилением в головном мозге связи между процессами окис-
ления и фосфорилирования.
ХИМИЗМ ПЕРЕДАЧИ НЕРВНОГО ИМПУЛЬСА
Электрические явления, наблюдающиеся в нерве при его возбуждении,
связаны с различием в концентрации ионов внутри аксона и на поверхности
мембраны, окружающей аксон. Установлено, что концентрация ионов калия
внутри аксона приблизительно в 30 раз выше, чем во внеклеточной жидкости
в то время как концентрация ионов натрия во внеклеточной жидкости при-
мерно во столько же раз выше, чем внутри аксона. Физиологические ис-
592
следования показывают, что при прохождении импульса по нерву электри-
ческая полярность в нем меняется от положительной к отрицательной,
и вместе с этим значительно уменьшается электрическое сопротивление
между внутренней и внешней поверхностями мембраны аксона. Эти данные
выявляют роль ионов, особенно калия, в процессе передачи нервного им-
пульса.
Наряду с ионной теорией передачи нервного импульса существует
теория химической передачи его, получившая широкое признание среди
физиологов и биохимиков. Согласно этой теории, процесс передачи нервного
возбуждения сопровождается освобождением в нервных окончаниях хими-
ческих веществ, получивших название химических медиаторов. Передача
возбуждения с помощью химических веществ происходит также и в цент-
ральной нервной системе. Установлено, что раздражение парасимпатиче-
ских нервов или двигательных нервов сопровождается освобождением аце-
тилхолина, раздражение же симпатических нервов — освобождением осо-
бых веществ симпатинов (производных адреналина). При возбуждении
центральной нервной системы также освобождается ацетилхолин. В зави-
симости от веществ, участвующих в передаче нервного импульса в пери-
ферических синапсах (месте контакта окончаний нерва с тем или иным
органом), различают холинэргические и адренэргические нервы.
фосфопировиноградная
кислота
пировиноградная
кислота + О
АДФ ~Р
связанный
комплекс, диссо-
циирующийся
А цх 1 ч*
. 4 7 движениями \
ионов
%
процесс,ускоряю-
щиеся движением
ионов сквозь мемб-
рану
эстераза.
АТф фосфокреатин
' Г
холин ацетат
«активная' уксусная кислотам
креатин
/холин - >
ацетил -
транс<ре -
< раза )
ацетил V*
коэнзим
киназа
Рис. 24. Схема образования, освобождения и разрушения ацетилхолина
С биохимической точки зрения, большой интерес имеет изучение процес-
сов обмена веществ, приводящих к образованию, а затем к распаду химиче-
ских медиаторов. В этом отношении подробно изучены процессы синтеза
и распада ацетилхолина.
Ацетилхолин представляет собой сложный эфир холина и уксусной
кислоты (стр. 338). Холин, как известно, образуется в организме синтети-
593
чески из этаноламина, возникающего в свою очередь из серина, и из метио-
нина (стр. 381); в известном количестве он поступает также в организм извне,
с пищей. В нервной ткани, как и в других тканях, содержится фермент,
катализирующий синтез ацетилхолина из холина и ацетил—SKoA — хо-
линацетилтрансфераза, действие которого детально изучено Д. Нахманзо-
ном, и фермент холинэстераза, катализирующий гидролиз ацетилхолина
с образованием холина и уксусной кислоты. Активность холинацетилтрансфе-
разы неодинакова в различных отделах нервной системы, она выше в тех
отделах нервной системы, где особенно интенсивно происходит синтез аце-
тилхолина. Передача возбуждения холинэргическими нервами связана не
только с синтезом и освобождением ацетилхолина, но и с действием холин-
эстеразы, под влиянием которой происходит гидролитическое расщепление
ацетилхолина. В нервной и в других тканях организма, следовательно,
существуют две связанные друг с другом системы синтеза и распада аце-
тилхолина. Распад ацетилхолина с помощью холинэстеразы приводит
к уничтожению его физиологической активности. Ацетил—SKoA, необхо-
димый для синтеза ацетилхолина, образуется как продукт превращения угле-
водов и других веществ. Д. Нахманзон, детально изучал процессы обмена
веществ, приводящие к образованию и освобождению ацетилхолина и к его
разрушению (см. схему на стр. 593).
Из схемы следует, что в синтезе ацетилхолина используются энергия
макроэргических фосфорных соединений, а также ионы магния, калия и
кальция, активирующие действие ферментов.
Существует ряд доказательств в пользу теории передачи нервных
импульсов с помощью химических медиаторов. Основные из них, подтвер-
ждающие положение о том, что ацетилхолин — медиатор парасимпатиче-
ской нервной системы, следующие: 1) гидролиз ацетилхолина под воздей-
ствием холинэстеразы — процесс, специфический для нервной ткани и про-
текающий с огромной скоростью; 2) скорость гидролиза ацетилхолина
совпадает со скоростью передачи нервного импульса; 3) холинэстераза
локализована исключительно на поверхности аксона; 4) торможение дей-
ствия холинэстеразы физостигмином, эзерином и другими веществами за-
медляет и прекращает передачу нервных импульсов. Отсюда можно заклю-
чить, что в основе передачи нервного импульса по парасимпатическим нер-
вам лежит биохимическая система, приводящая к синтезу и освобождению
ацетилхолина и затем к его разрушению.
В пользу теории химической медиации с помощью ацетилхолина гово-
рят также данные сравнительно-биохимического характера. Ацетилхолин
обнаружен в нервной ткани различных, далеко отстоящих по своему эво-
люционному развитию, животных. Концентрация ацетилхолина в электри-
ческом органе скатов (нервная ткань) прямо пропорциональна силе его
электрического разряда.
Передача нервного импульса по симпатической нервной системе, как
указывалось выше, осуществляется с помощью симпатинов.
Уже давно была показана близость симпатинов и адреналина. Однако
наряду со сходством физиологических эффектов, возникающих при раздра-
жении симпатических нервов и при действии адреналина, были отмечены
и некоторые различия между ними. Кеннон предложил различать симпа-
тии возбуждения—симпатии Е (англ, exitation — возбуждение) и симпа-
тии угнетения — симпатии 1 (англ, inhibition — торможение). Причем он
полагал, что в основе действия симпатинов лежит адреналин, который,
соединяясь в эффекторных органах с различными веществами, образует
разные симпатины.
Вопросами химической природы симпатинов много занимались Бакк,
Эйлер, Утевский и другие.
В последнее время получены многочисленные доказательства того, что
действие симпатинов более связано с действием норадреналина, чем адре-
налина.
594
Эйлер на основании ряда исследований пришел к выводу, что симпа-
тии — это норадреналин. А. М. Утевский и сотрудники показали, что про-
межуточные продукты окисления адреналина оказывают влияние на дейст-
вие адреналина и норадреналина. В условиях, когда образуются симпа-
тины, очевидно наряду с норадреналином и адреналином определенную
роль играют промежуточные продукты их обмена.
Таким образом, симпатии— это, несомненно, адренэргические вещества,
возникающие из адреналина и норадреналина.
Теория передачи нервных импульсов с помощью химических веществ
не опровергает теорию осуществления передачи нервного возбуждения
с помощью ионов, особенно калия. Следует вместе с этим подчеркнуть, что
в основе участия ионов в передаче нервных импульсов, а также в биотоках,
сопровождающих возбуждение тех или иных отделов нервной системы,
лежат процессы обмена веществ.
Веществами, специфически действующими на функцию центральной
нервной системы, являются у-аминомасляная кислота и 5-окситриптамин
(серотонин). О них уже сообщалось на стр. 591. у-Аминомасляная кислота
оказывает свое действие непосредственно на нервную клетку, тормозя ее
возбуждение. 5-окситриптамин действует в обратном направлении, усиливая
ее возбуждение.
СВЯЗЬ МЕЖДУ ФУНКЦИОНАЛЬНЫМ СОСТОЯНИЕМ
ГОЛОВНОГО МОЗГА И ПРОЦЕССАМИ
ОБМЕНА ВЕЩЕСТВ
Выяснение связи между функциональным состоянием нервной системы
и протекающими в ней химическими процессами — одна из важнейших
проблем биохимической науки. Между тем разрешение этой проблемы встре-
чает ряд трудностей. Основные из них заключаются в том, что функцио-
нально различные отделы нервной системы отличаются друг от друга как
по своему морфологиескому строению, так и по своему химическому составу,
и поэтому нуждаются в раздельном изучении. Изолирование отдельных
частей нервной системы, например серого вещества, белого вещества, под-
корковых центров головного мозга, без их травмирования практически не-
возможно.
Нервная система, особенно кора головного мозга, очень чувствительна
к недостатку кислорода. Время, необходимое для извлечения головного моз-
га, а также и иных его отделов, оказывается достаточным для создания кис-
лородного голодания, изменяющего химический состав ткани.
Трудности устраняются применением в исследованиях низких температур. За-
мораживание головного мозга погружением головы животного в жидкие газы (азот,
кислород, воздух) или же в случаях исследований на мелких животных, погружении
их целиком в жидкие газы приостанавливает течение ферментативных процессов, пре-
дохраняет головной мозг при его извлечении и дальнейшей обработке от изменения
состава.
Нервная система — непрерывно функционирующий орган, быстро реа-
гирующий на различные воздействия внешней и внутренней среды орга-
низма. Это обстоятельство также в значительной мере затрудняет изучение
изменений в его составе, связанных с деятельностью нервной системы.
Для изучения связи между функциональным состоянием головного моз-
га и процессами обмена веществ обычно прибегают к применению тех или
иных фармакологических веществ, которые или усиливают процессы воз-
буждения в коре головного мозга (фенамин, кардиазол и др.), или вызы-
вают и усиливают процессы торможения в коре головного мозга (барбиту-
раты, препараты брома и др.). Удобно изучать химические процессы в нерв-
ной системе при различных функциональных состояниях организма на
595
зимнеспящих животных, у которых во время спячки в нервной системе
имеет место сильное преобладание тормозных процессов.
В изучении обмена веществ в нервной системе при различных функ-
циональных ее состояниях большое место занимает изотопный метод.
Исследованиями Г. Я. Городисской в лаборатории Палладина, прове-
денными еще в двадцатых годах, была установлена связь между функ-
циональным состоянием зрительного центра коры головного мозга и содер-
жанием в нем небелковых азотистых веществ. Оказалось, что при пониже-
нии функционального состояния этого центра, вызываемого зашиванием
век, снижается содержание в нем азота, входящего в состав небелковых
веществ. В серии дальнейших исследований А. В. Палладина и его сотруд-
ников неоднократно устанавливалась связь между функцией головного мозга
и происходящими в нем процессами обмена веществ. Обнаружение в голов-
ном мозге макроэргических фосфорных соединений (креатинфосфорной и
аденозинтрифосфорной кислот) явилось стимулом к изучению их роли в
головном мозге.
Систематическими исследованиями Л. В. Палладина, Г. Е. Владими-
рова и их сотрудников с применением изотопного метода установлено, что
при возбуждении функции головного мозга, в нем в первую очередь исполь-
зуется энергия макроэргических фосфорных соединений и усиливаются
процессы обновления белковых веществ, фосфолипидов и других соеди-
нений. При торможении же функции головного мозга интенсивность обнов-
ления этих веществ оказывается сниженной.
Обнаружены изменения в интенсивности включения введенной в орга-
низм животных радиоактивной глюкозы в гликоген мозга при его возбу-
ждении и торможении. В первом случае включение радиоактивной глюкозы
в гликоген мозга оказалось в два раза большим, чем во втором.
Результаты исследований Палладина, Владимирова и их сотрудников
показали, что при торможении функции коры головного мозга при нарко-
тическом сне обмен веществ направлен к повышению содержания в нем
важных в энергетическом отношении веществ. Подобное явление было уста-
новлено Д. Л. Фердманом и его сотрудниками при изучении у зимнеспящих
животных содержания в головном мозге креатинфосфорной, аденозинтри-
фосфорной кислот и гликогена в период зимней спячки. Эти данные пред-
ставляют интерес, так как они показывают, что охранительное торможение
коры головного мозга следует рассматривать как активный процесс, харак-
теризующийся определенным течением процесса обмена веществ.
Возбуждение головного мозга сопровождается повышением содержания
в нем аммиака. Приведенные данные показывают, как шаг за шагом вскры-
ваются закономерности химических процессов, лежащих в основе проявле-
ния функции нервной системы.
СПИННОМОЗГОВАЯ жидкость
Спинномозговая жидкость (ликвор) имеет важное физиологическое зна-
чение для нормальной деятельности центральной нервной системы. Она
по своему химическому составу отличается от плазмы крови. Особенно это
относится к содержанию в них белковых веществ, а также холестерина.
Содержание белков в спинномозговой жидкости примерно в 300 раз меньше,
чем в плазме крови, а содержание холестерина в 1000 раз меньше. Это гово-
рит о том, что спинномозговую жидкость нельзя рассматривать как «ультра-
фильтрат» крови. Она в известной мере является внутренней средой для
мозга. Изучение скорости проникновения в мозг ряда веществ, введенных в
организм, а также оттока веществ из мозга в кровь, привело к заключению
о существовании так называемого «гематоэнцефалического барьера». Роль
этого «барьера» заключается в том, что он поддерживает постоянство внут-
ренней среды центральной нервной системы и предохраняет ее от воздей-
596
ствия тех или иных ядовитых веществ, которые смогли бы поступить из
крови.
Химический состав спинномозговой жидкости изменяется при различ-
ных заболеваниях нервной системы (воспалении мозговых оболочек, про-
грессивном параличе и др.).
ЛИТЕРАТУРА
Биохимия нервной системы. Сб. статей под ред. акад. А. В. П а л л а д и н а.
Изд. АН Украинской ССР, 1954.
VIII Всесоюзная конф, по биохимии нервной системы. Ереван, 1963.
Владимиров Г. Е. Пути и методы исследования функциональной биохи-
мии мозга. «Успехи биологической химии», 1954, т. 1, стр. 51.
Владимиров Г. Е. Функциональная биохимия мозга. Баховские чтения,
IX. Изд. АН СССР, 1954.
Вопросы биохимии нервной системы. Сб. статей под ред. акад. А. В. II а л л а-
д и н а. Изд. АН Украинской ССР, 1957.
Владимиров Г. Е. и С ы т и н с к и й И. А. Обмен 7-аминомасляной кис-
лоты и ее роль в функциональной деятельности нервной системы. «Успехи современной
биологии», 1961, т. 51, стр. 3.
М а к-И л ь в е й н Г. Биохимия и центральная нервная система. ИЛ, 1962.
НоздрачевА. Д. Некоторые современные представления о роли серотонина
в организме. «Успехи современной биологии», 1962, т. 54, стр. 129.
Палладии А. В. и ХайкинаБ. И. Биохимия головного мозга. «Успехи
биологической химии», 1954, т. II, стр. 27.
Палладии А. В. Биохимические процессы в головном мозге при раз-
личных функциональных состояниях. «Журн. высшей нервной деятельности», 1956,
т. VI, стр. 8.
Палладии А. В. Вопросы биохимии нервной системы. Изд-во «Наукова
думка», Киев, 1965.
III а п о т В. С. О природе особой чувствительности головного мозга к кислород-
ной недостаточности. «Успехи современной биологии», 1952, т. 34, стр. 244.
Глава двадцать восьмая
БИОХИМИЯ ЛЮМИНЕСЦЕНЦИИ
Среди животных встречаются виды, обладающие способностью све-
титься. Они составляют группу люминесцирующих организмов. Явление
свечения наблюдается также и у бактерий. Животные, способные светиться,
обладают специальным люминесцирующим органом, в котором сосредото-
чены процессы, сопровождающиеся испусканием света.
Люминесценция как биологическое явление с давних пор привлекает
к себе внимание исследователей. Изучение биолюминесценций получило
материальную основу начиная с последней четверти XIX столетия, когда
было установлено, что многие органические вещества при окислении их
в водном растворе люминесцируют. В связи с этим высказывалась мысль,
что свечение организмов является результатом превращения каких-то
веществ. Возникла необходимость изучения химической природы люминес-
цирующих веществ и ферментативных процессов, приводящих к люминес-
ценции.
В 1895 г. Р. Дюбуа показал, что при погружении светящего органа
жука Pyrophorus в горячую воду свечение прекращается, не возобновляясь
при охлаждении. Этим было показано, что люминесценция является фер-
ментативным процессом. При тепловом инактивировании ферментов люми-
несценция необратимо прекращается. В дальнейших исследованиях было
установлено, что из люминесцирующих органов можно извлечь вещество,
окисляющееся при участии фермента с испусканием света. Вещество это
получило название люциферин, а фермент, на него воздействующий —
люцифераза. Люциферин и люцифераза получены в кристаллическом виде
из люминесцирующего органа жука-светлячка (Photinus pyralis), что дало
возможность изучить взаимодействие между ними и выяснить биохимиче-
ские процессы, лежащие в основе люминесценции. Установлена эмпириче-
ская формула люциферина (C13H12N2S2O3) и наличие в нем карбоксильной
группы.
Люминесценция возникает в результате сложных химических превра-
щений люциферина, в которых участвуют аденозинтрифосфорная кислота,
дегидрогеназа и кофермент ацилирования (KoASH). Благодаря исследова-
ниям Мак-Ильрой и его сотрудников в настоящее время в значительной
мере выяснен ферментативный механизм биолюминесценции.
Давно уже установлено, что люминесценция у животных происходит
в присутствии кислорода; следовательно, люциферин проявляет свое люми-
несцирующее свойство в результате окисления; продукт окисления —
окисленный люциферин (С13Н 10^2^2^ з)*
Участие аденозинтрифосфорной кислоты в биолюминесценции устано-
влено в опытах, которые проводились следующим образом. К раствору
люциферина добавлялась люцифераза. Люминесценции при этом не наблю-
далось. При добавлении же к раствору люциферина и люциферазы, адено-
зинтрифосфорной кислоты, ионов магния и дегидрогеназы, люциферин на-
чинал светиться.
598
Механизм участия аденозинтрифосфорной кислоты в биолюминесцен-
ции заключается в том, что АТФ с помощью люциферазы присоединяется
к карбоксильной группе люциферина с образованием аденилата люцифе-
рина* *
ОН
Аденозин—О—Р--0
он
+ НООС — люциферин
ОН
ОН
^/О—О-С-люциферин
аденозин—О—Р— О
\он + ЩР2О7
Аденилат люциферина
Окисление аденилата люциферина в аденилат окисленного люцифе-
рина сопровождается испусканием квантов световой энергии, т. е. люми-
несценцией. Продукт окисления, по мере образования, тормозит реакцию
люминесценции, так как он связывает люциферазу. Установлено, что KoASH
усиливает реакцию люминесценции путем освобождения связанной люци-
феразы от окисленного люциферина. Окисленный люциферин затем восста-
навливается с образованием люциферина.
Из приведенных данных видно, что в основе биолюминесценции ле-
жат ферментативные процессы: 1) связывания люциферина с аденозинтри-
фосфорной кислотой с образованием аденилата люциферина (катализируется
люциферазой); 2) окисления аденилата люциферина (сопровождается люми-
несценцией) с образованием аденилата окисленного люциферина; 3) удале-
ния аденилата окисленного люциферина от люциферазы коферментом Л
(KoASH) и 4) восстановления окисленного люциферина с образованием лю-
циферина, вновь вступающего в ферментативные реакции, приводящие к
люминесценции.
Все эти ферментативные реакции сосредоточены в люминесцирующем
органе светящихся животных.
Энергия, необходимая для испускания света, доставляется макроэрги-
ческими связями АТФ. Интересно отметить, что использование световой
энергии зелеными растениями сопровождается фосфорилированием АДФ
с образованием АТФ, т. е. возникновением макроэргических фосфатных
связей (стр. 245).
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Абсолютная специфичность действия фер-
ментов 151, 152
Авенин 46
Авидин 119
Авитаминоз А 128, 129, 132
— Bil 10—112, 141, 589
— В2 ИЗ, 114
— В6 118, 141. 445
— С 106, 445
— Е 137, 138
— Н 119
— К 138, 139
— Р 107
— РР 115, 117
— фолиевой кислоты 122
Авитаминозы 104, 106, 138, 140, 444
— микроорганизмов 106, 140
Автолиз 184
Агар-агар 72, 84, 85
Аген 399
Агенизированные белки 399
Агликоны гликозидов 88—90
Агматин 152, 370
Агон 149
Аденаза 164, 450
Аденилат люциферина 599
----окисленного 599
Аденилаткиназа 171
Аденилаты аминокислот 269, 440, 441,
443, 472, 474, 558
Аденилкиназа 575, 576
Адениловая кислота 63, 64, 74, 116, 165,
269, 368, 423, 450, 456, 457,
461, 462, 467, 468, 472, 474,
518, 575, 578
3,5-Адениловая кислота 191, 509, 510
Аденилянтарная кислота 461
Аденин 55—57, 61—63, 144, 167, 450,
452, 456, 461, 463, 466, 467,
470, 471, 473, 523, 571, 584, 585
Адениндезоксирибоза-З-фосфорная кисло-
та 59
Адениндезоксирибозотрифосфаты 468
Аденинрибоза 468
Аденинрибозодифосфат 469
Аденинцитозингуанинтиминдезоксири-
бозотрифосфаты 468
S-Аденозилмеркаптан 372, 373
S-Аденозилметионин 371, 372, 373, 395,
396, 415, 421
S-Аденозилпропиламин 371, 372, 396
Аденозин 57, 169, 269, 270, 282, 450,
467, 472
Аденозиндезоксирибозо-З-фосфорная кис-
лота 59
Аденозиндифосфат 469
Аденозиндифосфорная кислота (АДФ) 64,
116, 168, 171, 250, 265, 266,
268, 296—301, 304, 309, 321, 331,
428, 430, 458, 462, 510, 559,
560, 574—576, 579, 593
Адепозинмонофосфорная кислота 469
Аденозинтрифосфатаза (АТФ-аза) 300, 301,
305, 574—576, 578
Аденозинтрифосфокреатинфосфофераза
(АТФ-креатинфосфофераза) 170
Аденозинтрифосфорная кислота (АТФ) 64,
111, 113, 115, 116, 167, 169—171,
191, 230, 232, 233, 249, 250, 265,
267—270, 281, 282, 285, 295,
296, 298—301, 304, 305, 309,
312, 313, 321, 326, 331, 336-
338, 371, 391, 394, 395, 422,
428—430, 440—442, 457—459,
462, 466—468, 472, 478, 479,
509, 510, 513, 515, 518, 544,
558—560, 567, 569, 570, 572—
576, 578,-582, 585, 588, 589,
591, 593, 596, 598, 599
Аденозин-5-фосфорная кислота 58, 63
Адермин 117
Адреналин 28, 189—193, 289, 290, 313,
395, 397, 411—413, 509, 593—
595
Адренокортикотропин 41
Адренокортикотропный гормон (АКТГ)
206, 207, 208, 290
Адренохром 192
Адренэргические вещества 595
— нервы 593
Адсорбция ферментов 148, 156
Азид натрия 267
Азот 9, 18, 109, 201, 216, 238, 242, 356,
357, 432, 425, 430, 433, 436—
438, 446, 447, 484, 490, 493,
494, 496, 498, 499, 523, 541
Азотистое равновесие (азотистый баланс)
9, 242, 436, 437, 443, 444, 496,
497, 499, 500
Азотистые основания 61, 62, 449
— соединения 423, 430, 432, 433, 435
— — фосфатидов 96, 98
— экстрактивные вещества 348, 570, 571,
573, 584—586
Азотная кислота 432, 493
Азотфиксирующие бактерии 238, 356, 357,
447
Акромегалия 206
Активаторы ферментов 154
Активация Г-актина 569
Активирование аминокислот 439—444, 472,
473, 558
600
Активирование аммиака 269
— веществ неорганических 268, 270
— — органических 268—270
— гексоз 268
— кислорода 257
— кислот жирных 269, 326, 336—338,
560
— — органических 269
— кислоты серной 270, 513
— — угольной 270
— — уксусной 478
— метионина 394, 395, 396
— трипсиногена 351
— углекислого газа 331
— химотрипсиногена 353
Активированные аминокислоты 473
— жирные кислоты 327
Активированный формальдегид 396
Активная кислотность мочи 520
— группа кодегидразы 170
— уксусная кислота 306—308, 593
— щелочность мочи 520
Активность амилазы 156
— дегидрогеназы 156
— каталазы 156
— липазы 155
— пепсина 156
— уреазы 156
— оерментов 154—157, 180—183
— фосфорилазы 156
— холинэстеразы 156
Активные группы ферментов 155
— центры ферментов 181, 182
— — — двухкомпонентных 182
— — эстераз 182
Активный иммунитет 539
— метионин 3*94, 395, 397
Актин 37, 42, 349, 568—570, 574, 578
Г-Актин 569
Ф-Актин 569
Актомиозин 18, 37, 569, 570, 574, 578
Акцелерин 552
Акцепторы водорода 175, 256—261, 263,
302, 306,
Аланилаланилглицин 30
Аланин 19, 22, 23, 30, 33, 35, 169, 306,
361, 380, 381, 393, 403—405,
474, 481, 482, 496, 541, 563, 569
а-Аланин 22
р-Аланин 120, 366, 370, 373, 390, 421,
422, 454
D-Аланин 380
L-Аланин 380
Алиментарная гипергликемия 287, 288
— глюкозурия 288
— креатинурия 419
— липемия 320
Алиментарное ожирение 481
Алкалоз 523, 532
Алкалоидные осадители 43
Алкалоиды 360
Алкаптонурия 358, 359, 409, 410, 413
Аллантоиназа 453
Аллантоин 450, 451, 453
Аллантоиназа 453
Аллантоиновая кислота 453
£-Аллоизолейцин 23
Аллоксан 197, 199, 315
Аллоксановый диабет 197, 199, 315
L-Аллотреонин 22
Аллофановая кислота 136
Альбуминоиды 584
Альбуминурия 526
Альбумины 45, 349, 443, 508, 537, 538,
540, 558, 563
Альбумозы 31, 349
Альдегид витамина А 128, 129
— кислоты а-аминоадипиновой 387
— — муравьиной 395
— — пальмитиновой 99
а-Альдегид-а-аминовалерьяновая кисло-
лота 364
Альдгидокислоты 366
Альдегиды 373, 374
— жирных кислот 99
Альдеогексозы 69, 70, 87
а-Альдогексозы 70
р-Альдогексозы 70
Альдозы 67
Альдолаза треонина 381
Альдолазы 172, 249, 295, 299, 466
Альдопентозы 74
Альдостерон 195
Альдотриоза 67
Амигдалин 89
Амид кислоты аминомуравьиной 163,
430
— — аспарагиновой 25
— — глутаминовой 25
— — никотиновой 115—117, 395, 445
— — щавелевоуксусной 366
Амидазы 163
Амидиновая группа 26, 164, 387, 388
Амидинферазы 378, 387, 415, 416
Амидирование аминокислот 25, 391
— белков 424
— кислоты аспарагиновой 25, 391
— — глутаминовой 25, 391, 590
— — никотиновой 116
Амидный азот 424, 431
— — глутамина 391, 392
Амиды 366, 390; 424, 430
Амилаза 11, 77, 154, 158, 182, 287, 303,
525, 540, 564, 589,
— поджелудочной железы 148, 151, 154,
277, 278, 351, 352
— слюны 148, 151, 154, 277, 278
— солода 151, 294
а-Амилаза 159, 160
р-Амилаза 159, 160
Амилодекстрины 80
Амилоза 80, 81, 286, 287
Амилопектин 80, 81, 83
Аминирование гипоксантина 456
— глюкозы 391
— а-кетокислот 250, 270, 366, 368, 369,
436
— кислоты инозиновой 461, 462
— — а-кетоглутаровой 250, 275, 368, 369,
387, 389, 425, 431, 445
— — а-кетоизокапроновой 383
— — ксантозинфосфорной 391, 462
— — пировиноградной 306, 482
— — уридиновой 466
— — щавелевоуксусной 482
— ксантина 456, 462
а-Аминоадипиновая кислота 365, 387
Аминоакриловая кислота 362
а-Аминоакриловая кислота 363
Аминоацидурия 400
Аминобензольная группа 188
а-Аминовая • кислота 22
Аминогексозы 87, 88
а-Аминоглутаровая кислота 25
601
а-Амино-с-гуанидин-н-валерьяновая кис-
лота 26
а-Аминоизовалерьяновая кислота 23
а-Аминоизокапроновая кислота 23
а-Аминоизомасляная кислота 382, 454
а-Амино-З-имидазолил пропионовая кис-
лота 28
4-Аминоимидазол-5-карбоксамид 456
5-Амино-4-имидазол-А-карбоксилрибо-
тид 459
5-Аминоимидазолриботид 458, 459
5-Амино-4-имидазол-/У-сукцинкарбокса-
мидриботид 459
а-Аамино-З-индолилпропионовая кисло-
та 28
а-Амино-н-капроновая кислота 23
а-Амино- р-кетоадипиновая кислота 545
Аминокислотный состав белков 19, 29,
38, 39, 180,
Аминокислоты 7, 8, 18—20, 29—31, 180, 33, 189,
35, 36, 38, 42, 44,
211- -214, 251, 268, 269, 345,
350- -358, 368—370, 374, 375,
377, 378, 381, 390, 400, 422,
423, 427, 428, 430, 433, 441 —
443, 469, 472—474, 481, 482,
484, 485, 493, 511, 518, 524,
539, 541—543, 548. 550, 556,
558, 563, 569, 571, 585, 586
— Р-ряда 19, 20, 359, 360, 361
— А-ряда 19, 20, 359, 361—363, 366,
431
— пищи 492, 496, 499
а-Аминокислоты 7, 18, 19, 29, 88, 168,
250, 251, 275, 369, 591
&-Аминолевулиновая кислота 545, 546
рАминомасляная кислота 214, 366, 370,
373, 390, 586, 590, 591, 595
а-Амино- -меркаптопропионовая кисло-
та 24
а-Амино-З-метилтиомасляная кислота 24
Аминоксидазы 193, 444
а-Амино-^-оксимасляная кислота 22, 127
а-Амино-^-оксипропионовая кислота 22,
380
2-Амино-6-оксипурин 55
а-Амино-^-оксифенилпроп ионовая кис-
лота 27
Аминопептидаза 162, 163
Аминополипептидаза 353
6-Аминопурин 55, 144
Аминосахара 88
а-Амино-^-тиомасляная кислота 397
Аминоуксусная кислота 21
а-Амино-^-уреидвалерьяновая кислота 27
а-Амино-^-фенилпропионовая кислота 27
Аминоферазы 168, 169, 171, 366, 367,
369, 445
Аминофосфатные связи 232, 576
— соединения 232
Аминофосфоаденозин 269, 270
а-Амино-^-этил-Ь-метил пропионовая кис-
лота 23
Аминоянтарная кислота 24
Амины 262, 369,—375, 400, 432
Аммиак 197, 221—223, 245, 251, 356—
363, 368, 369, 373—375, .390,
398, 401, 405, 409, 422—434, 439,
440, 445—447, 453, 461, 512,
518, 519, 522, 575, 580, 590,
591, 596
Аммоний 423—427
Аммонийные соли 233, 423—427, 434, 435,
446, 518, 522
Аммониотелические животные 425, 434,
435
Анаэробное брожение 301
—окисление 258—260
Анаэробные дегидрогеназы 175, 260, 261
Анаэробный гликолиз 293, 294, 298, 299,
303, 567, 568, 590, 592,
— распад глюкозы 301
— — углеводов 292, 293, 303, 306, 312,
477, 482, 510, 567, 574, 576, 581
Анаэробы 259, 361
Ангидрид креатина 414, 523
Ангидридная теория образования моче-
вины 426, 427
Ангидридные фосфорные связи 169
Ангидридфосфатные связи 232
— соединения 232
Ангидризация креатина 413, 414, 419,
420
Ангиотензин 213
Андрогенные гормоны 200—202
Андрогены 200, 201
Андростан 200, 202
3, И, 17-Андростендиол 201
3, 17-Андростендион 201
Андростерон 201, 202, 525
Анейрин 110
Анионы 43, 154, 216, 222
Аноксемия 400
Ансамбли ферментов 183
Ансерин 357, 395, 397, 402, 413, 421, 422,
571
Антагонизм действия ионов 225
Антианемический витамин 123
Антибериберийный фактор 110
Антибиотики 8, 142, 143, 361, 441
Антивитамины 140—142, 144
Антигеморрагические витамины 138
Антигемофилический глобулин 551, 552
Антигены 44, 87, 538, 539
Антидиуретический гормон 221
Антиксерофтальмический фактор (вита-
мин) 127, 133
Антиметаболиты 144, 145
Антиоксиданты 138
Антипеллагрический фактор (витамин) 115,
404, 421
Антипепсин 350
Антиполиневритный фактор ПО
Антирахитический витамин 133, 134
Антистерильные витамины 136
Антитела 44, 45, 87, 354, 530, 538, 539, 566
— молозива 539
Антитиреоидные вещества 188
Антитоксины 538
Антитромбины 552
Антиферменты 155
Антицинготный фактор 106
Антраниловая кислота 403—405, 408
Анурия 520, 521
Апоферменты 114
Апоферритин 236, 508
Апоэритеин 123
Арабаны 84
Арабиноза 74, 84, 85, 89, 526
Р-Арабиноза 84
L-Арабиноза 74
Арахидоновая кислота 93—95, 140, 330
Аргиназа 26, 151, 152, 157, 164, 387,
426, 427
602
Аргиниларгинин 152
Аргинин 19, 25—28, 33, 45, 171, 212,
353, 357, 361, 364, 374, 378—
380, 386—388, 390, 400, 414—
417, 426—431, 474, 496, 541,
563, 569, 571, 576, 591
А-Аргинин 26
Аргининкиназа 576
Аргининовая теория образования креа-
тина 414, 415
Аргининфосфорная кислота 26, 232, 415—
419, 571, 575, 576
Аргининфосфофераза 576
Аргининянтарная кислота 428—430
Аркаин 417
Ароматические аминокислоты 349, 353
Артериовенозная разница содержания кис-
лорода 263
Аскорбиновая кислота 106—109, 124,
125, 142, 192, 194, 386, 411, 445,
525, 564
А-Аскорбиновая кислота 107
Аскорбиноген 108
Аскорбиноксидаза 109, 236
Аспаргин 26, 211, 366, 391—392, 424,
430, 431, 474
А-Аспарагин 211
Аспарагиназа 163, 164, 392
Аспарагиновая кислота 20, 25, 26, 33,
168, 212, 253, 349, 361, 362,
367, 369, 380, 388—390, 428—
433, 455, 456, 458, 461, 462,
465, 474, 481, 482, 487, 496,
524, 563, 569, 575, 586
А-Аспарагиновая кислота 362
Аспартаза 362, 367
Аспартикоаминоферазы 168
Ассимиляция 5, 241, 483
Асфиксия 400
Астерубин 417
Атакуемость белков пепсином 349
Атофан 452
Атрофия мышц 581
Ауксина «а» 214
— «б» 214, 215
Ауксины 214, 215
Ауреомицин 143
Ахилия 348
Ахродекстрины 80
Ацеталь 99
Ацетальфосфатиды 96, 99, 586
Ацетил 174
N—Ацетиласпарагиновая кислота 586
Ацетилгистидин 213
Ацетилглутаминовая кислота 428, 429
Af-Ацетилглюкозамин 85
А^-Ацетил-£)-глюкозамин 86
Ацетилирование 179
— аминов 308, 373
— гистамина 213, 402
— холина 175, 338
Ацетилкиназа 593
Ацетилмалонил-SKoA 331
АААцетилнейраминовая кислота 587
Ацетилпроизводное гистамина 402
Ацетилхолин 160, 174, 338, 593, 594
Ацетильное производное кофермента А
(ацетил-SKoA) 174, 271—276, 307,
308, 326—332, 367, 384, 385,
389, 477—481, 511, 512, 518,
560, 574, 592, 594
Ацетильные производные аминов 373
А пето а цетил 308
Ацетоацетильное производное кофермента
А (ацетоацетил-SKoA) 308, 326—
332, 384, 385
Ацетон 315, 316, 332, 383, 396, 525, 527
Ацетоновое брожение 292
Ацетоновые вещества 324
Ацетонурия 527
Ацетоуксусная кислота 174, 221, 308,
315, 316, 323—329, 332, 333,
339, 383, 384, 410, 411, 413,
477, 480, 482, 511, 518, 525,
527, 542, 556, 557, 574
Ацидоз 223, 426, 519, 522, 523, 532, 535
Ациклические аминокислоты 19
Ациладенилаты аминокислот 440
р-Ацилдегидрогеназа 327
Ацилтиопроизводные соединения 326
Ацилфосфатные связи 439
Ацилфосфаты аминокислот 439
Ацильное производное кофермента А
(ацил-SKoA) 174, 327—332, 340, 560
Ацилы 174
Аэробное окисление 258, 260—262, 266,
267
— окислительное фосфорилирование 266
Аэробные дегидрогеназы 175, 261, 264
Аэробный гликолиз 312, 590
— распад углеводов 292, 308, 309, 312,
477, 482, 574, 576, 590
Аэробы 306, 361
Базедова болезнь 185, 187, 188
Бактериальные токсины 538, 539
Бактериостатическое действие антибиоти-
ков 142
Балансы превращений веществ 9, 242,
243
Безазотистые экстрактивные вещества 570,
571, 584
Белки 6—9, 12, 17—19, 29—46, 144, 148—
150, 158, 163, 180, 216, 223,
244, 245, 317, 353— 356, 386—
390, 422, 424, 432, 436— 438,
443, 446, 447, 472, 475, 476,
481, 482, 485, 486, 493, 496,
498, 499, 508, 523, 525—527,
539, 550, 551, 556, 558, 566,
584, 596
— гормоны 45
— крови 530, 533—535
Белки лимфы 553
— молозива 566
— молока 556, 558, 562, 563, 565 566
мышечной стромы 568, 570
— мышц 568, 570—574
— нервной ткани 584, 585
— пищи 345, 348, 437, 438, 489, 492,
494—502
— плазмы крови 443, 444, 531, 536—
540, 553
— сыворотки крови 516, 537—539
— ферменты 18, 346, 351, 422, 446, 475
Белковая природа ферментов 149, 150,
157, 181
Белковое голодание 345, 357, 358, 443,
497, 498, 500
— питание 437, 489, 492—502, 541
Белковолипидные комплексы 584, 588
603
Белковообразовательная функция пече-
ни 516
Белковые вещества (см. белки)
— гидролизаты 18, 19
— осадители 44
— компоненты ферментов 149, 178, 180
Белковый буфер 222, 223
— — крови 531
— минимум 498—500
— оптимум 500
Белок Бенс—Джонса 527
Бензойная кислота 27, 322, 377—380,
388, 413, 439, 515, 516, 524, 525
Бензойный альдегид 89
Бёри-бёри 104, 105, НО
Бесклеточное спиртовое брожение 292—
294
Бесклеточный дрожжевой сок 292—295,
298, 300, 301
Бесклеточные экстракты 243
Бетаины 127, 338, 379, 396, 420, 421, 434
Бикарбонатный буфер 222, 223
— — крови 531
Биливердин 547—549
Билирубин 516, 520, 527, 528, 541, 542,
547—549
Биозы 67
Биологическая химия (см. биохимия)
— ценность белков 498, 499
Биологические катализаторы 11
Биолюминесценция 598, 599
Биотин 119, 120, 182, 270, 340, 399
— авидин 119
Биохимическая статика (см. статическая
биохимия)
Биохимия 5, 9—13
— животных 13
— микроорганизмов 13
— растений 13
Бисульфит натрия 301, 302
Биурет 29, 432
Биуретовая реакция 29—31, 44, 432
Болезнь Гирке 511
Бром 233
Бромбензол 398
Бронзовая болезнь 194, 316
Бромноватокислотный натрий 432
Бутирил-SKoA 332
f-Бутиробетаин 420
Буфера 221, 222
Буферные свойства гемоглобина 531, 532,
535
— системы 221—223
— — крови 531, 532
Буфотенин 407
В
Вазопрессин 209—212, 221
Валерьяновая кислота 323
Валин 19, 23, 33, 361, 381—384, 474,
481, 496, 497, 541, 547, 563, 569
L-Валин 23, 381—383
Вальденаза 282
Вальденовская инверсия (вальденовское
обращение) 282, 283
Вердогемоглобин 547, 548
Вердоглобин 549
Вердопероксидаза 52, 178
Взаимопревращения моносахаридов 281—
283, 285
Видовая специфичность белков 44, 355,
471, 472, 474
— — гемоглобинов 49
— — нуклеиновых кислот 62, 63, 469—
474
Викасол 170
Виноградный сахар 70
Виолацеин 407
Витамин А 127—134, 138, 511, 564
— Ai 132
— А2 132
— Bi 106, ПО, 140, 182, 235, 589
Витамин В2 112—114, 140, 182, 444. 564
— Вб 117, 140, 182, 403, 445
— В12 123, 124, 237, 445
— В15 126, 127
— Вт 127, 421
— С 106, 108, 445, 525, 564
— D 133, 229, 237
— Di 133
— D2 101, 133, 134
— D3 100, 134—136, 509
— Е 136—138, 524
— Н 119
— К 138—140, 268, 550
— Ki 139, 140
— К2 139, 140
— М 122
__ Р 91 124 125
— РР 1’15—1’17, 140, 182, 421, 445
— роста 128
Витамины 8, 91, 103—105, 139—141, 182,
216, 251, 399, 444—446, 490,
502, 509, 556, 561, 564, 566, 573
— группы А 127, 509, 511
В 106, 110, 125, 525, 564
D 127, 133, 564
Е 127, 136, 564
К 127. 138
Вителленин 47
Вителлин 22, 47
Витин 47
Вода 9, 93, 173, 216—220, 224, 225, 227,
228, 246, 251, 254, 255, 262,
272, 274, 275, 301, 304, 306,
308, 357, 358, 422, 423, 493,
508, 510, 511, 530, 543, 568,
572—579, 588, 590, 591
Водный баланс 220, 228
Водорастворимые витамины 106
Водород 18, 66, 108, 114, 175—177, 216,
246, 248, 255—263, 266, 274,
275, 306, 374, 493, 494
Водородные мостики 32, 33
— связи белков 32, 33, 36, 42
— — нуклеиновых кислот 61, 62
Воска 91, 100, 101
— растений 102
Восстановительное дезаминирование ами-
нокислот 359, 361
Восстановительный этап гликолиза 297
Восстановление оксигемоглобина 533
— уксусного альдегида 297, 298
Восстановленная форма НАД (НАД-Н2)
175, 176, 259, 260, 266, 299,
304, 312, 327, 331, 361, 591
-----НАДФ (НАДФ-Н2) 177, 179, 248,
249, 259, 260, 331
-----ФАД (ФАД-Н2) 177, 259, 327
Восстановленный глутатион (GSH) 422
Всасывание азотистых оснований 449
— аминов 373
604
Всасывание аминокислот 354, 355, 361,
374
— D-аминокислот 361
— L-арабинозы 280
— белков 354, 492
— воды 220
— D-галактозы 280
— гексоз 280
— глицерина 318
— глюкозы 278, 280, 284, 287
— D-глюкозы 280
— железа 236
— жиров 319, 320, 333, 343, 492, 554
— кислот жирных 318
— — органических 278
— L-ксилозы 280
— D-маннозы 280
— мононуклеотидов 449
— моносахаридов 277—281, 284
— нуклеозидов 449
— пентоз 281
— полипептидов 354, 355
— стеринов 339
— углеводов 492
— фосфолипидов 319
— D-фруктозы 280
— холестерина 339
ядовитых веществ 374, 375
Вторая форма спиртового брожения 301,
302, 321, 477
Вторичная структура белков 36, 40
— — ферментов 181, 182
Вторичные ортофосфаты 229
— фосфаты 222
Выделение белков 40, 41
— воды 219,'220
Выделительная функция легких 223’
-----почек 223—225, 517—521
Высаливание белков 43
— ферментов 157
Вязкость крови 537, 538
Г
Газы крови 532, 533
Галактаны 84
Галактоза 72, 78, 79, 84, 85, 87, 89, 102,
279 —284, 314, 510, 516, 526,
558, 560
D-Галактоза 70, 72, 84, 282, 559
Галактозамин 86, 88
Галактоземия 284
а-Галактозидо-я-гликозидо-З-фруктозид 79
Галактозиды 72, 102
Галактозокиназа 282
Галактозо-1-фосфат 283
Галактозофосфорная кислота 268
Галактозо-1-фосфорная кислота 282, 283
Галактозо-6-фосфорная кислота 282, 283,
285
Галактозурия 284, 526
Галактоновая кислота 87
Галактуроновая кислота 84, 87, 88
D-Галактуроновая кислота 84
a-D-галактуроновая кислота 88
Галоидпроизводные уксусной кислоты 577,
582
Галоиды 234
Ганглиозиды 586, 587,
Гастрин 212, 213
Гексагидрогексаоксибензол 125
Гексапептиды 442
Гексозамин 539, 540, 550
Гексозодифосфат 301
Гексозодифосфорная кислота 293, 295
Гексозомонофосфаты 300
Гексозомонофосфорные кислоты 293
Гексазофосфаты 229, 293, 299—301
Гексозофосфорные кислоты 231, 280, 293,
300 542 572
Гексозы 67, 69, 249, 268, 282, 526, 539,
540, 587
Гексокиназы 268
Гексоновые основания 28
Гексуроновые кислоты 87
Гем 49—52, 123, 178, 253, .508, 545—547
Гематоэнцефалический барьер 596
Гематурия 527
Гемералопия 128
Гемин 50, 260
Гемицеллюлозы 71, 72, 74, 84, 277
Гемоглобин (НЬ) 37, 42, 49—51, 216, 235,
378, 508, 527, 530—536, 543—
549
— А (НЬА) 547
— F (HbF) 547
Гемоглобинурия 527
Гемоглобины 45, 534, 547
Гемолиз 49, 89, 336, 527, 544
Гемолизины 98, 336
Геморрагия 139, 550
Гемосидерин 236
Гемофилия 551
— «а» 551
— «б» 551
Гемоцианины 42, 49, 52, 53, 236, 534
Гемсодержащие ферменты 178
Гентиобиоза 88
Гепарин 85, 86, 319, 552
Гепатокупреин 236
Гептановая кислота 323
Гептапептиды 442
Гептозы 67, 69, 75
D-Гептулоза 75
Гептулозо-5-фосфорная кислота 310
Гептулозо-7-фосфорная кислота 247, 310
Гесперидии 125
Гетерогенный катализ 147
Гетерогликозиды 88—90
Гетерополисахариды 79, 84, 85, 87—89
Гетероциклические аминокислоты 27
— соединения 252, 421
Гиалбиуроновая кислота 85
Гиалуронидаза 85, 86
Гиалуроновая кислота 85, 86
Гигантизм 206, 207
Гидразин 39
Гидратазы 173
Гидратационная вода 217—219
Гидратация 218
— белков 218
Гидратирование углекислого газа 535
Гидрогенизация жиров 95, 96
— холестерина 339
Гидролазы 153, 158, 165
Гидролиазы 172
Гидролиз 149, 165, 217
— агар-агара 84
— амигдалина 148
— амидов 163
— амилопектина 159
— аргинина 152, 157, 164, 388, 426
— аспарагина 164
— ацетилхолина 160, 594
605
Гидролиз белков 7, 18,22—31,38, 158, 161,
162, 345, 349, 351—354, 360, 424,
438
— — агенизированных 399
— — йодированных 187
— гексозофосфатов 160
— гемицеллюлоз 71, 84
— гепарина 86
— гликогена 83, 154, 303, 304, 589
— гликозидов 72
— а-гликозидов 153
— глицерофосфата 160
— глутамина 164
— диглицеринфосфорного эфира 160
— динуклетидов 468
— дипетидов 353
— желатины 21
— жиров 94, 160, 221, 269, 318, 319,
321, 323, 327, 336, 351, 478,
481, 560, 564
— инулина 73, 83, 160
— казеина 187, 350
— казеиногена 349, 350
— канаванина 164
— кислоты аденозинтрифосфорной 300,
305, 576
— — гиалуроновой 85, 86
— — глюкозофосфорной 510
— — дезоксирибонуклеиновой 57
— — креатинфосфорной 575
— — пантотеновой 120
— — рубонукленовой 57
— — фумарилацетоуксусной 411
— — хондроитинсерной 86
— крахмала 80, 158, 159, 278
— лактозы 73, 78, 159
— лецитинов 336
— липидов 96
— мальтозы 77, 153, 158, 159, 278, 303
— а-метилгликозидов 159
— мононуклеотидов 449
— мочевины 152, 158, 163, 432, 453
— нуклеиновых кислот 55—59, 351,
449
— нуклеотидов 160
— паратгормона 189
пептидных связей 161, 162, 349, 353
— полинуклеотидов 160
полипептидов 39, 161 —163, 172, 351,
353
— полисахаридов вишневого клея 85
— полифосфатов 161
— проламинов 46
— раффинозы 79
— сахарозы 73, 77, 148, 159
— трегалозы 77, 159
— углеводов 158, 351
— формилкинуренина 403
— фосфатидов 335
— фосфоглицерина 302, 447
— хитина 86
— целлобиозы 278
— целлюлозы 78, 82, 160, 278
— церебозидов 102
— эфиров дифосфорных 160
— — монофосфорных 160
— — серных 161
— — сложных 160, 161, 181
— — фосфорных 160, 231
Гидролизаты белков 18, 22—28
— — щелочных 26
— нукленовых кислот 55, 57, 58
Гидролитические ферменты 154
Гидролитическое дезаминирование аде-
ниловой кислоты 423, 424,
— — аминокислот 358, 361
Гидрохинон 137, 177
Гипервитаминоз А 133
— D3 136
Гипергликемический — гликогенолити-
ческий фактор 199
Гипергликемия 191, 192, 196, 199, 206,
287—290, 313—315, 509, 526
Гиперпротеинемия 537
Гипертиреоз 185—188, 344, 492, 526
Гипертонические растворы 536
Гиперфункция щитовидной железы (см.
гипертиреоз)
Гиперхлоргидрия 348
Гиповитаминоз А 128, 132
— С 107
Гипогликемическая кома 290, 316, 526
Гипогликемия 90, 199, 290, 316, 589
Гипоксантин 433, 450, 452, 456, 457, 461 —
463, 523, 571
Гипоксемия 533
Гипоксия 533, 534
Гипопротеинемия 537
Гипотаурин 393
Гипотиреоз 185—187, 205, 208, 234, 316,
492, 540
Гипотиреоидизм 187
Гипотонические растворы 536
Гипофибриногенемия 550
Гипофизарное ожирение 344, 481
Гипофункция гипофиза 316
— надпочечников 316
— паращитовидных желез 139
— щитовидной железы (см. гипотиреоз)
Г ипохлоргидр ия 348
Гиппуровая кислота 322, 347—379, 439, 515, 516, 524, 525 413,
Гистамин 213, 348, 370, 371, 373, Гистаминаза 373 Гистидаза 401 402
Гистидин 19, 27, 28, 45, 182, 213, 252,
357, 361, 363, 371, 374, 396,
421, 474, 481, 496, 524, 546, 563, 569 541,
А-Гистидин 28
Гистидиндезаминаза 401
Гистидин-а-дезаминаза 363
Гистоны 26, 45, 46, 49, 53
Глиадин 46
Гликоген 59, 66, 70, 77, 79, 82, 83, 154,
158, 172, 191, 194, 284 286—289,
291,292, 294, 303—305, 312, 314,
321, 332, 380, 385, 393, 480,
481, 486, 509—511, 516, 530, 572,
573, 574, 576—584, 589, 590, 596
Гликогенная функция печени 284, 289,
290, 313, 509, 510, 516
Гликогенолиз 292, 303—306, 309, 311,
321, 574
Гликогенообразователи 251, 510
Гликодезоксихолевая кислота 343
а-Гликозидазы 158, 159
р-Гликозидазы 158, 159
Гликозидные связи 76, 80—89, 231, 303,
558, 560
— — мононуклеотидов 58, 60
-----парных соединений 513, 514
а-Гликозидо-1,1-гликозид 76
р-Гликозидо-1,1-р-гликозид 77
606
а-Гликозидо-1,4-глюкоза 76, 77
р-Гликозидо-1,4-глюкоза 76, 78
Гликозидосорбозид 172
Гликозидофруктозид 172
а-Гликозидо-1,2-р-фруктозид 76
Гликозидфосфатные связи 514, 515
— соединения 231
Гликозиды 72, 88, 89, 513
Гликокол 21, 253
Гликолевая кислота 378
Гликолевый альдегид 67, 247, 378
Гликолиз 244, 292, 294, 296—298, 300—
305, 312, 313, 544, 589, 590
Гликолипиды 586, 587, 592
Гликолитические ферменты 540, 573, 581
Гликолитохолевая кислота 343
Гликонеогенез 481, 482
Гликопротеиды 47, 48, 539, 550, 587
Гликосфингозиды 586
Гликохолевая кислота 343
Гликоциаминфосфорная кислота 418, 419
Глиоксалатный цикл 275, 376 Глиоксилевая кислота 275, 276, 365, 378,
450, 453 Глиоксилевый альдегид 275, 365 Глицерин 68, 93, 94, 169, 251, 302, 317—321, 327, 265, 301,
329, 333,
336, 396, 477—481, 560, 564,
584, 586
Глицеринальдегидфосфорная кислота 172,
299
Г лицеринальдегид-3-фосфорная кислота
311
Глицериновый альдегид 67, 68
Р(+)-Глицериновый альдегид 67, 68
L-(—)-Глицериновый альдегид 67
Глицеринфосфорная кислота 231, 293,
321, 336, 337
а-Глицеринфосфорная кислота 97
а-Глицеринфосфорная кислота 97
Гцерофосфат 160, 229
Глициаланин 30
Глицин 19, 21, 22, 35, 45, 171, 212, 253,
322, 342, 343, 357, 360, 361, 364,
377—381, 387, 396, 409, 415, 416,
421, 433, 439, 451, 452, 455,
456, 458, 462, 466, 474, 482,
487, 496, 512, 515, 541, 545,
546, 550, 563, 569, 571, 585
Глицинамид 211 Глицинамидриботид 458 Глицинбетаин 420 Глициноксидаза 364, 365
Глобин 546—548
Глобины гемоглобинов 49
Глобулин X 568, 570
Глобулины 44, 45, 185, 349, 443, 508,
537, 538, 556, 558, 563, 566, 569
Т-Глобулины 539
а-Глобулипы 537, 538, 563
Р-Глобулины 231, 537—540, 547
7-Глобулины 44, 537—540, 563
Глобулярные белки 41—43
Глутамикоаланиновая фераза 366, 367
Глутамикоаминоферазы 168
Глутамикоаспарагиновая фераза 376
Глутамикодегидрогеназа 431
Глутамикопирувикоаминофераза 168
Глутамилтрипептид 422
Глутамин 25, 211, 253, 366, 390—392,
409, 424—427, 430, 431, 433,
439, 455—458, 462, 474, 487, 512,
515, 518, 519, 524, 541, 542, 573,
586, 590, 591
L-Глутамин 211
Глутаминаза 163, 164, 392, 518, 590
Глутаминовая кислота 19, 24, 33, 46, 121
122, 168,212,214, 250, 275, 349,
361—369, 378, 380, 386—393, 401,
422, 430, 431, 439, 440, 445, 458,
462, 474, 481, 482, 496, 524, 547,
538, 569, 571, 573, 586, 590, 591
D-Глутаминовая кислота 361
L-Глутаминовая кислота 25, 365
Глутаровая кислота 387
Глутатион 192, 235, 378, 411, 413, 422,
439, 496, 543, 586
Глюкагон 41, 191, 199, 200, 206, 289,
290, 315, 316, 351, 509
Глюкоаскорбиновая кислота 142
Глюкоза 59, 68, 70, 71, 77—82, 87, 89,
90, 147, 154, 172, 191, 194, 197,
199, 242, 246, 250, 265, 278, 279,
281, 282, 284, 286—294, 298—
304, 309, 310, 312—316, 332, 391,
392, 455, 466, 486, 509, 510,
539,516, 525, 526, 530, 542, 544,
556—560, 589, 590, 596
D-Глюкоза 70, 82, 84, 87, 281, 282, 559
Р(+)-Глюкоза 68
а-Глюкоза 70, 76, 80, 82,
a-D-Глюкоза 70, 77, 83, 158
р-Глюкоза 70, 76, 78, 82, 89
P-D-Глюкоза 70
Глюкозамин 85—88, 391, 542, 552
Глюкозо-1,6-дифосфорная кислота 71, 179,
180, 294, 295
D-Глюкозо-!,6-дифосфорная кислота 71
Глюкозокиназа (глюкокиназа) 170, 284,
287, 294, 299, 304, 315, 509, 589
Глюкозо-1-фосфат 283
Глюкозо-6-фосфат 305
Глюкозо-1-фосфорная кислота 71, 165, 166,
172, 179, 180, 231, 250, 282,
283—288, 303, 304, 338, 486, 509,
510, 560, 589
D-Глюкозо-!-фосфорная кислота 71
Глюкозо-6-фосфорная кислота 71, 170,
171, 179, 250, 281, 282, 285, 287,
288, 291, 294, 295, 299, 303, 304,
309, 311, 312, 509, 510, 572, 589
D-Глюкозо-б-фосфорная кислота 71
Глюкозофосфорные кислоты 71, 173, 250,
268, 285, 287, 304, 311, 559, 589
Глюкозурия 90, 196, 206, 288—290, 313—
316, 383, 525, 526
Глюконовая кислота 87, 513
D-Глюконовая кислота 126
Глюконолактокиназа 309
Глюконо^-(7У-диазопропиламино)-уксус-
ная кислота 126
Глюкопираноза 76
Глюкуронид меркаптуровой кислоты 398
Глюкурониды 524, 525
Глюкуроновая кислота 85—88, 203—205,
375, 376, 398, 512—515, 552
a-D-Глюкуроновая кислота 88
Глютелины 45, 46
Гниение аминокислот 373, 374
— белков 370, 373, 377, 524, 525
Гнилостные бактерии 370—377
Гомарин 421
Гомогенаты (тканей и клеток) 243
Гомогенный катализ 147—148
607
Гомогентизиновая кислота 108, 109, 409—
411, 413, 445
Гомокарнозин 591
Гомополисахариды 79
Гомосерин 167, 171, 397
Гомоцистеин 24, 171, 394, 397, 398, 416
Гомоциклические аминокислоты 27
Гонадотропины 208
Гонадотропный гормон хориона 209
Гонадотропные гормоны 208, 209
Гордеин 46
Гормон беременности 204
—паращитовидных желез 188, 189, 561
— поджелудочной железы 314
— цветения 215
Гормоноподобные вещества 212—214
Гормоны 8, 41, 182, 184, 185, 212, 214,
216, 220, 242, 289, 290, 344,
356, 413, 441, 444—446, 496,
509, 525, 530, 561
— беспозвоночных 212
— гипофиза 45, 205—212, 344, 444, 445
— — доли задней 205, 210—212
— — — передней 205—209, 290, 291
— надпочечников 189, 194—196, 561
— — слоя адреналового 189, 192, 289,
290
— — — коркового 194—196. 339, 344,
445
— растений 214, 215
— роста 206, 207, 214, 215, 405, 445
— щитовидной железы 185, 187, 344, 561
Грамицидин 361
Грибной сахар 77
Групповая специфичность действия фер-
ментов 151, 152
Гуаназа 164, 450
Гуанидин 416, 417
Гуанидинкетовалерьяновая кислота 415
Гуанидинмасляпая кислота 415, 590, 591
Гуанидиновые соединения 416—418
Гуанидинуксусная кислота 171, 379, 387,
388, 394, 414—416, 571
Гуаниловая кислота 64, 65, 74, 391, 392,
450, 462, 464, 467, 474
Гуанин 42, 55—57, 61—63, 181, 450, 452,
456, 463, 464, 467, 471, 523,
571, 584, 585
Гуаниндезоксирибозотрифосфаты 468
Гуанинрибозодифосфат 469
Гуанозин 57, 450
Гуанозиндифосфорная кислота (ГДФ) 64,
65, 171
Гуанозинтрифосфат 171
Гуанозинтрифосфорная кислота (ГТФ) 64,
65
Гумми 85
Д
Двухкомпонентные ферменты 114, 149, 150,
175, 176, 178, 180, 182
Дегидраза янтарной кислоты 144
Дегидразы 256, 258, 264
Дегидратация 218
Дегидратирование 267
Дегидрирование 175, 274
— активированных жирных кислот 327
— жиров 511
— холестерина 100
Дегидроадреналин 192
Дегидроандростерон 201
Дегидроаскорбиновая кислота 107, 108
Дегидрогеназа альдегидов 564
— кислоты глутаминовой 387, 389, 445
— — L-глутаминовой 362, 364, 369
— — глюкозо-6-фосфорной 309
— — изолимонной 272, 273, 275
— — яблочной 272, 274
— — янтарной 144, 272
— фосфоглицеринальдегида 181, 296, 298,
299, 313
Дегидрогеназы 153, 175—179, 256—261,
307, 445, 598
Дегидрогенизация 175
— жирных кислот 335, 560
Дегидроизоандростерон 201, 202
11-Дегидрокортикостерон 195, 196
11-Дегидро-17-оксикортикостерон 195, 196
17-Дегидро-11 -оксикортикостерон 196
Дегидротерпен 341
Дегидрофенантренциклопентан 203
Дегидрохолестерин 100, 339
7-Дегидрохолестерин 100, 133—135
Дезамидазы 164, 165
Дезамидирование глутамина 590
Дезаминаза кислоты адениловой 164, 165,
461, 575, 590
— — глутаминовой 590
Дезаминазы 164, 165, 450, 461, 518, 590
— пуриновых оснований 164
Дезаминирование 368
— аденина 164, 450, 571
— азотистых соединений 423
— аланина 380
— аминов 373, 374, 406
— аминокислот 358—366, 368, 377, 413,
414, 423, 424, 556, 584, 590
— — диаминомонокарбоновых 360
— — моноаминодикарбоновых 360
— — моноаминомонокарбоновых 360
— D-аминокислот 380
— L-аминокислот 361—365
— аргинина 388, 415
— валина 381
— гистамина 213, 373, 402
— гистидина 401
— L-гистидина 363
— глицина 364, 378
— глутамина 519
— гуанина 164, 450, 571
— диаминов 373
— изолейцина 385
— кадаверина 373
— кислоты адениловой 165, 368, 423, 424,
461, 518, 575
— — аденозинтрифосфорной 580
— — 7-аминомасляной 214
— — аспарагиновой 272, 360, 362, 367
— — L-аспарагиновой 362
----глутаминовой 360, 362, 364, 445, 590
— — L-глутаминовой 362
— — мочевой 571
— — фенилуксусной 359
— L-лизина 365
— моноаминов 373, 374
— L-метионина 363
— L-оксипролина 364
— 5-окситриптамина 406
— орнитина 365
— полиаминов 373
— L-пролина 364
— пуриновых оснований 164, 433, 451,
452, 456
608
кислота 75
кислота 58
кислота 58,
кислота 75
Дезаминирование путресцина 373
— серина 381
— Л-серина 363
— серотонина 214
— тирозина 364, 410
— L-треонина 363
— триптофана 364, 402
— фенилаланина 364, 377
— цистеина 362, 363
— цитидина 453
2-Дезокси-2-амино-/)-галактоза 86
D-6-Дезоксигалактоза 72
Дезоксигексозы 72
Дезоксикортикостерон 196
11-Дезоксикортикостерон 195
L-6-Дезоксиманноза 72
Дезоксипиридоксин 141, 142
Дезоксирибоза 55, 57, 58, 449, 454, 455
463, 466, 468, 487, 585
D-Дезоксирибоза 56, 57, 74
p-D-Дезоксирибоза 57
Дезоксирибозонуклеозидтрифосфаты 468
Дезоксирибозофосфорная кислота 457,
463
D-Дезоксирибозо-!-фосфорная
Дезоксирибозо-З-фосфорная
Дезоксирибозо-5-фосфорная
466
D-Дeзoкcиpибoзo-5-фocфopнaя
Дезоксирибонуклеаза 160
Дезоксирибонуклеиновые кислоты (ДНК)
57—63, 244, 449, 454, 463, 468—
475, 487, 585, 588, 591, 592
— — типа АТ 63
--------ГД 63
Дезоксирибонуклеозиды 57
Дезокси рибонуклеопротеиды 470
Дезоксирибонуклеотиды 463
Дезоксирибоцитидин 453
Дезоксихолевая кислота 318, 342, 343
Декановая кислота 323
Декарбоксилаза гистидина 213
— диоксифенилаланина 371
— кислоты глутаминовой 390, 590
— кислоты пировиноградной 172, 307
— — цистеиновой 371
— — щавелевоянтарной 272, 273
Декарбоксилазы 172, 173, 262, 297, 309,
369—375, 445
— аминокислот 173, 445, 370—375
Декарбоксилирование S-аденозилметио-
нина 373
— аминокислот 173, 262, 272, 358, 369—
370, 377, 444
— — диаминомонокарбоновых 370, 371
— — циклических 371
— а-аминокислот 369
— аргинина 370
— гистидина 213, 370, 402
— 3,4,-диоксифенилаланина 412
— а-кетокислот 111, 173, 262, 263, 272,
413, 422
— кислоты а-амино-3-кетоадипиновой
545
— — аспарагиновой 370, 390
— — ацетоуксусной 316
— — глиоксилевой 378
— — глутаминовой 214, 370, 390
— — глюкозо-6-фосфорной 311
— — гуанидинкетовалерьяновой 415
— — а-кетоглутаровой 273
— — З-кето-6-фосфоглюконовой 308
Декарбоксилирование кислоты пировино-
градной 111, 112, 172, 262, 297,
301, 302, 306—308, 312
— — угольной 173
— — фенилпировиноградной 409
— — цистеиновой 371, 392
— — цистеинсульфиновой 393
— — щавелевоянтарной 273
— лейцина 370
— лизина 370, 371
— S-метилметионина 396
— 5-окситриптофана 406
— органических кислот 172. 262, 263
— орнитина 370—371
— серина 97, 381
— тирозина 370, 411
— триптофана 213, 375
— фенилаланина 190, 191, 370
— цистеина 393
Декстран 83
Декстринизация крахмала 80
Декстрины 80, 148, 159, 172, 277, 303
Декстрогенная амилаза 159
Декстроза 70
Денатурация белков 43, 44
Денитрификация 447
Денитрифицирующие бактерии 447
Деполимеразы нуклеиновых кислот 449
Деполимеризация нуклеиновых кислот 449
— рибонуклеиновых кислот 471
Депо-препараты инсулина 199
Депрессия мочи 522
Десульфгидраза цистеина 362, 363
Детоксицирующая функция печени (см.
обезвреживающая функция пе-
чени)
Детская креатинурии 419
Дефосфорилирование кислоты аденозин-
трифосфорной 64, 116, 300, 423,
440, 574, 578—580, 588
— — гексозофосфорной 281
— — глюкозо-6-фосфорной 281, 508
— — креатинфосфорной 579
— — фруктозо-1,6-дифосфорной 305
Дециловая кислота 95
Диабет 445
Диабетическая кома 316
Диазореактив Эрлиха 541, 542
Диализ дрожжевого сока 294
Диализат дрожжевого сока 294
Диальдегиды 374
Диаминобензол 188
а, з-Диаминовалерьяновая кислота 26
Диаминодифенилметан 188
а, с-Диаминокапроновая кислота 23
Диаминомонокарбоновые аминокислоты 19,
20, 25, 27, 33, 45, 360, 386
а, Е-Диамино-з-оксикапроновая кислота
26
2,6-Диаминопурин 144, 463
Диамины 371, 373, 374
Диафораза 260, 262, 306
L-Дигидрооротовая кислота 465
Дигидротимин 454
Дигидроурацил 454
Дигиталин 89
Диглицериды 318, 319, 337, 338
Диглицеринфосфорный эфир 160
Диенолы 108
Диазопропилфторфосфат 181
Дийодтирозин 27, 28, 186, 187, 208, 234,
412
609
Дикарбоновые кислоты 221, 542, 374
Дикетогулоновая кислота 108
L-Дикетогулоновая кислота 108
Диксантгидролмочевина 432
Дикумарин 268, 550, 551
5,6-Диметилбензимидазол 123
Диметилглицин 379
Диметилгуанидин 417
3,7-Диметилксантин 523
Диметилселен 396
Диметилтетин 396
Динамическая биохимия 5, 9—12
Динамическое состояние 11
— — аденозинтрифосфорной кислоты 488
— — белков 442, 483—486
— — гликогена 486
— — липидов 483, 487
— — нуклеиновых кислот 483, 4Ь7
----нуклеотидов 487
— — органических веществ 483, 488
— — производных пурина 487
— — пуринсодержащих веществ 487
— -- углеводов 483, 486
— — фосфатидов 335, 487
2,4-Динитробензоламинокислота 38
2,4-Динитрофенилгидразин 108
Динитрофенол 267
2,4-Динитрофторбензол 38
Динуклеотиды 454, 455, 467—469
Диоксиацетон 67, 68
Диоксиацетонфосфорная кислота 172, 249,
299
а-Диокси-З-Диметилмасляная кислота 120
Диоксидиэтилстильбен 204
2,6-Диокси-5-метилпиримидин 55
3,4-Диоксиминдальный альдегид 193
2,6-Диоксипиримидин 55
Диоксистеариновая кислота 564
Диоксифенилаланин 190, 191, 371
3,4-Диоксифенилаланин (Дофа) 411, 412
2,5-Диоксифенилпировиноградная кис-
лота 410
2,5-Диоксифенилуксусная кислота 409
3,4-Диоксифенилэтиламин 412
4,8-Диоксихинолин-2-карбоновая кисло-
та 403
Дипептидазы 162, 163, 353
Дипептиды 30, 353, 402, 421, 442
Дисахаразы 158
Дисахариды 66, 67, 72, 76, 85, 89, 158
Дисмутация уксусного альдегида 302
Диссимиляция 5, 241, 483
— аминокислот 357
Дистеарилфосфатидная кислота 337
Дисульфидные группы 24, 442
— мостики 32, 35
— связи 32, 35, 37
а,8-Дитиоди-а-аминопропионовая кисло-
та 24
Диурез 210, 221, 520, 521
1,3-Дифосфоглицериновая кислота 231,
232, 265, 266, 296, 299, 300, 304
2,3-Дифосфоглицериновая кислота 180
Дифосфопиридиннуклеотид 116, 117, 468
Дифосфотиамин 307
Дифосфоэстеразы 160
Дифтерийный токсин 538
Дихлорфенолиндофенол 108
Диэфирные связи мононуклеотидов 61
Добавочные факторы питания 105
Дрепаноцитоз 547
Дрожжевая зимаза 294, 298
Дыхание 138, 254, 259, 262—268
— растений 177
Дыхательная функция крови 530, 532—
535
Дыхательные хромогены 258
Дыхательный коэффициент 477, 479, 480,
490, 491
— фермент Варбурга 178, 260
^-Енолгидратаза 327
Енолфосфатные соединения 231
Енолпирофосфорная кислота 231
Енолфосфопировиноградная кислота 231,
297, 299
Естественные аминокислоты 20
Ж
Желатина 21, 26, 28, 370
Железо 8, 48—52, 216, 227, 235, 260, 508,
509, 515, 533, 534, 540, 544—
548, 565
Железопорфирин 51, 178
Железосодержащие белки 175
— ферменты 181, 508
— хромопротеиды 49, 51, 52, 534
Желтые окислительные ферменты 49, 53,
114, 177, 259
Желудочный сок 318, 345—350
Желчеобразовательная функция печени
515, 516
Желчные кислоты 100, 132, 154, 318,
319, 339, 342, 343, 378, 515
— пигменты 515, 516, 520, 525, 527, 543,
548, 549
Желчь 213, 318, 342, 343, 507, 511, 515,
516, 548, 549
Женские половые гормоны 200, 202
«Живой белок» 41
Животная зимаза 294
Животный крахмал 82
Жирные кислоты 92—95, 99, 100—103,
220, 221, 269, 317—327, 329, 332,
333, 335—337, 339, 389, 477—
480, 482, 487, 511, 515, 542,
544, 557, 560
— поликетокислоты 325
Жировая печень 328, 333, 334, 344
Жировые депо 320
Жирорастворимые витамины 106, 127 509,
511
Жиры 6, 8, 9, 92—96, 100, 145, 291,
317, 319, 320, 327, 329, 330,
332, 333, 348, 436, 476—482, 493,
508, 511, 515, 518, 542, 554,
556, 560, 566, 587
— молока 557, 558, 560, 562—564
— мышц 572
— пищи 345, 489, 494, 495, 497, 498, 500—
502
3
Заменимые аминокислоты 356, 436, 482,
496
Заместительная терапия 185
Запасное железо 508
610
Запасные жиры 90, 93, 344,
— полисахариды 79, 82
— углеводы 79, 82
Защитная функция крови 530, 539, 540
— — печени 516
Зеин 42
Зеленое мыло 95
Зерна крахмала 79, 80
Зимазы 294, 298
Зимины 293
Зимогены 155
Зоостерины 100
Зрительный пурпур 128, 129
И
Изоаллоксазин 113, 114, 177, 179
Изоамиламин 370
Изоандростерон 202
Изобутил-SKoA 382
Изобутиловое брожение 292
Изов*алерин-5КоА 384
p-Изовалерьяновая кислота 340
Изогуанин 463
Изолейцин 19, 23, 33, 211, 212, 348, 381,
383—385, 474, 482, 496, 497,
541, 563
£-Изолейцин 23, 211
Изолимонная кислота 273, 275, 389
Изолирование белков 40, 41
Изолированные белки 40, 41
— гормоны 41
— ферменты 41
Изомераза фосфотриоз 68, 296, 299
Изомеразы 173, 174, 249
Изомеры адреналина 190
— альдогексоз 70
— белков 44
— инозита 90, 125
— кетогексоз 70
— полипептидов 44
— стеринов 133
Изопентилпирофосфорная кислота 341
Изопреновые группировки 131, 341
Изопропиловое брожение 292
Изотонические растворы 536
Изотопный метод (метод меченых атомов)
12, 208, 243, 244, 251, 339, 342,
378, 433, 441, 442, 451, 463, 483,
484, 486, 487, 583, 585, 592, 596
Изоферменты 150
Изоцитраза 275
Изоэлектрическая точка белков 42, 43
Имидазол 28, 252, 400—402
Имидазол ацетил альдегид 231
Имидазолпировиноградная кислота 402
Имидазолсодержащие соединения 402
Имидазолуксусная кислота 402
Имидинфераза 171
Иминоглицин 364
Иминоглутаровая кислота 362
Иминокислоты 28, 29, 358, 360, 363
Иминопропионовая кислота 362, 363
Имины 373
Иммобильная вода 218, 219
Иммунитет 539, 587
Иммуноспецифические полисахариды 87
Иммунные вещества 553
— глобулины 530, 538, 539, 553, 566
— сыворотки 539
Инактивация гистамина 213
— ферментов 181
Инверсия сахарозы 77
Инвертаза 77, 159
Инвертный сахар 77
Ингибитор пепсиногена 348
Ингибиторы ферментов 154, 155
Индивидуальные белки 40, 41, 443
Индиго 407
Индирубин 407
Индоксил 376, 407, 512, 513
Индоксилсерная кислота 376, 524
Индол 252, 375, 376, 402, 404, 405, 407,
512, 525
Индолилуксусная кислота 404, 405
Индолил-З-уксусная кислота 215
Индолпировиноградная кислота 402
Индол-З-уксусная кислота 408
Индолэтиламин 375
Инозиновая кислота 165, 456, 457, 460—
462, 575, 580
-Инозит 90, 91, 96, 98, 125, 126, 586
Инозитиды 98
Инозитол 125, 344
Инозитолсодержащие фосфатиды 334
Инсулин 35, 39, 41, 45, 197—199, 217,
238, 279, 289—291, 313—316, 351,
444, 445, 509, 589
Инсулиназа 316
Интенсивность дыхания 263—265, 267
Интерферен 144
Инулаза 159, 160
Инулин 73, 79, 83, 158
Информационные РНК 469, 473—475
Ионная теория передачи нервного им-
пульса 592, 593, 595
Ионные связи белков 33
а-Ионон 131
р-Ионон 131, 132
Ихтулин 46
Й
Йод 95, 185,-188, 216, 217, 227, 233
234, 525, 543
Йодгоргоновая кислота 234
Йодирование белков 187
— тирозина 27, 187
— тиронина 186
Йодное число 95
Йодсодержащие белки 185—187
— соединения 186, 187
Йодтиреоглобулин 185
К
Кадаверин 370, 373, 400
Казеин 22, 24, 25, 27, 28, 42, 161, 162, 349,
350, 353, 562, 563
Казеинат кальция 349, 563
Казиноген 47, 161, 162, 349, 350, 558,
562, 563, 566
Калиевая соль индоксилсерной кислоты 376
Калиевое торможение 228
Калий 8, 137, 194, 196, 205, 216, 218,
226—228, 522, 543, 544, 565, 569,
570, 572, 588, 592—595
Калийное мыло 95
Калорийная ценность альбумина 494
— — белков 493, 494
— — глиадина 494
611
Калорийная ценность глюкозы 494
— — жиров 494
--- казеина 494
— — крахмала 494
— — креатинина 494
— — легумина 494
— — мочевины 494
— — пищевых веществ 493, 494, 495, 500,
501
— — сахарозы 494
— — углеводов 494
— — эдестина 494
Кальциевая соль казеина 562
— — казеиногена 562
Кальций 8, 135, 154, 188, 189, 216, 225-
229, 503, 504, 515, 522, 543,
544, 552, 563, 565, 572, 588,
593, 594
Кальцинат казеиногена 562
Кальциферол 133—135
Канавалии 164
Канаваназа 163, 164
Канаванин 164
Карбамил-Ь-аспарагиновая кислота 465
Карбамилфосфорная кислота 429—431, 465
Карбаминовая кислота 253, 430
Карбаминовокислый аммоний 426
Карбгемоглобин 536
Карбоангидраза 173, 217, 238, 347, 535
Карбогидразы 158, 161, 165, 277
5-Карбоксамид 456, 457
5-Карбоксамидриботид 459, 460
Карбоксиангидриды аминокислот 31
Карбоксигемоглобин (НЬСО) 51, 534, 536
Карбоксилаза 273
Карбоксилирование 270
— 5-аминоимидазолриботида 459
— кислоты 3-метил-|В-оксимасляной 340
— — пировиноградной 119, 272, 306, 482
Карбоксилфосфатные связи 232, 439—441
— соединения 231
Карбоксилфосфаты 233
— аминокислот 440
Карбоксимиоглобин 51
Карбоксипептидаза 39, 162, 307
Карбоксиполипептидазы 351, 353
4-Карбоксиурацил 464
Карбонильная группа 67
Кардиазол 595
Карнитин 127, 413, 420
Карнозин 357, 390, 394, 402, 413, 421,
499 4QR S7 1
Каротиназа isi, 132, 134, 511
Каротиноиды 131
Каротины 92, 129—134, 138, 508, 511,
539, 566
а-Каротины 130, 131
р-Каротины 130—132
7-Каротины 130, 131
Каприловая кислота 564
Каприновая кислота 564
Капронил — SKoA 332
Капроновая в шслота 95, 323, 325, 564
Каталаза 42, 49, 51, 52, 148, 15L 155,
158, 175, 178, 181 , 235, 262, 360,
564 Катализ 147 Катализаторы 146—148 Катепсин 161, 162 Катехол 193 Катехоламины 193 Катионы 43, 154, 216, 220, 222
Кахексия 344
Керазин 103
Кератины 24, 46, 161, 349, 585
Кератомаляция 128
а-Кетоадипиновая кислота 387
Кетогексозы 69, 70
а-Кетоглутаровая кислота 111, 168, 250,
273, 275, 362, 367, 368, 378,
387—390, 425, 431, 482, 542, 544,
590, 591
а-Кето-°-гуанидинвалерьяновая кислота
388
Кетозы 67
а-Кетоизовалерьяновая кислота 381, 382
а-Кетоизокапроновая кислота 383, 384
я-Кетокислоты 111, 168, 221, 250, 251,
263, 275, 358—362, 366—369,
389, 390, 422, 431, 436, 445, 482,
556, 591
р-Кетокислоты 330, 331
а-Кетомасляная кислота 363, 398
а-Кето-З-метилвалерьяновая кислота 385
Кетонемия 315
Кетоновые вещества 315, 316, 383, 385,
525, 542, 544
Кетонурия 315, 527
Кетопентозы 74
Кетопролин 364
fl-Кетотиолаза 327, 329
Кетотриоза 67
З-Кето-6-фосфоглюконовая кислота 309
Кефалины 96, 97, 334—337, 542, 587
Киназа кислоты пировиноградной 299
— — 3-фосфоглицериновой 299
Киназы 170
Кинуренин 380, 403—405
Кинурениназа 403, 404
Кинуреновая кислота 402—405
Кислая пища 222, 502, 503
Кислород 18, 50, 51, 66, 106, 107, 175,
177, 216, 246, 248, 254—268, 274,
306, 492, 493, 294, 532—535
Кислородная емкость крови 533
Кислотное число 95
Кислотность мочи 519, 520, 522
— пищи 502
Кислотно-щелочное равновесие 519, 525
Кислотный гидролиз белков 18, 28, 31
Кислотоамидные связи 7, 8, 44, 98, 102,
308, 343, 438
Кислотообразующие элементы пищи 502
Кислые мукополисахариды 85
— фосфатазы 160
— фосфаты 222
Кишечная микрофлора 374, 375
Кишечный сок 351—353
Классификация белков 45, 47
— — простых 45
— — сложных 47
— витаминов 106
— ферментов 157, 178
Клейстеризация амилопектина 80
— крахмала 80
Клубеньковые бактерии 447
Коагуляционный фактор 138
Кобальт 9, 123, 154, 227, 237, 525,
588
Кобальтовая недостаточность 237
Ковалентные связи белков 32, 33
Кодегидраза 176
Коды РНК 473, 474
Козимаза 294
612
Коллаген 26, 46, 229, 348, 349, 445, 508,
570, 585
Коллоид щитовидной железы 185
Компенсированный ацидоз 223, 532
Комплементарные основания нуклеино-
вых кислот 62
Конвертин 552
Конденсация 174
— ацетильных остатков 308
— кислоты ацетоуксусной 511
— — изопентилпирофосфорной 341
-----уксусной 174, 175, 272, 274, 316,
325, 326, 339
— органических кислот 174
Конденсирующие ферменты 174, 175, 272
Концевые аминокислоты 38, 39
Копропорфирин 520
Копростерин 100, 339
Кортизол 195
Кортизон 195, 196, 290
Кортикальные гормоны 339
Кортикостероидные гормоны 194—196
Кортикостероиды 195, 196, 207
Кортикостероны 195, 196, 207, 290
Кортикотропин 207
— В 207
Коферин 523
Кофермент аминофераз 366, 367
— ацетилирования 174, 179
— ацилирования (кофермент А, коэнзим
А, КоА) 120, 174, 179, 235,
268—272, 275, 307, 308, 329, 336,
337, 340, 384, 385, 390, 393,
445, 478, 598, 599
— дегидрогеназ (KoJ) 116, 175—177, 179,
259, 260, 296, 298, 302
— — анаэробных 179
— декарбоксилазы 111
— ферментов окислительных 306, 468
— — — желтых 112, 114, 259—261
— — флавиновых 260, 261
— фосфогликомутазы 180
— фосфоглицеромутазы 180
Коферменты 150, 178, 180, 444, 445
Коэффициент А/Г 538
— изнашивания тканей 483—485, 498, 499
Крахмал И, 70, 77—81, 146, 147, 158,
246 249 250 277 294
Креатин 21,’169, ’170, 265, 357, 378, 379,
387, 395, 397, 413—420, 452, 496,
523, 524, 541, 542, 544, 571, 572,
575—580, 585, 586, 593
Креатинин 413, 414, 419, 420, 438, 523,
524, 541, 542, 544
Креатининовый коэффициент 524
Креатиновый показатель 524
Креатипурия 419, 420, 524
КреатинфоссЬорная кислота 170, 232, 265,
414, 417—420, 523, 571—578, 580,
581, 585, 588, 596
Креатинфосфофераза 575
Крезол 375, 376, 513, 524, 525
Крезолглюкуроновая кислота 375
Крезолсерные кислоты 524
Кретинизм 187
Криптоксантин 131
Кристаллические белки 40
— ферменты 11, 149, 157
Кристаллический альбумин 40, 45
— гемоглобин 40
— p-глобулин 40
— миген 40
Кровь 529—537, 549, 553
Кровяные пигменты 525, 534
Кротон бета ин 420
Кротоновая кислота 323
Ксантгидрол 432
Ксантин 433, 450, 452, 456, 462, 463,
523, 571
Ксантиноксидаза 238, 433, 450, 564
Ксантозиновая кислота 462
Ксантозинфосфорная кислота 391, 392, 462,
463
Ксантоптерин 121, 122
Ксантопротеиновая проба 44
Ксантуреновая кислота 402—405
Ксерофтальмия 128
Ксиланы 84
Ксилоза 79, 85
D-Ксилоза 74, 84
L-Ксилулоза 526
Ксилулозо-5-фосфат 310
Ксилулозофосфорная кислота 310, 311
Ксилулозо-5-фосфорная кислота 310, 311
Кумарин 550
Куриная слепота 128, 129
Л
Лакказа 236
Лаковая кровь 544
Лактаза 159
— кишечного сока 277, 279
— поджелудочной железы 351
Лактальбумины 45, 558
Лактация 511, 555, 561, 566
Лактикодегидрогеназа 150, 153, 306
Лактогенный гормон 209, 561
Р-Лактоглобулин 42, 563
Лактоглобулины 558
Лактоза 70, 72, 78, 159, 277, 279, 284,
525, 526, 556, 558, 560, 562,
564, 565
D-Лактоза 559
£>(+)-Лактоза 78
Лактозазон 526
Лактозные дрожжи 72
Лактозо-1-фосфорная кислота 560
Лактозурия 525, 526
Лактпероксидаза 52, 178
Ланолин 99, 101, 102
Ланолиновый спирт 102
Ланостерин 341
Лауриновая кислота 95, 323, 564
Левулеза 72
Лейкоадренохром 193
Лейцин 19, 23, 33, 211, 212, 348, 361,
381, 383, 384, 474, 496, 497, 541,
563, 569
D-Лейцин 361
L-Лейцин 23, 211, 383, 384
Лецитиназа А 335, 336
— В 336
Лецитиназы 336
Лецитины 96—98, 333—338, 394, 487, 542,
544, 586
Лиазы 172, 173
Лигазы 174
Лигноцериновая кислота 102, 103
Лизатин 28
Лизин 19, 25, 26, 28, 33, 45, 353, 364—
366, 370, 374, 387, 400, 474, 496,
497, 541, 563, 569
21 Заказ № 581
613
L-Лизин 26, 365, 386
Лизокефалин 335
Лизолецитины 98, 335, 336, 544
Лизоцимы 143, 144
Лизуха 236
Ликвор 596
Лимонная кислота 173—175, 272, 274, 275,
389, 542, 544
Лимфа 529, 553, 554
Линейные полифосфорные кислоты 230
Линолевая кислота 93—95, 140, 330
Линоленовая кислота 93, 94, 140, 330
Лиотропные ряды 43
Лиофильная сушка 41
Липаза сока желудочного 317, 347
— — кишечного 318
— — поджелудочного 154, 318, 351, 352
Липазы 151, 155, 160, 317, 318, 478, 525
Липемия 320
Липиды 18, 53, 54, 66, 92, 96, 100—102,
194 , 200, 216, 244, 317, 508, 539,
542 556
— нервной ткани 583, 584—588, 592
Липоевая кислота 111, 307
Липозитолы 96, 98
Липокаическое вещество 344
Липопротеиды 53, 54, 539, 544, 551, 584
^-Липопротеиды 315, 539, 540
Липотиамидпирофосфат 111
Липотропное действие 333, 334
Литиевая соль мочевой кислоты 452
Литохолевая кислота 318, 342, 343
Лихенин 83
Ломбрицинфосфорная кислота 418, 419
Люизит 155
Люминесценция 598, 599
Люминесцирующие вещества 598
Люмистерин 134
Люмифлавин 113
Люмихром 113
Лютеинизирующий гормон 206, 208, 209
Люцифераза 598, 599
Люциферин 598, 599
М
Магнезиевый наркоз 228
Магний 8, 137, 154, 155, 216, 226, 228,
522, 543, 544, 565, 569, 570, 572,
578, 588, 593, 594, 598
Магнийсодержащие ферменты 181
Макроэлементы 216, 217, 226
Макроэргические фосфатные связи 169,
170, 231—233, 255, 265, 267,
270, 274, 297—300, 305, 306,
308, 312, 338, 347, 391, 422,
428—430, 439—442, 444, 462,
468, 515, 575, 576, 578, 581, 594,
596, 599
— фосфорные соединения 233
Малеилацетоуксусная кислота 411, 413
Маликодегидрогеназа 153, 274
Малонамид 29
Малонил-SKoA 331
Малоновая кислота 144
Мальтаза 78, 153, 154, 158, 159,287,303,
589
— дрожжевая 151, 294
— кишечная 151, 277, 278
— поджелудочной железы 351
Мальтодекстрины 80
Мальтоза 70, 76—78, 80, 159, 277—279,
294, 295, 303, 556
Манна 70
Маннаны 84
Маннит 87
D-Манногептулоза 75
Манноза 71, 85, 87, 510
D-Манноза 70, 71, 84
a-D-Манноза 71
a-D-Манноза 71
Маннозамин 587
Марганец 8, 154, 216, 227, 237
Маргарин 95
Масла 93—95, 101
Масляная кислота 95, 278, 292, 320, 323,
560, 564
7-Масляная кислота 415
Маслянокислое брожение 292
Мацерационный сок Лебедева 149
Мевалоновая кислота 340
Медицинская биохимия 11
Медная недостаточность 236
Медь 8, 9, 48, 53, 106, 216, 236, 509, 525,
534, 540, 544, 565, 588
Медьсодержащие хромопротеиды 52, 53,
534
Межклеточная вода 218, 220
Мезобилирубиноген 548, 549
Мезоинозит 90, 125, 126
Меланины 177, 412, 413
Меланурия 413
Мелибиоза 72
Меланофорстимулирующий гормон (МСГ)
210
Меркаптаны 398
Меркаптоэтиламин 179, 393
Меркаптуровые кислоты 398
Меромиозин 569
Я-Меромиозин 569
L-Меромиозин 569
Метаболиты 144, 271
Метаболические циклы 271
Метакрилил-SKoA 382
Металлопротеиды 216, 540
Металлсодержащие хромопротеиды 49, 52
Метан 374
Метафосфорная кислота 230
Метгемоглобин 51, 527, 534
Метиладенин 57
Метилаланин 193
2-Метил-6-амино-5-оксиметилпиримидин
111
Метиламиноэтанолпирокатехин 190
Метиларгинин 152
а-Метилацетоадетил-SKoA 385
а-Метилбутирил-SKoA 385
Мети л гистидин 213
а-Метилгликозидаза 151
р-Метилгликозидаза 151
а-Метилгликозиды 88, 89, 151
₽-Метилгликозиды 88, 89, 151
Метилглицин 365
М-Метилглицин 379
М-Метил-Ь-глюкозамин 143
Метилгуанин 57
Метилгуанидинуксусная кислота 414
Метиленовая синь 259
Метилизомалонил-SKoA 383
Метилиминоглицин 365
Мети л индол 376
Метилирование 24, 167, 168, 394—396, 466
614
Метилирование гистамина 213
— гомоцистеина 394
— гуанидина 417
— 3,4-диоксифенилэтиламина 412
— карнозина 413, 421, 394, 571
— кислоты гуанидинуксусной 394, 415,
508
— — гуанидинфосфорной 508
— — пиколиновой 421
— — уридиновой 466
— никотинамида 394, 395
— норадреналина 192, 394
— 5-окситриптамина 407
— пиридина 395
— соединений селена 395
— тирозина 411
— фенилаланина 190
— этилноламина 97, 167, 394
— ядовитых веществ 395
Метилированные гетероциклические со-
единения 421
— пурины 523
Метилмалонинизомераза 383
Метилмалоновая кислота 382, 383
Метилмеркаптан 363
S-Метилметионин 396
Метилмочевина 152
2-Метил-1,4-нафтохион 139
W-Метилникотинамид 117, 395, 397, 404
Метиловый спирт 88, 89, 396
а-Метил-З-оксибутирил-SKoA 385
р-Метил-р-оксимасляная кислота 340
2-Метил-5-оксиметил-6-аминопиримидин
110
4-Метил-5-оксиэтилтиазол 110
Метилпентоза 89
TV-Метилпиридин 117, 396
Метилтестостерон 201
Метилтиоурацил 188
5-Метилурацил 55
Метилфенол 375
Метилферазы 167, 168, 171, 394—396, 415,
416
Метилцитозин 57
5-Метилцитозин 56, 57
Метиновые группы 49
Метионин 19, 23, 24, 117, 126, 144, 167,
190, 333, 334, 338, 344, 357, 363,
371, 372, 392—400, 413, 415, 416,
466, 474, 496, 497, 512, 541, 563,
569, 571, 585, 594
£-Метионин 24
Метионинсульфоксимин 399
Метмиоглобин 51
Микроэлементы 8, 216, 217, 226, 227, 233,
237, 509, 525, 573, 588
— пищи 490
Микседема 187, 316
Миндальная кислота 358
Минеральные вещества 8, 9, 216, 217, 219,
220, 223—227, 229, 237, 251, 509,
515 , 525 , 556, 561, 566
— — кости 228, 229
-----молока 562, 563, 565
-----мочи 521, 522
— — мышц 572
-----пищи 489, 490, 502, 503
— — плазмы крови 536, 357, 542—544
----- нервной ткани 584, 588
Миоген 172, 568
Миогеновая фракция белков 568, 574,
575
Миоглобин 37, 51, 235, 508, 534, 535, 581
Миозин 37, 42, 349, 568—570, 574, 575, 578
Миозиновая фракция белков 568, 574, 575
Миокиназа 575
Миристиновая кислота 95, 564
Мирициловый спирт 102
Миросульфатаза 161
Мобилизация гликогена в печени 289, 290
Молибден 238
Молозиво 565
Молоко 555—566
Молочная кислота 66, 154, 183, 191, 221 251, 259, 260, 278, 288, 291—294
303—309, 312, 313, 417, 427, 476, 510, 556, 562, 567, 572, 577—582, 590 321, 530, 573, 374 542 574
Молочнокислое брожение 259, 260, 292
375
Молочнокислые бактерии 118, 259, 292
303, 375, 562
Молочный жир 317, 318
— сахар 72, 78, 159, 279
Моноаминодикарбоновые аминокислоты
19, 24,- 33, 182, 349, 360
Моноаминомонокарбоновые аминокисло-
ты 19—21, 23, 360
Моноаминооксидаза 214
Моноамины 369, 373, 374
Монобромуксусная кислота 577, 582
Моноглицериды 318, 319
Монойодуксусная кислота 155, 280, 295,
333, 577, 582
Монойодтирозин 186
Монокарбоновые кислоты 374
Монометилгуанидин 417
Мононатриевая соль мочевой кислоты 450,
451, 523
Мононуклеотиды 57—61, 449, 450, 454,
455, 461, 466—468, 474, 487
Моносахариды 66, 67, 69, 75, 76, 79, 84,
87, 88, 169, 487, 510
D-Моносахариды 67, 68
Монотонные полипептиды 31
Моча 517—528
Мочевая кислота 157, 252, 423—425, 430 432—436, 438, 447, 449—453, 455 456, 463, 494, 515, 523, 525, 528 541, 542, 544, 571
Мочевина 6, 9, 26, 27, 42, 152, 157, 164
181, 194, 221, 227, 251, 358, 369
387, 423—436, 438, 447, 450, 453
454, 494, 512, 515, 541—543, 571 522, 523, 525
Мочевой индикан 376, 399, 408, 524
— песок 24
Мочевые камни 528
— осадки 519, 528
— сростки 528
Мочеотделительная функция почек 220,
221, 517, 518, 519
Мужские половые гормоны 200
Мукоиды 48
Муконовая кислота 408
Мукополисахариды 85, 144, 235, 552
Мукопротеиды 391, 392, 540
Муравьиная кислота 253, 378, 379, 396,
401, 403, 430, 433, 455, 456, 458,
460, 466, 487
Муравьиный альдегид 378, 401, 564
Мутазы 174, 179
Мутаротация 70
615
Муцины 48, 515, 519, 526
Мыла 95, 318
— металлов тяжелых 95
— — щелочноземельных 95
Мышечная адинамия 194
— дистрофия 137, 524, 581
Мышечный гемоглобин 51
— сахар 90
Мясной пептон 349
Н
Набухание белков 43, 348
Надмуравьиная кислота 32, 38
Накопление жиров 344
Насыщенные жирные кислоты 93, 329
Натриевая соль кислоты индоксилсерной
376
—------мочевой 450, 451
Натрий 8, 194, 196, 205, 216, 218, 225—
228, 522, 543, 544, 565, 572, 588,
592
Натронное мыло 95
Небелковые азотистые соединения 356, 357,
413, 423, 425, 426, 430, 432,
438, 446, 447, 452, 496, 571, 585,
586, 596
— — — плазмы крови 541, 542
— компоненты дегидрогеназ 175, 177, 179
— — сложных белков 47
— — ферментов 8, 140, 142, 149, 150,
444, 445
Небелковый азот 541—543, 571
Недеятельные ферменты 142
Незаменимые аминокислоты 356, 357, 381,
383, 384, 386, 400, 408, 436, 437,
496, 497, 499, 500, 563
— жирные кислоты 140
Нейраминовая кислота 587
Нейрокератин 584, 585
Нейтрализация кислот аммиаком 426
Нейтральная сера 399
Нейтральные жиры 93, 319, 320, 333, 508,
515, 542, 557
— мукополисахариды 85
Некомпенсированный ацидоз 223, 532
Ненасыщенные жирные кислоты 93—95,
140, 329—331, 560
Неомыляемая фракция липидов 92
Неорганизованные ферменты 148
Неорганические фосфаты 222, 227, 229,
232, 233, 265, 267, 268, 280, 293,
298, 300, 333, 334, 522, 523, 531,
543, 588
— фосфорные соединения 230—232
Нервон 103
Нервоновая кислота 102, 103
Неполноценные белки 437, 497
Неприродные аминокислоты 358—360
Непрямая калориметрия 490, 491
Несахарный диабет 210, 211, 221, 521
Ниацин 115, 116
Никотин 115
Никотинамид 117, 178, 394, 395
Никотинамидадениндинуклеотид (НАД) 74,
116, 175, 177—179, 259, 266, 299,
304, 306, 307, 327, 331, 361, 362,
408, 467, 468, 514, 591
Никотинамидадениндинуклеотидфосфат
(НАДФ) 116, 175—179, 248, 249,
259, 331, 362, 468
Никотинамидрибоза 468
Никотинамидрибозофосфорная кислота 117
Никотиновая кислота 115—117, 141, 252,
404, 405, 408, 421, 444, 445
Никотинуровая кислота 421
Нингидриновая реакция 20, 21, 44
Нитраты 356, 357, 368, 432, 447
Нитриты 356, 368, 446, 447
Нитрификация 446, 447
Нитрифицирующие бактерии 356, 432, 446
Нонановая кислота 323
Норадреналин 189, 190, 192, 193, 289,
394, 406, 411—413, 594, 595
Норлейцин 23
L-Норлейцин 23
Нотатин 142
Нуклеин 53
Нуклеинацидазы 160, 351
Нуклеиновые кислоты 53, 55—63, 65, 74,
75, 245, 378, 441, 443, 449—451,
454, 455, 466—475, 487, 558, 572,
584, 585, 591, 592
Нуклеозидазы 449
Нуклеозиддифосфаты 63, 64, 469
Нуклеозиддифосфокиназы 171
Нуклеозиддифосфорные кислоты 171
Нуклеозидмонофосфаты 63
Нуклеозидтрифосфаты 63, 468, 473
Нуклеозиды 57, 58, 449, 450, 463, 467
Нуклеопротеиды 18, 46, 47, 53, 244, 441,
449, 454, 508, 570, 572, 584, 585
Нуклеотидазы 160, 449
Нуклеотидпирофосфатаза 468
Нуклеотиды 57, 59, 62, 63, 75, 378, 450,
461, 462, 467, 473, 474, 487
О
Обезвреживание аммиака 424—426, 430,
434, 435, 512
— аммония 424, 425, 590
— ароматических соединений 398
— индола 376, 512, 524, 525
— кислоты бензойной 27, 378, 380, 388,
515, 524, 525
— — фенилуксусной 322, 409, 515
— крезола 525
— скатола 525
— фенола 375, 525
— ядовитых веществ 21, 88, 235, 375—
377, 507, 512, 513, 515, 516,
523—525
Обезвреживающая функция печени 375,
377, 512—516, 524
Облигатные анаэробы 301, 361
Обмен аланина 380
— аминокислот 377—381, 386, 387, 392,
423, 444, 445, 524
-----серусодержащих 380, 381, 392, 399,
400
— аргинина 387, 388
— белков 345, 356, 369, 388, 436—438,
443—446, 482, 484, 488, 492, 541,
581, 585
— валина 381
— веществ 5, 9—13, 25, 109, 119, 120, 127,
129, 144, 145, 154, 157, 170, 182—
185, 187, 206, 212, 219—221, 226,
233, 241—244, 271, 275, 280, 281,
616
291, 292, 306, 308, 313, 315, 327,
332, 333, 343, 344, 366, 368, 378,
390, 409, 413, 415, 419, 424, 436,
443—446, 476, 479, 482, 483, 488,
489, 492, 493, 500, 529, 530, 532,
535, 537, 542—544, 563
Обмен веществ в костях 229
— — в мышцах 567, 573, 579—581
— — в нервной ткани 583, 589—591, 593—
596
— — в печени 507, 516
— — в почках 517, 519, 524, 525
— воды 219, 220, 227, 228, 508, 521
— гистидина 400, 401
— гликогена 486, 488
— глицина 378—380, 402
— динуклеотидов 455
— железа 508
— желчных пигментов 549
— жиров 317, 328, 330, 333, 343, 344, 378,
381, 436, 445, 476, 480, 482,
511
— изолейцина 381
— а-кетокислот 445
— кислот жирных 480
— — нуклеиновых 378, 441, 451, 455,
488
— кислоты аспарагиновой 388—390
— — глутаминовой 386, 388—390
— креатина 419
— лейцина 381
— лизина 386, 387
— метионина 392, 400
— мононуклеотидов 455
— оксипролина 385, 386
орнитина 385, 386
— основной 491, 492
— производных пурина 449, 451, 452, 525
— пролина 385, 386
— серина 378—380, 402
— соединений азотистых (азотистый об-
мен) 13, 201, 219, 242, 252, 356,
357, 362, 369, 387, 399, 425, 426,
430—436, 444—447, 512, 541, 571,
581, 588, 590
— — без азотистых 444, 445
— — фосфорных 233, 581
— стеридов 317
— тирозина 408, 410, 411
— треонина 381
— триптофана 402, 408
— углеводов 90, 111, 112, 192, 194, 196,242,
250, 277, 280, 290, 291, 294, 306,
313, 321, 330, 378, 380, 381, 388,
389, 393, 401, 436, 445, 480, 486,
492, 510, 516, 581, 589, 590
— — внутриклеточный 291
— — промежуточный 292
— — тканевой 291
— фенилаланина 408—411
— фосфатидов 317, 333, 334, 488
— холестерина 511, 592
— цистеина 392, 400
— цистина 392
Обновление аминокислот 484, 485
— белков 12, 442—445, 483—486, 590
— гликогена 486
— гликолипидов 592
— глюкозы 486
.— кислот нуклеиновых 441, 592
— — рибонуклеиновых 441
— кислоты аденозинтрифосфорной 488
Обновление кислоты мочевой 451
— — фосфорной 487, 488
— лецитинов 487
— мононуклеотидов 487
— органических веществ 483
— производных нурина 487
— стеринов 592
— фосфатидов 487
— фосфолипидов 592, 596
Обратимость гликогенолиза 305, 306
— действия липазы 153
— — мальтазы 153
----- пепсина 153
— — ферментов 153, 154
— — эмульсина 153
Общая сера 399
Общий азот мочи 437, 438, 484, 490, 498,
523
Овальбумины 45
Одноименные ферменты 150
Однокомпонентные ферменты 150, 180
Ожирение печени 508, 509
Озазон 526
Окисление аденилата люциферина 599
— адреналина 177, 192, 595
— адренохрома 192, 193
— альдегидов 179, 255, 256, 374, 564
— альдогексоз 87
— аминокислот 263
— — пищи 494
— — серусодержащих 523
— ароматических аминов 178
— ацетил-SKoA 481
— белков 220
— — пищи 490, 491, 493
— галактозы 87
— гексоз 338
— гемоглобина 533, 534
— гипоксантина 433, 450, 456, 462
— гипотаурина 393
— глутамилтрипептида 422
— глюкозы 87, 142, 254, 258, 262, 267,
292, 304, 305, 309, 311, 513, 514,
515, 589
— дегидроадреналина 192
— 3,4-диоксифенилэтиламина 412
— жирных кислот 157, 320—326, 328, 330,
332, 508
— — — ненасыщенных 329, 330
— жиров 220, 263, 320
— — пищи 490, 491, 493
— индола 512, 524
— кетокислот 179
— кислоты 7-аминомасляной 214
— — аскорбиновой 108
— — ацетоуксусной 329, 574
— — глиоксилевой 365
— — глицеринфосфорной 321
— — глутаровой 387
— — глюкозо-6-фосфорной 309—312
— — гомогентизиновой 411
— — изолимонной 273
— — инозиновой 462
— — капроновой 325
— — кетоглутаровой 267, 590
— кинуреновой 403
— — масляной 326
— — молочной 153, 304, 306, 312, 321,
530, 576, 577, 579, 582
— — мочевой 453
— — октановой 325
— — олеиновой 325
617
Окисление кислоты пальмитиновой 325
— — параоксифенилпировиноградной
410
— — пировиноградной 306, 307
— — стеариновой 325
— — уксусной 274, 308
— — цистеинсульфеновой 393
— — яблочной 153, 274
— —янтарной 144, 153, 258, 259, 274
— ксантина 450
— люциферина 598
— маннита 87
— меотионина 523
— моносахаридов 84, 87
— никотина 115
— оксикислот 255
— — активированных 327
— р-оксикислот 327, 330, 331
— органических веществ (биологическое
окисление) 12, 108, 114, 116, 138,
144, 175, 177—179, 183, 193, 217,
219, 220, 233, 244, 254—268, 271,
331, 389, 439, 441, 444, 445, 493,
544, 574, 576, 584, 592, 598
— — — пищи 490, 491
— подвижных метильных групп 396
— полифенолов 177
— производных пурина 433, 451, 452,456
— серы 502, 523
— — сульфидной 235 ~
— сорбита 87
— спиртов 87, 255, 256
— сульфгидрильной группы 24, 392, 393
— тирозина 177, 411, 445
— триметиламина 434
— триптофана 213, 406
— углеводов 220, 263, 267, 312, 518
— — пищи 490, 491, 493
— фенилаланина 190, 408, 409, 411
— фенолов 177, 178
— фосфоглицеринальдегида 265, 296—298,
302
— 6-фосфоглюконолактона 309
— хинонов 177
— холина 379, 434
— цистеина 392, 393, 523
— цистина 523
— цитохромов 175, 178, 260, 261
р-Окисление кислот жирных 321—332, 382,
477, 511, 518, 560
— — органических 423
— кислоты гуанидинмасляной 415
— — масляной 323
— — олеиновой 330
— — стеариновой 330
Окисленный глутатион (GS—SG) 422
— люциферин 598, 599
Окислительная теория Баха 257, 258, 261
— — палладина 257—259, 261
Окислительное дезаминирование амино-
кислот 358—360, 364, 366, 369,
373, 423, 424, 518
— — £)-аминокислот 359, 260
— — Д-аминокислот 359, 360
— — диаминов 373
— — моноаминов 373
— — полиаминов 373
— фосфорилирование 265—270, 285
Окислительные ферменты 12, 49, 52, 149,
175, 255, 257, 259, 306
Окись триметиламина 434
Окончательная моча 519
Окоченение мышц 577, 582
Оксалаты 528
Оксамид 29
Оксимаинокислоты 47
2-Окси-6-аминопиримидин 55
2-Окси-6-аминопурин 463
З-Оксиантраниловая кислота 404, 405
р-Оксиацилдегидрогеназа 327
Оксигемоглобин (НЬОг) 50, 51, 531—536
Оксигемоцианины 52
Оксигеназы 257
Оксиглутаминовая кислота 563
р-Оксиглутаминовая кислота 24, 25
Оксидаза а-кетоглутаровой кислоты 272
Оксидазы 175, 177, 236, 260
— аминов 373, 374
— аминокислот 359, 360
— £)-аминокислот 359—361, 380, 444
— £-аминокислот 359, 360, 362, 369, 444,
518
—‘ диаминов 373
— моноаминов 373, 374
— пролина 364, 386
17-Окси-11 -дегидрокортикостерон 195
Оксидоредуктазы 175
Оксидоредукция 256
— аминокислот 361
Р-Оксиизобутирил-SKoA 382
р-Оксиизовалерил-SKoA 384
Оксииндол иловые соединения 406, 407
5-Оксииндоилуксусная кислота 406, 407
5-Оксииндолуксусный альдегид 214, 406,
407
З-Оксикинуренин 404, 405
Оксикислоты 255, 327
а-Оксикислоты 358, 361
р-Оксикислоты 327, 330, 331
17- Оксикортикостерон 195, 196
Оксилйзин 25, 26
р-Оксимасляная кислота 221, 315, 316,
323, 332,- 383, 525, 527, 542, 556,
557
р-Окси-р-метилглутарил-SKoA 384
Р-Окси-р-метилглутаровая кислота 340
Оксимиоглобин 51
4-Оксипирродилин-2-карбоновая кислота
28
17-Оксипрогестерон 201
Оксипролин 19, 27—29, 36, 48, 361, 364,
385, 386, 445, 496
6-Оксипурин 433
Окситирамин 190, 191
Окситоцин 210—212
5-Окситриптамин 213, 404—407, 595
5-Окситриптофан 404, 406, 407
Оксифенилпировиноградная кислота 377,
410, 411, 413
Оксифенилпропионовая кислота 90
Оксифенилуксусная кислота 377, 411
Оксифлавон 90
4-Оксихинолин-2-карбоновая кислота 402
Оксихолестерин 100
Оксиэтилмалонил-SKoA 331
Оксоадренохром 193
Октановая кислота 95, 323, 325
Октапептиды 211, 212
Октил-SKoA 332
Октиловый спирт 360
Октопин 417
Олеиновая кислота 93—95, 100, 325, 330,
564
Олигазы 158
618
Олигосахариды 66, 76, 79, 88, 249
Олигурия 520
Омыление жиров 95
Омыляемая фракция липидов 92
Онкотическое давление 84, 224
Опсин 128, 129
pH-Оптимум действия ферментов 151
Организованные ферменты 148, 149
Органические вещества 6, 8, 11, 17, 216,
220, 317
— — кости 229
— — молока 556—565
— — мочи 521—525
— — плазмы крови 536, 537, 542
— кислоты 221, 223, 278, 422, 519
— фосфорные соединения 230—233, 293,
588
Органогены 216
Орнитин 25—27, 152, 157, 164, 361, 364—
366, 371, 379, 380, 386—390, 400,
416, 426—431, 481, 515, 591
L-Орнитин 365
Орнитуровая кислота 27, 377, 388, 515
Оротидин-5-фосфорная кислота 465
Оротовая кислота 464, 465
Ортодиоксибензол 189
Ортофосфаты 229
Ортофосфорная кислота 230—232, 395, 572
Осадители белков 540
Осаждение белков 41, 43, 44
Осахаривание крахмала 11, 294
Осмотическое давление 223—228, 434, 435,
547, 521, 530, 536
Оссеин 46
Остеомаляция 229, 230
Остеопороз 230
Отеки 218
Отложение жирных кислот 320
— жиров 319, 320, 344, 481
Отрицательный азотистый баланс 437, 444,
496, 497
Очистка белков 41
— ферментов 11, 156, 157
П
Пальмитальфосфатиды 99
Пальмитиновая кислота 93—95, 99, 100,
102, 320, 322, 339, 564
Пальмитолеиновая кислота 95
Пангамовая кислота 126, 127
Панкреатический диабет 197, 314
Панкреозимин 212
Пантотеновая кислота 120, 390, 444
Папаин 161, 162, 172, 550
Парааминобензойная кислота 121, 141
Парализаторы ферментов 154, 155
Параоксифенилпировиноградная кислота
410, 411, 413
Параоксифенилуксусная кислота 411
Параоксифенилэтаноламин 410
Паратгормон 189, 228, 229, 444
Парные (конъюгированные) соединения
375—377, 512—515
-----желчных кислот 378
— — индоксила 376
----- индола 376
— — кислоты бензойной 377
—------глюкуроновой 88, 513—515, 524,
525
— — — меркаптуровой 398
Парные соединения кислоты никотиновой
421
— — — серной 399, 513
— — — фенилуксусной 409
— — крезола 375
— — метилфенола 375
— — скатоксила 376
— — типа гликозидов 513, 514
— — фенола 375
Парэнтеральное белковое питание 443, 553
Пассивный иммунитет 539, 540, 566
Патока 80
Патологическая гипергликемия 288
— креатинурия 419
Патологические типы гемоглобина 547
— составные части мочи 525—528
Патологическое ожирение 481
Пектиновые вещества 74, 79, 84
Пеллагра 115, 117
— крыс 117
Пенициллин 143, 361
Пентаметилендиамин 370
Пентозаны 84, 85, 277, 526
Пентозный цикл превращения глюкозы
466
----- — углеводов 247, 310—312
Пентозофосфорные кислоты 57, 58, 61
Пентозурия 525, 526
Пентозы 67, 69, 74, 279, 449, 454, 455,
525, 526
— нуклеиновых кислот 56—59
Пепсин 31, 47, 148—151, 155, 158, 161,
162, 207, 209, 318, 347—353,
449, 539, 562, 585
Пепсиноген 161, 346, 348, 349
Пептидазы 161 —163, 165
Пептидные связи 8, 29—31, 33, 37, 38,
44, 349, 432, 338—442, 473, 515,
558
— — парных соединений 515
— цепи 35, 38, 39, 41, 42
Пептиды 31, 442
«Пептон» белка 349
Пептоны 31, 153, 349
Первичная моча 519, 521
— структура белков 33, 35, 37, 40
— — ферментов 180—182
Первичные ортофосфаты 229
— фосфаты 222
Пергидрофенантрен 99
Пергидрофенантренциклопентан 195, 201,
251, 252
Переаминирование 168, 275, 358, 366—
369, 377, 380, 383, 392—394, 423,
425, 427, 428, 430, 431, 444,
445, 584, 590
— аспарагина 366
— кислоты аспарагиновой 367
— — глутаминовой 250
— — цистеинсульфоновой 393
— метионина 394
— орнитина 388
— £-орнитина 365
— триптофана 402
— фенилаланина 408
Переваривание актина 349
— альбуминов 349
— белков 161, 345, 346, 348—355, 357,
374, 377, 446, 492, 497—499, 511,
512, 541
— глобулинов 349
— жиров 317—319, 343, 492, 515
619
Переваривание казеиногена 349, 350
—1 кератинов 349
— клетчатки 374
— коллагена 348, 349
— крахмала 278, 279
— лактозы 279
— миозина 349
— нуклеопротеидов 449
— пентозанов 279
— полипептидов 350, 351, 353
— полисахаридов 277—279, 281, 284
— триглицеридов 319
— углеводов 279, 492
— — сложных 277—279
— целлюлозы 278, 374
— эластина 348, 349
Перегликозидирование 172
Переживающие органы 243
Перекиси 57, 257
Перекисная теория окисления 257, 258
Перекись водорода 148, 175, 178, 262,
359, 360
Переметилирование 123, 394—396
Перепептидация 438
Пернициозная анемия 123
Пероксидазы 49, 51, 52, 155, 175, 178,
181, 257
Пигменты 257, 258
— мочи 519—521
Пиколиновая кислота 421
Пикринат лизина 26
Пирамин 111
Пиран 69
Пиранозы 69, 70, 76
Пиридин 252, 395, 396
Пиридин-З-сульфокислота 141
Пиридоксаль 118, 403, 444, 445
Пиридоксальфосфат 118, 168, 169, 363,
366, 367, 370, 381, 398, 403, 405,
445
Пиридоксальфосфорная кислота 367
Пиридоксамин 118, 367
Пиридоксаминфосфат 118
Пиридоксин 117—119, 141
Пиримидин 55, ПО, 111, 253, 464
Пиримидиновые основания 55—58, 61, 62,
74, ПО, 111, 253, 464
Пиритамин 141
Пировиноградная кислота 111, 112, 168,
169, 251, 259, 260, 291, 297,
299, 303—308, 362, 363, 367—
369, 375, 380, 381, 389, 393, 397,
404, 405, 481, 482, 542, 544, 571,
587, 589, 590, 593
Пирогаллол 177
Пирокатехины 125, 177, 189
Пирофосфат 230, 337
— кислоты мевалоновой 340, 341
— — р-окси-р-метилглутаровой
— кофермента А 269
Пирофосфатная связь 169
Пирофосфорилаза 468
Пирофосфорная кислота 114,
232, 395, 440, 465,
340
116, 230—
468, 478,
479, 513
Пирофосфоролиз 468
— динуклеотидов 468
Пиррол 21, 49, 50, 123, 253, 545, 546, 548
Пирролидин 123
Пирролидинкарбоновая кислота 28, 364,
386
Пирролин 123
Питательная функция крови 530, 536
Питуитрин 212
Пищеварительные ферменты 148, 149
Пищевые рационы 492, 494, 495, 497, 498,
502—504
Плазма крови 529, 531, 534, 536, 538—
542, 550—552 , 554
Плазменный компонент тромбопластина
551, 552
Плазминоген 553
Пластеины 153, 438
Плодовый сахар 72
Пограничные декстрины 159, 303
Подагра 451, 452, 541
Подвижные метильные группы 394—396,
466, 512
Полиазы 158, 159
Полиаминокислоты 31
Полиамины 371, 373
Полиглицин 31
Полиглутаминовая кислота 31
Полимераза ДНК 468
— РНК 469, 473
Полиневрит ПО—112, 141
Полинуклеотиды 59, 60, 160, 473
Полипептидные цепи 33, 35, 36, 38,
438
Полипептиды 30—36, 39, 42, 44, 211 —
213, 345, 349—354, 438—442,
485, 541, 556, 558, 586
Полисахариды 66, 70—72, 79, 82—85,
87, 88, 158, 249
— бактерий 87
Полисахариды вишневого клея 85
— групп крови 87
Полиуридиновая кислота 473
Полиурия 520, 521
Полифенилаланин 473
Полифенолоксидаза 177
Полифенолы 124, 177
Полифосфорные кислоты 230
Полифруктозиды 72, 83
Полноценные белки 437, 444, 497
Половые гормоны 189, 194, 200, 202, 339,
344, 445
Положительный азотистый баланс 437, 443,
499
Полуальдегид кислоты глутаминовой 364,
365, 386, 388
— — метилмалоновой 382
— — оксиглутаминовой 364
— — янтарной 591
Порог проницаемости почек 313, 314
Порфин 49
Порфиринурия 520
Пороирины 123, 378, 520, 545
Порфобилиноген 545, 546
Потенциальная кислотность мочи 520,
525
— щелочность мочи 520
Потребление воды 219, 220
Почечная глюкозурия 316
Правило изодинамии (Рубнера) 495, 497
Превращения аденина 463
— адреналина 192, 193
— аланина 380, 381
— аминов 373, 374,
— аминокислот 108, 118, 212—214,345,
356—358, 361, 366, 368, 369,
377, 378, 380, 381, 413, 423, 427,
428, 430, 431, 438, 444, 445, 476,
482, 493
620
Превращения аминокислот серусодержащих
445
— — в углеводы 481, 482
— аммиака 356, 423
— аргинина 388
— ацетил-SKoA 481
— ацетоацетил-SKoA 308
— белков 242, 438, 443, 444, 447, 476,
482, 484, 486
— валина 381, 382
— веществ 5—12
— — азотистых 444, 518, 590
— — органических 268, 270, 589
— галактозы 282—284
— гексоз 282
— гема 520
— гистидина 401, 402, 445
— гликогена 191, 510, 584
— глицерина 321
— глицина 378—381, 445, 452
— глюкозы 281—284, 291, 304, 466
— жиров 327, 333, 344, 476, 479, 480,
482, 511, 592
— — в углеводы 291, 479, 480
— изолейцина 381, 385
— казеиногена 349, 350
— каротина 511
— 5-карбоксамида 456, 457
— а-кетокислот 423
— кислот жирных 321—324, 327, 390,
479, 511
— — — активированных 327
— — — в углеводы 477
— — — (о-фенилзамещенных 323
— — нуклеиновых 449
— — органических 422, 423
— кислоты аденозинтрифосфорной 230
— — 7-аминомасляной 590, 591
— — ацетоуксусной 511
— — бензойной 322
— — глутаминовой 590, 591
— — глюкозо-1-фосфорной 304
— — изолимонной 275
— — никотиновой 421
— — олеиновой 330
— — пировиноградной 303, 306, 312, 393,
589
— — пропиновой 383
— — уксусной 272
— — фенилуксусной 322
— — цистеинсульфоновой 393
— лейцина 339, 381, 383, 384
— лизина 387
— липидов 317
— люциферина 598
— метионина 393, 394, 396, 397, 399
— 5-окситриптамина 405, 406
— орнитина 388
— пентоз 378
— производных пиримидина 453, 454,
— — пурина 449, 451
— пролина 364
— серина 379—381, 445
— тирозина 108, 358, 359, 376, 377, 408—
413, 445
— треонина 381
— триглицеридов 592
— триптофана 402—408, 445
— углеводов 280, 284, 287, 291, 312, 313,
362, 368, 380, 390, 476, 477, 482,
577 589 594
-----в жиры’251, 287, 291,330, 477, 479, 482
Превращения фенилаланина 108, 144, 190,
191, 358, 359, 376, 377, 408—
412
— фосфатидов 335
— фруктозы 281
— холестерина 511
— цистеина 362, 363, 392
— цистина 392
Прегнандиол 205
Прессорное действие адреналина 190, 191
— — норадреналина 192
Преципитат 44
Природные аминокислоты 19, 359
Проакцелерин 551
Проба Адамкевича 44
— на брожение 526
— Квика (на детоксицирующую функ-
цию печени) 377, 516
— Миллона 44
— Селиванова (на фруктозу) 526
— Шардингера 564
Провитамин D 133, 134
— D2 134
— D3 100, 134, 339
Провитамины А 130—132, 134, 509, 511
Прогестерон 204—206
Прогоркание жиров 95
Производные адреналина 593
— изоаллоксазина 113, 114
— кофермента А 268, 269, 271, 272
— 2-метил-1,4-нафтохинона 139, 140
— оксифлавона 90
— пиримидина 55, 62, ПО, 111, 449, 454,
455, 464—466, 487
— пиррола 49
— пурина 55, 62, 378, 433, 449—456, 461 —
466, 487, 523
— тиазола 110, 111
— тирозина 186
— углеводов 88—90
— фенантрена 89
— флавона 90
— холестерина 342
— циклопентанпергидрофенантрена 99,
100
Проколлаген 46, 386
Проконвертин 551
Пролактин 206, 209
Проламины 45, 46
Пролан А 209
— В 209
Пролидаза 163
Пролин 19, 27—29, 36, 46, 163, 211, 212,
361, 364, 385, 386, 388, 390, 474,
496, 563, 569
D-Пролин 360
L-Пролин 28, 211, 364
Пролиназа 162, 163
Пропердин 539
Пропиламин 371
Пропионил-SKoA 382, 385
Пропионовая кислота 278, 323, 324, 383
Простетические группы гликопротеидов 48
— — нуклеопротеидов 53
— — сложных белков 47, 48
— — ферментов 182
— — хромопротеидов 48
Пространственная структура белков 33—
37
— — гемоглобина 37
— — миоглобина 37
Простые белки 19, 29, 45, 46, 150
621
Протаминаза 351
Протамины 26, 28, 45, 46, 53, 161, 349
Протеазы 161, 525
Протеиназы 158, 161 —163, 165
Протеиногенные амины 369—374, 413
Протеиноиды 45, 46
Протеинурия 526, 527
Протеины 7, 17, 29
Протеолиз 485
Протеолипиды 584
Протеолитические ферменты 19, 48, 150,
161 — 165, 189, 213, 345, 348,
353, 355, 422, 442, 446,485,499,
539 , 550, 553
Протоплазматические жиры 92, 93
Протопорфирин 49, 50, 52, 378, 545, 546,
548
__ JX 123
Протромбин 138—140, 512, 516, 540, 549—
552
Профермент липазы 318
Проферменты 155
Прямая калориметрия 490, 491
Псевдоионон 131
Птеридин 121
Птериды 121
Птерины 121, 122
Птероилгептаглутаминовая кислота 122
Птероилглутаминовая кислота 121, 122
Птероиновая кислота 122
Пурин 55, 253, 464
Пуриновые основания 55—57, 61, 62, 462
Пуринсодержащие вещества 433, 487
— мононуклеотиды 462
Путресцин 370—373, 400
Пчелиный воск 101, 102
Р
Разделение белков 40, 41
— ферментов 11, 148
Рамноза 89, 90
/.-Рамноза 72
а- L-Рамноза 72
Раневые гормоны 214, 215
Распад (расщепление) аденозина 167
— аллантоина 450, 453
— амигдалина 89
— аминов 373, 377
— аминокислот 221, 271, 332, 356—358,
373, 374, 413, 422, 423, 444,
481, 482, 511, 581, 589
— — серусодержащих 399, 400
— — циклических 423
— аргинина 374
— ацетоацетила 308
— ацетилхолина 593, 594
— ацетил-SKoA 308, 574
— белков 12, 22—31, 245, 271, 345, 349,
351—358, 368, 379, 388, 399, 422,
423, 437, 442, 444, 445, 476, 477,
484, 485, 498, 499, 525, 556, 558
— — пищи 484, 490, 491, 494
— гема 520
— гемоглобина 541, 543, 547, 548
— гистидина 374, 401
— гликогена 154, 191, 192, 199, 281, 284,
287—294, 303, 305, 313, 315, 321,
482, 486, 507, 509—511, 530, 572,
573 , 576—582, 589
— глицерина 221, 271, 321
Распад глюкозы 10, 75, 242, 278, 291,
292, 294, 298—303, 321,560, 581,
590
— гормонов щитовидной железы 187
— декстринов 277, 303
— ди нуклеотидов 468
— дисахаридов. 279
— жиров 9, 93, 221, 245, 271, 317, 320,
321, 347, 476—480, 589
— — пищи 490, 491
— изолейцина 385, 482
— индола 407
— инулина 279
— кефалинов 335
— кислот дезоксирибонуклеиновых 468
-----жирных 271, 321, 323, 325, 326,
330, 447, 480, 507, 511, 581
— — — ненасыщенных 330
— — нуклеиновых 433, 449, 453, 487, 523
— — органических 423
— — рибонуклеиновых 469, 471
— кислоты аденозинтрифосфорной 575—
580, 582
— — аргининфосфорной 575, 576
-----ацетоуксусной 326, 329, 332, 333,
511, 574
— — гексозофосфорной 509
— — креатинфосфорной 418 , 575— 580,
582
— — молочной 306, 450—453, 574
— — мочевой 450—453
— — пропионовой 383
— — рацемической винной 149, 151
— — уксусной 272, 274, 308
----- уроканиновой 401
— — фруктозо-6-фосфорной 172
— крахмала 77, 147, 148, 277, 294
— лактозы 279
— лейцина 383, 482
— лейцитинов 335, 487
— лизина 374
— липидов 317
— мальтозы 279, 294
— метилгликозидов 151
— мочевины 245, 409, 520
— нуклеозидов 167, 449
— нуклеопротеидов 449
— нуклеотидов 433
— оксипролина 482
— органических веществ 9, 10, 12, 149,
579
— пептидных связей 443
— пиримидинового ядра 390, 454
— полипептидов 351, 353
— полисахаридов 294
— пролина 386
— сахарозы 279
— тимина 454
— тирозина 108, 374, 375, 410, 411, 482
— триптофана 374—376, 405, 407
— углеводов 9, 71, 75, 183, 221,228,231,
245, 247, 250, 271, 277, 279,
280, 292—294, 303, 308, 309, 312,
330, 332, 362, 368, 476, 477, 482,
510, 518,572, 574, 576, 584, 589,
590
-----пищи 490, 491
— — сложных 277—279
— урацила 454
— фенилаланина 108, 410, 411, 482
— фибрина 553
— фосфатидов 335, 336, 338, 487
622
Распад холестерина 342
— целлюлозы 82, 278, 279, 374
— цистатионина 398
— цистеина 374, 392
Растворение белков 41, 43
Растворимые РНК 469, 473, 474
Растворимый крахмал 80
Растительные жиры 93—95, 330
Раффиноза 70, 72, 79
Рахит 104, 133—135, 227, 229
Рацемаза 361, 380
Рацемирование аминокислот 18, 361
Рацемическая винная кислота 149, 151
Реактивный центр белковой молекулы 39
Реакции на аминокислоты 20, 21
Реакция Ван-Сляйка 20
— Гардена-Йонга 293, 300
— Пастера 312, 313
— преципитации 44, 45, 538
— Серенсена 20
— Стикленда 361
Регуляторная функция крови 530
Редуцирующие углеводы 525, 526
Резервные полисахариды 79
Ренальная глюкозурия 316, 526
Ренин 212, 349
Ретенция азота 201
Ретинен 128, 129
Рибитол 113
Рибоза 55—58, 449, 455, 463, 466, 468,
487, 584
D-Рибоза 56, 57, 74
p-D-Рибоза 57
Рибозокиназа 170
Рибозону к леоз и ддифосфаты 469
Рибозонуклеозидтрифосфаты 469, 473
Рибозофосфорная кислота 116, 457, 461,
462
Рибозо-1-фосфорная кислота 167, 467
Р-Рибозо-1-фосфорная кислота 75
Рибозо-З-фосфорная кислота 58
Рибозо-5-фосфорная кислота 58, 310, 311,
457, 466
Р-Рибозо-5-фосфорная кислота 75
Рибонуклеаза 34, 35, 39, 160, 181, 471
Рибонуклеиновые кислоты (РНК) 57, 59,
60, 62, 63, 244, 311, 441, 449,
464, 469—475, 585, 588, 592
— посредники 469, 473, 474
Рибонуклеозиды 57
Рибонуклеопротеиды 471, 473
Рибонуклеотиды 463, 473
Риботид 457
Рибофлавин 112—115, 117
Рибофлавинфосфорная кислота 113
Рибоцитидин 453
Рибулозо-1,5-дифосфорная кислота 247—
249
Рибулозо-5-фосфорная кислота 248, 309—
311
Родопсин 128, 129
Ростовые вещества микроорганизмов 106
Рутин 125
С
Сапонины 89, 544
Саркозин 365, 379, 396, 421
Сахара 66, 550
Сахараза 77, 148, 149, 159, 294
— дрожжей 151
— кишечного сока 277, 279
Сахарная болезнь 196, 197, 290, 314, 315
— кислота 87
— кривая 516
Сахарный диабет 196—200, 314—316, 324,
332, 481,482 . 520, 521, 526, 527
— порог почек 526
— укол 289
Сахароза 70, 72, 73, 76, 77, 172, 250, 277,
279, 290, 294, 314, 589
Сбраживание глюкозы 292—295, 298—302
— сахарозы 293
— углеводов 279, 557, 560
Свекловичный сахар 76
Свинцовое мыло 95
Свинцовый пластырь 95
Свертывание крови 86, 138, 139, 213, 512,
537, 540, 549—553
— молока 562, 563
Свободная вода 218—220
Связывание кислорода 533—535
— углекислого газа 535, 536
— угольной кислоты 535
Сгорание белков 493
— глюкозы 493
— жиров 493
— углеводов 493
Секретин 212, 352
Сенецеил-SKoA 384
Сенецеиловая кислота 340
Сера 18, 23, ПО, 216, 235, 392, 399, 493,
494
Серин 19, 22, 24, 35, 47, 48, 97, 171, 181,
333, 338, 361, 363, 378—381,
396, 397, 398, 413, 466, 474, 481,
496, 562, 563, 569, 594
L-серин 22
Серингидратаза 363
Серинфосфатиды 334, 381
Серинфосфорная кислота 48, 231
Серная кислота 48, 85, 86, 204, 235, 270,
375, 376, 392, 393, 399, 417,
493, 502, 512, 513, 519,522,523,
552
Сернистая кислота 393
Сернокислый аммоний 40, 43, 45
Серотонин 213, 214, 405—407, 595
Серповидный гемоглобин (HbS) 547
Серусодержащие аминокислоты 23, 235,
380, 381, 392, 397, 399, 400
Сиаловые кислоты 587
Симпатины 193, 412, 593—595
Симпатии Е 594
— J 594
Синерезис 218, 570
— белков 43
Синигрин 161
Синильная кислота 89, 155, 264, 360, 534
Синтез (биосинтез) аденилатов аминокис-
лот 440, 441, 444
— адреналина 190, 191, 357
— аланина 380
— амидов 424, 425, 430, 431
— аминокислот 251, 275, 356, 368, 381,
385, 390, 431, 436, 445, 447,
473, 476, 482, 484
— — L-ряда 152
— — серусодержащих 381
— — из углеводов 482
— а-аминокислот 250, 251
— ансерина 357, 422
— апоферритина 236
— аргинина 388, 428
623
Синтез аспарагина 390, 391, 424, 430, 431
— ацетилхолина 593, 594
— ацилфосфатов аминокислот 439
— белков 7, 8, 12, 40, 53, 62, 124, 182,
206, 220, 268, 269, 345, 355—
358, 361, 366, 388, 436—445,
447, 469—475, 484—486, 499,
507, 511, 558, 592
— — молока 556, 558, 560
— — плазмы крови 444
— — специфических 471—473
— гема 508, 545, 546
— гемоглобина 12, 236, 508
— гипоксантина 423, 456, 457
— гистидина 400, 401
— гликогена 154, 166, 199, 251, 268, 282,
284—288, 290, 291, 305, 306,
312—315, 321, 381, 382, 482, 486,
507, 509—511, 516, 579, 580, 589
— — из аминокислот 481, 482
— глицерина 477, 478
— глицина 378—380
— глутамина 390, 391, 424, 425, 430,
431, 439, 440, 512, 590
— глутатиона 378, 422, 439, 440
— глюкагона 357
— глюкозамина 392
— глюкозы 315
— — из аминокислот 481, 482
— — из жирных кислот 480
— D-глюкозы 152
— гормонов 185, 357, 441
— — гипофиза 357
— — щитовидной железы 187
— дезоксирибозы 466
— дезоксирибонуклеотидов 463
— дийодтирозина 187
— динуклеотидов 467, 468
— — фосфорилированных 454
— дисахаридов 250
— жиров 7, 269, 291, 319, 330, 476—482
— — из аминокислот 482
— — молока 557, 560, 561
— — из углеводов 251, 287, 291, 330,
477—479, 482
— инсулина 198, 357
— карнозина 357, 422
— а-кетокислот 250, 251, 368, 390
— кефалинов 334
— кислот дезоксирибонуклеиновых 468—
470, 475
— кислот жирных 308, 330, 331, 339,
381, 477, 478, 560
— — — ненасыщенных 330, 332
— — нуклеиновых 441, 449, 454, 455,
463, 464, 487
— — рибонуклеиновых 469, 473, 475
— — — информационных 473
— кислоты аденозинтрифосфорной 265,
267, 573, 579
— — аскорбиновой 73, 109, 389
— — ацетоуксусной 308, 324, 330, 384
— — гиппуровой 377, 378, 439, 440, 516
— — глутаминовой 362, 389, 390
— — L-глутаминовой 362
— — глюкуроновой 513
— — гуанидинуксусной 571
— — гуаниловой 392
— — дистеарилфосфатидной 337
— — а-кетоглутаровой 251, 362
— — креатинфосфорной 418, 575, 579
— — мочевой 424, 425, 432—434
Синтез кислоты оротовой 465
— — пировиноградной 251, 368
— — фолиевой 456
— — щавелевоуксусной 251, 368
— коллагенов 445
— кортизона 207
— крахмала 166, 249, 250
— креатина 12, 357, 378, 414—416,
571
— лактозы 283, 284, 556, 558, 560—561
— лецитинов 334, 487
— липидов 220, 317
— мононуклеотидов 466, 467
— — фосфорилированных 454, 466
— мочевины 6, 251, 369, 423—431, 508,
512, 523
— никотинамидадениндинуклеотида 468
— нуклеозидов 467
— нуклеотидов 463
— окситоцина 211
— олигосахаридов 249
— орнитина 388
— парных соединений глюкуроновой кис-
лоты 514, 515
— пептидных связей 438—444, 442
— подвижных метильных групп 396
— полипептидов 30, 31, 441, 442, 473,
474, 485
— полисахаридов 172, 249, 350
— производных пиримидина 123, 252, 253,
455, 464, 465
— — пиррола 252, 253
— — пурина 12, 123, 252, 253, 378, 391,
392, 452, 455—457, 460—464, 487,
523
— протопорфирина 381, 545
— рибозы 466
— рибонуклеотидов 463
— сахарозы 249, 250
— серина 381, 396
— серинфосфатидов 334
— соединений азотистых 356, 357, 368,
369, 389—391, 431, 447
— — гетероциклических 252
— — йодсодержащих 186
— — органических 6, 7, 9—12, 220,
233, 244, 245, 249, 250, 251,
253
— — циклических 251, 252
— спермидина 371, 373, 396
— спермина 371, 373, 396
— тестостерона 201, 202
— тирозина 408
— тироксина 185, 187, 188, 357
— триглицеридов 319, 320
— трийодтиронина 186
— углеводов 7, 220, 251, 330, 333, 381,
476, 478—482
— — из аминокислот 481, 482
— — из жиров 479, 480
— уридиндифосфоглюкозы 559, 560
— урацила 464
— фосфатидов 333—338, 381, 487, 507,
511
— — глицеринсодержащих 336
— — инозитолсодержащих 334
— фосфолипидов 319
— фенилацетилглутамина 391
— ферментов 182
— фосфатидов 511
— холестерина 201, 251, 252, 308, 339—
342, 381, 481, 592
624
Синтез холина 333, 334 , 338, 344
— целлюлозы 172, 250
— цистеина 397
— цитохромов 236
— цитруллина 428, 429
— эфиров сложных 269, 270
— — холестерина 511
Синтетические полинуклеотиды 473, 474
— полипептиды 30, 31
— рибонуклеиновые кислоты 473, 474
Ситостерин 101
Скатоксил 376, 513
Скатоксилсерная кислота 376
Скатол 376, 525
Сквален 341
Скорбут 106, 109, 123
Сладость глюкозы 79
— инвертного сахара 79
— ксилозы 79
— лактозы 79
— мальтозы 79
— рамнозы 79
— сахарозы 79
— углеводов 67, 79
— фруктозы 79
Слизевая кислота 87
Слизи 71, 72, 74, 85
Сложные белки 46—48, 150
— углеводы 146
Собачья истерия 145
Соединения селена 395
Созревание сыра 563
Сок поджелудочной железы 265, 266, 318,
351—353
Сократительная функция мышц 567
Сократительный белок мышц 568, 579
Соланин 89
Соли брома 234
— йода 234
— калия 220, 227—229
— кальция 220, 227—229
— кислот желчных 96, 318, 343
— — минеральных 216, 220
— кислоты индоксилсерной 376
— — мочевой 450—452, 519, 528
— — ортофосфорной 229, 230
— — пирофосфорной 230
— — синильной 155, 264, 534
— — фосфорной 230, 233
— магния 228, 229
— натрия 220, 228, 229
— тяжелых металлов 154
Солод 77, 148, 294
Солодовый сахар 77
Соляная кислота 212, 233, 234, 346—350,
522, 572
Сорбит 73, 87
Сорбоза 172
Л-Сорбоза 73
Составные части молока 555—566
— — мышц 568—573
Спермацет 101, 102
Спермидин 371—373, 396, 397
Спермин 371, 373, 395, 397
Специфико-динамическое действие ами-
нокислот 492
— — белков 492, 500
— — пищевых веществ 492
Специфические белки 472, 474
— полисахариды 87
— реакции на углеводы 526
Специфичность белков 44, 45
Специфичность действия ферментов 149,
151—153, 157, 181, 183
а-Спирали полипептидов 36
Спиртовое брожение 10, 148, 149, 242,
243, 258, 260, 262, 292—303,
476, 477
— — лактозы 564
Спонгин 161
Статическая биохимия 5
Стахидрин 421
Створаживание молока 161, 349, 350
Стеариновая кислота 93—95, 100, 322,
325, 330, 337, 564, 587
Стеародипальмитид 94
Стеаральфосфатиды 99
Стереоизомеры гексоз 68
— моносахаридов 67, 69
— пентоз 74
Стереохимическая специфичность действия
ферментов 151
Стериды 91, 99, 508
Стерины 91, 99, 100, 339, 586, 592
Стеркобилин 549
Стеркобилиноген 548, 549
Стероидные гормоны 100, 195, 196, 342,
525, 539
Стероиды 194, 196
Стигмастерин 101
Стильбэстрол 204
Стойкие эмульсии жиров 96
Страндин 586, 587
Стрептидин 143
Стрептобиозамин 143
Стрептоза 143
Стрептокиназа 553
Стрептомицин 143
Стронциевый рахит 237
Стронций 237
Строфантин 89
Структурные полисахариды 79, 82
Студни 84, 85
Сукциндегидрогеназа 144, 153, 258, 274
Сукцинил-SKoA 545
Сульфаниламиды 141, 200
Ах-Сульфанил-Мг-^-бутилкарбамид 200,
316
Сульфатазы 160, 161
Сульфатиазол 456
Сульфатиды 586, 588
Сульоаты 399, 400, 523, 543
Сульфгидрильная группа 24, 32, 392, 422
Сульфидная сера 234, 235
Сульфоксимин метионина 144
p-Сульфопировиноградная кислота 392,.
393
Супрастерин I 134
Супрастерин II 134
Сфингозин 96, 98, 102, 586, 587
Сфингомиэлины 96, 98, 542, 586, 587
Сыворотка крови 213, 537, 538, 54 L 543„
553
— молока 562—564
Сывороточные альбумины 42, 45, 516, 526,
527, 537—539, 552
— белки 516
— глобулины 42, 516, 537—539, 551, 552
Сычужный фермент 161
Т
Тартроновая кислота 98
Таурин 235, 342, 343, 371, 392, 393, 413,
586
625
Тауродезоксихолевая кислота 343
Тауролитохолевая кислота 343
Таурохолевая кислота 343, 371
Тауроциаминфосфорная кислота 418, 419
Тах истер ин 134
Темновая реакция фотосинтеза 246, 249
Темные пигменты 405, 409, 413
Температурный оптимум действия фер-
ментов 150
Теобромин 523
Теория образования мочевины по циклу
Кребса 427, 428
— 3-окисления жирных кислот 321
Тестостерон 200—202
Тетрайодтирон 186
Тетраметафосфорные кислоты 230
1,3,5,8-Тетраметил-2,4-дивинил-6,7-дипро-
пионовокислый порфин 50
Тетраметилендиамин 370
Тетрануклеотиды 469
Тетрапептиды 30
Тетрасахариды 86
Тетрозы 64, 75
Тиазол НО, 111
Тиамин 106, 110—112, 117, 141, 399, 444,
589
Тиаминаза 111
Тиаминпирофосфат 111, 273, 397
Тиглил-SKoA 385
Тимидиловая кислота 466
Тимин 55—57, 61—63, 453, 454, 464, 466,
471, 473, 585
Тиминдезоксирибозотрифосфаты 468
Тимонуклеиновая кислота 55
Тиокарбонамидная группа 188
Тиоловая группа 392, 393
Тиомочевина 188
у-Тионаза 363
Тиоурацил 188
Тиофен 119
Тиофераза 171
Тио хром ПО
Тиохромная реакция НО
Тирамин 370, 410
Тиреоглобулин 185, 187
Тиреотоксикоз 188
Тиреотропный гормон 187, 206, 207, 290
Тирозин 19, 27, 28, 44, 48, 186, 190, 191,
211, 212, 234, 353, 371, 374—
376, 408—413, 474, 482, 496, 541,
550, 563, 569
А-Тирозин 27, 211
Тирозиназа 177, 236
Тироксин 27, 185—188, 205, 208, 217,
234, 263, 267, 268, 290, 411 —
413, 445
р-2-Тиэнилаланин 144, 145
Тканевая специфичность белков 44
Тканевые гормоны 212, 213
— липазы 321
Токоферолы 136—138
а-Токоферолы 136, 137
^-Токоферолы 136, 137
7-Токоферолы 136, 137
Токсистерин 134
Травматиновая кислота 215
Трансальдолаза 310
Трансгликозидазы 172, 286, 287. 303
Трансгликозидирование 172
Трансгликозилаза 172, 287, 509, 589
Транскетолаза 310, 311
Транспептидазы 441, 442
Транспептидация 442, 558
Транспептидирование 172
Транспортные РНК 174, 469, 473
Трансферазы 167
Трансформации бактерий 471
Транс-формы ненасыщенных жирных кис-
лот 94
Трегалоза 76, 77, 78
Треонин 19, 22, 23, 47, 48, 363, 381, 474,
496, 497, 563, 569, 586
£-Треонин 22
Треонингидратаза 363
Треонинфосфорная кислота 48
L-Треоновая кислота 108
Третичная структура белков 36, 40
— — ферментов 181, 182
Третичные фосфаты 222
Третья форма спиртового брожения 302
n-Триаконтановый спирт 102
Триглицериды 93—95, 317—320, 564, 587
Тригонеллин 421
Трийодтирамин 187
Трийодтиронин 185—187, 234, 411—413,
445
Трийодтируксусная кислота 187
Трикарбоновые кислоты 221, 271,—276,
308, 329, 362, 367, 368, 383,
389, 431, 481, 482, 574, 581,
590
Триметафосфорные кислоты 230
Триметиламин 434
Тиметилбетаин гистидина 402
Триметилгидрохинон 137
Триметилгуанидин 417
1,3,7-Триметилксантин 523
Тринуклеотиды 469
Триозофосфорные кислоты 231, 295, 305
Триозы 67, 68
Триолеид 84
Триоксипурин 252
2,6,8-Триоксипурин 432
Трипельфосфат 528
Трипептиды 30, 422, 442
Триплетный код РНК 474
Трипсин 31, 148,-151, 155, 158, 161,
162, 181, 197, 198, 206, 209,
351—353, 449, 539, 585
Трипсиноген 162, 351, 352
Триптамин 375, 404
Триптофан 19, 27, 28, 33, 44, 115, 117,
213, 214, 252, 371, 374, 375, 380,
402—407, 474, 482, 496, 497, 524,
541, 563, 569
А-Триптофан 28
Трисахариды 72, 79, 89
Тристеарид 94
Трифосфопиридиннуклеотид 116
Трифосфорная кислота 230, 231
Трихлорамин 399
Трихлорэтанол 512
Тромбин 540, 459—553
Тромбозы 86, 550, 552, 553
Тромбокиназа 86
Тромбопластин 550—552
Тромбопропин 551, 552
Тромбоцитарный фактор 551, 552
Тропомиозин 570, 573
Тростниковый сахар 76
Тяжелые металлы 106, 155, 230, 235
626
Убихинон 261, 262
Угарный газ 50, 51, 534
Углеводная функция печени 516
Углеводное голодание 290, 327, 419, 420
Углеводы 6, 8, 9, 66, 67, 76, 90, 91, 216,
249, 276, 277, 291, 317, 380,
381, 436, 476—482, 493, 510,
518, 526, 540, 556, 560, 577,
578, 589, 590
— молока 556, 558, 564, 565
— пищи 80, 489, 494, 495, 497, 498, 500—
502
Углекислый аммоний 426
— газ 9, 10, 93, 119, 173, 220, 222, 242,
245—249, 251, 253, 254, 259, 262,
263, 272, 274, 275, 291—298, 300—
308, 311, 312, 320, 331, 357, 358,
396, 409, 422, 423, 426, 427, 432,
453, 456, 476, 487, 492, 493, 510,
511, 530, 531, 535, 536, 574,
576, 577, 579 , 590, 591
— кальций 216
Углерод 18, 67, 69, 70, 74, 75, 94, 100,
216, 252, 490, 493, 494
Углеродсодержащие вещества 6
Угольная ангидраза 173
— кислота 270, 426, 430, 531, 532, 535,
536
Уксусная кислота 48, 66, 85, 86, 126,
157, 174, 179, 201, 221, 251,
252, 271, 272, 274, 278, 284, 291,
302, 307, 308, 322—326, 330, 339,
374, 378, 384, 415, 477, 478, 557,
560, 593, 594
Уксусный альдегид 258—260, 297—299,
301, 302, 381, 466, 564
Ультрамикроэлементы 8, 9, 216
Ундекановая кислота 323
Упорядоченность действия ферментов 183
Ураты 451—452, 519
Урацил 55—57, 453, 454, 464, 473, 584, 585
Урацилрибозодифосфат 469
Уреаза 11, 63, 149, 151, 152, 158, 163,
432, 453
Р-Уреидизомасляная кислота 454
p-Уреидпропионовая кислота 454
Уремия 541
Уреотелические животные 426, 430, 432—
436, 438, 455, 494
Уридин 283, 454
Уридиндифосфогалактоза (УДФ-галакто-
за) 283, 559, 560
Уридиндифосфогексоза 172
Уридиндифосфоглюкоза (УДФ-глюкоза)
250, 282, 283, 286, 509, 514,
515, 559, 560, 589
кислота 514
(УДФ) 65,
Уридиндифосфоглюкуроновая кислота 515
Уридиндифосфоглюконовая
Уридиндифосфорная кислота
171, 250, 286, 560
Уридиновая кислота 64, 65, 74, 465—
467, 473
Уридинрибоза 514
Уридинтрифосфат 171, 172
Уридинтрифосфорная кислота (УТФ) 65,
250, 286, 509, 514, 558—560
Уриколиз 450, 452, 453
Уриколитические ферменты 157
Урикооксидаза 453
Урикотелические животные 432—436, 438,
452
Уробактерии 163, 245, 432, 520
Уробилин 520, 548, 549
Уробилиноген 520, 527, 528, 548, 549
Уроканаза 401
Уроканиновая кислота 363, 401, 402
Уроновые кислоты 84
Уропорфирин 520
Уропорфирин III 123
УрохрОхМ 520
Уроэритрин 519, 520
Устранение аммиака 368, 390, 423—425,
427, 430, 431, 434, 435
— аммония 424, 425, 427, 430, 590
— протеиногенных аминов 373
Утомление мышц 576—579, 580
Ф
Фактор просветления 319
Факторы роста 91, 119
Факторы роста микроорганизмов 120—122
Факультативные анаэробы 301
— аэробы 361
Фарнезин 341
Фенамин 595
Фенантрен 89, 99
Фенантренциклопентан 342
Фенацетуровая кислота 413, 515
Фенилаланин 19, 27, 33, 35, 144, 145, 190,
211, 212, 252, 353, 357, 361, 370,
371, 376, 377, 408—413, 473, 474,
482, 496, 497, 541, 563, 569
L-Фенилаланин 27
Фениламиноуксусная кислота 358, 359
Фенилацетилглутамин 391, 409, 413, 515
Фенилацетуровая кислота 409
(o-Фенилвалерьяновая кислота 322
Фенилгидантоин аминокислоты 38, 39
Фенилглиоксилевая кислота 358
Фенилглюкуроновая кислота 375
<о-Фенилзамещенные жирные кислоты 321 —
323
Фенилизотиоцианат 38
Фенилкетонурия 408, 412, 413
(о-Фенилмасляная кислота 322
Фенилмолочная кислота 408, 409
Фенилпировиноградная кислота 376, 408,
409, 413
ш-Фенилпропионовая кислота 322
Фенилсерная кислота 375
Фенилуксусная кислота 322, 376, 377, 391,
408, 409, 413
Фенилэтиламин 370
Фенолсерные кислоты 399, 524
Фенолы 177, 375, 376, 513, 524, 525
Феразы 171, 172
Ферментативное действие солода 148
Ферментативные синтезы 151, 152
Ферментативный гидролиз 154
— — белков 18
Ферментология 149, 157
Ферменты 11, 13, 41, 144—158, 180—184,
216, 244, 508, 525, 561, 564, 573
— бактерий 82, 86, 370, 373, 375, 377, 587
— — целлюлозорасщепляющих 277, 278
— гликолиза 298, 300, 312, 313
— дезаминирования аминокислот 359
— — L-аминокислот 362—365
— гликолиза 294
627
Ферменты дрожжей 294
— змеиного яда 98, 550
— плазмы крови 540
— сока желудочного 161, 347
— — кишечного 30, 162, 353
— — поджелудочной железы 162, 211,
212, 351—353
— фермента 351
Ферон 149
Ферритин 235, 236, 508, 509, 547, 548
Фибриллярные белки 41—43, 46
Фибрин 22, 37, 537, 540, 549—553
Фибриноген 512, 516, 537, 539, 540, 549—
552
— мономер 37
Фибринолиз 553
Фибринолизин 553
Фибринолизиноген 553
Фибриномономер 550
Фибринпептид 550—552
Фиброин 22, 42, 46
Физиологическая ценность аминокислот
496, 499
— — белков 494—496
— — жиров 494, 495
— — пищевых веществ 494, 495
— — углеводов 494, 495
Физиологические растворы 225, 226, 536
Физиологическое действие ионов 225
Физиология 5, 13
Физостигмин 594
Фикоцианин 549
Фикоэритрин 549
Фиксация атмосферного азота 238, 356,
357, 447
Фитин 91, 126
Фитогормоны 214, 215
Фитол 52, 136, 137, 139
Фитостерины 100, 101
Флавинадениндинуклеотид (ФАД) 113,
114, 176, 177, 179, 259, 260,
327, 360, 467
Флавинадениннуклеотид 53
Флавиновые ферменты 177, 260, 261, 327
Флавинсодержащие белки 359
Флавинфосфорная кислота 113, 359
Флавины 112, 444, 564
Флавоны 90. 124
Флавопротеиды 53, 359, 360, 364, 365
Флоретин 90
Флоридзин 89, 90, 316, 383, 526
Флороглюцин 90
Флуороз 234
Фолиевая кислота 121, 122, 141, 396, 445,
456
Фолиновая кислота 122
Фолликулин 203
Фолликулостимулирующий гормон (ФСР)
206, 208, 209
Формальдегид 396
Формамидглутаминовая кислота 401
4-Формамидоимидазол-5-карбоксамид 456
Формиглицин 379
Формилглицинамидриботид 458
Формиглутаминовая кислота 401
Формилкинуренин 403, 405
Формилтетрагидроптероилглутаминовая
кислота 122
Формил-//4-фолиевая кислота 456
Фосген 31
Фосфатаза глюкозофосфорной кислоты 509,
511
Фосфатаза кишечного сока 449
— остеобластов 229
Фосфатазы 160, 161, 228, 287, 288, 302,
305, 336, 449, 477, 510, 540
Фосфатидемия 333
Фосфатид ил инозиты 98
Фосфатидилсерины 96, 97, 586, 587
Фосоатидилхолины 96, 97, 586, 587
Фосфатидилэтаноламины 96, 97, 586, 587
Фосфатидные кислоты 98, 333, 336, 337,
487
Фосфатиды 91, 96, 98—100, 126, 231, 330,
333—335, 338, 344, 381, 486,
487, 508, 509,511, 539, 542, 551,
556, 557, 564, 572, 573, 586
— глицериды 96—99
— неглицериды 96, 98
— пищи 501
Фосфатный буфер 222
— — крови 531
Фосфоаденилат серной кислоты 270, 513
Фосфоаденозинтрифосфорная кислота 513
Фосфоаминокислоты 48
Фосфогалактоизомераза 282, 283
Фосфогликоизомераза 294
Фосфогликомутаза 47, 174, 179, 180, 285,
287, 299, 304, 509
Фосфоглицериды 586
Фосфоглицерин 296, 302, 477
2-Фосфоглицериновая кислота 173, 180,
296, 297, 299, 304, 305
З-Фосфоглицериновая кислота 180, 247—
249, 296, 297, 299, 304
Фосфоглицериновые кислоты 221, 247, 249,
250, 293
Фосфоглицериновый альдегид (фосфогли-
церинальдегид) 172, 173, 295,
296, 298, 300, 302, 304, 310,
311, 321, 477
Р(+)-Фосфоглицериновый альдегид 68
З-Фосфоглицериновый альдегид (З-Фос-
фоглицеринальдегид) 248, 249,
295, 466
Фосфоглицеромутаза 174, 180, 296
Фосфоглюкозокиназа 170, 559
6-Фосфоглюконолактон 309
Фосфодиоксиацетон 68, 172, 173, 295, 296,
302, 304, 477
Фосфоенолпировиноградная кислота 304,
305
Фосфокиназы 169—171, 340
Фосфокреатин 593
Фосфолипиды 91, 96, 319, 584, 586, 588,
592
Фосфомоноэстеразы 160
Фосфопиридоксамин 168, 169
Фосфопировиноградная кислота 173, 221,
247, 297, 593
Фосфопируватгидратаза 297
Фосфопротеиды 47, 48, 231, 562, 585, 588
Фосфор 8, 18, 135, 137, 216, 226—229,
233, 493, 494, 502—504, 544,
563, 565, 571, 572, 588
Фосфорибозиламин 457, 458
Фосфорибозилпирофосфорная кислота 457
5-Фосфорибозилпирофосфорная кислота
465
Фосфорилаза «а» 167, 191
— «б» 167, 191
— гликогена 166, 167, 191, 509, 511, 589
— крахмала 166, 167
— нуклеозидов 167, 467
628
Фосфорилаза РНК 469
— сахарозы 165
Фосфорилазы 47, 165, 166, 286, 287,
303, 313, 509, 511
Фосфорилирование 244, 265—268, 271, 285,
333, 445, 518, 544, 592
— аминокислот 439
— аргинина 26
— витаминов 444
— гексоз 268
— глицерина 321, 336, 338
— глюкозы 250, 268, 284, 285, 288, 291,
294, 304, 309, 315, 509, 559, 589
— дезоксирибозы 466
— жиров 319, 333
— кислоты адениловой 467
— — аденозиндифосфорной 64, 233, 249,
266—268, 285, 298—300, 305, 338,
441, 444, 518, 574, 576, 578, 599
— — гуаниловой 467
— — мевалоновой 340
— — р-окси-р-метилглутаровой 340
— — рибозофосфорной 457
----- уридиновой 467
— ,— фруктозо-6-фосфорной 281, 295
— '— цитидиновой 467
— креатина 170, 576
— моносахаридов 280
— нуклеозиддифосфатов 64, 65
— нуклеозидов 467
— рибозы 466
— рибофлавина 113
— тиамина 111
— фосфорилазы 167
— — «б» 191
— D-фруктозы 281
— холина 337, 338
Фосфорилированная глюкоза 71
— фруктоза 73
Фосфорилированные гексозы 268, 293
— гуанидиновые соединения 418, 419
— ди нуклеотиды 454
— енолы 231
— мононуклеотиды 65, 169, 454, 466
— нуклеотиды 232
— органические кислоты 231
— триозы 68
Фосфорилированный витамин Bi,307
Фосфорилхолин 588
Фосфорилэтаноламин 588
Фосфориты 503
Фосфорная кислота 47, 48, 55, 57—59,
98, 169, 170, 228, 230, 231, 265,
281, 287, 296, 299, 302, 304,
414, 418, 420, 430, 440, 449, 455,
457, 458, 462, 468, 469, 487,
488, 502, 522, 562, 563, 572,
574—578, 580
Фосфорнокислая аммиак-магнезия 528
Фосфорнокислый кальций 216, 218, 229,
528
Фосфорные соединения 572, 588, 589
— эфиры 231
Фосфоролиз 65, 165
— гликогена 165, 166, 231, 286, 303, 304,
509, 510, 589
— крахмала 165, 166
— нуклеозидов 165, 467
— полисахаридов 165
— сахарозы 165, 166
Фосфорсодержащие белки 22
Фосфорсерин 22
Фосфотриозы 68, 296
Фосфоферазные реакции 169, 170, 297,
300
Фосфоферазы 111, 166, 169—171, 228,
266, 268, 281, 282, 284, 297,
300, 313, 321, 336, 337, 446,
466, 509, 574—576
Фосфофруктокиназа 170, 295, 299
Фосоохолин 337, 487
Фосфоэфирная связь 170
Фотосенсибилизаторы 245
Фотосинтез 75, 152, 245—249
Фотохимические реакции 245, 246, 249
Фракционирование белков 41
Фракция сократительных белков мышц
568
Фруктоза 68, 72, 73, 77, 79, 83, 165, 172,
250, 279, 281, 282, 314, 510,
526
a-D-Фруктоза 73
fi-Фруктоза 76
D-Фруктоза 70, 72, 73, 281
D(—)-Фруктоза 68
Фруктозо-1,6-дифосфат 300
Фруктозодифосфатаза 160
Фруктозодифосфорная кислота 68, 305
Фруктозо-1,6-дифосфорная кислота 73, 172,
249, 295, 299, 304, 305
Фруктозокиназа (фруктокиназа) 170, 281
Фруктозо-6-фосфоизомераза 281
Фруктозо-1-фосфорная кислота 73
Фру ктозо-6-фосфорная кислота 73, 281,
282, 294, 295, 304, 305, 310,
311, 313, 572
Фруктозофосфорные кислоты 73, 173, 268
Фруктозурия 526
Фруктопираноза 77
Фруктофураноза 76, 77
D-Фруктофураноза 73
Фтор 8, 153, 226, 227, 233, 234, 525
Фторапатит 234
Фтористый магний 234
Фторкальциевая соль фосфорной кислоты
234
Фторорганические соединения 234
Фукоза 72
Фумараза 272, 274
Фумарилацетоуксусная кислота 411, 413
Фумаровая кислота 144, 173, 258, 259,
274, 275, 362, 367, 389, 411, 413,
427, 428, 430, 431, 459, 461, 462
Функциональная биохимия 5, 12, 13
Функциональное состояние печени 515,
516
Фуран 69
Фураноза 69 , 70 , 83
Фурфурол 526
X
Хиломикроны 319
Хилус 554
Химозин 161, 347, 349, 350, 562
Химическая теория передачи нервного им-
пульса 593—595
Химические медиаторы 193, 579, 593—
595
Химотрипсин 42, 161, 162, 172, 181,
197, 198, 206, 351, 353
Химотрипсиноген 162, 353
Хинолиновая кислота 403—405
629
Хиноновые соединения 177
Хиноны 137, 177
Хитин 79, 86
Хлор 218, 226, 227, 233, 235, 543, 544,
565
Хлорацетилаланин 30
Хлоралгидрат 512
Хлористый натрий 137, 220, 224, 225,
227, 228, 347, 515, 521, 522
Хлорокруорины 534
Хлорофилл 52, 137, 228, 245—248, 549
— «а» 52
— «в» 52
Хлорофиллы 123
Холевая кислота 318, 342, 343, 511
Холеиновые кислоты 318
Холестериды 99, 100
Холестенон 339
Холестерин 99—101, 194, 195, 204, 205,
252, 318, 339, 341—343, 481,
508, 509, 511, 515, 516, 539,
544 , 564 , 572, 586, 587, 592, 596
Холецистокинон 213
Холин 96—99, 126, 167, 333—335, 337,
337, 338, 344, 379, 381, 394—
397, 413, 421, 434, 487, 593, 594
Холинацетилаза 174
Холинацетилтрансфераза 593, 504
Холинацетилфераза 175
Холинсодержащие вещества 394
Холинфосфатиды 333, 335
Холинфосфорная кислота 336
Холинэргические нервы 593, 594
Холинэстераза 160, 181, 594
Хондрозамин 86
Хондрозин 86
Хондроитинсерная кислота 85, 86, 161,
229
Хондромукоиды 86
Хондросульфатаза 161
Хроматография белков 40, 41
— ферментов 156
Хромогены 257
Хромопротеиды 47—52, 534, 549
Ц
Цветные реакции на белки 43, 44, 432
Цезий 237
Целлобиаза 78, 278
Целлобиоза 76, 78, 82, 160, 278
Целлюлаза 78, 82, 159, 160, 278, 279
Целлюлоза 66, 70, 78—82, 84, 250, 277—
279
Цереброзиды 72, 91, 102, 103, 584, 586,
587
Цереброн 103
Цереброновая кислота 102, 103
Церебронсерная кислота 588
Цериловый спирт 102
Цетиловый спирт 102
Цианкобаламин 123, 124
Цианрезистентное дыхание 264
Цианиды 178, 264, 534
Цикл трикарбоновых кислот (цикл Креб-
са) 271—276, 308, 329, 362, 367,
368, 383, 389, 428, 430, 431,
481, 482, 574, 581, 590
Циклопентан 99
Циклопентанпергидрофенантрен 99
Циклизация сквалена 3*41
Циклические альдогексозы 70
— альдопентозы 74
аминокислоты 19, 27, 371, 423
— кетогексозы 70
Циклические изомеры моносахаридов 69,
70
— полифосфорные кислоты 230
Циклический полуацеталь 69
Цинга 104, 106, 107, 386
Цинк 8, 9, 216, 238, 525, 540, 588
Цис-аконитаза 272
Цис-аконитов а я кислота 173, 272, 273,
275, 389
Цис-изомеры ненасыщенных жирных кис-
лот 140
Цистатионин 171, 397, 398, 400
Цистеин 23, 24, 32, 171, 361—363, 374,
380, 392—394, 397—400, 413, 439,
474, 482, 496
D-Цистеин 361
Цистеиновая кислота 32, 371, 392, 333
Цистеинсульфеновая кислота 393
Цистеинсульфиновая кислота 392, 393
Цнстеинсульфоновая кислота 392, 393
Цистин 19, 23, 24, 32, 46, 211, 212, 392
397—400, 482, 496, 524, 563,
569
L-Цистин 24, 211
Цистиновые камни 400
Цистинурия 399, 400, 519, 524
Цис-формы ненасыщенных жирных кис-
лот 94
Цитидиловая кислота 466, 474
Цитидин 57, 453
Цитидиндезаминаза 453
Цитидиндифосфорная кислота (ЦДФ) 65,
171, 337
Цитидиндифосфохолин 337, 338
Цитидиндифосфоэтаноламин 337
Цитидинмонофосфорная кислота (ЦМФ) 337
Цитидиновая кислота 64, 65, 74, 467
Цитидинтрифосфат 171
Цитидинтрифосфорная кислота (ЦТФ) 65,
337
Цитозин 55—57, 61—63, 453, 464 , 471,
584, 585
Цитозиндезоксирибозотрифосфаты 468
Цитозинрибозодифосфат 469
Цитохромоксидаза 178, 256, 257, 260—
262, 264, 274, 306, 592,
Цитохромы 52, 175, 178, 235, 256, 257,
260—262, 264, 274, 306, 508,
592
— «а» 52, 260
— «в» 52
— «с» 52
Цитрин 124
Цитроворум-фактор 122
Цитруллин 27, 388, 427—431
Ч
Четвертичная структура белков 37
— — ферментов 181
Число омыления 95
— перехода 156
Щ
Щавелевая кислота 108, 365
Щавелевокислый кальций 528
630
Щавелевоуксусная кислота 119, 174, 175,
272, 274, 275, 306, 367—369,
389, 428, 430, 431, 464, 482
Щавелевоянтарная кислота 273, 275, 389
Щелочеобразующие элементы пищи 502
Щелочная пища 222, 502, 503, 522, 532
Щелочной гидролиз белков 18
Щелочность мочи 519, 520, 522
— пищи 502
Щелочные белки 26
— фосфатазы 160
— фосфаты 222
Э
Эдестин 42
Эзерин 594
Эквилибрированный физиологический
раствор 225
Экзогенная вода 220
Экскреторная функция крови 530
Экспериментальный диабет 480, 481
Экстрагирование белков 40
Экстрактивные вещества 571—573, 584—
586
Элаидиновая кислота 94, 333
Эластин 348, 349
Электрофорез белков 40, 41
Элюирование (элюция) ферментов 148, 156
Эмульгаторы жиров 96, 318, 343
Эмульгирование жиров 96, 317, 318, 347
Эмульсин 89, 148, 149
Эндемический зоб 187, 234
Эндогенная вода 219, 220
— мочевая кислота 523
Эндокринология 184
Энергетическая ценность пищевых про-
дуктов 500, 501
Энергия активации 147, 148
Энзимология 149
Энзимы 146
Энтерогастрон 212, 213
Энтерокиназа 162, 351, 352
Эпикатехин 125
Эпинефрин 189
Эргостерин 100, 101, 133—135, 339
Эрготионеин 402
Эрепсин 162, 353
Эридиктиол 125
Эритеин 123
Эритродекстрины 80
D-Эритроза 75
D-Эритрозофосфонная кислота 75
Эритрозо-4-фосфорная кислота 310, 311
Эритрокруорины 534
Эритроптерин 121
Эстеразы 160, 161, 165, 181, 336, 593
Эстрадиол 203, 204, 525
Эстран 203
Эстриол 203, 525
Эстрогены 202—204
Эстрон 203, 204, 525
Этаноламин 97, 98, 167, 333, 335, 337,
378, 381, 394, 413, 594
Этаноламинофосфатиды 335, 337
Этаноламинофосфорная кислота 336
Этилмалон ил-SKoA 332
Этиловый спирт 10, 242, 258—260, 292,
293, 294, 298—303, 308, 476
Этиохоланолон 202
Эфирная сера 399
Эфирные связи полинуклеотидов 59—61
Эфиросерные кислоты 399, 524
— связи парных соединений 513, 515
— соединения 235
Эфирофосфатные связи 232
— соединения 231
Эфирофосфорная связь 169, 170
Эфирфы серной кислоты 399, 513, 523
— холестерина 194, 339, 516, 539, 542
Я
Яблочная кислота 173, 274—276, 389, 431,
542
Ядовитые вещества 89 , 370 , 371, 373—
375, 377, 395
Язвенная болезнь 350
Яичный альбумин 42
— пептон 349
Янтарная кислота 144, 214, 253, 258, 259,
273—276, 278, 374, 383, 389,
465, 542, 544—546
ОГЛАВЛЕНИЕ
Предисловие к третьему изданию ...................................... 3
Введение .... 5
Биохимическая статика 6
Биохимическая динамика. Функциональная биохимия ,......................9
Литература ....................................................... 14
Раздел первый
Химический состав организмов
Глава первая
Белки — протеины, или простые белки
Продукты гидролитического расщепления белков ........................18
а-Амипокислоты . . . ................................19
Общие свойства а-аминокислот ............................ ... 19
Реакции на аминокислоты .........................................20
Ациклические аминокислоты 21
Моноаминомонокарбоновые кислоты .................................21
Серусодержащие аминокислоты .....................................23
Моноаминодикарбоновые кислоты ...................................24
Диаминомонокарбоновые кислоты ...................................25
Циклические а-аминокислоты 27
Формы связи аминокислот в белковой молекуле .........................29
Пептидные связи ............................................... 29
Дисульфидные связи ..............................................32
Водородные связи ................................................32
Иные формы связи ....................................................33
Уровни организации структуры белков ............................... 33
Первичная структура белковой молекулы .......................... 33
Вторичная структура белковой молекулы .......................... 36
Третичная структура белковой молекулы .......................... 36
Четвертичная структура белковой молекулы ....................... 37
Изучение последовательности размещения аминокислот в белковой молекуле 37
Выделение белков из тканей ... 40
Физико-химические свойства белков . 41
Глобулярные и фибриллярные белки ................................41
Молекулярный вес белков ........................................ 42
Оптические свойства белков ..................................... 42
Коллоидные свойства белков 42
Разнообразие белков. Серологическая специфичность белков . 44
Классификация белков . . 45
Литература.......................................... • . . . 46
632
Глава
вторая
Протеиды — сложные белки
Фосфопротеиды ..................................................... 47
Гликопротеиды ..................................................... 48
Хромопротеиды .......................................................48
Железосодержащие хромопротеиды ..................................49
Гемоглобин........................................... ® .. 49
Миоглобин................................................. * 51
Иные железосодержащие хромопротеиды.................... .... 51
Медьсодержащие хромопротеиды ... .................... 52
Флавопротеиды . ..............................................53
Нуклеопротеиды.............................................. 53
Липопротеиды............................................. . 53'
Литература ................................................ ..54
Глава третья
Нуклеиновые кислоты
Продукты гидролиза нуклеиновых кислот .... ................55
Пуриновые основания...............................................56
Пиримидиновые основания ..........................................56
Пентозы нуклеиновых кислот ...................................... 56
Схема структуры полинуклеотидной цепочки ДНК и РНК............... 60
О макромолекулярной структуре нуклеиновых кислот . . * 60
Нуклеозидмоно*, ди- и трифосфаты . . .................... 63
Литература ..................................................... 65
Глава четвертая
1
Углеводы
Моносахариды ................... . ... . .
Триозы ..................... ... . . .
Гексозы ................................. . . .
Пентозы ................................. . ..
Тетрозы..................... ... ...
Гептозы ................................... ....
Олигосахариды .................................................. . .
Сахароза. Свекловичный сахар, тростниковый сахар ... . .
Мальтоза, солодовый сахар ... . .
Трегалоза, грибной сахар ......................................
Целлобиоза .. ........................................
Лактоза, молочный сахар .....................................
Раффиноза .....................................................
Сладкий вкус различных моносахаридов и олигосахаридов .........
Полисахариды ...................... ...............................
Крахмал ....................................... ... ....
Целлюлоза ............................... .... . .
Лихенин .............................................. . . .
Гликоген, животный крахмал ....................................
Инулин ........... ......................... . . . .
Декстран ........................................’. . . . .
Пектиновые вещества ......................... . . . .
Г емицеллюлозы
67
67
69
74
75
75
76
76
77
77
78
78
79
79
79
79
81
82
82
83
83
83
84
Агар-агар ................................................... . 84
Слизи и гумми .............................................. ... 85
633
Мукополисахариды ................................................. 85
Хитин ............................................................ 86
Бактериальные полисахариды ... 86
Полисахариды групп крови ... 87
Производные углеводов ................................................ 87
Гексуроновые кислоты ............................................. 87
Аминогексозы ..................................................... 88
Гетерогликозиды .................................................. 88
Литература ...................................................... .90
Глава пятая
Липиды
Жиры, триглицериды ................................................... 92
Химия жиров ...................................................... 93
Свойства жиров ................................................... 94
Фосфолипиды (фосфатиды) .............................................. 96
Химия фосфатидов ................................................. 96
Фосфатиды-глицериды .............................................. 97
Фосфатиды-неглицериды ............................................ 98
Ацетальфосфатиды ..................................................... 99
Стерины и стериды 99
Воска .................. . . . 101
Цереброзиды......................................................... . 102
Литература ................................................ • 103
Глава шестая
Витамины
Из истории изучения витаминов 104
Классификация витаминов 105
Водорастворимые витамины .............................................106
Витамин С. антицинготный фактор, L-аскорбиновая кислота .... 106
Химическая структура L-аскорбиновой кислоты ... .... 107
Распространение аскорбиновой кислоты. Потребность в ней человека . 109
Витамины группы В ... . . ... . . . .110
Витамин Bi, антибериберийный фактор, антиполиневритный фактор, аней-
рин, тиамин (Ci2Hi?N4SO-НС1) . . .............ПО
Химическая структура витамина Bi . . . . .....................110
Нарушение процессов обмена веществ при Bi-авитаминозе.............111
Распространение тиамина. Потребность в нем организма .................112
Витамин Вг, рибофлавин (Ci7H2oN406) ............................. 112
Химическая структура витамина Вг..................................112
Распространение витамина Вг. Потребность в нем организма . . . .114
Витамин РР, антипеллагрический фактор, никотиновая кислота, ниацин
(C6H5O2N) ................................. .115
Химическая структура витамина РР........................ . . 115
Распространение никотиновой кислоты. Потребность в ней организма . . .117
Витамин В6, адермин, пиридоксин . . ..............117
Химическая структура витамина В6..................................118
Распространение пиридоксина. Потребность в нем человека ..........118
Витамин Н, биотин .... ... . . ...........119
Химическая структура биотина......................................119
Распространение биотина. Потребность в нем человека ............. 120
Пантотеновая кислота ........................................... 120
Химическая структура пантотеновой кислоты.........................120
Распространение пантотеновой кислоты. Потребность в ней организма 120
Пара-аминобензойная кислота ......................................121
634
Фолиевая кислота и близкие к ней соединения ......................121
Химическая структура фолиевой кислоты.............................121
Витамин В12, цианкобаламин, антианемический витамин...............123
Химическая структура витамина В12 ...................123
Витамин Р (цитрин, флавон) .......................................124
Инозит, гексагидрогексаоксибензол, инозитол.......................125
Холин .......................................................... 126
Витамин В15, пангамовая кислота ..................................126
Витамин Вт, карнитин ... 127
Жирорастворимые витамины .............................................127
Витамины группы А ................................................127
Витамин А, антиксерофтальмический витамин ........................127
Химическая структура витамина А ..................129
Распространение витамина А. Потребность в нем человека ...........132
Витамины группы D, антирахитические витамины .....................133
Витамин D ...................................................... 133
Химическая структура i витамина D.................................133
Действие витаминов D2 и D3. Практическое их применение ...........135
Витамины группы Е, антистерильные витамины, токоферолы . . . .135
Витамин Е.............. ...» . . • . 135
Химическая структура витамина Е...................................135
Авитаминоз Е . . ...................................137
Распространение токоферолов .................................... 138
Витамины группы К, антигеморрагические витамины, коагуляционный
фактор ......................................................... 138
Витамин К ........................................................138
Химическая структура витамина К....................... .... 139
Распространение витамина К. Потребность в нем организма . . . .140
Ненасыщенные жирные кислоты, обладающие свойствами витаминов . . 140
Антивитамины .................... .... ..........140
Антибиотики .................................................... 142
Антиметаболиты ................................................. 144
Литература 145
Глава седьмая
Ферменты
Ферменты как катализаторы биологической природы........... .... 146
Из истории изучения ферментов 148
Химическая природа ферментов .........................................149
Изоферменты (изоэнзимы) # . . ...............................150
Свойства ферментов ...................................................150
Температурные условия действия ферментов .........................150
Влияние pH на действие ферментов ..................... .... 151
Специфичность действия ферментов .................................151
Стереохимическая специфичность ...................................151
Абсолютная специфичность .........................................152
Абсолютная групповая специфичность ...............................153
Относительная групповая специфичность ............................153
Обратимость действия ферментов ..................... . . 153
Факторы, влияющие на активность ферментов ........................154
Методы изучения активности ферментов и методы получения чистых
ферментов....................................................... 155
Классификация ферментов . . ........... ...................157
Гидролазы..................................................... 158
Карбогидразы ................................................... 158
Эстеразы ....................................................... 160
Протеазы (протеолитические ферменты) ... ...............161
635
Амидазы ...................................................... . . 163
Дезаминазы пуриновых оснований................................. . . 164
i Фосфорилазы............. .......................... .• 165
Трансферазы................................................... . 167
Метилферазы .................................................. ... 167
Аминоферазы .................................................. ... 168
Фосфоферазы (фосфокиназы) .................................... ... 169
Другие феразы ................................................ ... 171
Лиазы......................................................... ... 172
Изомеразы...................................................... . . 173
Лигазы......................................................... • • 174
Оксидоредуктазы .................................................. . . 175
Дегидрогеназы ................................................. . . 175
Гемсодержащие ферменты ..............................................178
Химическая природа коферментов и их действие ...........................178
Особенности структуры ферментов. Активные центры ферментов .... 180
Действие ферментов в клетке. «Ансамбли» ферментов .... 182
Литература ..........................................................183
Глава восьмая
Гормоны
Щитовидная железа ....................................... .... . 185
Химическая природа гормонов щитовидной железы .... . ’ 185
Образование тироксина при йодировании белков .... . * 187
Действие гормонов щитовидной железы .................................187
Антитиреоидные вещества .................ь...........................188
Паращитовидные железы ..........................................188
Гормон паращитовидных желез .......................................188
Надпочечные железы .....................................................189
Мозговой слой надпочечников. Адреналин, норадреналин . . . . • 189
Образование адреналина . ........... ................’ 190
Действие адреналина . .....................................191
Продукты превращения адреналина ....................................192
Корковый слой надпочечников . . . ................. 194
Последствия удаления надпочечников . . .....................194
Кортикостероидные гормоны . . . .....................194
Поджелудочная железа и ее гормоны.................................... 196
Инсулин.............................................................197
Глюкагон ...........................................................199
Половые гормоны ........................................................200
Семенные железы. Мужские половые гормоны . .........................200
Обмен андрогенных гормонов ............................... . . 201
Яичники . . ................................... ... 202
Химия эстрогенов ...................................................202
Гормон желтого тела, прогестерон ...................................204
Гипофиз ................. . ....................................205
Гормоны передней доли гипофиза .....................................206
Гормон роста .... 207
Адренокортикотропный гормон (кортикотропин) ....................... 208
Тиреотропный гормон (тиреотропин) ..................................208
Гонадотропные гормоны (гонадотропины) ..............................208
Лактогенный гормон (пролактин) .....................................209
Меланофорстимулирующий гормон (МСГ) ...... .... 210
Гормоны задней доли гипофиза .......................................210
Вазопрессин ... 210
Окситоцин ..........................................................211
Гормоны беспозвоночных животных .......................................211
636
Тканевые гормоны (гормоноподобные вещества) .....................212
Гормоноподобные вещества органов пищеварения ....................212
Гормоноподобное вещество почек (ренин) ..........................212
Гормоноподобные вещества, возникающие из аминокислот .... 212
Гормоны растений. Фитогормоны ............. . . . • 212
Литература .... ......................................213
Глава девятая
Минеральные вещества
Вода „....217
Состояние воды в тканях .........................................217
Потребление и выделение воды .....................................И9
Регуляция водного обмена ..................................... .. 220
Буфера тканей и органов и регуляция pH......................... 221
Осмотическое давление ... .............................. 223
Физиологическое действие ионов . .. ....................... 225
Содержание минеральных веществ в тканях и органах................226
Потребность организма в минеральных веществах....................226
Роль отдельных минеральных веществ .........................227
Натрий и калий ..................................................227
Магний и кальций ................................................228
Фосфор. Процессы костеобразования .........................228
Фосфорные соединения . ............... . ...........230
Г алой ды ..........................................................233
Сера ............................................................. 235
Железо .......................................................... . 235
Медь 236
Кобальт . . ............... ...............................237
Стронций и цезий ................................................. 237
Прочие микроэлементы, встречающиеся в организмах ...................237
Литература ......................................................239
Раздел второй
Обмен веществ
Глава десятая
Представление об обмене веществ
Пути изучения обмена веществ ... . 243
Биохимические процессы в субклеточных элементах . 245
Литература ................................................ .... 245
Глава одиннадцатая
Биосинтез органических веществ
Фотосинтез ...................................................... 246
Синтез углеводов и других веществ в растениях...................250
Синтез органических веществ у человека и животных . . . . . 252
Литература ................................ • • • .............254
Глава двенадцатая
Окислительн ые процессы
Реакции окисления и восстановления ................................256
Теории окислительных процессов .................................257
Ферменты дыхания ..................................................259
Схема анаэробных и аэробных окислительных процессов ............260
Образование углекислого газа .................................. 262
Активность дыхания тканей и органов ........................ . . 263
Литература ........................................... * • . . 264
637
Глава тринадцатая
Окислительное фосфорилирование
Факторы, регулирующие клеточное дыхание . 267
Процессы активирования веществ в организме . 268
Литература . . .................. • 270
Глава четырнадцатая
Аэробный цикл трикарбоновых кислот
Литература ......................................... 276
Глава пятнадцатая
Обмен углеводов
Переваривание и всасывание углеводов ........................277
Взаимопревращение отдельных моносахаридов .....................281
Содержание глюкозы в крови. Образование и распад гликогена в пэчени 284
Связь между содержанием гликогена в печени, глюкозы в крови и потреб-
лением углеводов в мышцах ................................288
Регуляция гликогенной функции печени и содержания глюкозы в крови 289
Использование углеводов в клетках и тканях организма ............... 291
Анаэробный распад углеводов (анаэробный гликолиз) .... . . 292
История изучения анаэробного гликолиза ... ............. 293
Промежуточные этапы распада углеводов в дрожжевых клетках . . 294
Сбраживание глюкозы в дрожжевых клетках и в бесклеточном дрожжевом
соке 300
Физиологическое значение спиртового брожения ....................301
Управление процессом спиртового брожения ........................301
Анаэробный распад углеводов в тканях животных 303
Обратимость гликогенолиза .......................................305
Аэробный распад продуктов гликолитического расщепления углеводов . * . 306
Пентозный цикл аэробного распада ................ . . • 309
Связь между анаэробным и аэробным распадом углеводов. Реакция Пас-
тера ........................................................ . 312
Нарушения углеводного обмена. Гипергликемия. Сахарный диабет . . 313
Гипогликемия ...................................... . ... 316
Литература ......................................................316
Глава шестнадцатая
Обмен липидов
Обмен жиров .......................... . . 317
Переваривание и всасывание жиров .... . . 317
Транспорт и отложение жиров...................... . . . 319
Окислительный распад жиров ................................... .... 320
Теория ? -окисления жирных кислот ............................. .... 321
Роль печени в обмене жиров ..................... . ... 327
Потребление ацетоуксусной кислоты тканями ... ...........329
Превращение ненасыщенных жирных кислот ......................*329
Синтез жирных кислот в организме ................................. .... 330
О месте ацетоуксусной кислоты в промежуточном обмене ..................332
Обмен фосфатидов .......................... .... ... 333
Ферменты, участвующие в превращениях фосфатидов . » . .... 335
Обмен стеринов (холестерина) ...... . . .... 339
Биосинтез холестерина ........................................... 339
Распад холестерина .............................................. 342
Желчные кислоты 342
Регуляция обмена жиров ... . . . . .... . . 344
Литература ...... . . . , ................344
638
Глава семнадцатая
Обмен белков
Переваривание белков .... . ...........345
Состав желудочного сока ............... , . . 346
Секреция желудочного сока 347
Переваривание белков в желудке ..................... • • . 348
Переваривание белков и полипептидов в кишечнике.......................351
Состав сока поджелудочной железы 351
Действие протеолитических ферментов в кишечнике.......................352
Всасывание продуктов переваривания белков ........................... 353
Превращение аминокислот в организме ..................................355
Химические превращения аминокислот 357
Дезаминирование аминокислот ......................................... 358
Оксидаза L-аминокислот .......................................... 359
Оксидаза D-аминокислот ...........................................360
Иные пути дезаминирования L-аминокислот...........................361
Ферменты, катализирующие дезаминирование некоторых L-аминокислот. . 362
Процесс переаминирования аминокислот ... ... 366
Биологическое значение реакций переаминирования . ...........368
Декарбоксилирование аминокислот. Образование протеиногенных аминов . 369
Превращение протеиногенных аминов в организме 373
Бактериальное расщепление аминокислот в кишечнике ................374
Превращения отдельных аминокислот .... ..............377
Обмен глицина ....................................................378
Обмен аланина ....................................................380
Обмен серина .....................................................380
Обмен треонина ...................................................381
Обмен валина, лейцина и изолейцина ......................... . . 381
Обмен пролина, оксипролина и орнитина . . ..................385
Обмен лизина ................................................... 386
Обмен аргинина ...................................................387
Обмен аспарагиновой и глутаминовой кислот .................... . 388
Обмен серусодержащих аминокислот ..................... . 392
Образование цистеина из метионина ................................397
Продукты окисления серы, входящей в состав цистеина, цистина и метио-
нина ....................................... . .........399
Цистинурия ..................................................... 399
Обмен гистидина ............................................... ... 400
Обмен триптофана .................................................402
Обмен фенилаланина и тирозина .... ..................408
Синтез азотистых небелковых веществ из аминокислот . . ...........413
Креатин и его обмен . .......... . . ...........413
Выделение креатина и креатинина из организма ... ...........419
Бетаины животного происхождения . . ... . . . . 420
Метилированные гетероциклические соединения ... ...........421
Карнозин и ансерин .... ... ...........421
Глутатион .......................... ... ..... 422
Образование и устранение аммиака в организме ... ..... 422
Образование мочевины ............... . . . . . . 426
Свойства мочевины ........................................... ... 432
Синтез мочевой кислоты............. ...................... . . 432
Количественная сторона обмена белков . .....................436
Биосинтез белков ............... ..............................438
Обмен белками между кровью и тканями ...........443
Факторы, регулирующие азотистый обмен .... 444
Круговорот азота в природе .... 446
Литература . . ... 447
639
Глава восемнадцатая
Обмен нуклеиновых кислот
Распад нуклеиновых кислот .........................................449
Образование мочевой кислоты 450
Выделение мочевой кислоты 450
Распад мочевой кислоты. Уриколиз 452
Распад производных пиримидина .... ..................453
Биосинтез нуклеиновых кислот и близких им соединений ............• 454
Синтез производных пурина 456
Синтез производных пиримидина 464
Синтез рибозы и дезоксирибозы ...............................466
Синтез мононуклеотидов 466
Синтез ди нуклеотидов ........................... .... 467
Синтез нуклеиновых кислот (РНК и ДНК) ......................... • 468
Локализация в клетке нуклеиновых кислот .................. . . 469
Генетическая роль ДНК .............................. • 470
Роль РНК в биосинтезе белков ................. ............. . . 471
Литература ............................................ .. 475
Глава девятнадцатая
Взаимосвязь превращений углеводов, жиров и белков
Синтез жиров из углеводов..........................................477
Синтез углеводов из жиров .........................................479
Синтез углеводов из белков . ......................................431
Синтез жиров из белков , ....... ...............................432
Синтез аминокислот из углеводов .... .....................432
Глава двадцатая
Динамическое состояние химических составных частей
тканей организма
Динамическое состояние белков *.................................. 483
Динамическое состояние гликогена ®........................ ... 486
Динамическое состояние фосфатидов ........................ ... 487
Динамическое состояние пуринсодержащих веществ . ...............487
Глава двадцать первая
Биохимия питания
Энергетические затраты организма . . ......................490
Энергетические затраты организма при относительном покое (основной обмен) • 491
Специфико-динамическое действие пищевых веществ . . ... 492
Калорийная ценность отдельных веществ ....................... 493
Правило изодинамии Рубнера ................................... 495
Роль белков в питании ........................................496
Потребность организма в белках ................................... • 497
Энергетическая ценность пищевых продуктов ........... . . * 500
Общая оценка пищевых продуктов. Продукты «кислые» и «щелочные» * • 502
Фосфор и кальций в пищевых продуктах ..........................503
Литература ........................................... . . • 504
Раздел третий
Биохимия специализированных органов и тканей
Глава двадцать вторая
Биохимия печени
Химический состав печени . ..............................507
Гликогенная функция печени. Роль печени в обмене углеводов . . . 509
Ненормальное отложение гликогена в печени и в других органах , . .511
640
Роль печени в обмене липидов............................ . . 511
Роль печени в азотистом обмене............................. . ... ^ 511
Обезвреживающая функция печени .......... ...........512
Выделительная функция печени. Состав желчи ...... ...515
Изучение функционального состояния печени..............................*515
Глава двадцать третья
Обмен веществ в почках
Биохимические процессы в почках .......................................518
Физические свойства мочи и ее химический состав ................... ... 519
Физические свойства мочи .... ..........................519
Суточное количество мочи и ее плотность ...........................520
Химический состав мочи 521
Неорганические составные части мочи ...............................521
Органические составные части мочи ......................... . ... 523
Патологические составные части мочи....................................525
Глюкозурия ........................................................525
Протеинурия (альбуминурия) ........................................526
Кетонурия..........................................................527
Желчные пигменты (билирубин)..................................... 527
Литература....................................................... 528
Глава двадцать четвертая
Химия крови. Лимфа
Физиологические функции крови ........................................529
Физико-химические свойства крови ...............................* 530
Буферные системы крови............................................531
Дыхательная функция крови ............................................532
Газы крови .......................................................532
Транспорт кислорода гемоглобином ...........................• 533
Гипоксия ....................................................... 533
Хромопротеиды — переносчики кислорода ............................534
Токсичность кислорода ......................................... 535
Транспорт углекислого газа ...................................... 535
Осмотические свойства крови 536
Химический состав плазмы крови .......................................536
Белки плазмы крови ..............................................537
Сывороточные альбумины ..........................................537
Сывороточные глобулины ........................................ 538
Другие белки плазмы крови ............................539
Ферменты плазмы крови ................................................540
Азотистые небелковые вещества плазмы (сыворотки) крови . . ® . . . 541
Безазотистые органические составные части плазмы 542
Минеральные вещества плазмы крови ....................................542
Химический состав эритроцитов .......................... 543
Гемолиз...............................................................544
Ферментативные процессы в эритроцитах 544
Синтез гема. Распад гемоглобина. Образование желчных пигментов . . . 545
Биохимия свертывания крови ...........................................549
Фибриноген .......................................................550
Протромбин ................... . .................................550
Тромбопластин . *.................................................551
Другие глобулины, участвующие в свертывании крови.................551
Роль тромбоцитов . . 551
Антисвертывающие свойства крови .................................... 552
Фибринолиз (растворение фибрина) ................................. • . 553
641
Практическое использование белков плазмы крови .••••••• 553
Лимфа ................................................................553
Литература .................... . ................................554
Глава двадцать пятая
Обмен веществ в молочной железе
Химический состав молока ... ... 555
Предшественники составных частей молока .... 555
Предшественники белков молока . . .... 556
Предшественники лактозы ... . ♦ . . 556
Предшественники жиров ... . .... 557
Биохимические процессы в молочной железе . .... 558
Синтез белков ........................ .... 558
Синтез лактозы ............................... ... 558
Синтез жира ............................... . . 560
Другие физиологические процессы в молочной железе . . . 561
Регуляция процессов образования и отделения молока .... 561
Химический состав молока ........................................ .... 561
Белки молока ..................... . . .... 562
Углеводы молока .......................................... ....... 564
Жиры молока.................................................... 564
Другие органические вещества молока . ....................564
Минеральные составные части молока ...............................565
Химический состав и пищевая ценность молока различного происхождения . . 565
Молозиво . ........................................ ... 566
Литература .......................................................566
Глава двадцать шестая
Биохимия мышц
Химический состав скелетных мышц .....................................568
Белки мышц ................................................... 568
Экстрактивные вещества мышц ................................ ..... 570
Азотистые экстрактивные вещества мышц . . . . . . 571
Безазотистые экстрактивные вещества мышц . . ...........571
Фосфорные соединения мышц ... ...........571
Липиды скелетных мышц .... ... ...........572
Минеральные вещества скелетных мышц ... ..... 572
Химический состав сердца и гладких мышц .... . . . . 572
Ферментативные процессы в мышцах ............................... ..... 573
Химические процессы в работающей изолированной мышце .... 576
Обмен веществ в мышцах при работе организма ..... 579
Биохимические процессы в мышцах при тренировке . . . . . 580
Биохимические изменения в мышцах при их заболеваниях 581
Особенности обмена веществ в сердечной мышце . . ..... 581
Окоченение мышц 582
Литература 582
Глава двадцать седьмая
Биохимия нервной ткани
Химический состав нервной ткани . . .... ...... 583,
Белки нервной ткани ................ ...................... 584
Небелковые азотистые экстрактивные вещества 585
Липиды нервной ткани , 586
Минеральные вещества нервной ткани 588
Обмен веществ в нервной ткани ................................ . . 589
Обмен углеводов................................................... 589
Азотистый обмен 590,
642
Обмен липидов ..............................................592
Процессы окисления органических веществ и фосфорилирования . . 592
Химизм передачи нервного импульса . . . .... 592
Связь между функциональным состоянием головного мозга и процессами
обмена веществ ..................................... . 595
Спинномозговая жидкость ..........................................596
Литература .. ..........................................597
Глава двадцать восьмая
Биохимия люминесценции
Предметный указатель е w w s.................................. , . 600
Давид Лазаревич Фердман
Биохимия
Редактор О. В. Макарова
Художник Л. М. Чернышев
Художественный редактор Э. А. Марков
Технический редактор Т. Д. Г арина
Корректор Л. Н. Видревич
Т-09594. Сдано в набор 28/VI 1-65 г. Подп.
к печати 2/IX-66 г. Формат 70Х 108716-
Объем 40,25 печ. л., 56,35 усл. п. л.,
51,3 уч.-изд. л. Изд. № Е-2/64. Тир. 25 000 экз.
Цена 1 р. 98 к. Зак. 581.
БЗ-46/21 от 21/V-66 г.
Издательство «Высшая школа»
Москва, И-51, Неглинная ул., д. 29/14,
Ярославский полиграфкомбинат Главполиграфпро-
ма Комитета по печати при Совете Министров
СССР. Ярославль, ул. Свободы, 97.