Автор: Рагимов А.А. Еременко А.А. Никифоров Ю.В.
Теги: патология сердечно-сосудистой системы сердечно-сосудистые заболевания общая терапия медицина
ISBN: 5-89481-318-2
Год: 2005
Текст
А.А. Рагимов, А.А. Еременко,
Ю.В. Никифоров
ТРАНСФУЗИОЛОГИЯ
РЕАНИМАТОЛОГИИ
НЕДИЦИЬСКОЕ ИНФОРМАЦИОННОЕ
АГЕНТСТВО
Данный файл представлен исключительно
в ознакомительных целях.
Все авторские права на данный файл
сохраняются за правообладателем.
Любое коммерческое и иное использование
кроме предварительного ознакомления запрещено.
Публикация данного документа не преследует
никакой коммерческой выгоды. Но такие документы
способствуют быстрейшему профессиональному и
духовному росту читателей и являются рекламой
бумажных изданий таких документов.
Все авторские права сохраняются за правообладателем.
А.А. Рагимов, А.А. Еременко,
Ю.В. Никифоров
ТРАНСФУЗИОЛОГИЯ
в
РЕАНИМАТОЛОГИИ
Рекомендовано
редакционно-издательским Советом
ГОУВПО ММА им. И.М. Сеченова
МЕДИЦИНСКОЕ ИНФОРМАЦИОННОЕ АГЕНТСТВО
МОСКВА
2005
УДК 616.15
ББК 53.5
Р 14
р 14 Рагимов А.А., Еременко А.А., Никифоров Ю.В.
Трансфузиология в реаниматологии. — М.:
ООО «Медицинское информационное агентство»,
2005.-784 с.: 156 ил.
ISBN 5-89481-318-2
Внутрисосудистое введение крови, ее компонентов и препа-
ратов, растворов лекарственных и диагностических средств име-
ет важнейшее значение в процессе лечения многих патологических
состояний — при хирургических заболеваниях, в интенсивной те-
рапии, анестезиологии, акушерстве и гинекологии, педиатрии и др.
Особое значение трасфузионно-инфузионные мероприятия
имеют в интенсивной терапии и при проведении реанимационных
мероприятий. Практически ни одна продолжительная лечебная
процедура в отделении интенсивной терапии или реанимации не
проходит без применения различных инфузионных растворов, а в
ряде случаев компонентов крови, кровезаменителей и препаратов
для парентерального питания.
Книга представляет интерес для широкого круга врачей раз-
личных специальностей: трансфузиологов, реаниматологов, ге-
матологов, терапевтов, хирургов и всех других специалистов, кто
использует на практике арсенал трансфузиологического пособия.
Доступность и наглядность изложения помогут в обучении студен-
там медицинских институтов и курсантам системы постдипломно-
го профессионального образования.
УДК 616.15
ББК 53.5
© Рагимов А.А., Еременко А.А,
Никифоров Ю.В., 2005
© Оформление. ООО «Медицинское инфор-
мационное агентство», 2005
Все права защищены. Никакая часть данной
книги не может быть воспроизведена в какой бы
ISBN 5-89481-318-2 то ни было форме без письменного разрешения
владельцев авторских прав.
Оглавление
Сокращения .....................................11
Введение .......................................14
Глава 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ
ПОСОБИЕ ........................................18
(А.А. Рагимов, Г.Н. Щербакова, А.А. Еременко,
Ю.В. Никифоров)
1.1. Основные средства трансфузионно-инфузионного
пособия ........................................18
1.2. Отделение трансфузиологии и его задачи
в многопрофильной клинике.......................36
1.3. Инфузионно-трансфузионные процедуры .......39
1.4. Общие принципы компонентной гемотерапии....42
1.5. Кровь, ее компоненты и препараты...........46
1.5.1. Цельная консервированная донорская кровь.46
Компоненты консервированной донорской крови ... .52
1.5.2. Цельная консервированная аутокровь.......95
Компоненты аутологичной (аутогенной)
консервированной крови......................106
1.5.3. Противопоказания к переливанию крови
и ее компонентов...............................108
1.5.4. Препараты донорской крови...............109
1.6. Кровезаменители ..........................125
1.6.1. Кровезаменители гемодинамического
(противошокового) действия ....................126
Растворы желатина...........................130
Растворы декстрана..........................145
Растворы полиэтиленгликоля..................153
Растворы гидроксиэтилкрахмала (ГЭК).........155
Терапевтическая гемодилюция.................173
1.6.2. Кровезаменители дезинтоксикационного
действия.......................................176
1.6.3. Синтетические переносчики кислорода.....183
ОГЛАВЛЕНИЕ
1.6.4. Регуляторы водно-солевого обмена и кислотно-
основного состояния ..........................189
1.7. Препараты парентерального питания........205
1.7.1. Компоненты аминокислотного обеспечения.206
Аминокислотные растворы общего типа .......206
Аминокислотные растворы для больных
с патологией почек.........................218
Аминокислотные растворы для больных
с заболеваниями печени.....................220
Аминокислотные растворы, применяемые
в педиатрии................................223
Препараты с повышенным содержанием глютамина . .226
1.7.2. Углеводы ..............................227
1.7.3. Жировые эмульсии ......................227
1.7.4. Добавки к препаратам парентерального питания . .232
Список основной литературы ...................235
Глава 2. КЛИНИЧЕСКИЕ АСПЕКТЫ СОСТОЯНИЯ
И РЕГУЛЯЦИИ КИСЛОТНО-ОСНОВНОГО
ГОМЕОСТАЗА....................................241
{И. И. Дементьева)
2.1. Общие положения .........................242
2.2. Роль водородного иона ...................243
2.3. Закон поддержания постоянства pH.........246
2.4. Методы исследования КОР..................250
2.5. Обозначение основных показателей КОР ....250
2.6. Закон электронейтральности...............253
2.7. Метаболические нарушения КОР крови ......255
2.8. Респираторные нарушения КОР крови .......264
2.9. Смешанные нарушения КОР крови ...........271
2.10. Кислородный статус организма и КОР крови.274
2.11. Нарушения КОР крови во время
и после операции..............................283
2.12. Закон изоосмоляльности..................287
Заключение....................................311
Список основной литературы ...................312
4
ОГЛАВЛЕНИЕ_______________________________________
Глава 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ
СОСТОЯНИЙ, ТРЕБУЮЩИХ ПРОВЕДЕНИЯ
ИНФУЗИОННО-ТРАНСФУЗИОННОЙ
ТЕРАПИИ................................314
(А. А. Еременко)
3.1. Мониторинг состояния пациента ..........314
3.1.1. Кислородный статус организма..........314
Поступление кислорода.....................315
Содержание кислорода в артериальной крови.317
Транспорт кислорода ......................321
Высвобождение кислорода ..................323
Эффективность утилизации кислорода........324
3.1.2. Оценка гемодинамики ..................327
Сердечный выброс .........................327
Термодилюционные методы..................327
Метод Фика ..............................334
Метод разведения электроимпедансных
индикаторов..............................336
Определение сердечного выброса
методом разведения индикатора
с помощью ультразвукового флоуметра . .338
Метод разведения красителя...............341
3.1.3. Измерение артериального давления......342
Метод Короткова...........................342
Автоматическое неинвазивное измерение АД..343
Инвазивное (прямое) измерение АД..........345
3.1.4. Центральное венозное давление.........355
Методика установки центрального венозного
катетера..................................355
Измерение центрального венозного давления.355
Интерпретация результатов измерения ЦВД...356
Контроль за гемодинамическими показателями
в процессе проведения инфузионно-трансфузионной
терапии...................................358
3.2. Инфузионно-трансфузионная терапия
критических состояний........................360
3.2.1. Циркуляторный шок.....................360
5
ОГЛАВЛЕНИЕ
Гиповолемический шок.......................360
Септический шок ...........................362
Анафилактический шок.......................364
Кардиогенный шок...........................365
Ожоговый шок...............................366
3.2.2. Выбор плазмозамещающего раствора ......368
3.2.3. Компонентная терапия при острой
кровопотере...................................371
3.2.4. Оптимальный гематокрит ................372
3.2.5. Послеоперационная кровопотеря..........375
3.2.6. Инфузионная терапия при увеличенной
проницаемости микрососудистого русла..........377
3.2.7. Осложнения инфузионной терапии.........378
Заключение....................................381
Список основной литературы ...................382
Глава 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
В РЕАНИМАТОЛОГИИ..............................388
(Ю.В. Никифоров, А.А. Еременко, А.А. Рагимов)
4.1. Сосудистый доступ и варианты подсоединения
экстракорпорального контура...................391
4.2. Антикоагуляция при проведении ЗПТ........395
4.3. Мониторинг функции жизненно важных органов
и систем организма при проведении ЗПТ.........398
4.4. Теоретические и технические аспекты современных
методов ЗПТ...................................400
4.4.1. Перитонеальный диализ..................406
4.4.2. Аппаратный гемодиализ .................409
4.4.3. Методы постоянной заместительной
почечной терапии .............................417
4.5. Результаты клинического применения
постоянной ЗПТ в реаниматологии. Коррекция водно-
электролитного и кислотно-основного баланса...425
Заключение....................................458
Список основной литературы....................462
6
ОГЛАВЛЕНИЕ
Глава 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ
СОСТОЯНИЯХ В ХИРУРГИЧЕСКОЙ
КЛИНИКЕ .......................................465
(И.Н Соловьева, А.А. Рагимов, А.А. Еременко,
Ю.В. Никифоров)
5.1. Экстракорпоральная терапия при сепсисе....467
5.2. Плазмаферез при полиорганной недостаточности .. .473
5.3. Плазмаферез при синдроме диссеминированного
внутрисосудистого свертывания...................480
5.4. Плазмаферез при остром внутрисосудистом
гемолизе........................................484
5.5. Плазмаферез при синдроме длительного
сдавливания ...................................490
5.6. Плазмаферез при реперфузионном синдроме...496
5.7. Особенности плазмафереза при неотложных
состояниях в хирургической практике............503
Список основной литературы.....................508
Глава 6. ТРАНСФУЗИОННАЯ ТАКТИКА НЕОТЛОЖНЫХ
СОСТОЯНИЙ ПРИ ГЕМОЛИТИЧЕСКИХ
АНЕМИЯХ.................................510
(И.Э. Байрамалибейли, А.А. Рагимов, Ю.В. Никифоров)
6.1. Гемолитические анемии.....................510
6.2. Тактика неотложных мероприятий
при гемолитическом кризе, обусловленном
наследственным дефицитом фермента Г-6-ФД.......512
6.3. Терапия неотложных состояний при серповидно-
клеточной анемии .............................516
6.4. Тактика трансфузионной терапии гемолитической
болезни новорожденных.........................524
Список основной литературы....................532
7
ОГЛАВЛЕНИЕ
Пиша 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ
И ОСЛОЖНЕНИЯ...............................535
(А. А. Рагимов, А.А. Еременко, Ю.В. Никифоров,
А. В. Точеное, С.А. Порешина)
7.1. Классификация отрицательных последствий
гемотрансфузий.............................536
7.1.1. Постгрансфузионные реакции .........538
Пирогенные реакции......................540
Аллергические реакции...................541
Анафилактические реакции ...............542
7.1.2. Цитратная интоксикация..............544
7.1.3. Калиевая интоксикация...............545
7.1.4. Негемолитические реакции............546
7.1.5. Профилактика и терапия
посттрансфузионных реакций.................556
7.1.6. Гемотрансфузионные осложнения
и методы их профилактики ..................559
Основные причины осложнений.............559
Осложнения при изосерологически
несовместимых гемотрансфузиях..........561
Осложнения при переливании
инфицированной крови ..................573
Осложнения, связанные
с бактериальным загрязнением ..........573
Осложнения, связанные с нарушением
температурного режима при хранении
и применении крови и ее компонентов ...577
Осложнения, связанные
с погрешностями в технике
трансфузий .............................579
Осложнения при массивной
гемотрансфузии ........................586
Осложнения, связанные
с игнорированием противопоказаний
для гемотрансфузии.....................591
7.1.7. Трансфузионно обусловленная болезнь
«трансплантат-против-хозяина»...............591
8
ОГЛАВЛЕНИЕ
7.1.8. Посттрансфузионная иммуномодуляция ......594
7.1.9. Синдром иммунологической альтерации .....597
7.1.Ю. Реакции и осложнения при переливании
кровезаменителей ..............................600
7.1.11- Осложнения инфузионной терапии в реанимации
и интенсивной терапиии ........................603
Список основной литературы.....................607
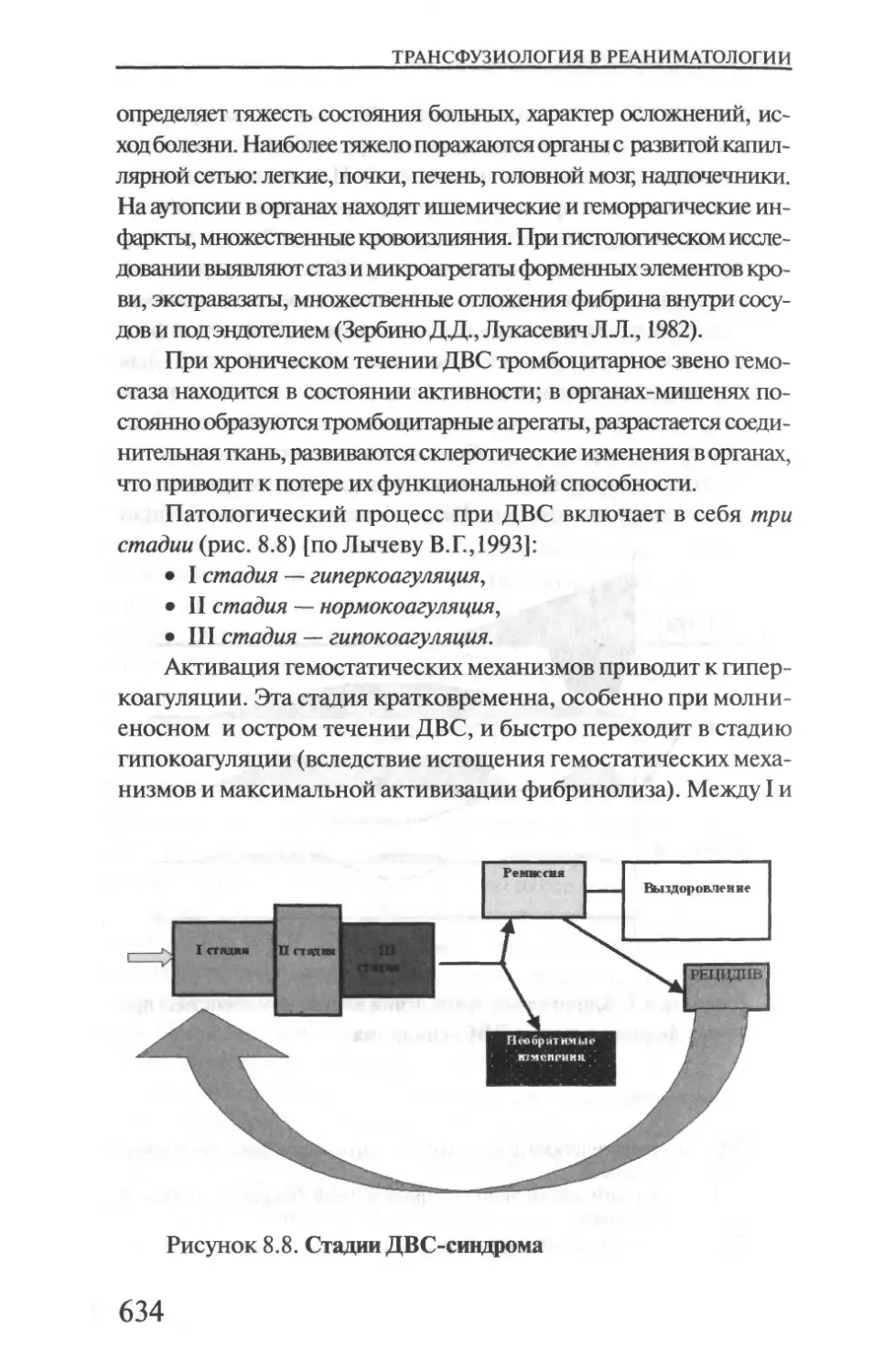
Глава 8. ДВС-СИНДРОМ...........................611
(Л.А. Алексеева, А.А. Рагимов, Ю.В. Никифоров)
8.1. Основные сведения о диссеминированном
внутрисосудистом свертывании крови.............611
8.2. Физиология системы гемостаза..............613
8.3. Этиология и патогенез ДВС-синдрома........623
8.4. Клиника ДВС-сивдрома......................639
8.5. Профилактика и терапия ДВС-синдрома.......642
8.6. Особенности ДВС-синдрома при различных
патологиях.....................................658
8.6.1. Сепсис..................................658
8.6.2. Синдром массивной гемотрансфузии .......664
8.6.3. ДВС-синдром в трансплантационной хирургии .. .666
8.6.4. ДВС-синдром после операций с искусственным
кровообращением ...............................669
8.6.5. Травма .................................672
8.6.6. 1емолитические трансфузионные осложнения ... .674
8.6.7. Онкологические заболевания .............677
8.6.8. Хроническая почечная недостаточность,
программный гемодиализ.........................678
8.6.9. Осложнения беременности и родов.........681
Список основной литературы.....................683
Глава 9. ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ
И ИНТЕНСИВНАЯ ТЕРАПИЯ В ХИРУРГИИ .. .689
(А.А. Рагимов, Г.Н. Щербакова, А.А. Еременко,
Ю.В. Никифоров)
Список основной литературы......................719
9
ОГЛАВЛЕНИЕ
Става 10. СОСУДИСТЫЕ ДОСТУПЫ
ДЛЯ ТРАНСФУЗИОЛОГИЧЕСКИХ
ПРОЦЕДУР..............................721
(А. А. Рагимов, И.Э. Байрамалибейли, А.А. Еременко,
Ю.В. Никифоров)
10.1. Венозный доступ........................721
10.1.1. Венепункция..........................722
10.1.2. Венесекция...........................752
10.1.3. Катетеризация вен....................754
10.2. Интрамедуллярный доступ................762
10.3. Артериальный доступ....................764
10.3.1. Пункция артерий......................765
10.3.2. Секция артерии ......................767
10.3.3. Катетеризация артерий................767
Список основной литературы...................772
СОКРАЩЕНИЯ__________
Сокращения
CHDA-1 С сао2 С\,О2 do2 FiO2 — цитрат-фосфат-декстроза-аденин — растяжимость — содержание кислорода в артериальной крови — содержание кислорода в венозной крови — доставка кислорода — фракционная концентрация кислорода во вду- ваемом (вдыхаемом) воздухе
pH Ра°2 — водородный показатель — парциальное давление кислорода в артериаль- ной крови
PvO2 — парциальное давление кислорода в венозной крови
расо2 — парциальное давление углекислого газа в арте- риальной крови
pvCO2 — парциальное давление кислорода в венозной крови
Hb HES — гемоглобин — гидроксиэтил крахмал в английской транскрип- ции
HLA — антигены главного комплекса гистосовмести- мости человека (human leucocyte antigens)
Ht Ig N PPSB RQ V АД АИК AJIT АПТВ — гематокрит — иммуноглобулины — общий азот — протромбиновый комплекс — дыхательный коэффициент — объем — артериальное давление — аппарат искусственного кровообращения — аланинтрансаминаза — активированное парциальное тромбопласти- новое время
АСГП АСП ACT — антисинегнойная плазма — антистафилококковая плазма — аспартатгрансаминаза
п
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
АТ-Ш — антитромбин III
АТФ — аденозинтрифосфорная кислота
ВИЧ — вирус иммунодефицита человека
ВПП — вспомогательное парентеральное питание
гэк — гидроксиэтилкрахмал
д — Дальтон (единица измерения молекулярной
массы)
ДВС-синдром — синдром диссеминированного внутрисосуди-
стого свертывания
дзлк — давление заклинивания в легочных капиллярах
жэ — жировая эмульсия
ивл — искусственная вентиляция легких
илп — искусственное лечебное питание
итт — инфузионно-трансфузионная терапия
кжст — толщина кожно-жировой складки
ККАЛ — килокалория (единица измерения энергоем-
кости)
код — коллоидно-осмотическое давление
К1ДС — кислотно-щелочное состояние
лк — лейкоцитный концентрат
лет — длинноцепочечные триглицериды
лтс — лейкотромбослой
ME — международные единицы (единица измере-
ния)
мм — молекулярная масса
мет — среднецепочечные триглицериды
нжк — незаменимые жирные кислоты
нпк — непрямое переливание крови
ОБ — общий белок
оо — основной обмен
опк — обменное переливание крови
отп — обогащенная тромбоцитами плазма
оцк — объем циркулирующей крови
оэ — отмытые эритроциты
пвп — поливинилпирролидон
пве — поливиниловый спирт
пнк — плазма нативная концентрированная
пп — парентеральное питание
12
СОКРАЩЕНИЯ
ппк — прямое переливание крови
ппп — полное парентеральное питание
ПФОС — перфторорганические соединения
РЭП — расчет энергии покоя
сзп — свежезамороженная плазма
спид — синдром приобретенного иммунодефицита
CPD — цитрат-фосфат-декстроза
тг — терапевтическая гемодилюция
тк — тробоцитный концентрат
ЦВД — центральное венозное давление
ЦБК — центральный венозный катетер
цмв — цитомегаловирус
цнс — центральная нервная система
чпп — частичное парентеральное питание
чсс — частота сердечного сокращения
ЩФ — щелочная фосфотаза
ЭВ — эритроцитная взвесь
эк — эритроконцентрат
ЭКГ — электрокардиограмма
эм — эритроцитная масса
ээг — электроэнцефалограмма
Введение
Парентеральное внутрисосудистое введение крови, ее компонен-
тов и препаратов, кровезаменителей, растворов лекарственных
и диагностических средств имеют важнейшее значение в процес-
се лечения многих патологических состояний: при хирургических
заболеваниях, в интенсивной терапии, анестезиологии, аку-
шерстве и гинекологии, педиатрии и др.
Комплексный подход в решении вопросов трансфузион-
но-инфузионного обеспечения больных, определяя поле деятель-
ности одного из разделов современной медицины — трансфузио-
логии, включает в себя:
• забор, переработку, хранение и распределение донорской
крови и ее компонентов;
• компонентную и препаратную гемотерапию;
• обеспечение инфекционной и изосерологической безо-
пасности гемотрансфузий;
• аутодонорство и аутогемотрансфузии (гемодилюцию, ре-
инфузию);
• трансфузиологическую гемокоррекцию (аферез, гемо-
диализ, гемосорбция, экстракорпоральное облучение крови,
иммуносорбция и др.);
• использование кровезамещающих растворов: гемодина-
мического и противошокового действия, дезинтоксикацион-
ных растворов, препаратов парентерального питания и др.;
• применение инфузионных растворов с диагностической
целью.
В специальной литературе можно встретить ряд терминов:
«трансфузиология», «трансфузионная медицина», «перелива-
ние крови», «служба крови» и т. п. Как правило, все вышепри-
веденные термины применяются как для описания процессов,
связанных с донорской кровью (заготовка, переработка, хране-
ние и клиническое применение), так и для определения комплек-
са лечебных мероприятий, связанных с использованием трансфу-
зиологического пособия для коррекции того или иного патоло-
гического состояния.
ВВЕДЕНИЕ
Несмотря на то что между процессами, объединенными
под тем или иным термином, имеется много общего, и их часто
используют как синонимы, необходимо различать то, что харак-
теризует особенности каждого:
«трансфузионная медицина» («трансфузиология») — наиболее
широкое понятие, охватывающее все разделы трансфузиологии;
«служба крови» — вопросы пропаганды и агитации донорства,
заготовки, переработки и хранения крови и ее компонентов;
«переливание крови» — часто используют по инерции (по-
казания к трансфузиям цельной консервированной крови край-
не ограничены) или в силу традиции (например, организован-
ный в 90-х годах XX столетия журнал «Переливание крови»).
Термин «трансфузионная медицина» («трансфузиология»)
получил признание во всех странах и стал общепринятым наз-
ванием отдельного раздела медицинской науки и практики, но-
вой медицинской специальности — трансфузиолога. В1998 го-
ду М3 РФ утвердило положение о враче-трансфузиологе и в
«Номенклатуру врачебных и провизорских специальностей»
была включена специальность — трансфузиолог.
Трансфузиология—раздел медицины, изучающий возможности
управления гомеостазом организма путем воздействия на системы
крови средствами и методами трансфузиологического пособия.
Трансфузиологическое пособие — комплекс лечебных,
профилактических и диагностических мер, включающее в себя:
—экстра- и интракорпоральные (васкулярные) методы (техно-
логии) непосредственного воздействия на кровь (гемаферез, гемо-
диализ, ультрофильтрация, фотомодификация, облучение и др.);
—трансфузионное пособие (трансфузионно-инфузионное) —
парентерально вводимые в сосудистое русло (внутривенно, вну-
триартериально, внутрилимфально) органические и неорганиче-
ские лекарственные средства — донорская кровь, ее компоненты
и препараты, кровезаменители, аутокровь и пр.;
—систему мониторинга безопасности и эффективности исполь-
зуемых в процессе лечения инфузионно-трансфузионных средств,
экстра- и интракорпоральных методов воздействия на кровь.
Трансфузиология преследует две главные цели:
—разработка и клиническое применение средств, методов и
рекомендаций для управления функциями организма путем напра-
15
ВВЕДЕНИЕ
вленного воздействия на системы крови (гемостаза, клеточного и
плазменного состава, кислотно-основного равновесия, агрегации,
иммунитета, водно-эликтролитного состава, белкового, липидно-
го и углеводного обмена и др.), и другие жидкие среды организма
(лимфа, спинномозговая и асцитическая жидкость и др.), а через
них на все органы и ткани организма;
—организация и оптимизация службы крови и трансфузиоло-
гической помощи.
Современная трансфузиология рассматривает целый ряд
вопросов от заготовки донорской крови, ее переработки на ком-
поненты, препараты, реагенты, до обеспечения всего трансфузио-
логического пособия в клинической практике: гемотерапии, эк-
стра- и интравоскулярных (корпоральных) процедур, парентераль-
ного питания и др.
Проблемы и задачи трансфузиологии формируются и решают-
ся в рамках четырех основных научно-практических направлений:
— служба крови (основная задача — заготовка и переработка
донорской крови на компоненты);
— клиническая трансфузиология (основная задача — исполь-
зование трансфузиологического пособия в профилактике и ле-
чении больных, гемотрансфузионных реакций и осложнений);
— трансфузионная иммунология (основная задача — сертифи-
кация крови доноров и больных, с целью обеспечения иммуно-
логической безопасности и эффективности гемотрансфузий);
—производственная трансфузиология (основная задача —
производство препаратов крови и реагентов из компонентов
донорской крови), существующие в тесной взаимосвязи
между собой и другими разделами медицины — хирургии, те-
рапии, фармакологии и др. [Рагимов А.А., 2002, 2003].
Несмотря на важнейшее значение службы крови,
трансфузионной иммунологии и производственной тран-
сфузиологии, в ближайшие годы основной «точкой рос-
та» всей трансфузионной медицины станет клиническая
трансфузиология.
Клиническая трансфузиология — раздел трансфузиоло-
гии, изучающий возможности управления гомеостазом
организма при различных патологических состояниях
средствами и методами трансфузиологического пособия.
16
ВВЕДЕНИЕ
В последние годы круг вопросов, решаемых клини-
ческой трансфузиологией, значительно расширился за
счет новых медицинских технологий, позволяющих че-
рез воздействие на кровь достигать лечебного эффекта.
Это методы экстракорпорального воздействия на кровь:
гемаферез, экстракорпоральная детоксикация — гемо-
сорбция, иммуносорбция, гемофильтрация, ультрафильт-
рация, экстракорпоральное облучение крови. Очевид-
но, сюда же можно отнести и методы гемодиализа, искус-
ственного кровообращения, парентерального питания.
Особое значение трасфузионно-инфузионные меро-
приятия имеют в интенсивной терапии и при проведении
реанимационых мероприятий. Практически ни одна про-
должительная лечебная процедура в отделении интенсив-
ной терапии или реанимации не проходит без применения
различных инфузионных растворов, а в ряде случаев —
без компонентов крови, кровезаменителей и препаратов
для парентерального питания.
В настоящее время назрела необходимость регламенти-
рования обоснованных и по возможности более простых,
эффективных и безопасных методов лечения, базирующих-
ся на комплексном применении современного медицин-
ского оборудования и лекарственных препаратов, включая
большой арсенал инфузионно-трансфузионных средств и
компонентов крови.
ГЛАВА!
Трансфузионно-инфузионное
пособие
1.1. Основные средства трансфузионно-
инфузионного пособия
Дефицит объема циркулирующей в кровяном русле и в
органах организма жидкости — одно из наиболее часто
встречающихся состояний у пациентов отделения ин-
тенсивной терапии. При выраженной гиповолемии происхо-
дит нарушение тканевой оксигенации и возникают клиниче-
ские и метаболические признаки циркуляторного шока. Это
состояние может осложниться кровотечением, сепсисом, пан-
креатитом, анафилактическими реакциями и диабетическим
кетоацидозом. В первую очередь основные лечебные меропри-
ятия направлены на восполнение объема плазмы. Однако до
сих пор вопросы тактики инфузионной терапии остаются дис-
кутабельными.
Не каждая клиника может позволить себе иметь в своем арсе-
нале весь набор трансфузиологического пособия. Как правило, в
этом нет необходимости, да и трудновыполнимо. Содержание
трансфузиологического пособия клиники формируется и наполня-
ется в зависимости от конкретных клинических задач, коечного
фонда, аппаратного оснащения, квалификации персонала, наличия
профильных отделений, хирургической активности и пр.
В настоящей книге сведения о трансфузионно-инфузион-
ных средствах представлены в виде лекарственного формуляра
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ____________
(табл. 1.1), который определяется как список лекарственных
средств, обязательных для применения в данном учреждении, ре-
гионе и т. д. При составлении формуляра авторы ориентирова-
лись на многопрофильную клинику, где имеются все основные
лечебные отделения — хирургические, гинекологические, тера-
певтические и др. Очевидно, что в зависимости от задач лечеб-
ного учреждения, коечного фонда, клинических отделений и
пр. состав лекарственного формуляра трансфузиологического по-
собия может быть изменен.
Трансфузионно-инфузионное пособие можно разделить на
две взаимодополняющие части:
а) донорская (и/или ауто-) кровь и ее компоненты;
б) лекарственные препараты (кровезаменители, препараты
парентерального питания, препараты из донорской крови и пр.).
Компоненты крови — клетки крови (эритроциты, лейкоци-
ты, тромбоциты) и плазма крови и ее производные с сохранен-
ными индивидуальными особенностями донора (ABO, RhO (D),
HLA, НРА, KELL, MNS и др.). При применении компонентов
донорской крови нельзя полностью исключить риск заражения
гемотрансмиссивными инфекциями (например, при кроводаче
в серонегативный период после заражения).
Препараты крови — трансфузионные среды, приготовлен-
ные из компонентов крови донора путем более сложной и мно-
гоэтапной переработки, в результате используемых технологий
лишенные индивидуальных особенностей донора. В препаратах
крови полностью исключена возможность наличия возбудите-
лей гемотрансмиссивных инфекций.
Таблица 1.1. Пример формуляра трансфузионно-
инфузионного пособия для многопрофильной клиники
1. КРОВЬ И ЕЕ КОМПОНЕНТЫ
1.1. Цельная консервированная донорская кровь:
• кровь консервированная;
• кровь консервированная, фильтрованная.
1.2. Компоненты консервированной донорской крови:
• эритроцитная масса;
• эритроцитная масса, обедненная лейкоцитами и тромбоцитами;
19
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Продолжение табл. 1.1
• эритроцитная взвесь с физиологическим раствором; '
• эритроцитная взвесь, размороженная и отмытая;
• плазма свежезамороженная;
• плазма антистафилококковая человеческая и плазма
антисинегнойная человеческая;
• криопреципитат;
• плазма нативная, концентрированная;
• тромбоцитный концентрат;
• лейкоцитный концентрат, гамма-облученный.
1.3. Цельная консервированная аутокровь:
• аутокровь консервированная;
• аутокровь консервированная, фильтрованная;
• аутокровь полостная, консервированная, фильтрованная для
реинфузии.
1.3.1. Компоненты аутологичной (аутогенной)
консервированной крови:
• аутоэритроцитная масса;
• аутоэритроцитная масса, обедненная лейкоцитами и
тромбоцитами;
• аутоэритроцитная взвесь;
• аутоэритроцитная взвесь, размороженная и отмытая;
• аутоплазма свежезамороженная из дозы крови;
• аутоплазма свежезамороженная, полученная дискретным
аферезом;
• аутоплазма свежезамороженная, полученная автоматическим
аферезом;
• аутоплазма свежезамороженная, фильтрованная.
2. ПРЕПАРАТЫ КРОВИ
• альбумин;
• протеин;
• иммуноглобулин нормальный человеческий для
внутримышечного введения;
• иммуноглобулин нормальный человеческий для внутривенного
введения;
• иммуноглобулин антистафилококковый человека жидкий;
• иммуноглобулин антирезусный.
20
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Продолжение табл. 1.1
3. КРОВЕЗАМЕНИТЕЛИ
3.1. Кровезаменители гемодинамического действия:
• желатиноль;
• гелофузин;
• модежель;
• полиглюкин;
• полифер;
• аналоги полиглюкина;
• реополиглюкин;
• реомакродекс - аналог реополиглюкина;
• реоглюман;
• полиоксидин;
• полиоксифумарин;
• волекам;
• инфукол 6 %-ый;
• инфукол 10 %-ный;
• волювен;
• хаес-стерил 10 %-ный;
• гемохес 6 %-, 10 %-ный;
• рефортан;
• рефортан плюс;
• стабизол.
3.2. Кровезаменители дезинтоксикационного действия:
• гемодез;
• неогемодез;
• глюконеодез;
• полидез.
3.3. Синтетические переносчики кислорода:
• перфторан;
• геленпол.
3.4. Регуляторы водно-солевого обмена:
• раствор натрия хлорида 0,9 %-ный;
• дисоль;
• лактосол;
• трисамин;
• трисоль;
• ацесоль;
21
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Окончание табл. 1.1
• квинтасоль;
• хлосоль, КМА, ионостерил.
3.5. Препараты для парентерального питания
3.5.1. Растворы аминокислот:
• полиамин (хаймикс);
• вамины (18 EF);
• аминосгерил КЕ10 %-ный;
• аминоплазмаль Е 10 %-ный;
• аминоплазмаль Е 5 %-ный;
• инфезол40—100;
• фреамин III 8,5 %-ный;
• аминосолы;
• аминоплазмаль Гепа 10 %-ный;
• аминосгерил N Гепа 5,8 %-ный;
• аминосгерил КЕ Нефро;
• нефрамин;
• нефротек;
• ваминолакт;
• аминовен инфант 10 %-ный;
• дипептивен.
3.5.2. Углеводы:
• глюкозы раствор для инфузий 5 %, 10 %,20 %,40 %-ный;
• глюкозы 40 %-ный и аскорбиновой кислоты 1 %-ный раствор;
• глюкозы 40 %-ный с аскорбинатом магния 5 %-ный раствор;
• глюкоза 10 %-ная декстроза;
• глюкостерил 20 %ный декстроза;
• декстроза 5 %-, 10 %-, 20 %-ная.
3.5.3. Жировые эмульсии:
• интралипид 10 %-, 20 %-ный;
• липовеноз 10 %-, 20 %-ный;
• липофундин МСТ/ЛСТ 10 %-, 20 %-ный;
• инфузолипол 10 %-ный.
3.5.4. Микродобавки к препаратам парентерального питания:
• аддамельЫ;
• виталипидЫ;
• солувит!*!
• церневит
22
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Основу формуляра трансфузионно-инфузионного пособия
многопрофильной клиники составил список средств для ин-
фузионно-трансфузионных процедур (табл. 1.2). Хотя предста-
вленный список и не является «официальным», он позволяет
трансфузиологам и другим специалистам ориентироваться в до-
статочно большом ассортименте как отечественных, так и зару-
бежных препаратов крови человека, кровезаменителей, препа-
ратов для парентерального питания и др.
Все лекарственные средства списка разделены на 8 групп,
каждая из которых состоит из подгрупп:
1. Искусственные переносчики газов крови.
2. Корректоры гемостаза и фибринолиза.
2.1. Корректоры сосудисто-тромбоцитарного гемостаза.
2.2. Корректоры плазменно-коагуляционного гемостаза.
2.3. Препараты фибринолитического действия.
3. Средства коррекции иммунитета.
3.1. Компоненты крови д ля иммунозаместительной терапии.
3.2. Препараты крови для иммунозаместительной терапии.
4. Объемозамещающие плазмозаменители.
4.1. Препараты плазмы человека.
4.2. Объемозамещающие искусственные коллоиды.
5. Дезинтоксикационные кровезаменители.
5.1. Препараты низкомолекулярного поливинилпирро-
лидона.
5.2. Препараты плазмы крови человека.
6. Препараты для парентерального питания.
6.1. Белковые гидролизаты.
6.2. Аминокислотные растворы.
6.3. Углеводные растворы.
6.4. Жировые эмульсии.
6.5. Растворы витаминов.
6.6. Микроэлементы.
7. Корректоры водно-солевого и кислотно-основного рав-
новесия.
7.1. Солевые растворы.
7.2. Корректоры электролитного и кислотно-основного со-
стояния.
8. Гемоконсерванты.
23
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Таблица 1.2. Список основных препаратов трансфузионно-
инфузионного пособия
1. Искусственные переносчики газов крови
1.1. На основе перфторуглеродов: Перфторан.
1.2. На основе гемоглобина: Геленпол.
2. Корректоры гемостаза и фибринолиза
2.1. Препараты крови человека: иммунат; коэйт ДВИ; октанат;
фактор VIII U; эмоклот Д. И.; антигемофильный фактор челове-
ка М (антигемофильный фактор человека, гемофил М); ко-
найн 80; иммунин; октанайн; репленин; фэйба ТИМ 4; агем-
фил В; препарат PPSB; фибриноген; аимафикс Д. И.
2.2. Рекомбинантные препараты: Ново Сэвен.
2.3. Препараты фибринолитического действия: фибринолизин;
целиаза (стрептокиназа); авелизин (стрептокиназа); актилизе
(алтеплаза); кабикиназа (стрептокиназа); пуроцин (урокиназа);
стрептаза (стрептокиназа); стрептокиназа; укидан (урокиназа);
урокиназа.
3. Средства коррекции иммунитета
3.1. Препараты крови для иммунозаместительной терапии
3.1.1. Препараты из крови человека: иммуноглобулин человека
нормальный для внутримышечного введения; иммуноглобулин
человека нормальный для внутривенного введения; иммуногло-
булин антистафилококковый человека для внутримышечного
введения; иммуноглобулин антистафилококковый человека для
внутривенного введения; иммуноглобулин противостолбнячный
человека для внутримышечного введения; иммуноглобулин че-
ловека антирезус Rh^ (D); иммуноглобулин человека против ци-
томегаловируса — цитотект; иммуноглобулин человека против
вируса гепатита В для внутривенного введения — гепатект; имму-
ноглобулин человека против вируса гепатита В для внутримы-
шечного введения — антигеп; поливалентный внутривенный им-
муноглобулин человека — пентаглобин; иммуноглобулин против
клещевого энцефалита человеческий жидкий; иммуноглобулин
человека для профилактики бешенства — имогам рабис; иммуно-
глобулин человека противококлюшный антитоксический; имму-
ноглобулин противогриппозный человека для внутримышечного
введения; иммуноглобулин антитоксический противодифтерий-
ный человека для внутримышечного введения;
24
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Продолжение табл. 1.2
интраглобин; октагам; веноглобулин; БИАВЕН; ВИГАМ-Лик-
вид; ВИГАМ-С; сыворотка Ф-стерилизованная; иммуноглобулин
противоаллергический человека; гистаглобулин; гистаглобин
триплекс; гистасероглобулин; гистаглобин; альфа-феррон; бета-
феррон; интерферон человеческий лейкоцитарный; интерферон
человеческий рекомбинантный; лейкинферон; вэллферрон; эбе-
рон-альфа-Р.
3.1.2. Препараты из крови животных: иммуноглобулин антираби-
ческий из сыворотки крови лошади жидкий; сыворотки противо-
ботулические типов А, В, Е лошадиные очищенные концентри-
рованные жидкие; иммуноглобулин против венесуэльского энце-
фаломиелита из сыворотки крови лошади жидкий; сыворотки
противогангренозные поливалентные лошадиные очищенные
концентрированные жидкие; сыворотка противодифтерийная
лошадиная очищенная концентрированная жидкая; иммуногло-
булин против клещевого энцефалита из сыворотки лошадей жид-
кий; иммуноглобулин противолептоспирозный из сыворотки
крови волов жидкий; иммуноглобулин против лихорадки Эбола
из сыворотки крови лошади жидкий; глобулин противосибиреяз-
венный лошадиный жидкий; сыворотка противостолбнячная ло-
шадиная очищенная концентрированная жидкая; иммуноглобу-
лин против японского энцефалита из сыворотки лошадей жид-
кий; иммуноглобулин G-моноклональный человеческий антире-
зус Rh0 (D); АТГАМ; антилимфолин Кз; антилимфолин Кр.
4. Объемозамещающие плазмозаменители
4.1. Препараты плазмы человека: альбумина раствор 5 %-ный;
альбумина раствор 10 %-ный; альбумина раствор 20 %-ный; про-
теин; лактопротеин; лактосорбал; альбумин человеческий 20 %-
ный; альбумин человеческий Десау 5 %-ный; альбумин человече-
ский Десау 20 %-ный; зенальб 20 %-ный; плазбумин-5; плазбу-
мин-20.
4.2. Объемозамещаюшие искусственные коллоиды
4.2.1. Препараты желатина: гелофузин; геможель; плазможель;
желатиноль.
4.2.2. Препараты декстрана: полиглюкин; неорондекс; макро-
декс; интрадекс; лонгастерил-70;
25
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Продолжение табл. 1.2
декстран-40; декстран-60/70; реополиглюкин; реополиглюкин с
глюкозой; реомакродекс; лонгастерил; полиглюсоль; ломодекс;
реоглюман.
4.2.3. Препараты гидрооксиэтилкрахмала: плазмастерил; стаби-
зол; 6-ХЕС; волекам; инфукол; рефортан; ХАЕС-стерил; рефор-
тан плюс.
4.2.4. Препараты полиэтиленгликоля: полиоксидин; полиокси-
фумарин.
5. Дезинтоксикационные плазмозаменители
5.1. Препараты низкомолекулярного поливинилпирролидона: ге-
модез Н; неогемодез (повидон); неокомпенсан; глюконеодез;
аминодез.
5.2. Препараты плазмы крови человека: церулоплазмин.
6. Препараты для парентерального питания
6.1. Белковые гидролизаты: инфузамин; гидрамин.
6.2. Аминокислотные растворы
6.2.1. Аминокислотные растворы общего типа: полиамин; вамин-
14; вамин-14 без электролитов; вамин-18; вамин-18 без электро-
литов; аминосгерил КЕ 10 %-ный безуглеводный; аминосгерил II
Новум; аминосгерил III Новум; аминоплазмаль 10 %-ный Е;
аминоплазмаль 10 %-ный СЕ; инфезол-40; фреамин; аминосол;
аминосол КЕ; интрафузин.
6.2.2. Аминокислотные растворы при заболевании почек: амино-
сгерил КЕ Нефро безуглеводный; нефроплазмаль; нефрамин.
6.2.3. Аминокислотные растворы при заболевании печени: ами-
ностерил Н Гепа; аминоплазмаль Гепа; гепасол А.
6.2.4. Аминокислотные растворы для детского питания: амино-
пед; ваминолакт; аминовеноз Н детский.
6.3. Углеводные растворы: глюкозы раствор для инфузий 5 %-
ный; глюкозы раствор для инфузий 10 %-ный; глюкозы раствор
для инфузий 20 %-ный; глюкозы раствор для инфузий 40 %-ный;
глюкозы 40 %-ной и аскорбиновой кислоты 1 %-ный раствор;
глюкозы 40 %-ной с аскорбинатом магния 5 %-ный раствор; глю-
коза 10 %-ная декстроза; глюкостерил 20 %-ный декстроза; дек-
строза 5 %-ная; декстроза 10 %-ная; декстроза 20 %-ная; фибри-
носол.
26
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ_______________
Окончание табл. 1.2
6.4. Жировые эмульсии: инфузолипол; интралипид 10 %-ный;
интралипид 20 %-ный; интралипид 30 %-ный; липовеноз; липо-
фундин.
6.5. Растворы витаминов: витогепат; солувит Н; церневит; ра-
створ витамина С.
6.6. Микроэлементы: аддамель.
7. Корректоры водно-солевого и кислотно-основного равновесия
7.1. Солевые растворы: натрия хлорида раствор для инфузий изо-
тонический 0,9 %-ный; натрия хлорида раствор 10 %-ный; нат-
рия хлорид 0,9 %-ный; раствор натрия хлорида 0,9 %-ный и 5 %-
ной глюкозы для внутривенных вливаний; раствор натрия хлори-
да изотонический.
7.2. Корректоры электролитного и кислотно-основного состоя-
ний: ацесоль; дисоль; трисоль; квинтасоль; йоностерил; лакта-
сол; мафусол; маннита раствор 15 %-ный (маннитол); сорбита
раствор 20 %-ный (сорбитол); натрия гидрокарбоната раствор
4 %-ный; нормасол; раствор Рингера; раствор Рингера лактата;
раствор Хартмана; Рингер солюшн; Рингера ацетат; хлосоль.
8. Гемоконсерванты-, лейкокриодмац; модежель; цитрат декстроза;
тромбокриодмац; фоглюк; эритронаф; эритропифаден; глицеро-
лит-57; глюгицир; ЦФДА-1; Цитрат натрия раствор 4 %-ный;
ЦАГМ; ЦФД; ЦФД/АДСОЛ; ЦФД/САГМ; Хельм-Гемакон
ЦФД-А.
Список разработан при участии: А.И. Воробьева (директо-
ра ГНЦ РАМН), В.М. Тородецкого (заместителя директора ГНЦ
РАМН), В.Н. Мшунова (заведующего лабораторией препаратов
плазмы крови ГНЦ РАМН), Г.К. Орловой (заведующей отделом
заготовки крови и ее компонентов ГНЦ РАМН), Л.Л. Шумило-
вой (заведующей отделением сбора крови и ее компонентов
ГНЦ РАМН), Б.В. Зингермана (заведующего отделом информа-
ции ГНЦ), Е.А. Селиванова (директора Российского НИИ гема-
тологии и трансфузиологии М3 РФ), Е.П. Сведенцова (замести-
теля директора Кировского НИИ гематологии и переливания
крови М3 РФ), А.А. Рагимова (заведующего кафедрой «Кли-
ническая трансфузиология» ММАим. И.М. Сеченова), М.И. Ла-
заренко (начальника медицинского отделения заготовки крови
27
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
СПК Главного военного клинического госпиталя им. Н.Н. Бур-
денко МО РФ).
Очевидно, что в объеме одной книги не представляется воз-
можным отразить особенности всех инфузионно-трансфузи-
онных лекарственных средств и компонентов крови. Ниже опи-
саны те из них, которые наиболее часто используются в клини-
ческой практике и/или должны составлять основу лекарствен-
ного формуляра трансфузионно-инфузионного пособия много-
профильной клиники.
Приведенные в книге компоненты крови соответствуют
требованиям отраслевого классификатора 91500.18.0001-2001
«Консервированная кровь человека и ее компоненты» (далее
ОКККЧиК).
Отраслевой классификатор ОК ККЧиК разработан спе-
циалистами ведущих учреждений Службы крови и трансфузио-
логии страны (Гематологическим научным центром РАМН, Рос-
сийским НИИ гематологии и трансфузиологии М3 РФ, Киров-
ским НИИ гематологии и переливания крови М3 РФ, Главным
военным клиническим госпиталем им. Н.Н. Бурденко МО РФ,
Российским научным центром хирургии РАМН, Московской ме-
дицинской академии им. И.М. Сеченова М3 РФ, Государствен-
ным институтом кровезаменителей и медицинских препаратов
Минздрава РФ) с учетом принципов, правил и требований, уста-
новленных в стандартах Государственной системы стандартиза-
ции РФ (ГОСТ Р 1.0-92-ГОСТ Р 1.5-92), приказов Минздрава РФ
«О введении в действие отраслевого стандарта «Стандарты ка-
чества лекарственных средств. Основные положения»» № 82 от
29 февраля 2000 г., «О введении в действие отраслевого стандар-
та «Порядок разработки, согласования, принятия, внедрения и
ведения нормативных документов системы стандартизации в
здравоохранении»» № 302 от 31 июля 2000 г., «О введении в дей-
ствие отраслевого стандарта «Принципы и порядок построения
классификаторов в здравоохранении. Общие положения»» № 301
от 31 июля 2000 г. и практического опыта отечественной и меж-
дународной классификации компонентов крови.
Отраслевой классификатор ОК ККЧиК 30 октября 2001 г.
рассмотрен и принят Экспертным советом по стандартизации в
здравоохранении М3 России.
28
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ____________
«Консервированная кровь человека и ее компоненты» (ОК
ККЧиК) — систематизированный свод лечебных средств, приме-
няемых для оказания трансфузионной помощи, разрешенных к
медицинскому применению, предназначен для применения в ли-
цензированных и аттестованных учреждениях здравоохранения
вне зависимости от ведомственной подчиненности, которым
разрешена заготовка, переработка, хранение донорской крови и
ее компонентов (разделы III и IV Закона Российской Федерации
от 09.06.93 № 5142-1 «О донорстве крови и ее компонентов»),
В ОК ККЧиК-стандарте используются термины в интерпре-
тации, делающей их однозначными для восприятия всеми участ-
никами лечебно-диагностического процесса (табл. 1.3).
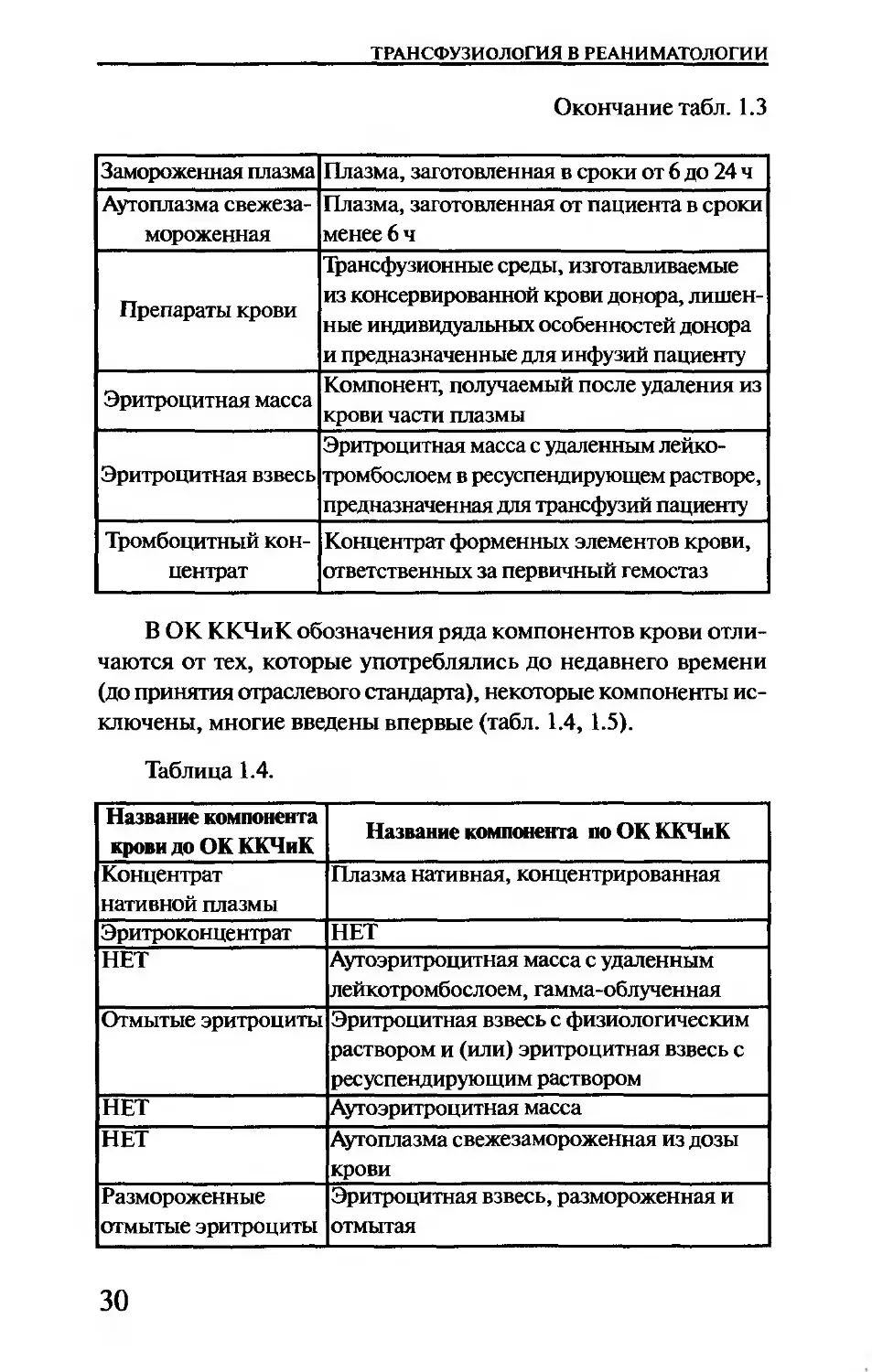
Таблица 1.3
Аферез Процесс, при котором один или более компо- нентов донорской крови избирательно изымают из нее, возвращая донору остальные составляю- щие компоненты донорской крови
Кровь консер- вированная Цельная кровь, взятая у донора в контейнер с консервантом и сохраненная официально разре- шенным способом. Предназначена для фракци- онирования или для трансфузий (при отсут- ствии донорских эритроцитов)
Компоненты крови Клетки крови (эритроциты, лейкоциты, тромбо- циты) и плазма крови с сохраненными индиви- дуальными особенностями донора (ABO, RhO (D), HLA, НРА, KEL, MNS и др.)
Криопреципи- тат Компонент плазмы крови, обладающий высо- кой антигемофильной активностью благодаря содержанию в нем фактора свертывания крови VIII, фактора Виллебранда и фибриногена
Плазма натив- ная концентри- рованная Производное супернатантной фракции плазмы с повышенным содержанием фактора IX
Плазма Часть крови, остающаяся после отделения фор- менных элементов крови
Свежезаморо- женная плазма Плазма, заготовленная в сроки менее 6 ч
29
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Окончание табл. 1.3
Замороженная плазма Плазма, заготовленная в сроки от 6 до 24 ч
Аутоплазма свежеза- мороженная Плазма, заготовленная от пациента в сроки менее 6 ч
Препараты крови Трансфузионные среды, изготавливаемые из консервированной крови донора, лишен- ные индивидуальных особенностей донора и предназначенные для инфузий пациенту
Эритроцитная масса Компонент, получаемый после удаления из крови части плазмы
Эритроцитная взвесь Эритроцитная масса с удаленным лейко- тромбослоем в ресуспендирующем растворе, предназначенная для трансфузий пациенту
Тромбоцитный кон- центрат Концентрат форменных элементов крови, ответственных за первичный гемостаз
В ОК ККЧиК обозначения ряда компонентов крови отли-
чаются от тех, которые употреблялись до недавнего времени
(до принятия отраслевого стандарта), некоторые компоненты ис-
ключены, многие введены впервые (табл. 1.4, 1.5).
Таблица 1.4.
Название компонента крови до ОК ККЧиК Название компонента по ОК ККЧиК
Концентрат нативной плазмы Плазма нативная, концентрированная
Эритроконцентрат НЕТ
НЕТ Аутоэритроцитная масса с удаленным лейкотромбослоем, гамма-облученная
Отмытые эритроциты Эритроцитная взвесь с физиологическим раствором и (или) эритроцитная взвесь с ресуспендирующим раствором
НЕТ Аутоэритроцитная масса
НЕТ Аутоплазма свежезамороженная из дозы крови
Размороженные отмытые эритроциты Эритроцитная взвесь, размороженная и отмытая
30
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
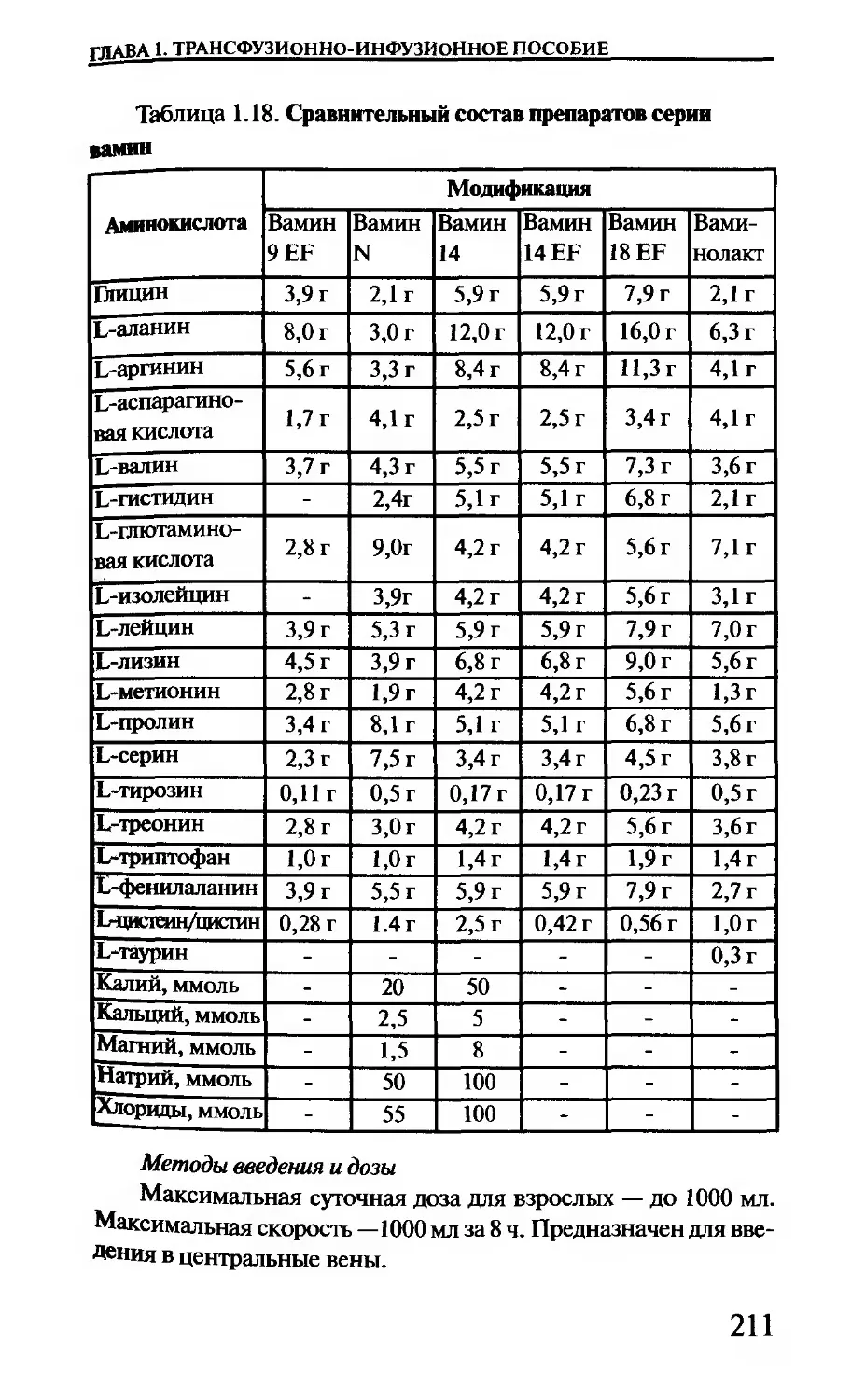
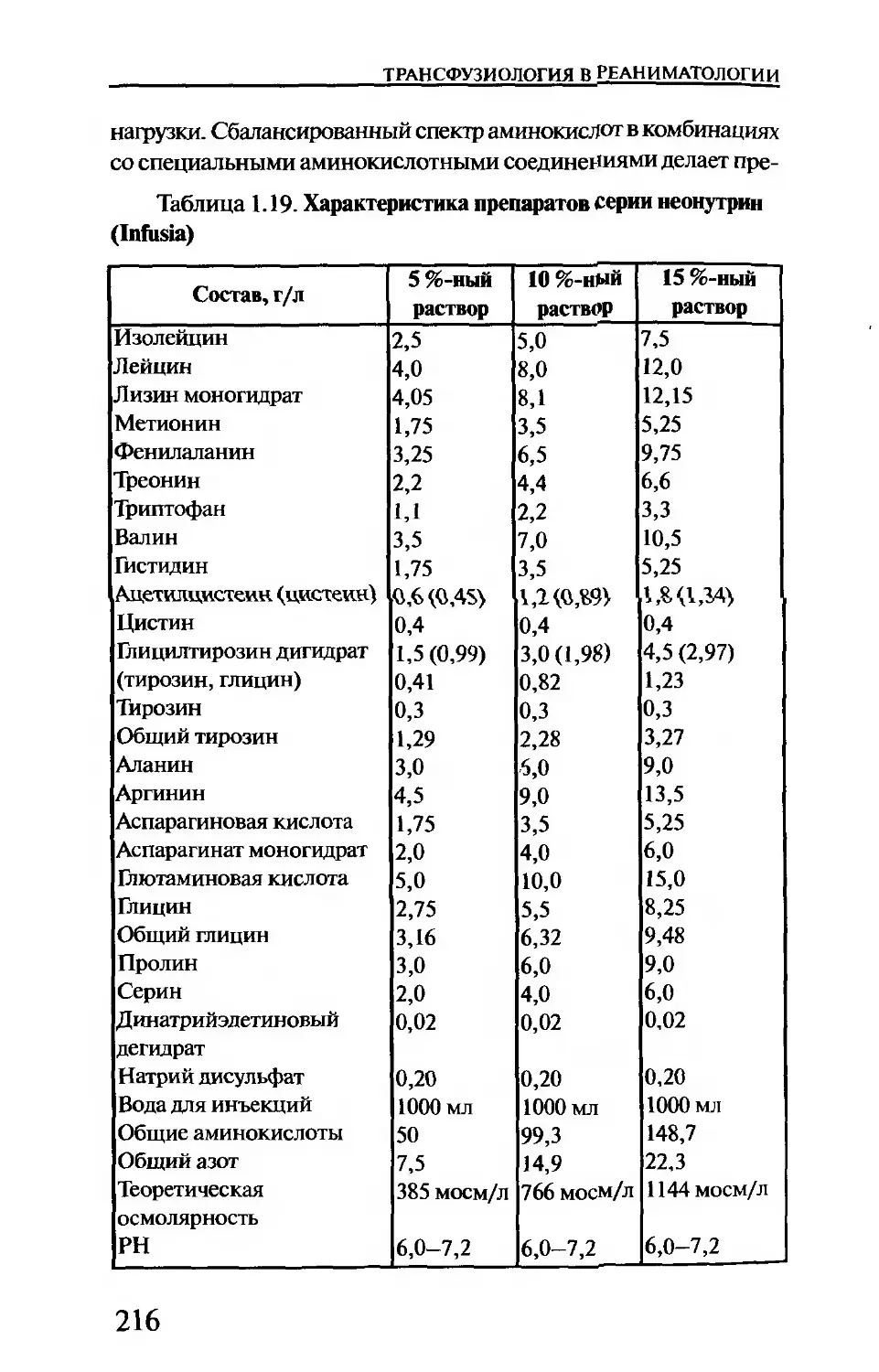
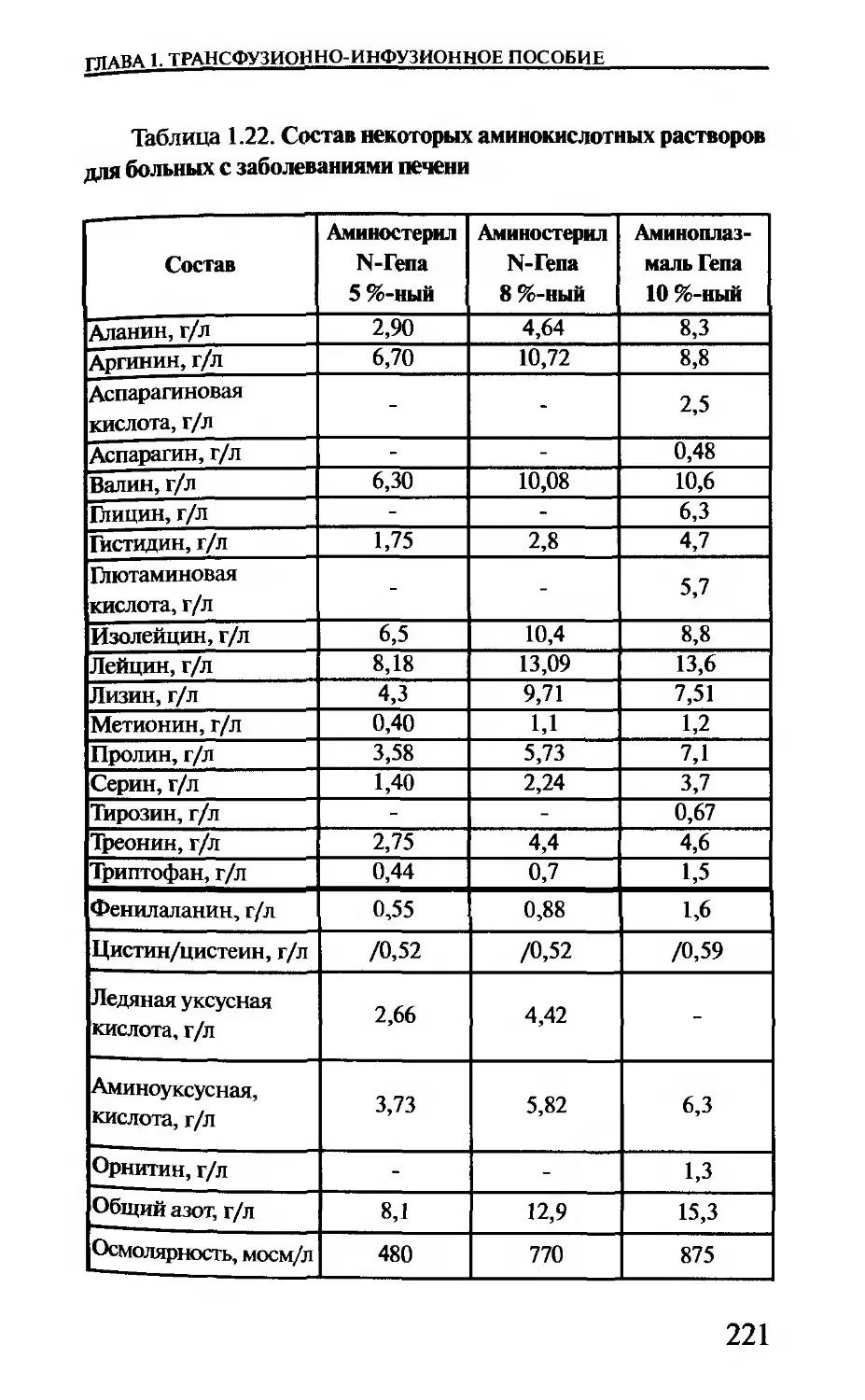
Таблица 1.5. Отраслевой классификатор
«Консервированная кровь человека и ее компоненты»
01 ПЕРЕНОСЧИКИ ГАЗОВ КРОВИ
01.01 Компоненты консервированной донорской крови
01.01.001 Эритроцитная масса
01.01.002 Эритроцитная масса, фильтрованная
01.01.003 Эритроцитная масса, гамма-облученная
01.01.004 Эритроцитная масса, обедненная лейкоцитами и тромбоцитами
01.01.005 Эритроцитная масса с удаленным лейкотромбослоем
01.01.006 Эритроцитная масса с удаленным лейкотромбослоем, фильтрованная
01.01.007 Эритроцитная масса с удаленным лейкотромбослоем, гамма-облученная
01.01.008 Эритроцитная взвесь с физиологическим раствором
01.01.009 Эритроцитная взвесь с ресуспендирующим раствором
01.01.010 Эритроцитная взвесь с ресуспендирующим раствором, фильтрованная
01.01.011 Эритроцитная взвесь с ресуспендирующим раствором, гамма-облученная
01.01.012 Эритроцитная взвесь, размороженная и отмытая
01.02 Компоненты аутологичной (аутогенной)
консервированной крови
01.02.001 Аутоэритроцитная масса
01.02.002 Аутоэритроцитная масса, фильтрованная
01.02.003 Аутоэритроцитная масса, гамма-облученная
01.02.004 Аутоэритроцитная масса, обедненная лейкоцитами и тромбоцитами
01.02.005 Аутоэритроцитная масса с удаленным лейкотромбослоем, фильтрованная
01.02.006 Аутоэритроцитная масса с удаленным лейкотромбослоем, гамма-облученная
01.02.007 Аутоэритроцитная взвесь с физиологическим раствором
01.02.008 Аутоэритроцитная взвесь с ресуспендирующим раствором
31
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Продолжение табл. 1.5
01.02.009 Аутоэритроцитная взвесь с ресуспендирующим раствором, фильтрованная
01.02.010 Аутоэритроцитная взвесь с ресуспендирующим раствором, гамма-облученная
01.02.011 Аутоэритроцитная взвесь, размороженная и отмытая
01.03 Цельная консервированная донорская кровь
01.03.001 Кровь консервированная
01.03.002 Кровь консервированная, фильтрованная
01.04 Цельная консервированная аутокровь
01.04.001 Аутокровь консервированная
01.04.002 Аутокровь консервированная, фильтрованная
01.04.003 Аутокровь полостная, консервированная, фильтрованная для реинфузии
02 КОРРЕКТОРЫ ГЕМОСТАЗА И ФИБРИНОЛИЗА
02.01 Корректоры сосудисто-тромбоцитного гемостаза
02.01.001 Тромбоцитный концентрат из дозы крови
02.01.002 Тромбоцитный концентрат из дозы крови, гамма- облученный
02.01.003 Тромбоцитный концентрат, пулированный, монодонорский
02.01.004 Тромбоцитный концентрат, пулированный, монодонорский, фильтрованный
02.01.005 Тромбоцитный концентрат, пулированный, монодонорский, гамма-облученный
02.01.006 Тромбоцитный концентрат, пулированный, монодонорский, гамма-облученный, фильтрованный
02.01.007 Плазма, обогащенная тромбоцитами, гамма- облученная
02.01.008 Тромбоцитный концентрат, пулированный, полидонорский
02.01.009 Тромбоцитный концентрат, пулированный, полидонорский, гамма-облученный
02.01.010 Тромбоцитный концентрат, пулированный, полидонорский, фильтрованный
32
t, ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Продолжение табл. 1.5
02.01.011 Тромбоцитный концентрат, пулированный, полидонорский, гамма-облученный, фильтрованный
02.01.012 Тромбоцитный концентрат, пулированный, полидонорский, полуавтоматический
02.01.013 Тромбоцитный концентрат, пулированный, полидонорский, полуавтоматический, гамма- облученный
02.01.014 Тромбоцитный концентрат, пулированный, полидонорский, полуавтоматический, фильтрованный
02.01.015 Тромбоцитный концентрат, пулированный, полидонорский, полуавтоматический, гамма- облученный, фильтрованный
02.01.016 Тромбоцитный концентрат, полученный дискретным аферезом
02.01.017 Тромбоцитный концентрат, полученный дискретным аферезом, гамма-облученный
02.01.018 Тромбоцитный концентрат, полученный дискретным аферезом, фильтрованный
02.01.019 Тромбоцитный концентрат, полученный дискретным аферезом, гамма-облученный, фильтрованный
02.01.020 Тромбоцитный концентрат, полученный автоматическим аферезом
02.01.021 Тромбоцитный концентрат, полученный автоматическим аферезом, гамма-облученный
02.01.022 Тромбоцитный концентрат, полученный автоматическим аферезом, фильтрованный
02.01.023 Тромбоцитный концентрат, полученный автоматическим аферезом, гамма-облученный, фильтрованный
02.01.024 Тромбоцитный концентрат размороженный
02.02 Копоектопы плазменно-коагуляиионного гемостаза
донорские
02.02.001 Плазма свежезамороженная из дозы крови
02.02.002 Плазма свежезамороженная, полученная дискретным аферезом
33
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Окончание табл. 1.5
02.02.003 Плазма свежезамороженная, полученная автоматическим аферезом
02.02.004 Плазма свежезамороженная, фильтрованная
02.02.005 Плазма замороженная
02.02.006 Плазма замороженная, фильтрованная
02.02.007 Криопреципитат
02.02.008 Плазма нативная, концентрированная
02.03 Корректоры плазменно-коагуляционного гемостаза
аутологичные (аутогенные)
02.03.001 Аутоплазма свежезамороженная из дозы крови
02.03.002 Аутоплазма свежезамороженная, полученная дискретным аферезом
02.03.003 Аутоплазма свежезамороженная, полученная автоматическим аферезом
02.03.004 Аутоплазма свежезамороженная, фильтрованная
03 СРЕДСТВА КОРРЕКЦИИ ИММУНИТЕТА
03.01 Компоненты крови для иммунозаместительной
терапии |
03.01.001 Плазма противопротейная человеческая
03.01.002 Плазма антисинегнойная человеческая
03.01.003 Плазма антисинегнойная антитоксическая человека
03.01.004 Плазма антистафилококковая человеческая
03.01.005 Лейкоцитный концентрат, гамма-облученный
Примечания: В ОК ККЧиК предусмотрена трехступенчатая
классификация. На каждой ступени классификация осуществля-
ется по значимым классификационным признакам.
На первой ступени классификации располагают типы ком-
понентов консервированной крови человека, на второй — клас-
сы компонентов консервированной крови человека, на третьей —
виды компонентов консервированной крови человека. Таким
образом, каждый компонент консервированной крови человека
имеет семизначный цифровой код следующей структуры:
XX. XX. XXX
XX — код типа компонента;
34
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
ХХ.ХХ — код класса компонента;
ХХ.ХХ.ХХХ —- код вида компонента.
При этом:
• код типа ОК ККЧиК принимает значение от 01 до 99;
• код класса ОК ККЧиК принимает значение от 01 до 99;
• код вида ОК ККЧиК принимает значение от 001 до 999.
Пример:
01 ПЕРЕНОСЧИКИ ГАЗОВ КРОВИ Код типа компонента
01.01 Компоненты консервированной донорской крови Код класса компонента
01.01.001 Эритроцитная масса Код вида компонента
В ОК ККЧиК 3 типовых раздела, что делает достаточным по-
рядковое значение этих кодов от 01 до 99; не более 4 классовых
разделов, что делает достаточным порядковое значение этих
кодов от 01 до 99. Разрядность кода вада компонента от 001 до
999 достаточна для резервации необходимого количества кодов
компонентов в каждом классе.
Разрядность типовых, классовых разделов и кода вида ком-
понента позволяет вносить изменения и дополнения в ОК
ККЧиК без изменения существующей кодировки компонен-
тов консервированной крови человека.
ОК ККЧиКразработан для решения следующих задач:
• нормативного обеспечения разработки и использования
Отраслевого стандарта «Компоненты крови. Общие требования»;
• нормативного обеспечения разработки и использования
Отраслевого стандарта «Порядок маркировки компонентов крови»;
• создания единого информационного пространства с ре-
гламентированным комплексом нормативных и методических
документов в составе Единой системы классификации и коди-
рования технико-экономической и социальной информации;
35
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• соответствия национальных требований гарантирован-
ной безопасности гемотрансфузий международным стандартам.
ОК ККЧиК является открытой системой, элементы кото-
рой могут быть скорректированы и дополнены. Так, например,
в настоящее время ряд компонентов крови, проходящих клини-
ческие испытания, будет включен в ОК ККЧиК по результатам
апробации. Очевидно, что с течением времени список лекар-
ственных средств трансфузиологического пособия будет изме-
няться, дополняться новыми препаратами. В процессе широко-
го клинического использования компонентов крови, кровезаме-
нителей, препаратов парентерального питания и др. в Л ПУ часть
средств трансфузиологического пособия может потерять свою ак-
туальность по разным причинам, что, соответственно, должно
привести к исключению неэффективного продукта из списка.
1.2. Отделение трансфузиологии и его задачи
в многопрофильной клинике
Комплекс мероприятий, связанных с реализацией тран-
сфузиологического пособия в лечебном учреждении, наиболее
целесообразно осуществлять через специализированное отделе-
ние. На наш взгляд, наиболее оптимально использовать для
этих целей потенциальные возможности отделения переливания
крови (или кабинеты переливания крови) лечебных учреждений,
которые могут явиться прототипом современного отделения
трансфузиологии. Отделение трансфузиологии может стать ба-
зой для организации всего комплекса мер по реализации тран-
сфузиологического пособия в ЛПУ. Необходимо уточнить, что
реорганизация этих подразделений в отделения трансфузиоло-
гии должна затронуть не только название, уже не отражающее
существо дела (более 20—30 лет цельная консервированная кровь
практически не применяется, а используются ее компоненты),
а главным образом функциональные обязанности. В новых усло-
виях, с расширением поля организационного, диагностическо-
го и клинического действия отделение трансфузиологии должно
стать организационно-методическим центром трансфузиоло-
гической службы всего лечебного учреждения. Эффективная
36
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ_____________
организация лечебной помощи в значительной степени опреде-
ляется работой отделения трансфузиологии.
Современное отделение трансфузиологии — это многопро-
фильное специализированное подразделение, позволяющее
обеспечить в полном объеме практически все потребности в
трансфузиологическом пособии лечебного учреждения [Кон-
стантинов Б.А., Рагимов А.А., Дадвани С.А., 2000].
Основные задачи отделения трансфузиологии:
• агитация и пропоганда донорства (совместно с обще-
ственными организациями: Красный Крест и др.), аутодонорства,
кровесберегающих технологий;
• забор крови доноров в стационарных и выездных условиях;
• переработка крови на компоненты (эритроцитарную мас-
су, тромбоконцентрат, свежезамороженную плазму и др.);
• хранение и распределение компонентов крови и кровеза-
менителей;
• проведение экстракорпоральных методов гемокоррек-
ции: гемафереза, ультрафиолетового облучения крови, имму-
носорбции и др.;
• проведение лабораторных исследований по изосерологи-
ческой и инфекционной сертификации крови доноров и больных;
• организация и выполнение работ по аутодонорству, про-
ведение периоперационной реинфузии крови;
• консультация и контроль за транфузионно-инфузион-
ным лечением в стационаре.
Задачи отделения трансфузиологии определяют профиль работ:
• организационная работа (комплектование доноров крови,
агитация и пропаганда донорства крови и плазмы);
• производственная деятельность (заготовка и переработка
крови на компоненты, их хранение);
• клиническая работа (процедуры экстракорпорального воз-
действия на кровь: гемаферез, гемоквантовые методы — фото-
модификация крови и др., парентерально-энтеральное пита-
ние, определение тактики и обеспечение безопасности и эф-
фективности инфузионно-трансфузионной терапии, аутодо-
норство и аутогемотрансфузии др.);
• распределение компонентов и препаратов крови, кровезаме-
нителей и др. препаратов для внутривенного введения, планиро-
37
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
вание и реализация трансфузиологического и инфузионно-
трансфузионного пособия и др.;
• лабораторные исследования — сертификация крови доноров
и больных (определение групп крови: ABO, Rh и др., тканевое ти-
пирование: антигены системы HLA и др., определение гемо-
трансмиссивных инфекций ВИЧ, сифилис, гепатиты В и С и др.);
• научно-педагогическая деятельность (в НИИ и вузах отде-
ления выполняют исследования по научным программ и темам).
На сегодня производственная мощность отделения тран-
сфузиологии (переливания крови) определяется двумя основ-
ными условиями: коечным фондом и объемом крови, исполь-
зуемой в лечебном процессе. Например, отделения трансфу-
зиологии организуются в клинических стационарах мощностью
более 150 коек и (или) потребностью в крови и ее компонен-
тах не менее 120 л в год. Как показывает практика, такой под-
ход безнадежно устарел и не позволяет адекватно отвечать на
все трансфузионные потребности клиники. Отделения тран-
сфузиологии необходимо организовывать и укомплектовы-
вать штатами и соответствующим оборудованием, исходя из со-
временных возможностей трансфузиологии и тех задач, кото-
рые стоят перед лечебным учреждением: обеспечение всех
клинических подразделений полным комплексом трансфу-
зиологического пособия — это компоненты донорской крови,
аутодонорство, кровезаменители, экстракорпоральные про-
цедуры, лабораторная диагностика гемотрансмиссивных ин-
фекций, серологические тесты, парентеральное питание и др.
Сотрудники отделения трансфузиологии обеспечивают
повышение квалификации и специализации врачей по во-
просам трансфузиологии, внедрения в практику новых тран-
сфузионных средств, техники переливания крови, ее компо-
нентов и препаратов, кровезаменителей, методов определения
групповой принадлежности крови, проведения индивидуаль-
ной совместимости переливаемой крови и др. по методикам и
приемам, обеспечивающим безопасность трансфузиологиче-
ских процедур.
Особое место в работе отделений трансфузиологии отво-
дится консультативной и лечебной помощи при посттрансфу-
зионных реакциях и осложнениях.
38
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
На отделение трансфузиологии возлагается ответственность
постоянного контроля качества заготовляемой крови, ее компо-
нентов и обеспечение условий хранения и распределения по за-
явкам лечебных подразделений клиники трансфузионных сред.
Внедрение в практику работы лечебного учреждения и
активное применение специальных методов гемотерапии (афе-
рез крови, экстра- и интракорпоральное облучение, гемосорб-
ция, заготовка и применение аутокрови, парентеральное пи-
тание и др. вопросы, относящиеся к разделу клинической
трансфузиологии) составляют важнейшую задачу отделений
трансфузиологии.
Можно ожидать, что в многопрофильных лечебных учреж-
дениях благодаря разработке и внедрению в практику новых
кровезаменителей, кровесберегающих технологий, медика-
ментозных методов коррекции гемограммы и гемостаза объем
работы отделений трансфузиологии, относящейся к разделу
клинической трансфузиологии, будет увеличиваться и может
достигнуть 50 % и более.
1.3. Инфузионно-трансфузионные процедуры
Необходимо различать инфузию и трансфузию.
Инфузия — парентеральное (внутривенное, внутриарте-
риальное, внутрилимфальное) введение в организм различных
жидкостей с лечебной или диагностической целью (рентгенокон-
трасты, соно-контрасты, красители и др.). Инфузия более ши-
рокое понятие и включает в себя процедуры трансфузий.
Трансфузия — введение (переливание) в кровяное русло
цельной крови или ее компонентов, т. е. гемотрансфузия.
Разновидности трансфузий.
• внутривенные — в крупную вену или в венозный синус;_
» внутриартериальные — в одну из крупных артерий;_____
• внутрикостные — в губчатое вещество кости;__________
• внутриматочные — плоду (пункция брюшной полости плода
после амниоцентеза);
• внутрисердечные — в левый желудочек сердца (в обнаженное
сердце или чрескожная пункция).
39
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Гемотрансфузии разделяют на прямые, непрямые, обратные
и обменные.
При прямом переливании кровь из кровяного русла доно-
ра непосредственно вводится в кровяное русло реципиента.
Этот метод используется в критических ситуациях, когда все
другие способы лечебных мероприятий по предотвращению ге-
моррагического шока себя исчерпали или не могут быть осущест-
влены. Прямые переливания применяются крайне редко.
В условиях лечебного учреждения, имеющего службу крови,
обязанностью которой является снабжение отделений необхо-
димым объемом компонентов крови и кровезаменителей, пря-
мые переливания необходимо рассматривать как результат не-
удовлетворительной работы трансфузиологической службы.
Как правило, в плановой хирургии используют непрямые пе-
реливания, т. е. трансфузии крови или ее компонентов, загото-
вленных заблаговременно в соответствии со стандартами, обес-
печивающими безопасность гемотрансфузий.
Обратная гемотрансфузия — реинфузия аутокрови, излив-
шейся в серозные полости во время хирургической операции.
Обменная гемотрансфузия — процедура трансфузии, при
которой определенный объем крови реципиента замещают со-
ответствующим объемом крови или ее компонентов от донора.
Массивная гемотрансфузия бывает в случае, когда количество
переливаемой крови или ее компонентов составляет в сумме
более 30 % от всего объема циркулирующей крови.
Разновидности инфузий:
• подкожные;
« внутримышечные;_______________________________________
• внутривенные;
• внутриартериальные;
« внутриаортальные;_____________________________________
« внутрибрюшинные;______________________________________
• внутрикостные;
• внутриплевральные.
По скорости выполнения трансфузии (инфузии) разделяют
на капельные и струйные.
40
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Важнейшими характеристиками инфузионно-трансфузион-
ных средств являются такие их параметры, как осмолярность, ос-
мотичность, онкотическое давление.
Осмолярность — моль-концентрация всех осмотически дей-
ственных молекул в 1 л раствора (осмоль — единица измерения ос-
мотически действенных ионов и недиссоциированных молекул ве-
щества в водном растворе: 1 мосмоль (мосм)/л = 1/1000 осмоль).
Осмотичность — моль-концентрация всех осмотически
действенных молекул в 1 кг воды.
Осмотическое давление — давление на раствор, отделенный от
чистого растворителя полупроницаемой мембраной, при котором
прекращается осмос, т е. переход молекул растворителя в раствор
через разделяющую их полупроницаемую мембрану или переход мо-
лекул растворителя через полупроницаемую мембрану от раствора
меньшей концентрации в раствор большей концентрации.
Коллоидно-осмотическое, или онкотическое, давление (КОД)—ос-
мотическое давление, обусловленное высокомолекулярными ве-
ществами.
Использование в процессе лечения инфузий (лекарственных
препаратов, кровезаменителей, плазмозамещающих жидкостей)
и (или) гемотрансфузий принято называть инфузионно-трансфу-
зионной терапией (ИТТ). Иначе говоря, ИТТ — комплекс методов,
при котором лечебный эффект достигается парентеральным вве-
дением различных растворов, препаратов искусственного лечеб-
ного питания, крови, компонентов и препаратов крови и др.
Лечебный эффект ИТТ реализуется в основном через коррек-
цию нарушений гомеостаза посредством [МокеевИ.Н., 1998]:
• восполнения объема циркулирующей крови (ОЦК) и
ликвидации гиповолемии;
• восстановления водно-электролитного баланса и кислотно-
щелочного равновесия;
• устранения нарушений реологических и коагуляционных
свойств крови;
• ликвидации расстройств микроциркуляции и обмена веществ;
• обеспечения эффективного транспорта кислорода;
• дезинтоксикации;
• стимуляции защитных систем организма и т. д.
41
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Парентеральное введение компонентов и препаратов кро-
ви, различных кровезаменяющих растворов, препаратов для
парентерального питания является основным составляющим
компонентом инфузионно-трансфузионной терапии, глав-
ная цель которой — коррекция нарушений гомеостаза.
1.4. Общие принципы компонентной
гемотерапии
Многолетние фундаментальные исследования гематоло-
гов, иммунологов, изосерологов, морфологов, биохимиков и
др. состава и функции клеток и плазмы крови, накопившийся
клинический опыт применения донорской крови и ее компонен-
тов позволили пересмотреть устоявшееся представление о пере-
ливании цельной консервированной крови как о методе гемо-
терапии «многостороннего действия».
На начальных этапах внедрение и клиническое применение
консервированной крови, особенно в военно-полевых усло-
виях, критических ситуациях, было оправданно и приносило
необходимую пользу при лечении больных. Но с течением вре-
мени такое положение перестало устраивать врачей.
Необоснованное и широкое назначение переливания крови для
поднятия «защитных» сил организма, для стимуляции гемопоэза,
активации иммунитета, ЦНС, миокарда, функции печени и др.
органов и систем в качестве «укрепляющего» или «питательного»
средства приводило в итоге к большому числу гемотрансфузион-
ных осложнений. Вред больному от гемотрансфузии в ряде случа-
ев превышал пользу, на которую рассчитывали врачи.
С течением времени пришло понимание, что необоснован-
ное назначение переливания крови крайне опасно.
Опыт многих десятилетий по применению консервирован-
ной крови позволил сначала выдвинуть, а затем шаг за шагом ре-
ализовать концепцию компонентной гемотерапии. Одна из ос-
новных аксиом современной трансфузионной медицины — ге-
мотерапию необходимо выполнять строго по показаниям и те-
ми компонентами крови, в которых испытывает недостаток ор-
ганизм больного.
42
ГЛАВА I. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Основу принципа компонентной гемотерапии составляет
дифференцированное получение от донора крови необходи-
мых компонентов клеточного состава или плазмы крови и за-
мещение ими недостающих компонентов крови у больного.
Другими словами, концепция компонентой гемотерапии — те-
рапия компонентами крови, т. е. переливанием. Такой подход
позволяет экономить ресурсы донорской крови (кровь одного
донора может приносить пользу сразу нескольким больным) и
обеспечивает оптимальный метод гемотрансфузии пациентам,
требующим большого количества того или иного специфическо-
го компонента крови. Существенное значение при дефиците до-
норских кадров имеет то обстоятельство, что внедрение идео-
логии компонентной гемотерапии, кроме очевидной клини-
ческого пользы, позволяет увеличить ресурсы банка крови в
препаратах крови, так как из одной дозы цельной консервиро-
ванной крови получают несколько ее компонентов.
Переход к компонентой гемотерапии стал возможен во мно-
гом благодаря двум обстоятельствам: внедрению в повседневную
практику забора цельной донорской крови в специальные пла-
стиковые емкости (мешки) и методам криоконсервирования —
сохранению разделенных компонентов крови при низких тем-
пературах продолжительное время.
К переливанию компонентов крови необходимо относить-
ся как к серьезной медицинской инвазивной процедуре — опе-
рации, могущей иметь как непосредственные, так и отдаленные
осложнения и последствия. Консервированная донорская кровь
и ее компоненты — это не лекарственные препараты, как их по-
нимают в обычном смысле, а ткань организма и, соответствен-
но, отношение к их применению должно быть таким же, как к
трансплантации других органов и тканей. В каждом конкретном
случае врач назначает и применяет тот компонент крови, кото-
рый наиболее необходим данному пациенту. Использование
отдельных компонентов крови — компонентная гемотерапия,
выполняющаяся на основании клинических и лабораторных
показателей, значительно повышает лечебную эффективность
гемотерапии, снижает риск и опасность реакций и осложнений.
Современная трансфузионная гемотерапия базируется пре-
имущественно на принципе заместительного и (или) гемостати-
43
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ческого лечебного эффекта соответствующего компонента кро-
ви. Так, в условиях анемизации при острой кровопотере о заме-
стительном действии гемотрансфузии эритроцитной массы сви-
детельствует улучшение клинического состояния пациента, со-
провождающееся повышением уровня гемоглобина, гематокри-
та и количества эритроцитов, насыщения крови кислородом и
нормализации артериовенозной разницы.
Одна из основных составляющих идеологии компонент-
ной гемотерапии заключается в том, что купирование дефици-
та компонента крови больного не производится по принципу «ка-
пля за каплю», т. е. нет необходимости в полном замещении
имеющегося дефицита того или иного клеточного или белково-
го компонента.
Лечебные мероприятия, проводимые с помощью препаратов и
компонентов крови, должны осуществляться на основании ана-
лиза всей совокупности клинических и лабораторных данных, ко-
торый дает врачу четкое представление о сге пен и дефицита отдель-
ных факторов дефицита крови и особенностях состояния больно-
го. Подобный анализ позволяет достичь необходимого лечебного эф-
фекта с минимальными объемами трансфузионных средств.
Толерантность больных к тому или иному уровню дефици-
та компонентов крови при той или иной патологии может быть
разной, что определяется многими причинами: состоянием сер-
дечно-сосудистой системы, компенсаторными возможностями
организма, характером и длительностью заболевания, травмой,
величиной кровопотери, наличием или отсутствием осложняю-
щих факторов и др. Поэтому при назначении компонентной
гемотерапии важно прежде всего выяснить, чем объясняется
клиническая симптоматика и тяжесть состояния больного с уче-
том множества факторов. Данные лабораторных исследований
дополняют клиническую оценку и указывают на вид дефицит-
ного компонента крови, уровень его снижения и с учетом кли-
нических показателей позволяют определить необходимую до-
зу трансфузии. Несмотря на это, цельная консервированная
кровь используется необоснованно часто. Неоправданные пере-
ливания цельной крови не только неэффективны, но и нередко
представляют определенную опасность. В консервированной
крови в процессе хранения происходят сложные биохимиче-
44
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
ские обменные процессы в клетках и плазме, которые в конеч-
ном итоге снижают качество крови и жизнеспособность отдель-
ных клеток. В эритроцитах снижается pH, содержание 2,3-ДФГ,
АТФ, увеличивается сродство гемоглобина к кислороду; разру-
шаются тромбоциты и лейкоциты, нарастает гемолиз, повыша-
ется концентрация ионов калия, аммиака; образуются микро-
агрегаты из клеточных элементов, освобождается активный
тромбопластин и серотонин. Изменения ферментных систем в
клетках и в плазме приводят к инактивации или извращению не-
которых факторов свертывания. В конечном итоге снижается ле-
чебная эффективность консервированной крови.
Внедрение в лечебную практику компонентной гемотера-
пии позволило дифференцированно вводить больному недо-
стающий клеточный или белковый компонент, не перегружая
кровяное русло. Переливание больших объемов цельной кро-
ви для получения аналогичного лечебного эффекта привело бы
к гиперволемии, перегрузке сердечно-сосудистой системы,
изосенсибилизации, а также к возможным изменениям в им-
мунной системе. Так, для восстановления оксигенирующей
функции крови отпала необходимость переливания цельной
крови, содержащей, кроме необходимых клеток — эритроци-
тов, другие клетки и плазму, в которых больной не нуждался.
Другой пример: для купирования тромбоцитопенической ге-
моррагии и восстановления уровня тромбоцитов вводится
100—200 мл тромбоконцентрата вместо эквивалентного пере-
ливания 4—6 л свежезаготовленной цитратной крови. Или при
гипо- и афибриногенемиях эффективной дозой являются 4—8 г
фибриногена, что эквивалентно 10 л цельной крови, а для ле-
чения гемофилии используется криопреципитат в дозе
50—100 мл (1000—1500 ЕД) или концентрат фактора VIII вме-
сто нескольких литров цельной крови.
Дополнительным аргументом в пользу использования ком-
понентов крови вместо цельной консервированной крови может
служить и тот факт, что иногда при введении массивных доз
консервированной крови наблюдаются кровотечения и крово-
точивость, снижение протромбинового и парциального тромбо-
пластинового времени и тромбоцитопения. Патогенез этих из-
менений остается невыясненным.
45
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Эти примеры убедительно свидетельствуют о преимуще-
ствах лечения отдельными концентратами клеточных компо-
нентов крови или препаратами плазмы.
1.5. Кровь, ее компоненты и препараты
1.5.1. Цельная консервированная донорская кровь
Цельная консервированная донорская кровь — венозная
кровь, заготовленная на утвержденных консервирующих ра-
створах от здоровых доноров крови. В литературе нередко обоз-
начается как «цельная кровь», «донорская кровь», «кровь кон-
сервированная донорская» и пр. В соответствии с классифика-
тором ОК ККЧиК «Цельная консервированная донорская кровь»
представляет собой неоднородную полидисперсную жидкость с
взвешенными форменными элементами. Одна единица кон-
сервированной крови, как правило, содержит 63 мл консерван-
та и около 450 мл донорской крови. Общий объем 510 мл. Плот-
ность крови 1,056—1,064 —у мужчин и 1,051—1,060 —уженщин.
Гематокрит цельной консервированной крови должен соста-
влять 36—44 %.
Забор донорской крови
Лица, пожелавшие сдать кровь, — доноры обязательно ре-
гистрируются, подвергаются медицинскому и лабораторному
обследованию строго в соответствии с требованиями инструк-
ций. Заготовленная кровь и ее компоненты этикетируются, до-
кументируются и подвергаются контролю качества.
Для забора крови и переработки ее на компоненты исполь-
зуются исключительно одноразовые стерильные системы, что по-
зволяет полностью исключить заражение донора гепатитом,
СПИДом, сифилисом или другими гемотрансмиссивными ин-
фекциями.
Забор крови производится в специальную закрытую сте-
рильную систему, состоящую из пластиковых контейнеров, со-
держащих специальные растворы для консервации крови, сое-
диненных между собой пластиковыми трубками. Если по каким-
либо причинам при заборе крови или при ее переработке систе-
46
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
ма была разгерметизирована, то цельная кровь и любой ее ком-
понент могут храниться при 4 °C не более 24 ч до клинического
применения. При таких условиях возможно гарантировать со-
ответствующее качество продукта с учетом вероятного риска
бактериального загрязнения собранной донорской крови как
следствия разгерметизации системы для забора крови.
Кровь консервированная
В реальном масштабе времени консервированная кровь в те-
чение 24 ч с момента ее забора практически недоступна. Этот пе-
риод времени необходим д ля соответствующей сертификации и
маркирования, что включает в себя комплекс лабораторных ме-
тодов исследования, направленных на обеспечение максималь-
ной трансфузиологической безопасности пациента от гемотран-
смиссивных инфекций и изоиммунологических осложнений.
Консервированная донорская кровь должна отвечать следу-
ющим требованиям: сохранность целостности и герметично-
сти упаковки; наличие оформленной этикетки с указаниями
срока годности и групповой и резус-принадлежности; при отстаи-
вании иметь четко выраженную границу разделения на плазму
и клеточную массу; плазма должна быть прозрачной, без мути,
хлопьев, нитей фибрина, выраженного гемолиза; глобулярный
(клеточный) слой крови должен быть равномерным, без неров-
ностей на поверхности и видимых сгустков.
Скорость трансфузии консервированной крови определя-
ется клиническими условиями. При отсутствии острой массив-
ной кровопотери трансфузия 450—500 мл крови должна быть
осуществлена в пределах 4 ч.
У взрослых больных один объем (450—500 мл) цельной кро-
ви увеличивает гемоглобин примерно до 10 г/л или гематокрит
примерно на 3—4 %.
Условия хранения
Сроки хранения цельной консервированной донорской
крови определяются консервирующими растворами и усло-
виями заготовки. Кровь, заготовленная в пластиковые мешки,
при использовании стерильной замкнутой системы и консерван-
та CPD (citrate-phoshate-dextrose) хранится при температуре
+2—6 °C в течение 21 дня, при использовании консерванта
CPDA-1 (citrate-phosphate-dextrose-adenine) — 35 дней (см.
47
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
табл. 1.5). Нарушение замкнутого контура системы или сборка
системы перед заготовкой крови и ее компонентов ограничива-
ет сроки хранения крови до 24 ч при температуре +2—6 °C.
Важно знать, что ни один из известных гемоконсервантов
не позволяет сохранять полноценно все свойства крови. Как
только кровь покинула сосудистое русло донора и была стаби-
лизирована и консервирована, начинаются необратимые процес-
сы «старения» крови. Постепенно происходит снижение фи-
зиологической полноценности эритроцитов, и в первую оче-
редь страдает их кислородно-транспортная функция. В зависи-
мости от используемого консерванта кислородно-транспорт-
ная функция эритроцитов консервированной крови сохраняет-
ся в течение 5—20 суток. После переливания консервирован-
ной крови длительных сроков хранения (10 суток и более) эта
функция эритроцитов in vivo восстанавливается через 16—18 ч.
В консервированной крови к последнему дню хранения остают-
ся жизнеспособными 70—80 % эритроцитов.
Вторые сутки знаменуются утратой физиологической пол-
ноценности лейкоцитов и тромбоцитов, разрушением антигемо-
фильного глобулина, гранулоциты не способны к фагоцитозу че-
рез 24—48 ч.
Активность факторов свертывания уменьшается по мере
увеличения сроков хранения, и через 6—7 ч хранения актив-
ность факторов V и VII практически сведена к нулю. В связи с
этим цельная консервированная кровь должна быть перерабо-
тана на компоненты в течение 6 ч с момента забора крови.
В процессе стабилизации и хранения донорской крови нака-
пливаются высвобождающийся при разрушении клеток свобод-
ный гемоглобин и калий; нарастает уровень аммиака и молочной
кислоты; снижается pH крови; эритроциты изменяют свою фор-
му, частично теряют свой элекгрокинетический потенциал, что
способствует образованию микроагрегатов. В результате совоку-
пных изменений до 25 % клеточных элементов консервированной
крови после переливания депонируются и секвестируются в ми-
кроциркуляторном русле, что делает ее использование при острой
кровопотере и анемии нецелесообразным.
Таким образом, наличие продуктов распада лейкоцитов
и тромбоцитов, микро- и макроагрегатов в консервирован-
48
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
ной донорской крови в процессе хранения и особенности ее
заместительного действия делают переливание цельной кро-
ви нецелесообразным, а переработку ее на компоненты край-
не актуальной.
Кровь консервированная, фильтрованная
В соответствии с современными требованиями консервиро-
ванную кровь перед ее разделением на компоненты (или непо-
средственно перед трансфузией) необходимо освободить от лей-
коцитов. С этой целью используются лейкофильтры. Удаление
лейкоцитов — это профилактика изосенсибилизации к лейкоци-
тарным антигенам, гемотрансмиссивных вирусных инфекций
(цитомегаловирусов), анафилактических, аллергических реак-
ций, обусловленных лейкореагинами. Для лейкофильтрации на-
иболее оптимальным является применение систем для забора
донорской крови, состоящих из нескольких связанных между
собой контейнеров с встроенным фильтром. Забор, фильтрация
и разделение крови на компоненты в таких системах происходит
без контакта с окружающей средой (закрытые системы).
Использование лейкофильтров, встроенных в замкнутую
систему контейнеров, не изменяет установленных сроков хране-
ния донорской крови и ее компонентов. Применение лейко-
фильтров, не встроенных в систему с контейнерами, приводит к
нарушению целостности замкнутого контура, и в соответствии
с инструкцией срок хранения такой среды сокращается до 24 ч.
Показания к применению
Несмотря на обоснованную пропаганду компонентной ге-
мотерапии, применение цельной крови имеет свои, хотя и огра-
ниченные показания:
массивные кровопотери с выраженными явлениями гипо-
волемического шока и анемической гипоксии и снижением
объема циркулирующей крови (эритроцитов и плазмы);
массивные обменные трансфузии (гемолитическая болезнь
новорожденных, острый гемолиз, токсикоз, хроническая по-
чечная недостаточность), особено в военно-полевых условиях,
при катастрофах, когда нет возможности немедленно получить
достаточное количество компонентов крови.
Однако во всех перечисленных случаях при правильной ор-
ганизации трансфузиологического пособия в стационарных
49
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
условиях более целесообразно и оправдано с медицинской и
рационально с экономической точек зрения применение гемо-
компонентов крови. Переливания цельной консервированной
крови в условиях многопрофильного стационара, в особенности
больным в плановой хирургии, необходимо рассматривать как
результат неудовлетворительной работы отделения трансфузио-
логии и службы крови.
Гемотрансфузия должна быть рекомендована лишь тогда,
когда она жизненно необходима, а ожидаемый лечебный эффект
исключает или превалирует над возможными осложнениями.
Продолжительность заместительного эффекта гемотран-
сфузий во многом зависит от исходного состояния организма.
При лихорадочных состояниях, высоком уровне катаболизма
при ожогах, обширных хирургических вмешательствах, сепси-
се, гемолизе и нарушениях коагуляции крови он сокращается.
В процессе трансфузии и ближайшие 2—3 суток после нее донор-
ская кровь может вызвать волемический эффект только в случае,
если объем перелитой крови не превышает 20—30 % ОЦК и от-
сутствуют микроциркуляторные сдвиги. Переливание крови в ко-
личестве, превышающем 30—50 % ОЦК, при наличии наруше-
ний периферического кровообращения приводит к ухудшению
кровообращения, нарушению стабильности гемодинамики, па-
тологическому депонированию крови.
К переливанию крови следует относиться как к операции
трансплантации со всеми вытекающими из этого последствиями —
возможному отторжению клеточных и плазменных элементов
крови донора. У больных с иммунодепрессией переливание
цельной крови чревато развитием опасной реакции «трансплан-
тат-против-хозяина».
К недостаткам гемотрансфузий следует отнести в первую
очередь реальную опасность вирусного, бактериального и пара-
зитарного инфицирования, возможность заражения сыворо-
точным гепатитом, сифилисом, СПИДом и другими гемотран-
смиссивными инфекциями. При длительном хранении консер-
вированная донорская кровь утрачивает целый ряд ценных
свойств и приобретает новые, нежелательные для пациента ка-
чества. Это и гиперкалиемия, и нарастание ацидоза, снижение
pH, образование и увеличение числа микросгустков.
50
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Одним из тяжелых и опасных осложнений массивных пере-
ливаний донорской крови является комплекс патологических
расстройств, получивших название синдрома гомологичной
крови.
Осложнения, связанные с трансфузией донорской крови,
могут возникнуть и в послеоперационном периоде. Это отсро-
ченные анафилактические реакции, легочный дистресс-син-
дром, почечно-печеночная недостаточность и др.
При определении противопоказаний к переливанию кон-
сервированной крови необходимо исходить из того, что боль-
ной не должен погибать от невозмещенной кровопотери, не-
зависимо от имеющейся у него патологии. Другими словами,
переливание крови не должно дополнительно вредить орга-
низму пациента. Несмотря на относительность любого проти-
вопоказания к трансфузии крови, можно уверенно опреде-
лить, что основным противопоказанием являются наличие у
больного декомпенсированной патологии основных органов и
систем организма (табл. 1.6).
Таблица 1.6. Противопоказания к переливанию донорской
крови (Мокеев И.Н., 1999)
Орган, система органов Патология
Сердечно-сосу- дистая система Острый и подострый инфекционный эндокардит с декомпенсацией кровообращения Пороки серд- ца, миокардиты в стадии декомпенсации Отек лег- ких Гипертоническая болезнь III стадии с выра- женным атеросклерозом сосудов головного мозга
Дыхательная си- стема Милиарный и диссеминированный туберкулез. Тромбоэмболия легочной артерии (ТЭЛА)
Пищеваритель- ная система Тяжелые нарушения функций печени Гепатаргия
Почки Прогрессирующий диффузный гломерулоне- фрит. Амилоидоз почек. Нефросклероз
Мозг Кровоизлияние в мозг. Тяжелые расстройства моз- гового кровообращения
51
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Компоненты консервированной донорской крови
На практике используются три метода разделения цельной
консервированной крови на компоненты:
• центрифугирование крови (например, 1500—2500 об/мин
в течение 20—25 минут);
• фильтрация крови через специальные устройства или ко-
лонки;
• спонтанное осаждение форменных элементов (хранение
при 4 °C 20-24ч).
Методами фракционирования из цельной консервирован-
ной крови можно получить:
• плазму;
• эритроциты;
• лейкоциты;
• тромбоциты и
• стволовые клетки периферической крови (на автоматиче-
ских сепараторах крови).
Эритроцитная масса (ЭМ)
ЭМ — один из основных компонентов крови, получае-
мый из цельной консервированной крови методом центрифу-
гирования и последующего удаления плазмы, лейкоцитов и
тромбоцитов.
Эритроцитная масса состоит из эритроцитов (70—80 %)
и плазмы (20—30 %) с примесью лейкоцитов и тромбоцитов.
По содержанию эритроцитов одна доза эритроцитной массы
(270 ± 20 мл) эквивалентна одной дозе (510 мл) крови. Гема-
токрит ЭМ составляет 65—80 % в зависимости от первоначаль-
ных гематологических параметров донора, консервирующе-
го раствора и метода получения эритроцитной массы.
Для улучшения реологических свойств эритроцитной мас-
сы непосредственно перед трансфузией допускается добавление
в контейнер 50—100 мл 0,9 %-ного раствора натрия хлорида.
Компонентная гемотерапия анемических состояний бази-
руется на преимущественном применении эритроцитной массы.
ЭМ, в сравнении с цельной кровью, в меньшем объеме содер-
жит то же количество эритроцитов, гемоглобина и значительно
(в 3—4 раза) меньше цитрата, тромбоцитов, лейкоцитов, продук-
52
ГЛАВА 1, ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
тов распада, антигенов белков плазмы и антител. По своим ле-
чебным свойствам ЭМ равноценна эритроцитам консервирован-
ной крови.
Условия хранения
ЭМ хранится при температуре +4—6 °C.
ЭМ по внешнему виду отличается от донорской крови тем,
что имеет меньший объем плазмы (20—30 %) над слоем осевших
клеток.
ЭМ из крови, заготовленной на консерванте CPD, имеет
срок хранения 21 день, а на консерванте CPDA-I — 35 дней.
В ЭМ могут быть примеси тромбоцитов и лейкоцитов.
В ЭМ 8—10-дневного хранения может обнаружиться незна-
чительный гемолиз, который не является противопоказанием для
ее клинического использования.
Показания к применению
Преимущества ЭМ по сравнению с цельной консервирован-
ной кровью:
• более высокая кислородтранспортная емкость в мень-
шем объеме продукта;
• минимальное содержание иммуногенных факторов —
белков плазмы, лейкоцитов, тромбоцитов;
• низкое содержание продуктов распада клеток и белков
плазмы;
• низкое содержание вазоактивных веществ — серотонина,
гистамина, натрия, калия, аммония и др.;
• низкое содержание микроагрегатов;
• низкое содержание факторов гемокоагуляции;
• низкое содержание консервирующего раствора;
• возможность приготовления отмытых эритроцитов
(имеет принципиально важное значение для больных, сенси-
билизированных антигенами лейкоцитов, тромбоцитов и бел-
ков плазмы);
• возможность разведения ЭМ необходимыми тран-
сфузионными средами (желатинолем, модежелем, гелофу-
зином и др.).
ЭМ назначают с целью купирования анемии для усиления
оксигенирующей функции крови. Гемотрансфузия ЭМ должна
осуществляться не только на основании показателей гемато-
53
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
крита, гемоглобина и количества эритроцитов, но и с учетом кли-
нического состояния пациента.
У больных с нормальными исходными показателями гемо-
глобина, гематокрита и белков плазмы при кровопотере в пре-
делах 10—15 % ОЦК нет необходимости в применении ЭМ. Для
поддержания стабильной гемодинамики и возмещения крово-
потери достаточно кровезаменителей.
При кровопотере более 15—20 % ОЦК, как правило, на-
блюдаются первые признаки нарушения кислородтранспорт-
ной функции крови, что требует адекватного восполнения дефи-
цита эритроцитов, т. е. применения ЭМ.
Применение эритроцитной массы значительно снижает ве-
роятность иммунизации больного белками плазмы, лейкоцита-
ми и тромбоцитами донорской крови и позволяет значительно
снизить неспецифические трансфузионные конфликты при хи-
рургических операциях.
Трансфузии ЭМ показаны в следующих случаях:
1. Травматический и операционный шок, осложненный
кровопотерей.
2. Анемическая гипоксия при нормо-гиповолемических
состояниях.
3. Постгеморрагические анемии.
4. Анемии, сопровождающие хронические заболевания.
5. В период подготовки больных с критически низкими
показателями гемограммы к обширным хирургическим вме-
шательствам.
6. Посттермические (при ожоговой болезни) анемии.
7. При наличии у анемизированного больного антилей-
коцитарных и антитромбоцитарных антител (рекомендует-
ся использовать отмытые или размороженные эритроциты).
В определении показаний к гемотрансфузии у хирургиче-
ских больных главным критерием следует считать кровопоте-
рю во время операции и в постоперационный период, а так-
же резервы компенсаторных возможностей организма. Одна-
ко ориентироваться на средние цифры операционной крово-
потери рискованно. Помимо особенностей патологии, обще-
го состояния пациента, тщательности предоперационной под-
готовки, вида операции, кровопотеря зависит от принципов и
54
ГЛАВА 1, ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
методов операционного гемостаза и квалификации хирурга.
Трудно переоценить значение тщательности и аккуратности ра-
боты хирурга в обеспечении гемостаза.
Установить какие-либо абсолютные лабораторные крите-
рии для назначения ЭМ не представляется возможным и вряд
ли целесообразно.
Прежде всего необходимо учитывать клиническое состояние па-
циента, сопутствующую патологию, степень и место травмы, при-
чину анемизации, время кровотечения и многие другие факторы. Так,
известно, что бальные с хронической анемией более адаптированы
к низкому уровню гемоглобина. В то же время больные артериаль-
ной гипотензией, с выраженной сердечно-легочной недостаточно-
стью, при инфекционных заболеваниях и др. требуют переливания
ЭМ и при более высоких значениях показателей красной крови.
При хронических кровопотерях или при недостаточности
кроветворения основанием для вливания эритроцитов в боль-
шинстве случаев является падение уровня гемоглобина крови ни-
же 80 г/л и гематокрита ниже 25 %.
Требования к методике подготовки и проведения трансфузии
такие же, как и при переливании консервированной крови.
1. Перед трансфузией контейнер с ЭМ (консервированной
кровью) выдерживают при комнатной температуре в течение
30—40 минут или во время трансфузии используют специальные
устройства для подогрева вводимой трансфузионной среды.
2. Врач должен лично провести следующие контрольные
исследования:
• определить групповую принадлежность крови реципиента
по системе АВО и сверить результат с данными истории болезни;
• определить групповую принадлежность эритроцитов доно-
ра и сопоставить результат с данными на этикетке контейнера;
• провести пробы на совместимость в отношении групп
крови донора и реципиента по системе АВО и резус-фактору;
• провести биологическую пробу.
3. Запрещается переливать кровь или ее компоненты из од-
ного контейнера нескольким больным.
1. В течение 2 часов после гемотрансфузии реципиент дол-
жен соблюдать постельный режим и находиться под врачебным
наблюдением.
55
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
2. На следующий день после трансфузии необходимо про-
извести клинический анализ крови и мочи.
3. После переливания контейнер с остатками трансфузион-
ной среды хранится в холодильнике в течение 2 суток.
4. Все действия врача, переливавшего кровь либо ее компо-
ненты, так же как и показания к гемотрансфузии, должны быть
зафиксированы в истории болезни пациента.
В зависимости от условий получения, присутствия допол-
нительных растворов, лейкофильтрации, облучения в ОК
ККЧиК выделяются:
• эритроцитная масса, фильтрованная;
• эритроцитная масса, гамма-облученная;
• эритроцитная масса, обедненная лейкоцитами и тром-
боцитами;
• эритроцитная масса с удаленным лейкотромбослоем;
• эритроцитная масса с удаленным лейкотромбосло-
ем, фильтрованная;
• эритроцитная масса с удаленным лейкотромбосло-
ем, гамма-облученная.
До недавнего времени эритроцитную массу, обедненную
лейкоцитами и тромбоцитами, с меньшим содержанием
плазмы обозначали как эритроконцентрат (ЭК). Более же-
сткое центрифугирование донорской консервированной
крови при разделении ее на компоненты позволяет получить
среду с гематокритом 85-90 %. В одной дозе ЭК (200 ± 20 мл)
содержится практически такое же количество эритроцитов,
как и в одной дозе крови.
Компонент донорской крови под названием эритро-
концентрат в ОК ККЧиК отсутствует.
Для улучшения реологических свойств ЭМ (или ЭК)
непосредственно перед трансфузией возможно добавление
в контейнер 50—100 мл 0,9 %-ного раствора натрия хлори-
да, что фактически превращает ее в эритроцитную взвесь с
физиологическим раствором (см. ОК ККЧиК).
Эритроцитная взвесь
Ресуспензируя ЭМ в специальном растворе (0,9% -ный
раствор хлорида натрия, модежель и др.), можно получить
эритроцитную взвесь (ЭВ). При этом ЭВ, приобретая более
56
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
высокую текучесть и, соответственно, более высокие реоло-
гические свойства, одновременно имеет более низкое гема-
токритное число (40—50 %).
Как правило, соотношение ЭМ и раствора составляет 1:1.
В соответствии с ОК ККЧиК выделяются:
• эритроцитная взвесь с физиологическим раствором;
• эритроцитная взвесь с ресуспендирующим раствором;
• эритроцитная взвесь с ресуспендирующим раство-
ром, фильтрованная;
• эритроцитная взвесь с ресуспендирующим раствором,
гамма-облученная;
• эритроцитная взвесь, размороженная и отмытая.
Не рекомендуется использовать для приготовления ЭВ раство-
ры глюкозы и растворы, содержащие ионы кальция. Использова-
ние 5 %-ного раствора глюкозы или его аналогов вызывает скле-
ивание и гемолиз эритроцитов. Растворы, содержащие ионы
кальция, вызывают свертывание и образование сгустков.
Показания к применению ЭВ те же, что и для ЭМ. На прак-
тике часто ЭМ разбавляют 30—50 мл изотонического раствора
хлорида натрия непосредственно перед введением с целью по-
вышения текучести раствора для ускорения скорости введения.
Трансфузия ЭВ может производиться капельно или струйно.
Несомненна целесообразность применения эритроцит-
содержащих сред в сочетании с кровезаменителями. Приме-
нение раствора ЭМ в реополиглюкине в соотношении 1:1 или
1:0,5 надежно сохраняет ОЦК, уменьшает агрегацию и секве-
страцию форменных элементов в период операции и на сле-
дующие сутки.
Применение ЭМ в растворе модежеля (декальцинирован-
ный желатиноль), представляющего собой оригинальный ком-
понент крови — эритроцитарный трансфузат, не только вос-
полняет кровопотерю и восстанавливает кислородтранспорт-
ную функцию крови, но и оказывает гемодинамическое дезагре-
гирующее воздействие с достаточно выраженным волемиче-
ским эффектом [Селиванов Е.А., Мельникова В.Н., 1995].
Необоснованное или чрезмерное введение ЭМ или ЭВ мо-
жет привести к гемоконцентрации, снижающей сердечный вы-
брос и тем самым ухудшающей гемодинамику в целом.
57
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Условия хранения. Срок хранения ЭВ О1раничен 24—72 ч (в за-
висимости от консервирующего раствора) при температуре +4 °C.
Показания к применению. Показания к переливанию ЭВ ана-
логичны показаниям к применению ЭМ.
Трансфузии ЭМ и ЭВ могут производиться капельно или
струйно.
Противопоказания к применению ЭМ и Ж
• гипокоагуляционные состояния;
• тромбоэмболии различного генеза;
• приобретенная негемолитическая анемия.
Чрезмерное введение ЭМ или ЭВ может привести к гемо-
концентрации, снижающей сердечный выброс и тем самым
ухудшающий гемодинамику в целом.
Эритроцитная масса, обедненная лейкоцитами и тромбоци-
тами (отмытые эритроциты — ОЭ)
Эритроцитная масса, обедненная лейкоцитами и тромбоци-
тами (отмытые эритроциты — ОЭ), представляет собой ЭМ, ли-
шенную плазмы, а также лейкоцитов и тромбоцитов путем
1—5-кратного повторного добавления физиологического ра-
створа и удаления надосадочной жидкости после центрифуги-
рования.
В процессе отмывания удаляются белки плазмы, лейкоци-
ты, тромбоциты, микроагрегаты клеток и стромы, разрушен-
ные при хранении клеточных компонентов.
ОЭ, как правило, готовят из ЭМ небольших (до 10 дней) сро-
ков хранения, в связи с чем они обладают достаточной кислород-
транспортной функцией.
ЭМ отмывают в тех же пластиковых контейнерах, в кото-
рых она хранится. Для отмывания используют ЭМ любых сроков
годности. Для детей, кардиососудистых больных предпочтение от-
дается эритроцитам малых сроков хранения (до 7 дней). ЭМ от-
мывают 1—5 раз стерильным физиологическим раствором. После
каждого добавления физиологического раствора ЭМ осаждают ме-
тодом центрифугирования. Существуют специальные приборы,
разработанные для отмывания ЭМ. Для этих целей можно исполь-
зовать и аппарат «Селл-север» (Cell-saver). Отмытые эритроциты
сохраняются до использования во взвеси 100—150 мл физиологи-
ческого раствора с гематокритом 0,70—0,80 (70—80 %).
58
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Поскольку отмывание ЭМ производится в открытой си-
стеме, то срок хранения до использования (из-за риска бакте-
риального загрязнения) может быть не более 24 ч при +1—6 °C.
Отмытую ЭМ применяют у пациентов, сенсибилизирован-
ных предыдущими гемотрансфузиями к плазменным факторам
или антигенам лейкоцитов и тромбоцитов. Отмытую ЭМ гото-
вят в отделении трансфузиологии по заявке на пациента из
5—10 доз крови, подобранных для больного в пробе Кумбса.
При отмывании, даже при тщательном подходе ко всем эта-
пам процедуры, происходит удаление с отмывающим раствором
части эритроцитов. Это обстоятельство надо иметь в виду и наз-
начать больному на 10—20 % больший объем отмытых ЭМ, чем
при назначении нативной ЭМ.
Необходимо помнить, что трансфузия отмытых эритроци-
тов хоть и снижает риск заражения больного гематогенными
инфекциями, но полностью не избавляет ЭМ от вирусов гепа-
тита, ВИЧ и др. инфекций. Кроме того, отмывание полностью
не избавляет от клеток лейкоцитарного ряда, что сохраняет
опасность у иммуноскомпрометированных больных провокации
реакции «трансплантат-против-хозяина».
Условия хранения
ОЭ хранят при температуре +4—6 °C. ОЭ, взвешенные в
0,9 %-ном растворе натрия хлорида, подлежат переливанию в те-
чение 24 ч с момента приготовления. Использование в каче-
стве консерванта препарата модежель позволяет продлить срок
хранения ОЭ до 72 ч.
Показания к применению:
• анемии различной этиологии, сопровождающиеся сенси-
билизацией реципиента к антигенам белков плазмы, лейкоци-
тов и тромбоцитов в результате повторных переливаний крови
или беременности;
• синдром гомологичной крови (как элемент комплексной
терапии);
• возмещение кровопотери у больных-аллергиков (бронхиал ь-
ная астма и др.) с целью профилактики анафилактических реакций.
В соответствии с современными требованиями ЭМ, так же
как и цельную консервированную донорскую кровь, в период заго-
товки или перед трансфузией освобожд ают от остатков лейкоцитов.
59
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Установлено, что причиной большинства трансфузионных
реакций негемолитического типа у больных, имевших в анамне-
зе множественные трансфузии компонентов крови, а также у
женщин, имевших беременности, являются изоантитела к анти-
генам лейкоцитов (в частности, HLA), которые, несомненно,
снижают эффект не только перелитого компонента, но и всей ле-
чебной процедуры.
В среднем в 450—500 мл консервированной крови или
эритроцитов содержится (2—3) х 10" лейкоцитов и боль-
шое количество тромбоцитов. Стандартный фильтр кро-
ви с диаметром пор 170 мк не задерживает и не удаляет
лейкоциты.
В отделениях трансфузиологии или на станциях перели-
вания крови лейкоциты и тромбоциты могут быть удалены из
консервированной крови или ЭМ методом отмывания (цен-
трифужным или на специальных автоматических машинах).
Размороженная ЭМ, готовая к использованию, также практи-
чески не содержит лейкоцитов и тромбоцитов.
Однако, как было сказано выше, срок хранения отмытых
эритроцитов в солевом растворе — всего 24 ч. Кроме того, в
отмытой солевым раствором ЭМ через 24 ч увеличивается
уровень свободного гемоглобина, т. е. происходит гемолиз
эритроцитов, который нарастает с течением времени и к
третьему дню более 35—40 % эритроцитов разрушаются. Срок
жизни отмытой ЭМ можно увеличить до 3—4 и более суток,
если в пакет после отмывания сразу добавить (при условии вы-
полнения всех процедур в условиях, обеспечивающих сте-
рильность) 50—100 мл раствора модежеля — декальцинирован-
ный модифицированный желатиноль [Рагимов А.А. и соавт.,
1998, 2000].
Удаление лейкоцитов с целью профилактики сенсибили-
зации пациентов, получающих компоненты крови, можно
обеспечить использованием специальных лейкоцитарных
фильтров. Приказ министра М3 РФ № 311 от 04.08.2000
предписывает внедрение в практику лечебно-профилактиче-
ских учреждений и учреждений службы крови методов фильт-
рации трансфузионных сред. Лейкоцитарные фильтры позво-
ляют удалять более 99 % лейкоцитов.
60
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Лейкоцитарные фильтры применяют для подготовки ЭМ:
• больным, имеющим антилейкоцитарные антитела вслед-
ствие сенсибилизации предыдущими гемотрансфузиями;
• женщинам, имевшим многократные беременности,
• в целях профилактики больным, которым планируются
многократные трансфузии компонентов крови.
Использование лейкоцитарных фильтров позволяет значи-
тельно уменьшить число посттрансфузионных реакций неге-
молитического типа и тем самым повысить эффект лечебных
процедур.
Эритроцитная взвесь, размороженная и отмытая
Наряду с консервированием крови при положительных тем-
пературах существует метод консервирования компонентов кро-
ви при отрицательных температурах.
Метод замораживания и хранения эритроцитов при
низких температурах позволяет получить после размора-
живания и отмывания функционально полноценные эритро-
циты. Для предотвращения гибели или повреждения клеток
при замораживании к ним в определенных соотношениях
добавляют специальные химические агенты (криопротекто-
ры, например: глицерин), которые при оттаивании эритро-
цитов должны быть удалены. Как правило, к замораживанию
подготавливают ЭМ малых сроков хранения (не более 5—6
суток). Замораживание ЭМ в растворе глицерина выпол-
няют в специальных металлических сосудах при низких
температурах: —65 или —200 °C. Температурный режим и
программа замораживания зависят от концентрации крио-
протектора. В замороженном состоянии эритроциты могут
находиться до 10 лет.
После оттаивания ЭМ отмывают специальными раствора-
ми от глицерина и ресуспензируют в физиологическом раство-
ре. Готовая к употреблению ЭМ должна иметь гематокрит в пре-
делах 70—80 %. Поскольку часть процедур при приготовлении от-
мытых размороженных эритроцитов происходит в условиях раз-
герметизации стерильных систем, то срок хранения готовой
продукции — не более 24 ч при +1—6 °C.
Метод замораживания ЭМ позволяет накопить и хранить
продолжительное время эритроциты доноров редких групп кро-
61
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ви и достаточно оперативно представлять их после разморажи-
вания и отмывания тем пациентам, которые в них нуждаются.
Возможность сохранять функционально полноценные эри-
троциты более длительно, чем при обычных условиях, открыло
возможность дробно заготавливать, замораживать и хранить до-
статочные объемы аутологичной крови, которую используют в пе-
риод операции для самого больного. Имеются сведения о целе-
сообразности применения метода замораживания, хранения
ЭМ доноров, не имеющих антител к цитомегаловирусам, для
трансфузии больным, которым переливание компонентов кро-
ви, содержащих ЦМВ, противопоказано (иммунокопрометиро-
ванные больные; пациенты, готовящиеся к трансплантации
органов и тканей).
Возможность замораживать и хранить достаточно боль-
шие объемы аутоэритроцитов позволяет использовать этот ме-
тод для хранения сколь угодно долгое время эритроцитов лю-
дей, чья профессия связана с риском механической, химической
или радиационной травмы.
В размороженных отмытых эритроцитах уровень свободно-
го гемоглобина перед трансфузией не должен превышать 2 г/л
при гематокритном показателе не менее 30 %, сохранность — не
менее 80 % клеток, 24-часовая посттрансфузионная прижива-
емость — не менее 70 %.
Условия хранения
Размороженные отмытые эритроциты, как и другие эритро-
цитные среды, должны храниться до трансфузии при темпера-
туре +2—6 °C.
Предельные сроки хранения размороженных отмытых эри-
троцитов составляют 24 ч после их оттаивания.
Показания к переливанию размороженных отмытых эритро-
цитов аналогичны назначениям ЭВ или нативных ОЭ. Однако
взвесь размороженных эритроцитов обладает целым рядом пре-
имуществ:
1. В процессе криоконсервирования и отмывания из
взвеси эритроцитов удаляются все другие клеточные элемен-
ты крови, вазоактивные вещества, калий и антикоагулянты,
входящие в состав гемоконсерванта, старые и нестойкие
эритроциты.
62
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
2. В процессе отмывания из взвеси эритроцитов практиче-
ски полностью удаляются вирусы гепатитов В и С.
3. Размороженные эритроциты практически лишены ал-
лергизирующих свойств, так как основные иммунизирующие
факторы удаляются в процессе отмывания.
Трансфузии ЭМ или ЭВ
Одной из трудностей, с которой встречается врач при ге-
мотрансфузии ЭМ, является скорость процедуры переливания.
Особое значение скорость введения компонентов крови, в
особенности ЭМ, приобретает в критических ситуациях при
массивной кровопотере. Основную роль в уменьшении ско-
рости инфузии цельной крови и ЭМ за счет увеличения вяз-
кости играют эритроциты. В целом стратегия гемотрансфузии
консервированной крови, ЭМ и других компонентов крови
аналогична таковым при внутривенных вливаниях жидко-
стей — солевых или плазмозаменяющих растворов. В соответ-
ствии с известным уравнением Гагена—Пуазейля скорость
трансфузии увеличивается:
• с повышением градиента давления в системе;
• при использовании катетеров большего диаметра;
• и/или при применении коротких катетеров;
• при снижении вязкости переливаемых препаратов крови.
Увеличения скорости трансфузии ЭМ или цельной кон-
сервированной крови можно добиться, используя достаточно
простые, но эффективные приемы. Поскольку определяющее со-
противление в трансфузии оказывают эритроциты, то увели-
чить текучесть ЭМ можно добавлением к ЭМ физиологическо-
го раствора. Для этой цели обычно применяют Y-образные со-
единительные трубки, позволяющие смешивать форменные эл-
ементы и изотонический раствор натрия хлорида в равных объе-
мах. Такой простой прием позволяет увеличить скорость инфу-
зии в 3 раза.
Разведение ЭМ следует производить физиологическим ра-
створом. При необходимости применения в этих целях других со-
левых растворов следует принять во внимание то обстоятельство,
что они могут иметь побочные эффекты. Так, например, ра-
створ Рингера с лактатом может усилить свертывание крови,
что связано с наличием ионов кальция.
63
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Другим способом, позволяющим увеличить скорость гемо-
трансфузии, является проведение инфузии под давлением (см.
рис. 1.1). Обычно для увеличения давление применяют надувные
манжеты для измерения артериального давления. Манжету на-
кладывают вокруг пластикового контейнера с ЭМ и нагнетают
воздух до давления в 200—220 мм рт. ст. Подобная процедура
обычно увеличивает скорость инфузии в 2—3 раза по отношению
к аналогичной процедуре, проводимой при атмосферном да-
влении. В отсутствие манжеты аналогичного результата можно
добиться, сжимая пакет руками.
Размер катетера также играет важную роль в скорости ин-
фузии. При равных условиях наибольшую скорость инфузии
компонентов крови можно обеспечить, используя катетер с
большим внутренним диаметром. Так, объем жидкости, проте-
кающей через катетер № 14, на 75 % больше, чем через катетер
№ 16 такой же длины, а скорость протекания жидкости через ко-
роткий (5 см) катетер на 50 % больше, чем через длинный (20 см)
катетер такого же диаметра.
Дополнительное сопротивление во время гемотрансфузии
могут создать и фильтры на системах для переливания крови или
дополнительно вмонтированные в систему для удаления лейко-
цитов, тромбоцитов и микроагрегатов. Фильтры систем для пе-
реливания крови (вместе со всей системой) рекомендуется ме-
нять после переливания 3—4 стандартных упаковок крови или
ЭМ, так как они достаточно быстро забиваются и препятствуют
прохождению гемотрансфузионного средства, что сказывается
на скорости его инфузии. При необходимости быстрой инфузии
компоненты крови необходимо пропустить через специальные
антилейкоцитарные, антитромбоцитарные и антиагрегатные
фильтры до их поступления к больному.
Подогревание крови также способствует ускорению гемо-
трансфузии. Согревание снижает вязкость охлажденной крови
в 2,5 раза. Обычно подогревание производят, погружая пакет с
ЭМ в воду, подогретую до температуры +37 °C на 20—30 мин. Не-
редко в условиях отсутствия возможности контроля за темпера-
турой нагревания, такая процедура приводит к перегреванию
крови и гемолизу части эритроцитов. Для подогревания компо-
нентов крови рекомендуется использовать специальные прис-
64
ГЛАВА I. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
пособления, позволяющие осуществлять контроль за процессом
согревания. Как правило, эти приборы имеют свернутую спи-
ралью трубку, накрученную вокруг нагревательного элемента,
температура в которой поддерживается на уровне 35—37 °C с
помощью электрических нагревательных элементов. Трубки,
через которые протекает компонент крови, одноразового ис-
пользования и монтируются перед фильтром системы д ля гемо-
трансфузии. Подогревание крови с помощью специальных
устройств позволяет увеличить скорость инфузии до 150 мл/мин.
Согревание компонентов крови снижает риск гипотермии
при массивных переливаниях охлажденных компонентов кро-
ви. При гемотрансфузии неподогретой крови иногда можно на-
блюдать желудочковые аритмии (обычно не развиваются до
снижения температуры тела ниже +28 °C). Минимальная реко-
мендуемая температура переливаемой крови и ее компонентов
равна +35 °C.
Плазма свежезамороженная
Среди компонентов крови по объему применения в клини-
ке плазма занимает первое место. Так, только в США ежегодно
используются 1,8—2,0 миллиона доз плазмы.
Плазма — бесклеточная жидкая часть крови человека. Плаз-
ма по объему занимает почти половину всей массы крови. Она
является внутренней жидкой средой организма, содержащей
Рисунок 1.1. Трансфузия
компонентов крови:
1 — надувная манжета на пласти-
ковом пакете с компонентом
крови;
2 — изотонический раствор нат-
рия хлорида (или другой крове-
заменитель);
3 — Y-образная соединительная
трубка с фильтром для крови;
4 — устройство для согревания
крови
65
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
композицию различных по составу и свойствам биологически ак-
тивных веществ (белковых, углеводных, липоидных и других
соединений), что определяет важную роль плазмы в обеспече-
нии жизнедеятельности человека.
Соотношение форменных элементов и плазмы в крови че-
ловека определяется показателем гематокрита. У здорового че-
ловека гематокрит равен 45 %, т. е. 45 % всего объема (50 % по
массе) составляют форменные элементы, остальная часть при-
ходится на долю плазмы.
Плазма крови — коллоидный раствор, содержащий 90 % во-
ды, 7—8 % белка: альбумина, альфа-, бета- и гамма-глобулинов,
фибриногена и др., а также их комплексов с липидами и углево-
дами (липо- и гликопротеидов) и 0,9 % неорганических соеди-
нений (электролиты и микроэлементы); pH плазмы = 7,0.
Плазму можно получить:
• фракционированием дозы консервированной крови ме-
тодом центрифугирования;
• на сепараторах (автоматический аферез);
• фильтрацией консервированной крови через специальные
мембраны, задерживающие клеточные элементы;
• путем спонтанного оседания клеточной массы крови под
действием силы тяжести (малоэффективен и практически не
используется).
Из одной стандартной дозы крови — 450—500 мл получают
200—250 мл плазмы. Различаются два вида плазмы: нативная и
свежезамороженная.
Практически всю плазму получают из консервирован-
ной крови в пределах 6 ч после забора крови. Полученная
плазма сразу же подвергается глубокому замораживанию
при температуре —45 °C. Приготовленная таким образом
плазма имеет название свежезамороженной плазмы (СЗП) и
содержит весь комплекс стабильных и лабильных факто-
ров гемостаза, фибринолиза, системы комплемента и про-
пердина, разномолекулярные белковые комплексы, обеспе-
чивающие онкотическое давление, антитела, иммунные
комплексы и другие факторы.
При —30 °C СЗП может храниться до одного года. Такие
условия позволяют сохранить с минимальными потерями
66
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
факторы V и VIII, а также другие неустойчивые факторы
свертывающей системы крови.
Нативная плазма, так же как и СЗП, содержит весь ком-
плекс стабильных и лабильных факторов гемостаза, фибрино-
лиза, системы комплемента и пропердина, разномолекуляр-
ные белковые комплексы, обеспечивающие онкотическое да-
вление; антитела и другие факторы, составляющие иммуноло-
гическую часть крови.
Белки плазмы обладают высокой иммуногенностью, что
может явиться причиной сенсибилизации больных, особен-
но в результате многократных трансфузий. В период или не-
посредственно после трансфузии СЗП у больных, сенсиби-
лизированных к белковым комплексам плазмы, могут возни-
кнуть осложнения в виде анафилактических трансфузионных
реакций. Больные с дефицитом иммуноглобулина А в этом
отношении должны находиться под особым наблюдением,
поскольку входят в группу повышенного риска предраспо-
ложенности к анафилактическим реакциям.
В рамках анализа лабораторных показателей в трансфузии
СЗП нет необходимости (стандарты американских патологов,
1994) при условии, что:
• протромбиновое время превышено не более чем в 1,5 ра-
за (> 18 с) среднего нормального показателя;
• активированное парциальное протромбиновое время
(АПТВ) превышено не более чем в 1,5 раза верхней границы нор-
мы (> 50-60 с);
• выявляется менее 25 % активности фактора свертывания.
При назначении СЗП необходимо помнить, что:
• не определена эффективность СЗП у больных с тяжелым
заболеванием печени при активном кровотечении;
• не определена роль трансфузии СЗП у больных, опериро-
ванных на печени, в послеоперационном периоде;
• СЗП не может корригировать коагуляционные наруше-
ния, связанные с тяжелыми заболеваниями печени;
• в целях купирования кровотечения у больных с пораже-
нием печени необходимы большие объемы СЗП — не менее 5 доз;
• СЗП малоэффективна при лечении иммунодефицитных
состояний;
67
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• одна доза СЗП для лечения взрослого больного во многих
случаях малоэффективна;
• СЗП не должна назначаться профилактически без лабо-
раторных исследований;
• СЗП под держивает коагуляционные тесты в нормальных
границах у больных с дефицитом факторов XI, VII, V, протеина
С, протеина S, антитромбина III (АТ-Ш).
При лечении тромботической тромбоцитопенической пур-
пуры рекомендуется плазмообмен с замещением СЗП.
Гиповолемия не требует трансфузий СЗП. Безопаснее, де-
шевле и доступнее в этих случаях инфузии коллоидных крове-
заменителей в сочетании с кристаллоидами и (или) растворов
альбумина. При отсутствии активного кровотечения больной
не должен получать СЗП, если протромбиновое время не более
чем на 3 с выше верхней границы нормы.
Число патологических состояний, при которых установле-
на эффективность трансфузий СЗП, весьма велико. СЗП обла-
дает большой лечебной эффективностью при кровотечениях и
кровоточивости, вызванных дефицитом комплекса свертываю-
щих факторов, коагулопатиями.
В нашей стране в условиях недостаточного количества
специфических концентрированных компонентов плазмы,
соответствующих фармакологических препаратов трудно пе-
реоценить значение трансфузий СЗП как эффективного ле-
чебного средства при ряде заболеваний. Особо следует отме-
тить следующее обстоятельство — основная масса данных об
эффективности СЗП была получена в тот период, когда на
рынке отсутствовали факторы гемостаза в виде лекарственных
препаратов. В настоящее время в большинстве из перечи-
сленных случаев при наличии препаратов плазмы (белковых
и специфических концентратов факторов свертывания) и
кровезаменителей использование СЗП можно ограничить, а
в ряде случаев предпочтительно обойтись без трансфузий
плазмы.
В соответствии с классификатором ОК ККЧиК в зависимо-
сти от способа получения, сроков замораживания, лейкофильт-
рации выделяют различные виды замороженной плазмы:
• Плазма свежезамороженная из дозы крови.
68
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
• Плазма свежезамороженная, полученная дискретным
аферезом.
• Плазма свежезамороженная, полученная автоматическим
аферезом.
• Плазма свежезамороженная, фильтрованная.
• Плазма замороженная.
• Плазма замороженная, фильтрованная.
Плазма, замороженная не позднее двух часов после взятия
крови у доноров, имеет рабочее название антигемофильная плазма,
так как содержит VIII фактор свертываемости — антигемофильный
глобулин в более высоких концентрациях, чем СЗП, полученная в
более поздние сроки (в ОК ККЧиК продукт крови под таким наз-
ванием отсутствует). В клинической практике может быть замене-
на криопреципитатом.
Условия хранения
СЗП может храниться при температуре —30 °C в течение 12
месяцев с момента пункции вены при условии сохранения герме-
тичности упаковки. В соответствии с приказом №193 МЗРФ от
07.05.2003 г. для карантинизированной свежезамороженной
плазмы допускается режим хранения 24 месяца при температуре
ниже —30 °C.
Подбор пары донор—реципиент производится по системе AB0.
Плазма группы AB(IV) в экстренных случаях может переливаться
бальному с любой группой крови.
Способ применения и дозы
Непосредственно перед переливанием СЗП оттаивают при
температуре +37—38 °C. При отсутствии специального оборудо-
вания для размораживания СЗП можно использовать водяные
бани (при строгом контроле за температурой воды — перегрев не
допускается!). После оттаивания до трансфузии допускается
хранение плазмы в течение короткого времени (не более 1 ч) при
+1—6 °C. Содержание в размороженной плазме хлопьев фи-
брина не препятствует переливанию через стандартные пла-
стиковые системы, имеющие фильтры. Повторное заморажи-
вание и использование размороженной плазмы не допускается.
Если консервированная кровь до разделения на компоненты не
Делейкоцитироволась, то рекомендуется переливать СЗП через спе-
циальные фильтры, задерживающие лейкоциты.
69
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Размороженная СЗП вводится, как правило, внутривенно. По
отдельным показаниям, при массивных хирургических кровотече-
ниях — внутриартериально. Плазму можно вводить в костный мозг,
подкожно.
СЗП используется прежде всего для восполнения факто-
ров коагуляции. С заместительной целью СЗП вводят струйно
в больших объемах, обычно в сочетании с полиглюкином.
Дозировки СЗП зависят от клинической ситуации и течения
заболевания и могут составлять от 250—300 мл до 1000 мл в сут-
ки. Введение капельное или струйное, в зависимости от показа-
ний к применению. Для лечения большинства заболеваний ре-
комендуется стандартная доза СЗП — 15 мл/кг. В тех случаях, ког-
да трансфузии СЗП сочетаются с трансфузиями тромбокоцен-
трата, следует принимать в расчет, что с каждыми 5—6 дозами
тромбоконцентрата больной получает объем плазмы, эквивалент-
ный 1 дозе СЗП.
Для достижения гемодинамического эффекта суммарная
доза инфузируемой СЗП должна обеспечивать устойчивое повы-
шение АД выше критического уровня (90 мм рт. ст.).
В целях дегидратации у пациентов с признаками отека го-
ловного мозга, отека легких в условиях отсутствия альбумина по-
казано введение концентрата нативной плазмы.
Показания к применению
Показания к переливанию СЗП неуклонно расширяются без
достаточных к тому оснований. Можно выделить две основные
причины, способствующие этому: высокая стоимость и отсут-
ствие в достаточном количестве и ассортименте (по крайней
мере, для отечественных клиник) специфических концентратов
свертывающих факторов, которые могли бы заменить СЗП, и,
что очень важно, отсутствие на сегодняшний день унифициро-
ванных рекомендаций и четких показаний к трансфузиям СЗП.
Применение СЗП показано при следующих клинических со-
стояниях:
• отсутствие специфического препарата для терапии изоли-
рованного дефицита факторов свертывания крови (II, V, VII,
IX, X, XI и XIII) или ингибиторов (антитромбина III, протеинов
С и S, С1-эстеразы);
• острый ДВС-синдром;
70
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
• тромботическая тромбоцитопеническая пурпура;
• сепсис (включая сепсис новорожденных);
• больные после операций на открытом сердце;
• экстракорпоральное кровообращение;
• необходимость срочной нейтрализации орального анти-
коагулянта в случаях их передозировки (при отсутствии соответ-
ствующих антидотов или их неэффективности);
• дефицит витамина К (у новорожденных);
• гемофилии А и В, сопровождающиеся кровотечениями;
• коррекция ОЦК при массивной кровопотере, наружные
и внутренние кровотечения;
• ожоговая болезнь — возмещение плазменного объема;
• гнойно-септические процессы различной этиологии —
возмещение плазменного объема и как дезинтоксикационное
средство;
• отеки головного мозга — с целью дегидратации.
Использовать плазму для возмещения плазменного объема,
как дезинтоксикационное средство и с целью дегидратации сле-
дует только при отсутствии соответствующих кровезамени-
телей.
До- и посттрансфузионная оценка состояния коагуляции у
пациента — важнейшая составляющая трансфузиологической
тактики при использовании СЗП. Она должна осуществляться
на основании комплекса клинических и лабораторных данных.
Противопоказания к переливанию плазмы
В последние годы появились публикации, в которых авто-
ры на основании личных наблюдений и рекомендаций обществ
трансфузиологов, конференций, съездов специалистов тран-
сфузионной медицины пытаются определить рекомендации для
трансфузий СЗП.
СЗП не показана:
• в качестве средства профилактики осложнений при мас-
сивной трансфузии;
• для нейтрализации гепарина при сердечно-легочной перфузии;
• для увеличения ОЦК;
• профилактически после сердечно-легочного шунтирования;
• профилактически вместе с массивной гемотрансфузией;
• для целей парентерального питания;
71
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• для профилактических трансфузий больным без клини-
ческих проявлений активного кровотечения, у которых име-
ется небольшое увеличение протромбинового времени (на 3 с
выше верхней границы нормы) при проведении замещения,
удаления грудных дренажей и других «открытых» хирургиче-
ских процедур, перед биопсией печени;
• при хроническом ДВС в отсутствие геморрагий;
• при выявлении у больных явлений гиперкоагуляции и по-
вышенной сенсибилизации к парентеральному введению белка.
Трансфузии СЗП не показаны в профилактических целях
больным с увеличенным протромбиновым временем (до 3 с и
выше верхней границы нормы).
Абсолютные противопоказания к трансфузиям СЗП:
• гиперкоагуляция;
• сенсибилизация к парентеральному введению белка.
Необходимо помнить, что плазма является основным но-
сителем маркеров инфекционных заболеваний.
Плазма антистафилококковая человеческая и плазма ан-
тисинегнойная человеческая
Иммунной считается плазма, содержащая антитела против
стафилококка в титре 6 ME и более (плазма антистафилококко-
вая человеческая — АСП) или синегнойной палочки 300 ЕД
ИФА и более (плазма антисинегнойная человеческая — АСГП).
Трансфузии АСП или АСГП показаны для лечения или
профилактики гнойно-септических осложнений, вызываемых
соответствующим бактериальным агентом (сепсис, раневая
инфекция, ожоговая болезнь, абсцедирующая пневмония,
гемобластозы и т. д.).
Плазма вводится внутривенно капельно ежедневно или че-
рез день — в зависимости от тяжести заболевания — по
200—300 мл или 3—5 мл/кг массы (не менее 18 ME). Курс: 3—5
раз и более в соответствии с тяжестью течения болезни и те-
рапевтическим эффектом.
Детям периода новорожденное™, в том числе недоно-
шенным, переливание антистафилококковой плазмы произ-
водят из расчета 10 мл/кг массы (не менее 60 ME). Для каждой
разновидности плазмы показания к переливанию будут различ-
ными (табл. 1.7).
72
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Таблица 1.7
Плазма Показания
Свежезаморо- женная плазма (СЗП) 1. ДВС-синдром. 2. Коррекция ОЦК при мас- сивной кровопотере, наружные и внутренние кровотечения. 3. Ожоговая болезнь. 4. Гнойно- септические процессы различной локализа- ции. 5. Коагулопатии с дефицитом II, V,VII и XIII и др. факторов свертывания. 6. Гемофи- лии А и В, сопровождающиеся кровотечения- ми. 7. Гепаринотерапия тромбозов
Концентрат на- тивной плазмы (КНП) Заболевания, сопровождающиеся значитель- ным дефицитом прокоагулянтов и диспроте- инемией
Антистафилокок- ковая плазма, ан- тисинегнойная плазма Терапия гнойно-септических осложнений, вы- званных соответствующей патогенной флорой
Препараты плазмы
Из плазмы донорской крови можно получить ряд эффектив-
ных препаратов.
Из препаратов плазмы — корректоров системы гемостаза —
широкое применение нашли криопреципитат (протромбино-
вый комплекс, или PPSB), плазма нативная концентрированная,
фибриноген, тромбин.
Криопреципитат
Криопреципитат — концентрированная смесь плазменных
факторов свертывания, полученная из СЗП методом криопре-
ципитации. В небольшом объеме содержит фибриноген и фак-
тор VIII в высокой концентрации. Одна доза, полученная из
дозы СЗП, содержит:
• фибриноген 250 мг;
• фактор VIII — активность не менее 90 ME;
• фибропектин;
• антитромбин III.
Показания к применению:
• Профилактика и лечение больных гемофилией А.
• Дефицит фибринстабилизирующего фактора.
73
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Показаниями для применения криопреципитата является
лечение и профилактика кровотечений у больных гемофилией
А и болезнью Виллебранда (ангиогемофилия), кровотечений
другой этиологии, при которых резко уменьшается фактор VIII
в крови больного.
Как правило, для остановки кровотечения при дефиците со-
ответствующих факторов свертывающей системы крови требу-
ется от 6 до 10 ЕД криопреципитата на одну гемотрансфузию. Ос-
новным потребителем криопреципитата являются больные ге-
мофилией. С разработкой и внедрением в клиническую практи-
ку лекарственных препаратов, полученных генно-инженерны-
ми методами, можно прогнозировать снижение использования
этого компонента крови. Следует иметь в виду, что степень рис-
ка заражения инфекциями, передающимися через кровь при
переливании криопреципитата, такая же, как и при переливании
СЗП или других компонентов крови.
Кроме больных гемофилией, имеющих генетически об-
условленный дефицит плазменных факторов свертывания
крови, показанием для применения криопреципитата явля-
ется не купируемое иными медикаментозными средствами
кровотечение при уремии, экстракорпоральном кровообра-
щении. Полагают, что присутствующий в криопреципитате
фактор Виллебранда (фактор VIII) восстанавливает функ-
циональную способность тромбоцитов. По-видимому, по-
ложительное влияние оказывает и антитромбин III, сниже-
ние которого отмечается при уремии и экстракорпоральном
кровообращении.
Криопреципитат в высоких концентрациях содержит фибро-
нектин, обладающий опсонизирующей активностью по отноше-
нию к инкапсулированным грамположительным бактериям (на-
пример, стафилококкам). Это, в свою очередь, способствует их
дальнейшему поглощению нейтрофилами. Отмечено, что у боль-
ных в тяжелом состоянии уровень циркулирующего фибропек-
тина часто снижается. Восполнить дефицит фнбринекгина мож-
но переливанием криопреципитата.
Условия хранения
Срок годности замороженного криопреципитата — 3 меся-
ца при температуре —30 °C.
74
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Плазма нативная концентрированная
Плазма нативная концентрированная (ПНК) содержит все
основные составные части свежезаготовленной плазмы (кроме
сниженного содержания фактора VIII), но в 2,5—4 раза меньшем
объеме (80 ± 20 мл). Концентрация общего белка выше, чем в на-
тивной плазме и должна быть не менее 10 % (100 г/л). Облада-
ет повышенными гемостатическими и онкотическими свой-
ствами вследствие увеличения содержания белков плазмы и
факторов свертывания (кроме фактора VIII).
Показания к применению
ПНК предназначена для лечения больных с выраженным де-
фицитом различных прокоагулянтов, гипо- и афибриногене-
мией; как дегидратирующее и дезинтоксикационное средство;
для лечения заболеваний, сопровождающихся белковой недоста-
точностью, развитием отечно-асцитического и геморрагиче-
ского синдромов.
Способ применения и дозы
При кровотечениях, обусловленных врожденным или прио-
бретенным дефицитом прокоагулянтов, ПНК вводят в дозе
5—10 мл/кг в сутки до полной остановки кровотечения.
При белковой недостаточности с развитием асцитического
синдрома возможно применение препарата в дозе 125—150 мл в сут-
ки с интервалами 2—3 дня, в среднем на курс 5—6 переливаний.
Противопоказания
ПНК не следует применять при тяжелых нарушениях функ-
ции почек с анурией. После введения препарата возможно ра-
звитие аллергических реакций, которые купируются введением
антигистаминных средств.
Условия хранения
Препарат хранится в замороженном состоянии. Срок год-
ности — 3 месяца при температуре —30 °C.
Тромбоцитный концентрат
Тромбоцитный концентрат (ТК) — это суспензия жизнес-
пособных и гемостатически активных тромбоцитов в плазме,
приготовленная методом серийного центрифугирования консер-
вированной крови или методом тромбоцитафереза крови од-
ного донора. ТК — высокоэффективный корректор сосудисто-
тромбоцитного гемостаза.
75
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
В зависимости от метода получения и числа доноров, от
которых были получены тромбоциты, пулирования (смешива-
ние различных доз), облучения, условий хранения, фильтрации
и пр. в ОК ККЧиК выделяют:
• Тромбоцитный концентрат из дозы крови.
• Тромбоцитный концентрат из дозы крови, гамма-облучен-
ный.
• Тромбоцитный концентрат, пулированный, монодонор-
ский.
• Тромбоцитный концентрат, пулированный, монодонор-
ский, фильтрованный.
• Тромбоцитный концентрат, пулированный, монодонор-
ский, гамма-облученный.
• Тромбоцитный концентрат, пулированный, монодонор-
ский, гамма-облученный, фильтрованный.
• Плазма, обогащенная тромбоцитами, гамма-облученная.
• Тромбоцитный концентрат, пулированный, полидонор-
ский.
• Тромбоцитный концентрат, пулированный, полидонор-
ский, гамма-облученный.
• Тромбоцитный концентрат, пулированный, полидонор-
ский, фильтрованный.
• Тромбоцитный концентрат, пулированный, полидонор-
ский, гамма-облученный, фильтрованный.
• Тромбоцитный концентрат, пулированный, полидонор-
ский, полуавтоматический.
• Тромбоцитный концентрат, пулированный, полидонор-
ский, полуавтоматический, гамма-облученный.
• Тромбоцитный концентрат, пулированный, полидонор-
ский, полуавтоматический, фильтрованный.
• Тромбоцитный концентрат, пулированный, полидонор-
ский, полуавтоматический, гамма-облученный, фильтрованный.
• Тромбоцитный концентрат, полученный дискретным афе-
резом.
• Тромбоцитный концентрат, полученный дискретным афе-
резом, гамма-облученный.
• Тромбоцитный концентрат, полученный дискретным афе-
резом, фильтрованный.
76
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
• Тромбоцитный концентрат, полученный дискретным афе-
резом, гамма-облученный, фильтрованный.
• Тромбоцитный концентрат, полученный автоматическим
аферезом.
• Тромбоцитный концентрат, полученный автоматическим
аферезом, гамма-облученный.
• Тромбоцитный концентрат, полученный автоматическим
аферезом, фильтрованный.
• Тромбоцитный концентрат, полученный автоматическим
аферезом, гамма-облученный, фильтрованный.
• Тромбоцитный концентрат, размороженный.
Содержание тромбоцитов в одной дозе ТК зависит от мето-
да его получения:
• ТК, приготовленный из обогащенной тромбоцитами плаз-
мы (ОТП), содержит в среднем 0,7 х 10“ тромбоцитов в 50—60 мл
плазмы и имеет примесь эритроцитов до 1,0 х I О9 и лейкоцитов
доО,2хЮ9;
• ТК, приготовленный из лейкотромбослоя (ЛТС), содер-
жит в среднем 0,65 х 10" тромбоцитов в 50—75 мл плазмы и име-
ет примесь лейкоцитов до 0,05 х 109;
• ТК, полученный тромбоцитаферезом, содержит не ме-
нее 2,0 х 10" тромбоцитов в 200—300 мл плазмы и имеет примесь
эритроцитов менее 1 х 1010 и лейкоцитов до 0,6 х 109.
Когда необходимо получить дозу с высоким содержанием
тромбоцитов, используют метод тромбофереза на автоматических
сепараторах крови. Методом гемафереза можно получить от од-
ного донора с соответствующим для определенного пациента
HLA фенотипом в течение 2—3 ч (3—5) х 10" тромбоцитов в
200—400 мл плазмы, т. е. в 6—8 раз больше, чем от одного доно-
ра при обычной кроводаче.
Метод аппаратного гемафереза позволяет свести к миниму-
му загрязнения ТК эритроцитами и лейкоцитами. В идеале же-
лательно получать ТК с большим содержанием тромбоцитов от
одного, хорошо обследованного донора.
ТК должен отвечать следующим требованиям (выбороч-
ный контроль):
• Не содержать макроскопических агрегатов, видимых
сгустков, нитей фибрина.
77
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• В конце разрешенного срока хранения pH должен быть не
ниже 6,0.
• До конца срока хранения содержание тромбоцитов в
ТК, выделенных из отдельных доз консервированной крови,
должно оставаться не менее 0,5 х 10"; полученных аферезным
методом — не менее 2,0 х 10' *.
• Объем плазмы в ТК должен быть в зависимости от мето-
да его получения 45—60 мл, 45—75 мл, 200—300 мл.
• Примесь лейкоцитов не должна превышать 0,2 х 10’ в
дозе ТК, выделенного из ОТП; 0,05 х 109 — в дозе, выделенно-
го из ЛТС; 1,0 х 109, полученного методом афереза.
• Примесь эритроцитов не должна превышать 1,0 х 109 в од-
ной дозе ТК.
• Упаковка ТК должна быть герметичной и иметь правиль-
ную маркировку.
При необходимости применения больших доз тромбоцитов
допускается их пулирование, т. е. объединение в одном объеме
нескольких доз тромбоцитов от различных доноров крови. Та-
кие тромбоциты должны быть перелиты в пределах 6 ч.
Для предотвращения реакции «трансплантат-против-хо-
зяина» тромбоконцентрат, который готовят для больных со сни-
женным иммунитетом, подвергают радиационному облучению
в специальных установках.
Условия хранения
Д ля хранения ТК можно использовать два температурных
режима: +4 °C и +24 °C:
1. Тромбоциты, хранящиеся при +4 °C, менее жизнеспо-
собны и через 48 ч такого температурного режима хранения
функционально неполноценны. Однако in vivo они дают немед-
ленный гемостатический эффект. Именно поэтому данные
тромбоциты предпочтительнее при тяжелом геморрагическом
синдроме.
2. Хранение тромбоцитов в специальных пластиковых кон-
тейнерах при температуре +22—24 °C при постоянном переме-
шивании способствует сохранению их жизнеспособности, под-
держанию стабильного pH на уровне 7 и обеспечению клеток ки-
слородом. При таком режиме хранения в течение 5 дней отсут-
ствует бактериальный рост. Тромбоциты, хранящиеся при ком-
78
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
натной температуре, теряют способность к агрегации и тем са-
мым гемостатическую функцию, что восстанавливается при
введении их в сосудистое русло. Следует учитывать, что храня-
щиеся в таком режиме тромбоциты не оказывают клиническо-
го гемостатического эффекта во время первых часов после их пе-
реливания. Поэтому при тяжелом геморрагическом синдроме,
как сказано выше, предпочтительнее использовать тромбоциты,
хранящиеся при +4 °C.
3. Возможно хранение тромбоцитов в замороженном со-
стоянии при температуре —80 °C.
В течение 6 ч размороженные тромбоциты должны быть
перелиты. Начальное посттрансфузионное восстановление раз-
мороженных тромбоцитов у реципиента такое же, как при пере-
ливании свежих тромбоцитов. Однако хранение тромбоцитов в
замороженном состоянии не нашло широкого распростране-
ния из-за большой потери клеток и грубого нарушения функцио-
нальных свойств (клинически полноценными сохраняются око-
ло 30 % клеток).
Показания к применению ТК
Несмотря на многолетний опыт применения, до сих пор
окончательно не установлены точные показания к перелива-
ниям тромбоцитов. Не существует единого критического поро-
га или количества тромбоцитов для назначения трансфузии.
Лечебное действие трансфузий ТК зависит не только от обще-
го состояния больного, наличия осложнений, но и от функцио-
нальной полноценности и дозы переливаемых тромбоцитов, а
также от иммунологической совместимости крови донора и ре-
ципиента.
Основные показания к назначению ТК:
• Недостаточное образование тромбоцитов в костном моз-
ге — амегакариоцитарная тромбоцитопения (лейкозы, гемато-
саркомы и другие онкологические процессы с поражением ко-
стного мозга, апластическая анемия, депрессия костно-мозго-
вого кроветворения в результате лучевой и/или цитостатиче-
ской терапии, острая лучевая болезнь, трансплантация костно-
го мозга).
• Повышенное потребление тромбоцитов (синдром ДВС в
фазе гипокоагуляции, при оперативных вмешательствах с ис-
79
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
пользованием аппарата искусственного кровообращения, где
наблюдается не только снижение количества тромбоцитов не-
критического уровня, но и изменение их функциональной ак-
тивности).
• Геморрагический синдром, обусловленный недостаточ-
ным количеством тромбоцитов или нарушением их функцио-
нальной способности.
Заболевания, при которых показано назначение трансфузий ТК:
• как элемент комплексной терапии при геморрагическом
диатезе, возникающем в связи с глубокой тромбоцитопенией
> 20-30 х Ю’/л;
• ДВС-синдром (III стадия);
• депрессия костно-мозгового кроветворения в связи с про-
ведением лучевой или цитостатической терапии. Различают три
степени тромбоцитопении (табл. 1.8).
Таблица 1.8. Три степени тромбоцитопении
Степень Число тромбоцитов, X 10’/л
Легкая 60,0-100,0
Умеренная 20,0-60,0
Выраженная <20,0
При легкой тромбоцитопении больные, как правило, не нуж-
даются в трансфузиях тромбоцитов при небольших операциях
или травме, за исключением оперативных вмешательств с высо-
ким риском большого кровотечения (> 500 мл крови), например,
сердечно-сосудистые операции с искусственным кровообраще-
нием, нейрохирургические операции и др.
При умеренной тромбоцитопении (менее 50 х 10’ тромбо-
цитов/л) оперативные вмешательства рекомендуется проводить
с применением профилактических трансфузий тромбоцитов.
Больные, получившие массивные трансфузии крови или эритро-
цитной массы (7—10 и более доз за несколько часов), могут стра-
дать умеренной степенью тромбоцитопении.
Больные с выраженной формой тромбоцитопении (это, в ос-
новном, пациенты с онкологической патологией) — перед опе-
80
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
рацией нуждаются в специальной медикаментозной предопера-
ционной гематологической коррекции гемостаза и трансфузио-
логической подготовке, включающей профилактическую и
обычно, по мере необходимости, постоперативную трансфу-
зию больших доз (> 8—10 и более) ТК.
Кровопотеря в постоперационный период > 5 мл/кг в час или
более 100 мл/ч должна рассматриваться как результат неадекватно-
го хирургического гемостаза и только во вторую очередь—как след-
ствие тромбоцитопении или (и) тромбоцитопатии [Р Tomasulo],
В настоящее время общепринято представление о том, что
число тромбоцитов 100 х 10’ /л или время кровотечения, не пре-
вышающее меньше чем в два раза нормальные показатели, по-
зволяет проводить большинство хирургических операций (абдо-
минальных, торакальных, ортопедических, гинекологических
и др.) без риска возникновения геморрагии, связанной с тром-
боцитопенией. Так, полагают, у больных с гипоплазией крове-
творения, не имеющих дополнительных осложнений, при содер-
жании тромбоцитов в периферической крови 5—10 х Ю’/л более
интенсивный тромбоцитопоэз обеспечивает суточную потреб-
ность в тромбоцитах, составляющую в среднем 4,7 хЮ’/клеток
вдень, что вполне может предупредить развитие спонтанной кро-
воточивости [А.Г. Румянцев, В.А. Аграненко].
Лабораторные данные помогают оценить функцию сверты-
вающей системы крови. На практике до получения лаборатор-
ных данных удобнее ориентироваться на клинически значимые
признаки нарушений гемостаза, включающие три критерия
[Murrey и соавт.]:
• повторное кровотечение из раны после остановки крово-
течения;
• усиление кровотечения без повышения артериального
или венозного давления, или изменений в области операцион-
ной раны;
• пониженная степень свертывания крови, скапливающей-
ся в области раны.
Тромбоциты теряются из кровотока посредством двух меха-
низмов [Slichter Sh., 1994]:
1) 17 %, или 7,1 х 10 из 41,2 ± 4,9 х 10 (т. е. < 3 % циркули-
рующего пула), у здоровых людей теряются ежедневно и удаля-
81
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ются из циркуляции (использованы для поддержания функции
эндотелия);
2) оставшиеся 83 % удаляются механизмом старения.
Средняя эффективная доза ТК для тромбоцитопеническо-
го кровоточащего взрослого составляет 5—10 доз. Для детей — од-
на доза на 10 кг веса ребенка.
Основанием для расчета лечебной дозы переливаемых тромбо-
цитов является необходимость получения определенного поспран-
сфузионного их прироста, достаточного для купирования геморра-
гического синдрома. Полагают, что увеличение числа тромбоцитов
на 50-70 х Ю’/л (50 000—70 000 в 1 мкл) сопровождается длитель-
ным гемостазом, так как после переливания 1 дозы ТК (в среднем
0,5—0,7 х Ю’/л тромбоцитов) прирост через 1 ч после трансфузии со-
ставляет по разным данным от 6 до 10 х 1 О’ /л (6000—10 000 в 1 мкл)
клеток. Одна доза ТК обычно увеличивает количество тромбоцитов
у взрослого больного весом 70 кг на 5 х Ю’/л.
Лечебный эффект щж переливании тромбоцитв наступает не
всегда и требует специального внимания. Трансфузии ТК могут не
сопровождаться увеличением числа циркулирующих тромбоци-
тов и (или) нередко отсутствует их гемостатический эффект.
Как правило, снижение количества тромбоцитов до
20 х Ю’/л клеток при отсутствии угрозы возникновения гемор-
рагических осложнений не является показанием для трансфузии
тромбоцитов. В случае, когда у больных не предполагается опе-
ративных вмешательств, сам по себе низкий уровень тромбоци-
тов не является показанием для назначения переливаний ТК.
Уровень тромбоцитов 85—50 х Ю’/л является достаточным и не
требует переливания ТК даже при полостных операциях при
нормальной функциональной способности клеток. Исключени-
ем являются операции на головном мозге, где опасность крово-
точивости высока. В этом случае количество тромбоцитов дол-
жно превышать 100 х Ю’/л.
На фоне глубокой тромбоцитопении абсолютным пока-
занием к трансфузии ТК является возникновение геморрагий
(снижение числа тромбоцитов до 20 х Ю’/л) на коже нижних
конечностей, спонтанной кровоточивости из слизистых рта
и носа. В этих случаях переливание тромбоцитов показано не
только при оперативных вмешательствах, нс> и при катетери-
82
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
зации магистральных сосудов, люмбальной пункции, лапа-
роскопии и пункционной биопсии органов, экстракции зу-
бов, вскрытии флегмон и абсцессов.
Показанием к экстренному переливанию ТК служит
появление геморрагий на верхней половине туловища, на
коже лица, кровоизлияний в конъюктиву и на глазном дне,
локальных кровотечений (желудочно-кишечный тракт,
матка, почки, мочевой пузырь).
В период острых кровотечений, кроме снижения числа
тромбоцитов, показанием для трансфузии ТК может слу-
жить время кровотечения, которое должно удваиваться по
отношению к исходному.
ТК неэффективен при идиопатической аутоиммунной
тромбоцитопенической пурпуре и диссеминированной
внутрисосудистой коагулопатии, малоэффективен у паци-
ентов с септицемией и гиперспленизмом.
Ряд вопросов, связанных с клиническим применением
тромбоцитарной массы остается до конца не выясненным.
Так, не имеется убедительных доказательств того, что пере-
ливание тромбоцитов уменьшает кровопотерю у кардиохи-
рургических больных.
При острой массивной кровопотере опасность предста-
вляет снижение числа тромбоцитов < 50 х 10 /л, что быва-
ет крайне редко. В подобных случаях в первую очередь
необходимо остановить кровотечение, т. е. обеспечить хи-
рургический гемостаз, восстановить адекватный уровень
показателей, отражающих состояние красной крови (гемо-
глобин, количество эритроцитов, гематокрит) и лишь за-
тем при необходимости производить трансфузию ТК. Пе-
реливания ТК желательно проводить после операции, при
тщательном лабораторном контроле.
Противопоказания:
Профилактические трансфузии ТК при отсутствии послео-
перационной кровоточивости.
Не рекомендуется переливать тромбоцитарную массу:
• при иммунных (тромбоцитолитических) тромбоцитопе-
ниях и тромботической тромбоцитопенической пурпуре (за ис-
ключением кровотечения, угрожающего жизни):
83
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• профилактически, после искусственного кровообращения;
• профилактически, параллельно с массивной гемотрансфузией.
Условия переливания и дозы:
Трансфузию ТК необходимо осуществлять с учетом груп-
повой совместимости донора и реципиента как минимум по
системам АВО.
При необходимости частых гемотрансфузий ТК сенсибили-
зированным к антигенам лейкоцитов и тромбоцитов больным
необходимо выполнять подбор доноров и реципиента по анти-
генам системы HLA и тромбоцитарным антигенам.
ТК переливается внутривенно капельно через одноразо-
вую систему с капроновым фильтром.
Успех заместительной терапии зависит от количества пере-
литых тромбоцитов и их функциональной полноценности. Стан-
дартной терапевтической дозой считается такая, которая со-
держит 4,0—5,0 х 10" донорских тромбоцитов. Однако для каж-
дого конкретного больного необходимое количество тромбо-
цитов может быть подобрано индивидуально. Могут быть реко-
мендованы несколько простых, доступных в повседневной ра-
боте методов расчета. Количество переливаемых тромбоцитов
должно составлять:
• 0,7—1,0 х 10" тромбоцитов на каждый литр циркулирую-
щей крови реципиента;
• 0,5—0,7 х 10" тромбоцитов на каждые 10 кг массы тела;
• 2,0—2,5 х 10" тромбоцитов на 1м2 поверхности тела
реципиента.
При спленомегалии, инфекционных осложнениях с ги-
пертермией и сепсисом, ДВС-синдроме, массивных кровотече-
ниях из желудочно-кишечного тракта потребность больного в
количестве донорских тромбоцитов возрастает на 40—80 % от
расчетной дозы.
В зависимости от характера заболевания и тяжести тромбо-
цитозависимого геморрагического синдрома концентраты тром-
боцитов вводят ежедневно или 2—3 раза в неделю.
Общепринята практика переливания 1 дозы ТК на 10 кг
веса тела больного или 4 доз КТ на 1 м2 поверхности его тела.
Естественно, что доза корректируется индивидуально с учетом
многих факторов. В частности, при наличии у больного ослож-
84
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
няюших факторов (инфекция, сепсис, спленомегалия и др.) или
аллоиммунизации объем трансфузий увеличивается в 1,5 раза и
даже до 2 доз ТК на 10 кг.
Основными критериями оценки лечебной эффективно-
сти трансфузий тромбоцитов являются клинические признаки
прекращения или уменьшения кровоточивости, увеличение
числа циркулирующих тромбоцитов через час и 18—24 ч после
трансфузии ТК.
В каждом конкретном случае для купирования кровотечен ия
или в целях профилактики доза ТК определяется индивидуально
для каждого больного, исходя из комплекса клинических и лабо-
раторных данных и прежде всего показателей коагулограммы.
Лабораторными признаками эффективности переливае-
мых тромбоцитов служат: увеличение количества тромбоцитов
у реципиента через час после трансфузии (не менее 50,0—60,0 х
х Ю’/л) и их повышенное содержание через 24 ч; коррекция
длительности кровотечения у больного через час и через 24 ч по-
сле трансфузии.
Даже при неудовлетворительных лабораторных показателях
необходимо помнить, что система гемостаза обладает огром-
ными резервными возможностями и позволяет обеспечить аде-
кватный гемостаз во многих ситуациях.
Оптимальным режимом трансфузий тромбоцитов является
такой, при котором длительность кровотечения нормализуется,
что обычно соответствует концентрации тромбоцитов в перифе-
рической крови реципиента, равной 40,0 х Ю’/л и выше. Число
тромбоцитов у больного с тромбоцитопенической кровоточиво-
стью в 1-й час после трансфузии ТК должно быть увеличено до
50-60 х Ю’/л.
Осложнения при переливании ТК
Переливание ТК может сопровождаться трансфузионными
реакциями негемолитического типа: повышением температуры
тела, ознобом, аллергическими реакциями. Крайне редко при
АВО-несовместимости (из-за плазмы) трансфузия может ослож-
ниться гемолизом.
Реакции и осложнения тромбоцитотерапии:
• трансфузионные фибрильные реакции;
• гемолитические реакции и осложнения;
85
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• циркуляторная перегрузка (особенно у детей);
• токсемия (при бактериальном загрязнении ТК);
• перенос гематогенных инфекций (ВИЧ, гепатиты В и С,
сифилис, ЦМВ и др.);
• «трансплантат-против-хозяина» (у иммуноскомпроме-
тированных больных);
• сенсибилизация к антигенам эритроцитов;
• сенсибилизация к HLA-антигенам;
• сенсибилизация к антигенам тромбоцитов;
• сенсибилизация к антигенам белков крови;
• гранулоцитопения и угнетение костно-мозгового крове-
творения (при многократных объемных трансфузиях ТК у онко-
логических больных).
Редко встречающееся осложнение при переливании ТК
«трансплантат-против-хозяина» представляет серьезную опас-
ность для больных с иммунодефицитами, после трансплантации
костного мозга или других органов и тканей, а также для ново-
рожденных. Развитие иммунологического конфликта можно
предупредить гамма-облучением ТК в дозе 15 грей
(1500—2000 рад) перед гемотрансфузией. Облучение позволяет
уничтожить иммуноактивные клетки, не разрушая и не нарушая
функциональной потенции тромбоцитов.
К сожалению, посттрансфузионные фибрильные реакции
наблюдаются часто. Озноб, кожные высыпания, повышение
температуры — характерные признаки реакции негемолитиче-
ского типа на трансфузию ТК Такие реакции связаны в основ-
ном с реакцией антиген-антитело и активацией вовлекающего-
ся в продолжение этого процесса каскада плазменно-клеточ-
ных факторов (высвобождение эндогенных пирогенов из лейко-
цитов, повышение цитокинов в КТ в процессе хранения и др.).
Полагают, что механизм запускается в основном антителами
против HLA-антигенов или специфическими антилейкоцитар-
ными, антитромбоцитарными антителами.
Наиболее эффективный способ избежать HLA-сенсибили-
зации — применение ТК, отфильтрованного через специаль-
ные фильтры, задерживающие более 95—99 % лейкоцитов.
Больные с высоким уровнем антитромбоцитарных и анти-
лейкоцитарных HLA-антител резистентны к переливаниям ТК,
86
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ____________
и достичь желаемого результаты у такой категории больных пе-
реливанием тромбоцитов не удается. Для таких больных необхо-
димо подбирать тромбоциты от доноров, совместимых по HLA-
системе и (или) тромбоцитарным антигенам.
Число тромбоцитов у больных необходимо подсчиты-
вать трижды: непосредственно перед переливанием, через
час и через 18—24 ч после трансфузии. Повысить информа-
ционную содержательность исследований можно, выполнив
параллельно иммунологические тесты на HLA- и тромбо-
цитарные антитела. Аллоиммунизация не всегда ведет к
рефрактерности, а больные с антитромбоцитарными ан-
тителами могут давать адекватный посттрансфузионный
прирост тромбоцитов с соответствующим гемостатическим
эффектом. Так, например, наличие в сыворотке крови боль-
ных анти-HLA антител не всегда вызывает рефрактерность
к трансфузиям ТК.
Полагают, что уровень 7,5— 10 х 109/л тромбоцитов в образ-
цах, взятых в течение от 10 минут до часа, и уровень тромбоци-
тов через 18—24 ч после гемотрансфузии не менее 4,5 х Ю’/л ука-
зывает на отсутствие рефрактерности, в частности, в связи с
наличием антител, направленных к антигенам, представлен-
ным на тромбоцитах.
Необходимо отдельно оговорить и возможность более вы-
сокого риска бактериального загрязнения ТК, так как он, в от-
личие от других компонентов крови, хранится при комнатной
температуре или в специальном инкубаторе при +22 °C.
Лейкоцитный концентрат, гамма-облученный
Лейкоцитный концентрат, гамма-облученный (ЛК) — тран-
сфузионная среда с большим содержанием лейкоцитов (10—20 х
х 109 лейкоцитов).
Лейкоциты — ядросодержащие клетки, склонные к адгезии
и необратимой агрегации. Гибель лейкоцитов в процессе хране-
ния происходит в течение нескольких дней. Это и определяет тот
факт, что для трансфузий применяют ЛК либо свежезаготовлен-
ный, либо со сроком хранения не более суток.
Однадоза, полученная от одного донора, содержит > 1,0х 10ю
гранулоцитов, достаточно большое количество лимфоцитов, тром-
боцитов и эритроцитов, взвешенных в 200—300 мл плазмы.
87
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Увеличить выход лейкоцитов можно, введя донору до забо-
ра крови растворы гидроксикрахмала и кортикостероиды.
Одну терапевтическую дозу ЛК, которая будет содержать в
среднем 12 млрд лейкоцитов, можно получить из 5 л крови од-
ного здорового донора на специальных сепараторах клеток.
ЛК хранится (пока донорская кровь проходит лабораторную
сертификацию) при 20—24 °C и переливается не позже 24 ч с мо-
мента заготовки. При обычных условиях хранения консервиро-
ванной цельной крови гранулоциты утрачивают фагоцитарную
активность через 48 ч.
ЛК может быть получен несколькими методами:
• снятием лейкоцитной пленки после центрифугирования
цельной крови и удаления плазмы;
• фильтрационным лейкоцитаферезом — фильтрацией ге-
паринизированной крови через нейлоновые фильтры с последу-
ющим отмыванием с них лейкоцитов;
• лейкоцитаферезом с применением автоматических сепа-
раторов непрерывного действия.
Как примеси в состав ЛК могут входить эритроциты, тром-
боциты и плазма.
Лейкоцитный концентрат подвергают гамма-облученнию
для инактивации лимфоцитов, обладающих высокой иммуно-
логической активностью, для профилактики грозного осложне-
ния, в особенности у иммуноскомпрометированных больных
(«трансплантат - против - хозяина»), а также против возбудите-
лей гемотрансмиссивных инфекций.
Основные показания для назначения ЛК:
• длительная и тяжелая нейропения (< 0,5 х Ю’/л);
• инфекционная бактериальная лихорадка в течение
24—48 ч, при неэффективной терапии антибиотиками;
• диагностированный или предполагаемый сепсис, нечув-
ствительный к антибиотикам или другим способам терапии;
• гематологические заболевания с гипоплазией костного мозга;
• серьезная дисфункция гранулоцитов;
• грамотрицательная бактериемия;
• инфекция, локализованная в жизненно важных областях
и паренхиматозных органах;
• грибковые инфекции.
88
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
Заболевания, при которых рекомендуется рассмотреть воз-
можность трансфузии ЛК:
• иммунодефицитные состояния при гнойно-септических
осложнениях в хирургии;
• профилактика иммунодефицита при цитостатической
болезни;
• коррекция дефицита лейкоцитов при миелотоксической
депрессии кроветворения.
Использование ЛК как профилактического средства имеет
сомнительную терапевтическую ценность.
С каждым годом во всем мире отмечается выраженная тен-
денция к снижению объемов применения ЛК. Это связано с
двумя обстоятельствами.
1. Адекватная терапия различных инфекций антибио-
тиками оказалась более эффективна, чем переливание гра-
нулоцитов. У больных с аплазией или гипоплазией костно-
го мозга (если восстановление функции костного мозга сом-
нительно) трансфузии гранулоцитов практически не влия-
ют на клиническую картину заболевания. Не получено убе-
дительных, однозначных данных о том, что трансфузии ЛК
существенно влияют на септический процесс в организме
больного. Сферу применения ЛК резко ограничивают и пре-
параты крови — иммуноглобулины направленного действия
против определенных инфекций внутримышечного и внутри-
венного применения.
2. Риск передачи цитомегаловируса от донора больно-
му при переливании ЛК очень велик. При рутинной рабо-
те в условиях, когда необходимо обеспечить большие и ча-
стые трансфузии этого компонента риск заражения гема-
трансмиссивными инфекциями возрастает многократно.
Серьезные сомнения вызывают и трансфузии ЛК больным
с высокими титрами цитотоксических антилимфоцитарных
антител. Даже для отделений трансфузиологии с хорошо ос-
нащенной лабораторной техникой и большой картотекой
типированных по HLA-антигенам доноров обеспечить
необходимыми объемами ЛК сенсибилизированных к лей-
коцитарным антигенам больных представляет непростую
задачу.
89
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
В связи с отсутствием убедительных доказательств эф-
фективности трансфузий ЛК, а также показаний к его приме-
нению принято считать, что при необходимости использова-
ния этого компонента крови для получения клинического
эффекта необходимо переливать не менее 2—4 доз ЛК в тече-
ние 4—5 дней ежедневно. Ежедневные трансфузии обусло-
влены коротким периодом жизни в кровяном русле донорских
лейкоцитов (6—8 ч).
Все большее число врачей справедливо считают, что ле-
чение инфекционно-септических осложнений более целе-
сообразно и эффективно антибиотиками комплексного дей-
ствия и специфическими иммуноглобулинами. В любом
случае, как правило, лечение больных с инфекцией следу-
ет начинать с применения антибиотиков, и только в случае
отсутствия лечебного эффекта может обсуждаться вопрос о
трансфузиях ЛК.
Довольно часто наблюдающиеся в период или сразу непо-
средственно после трансфузии ЛК реакции в виде озноба с по-
следующим повышением температуры, купируются назначе-
нием димедрола, супрастина, анальгина.
Необходимо иметь в виду опасность развития у иммуноском-
прометированных больных трансфузионно обусловленной бо-
лезни«трансплантат-против-хозяина».
Основные показатели эффективности трансфузий ЛК:
• снижение гипертермии;
• уменьшение частоты возникновения инфекций;
• купирование или положительная динамика течения ин-
фекционных осложнений;
• положительная динамика числа лейкоцитов в перифе-
рической крови после трансфузии;
• увеличение уровня комплемента в сыворотке;
• повышение гемотоксической активности;
• скорость купирования лихорадки;
• стерильность крови при бактериальных посевах;
• положительная динамика гнойно-септических осложнений.
Главный показатель эффективности трансфузии ЛК — из-
менения показателей, характеризующих клиническое состояние
больного.
90
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Осложнения при трансфузии ЛК:
• трансфузионные фибрильные реакции;
• перенос гематогенных инфекций (ЦМВ, ВИЧ, гепатиты
В и С, сифилис и др.);
• «трансплантат-против-хозяина» (у иммуноскомпроме-
тированных больных);
• сенсибилизация к антигенам эритроцитов;
• сенсибилизация к HLA-антигенам;
• сенсибилизация к антигенам тромбоцитов;
• сенсибилизация к антигенам белков крови;
• гранулоцитопения и угнетение костно-мозгового крове-
творения (при многократных объемных трансфузиях у онколо-
гических больных);
• непрогнозируемое воздействие на иммунную систему.
Условия хранения и переливания
ЛК рекомендуется вводить в первые 6 ч с момента заготовки.
Как исключение, допускается хранение ЛК при +4 °C до 24 ч.
Необходим подбор совместимых пар донор-реципиент,
основанный на типировании крови по системам АВО, резус,
HLA. У лиц, получавших многократные гемотрансфузии, ис-
следуют индивидуальную совместимость в реакции лейкоаг-
глютинации и/или лимфоцитотоксического теста (при пере-
ливании гранулоцитов, лимфоцитов, тромбоцитов). При
необходимости многократных гемотрансфузий лейкоцитарной
массы необходим подбор донора и реципиента по системе
гранулоцитарных антигенов.
Трансфузии ЛК производят ежедневно или через день вну-
тривенно капельно сразу после заготовки. Скорость трансфузии
30—40 капель в минуту. Для переливания ЛК используются стан-
дартные одноразовые системы с капроновым фильтром.
Терапевтическая доза составляет 1—4x10’° клеток. Для про-
явления эффекта терапевтическая доза ЛК должна переливать-
ся ежедневно не менее 3—4 дней подряд.
Решение о назначении трансфузий ЛК рекомендуется согла-
совать с врачом-трансфузиологом.
Вопросы лечебного эффекта от применения ЛК, состав-
ной частью которых являются гранулоциты, во многом все еще
остаются нерешенными и вызывают споры. В целом примене-
91
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ние ЛК, в отличие от других компонентов крови, не нашло ши-
рокого применения в клинике.
Методы переливания крови и ее компонентов
Непрямое переливание крови и ее компонентов
Непрямое переливание крови или ее компонентов (НПК) —
переливание крови (донорской или собственной) или ее компо-
нентов из пластикатного мешка (флакона). Это наиболее распро-
страненный метод в силу возможности заготовки и хранения кон-
сервированной донорской или аутокрови.
В зависимости от пути введения различают виды НПК:
• внутривенное;
• внутриартериальное;
• внутриаортальное;
• внутрикостное.
Переливание крови или ее компонентов в перифериче-
скую вену
Для переливания крови в вену используются два способа: ве-
непункция и венесекция.
Чаще всего для пункции используется одна из поверхност-
ных вен локтевого сгиба.
Переливание крови или ее компонентов в подключичную или
яремную вену
Эти доступы в сосудистую систему используют при необхо-
димости длительного либо многократного введения трансфузи-
онных сред, а также при невозможности по каким-либо причи-
нам провести трансфузию в периферические вены.
Венесекция
Применяется при недоступности для пункгирования не
только периферических, но и центральных вен. Места для вене-
секции — те же вены локтевого сгиба, предплечья, плеча, вну-
тренней лодыжки или тыла стопы. Операция производится под
местным обезболиванием.
Переливание крови или ее компонентов в артерию и аорту
В настоящее время практически не используется.
Метод внутриартериального переливания крови применя-
ют исключительно при проведении операций с высоким ри-
ском кровопотери. Для внутриартериальной инфузии использу-
ют, как правило, сосуды, наиболее близкие к сердцу.
92
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Данная методика позволяет максимально ускорить посту-
пление достаточного количества трансфузионной среды в сосу-
дистое русло, чего нельзя достичь, используя внутривенный
путь введения.
Показания для проведения внутриартериальных трансфузий:
• терминальные состояния при шоках любой этиологии;
• невозможность доступа к венам.
Следует помнить, что внутриартериальное переливание мо-
жет явиться причиной серьезных осложнений, связанных с пов-
реждением и тромбированием артериальных стволов.
Для внутриартериальных инфузий применяются специаль-
ные системы с вмонтированным прибором для измерения давле-
ния. Перед началом трансфузии кровь необходимо подогреть до
температуры тела. Нагнетание крови в артерию производится под
давлением 200—250 мм рт. ст. со скоростью 100—150 мл/мин.
Внутриартериальную инфузию рекомендуется завершить
после достижения стабильного повышения систолического
АД до 80—90 мм рт. ст. В дальнейшем трансфузионно-инфу-
зионную терапию выполняют с использованием внутривенно-
го доступа.
Переливание крови в костный мозг
Метод применяют обычно в педиатрической практике. По-
лагают, что использование методики оправдано тесной анатоми-
ческой связью между воронкообразными синусами костного
мозга и регионарными внекостными сосудами. Для внутрико-
стного переливания крови часто используют грудину, а также
эпифизы длинных трубчатых костей, пяточные кости, крылья
подвздошных костей.
Внутрикостно можно переливать кровезаменители и другие
препараты.
Прямое переливание крови
Метод переливания крови (только крови, а не ее компонен-
тов, препаратов, кровезаменителей) непосредственно от доно-
ра к реципиенту обозначают как прямое переливание крови
(ППК). При использовании ППК не требуется стабилизирова-
ния крови консервантом. При ППК кровь из вены донора заби-
рается в специальное устройство и сразу вводится в сосудистое
русло больного.
93
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Главное достоинство ППК заключается в том, что перели-
ваемая кровь сохраняет все свои полезные свойства в максималь-
ной степени.
В условиях стабильной и полноценной работы отделений
трансфузиологии и службы крови в применении этого метода нет
необходимости. Более того, ППК свойственны ряд недостатков,
которые нередко сводят на нет ожидаемый эффект, а именно:
• необходимость присутствия при ППК донора;
• сложное аппаратное обеспечение метода;
• дефицит времени (ППК требует максимально быстрого
переливания крови из сосуда донора в сосуд реципиента из-за
возможности тромбообразования);
• высокий риск эмболических осложнений;
• высокий риск заражения пациента гематогенными инфек-
циями (СПИД, гепатиты, сифилис и др.);
• невозможность обеспечить объем крови (количество до-
норов определенной группы) при массивных кровотечениях.
Метод необходимо рассматривать исключительно как вы-
нужденное лечебное мероприятие и использовать лишь в экстре-
мальных ситуациях: при внезапном массивном кровотечении,
при отсутствии необходимого объема компонентов крови
(в первую очередь, больших количеств эритроцитов).
Обменное переливание крови
Обменное переливание крови (ОПК) — метод, при котором
одновременно с переливанием донорской крови производится
эксфузия собственной крови реципиента.
При ОПК объем переливаемой донорской крови должен быть
либо адекватным, либо превышающим объем эксфузируемой крови.
ОПК выполняют через две вены (обычно на локтевом сги-
бе или любую доступную) больного: через одну вену кровь реци-
пиента эксфузируется, а через другую параллельно вливается
донорская кровь со скоростью 50—100 мл/мин. Число кровопу-
сканий и темп эксфузии устанавливаются индивидуально для
каждого конкретного больного, в зависимости от исходного со-
стояния больного и уровня АД во время операции.
Процедуру ОПК нельзя рассматривать только как простое
замещение «плохой» крови некоторым объемом «хорошей». При
ОПК сочетаются как минимум два эффекта — заместительный
94
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
и дезинтоксикационный. ОПК уменьшает степень интоксика-
ции, способствует нормализации гемостаза, микроциркуляции,
улучшает иммунологический статус реципиента.
Показания к проведению ОПК:
• прогрессирующие септические процессы;
• септический шок;
• тяжелые экзогенные отравления различными ящами;
• гипербилирубинемия при гемолитической болезни у но-
ворожденных.
При ОПК из кровотока удаляются крупномолекулярные
соединения, такие как гемоглобин и миоглобин. Для дости-
жения дезинтоксикационного эффекта, как правило, доста-
точно переливания 2—3 л донорской крови, т. е. замещения
до 1/3 ОЦК. В ряде случаев вместо обменного переливания
в последние годы используют адекватные методы селектив-
ного гемафереза.
1.5.2. Цельная консервированная аутокровь
В связи с постоянным уменьшением числа донорских ка-
дров, а также с увеличением количества инфицированных доно-
ров Службе крови все труднее удовлетворять в полной мере за-
просы клиник в компонентах и препарах донорской крови. В осо-
бенности это касается больных с редкими группами крови и
изосенсибилизированных реципиентов.
Переливая собственную кровь больного (аутокровь), мож-
но во многом разрешить проблему компенсации операцион-
ной кровопотери, исключить опасность гемотрансфузионных ре-
акций и осложнений, перенос инфекционных заболеваний, та-
ких как гепатит, сифилис, СПИД и др., сопутсвующих гемо-
трансфузиям компонентов донорской крови.
Аутогемотрансфузия — значительно более безопасный ме-
тод, чем переливание донорской крови или ее компонентов.
Этот простой метод позволяет сократить объемы использова-
ния донорской крови, а при ряде операций и обходиться без
них. Одним из аргументов в пользу аутодонорства следует от-
нести и положительное влияние предоперационного крово-
пускания, после которого отмечается стимуляция гемопоэза —
значительно увеличивается число ретикулоцитов (через 6—10 ч
95
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
после кровопускания и достигает максимума через 7—9 дней),
увеличивается продолжительность циркуляции эритроцитов
в крови реципиента.
Критерии отбора пациентов для аутодонорства
Донор аутокрови подвергается клиническому и лаборатор-
ному обследованию в соответствии с теми же требованиями,
которые предъявляются к донору гомологичной крови (опреде-
ление группы крови и резус-фактора, реакции на сифилис, ге-
патиты, ВИЧ и др.), а также с учетом основного и других забо-
леваний. Методика заготовки аутокрови производится по тем же
правилам и требованиям, по которым заготавливается кровь от
донора. Необходимо соблюдение всех мер, которые определены
инструкциями и положениями для заготовки, обследования,
переработки и хранения донорской крови. На этикетке, кроме
обязательных сведений для донорской крови: группа крови, ре-
зус-фактор, дата заготовки и др., обязательно указывается, что
данная ауто кровь предназначена только для определенного боль-
ного — Ф.И.О., номер истории болезни, диагноз.
Основные лабораторные показатели у донора аутокрови
должны соответствовать следующим требованиям:
• гемоглобин >11,4 г/дл;
• гематокрит > 34,0 %;
• общий белок > 60,0 г/л;
• проба Квика и частичное тромбопластиновое время в
пределах нормы;
• лейкоциты < 10 х Ю’/л;
• тромбоциты > 100 х Ю’/л.
Дача одной дозы крови снижает уровень гемоглобина на
10 г/л и уровень гематокрита на 3 %. Еженедельные кроводачи
одной дозы крови в 1,5 раза ускоряют эритропоэз (при условии
поддержания нормального уровня железа).
Трансфузиолог совместно с лечащим врачом больного и
консультации анестезиолога (если кроводача осуществляется
непосредственно перед операцией после вводного наркоза),
определяют программы аутокрови — назначают дозу и интервал
между кроводачами.
Рекомендовать больного к аутодонорству можно при со-
блюдении двух основных условий:
96
ГЛАВА 1, ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
1. Компенсированные функции органов (сердечно-сосуди-
стые, легочные, обменные, кроветворные).
2. Исключение острой генерализованной инфекции, в част-
ности, сепсис-бактериемии.
Стандартная доза кровопускания: 400—450 мл (5—7 мл/кг).
В зависимости от заболевания, тяжести патологического про-
цесса, сроков до операции, программ аутодонорства, одно-
кратная доза эксфузии может быть изменена — уменьшена
или увеличена.
Повторность, объем и промежутки между предоперацион-
ной эксфузией аугокрови определяются совместно лечащим
врачом, трансфузиологом и анестезиологом индивидуально для
каждого больного, с учетом его состояния и объема в зависимо-
сти от предполагаемой операционной кровопотери.
При отборе больных для аутодонорства, учитывается сле-
дующее:
а) необходимость использования переливания крови при
операции, исходя из степени глубины анемии, уровня гематокри-
та, объема циркулирующей крови у пациента, объема предпола-
гаемой кровопотери во время операции и после нее (не следует
прибегать к аутотрансфузии, если не предполагается существен-
ной кровопотери);
б) наличие инфекции — как противопоказание к аугокроводаче;
в) адекватный уровень гемоглобина и гематокрита;
г) способность больного перенести временную острую крово-
потерю (пациенты весом более 60 кг могут дать до 450 мл крови при
каждой эксфузии, при меньшем весе можно эксфузировать поло-
вину дозы или не более 10 % объема циркулирующей крови);
д) возможность развития вазовагальных реакций (по данным
различных авторов и по нашему опыту у 2—5 % аутодоноров на-
блюдались вазовагальные реакции).
Аутодонорство может сопровождаться легкой голов-
ной болью, кратковременным снижением артериального
давления, не требующим лечения; у 0,3 % доноров наблю-
даются обмороки с кратковременной потерей сознания, а
у 0,03 % — судороги, брадикардия, вплоть до остановки
сердца (типа синкопэ). При аутодонорстве необходимо каж-
дый раз взвешивать риск кроводачи даже у тяжелых больных.
97
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
по сравнению с риском возможных осложнений при аллоген-
ной трансфузии.
Следует особо обратить внимание на то обстоятельство, что, как
показывает опыт работы клиник, в которых программы аутодонор-
ства и аутотрансфузий внедрены и используются в ежедневной прак-
тике, накапливающийся опыт позволяет шаг за шагом суживать
противопоказания к заготовке аутокрови или ее компонентов.
Противопоказания к предоперационной заготовке аутокрови
от больных:
• анемия (НЬ ниже 100 г/л; Ht < 30—34 %);
• лейкоцитопения (число лейкоцитов ниже 4 х Ю’/л);
• тромбоцитопения (число тромбоцитов ниже 150 х Ю’/л);
• гипопротеинемия (общий белок ниже 60 г/л; альбумины ниже 35 г/л);
• гипотония (АД ниже 100/60 мм. рт. ст.);
• сердечно-сосудистая декомпенсация, клинически выраженная
сердечная недостаточность, тяжелый стеноз главного ствола, тя-
желый стеноз клапана аорты;
• нестабильная стенокардия, недавно перенесенный инфаркт мио-
карда, желудочковая аритмия, фракция изгнания < 30 %, AV-блокада;
• сепсис-бактериемия, вирусные заболевания;
• острые воспалительные заболевания;
• выраженное истощение и слабость пациента, адинамия;
гемолиз любого генеза:
• беременность;
• менструация и первые 5 дней после нее;
• выраженное нарушение функции почек с азотемией;
• поражения печени с гипербилирубинемией;
• выраженный атеросклероз коронарных и мозговых сосудов;
• возраст пациентов младше 8 и старше 75 лет;
• гемофилия;
• эпилепсия;
• наследственные заболевания крови (гемоглобинопатии и
ферментопатии).
• метастазирующий рак;
98
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Окончание
• тромбозы, тромбофлебитическая болезнь;
• антикоагулянтная терапия;
• тяжелая форма бронхиальной астмы;
• выраженное нарушение функции печени, почек;
• выраженные проявления (симптомы) или осложнения болезни
в день кроводачи.
Период предоперационного аутодонорства ограничен во
времени и составляет, в зависимости от используемого гемо-
консерванта, от 3 до 5 недель для цельной консервированной ау-
токрови и эритроцитной массы и 6 и более месяцев для свеже-
замороженной аутоплазмы.
Способность к сдаче требуемого количества крови выше у
пациентов с большей массой тела, более старшего возраста и с
более высоким исходным показателем гемоглобина.
Программы аутотрансфузий должны рассчитываться с уче-
том характера заболевания и предстоящей операции, объема
возможной кровопотери, клинического состояния больного,
его компенсаторных возможностей и перспективной необхо-
димости в крови и ее компонентах в процессе хирургического
вмешательства и/или после него.
При правильном отборе больных на аутодонорство, ком-
плексных программ аутотрансфузии при различной патологии,
с учетом особенностей конкретного больного, неиспользован-
ный объем аутокрови можно свести к минимуму.
Рекомендуется придерживаться двух основных правил при
решении вопроса о гемотрансфузии для больных, которым бы-
ла заготовлена аутокровь:
1)лучше не использовать дооперационную аутокровь (или
ее компоненты), чем переливать ее больному без показаний;
2) при необходимости гемотрансфузий больших доз ком-
понентов крови в первую очередь необходимо перелить аутоло-
гичную кровь.
99
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
При трансфузии аутокрови или ее компонентов следует
придерживаться правила — при удовлетворительных показа-
телях у больного НЬ и Ht и гемодинамики нет необходимости
производить аутогемотрансфузию к концу операции или в бли-
жайшем послеоперационном периоде.
Преимущества аутогемотрансфузий
Аутогемотрансфузии, в отличие от переливаний гомологич-
ной крови и ее компонентов, имеют следующие преимущества:
• исключается опасность заражения реципиента гемотран-
смиссивными инфекционными, вирусными, паразитарными и
другими заболеваниями;
• исключаются осложнения (риск аллоиммунизапии), свя-
занные с трансфузиями несовместимых компонентов крови;
• исключаются посттрансфузионные негемолитические
реакции;
• исключается риск осложнений, обусловленных имму-
носупрессивным воздействием аллогенных гемотрансфузий;
• исключается опасность развития болезни «трансплантат-
против-хозяина»;
• исключается опасность развития синдрома гомологич-
ной крови, синдрома острой легочной недостаточности.
Более выраженный эффект от аутотрансфузий по сравнению
с использованием гомологичной крови можно свести к следую-
щим моментам:
• более высокий лечебный (антианемический) замести-
тельный эффект трансфузии аутокрови;
• более быстрое послеоперационное восстановление кро-
ви, вследствие стимуляции гемопоэза повторной предопераци-
онной кроводачей;
• отсутствие иммунодепрессивного эффекта трансфузии;
• экономический эффект — сохраняются запасы донор-
ской гомологичной крови.
Аутогемотрансфузия, сохраняющая принцип «больной — до-
нор для себя», является одним из самых действенных средств про-
филактики большинства осложнений, связанных с примене-
нием донорской крови и ее компонентов.
Перелитая аутокровь не депонируется, а сразу же включает-
ся в кровоток. Аутоэритроциты циркулируют в сосудистом русле
100
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ____________
в 1,5—2 раза дольше, чем клетки донорской крови. При оператив-
ных вмешательствах с применением реинфузии анемии бывают
менее выраженными, а восстановление показателей гемоглоби-
на, эритроцитов, гематокрита и ОЦК происходит быстрее, чем при
использовании компонентов донорской крови. По сравнению с
донорской кровью, реинфузия аутокрови оказывает более выра-
женный клинический эффект по выведению больного из тяжело-
го состояния. Реинфузия аутокрови, являясь простым, безопас-
ным и в высокой степени эффективным методом, лишена недо-
статков, свойственных консервированной донорской крови. Ре-
инфузия собственной крови исключает развитие аллергических,
иммунологических реакций и осложнений по групповой и резус-
принадлежности, перенос гематогенных инфекций.
Таким образом, несомненными преимуществами приме-
нения аутокрови являются:
• отсутствие опасности заражения гемотрансмиссивными
инфекционными заболеваниями, посттранфузионных реакций
и осложнений и аллоиммунизации;
• лучшая, по сравнению с донорской кровью, клиническая
эффективность, приживаемость и функциональная полноцен-
ность перелитых эритроцитов в кровяном русле;
• лучшее восстановление сосудистого объема, улучшение
сердечно-сосудистой деятельности и микроциркуляции; повы-
шенное снабжение тканей кислородом;
• меньшая выраженность послеоперационной анемии и
ускоренное ее устранение.
Основные методы заготовки и применения аутокрови'.
• предоперационная заготовка крови;
• предоперационная гемодилюция;
• интраоперационная гемодилюция;
• интраоперационная аутотрансфузия;
• послеоперационная аутотрансфузия.
В соответсвии с ОК ККЧиК в разделе 1.5.2 «Цельная кон-
сервированная аутокровь» выделяют:
• Аутокровь консервированная.
• Аутокровь консервированная, фильтрованная.
• Аутокровь полостная, консервированная, фильтрован-
ная для реинфузии.
101
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Аутокровь консервированная
Предоперационная заготовка крови — аутокрови больного
(техническое исполнение) практически ничем не отличается от
заготовки ее у донора крови. Основная особенность — забор
крови у больного необходимо осуществлять с учетом заболева-
ний пациента, возможных осложнений, которые может справо-
цировать процедура.
В случае предоперационной заготовки крови у больного
однократно либо в течение нескольких недель до хирургиче-
ского вмешательства эксфузируют кровь, разделяют на компо-
ненты, хранят и затем используют во время операции или в бли-
жайшем послеоперационном периоде.
Последняя кроводача берется не менее чем за 3—4 дня до
оперативного вмешательства.
Если до операции достаточно времени (2—3 недели), то заготов-
ку аутокомпонентов (или аутокрови) можно осуществлять «методом
жсфузии-аутогемотрансфузии» или «ступенчатым методом». Заб-
ранная консервированная кровь или ее соответствующий компонент
через 5—7 дней возвращается бальному и забирается новая порция кро-
ви, превосход ящая первую на одну дозу. Этот метод позволяет загото-
вить достаточный объем аутоплазмы, аугоэритроцитов, а в некоторых
случаях (за 3—5 дней до операции) и ауготромбоконцентрат.
Аутокровь консервированная, фильтрованная
Если появляется необходимость трансфузии крови или ауто-
эритроцитной массы в сроки, превышающие 2—3 дня после заго-
товки, рекомендуется профильтровать кровь через лейкофильтры.
Метод аутотрансфузий целесообразно применять во всех слу-
чаях, когда показана трансфузия компонентов крови для возмеще-
ния кровопотери и отсутствуют противопоказания для эксфузии
крови у данного больного.
Наиболее часто метод аутогемотрансфузии применяют:
• при отсутствии крови, эритроцитной массы массы необхо-
димой групповой принадлежности или при наличии редкой
группы крови у больного;
• при невозможности подбора совместимой гемотрансфу-
зионной среды;
• при проведении хирургических операций с гемоди-
люцией;
102
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
• при наличии в анамнезе больного посттрансфузионных
реакций и осложнений;
• при наличии у больного противопоказаний к трансфузиям
гомологичной крови (нарушения функции печени, почек и др.).
Выбор того или иного метода заготовки аутокрови и/или ее
компонентов и их дозировка должны назначаться и планировать-
ся заблаговременно, в зависимости от тяжести операции, ее
длительности, травматичности и, главное, от предполагаемого
объема кровопотери. Особенность принятия решения о проце-
дуре аутодонорства заключается в том, что каждая процедура
должна устанавливаться индивидуально, с учетом всех обстоя-
тельств врачом-трансфузиологом и быть согласована с хирургом
и анестезиологом в соответствии с принятыми общими показа-
ниями к гемотерапии.
Предоперационная гемодилюция
В случае предоперационной гемодилюции часть ОЦК по-
сле эксфузии крови больного замещается кровезаменителями до
уровня зоной «оптимальной» гемодилюции: Ht 32—35 %. Собран-
ную кровь используют для компенсации периоперацонного
кровотечения. Предоперационная гемодилюция может снизить
потребность в переливании крови на 18—100 %.
Интраоперационная гемодилюция
Интраоперационная гемодилюция — метод, применяемый
когда у больного создается искусственная кровопотеря путем экс-
фузии крови непосредственно в операционной период, после
водного наркоза. Возмещение кровопотери проводится введени-
ем плазмозаменителей до тех пор, пока уровень гематокрита не
будет достигать минимально допустимого значения — не ниже
30 %. В исключительных случаях допустимо разведение крови до
Ht 21—22 % при обеспечении адекватного эффективного цирку-
лирующего объема и достаточной оксигенации организма.
В литературе описаны случаи вынужденной гемодилюции до
уровня гематокрита 10—15 % и снижения гемоглобина до 50 г/л
во время операций у пациентов, переливание крови которым бы-
ло невозможно по религиозным мотивам.
Противопоказания к интраоперационной гемодилюции в основ-
ном соответствуют противопоказаниям для проведения предо-
перационной заготовки аутокрови.
103
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Абсолютным противопоказанием к проведению гемодилю-
ции следует считать анемию:
• гемоглобин ниже 110 г/л;
• гематокрит менее 30 %;
• количество эритроцитов менее 3,5 х 10|2/л.
Относительными противопоказаниями являются:
• почечная недостаточность с признаками олигоанурии;
• сердечная недостаточность с явлениями отека легких, ас-
цитом, анасаркой;
• острые воспалительные заболевания;
• наличие геморрагического синдрома, обусловленного
тромбоцитопенией и фибриногенопенией;
• кахексия.
Аутокровь полостная, консервированная, фильтрованная
для реинфузии
Вариантом мероприятий, направленных на сокращение ис-
пользования компонентов крови доноров и максимального, на-
иболее полного сохранения собственной крови больного, счита-
ется интраоперационная аутотрансфузия (реинфузия аутокрови).
Реинфузия показана практически при всех операциях, тре-
бующих гемокоррекции. При плановых оперативных вмеша-
тельствах она наиболее эффективна там, где прогнозируемая
кровопотеря может составить более 20 % ОЦК, а при кровопо-
тере, превышающей 25—30 % ОЦК, реинфузию следует сочетать
с другими методами аутогемотрансфузий (предоперационная
заготовка аутокрови либо предоперационная гемодилюция и
интраоперационная управляемая гемодилюция).
Послеоперационная аутотрансфузия
Послеоперационная аутотрансфузия — возвращение боль-
ному крови, выделившейся по дренажам в ближайшем послео-
перационном периоде. Высокая фибринолитическая и тромбо-
пластическая активность при сниженном содержании фибрино-
гена, значительно повышенное содержание свободного гемогло-
бина, дисфункция тромбоцитов, а также опасность бактериаль-
ного загрязнения собираемой крови несколько ограничивают
возможности использования этого метода.
Реинфузия в послеоперационном периоде лучше всего про-
водится с отмыванием собранных по дренажам эритроцитов.
104
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Безопасным для трансфузии цельной аугокрови (без отмы-
вания эритроцитов) является гемолиз, не превышающий 2,5 г/л
(250 мг%) свободного гемоглобина в плазме.
Техника реинфузии
Если заготовка аутокрови как перед операцией, так и во
время интраоперационной гемодилюпии практически не отли-
чается от заготовки крови у доноров, то реинфузия аутокрови во
время операции сопряжена с определенными трудностями. Ее
необходимо эвакуировать из раны с наименьшей травматизаци-
ей, отфильтровать от сгустков, нитей фибрина и попавших в
отсос кусочков тканей, а также принять меры по предупрежде-
нию ее свертывания.
В основе метода реинфузии лежат ключевые принципы:
• сбор и стабилизация операционной крови;
• фильтрация;
• центрифугирование;
• отмывание.
При операциях с использованием искусственного кровооб-
ращения методика реинфузии дополнительно включает в себя
сбор кардиоплегического раствора, когда реинфузор работает как
гемоконцентратор, а также сбор «аппаратной» крови. На данных
этапах стабилизация крови не производится из-за наличия в
ней гепарина.
Для стабилизации крови чаще всего используют гемокон-
сервант, применяемый при заготовке донорской крови:
4 %-ный раствор лимоннокислого натрия из расчета 10 мл на
100 мл крови; раствор «глюгицир» из расчета 100 мл на 500 мл кро-
ви; раствор ACD в соотношении 1:3; раствор гепарина из расче-
та 1000 ЕД на 500 мл крови. Гепарин вводится в физиологический
раствор из расчета 5 мл на 1 л. Скорость подачи стабилизирующе-
го раствора в реинфузируемую кровь 50—60 капель в минуту.
Отмывание аутокрови практически не отличается от мето-
дики приготовления отмытых эритроцитов из донорской крови.
В зависимости от степени повреждения красной крови, ориен-
тируясь на уровень свободного гемоглобина, который не должен
превышать 2,5 г/л, определяется количество процедур отмыва-
ния — 1,2 или 3 раза, до получения бесцветной надосадочной
жидкости.
105
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
При отмывании эритроцитов из реинфузата, содержащего
кардиоплегический раствор, достаточна одна, реже две проце-
дуры, в то время как при отмывании реинфузата, содержащего
большое количество свободного гемоглобина, процедуру повто-
ряют, как правило, трижды. Отмывание эритроцитов, собранных
из магистралей аппарата ИК, проводят дважды, удаляя в основ-
ном содержащийся в ней гепарин.
В аппаратах «Cell-saver» отмывание производится в роторе-
колоколе автоматически при скорости вращения 5600 оборотов
в минуту 1,0—1,5 л физиологического раствора. Применение
«Cell-saver» оправданно при операциях, где прогнозируемая кро-
вопотеря требует массивных, более 50 % ОЦК, гемотрансфузий.
Относительные противопоказания для проведения интрао-
перационной реинфузии аутокрови дискутируются. К ним мож-
но отнести:
• операции по поводу злокачественных опухолей;
• кровотечения в связи с разрывом матки;
• хроническую почечную недостаточность.
Абсолютными противопоказаниями для реинфузии аутокро-
ви являются:
• контакт излившейся крови с содержимым гнойных поло-
стей при операциях по поводу острых и хронических заболеваний
легких (гангрена, абсцесс, бронхоэктазы и т. п.) и органов брюш-
ной полости (абсцессы, воспалительные инфильтраты и т. д.);
• повреждение полых органов брюшной полости с загряз-
нением крови кишечным или желудочным содержимым, со-
держимым кист и т. п.;
• пребывание аутокрови вне сосудистого русла более 6— 12 ч.
Наиболее серьезные осложнения, связанные с реинфузией
аутокрови и могущие представлять угрозу для жизни: эмболии,
бактериальная загрязненность и токсическое воздействие.
Компоненты аутологичной (аутогенной)
консервированной крови
Так же как и с донорской кровью, более целесообразно,
как с медицинской, так и с экономической точки зрения, заго-
тавливать вместо цельной консервированной аутокрови ее ком-
поненты — (аутогенные) аутологичные гемокомпоненты: эри-
106
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
троцитную массу, свежезамороженную плазму, в отдельных слу-
чаях тромбоконцентрат. При адекватной медикаментозной под-
готовке пациента (препараты железа, витаминотерапия, эри-
тропоэтин) за 2—3 недели до операции можно заготовить от
600—700 мл до 1500-1800 мл ауто СЗП, 400-500 мл эритроцит-
ной массы.
В зависимости от методов получения, гамма-облучения,
фильтрации, сроков и условий хранения получают различные
компоненты. В ОК ККЧиК выделены следующие аутологич-
ные гемокомпоненты:
• Аутоэритроцитная масса.
• Аутоэритроцитная масса, фильтрованная.
• Аутоэритроцитная масса, гамма-облученная.
• Аутоэритроцитная масса, обедненная лейкоцитами и
тромбоцитами.
• Аутоэритроцитная масса с удаленным лейкотромбослоем,
фильтрованная.
• Аутоэритроцитная масса с удаленным лейкотромбослоем,
гамма-облученная.
• Аутоэритроцитная взвесь с физиологическим раствором.
• Аутоэритроцитная взвесь с ресуспендирующим раствором.
• Аутоэритроцитная взвесь с ресуспендирующим раствором,
фильтрованная.
• Аутоэритроцитная взвесь с ресуспендирующим раствором,
гамма-облученная.
• Аутоэритроцитная взвесь, размороженная и отмытая.
• Аутоплазма свежезамороженная из дозы крови.
• Аутоплазма свежезамороженная, полученная дискрет-
ным аферезом.
• Аутоплазма свежезамороженная, полученная автоматиче-
ским аферезом.
Аутоэритроцитная масса
По технике выполнения процедуры получение аутоэри-
троцитной массы у больных практически не отличается от ме-
тода получения эритроцитной массы у доноров крови. Этот
компонент можно получить центрифугированием крови боль-
ного или методом автоматического гемафереза. Как правило,
одновременно с аутоэритроцитной масой получают и ауто-
107
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
плазму свежезамороженную, а при необходимости — и ауто-
ромбоцитный концентрат.
В ряде случаев из аутоэритроцитной массы получают ауто-
эритроцитную взвесь с физиологическим раствором или при допол-
нительной фильтрации — аутоэритроцитную взвесь с ресуспен-
дирующим раствором, фильтрованную. Для иммуноскомпроме-
тированных больных рекомендуется аутоэритроцитная масса,
гамма-облученная или аутоэритроцитная взвесь с ресуспендиру-
ющим раствором, гамма-облученная.
Условия хранения те же, что и для консервированной донор-
ской крови.
Гемотрансфузия аутоэритроцитной массы осуществляется
в интра- или постоперационный периоды по показаниям.
Аутоплазма свежезамороженная из дозы крови
Аутоплазма является высокоэффективным корректором
плазменно-коагуляционного гемостаза.
Получение аутоплазмы больного, последующее заморажи-
вание и хранение по своей технологии и процедурам выполне-
ния практически не отличаются от получения донорской СЗП.
В соответствии с ОК ККЧиК данная среда обозначена как ауто-
плазма свежезамороженная из дозы крови.
Аутоплазму у больных можно получить тремя способами:
• фракционированием цельной консервированной крови
методом центрифугирования (аутоплазма свежезамороженная,
полученная дискретным аферезом)'
• на автоматических сепараторах (аутоплазма свежезамо-
роженная, полученная автоматическим аферезом)',
• методом пропускания консервированной крови через
специальные мембраны (аутоплазма свежезамороженная, филь-
трованная).
Применяют размороженную (аналогично донорской СЗП)
аутоплазму в интра- и постоперационном периодах в целях кор-
рекции плазменно-коагуляционного гемостаза.
1.5.3. Противопоказания к переливанию крови
и ее компонентов
Основным противопоказанием к переливанию донорской
крови и ее компонентов (за исключением особых ситуаций, на-
108
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
пример, «по жизненным показаниям») является наличие у боль-
ного декомпенсированной патологии основных органов и систем
организма:
• острый и подострый инфекционный эндокардит с де-
компенсацией кровообращения;
• пороки сердца, миокардиты в стадии декомпенсации;
• отек легких;
• гипертоническая болезнь III стадии с выраженным атеро-
склерозом сосудов головного мозга;
• милиарный и диссеминированный туберкулез;
• тромбоэмболия легочной артерии;
• тяжелые нарушения функций печени;
• гепатаргия;
• прогрессирующий диффузный гломерулонефрит;
• амилоидоз почек;
• нефросклероз;
• кровоизлияние в мозг;
• тяжелые расстройства мозгового кровообращения.
В отличие от донорской крови и ее компонентов, у аутокро-
ви и ее компонентов нет противопоказаний к аутогемотрансфу-
зии. Исключение — гемолиз аутокрови или аутоэритроцитной
массы (взвеси) свыше 200 мг%.
1.5.4. Препараты донорской крови
Как было сказано выше, из донорской крови можно
получить несколько компонентов и более двух десятков
препаратов.
Компоненты крови — клетки крови (эритроциты, лейкоци-
ты, тромбоциты) и плазма крови и ее производные с сохранен-
ными индивидуальными особенностями донора (ABO, Rh0(D),
HLA, НРА, KEL, MNS и др.) (см. соответствующие разделы
главы выше). При применении компонентов донорской крови
нельзя полностью исключить риск заражения гемотрансмис-
сивными инфекциями (например, при кроводаче в серонегатив-
ный период после заражения).
Препараты крови — трансфузионные среды, приготовлен-
ные из компонентов крови донора путем более сложной и мно-
гоэтапной переработки, в результате используемых технологий
109
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
лишенные индивидуальных особенностей донора. В препаратах
крови полностью исключена возможность наличия возбудите-
лей гемотрансмиссивных инфекций.
Одним из наиболее часто используемых препаратов плазмы
является альбумин, который может быть отнесен к природным
коллоидам.
Альбумин
Физиологическая роль альбумина представлена двумя основ-
ными механизмами:
• обеспечение необходимого объема циркулирующей жид-
кости посредством поддержания внутрисосудистого коллоидно-
осмотического давления (КОД);
• обеспечение доставки с плазмой питательных веществ,
биологически активных субстанций, лекарств, ферментов, про-
дуктов метаболизма, микроэлементов.
Период полувыведения альбумина из внутрисосудистого
сектора составляет около 16 ч. 10 % альбумина покидают сосу-
дистое русло в течение двух часов, а 70 % — в течение двух суток.
Из плазмы альбумин поступает в основные внесосудистые депо:
интерстициальное пространство кожи, мышц и органов. В этих
областях содержится 60 % запасов альбумина.
Альбумин является белком сыворотки крови. В норме в
100 мл сыворотки содержится 7—8 г белка, из которых 4,1 г со-
ставляет альбумин. Альбумин имеет молекулярный вес в преде-
лах 66 000—69 000 Д, содержит ряд необходимых для организма
аминокислот: глютаминовую и аспарагиновую, аргинин, ци-
стеин, лизин, лейцин, валин, фенилаланин. В нем мало изо-
лейцина, метионина и триптофана. Вязкость концентрирован-
ного раствора альбумина (2—2,6) несколько меньше таковой
крови (3,8—5,3). Осмотическое давление плазмы на 80 % об-
условлено альбуминами и составляет 28 мм рт. ст [Филатов А.Н.,
Караванов А.Г.]. В крови взрослого человека содержится прибли-
зительно 125 г альбумина. Период полураспада — 15—20 дней.
Физиологическое действие альбумина зависит от его влияния на
осмотическое давление, объем циркулирующей крови и диу-
рез. Альбумин может обратимо связываться с катионами и анио-
нами, а также с различными токсическими веществами, на чем
основаны его транспортная и дезинтоксикационная функции.
110
ГЛАВА 1- ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
Введение концентрированных растворов альбумина в кро-
веносное русло больного значительно увеличивает объем цир-
кулирующей крови за счет притока жидкости в кровеносное ру-
сло. Так, 25 г альбумина увеличивают на 500 мл объем циркули-
рующей крови.
Отсутствие риска заражения реципиента вирусным гепа-
титом, так как в процессе заготовки альбумин подвергается пас-
теризации, возможность применения препарата без предвари-
тельной подготовки и определения группы крови реципиента яв-
ляются существенным преимуществом альбумина. Переливание
альбумина (в особенности 10—20 %) позволяет ввести значи-
тельное количество белка в небольшом объеме раствора, кото-
рый способен д лительное время удерживаться в кровяном русле,
поддерживая осмотическое давление и оказывая благотворное
дегидратационное действие.
Альбумин содержит небольшие количества натрия и ка-
лия, не обладает способностью накапливаться в органах и тка-
нях, не оказывает выраженного действия на свертывающую си-
стему крови (даже в больших дозах), при его применении край-
не редко происходит изосенсибилизация.
Изготавливаются растворы с концентрацией альбумина
2,5,5,10,20 и 25 %.
Растворы альбумина низкой концентрации практически не
имеют преимуществ перед растворами искусственных колло-
идов. Растворы альбумина человека высокой концентрации
продолжают относительно часто использовать при выражен-
ном падении содержания общего белка или альбумина в плаз-
ме, а также при низких показателях коллоидно-осмотического
давления. У больных с признаками повышенной проницаемо-
сти капилляров (например, с септическим шоком и пр.) ис-
пользованию природных и синтетических коллоидов должно
предшествовать применение кристаллоидных растворов, т. к. в
данной ситуации коллоиды проникают в интерстициальное
пространство и, создавая там повышенное онкотическое давле-
ние, удерживают воду в межклеточном депо.
Результаты многочисленных исследований свидетельству-
ют о том, что пока общий белок крови не ниже 30—40г/л, необхо-
димости вводить альбумин нет.
111
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Синтез альбумина в организме не регулируется плазматиче-
ской его концентрацией.
При некоторых патологических состояниях (сепсис, терми-
ческие и радиологические поражения, ожоги и др.) плазматиче-
ские белки, введенные в организм в большой пропорции, поки-
дают кровоток и попадают в интерстициальное пространство, что
неблагоприятно влияет на функцию легких.
Показания к применению. Основными показаниями для при-
менения альбумина являются следующие состояния:
• тяжелая гипотония, если повышенная проницаемость
капилляров не выражена, а лимит дозы синтетического колло-
ида уже достигнут;
• выраженная гипоальбуминемия — альбумин сыворотки
менее 2,5 г/дл.
Альбумин чаще всего используют при следующих клиниче-
ских ситуациях:
• острая почечная недостаточность, нефротический син-
дром;
• гемодиализ;
• объемзамещающая терапия у беременных и новорожден-
ных;
• тяжелые ожоги (но не в первые 24 ч из-за повышенной
проницаемости капилляров);
• цирроз печени с асцитом;
• повышенное внутричерепное давление при отсутствии
других лекарственных средств;
• лечебный плазмаферез.
Противопоказания. Альбумин не рекомендуется применять
при:
• тромбозах;
• выраженной гипертонии;
• продолжающемся внутреннем кровотечении.
Альбумин не является средством внутривенного парентераль-
ного питания.
Условия хранения, форма выпуска и условия переливания
Альбумин выпускают в стеклянных флаконах — 20 %-ный ра-
створ по 50 и 100 мл, 5 и 10 %-ные растворы по 100, 200 мл.
Срок хранения — до 5 лет при температуре +2—8 °C.
112
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Альбумин вводится внутривенно капельно, в отдельных
случаях струйно. Разовая доза зависит от концентрации препа-
рата и состояния больного. Менее концентрированные раство-
ры (10 %-ные) назначаются в объеме 200—300 мл, а более кон-
центрированные (20 %-ные) — в меньшем (до 100 мл). При ле-
чении заболеваний, сопровождающихся анемией, препарат при-
меняется в виде курса трансфузий по 100—200 мл. Длительность
курса зависит от динамики нормализации уровня альбумина в
плазме и картины красной крови.
ПЛАЗБУМИН 20 (Bayer Corporation Biological Products)
Альбумин человеческий 20 %-ный.
Препарат представляет собой 20 %-ный стерильный
водный раствор альбумина, производится из пула плазмы
крови доноров тестированных на отсутствие антител к ви-
русам ВИЧ-1, ВИЧ-2, гепатита С и поверхностного антиге-
на гепатита В. Производится с использованием двух неза-
висимых стадий инактивации вирусов: процесса соль-
вент/детергентной обработки и процесса тепловой обра-
ботки, что позволяет добиваться уменьшения инфицирую-
щей способности вирусов в 109—1022 раз. Стабилизирован
0,016 М каприлата натрия и 0,016 М ацетилтриптофана.
Содержание натрия в продукте составляет 145 мэкв/л. Не
содержит консервантов.
Показания к применению:
• экстренная терапия при гиповолемическом геморрагиче-
ском шоке;
• терапия ожогов;
• гипопротеинемия с отеком тканей или без него;
• аортокоронарное шунтирование (заполнение аппарата
искусственного кровообращения);
• острая печеночная недостаточность;
• гемолитическая болезнь новорожденных;
• гемодиализ.
Противопоказания:
• всем пациентам, имеющим риск развития волемической
перегрузки (хроническая сердечная недостаточность, хрониче-
ская почечная недостаточность, хроническая анемия);
• аллергические реакции на белок в анамнезе.
113
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Способ применения и дозы. Препарат применяется всегда только
внутривенно неразбавленным либо разбавленным в 0,9 %-ном ра-
створе хлорида натрия или 5 %-ным раствором глюкозы.
Дозы рассчитываются индивидуально соответственно уров-
ню гипопротеинемии, состоянию пациента и его ответу на про-
водимую терапию. Общее правило: терапию плазбумином 20
начинают при уровне альбумина в плазме крови < 25 г/л (или об-
щем белке < 50 г/л). Обычная суточная доза плазбумина 20 для
взрослых — 50—75 г, для детей — 25 г.
Форма выпуска, условия хранения и сроки годности. Плазбу-
мин 20 выпускается в виде раствора для внутривенных инфузий
во флаконах 50 мл (содержит 10 г альбумина) и 100 мл (содержит
20 г альбумина).
Хранят при комнатной температуре до 30 °C. Срок годности 3 года.
Протеин
Протеин представляет собой 4,3—4,8 %-ный раствор стаби-
лизированных каприлатом натрия пастеризованных белков до-
норской плазмы. Раствор состоит из альбумина (80 %) и стабиль-
ных альфа- и бета-глобулинов (20 %), а также эритропоэтических
активных веществ. Содержит трехвалентное железо в виде аль-
бумината.
Коллоидно-осмотическое давление препарата соответствует
плазме. Обладает всеми свойствами нативной плазмы по участию
в обмене веществ и д лительности пребывания в кровяном русле.
Показания к применению: аналогичны показаниям к при-
менению альбумина с некоторым ограничением в связи с более
высокой аллергенностью. Может быть использован для кор-
рекции анемий.
Противопоказания: все состояния, когда противопоказано
вливание белков и жидкости (кровоизлияние в мозг, тромбоэм-
болия, сердечная декомпенсация, гипертоническая болезнь II-
III степени).
Условия хранения, форма выпуска и условия применения. Про-
теин выпускается во флаконах по 250,400 и 500 мл. Хранится при
комнатной температуре. Срок годности 3 года. Вируса инфек-
ционного гепатита и ВИЧ содержать не может.
В зависимости от показаний вводят внутривенно капельно
или струйно. Разовая доза 250—500 мл. При хронических гипо-
114
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
прогеинемии и анемии препарат вводят ежедневно или через
день, длительность курса определяется динамикой показателей
крови.
В настоящее время протеин производится в ограниченном
количестве.
Иммуноглобулины
Из выделяемой фракции глобулинов донорской крови по-
лучают иммунологически активные препараты: гамма- и поли-
глобулины. Препараты иммуноглобулинов представляют собой
концентраты антител — продуктов иммунного обмена, опсо-
низирующая, нейтрализующая и комплементсвязывающая ак-
тивность которых является основным фактором их клиниче-
ской эффективности.
Для получения иммуноглобулина направленного действия
проводится активная иммунизация доноров соответствующим
антигеном. Когда в крови донора начинают выявляться антите-
ла с высоким титром, у него забирают иммунную плазму и вы-
деляют из нее иммуноглобулиновую фракцию.
Производят лекарственные формы иммуноглобулинов для
внутримышечного и внутривенного введения.
Иммуноглобулин человека нормальный донорский
Препарат представляет собой иммунологически активную
белковую фракцию, выделенную из человеческой сыворотки
или плазмы, очищенную и концентрированную методом фрак-
ционирования этиловым спиртом при температуре ниже О °C.
Прозрачная или слегка опалесцирующая жидкость, бесцветная
или со слабой желтой окраской. Действующим началом препа-
рата являются иммуноглобулины, обладающие активностью ан-
тител различной специфичности.
Показания к применению. Профилактика гепатита А, кори,
коклюша, менингококковой инфекции, полиомиелита, лече-
ние гипо- и агаммаглобулинемии у детей, повышение рези-
стентности организма в период реконвалесценции инфекцион-
ных заболеваний.
Противопоказания. Тяжелые аллергические реакции на вве-
дение препаратов крови человека в анамнезе.
Способ применения и дозировка. Препарат вводят внутримы-
шечно в верхний наружный квадрат ягодичной мышцы:
115
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• для профилактики гепатита А: детям дошкольного возра-
ста — 0,75 мл, остальным возрастным группам — 1,5 мл;
• для профилактики кори; детям с 3-месячного возраста —
1,5—3,0 мл однократно в течение 6 суток после контакта с больным,
взрослым при контакте со смешанными инфекциями —3,0 мл;
• для профилактики коклюша: детям, не болевшим ко-
клюшем, 3,0 мл двукратно с интервалом 24 ч;
• для профилактики менингококковой инфекции — одно-
кратно в течение 7 суток после контакта детям до 3 лет —1,5 мл,
детям старше 3 лет — 3,0 мл;
• для профилактики полиомиелита — однократно
3,0—6,0 мл в возможно более ранние сроки после контакта;
• для повышения резистентности организма —
0,15—0,2 мл/кг массы, кратность инъекций — до 4 с интервала-
ми между инъекциями 2—3 суток.
Форма выпуска, условия хранения и транспортировки. Ам-
пулы по 1,5 и 3,0 мл хранят в темном месте при температуре
+6 ±4 °C. Транспортировка всеми видами крытого транспорта
при такой же температуре. Срок годности 2 года, продлению
срока годности не подлежит.
Иммуноглобулин нормальный человеческий для внутри-
венного введения
Препарат представляет собой иммунологически активную
белковую фракцию, выделенную из человеческой плазмы доно-
ров, очищенную и концентрированную методом фракциониро-
вания этиловым спиртом при температуре ниже 0 °C. Активным
компонентом препарата являются иммуноглобулины, обладаю-
щие активностью антител различной специфичности. Препарат
обладает также неспецифической активностью, проявляющей-
ся в повышении резистентности организма. 25 мл препарата
содержат 1,25 г белка.
Показания к применению. Лечение тяжелых токсических
форм различной бактериальной и вирусной инфекций, послео-
перационных осложнений, сопровождающихся септицемией у
детей и взрослых.
Противопоказания. Иммуноглобулины не рекомендуется
вводить лицам, имеющим в анамнезе аллергические реакции
на препараты крови.
116
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
Способ применения и дозировка. Д ля взрослых разовая доза со-
ставляет 25—50 мл. Без дополнительного разведения иммуногло-
булин вводят внутривенно капельно со скоростью 30—40 ка-
пель в минуту. Курс лечения состоит из 3—10 трансфузий, про-
водимых через 24—72 ч (в зависимости от тяжести заболевания).
Перед введением флаконы выдерживают при комнатной темпе-
ратуре не менее 2 ч.
Для детей разовая доза составляет 3—4 мл на 1 кг массы, но
не более 25 мл, если не используется специально разработанный
курс лечения. Непосредственно перед введением иммуноглобу-
лин разводят 0,9 %-ным раствором хлорида натрия или 5 %-
ным раствором глюкозы из расчета 1 часть препарата и 4 части
разводящего раствора. Полученный разведенный иммуноглобу-
лин вводят внутривенно капельно со скоростью 8—10 капель в
минуту.
Форма выпуска. Флаконы по 10,25 и 50 мл.
Условия хранения и срок годности. Препарат хранят в темном
сухом месте при температуре +6 ±4 °C. Срок годности один год.
Продлению срок годности не подлежит.
ПЕНТАГЛОБИН
Пентаглобин (Biotest Pharma, Германия) — бесцветный или
светло-желтый, прозрачный или слегка опалесцирующий ра-
створ, 1 л которого содержит 50 мг белков плазмы человека, из
них 1g > 95 % (в т. ч. IgM — 6 мг, IgA — 6 мг и IgG — 38 мг).
Показания к применению:
• бактериальные инфекции;
• иммунодефицитное состояние;
• вторичный синдром недостаточности антител.
Противопоказания: гиперчувствительность. При беременно-
сти и кормлении грудью применять с осторожностью. У грудных
детей одновременное применение с глюконатом кальция может
сопровождаться нежелательными явлениями. Ослабляет эф-
фективность живых вирусных вакцин (против кори, краснухи,
эпидемического паротита, ветряной оспы).
Способ применения и дозы. Пентаглобин вводят внутривен-
но со скоростью:
• новорожденным и грудным детям — 1,7 мл/кг в час с
применением перфузора;
117
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• детям и взрослым — 0,4 мл/кг в час или первые 100 мл со
скоростью 0,4 мл/кг в час, затем 0,2 мл/кг в час непрерывно до
достижения дозы 15 мл/кг в течение 72 ч.
Перед введением препарат нагревают до температуры тела
или комнатной температуры.
Рекомендуемые дозы:
• новорожденным и грудным детям — 5 мг/кг в сутки в те-
чение 3 дней;
• детям более старшего возраста и взрослым — 5 мл/кг в сут-
ки в течение 3 дней при тяжелых бактериальных инфекциях, при
иммунодефиците и вторичном синдроме недостаточности анти-
тел 3—5 мл/кг.
Курс лечения можно повторить через 1 неделю.
Препарат можно смешивать только с изотоническим ра-
створом натрия хлорида. Возможно появление ложноположи-
тельных данных при серологическом исследовании.
Форма выпуска. Ампулы по 10, 20 мл и флаконы по 50,
100 мл. В картонной пачке 1 ампула или 1 флакон. Хранение в
соответствии с инструкцией.
К иммуноглобулинам G 4-го поколения относится препарат
ОКТАГАМ (Октафарма AG, Швейцария), который содержит
иммуноглобулин у с широким спектром антител против
инфекционных агентов.
Иммуноглобулин антистафилококковый человека жидкий
донорский
Препарат представляет собой белковый раствор иммуноло-
гически активной фракции человеческой гипериммунной плаз-
мы крови доноров, содержащий антитела к стафилококковому
экзотоксину. Прозрачная или слегка опалесцирующая жидкость,
бесцветная или слабо-желтой окраски. Действующим началом
препарата являются иммуноглобулины, обладающие активно-
стью антител к стафилококковому экзотоксину.
Показания к применению. Лечение различных заболеваний
стафилококковой этиологии у детей и взрослых.
Способ применения и дозировка. Иммуноглобулин антистафи-
лококковый предназначен д ля внутримышечного введения. При
генерализованной инфекции минимальная разовая доза пре-
парата составляет 5 ME антиальфастафилолизина на 1 кг массы
118
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
тела (для детей менее 5 лет разовая доза препарата должна быть
не менее 100 ME). При более легких локализованных заболева-
ниях минимальная доза препарата составляет не менее 100 ME.
Курс лечения состоит из 3—5 инъекций, проводимых ежеднев-
но или через день, в зависимости от тяжести заболевания и те-
рапевтического эффекта.
Противопоказания. Тяжелые аллергические реакции в анам-
незе на введение препаратов крови человека.
Лицам, страдающим иммунологическими системными забо-
леваниями (болезни крови, соединительной ткани, нефрит и т д.),
препарат следует вводить на фоне соответствующей терапии.
Форма выпуска. Иммуноглобулин антистафилококковый
человека выпускают в жидком виде по 3—5 мл в ампуле. Одна до-
за препарата содержит не менее 100 ME активной субстанции.
Условия хранения и срок годности. Препарат хранят в сухом
и темном помещении при температуре +2—10 °C. Срок годности
препарата 2 года.
ГАМИМУН Н 10 %-ный (Bayer Corporation Biological Pro-
ducts) (иммуноглобулин человеческий нормальный для внутри-
венного введения)
Препарат представляет собой иммунологически активную
белковую фракцию, выделенную из человеческой плазмы доно-
ров, тестированных на отсутствие антител к вирусам ВИЧ-1,
ВИЧ-2, гепатита С и поверхностного антигена гепатита В. Про-
изводится с использованием двух независимых стадий инакти-
вации вирусов: процесса сольвент/детергентной обработки и
процесса тепловой обработки, что позволяет добиваться умень-
шения инфицирующей способности вирусов в 109—1022 раз.
Содержит 9—11% белка, из которого не менее 98 % составля-
ет гамма-глобулин, 90 % которого находится в виде мономера.
Распределение подклассов Ig G в препарате такое же, как в нор-
мальной плазме.
По внешнему виду это прозрачная или слабо опалесцирую-
щая жидкость бесцветная или слабо желтой окраски.
Показания к применению:
• первичный гуморальный иммунодефицит;
• идиопатическая тромбоцитопения;
• ВИЧ-инфекция у детей;
119
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• профилактика инфекций при трансплантации костного
мозга.
Противопоказания:
• анафилактические или тяжелые системные реакции на
введение иммуноглобулина человека;
• селективный дефицит IgA при наличии антител к имму-
ноглобулину А.
Способ применения и дозы. Обыч ная доза препарата Гамимун Н
10 %-ный составляет 100—200 мг/кг (1,0—2,0 мл/кг) массы. Пре-
парат вводят 1 раз в месяц. Возможно более частое введение или
увеличение дозы до 400 мг/кг (4,0 мл/кг) в случае неадекватного
клинического эффекта или недостаточного повышения уровня
IgG в системе циркуляции. В случае необходимости допускается
разведение только 5 %-ным водным раствором глюкозы.
Форма выпуска, условия хранения и сроки годности. Флаконы
по 10, 25, 50, 100, 200 мл. Хранятся и транспортируются при
температуре от +2 до +8 °C. Не допускается замораживание.
Срок годности 2 года.
Иммуноглобулин антирезусный
Препарат содержит антирезусные антитела с высоким титром.
Показания к применению. Иммуноглобулин антирезусный
назначается:
• Юг0(В)-отрицательным женщинам, несенсибилизиро-
ванным к КЬв(О)-антигену и родившим Ий0(О)-положительно-
го ребенка;
• при искусственном прерывании беременности женщинам,
не сенсибилизированным ИЬл(В)-антигеном, в случае резус-
положительной принадлежности крови мужа.
Иммуноглобулин антирезус — Rh0(D) человека вводят по од-
ной дозе внутримышечно однократно роженице в течение пер-
вых 48 ч после родов, при искусственном прерывании беремен-
ности — непосредственно по окончании операции.
Противопоказания. Препарат нельзя назначать Rh0(D)-no-
ложительным женщинам.
Форма выпуска. Выпускается в ампулах по 1 и 2 мл, содер-
жащих 1 дозу иммуноглобулина антирезус- Rh0(D) человека.
Условия хранения и срок годности. Иммуноглобулин антире-
зусный хранят при температуре +2—10 °C в сухом защищенном от
120
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
света месте. Замораживание препарата категорически запрещает-
ся, так как в этом случае происходит разрушение препарата. Срок
годности не более 1 года. Применяют только в стационаре.
БейРоу-Ди (Bayer Corporation Biological Products)
Иммуноглобулин человека антирезус Rhfl(D).
Препарат представляет собой прозрачную или слегка опа-
лесцирующую жидкость бесцветной или слабо-желтой окраски
без посторонних включений. Одна доза препарата содержит им-
муноглобулина 300 мкг.
Иммунологически активная белковая фракция препарата
выделена из человеческой плазмы или сыворотки доноров, про-
веренных на отсутствие антител к вирусам ВИЧ-1, ВИЧ-2, гепа-
тита С и поверхностного антигена гепатита В. Препарат произ-
водится с использованием сольвент/детергентного метода инак-
тивации вирусов, что позволяет добиваться уменьшения инфи-
цирующей способности вирусов в 109—1022 раз.
Показания к применению:
• у Rh0(В)-отрицательных женщин, не сенсибилизирован-
ных к антигену Rh0(D), при условии первой беременности и
рождения Ю1п([))-положительного ребенка, кровь которого сов-
местима с кровью матери по группам крови системы АВО;
• при искусственном прерывании беременности у Rh0(D)-
отрицательных женщин, также не сенсибилизированных к
КЬо(0)-антигену, в случае КЬ0(В)-положительной принадлежно-
сти крови мужа.
Противопоказания:
• гиперчувствительность к препарату;
• ВЬ0(В)-положительные родильницы;
• Я110(В)-отрицательные родильницы, сенсибилизирован-
ные к антигену Rh0(B);
• новорожденные.
Способ применения и дозы. Препарат вводится по 1 дозе вну-
тримышечно однократно:
• родильнице — в течение первых 72 ч после родов;
• при искусственном прерывании беременности — непо-
средственно после окончания операции;
• для профилактики в предродовой период — 1 дозу прибли-
зительно на 28-й неделе.
121
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Форма выпуска, условия хранения и сроки годности. Препарат
выпускают в виде раствора для внутримышечных инъекций в
шприцах или флаконах, содержащих 300 мкг (1 дозу) иммуно-
логически активной белковой фракции.
Хранят в сухом и темном месте при температуре от +2 до
+8 °C. В процессе хранения допускается появление незначитель-
ного осадка, исчезающего при температуре 20 ±2 °C после встря-
хивания. Срок годности 2 года. Транспортировку проводят любым
видом крытого транспорта при температуре от +2 до +8 °C.
Имеются иммуноглобулины для профилактики кори, про-
тивогриппозный, противостолбнячный и др.
КОЭЙТ-ДВИ (Bayer Corporation Biological Products)
Антигемофильный фактор (человеческий) (АГФ, фактор
свертывания VIII).
Препарат представляет собой стерильный, стабильный,
очищенный сухой концентрат человеческого антигемофильно-
го фактора, полученный путем очищения охлажденной нераство-
римой фракции пула свежезамороженной плазмы доноров, те-
стированных на отсутствие антител к вирусам ВИЧ-1, ВИЧ-2, ге-
патита С и поверхностного антигена гепатита В. Препарат про-
изводится с использованием двух независимых стадий инакти-
вации вирусов: процесса сольвент/детергентной обработки и
процесса тепловой обработки, что позволяет добиваться умень-
шения инфицирующей способности вирусов в 109—1022 раз. Со-
держит фактор Виллебранда естественного происхождения.
Показания к применению. Лечение и профилактика кровоте-
чений у больных гемофилией А, в том числе при проведении эк-
стренного и планового хирургического вмешательства.
Противопоказания:
• повышенная индивидуальная чувствительность к препарату;
• диссеминированное внутрисосудистое свертывание кро-
ви (ДВС-синдром) и/или гиперфибринолиз.
Способ применения и дозы. Препарат должен вводиться толь-
ко внутривенно. Доза, необходимая для восстановления гемоста-
за, должна подбираться индивидуально, в зависимости от тяже-
сти кровотечения, наличия ингибиторов и требуемого уровня
фактора VIII. Пациенты с низким титром ингибитора (10 еди-
ниц Бетезеда) могут успешно лечиться Коэйт-ДВИ.
122
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Расчет необходимой дозы основан на том, что введение 1 ME
препарата на 1 кг массы тела повышает содержание фактора
VIII на 2 %.
Необходимая доза (ME) = [масса тела (кг) х желаемый
уровень фактора VIII (%)] / 2.
Выбор дозы зависит от локализации и степени кровотече-
ния:
• легкое кровотечение — 10 МЕ/кг, что приводит к увели-
чению уровня фактора на 2 %;
• умеренное кровотечение — 15—25 МЕ/кг, уровень факто-
ра следует поднимать на 30—50 %; при необходимости вводят
10-15 МЕ/кг повторно каждые 8—12 ч;
• тяжелые кровотечения — уровень фактора следует увели-
чивать на 80—100 %; начальная доза 40—50 МЕ/кг; поддержива-
ющая — 20—25 МЕ/кг вводится каждые 8—12 ч;
• хирургические вмешательства — уровень фактора следу-
ет увеличивать до 100 %; предоперационная доза— 50 МЕ/кг, па-
рентеральные введения могут повторяться каждые 6—12 ч в те-
чение 10—14 дней;
• профилактика — поддерживающая доза у больных тяже-
лой формой гемофилии — 20—30 МЕ/кг 2 раза в неделю.
Форма выпуска, условия хранения и транспортировки. Пре-
парат выпускается в виде порошка для в/в инъекций в ком-
плекте с растворителем, иглами и системой для введения.
Фактическое содержание фактора VIII указывается на упаков-
ке для каждой серии препарата и может варьировать: от 200
до 300 ME (5 мл), 400—600 ME (5 мл), 800—1200 ME (10 мл).
На упаковке имеется цветовой код дозировки.
Хранить следует при температуре от +2 до +8 °C. В слу-
чае лечения на дому лиофилизированный порошок можно
хранить в течение 6 месяцев при комнатной температуре.
КОГЕНЭЙТ-ФС (Bayer Corporation Biological Products)
Рекомбинантный фактор свертывания крови VIII, стаби-
лизированный сахарозой.
Препарат представляет собой стерильный, стабильный,
очищенный, апирогенный лиофилизат, полученный реком-
123
______________________ТРАНСФУЗИОЛОГИЯ в РЕАНИМАТОЛОГИИ
бинантным способом с помощью клеток почек детенышей хо-
мячков, в которые был введен ген фактора свертывания кро-
ви VIII человека. Препарат производится с использованием
сольвент/детергентного метода инактивации вирусов, что
позволяет добиваться уменьшения инфицирующей способ-
ности вирусов в 109—1022 раз.
Каждый флакон Когенэйт-ФС содержит активное веще-
ство (фактор свертывания крови VIII) 250,500,1000 ME. Вспо-
могательные вещества: каждый флакон содержит сахарозу
0,9—1,3 % (28 мг), глицин 21—25 мг/мл, гистидин
18—23 ммоль/л. Внутривенное введение сахарозы, входящей в
состав препарата, не изменяет концентрацию глюкозы крови.
Показания к применению. Лечение и профилактика крово-
течений у больных гемофилией А, в том числе при проведении
экстренного и планового хирургического вмешательства.
Противопоказания. Повышенная индивидуальная чув-
ствительность к препарату и его компонентам.
Способ применения и дозы. Приготовленный препарат
должен вводиться только внутривенно. Доза, необходимая для
восстановления гемостаза, должна подбираться индивиду-
ально в зависимости от тяжести кровотечения, наличия ин-
гибиторов и требуемого уровня фактора VIII. Пациенты с
низким титром ингибитора (10 единиц Бетсзеда) могут успеш-
но лечиться Когенэйт-ФС.
Расчет необходимой дозы основан на том, что введение
1 ME препарата на 1 кг массы повышает содержание фактора
VIII на 2 %.
Необходимая доза (ME) = [масса тела (кг) х желаемый
уровень фактора VIII (%)] / 2.
Выбор дозы зависит от локализации и степени крово-
течения:
• легкое кровотечение — 10 МЕ/кг, что приводит к увели-
чению уровня фактора VIII на 2 %;
• умеренное кровотечение — 15—25 МЕ/кг, уровень факто-
ра следует поднимать на 30—50 %; при необходимости вводят
10—15 МЕ/кг повторно каждые 8—12 ч;
124
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
• тяжелые кровотечения — уровень фактора следует увели-
чивать на 80—100 %; начальная доза 40—50 МЕ/кг; поддержива-
ющая — 20—25 МЕ/кг вводится каждые 8—12 ч;
• хирургические вмешательства — уровень фактора следу-
ет увеличивать до 100%; предоперационная доза 50 МЕ/кг, па-
рентеральные введения могут повторяться каждые 6—12 ч в те-
чение 10—14 дней;
• профилактика — под держивающая доза у больных тяже-
лой формой гемофилии — 20—30 МЕ/кг 2 раза в неделю.
Формы выпуска. Выпускается в виде порошка для в/в
инъекций во флаконах, содержащих 250, 500 и 1000 ME актив-
ности фактора VIII свертывания крови в комплекте с раство-
рителем (2,5 мл стерильной воды для инъекций), стерильной
двусторонней иглой, стерильной иглой с фильтром и стериль-
ной системой для введения. На упаковке имеется цветовой
код дозировки.
Условия хранения и срок годности. Хранить в оригинальной
упаковке в прохладном (от +2 до +8 °C), защищенном от света
месте. Срок годности 23 месяца. После приготовления раствор
должен быть введен в течение 3 ч.
1.6. Кровезаменители
Кровезаменители — лекарственные препараты, которые
при внутривенном введении могут заменять лечебное действие
донорской крови или ее отдельных компонентов. Само опреде-
ление указывает на способность кровезаменителей восполнять,
а в ряде случаев и эффективно восстанавливать функции крови:
• заполнять кровеносное русло и обеспечивать под держа-
ние на необходимом уровне артериального давления, нарушен-
ного в результате кровопотери или шока;
• восстанавливать осмотическое или электролитное равновесие;
• освобождать организм от токсинов, образующихся при
действии патогенных факторов и инфекционных агентов или по-
ступающих в организм при отравлениях;
• обеспечивать ткани необходимыми питательными веще-
ствами и источниками энергии (растворы аминокислот, сахаров,
жиров, витаминов, минеральных веществ).
125
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
На основе функциональных свойств кровезамещающих
препаратов и особенностей их действия Гавриловым О.К. и Ва-
сильевым П.С. в 1975 г. была разработана классификация кро-
везаменителей, которая положена в основу современного спис-
ка препаратов трансфузиологического пособия (см. табл. 1.9):
• препараты гемодинамического противошокового дей-
ствия;
• препараты дезинтоксикационного действия;
• регуляторы водно-солевого и кислотно-основного со-
стояний;
• переносчики кислорода;
• препараты для парентерального питания;
• кровезаменители комплексного действия.
1.6.1. Кровезаменители гемодинамического
(противошокового) действия
Препараты этого ряда называют еще плазмозамещаюшими
растворами. Основная задача препаратов гемодинамического
действия — заполнять кровеносное русло и обеспечивать поддер-
жание на необходимом уровне артериального давления, нару-
шенного в результате кровотечения или по другим причинам.
Препараты гемодинамического действия в зависимости от
компонента, составляющего их основу, разделяются на несколь-
ко групп:
Для оценки объемзамещающего действия (основного кли-
нического эффекта, создаваемого коллоидными плазмозаме-
щающими растворами) существует несколько параметров:
• максимальное объемное действие (объемный эффект) —
первоначальное максимальное возмещение объема циркули-
рующей жидкости, в процентах от объема введенного препара-
та без учета вторичных эффектов;
• продолжительность объемного действия — продолжитель-
ность промежутка времени, в течение которого сохраняется по ме-
ньшей мере 100 %-ное возмещение объема циркулирующей жид-
кости, в процентах от объема введенного препарата;
• продолжительность половинного объемного действия —
продолжительность промежутка времени, в течение которого
126
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Таблица 1.9
Природные коллоиды Искусственные коллоиды
Желатин Декстран Гидрокси- этилкрахмал Полиэти- ленгликоль
Альбумин 5 %-ный Желати- ноль Полиглю- кин Волекам Полиокси- дин
Альбумин 10 %-ный Модежель Макродекс Плазмасте- рил Полиокси- фумарин.
Альбумин 20 %-ный Геможель Полифер Xaes-стерил 3, 6,10 %- ный
Гелофузин Реополи- глюкин Инфукол HES6, 10 %-ный
Реотлюман Реомакро- декс Стабизол
Лонгасте- рил 40,70 Рефортан
Рефортан плюс
Гемохес 6, 10 %-ный
Волювен
сохраняется по меньшей мере 50 %-ное возмещение объема
циркулирующей жидкости, в процентах от объема введенного
препарата.
Природный коллоидный раствор альбумин является как
бы «золотым стандартом» для искусственных коллоидов.
Искусственные коллоиды
Идеальный препарат для замещения плазмы и восстано-
вления объема циркулирующей жидкости должен:
• быстро возмещать потерю объема циркулирующей крови;
• восстанавливать гемодинамическое равновесие;
• нормализовать микроциркуляцию;
127
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• иметь достаточно длительное время пребывания в крове-
носных сосудах;
• улучшать реологию циркулирующей крови;
• улучшать доставку кислорода и других компонентов, а
также тканевый обмен и функционирование органов;
• легко метаболизироваться, не накапливаться в тканях,
легко выводиться и хорошо переноситься;
• оказывать минимальное воздействие на иммунную систему.
История создания и клинического применения искусствен-
ных плазмозаменителей насчитывает почти два столетия (см.
табл. 1.10). В начале 30-х гг. XIX столетия английский врач Т. Lat-
ta в журнале «Lancet» опубликовал работу о лечении холеры
внутривенным вливанием растворов соды. В 1881 г. Landerer ус-
пешно провел вливание больному физиологического раствора
поваренной соли, после чего растворы кристаллоидов стали
широко использвать в клинической практике.
Таблица 1.10. Основные исторические даты перехода от
кристаллоидов к современным плазмозамещающим растворам
1881 г. Landerer — первое вливание физиологического раствора
1915 г. Lang К. и соавт. — использование раствора желатина
1940 г. Reppe, Weese, Hecht — раствор поливинилпирролидона
1944 г. Gronwall, Ingelmann — растворы декстрана, новые вариан-
ты растворов желатина
1962 г. Thompson, Britton, Walton — растворы
гидроксиэтилированного крахмала
Импульсом к созданию искусственных коллоидов в качестве
основных плазмозаменителей послужила теория Старлинга
(1896), исходя из которой осмотическое давление сывороточных
коллоидов является регулятором плазменного объема.
В1915 г. J. J. Hogan во время Первой мировой войны исполь-
зует препарат на основе желатина, который явился первым из ис-
кусственных коллоидных плазмозаменителей.
В 1940 г. был внедрен в практику Перистон — первый из
кровезаменителей на основе синтетического препарата поливи-
128
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
нилпирролидона. После 1944 г., когда были разработаны плаз-
мозамещающие растворы на основе декстрана, в течение четвер-
ти века препараты этой группы занимали лидирующее положе-
ние среди коллоидных растворов, используемых в клинике.
Клиническое внедрение растворов гидроксиэтилирован-
ного крахмала началось с 1962 г., однако широкое применение
они получили только к концу XX столетия.
Возврат интереса к препаратам на основе желатина про-
изошел в США в начале 50-х годов, после создания оксиполи-
желатина [Campbell D. Н. и соавт.], а затем модифицированно-
го жидкого желатина [Tourtelotte D. и Williams Н. E.J. Нескольки-
ми годами позже в Термании создают препарат желатина, связан-
ного мочевиной [Scmidt-Tomme J. и соавт., 1962]. Эти три пре-
парата к настоящему времени заслужили достойное место в кли-
нической медицине. Однако препараты желатина практически
не использовались на родине их создания, несмотря на тот факт,
что американские авторы некогда расценивали их как наиболее
перспективную группу плазмозаменителей. Основной причиной
этому послужили инструкции Вооруженных сил США, дей-
ствующие во время войны в Корее, которые требовали, чтобы
плазмозаменители сохраняли жидкое состояние при температу-
ре 0 °C, чему первые препараты желатина не соответствовали.
В этой связи плазмозаменители этой группы применялись до на-
стоящего времени в основном в Европе.
В последние годы разработаны новые препараты из желати-
на, разновидность модифицированного жидкого желатина —
гелофузин фирмы В. Braun (Германия) и отечественный модежель.
Использование искусственных коллоидов практически пол-
ностью исключает перенос инфекции. Они сравнительно де-
шевы и весьма стабильны при хранении и при клиническом
применении имеют достаточно низкий уровень нежелательных
побочных реакций. Помимо основного объемзамещающего дей-
ствия синтетические коллоидные растворы улучшают реологи-
ческие свойства крови и микроциркуляцию.
Для количественной оценки объемного действия колло-
идных растворов используют различные методы, в большин-
стве своем основанные на определении степени разведения мар-
керов: гемоглобина, гематокритного числа, эритроцитов, мар-
129
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
кированных флюоресценом или радиоактивным хромом, краси-
теля, альбумина, а также измерения показателей вязкости и
плотности плазмы.
Молекулы синтетического коллоида in vivo подвергаются
расщеплению и элиминации. Скорость этих процессов и опре-
деляет длительность объемзамещающего действия препарата.
Более мелкие молекулы в определенных пределах создают более
высокое коллоидное осмотическое давление, чем более кру-
пные молекулы, но они ускоренно элиминируются почками.
Более крупные молекулы при расщеплении на более мелкие
фрагменты создают вторичный объемный эффект, обеспечи-
вающий д лительное объемзамещающее действие. У больных с ге-
моррагическим шоком выраженный объемзамещающий эф-
фект после вливания коллоидного раствора вызывает увеличе-
ние почечного кровотока и ускоренное выведение действую-
щего вещества.
Помимо основного объемзамещающего действия, синте-
тические коллоидные растворы улучшают реологические свой-
ства крови и микроциркуляцию, что повышает обеспечение
тканей кислородом.
Высокая надежность действия синтетических коллоидов
сочетается с относительно низким уровнем побочных реакций.
Им всем свойственны следующие качества:
• способность задерживаться на длительный срок в клетках
ретикулоэндотелиальной системы;
• выраженное в той или иной степени влияние на систему
свертывания крови;
• действие на функцию почек;
• в исключительно редких случаях вызывать реакции непе-
реносимости.
Растворы желатина
Желатин производят из коллагеновой ткани (хрящей)
крупного рогатого скота методом термической деградации,
гидролиза и сукцинирования. С помощью различных мето-
дов получают короткие пептидные цепи, которые с исполь-
зованием той или иной технологии объединяют в более кру-
пные модифицированные молекулярные структуры. Основ-
130
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
ная часть желатина удаляется почками, небольшая доля
расщепляется пептидазами или удаляется через кишечник
Средний молекулярный вес — около 35 000 Д, концентра-
ция раствора — 3,0—5,5 %. Однако технологические факто-
ры ограничивают базовые свойства растворов желатина,
поэтому длительность его объемного действия невелика. За
это время не происходит существенного воздействия ни на
клетки ретикулоэндотелиальной системы, ни на общий уро-
вень иммунитета, но на 2—3-й день после введения раство-
ров желатина регистрируется снижение концентрации фи-
бронектина в плазме. По мнению некоторых авторов, влия-
ние растворов желатина на системы свертывания крови от-
носительно слабо. Однако известно, что растворы желати-
на замедляют образование тромбов и подавляют агрегацию
тромбоцитов. Введение желатина приводит к увеличению
диуреза, но даже при повторных вливаниях не нарушает
функцию почек. Диализные больные с нарушенной дея-
тельностью почек также не обнаруживают признаков ку-
муляции желатина.
Желатиноль
Желатиноль — 8 %-ный раствор полипептида, получаемо-
го из коллагена крупного рогатого скота, в 0,9 %-ном растворе
натрия хлорида. Средний молекулярный вес — 20 000 ± 5000 Д,
теоретическая осмолярность 371 мосм/л, pH = 6,8—7,4, относи-
тельная вязкость — 2,4—3,5. Содержит ряд аминокислот и элек-
тролиты: натрий (162 ммоль/л), калий (0,4 ммоль/л), кальций
(9,38 ммоль/л), хлор (162 ммоль/л). Величина объемного дей-
ствия — 60 %, продолжительность объемного действия 1—2 ч. Че-
рез час после окончания инфузии препарата АД снижается по
сравнению с исходным на 20 %.
Нетоксичен, апирогенен, не вызывает антигенных реакций.
Основная часть желатиноля удаляется почками, частично в
неизмененном виде, в результате чего в моче в течение 1—2 дней
обнаруживается белок.
Показания к применению
Желатиноль применяют:
• в качестве плазмозамещающего средства при геморра-
гиях, операционном и травматическом шоке I и II степеней;
131
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• для заполнения аппарата искусственного кровообраще-
ния при операциях на открытом сердце.
Кратковременность объемного действия и его небольшая ве-
личина ограничивают область применения желатиноля.
Кроме того, инфузия раствора желатиноля вызывает вы-
свобождение гистамина, что может способствовать тахикардии,
брадикардии, появлению крапивницы и бронхоспазма.
Желатиноль нарушает агрегацию тромбоцитов и гемостаз за
счет торможения адгезии тромбоцитов. Нарушение функции
тромбоцитов при введении раствора желатина может вызывать
увеличение времени кровотечения у больных с травмами.
Противопоказания и побочные действия. Введения желати-
ноля могут вызывать аллергические и анафилактические реак-
ции. Противопоказан при острых и хронических нефритах.
Дозы и методы введения. Перед инфузией желатиноля обя-
зательно проведение биологической пробы. При острой кро-
вопотере и шоке желатиноль вводят сначала внутривенно или вну-
триартериально струйно, затем переходят на капельное введение
до нормализации артериального давления. Одновременно может
быть введено не более 2000 мл. После переливания максималь-
ного объема необходимы трансфузии компонентов крови.
Форма выпуска', стеклянные флаконы по 450 мл.
Условия хранения: при температуре от +4 до +20 °C. При по-
явлении осадка препарат к употреблению непригоден.
Особая ситуация в последнее время сложилась в связи с
угрозой распространения возбудителя трансмиссивной спон-
гиоформной энцефалопатии крупного рогатого скота («бешен-
ство коров» — BSE). В рекомендациях Консультативного сове-
щания экспертов ВОЗ от 24—26 марта 1997 г. подчеркивается
необходимость принятия адекватных мер по снижению риска за-
ражения населения при использовании медицинских препара-
тов и изделий, получаемых из органов и тканей крупного рога-
того скота (обычно используемые режимы стерилизации не
инактивируют возбудителя BSE).
Гелофузин
Гелофузин (B.Braun, Германия) представляет собой 4 %-
ный раствор модифицированного жидкого желатина. Средняя
молекулярная масса — 30 000 Д. Теоретическая осмолярность —
132
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ_____________
274 мосм/л, вязкость — 1,9, pH = 7,1—7,7, объемный эффект —
100 %, длительность объемного действия — 3—4 ч. Содержит
ионы натрия (154 ммоль/л), кальция (менее 0,04 ммоль/л), хло-
ра (120 ммоль/л).
Период полувыведения гелофузина — 9 ч. 90—95 % препа-
рата выделяются почками, 5—10 % — кишечником.
Результатом лечебных действий гелофузина являются сле-
дующие эффекты:
• гемодилюционный — его введение снижает вязкость кро-
ви, что приводит к улучшению периферической микроциркуля-
ции и в конечном итоге — к значительному увеличению объема
циркулирующей крови с увеличением сердечного выброса;
• инфузии гелофузина вызывают снижение уровня гемато-
крита и, следовательно, уменьшают насыщение крови кислоро-
дом. Однако уменьшение вязкости и улучшение микроциркуля-
ции понижают нагрузку на сердце. Таким образом, сердечный
выброс увеличивается без повышения потребности сердца в ки-
слороде;
• улучшается транспортно-кислородная функция крови
(при условии, что гематокрит не снизится до уровня менее 25 %
или менее 30 % у пожилых);
• коллоидно-осмотическое давление гелофузина (33,3 мм
Hg) снижает развитие интерстициального отека.
Показания к применению'.
• профилактика и лечение абсолютной и относительной
гиповолемии, сопровождающейся гемоконцентрацией (с це-
лью гемодилюции);
• профилактика и лечение шока;
• экстракорпоральное кровообращение (заполнение аппа-
рата искусственного кровообращения);
• профилактика артериальной гипотензии (например, при
перидуральной анестезии);
• увеличение воспроизводства лейкоцитов при лейкоферезе.
При восполнении кровопотери, не превышающей 20 % об-
щего объема, дополнительных введений трансфузионных сред
не требуется. Однако при инфузии 2000—3000 мл раствора тре-
буется контроль белков сыворотки крови и при снижении их ни-
же 52 г/л — введение растворов альбумина, белков плазмы, эри-
133
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
троцитной массы. При массивных инфузиях возможно нару-
шение свертывания крови.
Противопоказания к применению:
• гипергидратация;
• гиперволемия;
• тяжелая сердечная недостаточность;
• серьезные нарушения свертывания крови;
• наличие в анамнезе аллергических и анафилактических
реакций, обусловленных применением гелофузина.
Гелофузин имеет ограниченное применение при:
• гипонатриемии, гипокальциемии;
• дегидратации;
• почечной недостаточности, т. к. обычный путь выведения
препарата может быть нарушен;
• хронических заболеваниях печени.
Не имеется данных по проникновению гелофузина в мате-
ринское молоко и по применению его у детей. Поскольку опас-
ность аллергических и анафилактических реакций не исключа-
ется, использовать гелофузин у беременных следует только в
крайних случаях.
Гелофузин может изменять показатели диагностических те-
стов на глюкозу, фруктозу, холестерин, жирные кислоты, скорость
оседания эритроцитов, плотность мочи.
При введении гелофузина возможность анафилактических
реакций составляет 0,0077 %.
Способ применения и дозы
• Перед началом инфузии гелофузина обязательно прове-
дение биологической пробы.
• Режим дозирования гелофузина устанавливается индиви-
дуально с учетом выраженности дефицита объема плазмы, ди-
намики ЧСС, АД, диуреза, состояния тканевой перфузии.
• При кровопотере средней степени тяжести препарат вво-
дят в дозе 500—1000 мл за 1—3 ч. Аналогично во время проведе-
ния операций.
• Теоретически при ликвидации шоковых состояний
объем переливаемого препарата может составлять 10—15 л.
Однако такая гемодилюция может вызывать нарушения ге-
мостаза, падение гематокрита ниже 25 % (у пациентов с сер-
134
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ____________
дечно-сосудистой и легочной недостаточностью это соста-
вляет 30 %), что требует переливания эритроцитной массы и
альбумина.
• При проведении изоволемической гемодилюции объем
вводимого гелофузина должен быть эквивалентен количеству
удаленной плазмы (не более 20 мл/кг в сутки).
• Для увеличения воспроизводства лейкоцитов при лей-
коферезе дозы введения могут составлять 500—1000 мл на про-
цедуру лейкофереза.
• Гелофузин не рекомендуется смешивать с жировыми
эмульсиями и другими лекарственными препаратами.
Форма выпуска. Полиэтиленовые контейнеры по 500 мл.
У словия хранения. Хранить при температуре не выше +25 °C.
Клинический опыт использования гелофузина в реанимации и
интенсивной терапии
Назначение инфузионной терапии пациентам с циркулятор-
ной недостаточностью, обусловленной низкой преднагузкой
сердца, ведет к увеличению объема циркулирующей крови, ве-
нозного возврата к сердцу и сердечного выброса. Для достиже-
ния этой цели можно использовать препараты крови, кристал-
лоидные или коллоидные растворы.
Использование плазмы и компонентов донорской крови
лимитируется проблемами организации донорской службы, от-
носительной их дороговизной, сложностями транспортировки
и хранения, а также риском инфицирования реципиента. Так-
же уместно указать на наличие анафилактических и анафилак-
тоидных реакций, частота которых при переливании плазмы
достигает 0,014 %. Некоторые из перечисленных проблем мож-
но отнести и к растворам человеческого альбумина, который
представляет собой более очищенный препарат. В числе этих про-
блем прежде всего — высокая стоимость и риск анафилактиче-
ских реакций.
Влияние гелофузина на показатели гемодинамики, кислород-
транспортную функцию и реологические свойства крови
Исследования, проведенные у добровольцев с нормоволе-
мией, показали, что раствор модифицированого жидкого жела-
тина приводит у них к пропорциональному увеличению ОЦК.
Его период полувыведения сравним с таковым у декстрана-40,
135
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
но короче, чем у декстрана-70 или гидроксиэтилкрахмала. В
этой связи некоторые авторы считают безопасным применение
больших объемов гелофузина.
Гемодинамический эффект гелофузина у пациентов с дефи-
цитом ОЦК исследован в целом ряде работ. Edwards J.D. и соавт.
(1989) оценили эффект быстрой инфузии 500 мл препарата у
пациентов отделения интенсивной терапии, находившихся на
И ВЛ и имевших нестабильную гемодинамику. Показаниями к
введению гелофузина были среднее артериальное давление ме-
нее 80 мм рт. ст. и давление заклинивания в легочной артерии ни-
же 10 мм рт. ст. Инфузия препарата сопровождалась статистиче-
ски значимым возрастанием среднего АД, давления заклинива-
ния в легочной артерии, индекса ударной работы желудочков
сердца, сердечного индекса и артериального транспорта кисло-
рода. Снижение концентрации общего гемоглобина и концен-
трации кислорода в крови авторы объясняли эффектом гемоди-
люции. Поскольку препарат не оказывал отрицательного влия-
ния на показатели оксигенирующей функции легких и наблю-
далось возрастание потребления кислорода, авторы делают вы-
вод о благоприятном его влиянии на гемодинамику и кислород-
транспортную функцию в целом.
В проспективном рандомизированном исследовании Be-
ards S.C. и соавт. сравнивали инфузию 500 мл гелофузина и ги-
дроксиэтилкрахмала Hespan, которые вводили в течение 10 ми-
нут пациентам с гиповолемическим шоком. Положительный
гемодинамический эффект, заключавшийся в возрастании про-
изводительности сердца и артериального транспорта кислоро-
да при некотором снижении концентрации гемоглобина, отме-
чен в обеих группах. Авторами не получено статистически досто-
верных различий между гемодинамическими реакциями на вве-
дение сравниваемых препаратов.
Beyer R. и соавт. (1997) сравнили динамику ряда показате-
лей у больных при больших ортопедических операциях с ис-
пользованием 6 %-ного раствора гидроксиэтилкрахмала и гело-
фузина. Разницы в значениях коллоидно-осмотического давле-
ния плазмы в течение 24 ч обнаружено не было. Через 2 ч после
начала операции в группе больных, получавших раствор ги-
дроксиэтилкрахмала, отмечено более выраженное снижение
136
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ____________
вязкости плазмы. Поскольку модифицированный жидкий же-
латин является полипептидом, он может давать ложное повыше-
ние показателя общего белка плазмы, что и было отмечено ав-
торами к концу операции.
Европейский опыт подтверждает, что раствор модифициро-
ванного жидкого желатина имеет преимущества по сравнению
с другими искусственными коллоидами, применяемыми в на-
стоящее время. Его молекулярная масса близка к идеальной, и
показатель полидисперсности более близок к белку плазмы кро-
ви, чем у других искусственных коллоидов. Гелофузин не оказы-
вал неблагоприятных воздействий на коагуляцию крови, даже
когда объемы инфузии превышали 4 л в сутки.
Существуют ограниченные противопоказания для приме-
нения гелофузина по гемодинамическому эффекту (в варианте
гипергидратации и высокой преднагрузки), но нет данных об от-
рицательном влиянии этого раствора на кислородтранспорт-
ную функцию крови.
Гелофузин при восполнении кровопотери
Накоплен опыт восполнения интраоперационной кровопо-
тери у больных с различными видами хирургических вмеша-
тельств, урологических, акушерско-гинекологических и больших
ортопедических операций. Объем инфузии может составлять
от 500до 3000 мл, и в некоторых клиниках общее количество пе-
реливаемого гелофузина составляет 72 % от всех используемых
коллоидов.
По мнению Марютина П.В. и соавт. (1997), у пациентов с
продолжающейся кровопотерей, получавших гелофузин, поли-
глюкин или гидроксиэтилкрахмал, наибольший волемический
эффект наблюдался при использовании гидроксиэтилкрахмала.
Однако при анализе показателей гемостаза и количества гемор-
рагических рецидивов выявлено несомненное преимущество
гелофузина. Поскольку раствор гидроксиэтилкрахмала может
оказывать отрицательное влияние на свертывающую систему
крови, его максимальную дозу рекомендуют ограничивать до
20 мг/кг массы тела. Раствор модифицированного жидкого же-
латина не влияет на свертывающую систему крови, даже если
объем инфузии составляет 2—3 л за 24 ч. Есть указания на осо-
бые его преимущества при исходной гипокоагуляции и/или
137
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
тромбоцитопении, а также в ситуациях с высоким риском разви-
тия ДВС-синдрома. Считается, что гелофузин при инфузионной
терапии гиповолемических состояний различного генеза у боль-
ных хирургического профиля оказывает стойкий волемический
и гемодинамический эффект, устраняет микроциркуляторные на-
рушения и улучшает газотранспортную функцию крови.
Гелофузин может применяться в качестве основного препа-
рата при проведении противоотечной терапии для профилакти-
ки реперфузионного синдрома у больных нейрохирургическо-
го профиля, перенесших черепно-мозговую травму.
Применение гелофузина в практике скорой помощи при
кровопотере различного происхождения (травма, желудочно-
кишечное кровотечение) на догоспитальном этапе может ре-
шить одновременно 2 задачи: стабилизировать гемодинамику у
больных с шоком и создать преемственность в работе бригад
скорой помощи и стационаров.
Дуткевич И.Г., оценивая перспективы использования раз-
личных коллоидных препаратов в медицине катастроф, счита-
ет, что препараты на основе декстрана, оксиэтилкрахмала и по-
лиэтиленгликоля имеют высокий волемический коэффициент
(120—130 % и более) за счет притока интерстициальной жидко-
сти в сосудистое русло, поэтому их применение опасно на фо-
не дегидратации у пострадавших. Кроме того, они нарушают
механизмы первичного и вторичного гемостаза, поэтому их вве-
дение при коагулопатиях и гемодилюции может вызвать гемор-
рагический диатез.
Применение гелофузина для намеренной нормоволемической ге-
модилюции и заполнения аппарата искусственного кровообра-
щения
Одним из перспективных направлений использования ге-
лофузина является намеренная предоперационная гемодилюция.
По мнению Наймушина А.В. и соавт., эксфузия крови в объеме
15—17 мл/кг с целью ее сбережения при одновременной замести-
тельной терапии гелофузином не оказывает отрицательного
влияния на гемодинамику, а кислородтранспортная функция
не страдает за счет компенсаторного увеличения сердечного
выброса. Сравнив гелофузин с 6 %-ным раствором хаес-сте-
рила у больных с АКШ, авторы обнаружили, что при использо-
138
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
вании последнего происходит накопление жидкости в интерсти-
циальном пространстве в течение 2—5 суток. Это проявлялось
прежде всего клиникой дыхательной недостаточности с арте-
риальной гипоксемией и рентгенологической картиной интер-
стициальной гипергидратации легких.
В ряде клиник гелофузин используют в качестве одного из
компонентов для заполнения аппарата искусственного кровооб-
ращения. Jansan P.G. и соавт. продемонстрировали, что при этом
можно поддерживать нормальное коллоидно-осмотическое да-
вление плазмы во время искусственного кровообращения при
минимальном первичном объеме заполнения аппарата. Резуль-
татом такой тактики явилось уменьшение общего объема вводи-
мой жидкости, улучшение результатов течения послеоперацион-
ного периода и сокращение времени госпитализации.
Himpe D.H. и соавт. сравнили результаты проведения
искусственного кровообращения в трех группах пациентов
с разным составом первичного заполнения АИК: с исполь-
зованием человеческого альбумина, сукцинированного же-
латина (гелоплазма) и желатина, связанного с мочевиной
(haemaccel). Основным выводом данной работы явилось то,
что сукцинированный желатин представляет собой адекват-
ную и безопасную альтернативу человеческому альбумину
при проведении ИК. Преимущества перед другими искус-
ственными коллоидами заключаются в отсутствии
выраженного влияния на свертывающую систему крови,
возможности использования в относительно больших до-
зах, умеренной стоимости. Кроме того, препарат не накапли-
вается в ретикулоэндотелиальной системе и не влияет на
концентрацию фибропектина. Вместе с тем авторы призна-
ют целесообразность применения альбумина в послеопера-
ционном периоде у больных с гипопротеинемией.
По мнению Барышева Б.А. (1997), использование гелофу-
зина для заполнения аппарата искусственного кровообраще-
ния, по сравнению с желатинолем и модежелем, уменьшало вы-
раженность тканевого отека и число осложнений, связанных с
отеком головного мозга (энцефалопатий). Этот эффект, по-ви-
Димому, обусловлен более высоким коллоидно-осмотическим да-
нлением гелофузина.
139
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Использование гелофузина во время проведения эфферентных
процедур
По мнению ряда авторов, применение гелофузина в каче-
стве компенсирующего раствора при проведении эфферентных
процедур (плазмаферез, плазмозамешение) предпочтительнее,
чем растворов декстранов и гидроксиэтилкрахмала, поскольку,
в отличие от последних, он не оказывает отрицательного воздей-
ствия на свертывающую систему крови, углеводный обмен, а так-
же функцию поджелудочной железы и почек.
Особого внимания заслуживает преимущество препаратов
желатина по сравнению с другими синтетическими коллоидами
у больных с почечной недостаточностью. В работе Kohler Н.
показано, что при снижении уровня клубочковой фильтрации с
90 до 0,5 мл/мин период полувыведения препаратов желатина
увеличивается менее чем в 2 раза, гидроксиэтилкрахмала —
в 2,5 раза, а декстрана-40 — в 7,5 раз.
Показано, что введение 500 мл коллоидных растворов
пациентам, находящимся на гемодиализе, сопровождается
различным эффектом, который определяется видом колло-
ида. В частности, наблюдается накопление в организме па-
циентов декстрана-40 и гидроксиэтилкрахмала, в то время
как для препаратов желатина это не характерно. Данный
факт объясняется тем, что при гемодиализе удаляются мак-
ромолекулы коллоидов, имеющие молекулярную массу ме-
нее 10 000 Дальтон. Более того, имеются указания на то,
что у больных с анурией усиление элиминации гидроксиэ-
тилкрахмала в печени может приводить к развитию пор-
тальной гипертензии и асцита. С другой стороны, посколь-
ку концентрация натрия в растворе гелофузина составляет
154 ммоль/л, нельзя забывать о возможности избыточного
накопления этого электролита в организме пациентов с по-
чечной недостаточностью.
Возможные побочные эффекты гелофузина
В настоящее время практически все исследователи сходят-
ся во мнении, что идеального плазмозаменителя не существует.
В этой связи при их назначении учитывают индивидуальные
особенности пациента и специфику проводимых терапевтиче-
ских процедур.
140
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
При использовании коллоидных растворов существует риск
анафилактических реакций, которые по степени тяжести по-
дразделяют на четыре типа. При реакциях III и IV типов, считаю-
щихся клинически значимыми для пациентов, требуется сроч-
ная замена препарата. Частота возникновения реакций III и
IV типов на препараты модифицированного жидкого желатина
сравнима с реакциями на другие синтетические коллоиды.
В частности, для гелофузина она составляет от 1 на 6000 до 1 на
13 000 случаев. Такие реакции являются результатом выброса
большого количества вазоактивных субстанций и чаше наблю-
даются улиц, предрасположенных к аллергии.
Имеются публикации о возможном негативном влиянии
растворов на основе желатина на систему иммунитета. По мне-
нию ряда авторов, эти препараты могут приводить к увеличению
выработки факторов воспаления, напимер, интерлейкина-1-
бета, а также стимуляции системы комплемента и снижению им-
мунореактивной концентрации фибронектина плазмы.
Поскольку препараты желатина изготовляются из костей
крупного рогатого скота, некоторые авторы высказывают мне-
ние об опасности заражения вирусом трансмиссивной губча-
той энцефалопатии, который вызывает болезнь Крейтцфель-
да—Якоба. Однако эта опасность учитывается при отборе живот-
ных, которые тщательно обследуются.
Анализ литературных данных показывает, что коллоидный
плазмозаменитель гелофузин нашел широкое применение в
практике анестезиологии, интенсивной терапии и реанимато-
логии. Препарат обладает положительным влиянием на со-
стояние гемодинамики и кислородтранспортную функцию
кровообращения при сравнительно небольшой частоте по-
бочных эффектов.
1елофузин может использоваться для восполнения крово-
потери, проведения намеренной нормоволемической гемодилю-
Ции, афферентных процедур и заполнения аппарата искусствен-
ного кровообращения.
Поскольку по сравнению с другими растворами синтетиче-
ских коллоидов препарат не вызывает перемещения в циркуля-
торное русло значительных объемов жидкости из интерсти-
циального и внутриклеточного пространств, гелофузин предпоч-
141
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
тительно использовать у пациентов с сердечной недостаточно-
стью и при выраженном обезвоживании.
Учитывая относительно небольшой период полувыведения
препарата и отсутствие отрипателньго влияния на функцию по-
чек. гелофузину отдают предпочтение у больных с клинически-
ми признаками почечной недостаточности.
Модежель
Модежель — отечественный 8 %-ный раствор декальци-
нированного пищевого желатина в 0,9 %-ном растворе натрия
хлорида. Средняя молекулярная масса 16 000 Дальтон, теоре-
тическая осмолярность 282 мосм/л, pH 6,5—7,4, содержание
ионов натрия (145 ммоль/л), кальция (0,31 ммоль/л), хлора
(59,8 ммоль/л).
Показания к применению'.
• профилактика и лечение гиповолемии;
• приготовление взвеси эритроцитов. У взвеси отмытых
эритроцитов (ОЭ) срок хранения может быть продлен до 72 ч вме-
сто 24 ч при консервировании их физиологическим раствором;
• заполнение аппарата искусственного кровообращения.
Трандиционно ресуспендирующей средой для ОЭ является
физиологический раствор, в котором ОЭ, в соответсвии с регла-
ментом, хранятся при температуре +4 °C в течение 24 ч с момен-
та заготовки, что достаточно неудобно и не всегда приводит к
полноценному использованию заготовленной трансфузионной
среды.
Отмытые эритроциты (ОЭ) представляют собой ареак-
тогенную трансфузионную среду и показаны больным, у ко-
торых в анамнезе имелись посттрансфузионные реакции не-
гемолитического типа, а также больным, сенсибилизирован-
ным к антигенам белков плазмы, тканевым антигенам и ан-
тигенам лейкоцитов и тромбоцитов. В связи с отсутствием в
отмытых эритроцитах стабилизаторов крови и продуктов ме-
таболизма клеточных компонентов, оказывающих токсическое
действие, их трансфузии показаны в терапии глубоких анемий
у больных с почечной и печеночной недостаточностью и при
«синдроме массивных трансфузий». Проведенные в РНЦХ
РАМН и РНИИ гематологии и трансфузиологии М3 РФ ис-
следования показали возможность использования модежеля
142
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
для получения взвеси эритроцитов. Эритроциты, ресуспенди-
рованные в модежеле (1:1), сохраняют свои морфофункцио-
нальные свойства до 21 суток не хуже, чем в собственной
плазме. Взвесь отмытых эритроцитов (ОЭ) 1 : 1 позволяет
продлить срок их жизни до 72 ч без существенного изменения
содержания свободного гемоглобина и уровня гемолиза. Из-
менение соотношения модежель: эритроциты позволяет ре-
гулировать уровень гематокрита (при соотношении 0,3:1 ге-
матокрит находится в пределах 69—73 %). Применение тран-
сфузионных сред на основе модежеля при операциях на серд-
це и сосудах позволяет в одном объеме совместить необходи-
мость поддержания гемодинамических показателей и транс-
порта кислорода к тканям. Проведенные исследования пока-
зали, что растворы отмытых эритроцитов в модежеле имеют
определенные преимущества при заполнении аппарата ис-
скуственного кровообращения. Уровень гемотокрита 26—27 %,
гемоглобина в пределах 8 г/дл, АД 80/65 и РО2 в пределах 60
для артериальной и 45—46 мм рт. ст. для венозной крови отве-
чают необходимым требованиям.
В результате проведенных лабораторных и клинических ис-
следований были сделаны следующие выводы:
1. Взвесь отмытых эритроцитов в модежеле может быть ис-
пользована для заполнения аппарата ИК.
2. Концентрация взвеси не имеет существенного значения
для поддержания АД, РО2 и гематокрита.
3. Для поддержания уровня гемоглобина 8—9 г/дл наиболее
оптимальна концентрация 1:0,5 (50 %).
Срок хранения отмытых эритроцитов может быть продлен
с 24 до 72 ч.
Перед переливанием необходимо проведение биологической
пробы.
Возможны температурные реакции легкой и средней тяжести.
Модежель-АФ
Модежель-АФ представляет собой препарат «модежель» с до-
бавлением аденина и натрия фосфата двузамещенного. Предназ-
начен для заготовки из эритроконцентрата эритровзвеси и по-
следующего ее хранения. Модежель-АФ добавляют к эритрокон-
Центрату в соотношении 1:1.
143
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Обеспечивает сохранность морфофункциональных свойств
эритроцитов при +4 °C в течение 42 суток хранения. Придает эри-
тровзвеси выраженные коллоидно-осмотические свойства, об-
еспечивая при переливании ее гемодинамическое, реологиче-
ское, детоксическое действие и нормализацию КОС. Взвесь
эритроцитов в модежеле-АФ обладает сниженной (по сравнению
с цельной консервированной кровью) иммунологической реак-
тогенностью.
Показания к применению. Взвесь эритроцитов в модежеле-АФ
используют вместо консервированной крови и других эритроцит-
ных сред для восполнения острой кровопотери, коррекции ане-
мии различного генеза.
Противопоказания. Противопоказаниями к введению боль-
ших объемов взвеси эритроцитов в модежеле-АФ являются отек
легкого, мозга, почечная недостаточность. При трансфузиях
взвеси эритроцитов в модежеле-АФ могут наблюдаться пост-
трансфузионные температурные реакции, обусловленные на-
личием в среде остаточных лейкоцитов и плазмы.
Способ применения и дозы. Взвесь эритпроцитов в модежеле-
АФ применяют внутривенно, до 3 л в сутки.
Форма выпуска и условия хранения. Выпускают модежель-
АФ в стеклянных бутылках по 200 и 450 мл. Хранят при темпе-
ратуре +4... +25 °C. Срок хранения 3 года.
В Госреестре препарат не зарегистрирован.
Модежель-глюкофосфат
Модежель-глюкофосфат предствляет собой препарат «мо-
дежель» с добавкой глюкозы и натрия фосфата двузамещенно-
го. Предназначен для ресуспендирования и хранения отмытых
эритроцитов. Добавляется к отмытым 0,9 %-ным раствором
натрия хлорида эритроцитам в соотношении 1:1.
Модежель-глюкофосфат обеспечивает морфофункциональ-
ную сохранность взвешенных в нем отмытых эритроцитов в те-
чение 21 суток хранения при +4 °C.
Модежель-глюкофосфат придает взвеси отмытых эритроци-
тов выраженные коллоидно-осмотические свойства, обусло-
вливающие при переливании ее гемодинамическое, реологи-
ческое, детоксическое действие и коррекцию кислотно-основ-
ного состояния крови.
144
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ____________
Взвесь отмытых эритроцитов в модежеле-глюкофосфате
обладает сниженной иммунологической реактогенностью вслед-
ствие низкого содержания в ней лейкоцитов (менее 30—35 %) и
плазменных белков (менее 0,25 г/л).
Показания к применению-.
• реципиентам с комплементзависимыми гемолитически-
ми анемиями;
• больным с анемиями различного генеза, изосенсибили-
зированным к антигенам лейкоцитов и белков плазмы;
• шок;
• кровопотеря;
• пересадка органов;
• наличие у пациентов в анамнезе посттрансфузионных
реакций и осложнений;
• выявление в крови реципиентов анти-НЬА-антител в
случаях невозможности использования лейкоцитарных фильтров
или криоконсервированных эритроцитов.
Противопоказаниями к введению больших объемов взве-
си отмытых эритроцитов в модежеле-глюкофосфате являют-
ся отек легкого, мозга, почечная недостаточность. При тран-
сфузиях взвеси отмытых эритроцитов в модежеле-глюко-
фосфате могут наблюдаться посттрансфузионные темпера-
турные реакции, обусловленные наличием в среде остаточ-
ных лейкоцитов.
Способ применения и дозы. Взвесь отмытых эритроцитов в
модежеле-глюкофосфате вводят внутривенно (капельно или
струйно):
• больным с анемиями по 1 —2 дозе однократно до получе-
ния клинического эффекта;
• при кровопотере — не более 2 л в сутки.
Форма выпуска и условия хранения. Выпускают модежель-
глюкофосфат в стеклянных бутылках по 200 или 450 мл. Хранят
при температуре +4... +25 °C. Срок годности 3 года.
В Госреестре препарат не зарегистрирован.
Растворы декстрана
Декстран — полисахарид, построенный из остатков глюко-
зы, получаемой из культур бактерий-продуцентов.
145
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Известны декстраны со средней молекулярной массой
60 000—70 000 Дальтон, которые нормализуют главным обра-
зом показатели макроциркуляции, и декстраны с низкой моле-
кулярной массой 40 000 Дальтон, которые могут влиять на ми-
кроциркуляцию.
• Растворы декстрана занимают первое место среди синте-
тических коллоидов по отрицательному воздействию на систему
свертывания крови, причем это действие прямо пропорционально
молекулярной массе и дозе декстрана [Mutschler Т., 1996].
• Декстран снижает способность тромбоцитов к адгезии на
сосудистой стенке и тенденцию тромбоцитов к агрегации и раз-
рушению. Снижается активность факторов II, V, VIII.
• При ограниченном диурезе быстрое выделение почками фрак-
ции декстрана-40 вызывает значительное повышение вязкости
мочи, в результате чего гломерулярная фильтрация резко падает,
вплоть до анурии.
• Высока вероятность возникновения анафилактоидных ре-
акций (0,032 %), связанных с конфликтом антиген-антитело. Для
профилактики анафилактоидных реакций у реципиентов влива-
нию основной дозы препарата должно предшествовать введение габ-
тена — декстрана с молекулярной массой 1000Далыпон, который
выпускает Fnesenius КаЫ под названием моновалентный декстран-
1 Фрезениус.
Полиглюкин
Полиглюкин — 6 %-ный раствор декстрана со средней мо-
лекулярной массой 60 000Дальтон в изотоническом растворе хло-
рида натрия. Теоретическая осмолярность — 308 мосм/л, pH —
4,0—6,5. Объемный эффект — 120 %, длительность объемного
действия — 4—6 ч. Основной путь выведения — с мочой (в тече-
ние суток из организма выводится 50 % препарата).
Показания к применению. Профилактика и лечение шока
(травматического, геморрагического, ожогового).
Противопоказания:.
• черепно-мозговая травма с повышением внутричереп-
ного давления;
• гиперволемия;
• сердечная недостаточность;
• заболевания почек с анурией;
146
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ____________
• отек легких;
• геморрагические диатезы;
• продолжающееся кровотечение.
Значительное повышение АД может спровоцировать усиле-
ние кровотечения, а обволакивающее действие декстрана на
тромбоциты провоцирует кровотечение при суточной дозе по-
лиглюкина 1,5—2,0 л.
Способ применения и дозы. Перед инфузией полиглюкина
обязательно проведение биологической пробы.
Дозы и скорость введения препарата устанавливаются в за-
висимости от состояния больного:
• При развивающемся шоке доза вводимого препарата мо-
жет составлять 400—1200 мл для взрослого и 10—25 мл/кг массы
тела—для ребенка. Первые 400 мл вводят струйно, после подъе-
ма АД и улучшения состояния больного переходят на капельное
введение. При кровопотере 500—750 мл крови у взрослого инфу-
зии полиглюкина целесообразно сочетать с переливаниями ком-
понентов крови.
• При операциях в целях профилактики операционного
шока вливание полиглюкина следует проводить капельно с пе-
реходом на струйное при падении артериального давления. Воз-
можен внутриартериальный метод введения.
• При лечении ожогового шока количество препарата и
скорость его введения зависят от общего состояния пострадав-
шего. При обширных ожогах следует сочетать с введением плаз-
мы, альбумина, иммуноглобулина, растворов электролитов,
энергетических субстратов, эритроцитной массы.
Форма выпуска и условия хранения. Полиглюкин выпускает-
ся в стандартных стеклянных флаконах по 100,200 и 400 мл. Пре-
парат следует хранить в сухом месте при температуре от +10 до
+20 °C. Срок годности 5 лет со дня изготовления.
Полифер
Полифер — 6 %-ный раствор среднемолекулярного декстра-
на (полиглюкин), содержащий 0,015—0,020 % связанного железа.
По гемодинамическому действию не отличается от полиглюкина.
Показания к применению те же, что и у полиглюкина. Наи-
более целесообразным является использование полифера при
оперативных вмешательствах у больных с исходной анемией, об-
147
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
условленной опухолевыми и длительно текущими гнойно-де-
структивными процессами и ожогами.
Противопоказания такие же, как и у полиглюкина.
Дозы и методы введения такие же, как и у полиглюкина.
Обязательно проведение биологической пробы.
Форма выпуска и условия хранения. Полифер выпускают во
флаконах по 100,200 и 400 мл. Хранят в сухом месте при темпе-
ратуре от +10 до +25 °C.
Аналоги полиглюкина:
Лонгастерил 70 (Fresenius Kabi) — декстран с молекулярной
массой 70 000 Дальтон. В РФ не зарегистрирован.
Макродекс 6 %-ный (Knoll A.G.)—декстран-60 (молекуляр-
ная масса 60 000 Дальтон) в изотоническом растворе хлористо-
го натрия. В РФ не зарегистрирован.
Показания и противопоказания, дозы и методы введения в
основном такие же, как и у полиглюкина.
Реополиглюкин
Реополиглюкин — 10 %-ный раствор декстрана с молекуляр-
ной массой от 30 до 40 000 Дальтон в изотоническом растворе хло-
рида натрия. Производится форма с 5 %-ным раствором глюко-
зы. Теоретическая осмолярность — 308 мосм/л, pH — 4,0—6,5. Во-
лемический эффект — 140 %, длительность волемического дей-
ствия — 3—4 ч. Содержит ионы натрия (154 ммоль/л) и хлора
(154 ммоль/л). Довольно быстро выводится из организма, в ос-
новном почками, в первые сутки — около 80 % препарата.
Препарат обладает антиагрегантным, гемодинамиче-
ским, дезинтоксикационным действием. Основной особен-
ностью фармакологического эффекта препарата является его
выраженная способность улучшать реологические свойства
крови и восстанавливать микроциркуляцию. Препарат уме-
ньшает вязкость крови и повышает ее суспензионную устой-
чивость, предотвращает или снижает агрегацию форменных
элементов крови, что способствует восстановлению кровото-
ка в мелких капиллярах.
Показания к применению:
• Профилактика и лечение микроциркуляторных наруше-
ний при травматическом, операционном и ожоговом шоках, при
сосудистых и пластических операциях, трансплантации органов
148
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
и тканей, при заболеваниях сетчатки и зрительного нерва, воспа-
лительных процессах роговицы и сосудистой оболочки глаза.
• Добавление к перфузионной жидкости в аппаратах искус-
ственного кровообращения при операциях на сердце. Кровеза-
менитель уменьшает разрушение эритроцитов и тромбоцитов,
в результате чего уменьшается гемолиз, снижается угроза послео-
перационной олигоанурии.
Противопоказания;
• почечная недостаточность;
• тяжелая застойная сердечная недостаточность;
• заболевания легких (бронхиальная астма, хроническая
пневмония);
• непереносимость лекарственных средств (сывороток, вак-
цин), внутривенных вливаний белковых препаратов и препара-
тов декстрана;
• гипергидратация;
• тяжелая дегидратация.
У больных с перечисленными клиническими состояниями
весьма велика возможность возникновения анафилактическо-
го шока (группа риска).
Способ применения и дозы. Для выявления пациентов груп-
пы риска перед переливанием реополиглюкина рекомендуется
проведение кожной пробы. Обязательно проведение биологиче-
ской пробы.
Реополиглюкин вводят внутривенно струйно, струйно-ка-
пельно, капельно. Дозы и скорость введения препарата следует
выбирать индивидуально в соответствии с показаниями и состоя-
нием больного.
1. При нарушениях капиллярного кровотока (различные
формы шока) реополиглюкин вводят внутривенно капельно
или струйно-капельно в дозе от 400 до 1200 мл до стабилизации
гемодинамических показателей. При необходимости количе-
ство препарата может быть увеличено до 1600 мл. У детей при раз-
личных формах шока реополиглюкин вводят из расчета
5—10 мл/кг массы тела, при необходимости доза может быть
Увеличена до 15 мл/кг.
2. При сердечно-сосудистых и пластических операциях рео-
полиглюкин вводят внутривенно капельно:
149
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• перед операцией в течение 30—60 минут взрослым и детям
в дозе 10 мл/кг;
• во время операции 400 мл взрослым и 15 мл/кг детям;
• после операции в течение 5—6 дней взрослым в дозе
10 мл/кг на однократное введение, детям в зависимости от воз-
раста 10 мл/кг или 5—7 мл/кг в течение 60 минут 1 раз, реже —
2 раза в сутки.
3. При операциях с искусственным кровообращением добав-
ляют к крови из расчета 10—20 мл/кг массы тела больного для за-
полнения насоса оксигенатора. Концентрация реополиглюки-
на в перфузионном растворе не должна превышать 3 %. Для
восполнения и поддержания водно-электролитного баланса
совместно с реополиглюкином целесообразно вводить кристал-
лоидные растворы. В офтальмологической практике реополиглю-
кин применяют путем электрофореза. Расход препарата на од-
ну процедуру составляет 10 мл. Процедуру проводят общепри-
нятым способом 1 раз в день. Курс лечения состоит из 5—10 про-
цедур.
Форма выпуска и условия хранения. Реоплиглюкин выпуска-
ют в стеклянных бутылках по 100,200 и 400 мл или по 250 и 500 мл
в емкостях из полиэтилена. Хранят в сухом месте при темпера-
туре +10...+25 °C.
Реомакродекс
Реомакродекс (Eczacibasi, Турция) — физиологический раствор
с 10 %-ным содержанием декстрана 40 000 Дальтон, аналог реопо-
лиглюкина по своему составу и гемодинамическому действию.
Показания к применению аналогичны показаниям к приме-
нению реополиглюкина.
Противопоказания и меры предострожности. Противопо-
казания аналогичны таковым у реополиглюкина, а также при вы-
раженной тромбоцитопении.
При использовании препарата всегда следует помнить о
возможности перегрузки сосудистой системы. Для поддер-
жания нормального водного и электролитного баланса с
реомакродексом следует применять кристаллоидные вод-
ные растворы. У больных с обезвоживанием организма ко-
личество вводимого реомакродекса не должно превышать
500 мл в течение 60 минут.
150
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
Дозы и методы введения. При переливании реомакродекса
обязательно проведение биологической пробы. Реомакродекс
применяется:
• при состояниях, сопровождающихся выраженной интра-
васкулярной агрегацией, доза для первоначальной внутривенной
инфузии составляет 500—1000 мл (500 мл в течение 30 минут).
В последующие двое суток доза обычно составляет 1000—2000 мл
в сутки. В последующие трое суток следует использовать лишь
половину указанных доз;
• при сосудистой хирургии непосредственно перед опера-
цией следует внутривенно ввести 500 мл препарата, во время
операции еще 500 мл, в послеоперационном периоде доза соста-
вляет 500 мл в сутки в течение трех суток;
• при операциях с использованием аппарата искусственно-
го кровообращения к перфузионному раствору реомакродекс
добавляют из расчета около 20 мл/кг массы тела больного;
• перед аортографией реомакродекс вводится внутривенно
из расчета 10—15 мл/кг массы тела в течение 30 минут.
Форма выпуска и условия хранения. Реомакродес выпускает-
ся во флаконах по 500 мл. Хранят при постоянной температуре,
йе превышающей 25 °C. При транспортировке оберегают от хо-
лода. При появлении хлопьев реомакродекс следует нагреть в те-
чение короткого времени при температуре 100 °C или в автокла-
ве при 110 °C.
Реоглюман
Реоглюман — 10 %-ный раствор реополиглюкина с добав-
лением 5 % маннита и 0,9 % натрия хлорида. Обладает гемоди-
намическим, реологическим и диуретическим действиями. Вы-
водится в основном через почки, в первые сутки — до 70 %.
Показания к применению. Реоглюман применяют для
улучшения капиллярного кровотока, мобилизации жидкости
из интерстициального и клеточного пространства, выведе-
ния через почки метаболических продуктов. Его использо-
вание показано:
• при нарушении капиллярного кровотока при травмати-
ческом, операционном, кардиогенном и ожоговом шоках;
• нарушениях венозного и артериального кровообращениях
(тромбозы, тромбофлебиты, эндартериигы, болезнь Рейно);
151
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• в сосудистой и пластической хирургии для улучшения
местной циркуляции и уменьшения тенденции к тромбозам в
трансплантате;
• у больных с почечной и почечно-печеночной недоста-
точностью с сохраненной фильтрационной функцией;
• при посттрансфузионных осложнениях;
• при ожогах, перитонитах, панкреатите, постгрансфузион-
ных осложнениях, вызванных вливанием несовместимой крови,
для проведения дезинтоксикации.
Противопоказания и возможные побочные явления и осложне-
ния. Применение реоглюмана противопоказано при:
• чрезмерной гемодилюции (гематокрит ниже 25%);
• геморрагических диатезах (тромбоцитопения);
• недостаточности кровообращения с резко выраженной
аносаркой;
• недостаточности почек, сопровождающейся анурией;
• значительной дегидратации больного;
• тяжелых аллергических состояниях неясной этиологии.
Не исключено появление аллергических реакций (уртикар-
ные высыпания, кожный зуд, отек типа Квинке и т. п.), учаще-
ние пульса и снижение артериального давления. В этих случаях
вливание реоглюмана должно быть прекращено. Больному сроч-
но должны быть введены антигистаминные средства, сердечные,
сосудистые и кортикостероидные препараты.
Способ применения и дозы. Реоглюман вводят внутри-
венно, капельно со скоростью 40 капель в минуту после
проведения биологической пробы. Струйное введение мо-
жет привести к гиперволемии за счет осмотического дей-
ствия препарата. Дозы и скорость введения следует выби-
рать в соответствии с показаниями, оценкой состояния
больного и его почасового и суточного диуреза. Для под-
держания жидкостного и электролитного баланса вместе
с реоглюманом целесообразно вводить растворы, содержа-
щие калий и натрий.
Дозы введения:
• при шоке — 0,4—0,8 л;
• после операций на магистральных сосудах — по 0,4—0,7 л
в течение 5—6 суток;
152
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
• при острой почечной недостаточности с сохраненной
фильтрацией — 0,4-0,8 л однократно.
Форма выпуска и условия хранения. Выпускается в бутылках
по 100,200 и 400 мл. Хранится при температуре +10... +25 °C, срок
годности указывается на этикетке препарата.
Растворы полиэтиленгликоля
Полиоксидин
Полиоксидин — 1,5 %-ный раствор полиэтиленгликоля
(средняя молекулярная масса 20 000 Дальтон) в 0,9 %-ном раство-
ре натрия хлорида. Теоретическая осмолярность 315 мосм/л,
pH 7,35—7,45. Обладает противошоковым действием. При мас-
сивной кровопотере и пролонгированной гипотензии введение
полиоксидина в объеме потерянной крови сопровождается стой-
ким восстановлением гемодинамики, нормализацией реологи-
ческих свойств и кислотно-основного состояния крови, капил-
лярного кровотока.
Основной путь выведения — через почки. Период полувы-
ведения из сосудистого русла равен 8 ч. 90 % препарата выводит-
ся в течение 7 суток.
Показания к применению. Препарат показан для лечения и
профилактики гиповолемии и шока различного генеза.
Противопоказания. Применение препарата противопока-
зано при лечении больных с черепно-мозговой травмой, проте-
кающей с повышением внутричерепного давления и при забо-
леваниях, при которых противопоказано внутривенное введение
больших доз жидкости.
Взаимодействие с другими лекарственными препаратами не-
известно.
Способ применения и дозы. При использовании полиоксиди-
на проведение биологической пробы обязательно. Препарат
вводится внутривенно струйно или капельно. Доза и скорость
введения выбираются в зависимости от показаний и состояния
больного.
1. Лечение шока. Препарат вводят струйно до подъема АД на
физиологический уровень, после чего переходят на капельное вве-
дение со скоростью 60—80 капель в минуту. Суточная доза — до
20 мл/кг. Максимальная доза — 1200 мл на одно введение.
153
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
2. Профилактика операционного шока. Препарат с началом
операции начинают вводить капельно со скоростью 60—80 капель
в минуту, а при падении АД ниже физиологического уровня пе-
реходят на струйное введение.
Форма выпуска и условия хранения. Полиоксидин выпуска-
ется во флаконах по 200 и 400 мл Хранится при обычных усло-
виях. Допускается замерзание препарата при условии сохране-
ния его герметичности. Срок годности 2 года.
Полиоксифумарин
Полиоксифумарин — коллоидный кровезаменитель гемо-
динамического действия с выраженным антигипоксическим
эффектом. В состав препарата входят полэтиленгликоль-20 000,
фумарат натрия, а также хлориды натрия и магния, йодид калия.
Полиоксифумарин обладает полифункциональными свой-
ствами:
• коллоидная основа обеспечивает стойкую коррекцию ге-
модинамики;
• антигипоксант фумарат натрия нормализует кислотно-ос-
новное состояние организма и энергетический обмен на клеточ-
ном уровне;
• солевой компонент поддерживает стабильность водно-
электролитного баланса;
• при введении полиоксифумарина возникает постинфу-
зионная гемодилюция, в результате которой уменьшается вяз-
кость крови и улучшаются ее реологические свойства;
• ннфузии препарата повышают диурез и способствуют ак-
тивации дезинтоксикационных процессов.
Многократные введения полиоксифумарина не приводят к
накоплению препарата в органах и тканях организма. Антиги-
поксант фумарат натрия полностью метаболизируется.
Показания к применению'.
• гиповолемические и гипоксические состояния различной
этиологии (кровопотеря, шок, травмы, ожоги, интоксикации);
• в качестве компонента перфузионной смеси для заполне-
ния контура АИК.
Противопоказания. Черепно-мозговая травма и все прочие
случаи, где противопоказано введение больших объемов жидко-
сти. Аллергических и других побочных реакций не вызывает.
154
ГЛАВА I. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Способ применения и дозы. Препарат вводят внутривенно в дозе
400—800 мл капельно или струйно, при необходимости до 2 л.
Форма выпуска и условия хранения. Выпускают препарат в бу-
тылках по 200 и 400 мл, с 2002 г. — в полимерной упаковке. Хра-
нят при температуре 0—25 °C в течение 2 лет, допускается замо-
раживание.
Растворы гидроксиэтилкрахмала (ГЭК)
Гидроксиэтилкрахмал (ГЭК) — природный полисахарид,
получаемый из амилопектинового крахмала и состоящий из ос-
татков глюкозы. Исходным сырьем служат натуральные расти-
тельные продукты: картофель, тапиока, зерна различных сортов
кукурузы, пшеницы или риса. Схема получения ГЭК включает
частичный кислотный или ферментативный гидролиз натив-
ного крахмала, имеющего молекулярную массу от 10 до 700 млн
Дальтон, до заданных параметров размера молекул, составляю-
щих 40 000 Дальтон (низкая молекулярная масса), 200 000 Даль-
тон (средняя молекулярная масса), 450 000Дальтон (высокая мо-
лекулярная масса). Далее следует гидроксиэтилирование, т. е.
включение гидроксиэтиловых групп в молекулу вещества с тем,
чтобы получить молекулярное замещение, например 0,5; 0,6
или 0,7. Используемая технология позволяет получить готовые
лекарственные формы 3,6 и 10 %-ные.
Растворы ГЭК разделены на две фармакологические груп-
пы. Препараты ГЭК со средней молекулярной массой
200 000 Дальтон и степенью замещения 0,5 отнесены к группе
Pentastarch (HES 200/0,5), а препараты с высокой молекулярной
массой 450 000 Дальтон и степенью замещения 0,6—0,8 — к фар-
макологической группе Hetastarch (HES 450/0,7).
Фармакологические свойства указанных групп препаратов
существенно различаются. Препараты с высокой молекуляр-
ной массой и степенью замещения 0,7 обладают способностью
более длительно удерживать воду в кровеносном русле, но нега-
тивно влияют на системы свертывания крови и длительно сох-
раняются в тканях и органах в виде баласта. В связи с этим бо-
лее широкое распространение в клинической практике получи-
ли растворы ГЭК с молекулярной массой 200 000 Дальтон и сте-
пенью замещения 0,5 (HES 200/0,5), которые при меньшем вре-
155
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
мени циркуляции в сосудистом русле обладают менее выражен-
ным влиянием на систему гемостаза. К ним относятся препара-
ты хаес-стерил 6 и10 %-ный (Fresenius Kabi, Германия), рефор-
тан (6 %-ный раствор) и рефортан плюс (10 %-ный раствор)
(Berlin-Chemie, Германия), гемохес 6 и 10 %-ный (В. Braun, Гер-
мания) и ГЭК последнего поколения инфукол 6 и 10 %-ный
(Serum-Werk Bemburg A.G., Германия). Препарат стабизол (Ber-
lin-Chemie), относящийся к группе Hetastarch, рекомендуется
применять только в единичных случаях.
Растворы ГЭК обладают низкой частотой побочных реак-
ций. Вероятность анафилактоидных реакций при использовании
растворов ГЭК 200/0,5 в 3 раза ниже, чем при введении желати-
на, в 2,4 раза ниже, чем при введении растворов декстрана,
и в 1,1 раза ниже, чем при введении растворов альбумина.
ГЭК значительно реже, чем другие группы коллоидов, вы-
зывают аллергические реакции. При их применении не зареги-
стрировано повышения уровня гистамина, что возникает при
введении растворов желатина, и отсутствует появление реак-
ции антиген-антитело, что характерно для декстранов. Не ока-
зывают отрицательного воздействия на иммунную систему че-
ловека и животных.
Применяемые в клинической практике по оптимальной
схеме растворы ГЭК (200/0,5) восстанавливают нарушенную
гемодинамику, повышают эффективность работы сердца, улуч-
шают доставку и потребление кислорода тканями. Их использо-
вание для профилактики и лечения шока позволяет предупре-
дить возникновение полиорганной недостаточности и в значи-
тельной мере улучшить результаты лечения при хирургических
вмешательствах, травмах, ожогах и сепсисе.
Использование растворов ГЭК (200/0,5) для острой и тера-
певтической нормоволемической гемодилюции обеспечивает
значительное улучшение реологии крови и оказывает высокую
эффективность при лечении ишемических поражений мозга,
тугоухости, ренопатии, окклюзионных заболеваний перифери-
ческих артерий.
Волекам
Волекам — 6 %-ный раствор оксиэтилированного крахмала с
молекулярной массой 170 000 Дальтон и степенью замещения 0,6
156
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ_____________
(170/0,6). Теоретическая осмолярность—308 мосм/л, pH — 5,0-7,0.
Волемический эффект —100%, длительность волемического дей-
ствия — 3-4 ч. Содержит ионы натрия (154 ммоль/л) и хлора
(154 ммоль/л). Расщепляется амилазой и выводится с мочой.
Показания к применению'.
• профилактика и лечение гиповолемии и шока;
• предоперационная изоволемическая гемодилюция;
• венозный тромбоз.
Противопоказания:
• тяжелая застойная сердечная недостаточность;
• почечная недостаточность;
• склонность к кровоточивости вследствие гипофибрино-
генемии или тромбоцитопении;
• гипергидратация;
• дегидратация;
• травма черепа, сопровождаемая повышением внутриче-
репного давления;
• аллергия к крахмалу.
Препарат может вызывать аллергические реакции.
Дозы и методы введения. При переливании необходимо про-
ведение биологической пробы. При терапии и профилактики ги-
поволемии и шока максимальная суточная доза — до 1500 мл.
Максимальная скорость инфузии: первые 500 мл внутривенно
струйно, далее капельно.
В настоящее время препарат не производится и его включе-
ние в данную работу можно рассматривать только как истори-
ческий аспект.
Инфукол ГЭК 6 %-ный
Инфукол ГЭК 6 %-ный (Serum-Werk Bembuig A.G., Герма-
ния) — 6 %-ный раствор гидроксиэтилкрахмала с молекулярной
массой 200 000 Дальтон и степенью замещения 0,5 (200/0,5).
Относится к фармакологической группе Pentastarch. Технология
его получения позволяет производить оригинальную субстанцию
с максимально узким молекулярно-массовым распределением
и точно заданными молекулярными параметрами, что обеспе-
чивает его высокую терапевтическую и экономическую эффек-
тивность. Теоретическая осмолярность 309 мосм/л, pH 5,0—7,0.
Содержит ионы натрия (154 ммоль/л) и хлора (154 ммоль/л). Во-
157
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
лемическое действие — 85—100 % от введенного объема. Длитель-
ность объемного действия составляет 4—6 ч.
Улучшает реологические свойства крови за счет снижения
показателя гематокрита; уменьшает вязкость плазмы, снижает
агрегацию тромбоцитов и препятствует агрегации эритроцитов.
Инфукол ГЭК депонируется в клетках ретикулоэндотели-
альной системы без проявлений токсического действия на пе-
чень, легкие, селезенку и лимфоузлы.
Под действием амилазы инфукол ГЭК расщепляется до
низкомолекулярных фрагментов (менее 70 000 Дальтон), кото-
рые удаляются почками.
Сходство структуры инфукола со структурой гликогена
объясняет высокий уровень переносимости и практическое от-
сутствие побочных реакций.
Период полувыведения через 12 ч с момента введения пре-
парата составляет 4,94 ч. Показатель клиренса — 7,33 мл/мин.
Максимальная концентрация препарата в сыворотке составля-
ет 11,1 ±2,7 мг/м; на третий день после введения в сыворотке
определяются следовые количества гидроксиэтилкрахмала.
В течение первых 12 ч после начала введения препарата в моче
присутствует 24,48 ± 3,93 г гидроксиэтилкрахмала (49 % от вве-
денного количества).
Показания к применению'.
• Профилактика и лечение гиповолемии и шока в связи с
операциями, острыми кровопотерями, травмами, ожогами и
инфекциями.
• Нарушения микроциркуляции.
• Гемодилюция.
• Препарат разрешен для клинического применения у де-
тей, включая новорожденных.
• При проведении инфузионной терапии у больных сахар-
ным диабетом введение препарата не сопровождается повыше-
нием уровня глюкозы в крови.
Противопоказания:.
• Гипергидратация.
• Гиперволемия.
• Декомпенсированная сердечная недостаточность.
• Почечная недостаточность с олигоурией или анурией.
158
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
• Аллергия на крахмал.
• Кардиогенный отек легких.
• Внутричерепные кровотечения.
• Выраженные нарушения свертываемости крови.
• Первые три месяца беременности.
Слишком быстрое внутривенное введение, как и примене-
ние больших доз, может приводить к нарушениям гемодина-
мики. Изредка может возникать кожный зуд, который вскоре
проходит.
Введение препарата оказывает влияние на результаты опре-
деления активности амилазы сыворотки крови, что не связано
с клиническими проявлениями панкреатита.
При лечении препаратом следует контролировать ионо-
грамму сыворотки и баланс жидкости, обеспечивать достаточ-
ное введение жидкости и контролировать функцию почек: со-
стояния дегидратации требуют предварительной коррекции;
проявлять осторожность при геморрагических диатезах.
Способ применения и дозы
При введении препарата обязательна биологическая проба.
Инфукол ГЭК 6 %-ный вводят внутривенно капельно в соответ-
ствии с потребностью замещения объема циркулирующей жид-
кости в следующих возрастных дозировках (табл. 1.11).
Таблица 1.11
Возрастная группа Среднесуточная доза, мл/кг массы тела Максимальная суточная доза, мл/кг массы тела
Взрослые и дети старше 12 лет 33 33
Детиотбдо 12лет 15-20 33
Дети от 3 до 6 лет 15-20 33
Новорожденные и дети до 3 лет 10-15 33
Суточная доза и скорость внутривенного введения рассчи-
тываются в зависимости от кровопотери и концентрации гемо-
глобина. У молодых больных без риска поражения сердечно-со-
судистой системы и легких контрольным уровнем применения
159
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
коллоидного плазмозамещающего препарата считается гемато-
крит, равный 30 % и менее. Максимальная суточная доза — до
33 мл раствора на 1 кг массы в сутки. Максимальная скорость ин-
фузии зависит от исходных показателей гемодинамики и со-
ставляет примерно 20 мл на 1 кг массы тела в час. Учитывая
возможные анафилактические реакции, первые 10—20 мл пре-
парата следует вводить медленно при тщательном наблюдении
за состоянием больного.
У новорожденных и детей до трех лет рекомендуется
придерживаться среднесуточной дозы препарата при тща-
тельном наблюдении за уровнем гидратации и содержания
электролитов.
Следует учитывать риск перегрузки системы кровообраще-
ния при слишком быстром введении или слишком высокой
дозе препарата.
Инфукол ГЭК не рекомендуется смешивать с другими ле-
карственными средствами в одной емкости и в одной системе.
Формы выпуска и условия хранения. Флаконы по 100, 250 и
500 мл или полимерные мешки по 250 и 500 мл. Хранить при тем-
пературе не выше +25 °C. Срок годности указан на упаковке.
Инфукол ГЭК 10 %-ный
Инфукол ГЭК 10 %-ный (Serum-Werk Bemburg A.G., Гер-
мания) — раствор гидроксиэтилкрахмала с молекулярной мас-
сой 200 000 Дальтон и степенью замещения 0,5, относится к фар-
макологической группе Pentastarch. Теоретическая осмоляр-
ность — 309 мосм/л, pH — 5,0—7,0. Содержит ионы натрия
(154 ммоль/л) и хлора (154 ммоль/л). Волемическое действие —
130—140 % от введенного объема. Длительность волемического
действия — 4—6 ч.
Способ применения и дозы. Инфукол ГЭК 10 %-ный предназ-
начен для внутривенных инфузий. Перед началом инфузии обя-
зательна биологическая проба. Инфукол ГЭК 10 %-ный вводят
капельно в соответствии с потребностью замещения объема
циркулирующей жидкости в следующих возрастных дозировках
(табл. 1.12).
Суточная доза и скорость внутривенного введения рассчи-
тываются в зависимости от кровопотери и концентрации гемо-
глобина. У молодых больных без риска поражения сердечно-со-
160
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Таблица 1.12
Возрастная группа Среднесуточная доза, мл/кг массы тела Максимальная суточная доза, мл/кг массы тела
Взрослые и дети старше 12 лет 20 20
Дети от 6 до 12 лет 10-15 20
Дети от 3 до 6 лет 10-15 20
Новорожденные и дети до 3 лет 8-10 20
судистой системы и легких пределом применения коллоидного
объемзамещающего препарата считается гематокрит, равный
30 % и менее. Максимальная суточная доза — 20 мл/кг в сутки.
Вся остальная информация идентична препарату инфукол
ГЭК 6 %-ный.
Для препаратов инфукол 6 и 10 %-ный разработана базовая
схема инфузионно-трансфузионной терапии операционной кро-
вопотери у детей, взрослых, беременных женщин и рожениц
[Молчанов И.В. с соавт., 1998,1999; ЛекмановА.У. и соавт., 2000].
При операционной кровопотере до 20 % ОЦК не показано ис-
пользование препаратов донорской крови. В течение операции кро-
вопотеря возмещается или инфузией 6 %-ного раствора инфуко-
ла ГЭК или растворов кристаллоидов. В раннем послеоперацион-
ном периоде используются только глюкозосолевые растворы.
При операционной кровопотере до 30 % во время операции
проводится инфузия 6 %-ного раствора инфукола ГЭК в дозе
20—25 мл/кг массы тела, при значительном снижении гематокри-
та (< 27 %) — трансфузия эритроцитной массы в дозах 6—8 мл/кг.
При операциях с кровопотерей до 50 % ОЦК 6 %-ный раствор
инфукола вводится в дозах 25—33 мл/кг, 10 %-ный раствор инфу-
кола в дозе 15—20 мл/кг в зависимости от показателей централь-
ной гемодинамики. Донорские эритроциты в дозе 6—8 мл/кг
назначаются в случае развития перегрузки сердечно-сосудистой
системы или снижения уровня гематокрита (< 27 %).
При операционной кровопотере 75 % ОЦК и более дозы 6 и
10 %-ных растворов инфукола могут достигать соответственно 45
161
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
и 30 мл/кг. Обязательным компонентом терапии являются в этом
случае трансфузии эритроцитной массы (115 мл/кг и более).
В раннем послеоперационном периоде проводятся инфузии кол-
лоидов и эритроцитной массы по показаниям. Трансфузии свеже-
замороженной плазмы и концентрата тромбоцитов необходимо
проводить только в случае значимых нарушений гемокоагуляции,
а раствора альбумина — только в случае гипоальбуминемии.
Формы выпуска и условия хранения. Инфукол ГЭК 10 %-ный
выпускается во флаконах по 100,250 и 500 мл или в полимерных
мешках по 250 и 500 мл. Хранят при температуре не выше +25 “С.
Срок годности указан на упаковке.
Хаес-стерил 6 %-ный
Хаес-стерил 6 %-ный (Fresenius Kabi, Германия) — 6 %-
ный раствор поли (О-2-гидроксиэтил) крахмала 200/0,5 в изо-
тоническом растворе хлорида натрия. Теоретическая осмоляр-
ность — 308 мосм/л, pH — 3,5—6,0. Содержит ионы натрия
(154 ммоль/л) и хлора (154 ммоль/л). Волемический эффект —
100 %, длительность волемического действия — 3—4 ч.
Показания к применению-.
• Профилактика и лечение гиповолемии и шока (табл. 1.14).
• Терапевтическая гемодилюция.
Противопоказания:
• Тяжелая застойная сердечная недостаточность.
• Почечная недостаточность (креатинин более
177 мкмоль/л).
• Тяжелые нарушения коагуляции крови.
• Гипергидратация.
• Тяжелая дегидратация.
• Внутричерепное кровотечение.
• Отек легких.
• Тяжелые хронические заболевания печени.
• Аллергия к крахмалу.
Инфузию хаес-стерила следует обеспечивать достаточным
количеством кристаллоидных растворов.
Данных о применении у детей, беременных и кормящих
матерей нет.
Применение препарата длительное время и в больших до-
зах может вызвать увеличение времени кровотечения.
162
ГПАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ_____________
В редких случаях может вызывать анафилактоидные реак-
ции. Длительное ежедневное применение часто вызывает кож-
ный зуд.
При применении хаес-стерила повышается концентрация
сывороточной амилазы, что может затруднять диагностику пан-
креатита.
При определении группы крови возможна псевдоагглюти-
нация эритроцитов, которая исчезает при добавлении 1 капли
0,95 %-ного раствора натрия хлорида.
Способы применения и дозы. Перед инфузией обязательно
проведение биологической пробы. При терапии и профилакти-
ке гиповолемии и шока максимальная суточная доза хаес-стери-
ла —33 мл/кг массы тела, максимальная скорость внутривенной
инфузии — 20 мл/кг массы в час (табл. 1.13). Степень и продол-
жительность гиповолемии определяют продолжительность и
уровень вливания хаес-стерила 6 %-ного.
При септическом и ожоговом шоке скорость переливания
должна быть меньше.
При хирургических операциях в отсутствие других указаний
для непосредственного предоперационного замещения соб-
ственной крови рекомендуется одновременное введение хаес-сте-
рила 6 %-ного в соотношении 1:1 (до показателя гематокрита
не ниже 30 %).
При терапевтической гемодилюции при отсутствии других
указаний используют следующие суточные дозы:
• 250 мл (низкая доза) за 0,5—2 ч;
• 500 мл (средняя доза) за 4—6 ч;
• 2 раза по 500 мл в сутки (высокая доза) за 8—24 ч.
Критерием выбора программы служит снижение показа-
теля гематокрита, определяемое для каждого больного. Дли-
тельность использования препарата в этом случае рекомендует-
ся до 10 дней.
Взаимодействие с другими лекарственными препаратами не
установлено.
Формы выпуска и условия хранения. Флаконы по 250 мл из пла-
стика и флаконы по 500 мл из стекла и пластика. Хранить при
температуре не выше +25 °C. Не замораживать. Срок годности
5 лет. В настоящее время снят с производства.
163
______________________ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Хаес-стерил 10 %-ный
Хаес-стерил 10 %-ный (Fresenius Kabi, Германия) — 10 %-
ный раствор поли (О-2-гидроксиэтил) крахмала 200/0,5 в изо-
тоническом растворе хлорида натрия. Теоретическая осмоляр-
ность — 308 мосм/л, pH — 3,5—6,0. Волемический эффект —
145 % в течение часа и 100 % в течение 2—3 ч.
Способы применения и дозы
При применении обязательно проведение биологической
пробы. При терапии и профилактике гиповолемии и шока мак-
симальная суточная доза до 20 мл/кг массы тела (1500 мл на
75 кг массы), максимальная скорость внутривенной инфузии —
до 20 мл/кг массы (табл. 1.13). Степень и продолжительность ги-
поволемии определяют продолжительность и уровень влива-
ния хаес-стерила 10 %-ного.
Вся остальная информация о препарате идентична хаес-
стерилу 6 %-ному.
Таблица 1.13. Рекомендуемые дозы хаес-стерила (HAES)
Мониторинг Дозировка
САД/ЦВД/ДЗ ХАЕС-стерил 6 % Суточная доза ХАЕС-стерил 10 % Суточная доза
Ht > 30 %
До 33 мл/кг/сутки (= 2 г/кг/сутки — 2500 мл/75 кг/сугки) Скорость инфузии До 20 мл/кг/сутки (=2 г/кг/сутки = 1500 мл/75 кг/сутки) Скорость инфузии
НЬ>100г/л
Факторы коагуляции Тромбоциты Белок плазмы
0,33 мл/кг/мин = 25 мл/75 кг/мин 0,33 мл/кг/мин = 25 мл/75 кг/мин
Исследование гемодинамических и кардиореспираторных
параметров на фоне гиперволемической гемодилюции 10 %-
ным HAES и 5 %-ным человеческим альбумином показало, что:
1) оба коллоидных раствора вызывают значимое повышение
среднего АД, ударного объема и утилизации кислорода;
164
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
2) степень снижения гемоглобина при гемодилюции обои-
ми растворами сопоставима;
3) 10 %-ный HAES-стерил не вызывал увеличения ЧСС, но
в большей степени, чем 5 %-ный человеческий альбумин, повы-
шал ударный объем и утилизацию кислорода.
Своевременное и обоснованное использование совре-
менных плазмозаменящих препаратов для профилактики и ле-
чения шока позволяет предупредить возникновение полиор-
ганной недостаточности и в значительной мере улучшить
прогноз и исход при хирургических вмешательствах, трав-
мах, ожогах и сепсисе.
Таблица 1.14. Рекомендации для терапии шока (J. Boldt
M.D. University Giessen F.R.G., 1992)
Клиническое состояние Неотложная ПОМОЩЬ
I класс II класс III класс IV класс
Кровопоте- ря менее 750 мл Кровопоте- ря 800— 1500 мл Кровопоте- ря 1500— 2000 мл Кровопоте- ря более 2000 мл Кровопоте- ря более 2000 мл
Ин<] >узионная терапия
0,75 л НАЕС-сге- рилб % или 0,5лНАЕС- стерил 10 % + 0,5 л Рин- гер-лактат 0,75-1,5 л НАЕС-сте- рил6% или 0,5-1,0 л НАЕС-сте- рил 10 % + 1,0 л Рин- гер-лактат 1,5лНАЕС- стерил 6 % или 1,0 л НАЕС- стерил 10 % + 0,5 л Рин- гер-лактат + Эритро- цитная мас- са 1,5 л НАЕС-сте- рилб % или 1,5лНАЕС- стерил 10 % + 0,5 л Рин- гер-лактат + Эритро- цитная мас- са + Свежеза- мороженная плазма + Тромбо- циты > 1,5 л НАЕС-сте- рил 6 % + 0,5 л Рин- гер-лактат
165
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Использование 6 и 10 %-ных растворов ГЭК (НАЕС 200/0,5)
для острой и терапевтической нормоволемической гемодилюции
обеспечивает значительное улучшение реологии крови и пока-
зывает высокую эффективность при лечении ишемических по-
ражений мозга, тугоухости, ретинопатии, окклюзионных забо-
леваний периферических артерий.
Гемохес 6 %-ный
Гемохес 6 %-ный (В. Braun, Термания)—6 %-ный раствор гидрок-
сиэтилкрахмала 200/0,5 в изотоническом растворе хлорида натрия.
Теоретическая осмолярность 310 мосм/л, pH—4,0-7,0. Содержит ио-
ны натрия (154 ммоль/л) и хлора (154 ммоль/л). Волемический
эффект и длительность волемического действия в инструкции не
указаны. Могут соответствовать таковым у других пентакрахма-
лов соответствующей концентрации.
Показания к применению'.
• Профилактика и лечение гиповолемии и шока.
• Профилактика артериальной гипотензии.
• Гемодилюция.
• Экстракорпоральное кровообращение.
Противопоказания'.
• Аллергия к крахмалу.
• Гипергидратация.
• Гиперволемия.
• Тяжелая сердечная недостаточность.
• Почечная недостаточность (креатинин более 180 ммоль/л).
• Тяжелые нарушения свертывающей системы.
• Хронические заболевания печени.
• Геморрагические диатезы.
• Церебральная геморрагия.
• Дегидратация (без введения сбалансированного количе-
ства электролитов).
• Гематокрит менее 25 %, а у пациентов с кардиологически-
ми или пульмонологическими расстройствами менее 30 %.
Безопасность и эффективность введения гемохеса детям
до 12 лет недостаточно изучены. При беременности исполь-
зовать препарат только в крайних ситуациях. Отсутствуют
какие-либо данные по использованию препарата гемохес у
кормящих матерей.
166
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
В редких случаях препарат может вызывать анафилактоид-
ные реакции как в сознании, так и под наркозом. Профилакти-
ческое назначение кортикостероидов неэффективно.
Повторные назначения препарата как в высоких, так и в
средних дозах могут приводить к упорному зуду, не поддающе-
муся терапии.
Использование пентакрахмала гемохес требует постоянно-
го контроля электролитов, параметров коагуляции и сывороточ-
ного альбумина.
Применение препарата на 3—5-е сутки вызывает повыше-
ние сывороточной амилазы, что может затруднять диагностику
панкреатита.
Способы применения и дозы. Перед переливанием обязатель-
но проведение биологической пробы. Гемохес 6 %-ный вводят
внутривенно капельно. При терапии и профилактики гипово-
лемии и шока максимальная суточная доза 33 мл/кг массы
тела (около 2500 мл/сутки при массе тела 75 кг) с максималь-
ной скоростью 33 мл/кг в час. При предоперационной гемо-
делюции суточная доза — не более 20 мл/кг. При терапевтиче-
ской гемодилюции суточная доза препарата — 500 мл в тече-
ние 4—6 ч.
Взаимодействие с другими лекарственными компонентами
не известно.
Формы выпуска и условия хранения
Гемохес 6 %-ный выпускают в полиэтиленовых контейне-
рах по 500 мл. Хранят при комнатной температуре. Не исполь-
зовать после срока годности, указанного на упаковке.
Рефортан
Рефортан (Berlin-Chemie, Германия) — 6 %-ный раствор
гидроксиэтилкрахмала с молекулярной массой 200 000 Даль-
тон и степенью замещения 0,5 (200/0,5). Теоретическая осмо-
лярность — 308 мосм/л, значение pH — 4,0—7,0. Содержит ио-
ны натрия (154 ммоль/л) и хлора (154 ммоль/л). Волемиче-
ский эффект и длительность волемического эффекта в ин-
струкции не указаны. Теоретически могут быть аналогичны
Другим ГЭК 200/0,5 данной концентрации: волемический
эффект — 100 %, длительность волемического эффекта —
3-4 ч.
167
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Показания к применению:
• Восполнение недостающего объема крови в сосудах при
состояниях недостаточного объема циркулирующей крови.
• Профилактика и лечение гиповолемического шока в свя-
зи с ожогами, травмами, операциями.
• Гемодилюция.
Противопоказания:
• Гиперволемия.
• Гипергидратация.
• Тяжелая застойная сердечная недостаточность.
• Почечная недостаточность в сочетании с олигоурией или
анурией (креатинин больше 2,0 мг/дл).
• Геморрагические диатезы.
• Внутричерепное кровотечение.
• Аллергия к крахмалу.
• Отек легких.
• Хронические заболевания печени.
При дегидратации рекомендуется вначале провести замеще-
ние жидкости с помощью кристаллоидных растворов.
О применении у беременных и кормящих, равно как и у де-
тей, данные отсутствуют.
В отдельных случаях возможны анафилактоидные реакции.
При продолжительной высокодозированной терапии возможно
появление кожного зуда.
При введении высоких доз препарата не исключена воз-
можность наступления повышенного кровотечения, обусло-
вленного гемодилюционной коагулопатией и специфическим
действием препарата на первичный и вторичный гемостаз.
Уровень амилазы в сыворотке после вливания препарата
рефортан заметно возрастает, однако через 3—5 дней приходит
в норму. Диагностических или терапевтических мероприятий
не требуются.
Способы применения и дозы. Перед переливанием обязатель-
но проведение биологической пробы.
Суточная доза и скорость внутривенного вливания зависят
от размеров потери крови и значения гематокрита. Продолжи-
тельность и масштабы терапии зависят от продолжительности и
масштабов гиповолемии.
168
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
При замещении объема крови среднесуточная доза составля-
ет, как правило, 250—1000 мл. Лишь в исключительных случаях
допускается превышение значения 20 мл на 1 кг массы тела.
При использовании рефортана в целях гемодилюции су-
точная доза обычно составляет 500 мл. Курсовая доза — не бо-
лее 5000 мл в течение 4 недель.
Скорость инфузии — не менее 30 минут на 500 мл препара-
та. Первые 10—20 мл следует вливать медленно при тщатель-
ном наблюдении за больным, т. к. анафилактоидные реакции
полностью не исключены.
Снижение гемоглобина ниже 100 г/л, гематокрита ниже
27 %, общего белка ниже 50 г/л считаются при использовании
рефортана критическими. В этих случаях показано введение
альбумина и эритроцитов. При потерях крови свыше 20—25 %
циркулирующего объема обязательно введение эритроцитов.
Следует иметь в виду, что рефортан может оказывать влия-
ние на клинико-химические показатели: глюкозу, белок, СОЭ,
жирные кислоты, холестерин, сорбит-дегидрогеназу, удельный
вес мочи, данные электрофореза мочи.
При смешивании с другими лекарственными средствами
следует проявлять осторожность. При одновременном примене-
нии с аминогликозидными антибиотиками рефортан может
инициировать их нефротоксичность.
Формы выпуска и условия хранения. Флаконы по 500 мл хранить
при температуре не выше +25 °C. Срок годности 60 месяцев.
Рефортан плюс
Рефортан плюс (Berlin-Chemie, Германия) — 10 %-ный ра-
створ гидроксиэтилкрахмала 200/0,5 в изотоническом растворе
хлористого натрия. Теоретическая осмолярность — 308 мосм/л,
pH — 4,0—7,0. Содержит ионы натрия (154 ммоль/л) и хлора
(154 ммоль/л). Волемический эффект и длительность его дей-
ствия в инструкции не представлены. Теоретически могут быть
такими же, как и у других ГЭК 200/0,5 в такой же концентрации:
волемическое действие — 130—140 % от введенного объема, дли-
тельность волемического действия — 4—6 ч.
Показания к применению:
• Восполнение недостающего объема крови в сосудах при
состояниях недостаточного объема циркулирующей крови.
169
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• Профилактика и лечение гиповолемического шока в свя-
зи с ожогами, травмами, операциями.
• Гемодилюция.
Противопоказания'.
• Гиперволемия.
• Гипергидратация.
• Тяжелая застойная сердечная недостаточность.
• Почечная недостаточность в сочетании с олигоурией или
анурией (креатинин больше 2,0 мг/дл).
• Геморрагические диатезы.
• Внутричерепное кровотечение.
• Аллергия к крахмалу.
• Отек легких.
• Хронические заболевания печени.
При дегидратации рекомендуется вначале провести замеще-
ние жидкости с помощью кристаллоидных растворов.
О применении у беременных и кормящих, равно как и у де-
тей, данные отсутствуют.
В отдельных случаях возможны анафилактоидные реакции.
При продолжительной высокодозированной терапии возможно
появление кожного зуда.
При введении высоких доз препарата не исключена воз-
можность наступления повышенного кровотечения, обусло-
вленного гемодилюционной коагулопатией и специфическим
действием препарата на первичный и вторичный гемостаз.
Уровень амилазы в сыворотке после вливания препарата
рефортан плюс заметно возрастает, однако через 3—5 дней при-
ходит в норму. Диагностические или терапевтические меропри-
ятия не требуются.
Способы применения и дозы. Перед инфузией обязательно
проведение биологической пробы.
Суточная доза и скорость внутривенного вливания рефор-
тана плюс зависят от размеров потери крови и значения гемато-
крита. Продолжительность и масштабы терапии зависят от про-
должительности и масштабов гиповолемии.
При замещении объема крови среднесуточная доза составля-
ет, как правило, 250—1000 мл. Лишь в исключительных случаях
допускается превышение значения 20 мл на 1 кг массы тела.
170
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
При использовании препарата в целях гемодилюции су-
точная доза обычно составляет 250—500 мл. Курсовая доза не бо-
лее 5000 мл в течение 4 недель.
Скорость инфузии — не менее 30 минут на 500 мл препара-
та. Первые 10—20 мл следует вводить медленно, внимательно на-
блюдая за состоянием пациента, т. к. нельзя полнстью исключить
возможность анафилактоидных реакций.
Снижение гемоглобина ниже 100 г/л, гематокрита ниже
27 %, общего белка ниже 50 г/л считается при использовании ре-
фортана плюс критическим. В этих случаях показано введение
альбумина и эритроцитов. При потерях крови свыше 20—25 %
циркулирующего объема обязательно введение эритроцитов.
Рефортан плюс может оказывать влияние на клинико-хи-
мические показатели: глюкозу, белок, РОЭ, жирные кислоты, хо-
лестерин, сорбит-дегидрогеназу, удельный вес мочи, данные
электрофореза мочи.
При смешивании с другими лекарственными средствами
следует проявлять осторожность. При одновременном примене-
нии с аминогликозидными антибиотиками рефортан плюс мо-
жет инициировать их нефротоксичность.
Формы выпуска и условия хранения. Флаконы по 500 мл.
Хранить при температуре не выше +25 °C. Срок годности 60 ме-
сяцев.
Стабизол
Стабизол (Beriin-Chemie, Германия) — 6 %-ный раствор ги-
дроксиэтилкрахмала с молекулярной массой 450 000 Дальтон и
степенью замещения 0,7 (450/0,7) в изотоническом растворе
хлорида натрия. Теоретическая осмолярность — примерно
300 мосм/л, pH — 4,0—7,0. Содержит ионы натрия (154 ммоль/л)
и хлора (154 ммоль/л). Волемический эффект и длительность во-
лемического действия в инструкции не указаны, однако ГЭК этой
фармакологической группы более длительно удерживаются в
кровеносном русле, чем пентакрахмалы.
Показания к применению:
• Восполнение недостающего объема крови в сосудах при
состояниях недостаточного объема циркулирующей крови.
• Профилактика и лечение гиповолемии и шока.
• Изоволемическая гемодилюция.
171
трансфузиология в Реаниматологии
Противопоказания:
• Гипергидратация.
• Гиперволемия.
• Тяжелая застойная сердечная недостаточность.
• Почечная недостаточность с олигурией или анурией (кре-
атинин более 180 ммоль/л).
• Хронические заболевания печени.
• Отек легких.
• Геморрагические диатезы.
• Дегидратация (без введения сбалансированного количе-
ства электролитов).
• Аллергия к крахмалу.
О применении у детей, беременных и кормящих матерей
данных нет.
В редких случаях препарат может вызывать анафилактоид-
ные реакции.
Длительное ежедневное применение препарата может вы-
зывать трудно поддающийся лечению кожный зуд.
При введении высоких доз препарата не исключена воз-
можность повышения кровоточивости, что может быть свя-
зано с эффектом гемодилюции или специфическим дей-
ствием препарата.
Применение препарата на 3—5-е сутки вызывает повышение
сывороточной амилазы, что затрудняет диагностику панкреатита.
Способы применения и дозы. Перед переливанием обязатель-
но проведение биологической пробы. Стабизод вводят внутри-
венно капельно. Суточная доза и скорость введения раствора рас-
считываются в зависимости от уровня кровопотери или показа-
теля гематокрита. Д лительность и объем лечения определяются
в зависимости от длительности и уровня гиповолемии. При от-
сутствии экстренной ситуации рекомендуемая продолжитель-
ность вливания — 500 мл за 30 минут.
Взаимодействие с другими лекарственными компонентами
неизвестно.
Препарат рекомендуется использовать в единичных случаях.
Формы выпуска и условия хранения. Флаконы по 100, 250,
500 мл. Срок годности 60 мес. Хранить при температуре не вы-
ше 25 °C.
172
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ______________
Волювен
Волювен (Fresenius Kabi) — новый усовершенствованный крах-
мал с улучшенным профилем безопасности. Исходное сырье—крах-
мал кукурузы восковой спелости. Средний молекулярный вес 130 000
Дальтон (ниже почечного порога). Степень замещения 0,4. Характер
замещения 9:1. В технологии производства использованы кислотный
гидролиз и диафильтрация. Волемический эффект —100 %, длитель-
ность волемического эффекта—4—6 ч. По своему волемическому дей-
ствию сравним с препаратом хаес-стерил 6 %-ный (ГЕК200/0,5). По
сравнению с хаес-стерилом, снижено накопление в тканях до 75 %, от-
сутствует аккумуляция в плазме, даже при повторных введенях свы-
ше 10 дней. Снижено влияние на коагуляцию (факторы
VIII, VIII-антиген).
Показания к применению', терапия и профилактика гипово-
лемии.
Противопоказания-.
• гипергидратация, включая отек легких;
• почечная недостаточность с олигурией или анурией;
• гемодиализ;
• внутричерепное кровотечение;
• тяжелая натрийемия и гиперхлоремия;
• гиперчувствительность к крахмалам.
В редких случаях может вызывать анафилактоидные реак-
ции. Во время введения может повышаться уровень амилазы в
крови. При высоких дозах возможны нарушения свертывания
крови. Взаимодействие с другими лекарственными препарата-
ми не зарегистрировано.
Способы применения и дозы аналогичны хаес-стерилу.
Форма упаковки и условия хранения. Волювен выпускается во
флаконах и пластиковых мешках по 250 и 500 мл.
Терапевтическая гемодилюция
На основе использования препарата Инфукол ГЭК Гольди-
ной О.А. и 1орбачевским Ю.В. (1998) разработана схема терапев-
тической гемодилюции (ТГ).
Различают два вида ТГ
• гиперволемическую (при гематокрите менее 40 %) — вве-
дение раствора ГЭК одного или в сочетании с кристаллоидами;
173
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• изоволемическую (при гематокрите более 40 %) — введе-
ние коллоидного раствора сочетается с одновременным забором
крови пациента.
При остром ишемическом церебральном инсульте рекоменду-
ется следующая схема ТГ [Асскали, Фестер, 1998; Koscielny et al.,
1992; Tuma et al., 1989; Попов B.B. и соавт., 2000]:
1. «Загрузочная доза» в зависимости от показателя гематокрита:
• при гематокритном числе менее 40 % (гиперволемическая
ТГ) — 500 мл раствора ГЭК 6 %-ного и 500 мл раствора электро-
литов в течение 1 ч;
• при гематокритном числе более 40 % (изоволемиче-
ская ТГ) — отбор 500 мл крови с одновременным введением
500 мл раствора ГЭК 6 %-ного и 500 мл раствора электролита
в течение 1 ч.
2. ТГ в 1—4-е сутки:
• при гематокрите менее 40 % — 1000 мл раствора ГЭК
6 %-ного и 1000 мл раствора электролита в течение 24 ч;
• при гематокрите более 40 % — отбор 500 мл крови с одно-
временным введением 500 мл раствора ГЭК 6 %-ного и 500 мл
раствора электролита в течение 1 ч.
З. ТГ на 5—10-е сутки: гиперволемическая ТГ — 500 мл
раствора ГЭК 6 %-ного + 500 мл раствора электролита в тече-
ние 12 ч.
Параллельно проводится лекарственная терапия сер-
дечными гликозидами и торможение агрегации тромбоцитов
ацетилсалициловой кислотой. ТГ начинать следует как мож-
но раньше. «Загрузочную дозу» следует вводить сразу после
того, как установлено отсутствие коматозного состояния
или диспноэ.
Дальнейшее лечение строится на индивидуальной основе с
использованием приведенной схемы.
Противопоказанием к проведению ТГпри церебральном ише-
мическом инсульте являются следующие состояния:
• тяжелый геморрагический диатез;
• инфаркт миокарда в течение последних 6 недель;
• стенокардия напряжения ГУФК, все варианты нестабиль-
ной стенокардии;
• недостаточность кровообращения ПБ—III стадии;
174
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ____________
• хроническая почечная недостаточность (креатинин сыво-
ротки не должен повышаться больше 2,0 мг/дл при начальном
значении 1,5 мг/дл);
• значительное повышение внутричерепного давления;
• судорожные припадки в анамнезе;
• повышенная индивидуальная чувствительность к ГЭК;
• профузные кровотечения;
• исходные значения гематокритного числа ниже 35 %;
• плохо коррегируемая гипотензивной терапией артериаль-
ная гипертония (АДс >180 мм рт. ст., АДд >120 мм рт. ст.).
При окклюзионных заболеваниях периферических артерий об-
щая схема ТГ может быть представлена следующим образом
[Асскали, Фестер, 1998; Koscielny et al., 1992; Tuma et al., 1989]:
1. ТГ проводят при содержании креатинина менее 2 мг/дл.
2. При гематокрите 40—42 % вводят 250—500 мл раствора ГЭК.
При гематокрите43—45%—отбирают250мл крови с одновременным
введением в противоположную вену 500мл раствора ГЭК При гема-
токрите более 45 % отбирают250—500мл крови с одновременным вве-
дением в противоположную вену 250—500 мл раствора ГЭК
3. При вязкости плазмы > 1,39 мПа вводят раствор ГЭК 6 %-
ный. При вязкости плазмы < 1,39 мПа вводят раствор ГЭК 10 %-
ный. Дополнительная лекарственная терапия проводится сугу-
бо по индивидуальным показаниям.
Противопоказанием для ТГ при окклюзионных заболева-
ниях периферических артерий служат следующие состояния:
• Тяжелый геморрагический диатез.
• Инфаркт миокарда в течение 6 последних недель.
• Сердечный выброс ниже 30 %, стеноз магистральных со-
судов более 60 %.
• Стенокардия IV стадии.
• Сердечная недостаточность Ш—IV стадии.
• Пороки сердца с выраженными гемодинамическими на-
рушениями.
• Состояние после декомпенсации сердечной деятельности,
синкопы сердечного происхождения.
• Тяжелые аритмии и блокады.
• Частота пульса ниже 50 в минуту или выше 100 ударов в
Минуту покоя.
175
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• Выраженное ухудшение общего состояния.
• Другие тяжелые заболевания, например, заболевания си-
стемы крови, цирроз печени, почечная недостаточность (креа-
тинин выше 2 мг/дл), судорожные припадки центрального про-
исхождения.
• Повышенная индивидуальная чувствительность к ГЭК.
1.6.2. Кровезаменители дезинтоксикационного
действия
Гемодез
Гемодез — 6 %-ный раствор низкомолекулярного поливи-
нилпирролидона (ПВП). Средняя молекулярная масса 12 600 ±
± 2700. Кроме ПВП в состав гемодеза входят ионы:
• натрия — 102 ммоль/л;
• калия — 6 ммоль/л;
• кальция — 4 ммоль/л;
• магния — 0,05 ммоль/л;
• хлора — 113 ммоль/л;
• НСО3 — 3 ммоль/л.
Теоретическая осмолярность — 228 мосм/л, pH — 5,2—7,0.
Основной путь выведения — с мочой. Скорость выведения —
12-24ч.
Механизм дезинтоксикационного действия основан на спо-
собности гемодеза связывать и выводить токсины из организма,
главным образом через почки. Дезинтоксикационный эффект ге-
модеза начинает проявляться вскоре после начала инфузии. Ге-
модез обладает свойством связывать токсины непосредственно
в кровеносном русле и нейтрализовать их, однако не все токси-
ны нейтрализуются в равной степени. Наиболее полно нейтра-
лизуются токсины, циркулирующие в крови при токсических
формах дизентерии, парентеральной диспепсии и салмонеллё-
зных пищевых отравлениях. При ожоговой болезни гемодезом до-
вольно полно связываются токсины, которые вырабатываются в
первые 4—5 дней болезни. Токсины, образующиеся в более поз-
дние сроки, связываются гемодезом значительно слабее.
Токсины, образующиеся при острой лучевой болезни, гемо-
дез не нейтрализует, но способствует интенсивному выведению
их из организма.
176
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Одним из важных свойств гемодеза является его способ-
ность ликвидировать стаз эритроцитов в капиллярах, развиваю-
щийся при интоксикации различного происхождения. Стаз эри-
троцитов в капиллярах развивается в той или иной степени при
всех интоксикациях. Ликвидация стаза под влиянием гемодеза
приводит к улучшению гемостаза, а высокая коллоидно-осмо-
тическая активность препарата вызывает переход межклеточной
жидкости в сосудистое русло.
Гемодез обладает способностью к восполнению ОЦК. Волеми-
ческий эффект — 30 % от первоначально введенного препарата.
Показания к применению:
• Токсические формы желудочно-кишечных заболеваний
(дизентерия, диспепсия, сальмонеллёзы и др.). Для снятия ин-
токсикации достаточно (чаще всего) однократного вливания
препарата.
• Интоксикация различного происхождения (сепсис, пери-
тонит и др.).
• Ожоговая болезнь в стадии интоксикации (2—5-й дни бо-
лезни). Для снятия явлений интоксикации показаны одно- или
двукратные вливания.
• Острая лучевая болезнь в фазе интоксикации (1—3-й дни
болезни). Вливания производят раз или два в сутки.
• Гемолитическая болезнь новорожденных.
• Следует помнить, что в большинстве случаев гемодез не
служит средством лечения заболевания, а лишь облегчает тече-
ние болезни, ликвидируя тяжелые явления интоксикации.
Противопоказания:
• Выраженная сердечно-легочная недостаточность.
• Тяжелые аллергии.
• Кровоизлияния в мозг.
Гемодез следует с осторожностью назначать пациентам с
легочной патологией, неустойчивой гемодинамикой, острой
почечной недостаточностью.
Быстрое введение гемодеза может приводить к снижению ар-
териального давления, тахикардии, отеку легких, боли за груди-
ной, ощущению нехватки дыхания, гиперемии кожи.
Способы применения и дозы. Гемодез вводят внутривенно со
скоростью 40—50 капель в минуту. Разовая доза — не более 5 мл/кг
177
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
массы тела. Для взрослых это 400 мл, детям 10—15 лет — 200 мл,
детям 5—10 лет — 150 мл, детям 2—5 лет — 100 мл, грудным де-
тям — 5—10 мл/кг, максимальная доза для них — 50 мл.
У взрослых дезинтоксикационный эффект проявляется уже
при дозах 100 мл. Суточную дозу чаще вводят в два приема с про-
межутком в 12 ч.
Повторное назначение препарата проводится в зави-
симости от состояния больного. Повторные инфузии тре-
буются при таких состояниях, как лейкозы, лучевая бо-
лезнь, гемолитическая болезнь новорожденных. При мно-
гократных введениях суммарная доза должна составлять не
более 1000 мл.
Форма выпуска и условия хранения. Стеклянные флаконы по
100,200 и 400 мл. Гемодез хранят при температуре от 0 до +20 °C.
Срок годности до 5 лет.
Неогемодез
Неогемодез — 6 %-ный раствор низкомолекулярного поли-
винилпирролидона со средней молекулярной массой 8000 Даль-
тон. В состав неогемодеза входят ионы:
• натрия — 102 ммоль/л;
• калия — 6 ммоль/л;
• кальция — 4 ммоль/л;
• магния — 0,05 ммоль/л;
• хлора — 113 ммоль/л;
• НСО3 — 3 ммоль/л.
Теоретическая осмолярность — 228 мосм/л, pH в ин-
струкции не указан. Основной путь выведения — с мочой.
Скорость выведения — 13 ч. За счет более быстрого выведе-
ния из организма результат действия неогемодеза эффек-
тивнее гемодеза.
Неогемодез связывает токсины, находящиеся в кровеносном
русле, и выводит их из организма главным образом через почки.
Дезинтоксикационный эффект неогемодеза начинает проявлять-
ся вскоре после начала инфузии.
Наряду с дезинтоксикационным действием неогемодез
обладает способностью прекращать стаз эритроцитов в микро-
циркуляторном русле, который обычно наблюдается при ин-
токсикациях.
178
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Неогемодез обладает способностью к восполнению ОЦК.
Показания к применению'.
• Токсические формы желудочно-кишечных заболеваний
(дизентерия, диспепсия, сальмонеллёзы и др.). Для снятия ин-
токсикации достаточно (чаще всего) однократного вливания
препарата.
• Интоксикация различного происхождения (сепсис, пери-
тонит и др.).
• Ожоговая болезнь в стадии интоксикации (2—5-й дни бо-
лезни). Для снятия явлений интоксикации показаны одно- или
двукратные вливания.
• Острая лучевая болезнь в фазе интоксикации (1 —3-й дни
болезни). Вливания производят одно- или двукратно в сутки.
• Гемолитическая болезнь новорожденных.
• Следует помнить, что в большинстве случаев неогемодез
не служит средством лечения заболевания, а лишь облегчает те-
чение болезни, ликвидируя тяжелые явления интоксикации.
Противопоказания:
• Выраженная сердечно-легочная недостаточность.
• Тяжелые аллергии.
• Кровоизлияния в мозг.
Неогемодез следует с осторожностью назначать пациентам
с легочной патологией, неустойчивой гемодинамикой, острой по-
чечной недостаточностью.
Быстрое введение неогемодеза может приводить к сниже-
нию артериального давления, тахикардии, отеку легких, боли за
грудиной, ощущению нехватки дыхания, гиперемии кожи.
Способы применения и дозы. Неогемодез вводят внутривенно
со скоростью 40—50 капель в минуту. Разовая доза — не более
5 мл/кг массы тела. Для взрослых это 400 мл, детям 10—15 лет —
200 мл, детям 5—10 лет — 150 мл, детям 2—5 лет — 100 мл, груд-
ным детям — 5—10 мл/кг, максимальная доза для них 50 мл.
У взрослых дезинтоксикационный эффект проявляется уже
при дозах 100 мл. Суточную дозу чаще вводят в два приема с про-
межутком в 12 ч.
Повторное назначение препарата проводится в зависимо-
сти от состояния больного. Повторные инфузии требуются при
таких состояниях, как лейкозы, лучевая болезнь, гемолитиче-
179
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ская болезнь новорожденных. При многократных введениях
суммарная доза должна составлять не более 1000 мл.
Форма выпуска и условия хранения. Стеклянные флаконы по
100, 200 и 400 мл. Неогемодез хранят при температуре от 0
до +20 °0С. Срок годности до 5 лет.
Глюконеодез
Глюконеодез — 6 %-ный раствор низкомолекулярного по-
ливинилпирролидона с молекулярной массой 8000 ± 2000 Даль-
тон в 5 %-ном растворе глюкозы.
Глюкоза призвана усиливать реологические и дезинтокси-
кационное действия и служить дополнительным источником
энергии.
Скорость выведения препарата 3—12 ч.
Показания к применению аналогичны показаниям для гемо-
деза и неогемодеза.
Противопоказания'.
• выраженная сердечно-легочная недостаточность;
• тяжелые аллергии;
• кровоизлияния в мозг;
• флеботромбоз и тромбоэмболия;
• сахарный диабет;
• гипергидратация.
Глюконеодез следует с осторожностью назначать пациентам
с легочной патологией, неустойчивой гемодинамикой, острой по-
чечной недостаточностью.
Быстрое введение глюконеодеза может приводить к сниже-
нию артериального давления, тахикардии, отеку легких, боли за
грудиной, ощущению нехватки дыхания, гиперемии кожи.
Способы применения и дозы. Глюконеодез вводят внутривен-
но со скоростью 20—40 капель в минуту. Разовая доза — не бо-
лее 5 мл на 1 кг массы тела. Для взрослых это 400 мл, детям
10—15 лет — 200 мл, детям 5—10 лет — 150 мл, детям 2—5 лет —
100 мл, грудным детям — 50—70 мл.
Дезинтоксикационный эффект препарата начинает про-
являться в течение первого часа после его введения. Суточную
дозу чаще вводят в два приема с промежутком в 12 ч.
Повторное назначение препарата проводится в зависимо-
сти от состояния больного. Повторные инфузии требуются при
180
ГЛАВА 1- ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ____________
таких состояниях, как лейкозы, лучевая болезнь, гемолитическая
болезнь новорожденных. При многократных введениях сум-
марная доза должна составлять не более 1000 мл.
форма выпуска и условия хранения. Стеклянные флаконы по 50,
100,200 и400 мл. Глюконеодез хранят при температуре от Одо +20 °C.
Полидез
Полидез — 3 %-ный раствор поливинилового спирта с мо-
лекулярной массой 10 000 ±2000 Дальтон в изотоническом ра-
створе хлорида натрия. Содержит ионы натрия (154 ммоль/л) и
хлора (154 ммоль/л). Теоретическая осмолярность — 308 мосм/л,
pH — 5,2—5,8. Около 80 % препарата выводится с мочой. Ско-
рость выведения — 24 ч.
По характеру действия препарат близок к гемодезу. Облада-
ет высокой способностью адсорбировать токсины, что позволя-
ет применять его в качестве дезинтоксикационного средства.
Показания к применению:
• Токсические формы желудочно-кишечных заболеваний
(дизентерия, диспепсия, сальмонеллёзы и др.). Для снятия ин-
токсикации достаточно (чаще всего) однократного вливания
препарата.
• Интоксикация различного происхождения (сепсис, пери-
тонит и др.).
• Ожоговая болезнь в стадии интоксикации (2—5-й дни бо-
лезни). Для снятия явлений интоксикации показаны одно- или
двукратные вливания.
• Острая лучевая болезнь в фазе интоксикации (1—3-й дни
болезни). Вливания производят один или два раза в сутки.
• Гемолитическая болезнь новорожденных.
Следует помнить, что в большинстве случаев неогемодез
не служит средством лечения заболевания, а лишь облегчает те-
чение болезни, ликвидируя тяжелые явления интоксикации.
Противопоказания:
• Выраженная сердечно-легочная недостаточность.
• Тяжелые аллергии.
• Кровоизлияния в мозг.
Полидез следует с осторожностью назначать пациентам с ле-
гочной патологией, неустойчивой гемодинамикой, острой по-
чечной недостаточностью.
181
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Способы применения и дозы. Полидез вводят внутривенно со
скоростью 20—40 капель в минуту. Разовая доза—не более 5 мл/кг
массы тела. Для взрослых это 250—500 мл, для детей — 5—8 мл/кг
массы тела.
У взрослых дезинтоксикационный эффект проявляется уже
при дозах 100 мл. Суточную дозу чаще вводят в два приема с про-
межутком в 12 ч.
Повторное назначение препарата проводится в зависимо-
сти от состояния больного. При многократных введениях сум-
марная доза должна составлять не более 1000 мл.
Форма выпуска и условия хранения. Стеклянные флаконы по
250 и 500 мл. Полидез хранят при комнатной температуре.
Препараты комплексного действия
Липоферол
Липоферол — липосомальный препарат с DL-альфа-токо-
феролом для внутривенного введения. В состав препарата вхо-
дят фосфолипиды сои, DL-альфа-токоферол, D сорбит-фос-
фатный буфер. Обладает антиоксидантным и мембраностабили-
зирующим действием. Антиоксидантное действие обусловлено
наличием в составе альфа-токоферола и проявляется в преду-
преждении развития перекисного окисления липидов, инакти-
вации свободнорадикального окисления, увеличения доставки
кислорода к органам и тканям. Мембраностабилизирующее
действие липоферола обусловлено наличием в его составе фос-
фолипидов, которые способствуют предупреждению развития
нарушений и ускорению восстановления нарушенных структу-
ры и функции клеточных мембран и органелл, обеспечивая ге-
патопротекторное действие. Способствует также стабилизации
мембран эритроцитов и уменьшению агрегационных свойств
тромбоцитов, тем самым улучшая реологию крови.
Липерферол безвреден, нетоксичен, не вызывает аллерги-
ческих реакций, не накапливается в организме вследствие пол-
ного метаболизма.
Показания к применению- самостоятельно и в схемах ком-
плексной терапии при ожоговом шоке, шокогенной травме,
токсемиях различного происхождения, токсических и инфек-
ционных гепатитах.
Противопоказания и побочные действия не выявлены.
182
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Способ применения и дозы. Препарат вводят внутривенно ка-
пельно со скоростью 40—60 капель в минуту (120—180 мл/ч).
Рекомендуемая суточная доза 6—10 мл/кг массы тела больного.
Курс лечения липоферолом определяется состоянием больного.
Форма выпуска и условия хранения. Выпукается в бутылках по
200 и 400 мл. Хранят при температуре +4... +8 °C. Заморажива-
ние не допускается. Срок годности 2 года.
1.6.3. Синтетические переносчики кислорода
Переносчики кислорода
Одна из основных, важнейших функций крови — транс-
порт кислорода и обеспечение им всех жизненно важных си-
стем организма, включая его доставку к органам и тканям, с
одновременным выводом двуокиси углерода. Нарушение
нормального дыхания и кровообращения приводит к гипо-
ксии и, как следствие, к обширному поражению тканей. Пе-
реливание гомологичной крови помогает успешно поддержи-
вать транспорт кислорода. Но наличие таких побочных эф-
фектов, как реакции и осложнения гемотрансфузий, имму-
носупрессия и гемотрансмиссивные инфекции, определило
направление поиска искусственных заменителей транспор-
та кислорода — модифицированные растворы гемоглобина и
Перфторуглеродные эмульсии (табл. 1.15). Современные пре-
параты модифицированного раствора гемоглобина и перфто-
руглеродные эмульсии не обладают выраженной токсично-
стью и антигенностью, имеют свойство поддерживать доста-
точный уровень доставки кислорода к тканям, вязкость, он-
котические, осмотические и реологические свойства, ана-
логичные свойствам крови. Оба вида растворов имеют корот-
кий период полураспада в организме и обладают свойствами
на определенное время выполнять функцию эритроцитов —
обеспечивать ткани кислородом.
Модифицированные гемоглобины производят из высоко-
очищенного гемоглобина человека (или крупного рогатого ско-
та), химически или методами генной инженерии видоизменен-
ного — рекомбинантного модифицированного гемоглобина.
Молекулы гемоглобина могут быть инкапсулированы в липосо-
мы совместно с другими молекулами.
183
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Перфторуглероды — биохимически инертные, густые жид-
кости, обладающие высокой способностью растворять газы
(пропорционально парциальному давлению) и выполняющие
функцию переноса и доставки кислорода без его химического
связывания. Данные растворы применяются в форме эмульсий.
Первое поколение перфторуглеродов (флуозол) оказалось неста-
бильным, неудобным в применении и вызыващим реакции,
связанные с активацией комплемента составом эмульгатора.
Эмульсии второго поколения (перфторан) более концентриро-
ваны (90 % вес/объем), стабильны и при соблюдении правил при-
менения не оказывают отрицательного влияния на организм.
Они изготавливаются при помощи линейных перфторуглеродов
и специальных эмульгаторов.
Таблица 1.15. Переносчики кислорода
Перфторуглероды Модифицированные гемоглобины
Перфторан (Россия) Разрабатывается из высокоочи- щенного гемоглобина человека или крупного рогатого скота
Флуазол (Япония)
Фторосан (Россия)
Эмульсия № 2 (Китай)
Оксифлуор Разрабатывается из рекомби- нантного модифицированного гемоглобина
Оксигент
Модифицированные гемоглобины и перфторуглероды при-
меняются в клинике при геморрагическом шоке, периопера-
ционной гемодилюции, инсульте, хронической анемии, ин-
фаркте миокарда, пластических операциях на коронарных сосу-
дах, а также при заготовке и хранении органов перед транс-
плантацией.
Несмотря на ряд преимуществ, которыми обладают ис-
кусственные переносчики кислорода по сравнению с донорски-
ми эритроцитами, определять показания к данным растворам
следует с определенной осторожностью. Катаболизм модифици-
184
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ____________
рованных растворов гемоглобина все еще остается малоизучен-
ным, при этом нельзя исключать возможность усиления оки-
слительных реакций с повреждением тканей. В отличие от гемо-
глобинов, перфторуглероды не метаболизируются и лишены
токсичности, но могут акумулироваться в паренхиматозных ор-
ганах. Высок риск насыщения и блокады моноцитарно-макро-
фагальной системы в случае неоднократного использования.
Для обоих видов переносчиков кислорода характерно короткое
время циркуляции в кровеносном русле, в связи с чем наиболее
оптимальным является использование модифицированных гемо-
глобинов и перфторуглеродов в экстремальных ситуациях.
Геленпол
Геленпол — первый отечественный кислородпереносящий
кровезаменитель на основе модифицированного полимеризован-
ного гемоглобина, полученного из эритроцитов донорской крови.
Представляет собой лиофильновысушенное полимерное
производное гемоглобина для внутривенного введения с моле-
кулярным весом 150—200 кДальтон, содержащее поликонденси-
рованный гемоглобин (4 г), глюкозу (3 г), натрия хлорид (0,8 г),
аскорбиновую кислоту (0,1 г).
Обладает полифункциональным действием:
• коррегирует газотранспортную функцию крови;
• восстанавливает гемодинамику;
• стимулирует гемопоэз.
Переливания геленпола не требуют предварительного опре-
деления группы крови и постановки реакций на совместимость
с кровью реципиента. Способ получения геленпола практически
устраняет опасность заражения реципиентов вирусными ин-
фекциями при введении препарата.
Показания к применению:
• Геморрагический и травматический шок.
• Интраоперационная кровопотеря.
• Анемии различной этиологии.
Противопоказания к применению. Геленпол отличается хоро-
шей переносимостью больными. Нарушений экскреторной
Функции почек в период введения и действия препарата не вы-
явлено. Побочных действий (в том числе при струйных введе-
ниях) не выявлено.
185
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Способ применения и дозы
Перед применением содержимое флакона растворяют в
400 мл изотонического раствора натрия хлорида или 5 %-ном
глюкозы. Вводят внутривенно капельно или струйно в количе-
стве от 400 до 2400 мл в зависимости от клинических показаний.
Условия хранения
Длительность хранения без потери функциональной ак-
тивности 2 года.
Перфторан
Перфторан — субмикронная эмульсия с газотранспортны-
ми функциями, содержащая 10 об% перфторорганических сое-
динений (ПФОС).
Состав:
• перфтордекалин — 13 г;
• перфторметилциклогексилпиперидин — 6,5 г;
• проксанол — 4 г;
• натрия хлорид — 0,6 г;
• магния хлорид — 0,019 г;
• калия хлорид — 0,039 г;
• натрия гидрокарбонат — 0,065 г;
• глюкоза — 0,2 г;
• натрия гидрофосфат — 0,02 г;
• вода для инъекций — до 100 мл.
Теоретическая осмолярность — 280—310 мосм/л, pH —
7,2—7,8, относительная вязкость — 2,5 сП, средний размер ча-
стиц эмульсии — 0,07 мкм.
Перфторан является полифункциональным кровезаменителем,
обладающим газотранспортной функцией за счет высокой спо-
собности ПФОС растворять кислород. Препарат имеет большую по-
верхность газообмена, что обусловливает высокую скорость диф-
фузии кислорода. За счет субмикронных частиц эмульсии обеспе-
чивается хорошее снабжение кислородом участков ткани с обеднен-
ной сосудистой сетью и зон значительной гипертрофии.
Соотношение между диаметром частиц эмульсии перфто-
рана и сечением самых узких капилляров обеспечивает ламинар-
ность потока и низкое сопротивление сосудов. Проксанол, вхо-
дящий в состав препарата, улучшает реологические свойства
крови и положительно влияет на микроциркуляцию в тканях.
186
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ____________
Препарат обладает реологическими, гемодинамическими,
диуретическими, мембраностабилизирующими, кардиопротек-
торными и сорбционными свойствами.
Влияние перфторана на газотранспорт определяется увели-
чением кислородной емкости и динамики газообмена. Кисло-
родная емкость перфторана почти в 3 раза выше, чем у всех тра-
диционных негазотранспортных кровезаменителей и плазмы, но
приблизительно во столько же раз она ниже кислородной емко-
сти цельной крови.
Период полувыведения перфторана из кровотока чело-
века — 24 ч. Проксанол 268 выводится с мочой в течение 1—2 су-
ток. ПФОС выводятся через легкие и кожу, в меньшей степе-
ни — с желчью. Перфторуглероды химически инертны и в ор-
ганизме не метаболизируются. Частицы эмульсии ПФОС вре-
менно аккумулируются в макрофагах печени, селезенки, ко-
стного мозга. Период полувыведения ПФОС из макрофагов со-
ставляет для перфтордекалина 14 дней (полное выведение —
1 месяц), для перфторметилциклогексипипервдина — 90 дней
(полное выведение — 18—24 мес.).
Показания к применению
Перфторан может применяться:
А) внутривенно-.
• при острой и хронической гиповолемии (травматиче-
ский, геморрагический, ожоговый и инфекционно-токсиче-
ский шок);
• при нарушениях микроциркуляции и периферического
кровообращения (изменения тканевого метаболизма и газооб-
мена, черепно-мозговая травма, ишемический отек головного
мозга, нарушения мозгового кровообращения, шоковая почка,
жировая эмболия при множественной травме, облитерирую-
щие заболевания сосудов конечностей);
• для противоишемической защиты донорских органов;
• при проведении операций на остановленном сердце для
заполнения аппарата искусственного кровообращения;
• при проведении глубокой изоволемической гемодилюции;
• при наличии анемической гипоксии, угрожающей жиз-
ни больного, в отсутствие донорской крови и эритроцитных
сред;
187
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Б) местно:
• для лаважа легких, промывания гнойных ран, промыва-
ния брюшной и других полостей, орошения раневой поверх-
ности слизистых и кожи.
Противопоказания:
• анафилактоидная реакция при проведении биологиче-
ской пробы;
• гемофилия;
• беременность;
• неостановленное хирургическими методами маточное
кровотечение в родах.
При применении перфторана возможны аллергические реак-
ции, учащение пульса, снижение артериального давления, повы-
шение температуры, головная боль, боль за грудиной и в пояснич-
ной области, затруднение дыхания, анафилактоидные реакции.
Введение перфторана можно сочетать с трансфузиями аль-
бумина, донорской крови, изотонических солевых растворов,
глюкозы, введением антибиотиков.
Перфторан несовместим с коллоидными кровезаменителя-
ми, которые способствуют резкому укрупнению частиц эмульсии
и изменяют ее биологические и физико-химические свойства.
Способ применения и дозы. При применении перфторана
обязательно проведение биологической пробы. При лечении
острой или хронической гиповолемии перфторан вводят внутри-
венно струйно или капельно в дозе 5—30 мл/кг (взрослым). Ра-
зовая и суммарная дозы препарата зависят от тяжести исходно-
го состояния и возраста больного. Эффект перфторана макси-
мален, если во время и после его инфузии в течение суток боль-
ной дышит смесью, обогащенной кислородом (40—60 %).
Д ля противоишемической защиты донорских органов перф-
торан используют в аппарате искусственного кровообращения
в составе перфузата из расчета 10—40 мл/кг массы тела.
При нарушении микроциркуляции и периферического кро-
вообращения перфторан вводят внутривенно капельно в дозе
4—10 мл/кг. Препарат можно вводить втой же дозе 2—3 раза с ин-
тервалом в 1—4 дня.
Перед забором органов для трансплантации перфторан вво-
дят донору капельно или струйно в дозе 20—30 мл/кг при по-
188
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
стоянной оксигенации препарата карбогеном. Реципиенту перф-
торан вводят за 2 ч до операции в дозе 110—20 мл/кг.
Форма выпуска. Перфторан выпускают во флаконах из сте-
кла по 50,100, 200 и 400 мл.
Срок годности и условия хранения. Перфторан следует хранить
в замороженном состоянии при температуре —18 °C. Разморажи-
вают препарат при комнатной температуре, но не выше +30 °C.
Время размораживания при комнатной температуре флаконов
с перфтораном по 200 мл 1,5—2 ч. После разморозки препарат
необходимо осторожно взболтать до полной однородности со-
става, а перед инфузией — согреть до +21... +23 °C. Допускает-
ся 5-кратное размораживание/замораживание. В разморожен-
ном виде препарат можно хранить в холодильнике при темпера-
туре +4 °C не более 2 недель.
Срок годности препарата при —18 °C до 3 лет.
Запрещается хранить перфторан при температуре ниже
—18 °C и размораживать при температуре выше +30 °C.
Препарат непригоден к использованию в случае:
• расслоения эмульсии;
• помутнения эмульсии до молочного цвета;
• появления белого осадка на дне флакона.
1.6.4. Регуляторы водно-солевого обмена
и кислотно-основного состояния
Жидкостные пространства организма
Общее содержание воды в организме составляет около 60 %,
при этом она распределяется в различных жидкостных про-
странствах. Согласно Херрисон и соавт. 2/3 воды находится во
внутриклеточном и 1/3 во внеклеточном пространствах. По-
следнее разделяется на:
• внутрисосудистое пространство (жидкость, находящаяся
внутри кровеносных сосудов);
• интерстициальное пространство (жидкость, находяща-
яся между клетками) и
• трансклеточное пространство (желудочно-кишечные со-
ки, желчь, спинно-мозговая жидкость, моча в мочевом тракте,
внутриглазная жидкость, перитонеальная, плевральная, перикар-
диальная и синовиальная жидкости).
189
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Минимальный суточный расход воды у взрослых со-
ставляет приблизительно 1700 мл, из которых 840 мл выде-
ляется через кожу и при дыхании, 100 мл — со стулом и
760 мл — с мочой (912 мосм/сутки веществ выводится из ор-
ганизма с мочой при максимально возможной осмолярно-
сти мочи 1200 мосм/л).
Внеклеточное пространство состоит из интерстициаль-
ного и внутрисосудистого секторов. Обычно 75 % внекле-
точной жидкости находится в интерстиции и 25 % — в сосу-
дистом русле. Плазма, интерстициальная и внутриклеточ-
ная жидкости содержат положительно и отрицательно заря-
женные ионы — электролиты, соотношение которых крайне
важно для поддержания физиологического состояния орга-
низма. Имеются значительные различия в электролитном
составе внутриклеточного и внеклеточного жидкостных про-
странств. В клетках преобладает содержание ионов калия, а
во внеклеточном пространстве — ионов натрия и хлора. Для
поддержания электролитного градиента необходимо функци-
онирование натрий-калиевого насоса.
В норме мембрана клетки обладает относительной про-
ницаемостью для ионов электролитов, но она свободно
проницаема для воды. Например, снижение концентра-
ции натрия и осмолярности во внеклеточном простран-
стве после инфузии 5 %-ного раствора глюкозы сопровож-
дается перемещением воды в клетку, что может привести к
уравниванию осмотического давления в этих жидкостных
секторах. И наоборот, увеличение концентрации натрия
и осмолярности во внеклеточном пространстве, напри-
мер, в результате инфузии гипертонического раствора нат-
рия, сопровождается перемещением воды из внутрикле-
точного во внеклеточное пространство. Инфузия изото-
нических растворов электролитов не изменяет осмоляр-
ности внеклеточного пространства и поэтому не приво-
дит к перемещению воды.
Перемещение воды между двумя компонентами внесосуди-
сгого пространства определяется прежде всего разностью кон-
центрации белка. Коллоидно-осмотическое давление является
основным фактором, благодаря которому эндотелий непрони-
190
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
даем для белков плазмы. При нарушениях белкового обмена в
результате осмотического дисбаланса вода переходит из интер-
стициального пространства в кровяное русло. Молекулы кристал-
лоидов не создают градиента давления, поскольку они свобод-
но проходят через мембрану капилляра. В норме 60 % КОД
обеспечивается за счет различных белков (из них 75 % — за счет
альбумина, остальное — за счет глобулинов и фибриногена).
40 % КОД поддерживается за счет концентрации катионов.
Исходя из концентрации общего белка плазмы (ОБ) для расче-
та КОД можно пользоваться следующим уравнением:
КОД = 2,1 ОБ + 0,16 ОБ 2 + 0,09 ОБ 3.
Weil и соавт. обнаружили низкую корреляцию между вычи-
сленными и измеренными значениями КОД плазмы у здоровых
субъектов, а у пациентов, находящихся в критическом состоя-
нии, эта корреляция еще ниже.
Для измерения КОД с одной стороны полупроницаемой
мембраны помещают раствор белка, а с другой — раствор, не со-
держащий белка. Жидкость проходит через мембрану до дости-
жения давления, которое препятствует дальнейшему осмосу.
У нормальных индивидуумов КОД составляет 25 мм рт. ст., в по-
ложении лежа — 22 мм рт. ст., а у пациентов отделения интен-
сивной терапии — от 18 до 20 мм рт. ст.
Инфузия изоонкотических растворов, например, 5 %-ного
раствора альбумина, приводит к увеличению внутрисосудисто-
го пространства без перемещения жидкости между другими про-
странствами. Введение гиперонкотического раствора, напри-
мер, 25 %-ного раствора альбумина, увеличивает ОЦК непропор-
ционально введенному раствору за счет перемещения воды и
электролитов из интерстиция. Однако, если осмолярность вне-
клеточного сектора при этом не изменяется, то вода не покида-
ет внутриклеточного пространства.
Феномен массопереноса воды между внутрисосудистым и
интерстициальным пространствами открыл Starling в 1896 г. Ма-
тематическое выражение этого процесса вывели Pappemheimer
и Soto-Rivera в 1948 г., оно получило название уравнения тран-
скапиллярного обмена Старлинга:
191
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Qf = Kf[(Pc —
где Qf — суммарный поток жидкости через капиллярную мем-
брану;
Kf — коэффициент фильтрации жидкости;
Рс — капиллярное гидростатическое давление;
Р; — интерстициальное гидростатическое давление;
о — осмотический коэффициент;
лс — капиллярное онкотическое давление;
к, — интерстициальное онкотическое давление.
Процесс фильтрации определяется градиентом давления
между Рс — Рг Гидростатическое давление в капилляре являет-
ся основным фактором, способствующим перемещению жидко-
сти в интерстициальное пространство, и обычно оно уравнове-
шивается гидростатическим давлением интерстициального про-
странства. Разница между давлениями в этих секторах становит-
ся положительной при возникновении отеков. Таким образом,
КОД плазмы является основным фактором, удерживающим
жидкость во внутрисосудистом пространстве. Коллоидно-ос-
мотическое давление интерстициального пространства напра-
влено в противоположную сторону, что описывается разницей
лс — лг Кр коэффициент фильтрации, определяется двумя фак-
торами: 1 -й из них — Lp — гидравлическая проводимость, кото-
рая отражает скорость прохождения жидкости через микрососу-
дистый обменный барьер (капиллярная мембрана, интерсти-
циальный гель и терминальная лимфатика). Второй — S — пло-
щадь капилляров, через которые осуществляется фильтрация.
Если один из компонентов Kf увеличивается, например, при
повреждении эндотелиальной мембраны или вазодилатации в от-
вет на увеличение сердечного выброса, количество фильтруемой
жидкости увеличивается.
Отражающий коэффициент фильтрации о определяет свой-
ства мембраны препятствовать переходу белка. Если о = 1, мем-
брана полностью непроницаема для белка; если с = 0, белки бе-
спрепятственно проходят через капиллярную мембрану. Значе-
ния о различны в различных участках организма. Для системных
капилляров ее значения составляют около 0,9, а д ля легочных ка-
пилляров — около 0,7.
192
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Поскольку отек легких относится к более тяжелым ослож-
нениям, чем системный отек, большинство исследований было
направлено на изучение массопереноса жидкости и белков в
малом круге кровообращения. Незначительное увеличение ле-
гочного капиллярного давления или снижение КОД плазмы
крови не приведет к отеку легких, т. к. в них существуют ме-
ханизмы, препятствующие накоплению жидкости в интерсти-
циальном пространстве. Гидростатическое давление в ин-
терстициальном пространстве легких в норме слабо поло-
жительно. Вследствие низкого компляйнса при накоплении
жидкости в интерстициальном пространстве р быстро возра-
стает. Это препятствует дальнейшему переходу жидкости,
поскольку сопровождается снижением градиента Рс — Рг
Если давление в интерстициальном пространстве легких воз-
растает выше атмосферного, это способствует переходу в не-
го жидкости, что сопровождается незначительным повыше-
нием л, величина которого при отеке легких составляет
от 1 до 5 мм рт. ст.
Второй компенсаторный механизм заключается в сни-
жении Л; в результате накопления в интерстициальном про-
странстве жидкости с низким содержанием белка. В норме он-
котическое давление в интерстициальном пространстве лег-
ких составляет 75 % от КОД плазмы крови. Онкотический
градиент на капиллярной мембране легких (лс — Л;) соста-
вляет всего 4—6 мм рт. ст. При снижении КОД плазмы крови
КОД интерстициального пространства пропорционально сни-
жается по мере поступления в него жидкости, что препят-
ствует значительному изменению онкотического градиента.
Л; снижается не только за счет разведения белка, но и за
счет удаления его лимфатической системой легких. Послед-
ний фактор имеет очень важное значение, поскольку в экспе-
риментальных исследованиях показано, что лимфатический
дренаж может возрасти в 10 раз в ответ на возрастание объе-
ма или давления в интерстициальном пространстве легких.
Назначение инфузионной терапии пациентам с циркуля-
торной недостаточностью, обусловленной низкой предна-
грузкой сердца, ведет к увеличению объема циркулирующей
крови, венозного возврата к сердцу и сердечного выброса.
193
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Для достижения этой цели можно использовать препараты
крови, кристаллоидные или коллоидные растворы.
Кристаллоиды
Нарушения водного баланса приводит к различным видам
дегидратации и гипергидратации: гипотонической, изотониче-
ской и гипертонической, при которых изменяется не только
соотношение воды в различных секторах организма человека, но
и соотношение электролитов.
Для коррекции нарушений водно-электролитного баланса
используют обычно различные солевые растворы. Натрий явля-
ется основным компонентом таких растворов, поскольку он
представляет собой главный электролит, содержащийся в жид-
кости внеклеточного пространства, причем 80 % его расположе-
но вне сосудистого русла. Следовательно, внутривенно введен-
ный в составе солевых растворов натрий вскоре окажется за
пределами сосудистой системы.
Кристаллоидные (содержащие натрий) растворы были раз-
работаны для увеличения именно объема интерстициального
пространства, а отнюдь не объема циркулирующей крови (в со-
судистом русле остается всего 20 % изотонического раствора
натрия хлорида после его внутривенной инфузии). Внутривен-
ное введение 1 л раствора Рингера с лактатом приводит к увели-
чению объема циркулирующей крови примерно на 200 мл у
среднего взрослого человека, что будет сопровождаться соответ-
ствующим распределением ионов натрия в различных водных
секторах.
Растворы кристаллоидов наиболее подходят для возмеще-
ния внеклеточной потери жидкости (внеклеточная дегидрата-
ция), но наряду с этим способствуют и восполнению кровопо-
тери. Острая кровопотеря (или гиповолемия) непременно ведет
к дефициту интерстициальной жидкости, который должен быть
немедленно устранен. В эксперименте было установлено, что
комбинированное применение гемотрансфузии и внутривен-
ных вливаний солевых растворов, способствующих восполнению
дефицита жидкости в интерстициальном пространстве, значи-
тельно увеличивало выживаемость животных при геморраги-
ческом шоке по сравнению со случаями, когда их лечение огра-
ничивалось только переливанием крови. Растворы кристалло-
194
ГПАВА1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
идов убедительно доказывают свою эффективность при реани-
мации больных с острой кровопотерей, а также находят широ-
кое применение при травмах различного генеза.
К важным положительным свойствам электролитных ра-
створов относится способность улучшать реологические свой-
ства крови, нормализовать микроциркуляцию, способствовать
профилактике развития диссеминированного внутрисосуди-
стого свертывания крови и образования микросгустков.
Наиболее часто применяемые солевые растворы —
регуляторы водно-солевого обмена:
Раствор Рингера-Локка
Раствор Гартмана
Ацесоль
Трисоль
Лактосол
Хлосоль
Дисоль
Йоностерил
Раствор Дарроу
Йоноцелл
Электролитные растворы применяются для коррекции на-
рушений:
• водного обмена;
• электролитного обмена;
• водно-электролитного обмена;
• кислотно-основного состояния (метаболический ацидоз);
• водно-электролитного обмена и кислотно-основного со-
стояния.
Рецептура электролитных растворов определяет их свойства:
осмолярность, изотоничность, ионность, резервную щелочность.
Раствор натрия хлорида 0,9 %-ный
Содержит ионы натрия (154 ммоль/л) и хлора (154 ммоль/л).
Теоретическая осмолярность — 308 мосм/л. Несколько гиперто-
ничен по отношению к плазме крови. Имеет слабокислую реак-
цию. Ионы натрия и хлора являются важнейшими неорганиче-
195
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
скими компонентами внеклеточной жидкости, поддерживающи-
ми соответствующее осмотическое давление плазмы и внекле-
точной жидкости. Раствор восполняет дефицит жидкости в ор-
ганизме при дегидратации.
Показания к применению. Препарат применяют при дегидра-
тациях различного происхождения; во время и после операций
для поддержания объема циркулирующей плазмы на физиоло-
гическом уровне; в качестве универсального растворителя для
различных лекарственных препаратов.
Противопоказания. Противопоказаниями к применению
препарата являются состояния гипергидратации, гипернатри-
емии, угроза отека легких или мозга.
Препарат следует с осторожностью применять у больных с
нарушением выделительной функции почек, при гипокали-
емии. Введение больших доз раствора может привести к хлорид-
ному ацидозу, гипергидратации, увеличению выведения калия
из организма.
Методика применения и дозы. Препарат вводят внутривенно,
чаще капельно. Дозировку и скорость введения выбирают инди-
видуально, в зависимости от клинической ситуации (до 3000 мл
за сутки).
При длительном применении препарата необходим контроль
концентрации электролитов в плазме и суточного диуреза.
Форма выпуска. Флаконы по 50,100, 200 и 400 мл.
Дисоль
Дисоль — полиионный солевой раствор следующего соста-
ва: натрия хлорида — 600 мг, натрия ацетата — 200 мг (ионы
натрия — 127 ммоль/л, ионы хлора — 103 ммоль/л, ионы ацета-
та — 24 ммоль/л). Теоретическая осмолярность — 254 мосм/л.
Слабощелочная реакция.
Препарат восстанавливает водно-электролитное и кислот-
но-щелочное равновесие в организме при обезвоживании раз-
личного генеза, препятствует развитию метаболического ацидо-
за, усиливает диурез.
Показания к применению. Регидратация и коррекция гипер-
калиемии, возникших вследствие обезвоживания (упорные ди-
ареи, рвота при холере Эль-Тор, острой дизентерии и пищевых
токсикоинфекциях и т. п.).
196
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ_____________
Противопоказания. Повышенная чувствительность к компо-
нентам препарата.
Методика применения и дозы. Введение внутривенное капель-
ное со скоростью 40—120 капель в минуту до нормализации по-
казателей электролитного баланса.
Препарат применяют под контролем электролитов в плаз-
ме и определения баланса введенной и потерянной жидкости
(каждые 6 ч).
Форма выпуска и условия хранения. Флаконы по 400 и 200 мл.
Хранят при комнатной температуре.
Лактосол (синонимы Рингер-лактат, лактатно-солевой ра-
створ, раствор Гартмана)
Полиионный раствор со сбалансированным содержанием
электролитов следующего состава:
• натрия хлорида 620 мг;
• калия хлорида 30 мг;
• кальция хлорида 16 мг;
• магния хлорида 10 мг;
• натрия лактата 336 мг;
• натрия гидрокарбоната в количестве, необходимом для до-
ведения pH раствора до 6,0—8,2.
Теоретическая осмолярность — 294 мосм/л, количество ио-
нов натрия — 140 ммоль/л, калия — 4 ммоль/л, кальция —
1,5 ммоль/л, магния — 1 ммоль/л, хлора — 115 ммоль/л, лакта-
та — 30 ммоль/л, бикарбоната — 3,5 ммоль/л.
Лактосол компенсирует нарушение водно-электролитного
баланса с одновременной коррекцией метаболического ацидоза
путем увеличения буферной емкости крови при превращении в
организме лактата натрия в бикарбонат. В результате полученной
гемодилюции и снижения вязкости крови улучшаются реологи-
ческие свойства крови и периферическая перфузия тканей.
При применении в достаточных количествах раствор оказы-
вает дезинтоксикационное и гемодинамическое действия, повы-
шает диурез и усиливает действие осмотических диуретиков.
Показания к применению. Применяют при острых циркуля-
торных нарушениях, сопровождающихся дефицитом экстра-
целлюлярной жидкости или дегидратацией в сочетании с мета-
болическим ацидозом.
197
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Противопоказания. Применение раствора противопоказано
при алкалозе (особенно декомпенсированном); во всех случаях,
когда не показано введение в организм больших количеств жид-
кости (закрытая травма черепа, декомпенсация сердечной дея-
тельности, отек легких, острая дегидратация и т. п.); при тера-
пии глюкокортикостероидами.
Рекомендуется ограничивать объем инфузий препарата при
почечной недостаточности, ожогах дыхательных путей, у боль-
ных пожилого и старческого возраста.
Методика применения и дозы. Раствор вводят внутривенно
струйно или капельно, в зависимости от клинического состоя-
ния больного. Средняя скорость введения — 70—80 капель в
минуту. Средняя доза для взрослого — 100—500 мл/сутки. Мак-
симальная суточная доза — 3000 мл.
При травматическом шоке раствор вводят в дозе от 1 до 3 л
в зависимости от стадии шока вначале струйно, при улучше-
нии гемодинамических показателей переходят на капельный
метод введения.
Лактосол используют при всех периодах ожоговой болезни
в дозе от 400 мл до 3 л, в зависимости от периода болезни.
При острых циркуляторных нарушениях в результате тяжелых
гнойно-хирургических осложнений (панкреатит, перитонит, се-
псис) препарат применяют в течение 3—4 дней до 2—4 л в сутки.
В предоперационном, операционном или послеопераци-
онном периодах вводят от 0,5 до 3 л раствора в зависимости от
степени локальной травмы и кровопотери.
При компенсации метаболического ацидоза доза препара-
та зависит от степени ацидотического сдвига. При умеренно
выраженном сдвиге достаточно 400 мл раствора, при глубоком
ацидозе вводят препарат в объеме 1600 мл и более. Инфузия
400 мл раствора приводит к увеличению буферной емкости кро-
ви на 1—1,5 мэкв/л.
Форма выпуска и условия хранения. Флаконы по 400 мл. Хра-
нят при комнатной температуре. При транспортировке допуска-
ется замерзание.
Трисамин
Парентеральное средство для коррекции ацидоза. Пред-
ставляет собой белое кристаллическое вещество, легко раство-
198
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ____________
римое в воде. Водный раствор трисамина (в концентрации
3,66 %) изоосмотичен плазме крови, pH — 10,2—10,7. Активное
вещество — трометамол.
Трисамин является буферным веществом, связывающим
ионы водорода органических кислот, анионы которых затем ли-
бо трансформируются, либо пополняют щелочные резервы.
Введенный внутривенно трисамин снижает концентрацию ио-
нов водорода в крови (повышает ее pH, устраняет ацидоз). Пре-
парат способен проникать через клеточные мембраны и устра-
нять внутриклеточный ацидоз. Оказывает также осмотическое
диуретическое действие. Медленно выводится из организма,
основной путь выведения — через почки.
Показания к применению. Коррекция метаболического аци-
доза любого происхождения (обезвоживание, гипоксия, шок,
массивные переливания крови, острый панкреатит и др.). Лече-
ние острых отравлений слабыми кислотами (барбитуратами,
салицилатами и т. п.).
Инфузии трисамина показаны во время и после реанимации
для быстрого устранения ацидоза. Обладая гипогликемическим
действием, трисамин может назначаться при лечении диабети-
ческого ацидоза.
Противопоказания:
• острая почечная недостаточность (выраженные наруше-
ния выделительной функции);
• острая дыхательная недостаточность, сопровождаемая
хроническим респираторным ацидозом;
• детям до 1 года.
Трисамин может приводить к уменьшению содержания
электролитов, острому уменьшению ионизированного кальция,
потерям натрия и калия.
Методика применения и дозы. Препарат в виде 3,66 %-ного
раствора используют для внутривенного капельного или струй-
ного введения. Средняя доза для больного массой 60 кг —
500 мл/ч (около 120 капель в минуту). Максимальная доза —
1.5 г/кг в сутки. Необходимое количество трисамина может быть
определено по формуле:
Количество раствора (мл) = BE (мэкв/л) х Вес больного (кг).
199
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Максимальная доза препарата не должна превышать 1,5 г/кг
в сутки.
Повторные введения допустимы лишь через 2—3 суток. Если
необходимо более частое использование препарата, то следует
уменьшать его дозировку.
При использовании больших доз трисамина перед употре-
блением к нему следует добавить (в расчете на 1 л) 1,75 г хлори-
да натрия, 0,372 г хлорида калия и 5—10 %-ный раствор глюко-
зы с инсулином (1 ЕД инсулина на 4 г сухой глюкозы) в дозе
10—15 мл/кг.
При передозировке трисамина может развиться алкалоз,
приводящий к угнетению дыхания и даже к его остановке. Мо-
гут возникать гипогликемия, гипотония, тошнота, рвота, мест-
ные реакции в виде флебитов.
Форма выпуска и условия хранения. Полиэтиленовые емко-
сти по 250 мл. Хранить следует в прохладном защищенном от све-
та месте.
Трисоль
Трисоль является комбинированным полиионным препара-
том, состоящим из следующих солей:
• натрия хлорида 5 г;
• калия хлорида 1 г;
• натрия гидрокарбоната 4 г (на 1 л раствора).
Раствор содержит ионов натрия 133 ммоль/л, ионов калия
13 ммоль/л, ионов хлора 98 ммоль/л, ионов бикарбоната
48 ммоль/л. Теоретическая осмолярность — 292 мосм/л. Ра-
створ имеет слабую щелочную реакцию.
Уменьшает гиповолемию, сгущение крови и метаболический
ацидоз, улучшает капиллярное кровообращение, функциональ-
ную способность сердца и почек, оказывает дезинтоксикацион-
ное действие.
Показания к применению:
• Лечение больных холерой Эль-Тор, острой дизентерией
и пищевой токсикоинфекцией для устранения или уменьше-
ния явлений обезвоживания и интоксикации организма.
• Потери воды и электролитов при патологии желудочно-
кишечного тракта (свищи, дренажи, перитонит, панкреатит
и т. п.) и форсированном диурезе.
200
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ______________
• Изотоническая дегидратация в сочетании с гипокали-
емией и метаболическим ацидозом.
Противопоказания:
• Гипергидратация.
• Алкалоз.
• Гиперкалиемия.
Методы введения и дозы
Трисоль применяют внутривенно струйно или капельно.
Общее количество вводимого раствора должно соответствовать
объему жидкости, потерянной с испражнениями, рвотными
массами, мочой и потом. Баланс потерянной и введенной жид-
кости определяют каждые 6 ч.
При тяжелых формах заболевания препарат вводят струй-
но с последующим переходом на капельное введение. Пред-
назначенный для введения раствор должен быть подогрет
до 38—40 °C. Препарат вводят под контролем лабораторных
исследований.
Форма выпуска и условия хранения
Флаконы по 500 мл хранят при комнатной температуре.
Ацесоль
Ацесоль — полиионный препарат, состоящий из следующих
солей:
• натрия ацетата 2 г;
• натрия хлорида 5 г;
• калия хлорида 1 г (на 1 л раствора).
Раствор содержит ионы натрия 110 ммоль/л, калия 13 ммоль/л,
хлора 99 ммоль/л, ацетата 24 ммоль/л. Теоретическая осмоляр-
ность — 246 мосм/л. Раствор имеет слабую щелочную реакцию.
Уменьшает гиповолемию, сгущение крови и метаболический
ацвдоз, улучшает капиллярное кровообращение, функциональ-
ную способность сердца и почек, оказывает дезинтоксикацион-
ное действие.
Показания к применению
Ацесоль применяют в качестве средства, устраняющего
или уменьшающего явления обезвоживания и интоксикации
организма.
Противопоказания: гипотоническая дегидратация, гиперкали-
емия, гипергидратация.
201
______________________ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Методы введения и дозы
Ацесоль применяют внутривенно струйно или капельно.
Общее количество вводимого раствора должно соответствовать
объему жидкости, потерянной с испражнениями, рвотными
массами, мочой и потом. Баланс потерянной и введенной жид-
кости определяют каждые 6 ч.
При тяжелых формах заболевания препарат вводят струйно с
последующим переходом на капельное введение. Предназначен-
ный для введения раствор должен быть подогрет до 38—40 °C.
Препарат вводят под контролем лабораторных исследований.
Форма выпуска и условия хранения
Флаконы по 500 мл хранят при комнатной температуре.
Хлосоль
Хлосоль — солевой раствор, в 1 л которого содержится:
• натрия ацетата 3,6 г;
• натрия хлорида 4,75 г;
• калия хлорида 1,5 г.
Препарат содержит ионы натрия 120 ммоль/л, ионы калия
23 ммоль/л, ионы хлора 104 ммоль/л. Теоретическая осмоляр-
ность — 286 мосм/л. Раствор имеет слабую щелочную реакцию.
Хлосоль оказывает дезинтоксикационное и гемодинамиче-
ское действия, повышает диурез, улучшает реологические свой-
ства крови.
Показания к применению
Хлосоль применяют при дегидратации и интоксикации ор-
ганизма, возникающих при различных заболеваниях (острая
дизентерия, пищевая токсикоинфекция, холера Эль-Тор и др.).
Противопоказания: гипергидратация, алкалоз, гиперкали-
емия.
Методы введения и дозы. Хлосоль вводят внутривенно струй-
но или капельно. Перед употреблением раствор подогревают
до 36—38 °C. Общее количество вводимого раствора должно со-
ответствовать объему жидкости, потерянной с испражнения-
ми, рвотными массами, мочой и потом. Баланс потерянной и вве-
денной жидкости определяют каждые 6 ч.
При тяжелых формах заболевания препарат вводят струй-
но с последующим переходом на капельное введение. Препарат
вводят под контролем лабораторных исследований.
202
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ____________
Форма выпуска и условия хранения
Хлосоль выпускают во флаконах по 100, 200 и 400 мл. Хра-
нят при комнатной температуре.
Квинтасоль
Квинтасоль — инфузионный электролитный раствор, кото-
рый содержит ионы:
• натрия 140 ммоль/л;
• калия 5 ммоль/л;
• кальция 2,5 ммоль/л;
• магния 1,5 ммоль/л;
• хлорида 103,0 ммоль/л;
• ацетата 50,0 ммоль/л.
Катионный состав раствора и содержание ионов хлора соот-
ветствуют электролитному составу плазмы, pH раствора 6,0—7,5.
Квинтасоль купирует метаболический ацидоз, нормализу-
ет кислотно-щелочное состояние, стабилизирует водный об-
мен и электролитный состав крови. В состав препарата включен
ион ацетата, который быстро метаболизируется с образованием
бикарбоната.
Показания к применению
Квинтасоль применяют у взрослых и детей как компонент
инфузионной терапии при:
• комплексном лечении шока, термической травмы и ос-
трой кровопотери;
• гипотонической и изотонической формах гипогидратации
и метаболическом ацидозе у тяжелых больных;
• коррекции водного и солевого баланса при остром разли-
том перитоните и кишечной непроходимости;
• лечении больных с кишечными свищами при декомпен-
сации электролитных нарушений;
• острых кишечных инфекциях, обезвоживании и метабо-
лическом ацидозе;
• лечебном плазмаферезе;
• диализно-фильтрационных методах.
Квинтасоль обладает небольшим непродолжительным во-
лемическим действием.
Противопоказания'.
• алкалоз;
203
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• гипертоническая дегидратация;
• в случаях, когда противопоказано введение больших объе-
мов жидкости.
Методы введения и допустимые дозы
Квинтасоль применяют внутривенно капельно со скоро-
стью 60—80 капель в минуту для взрослых и 30—60 капель в ми-
нуту — для детей. У взрослых допускается струйное введение. Су-
точная доза для взрослых — 5—20 мл/кг, для детей — 5—10 мл/кг
массы тела. Курс лечения обычно составляет 3—5 дней.
При лечебном плазмаферезе квинтасоль вводят в двухкрат-
ном объеме по сравнению с удаленной плазмой (1200—2400 мл)
в сочетании с коллоидными растворами в случае выраженной ги-
поволемии.
Форма выпуска и условия хранения
Квинтасоль выпукаюг во флаконах по 50,100,200 и 400 мл. Хра-
нят в сухом месте при температуре от +10 до +25 °C. Допускается
кратковременное замораживание во время транспортировки.
Препарат применяют только в условиях стационара.
Мафусол
Мафусол — солевой инфузионный раствор, основным фар-
макологически активным компонентом которого является фу-
марат натрия. В состав препарата входят также хлориды нат-
рия, калия и магния. Осмолярность мафусола — 400—410 мосм/л.
Обладает выраженным антигипоксическим действием, ко-
торое обеспечивает фумарат натрия. Фумарат натрия — вещество
естественной природы, содержащееся во всех клетках организ-
ма с аэробным типом дыхания. Это соединение, подобно лакта-
ту и ацетату натрия, способствует ликвидации ацидемии пу-
тем химической нейтрализации кислых продуктов метабо-
лизма. Однако преимущество фумарата перед лактатом и аце-
татом заключается в том, что он метаболизируется и при тя-
желой гипоксии, его утилизация сопровождается образовани-
ем АТФ. За счет своей осмолярности мафусол быстро вос-
полняет объем циркулирующей жидкости при гиповолемиче-
ских состояниях, предотвращает дегидратацию тканей. Пре-
парат уменьшает вязкость крови и улучшает ее реологиче-
ские свойства. Инфузии мафусола в достаточном количестве
оказывают гемодинамический эффект, повышают диурез.
204
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ_____________
способствуют активации дезинтоксикационных процессов,
приводят к снижению в крови продуктов перекисного окисле-
ния липидов, что свидетельствует об антиоксидантных свой-
ствах препарата.
Безвреден, нетоксичен, не накапливается в организме, а пол-
ностью метаболизируется. Не вызывает аллергических реакций.
Показания к применению:
• Гиповолемические и гипоксические состояния различ-
ной этиологии у детей и взрослых (кровопотеря, шок, травмы,
ожоги, интоксикации).
• Острые нарушения мозгового кровообращения, протекаю-
щие по ишемическому и геморрагическому типу (у взрослых).
• В качестве компонента перфузионной смеси для запол-
нения контура аппарата искусственного кровообращения при
кардиохирургических операциях у взрослых и детей.
Противопоказания
Во всех случаях, где противопоказано внутривенное введение
больших объемов жидкости. Побочные действия не отмечены.
Способ применения и дозы
У детей — 20—25 мл/кг массы тела, при тяжелых интокси-
кациях — 30—35 мл/кг массы тела.
У взрослых — до 2—3 л при шоке, вначале струйно, при
нормализации показателей гемодинамики — капельно (внутри-
венно или внутриартериально).
Форма выпуска и условия хранения
По 400—450 мл в бутылках или по 100,200,250,500 мл в по-
лимерной упаковке. Хранят при температуре от 0 до 25 °C. До-
пускается замораживание. Срок годности 2 года.
1.7. Препараты парентерального питания
Согласно мировой статистике госпитальное голодание па-
циентов с различными заболеваниями составляет от 30 до 50 %.
Причины недостаточности питания могут быть разными. Это и
неадекватное потребление питательных веществ, и нарушения
приема, ассимиляции или метаболизма питательных компо-
нентов вследствие заболевания, ранения или травмы. Недоста-
205
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
точность питания вызывает потерю массы тела, энергетических
запасов и тканевых белков, что может приводить к неудовлетво-
рительному течению лечебного процесса. В связи с этим необхо-
димость дополнительной питательной поддержки не вызывает
сомнения. Альтернативными вариантами питательной поддерж-
ки являются энтерально-зондовое (ЭЗП) и парентеральное пи-
тание (ПП). В многопрофильном стационаре не менее 25 % па-
циентов нуждаются именно в ПП. ПП должно включать те же пи-
тательные ингредиенты, что и естественное питание (белки,
жиры, углеводы, витамины, минеральные вещества).
Белковый компонент ПП обеспечивается растворами ами-
нокислот, энергетический — жировыми эмульсиями, глюко-
зой, фруктозой, многоатомными спиртами. Минеральные веще-
ства и витамины включаются в программу ПП в виде известных
соединений калия, натрия, кальция, фосфора, магния и спе-
циализированных добавок.
1.7.1. Компоненты аминокислотного обеспечения
Компонентами, обеспечивающими пациента пластическим
материалом, являются растворы аминокислот. Различают нес-
колько специфических групп аминокислотных растворов:
• растворы общего типа;
• растворы, используемые при заболеваниях почек;
• растворы, используемые при заболеваниях печени;
• растворы для детского парентерального питания;
• растворы аминокислот с высоким содержанием глю-
тамина.
В табл. 1.16 представлены наиболее часто встречающиеся
в настоящее время растворы аминокислот.
Аминокислотные растворы общего типа
Аминокислотные растворы общего типа содержат, как
правило, 18—20 L-аминокислот (незаменимых и замени-
мых) с добавками основных электролитов или без них. В не-
которых растворах имеются компоненты энергетического
обеспечения (сорбитол или ксилитол) (табл. 1.17). Содержа-
ние общего азота в этих растворах колеблется от 6,3 до 18 г/л.
Концентрированные растворы аминокислот гиперосмоляр-
206
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ_________
Таблица 1.16. Аминокислотные растворы общего
и специального назначения
Растворы аминокислот общего типа Специальные растворы аминокислот
Для нефрологии Для гепато- логии Для педиа- трии С высоким содержа- нием глю- тамина
Полиамин (ХАЙМИКС) Нефротек Амино- стерил Гепа 5 %, 8 %- ный Аминовен инфант 6 %, 10 %- ный Гламин
Аминоплаз- мальЕ 10 %, 5 %-ный Нефрамин Амино- плазмаль Гепа 10 %-ный Вамино- лакт Дипепти- вен
Аминостерил КЕ Нефро
Аминостерил КЕ10 %-ный
Фреамин
Вамин 18 EF, 14
Инфезол 40,100
Травмастерил
Неонутрин 5 %, 10 %, 15 %-ный
Аминосол КЕ, 600,800
НЫ и поэтому могут быть введены только в центральные ве-
ны. Высокая концентрация общего азота позволяет в мень-
шем количестве жидкости ввести больше пластического ма-
териала. Применяют аминокислотные растворы общего ти-
па Для коррекции белковой недостаточности в пред- и по-
слеоперационном состояниях, при кахексии любой этиоло-
207
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
гии, при нарушении акта глотания, кишечных фистулах,
патологических изменениях слизистой тонкой кишки и т. д.
При отсутствии противопоказаний в отделениях реанима-
ции предпочтительнее использовать высококонцентриро-
ванные растворы аминокислот.
Обращают внимание растворы аминоплазмаля Е 5 и 10 %-
ные, содержащие 20 аминокислот, в т. ч. орнитин. Орнитин сти-
мулирует глюкозоиндуцированную выработку инсулина и актив-
ность карбамоилфосфатсинтетазы, что способствует увеличению
утилизации глюкозы периферическими тканями, синтезу моче-
вины, а в сочетании с аспарагином — уменьшению уровня ам-
миака. Содержащийся в растворах фосфор активизирует глюко-
зофосфатный цикл.
Существенный интерес представляет аминокислотный раствор
неонутрин в концентрации 10 и 15 %, содержащий все заменимые
и незаменимые аминокислоты в сбалансированном соотношении.
Обладая высокой концентрацией, раствор имеет относительно низ-
кую осмолярность (10 %-ный раствор — общий азот 14,9 г/л, осмо-
лярность 766 мосм/л; 15 %-ный раствор — общий азот 22,3 г/л, ос-
Таблица 1.17. Состав некоторых аминокислотных растворов
общего типа
Состав, г/л Яичный белок Полиамин Вамин 18 б/э Аминоплазмаль Е 5 %-ный Аминоплазмаль Е 10 %-ный Аминостерил КЕ 10 %-ный Инфезол-40
Аланин 7,4 6,4 16,0 6,85 13,7 15,0 4,0
Аргинин 6,1 6,4 11,3 4,60 9,2 10,64 4,55
Аспарагиновая кислота 9,0 - 3,4 0,65 1,3 - 2,0
Аспарагина моногидрат 1,6 3,27
Валин 7,3 4,9 7,3 2,40 4,8 5,92 2,25
Гистидин 2,4 3,2 6,8 2,60 5,2 2,88 1,35
Глицин 3,6 8,0 7,9 - 1
208
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Окончание табл. 1.17
Состав, г/л Яичный белок Полиамин Вамин 18 б/э Аминоплазмаль Е 5 %-ный Аминоплазмаль Е 10 %-ный Аминостерил КЕ 10 %-ный Инфезол-40
Глютаминовая кислота 16,0 - 5,6 2,30 4,6 - 5,0
Изолейцин 6,6 4,4 5,6 2,55 5,1 4,67 2,1
Лейцин 8,8 9,8 7,9 4,45 8,9 7,06 2,75
Лизин 6,4 11,5 9,0 2,8 5,6 5,97 2,0
Метионин 3,1 5,7 5,6 1,9 3,8 4,1 1,75
Пролин 8,1 6,4 6,8 4,45 8,9 15,0 -
Серин 8,5 - 4,5 1,2 2,4 - -
Тирозин 4,2 - 0,23 0,65 1,3 - -
Треонин 5,1 4,3 5,6 2,05 4,1 4,21 1,6
Триптофан 1,6 1,44 1,9 0,9 1,8 1,82 -
Фенилаланин 5,8 7,0 7,9 2,55 5,1 4,82 3,15
Цистин/ цистеин 2,4 - 0,56 /0,25 /0,5 - -
Яблочная кислота - - 1,01 1,01 8,08 -
Эдетиновая кислота 0,05 0,05
Аминоуксусная кислота - - - - 15,95 -
Орнитин - 1.25 2,51 - -
Сорбит(ол) 50 - - - - -
Ксилитол - - - - - 50
Натрий, ммоль/л - - 43 43 30 40,
Калий, ммоль/л - - 25 25 20 25
Кальций, ммоль/л - - - - - -
Магний, ммоль/л - - 2,6 2,6 5,0 2,5
Дигидрофосфат 9,0 9,0 -
L-малат 7,5 7,5 -
Ацетат 59,0 59,0 -
Хлорид 29,0 57,0 60
Общий азот 11,3 18,0 8,0 16 16 6,3
осмолярность, мосм/л 1159 ИЗО 590 1030 1048 801,8
209
ТРАНСФУЗИОЛОГИЯ в РЕАНИМАТОЛОГИИ
молярность 1144 мосм/л), что позволяет использовать его у паци-
ентов, требующих ограниченного объема жидкости. Ограничен-
ное количество в растворе электролитов позволяет корректировать
вероятные изменения водного и электролитного баланса без необхо-
димости изменений в основной схеме питания. Все вместе позво-
ляет успешно применять препарат у пациентов в критическом со-
стоянии и у больных с признаками полиорганной недостаточности.
Полиамин (ХАЙ МИКС)
Единственный отечественный представитель аминокислот-
ных растворов, полиамин представляет собой 8 %-ный раствор
смеси 13 кристаллических L-аминокислот и D-сорбита. Общий
азот 11,3 г/л, осмолярность 1159 мосм/л.
Показания к применению
Предназначен для коррекции белковой недостаточности в
программе парентерального питания.
Противопоказания:
• острая почечная недостаточность;
• острая печеночная недостаточность.
Методы введения и дозы
При ВПП или ЧПП суточная доза — 400—600 мл, при
ППП — 800—1200 мл. Скорость введения — 20 капель в мину-
ту. Введение только в центральные вены.
Форма выпуска: флаконы по 400 мл.
Вамин 18 EF
Препараты серии «вамин» выпускаются в нескольких моди-
фикациях, отличающихся друг от друга концентрацией заме-
нимых и незаменимых аминокислот, уровнем общего азота (9,
14 и 18 г) и наличием или отсутствием в их составе электроли-
тов (см. табл. 1.18).
Вамин 18 EF (Fresenius Kabi) — белковый компонент ПП,
содержащий 18 аминокислот. Электролиты в состав препарата
не входят. Общий азот 18 г/л, осмолярность ИЗО мосм/л.
Показания к применению
Азотистый компонент в программе ПП у больных со значи-
тельно повышенной потребностью в белке.
Противопоказания:
• острая печеночная недостаточность;
• почечная недостаточность.
210
ГЛАВА 1- ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ_________
Таблица 1.18. Сравнительный состав препаратов серии
вамин
Аминокислота Модификация
Вамин 9EF Вамин N Вамин 14 Вамин 14 EF Вамин 18 EF Вами- нолакт
Глицин 3,9 г 2,1г 5,9 г 5,9 г 7,9 г 2,1г
Г^аланин 8,0 г 3,0 г 12,0 г 12,0 г 16,0 г 6,3 г
L аргинин 5,6 г 3,3 г 8,4 г 8,4 г 11,3г 4,1 г
L-аспарагино- вая кислота 1,7 г 4,1 г 2,5 г 2,5 г 3,4 г 4,1 г
L-валин 3,7 г 4,3 г 5,5 г 5,5 г 7,3 г 3,6 г
L-гистидин - 2,4г 5,1г 5,1 г 6,8 г 2,1г
L-глютамино- вая кислота 2,8 г 9,0г 4,2 г 4,2 г 5,6 г 7,1г
L-изолейцин - 3,9г 4,2 г 4,2 г 5,6 г 3,1г
L-лейцин 3,9 г 5,3 г 5,9 г 5,9 г 7,9 г 7,0 г
L-лизин 4,5 г 3,9 г 6,8 г 6,8 г 9,0 г 5,6 г
L-метионин 2,8 г 1,9 г 4,2 г 4,2 г 5,6 г 1,3 г
L-пролин 3,4 г 8,1г 5,1 г 5,1 г 6,8 г 5,6 г
L-серин 2,3 г 7,5 г 3,4 г 3,4 г 4,5 г 3,8 г
L-тирозин 0,11г 0,5 г 0,17 г 0,17 г 0,23 г 0,5 г
L-треонин 2,8 г 3,0 г 4,2 г 4,2 г 5,6 г 3,6 г
L-триптофан 1,0 г 1,0 г 1,4 г 1,4 г 1,9 г 1,4 г
t-фенил аланин 3,9 г 5,5 г 5,9 г 5,9 г 7,9 г 2,7 г
L-цисгеин/цисгин 0,28 г 1.4 г 2,5 г 0,42 г 0,56 г 1,0 г
L-таурин - - - - - 0,3 г
Калий, ммоль - 20 50 - - -
Кальций, ммоль - 2,5 5 - - -
Магний, ммоль - 1,5 8 - - -
Натрий, ммоль - 50 100 - - -
Хлорвды, ммоль - 55 100 - - -
Методы введения и дозы
Максимальная суточная доза для взрослых — до 1000 мл.
Максимальная скорость —1000 мл за 8 ч. Предназначен для вве-
дения в центральные вены.
211
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Форма выпуска:, флаконы по 500 и 1000 мл.
Остальные препараты этой серии в настоящее время имеют
меньшее распространение или не имеют регистрации в РФ.
Аминостерил КЕ 10 %-ный безуглеводный
Аминостерил КЕ 10 %-ный (Fresenius Kabi) — раствор сме-
си кристаллических аминокислот, обеспечивающий азотистое
питание в программе ПП. Содержание общего азота 16 г/л. Ос-
молярность 1048 мосм/л. Содержит электролиты: калий
20 ммоль/л, натрий 30 ммоль/л, магний 5 ммоль/л.
Показания к применению
Азотистый компонент в программе полного или вспомога-
тельного ПП.
Противопоказания:
• выраженные нарушения функции печени и почек;
• гиперкалиемия;
• хроническая сердечная недостаточность в фазе деком-
пенсации.
Методы введения и дозы
Максимальная суточная доза для взрослых — 1000 мл. Ско-
рость введения — 20—30 капель в минуту. Предназначен для
введения в центральные вены.
Форма выпуска: флаконы по 500 мл.
Аминоплазмаль ЕЮ %-ный
Аминоплазмаль Е10 %-ный (В. Braun)—раствор для ПП, содер-
жащий 20 аминокислот и электролиты, в том числе фосфор, чего нет
в других аминокислотных растворах, калий (25 ммоль/л), натрий (43
ммоль/л), магний (2,6 ммоль/л), дигидроген фосфат (9 ммоль/л).
Содержание общего азота — 16 г/л. Осмолярность —1030 мосм/л.
Показания
Азотистый компонент в программе полного и вспомога-
тельного парентерального питания.
Противопоказания'.
• тяжелые нарушения кровообращения;
• ацидоз;
• выраженные нарушения функции печени;
• почечная недостаточность с повышенными показателя-
ми остаточного азота;
• гипергидратация;
212
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ_____________
• гиперкалиемия;
• хроническая сердечная недостаточность.
Не рекомендуется назначать детям до двух лет, беремен-
ным и кормящим матерям.
Методы введения и дозы
Максимальная суточная доза — 1000 мл. Скорость введе-
ния — не более 20 капель в минуту. Предназначен для введения
в центральные вены.
Форма выпуска: флаконы по 500 и 1000 мл.
Аминоплазмаль Е 5 %-ный
Аминоплазмаль Е 5 %-ный (В. Braun) — раствор для ПП, со-
держащий 20 аминокислот и электролиты: натрий 43,0 ммоль/л,
калий 25 ммоль/л, магний 2,6 ммоль/л, ацетат 59,0 ммоль/л, хло-
рид 29,0 ммоль/л, дигидрофосфат 9,0 ммоль/л, L-малат 7,5 ммоль/л.
Содержание общего азота — 8 г/л. Осмолярность — 590 мосм/л.
Показания
Азотистый компонент в программе частичного и вспомога-
тельного парентерального питания.
Противопоказания:
• тяжелые нарушения кровообращения;
• ацидоз;
• выраженные нарушения функции печени;
• почечная недостаточность с повышенными показателя-
ми остаточного азота;
• гипергидратация;
• гиперкалиемия;
• хроническая сердечная недостаточность.
Не рекомендуется назначать детям до двух лет, беремен-
ным и кормящим матерям.
Методы введения и дозы
Для взрослых максимальная суточная доза—до 40 мл/кг мас-
сы тела в день, в зависимости от индивидуальных потребностей (до
2 г/кг в день). Скорость введения — до 45 капель в минуту.
Для детей 3—5 лет рекомендуемая суточная доза — 15 мл/кг
в сутки, для детей 6—14 лет — 10 мл/кг в сутки. Скорость введе-
ния препарата — до 1,0 мл/кг в час.
Предназначается для введения в периферические и цен-
тральные вены.
213
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Форма выпуска-, флаконы по 500 и 1000 мл. Хранить при
температуре не выше +25 °C в защищенном от света месте.
Инфезол 40
Инфезол 40 (Berlin-Chemie) — раствор L-аминокислот для
ПП. Содержит углеводы (ксилитол) и электролиты: калий
25 ммоль/л, натрий 40 ммоль/л, магний 2,5 ммоль/л. Содержа-
ние общего азота — 6,3 г/л. Осмолярность — 801 мосм/л.
Показания к применению
Используется для профилактики и терапии потерь бел-
ка в организме с одномоментной коррекцией нарушений
водного баланса. Возможно применение при ограниченной
функции почек.
Противопоказания:
• острая почечная недостаточность;
• тяжелые поражения печени;
• нарушения в обмене фруктозы и сорбитола;
• отравления метиловым спиртом;
• астма.
Методы введения и дозы
Максимальные дозы для взрослых — до 25 мл/кг массы те-
ла в сутки, для детей — до 50 мл на 1 кг массы тела в сутки.
Предназначается для введения в периферические вены.
Форма выпуска: флаконы по 500 мл.
Фреамин III 8.5 %-ный
Фреамин III 8,5 %-ный (Eczacibasi-Baxter) содержит 8 неза-
менимых и 7 заменимых аминокислот, электролиты (натрий и
фосфор). Содержание общего азота — 13 г/л.
Показания к применению
Поддержание уровня белка у больных с неярко выраженным
катаболизмом.
Противопоказания:
• анурия;
• печеночная кома;
• гиперчувствительность к компонентам препарата.
Методы введения и дозы
Общая дневная доза может достигать 3 л раствора. Возмож-
но введение в периферические вены.
Форма выпуска: флаконы по 500 мл.
214
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ_____________
Аминосол
Коррекцию белковой недостаточности возможно прово-
дить препаратами аминосола (Hemofarm). Все они содержат не-
заменимые и заменимые аминокислоты, углевод в виде сорби-
та, яблочную кислоту, основные электролиты и витамины (ри-
бофлавин, никотинамид, пантенол, пиридоксин). Известны три
препарата этой серии:
1. Аминосол 600 (содержание общего азота 8,46 г/л).
2. Аминосол 800 (содержание общего азота 16,92 г/л).
3. Аминосол КЕ (содержание общего азота 8,2 г/л), в раство-
ре помимо основных электролитов содержатся ионы магния.
Противопоказания:
• острая и хроническая почечная недостаточность;
• гепатопатия;
• непереносимость фруктозы;
• отравления метанолом;
• гиперкалиемия;
• декомпенсированная сердечная недостаточность.
Дозировка. 500—1000 мл/сугки со скоростью 20—30 капель в ми-
нуту. Максимальная доза сорбитола не должна превышать 0,5 г/кг
в час. Выбор пути введения зависит от осмолярности раствора.
Форма выпуска: флаконы по 500 мл.
Неонутрин (Infusia) — комплексный раствор L-аминоки-
слот, содержащий все незаменимые и заменимые аминокислоты
в сбалансированном соотношении, 20 % всех аминокислот соста-
вляют аминокислоты с разветвленной структурой (см. табл. 1.19).
Объем тирозина увеличен за счет добавления дипептида глицил-
тирозина, что обеспечивает достаточное его поступление даже
при катаболических состояниях, когда может иметь место блоки-
ровка преобразования фенилаланин-тирозин. Повышен объем ци-
стеина/цистина, важных для поддержания клеточной антиокси-
дантной защиты. Во всех концентрациях аминокислоты присут-
ствуют в равных соотношениях. Не содержит электролиты.
Показания к применению
Состояния, требующие дополнительного или полного парен-
терального питания, когда достаточное питание больного нель-
зя обеспечить пероральным или энтеральным путем. Предназна-
чен больным с базисной или средней степенью метаболической
215
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
нагрузки. Сбалансированный спектр аминокислот в комбинациях
со специальными аминокислотными соединениями делает пре-
Таблица 1.19. Характеристика препаратов серии неонутрин
(Infusia)
Состав, г/л 5 %-ный раствор 10 %-нЫй раствор 15 %-ный раствор
Изолейцин 2,5 5,0 7,5
Лейцин 4,0 8,0 12,0
Лизин моногидрат 4,05 8,1 12,15
Метионин 1,75 3,5 5,25
Фенилаланин 3,25 6,5 9,75
Треонин 2,2 4,4 6,6
Триптофан 1Д 2,2 3,3
Валин 3,5 7,0 10,5
Гистидин 1,75 3,5 5,25
Ацетилцистеин (цистеин) 0,6(0,45) 1,1(039) ,34)
Цистин 0,4 0,4 0,4
Пгицилтирозин дигидрат 1,5 (0,99) 3,0(1,98) 4,5 (2,97)
(тирозин, глицин) 0,41 0,82 1,23
Тирозин 0,3 0,3 0,3
Общий тирозин 1,29 2,28 3,27
Аланин 3,0 5,0 9,0
Аргинин 4,5 9,0 13,5
Аспарагиновая кислота 1,75 3,5 5,25
Аспарагинат моногидрат 2,0 4,0 6,0
Глютаминовая кислота 5,0 10,0 15,0
Глицин 2,75 5,5 8,25
Общий глицин 3,16 6,32 9,48
Пролин 3,0 6,0 9,0
Серин 2,0 4,0 6,0
Динатрийэдетиновый 0,02 0,02 0,02
дегидрат
Натрий дисульфат 0,20 0,20 0,20
Вода для инъекций 1000 мл 1000 мл 1000 мл
Общие аминокислоты 50 99,3 148,7
Общий азот 7,5 14,9 22,3
Теоретическая 385 мосм/л 766 мосм/л 1144 мосм/л
осмолярность
PH 6,0-7,2 6,0-7,2 6,0-7,2
216
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
парат подходящим при гиперкатаболических состояниях, рас-
стройстве функций органов и в детской практике. Нет противо-
показаний для использования у беременных и кормящих женщин.
Противопоказания: состояние шока; олигурическая почечная
недостаточность при отсутствии диализа; врожденное расстройство
аминокислотного обмена.
Препарат не предназначен для использования у недоно-
шенных и детей младше 2 лет.
Возможны одиночные случаи проявления непереносимости в
виде тошноты и рвоты, что обычно проходит после понижения ско-
рости введения.
Таблица 1.20. Методы введения и дозы
Степень ме- таболичес- кой нагрузки Аминокис- лоты, г/кг массы тела 5 %-ный р-р, мл/сутки для взрослого 10 %-ный р-р, мт/сугкидая взрослого 15 %-ный р-р, мл/сутки для взрослого
Базовая Средняя Высокая 0,7-1,0 1,0-1,5 1,5-2,0 1000-1400 1400-2100 500-700 700-1100 1100-1400 330-470 470-700 700-1000
Предельная скорость вливания — 0,1 г аминокислот на 1 кг
массы тела в час, т. е. не более 150 мл 5 %-ного раствора, 75 мл
10 %-ного раствора и 50 мл 15 %-ного раствора в час для взро-
слого пациента. Более точным будет расчет на массу тела.
Неонутрин 5 %-ный предназначен только для введения в пе-
риферические вены. Продолжительность вливания 1 упаковки
(500 мл) составляет 4—6 часов.
Неонутрин 10 %-ный предназначен прежде всего для введе-
ния по центральному венозному катетеру и для приготовления
состава «все в одном».
Неонутрин 15 %-ный предназначен только для центрально-
го венозного катетера и приготовления состава «все в одном».
Необходимо добавлять основные электролиты по табличным
данным (см. табл. 1.20) или по наблюдению за балансом.
Форма выпуска и условия хранения. Хранить в сухом защищен-
ном от света и мороза месте при температуре 10—25 °C. После сро-
217
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ка годности, указанного на упаковке, препарат становится не-
годным для применения. Упаковка 500 мл.
Аминокислотные растворы для больных
с патологией почек
Для больных с патологией почек предназначены растворы,
состоящие из незаменимых аминокислот и не содержащие элек-
тролиты (табл. 1.21). Введенные аминокислоты и мочевина ор-
ганизма используются для построения заменимых аминоки-
слот, что приводит к росту уровня общего белка и снижению мо-
чевины в крови и моче.
Таблица 1.21. Аминокислотные растворы для больных
с патологией почек
Состав Аминосгерил КЕ Нефро Нефрамнн
Валин, г/л 9,53 0,64
Гистидин, г/л 4,9 0,25
Изолейцин, г/л 7,52 0,56
Лейцин, г/л 11,32 0,88
Лизин, г/л 9,63 0,64
Метионин, г/л 6,59 0,88
Треонин, г/л 6,78 0,4
Триптофан, г/л 2,91 0,2
Фенилаланин, г/л 7,76 0,88
Цистеин/цистин - 0,02
Яблочная к-та, г/л 6,53 -
Сорбит 25 -
Ксилит 25 -
Натрий, ммоль/л - 5
Общий азот, г/л 8,8 5,4
Осмолярность, мосм/л 835 435
Аминосгерил КЕ Нефро
Аминосгерил КЕ Нефро (Fresenius Kabi) — 6,7 %-ный ра-
створ 8 классических незаменимых аминокислот. Содержит так-
же незаменимую для уремии аминокислоту гистидин, а также
218
ГЛАВЛ 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ_____________
углеводы сорбит и ксилит. Не содержит заменимых аминокислот
и электролитов. Содержание общего азота — 8,8 г/л. Теоретиче-
ская осмолярность — 835 мосм/л. Выпускаются варианты и без
углеводов.
Показания к применению
Препарат используется для проведения ПП при развитии у
больного послеоперационной азотемии, при явлениях острой и
хронической почечной недостаточности, для заместительной
терапии при потере аминокислот в результате диализа или гемо-
фильтрации. Согласно теории Josephson из незаменимых амино-
кислот и повышенного количества сывороточной мочевины у
больных с хронической почечной недостаточностью происходит
построение собственного белка. Одновременно вводится доста-
точное количество калорий (не менее 35 ккал/кг массы тела).
Противопоказания
Нарушения метаболизма аминокислот, хроническая сер-
дечная недостаточность в фазе декомпенсации, повышенная
чувствительность к компонентам препарата, анурия, непере-
носимость фруктозы и сорбита, отравление метанолом, дефицит
фруктозо-1,6-дифосфатазы.
Методы введения и дозы
Препарат вводится внутривенно капельно по 250—500 мл
ежедневно по окончании диализа. Максимальная скорость вли-
вания при массе пациента 70 кг должна составлять около 20 ка-
пель в минуту. Возможно введение в периферические вены.
Форма выпуска: флаконы по 250 мл.
Нефрамин
Нефрамин (Eczacibasi-Baxter) — 5,4 %-ный инфузионный
раствор незаменимых аминокислот и гистидина. Содержание об-
щего азота — 6,5 г/л. Расчетная осмолярность—435 мосм/л. Кон-
центрация электролитов: натрия — 5 мэкв/л, ацетата — 44 мэкв/л,
хлоридов — 3 мэкв/л.
Показания к применению
Взрослым и детям, больным уремией, в комплексной тера-
пии для парентерального питания. Обеспечивает синтез бел-
ков организма без увеличения мочевины в крови, нормализует
азотистый баланс. Вводится с достаточным обеспечением энер-
гетическими калориями.
219
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Противопоказания
Больным с некоррегируемым электролитным и кислотно-
щелочным дисбалансом, гипераммониемией, пониженным
объемом циркулирующей крови, врожденными нарушениями
аминокислотного метаболизма или повышенной чувствительно-
стью к одной или более аминокислотам, присутствующим в ра-
створе.
Методы введения и дозы
Максимальная суточная доза для взрослых — 500 мл в соче-
тании с концентрированным раствором глюкозы. Скорость вве-
дения — не более 20 капель в минуту в центральные и перифе-
рические вены.
Форма выпуска: флаконы по 500 мл.
Нефротек
Весьма перспективным для ПП больных с почечной недо-
статочностью является препарат нефротек (Fresenius Kabi), ко-
торый представляет собой сбалансированный 10 %-ный раствор
незаменимых и заменимых аминокислот и дипептида глицил-ти-
розина. Общее содержание азота — 16,3 г/л.
Форма выпуска: флаконы по 250, 500 мл.
В настоящее время препарат в России не зарегистрирован.
Аминокислотные растворы для больных
с заболеваниями печени
Растворы аминокислот, используемые при патологии пече-
ни, характеризуются снижением доли ароматических амино-
кислот и обогащением растворов аминокислотами с разветвлен-
ными боковыми цепями, которые тормозят проникновение аро-
матических аминокислот через гепатоэнцефалопатический
барьер (табл. 1.22).
Аминоплазмаль Гепа 10 %-ный
Аминоплазмаль Гепа 10 %-ный (В. Braun) представля-
ет собой раствор для парентерального питания, применяе-
мый при лечении больных с печеночной недостаточно-
стью. Он содержит 20 левовращающих изомеров аминоки-
слот, адаптированных для больных печеночной энцефало-
патией (повышенное содержание разветвленных аминоки-
слот за счет снижения содержания ароматических амино-
220
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Таблица 1.22. Состав некоторых аминокислотных растворов
для больных с заболеваниями печени
Состав Аминосгерил N-Гепа 5 %-ный Аминосгерил N-Гепа 8 %-ный Аминоплаз- маль Гепа 10 %-ный
Аланин, г/л 2,90 4,64 8,3
Аргинин, г/л 6,70 10,72 8,8
Аспарагиновая кислота, г/л - - 2,5
Аспарагин, г/л - - 0,48
Валин, г/л 6,30 10,08 10,6
Глицин, г/л - - 6,3
Гистидин, г/л 1,75 2,8 4,7
Глютаминовая кислота, г/л - - 5,7
Изолейцин, г/л 6,5 10,4 8,8
Лейцин, г/л 8,18 13,09 13,6
Лизин, г/л 4,3 9,71 7,51
Метионин, г/л 0,40 1,1 1,2
Пролин, г/л 3,58 5,73 7,1
Серин, г/л 1,40 2,24 3,7
Тирозин, г/л - - 0,67
Треонин, г/л 2,75 4,4 4,6
Триптофан, г/л 0,44 0,7 1,5
Фенилаланин, г/л 0,55 0,88 1,6
Цистин/цистеин, г/л /0,52 /0,52 /0,59
Ледяная уксусная кислота, г/л 2,66 4,42 -
Аминоуксусная, кислота, г/л 3,73 5,82 6,3
Орнитин, г/л - - 1,3
Общий азот, г/л 8,1 12,9 15,3
Осмолярность, мосм/л 480 770 875
221
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
кислот). Содержание общего азота — 15,3 г/л. Осмоляр-
ность — 875 мосм/л.
Показания к применению
Парентеральное питание у больных с печеночной недоста-
точностью, в том числе с явлениями энцефалопатии, а также у
больных, находящихся в состоянии печеночной комы.
Противопоказания. Нарушения аминокислотного метаболиз-
ма внепеченочной этиологии, гипергидратация, ацидоз, гипо-
калиемия.
Методы введения и дозы: суточная доза — 7—15 мл/кг массы
тела. Вводить преимущественно в центральные вены.
При лечении печеночной комы рекомендуется следующая
скорость введения препарата:
Время введения 1-й и 2-й час 3-й и 4-й час с 5-го часа и далее
Скорость вве- дения, мл/час 150 (50 капель/мин) 75 (25 капель/мин) 45 (15 капель/мин)
Форма выпуска: флаконы по 500 мл.
Аминостерил N-Гепа 5 %-, 8 %-ный
Аминостерил N-Гепа 5 %-, 8 %-ный (Fresenius Kabi) — это ами-
нокислотный препарат для ПП пациентов с печеночной недостаточ-
ностью. В профиле незаменимых и заменимых аминокислот 42% раз-
ветвленных аминокислот и только 2 % ароматических аминоки-
слот. Не содержит электролитов и углеводов. Содержание общего азо-
та в 5 %-ном растворе — 8,1 г/л, в 8 %-ном растворе —12,9 г/л. Тео-
ретическая осмолярность расна соответственно 480 и 770 мосм/л.
Показания к применению
Препарат используется для проведения парентерального
питания в случаях выраженного дефицита белка в организме
больного на фоне нарушений функции печени, в том числе со-
провождающихся энцефалопатией и комой.
Противопоказания
Нарушения метаболизма аминокислот, состояние гипер-
гидратации, гипокалиемия, гипонатриемия, хроническая сердеч-
ная недостаточность в фазе декомпенсации, беременность, дет-
ский возраст.
222
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
Побочные эффекты
Внутривенное введение препарата может приводить к повы-
шению образования соляной кислоты и обострению эрозивно-
язвенных поражений желудочно-кишечного тракта.
Методы введения и дозы
Препараты вводятся внутривенно капельно в центральные
и периферические вены в следующем режиме (табл. 1.23):
Таблица 1.23
Режим дозирования Модификация препарата
Аминостерил Гепа 5 %-ный Аминостерил Гепа 8 %-ный
Скорость введения 40—50 капель в минуту 30—35 капель в минуту
Средняя доза (для больного массой 70 кг) 1,7—2,1 мл/кг 1,3—1,5 мл/кг
Максимальная суточная доза 1,5 г аминокислоты/кг 1,5 г аминокислоты/кг
Форма выпуска-, флаконы по 500 мл.
Аминокислотные растворы, применяемые в педиатрии
В педиатрии предпочтительнее использовать специали-
зированные аминокислотные растворы, которые кроме 18 ами-
нокислот, необходимых для синтеза белка, содержат сульфоа-
минокислоту таурин, необходимую для нормального функци-
онирования сетчатки и других тканей (табл. 1.24). Аминокисло-
ты подобраны в пропорции, соответствующей соотношению
аминокислот в материнском молоке.
Ваминолакт
Ваминолакт (Fresenius Kabi) — раствор для осущест-
вления программ парентерального питания в педиатрии.
В состав препарата, кроме 18 аминокислот, необходимых
Для синтеза белка, входит сульфоаминокислота таурин,
необходимая для нормального функционирования сетчат-
ки и других тканей. Аминокислоты подобраны в пропорции,
соответствующей соотношению аминокислот в материн-
ском молоке.
223
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Таблица 1.24. Состав некоторых аминокислотных раство-
ров, используемых в педиатрии
Состав Ваминолакт Аминовеноз N детский 6 %-ный Аминовен инфант 10 %-ный
Аланин, г/л 6,3 4,3 9,3
Аргинин, г/л 4,1 3,84 7,5
Аспарагиновая кислота, г/л 4,1 - -
Валин, г/л 3,6 4,25 9,0
Гистидин г/л 2,1 2,48 4,76
Глицин, г/л 2,1 - 4,15
Глютаминовая кислота, г/л 7,1 - -
Изолейцин, г/л 3,1 3,84 8,0
Лейцин, г/л 7,0 6,45 13,0
Лизин, г/л 5,6 4,25 8,51
Метионин, г/л 1,3 2,58 3,12
Пролин, г/л 5,6 9,71 9,71
Серин, г/л 3,8 5,42 7,67
Тирозин, г/л 0,5 3,29 4,2
Треонин, г/л 3,6 3,09 4,4
Триптофан, г/л 1,4 1,1 2,01
Фенилаланин, г/л 2,7 2,74 3,75
Цистин/цистеин, г/л 1,0 0,38 0,52
Таурин, г/л 0,3 - 0,4
Аминоуксусная кислота, г/л - 2,48 4,14
Яблочная кислота, г/л - 0,75 2,62
Общий азот, г/л 9,3 8,6 14,9
Осмолярность, мосм/л Гипертоничен 520 885
Показания к применению
Препарат используется для проведения парентерального
питания новорожденных, грудных детей и детей более старше-
го возраста.
Противопоказания
Препарат противопоказан больным с выраженными нару-
шениями функции печени, тяжелой уремией (при отсутствии
возможности проведения диализа).
224
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Побочные эффекты
Возможно развитие тромбофлебита в месте инъекции пре-
парата. Со стороны желудочно-кишечного тракта возможна ре-
акция в виде тошноты.
Методы введения и дозы
Препарат вводится внутривенно капельно из расчета
30—35 мл/кг в сутки новорожденным и грудным детям. Детям
старше 1 года препарат назначают в дозе, рассчитанной на 1 кг
массы тела, ориентируясь на данные табл. 1.25:
Таблица 1.25
Масса тела, кг Доза препарата в сутки, мл/кг
10-20 24,0-18,5
20-30 18,5-16,0
30-40 16,0-14,5
Для обеспечения оптимальной утилизации вводимых ами-
нокислот необходимо повысить энергетическую ценность ра-
створа. Этого можно достичь, осуществляя одновременное вве-
дение ваминолакта и раствора глюкозы или изотонической жи-
ровой эмульсии.
Форма выпуска: флаконы по 100, 250 и 500 мл.
Аминовен инфант 10 %-ный
Аминовен инфант 10 %-ный (Fresenius Kabi) — аминоки-
слотный раствор для парентерального питания в педиатрической
практике. Содержит 52 % незаменимых аминокислот и 30 %
разветвленных аминокислот, кроме того, таурин — аминоки-
слоту, незаменимую для новорожденных. Содержание общего
азота — 14,9 г/л. Осмолярность — 885 мосм/л. Не содержит
электролитов и углеводов.
Показания
Парентеральное питание детей разных периодов жизни (не-
доношенных, новорожденных, грудничков и детей более стар-
шего возраста). Применяется совместно с расчетным количе-
ством углеводов, жиров, витаминов, электролитов и микроэле-
ментов.
Противопоказания
В соответствии с подобными препаратами.
225
______________________ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Дозировки
Максимальные суточные дозы следующие:
• 1 год — 15—25 мл/кг массы тела;
• 2—5 лет — 15 мл/кг;
• 6—14 лет — 10 мл/кг массы тела.
Форма упаковки: флаконы по 100,250 мл.
Препараты с повышенным содержанием глютамина
Дипептивен
Дипептивен (Fresenius Kabi) — активный компонент дипеп-
тивена М(2)-Ь-аланил-Ь-глютамин. 100 мл препарата содержат
20 г активного компонента (соответственно: L-аланина — 8,2 г,
L-глютамина — 13,46 г). Теоретическая осмолярность —
921 мосм/л. Показатель pH — 5,4—6,0. Максимальная концен-
трация — 3,5 %.
Показания к применению
Дипептивен используется как часть внутривенного питания
в качестве добавки к аминокислотным и инфузионным раство-
рам, в состав которых входят аминокислоты. Возмещает дефи-
цит глютамина при повышенном его потреблении в рамках па-
рентерального питания.
Противопоказания
Не следует вводить больным с тяжелой почечной недостаточ-
ностью (клиренс креатинина менее 25 мл/мин), тяжелой печеноч-
ной недостаточностью, тяжелым метаболическим ацидозом или
с повышенной чувствительностью к одному из ингредиентов
препарата. Отсутствуют данные о применении дипептивена у
беременных женщин, кормящих матерей и детей, поэтому вве-
дение препарата больным этих групп не рекомендуется.
Способ применения и дозы
Дипептивен предназначен для инфузии в центральные ве-
ны после добавления к совместимому раствору-носителю. В за-
висимости от тяжести катаболического состояния суточная до-
за составляет 1,5—2,0 мл/кг массы тела. Максимальная суточная
доза — 2,0 мл/кг, что соответствует 0,4 г М(2)-Ь-аланил-Е-глю-
тамина /кг.
Добавление дипептивена к аминокислотнуму раствору-но-
сителю рекомендуется проводить следующим образом:
226
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ_____________
• если суточная потребность в аминокислотах составляет 1,5 г/кг,
то необходимо ввести 1,2 г аминокислот и 0,3 г дипептивена;
• если суточная потребность а аминокислотах составляет
2 0 г то вводят 1,6 г аминокислот и 0,4 г дипептивена на 1 кг.
В среднем 100 мл дипептивена добавляют к 500 мл раство-
ра аминокислот. Скорость инфузии зависит от скорости введе-
ния раствора-носителя и не должна превышать 0,1 г аминоки-
слот на 1 кг массы тела в час. Длительность применения не дол-
жна превышать 3 недель.
форма упаковки и условия хранения. Препарат выпускается в
стеклянных флаконах по 50 и 100 мл. Хранят при температуре не
выше 25 °C. Не использовать дипептивен после окончания сро-
ка хранения, указанного на упаковке. Смешивать дипептивен с
раствором-носителем следует сразу же после вскрытия флако-
на, и данная смесь хранению не подлежит.
Присутствие в программе ПП добавок глютамина или ами-
нокислотных растворов с высоким содержанием глютамина
способствует профилактике атонии кишечника, сопровождаю-
щей длительное ПП.
Компоненты энергообеспечения
Для того чтобы белок полностью использовался на пласти-
ческие цели, необходимо каждый грамм вводимого азота обес-
печивать 150 ккал энергии. Считается, что энергетические по-
требности организма должны удовлетворяться калориями, по-
лученными от усвоения углеводов и жиров в соотношении
70 : 30 % или 60 : 40 %.
1.7.2. Углеводы:
• глюкоза;
• фруктоза;
• многоатомные спирты: сорбитол, ксилитол.
Особенности их применения — см. разд. 1.7 «Препараты па-
рентерального питания».
1.7.3. Жировые эмульсии
Жировые эмульсии являются не только энергетическим
компонентом ПП, но и источником незаменимых жирных ки-
слот и фосфора (табл. 1.26). По своим изоосмолярным свой-
227
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ствам могут вводиться в периферические вены. Не терпят сме-
шивания с другими растворами и лекарственными препаратами.
Таблица 1.26. Состав некоторых жировых эмульсий
Составляющие компоненты Интрали- пид Липофун- динС Липофун- дин МСТ/ЛСТ Липовеноз
Соевое масло, г 100-200 100-200 50-100 100-200
Яичные фосфоли- пиды, г 12 12
Соевые фосфолипи- ды, г - 7,5-15 - -
Среднецепрочечные триглицериды, г - - 50-100
Яичный лецитин, г - - - 12
Глицерол, г 22,5 25 - 25
Ксилитол, г - 50 - -
Дистиллированная вода, мл 1000 1000 1000 1000
Энергетическая ценность, ккал/л 1100-2000 1100-2000 1058-1908 1100-2000
Осмолярность, мосм/кг Н2О 310-60 310-360 345-380 310-360
Интралипид
Классика жировых эмульсий — интралипид, являющийся
источником энергии и эссенциальных жирных кислот.
Интралипид содержит фракционированное соевое масло,
эмульгированное с фосфолипидами яичного желтка. Соевое
масло состоит из смеси триглицеридов преимущественно поли-
ненасыщенных жирных кислот. Размер липидных глобул и био-
логические свойства интралипида идентичны таковым у хило-
микронов. Интралипид удаляется из кровотока посредством та-
ких же метаболических превращений, как и хиломикроны, и
утилизируется как источник энергии. Интралипид предотвраша-
228
HI aba 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
ет развитие недостаточности эссенциальных жирных кислот и
позволяет корригировать клинические проявления этого синдро-
ма. Препарат выпускается в концентрации 10, 20 и 30 %. Изо-
осмолярен.
Показания к применению
Интралипид используется как источник энергии и эссен-
циальных жирных кислот у больных, нуждающихся в паренте-
ральном питании.
Меры предосторожности
Интралипид должен применяться с осторожностью при за-
болеваниях, протекающих с нарушением обмена жиров, таких
как почечная недостаточность, сахарный диабет, панкреатит,
нарушение функции печени, гипотиреоз (если наблюдается ги-
пертриглицеридемия) и сепсис. Если он назначается таким боль-
ным, необходим тщательный контроль уровня триглицеридов в
сыворотке.
У больных с аллергией на соевый белок интралипид необхо-
димо применять с осторожностью и только после проведения ал-
лергических проб.
Повышенное внимание необходимо при использовании
препарата для новорожденных и недоношенных детей с гипер-
билирубинемией, а также при подозрении на легочную гипер-
тензию. У новорожденных, особенно у недоношенных, при дли-
тельном проведении ППП необходим контроль количества
тромбоцитов, печеночных проб и концентрации триглицеридов
в сыворотке крови.
Интралипид может оказывать влияние на результаты опре-
деленных лабораторных исследований (билирубин, ЛДГ, насы-
щение кислородом, гемоглобин и др.) в тех случаях, когда забор
крови производится до полного удаления жира из сосудистого
русла. Вследствие этого указанные исследования желательно
проводить спустя 5—6 ч после завершения инфузии препарата.
Форма упаковки: флаконы по 100, 250, 500 мл.
Липовеноз
Липовеноз (Fresenius Kabi) — жировая эмульсия для парен-
терального питания, полученная на основе соевого масла. Явля-
ется источником энергии и незаменимых жирных кислот. Суще-
ствует в концентрации 10 и 20 %. Изоосмолярен.
229
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Показания к применению
Препарат используется для проведения программ ча-
стичного или полного парентерального питания (в комбина-
ции с растворами аминокислот и углеводов) в предопераци-
онном и послеоперационном периодах, при оперативных
вмешательствах и заболеваниях желудочно-кишечного трак-
та, при тяжелых ожогах, при нарушениях функции почек,
при кахексии.
Противопоказания
Общие противопоказания для проведения ПП, а также вы-
раженные нарушения липидного обмена (тяжелые поражения пе-
чени, шок, декомпенсированный сахарный диабет, тяжелая фор-
ма почечной недостаточности), геморрагические диатезы,
1-й триместр беременности.
Побочные эффекты
При применении препарата возможно незначительное по-
вышение температуры тела, озноб, тошнота, рвота, одышка, го-
ловная боль, боль в спине, костях, грудине и пояснице.
Дозировки и применение
Препарат вводится внутривенно капельно. Суточную дозу
препарата определяют из расчета 2 г жиров на 1 кг или 20 мл
10 %-ного (10 мл 20 %-ного) раствора на 1 кг в час. Начальная
скорость введения составляет 50 мг/кг в час. Максимальная
скорость введения — 100 мг/кг в час. Препарат необходимо со-
четать с введением углеводов и аминокислотных растворов.
Форма выпуска: флаконы по 100, 250 и 500 мл.
Липофундин МСТ/ЛСТ
Липофундин МСТ/ЛСТ (В. Braun) — жировая эмульсия
для парентерального питания на основе соевого масла. Источ-
ник энергии и незаменимых (полиненасыщенных) жирных ки-
слот. Является жировой эмульсией второго поколения, содержа-
щей 50 % длинноцепочечных и 50 % среднецепочечных три-
глицеридов. Среднецепочечные триглицериды покидают крове-
носное русло и окисляются в организме значительно быстрее
длинноцепочечных, т. к. их метаболизм не зависит от активно-
сти фермента карнитинпальмитоилтрансферазы. В связи с этим
липофундин МСТ/ЛСТ быстрее других жировых эмульсий ус-
ваивается организмом из кровяного русла и защищает печень от
230
ГПАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ____________
ожирения и дисфункции, положительно воздействует на им-
мунную систему. Существует в концентрации 10 и 20 %. Изоосмо-
лярен.
Показания к применению
Применение липофундина МСТ/ЛСТ показано как источ-
ник энергии у больных, нуждающихся в полном парентеральном
питании. При осуществлении ППП в течение 5 суток и более яв-
ляется источником незаменимых жирных кислот с целью пре-
дупреждения их дефицита.
Противопоказания
Нестабильность основных жизненно важных систем орга-
низма, а также нарушения жирового обмена в виде патологиче-
ской гиперлипидемии, жирового нефроза или острого панкре-
атита, сопровождаемого гиперлипидемией.
Методы введения и дозы
У взрослых липофундин МСТ/ЛСТ может обеспечивать до
60 % суточных небелковых калорий с дозой 1—2 г/кг в сутки.
Липофундин МСТ/ЛСТ 10 %-ный. Первые 15 минут ско-
рость инфузии 0,5—1,0 мл/кг в час, затем — до 2 мл/кг в час.
Липофундин МСТ/ЛСТ 20 %-ный. Первые 15 минут ско-
рость инфузии 0,25—0,5 мл/кг в час, затем — до 1 мл/кг в час.
Инфузию препарата следует сопровождать одновременным
переливанием углеводных растворов, калорийность которых
должна составлять не менее 40 % от общей калорийности пере-
ливаемых растворов ПП.
Форма выпуска: флаконы по 100,250 и 500 мл.
Инфузолипол
Инфузолипол — первая отечественная жировая эмульсия для
парентерального питания. Основным компонентом эмульсии яв-
ляется соевое масло, эмульгатором служит соевый лецитин.
Изотоничность препарата обеспечивается 5 %-ным раствором
сорбита. Тонкая очистка компонентов и высокая степень диспер-
сности (размер глобул 0,2—0,6 мкм) способствует наилучшему
усвоению и снижению ректогенности препарата. Калорийность
препарата — 1200 ккал в 1000 мл. Снабжает организм триглице-
ридами, фосфором, незаменимыми жирными кислотами. Под-
держивает нормальный липидный состав и способствует восста-
новлению поврежденной липидной структуры клеточных мем-
231
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
бран. Проявляет азотсберегающее действие. Не вызывает на-
рушений в системе свертывания крови. Выводится из сосудисто-
го русла в течение 24 ч. Идентичен интралипиду.
Показания к применению:
• В предоперационном и послеоперационном периодах
(при операциях на желудочно-кишечном тракте, у онкологиче-
ских больных).
• При длительных бессознательных состояниях и анорек-
сии нервного происхождения.
• При лучевой терапии с применением цитостатических средств.
Противопоказания общие для всего парентерального пита-
ния в целом, нарушения липидного обмена.
Способ применения и дозы
Препарат вводится внутривенно со скоростью 20 капель в
минуту. Суточная доза: 1—2 г жира/кг массы тела.
Форма выпуска и условия хранения
Выпукают инфузолипол в стеклянных бутылках по 200 и
400 мл. Хранят в защищенном от света месте при температуре
4—8 °C. Замораживанию не подлежит. Срок годности 2 года.
1.7.4. Добавки к препаратам парентерального питания
ПП (особенно ППП) не может ограничиваться только вве-
дением основных продуктов питания (белки, жиры, углеводы).
Большинство микроэлементов и витаминов являются кофакто-
рами или катализаторами активности ферментов, что делает их
незаменимыми в регуляции биосинтетических процессов. Вве-
дение микроэлементов и витаминов в программу ПП является
необходимым условием оптимальной утилизации основных
продуктов и сохранения нормальной функции тканей.
Потребности в них могут варьировать в зависимости от воз-
никшей ситуации: характера заболевания, необходимости их
восполнения, сопутствующей патологии или профилактики ин-
токсикации. В большинстве случаев при адекватной калорийно-
сти ПП стандартные растворы электролитов, витаминов и микро-
элементов обеспечивают их суточные потребности в организме.
Алламель N
Аддамель N (Fresenius Kabi) — добавка микроэлементов к
инфузируемым питательным растворам. Комбинированный
232
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
препарат, действие которого определяется эффектами микроэле-
ментов, входящих в его состав (табл. 1.27).
Таблица 1.27. Состав адцамеля Н (мкмоль на 1 мл)
Хром (в виде хлорида гидрата) 0,02
Медь (в форме хлорида гидрата) 2,0
Железо (в форме хлорида гидрата) 2,0
Марганец (в форме хлорида гидрата) 0,5
Йод (в форме иодида калия) 0,1
Фтор (в форме натрия фторида) 5,0
Молибден (в форме молибдата натрия гидрата) 0,02
Селен (в форме селенита натрия гидрата) 0,04
Цинк (в форме хлорида) 10,0
Прочие ингредиенты', сорбитол, соляная кислота, вода для
инъекций.
Показания
Парентеральное питание ( в качестве добавки к растворам
аминокислот). Препарат можно назначать как взрослым, так и
детям (с учетом суточной потребности в микроэлементах у па-
циентов разного возраста).
Противопоказания
Повышенная чувствительность к компонентам препарата.
Режим, дозирования
После растворения препарат добавляют к растворам амино-
кислот. Не рекомендуется добавлять к препарату другие инфу-
зионные растворы.
Форма выпуска и условия хранения
Ампулы по 10 мл. Сохраняется при комнатной температу-
ре. Срок годности 2 года.
Виталипид N
Виталипид N (Fresenius Kabi) — добавка жирорастворимых
витаминов к жировой эмульсии. Виталипид N выпускается в
Двух формах: для взрослых и для детей (см. табл. 1.28).
Прочие ингредиенты-, очищенное соевое масло, очищенные
Фосфолипиды куриного яйца, глицерин, натрия гидроокись.
233
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Таблица 1.28. Состав виталипида N на 1 мл препарата
Ингредиенты Модификация препарата
Виталипид N взрослый Виталипид N детский
Ретинола пальмитат, мкг 194,1 135,3
Эргокальциферол, мкг 0,5 1
Альфа-токоферол, мкг 910 640
Фитоменадион, мкг 15 20
Специальная витаминсодержащая добавка к интралипиду
для парентерального питания взрослых и детей старше 11 лет д ля
удовлетворения суточной потребности в жирорастворимых ви-
таминах. Осмолярность — около 300 мосм/л.
Показания
Добавка к растворам для парентерального питания.
Противопоказания
Повышенная чувствительность к компонентам препарата.
Побочные эффекты
Возможны аллергические реакции на компоненты препарата.
Способы введения и дозировки
Рекомендуемая суточная доза для взрослых составляет 10 мл
эмульсии, для детей в возрасте до 11 лет дозу рассчитывают ис-
ходя из 1 мл/кг массы тела ребенка.
Эмульсию виталипида добавляют к основной жировой
эмульсии не ранее, чем за час до начала инфузии. Во избе-
жание микробного загрязнения инфузию следует завершить
в течение 24 ч.
Форма выпуска и условия хранения
Ампулы по 10 мл. Хранят в темном месте при температуре
+2...+8 °C. Срок годности 2 года.
Солувит N
Солувит N (Fresenius Kabi) — поливитаминная добавка к ин-
фузионным растворам. Представляет собой комплекс водора-
створимых витаминов и имеет следующий состав (на 1 флакон)
(см. табл. 1.29):
234
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ
Таблица 1.29. Состав солувита на 1 дозу препарата
Тиамина моногидрат, мг 3,1
Рибофлавина натрия фосфат, мг 4,9
Никотинамид, мг 40
Пиридоксина гидрохлорид, мг 4,9
Пантотенат натрия, мг 16,5
Аскорбат натрия, мг 113
Фолиевая кислота, мг 0,4
Цианокобаламин, мкг 5
Показания к применению
Препарат представляет собой комплекс водорастворимых
витаминов, добавляемых в питательные смеси при осуществле-
нии программ ППП.
Противопоказания
Повышенная чувствительность к компонентам препарата.
Побочные эффекты
Аллергические реакции на компоненты препарата.
Режим дозирования
После растворения препарат добавляют к растворам глюкозы.
Препарат можно назначать как взрослым, так и детям с
учетом возрастных потребностей.
Форма выпуска и условия хранения
Сухое вещество 1 мл во флаконе. Хранят при температуре от
+6 до +15 °C в защищенном от света месте.
Список основной литературы
1. Афонин Н.И., Гольдина О.А., Горбачевский Ю.В. Совре-
менные аспекты получения аутологичной крови с исполь-
зованием плазмозамещающих растворов на основе ги-
дроксиэтилированного крахмала для последующей гемо-
трансфузии // Вестник службы крови России. 1998. № 4
(октябрь). С. 37-41.
2- Барышев Б. А. Применение препарата гелофузин в клини-
ках СПбГМУ им. акад. И.П. Павлова// Тез. докладов. Но-
вое в трансфузиологии: опыт клинического применения
235
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
плазмозамещающего препарата гемодинамического дей-
ствия гелофузин. СПб., 1997. С. 3, 7.
3. Барышев Б.А. Кровезаменители. Справочник для врачей.
СПб., 2001.
4. Вретлинд А., Суджян А. Клиническое питание. Стокгольм;
М„ 1990.
5. Гольдина О .А., Горбачевский Ю.В. Гемодилюционная те -
рапия с использованием плазмозамещающих растворов
гидроксиэтилированного крахмала при нарушениях ми-
кроциркуляции Ц Вестник интенсивной терапии. 1998.
№ 3. С. 25-32.
6. Дуткевич И. Г. Перспективы использования препаратов
модифицированного желатина в медицине катастроф //
Тез. докладов. Новое в трансфузиологии: опыт клиническо-
го применения плазмозамещающего препарата гемодина-
мического действия гелофузин. СПб., 1997. С. 11—12.
7. Жибурт Е.Б., Чечеткин А.В., Баранова О.В. Плазмозамени-
тели на основе гидроксиэтилированного крахмала в кли-
нической практике // Terra Medica. 1999. № 1. С. 16—18.
8. Исаков Ю.С., Михельсон В.А., Штатнов М.К. Инфузион-
ная терапия и парентеральное питание в детской хирургии.
М„ 1985.
9. Карпун Н. А., Мороз В. В., Руденко М. И. и др. Операци-
онная нормоволемическая гемодилюция при хирургиче-
ском лечении ишемической болезни сердца // Вестник
интенсивной терапии. 1999. № 4. С. 11—18.
10. Костюченко А. Л. Современная инфузионная терапия: до-
стижения и возможности // Мир медицины. 2000. № 1-2.
11. Кротовский А. Г. Аутогемотрансфузия при операциях с ис-
кусственным кровообращением: Автореф. дис. ... канд.
мед. наук. М., 1990.
12. Константинов Б.А., Рагимов А.А., Дадвани С.А. Трансфу-
зиология в хирургии. М., 2000.
13. Кровезаменители, консерванты крови и костного мозга.
Справочник / Под ред. Г.Н. Хлябича. М., 1997.
14. Марино П. Интенсивная терапия. М., 1998.
15. Марютин П. В., Левченко Л. Б., Учваткин В. Г. и соавт.
Кровопотеря — гиповолемия, подходы к инфузионно-
236
ГЛАВА 1. ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ___________
трансфузионной терапии // Анестезиология и реанима-
тология. 1998. № 3. С. 35—41.
16. Марютин П. В., Левченко Л. Б., Учваткин В. Г. Примене-
ние гелофузина в интенсивной терапии пациентов хирур-
гического профиля // Тез. докладов. Новое в трансфузио-
логии: опыт клинического применения плазмозамещающе-
го препарата гемодинамического действия — гелофузина.
СПб., 1997. С. 8-10.
17. Мокеев И.Н. Инфузионно-трансфузионная терапия. Спра-
вочник. М., 1998.
18. Молчанов И.В., Гольдина О.А., Горбачевский Ю.В. Ра-
створы гидроксиэтилированного крахмала — современ-
ные и эффективные плазмозамещающие средства инфу-
зионной терапии. М., 1998.
19. Молчанов И. В., Афонин Н. И., 1орбачевский Ю. В. и со-
авт. Плазмозамещающие растворы на основе желатина —
все в прошлом // Вестник интенсивной терапии. 1999.
№ 3. С. 18-24.
20. Мороз В.В., Дергунов В.А. Трансфузионные средства с
высокой кислородной емкостью (перфторан) в клиниче-
ской медицине. Методы сбережения крови в хирургии.
Рига, 1997.
21. Наймушин А. В., Курапеев И. С., 1ордеев М. Л. Опыт про-
ведения аутогемотрансфузии с использованием гелофу-
зина при операциях аортокоронарного шунтирования //
Вопросы гематологии и трансфузиологии. 2000. № 2.
С. 34-40.
22. Островский А.Г, Карашуров Е.С. Переливание крови, пре-
паратов крови и кровезаменителей. Петрозаводск, 2000.
23. Осипов В. П., Шабалкин Б. В., Кротовский А. Г. Первый
опыт работы по программе полного сохранения крови па-
циента в кардиохирургии // Анестезиология и реанимато-
логия. 1989. № 5. С. 10-12.
24. Перфторорганические соединения в биологии и меди-
цине / Под ред. Г.Р. Иваницкого и В.В. Мороза. Пущи-
но, 2001.
25. Перфторорганические соединения в биологии и медици-
не. Пущино, 1999.
237
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
26. Попов В.В., Молчанов И.В., Карпуничев О.Б. и др.
Базовая интенсивная терапия ишемического цере-
брального инсульта. Метод терапевтической гемоди-
люции // Анестезиология и реаниматология. 2000.
№ 4. С 44-49.
27. Рагимов АА, Крапивкин И.А. Кровосберегающие тех-
нологии в сердечно-сосудистой хирургии. М„ 1999.
28. Рагимов А.А., Щербакова Г.Н., Соловьева И.Н. Паренте-
ральное питание в хирургии. М., 1999.
29. Руководство по военной трансфузиологии / Под ред.
Э.А. Нечаева. М., 1991.
30. Руководство по парентеральному и энтеральному пита-
нию / Под ред. И.Е. Хорошилова. СПб., 2000.
31. Рябов Г. А., Емцов Ю. Г., Титова И. А. Об оценке степени
тяжести состояния реанимационных больных по параме-
трам системы транспорта кислорода // Анестезиология и
реаниматология. 1988. № 5. С. 7—9.
32. Справочник по переливанию крови и кровезаменителей /
Под ред. О. К. Гаврилова. М., 1982.
33. Суханов Ю.С., Аграненко В.А. Аутогемотрансфузии.
М„ 1999.
34. Франке Р. Восполнение объема циркулирующей крови с
использованием коллоидных растворов // Анестезиология
и реаниматология. 1999. № 3. С. 70—76.
35. Ханин А. 3. Гелофузин в практике скорой медицин-
ской помощи // Тез. докладов. Новое в трансфузиоло-
гии: опыт клинического применения плазмозамещаю-
щего препарата гемодинамического действия гелофузин.
СПб., 1997. С. 13.
36. Хартиг В. Современная инфузионная терапия. Паренте-
ральное питание. М., 1982.
37. Чеботкевич Е. Н., Селиванов Е. А. Прионы — новая про-
блема трансфузиологии // Вестник Службы крови Рос-
сии. 1999. № 2. С. 51-57.
38. Шестопалов А. Е., Пасько В. Г. Объемзамещающая тера-
пия волемических нарушений препаратом «гелофузин» у
хирургических больных // Вестник Службы крови Рос-
сии. 1999. № 4 (декабрь).
238
ГЛАВА 1- ТРАНСФУЗИОННО-ИНФУЗИОННОЕ ПОСОБИЕ________________
39. Шевченко Ю.Л., Жибурт Е.Б. Плазмозаменители на осно-
ве гидроксиэтилированного крахмала в клинической прак-
тике. Безопасное переливание крови // Руководство для
врачей. СПб., 2000. С. 268-272.
40. Beards S. С., Watt Tracy, Edwards J. Denis, Nightingale Peter,
Farragher E. Brian. Comparison of the hemodynamic and ox-
ygen transport responses to modified fluid gelatin and hetastarch
in critically ill patients: A prospective, randomized trial //
Critical Care Medicine. 1994.Vol. 22. № 4.
41. Beyer R., HarmeningU., RittmeyerO., Zielmann S., MielckE, Kaz-
maier S. and Kettler D. Use of modified fluid gelatin and hydroxy-
ethyl starch for colloidal volume replacement in major orthopaedic
suigeiy //British Journal of Anesthesia. 1997. № 78. P 44—50.
42. Brodin B. et al. Decrease of plasma fibronectin concentration
following infusion of gelatin-based plasma substitute in man //
Scan. J. Clin. Lab. Invest., 1984. Vol. 44. P. 529—533.
43. Campbell D. H., Koepfli J. B., Pauling L., Abrahamson N.,
Dandliker W., Feigen G. A., Lanni G., Le Rosen A. Tex Rep.
Biol. Med., 1951. № 9. P. 235.
44. Edwards J. Denis, Peter Nightingale, Wilkins Robert G., Fa-
ragher E. Brian. Hemodynamic and oxygen transport respon-
se to modified fluid gelatin in critically ill patients //Critical Ca-
re Medicine. 1989. № 17. P. 996—998.
45. Edwards J. D., Wilkins R. G. Atrial fibrillation precipitated by
acute hypovolemia//Br. Med. J. 1987. Vol. 294. P. 283—284.
46. Gropper A. L„ Raisz L. G., Amspacher W. H. Suig Gynecol Ob-
stet. 1952.Vol. 95. P. 521.
47. Hartman F. W, Behrmann V. G. // JAMA. 1953. Vol. 152.
P.1116.
48. Heynkes R. Gelatin without BSE infectivity can only be produ-
ced from healthy animals // Therapiewoche, 15 October 1996.
Vol. 46. P. 1618-1620.
49. Himpe D., Van Cauwelaert P., Neels H., Stinkens D., Van Den
Fonteyne F., Theunissen W, Muylaert P., Hermans C., Goos-
sens G., Moeskops J., Van Hoof J., Alleman J. and Adriaensen H.
Priming Solutions for Cardiopulmonary Bypass: Comparison of
Three Colloids //Journal of Cardiothoracic and Vascular An-
esthesia. 1991. Vol. 5. № 5 (October). P. 457-466.
239
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
50. Hogan J.J. //JAMA. 1915. Vol. 64. Р. 721.
51. Jansan P.G.M., Н. te Velthuis, Wildevuur W.R., Huybregts
M.A.J.M., Bidder E.R., H.I. van der Spoel, A. Sturk, L. Eijs-
man and C.R.H. Wildevuur. Cardiopulmonary bypass with mo-
dified fluid gelatin and heparin-coated circuits // British Jour-
nal of Anesthesia. 1996. Vol. 76. P. 13—19.
52. Kohler H. Fortachr. Med., 1979. Vol. 97. P. 1809—1813.
53. Lundsgaard-Hansen P. and Tschirren B. Modified Fluid Ge-
latin As a Plasma Substitute // Blood Substitutes and Plasma
Expanders. Alan R. Liss. Inc. New York, N.Y., 1978.
P. 227-257.
54. Mishler J. Synthetic plasma volume expanders — Their phar-
macology, safety and clinical efficacy// Clin. Haematol. 1984.
Vol. 13. № 75.
55. Moore F. D. The Metabolic Care of the Surgical Patient. Phi-
ladelphia//Saunders. 1959. P. 220.
56. Ring J., Messmer K. Incidence and severity of anaphylactoid re-
actions to colloid volume substitutes // Lancet. 1977. P. 466.
57. Salewsky et al. “Der Einflib von kolloidalen Plasmaersatzmit-
teln auf die Freisetzung von L-lalfa und IL-beta in humanen Voll-
blut in vitro 11 Anaesthesist. 1995. Bd. 44. Supp. 1.1.
58. Schmidt-Thome J., Mager A., Schone H. H. Arzneim Forsch.
1962. \bl. 12. P. 378.
59. Shatney С. H., Deepika K., Militello P. R. et al. Efficacy of he-
tastarch in the resuscitation of patients with multisystem trau-
ma and shok // Arch Surg. 1983. Vol. 118. P. 804—809.
60. Starling E. H. J. Physiol. (London). 1896. Vol. 19. P. 312.
61. Tourtelotte D., Williams H.E. Acylated Gelatins and Their
Preparations // US Patent. 1958. № 2. P. 827.419-
62. Videm V., Mollnes T. E. Human complement activation by po-
lygeline and dextran-70 // Scand. J. Immunol. 1994. Vol. 39.
P. 314—320.
63. Watkins J. et al. Complement activation by polystarch and ge-
latin volume expanders // Lancet. 1990. \bl. 335. P. 233.
64. Watkins J., Hardy G. Immunological implications of comple-
ment activation by plasma volume expanders: comparison of po-
lystarch and a gelatin expander // In: Fluid replacement by
eloHaes. 1990. P. 31-32.
ГЛАВА2
Клинические аспекты
состояния и регуляции
кислотно-основного
гомеостаза
Проблема состояния и регуляции кислотно-основного
гомеостаза важна для многих областей медицины, осо-
бенно для хирургии, анестезиологии, реаниматологии,
терапии, педиатрии и клинической патологии. До сих пор для
многих практикующих врачей предмет этот представляет опре-
деленные трудности, что связано с/несколькими обстоятель-
ствами.
Во-первых, предмет физиологии кислотно-основного рав-
новесия в большей мере, чем другие области медицины, непо-
средственно связан с определенными дисциплинами, особенно
с физической химией, а в этой области медицинское образова-
ние не всегда достаточно.
Во-вторых, тему физиологии кислотно-основного равно-
весия (КОР) в традиционном плане учебного цикла часто пре-
подносят в виде разрозненных отрывков. Книг для клиници-
стов на русском языке единицы, так что к тому времени, ког-
да врач готов применить свои знания к диагностике и лечению
больных с нарушением КОР, в его распоряжении в лучшем
случае находится неполная фрагментарная картина измене-
ния гомеостаза.
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
В-третьих, лишь в последние годы у многих больниц и гос-
питалей появилась возможность приобрести анализаторы для ис-
следования КОР, и, таким образом, у врачей появился опыт
применения знаний в клинической практике и, следовательно,
необходимость в практическом пособии по диагностике нару-
шений КОР и их коррекции.
2.1. Общие положения
Среди физико-химических показателей организма важней-
шее место принадлежит кислотно-основному равновесию (КОР)
крови. От соотношения концентраций ионов водорода и ионов
ОН крови зависят активность ферментов, интенсивность оки-
слительно-восстановительных реакций, процессы расщепле-
ния и синтеза белка, окисления углеводов и липидов, чувстви-
тельность клеточных рецепторов к медиаторам и гормонам,
проницаемость клеточных мембран, физико-химические свой-
ства коллоидных систем клеток и межклеточных структур и
многое другое.
Водород — наиболее распространенный атом во всех клет-
ках в основном в составе воды. Ион водорода (Н+) играет глав-
ную роль в образовании кислот и оснований, его концентрация
должна находиться в строгих пределах, иначе клетки погибнут.
Это связано, главным образом, с действием Н+ на форму и функ-
цию белков и активных ферментов. Основание является акцеп-
тором ионов водорода, а кислота — донором ионов водорода.
Большая часть ионов водорода образуется в результате метабо-
лизма углеводов (С6Н12О6 + 6О2 —> 6СО2 + 6Н2О), жиров и белков.
Другим важным продуктом обмена веществ является угле-
кислый газ (СО2), который оказывает влияние на концентрацию
ионов Н. Углекислый газ называется кислотой, хотя к нему и не
присоединен ион Н, поскольку СО2 вступает в реакцию с водой
с образованием углекислоты (Н2СО3). Последняя диссоцииру-
ет с образованием протонов и является, таким образом, ведущим
фактором закисления среды: СО2 + Н2О <=> Н2СО3 <=> Н+ + НСО3.
При постоянной температуре давление газа над поверхно-
стью жидкости определяется количеством нерастворенного га-
242
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
за. Поскольку воздух представляет собой смесь газов, давление
каждого газа пропорционально его молекулярной концентрации.
Оно называется парциальным давлением.
При растворении углекислого газа в воде происходят два
важных события: небольшое количество углекислого газа пре-
вращается в углекислоту — количество образуемой углекисло-
ты прямо пропорционально количеству углекислого газа в ра-
створе и, следовательно, парциальному давлению СО2 (рСО2).
Углекислота является слабой кислотой и лишь в незначительной
степени диссоциирует на ионы водорода и бикарбоната.
Это приводит к тому, что повышение давления СО2 в альве-
олах увеличивает давление СО2 в легочных капиллярах, а также
количество углекислоты во внеклеточной жидкости и наоборот.
Третьим фактором образования водородных ионов являет-
ся соотношение окисленного и восстановленного гемоглобина
(превращение двухвалентного железа в трехвалентное и наобо-
рот): 2Fe++ + 1/2О2+ 2Н+ <=> 2Fe+++ + Н2О.
2.2. Роль водородного иона
Проблема КОР — это прежде всего проблема иона водоро-
да, поэтому основными вопросами являются: где образуется,
какую реакцию вызывает и как выводится этот ион. Нормаль-
ная концентрация водородных ионов настолько важна для ор-
ганизма, что самые незначительные изменения в скорости его
образования или выведения приводят к серьезным нарушениям
общего гомеостаза организма. Баланс ионов водорода в организ-
ме представлен в таблице 2.1.
Таблица 2.1
Накопление Удаление
1.СО2 3000 1. Легкие 13000
2. Лактат 1500 2. Печень/почки 1500
3. Белок, SO4“, РО4 45 3. Титрационныекислоты 30
4. Фосфолипиды 13 4. NH4- 40
5- Другие причины 12
243
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Можно видеть, ЧТО ОСНОВНЫМ ИСТОЧНИКОМ ИОНОВ ВОДО'
рода в клетке является углекислый газ, накапливающейся в
результате распада жиров и углеводов. Кроме того, их нако-
пление происходит при диссоциации органических кислот,
метаболизме белков, преобразовании неорганических ки-
слот, фосфолипидов или в результате каких-то других при-
чин. При условии адекватной работы механизмов компен-
сации соотношение между накопленными и удаленными
ионами Н+ находится в равновесии. Так, СО2 выделяется
легкими, лактат метаболизируется печенью и частично вы-
деляется почками. Почками также удаляются (в виде ти-
трационных кислот и аммония) ионы Н+, накопленные при
метаболизации белков, диссоциации неорганических ки-
слот, фосфолипидов и т. п.
Основные причины накопления водородных ионов сле-
дующие:
1. Дефицит выведения СО2.
2. Неадекватное снабжение клеток кислородом (накопление
молочной кислоты и увеличение продукции СО2 в клетках).
3. Аномальное образование кислот.
4. Неадекватное выведение кислот почками.
Первая причина обуславливается неадекватной работой
легких. Так, если легкие не в состоянии полностью вывести на-
копленное количество СО2, то соединенный с водой углеки-
слый газ образует угольную кислоту, которая вследствие дис-
социации образует ионы водорода и бикарбоната, т. е. реак-
ция будет сдвинута вправо — количество водородных ионов
увеличится:
СО2 + Н2О <=> Н2СО3 => Н+ + нсо3-.
Вторая причина определяется главным образом неаде-
кватным снабжением клеток кислородом, результатом чего
является интенсивное накопление молочной кислоты. Диссо-
циация кислоты образует ионы водорода и лактата. Кроме то-
го, вследствие накопления углекислого газа в клетках, соотно-
шение между продукцией СО2 и потреблением О2 в организ-
ме увеличивается более чем на 1, тогда как в норме оно соста-
244
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА______
вляет 0,8 (продукция СО2 = 200 мл/мин; потребление О2 =
= 250 мл/мин).
Третья причина обусловлена более быстрым процессом
накопления органических (например, кетокислот) и неор-
ганических кислот, чем возможным процессом их нейтра-
лизации.
Четвертая причина обычно наблюдается у больных с хро-
нической почечной недостаточностью, вместе с тем острая по-
чечная недостаточность такого влияния не оказывает, посколь-
ку общее выделение почками водородных ионов не превыша-
ет 100—200 ммоль в день.
Концентрация водородных ионов измеряется в нмоль/л, для
клинических целей используют отрицательный логарифм ио-
нов водорода — величину pH. Расчет величины pH проводит-
ся по уравнению 1ендерсона—Хассельбаха, в основу которого
положено состояние диссоциации наиболее мощной буфер-
ной системы (угольная кислота/бикарбонат), отражающей кон-
троль за КОР крови. Итак:
pH = рК + (1g НСО,) / («СО2 х рСО2),
(1)
где рК = 6,10;
аСО2 — константа растворимости углекислого газа, равная
0,03 ммоль/л/мм рт. ст.
Иначе д анное уравнение можно записать следующим образом:
pH = 6,1 + (1g НСО3) / (рСО2 х 0,03).
(2)
Нормальная концентрация актуального бикарбоната
(НСО3 ) составляет 27 ммоль/л, нормальная величина рСО2 =
= 40 мм рт. ст. — (40 х 0,03 = 1,35).
pH = 6,1 + (1g 27) / 1,35 = 6.1 + 1g 20 (lg20 = 1,3). (3)
В итоге получается:
pH = 6,1+1,3 = 7,40. (4)
245
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Именно изменение величины pH = 7,40 характеризует на-
рушения КОР крови: его уменьшение свидетельствует о накопле-
нии ионов Н и называется ацидозом, увеличение указывает на
уменьшение ионов Н и называется алкалозом-
Соотношение между концентрацией водородных ионов и pH
следующее: при величине pH = 7,40 концентрация водородных
ионов составляет 40 нмоль/л; каждое увеличение (или снижение)
pH на 0,01 ед. снижает (или увеличивает) концентрацию водо-
родных ионов на 1 нмоль/л.
2.3. Закон поддержания постоянства pH
Организм всегда стремится к удержанию pH в строгих пре-
делах, что создается и поддерживается тремя основными меха-
низмами: вне- и внутриклеточным буферированием, респиратор-
ной ретудянмей путем изменения частите'' и тлубины дыха-
ния; почечной регуляцией концентрации ионов бикарбоната
(НСО3~) и выделения ионов Н.
Основные компенсаторные механизмы, нормализующие pH.
Плазма:
Наиболее мощной в плазме является система угольная ки-
слота/бикарбонат. Только 5 % чистого СО2 переносится плазмой
в растворенном виде, 20 % — транспортируются в эритроци-
тах, остальные 75 % СО2 переносятся кровью как бикарбонат.
1. Угольная кислота/бикарбонат (Н+ +НСО3“<=> Н2СО3 <=>
СО2 +Н2О);
буферная мощность ~ 65 %.
При избытке ионов Н указанная реакция сдвигается впра-
во и, образующийся вследствие диссоциации угольной кислоты,
углекислый газ удаляется легкими, при избытки ионов НСО3 —
реакция сдвигается влево, при этом, усиливается выделение
почками бикарбоната и, концентрация ионов Н увеличивается.
2. Белки (Н+ + белок => НБ);
буферная мощность —5%.
Поскольку концентрация белков в плазме невелика, незна-
чительна их буферная мощность и в плазме. Однако в клетках они
играют существенную роль при переносе ионов между вне- и вну-
триклеточным пространством.
246
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА____
3. Фосфаты (Н+ + НРО4_ => Н2РО4);
буферная мощность = 7%.
Небольшая концентрация фосфатов в плазме определяет их
низкую буферную мощность, вместе с тем основная их роль как
буферных механизмов проявляется в клетках и в почках.
Эритроциты:
Н+ + НЬ=>ННВ;
буферная мощность = 29 %.
Особой по своей силе является гемоглобиновая буферная си-
стема. В эритроцитах при помощи фермента карбангидразы
СО2 соединяется с водой, образуя углекислоту, которая сразу
диссоциирует на ионы Н и НСО3. Ион водорода, как указано вы-
ше, соединяется с восстановленным гемоглобином. Ион би-
карбоната соединяется с калием, образуя бикарбонатную соль
КНСО3. Ионы бикарбоната накапливаются в эритроцитах и при
снижении их концентрации в плазме переходят туда (эритроци-
ты: КНСО3 —> К+ + НСО3“ -» в плазму). При этом в эритроци-
ты входят ионы хлора, соединяясь с калием; таким образом,
клетка остается нейтральной (плазма: CL- эритроциты
KCL). Кроме того, буферная емкость гемоглобина увеличивает-
ся содержащимся в нем белком.
Необходимо отметить буферную роль окисленного и восста-
новленного гемоглобина. Буферирование осуществляется ча-
стью гемоглобиновой молекулы, называемой имидазольной груп-
пой, присоединение же кислорода происходит с помощью желе-
зосодержащей группы. Каждая из имидазольных групп может от-
давать или присоединять ионы водорода, в зависимости от того,
присоединяет или отдает другая часть молекулы кислорода.
Гемоглобин можно сравнить с механической игрушкой, в
которой добавление кислорода с одной стороны вызывает с
другого ее конца «выстреливание» иона водорода и наоборот.
Итак, окисленный гемоглобин ведет себя как кислота, увели-
чивая концентрацию ионов Н, а восстановленный — как осно-
вание, нейтрализуя последние (см. рис. 2.1). Чем ниже насыще-
ние венозной крови кислородом, тем выше в ней содержание
восстановленного гемоглобина, а следовательно, концентра-
ция бикарбоната и значение BE также будут более высокими,
чем в артериальной крови.
247
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Образоваиие
оксигемоглобина
НС------------ N
Образование
восстановленного Нв/Н+
нс--------------ZN
Рисунок 2.1. Структурные формулы функциональных систем
гемоглобина
Время действия механизмов компенсации нарушений КОР крови
1. Внеклеточное буферирование: 10—15 мин.
2. Внутриклеточное буферирование: 2—4 ч.
3. Респираторная компенсация: 3—5 ч (максимальная: 12—24 ч).
4. Почечная (метаболическая) компенсация: 6—18 ч (макси-
мальная: 5—7 дней).
Механизм внеклеточной компенсации нарушений pH
вступает в действие практически мгновенно, если же его си-
ла недостаточна для возвращения pH к норме, то вступают в
действие три следующих механизма, причем внутриклеточ-
ное буферирование проходит на фоне респираторной и почеч-
ной компенсации. Легкие достаточно быстро проявляют свое
действие, усиливая или снижая выведение СО2. Почечный
механизм компенсации более медленный, он как бы делится
на три стадии (см. рис. 2.2).
Первая — буферирование: при преобразовании монофос-
фата в дифосфат с последующим его соединением с ионами
натрия или хлора и выделением в мочу (Н+ + НРО, =>
248
ПТАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
Кровь
Почечная
клетка
Моча
СО2 + Н2О
карбош мдраза
нсо3
НРО4"
NH3
1 '
НСОЗ* +
2*----НСОЗ+ + Н
♦ Н2РО4
3 •«---НСОЗ++ Н'
*М14
Рисунок 2.2. Почечный механизм компенсации КОР
Н2РО4А), при этом экскретируется 20—30 ммоль ионов водо-
рода в день. Вторая — при соединении аммиака с ионами Н+
формируется аммоний, который соединяется с ионами натрия
или хлора и выделяется с мочой (Н+ + NH3+ -» NH4+i), в день
экскретируется 30—50 ммоль водородных ионов. В условиях вы-
раженного метаболического ацидоза, таким образом, может
выводиться до 700 ммоль ионов Н в день. Третья — реабсорб-
ция бикарбоната. В почках с помощью фермента карбоанги-
дразы углекислый газ соединяется с водой, образующаяся
угольная кислота диссоциирует на ионы водорода и бикарбо-
ната (СО2 + Н2О -э Н2СО3 -э Н+А + НСО3_ -э). Ионы водоро-
да нейтрализуются путями, указанными в первой и второй
стадиях, а ионы бикарбоната остаются в организме. Почками
реабсорбируется и возвращается в кровь 85—90 % фильтруемо-
го бикарбоната. Недостаток ионов водорода в организме ком-
пенсируется почками в основном именно на третьей стадии,
т- е. бикарбонат не возвращается в кровь, а экскретируется с мо-
чой, кроме того, снижается экскрекция аммония и хлора.
249
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
2.4. Методы исследования КОР
Исследования КОР крови проводятся на специальных газо-
анализаторах, которые прямым методом измеряют pH (потен-
циометрия) и рСО2 (полярография), а также температуру и ба-
рометрическое давление. Затем автоматически проводится рас-
чет остальных показателей КОР.
2.5. Обозначение основных показателей КОР
pH — актуальное значение pH артериальной, капиллярной
или смешанной венозной крови, определенной без доступа воз-
духа при температуре 37 °C, измеряется в единицах;
рСО2 — актуальное значение рСО2 артериальной, капилляр-
ной или смешанной венозной крови, определенное без доступа
воздуха при температуре 37 °C, измеряется в мм рт. ст.;
АВ — актуальное (истинное) содержание бикарбоната в
плазме, рассчитанное при истинном рСО2 и истинном насы-
щении крови кислородом, измеряется в ммоль/л;
SB — стандартный бикарбонат, рассчитанное содержание
бикарбоната в плазме при 100 %-ном насыщении крови кисло-
родом, рСО2 = 40 мм рт. ст. и при температуре 37 °C, измеряет-
ся в ммоль/л;
(BE-В) — рассчитанный истинный избыток (дефицит) ос-
нований крови, т. е. количество сильного основания или ки-
слоты, необходимое для того, чтобы вернуть pH к норме при
рСО2 = 40 мм рт. ст. и температуре 37 °C, измеряется в ммоль/л.
Поскольку этот параметр относится к цельной крови, а
не ко всему внеклеточному сектору, а жидкость, вводимая
для коррекции нарушений pH, распределяется во всем вне-
клеточном секторе, целесообразнее использовать избыток
оснований экстрацеллюлярной жидкости(ВЕ-ЕСР), кото-
рый представляет собой BE во всей внеклеточной жидкости,
включая кровь, при концентрации общего гемоглобина, рав-
ной 3 ммоль/л. Последняя величина обусловлена следую-
щим обстоятельством.
Объем внеклеточной жидкости в три раза больше объема
крови, поэтому при расчете избытка оснований экстрацеллю-
250
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА_____
лярной жидкости нормальная концентрация гемоглобина, рав-
ная 9 ммоль/л, делится на три, что и дает значение концентра-
ции общего гемоглобина во внеклеточной жидкости, равное
3 ммоль/л. Итак:
(BE-ECF) — рассчитанный стандартный избыток оснований
во всей внеклеточной жидкости, измеряется в ммоль/л;
ТСО2 — рассчитанная общая концентрация углекислого га-
за, представляющая собой все формы, в виде которых он на-
ходится в организме (газообразная, НСО3, Н2СО3, физически
растворенный и связанный с белками), измеряется в ммоль/л.
Для полной картины метаболического компонента
КОР крови необходимо иметь представление еще об одном
показателе, который называется «буферные основания» (ВВ)
и является связывающим звеном между КОР и электро-
литами (ВВ = Na+ — CL-), непосредственно участвуя в под-
держании закона электронейтральности. Показатель ВВ
складывается из суммы бикарбоната и белка и измеряется
в ммоль/л.
Концентрация актуального бикарбоната изменяется
при дыхательных нарушениях КОР, что делает этот показа-
тель непригодным для оценки метаболического компонен-
та. Содержание стандартного бикарбоната позволяет оце-
нивать метаболические нарушения независимо от дыха-
тельного компонента. Вместе с тем, по самым последним ре-
комендациям, наиболее точным параметром, который опре-
деляет состояние метаболического компонента КОР, при-
нято считать стандартный избыток оснований (BE-ECF).
Нормы показателей КОР крови:
pH 7,35-7,45 *
рСО2 35—45 мм рт. ст.
АВ 2—28 ммоль/л
SB 21—25 ммоль/л
ВЕ-В ±2,5 ммоль/л
BE-ECF ±2,9 ммоль/л
ТСО2 24—33 ммоль/л
ВВ 45—50 ммоль/л
(* Референтные величины pH — для новорожденных (недо-
ношенные), 48 ч: 7,35—7,50; (доношенные) — при рождении:
251
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
7,11—7,36; через 5—10 мин: 7,09—7,30; через 30 мин: 7,21—7,38; че-
рез 60 мин: 7,26—7,49; 1 сутки: 7,29—7,45.
Для взрослых свыше 60 лет: 7,31—7,42; свыше 90 лет:
7,26-7,43.)
Нормальное значение pH крови в организме обычно со-
ставляет 7.35—7,45 ед. Эти пределы изменения pH являются
жизненно важными и наиболее жесткими из всех известных го-
меостатических показателей. Даже небольшие их отклонения
влекут за собой нарушение жизненно важных физиологических
процессов. Так, сдвиг pH на 0,1 ед. сопряжен с нарушением ды-
хательной и сердечно-сосудистой систем, снижение pH на 0,3
ед. вызывает ацидотическую кому, а на 0,4 ед. — как правило,
состояние, несовместимое с жизнью.
В зависимости от показателя pH отмечают два вида наруше-
ний КОР крови:
1. Ацидоз — при снижении pH менее 7,35.
2. Алкалоз — при увеличении pH более 7,45.
Причины возникновения нарушения КОР крови:
1. Метаболические, когда изменяется концентрация ос-
нований при сохранной скорости образования и выведе-
ния СО2.
2. Респираторные, характеризующиеся нарушением соот-
ношения между количеством образованного и выведенного
СО2 при неизменной метаболической концентрации ионов
бикарбоната.
Прежде чем мы более подробно остановимся на разборе
указанных нарушений, необходимо отметить следующее. Ки-
слотно-основное равновесие нельзя рассматривать отдельно
от водно-электролитного баланса, поскольку они тесно свя-
заны тремя основными законами. Один из них, физиологиче-
ский, гласит, что организм всегда стремится к поддержанию
постоянной pH, частично этот закон мы уже разобрали выше.
Два следующих закона физико-химические: закон электроней-
тральности, свидетельствующий, что сумма положительных
зарядов (катионов) всегда должна быть равна сумме отрицав
тельных зарядов (анионов), и закон изоосмоляльности, ука-
зывающий, что осмоляльность во всех жидкостных средах
должна быть одинаковой.
252
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА____
2.6. Закон электронейтральности
Этот закон показывает истинную связь КОР крови и элек-
тролитов, поэтому на нем необходимо остановиться более подроб-
но, что легко сделать по диаграмме Gamble, графически иллю-
стрирующей закон электронейтральности для плазмы (рис. 2.3).
Как можно видеть, суммы катионов и анионов равны. Ос-
новным катионом является натрий, основным анионом — хлор.
Сумма бикарбоната и белка составляет буферные основания (ВВ),
о которых говорилось выше. Именно буферные основания и
являются связывающим звеном между кислотно-основным рав-
новесием и электролитным балансом. Конечно, связывающим
звеном можно считать и просто ион бикарбоната, однако его по-
казатель сильно зависит от уровня рСО2 и поэтому не может
точно отражать метаболические нарушения КОР крови, тогда как
показатель ВВ дает более четкий ориентир. Поскольку сумма ка-
тионов калия, кальция и магния составляет 11 мэкв/л, т. е. близ-
ка к концентрации остаточных анионов, указанную диаграмму
можно упростить и принять, что:
Na+ = Cl- + ВВ или ВВ = Na+ - С1“.
ДИАГРАММА GAMBLE
Катионы -151 мэкв/л
Na+ 140
К+ 4.5
Са++ 5.0
Mg++ 1.5
Анноны -151 мэкв/л
С1- 100
НСОЗ- 24
ВВ 39
белок 15
I_________
остаточные
анионы 12
Рисунок 2.3. Диаграмма соотношения катионов и анионов
в плазме
253
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
В левой части данного уравнения метаболическое со-
стояние КОР, в правой — концентрация двух наиболее важ-
ных для плазмы электролитов. Едва ли можно более на-
глядно продемонстрировать связь между КОР и электро-
литным балансом.
В клинической практике, более чем буферные основания,
метаболический компонент КОР принято отображать символом
BE. Этот показатель тоже можно рассчитать, зная концентрацию
натрия, хлора и нормальное значение ВВ:
BE = ВВ - NBB или BE = Na+ - Cl“ - NBB.
Таким образом, если у постели больного необходимо бы-
стро оценить, имеются или нет метаболические наруше-
ния КОР, и нет возможности сделать полный его анализ, до-
статочно провести указанный расчет. Вместе с тем необхо-
димо помнить, что такой расчет показателя BE можно
проводить при условии неизменной концентрации оста-
точных анионов.
На величину остаточных (ОА) или резидуальных (R) анио-
нов хотелось бы обратить особое внимание, поскольку этот по-
казатель весьма информативен для оценки метаболических на-
рушений КОР крови, обусловленных накоплением в орга-
низме недоокисленных продуктов обмена. Итак, состав оста-
точных анионов: органические (кето-, молочная и др.) кисло-
ты — 6—8 мэкв/л, неорганические кислоты — фосфатная
(РО42-) 4—6 мэкв/л и сульфатная (SO42-) 2—4 мэкв/л, общая
сумма остаточных анионов в норме равна 8—16 мэкв/л.
Данная величина является разницей между катионами и
анионами. Вместе с тем, поскольку концентрация катионов
калия, кальция и магния в плазме невелика, при общем рас-
чете суммы катионов ими можно пренебречь, по аналогич-
ным причинам можно при расчете суммы анионов прене-
бречь концентрацией белка, органических и неорганиче-
ских кислот.
Иными словами, величину остаточных анионов можно про-
сто рассчитать из разницы между концентрацией натрия и хло-
ра с актуальным (истинным) бикарбонатом:
254
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
Неучитываемые катионы
К+ — 4,5 мэкв/л
Са2+ = 5,0 мэкв/л
Mg2+ =1,5 мэкв/л
Неучитываемые анионы
Белок = 15,0 мэкв/л
РО42~ = 2,0 мэкв/л
SO42 =1,0 мэкв/л
Органические кислоты = 5,0 мэкв/л
Сумма НК = 11,0 мэкв/л
Сумма НА = 23 мэкв/л
Na+ _ (С1- + НСО3) = НА - НК
Na+ - (Cl” + НСО, ) = R-
НА—HK=R
Поскольку разница между натрием и хлором с бикарбона-
том идентична разнице между неучитываемыми анионами и
катионами, то и тот, и другой подсчет можно использовать для
суждения о концентрации остаточных анионов.
Вместе с тем хотелось бы обратить внимание на следую-
щий факт. Несмотря на небольшую концентрацию в плазме,
ион калия играет весьма существенную роль в изменении КОР
крови (см. ниже), поэтому более правильно проводить расчет ос-
таточных анионов с включением этого катиона:
R~ = (Na+ + К+) - (СР + НСО3) = мэкв/л.
2.7. Метаболические нарушения КОР крови
Метаболический ацидоз — состояние, которое означает на-
копление метаболических кислот, не экскретируемых почками
в свободном виде, или потерю оснований из организма. Его ха-
рактерными признаками являются низкий показатель pH при от-
рицательном BE, нормальном уровне рСО2 и практически оди-
наковой низкой концентрации актуального и стандартного би-
карбоната.
Пример 1. Острый некомпенсированный метаболический ацидоз:
pH = 7,20;
РСО2 = 40 мм рт. ст.;
АВ = 15,0 ммол/л;
255
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
SB = 15,0 ммоль/л;
BE = (—13,5 ммоль/л).
Наиболее часто указанные показатели наблюдаются при
остром развитии метаболического ацидоза у больных в крити-
ческом состоянии, в том числе в условиях оперативного вмеша-
тельства.
Пример 2. Частично компенсированный метаболический ацидоз:
pH = 7,30;
РСО2 = 25 мм рт. ст.;
АВ = 11,5 ммоль/л;
SB = 13,5 ммоль/л;
BE = (—11,5 ммоль/л).
Данный пример свидетельствует о том, что в действии не
только буферные системы, но и легочный механизм компенса-
ции. Такое состояние можно характеризовать как хронический
метаболический ацидоз, оно часто встречается у больных с хро-
нической почечной недостаточностью и при болезнях желудоч-
но-кишечного тракта.
Пример 3. Полностью компенсированный метаболический
ацидоз:
pH = 7,40;
рСО2 = 20 мм рт. ст.;
АВ = 10,0 ммоль/л;
SB = 13,5 ммоль/л;
BE = (—11,5 ммоль/л).
Указанные изменения можно наблюдать в условиях сохра-
нения функциональной способности почек у больных, полу-
чающих диуретики, или при переливании больших количеств ра-
створов, содержащих хлор.
Причины развития метаболического ацидоза можно разде-
лить на две подгруппы: с нормальной и увеличенной концентра-
ций остаточных анионов.
Метаболический ацидоз без увеличения остаточных анионов
называют также гиперхлоремическим. Причины его развития
следующие:
• введение растворов, содержащих ионы хлора;
• введение ингибиторов карбоангидразы;
• ацидоз вследствие разведения;
256
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА_______
• диарея или желудочно-кишечные фистулы;
• проксимальный или дистальный канальцевый ацидоз;
• трансплантация мочеточника в кишечный тракт (сигмо-
видную кишку).
Общий пример для данной группы. Пациент с канальцевым
ацидозом:
pH = 7,30; Na+ = 140 ммоль/л;
рСО2 = 30 мм рт. ст.; К+ = 3,7 ммоль/л;
АВ = 14,0 ммоль/л; акт. НСО3' = 14 ммоль/л;
SB = 16,5 ммоль/л; С1_ = 120 ммоль/л;
BE = (-10,5 ммоль/л); R = (140 + 3,7) - (14 + 120) = 9,7
ммоль/л.
Метаболический ацидоз с увеличением концентрации остаточ-
ных анионов обусловлен следующими причинами:
Шок любой этиологии, определяющий увеличение лактата.
Пример. Пациент с геморрагическим шоком:
pH = 7,27; Na+ =135 ммоль/л;
рСО2 = 26,4 мм рт. ст.; К+ = 5,5 ммоль/л;
АВ = 12 ммоль/л; акт. НСО3 = 12,0 ммоль/л;
SB = 15,0 ммоль/л; С1_ = 87 ммоль/л;
BE = (-13,5 ммоль/л); R = (135 + 5,5) - ( 12 + 87) =
— 41,5 ммоль/л.
В данном случае причиной увеличения остаточных анионов,
способствующих развитию метаболического ацидоза, явилось на-
копление в организме недоокисленных продуктов обмена, а
именно: молочной кислоты.
Диабетический или неадиабетический кетоз.
Пример. Пациент с выраженным диабетом (глюкоза
32,3 ммоль/л):
pH = 7,20; Na+ =134 ммоль/л;
рСО2 = 12,5 мм рт.ст.; К+ = 4,7 ммоль/л;
АВ = 5,0 ммоль/л; акт. НСО3~ = 5,0 ммоль/л;
SB = 8,6 ммоль/л; СГ- = 100,0 ммоль/л;
BE = (—22,0 ммоль/л); R = (134 + 4.7) — (5 + 100) —
= 33,7 ммоль/л.
Причиной увеличения остаточных анионов, обуславливаю-
щих развитие метаболического ацидоза, явилось накопление
кетокислот.
257
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Острая или хроническая почечная недостаточность.
Пример. Пациент с хроническим нефритом:
pH = 7,28; Na+ = 132 ммоль/л;
рСО2 = 28 мм рт. ст.; К+ = 6,0 ммоль/л;
АВ = 14,0 ммоль/л; акт. НСО3_ = 14,0 ммоль/л;
SB = 17,0 ммоль/л; С1_ = 91 ммоль/л;
BE = (—10,0 ммоль/л); R- = (132 + 6) — (14 + 91) =
= 33,0 ммоль/л.
Увеличение концентрации остаточных анионов определя-
лось накоплением сульфатов, фосфатов и других метаболиче-
ских кислот, что и явилось причиной развития метаболическо-
го ацидоза.
Интоксикация салицилатами.
Пример. Пациент, принявший большую дозу ацетилсалицило-
вой кислоты (аспирина), концентрация салицилатов в крови со-
ставила 60 мг%:
pH = 7,40; Na+ = 140 ммоль/л;
рСО2 = 22,0 мм рт. ст.; К+ = 4,0 ммоль/л;
АВ = 14,0 ммоль/л; акт. НСО3_ = 14,0 ммоль/л;
SB = 16,0 ммоль/л; С1_ = 106 ммоль/л;
BE = (—10,5 ммоль/л); R- = (140 + 4) — (14 + 106) =
= 24 ммоль/л.
Причиной увеличенной концентрации остаточных анио-
нов, способствующих развитию метаболического ацидоза, явил-
ся высокий уровень метаболических кислот.
Клинические осложнения, обусловленные метаболическим аци-
дозом:
• снижение сердечного выброса;
• легочная гипертензия;
• нарушения ритма, вплоть до остановки сердца;
• олигурия;
• увеличение циркуляции эндогенных катехоламинов;
• психозы.
Таким образом, метаболический ацидоз является достаточно
грозным осложнением, требующим адекватной коррекции, осо-
бенно если он развивается на фоне гипоксии, обусловленной на-
рушением кровообращения. О гипоксическом метаболическом аци-
дозе необходимо говорить отдельно, что и будет сделано ниже.
258
ПТАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
Терапия метаболического ацидоза
Наиболее часто коррекция метаболического ацидоза осу-
ществляется растворами бикарбоната натрия различной кон-
центрации. Раствор распределяется главным образом во вне-
клеточном пространстве, составляющем 20 % от общей воды
организма, при этом, 1 г NaHCO3 содержит 12 ммоль НСО3_. Та-
ким образом, необходимое количество ионов НСО3 можно рас-
считать по формуле:
1 ммоль НСО, = вес больного х 0,2 х (BE изм. — BE норм.).
Д ля коррекции метаболического ацидоза, обусловленного
накоплением недоокисленных продуктов обмена, используют
также 3,6 %-ный раствор трометамина (синонимы: ТНАМ-Е,
трис[гидроксиметил]аминометан, трис, трис-буфер, трисамин).
Формула ТНАМ-Е:[(СН2ОН)3 C-NHJ; раствор содержит:
5 ммоль К+, 30 ммоль Na+, 35 ммоль С1_ и 300 ммоль НСО3~. Его
преимущество состоит в том, что он нейтрализует как внеклеточ-
ный, так и внутриклеточный избыток ионов водорода. Необходи-
мое количество раствора рассчитывают по следующей формуле:
3,6 %-ный р-р ТНАМ-Е (мл) = вес больного х BE изме-
ренное.
Для коррекции метаболического ацидоза используют так-
же растворы лактата или ацетата натрия, при метаболиза-
ции которых образуются ионы бикарбоната. Однако исполь-
зование этих растворов имеет ряд ограничений. Так, лактат
натрия можно вводить при условие адекватного кислород-
ного баланса и нормальной функции печени, поскольку лак-
тат метаболизируется в печени и для нормального метабо-
лизма необходим кислород, кроме того, в условиях кисло-
родного дисбаланса ткани сами выделяют молочную кисло-
ту. Ацетат натрия можно вводить при отсутствии нарушений
периферической циркуляции, поскольку ацетат метаболизи-
руется в периферических тканях. Иными словами, в усло-
виях гипоксии, а именно такие условия чаще всего определя-
•от развитие выраженного метаболического ацидоза у больных
259
_______________________ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
в критическом состоянии, введение этих двух растворов весь-
ма ограничено, более того, нежелательно.
Поскольку раствор ТНАМ-Е, к сожалению, весьма редко
имеется в арсенале отечественных клиник, для коррекции мета-
болического ацищоза обычно используют 4 %- или 7 %-ный ра-
створ бикарбоната натрия, причем многие клиницисты весьма
«легко» относятся к данному препарату и, считая его безвредным,
часто вводят в больших количествах и с высокой скоростью.
В связи с этим хотелось бы отметить, что введение данного ра-
створа может приводить к значительным осложнениям, усугуб-
ляющим тяжесть состояния больного.
Осложнения, развивающиеся при введении гипертонических
растворов бикарбоната натрия:
• увеличение осмоляльности и концентрации натрия;
• увеличение артериального рСО2;
• снижение концентрации кальция;
• резкое снижение калия на фоне гипокалиемии;
• ухудшение снабжения тканей кислородом.
Для предотвращения указанных осложнений необходимо помнить:
1. Введение гипертонических растворов NaHCO3 прово-
дить только при pH < 7,30 ед.
2. Скорость введения не должна превышать 100мл/ч (исклю-
чения: остановка сердца, шок любой этиологии).
3. Осуществлять постоянный контроль за показателями ки-
слородного баланса, КОР крови, электролитного баланса и ос-
моляльности.
Метаболический алкалоз — это состояние, при котором
отмечается накопление оснований или избыточная потеря кислот
из организма. Его характерными признаками являются высокое
pH с положительной величиной BE, при нормальном уровне
рСО2 и практически одинаковой высокой концентрации акту-
ального и стандартного бикарбоната.
Пример 1. Острый метаболический алкалоз:
pH = 7,70;
рСО2 = 40 мм рт. ст.;
АВ = 38,0 ммоль/л;
SB = 38,0 ммоль/л;
BE = + 15,0 ммоль/л.
260
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА______
Данное нарушение можно наблюдать преимущественно
при переливании больших количеств щелочных растворов или
при оперативных вмешательствах, сопровождающихся боль-
шой потерей крови с последующей ее коррекцией переливани-
ем различных компонентов крови.
Пример 2. Частично компенсированный метаболический ал-
калоз:
pH = 7,52;
рСО2 = 47 мм рт. ст.;
АВ = 37,0 ммоль/л;
SB = 34,5 ммоль/л;
BE = + 12,5 ммоль/л.
Данный пример свидетельствует о том, что в действие всту-
пили не только буферные системы, но и легочный механизм
компенсации, направленный на задержку СО2 в организме. Та-
кое состояние можно характеризовать как хронический метабо-
лический алкалоз, оно достаточно часто встречается при болез-
нях желудочно-кишечного тракта и после крупных хирургиче-
ских вмешательств.
Пример 3. Полностью компенсированный метаболический
алкалоз:
pH = 7,40;
рСО2 = 52 мм рт. ст.;
АВ = 39,0 ммоль/л;
SB = 34,5 ммоль/л;
BE = + 12,5 ммоль/л.
Указанное нарушение КОР крови свидетельствует о полно-
ценной легочной и почечной компенсации метаболического
алкалоза, так как pH = 7,40, вместе с тем оно обуславливает
необходимость более четкого поиска причин метаболического
алкалоза и его коррекции, поскольку любые компенсаторные ре-
акции не беспредельны и показатель pH вновь может изменить-
ся. Обычно причиной такого метаболического алкалоза служат
хронические заболевания желудочно-кишечного тракта, он так-
же может быть следствием переливания большого количества до-
норской крови или растворов лактата, ацетата или цитрата (с до-
норской кровью), при метаболизации которых образуются ио-
ны бикарбоната.
261
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Основные причины развития метаболического алкалоза:
• потеря ионов водорода и хлора вследствие рвоты, отсасы-
вания желудочного содержимого, диуретической терапии;
• потеря ионов калия в результате рвоты, диареи, гипе-
ральдостеронизма, терапии диуретиками, цирроза печени и т. д.;
• увеличение концентрации ионов бикарбоната вследствие
гиперкомпенсации респираторного ацидоза;
• увеличение концентрации ионов бикарбоната, обусло-
вленное избыточным введением щелочных растворов, метабо-
лизации лактата, ацетата или цитрата, введенного с донорской
кровью;
• увеличение концентрации ионов бикарбоната в результа-
те острого снижения экстрацеллюлярной жидкости.
Пример. Пациент с непрекращаклцейся рвотой.
pH = 7,58;
рСО2 = 44 мм рт. ст.;
АВ = 38,0 ммоль/л;
SB = 37,0 ммоль/л;
BE = + 15,2 ммоль/л;
2-й тип
pH = 7,53
рСО2 = 40 мм рт. ст.
АВ = 35 ммоль/л
SB = 34,5 ммоль/л
BE = +12,5 ммоль/л
Na+ =137 ммоль/л;
К+ = 3,5 ммоль/л;
акт. НСО3_ = 38,0 ммоль/л;
С1_ = 89 ммоль/л;
R- = ( 137 + 3,5 ) - ( 38 + 89) =
= 13,5 ммоль/л.
Метаболический алкалоз может протекать с низким или
нормальным значением калия плазмы:
1-й тип
pH = 7,62
рСО2 = 40 мм рт. ст.
АВ = 38,0 ммоль/л
SB = 37,5 ммоль/л
BE = +15,0 ммоль/л
К+ плазмы <3,5 ммоль/л К+ плазмы >4,0 ммоль/л
pH мочи < 4,5 pH мочи > 6,0
Диагностическим признаком изменения концентрации ка-
лия в этом случае служит величина pH мочи (норма 5,2). В усло-
виях дефицита калия, несмотря на избыток оснований в организ-
ме, моча усиленно выделяет ионы водорода, что снижает ее pH,
при нормальной концентрации калия усиленно выводятся ио-
ны бикарбоната и pH мочи увеличивается. Данное обстоятель-
ство свидетельствует, что при гипокалиемическом метаболиче-
ском алкалозе роль почек как компенсаторного механизма ре-
262
ГЯАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА_______
гулянии нарушений КОР крови практически не проявляется, сле-
довательно, для ее включения в действие основным моментом
является коррекция дефицита калия в организме.
Метаболический алкалоз является достаточно грозным
осложнением и весьма трудно поддается коррекции, особенно
у больных в критическом состоянии.
Клинические осложнения, обусловленные метаболическим алкалозом:
• тетания, симптомы Труссо и Хвостека при pH > 7,55;
• гипокапническая вазоконстрикция;
• ухудшение снабжения кислородом тканей вследствие
сдвига кривой диссоциации оксигемоглобина влево (упроче-
ние связи гемоглобина с кислородом);
• психозы;
• гипокалиемия и гипокальцемия;
• нарушения ритма сердца вплоть до полной его остановки.
Терапия метаболического алкалоза:
1. Восстановить объем экстрацеллюлярной жидкости (плаз-
ма, кровь, растворы хлоридов, если нет противопоказаний к
введению натрия — целесообразно введение изотонического
раствора хлористого натрия).
2. Восстановить нормальный объем общего калия (калийсох-
раняющие диуретики).
3. Использовать ингибиторы альдостерона (альдактон, ве-
рошпирон).
4. Снизить активность фермента карбоангидразы (аиетазо-
ламид и т. п.).
5. При необходимости быстрого снижения pH крови вводят
10 %-ный раствор соляной кислоты (HCL) или 0,9 %-ный раствор
хлористого аммония (NH4CL): 10 %-ный раствор HCL вводит-
ся в количестве 20 мл в день орально, растворяя 5 мл кислоты в
стакане воды по 4 раза в день; 0,9 %-ный раствор NH4CL вводят
в/в в количестве, определяемом дефицитом хлора (1 л 0,9 %-но-
го раствора NH4CL содержит 168 мэкв хлора).
Необходимо помнить:
• при метаболическом алкалозе рСО2 артериальной крови
компенсаторно увеличивается и для его нормализации требует-
ся определенное время, поэтому искусственно снижать его не ре-
комендуется;
263
ТРАНСФУЗИОЛОГИЯ в реаниматологии
• если у пациента используется искусственная вентиляция
легких (ИВЛ), то в условиях метаболического алкалоза целесо-
образно поддерживать режим умеренной гиповентиляции;
• растворы хлористого аммония можно вводить при усло-
вии нормальной функции печени.
В условиях гипоксии метаболический алкалоз протекает на
фоне внутриклеточного ацидоза, что значительно затрудняет
его диагностику и коррекцию. Гипоксический метаболический
алкалоз требует отдельного обсуждения и поэтому будет описан
более подробно ниже.
2.8. Респираторные нарушения КОР крови
Респираторный ацидоз — это состояние характеризуется
низким pH, высоким рСО2, нормальными значениями стан-
дартного бикарбоната и BE, тогда как содержание истинного би-
карбоната увеличено.
Пример 1. Острый (некомпенсированный) респираторный
ацидоз:
pH = 7,25;
рСО2 = 82 мм рт. ст.;
АВ = 34,0 ммоль/л;
SB = 26,5 ммоль/л;
BE = +2,5 ммоль/л;
Na+ = 145 ммоль/л;
К+ = 6,0 ммоль/л;
акт. НСО3_ = 34 ммоль/л;
С1_ = 105 ммоль/л;
R = (145 + 6,0) - (34 + 105) =
= 12,0 ммоль/л.
Указанное нарушение наиболее часто можно наблюдать
при острой дыхательной недостаточности или при условиях не-
адекватной работы аппарата ИВЛ. Острый респираторный аци-
доз всегда сопровождается увеличением концентрации калия, од-
нако резидуальные (остаточные) анионы при этом остаются в
пределах нормы.
Пример 2. Частично компенсированный респираторный ацидоз:
pH = 7,32;
рСО2 = 81 мм рт. ст.;
АВ = 34,0 ммоль/л;
SB = 29,0 ммоль/л;
BE = +6,0 ммоль/л;
Na+ = 140 ммоль/л;
К+ = 4,7 ммоль/л;
акт. НСО3 = 34,0 ммоль/л;
СГ = 90 ммоль/л;
R- = (140 + 4,7)-(34 + 90) = 20,7
ммоль/л.
264
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
Данный пример свидетельствует о включении буферных
систем в компенсацию нарушений КОР крови. При этом кон-
центрация калия нормализуется, однако за счет снижения ионов
хлора остаточные анионы умеренно увеличиваются.
Пример 3. Полностью компенсированный респираторный ацидоз:
pH = 7,40;
рСО2 = 68 мм рт. ст.;
АВ = 39,5 ммоль/л;
SB = 31,0 ммоль/л;
BE = +8,0 ммоль/л;
Na+ = 143 ммоль/л;
К+ = 5,2 ммоль/л;
акт. НСО3_ = 39,5 ммоль/л;
С1_ = 85 ммоль/л;
R- = (143 + 5,5) - (39,5 + 85) =
= 24 ммоль/л.
Полностью компенсированный респираторный ацидоз
встречается у пациентов с хроническими заболеваниями лег-
ких. Он свидетельствует о полной буферной (снижение ионов
хлора) и почечной (усиление реабсорбции ионов бикарбоната)
компенсации этого нарушения, показателем чего является pH
крови. Вместе с тем данное состояние сопровождается увеличе-
нием остаточных анионов вследствие умеренной гипоксемии, об-
уславливающей накопление лактата и других метаболических ки-
слот.
Основными причинами респираторного ацидоза являются:
• хронические заболевания легких (фиброз, эмфизема, аст-
ма и др.);
• депрессия дыхательного центра (например, передозиров-
ка наркотиков);
• ослабление нервно-мышечных функций (например, при
введении блокирующих препаратов);
• неадекватная работа аппарата ИВЛ, способствующая уве-
личению концентрации СО2 во вдыхаемой газовой смеси;
• увеличенная продукция СО2 (при лихорадке, метаболиза-
ции растворов, используемых в качестве энергетических суб-
стратов при парентеральном питании и др.);
• травматическое повреждение грудной клетки;
• тромбоэмболия легочной артерии;
• отек легких, диффузионные нарушения проницаемости
легочных мембран.
К состоянию хронического респираторного ацидоза орга-
низм легко приспосабливается, компенсируя низкий pH увели-
265
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
чением реабсорбции бикарбоната почками и возвращением его
в кровь, а артериальную гипоксемию — увеличением количества
эритроцитов.
Развитие острого респираторного ацидоза является гроз-
ным осложнением, способным привести к весьма неблагопри-
ятному исходу. Это обусловлено тем, что СО2 значительно
быстрее, чем ионы Н, проходит через цереброспинальный
барьер и снижение pH крови вследствие накопления СО2 про-
исходит быстрее, чем снижение ионов бикарбоната. В усло-
виях острого респираторного ацидоза снижение pH спинно-
мозговой жидкости происходит быстрее снижения pH крови,
что сопровождается депрессией центральной нервной систе-
мы. Острый респираторный ацидоз по своему действию ока-
зывает на организм более неблагоприятное влияние, чем ме-
таболический ацидоз.
Клинические осложнения, обусловленные острым респира-
торным ацидозом:
• синдром углекислого наркоза (Carbon-Dioxide Narcosis);
• угнетение ЭЭГ (вплоть до глубокой комы);
• нарушения ритма сердца (тахикардия, фибрилляция же-
лудочков);
• нестабильный уровень артериального давления;
• гиперкалиемия.
Особое внимание хотелось бы обратить на первое из ука-
занных осложнений, поскольку в этой ситуации накопление СО2
сопровождается снижением рО2 артериальной крови. В дан-
ном случае необходимо помнить, что в норме респираторный
центр очень чувствителен к количеству СО2, однако когда кон-
центрация рСО2 артериальной крови превышает 65 мм рт. ст., то
основным стимулом дыхательного центра становится снижение
рО2 артериальной крови ниже 85 мм рт. ст. Иными словами, в
данных условиях артериальная гипоксемия является защитно-
компенсаторной реакцией организма, направленной на сти-
муляцию дыхательного центра при неадекватной реакции по-
следнего на увеличенную концентрацию СО2. Если в данной си-
туации для коррекции гипоксемии больному дают кислород, то
тем самым срывается защитная реакция, а следовательно, и
скорость выведения СО2.
266
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА_______
В свою очередь, накопление углекислоты способствует еще
большему снижению pH крови, что в конечном результате мо-
жет привести к глубокой коме и даже к смерти больного. О воз-
можности возникновения данного синдрома необходимо пом-
нить при проведении анестезии, а также в раннем послеопера-
ционном периоде, когда на фоне высоких значений рСО2 арте-
риальной крови для коррекции гипоксемии больным дают ки-
слород. При наличии синдрома углекислого газа действия клини-
цистов в первую очередь должны быть направлены на снижение
СО2, что в дальнейшем автоматически приведет к нормализации
рО2 артериальной крови.
Терапия острого респираторного ацидоза:
1. Постоянная санация дыхательных путей, поскольку гипер-
капния способствует накоплению вязкого бронхиального секрета.
2. Введение дополнительного количества жидкости, что,
наряду с улучшением гемодинамики, способствует размягче-
нию бронхиального секрета и лучшему его удалению.
3. Введение щелочных растворов: NaHCO3 (при pH < 7,30)
или ТНАМ-Е в случае, если больной находится на ИВЛ, по-
скольку трис-буфер угнетает дыхательный центр и может спо-
собствовать еще большему увеличению СО2.
4. Увлажнение вдыхаемого воздуха д ля снижения вязкости
бронхиального секрета.
5. Если, несмотря на проводимую терапию, в артериальной
крови отмечается сочетание рСО2 > 70 мм рт. ст. и рО-, < 55 мм
РТ. ст., то рекомендуется перевод больного на ИВЛ.
Необходимо помнить:
• кислород давать больному только при рО2 артериальной
крови ниже уровня 55 мм рт.ст.;
• концентрация кислорода во вдыхаемом воздухе не должна
превышать 40 %.
Респираторный алкалоз — состояние, которое характеризу-
ется увеличением pH, снижением рСО2 при нормальных пока-
зателях стандартного бикарбоната и BE крови, тогда как актуаль-
ный бикарбонат снижен.
Пример 1. Острый (некомпесированный) респираторный алкалоз:
pH = 7,55; Na+ = 135 ммоль/л;
РСО2 = 20 мм рт. ст.; К+= 4,5 ммоль/л;
267
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
АВ = 16,5 ммоль/л;
SB = 24,0 ммоль/л;
BE = 0 ммоль/л;
акт. НСО3_ =16,5 ммоль/л;
С1_ = 109 ммоль/л;
R“ = (135 + 4,5) - (16,5 + 10) = 12
ммоль/л.
Данное состояние возникает при острой дыхательной недо-
статочности, при переливании больших количеств щелочных
растворов, при избыточной гипервентиляции самостоятельной
или искусственно созданной при работе аппарата ИВЛ. В этой
ситуации стандартный бикарбонат всегда выше актуального, а
концентрация электролитов и остаточных анионов находится в
пределах нормы.
Пример 2. Частично компенсированный респираторный алкалоз-.
pH = 7,49;
рСО2 = 21 мм рт. ст.;
АВ = 18,0 ммоль/л;
SB = 22,0 ммоль/л;
BE = (—3,5 ммоль/л);
Na+ =136 ммоль/л;
К+ = 4,0 ммоль/л;
акт. НСО3_ = 18,0 ммоль/л;
С1_ = 104 ммоль/л;
R- = (136 + 4,0) - (18 + 104) =
= 18 ммоль/л.
Данный пример свидетельствует о включении в действие бу-
ферных компенсаторных механизмов крови, на что показыва-
ет умеренное снижение стандартного бикарбоната и BE крови,
тогда как актуальный бикарбонат по-прежнему ниже стандарт-
ного. Отмечается также уменьшение концентрации хлора, оста-
точные анионы, хотя и увеличиваются, практически находятся
в пределах нормы.
Пример 3. Полностью компенсированный респираторный ал-
калоз:
pH = 7,42;
рСО2 = 26 мм рт. ст.;
АВ = 16,5 ммоль/л;
SB = 20,0 ммоль/л;
BE = (—5,5 ммоль/л);
Na+ = 140 ммоль/л;
К+ = 4,5 ммоль/л;
акт. НСО3_ = 16,5 ммоль/л;
С1 =100 ммоль/л;
R = (140 + 4,5) - (16,5 + 100) =
= 28 ммоль/л.
Такое состояние называют хроническим респираторным
алкалозом. Оно свидетельствует о вступлении в действие не
только буферных, но и почечных механизмов компенсации, в
этом случае увеличивается выделение бикарбоната с мочой.
Концентрация основных электролитов практически остается
268
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
без изменений, однако увеличение остаточных анионов указы-
вает на накопление органических кислот вследствие гипоксии
или нарушений периферического кровообращения.
Основные причины развития респираторного алкалоза'.
• избыточная гипервентиляция при проведении ИВЛ;
• истерическая гипервентиляция (страх, боль, стресс);
• повреждение центральной нервной системы (черепно-
мозговая травма, энцефалит и т. п.);
• тканевая гипоксия (анемия, шок, сепсис, острая сердеч-
но-сосудистая недостаточность);
• повреждение интерстиция легких;
• отек легких;
• печеночная недостаточность;
• интоксикация салицилатами;
• гиперкомпенсация метаболического ацидоза.
Как и любое другое нарушение КОР крови, респиратор-
ный алкалоз способствует ухудшению состояния больных вслед-
ствие влияния на общий гомеостаз организма.
Клинические осложнения, обусловленные респираторным алка-
лозом'.
• ухудшение кровоснабжения тканей вследствие сдвига
кривой диссоциации оксигемоглобина влево и усиления связи
гемоглобина с кислородом;
• предсердная и желудочковая тахикардия;
• тетания;
• психические расстройства при pH крови выше 7,54;
• нарушения электролитного баланса.
Терапия респираторного алкалоза определяется причиной
его развития:
• изменение режима работы аппарата ИВЛ;
• использование седативных препаратов;
• использование вдыхаемой смеси, содержащей 5 % СО, и
95 % О,;
• выведение избыточной жидкости;
• введение препаратов, коррегирующих тканевую гипоксию;
• использование препаратов, улучшающих функцию
печени;
• строгий расчет количества вводимых щелочных растворов.
269
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Определив все четыре основных нарушения КОР крови,
необходимо отметить следующее. В чистом виде как метабо-
лические, так и респираторные нарушения диагностируют-
ся достаточно непродолжительное время, поскольку, как бы-
ло указано выше, быстро вступают в действие механизмы
компенсации. Обычно метаболический ацидоз компенсиру-
ется респираторным алкалозом, а метаболический алкалоз —
респираторным ацидозом и наоборот. Первичные метаболи-
ческие и респираторные нарушения крови могут протекать
одновременно, при этом они оказывают противоположное
влияние на величину pH крови, так что (не видя больного) по
этому показателю бывает трудно определить, какое из нару-
шений первично.
Вместе с тем, необходимо помнить, что любая компенсация
направлена лишь на нормализацию pH, поэтому при pH выше
или ниже 7,40 нарушения КОР будут смешанными, и именно с
такими нарушениями чаще всего приходится встречаться в кли-
нической практике.
Отсутствие или наличие респираторных нарушений на фо-
не метаболических достаточно легко диагностируется по разни-
це между актуальным и стандартным бикарбонатом, поскольку
основная часть ионов НСО3 переносится в виде угольной кисло-
ты. Так, если:
• актуальный бикарбонат равен стандартному — респира-
торных нарушений нет;
• актуальный бикарбонат выше стандартного — в наличии
респираторный ацидоз;
• актуальный бикарбонат ниже стандартного — в наличии
респираторный алкалоз.
Для оценки нормальной компенсации нарушений КОР
крови проводится расчет на основании разницы между измерен-
ными и нормальными показателями рСО2 и актуального би-
карбоната, который представлен в табл. 2.2. При метаболическом
ацидозе или алкалозе, величина дельты рСО2 указывает то зна-
чение, которое обусловлено механизмами компенсации, если
рСО2 ниже или выше расчетной величины — это свидетельству-
ет о наличии, наряду с метаболическими, и респираторных на-
рушений. При остром или хроническом респираторном аци-
270
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА_____
дозе или алкалозе, аналогично оценивается величина дельты
актуального бикарбоната — если она выше или ниже расчетной
величины, то, наряду с респираторными, присутствуют и мета-
болические нарушения КОР крови.
Таблица 2.2. Нормальная компенсация нарушений КОР крови
Вид нарушения Степень компенсации Время полной компенсации
Метаболический ацидоз ДрСО2 = ДНСО3 х 1,2 12-24ч
Метаболический алкалоз ДрСО2 = ДНСО3 х 0,9 12-24ч
Острый респираторный ацидоз ДНСО3 = ДрСО2 х 0,07 Минуты
Хронический респиратор- ный ацидоз ДНСО3 = ДрСО2 х 0,4 3—5 дней
Острый респираторный алкалоз ДНСО3 = ДрСО2 х 0,2 Минуты
Хронический респиратор- ный алкалоз ДНСО3 = ДрСО2 х 0,5 2—3 дня
2.9. Смешанные нарушения КОР крови
Пример 1. Респираторный ацидоз + метаболический алкалоз:
pH = 7,40; Na+ = 138 ммоль/л;
рСО2 = 56 мм рт. ст.; АВ = 33,0 ммоль/л; SB = 30,0 ммоль/л; К+ = 4,8 ммоль/л; акт. НСО3_ = 33,0 ммоль/л; С1_ = 87 ммоль/л;
BE = +7,0 ммоль/л; R = (138 + 4,8) - (33 + 87) = = 22,8 ммоль/л.
У больного рСО2 и BE увеличены, актуальный бикарбо-
нат выше стандартного — это свидетельствует о наличии
респираторного ацидоза, вместе с тем pH нормальный.
В этом случае трудно определить, какое нарушение первич-
но, а какое вторично. Помощь в правильном диагнозе вида
нарушения КОР помогает установить формула расчета ком-
271
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
пенсации, из которой вытекает, что рСО2 выше, чем это об-
условлено компенсацией метаболического алкалоза, актуаль-
ный бикарбонат выше стандартного, увеличено и значение
остаточных анионов. Таким образом, можно констатиро-
вать, что в наличии полностью компенсированный хрониче-
ский респираторный ацидоз.
Пример 2. Респираторный алкалоз + метаболический ацидоз:
pH = 7,40; Na- = 144 ммоль/л;
рСО2 = 28 мм рт. ст.; К- = 5,6 ммоль/л;
АВ = 12,0 ммоль/л; акт. НСО3_ = 12,0 ммоль/л;
SB = 16,0 ммоль/л; СГ~ =115 ммоль/л;
BE = (-10,0 ммоль/л); R- = (144 + 5,6) - (12 + 115) =
= 22,6 ммоль/л.
У больного низкий показатель рСО2; то обстоятельство,
что актуальный бикарбонат ниже стандартного, свидетель-
ствует о наличии респираторного алкалоза. Отрицательное
значение BE указывает на наличие метаболического ацидо-
за, однако pH нормален. Для правильного определения ви-
да нарушений КОР крови необходимо воспользоваться фор-
мулами расчета компенсации, из которых вытекает, что по-
казатель измеренного рСО2 соответствует значению его
дельты при полной компенсации метаболического ацидоза.
Кроме того, концентрация электролитов и остаточных анио-
нов также более характерна для метаболического ацидоза.
Таким образом, окончательный тип нарушения КОР крови
можно характеризовать как полностью компенсированный
метаболический ацидоз.
Пример 3. Метаболический ацидоз + респираторный ацидоз.
pH = 7,06; Na+ = 148 ммоль/л;
рСО2 = 77 мм рт. ст.; К+ =6,1 ммоль/л;
АВ = 20,5 ммоль/л; акт. НСО3“ = 20,5 ммоль/л;
SB = 14,8 ммоль/л; С1~ =118 ммоль/л;
BE = (-12,8 ммоль/л); R = (148 + 6,1) - (20,5 + 118) =
= 15,6 ммоль/л.
Как можно видеть, у больного показатели pH и BE низ-
кие, что указывает на метаболический ацидоз, рСО2 высо-
кое, актуальный бикарбонат выше стандартного — это свиде-
тельствует о наличии респираторного ацидоза. Формулы рас-
272
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
чета компенсации выявляют, что измеренный рСО2 значи-
тельно выше необходимого для компенсации метаболиче-
ского ацидоза, также как и значение актуального бикарбона-
та — для компенсации респираторного ацидоза. Кроме того,
концентрация калия и остаточных анионов характерна для ос-
трых респираторных нарушений, тогда как значения натрия
и хлора — для частично компенсированных (по буферным
системам) метаболических нарушений. Таким образом, мож-
но констатировать, что имеется смешанное нарушение КОР
крови — острый респираторный ацидоз и частично компенси-
рованный метаболический ацидоз.
Пример 4. Метаболический алкалоз + респираторный алкалоз:
pH = 7,64;
рСО2 = 28 мм рт. ст.;
АВ = 29,0 ммоль/л;
SB — 32,5 ммоль/л;
BE = +9,5 ммоль/л;
Na+ = 135 ммоль/л;
К+ = 4,5 ммоль/л;
акт. НСО3_ = 29,0 ммоль/л;
С1_ = 96 ммоль/л;
R = (135 + 4,5) - (29 + 96) = 14,5
ммоль/л.
Итак, у больного показатели pH, стандартного бикар-
боната и BE высокие, что свидетельствует о наличии мета-
болического алкалоза. Значение рСО2 снижено, а актуаль-
ный бикарбонат ниже стандартного — это указывает на
респираторный алкалоз. Формулы расчета свидетельству-
ют, что значения измеренного рСО2 и актуального бикар-
боната не соответствуют величинам компенсации. Это под-
тверждается также концентрацией электролитов и оста-
точных анионов. Иными словами, имеется смешанное на-
рушение КОР крови — острый респираторный алкалоз и ос-
трый метаболический алкалоз.
Пример 5. Метаболический алкалоз + метаболический ацидоз:
pH = 7,54;
РСО2 = 49 мм рт. ст.;
АВ = 40,5 ммоль/л;
SB = 39,0 ммоль/л;
BE = + 16,0 ммоль/л;
Na+ = 139 ммоль/л;
К+ = 4,0 ммоль/л;
акт. НСО3” = 40,50 ммоль/л;
С1_ = 65 ммоль/л;
R- = (139 + 4,0 ) - (40,5 + 65) =
= 37,5 ммоль/л.
Данный пример наиболее ярко свидетельствует, что на-
рушения КОР крови нельзя оценивать без электролитного
273
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
баланса. Высокие значения pH, бикарбоната и BE указы-
вают на наличие метаболического алкалоза. Уровень
рСО2, а также то обстоятельство, что актуальный бикар-
бонат несколько выше стандартного, доказывают нали-
чие умеренных респираторных изменений. Иными слова-
ми, только по показателям КОР крови можно было бы
констатировать, что у больного метаболический алкалоз,
частично компенсированный респираторным ацидозом.
Ничто в данном анализе не указывает на наличие мета-
болического ацидоза и лишь при исследовании катион-
но-анионного равновесия можно видеть, что концентра-
ция остаточных анионов значительно увеличена. Таким
образом, в организме одновременно протекают два раз-
личных процесса: во внеклеточном пространстве — ме-
таболический алкалоз, обусловленный накоплением ионов
бикарбоната, тогда как во внутриклеточном простран-
стве — метаболический ацидоз, развивающийся вслед-
ствие накопления лактата или других метаболических
кислот. Такое состояние достаточно часто встречается
на 2—3 сутки у больных после крупных хирургических
вмешательств, при лечении шока любой этиологии, при
гипоксии, обусловленной нарушением периферическо-
го кровообращения и т. п. Итак, нарушение КОР крови
в данном случае диагностируется как одновременно при-
сутствующие внеклеточный метаболический алкалоз и
внутриклеточный метаболический ацидоз.
Адекватная коррекция смешанных нарушений КОР
крови возможна только при правильной оценке причин,
их вызвавших, особенно если эти нарушения обусловлены
дефицитом кислорода в организме. Данное обстоятельство
диктует необходимость рассмотрения кислородного стату-
са организма и его влияния на нарушения КОР крови.
2.10. Кислородный статус организма
и КОР крови
Ключевым фактором, определяющим последовательное нару-
шение гомеостаза, является кислородный дисбаланс, наблюдаемый
274
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА_____
в различной степени у всех больных в критическом состоянии.
В целом причины нарушения кислородного баланса можно раз-
делить на две основные группы.
Первая группа (обусловленная гемодинамическими и дыха-
тельными расстройствами):
• снижение сердечного выброса;
• снижение объема циркулирующей крови;
• нарушение микроциркуляции;
• дыхательная недостаточность;
• изменение водного и плазменного объемов.
Вторая группа (обусловленная количественными из-
менениями гемоглобина и химических обменных процес-
сов в клетке):
• снижение гемоглобина;
• изменение pH и рСО2;
• увеличение патологических фракций гемоглобина: мет-
гемоглобина (MetHb), карбогемоглобина (СОНЬ), сульфгемо-
глобина (SHb), фетального гемоглобина (FHb);
• увеличение сродства гемоглобина к кислороду;
• гипертермия;
• увеличение токсинов;
• гиперактивность продуктов перекисного окисления
липидов.
Обе эти группы обеспечивают доступность кислорода для ор-
ганизма, которая, в свою очередь, определяется тремя основ-
ными метаболическими процессами:
• поглощением кислорода легкими;
• транспортом кислорода;
• отдачей кислорода клеткам.
Поглощение кислорода легкими диагностируется по насы-
щению гемоглобина кислородом (sO2) и парциальному напря-
жению кислорода (рО2) артериальной крови.
Нарушение этого процесса может быть обусло-
влено (см. рис. 2.4):
• уменьшением фракции О2 во вдыхаемом воздухе;
• увеличением легочного шунта;
• Увеличением рСО2 артериальной крови;
• снижением давления окружающей среды.
275
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Артериальный статус
кислорода
Заболевания
легких
Сердечное н/л
шунтирование,
отек легочных
мембран
Низкая
альвеолярная
вентиляция
Рисунок 2.4. Причины сниженного поглощения кислорода
в легких
Транспорт кислорода обусловливается общей концентраци-
ей гемоглобина (tHb) и фракцией кислорода, связанной с гемо-
глобином (FO2).
Литгриальнмй craivc
Рисунок 2.5. Причины сниженного транспорта кислорода к
тканям
276
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
Снижение транспорта О2 в основном определяется двумя
причинами (см. рис. 2.5):
• уменьшением концентрации гемоглобина;
• увеличением патологических фракций гемоглобина.
Отдача кислорода тканям определяется по положению кри-
вой диссоциации оксигемоглобина (КДО), свидетельствующей
о степени сродства НЬ к О2 и диагностируется по показателю р50.
Снижение р50 свидетельствует о затруд ненной отдаче кисло-
рода тканям вследствие многих причин (см. рис. 2.6).
Артериальный статус кислорода
Рисунок 2.6. Причины низкой отдачи кислорода тканям
Влияние гемодинамики на метаболизм обусловлено изменени-
ем крово- и кислородоснабжения органов и тканей.
Общепринято, что критерием соответствия потребления
тканями кислорода их потребности в нем являются sO2 и рО2 сме-
шанной венозной крови (в норме: 72—75 % и 40—42 мм рт. ст. со-
ответственно), снижение которых указывает на наличие дефи-
цита кислорода. Однако у больных на фоне интенсивной тера-
пии нормальные или даже высокие их значения не гарантиру-
ют адекватный кислородный баланс в организме. Для оценки со-
277
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
МЕТАБОЛИЗМ ГЛЮКОЗЫ В НОРМЕ
Кислород необходим для
максимальной утилизации
глюкозы при образовании
НОРМАЛЬНОЕ ПОСТУПЛЕНИЕ
КИСЛОРОДА
Рисунок 2.7. Метаболизм глюкозы при нормальном балансе
кислорода
АНАЭРОБНЫЙ МЕТАБОЛИЗМ ГЛЮКОЗЫ
НЕДОСТА ТОЧНОЕ ПОСТУПЛЕНИЕ КИСЛОРОДА
Кислород необходим для макси-
мальной утилизации глюкозы
при образовании ДТФ (энергии)
Недостаток О, снижает
производство АТФ
(экер! ни) и приводит к
образованию молочной
кислоты
1ЮКО1
Глюкоза - основной источ-
ник энергии в организме
Образование молочной
кислоты вызывает
лцктат-ацидоз.
Содержание лактата,
Циркулирующего в
крови, можно измерить.
АТС
ЭНЕРГИЯ
Рисунок 2.8. Метаболизм тлюкозы при дефиците кислорода
в организме
278
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
стояния последнего, помимо sO2 и рО2 артериальной и смешан-
ной венозной крови, необходимо проводить динамическое ис-
следование концентрации лактата, который быстро увеличива-
ется в условиях дефицита кислорода (см. рис. 2.7 и 2.8).
Лактат является ценным показателем:
• раннего признака неадекватного снабжения тканей кисло-
родом;
• метода мониторинга и оценки проводимой терапии;
• диагностики степени гипоксии;
• прогностического показателя исхода лечения.
Динамическое исследование лактата весьма актуально у
больных в критическом состоянии: если на фоне интенсивной те-
рапии отмечается снижение лактата менее 3,5 ммоль/л, то выжи-
вают 90% больных; до 5,5 ммоль/л — 63 %; до 7,5 ммоль/л — 43 %,
но в случае, когда, несмотря на терапию, лактат остается более
9.0 ммоль/л — выживают лишь 7 % больных.
При невозможности определения лактата используют пока-
затель остаточных (резидуальных) анионов, который весьма
просто рассчитывается непосредственно у постели больного:
R [ммоль/л] = (Na+ + К+) - (НСО3“ + СП).
Корреляционная связь между лактатом и R следующая:
• в условиях дефицита кислорода г = 0,92; р<0,05;
• при диабете г = 0,18; р>0,05;
• при почечной недостаточности г = 0,30; р< 0,05.
Иными словами, если у больного нет диабета или выра-
женной почечной недостаточности, то увеличение остаточных
анионов будет свидетельствовать о дефиците кислорода в орга-
низме. Кроме того, одновременное определение КОР крови и ос-
таточных анионов позволяет достаточно легко определить, вы-
званы ли нарушения КОР наличием гипоксии.
Состояние кислородного баланса и метаболизма обычно
оценивают по таким показателям, как сердечный индекс (СИ),
Доставка кислорода (ДО2), потребление кислорода (ПО2), утили-
зация кислорода (УО2), рО2 смешанной венозной крови и лак-
тат. Наблюдаемые при этом нарушения кислородного гомеоста-
за можно разделить на 4 основные группы.
279
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Повышенная потребность в О2 при нормальном его транспорте
При данной ситуации отмечаются нормальные значения
СИ и ДО2 на фоне увеличенных ПО2 и УО2, умеренное сниже-
ние pvO2 и небольшое увеличение лактата. Это состояние в ос-
новном наблюдается при гипертермии, а также в раннем по-
слеоперационном периоде при согревании больного и перево-
де его на самостоятельное дыхание. Обычно при этом не требу-
ется какой-либо специальной терапии, поскольку организм
компенсирует дефицит кислорода, увеличивая скорость его ути-
лизации, что приводит к нормализации кислородного баланса.
Из многих лабораторных показателей наиболее четко о на-
личии или отсутствии гипоксии в этом случае свидетельствует
одновременное динамическое наблюдение за изменением pvO2
и лактата. Наиболее частым нарушением КОР крови является
метаболический ацидоз, который достаточно быстро компенси-
руется организмом.
Снижение транспорта О2 на фоне отсутствия или неэффек-
тивной его компенсации
Указанное нарушение сопровождается резким снижением
СИ, уменьшением ДО2 на фоне увеличения ПО2 и, несмотря на
повышение УО2, выраженным снижением pvO2 и увеличением
лактата. Данное состояние характерно для больных с синдромом
низкого сердечного выброса, обусловленного сердечной недо-
статочностью или гиповолемией (более 30 %). Метаболическим
контролем степени гипоксии и эффективности проводимой те-
рапии служит одновременное динамическое наблюдение за рО2
и лактатом. Нарушение КОР крови на начальном этапе на-
блюдения — метаболический ацидоз, затем смешанное наруше-
ние — метаболический и респираторный алкалоз.
Снижение транспорта О2 с компенсацией за счет увеличения
его экстракции тканями
В данной ситуации наблюдается умеренное снижение СИ
и ДО2 нормальное значение ПО2, выраженное увеличение УО2,
нормальные показатели pvO2 и лактата. Такое состояние обычг
но наблюдается в первые часы после операции по окончании дей^
ствия анестетиков или в условиях умеренной (до 30 %) типовое
лемии. При нормальных параметрах гемодинамики каких-либо
действий, направленных на коррекцию кислородного дефици-
280
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
та, не требуется, поскольку за счет сдвига КДО вправо (ослабле-
ние связи НЪ с О2) ткани получают адекватное их потребностям
количество кислорода. Лабораторные критерии оценки кисло-
родного баланса аналогичны указанным выше — одновремен-
ное динамическое наблюдение за pv О2 и лактатом. Наиболее ча-
сто при этом наблюдается метаболический ацидоз, который до-
статочно быстро коррегируется, однако если больной находит-
ся на ИВЛ, то часто используемый режим гипервентиляции мо-
жет способствовать развитию респираторного алкалоза, влия-
ющего на изменение электролитного баланса.
Снижение транспорта О2 на фоне централизации кровообра-
щения или низкой потребности организма в кислороде
При данном нарушении отмечаются резкое снижение СИ
с одновременным уменьшением ДО2 и ПО2, нормальные значе-
ния УО2 и pvO2, значительное увеличение лактата. Указанная
ситуация может быть обусловлена гипотермией, использовани-
ем препаратов, снижающих метаболизм, а также синдромом
низкого сердечного выброса вследствие сердечной недостаточ-
ности или снижения объема циркулирующей крови. В данном
случае решение о необходимости терапии кислородного дисба-
ланса и гемодинамики может быть принято только после согре-
вания больного и отмены или окончания действия вышеука-
занных препаратов. При этом наблюдаются два ответа организ-
ма на действие клинициста: в первом все показатели гемодина-
мики и метаболизма, включая КОР крови, нормализуются, во
втором степень нарушения указанных показателей еще более
углубляется, что позволяет выявить причину централизации
кровообращения и необходимость лечения данного состояния.
В такой ситуации динамическое одновременное наблюде-
ние за изменением pvO2 и лактата достаточно для оценки состоя-
ния кислородного баланса и эффективности проводимой тера-
пии. Однако более полную картину дает параллельное исследо-
вание концентрации НЬ, КОР крови и электролитного баланса.
Нарушение КОР крови при этом в первые часы характеризует-
ся наличием метаболического ацидоза, в дальнейшем — гипока-
лиемического метаболического алкалоза.
Влияние дыхательной недостаточности на кислородный
баланс обусловлено главным образом снижением содержания ки-
281
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
слорода (СаО2)и парциального напряжения кислорода (раО2) в
артериальной крови. Определенную роль при этом играет и низ-
кое насыщение кислородом смешанной венозной крови (svO2 <
< 50 %), затрудняющее адекватное присоединение кислорода к
гемоглобину за нормальный цикл его прохождения в легочных
капиллярах.
Высокую диагностическую значимость имеет определение
концентрации общего гемоглобина, что позволяет оценить его
«вклад» в возникновение гипоксии (рис. 2.9).
Дыха i с.щцдн цьюста ючнпс i ь
рО2(а) <55 ммрт.ст.
sO2(a) <75%
Нв 140 г/л
Лактат <2.5 ммоль/л
СВ 5,4 л/мин
А
рО2(а) <55 мм рт.ст.
sO2(a) < 75 %
Нв______100 г/л
Лактат 4.5 ммоль/л
СВ 5,4 л/мин
Рисунок 2.9. Влияние гемоглобина на степень гипоксии при
дыхательной недостаточности
Как можно видеть, в условиях нормального гемоглобина
даже значительная артериальная гипоксемия (рдО2 < 55 мм рт. ст.,
s^O, < 75 % ) сопровождалась лишь умеренной тканевой гипокси-
ей (лактат 1,6 ммоль/л). При этом в крови отмечался умеренный
метаболический ацидоз. Тогда как на фоне сниженного гемогло-
бина, при аналогичных кислородных показателях артериаль-
ной крови, степень тканевой гипоксии значительно увеличива-
лась (лактат 4,5 ммоль/л), что характеризовало и нарушение
КОР крови — выраженный метаболический ацидоз с умерен-
ной компенсацией респираторным алкалозом.
282
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
Особое внимание хотелось бы обратить на изменение мета-
болизма во время и после крупных хирургических вмешательств,
поскольку любое из них непосредственно влияет на нарушение
кислородного, кислотно-основного и водно-электролитного
гомеостаза.
2.11. Нарушения КОР крови во время
и после операции
Метаболический ацидоз часто обусловлен гемодилюцией,
избыточным переливанием растворов, содержащих хлор. Сни-
жение pH в такой ситуации обычно находится в пределах
7,32—7,34, BE крови до —6,0 ммоль/л, концентрация лактата не
превышает 1,5 ммоль/л. Данный метаболический ацидоз не
нуждается в коррекции, поскольку достаточно быстро нейтра-
лизуется буферными системами организма. Более того, перели-
вание в такой ситуации растворов бикарбоната натрия может
приводить к нежелательным нарушениям КОР крови и водно-
электролитного баланса.
В то же время гипоксический метаболический ацидоз (рис. 2.10),
развивающийся на фоне дефицита кислорода, весьма опасен в
связи со значительными нарушениями метаболизма.
• pH 7,23
• рСО2 32 мм рт.ст.
• BE (-10,5) ммоль/л
• svO2 52%
• pvO2 25,5 мм рт.ст.
• Лактат 6,5 ммоль/л
• К+ 3,5 ммоль/л
• Са 0,68 ммоль/л
Рисунок 2.10. Пшоксический метаболический ацидоз
283
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
При наличии указанного осложнения необходимо знать,
что введение только растворов бикарбоната натрия не кор-
регирует гипоксический ацидоз, поскольку лактат не ме-
таболизируется. Для адекватного лечения в арсенал терапии
должны быть включены препараты, способствующие улуч-
шению снабжения тканей кровью и кислородом или (если
это возможно) проведение больным сеансов баротерапии.
Только коррекция кислородного дисбаланса позволит аде-
кватно лечить нарушения КОР крови и водно-электролитно-
го баланса.
Метаболический алкалоз во время операции встречается
довольно редко и в основном обусловлен передозировкой ще-
лочных растворов или исходным алкалозом в связи с имею-
щимися электролитными нарушениями.
Вместе с тем в раннем послеоперационном периоде это
нарушение КОР крови встречается довольно часто. При-
чины развития послеоперационного метаболического ал-
калоза различны. Он может быть обусловлен метаболизаци-
ей цитрата натрия (вследствие переливания крови во время
операции), интраоперационной передозировкой растворов
бикарбоната натрия, что способствует потере ионов хлора,
чему также может способствовать увеличение ионов бикар-
боната вследствие снижения ОЦК на фоне усиленного ди-
уреза. Данный алкалоз протекает с pH до 7,48 и BE крови до
+5,0 ммоль/л, он не нуждается в коррекции, поскольку из-
быточные ионы бикарбоната усиленно выделяются почка-
ми, доказательством чему является увеличение pH мочи бо-
лее 6,8 ед.
Наиболее опасен для больного гипоксический метаболи-
ческий алкалоз (рис. 2.11), протекающий на фоне вторично-
го гиперальдостеронизма и возникающий обычно на 2—3-й
послеоперационный день. Этот процесс протекает на фоне ги-
поксии с выраженными нарушениями электролитного ба-
ланса, его весьма трудно коррегировать, поскольку в этой
ситуации почки не выделяют, а реабсорбируют ионы бикар-
боната, увеличивая тем самым их содержание в плазме и, со-
ответственно, pH крови. Последний, в свою очередь, препят-
ствует коррекции электролитных нарушений.
284
ГЛАВА2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
pH 7,57
рСО2 48 мм рт ст
BE (+12,5) ммоль/л
SvO2 62 %
pvO2 34 мм рт ст
Лактат 6,0 ммоль/л
К* 3.2 ммоль/л
Са2+ 0,65 ммоль/л
Рисунок 2.11. Гипоксический метаболический алкалоз
Значение pH мочи менее 4,0 ед. является отличительной
чертой гипоксического гипокалиемического метаболического ал-
калоза.
Д ля успешного лечения гипоксического метаболического ал-
калоза необходимо четко определять критерии его диагностики
и методы коррекции. Наш опыт позволил выделить основные
пункты диагностики и лечения гипоксического метаболического
алкалоза, наблюдаемого как после крупных хирургических опе-
раций, так и у больных в критическом состоянии.
Диагностика:
• pH мочи < 3,5;
• остаточные анионы > 22 ммоль/л;
• лактат > 3,5 ммоль/л;
• калий плазмы < 4,0 ммоль/л;
• калий мочи > 60 ммоль/л;
• отношение натрий/калий мочи < 2;
• осмоляльность плазмы >315 мосмоль/кг;
• ОЦК снижен.
Коррекция:
• увеличение ОЦК;
• введение ингибиторов альдостерона и карбоангидразы;
285
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• введение калия с учетом его суточных потерь с мочой в
«коктейле», содержащем кальций, магний, инсулин в растворе
глюкозы;
• поддержка режима гиповентиляции (если больной на
ИВЛ);
• увеличение фракции О2 во вдыхаемом воздухе;
• введение закисляющих растворов;
• по показаниям использовать плазмаферез.
Наличие респираторных нарушений КОР кроем по время и по-
сле операции главным образом обусловлено изменением режи-
ма ИВЛ или развитием дыхательной недостаточности.
При остром респираторном ацидозе накопление СО2 может
сопровождаться снижением рСО2 артериальной крови, о таком
состоянии написано выше. Необходимо еще раз вспомнить, что
в данной ситуации при увеличении РаСО2 более 65 мм рт. ст. не
углекислота, а именно снижение уровня кислорода (раО2 менее
80 мм рт. ст.) в артериальной крови является основным стиму-
лятором рецепторов дыхательного центра, т. е. компенсатор-
ной реакцией, обуславливающей газообмен в легких. Увеличе-
ние фракции кислорода во вдыхаемом воздухе в данном случае
может привести к срыву защитно-компенсаторной реакции ор-
ганизма и усугубить указанное нарушение и его последствия.
Действия клиницистов должны быть направлены в первую
очередь на снижение показателя раСО2, что в дальнейшем кор-
регирует и артериальную гипоксемию.
Острый респираторный алкалоз наиболее часто связан с
гипервентиляционным режимом ИВЛ. При развитии этого
осложнения необходимо учитывать два обстоятельства: во-пер-
вых, если pH крови выше 7,52 — это приводит к неадекватному
снабжению тканей кислородом вследствие усиления его связи с
гемоглобином, и, во-вторых, на фоне метаболического алкало-
за искусственная гипервентиляция препятствует компенсатор-
ным механизмам, направленным на снижение pH крови, что ве-
дет к нарушению электролитного баланса.
Как во время, так и после операции практически всегда от-
мечаются различной степени нарушения водного баланса вслед-
ствие введения большого количества кристаллоидных растворов,
стимуляции диуреза или перемещения жидкости на фоне опе-
286
ГЛАВА2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
рационного стресса. Степень выраженности нарушений вод-
ного баланса особенно ярко проявляется в послеоперационном
периоде на фоне полиурии, вызванной интраоперационным
введением диуретиков, или гипоксии, а также на фоне олигурии
у больных с острыми нарушениями кровообращения с задерж-
кой натрия и воды в организме.
Кроме того, у больных в критическом состоянии значитель-
ное влияние на изменение водного баланса оказывает гипоксия:
• с 1 мэкв натрия в клетку входят 7мл Н2О, что приводит к
задержке жидкости в тканях и искусственной гиповолемии;
• снижение воды в сосудистом русле ведет к увеличению ос-
моляльности плазмы, что обуславливает активизацию антидиу-
ретического гормона, снижающего диурез;
• уменьшение ОЦК сопровождается увеличением секреции
альдостерона, который способствует задержке натрия и жидко-
сти в организме.
Иными словами, возникает порочный круг, когда на фоне
внутриклеточного отека искусственная гипоксическая гипово-
лемия препятствует выведению избытка жидкости из организ-
ма. Попытка клиницистов в такой ситуации увеличить ОЦК
введением кристаллоидов является ошибкой и может значи-
тельно ухудшить состояние больного.
Для правильной оценки состояния водного баланса необхо-
димо знать третий закон, связывающий кислотно-основное рав-
новесие и водно-электролитный баланс — закон изоосмоляльно-
сти,
2.12. Закон изоосмоляльности
Данный закон гласит, что осмоляльность во всех жидких сек-
торах организма должна быть одинакова. Осмоляльность плазмы
в норме составляет 286 ± 2 мосмоль/кг и является весьма стабиль-
ной величиной. Увеличение или снижение этого показателя да-
же на 2 мосмоль/кг вызывает резкое изменение вне- и внутри-
клеточных перемещений воды. В свою очередь, стремление ура-
вновесить ее изменения в водных секторах сопровождается уве-
личением активности АДГ и альдостерона, что может приводить
к нарушениям важных параметров гемодинамики и гомеостаза.
287
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Компоненты, определяющие показатель осмоляльности плазмы;
Натрий 140
Хлор 98
Бикарбонат 18
Калий, кальций, магний 6
Глюкоза 5
Мочевина 3
Белок, кислоты 16
Итого: 286 мосмоль/кг ~
Как можно видеть, основными компонентами осмоляльно-
сти плазмы являются натрий и хлор, вторыми по значимости —
кислоты и белок, меньшее влияние оказывают глюкоза, моче-
вина и электролиты. Диагностическая значимость осмоляль-
ности плазмы весьма велика при решении вопроса о введении
различных кровозамещающих растворов. Особенно осторож-
ными действия клиницистов должны быть при наличии «ис-
кусственной гипоксической гиповолемии», в первую очередь
они должны быть направлены на коррекцию дефицита кисло-
рода, поскольку переливание жидкости для увеличения ОЦК
приведет к усугублению тяжести состояния больного и (на фо-
не отсутствия истинной гиповолемии) к усилению внутриорган-
ного и клеточного отека.
Компоненты, определяющие показатель осмоляльности мочи:
Мочевина 555
Натрий + хлор 200
Калий + хлор 140
Всего: 895 мосмоль/кг
В противоположность плазме, осмоляльность мочи коле-
блется в довольно широких пределах (550—950 мосмоль/кг).
Этот показатель в основном обусловлен содержанием мочеви-
ны и в меньшей степени — электролитов. В связи с этим для ди-
агностики нарушений функционального состояния почек ис-
пользуют в основном не осмоляльность мочи, а ее соотношение
с осмоляльностью плазмы.
По выделению осмотически активных веществ можно про-
вести дифференциальную диагностику между функциональным и
288
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
органическим повреждениями почек, оценивая показатель кон-
центрационного осмоляльного клиренса (Косм.) и клиренса свобод-
ной воды (КСВ) по следующим формулам:
Косм, [мл/мин] = (Осмоляльность мочи х объем) / Осмо-
ляльность плазмы (1)
(норма больше 1,0),
КСВ [мл/мин] = Объем мочи — Косм. (2)
(норма от —0,4 до -1,7).
При органических повреждениях почек: Косм.< 0,5 мл/мин;
КСВ < —0,2 мл/мин.
Соотношение осмоляльности моча/плазма можно ис-
пользовать для диагностики причин олигурии и правиль-
ной тактики ее лечения. Так, его показатель 2,7—4,0 сви-
детельствует о дегидратации организма', 2,0—1,3 — о сни-
женном кровотоке', менее 1,5 — об острой почечной недо-
статочности.
В условиях дефицита кислорода высокая корреля-
ционная связь между концентрацией лактата и осмоляль-
ностью плазмы (г = 0,91, р < 0,05) констатирует, что ос-
моляльность является достаточно четким критерием на-
личия гипоксии.
Для определения осмоляльности используют прибо-
ры, основанные на точке замерзания жидкости — осмоме-
тры. Данные приборы весьма необходимы для оценки
водного баланса, особенно у больных в критических со-
стояниях, они должны быть во всех отделениях интен-
сивной терапии для выбора адекватного метода лечения.
Если такого прибора в клинике нет, то осмоляльность
плазмы и мочи можно определить по формулам, позво-
ляющим в клинической практике быстро ориентировать-
ся на состояние водного баланса больного.
Величину осмоляльности плазмы можно рассчитать по формуле:
Осм. плазмы Глюкоза Мочевина
мосмоль/кг = l,86(Na+) + 18 +2,8,
289
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
где 1,86 — диссоциация ионов Na и Cl в растворе (осмоти-
ческий коэффициент каждого иона равен 0,93), таким образом,
0,93x2 = 1,86;
1/18 — м. в. глюкозы равен 180 г (т. е. каждые 180 мг% глю-
козы увеличивают осмоляльность плазмы на 10 мосмоль/кг);
1/ 2,8 — м. в. азота равен 2,8 г (т. е. каждые 28 мг% мочеви-
ны увеличивают осмоляльность плазмы наЮ мосмоль/кг).
Изменение концентрации глюкозы и мочевины оказывают
непосредственное влияние на содержание натрия:
• при увеличении глюкозы на 100 мг% от нормы Na+ уме-
ньшается на 1,6 ммоль/л;
• при увеличении мочевины на 28 мг% от нормы Na+ сни-
жается на 3,3 ммоль/л.
Таким образом, глюкоза и мочевина не только непосред-
ственно, но и через изменение концентрации натрия влияют
на осмоляльность плазмы.
Осмоляльность мочи вычисляется по формуле:
Осм. мочи [мосмоль/кг] = 33,3 х Д,
где Д — две последние цифры плотности мочи.
Причины увеличения осмоляльности.
• гипернатриемия;
• увеличение концентрации глюкозы и мочевины;
• гипоксия;
• дегидратация.
Причины снижения осмоляльности:
• избыточное количество воды (гипергидратация);
• гипонатриемия;
• сочетание гипергидратации с гипонатриемией.
Величина коллоидно-осмотического давления (КОД) плаз-
мы, хотя и занимает небольшое место в обшем блоке осмо-
лярности, является весьма важным параметром в поддер-
жании гомеостаза. В норме КОД составляет 25 ± 2 мм рт. ст.
По значению КОД плазмы, основу которого составляют бел-
ки (альбумины — 65—80 %, глобулины — 0—18 % и фибрино-
ген — 2 %), можно судить о необходимости введения плаз-
мы и выборе соотношения между переливаемыми кристал-
лоидными и коллоидными растворами. Последнее особен-
но важно, поскольку жизненные функции организма не мо-
290
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА_______
гут осуществляться при потере плазмы более чем на 30 % от
общего объема.
Данный показатель определяется на приборе онкометре.
При отсутствии приборов в экстренных случаях можно исполь-
зовать для расчета КОД следующую формулу:
КОД [мм рт. ст.] = 4,57 х (белок [г%]) + 0,19.
Снижение показателя КОД обусловлено следующими при-
чинами:
• увеличением проницаемости сосудов (переход белка в
интерстициальное пространство);
• печеночной недостаточностью (снижение концентрации белка);
• мобилизацией плазменного альбумина;
• потерей плазмы вследствие кровотечения;
• гемодилюцией (разведение плазменных белков).
Уменьшение КОД плазмы приводит к снижению соотношения
коллоидного и гидростатического давления, вызывая интерсти-
циальный отек органов и тканей (главным образом легких, мио-
карда, мозга), что утяжеляет
клиническое состояние больных и способствует развитию
полиорганной недостаточности.
Увеличению КОД способствуют следующие причины:
• дефицит объема плазмы при ограниченном поступлении
воды или избыточных ее потерях;
• увеличение концентрации белковых компонентов: фи-
бриногена, у-глобул инов или ctj-и а2-глобулинов;
• увеличение концентрации веществ, снижающих выход
белка из сосудистого русла, таких как экзо- и эндогенные кате-
холамины, глюкокортикоидные гормоны;
• увеличение возврата белка с лимфой на фоне снижен-
ной проницаемости сосудов;
• переливание гиперонкотических растворов.
Увеличение КОД способствует всасыванию и задержке воды
в сосудистом русле, обуславливая клеточную дегидратацию и ги-
перволемию; препятствует ультрафильтрации мочи во время ги-
потензивных состояний и является важным фактором в развитии
олигурии
291
ТРАНСФУЗИОЛОГИЯ в реаниматологии
Состояние водно-электролитного баланса непосредствен-
но влияет на осмоляльность и зависит от нее. Осмоляльность, об-
уславливая нарушение различных органов и тканей, способ-
ствует развитию дисбаланса КОР крови.
Таким образом, толысо оценка всех трех законов, связываю-
щих КОР крови и водно-электролитный баланс, позволяет пра-
вильно дифференцировать их нарушения.
Калий и кислотно-основное равновесие крови
Среди всех указанных выше электролитов особое внимание
хотелось бы уделить иону калия, поскольку его изменения оказы-
вают непосредственное влияние на нарушения КОР крови.
В свою очередь нарушения КОР крови также напрямую влияют
на концентрацию этого иона. Факторы, регулирующие клеточное
распределение калия в организме, представлены на рис. 2.12.
Как можно видеть, клеточное распределение калия регули-
руется естественными (физиологическими) причинами,и, кро-
ме того, изменение калия связано с патофизиологическими
причинами, первое место среди которых занимает кислотно-
основное равновесие.
Факторы, регулирующие
клеточное распределение калия
Физиологические
ИНСУЛИН
КАТЕХОЛАМИНЫ
АЛЬДОСТЕРОН
Патофизиологические
КИСЛОТНО-
ОСНОВНОЕ
РАВНОВЕСИЕ
ОСМОЛЯЛЬНОСТЬ
ЦЕЛОСТНОСТЬ
ТКАНЕЙ
Рисунок 2.12. Факторы, регулирующие распределение калия
в организме
292
ГПАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА_____
Перемещения калия, наблюдаемые при острых наруше-
ниях КОР крови, представлены на рис. 2.13.
Внутриклеточная жидкость Внеклеточная жидкость
АЦИДОЗ К+
АЛКАЛОЗ н+ м Na+ м к+
Рисунок 2.13. Перемещения калия при острых
нарушениях pH
Как можно видеть, в условиях ацидоза ионы водорода вхо-
дят в клетку, тогда как ионы натрия и калия выходят во внекле-
точную жидкость для поддержания электронейтральности. При
остром алкалозе наблюдается противоположный процесс дви-
жения этих ионов.
При острых нарушениях pH можно количественно опреде-
лить, насколько изменится концентрация калия (рис. 2.14).
| Острые нарушения pH |
При увеличении или снижении pH на 0,1 ед. калий
уменьшается или увеличивается на 0,63 ммоль/л
Рисунок 2.14. Изменения концентрации калия при острых
нарушениях pH
293
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Оценка калиевого баланса представлена на рис. 2.15.
Диагностические подходы к гипокалиемии
Рисунок 2.15. Оценка калиевого баланса
Видно, что снижение концентрации калия может быть ис-
тинное вследствие его перераспределения во вне- и внутрикле-
точном пространстве или потери (экстраренальные или связан-
ные с избыточной его потерей с мочой), а также ложное, что мо-
жет встречаться при избыточной терапии инсулином, вызы-
вающей значительное накопление калия в клетке с последующим
выходом его во внеклеточное пространство.
Потери калия, не связанные с функцией почек, характери-
зуются низким его выделением вследствие различных указанных
на рис. 2.16 причин, однако, как можно видеть, в одних случаях
это протекает при нормальных показателях КОР крови, в дру-
гих — ведет к метаболическим нарушениям КОР.
294
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
Избыточное выделение калия с мочой способствует обще-
му дефициту его в организме. При этом, как свидетельствуют
причины, указанные на рис. 2.17, КОР крови может быть в нор-
ме, но могут отмечаться и его метаболические нарушения, такие
как ацидоз или алкалоз.
Перемещение калия в почках при различных нарушениях
КОР крови представлено на рис. 2.18.
Как можно видеть, при нормальном состоянии КОР крови
в дистальных канальцах ионы калия и водорода экскретируют-
ся практически с равной скоростью в обмен на ион натрия, ко-
торый возвращается в кровь. При метаболическом ацидозе уси-
ливается экскреция ионов водорода, тогда как выделение калия
снижается и, следовательно, увеличивается его концентрация в
крови. В условиях метаболического алкалоза значительно воз-
растает экскреция калия, что ведет к снижению его концентра-
ции в крови. При общем дефиците калия в организме экскреции
Диагностические подходы к гипокалиемии
Рисунок 2.16. Экстраренальные потери калия
295
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Почечный каналь-
цевый ацидоз
Ацетазоламид
Диаб.кетоацидоз
Уретеросигмостомия
Рвота или промы-
вание желудка
Диарея с потерей С1
Лечение диуретиками
Гиперальдостеронизм
Дефицит калия
Потеря Mg
Антибиотики
Пенициллины
Аминогликозиды
Лейкоз
Рисунок 2.17. Потери калия, обусловленные выведением его
с мочой
Перемещение К+ в дистальных канальцах при нарушении КОР
Рисунок 2.18. Перемещение калия в почках при различных
нарушениях КОР
296
ГЛАВА 7.. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
его практически не отмечается, тогда как, несмотря на увеличе-
ние в крови ионов бикарбоната, значительно усиливается ско-
рость выделения ионов водорода, что приводит к выраженному
снижению pH мочи, т. е. к гипокалиемическому метаболическо-
му алкалозу, который подробно описан выше.
В клинических условиях при диагностике гипокалиемиче-
ского метаболического алкалоза для быстрой ориентировки в из-
менении и коррекции концентрации калия его показатель мож-
но рассчитать (см. рис. 2.19).
При метаболическом алкалозе
с незначительным увеличением
рСО2 - калий может быть рас-
считан по формуле:
К+пл. = 3,5 - 0,2 х BE
(ммоль/л)
Рисунок 2.19. Расчет концентрации калия при метаболическом
алкалозе
Необходимо помнить, что данный расчет концентрации
калия может быть адекватным лишь при остром или частично
компенсированном метаболическом алкалозе, поскольку в усло-
виях полной компенсации увеличенное значение рСО2 само
оказывает влияние на концентрацию калия.
При дефиците калия его коррекцию обычно проводят ра-
створами хлористого калия, ориентируясь на содержание этого
иона в плазме. Какой-либо точной формулы для определения
необходимого количества калия до сих пор нет, однако достаточ-
но достоверной и наиболее часто используемой является следую-
щая формула:
297
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
К+ [ммоль] = (К+норм. — К+изм.) х 0,4 х (вес тела [кг]).
При этом необходимо помнить, что 1 г хлористого калия
(КС1) содержит 13,9 ммоль калия.
Гиперкалиемия в основном наблюдается при острых наруше-
ниях КОР крови, таких как метаболический или респираторный
ацидоз.
Причины гиперкалиемии представлены на рис. 2.20.
Г иперкал иемия
Псевдогиперкалиемия
Г емолиз
Тромбоцитоз
Лейкоцитоз
Наложение жгута
Перераспределение калия
Ацидоз
Инсулин
Передозировка дигиталиса
Сукцилинхолин
Периодический паралич
Ь-Адреналитическая
блокада
Рисунок 2.20. Патогенетические причины гиперкалииемии
Патогенез развития гиперкалиемии различен. Она может
быть наведенной, связанной с ятрогенными факторами или ос-
трыми заболеваниями, в других случаях отмечается наличие ис-
тинной гиперкалиемии, обусловленной перераспределением
калия.
По скорости клубочковой фильтрации можно оценить острые
и хронические причины развития гиперкалиемии. В итоге мож-
но заключить, что основными причинами, вызывающими избы-
ток калия в организме, являются: острая и хроническая почечная
298
гпдвА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
не^о(таточность; метаболический или респираторный ацидлз;
2ОрМокалькая недостаточность, обусловленная гипоальдрстеро-
низМОМ (рис. 2.21). Избыток калия во внеклеточном простран-
стве наиболее часто связан с его выходом из внутриклеточного
пространства вследствие повремсдения клеток или ятрогенных
причин.
Рисунок 2.21. Причины избытка калия в организме
Терапия гиперкалиемии определяется причинами, ее вызвав-
шими: при передозировке калия (введение раствора хлористо-
го кальция); при остром метаболическом или респираторном
ацидозе (введение 20—40 %-ного раствора глюкозы с инсулином);
при почечной недостаточности (проведение гемодиализа и дру-
гих методов терапии).
Таким образом, изменение концентрации калия в организме Яв-
ляется существенным фактором, определяющим нарушения ки-
слотно-основного равновесия и, в свою очередь, напрямую завися-
щим от вида этого нарушения.
Интерпретация полученных лабораторных данных и аде-
кватность терапии
299
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Правильная интерпретация полученных данных весьма
важна, поскольку определяет необходимость выбора метода те-
рапии. В связи с этим врачи, работающие в лаборатории, должны
иметь соответствующую подготовку. Знание основных патофизио-
логических особенностей нарушения гомеостаза при стрессе явля-
ется непременным условием при работе в лаборатории экспресс-
диагностики. Только в такой ситуации лабораторные работники
могут полноценно сотрудничать, не только отвечая за досто-
верность проведенного анализа, но и помогая правильно оценить
полученные данные.
Примеры постановки диагноза и выбора терапии.
Пример 1. Больная К., 45лет, оперирована по поводу ише-
мической болезни сердца, проведено множественное аортоко-
ронарное шунтирование. Лабораторные исследования сделаны
в течение первых часов после операции. Больная находилась
на ИВЛ, используемые дозы кардиотоников — 3—5 мкг/кг. Ла-
бораторные данные представлены на рис. 2.22.
Больная К. первые часы после операции на сердце
16^ 173! 18?»
t°C 35 37 37,5
pH 7,39 7.35 7,38
рСО2, мм рт. ст. 37 45 48
BE, ммоль/л -4,0 -2,0 +2,0
SvO2,% 86 67 52 J'
pvOj, мм рт. ст. 58 Лактат, ммоль/л 3,5 Лактатацидоз умеренная гипотермия дефицит О2? 1—► 37 . 28 £ 5.6 1 6,4 Лактатацидоз Лактатацидоз на дефицит О2? фоне снижения тканевой
Снижение оксигенации
сердечного выброса
Рисунок 2.22. Лабораторные данные больной К.
300
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА_____
Интерпретация данных и терапия:
16 ч 50 мин — на фоне умеренной гипотермии КОР крови
практически в пределах нормы, высокие показатели кислород-
ного баланса венозной крови отмечены на фоне накопления
лактата. Дефицит О2№
Приняты меры, направленные на согревание больной.
17 ч 30 мин — нормотермия, умеренный респираторный
ацидоз, нормальные показатели кислородного баланса венозной
крови на фоне продолжающегося увеличения концентрации
лактата. Дефицит О2№
Изменен режим ИВЛ, дозы кардиотоников не увеличены.
18 ч 10мин — компенсированный респираторный ацидоз,
снижение показателей кислородного баланса венозной крови на
фоне увеличения концентрации лактата — тканевая гипоксия.
Увеличена доза кардиотоников до 7 мкг/кг и фракция кисло-
рода во вдыхаемом воздухе, проводили мероприятия, напра-
вленные на снижение температуры и поддержание показателя ге-
моглобина не ниже 112 г/л.
Вывод. На фоне интенсивной терапии нормальные пока-
затели КОР крови и кислородного баланса не всегда свиде-
тельствуют об отсутствии дефицита кислорода. У данной боль-
ной постоянное увеличение концентрации лактата явилось
наиболее четким критерием наличия циркуляторной гипо-
ксии, причиной которой было снижение сердечного выброса.
Неадекватное снабжение кровью и кислородом организма на-
иболее ярко проявились при согревании больной и восполне-
нии объема циркулирующей крови. Иными словами, увеличе-
ние степени лактатацидоза даже на фоне нормальных показа-
телей КОР и кислородного баланса венозной крови должно на-
стораживать клинициста, указывая на наличие дефицита кисло-
рода у пациента.
Пример 2. Больной М., 52 года. Проведена операция резек-
ции желудка. Лабораторные исследования сделаны на 1-е сутки
после операции (рис. 2.23).
Пример 3. Больной С., 43 года. Операция по протезированию
митрального клапана. Исследования проведены на 3-и сутки
после операции (рис. 2.23) на фоне острых расстройств крово-
обращения. Функция почек в пределах нормы.
301
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Результаты анализов больных М. и С.
Больной М. Больной С.
Введено 200 мл NaHCCb п/о на сердце
pH 7,56 7,58
рСО2 42 мм рт.ст. 41 мм рт.ст.
BE +14,0 ммоль/л +14,0 ммоль/л
К+ 4,0 ммоль/л 3,7 ммоль/л
С1- 85 ммоль/л 82,0 ммоль/л
рН
мочи 7,5 | 3,5 |
R 16 ммоль/л 26 ммоль/лТ
Рисунок 2.23. Лабораторные данные больного М.
и больного С.
Интерпретация данных и терапия'.
Больной М. Диагноз: некомпенсированный метаболический
алкалоз на фоне снижения концентрации хлора, усиленное вы-
деление ионов бикарбоната с мочой.
Больной С. Диагноз: некомпенсированный метаболический
алкалоз на фоне сниженной концентрации калия и хлора. Уси-
ление реабсорбции ионов бикарбоната почками, снижение pH
мочи, увеличение концентрации остаточных анионов, свиде-
тельствующих о накоплении кислот.
Терапия, проводимая у больных, представлена на рис. 2.24.
Как можно видеть, больному М. для коррекции некомпен-
сированного метаболического алкалоза вводили только растворы
хлора, тогда как бальному С. требовалось также использование ме-
тодов, направленных на улучшение кислородного баланса.
Заключение. У обоих больных имел место некомпенсиро-
ванный метаболический алкалоз, однако природа его была
различной. Исследование pH мочи свидетельствовало, что
у больного М. отмечалась почечная компенсация алкалоза,
у больного С. она отсутствовала и имело место значитель-
302
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
Диагностика нарушений КОР крови
и терапия у больных М. и С.
Бальной М.
Введено 200 мл NaHCOb
Метаболический алкалоз
Больной С
п/о на серин е
Гипокалиемический
метаболический алкалоз+
внулриклегочньй ашэдоз
3. Терапия: |
Умеренное введение ионов
хлора
♦
1. Улучшение
кислородного баланса
2. Введение ионов калия с
глюкозой и инсулином
Рисунок 2.24. Терапия, проводимая у больных М. и С.
ное выделение кислот, которое в свою очередь указывало на
дефицит калия в организме. Концентрация остаточных
анионов свидетельствовала об отсутствии накопления ки-
слот у больного М. и их наличии у больного С. Поскольку
у больного С. не отмечалось почечной недостаточности
или диабета, можно заключить, что увеличение остаточ-
ных анионов у данного пациента было обусловлено нако-
плением лактата, т. е. свидетельствовало о дефиците ки-
слорода в организме.
Вывод по примерам 2 и 3. Исследование только показа-
телей КОР крови не всегда позволяет правильно интерпре-
тировать полученные результаты. Это возможно только при
одновременном исследовании электролитного баланса, на-
рушения которого часто могут быть не только следствием,
но и причиной изменения КОР крови.
Ошибки интерпретации данных и корригирующей терапии.
Пример 1. Больная А., 52года. Диагноз: состояние после хо-
лецистэктомии, сахарный диабет. Исследование проведено в
первые сутки после операции (рис. 2.25).
303
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Больная А. Первые часы после операции
ЮЗЙ 11» 13й
7,19 7,21 7,22
ри 54 50 48
рСО2, мм рт. ст. -12,0 -8,0 -8,0
BE, ммоль/л 350 200 125
Глюкоза, мг%
66 60 56
SvOj, % 36 1 32 ? 27
pvOj, мм рт. ст. 20 26 29*
R, ммоль/л 1,5 2,1 2,9^
Лактат, ммоль/л Т Т ТГ
Т ТТ
Кетоацидоз Кетоацидоз Респираторный и
метаболический
апидоз
Рисунок 2.25. Лабораторные данные больной А.
Интерпретация данных и терапия'.
10 ч 30 мин — метаболический ацидоз на фоне выраженной
гипергликемии. Введены инсулин и 150 мл 7 %-ного раствора би-
карбоната натрия.
11ч 30мин — метаболический и респираторный ацидоз на фо-
не умеренной гипергликемии. Введены инсулин и 70 мл 7 %-но-
го раствора бикарбоната натрия.
13 ч 30 мин — метаболический и респираторный ацидоз.
У больной отмечено нарушение гемодинамики, потребовавшее
введения умеренных доз кардиотоников. Ошибки интерпрета-
ции полученных данных представлены на рис. 2.26.
Основной ошибкой интерпретации явилось то, что клиницис-
ты не уделили должного внимания изменению показателей ки-
слородного баланса венозной крови, которое на фоне увеличе-
ния лактата свидетельствовало о неадекватном крово- и кисло-
родоснабжении тканей.
Последствия ошибок:
• углубление степени дефицита кислорода;
• нарушения гемодинамики (гипотония и тахикардия).
304
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА______
Больная А. Терапия и интерпретация
результатов
Терапия: инсулин, гормоны, бикарбонат
Ошибки интерпретации результатов, следствием
чего явилась неадекватная терапия:
1. Не было обращено внимание на увеличение
лактата
2. На фоне снижения глюкозы—остаточные анионы
и лактат увеличивались— дефицит О2!
3. Необходимо было проводить оксигенотерапию
или другими средствами компенсировать дефицит
кислорода
Рисунок 2.26. Ошибки интерпретации результатов анализов
больной А.
Пример 2. Больной Л., 41 год, состояние после операции
аортокоронарного шунтирования, ИВЛ. Исследования выпол-
нены в артериальной крови в первые часы после операции. На
рис. 2.27—2.29 показаны результаты лабораторных анализов и
проводимая терапия.
15 ч 30 мин — респираторный ацидоз, снижение оксигенирую-
щей функции легких. Терапия заключалась в увеличении фрак-
ции кислорода во вдыхаемом воздухе.
16 ч 00мин — острый респираторный ацидоз, нарушение ды-
хательной функции легких. Изменен режим ИВЛ на гипервен-
тиляцию, увеличена фракция кислорода во вдыхаемом воздухе,
подключен PEEP.
16 ч 30мин — острый респираторный ацидоз. Усилен режим
гипервентиляции.
Ошибки интерпретации данных и, соответственно, прово-
димой терапии представлены на рис. 2.30.
Основной ошибкой терапии было первичное увеличение
Фракции кислорода во вдыхаемом воздухе, поскольку при уве-
личении рСО2 артериальной крови более 60 мм рт. ст. основным
305
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Больной Л.Первые часы после операции АКШ (1)
15^2
FO2-35%
pH 7,30 Терапия:
рСО2 64 мм рт. ст. Т увеличена
BE +4,0 ммоль/л фракция
раО, 74 ммрт.ст. 4- вдыхаемого
Лактат 1,4 ммоль/л кислорода
J
Нарушение оксигенирующей функции
легких
Рисунок 2.27. Лабораторные показатели больного Л. (1)
Больной Л.Первые часы после операции АКШ (2)
1622
FO2-50%
pH 7,26 I
рСО2 72 ммрт.ст. ft
BE 0 ммоль/л
раО2 >00 мм рт.ст
Лактат 2,2 ммоль/л f
Терапия: для
снижения
шунтирования в
легких увеличены
FO2 н поставлен
PEEP
Г“
Острый респираторный
ацидоз
Рисунок 2.28. Интерпретация анализов и терапия
больногоЛ. (2)
306
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
Больной Л. Первые часы после операции АКШ (3)
1622
FO2 - 70% , PEEP - 10 см Н2О
pH U
рСО2 80 мм рг. ст. ttt
BE +Д0 ммоль/л.
раО2 160 ммрг.ст.
I
Острый респираторный
ацидоз
Рисунок 2.29. Интерпретация анализов и терапия
больногоЛ. (3)
Больной Л. После операции АКШ
Ошибки интерпретации и терапии:
1. Не был распознан синдром “Carbon-
Dioxide Narcosis”
2. Терапия должна начинаться с режимов
ИВЛ, снижающих рСО2
3. Нарушения углубились срывом
компенсаторной гипоксемии
Рисунок 2.30. Ошибки интерпретации и лечения больного Л.
307
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
стимулятором рецепторовдыхательного центра, определяющих
газообмен в легких, является артериальная гипоксемия (сни-
жение рО2 до 70 мм рт. ст.).
Последствия ошибок интерпретации данных и терапии'.
о срыв компенсаторной реакции в легких, проявляющей-
ся умеренной артериальной гипоксемией;
• углубление обструктивных изменений в легких, сопро-
вождающихся значительным увеличением рСО2 артериаль-
ной крови;
• гемодинамические изменения (нестабильный уровень
АД, нарушения ритма сердца), потребовавшие интенсивной
кардиотерапии.
Приведенные примеры указывают, что правильная интер-
претация полученных данных газообмена, КОР крови и электро-
литного баланса весьма важна для адекватного выбора методов
интенсивной терапии клинического состояния больных.
Приборы для определения КОР крови
В настоящее время на Российском рынке достаточно мно-
го фирм, выпускающих анализаторы для определения КОР кро-
ви, поэтому покупка того или иного прибора в основном опре-
деляется экономическими возможностями покупателя. Име-
ются анализаторы, определяющие только КОР крови, есть и
более сложные анализаторы, позволяющие наряду с КОР кро-
ви исследовать некоторые параметры кислородного баланса,
электролиты и различные метаболиты.
Последнее особенно важно, поскольку для полной оценки
состояния больного исследование лишь КОР крови недоста-
точно, необходимо иметь одновременное представление об из-
менениях кислородного и водно-электролитного балансов, ока-
зывающих непосредственное влияние на кислотно-основной
гомеостаз организма. Наиболее распространенные в медицин-
ских учреждениях России и стран СНГ анализаторы представле-
ны в табл. 2.3.
Первые четыре типа анализаторов позволяют не только ис-
следовать КОР крови и газообмен, но и одновременно опреде-
лять наиболее важные электролиты (калий, натрий, кальций,
хлор), а также такие метаболиты, как глюкоза и лактат, что весь-
ма важно при оценке больных, находящихся в критическом со-
308
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
Таблица 2.3. Некоторые типы анализаторов для определения
КОР крови
Название Фирма Страна
ABL (поколения 500, 600,700) Radiometer Дания
NOVA (статпрофили 2-11) M&S Medical and Science Instruments Австрия
Анализаторы газов крови серии 800 Chiron/Diagnostics (Bayer) Германия
OMNI, типы 1-9 AVL США
IL серии 1300 Cultronics Франция
ЭЦ-60 Юнимед Россия
Easy Blood Gas Valtex США
стоянии, во время и после крупных хирургических вмешательств,
в любых отделениях интенсивной терапии.
В своей практике мы используем анализатор ABL-625 фир-
мы «Radiometer» (Дания), который, на наш взгляд, максималь-
но отвечает всем необходимым требованиям к автоматическим
анализаторам, позволяющим проводить одновременное иссле-
дование газообмена, КОР, электролитов и метаболитов. Дан-
ный анализатор, комбинированный с многоволновым оксиме-
тром (позволяющим точно измерять параметры общего гемогло-
бина, его патологические фракции — СОНЬ, MetHb и HbF, а так-
же sO2) и метаболической лабораторией (определяющей калий,
натрий, кальций, хлор, глюкозу и лактат), продемонстрировал
высокую диагностическую ценность результатов, полученных у
больных в критическом состоянии. Динамическое наблюдение
за изменением указанных параметров позволило значительно
улучшить диагностику нарушений гомеостаза (особенно на фо-
не интенсивной терапии), выбрать правильные методы коррек-
ции и прогнозировать исход лечения больных.
Особо важным нам представляется то, что данный анализа-
тор позволяет одновременно оценить кислородный статус орга-
низма (программа «OXYGEN STATUS ALGORITM», О. Siggaard-
Andersen, 1990), т. e. получить информацию о способности ар-
териальной крови снабжать ткани кислородом. Информация, по-
309
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
лучаемая при использовании указанной программы, дает пред-
ставление не только о поглощении кислорода в легких (по по-
казателю раО2 и альвеолоартериального шунта), но и о его транс-
порте кровью (по содержанию общего гемоглобина), о скорости
и адекватности отдачи его тканям (по показателям р50 и рх). Пол-
новесный анализ, проведенный на анализаторе ABL-625, пред-
ставлен на рис. 2.31.
Б-на М-, 43 г,
(6 Ч п/о)
Д-з: Остра? сердечная недостаток
НИ1
£
рН(а) 7.32 pH(v) 7.27
рСО2(а) 35.7 мм рт.ст. pCO2(v) 45.3 мм рт.ст.
ВЕ(а) (-7.1) ммоль/л BE(v) (-5.9) ммоль/л
sO2(a) 94.3 % sO2(v) 69.2 %
РОЛ») 78.7 мм рт.ст. pO2(v) 40.3 мм рт.ст.
ш 81,0 г/л K+ 3.5 ммоль/л
MetHb 0.9 Na+ 152.0 ммоль/л
СОНЬ 1.4 Ca2* 0.8 ммоль/л
Cl- 110.0 ммоль/л
Деьшудт -16.8. % в 30.5 ммоль/л
p50 28.6 мм рт.ст.
Глюкоза 15.7 ммудь/д px 26.6 мм рт.ст.
Лактат 12.4 шмыь/д
Рисунок 2.31. Ввд бланка анализа, получаемый на анализаторе
ABL-625
Возможность динамического получения показателей ки-
слородного статуса наряду с другими данными, такими как КОР,
электролиты и метаболиты, обуславливает адекватную оценку на-
рушений гомеостаза и позволяет проводить эффективную тера-
пию, что особенно важно у больных в критическом состоянии.
Для оценки и правильной диагностики нарушений кислот-
но-основного равновесия крови существуют специальные номо-
граммы, которые разработал датский ученый О. Siggaard-An-
dersen в 1971 году, одна из них представлена на рис. 2.32.
На указанную номограмму наносятся показатели КОР кро-
ви и по зонам, в которые они попадают, виден вид нарушений.
310
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
. ПОКАЗАТЕЛИ:
-рСО2
-pH
-SB
-НСОЗ (акт)
-BE
Рисунок 2.32. Номограмма для определения нарушений КОР
крови
В номограмме указана область нормальных значений КОР кро-
ви, острых или хронических метаболических и респираторных
нарушений.
При нанесении полученного анализа на такую номограмму
можно четко определить, какое нарушением КОР крови имеет-
ся у больного, и, следовательно, правильно выбрать методы его
коррекции.
Заключение
Постоянное совершенствование таких областей медици-
ны, как хирургия, анестезиология, реаниматология, терапия,
фармацевтика и др., внедрение в практику современных дости-
жений медицинской техники — все это позволяет в настоящее
время значительно расширить контингент оперируемых больных,
311
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
а также больных, полностью вылеченных или выведенных из эк-
стремальных состояний. Вместе с тем внедрение новых методов
лечения и использование самых современных лекарственных
средств наряду с положительным воздействием имеет и ряд от-
рицательных, поскольку часто ослабляют, а в ряде случаев и
срывают компенсаторно-защитные реакции организма, напра-
вленные на поддержание гомеостаза в критических ситуациях.
Великая «мудрость организма» заключается в том, что вся-
кое функциональное нарушение само активизирует компенса-
торный аппарат, который обезвреживает и восстанавливает пов-
режденный орган. Хорошо известное всем медикам правило
«не навреди!» в первую очередь означает глубокое уважение к
огромному количеству чудесных механизмов, существующих в
организме для поддержания его устойчивости в условиях неустой-
чивых внешний и внутренних факторов.
При любых критических состояниях наиболее быстрые вза-
имосвязанные изменения происходят с кислородным, кислот-
но-основным и водно-электролитным гомеостазом. Именно
поэтому правильная и своевременная оценка клинических ас-
пектов состояния и регуляции кислотно-основного гомеостаза,
включающая знание основных законов, поддерживающих по-
стоянство внутренней среды; оценку причин нарушения гоме-
остаза; степень компенсаторных реакций организма в экстре-
мальных условиях и т. п., способствуют адекватной оценке со-
стояния больного и выбору необходимых методов лечения.
Список основной литературы
1. Дементьева И.И. Лабораторная диагностика нарушений
гомеостаза у больных во время и после хирургических вме-
шательств// Клиническая лабораторная диагностика. 1997.
№ 1. С. 21-28.
2. Дементьева И.И. Исследование кислотно-основного рав-
новесия // Клиническая лабораторная аналитика / Под ред.
В. В. Меньшикова. М., 2000. Т. 3. С. 349-361.
3. Локтев Н. И., Войнов В.А. Физико-химический гомеостаз
// Гомеостаз / Под ред. П. Д. Горизонтова. М..* Медицина,
1976. С. 376-427.
312
ГЛАВА 2. РЕГУЛЯЦИЯ КИСЛОТНО-ОСНОВНОГО ГОМЕОСТАЗА
4. Bakker I., Vincent J.-L. The oxygen dependency phenomenon
is associated with increased blood lactate levels // J. Crit Care.
1991. Vol. l.№6. P. 152-159.
5. Goldberger E. A. Primer of Water, Electrolyte and Acid-Base
Syndromes. Philadelphia, 1985. 704 p.
6. Shaymman J. (Джеймс Шейман) Патофизиология почки.
СПб., 1999. 205 с.
7. Siggaard-Andersen О., Siggaard-Andersen М. The oxygen sta-
tus: a computer program for calculating pH and blood gas data
// Scand J. Clin Invest. 1990. Vol. 50. Suppl 203. P. 17-45.
8. Siggaard-Andersen M. Computer-Assisted Evaluation of Oxygen
and Acid-Base Status of the Blood // Advances in Critical Ca-
re Testing / Edd. W. List. N. Y, 1996. P. 124-135.
ГЛАВА3
Диагностика и лечение
критических состояний,
требующих проведения
инфузионно-трансфузионнои
терапии
3.1. Мониторинг состояния пациента
В основе проведения лечебных мероприятий, связанных с
переливанием продуктов крови и плазмозаменителей,
лежит оценка клинических данных, показателей кисло-
родного статуса и состояния гемодинамики пациентов.
3.1.1. Кислородный статус организма
Основная функция системы кровообращения заключает-
ся в распределении кислорода между метаболически активны-
ми тканями и выведении продуктов обмена и двуокиси угле-
рода. Потребность в кислороде является наиболее важным
регулятором кровотока в большинстве тканей. Например, по
данным К.A. Gaar (1987), достаточное снабжение клеток глю-
козой может сохраняться при тридцатикратном уменьшении
кровотока, в то время как для кислорода этот резерв значитель-
но меньше. Из этого следует, что главным результатом ос-
трой недостаточности кровообращения является циркуля-
торная гипоксия, возникающая вследствие несоответствия
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
доставки кислорода органам и тканям потребности в нем.
Для полной оценки кислородного статуса организма необхо-
димы данные, отражающие пять основных этапов кислород-
ного снабжения:
• поступление кислорода;
• содержание кислорода в крови;
• транспорт кислорода;
• высвобождение кислорода;
• эффективность утилизации кислорода.
Поступление кислорода
Поступление кислорода в легкие определяется:
• парциальным напряжением кислорода в альвеолярном
воздухе, которое, в свою очередь, зависит от атмосферного да-
вления или фракции кислорода на вдохе (FiO2), минутной вен-
тиляции легких и альвеолярного рСО2;
• степенью внутрилегочного шунтирования крови;
• диффузионной способностью легочной ткани.
Ключевым параметром, используемым для оценки адекват-
ности поступления кислорода, является парциальное напряже-
ние кислорода в артериальной крови (рО2а). Для расчета нор-
мальных или должных ндивидуальных значений рО2а (при усло-
вии, что FiO2 = 0,21) пользуются следующей формулой:
рО2а (должное) = 100 — половина возраста пациента.
Термин «внутрилегочное шунтирование крови» отражает
соответствие между вентиляцией и перфузией в различных
участках легочной ткани. Оксигенация притекающей к легким
венозной крови происходит лишь в капилляре, прилежащем к
вентилируемой альвеоле. В случае, когда вентилируемая альве-
ола прилежит клеточному капилляру, в котором кровоток отсут-
ствует, или, наоборот, открытый капилляр прилежит к невенти-
лируемой альвеоле, оксигенации венозной крови не происходит.
Чем больше таких несоответствий, тем выше фракция внутри-
легочного шунтирования.
Фракцию внутрилегочного шунтирования можно рассчитать
по формуле:
315
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Q/Q, = [0,03 х (А — а) рО2] / 0,03 X (А - а) рО2 + [ 1,36 х НЬ х
х (SaO2 — SvO2)].
При нормальных значениях Fshunt, составляющих 2—6 %,
адекватные значения рО2а будут определяться на фоне дыха-
ния атмосферным воздухом. По мере возрастания Fshunt для
поддержания достаточного рО2а необходимо использование по-
вышенных FiO2. При высокой степени внутрилегочного шунти-
рования, достигающей 30 % и выше, даже использование 100 %-
ного кислорода не позволяет достичь нормального рО2а.
В клинических ситуациях, связанных с проведением ин-
фузионно-трансфузионной терапии, к увеличению Fshunt мо-
жет приводить целый ряд факторов, вызывающих нарушения как
вентиляции, так и перфузии легких. Среди них:
• закупорка альвеол кровью или бронхиальным секретом,
количество которого может увеличиваться при гипергидратации;
• образование гемо- или гидроторакса;
• травма легкого;
• пневмоторакс;
• формирование ателектазов;
• бронхоспазм при анафилактических реакциях на перели-
вание продуктов крови и кровезаменителей и др.
Нарушения перфузии легких могут быть обусловлены зна-
чительным сокращением числа открытых капилляров при вы-
раженной гиповолемии, слдджем форменных элементов и обра-
зованием микросгустков при ДВС-синдроме, тромбоэмболи-
ческим синдромом, воздушной эмболией (например, при ис-
пользовании центральных венозных катетеров), сдавлением ле-
гочных капилляров при установке неоправданно высоких зна-
чений дыхательного объема или PEEP во время ИВЛ у пациен-
тов с гиповолемией.
Несмотря на то что во многих классических учебниках на-
рушению диффузионной способности легочной ткани придает-
ся второстепенное значение, у пациентов отделений реанимации
и интенсивной терапии этот фактор может играть ведушюю
роль в развитии артериальной гипоксемии. Известно, что избы-
точное введение кристаллоидных растворов приводит к увели-
чению интерстициального пространства легких. При нарушении
316
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
капиллярной проницаемости в интерстиции могут накапли-
ваться вводимые в вену альбумин и коллоидные растворы с от-
носительно небольшой молекулярной массой.
Содержание кислорода в артериальной крови
Содержание кислорода в артериальной крови ctO2(a) отра-
жает общее содержание кислорода в единице объема крови, ко-
торое зависит от следующих факторов:
• концентрации гемоглобина крови;
• концентрации дисгемоглобинов;
• парциального давления кислорода в артериальной крови;
• насыщения кислородом артериальной крови, которое, в
свою очередь, зависит от рО2а и сродства гемоглобина к кисло-
роду.
Рассматривая роль концентрации гемоглобина в крови,
необходимо отметить, что до сих пор в большинстве клиник
оценивают общую концентрацию гемоглобина (ctHb). Этот по-
казатель включает в себя все виды гемоглобина: деоксигемо-
глобин, оксигемоглобин, карбоксигемоглобин, метгемоглобин
и сульфгемоглобин. Гемоксиметры, позволяющие определять
все вышеперечисленные фракции гемоглобина, пока еще не
получили широкого распространения. В этой связи необходи-
мо учитывать, что в определенных клинических ситуациях при
повышенной концентрации дисгемоглобинов ориентироваться
на ctHb необходимо с большой осторожностью.
Известно, что наиболее частыми причинами высокого ctHb
являются истинная полицитемия, дегидратация, хронические за-
болевания легких, проживание в условиях высокогорья, занятия
спортом. Высокие значения ctHb приводят к увеличению вязко-
сти крови и нарушению микроциркуляции. Вместе с тем при пе-
реливании крови и определении оптимального уровня гемато-
крита иногда приходится ориентироваться на исходные (до кро-
вопотери) значения ctHb, поскольку полицитемия может носить
компенсаторный характер.
Причинами низкой ctHb являются кровотечение, гиперги-
Дратация, намеренная гемодилюция, гемолиз, нарушение про-
дукции эритроцитов, множественные заборы крови для анали-
зов (особенно у новорожденных). Снижение этого параметра сиг-
317
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
нализирует о риске тканевой гипоксии. Поскольку основным
фактором компенсации кислородного дефицита при анемии
является возрастание сердечного выброса, этот риск повышен
у пациентов с ишемической болезнью сердца, нарушениями
сократительной способности миокарда, а также при пороках
сердца, приводящих к препятствию изгнанию крови из него.
Нормальные значения ctHb еще не гарантируют адекватно-
го кислородного снабжения тканей, поэтому в условиях отделе-
ний реанимации и интенсивной терапии очень важно определять
все фракции гемоглобина.
Фракция оксигемоглобина артериальной крови FO2Hb(a)
представляет собой соотношение между концентрациями окси-
гемоглобина и общего гемоглобина и определяется как:
FO2Hb = cO2Hb / (cO2Hb + сННЬ + cCOHb + cMetHb).
Нормальные значения этого параметра составляют 94—99 %.
На практике чаще пользуются показателем насыщения ге-
моглобина крови кислородом (sO2), который представляет собой
отношение оксигенированной фракции гемоглобина к общей
фракции гемоглобина, переносящего кислород:
sO2 = cO2Hb / (cO2Hb + сННЬ).
Вместе с тем между sO2 и FO2Hb существует следующая за-
висимость:
FO2Hb = sO2 (1 - cCOHb + cMetHb + cSHb).
Это означает, что при отсутствии в крови дисгемоглобинов
фракция оксигемоглобина соответствует насыщению гемогло-
бина крови кислородом. В случае повышения концентрации в
крови какой-либо из аномальных форм гемоглобина между
этими показателями могут быть существенные различия.
Последнее иллюстрирует пример с повышением фракции
карбоксигемоглобина:
ctHb = 10;
сННЬ = 0,2;
318
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
сСОНЬ = 3;
сО2НЬ = 6,8;
FO2Hb = 6,8 / (6,8 + 0,2 + 3) х 100 = 68 %;
sO2 = 6,8 / (6,8 + 0,2) х 100 = 97 %.
Таким образом, присутствие повышенной фракции кар-
боксигемоглобина в данном случае дает разницу между сравни-
ваемыми параметрами в 31 %. Поскольку данное патологическое
состояние, т. е. карбоксигемоглобинемия, не является редкостью,
особенно при лечении пациентов с травмой и кровопотерей,
поступающих из районов стихийных бедствий, пожаров, взры-
вов и т. д., определение FO2Hb имеет для них чрезвычайно важ-
ное значение.
Сказанное выше верно и при использовании пульсокси-
метрии, поскольку насыщение крови кислородом, определя-
емое с помощью пульсоксиметра, соответствует sO2. Строго го-
воря, данные пульсоксиметра могут быть ниже FO2Hb при спаз-
ме периферических сосудов и нарушениях микроциркуляции и
выше этого показателя при высоких фракциях аномальных форм
гемоглобина. Это также означает, что проведение мониторинга
функции дыхания на основе одной пульсоксиметрии может да-
вать ложные результаты, и в этих случаях необходимо делать
поправку на ctHb.
Фракция карбоксигемоглобина определяется как отношение
концентраций карбоксигемоглобина и общего гемоглобина:
FCOHb = сСОНЬ / ctHb.
Нормальные значения этого показателя у взрослых соста-
вляют от 0 до 2 %. У злостных курильщиков FCOHb может до-
стигать 10-12 %.
Окись углерода обратимо связывается с ионами железа ге-
ма, однако сродство гемоглобина к СО в 200—250 раз выше,
чем к кислороду. Кроме того, карбоксигемоглобин приво-
дит к смещению кривой диссоциации оксигемоглобина вле-
во. Это означает, что при отравлениях СО наряду с уменьше-
нием кислородной емкости крови затруднена отдача кисло-
рода в тканях.
319
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
При острых отравлениях окисью углерода, когда FCOHb
превышает 30 %, отмечаются сильные головные боли, общая сла-
бость, рвота, одышка и тахикардия, а при уровне более
50 % — судороги, кома, летальный исход.
Лечение заключается в использовании вентиляции 100 %-
ным кислородом, гипербарической оксигенации, заменном пе-
реливании крови или синтетических кислородлереносящих кро-
везаменителей (перфторуглеродов).
Фракция метгемоглобина определяется как отношение кон-
центраций метгемоглобина и общего гемоглобина:
FMetHb = cMetHb / ctHb.
Нормальные значения этого показателя у взрослых соста-
вляют от 0,2 до 0,6 %. Метгемоглобин образуется в результате оки-
сления в геме двухвалентного железа в трехвалентное. Метгемо-
глобин неспособен переносить кислород. Кроме того, он за-
трудняет освобождение кислорода вследствие смещения КДО
влево. Большинство случаев метгемоглобинемии обусловлены
отравлением веществами, содержащими нитро- и аминогруппы.
При уровне FMetHb выше 10—15 % развивается псевдоцианоз,
при значениях, превышающих 30 %, появляются головная боль
и одышка, а метгемоглобинемия более 70 % может привести к ле-
тальному исходу. Лечение метгемоглобинемии заключается во
внутривенном введении метиленового синего и переливании
эритроцитарной массы.
Концентрация кислорода в артериальной крови
Концентрация кислорода в крови (ctO2) представляет собой
сумму концентраций кислорода, связанного с гемоглобином и
растворенного в плазме крови:
ctO2 = sO2 (1 - FCOHb - FMetHb - FSHb) + k x pO2.
Как видно из представленного уравнения, при расчете дан-
ного параметра учитываются все фракции гемоглобина и кон-
центрация кислорода, растворенного в плазме крови. Посколь-
ку в условиях нормального атмосферного давления коэффици-
ент растворимости кислорода в плазме мал (к = 0,031), вклад ра-
320
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
створенной фракции невелик. Вместе с тем в условиях гиперба-
рической оксигенации удается достичь увеличения ctO2 за счет
растворенной фракции до 6 об% (мл/100мл).
Нормальные значения ctO2 для мужчин составляют
8,4—9,9 ммоль/л (18,8—22,3 об%), а для женщин —
7,1—8,9 ммоль/л (15,8—19,9 об%).
Синонимом термина «концентрация кислорода» является
«содержание кислорода», поскольку ctO2 является интегральным
показателем, отражающим кислородтранспортные свойства
крови.
Транспорт кислорода
Артериальный транспорт кислорода представляет собой
общее количество кислорода, поступающего в систему боль-
шого круга кровообращения в единицу времени:
DO2 = ctO2 х Q,
где Q — сердечный выброс.
Менее точно артериальный транспорт кислорода можно
определить по формуле:
ТО2 = СВ х (НЬ х 1,36 х НЬО2 + 0,0031 х РаО2) х 10,
где ТО2 — артериальный транспорт кислорода, мл/мин;
СВ — сердечный выброс, л/мин;
НЬ — концентрация эффективного гемоглобина, г%;
1,36 — константа Хюффнера;
НЬО2 — насыщение гемоглобина артериальной крови кисло-
родом, %;
0,0031 — коэффициент растворимости кислорода в плазме
крови;
РаО2 — парциальное давление кислорода в артериальной
крови, мм рт. ст.
Поскольку антропометрические характеристики пациен-
тов Moiyr существенно варьировать, принято пользоваться ин-
дексированными параметрами сердечного выброса и ТО2, при-
водя их к величине поверхности тела.
321
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Следует обратить внимание на некоторые методические
особенности, способные повлиять на значение ТО2. Прежде
всего точность определения СВ зависит от методики его изме-
рения. В этой связи ниже приводится краткий обзор методов из-
мерения этого параметра, используемых в отделениях реани-
мации и интенсивной терапии.
Поскольку в ряде клинических ситуаций может возрастать
содержание в крови патологических форм гемоглобина (кар-
боксигемоглобина, метгемоглобина, сульфгемоглобина, а в пе-
диатрической практике — фетального гемоглобина), целесооб-
разно пользоваться приборами, позволяющими определять со-
держание в крои эффективного (кислородпереносящего) гемо-
глобина.
Константа Хюффнера, характеризующая способность гемо-
глобина крови связывать кислород, может варьировать в пре-
делах от 1,32 до 1,39, однако в связи с тем, что аппаратура, с по-
мощью которой ее измеряют, имеется в очень ограниченном чи-
сле отделений, а отличие в несколько сотых единиц вряд ли
окажет большое влияние на общий результат вычисления, ре-
комендуется наиболее часто встречаемый показатель, соста-
вляющий 1,36.
Важное значение имеет прямое определение НЬО2, посколь-
ку в ряде случаев, когда в газоанализаторе отсутствует гемокси-
метрический блок, данный параметр рассчитывают исходя из
значений РаО2. При отклонениях положения кривой диссоци-
ации оксигемоглобина различия между измеренными и расчет-
ными значениями НЬО2 могут быть весьма значительными.
Таким образом, учитывая вышеперечисленные замечания,
можно заключить, что для более точного определения DO2
необходимо пользоваться приборами, позволяющими непо-
средственно измерять ctO2.
Синонимами DO2 являются термины «доставка кислорода»
и «кислородный выброс». Это интегральный показатель, учиты-
вающий состояние всех вышеперечисленных процессов: посту-
пление кислорода в легкие, концентрацию гемоглобина и его
фракций, сродство гемоглобина к кислороду, растворенную в
плазме крови фракцию кислорода, а также производительность
сердца. Последнюю считают основной детерминантой арте-
322
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
риального транспорта кислорода, поскольку при одном и том же
ctO2 чем больше минутный объем кровообращения, т. е. СВ,
тем больше кислорода доставляется к органам и тканям. Кроме
того, СВ является основным фактором компенсации анемии и
артериальной гипоксемии, особенно в острых случаях.
Высвобождение кислорода
Высвобождение кислорода, т. е. разрыв его связи с гемогло-
бином, зависит от целого ряда факторов. Традиционно способ-
ность гемоглобина отдавать кислород оценивают по положе-
нию кривой диссоциации оксигемоглобина, которая отражает
зависимость между sO2 и рО2. При сдвиге КДО вправо способ-
ность гемоглобина отдавать кислород понижается, а при сдви-
ге влево — увеличивается.
Факторы, приводящие к сдвигу КДО влево:
• снижение концентрации 2,3-ДФГ в эритроцитах;
• снижение температуры тела;
• гипокапния;
• метаболический алкалоз;
• высокая концентрация фетального гемоглобина;
• повышение концентрации карбоксигемоглобина;
• повышение концентрации метгемоглобина;
• переливание крови длительного срока хранения (свыше
недели).
Факторы, приводящие к смещению КДО вправо:
• повышение концентрации 2,3-ДФГ в эритроцитах;
• гипертермия;
• гиперкапния;
• метаболический ацидоз;
• повышение концентрации сульфгемоглобина.
Поскольку для построения КДО необходимо применение
специальной аппаратуры или математических моделей, в ру-
тинной практике пользуются расчетным параметром р50, кото-
рый представляет собой парциальное напряжение кислорода
при сатурации гемоглобина, составляющей 50 %. Считается,
что данный показатель отражает сродство гемоглобина к ки-
слороду, и его уменьшение ассоциируют со смещением КДО
влево, а увеличение — со смещением КДО вправо.
323
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Sigaard-Andersen О. и соавт. (1990) указывают, что при рас-
чете р50 на основании пробы только артериальной крови досто-
верным этот параметр можно считать лишь в случаях, когда sO2a
не превышает 97 %.
Эффективность утилизации кислорода
Если проследить динамику парциального давления кисло-
рода по мере движения его по артериальной системе от легких
до капилляров, где происходит диффузия О2 в клетки, то уже на
уровне мелких артерий наблюдается заметное снижение рО2а.
Значительное его падение происходит по мере прохождения ка-
пиллярного русла, что собственно и отражает высвобождение или
потребление кислорода.
Совершенно очевидно, что в различных органах и тканях по-
требление кислорода неодинаково. Это определяется различной
их метаболической активностью.
В рутинной клинической практике об эффективности вы-
свобождения кислорода судят по интегральным показателям,
отражающим этот процесс во всем организме, однако суще-
ствует целый ряд способов оценки освобождения и потребления
кислорода в отдельных органах.
К числу интегральных показателей, отражающих эффек-
тивность утилизации кислорода, относят:
• потребление кислорода (VO2);
• артериовенозную разницу по кислороду (СаО2 - CvO2);
• коэффициент тканевой экстракции кислорода:
(СаО2 - CvO2) / СаО2 или VO2 / DO2.
Падение потребления кислорода, характерное для синдро-
ма шока, сопровождается снижением артериовенозной разни-
цы по кислороду и его тканевой экстракции. При восстановле-
нии циркуляторных нарушений на фоне возрастания DO2 про-
исходит увеличение VO2, причем обычно в течение некоторого
периода времени потребление О2 может значительно превы-
шать общепринятые нормальные значения. Данный факт объяс-
няется восполнением кислородной задолженности, возникшей
за период дефицита доставки кислорода.
Высокие значения коэффициента тканевой экстракции ки-
слорода и артериовенозной разницы указывают на абсолютный
324
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
или относительный дефицит доставки О2. Подобные изменения
можно рассматривать как проявление компенсаторных влияний,
направленных на устранение этого дефицита.
Адекватность тканевой оксигенации
Оценка адекватности тканевой оксигенации представляет
собой одну из наиболее сложных задач клинической практики.
В этих целях пользуются следующими параметрами:
• насыщение и парциальное напряжение кислорода в сме-
шанной венозной крови (SvO2 и PvO2);
• концентрация лактата в артериальной крови (cLac).
Отдельно взятые SvO2 и PvO2 обладают ограниченной ди-
агностической ценностью. Низкие их значения определенно
свидетельствуют о неадекватной тканевой оксигенации. Од-
нако относительно нормальные или повышенные цифры
встречаются в целом ряде клинических ситуаций, при кото-
рых наблюдается дефицит тканевой оксигенации и переход к
анаэрорбному метаболизму, смещение КДО влево и затрудне-
ние отдачи кислорода в тканях или существенное преоблада-
ние доставки О2 над потребностью в нем:
• синдром периферического артериовенозного шунти-
рования;
• гипотермия и/или глубокая анестезия;
• смещение КДО влево;
• гипердинамическое состояние кровообращения.
Лактат крови
Тяжелая степень клеточной гипоксии смещает аэроб-
ный метаболизм в сторону анаэробного, что сопровождает-
ся усиленной продукцией молочной кислоты. В большин-
стве случаев повышение концентрации лактата в крови яв-
ляется следствием гипоперфузии, нарушения артериаль-
ной доставки кислорода или комбинации этих факторов.
Нормальные значения лактата плазмы артериальной
крови (cLac) у взрослых составляют 0,5—1,4 ммоль/л, или
4,5—14,4 мг%. Высокие значения cLac обычно свидетель-
ствуют о плохом прогнозе. На рис. 3.1 показана зависи-
мость между концентрацией лактата и вероятностью цир-
куляторной гипоксии, полученная нами у кардиохируруги-
ческих больных.
325
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Рисунок 3.1. Зависимость между концентрацией лактата в
артериальной крови и вероятностью циркуляторной гипоксии (Р)
После значений cLac, составляющих 4 ммоль/л, вероят-
ность циркуляторной гипоксии достигает 100 %. Поскольку
данный клинический синдром сопровождается высокой леталь-
ностью, это свидетельствует о неблагоприятном прогнозе.
Зависимость между высоким содержанием лактата в крови
и вероятностью летального исхода исследована в нескольких
работах. Авторы показали, что при значениях cLac выше
8 ммоль/л летальность превышает 80 %.
Наш опыт показывает, что в ряде клинических ситуаций
благоприятный исход может наблюдаться даже при очень высо-
ких значениях cLac, если его содержание под влиянием лечения
быстро снижается. С другой стороны, длительно регистрируемые
умеренно повышенные значения лактата свидетельствуют о не-
адекватной терапии и могут привести к неблагоприятному ис-
ходу. Невысокие концентрации cLac могут наблюдаться при
выраженных нарушениях микроциркуляции ввиду низкой ско-
рости его «вымывания» из тканей. В этой связи рекомендуется
оценивать не абсолютные значения данного показателя, а дина-
мику его во времени. Высокие концентрации cLac могут на-
326
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
блюдаться при гипергликемии, после эпилептического припад-
ка и физических упражнений, поэтому рассматривать его необхо-
димо в комплексе с другими показателями и конкретной клини-
ческой ситуацией.
Таким образом, оценку состояния системы кровообращения
при проведении инфузионно-трансфузионной терапии целе-
сообразно проводить с учетом вышеперечисленных детерми-
нант артериального транспорта кислорода. Наиболее значи-
тельным и оперативно управляемым из них является сердеч-
ный выброс, т. е. количество крови, поступающей в аорту или в
легочную артерию в единицу времени. В этой связи авторы соч-
ли целесообразным описать методы его измерения, применяе-
мые у пациентов отделений реанимации и интенсивной терапии,
которые представлены в следующем разделе.
3.1.2. Оценка гемодинамики
Сердечный выброс
Известно достаточно большое число методов определения
сердечного выброса, однако немногие из них нашли свое при-
менение у пациентов отделений реанимации и интенсивной те-
рапии. Специфика этой категории пациентов требует примене-
ния методов, позволяющих определять СВ в режиме монитор-
ного наблюдения. Прежде всего это подразумевает возможность
многократного его измерения в течение коротких промежутков
времени. До сих пор не пред ложен метод, сочетающий в себе до-
статочную достоверность получаемых результатов с минималь-
ной инвазивностыо.
Несмотря на большое число известных методов определе-
ния СВ, каждый из них обладает целым рядом отрицательных ха-
рактеристик, в ряде случаев ограничивающих возможности его
использования у реанимационных больных.
Термодилюционные методы
Метод термодилюции с использованием катетера Свана-
Ганса. Принцип определения СВ с помощью изотоничекого ин-
дикатора, температура которого отличается от температуры кро-
ви, был разработан W. Lochner (1953) и G. Fegler (1954). Широ-
327
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
кое распространение метод получил после изобретения W. Swan
и R. Ganz (1972) многопросветных катетеров с баллоном на кон-
це и встроенным термистором.
Рисунок 3.2. Катетер Свана—Ганса
В настоящее время существует большое число модификаций
катетера Свана—Ганса. Классическая конструкция катетера
представлена на рис. 3.2. Катетер имеет три входа. Канал дисталь-
ного входа заканчивается на конце катетера и предназначен для
регистрации давления крови во время проведения катетера в
легочную артерию и легочного капиллярного давления. Канал
проксимального входа при установке катетера в позицию изме-
рения СВ заканчивается на уровне правого предсердия. Он слу-
жит для введения индикатора, а в перерывах между измерения-
ми СВ — для регистрации давления в правом предсердии или ин-
фузий. Вход канала предназначен для раздувания баллона, рас-
положенного на конце катетера, и снабжен краником, который
при закрытии препятствует обратному току воздуха после его вве-
дения. Благодаря наличию воздушного баллона облегчается
продвижение катетера по камерам сердца (катетер называют
плавающим), а также снижается риск перфорации стенок серд-
ца. Кроме того, при раздувании баллона после проведения ка-
тетера в одну из ветвей легочной артерии происходит ее «за-
клинивание», что позволяет измерить легочное капиллярное
328
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
давление. Данный параметр называют давлением заклинива-
ния легочной артерии (ДЗЛА). Катетер имеет встроенный тер-
мистор, конец которого находится в нескольких миллиметрах ди-
стальнее баллона. Разъем термистора предназначен для соеди-
нения его с термодилюционным блоком прикроватного мони-
тора или регистратора (термодилютора).
Катетер проводят в легочную артерию через специальную ка-
нюлю (интродьюсер), введенный в одну из центральных вен
(внутреннюю яремную, подключичную или бедренную). В ис-
ключительных случаях используют плечевую вену или выполня-
ют венесекцию одной из подкожных вен верхней конечности.
Перед введением дистальный и проксимальный просветы
катетера заполняют промывочным раствором (5000 ЕД гепари-
на на 500 мл физраствора) и присоединяют к тензометрическим
датчикам. Затем проверяют герметичность воздушного баллона.
Для этого баллон помешают в стерильный сосуд с физраствором
и в воздушный канал катетера вводят 1—2 мл воздуха. Поступле-
ние пузырьков воздуха из баллона свидетельствует о его негер-
метичности и требует замены катетера.
После введения дистального конца катетера в вену его по-
ложение определяют по форме кривой давления, отобража-
емой на экране прикроватного монитора или регистратора.
Для облегчения прохождения катетера по току крови воздуш-
ный баллон раздувают 1—2 мл воздуха. По мере прохождения
катетера по камерам сердца (правое предсердие, правый желу-
дочек, легочная артерия) форма кривой давления и его значе-
ния меняются (см. рис. 3.3).
После попадания катетера в ствол легочной артерии баллон
сдувают. В данной позиции производят измерение сердечного
выброса. Для этого в проксимальный просвет катетера вводят
тест-раствор, а кривая тераморазведения отображается и/или об-
рабатывается с помощью термодилюционного блока или термо-
дилютора. Для повышения точности определения сердечного
выброса целесообразно пользоваться специальными система-
ми, в которых предусмотрено измерение температуры тест-ра-
створа в емкости, в которой он находится, или в месте соеди-
нения шприца с проксимальным входом катетера (см. рис. 3.4).
Для этого используют дополнительный термодатчик.
329
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Рисунок 3.3. Динамика давления по мере прохождения катетера
Свана—Ганса по камерам сердца:
RA — правое предсердие; RV — правый желудочек; РА — ле-
гочная артерия; PAW — давление заклинивания в легочной ар-
терии
Рисунок 3.4. Закрытая система для измерения СВ при
комнатной температуре тест-раствора
330
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
Учитывая вариабельность антропометрических характери-
стик больных, получаемый объем сердечного выброса целесооб-
разно соотносить с поверхностью тела обследуемого, ориенти-
руясь на значения сердечного индекса (СИ).
Для регистрации ДЗЛА в воздушный просвет катетера вво-
дят 1—2 мл воздуха и катетер проводят вперед до появления ха-
рактерной кривой. После измерения ДЗЛА воздушный бал-
лон сдувают, а катетер подтягивают до уровня ствола легочной
артерии.
В настоящее время выпускаются модификации катетера
Свана—1анса с дополнительной функцией непрерывного опре-
деления насыщения кислородом смешанной венозной крови
(SvO2), а также системы для вычисления фракции изгнания пра-
вого желудочка сердца и непрерывного определения сердечно-
го выброса (ССО). Катетер для ССО снабжен дополнительной
спиралью, которая располагается между термистором и воздуш-
ным баллоном. Принцип определения СВ основан на измерении
энергии, необходимой для поддержания температуры спирали
на 1 °C выше температуры крови, измеряемой термистором ка-
тетера. Показатель этой энергии пропорционален объемной
скорости кровотока, т. е. сердечному выбросу. Первоначально
определяют базовое значение СВ с помощью инъекции индика-
тора, а в дальнейшем его значение вычисляется на основе выше-
указанного принципа.
Осложнения, связанные с использованием катетера Свана-
Ганса. В литературе описан целый ряд серьезных осложнений,
полученных при катетеризации легочной артерии с помощью ка-
тетера Свана—Ганса [6—13]. Среди них:
• повреждение сонных и подключичных артерий;
• пневмоторакс;
• нарушения ритма сердца: желудочковая экстрасистолия,
фибрилляция желудочков;
• перфорация стенки предсердия или желудочка сердца;
• тампонада сердца;
• разрыв баллона и воздушная эмболия;
• повреждение трикуспидального клапана или клапанов
легочной артерии;
• разрыв легочной артерии;
331
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• завязывание катетера, находящегося в полости сердца, в
узел;
• отрыв части катетера и катетерная эмболия;
• тромбирование просвета катетера и тромбоэмболия легоч-
ной артерии;
• эндокардит и катетерный сепсис.
В исследовании A.F. Connors и соавт. (1996) при анализе
результатов лечения 2184 пациентов отделения интенсивной
терапии было обнаружено, что при сравнимой тяжести состоя-
ния в группе больных, которым устанавливали катетер Свана-
Ганса, летальность была выше на 2 %.
Вышеперечисленные факты настраивают некоторых авто-
ров на весьма скептический лад в отношении данной процеду-
ры. В частности, J.E. Dalen и R.C. Bone (1996) предлагают поста-
вить вопрос перед FDA о запрете на использование катетеров
Свана—Ганса до проведения контролируемых рандомизирован-
ных клинических исследований.
По нашему мнению, более высокую летальность среди па-
циентов, у которых использовался катетер Свана—Ганса, мож-
но объяснить тем, что обычно его устанавливают наиболее тя-
желым больным.
Многолетний опыт использования катетера Свана—Ганса в
отделении реанимации РНЦХ РАМН показал, что при соблю-
дении правил постановки катетера и ухода за ним вышеперечи-
сленные осложнения встречаются не так часто. Не останавли-
ваясь на осложнениях, присущих любой процедуре катетериза-
ции центральных вен, за 25-летний период использования дан-
ных катетеров у более чем 2000 больных мы наблюдали 3 случая
завязывания катетера в узел и ни одного случая перфорации
стенок сердца, эмболии воздухом или тромбоэмболии. Появле-
ние нарушений ритма сердца нередко представляет серьезную
проблему, особенно у пациентов с ишемической болезнью серд-
ца. В этой связи во время катетеризации необходимо иметь
шприц с раствором лидокаина, который при необходимости
водят непосредственно в один из просветов катетера. У пациен-
тов с «чувствительным» миокардом от катетеризации правых
отделов сердца лучше отказаться и использовать альтернативные
методы оценки производительности сердца. Многие осложне-
332
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
ния могут быть связаны с повторным использованием катетеров,
что, по нашему мнению, недопустимо.
Несмотря на справедливость критических мнений в отно-
шении определения СВ термодилюционным методом при кате-
теризации правых отделов сердца, данный метод является наи-
более информативным и достоверным. В этой связи в настоящее
время он относится к наиболее распространенным в практике от-
делений реанимации и интенсивной терапии.
Помимо величины сердечного выброса с помощью катете-
ра Свана—1анса может быть получен большой объем важной ин-
формации. Измеряемое с его помощью среднее давление в пра-
вом предсердии соответствует конечно-диастолическому давле-
нию (КДД) в правом желудочке и отражает его преднагрузку. Да-
вление в легочной артерии отражает состояние малого круга
кровообращения. Среднее давление заклинивания в легочной ар-
терии соответствует КДД левого желудочка и отражает предна-
грузку левого желудочка сердца. Насыщение (SvO2) и парциаль-
ное напряжение (PvO2) кислорода в смешанной венозной кро-
ви, взятой из ствола легочной артерии, отражают эффектив-
ность кислородтранспортной функции кровообращения.
Вместе с тем предложен целый ряд альтернативных спосо-
бов определения СВ и работы по созданию менее инвазивных ме-
тодик, удобных для применения у пациентов, находящихся в кри-
тических состояниях.
Метод артериальной термодилюции
Работы, посвященные методу артериальной термодилю-
ции, основываются на недостатках метода терморазведения,
выполняемого посредством катетеризации легочной арте-
рии. Помимо осложнений, связанных с этой процедурой, их
авторы указывают на возможность получения недостовер-
ных результатов измерения СВ. В частности, Jullien Т. и со-
авт. (1995), используя контрастную эхокардиографию и допле-
рографию, показали, что ИВЛ может приводить к выражен-
ной недостаточности трикуспидального клапана и возника-
ющий при этом обратный ток крови существенно искажает
результаты измерения СВ.
Положительное давление в грудной клетке во время вдоха
при проведении аппаратного дыхания также может сказывать-
333
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ся на результатах измерения СВ, показатель которого зависит от
того, в какую фазу дыхательного цикла производится инъек-
ция индикатора [A. Perel, 1998].
Метод артериальной термодилюции основан на анализе
изменений температуры артериальной крови. Индикатор (охлаж-
денный изотонический раствор) вводят в центральный венозный
катетер, а кривую терморазведения регистрируют с помощью тер-
модилюционного катетера (4F), введенного в бедренную или
плечевую артерию [McLugie А. и соавт., 1996; Weyland А. и соавт.,
1994; Perel А., 1998].
Метод артериальной термодилюции может применяться в
режиме непрерывного измерения СВ. При этом, в отличие от до-
ступа через легочную артерию, нет необходимости в использо-
вании специального дорогостоящего катетера. После измерения
СВ методом артериальной термодилюции полученные данные
ударного выброса принимают за базовый уровень. В дальнейшем
значения СВ вычисляют исходя из результатов математической
обработки кривой артериального давления и базового значе-
ния УВ. В исследовании A. Perel (1998) при сопоставлении ре-
зультатов, полученных на основе непрерывного измерения СВ,
с термодилюционным методом коэффициент линейной корре-
ляции составил 0,95.
Несмотря на справедливость замечаний, высказываемых
авторами метода артериальной термодилюции, вряд ли его мож-
но признать менее инвазивным, чем термодилюционный метод,
осуществляемый с помощью установки катетера Свана—Ганса.
В этой связи оба метода применимы у наиболее тяжелой кате-
гории пациентов, требующих помимо проведения инфузионно-
трансфузионной терапии применения вазоактивных и кардио-
тонических препаратов.
Метод Фика
Метод разработан и описан A. Fick в 1870 году, который в ка-
честве индикатора предложил использовать кислород. Для из-
мерения СВ определяют количество кислорода, поглощаемое из
воздуха за определенный отрезок времени. Одновременно берут
пробы артериальной и смешанной венозной, взятой из устья
легочной артерии, крови и определяют в них содержание кисло-
334
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
рода. При этом необходимо определить разницу в содержании
кислорода в артериальной и венозной крови, то есть измерить
количество кислорода, которое связывается каждым кубиче-
ским сантиметром крови во время ее прохождения через легкие.
Сердечный выброс вычисляют по формуле:
СВ = ПО2 / (СаО2 —СвО2),
где СВ — сердечный выброс, л/мин (фактически — количе-
ство крови, проходящей через малый круг кровообращения);
ПО2 — потребление кислорода, мл/мин, СаО2 — содержание
кислорода в артериальной, а СвО2 — в венозной крови, мл/л.
Потребление кислорода определяют с помощью спироме-
тра, а артериовенозную разницу по кислороду оценивают, ана-
лизируя содержание кислорода в одной из магистральных арте-
рий и легочной артерии.
Поскольку принцип Фика, как любой из методов, осно-
ванных на разведении индикатора, подразумевает его равно-
мерное смешивание с кровью, на время проведения исследова-
ния необходимо соблюдение следующих условий:
• стабильное состояние дыхания и кровообращения в мо-
мент исследования;
• анализ содержания кислорода должен проводиться толь-
ко в смешанной венозной крови, взятой из ствола легочной ар-
терии, где сходятся все венозные сосудистые пути;
• с помощью прямого принципа Фика нельзя определять
СВ при наличии внутрисердечных сбросов крови, поскольку в
данном случае часть крови минует малый круг кровообращения.
Несмотря на то что прямой метод определения сердечно-
го выброса по Фику — один из самых точных, в отделениях ин-
тенсивной терапии и реанимации он применяется сравнитель-
но редко. Это обусловлено необходимостью сравнительно
сложного и дорогостоящего оборудования для оценки потре-
бления кислорода. Вместе с тем в условиях проведения искус-
ственной вентиляции легких эта задача облегчается при ис-
пользовании современных метаболических мониторов, позво-
ляющих определять содержание кислорода и углекислого газа
в контуре вдоха и выдоха. Показатель VO2 вычисляют, умножив
335
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
разницу содержания кислорода на вдохе и выдохе на величи-
ну минутного объема дыхания. В настоящее время имеются
аппараты ИВЛ со встроенным метаболическим монитором, в
которых помимо других параметров осуществляется постоян-
ное измерение VO2.
Для получения смешанной венозной крови необходима
катетеризация легочной артерии. Связанные с этим проблемы
описаны в разделе, посвященном методу терморазведения.
Для этих целей можно использовать плавающий катетер с бал-
лоном на конце типа Pulmobal, однако в клинической практи-
ке чаще используются термодилюционные катетеры Свана-
Ганса, которые от предыдущих отличает наличие встроенного
термистора. Поскольку при установленном катетере в легочную
артерию СВ проще определить с помощью метода термора-
зведения, метод Фика может быть оставлен для случаев, когда
отсутствует или неисправен регистратор (термодилютор).
Метод разведения электроимпедансных
индикаторов
Метод разведения электроимпедансных индикаторов раз-
работан в РНЦХ РАМН Н.М. Кривицким и В.В. Кислухиным.
Суть метода заключается в оценке гемодинамических показа-
телей по кривым изменения электрического сопротивления
крови, полученных в результате введения растворов, отли-
чающихся от нее по своему электрическому сопротивлению.
Введение индикаторов осуществляется внутривенно (болюсно
или в виде капельной инфузии), регистрация изменений ЭСК
производится при помощи тонкого биполярного игольчато-
го датчика (либо катетера), установленного в просвет любой
периферической артерии путем чрескожной пункции.
Для определения СВ последовательно болюсно вводят-
ся 2 изоосмотических индикатора: электролит (0,9 %-ный
раствор хлорида натрия) и диэлектрик (5 %-ный раствор глю-
козы). Объем вводимых растворов составляет 10-20 мл. По-
сле введения каждого тест-агента производится регистрация
кривой изменения ЭСК на двухкоординатном самописце.
Численное значение СВ находят по формуле, представленной
на рис. 3.5.
336
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
Рисунок 3.5. Изменение электрического сопротивления
артериальной крови в результате внутривенного болюсного введения
изоосмотических растворов хлорида натрия и глюкозы:
а — кривая 1 -го прохождения изоосмотического раствора хлори-
да натрия; б — кривая 1-го прохождения изоосмотического раство-
ра глюкозы; Zkp — электрическое сопротивление крови, Ом;
S<|> и Srn — площади под кривыми 1-го прохождения индикато-
ров, Ом х мин; Z<|> — электрическое сопротивление изоосмоти-
ческого раствора хлорида натрия, Ом; Уи — объем раствора при
болюсной инъекции индикатора, мл. Стрелкой указан момент
инъекции индикатора
Для оценки достоверности результатов определения СВ
данным методом выполнен ряд параллельных определений это-
го показателя с применением метода Фика и термодилюпии.
При сравнении с методом Фика получен коэффициент линей-
ной корреляции г = +0,96 (р < 0,01).
Сопоставление СВ, измеренного с применением ме-
тода разведения электроимпедансных индикаторов и тер-
модилюции, также обнаружило тесную корреляционную
связь (г = +0,92; р< 0,01).
Изучение воспроизводимости метода разведения электро-
импедансных индикаторов показало, что различия в измере-
337
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ниях в среднем не превышают 2,5 %, коэффициент корреля-
ции составляет +0,99 (р <0,001).
Таким образом, проведенные исследования показали, что
полученные значения СВ сопоставимы с наиболее корректны-
ми методами (Фика и термодилюции). Определение СВ дан-
ным методом в рамках мониторно-компьютерного наблюдения
за состоянием центральной гемодинамики и кислородно-транс-
портной функции кровообращения позволяет быстро и своевре-
менно диагностировать нарушения производительности сердца
и проводить их соответствующую медикаментозную коррек-
цию.
Дальнейшие работы по применению метода показали, что
он позволяет измерить величину объема циркулирующей кро-
ви, определить наличие и направленность патологического
шунтирования крови на уровне камер сердца и магистральных
сосудов.
Метод прост в исполнении, отличается малой инвазивно-
стью, реализуется на недорогой и доступной аппаратуре и по-
зволяет проводить многократные исследования в течение корот-
ких промежутков времени. При проведении вспомогательного
кровообращения метод дает возможность раздельно оценить
производительность собственного сердца пациента и аппарата
[Чаус Н.И. и соавт].
Определение сердечного выброса
методом разведения индикатора
с помощью ультразвукового флоуметра
В 1994 году Н.М. Кривицкий предложил способ измере-
ния СВ методом разведения индикатора при измерении ультраз-
вуковой плотности крови во время проведения экстракорпо-
ральной детоксикации. Определение СВ основано на регистра-
ции изменения скорости ультразвуковой волны в крови в ответ
на болюсную инъекцию определенного объема жидкости (0,9 %-
ного раствора NaCl). При измерении СВ во время использова-
ния аппарата для экстракорпоральной детоксикации ультразву-
ковой флоуметрический датчик помещают на проксимальный
по отношению к артериальному конец гемодиализной маги-
страли. В отсутствие аппарата для экстракорпоральной цирку-
338
(ЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
дации в лучевую артерию и в подкожную вену той же верхней ко-
нечности устанавливают канюли и соединяют их с катетером дли-
ной 20—40 см. На проксимальный по отношению к артериаль-
ной канюле участок помещают накидной ультразвуковой датчик
ультразвукового флоуметра.
Схема измерения СВ показана на рис. 3.6. Измеряют ско-
рость кровотока, что в реальном времени отражается в линейном
виде на экране монитора компьютера. Перед началом исследо-
вания проводится калибровочная инъекция 1 мл физиологиче-
ского раствора температуры, близкой к температуре тела, в прок-
симальный участок системы (перед датчиком). Проходя через
область датчика, эта порция индикатора дает кривую разведения
площадью 8кал. Затем в центральную вену вводят индикатор
(20 мл 0,9 %-ного р-ра NaCl), который, проходя через область дат-
чика, дает кривую изменения УЗ-плотности крови. Ее площадь
фиксируется как Shh. Поскольку скорость кровотока известна,
площадь под кривыми и объем калибровочной кривой также
известны, СВ рассчитывают по формуле:
СВ = Q х (Уин. / Укал.) х (8кал. / 8ин.),
Рисунок 3.6. Схема определения СВ методом индикаторной
Ультразвуковой флоуметрии
339
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
где Q — величина потока, измеренного УЗ-датчиком;
Уин. — объем инъекции; Укал. — объем калибровочной инъек-
ции; 8кал. — площадь под калибровочной кривой; Shh. — пло-
щадь под кривой первого прохождения индикатора. При расче-
те площадей под кривыми использовали методы линейной эк-
страполяции.
В экспериментальных исследованиях на животных показа-
тель СВ колебался от 0,7 до 3,5 л/мин. При сравнении с мето-
дом термодилюции коэффициент линейной корреляции со-
ставил 0,98.
При измерении СВ у пациентов во время сеансов экстракор-
поральной детоксикации его значения колебались в пределах от
2 до 8 л/мин. Коэффициент линейной корреляции, в сравнении
с термодилюционным методом, составил 0,97.
При клиническом испытании у пациентов с использова-
нием временного артериовенозного шунта разброс значений
СВ колебался от 3,0 до 9,1 л/мин. При этом коэффициент кор-
реляции, в сравнении с термодилюционным методом, соста-
вил 0,97.
Таким образом, были проведены три серии исследований по
сопоставлению результатов измерения СВ методом ультразвуко-
вой индикаторной флоуметрии с методом терморазведения.
Наиболее простым является определение СВ вышеописан-
ным методом при проведении сеансов экстракорпоральной де-
токсикации с подключением аппарата через артериовенозный
шунт. Оценка производительности сердца у пациентов отделе-
ний реанимации и интенсивной терапии во время таких проце-
дур имеет важное значение, поскольку проводить их нередко при-
ходится на фоне нестабильной гемодинамики, инфузии кар-
диотоников и вазопрессоров.
В эксперименте на животных и в клинической практике бы-
ла доказана возможность использования индикаторного метода
разведения УЗ-плотности крови для определения СВ без приме-
нения аппарата для экстракорпоральной циркуляции крови.
Предложенная процедура не требует дополнительных инвазивных
вмешательств у пациентов отделения интенсивной терапии кар-
диохирургического профиля, поскольку установка артериальной
и венозной канюль у них является обязательной, рутинной про-
340
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
цедурой. Ультразвуковой флоуметрический датчик устанавлива-
ют на пластиковую трубку, соединяющую артериальную и веноз-
ную канюли. Поскольку кровоток по ней пускают только на мо-
мент исследования СВ, остальное время она может быть выклю-
чена из кровотока и заполнена физиологическим раствором. При
этом артериальная канюля используется для мониторинга АД, а
венозная—для инъекций и инфузий. Потенциальная возможность
тромбирования шунта может быть снижена при использовании
трубок с внутренним антикоагулянтным покрытием.
Немаловажное значение имеет доступность аппаратуры и
индикаторов. Метод ультразвуковой флоуметрии в настоящее
время широко используется в хирургии сосудов, он позволяет с
высокой точностью определять объем кровотока по сосудам,
особенно сосудам малого диаметра. Он также может приме-
няться для определения производительности аппарата искус-
ственного кровообращения, аппаратов для экстракорпораль-
ной детоксикации, вспомогательного кровообращения, а при
введении индикатора (физраствора) — для оценки СВ как во вре-
мя данных процедур, так и в отсутствие системы для активной
экстракорпоральной циркуляции.
Метод разведения красителя
Метод разведения красителя [Stewart G.; 1897, Hamilton W.
и соавт., 1923,1932,1948] основан на внутривенном введении кра-
сителя и регистрации в артериальной крови изменения его кон-
центрации во времени. Для определения сердечного выброса
чаще применяют такие красители, как Т-1824 (Эванс синий), ме-
тиленовый синий или кардиогрин.
В силу ряда причин в настоящее время красители не нахо-
дят широкого применения в практике отделений реанимации и
интенсивной терапии. Прежде всего они непригодны для частых
и многократных измерений. Кроме того, общепринятая методи-
ка регистрации кривой первого прохождения индикатора с по-
мощью ушного датчика неприменима в условиях спазма пери-
ферических сосудов, который очень часто имеет место у паци-
ентов, находящихся в критических состояниях. Повторные ис-
следования с использованием Т-1824 влияют на показатель на-
сыщения гемоглобина крови кислородом. В редких случаях
341
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
встречаются публикации с использованием кардиогрина с оцен-
кой его количества в магистральной артерии или с помощью
пульсового фотометрического метода [Aoyagi Т., 1998].
В заключение следует отметить, что выбор метода опреде-
ления сердечного выброса зависит от возможностей отделения
реанимации и интенсивной терапии, особенностей патологиче-
ского процесса и тяжести гемодинамических нарушений, наблю-
даемых у пациента. В большинстве случаев при возникновении
синдрома шока, требующего прецизионной оценки центральной
гемодинамики и кислородтранспортной функции, при слож-
ном выборе лечебных воздействий и оценке их эффективности
предпочтение отдают методу термодилюции с использованием
катетера Свана—Ганса.
3.1.3. Измерение артериального давления
Неинвазивное измерение артериального давления прие-
млемо у большинства пациентов, поскольку у многих из них
нет необходимости в постоянной оценке гемодинамики. Не-
прямое измерение АД может осуществляться на основе аускуль-
тативного, осциллометрического и доплеровского методов. Кро-
ме того, в настоящее время неинвазивное измерение АД может
производиться на основе фотоплетозмографического метода.
Метод Короткова
Метод Короткова, основанный на аускультации, представля-
ет собой наиболее часто используемый способ неинвазивного из-
мерения АД. При правильном применении он позволяет до-
вольно точно измерять АД у больных со стабильной гемодина-
микой. Известно, что аускультативный метод дает неточные ре-
зультаты у больных с высоким общим периферическим сосуди-
стым сопротивлением, которое отмечается при синдроме шока
или использовании сосудосуживающих препаратов. Несмотря на
то что отмечена корреляция между данными, получаемыми с по-
мощью аускультативного метода и прямого измерения АД, при
сниженном тонусе периферических сосудов и при гиповоле-
мии аускул ьтативны й метод все-таки считается непригодным для
постоянного измерения АД, которое необходимо у нестабиль-
ного больного.
342
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
Автоматическое неинвазивное измерение АД
Устройства для автоматического неинвазивного измерения
АД приобрели большую популярность благодаря относительно
небольшой их стоимости, точности измерения АД и возможно-
сти многократных и частых измерений.
Осциллометрия представляет собой метод непрямого опре-
деления АД, базирующийся на измерении манометрических ос-
цилляций, вызванных пульсацией артерий во время сдувания
манжетки. Манжетка надувается и сдувается с помощью спе-
циальной помпы, помещенной в блок монитора или автомати-
ческий тонометр. Манжетка соединена с манометром. После
создания в ней давления, превышающего систолическое АД,
она постепенно сдувается. При первом появлении пульсирую-
щих волн под манжеткой на манометре появляются осциллятор-
ные колебания, которые соответствуют систолическому АД. По
мере сдувания манжетки амплитуда осцилляций увеличивается
до максимальной, что соответствует прямому измерению сред-
него АД. Диастолическое АД определяют при исчезновении ос-
цилляций.
Для измерения системного АД используется также доплеров-
ский метод.
Доплеровский датчик помещают над артерией. Датчик из-
лучает звуковые волны и воспринимает их после того, как они
отражаются от стенки сосуда. Затем производится частотный ана-
лиз отраженной волны, на основании чего можно судить о дви-
жении стенки сосуда или кровотоке в нем.
При использовании манжетки можно с приемлемой точно-
стью определить систолическое и диастолическое АД. Недо-
статки методики связаны с различными помехами, которые мо-
гут быть вызваны движениями пациента или перемещением
датчика.
Метод фотоплетизмографии позволяет осуществлять не-
прямое измерение АД благодаря использованию пальцевой ман-
жетки, содержащей источник инфракрасного излучения и фо-
тометрический датчик.
Объем кровотока мониторируют путем анализа отраженных
инфракрасных лучей. Давление в манжетке повышают до тех пор,
343
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
пока наружное давление, окружающее палец, позволяет под-
держивать постоянный кровоток. Это наружное давление экви-
валентно среднему АД. Поскольку устройство позволяет изме-
рять давление при каждом сердечном цикле, существует воз-
можность постоянного измерения систолического и диастоли-
ческого АД. Вместе с тем следует учитывать, что при перифери-
ческой вазоконстрикции могут быть получены неточные ре-
зультаты.
Сравнительные исследования аускультативного, осцилломе-
трического методов с инвазивным демонстрируют различные ре-
зультаты.
У взрослых индивидуумов со стабильной гемодинамикой не-
инвазивные методики могут завышать систолическое и занижать
диастолическое АД до 15 % по сравнению с одновременным
прямым измерением [Davis R.F., 1985; Hutton Р. и соавт., 1984].
Среди всех неинвазивных методов наиболее точно можно из-
мерить систолическое АД с помощью осциллометрического ме-
тода [Carrol G.C., 1998]. При непрямом измерении систоличе-
ского АД возможны погрешности, которые зависят от величи-
ны манжетки, а также используемого при этом мониторного
оборудования. Кроме того, к дополнительным факторам, кото-
рые могут приводить к ошибкам измерения, относят скорость
сдувания манжетки, ее размер и позицию на руке, объем конеч-
ности, смещение датчика и анатомические вариации артерий
[Johnson C.J.H. и соавт., 1985].
Частое надувание манжетки может привести к трофиче-
ским нарушениям на коже и повреждению локтевого нерва
[Gravenstein J.S. и соавт., 1987; Bruner J.M.R. и соавт., 1981]. При
неинвазивном измерении АД возможны ошибки, связанные с на-
рушением ритма сердца (Paulus D.A., 1981; Johnson C.J.H. и co-
авт., 1985). Кроме того, понижение эластичности артериальной
стенки, наблюдаемое при выраженном атеросклерозе, может
приводить к нарушению окклюзии артерии при надувании ман-
жетки, в результате чего измеренное неинвазивно АД выше из-
меренного с помощью артериального катетера [Paulus D.A.,
1981; Gravenstein J.S. и соавт., 1987]. Несмотря на вышеизло-
женное, автоматическое неинвазивное измерение АД предста-
вляет собой эффективный метод мониторирования у относитель-
344
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
но стабильного пациента, у которого не требуются частые изме-
рения АД в течение коротких промежутков времени.
При неустойчивой гемодинамике непрямые методы изме-
рения давления являются менее точными, поскольку требуют
определенных затрат времени на измерение и с их помощью
нельзя производить очень частые измерения. Аускультативный
метод существенно завышает систолическое АД [Bruner J.M.R.
и соавт., 1981], а осциллометрический и доплеровский методы
несостоятельны у нестабильных пациентов [Johnson C.J.H. и
соавт., 1985]. У оперированных пациентов ошибки непрямого из-
мерения могут превышать 30 мм рт. ст. У больных, которым осу-
ществляется введение вазоактивных препаратов, несоответствия
могут быть еще большими [Harrington D.P., 1978].
Показаниями к прямому измерению АД являются неста-
бильная гемодинамика, выраженная вызоконстрикция пери-
ферических сосудов, введение вазоактивных препаратов. Также
эта методика применяется у больных, состояние которых требу-
ет постоянного измерения АД. Установка артериального катете-
ра или канюли показана также при необходимости частого за-
бора проб для анализов артериальной крови.
Инвазивное (прямое) измерение АД
При ведении тяжелых больных, а также пациентов с неста-
бильной гемодинамикой для оценки состояния сердечно-сосу-
дистой системы и эффективности терапевтических воздействий
возникает необходимость в постоянной регистрации гемоди-
намических параметров.
Прямое измерения артериального давления осуществляют
через катетер или канюлю, введенную в просвет артерии. Пря-
мой доступ используют как для непрерывной регистрации АД,
так и для забора анализов газового состава и кислотно-основно-
го состояния крови. Показаниями к катетеризации артерии слу-
жат нестабильное АД и инфузия вазоактивных препаратов.
Наиболее распространенными доступами для введения ар-
териального катетера являются лучевая и бедренная артерии.
Значительно реже используются плечевая, подмышечная арте-
рии или артерии стопы. При выборе доступа учитывают сле-
дующие факторы:
345
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• соответствие диаметра артерии диаметру канюли;
• место катетеризации должно быть доступным и свобод-
ным от попадания на него секретов организма;
• конечность дистальнее места введения катетера должна
иметь достаточный коллатеральный кровоток, поскольку всег-
да существует вероятность окклюзии артерии.
Чаще всего используют лучевую артерию, поскольку она
имеет поверхностное расположение и легко пальпируется. Кро-
ме того, ее канюляция связана с наименьшим ограничением
подвижности пациента.
Во избежание осложнений предпочтительно пользоваться
не артериальными катетерами, а артериальными канюлями.
Перед канюляцией лучевой артерии проводят пробу Алле-
на (рис. 3.7). Для этого пережимают лучевую и локтевую арте-
рии. Затем пациента просят несколько раз сжать и разжать ку-
лак до побледнения кисти. Локтевую артерию освобождают и на-
блюдают за восстановлением цвета кисти. Если он восстана-
вливается в течение 5—7 с, кровоток по локтевой артерии счи-
тают адекватным. Время, составляющее от 7 до 15 с, свидетель-
ствует о нарушении кровообращения по локтевой артерии. Если
цвет конечности восстанавливается более через чем 15 с, от ка-
нюляции лучевой артерии отказываются.
Рисунок 3.7 Проба Аллена
346
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
Канюляцию артерии выполняют в стерильных условиях.
Предварительно заполняют раствором систему для измерения АД
и калибруют тензометрический датчик. Для заполнения и про-
мывки системы пользуются физиологическим раствором, в ко-
торый добавляют 5000 ЕД гепарина.
Мониторинг инвазивного АД обеспечивает непрерывное
измерение этого параметра в режиме реального времени, но
при интерпретации получаемой информации возможен целый
ряд ограничений и погрешностей. Прежде всего форма кривой
артериального давления, полученная в периферической артерии,
не всегда точно отражает таковую в аорте и других магистраль-
ных сосудах. На форму кривой АД влияют инотропная функция
левого желудочка, сопротивление в аорте и периферических со-
судах и характеристики системы для мониторирования АД. Са-
ма мониторная система может вызывать различные артефакты,
в результате чего меняется форма кривой артериального давле-
ния. Правильная интерпретация информации, получаемой с
помощью инвазивного мониторинга, требует определенного
опыта. Здесь следует указать на необходимость распознавания не-
достоверных данных. Это имеет важное значение, поскольку
неверный анализ и неверная интерпретация получаемых данных
могут приводить к неправильным врачебным решениям.
Оборудование для прямого измерения АД- Система для ин-
вазивного мониторинга артериального давления обычно состо-
ит из гидравлической системы, которую заполняют жидкостью,
жидкостно-механического интерфейса, трансдюсера и элек-
тронного оборудования, включающего в себя усилитель, мони-
тор, осциллоскоп и записывающее устройство (рис. 3.8).
Гидравлическая часть мониторной системы состоит из ка-
тетера (или канюли), соединительной трубки, краников, устрой-
ства для промывки катетера и головки трансдюсера. Обычно
применяются тефлоновые или полиуритановые внутриарте-
риальные катетеры или канюли. Несмотря на то, что короткие
широкопросветные катетеры обеспечивают максимально точное
отображение физиологических характеристик, в настоящее вре-
мя предпочитают использовать короткие катетеры небольшого
Диаметра, поскольку это значительно снижает вероятность тром-
боза сосуда. Коннектор, соединяющий катетер и трансдюсер, не
347
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Рисунок 3.8 Оборудование для прямого измерения АД
должен быть длиннее 1 м. Краник присоединяют непосред-
ственно к катетеру и используют для забора проб крови. Еще
один краник устанавливают на головку трансдюсера для того,
чтобы выставлять нулевой уровень давления. Система для про-
мывки, в которой создается давление до 300 мм рг. ст., обеспе-
чивает постоянную инфузию гепаринизированного физиоло-
гического раствора со скоростью от 1 до 3 мл в час для обеспе-
чения проходимости системы и снижения риска тромбоза.
Изменения внутрисосудистого давления передаются через
заполненную жидкостью соединительную трубку на мембрану
трансдюсера, где механические колебания преобразуются в элек-
трический сигнал, который пропорционален колебаниям да-
вления. Сигнал усиливается и фильтруется для удаления высо-
кочастотных помех. Кривая давления отображается на дисплее
монитора, на котором представлена графическая и цифровая ин-
формация. Калиброванная бумага, которая используется в пи-
шущем устройстве, позволяет проверять данные, отображаемые
на экране прикроватного монитора. Точность измерение АД за-
348
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
висит от свойств всей системы, и прежде всего от ее способно-
сти к передаче физиологического сигнала. Поскольку гидра-
влическая составляющая системы может быть источником оши-
бок (ввиду инерции при колебаниях столба жидкости), она яв-
ляется одним из слабых компонентов в мониторной системе.
Большое значение имеют частотные характеристики мони-
торной системы, а именно ее электронной части, поскольку ча-
стота работы нормальной сердечно-сосудистой системы ко-
леблется от 60 до 180 циклов в минуту или составляет 1—3 Гц
[Carrol G.C., 1998]. Следовательно, мониторная система для из-
мерения артериального давления должна иметь флотирующую
частоту, составляющую по меньшей мере от 5 до 20 Гц, что по-
зволяет обеспечить точное отображение сигнала. Любая си-
стема, заполненная жидкостью, имеет тенденцию к вибрации
(или осцилляции) и, кроме того, каждая из них имеет так на-
зываемую резонансную частоту. Физиологические частоты со-
судистой системы могут достигать 10—15 Гц, следовательно,
мониторная система должна иметь резонансную частоту, пре-
вышающую 15 Гц, алучше 25 Гц [Gardner R.M., 1981]. Ксожа-
лению, резонансная частота трубок, заполненных жидкостью,
колеблется от 5 до 20 Гц [Veremakis С. и соавт., 1989], следова-
тельно, кривая частотного ответа не всегда может соответство-
вать частотным характеристикам физиологического сигнала,
исходящего из сосудистой системы. В этой связи возможно
появление артефактов при усилении сигнала, соответствующе-
го систолическому давлению. Колебания столба жидкости в си-
стеме гасятся за счет сил трения, благодаря действию которых
система приходит к нулевой отметке. Этот эффект также зави-
сит от вязкости и компляйнса системы и называется демпин-
гом. Характеристики демпинга описываются демпинговым
коэффициентом.
При значении коэффициента, равном нулю, наблюдаются
избыточные осцилляторные колебания, в то время как при ко-
эффициенте, достигающем единицы, подавляются любые осцил-
ляции, даже обусловленные резонансом [Carrol G.C., 1998; Sha-
piro G.G. и соавт., 1970]. Теоретически оптимальный демпинго-
вый коэффициент находится в пределах от 0,6 до 0,7 [Graven-
stein J.S. и соавт., 1987].
349
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Основными характеристиками мониторной системы явля-
ются резонансная частота и демпинговый коэффициент. Обыч-
ные мониторные системы, применяемые в клинической прак-
тике, имеют резонансную частоту между 10 и 20 Гц, и для их нор-
мальной работы требуется демпинговый коэффициент в преде-
лах от 0,5 до 0,7. В системах, имеющих резонансную частоту, со-
ставляющую 25 Гц, возможен демпинговый коэффициент, дости-
гающий 0,2—0,3. Для увеличения частоты и оптимизации дем-
пингового эффекта применяют короткие удлинительные труб-
ки и небольшие тензометрические датчики, производят тща-
тельное удаление пузырьков воздуха [Shapiro G.G. и соавт., 1970;
Boutros А. и соавт.,1983; Shinozaki Т. и соавт., 1980] и использу-
ют минимальное количество краников и мест для инъекций
[Shinozaki Т. и соавт., 1980]. Для точного измерения давления
необходима калибровка системы и прежде всего нулевой точки.
Для этого краник на головке датчика давления открывают в ат-
мосферу, а сам тензометрический датчик помещают на уровне
правого предсердия (4-е межреберье, на уровне средней подмы-
шечной линии), после чего на мониторе нажимают кнопку ка-
либровки нуля. Необходимо помнить, что после калибровки
изменение уровня положения тензометрического датчика влия-
ет на получаемый показатель давления [Gardner R.M. и соавт.,
1986]. Если датчик находится ниже указанного уровня, получа-
емые значения давления будут завышенными и наоборот. Поло-
жение самого катетера или канюли относительно сердца не
влияет на точность измерения давления. Калибровку нуля сле-
дует проводить при любом изменении положения тела больно-
го или значительных изменениях артериального давления.
Тензометрический датчик необходимо периодически ка-
либровать. Для этого к нему присоединяют систему, заполнен-
ную водой, давление в которой известно. Если получаемые на мо-
ниторе числа соответствуют данному давлению, значит, тензо-
метрический датчик показывает верные результаты.
Кривая артериального давления. Нормальная кривая арте-
риального давления характеризуется быстрым подъемом, вы-
раженным дикротическим зубцом и четко выраженной конеч-
но-диастолической частью (рис. 3.9). Первый острый зубец А
отражает быстрое изгнание крови из левого желудочка в аорту.
350
Рисунок 3.9. Кривая
артериального давления:
А — первый острый зубец;
В — дикротический зубец;
С — конечно-диастоличес-
кая часть
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
Дикротический зубец В отражает обратный ток крови в аорте при
закрытии аортального клапана. В этот момент давление крови
в аорте превышает давление в левом желудочке.
Пик кривой соответствует систолическому давлению, кото-
рое в норме колеблется от 90 до
140 мм рт. ст. Дикротический зубец
отражает конец систолы и начало ди-
астолы левого желудочка. Нижняя
точка кривой С соответствует диасто-
лическому давлению, которое в нор-
ме составляет от 60 до 90 мм рт. ст.
Среднее артериальное давление ис-
пользуют для оценки перфузии жиз-
ненно важных органов. В большин-
стве прикроватных мониторов его ве-
личина определяется автоматически.
Нормальные значения среднего АД
составляют от 70 до 105 мм рт. ст Сгла-
живание или отсутствие характерных
зубцов на кривой АД наблюдается при
образовании тромба в просвете каню-
ли, попадании воздуха в систему или при использовании удли-
нительных систем избыточной длины. На форму артериальной
кривой оказывает большое влияние место канюляции и канюли-
руемая артерия. Считается, что канюляция лучевой, плечевой, бе-
дренной артерии и a. dorsalis pedis адекватно отражает показатель
центрального артериального давления, то есть давления в аорте.
Однако эти предположения не всегда верны.
При использовании плечевой артерии получают сигнал,
который достаточно точно отражает кривую давления в аорте, од-
нако при канюляции лучевой артерии могут быть получены ре-
зультаты, на 10—15 % превышающие получаемые в плечевой
артерии [Bryan-Brown C.W. и соавт., 1983]. И эти цифры могут
быть выше, чем получаемые при катетеризации бедренной ар-
терии. Данные, получаемые на a. dorsalis pedis, могут быть на 20
мм выше, чем при использовании лучевой артерии [Youngberg J.A.
и соавт., 1976]. То, что данные, получаемые в периферических ар-
териях, могут быть выше, чем в центральных, объясняется бо-
351
______________________ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
лее высоким сопротивлением в них, связанным с тем, что калибр
их меньше, таким образом, чем меньше диаметр канюлируе-
мой артерии, тем более высокие значения систолического и ди-
астолического давления получаются [Bruner J.R.M. и соавт.,
1981]. Величина среднего артериального давления подвержена
меньшей зависимости от места канюляции, поскольку д ля его из-
мерения производят интегрирование области, находящейся под
кривой давления, в результате периферическое среднее арте-
риальное давление соответствует полученному в центральных ар-
териях и может служить в качестве достаточно информативно-
го показателя при определении терапевтической тактики.
Одним из наиболее частых артефактов при записи кривой
АД, который наблюдается в клинической практике, является
систолический скачок. При измерении АД в периферической ар-
терии нередко может наблюдаться систолический пик, на
10—15 мм рт. ст. превышающий значение систолического АД в
центральном сосуде. Вместе с тем завышение АД на
20—40 мм рт. ст. очень часто наблюдается у больных в течение пер-
вых 48 ч после операции на сердце и магистральных сосудах. Этот
феномен подобен наблюдаемому у больных с генерализован-
ным, или мультифокальным атеросклерозом [O’Rourke M.F. и со-
авт., 1984]. Кроме того, систолический спайк может наблюдать-
ся у больных с гипердинамическим состоянием кровообращения
и при ЧСС, превышаюшей 120 ударов в минуту. Наблюдаемые
изменения могут являться суммой высокочастотной компонен-
ты сигнала АД, резонансной частоты мониторной системы и/или
особенностями сосудистого дерева пациента.
При гиповолемии и вазоконстрикции, когда контрак-
тильность миокарда не нарушена, на кривой АД может на-
блюдаться значительное уширение инотропного пика и ча-
сти, характеризующей изгнание крови из левого желудочка в
аорту. Как правило, такие изменения наблюдаются при реги-
страции АД в периферических сосудах. Иногда высокие зна-
чения систолического пика на кривой, получаемой в пери-
ферических сосудах, могут давать завышенные результаты, и
в этих случаях может ошибочно ставиться диагноз артериаль-
ной гипертензии. При одновременном измерении давления в
аорте значения его могут быть значительно ниже. Неправиль-
352
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
ная интерпретация результатов в этих случаях иногда приво-
дит к неправильной терапевтической тактике. Повышение
инотропного пика может также наблюдаться при использова-
нии различных фармакологических воздействий. Вазопрес-
соры могут приводить к увеличению систолического пика со
значительным снижением части кривой, отражающей перера-
спределение кровотока. В противоположность этому, вазоди-
лататоры снижают систолический пик и увеличивают часть
кривой, отражающей перераспределение кровотока [McGre-
gor М„ 1979]. Важно отметить, что подобные изменения, как
правило, наблюдаются при регистрации давления в перифери-
ческих артериях. На кривых, полученных из центральных ар-
терий, они встречаются крайне редко.
Важно отметить, что наличие систолического пика и его
увеличение не оказывают влияния на показатель среднего
АД. Следовательно, в подобных ситуациях необходимо ори-
ентироваться на среднее артериальное давление и меньше
обращать внимание на цифры систолического АД [Verema-
kis С. и соавт., 1989].
Есть сообщения об обратных взаимоотношениях между
периферическим и центральным АД, которые наблюдаются
непосредственно после операций, выполненных в условиях
искусственного кровообращения [Youngberg J.A. и соавт., 1976;
Stem D.H. и соавт., 1985; Gallagher J.D. и соавт., 1985]. В част-
ности, наблюдали систолическое АД, которое было ниже цен-
трального давления в аорте на 10—30 мм рт. ст. [Stem D.H. и со-
авт., 1985]. Авторы объясняют данный феномен изменением со-
противления периферических сосудов, и рекомендуют ориен-
тироваться на показатель центрального давления, которое ре-
гистрируют в аорте.
На величину и форму АД при прямом его измерении мо-
гут также оказывать влияние изменения внутриплеврального да-
вления. В норме АД немного снижается во время вдоха и уве-
личивается в фазу выдоха, что обусловлено изменениями пред-
нагрузки левого желудочка и изменениями синергизма рабо-
ты левого и правого желудочков сердца [McGregor М., 1979; El-
lis D.M., 1985]. Увеличение работы дыхания может влиять на
данный механизм, и в этих случаях может наблюдаться пара-
353
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
доксальный пульс, как, например, при тампонаде сердца или
тяжелом приступе бронхиальной астмы [McGregor М., 1979].
Вентиляция с положительным давлением может увеличивать
пульсовое давление прежде всего у пациентов с нарушением
функции левого желудочка в связи с уменьшением его предна-
грузки [Wise R., 1985]. Вместе с тем у больных с гиповолеми-
ей, которым начинают проводить искусственную вентиляцию
легких с положительным давлением, нередко наблюдается па-
дение систолического и диастолического АД. Следовательно,
при проведении искусственной вентиляции легких очень важ-
ное значение имеет оценка ее влияния на данные, получае-
мые при мониторинге АД.
Осложнения катетеризации артерии. К непосредствен-
ным осложнениям катетеризации артерии относят инфекцион-
ные осложнения, кровотечение и нарушение кровообращения
в конечности.
Инфекционные осложнения. Риск инфицирования снижа-
ется при соблюдении стерильности при катетеризации и забо-
ре проб крови, а также правил эксплуатации системы для из-
мерения АД. Необходимо периодически осматривать место
введения катетера на наличие признаков инфекции. При пере-
вязках, замене промывочного раствора и удлинителей и забо-
ре анализов пользуются стерильными перчатками. Пробы кро-
ви берут через трехходовой краник, после чего его промывают
и открытые порты закрывают стерильной заглушкой. Необхо-
димо избегать попадания воздуха и крови в систему.
Кровопотеря. При рассоединении системы д ля прямого из-
мерения АД возможна значительная кровопотеря. Во избежа-
ние этого конечность, в которую веден катетер, необходимо им-
мобилизировать. Части системы для измерения АД должны
быть надежно соединены между собой, и доступ к ним должен
быть свободным.
Нарушение кровообращения в конечности. Во избежание
этого осложнения сразу после канюляции и не реже чем раз в
8 ч исследуют цвет, чувствительность и подвижность конечно-
сти, в которую введен катетер. В случае появления симптомов
нарушения кровообращения в конечности катетер или каню-
лю немедленно удаляют.
354
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
3.1.4. Центральное венозное давление
Методика установки центрального венозного катетера
Катетер в центральную вену вводят в стерильных условиях,
предварительно обработав место инъекции. Врач пользуется
стерильными халатом и перчатками, маской и шапочкой. Так-
же одевается ассистент и любой персонал, находящийся в непо-
средственной близости от места введения катетера. Центральный
венозный катетер вводят через вены предплечья, плечевую ве-
ну, внутреннюю или наружную яремные вены, бедренную или
подключичную. Дистальный конец катетера устанавливают в
верхней или нижней полой вене вблизи от правого предсердия.
В некоторых случаях дистальный конец катетера может попасть
в правое предсердие. В этих случаях при использовании водно-
го манометра для измерения ЦВД появляются ритмические ко-
лебания столба жидкости, соответствующие частоте сердечных
сокращений пациента. Если используется мембранный тензоме-
трический датчик, гемодинамическая форма кривой, которая
отображается на экране прикроватного монитора, меняется.
В этих случаях катетер извлекают на несколько сантиметров до
достижения его нормальной позиции. Необходимо пользовать-
ся рентгенконтрастными катетерами. После установки поло-
жение дистального конца катетера проверяют с помощью рент-
генограммы органов грудной клетки.
Измерение центрального венозного давления
Использование водного манометра. На рис. 3.10 показана си-
стема для измерения ЦВД. Манометр, имеющий 3-ходовой кра-
ник, устанавливают между промывочным раствором и централь-
ным венозным катетером. Перед измерением ЦВД манометр
частично заполняют раствором, при этом краник поворачива-
ют таким образом, чтобы он соединял линию обычного катете-
ра с трубкой манометра, а линию, идущую к центральному ве-
нозному катетеру, отключают. Д ля промывания катетера краник
переключают в позицию, которая соединяет промывочную жид-
кость с внутривенным катетером, отключая при этом манометр.
Для измерения ЦВД краник устанавливают в позицию, при ко-
торой ЦВК сообщается с манометром.
355
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Рисунок 3.10. Система для измерения центрального
венозного давления
Измерение ЦВД с помощью тензометрическогого датчика.
При измерении ЦВД с помощью прикроватного монитора
и тензометрического датчика пользуются тем же оборудованием,
что и при измерении АД. В этом случае за позицией катетера на-
блюдают по кривой давления, которое отображается на экране
прикроватного монитора. Там же получают и показатели ЦВД.
ОСЛОЖНЕНИЯ катетеризации описаны в главе 10 «Со-
судистые доступы для трансфузиологических процедур».
Интерпретация результатов измерения ЦВД
ЦВД измеряется в сантиметрах водного столба или в мил-
лиметрах ртутного столба. Нормальными считают значения
ЦВД, составляющие от 5 до 8 см водного столба или от 0 до 6 мм
ртутного столба. Большое значение имеет мониторинг динами-
ки ЦВД, поскольку он позволяет не только оценить функцию
сердечно-сосудистой системы пациента, но и реакцию на раз-
личные медикаментозные и лечебные воздействия.
356
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
цВД отражает внутрисосудистый объем крови, объем кро-
ви в конце диастолы правого желудочка и насосную функцию
правого желудочка. С большими ограничениями можно счи-
тать, что ЦВД отражает состояние функции левого желудочка,
однако это верно только в отсутствие нарушений кровообра-
щения в малом круге.
Низкие значения ЦВД обычно свидетельствуют о гипово-
лемии и, как правило, являются показанием для инфузии жид-
кости. При адекватном восполнении ОЦК обычно наблюдают
повышение ЦВД.
При проведении диуретической терапии, которая снижает
объем внутрисосудистой жидкости, также может наблюдаться
снижение ЦВД. Низкие или пониженные значения ЦВД могут
быть связаны с вазодилатацией, которая наблюдается при сепси-
се или использовании вазодилататоров. В этих случаях говорят
об относительной гиповолемии, поскольку абсолютного дефи-
цита ОЦК может и не быть.
Высокие значения ЦВД могут быть следствием целого ря-
да причин.
Наиболее частыми причинами высокого ЦВД являются не-
достаточность правого желудочка и проведение ИВЛ, особенно
с использованием положительного давления в конце выдоха.
ИВЛ приводит к повышению внутригрудного давления, которое
передается через сосуды малого круга, правые отделы сердца
на полые вены. В ряде случаев увеличение внутригрудного да-
вления, обусловленное ИВЛ, приводит к самостоятельным на-
рушениям функции правого желудочка.
Причиной повышения ЦВД могут быть увеличение цен-
трального объема крови и гиперволемия.
Высокие значения ЦВД могут наблюдаться при пораже-
нии правого желудочка, вызванного инфарктом миокарда, или
при левожелудочковой сердечной недостаточности. Повышение
давления в легочной артерии, то есть легочная гипертензия, ко-
торая может быть связана как с левожелудочковой недостаточ-
ностью, так и с органическим поражением сосудов малого кру-
га, также проявляется повышением ЦВД.
Необходимо понимать, что ЦВД не является самостоятель-
ным диагностическим показателем, и обычно его рассматри-
357
ТРАНСФУЗИОЛОГИЯ в реаниматологии
вают в комплексе с другими клиническими данными — аускуль-
тация легких и сердца, шумов, измерение АД и ЧСС, запись
12 стандартных отведений ЭКГ, рентгенография органов груд-
ной клетки, темп мочеотделения и показатели газового состава
и КЩР крови.
В нашей практике встречались пациенты с высокими или
нормальными значениями ЦВД, сочетавшимися с абсолютной
гиповолемией. Внутривенная инфузия плазмозаменителей со-
провождалась снижением ЦВД, нормализацией частоты сер-
дечных сокращений и артериального давления. Поскольку при-
чиной повышения ЦВД может быть спазм сосудов малого кру-
га кровообращения, в сомнительных случаях проводят пробу с
быстрой инфузией плазмозаменителя.
У больных, оперированных на сердце и органах средостения,
причиной высокого ЦВД может являться кровотечение и там-
понада сердца. В этих ситуациях в качестве дополнительных
диагностических процедур используют рентгенографию органов
грудной клетки и трансторакальную эхокардиографию.
Контроль за гемодинамическими показателями
в процессе проведения инфузионно-трансфузионной
терапии
Вопросы контроля за гемодинамическими параметрами
при проведении инфузионной терапии являются весьма пробле-
матичными. Измерение отдельных параметров, например ЦВД
или ДЗЛА, не коррелирует с прямым определением ОЦК [Ле-
бедева Р.Н. и соавт., 1979]. Нередко на фоне гиповолемии наблю-
дается венозная и артериолярная вазоконстрикция, при этом мо-
гут наблюдаться высокие цифры ЦВД. Кроме того, на этот па-
раметр влияет целый ряд других факторов: давление в грудной
клетке, состояние сосудов малого круга кровообращения, функ-
ция трехстворчатого клапана, насосная функция левых и пра-
вых отделов сердца. Высокое ЦВД на фоне гиповолемии может
наблюдаться при использовании неоправданно больших ды-
хательных объемов и PEEP во время ИВЛ, у пациентов с легоч-
ной гипертензией, а также при сердечной недостаточности.
Кроме того, недостоверные результаты могут быть получены при
неправильной позиции центрального венозного катетера, к
358
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
примеру, при попадании его дистального конца в правый желу-
дочек сердца.
Показатель ДЗЛА также не всегда отражает состояние ОЦК
и преднагрузки левого желудочка. На этот показатель нельзя
ориентироваться у больных со II—III степенью легочной гипер-
тензии. Во избежание диагностических ошибок при значитель-
ных гемодинамических нарушениях во время восполнения ОЦК
помимо вышеперечисленных параметров необходим комплекс-
ный мониторинг с измерением сердечного выброса, ТО2, ПО2,
концентрации лактата и показателей оксигенации смешанной
венозной крови.
Для определения оптимального давления наполнения же-
лудочков сердца целесообразно пользоваться пробой с нагруз-
кой объемом жидкости. Для этого в центральную вену в бы-
стром темпе вводят раствор плазмозаменителя, регистрируя из-
менение СВ при увеличении ДЗЛК и ДПП на 1—2 мм Hg. Если
во время проведения пробы наблюдается снижение СВ, инфу-
зию жидкости прекращают. На рис. 3.11 представлены вариан-
ты кривых функции левого желудочка сердца. При нормаль-
ном ответе на пробу значения СИ достигают 2,5—3,5 л/мин/м2
после возрастания ДЗЛК до 10—12 мм рт. ст. (кривая 1). У неко-
торых больных нормальная производительность сердца наблю-
дается при высоких давлениях наполнения, достигающих
18—20 мм рт. ст. (кривая 2). Встречаются случаи, когда нормаль-
ДЗЛК (мм рт. ст.)
Рисунок 3.11. Варианты кривых функции левого желудочка
сердца
359
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ная производительность сердца наблюдается при относительно
невысоких значениях показателей преднагрузки (кривая 3). У ря-
да пациентов при низких давлениях наполнения желудочков
сердца инфузия небольших объемов приводит к резкому паде-
нию СИ, что свидетельствует о низких функциональных резер-
вах миокарда и необходимости инотропной поддержки (кри-
вая 4). В этих случаях возможно введение жидкости в медленном
темпе под прикрытием симпатомиметиков.
3.2. Инфузионно-трансфузионная терапия
критических состояний
3.2.1. Циркуляторный шок
Циркуляторный шок представляет собой клинический син-
дром общей недостаточности кровообращения с неадекватной
тканевой оксигенацией (ТО2), приводящей к снижению потре-
бления кислорода (ПО2), анаэробному метаболизму и лактат-аци-
дозу. Weil М.Н. и Henning подразделяют шок на 4 категории:
гиповолемический, кардиогенный, дистрибутивный, обусло-
вленный относительной гиповолемией, и обструктивный, об-
условленный обструкцией магистральных сосудов [Weil М.Н. и
соавт., 1979].
Гиповолемический шок обусловлен снижением ОЦК. Его
основными причинами являются кровотечение (травматиче-
ский или геморрагический шок) и дегидратация (ожоговый шок
или шок, обусловленный потерей жидкости и электролитов при
диарее, рвоте или через фистулу).
Дистрибутивный шок (увеличение емкости сосудистой си-
стемы):
• анафилактический шок;
• септический шок;
• неврогенный шок (нарушение центральной регуляции
сосудистого тонуса после церебральной или спинальной травмы).
Обструктивный шок (обструкция магистральных сосудов).
• тромбоэмболия легочной артерии;
• синдром верхней полой вены.
360
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
Гиповолемический шок
Снижение объема плазмы является основной причиной ги-
поволемичекого шока. В некоторых случаях нарушения ткане-
вой оксигенации могут быть обусловлены сочетанием абсолют-
ной и относительной гиповолемии. Снижение объема плазмы
приводит к снижению конечно-диастолического объема лево-
го желудочка, что сопровождается падением ударного выброса.
До определенного момента за счет активации симпатической
нервной системы, приводящей к тахикардии и вазоконстрикции,
артериальное давление и СВ поддерживаются на удовлетвори-
тельном уровне, однако при истощении компенсаторных меха-
низмов происходит резкое падение гемодинамики.
Клинические проявления гиповолемического шока зависят
от степени дефицита ОЦК. Согласно данным, представленным
в табл. 3.1, при первой степени, когда кровопотеря не превыша-
ет 15 %, обычно наблюдается беспокойство больного, тахикар-
дия и незначительное повышение шокового индекса.
Потеря 15—30 % ОЦК (II степень) может сопровождаться
двигательным беспокойством и агрессивностью больного, блед-
ностью кожных покровов, нарастанием тахикардии, снижени-
Таблица 3.1
Степень Дефицит ОЦК Конечности Цвет лица Состояние сознания
I <15% <0,75 л Обычный цвет Обычный цвет Тревожное
II 15-30% 0,75-1,5 л бледные бледный Беспокойство или агрессив- ность
III 30-40 % 1,5-2,0 л бледные бледный Беспокойство, агрессивность или сонливость
IV >40% >2,0 л бледные и холодные бледно- серый Сонливость, спутанность или отсутствие соз- нания
361
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ем диастолического АД и возрастанием шокового индекса до
2 норм. Появляются признаки нарушения периферической ми-
кроциркуляции — при сжатии пальцев руки их цвет восстанавли-
вается более чем через 2 с. При этом темп мочеотделения сни-
жается до 20-30 мл/ч.
При потере 30—40 % ОЦК (III степень) нарастают проявле-
ния нарушения сознания, беспокойство и агрессивность сменя-
ются заторможенностью и сонливостью. Снижается как систо-
лическое, так и диастолическое АД. Нарастает тахикардия, по-
является одышка, темп мочеотделения прогрессивно падает.
Потеря более чем 40 % ОЦК (IV степень) приводит к выра-
женной артериальной гипотензии, заторможенности, спутанно-
сти или отсутствию сознания. Кожные покровы приобретают
бледно-серый цвет, конечности холодные, иногда наблюдается
мраморная их окраска. Нарастают тахикардия, одышка, значе-
ния шокового индекса достигают трех норм, наблюдается оли-
гурия или анурия.
Септический шок
В экспериментальных моделях эндотоксинового шока до-
казано, что причиной данного синдрома является депонирова-
ние крови в сосудистом русле, преимущественно в венозной
системе [MacLean L.D., 1956]. У пациентов с септическим шо-
ком обычно наблюдается пониженное ЦВД на фоне нормально-
го ОЦК, что может служить подтверждением эксперименталь-
ных данных.
У больных с тяжелым сепсисом очень часто возникает от-
носительная гиповолемия, которая может приводить к развитию
гипотензии и клинической картины септического шока. Этому
способствует целый ряд факторов, среди которых недостаточное
введение жидкости, большие потери ее в результате гипертермии,
рвоты, диареи, выпот в брюшную полость у пациентов с пери-
тонитом, а также генерализованное повышение проницаемости
капилляров, приводящее к накоплению жидкости в интерсти-
циальном пространстве.
Абсолютный или относительный дефицит внутрисосуди-
стого объема крови сопровождается неадекватной производи-
тельностью сердца и тканевой перфузией.
362
ГЛАВЛ 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
Большинство исследований гемодинамики при септиче-
ском шоке, представленные в литературе, производились после
проведения инфузионной терапии. В то же время есть работы,
демонстрирующие, что до начала введения растворов среднее да-
вление заклинивания в легочной артерии и СВ обычно находят-
ся в районе нижней границы нормы. Гипердинамическое со-
стояние, характеризующееся высоким СВ, обычно наблюдает-
ся после проведения мероприятий по восполнению ОЦК.
Возмещение дефицита жидкости является первостепенной
задачей в лечении больных с септическим шоком. Это приводит
к увеличению венозного возврата, СВ, коррекции артериальной
гипотензии и олигурии.
Основная цель терапевтических мероприятий заключается
в увеличении доставки кислорода. Как правило, у больных сеп-
тическим шоком наблюдается повышенная потребность в кисло-
роде. В связи с этим оптимальный сердечный выброс у них пре-
вышает общепринятые нормальные значения. Shoemaker и со-
авт. считают, что у пациентов с септическим шоком необходи-
мо достигать гипердинамического состояния кровообращения,
что удается приблизительно в 68 % случаев [Shoemaker W.C. и со-
авт., 1988].
При проведении инфузионной терапии следует избегать
избыточного введения жидкости, поскольку это может привести
к нарушению оксигенирующей функции легких. В этой связи
проведение тщательного мониторинга гемодинамики и кисло-
родтранспортной функции, о котором говорилось в предыдущем
разделе, также актуально и для данной категории больных.
До сих пор окончательно не решен вопрос о выборе инфу-
зионных средств при септическом шоке. Коллоидные растворы
позволяют поддерживать адекватное КОД плазмы крови, что
способствует оптимизации ОЦК. Однако при увеличении про-
ницаемости микрососудов не всегда удается удерживать гради-
ент онкотического давления между внутрисосудистым и внесо-
судистым пространствами. Сторонники кристаллоидных ра-
створов указывают, что в этом случае коллоидные растворы мо-
гут попадать в интерстициальное пространство легких, повышая
там онкотическое давление и увеличивая накопление жидкости
во внесосудистом секторе [Sturm J.A. и соавт., 1979].
363
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Важную роль в контроле за проведением инфузионной те-
рапии играет мониторирование онкотически-гидростатическо-
го градиента по давлению. Разница между КОД плазмы крови и
ДЗЛК ниже 8 мм рт. ст. обычно сопровождается выходом жид-
кости из внутрисосудистого в интерстициальный сектор.
Большинство авторов настаивают на необходимости мо-
ниторирования ДЗЛК и СВ при проведении инфузионной тера-
пии у больных с септическим шоком. Это связано с отсутстви-
ем корреляции между ЦВД и ДЗЛК.
Для определения оптимальных значений ДЗЛК пользуют-
ся объемной нагрузкой. При этом оценивают, при каком сред-
нем давлении в легочных капиллярах наблюдаются значения
СВ, достаточные для достижения адекватного транспорта кисло-
рода. Обычно оптимальный сердечный выброс у этой категории
больных наблюдается при значениях ДЗЛК, составляющих око-
ло 12 мм рт. ст.
У больных с септическим шоком нередко отмечаются нару-
шения функции правого желудочка сердца, которые связаны с
поражением легких (пневмония, ОРДС). В этой связи монито-
ринг функционального состояния правого желудочка сердца у
данной категории пациентов также актуален.
При низких СВ и АД могут использоваться симпатомиме-
тики, однако их введение необходимо сочетать с адекватным
восполнением ОЦК.
В ряде случаев у пациентов с септическим шоком наблюда-
ется клиника сосудистой недостаточности, которая проявляет-
ся относительно нормальными или повышенными значениями
СВ на фоне низкого среднего АД (в основном за счет диастоли-
ческого АД). В такой ситуации оптимизации гемодинамики
удается достичь на фоне инфузии вазопрессоров: норадрена-
лина, мезатона, адреналина.
У пациентов с низкими функциональными резервами мио-
карда оправдано назначение добутамина или допамина.
Анафилактический шок
Основными патогенетическими признаками анафилакти-
ческого шока являются вазодилатация, депонирование крови в
периферических сосудах и системное увеличение проницаемо-
364
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
сти микроциркуляторного русла. В некоторых случаях в резуль-
тате увеличения проницаемости сосудов малого круга развива-
ется отек легких. При этом за счет перемещения жидкости в
интерстициальное пространство легких потеря объема циркули-
рующей плазмы может достигать 50 % [Fisher М., 1987].
Лечение анафилактического шока заключается в сочетан-
ном введении симпатомиметиков (адреналина и или норадрена-
лина), кортикостероидных гормонов и восполнении объема
циркулирующей плазмы. Клинический опыт показывает, что в
случаях тяжелого анафилактического шока более эффектив-
ным способом восполнения объема циркулирующей плазмы
служит введение коллоидных растворов [Fisher М., 1987].
При возникновении клиники интерстициального отека лег-
ких, что является явным признаком нарушения капиллярной
проницаемости, целесообразно введение растворов гидроксиэтил-
крахмала с высокой молекулярной массой, поскольку это может
способствовать возвращению жидкости в сосудистое русло.
Кардиогенный шок
В классической работе Forrester J.S. и соавт., посвященной
изучению гемодинамики у больных с инфарктом миокарда,
осложненным кардиогенным шоком, показано, что около 15 %
пациентов имеют низкие значения СВ на фоне невысоких зна-
чений ДЗЛК [Forrester J. S. и соавт., 1976]. У большинства из них
отмечаются низкий ударный объем и компенсаторная тахикар-
дия. Авторы считают, что комплексная терапия таких пациентов
обязательно должна включать инфузию плазмозаменителей.
Есть указания на то, что при инфаркте правого желудочка,
когда КДЦ в нем превышает таковое в левом, у значительного чи-
сла больных можно достичь улучшения гемодинамики только за
счет инфузионной терапии [Edwards D., 1986].
Forrester J.S. и соавт. (1976), Kaufman B.S. и соавт. (1988),
Edwards D. (1986) придерживаются мнения, что у больных с
кардиогенным шоком вследствие инфаркта миокарда показания-
ми к введению плазмозаменителей являются значения СИ ме-
нее 2,2 л/мин/м2 и ДЗЛК менее 18 мм рт. ст. Кданной рекомен-
дации следует относиться с большой осторожностью. Во всех слу-
чаях при восполнении ОЦК у больных с кардиогенным шоком
365
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
целесообразно проведение проб с нагрузкой жидкостью. Инфу-
зионная терапия у них оправдана, если в ответ на введение плаз-
мозамещающего раствора наблюдается возрастание произво-
дительности сердца.
Мы придерживаемся мнения, что у этой категории пациен-
тов более безопасным является восполнение ОЦК при параллель-
ной инфузии симпатомиметиков. Это связано с тем, что, как пра-
вило, быстрая инфузия плазмозаменителя может усугублять сер-
дечную недостаточность, а при медленном темпе инфузии для
адекватного повышения СВ может потребоваться длительное
время, в течение которого наблюдается неадекватная тканевая
оксигенация.
У пациентов с кардиогенным шоком гиповолемия может но-
сить ятрогенный характер. К примеру, подобные ситуации мо-
гут возникать при избыточном введении диуретиков и морфи-
на при лечении отека легких. В этих случаях существенную по-
мощь также оказывает исследование центральной внутрисердеч-
ной гемодинамики. Несмотря на присутствие клинических приз-
наков застоя в легких (влажные хрипы, изменения на рентгено-
грамме), при низких значениях ДЗЛК и СВ уданной категории
пациентов некоторые авторы считают целесообразным прове-
дение инфузионной терапии [Figueras J. и соавт., 1979]. Наш
опыт свидетельствует о необходимости тщательного контроля
производительности сердца при проведении инфузии плазмо-
заменителей у данной категории больных. Если в ответ на повы-
шение ЦВД и ДЗЛК сердечный выброс не возрастает, инфузию
прекращают.
Ожоговый шок
Инфузионная терапия при ожоговом шоке имеет свои
особенности. При обширных ожогах на ранних стадиях наблю-
дается типичная клиника гиповолемического шока, обусло-
вленного нарушением капиллярной проницаемости, приво-
дящей к потере белков и жидкости из внутрисосудистого во
внесосудистое пространство. Эти процессы связаны с непо-
средственным разрушением клеток и освобождением вазо-
активных субстанций. Потеря внутрисосудистого объема плаз-
мы прямо пропорциональна степени ожога и величине ожо-
366
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
говой поверхности. Ожоговую поверхность принято оценивать
по правилу девяток:
• область головы и шеи — 9 %;
• верхняя конечность — 9 %;
• нижняя конечность — 18 %;
• передняя поверхность грудной стенки и живота — 18 %;
• задняя поверхность грудной стенки и спины — 18 %.
В первые 24 ч рекомендуется проводить инфузию растворов
натрия, причем существуют три схемы, предусматривающие ис-
пользование гипотонических, изотонических и гипертониче-
ских концентраций.
При гипотонической схеме пользуются формулой Parkland,
согласно которой переливают растворы, имеющие концентра-
цию натрия в пределах 130—140 мэкв/л из расчета: 4 мл/кг мас-
сы тела/% ожоговой поверхности. Таким образом, пациент ве-
сом 60 кг с ожоговой поверхностью, составляющей 70 %, полу-
чает в первые сутки около 17 л раствора, причем половина объе-
ма вводится в течение первых 8 ч. При данной схеме возможно
избыточное введение жидкости и развитие отеков, в том числе
отека легких и мозга, однако наблюдается меньшая частота ра-
звития почечной недостаточности.
При изотонической схеме используют растворы, содержа-
щие 150—160 мэкв/л натрия. Пациент с вышеуказанными пара-
метрами в первые сутки получает 12—13 л раствора, и половина
объема вводится в первые 8 ч. По сравнению с предьщущей,
при данной схеме наблюдается менее выраженное прибавле-
ние в весе, что объясняется более интенсивным натрийурезом.
Вместе с тем частота отечных осложнений также ниже.
Гипертоническая схема подразумевает введение растворов,
содержащих 225—250 мэкв/л натрия в количестве 2—2,5 мл/кг/%
ожоговой поверхности. При данном подходе повышается риск
гипернатриемии и почечной недостаточности.
Согласно современным концепциям, коллоидные раство-
ры начинают вводить через 24 ч, поскольку к этому времени
обычно нормализуется капиллярная проницаемость. В этот пе-
риод важное значение имеет поддержание концентрации белка
плазмы крови, что обеспечивается за счет инфузии плазмы и аль-
бумина.
367
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Спустя 48 ч после ожога обычно применяют растворы, не со-
держащие натрий, поскольку в этот период наблюдается его на-
копление в организме пациента.
На всех этапах лечения ожогового шока чрезвычайно важ-
ное значение имеет тщательный мониторинг состояния гемоди-
намики, функции легких, почек и центральной нервной систе-
мы пациента и водно-электролитного баланса.
3.2.2. Выбор плазмозамещающего раствора
Основной задачей в лечении гиповолемического шока яв-
ляется быстрое восполнение ОЦК и улучшение тканевой окси-
генации. При использовании в этих целях растворов коллоидов
и кристаллоидов капиллярный кровоток улучшается в большей
степени, чем при гемотрансфузии. Считается, что умеренная
гемодилюция (снижение гематокритадо 30—35 %) хорошо пере-
носится большинством пациентов и при восполненном OIIK не
приводит к снижению ТО2 [Messmer К., 1975].
Вопрос выбора раствора для восполнения ОЦК до сих пор
остается спорным. Сторонники применения кристаллоидов счи-
тают, что первичную роль в патофизиологии гиповолемическо-
го шока играет дефицит внеклеточной жидкости и для улучше-
ния выживаемости больных необходимо срочное его восполне-
ние. При дефиците внеклеточной жидкости особое значение
придается нарушению функции натрий-калиевого насоса. В этой
связи на основании данных экспериментальных и клинических
исследований многие авторы считают обязательным введение
сбалансированного раствора хлорида натрия при лечении па-
циентов с гиповолемией [Shires G.T. и соавт., 1964; Shires G.T. и
соавт., 1972; Carrico C.J. и соавт., 1976; Shires G.T., 1965; Shires G.T.
и соавт., 1960]. В современных рекомендациях Американского
колледжа хирургов указывается, что лечение больных с травма-
тическим геморрагическим шоком необходимо начинать с бы-
строй инфузии раствора Рингера-лактата в объеме до 2 л.
Если при этом не удается достичь стабилизации гемодина-
мики, дальнейшее восполнение дефицита ОЦК осуществляют
с помощью эритроцитарной массы.
Сторонники применения коллоидов делают акцент на сни-
жение ОЦК и транспорта кислорода в качестве основного пато-
368
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
физиологического фактора гиповолемического шока. В этой
связи они считают первостепенным восполнение внутрисосуди-
стого объема крови.
Гемодинамический эффект инфузионной терапии зави-
сит от выбора плазмозаменителя, сосудистого тонуса и функ-
ционального состояния сердца. Сравнение гемодинамических
эффектов кристаллоидов и коллоидов проводилось в целом
ряде исследований. В исследовании Shoemaker проведено со-
поставление эффекта инфузии 500 мл цельной крови, 500 мл
5 %-ного альбумина, 500 мл декстрана-70, 500 мл 10 %-ного
декстрана-40 и 1000 мл раствора Рингера-лактата у пациен-
тов, находящихся в критическом состоянии [Shoemaker W. С.,
1976]. Все растворы вводились в течение часа. Цельная кровь
и коллоиды значительно увеличивали ОЦК, СВ, ударный ин-
декс, индекс ударной работы левого желудочка, ЦВД и давле-
ние заклинивания в легочной артерии. Однако, несмотря на то,
что объем введенного кристаллоидного раствора был в 2 раза
больше, достоверных изменений вышеперечисленных пара-
метров получено не было.
Таким образом, при возникновении артериальной гипо-
тензии, обусловленной выраженной гиповолемией, для более бы-
строй стабилизации гемодинамики большинство авторов отда-
ет предпочтение не кристаллоидным, а коллоидным растворам
[Shoemaker W.C. и соавт., 1981; ModigJ., 1986].
По нашему мнению, необходим индивидуальный под-
ход к назначению кристаллоидных и коллоидных растворов
с учетом степени дефицита ОЦК, причины, его вызвавшей, об-
щего состояния пациента и сопутствующих заболеваний и
осложнений.
Необходимо учитывать следующие основные особенности
кристаллоидных растворов:
• кристаллоиды не имеют коллоидно-осмотического да-
вления, что приводит к переходу жидкости во внеклеточное
пространство;
• быстрое выведение почками;
• ограниченный волемический эффект и его продолжи-
тельность;
• сложность восполнения гиповолемии, превышающей 30 %;
369
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• риск переполнения интерстициального пространства с
развитием отека легких и гипоксии, а также периферических оте-
ков и отека внутренних органов;
• у пациентов с заболеваниями сердца и почек объем вво-
димых кристаллоидных растворов должен быть ограничен.
Коллоидные растворы отличают следующие особенности:
• концентрация натрия в пределах 130—155 ммоль/л;
• КОД, обусловленное наличием субстанций большой мо-
лекулярной массы;
• способность удерживать жидкость в сосудистом русле;
• способность поддерживать или увеличивать ОЦК;
• более медленное, чем у кристаллоидов, выведение через
почки;
• значительно более продолжительный, чем у кристалло-
идов, волемический эффект.
Таким образом, основными показаниями к введению кри-
сталлоидных растворов являются:
• восполнение объема внеклеточной жидкости;
• поддержание объема внеклеточной жидкости во время
операции и в послеоперационном периоде;
• лечение умеренной гиповолемии (препараты для первич-
ного восполнения ОЦК).
Показания к введению коллоидных растворов:
• лечение выраженной гиповолемии и шока (первичное
восполнение ОЦК при кровотечении, травме и сепсисе);
• использование кровесберегающих технологий — наме-
ренная нормоволемическая гемодилюция или компонентное
кровевосполнение;
• профилактика относительной гиповолемии во время спи-
нальной и эпидуральной анестезии;
• первичное заполнение аппарата ИК.
Коллоидным плазмозаменителям отдается предпочтение в
случае развития гиповолемического шока. Объемы переливае-
мых коллоидных плазмозаменителей необходимо расчитывать,
основываясь на значениях шокового индекса в соответствии с
классификацией степени кровопотери (рис. 3.12). В случаях,
когда уровень водного баланса организма невозможно оценить,
следует стремиться к восполнению ОЦК, избегая при этом на-
370
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
Кровопотеря (%) Последствия Терапия
до 30% до 40% м до 60% же м ДО 80% им I ОЦК-100*4 от# Р-ры кристаллоидов (дефицит интерстициального пр-ва) Р-ры коллоидов (дефицит ОЦК)
п Гематокрит <25% (Hb <7Jg/dl) I + эритромасса
мм > 80% ш Сывороточный альбумин < 25 г/л Факторы свертывания <35%otN 11 + повышение КОД р-рами коллоидов (р-р альбумина)
IIV 11+ факторы свертывании (свежезамороженная плазма)
[у Тромбоциты < 50.000/mm3 11 + факторы свертывания (свежезамороженная плазма) + тромбоциты или свежая кровь(0- 48час)
Рисунок 3.12. Принципы компонентной терапии
копления коллоидных растворов в интерстициальном простран-
стве. Они должны приводить к стабилизации состояния паци-
ента в течение нескольких часов, но не иметь большой продол-
жительности действия, чтобы не усложнять проведения лечеб-
ного процесса в условиях стационара. Коллоидные плазмозаме-
нители не должны влиять на свертывающую систему крови,
определение группы крови и crossmatch-реакции. При введении
коллоидных плазмозаменителей необходимо учитывать количе-
ство содержащихся в них электролитов. При проведении сбалан-
сированного восполнения дефицита ОЦК коллоидные раство-
ры вводят в сочетании с кристаллоидными во избежание обез-
воживания интерстициального пространства организма.
3.2.3. Компонентная терапия при острой кровопотере
Известно, что при различном объеме острой кровопотери на
первый план выступает дефицит определенных компонентов
крови. Говоря иначе, на каждой стадии гиповолемии недостаток
этих компонентов приобретает критическое значение. В этой свя-
зи показания к назначению плазмозаменителей и компонен-
тов крови необходимо определять в соответствии с классифика-
цией выраженности гиповолемии.
371
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
У исходно здоровых субъектов потеря менее 15 % ОЦК мо-
жет быть полностью компенсирована за счет внутренних ре-
зервов — активации симпато-адреналовой системы, перехода
жидкости из внесосудистого во внутрисосудистое простран-
ство, поступления альбумина и эритроцитов из естественных де-
по организма.
Кровопотеря, достигающая 30 %, обычно сопровождается
снижением сердечного выброса и артериального давления.
В этих случаях восполнение дефицита ОЦК осуществляют син-
тетическими коллоидными растворами, а дефицит жидкости в
интерстициальном пространстве восполняют кристаллоидными
растворами.
При кровопотере от 30 до 40 % наблюдается критическое
снижение гемоглобина и гематокрита крови, поэтому наряду с
вышеперечисленными мероприятиями необходимо назначение
эритроцитарной массы или цельной крови.
Потеря от 40 до 60 % циркулирующей крови приводит к
гипоальбуминемии и снижению КОД плазмы. При концентра-
ции сывороточного альбумина ниже 2,5 г/л показана инфузия ра-
створов человеческого альбумина.
При значительной кровопотере, превышающей 60 %, воз-
никает дефицит факторов свертывания и падение содержания
тромбоцитов крови до критического уровня. Помимо указан-
ных выше мероприятий пациентам показано переливание све-
жезамороженной плазмы, криопреципитата, антитромбина-
111, фибриногена и тромбоцитарной массы. У пациентов дан-
ной категории оправдана трансфузия свежезаготовленной (сро-
ком до 12 ч) цельной крови. При значительной кровопотере наз-
начают апротинин (трасилол), который помимо активации
функционального состояния тромбоцитов оказывает стаби-
лизирующее влияние на альвеоло-капиллярную мембрану лег-
ких, что снижает риск развития острого респираторного ди-
стресс-синдрома.
3.2.4. Оптимальный гематокрит
Большинство исследователей считают, что при условии аде-
кватного восполнения объема циркулирующей плазмы допу-
стимыми являются значения гематокрита крови в пределах
372
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
30—35 %. Наблюдаемое при этом снижение содержания кисло-
рода в артериальной крови должно компенсироваться за счет аде-
кватного возрастания сердечного выброса и улучшения микро-
циркуляции.
С нашей точки зрения, более корректно ориентироваться на
показатель эффективного (кислородпереносящего) гемоглоби-
на, поскольку показатель гематокрита представляет собой сум-
му всех фракций гемоглобина (в том числе и дисгемоглобинов).
Критерием адекватности компенсации снижения гемогло-
бина в крови являются нормальные значения артериального
транспорта кислорода. Совершенно очевидно, что данная ком-
пенсация может быть обеспечена при условии сохранных функ-
циональных резервов миокарда. При ограниченном кардиорес-
пираторном резерве (например, у пациентов с атеросклеротиче-
ским и постинфарктным кардиосклерозом, у кардиохирургиче-
ских больных) необходима индивидуальная оценка реакции
кровообращения и его кислородтранспортной функции на низ-
кое содержание гемоглобина в крови.
Исследования, проведенные у больных, оперированных на
открытом сердце, показали, что возможны различные вариан-
ты изменения кислородтранспортной функции кровообращения
в ответ на одинаковую степень снижения гемоглобина крови
(рис. 3.13). Нами были выделены три группы больных с одина-
ковой степенью снижения гемоглобина крови (в среднем до
100 г/л) при нормоволемической гемодилюции.
Больные исследуемых групп не различались по основным
показателям гемодинамики — артериальному и центральному ве-
нозному давлению, ЧСС и давлениям наполнения желудочков
сердца, что свидетельствовало об адекватном восполнении ОЦК.
Не было также различий в показателях оксигенации артериаль-
ной крови (РаО2, НЬО2 и концентрации кислорода). Средние зна-
чения полученных показателей сравнивали с таковыми у паци-
ентов, имевших неосложненное течение послеоперационного пе-
риода, которые были приняты за 100 %. Снижение НЬ привело
к возрастанию сердечного индекса в среднем на 35 %, при этом
показатели артериального транспорта кислорода и адекватности
тканевой оксигенации существенно не отличались от таковых в
контрольной группе. Полученные данные свидетельствуют об
373
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Рисунок 3.13. Варианты изменения кислород-транспортной
функции при гемо дилюции
адекватном кардиореспираторном резерве и допустимости на-
меренной нормоволемической гемодилюции в данной группе па-
циентов.
По сравнению с контрольной, во 2-й труппе обнаружена тенден-
ция к увеличению СИ в среднем на 12 % и уменьшению Т02 на 13 %,
однако различия этих показателей были статистически недостовер-
ны. Экстракция кислорода была увеличена в среднем на 26 % (р < 0,05),
а показатель лактата артериальной крови существенно не отличался
от нормы. Следовательно, у больныхданной труппы компенсация низ-
кой кислородной емкости крови обеспечивалась в основном за счет
возрастания тканевой экстракции кислорода. Можно считать, что при
таком варианте нормоволемическая гемодилюция допустима, одна-
ко данные пациенты требуют более тщательного мониторинга кисло-
родного статуса организма.
Интересные данные были получены у пациентов 3-й группы.
При отсутствии достоверных различий в значениях СВ и ТО2, по
сравнению с контрольной группой, наблюдались крайне высокие
показатели коэффициента тканевой экстракции кислорода — 183
% и содержания лактата в артериальной крови — 180 % от нормы.
Объяснить столь выраженную недостаточность тканевой оксигена-
ции у пациентов 3-й группы можно повышенной потребностью в
кислороде. У кардиохирургических больных чаще всего это может
быть связано с длительным или неадекватным искусственным кро-
вообращением или предшествующими нарушениями гемодина-
мики. Подобные ситуации нередки и в общеклинической практи-
374
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
ке. Например, при травматическом или геморрагическом шоке
восполнение кровопотери до относительно нормальных значений
гемодинамических показателей и рекомендуемого уровня гемато-
крита крови в пределах 30-35 % не всегда свидетельствует о полном
благополучии в кислородном статусе организма. Чем больше кро-
вопотеря и продолжительнее состояние шока, тем больше «кисло-
родная задолженность». В подобных случаях необходимо делать
выбор между применением инотропных средств в целях повыше-
ния сердечного выброса или гемотрансфузией. Поскольку у паци-
ентов со сниженным кардиореспираторным резервом возможность
трансфузии крови в быстром темпе ограничена, начинают тера-
пию с инфузии симпатомиметиков (добутамина или допамина), а
затем производят переливание эритроцитарной массы. В подоб-
ных случаях важное значение имеет мониторинг показателей гемо-
динамики, транспорта кислорода и его эффективности.
На основании вышеизложенного можно сделать несколько
важных заключений:
• При восполнении дефицита ОЦК или проведении наме-
ренной нормоволемической гемодилюции целесообразно ориенти-
роваться в большей степени не на показатель гематокрита, а на
концентрацию эффективного гемоглобина крови. Значения этих па-
раметров определяют индивидуально для каждого пациента.
• Основным компенсаторным механизмом при снижении ге-
моглобина крови является увеличение сердечного выброса, а при
отсутствии резервов увеличения производительности сердца — по-
вышение тканевой экстракции кислорода (либо их комбинация).
• Гемодилюция применима прежде всего у больных с сох-
ранными компенсаторными возможностями. В случаях значи-
тельного увеличения потребности в кислороде, а также при не-
состоятельности компенсаторных влияний или угрозе их сры-
ва в зависимости от клинической ситуации необходимо решать
вопрос о гемотрансфузии либо использовании кардиотониче-
ских препаратов.
3.2.5. Послеоперационная кровопотеря
Клиническая оценка послеоперационной кровопотери
осложняется влиянием предшествующей общей анестезии, а
также проведением лечебных мероприятий в отделении интен-
375
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
сивной терапии, связанных с особенностями основной патоло-
гии и произведенного оперативного вмешательства.
Оценка кровопотери по дренажам не всегда позволяет полно-
стью котролировать ее объем. Часть крови может задерживаться в
полостях организма, проходимость дренажей может нарушаться в
результате образования в них сгустков крови, сдавления или пере-
гиба. В этой связи у больных, оперированных на органах грудной
клетки, в первые часы послеоперационного периода контролиру-
ют показатели гематокрита и свертывающей системы крови, пара-
метры гемодинамики и газового состава артериальной крови. Обя-
зательно выполняют рентгенографию органов грудной клетки, а при
подозрении на скопление жидкости в области средостения и пери-
карда — трансторакальную эхокардиографию.
Значимой считается потеря по дренажам более 70 мл/м2 ге-
моррагической жидкости с гематокритом, близким по значению к
гематокриту крови в течение 2—4 ч в отсутствие выраженных нару-
шений свертывающей системы крови или при наличии признаков
гиперкоагуляции. Эго является показанием к повторному оператив-
ному вмешательству с целью гемостаза. При подозрении на внутрен-
нее кровотечение объем потери эритроцитарной составляющей
ОЦК можно приблизительно определить по степени падения гема-
токрита крови:
АНГхОЦК,
где Ht выражен в %, а ОЦК вычисляют из расчета 70 мл на 1 м2 по-
верхности тела пациента.
Данная формула дает приблизительный результат, поскольку не
учитывает объема эритроцитов, поступающих из внутренних депо
организма, а также перемещения жидкости из внесосудистых про-
странств организма. Кроме того, необходимо учитывать объем введен-
ных инфузионно-трансфузионных препаратов.
При подозрении кровотечения в брюшную полость или забрю-
шинное пространство выполняют ультразвуковое исследование.
У больных, имеющих в анамнезе язвенную болезнь желудка и
двенадцатиперстной кишки, а также пациентов с высоким риском
развития стрессорных язв при исключении других источников
кровотечения устанавливают назогастральный зонд и оценивают
цвет стула.
376
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
Восполнение послеоперационной кровопотери производят в со-
ответствии с принципами, изложенными в разделе «Компонентная
терапия при острой кровопотере».
Поскольку хирургическое кровотечение обычно сопровождается
вторичными нарушениями гемостаза, в первые часы при наличии приз-
наков кровотечения проводят консервативную гемостатическую терапию:
• апротинин 2000—4000млн Ед.;
• переливание криопреципитата и свежезамороженной плазмы;
• переливание тромбоконцентрата в объеме 6—8 доз.
За исключением профузного кровотечения, дифференциальная
диагностика между хирургической причиной кровотечения и наруше-
ниями гемостаза нередко представляет очень сложную задачу. В этих
случаях важно не допустить потери больших объемов крови.
Следствием массивной кровопотери и гемотрансфузии явля-
ются ДВС-синдром, синдром системной воспалительной реакции и
синдром полиорганной недостаточности.
Если кровотечение продолжается после проведения консерва-
тивных мероприятий, вопрос решается в пользу повторного опера-
тивного вмешательства.
3.2.6. Инфузионная терапия при увеличенной проницаемости
мшфососудисгого русла
Наиболее часто увеличениетгрониттаемосгимитфсхххудовкакдля жид-
кости, так и для макромолекул наблюдается при септическом синдроме,
ОРДС, ожогах, анафилактических реакциях и при некоторых отравле-
ниях. Длительность нарушения проницаемости может быть небольшой,
как, например, при анафилаксии, или продолжаться втечение нескольких
дней, например, при ОРДС. Поскольку перераспределение воды из вну-
трисосудистого в интерстициальный сектор неред ко сочетается с вазод и-
латацией, втаких случаях может возникать абсолютная или относительная
гиповолемия, вплоть до развития гиповолемического шока.
Показания и выбор инфузионных препаратову бальных с ОРДСос-
таются спорными [Finch J.S-исоавт., 1983]. В условиях повышенной про-
ницаемости ми крососудов для воды и белков плазмы основным факто-
ром,определяющим перемещение жидкости из внутрисосудистого вин-
терсгициальное пространство, является гидростатическое давление вле-
гочных капиллярах. Влияние КОД на перемещение жидкости между эт-
ими пространствами уменьшается по мере возрастания проницаемости
377
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
микрососудов. При этом на фоне развивающегося отека легких переход
жидкости в интерстициальное пространство может происходить при нор-
мал ьном осмошчески-гцдростигическом градиенте по давлению.
При нижих значениях ДЗЛК вероятность развития отекалеткихсни-
жаегся, что подтверждается уменьшением объема внесосудистой жид-
кости влегких [Prewitt R.M. и соавт., 1981].
Лечение бальных с ОРДС осложняется тем, что терапия, напра-
вленная на уменьшение ДЗЛК и внесосудистой жидкости в легких
(ограничение введения жидкости, применение диуретиков), может
привести к снижению венозного возврата и уменьшению СВ и достав-
ки кислорода. В этих случаях необходимо рациональное сочетание
инфузионной терапии и кардиотонической поддержки.
Проведение инфузионной терапии у больных с ОРДС на фоне ге-
мсииафильтрапии более безопасно, поскольку прегюставляетболыпие воз-
можности для коррекции жидкостного баланса организма.
При выраженных нарушениях проницаемости микрососудов, ког-
да наблюлдетсясвободное перемещение белков плазмы идругих макро-
молекул, нет большой разницы в выборе между вливанием кристалло-
идныхи коллоидных растворов. Вместе с тем, по-видимому лучше отда-
вать предпочтение последним, поскольку они позволяют удерживать
КОДна более высоком уровне. Терапия коллоидными растворами более
эффективна на ранних стадияхОРДС. У больных, находящихся втерми-
нальной фазе ОРДС, выбор плазмозаменителя не имеет значения.
3.2.7. Осложнения инфузионной терапии
Острая сердечная недостаточность
Избыточное введение плазмозамениклей может приводить к пере-
грузке сердца и клиническим признакам декомпенсации кровообращения:
уведичениюпечени,иьперс1Ипиалызомуилиальвеолярномуслекуз1егкихРиск
зяихооюжненийнаиболеевеликупсжилыхпациенговикардиалогических
больных В згой связи инфузию плазмазаменигелейутаких пациентов про-
ведягпритшательномклиническомигемодинамическом мониторинге.
Некардиогенный отек легких
Развитие отека легких во время или после лечения циркуляторно-
го шока или проведения реанимационных мероприятий увеличивает
вероятность легального исхода [Shoemaker WC. и соавт.,1979].
Многие специалисты связывают данное осложнение с выбором
между коллоидными и кристаллоидными растворами. Вопрос о том,
378
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
влияет ли вид расгвораначастспунекардиогенногоотекалегких, досих
пор дискутируется. С этой целью было проведено большое число экс-
периментальных и клинических исследований, однако окончательно-
го ответа на поставленный вопрос эти исследования не дали.
Многиедиагносгические методы, прешигаемьЕвкачестве критериев на-
рушенияфункции легкихврезулыаге инфузионнойтерапии, нельзя признать
сгрогоспепифичными. Кихчистусяносягсяфракпиявнугрилегочногошун-
тирования,альвесиярно-аргериалжь1Йград1Енггюкислорсиусга1ическийком-
пляйнсзЕП01х,паригилшод1^1ряжниекиаюроааваргер1ельнойкров1,объем
внесосудистой жидкости влегких,атакжееерийньте рентгенологические ис-
следования легких Каждый из них имеет свои ограничения.
Показатель объема внесосудистой жидкости в легких не всегда
коррелирует со значениями фракции внутрилегочного шунтирова-
ния и альвеоло-артериального градиента по кислороду у больных с
отеком легких и ОРДС [Sibbald W.J. и соавт., 1983; Brigham K.L. и со-
авт, 1983]. Объем внесосудистой жидкости в легких может значитель-
но повышаться при отсутствии нарушений газообмена.
Оценка степени повреждения легких на серийных рентгенов-
ских снимках также имеет свои ограничения. Во-первых, это связа-
но с невозможностью их многократного выполнен ия в течение корот-
ких промежутков времени. Во-вторых, известно, что даже после ку-
пирования клинических признаков отека легкихрентгенологическая
картина может сохраняться в течение нескольких дней.
По мнению ряда авторов, градиент между коллоцдно-осмслическим
давлением и давлением заклинивания в легочной артерии является хоро-
шим прогностическим критерием, указывающим на возможность разви-
тия отека легких [Guyton АС. и соавт, 1959; Puri VOLK, и соавт.,1980].
Известно, что, посравнениюсксллоцщтыми, кристаллоидные раство-
ры чаще приводят к системному отеку и нарушениям оксигенирующей
функции легких вследствие снижения КОД плазмы крови. С другой сто-
роны, существует мнение,что иэслированноеснижение коллоидно-осмо-
тического давлениявплазме при отсутствии сопугствующихфакторов,пов-
реждающих легкие, может не приводить к их отеку даже при существен-
ном снижении градиента между котшоцдно-осмогическимдавлениемида-
влением заклинивания в легочной артерии [Zarins С.К. и соавт., 1978].
Несмотря на неоднозначность суждений поданному вопросу, на
основании результатов клинических исследований можно указать
на ряд доказанных положений:
379
ТРАНСФУЗИОЛОГИЯ в реаниматологии
• при повышении ДЗЛК и одновременном снижении КОД плаз-
мы крови вероятность развития отека легких возрастает;
• у ранее здорового пациента, имеющего значительные запа-
сы альбумина в организме при нормальном ДЗЛК, вероятность
отека легких невелика даже при значительном снижения КОД;
• отек легких может развиваться при нормальных значениях
ДЗЛК и сниженном КОД у больных с хроническими заболеваниями
и, следовательно, с ограниченными запасами белка в организме;
• убольных,перенесшихсиндромшока,атакжеупациенговсхрони-
ческимизабстеваниями могут наблюдаться нарушения капиллярной прони-
цаемости, палому отек легкихидрушхорганову них может развиваться вне
зависимости от вида раствора, юлирый применяют для восполнения ОЦК.
Системный отек
Этот вид осложнений довольно часто встречается у пациентов
отделений реанимации и интенсивной терапии. Нережо фактором,
предрасполагающим к возникновению этого осложнения, являет-
ся инфузия различных растворов. Наиболее часто отек развивает-
ся в таких органах, как кишечник, сердце, мозг, кожа, мышцы и жи-
ровая ткань. К примеру, в исследованиях P&ppova Е. и соавт. [Р&р-
pova Е. и соавт., 1977] было показано, что при использовании боль-
ших объемов кристаллоидов для восполнения дефицита объема
плазмы, 25 % жидкости накапливается в жировой ткани, 25 % — в
мышечной и около 37 % — в коже. Даже при нормальной функции
почек у больных, которые длительно находятся в отделении реани-
мации и интенсивной терапии после различных хирургических
вмешательств и травм, может наблюдаться положительный жид-
костный баланс.
Результатом отека мягких тканей является увеличение диффу-
зионного пространства кислорода от капилляра к клетке. Эго имеет це-
лый ряд клинических последствий:
• ухудшение заживления ран, поскольку низкая оксигенация
тканей нарушает образование коллагена и эпителизацию ран;
• снижение фиксирующей силы швов, которое может сопро-
вождаться их прорезыванием;
• уменьшение бактерицидной активности лейкоцитов, приводя-
щее к увеличению риска раневой инфекции [Hohn D.C. исоавт., 1976];
• даже после восстановления адекватного транспорта кислоро-
да могут наблюдаться признаки анаэробного метаболизма.
380
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
Как правило, системные отеки развиваются в результате гипопроте-
инемии и снижения КОД плазмы крови. Известно также, что гипопро-
теинемия может приводить к выраженным нарушениям функции желу-
дочно-кишечного тракта. Нередко на фоне системных отеков наблюда-
ется развитие стрессорных язв. Имеются также данные, указывающие
на существование корреляции между гипоал ьбуминемией и отеком стен-
ки кишечника, чтоприводиткнеэффективносги энтерального зондово-
го питания [Brinson R. и соавт., 1985]. Даже умеренные гипоонкогические
состояния могут сопровождаться увеличением интерсти циального да-
вления в кишечнике и нарушением всасывания, что сопровождается ди-
ареей. Скопление жидкости втолстом кишечнике приводит крефлектор-
ному снижению его перистальтики и нарушению функции тонкого ки-
шечника Для улучшения перистальтики кишечника иуменыцения его аге-
карекомендуетсяисподьэоватьинфузиюальбумина. Следствием агекаки-
шечника и нарушения всасывания является транслокация бактерий че-
рез слизистую кишечника в мезентериальные лимфатические узлы, что
повышает риск развития септических осложнений. Считается, что нару-
шение функции кишечника также является одним из определяющих
факторов, приводящих к развитию синдрома системной и полиорганной
недостаточности [Moore FA и соавт, 1989; Deitch Е А и соавт., 1987].
Заключение
Первостепенной задачей восполнения дефицита ОЦК является вос-
становление адекватного сердечного выброса итранспорга кислорода. В це-
лом ряде клинических ситуаций выбор жидкости для восполнения дефи-
тщтаОЦК неявляется определяющим. Первостепенное значение имеетбы-
строта восстановления адекватного артериального транспорта кислорода
Важное значение иместобоснованное использование инвазивного гемо-
динамического мониторинга Эгошюляегнетолыюоптимизироватьсампро-
цесс восполнения дефипитаОЦК^ноиснизитьриск перегрузки жидкостью.
Выбор раствора, используемого для восполнения дефицита ОЦК,
должен зависеть от конкретной клинической ситуации. Вэгом отношении
не можетбыть всеобъемлющих рекомендаций. Пример: молодой пациент,
получивший травму можетбытьуспешно пролечен какколлоцдными, так
и кристаллоидными растворами, однако в этом случае адекватное вос-
полнение кристаллоидами предпочтительно, поскольку этосвязанос ме-
ньшими финансовыми затратами. Вместе стем мы являемся сгоронника-
ми сбалансированной инфузионной терапии, суть которой заключается в
рациональном сочетании коллоидных и кристаллоидных растворов.
381
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Список основной литературы
1. Bernstein D.P. Noninvasive Cardiac Output Doppler Flowme-
try and Gold-Plated assumptions // Crit. Care Med. 1987.
Vol. 15. № 9. F. 886-888.
2. BoyAios A., Albert S. Effect of dynantfe response of transdu-
cer-tubing system on accuracy of direct blood pressure mea-
surement in patients//Crit. Care Med. 1983. Vol. 11.№ 124.
3. Brigham K.L., Kariman K., Harris T.R. et al. Correlation of ox-
ygenation with vascular permeability-surface area but not with
lung water in humans with acute respiratory failure and pulmo-
nary edema // J- Clin Invest., 1983. Vol. 72. № 339.
4. Brinson R., Guild R., Kelts B. Diarrhea and hypoalbuminemia
in a medical intensive care unit // Gastroenterolog. 1985.
Vol.88. № 1336.
5. Bruner J.M.R., Krenis L.J., Kunsman J.M. et al. Comparison
of direct and indirect methods of measuring arterial blood pres-
sure. Part III // Med. Instrum., 1981. Vol. 14. № 182.
6. Bruner J.M.R., Krenis L.J., Kunsman J.M. et al. Comparison
of direct and indirect methods of measuring arterial blood pres-
sure // Med. Instrum., 1981. Vol. 15. № 11.
7. Bryan-Brown C.W., Kwun K.B., Lumb P.D. et al. The axillary
artery catheter// Heart Lung., 1983. Vol. 12. № 492.
8. Carrico C.J., Canizaro P.C., Shires G.T. Fluid resuscitation fol-
lowing injury: Rationale for the use of balanced salt solutions //
Crit. Care Med., 1976. Vol. 4. № 46.
9. Carrol G.C. Blood pressure monitoring I I Crit. Care Clin. 1998.
Vol. 4. №411.
10. Davis R.F. Clinical comparison of automated auscultatory and
oscillometric and catheter-transducer measurements of arteri-
al pressure //J. Clin. Monit., 1985. Vol. 1. № 114.
11. Deitch E.A., Winterton J., Berg R. The gut as a portal of entry
for bacteremia 11 Ann Surg., 1987. Vol. 205. № 681.
12. Edwards D., Whittaker S., Prior A. Cardiogenic shock without
a critically raised left ventricular end diastolic pressure: Mana-
gement and outcome in eighteen patients // Br. Heart. J. 1986.
Vol. 55. № 549-
382
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
13. Ellis D. М. Interpretation of beat-to-beat blood pressure values
in the presence of ventilatory changes // J. Clin. Monit. 1985.
Vol.l.№65.
14. Figueras J., Weil M.H. Hypovolemia and hypotension compli-
cating management of acute cardiogenic pulmonary edema //
Am. J. Cardiol. 1979. Vol. 44. № 1349.
15. Finch J.S., Reid C., Bandy K. et al. Compared effects of se-
lected colloids on extravascular lung water in dogs after oleic
acid — induced lung injury and severe hemorrhage // Crit. Ca-
re Med. 1983. Vol. 11. № 267.
16. Fisher M. Anaphylaxis. Dis. Mon. 1987. Vol. 33. № 433.
17. ForresterJ.S., Diamond G., Chatterjee K. et al. Medical thera-
py of acute myocardial infarction by application of hemodyna-
mic subsets /1N Engi. J. Med. 1976. Vol. 295. № 1356.
18. Gallagher J.D., Moore R.A., McNicholas K.W. et al. Comparison
of radial and femoral arterial blood pressures in children after car-
diopulmonary bypass//J. Clin. Monit. 1985. Vol. 1. № 168.
19. Gardner R.M. Direct blood pressure measurement — Dynamic
response requirements //Anesthesiology. 1981. Vol. 54. № 227.
20. Gardner R.M., Chapman R.H. Trouble-shooting pressure mo-
nitoring systems: When do the numbers lie№ / In: Fallat R.G.,
Luce J.M. (eds): Clinics in Critical Care Medicine, Cardiopul-
monary Critical Care Managment. N.Y., Churchill Livingstone,
1988. P. 145.
21. Gardner R. M., Hollingsworth K. W. Optimizing the electrocar-
diogram and pressure monitoring // Crit. Care Med. 1986.
Vol. 14. № 651.
22. Gravenstein J.S., Paulus D.A. Clinical Monitoring Practice.
2nd ed. Philadelphia, J.B. Lippincott. 1987.
23. Guyton A. C., Lindsey A. W. Effect of elevated left atrial pressu-
re and decreased plasma protein concentration on the develop-
ment of pulmonary edema // Circ. Res. 1959. Vol. 7. № 649.
24. Harrington D.P. Disparities between direct and indirect arteri-
al systolic blood pressure measurements // Cardiovasc Pulmo-
nary Technol. 1978. Vol. 6. № 4.
25. Hillis L.D., Firth B.C., Winniford M.D. Analysis of Factors Affec-
ting the variability of Pick Versus Indicator Dilution Measurements
of Cardiac Output //Am. J. Cardiol., 1985. Vol. 56. P. 764—768.
383
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
26. Hohn D.C., Макау R.D., Halliday В. et al. The effect of Oa ten-
sion on microbicidal function of leukocytes in wounds and in vi-
tro // Surg Forum. 1976. Vol. 27. № 18.
27. Hutton P., Dye J., Prys-Roberts C. An assessment of the Dina-
map 845 //Anaesthesia. 1984. Vol. 39. № 261.
28. Johnson C.J.H., Kerr J.H. Automatic blood pressure monitors.
A clinical evaluation of five models in adults // Anaesthesia.
1985. Vol. 40. № 471.
29. Kaufman B.S., Rackow E.C., Falk J.L. Response to fluid chal-
lenge in patients with acute myocardial infarction and hypovo-
lemia 11 Clin. Res. 1988. \bl. 31. № 824A.
30. MacLean L.D., Weil M.H. Hypotension in dogs produced by
Escherichifl coli endotoxin//Circ. Res., 1956. Vol. 4. № 546.
31. McGregor M. Pulsus paradoxus // N Engl. J. Med. 1979.
\bl. 301. № 480.
32. Messmer K. Hemodilution // Surg. Clin. North Am. 1975.
\bl. 55. № 659.
33. Modig J. Effectiveness of dextran 70 versus Ringer’s acetate in
traumatic shock and adult respiratory distress syndrome // Crit.
Care Med. 1986. Vol. 14. № 454.
34. Moore F.A., Moore E.E., Jones T.N. et al. TEN versus TPN fol-
lowing major abdominal trauma — Reducing septic mortality. J.
Trauma. 1989. Vol. 29. № 916.The crystalloid versus colloid con-
troversy: Bias, logic and toss-up //Theor. Surg, 1989. Vol. 4. № 205.
35. O’Rourke M.E, Yaginuma T. Wave reflections and the arterial
pulse // Arch. Intern. Med. 1984. Vol. 144. № 366.
36. Pappova E., Bachmeier W., Crevoisier J. L. et al. Acute hypopro-
teinemic fluid overload: Its determinants, distribution and tre-
atment with concentrated albumin and diuretics // \bx Sang.
1977. \bl. 33. № 307.
37. Paulus D.A. Noninvasive blood pressure measurement // Med
Instrum. 1981. Vol. 15. №91.
38. Prewitt R.M., McCarthy J., Wood L.D.H. Treatment of acute
low pressure pulmonary edema in dogs // J. Clin. Invest. 1981.
Vol. 67. № 409.
39. Puri VOL.K., Weil M.H., Michaels S. et al. Pulmonary edema
associated with reduction in plasma oncotic pressure // Suig Gyn-
ecol. Obstet. 1980. Vol. 151. № 344.
384
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
40. Rothe С.Е, Kim К.С. Measuring systolic arterial blood pressu-
re. Possible errors from extension tubes of disposable transducer
domes // Crit. Care Med. 1980. Vol. 8. № 683.
41. Shapiro G.G., Krovetz L.J. Damped and undamped frequency
responses of underdamped cathether manometer systems //
Am. Heart J. 1970. Vol. 80. № 226.
42. Shires T., Coin D., Carrico J. et al. Fluid therapy in hemorrha-
gic shock//Arch. Surg. 1964. Vol. 88. № 688.
43. Shires G.T., Cunningham J.N., Baker C.R.F. et al. Alterations
in cellular membrane function during hemorrhagic shock in
primates 11 Ann Surg. 1972. Vol. 176. № 288.
44. Shires G.T. The role of sodium containing solution in the treatment
of oligemic shock // Suig. Clin. North Am. 1965. Vol. 45. № 365.
45. Shires G.T., Williams J., Brown E Simultaneous measurement
of plasma volume, extracellular fluid volume and red blood cell
mass in man utilizing 1131, Cr51 // J. Lab. Clin. Med. 1960.
Vol. 55. № 776.
46. Shoemaker W.C., Appel P.L., Kram H.P. et al. Multicom-
ponent noninvasive physiologic monitoring of the circulato-
ry function // Crit. Care Med. 1988. Vol. 16. № 5. P. 482—490.
47. Stem D.H., Gerson J.I., Allen EC. et al. Can we trust the direct
radial artery pressure immediately following cardiopulmonary by-
pass№//Anesthesiology. 1985. Vol. 62. № 557.
48. Sibbald W.J., Warshawski F.J., Short A.K. et al. Clinical studies of
measuring extravascular lung water by the thermal dye technique
in critically ill patients // Chest. 1983. Vol. 5. № 725.
49. Shinozaki T., Deane R.S., Mazuzan J.E. The dynamic respon-
ses of liquid-filled catheter systems for direct measurements of
blood pressure // Anesthesiology. 1980. Vol. 53. № 498.
50. Shoemaker W.C., Hauser C.J. Critique of crystalloid versus col-
loid therapy in shock and shock lung // Crit. Care Med. 1979.
Vol. 7. № 117.
51. Shoemaker W.C. Comparison of the relative effectiveness of
whole blood transfusions and various types of fluid therapy in res-
uscitation 11 Crit. Care Med. 1976. Vol. 4. № 71.
52. Shoemaker W.C., Appel P.L., Kram H.B. Prospective trial of
supranorma values of survivors as therapeutic goals in high-risk
surgical patients // Chest. 1988. Vol. 94. № 1176.
385
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
53. Shoemaker W.C., Schluchter М., Hopkins J.A. et al. Compari-
son of the relative effectiveness of colloids and crystalloids in
emergency resusci-tation// Am. J. Surg. 1981. Vol. 142. № 73.
54. Sturm J.A., Carpenter M.A., Lewis F.R. et al. Water and protein
movemen in the sheep lung after septic shock: Effect of colloid ver-
sus crystalloil resuscitation // J. Surg Res. 1979. Vol. 26. № 233.
55. Veremakis C., Halloran T.H. The technique of monitoring arte-
rial blood pressure //J. Crit. Illness. 1989. Vol. 4 (10). № 82.
56. Wise R. Effect of alterations of pleural pressure on cardiac out-
put // South Med. J. 1985. Vol. 78. P. 423.
57. Weil M. H., Henning R.J. New concepts in the diagnosis and fluid
treatment of circulatory shock // Anesth. Analg. 1979.
Vol. 58. № 124.
58. Youngberg J. A., Miller E.D. Evaluation of percutaneous cannu-
lations of the dorsalis pedis artery // Anesthesiology. 1976.
Vol. 44. № 80.
59. Zarins C.K., Rice C.L., Peters R.M. et al. Lymph and pulmo-
nary response to isobaric reduction in plasma oncotic pressure
in baboons // Circ. Res. 1978. Vol. 43. № 925.
60. Власов В. В. Эффективность диагностических исследова-
ний. М.: Медицина, 1988. 253 с.
61. Кислухин В. В., Кривицкий Н.М. Определение параме-
тров гемодинамики по электрическому сопротивлению
крови методом разведения // Мед. техника 1987.
№ 1. С. 3-6.
62. Кривицкий Н.М., Кислухин В.В., Аббакумов В.В. и др.
Определение сердечного выброса методом разведения элек-
троимпедансных индикаторов // Анест. и реаниматол. 1988.
№3. С. 51-52.
63. Кривицкий Н.М., Кислухин В.В., Максименко В.А. и др.
Применение 0,9 %-ного раствора хлорида натрия в качестве
индикатора для определения объема циркулирующей кро-
ви. Кровоснабжение, метаболизм и функции органов при
реконструктивных операциях: Тезисы докладов 4-й Всесо-
юзной научной конференции. Ереван, 1989. 106 с.
64. Лебедева Р.Н., Аббакумов В.В., Свирщевский Е.Б. Недоста-
точность кровообращения у оперированных больных. Таш-
кент: Медицина, 1979.190 с.
386
ГЛАВА 3. ДИАГНОСТИКА И ЛЕЧЕНИЕ КРИТИЧЕСКИХ СОСТОЯНИЙ
65. Лебедева Р.Н., Аббакумов В.В., Борисова И.В. и др. Совре-
менные методы оценки гемодинамики в условиях отделе-
ния интенсивной терапии (сравнительный аспект) //Анест.
и реаниматол. 1989. № 4. С. 3—8.
66. Маршалл Р.Д., Шеферд Дж.Т Функция сердца у здоровых
и больных. М.: Медицина, 1972. 391 с.
67. Рашнер Р.Ф. Динамика сердечно-сосудистой системы. М.:
Медицина, 1981. 600 с.
ГЛАВА4
Заместительная почечная
терапия в реаниматологии
Интенсивная терапия критических состояний в результа-
те целого ряда технологических достижений к настоя-
щему времени оформилась в одно из наиболее приори-
тетных научно-практических направлений современной реа-
ниматологии. В случае развития неконтролируемых фармакоте-
рапией нарушений кислотно-основного состояния, водно-элек-
тролитного баланса, метаболизма, эндотоксемии у больных с ос-
трой почечной недостаточностью и полиорганными наруше-
ниями патогенетически обоснованным является применение
методов временного или постоянного замещения функции по-
чек по поддержанию гомеостаза, выведению конечных продук-
тов метаболизма.
Наряду с коррекцией уремических нарушений и контролем
водно-электролитного гомеостаза перед заместительной
почечной терапией (ЗПТ) ставится задача коррекции эндотоксе-
мии, обусловленной генерализованным воспалением, массив-
ным цитолизом, выраженным протеинолизом, а также создание
условий для объемной инфузионной терапии и гиперкалориче-
ского питания с высоким содержанием носителей азота, а так-
же другие показания (табл. 4.1).
Ведущим показанием к проведению ЗПТ у критически тя-
желых больных является острая почечная недостаточность
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
Таблица 4.1. Основные показания к применению ЗПТ
в отделениях реанимации
Показания Комментарии
Острая почечная не- достаточность Олигоанурия, 12 и более часов резистент- ная к консервативной терапии; снижение скорости клубочковой фильтрации до 0,35 мл/мин на 1 кг; прогрессирующие азотемия, гипергидратация, нарушения водно-электролитного и кислотно-основ- ного состояний
Острое прогресси- рование хрониче- ской почечной недо- статочности Увеличение более чем в два раза уровня азотемии и усугубление других нарушений гомеостаза у больных с ХПН, не получаю- щих диализа
Печеночная недостаточность Изолированная форма или в составе поли- органной недостаточности, обусловленная отравлениями, шоком, аллотрансплантаци- ей печени, фульминантной формой гепати- та; печеночно-почечный синдром
Острые экзогенные отравления и инток- сикация лекарствен- ными средствами В фазу токсемии с целью элиминации цир- кулирующих токсинов малой и средней мо- лекулярной массы; в фазу органной недо- статочности как способ заместительной те- рапии
Перегрузка жидко- стью Резистентные к терапии диуретиками ги- пергидратация, гиперволемия, гемодилю- ция у больных с сердечной недостаточно- стью, нефротическим синдромом, при про- ведении экстракорпорального кровообра- щения
Нарушения электро- литного баланса Гипернатриемия в сочетании с олигоурией; гипонатриемия в сочетании с гипергидра- тацией и набуханием мозга; гиперкалиемия различного генеза; гиперкальциемия; ги- пермагниемия
389
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Окончание табл. 4.1
Показания Комментарии
Нарушения кислот- но-основного со- стояния Метаболический ацидоз; лактат-кетоаци- доз; гиперхлоремический ацидоз при урос- тазе, рефлюксе или резорбции мочи; мета- болический алколоз
Высокообъемное парентеральное пи- тание У больных с олигоурией и угрозой пере- грузки жидкостью, развития электролитно- го и кислотно-основного дисбаланса и про- грессирования азотемии вследствие высо- кого содержания азота в питательных ра- створах
Превентивное при- менение У больных с синдромом системного воспа- лительного ответа и прогрессирующей по- лиорганной дисфункцией вследствие се- псиса, политравмы, продолжительного эк- стракорпорального кровообращения, пан- креонекроза, острой недостаточности кро- вообращения, тяжелых специфических ин- фекций и т .д., независимо от функцио- нального состояния почек
Гипертермия Резистентная к фармакологическим препа- ратам и физическим методам лечения
(ОПН) — полиэтиологический синдром, характеризующийся
значительным и быстрым снижением скорости клубочковой
фильтрации, определяющей способность почек поддерживать в
норме состав и объем жидкостей и электролитов организма и эк-
скрецию конечных продуктов метаболизма. Острая почечная не-
достаточность может быть изолированным критическим синдро-
мом, однако значительно чаще она сочетается с нарушениями
функции других органов или систем организма (синдром полиор-
ганной недостаточности), что в значительной стадии повышает
риск развития осложнений ЗПТ и ухудшает прогноз заболевания.
В настоящее время методы ЗПТ подразделяются на интра-
корпоральные и экстракорпоральные. Механизм действия ука-
390
ГЛАВА 4, ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
данных методов внепочечного очищения крови основан на двух
основных физических принципах—диффузии и конвекции ра-
створенных веществ через полупроницаемую мембрану, которые
используются либо раздельно, либо совместно.
Применение ЗПТ у критически тяжелых больных имеет це-
лый ряд организационно-технических и терапевтических особен-
ностей, изучение которых является важной задачей современной
реаниматологии.
4.1. Сосудистый доступ и варианты
подсоединения экстракорпорального
контура
После принятия решения о проведении сеансов почечно-
заместительной терапии (ПЗТ) необходимо выбрать способ со-
единения линий экстракорпорального контура с магистральны-
ми сосудами пациента. Адекватно выбранный сосудистый до-
ступ является существенным моментом успешного проведения
ПЗТ. Существуют варианты артериовенозного и вено-веноз-
ного подсоединения экстракорпорального контура (ЭКК).
Артериовенозное подсоединение ЭКК осуществляют пу-
тем хирургического наложения шунта между артерией и веной
предплечья или голени, либо пункции и катетеризации бе-
дренной артерии (реже a. radialis) и одной из вен бассейна ни-
жней или верхней полой вены (w. femoralis, jugularis, subclavia).
Преимущества артериовенозного доступа:
• обеспечение высокой скорости кровотока через гемо-
фильтр-диализатор (до 350 мл в минуту);
• возможность проведения малопоточных ультрафильтра-
ции и гемофильтрации без «кровяного» насоса;
• многократное взятие проб артериальной крови для иссле-
дования КЩС и газообмена в процессе процедуры;
• мониторинг минутного объема сердца методами разведе-
ния электроимпедансных индикаторов и «ультразвукового» раз-
ведения крови.
Недостатки артериовенозного доступа:
• опасность развития осложнений — артериальное крово-
течение; гематома в месте пункции; нарушение артериального
391
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
кровообращения в конечности; тромбоз шунта, артерии; ин-
фицирование шунта, места пункции артерии;
• необходимость системной антикоагуляции в междиализ-
ном периоде у пациентов с артериовенозным шунтом;
• существенная гемодинамическая реакция организма на
этапе подсоединения ЭКК;
• невозможность или значительные технические трудности
осуществления артериального доступа у пациентов с атеро-
склеротическим поражением аортоподвздошно-бедренного
сегмента;
• артериовенозное шунтирование крови в междиализном
периоде.
Артериовенозный шунт (шунт Скрибнера)
Под инфильтративной анестезией раствором местного ане-
стетика делают разрез в нижней трети предплечья по проекции
a. radialis и одной из ветвей v. cephalica. Сосуды выделяют и бе-
рут на держалки. Дистальные концы артерии и вены перевязы-
вают и пересекают. Сосуды вскрывают и в их просвет вводят
тефлоновые канюли с присоединенными к ним силастиковыми
трубками. Концы этих трубок выводят через контрапертуры на-
ружу, соединяют между собой артерию и вену для осуществле-
ния кровотока по шунту в междиализный период.
При установке шунта необходимо строго соблюдать соответ-
ствие диаметров канюли и сосуда: широкая канюля травмирует
стенку сосуда и сокращает срок функционирования шунта; уз-
кая венозная канюля, замедляя кровоток, способствует тромби-
рованию шунта.
Пункция и катетеризация бедренной артерии (метод
Селъдингера)
Пункцию бедренной артерии осуществляют в скарпов-
ском треугольнике ниже пупартовой связки в месте ее пуль-
сации после предварительной обработки кожных покровов
(бритье, антисептические препараты). Следует применять
только специализированные наборы для пункции и катетери-
зации артерии, которые состоят из нескольких игл для пунк-
ции, J-образного проводника, артериального катетера на со-
судистом расширителе с гемостатическим клапаном. Диа-
метр и длина устанавливаемого катетера должны отвечать
392
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ________________
требованиям безопасности больного и обеспечивать эффек-
тивный кровоток в ЭКК. Обычно используют наборы с кате-
терами диаметром 8, 10 French и длиной 10 и 11 см соответ-
ственно. Сосудом для возврата прошедшей ЭКК крови чаще
всего является одноименная вена, либо любая другая вена,
пригодная для установки катетера не менее 8 French. В про-
цессе эксплуатации артериального катетера особо следует
следить за местом пункции (опасность гематомы, кровотече-
ния, дислокации катетера) и состоянием артериального кро-
вообращения в ноге.
Вено-венозное подсоединение ЭКК подразумевает забор
крови в ЭКК из системы нижней или верхней полой вены (НПВ,
ВПВ) и возврат ее в венозное русло пациента через одну из цен-
тральных или периферических вен достаточного диаметра.
Преимущества вено-венозного доступа:
• методикой пункции и катетеризации центральных вен
владеют все врачи отделений реанимации;
• не проводится системная антикоагуляция в период меж-
ду процедурами;
• гемодинамическая стабильность процедуры в случаях ис-
пользования двухпросветного катетера.
Недостатки вено-венозного доступа:
• ограниченная скорость кровотока по ЭКК;
• высокая частота (20—70 %) тромбоза катетера;
• осложнения пункции и катетеризации центральных вен;
• осложнения воспалительного и инфекционного харак-
тера обусловленные эксплуатацией катетера;
• ограничение времени нахождения катетера (5—10 дней) и
необходимость осуществления иного сосудистого доступа;
• рециркуляция части объема крови больного в случаях
применения двухпросветного катетера (снижение эффектив-
ности детоксикации).
В настоящее время используют, как правило, доступы, ко-
торые осуществляют путем пункции вены и проведения катете-
ра в верхнюю или нижнюю полую вену методом Сельдингера.
Выполнение пункционной катетеризации центральных вен
осуществляет врач анестезиолог-реаниматолог, в совершенстве
владеющий техникой процедуры, обладающий необходимыми
393
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
теоретическими знаниями и неукоснительно соблюдающий ме-
тодические правила установки катетеров в центральные вены.
Катетеризацию ВПВ осуществляют через внутреннюю яремную или
подключичную вены; катетеризацию НПВ—через бедренную вену.
Современные катетеры для проведения экстракорпоральных
методов детоксикации изготавливаются из полиуретана и
силикона, что определяет их высокие эксплутационные свойства
и увеличивает время эффективной эксплуатации за счет термопла-
стичности, низкого повреждающего действия на сосуд и сниже-
ния тромбогенности просвета катетера. Различные фирмы-произ-
водители предлагают на медицинском рынке одно- и двухпро-
светные полиуретановые катетеры различных модификаций, ко-
торые различаются между собой формой, длиной, наружным ди-
аметром; диаметром внутреннего просвета; количеством, фор-
мой, диаметром и локализацией перфоративных отверстий в ди-
стальной части катетера.
Общая характеристика двухпросветных катетеров для взрослых:
• диаметр наружный 11—12 French;
• максимальная скорость потока крови — 250—300 мл/мин;
• давление крови навозврате(генозноедавление) — менее 150ммрт ст;
• рециркуляция 2—5 %.
При выборе длины катетера следует помнить о расстоянии от ме-
ста пункции веныдо оптимального расположения дистального конца ка-
тетера. Оптимальным положением перфорированных отверстий кате-
тера при яремном или подключичном доступе является просвет верхней
попой вены и 1 —2 см в полости правого предсердия; при бедренном до-
ступе —просвет нижней полой вены. В табл. 4.2 представлены рекомен-
дуемые сосудистые доступы для катетеров различной длины.
Таблица 4.2. Сосудистые доступы для катетеров различной
длины
Длина катетера, см Венозный доступ
12,5 Правая яремная/правая подключичная
15 Правая и левая яремная/правая и левая подключичная
20 Правая яремная/правая подключичная
24 Бедренная вена
394
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
По мнению большинства исследователей и практикующих
врачей, приоритеты при выборе сосудистого доступа для нача-
ла проведения ЗПТ посредством двухпросветного катетера сле-
дует расстанавливать в следующем порядке: 1) внутренняя ярем-
ная вена справа; 2) внутренняя яремная вена слева; 3) подклю-
чичная вена справа и слева; 4) катетеризация НПВ через бе-
дренные вены. Эти рекомендации в зависимости от клинической
ситуации и материального обеспечения процедуры могут быть
подвергнуты обоснованной коррекции.
В ряде случаев предпочтительнее использовать однопро-
светные венозные катетеры, которые позволяют осуществлять
проведение процедуры на более высоких скоростях циркуля-
ции крови через ЭКК, так как при одном и том же внешнем ди-
аметре внутренний диаметр больше у однопросветного катете-
ра. Выбор места пункции и катетеризации центральной вены од-
нопросветным катетером определяется всегда индивидуально и
зависит от количества уже установленных центральных катете-
ров, т. е. от наличия «свободных» мест для пункции, клиническо-
го состояния места пункции (инфицирование, повреждение
кожных покровов, наличие трахеостомы, гематомы), состоя-
ния катетеризируемых сосудов (тромбофлебит, флеботромбоз,
тромбоз).
После достижения адекватного сосудистого доступа для
сохранения его высоких эксплуатационных качеств медицинско-
му персоналу следует соблюдать комплекс мероприятий по ухо-
ду за установленным катетером: а) катетер к коже фиксируют
подшиванием; б) строго соблюдают профилактику инфекцион-
ных и воспалительных осложнений; в) в период между проведе-
нием сеансов ПЗТ не используют катетер для забора проб кро-
ви и проведения инфузионной терапии; г) производят «тугое» за-
полнение и периодическое промывание каналов катетера ра-
створом антикоагулянта; д) в случаях нарушения гемореологи-
ческих свойств крови проводят их системную коррекцию.
4.2. Антикоагуляция при проведении ЗПТ
При контакте крови с экстракорпоральным контуром (ЭКК)
происходит активация тромбоцитов и плазменных факторов
395
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
свертывания, в этой связи применение антикоагулянтов для
профилактики тромбообразования в контуре является обяза-
тельным. Адекватная антикоагуляционная терапия играет клю-
чевую рольв эффективности работы фильтра при удалении жид-
кости и растворенных в ней веществ, общей продолжительно-
сти работы фильтра и, следовательно, в результатах лечения
больного. В случаях неэффективной антикоагуляции нарушает-
ся фильтрация, возникают условия для тромбоза капилляров
фильтра, а чрезмерная антикоазуляция способствует кровотече-
нию. Частота кровотечений при проведении ЗПТ на фоне при-
менения антикоагулянтов регистрируется в 5—26 % случаев
[Mehta R.L., 1988].
Методы антикоагуляционной терапии [пит. по
Mehta R.L.,1998]:
Гепарин нефракционированный (молекулярная масса
15 000 ± 6000 Д).
• Подготовка фильтра — промывание 2 литрами
0,9 %-ного р-ра NaCl с 2500-10 000 ЕД нефракционирован-
ного гепарина.
• Начальная доза 5—10 ЕД/кг массы тела пациента.
• Поддерживающая доза -3-12 ЕД/кг/ч.
• Мониторинг — ACT (activated clotting time) 200—250 с;
АЧТВ (активированное частичное тромбопластиновое время)
1,5—2 нормы.
• Преимущества-, метод стандартный, недорогой, удобный
в применении.
• Недостатки-, риск кровотечения, тромбоцитопении.
Гепарин фракционированный (низкомолекулярный) — моле-
кулярная масса 4500 ± 500 Д. Например, фраксипарин (надро-
парин кальций), в 1 мл которого содержится 10 250 ЕД анти-Ха.
• Подготовка фильтра — промывание 2 литрами 0,9 %-но-
го р-ра NaCl.
• Начальная доза — 0,1 мл/10 кг массы.
• Поддерживающая доза — 0,02 мл/кг массы.
• Мониторинг — Ха-фактор поддерживать на уровне
0,1—0,4 ЕД/мл.
• Преимущества, снижение риска кровотечения, тромбоци-
топении.
396
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
• Недостатки: необходимы специальные методы контро-
ля за уровнем Ха-фактора; дорогой.
Региональная гепаринизация
• Подготовка фильтра — промывание 2 литрами
0,9 %-ного р-ра NaCl с 2500 ЕД нефракционированного ге-
парина.
• Начальная доза — 5—10 ЕД/кг массы.
• Поддерживающая доза — 3—12 ЕД/кг в час гепарина пе-
ред фильтром и протамина сульфат после фильтра.
• Мониторинг — ACT перед фильтром 200—250 с, АЧТВ
1,5—2,0 нормы.
• Преимущества: снижение риска кровотечения.
• Недостатку, сложный; риск тромбоцитопении; отрица-
тельные эффекты протамина сульфата.
Физиологический раствор
• Подготовка фильтра — промывание 2 литрами 0,9 %-но-
го р-ра NaCl.
• Начальная доза — 150—250 мл 0,9 %-ного р-ра NaCl перед
фильтром.
• Поддерживающая доза — 100—250 мл/ч 0,9 %-ного р-ра
NaCl перед фильтром.
• Мониторинг — визуальный контроль тромбообразования.
• Преимущества: не используются антикоатулянты.
• Недостатки: непродолжительное время функционирова-
ния фильтра.
Факторы, определяющие продолжительность эффектив-
ной работы диализатора—гемофильтра:
• сосудистое сопротивление, антикоагуляционная терапия
(метод антикоагуляционной терапии, доступность и опыт при-
менения антикоагулянта, способ введения антикоагулянта,
качество мониторинга ACT, АЧТВ);
• скорость кровотока и ультрафильтрации; методика
введения замещающего раствора при постоянной ЗПТ —
предилюция /постдилюция.
• функциональное состояние звеньев гемостаза боль-
ного (количество и функциональное состояние тромбоци-
тов, AT III, фибриноген, гематокрит) и адекватность мето-
дов диагностики их нарушений;
397
______________________ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• сосудистый доступ и ЭКК (взаимодействие воздуха и кро-
ви в «ловушке воздуха»; диаметр катетера и место расположения
перфоративных отверстий в ВПВ или НПВ, процент рецирку-
ляции крови в случае применения двухпросветного катетера);
• функциональное состояние системы кровообращения
(ОЦК, сердечный выброс, сердечный ритм, артериальное давле-
ние, периферическое сосудистое сопротивление).
4.3. Мониторинг функции жизненно важных
органов и систем организма
при проведении ЗПТ
1. Клиническое состояние пациента
• сознание (шкала Глазго — кома);
• вес;
• степень гидратации;
• баланс жидкости;
• температура.
2. Система гемостаза
• гемоглобин, гематокрит;
• ACT (activated clotting time);
• АЧТВ (активированное частичное тромбопластиновое
время);
• время свертывания по Ли—Уайт;
• количество тромбоцитов;
• тромбиновое время;
• протромбиновый индекс;
• фибриноген;
• антитромбин III;
• визуальный контроль возможных источников кровоте-
чения (место пункции сосудов, ЛОР-органы, мочевыводящие пу-
ти, желудок и 12-перстная кишка, послеоперационная рана).
3. Респираторная система
• частота дыханий;
• дыхательный объем;
• фракция вдыхаемого кислорода;
• насыщение артериализованной капиллярной крови ки-
слородом (НЬО2);
398
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
• напряжение СО2 в выдыхаемом воздухе (рехСО2);
• напряжение кислорода в артериальной крови (раО2);
• насьпцениегемопюбинакислорс1Ж>мв^лериаи>нойкрови(НЬа02);
• напряжение углекислого газа в артериальной крови (раСО2).
4. Система кровообращения
• ЧСС, ритм сердца;
• артериальное давление;
• центральное венозное давление (ЦВД);
• сердечный выброс;
• гемодинамика малого круга кровообращения (катетер
Swan—Ganz).
5. Гомеостаз
• pH артериальной, венозной крови и мочи;
• НСО3 артериальной, венозной крови и мочи;
• К+
плазма/моча9
• Na+
плазма/моча9
* Ga плазма/моча9
• Mg плазма/моча9
* G1 плазма/моча9
• осмолярность^^;
• креатинин^^;
• мочевин^^^
• глюкоза^ь/хюто;
• лактатмомо.
6. Нутритивный статус
7. Мониторинг параметров процедуры ЗПТ(on-line)
• скорость кровотока (QB);
• процент рециркуляции крови (по возможности);
• скорость ультрафильтрации (процент фильтрации);
• скорость потока (QD) и расход диализирующего раствора;
• температура диализирующего раствора;
• скорость noTOKa(QLIF) и расход замещающего раствора;
• трансмембранное давление (ТМР);
• давление в артериальной линии ЭКК (вход в гемофильтр—
диализатор);
• давление в венозной линии ЭКК (выход из гемофиль-
тра—диализатора) ;
• продолжительность процедуры.
399
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
4.4. Теоретические и технические аспекты
современных методов ЗПТ
В норме почки функционируют главным образом для под-
держания состава и объема жидкости, содержащейся во вне-
клеточном пространстве. Однако постоянный обмен воды и со-
лей, происходящий через все клеточные мембраны, позволя-
ет оказать значительное влияние также и на регуляцию объе-
ма и состав внутриклеточной жидкости. Для выполнения эт-
их задач в почках человека приводится в действие ряд физио-
логических механизмов, которые дают возможность экскрети-
ровать любые избыточные количества воды и неметаболизи-
рованных растворенных веществ, содержащихся в пищевом ра-
ционе, так же, как и нелетучих конечных продуктов обмена азо-
та, таких как мочевина, креатинин и др.
Суточный объем экскретируемой мочи (около 1,5 л или
приблизительно 1 мл/мин) представляет собой небольшой
остаток, образующийся в результате двух во многих отноше-
ниях противоположных процессов — ультрафильтрации 180
или более литров жидкости в сутки (приблизительно 125
мл/мин) через капилляры клубочков, с одной стороны, а с дру-
гой — регенерации (или реабсорбции) более 99 % этого ульт-
рафильтрата при помощи транспортных процессов, действую-
щих в почечных канальцах. Значение почек на начальном
этапе этого процесса в организме человека подчеркивается тем
фактором, что в состоянии покоя через них проходит около
20 % минутного объема сердца, в то время как на долю самих
почек приходится менее 1 % массы тела.
Образование мочи начинается с выработки безбелково-
го фильтрата плазмы крови. Скорость клубочковой фильтра-
ции (СКФ) определяется тремя факторами: 1) соотношени-
ем давлений по обе стороны стенки капилляра; 2) скоростью
тока крови через клубочки; 3) проницаемостью и величиной
общей поверхности фильтрующих капилляров.
Снижение СКФ происходит в случаях, если: 1) понижено
гидростатическое давление в клубочках (артериальная гипотен-
зия); 2) повышено гидростатическое давление в канальцах
(окклюзия путей оттока мочи); 3) онкотическое давление уве-
400
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ_______________
личивается в плазме крови до необычайно высоких значений
(гемоконцентрация, дегидратация, гиперпротеинемия — ми-
еломная болезнь); 4) снижен ток крови через почки (недоста-
точность кровообращения острая или хроническая, гиповоле-
мия); 5) снижена проницаемость и/или суммарная фильтрую-
щая поверхность (острый или хронический гломерулонефрит).
При прогрессирующем снижении СКФ до 20—35 % от ее нор-
мального значения появляются клинические признаки по-
чечной недостаточности и возникает необходимость в искус-
ственной замене почечных функций.
Методы временного или постоянного замещения функ-
ции почек по поддержанию гомеостаза, выведению конечных
продуктов метаболизма, эндо- и экзотоксинов из организма в
настоящее время подразделяются на интракорпоральные (пе-
ритонеальный, кишечный диализ) и экстракорпоральные (изо-
лированная ультрафильтрация, гемофильтрация, гемодиализ, ге-
модиафильтрация) (табл. 4.3). Механизм действия указанных ме-
тодов внепочечного очищения крови основан на двух основных
физических принципах: диффузии и конвекции растворенных
веществ через полупроницаемую мембрану, которые использу-
ются либо раздельно (диализ/фильтрация), либо совместно (ге-
модиафильтрация) .
Диализ (от греч. dialysis — разложение, отделение) — удале-
ние низкомолекулярных примесей из коллоидных систем и ра-
Таблица 4.3. Методы заместительной почечной терапии
Технология Аббревиатура Диффузия Конвекция
Интермиттирующий гемодиализ ГД/HD +++++ —
Интермиттирующая гемофильтрация ГФ/HF — 4-4—1—1—F
Интермиттирующая гемодиафильтрация ГДФ/HDF +++— 4—1—h—
Интермиттирующий высокообъемный ге- модиализ ГДВ/HFD +4—I-4-- ++—
401
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Окончание табл. 4.3
Технология Аббревиатура Диффузия Конвекция
Постоянная артерио- венозная гемофильт- рация ПАВГФ/CAVH +++++
Постоянная вено-ве- нозная гемофильтра- ция ПВВГФ/CWH —' +++++
Постоянный арте- риовенозный гемо- диализ ПАВГД/CAVHD +++++ +—
Постоянный вено- венозный гемодиализ ПВВГД/CWHD +++++ +—
Постоянная артерио- венозная гемодиа- фильтрация ПАВГДФ/CAVHDF +++- +++—
Постоянная вено-ве- нозная гемодиа- фильтрация ПВВГДФ/CWHDF +++— +++—
Интермиттирующая ультрафильтрация УФ/UF +++++
Постоянная малопо- точная ультрафильт- рация ПМУФ/SCUF —— +++++
Перитонеальный диализ ПД/PD 4-4-4-++ +—
створов высокомолекулярных соединений путем диффузии че-
рез полупроницаемую мембрану (целлофан, аЦвтатцеллюлоза,
полиакрилонитрил и полиметилметакрилат), которая пропу-
скает малые молекулы и ионы, но задерживает коллоидные ча-
стицы и макромолекулы. При гемодиализе одной из жидкостей
является кровь пациента, другой — диализный раствор, а роль
полупроницаемой мембраной играет диализатор. При перито-
неальном диализе функцию полупроницаемой мембраны выпол-
няет брюшина.
402
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
Существуют три механизма, посредством которых раство-
рители и растворенные в них вещества проникают через мембра-
ну: диффузия, ультрафильтрация и осмос.
Диффузия (от лат. diffusio — распространение, растека-
ние) — движение частиц среды, приводящее к переносу веще-
ства и выравниванию концентраций или к установлению рав-
новесного распределения концентраций частиц данного сор-
та в среде (см. рис. 4.1).
Полупроницаемую (диализную) мембрану можно рассма-
тривать как «сито» с порами, размеры которых сопоставимы с
размерами молекул. Скорость диффузии зависит от свойств
мембраны (количество и размер пор, толщина мембраны), гра-
диента концентрации растворенных веществ по обе стороны
мембраны, размера молекул (форма молекул и молекулярная
масса растворенного вещества), скорости хаотического движе-
ния молекул (температуры) раствора.
Если полупроницаемая мембрана несет на себе электриче-
ский заряд, то скорость диффузии зависит и от заряда молекул
растворенного вещества.
Суммарное свойство мембраны пропускать те или иные ве-
щества описывается понятием диффузионная проницаемость
мембраны. При этом различают как собственно сопротивление
мембраны, обусловленное ее геометрией (площадь, размер и ко-
личество пор, толщина), так и сопротивление мембраны, обусло-
вленное наличием вдоль поверхности мембраны слоя жидкости
с уменьшенным концентрационным градиентом растворенного
вещества. Это сопротивление зависит от скорости потока крови
и диализирующего раствора и конструкции диализатора.
Таким образом, диффузионный поток (скорость диффу-
зии) жидкости пропорционален диффузионной проницаемо-
сти мембраны и градиенту концентрации:
Js (диффузионный поток) = Рт (диффузионная проница-
емость мембраны) х ДС5 (градиент концентраций).
Диффузия ускоряется при повышении температуры раство-
ра и при уменьшении размера молекул вещества. Различные ве-
щества диффундируют с различной скоростью, которая зависит
403
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
от молекуллярного веса и градиента концентрации по обе сто-
роны мембраны (кровь/дализирующий раствор). Следователь-
но, подбирая пропись состава диализирующего раствора, воз-
можно, избирательно удалять из крови одни растворенные ве-
Рисунок 4.1. Диффузия
щества и сохранять или
даже увеличивать концен-
трацию других.
Для оценки эффек-
тивности процедуры ГД
используют понятие кли-
ренса крови в диализаторе
Под (С) принимают услов-
ный объем крови, очи-
щенный от мочевины и
креатинина за единицу
времени (мин).
Клиренс азотистых ныа-
ков при диффузии:
С = QB х (1 - [BJ/IBJ),
где QB — скорость кровотока в диализаторе; Ве — концентра-
ция вещества в крови на выходе диализатора; В. — концентрация
вещества в крови на входе диализатора.
Клиренс крови в диализаторе (С) уменьшается при увели-
чении сопротивления мембраны (R) и повышается при увели-
чении объема крови, проходящей через диализатор (QB),увели-
чении площади мембраны диализатора (А), а также скорости по-
тока диализирующего раствора (QD).
Если принять QB = Qd, то С = А х Qb/A + R х Qb.
Конвективный транспорт
Конвекция (от лат. convectio — принесение, доставка, сов-
местное движение) — перемещение макроскопических частей
среды (газа, жидкости), приводящее к переносу массы, тепло-
ты и других физических величин (см. рис. 4.2). Ультрафильтра-
ция — это совместное движение растворителя (воды) и раство-
ренных веществ через полупроницаемую мембрану под воздей-
ствием гидростатического или осмотического давления.
404
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ_____________
ТМР
Рисунок 4.2. Конвекция
Клиренс крови в ге-
мофильтре рассчитывают
по формуле:
С = Qf [УФ]/[Р],
где Qf — скорость
ультрафильтрации; УФ —
концентрация вещества в
ультрафильтрате; Р —
концентрация вещества в
крови.
При использовании только ультрафильтрации клиренс кро-
ви определяется исключительно скоростью ультрафильтрации,
т. е. С = Qr
Скорость ультрафильтрации зависит от градиента гидро-
статического (ТМР) давления, гидравлической проницаемости,
площади, размера пор и сопротивления мембраны:
Qf=KfXTMPxA,
где — коэффициент гидравлической проницаемости
мембраны; А — площадь полупроницаемой мембраны; ТМР—
трансмембранное давление, которое рассчитывается как
ТМР = Рв + PUF — п; Рв — гидростатическое давление крови;
PVF—давление (разрежение) со стороны диализирующего раство-
ра; и — онкотическое давление крови.
Таким образом, ТМР, или давление ультрафильтрации, до-
стигается нагнетанием крови в диализатор—гемофильтр и соз-
данием разрежения со стороны диализирующего раствора.
Осмос — осмосом называют спонтанное движение раство-
рителя из раствора с низкой концентрацией частиц в раствор с
высокой концентрацией их через мембрану, проницаемую толь-
ко для растворителя. Осмотическое давление — избыточная ве-
личина гидростатического давления, которое должно быть при-
ложено к раствору, чтобы уравновесить диффузию растворите-
ля через полупроницаемую мембрану. Осмотическое давление
определяется законом Вант—Гоффа:
405
______________________ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
71 = nx Сх Т,
где п — константа диссоциации молекул растворенных ве-
ществ, С— концентрация растворенного вещества, R — газовая
постоянная и Г- температура.
Осмотическое давление (р) зависит только от концентрации
частиц, растворенных в растворе и не зависит от их массы, раз-
мера и валентности. Таким образом, осмотическое давление
создают в растворе все частицы — как ионы (Na+, К+, СГ,
НСО3_), так и нейтральные молекулы (глюкоза, мочевина).
Влечении «диализной» почечной недостаточности принцип
осмоса используется в перитонеальном диализе для удаления из-
бытка воды. В диализирующий раствор добавляют декстрозу, и
избыток воды по осмотическому градиенту переходит из крови
в диализат. В растворах, используемых для ПД, концентрация
декстрозы составляет 1,5, 2,5 и 4,25 %, что позволяет менять
скорость удаления жидкости.
Обратный осмос используют для приготовления высокочи-
стой воды для диализа.
4.4.1. Перитонеальный диализ
Перитонеальный диализ (ПД) подразделяется на острый и
хронический ПД. В отделениях реанимации используют острый
ПД для коррекции уремии, нарушений водно-электролитного и
кислотно-основного гомеостаза. Преимуществом ПД перед дру-
гими методами диализа и фильтрации является возможность ле-
чения ОПН у пациентов с высоким риском применения антикоа-
гулянтов, технически сложно осуществляемым сосудистым досту-
пом и без применения дорогостоящего диализного оборудования
и специальной водоподготовки. Поскольку клиренс небольших
молекул зависит главным образом от скорости кровотока и ско-
рости течения диализата, которые имеют более высокие значения
при гемодиализе, а клиренс более крупных молекул больше зави-
сит от площади поверхности мембраны и времени диализа, кото-
рые больше при перитонеальном диализе, следовательно, ПД
может оказаться более эффективным способом выведения из ор-
ганизма веществ, обладающих большей молекулярной массой
(миеломная болезнь, лекарственная ОПН, печеночно-почечная
406
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ ______________
недостаточность). Кроме того, ПД (в сравнении с интермиттиру-
ющим ГД) обеспечивает стабильность гемодинамики, не вызы-
вает развития «диализной» артериальной гипотензии.
Показанием к применению ПД является ОПН у новорож-
денных, детей и больных с невысокой массой тела.
Ограничения метода: недостаточно эффективен при гипер-
катаболизме; высокой стадии гипергидратации, значительном
снижении остаточной функции почек (клиренс эндогенного
креатинина <15 мл/мин).
Противопоказания: повреждения, деформация, хрониче-
ские заболевания передней брюшной стенки, позвоночника и ор-
ганов брюшной полости; перитонит.
Осложнения, связанные с катетеризацией брюшной поло-
сти: инфекция выходного отверстия, обструкция, перегибы,
«всплытия»; внутрибрюшное кровотечение; грыжи; перитонит.
Нарушения водно-электролитного баланса (гипергидратация, ги-
по/гипернатриемия), гипергликемия.
Методика острого ПД:
1. Имплантация катетера в брюшную полость:
а) пункционная имплантация стилет катетера длительно-
стью до 3 суток;
б) хирургическая имплантация катетера Тенкхоффа при про-
ведении ПД более 1 недели.
2. ОПД проводят ручным методом через временный пери-
тонеальный катетер или автоматическим методом через катетер
Тенкхоффа с помощью аппарата—циклера или монитора для
интермиттирующего перитонеального диализа. Стандартный
раствор (см. табл. 4.4 и 4.5) в объеме 1,5—2,0 литра вводят вну-
трибрюшинно с экспозицией от 40—60 до 120 минут, а затем
сливают и повторяют процедуру.
Выбор дозы процедуры (объем и кратность введения ра-
створа в брюшную полость, длительность лечения ПД) произ-
водят с учетом остаточной функции почек, весом, поверхно-
стью тела пациента. При проведении ПД рассчитывают сле-
дующие индексы: D/Р по креатинину или мочевине (отношение
концентрации креатинина/мочевины диализата к его концен-
трации в крови); D/DO (отношение концентрации глюкозы
диализата к ее исходной концентрации); индекса КТ/V по мо-
407
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Таблица 4.4. Лактатные диализирующие растворы для
перитонеального диализа
Электролиты Раствор 1-й, мэкв/л Раствор 2-й, мэкв/л
Натрий 132 132
Калий 0 0
Магний 1,5 0,5
Кальций 3,5 3,5
Хлориды 102 96
Лактат 35 40
Таблица 4.5. Ацетатные диализирующие растворы для
перитонеального диализа
Электролиты Раствор 1-й, мэкв/л Раствор 2-й, мэкв/л
Натрий 130 130
Калий 0 0
Магний 1,0 0,5
Кальций 3,25 3,25
Хлориды 105 98
Ацетат 35 40
Примечание. Стерильный диализирующий раствор находится в пластиковых
контейнерах объемом от 1,5 до 3,0 литров, с концентрацией глюкозы 1,5,2,5,
4,25 %.
чевине (где К — клиренс мочевины, Т — время процедуры, V —
общее количество воды в организме, которое рассчитывается по
номограмме).
D/Р — характеризует диффузионную способность перито-
неальной мембраны. При D/Р > 0,65 диффузионная способ-
ность мембраны высокая, в случае снижения этого показателя
интенсивность (дозу) ПД следует увеличивать.
D/DO — характеризует скорость ультрафильтрации через пе-
ритонеальную мембрану. При D/DO <0,2 (интенсивное всасы-
вание глюкозы) скорость ультрафильтрации низкая и следует ис-
пользовать диализирующие растворы с высокой концентраци-
ей глюкозы.
408
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
КТ/V (индекс адекватности) — характеризует эффектив-
ность проводимого ПД. Снижение данного индекса в процессе
лечения ОПН свидетельствует о низкой эффективности пери-
тонеального диализа и служит рекомендацией к пересмотру ме-
тодики или метода ЗПТ.
4.4.2. Аппаратный гемодиализ
Аппарат «искусственная почка»
Индивидуальный аппарат «искусственная почка» состоит из
трех основных компонентов:
• системы подготовки и подачи диализирующего раствора;
• экстракорпорального контура кровообращения;
• одноразового диализатора—гемофильтра.
К техническим задачам аппарта относятся:
• производство диализирующего раствора;
• управление ультрафильтрацией и удаление ультрафильтрата;
• перфузия крови.
Водоподготовка
Среди факторов, обеспечивающих адекватный ГД, боль-
шое значение имеет степень очистки воды, используемой для
приготовления диализирующего раствора. При проведении од-
ного сеанса ГД расходуется 120—150 л очищенной водопровод-
ной воды.
Примеси в воде
• Нерастворенные частицы и коллоиды: ил, песок, отложе-
ния водопроводных труб. Степень загрязненности воды органи-
ческими и неорганическими коллоидами определяется путем из-
мерения мутности воды после фильтрации через 22-мкм фильтр.
• Растворенные неорганические соединения: бикарбонаты
и сульфаты кальция и магния (формируют синдром жесткой
воды); углекислый газ, соли натрия, ферриты и железо, хлори-
ды, алюминий, фосфаты, нитраты. Растворенные соли выде-
ляют выпариванием при температуре 180 °C.
• Органические соединения: жиры, масла, растворенные ос-
татки гербицидов, пестицидов, бактериальные эндотоксины и
пирогены. Органические примеси придают воде желто-корич-
невую окраску и характерный запах. Для определения общего за-
грязнения используют тест с перманганатом натрия.
409
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• Бактерии. Питьевая вода после хлорирования свобод-
на от одноклеточных организмов (водоросли, простейшие),
но содержит бактерии. Уровень бактериального загрязнения
водопроводной воды не должен превышать 1 колонию на 1 мл.
Принцип последовательного применения способов во-
доочистки положен в основу работы современных аппара-
тов водоподготовки. Производительность таких аппара-
тов составляет от 10 до 40 л/ч. Они обеспечивают удаление
более 95 % солей, более 99,9 % бактерий и эндотоксинов,
более 99 % веществ с молекулярной массой до 200 Дальтон.
Результирующий показатель очистки воды — проводи-
мость. Адекватно очищенная вода имеет проводимость ме-
нее 2 мкС/см2.
Методы очистки воды
• Дистилляция — получение конденсата при охлаждении
пара, который образуется при нагревании воды. В современ-
ных аппаратах водоочистки данный метод не применяется.
• Фильтрация — применение песчаного фильтра, который
задерживает все крупные взвешенные в воде частицы.
• Промежуточная адсорбция — применение угольных филь-
тров для удаления веществ с массой от 60 до 300 дальтон: хлор и
другие растворенные газы, хлорамин, соли алюминия, железа,
меди, цинка.
• Деионизация — применение синтетических ионообмен-
ных смол (катионитов) для уменьшения жесткости воды.
• Обратный осмос — создание давления выше осмотическо-
го со стороны раствора с большей концентрацией растворенных
веществ с целью изменения направления движения воды через
мембрану.
• Микропористая фильтрация. Микропористый мембран-
ный фильтр, применяемый на конечной стадии очистки, служит
барьером для частиц размером 0,1—1,0 мкм.
• Ул ьтрафил ьтрация — прохождение воды через мембраны
с величиной пор более 0,001—0,02 мкм и задержка частиц с мо-
лекулярной массой более 10 000 Дальтон.
Диализирующие растворы
Производство диализата включает смешивание концентра-
та и воды, его подогрев и дегазацию.
410
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
Существует несколько принципов приготовления диализа-
та. Наиболее совершенным является смешивание по объему (во-
люметрическое смешивание). Исходя из возможности получения
максимальной концентрации солей в диализном концентрате
волюметрическое смешивание предполагает, что единица объе-
ма диализата состоит из 35 частей. В одних аппаратах отмеряет-
ся 32,77 части воды и добавляется 1 часть кислотного и 1,23 ча-
сти бикарбонатного концентрата. В других отмеряется небольшое
начальное количество воды, добавляется 1 часть кислотного,
1,23 части бикарбонатного концентрата, после чего этот общий
объем дополняется водой до 35 частей. При использовании аце-
татного концентрата общее количество воды составляет 34 части,
концентрата — 1 часть. То есть достигается соотношение 34:1.
Существуют и другие принципы подготовки диализата: с ис-
пользованием специальных патронов или мешков для получе-
ния бикарбонатной части непосредственно в процессе гемо-
диализа (BICART, BIBAG).
Подогрев приготовленного диализата осуществляется обыч-
но до температуры 37 °C.
С целью настройки оптимальной температуры тела больно-
го и диализата для последнего поколения аппаратов «искус-
ственная почка» (Fresenius 4008) разработан специальный мони-
тор температуры крови (ВТМ). ВТМ — это интегральная часть
диализного аппарата (встроенный модуль), измеряющий арте-
риальную (Та) и венозную (Тв) температуру крови больного с вы-
сокой точностью (± 0,1 °C) неинвазивным методом. ВТМ име-
ет доступ к системе нагревательного контроля диализного аппа-
рата и способен поддерживать определенный энергетический те-
пловой баланс в соответствии с целью лечения и предписанием
врача. Состав стандартного ацетатного и бикарбонатного диали-
зирующих растворов представлен в табл. 4.6.
Ацетатный диализирующий раствор
Ацетатный гемодиализ бьи впервые предложен С. Mion в
1964 году в связи с технологическими сложностями, возника-
ющими при использовании (хранении) бикарбонатного диали-
за. Ацетат диализирующего раствора в печени метаболизирует-
ся в бикарбонат и временно нормализует кислотно-основной ба-
ланс крови. Диализанс ацетата составляет примерно 70 % кли-
411
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Таблица 4.6. Состав стандартного ацетатного и бикарбонатного
диализирующих растворов
Компоненты Концентрация, мэкв/л
Ацетатный раствор Бикарбонатный раствор
Натрий 135-145 135-145
Калий 0-4,0 0-4,0
Кальций 2,5-3,5 2,5-3,5
Магний 0,5-1,0 0,5-1,0
Хлор 100-119 100-119
Ацетат 35-38 2-4
Бикарбонат 0 30-38
Декстроза 11 11
РСО2, мм рт. ст. 0,5 40-100
PH Вариабелен 7,1-7,3
рейса мочевины, поэтому при высокоэффективном ГД, осо-
бенно у больных с небольшой массой тела, отрицательное дей-
ствие ацетата будет явным. Однако, если проводить низкоэффек-
тивный ГД (клиренс мочевины менее 120 мл/мин), симптомы,
обусловленные ацетатом (артериальная гипотония, тошнота,
рвота, головная боль, общая слабость), возникают редко. Суще-
ствует и индивидуальная непереносимость ацетата, проявляю-
щаяся кожным зудом, крапивницей, бронхоспазмом.
Бикарбонатный диализирующий раствор
Современный бикарбонатный диализирующий раствор го-
товят последовательно из двух компонентов: собственно би-
карбонатной части и кислотной части, с целью предупреждения
выпадения осадка в виде карбонатов кальция и магния.
Кислотная часть концентрата после разведения 1 : 34 имеет
следующие концентрации ионов: натрия — 75 мэкв/л, калия —
2,0 мэкв/л, кальция — 1,75 ммоль/л, магния — 0,5 ммоль/л,
хлора —81,5 ммоль/л. Бикарбонатная часть концентрата после
разведения 1,83 : 34 имеет следующие концентрации ионов:
натрия — 65 мэкв/л, бикарбоната — 34,8 мэкв/л, хлора —
26 мэкв/л, СО2 — 5,0.
412
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
Стерильные диализирующие растворы
Это стерильные фабрично приготовленные растворы, кото-
рые поставляются в пластиковых контейнерах по 4500—5000 мл
с ацетатным, лакгатным, бикарбонатным буферами и различны-
ми концентрациями глюкозы и калия (см. табл. 4.7). Данные ра-
створы предназначены для проведения постоянной замести-
тельной почечной терапии — ПАВГД, ПВВГД, ПАВГДФ,
ПВВГДФ.
Таблица 4.7. Составы стерильных диализирующих растворов
для проведения ПЗПТ фирмы «Hospal»
Компоненты, ммоль/л Лактатный раствор Бикарбо- натами раствор
L0 LG2 LG4 ВО
Na+ 1 140 142 140 140
Са++ 1,75 1,75 1,75 1,75
Mg++ 0,75 0,75 0,75 0,5
К+ 0 2 4 0
С1- 105 109 109,5 109,5
СЗН5ОЗ- 40 40 40 3,0
нсоз- - - - 32
Глюкоза, г/л 0 1,1 1,1 0
Осмолярность, мосм/л 287,5 302,3 302,1 287,0
Растворы для перитонеального диализа фирм «Fresenius
AG», «Baxter» поставляются в пластиковых контейнерах по
500—5000 мл с ацетатным, лактатным, бикарбонатным буфером
и различными концентрациями глюкозы, натрия, кальция.
Стерильный диализирующий раствор может быть получен
и в процессе водоподготовки (on-line) с использования трех
уровней защиты от бактериального загрязнения: 1) ультрафильт-
рация посупающий воды, 2) два последовательно соединенных
стерилизующих гемофильтра на линии подачи диализата и 3) аба-
ктериальный фильтр на линии введения субституата. Такая си-
стема приготовления стерильного диализирующего раствора
предусмотрена в аппаратах «искусственная почка» — «Fresenius
AG—4008Е», «Gambro» АК 100 Ultra.
413
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Управление ультрафильтрацией
Существуют два метода управления ультрафильтрацией:
• подавлению;
• по объему.
Контроль за объемом уд аленной в процессе сеанса жидкости осу-
ществляется волюметрическим методом с погрешностью ± 50 мл/ч.
Управление по давлению. Посредством системы насосов и
дросселей создается трансмембранное давление в диализаторе.
Количество удаленной жидкости контролируется путем измере-
ния входного и выходного потоков диализирующего раствора.
Управление по объему. Трансмембранное давление достига-
ется посредством удаления из замкнутого объема, созданного ба-
лансировочной камерой или насосами, установленного объема
жидкости. Подсчет количества УФ осуществляется путем из-
мерения объема порций, периодически удаляемых из замкнуто-
го контура.
Приготовление, подачу и регулирование скорости потока,
осмотическую концентрацию (электропроводность), температу-
ру диализирующего раствора и управление ультрафильтрацией
выполняет монитор диализирующего раствора.
Монитор диализирующего раствора включает'.
• регулятор скорости потока диализирующего раствора;
• индикатор кондуктивности (электропроводности раствора;
• регулятор уровня отрицательного давления в диализи-
рующей полости диализатора;
• датчик величины ТМД;
• регулятор уровня натрия бикарбоната диализирующего ра-
створа, объема УФ;
• датчик объема УФ;
• детектор прорыва крови;
• температурный датчик.
Монитор крови предназначен д ля обеспечения эффективно-
го и безопасного кровотока по экстракорпоральному контуру (ар-
териальная линия — диализатор-гемофильтр — венозная ли-
ния) кровообращения.
Монитор включает'.
• насос (или два насоса) с регулируемой скоростью крово-
тока 50—600 мл/мин;
414
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
• устройство дозированного введения гепарина;
• датчики давления на входе в артериальную линию крови;
• датчик на входе и выходе диализатора;
• датчик объема воздуха в камере венозного фильтра;
• систему безопасности;
• диализаторы.
Существуют два типа диализаторов: пластинчатые и капил-
лярные. Пластинчатый диализатор состоит из 25—35 пластин,
между которыми укладывается по 2 листа полупроницаемой
мембраны. Внутри между листами мембраны протекает кровь.
Снаружи мембрану омывает диализирующая жидкость. Пла-
стины играют роль поддерживающего каркаса, который преду-
преждает разрыв мембраны и позволяет создать относительно вы-
сокое ТМД, достигающее в ряде случаев 300—400 мм рт. ст. Пло-
щадь диализирующей мембраны составляет от 0,23 до 1,0 м2.
Недостаток пластинчатого диализатора заключается в том, что
для его первоначального заполнения требуется относительно
большой объем крови (от 60 до 170 мл).
В капиллярном диализаторе мембрана сделана в виде полых
волокон, помещенных в цилиндрический корпус. Внутри капил-
ляров проходит кровь, снаружи их омывает диализирующая
жидкость. Преимущества диализатора такой конструкции об-
условлены линейным потоком крови, низким внутренним сопро-
тивлением крови, малым объемом заполнения (от 35 до 75 мл).
Как в пластинчатом, так и в капиллярном диализаторе, для уве-
личения градиента концентрации кровь и диализирующая жид-
кость поступают в диализатор и оттекают от него по специаль-
ным магистралям в противоточном направлении.
В современных диализаторах используют два вида диализ-
ных мембран: целлюлозные (купрофан, гемофан, ацетатцеллю-
лоза) и синтетические (полиамид, полисульфон, полиакрилони-
трил, полиметилметакрилат). Диализные мембраны различают
по рабочим характеристикам (клиренсы низкомолекулярных
веществ и средних молекул, проницаемость для воды) и стадии
биосовместимости.
Недостатками целлюлозных мембран являются их невысокая
прочность и низкая проницаемость для воды, низкий клиренс Р-2-
микроглобулина и средних молекул, активируют комплемент.
415
______________________ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Синтетические мембраны по сравнению с целлюлозными
обладают более высокой проницаемостью для воды, меньше
активируют комплемент, более эффективно выводят средние
молекулы и 0-2-микроглобулин.
Выбор диализной мембраны осуществляют исходя из осо-
бенностей клинического течения почечной недостаточности и
планируемого метода диализной терапии (стандартный гемодиа-
лиз, высокообъемный гемодиализ, гемодиафильтрация). Следу-
ет учитывать, что низкопоточный диализатор не позволяет осу-
ществлять транспорт молекул с массой более 5000—10 000 Даль-
тон, а высокопоточный способен эффективно элиминировать
молекулы с массой до 40 000—60 000 Дальтон.
Биосовместимость диализных мембран
Биосовместимость — отсутствие патологической реакции
(системный воспалительный ответ) при контакте крови па-
циента с биоматериалами экстракорпорального контура кро-
вообращения и компонентами диализирующего раствора.
К факторам, влияющим на биосовместимость, относят-
ся: тип диализной мембраны, состав диализирующего ра-
створа, вид диализного лечения, индивидуальные особен-
ности пациента. Выбор мембран и систем водоочистки явля-
ется ключевым моментом в предотвращении клинических
проявлений острого нарушения биосовместимости, к кото-
рым относятся:
• лихорадка;
• синдиализная артериальная гипотония;
• синдиализная лейкопения;
• синдром нового диализатора, тип А (анафилактическая ре-
акция) и тип В;
• анафилактоидные реакции вследствие активации калли-
креин-кининовой системы;
• тромбозы диализатора, сосудистого доступа;
• тромбоцитопения с геморрагическим синдромом;
• эндотоксинемия, обусловленная обратной фильтрацией
при применении высокопроницаемых мембран и бикарбонатно-
го диализирующего раствора;
• синдром непереносимости ацетатного диализирующего
раствора.
416
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
Острые осложнения при гемодиализе:
• синдром нарушенной осмолярности (dialys sindrom disequi-
librium);
• острый гемолиз;
• воздушная эмболия;
• синдром нового диализатора (тип А и тип В);
• эндотоксинемия.
4.4.3. Методы постоянной заместительной
почечной терапии
До конца 70-х годов выбор средств лечения больных с на-
рушенной функцией почек в отделениях реанимации ограничи-
вался диуретиками, перитонеальным диализом (ПД) или гемо-
диализом с помощью аппарата «искусственная почка» (ГД).
ПД, где роль диализной мембраны играет брюшина, эф-
фективен для удаления азотистых шлаков, некоторых лекар-
ственных препаратов; скорость удаления жидкости не высокая,
а сам ПД сопровождается потерей белка, что может вызвать ги-
попротеинемию. Кроме того, проведение ПД может привести к
развитию перитонита, пареза кишечника, значительному по-
вышению внутрибрюшного давления и нарушению функции
дыхания.
ГД с использованием аппарата «искусственная почка» явля-
ется высокоэффективной процедурой для лечения больных с
почечной недостаточностью, и также не лишен ряда недостат-
ков: диализная гипотензия (25—30 %), синдром нарушенной ос-
молярности, ограниченный по молекулярной массе спектр уда-
ляемых веществ, сложное оборудование, необходимость в боль-
шом количестве очищенной водопроводной воды.
Эволюция в области аппаратного гемодиализа привела к
параллельному возникновению новых систем для лечения ОПН,
которые обеспечивают адекватный контроль за балансом жид-
кости и уровнем уремических токсинов, более широкий по срав-
нению с ГД спектр удаляемых патологических веществ и не
провоцируют сердечно-сосудистую нестабильность у пациентов,
находящихся в критическом состоянии.
Гемофильтрация (ГФ) — метод внепочечного очищения
крови посредством конвекционного транспорта веществ через
417
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
высокопористую мембрану за счет создания градиента гидравли-
ческого давления. Использование конвекции, посредством че-
го вещества переносятся с потоком жидкости через высокопо-
ристую мембрану по градиенту давления, позволяет моделиро-
вать гломерулярную фильтрацию. Канальцевую реабсорбцию
моделирует подача замещающего раствора.
Научной базой для создания современных методик мем-
бранной фильтрации послужили работы L. Brull, в которых еще
в 1928 г. было предложено использовать мембрану из коллодия
для получения ультрафильтрата крови у собак. Началом совре-
менной эры ГФ можно считать 1966 год, когда L.W. Henderson
и соавторы стали использовать высокопористые мембраны для
очищения крови посредством ультрафильтрации. В настоящее
время для гемофильтров применяются синтетические мембра-
ны из полиакрилнитрила, полисульфона, полиамида, поликар-
боната, полиметилметакрилата. Производительность мембраны
(скорость фильтрации) при ГФ зависит от гидравлической про-
ницаемости мембраны и площади ее эффективной поверхности,
а также от гематокрита, коллоидно-онкотического и трансмем-
бранного давления.
В 1977 г. R. Kramer и соавторы первыми описали успешную
непрерывную артериовенозную гемофильтрацию, которая стала
базовой моделью для развития методов мембранной фильтра-
ции. Постоянная артериовенозная гемофильтрация (ПАВГФ)
представляет собой метод лечения, эффективность которого обес-
печивается артериальным давлением больного (рис. 4.3).
Кровоток по экстра-
корпоральному контуру
осуществляется по гради-
енту давления артерия-
вена. Как следует из назва-
ния методики, избыток
жидкости и шлаков по-
стоянно удаляется из кро-
ви так же, как это проис-
ходит при нормально ра-
ботающих почках.
ПАВГФ является только
Рисунок 4.3. Метод лечения
постоянной артериовенозной
гемофильтрацией
418
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ_______________
конвекционным методом лечения, т. е. очищение крови дости-
гается ультрафильтрацией и замещением жидкости, потерян-
ной при фильтрации, в то время как диффузия (основной меха-
низм стандартного гемодиализа) отсутствует.
В начале 80-х годов ПАВГФ впервые была применена у
Крайне тяжелых пациентов, критическое состояние которых не
позволяло применять другие виды заместительной почечной
терапии, кроме продолженного экстракорпорального очище-
ния крови. Более того, ПАВГФ давала возможность клиникам,
не оборудованным аппаратурой для машинного гемодиализа,
проводить острую ЗПТ. В то же время, несмотря на то что
ПАВГФ являлась превосходным способом контроля за балансом
жидкости, у данного метода были и свои ограничения в эффек-
тивности очищения крови. Так как скорость фильтрации опре-
деляется уровнем артериального давления, то в случаях его зна-
чительного снижения фильтрация может прекратиться. В этой
связи процедура ПАВГФ является саморегулирующейся, по-
скольку при ней удаляется жидкости не больше, чем это может
перенести больной. Максимальное количество ультрафильтра-
та, которое можно достигнуть при ПАВГФ, находится в преде-
лах 12—18 л в сутки, что ограничивает клиренс мочевины
16—18 л/сутки. Так как у большинства крайне тяжелых пациен-
тов диагностируется состояние гиперкатаболизма, данное коли-
чество выводимой мочевины и иных субстанций приводит к
недостаточному контролю за их уровнем и, естественно, неаде-
кватной ЗПТ.
Медленная постоянная ультрафильтрация (МПУФ) предста-
вляет собой еще более простой вариант ПАВГФ с такой же си-
стемой перфузии крови, но при этой процедуре удаляется мень-
ше жидкости и не вводится замещающих растворов. Главной
целью этой процедуры является создание возможности для про-
ведения парентерального питания и высокообъемной инфу-
зионной терапии. При МПУФ удаляется до 3 л жидкости в день,
а при наличии гипергидратации, гиперволемии 5—6 и более ли-
тров ультрафильтрата. К самостоятел ьному фильтрационному ме-
тоду лечения, который, по нашему мнению, следует рассматри-
вать как вариант гемофильтрации, некоторые отечественные и
зарубежные авторы относят изолированную ультрафильтрацию
419
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
(ИУФ). Свое название эта методика получила благодаря ис-
пользованию мембраны диализатора только для получения
фильтрата под действием приложенного с внешней стороны
мембраны отрицательного давления (рис. 4.4).
Рисунок 4.4. Изолированная ультрафильтрация
ИУФ позволяет у больных с гипергидратацией в течение
ограниченного промежутка времени удалять значительное
количество жидкости и не нарушать при этом главные кон-
станты водно-электролитного и кислотно-основного со-
стояний больного. Скорость ультрафильтрации, помимо
скорости потока крови и трансмембранного давления, опре-
деляется уровнем гематокрита и концентрацией белка в
плазме. По мнению L.W. Henderson (1980), у каждого боль-
ного в процессе ИУФ имеется своя ограниченная скорость
восполнения жидкостью объема циркулирующей плазмы
из внесосудистого пространства, и если удаление плазмен-
ной воды с помощью ИУФ превышает скорость восполне-
ния внутрисосудистого объема достаточно длительное вре-
мя, то вероятность возникновения гиповолемии и снижения
производительности сердца возрастает. К факторам, спо-
собствующим восполнению объема плазмы в процессе ИУФ,
наряду со степенью гидратации интерстициального водно-
го сектора, относятся увеличение сопротивления прека-
пиллярных сосудов с последующим падением капиллярно-
го давления и увеличение возврата тканевых белков в кровь
по лимфатической системе.
420
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
Эффективность фильтрационных методов зависит от пото-
ка крови через гемофильтр. Для обеспечения достаточного по-
тока крови используются катетеры с широким просветом или ар-
териовенозные шунты. Низкий кровоток ограничивает объем
фильтрации и тем самым уменьшает количество удаляемых па-
тологических веществ. Одним из путей повышения кровотока в
экстракорпоральном контуре, независимо от уровня артериаль-
ного давления пациента, является установка насоса для крови.
При этом вместо артериовенозного может использоваться вено-
венозный сосудистый доступ. Вариант гемофильтрации с подоб-
ным сосудистым доступом получил название постоянной ве-
но-венозной гемофильтрации (ПВВГФ) (рис. 4.5).
Возмещение фильтрата сбалансированной полиэлектроли-
тной смесью является важнейшим элементом ГФ, моделирую-
щим канальцевую реаб-
сорбцию. В клинической
практике применяют два
способа введения заме-
щающего раствора: пре-
дилюция и постдилюция.
Предилюция (раствор вво-
дится в артериальную ма-
гистраль перед гемофильт-
ром) приводит к тому, что
Рисунок 4.5. Постоянная вено- некоторая часть веществ,
венозная гемофильтрация предварительно связан-
ных или секвестрирован-
ных, может быть дополнительно удалена при ультрафильтра-
ции. При этом способе существенно снижается гематокрит кро-
ви, притекающей к фильтру, что позволяет снижать эффектив-
ную дозу антикоагулянтов. Вместе с тем д ля увеличения клирен-
са веществ методом предилюции приходится использовать вдвое
больший объем замещающего раствора, чем при постдилюции,
что усложняет контроль за балансом жидкости и увеличивает сто-
имость лечения. Замещающие растворы имеют различную осмо-
ляльность, электролитный состав (нормальная или пониженная
концентрация калия, нормальная или повышенная концентра-
ция кальция, натрия), тип буфера (ацетат, лактат, бикарбонат).
421
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Рисунок 4.6. Пример
постоянного малопоточного
гемодиализа
ГФ представляет собой относительно физиологичную
процедуру, поскольку она достаточно точно воспроизводит
работу нормальной почки по клубочковой фильтрации и ка-
нальцевой реабсорбции. Однако в случаях ОПН у боль-
ных с высоким уровнем катаболизма часто возникает
необходимость в применении стандартного гемодиализа,
так как необходимый клиренс креатинина и мочевины в
процессе гемофильтрации не достигается. Для повыше-
ния клиренса низкомолекулярных водорастворимых ве-
ществ, при сохранении преимуществ гемофильтрации, был
разработан (рис. 4.6)и
внедрен постоянный
малопоточный гемодиа-
лиз [Geronemus R.,
Schneider N., 1984], а за-
тем и постоянная гемо-
диафильтрация, при ко-
торой диализ и фильт-
рация происходят одно-
временно (рис. 4.7).
Присутствие диа-
лизирующего раствора
позволяет молекулам
веществ с небольшим
размером путем диффу-
зии проникать из кро-
ви в диализирующий
раствор, в то время как
более крупные молеку-
лы сохраняют возмож-
ность проходить через
мембрану путем кон-
векции с профильтро-
вавшейся жидкостью.
Фильтры, используе-
мые при проведении ПГДФ, являются принципиально
новыми и представляют собой гемофильтры-диализаторы
(табл. 4.8).
Рисунок 4.7. Схема постоянной
гемодиафильтрации
422
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ______________
Таблица 4.8. Характеристики капиллярных гемофильтров-
диализаторов
Тип Изгото- витель Мембрана Пло- щадь, м2 КУФ, мл/чна 1 мм рт. ст. Объем запол- нения, мл
Renaflo IIHF-700 Renal Systems Полисульфон 0,71 15,0 53
Renaflo IIHF-400 Renal Systems Полисульфон 0,30 4,8 28
Ultraflux AV 400 Fresenius Полисульфон 0,70 48
Ultraflux AV 600 Fresenius Полисульфон 1,35 90
F-5 Fresenius Полисульфон 0,90 4,2 63
F-6 Fresenius Полисульфон 1,2 5,5 63
F-8 Fresenius Полисульфон 1,8 7,5 120
F-40 Fresenius Полисульфон 0,65 20 44
Multiflow 60 Hospal (CGH) AN 69 0,60 15 47
FH66 Gambro Полиамид 0,60 14-15 43
FH88 Gambro Полиамид 2,0 137
CA210 Baxter Ацетат целлюлозы 2,1 10,1 133
PAN-50 Asahi Полиакрилон итрил 0,5 15 50
D 10 Amicon Полисульфон 0,2 15
D20 Amicon Полисульфон 0,25 7,2 38
D30 Amicon Полисульфон 0,60 8,5 58
Они изготовлены из кополимера акрилонитрила и мета-
лилсульфоната натрия. По сравнению со стандартными гемо-
фильтрами и диализаторами они обладают рядом преимуществ:
• высокая биологическая совместимость и проницаемость;
• совмещение процессов диффузии, конвекции и частич-
но адсорбции;
• минимальная активация тромбоцитов, поэтому требует-
ся вводить меньшие дозы антикоагулянтов;
• обеспечение высоких клиренсов мочевины и креатинина.
423
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
С помощью этих фильтров возможно проведение следующих ме-
тодов ПЗТ:
• изолированная ультрафильтрация;
• непрерывная продленная ультрафильтрация и гемофильт-
рация;
• непрерывные продленные малопоточные гемодиализ и ге-
модиафильтрация .
Для проведения ПГД и ПГДФ применяется два вида сосу-
дистого доступа: артериовенозный и вено-венозный. Больным
со стабильной гемодинамикой артериовенозный сосудистый
доступ позволяет проводить сеанс ПГДФ без использования на-
соса по крови, при этом среднее артериальное давление должно
быть не менее 60—80 мм рт. ст. В этом случае скорость кровото-
ка через фильтр (QB) может быть от 50 до 200 мл/мин. При ар-
териальной гипотензии, или при вено-венозном сосудистом до-
ступе использование насоса обязательно. Наибольшая эффек-
тивность ПГДФ достигается при QB от 150 мл/мин.
Представленные варианты гемофильтрации относятся к со-
временным эффективным и достаточно физиологичным мето-
дам внепочечного очищения крови, позволяющим активно ре-
гулировать водный и электролитный баланс организма, элими-
нировать циркулирующие в кровяном русле мелко- и среднемо-
лекулярные патологические субстанции, стабилизировать ге-
модинамику.
У критических больных гемофильтрация в различных ее
вариантах применяется как метод выбора для коррекции грубых
нарушений гомеостаза, лечения острой почечной недостаточно-
сти, респираторного дистресс-синдрома, СПОН.
Гемодинамическая стабильность процедур гемофильтра-
ции является важным ее преимуществом перед другими метода-
ми ЭКД у критических больных. Гемодинамическую стабиль-
ность связывают в основном с отсутствием в процессе ГФ рез-
ких колебаний основных констант гомеостаза (pH, осмоляр-
ность) и эффективным удалением широкого спектра патологи-
ческих веществ, ответственных за развитие полиорганных нару-
шений. Гемофильтрация позволяет снижать концентрацию цир-
кулирующих цитокинов (TNF — а, интерлейкин-1), фактора, уг-
нетающего миокард, простагландина Е2, тромбоксана В2, вазо-
424
ГЛАВА4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ______________
активных веществ — катехоламинов, гистамина, серотонина,
брадикинина.
4.5. Результаты клинического применения
постоянной ЗПТ в реаниматологии.
Коррекция водно-электролитного
и кислотно-основного баланса
Продолженная ЗПТ может применяться для коррекции
водно-электролитного баланса путем изменения состава заме-
щающего раствора и диализата. Эффективность гемофильтрации
в плане снижения уровня плазменного калия прямо пропор-
циональна объемам удаляемой во время процедуры жидкости и
ее замещающих растворов, не содержащих калий. Однако эффек-
тивность ПАВГФ и ПВВГФ в достижении нормального значе-
ния плазменной концентрации калия достаточно низкая. В этой
связи при клинически значимой гиперкалиемии следует приме-
нять продолженный гемодиазиз или гемофильтрацию с диали-
зирующим раствором, не содержащим калий (Lo, Во —Hospal).
При коррекции метаболического алколоза концентрацию
бикарбоната в течение сеанса гемофильтрации можно измерить
или предсказать, используя формулу:
НСО3 (1) = UFx НСО3 (s) x 1,124,
где HCO3 (f) и HCO3 (s) — концентрация бикарбоната в
ультрафильтрате и сыворотке крови; UF — общее количество
ультрафильтрата; 1,124 — средний коэффициент просеивания би-
карбоната.
Когда гемофильтрация применяется в режиме дегидра-
тационной терапии (без замещающего раствора), потери би-
карбоната компенсируются за счет снижения потребности
организма в основаниях, и в этом случае концентрация би-
карбоната в плазме изменяется незначительно. Напротив,
при использовании замещающего раствора для поддержа-
ния баланса жидкости в организме количество теряемого би-
карбоната с ультрафильтратом значительно увеличивается и
425
ТРАНСФУЗИОЛОГИЯ в реаниматологии
может обусловить снижение pH крови (нормализация pH
при алколозе или ацидоз). Проведение процедур ЗПТ с ис-
пользованием бикарбонатных диализирующего и замещаю-
щего растворов обеспечивает адекватный буферный баланс и
меньшие колебания КОС.
Коррекция гиперволемии, гипергидратации
Одной из наиболее отличительных и важных характери-
стик постоянных методов ЗПТ является их способность уда-
лять большие объемы свободной воды из плазмы. Конвекция —
наиболее эффективная диуретическая терапия, поскольку при
этом напрямую удаляется вся вода, содержащаяся в плазме.
Ограничением этой диуретической терапии является временная
задержка восполнения ОЦП из интерстициального пространства
и возникновение гиповолемии при высокой скорости ультра-
фильтрации.
Удаление значительных объемов жидкости посредством ге-
мофильтрации может быть полезным в различных ситуациях:
ОПН, респираторный дистресс-синдром, высокообъемное па-
рентеральное питание, острая левожелудочковая недостаточ-
ность (отек легких).
Применение ЗПТ в форме изолированной ультрафильтра-
ции представляет особый интерес при лечении застойной сер-
дечной недостаточности и коррекции гемодилюции при искус-
ственном кровообращении (в первую очередь, в кардиохирургии
новорожденных и детей).
Хроническая сердечная недостаточность
При хронической сердечной недостаточности обычно нару-
шается функция почек, что усугубляет задержку жидкости и
создает резистентность к диуретикам. Застойная (перегрузочная)
сердечная недостаточность является следствием порочного кру-
га, в котором функциональные изменения сердца и почек усу-
губляют выраженность друг друга. Снижение сердечного вы-
броса, связанное с сердечной недостаточностью, индуцирует
различные неврологические и гуморальные реакции, напра-
вленные на поддержание тканевой перфузии. Эти регулятор-
ные механизмы приводят к повышению периферического сосу-
дистого сопротивления за счет артериальной вазоконстрикции
и увеличения объема плазмы вследствие повышенной реабсорб-
426
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
ции натрия и воды. Механизм перегрузки жидкостью заключа-
ется в активации ренин-ангитензиновой системы, которая вы-
зывает снижение перфузии почек и высвобождение альдостеро-
на, сочетающееся с высвобождением вазопрессина. Повышен-
ное высвобождение предсердного натрийуретического пептида
стимулирует натрийурез и способствует сохранению баланса
натрия. Однако в случае сердечной недостаточности влияние по-
чек на выработку натрийуретического пептида незначительно.
Проблему лечения тяжелой сердечной недостаточности,
рефрактерной к традиционно проводимой терапии сердечными
гликозидами, диуретиками, периферическими вазодилататора-
ми, ингибиторами ангиотензинпревращающего фермента, а
также специальным мероприятиям (постельный режим, ограни-
чения в диете и в парентеральном введении жидкости, приме-
нение допамина добуталине (ДБ) в малых — менее 5 мкг/кг в
1 мин — дозах как в виде монотерапии, так и в сочетании с пет-
левыми диуретиками или эуфиллином), в настоящее время нель-
зя считать решенной. Существенное место в этой проблеме за-
нимают вопросы предоперационной подготовки больных с хро-
нической декомпенсацией кровообращения, отечным синдро-
мом. Успешное лечение декомпенсации кровообращения позво-
ляет ускорить сроки оперативного лечения, снизить частоту тя-
желых периоперационных осложнений в системе кровообра-
щения и, следовательно, улучшить прогноз. Одним из наиболее
эффективных методов лечения рефрактерной сердечной недо-
статочности стала изолированная ультрафильтрация (ИУФ), ко-
торая достаточно длительное время применяется для плановой
и экстренной дегидратации больных с почечной недостаточно-
стью, а в настоящее время ее используют в комплексном лече-
нии больных с тяжелой сердечной недостаточностью для сниже-
ния увеличенной преднагрузки сердца, терапии отечного син-
дрома, устойчивого к проводимой терапии диуретиками раз-
личных групп. Преимуществом данного метода является возмож-
ность быстрого и программированного удаления значительно-
го количества жидкости у больных с гипергидратацией, гипер-
волемией сохраняя при этом стабильными основные параметры
гомеостаза (кислотно-основное равновесие, осмоляльность,
электролитный состав организма), а также возможность влиять
427
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
на факторы, определяющие преднагрузку желудочков и объем
сердечного выброса.
Наряду с хорошим терапевтическим эффектом ИУФ (уме-
ньшение одышки, асцита и периферических отеков, размеров пе-
чени, улучшение функционального состояния почек и сердца)
у целого ряда больных данная процедура не улучшает, а приво-
дит к усугублению имеющихся нарушений центральной и пери-
ферической гемодинамики, что диктует необходимость даль-
нейшего изучения механизмов воздействия данной процедуры
на систему кровообращения.
Нами исследована клиническая и гемодинамическая эффек-
тивность изолированной ультрафильтрации при лечении
15 больных с рефрактерной сердечной недостаточностью и отеч-
ным синдромом в возрасте от 21 до 75 лет (12 мужчин и 3 жен-
щины). Причиной тяжелой сердечной недостаточности (ста-
дии ПБ и III по классификации Н.Д. Стражеско и В.Х. Василен-
ко; III—IV функциональный класс NYHA) у 6 больных были
ревматические пороки сердца, у 4 — сдавливающий перикардит,
у 1 больного острый инфекционный эндокардит, недостаточность
митрального и аортального клапанов, у 4 больных хроническая
ишемическая болезнь сердца, крупноочаговый постинфарк-
тный кардиосклероз. Состояние больных до применения ИУФ
расценивалось как тяжелое. У всех больных отмечалась одыш-
ка в покое, акроцианоз, набухание шейных вен. В легких ниже
угла лопаток у 11 больных выслушивались влажные хрипы. При
рентгенологическом исследовании органов грудной клетки боль-
ных с пороками сердца выявили выраженный застой в малом кру-
ге кровообращения. У всех больных был асцит, увеличение раз-
меров печени, периферические отеки, олигоурия.
Всего проведено 52 сеанса ИУФ (от 1 до 9 сеансов у больно-
го). У неоперированных больных — 22 сеанса ИУФ, у опериро-
ванных — 30 сеансов ИУФ (в предоперационном периоде у
5 больных 16 сеансов, в послеоперационном периоде у 4 боль-
ных 5 сеансов ИУФ и у 1 больного в пред- и послеоперационном
периодах 9 сеансов ИУФ). Скорость перфузии крови через гемо-
фильтр составляла от 100 до 200 мл/мин. За один сеанс, в зави-
симости от переносимости процедуры, удаляли от 1000 до 6700 мл
ультрафильтрата. Длительность сеансов ИУФ была в пределах
428
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
1,5—5,5 ч. Скорость ультрафильтрации находилась в пределах
10—15—30 (14,8 ± 0,8) мл/мин.
Непосредственно до, во время и после ИУФ регистрирова-
ли параметры системной гемодинамики. Сердечный выброс из-
меряли методом разведения электроимпедансных, ультразву-
ковых и термических индикаторов.
Результаты. Центральная гемодинамика больных с застой-
ной сердечной недостаточностью до применения ИУФ характе-
ризовалась низкой производительностью сердца, высокой пред-
и постнагрузкой желудочков сердца на фоне объемной пере-
грузки (ОЦК 85 ± 10 мл/кг) (см. табл. 4.9).
Общее потребление кислорода при этом в состоянии физи-
ческого покоя пациентов соответствовало практически нор-
мальным значениям, а напряжение кислорода в смешанной ве-
нозной крови было в среднем по группе 33,18 ± 1,42 мм рт. ст.,
что свидетельствовало о формальном соответствии кардиорес-
пираторной доставки кислорода метаболическим запросам ор-
ганизма.
Под воздействием ИУФ у больных с застойной сердечной не-
достаточностью происходила изотоническая дегидратация (мас-
са тела больных снижалась при сохранении стабильными пока-
Таблица 4.9. Влияние ИУФ на параметры центральной
гемодинамики у больных с застойной недостаточностью
кровообращения (М ± ш)
Параметр До ИУФ (п = 8) После ИУФ (п = 8)
ЧСС, ударов в минуту 90,12 ±5,05 88,6 ±3,1
АДсис., мм рт. ст. 115,0 ±5,08 118,75 ±4,3
АДср., мм рт. ст. 88,62 ± 2,69 88,79 ± 2,79
АДдиаст., мм рт. ст. 71,25 ±3,86 74,37 ±4,27
ЦВД, мм рт. ст. 20,0 ± 1,35 15,93 ± 1,81*
СИ, л/(мин2х м2) 2,46 ±0,14 3,09 ± 0,27*
У И, мл/(мин2х м2) 27,.44 ± 1,1 35,17 ± 3,36*
ОПСС, динхс/(см5хм2) 2168,2 ± 139,18 1984,01 ±213,18
ИУРЛЖ, гхм/м2 31,95 ± 1,61 42,82 ± 4,7*
•Достоверные (р < 0,05) различия между параметрами.
429
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Таблица 4.10. Влияние ИУФ на кислородный гомеостаз у
больных с застойной недостаточностью кровообращения (М ± ш)
Параметр До ИУФ (п = 8) После ИУФ (п = 8)
раО2, мм рт. ст. 71,77 ±5,36 67,95 ± 1,85
pvO2, мм рт. ст. 33,18 ± 1,42 31,03 ± 1,84
АВРО2, мл/л 58,2 ± 6,5 73,6 ±5,1*
ТЭО2, % 38,86 ± 3,09 45,28 ± 2,23*
ИПО2, мл /(минхм2) 139,99 ±17,76 227,28 ± 24,55*
ИТО2, мл/(минхм2) 408,7± 29,24 529,5 ± 56,67*
•Достоверные (р < 0,05) различия между параметрами.
зателей концентрации натрия и осмоляльности плазмы крови).
Показатель Ht в процессе одного сеанса ИУФ также достовер-
но не изменялся, однако имел тенденцию к увеличению за счет
изменения соотношения объема циркулирующих эритроцитов
к объему циркулирующей плазмы (табл. 4.11).
Таблица 4.11. Динамика некоторых лабораторных показателей
при проведении ИУФ у больных с застойной недостаточностью
кровообращения (М ± ш)
Параметр До ИУФ (п = 8) После ИУФ (п = 8)
НЬ, г/л 13,0 ± 0,7 13,4 ± 0,8
Ht,% 38,7 ± 2,02 40,5 ± 2,3
К+пл., ммоль/л 4,0 ±0,13 Г 4,18 ±0,17
Na++rui., ммоль/л 136,37 ± 1,26 138,12 ± 1,34
Osmol.iui., мосм/л 297,6 ± 14,02 293,0 ± 8,5
В системе кровообращения произошли следующие изменения:
ЦВД снизилось в среднем на 20 %, артериальное давление систоли-
ческое (АДсис.), среднее (АДср.) и диастолическое (АДдиаст.), ЧСС,
ОПСС оставались на стабильном уровне; СИ, УИ, ИУРЛЖ возро-
430
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
ели в среднем на 25—35 %. Индекс потребления кислорода (ИПО2),
составлявший д о ИУФ 139,9 ± 17,76 мл/мин/м2, возрастал на 62,3 %.
Компенсация ИПО2 достигалась увеличением доставки кислорода
(ИТО2 возрос на 30 %) и повышением тканевой экстракции кисло-
рода в среднем с 35,86 ± 3,09 до 45,28 ± 2,23 %. Напряжение кисло-
рода в смешанной венозной крови при этом имело тенденцию к
снижению вплоть до пограничного с циркуляторной гипоксией
уровня и составляло 31,03 ± 1,84 мм рт. ст. (см. табл. 4.10).
С помощью ИУФ удалось во всех случаях уменьшить клини-
ческие проявления сердечной декомпенсации. У больных после
проведенного лечения уменьшались одышка, периферические
отеки, асцит, размеры печени; увеличивался диурез, восстанавли-
валась терапевтическая эффективность диуретиков, что, по наше-
му мнению, было обусловлено уменьшением объемной перегруз-
ки сердца, гипергидратации паренхиматозных органов.
Приводим два наиболее типичных клинических наблюде-
ния, характеризующих терапевтическую эффективность ИУФ
при лечении рефракторной сердечной недостаточности и отеч-
ного синдрома.
Клиническое наблюдение
Больной С., 37 лет, поступил в НЦХ РАМН 31 мая 1989г.сди-
агнозом: ревматизм, неактивная фаза. Дисфункция биологическо-
го протеза митрального клапана (стеноз атриовентрикулярного
отверстия, недостаточность клапанов протеза). Органический три-
куспидальный порок сердца. Состояние после протезирования ми-
трального клапана протезом БАКС-М-28 и трикуспидальной комис-
суротомии в январе 1987 г. Кардиомегалия. Постоянная форма мер-
цания предсердий. Недостаточность кровообращения III стадии
(классификация В.Х. Василенко и Н Д. Страшеско, IV Ф.К. NYHA).
Асцит. .Хронический бронхит Мочекаменная болезнь. Операции:
закрытая митральная комиссуротомия в 1972 и 1980 годах.
Ревматический митральный порок сердца выявлен в семи-
летием возрасте. В 21-летнем возрасте (1972) произведена зак-
рытая митральная комиссуротомия с хорошим лечебным эффек-
том вплоть до 1978 г. В 1980 г. произведена повторная закрытая
комиссуротомия. С1983 г. появились признаки декомпенсации
по обоим кругам кровообращения. При обследовании выявле-
ны рестеноз левого атриовентрикулярного отверстия, недоста-
431
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
точность правого атриовентрикулярного клапана. 15 января
1987 г. в условиях искусственного кровообращения произведе-
но протезирование митрального клапана протезом БАКС-28,
открытая трикуспидальная комиссуротомия. Возобновление
жалоб в течение первого полугодия после операции.
При поступлении общее состояние больного тяжелое. Жалобы
на одышку при минимальной физической нагрузке, боли в области
сердца, наличие отеков поясничной области, ног, увеличение разме-
ров живота. При осмотре-кожные покровы бледные, акроцианоз.
Отеки поясничной области, ног. Живот резко увеличен в объеме за
счет асцита. Пупочное кольцо растянуто до 4 см. Печень эластиче-
ской консистенции, выступает из-под гфая реберной дуги на 6 см. Ча-
стота дыхания в покое 18—20 в минуту. В легких в задненижних от-
делах с обеих сторон выслушиваются застойные хрипы. На ЭКГ —
мерцание предсердий, неполная блокада правой ножки пучка 1и-
са. Гипертрофия правого желудочка. По данным эхокардиографии,
размер полости левого желудочка диастолический 5,0 см, систоли-
ческий — 3,6 см. Размер полости правого желудочка 3,7 см; размер
полости левого предсердия 7,6 см. По данным рентгенографии ор-
ганов грудной клетки, общий объем сердца равен 2914 см3, что со-
ставляет 398 % от нормального. При радиологическом исследова-
нии объема циркулирующей крови (ОЦК), ОЦК 113,4 мл/кг (нор-
ма 60—85 мл/кг), сердечный индекс —1,9 лхмин '/м2.
С целью терапии застойной сердечной недостаточности,
рефракторной к медикаментозной терапии и подготовки к
оперативному лечению больному были проведены сеансы изо-
лированной ультрафильтрации (ИУФ). На правом предплечье
сформирован артериовенозный шунт и в период с 5 по 10 ию-
ня 1989 г. проведено 5 сеансов ИУФ с удалением от 1000 до
4000 мл ультрафильтрата за процедуру (всего 15 л). Средняя
скорость ультрафильтрации составляла 15—18 мл/мин. После
окончания процедур ИУФ вес больного уменьшился на 15 кг.
Возрос диурез с 60—800 до 1500—1700 мл/сутки. Возросла то-
лерантность к физической нагрузке. Одышки в покое нет.
В брюшной полости, по данным ультразвукового сканирова-
ния, определяется небольшое количество свободной жидкости.
Периферических отеков нет. По данным исследования кро-
вообращения, зарегистрировано снижение центрального ве-
432
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
нозного давления с 23 до 16 мм рт. ст., повышение сердечно-
го индекса с 1,96 до 3,6 лхмин ’/м2. После проведенной те-
рапии больного было решено оперировать, однако в связи с
развитием воспалительных явлений в области артериове-
нозного шунта и обострения хронического бронхита опера-
ция была отложена. Ухудшение состояния через три недели по-
сле окончания курса лечения ИУФ. В связи с декомпенсаци-
ей по обоим кругам кровообращения (отек легких, асцит, оте-
ки ног, гепатомегалия) больному дважды (10 и 11 июля 1989 г.)
проведены сеансы ИУФ. Удалено 7 500 мл ультрафильтрата. Со-
стояние улучшилось, и 20 июля 1989 г. в условиях искусствен-
ного кровообращения произведено репротезирование ми-
трального клапана протезом ЭМИКС-31, аннулопластика три-
куспидального клапана по Де Вега. Время ИК —122 минуты.
Течение послеоперационного периода без осложнений.
Необходимости в повторных сеансах ИУФ не возникало. Пе-
реведен 20 августа 1989 г. в санаторий для долечивания.
Клиническое наблюдение
Больная С., 52 лет, поступила в НЦХ РАМН 10 марта 1989 г.
с диагнозом: ревматизм, неактивная фаза. Ревматический ми-
тральный порок сердца: стеноз левого атриовентрикулярного
отверстия, недостаточность митрального клапана. Относитель-
ная недостаточность трехстворчатого клапана. Кардиомегалия.
Мерцательная аритмия. Недостаточность кровообращения
ПБ стадии (классификация В.Х. Василенко и Н.Д. Страшеско).
Ревматический митральный порок сердца выявлен в 1979 г.
С1986 г. постоянная форма мерцания предсердий. Летом 1988 г.
появились и постепенно прогрессировали признаки недоста-
точности кровообращения по обоим кругам. Значительное ухуд-
шение состояния с начала 1989 г. Стала беспокоить одышка в по-
кое, появились значительные отеки ног, гепатомегалия.
При поступлении общее состояние тяжелое. Кожные покровы
бледные, акроцианоз. Отеки голеней с трофическими нарушения-
ми кожи. Частота дыхания в покое 22 в минуту. В легких дыхание же-
сткое, ослаблено в задненижних отделах. Артериальное давление
140 и 80 мм рт. ст., ЧСС 86, ритм неправильный. Живот увеличен в
объеме за счет асцита. Печень плотноэластической консистенции,
выступает из-под края реберной дуги на 12 см. Рентгенологически
433
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
в малом круге кровообращения выраженные признаки артериально-
капиллярного застоя, жидкость в правой плевральной полости с за-
теканием ее по междолевым щелям; сердце значительно увеличено
в объеме (397 % от нормы). На ЭКГ мерцание предсердий, призна-
ки гипертрофии обеих желудочков сердца, преимущественно пра-
вого. По данным эхокардиографии, размер полостей левого желудоч-
ка систолический 3,9 см, диастолический — 5,3 см; левого предсер-
дия — 7,6 см, правого желудочка — 2,4 см. При радиоизотопном ис-
следовании системы кровообращения — ОЦК 78,8 мл/кг, сердечный
индекс — 2,32 л/(минхм2), ударный индекс — 20,3 мл/м2. Биохими-
ческие показатели крови, электролиты, гемоглобин и гематокрит в
пределах нормы.
Учитывая неэффективность консервативной терапии (сер-
дечные гликозиды, салуретики, периферические вазодилатато-
ры в течение 10 суток, инфузия малых доз допамина в течение
2 суток) больной проведено 2 сеанса изолированной ультра-
фильтрации. Катетеризированы правая бедренная и правая
внутренняя яремная вены. Удалено 2500 и 3000 мл ультра-
фильтрата за процедуру. Состояние больной улучшилось: уме-
ньшились одышка, гепатомегалия (печень выступает из-под
края реберной дуги на 1,5 см), асцит (свободной жидкости в
брюшной полости не определяется), исчезли отеки на ногах,
возрос диурез без применения мочегонных препаратов с
400—500 до 1200—1500 мл в сутки. При исследовании централь-
ной гемодинамики отмечено снижение ЦВД с 23 до 11 мм рт.
ст., повышение СИ с 2,8 до 4,2 л/(мин~‘хм2). В дальнейшем
больная еще дважды госпитализировались в наше отделение в
связи с декомпенсацией кровообращения, преимущественно по
большому кругу. Проводились повторные сеансы ИУФ: в мае
1989 г. — три, удалено суммарно 9500 мл ультрафильтрата; в ок-
тябре 1989 г. — один, удалено 3200 мл ультрафильтрата. Отме-
чалось значительное улучшение состояния больной, восстано-
вление чувствительности к проводимому ранее лекарственно-
му лечению. Существенных побочных эффектов от проведен-
ных сеансов ИУФ не отмечали.
Таким образом, полученные данные свидетельствуют о вы-
сокой эффективности ИУФ при лечении застойной сердечной
недостаточности, что подтверждают и другие исследователи.
434
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
Главным положительным эффектом ИУФ наряду с уменьше-
нием генерализованных отеков является повышение сердечно-
го выброса у больных с декомпенсированной сердечной недоста-
точностью.
Как показали наши исследования, ИУФ не для всех катего-
рий больных с сердечной недостаточностью является эффектив-
ным и безопасным методом лечения.
В случаях терминальной стадии сердечной недостаточности
применение ИУФ ведет к дисбалансу между значительно возра-
стающим потреблением кислорода и возможностью кардиорес-
пираторной системы по увеличению доставки кислорода тканям
и дальнейшему ухудшению состояния больных.
Нами были проведены исследования по изучению влия-
ния препарата добутамин в дозах от 3 до 5 мкг/ кг в минуту на па-
раметры центральной гемодинамики у больных с застойной
сердечной недостаточностью в процессе проведения ИУФ.
Результаты исследования влияния препарата добутамин на
параметры ЦГ приведены в табл. 4.12.
Таблица 4.12. Влияние добутамина на параметры центральной
гемодинамики у больных с застойной недостаточностью
кровообращения (М ± ш)
Параметр Исход (п = 8) Добутамин 3— 5 мкг/кг/мин (п = 8)
СВ, л/мин 4,3 ± 0,4 5,4 ± 0,4*
ЧСС, ударов в минуту 94,0 ± 5,75 93,5 ± 4,8
АД сис., мм рт. ст. 113,8 ±5,01 119,0 ±3,55
АД ср., мм рт. ст. 84,75 ± 2,35 85,75 ± 2,32
АД диаст., мм рт. ст. 69,25 ± 3,83 70,75 ± 3,9
ЦВД, мм рт. ст. 17,75 ± 1,48 15,37 ± 1,36*
СИ, л/(мин2хм2) 2,25 ±0,19 2,82 ± 0,2*
УИ, мл/(мин2хм2) 24,5 ± 2,24 30,57 ±2,31*
ОПСС, динхс/(см5хм2) 2455,0 ± 183,8 2037,0 ± 111,9*
НКЛЖ, гхм/м2 2,63 ± 0,3 3,33 ± 0,33*
ИУРЛЖ, гхм/м2 28,4 ± 2,9 34,7 ± 3,7*
’Достоверные (р < 0,05) различия между параметрами.
435
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Перед назначением добутамина у исследуемых боль-
ных имел место синдром низкого сердечного выброса, об-
условленный миокардиальной недостаточностью, высокой
пред- и постнагрузкой желудочков сердца. Инфузия препа-
рата добутамин в дозах от 3 до 5 мкг/кг в минуту приводи-
ла к достоверному увеличению производительности серд-
ца как за счет увеличения инотропизма миокарда, так и за
счет снижения (оптимизации) давлений пред- и постна-
грузки желудочков сердца при их первоначально высоких
значениях. У больных снижались ЦВД и ОПСС в среднем
на 14-18 % и на 25—28 % повышались СВ, СИ, УИ, ИУРЛЖ,
НКЛЖ. Инотропная поддержка миокарда добутамином по-
зволяла нам применять ИУФ у больных с критическим сни-
жением ударного выброса, как вследствие нарушения со-
кратительной функции миокарда, так и объемной пере-
грузки полостей сердца.
Применение ДБ позволило добиться значимого прироста
УИ при снижении давлений наполнения желудочков сердца,
что расширило показания к проведению ИУФ у наиболее тяже-
лых больных, обеспечило гемодинамическую стабильность про-
цедуры и ее клиническую эффективность.
Примером успешного использования ИУФ в сочетании с
инотропной поддержкой ДБ может служить следующее клини-
ческое наблюдение.
Больной Б., 65 лет, переведен из терапевтической клиники
ММАим. И.М. Сеченова для проведения сеансов изолирован-
ной ультрафильтрации с клиническим диагнозом: ишемическая
болезнь сердца; гипертоническая болезнь, склеротическая ста-
дия; атеросклероз сердца, мозга, аорты; атеросклеротический
кардиосклероз с нарушением ритма и проводимости (блокада ле-
вой ножки пучка Гиса); хронический бронхит; эмфизема легких;
недостаточность кровообращения III стадии (классификация
В.Х. Василенко и Н.Д. Страшеско, IV Ф.К. NYHA).
В терапевтическом стационаре в течение 42 дней получал те-
рапию сердечными гликозидами, диуретиками, антагонистами
ангиотензинпревращающего фермента, препаратами, улучшаю-
щими метаболизм сердечной мышцы, однако без существен-
ного эффекта. При поступлении у больного сохранялась одыш-
436
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
ка при минимальной физической нагрузке, акроцианоз, ана-
сарка, гепатомегалия, олигоурия.
Учитывая наличие рефрактерной к медикаментозному ле-
чению сердечной недостаточности, возраст больного и сопут-
ствующую легочную патологию, решено проводить сеансы
ИУФ под мониторным контролем ЦГ (катетер Swan—Ganz),
который установлен в правые отделы сердца и легочную арте-
рию через V. jugularis dexta. Параметры ЦГ и кислородного ба-
ланса на различных этапах лечения больного представлены
в табл. 4.13.
Поданным исследования ЦГ и КТФК, у больного перед се-
ансами ИУФ выявлена декомпенсированная сердечная недоста-
точность, преимущественно левожелудочковая; резко увели-
ченные показатели преднагрузки и постнагрузки левого желу-
дочка сердца; легочная гипертензия II степени; значительное
снижение артериального транспорта кислорода, компенси-
руемое повышенной тканевой экстракцией кислорода. С целью
инотропной поддержки миокарда у больного с застойной недо-
статочностью кровообращения и легочной гипертензией при-
менен ДБ в дозе 3 мкг/кг в минуту. Динамика параметров ЦГ и
КТФК представлена в табл. 4.13. У больного отмечено суще-
ственное возрастание УИ, ИУРЛЖ, ИУРПЖ при одновремен-
ном снижении преднагрузки ЛЖ и ПЖ, среднего давления в ле-
Таблица 4.13. Параметры ЦГ и баланса кислорода у больного
Б., 65 лет, при проведении ИУФ
Параметр Исход На фоне ДБ 3 мкг/кг в минуту ДБ + ИУФ Исход перед 2-м сеансом ИУФ Нормаль- ные значе- ния
ЧСС, ударов в минуту 98 93 96 100 60-80
АД сис., мм рт. ст. НО 112 114 101 90-140
АД ср., ммрт. ст. 85 83 80 80 70-105
АДдиаст., мм рт. ст. 69 66 61 60 60-90
437
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Окончание табл. 4.13
Параметр Исход На фоне ДБ 3 мкг/кг в минуту ДБ + ИУФ Исход перед 2-м сеансом ИУФ Нормаль- ные значе- ния
ДЛА сис., мм рт. ст. 75 72 50 54 28-36
ДЛА ср., мм рт. ст. 46 40 35 42 16-19
ДЛАдиаст., мм рт. ст. 33 26 21 32 10-14
ДЗЛК, мм рт. ст. 32 26 16 23 4-8-12
ЦВД, мм рт. ст. 12 10 7 13 1-6
СИ, л/(мин2хм2) 1,53 2,16 1,9 1,8 2,5-4,0
УИ, мл/м2 15,6 23,2 20,0 17,03 41-51
ОПСС, динхс/(см5хм2) 3821 2700 3121 3094 1970-2390
ОПСС, динхс/(см5хм2) 733 518 812 877 100-200
ИУРЛЖ, гхм/м2 18,0 26,2 21,2 18,8 50-62
ИУРПЖ, гхм/м2 9,8 12,65 9,28 9,89 7,9-9,7
АВРО2, мл/л 9,6 5,9 7,1 8,9 4,2-5,0
ТЭО2, % 0,45 0,29 0,35 0,47 0,24-0,28
ИПО2, мл /мин/м2 146,4 120,4 132,2 154,7 115-165
ИТО2, мл/мин/м2 326,6 435,9 395,6 331,8 550-650
точной артерии и ОПСС. При этом значительно возрос арте-
риальный транспорт кислорода, что привело к нормализации
тканевой экстракции О2. На этом гемодинамическом фоне на-
чат сеанс ИУФ: гемофильтр HF-55 «Gambro», скорость ультра-
фильтрации 10—14 мл/мин. Длительность процедуры — 5ч
30 мин. Без осложнений удалено 4500 мл ультрафильтрата. От-
мечено снижение вдвое по сравнению с исходными значения-
438
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
ми давления заклинивания легочных капилляров, а также сни-
жение стаепени легочной гипертензии. Нарушения КТФК не
усугубились, так как производительность сердца оставалась на
уровне, превышающем исходные значения. После окончания
ИУФ инфузия ДБ была прекращена. Следующие исследова-
ния параметров ЦГ и КТФК проведены через 20 ч (см.
табл. 4.13). Перед повторным сеансом ИУФ у больного сохра-
няется левожелудочковая сердечная недостаточность, однако
при измененных условиях внутрисердечной гемодинамики
(сниженное на 9 мм рт. ст. ДЗЛК).
Клинически у больного отмечено уменьшение одышки, ас-
цита, периферических отеков и плеврита, увеличение суточно-
го диуреза без применения мочегонных препаратов. В последую-
щем проведены еще два сеанса ИУФ на фоне инотропной под-
держки миокарда добутамином. Суммарно удалено 12 500 мл
ультрафильтрата. Состояние больного после проведенного лече-
ния улучшилось значительно: ликвидированы плеврит, асцит, пе-
риферические отеки. Уменьшилась одышка. Возросла толерант-
ность к физической нагрузке и восстановилась чувствитель-
ность к проводимой фармакотерапии сердечной недостаточно-
сти (сердечные гликозиды, ингибиторы АПФ, диуретики). Пе-
реведен в терапевтическую клинику ММА им. И.М. Сеченова
в состоянии средней тяжести.
Таким образом, в результате исследования клинической и ге-
модинамической эффективности ИУФ у больных с хрониче-
ской сердечной недостаточностью и отечным синдромом мы
обнаружили следующее:
— изолированная ультрафильтрация является эффектив-
ным и относительно безопасным методом лечения рефрактер-
ной сердечной недостаточности и отечного синдрома;
— клиническая эффективность ИУФ обусловлена уменьше-
нием объемной перегрузки сердца, повышением сердечного
выброса, устранением гипергидратации паренхиматозных орга-
нов в результате программированной изотонической дегидрата-
ции внеклеточного пространства;
— главным механизмом прироста СВ в процессе ИУФ яв-
ляется, по видимому, смещение точки УИ на кривой функции
желудочков сердца из области нисходящего колена влево, в
439
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
область с оптимальными для реализации механизма Франка-
Старлинга значениями преднагрузки желудочков сердца. Избы-
точное, бесконтрольное снижение преднагрузки желудочков
сердца ведет к снижению СВ, централизации кровообращения
и циркуляторной гипоксии;
— в случаях терминальной стадии сердечной недостаточ-
ности применение ИУФ ведет к дисбалансу между значитель-
но возрастающим потреблением кислорода и реально возмож-
ным увеличением кардиореспираторной доставки кислорода
тканям;
— добутамин в дозах 3—5 мкг/кг в минуту у больных с хро-
нической сердечной недостаточностью увеличивает в среднем на
25 % производительность сердца путем повышения инотропиз-
ма миокарда и механизма Франка—Старлинга. Применение до-
бутамина с целью инотропной поддержки миокарда у больных
с рефрактерной сердечной недостаточностью расширяет пока-
зания к использованию ИУФ, обеспечивает ее гемодинамиче-
скую и клиническую эффективность и безопасность.
Исследование ЦГ и КТФК в процессе ИУФ позволяет вы-
бирать наиболее оптимальные режимы экстракорпоральной де-
гидратации, своевременно диагностировать и проводить коррек-
цию нарушений в системе кровообращения у данной катего-
рии больных.
Применение в хирургии «открытого сердца»
Проведение операций на остановленном сердце в усло-
виях искусственного кровообращения (ИК) сопровождает-
ся планируемой гемодилюцией и гипергидратацией раз-
личной стадии выраженности. После окончания ИК у боль-
ных с сохраненной функцией почек спонтанный или инду-
цированный мочегонными препаратами диурез позволяет
быстро добиваться повышения уровня гематокритного чи-
сла. У новорожденных, пациентов с недостаточной выдели-
тельной функцией почек регуляция водного баланса и фи-
зиологическая коррекция гипергидратации и гемодилю-
ции неэффективны, поэтому этой категории пациентов не-
посредственно после прекращения искусственного крово-
обращения требуется проведение гемоконцентрации ме-
тодом ультрафильтрации.
440
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
Наиболее эффективна ультрафильтрация для коррекции
гемодилюции у новорожденных и маленьких детей, у которых
объем первичного заполнения экстракорпорального контура
непропорционален объему циркулирующей крови. У этой кате-
гории пациентов после И К для уменьшения количества аккуму-
лированной в тканях воды применяют гемофильтрацию в виде
модифицированной ультрафильтрации [Naik S. et al., Elliot M. et
al., Ярустовский М.Б. и соавт.]. Эта методика позволяет эффек-
тивно снижать количество тканевой жидкости, уменьшать объем
внесосудистой жидкости в легких, стабилизировать гемодина-
мику и значительно снижать послеоперационные дренажные
потери крови.
Функция легких и ЗПТ
Основная функция легких заключается в обеспечении га-
зообмена между вдыхаемым воздухом и венозной кровью. На-
рушения функции дыхания могут быть обусловлены патоло-
гией легочной вентиляции, диффузии газов через альвеолока-
пиллярную мембрану, соотношения вентиляции и перфузии,
механики дыхания и метаболических процессов в легких. Син-
дром дыхательных расстройств (в зарубежной литературе рес-
пираторный дистресс-синдром взрослых — ARDS) — одно из
наиболее часто встречающихся и трудно поддающихся лече-
нию критических состояний организма. Летальность при ра-
звитии ARDS у критических больных достигает 50 % и возра-
стает при сочетании ARDS с нарушениями функции других
жизненно важных систем организма. С позиций патофизио-
логии синдром характеризуется нарушением диффузии газов
и возникновением внутрилеточного сброса крови (шунта)
справа налево. Вне зависимости от конкретного этиологиче-
ского фактора ARDS во всех случаях характеризуется гиперги-
дратацией легочной ткани. Являясь одной из форм отека лег-
ких, ARDS принципиально отличается от кардиогенного оте-
ка легких нормальными значениями гидростатического да-
вления в легочных капиллярах. Основным патогенетическим
механизмом развития отека легких при ARDS служит патоло-
гическое повышение проницаемости альвеолярно-капилляр-
ной мембраны вследствие различных причин. Диагностически-
ми критериями ARDS, принятыми Американо-Европейской
441
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
согласительной конференцией 1994 г., являются: двусторонние
диффузные изменения на рентгенограммах грудной клетки,
глубокая артериальная гипоксемия и резкое снижение подат-
ливости легких при легочно-капиллярном давлении ниже
20 мм рт. ст. и/или отсутствие грубых признаков застойной
левожелудочковой сердечной недостаточности. Основой тера-
пии ARDS является ИВЛ, которая направлена на поддержание
адекватного газообмена и профилактику гипоксического пов-
реждения органов. В случаях, когда ARDS сочетается с ос-
трой почечной недостаточностью, тяжелыми экзо- и эндото-
ксикозами, патогенетически обоснованным является приме-
нение методов экстракорпорального очищения крови. Счита-
ется, что детоксикационнные методы способны корригировать
ионный состав и водный баланс, удалять токсические вещества
различной молекулярной массы, воздействовать на иммуно-
реактивность организма и улучшать прогноз при развитии ос-
трой легочной недостаточности.
Одним из механизмов экстракорпорального воздействия
гемофильтрации является программированное изотоническое
удаление избытка жидкости из организма в случаях его гипер-
гидратации и/или гиперволемии. Гемодинамическими критерия-
ми эффективного лечения гиперволемии малого круга кровооб-
ращения, наряду с другими, является достоверное уменьшение
давления заклинивания легочных капилляров (преднагрузки
левого желудочка сердца), что теоретически может способство-
вать улучшению условий внутрилегочного газообмена. Мы изу-
чили газообменную функцию легких в процессе изотонической
дегидратации у 18 пациентов. В табл. 4.14 представлены параме-
тры центральной гемодинамики и газообменной функции лег-
ких у больных с эффективной дегидратацией.
У исследованных больных в процессе дегидратации досто-
верно снизились ДЗЛК на 25 %, ЦВД на 18 %. Изменения дру-
гих параметров ЦГ были недостоверными, за исключением ин-
декса ударной работы правого желудочка сердца, который из
области гипердинамического состояния перешел в нормальное.
Вследствие уменьшения внеклеточной гипергидратации у боль-
ных достоверно снизился альвеолярно-артериальный градиент
по кислороду на 17,5 % и внутрилегочный шунт на 21 % (р < 0,05).
442
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
Таблица 4.14. Состояние ЦГ и газообменной функции легких
в процессе дегидратации
Параметр Исход перед ГФ (п=18) 7—8 ч непрерывной ГФ (п = 18)
АД ср, мм рт. ст. 83,7 ± 3,9 84,1 ± 3,7
ДЛАср. ммрт. ст. 24,4 ± 1,9 23,05 ± 2,15
ДЗЛК, мм рт. ст. 14,5 ± 1,15 11,0 ±0,81*
ЦВД, мм рт. ст. 10,7 ± 0,89 8,75 ± 0,68*
УИ, мл/м2 28,9 ± 1,8 28,02 ± 1,3
ИУРЛЖ, гхм/м2 33,6 ± 3,2 32,5 ± 2,5
ИУРПЖ, гхм/м2 9,64 ± 1,03 8,83 ± 0,96*
раО2, мм рт. ст. 123,6 ± 11,2 128,5 ± 14,9
НЬО2, % 97,8 ± 0,4 97,8 ± 0,48
раСО2, мм рт. ст. 40,6 ± 1,7 38,0 ± 1,5
р,О2, мм рт. ст. 35,6 ± 1,6 34,1 ± 1,7
(А-а)О2, мм рт. ст. 256,4 ± 33,2 211,2 ±27,16*
Q/Q,, % 19,04 ±2 ,25 15,03 ± 1,85*
paO2/FIO2, мм рт. ст. 240,8 ± 25,5 249,9 ± 25,06
•Достоверные (р < 0,05) различия между этапами исследования.
Напряжение кислорода в артериальной крови в среднем по груп-
пе оставалось на прежнем уровне. Следует отметить две главные
особенности полученных данных. Первая — эффективная деги-
дратация у критических больных не нормализовала оксигенирую-
щую функцию легких, а только уменьшала степень ее наруше-
ния. Вторая —эффективная дегидратация в процессе ПВВГФ бы-
ла возможна лишь у пациентов без клинических и гемодинами-
ческих проявлений шока.
Следующий клинический пример иллюстрирует лечебную
эффективность ГФ при лечении ARDS у больной с полиорган-
ной недостаточностью.
Клиническое наблюдение
Роженица С.-С., 38 лет, поступила в отделение реанима-
ции и интенсивной терапии НЦХ РАМН 11 апреля 1990 г. в 20 ч
443
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
20 мин. Диагноз при поступлении: состояние после первых сво-
евременных родов путем операции кесарева сечения; нефропа-
тия III стадии; эндокринопатия; ожирение II стадии; аспирация
желудочным содержимым трахеи и бронхов; асфиксия; оста-
новка кровообращения (фибрилляцияжелудочков); состояние
после сердечно-легочной и церебральной реанимации в течение
15 минут 10 апреля 1990 г.; острая легочная недостаточность
(синдром Мендельсона); гипергидратация; отек мозга; сопор.
При поступлении состояние больной тяжелое. Разверну-
тая клиническая картина полиорганной недостаточности с
повреждением функции ЦНС (сопор), кардиореспираторной
системы (острая легочная недостаточность, синдром низкого
сердечного выброса), почек (олигоанурия, гипоизостенурия,
протеинурия). Тяжесть состояния усугубляли грубые наруше-
ния водно-электролитного баланса и метаболизма (изотониче-
ская гипергидратация органов и тканей, декомпенсирован-
ный метаболический алколоз), анемия, парез желудка и кишеч-
ника, интоксикация.
При биохимическом исследовании крови выявлены гипо-
протеинемия, гипергликемия, гиперферментемия. Уровень ас-
парагиновой и аланиновой аминотрансфераз превышал нор-
мальный в 30—40 раз. По данным клинического исследования пе-
риферической крови — лейкоцитоз с палочкоядерным сдви-
гом, тромбоците- и лимфопения, гипохромная анемия, токси-
ческая зернистость лейкоцитов. На ЭКГ признаки острой систо-
лической перегрузки и недостаточности кровообращения ле-
вого желудочка сердца. На рентгенографии интерстициальный
отек легких, гиповентиляция нижней доли правого легкого.
В табл. 4.15 приведены основные параметры функционального
состояния сердца, легких и почек больной при поступлении и в
процессе комплексной интенсивной терапии.
Для поддержания напряжения кислорода в артериальной
крови на относительно удовлетворительном уровне и элими-
нации углекислого газа требовалась принудительная ИВЛ с ми-
нутным объемом вентиляции 18 л/мин, 100 %-ной фракцией
вдыхаемого кислорода и PEEP 10 см Н2О. ИВЛ проводили ап-
паратом «Newport Е—100». Терапия артериальной гипертензии
(АДср >130 мм рт. ст.), синдрома низкого сердечного выброса,
444
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
почечной недостаточности и гипергидратации с помощью гипо-
тензивных средств и высоких доз диуретиков (лазикс более
1000 мг в сутки), сердечных гликозидов, глюкокортикоидных гор-
монов, препаратов, улучшающих реологические свойства кро-
ви, была малоэффективной.
Учитывая роль эндотоксикоза, нарушений водно-элек-
тролитного баланса и метаболизма в патогенезе синдрома по-
лиорганной недостаточности у больной с исходно тяжелой
формой нефропатии, было решено дополнить комплекс интен-
сивной терапии гемофильтрацией. Вено-венозная гемофильт-
рация проводилась аппаратом «Gambro», гемофильтр HF-66
«Gambro», со скоростью перфузии 150—250 мл/мин. Средняя
скорость ультрафильтрации составила 20—22 мл/мин. Гепарин
Таблица 4.15. Функциональное состояние сердца, легких и
почек у больной С.-С. (38 лет) в процессе лечения
Параметр 1-е сутки 3-е сутки 6-е сутки 7-е сутки 9-е сутки
ЧСС, ударов в минуту 140 106 115 90 по
АД ср., мм рт. ст. 140 117 105 90 80
ЦВД, мм рт. ст. 12 6 5 6 4
СИ, л/(минхм2) 2,4 3,0 3,2 3,5 3,5
ОПСС, динхс/(см5хм2) 4264 2958 2498 1919 1736
pH арт. 7,49 7,61 7,45 7,46 7,37
раСО2, мм рт. ст. 51,8 37,1 44,5 40,1 47,3
раО2, мм рт. ст. 50,8 83,4 109,3 62,5 70,1
НЬО2, % 80,1 95,1 98,0 90,0 90,0
МВЛ, л/мин 18,0 11,5 12,0 11,5 12,0
PEEP, см Н2О 10,0 10,0 0 0 0
fio2 1,0 0,6 0,7 0,5 0,4
paO2/FIO2, мм рт. ст. 50,8 139,0 156,2 125,0 175,25
С tot., л/см Н2О 0,015 0,02 0,03 0,03 0,03
Мин. диурез, мл/мин 0,31 1,8 2,5 2,7 1,25
445
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Окончание табл. 4.15
Параметр 1-е сутки 3-е сутки 6-е сутки 7-е сутки 9-е сутки
Клиренс по мочевине, мл/мин 1,16 3,58 40,6 70,8 15,9
Фильтр, по энд. креат., мл/мин 34,9 25,2 70,0 141,0 43,3
Осмолярность пл., мосм/л 301 305 330 316 340
Осмолярность мочи, мосм/л 323 305 537 542 641
в дозе 1000 ЕД/ч вводили непосредственно перед гемофильт-
ром в постоянном режиме. Сеанс гемофильтрации длился 14 ч.
За сеанс удалено 16 л ультрафильтрата, а кроме того, без сти-
муляции мочегонными больная выделила 1600 мл мочи; из же-
лудка удалено 1000 мл застойного содержимого. Возмещение
объема циркулирующей плазмы (ОЦП) проводили стандартны-
ми растворами для гемофильтрации «Gambro», нативной плаз-
мой и растворами человеческого альбумина. Всего за сеанс
введено 10 л растворов. Таким образом, дефицит массы тела
больной за 14 ч сеанса составил 8 кг.
К концу сеанса сознание больной прояснилось. По клини-
ческим и рентгенологическим данным отмечен регресс интерсти-
циального отека легких. В значительной стадии уменьшились пе-
риферические отеки, сократились размеры печени, уменьши-
лась степень гемодилюции и гипопротеинемии, улучшилось со-
стояние системы кровообращения, легких, почек (см. табл. 4.15).
С момента поступления в отделение реанимации больной до
3—4 раз в сутки проводилась лечебно-диагностическая фибро-
бронхоскопия через назотрахеальную трубку. Регулярное прове-
дение ФБС позволяло избегать бронхиальной обструкции, кон-
тролировать положение интубационной трубки, избегать возмож-
ных осложнений во время переинтубации трахеи.
Стабилизировать патологический процесс удалось в течение пер-
вых трех суток интенсивной терапии, а начиная с четвертых суток от-
446
ГЛАВА 4, ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
мечено улучшение состояния больной. При проведении ИВЛ удалось
снизить фракцию вдыхаемого кислорода, минутную вентиляцию лег-
ких. Периодически с 4—5-х и постоянно с 6-х суток лечения больная
находилась на вспомогательных режимах ИВЛ. Экстубирована на 9-
е сутки лечения в отделении интенсивной терапии и реанимации
НЦХ РАМН. В дальнейшем состояние бальной оставалось тяжелым,
что в первую очередь было обусловлено дыхательной недостаточно-
стью вследствие массивной правосторонней аспирационной пне-
вмонии, вялотекущим эндометритом, последствиями перенесенной
гипоксической и циркуляторной гипоксии, тяжелой нефропатией.
Больной были продолжены сеансы лечебной ФБС; респираторная те-
рапия включала также ингаляции бронхо- и муколитиков, увлаж-
ненного кислорода, Л ФК, постуральный дренаж. Продолжали анти-
бактериальную терапию, коррекцию нарушений водно-электролитно-
го, белкового и энергетического балансов. Больная переведена из от-
деления интенсивной терапии НЦХ РАМН через 15 суток для продол-
жения лечения вне специализированного отделения реанимации.
Таким образом, тяжелое течение синдрома полиорганной не-
достаточности, причиной которого явились аспирационный
пневмонит, остановка кровообращения у роженицы с нефропа-
тией III стадии, закончилось на этапе интенсивных лечебных ме-
роприятий благоприятно. По нашему мнению, этому способство-
вал оптимально подобранный комплекс лечебно-тактических ме-
роприятий по интенсивной терапии. Применение же в ранние
сроки гемофильтрации позволило достигнуть максимально бы-
строй коррекции гиперволемии и гипергидратации, наруше-
ний водно-электролитного баланса и метаболизма, уменьшить
степень эндотоксикоза, улучшить функциональное состояние
ЦНС, почек, сердечно-сосудистой системы и легких.
Сбалансированный обмен жидкости через стенку микросо-
судов легких имеет первостепенное значение для обеспечения
адекватного газообмена и предохранения этого органа от отека.
У больных в критических состояниях наблюдается накопление
жидкости в интерстициальном и/или клеточном секторе легких,
что обусловливает нарушения биомеханики дыхания, оксигени-
рующей функции легких, элиминации углекислого газа. Нако-
пление жидкости в легких может развиться в результате умень-
шения внутрисосудистого онкотического давления; увеличе-
447
_______________________ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ния проницаемости капилляров для белка, способствующего
выходу коллоида в интерстициальную жидкость и снижающего
эффективное онкотическое давление в капилляре; увеличения
среднего гидростатического давления в капилляре; нарушения
лимфооттока, препятствующего удалению жидкости и колло-
идов, профильтровавшихся, но нереабсорбированных на ка-
пиллярном уровне, а также в результате других причин.
Среди способов коррекции увеличенного объема внесосудистой
жидкости особого внимания в связи с высокой лечебной эффектив-
ностью заслуживают методы ЗПТ, с помощью которых возможна
ультрафильтрация крови: гемодиализ, изолированная ультрафильтра-
ция, гемофильтрация, гемодиафильтрация. Данные методы позволя-
ют удалять из организма фильтрат, идентичный по составу «первич-
ной» моче, со скоростью от 5—10 до 50—60 мл и более в 1 минуту. Од-
нако столь эффективная общая дегидратация организма не во всех слу-
чаях ведет к желаемому улучшению состояния легких, что, вероятно,
может быть обусловлено регионарными особенностями гццробалан-
са легких под воздействием различных методов Э КД.
Обследованы 40 пациентов в возрасте от 19 до 63 лет после об-
ширных реконструктивных операций на органах грудной и брюш-
ной полости. Показанием к ЭКД У 30 больных была острая почеч-
ная недостаточность в сочетании с нарушениями функции других
органов (СПОН). Кровообращение и дыхание поддерживалось
ИВЛ и инфузией катехоламинов. Ацетатный гемодиализ проведен
у 13, гемофильтрация также у 13 и изолированная ультрафильтра-
ция у 4 пациентов. В качестве контроля служили 10 больных без
ОПН, у которых гипергидратацию устраняли с помощью диурети-
ков (фуросемид 40—60 мг внутривенно однократно).
Исследования объема внесосудистой жидкости легких про-
водили непосредственно до сеанса ЭКД и после удаления
2000—2500 мл ультрафильтрата в течение 4—5 ч, до и через час по-
сле введения фуросемида. Показатели водного баланса легких
(объем интерстициальной и клеточной жидкости легких —
ОИЖЛ и ОКЖЛ и суммарный объем внесосудистой жидкости
легких — ОВЖЛ), сердечный выброс определяли с помощью ме-
тода разведения электроимпедансных индикаторов.
Все больные, к которым применили методы ЭКД, были разде-
лены на несколько сравниваемых групп. По клиническим призна-
448
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
кам были выделены две группы. В первую вошли 12 пациентов с
ухудшением клинического и гемодинамического статуса в процес-
се ЭКД (ГД — 5 бальных, ГФ — 4 больных, ИУФ — 3 больных), во
вторую группу вошли 13 пациентов, у которых ЭКД была эффектив-
ной на фоне стабильной гемодинамики (ГД—больных, ГФ—6 баль-
ных, ИУФ — 1 больной). В таблице 4.16 приведены параметры цен-
тральной гемодинамики и баланса внесосудастой жидкости легких
у больных 1-й и 2-й группы в процессе ЭКД.
Таблица 4.16. Динамика ЦГ, ОИЖЛ, ОКЖЛ у больных
в процессе ЭКД (М ± ш)
Параметр До ЭКД После ЭКД
1-я группа (п=12) 2-я группа (п=13) 1-я группа (п=12) 2-я группа (п=13)
ЧСС, ударов в минуту 118,4 ±4 110,0 ±7 111,0 ±6 105,0 ± 5
АД ср., мм рт. ст. 67,3 ± 3 88,0 ± 6* 69,0 ± 4 89,0 ± 5**
ЦВД, мм рт. ст. 13,0 ± 1,0 8,0 ± 1,0* 11,0 ±2,0 7,0 ± 1,0**
СИ, л/(минхм2) 3,5 ±0,3 2,9 ± 0,2* 2,9 ±0,4* 3,1 ±0,2
опсс, динхсДсм^м2) 711,0 + 51 1268,0 ±81* 1204 ± 272* 1301,0 ± 147
ОИЖЛ, мл 304,0 ± 6 364,0 ±127 309,0 ± 78 193,0 ± 46“
ОКЖЛ, мл 286,0 ± 133 152,0 ±25 520,0 ± 170* 141,0 ±2,7**
Осмол.пл., мосм/л 332,5 ± 5,7 315,2 ±5,8 306,9 ± 3,5* 314,2 ±5,4
Na плазм., мэкв/л 143,6 ±1,9 142,5 ± 2,0 139,3 ± 1,3* 142,6 ± 1,9
‘Достоверные различия между 1-й и 2-й группами до ЭКД.
“Достоверные различия между 1-й и 2-й группами после ЭКД.
’Достоверные различия в 1-й группе в процессе ЭКД.
“’Достоверные различия во 2-й группе в процессе ЭКД.
449
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Перед сеансами ЭКД гемодинамический статус больных
1-й группы был более тяжелым, по сравнению со 2-й группой,
и соответствовал шоку. У больных 1-й группы достоверно ниже
были среднее артериальное давление, сердечный индекс и общее
периферическое сосудистое сопротивление, а ЦВД было выше.
Различий по другим параметрам перед ЭКД у больных 1-й и
2-й группы не было. В процессе ЭКД у больных 1 -й группы до-
стоверно увеличилось периферическое сосудистое сопротивле-
ние, объем клеточной жидкости легких и снизились сердечный
индекс, осмолярность и концентрация натрия плазмы (р < 0,05).
Во второй группе достоверно снизился объем интерстициальной
жидкости легких, и при этом параметры гемодинамики остава-
лись стабильными. После окончания ЭКД больные 1 -й и 2-й
групп различались по величине среднего артериального давле-
ния, ЦВД и объему клеточной жидкости легких.
Мы провели сравнительное изучение влияния ацетатно-
го гемодиализа и гемофильтрации на динамику внесосуди-
стой жидкости легких у 20 критических больных. Результа-
ты представлены в табл. 4.17. Непосредственно до сеансов
ЭКД пациенты 1-й и 2-й групп были сопоставимы по основ-
ным гемодинамическим параметрам, кислородтранспортной
функции крови, объему внесосудистой жидкости легких. У
больных 1-й группы были достоверно выше концентрация
натрия и осмолярность плазмы крови на 5 и 6 % соответ-
ственно. В результате ультрафильтрации крови у больных 1 -
й группы не произошло достоверного уменьшения объема
внесосудистой жидкости легких, а у больных 2-й группы
отмечено достоверное снижение ОИЖЛ на 34 % и ОВЖЛ на
29 %. Изменений ОКЖЛ в обеих группах не было, между тем
после сеансов ЭКД у больных 2-й группы значения ОКЖЛ
на 31 % были меньше по сравнению с показателем 1-й груп-
пы. В процессе гемодиализа достоверно снизились осмо-
ляльность и концентрация натрия плазмы на 5,5 и 4,7 %
соответственно.
У 10 пациентов без ОПН после внутривенного введения
фуросемида зарегистрировано снижение ОИЖЛ с 337 ± 20,6 до
181 ± 16,2 мл (46,3 %) и ОКЖЛ с 71,8 ± 8,5 до 45,6 ± 9,9 мл
(36,5 %), ОВЖЛ на 44,6 % (р < 0,05).
450
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ_____________
Таблица 4.17. Динамика ОИЖЛ, ОКЖЛ, ОВЖЛ,
осмолярности и концентрации натрия плазмы у больных в процессе
ЭКД (М ± ш)
Параметр 1-я группа (п = 9) Гемодиализ 2-я группа (п = 11) Гемофильтрация
до ЭКД после ЭКД до ЭКД после ЭКД
ОИЖЛ, мл 244,5 ± 57,3 250,1 ± 65,4 191,3 ± 27,5 126,0 ± 17,26*
ОКЖЛ, мл 240,0 ± 90,5 367,6 ± 125,6 153,3 ± 27,8 117,1 ± 20,15*
ОВЖЛ, мл 484,5 ± 142,6 617,0 ± 170,15 344,5 ± 41,4 243,1 ± 14,86*,**
Осмол.пл., мосм/л 325,4 ± 5,28 307,5 ± 3,24* 305,18 + 5,76** 305.9 ± 5,04
Na+ пл., мэкв/л 145,3 ± 3,07 138,5 ± 1,52* 138,36 ± 1,5** 141,0 ± 1,92
‘Достоверные различия в процессе сеанса ЭКД.
•‘Достоверные различия между 1-й и 2-й группами до и после сеансов ЭКД.
Полученные данные свидетельствуют о наличии нескольких
возможных динамических состояний легочного гидробаланса
при проведении ультрафильтрации крови:
а) ОВЖЛ не изменяется;
б) ОИЖЛ уменьшается при неизменном ОКЖЛ;
в) ОКЖЛ увеличивается при неизменном или уменьшаю-
щемся ОИЖЛ;
г) уменьшаются ОИЖЛ и ОКЖЛ. Объем клеточной жидко-
сти легких достоверно возрастал на фоне значимого уменьше-
ния осмолярности плазмы крови при проведении гемодиализа
и у больных с шоком. Снижение объема интерстициальной жид-
кости легких происходило при неизменных в процессе ЭКД
значениях осмолярности плазмы крови.
Сопоставляя полученные результаты с классическими пред-
ставлениями о регуляции объема жидкости организма человека,
451
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
можно сделать несколько предварительных выводов по иссле-
дуемой проблеме:
а) гемодиализ по сравнению с гемофильтрацией является бо-
лее «жестким» методом коррекции гомеостаза, о чем свидетель-
ствует достоверное снижение (за ограниченный период време-
ни) осмоляльности плазмы крови за счет как снижения кон-
центрации натрия, калия, так и эффективного удаления моче-
вины, так как осмоляльнось (расчетная) = 2 (натрий + калий) +
+ глюкоза/18 + азот мочевины/2,8. В стабильном состоянии
общее осмотическое давление внеклеточной и внутриклеточной
жидкости одинаково и конвективный поток воды через клеточ-
ные мембраны отсутствует. Осмоляльность раствора зависит от
общей концентрации частиц в этом растворе. Во внеклеточной
жидкости на натриевые соли (хлористый натрий и бикарбонат
натрия) приходится 90—95 % от общей концентрации частиц. Из-
менение концентрации солей натрия является, таким образом,
основной причиной изменения осмоляльности внеклеточной
жидкости. Значимые снижения концентрации натрия, калия, мо-
чевины вызывают снижение осмолярности внеклеточной жид-
кости, что направляет ток воды из внеклеточного сектора во
внутриклеточный (sindrom dialysis disequlibrium);
б) в процессе гемофильтрации происходит изотоническая де-
гидратация организма, в первую очередь внеклеточного секто-
ра, что для больных с нарушениями функций кардиореспиратор-
ной и центральной нервной систем более предпочтительно;
в) у больных с шоком методы диализа и фильтрации усугуб-
ляют гемодинамические нарушения, увеличивают объем внесо-
судистой жидкости легких за счет внутриклеточного сектора
вследствие значительного колебания осмотического давления
вне- и внутриклеточной жидкости и тотального нарушения ми-
кроциркуляции и проницаемости мембран.
Состояние центральной гемодинамики и кислородтранспорт-
ной функции кровообращения при проведении длительной гемо-
фильтрации у критически тяжелых больных
ЦГ и КТФК изучены в процессе непрерывной гемофильт-
рации у 37 больных с синдромом полиорганной недостаточно-
сти, развившимся как осложнение ближайшего периода после
операций на «открытом сердце». Этапы исследования:
452
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ_____________
1-й этап — исход перед ГФ; 2-й этап — 3—4 ч ГФ; 3-й этап — 7—8 ч
ГФ; 4-й этап —15—16 ч ГФ; 5-й этап — 23—25 ч непрерывной ГФ.
Для того чтобы нивелировать индивидуальные и групповые
(ОССН, шок, гипердинамия) реакции системы кровообращения
на ГФ, мы объединили всех 37 пациентов в одну группу.
Перед ГФ, несмотря на применение ИВЛ и катехолами-
нов, у исследуемых больных сохранялись тяжелые нарушения во
всех звеньях кардиореспираторного транспорта и потребления
кислорода. При формально нормальных значениях наполне-
ния желудочков сердца (оцениваемых по ДЗЛК, ЦВД), отмече-
но резкое угнетение сократительной функции преимуществен-
но левого (ИУРЛЖ, НКЛЖ) желудочка сердца. Концентрации
кислорода в артериальной и смешанной венозной крови также
были значительно снижены вследствие нарушения оксигенирую-
щей функции легких (paO2/FIO2 = 202,86 ± 17,3) и наличия по-
слеоперационной анемии, гемодилюции. Нарушение оксиге-
нирующей функции легких, насосной функции сердца, а также
анемия обуславливали низкие показатели доставки кислорода
тканям (ИТО2 = 397,18 ± 18,9 мл/(минхм2)). Индивидуальные
значения ИПО2 и тканевой экстракции находились в широких
пределах (ИПО2 от 50 до 370 мл/(минхм2)) и не отображали ис-
тинного состояния тканевого газообмена, так как даже при фор-
мально нормальных показателях у ряда больных имел место
лактатацидоз.
Гемофильтрацию проводили в нормотермическом, либо
умеренном гипотермическом режимах, что достигалось введени-
ем заместительных растворов, имевших температуру окружаю-
щей среды. В течение первых 3—4 ч происходило снижение цен-
тральной температуры тела в среднем с 37,6 ± 0,3 до 36,1 ± 0,3 °C
и в дальнейшем сохранялась умеренная гипотермия. Первые
значимые изменения в системе кровообращения были зареги-
стрированы через 3 ч (2-й этап): на фоне умеренной дегидрата-
ции снизились ДЗЛК на 11 %, СИ на 8 %, ИУРПЖ на 12 %; по-
высились ОПСС и ОЛСС на 15—16 % (р < 0,05). К 7—8-му часу
сохранялись повышенными ОПСС на 10 % и ОЛСС на 30 %, а
значения других параметров не отличались от исходных. К 3-му
этапу отмечено достоверное снижение дозы вводимого норад-
реналина на 50 %, препарата с преимущественно а-стимулиру-
453
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ющим эффектом. Через 15—17 ч непрерывной гемофильтрации
достоверных различий параметров ЦГ и КТФК по сравнению с
1-м этапом не регистрировалось, за исключением ДЗЛК, кото-
рое снизилось на 14 % (р < 0,05). Через сутки непрерывной ге-
мофильтрации у больных сохранялось сниженным на 26 % ДЗЛК
(9,4 ± 0,72 мм рт. ст.); повысились концентрация кислорода в ар-
териальной крови на 7 %, артериовенозная разница по кислоро-
ду — на 16 % и индекс потребления кислорода — на 15 %. Осталь-
ные параметры ЦГ и КТФК оставались на уровне исходных
(1-й этап) значений. Как следует из представленной динамики
параметров ЦГ и КТФК, в процессе первых трех этапов непре-
рывной ГФ отчетливо изменялись лишь ДЗЛК, УИ, ОПСС,
ОЛСС при стабильных, вплоть до 5-го этапа, показателях КТФК.
При детальном рассмотрении параметров КТФК мы выявили,
что в процессе гемофильтрации на первых трех этапах суще-
ствуют два противоположных варианта динамики индекса по-
требления кислорода, которые в итоге нивелируют изменения па-
раметров КТФК в среднем по общей группе.
Для 1-го варианта (п = 15) характерно достоверное увели-
чение ИПО2 на 19 % с компенсацией АВРО2 и ТЭО2 (увеличи-
лись на 19 %), при снижении на 19 % ДЗЛК и неизменных УИ
и ОПСС. Для 2-го варианта (п = 17) было характерным сниже-
ние ИПО2 на 17 % на фоне уменьшения транспорта кислорода
на 17 %, обусловленного депрессией УИ на 11 %, и повышения
на 22 % ОПСС (централизация кровообращения).
Изменения ИПО2 при обоих вариантах происходили на фо-
не снижения температуры тела на 4 % (с 37,6 ± 0,36 до 36,3 ±
± 0,28 °C). Необходимо отметить, что исходные значения ЦГ и
дозы вводимых катехоламинов у пациентов обеих групп были со-
поставимы, а изменения КТФК произошли в процессе ЗПТ.
В группе пациентов, у которых в последующем происходи-
ла централизация кровообращения и уменьшение потребления
кислорода, исходная величина ИПО2 была выше на 28 % (147,8 ±
± 12,14 и 107,4 ± 7,56 мл/(минхм2) соответственно).
Через сутки (5-й этап исследования) у 11 из 18 пациентов за-
регистрировано повышение уровня потребления кислорода по
сравнению с исходными значениями, что в итоге и дало досто-
верное повышение ИПО2 в среднем по группе на 14 % (р < 0,05).
454
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ_______________
В группе из этих 11 пациентов между 1-м и 5-м этапами не
было достоверных различий в температуре тела, показателях
производительности сердца (СИ, УИ), ОПСС, транспорта ки-
слорода. В то же время на 34 % увеличилось потребление кисло-
рода организмом, с компенсацией увеличенной артериовеноз-
ной разницей по кислороду и повышенной тканевой экстракци-
ей кислорода тканями на 28 % (р < 0,05). При этом отмечено до-
стоверное уменьшение преднагрузки желудочков сердца (ЦВД
и ДЗЛК) на 25 % вследствие эффективной дегидратации орга-
низма к 24 часу процедуры.
Механизмы регуляции сердечного выброса в процессе гемо-
фильтрации
Для понимания происходящих в процессе гемофильтрации
механизмов регуляции ударного индекса больные были разделе-
ны на две группы. Первую группу составили больные (п = 13), у
которых УИ увеличивался, вторую (п = 21) те, у которых УИ до-
стоверно снижался в процессе ЗПТ. Перед ГФ параметры гемо-
динамики, дозы вводимых катехоламинов у больных обеих групп
не отличались достоверно друг от друга (р > 0,05). В первой груп-
пе УИ, ИУРЛЖ, НКЛЖ достоверно возросли на 2-м этапе иссле-
дования на 12—15 %, а остальные гемодинамические параметры
оставались на стабильном уровне На 3-м этапе исследования
параметры гемодинамики не отличались от исходных.
Во 2-й труппе на 2-м этапе зарегистрировано достоверное сни-
жение УИ, ИУРЛЖ, НКЛЖ, ИУРПЖ, НКПЖ на 17-20 % и по-
вышение на 30—35 % ОПСС и ОЛСС. Дозы вводимых катехола-
минов у больных обеих групп при этом достоверно не изменялись.
На 3-м этапе у больных 2-й группы оставалось повышенным
ОЛСС по сравнению с исходным значением. Параметры гемоди-
намики через 7—8ч (3-й этап) ГФ у больных обеих групп вновь ста-
ли сопоставимы, за исключением ОПСС, которое стало достовер-
но выше у больных 2-й группы на 30 % (р < 0,05).
Следует отметить, что в обоих случаях динамика УИ проис-
ходила без достоверных изменений преднагрузки желудочков
сердца (ЦВД, ДЗЛК) и доз вводимых катехоламинов. Досто-
верное повышение ОПСС и ОЛСС у больных 2-й группы носи-
ло компенсаторный характер в ответ на депрессию ударного
индекса.
455
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Общее периферическое сосудистое сопротивление, которое
определяется показателями сердечного выброса, среднего арте-
риального давления и давления в правом предсердии (ЦВД), явля-
ется одним из наиболее динамичных параметров гемодинамики у
больных при проведении ЗПТ. Мы исследовали динамику ОПСС
в связи с УИ и температурой тела больных. Выявили, что в общей
группе больных, подвергнугых процедурам гемофильтрации, ОПСС
достоверно увеличивается ко 2-му этапу и остается повышенным
по отношению к исходу на 3-м этапе исследования. Температура те-
ла больных в это же самое время снижалась ко 2-му этапу на 5 % и
оставалась достоверно ниже исходных значений до 5-го этапа.
На показатель ОПСС у рассматриваемых больных в процес-
се ГФ оказывало существенное влияние применение катехола-
минов и, в частности, препаратов с преимущественным (/-эффек-
том (норадреналин, адреналин).
При изучении динамики ОПСС в группе больных с шоком
выявили, что рост периферического сосудистого сопротивления
происходит на 2-м этапе как компенсаторная реакция на де-
прессию СИ, УИ и снижение температуры тела при одновремен-
ном снижении средних доз норадреналина.
Примером успешного использования гемофильтрации у
больного с выраженной сосудистой недостаточностью может
служить следующее клиническое наблюдение.
Клиническое наблюдение
Больной Л., 56 лет. Клинический диагноз: ИБС, нестабиль-
ная (прогрессирующая) стенокардия; атеросклероз коронарных
артерий сердца (стеноз передней нисходящей артерии в средней
трети 70 %, стеноз артерии тупого края 40 %); постинфарктный
кардиосклероз с исходом в аневризму левого желудочка и при-
стеночным тромбом; гипертоническая болезнь II стадии; недо-
статочность кровообращения Ш-ГУ ф.к. NYHA.
В декабре 1993 года произведена операция: аневризмораф-
фия, удаление тромба из левого желудочка сердца, аутовенозное
аортокоронарное шунтирование передней межжелудочковой
артерии сердца. Длительность искусственного кровообраще-
ния — 45 минут, ишемии миокарда — 25 минут. В постперфу-
зионном периоде развилась острая сердечно-сосудистая недоста-
точность, в связи с чем начата инфузия катехоламинов.
456
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ_______________
В 1-е сутки после операции тяжесть состояния обуславли-
валась острыми расстройствами кровообращения вследствие
малого сердечного выброса (снижение УИ до 15 мл/м2, ИУРЛЖ
и ИУРПЖ до 16,0 и 4,0 гхм/м2 соответственно), а также по
мере согревания больного — прогрессирующей вазоплегией.
Относительной стабилизации гемодинамики и нормализации
транспорта кислорода удавалось добиваться введением комби-
нации катехоламинов (адреналин — до 1,3 мкг/кг в минуту,
норадреналин — до 1,0 мкг/кг в минуту, добутамин —до
6,0 мкг/кг в минуту), нормализацией преднагрузки сердца ин-
фузионной терапией.
2-е сутки после операции характеризовались выраженной
сосудистой недостаточностью при отсутствии признаков ги-
поволемии и постепенном улучшении насосной функции серд-
ца: АД ср. — 64 мм рт. ст., ЦВД — 7 мм рт. ст., ДЗЛК — 9 мм рт.
ст., УИ — 35,0 мл/м2, ИУРЛЖ и ИУРПЖ — 31,0 и 8,0 гхм/м2,
ОПСС —1019 (динхс/(см5хм2); нарастающей эндогенной инток-
сикацией вследствие гипоксического повреждения внутренних
органов (повышение уровня сывороточных ферментов и креа-
тинина); метаболическими и электролитными нарушениями
(метаболический алколоз, гипернатриемия); ухудшением ок-
сигенирующей функции легких при отсутствии вентиляционных
нарушений. Доза вводимых катехоламинов (адреналина и норад-
реналина) составила 0,45 и 0,4 мкг/кг в минуту.
Учитывая клиническую ситуацию, решено в комплекс ин-
тенсивных лечебных мероприятий включить сеанс гемофильт-
рации. Для забора и возврата крови в бедренную вену установлен
двухпросветный катетер. Использовали HF-88 «Gambro». Про-
цедура продолжалась 5 ч со средней скоростью ультрафильтра-
ции 66 мл/мин. Без изменения массы тела больного было уда-
лено 18 л ультрафильтрата; возмещение осуществляли специаль-
ными сбалансированными полиионными растворами для ГФ,
свежезамороженной плазмой крови.
К окончанию процедуры отмечены положительные сдвиги
со стороны системы кровообращения: одновременно с уменьше-
нием дозы адреналина и норадреналина (в 3 и 4 раза соответ-
ственно) возросли среднее артериальное давление на 33 %, ин-
дексы ударной работы желудочков сердца (левого — на 38 %, пра-
457
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
вого — на 31 %), системного сосудистого сопротивления (на
75 %) при неизменных уровнях давления наполнения камер
сердца. Нормализовались метаболические и электролитные по-
казатели, уровни сыворотночных амилазы и креатинина.
В последующие сутки введение катехоламинов было полно-
стью прекращено, сердечная недостаточность компенсировалась
сердечными гликозидами. На фоне улучшающихся показате-
лей газообмена на 5-е сутки послеоперационного периода боль-
ной был экстубирован и после активизации в состоянии сред-
ней тяжести на 10-е сутки переведен в профильное хирургиче-
ское отделение.
Заключение
Главным показанием для ЭКД у критических больных яв-
ляется необходимость коррекции тяжелых эндо- и экзотоксико-
зов, нарушений гомеостаза и временного замещения функции
жизненно важных органов. Диализ и фильтрация относятся к ме-
тодам временного замещения функции почек по под держанию
баланса жидкости и электролитов, кислотно-основного состоя-
ния, метаболизма и коррекции эндотоксикоза. В этой связи,
естественно, главным показанием к их применению является
острая почечная недостаточность либо в виде самостоятельно-
го критического синдрома, либо как компонента синдрома по-
лиорганной недостаточности.
В настоящее время известно, что прогноз ОПН, СПОН за-
висит от исходного состояния пациента, количества органов,
вовлеченных в патологический процесс, метода и режимов про-
ведения ЭКД, характеристики гемодиафильтров и ряда других
факторов. Bellomo R. and Ronco С. в обзоре «Acute Renal Failure
in the Intensive Care Unit: Which Treatment Is Best?» приводит сум-
мированные результаты лечения ОПН различными авторами и
методами ЭКД (см. табл. 4.18). Стандартный гемодиализ приме-
нен у 482 больных, из них выжили 167 (34,6 %), постоянные ме-
тоды внепочечного очищения крови (ПАВГФ, ПВВГФ, ПАВГД,
ПВВГД) применены у 1131 больного, из них выжили 450 (39,8 %).
Как следует из приведенных данных, выживаемость больных
с ОПН находится в пределах от 6,9— 11,6 до 60,6 % и зависит, по мне-
нию многочисленных исследований, от целого ряда причин.
458
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
Таблица 4.18
Автор Год Метод ЭКД Число больных Число (%) выживших больных
KierdorfS. 1991 ГД 73 5 (6,9)
McDonald В. and Mehta R. 1991 ГД 10 3(30)
Schaefer H. et al. 1991 ГД 134 58 (43,3)
Berisa F. et al. 1990 ГД 59 25 (42,4)
Spiegel D. et al. 1991 ГД 43 5(11,6)
Ishitani M. et al. 1993 ГД 33 20 (60,6)
Bellomo R. et al. 1992 ГД 80 24 (30)
Frost L. et al. 1991 ГД 50 27 (54)
Pataca M.et al. 1992 ПАВГД 1 33 18(54,5)
AlarabiA. etal. 1993 ПАВГД 43 26 (60,5)
Badouin S. et al. 1993 ПВВГФ 35 6(17)
Tominaga G. et al. 1993 ПАВГД 26 9 (34,6)
Vesconi S. et al. 1993 ПВВГФ 18 8 (44,4)
Reynolds H. et al. 1991 ПАВГД 28 5 (17,9)
Barton I. et al. 1993 ПВВГФ 250 132 (53)
Storck M. et al. 1991 ПАВГФ/ПВВГФ 120 20 (16,7)
Bellomo R. et al. 1993 ПАВГД/ПВВГД ПО 42 (38,2)
Alarabi A. et al. 1991 ПАВГФ 112 58 (51,2)
Sluiter H. et al. 1991 ПАВГФ 89 39 (43,8)
Keller E. et al. 1991 ПАВГД 26 4 (15,4)
Keusch G. et al. 1991 ПАВГФ/ПВВГФ 49 18 (36,7)
Так, тип диализной мембраны, по мнению Schifil Н. et al.,
играет существенную роль для прогноза ОПН у критических
больных. Автором были изучены результаты лечения бикарбо-
натным диализом 76 больных с ОПН, в том числе 59 с послео-
перационной почечной недостаточностью. У 38 (50 %) пациен-
тов были использованы диализаторы с мембраной из купрофа-
на (1-я группа) и у 38 (50 %) — из полиакрилонитрила (PAN).
Выявлены достоверно лучшие результаты по восстановлению
459
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
функции почек и госпитальной выживаемости в группе боль-
ных, леченных с помощью биосовместимой мембраны PAN.
В 1 -й группе восстановление функции почек наступило у 23 %,
во второй — у 58 % больных (р < 0,05). Летальность в 1-й груп-
пе — 66 %, во второй — 37 % (Р < 0,05).
Bellomo R. et al. изучали результаты лечения ОПН как ком-
понента синдрома полиорганнной недостаточности у больных
с сепсисом в зависимости от тяжести исходного состояния (шка-
ла APACHE II) и примененных методов внепочечного очище-
ния крови (постоянная гемодиафильтрация — 87 пациентов,
традиционнный ГД — 40 пациентов). Показано, что при APAC-
HE II < 30 выживаемость достоверно выше в группе больных, ле-
ченных постоянной гемодиафильтрацией, по сравнению с груп-
пой больных, леченных традиционным ГД (51,2 и 26,6 % соот-
ветственно).
Maher E.R. et al. изучали результаты выживаемости среди
90 больных с ОПН в зависимости от тяжести исходного со-
стояния, применяемых методов интенсивной терапии.
33 % пациентов переведены из отделения интенсивной терапии,
госпитальная выживаемость — 24 %. Метод внепочечного очи-
щения крови не влиял на выживаемость, однако дополнитель-
ный машинный гемодиализ потребовался 33 из 65 пациентов,
леченных ПАВГФ, и не одному из 22, леченных ПГДФ (р <
< 0,001). Артериальная гипотензия, необходимость инотропной
поддержки, олигоурия и сепсис значительно ухудшали прогноз
ОПН. APACHE II Score при поступлении хорошо предсказы-
вала выживаемость. Среди пациентов с APACHE II Score > 40
выживших не было, по сравнению с выжившими 40 % больных,
у которых APACHE II была 10—19. Авторы предлагают исполь-
зовать APACHE II Score для последуюшего сравнительного
анализа результатов лечения больных с ОПН в различных ле-
чебных учреждениях.
Barton I.K. (1993), изучив результаты лечения 250 больных
с ОПН постоянной гемофильтрацией (общая выживаемость —
53 %), выявил, что исход заболевания был связан с возрастом,
необходимостью использования ИВЛ и катехоламинов, объемом
мочи (анурия, олигоурия), метаболическим ацидозом, уровнем
билирубинемии.
460
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ
Storck М. et al. изучали результаты лечения 116 больных с
ОПН в зависимости от суточного объема удаляемого ультра-
фильтрата. Использовали постоянную спонтанную артериове-
нозную гемофильтрацию (суточный объем 7 ± 0,4 л ультра-
фильтрата) и постоянную высокопоточную (кровяная помпа) ар-
териовенозную гемофильтрацию (суточный объем 15,6 ± 1,9 л
ультрафильтрата). Оба метода адекватно контролировали азоте-
мию и водно-электролитный гомеостаз. Выживаемость боль-
ных ОПН коррелировала с суточным объемом ультрафильтра-
ции и была значительно выше в группе больных, у которых ис-
пользовали кровяную помпу (29,4 %), по сравнению с больны-
ми, которых лечили спонтанной гемофильтрацией (12,5 %).
Frost L. et al. приводят результаты лечения 68 пациентов с
ОПН, что составило 3,4 % от всех оперированных на «открытом
сердце». Половина всех смертей произошла в первые несколь-
ко послеоперационных суток и была обусловлена синдромом
низкого сердечного выброса и прогрессированием синдрома
полиорганной недостаточности. Госпитальная смертность соста-
вила 63 %.
Baudouin S. et al. приводят результаты лечения 35 пациен-
тов, которым после операций на «открытом сердце» потребова-
лось проведение ГФ для лечения ОПН (2,7 % от общего коли-
чества оперированных в условиях ИК). 26 пациентов (74 %)
умерли во время пребывания в отделении интенсивной терапии.
Еще 3 пациента умерли во время нахождения в госпитале после
перевода из ОИТ. Исход заболевания был особенно неблаго-
приятным у пациентов с послеоперационной сердечно-сосуди-
стой недостаточностью (16 пациентов, 0 выживших). Выжива-
емость определялась числом поврежденных органов в начале
лечения ГФ. Так, выжили 100 % пациентов с недостаточностью
одной системы и лишь 10 % пациентов с недостаточностью трех
и более систем организма.
Представленные многочисленные литературные данные
характеризуют гемодиализ и гемофильтрацию как методы, по-
зволяющие замещать функцию почек при острой почечной не-
достаточности и синдроме полиорганной недостаточности, эли-
минировать циркулирующие патологические субстанции при
эндотоксикозах, корригировать нарушения гомеостаза и актив-
461
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
но воздействовать на функцию жизненно важных органов и си-
стем организма, в первую очередь на кардиореспираторную си-
стему критически тяжелых больных. В настоящее время пробле-
ма применения этих высокоэффективных методов внепочеч-
ного очищения крови, безусловно, нуждается в дальнейшей раз-
работке для уточнения показаний и противопоказаний, кор-
ректировки режимов процедуры, разработки принципов диффе-
ренцированного их применения у различных категорий больных.
Список основной литературы
1. Банкетов Я.В. Клинические аспекты применения пери-
тонеального диализа у детей с острой почечной недостаточ-
ностью после коррекции врожденных пороков сердца:
Дис.... канд. мед. наук. М., 2002.
2. Бирюкова Л.С. Острая почечная недостаточность в гема-
тологической практике: Дис.... д-ра. мед. наук. М., 2002.
3. Григорянц Р.Г. Заместительная почечная терапия в перио-
перационном периоде у критичеки тяжелых пациентов с за-
болеваниями сердца и сосудов: Дис. ... д-ра мед. наук.
М., 2002.
4. Никифоров Ю. В., Грязнов С. В. Гемодинамические аспек-
ты применения гемодиализа и гемофильтрации у больных
с сидромом низкого сердечного выброса в послеопераци-
онном периоде //Анестезиология и реаниматология. 1994.
№ 1. С. 22-27.
5. Никифоров Ю.В., Лебедева Р.Н., Грязнов С.В. Применение
изолированной ультрафильтрации для лечения застойной
недостаточности кровообращения // Анестезиология и ре-
аниматология. 1994. № 2, С. 47—50.
6. Никифоров Ю.В., Грязнов С.В. Механизмы экстракорпо-
рального воздействия гемофильтрации на систему крово-
обращения больных, оперированных на «открытом серд-
це». // Анестезиология и реаниматология. 1995. № 1.
С. 25-28.
7. Никифоров Ю.В., Тугаринов С.А., Кислухин В.Н. Динами-
ка показателя объема внесосудистой жидкости легких при
проведении экстракорпоральной детоксикации у больных
462
ГЛАВА 4. ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ________________
в критических состояниях // Анестезиология и реанимато-
логия. 1995. № 2. С. 89—91.
8. Никифоров Ю.В., Максименко В.А., Чудаков И.Е. Крите-
рии выбора метода эктракорпоральной детоксикации у
больных с послеоперационной почечной недостаточно-
стью И Анестезиология и реаниматология. 1995. № 4.
С. 38-41.
9. Никифоров Ю.В., Чудаков И.Е. Непрерывная гемодиа-
фильтрация // Анестезиология и реаниматология. 1996.
№ 3. С. 60-63.
10. Никифоров Ю.В., Лебедева Р.Н., Чудаков И.Е., Гряз-
нов С.В. Внепочечное очищение крови у больных с поли-
органной недостаточностью: результаты, прогностические
критерии //Анестезиология и реаниматология. 1997. № 3.
С. 42-45.
11. Никифоров Ю.В., Лебедева Р.Н. Фармакологическая кор-
рекция низкого сердечного выброса при проведении гемо-
фильтрации // Анестезиология и реаниматология. 1997.
№ 3. С. 87-89.
12. Никифоров Ю.В. 1азообменная функция легких у больных
с полиорганной недостаточностью при проведении гемо-
фильтрации // Анестезиология и реаниматология. 1995.
№ 2. С. 57-59.
13. Никифоров Ю.В., Кислухин В.В. Новоые методы опреде-
ления сердечного выброса при проведении экстракорпо-
ральной детоксикации // Анестезиология и реаниматоло-
гия. 2003. № 3. С. 57-59.
14. Рахимов А.Т. Диагностика и интенсивная терапия наруше-
ний нереспираторных функций легких у больных с острой
почечной и печеночной недостаточностью: Дис. ... д-ра
мед. наук. М., 2001.
15. Яковлева И.И. Экстракорпоральное очищение крови в па-
тогенетической терапии сепсиса и септического шока:
Дис.... д-ра мед. наук. М., 2002.
16. Barenbrock М., Hausberg М., Matzkies М. et al. Effect of bi-
carbonate and lactate-buffered replacement fluidson cardiovas-
cular outcome in CWH patients // Kidney International. 2000.
Vol. 58. P. 1751-1757.
463
_________________________ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
17. Daugirdas J., Blake Р., Ing Т. Handbook of Dialysis. 2001.
18. Manns M., Sigler M. and Teehan B. Continous renal replace-
ment therapies. An update. // Am J. Kidney Dis. 1998. Vol. 32.
P. 185-207.
19. Murrey P.T. Use of dopaminergetic Agonist for renal protection
in the ICU // Yearbook of Intensive Care and Emergency Me-
dicine. 2003. P. 637—648.
20. Ronco C., Artigas A., Bellomo R. Circulation in native and ar-
tificial kidneys. 1997.
21. Tetta C., Bellomo R., Ronco C. Interpreting the mechanisms of
CRRT in sepsis: the peak concentration hypothesis // Yearbo-
ok of Intensive Care and Emergency Medicine. 2003. P. 649—662.
ГЛАВА5
Плазмаферез при неотложных
состояниях в хирургической
клинике
Одним из первых методов экстракорпоральной детокси-
кации (ЭКД) является плазмаферез. Так же, как и метод
гемодиализа, плазмаферез впервые был внедрен в кли-
ническую практику в середине 40-х годов XX века. Пик приме-
нения ПФ в России пришелся на конец 70-х — 80-е годы XX сто-
летия.
ПФ относится к гравитационным методам ЭКД, основан-
ным на центрифугирповании. Принцип метода состоит в том, что
при центрифугировании, когда на кровь воздействуют центро-
бежные силы, форменные элементы располагаются слоями во-
круг оси вращения. Наиболее плотные клетки оказываются на
периферии (эритроциты), ближе к центру будут клетки, имею-
щие меньшую плотность (лейкоциты, затем тромбоциты).
В центре делительной камеры остается чистая плазма, которая
в случае проведения терапевтического ПФ удаляется целиком,
со всеми содержащимися в ней физиологическими и токсиче-
скими компонентами и замещается свежезамороженной донор-
ской или кровезаменителями. Таким образом, ПФ расценивает-
ся как универсальный эфферентный метод, позволяющий воз-
действовать на токсические субстраты любой природы, молеку-
лярной массы, электрохимического заряда. Хотя плазмаферез
традиционно относят к гравитационным эфферентным методам,
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
за последние годы широкое распространение получили плазмен-
ные мембранные фильтры, позволяющие отделять жидкую часть
крови от ее форменных элементов.
ПФ обладает выраженным детоксикационным, иммуно-
модулирующим, деплазмирующим, а также дренирующим дей-
ствиями, что позволяет воздействовать на все жидкостные про-
странства организма (внутриклеточное, межклеточное, внутри-
сосудистое). ПФ позволяет воздействовать на структуру кле-
точных мембран эритроцитов, тромбоцитов и лейкоцитов. От-
мечается, что суммарное детоксикационное действие ПФ, его
воздействие на реологию и иммунитет по сравнению с другими
эфферентными методами существенно выше.
ПФ может выступать как самостоятельный метод ЭКД, так
и являться частью детоксикационных мероприятий, если плаз-
ма, полученная путем плазмафереза, будет подвергнута сорбции,
фильтрации, преципитации или другим воздействиям.
Свои особенности имеет такой вариант ПФ, как плазмооб-
мен, когда удаляется не менее одного расчетного объема циркули-
рующей плазмы, которая не менее чем на 70 % от удаленного объе-
ма замещается свежезамороженной донорской или 5 %-ным раство-
ром альбумина. Этот вариант ПФ обычно используется для борь-
бы с синдромом эндогенной интоксикации.
Плазмаферез и плазмообмен относят к группе неселектив-
ных методов экстракорпоральной детоксикации. Между тем толь-
ко эти ЭКметоды эффективны при эндотоксикозах, вызванных па-
тологическими субстратами высокомолекулярной природы, или
политоксикозах, когда причиной патологического состояния явля-
ется избыток токсических субстратов различной молекулярной
массы.
В настоящее время все большее распространение получают
методы селективного ПФ, основанные на криогепариновой преци-
питации. Методики селективного ПФ позволяют не только повы-
сить эффективность процедуры, но и сократить количество
необходимых плазмозамещающих сред.
Метод криоафереза или криогепариновой преципитации
основан на свойстве белка плазмы фибронектина полимеризо-
ваться в присутствии гепарина на холоде и образовывать преци-
питат, в состав которого помимо фибронектина входят цирку-
466
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
пирующие иммунные комплексы, иммуноглобулины М, А и G,
криоглобулины, фибриноген, СЗ-компонент комплемента, пе-
рекисно-модифицированные липопротеиды, фактор Вилле-
бранда. Метод позволяет удалять из плазмы от 30 до 50 % пере-
численных веществ, более 80 % криоглобулинов, около 90 %
фибронектина при сохранении до 85-90 % альбумина. Таким об-
разом, селективный ПФ повышает иммунокорригирующее и
реокорригирующее действия метода и уменьшает вероятность
осложнений, связанных с плазмозамещением.
По вполне понятным причинам плазмаферез имеет вполне
широкое клиническое применение и занял прочное место в ле-
чении целого ряда заболеваний самой различной природы. Пра-
вда, следует отметить, что бум увлечения этим методом постепен-
но проходит, и круг показаний к ПФ сужается. В клинике опре-
деляются вполне конкретные ситуации, когда необходим тот
или иной метод ЭКД с учетом эфферентных возможностей и осо-
бенностей.
В условиях многопрофильного хирургического стационара
приходится сталкиваться с целым рядом ситуаций, когда ПФ как
метод ЭКД по праву становится методом выбора или использу-
ется в комплексе с другими эфферентными методиками. В на-
стоящем разделе представлен опыт наблюдения 250 пациентов,
находившихся на лечении в стенах Российского научного цен-
тра хирургии РАМН в 1990—2002 годах. Было выполнено более
500 сеансов обменного плазмафереза.
5.1. Экстракорпоральная терапия при сепсисе
Синдром системного воспалительного ответа или сепсис
можно рассматривать как злокачественную форму внутрисосу-
дистого воспаления, критический эндотоксикоз. Процесс раз-
вивается в организме в случаях активации хронической микро-
флоры, попадания микрофлоры из вне, в том числе и внутри-
больничной на фоне специфического иммунного ответа.
Для запуска воспалительной реакции требуется воспали-
тельный стимул.
К пусковым воспалительным медиаторам относятся
элементы клеточной стенки бактерий и дрожжей, такие как
467
______________________ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
эндотоксин (липополисахариды), экзотоксины и другие про-
дукты, сосудистый коллаген, поврежденная поверхность эндо-
телия, денатурированные белки вследствие термального пов-
реждения и окислительного стресса. Все эти факторы могут сти-
мулировать воспалительную реакцию. Эти воспалительные ме-
диаторы связываются с поверхностными рецепторами клеток,
способствуя передаче трансмембранного сигнала и индукции
внутриклеточной реакции путем активации ряда специфиче-
ских белков активаторов гена. Многие не связанные между со-
бой экзогенные стимуляторы, такие как активированный ком-
племент (С5а), фактор Хагемана и продукты генерализованно-
го повреждения клеток, могут вызвать синтез иммунокомпе-
тентными клетками (обычно моноцитами) фактора некроза
опухоли альфа и интерлейкинов. Согласно существующей в на-
стоящее время гуморальной теории системного воспалитель-
ного ответа последствием чрезмерной активации воспалитель-
ного ответа организма на внедрение бактериального агента яв-
ляется мощный выброс медиаторов септического процесса (мно-
гие из них не идентифицированы) и стимуляция первичных ре-
акций в клетках-мишенях через механизмы, аналогичные опи-
санным для начальной активации. Медиаторы септического во-
спаления вызывают мощное вазодилатирующее действие с по-
следующим нарушением микроциркуляции, агрегатных свойств
крови и обеспечения тканей организма кислородом. Повреждаю-
щее действие медиаторов септического процесса в первую оче-
редь реализуется в эндотелии сосудов органов-мишеней, таких
как легкие, почки, печень, что выражается в формировании по-
лиорганной недостаточности и диссеминированном внутрисо-
судистом свертывании. Характер активации иммунного ответа
уже с самого начала определяет прогноз данного состояния.
Так, у пациентов с риском развития полиорганной недостаточ-
ности и летального исхода встречается скорее персистирующее
повышение содержания фактора некроза опухоли альфа и ин-
терлейкина-6 в крови, чем максимальные уровни любого из
других специфических цитокинов.
Развитие гуморальной теории сепсиса, согласно которой
медиаторы воспаления, действующие в нормальных условиях
пара- или эндокринным путем, в случае развития тяжелого се-
468
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
псиса или септического шока начинают действовать систем-
ным или эндокринным путем. В этих обстоятельствах возника-
ет состояние иммунной токсемии, требующее очищения крови.
В качестве методов выбора большинство клиницистов исполь-
зуют методы заместительной почечной терапии, в частности
продолженную гемодиафильтрацию (ПГДФ), высокообъемную
гемодиафильтрацию (ГФ). Так, при ПГДФ элиминируется суще-
ственное количество ТНФ а посредством фильтрации и частич-
ной адсорбции на мембране гемофильтра. Развиваются новые
технологии д ля лечения септического шока, в частности, техно-
логии сорбентов. В Японии эта технология включает гемопер-
фузию с полимиксином В, а в Европе — двойную плазмофильт-
рационную адсорбцию.
Активно изучаются методы поддержки печени д ля очище-
ния крови, использующие системы, основанные на фильтра-
ции через древесный уголь и на мембранном разделении, а так-
же другие системы, применяющие повторное использование
диализата на основе альбумина (так называемые системы МАРС).
Эфферентные воздействия при сепсисе направлены на уда-
ление из организма экзо- и эндотоксинов, антител и иммун-
ных комплексов, продуктов патологического метаболизма, ком-
понентов старых, разрушенных и дефектных клеток и выделя-
емых ими ферментов, гормонов, пептидов, кининов и других ток-
сичных и биологически активных веществ, продуктов жизнедея-
тельности микроорганизмов, выделяемых ими токсических суб-
стратов и самих бактерий.
Плазмаферез также может быть использован как патогене-
тический метод лечения сепсиса с целью удаления всех извест-
ных и неизвестных медиаторов септического процесса из систе-
мы кровообращения и межуточного пространства., а также всех
перечисленных выше субстратов. При этом уровень летальности
снижается почти на 20 %.
Обязательным условием успешного применения ПФ у боль-
ных с хирургическими эндотоксикозами и сепсисом в том числе
является тщательная санация всех гнойных очагов. Это прави-
ло касается не только плазмафереза. Любому варианту эфферент-
ной детоксикационной терапии должно предшествовать хирур-
гическое или эндоскопическое вмешательство, направленное
469
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
на санацию первичного гнойного очага (абсцесса, медиастини-
та, перитонита, панкреатита, эмпиемы плевры и других).
Помимо этого, проведению эфферентной терапии должна
предшествовать активная инфузионная терапия, направленная
на коррекцию нарушений КЩС, водно-электролитного балан-
са, онкотического давления, показателей гемостаза, восполне-
ние ОЦК и улучшение реологических свойств крови. Следует воз-
держаться от эфферентных методов лечения больных с крайне
тяжелыми, некорригируемыми гиповолемическими наруше-
ниями.
Согласно принятой тактике эфферентной терапии плазма-
ферез при сепсисе носит характер обменного. Однократные
объемы плазмозамещения должны приближаться к объему цир-
кулирующей плазмы, а замещение следует выполнять свежеза-
мороженной донорской, желательно гипериммунной (с учетом
результатов бактериологического посева из первичного очага и
крови) плазмой, что позволяет нормализовать гомеостаз. Коли-
чество плазмообменов определяется тяжестью исходного со-
стояния больного и динамикой процесса.
В силу возможного переноса токсинов на мембранах эритро-
цитов ПФ при сепсисе может сочетаться с отмыванием реинфу-
зируемых эритроцитов физиологическим раствором. Одним из
вариантов селективного ПФ в данной ситуации может быть
криоаферез, который позволит сохранить в кровяном русле оп-
тимальную концентрацию вводимых лекарственных препаратов,
сократить количество необходимой донорской плазмы и тем
самым снизить вероятность осложнений данного эфферентно-
го метода.
Следует отметить, что в клинической практике достаточно
часто встречаются ситуации, когда выполнить плазмообмен в
адекватном объеме не представляется возможным. Особенно
часто это наблюдается в кардиохирургии, после операций с ис-
кусственным кровообращением. Сердечно-сосудистая недоста-
точность на фоне перенесенного оперативного вмешательства,
осложненного послеоперационного течения, циркуляторных
расстройств, бактериальной инвазии усугубляется вазодилата-
цией, нарушениями сосудистой проницаемости, гемостазом,
вызванными развившимся политоксикозом. В ряде случаев эти
470
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
нарушения настолько выражены, что наблюдается резкое сни-
жение центральной и периферической гемодинамики, гипото-
ния, низкий уровень центрального венозного давления, отеч-
ность мягких тканей. Введение коллоидных кровезаменителей,
в том числе альбумина, не приводит к желаемому результату.
Параллельно развиваются нарушения свертывающей системы
крови — от явлений гиперкоагуляции до диссеминированного
внутрисосудистого свертывания и гипокоагуляционных крово-
течений. В начальных стадиях сепсис часто манифестируется вы-
сокими цифрами фибриногена (до 1000—1200 мг%) и тромбоци-
тов (до 600—800 х 10) с активацией их агрегационной функции.
Такие нарушения свертывающей системы у пациентов, пере-
несших операции на артериях небольшого диаметра (коронар-
ных, дистальных артериях конечностей) опасны тромбозами
оперированных сосудов и острой ишемией оперированной зо-
ны (острый инфаркт миокарда, острая ишемия нижних конеч-
ностей). Введение низкомолекулярного гепарина в подобной
ситуации недостаточно эффективно.
В подобной ситуации задачей эфферентной терапии стано-
вится не только борьба с септическим эндотоксикозом, но и
профилактика возможных осложнений септического процесса.
В условиях сосудистой недостаточности, низкой гемоди-
намики, гиперкоагуляции даже при пункции крупных централь-
ных вен (яремной или подключичной) и достаточном диаметре
катетера (1,6 и выше) часто не удается добиться ни спонтанно-
го тока крови во флакон или пластиковый контейнер, ни адекват-
ного потока во фракционаторе крови. Используя сепараторы
крови прерывистого действия, в течение 3—5 ч удается удалить
не более 700—1000 мл плазмы, что явно недостаточно для пол-
ноценной детоксикации.
Многолетний опыт проведения экстракорпоральной тера-
пии у крайне тяжелого контингента больных, в том числе опе-
рированных на коронарных ветвях, аорте, после серьезных ре-
конструктивных вмешательств, продемонстрировал, что в подоб-
ных случаях более эффективно сочетание нескольких экстракор-
польных методов, например, плазма- и цитафереза и ультра-
фиолетового облучения крови. В ходе одной процедуры удаля-
ется 300—400 мл плазмы или плазмы, обогащенной тромбоци-
471
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
тами. Реинфузируемая эритромасса подвергается ультрафиоле-
товому облучению в аппарате с длинноволновым спектром облу-
чения (350—400 нм; Иг-3, Юлия-4, Воронеж). Курс лечения в ос-
тром периоде сепсиса состоит из 3—5 процедур.
При использовании такой методики экстракорпоральной
гемокоррекции в большинстве случаев наблюдается быстрая по-
ложительная динамика клинико-лабораторных показателей:
нормализация температуры, ликвидация мозговых явлений,
улучшение состояния первичного гнойного очага, положитель-
ные гематологические и иммунные сдвиги, уровень средних мо-
лекул снижается вдвое по сравнению с исходным. Такая щадящая
экстракорпоральная методика позволяет справиться с гиперко-
агуляцией и предупредить септический тромбоз коронарных
шунтов и других сосудов. Уровень фибриногена на фоне ЭК те-
рапии, введения фраксипарина и других консервативных меро-
приятий снижается в 2—3 раза, уровень тромбоцитов — в 2 раза.
Одновременно такая методика ЭК гемокоррекции не пре-
пятствует проведению адекватной терапии антибактериальны-
ми препаратами и иммунокорректорами (пентоглобином, им-
мунофаном, гипериммунной плазмой и другими), так как не
оказывает отрицательного влияния на концентрацию лекар-
ственных веществ в крови. Проведение антибактериальной и им-
муностимулирующей терапии медикаментозными средствами
и ультрафиолетовыми лучами длинноволнового спектра обес-
печивает выраженный бактериостатический и бактерицидный
эффекты и стимуляцию собственных детоксикационных си-
стем организма. В том числе его иммунных функций. Исполь-
зуемый метод позволяет в 100 % случаев избежать таких опас-
ных для больного осложнений, как коагулопатические и хи-
рургические кровотечения. Использование комплексной эк-
стракорпоральной методики позволяет добиться выздоровления
в 88 % случаев, тогда как использование стандартного плазма-
фереза с удалением за одну процедуру 700—1200 мл плазмы —
только в половине случаев.
Одновременное использование нескольких экстракорпо-
ральных методов является современной тенденцией ЭК медици-
ны. Сочетанные и комбинированные методики направлены на:
• повышение эффективности ЭК воздействия;
472
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
• сокращение объема крови, подвергаемой ЭК обработке;
• снижение вероятности осложнений, связанных с ЭК ме-
тодом.
В настоящем разделе упоминалось, что при сепсисе могут
использоваться диализные, фильтрационные, гравитационные,
гемоквантовые ЭК методы. В литературе имеются сведения о
применении ксеносорбции и ксеноперфузии и ряда других. К со-
жалению, несмотря на все многообразие возможных ЭК мето-
дик, окончательного протокола экстракорпоральной терапии
при сепсисе и септическом шоке до настоящего времени не су-
ществует. Все имеющиеся разработки весьма перспективны и ин-
тересны, и существует надежда на их широкое распространение,
несмотря на то что технологии очистки крови по-прежнему ос-
таются очень сложными с технической точки зрения. Все суще-
ствующие ЭК методики, используемые при сепсисе, ждут про-
ведения серьезных рандомизирпованных контролируемых иссле-
дований.
5.2. Плазмаферез при полиорганной
недостаточности
Полиорганная недостаточность (ПОН) может возникнуть в
результате любого тяжелого стресса: множественной травмы,
кровопотери, кардиогенного или ожогового шока, сепсиса, ин-
фекционного заболевания, экзогенной интоксикации и по дру-
гим причинам. Кроме того, причиной ПОН могут служить пе-
реливание больших количеств консервированной крови, особен-
но длительных сроков хранения, недостаточно квалифицирован-
ное проведение искусственной вентиляции легких и другие фак-
торы. В хирургии одной из основных причин развития ПОН
являются инфекционные осложнения, вызывающие наруше-
ние иммунного статуса больных, метаболизма, а также системы
гемостаза. ПОН осложняет течение послеоперационного пе-
риода при экстренных операциях в 7—22 % случаев. При гной-
ных осложнениях острых воспалительных заболеваний органов
брюшной полости его частота достигает 50 % .
Важное значение в этиологии ПОН имеют массивная кро-
вопотеря, гиповолемический шок и массивное переливание
473
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
крови. К развитию ПОН может приводить синдром постишеми-
ческих нарушений, развивающийся после включения в крово-
ток больших сегментов конечностей, находящихся ранее в со-
стоянии длительной критической ишемии, или после репланта-
ции ампутированного фрагмента конечности.
Помимо указанных состояний, пусковым механизмом па-
тологических процессов, приводящих к ПОН, могут быть цир-
куляторные расстройства во время или после операции, перио-
перационный инфаркт миокарда, анафилактический шок, син-
дром диссеминированного внутрисосудистого свертывания, ос-
трый внутрисосудистый гемолиз, опухолевая непроходимость
желчевыводящих путей с выраженной механической желтухой,
острый вирусный гепатит, терминальная стадия хронического ге-
патита или цирроза печени, криз отторжения печеночного транс-
плантата, терминальная стадия хронической почечной недо-
статочности и многие другие состояния.
В основе развития синдрома ПОН у больных, оперирован-
ных на сердце и крупных сосудах в условиях искусственного
кровообращения, лежит, как правило, шок различной этиологии,
синдром массивной кровопотери и гемотрансфузии, синдром ос-
трого повреждения легких и респираторный дистресс-синдром,
длительный период искусственного кровообращения и ишемии
миокарда, острый внутрисосудистый гемолиз, сепсис.
Прогноз при развитии синдрома полиорганной недоста-
точности зависит от степени дисфункции и количества поражен-
ных органов. При сочетанном поражении двух органов смерт-
ность достигает 30—40 %, четырех — 90—100 %. Развитие в по-
слеоперационном периоде ПОН является основной причиной
летальности кардиохирургических больных. Наиболее тяжелы-
ми вариантами ПОН, приводящими к летальному исходу, явля-
ются комбинация почечной недостаточности с дыхательной или
дыхательной недостаточности с тяжелыми метаболическими
нарушениями.
На степень нарушения функции органов влияют исходное
состояние органа, толерантность его к повреждению и интенсив-
ность воздействия повреждающего фактора. Поражение органов
происходит одновременно, но клинически сразу не проявляет-
ся. В силу малой чувствительности методов оценки функции
474
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
отдельных органов и систем ПОН диагностируется только в ста-
дии декомпенсации, когда лечебные меры малоэффективны.
Некоторые авторы считают, что недостаточность одного органа
индуцирует поражение других с постепенным вовлечением их в
патологический процесс. Значительную роль в формировании
синдрома ПОН играет нарушение процессов регуляции агрегат-
ного состояния крови, а именно развитие гиперкоагуляции.
Клинические проявления данного осложнения обусловле-
ны нарушениями сердечно-сосудистой, дыхательной, централь-
ной нервной систем, функции печени, почек, а также систем ге-
мостаза и обмена веществ в целом. В структуре синдрома ПОН
наиболее часто встречается повреждение легких. Дыхательная не-
достаточность наблюдается у 65,3 % больных, сердечно-сосуди-
стая и почечная — у 60,2 %, печеночная — у 56,1 %. Впервые кли-
ническая картина прогрессирующей ПОН у тяжелых хирурги-
ческих больных была описана Вайе А.Е. в 1969 году.
Течение синдрома ПОН характеризуется 4 стадиями в зави-
симости от тяжести нарушения функции различных органов и
систем.
На первой стадии осложнения клинических проявлений
практически нет. Однако при тщательном и целенаправленном
исследовании можно обнаружить изменения со стороны сердеч-
но-сосудистой системы, почек. Умеренный респираторный ал-
калоз, увеличение потребности организма в инсулине.
На второй стадии осложнения выявляются клинические
симптомы. Время наступления второй стадии колеблется от 3 до
8 дней в зависимости от тяжести течения синдрома. Возможно,
гораздо более быстрое течение процесса. При обследовании
больных обнаруживаются различные гемодинамические рас-
стройства, обусловленные гипердинамической реакцией сер-
дечно-сосудистой системы: гипоксия, незначительная азоте-
мия, тяжелые катаболические сдвиги. Могут отмечаться желту-
ха, лейкоцитоз, тромбоцитопения. Лимфопения, а также различ-
ные расстройства центральной нервной системы.
Третья стадия ПОН характеризуется нарастанием вышеука-
занных нарушений, присоединяются тромбогеморрагический
синдром, метаболический ацидоз, гипергликемия, снижается
сердечный выброс.
475
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Четвертая стадия синдрома ПОН — терминальная.
Эта клиническая классификация весьма условна, так как не
всегда обнаруживаются все описанные нарушения. Часть из них
может являться симптомами основного заболевания или со-
стояния, вызвавшего развитие осложнения. Функциональные
сдвиги нередко протекают скрыто и клинические симптомы
выявляются только в стадии необратимой декомпенсации.
В клинической практике диагноз синдрома ПОН ставится
только на второй-третьей стадиях, то есть уже при наличии чет-
ких клинических симптомов недостаточности органов.
Трудность диагностики, сложность и недостаточная изу-
ченность патогенеза определили необходимость комплексного
подхода к лечению синдрома ПОН. Основные принципы тера-
пии синдрома ПОН зависят от его формы и степени выражен-
ности и включают попытки проведения патогенетической тера-
пии. Первостепенным компонентом терапии является устра-
нение основного этиологического фактора, а при наличии гной-
но-септического очага необходимы его неотложная адекватная
санация и дренирование.
Одновременно выполняют коррекцию расстройств гемоди-
намики, газообмена, метаболических нарушений, а также воз-
действуют непосредственно на функцию пораженных органов.
Лечебные мероприятия должны включать коррекцию микроцир-
куляции, реологических свойств крови, искусственное лечебное
питание — парентеральное или энтерально-зондовое. Медика-
ментозная терапия в основном направлена на ингибирование ли-
зосомальных ферментов, подавление синтеза биологически ак-
тивных веществ, нормализацию процессов фибринолиза. Еще
один аспект терапии синдрома ПОН — удаление повреждающих
факторов и моделирование функции поврежденных органов с по-
мощью методов экстракорпоральной детоксикации.
Методы экстракорпоральной детоксикации в настоящее
время являются едва ли не главным компонентом комплекс-
ной терапии синдрома ПОН, использование этих методов позво-
ляет значительно снизить летальность при данной патологии. ЭК
методы направлены не только на механическое удаление повреж-
дающих факторов, но и на частичное протезирование жизнен-
но важных функций поврежденных органов. Исходя из много-
476
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
образия функций поврежденных органов совершенно одноз-
начно можно предполагать, что в зависимости от преобладаю-
щего поражения того или иного органа следует использовать
тот или иной способ экстракорпоральной детоксикации или
совокупность нескольких методов. Еще одним определяющим
фактором является степень органной дисфункции.
При шоковом легком обязательно используется метод искус-
ственной вентиляции легких. Из ЭК методов предпочтительна ге-
мофильтрация, эффективность которой обусловлена удалени-
ем медиаторов и среднемолекулярных токсинов, вызывающих ра-
звитие повышенной проницаемости микрососудов легких, уме-
ньшением объема внесосудистой жидкости в легких, а также
улучшением показателей кислородтранспортной функции кро-
ви. Объем фильтрата должен составлять не менее 20 л при дефи-
ците восполнения. Наибольшая эффективность процедуры до-
стигается на фоне параллельного введения нитратов (нитролин-
гвал, перлинганит) под контролем системной гемодинамики.
Эти препараты снижают давление в системе легочной артерии и
способствуют улучшению перфузионных процессов в легких.
Плазмаферез показан при острой печеночной и начальных
стадиях острой почечной недостаточности, обусловленной пре-
ренальными факторами. Этот метод ЭКД позволяет справить-
ся с повышенным уровнем трансаминаз, даже если их количе-
ство почти в 100 раз превышает нормальные значения, а также
корригировать содержание желчных пигментов. Кроме того,
отмечается коррекция нарушенной белоксинтезирующей функ-
ции печени, частичная элиминация азотистых метаболитов.
Эффективность плазмафереза в данном случае однозначно
определяется объемом и характером плазмозамещения. Объем
удаляемой плазмы может быть рекомендован в пределах
1,5—2 ОЦП, плазмозамещения — с положительным балансом по
белку. Развитие более совершенных ЭК технологий, по-видимо-
му, приведет к тому, что вместо ПФ в подобных ситуациях будет
использоваться система очистки крови МАРС, однако пока это
время еще не наступило.
При сформировавшейся острой почечной недостаточно-
сти проведение ПФ нецелесообразно, поскольку возмещение
эксфузированного объема плазмы белковыми препаратами не-
477
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
избежно приведет к нарастанию азотемии. В данной ситуации
предпочтительнее проведение гемофильтрации, как наиболее ща-
дящего метода. ГФ способствует коррекции таких важнейших по-
казателей гомеостаза, как pH крови и осмолярность плазмы,
позволяет удалять большое количество токсинов среднемолеку-
лярной массы.
Гиперкалиемия свыше 6—7 ммоль/л является показанием к
гемодиализу.
ЭК методы детоксикации наиболее эффективны в случае
раннего их включения в комплекс терапии синдрома ПОН. Ран-
нее начало эфферентных мероприятий позволяет снизить леталь-
ность при синдроме ПОН практически вдвое. Кроме того, эф-
ферентная терапия может быть методом профилактики разви-
тия полиорганной дисфункции и диссеминированного внутри-
сосудистого свертывания.
Плазмаферез как способ экстракорпоральной детоксикации
может быть методом профилактики синдрома полиорганной
недостаточности после осложненных операций с искусственным
кровообращением, если он выполняется в первые послеопера-
ционные часы, сразу после поступления пациента в отделение
кардиологической реанимации. Показаниями к такому ранне-
му ПФ являются следующие осложнения оперативного вмеша-
тельства на открытом сердце:
— кардиогенный шок;
— интраоперационный инфаркт миокарда;
— интраоперационный внутрисосудистый гемолиз;
— интраоперационные анафилактические осложнения
(чаще всего возникают на переливание свежезамороженной
плазмы, протамина сульфата);
— длительное искусственное кровообращение (4—6 ч);
— массивная кровопотеря (более 4 л — 1 ОЦК) с массив-
ным кровезамещением;
— раннее послеоперационное кровотечение с последую-
щей рестернотомией;
— интраоперационный ДВС-синдром;
— два и более перечисленных осложнения.
Перечисленные осложнения встречаются в 3—5 % операций,
выполняемых в условиях искусственного кровообращения. Все
478
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
эти состояния приводят к накоплению в тканях и кровяном ру-
сле различного рода метаболитов, биологически активных ве-
ществ, тканевого фактора и фактора некроза опухоли, продук-
тов тканевого и клеточного распада, недоокисленных продуктов
межуточного обмена, создавая таким образом показания для
срочной эфферентной терапии.
Первые признаки синдрома ПОН (легочная и сердечно-
сосудистая) развиваются уже к концу оперативного вмешатель-
ства. В первые послеоперационные сутки присоединяется кар-
тина печеночной и почечной дисфункций, на вторые-третьи
послеоперационные сутки наблюдается выраженная клиниче-
ская и лабораторная картина ПОН с поражением не менее
3—5 органов. Эффективность всех лечебных мероприятий при
этом резко снижается, создается угроза развития генерализован-
ной инфекции.
Ранний ПФ при осложнениях подобного рода целесооб-
разно выполнять в объеме 1500—3000 мл или 0,5—1,0 объема
циркулирующей плазмы, рассчитанного на момент поступления
больного в отделение реанимации на основании его массы те-
ла и исходного гематокрита. Заместительная терапия выполня-
ется в основном свежезамороженной донорской плазмой, частич-
но растворами альбумина.
При такой тактике ранней эфферентной терапии прогрес-
сирование синдрома ПОН отмечено только в 25 % случаев,
развитие септических осложнений — у 19 % больных. Повтор-
ные сеансы плазмафереза выполняются не более чем 50 %
больным самостоятельно или в сочетании с фильтрационны-
ми методами ЭК детоксикации. Несмотря на осложненное те-
чение оперативного вмешательства и тяжелый послеопераци-
онный период, выздоровление отмечено в 75 % случаев, леталь-
ные исходы — в 25 %.
Отсроченное начало эфферентных мероприятий приводит
к тому, что тяжесть полиорганных расстройств быстро прогрес-
сирует, а число летальных исходов возрастает более чем вдвое.
Таким образом, своевременное использование плазмафере-
за в качестве основной детоксикационной терапии при ослож-
ненном течении оперативных вмешательств, выполняемой с
искусственным кровообращением, позволяет существенно улуч-
479
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
шить как течение послеоперационного периода, так и результа-
ты оперативного лечения в целом.
5.3. Плазмаферез при синдроме
диссеминированного внутрисосудистого
свертывания
ДВС-синдрому в настоящей книге посвящена целая глава.
Однако и этот раздел будет неполным без упоминания об этом
серьезном, подчас критическом состоянии, часто встречающем-
ся в хирургической практике.
В предыдущей главе четко показано, что синдром диссеми-
нированного внутрисосудистого свертывания, так же как син-
дром ПОН, всегда вторичен и может быть следствием самых
различных состояний. В их числе опухоли, многие сосудистые
заболевания, инфаркт миокарда, различная гинекологическая па-
тология, хирургические кровотечения, инфекционные заболе-
вания, врожденные пороки сердца, нарушения липидного обме-
на, гемолитические осложнения, массивные повреждения тка-
ней (травмы, обширные операции, синдром длительного разда-
вливания и позиционное сдавление), острые воспалительные за-
болевания органов брюшной полости, сепсис, трансплантация
органов, тканей, костного мозга, шок различной этиологии и
многие другие.
В целом можно сказать, что развитие тяжелого ДВС-синдро-
ма начинается тогда, когда имеется массивная длительная акти-
вация свертывания. В хирургии одной из главных причин разви-
тия этого состояния является массивная кровопотеря и, следо-
вательно, массивная гемотрансфузия.
Кровопотеря сама по себе всегда сопровождается наруше-
ниями гемокоагуляции по типу коагулопатии потребления. Ин-
фузия крови на этом фоне сопровождается ускорением и гене-
рализацией ДВС-синдрома, возникновением спонтанной кро-
воточивости. Больного, как правило, удается застать во второй
фазе ДВС-синдрома — гипокоагуляции. Следствием нарушений
в системе гемостаза является полиорганная недостаточность.
По некоторым литературным данным, после кардиохирургиче-
ских вмешательств признаки ДВС-синдрома выявляются у 40,9 %
480
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
больных. В 72,2 % случаев кардиохирургический ДВС-синдром
протекает с выраженными полиорганными нарушениями.
При острых формах ДВС-синдрома возможен внутрисосу-
дистый гемолиз. Эритроциты, особенно донорские, потеряв-
шие способность к деформации, разрезаются, фрагментируют-
ся нитями фибрина. Развивающаяся анемия имеет сложную
природу и является следствием исходной кровопотери, внутри-
сосудистого гемолиза и продолжающегося кровотечения.
В наиболее общих чертах клинические проявления хирур-
гического ДВС-синдрома складываются из ряда синдромов, в чи-
сле которых:
— тромботические явления;
— геморрагический синдром;
— нарушения микроциркуляции, приводящие к расстрой-
ству функции внутренних органов;
— анемический синдром;
— нарушения гемодинамики.
Эффективность лечения острого ДВС-синдрома и связан-
ных с ним полиорганных расстройств в значительной степени за-
висит от быстроты его распознавания и адекватности проводи-
мых лечебных мероприятий. Терапию ДВС-синдрома следует на-
чинать, ориентируясь на клинические параметры, не дожидаясь
результатов лабораторных анализов.
Известны работы, свидетельствующие об успешной терапии
ДВС-синдрома, вызванного массивной гемотрасфузией (до
10—15 единиц эритроцитарной массы в течение суток), на фо-
не применения гепарина, антитромбина III, свежезамороженной
плазмы, тромбо- и эритроконцетратов. В то же время весьма
часто терапия, включающая массивное переливание СЗП
(до 10 единиц в день), тромбоконцентрата, препаратов низкомо-
лекулярного гепарина и антитромбина III оказывается неэф-
фективной, и клиника коагулопатического кровотечения нара-
стает. В биохимических анализах при этом отмечается резкое
снижение уровня фибриногена или афибриногенемия, тром-
боцитопения, нарастает содержание продуктов деградации
фибриногена и фибрина.
В этом отношении наиболее показательны случаи ДВС-
синдрома у пациентов, оперированных по поводу обширных
481
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
аневризм аорты. Кровопотеря в подобных случаях может до-
стигать 7—12 л, а замещение составляет 15—20 единиц эритроци-
тарной массы в течение 7—12 ч. Выраженность коагулопатии в
этих случаях особенно высока. Истечение крови наблюдается не
только по дренажам, но и из краев раны, из проколов кожи, об-
разуются обширные внутрикожные гематомы. Геморрагический
синдром может иметь фатальный характер.
Выраженная клиническая картина гипокоагуляционного
кровотечения и неэффективность проводимых трансфузион-
ных, медикаментозных и других лечебных мероприятий дол-
жны стать показанием к началу обменного плазмафереза, даже
если получить биохимические данные экстренно не предста-
вляется возможным.
Некоторые специалисты рекомендуют включать плазма-
ферез в комплексную интенсивную терапию после операций,
осложнившихся большой кровопотерей, не дожидаясь клиниче-
ской манифестации синдрома полиорганных нарушений.
Например, в отделении неотложной гематологической по-
мощи ГНЦ РАМН на основании имеющихся сведений о стадий-
ности течения реанимационного периода и патогенетических ме-
ханизмов формирования синдрома ПОН и ДВС-синдрома у ро-
жениц с массивной кровопотерей был предложен высокоэф-
фективный эфферентный метод их профилактики. Способ ос-
нован на элиминации эндотоксинов и недоокисленных про-
дуктов обмена из кровеносного русла на ранних стадиях реани-
мационного периода, а именно, не более чем через 12 ч после
проведения радикального хирургического гемостаза. Детокси-
кация осуществляется проведением дискретного плазмафереза
в объеме не менее 50 % ОЦП. Оптимальный объем плазмозаме-
щения — 70 % ОЦП. Замещение проводится естественными
коллоидами и гипертоническими растворами углеводов. Пред-
почтение авторы метода отдают донорской свежезаморожен-
ной плазме как источнику факторов свертывающей и противо-
свертывающей систем в их естественном соотношении, а также
гуморальных факторов иммунитета. Уменьшение количества
СЗП в трансфузионной программе опасно усугублением ДВС-
синдрома и развитием ятрогенного иммунодефицита. Проведе-
ние плазмафереза приводит к нормализации системной гемоди-
482
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
намики, нормализации хронометрических показателей гемо-
стаза, восстановлению уровня фибриногена, снижению уровня
маркеров ДВС-синдрома, купируется клиника отека мозга, вос-
станавливается темп диуреза. Проведение раннего ПФ способ-
ствует раннему переводу рожениц на самостоятельное дыхание,
так как к концу процедуры восстанавливается микроциркуляция
и ликвидируется гипоксия, что подтверждается улучшением по-
казателей КОС и нормализацией сатурации. В дальнейшем во
всех случаях использования раннего плазмафереза отмечено
благоприятное послеродовое течение.
ДВС-синдром является обязательным компонентом ран-
него послеоперационного периода у пациентов, оперирован-
ных по поводу обширных аневризм аорты и других оперативных
вмешательств, сопровождающихся кровопотерей до одного
объема циркулирующей крови и более. При обширных рекон-
структивных вмешательствах на аорте и ее ветвях существует
целый ряд предпосылок к развитию ДВС-синдрома непосред-
ственно в послеоперационный период. Это такие факторы, как:
— массивная кровопотеря;
— массивное кровозамещение, синдром гомологичной
крови;
— охлаждение организма во время операции;
— использование синтетических пластических материалов;
— хронический ДВС-синдром, сопутствующий исходно-
му заболеванию;
— большой объем операции, высокая степень травматиза-
ции тканей;
— интраоперационные гемодинамические сдвиги, наруше-
ния микроциркуляции;
— использование методов вспомогательного и искусствен-
ного кровообращения и связанные с этим осложнения и др.
Все эти факторы указывают на высокий риск развития ДВС-
сивдрома и полиорганной дисфункции в раннем послеопераци-
онном периоде. Одним из способов профилактики подчас фа-
тальных осложнений может быть ЭК детоксикация в виде плаз-
мафереза, выполненного в первые часы после хирургического
вмешательства. Как показывает наш опыт, при своевременно на-
чатом ПФ клинического результата можно достичь, если объем
483
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
плазмозамещения составит 50—70 % ОЦП. При развернутой
картине ДВС-синдрома необходимый объем удаляемой плазмы
составляет один рассветный ОЦП. Замещение выполняется све-
жезамороженной донорской плазмой в соотношении не менее
1:1. Адекватная своевременная эфферентная терапия позволя-
ет добиться дальнейшего благоприятного послеоперационного
течения или снизить число дальнейших послеоперационных
осложнений.
5.4. Плазмаферез при остром
внутрисосудистом гемолизе
Перечень основных причин острого внутрисосудистого ге-
молиза в хирургической клинике:
• гемолитические гемотрансфузионные осложнения;
• несовместимость крови донора и реципиента по системе
АВО или по другим эритроцитарным антигенам;
• переливание недоброкачественной крови;
• осложнения экстракорпоральной гемоперфузии;
• болезнь Вильсона—Коновалова;
• аутоиммунные гемолитические анемии.
О проблеме внутрисосудистого гемолиза у пациентов с ау-
тоиммунными гемолитическими анемиями речь в данном раз-
деле идти не будет.
Гемотрансфузионные гемолитические осложнения могут
быть иммунной или неиммунной природы. Иммунные ослож-
нения связаны с несовместимостью крови донора и реципиен-
та по антигенам эритроцитов. Наиболее тяжелыми бывают
осложнения, вызванные переливанием крови, несовместимой по
групповым факторам системы АВО. Клиника осложнений, вы-
званных переливанием крови, несовместимой с кровью реципи-
ента по резус-фактору и другим эритроцитарным антигенам,
характеризуется более поздним началом и менее бурным тече-
нием. Сравнительная активность изоантигенов представляется
следующим образом:
Д>С>с>Е> Келл > Даффи > Кидд.
484
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
Еще меньшей иммуногенностью обладают антигены си-
стем М, N, S, s, Левис, Р, Челлано и другие. Согласно данным
зарубежной литературы, иммунные осложнения составляют
от 50 до 94 % всех гемолитических гемотрансфузионных
осложнений.
Неиммунные гемотрансфузионные гемолитические ослож-
нения связаны с недоброкачественностью перелитой крови: ее
бактериальным загрязнением, перегревом, гемолизом в про-
цессе хранения или подготовки к трансфузии, денатурацией
белков, длительным хранением, несоблюдением температур-
ного режима хранения — перегревом или переохлаждением.
Случаи внутрисосудистого и внутриаппаратного гемолиза
нередки при лечении больных с использованием методов экстра-
корпоральной гемоперфузии. Он может быть связан с бакте-
риальным загрязнением ЭК контура, перегреванием крови, на-
ходящейся в ЭК контуре, попаданием в контур дезинфицирую-
щих средств и других веществ, вызывающих разрушение формен-
ных элементов крови и денатурацию белков. Возможна механи-
ческая или баротравма эритроцитов в ЭК контуре.
При гемодиализе причиной гемолиза могут стать откло-
нения в составе диализирующей жидкости. Нередки гемоли-
тические осложнения вследствие технических погрешностей
при проведении искусственного или вспомогательного крово-
обращения.
Описано развитие острого гемолиза во время плазмафе-
реза, выполняемого фильтрационным методом на аппарате
фирмы «Гамбро», что было связано с нарушением трансмем-
бранного давления.
В доступной литературе данные о гемолизе вообще и об ап-
паратном, в частности, встречаются крайне редко. В основе ап-
паратного гемолиза лежат ятрогенные причины, точно так же
как и в основе гемолиза гемотрансфузионного. Поэтому сле-
дует отметить, что на самом деле аппаратный гемолиз встре-
чается отнюдь не реже гемотрансфузионного, а может быть, и
чаще. Нередко он связан с низкой резистентностью мембра-
ны эритроцитов.
В этом разделе следует также остановиться на проблемах,
связанных с заболеванием Вильсона—Коновалова. Для этого
485
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
состояния характерны спонтанные гемолитические кризы.
В основе патогенеза болезни лежит генетически обусловлен-
ный дефект (отсутствие фермента церрулоплазмина) метабо-
лизма меди, что приводит к эндогенной интоксикации этим эл-
ементом. Первым органом, подвергающимся токсическому воз-
действию избытка меди, является печень, непосредственно уча-
ствующая в депонировании и элиминации этого металла. При
прорыве печеночного барьера происходит существенное повы-
шение концентрации меди в кровотоке, последствием чего ста-
новится массивный гемолиз эритроцитов.
Единственным способом, позволяющим обеспечить полную
нормализацию метаболизма меди, является трансплантация до-
норской печени. Беспеченочный период этой сложной продол-
жительной операции особенно опасен развитием массивного
внутрисосудистого гемолица эритроцитов. Вероятность гемоли-
за в беспеченочный период операции трансплантации печени
усугубляется необходимостью использования вспомогательно-
го кровообращения, а именно вено-венозного шунтирования, в
процессе которого может наблюдаться травматизация эритроци-
тов и последующий внутрисосудистый гемолиз.
В основе патогенеза любого гемолитического осложнения ле-
жит массивное внутрисосудистое или внутриаппаратное разру-
шение донорских или собственных эритроцитов пациента. При
этом развивается биохимическая травма практически всех орга-
нов продуктами распада эритроцитов, других форменных эл-
ементов, белков. Наблюдается накопление биологически актив-
ных веществ и тканевого тромбопластина. Развивается недоста-
точность собственных детоксикационных систем организма.
Клиника гемолитического осложнения характеризуется ра-
звитием тяжелого шока, респираторного дистресс-синдрома,
диссеминированного внутрисосудистого свертывания, крайне тя-
желых признаков токсикоза с последующим развитием полиор-
ганной недостаточности. Уже через 10—12 ч от начала осложне-
ния, а в тяжелых случаях и раньше, наблюдается развитие приз-
наков острой почечной недостаточности в виде выделительно-
го нефроза. Развитие выделительного нефроза связано с меха-
нической закупоркой мочевыводящих путей продуктами распа-
да крови и образовавшимся солянокислым гематином, а также
486
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
с нарушениями почечного кровотока вследствие децентрализа-
ции кровообращения и развития ДВС-синдрома.
Степень гемолиза и, соответственно, тяжесть гемолитиче-
ского осложнения определяются тем, какие эритроциты по-
страдали — собственные или донорские, то есть количеством ге-
молизированных клеток, а также длительностью воздействия
повреждающего фактора, если речь идет об аппаратном гемоли-
зе. Наиболее выражен, как правило, гемолиз аппаратного про-
исхождения. При гемолизе химической природы содержание
свободного гемоглобина в сыворотке крови может превышать
2000 мг%. Крайне неблагоприятен прогноз при гемолизе, свя-
занном с нарушениями в аппарате искусственного кровообра-
щения — в этих случаях полиорганная недостаточность разви-
вается особенно быстро.
Первым клиническим проявлением гемолитического ослож-
нения является шок. Степень выраженности его различна.
В тяжелых случаях наблюдается внезапное резкое падение арте-
риального давления, иногда систолическое давление падает до
нуля, снижается объем циркулирующей крови за счет депони-
рования ее во внутренних органах: легких, печени, почках, го-
ловном мозге и т д. Шок д лится от нескольких минут до несколь-
ких часов, и его следует рассматривать как начальный период по-
лиорганной недостаточности.
Диагностировать причину шока и характер осложнения
обычно удается только после нормализации гемодинамики и
появления первых порций мочи характерного темно-бурого или
красного лакового цвета.
Еще более сложна диагностика гемолитического осложне-
ния у пациентов с ренопривным состоянием, терминальной
стадией хронической почечной недостаточности, находящихся
на программном гемодиализе, у которых типичная клиниче-
ская картина гемолитического осложнения не выявляется.
В случае внезапных гемодинамических осложнений у таких
больных следует обязательно исследовать кровь на содержание
свободного гемоглобина.
Гемотрансфузионные и подобные им гемолитические ослож-
нения требуют экстренных реанимационных мероприятий, на-
правленных на выведение больного из состояния шока, восста-
487
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
новление и поддержание функций жизненно важных органов,
купирование геморрагического синдрома, предупреждение по-
лиорганной недостаточности. Чем раньше больному оказана
помощь, тем благоприятнее исход. Основные задачи проводи-
мой медикаментозной и трансфузионной терапии состоят в:
— восстановлении объема циркулирующей крови;
— улучшении реологических свойств крови и микроцир-
куляции;
— дезагрегации форменных элементов;
— выведении токсических продуктов из организма;
— поддержании диуреза;
— предупреждении внутрисосудистого свертывания крови;
— нейтрализации протеолитических ферментов и вазо-
активных веществ.
Для стабилизации кислородтранспортной функции крови
и профилактики тканевой гипоксии крайне важно своевремен-
но устранить фактор, вызвавший гемолитическое осложнение,
обеспечить больному адекватную вентиляцию легких, при
необходимости используя ИВЛ, выполнить трансфузию отмы-
тых индивидуально подобранных эритроцитов. При развитии яв-
лений полиорганной дисфункции в комплексе реанимационных
мероприятий целесообразно использовать различные методы
экстракорпоральной детоксикации: гемофильтрацию, гемоди-
афильтрацию, гемодиализ, что позволяет повысить эффектив-
ность терапии, снизить летальность. На ранних стадиях гемоли-
тического осложнения наиболее эффективен плазмаферез. Этот
универсальный метод ЭКД оказывает положительное влияние
практически на все звенья патологического процесса, разви-
вающегося при гемолизе. ПФ в достаточно короткие сроки вы-
водит из кровяного русла свободный гемоглобин, строму разру-
шенных эритроцитов, другие продукты клеточного распада,
биологически активные вещества, тканевый тромбопластин и т. д.
Кроме того, ПФ усиливает поступление свежей плазмы из соб-
ственных тканей организма, улучшает микроциркуляцию в пе-
риферическом сосудистом русле, в сосудах печени, почек, малом
круге кровообращения, оказывает влияние на реологию, гемо-
коагуляционную систему, иммунитет. Все эти воздействия в це-
лом позволяют предотвратить развитие полиорганной недоста-
488
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
точности. Успех плазмафереза в профилактике ПОН определя-
ется целым рядом факторов: временем начала эфферентных ме-
роприятий относительно момента возникновения осложнения,
объемом удаленной плазмы, наличием признаков гемолиза по-
сле окончания процедуры ПФ.
Имеющийся опыт доказывает, что признаки острого гемоли-
за удается ликвидировать в течение 3—10 ч, если плазмаферез на-
чать сразу после купирования явлений шока. В тяжелых случаях
процедуры плазмафереза следует повторять, а у пациентов с от-
сутствующей функцией почек чередовать с методами замести-
тельной почечной терапии. ПФ следует продолжать до полной
ликвидации признаков гемолиза в плазме и моче. Методы ЗПТ по-
зволяют также снизить содержание в крови некоторых метаболи-
тов, задействованных в развитии гемолитического осложнения.
Объем удаляемой плазмы однозначно определяется исход-
ным уровнем свободного гемоглобина в плазме. Если исход-
ный уровень свободного гемоглобина не превышает 1000 мг%,
то для достижения клинико-лабораторного результата доста-
точно удалить один объем циркулирующей плазмы. Если исход-
ный уровень свободного гемоглобина до 2000 мг%, следует за-
мещать 2 ОЦП, при более высоких цифрах — до 3 ОПП. Заме-
щение выполняется свежезамороженной плазмой, изотониче-
скими растворами глюкозы, кристаллоидами. У пациентов с
сохраненной функцией почек замещение проводится в режиме
гиперволемии. При отсутствии самостоятельного диуреза — в со-
отношении 1:1с объемом удаленной плазмы.
Для коррекции явлений энцефалопатии и гемокоагуля-
ционных расстройств было достаточно эксфузировать 1 ОЦП с
адекватным плазмозамещением.
Подобная тактика эфферентной терапии, внедренная в от-
делениях реанимации и трансфузиологии РНЦХ РАМН 12 лет
назад, позволяет избежать развития симптомов полиорганной
дисфункции в 90 % случаев. Ни в одном случае не потребовалось
перевода больного, находящегося на самостоятельном дыха-
нии, на ИВЛ.
Через 8—12 ч после окончания ПФ отмечалось не более чем
двукратное повышение уровня билирубина и трансаминаз, ко-
торое корригировалось консервативными мероприятиями в те-
489
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
чение ближайших суток и не требовало повторения эфферент-
ных мероприятий. Лабораторных и клинических проявлений
острой почечной недостаточности также не наблюдалось.
Позднее начало экстракорпоральных мероприятий, недоста-
точный объем плазмозамещения может стать причиной разви-
тия гемоглобинурийного нефроза и дальнейшего прогрессиро-
вания ПОН.
Таким образом, включение обменного плазмафереза в ком-
плекс реанимационных мероприятий при остром внутрисосуди-
стом гемолизе является эффективным способом профилактики
полиорганной недостаточности при своевременном начале ЭК
мероприятий и достаточном объеме плазмозамещения.
5.5. Плазмаферез при синдроме длительного
сдавливания
Синдром длительного сдавливания (СДС) или краш-сивдром
развивается вследствие длительной компрессии мягких тканей и
характеризуется сложным патогенезом.
Особенно тяжелые патогенетические изменения в процессе
компрессии происходят в тканях, подвергающихся непосредствен-
ному сдавливанию, а также в тканях находящихся дистальнее от ме-
ста приложения сдавливающей силы. В этих тканях, как правило,
почти полностью отсутствуют гемоциркуляция и отток лимфы.
В условиях продолжительной ишемии очень быстро истощаются
возможности анаэробного типа тканевого дыхания, происходит
накопление недоокисленных продуктов обмена, главным обра-
зом, молочной и пировиноградной кислот, развивается метаболи-
ческий ацидоз. Затруднение притока артериальной крови ведет к
нарушению микроциркуляции. Развиваются признаки повышен-
ной свертываемости крови в капиллярах.
Спустя 4—6 ч от начала компрессии в месте приложения сдавли-
вающего фактора и дистальнее него в тканях наступают процессы де -
сгрукции вплоть до их распада. Наблюдается распространенный ко-
ликвационный некроз мышечных волокон по дискоидному типу,
проявляющийся резкой релаксацией волокон с лизисом инотро-
пных дисков, деструкцией внутриклеточных мембран и цитолем-
мы. Степень дегенеративно-некротических изменений в тканях и
490
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
скорость их развития зависят от силы сдавливания и времени воздей-
ствия сдавливающего фактора.
Общие изменения, характерные для синдрома длительного сда-
вливания, сводятся к снижению гемоперфузии, тканевой и орган-
ной гипоксии. Под влиянием нервно-рефлекторных и нейротумо-
ральных механизмов возникает выраженный прекапиллярный стаз
в коже, скелетной мускулатуре, органах живота, забрюшинном про-
странстве. В межклеточных пространствах накапливаются недооки-
сленные продукты обмена, вазоактивные вещества. Повышается
свертывающая активность крови. Уменьшается объем циркулирую-
щей крови и плазмы. Скорость кровотока в магистральных сосудах
снижается вдвое.
Выделяют четыре основные причины возникновения эндотокси-
коза при синдроме длительного сдавливания:
• задержка в организме конечных продуктов метаболизма;
• избыточное накопление промежуточных продуктов метабо-
лизма;
• всасывание продуктов распада тканей;
• микробный токсикоз.
Ведущую роль при этом играет метаболический эндотокси-
коз. Токсемия служит основной причиной необратимых изме-
нений в организме пострадавшего, вплоть до летального исхода.
Пиком токсического воздействия является декомпенсация постра-
давших тканей.
Из разрушенных при раздавливании тканей в общий кровоток
поступают такие биологически активные вещества, как лизосо-
мальные ферменты, гепарин, серотонин, гистамин, тканевый фак-
тор и фактор некроза опухоли, крупные полипептиды, обладающие
высоким токсическим действием. Основным источником токсемии
считают поврежденную мышечную ткань, при распаде которой об-
разуется значительное количество ионов калия, неорганического
фосфора, белков, компонентов остаточного азота, гистамина. Ток-
сическими свойствами обладает миоглобин (высокомолекулярное
соединение — 16700 Дальтон), выделяющийся из разрушенных
мышечных волокон. В кислой среде миоглобин выпадает в осадок
в виде солянокислого миоглобина. Это соединение может блоки-
ровать почечные канальцы, провоцируя возникновение острой по-
чечной недостаточности.
491
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
В генезе эндотоксикоза при СДС большое значение также име-
ют токсины средней молекулярной массы, обладающие высокой
биологической активностью и оказывающие угнетающее действие
на основные физиологические и биологические процессы организ-
ма. В зависимости оз' тяжести поражения уровень среднемолеку-
лярных токсинов при СДС возрастает более чем в два раза.
Кроме того, выраженные токсические свойства имеют продук-
ты нарушенного свободнорадикального окисления липидов, возни-
кающего в условиях ишемии при СДС.
Особое значение в патогенезе СДС придают нарушению со-
судистой проницаемости, в результате которого происходит мас-
сивная потеря плазмы, нередко являющаяся причиной гибели по-
страдавшего.
После освобождения тканей от компрессии в общий крово-
ток поступают токсичные продукты из поврежденных тканей, ко-
торые вместе с вазоактивными веществами и протеолитически-
ми ферментами оказывают повреждающее воздействие на эндо-
телий микроциркуляторного русла и форменные элементы кро-
ви. Активируется гемокоагуляция за счет тромбопластина, вы-
деляемого поврежденными тканями и форменными элемента-
ми. Возрастает риск развития ДВС-синдрома. В крови появля-
ются частички дезэмульгированного жира, что тоже усугубляет
расстройства микроциркуляции, гемокоагуляции, ведет к бло-
каде легочных капилляров. Развивается прогрессирующая тка-
невая гипоксия, вплоть до гибели клеток мозга, легких, печени,
почек, кардиомиофибрилл. Возникает угроза развития поли-
ортанной недостаточности.
Полиорганные изменения при СДС начинают формироваться
уже в раннем его периоде, до наступления декомпрессии. При этом
существенную роль играют нарушения центральной гемодинамики
и регионарного кровотока. Выраженность начальных полиорганных
изменений зависит от продолжительности сдавливания и масшта-
бов повреждения мягких тканей.
Восстановление кровотока в ишемизированном сегменте при-
водит к резкому нарастанию эндотоксикоза и ухудшению функции
органов и систем, особенно сердца, печени, почек. Вторичный им-
мунодефицит создает условия для развития гнойно-септических
осложнений. Таким образом, тяжесть полиорганных расстройств, осо-
492
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ__________
бенно печеночно-почечных, определяет не только характер тече-
ния СДС, но и его исход.
Патогенетическое лечение СДС требует устранения первичных
источников интоксикации, ликвидации токсемии и коррекции
тканевого метаболизма. Одним из наиболее важных направлений
в терапии СДС является профилактика осложнений и борьба с
эндогенной интоксикацией, обусловленной поступлением в кро-
веносное русло из поврежденных, ишемизированных тканей про-
дуктов аутолиза и других токсических веществ.
Комплекс различных методов экстракорпоральной детокси-
кации занимает в лечении СДС одно из ведуцих мест. При этом
большое значение имеет своевременность проведения детоксикации
еще до наступления выраженных структурных изменений в жизнен-
но важных органах.
Комплекс детоксикационных мероприятий должен проводить-
ся с учетом состояния пострадавшего, характера повреждения, вре-
мени, прошедшего с момента травмы, длительности сдавливания, сте-
пени кровопотери и обезвоживания организма, выраженности ток-
семии, наличия гнойно-септических и других осложнений.
При проведении детоксикации у пострадавших с умеренными
проявлениями токсемии без признаков печеночно-почечной недо-
статочности можно ограничиться консервативными методами.
К ним относят управляемую гемодилюцию и стимуляцию диуреза,
проводимые на фоне интенсивной инфузионной и гемоквантовой
терапии (ультрафиолетового облучения крови) и сеансов гипербари-
ческой оксигенации.
У пострадавших с СДС средней степени тяжести и явными
признаками эндогенной интоксикации, но с сохраненными
функциями печени и почек методом выбора является обмен-
ный плазмаферез.
Проведение ПФ позволяет предупредить развитие полиорган-
ной дисфункции. Эффективность ПФ повышается при сочетании
его с фильтрационными методами детоксикации, что позволяет
ускорить процесс элиминации из кровеносного русла токсических
веществ низкой и средней молекулярной массы.
У пострадавших с клиникой печеночно-почечной недостаточ-
ности с высоким уровнем азотемии, гиперкалиемии, миогло-
бинемии, гнойной интоксикации, трудно корригируемыми нару-
493
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
шениями кислотно-основного состояния, гипергидратацией по-
казаны различные методы заместительной почечной терапии в со-
четании с обменным плазмаферезом. Могут быть эффективны
ультрафильтрация с последующим плазмаферезом или гемосорб-
цией или ПФ с последующей гемосорбцией и гемодиализом. При
выраженной гипергидратации показана ультрафильтрация. А за-
тем гемофильтрация, гемосорбция или гемодиализ. В случае раз-
вернутой картины ПОН показаны гемодиафильтрация или ге-
модиализ с гемосорбцией. Возможно использование лимфоген-
ных методов детоксикации (лимфосорбция, лимфодиализ, ульт-
рафиолетовое облучение лимфы).
Плазмаферез зарекомендовал себя как один из наиболее эффек-
тивных методов детоксикации при СДС. Он позволяет в достаточ-
но короткие сроки удалить плазму бального со всеми содержащими-
ся в ней токсическими субстратами и предотвратить развитие поли-
органных расстройств. Плазмаферез рекомендуется практически
всем пациентам с СДС в ранние сроки после декомпрессии поражен-
ной конечности. Основные показания к ПФ при краш-синдроме
можно сформулировать следующим образом:
• эндогенная интоксикация;
• энцефалопатия;
• высокое содержание миоглобина в жидких средах организма.
В отношении последнего следует исходить из того, что миогло-
бинурия появляется тогда, когда содержание свободного миоглоби-
на в крови превышает 30 мг/л. Таким образом, уровень миоглобина
в крови, близкий к этому значению, является показанием к обяза-
тельному началу эфферентной терапии, а именно — плазмаферезу.
Проведению ПФ должны предшествовать мероприятия, на-
правленные на стабилизацию гемодинамики, коррекцию электро-
литного баланса, кислотно-основного баланса.
Адекватное проведение сеансов ПФ приводит к выражен-
ному эффекту. Отмечается улучшение самочувствия, снижение
температуры тела, частоты сердечных сокращений, частоты ды-
хания. Снижается токсичность плазмы на 30—65 %, в том числе
токсинов средней молекулярной массы. Отмечается улучшение
показателей лейкоцитарной формулы, снижается СОЭ, улучша-
ется функциональная активность гуморальных звеньев иммуни-
тета. Удаление из кровяного русла свободного миоглобина спо-
494
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
собствует коррекции энцефалопатии, улучшению диуретиче-
ской функции почек.
В ряде случаев ранний ПФ позволяет предупредить развитие ос-
трой почечной недостаточности. Это происходит за счет уменьше-
ния воздействия токсических веществ на канальцевый аппарат по-
чек, улучшения почечного кровотока, особенно в микроциркулятор-
ном русле. У некоторой категории бальных проведение ПФ способ-
ствует переходу стадии олигурии сразу в стадию полиурии, минуя кли-
нически тяжелую стадию анурии. Если ПФ начать в первые сутки по-
сле устранения сдавливающего фактора, то количество показаний к
гемодиализу существенно снизится.
ПФ имеет важное значение для профилактики и лечения ДВС-
синдрома, который также может быть осложнением СДС. На фоне
ПФ происходит удаление из плазмы крупнодисперсных комплексов
тканевого распада, удаляется фактор агрегации тромбоцитов, акти-
вируется фибринолиз, снижается содержание фибриногена умень-
шается вязкость крови.
ПФ способствует нормализации детоксикационной и белково-
синтетической функций печени.
ПФ пострадавшим от СДС также следует выполнять в режиме
плазмообмена, замещая удаляемую плазму свежезамороженной до-
норской. Для сохранения собственных белков организма ПФ целе-
сообразно сочетать с плазмасорбцией. При этом в каждом литре се-
парированной плазмы содержится 60—80 г белка и только 1 г токси-
ческих веществ. Для более полного удаления токсичных веществ у
бальных СДС ПФ можно сочетать с гемосорбцией и заместительной
почечной терапией. Интервал между процедурами должен составлять
6—24 ч, что обусловлено выбросом токсичных веществ из поврежден-
ных тканей.
Д лительная компрессия мягких тканей у бальных в коматозном
состоянии является предрасполагающим фактором для возникно-
вения синдрома позиционного сдавливания (СПС). Это один из
частных вариантов синдрома д лительного сдавливания, развиваю-
щийся в основном у пациентов, находящихся в состоянии глубокой
наркотической, алкогольной или смешанной интоксикации. Разви-
вающийся при СПС отек мягких тканей, с последующей деструкци-
ей миофибрилл и выходом в микроциркуляторное русло миоглоби-
на, может приводить к острой почечной недостаточности (ОПН).
495
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Почти в 80 % случаев к ОПН присоединяется печеночная, сердеч-
но-сосудистая и легочная дисфункции. Течение заболевания ослож-
няется имеющимися в анамнезе алкогольным (у 50 % больных) или
вирусным гепатитом (у 30 %). Водно-электролитные нарушения
при СПС характеризуются гипергидратацией легких П—III степени
и гиперкалиемией.
В качестве меры профилактики ОПН на ранних этапах ле-
чения синдрома позиционного сдавливания также рекомендует-
ся мембранный или гравитационный плазмаферез. Если экстра-
корпоральная терапия начата при сформировавшейся клинике
ОПН, используются методы заместительной почечной терапии
и плазмосорбция.
Для максимального снижения миоглобинемии и эндото-
ксикоза целесообразна следующая схема ЭКД: у всех больных с
синдромом позиционного сдавливания: в первый день следует вы-
полнять плазмаферез или плазмаферез в сочетании с плазмосорб-
цией, затем для максимального удаления токсинов низкой и
средней молекулярной массы — ГДФ и ГД. У пациентов с кли-
никой ОПН уже с первых суток следует прибегнуть к ГД или
ГДФ. Такие меры позволяют эффективно уменьшить интокси-
кацию, корригировать КЩС, проводить адекватную инфузион-
но-трансфузионную терапию и парентеральное питание; в резуль-
тате вероятность развития ОПН существенно снижается, уско-
ряется процесс выздоровления. Таким образом, раннее исполь-
зование ПФ является оптимальным решением проблемы ЭК те-
рапии как при синдроме длительного сдавливания, так и при
позиционном сдавливании тканей.
5.6. Плазмаферез при реперфузионном сивдроме
Существуют и другие клинические ситуации, при которых па-
тофизиология развивающегося токсикоза близка к механизмам,
определяющим развитие синдрома длительного сдавливания. Опи-
сано состояние, называемое реперфузионным синдромом, или син-
дромом постишемических расстройств, или синдромом ишемии-ре-
перфузии. Реперфузионный синдром (РПС) можно характеризовать
как острый полиэтиологичный токсикоз, связанный с внезапным вы-
496
ГЛАВА 5, ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
бросом в кровоток продуктов дефектного анаэробного метаболизма
и деструкции пораженных тканей и реакцией иммунной системы ор-
ганизма в ответ на этот выброс. Причиной развития РПС является
восстановление магистрального кровотока в конечности или ее сег-
менте, ранее пребывавшем в состоянии критической ишемии вслед-
ствие закупорки магистральной артерии или травматической ам-
путации. Подобное состояние развивается также после пуска крово-
тока при трансплантации донорского органа.
Степень выраженности реперфузионного синдрома определя-
ется длительностью периода критической ишемии или временем,
прошедшим между травмой и реплантацией, условиями хранения ре-
плантанта, исходным состоянием трансплантата (травма, инфек-
ция), временем предоперационной ишемии органа, длительностью
основного этапа операции, качеством консервации и другими фак-
торами.
Проявления РПС можно характеризовать как местные (состоя-
ние поврежденной конечности или пересаженного органа) и об-
щие, определяющиеся реакцией всего организма на операцию и ее
последствия (развитие полиорганной дисфункции). От степени вы-
раженности реперфузионного синдрома зависит как состояние и
функция реперфузированной конечности или органа, так и степень
сопутствующих полиорганных расстройств.
Хирургическое включение в кровоток крупных реплантантов
сопровождается явлениями выраженной токсемии, связанной с
мощным выбросом из ишемизированного ампутированного фраг-
мента свободного миоглобина, стромы разрушенных миофи-
брилл и клеток крови, биологически активных веществ, продук-
тов паракоагуляции, тканевого тромбопластина, продуктов по-
рочного анаэробного метаболизма и жизнедеятельности микро-
организмов, других патологических субстратов. Ответной реак-
цией организма на этот выброс является активация иммунной, в
том числе цитокиновой системы, проявляющаяся выбросом тка-
невых факторов. Развивающаяся при этом клиническая картина
сходна с клиникой краш-синдрома на момент декомпрессии.
При этом чем больше срок ишемии и объем ампутированного
фрагмента, тем угроза полиорганной и, прежде всего, почечной
недостаточности выше. Кроме того, имеют значение характер ам-
путации (полная, неполная), степень травматизацииампутиро-
497
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ванного сегмента, соблюдение условий его хранения в процессе
транспортировки, возможные осложнения в процессе опера-
ции. Развитие токсикоза начинается еще в предоперационном пе-
риоде, пиком выброса эндотоксинов в центральный кровоток яв-
ляется момент восстановления целости сосудов пораженной ко-
нечности. Поэтому для борьбы с эндотоксикозом должны быть
приняты экстренные меры. В противном случае очень быстро
развивается картина диссеминированного внутрисосудистого
свертывания и полиорганные расстройства: нарушения функ-
ции печени и почек, энцефалопатия, сердечная и сосудистая не-
достаточность на фоне децентрализации кровообращения, рес-
пираторный дистресс-синдром. Первые признаки почечной не-
достаточности могут наблюдаться уже в ближайшие сроки после
поступления больного в отделение реанимации. Все эти ослож-
нения ставят под сомнение вероятность сохранения реплантан-
та, создают угрозу развития генерализованной инфекции, тем са-
мым, создавая опасность для жизни пациента.
Еще одной хирургической ситуацией, приводящей к выражен-
ному эндотоксикозу, является, синдром ишемических расстройств,
возникающий при острой закупорке (тромбоз или эмболия) крупных
сосудов конечностей или вследствие длительно существующих на-
рушений артериального кровоснабжения нижних конечностей.
Степень выраженности ишемического синдрома зависит от его
длительности, уровня обтурации и выраженности коллатерального
кровообращения. Оперативное вмешательство, направленное на
восстановление проходимости магистрального сосуда, способству-
ет усилению эндотоксикоза, так как восстановление кровотока в
пораженной конечности приводит к массивному выбросу в цирку-
ляцию продуктов анаэробного метаболизма, стромы разрушенных
клеток и миофибрилл, других патогенных субстратов. Таким обра-
зом, развивается синдром постишемических расстройств, сходный
с описанным ранее при синдроме длительного сдавливания. Созда-
ется угроза ДВС-синдрома и полиорганной дисфункции. Эти два
осложнения определяют дальнейшее течение послеоперационного
периода. Особенно велика угроза острой почечной патологии вслед-
ствие развития миоглобинурийного нефроза и блокады почечных ка-
нальцев продуктами тканевого распада, а также нарушений микро-
циркуляции.
498
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
В подобных ситуациях возникает проблема профилактики репер-
фузионного синдрома. Можно полагать, что применение эфферент-
ных методов после пуска кровотока в ишемизированных или ампу-
тированных участках конечностей позволит предупредить прогрес-
сирование эндотоксикоза, возможные полиорганные расстройства и
ДВС-синдром. Своевременность начала эфферентных мероприя-
тий однозначно определяет тяжесть послеоперационного периода у
подобной категории больных. Даже небольшая отсрочка в их прове-
дении приводит к развитию почечной, печеночной дисфункции и эн-
цефалопатии уже спустя 6—8 ч после операции. В наиболее тяжелых
случаях явления почечной недостаточности — снижение минутно-
го диуреза, олигурия, темно-бурый цвет мочи — развиваются уже к
концу операции, то есть через 2—4 ч после восстановления кровото-
ка в пострадавшей конечности. На вторые послеоперационные сут-
ки отмечается двух-четырехкратное повышение печеночных фер-
ментов, клиника энцефалопатии. Явления послеоперационной дис-
функции прогрессивно нарастают, если в схеме реанимационных
мероприятий не используются методы ЭКД. В оптимальном вариан-
те всем больным немедленно после поступления в отделение реани-
мации следует начинать сеансы ЭКД. Ведущим экстракорпоральным
методом в подобной ситуации, характеризующейся политоксико-
эом, является обменный плазмаферез—самый универсальный из всех
существующих методов ЭКД.
Если условие раннего начала эфферентных мероприятий соблю-
дено, то объем плазмы, уд аление которого достаточно для достиже-
ния необходимого клинического эффекта, приближается к 1 ОЦП.
Одним из критериев завершения обменного ПФ является нормали-
зация минутного диуреза и цвета мочи. Повторные сеансы ПФ по
необходимости выполняются на вторые-третьи послеоперацион-
ные сутки.
Опыт, накопленный в нашей клинике, показывает, что, если пер-
вый сеанс послеоперационного плазмафереза был выполнен свое-
временно, сразу после операции, то повторных процедур обычно не
требуется.
При отсроченном начале ПФ (4—6 ч после операции) наблюда-
лась клиника миоглоби нурийного нефроза и начальной почечной не-
достаточности: олигурия, темно-бурый цвет мочи, небольшое повы-
шение почечных шлаков и ионов калия в плазме.
499
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
В этом случае требуется не менее двух процедур ПФ с интерва-
лом в сутки. Потребности в заместительной почечной терапии, как
правило, не возникает.
Если время для начала ПФ было упущено, то развивается клини-
ческая картина ПОД с преобладанием печеночной, почечной недо-
статочности и энцефалопатии. В этом случае выполняются 2—3 сеан-
са обменного ПФ с интервалом в 24 ч. Более интенсивной эфферент-
ной терапии, как правило, также не требуется.
Таким образом, эффективность раннего или отсроченного ПФ
при реперфузионном синдроме в сосудистой и реконструктивной хи-
рургии весьма высока и состоит в возможности профилактики или
коррекции явлений полиорганной дисфункции, что позволяет ста-
билизировать состояние бального, облегчить течение послеопераци-
онного периода, снизить летальность. Помимо этого, улучшение
реологии и микроциркуляции, устранение явлений эндотоксикоза
позволяют добиться более благоприятных условий для восстано-
вления метаболизма в реперфузируемой конечности, улучшить ре-
зультаты лечения. Несомненен тот факт, что ранний послеопераци-
онный ПФ позволяет положительно воздействовать на обе стороны
реперфузионного синдрома, то есть на общие и местные изменения.
Не менее серьезной является проблема ишемии-реперфузии в
трансплантологии. Синдром реперфузионных расстройств развива-
ется в организме, перенесшем трансплантацию донорского органа:
почки, печени, сердца и т. д. Наиболее изучена проблема постише-
мических расстройств у реципиентов аллопочек.
Количество функционирующих в трансплантате нефро-
нов в большой степени определяется обстоятельствами опе-
рации и ближайшего послеоперационного периода. Травма,
связанная с ишемией-реперфузией, включает разные патоге-
нетические механизмы. В частности, образование свободных
радикалов может как уничтожить часть нефронов, так и запу-
стить процессы, повреждающие нефроны в ближайшем или
отделенном будущем. Соответственно, функция пересажен-
ного органа будет, несомненно, лучше, если удастся избе-
жать воздействия факторов реперфузионной травмы. По ли-
тературным данным, креатинин плазмы через неделю после
пересадки почки в 3,2 раза ниже у больных без реперфузион-
ной травмы, а выживаемость трансплантата в течение года
500
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
составляет 100 % по сравнению с 75 % больных, перенесших
постишемическую травму.
Отсроченная функция почеч кого аллотрансплантата зависит от
непосредственного действия реперфузионной травмы на паренхи-
му почки. Реперфузионная травма в трансплантате в дальнейшем ста-
новится одним из факторов развивающегося процесса его отторже-
ния. Соответственно, чем реперфузионная травма выражена мень-
ше, тем отторжение встречается реже. Например, результаты транс-
плантации от родственных доноров лучше, чем от трупных. Очевид-
но, это в значительной степени обусловлено тем, что реперфузион-
ная травма пересаживаемого органа при трансплантации от живо-
го донора меньше.
Конечной целью всех лечебных мероприятий, направленных
на уменьшение воздействия реперфузионной травмы, является
профилактика отторжения. Попытки сохранить в максимальной сте-
пени массу функционирующих нефронов по своей сути идентич-
ны профилактике отторжения, так как уменьшение реперфузион-
ной травмы трансплантата приводит к снижению экспрессии транс-
плантационных антигенов. Для борьбы с последствиями реперфу-
зионной травмы были предложены различные методы. Среди ме-
дикаментозных средств — маннитол, аллопуринол, верапамил, су-
пероксвд-дисмутаза, витамин Е и другие.
Несомненно, одним из методов, способных снизить экспрессию
трансплантационных антигенов, является плазмаферез. Имеющие-
ся в литературе доказательства гуморал ьного механизма реперфузион-
ной травмы, а также эффективность ПФ при кризе отторжения и при
реперфузионном сицдроме в сосудистой и реконструктивной хирур-
гии стали предпосылками для использования этого метода ЭКД с це-
лью профилактики реперфузионной травмы у реципиентов аллопо-
чек. В доступной литературе публикации подобного рода отсутству-
ют. Исследование, проводимое в РНЦХ РАМН совместно специа-
листами отделений трансплантации почки (зав. отделением М.М. Ка-
абак) и тансфузиологии, продолжается более двух лет.
За указанный срок наблюдали 30 пар реципиентов аллопочек,
которым были трансплантированы почки от одного и того же
донора. 30 пациентам, оперированным в РНЦХ РАМН, после
операции аллотрансплантации трупной почки выполняли сеанс
обменного плазмафереза. 30 больным, перенесшим подобную
501
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
операцию в других лечебных учреждениях города Москвы, ЭК
коррекция реперфузионного синдрома не проводилась. В ходе ис-
следования оценивали влияние ПФ на функцию трансплантата
в ранние послеоперационные сроки на основании сравнения ди-
уреза в первые 24 ч после операции и потребности в гемодиали-
зе в раннем посттрансплантационном периоде, изучали сроки
субнормализации креатинина крови и годичную выживаемость
функционирующих аллотрансплантатов.
Обе сравниваемые группы больных были идентичны по полу,
возрасту, числу Н LA (А, В, Дг) несовпадений. Длительность консер-
вации почки также была одинакова в обеих группах и в среднем со-
ставила 17,5 ч.
В исследуемой группе сразу после перевода больного в отде-
ление реанимации, то есть через 2—3 ч после включения донорско-
го органа в кровоток реципиента, выполняли сеанс обменного
плазмафереза. Для ПФ использовали аппаратуру фирмы
HaeMonetics PC S — Ultralite и MCS+. За одну процедуру удаляли один
расчетный объем циркулирующей плазмы, определяемый по та-
блицам Moore и исходному гематокриту, составлявшему у данной ка-
тегории больных около 25—30 %. Практически удаляемый объем
плазмы составлял от 2000до 4000 мл. Скорость проведения проце-
дуры — около 1000 мл плазмы в час.
В качестве основного сосудистого доступа использовали арте-
риовенозную фистулу, у детей—катетер, установленный в яремной
или подключичной вене.
Заместительная терапия составляла 80—120 % от объема удален-
ной плазмы. Объем и характер замещения определяли по состоянию
гемодинамики, объему диуреза, характеру и темпу потерь по дрена-
жам. Около 30 % объема заместительной терапии составлял 10 % —
раствор альбумина, 20 % — свежезамороженная донорская плазма,
50 % — растворы кристаллоидов.
Диурез в первые 24 ч после операции у пациентов, перенес-
ших операцию ПФ, составил 4,99 л, у больных второй группы в два
раза меньше — 2,48 л. Олигоанурия после ПФ наблюдалась только
у 4 (13 %) больных, во второй группе — у 13 (43 %). Проведение се-
ансов гемодиализа в раннем посттрансплантационном периоде в
исследуемой группе понадобилось только 4 больным, а во второй —
11. В среднем на одного больного первой группы пришлось 0,75 ге-
502
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
модиализа, а во второй—4,4 ГД. Разница везде статистически досто-
верна. Таким образом, начальная функция трансплантированной поч-
ки после ПФ оказывалась значительно лучше.
функциональное состояние трансплантата в раннем послеопе-
рационном периоде оценивали также по снижению креатинина
крови до 3 мг% — субнормализации уровня креатинина. После ПФ
креатинин крови снижался до искомого уровня в основном в тече-
ние первой недели после операции. В среднем субнормализация
креатинина наступала на 6—7-е сутки. У пациентов, оперированных
без ПФ, субнормализация креатинина крови наблюдалась преиму-
щественно в течение третьей недели после трансплантации. Уровень
креатинина на 21 -е сутки после операции бьи достоверно ниже у па-
циентов, перенесших ПФ.
У пациентов после раннего послеоперационного ПФ актуарная,
то есть годичная, переживаемость функционирующих транспланта-
тов составила 90,6 % и была на 10,6 % выше, чем в группе, где ПФ
не проводился. Послеоперационные осложнения и летальные исхо-
ды отмечены в обеих группах больных. Однако в исследуемой груп-
пе это были экстраренальные осложнения у двух больных, потребо-
вавшие отмены иммуносупрессии и удаления трансплантата. В срав-
ниваемой группе острый канальцевый некроз, приведший к отсут-
ствию функции аллотрансплантата, наблюдался у трех больных
(10 %), у одного из них с летальным исходом.
Таким образом, можно утверждать, что проведение ПФ непо-
средственно после операции оказывает положительное влияние на
течение раннего и отдаленного посттрансплантационного перио-
дов и на результаты операции пересадки трупной почки: наблюда-
ется более быстрое восстановление функции пересаженного орга-
на, выше актуарная выживаемость аллогенных почек.
5.7. Особенности плазмафереза при неотложных
состояниях в хируршческой практике
В предыдущих разделах главы были рассмотрены некоторые па-
тофизиологические аспекты и клинические особенности ряда нео-
тложных состояний, достаточно часто встречающихся в практике от-
делений интенсивной терапии и хирургической реанимации. Эго —
пслиорганная недостаточность, синдром диссеминированного вну-
503
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
трисосудистого свертывания, реперфузионный синдром, острый
внутрисосудистый гемолиз и другие. Были обоснованы патофизио-
логические аспекты использования ряда эфферентных методик, в том
числе плазмафереза, при указанных состояниях. В клинике все эти
критические для организма состояния часто тесно переплетаются,
сопутствуя одно другому или провоцируя одно другое. В общей кли-
нической картине могут преобладать те или иные симптомы, или нес-
колько одновременно. Все перечисленные синдромы характеризу-
ются выраженным эндотоксикозом, коагулопатией, нарушением
функции всех жизненно важных органов и систем организма, вто-
ричным иммунодефицитом. При всех названных состояниях суще-
ствует угроза присоединения инфекции и ее генерализации.
Во всех перечисленных ситуациях включение в комплекс ре-
анимационных мероприятий одного или нескольких методов ЭКД
оказывается весьма целесообразным и эффективным, но ни в од-
ном случае не может быть какого-то одного универсального мето-
да ЭКД. Роль каждого из существующих эфферентных методов
достаточно четко определена в соответствии с характером эндо- или
экзотоксикоза и возможностями каждого конкретного способа
ЭКД элиминировать структуры определенного характера. Плазма-
ферез с адекватным плазмозамещением помогает бороться с син-
дромом эндогенной интоксикации, регулировать агрегатное со-
стояние крови, то есть оказывать патогенетическое воздействие
на основные звенья перечисленных здесь патологических про-
цессов. На основании анализа всего приведенного материала опре-
деляется главное, вполне конкретное место плазмафереза в схеме
эфферентной терапии неотложных хирургических состояний. Это
профилактика полиорганной недостаточности, вероятность разви-
тия которой в подобных ситуациях составляет 100 %. Плазмаферез
целесообразен, эффективен и имеет преимущества перед другими
методами ЭКД тогда, когда наблюдается полиэндотоксикоз, а ве-
личина молекул эндотоксинов различна — от отдельных ионов
(например, калия) до крупномолекулярных соединений. Такая
картина наблюдается, например, при остром внутрисосудистом
гемолизе, реперфузионном синдроме и других. Именно в подобных
ситуациях выбор ПФ как универсального метода ЭКД является па-
тогенетически обоснованным. В тех случаях, когда эндотоксикоз
обусловлен в основном токсинами низкой или средней молекуляр-
504
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
ной массы, более эффективно и целесообразно использовать ме-
тоды заместительной почечной терапии.
Методики плазмафереза при всех неотложных состояниях в
комплексе реанимационных мероприятий и интенсивной терапии
имеют много общего. Прежде всего важно как можно раньше начать
экстракорпоральные мероприятия. При остром внутрисосудистом
гемолизе ПФ следует начинать немедленно при появлении темной
мочи и определении содержания свободного гемоглобина в сыворот-
ке крови свыше 200мг% или меньших показателях, но имеющих тен-
денцию к нарастанию. В качестве подготовки требуется лишь отно-
сительная стабилизация гемодинамики. В случае интраоперацион-
ного возникновения осложнения ПФ необходимо и вполне реаль-
но выполнять, не дожидаясь окончания операции, катетеризировав
д ля его проведения дополнительную вену.
При поступлении пациента с синдромом д лительного или по-
зиционного сдавливания ПФ следует начинать, как только позволит
состояние гемодинамики и будут устранены источники хирургиче-
ского кровотечения. Допустимым началом обменного ПФ являют-
ся первые сутки после декомпрессии пораженного участка. При
этом не следует допускать увеличения содержания свободного мио-
глобина в сыворотке крови выше 30 мг/л, так как при более высо-
ких показателях свободный миоглобин и его солянокислые соеди-
нения активно выходят в мочу и блокируют почечные канальцы.
В случае оперативного восстановления кровотока в ишемизи-
рованной конечности или реплантации крупного сегмента конечно-
сти крайним сроком начала ПФ можно считать перевод пациента в
отделение реанимации по окончании оперативного вмешательства.
То же можно сказать и о начале ПФ с целью профилактики репер-
фузионного синдрома при трансплантации органов.
В случае развернутой клиники полиорганной дисфункции плаз-
маферез также имеет вполне конкретное применение. Из всех мето-
дов ЭКД он наиболее эффективен в случае преобладания печеноч-
ной недостаточности и энцефалопатии, в крайнем случае, при не-
больших явлениях почечной недостаточности. Плазмаферез вы-
полняется в случае явной тенденции к нарастанию печеночных фер-
ментов (аминотрансфераз, лактатдегидрогеназы, креатининфосфо-
киназы) и желчных пигментов. Часто показанием к проведению
ЭКД может быть уже двух-трехкратное увеличение указанных мета-
505
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
болитов. Когда в патологический процесс вовлекаются 3—5 систем
органов, ПФ сочетают с методами заместительной почечной тера-
пии. В некоторых ситуациях две ЭК методики могут выполняться од-
новременно через разные венозные доступы. В самых тяжелых,
иногда критических случаях такая тактика эфферентной терапии по-
зволяет выиграть время и спасти жизнь пациента.
Тяжесть исходного состояния пациента не должна останавливать
врача при назначении сеансов ЭКД. Противопоказанием к ПФ мо-
жет быть только агональное состояние больного. Во всех остальных
случаях процедура может быть выполнена после соответствующей кор-
рекции гемодинамики, объема циркулирующей крови, кислотно-
основного состояния, электролитного состава плазмы, коллоидно-
осмотического давления и т. д.
При диссеминированном внутрисосудистом свертывании ран-
нее начало ПФ также немаловажно — оно позволяет в ряде случаев
предупредить развитие полиорганной дисфункции. Выраженная
клиническая картина гипокоагуляционного кровотечения и неэф-
фективность проводимых медикаментозных и трансфузионных ме-
роприятий должны стать показанием к началу ПФ, даже если полу-
чить биохимические данные не представляется возможным. Вклю-
чение ПФ в схему лечения больных с Д ВС эффективно только в пер-
вые 6—12ч.
Второй особенностью плазмафереза при неотложных со-
стояниях является интенсивность процедуры. Методика предус-
матривает массивное одномоментное плазмозамещение. Опти-
мальным является удаление за одну процедуру одного объема
циркулирующей плазмы, определенного на момент первичного
осмотра пациента с учетом исходного гематокрита. Кратность
процедур определяется в соответствии с состоянием пациента, сте-
пенью эндогенной интокскации и темпами ее нарастания. Так, при
массивном остром внутрисосудистом гемолизе необходимо уда-
лить до 2—3 ОЦП. При ДВС, РПС, СДС и СПС для достижения
необходимого клинического эффекта, как правило, бывает доста-
точно плазмозамещения в объеме одного ОЦП. При полиорган-
ной дисфункции обычно выполняются 3—4 процедуры ПФ с сум-
марным плазмозамещением 1,5—2 ОЦП. Эффективность прово-
димых ЭК мероприятий оценивается на основании клинических
и лабораторных данных.
506
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
Плазмаферез при всех неотложных состояниях носит ха-
рактер плазмообмена, поэтому замещение удаленного объема
плазмы выполняется в соотношении 1:1 свежезамороженной
донорской или растворами альбумина. Использование СЗП —
единственный способ поддержания гомеостаза при больших
плазмопотерях.
Свежезамороженная плазма содержит в естественном соот-
ношении различные белки, факторы свертывающей и противо-
свертывающей систем, в том числе антитромбин III, протеин С,
иммуноглобулины, фракции комплемента и другие составляющие
гуморального иммунитета. Переливание свежезамороженной
плазмы позволяет достичь нормокоагуляции и справиться с ги-
покоагуляционными кровотечениями, поддержать необходимый
уровень иммунных факторов и предупредить развитие инфек-
ционных осложнений.
Проведение сеансов обменного ПФ наиболее целесообраз-
но с использованием современных фракционаторов крови непре-
рывного или прерывистого действия, мембранных или гравита-
ционных. Использование аппаратного ПФ позволяет ускорить
выполнение процедуры и избежать многих неприятностей, воз-
можных при попытке удалить у тяжелого больного большие
объемы плазмы дискретным способом. При выборе аппаратуры
наиболее современными позициями являются использование
фильтрационного плазмафереза, выполняемого на аппаратах
типа АДМ 08 (Fresenius), предназначенных одновременно для це-
лого комплекса методов заместительной почечной терапии, а
также фракционаторов крови «одноигольного принципа дей-
ствия», позволяющих проводить не только удаление плазмы, но
и заместительную терапию через тот же венозный доступ, напри-
мер, MCS+ фирмы HaeMonetics. При отсутствии современных се-
параторов крови ПФ может выполняться любым доступным
способом при соблюдении условий объема удаляемой плазмы и
характера плазмозамещения.
При соблюдении всех перечисленных положений плаз-
маферез при неотложных состояниях в хирургической кли-
нике эффективен в 70—90 % случаев, что позволяет суще-
ственно улучшить результаты лечения крайне тяжелой ка-
тегории пациентов.
507
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Список основной литературы
1. Актуальные аспекты экстракорпорального очищения кро-
ви в интенсивной терапии. М., 2000.141 с.
2. Актуальные проблемы очищения крови, нефрологии и ге-
мафереза. М., 2000. 242 с.
3. Бякин С.П. Селективные и комбинированные эфферент-
но-квантовые трансфузиологические операции в хирур-
гии: Автореф. дис... д-ра мед. наук. СПб., 1999.43 с.
4. Дюгеев. А.Н., Ковалев В.Ф., Фомин М.Д. Современные
принципы лечения и профилактики синдрома полиорган-
ной недостаточности при массивной акушерской кровопо-
тере. И Методы гравитационной хирургии крови и интен-
сивной терапии в акушерстве и гинекологии. М., 1996.
С. 43-50.
5. Каабак М.М., Соловьева И.Н., Горяйнов В.А. и др. Ис-
пользование плазмафереза для коррекции реперфузионной
травмы при трансплантации почки // Анналы РНЦХ
РАМН. М., 2002. С. 48-52.
6. Кассиль В.Л. Полиорганная недостаточность // Проблемы
гематологии. 1995. № 2. С. 45—49.
7. Морозов Б.Н. Применение плазмафереза при лечении
больных с ДВС-синдромом и синдромом полиорганной
дисфункции в ранние сроки после операций в условиях ИК:
Дис.... канд. мед. наук. М., 1997. 137 с.
8. Недашковский Э.В., Утробин Ю.К., Куклин В.Н., Busund R.
Анализ эфферентного применения плазмафереза в ком-
плексном лечении септических больных / Седьмая конфе-
ренция московского общества гемафереза. М., 1999. С. 104.
9. Нечаев Э.А., Ревской А.К., Савицкий Г.Г. Синдром длитель-
ного сдавления. М., 1993. 208 с.
10. Помелов В.С., Жумандинов Ж.Ш. Синдром полиорган-
ной недостаточности в хирургии // Хирургия. 1990.
№ 7. С. 158-161.
11. Проблемы физиологии и патологии системы гемостаза.
Барнаул, 2000. 346 с.
12. Рагимов А.А., Алексеева Л.А. ДВС-синдром в хирургии. М.,
1999. 100 с.
508
ГЛАВА 5. ПЛАЗМАФЕРЕЗ ПРИ НЕОТЛОЖНЫХ СОСТОЯНИЯХ
13. Рагимов. А.А., Соловьева И.Н. Гемаферез в хирургии. М.,
1999.92 с.
14. Barte P.S., Hydro L.J., Fischer Е.А. A prospective companion
of two multiple organ dysfunction failure scoring systems for pre-
diction of mortality on kritical surgical illness // J. Trauma.
1994. Vol. 37. P. 660-662.
15. Knaus W.A., Draper E.A. Prognosis in acute organ-system fai-
lure. //Ann. Surg. 1985. Vol. 202. P. 685-687.
16. lens B., Goandzilioad, Miliciu D. et al. Prophelaxis and treament
of disseminated untravascular coagulation (DIC) associated
with massih transfuzion // Tnt.G. of Transfusion medicine.
1998. Vol. 74. Suppl 1. № 1594.
17. Sauaia F., Moore EA., Moore E.C., Lezotte D.C. Early Risk fac-
tors for postinjury multiple organ falure //World. G.Surg. 1996.
Vol. 20. P. 392-400.
18. Tran D.D., Cuesta M. A. et al. Risk factors for multiple organ fa-
ilure and death in critically injured pacients // Surgery. 1993.
P. 114-121.
ГЛАВА6
Трансфузионная тактика
неотложных состояний
при гемолитических анемиях
6.1. Гемолитические анемии
Гемолитические анемии — это группа заболеваний, характе-
ризующихся повышенным разрушением эритроцитов, об-
условленным сокращением продолжительности их жизни.
В нормальных условиях существует динамическое равнове-
сие, обеспечивающее постоянное количество эритроцитов в
крови. При сокращении продолжительности жизни эритроци-
тов процесс деструкции красных клеток в периферической кро-
ви происходит интенсивнее, чем их образование в костном моз-
ге и выброс в периферическую кровь. Наблюдается компенса-
торное увеличение активности костного мозга в 6—8 раз, что
подтверждается ретикулоцитозом в периферической крови. Ре-
тикулоцитоз в сочетании с той или иной степенью анемии мо-
жет свидетельствовать о наличии гемолиза.
Гемолиз представляет собой диффузию гемоглобина из
эритроцитов, который связывается плазменными белками:
альбумином, гаптоглобином, гемопексином. Образующееся
соединение гемоглобин — гаптоглобин не проникает через
гломерулярный аппарат почек и удаляется из крови клетками
ретикулоэндотелиальной системы. Снижение уровня гапто-
глобина в сыворотке является показателем гемолиза, так как
ГЛАВА 6. ТРАНСФУЗИОННАЯ ТАКТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ
в этом случае расход гаптоглобина больше его количества,
синтезируемого печенью. При гемолизе резко увеличивается
содержание непрямого билирубина, усиливается экскреция
пигментов гема в желчь. При превышении количества свобод-
ного гемоглобина в плазме над гемоглобиносвязывающей
способностью гаптоглобина развивается гемоглобинурия.
Появление темной мочи обусловлено содержанием в ней как
гемоглобина, так и метгемоглобина, образующегося при стоя-
нии мочи, а также продуктов распада гемоглобина — гемоси-
дерина и уробилина.
Различают внутриклеточный и внутрисосудистый гемолиз.
Внутриклеточный гемолиз характеризуется разрушением
эритроцитов в клетках ретикулоэндотелиальной системы (селе-
зенке, печени, костном мозге) и сопровождается сплено-и гепа-
томегалией, повышением уровня непрямого билирубина и сни-
жением содержания гаптоглобина. Отмечается при мембрано-
и энзимопатиях.
Внутрисосудистый гемолиз — это разрушение эритроцитов
в кровеносном русле. Резкое увеличение количества свободно-
го гемоглобина в плазме влечет за собой гемоглобинурию с воз-
можным развитием острой почечной недостаточности и ДВС-
синдрома. В моче через некоторое время после развития криза
выявляется гемосидерин. Для внутрисосудистого гемолиза не-
характерно увеличение селезенки.
В клинической картине всех гемолитических анемий, неза-
висимо от причин их возникновения, различают 3 периода:
1. Гемолитический криз, который имеет две составляющие:
• анемический синдром со всеми характерными признаками,
свойственными любой анемии: бледность кожных покровов и
слизистых, глухость сердечных тонов, тахикардия, одышка, си-
столический шум на верхушке, слабость, головокружение;
• билирубиновая интоксикация — иктеричность кожи и сли-
зистых, тошнота, повторная рвота с примесью желчи, боли в жи-
воте и головные боли, головокружение, в тяжелых случаях — рас-
стройство сознания и появление судорог. Именно в этот период
возможны различные осложнения: ДВС-синдром, острая по-
чечная недостаточность, острая сердечно-сосудистая недостаточ-
ность и т.д.
511
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
2. Период субкомпенсации гемолиза с повышенной активно-
стью эритроидного ростка костного мозга и печени при сохра-
нении умеренно выраженных клинических симптомов (блед-
ность, субиктеричность кожи и слизистых).
3. Период компенсации гемолиза (ремиссии) характеризуется
снижением интенсивности разрушения эритроцитов, купирова-
нием анемического синдрома за счет гиперпродукции эритро-
цитов, снижением уровня билирубина до нормальной величи-
ны, то есть происходит компенсация за счет повышения функ-
циональной активности костного мозга и печени. Однако в этот
период возможно развитие инфарктов и разрывов селезенки, ге-
мосидероза внутренних органов, дискенезии желчных протоков.
Гемолитический криз при некоторых наследственных ане-
миях требует проведения неотложных мероприятий, таких как
интенсивный плазмаферез, обменные или заменные перелива-
ния крови.
6.2. Тактика неотложных мероприятий
при гемолитическом кризе,
обусловленном наследственным
дефицитом фермента Г-6-ФД
Наиболее частой причиной, вызывающей появление гемо-
литических кризов, является дефицит фермента глюкозо-6-фос-
фатдегидрогеназы (Г-6-ФД).
Г-6-ФД — ключевой фермент одного из путей утилизации
глюкозы — гексозомонофосфатного пути (путь Эмбдена—Мейер-
гофа, пентозофосфатный путь, гексозомонофосфатный шунт —
ГМФШ). В энергетическом плане роль этого пути невелика.
В молодых клетках в нем утилизируется 75 % глюкозы, в зрелых
же гексозомонофосфатный путь дает 1/4 часть всей энергии
клетки, утилизируя 3—11% глюкозы. Основная роль пентозно-
го цикла — поддержание уровня НАДФ-Н, необходимого для
восстановления глютатиона. Восстановленный глютатион, в
свою очередь, является основным веществом, препятствующим
воздействию окислителей: нейтрализует перекисные соединения,
образующиеся в мембране и разрушающие ее. Восстановленный
глютатион представляет собой биокатализатор, имеющий важ-
512
ГЛАВА 6, ТРАНСФУЗИОННАЯ ТАКТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ
ное значение для сохранения нормальной функции и структу-
ры эритроцитов.
Наследственный дефицит фермента глюкозо-6-фосфатде-
гидрогеназы, вызывая блокирование первого этапа в пентоз-
ном цикле, приводит к уменьшению количества редуцирован-
ных нуклеотидов, что, в свою очередь, обуславливает резкое
снижение содержания восстановленного глюгатиона. В зрелых
эритроцитах ГМФШ является единственным источником
НАДФ-Н. Обеспечивая окислительный потенциал клетки, ко-
фермент НАДФ-Н тем самым предотвращает или делает обра-
тимыми окислительные процессы, ведущие к увеличению оки-
сленного глютатиона, или метгемоглобина.
Дефицит Г-6-ФД обуславливает недостаточную скорость
регенерации глютатиона через глюгатион-редуктазу. Восстано-
вленный глютатион не может противостоять окислительному
действию обычных доз лекарственных препаратов — происхо-
дит окисление гемоглобина, выпадение в осадок его цепей. Об-
разующиеся тельца Гейнца при прохождении через селезенку
«вырываются» из эритроцитов. При этом теряется часть поверх-
ности клетки, что приводит к ее гибели. Происходит перекис-
ное окисление мембраны эритроцитов и их разрушение в сосу-
дистом русле под действием окислителей. Таким образом, дефи-
цит Г-6-ФД влечет за собой снижение противооксидантной
функции эритроцитов и, как следствие, — гемолиз.
Среди факторов, провоцирующих возникновение гемоли-
тического криза при наследственной аномалии, — употребление
определенных лекарственных препаратов или пищевых про-
дуктов, инфекции.
Гемолитический криз (острый внутрисосудистый гемолиз)
при наследственном дефиците Г-6-ФД развивается через нес-
колько часов или несколько дней после воздействия провоци-
рующего фактора. При этом надо отметить, что чем раньше раз-
вивается гемолиз, тем более вероятно его тяжелое течение.
Выраженность гемолиза варьирует в зависимости от вари-
анта фермента, уровня активности Г-6-ФД и дозы принятого пре-
парата. Распространенный на территории Азербайджана сре-
диземноморский вариант — Г-6-ФД Med- характеризуется чув-
ствительностью к более низкой дозе оксиданта, чем другие ва-
513
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
рианты фермента. Кроме того, для него характерна уменьшен-
ная активность Г-6-ФД и в молодых клетках — ретикулоцитах.
Поэтому наблюдаемое при африканском варианте самоограни-
чение гемолиза для Г-6-ФД Med- многими авторами оспарива-
ется. Необходимо отметить, что ретикулоцитоз, ограничива-
ющий гемолиз за счет более высокого уровня Г-6-ФД в молодых
клетках, а ему отводится основная роль в самоограничении ге-
молиза, развивается лишь на 4—6-е сутки от начала гемолитиче-
ского криза.
Фавизм представляет собой одно из проявлений носитель-
ства гена недостаточности активности фермента Г-6-ФД и воз-
никает при употреблении в пищу конских бобов (черники, го-
лубики, фасоли, гороха), вдыхании пыльцы этого растения или
нафталиновой пыли. Развитию криза может предшествовать
продромальный период, слабость, озноб, сонливость, боли в
пояснице и животе, тошнота, рвота.
Гемолитический криз при фавизме носит стремительный и тя-
желый характер, чаще других эта форма недостаточной активно-
сти Г-6-ФД осложняется развитием почечной недостаточности.
Лечение в период гемолитического криза всегда проводит-
ся в стационаре и направлено на купирование анемического
синдрома, билирубиновой интоксикации и профилактику ослож-
нений.
Существующая тактика лечения гемолитического криза
при дефиците Г-6-ФД проводится по принципу терапии ДВС-
синдрома. Для предупреждения или устранения острой почеч-
ной недостаточности показана инфузионная терапия на фоне де-
гидратации.
Тактика лечения гемолитического криза при дефиците Г-6-ФД:
1) для предупреждения развития метаболического ацидоза
внутривенно капельно вводят 500—800 мл 4—5 %-ного раствора
гидрокарбоната натрия. Действуя как слабое диуретическое
средство, он способствует быстрейшему выведению продуктов
гемолиза;
2) для улучшения почечного кровотока внутривенно назна-
чается 10—20 мл 2,4 %-ного эуфиллина;
3) для поддержания форсированного диуреза — 10 %-ный
раствор маннитола из расчета 1 г/кг;
514
ГЛАВА 6. ТРАНСФУЗИОННАЯ ТАКТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ
4) для борьбы с гиперкалиемией — внутривенно раствор
глюкозы с инсулином;
5) профилактику почечной недостаточности обеспечивает
также лазикс (фуросемид) по 4—60 мг внутривенно через
1,5—2,5 ч, вызывающий форсированный натрийурез;
6) для профилактики ДВС целесообразны малые дозы гепа-
рина под кожу живота;
7) при развитии анурии введение маннитола не показано,
а при нарастании почечной недостаточности проводится пери-
тонеальный диализ или гемодиализ.
Эффективны препараты витамина Е, эревит. Ксилит — по
0,25—0,5 г 3 раза в день в сочетании с рибофлавином по
0,02—0,05 г 3 раза в день способствует увеличению восстано-
вленного глютатиона в эритроцитах.
Сведения по применению экстракорпоральных методов ге-
мокоррекции при острых гемолитических кризах, обусловлен-
ных недостаточностью активности Г-6-ФД, отсутствуют.
Нами был применен плазмаферез в раннем периоде разви-
тия гемолитического криза при фавизме (5 человек) и при лекар-
ственно индуцированном гемолизе (6 человек), обусловленном
дефицитом фермента Г-6-ФД.
Во всех описанных случаях активность Г-6-ФД колебалась
в пределах 0—5 % от нормального его количества. Среди паци-
ентов 8 мужчин (18—32 лет) и 3 женщины (18—27 лет).
Процедура проводилась при первых признаках развития
гемолитического криза: через 6 ч, 2 ч, через сутки после употре-
бления в пищу бобовых культур. Плазмаферез осуществляли
дискретным центрифужным методом с удалением в среднем
1—1,5 ОЦП. Замещение осуществляли донорской плазмой, ра-
створами кристаллоидов.
Критерием для объема удаляемой плазмы служило количе-
ство свободного гемоглобина плазмы.
Надо отметить, что уже на фоне процедуры детоксикации от-
мечалось значительное улучшение общего состояния пациентов,
снижение симптомов билирубиновой интоксикации (сниже-
ние уровня билирубина до значений, корригируемых консерва-
тивными мероприятиями в течение следующих суток) и наблю-
далось просветление мочи. Период реконвалесценции был су-
515
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
щественно уменьшен по сравнению с пациентами, которым
при гемолитическом кризе не применялся плазмаферез. Ни у од-
ного пациента после проведенного плазмафереза не развились
симптомы острой почечной недостаточности.
В одном случае гемолитического криза при фавизме был
проведен повторный сеанс плазмафереза через сутки с удалени-
ем ОЦП.
Проведенные исследования позволяют рекомендовать вклю-
чить проведение плазмафереза на ранних стадиях гемолитиче-
ского криза при дефиците Г-6-ФД (особенно при фавизме) в
стандартный протокол комплексной интенсивной терапии.
Плазмаферез позволяет удалить свободный гемоглобин плазмы,
продукты клеточного распада, строму разрушенных дефектных
эритроцитов из тканевого русла, значительно уменьшает коли-
чество эритроцитов с дефектами мембран и старых функциональ-
но малоактивных форм. Кроме того, процедура плазмафереза
способствует увеличению поступления свежей плазмы из соб-
ственных тканей организма, улучшению микроциркуляции в
периферическом сосудистом русле, в сосудах печени, почек,
малом круге кровообращения, оказывая влияние на реологию,
гемокоагуляционную систему, иммунитет. Помимо детоксика-
ции, надо отметить антиоксидантный эффект экстракорпораль-
ных процедур. Элиминация продуктов окисления свободных
радикалов из организма приводит к увеличению активности
факторов оксидантной защиты, что имеет особое значение при
дефиците фермента Г-6-ФД.
6.3. Терапия неотложных состояний
при серповидно-клеточной анемии
Серповидно-клеточная анемия (СКА) — гемоглобинопатия,
наиболее широко распространенная у народов Америки, Афри-
ки, Индии, жителей Средиземноморья и Средней Азии, предста-
вляет собой группу генетических нарушений, характеризую-
щихся присутствием гемоглобина S в эритроцитах. При гомози-
готном носительстве говорят о серповидно-клеточной анемии
(частота СКА составляет у новорожденных 1:625), при гетеро-
зиготном — о серповидно-клеточной болезни.
516
ГЛАВА 6. ТРАНСФУЗИОННАЯ ТАКТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ
Впервые описана Herrick (1910), Wasbum (1911), Cook и
Meyer (1915), а в 1967 году исследования Livingstone установи-
ли защитную роль гена СКА от малярии.
СКА представляет собой наследственную патологию. Ге-
моглобин S образуется в результате точечной мутации в гене Р-
цепи на хромосоме 11, приводящей к замещению в 6-м положе-
нии глутаминовой кислоты валином. Результатом этого являет-
ся изменение отрицательного заряда НЬА на нейтральный, ха-
рактерный для HbS, с усилением связи между молекулами гемо-
глобина, развитием структурной неустойчивости и уменьше-
нием растворимости восстановленной формы HbS. Такой ге-
моглобин, лишенный кислорода, обладает пониженной раство-
римостью (уменьшается в 100 раз при отдаче гемоглобином S ки-
слорода) и способностью к полимеризации. Аномальный гемо-
глобин откладывается в виде мононитей, с последующим пре-
вращением последних в кристаллы — тактоиды. Кристаллы
имеют веретенообразную остроконечную форму, изменяют мем-
брану клеток. Образуется серповидность эритроцитов, увеличи-
вается вязкость крови, замедляется кровоток и возникает стаз
крови в капиллярах. Нарушение процессов гликолиза, снижение
уровня АТФ и другие изменения в жизненном цикле эритроци-
тов ведут к повышению их аутогемолиза [Bunn Н. F., Ferget В. G.,
1986; Bunn Н. Е, 1994; Embury S. Н. et al., 1994]. Таким образом,
патофизиологические последствия ригидности и серповвдности
эритроцитов — это хроническая гемолитическая анемия и эпи-
зоды повреждения тканей, называемые кризами.
Гомозиготная форма гемоглобинопатии S (при этой форме
гемоглобин HbS составляет 80—100 % гемоглобина клетки) ча-
ще встречается у детей и протекает тяжело. Все клинические
проявления болезни связаны с закупоркой сосудов серповид-
ными эритроцитами. По мере снижения в постнатальном перио-
де фетального гемоглобина растет концентрация HbS. Уже к
5—6-му месяцу жизни у такого ребенка проявляются первые
признаки болезни: гемолитические кризы, болезненность и
припухлость стоп и кистей — серповидно-клеточный дакти-
лит (из-за окклюзии плюсневых и пястных костей) голеней,
суставов. Эти изменения в суставах связаны с тромбозом сосу-
дов, питающих кости. Частое осложнение — асептический не-
517
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
кроз головок бедренной и плечевой костей, проявляющийся
мучительными болями и припухлостью мягких тканей вокруг
места поражения. В связи с тромбозом сосудов наблюдается
инфаркт легкого (см. табл. 6.1) [Шиффман Ф.Дж., 2000].
Таблица 6.1. Клинические проявления серповидно-клеточной
анемии
Органы Острые проявления Хронические проявления
Легкие Острый грудной синдром Хроническая гипоксемия
Мочеполовая система Гематурия Папиллярный некроз Приапизм Гипостенурия Тубулярные дефекты Хроническая почечная недостаточность
Нервная система Тромботический ин- сульт Геморрагический ин- сульт Припадки Транзиторные ишеми- ческие приступы Заболевания спинного мозга Неоваскуляризация с образованием аневриз- мы
Гепато-билиар- ный тракт Синдром правого верхнего квадранта Вирусный гепатит Холелитиаз Гепатопатия
Скелет Остеомиелит (особен- но вызванный саль- монеллой) Костный инфаркт Аваскулярный некроз Рентгенологическая па- тология (деформация «рыбий рот»)
Глаза Ишемия и геморрагии сетчатки Пролиферативная рети- нопатия
Кожа Отслоение сетчатки Кожные язвы
Обращает на себя внимание и внешний вид таких боль-
ных — чаще всего высокие, худые, имеют искривленный позво-
ночник (кифоз грудного отдела или лордоз поясничного), высо-
кий башенный череп, измененные зубы, готическое нёбо, могут
518
ГЛАВА 6. ТРАНСФУЗИОННАЯ ТАКТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ
наблюдаться инфантилизм и евнухоидизм [Soliman А.Т. et al.,
19991- Удлинение нижних конечностей обусловлено замедле-
нием процессов окостенения в эпифизах. По мере развития ре-
бенка нарастает отставание в физическом развитии, причем
больше выражено нарушение в весе. Однако к периоду полово-
го созревания, который наступает позже, чем у здоровых подро-
стков (у девочекв 15—17 лет, у мальчиков в 16—18 лет), дети до-
гоняют своих сверстников в росте.
Тромбозы сосудов влекут за собой поражения многих орга-
нов: страдает зрение (возникновение пролифератов на сетчатке,
отслоение ее, вплоть до слепоты), почки, легкие, сосуды голов-
ного мозга. У 25 % больных развиваются острые неврологические
нарушения (припадки, тромботические и геморрагические ин-
сульты). Мозговые инсульты — это результат закупорки крупных
сосудов, возникают в основном у детей (иногда имеют послед-
ствия в виде гемиплегий). У взрослых пациентов встречаются ос-
трые геморрагические инсульты, обусловленные неоваскуляри-
зацией и образованием аневризмы сосудов головного мозга.
Описаны случаи абдоминальных кризов, обусловленных тром-
бозом капилляров брыжейки, — состояние по типу острого жи-
вота. Это вариант болевого (вазоокклюзивного) криза, возникающе-
го в случае, когда деформированные серповидные эритроци-
ты, взаимодействуя с тромбоцитами, эндотелием, коагуляцион-
ными белками и другими циркулирующими факторами, вызы-
вают нарушение микроциркуляции. Вследствие этого развива-
ется тканевая гипоксия, инфаркты и болевые приступы. Чаще
всего такие острые вазоокклюзивные кризы провоцируются ин-
фекцией, холодом, физической и эмоциональной нагрузками
[Bunn Н.Е, Ferget B.G., 1986; Embury S.H. et al., 1994; Cha-
rache S.,1996; Yund G.L. et al., 1998].
Острый грудной синдром характеризуется болью в груди,
одышкой, гипоксемией, лихорадкой и обусловлен появлением
в микрососудах легких серповидных эритроцитов. В этих случаях
часто неверно диагностируется пневмония. Такое состояние
угрожает жизни больных и является показанием для проведения
заменных трансфузий и постоянного мониторинга.
Увеличенная селезенка обычно к 5 годам уменьшается вслед-
ствие фиброза из-за частых инфарктов (так называемая «аутос-
519
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
пленэктомия»). У пациентов с аутоспленэктомией в эритроци-
тах обнаруживаются тельца Жолли, выявляются мишеневид-
ные клетки и акантоциты.
Увеличена печень: хроническая гепатомегалия с дальнейшим
развитием фиброзной ткани в зонах некроза и переходом гепа-
топатии в цирроз.
У мужчин (у 50 % больных с СКА) наблюдается приапизм,
продолжающийся несколько часов из-за застоя крови в пещери-
стых телах. Предрасполагающими факторами являются инфек-
ции, половой акт, мастурбация, местная травма.
У женщин отмечается более позднее наступление менструа-
ций, часто встречаются самопроизвольные аборты и прежде-
временные роды, беременность сопровождается нарушением
мозгового кровообращения, сердечной недостаточностью. При
исследовании глазного дна характерно выявление жировых эм-
болий в сосудах сетчатки.
Нередко на фоне инфекций (пневмония, корь и др.) возни-
кают тяжело протекающие гемолитические кризы. Отмечается оз-
ноб, повышение температуры, гемоглобинурия, прогрессирую-
щая анемия. Появляется иктеричность склер, видимых слизи-
стых и кожных покровов, повышается непрямой билирубин в
крови, уробилин в моче и стеркобилин в кале.
Вследствие укорочения жизни эритроцитов больные очень
чувствительны к транзиторной супрессии костного мозга, вы-
званной инфекцией (парвовирус В19, пневмококк, сальмо-
нелла, вирус Эпштейн—Бара и др.). Описаны случаи возникно-
вения так называемых апластических кризов, когда во время ин-
фекции или сразу после нее происходит разрушение эритро-
кариоцитов в костном мозге, исчезают ретикулоциты, умень-
шается количество нейтрофилов и тромбоцитов. Возможно
появление признаков сердечной недостаточности. Заканчива-
ется апластический криз спонтанно через 10—14 дней с повы-
шением количества ретикулоцитов и уровня гемоглобина. Та-
кая картина была описана при инфицировании парвовиру-
сом [Pattison et al.,1981].
Таким образом, в клинике серповидно-клеточной анемии
доминируют гемолитические и сосудисто-тромботические (ва-
зоокклюзивные) кризы. Реже встречаются апластические и сек-
520
ГЛАВА 6. ТРАНСФУЗИОННАЯ ТАКТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ
вестрационные кризы (у детей в возрасте от 5 месяцев до 2 лет),
которые связаны с внезапным удалением (без разрушения) и
депонированием значительного количества эритроцитов в пече-
ни и селезенке, что вызывает резкую слабость, снижение коли-
чества эритроцитов и гемоглобина без признаков гемолиза. Мо-
жет развиться коллапс.
Повторяющиеся моменты сосудистой окклюзии и хрониче-
ский гемолиз ведут к прогрессирующей дисфункции практи-
чески всех органов (см. табл. 6.1). Одним из первых нарушений
функции почек является гипостенурия — неспособность концен-
трировать мочу, поэтому больные с СКА очень чувствительны к
дегидратации.
Гемотрансфузионная терапия при серповидно-клеточной анемии
В трансфузионной терапии при СКА необходимо выделить
несколько режимов ее проведения: неотложные переливания
крови, заменные и постоянные переливания.
Неотложные трансфузии осуществляются при секвестра-
ционном и апластическом кризах, тяжелой анемии и кровопо-
терях и имеют целью увеличение транспортной функции кро-
ви без выраженного снижения уровня HbS. Постоянные тран-
сфузии могут быть как простыми, так и заменными (обменны-
ми). В первом случае достигается уменьшение количества HbS
ниже 35 %, во втором — нормализация уровней гемоглобина S
и гематокрита.
Простые и обменные трансфузии
Показаниями для заменных трансфузий при СКА являют-
ся острый грудной синдром с гипоксемией, некроз костного
мозга, приапизм, непереносимая боль, у определенных больных
перед плановыми или ургентными операциями.
Цель обменных трансфузиях — в снижении доли гемогло-
бина S до уровня менее 35 %. Этого можно добиться двумя пу-
тями. Если у больного выраженная анемия, ему переливают до-
норскую эритроцитную массу до достижения нормального уров-
ня гемоглобина. Простые трансфузии легко выполнимы, способ-
ствуют уменьшению пропорции серповидных клеток у реци-
пиента. Их эффект становится более выражен со временем, так
как перелитые эритроциты имеют большую продолжительность
жизни, чем собственные клетки. Простые переливания увели-
521
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
чивают гематокрит, подавляя эндогенный (собственный) эритро-
поэз больного, и количество серповидных эритроцитов некото-
рое время не будет превышать 30 % от общей массы эритроци-
тов [Zinkham et al., 1994]. Простые трансфузии являются наибо-
лее приемлемой процедурой у пациентов с резко выраженной
анемией (например, при HbSS-болезни). Однако, так как про-
стые трансфузии поднимают гемоглобин приблизительно на
10 г/л на одну дозу эритроцитной массы (у взрослых), они не наз-
начаются пациентам с более высоким гематокритом, таким как
с HbSC и HbS-b+-талассемией. У этих больных простые тран-
сфузии, повышая гематокрит, могут увеличить вязкость крови.
В этих случаях предпочтительнее обменные переливания, кото-
рые быстро уменьшают пропорцию серповидных клеток без по-
дъема гематокрита. Если у пациента тяжелый криз развивается
на фоне относительно высокого гемоглобина (80 г/л и выше),
производят частичное обменное переливание путем забора од-
ной дозы крови с одновременным замещением ее одной дозой
донорской крови. Эту процедуру повторяют до тех пор, пока
число серповидных эритроцитов не снизится до 30 %. После
достижении такого состояния, его можно достаточно долго под-
держивать: каждые 3—4 недели производить переливания до-
норской крови для подавления собственного эритропоэза. Все
манипуляции необходимо сочетать с регулярным контролем
состава эритроцитов в крови пациента [Yund G.L. et al., 1998].
Необходимо отметить, что большинству больных СКА при уров-
не гемоглобина 80—100 г/л не следует проводить гемотрансфу-
зии, так как они могут способствовать повышению гематокри-
та и вязкости крови, что может спровоцировать криз.
Обменные трансфузии обладают следующими преимуще-
ствами для всех пациентов с серповидными клетками:
• более физиологичный (более низкий) постгрансфузион-
ный гематокрит;
• более быстрое и выраженное снижение процентного со-
держания серповидных клеток;
• значительно ниже нагрузка железом, чем при простом
переливании.
Чем больше используется доноров крови, тем более выра-
жены недостатки обменных трансфузий. Кроме того, они тре-
522
ГЛАВА 6. ТРАНСФУЗИОННАЯ ТАКТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ
буют адекватного сосудистого доступа, что представляют собой
определенную проблему для многих больных.
Обменные трансфузии выполняются различными неаппа-
ратными методами [Wayne A.D. et al., 1993] или с использовани-
ем автоматического оборудования (эритропитоферез) [Castro О.
et. al., 1986]. Ниже приводим простой метод неаппаратного об-
менного переливания у пациента с СКА при гемоглобине не
ниже 70 г/л или гематокрите не ниже 20 %. При более низком
уровне гемоглобина и гематокрита перед обменным перелива-
нием назначается 1 доза эритроцитной массы у взрослых или
5 мл/кг у детей. Если данное количество эритроцитной массы не
повысило уровень НЬ до 70 г/л, при подготовке больного к опе-
рации применяют простые переливания вместо обменных.
Метод ручного обменного переливания (инфузионно-трансфу-
зионная терапия):
1. Удаление 1 дозы крови (450 мл) у взрослых или 7,5 мл/кг
у детей из вены руки.
2. Восстановление объема крови быстрой инфузией солево-
го раствора: 500 мл у взрослых и 8 мл/кг у детей.
3. Повторяется 1-я ступень.
4. Переливание двух доз эритроцитной массы у взрослых или
10 мл/кг у детей.
5. У пациентов с СКА 1—4-я ступени повторяются неодно-
кратно, а у больных с более высоким уровнем гематокрита (на-
пример, при HbSC) — дважды.
Этим методом удаляются 4 единицы (дозы) крови у взрослых с
восполнен ием 4 дозами эритроцитной массой и 1000мл солевого ра-
створа. У взрослых с более высоким уровнем гематокрита (при
HbSC) удаляются 6 единиц крови и возвращаются 6 доз эритроцит-
ной массы и 1500мл солевого раствора. После таких обменов коли-
чество НЬА превышает 50 %, а уровень HbS (при СКА) или HbS+HbC
(при HbSC-болезни) становится ниже 50 %. Основная цель инфу-
зионно-трансфузионной терапии — достижение нормоволемии и
уровня гемоглобина до 100 г/л, снижение гемоглобина S.
При использовании автоматического оборудования (клеточ-
ные сепараторы) возможны обмены эритроцитов [Kim Н.С. et al.,
1994] или эритроцитоферез. Каки при ручном способе, обмени-
ваются 4 дозы эритроцитов у взрослых с СКА и 6 доз у пациен-
523
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
тов с HbSC. Автоматический обмен эритроцитов выполняется
с поддержанием экстракорпорального кровяного объема около
250 мл у взрослых, в то время как при ручном обмене экстракор-
поральный объем больше 500 мл.
У больных с серповидностью часто наблюдаются осложнения
во время хирургических вмешательств и в послеоперационном пе-
риоде, так как операция и анестезия сами по себе являются фак-
торами риска для возникновения различных вазоокклюзивных на-
рушений и увеличения смертности. У пациентов с СКА наиболее
частые осложнения во время хирургических вмешательств — это
послеоперационный грудной синдром и послеоперационный ва-
зоокклюзивный криз, в основе которых лежат гипоксия, гипопер-
фузия, стаз, ацидоз, дегидратация и гипотермия во время опера-
ции [Scon-Conner С.Е.Н. et al., 1994; Sharon B.I., 1994]. Суще-
ствует предположение, что предоперационные трансфузии уме-
ньшают частоту послеоперационных осложнений при СКА, так
как уменьшают процент циркулирующих эритроцитов, имею-
щих склонность к серповидности. Экспериментальные и кли-
нические наблюдения подкрепляют выдвинутую концепцию о
том, что гемотрансфузии улучшают тканевую перфузию и преду-
преждают вазоокклюзию серповидных клеток.
В связи с вышеизложенным большинство гематологов рекомен-
дуют проведение предоперационных трансфузий пациентам с на-
иболее тяжелыми формами серповидно-клеточной болезни, а имен-
но СКА и при сочетании с 0-талассемией. Трансфузии в действи-
тельности не являются необходимыми для увеличения насыщения
крови кислородом, так как большинство пациентов с СКА в стадии
ремиссии адаптированы к своему низкому уровню гемоглобина и,
как правило, не нуждаются в коррекции анемии. Предоперацион-
ные трансфузии рекомендуются, главным образом, для улучшения
тканевой перфузии в течение операции и анестезии, так как снижа-
ют количество эритроцитов, склонных к серповидности.
6.4. Тактика трансфузионной терапии
гемолитической болезни новорожденных
Гемолитическая болезнь новорожденных (ГБН) — изоим-
мунная гемолитическая анемия, возникающая в результате
524
ГЛАВА 6. ТРАНСФУЗИОННАЯ ТАКТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ
изоиммунизации беременной женщины несовместимыми эри-
троцитарными антигенами плода, проникновением иммунных
антител матери через плаценту, фиксацией их на эритроцитах
плода и гемолиза. Антитела вырабатываются иммунной систе-
мой резус-отрицательной женщины и чаще всего направлены
против антигена D резус-положительного ребенка.
Чаще всего ГБН связана с несовместимостью матери и пло-
да по антигену D, реже по антигенам системы АВО, еще реже по
другим антигенам — С, с, К и др.
Причиной наиболее тяжелого течения гемолитической бо-
лезни новорожденных, нередко заканчивающейся смертью пло-
да, являются анти-D, анти-с, анти-К-антитела.
Болезнь развивается из-за проникновения антител матери
через плаценту и фиксации их на мембране эритроцитов плода.
Затем происходит разрушение сенсибилизированных эритроци-
тов макрофагами с развитием гемолитической анемии.
ГБНприАВО-несовместимости. АВО-несовместимость суще-
ствует приблизительно в 20 % всех беременностей, но только в
10 % случаев антитела матери влияют на плод. Образование ан-
ти-А и анти- В антител класса IgG может быть обусловлено раз-
личными факторами и не только беременностью. Они встреча-
ются у женщин и мужчин без предшествующей иммунизации.
Поэтому ГБН, обусловленная АВО-несовместимостыо, может на-
ступить даже при первой беременности, что особенно часто
встречается у женщин с группой крови 0 (I) и у новорожденных
с А(П), составляя 40 % всех иммунологических осложнений,
обусловленных групповой несовместимостью [Molison, 1967].
В России у 0,6 % всех новорожденных выявляется ГБН, вы-
званная АВО-несовместимостыо [Златников А.Л. и соавт., 1997].
ГБН при несовместимости по резус-фактору. Заболевание от-
мечается при иммунизации резус-отрицательной матери резус-
положительными эритроцитами плода. Являясь неполными ан-
тителами класса IgG, образующиеся при этом анти-D-антитела
легко проникают через плаценту. Гемолитическая болезнь ново-
рожденных развивается при достижении определенного титра ан-
тител в организме плода, чего обычно не происходит при первой
беременности и ребенок рождается здоровым. При повторных бе-
ременностях (особенно с коротким интервалом между беремен-
525
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ностями), сенсибилизирующих организм женщины, происхо-
дит образование большого количества антител, которые вызыва-
ют у плода гемолиз и развитие ГБН. Во время первой беремен-
ности частота возникновения ГБН составляет 9—10 %, а при вто-
рой — 42—47 % [Van Logrem, 1948; Jouvenceaux A., Michand D.,
1961]. Если же первая беременность заканчивается самопроиз-
вольным выкидышем, абортом, ГБН и т. д., риск развития ГБН
и гибели плода при второй беременности составляет уже 96 %
[Дойчинова Н., 1964], то есть частота ГБН увеличивается при аку-
шерских вмешательствах и патологии плаценты.
Рискрезус-иммунизации при резус-положительном ребен-
ке у резус-отрицательной матери составляет 2—3 % при несов-
падении групп крови по системе АВО, в то время как при одной
группе крови — 15 % [Levine Р.,1944]. Продукция антител у ма-
тери зависит от времени персистирования в ее кровеносном ру-
сле резус-положительных эритроцитов плода. Эритроциты дру-
гой группы агглютинируются естественными агглютининами
системы АВО матери, не успевая ее иммунизировать. При АВ0-
совместимой беременности Rh-несовместимые эритроциты
плода находятся в организме матери достаточное время для вы-
работки анти-КЬ-антител.
Выделяют следующие формы гемолитической болезни но-
ворожденных:
1) гемолитическая анемия новорожденных;
2) желтуха новорожденных;
3) фетоплацентарнаяанасарка(фегоплацентарная геморрагия).
Эти формы ГБН обусловлены различным количеством ан-
тител, проникающих через плаценту.
Самая легкая форма — гемолитическая анемия новорожден-
ных. После рождения нормального ребенка через несколько
дней у него развивается анемия. Отмечаются бледность кожи,
почти нет желтушности, снижается уровень гемоглобина и эри-
троцитов, выявляется ретикулоцитоз и лейкоцитоз, увеличение
печени и селезенки. Тяжесть заболевания определяется степенью
анемии. В тяжелых случаях без адекватного лечения может на-
ступить смерть ребенка.
Желтуха новорожденных характеризуется стремительным ра-
звитием, когда с первых часов жизни ребенка происходит нара-
526
ГЛАВА 6, ТРАНСФУЗИОННАЯ ТАКТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ
стание желтухи, усиление анемии, увеличение печени и селезен-
ки, непрямого билирубина. Самое опасное осложнение — разви-
тие ядерной желтухи с симптомами поражения центральных
ядер мозга: отмечается нистагм, тремор конечностей, гиперто-
нус, рвота, нарушение дыхания. Современное понятие «ядерной
желтухи» — это билирубиновая энцефалопатия, развивающая-
ся вследствие токсического воздействия непрямого билируби-
на на нейроны головного мозга. При этом уровень непрямого би-
лирубина играет определяющую роль в протекании болезни и в
ее последствиях. Критический уровень непрямого билируби-
на, при котором развивается ядерная желтуха, —
310—344 мкмоль/л [Таболин В.А., 1967; Персианинов Л.С. и со-
авт., 1981], при 430—490 мкмоль/л ядерная желтуха манифести-
руется у 30 % новорожденных, при 513—650 мкмоль/л — у 70 %
[BehrmanR., 1979]. При нарушении функции гематоэнцефали-
ческого барьера критическая величина непрямого билирубина
снижается до 140—170 мкмоль/л. У детей, выживших после ядер-
ной желтухи, развиваются необратимые изменения нервной си-
стемы, глухота, страдает интеллект.
В самых тяжелых случаях ГБН — при фетоплацентарной ана-
сарке у плода развиваются обширные отеки, асцит, появляется
транссудат в плевральной полости. Резкий отек связывают с не-
достаточностью кровообращения из-за тяжелой анемии. Как
правило, данная форма заболевания проявляется при 3—4 бере-
менности, когда титр анти-КЬ-антител достигает очень высоких
цифр. Наступает внутриутробная смерть плода, ребенок рожда-
ется мертвым или в крайне тяжелом состоянии.
Необходимо отметить, что у доношенных новорожденных
детей гемолитическая болезнь, обусловленная резус-несовмести-
мостью, протекает тяжелее, чем у детей, рожденных за 2—3 не-
дели до срока, что объясняется меньшим количеством резус-
антигенов, прикрепленных на мембране эритроцитов недоно-
шенного ребенка.
При АВО-несовместимости клиническая картина более лег-
кая: менее выражены анемия, гипербилирубинемия, увеличение
печени и селезенки, не характерна ядерная желтуха. Кроме то-
го, при болезни AB0 никогда не прибегают к досрочному родо-
разрешению, в отличие от резус-несовместимости.
527
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Величины показателей периферической крови зависят от тя-
жести заболевания. В тяжелых случаях при рождении НЬ ре-
бенка падает до 60—80 г/л, отмечается ретикулоцитоз, лейкоци-
тоз со сдвигом влево, появляются эритрокариоциты в перифе-
рической крови. В 1981 году Персианинов Л .С. и соавт. предло-
жили деление ГБН по степени тяжести, используя всего лишь
3 показателя: гемоглобин и билирубин (лабораторные показате-
ли) и отечность (клинический показатель) (данные авторов све-
дены нами в табл. 6.2).
Таблица 6.2. Степени тяжести ГБН
Показатель 1-я степень 2-я степень З-я степень
НЬ, г/л 150 100-150 * 100
Билирубин, мкмоль/л *86 80-137 * 139
Отечность Пастозность подкожной клетчатки Отечность и асцит Универсальный отек
В постановке диагноза гемолитической болезни новорож-
денных (чаще всего во время беременности) большое значение
имеет типирование эритроцитов родителей. Когда велик риск ра-
звития ГБН (мать — резус-отрицательная, отец — резус-положи-
тельный), возникает необходимость динамического наблюдения
за появлением и изменением титра антител [Рагимов А.А., Даш-
кова Н.Г., 2001]. Существует определенная корреляция между
уровнем антиэритроцитарных антител в крови беременной жен-
щины и возможным прогнозом тяжести ГБН. При этом значе-
ние, кроме титра, имеют вид и специфичность антител, класс и
подкласс иммуноглобулинов, к которым они принадлежат, аку-
шерский и трансфузиологический анамнез женщины.
В течение беременности неоднократно должно проводить-
ся тестирование на наличие антител и определение их титра,
что способствует обнаружению изменения титра уже выявлен-
ных антител и возможного появления антител другой специ-
фичности. При обнаружении антител в непрямом антиглобули-
528
ГЛАВА 6. ТРАНСФУЗИОННАЯ ТАКТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ
новом тесте повторные тестирования необходимо проводить
ежемесячно до 28-й недели беременности, а затем через каждые
2 недели.
Повышение титра антител, выявляемое в последние неде-
ли беременности, свидетельствует о серьезном поражении пло-
да. Однако при повторных резус-несовместимых беременно-
стях может наблюдаться низкий титр антител при значительном
повреждении плода. Снижение титра в третьем триместре бере-
менности без проведения профилактического лечения являет-
ся неблагоприятным прогностическим признаком.
Наиболее достоверным методом постановки диагноза и
прогноза развития ГБН является исследование крови плода,
но, учитывая тот факт, что смертность плода при этой процеду-
ре достигает 5 %, оно должно применяться лишь при крайней
необходимости. Трансабдоминальный амниоцентез необходи-
мо проводить только после ультразвукового определения ме-
сторасположения плаценты. Исследование оптической плот-
ности амниотической жидкости (при 450 нм) между 27—28-й
неделями беременности позволяет определить уровень били-
рубина и тем самым оценить степень гемолиза. Этот метод ре-
комендуется применять в случаях, когда уровень анти-О-анти-
тел выше 4 нг/мл или титр антител в непрямой пробе Кумбса вы-
ше, чем 1:16, при стремительном нарастании титра антител. Од-
нако анти-К- и анти-К-антитела могут обуславливать ГБН при
нормальных показателях, полученных при тестировании амни-
отической жидкости.
Появление антител до 28 недель беременности заставляет
предполагать возможное тяжелое течение болезни, требующее
обменного переливания крови у новорожденного. Появление ан-
тител в более поздние сроки и в низких титрах, как правило, не
вызывает развитие ГБН, либо обусловливает легкую форму.
Основные задачи лечения ГБН:
• борьба с асфиксией;
• коррекция ацидоза;
• ликвидация анемии;
• предотвращение гипербилирубинемии;
• элиминация антител против эритроцитов плода или но-
ворожденного.
529
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
При установлении диагноза ГБ еще в период беременно-
сти проводят трансфузии небольших объемов крови через эм-
бриональную пуповину после 20 недель беременности. С этой
целью переливают свежезаготовленную эритроцитную массу
(до 5 дней хранения) с гематокритом 80, а у новорожденных с
ГБ - с № 50-60.
Обменные переливания при ГБН
Абсолютные показания к проведению обменных перелива-
ний крови у доношенных детей, не имеющих факторов риска ра-
звития ядерной желтухи:
• содержание билирубина в пупочной крови при рожде-
нии свыше 60 мкмоль/л;
• почасовой прирост сывороточного билирубина более
6 мкмоль/л;
• гипербилирубинемия выше 340 мкмоль/л [Behrman R.E.,
1987; Cartner L.M., 1997].
У недоношенных детей обменное переливание проводят
при уровне сывороточного билирубина 200—300 мкмоль/л. При
наличии у новорожденного более 2 факторов риска развития
ядерной желтухи процедуру начинают и при меньшем уровне би-
лирубина. В начале переливают 20 мл альбумина для связывания
билирубина. Затем многократно выпускают по 20 мл крови но-
ворожденного и вливают по 20 мл свежей одногруппной
Rh-отрицательной донорской крови (всего 500—600 мл крови до-
нора). Обменное переливание проводят в объеме не менее
2 ОЦК (160—180 мл/кг). Это позволяет заменить 80—85 % кро-
ви новорожденного, тем самым снизить гипербилирубинемию,
что в свою очередь уменьшает нейротоксическое действие непря-
мого билирубина. Для этой же цели эффективным является
применение УФО, что в ряде случаев при раннем его примене-
нии позволяет избежать обменных переливаний крови.
Показания для повторного обменного переливания крови —
наличие не менее двух нижеследующих признаков:
• нарастание признаков гемолитической болезни;
• почасовой прирост билирубина > 5 мкмоль/л;
• нарастание анемии (сохраняющийся гемолиз);
• низкая способность к связыванию альбумина крови
(ССА < 80 % при норме 100 %) [Жибурт Е.Б. и соавт., 2002].
530
ГЛАВА 6. ТРАНСФУЗИОННАЯ ТАКТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ
Определены следующие критические уровни билирубина
при ГБН:
— пуповинная кровь — 60 мкмоль/л;
— 24 ч жизни — 150 мкмоль/л;
— 48 ч жизни — 240 мкмоль/л при резус-конфликте и
270 мкмоль/л при АВО-конфликте;
— 4-й день жизни — 265 и 300 мкмоль/л соответственно.
При АВО-несовместимости к обменным переливаниям кро-
ви (кровь 0 (I) группы, совместимая по Rh-фактору) прибегают
крайне редко.
Применение плазмафереза в лечении ГБН
Опыт зарубежных исследователей рекомендует проведение
сеансов плазмафереза (до 20—22 сеансов) во второй половине бе-
ременности. При этом за одну процедуру удаляется до 4 л плазмы,
то есть 1,5—2 ОЦП. Возмещение этого объема осуществляется до-
норской плазмой и белковыми препаратами, что предупреждает воз-
никновение гемодинамических расстройств и у матери, и у плода.
Если во время беременности не удалось достичь снижения
титра антител у матери, нет возможности их определения у но-
ворожденного в первые минуты после родов, рекомендуется
провести плазмаферез у новорожденного сразу после родов.
Процедура осуществляется с максимальным удалением плаз-
мы и замещением удаленного объема донорской плазмой. На-
до иметь в виду, что при удалении плазмы происходит дилюция,
удаление половины ОЦП сразу же вызовет снижение исходных
показателей до 30 %. Проведение дальнейшей эксфузии стано-
вится малоэффективным. Поэтому рекомендуется проводить
плазмаферез прерывистым способом (2 раза в день). Между
процедурами происходит выход плазмы из микроциркуляторно-
го русла, внесосудистых пространств, отток плазмозамещаю-
щих растворов в ткани, что вызывает увеличение концентрации
патологических веществ в крови.
Развитие желтухи у новорожденного является абсолютным по-
казанием к немедленному плазмаферезу. Если нет возможности в
его осуществлении, проводят обменные переливания крови.
При наличии в анамнезе резус-конфликга показано превен-
тивное выведение антител из крови женщины перед следую-
щей предполагаемой беременностью.
531
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Список основной литературы
1. Алексеев Г.А. Наследственные гемолитические энзимопа-
тии эритроцитов И Клин. мед. 1980. № 9. С. 60—68.
2. Байрамалибейли И.Э., Рагимов А.А. Лейкоцитарный и
эритроцитарный дефицит фермента Г-6-ФДГ в популя-
циях с высокой частотой этой аномалии // Гематология и
трансфузиология. 1988. № 1. С. 15—18.
3. Байрамалибейли И.Э., Рагимов А.А. Гемокомпонентная
терапия в регионах с высокой частотой наследственного де-
фицита фермента Г-6-ФДГ // Актуальные вопросы гема-
тологии и трансфузиологии: Материалы Российской науч-
но-практической конференции, посвященной 70-летию
Рос. Научно-исследовательского института гематологии
и трансфузиологии. СПб., 18—20 июня 2002 г. С. 242—243.
4. Болезни системы крови / Ф.Э. Файнштейн, Г.И. Козинец,
С.М. Бахрамов, М.Г. Хохлова. Ташкент: Медицина, 1980.
582 с.
5. Бойтлер Э. Нарушения метаболизма эритроцитов и гемо-
литическая анемия. Пер. сангл. М.: Медицина, 1981.256 с.
6. Джавадов Р.Б. Фавизм. Азербаджан, 1975. 85 с.
7. Жибурт Е.Б., Баранова О.В., Ильин А.Б. Гемолитическая
болезнь новорожденных. Трансфузиология. 3 (Том 3)/2002.
С. 76-94.
8. Златников А.Л., Вихирева З.Н., Карасева Л.Н., Бесчетно-
ва Е.Б. Трудности диагностики гемолитической болезни но-
ворожденных (случай из практики) // Новое в трансфузио-
логии. 1997. Вып. 20. С. 69.
9. Идельсон Л.И., Дидковский Н.А., Ермильченко ГВ. Ге-
молитические анемии. М.: Медицина, 1975. 288 с.
10. Персианинов Л.С., Сидельникова В.М., Елизарова И.П. Ге-
молитическая болезнь плода и новорожденного. Л.: Меди-
цина, 1981. 208 с.
11. РагимовА.А., Байрамалибейли И.Э. Основы диагностики,
профилактики и лечения анемий. М.: ГОУ ВУНМЦ М3 РФ,
2002. 288 с.
12. Рагимов АА, Дашкова Н.Г. Трансфузионная иммунология.
М.: ВУНМЦ М3 РФ, 2000. 284 с.
532
ГЛАВА 6. ТРАНСФУЗИОННАЯ ТАКТИКА НЕОТЛОЖНЫХ СОСТОЯНИЙ
13. Румянцев А.Г., Аграненко В.А. Клиническая трансфузио-
логия. М.: ГЭОТАР Медицина, 1997. 575 с.
14. Сержан Дж. Р. Серповидно-клеточная болезнь // Гем. и
трансф. 1991. № 7. С. 27-30.
15. Шевченко Ю.Л., Жибурт Е.Б. Безопасное переливание
крови: Руководство для врачей. СПб.: Питер, 2000. 320 с.
16. Шиффман Ф. Дж. Патофизиология крови. Пер. с англ. СПб.:
«Издательство БИНОМ» — «Невский диалект», 2000.448 с.
17. Bunn Н. Е Sickle hemoglobin and other hemoglobin mutants.
In: Stamatoyoannopolous G., Nienhuis A.W., Majerus P.W.,
Varmus H. (eds). The molecular Basis of Blood Diseases, Phi-
ladelphia, 1994. P. 207-256.
18. Bunn H.F., Forget B. G. Hemoglobin: Molecular, Genetic and
Clinical Aspects. Philadelphia: W.B. Saunders, 1986.
19. Castro O., Finke-Castro H., Coats D. Improved method for
automated red cell exchange in sickle cell disease I I J.Clin.
Apheresis. 1986. Vol. 3. P. 93—99.
20. Castro O., Sandier S.O. Estimating the effect of donor-recipi-
ent phenotype mathing for transfusions in sickle cell pathients
(abstract) // Blood. 1995. Vol. 86. P. 644a.
21. Charache S. Treatment of sickling disorders. Curs. Opin. // He-
matol. 1996. Vol. 3(2). P. 139-144.
22. Charache S., DoverG.J., Moore R.D. etal. Hydroxyurea: effects
on HbF production in patients with sickle cell anemia // Blo-
od. 1992. Vol. 79. P. 2555-2565.
23. Charache S., Terrin M.L., Moore R.D. et al. Effect of Hydro-
xyurea on the frequency of paiful crises in sickle cell anemia //
N. Engl. J. Med. 1995. Vol. 332. P. 1317-1322.
24. Embury S.H., Hebbel R.P., Mohandas N., Steiberg M.H. Sic-
kle Cell Disease: Basic Principles and Clinical Practice. N. Y.:
Raven Press, 1994.
25. Kim H.C., Dugan N.P., Silber J.H. et al. Erythrocytapheresis the-
rapy to reduce iron overload in chronically thransfiised patients
with sickle ceii disease // Blood. 1994. Vol. 83. P. 1136—1142.
26. Scott-Conner C.E.H., Brunson S.D. Surgery and anesthesia. In:
Embury S.H., Hebbel R.P., Mohandas N., Steinberg M.H.,
eds. Sickle cell disease. Basic principles and clinical practice. N.
Y.: Raven Press, 1994. P. 809-827.
533
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
27. Sharon B.I. Transfusion therapy in congenital hemolytic an-
emias. Hematol.Oncol 11 Clin. North. Am. 1994. Vol. 8.
P. 1053-1086.
28. Soliman A.T., Zalabamy M., Amer M., Ansari P.M. Growth
and pubertal development in transfusion-dependent children
with thalassemia major and sikle cell disease a comparative stu-
dy // J. Trap. Pediatr., 1999. Vol. 45 (1). P. 23—30.
29. Van der Weyden M. Anaemia / In: MIMS Disease Index, Syd-
ney: IMS Publishing. 1991/92. P. 34—37.
30. Yund G.L., Channick R.N., Fedulio P.K. et al. Succesful pul-
monary thromboendarerectomy in two patients with sickle cell
disease // Am.J.Respir.Crit.Care Med. 1998. Vol. 157 (5. Pt.
1). P. 1690-1693.
31. Zinkham W.H., Seidier A.J., Kickler T.S. Variable degrees of sup-
pression of hemoglobin S synthesis in subjects with hemoglobin
SS disease on a long-term transfusion regimen // J. Pediatr.
1994. Vol. 124. P. 215.
ГЛАВА7
Гемотрансфузионные реакции
и осложнения
Гемотрансфузия, как и любая инвазивная процедура,
таит в себе множество опасностей. При отступлении от
четких правил, а также при нарушении порядка серо-
логических исследований и техники проведения гемотран-
сфузий могут возникать неблагоприятные последствия, ко-
торые проявляются в виде посттрансфузионных реакций и
осложнений.
Посттрансфузионные реакции — неблагоприятные по-
бочные последствия гемотрансфузий, не сопровождаю-
щиеся серьезными и длительными нарушениями функций
органов и систем реципиента (табл. 7.1).
Посттрансфузионные осложнения — неблагоприятные
побочные последствия гемотрансфузий, характеризую-
щиеся тяжелыми клиническими проявлениями, предста-
вляющими опасность для больного (табл. 7.1).
Необходимо помнить, что неблагоприятное послед-
ствие гемотрансфузии может начаться как слабо выражен-
ная реакция, а затем очень быстро перерасти в осложнение.
Нередко у одного больного отмечается комплекс призна-
ков реакции или осложнений (например, фебрильные ре-
акции сопровождаются гемолизом). В ряде случаев острые
трансфузионные реакции при отсутствии или неадекватной
терапии переходят в отсроченные.
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Таблица 7.1. Постгрансфузионные реакции и осложнения
1. Острые 2. Отсроченные
1.1. Иммунные 1.1.1. Гемолитиче- ские 1.1.2. Фебрильные негемолитические 1.1.3. Аллергические 1.1.4. Гемотрансфу- зионное острое по- ражение легких 1.2. Неиммунные 1.2.1. Бактериальные вирусные 1.2.2. Циркуляторная перегрузка 1.2.3. Гемолиз (физи- ческий, химический) 1.2.4. Эмболия 1.2.5. Цитратная ин- токсикация 2.1. Иммунные 2.1.1. Гемолитиче- ские 2.1.2. Болезнь «трансплантат-про- тив-хозяина» 2.1.3. Посттрансфу- зионная пурпура 2.2. Неиммунные 2.2.1. Гемосидероз 2.2.2. Инфекцион- ные
Крайней степенью осложнения, связанной с переливанием
крови или ее компонентов, является гемотрансфузионный шок,
тяжесть которого обусловлена иммунологическим конфликтом,
острым внутрисосудистым гемолизом, коагулопатией, токси-
козом и в конечном итоге полиорганной недостаточностью.
7.1. Классификация отрицательных
последствий гемотрансфузий
Постгрансфузионные реакции и осложнения наблюдаются
при нарушении установленных правил техники и методики за-
готовки, хранения и переливания крови, ее компонентов, если
не учитываются показания и противопоказания, неадекватно
оценивается состояние реципиента перед трансфузией.
В литературе приводится множество классификаций гемо-
трансфузионных осложнений и реакций.
Гемотрансфузионные реакции и осложнения в зависимости
от причин и клинического течения подразделяются на:
1)острые и поздние (замедленные, или отсроченные);
2)клинически значимые и мало- или незначимые;
3) иммунные и неимунные;
4) гемолитические и негемолитические (острые и поздние):
536
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
— пирогенные,
— уртикарные,
— аллергические;
5)анафилактические;
6) связанные с техническими погрешностями гемотрансфузий;
7) связанные с физико-химическими факторами (перегре-
вание, нарушение условий хранения и др.);
8) связанные с инфицированностью компонентов крови
(бактериями, вирусами, паразитами).
Классификация не может претендовать на полноту и содер-
жит сведения об основных, наиболее часто встречающихся на
практике реакциях и осложнениях гемотрансфузии.
В отечественной литературе часто приводится классифика-
ция В.А. Аграненко и Н.Н. Скачиловой (1979).
Гемотрансфузионные реакции подразделяются'.
1. По степени тяжести:
а) легкие;
б) средней степени;
в) тяжелые.
2. По этиологии:
а) пирогенные;
б) антигенные (негемолитические);
в) аллергические;
г) анафилактические.
Причинами гемотрансфузионных осложнений могут явиться:
1. Несовместимость крови донора и реципиента по эритро-
цитам (по групповым факторам АВО, Rh-фактору и др.).
2. Недоброкачественность перелитой крови (бактериаль-
ное загрязнение, перегревание, гемолиз, денатурация белков
вследствие длительного хранения, нарушения температурного ре-
жима хранения и др.).
3. Нарушения методики трансфузии (воздушная эмболия,
тромбоэмболия, циркуляторная перегрузка, сердечно-сосудистая
недостаточность и др.).
4. Массивные гемотрансфузии.
5. Недоучет противопоказаний к переливанию крови и недооцен-
ка состояния реципиента перед проведением гемотрансфузий (аллерги-
ческая настроенность, сенсибилизация, повышенная реактивность и др.).
537
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
6. Перенос возбудителей инфекционных заболеваний с пе-
реливаемой кровью.
Все неблагоприятные последствия гемотрансфузий можно
разделить на две группы: реакции и осложнения иммунного и не-
иммунного характера.
Иммунные реакции и осложнения гемотрансфузий развивают-
ся при несовместимости:
• эритроцитарных антигенов донора и реципиента (преж-
де всего это несовместимость по системам АВО и RD);
• по лейко- и/или тромбоцитарным антигенам донора и
реципиента (сенсибилизация к лейкоцитарным и тромбоци-
тарным антигенам);
• плазменных факторов крови донора и реципиента.
Неиммунные реакции и осложнения гемотрансфузий могут
развиваться при.
• попадании в кровоток пирогенных веществ;
• переливании недоброкачественной крови;
• передаче донору болезней реципиента;
• технических ошибках гемотрансфузий;
• нарушении кислотно-щелочного состояния крови;
• нарушении гемодинамики.
На рис. 7.1 и 7.2 приведено распределение частоты встреча-
емости осложнений гемолитичекого и негемолитического типов,
а также симптомов негемолитических реакций среди выявлен-
ных случаев посттрансфузионных осложнений (по данным за-
рубежных авторов).
• Особо необходимо выделить осложнения, которые
возникают у больных, получающих интенсивную инфузион-
но-трансфузионную терапию при реанимационных меро-
приятиях. Это:
— острая сердечная недостаточность',
— некардиогенный отек легких-,
— нарушение тканевой проницаемости.
7.1.1. Посттрансфузионные реакции
Поспрансфузионные реакции, как правило, не сопровождаются
серьезными и длительными нарушениями функции органов и систем
и не представляют непосредственной опасности для жизни больного.
538
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
Острый
14% 56%
Рисунок 7.1. Трансфузионные реакции и осложнения.
[«Transfusion Medicine and Alternatives to Blood Transfusion», chap-
ter III, C. Taylor, M. Contreras]
Анафилаксия
28%
Рисунок 7.2. Частота симптомов негемолитических реакций.
[Минеева Н.В. Постгрансфузионные гемолитические осложнения
(причины, изосерологическая диагностика и профилактика):
Пособие для врачей. СПб., 1997]
539
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Реакции чаще всего начинаются через 10—25 мин после
начала гемотрансфузии. У некоторых пациентов они
развиваются после окончания гемотрансфузии. Гемотран-
сфузионные реакции, в зависимости от степени тяжести, мо-
гут продолжаться от нескольких минут до несколько часов.
Различают следующие виды гемотрансфузионных реакций:
• пирогенные;
• аллергические;
• анафилактические;
• фибрильные (негемолитические).
По тяжести клинического течения (температуры тела и дли-
тельности проявления) выделяют три степени посттрансфузи-
онных реакций: легкие, средние и тяжелые.
Легкие реакции характеризуются незначительным повы-
шением температуры, головной болью, небольшим ознобом
и недомоганием, болями в мышцах конечностей. Эти явления,
как правило, кратковременны, не более 20—30 мин. Обычно
для их купирования не требуется каких-либо специальных
лечебных мероприятий.
Средние реакции характеризуются учащением пуль-
са и дыхания, повышением температуры на 1,5—2 °C,
нарастающим ознобом, иногда высыпанием крапивни-
цы. В большинстве случаев медикаментозной терапии не
требуется.
Тяжелые реакции сопровождаются цианозом губ, рвотой,
сильной головной болью, болью в пояснице и костях, одыш-
кой, крапивницей или отеками (типа Квинке), температу-
ра тела повышается более чем на 2 °C, наблюдается сильный
озноб, лейкоцитоз. Необходимо как можно скорее присту-
пать к медикаментозной коррекции гемотрансфузионного
осложнения (см. ниже).
Пирогенные реакции
Пирогенные реакции (гипертермия) развиваются при
поступлении в кровеносное русло реципиента пирогенов вместе
с консервированной кровью или ее компонентами.
Пирогены — это неспецифические протеины, продукты
жизнедеятельности микроорганизмов. Посттрансфузионные
540
ГЛАВА 7, ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
пирогенные реакции могут возникать также у изосенсибили-
зированных повторными гемотрансфузиями больных или у жен-
щин, имевших в анамнезе неоднократную беременность при
наличии антилейкоцитарных, антитромбоцитарных или анти-
белковых антител.
При возникновении пирогенных реакций появляется озноб,
температура повышается до 39—40 °C обычно через 1—2 ч после
переливания крови, реже во время него. Лихорадка сопровож-
дается головной болью, миалгией, дискомфортом в грудной
клетке, болями в поясничной области. Клиническая картина
может иметь различную степень выраженности. Гемотрансфузии
достаточно часто сопровождаются субфебрильной температурой,
которая обычно скоро проходит.
Низкомолекулярные протеины, высвобождаемые лейко-
цитами, моноцитами, гранулоцитами крови и макрофагами, —
эндогенные пирогены также могут явиться причиной пироген-
ных реакций. Так, установлено, что лейкоцитарные факторы, по-
падающие в компоненты крови из клеток: интерлейкин-1, ин-
терферон и фактор некроза опухоли, стимулируя простогландин
в гипоталамусе, повышают уровень температурной реакции [Di-
narelloetal., 1984].
Одним из основных факторов контаминации гемотрансфу-
зионных сред пирогенами является нарушение инструкций по
заготовке и хранению крови, приготовлению растворов и др.
Наиболее частой причиной возникновения подобных реакций
является низкое качество воды, на которой готовят в аптеке
клиник растворы для внутривенного введения (в частности,
несоответствие pH ГОСТу, использование дистиллированной
воды вместо бидистиллированной и др.). Переход на офици-
нальные растворы позволяет в большинстве таких случаев решать
проблему пирогенных реакций, связанных с качеством воды.
Прогноз при пирогенных реакциях благоприятный. Клини-
ческие признаки исчезают через несколько часов.
Аллергические реакции
Аллергические реакции различной степени выраженности
отмечаются в 3—5 % случаев гемотрансфузий. Аллергическая
реакция, как правило, регистрируется у больных, сенсибилизи-
541
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
рованных предшествующими гемотрансфузиями или имевших
в анамнезе повторные беременности с антителами к антигенам
плазменных белков, лейкоцитов, тромбоцитов и даже иммуно-
глобулинам.
У части больных аллергические реакции наблюдаются уже
при первом переливании гемокомпонентов и не связаны с пред-
шествующей изосенсибилизацией. Полагают, что аллергиче-
ские реакции в таких случаях обусловлены наличием «спонтан-
ных» антител к иммуноглобулинам и обусловлены ответом им-
муноглобулинов Е тучных клеток реципиента на перелитый
специфический антиген донора, который часто ассоциирован с
тромбоцитами или плазменными белками.
Аллергические реакции могут возникать как во время пере-
ливания крови или ее компонентов, так и спустя 1—2 ч после
окончания процедуры.
Характерный признак аллергической постгрансфузионной
реакции — аллергическая сыпь, нередко сопровождающаяся зу-
дом. При более тяжелом течении реакции — озноб, головные бо-
ли, лихорадка, боли в суставах, диарея. Следует иметь в виду, что
аллергическая реакция может протекать с симптомами анафи-
лактического характера: нарушением дыхания, цианозом и иног-
да быстрым развитием отека легких [Popovsky М., 1992].
Анафилактические реакции
Одним из самых грозных осложнений гемотрансфузий яв-
ляется анафилактическая реакция, иногда молниеносно разви-
вающаяся до анафилактического шока.
Анафилактические реакции могут развиться даже после
нескольких миллилитров крови, ее компонентов, кровезаме-
нителей (полиппокина, гемодеза, желатиноля и др.). Частота
их возникновения составляет (1:20 000)—(1:400 000) трансфу-
зий. Реакция проявляется резким изменением состояния боль-
ного во время или сразу после трансфузии.
В патогенезе анафилактического шока основную роль играет
реакция антиген—антитело, сопровождающаяся выделением био-
логически активных веществ, вызывающих повреждение сосуди-
стой стенки с образованием отека, бронхоспазмом, нарушением
кровообращения, с резким падением артериального давления.
542
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
Полагают, что в большинстве случаев реакции обусловлены
изосенсибилизацией реципиента к иммуноглобулину А В целях
профилактики целесообразно выявлять доноров с IgA-дефици-
том и делать специальную отметку в донорском журнале. Одна-
ко анафилактические реакции описаны и у лиц, несенсибилизи-
рованных к иммуноглобулину. Поскольку такого типа реакции
имеют более вариабельный механизм развития, чем простое вы-
деление гистамина при разрушении базофилов и тучных кле-
ток, реакции подобного типа обозначают как анафилактоидные.
Действительно, у некоторых больных с дефицитом иммуногло-
булина А, а также при наличии антител, направленных против им-
муноглобулина А, многократные переливания крови, альбуми-
на, введение иммуноглобулинов, которые содержат помимо IgG
и IgA, или синтетических кровезаменителей (полиглюкина, по-
лифера, реополиглюкина, реоппомана), могут вызывать анафи-
лактоидные реакции различной степени выраженности. В имму-
норадиометрическом тесте установлено, что частота анти-IgA-ан-
тител у больных с уртикарными трансфузионными реакциями со-
ставляла около 8 %. Aнти-IgA-aнтитeлa обнаруживаются у паци-
ентов, которым никогда не проводились гемотрансфузии, а так-
же у женщин, не имевших беременности. Основной способ про-
филактики анафилактоидных реакций у больных, содержащих в
крови классоспецифические анти-IgA-антитела, — использова-
ние только компонентов крови, лишенных IgA
Анафилактическая реакция проявляется к 5—30 мин гемо-
трансфузии острыми вазомоторными расстройствами: гипер-
емия кожи лица, шеи, груди, крапивница, отек Квинке, сниже-
ние АД, свистящее дыхание, удушье, беспокойство, тошнота,
рвота, озноб, лихорадка. Для анафилактической реакции ха-
рактерны также боли в нижней части спины, кашель, которые
появляются во время гемотрансфузии, но могут быть и отсроче-
ны на несколько часов и даже суток.
Тоны сердца глухие, акцент 2-го тона на легочной артерии.
При перкуссии легких определяется коробочный звук, при ау-
скультации — свистящие сухие хрипы. Возможно развитие оте-
ка легких с клокочущим дыханием, пенистой мокротой.
Реактивные явления могут произвольно быстро исчезнуть,
но в большинстве случаев купируются только после введения ад-
543
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
реналина (подкожно или внутримышечно), ингаляции кислоро-
да, назначения антигистаминных препаратов и эуфиллина.
Иногда организм реагирует на введение антигенов очень бур-
но. В результате этого развивается тяжелейшее осложнение —
анафилактический шок, требующий немедленной комплексной
терапии, а нередко и реанимационных мероприятий. Исход ана-
филактического шока во многом определяется быстротой и пол-
нотой проводимых лечебных и реанимационных мероприятий.
7.1.2. Цитратная интоксикация
При массивных гемотрансфузиях уровень лимонной кисло-
ты в плазме может достигнуть 100 мг% и выше и вызывать тяже-
лую токсическую реакцию, обусловленную снижением уровня ио-
низированного кальция. Так, при обменном переливании 500—600
мл крови новорожденный в течение часа гемотрансфузии может
получить до 600 мг цитрата, что клинически проявится тремором
мышц и заметным увеличением на ЭКГ зубца ST.
Гипокальциемия развивается при трансфузиях больших доз
и/или при быстром переливании плазмы или крови, содержа-
щих цитрат натрия. Имеется обратная зависимость между ско-
ростью внутривенного введения с кровью консервирующего ра-
створа и кумулятивным количеством цитрата, которое вызыва-
ет осложнение со стороны сердечной деятельности [Nakasone В.
etal., 1985]. Признаки цитратной интоксикации у взрослых па-
циентов развиваются при трансфузиях 1 л консервированной
крови за 10—12 мин.
Цитрат натрия связывает в кровяном русле свободный каль-
ций, вызывая гипокальциемию. Если трансфузия крови или
плазмы производится со скоростью 50 мл/мин содержание сво-
бодного кальция реципиента меняется незначительно, тогда
как при увеличении скорости трансфузии в три раза
(150 мл/мин), содержание свободного кальция снижается мак-
симально до 0,6 ммоль и возвращается к норме сразу после пре-
кращения переливания. Это связано с быстрой мобилизацией
кальция из эндогенных депо и метаболизмом цитрата в печени.
В связи с большой ролью паренхиматозных органов в утилиза-
ции цитрата, особое внимание следует проявлять к больным
циррозом печени, активным гепатитом, хронической почечной
544
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
недостаточностью, D-авитаминозом, панкреатитом, токсико-ин-
фекционным шоком. С осторожностью следует использовать
кровь и плазму при постреанимационном состоянии, длитель-
ной терапии кортикостероидными гормонами и цитостатиками,
так как в этих случаях высок риск цитратной интоксикации.
При приготовлении компонентов крови — эритроци-
тарной массы (ЭМ) и плазмы — 80 % цитрата остается в плаз-
ме. В плазме консервированной крови содержится пример-
но 1 мг% цитрата.
Цитратная интоксикация может быть спровоцирована
не только отсутствием в кровотоке ионизированного каль-
ция, но и другими факторами: снижением pH и повышени-
ем концентрации калия.
У больных с высоким риском предрасположенности к ци-
тратной интоксикации, в частности, у пациентов с заболева-
ниями печени, целесообразно использовать эритроцитарную
массу, а еще лучше отмытые донорские эритроциты.
В пользу использования при гемотрансфузиях компонентов
крови говорит и тот факт, что при переливании консервиро-
ванной крови может наблюдаться комбинированный эффект
цитрата, калия и аммиака.
Цитратную интоксикацию достаточно легко предупредить
или значительно ослабить ее проявления назначением 10 %-ного
р-ра глюконата кальция (10 мл на каждый литр цитратной кро-
ви). При трансфузии больших объемов с высокой скоростью
(500 мл/мин) целесообразно вводить 10 мл 10 %-ного р-ра глю-
коната кальция до и после каждых 500 мл крови.
7.1.3. Калиевая интоксикация
В норме содержание ионов калия в плазме доходит до
5,5 ммоль/л, а уровень в 7 ммоль/л считается опасным для че-
ловека. В длительно хранившейся донорской крови из-за
разрушения эритроцитов увеличивается содержание калия (ги-
перкалиемия). Опасность гиперкалиемии возникает при массив-
ных переливаниях, вызывающих резкое повышение содержания
калия в крови реципиента.
Гиперкалиемия достаточно просто диагностируется при ис-
следовании крови. Клинически гиперкалиемия проявляется
545
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
апатией (после кратковременного периода возбуждения), сон-
ливостью, вялостью, судорожным подергиванием мышц, вплоть
до развития вялых параличей, падением АД, брадикардией,
аритмией, нарушением дыхания, вплоть до остановки, атонией
кишечника. При концентрации в плазме калия до 8 ммоль/л
типичные ЭКГ-признаки гиперкалемии: нарушения внутри-
сердечной проводимости (расширение зубца Р), возможна си-
ноаурикулярная блокада (снижение зубца R, углубление и уши-
рение зубца S). При гиперкалиемии (свыше 8 ммоль/л) наруша-
ется внутрижелудочковая проводимость (расширение комплек-
са QRS), развивается желудочковая тахикардия, переходящая в
асистолию. На ЭКГ появляются высокие остроконечные зубцы
Т с узким основанием.
Дифференциальный диагноз калиевой интоксикации сле-
дует проводить при метаболическом ацидозе, почечной недоста-
точности, дефиците минералокортикоидов.
Профилактика гиперкалемии заключается прежде всего в
своевременном выявлении больных с потенциальной гипокаль-
циемией и в переливании свежей крови или ЭМ. Скорость ге-
мотрансфузии должна быть не более 50—70 мл/мин. Необходи-
мо профилактическое введение растворов кальция (глюконат,
хлорид кальция — 10 мл на каждые 0,5 л плазмы или крови).
Лечение гиперкалиемии:
• отмена всех препаратов, содержащих калий, в том числе
калийсберегающих;
• внутривенные вливания 5 мл 10 %-го р-ра хлорида или
глюконата кальция и хлорида натрия после трансфузии каж-
дых 500 мл цитратной крови;
• внутривенное введение 20—40 %-го р-ра глюкозы
(100—200 мл) с инсулином (1 ЕД на 5 г глюкозы);
• не содержащие калий кровезаменители (дисоль или фи-
зиологический раствор хлорида натрия);
• назначение диеты с низким содержанием белка.
7.1.4. Негемолитические реакции
Основная причина посттрансфузионных реакций негемо-
литического типа при гемотрансфузии крови или ее компонен-
тов — взаимодействие между антигенами лейкоцитов, тромбо-
546
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
цитов, белков плазмы и иммунными антителами против них.
Клинически данный тип реакции у реципиента проявляется
лихорадкой, покраснением лица — фебрильной негемолитиче-
ской трансфузионной реакцией (ФНГГР). Причиной фебриль-
ных реакции могут быть антилейкоцитарные, антитромбоцитар-
ные, антибелковые антитела реципиента.
Сенсибилизация пациента происходит вследствие много-
кратных гемотрансфузий или предшествующих беременностей.
Реакция антиген—антитело активирует комплемент, приводящий
к высвобождению вазоактивных субстанций. Доказательства,
подтверждающие гипотезу о том, что ФНГТР обусловлена при-
сутствием лейкоцитов в трансфузируемых компонентах, стали
появляться с 1950 года. Реакция «антиген—антитело» приводит
к высвобождению эндогенных пирогенов (цитокины донор-
ских лейкоцитов ИЛ-1в, ИЛ-6 и фактор некроза опухоли).
ФНГТР может быть также следствием высвобождения цитоки-
нов из активированных макрофагов реципиента. В этом случае
антитела реципиента при взаимодействии с лейкоцитами донор-
ской крови активируют комплемент. Комплекс «антиген—анти-
тело-комплемент» может вызывать активацию макрофагов ре-
ципиента с выработкой эндогенных пирогенов.
Антитела к лейкоцитам обнаруживаются у 70 % и более па-
циентов, перенесших ФНГТР. К ним относятся HLA-антитела,
определяемые лимфоцитотоксическим тестом, а также антите-
ла к гранулоцитам. Снижение уровня лейкоцитов менее 5 х 106
в компонентах значительно уменьшает риск возникновения
ФНГТР.
Однако не все ФНГТР обусловлены антилейкоцитарными
антителами. У 30 % пациентов, перенесших данное осложнение,
были выявлены антитела не к лейкоцитам. При трансфузиях
тромбоцитов среди 20 % реципиентов, перенесших ФНГТР, у
55 % первая реакция развилась во время первых трех процедур.
При изучении этих случаев стало ясно, что срок хранения ком-
понентов крови является важным фактором в возникновении
ФНГТР, обусловленной накоплением биологически активных ве-
ществ в компонентах во время хранения.
Частота возникновения ФНГТР более высока при тран-
сфузиях концентрата тромбоцитов, чем эритроцитарной массы,
547
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
при одинаковом абсолютном числе лейкоцитов в переливаемых
компонентах. Возникновение реакции впервые при трансфузии
тромбоцитов означало отсутствие предварительной сенсибили-
зации реципиента к лейкоцитам, следовательно, лихорадка при
ФНГТР не была иммунного генеза. Увеличение концентрации
цитокинов, как эндогенных, так и экзогенных, является опас-
ным для реципиента, вызывая активацию эндогенных пироге-
нов. Такие цитокины, как ИЛ-1в, ИЛ-8 и TNF, активно синте-
зируются и высвобождаются при хранении тромбоцитов и эри-
троцитов. Существует корреляционная зависимость между уров-
нем цитокинов, содержанием лейкоцитов и сроком хранения
препарата. Цитокины накапливаются при температуре хране-
ния более чем 22 °C. Предварительное удаление лейкоцитов из
препарата предупреждает накопление цитокинов при хране-
нии и сопровождается значительным снижением частоты воз-
никновения ФНГТР. Эффекты ИЛ-1 обусловлены собствен-
ной пирогенной активностью и/или опосредованной ИЛ-6 или
ПГ Е-2 стимуляцией гемопоэза и активацией нейтрофилов и
тромбоцитов. TNF также является мощным пирогеном, усили-
вающим пролиферацию В-клеток и активирующим коагуля-
цию по внешнему пути через тканевый фактор. ИЛ-6 усилива-
ет реакцию антител и стимулирует пролиферацию и диффе-
ренцировку В-клеток. ИЛ-8 является хемотаксическим факто-
ром для нейтрофилов и Т-клеток, стимулирующим выделение
окислительных ферментов нейтрофилами и высвобождение
гистамина базофилами.
При соприкосновении плазмы с пластиковой поверхно-
стью возможна активация комплемента по альтернативному пу-
ти. Активированный СЗ-компонент комплемента выявляется
в любых двух донорских компонентах крови и в одном концен-
трате аферезных тромбоцитов в случае хранения при комнатной
температуре в течение 5 дней. Механизм активации СЗ не явля-
ется клеточнозависимым, так как остаточные лейкоциты в тром-
боцитарной взвеси имеют высокий уровень активности СЗ. СЗа
обладает множественными патофизиологическими эффекта-
ми: поддерживает высвобождение гистамина макрофагами, яв-
ляется вазодилататором, повышающим микрососудистую про-
ницаемость, также увеличивает in vitro агрегацию тромбоцитов
548
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
и высвобождение серотонина и брадикинина, что вызывает ве-
нозную вазодилатацию, снижение давления, увеличение сосу-
дистой проницаемости, спазм гладкой мускулатуры, активацию
фосфолипазы А2 и усиление метаболизма арахидоновой кисло-
ты. Таким образом, активация комплемента может стимулиро-
вать моноциты в концентрате тромбоцитов к продуцированию
цитокинов, что усугубляет характерные симптомы ФНГТР. Не-
которые из современных лейкоцитарных фильтров способны
поглощать СЗа из концентрата тромбоцитов и могут быть исполь-
зованы для профилактики возникновения ФНГТР.
Иммунологическая диагностика заключается в выявлении
иммунных антител, направленных к антигенам лейкоцитов,
тромбоцитов или белков плазмы. Для профилактики негемоли-
тических реакций с целью планирования трансфузионной так-
тики важное значение имеет тщательный сбор анамнестиче-
ских данных: наличие и количество предыдущих гемотрансфу-
зий, у женщин — наличие в анамнезе родов, беременностей,
абортов. Лабораторная диагностика — выявление иммунных
антител — не всегда бывает успешной.
Фибрильные реакции регистрируются через 5 мин после
начала трансфузии и проявляются гиперемией лица, а через
50—60 мин наступает тяжелая реакция — высокая температура
(повышение на 1 °C и более), озноб, головные боли. Могут иметь
место и опасные клинические симптомы в виде бронхоспазма, ос-
трой дыхательной недостаточности, ангионевротического отека.
Реакции, вызванные HLA-антителами, антилейкоцитар-
ными антителами с высоким титром могут выражаться и ос-
трым легочным синдромом (одышка, кашель, гипотензия; рент-
генологически выявляются инфильтрация нижних долей легких,
множественные узелки в области ворот легких).
Одним из наиболее эффективных методов профилактики
посттрансфузионных реакций негемолитического типа явля-
ется фильтрация крови или компонентов крови через спе-
циальные фильтры, задерживающие лейкоциты, и свободно
пропускающие в зависимости от типа фильтра эритроциты,
тромбоциты или плазму. Использование фильтров помимо
профилактики фибрильных посттрансфузионных реакций
позволяет решить и другие задачи, например, резко снижа-
549
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ется риск иммуносупрессии, реакции «трансплантат-про-
тив-хозяина» у иммунокомпрометированных больных, пе-
редачи отдельных вирусов (цитомегаловирусной инфекции
(CMV) с лейкоцитами). Клинически значимая аллосенси-
билизация встречается с меньшей частотой, чем анергия,
иммунологическая толерантность и т. п. после гемотрансфу-
зий, поэтому большой интерес представляют данные об ин-
фекционных осложнениях у хирургических больных. Так,
если послеоперационные инфекции у хирургических больных
наблюдаются с частотой около 5 % случаев, то у реципиентов,
получивших 2 и более дозы аллогенной крови, их частота
возрастает до 20—30 %. При этом реципиенты аутологичной
крови имеют такую же частоту инфекций, как и больные, не
получавшие гемотрансфузий. При проведении гемотрансфу-
зий компонентами крови, из которых удалены лейкоциты
лейкоцитарными фильтрами, частота послеоперационных
осложнений снижается до 2 %. Кроме нежелательных им-
мунологических эффектов с донорскими лейкоцитами воз-
можна передача клеточно-ассоциированной вирусной ин-
фекции. Риск передачи ЦМВ с небольшой дозой лейкоцитов,
содержащихся в компонентах крови, весьма велик. В латент-
ной форме ЦМВ присутствует примерно у 50 % доноров. При
переливании донорских лейкоцитов ЦМВ передается реци-
пиенту, и при наличии иммуносупрессии может вызвать за-
болевание. Например, при ТКМ у 26 % пациентов возника-
ют цитомегаловирусные пневмонии, а причиной летального
исхода среди умерших после трансплантации почки в 60—90 %
случаев также является цитомегаловирусная инфекция. Риск
передачи ЦМВ напрямую связан с числом перелитых лейко-
цитов. Поэтому освобождение крови от лейкоцитов мето-
дом фильтрации является альтернативой тестированию кро-
ви на ЦМВ. Аналогичным образом могут передаваться и дру-
гие клеточно-ассоциированные вирусы.
Существуют факторы, влияющие на механизм фильтрации.
Это реологическое состояние крови (величина гематокрита),
начальное число лейкоцитов и их функциональная активность,
содержание белков плазмы, число тромбоцитов, наличие анор-
мального гемоглобина, вид консерванта, метод заготовки цель-
550
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
ной крови, типа фильтра, используемого при фильтрации, и
условия хранения компонентов.
В зависимости от принципа действия и фирмы-производи-
теля лейкоцитарные фильтры крови позволяют удалять 91—99%
лейкоцитов от исходного их содержания в дозе эритроцитарной
массы или концентрата тромбоцитов. Трансфузионные среды с
содержанием лейкоцитов менее 5 х 106 считаются компонентами
крови, не содержащими лейкоцитов.
В последние годы для удаления лейкоцитов из цельной кон-
сервированной крови, эритроцитарной массы и при получении
концентрата тромбоцитов активно используют специальные
фильтры.
В среднем в 450—500 мл консервированной крови или эри-
троцитов содержится 2—3 х 10" лейкоцитов и большое количе-
ство тромбоцитов. Стандартный просеивающий фильтр крови
с диаметром пор 170—260 мкм не задерживает и не удаляет лей-
коциты.
Лейкоцитарный адгезивный фильтр удаляет до 95 % лейко-
цитов, но концентрацию цитокинов не изменяет. Примером
данного типа фильтра является УЛЛ-01 «Интероко». Он удаля-
ет около 95 % лейкоцитов, что составляет около 108 — остаточ-
ный уровень.
Это позволяет добиться лишь снижения риска возникнове-
ния иммунологических эффектов и передачи клеточно-ассо-
циированных клеточных инфекций.
Существуют определенные минусы при проведении фильт-
рации только по принципу прямой адгезии.
Взаимодействие между клетками и материалом фильтра
приводит к изменению формы и активности клеток. Обычно до-
статочно активации одной ферментной системы клеток, чтобы
они начали высвобождать медиаторы. Однако более часто клет-
ки разрушаются и в этом случае в компоненты крови попадают
клеточно-ассоциированные вирусы и бактерии. К тому же при
использовании этих фильтров нужно соблюдать оптимальный ре-
жим фильтрации:
• предварительное освобождение компонентов от лейко-
тромбослоя;
• сроки хранения — не более 48 ч;
551
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• гематокрит фильтруемой среды в пределах 60—70 %;
• требуется обязательное заполнение фильтра перед рабо-
той физраствором (около 200 мл): 50 мл для вытеснения возду-
ха, а 150 струйно. Скорость: 60—80 капель в минуту;
• до процесса фильтрации компоненты должны быть в те-
чение 15—30 мин, а по последней инструкции — до 60 мин при
комнатной температуре;
• скорость фильтрации составляет 2—7 мл/мин (40—60 капель).
Адгезивно-адсорбционные импортные лейкоцитарные
фильтры позволяют удалять более 99 % лейкоцитов, что соответ-
ствует содержанию 2,0 х 105 клеток. Эти лейкоцитарные филь-
тры удаляют из гемокомпонентов почти 100 % микросгустков и
нитей фибрина диаметром не менее 4 мкм.
Эти фильтры эффективны для профилактики образования
микросгустков: через 15 дней в 1 мкл — 500 сгустков, а в от-
фильтрованном в 2 раза меньше. На 42 день: без фильтрации —
15 000, а при заблаговременном удалении лейкоцитов — 2000.
Фильтрующим материалом является микропористый по-
лимер, заключенный в поликарбонатный корпус. Высокая
эффективность очистки обусловлена тем, что фильтрующий
материал лейкоцитарных фильтров для очистки эритромассы
состоит из двух слоев: поверхностного (так называемого пре-
фильтра), представляющего собой нетканый фильтр (подоб-
ный микрофильтру), и основного внутреннего слоя филь-
трующего материала, изготовленного из микропористого по-
лимера, в котором и осуществляется процесс фильтрации.
Таким образом, в процессе фильтрации происходит меха-
ническое удаление лейкоцитов, которые задерживаются по-
рами малого размера. Отсутствует активация клеток и взаимо-
действие между клетками и материалом, из которого изгото-
влен фильтр. На данном этапе нет деструкции клеток и не
высвобождаются содержащиеся в них инфекционные агенты
в фильтрат.
Надо отметить, что при использовании нового поколения
фильтров потери тромбоцитов при фильтрации составляют ме-
нее 10 %. Это существенно превосходит то, что можно полу-
чить, применяя обычные методы центрифугирования (80—90 %
лейкоцитов и 20—30 % тромбоцитов).
552
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
К тому же существенная разница наблюдается в посттрансфу-
зионном приросте тромбоцитов при переливании фильтрованных
и нефильтрованных тромбоцитов: 40 и 23 % соответственно (че-
рез 2—4 ч после трансфузии), а на следующие сутки — 15 и 5 %.
Данные частоты возникновения реакций при трансфузиях
тромбоцитов:
1)в момент трансфузии:
при использовании фильтра — 7—8 %;
без — более 60 %;
2) через 2—3 ч:
при использовании фильтра — 1—1,5 %;
без — 20 %;
3) через сутки:
при использовании фильтра — нет;
без — 5—6 %.
Необходимо отметить и возможность более высокого рис-
ка бактериального загрязнения тромбоконцентрата, так как он,
в отличие от других компонентов крови, хранится при комнат-
ной температуре. Из фракции плазмы концентрата тромбоцитов
эти лейкоцитарные фильтры также адсорбируют:
• до 95 % активированных компонентов комплемента (ана-
филотоксины СЗа, С5а);
• до 35 % эндогенного агониста агрегации тромбоцитов
(бета-тромбоглобулин);
• до 85 % хемокинов (цитокины, обладающие в основном
хемоаттрактантной активностью) — ИЛ-8, антигепариновый
фактор тромбоцитов;
• не активируют провоспалительные цитокины лейкоцитов —
ИЛ-1-бета, TNF.
Существуют два подхода к делейкотизации крови, или ЭМ:
использование фильтра непосредственно у постели больного
или применение фильтра для удаления лейкоцитов на этапе пе-
реработки цельной консервированной крови на компоненты.
В связи с этим в настоящее время используются лейкоцитарные
фильтры для эритроцитов и тромбоцитов прикроватного (при-
меняется в процессе переливания, у постели больного) и банков-
ского (применяется в процессе изготовления эритроцитсодер-
жащих сред и заготовки крови на станции или в отделениях пе-
553
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
реливания крови) типов, а также перфузионные фильтры, при-
меняемые в линии экстракорпорального кровообращения.
На российском рынке большое количество фирм предста-
вляют данные виды фильтров. Данные фильтры комплектуют-
ся трансфузионной системой, фильтруемыми средами для них
являются цельная кровь, эритромасса или эритровзвесь. Ис-
пользование данных фильтров обеспечивает хранение ком-
понентов крови в течение максимального срока, скорость
фильтрации составляет 10—25 мин. Дополнительное разведе-
ние физиологическим раствором не требуется. Существует
особый тип фильтров — операционный, позволяющий филь-
тровать под давлением до 300 мм рт. ст., что сокращает время
фильтрации до 3 мин.
Прикроватный способ фильтрации компонентов крови
имеет и свои минусы. Как говорилось ранее, в цельной кон-
сервированной крови и эритроцитарной массе практиче-
ски все лейкоциты разрушаются и выделяют в среду различ-
ные биологически активные вещества, которые могут стать
причиной нежелательных посттрансфузионных реакций у
пациента. Остается невыясненным, в какой степени филь-
тры позволяют очистить кровь от разрушенных клеточных
элементов и фрагментов клеточной мембраны лейкоцитов,
которые обладают достаточно высокой сенсибилизирую-
щей активностью. Необходимо обратить внимание и на то,
что при хирургических операциях, где планируется боль-
шая кровопотеря, в короткие сроки требуются достаточно
большие объемы компонентов крови, поэтому оптималь-
ным является применение фильтров на этапе заготовки и пе-
реработки крови. Это позволяет выполнять процедуру очист-
ки в стандартных условиях с соблюдением всех необходимых
мер предосторожности. Такой подход позволяет по соот-
ветствующей заявке лечащего врача готовить столько доз де-
лейкоцитированных компонентов крови, сколько необходи-
мо для конкретного больного.
Лейкоцитарные системы фильтрации, используемые для
банков крови, подразделяются на 2 типа: для фильтрации цель-
ной крови перед разделением ее на компоненты и для фильтра-
ции во время разделения на компоненты крови.
554
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
Перфузионный тип фильтров (используемые в линии эк-
стракорпорального кровообращения) представлены 2 видами
фильтров:
Первый — где фильтруемой средой является артериаль-
ная кровь при экстракорпоральном кровообращении (LG-6).
Используется для удаления активированных лейкоцитов;
максимальная скорость фильтрации — 6 л/мин при быстром
заполнении и дегазации фильтра.
Второй — атериальный лейкофильтр для экстракорпо-
рального кровообращения. Используется для создания не-
турбулентного тангенциального потока, уменьшающего опас-
ность реологического стресса и повреждения клеточных ком-
понентов крови. Максимальная скорость фильтрации —
8 л/мин при быстром заполнении фильтра.
При фильтрации заготовленных компонентов крови
используются системы для получения очищенной от
лейкоцитов одной дозы тромбоконцентрата после афе-
реза или тромбоконцентрата от 4—6 доноров, загото-
вленного обычным способом. Лейкоцитарные фильтры
для тромбоцитов также делятся на прикроватный и бан-
ковский типы.
Трансфузии компонентов крови — эритроцитной массы,
плазмы или концентратов тромбоцитов, обедненных лейко-
цитами, — рекомендованы:
• при повторных гемотрансфузиях для профилактики не-
гемолитических фибрильных трансфузионных реакций;
• для профилактики аллоиммунизации и рефрактерности
к трансфузиям тромбоцитов;
• больным с иммунодефицитом и серонегативным к цито-
мегаловирусу;
• пациентам с гемоглобинопатиями и наследственными
гемолитическими анемиями;
• возможным кандидатам аллогенной и аутологичной
трансплантации костного мозга;
• пациентам с перспективой пересадки почек, печени и
сердца;
• беременным и новорожденным до 3 месяцев;
• при отягощенном аллергологическом анамнезе.
555
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Для обеспечения полноценного эффекта трансфузии
(лейкоцитов) и тромбоцитов необходимо выполнять инди-
видуальный подбор донора с учетом выявленных у больно-
го антител к групповым антигенам клеток и белкам плазмы
и перекрестной лимфоцитотоксической пробы донорских
лейкоцитов с сывороткой реципиента.
7.1.5. Профилактика и терапия
посттрансфузионных реакций
В целях профилактики пирогенных и аллергических
реакций у больных с изосенсибилизацией к антигенам
HLA, лейкоцитарным или тромбоцитарным антигенам
необходимо использовать отмытые донорские эритроци-
ты, концентраты тромбоцитов, лейкоцитную массу, по-
добранные с учетом специфичности антител у реципиен-
та. Пациентам, сенсибилизированным множественными
гемотрансфузиями, рекомендуется проводить перед пе-
реливанием медикаментозную антигистаминную премеди-
кацию препаратами, предупреждающими проявление ал-
лергических реакций.
Профилактика гемотрансфузионных реакций включает:
До трансфузии:
1) строгое выполнение всех требований и условий по заго-
товке, хранению и переливанию консервированной крови, ее
компонентов и препаратов;
2) применение систем одноразового использования;
3) тщательный сбор трансфузионного и акушерского анам-
неза:
• количество предшествующих трансфузий;
• интервал между ними;
• переносимость;
• вид трансфузионного раствора;
• через сколько времени после трансфузии была реакция и
ее характер (повышение температуры на 0,5—2,0 °C, мышечные
боли, удушье, отеки, кожная сыпь, одышка);
• признаки посттрансфузионного гемолитического ослож-
нения (желтушность кожи и слизистых, темный цвет мочи, бо-
ли в пояснице, животе, за грудиной);
556
ГЛАВА 7, ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
• количество беременностей, родов, ранних выкидышей,
антенатальной гибели плода, гемолитической болезни ново-
рожденных;
• клинические и лабораторные исследования, напра-
вленные на выявление повышенной чувствительности к
вводимым белкам, сенсибилизации повторными трансфу-
зиями и беременностями с образованием антилейкоци-
тарных, антитромбоцитарных антител, антител к плазмен-
ным белкам и т. д., а также антител к антигенам эритроци-
тов крови;
4) определение групповой и резус-принадлежности врачом
и в лаборатории. Скрининг антител в лаборатории;
5) определение показания для применения донорской кро-
ви и ее компонентов;
6) проведение контрольных исследований групп крови боль-
ного и донора. Постановка проб на совместимость.
Во время трансфузии:.
1) трансфузии (за исключением экстренных) должны про-
изводиться капельным методом или со скоростью 500 мл/ч;
2) биологическая проба;
3)во время гемотрансфузии за больным устанавливается
наблюдение со стороны врача или среднего медицинского пер-
сонала для своевременного выявления клинических проявлений
постгрансфузионных реакций или осложнений.
После трансфузии:.
1) наблюдение за больным в течение 24 ч после трансфузии:
• на протяжении первых 2 ч после окончания перелива-
ния регистрируют температуру тела и артериальное давление;
• каждый час: объем, цвет первой порции мочи, суточный
диурез. Возникшую посттрансфузионную реакцию или ослож-
нение врач записывает в историю болезни/родов;
2) мешок или флакон с остатком (не менее 10 мл) гемотран-
сфузионной среды с этикеткой хранят 48 ч, а пробирку с кровью
больного, взятую до переливания, хранят в течение 7 дней в хо-
лодильнике при +2—6 °C;
3) каждая трансфузия записывается в:
• журнал регистрации переливания трансфузионных сред,
форма 009/у (приказ М3 СССР № 1030 от 04.10.80);
557
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• историю болезни/родов в виде протокола или в листке ре-
гистрации переливания трансфузионных сред, форма 005/у
(приказ М3 СССР № 1030 от 04.10.80).
Реакции легкой и средней степени тяжести не требуют спе-
циального лечения. Больного укрывают теплым одеялом, к но-
гам кладут теплые грелки, дают пить горячее сладкое питье. Те-
рапию пирогенных реакций производят, используя жаропони-
жающие (325—500 мг ацетаминофена). Следует избегать назна-
чения аспиринсодержащих препаратов из-за их неблагоприят-
ного воздействия на функцию тромбоцитов. Десенсибилизи-
рующие и симптоматические средства.
При тяжелой реакции проводится комплексная медика-
ментозная терапия по показаниям:
• адреналин 0,1 %-ный — 1 мл;
• хлористый кальций 10 %-ный или глюконат кальция 10 %-
ный — по 10 мл;
• гидрокортизон (не менее 100 мг), целестон — 4 мг, декса-
метазон 4 мг или другие глюкокортикоиды — в дозе, эквивалент-
ной 60 мг преднизолона, и выше;
• лазикс — 20—40 мг (после купирования метаболического
ацидоза);
• кристаллоидные растворы на фоне нормального венозного
давления.
При лечении аллергических реакций назначают антигиста-
минные и десенсибилизирующие препараты (димедрол, супра-
стин, хлорид кальция, кортикостероиды), промедол.
Лечение анафилактического шока зависит от быстро-
ты и эффективности экстренной и интенсивной терапии,
включает ингаляцию кислородом, восстановление прохо-
димости дыхательных путей и, при необходимости, ИВЛ.
Внутривенно медленно вводят 100—200 мг преднизолона в
20 мл 5 %-ного раствора глюкозы или физиологического ра-
створа (2—3 мл 3 %-ного р-ра преднизолона или 2—3 мл
0,4 %-ного р-ра дексаметазона). При отсутствии эффекта в
течение 15—20 мин введение глюкокортикоидов повторяют.
При бронхоспазме внутривенно ввводят 10 мл 2,4 %-ного р-
ра эуфиллина с 10—20 мл 5 %-ного р-ра глюкозы. Острый
отек гортани с асфиксией служит показанием к срочной
558
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
трахеостомии. При нарастании процесса развития дыха-
тельной недостаточности применяют искусственную ле-
гочную вентиляцию.
При судорожном синдроме вводится внутривенно 2—4 мл
0,5 %-ного р-ра седуксена в 10—20 мл физиологического ра-
створа.
Важным моментом лечебных мероприятий является коррек-
ция ацидоза. С этой целью внутривенно назначают 200 мл
4 %-ного р-ра гидрокарбоната натрия.
Для стимуляции диуреза применяют внутривенное введение
20—40 мг лазикса.
7.1.6. Гемотрансфузионные осложнения
и методы их профилактики
В отличие от посттрансфузионных реакций, гемотран-
сфузионные осложнения характеризуются тяжелыми кли-
ническими проявлениями, представляющими опасность для
жизни больного вследствие нарушения деятельности органов
и систем организма, осуществляющих жизненно важные
функции.
Наиболее частой (около 90 %) причиной посттрансфузи-
онных осложнений является переливание крови или эритро-
цитарной массы, несовместимой по группе АВО и Rh-факто-
ру. Эти ошибки совершаются главным образом в акушерско-
гинекологических и хирургических отделениях [Воро-
бьев А.И., 1999]. Значительно реже встречаются осложне-
ния, связанные с недоучетом противопоказаний к гемотран-
сфузии, погрешностями в методике трансфузии, с трансфу-
зиями недоброкачественной крови. В табл. 7.2 рассмотрены
причины осложнений с летальным исходом после перелива-
ния крови, имевших место в госпиталях США в 1976—1985 гг.,
в таблице приведен анализ 355 случаев.
Основные причины осложнений
Осложнения могут быть обусловлены:
1) качеством и свойствами крови (компонентов) вследствие
несоблюдения правил заготовки;
559
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Таблица 7.2. Некоторые причины осложнений, вызвавшие
летальный исход у больных после переливания крови (Sazama, 1988)
Осложнение Число случаев Процент от общего числа Примечание
Острый гемолиз после переливания несовме- стимой крови 159 48,5 В 8 случаях причина неиз- вестна
Гепатит (кроме А и В) 44 13,4
Гепатит В 26 7,9
Отек легких 33 10,1
Бактериальное загряз- нение 26 7,6
Гемолиз, вызванный физико-химическими агентами 7 2Д
СПИД 3 0,9
Реакция «трансплан- тат-против-хозяина» 1 о,з
Отсроченный гемолиз 28 7
2) несоблюдением правил переливания;
3) серологической несовместимостью;
4) вирусной зараженностью;
5) бактериальным загрязнением;
6) нарушением режима и сроков хранения, транспортиров-
ки и т.д.;
7) наличием у реципиентов заболеваний или состояний (на-
пример, сенсибилизация), при которых переливание крови или
определенного компонента противопоказано.
Непосредственно при гемотрансфузии или в раннем
посттрансфузионном периоде наиболее часто наблюдают-
ся гемотрансфузионный шок, острый внутрисосудистый ге-
молиз и геморрагический синдром. У оперированных больных
может развиться острая почечно-печеночная недостаточ-
ность.
560
ГЛАВА 7, ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
Основные причины гемотрансфузионных осложнений:
• несовместимость крови донора и реципиента по эритро-
цитарным антигенам системы АВО, резус-фактору, Келл и др.;
• недоброкачественность крови или ее компонентов (бак-
териальное, паразитарное или вирусное загрязнение, гемолиз, на-
рушения температурного режима хранения, в частности, пере-
гревания — денатурация белков, и др.);
• погрешности в методике трансфузии (воздушная эмболия,
тромбоэмболия, циркуляторная перегрузка, кардиоваскуляр-
ная недостаточность и др.);
• массивные дозы гемотрансфузии;
• недоучет противопоказаний к переливанию крови и/или
ее компонентов;
• состояние реципиента перед гемотрансфузией (повы-
шенная реактивность, сенсибилизация и др.);
• трансфузионно обусловленная болезнь «трансплантат-
против-хозяина»;
• трансфузионная иммуносупрессия.
В.А. Аграненко (1998) приводит анализ 766 гемотрансфу-
зионных осложнений у больных в различных лечебных учреж-
дениях. Было установлено, что в 625 случаях (81,6 %) причи-
на заключалась в переливании крови, несовместимой по груп-
повым факторам крови, из них 274 (35,8 %) — по системе АВО,
328 (42,8 %) — по резус-фактору и 23 (3 %) — по антигенам дру-
гих систем. Осложнения, связанные с переливанием недобро-
качественной крови, ее компонентов и препаратов были зафик-
сированы в 95 случаях (12,4 %); в 23 (3 %) — в связи с состоя-
нием реципиента до трансфузии, в 3 случаях (0,4 %) они на-
ступили из-за погрешностей в технике трансфузии (воздушная
эмболия); в 20 (2,6 %) причина осложнений не была установле-
на ввиду отсутствия необходимых сведений.
Осложнения при изосерологически
несовместимых гемотрансфузиях
Наиболее опасной причиной гемотрансфузионных ослож-
нений является переливание крови, эритроцитной массы (ЭМ),
несовместимых по эритроцитарным антигенам системы АВО и
резус-фактору.
561
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
В подавляющем большинстве случаев осложнения развива-
ются из-за:
• нарушения методики определения группы крови;
• несоблюдения правил проведения пробы на групповую
совместимость;
• нарушения техники переливания крови (компонентов).
В патогенезе посттрансфузионных осложнений, вызван-
ных несовместимостью крови донора и реципиента по системе
АВО, ведущую роль играет разрушение (гемолиз) эритроцитов до-
нора антителами. Скорость, интенсивность и степень внутрисо-
судистого гемолиза определяются:
• объемом перелитой крови или эритроцитной массы;
• классом иммуноглобулинов;
• уровнем компонентов комплемента;
• количеством антител.
В результате гемолиза в плазме реципиента повышается
концентрация калия, появляется свободный гемоглобин, био-
генные амины, тромбопластин и другие биологически активные
вещества.
Несовместимость чаще всего проявляется гемолизом пе-
релитых эритроцитов, что является результатом сложных имун-
нобиохимических процессов с участием антигенов, специфиче-
ских к ним антител реципиента, компонентов комплемента,
пропердина и других плазменных факторов крови. Но причиной
внутрисосудистого гемолиза могут быть и антитела донора, со-
держащиеся в переливаемой плазме (или цельной крови), кото-
рые разрушают эритроциты реципиента.
Тяжелая острая ГТР, развивающаяся в первые 24 часа после
трансфузии, сопровождается внутрисосудистым гемолизом, об-
условленным связыванием 1g М-антител комплементом. Одна-
ко менее тяжелые ГТР могут сопровождаться внесосудистым
гемолизом при наличии у реципиента антител, относящихся к
иммуноглобулинам класса G (анти-D, анти-К), у пациентов,
сенсибилизированных предыдущими гемотрансфузиями или
беременностью. Частота появлений в среднем составляет
1:25 000 трансфузий. Отсроченная ГТР возникает через 3—5 дней
после трансфузии и является следствием анамнестических не-
точностей или возникает как вторичный иммунный ответ у ра-
562
ГЛАВА 7, ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
нее сенсибилизированных пациентов. В данном случае в пре-
трансфузионных анализах антитела отсутствовали и развитие
реакции данного типа происходило по механизму внесосуд исто-
го гемолиза. Частота ГТР такого типа составляет приблизитель-
но 1:2500 трансфузий.
Наиболее общими симптомами острой и отсроченной ГТР
являются лихорадка и озноб. Гипотензия, рвота и диарея более
характерны для острой реакции, а боли в груди и пояснице — для
отсроченной. При любом типе трансфузионной реакции мо-
жет возникать лейкоцитоз. Острый внутрисосудистый гемолиз
проявляется желтухой, повышением лактат дегидрогиназы,
признаками почечной недостаточности и гипербилирубине-
мией, гемоглобинемией и гемоглобинурией, которые являют-
ся патогномоничными и могут появиться при ГТР, протекающей
с внесосуцистым гемолизом, если очень мощные антитела вы-
зовут гемолиз путем активации цитотоксических реакций. По-
нижение уровня гаптоглобина возможно при обоих типах реак-
ции, но более выражено при внутрисосудистом гемолизе. ДВС
и почечная недостаточность более часто наблюдаются при острой
ГТР, но также могут встречаться и при отсроченной, что иног-
да является причиной смертельного исхода. Такой финал наи-
более вероятен для острой ГТР. Биохимическими тестами выяв-
ляется гемоглобинемия.
Изредка ГТР может быть результатом трансфузии не эритро-
цитов, а свежезамороженной плазмы или тромбоцитов. Трансфу-
зии плазмы, при которой обычно 0 группу переливают реципи-
ентам, имеющим А-, В- и АВ-антигены, могут вызвать гемолиз,
если она содержит мощные антитела против А- и В-антигенов
эритроцитов реципиента. В редких случаях может возникнуть
несовместимость между эритроцитами одного донора и плазмой
другого, когда оба препарата переливают одному реципиенту
(«внутридонорская несовместимость»).
Характеристика аллоантител и их специфических детерми-
нант является основным при ГТР. Аллоантитела эритроцитов
представлены в основном иммуноглобулинами класса Сив ме-
ньшей степени М. Антитела, относящиеся к иммуноглобулину
класса М, и являются классической причиной острой ГТР, со-
провождающейся внутрисосудистым гемолизом. Антитела, яв-
563
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ляющиеся иммуноглобулинами класса G, вызывают внесосуди-
стый гемолиз, который может быть острым (если титр антител
достаточен к моменту трансфузии) или отсроченным (в случае
отсутствия антител при постановке претрансфузионного теста
их появление стимулируется трансфузией и определение возмож-
но только через 5—8 дней после разрушения эритроцитов).
Таблица 7.3 демонстрирует сочетание антигенов с типом
гемолитической реакции (вне- или внутрисосудистый). Другие
антиэритроцитарные антитела могут быть причиной внесосуди-
стого гемолиза и, как правило, не представляют угрозу для жиз-
ни.
Патофизиология
Внутрисосудистые гемолитические реакции (обусловленные
анти-А, анти-В, анти-АВ, анти-Le, РР, Р).
При активации каскада реакций комплемента по класси-
ческому пути, с Cl-C9,Ig М вызывают гемолиз, сопровождаю-
щийся гемоглобинемией и гемоглобинурией. Наиболее частой
причиной несовместимости по антигенам системы АВО явля-
ются технические ошибки (например, ошибки в определении
Таблица 7.3. Специфические сочетания антигенов с типом
гемолитической реакции
Системы групп крови Интраваскулярный гемолиз: анти- Экстраваскулярный ге- молиз: анти-
АВО, Н А, В, H (в группе «Бомбей»)
Lewis Lea (Leb)
Р Р + Pl + Pk (Tja) Pl
1,1 I, i (очень редко)
Rh D, с, E, С, e
Duffy Fya, Fyb
MNS S, s, U, M (редко), N (редко)
Lutheran Lu
Kell K, k, Kpa, Kpb, Js% Jsb
Kidd Jka, Jkb, Jk3
Vel Vel Vel
564
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
группы крови или другие лабораторные неточности). Самое
большое количество смертельных исходов при трансфузии нес-
овместимой группы крови наблюдается при переливании эритро-
цитов групп А или В реципиентам с 0 группой крови, что обусло-
влено более высокой активностью агглютининов, содержащих-
ся в О группе, чем анти-А и анти-В в группах В и А соответствен-
но. Активация С1-С9 вызывает высвобождение анафилотокси-
нов СЗа и С5а, ответственных за проявление симптомов иммун-
ного внутрисосудистого гемолиза (гипотензия, шок, почечная не-
достаточность, ДВС). В данном случае симптомы протекают бо-
лее тяжело, чем те же проявления интраваскулярного гемолиза,
не имеющего иммунного механизма в своей основе, или внесо-
судистого гемолиза, обусловленного иммунологическими при-
чинами. СЗа и С5а активируют мононуклеарные фагоциты (мо-
ноциты, нейтрофилы) для пероксидазного окисления с последу-
ющим усилением экспрессии СЗв рецепторов на этих клетках. СЗа
и С5а стимулируют высвобождение из макрофагов и базофилов
медиаторов, уже накопленных в их гранулах (гистамин, фактор
активации тромбоцитов, TNF, ИЛ-1,3,4,5,6) или вновь синте-
зируемых через метаболизм арахидоновой кислоты (лейкотриены
и ПГ). Моноциты активируются фагоцитозом per se и С5а при со-
путствующей секреции медиаторов острой фазы (TNF, ИЛ-1,8,
ПГЕ-2, фактор активации и хемотаксиса нейтрофилов). Тромбо-
пластин высвобождается при гемолизе, и активация компле-
мента в таких условиях запускает процесс свертывания по вне-
шнему пути с последующим развитием ДВС-синдрома.
Внесосудистые гемолитические трансфузионные реакции, об-
условленные анти-Rh, анти-К и др.
Агрегация эритроцитов, нагруженных антителами класса
IgGp IgG3 и/или С3в с Fc-фрагментами рецепторов (FcRl, FcR2,
Fc R3) или с компонентом комплемента на моноцитах или лим-
фоцитах, также стимулирует фагоцитоз или развитие цитотокси-
ческих реакций. Цитотоксичность опосредована в основном
лизосомальными ферментами, высвобождаемыми моноцита-
ми, когда эритроциты покрыты АТ класса иммуноглобулинов G,,
G3. Незначительное количество АТ, фиксированных на эритро-
цитах, стимулирует фагоцитоз. Те АТ, которые относятся к клас-
су Ig G и фиксированы комплементом (такие, как анти-Лс"), яв-
565
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ляются менее активными, чем АТ, относящиеся к Ig М. Они бу-
дут активироваться Сг компонентом комплемента при каскаде
реакций. Только Сзь компонент комплемента не вызывает реак-
ции цитотоксичности или фагоцитоз, но в значительной степе-
ни усиливает IgG-индуцированный фагоцитоз или реакции ци-
тотоксичности через взаимодействие рецепторов комплемента
(только в отношении Сзь) на моноцитах. Свободный IgG в плаз-
ме ингибирует связывание IgG эритроцитарных антител с Fc-pe-
цепторами моноцитов. Таким образом, эритроциты, покрытые
нефиксированными комплементом AT IgG! и 3 (анти- D,E, с), раз-
рушаются главным образом в селезенке. Сзь, имеющий очень ко-
роткий период полужизни на эритроцитах, снимает ингибитор-
ный эффект содержащегося в плазме свободного Ig G в отноше-
нии Fc-рецепторов моноцитов: в плазме не обнаруживается
свободный Сзь фрагмент комплемента. Клетки, покрытые Сзь, бу-
дут легко связываться с CR 1-рецепторами. Поэтому эритро-
циты, покрытые IgG], G3 (в основном анти-1ка и Jk”, менее ан-
ти-К и анти- Fya), разрушаются преимущественно в печени,
где хороший кровоток и большое количество фагоцитов. В дан-
ном случае эритроциты разрушаются быстрее, чем если бы бы-
ли покрыты только АТ класса IgG. Более клинически значи-
мыми являются антиэритроцитарные АТ класса IgG,, G3. IgG
данных типов обладают большей разрушительной способно-
стью, т. к. Fc-рецепторы «узнают» только эти подклассы. Те
IgM, которые не активируются компонентами комплемента, не
являются причиной гемолиза эритроцитов. Антиэритроцитар-
ные алло-АТ, относящиеся только к классу IgA, не обнаружены.
Клинические проявления ГТР
Первыми симптомами ГТР являются лихорадка и озноб,
которые практически невозможно отличить ее от пирогенной
посттрансфузионной реакции негемолитического типа.
Боль в спине и пояснице является неспецифическим и об-
щим симптомом.
Ощущение удушья и диспноэ обусловлены периваскуляр-
ным и перибронхиальным отеком легких.
Гипотензия, шок и почечная недостаточность встречаются
у 10 % пациентов при интраваскулярной ГТР и редко
наблюдаются при внесосудистом гемолизе. Активация компле-
566
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
мента может быть значительным фактором в развитии этих сим-
птомов, и в данном случае более значимыми, вероятно, являют-
ся анафилотоксины С3а, С5а. В добавление к цитокинам, TNF и
ИЛ-1 могут стать причиной понижения давления и шока. Разви-
тие почечной недостаточности возможно при обоих типах ГТР,
хотя более вероятно ее появление при остром варианте. В лег-
ких случаях наблюдается повышение в сыворотке крови уровня
мочевины и креатинина, протекающие без клинических симпто-
мов. В более тяжелых случаях у пациентов возникает анурия, что
требует проведения диализа, с гипотензией и диссеминирован-
ным внутрисосудистым свертыванием, усугубляющим почеч-
ную недостаточность. Патофизиологической основной ОПН
является острый тубулярный некроз, тромбоз почечных артериол,
который может быть причиной инфаркта коркового слоя. Наи-
большей нефротоксичностью обладает свободный гемоглобин,
который в почечных канальцах превращается в солянокислый
гематин. На фоне стрессового спазма почечных сосудов в про-
свете почечных канальцев наряду с остатками разрушенных
эритроцитов накапливается гематин. Снижается почечный кро-
воток и клубочковая фильтрация, что в сочетании с некробио-
тическими изменениями эпителия канальцев является причи-
ной олигоанурии. Клинически олигоанурия проявляется нару-
шением гемодинамики и поражением почек по типу острой
циркуляторной нефропатии. При проведении соответствующе-
го лечения функция почек восстанавливается.
Под влиянием стрессового воздействия и высоких концен-
траций биологически активных веществ, выделяемых клетками
при разрушении эритроцитов, происходит раздражение интеро-
рецепторов, а затем, если воздействие не прекращается, разви-
вается запредельное торможение.
В этом случае клиническая картина осложняется поражени-
ем других паренхиматозных органов: легких, печени, эндокрин-
ных желез и др. внутренних органов. Первостепенная роль в
нарушении функции этих органов принадлежит ДВС-синдрому.
ДВС наблюдается при внутрисосудистом гемолизе и крайне
редко при ГТР, протекающей по экстраваскулярному типу. Ве-
роятно, это возникает при активации комплемента и высво-
бождении тромбопластина, обусловленного внутрисосудистым
567
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
гемолизом эритроцитов и присутствием медиаторов воспале-
ния. Данный процесс может создать определенные трудности в
дифференцировании причин коагулопатии, которая может воз-
никать при массивных трансфузиях или заболеваниях печени.
Пациенты, которым была проведена трансфузия и возникло
капиллярное кровотечение, должны расцениваться как имеющие
ОГГР и обследованы соответствующим образом. Коагулограм-
ма и количество тромбоцитов учитывается при проведении ле-
чения.
Если не предпринять экстренных реанимационных мер ге-
мотрансфузионный шок может привести к смерти больного.
Четкой связи между тяжестью гемотрансфузионного шока,
дозой перелитой крови, скоростью и путями ее введения и ве-
роятностью летального исхода не установлено. Полагают, что ре-
шающим фактором является состояние больного в момент, пред-
шествующий гемотрансфузии. Следует отметить, что перелива-
ние струй но 50—75 мл крови, ЭМ или плазмы во время биоло-
гической пробы, не могут привести к летальному исходу.
Реактивные проявления и симптомы шока чаще всего отсту-
пают или бывают выражены незначительно при несовмести-
мой гемотрансфузии больным, находящимся под наркозом, в
бессознательном состоянии или получающим гормональную, лу-
чевую терапию. При проведении операции фармакологическая
обездвиженность пациента препятствует появлению судорог.
Поддержание гемодинамики инотропными препаратами ма-
скирует вазомоторную нестабильность. В этом случае первым
проявлением ОГТР может быть неконтролируемое кровотечение
в результате развития ДВС-синдрома. Уменьшение числа тром-
боцитов, низкий уровень фибриногена и наличие продуктов
деградации фибрина и D-димеров указывает на Д ВС. К сожале-
нию, если в такой ситуации ОГТР не распознается рано, может
быть перелито большое количество несовместимой крови для
уменьшения кровопотери. При осуществлении гемотрансфу-
зии у такой категории больных необходимо ориентироваться
на АД (гипотонию), ЧСС (тахикардию) и окраску кожных покро-
вов лица и шеи.
Как показывает мировая статистика, большинство несовме-
стимых гемотрансфузий по системе АВО и резус-фактору, реги-
568
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
стрируется в акушерско-гинекологических, хирургических и ре-
анимационных отделениях лечебных учреждений. В большинстве
случаев эти осложнения регистрируются при необходимости ге-
мотрансфузий по экстренным показаниям: шок, острая крово-
потеря, обширные травмы, хирургические вмешательства и др.
Клиническая картина
Первые признаки гемотрансфузионного шока, вызванного
переливанием крови, несовместимой по системе АВО, возника-
ют в момент вливания 20—40 мл крови. Реже развернутая реак-
ция регистрируется в конце переливания, а в отдельных слу-
чаях — через несколько дней.
При гемотрансфузиях очень внимательно следует относить-
ся к субъективным ощущениям и жалобам пациента: ухудшению
самочувствия, стеснению в груди, сердцебиению, ознобу, появле-
нию ощущения жара во всем теле, головной и абдоминальной
болям, а также поясничным болям, довольно сильно выраженным
(этот симптом считается специфичным для данного вида ослож-
нения).
Из объективных признаков наибольшее значение имеет
снижение АД и тахикардия. Отмечается беспокойство больно-
го, изменение окраски лица (покраснение, которое сменяется по-
бледнением), в тяжелых случаях — рвота, непроизвольное мо-
чеиспускание, дефекация.
В большинстве случаев при своевременном выявлении и
прекращении процедуры гемотрансфузии через 1—2 ч все выше-
описанные симптомы постепенно стихают: АД повышается, бо-
ли уменьшаются. Еще некоторое время боли сохраняются в по-
яснице. Субъективно больной начинает чувствовать себя лучше.
Врач не должен обманываться этим улучшением, так как обыч-
но через 3—4 ч состояние больного ухудшается: усиливается го-
ловная боль, повышается температура тела, адинамия, появля-
ется нарастающая желтушность склер, слизистых оболочек и
кожных покровов. На первый план выступают расстройства
функции почек. Диурез резко снижается. В моче — гематурия,
вплоть до вида «мясных помоев», протеинурия и лейкоцитурия
(моча становится бурой, что свидетельствут о гемоглобинурии).
При отсутствии своевременной адекватной терапии через 24—36 ч
может развиться острая почечная недостаточность — олигоану-
569
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
рия или полная анурия. Лечение пациента следует продолжать
с использованием метода гемофильтрации в отделении «искус-
ственная почка».
При благоприятном течении осложнения, своевременном
и адекватном лечении диурез восстанавливается. Однако не-
редки случаи, когда, несмотря на все лечебные мероприятия,
острая почечная недостаточность на 2—3-й неделе может за-
кончиться летальным исходом.
Лабораторная диагностика ПГО
Результаты лабораторных исследований при ПГО выявляют:
• гемоглобинемию;
• гемоглобинурию;
• положительный прямой антиглобулиновый тест;
• гипербилирубинемию;
• снижение гематокрита;
• снижение или отсутствие сывороточного гаптоглобина;
• наличие у реципиента антител к антигенам эритроцитов.
Необходимо тщательно исследовать каждый случай гемоли-
тической трансфузионной реакции или осложнения.
Анализ многих ПГО затруднен, потому что в некоторых
случаях осложнения хотя и являются истинно гемолитиче-
скими, но протекают без клинических признаков. Един-
ственным проявлением осложнения в таких случаях являет-
ся повышение температуры тела реципиента, поэтому важ-
но наблюдать за изменением температуры тела в течение 2 ч
после трансфузии.
Лабораторный анализ случаев затрудняется из-за отсут-
ствия достаточного количества материала для исследования:
образца крови реципиента, взятого до трансфузии. Такие образ-
цы от каждого больного необходимо сохранять для получения
возможности типирования антигенов эритроцитов и подтвержде-
ния специфичности антител, вызвавших ПГО. Типирование об-
разца крови больного, взятого после трансфузии, не является ин-
формативным из-за одновременного присутствия в нем эри-
троцитов донора.
Образец крови реципиента, взятый до трансфузии, необхо-
дим также для сравнения уровня билирубина и гаптоглобина
до и после трансфузии.
570
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
При подозрении на возникновение ПГО и для выявления
причин ПГО необходимо:
1. Проверить, не была ли допущена техническая ошибка
при подготовке крови к трансфузии: не перепутаны ли пробир-
ки с образцами крови реципиентов, правильно ли промаркиро-
вана кровь доноров, проба на совместимость и контрольные
исследования АВО-принадлежности выполнены и интерпрети-
рованы правильно. Если установлено, что реципиенту перели-
ли не ту порцию, которую предполагали, необходимо предотвра-
тить последующие трансфузии несовместимой крови другим
реципиентам.
2. Взять образец крови реципиента и направить на ис-
следование в лабораторию. Визуально исследовать сыворотку
или плазму образца крови реципиента на наличие гемолиза.
Для этого надо сравнить окрашивание образца сыворотки или
плазмы реципиента, взятой до трансфузии, с образцом, взятым
после трансфузии. Появление розового или красного окра-
шивания в образце сыворотки после трансфузии указывает
на разрушение эритроцитов и присутствие свободного гемо-
глобина. Важно быть уверенным, что окрашивание сыворот-
ки не произошло из-за механического разрушения эритроци-
тов во время забора крови. В этом случае необходимо взять но-
вый образец крови реципиента. Через 5—7 ч после гемолиза в
плазме реципиента появляется продукт деградации гемогло-
бина — билирубин, вызывая желтое или коричневое окраши-
вание. В некоторых случаях наблюдают раннее появление би-
лирубина через час после трансфузии. Исчезновение били-
рубина может происходить уже через 24 ч при условии, что
функция печени не нарушена.
3. Исследовать образец мочи реципиента. При острых гемо-
литических реакциях в моче присутствует свободный гемогло-
бин, но отсутствуют свободный миоглобин или эритроциты.
4. Исследовать образец крови в иммуногематологической ла-
боратории, для чего необходимо взять у реципиента образец
крови после трансфузии и направить его на исследование в ла-
бораторию вместе с образцами (остатками) перелитых гемо-
трансфузионных сред и образцом крови реципиента, взятым до
трансфузии.
571
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Дифференциальный диагноз гемолитических посттрансфу-
зионных осложнений проводится с:
1) бактериальным загрязнением эритроцитарной массы
(септицемия или эндотоксический шок);
2) аутоиммунная гемолитическая анемия;
3) аутоиммунная гемолитическая анемия, обусловленная
появлением холодовых гемаагглютининов;
4) гемолиз неимунного генеза:
• несовместимые переливания;
• нарушение условий хранения эритроцитов;
• нарушение режима размораживания компонентов;
• неисправность устройства, подогревающего кровь, или
инфузионного насоса, малый диаметр иглы, высокий гематокрит;
5) наследственные гемолитические анемии:
• дефицит глюкозо-6-фосфат дегидрогеназы;
• наследственный сфероцитоз;
6) гемоглобинопатии;
7) лекарственно индуцированный гемолиз;
8) микроангиопатическая гемолитическая анемия;
• тромботическая тромбоцитопеническая пурпура;
• гемолитический уремический синдром;
• HELLP-синдром;
9) дисфункция искусственных клапанов сердца;
10) пароксизмальная ночная гемоглобинурия;
11) инфекции:
• Clostridium welchii;
• Малярия;
• Бабезиоз.
Профилактика несовместимых гемотрансфузий осно-
вана на соблюдении правил определения групп крови,
проведении пробы на групповую совместимость, техники
переливания крови. Большинство пациентов хорошо пе-
реносят отсроченную ГТР и нуждаются только в тщатель-
ном наблюдении. Такие осложнения, как почечная недо-
статочность или болевой синдром, подвергаются обыч-
ной терапии. При большом числе антиген-позитивных
эритроцитов должен быть рассмотрен вариант обменного
переливания. Следует избегать трансфузий, пока не будут
572
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
выявлены специфические антитела и отсутствует анти-
ген-негативная доза крови.
При экстраваскулярном гемолизе, который схож с ЛИ-
ГА, могут быть использованы высокие дозы в/в ИГ. Также
ВИГ может быть применен в лечении отсроченной ГТР. Ра-
зовая доза ВИГ (400 мг/кг), введенная в течение 24 ч после
трансфузии, способствует предотвращению развития тран-
сфузионных реакций у аллоиммунизированных пациентов
при отсутствии совместимой крови.
Осложнения при переливании
инфицированной крови
Источником инфекции при переливании крови может
служить кровь донора-бациллоносителя, кровь больного
в инкубационном периоде заболевания либо больного с
бессимптомным течением заболевания. Несмотря на
строгую регламентацию по инфекционной сертифика-
ции донорской крови существует опасность заражения
СПИДом, вирусными гепатитами, сифилисом, малярией,
герпесом. Предотвращение заражения пациента при пе-
реливании крови или ее компонентов, как говорилось
выше, перечисленными инфекциями осуществляется на
основе строго регламентированного клинического и ла-
бораторного обследования донора и его крови до и после
забора крови.
Осложнения, связанные с бактериальным
загрязнением
Инфицирование крови и ее компонентов может произой-
ти как в процессе заготовки крови, переработки ее на компонен-
ты, так и при клиническом использовании.
Бактериальное загрязнение при заготовке крови может быть
связано:
• с недостаточной обработкой кожи руки донора перед взя-
тием крови;
• с нераспознанной у донора транзиторной или хрониче-
ской бактериемией.
573
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Основные причины бактериального загрязнения крови в
период переработки крови:
• нарушение герметичности упаковки контейнера;
• применение нестерильных консервантов;
• повторное прокалывание иглой тубуса пластикатного
контейнера или пробки флакона;
• изъятие отдельных порций крови, ЭМ для трансфузии и
последующее хранение в первоначальной емкости с использо-
ванием остатков крови;
• неправильная методика разделения объема трансфузион-
ной среды на несколько доз;
• несоблюдение правил транспортировки и хранения.
Для бактериальных осложнений характерно:
^одновременное возникновение тяжелых реакций и
осложнений у нескольких больных (в одном или нескольких ле-
чебных учреждениях) после переливания крови и/или ее ком-
понентов, заготовленных в один и тот же день, на одном пунк-
те службы крови;
2)ранний гемолиз, наличие в плазме мутности, хлопьев,
сгустков, пленки, и др„ обнаруживаемых в нескольких контей-
нерах или флаконах с кровью, ее компонентами, заготовленны-
ми одновременно с перелитой средой;
3) выявление при бактериологическом исследовании из ос-
татков переливавшейся крови, ее компонентов, в консервирую-
щих растворах (той же серии), заготовленных в тот же день, а не-
редко и из крови реципиента однородной микрофлоры;
4) клинические признаки тяжелого токсикоза, характери-
зующегося гипертермией, потрясающим ознобом, возбуж-
дением, судорогами, нарушением сознания, вплоть до со-
пора или комы, снижением АД не менее чем на 30 мм рт. ст.
по сравнению с обычными для больного цифрами, аритми-
ей, тахипноэ.
Клинические проявления токсико-инфекционного ослож-
нения (токсического шока):
• резкое повышение температуры тела;
• цианоз;
• нарушение сознания, вплоть до сопора или комы;
• судорожные подергивания мышц;
574
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
• резкое падение АД (не менее чем на 30 мм рт. ст. по срав-
нению с обычными для больного цифрами);
• тахикардия;
• рвота;
• боли в животе со спазмами;
• диарея;
• непроизвольные мочеиспускания и дефекация;
• острая сердечно-легочная недостаточность;
• почечная и печеночная недостаточность;
• ДВС-синдром.
Наиболее часто в бактериально загрязненных компонентах
крови выявляется Yersinia enterocolitica и грамотрицательные
бактерии (Pseudomonas). Это объясняется их способностью ра-
сти при низких температурах в среде с высоким содержанием же-
леза. Грамположительные (стафиллококки и стрептококки) и
грамотрицательные виды (сальмонелла, эшерихия и серрация)
обнаруживаются в концентрате тромбоцитов.
Д ифференциальный диагноз проводится с гемолитически-
ми реакциями, негемолитическими фибрильными реакциями,
синдромом острой легочной недостаточности и сепсисом. Ди-
агноз устанавливается при обнаружении культуры в исследуемой
дозе крови и крови пациента, выявлении эндотоксина или на ос-
новании DNA — микробиологического метода.
При первых же признаках инфекционно-токсического
осложнения следует незамедлительно приступить к проведе-
нию ряда экстренных лечебных мероприятий интенсивной те-
рапии. Необходимо:
• перевести больного в реанимационное отделение;
• лечебные мероприятия начинать, основываясь на кли-
нических и экстренных лабораторных показателях, не ожидая ре-
зультатов бактериологического исследования;
• экстренные лечебные мероприятия согласовать с напра-
влением образцов крови больного и остатков донорской крови (ее
компонентов и других трансфузионных сред, использованных для
этой категории больных) на бактериологическое исследование;
• незамедлительно изъять трансфузионные среды;
• срочно известить учреждения, заготовившие компонен-
ты крови.
575
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Лечебные мероприятия должны проводиться незамедли-
тельно и включать:
• Немедленное прекращение трансфузии сред, вызвавших
осложнение.
• Противошоковые мероприятия.
• Введение антибиотиков широкого спектра действия.
• Дезинтоксикационные средства.
• Сердечно-сосудистые средства.
• Гормональные препараты (кортикостероиды).
• Реологически активные препараты.
• Плазмаферез с плазмообменом.
При переливании инфицированной крови больные могут
погибнуть как на высоте гемотрансфузионного шока, так и в бо-
лее поздний период от сепсиса в течение 3—7 дней после тран-
сфузии при явлениях острой сердечно-сосудистой и почечно-пе-
ченочной недостаточности.
Как и при любых критических состояниях, результаты ле-
чения бактериального токсикоинфекционного шока тем эф-
фективнее, чем раньше оно начато и активнее проводится.
При лечении токсикоинфекционного шока особое внима-
ние следует обращать на купирование гиповолемии и коагуоло-
патии.
При бактериальном шоке на уровне микроциркуляции про-
исходит внесосудистая потеря плазмы, снижается венозный
возврат, падают минутный объем сердца и артериальное давле-
ние, отмечается тканевая гипоксия. Для коррекции этого состоя-
ния целесообразно использование при низком гематокрите
(< 0,20 л/л) из-за внутрисосудистого гемолиза — трансфузии
крови, эритроцитной массы, трансфузий плазмы (1 л и более) и
ее заменителей, растворов глюкозы. Хороший эффект оказыва-
ет своевременное, как можно более раннее, применение обмен-
ных переливаний крови, плазмафереза с плазмообменом в мас-
сивных дозах.
С целью дезинтоксикации показано введение глюкозы.
Комплекс лечебных мероприятий включает введение 10—
20 %-ного р-ра альбумина, глюкозо-новокаиновой смеси, эти-
лового спирта, проведение плазмафереза с плазмообменом или
обменно-заменных переливаний крови. Комбинированное при-
576
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
менение массивных доз 2—3 антибиотиков. Целесообразно так-
же введение сердечных гликозидов, ингибиторов протеаз (кон-
трикал, гордокс), и иппотропная поддержка. Профилактика ко-
агулопатических расстройств осуществляется введением
низкомолекулярных гепаринов.
Рекомендуется использовать большие дозы кортикостерои-
дов, например, 60—120 мг преднизолона в сутки.
Важным моментом в комплексном лечении является ку-
пирование ацидоза (внутривенное введение р-ров гидрокарбо-
ната натрия, лактата и других препаратов, промывание желудоч-
но-кишечного тракта щелочными растворами). Для коррекции
метаболических нарушений (ацидоз, гиперкалиемия, азотемия
и др.) необходимы введение р-ров щелочей, кортикоидов, углево-
дов (2—3 тыс. калорий в сутки), коррекция водно-электролитно-
го баланса. При нарастании уремии, продолжающейся анурии
и неэффективной медикаментозной терапии необходимо при-
ступить к гемодиализу. Результатом приводимого комплекса ле-
чебных мероприятий должно стать повышение центрального
венозного давление (> 10 см вод. ст.) и артериального давле-
ния, возобновление диуреза (> 50 мл/ч).
Профилактику осложнений, связанных с бактериальным
загрязнением трансфузионных сред, можно сформулировать
кратко: строгое выполнение санитарно-бактериологических
условий и всех требований инструкции по заготовке, переработ-
ке крови и ее компонентов, соблюдение правил по клиниче-
скому применению трансфузионных средств.
Осложнения, связанные с нарушением
температурного режима при хранении
и применении крови и ее компонентов
Одна из наиболее частых причин посттрансфузионных
осложнений связана с нарушением температурных условий при
заготовке, хранении и использовании крови и ее компонентов.
Недоброкачественность переливаемой крови, ее компо-
нентов, изменение их свойств могут быть связаны с денатураци-
ей белков клеток крови и плазмы, гемолизом и возникают при:
• перегревании;
577
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• переохлаждении;
• превышении установленных сроков хранения консерви-
рованной крови или ее компонентов;
• использовании инфицированных стабилизирующих ра-
створов;
• неправильной транспортировке;
• значительных колебаниях температурного режима хра-
нения (резкая смена температуры) крови, ее компонентов.
Цельная кровь и ее компоненты должны храниться при
определенных температурных режимах: цельная консервиро-
ванная кровь, эритроцитная масса — при +4 °C, тромбокон-
центрат — при +22 °C в условиях постоянного помешивания,
СЗП - при -30...-40 °C.
Оптимальная температура трансфузионных сред перед введе-
нием должна быть не ниже +35 °C. Как правило, для ускоренно-
го подогрева крови используют водяную баню или горячую воду
из водопровода, а температура воды контролируется не термоме-
тром, а на ощупь. При таких условиях подогревания возможен
перегрев выше +38 °C (+39... +40 °C), что приводит к денатурации
белков, частичному изменению их структуры и гемолизу. Нельзя до-
пускать повторного нагревания, раже до температуры +37 °C.
Трансфузии охлажденной крови или СЗП, особенно в
массивной дозе, со скоростью 50—100 мл/мин могут вызы-
вать тяжелые нарушения деятельности сердца, вплоть до его
остановки.
Клиническая картина осложнений при трансфузии крови
или ее компонентов, подготовленных к использованию с на-
рушением температурных условий, характеризуется явления-
ми гемотрансфузионного шока, внутрисосудистого гемолиза
и токсикоза. Все лечебные мероприятия аналогичны тем, ко-
торые проводят при посттрансфузионном шоке, вызванном пе-
реливанием несовместимой крови, с дополнительным введе-
нием антибиотиков широкого спектра действия.
Профилактика осложнений, связанных с бактериальным
загрязнением, нарушением температурных условий хранения
и применения крови и ее компонентов, включает:
1. Строгое соблюдение асептики при заготовке крови и в
процессе приготовления ее компонентов.
578
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
2. Соблюдение правил транспортировки крови (использо-
вание специальных изотермических сумок).
3. Абсолютную герметичность контейнеров с кровью (или
любым компонентом крови) и хранение их при соответствую-
щих для данного продукта условиях: эритроцитная масса, цель-
ная консервированная кровь — при температуре +2...+6 °C в хо-
лодильнике, тромбоконцентрат — при +22 °C при постоянном
помешивании, СЗП — в морозильнике при —30...—40 °C.
4. Обязательную макроскопическую оценку флакона с
кровью перед гемотрансфузией.
5. Переливание трансфузионной среды из одного флако-
на или контейнера строго одному больному. Запрещается из-
влекать из контейнера часть крови (или компонента), а оста-
ток оставлять для последующего использования.
6. Недопустимость использования трансфузионных сред с
просроченным сроком годности. Цельная консервированная
кровь и эритроцитная масса хранятся в течение 24—35 дней (в
зависимости от консерванта), тромбоконцентрат — не более
5 дней, срок хранения СЗП — не более 1 года. Срок годности
исчисляется со дня заготовки крови, а не со времени пригото-
вления соответствующего компонента.
7. Температура воды (или специальных прикроватных
устройств для подогрева трансфузируемого раствора) для подо-
грева контейнера с кровью должна быть не выше +37 °C. Повтор-
ный подогрев крови или компонента крови не рекомендуется.
8. Трансфузии необходимо осуществлять исключительно
одноразовыми системами.
Осложнения, связанные с погрешностями
в технике трансфузий
Воздушная эмболия — достаточно редко встречающееся, но
тяжелое гемотрансфузионное осложнение, которое происходит от
проникновения в вену больного вместе с трансфузионной средой
некоторого количества воздуха. Одномоментное поступление в ве-
ну 2—3 мл воздуха представляет опасность для жизни человека.
Причины воздушной эмболии:
1) неправильное заполнение трансфузионной средой (кро-
вью или др.) системы трубок перед началом трансфузии — с пе-
579
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
реливаемой средой остаюшийся в системе воздух может попасть
в вену больного;
2) нарушение техники трансфузии при использовании на-
гнетательной аппаратуры (при несвоевременной остановке
трансфузии воздух может попасть в вену больного в конце
трансфузии);
3) неправильный монтаж аппаратуры и системы для тран-
сфузии.
Воздух, попавший в вену с током крови, поступает в правые
отделы сердца и из него в легочную артерию, где создается воздуш-
ный эмбол, механически препятствующий кровообращению.
При попадании воздуха в вену необходимо в первую очередь
придать пациенту положение, при котором ноги подняты, а го-
лова опущена. Лечебные мероприятия заключаются во введении
сердечных гликозидов и средств, повышающих АД, а при необхо-
димости — в проведении искусственного дыхания.
Клинические проявления воздушной эмболии: внезапное и
резкое ухудшение состояния больного во время трансфузии,
общее возбуждение, беспокойство. Больной начинает задыхать-
ся, хватается руками за грудь, ощущает в ней чувство давления
и боли. Быстро развивается цианоз губ, лица, шеи (верхняя
половина туловища), катастрофически падает АД, пульс стано-
вится нитевидным, частым. При быстром введении 2—3 мл и бо-
лее воздуха смерть, как правило, наступает через несколько ми-
нут от острой сердечно-легочной недостаточности.
Профилактика воздушной эмболии:
1. Тщательный монтаж и проверка на герметичность си-
стем и аппаратуры перед началом трансфузии.
2. Тщательное заполнение кровью или другой трансфузион-
ной средой всех трубок системы или аппаратуры до начала тран-
сфузии.
3. Во время трансфузии около больного должен постоянно
находиться врач или медицинская сестра.
4. При использовании нагнетательной аппаратуры следует
своевременно прекратить трансфузию, оставив в контейнере
или флаконе некоторое количество крови.
Исход воздушной эмболии чаще всего неблагоприятный. Ле-
чение должно проводиться на месте путем незамедлительных ре-
580
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
анимационных мероприятий и быть направлено на выведение
больного из угрожающего состояния — применение искусствен-
ного дыхания, непрямой массаж сердца и введение сердечных
средств.
Тромбоэмболия — состояние, которое развивается при попа-
дании в сосудистую систему легких сгустков из переливаемой
крови и ее компонентов или из тромбированных вен больного.
Клинические проявления тромбоэмболии обычно харак-
теризуются явлениями легочного инфаркта. В период гемотран-
сфузии или сразу после переливания у больного появляются
одышка, боли в груди, кровохарканье и лихорадка, цианоз
верхней половины туловища, гипотензия.
Профилактика тромбоэмболии.
• соблюдение инструкций и правил заготовки крови и ее
компонентов;
• соблюдение техники венопункции — минимальная трав-
матизация вены при пункции (избегать повторных пункций);
• пункгирование нетромбированных вен;
• прекращение переливания данной порции трансфузион-
ной среды при подозрении на наличие в ней сгустков;
• использование для гемотрансфузий систем для перелива-
ния с фильтрами и/или микрофильтрами (при массивных тран-
сфузиях).
Лечение тромбоэмболии
Введение через катетер в легочную артерию для локально-
го воздействия на тромб активаторов фибринолиза: стрептазы
(стрептодеказа, урокиназа). Внутривенное введение
24 000—40 000 ЕД гепарина в сутки, переливание плазмы. При-
менение болеутоляющих и сердечно-сосудистых средств (по
показаниям).
Тромбофлебит как осложнение трансфузии развивается при
многократных венепункциях или неправильном уходе за
перифирическим катетером, введении растворов, в основном па-
рентерального питания, и выражается уплотнением по ходу вены
и покраснением кожи. Одна из причин тромбофлебита — длитель-
ная (более 8 ч) капельная инфузия или трансфузия. Другая при-
чина — тромбирование вен и развитие тромбофлебита в резуль-
тате неудачной венепункции с проколом сосуда, его разрывом и
581
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
образованием гематомы. Введение в вены на длительное время
пластиковых катетеров или канюль также может явиться причи-
ной развития тромбофлебита, в т. ч. септического.
Профилактика тромбофлебита включает:
• тщательную обработку кожи в месте пункции вены;
• строгое выполнение техники постановки и мер хирурги-
ческой асептики при катетеризации центральных и
периферических венозных стволов;
• соблюдение инструкций по внутривенному, особенно
длительному (более 6—8 ч) введению различных трансфузион-
ных сред.
Синдром острой легочной недостаточности. Трансфузия
цельной крови или эритроцитной массы, содержащей микро-
агрегаты, может стать причиной эмболии легочных капилляров
и развития синдрома острой легочной (альвеолярной) недоста-
точности — «шоковое» легкое. Особо повышенную опасность
такая гемотрансфузия представляет для больных с заболевания-
ми легких. Осложнение наступает через 2—6 ч после трансфузии
и встречается с частотой 1:5000 трансфузий плазмасодержащих
компонентов, часто не диагностируется и протекает тяжело.
Полностью механизм развития подобных осложнений ос-
тается невыясненным.
Накопление микроагрегатов начинается с первого дня кон-
сервирования крови и, нарастая, после 5—7-го дня хранения
превышает 15 хЮ9 /л. Микроагрегаты имеют диаметр от 10 до
200 мкм, состоят из тромбоцитов и лейкоцитов, частей разрушен-
ных клеток, фибрина и денатурированного белка.
Вероятно, острое повреждение легких после массивных ге-
мотрансфузий чаще всего, обусловлено гранулоцитарно-реактив-
ными HLA-антителами донора [Mollison Р., 1994]. В 80—90 % слу-
чаев в течение 7—8 дней осложнение разрешается, однако у
10—20 % больных заканчивается летально.
Ряд исследователей считают, что причина развития этого
синдрома связана не только с микроагрегатами, но и с вазоак-
тивными молекулами средней массы — олигопептидами, обра-
зующимися при разрушении лейкоцитов и тромбоцитов. В со-
судистом русле реципиента эти вещества активируют тромбоци-
ты и лейкоциты, способствуют их скоплению и образованию ми-
582
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
кроагрегатов, способных повредить эндотелий сосудов и приве-
сти к избыточному накоплению жидкости, к отеку легких. Не-
кардиогенный отек легких после гемотрансфузий может быть об-
условлен как их массивной дозой, так и антилейкоцитарными ан-
тителами, образующимися вследствие изосенсибилизации пред-
ыдущими трансфузиями или беременностями. Иммунологиче-
ская реакция антиген—антитело, активация компонентов ком-
племента с последующей агрегацией нейтрофильных клеток в ко-
нечном итоге ведет к повреждению легочных сосудов и выпоте-
ванию из них жидкости в альвеолы и интерстиций.
Профилактика попадания с трансфузионными средами
микроагрегатов заключается в использовании на этапе пере-
работки крови специальных антилейкоцитарных и антитром-
боцитарных фильтров. При использовании для трансфузии
консервированной крови малых сроков хранения, когда лей-
коциты и тромбоциты еще жизнеспособны, достаточно при-
менение микрофильтров с порами величиной < 40 мкм. По-
добными фильтрами снабжены практически все полимерные
системы для переливания крови (не путать с системами для
инфузии солевых растворов). Использование микрофильтров
у постели больного при трансфузиях крови или эритроцитной
массы более 3—5 дней хранения нецелесообразно, так как в та-
кой крови много микроагрегатов и продуктов распада, разру-
шенных тромбоцитов и лейкоцитов (лизосомальные фермен-
ты и другие вредные вещества), не поддающихся фильтра-
ции и попадающих в кровеносное русло реципиента. Кроме
того, микрофильтры вследствие контакта клеток могут акти-
визировать коагуляцию, процесс агрегации тромбоцитов, вы-
ход вазоактивных веществ и освобожденного гемоглобина
[Haase, 1984]. Примером данного типа фильтров является ми-
крофильтр для крови трансфузионный одноразовый (МФТ).
Он предназначен для микрофильтрации крови с минимальным
сроком хранения до 35 дней и эритроцитарной массы со сро-
ком хранения до 26 дней. Используется совместно с устрой-
ствами для переливания инфузионных растворов (типа ПР)
или переливания крови (типа ПХ) при гемотрансфузиях. Ос-
новной эффект от применения — это устранение тромбоэм-
болических осложнений жизненно важных органов за счет
583
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
очистки крови от микрореагентов размером более 30 мкм.
При отсутствии специально отфильтрованной крови реко-
мендуется переливать больным с высоким риском посттран-
сфузионных легочных осложнений отмытую ресуспендирован-
ную эритроцитную массу.
Клинические проявления синдрома характеризуются посте-
пенным развитием гипоксемии, гипотензии, гипервентиляции.
Рентгенологически наблюдается двусторонняя мелкоочаговая
инфильтрация нижних долей легких, множественные узелки в
области ворот легких; инфильтрация и отек легочной ткани.
Некардиогенный отек легких чаще всего обусловлен сердеч-
ной недостаточностью вследствие гиперволемии, клинически ха-
рактеризуется респираторным дистрессом, двусторонним отеком
легких и тяжелой гипоксемией, гипотонией и лихорадкой [Ро-
povskyM., 1992].
Для диагностики синдрома острой легочной недостаточ-
ности необходимо:
• прежде всего исключить кардиогенную причину;
• провести идентификацию антилейкоцитарных (чаще все-
го анти-НLA- или антинейтрофильных) антител в плазме донора.
Дифференциальный диагноз следует проводить с циркуля-
торной перегрузкой, осложнениями, связанными с бактериаль-
ным загрязнением компонентов крови, аллергическими реакци-
ями, острым респираторным дистресс-синдромом, эмболией
легочной артерии и легочным кровотечением. Синдром острой
легочной недостаточности длится не более 48—96 ч.
Лечение:
• активная респираторная поддержка: от масочного кисло-
рода до интубации с искусственной вентиляцией легких;
• экстракорпоральная мембранная оксигенация.
При своевременном и адекватном лечении у большинства
больных в течение 12—24 ч клинические симптомы купиру-
ются, а через 5—7 дней исчезают затемнения в легких [POpov-
skyM., 1992].
Циркуляторная перегрузка и сердечно-сосудистая недоста-
точность. У людей со здоровым сердцем это осложнение возни-
кает редко. Предрасполагающим моментом к развитию кардио-
васкулярной недостаточности при трансфузионно обусловлен-
584
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
ной циркуляторной перегрузке является поражение сердечной
мышцы больного (склеротическое воспаление, дистрофические
изменения, пороки сердца и др.).
Острое расширение и остановка сердца во время трансфу-
зии происходит вследствие перегрузки правых отделов сердца
большим объемом быстро вводимой в венозное русло трансфу-
зионной среды. При недостаточной дренажной функция право-
го сердца в системе полых вен и предсердия возникает застой кро-
ви. Нарушение общего и коронарного кровотока влияет на про-
водимость и сократительную способность миокарда — снижа-
ется его тонус, вплоть до атонии и асистолии.
Клиническая картина. Во время трансфузии больной ощуща-
ет затруднение дыхания, чувство стеснения в груди и боли в
области сердца. Развивается цианоз губ, резко снижается АД, по-
вышается центральное венозное давление, пульс становится ча-
стым и малого наполнения, отмечается тахикардия, аритмия.
В случае непринятия необходимых экстренных мер наступает
смерть.
Дифференциальный диагноз проводится с острым легочным
синдромоми аллергическими реакциями.
Первая помощь и лечение. Если лечение не начать немед-
ленно после появления первых признаков осложнения, может
наступить смерть.
При первых симптомах осложнения необходимо немедлен-
но прекратить внутривенное вливание и через ту же иглу произ-
вести кровопускание (200—300 мл под контролем параметров
гемодинамики), чтобы разгрузить «правое» сердце. Наладить
оксигенотерапию — увлажненный кислород, лучше под давле-
нием. Для нормализации гемодинамики, показаны вазопрес-
сорные амины (норадреналин, мезатон, эфедрин и др.) и ги-
пертонические растворы глюкозы. Введение сердечных глико-
зидов, лазикса. Внутривенное введение строфантина, корглико-
на, а при брадикардии — атропина.
Профилактика острого расширения сердца во время массив-
ных трансфузий: больным с заболеваниями сердца и ослаблен-
ной сердечной деятельностью трансфузионные мероприятия
выполняются капельно, а при необходимости использования
струйного метода вводят эритроцитную массу или кровь не-
585
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
большими (до 200 мл) дробными дозами, чередуя их с кровеза-
менителями и под контролем центрального венозного давле-
ния, причем с особой осторожностью, если оно выше 150 мм вод.
ст. Рекомендуется введение мочегонных средств для усиления
работы почек. Больным с заболеваниями сердца и признаками
сердечной недостаточности трансфузию следует производить
капельно, вместо нативной плазмы — концентрированную плаз-
му. Противопоказано введение гиперонкотических р-ров (поли-
глюкин, 20 %-ный альбумин), которые значительно повышают
ОЦК. В целях профилактики желудочковой аритмии, внезапной
остановки сердца, очень важно использовать только подогретую
до +37 °C консервированную кровь или эритроцитную массу.
Некоторые авторы полагают, что опасность циркулятор-
ной перегрузки значительно преувеличена [Жизнев-
ский Я.А., 1994]. Необходимо учитывать, что в основе развития
циркуляторной перегрузки при переливании крови лежат, глав-
ным образом, экстракардиальные факторы, обусловливающие
возрастание периферического сопротивления кровотоку и по-
вышение непроизводительной работы сердца, что при его изна-
чальной слабости чревато декомпенсацией. Это подтверждает-
ся и тем, что симптомы перегрузки возникают чаще всего не в
начальном периоде терапии гиповолемии, а после прекращения
кровотечения, когда ОЦК достигает удовлетворительного уров-
ня, но инфузионная-трансфузионная терапия продолжается в
том же быстром темпе.
Осложнения при массивной гемотрансфузии
Ситуации, при которых в кровяное русло больного в тече-
ние короткого периода (до 24 ч) вводят количество крови (или
комбинацию ее компонентов), превышающее на 40—50 % объем
циркулирующей крови, принято обозначать термином «мас-
сивная гемотрансфузия».
Массивные гемотрансфузии могут потребоваться при:
• интенсивной терапии шока различного генеза;
• интенсивной терапии коагулопатического кровотечения
(ДВС-синдром);
• операции замещения крови при внутрисосудистом гемолизе;
• операциях в условиях искусственного кровообращения.
586
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
Одну из наиболее подробных классификаций клинических
осложнений массивных гемотрансфузий, которая не потеряла
своего значения и на сегодняшний день, приводит Б.В. Петров-
ский (1972). В соответствии с этой классификацией выделены:
1. Осложнения со стороны сердечно-сосудистой системы
а) сосудистый коллапс;
б) асистолия;
в) брадикардия;
г) остановка сердца;
д) фибрилляция желудочков.
2. Изменения в крови
а) сдвиг pH в кислую сторону;
б) гипокальциемия;
в) гиперкалиемия;
г) повышение вязкости крови;
д) гипохромная анемия с лейко- и тромбоцитопенией, сни-
жением содержания гамма-глобулинов и альбумина.
3. Нарушение в системе гемостаза
а) спазм периферических сосудов;
б) кровоточивость ран;
в) снижение уровня фибриногена, протромбина, акцеле-
рина, конвертина, числа тромбоцитов, повышение фибриноли-
тической активности.
4. Осложнения со стороны внутренних органов
а) мелкоточечные кровоизлияния;
б) кровотечения из сосудов почек, кишечника;
в) печеночно-почечная недостаточность.
1. Снижение иммунобиологической активности реципи-
ента, падение титра агглютинирующих антител в перифериче-
ской крови, плохое заживление послеоперационной раны
Лечение ДВС-синдрома, обусловленного массивной ге-
мотрансфузией, основано на комплексе мероприятий, на-
правленных на нормализацию системы гемостаза и устране-
ние других ведущих проявлений синдрома, в первую очередь
шока, капиллярного стаза, нарушений кислотно-щелочно-
го, электролитного и водного балансов, поражения легких, по-
чек, печени, надпочечников, анемии. Эффективность лечения
ДВС-синдрома определяется ранней диагностикой, как мож-
587
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
но более ранним началом лечения и возможностью контро-
ля системы гемостаза.
Более подробно о диагностике, профилактике и лечении
ДВС-синдрома рассказано в главе 8.
Как правило, при гемотрансфузиях больших объемов кон-
сервированной крови (2,5 л или 40—50 % ОЦК реципиента)
практически не удается избежать осложнений. Важнейшая за-
дача врача в подобной ситуации — максимальное уменьшение
патологического влияния массивной гемотрансфузии на орга-
низм больного.
Осложнения и летальные исходы массивных гемотрансфу-
зий, составляющие, по данным разных авторов, от 40 до 70 %,
связаны с действием физических, химических и биологических
факторов.
Тяжесть последствий массивного переливания крови зависит от:
• рецепта консерванта;
• вида препарата крови (компонента);
• срока хранения крови (более 5 суток).
Изменения в организме больного вследствие массивных
вливаний донорской крови получили название синдрома гомоло-
гичной крови.
В результате массивного кровезамещения могут развиться
следующие нарушения:
1. Реакция несовместимости компонентов донорской крови
с кровью реципиента. При массивных, в особенности экстрен-
ных, гемотрансфузиях нет возможности учесть весь широкий
спектр антигенных характеристик крови донора и реципиента.
2. Цитратная интоксикация (см. выше) и как следствие:
а) гипокальциемия (кальций связывается цитратом, вслед-
ствие чего усиливается гипокоагуляция крови);
б) снижение возбудимости миокарда и его сократительной
способности (отрицательный инотропный эффект и аритмии);
в) повышение сосудистого сопротивления в малом круге
кровообращения, что способствует возникновению синдрома
«шокового легкого».
3. Метаболический ацидоз как следствие повышенной ки-
слотности (pH = 6,0—6,6) консервированной крови длительных
сроков хранения. Цитрат натрия после гемотрансфузии преоб-
588
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
разуется в организме больных в лактат, особенно при нарушении
функции печени.
4. Гиперкалиемия, обусловленная выходом ионов калия из
эритроцитов в плазму при длительном хранении консервирован-
ной крови (более 10 суток).
5. Свободный гемоглобин. При массивном кровезамещении
консервированной кровью, когда из-за срочности прибегают
к введению крови под давлением, степень гемолиза неизмен-
но возрастает. Свободный гемоглобин может дать патологиче-
ский эффект, аналогичный развиваюшемуся при внутрисосу-
дистом гемолизе.
6. Общая гипотермия больного — осложнение вследствии
трансфузии консервированной крови или эритроцитной массы,
которая хранилась при +4 °C. Переливание больших количеств
неподогретой крови предъявляет повышенные требования к
организму больного.
7. Септический шоковый синдром (см. раздел «Осложнения,
связанные с бактериальным загрязнением»).
8. Повреждение легких. Массивные гемотрансфузии вы-
зывают распространенные микротромбозы с шунтировани-
ем легочного капиллярного кровотока, нарушается вентиля-
ционно-перфузионное равновесие, развивается функцио-
нальная легочная недостаточность. При переливаниях не-
больших количеств крови микротромбы клинически не про-
являют себя. (Подробнее см. раздел «Осложнения, связанные
с погрешностями в технике трансфузий».)
9. Острая сердечная недостаточность. Острая сердечно-
сосудистая недостаточность при массивных гемотрансфузиях
может достичь опасной степени и, усугубляясь явлениями ци-
тратной и калиевой интоксикации, гипотермическими наруше-
ниями, нарушениями легочного кровотока из-за микротром-
боза сосудов легких, привести даже к смерти больного.
Уменьшить опасные последствия массивных гемотран-
сфузий можно при соблюдении следующих условий:
• использовать свежезаготовленную кровь со сроком хра-
нения не более 3 суток;
• часть трансфузий осуществлять теплой донорской кровью
методом, близким к прямому переливанию;
589
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• избегать трансфузии значительных объемов плазмы, от-
давая предпочтение отмытым эритроцитарным препаратам и
плазмозаменителям;
• своевременно диагностировать и лечить осложнения мас-
сивных гемотрансфузий, дифференцируя их от проявлений ос-
новного заболевания;
• при необходимости выбора между массивной (более 2,5 л)
и ограниченной (менее 2,5 л) гемотрансфузией со значительной
гемодилюцией отдавать предпочтение последней, не допуская,
однако, чтобы гематокрит стал менее 0,25 г/л, а содержание ге-
моглобина — менее 60—80 г/л.
Профилактика синдрома массивных трансфузий:
• производить массивные гемотрансфузии исключительно
по жизненным показаниям: шок, массивная кровопотеря, тяже-
лые гемодинамические нарушения;
• максимально использовать вместо цельной консервированной
крови эритроцитную массу, в том числе размороженную или отмытую;
• использовать кровезаменители: реополиглюкин, жела-
тиноль и др., добиваясь гемодилюции;
• при оперативных вмешательствах с высоким риском кро-
вотечения применять метод заблаговременной заготовки ауто-
крови и использовать метод нормоволемической гемодилюции.
Противопоказания для гемотрансфузии'.
1) тяжелые соматические заболевания: острый и подострый
септический эндокардит, пороки сердца, миокардит и миокар-
диосклероз с нарушением кровообращения И—III степени, ос-
трый ревматизм, диффузионный гломерулонефрит с резко вы-
раженным гипертоническим синдромом;
2) нарушения мозгового кровообращения, кровоизлияния в
мозг, выраженный атеросклероз сосудов головного мозга, гипер-
тоническая болезнь III стадии;
3) тяжелые нарушения функции печени, отек легких, не-
фросклероз, тромбоэмболическая болезнь, геморрагический
васкулит, общий амилоидоз, остротекущий и диссеминирован-
ный туберкулез;
4) аллергические проявления, повышенная чувствитель-
ность к медикаментам, пищевым продуктам, белковым препа-
ратам и др.;
590
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
5) тяжелые гемотрансфузионные реакции или осложнения
в анамнезе реципиента.
Осложнения, связанные с игнорированием
противопоказаний для гемотрансфузии
Выше неоднократно подчеркивалось, что при определен-
ных заболеваниях и состояниях переливание крови, ее компо-
нентов может нанести больному больше вреда, чем пользы.
Очевидно, что в ряде случаев гемотрансфузии приходится вы-
полнять по прямым витальным показаниям (острая массивная
кровопотеря, шок, обширные хирургические вмешательства с
кровопотерей и другие), несмотря на противопоказания к этой
процедуре у больного. Следует иметь в виду, что противопока-
зания для гемотрансфузии носят относительный характер и при
критических состояниях для спасения жизни больного прихо-
дится их игнорировать, а сами гемотрансфузии выполнять с
большой осторожностью, с использованием всех мер, обеспе-
чивающих положительный эффект процедуры.
7.1.7. Трансфузионно обусловленная болезнь
«трансплантат-против-хозяина»
Болезнь «трансплантат-против-хозяина» (БТПХ) — состоя-
ние после аллогенной трансплантации органов, тканей, в том
числе костного мозга. Состояние БТПХ, возникающее после ге-
мотрансфузий, получило название трансфузионно обусловленной
болезни «трансплантат-против-хозяина» (ТО-БТПХ). Несмотря
на огромное число гемотрансфузий, которые выполняются во
всем мире, в различных клиниках, ТО-БТПХ — достаточно ред-
ко встречающаяся патология.
ТО-БТПХ—тяжелейшее осложнение, чаще всего заканчиваю-
щееся летально. Анализ 131 случая [Greenbaum, 1991] развития ТО-
БТПХ показал, что смертность от нее составила 90 %.
Минимальная доза лимфоцитов, способная спровоциро-
вать ТО-БТПХ, составляет чуть более 100 функционально ак-
тивных клеток. Врач, готовящий пациента к гемотрансфузии,
должен иметь в виду, что одна доза эритроцитной массы
(а тем более тромбоконцентрата или гранулоцитов) способна
вызвать заболевание «трансплантат-против-хозяина».
591
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Наиболее высок риск развития ТО-БТПХ при гемотран-
сфузии у больных с иммунодепрессией при врожденном или
приобретенном (химио- и лучевая терапия) иммунодефиците.
Пародоксально, но в литературе пока не описан ни один
случай ТО-БТПХ у больных с синдромом приобретенного им-
мунодефицита (СПИД). Недавние эксперименты с выбороч-
ным снижением уровня CD4+, CD8+ и NK-клеток у реципи-
ента позволяют предположить, что CD4+ участвуют в патоге-
незе ТО-БТПХ, тогда как CD8+ и NK-клетки относятся к ме-
ханизмам защиты. Этим можно объяснить отсутствие возникно-
вения ТО-БТПХ у больных СПИДом.
При ТО-БТПХ донорские Т-лимфоциты пролифериру-
ют и приживаются у иммунокомпрометированного хозяина,
который неспособен отторгать чужеродные клетки [Hoak J.,
Коереке J.,1976], Полагают, что минимальная доза лимфоци-
тов, способная вызывать ТО-БТПХ, составляет 107 жизнеспо-
собных клеток [Brubaker D., 1988]. В среднем одна доза концен-
тратов эритроцитов, тромбоцитов или гранулоцитов содер-
жит это количество лимфоцитов [Leitman A., Holland Р., 1985].
К группе повышенного риска ТО-БТПХ относят [Согласи-
тельная конференция Национального института здоровья США,
1986; Rebulla Р, 1993; Rock G., 1993] следующие категории:
• недоношенные новорожденные;
• новорожденные с гемолитической болезнью, получающие
внутриматочные или обменные трансфузии;
• больные гемобластозами с супрессией костного мозга в ре-
зультате химио- или лучевой терапии или с иммунной дисфунк-
цией (как при болезни Ходжкина);
• иммунокомпрометированные больные, получающие
кровь от родителей и родственников первого поколения или
HLA-совместимых доноров;
• реципиенты аллогенного или аутологичного костного мозга;
• больные с выраженным наследственным иммунодефицит-
ным синдромом;
• пара реципиент—донор в генетически гомологичных по-
пуляциях.
К группе среднего риска ТО-БТПХ относятся пациенты с неходж-
скиными В-клеточными лимфомами и солидными опухолями.
592
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
Низкий уровень риска ТО-БТПХ — у доношенных новорож-
денных, пациентов со СПИДом и пациентов, получающих им-
муносупрессивную терапию.
Кроме групп реципиентов, перечисленных выше, ТО-БТПХ
описана и у неиммунокомпрометированных больных (беремен-
ных женщин, пациентов, перенесших операцию на сердце и со-
судах или брюшной полости, а также пациентов с активным
ревматоидным артритом и травмами).
Клинические симптомы ТО-БТПХ обычно появляются на
8— 10-й день после трансфузии. Симптомокомплекс включает в
себя лихорадку, диарею, повышение уровня функциональных
проб печени, а также возникновение характерной сыпи, особен-
но выраженной на ладонях, и резкой панцитопенией, более глу-
бокой у больных лейкозом. Это объясняется тем, что, в отличие
от БТПХ, возникающей при трансплантации костного мозга, ге-
мопоэз при ТО-БТПХ осуществляется клетками реципиента,
которые «атакуются» донорскими Т-лимфоцитами.
Диагностика данного осложнения крайне трудна. Досто-
верным критерием является только обнаружение донорских
лимфоцитов в кровотоке и тканях реципиента. Характерные
гистологические изменения могут быть обнаружены при биопсии
кожи, в которой обнаруживается дегенерация в базальном кле-
точном слое с его вакуолизацией, разделение дермы и эпидер-
миса, формирование булл. При биопсии печени возможно об-
наружение повышенного количества эозинофилов, а анализ ко-
стного мозга выявляет его аплазию с лимфоидной инфильтра-
цией. Использование нескольких методов диагностики позво-
ляет с большей вероятностью поставить правильный диагноз.
Лечение ТО-БТПХ малоэффективно. В терапию включают
препараты ГКС, антитимоцитарный глобулин, циклоспорин и
циклофосфамид, а также Т-клеточные моноклональные анти-
тела. Данные препараты иногда используются при БТПХ, воз-
никающей после трансплантации стволовых клеток, но большая
эффективность наблюдается при ТО-БТПХ. Таким образом, ос-
новное внимание необходимо уделять профилактике, которая за-
ключается в предтрансфузионном гамма-облучении клеточных
компонентов крови донора. По данным Национального инсти-
тута здоровья США, среди 8300 больных со злокачественными
593
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
заболеваниями крови, получавших трансплантацию костного
мозга и трансфузии клеточных компонентов крови, не было
случаев ТО-БТПХ. До трансфузии компоненты крови облучали
гамма-лучами, т. е. лишали донорские клетки иммунологической
активности.
7.1.8. Посттрансфузионная иммуномодуляция
Гемокомпонентная терапия обладает мощным иммуномо-
дифицирующим действием. Вопросы, связанные с влиянием
гемотрансфузий на состояние иммунной системы, остаются до
конца не изученными. Отдельного рассмотрения заслуживают
вопросы постгрансфузионной иммуносупрессии. Не затрагивая
возможности передачи с гемокомпонентами микроорганизмов
и их способности оказывать влияние на иммунную систему, сле-
дует подчеркнуть, что такие изменения в иммунной системе ре-
ципиентов после гемотрансфузий, как анергия, иммунологиче-
ская толерантность, сниженный иммунный ответ, встречаются
с чаще, чем клинически значимая аллосенсибилизация. Внутри-
венные гемотрансфузии значительно выраженнее предраспола-
гают реципиента к анергии, чем к аллоиммунизации.
Одни из первых доказательств о иммуносупрессивном дей-
ствии гемотрансфузий были получены при анализе результатов
трансплантации почек у больных, имевших в анамнезе различ-
ное количество переливаний компонентов крови [Opelz G. et al.,
1973]. В настоящее время не вызывает сомнений, что гемотран-
сфузии существенным образом влияют на иммунную систему ор-
ганизма и в конечном итоге предопределяют течение различных
заболеваний — инфекций, онкологических патологий, прижи-
вление трансплантата и др.
В этом плане большой интерес представляют данные об
инфекционных осложнениях у больных с хирургическими ме-
тодами лечения. Так, если послеоперационные инфекции у хи-
рургических больных наблюдаются в 5 % случаев, то у реципи-
ентов, получивших 2 и более дозы аллогенной крови, их часто-
та возрастает до 20—30 % (Blumberg N. et al., 1988]. При этом ре-
ципиенты аутологичной крови имеют такую же частоту инфек-
ций, как и больные, не получавшие гемотрансфузий [Mez-
row С.К. et al., 1993]. При проведении гемотрансфузий компонен-
594
ГЛАВА 7, ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
тами крови, из которых удалены лейкоциты (лейкоцитарными
фильтрами), частота послеоперационных инфекционных ослож-
нений снижается до 2 % против 20 % у больных, получавших не-
фильтрованные компоненты крови.
При выполнении гемотрансфузий надо иметь в виду и воз-
можность реактивации и генерализации латентных вирусных ин-
фекций у реципиентов гемокомпонентов, что ведет к угнетению
противоинфекционной резистентности [Sloand Е. et al., 1975].
О выраженном влиянии гемотрансфузий на иммунную систе-
мы указывают и результаты анализов лечения онкологических
больных. Так, например, при ретроспективном анализе больных
с колоректальным раком [Blumberg N. et al., 1988] опухолями лег-
ких [Piantadosi S., 1992], у пациентов с аденокарциномой обо-
дочной и прямой кишки обнаружено увеличение летальности в
группе лиц, получавших гемотрансфузии в предперационном пе-
риоде. Смертность больных зависела не только от стадии опухо-
левого роста, размеров опухоли, но и от трансфузионного режи-
ма. Применение аутологичных гемокомпонентов оказывает более
благоприятный эффект в послеоперационном периоде [Ablin R.,
Conder М., 1984] и даже способствует снижению частоты рециди-
вов колоректальных опухолей [Blajman М.А. et al., 1993].
Следует отметить важное обстоятельство, что в клинических и
экспериментальных исследования при проведении аллогенных ге-
мотрансфузий выявлена значительная вариабельность опухолево-
го роста (от усиления до ингибиции) [Blajman М.А et al., 1993].
Проведенные в последние годы клинические исследова-
ния показали, что трансфузионный эффект не может быть объяс-
нен ни стадией опухолевого роста, ни другими клиническими па-
раметрами. Иммуносупрессия выявлена даже при единичных
трансфузиях отмытых эритроцитов или аллогенной плазмы,
при этом установлена ее дозозависимость и связь с типом при-
меняемого гемокомпонента [Wobbes Т. et al., 1989].
У реципиентов аллогенной почки, получавших гемотрансфу-
зии, в течение длительного времени снижена пролиферативная
активность лимфоцитов на митогены и антигены, антигенпре-
зентирующая функция макрофагов, активность естественных
киллеров, Т-клеточная пролиферация и секреция лимфокинов
[Fisher Е., et al., 1980], число естественных киллеров и отмеча-
595
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ется инверсия соотношения хелперов/супрессоров за счет сни-
жения CD4+-лимфоцитов, увеличивается количество CD8+-
клеток, В-лимфоцитов [GafterU. et al., 1992].
Проникновение в периферическую кровь большого коли-
чества антигенного материала, одновременно обладающего ал-
логенными, подобными и идентичными организму реципиен-
та детерминантами, вызывает многообразные изменения в им-
мунной системе. Значительное повышение количества даже ау-
тологичных антигенных детерминант приводит к снижению ак-
тивности многих иммунных реакций, как это происходит при ау-
тоиммунных процессах.
В процессах гемотрансфузионной имуномодуляции суще-
ственная роль принадлежит образующимся циркулирующим
иммунным комплексам (ЦИК). Связываясь с различными суб-
популяциями лимфоцитов, макрофагов, нейтрофилов, ЦИК
ингибируют активность клеток.
Иммуносупрессия индуцируется и некоторыми фактора-
ми нормальной плазмы — растворимые HLA-антигены, фер-
мент трансглютаминаза (так называемый фибринстабилизи-
рующий фактор, или фактор XIII) имеют выраженное иммунос-
упрессивное действие на Т-лимфоциты и способствуют проли-
ферации В-лимфоцитов. Введение препаратов плазмы и кон-
центратов факторов свертывания, содержащих значительное ко-
личество фибриногена, приводит к повышению уровня альфа-
2-макроглобулина, являющегося иммуносупрессорным аген-
том, ингибитором ИЛ-1, способным подавлять пролифера-
цию лимфоцитов, естественную цитотоксичность и антитело-
зависимый киллинг.
Интерлейкин-1, интерлейкин-6 и TNF являются основной
причиной постгрансфузионных фибрильных реакций [Ed. by
D.Dunon, C.R.Mackay, 1993]. Физиологические эффекты цито-
кинов, накапливающихся в процессе хранения в контейнерах с
гемокомпонентами и попадающих в организм реципиента, не
учитываются при определении показании и не всегда сочетают-
ся с задачами гемотрансфузии.
Посттрансфузионную иммуносупрессию следует рассма-
тривать как результирующую всех 4 основных иммунопатологи-
ческих синдромов [Петров Р.В. и соавт., 1984]:
596
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
— инфекционного;
— аллергического;
— аутоиммунного;
— лимфопролиферативного.
Оптимизация функционального потенциала иммунной си-
стемы, обеспечивающей постоянство внутренней среды организ-
ма — одна из важнейших задач при лечении больных.
Профилактика иммуномоделирующего действия гемотран-
сфузий осуществляется на основе диагностического монито-
ринга функционального состояния иммунитета и неспецифиче-
ской резистентности. Такие процедуры, как удаление лейкоци-
тов из эритроцитной массы и плазмы, подбор гистосовместимых
пар донор-реципиент, максимальная реализация правила «один
донор — один реципиент», использование аутологичных гемо-
компонентов и др. позволяют минимизировать отрицательные
иммунологические последствия гемотрансфузий.
Целенаправленная профилактика и своевременная кор-
рекция посттрансфузионной иммуносупресии позволят повы-
сить эффективность лечения хирургических и терапевтических
пациентов.
7.1.9. Синдром иммунологической альтерации
Аллогенные гемотрансфузии, предшествующие транс-
плантации органов и тканей (в частности, при пересадке по-
чек), улучшают результаты приживления трансплантата. Ме-
ханизм эффекта неясен, но вклад иммунологического ком-
понента в это явление несомненен. Полагают, что активация
специфических и неспецифических иммуносупрессорных кле-
ток, возникающая в ответ на трансфузию, подавляет развитие
специфических посттрансплантационных реакций при пере-
садке почки. Определенную роль могут играть формирую-
щиеся после трансфузии антитела (антилимфопитарные тепло-
вые и/или холодовые антитела, идиопатические антитела и
др.), которые подавляют клеточную иммунологическую ре-
активность организма реципиента.
Выяснение механизмов иммунносупрессивного воздей-
ствия на организм реципиента гемотрансфузий нуждается в
дальнейшем изучении.
597
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Гипотензивные реакции
Гипотензивная реакция при трансфузиях является тран-
сфузионной реакцией, описанной сравнительно недавно. Дан-
ная реакция проявляется понижением давления, возникшим
во время трансфузии при отсутствии каких-либо симптомов
других трансфузионных реакций (лихорадка, озноб, диспноэ, ур-
тикарные высыпания или покраснение). Уровень понижения
давления, при котором можно установить данный диагноз, чет-
ко не определен. Достоверным считается снижение уровня си-
столического и диастолического давления на 10 мм рт. ст. по
сравнению с претрансфузионным давлением реципиента. Если
давление перед трансфузией было типичным для данного реци-
пиента, а впоследствии наблюдалось лишь снижение диастоли-
ческого давления, то данные изменения не рассматриваются
как гипотензивная трансфузионная реакция. Гипотензия разви-
вается во время трансфузии и быстро прекращается после окон-
чания процедуры. Если снижение давления наблюдается в тече-
ние 30 минут после прекращения трансфузии, следует предпо-
ложить другую причину. Гипотензивная реакция чаще всего воз-
никает при трансфузии эритроцитов или тромбоцитов.
Диагноз ставится по клиническим симптомам.
Дифференциальный диагноз проводится с гемолитически-
ми реакциями, осложненями, связанными с бактериальным за-
грязнением компонентов крови, острым легочным синдромом,
аллергическими реакциями, аритмией, инфарктом миокарда, ос-
трым кровотечением, лекарственными реакциями и другими
причинами гипотензии.
Лечение
При резком падении давления трансфузию прекращают и
начинают инфузионную терапию. Пациента переводят в поло-
жение Тределенбурга и назначают инфузию 0,9 % изотоническо-
го раствора хлорида натрия. Медикаментозная поддержка уров-
ня давления проводится только при тяжелой гипотензии, рефрак-
терной к инфузионной терапии.
Посттрансфузионная пурпура (ПТП)
По механизму развития посттрансфузионная пурпура анало-
гична отсроченной гемолитической трансфузионной реакции.
У реципиента формируются аллоантитела к антитгенам тромбо-
598
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
цитов трансфузируемой крови. Антитела, продуцируемые у реци-
пиента при ПТП, через определенное время разрушают аутоло-
гичные антиген-негативные тромбоциты. Тромбоцитопения у
реципиента развивается через 5—10 дней после трансфузии, хотя
были описаны случаи, когда первые проявления возникали через
3 недели. До конца механизм разрушения аутологичных тромбо-
цитов не выяснен, предположительно он является иммунозави-
симым. Предположительно происходит связывание аутологичных
тромбоцитов с FC-рецепторами, быстрое продуцирование ауто-
антител и адсорбция растворимых тромбоцитарных антигенов
из донорской плазмы. Последующая трансфузионная реакция
может возникнуть после переливания любых компонентов кро-
ви. Наиболее частыми симптомами являются глубокая тромбоци-
топения, пурпура или кровотечение. Может возникнуть фебриль-
ная реакция. Выздоровление наступает через 7—48 ч.
Дифференциальный диагноз проводится с ИТП, сепсисом,
ДВС-синдромом, недостаточностью костного мозга, лекарствен-
но-зависимой тромбоцитопенией и с наличием антигепарино-
вых антител. Обнаружение тромбоцитарных аллоантител и со-
ответствующих им тромбоцитарных антигенов служит подтвер-
ждением диагноза. Фактически все антигены тромбоцитов че-
ловека способны вызывать ПТП, однако НРА-1 описываются ча-
ще. ПТП, обусловленная присутствием HLA-антител, встреча-
ется гораздо реже.
Лечение
Проводится плазмаферез для удаления циркулирующих тром-
боцитарных антител. Эффективность плазмафереза различна, но
сообщается, что в среднем достигает 12 дней. Применение заме-
стительной инфузионной терапии спорно. Предполагается, что
при замещении СЗП достигается более быстрое выздоровление,
однако это увеличивает эффект трансмиссионной передачи ин-
фекционных заболеваний. Реже описано применение высоких доз
внутривенного ИГ (400—500 мг/кг в день) в течение 10 дней. У не-
которых пациентов эффект достигался при однократном введе-
нии ИГ. При использовании кортикостероидов (преднизолон —
1—2 мг/кг) нормализация уровня тромбоцитов возможна в тече-
ние 1 недели. Спленэктомия является резервным методом для
пациентов с рефрактерностью или высоким риском опасных для
599
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
жизни кровотечений (внутричерепные кровотечения и т. п.).
Трансфузии тромбоцитов малоэффективны при ПТП.
7.1.10. Реакции и осложнения при переливании
кровезаменителей
При применении современных кровезаменителей реакции и
осложнения в клинической практике наблюдаются редко (табл. 7.4).
Высокомолекулярные кровезаменители оказывают сложное
действие на кровь больного: с одной стороны, повышают аттлю-
тинабельность эритроцитов реципиента, а с другой — изменя-
ют свертывающую способность (гипокоагуляция).
Таблица 7.4. Частота посттрансфузионных реакций при
переливании кровезаменителей
Кровезаменители По Watkins По Ring
Белковые препараты 1:10000 1:10 000
Желатины 1:1000 1:1000
Декстраны 3: 10000 3: 10 000
Больным, которым намечают инфузии растворов декстра-
на или поливинилпирролидона, необходимо определить груп-
пу крови и резус-принадлежность до начала трансфузии. Это свя-
зано с тем, что данные кровезаменители могут изменить агглю-
тинабельность эритроцитов и реакция определения групп кро-
ви может быть прочитана неверно.
Среди всех посттрансфузионных осложнений реакции и
осложнения, возникающие после применения кровезамените-
лей, составляют 14,6 % [Белоусов В.В. и соавт., 1980]. По дан-
ным различных авторов, при трансфузии декстранов частота
анафилактических реакций и осложнений колеблется от 0,5 до
10 % и более [Голубцов М.О. и соавт., 1973; Данилюк ТВ. и со-
авт., 1980; Furhoff, 1977].
Осложнения после вливания кровезамещающих жидкостей
[Филатов А.Н., 1975; Белоусов В.В. и соавт., 1980]:
1. Осложнения технического характера:
• воздушная эмболия;
• эмболия инородными включениями, взвешенными в растворах.
600
ГЛАВА 7, ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
2. Осложнения гиперволемического характера.
3. Осложнения, вызванные вливанием инфицированных
кровезамещающих жидкостей.
4. Пирогенные реакции.
5. Анафилактические реакции.
6. Осложнения, зависящие от первичной токсичности ра-
створа.
7. Осложнения, обусловленные токсичностью, приобре-
тенной растворами в процессе их хранения.
8. Осложнения, связанные с влиянием кровезамещающих
растворов на кровь реципиента:
• ложная агглютинация;
• кровоточивость.
Пирогенные, токсические и анафилактические реакции, по
мнению Шабалина В.Н. и соавт. (1982), необходимо выделить в
специфические реакции, которые зависят от особенностей со-
става, структуры кровезаменителей и степени их очистки.
Пирогенные реакции обусловлены недостаточной очисткой
препаратов от бактериальных и клеточно-тканевых пирогенов,
а также образованием биологически активных продуктов в резуль-
тате контакта бактериальной флоры с белками плазмы. По кли-
ническому течению и последствиям это наиболее легкие и непро-
должительные реакции, которые ограничиваются, как правило,
учащением пульса на 15—20 ударов в минуту, появлением озно-
ба, повышением температуры тела на 1,5—2 °C.
Токсические реакции подразделяют на ранние и поздние (в
зависимости от времени их проявления).
Ранние токсические реакции могут быть вызваны вредным
воздействием химических веществ, находящихся в растворах,
вследствие плохой их очистки при производстве или в результа-
те образования сразу же после введения растворов в кровяное ру-
сло. Клинически характеризуются тошнотой, рвотой, судорож-
ным синдромом, нарушением сердечной деятельности. При по-
явлении каких-либо признаков токсичности вливание необхо-
димо немедленно прекратить. Интенсивная терапия должна
быть направлена на поддержание функции жизненно важных ор-
ганов, профилактику печеночно-почечной недостаточности и на-
рушений системы РАСК.
601
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Необходимо напомнить, что сходные с токсическими реак-
циями осложнения могут наблюдаться при быстром введении ги-
дролизатов и аминокислотных растворов. Но, как правило, все
признаки токсичности полностью устраняются при мед ленном
капельном вливании этих растворов.
Поздние токсические реакции. При несоблюдении темпера-
турного и других режимов хранения и введения растворов в них
может происходить спонтанная полимеризация с образованием
высокомолекулярных фракций, образующих гель или выпа-
дающих в осадок. Чаще всего поздние токсические реакции воз-
никают при введении коллоидных растворов, которые имеют вы-
сокую молекулярную массу.
Поздние токсические реакции развиваются через 2—3 неде-
ли после инфузии и характеризуются нарушением функций
многих органов и систем. Это и повышение проницаемости ка-
пилляров, геморрагический синдром с явлениями диффузного
гломерулонефрита, и токсический гепатит, и др.
Анафилактические реакции и анафилактический шок мо-
гут возникнуть при введении растворов, полученных путем
бактериального синтеза или включающих белковые веще-
ства. Известно, что полярные концевые группы синтетических
полимеров способны вступать в комплексные соединения с
белками, метаболитами и другими химическими вещества-
ми и образовывать высокоиммуногенные соединения. Дек-
стран при повторном введении может стать причиной типич-
ной анафилактогенной реакции, которая в зависимости от
тяжести клинических проявлений будет протекать как реак-
ция или как осложнение.
Рекомендация не переливать кровь, эритроцитную массу или
плазму крови одновременно с препаратами декстрана основана
на том, что адсорбированные на эритроцитах молекулы дек-
страна, а также соединенные с белками плазмы крови являют-
ся более выраженными антигенами, чем собственно декстран
[Dresch С. et al., 1970].
Аллергическая реакция может возникнуть и на первое вве-
дение декстранов. Полагают, что реакция может быть связна с
сенсибилизацией реципиента к декстрану в результате наличия
примесей этого полимера в пищевых углеводах, либо в связи с
602
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
образованием антител к антигенам микроорганизмов у боль-
ных, перенесших инфекционно-воспалительные заболевания.
Это подтверждается и тем, что у больных с гнойными процесса-
ми реакции на вливание полиглюкина возникали чаще.
Клиническая картина сходна с наблюдаемой при лекар-
ственном анафилактическом шоке: острая боль за грудиной,
удушье, головная боль, боли в животе, пояснице, тошнота, рво-
та, непроизвольное мочеиспускание и дефекация после введе-
ния нескольких миллилитров (10—20, иногда 50) полиглюкина.
Важное, а иногда решающее значение в генезе смерти от ана-
филактического шока имеет гипоксия. Она клинически проявля-
ется цианозом кожи, лица, шеи, кистей рук, верхней половины ту-
ловища, частым и шумным дыханием, артериальное давление
снижается до критического уровня, тоны сердца глухие, пульс
нитевидный, до 160 ударов в минуту, аритмичный, иногда не опре-
делялся. Резкий цианоз развивается до появления признаков на-
рушения кровообращения и остановки сердечной деятельности.
Грудная клетка «застывает» в положении глубокого вдоха, больной
«синеет на глазах». Потере сознания нередко предшествует психо-
моторное возбуждение, чувство страха, судороги. Затем быстро на-
ступает остановка дыхания и клиническая смерть.
Лечение: при первых же признаках анафилактической ре-
акции необходимо немедленно прекратить трансфузию и начать
реанимационные мероприятия, направленные на поддержание
функции жизненно важных органов и систем организма.
Следует помнить, что тщательный учет показаний и проти-
вопоказаний для проведения гемотрансфузии, соблюдение уста-
новленных правил по технике и методике выполнения всех се-
рологических реакций позволяют провести процедуры перели-
вания крови и ее компонентов в подавляющем большинстве
случаев без отрицательных для пациента последствий.
7.1.11. Осложнения инфузионной терапии
в реанимации и интенсивной терапиии
Острая сердечная недостаточность
Избыточное введение плазмозаменителей может приво-
дить к перегрузке сердца и клиническим признакам декомпен-
сации кровообращения: увеличению печени, интерстициаль-
603
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ному или альвеолярному отеку легких. Риск этих осложнений на-
иболее велик у пожилых пациентов и кардиологических больных.
В этой связи инфузию плазмозаменителей у таких пациентов
проводят при тщательном клиническом и гемодинамическом мо-
ниторинге.
Некардиогенный отек легких
Развитие отека легких во время или после лечения циркулятор-
ного шока или проведения реанимационных мероприятий увеличи-
вает вероятность летального исхода [Shoemaker WC. и соавт., 1979].
Многие специалисты связывают данное осложнение с вы-
бором между коллоидными и кристаллоидными растворами.
Вопрос о том, влияет ли вид раствора на частоту некардиоген-
ного отека легких, до сих пор дискутируется. С этой целью бы-
ло проведено большое число экспериментальных и клиниче-
ских исследований, однако окончательного ответа на поста-
вленный вопрос эти исследования не дали.
Многие диагностические методы, предлагаемые в качестве
критериев нарушения функции легких в результате инфузион-
ной терапии, нельзя признать строго специфичными. К их чи-
слу относятся фракция внутрилегочного шунтирования, альве-
олярно-артериальный градиент по кислороду, статический ком-
пляйнс легких, парциального напряжения кислорода в арте-
риальной крови, объем внесосудистой жидкости в легких, а так-
же серийные рентгенологические исследования легких. Каж-
дый из них имеет свои ограничения.
Величина объема внесосудистой жидкости в легких не всег-
да коррелирует со значениями фракции внутрилегочного шун-
тирования и альвеоло-артериального градиента по кислороду у
больных с отеком легких и ОРДС [Sibbald W.J. и соавт., 1983;
Brigham K.L. и соавт., 1983]. Объем внесосудистой жидкости в
легких может значительно повышаться при отсутствии нару-
шений газообмена.
Оценка степени повреждения легких на серийных рентгенов-
ских снимках также имеет свои ограничения. Во-первых, это свя-
зано с невозможностью их многократного выполнения в течение ко-
ротких промежутков времени. Во-вторых, известно, что даже после
купирования клинических признаков отека легких рентгенологи-
ческая картина может сохраняться в течение нескольких дней.
604
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
По мнению рада авторов, градиент между коллоидно-осмо-
тическим давлением и давлением заклинивания в легочной ар-
терии является достоверным прогностическим критерием, ука-
зывающим на возможность развития отека легких [Guyton А.С.
и соавт., 1959; Puri V.K. и соавт.,1980].
Известно, что по сравнению с коллоидными кристалло-
идные растворы чаще приводят к системному отеку и наруше-
ниям оксигенирующей функции легких вследствие снижения
КОД плазмы крови. С другой стороны, существует мнение, что
изолированное снижение коллоидно-осмотического давления в
плазме при отсутствии сопутствующих факторов, повреждающих
легкие, может не приводить к их отеку даже при существенном
снижении градиента между коллоидно-осмотическим давлени-
ем и давлением заклинивания в легочной артерии [Zarins С. К.
и соавт., 1978].
Несмотря на неоднозначность суждений по данному во-
просу, на основании результатов клинических исследований
можно указать на рад доказанных положений:
1. При повышении ДЗЛК и одновременном снижении КОД
плазмы крови вероятность развития отека легких возрастает.
2. У ранее здорового пациента, имеющего значительные за-
пасы альбумина в организме, при нормальном ДЗЛК вероятность
отека легких невелика даже при значительном снижения КОД.
3. Отек легких может развиваться при нормальных значениях
ДЗЛК и сниженном КОД у больных с хроническими заболева-
ниями и, следовательно, с ограниченными запасами белка в ор-
ганизме.
4. У больных, перенесших синдром шока, а также у пациен-
тов с хроническими заболеваниями могут наблюдаться нару-
шения капиллярной проницаемости, поэтому отек легких и дру-
гих органов у них может развиваться вне зависимости от вида ра-
створа, который применяют для восполнения ОЦК.
Системный отек относится к довольно частым осложне-
ниям, встречающимся у пациентов отделений реанимации и ин-
тенсивной терапии. Нередко фактором, предрасполагающим к
возникновению этого осложнения, является инфузия различ-
ных растворов. Наиболее часто отек развивается в таких органах,
как кишечник, сердце, мозг, кожа, мышцы и жировая ткань.
605
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
К примеру, в исследованиях Pappova и соавт. (1977) было показа-
но, что при использовании больших объемов кристаллоидов для
восполнения дефицита объема плазмы 25 % жидкости накаплива-
ется в жировой ткани, 25 % — в мышечной ткани, и около 37 % —
в коже. Даже при нормальной функции почек у больных, кото-
рые длительно находятся в отделении реанимации и интенсив-
ной терапии после различных хирургических вмешательств и
травм, может наблюдаться положительный жидкостный баланс.
Результатом отека мягких тканей является увеличение диф-
фузионного пространства кислорода от капилляра к клетке. Это
имеет целый ряд клинических последствий:
1. Ухудшение заживления ран, поскольку низкая оксиге-
нация тканей нарушает образование коллагена и эпителизацию
ран.
2. Снижение фиксирующей силы швов, которое может со-
провождаться их прорезыванием.
3. Уменьшение бактерицидной активности лейкоцитов,
приводящее к увеличению риска раневой инфекции [Hohn D.C.
и соавт., 1976].
4. Даже после восстановления адекватного транспорта ки-
слорода могут наблюдаться признаки анаэробного метаболизма.
Как правило, системные отеки развиваются в результате
гипопротеинемии и снижения КОД плазмы крови. Известно
также, что гипопротеинемия может приводить к выраженным на-
рушениям функции желудочно-кишечного тракта. Нередко при
развитии системных отеков наблюдается развитие стрессорных
язв. Имеются также данные, указывающие на существование ко-
релляции между гипоальбуминемией и отеком стенки кишечни-
ка, что приводит к неэффективности энтерального зондового пи-
тания [Brinson R. и соавт., 1985]. Даже умеренные гипоонкоти-
ческие состояния могут сопровождаться увеличением интер-
стициального давления в кишечнике и нарушением всасывания,
что сопровождается диареей. Скопление жидкости в толстом
кишечнике приводит к рефлекторному снижению его пери-
стальтики и нарушению функции тонкого кишечника. Для улуч-
шения перистальтики кишечника и уменьшения его отека реко-
мендуется использовать инфузию альбумина. Следствием оте-
ка кишечника и нарушения всасывания является транслокация
606
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
бактерий через слизистую кишечника в мезентериальные лим-
фатические узлы, что повышает риск развития септических
осложнений. Считается, что нарушение функций кишечника
также является одним из определяющих факторов, приводя-
щих к развитию синдрома системной и полиорганной недоста-
точности [Moore F.A. и соавт., 1989; Deitch Е.А. и соавт., 1987].
Таким образом, первостепенной задачей восполнения дефи-
цита ОЦК является восстановление адекватного сердечного вы-
броса и транспорта кислорода. В целом ряде клинических ситуа-
ций выбор жидкости для восполнения дефицита ОЦК не являет-
ся определяющим. Первостепенное значение имеет быстрота вос-
становления адекватного артериального транспорта кислорода.
Важное значение имеет обоснованное использование инва-
зивного гемодинамического мониторинга. Это позволяет не
только оптимизировать сам процесс восполнения дефицита
ОЦК, но и снизить риск перегрузки жидкостью.
Выбор раствора, используемого для восполнения дефици-
та ОЦК, должен зависеть от конкретной клинической ситуа-
ции. В этом отношении не может быть всеобъемлющих рекомен-
даций. Пример: молодой пациент, получивший травму, может
быть успешно пролечен как коллоидными, так и кристалло-
идными растворами, однако в этом случае адекватное восполне-
ние кристаллоидами предпочтительно, поскольку оно связано
с меньшими финансовыми затратами. Вместе с тем мы являем-
ся сторонниками сбалансированной инфузионной терапии, суть
которой заключается в рациональном сочетании коллоидных
и кристаллоидных растворов.
Список основной литературы
1. Аграненко В.А., Скачилова Н.Н. Гемотрансфузионные ре-
акции и осложнения. 2-е изд. М.: Медицина, 1986.238 с.
2. Воробьев А.И. Острая кровопотеря и переливание крови //
В приложении к журналу «Анестезиология и реаниматоло-
гия». 1999. С. 18-26.
3. Гаврилов О.К. Биологические закономерности регулирова-
ния агрегатного состояния крови и задачи ее исследования
// Пробл. гематол. и перелив, крови. 1979. № 7. С. 16—24.
607
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
4. Колосова ТВ. и др. Ретроспективное исследование очага гепатита
у доноров плазмы// Гематол. итрансфузиол. 1993. № 2. С 42—44.
5. Доменик Виньон. Риск, связанный с переливанием крови
И В приложении к журналу «Анестезиология и реанимато-
логия». 1999. С. 27—42.
6. Изоиммунология и вопросы клиники и лечения гемотрансфу-
зионных осложнений: Сборник инструкций. М., 1979.264 с.
7. Константинов Б.А., Рагимов А.А., Дадвани С.А. Трансфу-
зиология в медицине. М.: Аир-Арт., 2000. 528 с.
8. Минеева Н.В., Кирина О.Н. Гемолитические трансфузион-
ные реакции: причины возникновения, механизмы разви-
тия, вопросы профилактики // Трансфузиол. Медицина.
СПб., 1995. № 5. С. 73-75.
9. Петровский Б.В. Переливание крови в хирургии. М., 1954.
10. Петровский Б.В., Гусейнов Ч.С. Трансфузионная терапия
в хирургии. М., 1971.
11. Петровский Б.В., Аграненко В.А. Методы переливания
крови. Руководство по общей и клинической трансфузио-
логии. М.: Медицина, 1979.
12. Рагимов А.А., Дашкова Н.Г. Трансфузионная иммунология.
М.: ВУНМЦ, 2000.284 с.
13. Румянцев А.Г., Аграненко В.А. Клиническая трансфузио-
логия. М.: ГЭОТАР-медицина, 1997. 575 с.
14. Филатов А. Н. Опасность и осложнения при переливании
крови и кровезаменителей. Руководство по перелива-
нию крови и кровезаменителей. Л.: Медицина, 1973.
С. 453-498.
15. Шабалин В.Н., Серова Л.Д., Бушмарина ТА. Изоиммунные
посттрансфузионные реакции негемолитического типа /
Методика и техника переливания крови. Л., 1975. С. 92—94.
16. Anderson К.С., Weinstein Н J. Current concept: Transfusion as-
sociated graft-versus-host disease // N. Engl. J. Med. 1990.
Vol. 323. № 5. P. 315-321.
17. Brigham K.L., Kariman K., Harris T.R. et al. Correlation
of oxygenation with vascular permeability-surface area but
not with lung water in humans with acute respiratory fai-
lure and pulmonary edema // J Clin Invest. 1983. Vol. 72.
P. 339.
608
ГЛАВА 7. ГЕМОТРАНСФУЗИОННЫЕ РЕАКЦИИ И ОСЛОЖНЕНИЯ
18. Brinson R., Guild R., Kolts В. Diarrhea and hypoalbuminemia
in a medical intensive care unit // Gastroenterology. 1985.
Vol. 88. P. 1336.
19. Brubaker D., Romnie C. The in vitro evaluation of twofilters for
white cell-poor peatelet concentrates // Transfusion. 1988.
№ 18. P. 383.
20. Confreres M. Immunomodulatory effect of blood transfusion: an
overestimated problem I European School of Transfusion Me-
dicine. St.-Petersburg, 1993. P. 35—41.
21. Deitch E.A., Winterton J., Berg R. The gut as a portal of entry
for bacteremia//Ann Surg. 1987. Vol. 205. P. 681.
22. Greenwait T. Pathogenesis and management of haemolytic tran-
sfusion reaction// Sem. Hematol. 1981. Vol. 18. P. 84—94.
23. Guyton A.C., Lindsey A.W. Effect of elevated left atrial
pressure and decreased plasma protein concentration on
the development of pulmonary edema // Circ Res. 1959.
Vol. 7. P. 649.
24. Hoak J.C., Koepeke J.A. Platelet transfusion // Clin. Hematol.
1976. № 5. P. 69-79.
25. Hohn D.C., Макау R.D., Halliday B. et al. The effect of Oa ten-
sion on microbicidal function of leukocytes in wounds and in vi-
tro // Surg Forum. 1976. \bL 27. P. 18.
26. Huetis D.W., Bove J.K., Buseh Sh. (eds). Practical blood tran-
sfusion. Boston: Little, brown Co., 1981. P. 489.
27. Kanter M.H. Transfusion-associated graft-versus-host disease:
do transfusions from second-degree relatives pose a greater risk
than those from first-degree relatives // Transfus. 1992. № 32—4.
P. 323-327.
28. Lenner P., Holland P. Diagnosis and Management of Transfus-
ion Reactions / Pett L. et. al. (eds) / Clinical Practice of Tran-
sfusion Medicine. NV: Churchi U Zivingstone. 1996.1115 p.
29. Merphy W.G. Adverse effects and complications of transfusion
I Quality Assurance in Transfusion Medicine. CRC Press. 1993.
P. 443-469.
30. Mollison P. et al. (eds) // Blood Transfusion in clinical Medici-
ne Blackwey publ. 1994. P. 1112.
31. Moore EA., Moore E. E., Jones T.N. et al. TEN versus TPN fol-
lowing major abdominal trauma—Reducing septic mortality. J
609
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Trauma 29:916, The crystalloid versus colloid controversy: Bi-
as, logic and toss-up I I Theor Surg. 1989. Vol. 4. P. 205.
32. Pappova E., Bachmeier W., Crevoisier J.L. et al. Acute hypopro-
teinemic fluid overload: Its determinants, distribution and tre-
atment with concentrated albumin and diuretics // Vox Sang.
1977. Vol. 33. P. 307.
33. Parkins H. Safety of the blood supply: making decisions in tran-
sfusion medicine / Nance S. (eds) I I Blood Safety: curent Chal-
lenges. Bethesida: AABB. 1992. P. 125.
34. Petz L. et al. Transfusion-associated graft-veisng-host desiase in
immunocompetent patients / Ibid. 1993. Vol. 33. P. 742.
35. Popovsky M.A., Moore S.B. Diagnostic and pathogenic consi-
derations in transfusion-related acute lung injury / Transfiis.
1985. Vol. 25. P. 573-577.
36. Popovsky M. et al. Transvusion related acute lung injury: neglec-
ted, serious complication of tnerapy / Ibid. 1992. Vol. 32. P. 589.
37. Puri V.K., Weil M.H., Michaels S. et al. Pulmonary edema as-
sociated with reduction in plasma oncotic pressure // Surg Gyn-
ecol Obstet. 1980. Vol. 151. P. 344.
38. RockG., Segafchian M.G. (eds)/Quality assurance in Transfus-
ion medicine. Vol. III. Meth-odological advances and clinical
aspects. CRC Press, Boca Raton, Ann Arbor — London. Tokyo.
1990. P. 450-452.
39. Sibbald W.J., Warshawski EJ., Short A.K. et al. Clinical studi-
es of measuring extravascular lung water by the thermal dye
technique in critically ill patients // Chest. 1983. Vol. 5. P. 725.
40. Shoemaker W.C., Hauser C.J. Critique of crystalloid versus col-
loid therapy in shock and shock lung // Crit Care Med. 1979.
Vol. 7. P. 117.
41. Wexler L.B. et al. The fate of citrate in erythoblastic infants with
exchange transfusion // J.Clin. Invest. 1949. Vol. 29. P. 474.
42. Zarins C.K., Rice C.L., Peters R.M. et al. Lymph and pulmo-
nary response to isobaric reduction in plasma oncotic pressure
in baboons // Circ Res. 1978. Vol. 43. P. 925.
ГЛАВА8
ДВС-синдром
8.1. Основные сведения о диссеминированном
внутрисосудистом свертывании крови
Диссеминированное внутрисосудистое свертывание кро-
ви (ДВС) — одна из наиболее часто встречающихся в
интенсивной терапии патологий системы гемостаза.
ДВС — сложный патологический процесс, проявляю-
щийся в массивном свертывании крови, ведущем к блока-
де микрониркуляторного русла в жизненно важных органах
(легких, почках, печени, надпочечниках и др.) с последую-
щим развитием их дисфункции. Увеличение количества
диагностируемых случаев ДВС-синдрома при различных
заболеваниях связано как с выявлением новых данных об эт-
иопатогенезе этого заболевания, так и с возросшими диаг-
ностическими возможностями.
Клинические проявления ДВС и диагностические кри-
терии различны. Несмотря на длительные исследования
ДВС в научных центрах многих стран, пока еще не разра-
ботаны единые принципы терапии этого синдрома.
Синдром ДВС всегда является следствием или ослож-
нением основного заболевания. Триггером ДВС может
быть сепсис, шок любой этиологии, ВИЧ-инфекция, тя-
желые хирургические заболевания (панкреатит, травма-
тичные хирургические вмешательства), акушерская па-
тология (подробнее этиология ДВС-синдрома рассматри-
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
вается ниже). Смертность зависит от тяжести заболевания,
вызвавшего ДВС: чем тяжелее течение основного заболе-
вания, тем выраженнее проявление ДВС-синдрома.
Для ДВС характерны следующие изменения в органах:
• микрососудистый тромбоз;
• признаки системного воспаления;
• кровоточивость;
• тканевая дисфункция.
Повреждение органов является результатом неконтро-
лируемой активации системы гемокоагуляции и воспаления.
Терминология, употребляемая для обозначения дан-
ного патологического процесса, довольно разнообразна:
• синдром диссеминированного внутрисосудистого
свертывания, или ДВС-синдром;
• синдром РВС, или СРВС — синдром рассеянного
внутрисосудистого свертывания;
• гиперкоагуляционный синдром;
• ТГС — тромбогеморрагический синдром;
• ВСФ — внутрисосудистое свертывание и фибринолиз;
• коагулопатия потребления.
В последние годы наиболее часто используют термин
«диссеминированное внутрисосудистое свертывание кро-
ви», или ДВС-синдром.
В настоящее время ДВС рассматривают как общебио-
логический процесс, заложенный в генезе в целях оста-
новки кровотечения при травме сосудов и ограничения по-
раженного участка организма (тканей, органа) от всего ор-
ганизма.
ДВС-синдром неспецифичен и универсален, характе-
ризуется рассеянным свертыванием крови с тромбообразо-
ванием, протекающим на фоне массивного потребления
факторов свертывания крови, тромбинемии и в ряде случа-
ев вторичной сверхактивацией фибринолиза, что, в свою
очередь, и является причиной кровотечений различной ло-
кализации [Папаян Л.П., Князева Е.С., 2002].
ДВС-синдром полиморфен, т. е. клинические и лаборатор-
ные показатели, тяжесть и темпы его развития различаются в
широких пределах.
612
ГЛАВА 8. ДВС-СИНДРОМ
8.2. Физиология системы гемостаза
Система гемостаза препятствует потере крови при повреж-
дении кровеносных сосудов, поддерживает жидкое состояние
крови, сохраняет нормальный объем циркулирующей крови,
способствует удержанию клеточных элементов крови в сосуди-
стом русле, восстанавливает целостность поврежденного сосуда.
Система гемостаза включает три компонента-.
1) сосудистый;
2) тромбоцитарный;
3) плазменный.
Плазменный компонент в свою очередь подразделяется на:
• систему коагуляции крови;
• антикоагулянтную систему;
• фибринолитическую (плазминовую) систему;
• кинин-калликреиновую систему, систему комплемента.
Сосудисто-тромбоцитарный гемостаз представлен:
• тромбоцитами крови;
• эндотелием и гладкой мускулатурой сосудов.
Эндотелий обладает низкой контактной активностью —
феноменом несмачиваемости вследствие наличия на нем ней-
трального полисахаридного комплекса. Клетки эндотелия спо-
собны к сокращению под воздействием ряда биологически ак-
тивных веществ: гистамина, брадикинина и др. При механиче-
ском, химическом, токсическом повреждении сосудистой стен-
ки происходит активизация гемостаза, а в дальнейшем гемоста-
тический потенциал эндотелия может истощаться. При этом па-
тологический процесс усугубляется гипоксией, продуктами из-
мененного метаболизма, применением вазопрессорных пре-
паратов, что в результате приводит к сладж-синдрому. Кроме это-
го клетками эндотелия вырабатывается простациклин — инги-
битор агрегации тромбоцитов, а на поверхности эндотелиаль-
ных клеток фиксируется активный комплекс антитромбин III
(AT III) + гепарин.
При повреждении возникает спазм гладкой мускулатуры
сосуда в месте травмы и травмированные клетки эндотелия вы-
деляют в кровоток факторы, активизирующие:
• агрегацию тромбоцитов (фактор Виллебранда, АДФ);
613
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• фибринолиз (тканевый активатор фибринолиза);
• плазменный гемостаз (тканевый тромбопластин).
Основную роль в первичном гемостазе, тромбообразова-
нии играют тромбоциты, которые:
1) способствуют восстановлению нормальной структуры
эндотелия — амиотрофическая функция',
2) образуют тромбоцитарный тромб — агрегационная функ-
ция. Процесс агрегации 2-фазный: обратимая и необратимая ста-
дии, когда между тромбоцитами лизируются мембраны и обра-
зуется единый конгломерат;
3) способны прилипать к поврежденному эндотелию или к
чужеродной поверхности — адгезивная функция',
4) участвуют в плазменном гемостазе — в процессе агрега-
ции вырабатывают тромбоцитарный фактор III (р3).
Первичный (тромбоцитарный) тромб образуется при повреж-
дении стенки кровеносного сосуда. Тромбоциты контактируют
с субэндотелием и адгезируют к поврежденным участкам. В про-
цессе адгезии тромбоцитов участвуют плазменные кофакторы (ио-
ны Са и фактор Виллебранда). В настоящее время хорошо изу-
чены 12 тромбоцитарных факторов, такие как фибринопласти-
ческий фактор, тромбоцитарный тромбопластин (отличается от
тканевого тромбопластина отсутствием апопротеина III), анти-
гепариновый фактор, АДФ (фактор агрегации тромбоцитов) и др.
При состояниях, сопровождающихся тромбоцитопенией, тром-
боцитопатией или дефицитом фактора Виллебранда, происходит
замедление тромбообразования. Клинически эго проявляется в
виде обильных кожных геморрагий, петехий.
Одновременно с адгезией происходит агрегация тромбо-
цитов, которая стимулируется катехоламинами, серотонином,
АДФ, тромбоксаном Aj. Простациклин Е (Pgl2) является анта-
гонистом тромбоксана, при дефиците простациклина повыша-
ется агрегационная способность тромбоцитов, что в свою оче-
редь увеличивает риск тромбообразования. Нарушение синте-
за тромбоксана \ приводит к снижению функциональной спо-
собности тромбоцитов и кровоточивости. Простациклин сосу-
дистой стенки и тромбоксан \ синтезируются из одного пред-
шественника — эндоперекисей простагландинов. В норме их
синтез уравновешен, однако в условиях патологии синтез тром-
614
ГЛАВА 8, ДВС-СИНДРОМ
боксана \ превалирует над синтезом простациклина, что при-
водит к активизации агрегации тромбоцитов (см. рис. 8.1).
Рисунок 8.1. Механизм воздействия на агрегационные свой-
ства тромбоцитов
При адгезии и агрегации тромбоциты вырабатывают тром-
боцитарный фактор III, который еще более усиливает агрега-
цию клеток. Результатом взаимодействия тромбоцитарных и
плазменных факторов свертывания является образование
тромбина, который инициирует дальнейшее свертывание кро-
ви и образование фибрина.
Плазменный (коагуляционный) гемостаз осуществляется по-
следовательным взаимодействием 13 факторов свертывания крови
с участием белков плазмы и ионизированного кальция. В результа-
615
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
те формируется фибриновый сгусток, который уплотняет тромб и
закрепляет его в месте повреждения сосуда.
Факторы свертывания подразделяют на 2 группы:
1) ферментные — активные факторы, непосредственно уча-
ствующие в процессе свертывания крови;
2) неферментные — мощные кофакторы свертывания (фак-
торы V и VIII).
Основным этапом плазменного гемостаза является обра-
зование фибрина из фибриногена (фактор I). От фибриногена
под воздействием тромбина отделяются фрагменты — фибрино-
пептиды, в результате образуются мономеры, димеры фибрина,
а затем полимерное волокно фибрина, которое стабилизирует-
ся фактором XIII.
Переход неактивного фактора II — протромбина в актив-
ный фактор Па — тромбин, который активирует синтез фибри-
на, проходит под воздействием протромбиназы (фактор Ха).
Протромбиназа активизируется тромбоцитарным фактором III,
фактором V при участии ионов Са.
Протромбиназа активизируется посредством двух механизмов:
внешнего и внутреннего. При внешнем механизме процесс запуска-
ется тканевым тромбопластином (фактор III, тканевый фактор),
который поступает в кровоток в результате [Сидоркина А.Н., 2000]:
• травматизации, повреждения тканей, сосудов;
• при поступлении в русло значительных объемов интерсти-
циальной, межтканевой жидкости вследствие дегидратации,
кровопотери;
• гипоксии, ацидозе, сладж-синдроме, повреждении эн-
дотелия протеазами, эндо- и экзотоксинами, вследствие чего в
клетках эндотелия активизируется синтез тканевого фактора;
• при поступлении в русло гетерогенного тканевого тром-
бопластина (например, эмболия околоплодными водами).
Наибольшее количество фактора III содержат эпителиаль-
ные и глиальные клетки. Соединение тканевого тромбопласти-
на с фактором III (в присутствии ионов Са) активизирует про-
тромбиназу (фактор Ха) и инициирует образование фибрина. На
этот процесс необходимо менее 20 с.
Внутренний механизм образования протромбиназы бо-
лее сложный. При контакте с поврежденным эндотелием ак-
616
ГЛАВА 8. ДВС-СИНДРОМ
тивизируется фактор XII (фактор Хагемана), который ини-
циирует каскад сложных реакций, в которых последовательно
активизируются факторы свертывания: ХПа—XI, Xia—IX,
IXa—VIII. Весь этот сложный процесс происходит на фосфо-
липидных матрицах, которые вырабатывают активизирован-
ные тромбоциты. Конечным результатом каскада реакций яв-
ляется образование фактора X (под воздействием протром-
биназы). Этот механизм более длителен, занимает 10—20 мин.
В норме свертывание крови происходит как по внешнему, так
и по внутреннему механизмам. Дефицит или качественный
дефект факторов свертывания сопровождаются замедлением
скорости образования фибрина и тромбов. Клинически это
проявляется повышенной кровоточивостью и кровоизлия-
ниями гематомного типа (рис. 8.3).
Свертывание крови контролируется антитромботически-
ми механизмами, которые представлены системой физиоло-
гических антикоагулянтов. Естественные антикоагулянты син-
тезируются клетками сосудистого эндотелия и гепатоцитами.
Артериальные или венозные тромбозы возникают вследствие
локальной (местной) недостаточности антитромботических
механизмов, в отличие от синдрома диссеминированного вну-
трисосудистого свертывания, при котором имеется системный
дефицит физиологических антикоагулянтов. По мере про-
грессирования ДВС-синдрома система гемостаза становится
крайне нестабильной вследствие резкого истощения гемоста-
тических и антитромботических механизмов.
Внедрение в клиническую практику новых лекарствен-
ных средств, влияющих на систему гемостаза, в частности,
препарата Ново-Севен (Ново Нордиск, Дания) — рекомби-
нантного активированного фактора Vila (rVIIa), несколько
изменило представление о механизме свертывания крови. В со-
временной модели отсутствует деление гемостаза на внешний
и внутренний пути коагуляции. Весь процесс свертывания кро-
ви представлен общим механизмом, который условно подраз-
деляется на 3 фазы:
• фаза инициации;
• фаза начальной активации;
• фаза воспроизводства (усиления) гемостаза (рис. 8.2).
617
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Современная модель гемостаза
Рисунок 8.2. Схема новой модели гемостаза
[цит-по Hoffman М., 2003]
1) сосудистое повреждение приводит к высвобождению тка-
невого фактора (ТФ), при этом происходит образование ком-
плекса ТФ/фУПа.
2) комплекс ТФ/фУНа активизирует ф1Х и фХ. Незначитель-
ное количество фХа связывается с фУа.
3) комплекс фХа/фУа, воздействуя на небольшое количе-
ство протромбина, превращает последний в тромбин.
4) тромбин в незначительной концентрации активизирует
фУ, фУШ, фХ1 и тромбоциты (в месте повреждения сосуда).
5) фУа, фУШа и ф1Ха, связываясь с поверхностью активи-
зированных тромбоцитов, проводят к инициации образования
значительного количества фХа и образованию комплекса
фХа/ фУа.
6) комплекс фХа/фУа трансформирует огромное количество
протромбина в тромбин, вызывая «тромбиновый взрыв».
618
ГЛАВА 8. ДВС-СИНДРОМ
7) под воздействием тромбина происходит синтез фибрина
из фибриногена и формирование сгустка в месте первичного
сосудистого повреждения. Тромбин также активизирует фХШ,
который стабилизирует, прошивает образовавшийся фибрин,
превращая его в нерастворимую форму.
В соответствии с новой моделью гемостаза контактные фак-
торы свертывания, такие как фХП, высокомолекулярный кинино-
ген и прекалликреин, существенную роль в процессе гемостаза не
играют. Их дефицит не приводит к усилению кровоточивости.
Физиологические антикоагулянты контролируют процессы
свертывания крови и препятствуют тромбообразованию (см.
табл. 8.1). Важнейшими медиаторами антитромботической си-
стемы являются антитромбин III (AT III), протеин С и S, гепа-
рин. AT III — гликопротеин, относящийся к семейству а2—гло-
булинов крови, ММ 56 000—65 000 Д. Надолго AT III приходит-
ся до 80 % всей антикоагуляционной активности, и при его де-
фиците резко возрастает риск тромбообразования. Первые пу-
бликации, посвященные роли антитромбина III в генезе ДВС-
синдрома, тромбозов, тромбоэмболий, появились в конце 70-х
годов [Sacuragawa N., 1977; MarxR., 1981].
AT III инактивирует тромбин, факторы Ха, ХПа, Xia, 1Ха,
т. е. блокирует оба механизма плазменного гемостаза. Серино-
вые протеазы блокируются антитромбином III лишь в присут-
ствии гепарина. Скорость взаимодействия AT III с факторами
свертывания крови зависит от концентрации гепарина в крови.
Активность AT III в физиологических условиях варьирует в пре-
делах 85—115 %. Период полужизни AT III в русле составляет
54,7 ± 3,1 ч. Показано, что спонтанные тромбозы и эмболии
наблюдаются при снижении содержания AT III < 60 %.
Необходимо отметить, что кофактором гепарина является
AT III: при незначительном снижении содержания антитромби-
на III гепарин будет оказывать антикоагулянтное действие. Од-
нако при снижении содержания AT III до 75 % для достижения
достаточного терапевтического эффекта доза гепарина увеличи-
вается в 2 раза, а при снижении до 50 % — в 5 раз по сравнению
с нормальным показателем AT III. В то же время интенсивная ге-
паринизация приводит к еще большему усугублению дефицита
антитромбина III.
619
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Повреждение сосудистой стенки
Внутренний
механизм
Внешний
механизм
Фактор ХП
ВМЪ
Пр екалликреин
Фактор УПа
Фактор <
Фактор IX Фактор 1Ха
Фактор Х1а
Тканевый
фактор
Фактор 1
Фактор IX
Фактор Villa
Факторна
Фактор X
S
Фактор Ха
фШтррУа
Фибрин пер екр ес тносвяз аннып
Рисунок 8.3. Схема свертывания крови
620
ГЛАВА 8. ДВС-СИНДРОМ
Таблица 8.1. Медиаторы системы гемостаза
Медиаторы гемостаза: Тромбоциты, тромбоцитарные факторы Фибриноген Протромбин Факторы V, VII, VIII, IX, XI, XII, XIII Кининоген высокой молекулярной массы Прекалл икреин Антитромботические механизмы: Простациклин Антитромбин III Гепарин, протеины С и S Тромбомодулин Ингибитор С -эстеразы Альфа 1-антитрипсин Альфа 2-макроглобулин Ингибитор компонента С,- комплемента Антитромбоп п астин
Ингибиторы фибринолиза: Ингибитор активатора плазминогена (HAIIj, ИАП2), а2-ингибитор плазмина (а2- антипл азмин), а2-макроглобулин Активаторы фибринолиза: Тканевый активатор плазминогена (ТАП) Плазминоген Проурокиназа
Физиологические антикоагулянты подразделяют на 2 груп-
пы: первичные и вторичные.
Первичные антикоагулянты, к которым относятся AT III,
протеины С и S, антитромбопл астин, фосфатидил серин, инги-
битор С| -компонента комплемента, синтезируются в печени,
сосудистом эндотелии и постоянно циркулируют в сосудистом
русле. Протеины С и S — К-витаминозависимые антикоагулян-
ты, которые ингибируют факторы Villa и Va.
Необходимо отметить, что антитромботические механизмы
быстро истощаются вследствие массивного потребления анти-
тромбина III. Дефицит протеинов С и S развивается медленнее.
Вторичные антикоагулянты образуются в процессе сверты-
вания крови. К ним относятся продукты деградации фибрина,
фибриногена, растворимые комплексы фибрин-мономеров.
В норме содержание ПДФ, РКФМ минимально. При патологии
содержание этих продуктов резко возрастает, что может приве-
сти к гипокоагуляции.
621
ТРАНСФУЗИОЛОГИЯ ВРЕАНИМАТОЛОГИИ
Важнейшим антитромботическим механизмом является
фибринолиз, который направлен на расщепление фибрина, уда-
ление его из сосудистого русла и поддержание крови в жидком
состоянии (рис. 8.4). Фибрин расщепляется под действием про-
теолитического фермента плазмина, который образуется из
плазминогена (связанного с фибрином) под действием актива-
тора плазминогена тканевого типа (ТАП). Фибринолитическая
система крови является основной протеолитической системой
в организме человека, следовательно, для подавления избыточ-
ной активности фибринолиза показано применение полива-
лентных ингибиторов протеаз.
Активатор плазминогена тканевого типа (алтеплаза), урокиназа, стрептокиназа
Ингибитор активатора плазминогена
ПЛАЗМИНОГЕН
ПЛАЗМИН
А. гьфа-2-антинл азмин
ФИБРИН ПДФ (продукты деградации фибрина)
Рисунок 8.4. Основные этапы процесса фибринолиза
Плазминоген может также активироваться урокиназой (се-
риновой протеазой, продуцируемой в органах мочевыделитель
ной системы) или стрептокиназой, продуцируемой гемолитиче-
ским стрептококком. Циркулирующие в крови альфа2-анти-
плазмин и ингибитор активатора плазминогена ограничивают
фибринолиз и препятствуют деградации фибриногена. Сниже-
ние активности фибринолиза возможно вследствие нарушения
синтеза активаторов плазминогена, повышения содержания ин-
622
ГЛАВА 8. ДВС-СИНДРОМ
гибиторов активаторов плазминогена и антиплазмина, сниже-
ния концентрации плазминогена, что имеет место при хрони-
ческом, рецидивирующем течении ДВС-синдрома.
8.3. Этиология и патогенез ДВС-синдрома
Синдром диссеминированного внутрисосудистого сверты-
вания — неспецифический синдром, развивающийся как ослож-
нение основного заболевания — индуктора, при котором в си-
лу каких-либо обстоятельств активируется система коагуляции
(см. рис. 8.5). Для ДВС-синдрома характерны следующие пато-
генетические механизмы:
• активизация свертывающей системы крови. На всех ста-
диях ДВС, даже в фазу выраженной кровоточивости, в цирку-
ляции имеется значительное количество активизированных
факторов свертывания крови, что вызывает необходимость вве-
дения антикоагулянтов;
• активизация тромбоцитарного звена гемостаза за счет
поступления в русло тканевого тромбопластина, тромбоксана Аз,
что приводит к развитию сладж-синдрома. С целью деблокады
микроциркуляторного русла показано применение препаратов
реологического и антиагрегантного действий;
• истощение противосвертывающих механизмов — де-
фицит естественных антикоагулянтов: антитромбина III, про-
теинов С и S, а также компонентов фибринолитической и ки-
нин-калликреиновой систем. Восполнить дефицит AT III воз-
можно за счет трансфузии донорской плазмы, введения пре-
паратов AT III;
• истощение ретикулоэндотелиальной системы, системы
мононуклеарных фагоцитов, что приводит к накоплению в кро-
вотоке БАВ, активизированных факторов свертывания, пов-
режденных тромбоцитов, эритроцитов, микросгустков. Приме-
нение методов экстракорпоральной гемокоррекции позволяет
компенсировать недостаточность системы естественной деток-
сикации организма;
• снижение противосвертывающего потенциала эндоте-
лия за счет его качественного дефекта, что оправдывает введе-
ние препаратов, обладающих вазопротекторным эффектом.
623
______________________ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Ниже приводится список потенциально опасных состояний,
вызывающих развитие ДВС-синдрома.
I. Инфекция — сепсис, септический шок, постспленэк-
томический синдром — молниеносная форма пневмококково-
го сепсиса, тяжелые вирусные инфекции, СПИД.
2. Шок различной этиологии — анафилактический, септи-
ческий, травматический, кардиогенный, ожоговый и другие.
3. Острый внутрисосудистый гемолиз, вызванный тран-
сфузиями несовместимой крови, отравлениями гемолитиче-
скими ядами.
4. Онкология — особенно диссеминированные формы ра-
ка, острые лейкозы, бластные кризы хронических лейкозов,
синдром повышенной вязкости крови (полиглобулия, парапро-
теинемия).
5. Хирургическая травма — травматичные хирургиче-
ские вмешательства, трансплантация органов, тканей, сосу-
дистое и клапанное протезирование, использование аппара-
тов искусственного кровообрашения и почки. Риск развития
ДВС возрастает с ростом травматичности хирургического
вмешательства и при наличии сопутствующей патологии,
предрасполагающей к развитию ДВС: онкология, хроническая
сердечно-сосудистая патология и т.д.
6. Патология сердечно-сосудистой системы — острый
инфаркт миокарда, врожденные и приобретенные пороки
сердца, застойная сердечная недостаточность, тромбозы глу-
боких вен, тромбоэмболия легочной артерии, гигантские ге-
мангиомы, телеангиоэктазии.
7. Острые и хронические воспалительные, деструк-
тивные заболевания легких, поджелудочной железы, пе-
чени, почек.
8. Травмы — переломы трубчатых костей, травматиче-
ский шок, ожоги, отморожения, электротравма, краш-син-
дром и др.
9. Акушерская патология — эмболия околоплодными
водами, преждевременная отслойка плаценты, атонические
маточные кровотечения, антенатальная гибель плода, пло-
доразрушающие операции, септический аборт, тяжелый поз-
дний токсикоз беременности, эклампсия.
624
ГЛАВА 8. ДВС-СИНДРОМ
10. Массивные гемотрансфузии и реинфузии крови.
11. Иммунные патологии — СКВ, ревматоидный полиар-
трит, болезнь Шенлейн—Геноха, диффузный гломерулоне-
фрит, криоглобулинемия, васкулиты и коллагенозы.
12. Отравление гемокоагулирующими ядами.
13. Трансплантация органов и тканей.
14. Терминальное состояние, остановка сердца с реани-
мационными мероприятиями (в 100 % случаев).
Таким образом, можно утверждать, что ДВС-синдром со-
путствует или осложняет большинство тяжелых заболеваний
и терминальных состояний. Необходимо особо отметить, что
в подавляющем большинстве случаев диагностика многих из
приведенных заболеваний означает, что ДВС-синдром либо
уже спровоцирован, либо может развиться, если не будут на-
чаты профилактические мероприятия [Макеев И.Н., 1998].
Перечень заболеваний и состояний, часто осложняющихся
ДВС-синдромом (по Воробьеву А. И., Тамарину И.В., Городецко-
му В.М., Панченкову Н.Р., 1994), с дополнениями:
Аборт
Амилоидоз
Ангиоматоз Казабаха—Меррит (множественные и гигант-
ские ангиомы)
Аневризмы
Аортит Такаясу
Ацидоз, гипоксия
Вирусные инфекции (герпес, краснуха, оспа, цитомегало-
вирус)
Внематочная беременность
Внутрисосудистый гемолиз
Внутриутробная смерть плода
Врожденные пороки сердца
Гемолитико-уремический синдром
Гемоперфузия (на угольных фильтрах)
Геморрагическая лихорадка
Гиперлипидемия
Гистиоцитоз
Глистная инвазия (кара-азар)
Дефицит фермента Г-6-ФДГ (провоцированный гемолиз)
625
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Жировая эмболия
Злокачественные (солидные) новообразования различных
локализаций
Иммунокомплексные заболевания (васкулиты)
Инфаркт миокарда
Карциноид, нейробластома
Кесарево сечение
Коарктация аорты
Конфликт матери и плода по системам АВО и Rh
Малярия
Массивные поражения тканей (crush-синдром)
Острые и хронические заболевания печени
Острый панкреатит
Осложнения родов
Острый промиелоцитарный лейкоз
Отравления и интоксикации (змеиным ядом, лекарственны-
ми средствами)
Отслойка плаценты
Переливание несовместимой крови
Рабдомиосаркома
Рестернотомия
Сепсис
Септический аборт
Серповидноклеточная анемия (криз)
Синдром гомологичной крови
Травматичные хирургические операции
Трансплантация органов и тканей
Трансплантация костного мозга
Тромбоэмболии легочной артерии
Тяжелая эклампсия
Хирургические кровотечения (отсутствие тщательного гемостаза)
Хирургическая ангиопластика
Хронический мегакариоцитарный лейкоз
Шок (травматический, геморрагический, ожоговый, анафи-
лактический, септический)
Эксикоз
Эмболия околоплодными водами
Эритремия
626
ГЛАВА 8. ДВС-СИНДРОМ
В развитии ДВС-синдрома ведущая роль принадлежит:
• первичному поражению эндотелия сосудов;
• тромбопластическим веществам, попадающим в кровь;
• первичному поражению тромбоцитов.
В результате этих механизмов (как каждого в отдельности,
так и в различных комбинациях) развивается процесс множе-
ственного микросвертывания с тромбозами, развитие коагуло-
патии потребления с последующей активацией фибринолиза.
ДВС-синдром классифицируется по патогенетическому, эт-
иологическому и клиническому признакам.
Ниже представлена детализированная классификация тром-
богеморрагических синдромов, предложенная М.С. Мачабели
(1970,1981) [цит. по И.Н. Мокееву, 1998 г.].
В патогенетической классификации различают следующие
стадии в развитии ДВС-синдрома:
I — гиперкоагуляция и тромбообразование (характеризу-
ется поступлением в кровоток тромбопластина);
II — нарастающая коагулопатия потребления с усилени-
ем фибринолитической активности;
III — дефибринационно-фибринолитическая (характери-
зуется глубокой гипокоагуляцией, вплоть до полной несверты-
ваемости крови и выраженной тромбоцитопении);
IV — восстановительная стадия, или стадия остаточных
тромбозов и блокад (характеризуется восстановлением фибри-
ногена и других факторов свертывания крови).
В этиологической классификации выделяют:
I. Тромбогеморрагические синдромы с преобладанием акти-
вации по линии внешней системы гемостаза, вызванные появлени-
ем тканевого тромбопластина в кровотоке.
1. Введение извне тканевого тромбопластина.
2. Введение извне тромбина.
3. Хирургическая травма: операции на сердце, легких,
предстательной железе, поджелудочной железе, матке.
4. Генерализованный тромбоз.
5. Акушерская патология.
6. Ожоги.
7. Кровопотери.
8. Геморрагический и травматический шок.
627
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
9. Метастатический рак: рак поджелудочной железы, рак
предстательной железы.
10. Отравление ядами некоторых видов змей.
11. Внезапная смерть.
12. Мезентериальный тромбоз с геморрагическими про-
явлениями.
13. Геморрагические инфаркты.
14. Тромбоз легочной артерии с кровохарканьем.
15. Гипоксия.
II. Тромбогеморрагические синдромы с преобладанием актива-
ции по линии внутренней системы гемостаза, вызванные появлени-
ем клеточно-тромбоцитарного, эритроцитарного и лейкоцитар-
ного тромбопластина в кровотоке.
1. Хронические лейкозы.
2. Эритремия.
3. Тромбоцитемии, сопровождающие другие заболевания,
а также состояния после спленэктомии.
4. Гемолитическая анемия.
5. Переливание несовместимой крови.
6. Пароксизмальная ночная гемоглобинурия.
7. Гемолитический шок.
8. Гемолитическая уремия.
9. Отравление ядами некоторых видов змей.
III. Тромбогеморрагические синдромы с преобладанием акти-
вации по линии системы гемостаза, связанные с острым и хрони-
ческим васкулитом.
А. Патологические состояния, при которых создаются усло-
вия для поступления в кровоток бактерий'.
1. Феномен Санарелли.
2. Феномен Швартцмана.
3. Септический аборт.
4. Дифтерия.
5. Дизентерия.
6. Тонзиллит.
7. Менингококковый сепсис.
8. Гастроэнтериты.
9. Кумариновый некроз.
Б. Аллергические реакции'.
628
ГЛАВА 8, ДВС-СИНДРОМ
1. Феномен Артюса.
2. Болезнь Мошковиц — тромботическая тромбоцитопе-
ническая пурпура.
3. Болезнь Шенлейна—Геноха.
4. Анафилактические состояния.
5. Заболевания, приводящие к геморрагическому нефри-
ту с цилиндрурией.
ДВС возникает при условии мощной активации системы ге-
мостаза, при этом активность гемокоагуляции значительно пре-
вышает возможность антитромботических механизмов контро-
ля за свертываемостью.
Основные механизмы активации системы гемостаза пред-
ставлены следующим образом:
1) Интенсивное высвобождение тканевого субстрата
Тканевый фактор находится на поверхности большинства кле-
ток, максимальное его количество на поверхности эпителиальных
и глиальных клеток. Клетки эндотелия сосудов, моноциты в нор-
ме не содержат тканевого фактора, но в ответ на патологическую сти-
муляцию эндотоксинами, фактором некроза опухоли (TNF), интер-
лейкином- 1 происходит массивный выброс тканевого фактора в со-
судистое русло и активация гемостаза. Примером реализации это-
го механизма активации гемокоагуляции могут служить:
а) «классический» акушерский тромбогеморрагический син-
дром, когда из матки в кровоток интенсивно поступают тромбо-
пластические вещества;
б) травматичные хирургические вмешательства, особенно на
паренхиматозных органах;
в) сепсис, септический шок;
г) массивная реинфузия аутокрови, излившейся в рану во
время операции (в ней содержатся не только микроагрегаты
клеток, но и тканевый фактор, концентрация которого пропор-
циональна степени травматичности операции).
2) Контактная активация гемостаза
Внутренний механизм и тромбоцитарное звено гемостаза ак-
тивизируются при контакте с «чужеродными» поверхностями, на-
пример, при циркуляции крови в аппарате искусственного кро-
вообращения, во время гемодиализа, гемодиаультрафильтрации,
629
ТРАНСФУЗИОЛОТ ИЯ В РЕАНИМАТОЛОГИИ
при контакте с искусственным клапаном сердца, сосудистым
протезом, атеросклеротической бляшкой. Вероятность развития
ДВС зависит от следующих факторов: от количества крови, про-
ходящей через аппарат, от времени контакта крови с «чужерод-
ной» поверхностью и от качества (степени тромбогенности) ма-
териала, из которого изготовлен протез, магистрали аппарата.
3) Чрезмерная активация гемокоагуляции
Наблюдается при большинстве онкологических заболеваний
(вырабатываются неопластические прокоагулянтные факторы),
панкреатите (в кровеносное русло попадает большое количе-
ство протеолитических ферментов), при укусах ядовитых змей
(вырабатывается множество гемокоагулирующих протеаз).
4) Дефицит антикоагуляционных факторов
Как следствие врожденного или приобретенного дефицита
естественных антикоатулянтов. Врожденный дефицит AT III (ме-
Рисунок 8.5. Патогенез ДВС-синдрома
630
ГЛАВА 8, ДВС-СИНДРОМ
нее 70 %) приводит к тромбозам глубоких вен, ТЭЛА. Приобре-
тенный дефицит AT III появляется вследствие повышенного его
потребления: при длительном применении больших доз гепари-
на (более 20 тыс. ЕД в сутки), при постоянной активации сверты-
вающей системы (беременность, хронические заболевания).
Всю схему развития ДВС-синдрома можно представить в
виде следующей последовательности патофизиологических
процессов (рис. 8.6).
Рисунок 8.6. Схема развития ДВС-синдрома
Большое значение в формировании ДВС имеет агрегация
клеток крови (сладж-синдром) и скорость кровотока , особен-
но в зоне микроциркуляции. Длительное сладжирование приво-
дит к освобождению клеточных тромбопластинов, нарушению
микроциркуляции, ацидозу, выходу тканевого фактора и разви-
тию микротромбирования. Это наблюдается при шоке, сопро-
вождающемся падением сердечного выброса, полиглобулиях,
тромбоцитозах.
631
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Клиническая классификация ДВС:
• острый (вплоть до молниеносного);
• подострый;
• хронический;
• рецидивирующий;
• латентный.
Молниеносные формы ДВС с тяжелейшими геморрагиями
характерны для акушерской патологии, трансплантации пече-
ни. Характерной особенностью молниеносного ДВС-синдрома
является минимальный срок его развития: от нескольких минут.
Острый ДВС развивается при интенсивной, длительной
активации свертывающей системы крови. При ДВС факторы
свертывания крови потребляются гораздо быстрее, чем восста-
навливаются. Таким образом, ДВС проявляется преимуществен-
но коагулопатией потребления. Острота и выраженность синдро-
ма зависит от тяжести заболевания-триггера. Тенденция к кро-
воточивости часто является первым симптомом начинающего-
ся ДВС. Однако основу клинических проявлений ДВС-синдро-
ма определяют выраженные микротромбоэмболические наруше-
ния органов, которые являются причиной развития полиорган-
ной дисфункции (недостаточности) (рис. 8.7). ДВС острого те-
чения типичен для сепсиса, травматичных хирургических вме-
шательств, краш-синдрома, массивных гемотрансфузий, рас-
пада опухоли, возможен при применении бактерицидных анти-
биотиков. Продолжительность развития острого ДВС-синдро-
ма может быть от нескольких часов до нескольких суток.
Подострое течение ДВС наблюдается при аутоиммунных
заболеваниях (СКВ, аутоиммунный геморрагический васкулит),
хронических инфекциях. Протекает в течение нескольких недель,
характеризуется менее выраженными, чем при остром течении,
клиническими проявлениями с преобладанием микроциркуля-
тор ных нарушений органов (рис. 8.7).
Хроническая форма ДВС сопровождает тяжелую терапевти-
ческую патологию — хроническую сердечно-сосудистую недо-
статочность, ИБС, легочное сердце, гипертоническую болезнь,
сахарный диабет, диабетическую ангиопатию, хронический пи-
ело- и гломерулонефрит. Данный вариант синдрома протекает
в течение нескольких лет на фоне хронических терапевтиче-
632
ГЛАВА 8. ДВС-СИНДРОМ
ских патологий. В начальные стадии заболевания, как правило,
бессимптомен, в ряде случаев диагностируется преимуществен-
но на основе лабораторных показателей. Нарастание клиниче-
ской симптоматики происходит при прогрессировании заболе-
вания, спровоцировавшего этот процесс (рис. 8.7).
Кровоточивость при молниеносном ДВС носит неукротимый
характер, проявляется профузными маточными кровотечениями,
кровотечениями из желудочно-кишечного тракта. Для острой фор-
мы ДВС характерны кровотечения из мест инъекций, диффузная
кровоточивость из операционной раны, носовые, десневые крово-
течения, позже появляются кровотечения из органов желудочно-ки-
шечного тракта, образование обширных внутренних гематом.
Необходимо отметить однотипность м икроциркуляторных изме-
нений при различных формах ДВС — блокада микроциркуляции
острый ДВС
подострьц
ДВС
хронический
ДВС
время
Рисунок 8.7. Клинические проявления нарушений гемостаза при
различных формах течения ДВС-синдрома
Примечание:
— геморрагический диатез на фоне высокой фибринолитической
активности
— геморрагический диатез на фоне низкой фибринолитической
активности
— микрососудистый тромбоз
633
ТРАНС ФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
определяет тяжесть состояния больных, характер осложнении, ис-
ход болезни. Наиболее тяжело поражаю! ся органы с развитой капил-
лярной сетью: легкие, почки, печень, головной мозг, надпочечники.
На аутопсии в органах находят ишемические и геморрагические ин-
фаркты, множественные кровоизлияния. При гистологическом иссле-
довании выявляют стаз и микроагрегаты форменных элементов кро-
ви, экстравазаты, множественные отложения фибрина внутри сосу-
дов и под эндотелием (Зербино Д.Д., Лукасевич Л Л., 1982).
При хроническом течении Д ВС тромбоцитарное звено гемо-
стаза находится в состоянии активности; в органах-мишенях по-
стоянно образуются тромбоцитарные агрегаты, разрастается соеди-
нительная ткань, развиваются склеротические изменения в органах,
что приводит к потере их функциональной способности.
Патологический процесс при ДВС включает в себя три
стадии (рис. 8.8) [по Лычеву В.Г.,1993]:
• I стадия — гиперкоагуляция,
• II стадия — нормокоагуляция,
• III стадия — гипокоагуляция.
Активация гемостатических механизмов приводит к гипер-
коагуляции. Эта стадия кратковременна, особенно при молни-
еносном и остром течении ДВС, и быстро переходит в стадию
гипокоагуляции (вследствие истощения гемостатических меха-
низмов и максимальной активизации фибринолиза). Между I и
Рисунок 8.8. Стадии ДВС-синдрома
634
ГЛАВА 8. ДВС-СИНДРОМ
II стадиями имеется очень кратковременный период нормоко-
агуляции.
I стадия ДВС (гиперкоагуляционная фаза) характеризуется ги-
перкоагуляцией и повышенной агрегацией тромбоцитов. Дли-
тельность стадии зависит от остроты и тяжести основного забо-
левания. Характерное проявление этой стадии — мгновенное
свертывание крови в игле или пробирке, что фиксируется
лабораторными тестами (см. табл. 8.2).
Таблица 8.2. Лабораторные тесты, подтверждающие наличие
I стадии ДВС
Показатели Норма При ДВС
Время свертывания по Ли-Уайту 8—12 мин Укорочение
Время кровотечения по Дюке 2—4 мин Укорочение
Активированное частичное (пар- циальное) тромбопластиновое время (АЧТВ). Самый чувстви- тельный метод из ориентировоч- ных тестов свертывания 40-50 с Укорочение
Фибриноген (по Рутберг) 2,0—4,0 г/л Увеличивается
Количество тромбоцитов 180-320 Ю’/л Уменьшаемся или не меняется
Агрегация тромбоцитов (опреде- ляется гемолизат-агрегационным методом) 20-40 с Укорочение времени агрега- ции
На этой стадии вследствие микротромбирования возни-
кает блокада микроциркуляции. В ответ на микротромбооб-
разование резко активизируется фибринолиз, что можно за-
регистрировать посредством следующих лабораторных те-
стов (табл. 8.3).
При интенсивной активации коагуляции тромбоциты на-
ходятся в активизированном состоянии, контактируют друг
с другом, сладжируют, выделяют в кровь тромбоцитарные
факторы. Постепенно количество тромбоцитов уменьшается,
истощается система физиологических антикоагулянтов.
635
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Таблица 8.3. Лабораторные тесты, подтверждающие активацию
фибринолиза
Показатели Норма При ДВС
Продукты деградации фибрино- гена (ПДФ) 5—10 мкг/л Происходит по- степенное уве- личение ПДФ
D-димер (позволяет оценить со- держание продукта расщепления плазминогеном нерастворимого фибрина) < 500 нг/мл Увеличение со- держания D-ди- мера
Тесты паракоагуляции (этаноло- вый, протамин-сульфатный те- сты) Позволяют оценивать содержа- ние в плазме растворимых фи- брин-мономерных комплексов — РФМК Отрицатель- ные Положительные на! стадии ДВС
Ортофенантролиновый тест(по- зволяет оценивать содержание РФМК) 120 с Происходит по- степенное уве- личение содер- жания
II стадия ДВС (фаза нормокоагуляции) характеризуется на-
растающей коагулопатией потребления и тромбоцитопени-
ей. Лабораторные тесты могут подтвердить наличие нормо-
коагуляции, которая возможна вследствие сочетания повы-
шения коагуляции и начинающейся коагулопатии потребле-
ния (в первую очередь истощаются плазменные факторы
свертывания: фибриноген, протромбин). Снижается содер-
жание AT III, что связано с потреблением его на инактива-
цию тромбина и активированных факторов свертывания.
Снижение AT III ниже 70—75 % является фактором тромбо-
генности, отражает тяжесть ДВС. Во II стадии возможно по-
явление повышенной кровоточивости, кровоизлияний на
коже, слизистых.
При острой форме ДВС I и II стадии очень кратковремен-
ны и быстро переходят в III стадию.
636
ГЛАВА 8. ДВС-СИНДРОМ
III стадия (гипокоагуляционная фаза) характеризуется
выраженной гипокоагуляцией и коагулопатией потребле-
ния. На первых стадиях ДВС происходит выработка значи-
тельного количества тромбина, вследствие чего резко возра-
стает содержание фибрин-мономеров. Максимально активи-
зируется фибринолиз, часть плазмина расщепляет фибри-
ноген и другие нестабилизированные продукты превращения
фибрина (в том числе фибрин-мономеры, и их комплексы с
фибриногеном). Это приводит к накоплению продуктов де-
градации фибриногена. Часть ПДФ поглощается макрофага-
ми, однако большая часть ПДФ остается в сосудистом русле,
формируя растворимые фибрин-мономерные комплексы
(РКФМ). На РКФМ тромбин не оказывает свертывающего
действия — развивается гипокоагуляция. Таким образом, в
крови больного находится еще достаточное количество акти-
визированных факторов свертывания крови, в том числе
тромбина, но коагуляции не происходит из-за блокирова-
ния перехода фибриногена в фибрин продуктами паракоагу-
ляции. Это состояние иногда ошибочно называют афибрино-
генемией. Повышение содержания ПДФ и D-димеров — на-
иболее надежный прогностический признак ДВС-синдрома
[Мелкумян А.Л., 2001; Yu М., 2000].
На этом этапе происходит истощение системы фибри-
нолиза, образующиеся микросгустки не подвергаются лизи-
рованию. Клинически это проявляется «неудержимой» кро-
воточивостью и развитием вследствие блокады микроцир-
куляции полиорганной недостаточности. Развивается тром-
боцитопения потребления — большая часть тромбоцитов
уходит в микросгустки. Отмечается также тромбоцитопа-
тия — нарушение функции тромбоцитов, развивающееся
вследствие ингибирования агрегации тромбоцитов продук-
тами паракоагуляции.
III стадия является критической в течении ДВС даже
при адекватной медикаментозной и хирургической тера-
пии основного заболевания. Благоприятный исход возмо-
жен лишь в 30—40 %. Длительность реконваленсценции
зависит от степени тяжести поражения органов-мишеней
[Баркаган З.С., 1988].
637
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ДВС иногда сопровождается внутрисосудистым гемоли-
зом, который усугубляет геморрагическую анемию. Гемолиз
обусловлен тем, что эритроциты, потерявшие способность к
деформации, при прохождении по микроциркуляторному
руслу фрагментируются нитями фибрина.
При хронически протекающем ДВС активация свертыва-
ния носит менее выраженный характер, что подтверждается уме-
ренными изменениями лабораторных показателей (см. табл. 8.4):
• ПДФ — незначительное повышение.
• Количество тромбоцитов — в норме или повышено.
• Агрегация тромбоцитов — снижение (вследствие тром-
боцитопатии).
• AT III — умеренное снижение.
• Фибриноген — значительно повышен.
Таблица 8.4. Лабораторная диагностика ДВС-синдрома
Лабораторные показатели I стадия II стадия III стадия
Количество тромбоцитов Не меняется или
АЧТВ
Протромбиновое время Не меняется f
Фибриноген 1 Снижается до нормы
AT III Не меняется
Время кровотечения ф н
Время свертывания
Тесты паракоагуляции + + + - (Отр.)
ПДФ 1
638
ГЛАВА 8. ДВС-СИНДРОМ
Менее выражен гемолиз эритроцитов, анемия умеренная.
Микроциркуляторные нарушения при хронических формах
ДВС играют значительную роль в прогрессировании основно-
го заболевания, при этом нарушаются репаративные процес-
сы, развиваются склеротические изменения органов-мишеней.
Лабораторная диагностика ДВС подразделяется на 2 этапа:
I этап — ориентировочные лабораторные тесты (к ним
относятся вышеуказанные методики, доступные всем лечеб-
ным учреждениям);
II этап — подтверждающие лабораторные тесты, к кото-
рым относятся исследования агрегирующих свойств тромбо-
цитов, определение толерантности плазмы к гепарину, вре-
мя эуглобулинового лизиса сгустка, ХПа-зависимый фибри-
нолиз и другие.
Лабораторный мониторинг позволяет не только устано-
вить диагноз ДВС, но и осуществить контроль эффективно-
сти терапии заболевания-триггера и ДВС.
8.4. Клиника ДВС-синдрома
Наряду с характерными для ДВС изменениями лаборатор-
ных показателей важное место в диагностике этого синдрома за-
нимают его клинические проявления. В тяжелых случаях, ког-
да у пациента развивается циркуляторная, дыхательная недоста-
точность, снижается диурез, появляются кожные петехии, экхи-
мозы, носовые, десневые кровотечения установить диагноз не-
трудно. Однако нередко при подостром и хроническом тече-
ниях синдрома клиническая манифестация ДВС нетипична, а ла-
бораторные исследования малоинформативны.
Диагностика ДВС-синдрома основывается на анализе:
• клинических данных;
• показателей системы гемостаза, позволяющих опреде-
лить формы и стадии синдрома;
• реакции системы гемостаза на проводимую терапию.
Ранняя диагностика основана на выявлении заболеваний
и патологических состояний, при которых развитие ДВС-син-
дрома закономерно. При отсутствии подтверждающих ДВС
639
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
тестов методом идентификации может служить биопсия пора-
женных органов, при которой выявляются множественные
микрососудистые тромбозы. Наряду с поражением органов-ми-
шеней при ДВС происходят изменения и в коже. Кожа — это
орган, который наиболее активно (после почек и легких) вовле-
кается в патологический процесс. Максимальная выражен-
ность поражения кожи имеет место при молниеносной форме
ДВС. В прижизненных биоптатах кожи определяются приз-
наки ангиита, гиалиновые тромбы в просветах мелких сосудов
(преимущественно венул), расположенных в сосочковом и сет-
чатом слоях дермы, в подкожной клетчатке [Зербино Д.Д., Лу-
касевичЛЛ., 1982].
Основные типичные клинические проявления ДВС обусло-
влены распространенными геморрагиями и/или тромбозами и по-
лиорганной дисфункцией (недостаточностью) [Лычев В.Г.,1993;
Bick R., Anin В., 1999]. ПОН развивается вследствие тромбогемор-
рагических повреждений органов, имеющих хорошо развитую ми-
кроциркуляторнуюсеть, в первую очередь легких, почек, голов-
ного мозга, кожи, надпочечников, печени. Необходимо отметить,
что в большинстве случаев превалирующей клинической симпто-
матикой ДВС является ПОН, тогда как геморрагическая симпто-
матика встречается лишь в 24 % случаев.
Легочная система. Первым симптомом поражения легких яв-
ляется диспноэ и падение артериальной оксигенации. Острая ды-
хательная недостаточность (в разной степени выраженности)
развивается вследствие:
А — сосудистого микротромбирования;
Б — высвобождения из тромбоцитов вазоактивных суб-
станций.
Капилляры и бронхиолы под воздействием вазоактивных
субстанций сужаются, падает артериальная оксигенация, нара-
стает рСО2, увеличивается частота дыхания, возникает острая ле-
гочная гипертензия. В случае своевременного устранения пато-
логического триггерного механизма прогноз благоприятен, так
как эндотелий сосудов легких обладает очень высокой фибри-
нолитической активностью, которая позволяет лизировать об-
разовавшиеся микротромбы в легочных капиллярах в течение
нескольких часов.
640
ГЛАВА 8, ДВС-СИНДРОМ
При неадекватной терапии, либо при развитии инфек-
ционных или других осложнений имеет место отсроченный
микроэмболический синдром. Этот синдром характеризуется
интенсивным длительным процессом микротромбирования в
системе легочного кровообращения. Фибринолитическая актив-
ность эндотелия легочных сосудов истощается, что является
важным патогенетическим фактором. Система фибринолиза
не в состоянии разрушить микротромбы, происходит замедле-
ние выведения продуктов деградации фибрина и медиаторов во-
спаления. Накопление ПДФ вызывает длительную вазокон-
стрикцию, в результате которой повышается сосудистая прони-
цаемость для жидкости, белков плазмы, возникает интерсти-
циальный, альвеолярный отек легких. Продукты распада лей-
коцитов осложняют патологический процесс дополнительной
вазоконстрикцией, усугубляя повреждение альвеоло-капил-
лярных мембран.
Таким образом, ДВС-синдром является одной из причин ра-
звития острого респираторного дистресс-синдрома. Вследствие
повреждения альвеоло-капиллярных мембран применение ди-
уретиков мало- или неэффективно.
Почки. Отложение фибрина в гломерулярных сосудах почек
приводит к почечной недостаточности; периоду олигурии иног-
да предшествует полиурия. В кортикальном слое почек появля-
ются множественные билатеральные некрозы, что проявляется
микро- и макрогематурией. Осмолярность мочи, как правило,
не меняется; диуретическая терапия оказывает слабо выражен-
ный эффект. Гемодиализ показан при высоких цифрах мочеви-
ны, креатинина крови, при выраженной гипергидратации и
серьезных электролитных нарушениях.
Центральная нервная система. Степень выраженности энце-
фалопатии определяется тяжестью состояния. В случае фулми-
нантного ДВС возможно менингиальное кровотечение, которое
проявляется явлениями менингизма. Очаговая неврологиче-
ская симптоматика развивается при паренхиматозных кровоиз-
лияниях в головной или спинной мозг.
Кожа, слизистые оболочки. Микротромбирование сосудов
кожи приводит к локальным геморрагическим некрозам, кото-
рые локализуются на лице, конечностях. Для ДВС характерны
641
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
петехиальный, гематомный тип кровоточивости, носовые, дес-
невые кровотечения, кровотечения из мест инъекций. Такая
кровоточивость обусловлена формированием неплотных, легко
лизирующихся сгустков.
8.5. Профилактика и терапия ДВС-синдрома
На сегодняшний день, в силу выраженной гетерогенности
причин, приводящих к ДВС-синдрому, не представляется воз-
можным выработать единые рекомендации, которые можно
было бы использовать при лечении различных патологических
состояний, вызвавших ДВС-синдром. Но, учитывая тот факт, что
независимо от заболевания-триггера, провоцирующего ДВС-
синдром, течение процесса имеет общие характерные особенно-
сти, можно определить основные принципы профилактики и те-
рапии этого грозного осложнения. Очевидно, что основные уси-
лия должны быть направлены в первую очередь на ликвидацию
или активную терапию основного заболевания. Активная эт-
иотропная терапия, ранний перевод пациентов с клиникой раз-
вившегося ДВС-синдрома в реанимационное отделение, по-
зволяет оптимизировать течение заболевания.
Основные принципы, которых следует придерживаться при
лечении ДВС-синдрома:
• комплексность;
• патогенетичность;
• д ифференцированность в зависимости от стадии процесса.
Пациенты, у которых диагностирован ДВС-синдром, а осо-
бенно его острая или молниеносные формы — это пациенты
реанимационного профиля, нуждающиеся в лечении в усло-
виях отделения интенсивной терапии с обязательным привле-
чением к лечебному процессу трансфузиологов и специалистов
по патологии системы гемостаза.
Пациентам, попадающим в группу риска по ДВС, обязате-
лен мониторинг лабораторных показателей и функций жизнен-
но важных органов, который включает в себя контроль:
• почасового диуреза;
• показателей КЩС, РаО2, содержания лактата;
• мочевины и креатинина крови, ЛДГ;
642
ГЛАВА 8. ДВС-СИНДРОМ
• электролитов;
• клинического анализа крови + тромбоцитов;
• АЧТВ;
• протромбинового времени;
• AT III;
• D-димеров фибриногена, ПДФ, РКФМ.
Данные лабораторных показателей в первые часы заболева-
ния могут не выходить за пределы физиологических параме-
тров. Однако регулярный их контроль в течение нескольких
часов способствует ранней диагностике ДВС, определению ста-
дии и активности патологического процесса, а также осущест-
влению контроля за эффективностью выбранной терапии.
Основополагающий принцип при терапии ДВС — макси-
мально раннее устранение триггерного фактора:
• антибиотикотерапия гнойно-септических состояний и
осложнений, хирургическая санация, дренирование очагов ин-
фекции;
• адекватная инфузионная терапия гиповолемии;
• коррекция анемии;
• кардиопрессорная терапия при различных вариантах шока;
• хирургическое лечение акушерской и гинекологической
патологий и другие лечебные мероприятия.
Таким образом, основой профилактики ДВС является ран-
няя терапия патологии, обусловившей тяжесть состояния боль-
ного. Особое значение в профилактике ДВС отводится быстро-
му восстановлению перфузии тканей, улучшению реологических
свойств крови и ее кислородтранспортной функции.
1) Антикоагулянтная терапия. Гепарин — наиболее часто
применяемый препарат для профилактики и лечения тромбоэм-
болических состояний. Использование гепарина оправдано на
любой стадии лечения ДВС-синдрома. Гепарин противодей-
ствует развитию внутрисосудистого тромбообразования, обла-
дает антитромбопластиновым и антитромбиновым действиями,
тормозит переход фибриногена в фибрин, снижает агрегацию
эритроцитов и, в меньшей степени, тромбоцитов.
Назначение антикоагулянтов при терапии ДВС преследует
следующие цели:
• восстановление нормального гемостаза;
643
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• профилактика дальнейшего тромбообразования;
• удаление образовавшихся тромбов и восстановление
функций пораженных органов.
Гепарин — сульфатизированный полисахарид, относящий-
ся к семейству глюкозоаминогликанов, молекулярной массой
4000—30 000 Дальтон, средняя молекулярная масса —
13 000 Дальтон. Гепарин — антикоагулянт прямого действия, бло-
кирует биосинтез тромбина, снижает агрегационную способность
тромбоцитов, незначительно активизирует фибринолиз. Кофак-
тором гепарина является AT III. При дефиците этого естественно-
го антикоагулянта гепарин не оказывает антикоагуляционного
действия. Следует иметь в виду, что гепарин обладает рядом побоч-
ных эффектов, наиболее опасными из которых являются:
• Тенденция к повышенной кровоточивости, что особенно
опасно в послеоперационном периоде.
• Гепарининдуцированная тромбоцитопения. Через
2—10 суток гепаринотерапии возникает незначительная тромбо-
цитопения. Как правило, уровень содержания тромбоцитов при
этом остается выше 100 000 в 1 мкл и гепаринотерапия может
быть продолжена. Однако в ряде случаев через 6—12 суток вну-
тривенного или подкожного введения гепарина возникает тяже-
лая отсроченная тромбоцитопения, очевидно, иммунного про-
исхождения. При повторном назначении гепарина у больных, по-
лучавших его ранее, в течение нескольких часов или суток мо-
жет развиться тяжелая тромбоцитопения, которая сопровож-
дается артериальными тромбозами. У всех больных, получающих
гепарин, необходимо периодически определять количество
тромбоцитов. При возникновении тяжелой тромбоцитопении
препарат необходимо отменить. Не рекомендуется такой кате-
гории больных форсированно назначать тромбоконцентрат из-
за высокого риска рикошетных артериальных тромбозов.
• Усугубление дефицита AT III. Комплекс АТ Ш +гепарин
быстро выводится из циркуляторного русла. При использовании
больших доз гепарина запасы AT III быстро истощаются и на-
ступает рикошетная гиперкоагуляция.
В ряде случаев гепаринотерапия не оказывает ожидаемого
эффекта несмотря на увеличение дозы антикоагулянта. Такое со-
стояние называется гепаринорезистентностью и во многом об-
644
ГЛАВА 8. ДВС-СИНДРОМ
условлено дефицитом AT III. В подобных ситуациях для восста-
новления антикоагулянтного действия гепарина необходимо
восполнить дефицит AT III, а не увеличивать дозу гепариноте-
рапии [Баркаган З.С., 2000].
Назначение гепарина при ДВС-синдроме необходимо на-
чинать с малых доз — 500 мЕ в час в виде постоянной инфузии,
затем дозу вводимого препарата при необходимости можно по-
степенно увеличить.
Основной способ введения гепарина при терапии ДВС-
синдрома — внутривенный капельный (в изотоническом ра-
створе хлорида натрия, с плазмой). В некоторых случаях внутри-
венное введение можно дополнить подкожными инъекциями ге-
парина в клетчатку передней брюшной стенки.
Тактика гепаринотерапии, доза и частота введения препа-
рата зависят от течения и фазы ДВС-синдрома. Важное значе-
ние при назначении гепарина имеют такие факторы, как нали-
чие или отсутствие у больного раневой поверхности, кровоте-
чения (из желудочно-кишечного тракта, маточного, из распадаю-
щейся опухоли и т. д.). Так, при наличии у больного свежей ра-
ны гепарин следует применять с большой осторожностью. Если
ДВС-синдром сопровождается профузным кровотечением или
имеется высокий риск его возникновения (в раннем послеопе-
рационном периоде) суточная доза гепарина должна быть сни-
жена в 2—3 раза, либо его вообще необходимо отменить.
Если при остром течении ДВС-синдрома, для того чтобы ра-
зорвать порочный круг — внутрисосудистое свертывание — кро-
вотечение, часто бывает достаточно однократного применения
минимальной дозы гепарина, то подострое течении ДВС-син-
дрома требуется повторных введений гепарина.
Доза гепарина также может варьироваться в достаточно ши-
роких пределах в зависимости от формы и фазы ДВС-синдрома.
В стадии гиперкоагуляции применение гепарина имеет профи-
лактическое значение и его суточная доза при отсутствии обиль-
ного исходного кровотечения может составить 40 000—60 000 ЕД
в сутки (500—800 ЕД/кг в сутки). Первую дозу 5 000—10 000 ЕД
вводят внутривенно болюсно, а затем капельно, желательно при
помощи инфузомата [Лычев В.Е,1993]. Необходимую дозиров-
ку гепарина подбирают по лабораторным показателям.
645
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Оценить эффективность гепаринотерапии после в/в вве-
дения 5000 ЕД можно по динамике следующих лабораторных по-
казателей:
а) время свертывания крови — удлинение в 1,5 раза по срав-
нению с нормальными значениями;
б)АСТ-тест — удлинение до 160—170 с (N = 110—120 с);
в) АЧТВ — удлинение в 1,5—2,5 раза по сравнению с нор-
мальными показателями (N = 35—45 с).
Максимальные дозы гепарина необходимы при наличии в
крови больного белков «острой фазы» (при острых инфекцион-
но-септических процессах, краш-синдроме, ожогах и пр.), ко-
торые инактивируют гепарин, препятствуя его антикоагулянт-
ной активности. Как было сказано выше, неэффективность ге-
парина также связана с блокадой и/или снижением содержания
в плазме больного плазменного кофактора гепарина — анти-
тромбина III.
В III стадии ДВС-синдрома — в фазе глубокой гипокоагу-
ляции гепарин используется под прикрытием трансфузиями
СЗП в гораздо меньших дозировках, например, в начале каждой
трансфузии вводят 2500—5000 ЕД гепарина внутривенно или
капельно. С целью снижения дозировки гепаринотерапии успеш-
но применяют следующую схему: непосредственно перед тран-
сфузией СЗП в нее добавляют 0,1—0,25 ЕД гепарина на 1 мл
плазмы. Данная схема позволяет значительно снизить не толь-
ко объем трансфузии плазмы, но и дозу гепаринотерапии [Лы-
чев В.Г.,1993].
В результате применения гепарина должно улучшиться со-
стояние больного, возрасти концентрация фибриногена, число
тромбоцитов и снизиться содержание ПДФ. Обязателен контроль
времени свертывания крови, терапевтический эффект возможен
при удлинении времени свертывания в 1,5—2 раза.
Путем фракционирования и деполимеризации синтезирован
гепарин с низкой молекулярной массой — от 1000 до 10 000 Даль-
тон, средняя молекулярная масса 4500 Дальтон. Препараты низ-
комолекулярного гепарина (НМГ) (фраксипарин, надропарин-
кальций и др.) оказывают более выраженное по сравнению со
стандартным гепарином антитромботическое действие за счет:
• выраженной активности против фактора Ха;
646
ГЛАВА 8. ДВС-СИНДРОм
• высокой биодоступности;
• значительно более длительного терапевтического эффекта.
Молекулы фраксипарина массой менее 5400 Дальтон взаи-
модействуют с AT III плазмы, активизируя последний. К комплек-
су AT III + гепарин присоединяется фактор Ха, происходит инак-
тивация фактора Ха. Молекулы фраксипарина массой более
5400Дальтон также активизируют AT 111, но при этом образует-
ся комплекс с тромбином (см. рис. 8.9). Анти-Па-активность
фраксипарина замедляет процесс синтезирования тромбина,
тогда как анти-Ха-активность препарата уменьшает количество
уже образовавшегося тромбина. Исследования фармакокинети-
ки препарата показали, что фраксипарин молекулярной массой
более 5400 Дальтон элиминируется быстрее, чем молекулы мас-
сой менее 5400 Дальтон. Именно эта особенность обуславлива-
ет пролонгированный анти-Ха-эффект фраксипарина.
Помимо активизации AT III, фраксипарин оказывает еще
ряд эффектов на систему гемостаза:
Антитромбин Ш — независимый эффект фраксипарина-.
• в меньшей степени взаимодействует с эндотелием сосу-
дов, за счет чего оказывает более длительный, по сравнению с
гепарином, терапевтический эффект;
Фраксипарин ММ < 5400 Д
Фраксипарин ММ > 5400 Д
Рисунок 8.9. Механизм действия фраксипарина на факторы
свертывания
647
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• инициирует выработку ингибитора тканевого фактора
(ингибитора тканевого тромбопластина), концентрация его по-
сле введения фраксипарина возрастает в 3 раза;
• активизирует фибринолиз вследствие увеличения содер-
жания активатора плазминогена;
• улучшает гемореологию, нормализует вязкость крови.
Препараты низкомолекулярного гепарина назначаются под-
кожно; вводится 0,3 мл препарата, а затем один раз в сутки в те-
чение 7 дней под котролем коагулограммы.
Критерии эффективности терапии препаратами низкомо-
лекулярного гепарина:
а) удлинение времени свертывания крови в 1,5—1,8 раза по
сравнению с нормальными показателями;
б) удлинение АСТ-теста до 140—160 с;
в) удлинение АЧТВ в 1,5—2,5 раза по сравнению с нормой;
г) нормализация тромбинового времени — исчезновение
тромбинемии.
НМГ в терапии ДВС-синдрома показали достаточный эф-
фект при меньшем риске возникновения кровотечений и при
меньшем, по сравнению со стандартным гепарином, потребле-
нии AT III [Мелкумян А.Л., 2001; Sakuragawa N., 1993].
В последние годы в литературе появились сообщения о
применении рекомбинантного гирудина и синтетических ин-
гибиторов тромбина с хорошим терапевтическим эффектом.
Однако при их использовании резко возрастает риск неконтро-
лируемых кровотечений, так как еще не разработаны специфи-
ческие антидоты к этим препаратам [Панченко Е.П., Добро-
вольский А.Б.,1999; Баркаган 3.С.,1988].
2) Заместительная инфузионная терапия направлена на
устранение дефицита компонентов системы гемостаза и в пер-
вую очередь дефицита AT III. Свежезамороженная плазма (СЗП)
является оптимальным препаратом для этих целей, так как в ней
содержатся в естественном виде достаточные концентрации
всех необходимых компонентов.
В стадии гипокоагуляции доза инфузируемой плазмы должна соста-
влять 10—15мл на 1кг веса, при необходимости объем трансфузии уве-
личивают. Размороженную СЗП предпочтительнее переливать быстро
капельно или с/ируйно [Воробьев А.И., 2001; Баркаган З.С.,1988].
648
ГЛАВА 8. ДВС-СИНДРОМ
Эффективность терапии достигается как можно ранним
струйным переливанием СЗП до 800—1600 мл в сутки. Перво-
начальная доза 600—800 мл, затем по 300—500 мл через каж-
дые 3—6 ч.
Трансфузии СЗП показаны на всех стадиях ДВС-синдрома
и позволяют:
• возместить недостаток практически всех компонентов ге-
мостаза, в том числе AT III и факторов С и S (снижение содер-
жания которых при ДВС-синдроме идет особенно интенсивно —
в несколько раз быстрее, чем всех прокоагулянтов);
• ввести полный набор естественных антипротеаз и факто-
ров, восстанавливающих антиагрегационную активность крови
и тромборезистентность эндотелия.
Размораживание плазмы необходимо выполнять в спе-
циальных устройствах для размораживания при температуре
+37-38 °C [Plotz R.D., Giotola R.T., 1988].
Добавление небольших доз гепарина (около 500 ЕД) непо-
средственно перед трансфузией в размороженную плазму позво-
ляет существенно уменьшить объем переливаемой плазмы и
усилить лечебный эффект трансфузии [Лычев В.Г., 1998]. Гепа-
рин активизирует антитромбин III, вводимый с плазмой, превра-
щая его в антикоагулянт немедленного действия. Выраженный
терапевтический эффект связан с быстрым обрывом внутрисо-
судистого свертывания комплексом AT III + гепарин.
Трансфузии плазмы со сниженным содержанием фибри-
ногена и ряда других факторов свертывания крови оказывают вы-
раженный терапевтический эффект при лечении ряда форм
ДВС-синдрома [Баркаган З.С., Елыкомов В.А., 1994]. Так, с
этой целью успешно применяют концентрат нативной плазмы
(КНП) — супернатантная фракция плазмы (ее получают после
удаления криопреципитата), в которой в достаточном количе-
стве содержатся плазменные белки, факторы свертывания кро-
ви и фибриногена в незначительной концентрации. Примене-
ние КНП показано в гиперкоагуляционную фазу ДВС или при
ДВС хронического, рецидивирующего течения.
Если свежезамороженная плазма является обязательным
компонентом терапии ДВС, то трансфузия эритромассы и тром-
боконцентрата производится по строгим показаниям: мини-
649
______________________ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
мальное содержание НЬ 70—80 г/л, гематокрит 25 %, количество
эритроцитов 2,5—3 х 10|2/л; тромбоцитопения без клинических
проявлений повышенной кровоточивости не требует замести-
тельной терапии [Сидоркина А.Н.,2001].
Необходимо придерживаться следующих правил при назна-
чении трансфузий препаратов красной крови:
• осуществлять трансфузии эритроцитной массы, а не цель-
ной консервированной крови;
• переливать эритроцитную массу малых сроков хранения
(не более 3 суток хранения);
• гемотрансфузии осуществлять после индивидуального
подбора в пробе Кумбса;
• все гемотрансфузии осуществлять через лейкоцитарные
микрофильтры или переливать отмытые эритроциты (ЭМОЛТ);
• переливаемые компоненты крови необходимо подогревать
до 35-36 °C;
• строго учитывать объем трансфузий, кровопотерю, поте-
рю организмом жидкости, диурез;
• избегать гиперволемии.
Фаза гипокоагуляции ДВС характеризуется нарастающей
тромбоцитопенией, которая требует адекватной заместительной
терапии. Показания к трансфузии донорских тромбоцитов:
а) тромбоцитопения < 100—50 х 109/л;
б) тромбоцитопатия — снижение агрегационных свойств
тромбоцитов;
в) клиническая картина повышенной кровоточивости — по-
явление петехиальной, спонтанной кровоточивости слизистых
оболочек, кровотечения из операционной раны (при ревизии ра-
ны источник хирургического кровотечения выявить не удается).
Концентрат тромбоцитов (КТ) переливают в терапевтиче-
ской дозе, равной 6—10 единицам КТ. Критериями эффективно-
сти заместительной терапии являются:
— количество тромбоцитов больше предтрансфузионного;
— нормализация/укорочение времени свертывания крови;
— прекращеиие/уменыпение кровоточивости.
Если показано дальнейшее введение СЗП больному с высо-
ким ЦВД необходимо проведение обменного плазмафереза, ко-
торый позволит осуществить трансфузию СЗП в нужном объе-
650
ГЛАВА 8, ДВС-СИНДРОМ
ме, не увеличивая ОЦК и не повышая центрального венозного
давления.
Как сказано выше, СЗП является основным источником
сериновых протеаз, фибриногена, AT III. Помимо противосвер-
тывающего эффекта антитромбин III оказывает выраженное
противовоспалительное воздействие на сосудистый эндотелий.
Этот механизм AT III осуществляет за счет стимуляции синте-
за противоспалительных простагландинов клетками сосудисто-
го эндотелия, что приводит к снижению агрегации тромбоцитов
и деблокаде микроциркуляции.
Для эффективной гепаринотерапии содержание AT III
необходимо поддерживать на уровне более 80 %. Для одномо-
ментного восполнения дефицита этого естественного антикоа-
гулянта необходима трансфузия значительных объемов СЗП.
Помимо инфекционных, аллергических осложнений, трансфу-
зия больших объемов СЗП чревата развитием гиперволемии и де-
компенсации сердечной недостаточности. Поэтому трансфу-
зию СЗП желательно сочетать с препаратами AT III (например,
кубернином HS). Необходимо учитывать, что при остром ДВС
период полужизни AT III укорачивается до 4 ч, поэтому показа-
но постоянное или частое введение препаратов под контролем
его активности.
Раствор лиофилизированного препарата AT III в начальной
дозе 1000—1500 МЕ в сутки вводится внутривенно со скоростью
50 МЕ в минуту (около 60 мл в час) в течение 3—6 дней, суммар-
ная доза на курс — около 8000 МЕ. При введении 1 МЕ на 1 кг
массы тела активность антитромбина повышается на 1 % по
сравнению с нормальным значением. При быстром введении воз-
можно развитие коллаптоидных состояний. Снижение содержа-
ния маркеров гиперкоагуляции (комплексов тромбин—анти-
тромбин, фибринопептида А, РКФМ) и регрессия клинических
симптомов свидетельствуют об эффективности выбранного ре-
жима терапии.
Установлено, что заместительная терапия препаратами АТ
III значительно сокращает длительность заболевания и снижа-
ет смертность больных от ДВС [Vinazzer Н., 1989].
3) Поливалентные ингибиторы протеаз применяются в гипокоа-
гуляционную фазу ДВС-синдрома в сочетании с трансфузией СЗП.
651
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Лекарственные препараты контрикал, апротинин, гордокс,
антагозан обладают поливалентным действием:
• подавляют процессы протеолиза;
• инактивируют лизосомальные ферменты;
• стабилизируют мембрану клеток (встраиваясь в клеточную
мембрану);
• являются универсальными протекторами шока.
Определенные трудности вызывает расчет необходимой до-
зы препаратов данной группы, поскольку контрикал дозируется
в антитрипсиновых единицах (АтрЕ), а остальные препараты —
в калликреин-инактивируюших единицах (КИЕ): 1 АтрЕ соот-
ветствует 1,33 КИЕ.
Апротинин (трасилол): 10 мл раствора содержит
100 000 КИЕ препарата. Апротинин ингибирует калликреин и
другие протеиназы плазмы: плазмин, кининогеназы, трипсин,
химотрипсин, снижает фибринолитическую активность крови
(рис. 8.10,8.11). Применяется в качестве элемента комплексной
терапии различных видов шока: эндотоксического, ожогового,
травматического, геморрагического.
Для терапии первичных гиперфибринолитических кровоте-
чений и коагулопатий, характеризующихся вторичным гиперфи-
бринолизом, применяют начальную дозу — 500 000 КИЕ, поддер-
живающую дозу — 50 000 КИЕ/ч. Для профилактических целей
вводится до операции 200 000 КИЕ, далее в течение 2 суток по-
сле операции по 100 000 каждые 6 ч внутривенно капельно.
Контрикал: 10 мл раствора содержит 10 000 АтрЕ. Препарат
вводится внутривенно болюсно или капельно в начальной дозе
350 000 АтрЕ, поддерживающая доза — 140 000 АтрЕ каждые 4 ч
до нормализации показателей гемостаза.
В остром периоде ДВС-синдрома целесообразно сочетать
ингибиторы протеаз с мини-дозами гепарина; возможно введе-
ние гепарина в СЗП.
4) Антифибринолизные препараты (трансамча, экзацил) ин-
гибируют активатор плазмина и плазминогена. Применяются для
лечения и профилактики кровотечений, вызванных гиперак-
тивацией фибринолиза. Ампула препарата содержит 50 мг тран-
сексамовой кислоты. Разовая доза препарата 10—15 мг на 1 кг мас-
сы тела внутривенно, повторные введения при необходимости
652
ГЛАВА 8. ДВС-СИНДРОМ
ТРИПСИН
♦ БРАДИКИНИН
ПРОДУКТЫ
РАСЩЕПЛЕНИЯ
КИНИНОГЕН
КИНИНАЗА (карбоксипептибаза В)
КАЛЛИКРЕИН
♦ КАЛЛИДИН
ПРОДУКТЫ
РАСЩЕПЛЕНИЯ
Рисунок 8.10. Схема ингибирующего действия апротинина в
кининовой системе [Чарная М.А., 1993]
ПРОДУКТЫ ДЕГРАДАЦИЙ
ФИБРИНА
Рисунок 8.11. Ингибирование фибринолиза и фибриногеноли-
за апротинином [Чарная М.А., 1993]
653
______________________ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
через 8—12 ч. Максимальная суточная доза — 2 г. При наруше-
нии выделительной функции почек применяют в меньших до-
зировках. В сочетании с гепарином и другими антикоагулянта-
ми применяют с осторожностью, а также при тромбозах или
угрозе их развития. При сочетании с гемостатиками возможна
активация тромбообразования.
5) Дезагреганты и препараты реологического действия
Важным компонентом в комплексной программе терапии
ДВС-синдрома является применение дезагрегантов и препара-
тов, улучшающих микроциркуляцию крови в органах.
Наибольшее распространение получили трентал, тиклид, де-
фибротид, курантил, ацетилсалициловая кислота, плавике и
некоторые другие.
Антиагрегационное действие ацетилсалициловой кислоты
связано с активацией высвобождения простагландинов из сосу-
дистого эндотелия, в том числе простациклина, который снижа-
ет агрегацию тромбоцитов. Аспирин также уменьшает образова-
ние тромбоксана А2, который является активным прокоагуля-
ционным фактором. Однако аспирин в больших дозах тормозит
биосинтез простациклина и некоторых других антиагрегацион-
ных простагландинов (D2, Е,). При этом нарушается нормаль-
ное соотношение простациклин/тромбоксан, что чревато ра-
звитием тромбоэмболических осложнений. В связи с этим при-
меняются малые дозы ацетилсалициловой кислоты — в среднем
100—150 мг в сутки.
Многие исследователи патологии гемостаза, в том числе
З.С. Баркаган (1988), не рекомендуют назначать препараты
ацетилсалициловой кислоты при подостром, остром и тем бо-
лее молниеносном вариантах ДВС-синдрома из-за резко воз-
растающего риска желудочно-кишечных кровотечений. В слу-
чае необходимости применения препаратов данной группы
предпочтение отдают препаратам для внутривенного введе-
ния: ацелизину, аспизолу, в состав которых входят водора-
створимые производные ацетилсалициловой кислоты, гли-
цин и DL-салицилат лизина. Эти препараты лишены многих
побочных эффектов таблетированного аспирина: не вызыва-
ют изъязвление слизистых желудочно-кишечного тракта, тош-
ноту, рвоту. Однократное введение 250 мг ацелизина оказыва-
654
ГЛАВА 8. ДВС-СИНДРОМ
ет мягкое воздействие на свертывающую систему крови, кото-
рое приводит к достаточно длительному, до 3 суток, состоянию
умеренной гипокоагуляции.
Тиклид, плавике в дозе 500 мг в сутки ингибируют агре-
гацию и адгезивность тромбоцитов и эритроцитов, стиму-
лируют синтез простагландинов Е] и D2, обладающих анти-
агрегационным действием, улучшают микроциркуляцию. В
отличие от аспирина, подавляют агрегационную функцию
тромбоцитов через 5—6 дней от начала приема препарата. В
процессе лечения необходимо систематически контролиро-
вать гематологические показатели, так как возможно разви-
тие тромбоцитопении, лейкопении, агранулоцитоза. Пла-
вике (клопидогрель) назначается в меньших, по сравнению
с тиклидом, дозировках — 75—100 мг в сутки, реже вызыва-
ет.лейко- и нейтропению, что позволяет применять его в
течение длительного времени.
Таблетированью препараты аспирина, тиенопирвдинов (ти-
клид, плавике) назначаются в гиперкоагуляционную фазу, при
хроническом, подостром течении ДВС-синдрома.
Пентоксифиллин (трентал) улучшает микроциркуляцию и
реологические свойства крови, оказывает сосудорасширяющее
действие, улучшает снабжение тканей О2. Уменьшает агрегацию
тромбоцитов, приводит к их дезагрегации, повышает деформи-
руемость эритроцитов, снижает вязкость крови. Для терапии
ДВС используются большие дозы трентала — 800—1200 мг в
сутки, в/в медленно.
Выраженным дезагрегационным действием обладают рео-
логические растворы', реополиглюкин, растворы гидроксиэти-
лированного крахмала (6 и 10 %-ные растворы HAES, ON-
KOHAS). Они улучшают кислородтранспортную функцию кро-
ви за счет увеличения ОЦК, сердечного выброса и скорости
циркуляции эритроцитов, нормализуют также реологические
свойства крови и микроциркуляцию. Препараты, при отсут-
ствии противопоказаний, вводят в дозе 5—7 мл/кг в сутки.
Необходимо отметить существенное снижение содержания в
крови фактора V III при инфузии значительных объемов ра-
створов ГЭК, что принципиально при наличии геморрагиче-
ских проявлений ДВС-синдрома.
655
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
6) Фибринолитики (активаторы плазминогена)
При преобладании у больных массивных тромбоэмболи-
ческих осложнений и тяжелых нарушений функций органов-ми-
шеней ишемического характера оправдано применение тромбо-
литической терапии. В этих целях используются препараты
стрептокиназа, урокиназа и другие. Однако установлено, что
уже к концу первых суток лечения наступает угнетение (истоще-
ние) системы плазминоген-плазмин. В связи с этим для дости-
жения тромболитического эффекта и профилактики осложне-
ний необходима трансфузия СЗП и прерывистое введение не-
больших доз тромболитиков под контролем уровня плазмино-
гена [Лычев В.Г.,1993]. Это позволяет избежать дефицита плаз-
миногена и усилить тромболитический эффект. Обычно вво-
дится 400—600 мл СЗП с гепарином (5000—10 000 ЕД), после
чего в/в капельно инфузируется стрептокиназа (или другие пре-
параты) в дозе 500 000 ЕД. В последующем, каждому введению
тромболитиков обязательно предшествует лабораторный кон-
троль и трансфузия СЗП.
Целесообразность применения фибринолитических пре-
паратов еще не получила окончательного подтверждения. Не-
которые клиницисты считают, что тромболитики не должны
применяться для лечения ДВС, так как при острых формах син-
дрома они усиливают геморрагический синдром, а в случаях
хронического течения синдрома активаторы фибринолиза
оказывают чрезмерное действие [Воробьев П.А., 1996; Сидор-
кина А.Н., 2001].
Применение фибринолитиков показано при массивных
тромбозах, повторяющихся тромбоэмболических эпизодах, ко-
торые возможны при редко встречающемся тромбоэмболическом
варианте ДВС.
7) Экстракорпоральная детоксикация
Одним из важных компонентов комплексной терапии ДВС
и сопровождающей его полиорганной недостаточности явля-
ются методы экстракорпоральной детоксикации.
Плазмаферез, проводимый на фоне медикаментозной те-
рапии, позволяет удалить активаторы гемостаза, продукты па-
ракоагуляции, активизированные факторы крови и тем самым
осуществить коррекцию гипокоагуляции. За счет элиминации
656
ГЛАВА 8. ДВС-СИНДРОМ
микротромбов, микроагрегатов клеток крови, циркулирую-
щих иммунных комплексов, крупномолекулярных соедине-
ний деблокируется микроциркуляторное русло, снижается ак-
тивность процессов гиперкоагуляции. Выраженный дезинток-
сикационный эффект плазмафереза связан с удалением из
циркуляции эндотоксинов, провоспалительных цитокинов
олигопептидов средней молекулярной массы, билирубина,
азотистых метаболитов, лизосомальных протеаз. При проведе-
нии плазмафереза восстанавливается белково-синтетическая
функция печени. Использование обменного плазмафереза при
краш-синдроме в первые сутки после декомпрессии позволя-
ет элиминировать из циркуляции миоглобин и тем самым пре-
пятствовать развитию ОПН.
Известно, что условием эффективности плазмообмена яв-
ляется выполнение следующих принципов [Рагимов А.А., 1999]:
• плазмаферез необходимо проводить в максимально ран-
ние сроки ДВС;
• достаточная интенсивность плазмообмена — эксфузия не
менее 50 % ОЦП за одну процедуру;
• обязательная трансфузия СЗП в объеме, адекватном уда-
ленной плазме.
Трансфузия донорской плазмы, как сказано выше, позво-
ляет восполнить дефицит компонентов системы гемостаза, а
также предотвратить развитие гипопротеинемии и иммуноде-
фицита.
Цитаферез — удаление эритроцитов, тромбоцитов и их аг-
регатов — необходим пациентам с рецидивирующими и хрони-
ческими формами ДВС, сопровождающимися полиглобулией,
эритремией, тромбоцитозом и синдромом гипервязкости.
Сформировавшаяся ОПН является показанием для прове-
дения гемофильтрации и гемодиализа. Детоксикация крови при
вено-венозной или артериовенозной гемофильтрации осущест-
вляется за счет конвективного транспорта токсических веществ
через высокопорозную мембрану, обладающую выраженной ги-
дравлической проницаемостью. При этом нормализуется pH
крови, осмолярность плазмы, элиминируются низко- и средне-
молекулярные токсины, фактор некроза опухоли (TNF), ин-
терлейкин-1. Замещение удаленной жидкости осуществляется
657
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
специальным сбалансированным электролитным раствором,
который смешивается с кровью и поступает в русло больного.
Гемофильтрацию успешно применяют при остром дистресс-
синдроме. За счет удаления медиаторов, вызывающих повыше-
ние проницаемости капилляров легких, уменьшается объем
жидкости в интерстиции, улучшается кислородтранспортная
функция крови. Длительная, в течение 2—3 суток, гемофильтра-
ция имеет выраженный терапевтический эффект. Ее необходи-
мо выполнять как можно в более ранние сроки ДВС-синдрома.
[Hach-Wunderle V., Nowroth Р.Р., 1997].
Методы экстракорпоральной детоксикации и плазмообмен
повышают эффективность как самого лечения ДВС-синдрома
так и заболеваний-триггеров, что позволяет снизить леталь-
ность. Все вышесказанное позволяет считать методы эфферент-
ной медицины одними из основных способов терапии больных
с ДВС-синдромом.
8.6. Особенности ДВС-синдрома
при различных патологиях
8.6.1. Сепсис
Инфекция является триггером ДВС в более чем половине слу-
чаев. Таким образом, сепсис — основная причина острого ДВС, а
ДВС — наиболее частое осложнение сепсиса. Грамнегативная сеп-
тицемия часто сопровождается тяжелыми тромбогеморрагически-
ми осложнениями, например: генерализованная реакция Швар-
цмана (симметричная гангрена конечностей), синдром Уотерхауза—
Фридерексена (геморрагический некроз надпочечников).
Активация при сепсисе системы гемостаза обусловлена эцдото-
ксемией и бактериальными липополисахаридами (рис. 8.12). Цен-
тральным медиатором сепсиса является фактор некроза опухоли
(TNF—tumor necrosis factor), который вырабатывается в ответ на по-
ступление эндотоксина. Вторичный медиатор — интерлейкин-1,
концентрация которого резко возрастает после поступления в сосу-
дистое русло TNE Вслед за выработкой этих провоспалительных ме-
диаторов происходит повышение уровня интерлейкина-6, который
активизирует синтез в печени белков острой фазы.
658
ГЛАВА 8 ДВС-СИНДРОМ
Рисунок 8.12. Влияние токсемии на гемостаз при ДВС
Рисунок 8.13. Активация цитокинового механизма при сепсисе
659
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Имеется корреляция между исходом заболевания и уровнем
содержания интерлейкина-6: чем выше его содержание, тем ху-
же прогноз заболевания [Bohrer Н., Nowroth Р.Р.,1997].
Цитокиновый механизм реализации ДВС при сепсисе
(рис. 8.13) подробно изучен в последние годы [Hach-Wunderle V.,
Nowroth Р.Р., 1997]. Липополисахариды, покрывающие бактерии,
связываются с липополисахаридсвязывающим протеином, этот
комплекс взаимодействует с рецептором макрофагов. При этом
происходит высвобождение макрофагальных цитокинов и ини-
циация активности каскада медиаторных систем: увеличивает-
ся содержание брадикинина, гистамина, эйкозаноидов (про-
стагландины, лейкотриены, тромбоксан, простациклин), фрак-
ций комплемента, радикалов перекисного окисления, активи-
зируются факторы свертывания крови. В результате этих слож-
ных реакций развивается генерализованное эндотелиальное во-
спаление — синдром системного воспалительного ответа (SIRS).
Провоспалительные цитокины увеличивают проницаемость эн-
дотелиальных клеток для жидкости и белков; факторы, активи-
зирующие тромбоциты, также повышают сосудистую прони-
цаемость, действуя синергически с цитокинами.
Одним из первых клинических проявлений повышенной ка-
пиллярной проницаемости является ухудшение вентиляцион-
ных респираторных параметров и периферические отеки.
Интерлейкин-1 снижает выработку эндотелием тканевого
активатора плазминогена, в то время как продукция ингибито-
ра активатора плазминогена повышается. Интерлейкин-1 от-
ветственен также за активность комплекса тромбомодулин +
+ протеин С, который оказывает ингибирующий эффект на
факторы V, VIII и на ингибитор активатора плазминогена.
Полисахариды грампозитивных бактерий также могут по-
средством цитокинов активизировать систему гемостаза, что
резко увеличивает риск ДВС.
Иногда ДВС индуцируется фулминантной вирусной ин-
фекцией. Тяжело протекающие инфекции сопровождаются
обычно лейкоцитозом. Нейтрофильные лейкоциты вырабаты-
вают ряд субстанций (в том числе нейтрофильную эластазу),
которые вызывают дефицит АТ 111, а гепаринотерапия усугубля-
ет этот процесс.
660
ГЛАВА 8. ДВС-СИНДРОМ
Следует иметь в виду, что применение бактерицидных
антибиотиков увеличивает риск возникновения септическо-
го шока вследствие массивного поступления в русло эндото-
ксинов из разрушенных бактерий. Молниеносные формы се-
псиса возникают на фоне иммуносупрессивной терапии.
Смертность при септическом шоке достигает 40 %. Септиче-
ский шок, рефракторный к терапии, быстро, в течение нес-
кольких часов приводит к полиорганной недостаточности и
ДВС-синдрому.
В ряде случаев не удается установить возбудителя инфекции
в гемокультуре больных сепсисом. Концепция системного воспа-
лительного ответа предполагает наличие сепсиса при отсут-
ствии (невозможности определения) возбудителя в крови в слу-
чаях выраженной характерной клиники:
• фебрильная температура (> 38 °C) или гипотермия
(< 35,5 °C встречается у 10 % больных);
• тахикардия;
• тахипноэ, гипервентиляция с респираторным алкалозом.
Для лабораторных показателей характерно:
• лейкоцитоз > 15 000 /мм3 или лейкопения < 3500 /мм3;
• сдвиг лейкоцитарной формулы влево, токсическая зернистость;
• изменения коагуляции — снижение числа тромбоцитов
более чем на 30 % за 24 ч, снижение АТ 111;
• метаболические сдвиги — гиперлактатемия, гиперглике-
мия, гипофосфатемия.
Д ля сепсиса характерен дефицит системы естественных ан-
тикоагулянтов, причем снижение АТ 111 происходит ранее основ-
ных клинических проявлений сепсиса. При снижении содержа-
ния АТ 111 ниже 60 % смертность резко возрастает.
Количество тромбоцитов при сепсисе снижается вслед-
ствие тромбоцитопении потребления — тромбоциты связывают-
ся с фибрином, адгезируют к поврежденному эндотелию, секве-
стрируются в легких и печени. Тромбоцитопатия — снижение аг-
регирующих свойств тромбоцитов — может быть вызвана дли-
тельным применением антибиотиков.
Лечение сепсиса, септического шока и ДВС-синдрома дол-
жно носить комплексный характер и основываться на следую-
щих принципах:
661
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
1. Хирургическое лечение очага инфекции (санация и дре-
нирование).
2. Антибиотикотерапия, основанная на идентификации
возбудителя и определении его чувствительности к соответ-
ствующей группе антибиотиков.
3. Адекватная оксигенация — необходима ранняя ИВЛ в
различных режимах.
4. Инфузионная терапия — высока опасность гипергидра-
тации, особенно в условиях тканевой гипоксии и повышения ка-
пиллярной проницаемости. Трансфузия эритроцитов не только
повышает кислородтранспортную функцию крови, но и обеспе-
чивает эффективность трансфузионной терапии. Критическим
для септических больных считается содержание гемоглобина
менее 70—80 г/л. Предпочтительна трансфузия свежезагото-
вленной эритроцитной массы.
5. Применение катехоламинов. Содержание фактора некроза
опухоли (TNF) при сепсисе значительно возрастает (TNF — меди-
атор, обладающий выраженным кардиодепрессивным действием).
6. Препараты AT III.
В 1985 году В. Blauhut опубликовал результат клинических ис-
следований по применению препарата AT III (кубернина HS).
У пациентов с клиникой септического шока и ДВС, которым был наз-
начен кубернин HS, отмечено ускоренное восстановление показа-
телей коагуляции, хотя и не было отмечено снижение смертности.
Некоторые исследователи рекомендуют поддерживать со-
держание AT III на уровне 140 %, это возможно при введении
препарата в суммарной дозе 18 000 ЕД. Содержание AT III не дол-
жно снижаться менее 80 %.
7. Фибринолитические препараты. Установлено, что у погиб-
ших от сепсиса больных отмечалась выраженная активация коа-
гуляции и еще более выраженное угнетение фибринолиза, что
позволило предположить, что назначение фибринолитических
препаратов приведет к коррекции гемостаза. Применение препа-
ратов в экспериментах на животных с эндотоксемией повышает вы-
живаемость и препятствует развитию легочной недостаточности.
8. Адекватное энтеральное и парентеральное питание.
Рекомендуется ранний переход на энтеральное питание,
которое препятствует развитию пареза желудочно-кишечного
662
ГЛАВА 8. ДВС-СИНДРОМ
тракта и уменьшает интестинальную атрофию. В питательные
смеси для энтерального питания вводятся специальные добав-
ки: омега-3 жирные кислоты, аргинин, глутамин, рыбий жир.
Раннее энтеральное питание с вышеуказанными пищевыми до-
бавками оказывает благоприятное влияние на иммунный статус
больных, и получило название «иммунного питания».
9. Поливалентные иммуноглобулины используются для
нейтрализации эндотоксинов. Отмечено снижение смертности
при их применении у кардиохирургических больных.
10. Методы экстракорпоральной детоксикации: гемофильт-
рация, плазмаферез.
В последние годы гемофильтрация все чаще применяется в
качестве экстракорпоральной методики, позволяющей элими-
нировать низко- и среднемолекулярные соединения. Устано-
влено, что при длительной гемофильтрации активно удаляются
TNP и интерлейкин-1, при этом содержание эндотоксина и ин-
терлейкина-6 практически не меняется. Применение гемо-
фильтрации ранние сроки сепсиса и ДВС позволяет получить бо-
лее выраженный клинический эффект.
Плазмаферез позволяет удалить эндотоксины, цитокины,
активаторы свертывания, продукты паракоагуляции. При се-
псисе плазмаферез в сочетании с другими методами терапии
позволяет стабилизировать гемодинамику, является методом
профилактики в лечения полиорганной недостаточности.
Разрабатываются новые виды медикаментозного воздей-
ствия. Так, имеются сообщения об эффективном применении
ингибиторов синтетазы, препаратов антиоксидантной защиты,
опиатных антагонистов и др. Однако основными принципами,
которых следует придерживаться в терапии сопутствующего се-
псису ДВС-синдрома, являются следующие:
• интенсивная симптоматическая терапия;
• препараты AT III (поддерживать содержание в крови не
менее 80 %);
• гепаринотерапия (под контролем лабораторных показа-
телей);
• заместительная инфузионная терапия — СЗП (обязатель-
но), эритроцитная масса и тромбоконцентрат (по показаниям);
• экстракорпоральная детоксикация.
663
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Включение в процесс лечения ДВС-синдрома методов
экстракорпоральной детоксикации: плазмафереза, гемо-
фильтрации, гемодиафильтрации позволяет оптимизиро-
вать течение патологического процесса и является жела-
тельным в программе терапии как самого сепсиса, так и об-
условленной им полиорганной недостаточности и ДВС-
синдрома.
8.6.2. Синдром массивной гемотрансфузии
Синдром массивной гемотрансфузии — это симптомо-
комплекс, возникающий при кровопотере более I ОЦК и по-
следующей гемотрансфузии цельной крови или эритроцит-
ной массы в объеме более 10—12 единиц в течение 24 часов.
Массивная трансфузия крови сопровождает политравму, раз-
рыв аневризмы аорты, хирургию магистральных сосудов, аку-
шерские кровотечения, трансплантацию печени, желудочно-
кишечные кровотечения. Смертность от синдрома массивной
гемотрансфузии достигает у взрослых 40 %.
Помимо известных нежелательных эффектов переливания
крови, при массивных гемотрансфузиях возникают специфиче-
ские нарушения гемостаза:
• дилюционная коагулопатия;
• тромбоцитопения;
• тромбоцитопатия;
• микроэмболия.
Изменения в системе гемостаза приводят к развитию в по-
слеоперационном периоде геморрагического диатеза и диффуз-
ной микрососудистой кровоточивости, имеющей место в
20-30 % случаев.
Основными причинами развития синдрома массивной ге-
мотрансфузии являются:
• кровопотеря и дефицит факторов свертывания, тромбо-
цитопения;
• массивная травма тканей и поступление в русло тканево-
го тромбопластина, активация гемостаза;
• потребление факторов коагуляции;
• инфузионная терапия, усугубляющая гемодилюционную
коагулопатию;
664
ГЛАВА 8. ДВС-СИНДРОМ
• применение адреномиметиков, которые также активи-
зируют гемостаз, повышают концентрацию факторов свертыва-
ния крови (в частности, фактор VIII, фактор фон Виллебранда),
тканевого активатора плазминогена и способствуют еще более
быстрому истощению противосвертывающей системы
• и, наконец, сама гемотрансфузия.
Эти патологические процессы завершаются развитием ДВС
и полиорганной недостаточности.
Наиболее типичными осложнениями и особенностями син-
дрома массивной гемотрансфузии, которые необходимо учи-
тывать при лечении ДВС-синдрома, являются:
1. Дилюционная тромбоцитопения — развивается при пере-
ливании крови в объеме, превышающем 1,5 ОЦК.
2. Избыточное введение натрия цитрата может привести к
связыванию ионов Са++ и, следовательно, к снижению содержа-
ния ионизированного Са++.
3. Гиперкалиемия вследствие переливания крови (встреча-
ется довольно редко).
При трансфузии больших объемов крови необходимо ис-
пользовать фильтры, задерживающие лейкоциты и микротром-
бы, и обязательно согревать трансфузионные среды до 35—37 °C.
Терапия синдрома направлена на коррекцию дилюцион-
ной коагулопатии и предусматривает трансфузию свежезаморо-
женной плазмы, тромбоконцентрата, эритроцитарной массы.
В некоторых клиниках с целью коррекции дефицита факторов
свертывания применяются препараты AT III, фибриногена. Ак-
тивную гемотрансфузионную тактику при ДВС-синдроме
необходимо выполнять с учетом того обстоятельства, что тран-
сфузия эритромассы предпочтительнее переливания цельной кро-
ви, которая имеет ряд недостатков:
• масса менее стабильна при хранении;
• лейкоциты и тромбоциты уже в ранние сроки хранения
формируют микроагрегаты, которые являются причиной ми-
кроэмболии и развития дистресс-синдрома;
• содержание ряда факторов гемостаза (факторы V, VIII, фак-
тор Виллебранда) снижается до 25 % от исходного уровня уже в пер-
вые часы консервации. При замораживании плазмы эти факторы
сохраняют свою активность в течение 6—12 месяцев.
665
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Неблагоприятным прогностическим признаком при ДВС-
синдроме, развившемся на фоне массивной гемотрансфузии,
считается усугубление тромбоцитопении (содержание тромбо-
цитов менее 50 х 109/л) и развитие глубокой гипофибриногене-
мии (фибриноген менее 0,5 г/л).
В заключение необходимо отметить, что при массивной
кровопотере эритроцитную массу и СЗП рекомендуется перели-
вать в соотношении 1:1. Именно такой режим трансфузионной
терапии позволяет купировать дилюционную коагулопатию.
8.6.3. ДВС-синдром в трансплантационной хирургии
Геморрагические осложнения в трансплантационной хи-
рургии обусловлены как характером хирургического вмешатель-
ства, так и специфическими изменениями гемостаза вследствие
исходного органного поражения.
Трансплантация сердца. Дефект гемостаза, развивающийся
вследствие декомпенсации сердечной недостаточности и со-
путствующей полиорганной дисфункции, усугубляется экстра-
корпоральным искусственным кровообращением.
В настоящее время в силу совершенствования оператив-
ной техники вероятность геморрагических осложнений и связан-
ных с ними коагулопатий, в том числе ДВС-синдрома, после
трансплантации сердца крайне мала и практически не превыша-
ет таковую при АКШ и других операциях с ИК. Тем не менее риск
геморрагии при трансплантации сердца выше, чем при операции
аортокоронарного шунтирования.
Трансплантация печени. Трансплантация печени, несомнен-
но, является более травматичным хирургическим вмешатель-
ством, и исключить развитие ДВС-синдрома в посттрансплан-
тационном периоде гораздо сложнее. Предпосылки к этому
имеются уже на фоне самого исходного заболевания, ведущего
к необходимости подобной операции.
Печень играет центральную роль в системе гемостаза: гепа-
тоцитами синтезируются факторы коагуляции, фибринолиза,
естественные антикоагулянты, а также важнейшие ингибиторы
протеаз.
Трансплантация печени, обычно ортотопическая, усугубляет
исходные нарушения гемостаза, которые можно расценивать как
666
ГЛАВА 8. ДВС-СИНДРОМ
хронический ДВС. Это проявляется главным образом диффузной
интра- и послеоперационной кровоточивостью. Исходная патоло-
гия, приведшая к необходимости трансплантации, ведет к угнете-
нию всех звеньев гемостаза. Кровотечения при ортотопической
трансплантации печени занимают первое место в причинах смерт-
ности бальных во время операции или в ближайшем постгрансплан-
тационом периоде [Андрианова М.Ю. и соавт., 1997].
Для больных, страдающих хроническими заболеваниями
печени, характерен усиленный распад эритроцитов, о чем сви-
детельствует анемия, полихромазия эритроцитов и ретикуло-
цитоз. Основные причины распада эритроцитов: гиперспле-
низм и дефект мембраны эритроцитов.
Тромбоцитопения развивается вследствие секвестрации
тромбоцитов в селезенке. Для этих больных характерна и тром-
боцитопатия. Нередко выявляются антитромбоцитарные анти-
тела (при гепатите С — в 88 % и при гепатите В — в 47 % случа-
ев). Снижается агрегация тромбоцитов, их синтез вследствие
дефицита фолиевой кислоты.
Гепатоцит — клетка, в которой синтезируется все (за ис-
ключением фактора Виллебранта) сериновые протеазы, ингиби-
торы свертывания, антитромбин III протеины С и S, кофактор
II гепарина. При патологии печени генерация ингибиторов ге-
мостаза значительно снижается, однако, их дефицит не приво-
дит к тромбозам. Для заболеваний печени характерна дисфибри-
ногенемия — может выявляться фибриноген низкой молеку-
лярной массы. Аномалии фибриногена приводят к удлинению
протромбинового времени.
Развитию геморрагических осложнений способствуют сле-
дующие факторы:
• большая хирургическая травма (поступление тканевого
тромбомастина);
• выброс в циркуляцию активизированных медиаторов ге-
мостаза как из печени больного, так и во время реперфузии
донорского органа;
• контакт крови с «чужеродной» поверхностью экстракор-
порального портосистемного обхода;
• назначение ряда медикаментозних препаратов в предопе-
рационный период;
667
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• предшествующие гемотрансфузии.
Для беспеченочного периода характерны:
• выраженная активация фибринолиза и
• повышение активности активатора плазминогена и плазмина.
Отмечено, что во время реперфузии печени донора значи-
тельно активизируется система гемостаза: значительно повыша-
ется содержание комплексов тромбин-антитромбин, фибрин-мо-
номеров на фоне снижения фибриногена, AT III, протеина С. Это
соответствует картине ДВС-синдрома, развивается коагулопа-
тия потребления. После неосложненной трансплантации посте-
пенно, в течение 12 ч нарастает содержание фибриногена, AT III,
протеина С, что указывает на нормализацию белково-синтети-
ческой функции трансплантата [Андрианова М.Ю.,1997].
Изменения тромбоэластограммы и времени лизиса эугло-
булинового сгустка во время реперфузии печени и в ближайший
посттрансплантационный период подтверждают резкую актива-
цию фибринолиза. Возросшая активность фибринолитической
системы обусловлена снижением клиренса активатора плазми-
ногена и уменьшением содержания ингибитора активатора плаз-
миногена. Ретикулоэндотелиальная система печени ответствен-
на за клиренс активированных факторов гемостаза и их комплек-
сов с ингибиторами.
В последние годы установлено, что важным фактором, усу-
губляющим расстройства гемостаза во время трансплантации пе-
чени, является повышение активности лейкоцитарной системы
[Riess Н., 1997]. При активации лейкоциты вырабатывают лизо-
сомальные протеазы (гранулоциты — эластазу, макрофаги —
катепсин В), которые поступают в циркуляцию. Увеличивается
также содержание фактора некроза опухоли и неоптерина. Со-
держание комплекса эластаза + ингибитор протеиназы и кате-
псина В резко возрастает во время реперфузии органа и посте-
пенно, в течение 12 часов снижается до исходного уровня.
В ближайшие часы постграсплантационного периода раз-
вивается тромбоцитопения. Снижению количества тромбоци-
тов способствуют следующие патологические процессы:
1. Секвестрация тромбоцитов в печени.
2. Повреждение сосудистой системы донорского органа
вследствие ишемии и консервации.
668
ГЛАВА 8. ДВС-СИНДРОМ
3. Коагулопатия потребления, которой способствует мощ-
ная активация плазменного гемостаза.
4. Синдром массивной кровопотери + гемотрансфузии —
дилюционная коагулопатия.
Терапия основана на заместительной инфузионной про-
грамме, включающей трансфузию СЗП, эритроцитной массы,
тромбоконцентрата в сочетании с применением других препа-
ратов: концентрата AT III и фибриногена. В большинстве слу-
чаев хороший гемостатический эффект оказывает применение
синтетических антифибринолизных препаратов (трансамча) и
поливалентных ингибиторов протеаз. Применение комплекса эт-
их препаратов существенно улучшает лабораторные показатели
(купируется фибринолиз) и не увеличивает частоту тромбоэм-
болических осложнений, при этом не требуется назначение ан-
тикоагулянтов во время операции с целью профилактики ДВС.
Антифибринолизные препараты особенно эффективны в случаях
выраженной диффузной кровоточивости.
В зарубежной литературе появились сообщения об успешном
использовании малых доз простагландина Е для профилактики
тромбоцитопении и тромбоцитопатии во время и после транс-
плантации печени [Mannucci Р.М., Federici А.В., Sirchia G., 1982].
8.6.4. ДВС-синдром после операций
с искусственным кровообращением
Несмотря на усовершенствование технологий операций,
аппаратуры для искусственного кровообращения, усовершен-
ствование трансфузионной и медикаментозной терапии, пробле-
ма профилактики и лечения ДВС стоит очень остро. По литера-
турным данным, частота этого осложнения достигает 40 % кар-
диохирургических операций. В большинстве случаев ДВС про-
текает на фоне выраженной полиорганной недостаточности
[Кузин М.И., Шимкевич Л.Л., Титова М.И., 1995].
Во время операций с использованием аппарата искусствен-
ного кровообращения (АИК) имеется реальный риск реализа-
ции всех основных патогенетических механизмов ДВС, так как:
• операции на открытом сердце отличаются большой трав-
матичностью и массивным поступлением в русло тканевого
тромбопластина;
669
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• после окончания ИК и нейтрализации гепарина прота-
мин-сульфатом возможно развитие «рикошета» гепарина с ра-
звитием послеоперационного кровотечения;
• механическая травматизация форменных элементов кро-
ви при циркуляции в АИК приводит к активации агрегационных
свойств тромбоцитов, развивается тромбоцитопения и тромбо-
цитопатия. Стимулированные лейкоциты вырабатывают биоло-
гически активные субстанции, усугубляющие нарушения гемо-
стаза. Снижается поверхностный отрицательный заряд эритро-
цитов, что приводит к их сладжированию и, как следствие, к ми-
кротромбированию капилляров;
• исходное атеросклеротическое повреждение эндотелия
сосудов ведет к снижению антитромботического потенциала
сосудистой стенки [Милас Б.,2002].
В условиях искусственного кровообращения произво-
дятся операции на аорте, магистральных сосудах, ради-
кальная коррекция врожденных и приобретенных пороков
сердца, хирургическое лечение терминальных стадий ИБС.
Наличие септического эндокардита, декомпенсированной
сердечной недостаточности, синдрома гипервязкости, ха-
рактерного для ИБС, резко увеличивает риск развития ДВС
и полиорганного повреждения у кардиохирургических боль-
ных. Для этой категории характерны острые и молниенос-
ные формы с быстрым развитием ПОН. Факторы риска,
провоцирующие развитие ДВС во время операций с ис-
пользованием АИК:
• шок любой этиологии (анафилактический, кардиоген-
ный, геморрагический);
• метаболические нарушения (ацидоз, гипокалиемия и др.);
• сердечно-сосудистая недостаточность;
• длительное время ИК (> 150 мин), применение ВАБК;
• гемотрансфузия и массивная реинфузия крови [Милас Б., 2002].
Большое значение в развитии этого осложнения играет
время проведения ИК: при увеличении длительности ИК
возрастает объем крови, проходящей через аппарат искус-
ственного кровообращения, время контакта крови с мем-
браной оксигенатора и, соответственно, степень травматиза-
ции форменных элементов крови. Определенный вклад в
670
ГЛАВА 8. ДВС-СИНДРОМ
риск возникновения ДВС вносит и гипотермия, применяемая
при ИК. Гипотермия, с одной стороны, позволяет улучшить
защиту мозга и миокарда во время операции, но, с другой сто-
роны, при гипотермии существенно повышается вязкость
крови, что оказывает отрицательное влияние на реологиче-
ские свойства крови [Дементьева И.И., 1994,1998].
Следует иметь в виду, что у большинства пациентов, опери-
рованных в условиях ИК, стадия гиперкоагуляции (1 стадия
ДВС) очень кратковременна и поэтому ДВС нередко манифести-
рует тяжелыми геморрагическими осложнениями в виде диффуз-
ной кровоточивости из операционной раны, мест инъекций,
кровотечениями из острых стрессорных язв и эрозий желудоч-
но-кишечного тракта и развитем ранней ПОН.
Основные принципы терапии ДВС после искусственного
кровообращения не отличаются от лечения ДВС при других па-
тологических состояниях и включают:
1. Устранение действия триггерного фактора — терапия шо-
ка, кровопотери и др.
2. Антикоагулянтная терапия малыми дозами прямых анти-
коагулянтов (гепарин или фраксипарин) по показаниям. В ос-
новном применяются в I стадию ДВС, при подостром или реци-
дивирующем течении.
3. Заместительная инфузионная терапия большими объема-
ми СЗП позволяет нормализовать состояние гемостаза. Вос-
полнение дефицита AT III возможно осуществить применени-
ем концентратов AT III. Проводится коррекция анемии и тром-
боцитопении.
4. Препараты антифибринолизного действия (трансамча)
показаны при кровотечениях, связанных с активацией фибри-
нолиза.
5. Для восстановления реологических свойств крови и нор-
мализации микроциркуляции применяются препараты дезагре-
гационного и реологического действия. Эти препараты явля-
ются обязательным компонентом терапии. Наибольшее рас-
пространение получил трентал, который вводится в/в в дозе
1000—1200 мг в сутки в течение длительного времени. С этой же
целью проводится гемодилюция, которая снижает вязкость кро-
ви, улучшает перфузию тканей.
671
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
6. Использование поливалентных ингибиторов протеаз для
профилактики и лечения ДВС позволяет значительно сокра-
тить частоту геморрагических осложнений.
7. Применение экстракорпоральной детоксикации: гемо-
фильтрация, плазмаферез. Обменный плазмаферез позволяет
нормализовать микроциркуляцию за счет элиминации продук-
тов паракоагуляции, микротромбов и микроагрегатов.
8.6.5. Травма
Травлю — вторая по частоте (после сепсиса) причина ДВС. Цир-
куляторный коллапс, развивающийся вследствие травматического шо-
ка, резко повышенное содержание катехоламинов и нарушение микро-
циркуляции значительно увеличивают риск развития ДВС. Травмати-
ческие повреждения способствуют поступлению в циркуляцию огром-
ного количества тканевого фактора—это, как сказано выше, является
основным механизмом реализации ДВС. Гнойно-септические ослож-
нения очень часто усу губля ют течение посттравматического периода и
увеличивают частоту ДВС. Основной причиной снижения резистент-
ности организма к инфекциям является развитие вторичного иммуно-
дефицита вследствие длительной гипоксии, характерной для шока.
Травма, травматический шок вызывают ряд изменений в гемо-
стазе, способствующих развитию ДВС [Золотокрылина Е. С., 1998]:
• резкое замедление кровотока, вплоть до полного стаза;
• поступление в кровяное русло эндогенных активаторов
свертывания крови и агрегации тромбоцитов, ацидоз, увеличе-
ние концентрации кетоновых тел, тканевых протеаз, тканевого
тромбопластина (освобождаемого из поврежденных тканей, раз-
рушенных эритроцитов и тромбоцитов), в циркуляцию поступа-
ют простагландины, эндотоксины, НЭЖК, фракции комплемен-
та, комплексы антиген-антитела;
• экзогенные факторы свертывания крови — бактериальные
эндотоксины;
• образование агрегатов форменных элементов крови (лей-
коцитов, эритроцитов, тромбоцитов);
• повреждение эндотелия сосудов вследствие воздействия
гуморальных факторов, сопровождающих гипоксию;
• образование пристеночных и обтурирующих микротром-
бов в местах повреждения эндотелия сосудов;
672
ГЛАВА 8. ДВС-СИНДРОМ
• блокада РЭС на фоне изменений иммунного статуса.
Уже через 10-20 минут после травмы выявляется активация фи-
бринолиза (определяется эуглобулиновым методом), гипофибри-
ногенемия, тромбоцитопения. Однако клинически выраженная
активация фибринолиза в виде коагулопатических кровотечений
у больных с травмой встречается довольно редко.При благоприят-
ном течении постгравматического периода показатели гемостаза
нормализуются, а затем формируется тенденция к гиперкоагуля-
циии. В среднем через 8—16 ч после травмы (в зависимости от тя-
жести травматического повреждения) фибринолитическая актив-
ность приходит в норму, концентрация фибриногена повышается:
к концу первых суток лечения у большинства больных активность
фибринолиза снижается, концентрация фибриногена достигает
верхней границы нормы, а у 30 % бальных в 1,5 раза превышает нор-
му. Время свободного гепарина увеличено, снижается тромбино-
вое время. Тенденция к гиперкоагуляции достигает максимума к
4—5 суткам постгравматического периода [Неговский В. А., Золо-
токрылинаЕ.С., 1987]. Концентрация фибриногена резко возраста-
ет, фибринолиз замедляется, свободный гепарин отсутствует.
Фаза гиперкоагуляции и угнетения ферментативного фибри-
нолиза является самой продолжительной, при адекватной тера-
пии происходит постепенная нормализация гемостаза. Однако
при продолжающемся поступлении тканевого тромбопластина
в кровоток (в случаях тяжелого травматического повреждения)
на фоне гиперкоагуляции и замедления фибринолиза создают-
ся благоприятные условия для активного микротромбирова-
ния, поражаются органы-мишени, развивается ПОН. На этом
фоне иногда вновь возникает кровоточивость из послеопераци-
онных ран, желудочно-кишечные кровотечения.
Тенденция к гипокоагуляции связана не только с дефици-
том факторов свертывания крови, но и с повышением концен-
трации продуктов деградации фибрина, которые обладают вы-
раженным антикоагуляционным эффектом.
Наряду с этим при травме имеют место следующие измене-
ния гемостаза:
• замедление и нарушение трансформации фибриногена
в фибрин, увеличивается содержание патологических форм фи-
бриногена, затрудняется образование сгустков;
673
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• снижение активности фибринстабилизирующего факто-
ра — фибриназы (ф XIII);
• тромбоцитопения и значительное нарушение тромбоци-
тарного звена гемостаза;
• усиление активности генерации тромбина;
• быстрое истощение активности системы естественных
антикоагулянтов — особенно быстро развивается дефицит AT III,
который расходуется на нейтрализацию тромбина. Снижение АТ
III приводит к инактивации гепарина (AT III — кофактор гепа-
рина).
Комплексная терапия ДВС-синдрома при травме (травма-
тическом шоке) включает следующие лечебные мероприятия:
• купирование болевого синдрома;
• хирургическая остановка кровотечения;
• коррекция гиповолемии, анемии, нарушений перифери-
ческого кровообращения;
• коррекция реологических свойств крови — адекватная
инфузионно-трансфузионная терапия;
• коррекция гипоксии, сердечно-сосудистой недостаточно-
сти, выраженных электролитных нарушений;
• терапия гемокоагуляционных расстройств под контро-
лем клинических и лабораторных показателей, с учетом харак-
тера патологий гемостаза и применением антикоагулянтной те-
рапии стандартным и НМ гепаринами;
• профилактика и лечение гнойно-септических осложнений
которые являются основной причиной смерти больных, перенес-
ших тяжелую травму.
8.6.6. Гемолитические трансфузионные осложнения
Гемолитические трансфузионные осложнения обусловле-
ны иммунным конфликтом, в основе которого взаимодействие
антител реципиента с соответствующими антигенами донора.
1ораздо реже гемолиз наступает в результате разрушения эритро-
цитов реципиента антителами донора. Установлено, что существу-
ют два механизма цитолиза: в кровеносном русле (внутрисосуди-
стый) и в тканях (внесосудистый — в основном в селезенке и пе-
чени). Антигенам донорских эритроцитов противодействуют
специфические антитела, которые способны фиксировать ком-
674
ГЛАВА 8. ДВС-СИНДРОМ
племент на поверхности эритроцитов донора. Образовавшийся
комплекс антиген + антитело активизирует систему комплемен-
та, что приводит к лизису мембран эритроцитов донора. Клини-
ческие признаки гемолиза метут проявиться после трансфузии
незначительного объема несовместимой крови или даже во вре-
мя биологической пробы. Эти, наиболее тяжелые гемолитические
постгрансфузионные осложнения связаны с несовместимостью
крови донора и реципиента по системе АВО. Антитела способны
фиксировать комплемент за счет наличия на тяжелых цепях зон,
взаимодействующих с С1-компонентом комплемента. Резус-ан-
титела неспособны фиксировать комплемент и поэтому не вы-
зывают внутрисосудистый гемолиз эритроцитов. При перели-
вании крови, несовместимой по антигенной системе резус, про-
исходит внесосудистый гемолиз. Антитела адсорбируются на
несовместимых эритроцитах. Fc-рецепторы макрофагов, моно-
цитов печени и селезенки фиксируют комплекс антиген + анти-
тело, после чего следует фагоцитоз и внутритканевый гемолиз.
Поврежденный эндотелий и тромбоциты вырабатывают се-
ротонин, гистамин, цитокины, тромбоксан, эндотелии, лейкот-
риены. А разрушение стромы эритроцитов приводит к выделе-
нию эритроцитина. Накопление данных медиаторов приводит к
активации внутреннего и внешнего механизмов свертывания
крови. Этомуже способствует массивный выброс в кровеносное
русло тканевого тромбопластина. У пациента развивается коагу-
лопатия потребления (дефицит факторов свертывания), тромбо-
цитопения, тромбоцитопатия. В дальнейшем происходит лизис
фибрина, фибрин-мономеров, фибриногена, развивается гипо-
или афибриногенемия, что характерно для фибринолиза. Резко
возрастает содержание ПДФ, которые обладают тормозящим
действием на свертывание крови. На этом фоне формируются
рыхлые тромбы, неспособные закрыть просвет поврежденного со-
суда, резко возрастает риск тяжелых геморрагий.
Специфические иммуноглобулины, связываясь с клеточны-
ми рецепторами эритроцитов донора, вызывают сладжирование
и агглютинацию клеток крови. Это является причиной диссеми-
нированой микроэмболизации и блокады капиллярного русла,
развития ДВС-синдрома и повреждения органов-мишеней с
формированием полиорганной недостаточности. Однако в на-
675
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
иболыпей степени нарушаются функции почек, при несвоевре-
менном лечении развивается острая почечная недостаточность.
ОПН при гемолитических посттрансфузионных осложнениях
развивается вследствие:
• гипоксического повреждения почек;
• блокады микроциркуляции;
• накопления в просвете канальцев почек дериватов свобод-
ного гемоглобина;
• повреждения канальцевого эпителия.
Эндотоксинемия, которая развивается вследствие резкого
увеличения содержания в крови билирубина, желчных кислот,
продуктов метаболизма белков (мочевины, креатинина, мочевой
кислоты и др.) довершает клинику гемолитического шока. Смерт-
ность в случаях тяжелых гемолитических осложнений достига-
ет 40—60 %. Исход зависит от своевременности диагностики и
лечения; диагностика основана на выявлении гемоглобинемии
и гемоглобинурии. Содержание непрямого билирубина в крови
резко повышается и сопровождается выделением уробилина с
мочой и стеркобилина с калом.
После появления первых клинических симптомов гемо-
литического осложнения трансфузию крови прекращают и
немедленно начинают терапию. Первый этап терапии предус-
матривает ряд симптоматических мероприятий: терапию сер-
дечно-сосудистой недостаточности, применение глюкокорти-
коидов в больших дозировках (по 300 мг болюсно до 2000 мг),
коррекцию гиповолемии, искусственную вентиляцию лег-
ких, коррекцию водно-электролитных и метаболических рас-
стройств, форсированный диурез. При сохранении диуреза
вводят 250 мг лазикса в 400—600 мл 40 %-ного раствора глю-
козы. В случае эффективности диуретической терапии ин-
фузию продолжают до прекращения гемоглобинурии.
Для успешного лечения гемолитического осложнения
необходимо проведение экстракорпоральной детоксикации,
целью которой является купирование ДВС-синдрома и эндо-
токсинемии. Применение обменного плазмафереза в ранние
сроки клинических проявлений позволяет предупредить ра-
звитие полиорганных нарушений. Во время плазмафереза из
циркуляции удаляются продукты гемолиза, свободный гемо-
676
ГЛАВА 8. ДВС-СИНДРОМ
глобин, строма разрушенных клеток, ПДФ, медиаторы во-
спаления, иммунные комплексы, микроагрегаты клеток кро-
ви. Адекватное плазмозамешение позволяет быстро воспол-
нить дефицит факторов свертывания и естественных антикоа-
гулянтов. Для коррекции содержания AT III применяется
препарат кубернин в дозе 1500—2000 ЕД в первые сутки лече-
ния. Терапевтический эффект плазмафереза зависит от объе-
ма эксфузии плазмы — детоксикация достигается при боль-
ших и сверхбольших объемах (более 1,5—2 ОЦП за процеду-
ру) плазмообмена.
В случаях нарастания почечной недостаточности показа-
но применение гемодиализа. Гемофильтрация и гемодиаульт-
рафильтрация позволяют не только произвести коррекцию
нарушений водно-электролитного баланса, но и элимини-
ровать из циркуляции низко- и среднемолекулярные олиго-
пептиды, энзимы, цитокины.
Трансфузии эритроцитарной массы применяются для
коррекции гемолитической анемии. При тромбоцитопении,
геморрагическом синдроме показаны трансфузии концен-
трата тромбоцитов в терапевтической дозе (6—8 ЕД ТК). Для
успешной гемотрансфузии необходимо провести фенотипи-
рование эритроцитов, тромбоцитов реципиента и донора.
8.6.7. Онкологические заболевания
Онкологические заболевания повышают риск тромбоэмбо-
лических состояний. Особенно высокому риску развития ДВС
подвергаются пациенты, страдающие диссеминированными
формами рака, острыми лейкозами (в первую очередь острым
промиелоцитарным), хроническими лейкозами (при бластных
кризах).
Развитию тромбоэмболических осложнений при онкологи-
ческих заболеваниях способствуют:
• высокий уровень клеточного повреждения и распада;
• выработка клетками злокачественной опухоли прокоа-
гулянтных субстанций.
ДВС у данных пациентов протекает в стертой (субклиниче-
ской) хронической форме. Однако хирургические вмешательства или
инфекционные осложнения часто приводят к обострению ДВС.
677
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Хронический ДВС характеризуется полной или частичной
компенсацией гемостаза, но у большинства больных имеются
специфические изменения показателей свертывающей системы:
увеличивается количество тромбоцитов, возрастает содержа-
ние факторов свертывания, а также продуктов деградации фи-
бриногена, фибрина. Несмотря на это активация гемокоагуля-
ции имеет менее выраженный характер, что подтверждается
нормальными показателями свертывания крови. Уровень АТ
III снижается незначительно, активность фибринолитической
системы несколько падает.
Установлено, что при метастазировании опухолей хронический
ДВС диагностируется у 75 % больных [Nielsen J.J. Нарушения гемо-
стаза нередко проявляются тенденцией к кровоточивости, однако
склонность к тромбозам, тромбоэмболическим осложнениям у этих
больных представляет гораздо большую проблему для терапии.
Ткань поджелудочной железы богата тканевым фактором и
содержит трипсин — протеолитический фермент, который ак-
тивизирует свертывающую систему крови. Новообразования
поджелудочной железы, тяжелый панкреатит, а также хирурги-
ческие вмешательства на этом органе резко увеличивают риск ра-
звития ДВС или тромбоэмболических осложнений.
Химиотерапия провоцирует обострение хронического ДВС
и развитие микроангиопатической гемолитической анемии.
При злокачественных опухолях мочевыводящей системы, мела-
номе и промиелоцитарном лейкозе возможно развитие гемор-
рагического диатеза (капилляротоксикоза). Причиной этого
осложнения является резкое увеличение продукции ферментов
фибринолиза клетками опухоли данной локализации.
8.6.8. Хроническая почечная недостаточность,
программный гемодиализ
Роль почек в поддержании физиологического состояния
гемостаза крайне велика:
• почки вырабатывают и выделяют в кровь и мочу факто-
ры VIII, VII, IX, X, тромбопластин и некоторые другие;
• почки синтезируют противосвертывающие факторы: ге-
парин, урокиназу, тканевый активатор плазминогена, соедине-
ния, ингибирующие фибринолиз;
678
ГЛАВА 8. ДВС-СИНДРОМ
• почками поглощаются и катаболизируются фактор XII
и часть фибриногена. Фактор XII необходим для участия в син-
тезе коллагена базальными мембранами капиллярных стенок в
клубочке.
При патологии почек снижается функциональный
вклад этого органа в гемостаз и возникает процесс локаль-
ной активации системы свертывания крови. Этот процесс
способен перерасти (при определенных условиях) в дис-
семинированное внутрисосудистое свертывание. По мере
прогрессирования почечной недостаточности тяжесть на-
рушений гемостаза прогрессирует, возрастает частота гемор-
рагических осложнений. Геморрагический синдром встре-
чается более чем у 50 % больных ХПН. Кровоточивость но-
сит гематомно-петехиальный характер, типичны носовые,
десневые кровотечения, кровотечения из желудочно-ки-
шечного тракта.
Для больных ХПН характерны разнонаправленные
изменения гемостаза (возможны как гипер- так и гипо-
коагуляция); нередко наблюдается наклонность к тром-
бозам — возникают тромбозы мезентериальных сосудов,
вен сетчатки, тромбоз артериовенозных фистул. Во вре-
мя диализа у этих больных тромбируются фистульные
иглы, мембраны диализатора. Превентивное введение
гепарина не препятствует развитию тромбозов.
В лабораторных тестах имеются характерные для боль-
ных ХПН изменения:
• снижение агрегационных и адгезивных свойств тром-
боцитов — тромбоцитопатия. Количество тромбоцитов нор-
мальное либо имеется незначительная тромбоцитопения;
• повышается содержание фибриногена, возрастают
ПДФ, появляются аномальные формы фибриногена, те-
сты паракоагуляции положительны. Образовавшийся сгу-
сток неполноценен, так как снижена фибриназная актив-
ность, замедлены процессы ретракции сгустка;
• изменения фибринолитической активности как в
сторону активации, так и угнетения фибринолиза;
• развивается анемия, но повышается агрегационная спо-
собность эритроцитов, чему способствует увеличение содержа-
679
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ния крупномолекулярных соединений, в первую очередь фибри-
ногена, бета-липопротеидов.
Все вышеуказанные клинические и лабораторные измене-
ния свидетельствуют о наличии хронического ДВС-синдрома.
Декомпенсация нарушений гемостаза возможна в терминальных
стадиях заболевания, при наличии гнойно-септических ослож-
нений и в постгрансплантационный период.
Активация свертывания крови и развитие ДВС при про-
граммном гемодиализе связаны со следующими факторами:
• контакт с чужеродной поверхностью мембран диализатора;
• активация свертывающей системы крови (посредством
воздействия на ХП-фактор) иммунными комплексами, экзо-
токсинами и бактериальными эндотоксинами, тканевым тром-
бопластином (вырабатывается при гемолизе, цитолизе);
• гепаринизация (истощает запасы AT III, что иногда при-
водит к рикошетным тромбозам).
Все материалы, применяемые для гемодиализа, в той или
иной степени обладают тромбогенностью. Решение этой пробле-
мы состоит в создании мембран, обладающих наибольшей био-
совместимостью, а также в применении антикоагулянтов. Гепа-
рин, применяемый во время гемодиализа, гетерогенен по отно-
шению к эндогенному гепарину как по структуре, так и по мо-
лекулярной массе. Поэтому нередки тяжелые побочные эффек-
ты, связанные с применением гепарина: тромбоцитопения, по-
вышение содержания трансаминаз, аллергические реакции,
кожный зуд, повышенная кровоточивость.
В последние годы установлено, что активация коагуляции
связана с длительной циркуляцией и контактом крови с диализ-
ной мембраной. Изменения показателей свертывающей систе-
мы у больных, находящихся на программном гемодиализе, пре-
терпевают ряд характерных изменений. Состояние свертыва-
ния крови после диализа соответствует резко выраженной гипер-
коагуляции: нарастает содержание фибриногена (средний уро-
вень содержания фибриногена у больных ХПН значительно
превышает нормальные величины), повышается содержание
протромбина, факторов VIII, X, XII.
Терапия нарушений гемостаза зависит от характера патоло-
гии свертывающей системы крови. Наиболее общие принципы
680
ГЛАВА 8. ДВС-СИНДРОМ
терапии ДВС-синдрома при программном гемодиализе можно
представить следующим образом:
• При гиперкоагуляции показан гепарин в дозе 10 000 ЕД в
сутки 3—4 раза в день под кожу. Применение малых доз гепарина
не требует постоянного контроля за свертываемостью крови.
• СЗП для восполнения дефицита AT III. При профузных
кровотечениях переливание больших объемов СЗП проводит к
быстрой их остановке. При проведении амбулаторного про-
граммного гемодиализа применяются небольшие дозы СЗП в со-
четании с мини-дозами гепарина.
• Адекватная терапия инфекционных осложнений.
Использование трансфузий СЗП в сочетании с мини-доза-
ми гепарина дают выраженный клинический эффект с положи-
тельной лабораторной динамикой — восстанавливаются функ-
ции тромбоцитов, нормализуется ТЭГ, паракоагуляционные те-
сты отрицательны.
8.6.9. Осложнения беременности и родов
Во время нормально протекающей беременности система ге-
мостаза (начиная со второго триместра) претерпевает ряд изме-
нений:
• повышается активность тромбоцитов;
• снижается антикоагулянтный потенциал крови;
• повышается содержание факторов свертывания крови
(II, V, VIII, IX, X, XI, XI и XII);
• увеличивается содержание фибриногена, укорачивается
АЧТВ.
Таким образом, во время беременности имеет место акти-
вация свертывающей системы крови. В процессе родов отмеча-
ется еще большее повышение количества фибриногена, про-
конвертина, тромбоцитов, но при этом активность фибриноли-
тической системы практически не меняется. В послеродовом пе-
риоде в течение 4—6 недель постепенно снижается гемокоагуля-
ционная активность, удлиняется время свертывания крови и
ретракции кровяного сгустка, нормализуется АЧТВ.
Срыв адаптационно-компенсаторных механизмов гемо-
стаза имеет место при следующих патологиях беременности
и родов:
681
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• преждевременная отслойка нормально расположенной
плаценты; предлежание и разрывы плаценты;
• эмболия околоплодными водами;
• атонические маточные кровотечения, гипотония матки,
разрыв матки;
• антенатальная гибель плода;
• плодоразрушающие операции;
• кесарево сечение (всегда сопровождается акушерской па-
тологией);
• пузырный занос;
• гестозы беременных;
• преэклампсия, эклампсия;
• септический аборт.
Акушерские кровотечения являются «классической» мо-
делью молниеносного ДВС-синдрома. Констатируется двух-
фазность изменений гемостаза: кратковременная стадия гипер-
коагуляции сменяется фазой гипокоагуляции, вследствие ос-
трого фибринолиза развивается коагулопатия потребления.
Чрезмерная активация фибринолиза приводит к лизису не толь-
ко сгустков фибрина, но и циркулирующих факторов свертыва-
ния, имеет место усиление генерации плазмина. Развивающие-
ся на фоне кровопотери ДВС, полиорганная недостаточность яв-
ляются непосредственной причиной летальности. О наличии
ДВС свидетельствует также накопление ПДФ, РКФМ (в норме
отсутствуют).
Терапия направлена на следующие патогенетические звенья:
1) Коррекция гиповолемии — восполнение дефицита ОЦК
посредством адекватной инфузионно-трансфузионной тера-
пии. На этапе хорошо зарекомендовали себя инфузионные ра-
створы гидрооксиэтилированного крахмала (6 и 10 %-ный HES),
которые, помимо коррекции гиповолемии, оказывают положи-
тельный эффект на реологические свойства крови и микроцир-
куляцию.
С целью коррекции коагулопатии осуществляется трансфу-
зия СЗП в дозе 15 мл на 1 кг веса.
2) Медикаментозное воздействие на гемокоагуляцию:
• поливалентные ингибиторы протеаз нормализуют процес-
сы фибринолиза, кининогенеза;
682
ГЛАВА 8. ДВС-СИНДРОМ
• антифибринолизные препараты оказывают блокирующее
действие на плазмин, конкурентно ингибируют рецепторы плаз-
мина и плазминогена, препятствуют деградации фибриногена.
3) Коррекция реологических свойств крови — введение де-
загрегантов (трентал в больших дозировках, аспизол, агапурин),
применение гепарина имеет ограниченные показания.
4) Симптоматическая терапия — направлена на поддержа-
ние функций жизненно важных органов, профилактику и лече-
ние полиорганной недостаточности и гнойно-септических
осложнений.
5) Экстракорпоральная детоксикация — терапевтический
эффект достигается механическим удалением патогенных субстан-
ций (БАВ, активизированные факторы свертывания крови, ПДФ
и другие). Гемофильтрация применяется для терапии острого ди-
стресс-синдрома и ОПН. Плазмаферез показан при начальных ста-
диях острой печеночной и почечной недостаточности.
Список основной литературы
1. Аграненко В.А., Скачилова Н.Н. Гемотрансфузионные ре-
акции и осложнения. М.: Медицина, 1986.
2. Андрианова М.Ю., Белоус А.Е., Броун Н.К., Тбтье С.В., Жид-
ков И.А., Михайлов Ю.Е. и др. Диагностика и коррекция на-
рушений гемостаза в беспеченочном и реперфузионном пе-
риодах при ОТТП. Итоги — результаты научных исследова-
ний НЦХ РАМН по программной тематике. М., 1997.
3. Баркаган З.С. Узловые вопросы комплексной терапии ос-
трого и подострого ДВС-синдрома // Вестник интенсивной
терапии. 1992. № 1.
4. Баркаган З.С. Геморрагические заболевания и синдромы.
М„ 1988.
5. Баркаган З.С. Очерки антитромботической фармакопро-
филактики итерации. М., 2000.
6. Беляевский А.Д., Беляевский С.А. Диссеминированное
внутрисосудистое свертывание крови. М.,1996.
7. Буянов В.В. Экспериментальное изучение нарушений ге-
мостаза при ортотопической трансплантации печени: Ав-
тореф. дис.... канд. мед. наук.
683
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
8. Бокарев И.Н. ДВС-синдром, современные представления
и проблемы // Клиническая медицина. 1992. № 2.
9. Бокарев И.Н. Достижения и перспективы противотромбо-
тической терапии. Противотромботическая терапия в кли-
нической практике. М., 1990.
10. Белобородов В.Б., Джексенбаев О.Ш. Эндотоксины грамо-
трицательных бактерий, цитокины и концепция септиче-
ского шока: современное состояние проблемы //Анест. и
реаниматология. 1991. № 4.
11. Введение в клиническую трансплантологию / Под ред.
Б.А. Константинова, С.Л. Дземешкевича. М., 1993.
12. Воробьев П.А., Дворецкий Л.И. Методы экстракорпораль-
ного воздействия на кровь: Учебно-методическое пособие.
М., 1992.
13. Воробьев А.И., Городецкий В.М., Шулутко Е.М., Василь-
ев С.А. Острая массивная кровопотеря. М., 2001.
14. Воробьев П.А. Диссеминированное внутрисосудистое свер-
тывание крови. М„ 1994.
15. Ватазин А.В. Гемофильтрация и ее модификации при син-
дроме полиорганной недостаточности // Анестезиология
и реаниматология, 1995. № 3.
16. 1ородецкий В.М. Синдром массивных гемотрансфузий //
Гематология и трансфузиология. 1996. № 1.
17. Глазунов И.И., Григорьев А.В. Влияние гепарина на повреж-
дение эритроцитов при различных токсикогенных ДВС-
синдомах // Гематология и трансфузиология. 1990. № 7.
18. Гусейнов Ч.С. Тромбоз и фибринолиз в хирургии. М., 1998.
19. Дементьева И.И., Ройтман Е.В. Агрегатное состояние кро-
ви больных в ранние сроки после операции в условиях ис-
кусственного кровообращения // Анестезиология и реани-
матология, 1994. № 6.
20. Дементьева И.И., Еременко А.А., Леонова С.Ф., Михай-
лов Ю.М., Ройтман Е.В. Разработка компьютерного
алгоритма для диагностики тромбогеморрагических
осложнений у кардиохирургических больных в раннем
послеоперационном периоде. Итоги — результаты на-
учных исследований НЦХ РАМН по программной те-
матике. 1998.
684
ГЛАВА 8. ДВС-СИНДРОМ
21. Дементьева И.И., Чарная М. А., Дземешкевич С.Л., Зюля-
ева Т.П. Превентивная роль больших доз апротинина в
снижении степени нарушений метаболизма при опера-
циях аортокоронарного шунтирования // Анестезиология
и реаниматология. 1996. № 1. С. 55—58.
22. Чарная М.А. Патофизиологические аспекты применения
больших доз апротинина при операциях с искусственным
кровообращением: Дис.... канд. биол. наук. М., 1993.
23. Дюгеев А.Н., Ковалев В.Ф., Фомин М.Д. Современ-
ные принципы лечения и профилактики синдрома по-
лиорганной недостаточности при массивной акушер-
ской кровопотере. Методы гравитационной хирургии
крови и интенсивной терапии в акушерстве и гинеко-
логи / Под ред. акад. В.И. Кулакова, чл.-корр. В.Н. Се-
рова. М., 1997.
24. Дюгеев А.Н., Фомин М.Ф. и др. Плазмаферез в комплекс-
ной терапии акушерского сепсиса и септического шока //
Вестник акуш.-гинеколога. 1996. № 3.
25. Зербино Д.Д., Лукасевич Л.Л. Синдром ДВС крови: морфо-
логические критерии. Архив патологии. 1982. Т. 44. Вып. 7.
26. Золотокрылина Е.С. Диссеминированное внутрисосуди-
стое свертывание крови у больных с массивной кровопо-
терей и тяжелой сочетанной травмой // Русский мед. жур-
нал. 1998. Т. 6. № 24.
27. Лычев В.Г. Диагностика и лечение ДВС крови. М., 1993.
28. Лопаткин Н.Л., Козлов В.А. Плазмаферез в комплексной
терапии острой реакции отторжения и гнойно-септиче-
ских осложнений посттрансплантационного периода //
Урология и нефрология. 1989. № 4.
29. Кузин М.И., Шимкевич Л.Л., Титова М.И., Авруц-
кий М.Я. Послеоперационные нарушения в системе гемо-
стаза: диагностика и лечение // Актуальные вопросы ис-
следования системы гемостаза в клинической практике.
М., 1995.
30. Матвеев С.А. Плазмаферез в лечении септического шока
// Вестник хирургии. 1991. Т. 146. № 4.
31. Макаров В.А. Актуальные проблемы гемостазиологии //
Клиническая медицина. 1990. Т. 68. № 6.
685
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
32. Макеев И.Н. Инфузионно-трансфузионная терапия.
М., 1998.
33. Маттиас Ф.Р., Лаш Х.Г. ДВС и циркуляторный шок// Кар-
диология. 1982.
34. Машковский М.Д. Лекарственные средства. М., 1993.
35. Мелкумян А.Л., Морозов К.М., Самсонова Н.Н. и др.
Факторы риска системы гемостаза при заболеваниях аор-
ты, магистральных и периферических сосудах: Метод,
пособие. М., 2001.
36. Мерсин Н.А., Полянцев Л.Р., Козловская Л.В. Клиническое
значение исследования гемостаза в нефрологии. Тер. архив.
1988. Т. 60. № 6.
37. Милас Б.Ю., Джоутс Д., Горман Р. Терапия кровотечений
и коагулопатий после операций на сердце. Серд.-сосуд,
заболевания. Бюллетень НЦССХ им. А.Н.Бакулева, 2002,
Т.3, №4.
38. Морозов Б.Н. Применение плазмафереза при лечении боль-
ных с ДВС-синдромом и синдромом полиорганной дис-
функции в ранние сроки после операции в условиях искус-
ственного кровообращения: Дис.... канд. мед. наук. М., 1997.
39. Неговский В.А., Гурвич AM., Золотокрылина Е.С. По-
стреанимационная болезнь. М., 1987.
40. Панченко Е.П., Добровольский А.Б. Тромбозы в кардио-
логии. М.,1999.
41. Папаян Л.П., Князева Е.С. D-димер в клинической прак-
тике. М., 2002.
42. Профилактика и лечение кровотечений в акушерстве и
гинекологии. Мет. рекомендации. М., 1997.
43. Практическая трансфузилогия. М., 1997.
44. Потапова И.В., Жаворонкова Е.К. Геморрагические ослож-
нения у больных с ХПН // Клиническая медицина. 1978.
Т. 58. № 7.
45. Осложнения при анестезии / Под ред. Ф.К. Оркина,
Л.Х. Куперман. М., 1994.
46. Рагимов А.А., Соловьева И.Н. Гемаферез в хирургии.
М.,1999.
47. Сидоркина А.Н., Сидоркин В.Г., Преснякова М.В.
Биохимические основы системы гемостаза и
686
ГЛАВА 8. ДВС-СИНДРОМ
диссеминированное внутрисосудистое свертывание крови.
Н. Новгород, 2001.
48. Стицюк Е.А., Лопаткин Н.А., Михеева Л.А. Влияние гемо-
диализа на свертывающую систему крови // Урология и не-
фрология. 1988. № 4.
49. Тарабыкин АА, Кликин Б.М., Басаргин С.Т. Плазмаферез в
комплексе мероприятий по профилактике послеоперацион-
ных тромбоэмболических осложнений у онкологических
больных//Анестезиология и реаниматология. 1990. № 1.
50. Шульцев Г.П., Панченко В.М., Базгадзе В.М. ДВС у больных
гломерулонефритом // Клиническая медицина. 1981. Т. 59.
№10.
51. Bellomo R., Tipping В, Воусе N. Continuous veno-venous he-
mofiltration with dialysis removes citokines from the circulatin
ofseptic patients. Crit. Care med. 1993. № 21.
52. Bellomo R., Farmer M. Treatment of sepsis-associated severe
acute renal failure with continuous hemofiltration /( Blood pu-
rif. 1995. № 3.
53. Bick. R., Arun B., Frenkel E. Disseminated intravascular coagu-
lation. Clin, and path, mechanism and manifistation// Haemo-
stasis. 1999, 29.
54. Brett P. Critical care medicine. 1993. \bl. 21. № 5.
55. Boldt G., Kling D., Zickmann B. Acute plasmapheresis during
cardiac surgery: volume replacement by crystalloids versus col-
loids // J. Cardiothoracic anest. 1990. Vol. 4. № 5.
56. Boue A.E. Multiple organ failure, multiple organ dysfunction syn-
drome and the systemic inflammatory response syndrome —
where de we stand. Shock. 1994.
57. Bone RC., Balk R. Adult respiratory distress syndrome. Se-
guence and importance of development of multiple organ failu-
re chest., 1992. Vol. 101. № 2.
58. Bohrer N., Nawroth Р.Р. Pathophysiology, presentation and tre-
atment of conditions associated DIC. In: Life — Threatening co-
agulation disorders in critical care medicine. 1997.
59. International Medical Reviews. Концепция экстракорпо-
ральной гемокоррекции. 1994. Vol. 2.
60. Hach-Wunderle V., Nawroth P.P. Life — Threatening coagula-
tion disorders in critical care medicine. 1997.
687
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
61. Hoffman М. Acell-based model of coagulation and the role of
factor Vila. Blood reviews, 2003. №17.
62. MannucciP.M., FedericiA.B., SirchiaG. Hemostasis testing du-
ring massive blood replacement. 1982.
63. Pollack M. Blood exchange and plasmapheresis in sepsis and sep-
tic shock. Clin. Infect. Dis., 1992. № 15.
64. Riess H. Bleeding in transplantation surgery. In: Life — Threa-
tening coagulation disorders in critical care medicine. 1997.
65. Sakuragawa N., Hasegawa H., Maki M. et al. Clinical evalua-
tion of low-molecular-weight heparin on DIC.Thromb.
res.,1993,72(6).
66. Sauaia E, Moore EA., Lezotte D.C. Early risk factors for postin-
jury multiple organ failure //World J. Surg. 1996. Vol. 20.
67. Seyter A.E., Seaber A.V., Dombrose EA. Coagulation changes
in elective surgery and trauma. Fnn. Surg. 1981. № 193.
68. Shapiro L., Jelfant G.A Citokines and sepsis: pathophysiology
and therapy//J. New Horiz. 1993. № 1.
69. Tonnesen E., Hansen M.B., Diamant M., Toft P. Cytokines in
plasma and ultrafiltrate during continuous arterio-venous hae-
mofiltration//Anaesth. Intens. Care. 1993. № 21.
70. Yu M., Nardella E, Pechet L. Screening tests of DIC: guideli-
ness for rapid and specific laboratory diagnosis // Crit.care med.
2000. № 28(5).
ГЛАВА9
Парентеральное питание
и интенсивная терапия
в хирургии
Под парентеральным питанием (ПП) понимают введение
питательных веществ внутривенным путем, минуя про-
цесс пищеварения в желудочно-кишечном тракте. Так
как питательные вещества попадают непосредственно в кровь,
то для ПП используют легко усваиваемые элементы пищевых
продуктов в определенных количествах и соотношениях.
Особую проблему представляет питательная поддержка
больных, находящихся в тяжелом стрессовом состоянии при
наличии нарушений питания.
Основной принцип, заложенный в основу ПП, заключает-
ся в обеспечении организма энергией и белком, что позволяет
противостоять таким факторам агрессии, как инфекция, ожоги,
травма и хирургическое вмешательство.
Большинство пациентов, поступающих в стационар, нахо-
дятся в той или иной степени голодания. По данным амери-
канских исследователей, частота госпитального голодания у хи-
рургических больных одна из наиболее высоких — до 50 %, в от-
дельных случаях она может доходить до 65 %. У терапевтических
больных частота голодания, а следовательно, и процент больных,
нуждающихся в питательной поддержке, — 48 %. По данным
клиник ВОНЦ АМН РФ, среди онкологических больных госпи-
тальное голодание наблюдается в 30 % случаев. Данные обшир-
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ной литературы указывают на влияние госпитального голодания
на течение послеоперационного периода — это и повышение чув-
ствительности к инфекции, и образование отеков, угнетение
перистальтики как желудочно-кишечного тракта, так и бронхи-
ального дерева. Выраженный дефицит массы тела, истощение и
дистрофия представляют собой значительный фактор риска для
возникновения многочисленных, в том числе инфекционных
осложнений.
Стресс, вызванный хирургическим вмешательством, трав-
мой, сепсисом, характеризуется гиперметаболизмом и гиперка-
таболизмом — усиленным потреблением энергии из собствен-
ных запасов жира, гликогена и функциональных внутриклеточ-
ных белков, что приводит к выраженной белково-энергетической
недостаточности.
Изменения углеводного обмена сопровождаются пониже-
нием толерантности к глюкозе, развитием диабетогенного обме-
на веществ. Спустя сутки в печени и мышцах остается лишь не-
большая часть свободного гликогена, которая недостаточна для
обеспечения потребностей мозга, пополняемых за счет глюко-
неогенеза в печени, в процессе которого используются амино-
кислоты расщепляющихся белков мышц и глицерола, образую-
щегося при липолизе депонированных триглицеридов.
Значительно увеличивается мобилизация жира — основ-
ного источника энергии. В плазме повышается концентрация
свободных жирных кислот, образуются кетоновые тела, кон-
центрация которых постепенно возрастает, и мозг переключает-
ся с окисления глюкозы на кетоновые тела. За их счет покрыва-
ется более половины энергетических потребностей мозга. Через
4—5 дней голодания имеющиеся запасы гликогена полностью ис-
тощаются и основным источником энергии остаются белковые
и жировые запасы. При наличии дострессового нарушения пи-
тания жизненные резервы пациентов особенно снижены и дан-
ный феномен может наступить уже через 24 часа.
В этой связи стрессовые состояния характеризуются повы-
шенным распадом белка. Однако для эндогенного питания мо-
гут быть использованы только 20—30 % собственных белков,
дальнейшее истощение их запасов приводит к смерти от поте-
ри азота организма. Одновременно с распадом белка при стрес-
690
ГЛАВА 9. ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ
се происходит и синтез белка. Повышенная потребность в ами-
нокислотах диктуется построением в этой фазе белков и белых
клеток крови, которые участвуют в борьбе с инфекцией, процес-
сах очищения и заживления ран.
Возникающая гипергликемия объясняется дефицитом инсу-
лина и тем, что глюкоза при анаэробном гликолизе служит толь-
ко источником энергии — она не окисляется, а переход ит в лак-
тат, который немедленно ресинтезируется в печени в глюкозу.
Негорригированная белково-энергетическая недостаточ-
ность сопровождается неадекватностью процессов восстановле-
ния и восприимчивостью к различным инфекционным ослож-
нениям. У хирургических больных после операции это состояние
без адекватной нутритивной поддержки сопровождается разви-
тием ранних послеоперационных осложнений (пневмония, уро-
инфекция, плохое заживление ран и пр.) с возможностью возни-
кновения сепсиса и полиорганной недостаточности.
Доставку питательных ингредиентов у больных хирургическо-
го профиля не всегда можно осуществить естественным путем.
Накопленный мировой опыт позволяет дифференцирован-
но подойти к назначению различной нутритивной поддержки —
полного ПП, смешанного питания или энтерального питания.
Полное парентеральное питание (ППП) применяется толь-
ко в тех случаях, когда естественное питание через рот невозмож-
но или должно быть ограничено. Следует считать неправильным
назначение ППП при сохраненной функции желудочно-ки-
шечного тракта.
Если энтеральное питание возможно, но недостаточно, то
следует рассмотреть возможность проведения дополнительно-
го парентерального питания.
При этом следует помнить, что современные инфузионные
растворы для ПП обладают широким спектром фармакологиче-
ского действия на системном, органном, клеточном и субклеточ-
ном уровнях, что позволяет использовать их для регуляции ме-
таболических процессов.
Таким образом, показаниями для ППП являются все забо-
левания и патологические состояния с органической или функ-
циональной несостоятельностью желудочно-кишечного тракта
пациентов, находящихся в критическом состоянии:
691
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• ишемия кишечника после операций на желудочно-ки-
шечном тракте;
• осложнения после операций на желудочно-кишечном
тракте (несостоятельность анастомозов, гнойно-септические
осложнения, кишечные фистулы);
• состояние после обширных резекций кишечника (син-
дром «короткой петли»);
• заболевания пищевода и желудка, связанные с нарушени-
ем доставки пищи;
• болезнь Крона и другие формы колитов;
• синдром малабсорбции;
• непроходимость кишечника различной этиологии;
• коматозные состояния, связанные с нарушением акта
глотания;
• острые кишечные инфекции;
• выраженный гиперметаболизм, связанный со значитель-
ными потерями белка (например, у больных с травмами и ожо-
гами даже в случаях, когда возможно осуществление обычного
питания);
• сепсис.
В остальных случаях невозможности полноценного питания
натуральными продуктами или необходимости метаболической
коррекции используются вспомогательное или частичное ПП.
Сюда относятся:
— онкологические заболевания (период подготовки к опе-
рации, лучевой и химиотерапии);
— ранний период после больших внебрюшинных операций;
— гнойно-септические осложнения;
— язвенная болезнь желудка и двенадцатиперстной кишки;
— различные формы колита;
— дистрофия и кахексия любого генеза;
— патология органов гепатобилиарной системы с функ-
циональной недостаточностью печени;
— хроническая почечная недостаточность;
— острые кишечные инфекции;
— хронические воспалительные процессы;
— выраженные эндо- и экзотоксикозы;
— психическая анорексия.
692
ГЛАВА 9. ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ
Стандартно в практике ПП применяются следующие термины:
• полное парентеральное питание (ППП), которое подразу-
мевает введение всех питательных ингредиентов в количествах,
полностью покрывающих потребности организма (использует-
ся при абсолютной невозможности потреблять или усваивать
естественные продукты, осуществляется только через централь-
ные вены);
• вспомогательное, или дополнительное, парентеральное пи-
тание (ВПП) подразумевает введение всех питательных компо-
нентов в количествах, дополняющих получение их естественным
путем;
• частичное парентеральное питание (ЧПП) применяется
для решения проблем недолгосрочной поддержки организма и
включает отдельные питательные компоненты;
• адекватное ПП применяется для оценки всех вариантов
ПП и подразумевает обеспечение организма всеми необходимы-
ми питательными компонентами в сбалансированной пропор-
ции, т. е. ингредиенты питания должны покрывать как основные
потребности, так и компенсировать повышенные потери и
имеющийся дефицит [Вретлинд А., Суджян А., 1990; Хартиг,
1982; Rombeau J.L., Cfldwell M.D., 1993].
В зависимости от способа доставки питательных компо-
нентов различают:
• центральное ПП — через магистральные сосуды;
• периферическое ПП — через периферические вены.
Выбор режимов ПП диктуется имеющейся ситуацией и со-
стоянием больного. При подготовке больного к хирургическо-
му вмешательству в зависимости от его питательного статуса
может быть использовано ВПП или ЧПП, которые при относи-
тельно небольших сроках проведения могут осуществляться че-
рез периферические сосуды. Послеоперационное ПП пациен-
тов, находящихся в отделениях реанимации либо интенсивной
терапии, подразумевает ППП и проводится через центральные
вены; при небольших сроках использования этого метода воз-
можно ЧПП. При выборе способа доставки питательных ком-
понентов следует помнить, что введение препаратов в перифе-
рические вены является только временной мерой у больных,
которых в ближайшие 3—5 дней планируется перевести на энте-
693
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ральное питание. При абсолютной невозможности питаться
естественным путем (нарушение акта глотания, непроходимость
кишечника, отсутствие полноценного усвоения, кишечные фи-
стулы, несостоятельность анастомоза, резекции тонкой киш-
ки, т. е. все варианты длительного ПП) используется только
ППП через центральные вены. Полное периферическое ПП по
сравнению с центральным требует существенно большего объе-
ма жидкости, ухудшает венозный кровоток и чревато тромбозом
вен конечностей, как правило, не давая при этом адекватного
белкового и калорийного обеспечения [McClave S.A. et al., 1990;
Sheldon G.E, Way О.W., 1975]. ППП предъявляет наиболее вы-
сокие требования как к персоналу, так и к материальному обес-
печению лечебного учреждения.
При этом любой из выбранных режимов подразумевает
прежде всего адекватность обеспечения питательными компо-
нентами, поэтому весьма важным процессом является опреде-
ление потребности больного в питательных компонентах.
Вретлиндом и Суджяном выдвинуты три основных принци-
па ИЛП, не зависящих от метода доставки питательных ингре-
диентов:
• своевременность начала проведения ИП, ибо предупре-
дить кахексию легче, чем ее лечить;
• оптимальность срока проведения ИП, что означает, что
проводить его следует до момента стабилизации основных пара-
метров трофического статуса — метаболических, антропоме-
трических, иммунологических;
• адекватность проведения ИП, т. е. полноценное обеспе-
чение пациента всеми питательными компонентами (белки,
жиры, углеводы, витамины, минеральные вещества).
ПП — метод введения питательных компонентов непо-
средственно в сосудистое русло и далее в печень связан с доволь-
но большой водной нагрузкой, нарушением осмолярности и
кислотно-щелочного состояния крови, вмешательством в мета-
болические процессы на уровне биологически активных ве-
ществ (свободные аминокислоты и жирные кислоты, триглице-
риды, простые сахара и т. п.). Для успешного усвоения и мета-
болизма вводимых основных питательных компонентов (белков,
жиров, углеводов) требуется достаточное обеспечение кисло-
694
ГЛАВА 9. ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ
родом, фосфором и другими веществами, активно влияющими
на метаболические процессы. Поэтому ПП противопоказано
при шоке, остром кровотечении, гипоксемии, дегидратации и ги-
пергидратации, декомпенсации сердечной деятельности, ос-
трой почечной и печеночной недостаточности, значительных на-
рушениях осмолярности, кислотно-щелочного состояния (КЩС)
и ионного баланса.
В то же время в практике интенсивной терапии весьма зна-
чительное и частое явление — циркуляторный шок. Независи-
мо от этиологии шока общим для всех форм является остро на-
ступающее уменьшение кровотока тканей с нарушением кровос-
набжения клеток различных органов и расстройством микроцир-
куляции. Критическое уменьшение кровотока означает недоста-
точное снабжение кислородом тканей и нарушение притока
продуктов обмена веществ и оттока шлаков. Следствием этого
является нарушение или утрата нормальной функции клеток, а
в крайних случаях — гибель самой клетки. Патофизиологически
это означает расстройство капиллярной перфузии с недоста-
точным снабжением кислородом и нарушением обмена веществ
клеток различных органов. Нормальное снабжение органов и тка-
ней кислородом и питательными веществами не может поддер-
живаться в условиях критического падения периферического
кровоснабжения. Истощается энергоснабжение, накапливают-
ся патологические продукты обмена веществ, развиваются ги-
поксия и ацидоз. В отсутствие своевременного и адекватного ле-
чения первоначально поправимые нарушения переходят в
необратимые повреждения клеток и органов.
В основе нарушений гемодинамики лежат снижение объе-
ма циркулирующей крови или ее патологическое перераспреде-
ление, уменьшение внутрисосудистого давления и сердечного
выброса, сочетающиеся с увеличением сопротивления току кро-
ви в периферических сосудах и сосудах легких, как следствие цен-
трализации кровообращения. Гиповолемические состояния со-
провождаются нарушениями макро- и микроциркуляции.
Нарушения микроциркуляции в различных органах харак-
теризуются изменениями реологии крови: повышается вяз-
кость крови и плазмы, увеличивается агрегационная способ-
ность эритроцитов, возрастает уровень фибриногена. Помимо
695
ТРАНСФУЗИОЛОГИЯ В-РЕАНИМАТОЛОГИИ
этого повышается агрегационная способность тромбоцитов и
свертываемость крови, что сопровождается увеличением про-
ницаемости сосудов.
В целом, основной проблемой при шоке является несоот-
ветствие между потребностью и возможностью обеспечения
тканей и органов кислородом и другими питательными ком-
понентами, транспортируемыми системой кровообращения.
В связи с этим собственно ПП должны предшество-
вать ряд лечебных мероприятий, направленных на под-
держание нормальной гемодинамики и реологических
свойств крови, коррекцию нарушений водно-солевого и
кислотно-щелочного состояний, ликвидацию гипоксемии.
Критериями длительности введения кристаллоидных и
плазмозамещающих растворов могут служить увеличение
диуреза, коррекция гематокрита, нормализация кислотно-
щелочного состояния.
Компоненты нутритивной поддержки-.
• жидкость;
• энергетические компоненты (жиры, углеводы);
• белки;
• электролиты, минеральные вещества;
• витамины.
Определение потребности в основных питательных компонентах.
А. Потребность в жидкости
Потребность в жидкости при проведения ПП составляет
1500 мл (+ 20 мл на каждый последующий кг свыше 20 кг), если
нет противопоказаний.
Увеличение потребности в жидкости связано с диареей,
рвотой, дренажом фистулы, потоотделением, повышением тем-
пературы тела свыше 37 °C, обезвоживанием.
Существенно снижается при циррозе печени, застойной
сердечной недостаточности, отеке легких, респираторном ди-
стресс-синдроме у взрослых или при почечной недостаточности.
Внешние потери жидкости (при отсасывании из назога-
стрального или кишечного зондов, дренировании желчных пу-
тей, обильном свищевом отделяемом, диарее или рвоте) вос-
полняются в соотношении 1: 1 растворами для внутривенного
введения каждые 8 часов.
696
ГЛАВА 9. ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ
При ППП возможна задержка жидкости. Прибавка веса на
1—2 кг в неделю может быть связана с этой причиной.
В связи с чрезвычайно высокой стоимостью растворов для
ПП следует по возможности избегать ППП для восполнения
внешних потерь жидкости и электролитов и использовать вну-
тривенные инфузии обычных растворов электролитов.
Б. Определение потребности в энергии осуществляется следую-
щими методами:
• с помощью уравнения Харриса—Бенедикта (определя-
ются энергозатраты покоя);
• методом непрямой калориметрии;
• по соотношению небелковых калорий и азота.
1. Уравнение Харриса—Бенедикта служит для определения
основного обмена (ОО):
ОО для мужчин = 66,47 + (13,75 х М) + (5,0 х Р) — (6,76 х В);
ОО для женщин = 655,1 + (9,56 х М) + (1,85 х Р) - (4,68 х В),
где М — масса тела, Р — рост, В — возраст.
Чтобы учесть двигательную активность и стрессовый фак-
тор болезни, полученный результат умножают на коэффици-
ент метаболической активности и/или используют расчетное
уравнение (см. табл. 9.1):
ИРЭ = ОО х ФА х ФП х ТФ,
где ИРЭ — истинный расход энергии, ФА — фактор актив-
ности, ФП — фактор повреждения, ТФ — температурный фак-
тор.
2. Метод непрямой калориметрии
В условиях отделения интенсивной терапии у тяжелых боль-
ных для определения расхода энергии наиболее целесообразно
использовать этот метод. Он основан на прямом измерении по-
требления О2 и выделения СО2. В этом случае оценка суточно-
го расхода энергии может быть выполнена в течение 15—20 мин
с погрешностью не более 10 %. Сущность данного метода осно-
вывается на биологическом окислении в организме основных пи-
697
ТРАНСФУЗИОЛОГИЯ в реаниматологии
Таблица 9.1. Коэффициент расхода энергии
ФА ТФ ФП
Постельный ре- жим —1,1 38 °C — 1,1 Пациент без осложнений — 1,0 После операции — 1,1
Полупостельный режим —1,2 39 °C - 1,2 Перелом — 1,2 Сепсис —1,3
Ходячий режим -1,3 40 °C - 1,3 Перитонит — 1,4 Политравма, реабилитация -1,5
41 °C - 1,4 Политравма + + сепсис —1,6 Ожоги 30—50 % -1,7
Ожоги 50—70 % -1,8 Ожоги 70—90 % -2,0
тателъных веществ с образованием тепловой энергии, которую
при выделении через кожу измеряют в килокалориях (табл. 9.2).
Суммарный метаболизм трех основных групп питательных ве-
ществ (белки, жиры, углеводы) будет определяться общим по-
треблением кислорода, продукцией углекислого газа и выделе-
нием энергии.
Таблица 9.2. Энергетическая ценность питательных
компонентов, ккал/г
Белки 4,2
Углеводы 4,1
Жиры 9,3
Алкоголь 7,1
Таблица 9.3. Дыхательный коэффициент RQ
Более 1,0 Преобладает липогенез. Встречается при нестабильных состояниях, гипервентиляции, переедании
1,0 Преимущественное окисление углеводов
0,85 Смешанное окисление углеводов и жиров
0,71 Окисление липидов
0,67 Метаболизм спирта и кетоновых тел
698
ГЛАВА 9. ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ
Энергию покоя РЭП рассчитывают по уравнению:
РЭП (ккал/мин) = 3,94 х VO2 + 1,1 х VCO2
или
РЭП (ккал/сутки) = 3,94 х VO2 + 1,1 х VCO2 — 2,17 х N,
где VO2 — объем потребленного кислорода, VCO2 — объем
выделенного углекислого газа, N — азот суточной мочи.
Повышение температуры тела на 1 °C увеличивает потреб-
ность в энергии на 10—13 %.
У тяжелой категории больных суточная потребность в энер-
гии составляет в среднем 3000—3500 ккал.
В. Потребность в белке может быть определена тремя раз-
личными методами:
• по средней потребности в белке, исходя из фактической
массы больного;
• по определению содержания азота в суточной моче;
• по соотношению небелковых калорий и азота.
1. Рассчитывается на основе фактического веса и составля-
ет от 1,0 до 2,0 г/кг в день. Показатель может быть индивидуаль-
но уточнен путем умножения 1,0 г/кг в день на показатель ме-
таболической активности данного больного.
2. Наиболее точный метод основан на исследовании азоти-
стого баланса.
Азотистый баланс = N поступления — N потери.
Азот потерь состоит из общего азота, выделяемого с мо-
чой, через кожу, волосы и кал. Общий азот мочи рассчитывают
путем определения мочевины в суточной моче, где азот мочеви-
ны составляет 80 % от общего азота мочи. Азот мочевины опре-
деляется путем умножения суточной мочевины, в граммах, на ко-
эффициент 0,466, а общее количество азота в моче — умноже-
нием полученного значения на коэффициент 1,25.
Общий азот мочи = М (мочевина мочи, г) х 0,466 х 1,25.
К полученному значению следует добавить 6 г азота (4 г —
добавочные потери белка через кожу, волосы и кал, и 2 г — для
достижения положительного азотистого баланса).
Мочу следует собирать в стабильных условиях при неизмен-
ной функции почек. Цель определения азотистого баланса —
699
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
обеспечение поступления в организм большего количества
белка, чем его распадается, и обеспечение пластическим мате-
риалом процессов репарации после хирургического вмеша-
тельства.
Пример: больной за сутки выделил 20 г мочевины, что со-
ставляет:
20 х 0,466 = 9,32 г азота мочевины;
общее количество потерянного с мочой азота составит
9,32 х 1,25 = 11,65 г/сутки.
Таким образом, общее количество выделившегося за сутки
с мочой белка составит:
11,655x6,25 = 72,81 г.
Для расчета общей потребности в белке следует к су-
точному азоту добавить 6 г, а полученную величину умножить
на 6,25, т. е.:
11,65 + 6= 17,65x6,25= ПО,31, или 110 г.
3. Используется соотношение небелковых калорий и вводи-
мого азота в соответствии с данными Sheldon, который наибо-
лее оптимальным соотношением калорий к вводимому азоту
считает соотношение 150 : 1. В этом случае потребность в бел-
ке может быть вычислена делением общего количества калорий
на 150, что определяет количество граммов необходимого азо-
та. Умножение полученной цифры на 6,25 дает требуемое коли-
чество белка в граммах [McClave S.A. et al., 1990].
Здоровому человеку необходимо белка в сутки 0,60—0,8 г/кг,
больному на стационарном лечении — 0,8—1,0 г/кг. Для купиро-
вания белкового дефицита требуется 1,1—1,5 г/кг. Более 1,5 г/кг
белка в сутки требуется при энтеропатиях с большой потерей бел-
ка и тяжелых ожогах. Больным с почечной или печеночной не-
достаточностью (без диализа) требуется не менее 0,55 г/кг. При
гемодиализе добавляют 6—9 г белка в сутки (1,0—,2 г/кг). Для аде-
кватного усвоения белков рекомендуются следующие их соот-
ношения с углеводами и жирами (табл. 9.4):
Таблица 9.4
Соотношение Белки Углеводы Жиры
Весовое, г 1 5 1,8
По калорийности, % 10 50 40
700
ГЛАВА 9. ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ
В настоящее время оптимальным по калорийности (в зави-
симости от показаний) считается следующее соотношение меж-
ду углеводами и жирами: 70: 30 % или 60: 40 %.
Питательные среды для ПП
1. Компоненты белкового питания
Коллоидные белки (альбумин, протеин, плазма) не являют-
ся препаратами белкового питания.
Компонентами, обеспечивающими пациента пластическим
материалом, являются растворы аминокислот. Различают нес-
колько специфических групп аминокислотных растворов:
• растворы общего типа;
• растворы, используемые при заболевании почек;
• растворы, используемые при заболевании печени;
• растворы для детского парентерального питания;
• растворы аминокислот с высоким содержанием глютамина.
Подробный перечень компонентов современного аминоки-
слотного обеспечения представлен в главе 1.
2. Углеводы
Глюкоза (декстроза) является одним из наиболее распростра-
ненных ингредиентов ПП. Роль ее в метаболических процессах,
происходящих в организме, весьма велика. Это:
• незаменимый субстрат для ЦНС;
• один из основных поставщиков энергии (40—50 %);
• построение клеточных субстанций, клеток крови;
• активный компонент работы надпочечников.
Минимальная суточная доза глюкозы 200—300 г (2—4г/кг).
100—150 г глюкозы требуется только для работы мозга и по-
крытия облигатных потребностей организма. Стандартная доза
глюкозы при ПП 350—400 г, максимально допустимые дозы
5—6 г/кг в день или 0,25 г/кг в час.
Для восполнения энергозатрат можно использовать раз-
личные концентрации раствора глюкозы: 5, 10, 20, 40, 50 и
70 %-ные (табл. 9.5).
В клиниках нашей страны, как правило, применяют 20 и
30 %-ные растворы глюкозы. При коротких курсах полного па-
рентерального питания, или при противопоказаниях к введению
жира возможно использование более концентрированных ра-
створов глюкозы (например, 40—50 %-ные). Однако следует
701
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
помнить, что увеличение концентрации глюкозы ведет к повы-
шению осмолярности ее растворов.
Таблица 9.5. Характеристика используемых растворов глюкозы
Концентрация ра- створов, % Осмолярность, мосм/л Энергетическая ценность, ккал/л
Глюкоза — 5 290 205
Глюкоза —10 523 410
Глюкоза — 15 800 615
Глюкоза — 20 1250 820
Глюкоза — 30 2100 1230
Глюкоза — 50 3800 2050
Плазма 290 —
Для коррекции нарушений толерантности к глюкозе ис-
пользуется капельное введение инсулина. ПП не начинают до за-
вершения коррекции уровня гликемии. Перед началом ПП глю-
коза крови должна быть ниже 11 ммоль/л. Обычно добавляют
1 ЕД простого инсулина на 10 г глюкозы (10 ЕД на 1 л 10 % ра-
створа глюкозы), максимальная доза простого инсулина: 2 ЕД на
10 г глюкозы, что в отделениях интенсивной терапии предпоч-
тительнее. При отсутствии глюкозурии уровень глюкозы не ре-
комендуется снижать ниже 8 ммоль/л из-за опасности возникно-
вения гипогликемии.
В качестве энергетического компонента могут использо-
ваться также фруктоза и многоатомные спирты сорбитол и кси-
литол. Однако по ряду причин они не имеют широкого распро-
странения (табл. 9.6).
Фруктоза, сорбитол, ксилитол как энергетические компо-
ненты не имеют самостоятельного применения. Они могут иметь
место в виде добавок к аминокислотным растворам или в спе-
циальных углеводных растворах, состоящих из нескольких ком-
понентов (например: глюкоза, фруктоза, ксилит в соотноше-
нии 1:1:1). Одним из примеров подобных препаратов может
служить стерофуидин. В настоящее время в практике российско-
го здравоохранения такие препараты отсутствуют.
В связи с многочисленными противопоказаниями приме-
нение этилового спирта также крайне ограничено.
702
ГЛАВА 9. ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ
Таблица 9.6. Некоторые побочные реакции, возникающие по-
сле инфузии фруктозы, сорбитола и ксилитола
Осложнения Углеводы П о л н о л ы
Фруктоза Сорбитол Ксилитол
Метаболический ацидоз + + +
Гиперурикемия + + +
Снижение адениннуклеотида в печени и фосфата в крови + + +
Осмотический диурез с потерей электролитов + +
Отложение кристаллов в поч- ках и мозговой ткани +
3. Жиры
Наиболее эффективными энергетическими субстратами
при ПП являются жировые эмульсии, что связано с высокой
энергетической ценностью жира и его осмотической неактивно-
стью.
При отсутствии противопоказаний суточная доза жира рав-
на 1—2 г/кг. Для профилактики дефицита незаменимых жир-
ных кислот (НЖК) содержание жиров в дневном рационе дол-
жно составлять 2—4 % от общего количества калорий. Отсутствие
жировых эмульсий в составе ППП приводит к появлению дефи-
цита НЖК в течение 2 недель, клинические признаки развива-
ются через 6 недель.
Три поколения жировых эмульсий
1. Длинноцепочечные жировые эмульсии-Л СТ (интралипид,
липовеноз, липофундин С, инфузолипол).
2. МСТ/ЛСТ 50-50 % (липофундин МСТ/ЛСТ), где МСТ -
среднецепочечные триглицериды.
3. Структурированные липиды (структолипид) и эмульсии
с преобладанием 3-омега жирных кислот (омегавен, липоплюс).
В настоящее время наиболее эффективными и безопас-
ными являются жировые эмульсии второго поколения, такие как
липофундин МСТ/ЛСТ. Наличие в составе эмульсии 50 % три-
глицеридов со средней длиной цепи способствует более быстро-
му ее усвоению, что повышает скорость энергообразования и
703
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
синтеза белка, а также предотвращает липидные перегрузки и
связанные с ними осложнения.
Жировые эмульсии выпускаются в виде 10 и 20 %-ных растворов.
Состав некоторых жировых эмульсий и их характеристики
представлены в главе 1.
Таблица 9.7. Потребность в электролитах при парентеральном
питании
Наименование Взрослые Дети
Натрий Калий Кальций Магний Фосфор 80—130 мэкв в сутки 70—150 мэкв в сутки 1,8—2,7 г в сутки 0,25—0,35 мэкв в сутки 930—1390 мг в сутки 3—4 мэкв/кг в сутки 2—3 мэкв/кг в сутки 60—90 мг/кг в сутки 0,25-0,5 мэкв/кг в сутки 47—70 мг/кг в сутки
Приведенные в табл. 9.7 дозы электролитов можно повышать
и понижать в зависимости от клинического состояния и потребно-
сти пациента. Магний и фосфор необходимо восполнять всегда (за
исключением тяжелой почечной недостаточности). В случае оче-
видных признаков истощения следует помнить о скрытом вну-
триклеточном истощении калия, фосфатов и магния, которое не
всегда сопровождается понижением их концентрации в плазме.
Общее количество микроэлементов в организме человека —
10 г, однако они играют существенную роль в метаболических
процессах. Большинство микроэлементов являются кофактора-
ми или катализаторами активности ферментов, что делает их
необходимыми для оптимальной утилизации основных продук-
тов и сохранения нормальной функции тканей. В программу
ПП микроэлементы вводят в виде специализированных добавок
к растворам аминокислот или углеводов (1 доза в первый литр
инфузируемых растворов). Одной из таких добавок является ад-
дамель (состав аддамеля Н(на 1 мл) представлен в главе Г).
Дефицит микроэлементов развивается через 3 недели после
начала ППП, не содержащего микроэлементов, поэтому введе-
ние их в процессе кратковременного парентерального пита-
ния послеоперационных больных необязательно, но крайне
необходимо для больных, находящихся на длительном ППП
704
ГЛАВА 9. ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ
(особенно с тонкокишечными фистулами, обширными резек-
циями тонкой кишки, печеночной недостаточностью).
Важным компонентом ПП являются витамины. Активно
участвуя в обмене белков, углеводов и жиров, витамины являют-
ся стимуляторами метаболических процессов в организме и на-
ряду с микроэлементами способствуют оптимальной утилизации
основных продуктов ПП. В ПП используются в виде специали-
зированных добавок, таких как солувит (водорастворимые ви-
тамины) и виталипид (жирорастворимые витамины). Водора-
створимые витамины, как правило, добавляют в растворы глю-
козы, жирорастворимые витамины — в жировые эмульсии (од-
на доза в первый литр инфузируемых растворов).
Состав витаминных добавок представлен в главе I.
Больным, которые не находятся в состоянии истощения, жи-
рорастворимые витамины можно начинать вводить через
14 дней после начала комплексного парентерального питания.
ПРОТОКОЛ ДЕЙСТВИЙ ЛЕЧАЩЕГО ВРАЧА
ПРИ НАЗНАЧЕНИИ ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ
• Оценка питательного и трофического статуса больного,
определение суточных потребностей больного в энергетических
и пластических компонентах.
• Определение противопоказаний для проведения ПП в
целом или для его отдельных компонентов.
• На основании предыдущих действий выбор вида парен-
терального питания (полное, вспомогательное или частичное);
исходя из необходимого вида ПП, выбор способа введения (цен-
тральное или периферическое).
• Учитывая все предыдущие сведения, расчет схемы па-
рентерального питания на сутки и определение приблизитель-
ной длительности проведения ПП.
• В случае выбора полного парентерального питания или
длительного курса введения питательных компонентов постанов-
ка катетера в центральные вены.
• Назначение обязательной схемы биохимического и ге-
матологического контроля состояния пациента (табл. 9.8).
• Коррекция деятельности жизненно важных систем орга-
низма: водно-электролитного обмена и кислотно-основного
705
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
равновесия, восполнение внутрисосудистого пространства по
глобулярному и плазменному объемам, ликвидация гипоксии.
• Проведение собственно парентерального питания.
ПРАВИЛА ПРОВЕДЕНИЯ ПАРЕНТЕРАЛЬНОГО ПИТА-
НИЯ
1. Аминокислотные растворы и растворы углеводов вво-
дят параллельно, желательно через У-образный переходник.
2. Жировые эмульсии нельзя сочетать с растворами элек-
тролитов, аминокислот, лекарственных препаратов. Вводят по
отдельной системе.
3. Период инфузии должен составлять в среднем 10—12ча-
сов. Более медленная и длительная инфузия требуется боль-
ным, которые плохо переносят нагрузку жидкостью.
4. Скорость введения:
• аминокислот — до 0,1 г/кг в час (20—30 капель в минуту);
• глюкозы до 0,5 г/кг в час, для 20 %-ного раствора 40 ка-
пель в минуту (более концентрированные растворы, а также де-
тям как можно медленнее);
• жиров до 0,15 г/кг в час (10 %-ную жировую эмульсию до
100 мл/ч, 20 %-ную жировую эмульсию не более 50 мл/ч).
5. Гиперосмолярные растворы следует вводить только в
центральную вену. В периферическую вену можно вводить
растворы, показатель осмолярности которых не превышает
830 мосм/л.
6. Для профилактики гипогликемии инфузия концен-
трированных растворов должна прекращаться постепенно.
Скорость инфузии уменьшают в 2 раза в течение 15 минут.
В течение последующих 15 минут инфузию постепенно пре-
кращают. Этот период может быть увеличен до 45—60 минут,
если при обычном режиме у больного развивается гипоглике-
мия. Период постепенного прекращения инфузии не входит
в общее время парентерального питания.
7. Если возникает потребность в дополнительном введе-
нии инсулина, следует помнить, что инсулин не следует добав-
лять в раствор ПП во время инфузии.
8. Окончательное приготовление и доводка инфузион-
ных смесей (введение в основные растворы электролитов, ви-
706
ГЛАВА 9. ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ
таминов, микроэлементов и пр.) должны проводиться в асепти-
ческих условиях. Если раствор приготавливается в отделении, то
он должен быть использован немедленно после приготовления.
9. Вводимые растворы должны подогреваться до темпера-
туры тела (36—37 °C).
10. Введение питательных растворов и переливание крови
должны проводиться через разные системы.
11. Не использовать место введения питательных раство-
ров для других внутривенных манипуляций, в том числе для за-
бора крови.
Таблица 9.8. Мониторинг парентерального питания
Показатели Нестабильные пациенты Стабильные пациенты
Температура Пульс Кровяное давление Частота дыхания Кровь: Глюкоза* Гемоглобин Гематокрит Лейкоциты Тромбоциты Протромбиновое время КЩС Калий, натрий, хлор, кальпий, магний Креатинин, мочевина Альбумин Триглицериды** Ежедневно Ежедневно Ежедневно Ежедневно Ежедневно Ежедневно Ежедневно Ежедневно Ежедневно Ежедневно Ежедневно Ежедневно Ежедневно Ежедневно 3 раза в неделю Ежедневно Ежедневно Ежедневно Ежедневно Ежедневно 2 раза в неделю 2 раза в неделю 2 раза в неделю 2 раза в неделю 2 раза в неделю 2 раза в неделю Ежедневно Ежедневно 2 раза в неделю 2 раза в неделю
* Глюкоза при нестабильном состоянии определяется каждые 6 часов при постоян-
ной скорости инфузии и через 2 часа после каждого повышения скорости ин-
фузии. Концентрацию глюкозы в крови смотрят через 30 и 60 мин после от-
ключения ПП.
** Триглицериды определяют не менее чем через 6 часов после окончания инфу-
зии жировой эмульсии.
707
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Окончание табл. 9.8
Показатели Нестабильные пациенты Стабильные пациенты
ACT, АЛТ, билирубин Осмолярность Моча: Глюкоза Мочевина Осмолярность Ежедневно 3 раза в неделю Ежедневно Ежедневно Ежедневно 3 раза в неделю 2 раза в неделю Ежедневно 2 раза в неделю 3 раза в неделю
Оценка эффективности нутритивной поддержки
1. Изменение параметров нутритивного статуса: уровни аль-
бумина, трансферрина, лимфоцитов.
2. Динамика веса относительно идеальной массы тела.
3. Динамика индекса масса/рост.
4. Толщина кожно-жировой складки (КЖСТ) в динамике.
5. Окружность мышц плеча (в динамике).
6. Азотистый баланс.
7. Состояние хирургической раны.
8. Динамика клинического состояния пациента, выражен-
ность и течение органной дисфункции.
Осложнения парентерального питания
Технические:
• пневмоторакс;
• гидроторакс;
• перфорация вены;
• пункция артерии;
• воздушная эмболия;
• катетерная эмболия;
• венозный тромбоз;
• синдром верхней или нижней полой вены;
• повреждение плечевого сплетения;
• перфорация миокарда, тампонада сердца;
708
ГЛАВА 9. ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ
• аритмии;
• повреждение грудного лимфатического протока;
• повреждение катетера;
• окклюзия катетера;
• тромбоз катетера.
На окклюзию катетера указывают следующие факторы:
• катетер непроходим для жировой эмульсии, даже если
он пропускает растворы глюкозы и аминокислот;
• затруднения при промывании ЦВК;
• невозможность получения крови из ЦВК;
• заброс крови в инфузионную систему.
При тромбозе катетера для устранения блока ЦВК (при от-
сутствии противопоказаний) вводят небольшое количество уро-
киназы, которая устраняет блок внутреннего просвета ЦВК, не
влияя на общее время свертывания. При возникновении отека
лица или шеи, конечностей проксимальнее ЦВК или болезнен-
ности по ходу катетера во время инфузии не следует применять
внутривенное введение урокиназы до выполнения ангиографи-
ческого или ультразвукового исследования для исключения
тромбоза сосудов.
Если урокиназа не восстановила проходимость катетера,
можно думать о нетромботической природе окклюзии, которая
бывает вызвана плохой растворимостью фосфора, кальция, дру-
гих двухвалентных катионов. Для растворения минерального
осадка применяют 0,1Н соляную кислоту.
Септические осложнения:
катетерный сепсис (5—6 % случаев), который характеризу-
ется следующими признаками:
— повышение температуры выше 38,5 °C на фоне ПП;
— если после прекращения ПП температура снижается, а
при его возобновлении вновь повышается, то источником ин-
фекции наверняка является либо катетер, либо питательный
раствор;
— клиническая картина сепсиса при отсутствии других
причин для возникновения инфекции;
— рост идентичной флоры в пробе крови, взятой из кате-
тера и из другой вены;
— внезапное нарушение толерантности к глюкозе;
709
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
— воспаление кожи в месте выхода катетера из вены;
— гипотензия, олигурия.
Соблюдение асептики и протокола по уходу за ЦВК позво-
ляют свести инфекционные осложнения к минимуму.
Метаболические осложнения (3—25 % случаев):
• гипо- и гипергликемия;
• нарушения электролитного баланса;
• повышение уровня азота мочевины в крови;
• повышение уровня аминотрансфераз;
• холецистит (у больных, длительное время находящихся
на ПП);
• нарушение баланса липопротеинов (нельзя допускать
концентрацию триглицеридов > 10 г/л);
• обменные заболевания костей (у больных, длительно по-
лучающих ПП);
• почечная недостаточность;
• замедленное опорожнение желудка, синдром быстрого
насыщения, перенасыщение.
Профилактикой гипо- и гипергликемии является постоян-
ный контроль уровня глюкозы в крови и моче, соблюдение пра-
вил техники введения растворов глюкозы, учет клинических
особенностей пациента.
Наиболее часто нарушается баланс калия, фосфора и маг-
ния, поэтому, как правило, эти электролиты вводятся постоян-
но. Исключение составляют пациенты с острой почечной недо-
статочностью. Нарушения баланса кальция встречаются зна-
чительно реже. Для лечения гиперхлоремического метаболиче-
ского ацидоза хлориды натрия и калия заменяются ацетатными
солями. При наличии диареи, свищей дефицит электролитов за-
мещают электролитными растворами отдельно от парентераль-
ного питания.
Причиной повышения уровня азота мочевины в крови яв-
ляются, как правило, катаболические процессы из-за недоста-
точного поступления белков и/или калорий или избыточное
поступление белков.
Через 2—14 дней после начала ПП мотуг повыситься ACT,
АЛТ и/или щелочная фосфатаза (ЩФ). Обычно ACT и АЛТ нор-
мализуются без прекращения ПП. Незначительное повышение
710
ГЛАВА 9. ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ
ЩФ может сохраняться из-за холестатического эффекта ПП и за-
стоя желчи у больных, находящихся на ПП более 4 недель.
Повышение уровня триглицеридов может быть связа-
но с инфузией жировых эмульсий. Снижение клиренса
триглицеридов наблюдается при почечной недостаточно-
сти и использовании циклоспорина. Для цирроза печени
это нехарактерно. При концентрации триглицеридов вы-
ше 10 г/л может развиться острый панкреатит. Для выяс-
нения поглотительной способности липидов пациентам
проводится тест: через 12 часов после инфузии жировой
эмульсии берется 1—2 мл сыворотки крови больного. Если
сыворотка прозрачная, то жировую эмульсию включают в
программу ПП. При наличии в сыворотке хилеза от пере-
ливания жиров воздерживаются.
Глюкозо-аминокислотные растворы и жировые эмульсии
вызывают замедленное опорожнение желудка и быстрое на-
сыщение, что может приводить к нарушению сердечной дея-
тельности и нейромышечной дисфункции, в связи с чем ка-
лорийность питательных смесей должна повышаться посте-
пенно в течение недели. Эффект быстрого насыщения может
сохраняться спустя некоторое время после отмены ППП.
Для профилактики перегрузки жидкостью и последующего
развития застойной сердечной недостаточности начало ПП
должно быть постепенным.
При длительном ПП отмечено снижение скорости клу-
бочковой фильтрации. Возможно, это связано с избыточ-
ным поступлением хрома и системными инфекциями.
Полный покой кишечника в течение длительного време-
ни приводит к дегенеративным изменениям в слизистой обо-
лочке тонкой кишки и, соответственно, к повреждению за-
щитного барьера слизистой оболочки. Профилактикой это-
го процесса является использование глютамина и раннее
подключение энтерального питания специализированными
смесями.
Таким образом, профилактика метаболических осложне-
ний — адекватное обеспечение пациента всеми компонентами
ПП, соблюдение всех правил введения питательных растворов,
мониторирование гомеостаза.
711
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Особенности парентерального питания при различных па-
тологических состояниях
При расчете программ ПП должны учитываться не только
общие потребности организма в белке и калориях, но также и
особенности метаболизма, присущие различным заболеваниям
и их стадиям. Патология желудочно-кишечного тракта чаще
всего является показанием для применения ПП. Именно для его
заболеваний разработаны стандартные программы ПП, предста-
вленные в табл. 9.9.
Обязательно введение электролитов и витаминов в соот-
ветствии с суточными потребностями.
ВПП или ЧПП могут применяться при подготовке больных
к хирургическому вмешательству, в послеоперационном перио-
Таблица 9.9
Основные характеристики Полное ПП Вспомога- тельное ПП
Количество условного белка на 1 кг массы тела, г/кг в сутки 1,0-2,0 0,6-0,7
Количество общей энергии на 1 кг массы тела, ккал/кг в сутки 30-40 16-30
Количество небелковой энергии на 1 г азота, ккал/г 150-200 60-120
Количество жидкости на 1 кг массы тела, мл/кг в сутки 30-35 Не менее 20
Продолжительность курса, сутки 10-14 10-14
де при благоприятном его течении, неполной проходимости
пищевода, синдроме мальабсорбции, коррекции врожденных ме-
таболических аномалий, кишечной инфекции и т. п.
ППП назначается в случаях длительного его использования:
осложнения послеоперационного периода, в т. ч. кишечные фи-
стулы, несостоятельность анастомозов, гнойно-септические
осложнения; обширные резекции тонкой кишки, отсутствие
712
ГЛАВА 9. ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ
акта глотания любой этиологии, дисфагия и т. д. ППП предъя-
вляет особо повышенные требования к обеспечению минераль-
ными компонентами и витаминами. Следует помнить, что ис-
пользование антибиотиков резко сокращает обеспеченность ор-
ганизма витаминами. При кишечных инфекциях, кишечных
фистулах, резекции тонкой кишки организм страдает от повы-
шенной потери электролитов и микроэлементов. Чем дольше па-
циент находится на ППП, тем острее может сказываться недо-
статочность минеральных компонентов и витаминов при не-
адекватном ими обеспечении.
Пример стандартных протоколов ППП и ВПП с использо-
ванием растворов аминоплазмаля и жировой эмульсии 2-го по-
коления приведен в табл. 9.10.
ПП при заболеваниях печени
При заболеваниях печени, сопровождающихся печеноч-
ной недостаточностью, происходит нарушение метаболизма
аминокислот с накоплением в плазме продуктов белкового ме-
Таблица9.10
Питательные компоненты Качественный состав
Полное парентеральное питание
Аминоплазмаль 10 % Е: 500-1000 мл Глюкоза 20 %-ная: 800—1600 мл Липофундин МСТ/ЛСТ 20 %- ный: 200—500 мл Аддамель* Виталипид* Солувит* Количество белка: 50—100 г Количество энергии: 1056— 2312 ккал Количество ккал/1 г азота: ISO- MS Углеводы: жиры: 60 :40 % Объем жидкости: 1500— 3100 мл** Содержание ионов натрия: 43 ммоль*** Содержание ионов калия: 25 ммоль*** Содержание ионов магния: 2,6 ммоль Содержание дегидрофосфата: 9,0 ммоль
713
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Окончание табл. 9.10
Питательные компоненты Качественный состав
Вспомогательное парентеральное питание
Аминоплазмаль 5 % Е: 500— 1000 мл Глюкоза 10 %-ная: 400—1200 мл Липофундин МСТ/ЛСТ **** 20 %-ный: 100—200 мл Аадамель* Виталипид* Солувит* Количество белка: 25—50г Количество энергии: 364— 895 ккал Количество ккал/г азота: 91—112 Углеводы: жиры: 60:40% или 50:50 % Объем жидкости: 1000— 2400 мл** Содержание ионов натрия 43 ммоль*** Содержание ионов калия 25 ммоль*** Содержание ионов магния 2,6 ммоль Содержание дигидрофосфата 9,0 ммоль
•Добавки аддамеля, виталипида и солувита вводят в количестве 1 дозы в первом
литре раствора.
**Для снижения объема жидкости увеличивают концентрацию раствора глюко-
зы или дозу используемой жировой эмульсии.
***По показаниям основные электролиты могут вводиться дополнительно.
****В связи с тем что в первые двое суток после операционной травмы происхо-
дят глубокие нарушения жирового и углеводного обменов при снижении спо-
собности усваивать вводимые питательные вещества, а у неистощенных боль-
ных дефицит жирных кислот возникает примерно через 2 недели, включение
жировых эмульсий при коротком курсе послеоперационного ПП необяза-
тельно.
таболизма (ароматические аминокислоты, метилмеркаптаны,
серотонин, аммоний и др.), что способствует развитию печеноч-
ной энцефалопатии (цирроз печени, гепатиты, холестаз, мно-
жественные травмы, алкогольные поражения, воздействие ток-
714
ГЛАВА 9. ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ
сических продуктов и т. п.). Риск прогрессирования процесса мо-
жет быть уменьшен при снижении количества белка, вводимо-
го при ПП, или путем введения специальных аминокислотных
растворов с высокими концентрациями аминокислот с развет-
вленными цепями и низкими концентрациями ароматических
аминокислот по протоколу ПП, приведенному в табл. 9.11 [Ца-
цаниди К.Н., Манукян Г.В., 1990].
После снятия болевого синдрома и стабилизации функции
печени и поджелудочной железы количество вводимого белка и
энергетических калорий могут быть увеличены. У больных с ал-
когольным поражением печени или холестазом, которые плохо
Таблица 9.11. Протокол ПП при заболеваниях печени
и поджелудочной железы
Питательные компоненты Количественный состав
Аминоплазмаль Гепа 10 %-ный: 500 мл Глюкоза 10—20 %-ная: 400 мл Липофундин МСТ/ЛСТ 20 %- ный 0—100 мл Электролиты: натрий, калий, магний Аддамель Солувит Виталипид Количество белка: 48—50 г Количество энергии: 164— 520 ккал Количество ккал на 1 г введенного азота: 21—69 Объем жидкости: 900—1000 мл
переносят введение жиров с длинноцепочечными триглицери-
дами, в составе ПП увеличивают удельный вес калорий углевод-
ного происхождения и жировые эмульсии со среднецепочечными
триглицеридами.
ПП при панкреатитах
С большой потерей белковых компонентов связано тече-
ние панкреатитов, особенно в острой стадии. Так как острый
панкреатит нередко сопровождается печеночной недостаточ-
ностью, то в острый период рекомендуется малобелковое и
низкокалорийное ПП с применением аминокислотных ра-
створов специального назначения при полном исключении
715
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
приема пищи через рот. Продолжительность лечебного голо-
дания с внутривенным обеспечением питательными компо-
нентами зависит от тяжести течения острого панкреатита:
при легком течении и рецидивах воспаления — до 7 суток, при
средней тяжести — до 8—12 суток и до 18—22 суток — при
тяжелом течении заболевания. Только полная нормализация
ферментов поджелудочной железы позволяет пересмотреть
схему ПП в сторону увеличения квоты основных питательных
компонентов и подключения специализированного энте-
рального питания [Пугаев А.В., 1988; Пугаев А.В. и др., 1986].
ПП при заболеваниях почек
Снижена переносимость белка и у больных с заболева-
ниями почек. Катаболические состояния нередко ослож-
няются повышением уровня калия, фосфора и магния в сы-
воротке крови, увеличением уровня аминокислот при выра-
женной гипоальбуминемии. ПП следует проводить с учетом
этих нарушений. Рекомендуется снижать количество вводи-
мого белка (0,7—0,8 г/кг в сутки) с одновременным повыше-
нием отношения небелковых калорий к азоту (до 300 : 1), что
способствует усилению анаболических процессов и возвра-
щению белка в клетку. Для краткого и среднего по времени
ПП у больных с почечной недостаточностью применяют
растворы, содержащие только незаменимые аминокисло-
ты (табл. 9.12) [Щербакова Г.Н., Горяйнов В.А., 1997; Ма-
лышев В.Д., 1998].
Программа ПП подключается за 40—60 мин до окончания
гемодиализа.
Таблица 9.12. Протокол ПП у больных с хронической почечной
недостаточностью
Питательные компоненты Качественный состав
Аминостерил Нефро: 250 мл Глюкоза 20 %-ная: 400 мл Липофундин МСТ/ЛСТ 20 %- ный: 0—100 мл Количество белка: 13,75 г Количество энергии: 320— 520 ккал Количество ккал/1г азота: 145-236 Объем жидкости: 650—750 мл
716
ГЛАВА 9. ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ
ПП при заболеваниях легких
Использование ПП у больных с заболеваниями легких
имеет свои особенности. Выраженный белково-энергети-
ческий дефицит сопутствует большинству хронических за-
болеваний легких, который не всегда удается корригиро-
вать средствами натурального или дополнительного энте-
рального питания. Такие пациенты негативно реагируют на
избыток в питательном рационе жидкости, белка и особен-
но углеводов. В результате метаболизма углеводов (а также
избыточного количества белка, не обеспеченного небелко-
выми калориями) образуется большое количество углеки-
слого газа. При наличии хронических обструктивных пора-
жений легких выведение углекислого газа нарушено, поэто-
му последствия могут быть весьма серьезными, вплоть до
развития респираторного дистресс-синдрома. Инфузия бел-
ка повышает минутную вентиляцию, увеличивая чувстви-
тельность к углекислому газу, т. е. увеличение в составе ПП
белка может способствовать улучшению вентиляции у боль-
ных, которых переводят с искусственной вентиляции на
естественное дыхание. Однако избыток белка может вызы-
вать одышку и ухудшение дыхательных функций. Профилак-
тикой подобных явлений может быть поступление белка в
дозе 1 г/кг с адекватным его энергетическим обеспечением,
при котором соотношение калорий углеводного и жирово-
го происхождения должно быть либо равным, либо соста-
влять 40 : 60 % [Лукомский Г.И., Алексеева М.Е., 1976].
ПП при сердечной недостаточности
При сердечной недостаточности, синдроме Пиквика
больше пользы приносят гипокалорийная диета и потеря
массы. При отсутствии выраженной сердечной недостаточ-
ности обычно нет противопоказаний к ПП. Больные с сер-
дечной патологией в условиях аэробного гликолиза хорошо
переносят все основные компоненты ПП. Сложности возни-
кают с объемом жидкости, электролитным составом и осмо-
лярностью инфузируемых растворов [McClave S.A. et
al.,1990], поэтому у больных кардиохирургического профи-
ля в послеоперационном периоде предпочтительнее раннее
энтеральное питание специализированными смесями.
717
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ПП при синдроме «короткой петли»
Особенно тщательный подход необходим при проведении
ПП длительное время (30 дней и более), как, например, при
синдроме «короткой петли». ППП в ближайшем послеопераци-
онном периоде требует тщательной сбалансированности по всем
питательным компонентам в адекватных количествах. Переход
к питанию легкоусвояемыми смесями и натуральными продук-
тами должен быть постепенным. Сроки перехода зависят от
объема выполненной резекции. Длительно сохраняются ограни-
чения для введения энтеральным путем жировых компонентов.
ПП и сепсис
Клиническая картина при сепсисе представляет собой ре-
зультат воздействия на организм бурно развивающейся патоло-
гической микрофлоры, с одной стороны, и реакцию организма
на эту микрофлору, с другой стороны. Поэтому сепсис характе-
ризуется наличием микроорганизмов в крови, циркуляторными
нарушениями, метаболическими нарушениями и органной не-
достаточностью. Причем разные стадии сепсиса имеют свои ме-
таболические и другие особенности. В целом характерным изме-
нением метаболизма при сепсисе является усиление окисления
белка. Потери азота могут достигать 30-50 г в сутки. В1 -3-й ста-
диях наблюдаются гипергликемия и инсулинорезистентность.
Мышечная ткань получает энергию в результате окисления ами-
нокислот и гликолиза, вследствие чего часто наблюдается гипер-
лактатемия, особенно в 3-й и 4-й стадиях, когда страдает функ-
ция печени. Липолиз усиливается в 1-й и 2-й стадиях, снижает-
ся в 3-й стадии и снова усиливается в 4-й стадии. Клиренс жиров
возрастает в 1-й стадии, находится в пределах нормы во 2-й ста-
дии и значительно снижается в 3-й и 4-й стадиях.
Учитывая все многообразие метаболических изменений в
разных стадиях сепсиса, рекомендации по составу и количеству
парентерального питания также отличаются разнообразием и по-
рой противоречат друг другу, что вызывается сложностью мета-
болических процессов при сепсисе. Дозы аминокислот не дол-
жны превышать 2,0—2,5 г/кг массы тела в сутки, несмотря на то
что это не компенсирует большие потери азота. В 3-й и 4-й ста-
диях с учетом печеночной недостаточности рекомендуется наз-
начать адаптированные растворы аминокислот. Энергетическое
718
ГЛАВА 9. ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ И ИНТЕНСИВНАЯ ТЕРАПИЯ
обеспечение при сепсисе также является довольно спорным.
Одними авторами подчеркивается, что формально сепсис явля-
ется противопоказанием для введения жировых эмульсий, одна-
ко гипергликемия и инсулинорезистентность не дают покрыть
возникающие энергетические потребности одними углевода-
ми. Поэтому другие авторы рекомендуют до 50 % небелковых ка-
лорий восполнять жирами. Однако доза должна подбираться
индивидуально в соответствии со способностью организма к
клиренсу жиров, особенно в 3-й и 4-й стадиях, когда клиренс за-
тягивается.
Список основной литературы
1. Бахман Аллан Л. Искусственное питание: Справочное ру-
ководство по энтеральному и парентеральному питанию.
СПб., 2001.
2. Вретлинд А., Суджян А. Клиническое питание. М., 1990.
3. Исаков Ю.Ф., Михельсон В.А., Штатнов М.К. Инфузион-
ная терапия и парентеральное питание в детской хирургии.
М., 1985.
4. Костюченко А.П., Костин Э.Д., Курыгин А.А. Энтераль-
ное искусственное питание в интенсивной медицине.
СПб., 1996.
5. Козлов И.А. Интенсивное энтеральное и парентеральное
питание как компонент анестезиологического обеспечения
кардиохирургических вмешательств: Дис. ... канд. мед.
наук. М., 1985.
6. Константинов Б.А., Рагимов А.А., Дадвани С.А. Трансфу-
зиология в хирургии. М., 2002.
7. Корчак А.М., Щербакова Т.Н. и др. Внутривенное питание
больных после резекции тонкой кишки // Вопросы пита-
ния. 1987. №4. С. 28-31.
8. Луфт В. М., Костюченко А.Л. Клиническое питание в интен-
сивной медицине. Практическое руководство. СПб., 2002.
9. Лукомский Г.И., Алексеева М.Е. и др. Парентеральное пи-
тание больных с гнойными заболеваниями легких и плев-
ры // Грудная хирургия. 1976. № 2. С. 57—61.
719
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
10. Лыскин Г.И., Щербакова Г.Н. и др. Искусственное лечеб-
ное питание в хирургии пищевода // Вестник АМН
СССР. 1990. № 10. С. 54-59.
11. Малышев В.Д. Парентеральное питание: современные
концепции и методические приемы // Анестезиология и ре-
аниматология. 1998. № 1. С. 55—64.
12. Мокеев И.Н. Инфузионно-трансфузионная терапия. Спра-
вочник. М., 2002.
13. Попова Т.С. Тамазошвили Т.Ш., Шестопалов АЕ. Парен-
теральное и энтеральное питание в хирургии. М., 1996.
14. Попова Т.С., ШестопаловА.Е.,ТамазашвилиТ.Ш., Лейдер-
ман И.Н. Нутритивная поддержка больных в критическом
состоянии. М., 2002.
15. Пугаев А.В. Тактика лечения острого панкреатита: Дис....
д-ра мед. наук. М., 1988.
16. Рагимов А.А., Щербакова Г.Н., Соловьева И.Н. Паренте-
ральное питание в хирургии. М., 1999.
17. Руководство по парентеральному и энтеральному пита-
нию / Под ред. И.Е. Хорошилова. СПб., 2000.
18. Салтанов А.И., Обухова О.А., Кадырова Э.Г Оценка пита-
тельного статуса в анестезиологии и интенсивной терапии
Ц Вестник интенсивной терапии. 1996. № 4. С. 42—49.
19. Современная инфузионная терапия. Парентеральное пи-
тание / Под ред. В. Хартига. М., 1982.
20. Цацаниди К.Н., Манукян ЕВ. Метаболическая основа бел-
ково-энергетической недостаточности и роль питатель-
ной поддержки у больных циррозом печени // Хирургия.
1990. №4. С. 137-145.
21. Щербакова Г.Н., Горяйнов В.А. Аминостерил КЕ Нефро в
коррекции гипопротеинемии у больных с хронической по-
чечной недостаточностью // Новое в трансфузиологии.
М., 1997. № 18. С. 30-32.
22. Щербакова Г.Н., Рагимов А.А. Парентеральное питание в
клинике: Учебн. пособие. М., 2002.
23. McClave S.A., Short A.F. et al. Total parenteral nutrition.
Conquering the complexities I I Postgraduate Medicine. 1990.
Vol. 88. № 1. P. 235-248.
ГЛАВА 10
Сосудистые доступы
для трансфузиологических
процедур
Большинство наиболее часто применяемых на практике
инвазивных процедур выполняются посредством того
или иного сосудистого доступа — от простой венепунк-
ции до реанимационных мероприятий, с диагностической целью
(от забора крови до введения контрастных веществ в коронар-
ные артерии), при проведении трансфузионной и инфузион-
ной терапии.
Трансфузия может быть произведена в зависимости от состоя-
ния и степени тяжести больного в венозную систему, артериаль-
ную систему и костный мозг. В повседневной клинической прак-
тике наиболее часто применяется и поэтому лучше освоен врача-
ми венозный доступ. Трансфузия в артериальную систему обыч-
но используется в реанимационной практике при крайне тяжелом
состоянии больного в порядке чрезвычайной срочности. Интра-
медуллярные переливания применяются в основном в педиатрии
в силу физиологических особенностей детского организма.
10.1. Венозный доступ
В зависимости от характера патологии и объема интенсив-
ной терапии используются различные способы пункции и ка-
тетеризации периферических и магистральных сосудов:
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
• чрескожная пункция периферических вен (венепункция);
• чрескожная пункция и катетеризация периферических вен;
• чрескожная пункция и катетеризация магистральных вен;
• пункция и катетеризация вен открытым способом;
• венесекция.
1 0.1.1. Венепункция
Венепункция (от лат. vena — вена и punctio — прокол) — ма-
нипуляция, представляющая собой чрескожный прокол стенки
вены с последующим введением иглы в просвет сосуда.
Венепункцию применяют для взятия крови с диагностиче-
ской и лечебной целями, для введения лекарственных веществ,
при непродолжительной инфузионной терапии.
Венепункция осуществляется преимущественно на верх-
них конечностях. Обычно местом пункции служат поверхност-
ные вены локтевого сгиба. При их недостаточной выраженно-
сти (особенности анатомического строения, спадение при шо-
ке, коллапсе) можно провести пункцию на тыле стопы или в
области внутренней лодыжки (табл. 10.1). При необходимости
инфузионной терапии в течение 2—3 дней производят или вене-
секцию, или чрескожную катетеризацию вен большего диаме-
тра, так как крупные вены менее подвержены воспалительным
изменениям. Кроме того, периферическая вена не всегда может
обеспечить достаточную объемную скорость введения трансфу-
зионных сред. Обычно катетеризацию центральных вен прово-
дят в отделении реанимации и интенсивной терапии.
Освоение артериального и венозного доступа необходимо
врачам всех специальностей. Навыки подобных манипуляций
приобретаются уже на рабочем месте. Однако венозная система
чрезвычайно вариабельна в силу конституционных особенно-
стей, различных анатомических вариантов, развития подкожно-
жировой клетчатки. Кроме того, при пункции некоторых вен
имеется риск повреждения жизненно важных структур. Многие
инфекционные заболевания передаются через кровь, среди ко-
торых такие опасные болезни, как СПИД, гепатиты, сифилис и
т. д. Это диктует необходимость обеспечения безопасности ин-
вазивных процедур не только для больного, но и для медицин-
ского персонала. Поэтому практикующий врач нуждается в чет-
722
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
ких методических рекомендациях для проведения подобных
манипуляций, что позволит ему приобрести нужные знания без
риска и опасностей, связанных с их изучением.
Общие осложнения венепункции
Ошибки при введении препарата. Препараты, введенные вну-
тривенно, действуют очень быстро, а при введении непредусмо-
тренного препарата или передозировке назначенного препара-
та может наступить смертельный исход до введения антидота. По-
этому необходимо внимательно проверять препараты перед вну-
тривенным введением. Название и дозу препарата надо читать
на ампуле, а не на коробке. Иногда, когда вовремя замечена
ошибка, больного спасает быстрота введения антидота, чаще
же требуется поддержание жизненно важных функций организ-
ма. Например, при глубоком угнетенном дыхании необходимо
искусственное дыхание изо рта в рот или изо рта в нос, пока не
будет начата искусственная вентиляция легких более совершен-
ным методом.
Глубокую гипертензию устраняют, приподняв ноги боль-
ного или поместив его в положение Тренделенбурга. Кроме то-
го, используют переливание внутривенно и в быстром темпе
любой имеющейся в наличии трансфузионной среды. Сердеч-
ная недостаточность выражается слабым пульсом, одышкой,
набуханием шейных вен.
В этом случае больного сажают, дают кислород и вводят мор-
фин или диоксин. При остановке сердца рекомендовано прове-
дение искусственного дыхания и закрытого массажа сердца.
Случайная внутриартериальная пункция. При проколе стен-
ки артерии достаточно прижать место прокола в течение 5 минут.
После этого заживают без осложнений даже большие дефекты.
Случайное введение любого раствора в артерию. В этом слу-
чае возможно развитие ишемии и некроза тканей. Первыми
признаками внутриартериального введения раздражающего ра-
створа являются жгучие боли, распространяющиеся вниз от ме-
ста введения. Иногда при отсутствии болей вслед за инъекцией
развивается выраженный артериальный спазм с побледнением
конечности и исчезновением периферического пульса. Возмож-
но развитие вазомоторного коллапса с замедлением действия вве-
денного препарата.
723
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
При подобной ошибке рекомендуется оставить иглу в про-
свете артерии и ввести через нее папаверин из расчета 40—80 мг
на 10—20 мл изотонического раствора хлорида натрия, 100—150 мл
местного анестетика в 0,5—1 %-ном растворе. Препараты можно
вводить в подключичную артерию и инфильтрировать вокруг
спазмированного сегмента артерии. Также начинают гепарино-
терапию для предотвращения тромбирования артерии и обеспе-
чивают венозный и лимфатический опок, приподняв конечность
до уровня сердца. Кроме того, рекомендуется погрузить проти-
воположную конечность в теплую воду для активизации колла-
терального кровообращения на пораженной конечности. Также
пораженную конечность заворачивают в стерильные полотенца
и содержат в тепле, но не допуская перегревания ее.
Воздушная эмболия. Воздушная эмболия — достаточно ред-
ко встречающееся, но тяжелое осложнение, связанное с прони-
кновением в вену больного некоторого количества воздуха. Од-
номоментное поступление в вену 2—3 мл воздуха представляет
опасность для жизни человека. Воздушная эмболия может быть
осложнением пункции как центральных, так и периферических
вен. Мы не будем останавливаться на случаях, являющихся
следствием оперативного вмешательства и проведения процедур,
связанных с инсуффляцией воздуха (при наложении пневмото-
ракса, пневмоперитонеума), а рассмотрим лишь осложнения
при внутривенных вливаниях.
Причиной воздушной эмболии в этих случаях могут явиться:
• неправильное заполнение кровью системы перед началом
трансфузии, когда оставшийся там воздух попадает в вену с пер-
вой порцией переливаемых растворов;
• несвоевременная остановка трансфузии, которая ведет
к попаданию воздуха в конце манипуляции;
• негерметичность или неправильный монтаж используе-
мой системы для трансфузий.
Значительные воздушные эмболии, вызванные внутривен-
ной терапией, всегда наблюдались редко, а с применением со-
временного инструментария частота их еще более уменьши-
лась, что обусловлено выпуском вместо флаконов пластиковых
пакетов для трансфузионных сред. Пакеты при опорожнении не
заполняются воздухом и содержат его очень немного, тем самым
724
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
исключая опасность воздушной эмболии. Она может развиться
при негерметичности систем во время проведения трансфузион-
ных процедур. Воздух, попавший в одну из вен, с током крови
поступает в правые отделы сердца, из него — в легочную арте-
рию. Здесь образуется воздушный эмбол, механически препят-
ствующий кровообращению.
Клинические проявления воздушной эмболии — внезапное
и резкое ухудшение состояния больного во время процедуры, об-
щее возбуждение, беспокойство. Больной задыхается, хватает-
ся руками за грудь. В груди возникает ощущение давления и
боли. Развивается цианоз губ, лица, шеи, катастрофически па-
дает АД, пульс нитевидный, частый. Как правило, при быстром
введении воздуха в количестве 2—3 мл и более смерть наступа-
ет через несколько минут от асфиксии.
Для исключения возможности воздушной эмболии в процес-
се пункции центральных вен больного укладывают на кровать с
опущенным головным концом, чтобы создать в пунктируемой ве-
не положительное давление. Если пункция связана с последую-
щей трансфузионной терапией, необходимо тщательно проверять
до начала манипуляции герметичность системы, заполнение
кровью или другой трансфузионной средой всех трубок системы
или аппаратуры. При использовании нагнетательных способов
следует своевременно прекратить трансфузию, оставив в контей-
нере или флаконе некоторое количество крови.
Исход воздушной эмболии чаще всего неблагоприятный.
При ее возникновении необходимо уложить больного в положе-
ние Тренделенбурга, чтобы воздух не обтурировал выходной от-
дел правого желудочка. Если наступает остановка сердца, про-
водят быструю торакотомию, аспирацию воздуха из правого же-
лудочка через толстую иглу, открытый массаж сердца и другие ре-
анимационные мероприятия.
Тромбоэмболии. Возникают при попадании в вену сгустков
различной величины, которые могут образоваться в переливае-
мой крови, эритроцитной массе или разноситься током крови из
тромбированных сосудов пациента. Клинически характеризуют-
ся появлением симптомов легочного инфаркта. Через некоторое
время после трансфузии у больного возникают боли в груди,
кровохарканье, лихорадка. Если большой стусток закупоривает
725
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
легочную артерию или ее ветвь, наблюдается картина воздушной
эмболии. Чаще всего причиной тромбоэмболии является неудач-
ная пункция сосуда, неправильная техника заготовки и хране-
ния крови и ее компонентов. Последние две причины реже спо-
собствуют возникновению тромбоэмболии, так как сгустки не
могут пройти через иглу. При закупорке иглы следует немед-
ленно прекратить трансфузию и удалить иглу. В качестве тера-
пии применяют стрептазы (стрептодеказа, урокиназа) — акти-
ваторы фибринолиза. Их вводят через катетер в легочную арте-
рию для местного воздействия на тромб. Также назначают гепа-
рин внутривенно (24 000—35 000 ЕД в сутки), сердечно-сосуди-
стые и болеутоляющие препараты.
Тромбофлебит. Возникает при многократных пункциях, при
длительных вливаниях (более 7—12 ч), при неудачной пункции
вены с ее проколом и образованием гематомы, при пункции
тромбированного сосуда. Характеризуется уплотнением по хо-
ду вены. Главное правило профилактики этого осложнения — со-
блюдение асептики при пункции вены.
Таблица 10.1. Выбор места для венепункции и катетеризации
Место пункции Показания
Рука'. Медиальная подкожная вена Латеральная подкожная вена Вены предплечья Вены тыльной поверхности руки Для непродолжительного ис- пользования Для длительной катетеризации
Подмышечная вена: Проксимальная часть медиаль- ной подкожной вены Латеральная подкожная вена При невозможности использо- вания дистальных вен руки
Грудная клетка'. Подключичная вена — над ключицей — под ключицей Длительное парентеральное пи- тание Длительная инфузия лекар- ственных препаратов
726
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
Окончание табл. 10.1
Место пункции Показания
Шея: Наружная яремная вена Внутренняя яремная вена Гемодиализ Измерение и мониторинг ЦВД Затруднение при пункции пери- ферических вен При недоступности поверхност- ных вен для введения централь- ного венозного катетера Для длительного парентераль- ного питания При недоступности поверхност- ных вен При искусственной вентиляции легких Мониторинг ЦВД Парентеральное питание Длительная инфузия лекар- ственных средств Гемодиализ Введение инотропных агентов
Нога: Бедренная вена Поверхностные вены голени Поверхностные вены тыла стопы При легочно-сердечной реани- мации При кратковременном доступе у больных в коматозном состоя- нии Гемодиализ Невозможность катетеризации подключичной или внутренней яремной вены для измерения ЦВД или введения инотропных агентов
727
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Рисунок 10.1. Места доступов к
веиам:
1 — внутренняя яремная вена;
2 — у. cephalica;
3 — v. basilica;
4 — v. cephalica policis;
5 — v. saphena magna;
6 — наружная яремная вена;
7 — ключица;
8 — первое ребро;
9 — подключичная вена;
10 — паховая складка;
11 — бедренная артерия;
12 — бедренная вена
Таблица 10.2. Размеры игл для венепункции у взрослых
Место введения Наружный диаметр иглы, № Минимальная длина иглы, мм
Вены руки Мили 16 Короткая — 40
Внутренняя яремная вена Мили 16 Короткая — 40, иногда 70
Подключичная вена Мили 16 Среднеключичный доступ — 60, более латеральный — 70
Наружная яремная вена 14 или 16 Короткая — 40
Бедренная вена 14 Короткая — 40
Обработка места пункции
Оперирующий должен обработать руки (достаточно мытья
с мылом), надеть халат, маску, перчатки. Если волосы на теле
больного не закрывают доступа к вене, их можно не сбривать.
Вначале кожу в месте пункции обрабатывают мылом или де-
728
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
тергентом, растворенным в воде, затем антисептическим препа-
ратом. Далее место обрабатывают спиртовым раствором йода
(1—2 %-ным) с последующей обработкой 70 %-ным этиловым
спиртом. Кожу очищают, начиная от места пункции, и обраба-
тывают по направлению от места венепункции круговыми дви-
жениями.
При пунктировании глубоких вен применяют местную ане-
стезию (1 %-ный раствор лидокаина вводится в кожу и подкож-
ную клетчатку).
В экстремальных ситуациях оперирующий должен действо-
вать по обстоятельствам в соответствии с реальными возможно-
стями соблюдения стерильности.
Существует несколько приемов, позволяющих облегчить
ход венепункции:
1. Наложение жгута способствует лучшему контурированию
вен. При этом должна сохраняться артериальная пульсация. Приме-
няется при венепункции поверхностных вен руки, подмышечной ямки.
2. Положение Тренделенбурга — больной лежит на столе, ру-
ки вытянуты вдоль туловища, головной конец стола опущен на
15—25°. Это увеличивает венозный приток, облегчает попадание
крови в шприц даже при минимальной аспирации и уменьшает опас-
ность воздушной эмболии. Используется при пункции и последующей
катетеризации подключичной вены, внутренней яремной вены.
3. Сдавливание вены пальцем выше места пункции для допол-
нительного контурирования вены. Применяется при доступах к на-
ружной яремной вене.
4. Применение пробы Вальсальвы — больного просят выдохнуть
при закрытой голосовой щели, а если проводится управляемое дыха-
ние, производят задержку дыхания на вдохе. Это увеличивает на-
полнение вены, уменьшает опасность пневмоторакса. Использует-
ся при пункции и катетеризации внутренней яремной вены.
Венепункция проводится иглой, отсоединенной от системы.
Размеры игл для венепенкции представлены в табл. 10.2. Пункция
включает в себя прокол кожи над веной и прокол ее стенки с вве-
дением иглы в просвет сосуда (приблизительно 1/2 длины иглы). По-
сле поступления из просвета иглы капель крови можно отсоеди нять
канюлю от системы или проводить катетеризацию. При получении
проб крови достаточно, чтобы только часть среза иглы находилась
729
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
в вене и обеспечивала вытекание крови. При внутривенных инъек-
циях это недопустимо, так как через оставшийся вне просвета со-
суда срез иглы вводимый раствор попадет в окружающие ткани. По-
этому при попадании кончика иглы в вену шприц прижимают к ко-
же, что при правильном нахождении среза иглы (повернут вверх) де-
лает безопасным продвижение ее внутрь сосуда, не опасаясь его
перфорации. Если пункция вены произведена с целью вливания ка-
ких-либо медикаментозных жидкостей, правильность попадания
иглы в сосуд проверяют потягиванием поршня шприца к себе. При
правильном попадании иглы струя крови свободно потечет в шприц.
Перед пункцией вены следует убедиться, нет ли в шприце с набран-
ным лекарством пузырьков воздуха. Для этого устанавливают шприц
строго вертикально иглой вверх и выпускают через иглу воздух и не-
большую часть вводимого раствора. При введении лекарства шприц
должен быть постоянно прижат к коже, чтобы кончик иглы нахо-
дился близко к ней. В этом случае попадание раствора под кожу мож-
но сразу заметить.
Места доступов к венам представлены на рис. 10.1
Вены руки: доступ через локтевую ямку
Наиболее часто венепункция осуществляется в перифери-
ческие вены руки в локтевой ямке (рис. 10.2).
Рисунок 10.2.
Венепункция периферических
вен руки:
1 — v. cephalica;
2 — V. cephalica;
3 — v. basilica;
4 — v. mediana cubiti
730
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
Преимущества. Вены локтевой ямки видимы, пальпируют-
ся, не наблюдается осложнений при непродолжительной кате-
теризации и, что самое главное, практически любой клиницист
имеет опыт венепункции в этой области.
Недостатки. Поверхностные вены руки непригодны для
длительной катетеризации, так как быстро развивается тромбо-
флебит и воспаление (через 24—48 ч после введения катетера).
Возможность подтекания раствора в подкожную клетчатку,
инфицирования и тромбозирования вен исключает введение
концентрированных растворов, препаратов калия, раздражаю-
щих сосудистую стенку и др. В связи с этим целесообразно ме-
нять место пункции каждые 24 ч или при появлении признаков
воспаления. Исключается возможность массивных инфузий.
Противопоказания. После наложения жгута вены невидимы
и не пальпируются. Наличие на руке флебита или воспаления
мягких тканей.
Используемые вены. Медиальная подкожная вена руки, ла-
теральная подкожная вена руки, вена на заднемедиальной по-
верхности предплечья.
Место пункции. Вблизи выбранной вены.
Положение больного. Сидя, рука отведена на 45°.
Инструменты. Игла № 14, минимальная длина — 40 мм.
Анатомия локтевой ямки. Венозная кровь из руки оттекает
по двум основным сообщающимся венам — медиальной и лате-
ральной подкожным венам руки.
Медиальная подкожная вена (v. basilica) поднимается вдоль
медиальной поверхности предплечья с тыльной поверхности ки-
сти в виде двух ветвей, сливающихся между собой перед локте-
вым сгибом. У локтя вена проходит спереди от медиального
надмыщелка, соединяясь с промежуточной веной локтя. Затем
вена ложится в медиальную борозду двуглавой мышцы плеча и
на половине протяжения плеча прободает фасцию. Остальные
вены заднемедиальной поверхности предплечья впадают в ме-
диальную подкожную вену. Они хорошо контурируются, но,
так как плотно не связаны с подкожно-жировой клетчаткой,
при пункции легко уходят из-под иглы.
Латеральная подкожная вена (v. cephalica) следует с тыльной
поверхности кисти на переднюю поверхность лучевого края
731
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
предплечья, где принимает многочисленные кожные вены пред-
плечья, укрупняется и идет к локтевой ямке. Здесь она анасто-
мозирует с медиальной подкожной веной и по боковой борозд-
ке двуглавой мышцы плеча ложится в бороздку между дельтовид-
ной и большой грудной мышцей, где прободает фасцию и впа-
дает под ключицей в подмышечную вену.
Промежуточная вена локтя. Представляет собой большую
соединительную вену, которая отделяется от латеральной под-
кожной вены ниже локтевого сгиба, проходит наискосок и над
локтевым сгибом впадает в медиальную подкожную вену руки.
Ход пункции. Для лучшего контурирования вены наклады-
вают жгут на верхнюю часть плеча, не сдавливая артерию
(рис. 10.3). (Силу ее сжатия определяют по исчезновению или ос-
лаблению пульса.) Больной несколько раз сжимает и разжима-
ет пальцы для лучшего наполнения вен кровью. Место обраба-
тывают йодной настойкой, затем спиртом. Пункция может быть
Рисунок 10.3. Пункция
периферических вен руки
проведена только иглой или иглой, соединенной со шприцем.
Иглу вкалывают правой рукой, опираясь ею же на руку больно-
го. Левой слегка натягивают кожу и постепенно проводят иглу
через кожу и стенку вены. Как только показалась капля крови,
732
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
иглу опускают слегка книзу и продвигают по ходу сосуда. Если
пункция осуществлена для внутривенной инъекции, то после по-
явления капли крови в игле жгут удаляют. При взятии же крови
из вены его оставляют до конца манипуляции. Иглу вводят на по-
ловину длины. После пункции иглу быстро извлекают, место уко-
ла придавливают стерильной марлевой салфеткой и смазывают
йодом. Больной сгибает руку в локте, сдавливая тем самым сал-
фетку. Отверстие в вене сразу затягивается.
Если в локтевой ямке пригодной для пункции вены нет,
руку поворачивают кнаружи и ищут удобный для венепункции
сосуд на заднемедиальной поверхности предплечья.
Пункция подмышечной вены
Показания к применению. При невозможности использова-
ния дистальных вен руки.
Преимущества. Пункцию подмышечной или дистальной
части подкожной вены производят вслепую, ориентируясь на
подмышечную артерию, которую находят пальпацией. Эта ве-
на используется при коллапсе, когда спадаются перифериче-
ские вены.
Анатомия. Поднявшись до подмышечной впадины, меди-
альная подкожная вена руки переходит в подмышечную вену (см.
рис. 10.4). Латеральная граница подмышечной впадины образу-
ется латеральным краем большой грудной мышцы. В верхней
Рисунок 10.4. Анатомия
подмышечной вены:
1 — подмышечная арте-
рия; 2 — медиальный кож-
ный нерв плеча; 3 — плече-
вое сплетение; 4 — малая
грудная мышца; 5 — боль-
шая грудная мышца;
6 — подмышечная вена;
7 — медиальная подкожная
вена руки
части подмышечной области на уровне нижней границы перво-
го ребра подмышечная вена переходит в подключичную вену.
733
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Недалеко от этого места в нее впадает латеральная подкожная ве-
на руки. В месте пересечения подмышечной вены и малой груд-
ной мышцы вена делится на три части. Наиболее удобна для
пункции из-за ее поверхностного расположения дистальная
часть подмышечной вены. Она отделена от кожи фасцией и
подкожно-жировой клетчаткой. К ней прилегает медиальный
подкожный нерв предплечья, а к нерву — подмышечная артерия.
Повреждение остальных образований плечевого сплетения во
время пункции маловероятно, так как они расположены ближе
к плечевой артерии.
Положение больного. Больной лежит на спине, голову держит
прямо, под головой подушка. Рука для пункции отведена, ладонь
подложена под затылок.
Положение врача. Стоя со стороны пункции.
Ориентиры. Пальпируют подмышечную артерию. Опреде-
ляют место перехода медиальной подкожной вены в подмы-
шечную вену.
Инструменты. Игла № 14, минимальная длина — 40 мм.
Место пункции. На 1 см медиальнее артерии, в месте пере-
хода медиальной подкожной вены руки в подмышечную вену.
Ход пункции. Асептические условия, при необходимости —
применение местной анестезии.
Для контурирования вен на подмышечную область на-
кладывают жгут как можно выше. Если подмышечная область
выражена сильно, то для лучшего пережатия вен подкладыва-
ют под жгут марлевую салфетку либо прижимают пальцами
свободной руки вену медиальнее пульсации подмышечной
артерии. Или, если есть ассистирующий, с его помощью мож-
но облегчить венепункцию, нажимая на медиальную часть
подмышечной области.
Конец иглы устанавливается в месте пункции, наклоняя ее
под углом 30° к поверхности тела и направляя к грудной стенке
параллельно подмышечной артерии. Во избежание повреждения
и ограничения этой артерии желательно держать на ней во вре-
мя пункции палец.
Подключичная вена
Преимущества. Преимущества использования подключич-
ной вены в трансфузиологии обусловлены ее анатомо-физиоло-
734
ГЛАВА 10, СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
гическими особенностями. Вена имеет большой диаметр (ее
диаметр у взрослого —12—14 мм).
Влагалище вены сращено с надкостницей ключицы и 1-го
ребра, грудино-ключичной фасцией, поэтому она отличается
постоянным расположением, неподвижностью, не изменяет
своего положения при перемене положения тела.
Связанная с окружающими тканями, вена не спадается да-
же при коллапсе, то есть когда другие сосуды становятся недо-
ступными для венепункции. Расположение вены обеспечивает
минимальную опасность внешнего инфицирования.
Кроме того, значительная скорость кровотока в вене препят-
ствует тромбообразованию, делает возможным вливание гипер-
тонических растворов, а большой диаметр позволяет одномо-
ментное введение значительных количеств жидкости.
Также необходимо отметить сравнительную простоту
проведения пункции и комфортные условия для пациента
(нет ограничений подвижности пациента в пределах постель-
ного режима).
Низкое давление в вене и плотность окружающих ее тканей
препятствуют образованию постинъекционных гематом.
Показания
1. Для введения катетера в центральные вены.
2. Измерение и мониторинг ЦВД.
3. При необходимости длительного и многократного введе-
ния трансфузионных средств в случаях невозможности тран-
сфузии через периферические вены (при шоке, спазме пери-
ферических сосудов).
4. Парентеральное питание.
5. Введение инотропных средств.
6. Гемодиализ.
7. При необходимости быстрой инфузии жидкостей.
Противопоказания
1. Венозный тромбоз.
2. Повышенная кровоточивость.
3. Нелеченый сепсис.
4. Травма ключицы.
5. Выраженная дыхательная недостаточность.
6. Синдром верхней полой вены.
735
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Анатомия. Подключичная вена расположена в нижней ча-
сти подключичного треугольника, образованного задним кра-
ем грудино-ключично-сосцевидной мышцы, средней частью
ключицы и передним краем трапециевидной мышцы, и пред-
ставляет собой продолжение подмышечной вены. Начинаясь
от нижней границы 1-го ребра и проходя за ключицу до соеди-
нения с внутренней яремной веной позади грудино-ключично-
го сочленения, на всем протяжении подключичная вена спере-
ди отделяется от кожи ключицей. На уровне верхней границы
ключицы подключичная вена достигает своей наивысшей точ-
ки. Вена лежит на передней лестничной мышце, а под мыш-
цей — подключичная артерия. Верхушка легкого расположена
глубже артерии.
Все существующие методы пункции подключичной вены
можно разделить на 2 группы: с надключичным и подключич-
ным доступом.
Надключичный доступ. Является более удобным доступом,
так как расстояние от кожи до вены короче (0,5—4 см), вена
расположена прямо под кожей и игла при пункции проходит
только через кожу и фасцию. При необходимости введения ка-
тетера в центральную вену надключичный доступ имеет большую
вероятность попадания. Игла проходит дальше от плевры, поэ-
тому меньше риск пневмоторакса. Преимущество этого досту-
па перед подключичным состоит и в том, что пункция более
доступна анестезиологу в ходе операции, когда он находится со
стороны головы больного: ход иглы при пункции соответству-
ет направлению вены. При этом игла постепенно отклоняется от
подключичной артерии и плевры, что снижает риск их повреж-
дения. Однако необходимо отметить, что длительная фиксация
иглы или катетера при этом доступе затруднена.
Подключичный доступ. В этом случае необходима игла боль-
шей длины, так как она проходит фасцию, кожу, мышечный
слой. Этот доступ более предпочтителен при длительной кате-
теризации (легче закрепить катетер и меньше условий для разви-
тия инфекции). При подключичном доступе лучше используют-
ся выраженные анатомические ориентиры, что способствует
большей безопасности, поэтому данный метод можно рекомен-
довать к применению у тучных больных.
736
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
К редким осложнениям пункции подключичной вены от-
носится повреждение нервных стволов, трахеи и щитовидной
железы, появление признаков тромбоза и тромбофлебита под-
ключичной и плечеголовной вен.
Подключичный доступ
Большинство авторов используемых методов предпочита-
ют выполнять пункцию подключичной вены на уровне середи-
ны ключицы.
Положение больного. Больной лежит на спине, головной ко-
нец стола опущен на 25° (положение Тренделенбурга). Руки вы-
тянуты вдоль туловища. Голову больного поворачивают в сторо-
ну, противоположную месту пункции. Под грудную клетку под-
кладывают валик или подушку.
Положение врача. Стоя со стороны пункции. Большинство
врачей отдают предпочтение правой стороне, так как при левос-
тороннем подходе имеется опасность повреждения грудного
лимфатического протока, впадающего в венозный угол у места
слияния внутренней яремной и левой подключичной вен.
Инструменты. Иглы № 14, минимальная длина — 60 мм.
Острие заточено под углом 35°, клиновидной формы с отогну-
тым к основанию среза иглы на 15°. Такая форма позволяет лег-
ко проходить кожу, связки, стенку вены и защищает кровенос-
ный сосуд от попадания жировой ткани.
Ориентиры. Середина ключицы, нижний край ее — треуголь-
ник, образованный грудинной и ключичной головками груди-
но-ключично-сосцевидной мышцы и верхним краем ключицы
(см. рис. 10.5).
Место пункции. На 1 см ниже середины нижнего края клю-
чицы (у детей — сразу у середины нижнего края ключицы).
Ход пункции. Асептические условия, при необходимости при-
менение местной анестезии. У больных с одышкой пункцию под-
ключичной вены и ее катетеризацию целесообразно выпол нять по-
сле интубации трахеи в состоянии искусственной вентиляции
легких. Это предотвращает образование воздушной эмболии.
Конец иглы устанавливается в место пункции. Шприц с
иглой поворачивают по направлению к голове. Затем его разво-
рачивают кнаружи, чтобы острие иглы указывало на треугольник,
образованный грудинной и ключичной головками грудино-клю-
737
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Рисунок 10.5. Наружные анатомические ориентиры при
венепункции и катетеризации подключичной и внутренней
яремной вен:
1 — подключичный доступ при венепункции подключич-
ной вены; 2 — надключичный доступ при венепункции под-
ключичной вены; 3 — внутренняя яремная вена; 4 — грудино-
ключично-сосцевидная мышца
чично- сосцевидной мышцы и верхним краем ключицы (из по-
ложения А в положение В) или в сторону яремной вырезки, по-
местив в нее в качестве ориентира палец. Иглу продвигают поза-
ди ключицы (конец ее должен скользить по задней поверхности
ключицы), держа шприц строго параллельно фронтальной пло-
скости тела для предотвращения пневмоторакса. Срез иглы дол-
жен быть повернут вниз.
Если нет появления венозной крови в шприце после прохож-
дения 5 см, слегка извлекают иглу, создавая разрежение в шпри-
це (игла могла проколоть обе стенки вены). Если кровь не аспи-
рируется, полностью извлекают иглу и повторно ее вводят, на-
правляя на 1 см выше яремной вырезки.
Возможны и другие точки пункции подключичной вены
при подключичном доступе:
738
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
а) непосредственно у нижнего края ключицы на уровне гра-
ницы между медиальной и средней третью ключицы. Такое рас-
положение точки пункции, по мнению ее сторонников, снижа-
ет возможность травмирования подключичной артерии, плече-
вого сплетения и плевры;
б) точка пункции расположена латеральнее середины клю-
чицы на I см книзу от нижнего края ключицы. По мнению ря-
да авторов, более латеральное расположение места пункции
уменьшает риск пневмоторакса.
Надключичный доступ
Существует много описаний методик пункций подключич-
ной вены с надключичным доступом, проводимых в одном и том
же месте, но различающихся направлением иглы (см. рис. 10.6).
Рисунок 10.6. Доступы при венепункции и катетеризации
подключичной вены: 1 — Aubaniac (1962); 2 — Mogil et al.
(1967); 3 — Morgans, Harkins (1972); 4 — Yoffa (1965);
5 — James, Myers (1973); 6 — Haapaniemi, Slatis (1974);
7 - Tofield (1969)
Положение больного. Больной лежит на спине, головной ко-
нец опущен на 25°. Руки вытянуты вдоль туловища. Голову боль-
ного поворачивают в сторону, противоположную месту пункции.
Под грудную клетку подкладывают подушку и валик.
Положение врача. Стоя со стороны пункции.
Инструменты. Иглы № 14—16, минимальная длина — 60 мм.
739
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Ориентиры. Латеральный край ключичной головки грудино-
ключично-сосцевидной мышцы сразу у верхнего края ключицы
(рис. 10.5).
Если больной в сознании, для лучшего контурирования
мышцы его просят приподнять голову, при этом нажимая рукой
на лоб больного.
1. Место пункции. Угол между ключичной головкой груди-
но-ключично-сосцевидной мышцы и верхним краем ключицы.
Ход пункции. Асептические условия, при необходимости
применение местной анестезии.
Острие иглы помещают в точку пункции так, чтобы оно
было расположено в каудальном направлении (положение А). За-
тем разворачивают шприц на 45° кнаружи (из положения А в по-
ложение В) и под углом 15° ниже фронтальной плоскости (по-
ложение С) (см. рис. 10.7). Обычно расстояние до вены 1—1,5 см.
Рисунок 10.7. Подключичный доступ при катетеризации
подключичной вены
740
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
2. Место пункции. Вершина угла между задней границей
грудино-ключично-сосцевидной мышцы и ключицей.
Ход пункции. Острие иглы помещают в точку пункции, держа
шприц в каудальном направлении. Затем его разворачивают
кнаружи, опуская ниже фронтальной плоскости на 10°. Иглу
вводят в направлении области, расположенной за рукояткой
грудины на уровне угла грудины.
3. Место пункции. На 2—3 см выше ключицы сразу у задне-
го края грудино-ключично-сосцевидной мышцы.
Ход пункции. Техника та же, но угол разворота шприца кнару-
жи из положения А в положение В меньше — 35°.
Осложнения:
1. Прокол артерии:
• немедленно извлекают иглу и прижимают пальцем на
5 минут.
• контролируют гемодинамику и дыхательные шумы для ис-
ключения пневмоторакса.
2. Воздушная эмболия:
• попытка извлечь воздух аспирацией через катетер;
• при стабильной гемодинамике поворачивают больного
на левый бок в положении Тренделенбурга для того, чтобы «за-
переть» воздух в правом желудочке. Воздух постепенно исчезнет.
3. Пневмоторакс:
• при подозрении на напряженный пневмоторакс вводят
иглу № 16 во второе межреберье по среднеключичной линии для
декомпрессии;
• если пневмоторакс меньше 10 %, проводят ингаляцию
100 %-ным кислородом и рентгенологический контроль каждые 4 ч;
• если пневмоторакс больше 10 %, дренируют плевраль-
ную полость.
4. Повреждение грудного лимфатического протока. Про-
является значительной наружной лимфореей. В таких случаях
необходимо удалить катетер и асептически закрыть место вкола.
Внутренняя яремная вена
Показания:.
1. Мониторинг ЦВД.
2. Парентеральное питание.
3. Длительная инфузия лекарственных средств.
741
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
4. Введение инотропных агентов.
5. Гемодиализ.
6. Искусственная вентиляция легких.
7. При недоступности или непригодности для пункции пе-
риферических вен.
Противопоказания:.
1. Нелеченый сепсис.
2. Венозный тромбоз.
3. Хирургическое вмешательство на шее в анамнезе (со сто-
роны предполагаемой пункции или катетеризации).
Преимущества. К положительным сторонам пункции вну-
тренней яремной вены относится минимальный риск пневмо-
торакса. Также необходимо отметить, что венепункция внутрен-
ней яремной вены предъявляет меньше требований к опыту и тех-
ническим навыкам врача, чем подобная манипуляция на подклю-
чичной вене, в связи с этим отмечается больший процент успеш-
ных катетеризаций. Кроме того, имеется возможность контро-
лировать кровотечение.
К отрицательным моментам следует отнести высокий риск
повреждения сонной артерии и грудного лимфатического про-
тока (при левостороннем доступе), дискомфорт для больного,
особенно при проведении длительного парентерального пита-
ния, плохая контурируемость вены у тучных больных, возмож-
ность спадения при глубоком волемическом шоке.
Анатомия. Внутренняя яремная вена — крупная вена, кото-
рая, как и подключичная, может быть использована для введения
короткого или центрального катетера. Ветви ее делятся на внутри-
черепные и внечерепные. Начавшись в яремном отверстии чере-
па, где она имеет расширение, вена проходит вдоль шеи под гру-
дино-ключично-сосцевидной мышцей. Яремная вена, сонная
артерия и блуждающий нерв проходят вместе в соединительно-
тканном влагалище, в котором вена лежит латеральнее блуждаю-
щего нерва и сонной артерии. Начинаясь в области медиального
края верхушки грудино-ключично-сосцевидной мышцы на шее,
заканчивается в латеральных отделах мышцы (место прикрепле-
ния латеральной головки мышцы к грудине) у основания шеи
(рис. 10.8). Позади вены расположена предпозвоночная пластин-
ка шейной фасции, предпозвоночные мышцы, поперечные отро-
742
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
стки шейных позвонков. Ниже к основанию шеи рядом с веной
расположены подключичная артерия, диафрагмальный и блуж-
дающий нервы, купол плевры. Позади грудино- ключичного соч-
ленения внутренняя яремная вена сливается с подключичной ве-
ной, образуя плечеголовную вену. Вена обладает способностью к
значительному изменению своего внутреннего объема в зависи-
мости от притока крови. Обе плечеголовные вены образуют верх-
нюю полую вену.
Рисунок 10.8.
Анатомия внутренней и
наружной яремной вены:
1 — наружная ярем-
ная вена; 2 — грудино-
ключично-сосцевидная
мышца; 3 — внутренняя
яремная вена; 4 — сонная
артерия
В месте слияния внутренней яремной и подключичной вен
слева впадает грудной проток, а справа — правый лимфатический
проток.
Ориентиры. Как отмечалось выше, внутренняя яремная ве-
на проходит по шее под грудино-ключично-сосцевидной мыш-
цей. Когда голова повернута в противоположную сторону, вена
расположена прямо по линии, соединяющей ушную раковину
с грудино-ключичным сочленением (рис. 10.5).
Положение больного. Больной лежит на столе, руки вытяну-
ты вдоль туловища. Головной конец стола опущен на 25° (поло-
жение Тренделенбурга). Под плечи подкладывается небольшое
полотенце. Шея повернута в противоположную от пункции сто-
рону. Обычно предпочтение отдается правой стороне, так как до-
ступ слева сопровождается большим риском повреждения груд-
743
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ного протока, образующего на уровне 7-го шейного позвонка ду-
гу, вливаясь в левую яремную вену и располагаясь прямо под ней.
Положение врача. Стоя у головы больного или с противопо-
ложной от пункции стороны.
Инструменты. Иглы № 14.
Ход пункции. Условия асептические, при необходимости
применяют местную анестезию.
Ниже описываем ход пункций, общий для всех вариантов до-
ступа.
1. Определяют место введения иглы на коже.
2. Помещают в эту точку иглу, направляя шприц каудально
(положение А).
3. В зависимости от метода шприц разворачивают кнутри
или кнаружи (из положения А в положение В).
4. Опускают или поднимают шприц относительно фрон-
тальной плоскости (из положения В в положение С).
5. Прокалывают.
Различают следующие виды доступа в зависимости от рас-
положения точки пункции относительно верхушки легкого — вы-
сокий (рис. 10.9), низкий (или центральный), задний, передний.
з
Рисунок 10.9.
Высокий медиальный
доступ при венепункции
и катетеризации
внутренней яремной вены
X — щитовидный
хрящ
Передний доступ. Позволяет пальпировать внутреннюю
яремную вену и сонную артерию. Определяют треугольник,
образованный головками грудино-ключично-сосцевидной
744
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
мышцы и ключицей. На вершине пальпируют сонную арте-
рию и сдвигают ее в медиальном направлении. Иглу вводят
в средней точке переднего края грудино-ключично-сосце-
видной мышцы и направляют к пересечению 4-го ребра с
парастернальной мышцей под углом 45° (скос иглы направлен
кверху). Глубина — 5 см. Если в игле не появляется кровь по-
сле ее продвижения, медленно извлекают иглу, постоянно
поддерживая разрежение в шприце. Если вновь кровь не по-
является, не меняя точки прокола, изменяют направление
иглы на 1—3 см латеральнее.
При проколе сонной артерии кровь красная и пульсирует.
В этом случае иглу удаляют и тампонируют область на 10— 15 минут.
Задний доступ. Хотя он менее удобен, но при этом доступе
меньше риск попадания в сонную артерию (рис. 10.10).
Рисунок 10.10.
Задний доступ внутренней
яремной вены:
1 — наружная
яремная вена
Точка пункции — иглу вводят под грудино-ключично-
сосцевидную мышцу под углом 15° на границе средней и нижней
трети ее латеральной части и направляют к над грудинной ямке,
постоянно поддерживая разрежение в шприце. Если нет обрат-
ного тока крови после продвижения иглы на 3 см, иглу медлен-
но извлекают, аспирируя шприцем.
Вена находится на глубине 5—6 см от поверхности кожи.
Необходимо удерживать иглу точно под брюшком мышцы.
Облегчает пункцию задержка дыхания на вдохе и применение
745
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
пробы Вальсальвы (увеличивает наполнение вены и уменьшает
опасность пневмоторакса).
Низкий (или центральный) доступ. Иглу вкалывают в точке
на расстоянии 0,5—1 см от медиального края наружной ножки
грудино-ключично-сосцевидной мышцы и на 1 см выше клю-
чицы, затем направляют каудально под углом 30—40° к гори-
зонтальной плоскости (рис. 10.11). При этом дважды возника-
ет ощущение препятствия и последующего «проваливания» иглы
при проколе фасций шеи и вены.
Осложнения
1. Прокол сонной артерии. Немедленно извлекают иглу и за-
жимают место пальцем.
2. Воздушная эмболия. В этом случае пытаются извлечь
воздух аспирацией через катетер. При остановке сердца начина-
ют реанимацию. Если состояние гемодинамики стабильное,
больного поворачивают в позе Тренделенбурга на левый бок
для «запирания» воздуха в правом желудочке. Воздух постепен-
но исчезает.
3. Пневмоторакс. При напряженном пневмотораксе вво-
дят иглу № 16 во второе межреберье по среднеключичной линии
для декомпрессии. В других случаях при необходимости дре-
нируют плевральную полость.
746
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
Наружная яремная вена
Преимущества. Вена расположена поверхностно, и вслед-
ствие этого нет опасности травматических осложнений пункции,
нет риска пневмоторакса. Вена хорошо контурируема даже у
тучных больных. Возможно использование у больных с различ-
ными нарушениями в свертывающей системе. Также необходи-
мо отметить удобное для больного положение головы при кате-
теризации и пункции этой вены и легкую контролируемость
кровотечения.
Показания-
1. Для введения центрального венозного катетера.
2. При длительном парентеральном питании.
3. При недостаточности периферических вен руки и при
отсутствии достаточного опыта пункции внутренней яремной и
подключичной вен.
Недостатки. Технические трудности при катетеризации
(особенно у молодых и апоплексичных больных). Затрудненный
уход при длительной катетеризации. Эта процедура может по-
влечь нарушение подвижности шеи.
Анатомия. Начавшись позади ушной раковины в области
заднечелюстной ямки, наружная яремная вена спускается, покры-
тая подкожной мышцей шеи, по наружной поверхности груди-
но-ключично-сосцевидной мышцы, пересекая ее наискосок
книзу и кзади (рис. 10.8). Затем она проходит за этой мышцей и
грудино- ключичным сочленением и под острым углом соединя-
ется подключичной веной. Именно это место является основным
препятствием для введения катетера из наружной яремной вены.
Вена имеет различную величину, и ее выраженность зави-
сит от конституционных особенностей пациента.
Положение больного. Больной лежит на спине, руки вытяну-
ты вдоль туловища, головной конец стола опущен на 25°. Голо-
ва повернута в сторону, противоположную месту пункции.
Положение врача. Стоя за головой больного.
Инструменты. Игла № 14—16, длина — 40 мм.
Ориентиры. Грудино-ключично-сосцевидная мышца, на-
ружная яремная вена.
Ход пункции. Условия асептические, при необходимости
применяется местная анестезия.
747
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Пункцию производят в месте, где вена лучше всего видна
(рис. 10.12). Она слабо фиксирована соседними тканями и ото-
двигается от иглы. Во время введения иглы вену можно фикси-
ровать между большим и указательным пальцами. Вену сдавли-
вают выше места пункции пальцем (на 1—2 см выше ключицы),
Рисунок 10.12.
Венепункция и
катетеризация наружной
яремной вены
в результате чего происходит ее наполнение и лучшее контури-
рование. Скос иглы при пункции направлен кверху, сама игла —
по ходу сосуда. Вену перестают сдавливать над ключицей лишь
после поступления крови из просвета иглы и присоединения си-
стемы для трансфузий. Это предохраняет от развития воздушной
эмболии, так как в венах шеи отрицательное давление.
Бедренная вена
Показания'.
1. При легочно-сердечной реанимации.
2. Для кратковременного доступа к центральным венам у
больных в коматозном состоянии и у парализованных больных.
3. Гемодиализ.
Преимущества:
1. Простота введения катетера.
2. Нет риска пневмоторакса.
3. Удобное анатомическое расположение.
Осложнения:
1. Высокая склонность инфицирования.
748
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ___________
2. Возможность тромбоза (в 10-12 % случаев).
3. Пункция бедренной артерии (в 5 % случаев).
Противопоказания. Относительным противопоказанием
могут являться хирургические операции в паховой области в
анамнезе. Также не следует применять катетеризацию бедренной
вены у больных с выраженной коагулопатией, так как высок
риск повреждения бедренной артерии.
Анатомия. Венозный отток от нижних конечностей осу-
ществляется через систему поверхностных и глубоких вен. По-
верхностные вены расположены под кожей, а глубокие сопро-
вождают основные артерии.
Бедренная вена — основная глубокая вена нижней ко-
нечности — сопровождает бедренную артерию на бедре, ле-
жит в бедренном влагалище медиальнее артерии. В области
паховой связки бедренное влагалище находится на глубине
нескольких сантиметров от поверхности кожи. В бедрен-
ном треугольнике в вену впадают несколько крупных по-
верхностных вен. От кожи отделяется глубокой и поверх-
ностной фасциями бедра. Бедренная вена заканчивается на
уровне паховой связки, где переходит в наружную подвздош-
ную вену.
Ориентиры. Находят вену ниже паховой связки посред-
ством пальпации в центре воображаемого отрезка между верх-
ней передней подвздошной остью и лонным сочленением. Ве-
на расположена параллельно и медиальнее артерии.
Инструменты. Иглы № 14, длина не менее 50 мм.
Положение больного. Лежа на спине. Под ягодицы подкла-
дывают подушку, чтобы паховая область выступала кверху. Бе-
дро отводят и поворачивают немного кнаружи. Врач стоит со сто-
роны пункции лицом к голове.
Ход пункции. Проводится в асептических условиях под ме-
стной анестезией. Необходимо побрить кожу пациента. Вводят
иглу в бедренный треугольник ниже паховой складки. Вена
расположена на 1—2 см медиальнее пальпируемой артерии.
Угол наклона иглы к поверхности бедра 45—50° параллельно
пульсирующей артерии. Риск неудачной венепункции меньше
при медиальном подходе к сосуду, чем при латеральном. Обыч-
но в вену попадают на глубине 2—4 см (рис. 10.13).
749
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
Рисунок 10.13
Венепункция
и катетеризация
бедренной вены:
1 — бедренная вена;
2 — место пересечения
вены и связки;
3 — место пункции, на
1 см дистальнее связки
Осложнения. Прокол бедренной артерии. Если после по-
падания иглы в просвет сосуда вытекает пульсирующая красная
кровь, значит, пункция произведена неудачно. Иглу удаляют, там-
понируют паховую область в течение 20 минут. Затем наклады-
вают давящую повязку еще на 30 минут. Постельный режим не
менее 4 ч.
Вены лодыжки и стопы
Вены тыла стопы. В поверхностных слоях тыла стопы нахо-
дится венозное сплетение, из медиального отдела которого воз-
никает большая подкожная вена (v. saphena magna), из латераль-
ного — малая подкожная вена (v. saphena parva). Дистально от ве-
нозной сети стопы находится тыльная венозная дуга стопы, ar-
cus venosus dorsalis pedis, куда впадают тыльные плюсневые вены.
Места венепункции стопы изображены на рис. 10.14.
Рисунок 10.14.
Венозная сеть стопы.
Места венепункции
Поверхностные вены голени проходят между поверхност-
ной и собственной фасцией.
750
ГЛАВА 10, СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
А) Большая подкожная вена берет начало в области меди-
альной лодыжки. Проходит по переднемедиальной поверхности
ноги и впадает в бедренную вену на уровне овальной ямки. При-
нимает многочисленные притоки: подкожные вены передней по-
верхности голени и бедра, а также подкожные вены наружных
половых органов и передней стенки живота.
Б) Малая подкожная вена начинается на уровне латераль-
ного края стопы около латеральной лодыжки и впадает в подко-
ленную вену между головками икроножной мышцы, прободая
собственную фасцию.
Вены ног менее пригодны для пункций, так как в них лег-
ко возникают флебиты.
Вены тыльной поверхности кисти
В последние годы стали чаще использовать этот венозный
доступ, так как появились специальные катетеры, приспосо-
бленные для катетеризации вен кисти. Поверхностные вены ра-
звиты сильнее на тыле кисти, чем на ладонной поверхности.
В поверхностных слоях находятся многочисленные вены, кото-
рые служат истоками v. cephalica (на лучевой стороне) и v. basi-
lica (на локтевой стороне) и образуют rete venosum dorsale manus.
Основу этой сети составляют тыльные пястные вены (w. meta-
сагреае dorsales), из которых и формируются крупные подкож-
ные вены верхних конечностей.
Места венепункции тыла кисти изображены на рис. 10.15.
Рисунок 10.15.
Венозная сеть тыла кисти.
Места венепункции
Надо помнить, что инфузия раздражающих растворов (на-
пример, диазепама) в мелкие вены тыльной поверхности кисти
очень болезненна, а введение такого препарата, как тиопентал,
751
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
может вызвать развитие фиброза мелких мышц кисти за счет ре-
троградного его поступления в артериальное русло кисти.
10.1.2. Венесекция
Венесекция (от лат. vena — вена и sectio — рассечение) — ма-
нипуляция, представляющая собой вскрытие просвета вены
с последующим введением в ее просвет иглы, канюли, кате-
тера для проведения трансфузионной терапии. Применяется
при недоступности подкожных периферических вен. Необхо-
димость в этой манипуляции возникает из-за анатомических
особенностей организма (сильное развитие подкожной клет-
чатки, слабая развитость венозных стволов — так называемый
рассыпной тип) или вследствие функциональных причин
(шок, гиповолемия). Кроме того, данная процедура приме-
няется при проведении длительной инфузионной терапии.
Преимущества. Визуальный контроль введения катетера в ве-
ну и его надежная фиксация.
Ход манипуляции. Производят разрез кожи и клетчатки длиной
2—3 см поперечно, косо или параллельно проекции сосуда. Тупым
концом пинцета осторожно выделяют вену на протяжении 1,5—2 см
и подводят под нее 2 шелковые лигатуры. Дистальную лигатуру за-
вязывают и натягивают для фиксации вены. Стенку вены между
двумя лигатурами пунктируют толстой иглой или надрезают ее
на 1/2—1/4 диаметра. В просвет сосуда вводят итлу, канюлю или ка-
тетер. Над ним затягивают вторую лигатуру, присоединяют си-
стему для переливания. Края раны сближают шелковыми нитями.
Одним из швов дополнительно фиксируют катетер или иглу.
Из-за опасности развития флеботромбоза не рекомендует-
ся оставлять катетер в вене более 12—24 ч.
После окончания процедуры удаляют иглу или катетер из ве-
ны. Накладывают асептическую давящую повязку на 6—12 ч.
Осложнения. Полное пересечение вены, тромбоз, флебит,
тромбофлебит, инфицирование раны, ранение артерии.
Наиболее часто венесекция применяется на большой под-
кожной вене ноги.
Венесекция в области большой подкожной вены ноги
Показания. Проводится при невозможности чрескожного до-
ступа к венозной системе.
752
ГЛАВА 10, СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
Противопоказания:
1. Коагулопатия (протромбиновый индекс меньше 1,3).
2. Венозный тромбоз.
Необходимые условия и оборудование. Местная анестезия 1 %-
ным лидокаином.
Жгут, асептический раствор, стерильные повязки и перчат-
ки, скальпель, кровоостанавливающий зажим, ножницы, вну-
тривенный катетер, шелковые нити 3—0.
Положение больного. Лежа на спине с ногой в удобном для
венесекции положении.
Место венесекции. Большая подкожная вена ноги обычно
располагается приблизительно на 1 см спереди и на 1 см выше
внутренней лодыжки (рис. 10.16).
Рисунок 10.16.
Венесекция в области
большой подкожной вены
ноги:
1 — место разреза;
2 — медиальная
лодыжка;
3 — у. saphena
Ход манипуляции. Жгут, как правило, не накладывают. Обра-
батывают кожу над веной антисептиком и обкладывают сте-
рильным материалом.
Кожу над веной инфильтрируют лидокаином и производят
разрез кожи длиной 2,5 см (рис. 10.16). Осторожно выделяют ве-
ну, изолируя ее от нерва, проходящего по передней стенке ве-
ны (повреждение нерва вызовет в дальнейшем боли). Поднима-
ют вену, выделяя ее из ложа на протяжении 2 см, и проводят под
нее 2 лигатуры (дистально и проксимально). Перевязывают ве-
ну дистально, оставляя концы нити для подтягивания. Осторож-
но делают поперечный разрез на вене и расширяют его сомкну-
753
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
тым зажимом. Вводят внутривенный катетер в вену. Завязыва-
ют проксимальную лигатуру для фиксации катетера, не пережи-
мая его. Зашивают рану непрерывным нейлоновым швом и на-
кладывают стерильную повязку с мазью антибиотика.
Осложнения:.
1. Кровотечение. Прижимают место кровотечения стериль-
ной марлевой подушечкой.
2. Инфекция. Извлекают катетер и при необходимости наз-
начают антибиотики.
3. Флебит. Извлекают катетер и накладывают теплый ком-
пресс.
10.1.3. Катетеризация вен
Катетеризация — введение катетера в просвет вены посред-
ством чрескожной венепункции или венесекции с лечебной или
диагностической целью.
Различают катетеризацию центральных и периферических
вен. Катетеризация центральных вен обычно проводится в от-
делениях интенсивной терапии и реанимации. Для пункции
видимых поверхностных вен пользуются обычно короткими
иглами и канюлями (около 40 мм), для центральных вен необхо-
дима длина 60—70 мм. Максимальная длина катетера должна
быть равной расстоянию от места пункции до точки нахождения
конца катетера в вене и длине наружной части катетера, необхо-
димой для надежной фиксации его к коже больного. Осущест-
вляется процедура под местной анестезией (новокаином или
лидокаином). Начало всех манипуляций мы дали в разделе 10.1.1
«Венепункция» (см. соответствующие вены), поэтому здесь ход
процедуры будет изложен с момента попадания иглы в сосуд. До
настоящего времени нет четкого определения термина «катете-
ры» и «канюли». Обычно канюлями называют трубки меньше-
го диаметра, применяемые для инфузионной терапии через пе-
риферические вены. Катетеры имеют большую длину и исполь-
зуются для введения в центральные вены (подключичную или
внутреннюю яремную).
Способы введения катетеров
1. Введение катетера на игле (рас. 10.17). Катетер плотно одет
на иглу, которая находится внутри катетера. Свободным кончи-
754
ГЛАВА 10, СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
ком иглы осуществляют пункцию вены. После попадания в со-
суд проводят катетер и извлекают иглу. Отрицательной стороной
является то, что конец катетера острый и твердый, так как он про-
ходит через кожу. Поэтому возможно повреждение вены во вре-
Рисунок 10.17.
Методика введения
катетера на игле
(1,2,3 — этапы введения)
мя катетеризации или после установки катетера. Кроме того, по-
явление крови в шприце не является гарантией того, что кате-
тер находится в венозном сосуде, так как неизвестно, попал ли
в вену конец катетера, а не только иглы. Применяют для кате-
теризации подключичной и внутренней яремной вен.
2. Катетер вводится через иглу. Через широкий просвет
иглы, которой пунктировали вену, вводят катетер. Затем извле-
кают иглу. Так как через кожу и глубже лежащие ткани катетер
проходит через иглу, он может быть изготовлен из мягкого гиб-
кого материала и его конец не заостряется. Однако необходимо
указать на некоторые отрицательные стороны этого способа
введения катетера. Из-за того, что диаметр катетера меньше ди-
аметра места вкола иглы, имеется возможность просачивания
крови. Также существует опасность повреждения катетера сре-
зом иглы при попытке его извлечения при нахождении иглы в
просвете сосуда.
3. Введение катетера по проводнику — метод Селъдингера.
Начинается с введения иглы в вену. Через просвет иглы вводят
гибкий проводник, а после удаления иглы по проводнику прояви-
755
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
гают катетер. Основное преимущество этого способа введения ка-
тетера — прокол вены осуществляется иглой меньшего диаметра,
чем при других вариантах. До минимума уменьшается риск трав-
мирования жизненно важных структур (в том числе артерий). Од-
нако введение по проводнику нередко затруднено из-за клапанов
вен или их разветвлений. Используют при катетеризации подклю-
чичной, внутренней яремной и бедренной вен.
Общее правило при введении катетера: если катетер при
продвижении (с помощью вращательных движений вокруг оси)
встречает сопротивление, необходимо его извлечь и предпринять
новую попытку с изменением точки пункции. Прикладывание
силы при прохождении катетера по сосуду может вызвать пер-
форацию последнего, травмирование окружающих тканей и
повреждение самого катетера.
Фиксация катетера. После установки катетера производят
его фиксацию следующими способами:
1. С помощью лейкопластыря, который проводят под кате-
тером липкой стороной вверх, перекрещивают его над ним и при-
крепляют к коже. Применяется для фиксации на непродолжи-
тельное время. Пластырь быстро теряет свои свойства и может
вызвать раздражение кожи.
2. Для более длительной фиксации рекомендуются кожные
швы. При этом прошивают кожу и подкожную клетчатку шел-
ковой нитью, оборачивают концы ее вокруг катетера и туго за-
вязывают. Такой способ фиксации значительно уменьшает риск
эмболии катетером при его случайном отсечении.
Фиксация катетера препятствует его движениям, тем са-
мым снимая механическое раздражение интимы сосуда, и уме-
ньшает возможность появления местного тромбофлебита. Кро-
ме того, и это самое главное преимущество фиксации, при слу-
чайной перерезке катетера он не будет потерян в вене.
Общие осложнения катетеризации
1. Перфорация вены. Это может произойти как при вене-
пункции, так и при продвижении катетера. Результатом являет-
ся возникновение гематомы и попадание вливаемого раствора
в окружающие ткани, что в ряде случаев (в зависимости от пре-
парата) может вызвать их некроз. Для профилактики подобных
осложнений необходима тщательная фиксация катетера.
756
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
2. Тромбирование катетера и вены. Для предупреждения
данного осложнения необходим тщательный уход за катетером.
С этой целью его промывают раствором гепарина для удаления
фибриновой пленки, тем самым снижая и риск инфекции. При
длительном парентеральном питании рекомендуется 1 ЕД гепа-
рина на 1 мл инфузируемого раствора. Также следует использо-
вать катетеры, диаметр которых не мешает нормальному крово-
току в вене вокруг них. При тромбировании катетера его необхо-
димо удалить во избежание тромбоэмболии.
3. Флебит. Катетер, являясь инородным предметом, может
вызвать воспаление стенок венозных сосудов: механическое раз-
дражение, при этом с увеличением времени нахождения катете-
ра в вене возрастает риск возникновения флебита. Иногда воспа-
ление стенок связано с характером вводимого раствора — хими-
ческое раздражение. В данном случае рекомендуется разведе-
ние растворов и введение с минимальной скоростью. (Исключе-
ние составляют жировые эмульсии, концентрированные раство-
ры глюкозы, которые не вводят в периферические вены.)
Для профилактики этого осложнения необходима хорошая
фиксация катетера. При возникновении флебита катетер удаля-
ют и назначают противовоспалительную терапию.
4. Инфекции. Необходимо тщательное соблюдение правил
асептики, правильная обработка рук персонала, места пунк-
ции, инструментов. Инфицирование места пункции может вы-
звать тромбофлебиты, флебиты, тромбоэмболии и септицемию.
При появлении этих осложнений катетер сразу удаляют. Пе-
риодически проводят посевы инфузируемых растворов, крови па-
циента, с поверхности кожи в месте введения катетера. В случае
наложения стерильной повязки надо помнить, что она не дол-
жна быть полностью герметичной, так как в таких условиях
иногда обнаруживается быстрый рост бактерий и грибков (ис-
ключение — при нахождении места пункции вблизи открытой
раны, ожога или трахеостомы).
5. Воздушная эмболия. См. в разделе 10.1.1 «Венепункция».
6. Пневмоторакс. Чаше всего возникает при катетеризации
подключичной вены. В случае значительного спадения легкого
и смещения органов средостения (пневмоторакс > 10 %) необхо-
димо хирургическое вмешательство с аспирацией воздуха и дре-
757
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
нированием плевральной полости. При пневмотораксе < 10 %
рекомендуется ингаляция 100 %-ным кислородом и рентгеноло-
гический контроль каждые 4 ч. Если подозревается напряжен-
ный пневмоторакс, вводят иглу № 16 во второе межреберье по
среднеключичной линии для декомпрессии.
7. Поломка катетера. Благодаря новым технологиям по-
ломка катетера встречается редко и обычно в области наружных
его отделов. В этих случаях необходимо немедленное извлече-
ние и замена на новый катетер.
8. Циркуляторная перегрузка. Клинически характеризуется
кардиоваскулярной недостаточностью. При быстром введении
большого количества инфузируемых растворов может произой-
ти перегрузка правого отдела сердца с острым расширением и
остановкой сердца во время трансфузии. Это осложнение возни-
кает редко и обычно у пациентов с поражением сердечной мыш-
цы (воспаление, пороки сердца, склеротические или дистрофи-
ческие изменения и т. д.). Во время трансфузии появляется затруд-
нение дыхания, чувство стеснения в груди, цианоз губ. После это-
го наступает резкое нарушение сердечной деятельности и смерть.
Профилактика — введение капельно инфузируемых растворов,
при необходимости струйного введения — применение дроб-
ных доз. При появлении первых признаков этого осложнения не-
медленно прекращают трансфузию и для разгрузки правого от-
дела сердца делают небольшое кровопускание. После этого ре-
комендовано назначение оксигенотерапии, гипертонических
растворов глюкозы, норадреналина (мезатона, эфедрина), стро-
фантина (внутривенно), коргликона. В случае клинической смер-
ти проводят комплекс реанимационных мероприятий.
9. К осложнениям катетеризации нужно отнести такие ред-
кие виды, как гемоторакс, гемоперикард, гидроторакс, гидропе-
рикард. Для их устранения проводят целенаправленные хирур-
гические манипуляции. Также надо отметить возможность воз-
никновения нарушений сердечного ритма при механическом
воздействии катетера на миокард. Тампонада сердца может воз-
никнуть, когда конец катетера располагается ниже верхней гра-
ницы перикарда и перфорирует стенку сосуда или сердца. Иног-
да возможно расслоение аорты (при многочисленных попытках
катетеризации внутренней яремной вены катетером на игле).
758
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
Уход за катетером. Уход за катетером начинается с момен-
та его ввода в сосуд. Это соблюдение асептики во время установ-
ки, при смене повязки и инфузионной системы, надежная фик-
сация для исключения травмирования вены. Как уже отмечалось
выше, необходима гепаринизация для профилактики образова-
ния кровяного сгустка, а следовательно, для снижения вероят-
ности септических осложнений.
Вопрос о частоте смены катетера является спорным. Мно-
гие клиницисты считают, что лучше его заменять только при
появлении септицемии, лихорадки. Смену катетера можно про-
водить по методу Сельдингера без пункции вены, в асептических
условиях — в катетер вводится проводник, старый удаляется, а
по проводнику проводится новый катетер. После этого катетер
фиксируется к коже.
Периферический венозный доступ
Показания:
1. Длительная инфузионная терапия.
2. Частые внутривенные вливания.
3. Экстракорпоральная терапия.
4. Повышенный риск катетеризации центральных вен.
5. Необходимость проведения наркоза.
Противопоказания. Любое патологическое состояние пе-
риферической вены: флебиты, тромбофлебиты, инфицирование
места пункции.
Катетеризация через локтевую ямку. Минимальная длина ка-
тетера — 600 мм. После пункции в вену вводят на 2—4 см кате-
тер и распускают жгут.
Катетеризация через подмышечную вену. Минимальная длина ка-
тетера — 600 мм. Частота успешных катетеризаций — 90 %. После
пункции вводят катетер, положение которого определяют рентгено-
графически. Из осложнений иногда отмечается преходящая боль.
Центральный венозный доступ
Показания:.
1. Длительная инфузионная терапия.
2. Измерение центрального венозного давления.
Преимущества
Основное достоинство — быстрое разведение раствора кро-
вью и предотвращение раздражения стенки вены благодаря бы-
759
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
строму кровотоку. Возможность введения больших объемов ин-
фузионных растворов. Кроме того, необходимо отметить малую
вероятность выпадения катетера из вены (тщательная фиксация
катетера у места вкола препятствует его слишком далекому про-
движению, исключая опасность перфорирования стенки пра-
вого предсердия и возникновения летального гемоперикарда).
Центральный венозный катетер вводят через подключич-
ную, подмышечную или яремную вены. Для контроля положе-
ния катетера и исключения пневмоторакса проводят рентгено-
графию.
Признаки правильного нахождения катетера в центральной ве-
не: по катетеру должна поступать кровь, при соединении кате-
тера с манометром уровень давления колеблется соответствен-
но с дыхательными движениями, данные рентгенографии (если
кончик катетера перфорировал стенку сосуда и находится вне
его, вокруг него будет видно облачко контрастного вещества).
Катетеризация через подключичную вену (рис. 10.18). Мини-
мальная длина катетера — 200 мм. После успешного выполне-
ния пункции через иглу по направлению к сердцу вводят J-об-
разный проводник. Он не должен встречать сопротивления.
Если это происходит, проводник извлекают и проверяют на-
Рисунок 10.18. Катетеризация подключичной вены:
1 — подключичная артерия; 2 — латеральная подкожная
вена руки; 3 — подключичная вена; 4 — ключица; 5 — первое
ребро; 6 — второе ребро
760
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
хождение иглы, создавая разрежение в шприце: при интенсив-
ной струе крови повторяют введение проводника. После продви-
жения проводника производят извлечение иглы, расширяют
пункционное отверстие скальпелем, вводят расширитель по
проводнику на 3—4 см. Затем расширитель извлекают и вводят
центральный венозный катетер по проводнику (при правосто-
роннем доступе на длину 150 мм, при левостороннем — на
180 мм) Удаляют проводник, фиксируют катетер шелковыми
швами к коже и начинают инфузию. Помимо общих осложне-
ний венепункции и катетеризации, может наблюдаться ослож-
нение в виде неправильного нахождения катетера:
• в правом предсердии или правом желудочке. При таком
положении могут возникать нарушения ритма сердечных со-
кращений. Это связано с раздражением стенок правых отделов
сердца катетером. В данном случае подтягивают катетер, пока он
не попадет в верхнюю полую вену. При этом нарушения сердеч-
ного ритма проходят;
• в яремной или грудной вене. Необходимо повторное вве-
дение проводника в катетер, удаление катетера, а по проводни-
ку вводят длинный внутривенный катетер. После подтвержде-
ния нахождения его в вене проводник можно ввести в верхнюю
полую вену, изменив положение пациента — подтягивание ру-
ки в каудальном направлении и поворачивание головы и шеи в
сторону катетеризации.
Катетеризация внутренней яремной вены (рис. 10.19). После
успешной венепункции через иглу вводят J-образный проводник
(метод Сельдингера), затем извлекают иглу, расширяют пунк-
Рисунок 10.19.
Катетеризация внутренней
яремной вены:
1 — грудино-ключично-
сосцевидная мышца;
2 — внутренняя яремная
вена; 3 — первое ребро
761
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
ционное отверстие и вводят по проводнику центральный ве-
нозный катетер (справа на длину 90 мм, слева — на 120 мм). За-
тем извлекают проводник. После подтверждения правильно-
сти нахождения катетера (аспирацией крови) начинают инфу-
зию. Фиксируют катетер шелковыми швами к коже, наклады-
вают стерильную повязку. Осложнения могут наблюдаться те
же, что и в предыдущем варианте (неправильное положение ка-
тетера и нарушение сердечного ритма). Иногда отмечается син-
дром Горнера — птоз, миоз и энофтальм вследствие раздражения
каротидного клубочка, при повреждении иглой или гематомой
шейной части симпатического ствола, расположенного позади
сонной артерии, но вне сонного влагалища. Обычно это со-
стояние самостоятельно проходит и не требует специальной те-
рапии. К факторам, затрудняющим катетеризацию внутренней
яремной вены, относятся ожирение, короткая толстая шея у па-
циента, гиповолемия.
10.2. Интрамедуллярный доступ
Переливания в костный мозг. Целесообразность проведения
этого метода — в тесной анатомической связи между воронкооб-
разными синусами костного мозга и региональными сосудами.
Для внутрикостного переливания крови используются ко-
сти с достаточным количеством губчатого вещества (грудина,
эпифизы трубчатых костей, пяточные кости, крылья подвздош-
ных костей).
Интрамедуллярно можно переливать кровь, кровезамени-
тели и другие препараты.
Применение. Наиболее широко используется в педиатриче-
ской практике (что обусловлено мягкостью эпифизарных участ-
ков кости), когда другие способы оказались безуспешными, а вре-
мя не позволяет произвести венесекцию, при затруднении при-
менения обычных способов трансфузии. У детей до 3 лет не
проводится трансфузия в пяточную кость в связи с недостаточ-
ной ее васкуляризацией и слабым оттоком крови из нее.
Преимущества. Прочная фиксация иглы в кости позволяет
длительно вводить необходимое количество жидкости, не
опасаясь осложнений в виде флебитов и тромбофлебитов, эмбо-
762
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
лий, особенно при необходимости транспортировки беспокой-
ных больных с системой для трансфузий.
Техника внутрикостного переливания достаточно проста,
необходимы лишь специальные иглы для внутрикостной пункции.
Есть 2 способа внутрикостного введения — струйный и ка-
пельный. При капельном скорость введения составляет
5—20 капель в минуту. На переливание 200—300 мл крови нуж-
но 12 ч, поэтому данный способ интрамедуллярного вливания
не получил широкого распространения. При струйном способе
трансфузия проводится под давлением, скорость введения —
20—25 мл/мин, однако при струйных внутрикостных трансфу-
зиях наблюдается болезненность, вызванная давлением на губ-
чатую субстанцию. Болевой синдром менее выражен при тран-
сфузии в плоские кости (крылья подвздошной кости и грудину).
Осложнения. Редко при пункции грудины возможно проникно-
вение иглы в загрудинное пространство с возможным повреждени-
ем внутренних органов. Во избежание этого необходимо применять
иглы с оградительной муфтой, установленной на определенном
уровне (у взрослых — 1—1,2 см, у детей — 0,4—0,6 см). Безопаснее
вливания в подвздошные и бол ыпеберцовые (передняя внутренняя
плоская поверхность, на 1 см ниже бугристости) кости.
Ход пункции. При пункции костного мозга трубчатых костей
предпочтение отдается большой берцовой на 2—3 см ниже ее бу-
гристости. Нижняя треть данной кости также может быть исполь-
зована. Под местной анестезией под углом 60—90 ° вводят иглу
срезом вверх и прокалывают мягкие ткани. Затем иглу наклоня-
ют к периферии и вращательным движением в сочетании с бы-
стрым надавливанием вводят в компактный слой кости. Приз-
нак проникновения иглы в губчатое вещество — уменьшение со-
противления. Вводят новокаин, затем начинают трансфузию.
Аспирация костного мозга подтверждает правильность по-
ложения иглы. Другим признаком правильного положения иглы
является устойчивое вертикальное положение иглы в кости и сво-
бодная инфузия 5—10 мл жидкости. После проникновения иглы
в костный мозг производят ее фиксацию.
Для доступа к костному мозгу грудины применяют стернальную
иглу—иглу Кассирского. Место прокола обезболивают 2 %-ным ра-
створом новокаина (послойно: от кожи методом лимонной корки до
763
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
надкостницы). После прокола кортикального слоя активным свер-
лящим движением игла должна неподвижно стоять в кости. При
этом можно производить несколько проколов в разных местах для
ускорения переливания (через 2—3 иглы). Извлекают мандрен,
насаживают шприц с 1 %-ным раствором новокаина и вводят 5—10 мл
внутрикостно. После этого вместо шприца к игле присоединяют
приготовленную систему и приступают к гемотрансфузии.
Осложнения
1. Инфильтрация. В этом случае извлекают иглу и вводят в
новом месте.
2. Воспаление мягких тканей. Удаляют иглу и проводят ле-
чение антибиотиками.
3. Остеомиелит. Назначают необходимые медикаменты.
4. Компартмент-синдром — введение жидкости в фасциальное
влагалище. При этом осложнении производят фасциотомию.
10.3. Артериальный доступ
Как и при венозном доступе, доступ через артериальное русло
применяется с различными целями:
• для внутриартериального переливания крови;
• при катетеризации артерий.
Для внутриартериальной инфузии используют сосуды, наи-
более близкие к сердцу. Внутриартериальное переливание кро-
ви технически сложнее, чем внутривенное. Кроме того, воз-
можны осложнения в виде повреждения и тромбирования арте-
риальных стволов. В связи с этим в настоящее время данный ме-
тод практически не применяется.
Показания:
• клиническая смерть вследствие массивной невосполнен-
ной кровопотери;
• терминальное состояние при шоках любой этиологии
(АД составляет 60 мм рт. ст. и ниже);
• нет доступа к венам.
Преимущества. Данный доступ позволяет переливать до-
статочное количество трансфузионной среды в сосудистое русло
в максимально сжатые сроки. Непосредственное снабжение
кровью сосудов головного мозга и коронарных сосудов. Рефлек-
764
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
торная стимуляция сердечной деятельности. Кроме того, необхо-
димо отметить, что диаметр игл при артериальном доступе зна-
чительно меньше, чем при венозном.
10.3.1. Пункция артерий
Необходимость в данной манипуляции возникает при:
• получении проб артериальной крови;
• прямой регистрации артериального давления;
• введении контрастных веществ в случаях проведения
определенных методов обследования.
Наиболее часто используется пункция лучевой и бедренной
артерий.
Пункция лучевой артерии
Применяется чаще всего, так как в этом случае даже при на-
рушении кровообращения в лучевой артерии обычно не изме-
няется кровоснабжение кисти. Перед пункцией надо убедиться
в нормальном функционировании локтевой артерии и ее анасто-
мозов с ладонной дугой — тест Аллена на адекватность колла-
терального кровообращения: пережимают локтевую и лучевую
артерии пальцами так, чтобы кровь по венам оттекла от кисти и
она побледнела. Больного просят несколько раз сжать и раз-
жать ладонь. При этом ладонь приобретает мертвенно-бледный
оттенок. Освобождают локтевую артерию, и при достаточном
коллатеральном кровообращении, несмотря на пережатую луче-
вую артерию, нормальный цвет кожи восстанавливается через
5—10 с. Если же окраска руки не вернется за это время к исход-
ной, тест Аллена считается отрицательным, что указывает на
окклюзию лучевой артерии.
Анатомия. Лучевая и локтевая артерии являются ветвями
плечевой артерии и снабжают кровью кисть через поверхност-
ную и глубокую ладонную дугу. Лучевая артерия расположена
вдоль латерального края предплечья, пальпируется на запястье
у дистального конца лучевой кости. Здесь она покрыта лишь
фасцией и кожей.
Ход пункции. Кисть разгибают в лучезапястном суставе,
укладывают на валик, определяют пульсацию артерий. Кожу и
подкожную клетчатку инфильтрируют раствором анестетика,
так как пункция артерий является болезненной для пациента
765
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
процедурой. Анестезия устраняет также артериальный спазм.
Сосуд фиксируют между указательным и средним пальцами,
иглу вводят в проксимальном направлении под углом 45° к го-
ризонтальной плоскости. При медленном приближении к арте-
рии возникает ощущение передаточной пульсации. Иглу продви-
гают до появления крови. Более опытный врач может пункти-
ровать артерию под прямым углом, что снижает до минимума
травму артерии. На нахождение иглы в артерии указывает посту-
пление в шприц алой пульсирующей крови.
Пункция бедренной артерии
Анатомия. Бедренная артерия является продолжением ство-
ла наружной подвздошной артерии. Артерия пересекает середину
линии, проведенной от передней верхней ости подвздошной ко-
сти к лонному сочленению. Медиальнее артерии лежит бедренная
вена, оба сосуда проходят вместе в скарповском треугольнике.
Ход пункции. Бедренная вена пунктируется у пупартовой
связки (паховой). Используют крупную иглу диаметром 1,2 мм.
Для удобства манипуляции иглу насаживают на шприц. Сред-
ним и указательным пальцами левой руки прощупывают пульса-
цию стенки сосуда. Иглу вводят между пальцами срезом вниз во
избежание прокола противоположной стенки и направляют под
небольшим углом к коже. Как только игла проникает в просвет ар-
терии, кровь под сильным давлением поступает в шприц. После
этого шприц отсоединяют и приступают к дальнейшим необхо-
димым мероприятиям (трансфузия, катетеризация).
Осложнения пункции артерий
Гематома. Практически всегда возникает небольшой си-
няк, но его проявление можно уменьшить, прижав артерию во
время извлечения иглы в течение 4—5 минут (не меньше). Если
соблюдать это правило, то гематома не образуется.
Тромбоз. При однократной пункции полная закупорка просвета
артерии встречается крайне редко. Однако при нахождении канюли в
артерии в 10 % случаев [Ожильви К.,1984] на один-двадня исчезает пуль-
сация артерии дистальнее места пункции. При достаточном развитии
коллатерального кровообращения последствий не наблюдается.
При проведении манипуляций на крупных артериях ослож-
нения могут быть более серьезными, поэтому, если есть воз-
можность, желательно использовать лучевую артерию.
766
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИОЛОГИЧЕСКИХ...
Воздушная эмболия артерий. Чаще всего возникает при мо-
ниторинге артериального давления прямым методом. Попав-
ший в артериальную систему воздух быстро изгоняется из ле-
вого желудочка с закупоркой коронарных, мозговых и др. ар-
терий, что иногда чревато развитием тяжелых неврологиче-
ских поражений и внезапной смертью. Эти осложнения редко
встречаются при проведении манипуляций на перифериче-
ских артериях. Однако при промывании катетеров возможно
попадание пузырьков воздуха из шприца.
Больного необходимо уложить головой вниз на левый
бок, что уменьшает вероятность попадания воздуха в коронар-
ные артерии. Проводят гипербарическую терапию и ингаля-
цию кислородом, что способствует уменьшению размера пу-
зырьков воздуха.
10.3.2. Секция артерии
Ход манипуляции:
• Оперативным путем обнажается артерия.
• Артерия берется на 2 лигатуры.
• Периферический отдел пережимается марлевым или ре-
зиновым жгутом.
• Для предотвращения спазма артерии в нее вводится
10—15 мл 0,5 %-ного раствора новокаина.
• Пунктируется артерия.
• Фиксируют лигатурой иглу.
Кровь подогревается до температуры тела. Скорость пода-
чи 100—150 мл/мин под давлением 200—250 мм рт. ст. Инфузия
прекращается при быстром улучшении состояния больного и уве-
личении артериального систолического давления до 80—
90 мм рт. ст., что позволяет перейти к внутривенному доступу.
10.3.3. Катетеризация артерий
Данная манипуляция позволяет осуществлять непрерыв-
ный мониторинг частоты сердечных сокращений и артериаль-
ного давления в отделениях реанимации, частый забор проб
крови для определения ее газового состава. Внутриоперацион-
ный мониторинг проводят больным при высоком риске разви-
тия осложнений со стороны сердечно-сосудистой системы. По
767
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
частоте использования некоторые авторы [Чен Г. и соавт., 1996]
располагают артериальные доступы в следующем порядке:
• лучевой;
• бедренный;
• тыл стопы;
• подмышечный.
Эти же авторы предпочитают использовать лучевую артерию
и артерии тыла стопы для катетеризации «быстрыми» катетера-
ми или внутривенными ангиокатетерами, а бедренную и подмы-
шечную артерии канюлировать по методике Сельдингера.
Абсолютным противопоказанием к введению артериаль-
ного катетера считается наличие диализного шунта или артерио-
венозной фистулы в непосредственной близости от предполага-
емого места введения катетера.
Относительными противопоказаниями могут быть рас-
стройство гемостаза, наличие очага инфекции, нарушение пер-
фузии в области кровоснабжения выбранной для манипуляции
артерии.
Для катетеризации рекомендуется использовать некониче-
ский тефлоновый катетер (размер 20). Маленький диаметр ка-
тетера способствует адекватной перфузии дистальных по отно-
шению к месту введения участков. Введение конических кате-
теров чаще вызывает нарушение перфузии дистальных отделов.
Использование катетеров большего диаметра часто ведет к та-
кому осложнению, как образование тромбов.
Следует регулярно проверять перфузию дистальных по
отношению к месту введения катетера отделов после катете-
ризации сосуда. Иногда единственным проявлением нару-
шенной перфузии является боль либо в месте вокруг канюли,
либо дистальнее. Побледнение участков кожи в этих местах и
отсроченное заполнение капилляров является показанием к
удалению катетера. В ряде случаев для улучшения перфузии ис-
пользуют лекарственные препараты или прибегают к хирурги-
ческим методам.
Катетеризация лучевой артерии
Показания:
• проведение мониторинга гемодинамики;
• мониторинг газового состава артериальной крови.
768
ГЛАВА 10, СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
Противопоказания. Отрицательная проба Аллена.
Положение больного. Сидя или лежа. Кисть — ладонью вверх,
разогнута в запястном суставе (для лучшего разгибания под за-
пястье помещают свернутое валиком полотенце). Ладонь и пред-
плечье фиксируют к подставке для руки.
Ход манипуляции. Анестезия 1 % -ным раствором лидокаи-
на. Кожа обрабатывается антисептиком и обкладывается стериль-
ными марлевыми салфетками. Пункция осуществляется в месте
пальпации пульса у дистального конца лучевой кости ангиока-
тетером (20-й калибр) под углом 45°. Необходимо срез его дер-
жать вверх и продвигать до появления крови из иглы. После
этого ангиокатетер проводят для лучшего внутрисосудистого
расположения еще на 2 мм, удерживая иглу. Затем отсоединяют
иглу, пережимают пальцем проксимальный отдел лучевой арте-
рии, присоединяют систему для инфузии и фиксируют катетер
к коже с помощью шелковых швов.
Осложнения:
• кровь не появилась — извлекают ангиокатетер и повторя-
ют пункцию под углом 60°;
• кровь не появилась при извлечении иглы — катетер не на-
ходится в просвете артерии — катетер извлекают, пережимают
место пункции пальцем на 5 минут;
• ишемия пальцев руки — удаляют катетер.
Катетеризация бедренной артерии
Показания:
1. Длительное наблюдение за гемодинамикой.
2. Артериографические исследования.
3. Введение внутриаортального баллонного насоса.
Противопоказания
В анамнезе — наличие операций в паховой области.
Положение больного: лежа на спине.
Ход манипуляции. Область паха после бритья обрабатывается
антисептическим раствором и обкладывается стерильными салфет-
ками. Вводят лидокаин в кожу и подкожную клетчатку по ходу ар-
терии. Дальше ход процедуры, как при пункции бедренной артерии
(см. выше). После подтверждения того, что игла (18-го калибра) на-
ходится в артерии, отсоединяют шприц, зажимая канюлю иглы
пальцем (для предупреждения сильного кровотечения), и вводят
769
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
через иглу J-образный проводник по методике Селвдингера по на-
правлению к сердцу. После прохождения проводника извлекают
иглу, расширяют отверстие скальпелем и вводят центральный веноз-
ный катетер (16-го калибра) по проводнику в артерию. Затем удаля-
ют проводник и присоединяют необходимые системы или датчики.
Катетер фиксируется к коже шелковыми швами, сверху накладыва-
ют стерильные повязки. Необходимый постельный режим в течение
всего времени нахождения катетера в артерии.
Осложнения:
1. В шприце не появилась артериальная кровь — повторя-
ют процедуру с уточнением ориентиров. При повторной неуда-
че рекомендовано прекращение манипуляции.
2. Прокол бедренной вены — извлекают иглу и зажимают ме-
сто пункции рукой в течение 10 минут.
3. Проводник встречает сопротивление при движении по
игле — извлекают проводник, уточняют положение иглы аспи-
рацией крови и снова повторяют этап манипуляции.
4. Гематома — удаляют катетер, пережимают рукой место
пункции в течение 15—20 минут, накладывают тугую повязку на
30 минут. Необходимо соблюдать постельный режим 3—4 часа.
5. Тромбоз—удаляют катетер и наблюдают за пульсом на ар-
териях для своевременного распознавания дистальной эмболии.
Катетеризация подмышечной артерии
Показания:
• длительное наблюдение за гемодинамикой;
• артериографические исследования.
Противопоказания:, практически нет. Не рекомендуется про-
водить при плохом пульсе на дистальном конце лучевой артерии.
Положение больного. Лежа на спине, рука отведена и плечо
повернуто кнаружи.
Ход манипуляции. После бритья обрабатывают антисептиком
подмышечную область и обкладывают ее стерильными салфет-
ками. Вводят лидокаин в кожу и подкожную клетчатку по ходу
артерии. Пунктируют кожу иглой (18-й калибр) со шприцем и
продвигают ее под углом 45° по направлению к пульсу на под-
мышечной артерии, создавая разрежение в шприце. При по-
ступлении артериальной крови в шприц его отсоединяют, при-
жимают отверстие иглы пальцем и вводят J-образный провод-
770
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
ник по направлению к сердцу. При прохождении проводника
иглу извлекают, расширяют место пункции скальпелем и вводят
центральный венозный катетер (16-й калибр) по проводнику в
артерию. Затем удаляют проводник, присоединяют датчики и
фиксируют катетер шелковыми швами к коже. Сверху наклады-
вают стерильные повязки.
Осложнения:
1. Кровь не поступает в шприц на глубине 5 см — извлека-
ют иглу, поддерживая разрежение в шприце. При повторной
неудачной попытке пунктируют на 1 см дистальнее по ходу ар-
терии.
2. Пункция вены — при появлении в шприце венозной кро-
ви извлекают иглу и зажимают место пункции рукой на 10 минут.
3. Проводник встречает сопротивление — извлекают его и
уточняют положение иглы аспирацией крови в шприц.
4. Тромбоз — удаляют катетер и наблюдают за пульсом по хо-
ду сосуда.
5. Повреждение плечевого сплетения — удаляют катетер,
проверяют чувствительность и двигательную функцию, при
необходимости — консультация нейрохирурга.
Катетеризация артерии тыла стопы
Показания: наблюдение за гемодинамикой.
Противопоказания:, отсутствие пульса на артерии тыла стопы.
Ход манипуляции. Обрабатывают тыльную поверхность сто-
пы асептическим раствором и обкладывают стерильными сал-
фетками. Пальпируют пульс на уровне 1-го плюснево-клиновид-
ного сустава латеральнее длинного сгибателя пальца стопы. Ли-
докаином анестезируют кожу и прокалывают ее ангиокатетером
(20-й калибр).
Иглу направляют срезом вверх под углом 45° к поверхности ко-
жи. Продвигают катетер до появления крови. После этого ангиокате-
тер продвигают еще на 2 мм и, удерживая иглу, направляют катетер
внутрь артерии. Затем удаляют иглу и зажимают пальцем для преду-
преждения кровотечения. Устанавливают систему, фиксируют кате-
тер к коже шелковыми швами и накладывают стерильную повязку.
Осложнения:
1. Кровь не появилась в шприце — извлекают ангиокатетер
и пунктируют снова под углом 60°.
771
ТРАНСФУЗИОЛОГИЯ В РЕАНИМАТОЛОГИИ
2. Катетер не в просвете артерии — нет кровотечения после
удаления иглы — удаляют катетер и прижимают пальцем место
пункции на 15 минут.
3. Ишемия пальцев стопы — удаляют катетер и наблюдают
за состоянием пальцев.
Список основной литературы
1. Анестезиология и реанимация / Под ред. О.А. Долиной. М.:
Медицина, 1998.544 с.
2. Бунятян А.А. и соавт. Руководство по анестезиологии. М.:
Медицина, 1994. 656 с.
3. Дон X. Принятие решений в интенсивной терапии. М.:
Медицина, 1995.224 с.
4. Интенсивная терапия. Пер. с англ./ Под ред. А.И. Марты-
нова. М.: ГЭОТАР Медицина, 1999.640 с.
5. Клиническая хирургия. Пер. с англ./ Под ред. Р. Кондена
и Л. Найхуса. М.: Практика, 1998. 716 с.
6. Козинец Г.И. и соавт. Практическая трансфузиология. М.:
Триада X, 1997.
7. Малышев В.Д. Интенсивная терапия. М., 1997.
8. Мокеев И.Н. Инфузионно-трансфузионная терапия.
М., 1998.
9. Мухина С.А., Тарковская И.М. Атлас по манипуляции тех-
ники сестринского ухода. М.: АНМИ, 1995.256 с.
10. Основы неотложной хирургической помощи. Руководство
для врачей общей практики / Под ред. Р.Н. Калашникова.
Архангельск, 1999. 291 с.
11. Островерхов Г.Е., Бомаш Ю.М., Лубоцкий Д.Н. Опера-
тивная хирургия и топографическая анатомия. М.: Литера,
1998. 320 с.
12. Роузен М., Латто Я.П., Шэнг У. Нг. Чрескожная катетери-
зация центральных вен. Пер. с англ. М.: Медицина,
1986. 160 с.
13. Чен Г., Сола Х.Е., Лиллемо К.Д. Руководство по технике
врачебных манипуляций. Пер. с англ. Витебск, 1996.384 с.
14. Экстренная помощь в медицинской практике / Под ред.
К. Ожильви. Пер. с англ. М.: Медицина, 1984. 704 с.
772
ГЛАВА 10. СОСУДИСТЫЕ ДОСТУПЫ ДЛЯ ТРАНСФУЗИИ
15. Adar R., Mozes М. Fatal complications of central venous cathe-
ters /1 Brit. Med. J. 1971. № 3. P. 746.
16. Ayim E.N. Percutaneous catheterisation of the axillary vein and
proximal basilc vein 11 Anaesth. 1977. № 32. P. 753.
17. Aubaniac R. L’injection intraveineuse sous-claviculaire; advan-
tages et technique // Press Medicale 1952. Vol. 60. P. 1456.
18. Blitt C.D., Wright W.A., Petty W.G., Webster T.A. Central ve-
nous catheterisation via the external jugular vein 11 J. of the
Amer. Med. Assoc. 1974.Vol. 229. P. 817.
19. Bridges B.B., Carden E., Tacacs F.A. Introduction of central ve-
nous pressure catheters through arm veins with a high success ra-
te 11 Can. Anaesth. Soc. J. 1970. Vol. 26. P. 128.
20. Brikman A. J., Costley D.O. Internal jugular venipuncture // J.
of the Amer. Med. Ass. 1973. Vol. 223. P. 182.
21. Boulanger M., Delva E., Mailleet J.G., Paiment B. Une nouvel-
le voie d’abord de la veine jugulaire interne // Can. Anaesth. Sov.
J. 1976. Vol. 23. P. 609.
22. Civetta J.M., Gabel J.G., Gemer M. Intemal-jugular-vein pun-
cture with a margin of safety // Anaesthesiology. 1972. Vol. 36.
P. 622.
23. Daily P.O., Griepp R.B., Shumway N.E. Percutaneous internal
jugular vein cannulation //Arch. ofSuigery. 1970. Vol. 101. R 534.
24. Dufly B.J. The clinical use of polyethylene tubing for intravenous
therapy // Annals of Surgery. 1949. Vol. 130. P. 929.
25. English I.C.W., Frew R.M., Pigott J.F., Zaki M. Percutaneous
catheterization of the internal jugular vein // Anaesthesia. 1969.
Vol. 24. 521.
26. James P.M., Myers R.T. Central venous pressure monitoring:
complications and a new technic // Amer. Surgeon. 1973. Vol.
39. P. 75.
27. Gardner W.C., Mahr M.M., Milbum J.L. et al. Jemigan inter-
naljugular vein for placement of central venous catheter // Sur-
gery, Gynec. And Obstetrics. 1970. Vol. 130. P. 520.
28. Malatinsky J., Kadlic M., Majek M., Samel M. Misplacement
and loop formation of central venous catheters 11 Acta Anaesth.
Scand. 1976. Vol. 20. P. 237.
29. Mogil R.A., Delaurentis D.A., Rosemoud G.P. The intraclavi-
cular venepuncture //Arch, of Surgery. 1967. Vol. 95. P. 320.
773
ТРАНСФУЗИОЛОГИЯ в РЕАНИМАТОЛОГИИ
30. Mostert J.W., Кеппу G.M., Murphy G.P. Safe placement of
central venous catheter into internal jugular veins // Arch.of
Surg. 1970. Vol. 101. P. 431.
31. Morgan W.W., Harkins G.A. Percutaneous introduction of long-
term indwelling venous catheters in infants // J. of Pediatr. Sur-
gery. 1972. Vol. 7. P. 538.
32. Ross S.M., Freedman P.S., Farman J.V. Air embolism after ac-
cidental removal of intravenous catheter // British Medical J.
1979. Vol. 987.
33. Sanders R.A., Sheldon G.F. Septic complications of total paren-
teral nutrition //Am. J. of Surgery.1976. Vol. 132. P. 214.
34. Sprackien F.H.N., Niesche D., Lord P.W., Beterman E.M.M.
Percutaneous catheterisation of the axillary vein // Cardiov.
Res. 1967. Vol. 1. P. 297.
35. Tofield J. J. A safer technique of percutanoesous catheterisation
of the cubclavian vein // Surgery, Gynec. and Obstetrics. 1969.
Vol. 128. P. 1069.
36. Vaughan R.W., Weygandt G.R. Rebiable percutaneous central
venous pressure measurement // Anesthesia and Analgesia: Cur-
rent Researches. 1973. Vol. 52. P. 709.
37. Wilson J.N., Grow J.B., Demong C.V., Prevedel A.E., Owens J.C.
Central venous pressure in optimal blood volume maintenance
//Arch, of Surgery. 1962. Vol. 85. P. 563.
38. Yoffa D. Supraclavicular subclavian venepuncture and cathete-
risation // Lancet. 1965. Vol. 2. P. 614.
Авторский коллектив:
Рагимов Алигейдар Агаалекперович — д.м.н., профес-
сор, заведующий кафедрой «Клиническая трансфузио-
логия» ФППО ММА им. И.М. Сеченова, зав. отделени-
ем трансфузиологии РНЦХ РАМН.
Еременко Александр Анатольевич — д.м.н., профес-
сор, зав. отделением кардиореанимации РНЦХ РАМН.
Никифоров Юрий Владимирович — д.м.н., профес-
сор, кафедра «Клиническая трансфузиология» ФППО
ММА им. И.М. Сеченова.
Дементьева Инна Иосифовна — д.м.н., профессор, зав.
лаборатории экспресс-диагностики РНЦХ РАМН.
Точеное Александр Владимирович — д.м.н., профессор,
кафедра «Клиническая трансфузиология» ФППО
ММА им. И.М. Сеченова.
Щербакова Галина Николаевна — к.б.н., доцент, ка-
федра «Клиническая трансфузиология» ФППО ММА
им. И.М. Сеченова, в.н.с. отделения трансфузиологии
РНЦХ РАМН.
Байрамалибейли Имнара Энверовна — к.м.н., доцент,
кафедра «Клиническая трансфузиология» ФППО
ММА им. И.М. Сеченова.
Соловьева Ирина Николаевна — к.м.н., доцент, ка-
федра «Клиническая трансфузиология» ФППО ММА
им. И.М. Сеченова, с.н.с. отделения трансфузиологии
РНЦХ РАМН.
Алексеева Лариса Алексеевна — к.м.н., ассистент, ка-
федра «Клиническая трансфузиология» ФППО ММА
им. И.М. Сеченова.
Порешина Светлана Александровна — м.н.с. отделе-
ния трансфузиологии РНЦХ РАМН, кафедра «Кли-
ническая трансфузиология» ФППО ММА им. И.М. Се-
ченова.
775
Научное издание
Рагимов Алигейдар Агаалекперович
Еременко Александр Анатольевич
Никифоров Юрий Владимирович
ТРАНСФУЗИОЛОГИЯ
В РЕАНИМАТОЛОГИИ
Руководитель научно-информационного отдела
канд. мед. наук А. С. Макарян
Главный редактор, канд. мед. наук А. С. Петров
Зам. главного редактора С.А. Зайцева
Ответственный за выпуск О.В. Жукова
Корректор Ю.В. Борисенко
Компьютерная верстка М.Б. Неробеев
Санитарно-эпидемиологическое заключение
№ 77.99.02.953. Д. 001179.03.05 от 15.03.2005 г.
Подписано в печать 18.07.05.
Формат 84 х 108/32. Бумага офсетная. Гарнитура Newton.
Печать офсетная. Объем 24,5 печ. л. Тираж 3000 экз. Заказ № 0510760.
ООО «Медицинское информационное агентство»
119048, Москва, М. Трубецкая ул., д. 8
(ММА им. И.М. Сеченова).
Тел./факс 245-86-20,242-91-10
E-mail: miapubl@mail.ru http://www.medagency.ru
Интернет-магазин: www.medkniga.ru
Отпечатано в ОАО «Ярославский полиграфкомбинат»
150049, г. Ярославль, ул. Свободы, 97
|Ы1||Г|
ISBN 5-89481-318-2