Текст
МИПЕВХЛЫ
АКАДЕМИЯ НАУК СССР
ИНСТИТУТ ГЕОЛОГИИ РУДНЫХ МЕСТОРОЖДЕНИИ
ПЕТРОГРАФИИ, МИНЕРАЛОГИИ И ГЕОХИМИИ
МИНЕРАЛЫ
СПРАВОЧНИК
ДИАГРАММЫ ФАЗОВЫХ РАВНОВЕСИЙ
Выпуск 1
ФАЗОВЫЕ РАВНОВЕСИЯ,
ВАЖНЫЕ ДЛЯ ПРИРОДНОГО МИНЕРАЛООБРАЗОВАНИЯ
в
ИЗДАТЕЛЬСТВО «НАУКА»-
МОСКВА 1974
УДК 549. 091. 17
В справочнике собрано большое количество фазовых диаграмм силикатных, окисных,
сульфидных, солевых и металлических физико-химических систем, характеризующих ус-
ловия возникновения и поля устойчивости выделяющихся в этих системах фаз, аналоги
которых встречаются в природных образованиях, в связи с чем эти диаграммы пред-
ставляют значительный интерес для минералогии. Приводятся также (вып. 2) некоторые
диаграммы свойства-состав, характеризующие зависимость между параметрами элемен-
тарной ячейки фаз, их оптическими свойствами и удельным весом от состава твердых
растворов в дадной физико-химической системе. Эти диаграммы дают одновременно пред-
ставление и о пределах образования твердых растворов.
В вып. 1 'Фазовые равновесия, важные для природного минералообразования' рассмат-
риваются также общие вопросы построения фазовых диаграмм с целью более легкого по-
нимания и использования читателями диаграмм фазовых равновесий.
Справочник предназначен для минералогов и экспериментаторов, работающих в облас-
ти минералогии природного и технического камня.
Ответственные редакторы:
академик
Ф.В. ЧУХРОВ,
доктора геол.-мин. наук:
И. А. ОСТРОВСКИЙ, В.В. ЛАПИН
М
04 2 (СП)-74
БЗ- 30-
1972 - 10
© Издательство 'Наука', 1974 г.
ПРЕДИСЛОВИЕ
Достаточно подробным способом сообщения важней-
ших сведений об условиях образования кристаллических
фаз, которыми является большинство природных мине-
ралов, служит собрание диаграмм состояния физико-хи-
мических систем, важных для минералогии и петрологии.
Дать настоящий том справочника 'Минералы* именно в
такой форме казалось составителям наиболее целесооб-
разным.
Современного читателя уже не могут удовлетворить
указания на "гидротермальное* или "пневматолитиче-
ское* происхождение того или иного минерала. Необ-
ходимы более точные сведения об областях устойчивос-
ти минерала в координатах температура-давление либо
температура-состав. Эти сведения в наиболее нагляд-
ной и сжатой форме можно почерпнуть именно из диаг-
рамм состояния соответствующих систем. Так как к од-
ной сложной системе обычно относится несколько ми-
нералов, то было сочтено разумным не повторять одйу
и ту же диаграмму в описаниях отдельных минералов.
Вместо этого все диаграммы состояния были выделены
в особый том. Отыскание системы, к которой принад-
лежит определенный минерал, облегчается указателями,
составленными отдельно для минералов и для систем.
Предлагаемый том разделен на два выпуска, в пер-
вом из которых собраны диаграммы, важные для при-
родного минералообразования, а во втором - фазовые
диаграммы и диаграммы состав-свойства (параметры
элементарной ячейки, показатели светопреломления
твердых растворов, уд. вес и проч.), в основном имею-
щие значение для познания процессов образования ми-
неральных фаз в технике, а также для эксперименталь-
ных исследований процессов природного и технического
минералообразования.
Все диаграммы первого выпуска подразделены по
отношению к одному из параметров - давлению - на
две основные категории: системы при атмосферном или
меньшем давлении; системы при высоком давлении. В
пределах первой категории, как в первом, так и во вто-
ром выпусках, выделены главные группы: самородные
элементы, бориды, карбиды, нитриды (составители
В.В,Лапин и Н.И .Овсянникова), сульфиды (составители
В.И.Сорокин, В.С.Груздев и А.А.Филимонова), окислы
(составители В.В.Лапин, Н.И.Овсянникова) и соли (сос-
тавитель Л.Н.Когарко). Вторая категория систем (при
высоком давлении) разбита на аналогичные группы.
Составители Г.П.Орлова и Т.Б.Карпинская.
Внутри указанных групп принят простой алфавитный
порядок расположения систем. Это вызвано логической
невозможностью размещения диаграмм многокомпонент-
ных систем в какой-либо строгой химической последо-
вательности.
Конечно, предлагаемый вниманию читателя справоч-
ник не является исчерпывающим. Во-первых, исследо-
ваны далеко не все системы, к которым относятся при-
родные минералы. Во-вторых, не все исследования сис-
тем выполнены на надлежащем научном уровне. Соста-
вители стремились отобрать наиболее достоверные и
основательные результаты, отдавая предпочтение более
новым и современным работам. Работа составителей бы-
ла облегчена благодаря наличию ряда подобных сборни-
ков, выполненных для других целей отдельными учеными
или группами ученых. Авторы с благодарностью ими поль-
зовались. Перечисляем главнейшие:
Д.С. Бе лянкин f Н.А.Торопов, В .В .Лапин. Физико-
химические системы силикатной технологии. 1954.
Справочник по плавкости систем из безводных неор-
ганических солей. Под ред. Н.К.Воскресенской и др. 1961.
Диаграммы состояния металлических систем. Под ред.
Н.В.Агеева. 1956-1960 г.
Эйтелъ В. Физическая химия. 1962.
Levin Е.М., Robins C.R., McMurdie, Howard F . Phase
diagrams for ceramists. - Am. Ceram. Soc., 1964.
Morey G.W„ Phase-equilibrium relations of the common
rock—forming oxides except water. 1964.
Muan A., Osborn E F. Phase equilibria among oxides in
steelmaking, 1965.
Пользуясь для ориентировки этими и некоторыми дру-
гими сводками, составители тем не менее все диаграм-
мы заимствовали непосредственно из оригинальных ра-
бот. По возможности, были учтены все доступные пуб-
ликации, включая 1968 г.
Чтение диаграмм не должно представлять затрудне-
ний для минералогов и петрологов, получающих сейчас
удовлетворительную физико-химическую подготовку.
Имея в виду, однако возможность использования спра-
вочника более широким кругом читателей, составители
сочли возможным предпослать ему нижеследующий крат-
кий словарь важнейших физико-химических терминов,
встречающихся на диаграммах (составлен И.А.Островс-
ким). Для этого использованы главным образом следую-
щие источники:
Levin Е.М., McMurdie, Hall F.P. Phase diagrams for
ceramists. — Am. Ceram. Soc., 1956.
Древинг В.П., Калашников Я .А. Правило фаз 1964
Скрейнемакерс Ф. А. Нонт моно-, дивариантные рав-
новесия. 1948.
Астахов К.В., Носов М.В. Терминология термодина-
мики.-Бюлл. Ком. техн. терминологии АН-СССР, 1937.
3
СЛОВАРЬ ВАЖНЕЙШИХ ТЕРМИНОВ
Алькемаде (Ван Рейн ван Алькемаде) теорема.
На пограничной кривой между двумя смежными фазовыми
полями температура всегда падает в направлении от сое-
динительной линии Алькемаде. Если линия Алькемаде пе-
ресекает пограничную кривую, то точка пересечения ли-
ний (или их продолжений) служит температурным макси-
мумом на пограничной кривой.
Вариантность. См. степеней свободы число.
Взаимные системы. Системы, в которых может
идти реакция обмена. В расплаве, например, из четырех
солей возможна реакция KCl+NaBr=NaCI +КВг.Такая сис-
тема является трехкомпонентной и может быть изобра-
жена на плоскости с помощью изобарической квадратной
диаграммы Енеке. Каждой из вершин квадрата отвечав?
100%-ное содержание одной из четырех солей. К диаг-
рамме Енеке применимо правило рычага.
Гетерогенное равновесие. Система является
гетерогенной и находящейся в гетерогенном равновесии,
если она состоит из двух (или более) гомогенных фаз,
находящихся в равновесии. При обычном приложении пра-
вила фаз не рассматриваются те Изменения условий рав-
новесия, которые сопряжены с силами электрическими,
магнитными, капиллярными и гравитационными. Прини-
мают во внимание только изменения, обусловливаемые
температурой, давлением и концентрацией (составом).
Гомогенное равновесие. Система является го-
могенной и находится в гомогенном равновесии, если
она состоит из одной фазы и все процессы, или реак-
ции, совершающиеся в этой фазе являются обратимо-
равновесными. Гомогенная фаза не должна обязательно
состоять из атомов, или молекул одного вида. На-
пример, в растворе хлорида натрия, представляющем од-
ну фазу, могут присутствовать как ионы Na+,C1”,OH“,
так и ассоциированные молекулы, однако реакции, в ко-
торых они принимают участие, должны быть реакциями
равНЪве сн ыми.
Девитрификация. Образование кристаллов из
стекла.
Диаграмма состояния. Графическое выражение
равновесных закономерностей между давлением, объемом,
температурой и составом системы.
Диаграмма Р-Т. Проекция диаграммы состояния на
плоскость давление - температура. Представляет в об-
щем случае систему инвариантных точек, из которых
выходят линии моновариантных равновесий. Эти линии
.ограничивают поля инвариантных фазовых комбинаций.
Позволяют изобразить на плоскости отношения в слож-
ной (многокомпонентной) системе. Не смешивать с се-
чением (разрезом) бинарной диаграммы состояния, вы-
полненным для некоторого определенного состава.
Диаграмма Х-Т. Проекция диаграммы состояния
на плоскость температура - состав. Не смешивать с
изобарическим сечением диаграммы состояния, выпол-
ненным для определенного давления.
Изобара. Геометрическое место точек, отвечаю-
щих одному и тому же давлению.
Изофракта. Для составов в тройной системе гео-
метрическое место точек, отвечающих стеклам с од-
ним и тем же значением показателя светопреломления.
Изоплета. Линия (геометрическое место точек)
постоянного состава на фазовой диаграмме.
Изоплетическое исследование. Метод изу-
чения изменений, совершающихся в системе при изме-
нении температуры, но при постоянном составе.
Изохора. Геометрическое место точек, отвечаю-
щих одному и тому же объему.
Изотерма. В тройной системе геометрическое
место всех точек ликвидуса, отвечающих одной и той
же температуре.
Изотермическое исследование. Метод рас-
смотрения изменений, происходящих в системе при пос-
тоянной температуре, но при переменном составе (либо
давлении).
Инвариантная точка в системе определяется
таким набором факторов равновесия (давление, темпе-
ратура, состав), при котором число степеней свободы
системы равно нулю. Иными словами в инвариантной
точке нельзя осуществить независимые изменения сос-
тояний системы.
Инверсии точка. Температура, при которой од-
на полиморфная форма вещества превращается в дру-
гую в условиях инвариантного равновесия.
Индифферентная точка. В бинарных, или бо-
лее сложных системах, так называются особые усло-
вия, в которых две фазы становятся тождественными
по составу и система теряет одну степень свободы.
Типичными случаями являются точки температурного
максимума, либо минимума в сериях твердых раство-
ров, а также точки плавления конгруэнтно плавящих-
ся определенных соединений.
Инкогруэнтного плавления температура-
температура, при которой (давление фиксировано) одна
твердая фаза превращается в другую твердую фазу плюс
жидкость, причем обе новые фазы имеют состав, отли-
чающийся от состава исходного вещества.
Компоненты (независимые). Составляющие веще-
ства системы, концентрации которых могут быть выб-
раны произвольно, без изменения числа фаз системы.
Иначе: химические вещества, наименьшим числом кото-
рых можно выразить составы всех фаз системы.
Конгруэнтного плавления точка. При задан-
ном давлении температура, при которой твердое вещество
превращается в жидкость тождественного химического
состава.
Конденсированная система. Система, в кото-
рой упругость пара имеющихся твердых и жидких фаз
является несущественно малой по сравнению с атмосфер-
ным давлением. Такие системы, например огнеупорные
о кислы, теряют одну степень свободы, поскольку дав-
ление может считаться постоянным, правило фаз соот-
ветственно, может быть видоизменено: сумма числа фаз
плюс число степеней свободы равна числу компонентов
плюс единица (вместо двойки).
4
К о но да (или бинодаль, нода, соединительная линия).
Прямая линия, соединяющая (при заданной температу-
ре) точки составов двух равновесных (сопряженных)
фаз.
Котектическая линия. См. эвтектикаль и пе-
ритектикаль.
Критическое давление. В однокомпонентной
системе то единственное значение давления, при кото-
ром жидкая и газовая фазы становятся тождественными.
Иначе: давление вещества в его критическом состоянии.
Критическая температура. В однокомпонент-
ной системе то единственное значение температуры, при
котором жидкая и газовая фазы становятся тождествен-
ными. При критической температуре система переходит
из гетерогенного в гомогенное состояние. Выше крити-
ческой температуры жидкость не может существовать
ни при каком давлении.
Критические точки: Р (нижняя или первая) и Q,
(верхняя или вторая). На РТ-диаграмме бинарной сис-
темы точки пересечения так называемой трехфазовой
кривой с кривой конечных точек складки (иначе крити-
ческой кривой).
• Ле Ill ателье теорема. Если нарушить условия
системы, находившейся в равновесии, то в системе стре-
мится протекать такая реакция, которая противодейству-
ет произошедшему нарушению, т.е. реакция, частично
уничтожающая эффект нарушения. Теорема Ле Шателье яв-
ляется важным добавлением к правилу фаз, так как она
помогает качественно предсказать действие внешних из-
менений на равновесия в системе.
Ликвидус. В диаграмме состав - температура лик-
видус представляет геометрическое место точек, пред-
ставляющих максимальную растворимость (насыщение)
твердой фазы в жидкости. В бинарной системе это линия,
в тройной - поверхность, обычно искривленная. При тем-
пературах выше ликвидуса система является жидкостью,
а в точке ликвидуса имеет место равновесие между жид-
костью и в общем случае одной кристаллической (первич-
ной) фазой.
М ет а ст а би ль ная фаза. Фаза, имеющая более вы-
сокую упругость пара, чем стабильная фаза. Метастабиль-
ная фаза в отсутствии стабильной может существовать в
системе, однако она не должна присутствовать в оконча-
тельном (термодинамическом) равновесии.
Монотропная форма. В некоторых случаях поли-
морфизма (см. стр. 5) кривые упругости пара двух моди-
фикаций не пересекаются ниже точки плавления, поэтому
стабильная точка инверсии отсутствует и форма с более
высокой упругостью пара является метастабильной по от-
ношению к другой форме при всех температурах ниже точ-
ки плавления. Такие формы называются монотропными и
превращение может идти только в одном направлении (об-
ратный переход неосуществим).
Непрерывности принцип. При непрерывном изме-
нении параметров системы свойства, системы и ее отдель-
ных фаз изменяются непрерывно, если не происходит из-
менения фазового состава.
Парциальная мольная величина компонен-
та. Изменение какой-либо экстенсивной величины при
изменении содержания данного компонента на один моль.
Первичная фаза. Единственная кристаллическая
фаза, которая может существовать в равновесии с жид-
костью данного состава. Первичная фаза является пер-
вой кристаллической фазой, образующейся при охлажде-
нии жидкости. Иначе, это фаза, исчезающая последней по
мере нагревания данного состава.
Перитектическая точка. Инвариантная точка,
в которой состав жидкой фазы в равновесии с тверды-
ми не может быть выражен только положительными ко-
личествами твердых фаз. В то время как в эвтектиче-
ской точке состав жидкости всегда лежит внутри преде-
ла составов равновесных твердых фаз, в перитектике
состав жидкости всегда лежит вне этого предела. В пе-
ритектической точке моновариантные кривые пересекают-
ся, не образуя минимума температуры.
Перитектикаль.В тройной ТХ-диаграмме в проек-
ции на плоскость составов линия, изображающая состав
жидкой фазы, находящейся в равновесии с двумя тверды-
ми, причем состав жидкости не может быть .выражен
только положительными количествами твердых фаз.
П ери те кт о и д. Инвариантная точка, в которой фазо-
вые реакции в связи с изменением теплосодержания при
постоянной температуре совершенно аналогичны тем, ко-
торые имеют место в перйтектике, с той разницей, что
жидкость отсутствует и все фазы являются кристалли-
ческими.
Пограничная (граничная) . кри вая. Геометриче-
ское место пересечения смежных поверхностей ликви-
дуса в тройной фазовой диаграмме. Поле, ограниченное
пограничными кривыми, называется полем первичной
фазы.
Поле первичной фазы. Область всех составов
на фазовой диаграмме, имеющих общую первичную фазу.
Полиморфизм. Способность некоторых веществ
существовать в нескольких кристаллических формах од-
ного и того же химического состава, но отличающих-
ся кристаллической структурой и физическими свойства-
ми. При плавлении или испарении они дают тождествен-
ную жидкость или пар.
Правило фаз. В системе, находящейся в условиях
термодинамического равновесия, число фаз плюс чис-
ло степеней свободы должно быть равно сумме числа
компонентов плюс два:
Ф+С=К+2
При этом предполагается, что условия существова-
ния системы определяются двумя независимыми ин-
тенсивными параметрами; обычно это давление и тем-
пература. В ином случае правило фаз соответственно
видоизменяется.
Прот ыка ни я (прокола) ' точка. См. псевдоинва-
риантная точка.
Псевдосистема.Часто оказывается удобным или
необходимым, говорить о такой части бинарной, тройной
и других систем, которая в строгом смысле не являет-
ся субсистемой. В Таких случаях употребляется термин
псевдобинарная, псевдотройная система.
Псевдоинвариантная точка ( Piercing point,
гточка протыкания* американских авторов). В четверной
системе это пересечение моновариалтной кривой плос-
костью некоторого сечения в точке, отличающейся
от тройной инвариантной точки. В связи с этим не все
составы сосуществующих фаз лежат в плоскости рас-
сматриваемого сечения, т.е. сечение является псевдо-
тройным, а 'точка протыкания* - псев до инвариантной.
Равновесие стабильное. Условия равновесия
могут быть точно сформулированы с позиций теорети-
ческой термодинамики: в любом обратимом (равновес-
ном) процессе малое воздействие вызывает, и малое
изменение состояния, а перемена знака воздействия
меняет и знак изменения.
С практической (экспериментальной) точки зрения,
однако, действительное достижение системой равновес-
5
ного состояния может быть установлено лишь с боль-
шим трудом.Три критерия применяются для того (вмес-
те либо порознь):
1) критерий времени, основывающийся на неизмен-
ности фазовых свойств (фазового состава И.О.) во вре-
мени; 2) критерий достижения равновесного состояния
путем подхода с двух сторон, причем получаются в
одинаковых условиях одинаковые фазы; примеры тако-
го подхода:*со стороны пересыщения и недосыщения или
путем, поднятия и опускания температуры до одного и
того же значения; 3) критерий получения в результате
различных процессов фаз с тождественными свойствами
в тех случаях, когда достигаются одни и те же параметры.
Ни один из этих критериев не является вполне доста-
точным для исключения метастабильных отношений. В си-
ликатных системах метастабильные равновесия особенно
распространены и могут существовать длительное время
и при высоких температурах. Для окончательного ана-
лиза интерпретация и суждение экспериментатора име-
ют первостепенное значение.
Расслаивание (несмесимость в жидкой фазе).
Сосуществование двух равновесных жидкостей разно-
го состава , обладающих одинаковой упругостью пара.
Рычага правило (или принцип центра тяжести).
Если некоторый состав разделяется только на две фа-
зы, то и исходный состав и точки составов обеих фаз
лежат на одной прямой; далее количества выделившихся
фаз обратно пропорциональны растояниям их точек до
исходного состава. Так, если А и В представляют точки
двух фаз, образовавшихся из состава С, то количество А,
умноженное на длину АС, равно количеству В, умножен-
ному на длину ВС, или:
А_ВС
В АС
-Г“Г-Г
С е ч е н и е (разрез). Область фазовой диаграммы, пред-
ставляющая все смеси, которые могут быть образованы
определенным числом избранных составов. Сечение может
быть бинарным (прямая линия), тройным (плоскость) в
зависимости от количества избранных составов. Эти сос-
тавы не обязательно должны отвечать определенным сое-
динениям, однако следует, чтобы ни один из них не мог
быть образован при помощи какого-либо сочетания других*
Сингулярные точки. Точки, лежащие на пере-
сечении или на изломе кривых "состав - свойство" и
указывающие на наличие тут химического соединения.
Система. Одно тело или такая совокупность тел,
в которой между телами возможен теплообмен, а также
диффузия хотя бы одного из веществ.
Скрейнемакерса правило чередования в РТ-
диаграмме моновариантных линий вокруг инвариантной
точки позволяет на основании концентрационных отно-
шений установить общую последовательность стабиль-
ных лучей моновариантных равновесий, не решая, одна-
ко, вопроса о том, в каком направлении эта последова-
тельность соблюдается (по или против часовой стрелки).
Если, например, в одном из моновариантных равно-
весий (без участия фазы 5) уравнение реакции (5) :
1+2=3 + 4,то выходящие из инвариантной точки стабиль-
ные лучи реакций (1) и (2) располагаются по одну сто-
рону от луча реакции (5), а лучи (3) и (4) - по другую.
Как обычно, моновариантные реакции здесь обозначены
символом фазы, не участвующей в реакции, взятым в
скобки.
Соединительная линия (линия Алькемаде). Ли-
ния, соединяющая в тройной фазовой диаграмме фигура-
тивные точки составов именно тех фаз, поля которых
являются смежными (см. конода).
Солидус.В диаграмме состав-температура геомет-
рическое место точек при таких температурах, выше ко-
торых в равновесии сосуществуют твердое вещество и
жидкость, а ниже которых система находится в твердом
состоянии. В бинарных системах без твердых растворов
это прямая линия, отвечающая постоянной температуре,
а в системах с твердыми растворами это кривая или
комбинация из кривых и прямых линий. Аналогично это-
му в тройных системах солидус изображается плоскостью
или, соответственно, искривленной поверхностью.
Сольвуса линия. На бинарной ТХ-диаграмме линия,
ограничивающая область стабильности твердых растворов;
Соответствия принцип. Каждому равновесному
комплексу фаз системы соответствует на диаграмме со-
стояния определенный геометрический образ.
Сопряженная фаза. Одна из двух равновесных
фаз, фиксирующих коноду.
Стекло.При исследовании силикатных фазовых рав-
новесий стекло рассматривается как переохлажденная
жидкость.
Степеней свободы число)вариантность). Чис-
ло обычно интенсивных параметров, которые могут
быть произвольно и независимо изменены так, что это
не вызовет исчезновения фазы или образования новой.
Интенсивные параметры это те, которые, как давление
и температура, не зависят от массы фйз. • .
Число степеней свободы системы может также быть
определено, как "число переменных факторов (темпера-
тура, давление, концентрация компонентов), которые
должны быть фиксированы, чтобы состояние системы бы-
ло бы полностью определено"(Финдлей и др.).
Система называется инвариантной, моно вариантной,
дивариантной в зависимости от того, обладает ли она
0,1 или соответственно 2 степенями свободы.
Субсистема (подсистема). Любая часть бинар-
ной или более сложной системы, которая может рас-
сматриваться как самостоятельная система.
Твердый раствор. Кристаллическая фаза, со-
став которой может изменяться в определенных преде-
лах, без появления какой-либо дополнительной фазы.
Тетраэдр состава. В фазовой диаграмме кон-
денсированной четверной системы тетраэдр образуют
четыре треугольные плоскости, соединяющие точки
составов четырех твердых фаз, которые могут сосу-
ществовать в равновесии с жидкостью. Состав жидкос-
ти изображается четверной инвариантной точкой, ко-
торая может лежать как внутри тетраэдра состава
(эвтектическая точка), так и вне его (перитектиче-
ская, или реакционная точка).
Треугольник состава в тройной конденсирован-
ной системе образуется тремя линиями, соединяющими
точки составов -трех первичных фаз, поверхности лик-
видуса которых пересекаются в точке.
Если в диаграмме тройной системы могут быть
построены все соединительные линии, то диаграмма
окажется разделенной на несколько треугольников
состава. Если три вещества, отвечающие вершинам
любого из треугольников, не смешиваются в твер-
дом состоянии,* то соответствующие точки изобража-
ют конечный продукт кристаллизации при температуре
солидуса для составов, лежащих внутри треугольника.
В том случае, когда между любыми из трех веществ
образуются твердые растворы, число продуктов окон-
6
нательной кристаллизации может быть уменьшено на
один или на два.
Фаза. Любая физическая гомогенная часть сис-
темы (включая всю систему), ограниченная поверх-
ностью фазового раздела так, что она механически-
(в принципе) может быть обособлена от других час-
тей. Она не должна обязательно быть непрерывной (нап-
ример, жидкость, диспрегированная в другой жидкости).
Однофазовая система является гомогенной, систе-
ма, слагающаяся двумя и более фазами, является ге-
терогенной. Для приложения правила фаз (см. стр. 5)
фазы должны находится в состоянии термодинамическо-
го равновесия (гомогенного, или гетерогенного).
Эвтектика.Эвтектика представляет инвариантную
(фиксированные температура, давление, состав) точку,
в которой при добавлении или отнятии тепла от сис-
темы фазовые реакции приводят к увеличению или умень-
шению доли жидкости относительно кристаллических фаз,
без изменения температуры. В эвтектической точке сос-
тав жидкой фазы в равновесии с твердыми всегда мо-
жет быть выражен положительными значениями коли-
честв твердых фаз.
Эвтектический состав простой системы представляет
такую комбинацию компонентов, которая имеет наиниз-
шую точку плавления и находится на пересечении двух
кривых растворимости в бинарной системе и на пере -
сечении трех поверхностей растворимости в тройной
системе.
Эвтек тикаль. В тройной ТХ-диаграмме в проек-
ции на плоскость составов линия, изображающая состав
жидкости, равновесной с двумя твердыми фазами. При
этом состав жидкости может быть выражен только по-
ложительными количествами твердых фаз. Иначе - ко-
тектическая линия, котектикаль.
Эвтектоид. Инвариантная точка, в которой участ-
вуют исключительно твердые фазы и в которой добав-
ление или отнятие тепла вызывает такие изменения в
количественных соотношениях твердых фаз, которые
аналогичны тому, что имеет место в эвтектической
точке (в которой одна фаза является жидкостью).
Энантиотропные модификации. Фазы, ко-
торые находятся в обратимом равновесии в точке ин-
версии. Иначе - модификации, способные к взаимным
превращениям. Кривые их упругости пара пересекают-
ся при температуре ниже точки плавления наиболее
высокотемпературной фазы. Примеры: а- и р-кварц,
а - и р~ 2CaO.SiO2-
ТИПИЧНЫЕ СОКРАЩЕНИЯ В СПИСКАХ ЛИТЕРАТУРЫ
АН - Академия наук (АН СССР,
АН Арм.ССР, АН УССР и
т.д.)
Вести. - Вестник
ДАН - Доклады Академии Наук
Журн. - Журнал
Изв. - Известия
Ин-т - Институт
Крист. - Кристаллография
Матер.- Материалы
НИИ - научно-исследовательский
институт
Неорг. - неорганический, -ские и т.д.
Отд. - Отделение
Прикл. - прикладной
Сб. - Сборник
Сер. - Серия
Тр. - труды
Физ. - Физический, физика
Хим. - Химия, химический
а - and
Allgem. - Allgemeine
Am. - American
Ann. - Annales, annali
Anorg. - Anorganische
Assoc. - Association
Вег. - Berichte
thill. - Bulletin
Bur. - Bureau
Ceram. - Ceramic
Chem.— Chemical, Chemie, Chemica,
Chemie, Chemistry
Chim. - Chimica
C.R. - Comptes Rendus, Academie
des Sciences
Cosm.— Cosmochimica
Cryst. - Crystallographica
Dtsch.- Deutschen
Electrochem. - Electrochemical
El ekt roc hem. — Elektrochemie
Fortschr. — Fortschritte
Geoch. — Geochemica
Geol.- Geological, Geology, Geologie
Geol.For. Forh. - Geologisca Foreningens
i Stockholm Forhandlingar
Ges. — Gesellschaft
Glastechn.— Glastechnische
Industr. - Industrial
Inorg. - Inorganical
J. - Journal
Keram. - Keramischen
Krist. - KristaHographie
Mater. - Materia]
Met. - Metallurgical
Min. - Mineralogical, Mineralogie, Mineralogist
Monatsh.- Monatshefte
Nation. — National
NucL — Nuclear
Phys. - Physical, Physics, Physikalische
Proc. - Proceeding
Rept. - Report
Res. — Research
Rev. - Review
Scand. — Scandinavica
Sci. — Science
Soc. - Society, Societe
Stand. — Standards
Techn. - Technology
Trans. — Transaction
U.S. - United States
Zs. - Zeitschrift
СПИСОК ПРИНЯТЫХ СОКРАЩЕНИЙ
А - андалузит Гел - геленит Кс — кальсилит
Аб - альбит Гем гемиморфит Кео ксонотлит
Ак - акантит Гер герцинит Ксф — ксантофиллит
Акт - актинолит Ги гиролит Кт каруит
Алм - альмандин Гиб - гиббсит Куб — кубический
Ам - амезит Гид - гидральсит ( о-ц куб, г-ц куб)
Амф - амфибол Гил гиллебрандит Кфс клиноферросиллит
Ан - анортит Гип гиперстен Кх — кальциохондродит
Ана - анатаз Гл - глаукофан Кхл - клинохлор
Анал - анальцим Гма - гидромагнезит Кц — кальцоксид
Анд - андезин Гр гранат Кцз — клиноцоизит
Андр - андрадит Гросс - гроссуляр Кэн - клиноэнстатит
Анк - анкерит Грю грюнерит
Анор Ант - анортоклаз - антофиллит Гт Гта гематит гидроталькит Ла Лабр — ларнит лабрадор
Ап - апатит Гф - герсдорфит Лав — лавсонит
Араг Apr - арагонит - аргентит Гфт - Г-ц - графит гранецентрированный Лг Лейк Лом лёллингит лейкоксен ломонтит
Ард - аргиродит Д диаспор Лц лейцит
Арс - арсенопирит Дг - дигенит
А- Дж джарлеит М — мета
силик - алюмосиликат Ди диопсид Мд — морденит
Ат - акмит Дик дикит Ма — магнезит
Афв - афвиллит Дол доломит Мау - маухерит
Бе - бемит Др - дравит Мв — магнезиовюстит
Бей - бейделлит Дс - N а дисиликат Мел — мелилит
Бер - берилл Дф цифренуазит Мер — мервинит
Би - биотит Мет — металличе ское
Бм - баумгауерит ж Жд - жидкость жадеит Ми Мн- — миллерит
Бо - борнит Жед - жедрит сал мангансалит
Бр Бром - брусит - бромеллит Жел - железо Мон — монтмориллонит
Брук - брукит Ид идаит 2*10—
Бт - бертрандит Илм - ильменит НОКЛ — моноклинная
Бу Буст - бунзенит - бустамит Иод Ир иодерит иорданит Монт Мр — монтичеллит магнезиорибекит
Ист - истонит Мир — миаргирит
В-т - высокотемпературный М-
Ва - ваэсит К кианит силик - метасиликат
Вай - вайракит Ка кальцит Мт — магнетит
Вез - везувиан Каол - каолинит Му - мусковит
Ви - виоларит Кан канкринит Мул - муллит
Вил - виллемит Карн - карнегиит Мф - магнезиоферрит
Вм - вилламанинит Кб кубанит М-хл - марганцовый хлорит
Волл - волластонит Кв кварц Наг
Вюс - вюстит К-дс - калиевый дисиликат — нагельшмидтит
К-тс - калиевый тетрасиликат Нак — накрит
Г - газ Ким кимрит Нат — натролит
Га - галенит Кл клино- Na-
Гал - галлуазит Ков ковеллин дисилик
Ган - ганит Кор - корунд (N a -flc)-Nа-дисиликат
Гарн - гарниерит Корд - кордиерит ГМ а-
Ггр - гидрогранат Коус - К.пдц. - коусит калиево-полевой шпат мсилик - ’ N а- метасиликат
Ггросс- гидрогроссуляр Na-
Ге - гейландит Кр - кремнезем осилик — N а-орток силикат
Гек- - гексагональный Крист - кристобалит Не — несквогонит
сагон Кр.т. - критическая точка Нек - некоит
<>48 2
9
V. - Рат - ратит У по-
мел — \ ,1^-мелилит Рм — раммельсбергит ряд - упорядоченны
Н(‘(|) 1 к'ф - п<‘ един Рог Ф - флюид
- нефелиновый гидрат обм — роговая обманка Фа - фаматинит
гид Род — родонит Ф-ап - фторапатит
Ни - никелин Ромб - ромбический Фен - фенакит
i IK 1 lo’i - никколит - нонтронит Ром- боэдр ромбоэдрический Фер Фл - феррит - флогопит
Н-т - низкотемпературный Рут — рутил Фил - филлипсит - флюорит
Нс - Nа -метасиликат Рэнс - ромбический энстатит Флю
О - орто с — сфен Фо - форстерит
Ок - океанит Са — сарторит Фош - фошагит
Окм - окерманит Сал — салит Фс - ферросилит
Оке - окисел Сан — санидин Фт - фаялит
Ол Олг - оливин - олигоклаз Сап Сб - сапфирин санборнит Хв Хз - хизлевудит - халькозин
Омф Опир - омфацит - ортопироксен Сел Сер — селадонит серицит Хло - хлорит
О- Серп — серпентин Хлд
ромб - орторомбический Си — сидерит - хлоритоид
Орт - ортоклаз Сил — силлиманит Хп - халькопирит
О- Ск — силикокарнотит Хр - хризоберилл
силик - ортосиликат Скол — сколецит Хриз - хризотил
Отриц - ортринательный Сл — слюда Хт - хаттонит
Офс - ортоферросилит Сод — содалит Чер - чермакит
О-ц - объемпоцентрированный Сок — соконит Шп
Оэнс - ортоэнстатит Сп — сподумен - шпинели
П Параг - пар - парагонит Спее Ст — спессартин спёррит ставролит стишовит Штр Цеол - штромейерит - цеолит
Пбрук Пволл - псевдобрукит - псевдоволластонит Став Стиш Цл Цн - цельзиан - цинкит
Пер Пи Пир - периклаз - пироксен - пираргерит Стр Сф т структура сфалерит тоберморит Цо Эв Энс - цоизит - эвкриптит — энстатит
Пирф - пирофиллит Та — тальк Эп - эпидот
Пл - плагиоклаз Тв — твердое тело Эс - эпистильбит
Плом - пломбьерит Тв. Ялп 'А
Пн - пентландит Р-Р — твердый раствор - ялпаит
П-ок - полутораокись Тет- ' 'А,2°3
Пр - пирротин раг - тетрагональный С - СаО
Прд - пироксеноид Теф - тефроит К - к2о
Прм Прп - парараммельсбергит - пироп Ти Том теннантит томсонит м -MgO •
Пре - пирсеит Тор - торит N - Na2O
Пт - пирит Тр — тридимит S - Si09
Пфе - протоферросиллит Трем — тремолит
П-шп - полевой шпат Триг — тригональный т - Г1О2
Пхром - пикрохромит Трик - триклинный Z - Zro2
Пэнс - протоэнстатит Тру - трускотит Ln — лантаноиды
Ра - ранкинит Увар — уваровит
СИСТЕМЫ ПРИ АТМОСФЕРНОМ ИЛИ МЕНЬШЕМ ДАВЛЕНИИ
СИСТЕМЫ, ВКЛЮЧАЮЩИЕ САМОРОДНЫЕ ЭЛЕМЕНТЫ
Ag - As
Au - Bi
Фиг. 3. Ликвидус системы Bi—Au
1 - отбор проб при Охлаждении; 2 - отбор проб при нагреве;
3 - термический анализ; 4 - по Фогелю
Nathan Marcel Ж., Leider Marjorie., J .Phys. Chem., 1962,
S& 10,2012-2015
Фиг. 1. Диаграмма состояния системы As-Ag. £ -
фаза имеет ГП-решетку (ГП- гексагональная, плотно-
упакованная)
Eade G.A., Hume-Rothery W.Z.,Metallkunde, 1959, 50,
3, 123-126. (Взята из Сб. * Диаграммы состояния ме-
таллических систем*, М., 1959, с.74)
Ag - Bi
Фиг. 2. Ликвидус системы Bi—Ag
1 - отбор проб при охлаждении; 2 - отбор проб при нагреве;
3 - термический анализ; 4 - данные других авторов
Nathan Marcel W., Leider Marjorie., J.Phys.Chem., 1962,66,10»
2012-2015.
Фиг. 4. Диаграмма .состояния системы в области AuCu
и АиСиз. В сплавах, близких по составу к AuCu3 »
наблюдаются структурные формы а,1 и П, аналогич-
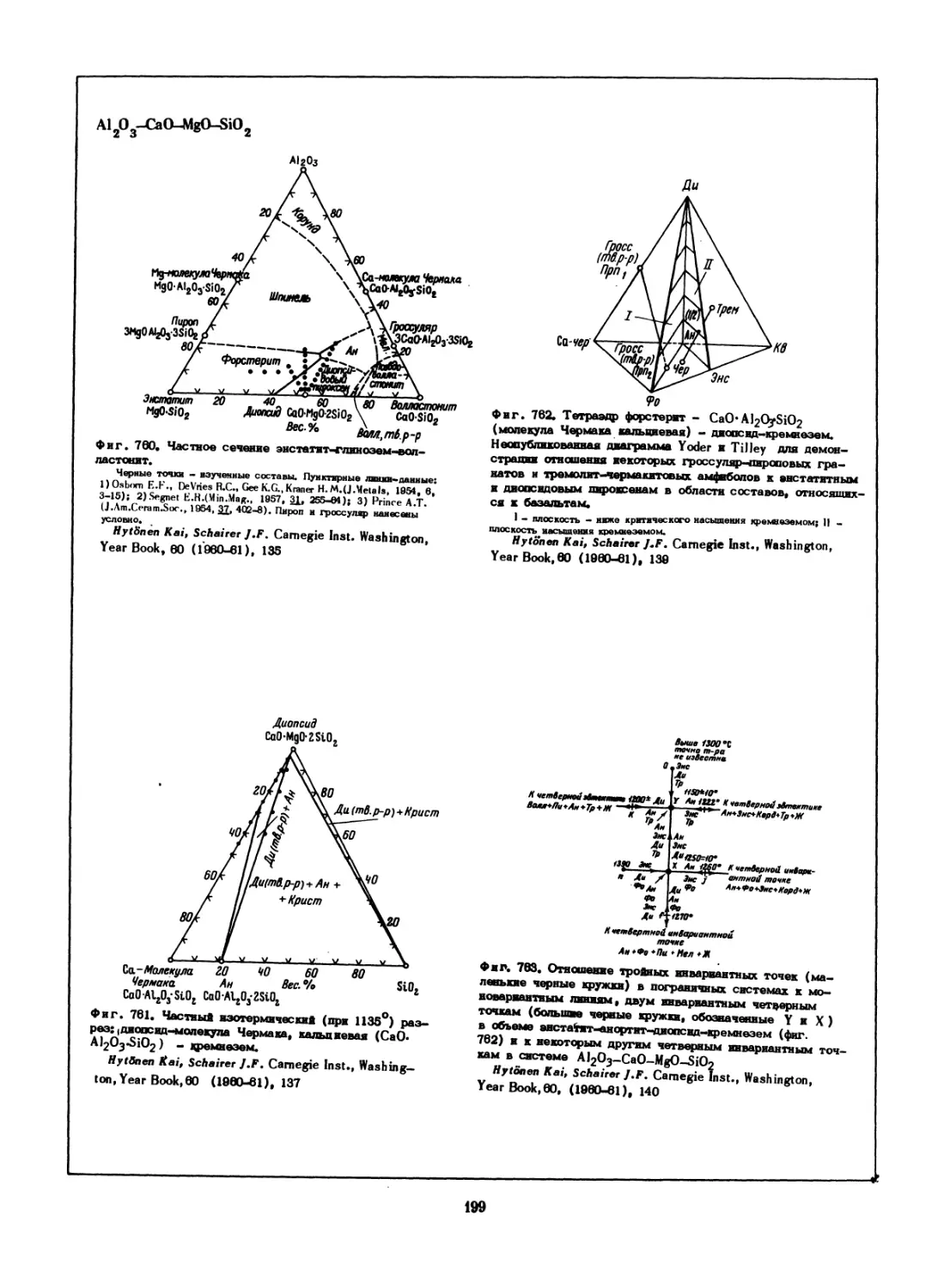
ные структурным формам AuCu. Области 11,(1 + II)
и (П + а ) взаимно перекрываются
а - твердый раствор имеет неупорядоченную структуру с Г1ДК -
решеткой; I - упорядоченная форма с кубической решеткой с 4 ато-
мами в элементарной ячейке; [[ - упорядоченная форма с ортором-
бической оешеткой с удлиненными гранями
Pianelti A., Faivre R.,C.R. (Paris), 1959. 248. 11, 1661—
1663
It
Au - Си
Au - Rh
Фиг. 5. Ликвидус и солидус системы Au—Си
Ликвидус: 1 - настоящее исследование, 2 - данные других иссле-
дований
Bennett Н.Е., J.Inst. Metals, 1962» 91» 4» 158
Rh,Zte.%
Фиг. 7. Диаграмма со-
стояния системы Au—Rh
Рудницкий А.А,,Хотин-
скал А,Нч Жури, неорг.
хим.,1959, 4, 11, 2518-
2524
Bi - Те
Au - Pt
Те, бес. %
Фиг. 8. Диаграмма состояния системы Bi-Te
Абрикосов Н,Х.,Банкина Я.Ф-Журн. неорг. хим., 1958
Д, 3, 859-667
Си - Fe
Фиг. в. Диаграмма состояния системы Au—Pt
1 - данные настоящего исследования
Munster Д., Save/ K.Zs. Phys. Chem. (B.R.D.),
1960, 23, 5-6, 415-425
Фиг. 9. Диаграмма состоя-
ния системы медь-железо.
Чижов СЛ.'Иэв. высших
уч. зав., Цветная металлур-
гия, 1962, №5, 123
12
Си - Sb
Фиг, 10. Диаграмма состояния системы Си—Sb и
кривая растворимости Sb в Си; £ - фаза имеет
гранецентрированную кубическую (ГЦК) решетку,
с а = 6,0 кХ; q , 6 - фазы имеют гексагонально-
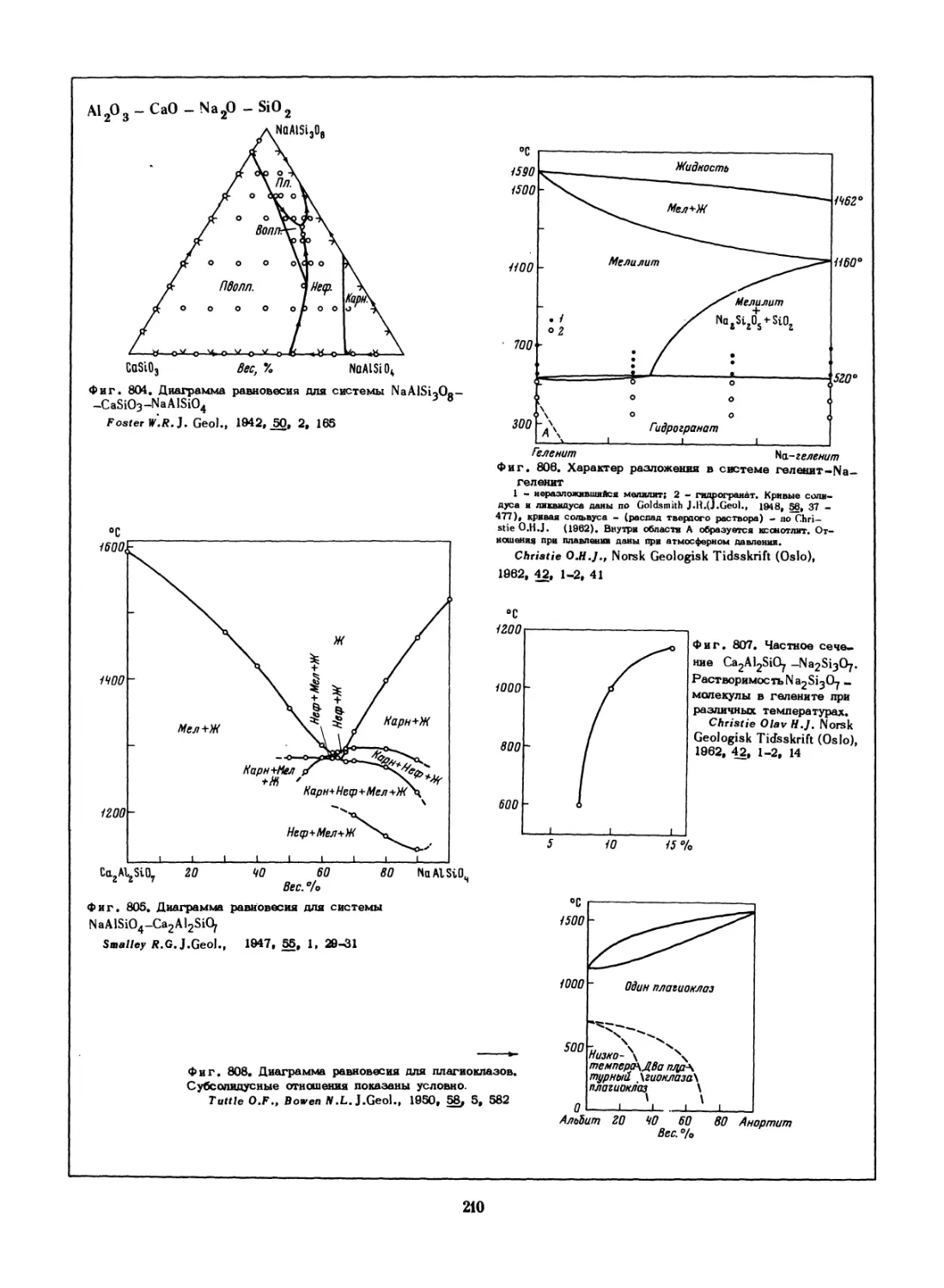
плотноупакованную (ГП) решетку, с а = 2,686 кХ и
с = 1,6031 и а “2,711 кХ, с/а=1.58, соответственно
Raida #.,Hutnicke Listy ,1958,13..8- Ргасе ceskosl
Hutn vyzk.,.2, 21, 193-200 (Взята из Сб. гДиаграм-
мы состояния металлических систем*,М.,1958,с. 72)
Fe-Pt
lr - Pt
о г * б в ю
pi,am%
Фиг. 12. Разрыв смесимости в системе Pt—1г
Raub Е., Plate IF.Z.,MetaDkunde, 1956, 4Z. Ю,
668-693. (Из сб. * Диаграммы состояния металли-
ческих систем*, М., 1956, с. 33)
Фиг. И. Кривые ликвидуса и солидуса системы Fe-Pt
Buckley R.A., Ните—Roth ery W., J.Iron a. Steel Inst.,
1959, 123, 1, 61-62
13
СИСТЕМЫ С КАРБИДАМИ
C-Si
Фиг. 13. Диаграмма состояния сплавов железа с
углеродом (в ат.%)
В ерям ан А.А., Григорович BJC,, Недумов Н ,А,,
Самарип А.М,, ЦМА СССР, 1964, 159. 1, 122
Фи г. 15. Wright W.V., Bartels., Silicon Carbide a high tempe-
rature Semiconductor, Proceedings of the Conference on Si-
licon Carbide, Boston, Massachusetts, april 2-3, 1959,Perga-
mon Press, 1960, 32
C - Si
В C — SiC
4
°C ~
3600-
Ж
3200-
2800-
Ж + SIC
2000
1600
Ж
Ж+С
'' Sic
2830*
SiC+C
!406\
Si + SIC
120(К-1—।—।—।——।—।—J-
0 20 40 60 80
Si C, am. %
100
С
Фиг. 14. Scace R.Z., SZac* G.A., Silicon carbide a
high temperature Semiconductor, Proceedings of
the Conference on Silicon Carbide, Boston, Mas-
sachusetts, april 2-3, 1959» Pergamon Press,
1960, 27
Фиг. 16. Диаграмма состояния системы B^C-Si С
Secrist D.R.,J.Am. Ceram. Soc., 1964, 47, 3, 129
14
СУЛЬФИДНЫЕ СИСТЕМЫ
Двухкомпонентные
Ag — S
•с
Ж
600
AcF*
W
№'*2
$+г.-ц.ку0§
а-4-^Ад^
586**3
906**1
Ь*о.-ц.кубА$
2Ж
/
/
2Ж
7ю*г
^^^32223
о-ц.куб +Ж
200
176,3**0,5
ап
177,6'±0,7
Н9,3'±07
Ж'
0L
Ад
го
W 60
Мм. 7.
до
S
Фиг. 19. Диаграмма состояния системы As—S
Ж - жидкость, Г - газ.
Jonker Г.Р. Z. anorg. Chejmie, 1909, 62. 89-107
’Фиг. 17. Диаграмма состояния системы Ag-S
Kracek F,C. Trans. Am. Geoph. Union, 1946,
2Z, 363-374; Skinner B.J. Econ. Geol., 1966,hL b
1-26
As- S
Фиг. 18. Фазовая диагоамма трисульфида мышьяка
0-As^L моноклинной структуры; а - высокотемпера-
турная красная модификация As2S^
ЛаркммскийР А.'Рлносов А.П,,Якушев В.Г., Изв.
АН СССР, 1987, Неорг. матер., 3, 10,1931-19&в
800
600
900
х Данные Ку меру да
200-
301----
s
412,84
ж+г
1
Къ^+Ж+Г
/
I
I
32П
к+ж+г
AsS+A$V
>1
if Zk-r7 AsS
AS*S’ 23 As,®77.7.
№
As
Фиг. 20. Фазовые отношения в системе As—S
Куллеруд Г. Проблемы эндогенных месторождений,
1966, вып. 3, 18
15
Au - S
Co — S
Bi — S
Фиг. 21. Вторая точка кипения в системе Au-S
Vo gel R., Roff dieter G.t Zs. MetaBkunde, 1961,
£2, 5, 318-320
S, dec.*/.
0 10 W 30 90 50 60 70 80 90100
•c
1000
600
CoS.+S(W)
zoo
CoS2+Sf/ra^
x 872* x x
1995* 1
1900-
t Sp^=5M
0 20 90 60 60 100
Co S, am. /• S
|^0-CoS
IL/-COS
Кв2Г
Фиг. 22. Диаграмма состояния. Сплошной линией и
точками даны результаты настоящей работы.
1 - ликвидус, по Aten A.H.W. Z anorg.Chemie, 1905, 41, 387-
398; 2 - ликвидус, по Уразову Г.Г,, Большакову К.Ф., Федорову ПЛ.,
Василевской ИЛ. (Жури, неорг. химии, 1960, 630-036).
Cubicciotti D.J.Phys.Chem., 1962^6.1205-1206
Фиг. 24. Схематическая Т-Х анаграмма системы
Штриховая линия - результаты предыдущих работ или предпола-
гаемые границы а , р - Cq _XS
El Goresy A., Kullerud G. Ann. Rep. Geophys. Lab.
Carnegie Inst. Washington, 1967—1968, 182—187
Фиг. 23. Диаграмма состояния системы Со—S
Кузнецов ВЛ1., Елисеев А.А,, Япак 3,С,, Пал-
кина К,К., Соколова А,К,, Дмитриева А,В, Сб.
'Вопросы металлургии и физики полупроводников'.
Изд-во АН СССР, 1961
16
Си - S
Фиг. 27. Предполагаемая фазовая анаграмма, осно-
ван ная на данных Скиннера для составов Ci^ S и пред-
положении, что твердый раствор тетрагональной фа-
зы становится устойчивым при высоком давлении. Для
простоты принято, что орторомбический халькозин,
гексагональный халькозин и тетрагональная фаза
имеют один и тот же предел составов в богатой медью
части; давление несколько сотен атмосфер,
Б. Несколько более низкое аавление, чем в А, В. Фазовая
анаграмма при цавлении паров конденсированных фаз
RoaeboomE.H. Еconот. Geol., 1966 , 61, 4, 641—672
tfazXS 23 22 21 20 Ю
CuxS Г«/,7/7 1,00 1,90 2fi0 2,10
Фиг. 25. Фазовая диаграмма системы Си-S.Все фа-
зы находятся в равновесии с газом. Кривые плавле-
ния по Хдясеяу М. и Лядерхо X, (Структура двойных
сплавов. Изд-во черн. и цвет, мет., 1962), по Jenaen Е.
(Am. J. Sci, 1942, 240. 695-709) и Куллеруду Г. (Сб.
'Проблемы эндогенных месторождений, 1966, выл. 3,
22, Изд-во 'Мир'), поле 'остающегося синим' (Ьс)
ковеллина no-Moh G.H. (Carnegie Inst. Washington, 1964,
Year Book,63, 209).
Roaeboom E.H. Econ. Geol., 1966, 61, 4, 641—672
Фиг. 26. Влияние состава на температуру перехода
между халькозином и гексагональным халькозином.
Roaeboom Е.Н. Ес on. Geol., 1966, 61,4, 641-672
S, /7/77. %
Фиг. 28. Диаграмма состояния системы Cu-CujS
lohansen F„ Vollmer H. Z. Erzb.Metallh.,1960,13,7»
313-322
3
17
Cu-^S
CijqS^ CuS
150
100
50
0
70 76 74 72 70 66 66 64
№,Oec.%
Фиг. 29. Фазовые отношения при низких температурах
в системе CunSr— CuS. 'Остающийся синим' ковеллин
содержит от о7,0 до 68,5 вес. % меди и устойчив ниже
157°С в присутствии газа
Moh G.H. Carnegie Inst. Washington, 1964» Year Book,
63, 209
Фиг. 31. Схематическая диаграмма температура-состав
системы Fe—S при давлении Рр равно приблизительно
1 атм. Полиморфные превращения не показаны, раство-
римость железа в сере для ясности преувеличена
Куллеруд Г., Йодер X. Проблемы эндогенных место-
рождений, 1966, вып. 3. Изд-во 'Мир', 1966
Фиг. 30. Диаграмма состояния системы Fe-S
Rosenquist Т./. Iron. Steel Inst., 1954, 176, 1,
37-57
1200
1000-
- rnp
ooo - w
600
(Пт) Onfalty
лПр^Пт
аПр
гоо-
",
рПр*(Ж) уПр+Ж
------
Пт(Ж)
&Лр
Пт+Ж
лПр- 2
FeS — Fe,ftcX
1К(у/]р)
VW
Фиг. 32. Предположительная диаграмма равновесий в
системе FeS-S для давления 30 бар. Точки - составы
пирротинов при давлении пара системы, спроектирован-
ные на данное изобарическое сечение.
1 - литературные аанные; 2 - пирротин, сосуществующий с пи-
ритом
Kullervd G., Yoder H.S. Carnegie Inst., Washington, 1957, Year
Book, 56, 192
Фиг. 33. Диаграмма состоя-
ния системы Fe—S,a, у, £ - фазы Fe
1 - аанные настоящего исследования
Barlofa Л.В., Bock K.R., Parlee ff .Trans.
Met. Soc. AIME, 1961,221,173-179
18
Fe — S
6353 6300 SHOD 56,00 t 47,004600
20Q\\ i i i i i । t i i 1 .1 । । 5 Л-Т! । i_J
50,00 48,00 46JJO 4400 34,00 3800
теме FeS—FeS^
Yund R.A., Hall H.T. Mat. Res. Bull., 1968, 3, 779-783
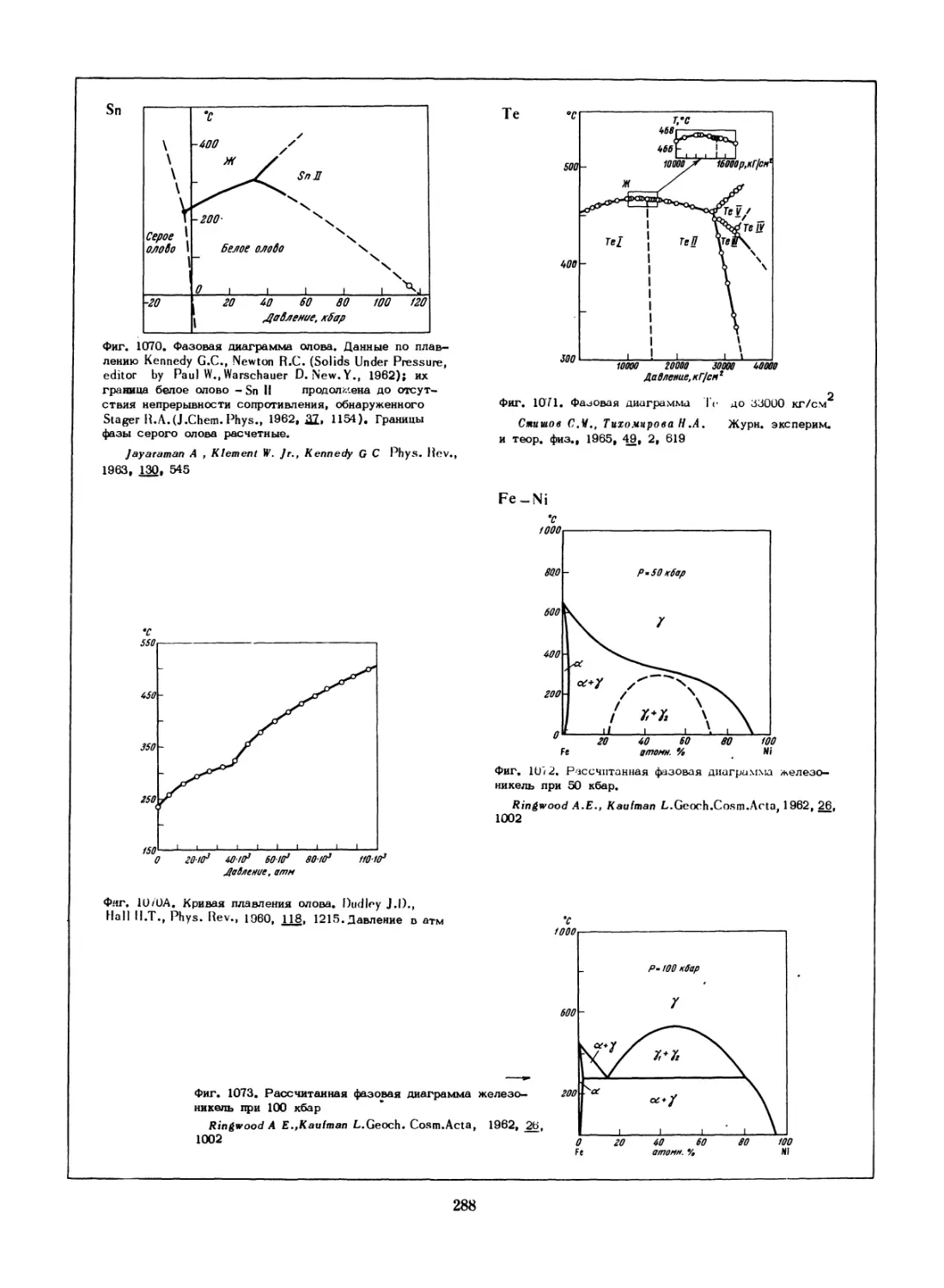
fyom.1
Фиг. 34. Равновесные отношения между пирротином и
пиритом в системе FeS—S.
Лрнолъд Р.Сб. 'Проблемы эндогенных месторожде-
ний', 1966, вып. 3, Изд-во 'Мир', 1966
Фиг. 35. Равновесие диссоциации пирита в системе
FeS—S? при низкой температуре. Данные выше 325°
по Arnold R.G. (Econ. Geol., 1962, 57, 72-90)
Кано Снмпей, Намбу Мацуо, Japan Assoc. Min., Petrol,
a. Econ. Geol., 1967 , 57,81-97
Фиг. 37. Фазовые отношения в системе FeS-FeS-.
Пирротины со сверхструктурой 1-2А, 7С; 2-2AJ
5С; 3-2В, 4С.
Сольвус пирит-пирротин: а - синтетические, б — метастабнль—
ные по Arnold R.G. (Econ. Geol. 1962, 57, 72-90)
Des borough G.A., Carpenter R.H. Econ. Geol., 1965, 60, N 7
Фиг. 38. Фазовая диаграмма
системы Fe—S с линиями
равной активности серы.
Urbain G., В иг gm an п Ж.,
F г oh berg M.G., C.R. (Paris),
1966, С-263, N 8, 595-597
19
Fe - S
Фиг. 39. Состав пирротина в системе FeS-$2 как
функция температуры и летучести серы.
NpeS ” мольная доля FeS в системе FeS-S2
Тулмин П.9 Бартон П,Б, Термодинамика постмаг-
матических процессов. 'Мир*, М., 1968, 182-229
Фиг. 41. Результаты нагревания природного моно-
клинного пирротина в течение времени от 6 мин. до
1 года. При выдержке в 1 год превращение происхо-
дит при 265°С.
1 - моноклинный; 2 - гексагональный; 3 - моноклинный + гекса-
гональный
z Kullerud G., Doe B.R., Buseck P.R,f Trofften P.F. Carnegie
Inst, Washington, 1963, Year Book 6 2,210-211
1000
T
1200
Ga - S
s
5
600
935*
I /iT*Ga2S
M+GaS
^/-6a4S5
п - . J60\
°-----о -о О -Д<
О z»r*6aS '
M+Ga2S
Gq.S GaS
^-6b4S,
Фиг. 40. Активность FeS
в системе FeS—S2 как функ-
ции 1g fg и 1 000/T.
Тулмин П,, Бартон П.Б,
Термодинамика постмаг-
матических процессов,
1968, 182-229, М., 'Мир*.
600
0
10
GaS+a-6(^85
&
4
a S
1 '55O6OO\
W IS
:: «S
c *
50
60
Ga+Ga,S i
J9,6*~ Л 2
p - 9* pbswo-< о о <
I л I ill 1
20 30 40
S, am. %
Фиг. 42. Диаграмма состояния системы Ga—S
Рустамов П,Г,, Мардахаев Б.Н,, Сафаров М,Г, неорг. матер., 1967,
Иэв. АН СССР, 3, 479-483
20
ФигДЗ. Диаграмма состояния системы In—^S^
Stubbs M»F.t Schufle],A,, Thompson A,]»,
Duncan J.M. J.Am. Chem. Soc., 195 2, 74, 6,1441-
1443
T,°C
Фиг, 45, Часть диаграммы Т-Р для реакций nHgS
(красн.)-»nHg (газ)+Sn (газ) и nHgS (4epH.)-»nHg
(raa)+Sn (газ) по определениям Rinse /.(Rec.Trav.
Chim., 1.928, 47, 28)
1 - киноварь, 2 - метациннабарит
Dickson F.W., Tunnel G. Am. Min., 1959, 44, 471
Ni -S
Hg-S
Фиг. 44. Фазовые отношения в системе Hg-S. Пар присутствует во
Фиг. 46. Диаграмма состояния
системы Ni—S 0-Ni3+xS2
Соколова ДМ.Журн. неорг.
химии, 1956, h в, 1440-1454
всех случаях
Kullerud G., Carnegie Inst. Washington, 1965, Year Book 64, 193-195
21
Ni
S S, am. %
Фиг. 47. Диаграмма состояния системы
Ni—S. Все фазы находятся в равновесии
с паром
1 - жидкость; 2 - жидкость + твердый раствор
Ni; 3 - твердый раствор NHNi3+xS2 J 4 “ жид*‘
кость+№31 Xs?'’ 5 “ NioS2+Ni3+xS2 ; 6 - твер-
дый раствор Ni + Ni3S2; ' - Ni3S2 + pNi7S6;8 -
Ni3S2 + <x-Ni7S *9 -Ni3S2 + Ni3 XS2; Ю-nL XS2 +
+Ni756 -Ni3_xS2+a-NiS; 12 - жидкость +a_
-Nij_XS; 13 - a-Ni7S6+a_NiS; 14-P-Ni?S6 +a-NiS;
15 - 3-Ni?S6 + P-NiS; 16 - P-Ni1-xS + Ni3S4; 17 -
Ni^+Ni^; 18 -a+P -NilxS; 19 - a _ Nij^Ni^;
20 - aNij_xS + NiS2 ; 21 - a-Ni, XS + жидкость;
22 - жидкость* NiЪ2; 23 -Ni S2 + жидкость;
24 - две жидкости; 25 —Ni S2 + жидкость
Kullerud G., Yund R.A.f J.Petrol.,1962,
3,1,126-175
Фиг. 48. Фазовые отношения в системе
Ni-S. Все фазы находятся в равнове-
сии с паром.
Kullerud G., Yund R.A. J. Petrol.
1962, 3, 1,126-175
22
Pb-S
Sb-S
л
Фиг. 49. Фазовые отношения в части системы, содер-
жащей от 0 до 30 вес %S.,Bce фазы находятся в рав-
новесии с газовой фазой.
Kullerud G. Amer J. Sci., Schairer vol., 1969, A 267.
233-256
r
Mf!
A<!
MflT
500
6
WO
300-
•С
1200\
Жидкость
ЛК
1000-
800-
2 жидкости
Ж.+Ж.
Жид/ioam 1
ШЗ'
$,4кХ
! г з » з з 7 s з ю а го а к чо so то so
|г*|
ж.
Жидкость+Уой
ООО'
70,10
Жидкость + PbS
^PbS
PbS
Жидкость
600
400 •
337 i.
861
200
Pb + PbS
PbS+Жидкость
OL
Pb
20
40
S, ат. %
*v в&%
- / - -Т /Zt
11 “ йГ-
РЬ8*51-до£
_J_____ ।
60
60
Фиг. 50. Диаграмма состояния системы Pb-S. Всефазы и
ассоциации находятся в равновесии с газовой фазой.
Кривая растворимости серы в жидком свинце ниже
825°С по Blank. Р.К, Willi. G.lt. (Met. Soc. Conf.,
1961, 8; Phys. Chem. of Process Met., pt., 2, 991-1028,
Inst. Publ. N.Y.)
Kulterud G. Amer. J.Sci., Schairer vol., 1969. A 267 T
233-256
Л^+Sb
в er и-----cr-Д и OQQ
M.+SLS.
Sb+SbgSij
\ *2
~ ° о OoO
200\------1------1______i______i_____l_
0 5 10 15 20 25
a Sb2SJ
Фиг. 51. Диаграмма состояния .системы Sb-5
Уразов Г,Г., Большакова К.Ф., Федоров П.И.,
. Василе в скал ИЛ. Журн. неорг. химии, 1960, £,
2, 449-455
Sn - S
юо
Фиг. 52. Диаграмма плавкости системы Sn-S
Карахамоса М.И., Пашпхип А.С., Новоселова А.В.
Иэв. АН СССР, неорг. материалы, 1966, 2, 6,
991-996
23
Sn-S
*0
1000*
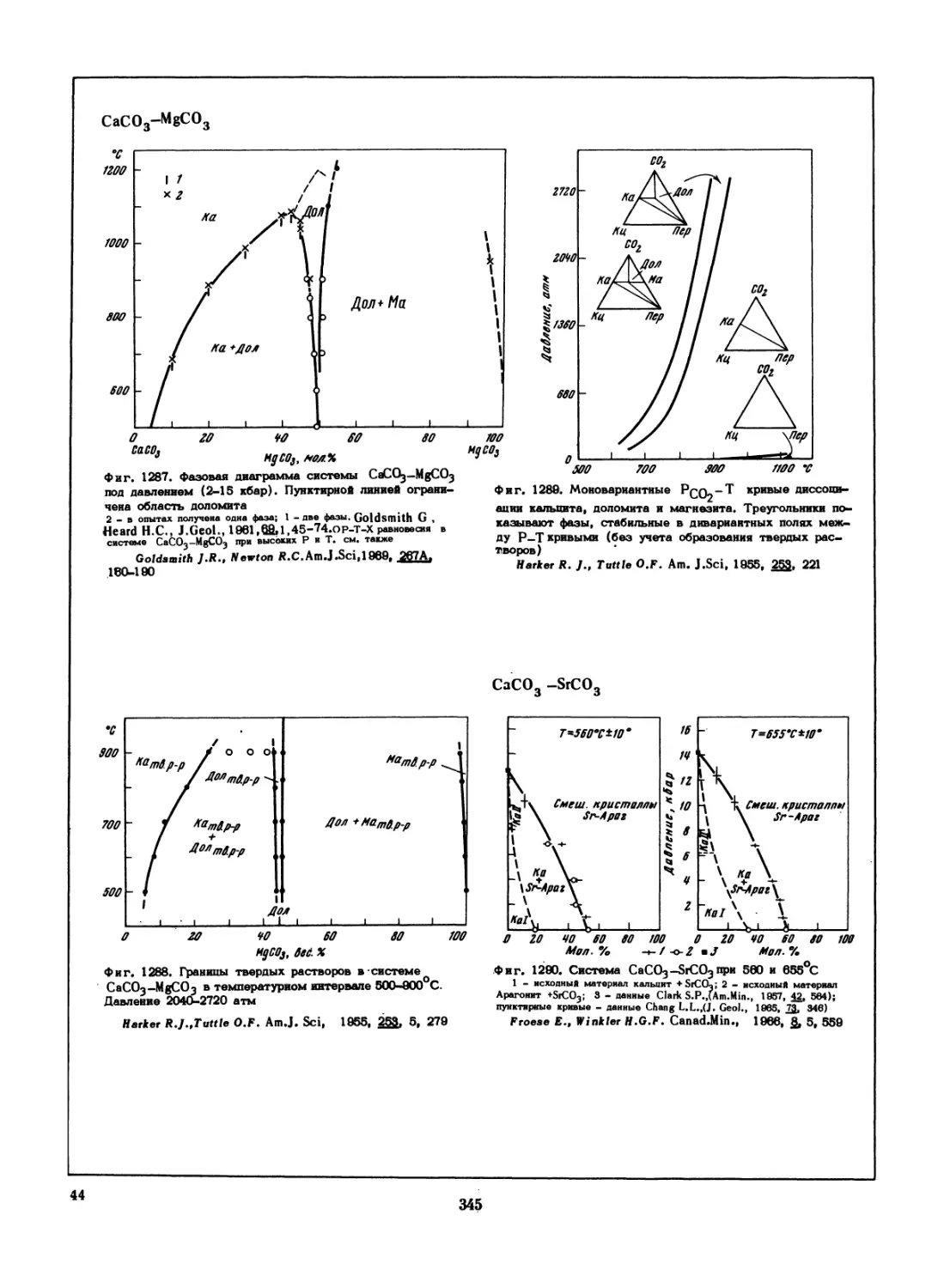
•с
!200-
1000
800
600
2 расплава
ЖрЖг*пар
'Mi+nO.^nap
х 860*5'
Ж^тб^пар
Ж2+пар
SnS
S113S4
5пгЬР
SnS2
\i2pacnna0a?\
ан^парП
400
Ж+'ът&г+пар
200
252'
тв.^тв.^лар
И9*
900
800 -
700 \
500*
400
300
800
О 30
Sn
40 60
S, ат. %
80 100
S
100 -
Фиг. 53. Диаграмма состояния системы Sn-S
Albers Ж., ScholK. Philips Res. Rept., 1961,
N 16, 329-342
Зависимость давления паров серы
от состава жидкости Х^.
Фиг. 54.
(logPS2)
Albers W., ScholK. Philips Res.Rept., 1961,
N 16, 329-342
va «у
4*5,
* МИ
<756*5
£
£
50 60
SnS
Ti -s
| 2 жидкости
I ипз
<+arSnS,
Sn2S3+«SnS2
'693*1
70 ВО
Ат. %
90 100
S
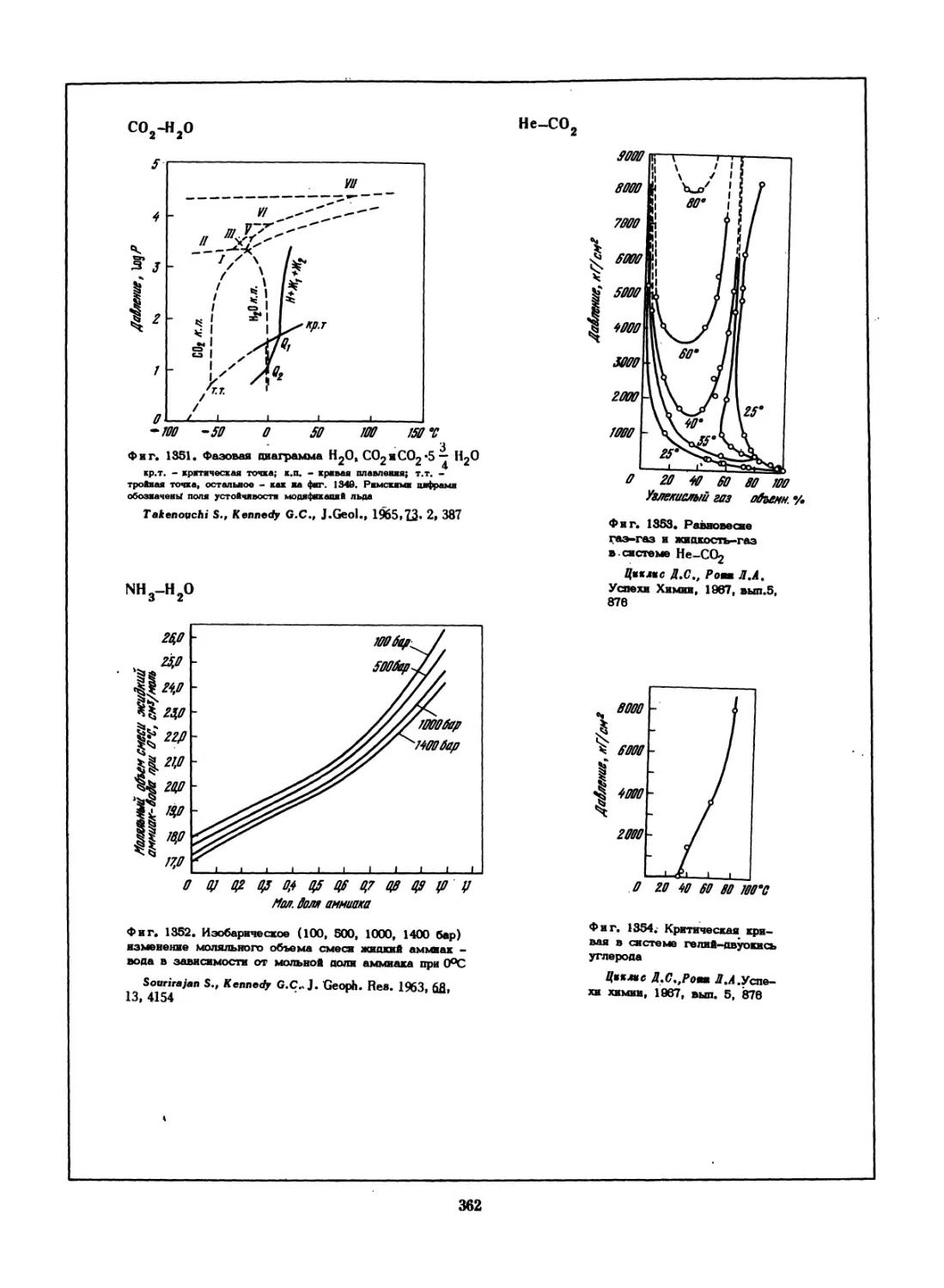
Фиг. 55, Фазовые от-
ношения в части SnS-S
системы Sn-S.
Moh G.H. Carnegie Inst.
Washington, 1963, Ycar
Book 62, 198
Фиг. 56. Предварительный вариант диаграммы состоя-
ния системы Ti—S
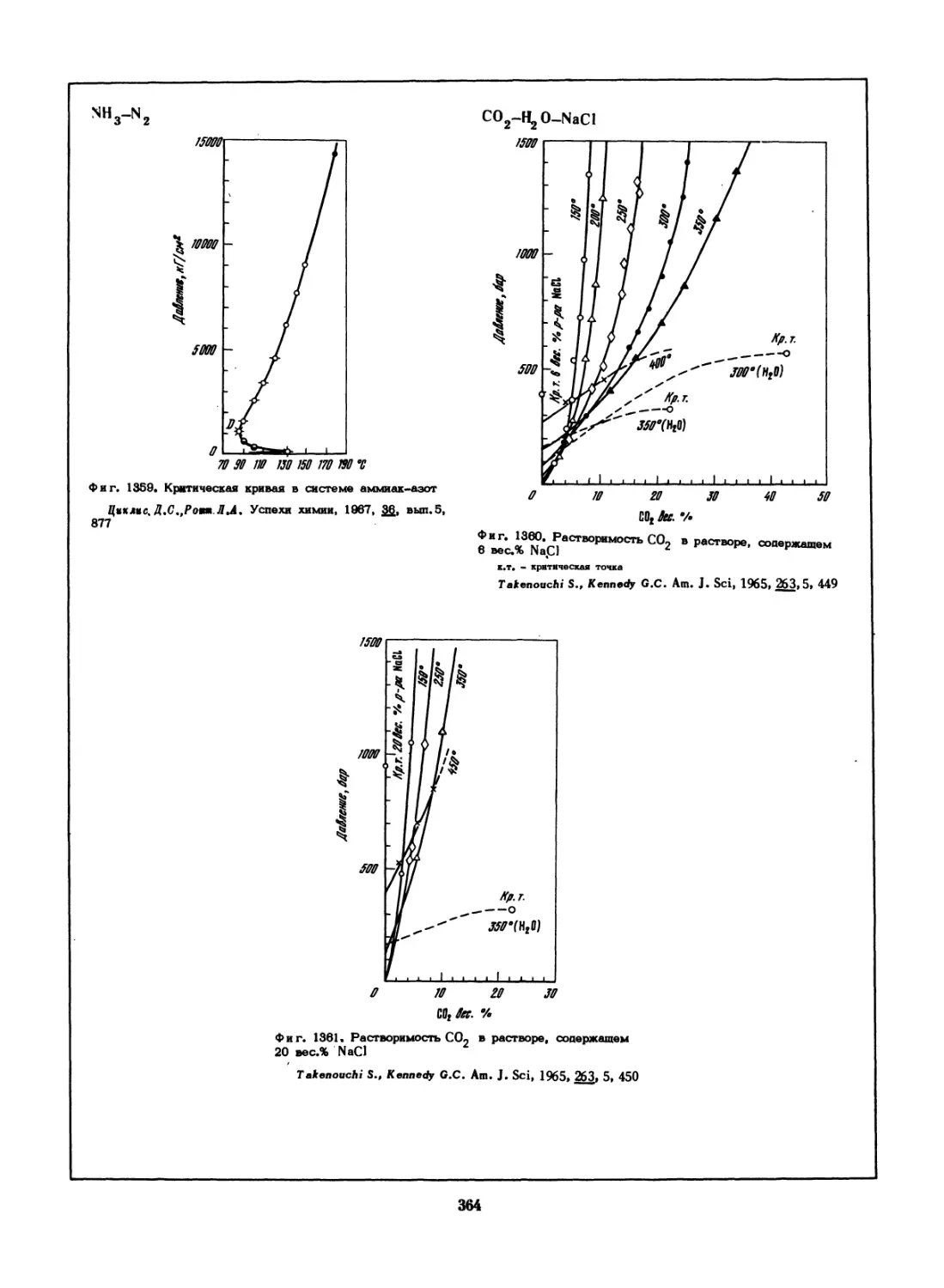
1 - данные термического анализа; 2 - дилатометрические опреа« -
ления; 3 - оптические определения температуры появления жидкой
фазы; 4 - однофазные сплавы; 5 - двухфазные сплавы; а, р - фал.
Ti, в, 5 - тц+х$; т» г’- Tii_xs
Еременко ВЛ .^Лисяоенн^нй В.Е.Халькогениды, Киев,
1967, 61-78
24
Трехкомпонентные
Ag - As - S
Ag - Bi - S
Фиг. 57. Диаграмма состояния системы Ag-As-S
Jaeger F,B., Van Klooster H.S.Z.anorg. Chem., 1912»
za,266
343*2*
Температура, °C >
Фиг. 59. Схематическая P-T диаграмма системы
Ag—Bi—S, показывающая положение инвариантной точ-
ки, которая определяет максимальную устойчивость
ассоциации Ag - матильдит в присутствии пара.
Craig J.R., Min era Hum Deposits, 1967, N |
7?
520
W
W
400
350
0 10 20 30 40 50
Фиг. 58. Диаграмма состояния системы Ag^S—As^Sj
1 и 2 - области появления метастабильных а - фазы и ксанто-
конита: 1 - не отожжённый, 2 - отожжённый при 600°С
IFeftmeier F.H., Laudiae R.A., Shiever JJi. Mat.Res.Bull.,
1968,3,9, 767-777
°Z?€------------
"О
1 7
600
200,
iV-’ I
ol /
(Ag^/AgBiS,,
(Ад28)я*ЙАдВ152
1 I
0
T I AgzS-3BiSj
--------------
' /Ageism
+AgzS-3Bl2S3
1
AfeS 3Bi8Ss*/W ,
ASgSSBlgSg-
+ «MS
Ag2S 20 40 60 80 Bi2S3
Мол. /
Фиг. 60. Диаграмма состояния системы A^S—
Ag2^ni “ акантит» ^82^11 " аРгвнтит с Объемноцентриро-
ванной ячейкой; Ag2$] ~ аргентит с гранецентрированной ячейкой.
Van Hook HaJ. Econ.Geol., 1960, 55» 4, 759-788
В 4
25
Ag-Bi-S
Фиг. 61. Изотермические
Ag
Ag - Cd - S
Фиг. 63. Бинарное сечение Ci^S-Ag^S
о.-ц. куб. - аргентит с объемвоцентрнрованиой ячейкой; г.-ц.куб. -
фаза кубическая с гранецентрированной ячейкой; гекс. пл.уп. - фаза
с гексагональной плотнейшей упаковкой, р-Си
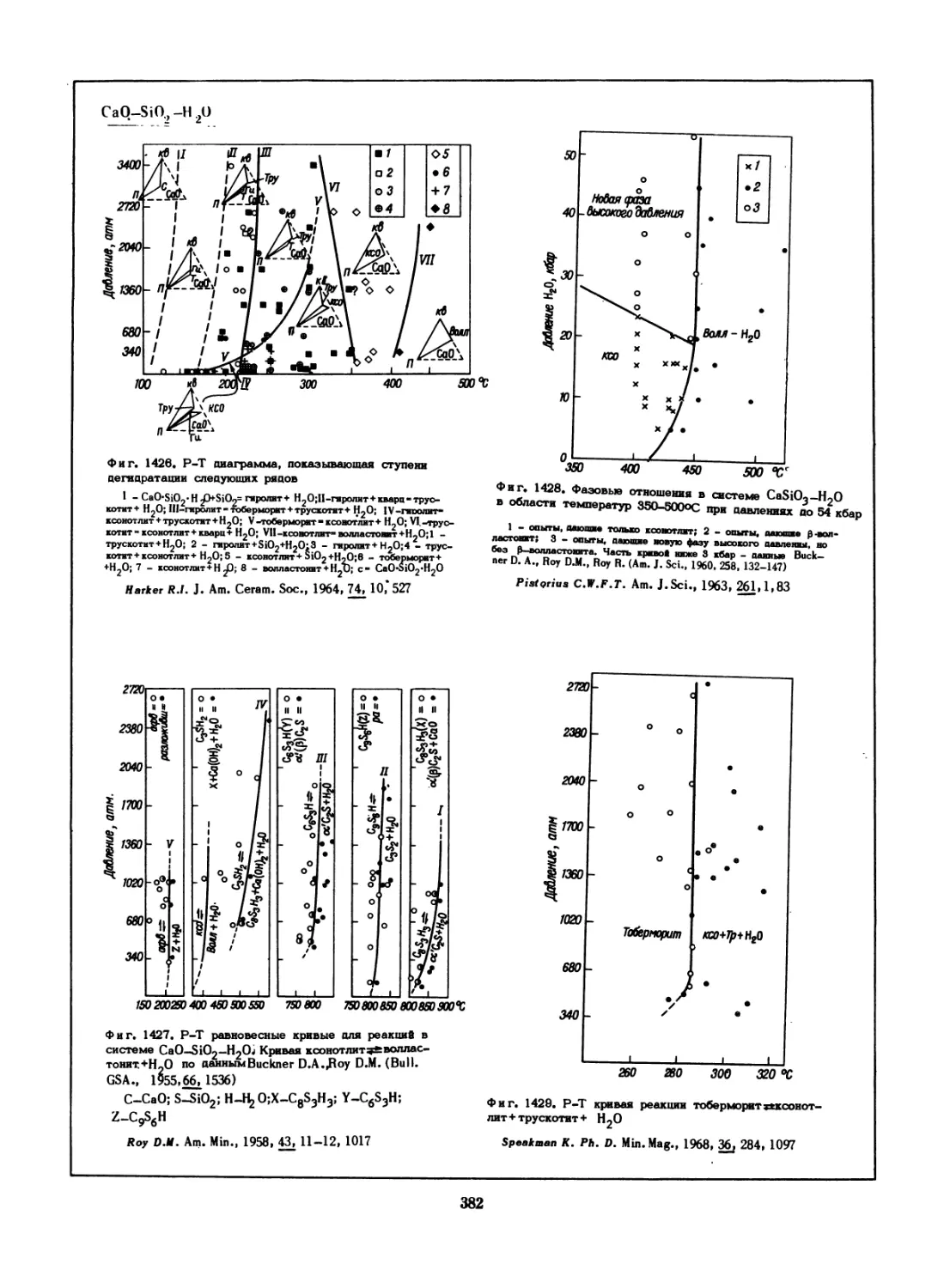
находятся в равновесии с газом.
Skinner B.J. Econ. Geo)., 1966 , 61, 1, 1—26
o/Sl,?* Все^ы
Woodbury H.H. J. A ppi. Phys., 1965, 36, 7, 2287-2293
26
Ag — Ge — S
Фиг. 64. Диаграмма состоя
ния системы Ag2$—Ci^S
Крестовников А Л.,Мен
делевнч AJD., Глазов ВЛ,
Изв. АН СССР, неорг. ма
тер., 1968, 4, 7, 1189-1190
Фиг. 66. Диаграмма состояния системы Ag2^-GeS2
Gorochov О. Bull Soc. Chim. France, 1968,N 6,2263—2275
Ag - Pb _ S
Фиг. 67. Диаграмма состояния системы Ag2^—PbS
(Ag^HI “ акантит; “ кубический с объемнонентри-
рованяой ячейкой; (Ag2^)j - кубический с граЬепентрированной
ячейкой.
Van Ирок И.}. Econ. Geol., 1960, 5§> 759-788
Фпг. 65.Фазовые взаимоотношения в системе
а - при 25°С по DjurleS. (Acta Chem. Scand., 1958, 12, 1427-1436)
б - при 250pC; в - при 400°C; г - при 1150°С; P-Cu0f8Ag1,2S; «о.-ц.куб. -
кубический с объемнопеаггрированной ячейкой; г.-ц.куб. - кубичеошй с
гранецентрированной ячейкой;. гекс.пл.уп. - гексагональная плотней-
шая упаковка, черное - поля жидких гомогенных фаз.
Все фазы находятся в равновесии с газом.
Skinner B.J. Ес on. Geol., 1966, £1, 1, 1—26
27
Фиг. 68. Изотермические разрезы системы *
а - при 400°С; б - при 900-925сС. Заштрихованы области гомогенных жидких фаз.
Craig J.R. Mineralium Deposits, 1967, 1, N 4
Ag - Sb - S
МолЛ Ag,Sb
Фиг. 69. Соотношение твердые фазы - жидкость в
псевдобинарной системе 3Ag2S*Sb2S3—Ag^Sb
Soman chi S. Metals and Minerals Rev., 1966,5» L
10-12
Фиг. 71. Фазовые отношения в поле
Ag2S-Sb2S3—Sb—Ag
В ar St ad J. Acta Chem. Scand., 1959, 13» 8» 1703-1708
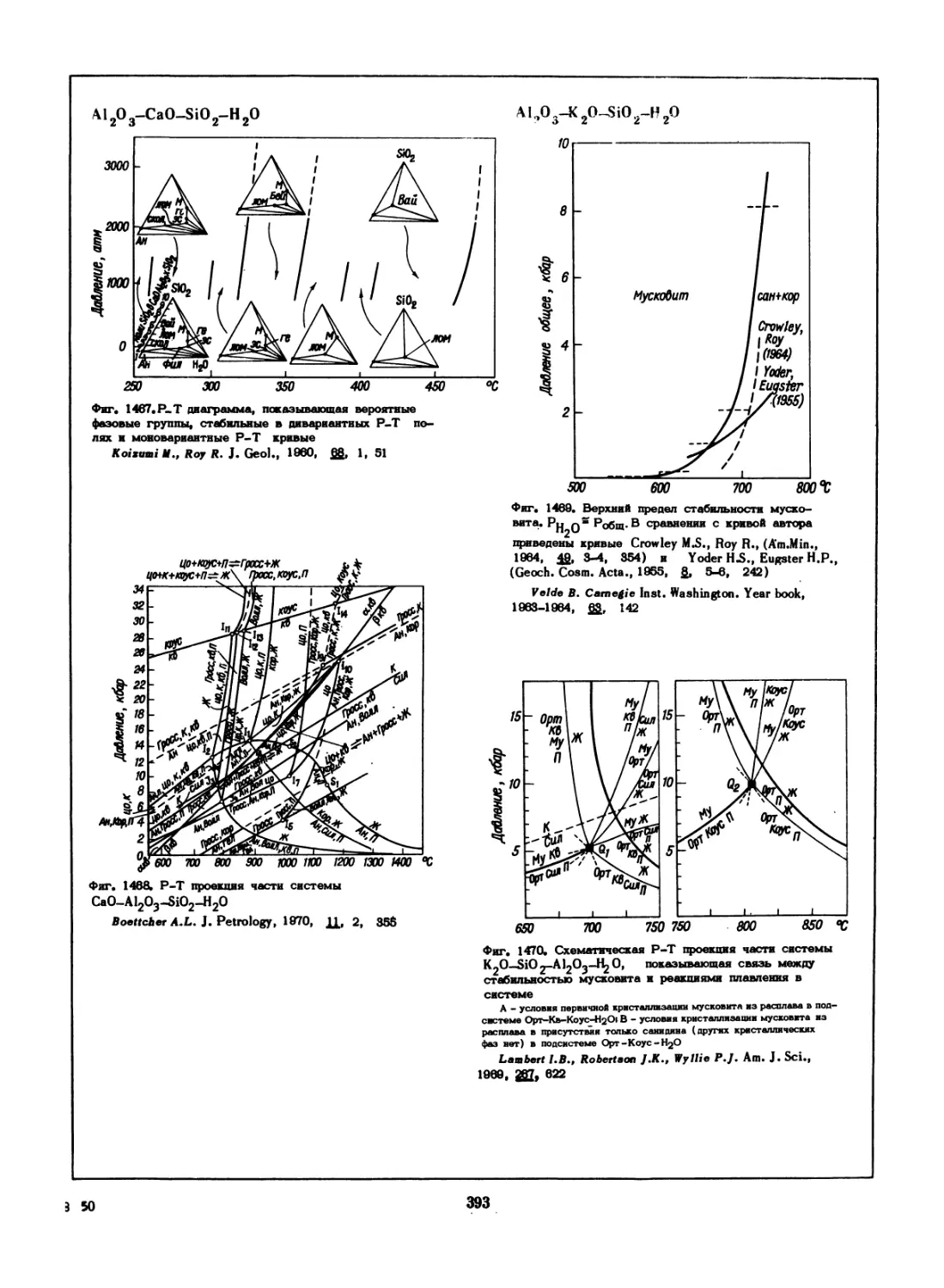
Фиг. 70, Диаграмма состояния системы Sb2S^
Jensen E. Norske Vidensk. Akad. Oslo, Abhandl I,
Mat.—Nat. KI., 1947, N 2, 23
Фиг. 72. Гетерогенные равновесия в системе Ag—Sb—S
при 400°С. Цифры внутри фазовых полей - проценты
H2S в газе (H2S+H2) наа твердыми фазами
Schenck R. Z.anorg. Chem., 1942, 249,1, 82-84
28
Ag - Si - S
Ag — T1 — S
Ш-
800-
600-
m-
200-
0 -
AgsSiS3
7ЧЦ
orAggSiSg
•\ r
i!l36'
+Лд? J
Арз
/*9,318,*
+Ад?
2W.
|Швв1
*Agesis6+
+Арг
aAgeStS6+
+/U
Фиг. 75. Диаграмма состояния системы Ag2S-Tl2S
Huber H. Z. anorg. Chem., 1921, 116, 140
200\-----1-----1-----1------1---!-----1-----•----------1----
SIS, 20 К 60 80 Age
2 Мол. % ”2
Фиг. 73. Диаграмма состояния системы Ag^S—SiS2
Gorochov О. Bull. Soc. Chim. France, 1968, N 6,
2263-2275
Ag - Sn - S
Corochov 0. Bull.Soc. Chim. France, 1968,N 6,
2263 -2275
Фиг. 76. Фазовые отношения в системе при 600°С. Все
ассоциации находятся в равновесии с газом. Давление
колеблется от долей миллиметра ртутного столба до
нескольких атмосфер
Кларк Л. Проблемы эндогенных месторождений,
1966, вып. 3. 161-250
29
Фиг, 79, Изотермическое сечение системы при 450°С,
Yund R.A. Amer. l.Sci., 1962, 260,10, 761-782
Фиг, 77, Фазовые анаграммы ассоциаций, стабильных
с паром в определенных температурных областях.
а - ниже 491±12°С; б - 0ОО°С; в - 688±3°С - 702+ЗОС; г -
702±3°С - 743±2°С; а - выше 743°С
Кларк Л. Проблемы эндогенных месторождений, 1966,
выл, 3, 161-250
As - Ni - S
Фиг. 78. Кривая сольвуса в системе NiAs~NiS
Yund R.A. Am, J.Sci., 1962,260,10, 761-782
Фиг. 80. Изотермическое сечение системы
при 500°С.
Yund R.A, Carnegie Inst. Washington, 1959,;
Year Book, 58, 138-170
30
As — Ni — S
As - Pb - S
Ni
Bee. %
Фиг. 81. Изотермическое сечение системы при 600°С.
Граница фазы Ni^+^2 приблизительная, за исключе-
нием участка вдоль бинарного сечения.
YundR.A. Am. J.Sci., 1962, 260, 10, 761-782
Фи г. 83. Фазовая диаграмма квазибинарной системы
PbS-As2S3
Kutoglu 4.N.Jb. Min. Monatsh., 1969, N 2, 68—72,
Фиг. 82. Фазовые отношения в системе при 700°С. Гра-
ницы верхнего поля жидкости nNijJ^ в пределах
тройного сечения приблизительные
YundR.A. Am. J.Sci., 1962, 260,10, 761-782
As - TI - S
Фиг. 84. Диаграмма состояния системы As^S^-T^S
Сапп eri G., Fernandes L.Atti reale accad. Lincei, Ser.l,
1925, 1, 674
Ba - Sn - S
V
800
Ba,Sn.
7Z7Z7
B^Sn^S
Важ8л1я8-»-1 „ „ —
*8«nS<4H»S,« 1 f
Bq ShjSjP
BaSnSg
BaS
+
BaSnSg
BaSngSja+BaSnSj
Фиг. 85. Фазовые отношения в системе BaS-SnS при 600-
650-800°С.
Herviev Perez G.,Hagenmuller P. Bull. Soc. Chim. ------------------L_
France, 1967, N 6, 2189-2194 SnS
Ц5 BaS x
31
Bi - Си - S
Фиг. 86. Часть анаграммы состояния системы Bi—Си—S
(Bi—CU2S—Cu)af у - твердые растворы CU2S —
В12§з
Vogel R. Zs. Metallkunde, 1956, 4J, 10, 694-699
Фиг. 88. Диаграмма состояния системы Bi—Си—S
Разрез: 80 вес.% Bi и 20 вес.% Cu-Bi2S3; а, р, у - твердые
растворы Cu2S-Bi2S3
Vogel R. Zs. Metallkunde, 1956 , 47, 10, 694-699
Фиг. 87. Диаграмма состояния системы Bi—Си—S
Разрез: 10 вес.% Sh90 вес.% Bi - 10 eec.%S и 90 вес.% Си.
а, р, у - твердые растворы CujS—Bi2$j
Vogel R. Zs.Metallkunde, 1956 , 47,10, 694-699
Фиг. 89. Диаграмма состояния системы Bi—Си—S
Разрез: 65 вес.% Bi и 35 вес.% Си - 65вес.%Bi % и 35 вес.% S;
а, р, у - твердые растворы Cu2S-Bi2S3
Vogel R. Zs. Metallkunde, 1956 , 47, 10, 694-699
32
Bi - Fe - S
Bi2S3 10 20 30 40 50 60 № & 60 60 40 20 FeS
Bl, to %
Bi2Sj 20
40 60
Fe,to%
00 Fe
Фиг. 90. Диаграмма сос-
тояния системы Bi—Fe—S
a - разрез Bi2S3-FeS; б - раз-
рез Bi-FeS; в - разрез Bi2Sj-Fe
Уразов Г.Г., Больша-
ков К.Ф., Федоров П.И.,
Василевская И.Н.
Ж урн. неорг. химии, 1960,
5, 3, 630-636
Фиг. 91. Поверхность ликвидуса в сис-
теме Bi-Fe-S
Уразов Г,Г,,Большаков К.фФедо-
ров П,И^Василевская И,Н. Журн. неорг.
химии, 1960, 5,3, 630-636
Фиг. 92. Границы области расслаивания
в системе Bi —Fe-S
Уразов Г,Г.9 Большаков К,Ф,, Федо-
ров ПЛ,, Василевская И,Н. Журн. неорг,
химии, i960, 5, 3, 630-636
Фиг. 94. Фазовые отношения в системе Bi—Mo—$ при
750°С. Растворимость M0S2 в жидкости Ж1 несколько
преувеличена. Ж2 - жидкость.
Stemprok И. Carnegie Inst. Washington, 1966, Year
Book 65, 337
Фиг. 93. Фазовые отношения в системе Bi—Мо—S при
600°С. Растворимость молибдата в жидкости - Ж мно-
го меньше 0,1 вес.%.
Stemprok М, Carnegie Inst. Washington, 1966, Year Book
65, 337
648 5
33
Bi _ Pb - S
Фиг. 95. Диаграмма состояния системы BijSj-PbS
Крап - твердые растворы; П - гунгаррит РЬ^В12^;
1П - лиллианит PbcBi.S.,; IV - галеновисмутин; V -
PbBi4S7
Craig J.R. MineraKum Deposita, 1967,1, N 4
Фиг. 97. Диаграмма состояния
Takahashi Fasuyo.Mem.Coll.
1919, 4, 49
системы BiS~Sb2S3
Sci., Kyoto Univ,
34
Bi - Se - S
Фиг. 98. Фазовая диаграмма системы I^S^—Bi2Se3
A - по данным Дьячковой И.Б. (Труды Ин-та минер., геол.,
кристаллох редких элементов, 1961, вып. 7).
Neumann G., Scheidegger R., Helv. Phys. Acta, 1967,15,
3, 293-300
Фиг. 99. Общий вид диаграммы состояния системы
Bi-Bi2S3-Bi2Se3
aid и abed - ликвидус и солидус системы Bi2S3 Bi^Se3; an
и a'n - ликвидус и солидус системы Bi—Bi2S3; dpn и d fen -лик-
видус и солидус системы Bi-Bi2Se3; alp’n - области кристаллизации
твердого раствора на основе висмутина;Idp'p - область кристалли-
зации твердого раствора на основе гуанахуатита; рр'п - область
кристаллизации лайтакариита;1р' - линии кристаллизации двух твер-
дых растворов на основе висмутина и гуанахуатита; рр' - линии
перитектической реакции Bi2Se3 (тв. р-р)+Жз£Л; р'п - линия трех-
фазного равновесия BioSj (тв. р-р) + Ж^Л.р' - четырехфазная точка
Bi2S- (тв. р-р) + Bi253 (тв. р-р) +Л5&Ж, Л - лайтакариит.
Годовиков А .А. Илъяшева Н,А, Геология рудных
месторождений, 1967, 9, 4, 84-86
Фиг. 100 Изотермические сечения анаграммы сис-~
темы Bi -Bi2S3-Bi 2Se3
а - 650°С; б - 600°С; в - 5SO°C; г - 450°С; а - ниже поверх-
юсти солидуса; 1 - жидкость; 2 - BUS, (тв. р-р) + Ж; 3 - Bi,Se3* Ж ;
4 ”\B1(?S3az - ?Гр) + Bi2Se3 (тв* Р-Р1+Ж; 5 - Л; 6 - Bi9Se3 (тв.
₽-₽)*Л^; 7 -BbSe W р-р) + Л; 8 . л + Ж; 9 - BiA ?™.
Л1-?»?- 12ТВ’вГ? ?nJn "B,4Se3 <тв-.₽-Р> + л: и -Bi2s23 3 (тв. р-р)+
, 12 -Bi2S3 +Л+ Bi, 1з _ л+ Bi; Л-лайтакариит;.
Годовиков А.А.,Илъяшева Н.4.Геология рудных
месторождений 1967, 9, 4, 84-86
Фиг. 101. Поверхность ликвидуса системы
Bi-Bi2S3-Bi2Se3
Области кристаллизации: ] - висмутина, П — гуанахуатита;
III - лейтакариита, IV - висмута
Годовиков A.AtfHлъяшева Н.Л.Геология рудных
месторождений, 1967, 4, 84-86
35
Bi - Те - S
Co - Fe - S
Bi2Te3-Bi2S3
у - у-тетрадимит; p - 0-тетрадимит; a - твердый раствор на
основе Bi2Te3
Glatz А.С. Am. Min., 1967, 52, 1-2, 161-170
Фиг. 105. Диаграмма плавкости системы
CoSl,05“Fel2S13
Gurlook W.tPid$eon L.M. Canad. Mining Metal).
Bull., 1953, 46, 493, 297-301
Cd - Mn - S
Фиг. 103. Фазовые отношения в системе CdS—MnS
Cook W.R. Ir. J. Am. Ceram. Soc., 1968,51,518-520
Фиг. 106. Кривая ликвидуса системы CoS-FeS
Asanti P.t Kohlmeyer E.J. Zs. anorg. Cehm.,
1951, 265, 1-3, 90-104
Фиг. 107. Диаграмма состояния квазибинарной систе-
мы FeS—Co^S^
0 - твердый раствор Co.S. (24 вес.%) в FeS; а - твердый раст-
вор FeS (20 вес.%) в Co4Sj 3
Колева Н.Г. Кусакин П.С., Ветренко Е.А., Диев Н.П.
Журн. неорг. химии, 1958, 4, 904-910
Фиг. 104. Изотермы 100 , 200 , 300 , 400 и 500°С
системы CdS—MnS
1 - твердый раствор со структурным типом вюртцита; Ц - твер-
дый раствор со структурой NaC’; 1П - незакаливаюшаяся фаза;
m - фаза, богатая марганцем, с - кадмием. Составы в мол.%
Miller R.O., Dachille F., Roy R. J. A ppi. Physics,
1966, 37,4913-4918
36
Co, dec. J.
Фиг. 108. Изотермы ликвидуса системы Со—Co^S^-FeS-Fe
If о ле в а Н.Г., Кусакин П.С., Ветренко Е, А,, Диев Н.П, Жури, неорг. химии, 1958, 3..4, 904-910
Со -Н - S
Co — Ni — S
Фиг. 109. Зависимость отношения H2S/H2 07 0/1,1
системы Co-S. Цифры внутри фазовых полей - соста-
вы сплавов в вес.% S; х - данные Hulsmann 0.,
Biltz W., Meise] K.(Zs.anorg. Chem., 1935,224. 73-83)
Rosenquist rd. Iron Steel Inst., 1954,176.1, 37-57
ЛЖ7-
_____1J___________
NISj+Co
« Аю.% I
«Л (Co,Nl)Sj
700 ~ (Co,Hl)sS4
(Co, Hl) S
0
C0S2
50
Am. 7.
Фиг. ПО. Фазовые отношения в системах NiSj— Со,CoS2-Ni
Delafosse D., Ro&enthal Ж. C.R. (Paris), 259.4. 807—810
Co - Sb - S
CoS
vu OU OU UUOO fU bUJOg uy 00
Sk.&eX
Фиг. 111. Гипотетическая анаграмма состояния системы Со—CoS—SbjS-?—Sb
Lanje Ж., Schlegel H. Zs. Metallkuride, 1951, 42, 257- 258
37
Cr — Fe — S
Fe «FeCrfr^/J
^CrFe*(Cr,Fe)bxS*r
Ztfi(Up-p) Cr
Фиг. 112. Фазовые отношения в системе при 6ОО°С (а) и 700°С (б). Все ас-
социации находятся в равновесии с газовой фазой.
Goresy A., Kullerud G. Ann. Rep. Geophys. Lab. Carnegie Inst. Washington, 1967—
1968, N 1520,183-187
38
Си - Fe - S
S
100000мм
Bee. 7. Fe
Фиг. 113. Фазовые отношения в системе Си—Fe-S при
постоянном давлении паров серы (455 мм рт.ст.)
Merwin Н.Е,, Lombard R,H, Econ. Geol., 1937, 32, 2,
Suppl., 203-284
10000
T
1000
455
100
10
400 500 600 700 800е
ЦТ
Фиг, 114, Проекция на плоскость' давление-температу-
ра части системы Си—Fe—S.Точки на пунктирной линии,
параллельной оси температур, даны по Merwin Н.Е’.,
Lombard R.H. (Econ. Geol., 1937, 32, 203-284).
Ж - раствор серы; Г - пары серы.
Roseboom Е.Н., Kullerud G. Carnegie Inst. Washington,
1958, Year Book 57, 223
Фиг. 115. Схематическая диаграмма фазовых отноше-
ний в борнит- халькозин-дигенитовой области при 200°С.
Пунктир - плоскость Cu2S-Cu5FeS4
Brett P,R. Camegie Inst. Washington, 1963, Year Book
62, 193-196
Фиг. 116. Изотермическое сечение системы Си—Fe—S при 200°С. заштрихованы области твердых растворов.
Yund R.A., Kullerud G. J.Petrology, 1966, 7, 454—488
39
Cu -Fe —S
Фиг. 117. Изотермическое сечение системы Cu-Fe-Snpn 300°С.
Yund R.A., Kullerud G. J.Petrology, 1966,7, 454-488
Фиг. 118. Изотермическое сечение системы Си—Fe—5при 400°С. Заштрихованы твердые растворы.
YundR.A., Kullerud G. J. Petrology, 1966,7, 454-488
40
S (Жидкость)
454-488
S (жидкость)
Фиг. 119. Изотермическое сечение системы
Cu-Fe-Snpn 500°С. Заштрихованы области .
твердых растворов
Yund R.A., Kullerud G, J. Petrology, 1966,7,
Си
Вес. %
Фиг. 120. Изотермическое сечение системы
Си—Fe—Бпри 700°С. Заштрихованы области
твердых растворов
Yund R.A,, Kullerud G. J.Petrology, 1966,7,
454-488
Фиг. 121. Область борнитового .твердого рас-
твора (заштрихована) в системе Qu-Ffc-S
при 700°С.
Yund R.A., Kullerud G. J. Petrology, 1966 , 7,
454-488
Фиг. 122. Область халькопиритового твердого
раствора (заштрихована) в системе Cu-Fe-S
при 700°С.
Yund R.A., Kullerud G. J.Petrology, 1966, 7,
454-488
6
41
KL
Фиг. 124. Фазовые отношения в псевдобинарной сис-
теме СиРе$2_х-СиЕе25з «0,08 <Х<0,3
Yund R.A.t Kullerud G. J.Petrology, 1966, 7,454—488
300
100
ggSS —* * *
B-TBo
B-T Во+Хз(т0.рр)
seefi JL__&_______£______
H-TBo-X
Н-ТВо+Хз ।
I
ЙЙ « 8 « « 8|
i i i i i i i i i I
0 20 Ы 60 BO 100
Cu2S Мол. X Cu5feS4
Фиг. 127. Фазовые отношения в сечении Cu2S-Cu5FeS4
системы Cu-Fe-S
Brett P.R. Camegie Inst. Washington, 1963, Year Book,
62, 193-196
Фиг. 125. Смесимость в системе халькопирит-пирро-
тин. Кружки - состав шихты, черные точки и области -
составы твердых растворов халькопирит-пирротин.,Пунк-
тир - области существования твердых растворов халь-
копирит-пирротин.
Такэноути Сукунэ, Фудэики Иосинори. J.Min.Met.Inst.
Japan, 1968,£4,N 957,1-6
Фиг. 128. Фазовые отношения в системе CuFeS?--
Cu5FeS4
Brett P.R, Camegie Inst. Washington, 1963, УеагBook
62, 193-196
В-ТДг
60 ~Дг(mtj.p-p)
/ В-Тбо +В-ТДг
a_j_aaj
Н-Т 60+В-Т Де
" / Н-ТДг + Н-Тбо
- Й 4/ й Й Й 8
Н-Т Дг+Дж Г
8 88
°C
wo
300
200
100
0 20 W 60 00 100
Cu^S5 Мол.'/. Cu5RS4
Фиг. 126. Фазовые отношения в сечении Cu5FeS4-Cu9 2$5
системы Си—Fe—S
Brett P.R. Camegie Inst. Washington, 1963, Year Book 62,
193-196
43
Си — Fe — S
Фиг. 129. Проекция линий солидуса в системе Си—Fe—S
на сторону Си—Fe
Roseboom Е.Н., Kullenid G. Carnegie Inst. Washington.
1958, Year Boom 57, 223-224
Фиг. 130. Твердофазовые отношения в системе Си—Fe—S
в интервале 400-800°С.
Roseboom EJi.t Kullerud G. Carnegie Inst. Washington,
1958, Year Book 57, 223-224
Fe, вес./
Фиг. 131. Равновесные отношения кристаллических и жидких фаз в части системы Си—Fe—S
Изотермы проведены по поверхности ликвидуса. Заштрихованные поля являются полями твер-
дых фаз
1 - изотермы; 2 - жидкость+ 2 кристаллические фазы; 3 - жидкость + кристаллическая фаза; 4 - кристалличе-
ская фаза+ 2 жидкости; 5 - кристаллическая фаза + жидкость. Нижняя часть диаграммы по Schlegel II., Schuller А.
(Freiberger Forschungsh., В., Huttenvesen Metallurgie, 1952, 2, 31)
Greig J.W., Jensen E., Merwin H.E. Carnegie Inst. Washington, 1955, Year Book 54,129-134
44
Си - Fe - S
Cu - Fe - ZnS
Фиг. 132. Область иесмесимости в жидком состоянии
в богатой серой части системы Си—Fe—S. Точки 1,
2, 3 отвечают составам борнита, халькопирита и ку-
банита соответственно
Kullerud G. Carnegie Inst. Washington, 1964, Year Book
63,201-202
амад ewcujS
Фиг. 135. Диаграммы состояния системы Cu-Fe-ZnS.
Разрезы: Ее - 80 вес.% Cu2S и 20 вес.% FeS-ZnS;
Дд - 60 вес.% Cu2S и 40 вес.% FeS—ZnS; а - твер-
дый раствор ZnS в Cu2S; р - твердый раствор
Cu2S в ZnS
Новоселов С.С, Цветные металлы, 1955, № 3, 15-20
Г
1100
000
1000-
900
Cu-S FenS
Фиг. 133. Температуры появления иесмесимости в
жидком состоянии по сечению с 50 вес.% серы
Kullerud G. Carnegie Inst. Washington, 1964,Year
Book 63, 201-202
Ч
1100\
000
1000
900
700
GUgFeS^ 5
10
Z,Oec.%
I 2 жидкости
040'
Cu2.sS*Gu*£
Си - Ge - S
S
Cu.-S
Tg+s+Ge
Я Am. %
Фиг. 136. Изотермическое сечение системы Cu— Ge_S
при 600°C.
Cu a-Cu £
E+GeS2+6eS
wS+Ge
Ж
7>Ge+M
6о
Фиг. 134. Диаграмма плавкости сечения Cu^FeS^—S
системы Cu—Fe—S
Kullerud G. Carnegie Inst. Washington, 1964, Year
Book, 63,201-202
$U2u5Ge, j-Cu3Ge; Cuj.jjS - высокотемпературный дигенит;
T|—Cu2GeS3; T2“GugGeS^(Cu5jGejS ^q)
Viaene W,, V erkaerenjMoreau J» C.R. (Paris), 1968,
266D, 14, 1451-1454
45
Си — Ge — S
flm.%
CuS
вс(гпВ.р-р)
CUgSg
Cu1>g6S
Cu?S
Cu
Си - Ni - S
(rCSfc
Си.г-х S
иг. 139. Диаграмма состояния системы Cu2S-Ni2S
Friedrich К, Zs. Metall. u. Erzbergbau, 1914, 1, 164
MM
Си—Mo — S
S
Bee.'/.
Viaene Ж., Verkaeren J., Moreau J, C.R. (Paris), 1968,
266P, 14, 1451-1454
Фиг. 137. Изотермическое сечение системы Си—Ge—S
при 700°С
C-Cu^Ge, ^j-Cu^Ge, Cu2_xS высокотемпературный дигенит;
Tj-CujGeS^, T2-CusGe(Cu^GeyS^Q)
JZ_
50
Cu
Ш.
Cu «-Cu £
(Gu,Ni) S2 (mfl n-p)
CugS
СиЛ
GuMo2S3(mB.p-p)
Вес. 7.
NiS
J3Nl7S6
NigS2
Ni
Фиг. 140. Фазовые отношения в системе Cu-Ni—S
_при 100°С
be — " blaubleibender" ковеллин
Moh G.H., Kullerud G. Carnegie Inst. Washington,
1964, Year Book, 63, 210-211
Си
Фиг. 138. Изотермическое сечение системы
при 800°С
Grover В. . Jb. Min. Monatsh., 1965, N 7,
Mo
46
47
Cu-Ni - S
S
Фиг. 144. Фазовые отношения в системе Cu—Ni—S
при 500°С
Moh G.H., Kullerud G. Carnegie Inst. Washington,
1963, Year Book 62, 190-192
S
Фиг. 145. Фазовые отношения в системе Cu—Ni—S
при 600°С
Moh G.H., Kullerud G. Carnegie Inst. Washington,
1963, Year Book 62, 190-192
48
7
49
50
Cu - Pb - S
Фмг. 152. Схематические фазовые отношения в систе-
ме Cu-Pb-S при 600°С
Craig J.R., Kullerud G. Am. Min., 1968, S3, 1/2,145-161
Craig J.R., Kullerud G. Am. Min., 1968, 53, 1/2, 145-161
Фиг, 153. Схематические фазовые отношения в систе-
ме Cu—Pb—S при 1130°С
Craig J.R., Kullerud G. Am. Min., 1968, £3, 1/2,145-161
51
Gu
52
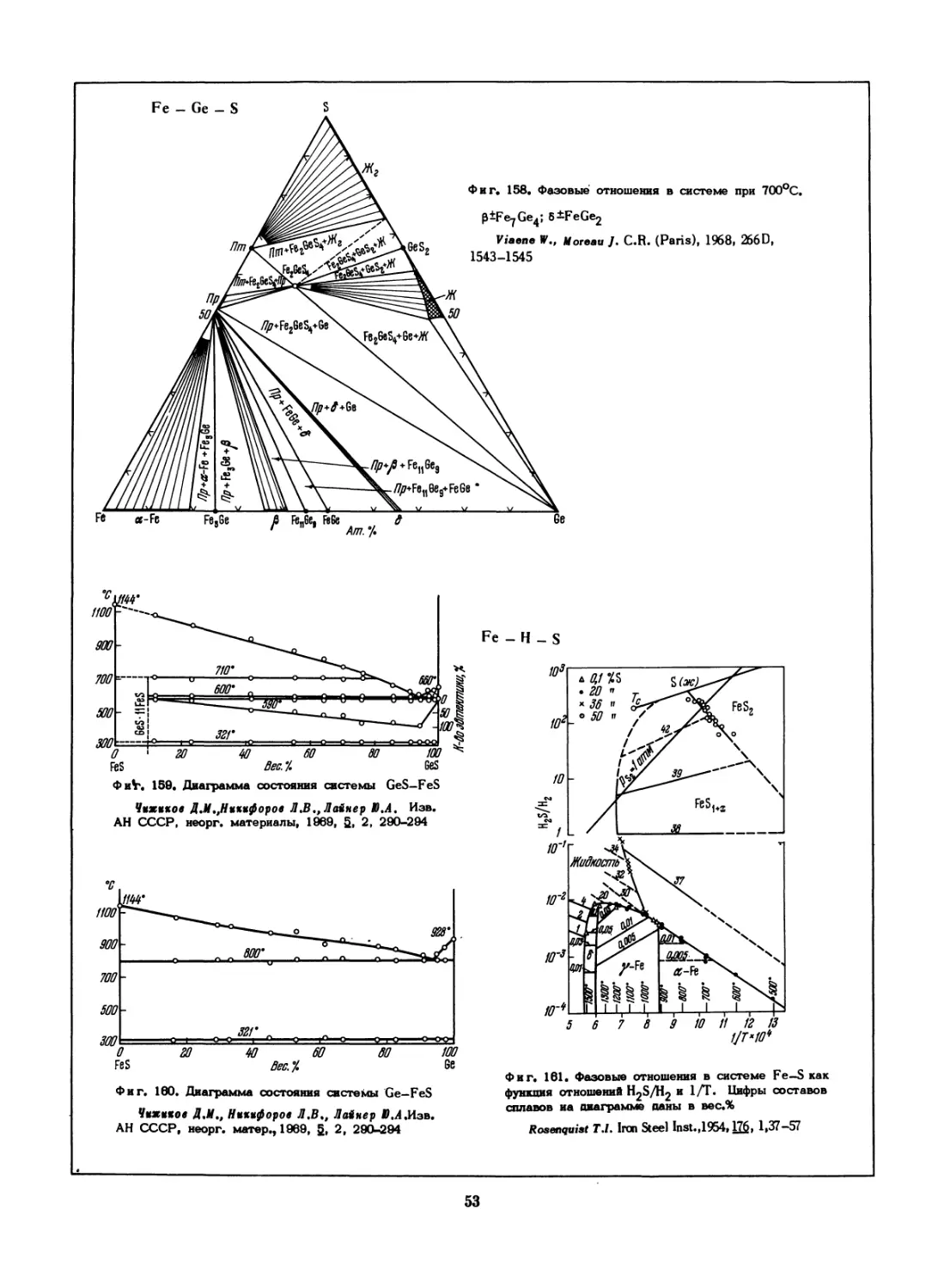
ФиН 159. Диаграмма состояния системы GeS—FeS
Чижиков Д .К.,Никифоров Л .В,, Лайнер Ю.А, Иэв.
АН СССР, неорг. материалы, 1969, 5, 2, 290-294
Фиг. 160. Диаграмма состояния системы Ge-FeS
Чижиков ДМ., Никифоров Л.В., Лайнер Г.Л,Иэв.
АН СССР, неорг. матер., 1969, §, 2, 290-294
Fe - Н _ S
Фиг. 161. Фазовые отношения в системе Fe—S как
функция отношений H2S/H2 и 1/Т. Цифры составов
сплавов иа анаграмме даны в вес.%
Rosenquist T.l. Iron Steel Inst.,1954» 176» 1,37—57
53
Фиг. 165. Фазовые отношения в системе Fe—Mo—S
при 735^С. Черное - жидкость
Kullerud G. Carnegie Inst. Washington, 1966» Year
Book 65, 339-341
s
Fe - Ni - S
s
Фиг. 162 — 164. Фазовые отношения в системе Fe—Mo—S
при 600°С, 610-726°С 726-732°С.
Kullerud G. Carnegie Inst. Washington, 1966, Year
Book 65, 339-341
Фиг. 166. Фазовые отношения в части системы
(Fe,Ni)-S, (Fe,Ni)-38,6 вес.% Ni;S > 30 вес.%
Kullerud G. Carnegie Inst. Washington, 1962,
Year Book 61.144-150
54
Fe — Ni — S
Фиг. 167о Сечение 44 вес.% Fe и 56 вес.%
Ni—S системы Fe-Ni—S
АКВ - (Fe,Ni) + жидк.; pCE - FeS+Ni; CBEH-
тройной тв. раствор + жидк. + продукт перитектической
реакция СЕ; KHNM-(Fe,Ni ) + тройной твердый раст-
вор; EHN -тройной твердый раствор; MN - неизвест-
ное превращение; PR - превращение тройного твер-
дого раствора в тройное соединение.
Hawley J,E4 Colgrove G.L., Zurbrigg H,F.
Econ. Geol.,1943, 5, 335-388
Фиг. 169. Фазовые отношения в системе FeS—№382
I “ FeS тв. раствор с 1,83 вес.% [Vi макс.; || - тройной твер-
дый раствор; |Ц - (FeS)2Ni3S2+Ni3S2
Hawley J.E., Colgrove G.L., Zurbrigg H.F. Econ. Geol
1943, 3g, 5, 335-388
Фиг. 168. Сечение 56 вес.% Fe и 44 вес.% Ni—S
системы Fe—Ni—S
Hawley J.E., Colgrove G.L., Zurbrigg H,F. Econ.
Geol., 1943, 3g, 5, 335-388
Фиг. 170. Диаграмма состояния системы FeS—Ni^
Ванюков В,А.,Ванюков A. В. t Таращу к //.Т\Цветн.
металлы. 1955, №4, 23-27
Фиг. 171. Диаграмма состояния системы
Ванюков В.АчВанюков А, В., Таращу к //.Т.Цветн,
металлы, 1955, №4, 23-27
FeS-NigSj
55
Fe-Ni-S
Т
800
•c
200 ft"
700
^-Nl3±IS2
160
Пирит +ваэсит
137'*6
600
610**2___________
^+Ni3tXS2
120 \
I
500-
Пн+Пр
80 к
Пн+хизлевудит
FeS2
+
бравоит
hi
I1
<1-1
бравоит
ваэсит
W го 46> 60 80 NiW,
ir6,ni,JgDg
Фиг. 172. Схема распаца пентланаит-пирротин - Nij±xS2
при 610t2°C
Kullerud G. Carnegie Inst. Washington, 1962, Year Book
144-150
61,
Фиг. 173. Разрез (Fe,Ni)15Slg -(Fe,Ni)QSo системы
Fe-Ni-S. Отношение Fe/Ni = 1
Kullerud G., Carnegie Inst. Washington, 1956, Year Book 55.
175-177
40-
FeS- 20 40 60 80 NIS-
2 Oec.l
Фиг. 174. Схема распада бравоита в системе FeS2-NiS2
Clark L.A., Kullerud G. Econ. Geol., 1963, 51,6, 853-855
V
600
600
200
0 47 40 60 80 1Л
FeS2 NlSj.ttaX HIS,
Фиг. 175. Фазовые отношения между пиритом и ваэси-
том, в присутствии богатой серой жидкости и пара.
Clark L.A., Kullerud G. Econ. Geol., 1963, 58 , 6 , 853-885
S
Fe
(Fe,Nl)Sg+>W
(Ni,Fe)S2+,W
FeS+a
У Ni
/♦(Fa,Nl)9Se+FeNi8 ' FeNi^NiA
(Fe,NlJgS.
FeS+^+a
FeS+^
Фиг. 176. Изотермическая диаграмма системы при
400°С. Все фазы находятся в равновесии с газовой
фазой
м.тв.р-р - моносульфидный твердый раствор (
Craig J.R.t Naldrett A.]., Kullerud G, Ann. Rep.
Geophys. Lab. Carnegie Inst. Washington, 1966-1968,
N 1499, 440-441
(FeJ<OS.*(Nt,Fe)Sg+/W
(FeJlDSg
(Fe,Nl)S24Nl1Fe)5S4^^
М(яйр-р)
FeNI
®)S»
ft)ij+(Ni,Fe)8S4
(Ni/e)8S4+Mrflz4#^
(^NOgV^^NlA
РЗДОД+ЖД+МД
56
8
57
Fe —Ni—S ы)в№1.
Fe,*c7.
Фиг. 181. Область существования моносульфидного
твердого раствора (Ni,Fe). S в части системы Fe-Ni-S
в интервале температур 300-В00°С.
Naldrett A.J., Kullerud G. Carnegie Inst. Washington. 1966.
Year Book 65,320-327 e
w,oec.%
Фиг. 180, Фазовые отношения в части системы, при
300-500°С. Виоларит устойчив с 481±3°С в области,
ограниченной (FejNOS?, (Ni.Fe^ и моносульфидным
твердым раствором (М.тв.р-р).
Craig J.R. Ann. Rep. Geophys. Lab. Carnegie Inst.
Washington, 1966-1967, N 1499, 434-436
Фиг. 182, Парциальное давление паров серы как функ-
ция состава моносульфидного твердого раствора (FeJVi) S
Цифры на изолиниях - 1g Рс
°- c"",sie >«.
s
(Ni,Fe)S2*M*f
<r+FeS*/“
Bee. %
(Fe^OSj+fNl^elSfM*/-
-----► WW
Фиг. 183. Фазовые отношения в системе
Fe-Ni-S при 600°С.
М.тв.р-р - моносульфмдный твердый раствор.
Поле М.тв. р-ра заштриховано.
Kullerud G., Carnegie Inst. Washington,
1963, Year Book 62,175-189
M(m0.p-pf№ft) 5*1 S,'»/’
(Nl,Fe)JtxSf/-
v+Fes+/
FeS+tNlM^yV
Ni
58
59
Fe—Ni—S
Фиг. 188. Фазовые отношения d системе Fe—Ni—S
при 860°C.
M.TB.p-p (Fe,Ni)l xS
Kullerud G. Camegie Inst. Washington, 1963, Year
Book 62, 175-189
Фиг. 190. Фазовые отношения в системе Fe-Ni-S
при 1000°С.
М.тв.р-р - (Fe,Ni)j_xS
Kullerud G, Camegie Inst. Washington, 1963, Year
Book 62, 175-189
Фиг. 189. Фазовые отношения в системе Fe—Ni—S
при 900°С.
Л\.тв.р-р - (Fe,Ni)j_xS
Kullerud G. Camegie Inst. Washington, 1963, Year
Book 62, 175-189
Фиг. 191. Фазовые отношения в системе Fe-Ni-S
при 1100°С.
М.тв.р-р - (Fe, NiJj-xS,
Kullerud G.Camegie Inst. Washington, 1963, Year
Book 62, 175-189
60
Жирные линии от 1192°C к 992°C показывают максимумы сос-
тавов и температуры плавления серии твердых растворов (Fe,Ni)j _XS
Kullerud G. Carnegie Inst. Washington, 1962, Year
Book 61, 144-150
Фиг. 195. Растворимость пирита в ваэсите в систе-
ме как функция температуры
Clark L. A,t Kullerud G. Econ. GeoL, 1963, §8, 6,
853-885
Fe - О - S
Фиг. 193о Диаграмма плавкости системы Fe—Ni—S
Ванюков В.А. Ванюков A.B., Таращу к Н.Т. Цветные
металлы, 1955, №4, 23-27
^Робщ
750
1'0
Фиг. 196. Диаграмма сос-
тояния сечения 60 вес.% Fe-
40 вес.% FeO и 30 вес.% FeO-
70 вес.% FeS системы
Fe-FeS-FeO
Vogel R., Fulling Ж. Fest-
krift TillSgnad J. Arvid Hed—
vail den 18 Januari 1948, Gote—
borg, 1948, 31-42
Фиг. 194. Схематическая диаграмма P - T, части
системы Fe-Ni -S *
М.тв.р-р - (Fe.Ni )j_xS
Clark L.A., Kullerud G. Econ. Geol., 1963, 5g, 6,853-885
61
Фиг. 197, Диаграмма состояния сечения 20 вес.% ИеО-
80 вес.% Fe и 15 вес.% FeO “ 85 вес.% FeS системы
Fe-FeS-FeO
Vogel R., Fiilting Ж. Festkrift Tillagnad J. Arvid
Hedvall den 18 Januari 1948, Goteborg, 1948, 31-42
Фиг. 199. Диаграмма состояния системы Fe—FeS—FeO
Vogel R,t Fulling Ж. Festkrift Tillagnad J. Arvid
Hedvall den 18 Januari 1948, Goteborg, 1948, 31-42
Vogel R., Fulling Ж. Festkrift Tillagnad J. Arvid
Hedvall den 18 Januari 1948, Goteborg, 1948, 31—42
Фиг. 200. Диаграмма состояния системы Fe-FeS-Fe^O*
Vogel R., Fulling Ж. Festkrift Tillagnad J. Arvid Hedvall
den 18 Januari 1948, Goteborg, 1948, 31—42
62
Fe-O-S
Фиг. 201. Диаграмма состояния системы FeS-FeO-Fe
Олъшански* Я.И.ДАН СССР, 1861, SQ, 6, 888-886
Фиг. 202. Фазовые отношения в системе Fe-0-S
а - ниже в75°С; Ь - при 675-700°С; с - при 700-743°; d - выше 743°С
Kullerud G. Carnegie Inst. Washington, 1957, Year Book 56,
198 - 200
63
Fe—0-S
«7X0
90
Fe
Тройная
эвтектика
Пирротин (mO.p-p) # % S
80 70
Fe, вес. %
•V Гематит
^Магнетит
Вюстит
M.p-p)
20
Фиг. 203. Изотермическое сечение части системы при
900°С. Все фазы находятся в равновесии с газовой фа-
зой
Naldrett A.J, Ann. Rept. Geophys. Lab. Carnegie Inst.
Washington, 1966-1967,N 1499, 419-427
50%
Фиг. 204. Диаграмма плавкости и поверхности ликвидуса части системы. Пунктирные
линии - по Hilty D.C., Grafts W. (J. Metals, 1952, 4, 1307-1312)
Naldrett A J. Ann. Rep. Geophys. Lab. Carnegie Inst. Washington,1966-1967, N 1499,
419-427
64
Fe-Pb-S
Фиг. 205. Диаграмма плавкости системы FeS-PbS
Friedrich К. Metallurgie, 1907 , 4, 479-486
s
Вес 7.
S
Фиг. 208. Фазовые отношения в системе
Fe-Pb-S
а - при 700°С: 1 -FeS2+PbS+SM+ Гж, 2 - FeS2+PbS+r ,
3 - FeS2 + PbS+Fe^^+Г, 4 - PbS+Fe, _xS+r, 5 - РЬЖ+
PbS+Fej_XS+Г,6 - РЬЖ+Fej_xS+r, 7 - PbM+Fej_xS +
+ Г+Fe; б- при 716°C: 1 - SM+FeS2+Ж + Г, 2 -5ж+Ж +
+ Г, 3 - Бж+ Ж + PbS+Г, 4 - Ж+ Г,5-FeS^ Ж + Г, 6 -PbS+
+ Ж+ Г , 7 - FeS2 + РЬБ+Ж+ Г, 8 - Fe^+PhS* Г, 9 -FeS2+
+ PbS+Fe|_xS+r,10 - PbS+Fej-^+r; 11 - PbS+Fej_xS+
+ РЬЖ+Г, 12 - РЬЖ+ Fej-^+Г, 13-Pb^Fe+Fej-^S+r
Brett Re, Kullerud G. Econ.Geol., 1967, 62, 3,
354-365
Фиг. 208. Фазовые отношения в системе Fe-Pb-S
при 730°С.
1 - PbM+Fe+FeS; 2 -PbM+PbS+ FeS; 3-PbS+Fe^S*
+ Ж; 4 - FeS2+Fe1 .^Ж;5 - FeS+ Ж + 6 - РЬ8+Ж+Бж .
Brett P.R., Kullerud G. Camegie Inst. Washington,
1964, Year ВоокбЗ, 202-204
Фиг. 207. Фазовые отношения в системе Fe—Pb—S
а - при 720°С; б - при 730°С; в - схематическая диаграм-
ма плавкости; 1 - S>+FeS2+Ж + Г, 2-5ж+Ж+Г,3- РЬ5+5ж+Ж+Г;
4 - Ж + Г; 5 - PbS + Ж + Г; 6 - FeS2 + Ж + Г; 7 - FeS2 + Fej _XS+
+Ж+Г; 8 - Fej_xS + Ж + Г; 9 - Fe1-xS + PbS+Ж+Г; 10 - Fe1UxS +
+PbS+r;ll -Fei_xS+PbS+Pb/ Г;12 - Pb^Fe, >Г; 13 - РЬЖ+
* « m Ж i —Л ' Ж
+Fe+Fej_xS+r
Brett R„ Kullerud G. Econ. Geol., 1967, 62, 3, 354-365
I 9
65
Фиг. 209. Фазовые отношения в системе Fe—РЬ-8
при 750°С. Все фазы находятся в равновесии с газом.
1 _ РЬЖ+ Fe+ FeS; 2 - РЬЖ+ FeS+ PbS; 3 -PbS + Fe^^
+Ж; 4 - Fej-^I+S* 5 - PbS + Ж + 5Ж
Brett P.R., Kullerud G. Carnegie Inst. Washington, 1964,
Year ВоокбЗ, 202-204
Фиг. 210. Фазовые отношения в системе Fe—Pb—S
при 850°С. Все фазы находятся в равновесии с газом.
1'_ РЬЖ+ Fe+ FeS; 2 - РЬЖ+ FeS+ Ж; 3 - РЬж+РЬ5+Ж;
4 - Fe^S + Ж +S^ 5 - PbS +Ж + 5ж
Brett P.R., Kullerud G. Carnegie Inst. Washington,
1964, Year Book 63, 202-204
0 5 10 15 ZO 25
Wee:/.
rv
‘0
1200Г
800
i
\ж,
tr
I- ^,*FeS j|^f4
M,+FeS
№
I
V
I | !FeS*Sb<Sbft
0 5 10 15 20 25 30
S, вес. 1.
_____i___I___i___i___i—i____i___\400
ftSb2 60 W 20 FeS
Фиг. 211 — 212. Диаграмма состояния системы Fe-FeS-St^S^-Sb
Разрезы:! -Fe-SbjS^, II — FeS—Sb; e-FegSbj; III - FeS^-Sb^’.IV - e Fe^Sbg-Sb^ ; V-FeS^-FeS; ,-Fe6S^
Урдзое Г.Г., Большаков K.A., Федоров ПЛ,, Василевская ИМ. Журн. неорг. химии. I960, 2, 449-455
66
Фиг. 213. Диаграмма состояния системы
Fe—FeS-SI^S^-Sb
Разрез FeS - Fe^Sb^
Уразов Г .Г,, Большаков К.А., Федоров ПЛ,,
Васи ле в скал И Л Жури, неорг. химии, 1960, 5,
2, 449-455
Фиг. 215. Поверхность ликвидуса (изотермы в °C)
в системе Fe-FeS-Sl^S^-Sb
Уразов Г,Г., Большаков К,А,, Федоров ПЛ»,
Василев скал И Л. Журн. неорг. химии, 1960, 2,449-455
Фиг. 214. Границы области несмесимости в жидком
состоянии в системе Fe-FeS-St^S^-Sb
Ура*зов Г.Г., Большаков К.А., Федоров П.И,,
Васи лев скалИЛ. Журн. неорг. химии, 1960, 5, 2,
449-455
фиг. 216. Диаграмма состояния системы SnS-FeS
Пушкарева АЛ. Изв. ВУЗ, Цветные металлы, 1966,
№1, 110-115
Фиг. 217. Фазовые отношения в системе Fe—Sn—S
при 600°С
Moh G.H. Carnegie Inst. Washington, 1963, Year
Book 62, 197-200
S
FeS2
fW
V/77 + SnS-+>Mf
Пр + SnS +Ж
Пр+аЪ+Ыъъ
Fe orfe
FeSn
Am.
Пр + Sn2S3+SnS
/to+FeSn
Жидкость
Sn
67
Fe—W—S
FeS, Вес. /•
Фиг. 218. Диаграмма состояния системы FeS—W
Vogel R., Weisenkom H.H. Archiv Eisenhiittenwe-
sen,1961, 32,6, 413-420
Фиг. 221. Диаграмма состояния системы Fe—W$2
Vogel R., Weisenkom H.H. Archiv Eisenhiittenwe-
sen, 1961, 32,6, 413-420
!00 90 80 70
FeS, Bee.
Фиг. 222. Диаграмма состояния системы Fe—FeS—WS2—W
Разрез при 10 вес.% S
Vogel R.r Weisenkom HJi. Archiv Eisenhiittenwesen, 1961,
32, 6, 413-420
Фиг. 219. Диаграмма состояния системы FeS—WS2
Vogel R., Weisenkom H.H. Archiv Eisenhiittenwe-
sen, 1961, 32, 6, 413-420
Fe8W2,zfc£%
Фиг. 220. Диаграмма состояния системы FeS—Fe^i^
Vogel R.t Weisenkom H.H. Archiv Eisenhiittenwesen.
1961, 32, 6, 413-420
W,Bec.7.
Фиг. 223. Диаграмма состояния системы Fe—FeS—WS2—W
Разрез при 20% S
Vogel R., Weisenkom H.H. Archiv Eisenhiittenwesen, 1961,
32, 6, 413-420
65
69
Фиг. 232. Состав сфалерита в равновесии с пиритом
и пирротином
Воогшап R.S. Econ. Geol., 1967.62,614-631
Фиг. 235. Диграмма состояния системы HgS—HgSe
1 - эффекты на кривых охлаждения; 2 - одна изотропная фа-
за; 3 - одна киноварная фаза; 4 - киноварь и изотропная фаза
Малевсний А .Ю,,Чжун Цзл-жун. Экспериментальные
методы исследования рудных минералов. М., * Наука",
1965
Hg - S - Те
Фиг. 233. Состав сфалерита в равновесии с
как функция fs^
и температуры,
Fe, Fe. XS
в мол.% FeS
Фиг. 236. Диаграмма состояния системы HgS—HgTe
1 - эффекты на кривых охлаждения; 2 - одна киноварная фа-
за; 3 - киноварная и изотропная фазы; 4 - одна изотропная фаза;
5 - две изотропные фазы
Налевский А,К),,Чжун Дэл-жун^ Экспериментальные
методы исследования рудных минералов. М., "Наука",
1965
или FeS2
Бартон П. Б, Ту л мин Л .Термодинамика постмагма-
тических процессов. М.» "Мир", 1968, 239-289
MnO-0-S
Фиг. 234. Диграмма рав-
новесия твердых фаз в
системе ZnS—03383
А - твердый раствор со
структурой вюртцита; В -
твердый раствор со струк-
турой сфалерита; С - твер-
дый раствор со структурой
тетрагональной фазы
Малевский AJ0, Эк-
спериментальные иссле-
дования в области ми-'
нералогйн и геохимии
редких элементов.
М., "Наука", 1967
Фиг. 237. Диаграмма состояния системы MnO—MnS
Andrew J.H., Haddocks W.R., Fowler E.A. J. Iron
Steel Inst., 1931, 124, 2, 298
70
Мп — Se — S
Фиг. 238. Диаграмма состояния системыMnS—MnSe
1 - жидкость; 2 - жидкость + тв. фаза; 3 - тв. фаза; 4 - со-
лидус по рентгеновой дифракции (X-га у diffraction)
Mehta J.M.t Riewald P.G.t VanVlack L.H. J. Am. Ceram.
Soc.,1967, 50,164
Фиг. 240. Диаграмма
состояния системы
PbS-Sb2S3
litsuka D, Coll. Sci.
Kioto Univ., 1919, 4, 61
Pb - Se - S
Фиг. 241. Диаграмма состояния системы PbS—SeS.
Все ассоциации находятся в равновесии с газовой
фазой
Simpson D.R. Econ. Geol., 1961, 59, 1, 150—153
Ni — Sb — S
S
Т-Ш
Фиг. 242. Фазовая диаграмма системы PbS—РЬТе
1 - две твердые фазы после закалки; 2 - одна твердая фаза
после закалки; 3 - одна твердая фаза после закалки (со следами
второй), 4 - фазовые границы по рентгеновским данным, 5 - фазо-
вые границы по данным ДТА.
Darrow M.S., White W.B., Roy R. Trans. Met. Soc. AIME,
1966 , 235, 5, 654-658
Фиг. 239. Диаграмма состояния системы Ni—Sb—S
Цифры в фазовых полях - % в газе над соответствующей ас-,
социацией твердых сульфидов
Schenck R., Forst Р. Zs. anorg. Chemie, 1939, 241,
145-157
71
Pb - Т1 - s
Sn — Se — S
Фиг. 243. Диаграмма
состояния системы
PbS-Tl2S
Серебряная Н,Р,
Зап. Всес. мин. об-ва.
1962, 92, 2. 241-246
________I________I_______I_______।_______
SnS QZ 44 OJS Ofi SnSe
Мол. дали
Фиг. 244. Диаграмма
состояния системы
PbS-ZnS
Аветисян Х>К,,Гна-
яытенхо ГЛ,
Иэв. АН Каэ.ССР,
сер. горн, дела и
мет., 1956, вып. 6,
11-25
S - Sn - Те
Фиг. 248. Диаграмма сос-
тояния системы SnTe—SnS
Насиров ЯЛ,, Фейзиее Я,С,
Иэв. АН СССР, неорг. ма-
тер., 1969, £, 2 , 380-382
Sb -О - S
Фиг. 245. Диаграмма сос-
тояния системы Sb2O^—
S^S^
Quercigh E, Attireale
Accad.Lincei,Ser.l, 1912,21,418
Четырехкомпонентные
Ag - As - Cu - S'|
Sb - Sn -S
Фиг. 246. Диаграмма сос-
тояния системы Sb2S^-SnS
Panavano N., DeCesaris P.
Фиг. 249. Диаграмма состояния системы 3,25
Cu2S As2S^—Ag2$
Cambie L.t Elli Af.Chim.e ind., 1967, 42,9,
932-943
Gas.Chim.ltal., 1912, 42., 11, 6
72
Ag - Bi _ Н _ S
Фиг. 250. Гетерогенные равновесия в системе Bi—
Ag—S при 510°С. Цифры внутри фазовых полей -
содержание H2S в.газе (H2S+H2) над твердыми
фазами.
Schenck R. Z.anorg. Chem., 1942, 249,1, 82-84
Фиг. 252. Диаграмма состояния системы AgBiS2-PbS
Пунктир - предполагаемые фазовые взаимоотношения
Van Hook H.J. Econ. Geol., 1960, 55, 4, 759—788
Ag — Bi — Pb — S
Фиг. 251. Диаграмма псевдобинарного сече-
ния AgBiS2—PbS системы PbS—Ag2S—81283
Wemik J.H, Am. Min., 1960 , 45 . 5/6, 591
Фиг. 253. Изотермические сечения системы
Ag2S-Bi2S3-PbS при 180°С (а), 400<>С (б) и 600°С (в).
Области твердых растворов заштрихованы.
Van Hook H.J, Econ. Geol., 1960, 55 . 4 , 759—788
8 10
73
Ag - Bi - Pb-S
Ag-Bi-S - Se
Фиг. 255. Диаграмма системы AgBi$2—AgBiSej
Wemick J.H. Am. Min., 1960, 45, 5/6, 591
Ag - Cu - Sb - S
Фи г. 256. Схематическая диаграмма системы
A g2S-C и 2$-S S3
Серы избыток. В - фаза В.
Gaudin А.М., McGlashan D.W. Ес on. Geol., 1938,
2, 143-193
Фиг. 254. Схематические фазовые диаграммы системы
а - при низких температурах; б - при 400°С; в - при 1000°С.
Черное - области твердых растворов, густой крап - гомогенные
жидкости; II - РЬ4В12&7; III - PbjBi^Sj j ;IV — галеновисмутит.
Craig J.R. Min era Hum Deposita, 1967,1, N 4
74
Ag-Pb-Sb-S
Bi - Co - H - S
Фиг. 257. Диаграмма псевдобинарного сечения
AgSbS2-PbS системы PbS-Ag2S—SI^S^
P— [i—миаргирит, а—а -миаргирит
Wemick J.H. Am.Min., 1960, 45, 5/6,591
Фиг. 259. Изотермическое сечение системы Со—Bi—Н—S
при 450°С.
Schenck R. ZS. anorg. Chemie, 1942, 249, 1, 83—85
Фиг. 258. Разрез тетраэдра 5% S (а), 20% S (в) при
1100-1200°С
А — Cu2S+Cu-3As+NiAs+NiAs2;
В — C^S+Cu-jAs+NiAs+Nij । Asgj
С — Ci^S+Cu-jAs+Cu— Mk+Nij ] Asg;
D — Ci^S+Cu— Mk+N Ц i Asg
E - Cu2S+(Ni,Cu)5 As2+Cu-Mk+
bNijjAsg;
F — Cii2S+(Ni,Cu)5As2+Cu—Ni—Mk
G — Cu2S+(Ni,Cu)5 As2+N Ц । Asg
Cu2S+Cu- Ni-Mk
Ni3S2+Ni-Mk
1 - четырехфазовые области; 2
i а ст и; 3 - двухфазовые области.
Dittrich H.t Gerlach J., Hennig U, Zs. Erzbergbau und
MetaHurhiittenwesen, 1967, 20. 7, 308—314
H - Cu2 S+N iS+N i A s+N i ц A sg;
К -CuoS+NiS+Ni^Sj+Nij i As8;
L - CiijSHN i ,611)5 Asj+N i3 Sj+Ni j j As 8;
M -Cu2S+(Ni,Cu)5As2+NL3S2
Mk—смешанные кристаллы
N — Cii2S+(Ni,Cu)5As2+Ni3S2+Ni—Mk
O-(Ni,Cu)5As2+Ni3S2 +Nij j As8
P-(Ni,Cu)5As2+Ni3S2*Ni- Mk
Q — Ci^S+Ni-^+Ni—Mk
Cu2S+(Ni,011)5 As?-Mk
Ni3S2+(Ni,Cu)5As2~Mk'
- трехфазовые об-
75
Bi - н - Ni - S
Bi-Pb-Se-S
Фиг. 260. Изотермический разрез системы Bi—Н—Ni—S
при 400°С
Schenck R., Forst Р. Zs. anorg. Chemie, 1939, 241 >
145-157
Фиг. 262. Диаграммы состояний сечений вида PbxSej_x-
®^2^x^el-xh
а - х-0,5; б - х=0. Области твердых растворов эаштри-
Малеесхий А. Ю,, Рихтер Т9 Л.,Верес ГЛ. Тр. ИМГРЭ, 1963,
вып. 18, 30-43
Bi _ Ni _ Pb _ S
Фиг. 261. Диаграмма состояния системы
Ni33i2S2-Ni3Pb2S2
Du Preez J.W. Ann. Univ.Stellenbosch., 1945, 22, 97-104
Bl2Se3 Bi2Ss
Фиг. 263. Области твердых растворов в система FbSBi2S^“
-Bi2Se3-PbSe (заштрихованы). Точки соответствуют сос-
тавам природных материалов
Валевсхий А, Ю.,Рихтер Т.Л.,Верес ГЛ. Тр. ИМГРЭ, 1963,
вып. 18, 30-43
Bi- Pb-Tl-S
Фиг. 264. Диаграмма состояния системы PbS-TlBii^
Малеесхий А.Ю. ДАН СССР, 1966, 169, 6, 1324-1327
76
Фиг. 265. Область расслоения в системе CaS-CaO-SiO2
Сплошной линией обозначена граница расслоения при 1800°С,
пунктирной - при 1700°С
Ольшанский Я.И.Тр. 1-го Совет, по эксперим. • мин.
и петр., 1951, вып. 1, 55-63
Cd - Мп - Zn - S
MnS
Фиг. 267. Фазовые отношения при 900°С в плоскости
MnS-CdS-ZnS системы Cd-Mn-Zn-S
Kroger F.A. Krist. (A),1939, 102, 2, 132-135
Cd - Fe - Zn - S
Фиг. 266. Приблизительные пределы составов твердых
растворов сфалерита.
Цифры в пц^вой части диаграммы - элементарной ячейки
^cTJnerV/. Am. Min., 1961, 46, 11/12, 1399-1411
Со — Fe — О — S
Фиг. 268. Диаграммы плавкости систем FeO—
FeS, CoO-FeS, СоО- CoS
Asanti P., Kohlmeyer E.J. Zs. anorg. Chem.,
1951, 265, 1-3» 90-104
77
Co - Fe - Ni - S Co4S3
Bee. % —►-
Фиг.269 Поверхность ликвидуса системы Co^Sn-FeS—
Ni3S2
Акишева H,A,f Кусании II.С. Жури, неорг. химии, 1958,
3, 4, 915-921
Фиг.271. Диаграмма состояния разреза 7Ni3S2‘
‘ 3Co4S3 (вес.отн.) - FeS, системы Co4S3-
-FeS-Ni3S2
а, р, 5 - твердые растворы типа (Со, Fe, Ni )xSn ;
у-твердые растворы на основе ( Со, Ni )xSn - твер-
дые растворы на основе 2FeS‘Ni-3S2
Анишева Н.А,, Кусании П.С№прнв неорг.
химии, 1958, .3, 4, 915-921
Анишева Н,АКусании П.С. Журн. неорг.
химии, 1958, 3, 4 , 915-921
FeSo-CbSo-NiS? при различных температурах (ос).
Klemm D.D. N.Jb.Min. AbhandL, 1965, 103,3,205-255
78
Cu
79
80
FaS
Фиг.280. Поверхность ликвидуса системы Cu2S—FeS—PbS
Уразов Г.Г.,Ногинов //.//.Тр. ЦНИГРИ, 1935, вып.19
Фи г.278. Поверхность ликвидуса части сис-
темы Cu2S—FeO-FeS
Yazawa Akira, Kame da Mitsuo. Technol. Rept.
Tohoku Univ., 1954,19, 242
Cu—Fe—Pb—S
Fe
Ф и r.279. Диаграмма состояния системы Cu—Fe- Pb—S
при 450°C
Craig J.R., Kullerud G, Carnegie Inst. Washington,
1966, Year Book 65, 345-352
Фиг.281. Политермический разрез PbS-0,8Cu9 S-0,2 FeS
системы Cu^S-FeS—PbS 2
Уразов ГТ.,Ногинов НМ. Тр. ЦНИГРИ, 1935, вып.19
ЗвтВС+Ж_ ,
РЬ5+М
Хп+Ж
-------— 600
Хп*36тМ -
V
1200
1000
800
50 ______ 0
~sd Tool.
£f%Cu2S+MFeS
Хп*36т1)*Ж IMniA
WSfflOO
0~
0 -эвт (PbS+лЫ/. шч}
ВС - эвт { Пирротин+борн. тв.р-р)
FBl-эвт (Wb+борн.тб.р-р)
Фиг. 282. Политермический разрез PbS-0,65Cu2 S*0,35FeS
системы Cu2 S-FeS—PbS
Уразов Г.Г.'Ногинов H.H. Тр. ЦНИГРИ, 1935,вып.19
>8 П
81
Cu-Fe-Pb-S 4
•с
Л1200
01.
50 100
501.^501^
pbsm so о
01. 50 100
751НЮ51Щ>
Фи г.283. Политермический разрез FbS-0,5Cu2 S «0,5 FeS
системы Ci^S-FeS-FbS
В - эвт. ( РЪ5*медн.колч.); GHI - эвт. (PbS* борн.тв.раств.);
CD - эвт. (пирротин+борн.тв.раств.)
Уразов Г.Г„ Ногинов Н.4.Тр. ЦНИГРИ, 1935,вып.19
Фи г.285. Политермический разрез PbS-0^5Cu2 S*0,75 FeS
системы Cl>2 S “ F^S—PbS
С - эвт. (пирротин* PbS); G - эвт. (медный колчед.* PbS);
FLM - эвт.(борн.тв.р-р+PbS); H - эвт. (борн.тв. раст.+пирротин).
Уразов Г.Г., Ногинов ЯЛ.Тр. ЦНИГРИ, 1935, вып. 19
*С
-\900
-1200
Пр<МЕ*Ж~
Пр+э6гп.В*э0т7*ж\^.
РЬ5*ЛГ
-ООО
К Z
---------------. j-----(___________600
I +ХПШЬ \+ЗаП.Мли
J-----------------------___________1400
50________________0^
~50 Ю0
#XftS*4#Gu2S
Лр+Ж
D--------
Пр4№6*Ж
Е-----------
Пр*э0т.№*
*э0т.Е6Н*Ж
F-----------
Лр*зйпЛ6*
+эдт.Е6И+
700
PbS+ЛГ
PbS> х
РЬ5*ЖА?*|
'зОтЮМ Lfc/jjy.A н
-----------I--------- 600
PbS^/^l PbS* I >
-эвт/SH' | *з0гп.ЕВИ' I £
*зМ! | *30m.FHI | - 600
I ' I ___________। I ____
№1001
।____
01
PbS»% 66 67 66 6g 70
FeS 4% Of П \ -Q^
^of о в to гг зо
Фи г.284. Политермический разрез FbS-0,4Ca2S *0,6 FeS
системы Cu2S - FeS-PbS
В - эвт. (RjS + пирротин); ] - эвт. (FbS-медн. колч.);0Е -
эвт. (Пирр.+борн.тв.раст.); HKh - эвт. ( PbS+борн.тв.раств).
Уразов Г,Г., Ногинов Н.Н. Тр. ЦНИГРИ, 1935, вып. 19
Фи г.286. Политермический разрез 0,65 PbS *0,35 FeS-
- 0,7 PbS «0,3012 S системы Oi2 S - FeS -PbS
DG - эвт. (Пр.* PbS); EGH - эвт. (Хп* РЬ5),ГН1-эвт.(борн.
тв.растЛ PbS)
Уразов Г,Г.Jiaiинов /ZJ/.Тр.ЦНИГРИ, 1935,выл.19
Н
Фи г.287. Политермический разрез 0,4PbS *0,6FeS-
'“0,4РЬ5’0»вСи2$ системы O12S - FeS—PbS
E - эвт.( PbS *пирротин); FH1 -эвт. (PbS*Xn);GlK - эвт.(РЬ5+
•борн.тв .pa ст.)
Уразов Г.Г„Ногинов НМ. Тр.ЦНИГРИ, 1935, вып. 19
82
Cu —Fe —Pb —S
Фиг.288. По литер мический разрез 0,15FbS*0,85FeS-
-0,15 FbS*O,85012S системы Ci^S-FeS-FbS
В - эвт.(11р +борн.тв.раст.); Е - эвт. (Пр.+ FbS );FGI -эвт.
(ме дн.колче дан+ PbS ); HIM - эвт. ( PbS +борн.тв.раст.).
Уразов Г,Г.,Ногинов Н.Н, Тр. ЦНИГРИ, 1935, вып. 19
Фи г.290. Проекция части системы Cu—Fe— Pb—S
на сечение CugSg—PbS—FeSj при 600°С
Craig J.R., Kullerud G. Carnegie Inst.
Washington, 1966, Year Book 85, 345—352
2 жоОюагш
CUgS5
*c
1200г
1000-
000
400\-
Gif-S
части системы Cu—
Фиг.289. Проекция богатой серой
-’Fe—Pb—Sna основание Cu—Fe—Pb • Все фазы находятся
в равновесии с газом.
Craig J.R., Kullerud G. Carnegie fast. Washington,
1966, Year Book 65,345—352
Жидкость
PbS
(mO.p-p)
Га+во+Хп
'Ыр-р)
Га+Пр+Хп
F’t-xS
Фиг.291. Изотермичес-
кое сечение при 600°С
системы Cu—Fe—Pb—S
по 21,9 вес. % S иа сто-
роне Cu—S; 40,8 вес.%8
на стороне Fe—S и 13,4
вес. % S на стороне
Pb-S
Craig J.R., Kulle-
rud G. Carnegie Inst.
Washington, 1966, Year
Book 65, 345-352
83
Cu - Fe - Pb - S
Cu —Fe — Zn —S
ДО/FeS — %ZnS fl7/FeS-»-%ZnS J5%FeS —%ZnS
Фиг .292. Проекция богатой PbS и S части сис-
темы Cu-Fe-Pb—S на сторону Fe—Cu
Craig J,R.f Kullerud G. Carnegie Inst. Washington,
36, Year Book 65 , 345-352
Фиг.294. Диаграмма состояния системы
Cu2$ - FeS—ZnS
Разрезы: A-20 вес. %Си2$и 80 вес. % FeS—ZnS; Б -
40 вес. % Ci^S и 60 вес. % FeS—ZnS; В - 45 вес. % Cu^S
и 55 вес.% FeS—ZnSja-гвердый раствор ZnS в Cu^S; [3-
твердый раствор Ci^S в ZnS
Новоселов С.С.Цветн. металлы, 1955, №3,
15-20
Cu-H-Sb-S
900
воо
700
600
500
400
300
200
Си
Пт+Ков+Га+Ъ*
I _ J___________________________________________________I--------------------------1---------------------------l
40 50 80 РЬ
Вес. %
Фиг.295. Изотермическое сечение системы
Sb-Cu-S при 400°С в % - содержание F^S
над твердыми фазами.
Schenck RM Нoilmen J,, Knepper Ж., Vogler H, Zs.
anorg. Chemie, 1939, 240. 173-197
Фи г.293. Проекция части • системы Cu—Fe—Pb—S,
богатой Ре$2И^ на сторону Си—РЬ.Все ассо-
циации находятся в равновесии с газовой фазой.
Craig ]»R,t Kullerud G. Camegie Inst. Washing-
ton. 1966, Year Book, 65 , 345-352
84
Фиг.299. Диаграмма состояния системы FeS—FeO—SiC^.
I - S1O2 + жидкость; II - фаялит + жидкость; III - вюстит +жид-
кость; IV - пирротин + жидкость; V-SiO^ 2 жидкости.
Ольшанский Я.И.ДАН СССР, 1950, 70, 2 , 246
Фи г.296. Составы твердых растворов сфалерита в
системе ZnS-FeS-MnS. Цифры в правой части диаграм-
мы - размеры ао сфалерита в А
Skinner B./.Am.Min., 1961,46, 11/12, 1393-1411
Фи г.297. Диаграмма равновесия системы FeS—2FeOSi02
Andrew J.H.t Haddocks W,R. J.Iron Steel Inst.,
1933, 126. 11, 351-365
Фиг.298. Перитектическое образование фаялита в
системе FeS-SiO2-FeO
Ольшанский Я.И. ДАН СССР, 1948, 59, 3, 513
Фиг.300. Диаграмма состояния системы FeS—FeO—SiCL
в случае, если образование фаялита происходит по ре-
акции Fj+SK^ = фаялит+р2?РрР2 - жидкие фазы
Vogel R. Arch. Eisenhiittenwesen, 1965, 3&, 7, 181-484
85
Фиг.301. Диаграмма состояния системы FeS—Fe2SiO^
в случае, если образование фаялита происходит по ре-
акции Fj+SiO2 я фаялит + р2» ^1»^2
ж, ж^ - жидкие фазы ’
Vogel R. Arch. Eisenhiittenwesen, 1965, 36» 481-484
1000\- Ж+Фаялит+Я&ъ
Фаялит* FeS
800-
Фаялит FeS
Фиг.Э03. Диаграмма состояния системы FeS—Fe2SiO^ в
случае, если образование фаялита происходит по реакции
F1=SiO2 + фаялит + F2. Fp F2
ж, Xj - жидкие фазы
Vogel R. Arch. Eisenhiittenwesen, 1965, 3£,7, 481—484.
Фиг.304. Диаграмма
состояния системы
F^S-PbS-ZnS
Разрез: 17 вес. % FeS
и 83 вес. % PbS - ZnS
Авеяислн Х.К.,
Гнаяыяенко ГМ.
Изв. АН Каз. ССР,
сер. горн, дела и мет.,
1956, вып. 6, 11-425
Фи г.302. Диаграмма* состояния системы FeS—FeO—SK^,
в случае, если образование фаялита происходит по
реакции Р|=5Ю2+фаялит + ^^Fj и F2 жидкие фазы.
Vogel R. Arch. Eisenhiittenwesen, 1965,26,7,481-484
Фи г.305. Диаграмма состояния системы FeS-FbS-ZnS
Разрез: 27 вес. % FeS и 73 вес. % PbS—ZnS
Авеяисян Х,КчГнаяышенко Г,И.Мзв. АН Каз. ССР, сер.
горн, дела н мет., 1956, вып. 6, 11-25
86
Fe — Pb — Zn —S
Фиг.306. Диаграмма сос-
тояния системы FeS—PbS—
-ZnS
Разрез: 50 вес. % FeS и 50
вес. %
Аветисян Х,К.9 Г ноты-
шенко ГЛ. Изв.АН Каз.ССР,
сер «горн, дела и мет., 1956,
вып. 6, 11 -25
Ф и г.309. Диаграмма состояния системы FeS—PbS—ZnS
Разрез: 8,5 вес. %ZnS + 91,5 вес. % PbS - 8,5 вес.% ZnS+91,5
вес. % FeS •
Аветисян Х.К ^Гнатышенко ГЛ. Изв. АНКаз.ССР, сер.
горн, дела и мет., 1956, вып. 6, 11-25
Фи г.307. Диаграмма сос-
тояния системы FeS—PbS-
-ZnS
Разрез: 70 вес. * FeS +30 вес. %
PbS - 30 вес. % ZnS + 70 вес. % FeS
Аветисян X,K.t Гнаты шен-
ко ГЛ. Изв. АНКаз.ССР,
сер.горн.дела и мет., вып.6
11-25
ZnS
Вес. У.
Фи г.310. Диаграмма состояния системы FeS-FbS-ZnS,
поверхность ликвидуса
Аветисян Х.К.,Гнатышенко Г.И.Изь. АН Каз.ССР,
сер. горн, дела и мет., 1956, вып.6, 11-25
ю го зо?м
mm -«-ZnS,te%
Hg - S - Se - Те
ООО
1000
•о
1200
-£
351W
ВО/. PbS
10
20^7%ZnS
7О7.РЬ$
ZnS, to %
Фи г.308. Диаграмма сос-
тояния системы FeS—PbS—
-ZnS
Разрез: 35 вес.% FeS + 65 вес. %
PbS - 30 вес. %ZnS + 70 вес. %
PbS
Аветисян Х.К., Гнатышен
ко ГЛ. Изв. АН Каз.ССР,
сер.горн.дела и мет., 1956,
вып. 6, 11-25
HgSe
Фи г.311. Изотермическое сечение системы HgS-HgSe—
—HgTe при 300°С.
1 - однофазные образцы, 2 - двухфазные образцы
Малевский А.Ю.,Чжун Цз»-жун. Эксп. методы исслед.
рудн. минералов. М., 'Наука*; 1865
87
Pb - Se - Те - S
Поликомпонентные
As - Со - Fe - Ni - S
Фи г.312e Диаграмма состояния системы PbS—PbSe—
-РЬТс при постоянном содержании PbSe, равном 20вес.%
(б) и 40 вёс. % (в)
Малевский А.Ю.ЦЬН СССР, 1963, 152. 1,191-194
FeAsS
CoAsS NtAsS
Фиг.314. Области смешанных кристаллов в системе
FeAsS—CoAsS—NiAsS
Klemm D.D. N. Jb. Min. Abhandl, 1965, 103, 3.205-255
PbTe
Bee. 7
Фиг.313. Фазовые отношения в системе PbS-PbSe—
-PbTe ниже 900° С
Область твердых растворов заштрихована
Малевский А.Ю. ДАН СССР, 1963, 152, 1, 191-194
Fe - Мп - О - Si - S
Фиг.ЗГЗ. Диаграмма состояния системы 2FeO • SiC^-MnS
Andrev J.H., Maddocks W.R., Fowler E.A. J. Iron Steel
Inst., 1931, 124 , 2, 298
88
СИСТЕМЫ МЕТАЛЛ—КИСЛОРОД, ВКЛЮЧАЮЩИЕ ЭЛЕМЕНТЫ
С ПЕРЕМЕННОЙ ВАЛЕНТНОСТЬЮ
Двухкомпонентные
Фи г.316. Бинарные частные системы Си—Ci^O
и РЬ-РЬО
GebKbrdt Е», Obrowski Ж Zs. Metallkunde, 1954,
45, 6, '333
Фиг. 318. Частная система Fe2O^— Fe^O^
Schmah 1-Marburg H.G. Zs. Elektrochem. Angew.Phys.
Chem.,1941, 47,12,835
Фиг. 317. Диаграмма равновесия части системы
железо-кислород
Darken L.S., Gurry R,W. J. Am.Chem. Soc., 1945, 67,
8,1398; 1946,68,5, 798
18 12
89
Fe-O2
Mn-O2
OJ 0# M Oft 22 2$ 26 28 FeA
Кислород, вес.%
Фи г.320. Диаграмма стабильных отношений фаз МгцО4
и МпО в зависимости от давления О2[ togPo2 (атм)} и 4
температуры ( 1/т • Ю4 (К°) ].
Черные точки относятся к стабильной Mnj04, черные квадратики -
к Мп^О4 и МпО , соответственно, прямая сплошная линия отвечает
экспериментальным данным, пунктирная линия представляет рассче!-
ную равновесную кривую по Coughlin J.P.(L'.S.Bur.Mines Bull., 1954,
№ 542, XII)
Hahn W.C., lr.9 Muan A. Am.J.Sci., I960, 1.73,
Ф и г.319. Диаграмма термического равновесия системы
железо-кислород
Mathewson, Spire, Milligan.(Trans. Am. Soc.
Steel Treating, 1931,12» P« 66); White, Graham, Hay (J.Iron,
a. Steel.Inst., 1935 N*l, 91); Greig, Posnjak, Merwin, Sos-
man (Am. J. Sci. 1935, 32, N*5, N»9, 239-316), White
(Iron a. Steel Inst., Carnegie Scholarship Memoirs, 1938.
2Z.P.1)
Кривая (ab) показывает результаты Chipman и Fetters, (Trans.
Am.Soc. Metals, 1941, 2$, p. 953
White J, J.Iron a.Steel Inst., 1943, 148. 2 , 615
Фиг«321. Диаграмма, показывающая фазовые отношения
Мп20оиМп^04 в зависимости от давления O2[log Ро9
(атм.)] и температуры [ 1/т-Ю4 (К°)].
Черные треугольнички и точки относятся к наблюдаемым стабиль-
ным Мп 2O3 и Мп^О^,соответственно,а сплошная линия отражает экспе-
риментальные данные. Пунктирная кривая относится к тем же случа-
ям равновесия, но выведена на основе расчетных данных Coughlin J.P.
(1 ,S. Bur. Mines Bull., 1954, №542, .XII >
Hahn W.C., 1г., Muan A. Am. J. Sci., 1960, 258. 1, 69
90
Трехкомпонентные
Л1 - Fe - О
2
fb2os го w а во м2о, fe2o5 го w во во Л12о,
Fe20jAl2D3
Фи г.322. Диаграмма, иллюстрирующая вли-
яние изменения парциального давления С>2
на равновесие при температурах субсолиду-
са в частной системе Fe2O^—А^О^.
Диаграммы (а), (б) и (в) показывают, в последова-
тельном порядке, фазовые отношения при 1, 0,2 и 0,03
атм, давлении О2; диаграмма (г) представляет схему
фазовых ассоциаций при парциальном давлении 0'2 нес-
колько ниже 0,03 атм.
МиапД. Am. J.Sci., 1958, 256 , 6, 420
Фи г.323. Фазовые отношения в системе
Fe-Al-Опри 1000°С
A t/as L.M., Sumida W.K. J. Am. Ceram.
Soc., 1958, 41, 5, 157
91
92
Al-Fe-O2
Фи г.327. Диаграмма равновесных состояний
системы Al—Fe—О
Области существования: 1 - (FeO+A^Qj) ж, II -
(FeA^O^)тв., HI -(a — A^O-j), тв.; 1 - опытные точки;
2 - расчетные точки
Новохатский И,А,,Белов Б, Ф.Изв. АН СССР,
металлы, 1966, № 1, 46
Фи г.328. Изотермические сечения, показывающие об-
ласти стабильности магнетит-герцинитовых твердых
растворов (MtTB>p_pf Нств>р_р ) в зависимости от
летучести кислорода, (fo^ )
Шптв.Р-Р (шпинельный твердый раствор) употребляется в случае,
когда неограниченный твердый раствор образуется по соединитель-
ной линии магнетит-герцинит; 1 - данные Eugster,. Н-Р. VonesD.R.
J.Petro)., 1962, 3, 82 ; 2 - данные Richards R.G., White J. Trans.
Brit. Ceram. Soc. 1954 , 53, 233-270; 3 - результаты настоящего
исследования
Lindsley D Л. Carnegie Inst. Washington Year Book,,
60(1960-61), 155
93
AIA - Fe - 02
Фи г.329. Изотермические сечения диаграмм
фазовых отношений в системе FeO—Fe9Oo—
-А12О3
Соединительные линии являются горизонталями летучес-
ти кислорода, выраженные в - log fo (летучесть кислорода,
f, в атмосферах)
Т urn ос к А.С., Lindsley D.H.Camegie Inst., Wa-
shington.Year Book, 60 (1960-61), 157
Фиг.331. Фазовые отношения в системе
Fe-Co-О при 1000° С
1 - 1x10° атм.
2 - 2.1Х10-1 атм.
3 - 1х10“2 атм.
д -15 атм.
—Г20 атм.
Co-Fe-02
Roiter ВЛК, Paladino A.E.,J.Am.
Ceram. Soc., 1962,4^, 3, 128-133
Фиг.ЗЗО. Соотношение окислов в системе Fe-Со—02
(показаны атомные отношения)*
Оттененная линия СоО означает, что в этой части ди-
аграммы некоторое количество кобальта должно находится в сос-
тоянии окисления, соответствующего большей валентности кобаль-
та, чем два.
Smiltens J. J. Am.Chem. Soc., 1957, 12, 18, 4882
94
Cr-Fe-O2
Cr-V-O2
О
Fe 20 W 60 GO Or
Or, am. */.
Фиг.332. Изотермическая фазовая диаграмма при
1300° С для системы Cr— Fe-0
Фиг.334. Схематическое представление путей первич-
ной кристаллизации в области V^-CrVO.-V0- данной
системы. z
е- эвтектика V6O13-V2Oj( 663°С); Е - эвтектика V2O5-CrVO4-
- V6013(640°C); Pj - перитектика V’60j 3-V0^700°C); P2 - пе-
ритектика СгУО4-СггОз(810°С); Р3 - перитектика VLO, ,-CrVO.-
-Cr2O3 (**670 С). Р4 - перитектика VgOj 3-VO2 - Cr2O3 (680°С);
е2” эвтектика V2O5-CrVO4 (665°С)
Burdese A. Ann. Chim., 1958, 48, 6-7, 516
Seybolt АЛ. J.Electrochem.Soc., I960, IflZ, 3, 152
Cu - Fe - 02
0
Фиг.335. Изотермический разрез при 800°.
YundR.A., Kullerud G.,Carnegie Inst., Wa-
shington, Yefir Book,60, (1960-61),181
dec. %
ФиГ'ЗЗЗ, Отношения твердых фаз в системе при тем-
пературах выше 575° С
Woodhouse D., White J. Trans. British Ceram. Soc-1955,
51, 6, 365 ' .
95
Cu- Fe-02
Фи Го ЗЗбо Изобарическое сечение фазовой диаграммы
системы Cu—Fe—О на воздухе:
А - система Ci^O-Fe^O^-l.^С^; Б - система CuO — (мол.%)
Gadalla А.М.М., White J. Trans. British Ceram. Soc.,1966,
65, 1, 7
Фи Го 338. Изобарическое сечение диаграммы тройной
системы Cu-Fe-Опри давлении кислорода в 1 атм
А - система Ci^O—Fe^O^ — 1, 2^2’ Б - система CuO — Fe2O^
Gadalla А.М.М., White J..Trans. British Ceram. Soc.,
1966, 65,1,14
Фи г. 337. Изобарическое сечение диаграммы тройной
системы Cu—Fe—О при давлении кислорода в 0,6 атм,
96
Фиг, 339, Предполагаемое сечение Т-х для системы
Си—Мп—О на воздухе
□ а
х 6
в
• г
S д
а е
в ж
а j
о "
Фаза со структурой гаусманита или шпинели (а); фаза со структу-
рой а — МП2О3 (б); СиО( в); креднерит (г); шпинель и СиО (а); шпи-
нель и креднерит (е); две шпинели (ж) или шпинель и а—Мг^О^
(з); расплав (и). Структуры типа: Г - гаусманита, Ш - шпинели,
К - креднерита, Д - делафоссита
Driessens F.C.M., Rieck G.D. Zs. anorg. allgem. Chem.,
1967,351,1-2, 52
Фиг. 341. Схематическое изображение диаграммы
состояния системы железо-марганец-кислород
Третъяков Ю.Д., Саксонов Ю.Г., Гордеев И .В. Изв.
АН СССР, неорг. матер. 1965, 1, 3, 413
Фиг. 340, Предполагаемое сечение logPo2« х для
системы Си-Мп-О при 1000°С, построенное по резуль-
татам исследования методом высокотемпературного
рентгенографического анализа и по данным -Schmahl N.G.,
Muller F. (Zs. anorg. allgem. Chem., 332, 12 (1904)
Структуры типа: Г - гаусманита, Ш - шпинели, К - креднери-
та, Д - делафоссита.
Driessens F.C.M., Rieck G.D. Zs. anorg. allgem.
Chem., 1967,351, 1-2,56
Фиг. 342. Система псевдобинарная и скорее явля-
ется кислородным изобарическим сечением через
систему Fe—Мп-0
Muan A., Somiya SA. Am. Min., 1961, 46, 3—4, 367
I 13
97
Фиг. 343. Диаграмма, показывающая фазовые отноше-
ния в системе окись железа - окись марганца на воз-
духе
Миап A., Somiya Sh. Am. J. Sci., 1962, 260. 3, 233
Фиг. 344. Изотермический разрез диаграммы Fe^O^—
МП3О4—О при 1400°С
Изобара РО2=1атм; изобара РО2=Ю,21 атм; изобара РО2=10“3атм
Комаров В.Ф,, Олейников Н,Н,} Саксонов Ю,Г,,Тремъл-
ков Ю,Д, Изв. АН СССР, неорг. матер.. 1965, 2, 3, 401
Фиг. 345. Изотермическое' сечение при 800-1100°С
части системы Fe-Mo-0
Jager Ж., Rahmel A,, Becker К* Arch. Eisenhiittenwesen,
1959, ?0, 7, 439
98
Fe-\i—02
Фиг. 348. Стабильные фазы в системе Fe—Si—О,
в присутствии твердого кремнезема.
4
3
Гематит +Кремнезем
Магнетит+Кремнезем
_ Магнетит +Фаялит
Магнетит^Расплав
О
-/
Вюстит + Фаялит
Металл+Фаялит
Металл+Кремнезем
-г -
Darken L.S. J. Am.Chem. Soc., 1948» 70. 6,2051
Вюстит
Расплав
800 t2OJ f600'C
Фиг. 349. Стабильные фазы в системе Fe—Si—О
при малых количествах кремния.
Darken L.S. J.Am. Chem. Soc., 1948, 70,6, 2051
99
Fe -Si-O2
Fe— Ti -02
1700-
I
I
I
Жидкость
1500
1300-
20
Рутил
Тридимит* Жидкость
Магнетит + Тридимит
Гематит+Тридимит
80
,-ю
^й^Оз
fto
<V%y tШпинель
У//Г/
л - Окисел
Шпинель
ас -Окисел
Окисел Ромо
2 жидкости
Кристобалит ^Жидкость
// Рутил \ \
40 60
Вес. %
Фиг. 350. Фазовые отношения в системе
окисел железа-кремнезем на воздухе
Masse D»P., Muan A. J. Am. Ceram. Soc.,
1965, 48, 39, 466—69. См. также:M.uan A.
Trans. AIME, 1955 , 203.9, 965-976
Fe - Ti - 02
Фиг. 352. Частная система FeO—Fe2O^-TiC^npn 1200° с нанесением изобар
кислорода
Изобара 1,6 х 10 11 атм показана только в поле (вюстит + шпинель), так как в других
полях она совпадает с изобарой 2,5 х Ю”11 атм. Изобары 4,8 х 10“^ и 1,8 х 10~® атм
также почти совпадают с полем шпинели и представлены только одной линией. (Орто-орто-
ромбический окисел). Ниже приводятся значения logP для различных составов атмосферы
° 02
Jog Р
°2__________
0,68
2,56
3,84
8,74
9,32
10,60
10,79
11,54
при 1 см Hg
0,08
0,16
0,68
0,85
0,85
-2
-4
*0
-10
-12
i ОкйселГромб. P t ।
0,5
Fe/(Fe+Ti)
Окисел,ромб.*рутил
V •
Рутил- -
8
8
о
Атмосфера
Воздух
садух
С0/С09
со со/
со со,
со со;
и;
Webster А.Н., Bright Norman F.H. J. Am. Ceram. Soc.,
1961, 44, 3, 115
втг?в’
1,0
У-14
0
Фиг. 351. Присутствующие при 1200°
в системе Fe-Ti-О фазы, в зависимости
от атомного отношения Fe(Fe+Ti)
и парциального давления кислорода
Примерно при значении log Ро^-* показана
область, в которой небольшое изменение парци-
ального давления кислорода сопровождается боль-
шим изменением состава а—окисного твердого
раствора. Поле а—окисла в этой области имеет
очень незначительную и неопределимую ширину
Webster А.Н., Bright Norman F.H. j. Am,
Ceram. Soc., 1961, 44» 3, 112
100
Fe-Ti-O2
Фиг. 353. Диаграмма части системы Fe—Ti—О
в пределах составов равновесных смесей при пар-
циальном давлении кислорода, определяющем рав-
новесие железо-вюстит, при температурах 1250-1350°С.
Черные точки представляют составы, определенные
химическим анализом, и штриховые кривые проходят
приблизительно через эти точки. Тонкие штрих - ли-
нии соединяют твердые растворы (магнетит-ульво-
Фиг. 354. Составы фаз в системе Fe—Ti—О. а—Ь,
с—d представляют примеры изменения, происходящего
с простыми окислами при постоянном отношении Fe':
:Ti. Оттененная область представляет поле составов
шпинель, гематит-ильменит и псевдобрукиты)
MacChesney J.Be,Muan A. Am. Min., 1961, 46, 5-6, 579
обычных первичных рудных минералов изверженных
пород
Vincent F.A. N. J. Min.Abhandl, 1960, 94, 2, 1011
F?3O4_U°2-°2
Фиг. 355. Проекции изобарических сечений (UjOg-Fe2Oj и U^O^-Fe^O^) в тройной системе UC^-Fe^O^-02
А - 0,21 атм; Б - 0,07 атм; В - 0,035 атм; Г - 0,0175 атм; Д - 0,0088 атм;
Е - 0,0058 атм. 1/3 U3O8=UO2 +2/3 0; 3/2 I?e2O3 “Fe3O4+l/2 О
Evans White]. Trans. British Ceram. Soc., 1964, 63, 12, 721
101
*0 ~
1300-
W
900
6
\WT—
T+R
H+B /
/
/ В
Л>
R+S
_____L—I___I I____I I 1 1 1
Mn30A 90___90______60 80 SlOg
Фиг. 356. Диаграмма^ показывающая фазовые отношения при различных пар-
циальных давлениях О') в системе Mn-Si—О. Парциальное давление On (в атм.)
для диаграмм: а - 10-ОД, б - Ю"1»10, в - 10-1.35, г _ 10-2,5. Диаграммы
отражают тройные отношения в сечении МП3О4—Si02. Диаграмма (с,) как исклю-
чение, ^показывает фазовые ассоциации, присутствующие при давлении О9
(10" » атм), соответствующем тройным субсолидусным отношениям в систе-
ме Мп—Si—О
М-куб. Мпо04; Н-гаусманнит (тетраг^МпоО. ); В - браунит, R - родонит; Т - тефроит; S —
кремнезем (SiO^)
Миап A. Am.Min., 1959, М. 9/10,954
Фиг. 357. Предполагаемая фазовая диаграмма системы
Zn—Мп—О на воздухе. Стабильная область (С) представляет
собой шпинель с кубической структурой
(Т) - шпинель с деформированной тетрагональной структурой;
(а) - поле а — l^OjHZ) - поле ZnO« Шпинель с деформирован-
Фиг. 358. Часть системы Zr—Ni—О, обогащенная 7г
при 950°С.
N&vitt M.V., Downey J.W. Trans. Met. Soc. AIME,
1961, 221, 5, 1016
ной тетерагональной структурой (1); смесь из двух шпинелей с
деформированной структурой (Sha-MnnO-j с кубической структу-
рой (3). или шпинель с деформированной структурой+ ZpOGl)
Driessens Rieck G.D. J. Inorg. Nucl. Chem., 1966,
28, 8,1595
102
Ta- Zr — 02
I a - li -02
Фиг. 359. Изотермическое сечение системы Та—Ti—О
при 1500°С
1 - аве фазе:; 2 - три фазы
Hoch М., Butrymowicz D.B. Trans. Met. Soc. AIME,
1964, 230,1, 188
Фиг. 360. Изотермическое сечение системы Та—Zr—О
при 1500°С.
1 - две (разы; 2 - три фазы; П) - тетрагональная ^за.
Hoch М., Butrymowicz D.B. Trans. Met. Soc., A1ME,
1964, 230, 1, 189
Четырехкомпонентные
Al _ Fe - Mg - O2
Ч0-.
A
8,32
8,20
8,08
ВосстаноОление —
Фиг. 361. Изменение параметров элементар-
ной ячейки шпинельной (а\)е О вюститной
(аДОёО) и металлической фаз от сте-
пени восстановления ферроалюмината магния
25 ре1, 17^4
Корнеев Ю.А,, Балакирев В,Ф., Чуфаров ГЛ,
ДАН СССР, 1964, 159, 5, 1092
103
ОКИСНЫЕ СИСТЕМЫ
Системы, включающие только окислы
Однокомпонентные
Двухкомпонентные
СеО2
Структуры
Фиг. 362. Схематическая Р-Т - анаграмма для сис-
темы GeO2
Sarver J.F. Am. J.Sci., 1961 > 259,^h 713
A12O3 — BeO
Фиг. 364. Диаграммы равновесия системы BeOA^Oy-
А^О^ по работам различных исследователей).
Foster W.R., Royal H.F. J. Am. Ceram. Soc., 1949, 32,
1, 32-33
Фиг. 363. Классификация фаз кремнезема при давле-
нии в одну атмосферу по пересмотренным данным 1955г.
Сплошные линии показывают твердое состояние, пунктирные
пинии - метастабилыюе состояние
Sosman R.B. Trans. British Ceram. Soc., 1955» 54, 11,666
Фиг. 365. Диаграмма состояния системы ВеО-А^О^
по Лангу, Филлмору и А^ксвеллу, дополненная резуль-
татами настоящей работы.
Галахов Ф,Я, Изв. АН СССР, отд. хим. наук, 1957,
№ 9, с. 1035
104
A12°3“ Cr2°3
Фиг. 366. Фазовая диаграмма для системы C^O^-A^O^
Bunting E.N. U.S. Nation Bur. Stand J. Research, 1931,
6, 6, 948
Фиг. 368. Диаграмма состояния системы FeO—
Fischer W.A., Hoffmann A. Arch. Eisenhiittenwesen, 1956,
27, 5, 344
A12O3 - CuO; A12O3-Cu2O
Фиг. 367. Фазовая диаграмма A^O^-CuO и Cu2O—А12О3
Пунктирной линией обозначен ликвидус по Wartenberg Н.»«Reusch H.J.
(Zs.anorg., allgem. Chem., 1932, 207, 3, 1—12)
Misra S.K.9Chaklader A.C.D. J.Am. Ceram. Soc., 1963, 46,
10, 509
Фиг. 369. Уточненная диаграмма фазовых равновесий
системы FeO-Al2O3(корунд).
Новохаяский И.А,,Белов Д.Ф.Изв. АН СССР, метал-
лы, 1966, № 1, с. 40
14
105
А12О3 - Fe2O3
•с
20 W 60 80 Al-O.
K2<W3 ,
Вес.'/.
Фиг. 370. Квазибинарная диаграмма системы А^О^—
Fe20^. Штриховые линии - результаты исследования
выше 1410°С по Muan А. и Gee G.L. (J.Am. Ceram.Soc.,
1956 , 39, р. 207)
Willshee J.C., White J. Trans. British.Ceram. Soc.,
1968, 62» 7, 281
Фиг. 372. Частный разрез MgO^ALOj (шпинель) -
А120з (корунд)
Roy D.-M., Roy R,f Osborn E,F, J. Am. Ceram. Soc.,
1953, 36,5,149
Al2O3-MgO
•0
2600b-
2600
2600
2200-
2000
A
Периклаз+Шпинель
j_____i—Li—.—i---------1----1-----*-
Ю0 60 60 60
MgO, вес. %
»-----1----i——।-------J-----L-
o 20 60 60
Al203,6ec.%
Фиг. 371. Диаграмма фазового равновесия системы
MgO—MgA ^О^.Светлые кружочки - температура плав-
ления; черные кружочки - составы твердого раст-
вора.
Alper А»М., McNally R.N., Ribbe Р.Н», Doman R.C.
J. Am. Ceram. Soc., 1962, 45 , 6 , 264
wl—l---L.
MgO 20
V) 60 80 «МД
Мдомд
I 6 'C
IT'' гт
I —
MgO-МД /МД
Фиг. 373. A . Система а— А^^з-MgO.B. Частная система
MgO'A^^ — Р—AI2O3 ~
Rankin G.A.t Merwin Н.Е. J. Am. Chem.Soc., 1916, 38, 571
106
А120 3 - MnO
Фиг. 374. Диаграмма фазовых равновесий системы МпО—
А12О3 (корунд).
Новохатский И,А., Ленев Л.М., Сави некая А.А,, Горох А,В,
>Ьурн. неорг. хим., 1966, П, ч2, 428
А12°з -Ni°
°C
2100 -
Жидкость
-Жидкость /Жидкость
/^шпинель
1900 А \ /
। NtO (тдр-р.)
1700
1500 v
Жидкость
I Ni-шпинель *
им
мель I
N10 (т&р-р.)^-шпинель
• •}<$>
□ - /
0-2
•-3
Д- 4
А- 5
____I gl I а I I II
NtO 20 00 60
Мол. %
<»
80 RbfcOj
Фиг. 376. Диаграмма равновесия системы NiO-A^Oj.
При построении диаграммы использованы данные:
Y.Iida (J.Japan Soc. Powder Met., 6[2], 55-58, 1959);
H.Wartenberg, H.J. Reusch (Z. anorg. allgem. Chem., 1932,
207, 1, 1-20)
1 - NiO; 2 - корунд; 3 - никелевая шпинель; 4 - жидкость;
5 - твердая фаза
Фиг. 375. Диаграмма, показывающая фазовые отно-
шения в системе окись марганца - окись алюминия на
воздухе
Ranganathan T.f MacKean В.Е., MuanA. J.Am. Ceram.
Soc., 1962, 45,6,280
Phillips В., Hutta J.J., Warshaw I. J. Am. Ceram. Soc.,
1963, 46, 12, 581
Фиг. 377. Диаграмма равновесия системы А12О^—SiO2
по Shepherd, Rankin и Wright
Bowen N.L.,Greig J.W. J. Am. Ceram. Soc., 1924,.7,3,
242
107
Фиг. 378. Диаграмма состояния системы А^О^—SiC^
1 - кристобалит* жидкость; 2 - твердый раствор + жидкость;
3 - твердый раствор;. 4 - корунд + жидкость; 5 - муллит + корунд;
в - муллит*жидкость; 7 - кристобалит*твердый раствор.
Будников П.Л., Кушаков ский Z?./7.Wph« прикл. хим.,
1962 , 35,10, 2155
*0
1900
1850
1800-
65
Al20g,te.%
70 75
80
1 । • г I I I I । ।—।—।—।—।—।—।—г
Корунд+
Жидкость Жйдкость'уС
Муллит (тв.р-р)
+Жидкость /
11\ :/ i
Муллит (гпв.р-р)
Жидкость
§
Г * 1
Муллит (тв.р-р)
Корунд
/7JZ7Ll_l.
50
55 60 63 67 70
Ь\$ъ,мм.7»
Фиг. 381. Детали области муллита на диаграмме А190я-
SiC^. Штриховая линия показывает возможные измене-
ния формы ликвидуса и солидуса. Aramaki S., Roy R.Am.
Ceram. Soc., 1962, 45, 5, 239
ALz03, 6bc. Io
Фиг. 379. Пересмотренная диаграмма равновесия.
Же/ch J.H. Nature, 1960, 186 , 4724, 546
2100г
Фиг. 382. Диаграмма состояния системы A^O^—SiC^
Tromel G., Obst K.H., К on о picky К., Bauer H., Patzakl.
Bet, Da, Keram.Ges., 1957 , 34,12, 401
AL2O3,8ec.°/o
Stoz 30 70 АЦО3
Alz03, нол.°/0
Фиг. 383. Фазовая диаграм-
ма системы A^Oo-SiC^c
областью метастабильной
иесмесимости, показанной
схематично. Штриховые ли-
нии указывают иа мета ста-
бильность; "точечные* ли-
нии показывают границы при
быстрой закалке. Стабильные
равновесия даны no:Shigeo
Aramaki, Rustum Roy, ("Revi-
sed Phase Diagram for the Sy-
stem. ALO^-SiOn."), J.Am.
Ceram. Soc., 1962, 45,5,
229-242
Mac Dow ell J.F., Beall G.H,
J.Am. Ceram. Soc., 1969, 52,
1, 24
Ф ii г. 380. Пересмотренная фазовая диаграмма.
Aramaki S., Roy R. J. Am. Ceram. Soc., 1962, 4fj,5, 239
108
Al2O.rSiO2
5Юг 20 40 60 80 Al2U3
Вес. °/о
Фиг. 384. Диаграмма состояния системы A^O^—SiC^
по Торопову и Галахову (вариант 1956 г.).
Торопов Н ,АГалахов ФЛ, Иэв. АН СССР, Отц. хим.
наук, 1958, № 1, 8-11. Также: Торопов Н ,А „Б ар запое -
ский В.П.,Лапин В,В, Бурцева НЛ. Диаграммы состояния
силикатных систем. Справочник, 1969, вып. 1. Двой-
ные системы. Изд. 2-е, дополненное. Л., "Наука*.
Фиг, 386. Диаграмма равновесия системы А^О^—TiO2*
Belos Louis, Forestier Hubert, C.R. (Paris). Chimie,
1964, 258, gr. 8, 13, 4284
Фиг. 385. Диаграмма состояния системы A^O^-SnC^
Barczak V,J.,lnsley R.H, J. Am.Ceram Зое., 1962,45, 3,144
Вес. %
Фиг. 387. Диаграмма равновесия системы AI2O3—ТЮ2.
В правом верхнем углу диаграммы показан в кружке
возможный вариант участка диаграммы при инконгруэнт-
ном плавлении ТК^А^О^
Lang S.M,, Fillmore C.L,, Maxwell L.H. U.S. Nation. Bur.
Stand. J. Research, 1952, 48, 4, 301
109
Al 0, — ZnO
z u
•c
ZlOOt----------
Во0.. - СаО
£ V
1700
1900\-
100
20 50
ZnO, мол. °/o
Фиг. 388. Диаграмма плавкости системы AJ2O^—ZnO
Bunting ЕЛ. U.S. Nation. Bur.Stand., J.Research.,
1932,8,2, 280
ALO_ _ ZrOa
Zu 4*
Фиг. 391. Диаграмма фазового равновесия СаО—В20^
Carlson Е.Т. U.S. Nation. Bur. Stand. J .Research,1932,
9, 6, 830
Фиг, 389. Эвтеника А)2О^
с ZrO2 при 1890 +5° и 45%
А12О3 И 55% ZiC2
Suzuki H»t Kimura S., Ya-
mada Yamauchi T. J. Ce-
ram. Assoc. Japan, 1961, 69,
782, 2, 54
0 3 “ MgO
го
1700 -
1500
1300
90
Мал %
60 80
100
1Ж(а)
гм
Мол. °/0
им
' MgQ*tf
МзВ*т /
1358*
1313*
1100
900
2Мд0'Вг03*ЛГ
989°
MgO^Oj+M
МдО;ВгО3
МгВ*
МзВ
3 Mg О’ В2О3
+ МдО
20 90 60
МдО • ВгОз ZMgO'B^Oj
MgO, Bee. %
Фиг. 392. Диаграмма состояния системы В2О^—MgO
Davis Н.М., Knight M.A. J. Am. Ceram. Soc., 1945,
28, 4, 100
О
В2О3
80
100
МдО
Фиг. 390. Диаграмма состояния системы A^O^—ZrO2
Ceva/es G« Dtsch.Keram. Ges., 1968, 45, 5, 217
110
Фиг. 393. Диаграмма фазового равновесия системы
В2О3—Si02
Rockett T.J., Foster W.R. J. Am. Ceram. Soc., 1965,
48,2, 78
BeO - SiO2
•c
2500^--------------------------
Жидкость
2100 - 4>\
\
BeO +Жидкость X
’ \W
1700 z.117^._________________
-£$0'— BeO+SbOj____________
’ ZBeOSLOt+BeO ZBeOSvOf SiOt
L_i__1__l—j__J_j___1__i_1__
BeO 60 5lOz
5ьОг, 6ec.7o
I
Фиг. 395. Предполагаемая диаграмма состояния сис-
темы BeO—SiC>2
Morgan R.A., Hummel.F.A. J. Am. Ceram. Soc., 1949,
32, 8, 255
BaO - SiO2
/7/J-j '0
Фиг. 396. Кривая плавкости смесей в системе BeO—SiC^
Будников П,П,,Черепанов А,М, Вопросы петрографии
и минералогии. Изд-во АН СССР, II, 1953, с. 243
Ж
4430' -1440
Si02-тридимит/~*\ Levin, I
^живюат /
!2жидюсти\ - 1380
тридимит} \ I jggg
1 i jg-B5z^l0i-/ZjP^W/77 / , , , , ! ,
1 ч ilii «II 1 , 1 1 ! 1 1 t n 1
Я7 164 68 727660 6468 92 96 100
B2S3j^^"BS2
Фиг. 394. Высококремиеземистая область диаграммы
состояния системы За О—SiC^
Гребенщиков Р,Г, Силикаты и окислы в химии вы-
соких температур, 1963, с. 290-301
BeO - TiO
Фиг. 397. Фазовая анаграмма системы BeO-TiO?
Trzebia'owsH W.,Drys И., Baran W. Roczniki Chem.,
1963, 27. 3-4, 440
111
Фиг. 398. Диаграмма состояния системы ВеО—TiC^
Lang S.M., Fillmore C.L., Maxwell L.H. U.S.Nation.Bur.
Stand, J.Research, 1952, 48. 4.300
Bi2°3-PbO’ Bi2O3-NtoO3, PbO-MoO3
Фиг. 400. Боковые стороны: 1 - Bi90q-Pb0; 2 -Bi0Oq-
-Mo03;3 - PoO-Mo03 1 J
Беляев И,4Смолянинов HЛ. Журн. неорг. хим., 1962,
7, 5, 1127
В* 2® 3 “ Ре 2® 3
300
700
60 80 В1г0,
Въг03, мол. °/о
Фиг. 399. Фазовая анаграмма системы Bi2O3-Fe2O3,
по термографическим данным.
Сперанская Е ,И .,Скориков В.М,,Роде ЕЛ.Изв. АН СССР,
сер. хим., 1965, № 5, с. 905
Мол.'/.
Фи г.401. Фазовая диаграмма системы В120з~ SiC^
Сперанская Е.И., Скориков В,М,,Сафронов Г.М.,
Мишкина Г.Д. Изв.АН СССР, неорг. матер., 1968,
4,8,1374
112
Фиг. 402. Кривая ликвидуса (1) и кривые коэффициен-
тов линейного расширения (2).
Смолянинов Н.П,, Беляев И» Н, Журн.неорг. хим., 1963,
8, 5, 1219
СаО - Fe203
-СаО* К
/ж -
1300
1100
Bi,0_-W0_; Bi„0„ —РЬО;
О О а о
Фиг. 403. Система Bi2O3—W0^(l); PbO—Bi2O3(2); РЬО-
WO3(3); Bi2(WO4)3-PbWO4(4)
Смолянинов Н.П. Беляев Я.Я.Журн.неорг. хим., 1962,
7, И.» 2592
IК СаО
' ZS70
2CaOFe,(k*K
(та
СаО*
+гСаО1ЗД
Гт(тв.р-р)+)К j
ZWM пи*
СаО-2ГегОз+ Гт -
ZCaOFe^M
1Z16*
°. СаО ад+Я
саГедчтед
ZCaO-fWCoOfi^
СаО • Ре^Оз + Гематит Л
Мт(тбр-р)
мт(тЗр-р)
mfinl-p-pj
900 Ц I . .. dJ------
О 60
СаО 2CaO-Fe2O3
К СаО 2СаОЯе2$
70 80 90 100
Са0Рег0з^^а0-2Рег0з Fe^Oj
70 CqOFEjOj 80
аг
еО * Fe2O3
Фиг. 404. Диаграмма равновесных фазовых отношений
в системе Са О - окисел железа на воздухе. В трой-
ной системе СаО-Ре2О3-ЕеО (нижняя часть фигуры),
кривая А7-А представляет составы жидкости при тем-
пературах ликвидуса
Phittips В», Muan A. J. Am. Ceram.Soc., 1958, 41» 11,
448
I 15
113
CaO—Fe2,O3
CaO - MnO
z «*
1700
1500
7300
7700
CaO*
ЧГ
| К CaO
1 2570
СГ
ZCa0fe203*^
гСаОТе2Оз*М
CaO ОД'СаО-гед
CaO*
ZCaO. ^jOj
Мттпйр-р
Tmfm&p-p)
Гттдр-р+Ж
^FeOj*/T n2B
fj Cag-ZftjO^
7772*
Mm*mipp
mdp-p+
Ип,т&.р-р
ZCaOFy^CaO- FtjOj
CaO’^Oj*/^
FfyOj Bee. %
4F
70 CaO ft2O3 CaO-ZF^Oj
WL
CaO ZCaOftjOs
Фиг. 405. Диаграмма равновесных фазовых отношений
в системе СаО - окисел железа при давлении Ог в
1 атм. В тройной системе СаО-Ие2О3- FeO (нижняя часть
фигуры) кривая В^-В представляет составы жидкости
71
2500
2300Y\
2700
7900
Я
7700
7500
7300
7700
CaO* л
Шпинель
1 ,7» 1
i Мп3Оц
Вес. %
Шпинель ♦
/Жидкость
Шпинель *
Тетрие. Мп3Оц
Мп,Оч
90 МП2О3
Са0Мпг03
Фиг. 407. Диаграмма состояния системы СаО-Мп2Оз
Riboud P.V., Muan A. J. Am. Ceram. Soc., 1963, 46,1,36
CaO - NiO
при температурах ликвидуса.
Phillips В„ Миап A. J.Am. Ceram. Soc., 1958, 41» 11,449
CaO - MnO
T
18ч8
i_____I______I-----1------1------1-----1------1------1----J
0 30 90 60 80 700
MnO Bec.l MJ
Фиг. 406. Диаграмма состояния системы CaO-MnO
] - экспериментальные точки; 2 - данные, вычисленные из Alls (МпО)
Schench Н„ Fro/iberg M.G., Nunnin&hoff R. Arch. Eisen-
huitrnwesen, 1964, 35, 4, 270
Фиг. 408. Диаграмма состояния системы СаО-
NiO по Tikkanen М.Н. (личное сообщение)
Levin Е.М., Bobbins C.R., McMurdie h.F. Phase dia-
grams for ceramists. U.S.A.,Columbus, 1964, p.lO2,fig.23O
114
CaO - P2O5
СаО - SiO2
77
2000V
к CaO
W
1600
1400
1200
Жидкость
C4P+CaO
1120
уС^^ЪЧпЛр-р) □ \ О
1140*
1000
£____У—
¥
СаО+й¥
IfflT
с4р+лг
/Лгм
CjP
c4p
CaO,0#.%
6?
4
Фиг. 411. Диаграмма состояния части системы
СаО—SiC^
Же/с А /Л., Gutt W. J. Am. Ceram. Soc., 1959, 42, 1, 11
Фиг. 409. Частная система 2СаО*Р2О5~СаОЛунктир-
ные линии указывают предполагаемые пограничные
кривые. Температуры соответствуют международной
температурной шкале 1927 г.
Welch J.H., Gutt Ж J.Chem.Soc., 1961, N-Ю» с.4443
Фиг. 410. Пересмотренная диаграмма системы
СаО-Р2 05. С = СаО; Р = Р2О5
К re idler E.R., Hummel F.A. Inorg. Chem., 1967,6,
5, 891
Фиг. 412. Полиморфизм Ca2SiO^
А. Данные по: 1 _ Chromy S., J. Am. Oram. Soc.,
1967, jO, 12, 677-81; 2 - Bredig M.A J. Am. Oram. Soc.,
1950, 33. 6, 188-92; 3 - Nurse R.W. Proc. lntem.Symp.
Chem. Oment, 3 rd Symp., London, 1952, p. l-22.Oment
and Concrete Association, London, 1954; 4 — Kurdowski W.
p.263-72, в " Proceedings of the Sixth Conference on
the Silicate Industry, Bu&pest, October, 1961, publ.,1963:
5 - Ampian S.G. (J.S.Bur. Mines Rept.Invest., 1961, №6428,
p.53
Б. Данные по: 1- Roy D.M. J. Am. Ceram. Soc., 1958, И,
8, 293-99; 2 — Smith D.K., Majumdar A.J., Ordway E.
J. Am. Oram. Ъос.. -1961. 44,8, 105-11;3 - Levin E.M.j Rob-
bins C.R., McMurdie ILK. " Phase Diagrams for Ceramists,
fig. 238, p. 104 Columbus, Ohio, 1964: I - Smith D.K.,Majum-
dar A., Ordway E. Acta Cryst., 1965, 18, 4, 787-95
В. Данные no: Buerger M.J. p. 183-211. в
" Phase Transformations in Solids." , New York, 1951.
Foster W.R. J. Am. Ceram. Soc., 1968, 51,6,
354 ~
115
СаО - TiO
2
CaO - A12O3; CaO - Cr2O3; CaO - Fe2O3;
Фиг. 413. Предполагаемая фазовая диаграмма.
Черные точки - ценные, полученные закалкой; светлые кру-
жочки - результаты, полученные в печи, с пластинчатым на-
гревателем; различные значки показывают разные условия опытов.
DeVries R.C., Roy R., Osborn E.F. J. Phys. Chem.,
1954, 58, 12, 1072
Фиг. 415. Диаграммы плавкости
Wartenberg H.V., Reusch H.J., Saran E. Zs.anorg.
allgem. Chem., 1937, 230, 3, 266
CaO - W03
2250*20*
CaW04+W03
(тетри )
"w# *
CaM)4+W0,
, (рмб.)
CaO ZO W BO 80 IVO.
МОЛ.1
Фиг. 414. Фазовые отношения в системе СаО—WO^
Chang L.YScroger M.G., Phillips В. J. Am. Ceram.
Soc., 1966, AS, 7, 387
Ce02 " Fe3°4; Ce02 - Mn3°4; Ce02 - Ti02
Фиг. 416. Кривая ликвидуса в системах СеО2-Мп3О4;
СеО2—Fe^O4; CeO2-TiO2
Wartenberg H.V., Eckhardt K.Zs. anorg. allgem. Chem., 1937,
232, 2, 181
116
Се2°4- А!2°з;Се2° j —Ве°;Се204-GaO;
Се2°4" Сг2°з- Се2°4 - Fe3°4; Се2О4- MgO;
Ce2O4-Mn3O4; Ce2O4-ZrO2
Cr203 - FeO
2300
Фиг. 417. Кривые ликвидуса.
Wartenberg H.V., Eckhardt К., Zs. anorg. allgem.
Chem.,1937, 232, 2, 18
2100 -
1300
1700
~ Жидкость /
<Л\ /
/ ЬМг'
/Шпинель!
/ + I
/Жидкость! Шпинель
Шпигель
Gr,0,
1500 - • Р к ’
_____t3Q □ О ’
Ж Н Вюсгпит+\
.it..,
FeO 20 40 60 80 Cr203
Вюстит+ \
Фиг. 419. Диаграммы
равновесных фазовых от-
ношений в системе окисел
железа -Сг^Оз в ат-
мосфере, состоящей из
равных частей СО2 иН2«
Для простоты, отношения
фаз спроектированы на
плоскость ЕеО’С^Оз,
хотя система не бинарная
(а). В нижней части фи-
гуры (б), в увеличенном
масштабе дана часть сис-
темы в пределах составов
от 0 до 21,7% Сг^О3
Riboud P.V., Миап А,
Trans.Met.Soc. AIME, 1964,
230,1. 89
CoO — ZnO
^r2®3 “ Fe2®3
Фиг. 418. Фазовая диаграмма системы CoO—ZnO
Bates С.Я., White W.B.t Roy R. J.Inorg. Nucl.Chem.,
1966 , 28 , 2, 400
Фиг. 420. Результаты (I) Richards R.G. и White J.
(Trans. Brit. Ceram. Soc., 1954, 53, p. 422-59);данные
настоящего исследования (II)
Штриховые кривые относятся к равновесию полутораокись шпинель,
Миап A., Somiya Sh. J. Am. Ceram.Soc., 1960, 43 , 4 , 208
117
Фиг. 421. Диаграмма плавкости системы - Ре20з
Людвинский А ,И,Научи, труды Днепропетровского
металлург, ин-та. Технология силикатов. 1962, в. 1,с. 3
Сг2О3- Мп2О3
7?
2300
2100-
1900
1700
1500
1300
Жидкость
Шпинель* Ж
Шпинель
ТЪтрсл Mnfy
1100
МпД+Ztasa
800 т№° ’
Л»-*Мп20, •
'Mn.0. f
ЧОО- '
Шпинель
+Мп20,
Сг205+ЛУ
—।----
1
Мп203+ Сг203
МпД 20 10 '~60
23 дес. I
Сг203
1
80 Сг208
Фиг. 422. Диаграмма
MgO-Cr2O3, согласно
Gee с изменениями
а= 4MgO.Cr2O3;M=MgO,
Wilde W.T., Rees W.J
Trans. Brit. Ceram.
1943, 62, 7, 143
Фиг. 424. Фазовые отношения в системе МП2О3-СГ2О3
на воздухе.
Speidel D.H., Muan A. J. Am. Ceram. Soc., 1963, 46, 12,
578
f',0,- S02
MgCr20t
MgO
Сгг03,Лл7о
Фиг. 425. Предполагаемая диаграмма фазовых отно-
шений
G/asser F.P., Warshaw I., Roy R. Hhys. Chem. Glasses,
1960,1,2, 44
Soc
Фиг, 423. Диаграмма фазового равновесия системы
MgO_MgCr2O4
1 - сплавленный; 2 - частично сплавленный; 3 - не сплавлен-
ный: 4 - экспериментальный тв. р-р.
Alper А.М., McNally R.N., Doman R.C., Keihn F.G.
J. Amer. Ceram. Soc., 1964, 47, 1, 30
118
Cr^O 3 - SiO 2
CuO - SiO2
®C
2000г
I
Кристобалит
1723 +^
жидкость
I
I
I
Жидкость А+В
2200 +
Окись хрома
жидкость
А
1720 ±
Кристобалит +окись хрома
1
I 22S5t25
f Окиа хрома
Л жидкость В
1600
2 жидкости
~~6S0
SlO«+ жидкость
Тридимит + жидкость
1200 > СихО*лг
X
СигО+ крист.
CuO* крист
1&+$\Лх(аморфн или кварц)
1713
1050
1025
WL-
CuO
ЬО
Вес. %
070
ВО
$Ю2
Фиг. 429. Диаграмма состояния системы CuO-SK^
в атмосфере воздуха.
Устълнцев В.М,, Судакова Л.IIБессонов А.Ф. Журн,
неорг. хим. 1966, 11, 5, 1181
Stoz СггО3
Фиг. 426. Предполагаемая диаграмма для системы
Сг20з—SiO2 поданным Bunting E.N.
Keith M.L. J.Am.Ceram. Soc., 1954, 37, 10,490
(L’.S.Nation. Bur.Stand.J. Research, I930,_5, 2, 325)
Фиг. 427. Кривая плав-
кости Cr2O3_TiO2
Гузенко Г,Ф. Сб. науч-
ных тр. Укр. НИИ Огне-
упоров, 1968, №9, 60
FeO - Fe O,
Ль Л
CuO - MgO
Фиг. 428. Фазовая диа-
грамма системы СиО-
MgO, отображающая суб-
соли дусные отношения.
Г - промежуточная фаза,
поггенит. Составы выраже-
ны в мол.%.
Gadalla А.М.М., White J.
Frans. British Ceram. Soc., ~
1964, £3, 3 133 Фиг. 430. reO - вюстит. Пунктирные линии
вают возможные фазовые отношения между
под давлением, достаточным для предотвраще-
ния их диссоциации.
Mason В, Geol. Fof. Forh., 1943, 65, 2, 120
показ ы-
резО4 и
119
FeO—MgO
FeO- MnO
Фиг. 431. Общая форма диаграммы равновесия сис-
темы MgO-FeO
Bowen N.L., Schairer J.F. Am. J. Sci., 1935. 29. 170,
153
Фиг. 433. Сплошными линиями показаны данные Hay R.,
Howat D.D., White J. (J. West. Scotl. Iron. Steel. Inst., 1933-
-34, 41,97)
Herty C.H. L.S. Bur. Mines., Rept. Investigations, 3054.
1930
Фиг. 432. Границы растворимости магнезиовюститового
твердого раствора
А - по Н .S.Roberts, H.E.Merwin (Amer. J. Sci., 1931,21,145);
Б - согласно настоящей работе. На анаграмме справа, выраженной
в мол.%: а - исходные полностью окисленные составы, выраженные
в вице MgO. б - частично, диссоциированные смеси, выраженные в
виде MgO
Woodhouse D., White J. Trans. British Ceram. Soc., 1955,
54, p.351
Фиг. 434. Диаграмма равновесия системы FeO—MnO
Andrew J.H., Maddocks W.R., Howat P. J. Iron Steel Inst.,
1931, 24, 2, p. 1, 293
120
FeO - SiO2
Фиг. 435. Диаграмма равновесия системы FeO-SiC^.
В верхней части фигуры показаны истинные количе-
ства Рв20з в жидкости при температурах ликвидуса,
определяющие степень отклонения от бинарного ха-
рактера
Bowen N.L., Schairer J.F. Am. J. Sci., 1932, ser. 5»
24, 141, 200
Фиг. 437. Диаграмма термического равновесия для
системы FeO— TiC^
Grieve ],, White J. J. Royal Technical College (Glas-
gow), 1940,4, 4, 660
Фиг. 436. Частное сечение фаялит-вюстит, Fe2SiO4 -
" FeO”
1 - результаты настоящего исследования в атмосфере азота;
2 - в атмосфере СО/СО2; 3 - результаты Bowen N.L. и Schai-
rer J.F. (Am. J.Sci., 24 (1411,177-213 (1932); Ceram. Abstr., 12(21,83
(1933); 4’- no Schuhmann R., Ir. и Ensio P.J. ("Thermodynamics
of Iron Silicate Slags: Slags Saturated with Gamma Iron. % J. Metals,
1951, 3, 5, 401-11; Trans. Am. Inst. Mining Met. Engrs., 1951, 191,
401~Allen Ж.С., Snow R.B. J. Am. Ceram. Soc., 1955, 38,
8, 268
Фиг. 438. Диаграмма состояния системы FeO—Т1О2
Я,епочкина Н,И, Физико-химические исследования
титанатов бария и железа. Тр. ИГЕМ АН СССР, 1958,
в. 11, с. 53
1 16
121
IeO-liO2
Fe2O3_MgO
Фиг. 439. Фазовая диаграмма системы закись желе-
за-окись титана при давлении кислорода, определя-
ющем равновесие железо-вюстнт.
Штриховые линии указывают на неопределенность положения
пограничных кривых.
MacChesney J.B., Миап A, Am. Min., 1961, 46, 5—6,
578
1600
1200
W 20 40 60 ИдОРеД ЙД.
Pen %
Фиг. 440. Диаграммы состояния систем (a) FeO-TiO2
(рутил); (6)FeO-TiO2 (брукит), по данным:(1)Белян-
кин Д.С., Торопов Н.А., Лапин В.В. (Физико-химиче-
ские системы силикатной технологии, М., Промстрой-
издат, 1954; (2) Руднева А.В., Модель М.С. (Металлур-
гия и горное дело. Изв. АН СССР, О.Т.Н., 1963, №1,
59) и результатам настоящего исследования
Новохатский И .А., Ленев Сабинская АЛ .Изв.
АН СССР, металлы, 1965, № 2, с. 69
Фиг. 441. Диаграмма фазовых отношений в системе
окись магния - окисел железа на воздухе, основанная
на результатах настоящего исследования и данных
H.S.Roberts, Н.Е. Merwin (Am. J.Sci, [5th ser.J , 21»
C122T 145-57(1931); R.G. Richards, J. White. (Trans.Brit.
Ceram.Soc., 53» [7],422-59 (1954), M. Koizumi, R. Roy
("Subsolidus Equilibria in Some MFe20. -FejO^ Sys-
tems" t в "Sixtieth Annual Meeting, Tne American Ce-
ramic Society", Pittsburgh, Pa, April 30, 1958).
Phillips B., Somiya Sh., Muan A. J. Am. Ceram. Soc.,
1961, 44, 4, 169
Фиг. 442. Фазовые отношения в системе Ре20з-Мп20з
Пунктир - приблизительная кривая диссоциации. Состав мине-
ралов: 1 и 2 - Rio Chubut, Patagonia, 3 - Thomas Range, Ltah,
4 - Black Range, Xew Mexico, 5 - Sitapar, India, 6 - Langban,
Sweden,7,8- Postmasbury, South Africa,
1-4 - биксбииты; 5,6 и 7 - ситапариты; 8 - партриажит.
Mason В. Am. Mineralogist, 1944, 29, 1 и 2, 67 (см. •
также Mason В. Geo). Fdr.ftrh., 1943, 65, 2, 170)
122
^е2®3 ~ ^C2®3
Fe2O3- ZnO
Фиг. 443. Диаграмма состояния системы Ее2О^-5с2Оз
вс - угол отражения оля параметра с.
Cassedanne J., Forestier H.t C.R. (Paris), 1960, 250 t
17 , 2899
Фиг. 445. Фазовая диаграмма системы y-FeO-ZnO
Bates C.H., White W.B., Roy R. J. In org. Nucl.Chem.,
1966,28, 2, 399
Fe3°4“Mn3°4
4Fe2^3 “ TiO 2
•c
noo-
a-Pe203
» Рег03-П0г
Евг0з-П0г+П0г
•/
oZ
о/
800 -
w
ио аз)
ffl (2)e)(4llf/ (i У eg ({) <y/7^|CT|
FMj '* 20 io 00 ' 00 ' TWt
c * Ba*
80 ' n O z
Фиг. 444. Сводка экспериментов по сухой закалке.
1 — a—Fe2Oj; 2 — а—Fe2Oj+Fe2OyTiO2; 3 — Fe2O^*TiO2; 4 —
Fe2O3-TiO2 + TiO2; 5 - ТЮ2(рутал)»6 - x-Fe2O3+X+Fe2O3-TiO2+
+ TiO2 (отсутствие равновесия). Цифры в скобках указывают номер
сс става.
Karkhanavaia M.D., Momin А.С. J.Amer. Ceram. Soc.,
1959,42» 8, 400
Фиг. 448. Фазовые отношения в части системы
Fe3°4“Mn3°4
McMurdie H.F., Sullivan В.М., Mauer F.A. U.S.Na—
tion. Bur. Stand., J. Research., 1950, 45, 1, 38
123
Фиг. 447. Фазовые равновесия в системе Fe^O^—Мп^О^
Van Hook H.J., Keith M.L. Am. Min., 1958, 43j 1/2, 80
MgO—MnO
Фиг. 449. Диаграмма состояния системы окись мар-
ганца - окись магния
1 - экспериментальные данные; 2 - расчетные данные из ве-
личины AHs(MnO)
Schench Н., Frohberg M.G,, Nunninghoff R. Arch.
Eisenhiittenwesen, 1964, 35 . 4 , 270
K2O-SiO2
Фиг. 450. Диаграмма фазовых отношений в системе
MgO- окисел марганца выше 1000°С.
Riboud P.V., Миап 4. J. Am. Ceram. Soc., 1963,46, 1,
35
Фиг. 448. Диаграмма фазовых превращений в сис-
теме SiO2-K2O
Wollast R. Silicates industriels, 1961, 26, 12, 91
124
MgO-P2O5
Фиг. 451. Фазовые отношения в системе MgO-P2Oe
Berak J. Rozniki Chem. 1958» 32, 17
Фиг. 453. Диаграмма состояния системы МgO-Si02
Никитин В,Д. Изв. сектора физ.-хим. анализа
ИОНХ АН СССР, 1948, 16, 3 , 29
MgO - SiO2
‘С -
1900-
Лер^УЖ
___
1700-
• 2>K 1705^
ЛэняА-----™----1
\ \l Kpucm^Xty+M
1100
ООО
500
1557'
1500-
_ <MMg2SlO4) +Пер
Пэнс + Vo /7^ж(Мд5103) +Крист
Пэнс+Тр($\Ъг} -990'
Рзнс+Фо А 1 -( Рзнс+Тр 870'
PaHc+a-KOfti^ 573' 2
Рэнс+JMO b—1 1 1
МдО 20
P’P<nf
М 60
Mg2SlO4 MgSlO3
5102,Дяь%
80
SIO2
Фиг. 452. Фазовая диаграмма системы MgO-SiO^Bo-
wen N.L,,Andersen O.A.(Am.J.Sci.,1914^,37,417), с измене
ниями no Greig J.W. (Am.J.Sci., 1927, 5, 13» 1); с про-
тоэнстатитом, высокотемпературной устойчивой формой
MgSiOo, по Foster W.R. (J. Am. Ceram. Soc., 1951, 60, 2,
255) и Atlas L.(J.Geol., 1952, 60, 2, 127). R- ромб.
G/asser FOsborn E. J. Am. Ceram. Soc., 1960, 43 , 3,
132-140
Фиг. 454. Область существования двух несмешиваю-
щихся жидкостей в системе MgO—SiO2
о - одна жидкость; х - одна жидкость погрейгу; • - две
жидкости; - две жидкости по Грейгу; о - составы стекол, най-
денные интерполяцией по коэффициенту преломления
Ольшанский ЯЛ. ДАН СССР, 1951, Zfi, 1, 93
125
MgO - SiO2
MgO - U02
Фиг. 457. Диаграмма
состояния идеализиро-
ванной системы и02 —
MgO. Штриховые ли-
нии - данные Lambert-
son W.A., Mueller М.Н.
(J. Am. Ceram. Soc.,
1953, 36, Ю, 332-334)
Будников П. П. Тре-
святский С, Г, , Куша-
ковский В. И,
Тр. 11 Международной
конф, по мирному ис-
пользованию атомн,
энергии (Женева,
1958), т. 3. Ядерное
горючее и реакторные
металлы, Атомиздат,
1959, с. 322
Фиг, 455. Схематическая Р-Т-диаграмма для MgSiO^
Sarver J.F., Hummel F.A. J. Am. Ceram. Soc., 1962,45,
4, 156
MgO- ZnO
MgO-TiO2
Вес. °/о
Фиг. 458. Предполагаемая диаграмма системы MgO-ZnO
В нижней части фигуры показана зависимость величины элемен-
тарной ячейки (х) и показателей преломления (•) от состава твердых раст-
воров MgO-ZnO
Segnit E.R., Holland А.Е. J. Am. Ceram. Soc., 1965, 48»
8, 412
126
Фиг. 459. Диаграмма состояния системы MnO-SiO2
Glasser F.P. Am. J. Sci., 1958, 256 , 6 , 405
Mn „0 _ SiO „
3 4 Z
/ж-
1600
Жидкость
,МпО-5Юг
Mn 0•SiO2 +тридимит
Тефроит +Мп0-510г
IWOX-Кцб Мл3О^
★жидкость
~ Тефроит +
жидкость
1200
_Мп30и+Мп,0
7Z7Z7Z7|-Mti.O
МП.О
Мп3О% 20
2 жидкости
Кристобалит
жидкость
Тридимит+жидкость
Мп 0 * Si 0. жидкость
I Мпг03+Мп0-510г
/
kO 60
Вес. */•
। ।
80 510г
Фиг. 461. Псеваобинарная система окись мар-
ганца - SiO2 на воздухе (скорее является кис-
лородным изобарическим сечением системы
Mn-Si-O)
Muan A., Somiya Sh. Am. Min., 1961, 46, 3—4,366
MnO - Zn0‘
MoO, - CaO, MoO, - PbO; MoO„ - ZnO
3 3 •>
Фиг. 460. Фазовая диаграмма системы MnG-ZnO
Bates C.H., White W.B., Roy R. J. Inorg. Nucl.Chem.,
1966,28,2,398
I I I I I I_______L I 1 , I
Им. I
MoO3- ThO2
Mo03+a
/♦ThOt
ThOa
Фиг. 463. Часть диаграммы состояния системы
MoO^-ThC^ при 1000°С (схема)
Freundlich Ж., Thoret J. C.R. (Paris), Ser. С,
1967,265, 2, 97
127
MoO -ThO
3 2
PbO - SnO2
ИоОз+/
/+™2
O—
№03
' 1000'C
—6
Th02
Фиг. 464. Часть диаграммы состояния системы
Mo03-Th02 при 700°С (схема)
Freundlich W., Thoret J. C.R. (Paris).Ser. C, 1967,
265, 2,- 97 ‘
Фиг. 467. Диаграмма состояния системы
PbO—SnO2
Уразов Г.Г., Сперанская Е.И.,Гуляницкая З.Ф.
Жури. неорг. хим., 1958, 1, 6, 1413
Фиг. 465. Диаграмма состояния V2O^-NaVO3
И ларрионов В.В., Озеров Р.П., Килъдишева Е.В, Жури,
неорг. хим., 1957, 2, 4, 884
NiO - ZnO
Фиг. 466. Фазовая диаграмма системы NiO—ZnO
Bates С.Н., White W.B., Roy K.J.lnorg. Nucl.
Chem., 1966 , 28, 2, 401
Фиг. 468. Частный разрез PbO-PbWO^
Jaeger F.M., Germs H.C.Zs. anorg. allgem.Chem.,
1921, 119, 12, 162
128
SiO 2 - SnO
SiO2- ZnO
30 50 70 90
Мол. 7o
1710°
i । . . । . 1933,32» 10, 185
20 60 100
Sn0 Bee. % Si,02
SiO2 - ThO2
Фиг. 470, Диаграмма состояния системы ThC^—SiC^
Lungu S. Nucl. Mater., 1966, 19, 2, 157
Фиг. 469. Диаграмма
состояния системы
SnO-SiO2
Kohlmeyer F.J., Keys-
selitz B. Metal] u.Erz,
Bunting E.N, J.Am. Ceram.Soc., 1930, 13, 1, 8
SiO2-ZrO2
°C
2800
I 2Ж
CL
°C
2200 -
ThO2+ Жидкость
Жидкость
1975*50°
-ThO2 +
ТЬ0г-5Ю2
1800
ThO2 • 5t 0 2+ Жидкость
SUJ2+W
1700*10°
ТЬ0г*8ъ0г+ StO2
Th02
Bee.
60
7о
100
StO2
2Ч00\ 1гЩт(1.р-р) + Ж
2000
_ДгО2 (mO.p-p)
1600
Zr&Oii+M
ZrSiOq+SiO2
। -i ZrOz (mO.p-pJ +
Zr SiO4
ZrO2 20 40 60 80 SlO2
5Юг, мол. % —►-
2800
2400
2000
ZrO2 (mO.p-p) +• Ж
\ 1гЪг(т8.р-р)
1600
.! ZrO2/mfip-£)
| ZrSiOq
SL02
Фиг. 471. Диаграмма состояния системы ThC^—SiC^
Harris L.A. J. Am. Ceram. Soc., 1959, 42, 2, 74
гг810ц+ж
ZrSlO4+SU)2
I_______L.
Zr02 20 60
SiiOg ]МОЛ.96 ►
Фиг, 473, Преоположительная фазовая диаграмма (а),
Аля сравнения та же диаграмма (б) по данным Gel-
ler R.F., Lang S.M., но пересчитанная с вес.% на мол,%
(Levin Е.М., McMurdie H.F., Hall F.P. " Phase Diagrams for Ce-
ramists", 1956, fig. 132)
Glasser F.P., Warshaw L, Roy R. Phys Chem. Glasses,
1960,1, 2, 44
17
129
Фиг. 474. Диаграмма состояния системы ZrC^-SiC^
по данным С.Е.Curtis, H.G. Sowman (J. Am. Ceram.
Soc., 1953 , 36 , 6)
Торопов H.A., Галахов Ф.Я, Изв. АН СССР, Отд. хим.
наук, 1956, №2, 160
ThO2-UO2
Фиг. 476. Сравнение теоретических и эксперименталь-
ных результатов
1 - экспериментальные данные; 2 - теоретические данные
Lambert son Ж.А., Mueller М.Н., Gunzel F.H. J. Am. Ceram.
Soc., 1953,3£, 12, 399
Трехкомпоиентные
SiO2-ZrO2
Al203 - BeO - MgO
•С
2800
куб 2
*Ж
'2285
zooo
1200
Тетраг
Тетраг
1687
-1676
Тетраг
Циркон
J170
2430
'УК^
2250
2гО,*Ж
Ж
ZrO2+Кристобалит
i47Q Циркон*Кристобалит
Циркон*- Тридимит
чоог
~бадделеит
JMokom.
Zr02)
Циркон
867
Циркон*- В-Т Кварц
573 __________________
Црркон*Н~Т Кфарц (
Zr02 20 lr 70 60 80 St02
Вес. °/о
Фиг. 475. Предполагаемая фазовая диаграмма системы
ZrO2—SiQ2
Butterman W.C,, Foster W.R. Am. Min., 1967, 52, 5-6,884
Фиг. 477. Диаграмма состояния системы Ве0-А1п0о-
MgO 2 3
Geller R.F., Yavorsky P.J., St ei er man B.L., Creamer A.S.
U.S. Natl. Bur. Stand. J. Research, 1946 , 36 , 3 , 289
130
131
Мз U.S 21,7 32.8
C4AF
-----Fe2OB, вес %
Фиг. 481. Диаграмма состояния бинарной системы
5СаО-ЗА12О3-4СаО-А12О3- Fe2O3;F-Fe/)3
(1) - граница по Торопову Н.А., Шишакову Н.А., Меркову Л.Д.
(Цемент, 1937, № 1,28)
Торопов Н.А., Байкова Л./Г,Журн. неорг. хим., 1956,
1, 9, 2108
Фиг. 482. Диаграмма равновесия системы СаО—Al2O3-Fe2O3.
F=Fe2O3
Batti Р. Ann.Chim., 1959, 42» 7-8, 1340
Фиг. 485. Диаграмма равновесия системы CaSiO.
анортит (см. также Rankin G.A., Wright F.E. Am. J
Sci,, 1915, 4th. Ser., 39, 42)
Prince A.T. J. Am. Ceram. Soc., 1951, 34, 2
Волл Гросс Ан + Гел
Фиг. 483. Псевдобинарное сечение волластонит-
анортит в системе СаО—А^О^—SiO2
Yoder HS., Ir. J. Geol., 1950, 58, 3 , 225
Фиг. 484. Бинарная система геленит-дикальцие-
вый силикат (См. также: Rankin G.A.,Wright F.E.,
Am. J.Sci, 1915, 4th Ser., 39, 43)
Prince A.T. J. Am. Ceram. Soc., 1951, 34, 2, 46
132
Л12О3- CaO -SiO2
Фиг. 486. Пересмотренная фазовая диаграмма сис-
темы CaO-A^C^-SiO? (Osborn E.F., Миап A. Phase
Equilibrium Diagrams of Oxide Systems. The American
Ceramic Society, Inc. Columbus, Ohio, I960), включаю-
щая пересмотренное в настоящем исследовании поле
первичной кристаллизации гексаалюмината кальция
(см. также: Торопов Н.А., Галахов Ф. Я. ДАН СССР,
1951, 78, 2, 299-302; Филоненко Н. Е., Лавров И. В.,
ДАН СССР, 1949, 66, 4, 676)
Gentile A.L., Foster-W.R. J. Am. Ceram. Soc., 1963,
4£, 2, 76
Фиг. 488. Диаграмма состояния системы анортит-
кремнезем (См. также: Rankin G.A., Right F.E.,
Am.J.Sci., 1915, 4th. Ser. 39, 42, Schairer J.E.,Bown N.L.,
Bull. Soc. Geol.. Finlande, 1947, 20, 71)
Pierre P.D.S. J. Am. Ceram. Soc., 1956 , 39,4.147
Osborn E.F., Schairer J.F. Am. J.Sci., 1941, 239, 10, of the Fourth International Symposium, Nation.Bur.
1 Stand., Washington, 1960, monograph, 43, vol.l,p. 23
133
Al,0,-CoO-SiO
4'0 &
Фиг. 490. Проекция поверхности ликвидуса в сис-
теме СоО-А120з-SiO2 на воздухе.
Штриховая линия, оттененная с одной стороны, указывает на об-
ласть существования двух жидкостей. Протяженность этой области
экспериментально не определялась.
Dayal R.R., Johnson R.E., Миап A, J. Am.Ceram.
Soc., 1967, 52, Ю, 538
Фиг. 491. Поверхность ликвидуса в системе СоО-
AI2O3-Si02, с ассоциациями кристаллических фаз
внутри различных областей составов и температу-
рами солидуса.
Dayal R.R., Johnson R<E., Uuan A. J. Am. Ceram.
Soc., 1967, 50, 10, 539
Al90q — Cr„O „ — Fe20.4
£ О £ <3 £ <3
проходящими через точки составов кристаллических фаз, находящихся в равновесии в двухфазных областях, тонкие
линии - соединительные линии. Символы и а-'В2^3ИСПОЛЬЗуюТСЯ для о^означения окиси железа и полутора-
окислов, богатых ALOo, соответственно} оба соеднинения имеют корундовую структуру; символом 1:1 обозначено
соединение ~ ОДНа полУтоРаокисная Фаза, II - шпинель+полутораокись.
Muan A., Somiya Sh. J. Am. Ceram. Soc., 1959, 42» 12, 603-613
134
A,2°3-Cr203-FC2°3
Фиг. 493. Серия изотерми-
ческих сечений системы оки-
сел железа - А^О на
воздухе, отображающих фа-
зовые «изменения, по мере
увеличения температуры от
1385° до 1415°С
Сечения, отмеченные от а до
г, даются яля температур 1385 ,
1390°, 1410 и 1415°С, соответствен-
но.
Sp- твердые растворы со
шпинельной структурой (FeO*
b>2O^FeO -А^О j-FeO-Cr^).
1 — одна полутораокис-
ная фаза*
Миап A., Somiya Sh. J. Am.
Ceram. Soc., 1959, 42, 12,603-613
Фиг. 494. Изотермические сечения системы при парциальном давлении СЬ в 1 атм.
Сечения от а до г даются для температур 1300°. 1418°, 1483°я 1500°С, соответственно. 1 - одна полутора-
оввсная фаза. Sp - твердые растворы со шпинельной структурой.
Миап A., Somiya Sh. J. Am. Ceram. Soc., 1959, 12, 603—613
135
Л,2°з- Cr203-Mg°
^*203 Cr2°3-Si02
Фиг. 495. Плайление шпинелей в системе
А12О3 — Сг2О3 — MpjO
El-Shahat R.M., White J. Trans.British
Ceram. Soc., 1966, 65, 9,497-519
Фиг.498. Фазовые равновесия в системе А1903-Сг90о
-SiO2
Roeder P.L.t Glasser F.P., Osborn E.F. J. Am.Ceram.
Soc. J 968, 51, 10, 587
Фиг. 496. Температуры плавления смесей
MgO-Cr2O3 -MgO- Al2O3
Wilde W.T. Rees W.J. Trans. British. Ceram.
Soc., 1943, 62, 7, 127
Фиг. 499. Изотермическое сечение системы Al О
Сг2О3- SiO2 при 1700°С 2 3
-Roeder P.L., Glasser F.P., Osborn E.F. J.Am.
Ceram. Soc., 1968, 51, 10, 585-594
Ф и г. 497. Изотермы плавления в системе
Wilde W.T., Rees W.J. Trans. British Ceram. Soc.,
1943, 62, 7, 127
136
Al,0, Вес. % Cr О
Z 3 6 °
Фиг. 500. Изотермическое сечение системы А120з -
Сг2Оз-51О2 для 1575°С
Roeder P.L., Glasser F.P., Osborn E.F. J.Am.
Ceram. Soc., 1968, .51, 10, 593
A,2O:rFeO-Fe2O3
Фиг. 502. Диаграммы фазовых отношений в системе
окислы железа - А12О3 на воздухе. Верхняя диаграмма -
псевдобинарная система А120^ — Fe2O^ .
Сплошные линии указывают на бинарные отношения. Штриховые
линии проведены в тех частях системы, где только шпинель явля-
ется конденсированной фазой, состав которой лежит на соединитель- -
ной линии Fe 0^ - А^Оз-Пунктирная линия используется, где при-
сутствует жидкая фаза. На нижней диаграмме А1_0„ - FeO - Fe„0
показаны кривые, представляющие составы <|>аз, гатгодяшихся в рав-
новесии вдоль пограничных кривых.
Ifuan A., Gee С. L. Am. J. Sci., 1958, Р« 415
АЧ°3 -Cr2°3-Si02
Фиг. 501. Изотермическое сечение си-
стемы А120^ -Сг2О^ - S1O2 Для 1800°С
Roeder Р. L.,Glasser F.P.,Osborn E.F.
J.Am.Ceram. Soc., 1968, 51, 10, 592
Al2O.{-FeO-Fe2O.,
Фиг. 503. Диаграммы фазовых отношений в системе
окислы железа - А^О^ при давлении кислорода в
Ми an A., Gee C.L. Am. J. Sci., 1958, 256, p. 415
18
137
Фиг. 504. Фазовая диаграмма, показывающая равно-
весие между полутораокисными фазами и шпинельной
фазой при давлении кислорода 15,9 см Hg
1 - составы, представляющие верхнюю границу превращения по-
лутораокись - шпинель; 2 - то же, но нижияи граница превращения;
3 - составы при 1430 ; 4 - составы при 1460 ; 5 - составы при
1500°. Цифры слева от линии Ь^О^-А^О^ обозначают номера изу-
ченных смесей. Пути диссоциации показаны прерывистыми линиями
Richards R.Q., White J. Trans. British Ceram. Soc.,
1954, 5& 4, 253
M0Л %
Фиг. 506. Изобарическое сечение фазовой диаграммы
системы А12 03 - FeO - Fe2O3
F G - изобара солидуса; F* I. - изобара ликвидуса; HGL - сое-
динительный треугольник
1 - измерения при диссоциации в твердом состоянии; 2 - изме-
рения при плавлении
Willshee J. С., White J. Trans. British Ceram. Soc.,
1968, 67, 7, 271-284
Fe20j W 60c n W 20 FeO
i Fe3O<
Фиг. 507. Изменение равновесия твердого раствора с
температурой
R.W.= Hicharas R.G. и White J.(Trans. British. Ceram.Soc., 145 I,
53, p. 233-70); I - к вершине вюстита; II - к вершине Fe
Atlas L., Sumida W.K. J.Am. C era m.Soc. 1958, 41, 5,
158
Фиг.505. Изобарическое сечение фазовой диаграммы сио
темы А120 3-FeO-Fe 20з»построенное по кривым дис-
социации, с изотермами выше 1591 С.G-39,2% FeO,
21,6% Fe 0 39,2% ALO ; L-40,0% FeO, 33,3%
Fe2O3,26,7%’Al2O3 2 3
EG изобара солидуса; FL - изобара ликвидуса; HGL. соединительный
треугольник
1 - измерения при диссоциации в твердом состоянии; 2 - измерения
при плавлении (см. фиг. 306)
Willshee J. С., White]. Trans British Ceram. Soc.,
1968, 67, 7, 279
138
Al /)3- FeO- Fe2O;,
AI2O3-FeO-SiO2
АЦ0,
(7597°С) Вес. °/o Вюс+жидкий 6 юс FeO
Фиг. 508. Солидусные равновесия в части FeO—Fe304—
системы Fe-AI-O. Шп-Fc(Fe,Al)2O4 - шпи-
нель, В — вюстит. I - равновесная диссоциация кислорода;li-
no: l)Richards Н.М. и White J. (Trans. British Ceram.
Soc., 1954, 53, p.233-70); 2) MuanA., Gee C.MJ.Am. Ceram.
Soc., 1956, 39, 6, 207-14)
Atlas L., Sumida W.K. J. Am. Ceram. Soc., 1958, 41.,
5, 159
Фиг.509. Диаграмма равновесия системы, показываю-
щая поля первичных кристаллических фаз, коноды и ин-
вариантные точки
Schairer J.F., Уagi Kenzo. Am.J. Sci., 1952, Bowen
volume, part 2, 488
Al n -FeO-SiO2
i &
Фиг. 510. Диаграммы указывают качественные возмож-
ные изменения в фазовых отношениях в системе FeO—
Fe2O3-A12O3~SiO2 , с изменением давления О2.при
сильно восстановительных условиях 4
Цифры указывают температуры соответствующих точек пересече-
ния и ликвидусных инвариантных точек IV и V. Диаграммы показы-
вают в последовательном порядке фазовые отношения по мерс умень-
шения давления 02, примерно, от 10"1® атм на диаграмме а до
1СГ™ атм; 09 - на диаграмме f; f дано noSchairer и Yagi (Vn.J.
Sci.,Bowen Vol. 1952; p.2,488).Fe- корд - железистый кордиерит,
Вюс - ВЮСТИТ
Миап А„ J. Am. Ceram. Soc., 1957, 40, 12, 429
139
S1O2 no Schairer I.F., Yagi K. (Am. J.Sci., 1952,
Bowen volume, p. 2, 471), дополненная результатами на-
стоящей работы (границы корунд-муллит и корунд -гер-
Фиг. 513. Диаграмма равновесия бинарной системы
лейцит-кремнезем
Schairer J.F,t Bowen N.L. Bull .Soc. Geol. Finlande,
1947, 20, p. 74
цинит) вес.%
Галахов Ф .Я. Изв. АН СССР, отд. хим. н., 1957, 5,
530
AI.0. — K.0 — SiO.
£ & £ &
Фиг. 512. Диаграмма равновесия.
Температуры двойных и тройных инвариантных точек: II - 867 +
3°; I - 990 * 20°; J - 1470* 10°; М - 985 + 20°; N - П40 + 2(Р;
О - 1150 + 20°; Р - 710+20°; Q = 725+ 5°; R - 810 + 5°; S~-
695 + 5°; Т - 918+5°; l" - 905 + 10; V - 923 + 5°; х - 1686 + 5°;
А-Г315+1О°; ЕГ- 1588 + 5°; С*- 1553+ 5 О' - 1615 + 1(Р;
1У - 1680+ 10°; Hz - 1540° +; |'- 1540°+ . X = !<2O-AI2O3.4SiO2
(лейцит); VI s КоО* Ai2O3-6SiO2 (калиевый полевой шпат);Е# =
= knO «ALOo^SiOj (гексагональный и ромбический KAISiO^hG*-
- ^О- \I2O3 -Si02
Schairer J.F. Bowen /V.L.Am.J. Sci., 1947. 245. 199,201
Фиг. 514. Диаграмма равновесия частной бинарной
системы лейцит (KAlSi2O6) - корунд (AI2O3)
Schairer J.F., Bowen N.L. Am. J. Sci., 1955, 253. 12,
719
140
Al203_K2°-Si02
1800 ~
1700
1615±1lf.
1600 '
О-ромб. "
KRlStOi»
и
Ж
О~ромб.
КЯШОц
и Лейцит
41686±5'
Лейцит и Ж
1615 ±10'
KRLSiOH 20
K2O Rl203- 2SiOz
00
60
Вес. %
80 Лейцит
K20-Rl2D3'HSIO2
Ф иг. 515. Диаграмма равновесия частной бинарной си-
стемы калиофиллит (КAISiO4) - лейцит (КAISi2O6 )
Schairer J.FBowen N.L. Am.J. Sci., 1955, 253. 12, 720
Фиг. 516. Диаграмма равновесия частной бинарной си-
стемы KAlSiO4-AI2O3
Schairer J.F., Bowen N. L. Am.J. Sci., 1955, 253. 12.
722 ’
Фиг. 517. Диаграмма равновесия для частного сечения
K2Si4O9’ К A) Si3O8
Жирные кривые относятся к бинарному равновесию, тонкие -
к тройному
Schairer J.F.t Bowen N.L. Am. J. Sci., 1955, 253. 12,
723
AI2°3-Li2O-SiO2
171/
Кристобалит
Я
Тридимит
Li^OZSlO^
Фиг. 518. Система LLO—AI^O^—SiO^ с нанесенной
соединительной линией метасиликат лития - (3-эвкри-
птит
Р _ L^O-ALO^SSiO? — петалит; R _ Li2O -AloOj-bSiCU-'литие-
вый ортоклаз'; Ъ - Li2(J* A^O-j* lSiO2 - сподумен; £ _ A^Oy
•2SiO2 - эвкриптит
Murthy M.K., Hummel F.A.J.Am.Ceram.Soc., 1954, .37, 1,
17
SiOj,
uto-
Муллит
U20
m
1255*
2SiOz
2050*
50
Вес. V.
141
Фиг. 519. Частное сечение L^O AS1O2, системы
ALOn-l^O —SiO9
Saalfeld Н. Ber.Dtsch. Keram. Ges., 1961, 38, 7-8, 283
Al„O„— CaO - SiO2 Al О - MgO - SiO ;
MgO -*"Al203 CoO -*~-Al2O3
.Фиг. 520. Участки тройных диаграмм:
MgO —A^Oq—SiO2» CaO-A^O-j—Si(?2; 1 - граница между по-
лями AI2O3 и ЗА^ОуЗБЮп: а) по данным Ранкина и Мервина; б) по
данным Ранкина и Райта; 2 - та же граница, по данным Института
химии силикатов
Торопов Н.А., Галахов Ф,Я. Вопросы петрографии и
минералогии, Изд-во АН СССР, 1953, II, с. 253
Al2O3-MgO-SiO2
Фиг. 521 . Диаграмма фазового состояния псевдоби-
нарной системы MgO-SiC^-A^O^
Saalfeld И., Junge Н. Вег. Dtsch. Keram. Ges.,
1967, 44, 9, 428
Фиг. 522. Пересмотренная часть системы. Ранее уста-
новленные границы мул лит-корунд показана линиями из
точек. Термин "индиалит* относится к высокотемпера-
турной полиморфной форме кордиерита, которая устойчива
при температурах ликвидуса.
Roy R.t Aramaki S, J.Am.Ceram. Soc., 1959, 42. 12,
644-645
142
Al2O.,_MgO-SiO2
SiO,
Фиг. 523. Пересмотренная диаграмма равновесия, по-
строенная на основе работ Rankin и Merwin (Am.J.
Sci., 1918,4th ser., 45, 322), Bowen, Greig (J.Am.Ce-
ram. Soc., 1924, 7, 238); Greig (J. Am.Ceram.Soc., 1927,
13, 12);Schairer (J.Am. Ceram. Soc., 1942, 25, 241);
Foster (J. Am.Ceram. Soc., 1950, 33, 73; там же 1951, .34,
255),Keith, Schairer (J. Geol., 1952, SQ, 2, 182). Соеди-
нительные линии, связывающие кордиерит с другими кри-
сталлическими фазами, относятся только к температур-
ному интервалу 800- 1300 С. Выше этой температуры
кордиерит образует бинарные твердые растворы вдоль
линии с поперечными штрихами. Максимальные твердые
растворы муллита даны по Gelsdorf G, Muller - Hesse Н.,
Schwiete Е.—Е.( Arch.Eisenhiittenwesen, 1958, 29. 513-19)
Schreyer W.t Schairer J.F. J. Petrol., 1961. 2. 3, 332
Фиг. 525. Диаграмма фазового равновесия для системы
MgO-Mg2SiO4
Schlaudt CM , Roy D.M. J. Am. Ceram. Soc., 1965, .48,
5, 250
Фиг. 526. Диаграмма ликвидусных отношений для си-
стемы MgO-MgA12O4-Mg2SiO4
1 - пределы бинарных твердых растворов; 2 - пределы тройных
твердых растворов
Schlaudt С.М., Roy D M.J.Am.Ceram. 1065, 48. 5, 250
Фиг. 524. Диаграмма фазового состояния системы
Mg2SiO4-MgAl2O4
Schlaudt С.М., Roy D.M. J.Am. Ceram. Soc., 1965,
48. 5, 249
143
A12O3 _ MnO - SiO2
MnDSi
SO
ZMnOZAkOjSSiO,
JAljO^-ZSiOj
aMnoA^Oj-jsio,'^’*1'
2MnO-5iOz .
Вес. 7*
Фиг. 527. Изотермы в части системы МпО—А^Оз—SiO2
Snow R.B. J.Am. Ceram. Soc., 1943, 26. 1, 15
Mn0-Si02
AliOjZSIOt
ZMnOSIO
МлО
MnO'ALjOj
Al^Oj
ЗМл0А120л-35|0г
sto2
MnO*
MnO
Tea
Мул
Фиг. 528. Диаграмма равновесия части системы
MnO—AI2Q3—SiO 2
Snow R.B. J. Am. Ceram. Soc., 1943,26» 1» 14
t rT'c529' n "агРамма состояния системы МпО-ALQ,-
biQ2*Snow R.B.(J.Am. Ceram. Soc., 1943 26 1 15) noZ
"ZeHHafl реэультатами настоящей работа (граница’ко-
рунд - муллит; в вес.%)
м. ГкаЛ^вФ'Я- Иэв- АН СССР* отд-хим.наук, 1957,
№ 5, 530
Крист
Tp
Мул
SR^OjZSUfe
ЗМпО-ЯЦРзЗЭД foP!^
Галаксит
Фиг. 530. Диаграмма равновесия системы
NanO-SiOj- А)2О3
г - альбит (Na2O*AI2O3*6SiO2 ); - карнегиит,
нефелин (F^O-A^OyZSi^); Е - 767 + 3°; F -
1116 + 3 ; G - 740 +5; Н - 867 + 3°: , I -1062+
+ 3°; J - 1470 + 10°; М - 1050 Т 10 ; N - 1104+
+ 3°: О - 1108 + 3°: Р - 1063 + 5°; Q - 1068 +
+ 5 ; R - 1270 7 10 ; S - 1260°+. Т* - 732 + 5°;
L - 768 + 5°; V- 1248 + 5°; W - 1526 + 2°; X
1475 + 10°; Е' - 955 + 5°; G’ - 760 + 5 ; Н' .
900 +2°; Г - 1163 + 5° .
Schairer J.F., Bowen N.L. Am.J. Sci.,
1956, 254; 3, 137
Кристобалит
147OUO1
Na,O2Sl(h
Я
NajOSiO
1009±1
На-осили
2Na2OSlO2
70
А1£з- Na 2°
SiOz
1713*5°
1565*10*
90
“-------flL203
Вес. %
Al203
NfljOAljOj 70
Na?0
144
Фиг. 531. Диаграмма равновесия бинарной системы аль-
бит (NaAlSi-^Og) - кремнезем (SiC^)
Schairer J.FBowen N.L. Am.J. Sci.. 1956. 254. 3,
161
Фиг. 533. Диаграмма равновесия для системы (Nao0 •
AI2O3 • 2SiO2 —Na2O. A^O^. bSiCK (нефелин, карнегиит-
альбит)
Greig J.W., Barth T.F.W. Am. J. Sci., 1038, 5, ser.,
ЗЭД, p. 94
NaAVSi30g
Фиг. 532. Диаграмма равновесия бинарной системы
альбит (NaAlSi^Og) - корунд (А^О^) 4
Schairer J.F., Bowen N.L. Am. J. Sci., 1956, 254. 3,
163
Фиг. 534. Диаграмма равновесия системы NiO-ALO.-
SiO2. Двойная система А12О3-SiO2 дана по Aramaki S.,
Roy R.(J.Am. Ceram. Soc., 1962, 45, 5,.229-42)
8 19
145
Л12О3- ZnO -SiO2
Фиг. 535: Диаграмма состояния системы A^O^—ZnO—SiC^
Bunting E.N., U.S. Nation. Bur.Stand., J. Research., 1032,
& 2. 281
Фиг. 537. Диаграмма состояния системы A]2O3-ZrO2-SiO2
Будников П.П., Литваковский А.А. ДАН СССР, 1056,
106, 268
Al2O3-SiO2_ZrO2
Фиг. 536. Треугольники составов и изотермы
ликвидуса в частной системе ЗА1^Эз*251О 2“ ZrO2“ SiO2
Qureshi М.Н., Brett N.H, Trans. British. Ceram. Soc.,
1968, 67, 11, 576
Фиг. 538. Изученные составы и границы полей стабиль-
ности (в вес.%). В—В2О3
Flint Е.Р., Welts Lansing S. U.S. ^Nation. Bur. Stand., J.Re-
search, 1936, U, 5, 731
146
147
Фиг. 543. Диаграмма состояния системы BeO—MgO—TiO2
Massazza F. Ann. Chim., 1961, 51. 1, 86
Фиг. 545. Ортогональная проекция пространственной
диаграммы системы В120^-Мо0з-РЬ0 на треугольник
составов
Беляев И,Н., Смолянинов Н.П, Журн. неорг. хим.,
1962, 1.5, 1129
Фиг. 544. Часть системы PuO2-BeO-ThO2»c эвтекти-
ками
1 - первичная фаза ВеО; 2 - первичная фаза PuO2>ThO2 и™
PuO2/ThO2; 3 - образцы, использованные для определения темпера-
тур плавления
Hough A., Marples J.A.C. J.Nucl. Materia Is, 1965, 15,
4, 306
Фиг. 546. Фазовая диаграмма, включающая настоящее
исследования и данные других авторов (Zambonini F.
Gazzetta Chim. Ital., 1920, [II] 139)
Howard D.F., Bowman G»P.t Saxer R,K,t Myers J Rs Trans,
metallurg. Soc.AIME, 1964, 230, 4, 852
148
MgO MgO
CaO „PW”CaOCr2O. Cr,O. CaO CaO Cr.O- Cr.O,
a J
Фиг. 550. Распределение фаз в 'тройной* системе вы-
ше 1000 С на воздухе (а) и в вакууме (б). Диаграмма
псевдотройная, так как кислород реагирует с образова-
нием 9 СаО • 4Сг.О3«Сг2О3 (" 941")
FordW., Rees Ж. Trans. British. Ceram. Soc., 1949, 48.
8, 306
CaO-Cr2O3-SiO2
CaO - Cr О - MgO
Z «Э
Фиг. 548. Распределение фаз
в * тройной* системе до 800 С
на цоздухе. Система - псе-
вдотройная, так как кислород
реагирует с образованием
СаСгО4
Ford Ж,, Rees W., Trans.
British Ceram. Soc., 1949, 4g,
8, 306
MgO
Mg0Cr203
CaO CaCr»O4 Cr203
Фиг. 551. Фазовая диаграмма системы CaO-Cr?Oq-
—SiQ,. Линии, оттененные с одной стороны, определяют
границы области двух жидкостей
А*- 1418°; В - 1514°; С - 1407°; D - 1430°; Е - 1566°; F -
1720 . Вершина SiO2 увеличена с» в 30 раз.
Glasser F.Pr, Osborn E^F. J.Am.Ceram.Soc., 1958, 41, 9,
362
Фиг. 549. Распределение фаз*
в * тройной* системе в пре-
делах 800-1000°С на воздухе.
Система псевдотройная, так
как кислород реагирует с
образованием СаСгОл и 9СаО-
.4СгО3-Сг2О3("941")
Ford W., Rees IF.Trans.
British Ceram^oc., 1949, 48,
8, 306
MgO
CaO
CaCrO4
Cr2°3
MgO-
CrA
2200
2Ж
Сг2О,*Ж
*•2251
*•2201
Ж
1800
1400
<*СИЯ1,*Ж
Cr20j*ZM
—
Сг2О,*Ж
Фиг. 552. Диаграмма, фазовых отношений в сечении
CaSiO) —Сг2О3
Glasser F.P., Osborn E.Fr J. Am.Ceram.Soc., 1958, £1,
9, 364
ccCaSiij+Cr20j
18т0
CdjCr2Sfj0f2 ♦ CTjOj
C&SIO, 2ff
00
вес'/•
ЮО
Cr2llj
149
CaO-Cr«O,-SiO
£ о 2
Фиг. 553. Изотермическое сечение при 1350°С для данной
системы „ Л Л
Glasser F.P,, Osborn E.F. J. Am.Ceram.Soc.,1958, 41_, 9,365
Фиг. 555. Изобарическая фазовая диаграмма системы
CuO-Cu2O -CaO при давлении кислорода в 1,0 атм
А - система СаО — 1/2 Cu2O-CuO; В - псевдобинарная систе-
ма СаО-СиО (1/2Си2О) (в мол.%)
Gadalla А.М.М., White J, Trans. British Ceram. Soc.,
1966, 65, 4, 187
Фиг. 554. Изобарическая фазовая диаграмма системы
CuO-Ci^O-CaO на воздухе
А - система СиО—1/2 Си2О-СаО; В - псевдобинарная система
CaO-CuO (1 /2 Си2О ) (в мол.%) С.- СиО. 2СаО
Gadalla А.М.М., White J. Trans.. British. Ceram. Soc.,
1966, 6§, 4, 185
CaO _ FeO _ MgO
Фиг. 556. Фазовые отношения в системе CaO-MgO-
окисел железа при 1500 С при давлении кислорода в
10-9 атм
Johnson R.E., Миап A. J.Am.Ceram. Soc., 1965, 48.7.
364
150
CaO - FeO - SiO
Si
caosio.
ttaOZSi
?CaOSi(h
WeOSUJ,
ms‘
оюс
1500>
CaO_
-7570°
Фиг. 557. Пересмотренная и построенная с учетом ли-
тературных данных Осборном и Муаном диаграмма фа-
FeOSUk
wo9
170°
зового равновесия.
Температуры до 1550 С даются по шкале Геофизиче-
ской лаборатории; выше 1550 С температуры даются по
Интернациональной шкале 1948 г.
Основная литература: A.L. Day, E.S. Shepherd, F.E. Wright, Am.J.
Sci., (4th Ser.), 22. 265-302 1906);
G.A.Rankin, F.E. Right, Am. J. Sci., (4th. Ser.), 3ft 1-78 (1915);
J.H. Welch, W. Gutt, J. Am.Ceram. Soc., 4ft 11-15 (1959);
N.L.Bowen, J.F. Schairer. Am .J .Sci., (5th Ser.) 24, 1-77 ; 213-£4
(1932);
J.W. Greig, Am. J. Sci., (5th Ser.), 13. 1-44; 133-54 (1927);
N.L.Bowen. J.F. Schairer, E.Posnjak, Am. J. Sci.,(5th Ser.), 26» 193-
284 (1933);
W.C.Allen, R.B. Snow. J. Am.Ceram.Soc.,2ft 264-80 (1955);
E.F. Osborn, A.Muan, ''Phase Equilibrium Diagrams of Oxide Sy-
stems" , Plate,7, publ. American Ceramic Society a. the Edward Or-
ton, Ir., Ceramic Foundation, 1960;
Levin E.B., Robbins C.R., McMurdie H.F, Phase Diag-
rams for Ceramists, Publ. American Ceramic Society, 1964.
fig. 586.
СаО - FeO - SiO2
15S0
1400 -a Ca?l°3
Ж
Крист *Ж
Тр*Ж
- /''QSotf-C(iSi>03(
1200 ~A
с р^ЪхЛ^Ыр-рьВ
♦ a-CaSiO3
Тр+Ол+Ж
woo -
800 -
? \Tp+&?
p~ CaSiO3 (тВр-ры)
Гев (аЛр-ры) \ T^gj,
Гей
80 „FeSiOj
CaSiO3 20
40 CaFeStjOj
Bee. %
Фиг. 559. Диаграмма равновесия смесей из метасили-
катов, CaSiO3-FeSiO3
FeO Жирные кривые относятся к бинарном; равновесию; тонкие кри-
вые - к тройному равновесию.
Вожеп N.L., Schairer J.F., Posnjak Е. Am.J.Sci., 1933,
153, 213
Фиг. 560. Фазовые отношения при 1285°..
Bowen N.L., Schairer J.F., Posnjak E. Am. J.Sci., 1933,
2g, 153 , 222
Фиг. 558. Часть системы CaO-Fe2O^-SiO2 с изотер-
мами и треугольниками составов.
Burdick M.D. U.S. Nation. Bur. Stand. J.Research, 1940,
2g, 4, 466
151
CaO-FeO-SiO2
Фиг. 561. Фазовые отношения при 1160°.
Ложел N.L., Schairer J.FPoanjak E. Am.J.Sci., 1933,
26. 153, 228
Фиг. 582. Фазовые отношения при 1130°.
Bowen N.L.f Schairer J.F., Poanjak E. Am.J.Sci., 1933,
& 153, 229
22. “м,вЛ230Ь’' SC*e,W Poaaiai £-Am J.Sci., 1833.
Bowen N.L., Schairer J.F., Poanjak E. Am.J.Sci., 1933,
26. 153, 229
Ф
▼uqvdimo и-гнишения при HBU
Bowen N.L., Schairer J.F., Poanjak E.Am.J .Sci., 1933
26» 153, 232 ’
Фиг. 567. Фазовые отношения при 700°
Bowen N.L.tSchairer J.F., Poanjak E.Am.J.Sci., 1933,
26. 153. 232
152
Вес. %
Фиг. 568. Частное сечение CaSiO3-CaFeSiO4 в систе-
ме CaO-FeO-SiO2
Bowen N.L., Schairer J.FPoanjak E.Amer.J.Sci., 1933,
2g, 153, 193-284
Bee. %
Фиг. 570. Диаграмма состояния частной псевдобинар-
ной системы CaO-SiO2~FeO-SiO2 (в вес %)
1Г" '“**Е’
CaO - FeO - W03
Фиг. 569. Диаграмма состояния частной системы 2СаО»
• SiO —2FeO«SiO2— известково-железистые оливины
(в вес.%). Цифры 0,1 и 3—вес.% Fe^D^ в жидкости при
температуре ликвидуса
Bowen N.L., Schairer J.F., Poanjak Е.Amer.J.Sci., 1933,
2Ц. 153, 193-284
Фиг. 571. Твердый раствор шеелита в вольфрамите в
зависимости от температуры
Grubb P.L.С.Am.Min., 1967, 52, 3-4, 423
3 20
153
Фиг. 572. Фазовые отношения в системе СаО—MgO -
окись железа при 1500 С на воздухе
МВ - магяеэиовюстит; МФ - магнезиоферрит
Johnson R.E., Миап A. J.Am.Ceram. Soc., 1965, 48. 7, 363
Фиг. 574. Диаграмма состояния системы СаБЮз—
- CaGeO3
Гребенщиков Р.Г., IB up вин скал А .К,,Шитова В,И,, То-
ропов Н.А. Химия высокотемпературных материалов.
Труды II Всес. совещания по химии окислов при высо-
ких температурах, 26-29 ноября 1965 г., опубл, в 1967 г.,
с. 111
СаО -GeO2-SiO2
Фиг. 573.Диаграмма состояния системы Ca2SiO4-
- Ca2GeO4
Гребенщиков Р.Г .,.Ширвинская А.Квитова В.И., Торо-
пов И,А, Химия высокотемпературных материалов. Тру-
ды II Всес. совещания по химии окислов при высоких
температурах, 26-29 ноября 1965 г., опубл, в 1967 г.,
с. ПО
Фиг. 575. Схематические изотермические сечения и
'пространственная диаграмма системы CaO-MgO-MnO
Schench В., F г oh berg M.G., Nunnin£hof( R. Arch.
Eisenhiittenwesen, 1964, 35, 4, 269-^77
154
Фиг. 576, Частное сечение 2СаО •SiCk-SCaCbMgO*
•2SiO2
1 - температуры ликвидуса; 2 - определения с помощью высоко-
температурной рентгенографии; Т - новый магнезиосилйкат кальция;
3 - температура перехода • а-» а -2CaO*SiO9 (оптический метод);
C=CaO; S=SiO2; Н=М«О z
Gutt W. Nature, 1965, 207, 4993, 184
%
Фиг. 578. Псевдобинарный разрез 2СаО« SiO?-2СаО
•MgO*2SiO2
Жирные линии показывают бинарные равновесные отношения;
тонкие линии показывают отношения, лежащие вне плоскости диа-
граммы
Osborn E.F.J. Am.Ceram. Soc., 1943, 26, 10, 328
2000
1800
1600
1400
1200
Юпп' I I I I । । I 1
10 30 50 70 90
CaOMgOSiOj Bec.% ZMgOSW2
Фиг. 577. Диаграмма фазовых отношений для частного
разреза монтичеллит (CaMgSiO4) - форстерит (Mg2SiO4).
Жирные кривые ограничивают области бинарного равно-
весия; в других областях получены тройные отношения
Ricker R.W.tOsborn E.F. J.Am.Ceram.Soc., 1954, 32»
Фиг. 579. Псевдобинарный разрез 3CaO‘MgO‘2SiO2-2CaO'
• MgO‘2SiOn
Жирные лйнии представляют бинарные равновесные отношения;
тонкие линии показывают отношения, лежащие вне плоскости этой
диаграммы
Osborn E.F. J.Am.Ceram. Soc., 1843. 26 10 329
3, 136
155
CaO-MgO-SiO2
Фиг. 580. Фазовая диаграмма для субсолицусного уча-
стка частного разреза Mg2Si20g — CaMgSi20g
Ликвидусная кривая по Bowen N.L. (Am. J.Sci., 4th Ser., 1914,
38. 207-264). R= ромб.
Atlas L.M., J.GeoL, 1952, 60, 288
CaSiOs 20
40 60 80 CaMgSl206
Bee. %
Фиг. 582. Диаграмма равновесия бинарной системы
Са810з (волластонит, псевдоволластонит) -CaMgSi2O^
(диопсид)
Schairer J.F., Bowen N.L. Am.J. Sci., 1942, 240, 10,
730
CaMgSizO6
Фиг. 581. Диаграмма равновесия тройной системы фор-
стерит-диопсид-кремнезем, показывающая отношения
при плавлении пироксенов: диопсида и клиноэнстатита
(MgSiO3). Диаграмма дана по Bowen N.L.(Am.J.Sci.,
1914, 38, 207-264)
Schairer J.F., Bowen N.L. Am. J. Sci., 1942, 240, 10,
729
Фиг. 583. Диаграмма равновесия системы Са5Юз
(волластонит, псевдоволластонит) - Ca2MgSi2O7
(окерманит). При всех температурах отношения не би-
нарны, благодаря неустойчивости окерманита примерно
ниже 1325°.
Schairer J.F., Bowen N.L. Am.J. Sci., 1942, 240. 10, 741
156
Osborn E.F. Am.J. Sci., 1942, 240. 11, 785
Фиг.587. Частная система CaMgSi20g—Mg2$iO4
Bowen N.L. Am.J. Sci., 1914, 38, 225, 212
Mg2SiOM мол. %
Фиг. 585. Фазовые отношения в псевдобинарном сече-
нии Ca2SiO4-Mg2SiO4 тройной системы CaO-MgO-SiO2
Пограничные кривые нанесены условно.
В redig М.А. J. Am. Ceram. Sot., 1950, 33. 6, 190
Фиг. 588. Пересмотренная диаграмма равновесия систе-
мы диопсид (CaMgSi20$) - форстерит (Mg2SiO4)
Kushiro L, Schairer J.F. Camegie Inst. Washington,
Year Book, 62 (1962-63), 1963, p. 98
°C
№20
MO
Я86И9
1380
r -
WW'fofypfyW \
1360
MgSiOf
B91,5
Фиг. 580. Бинарная система СаО-MgO *2SiO^-2CaO-
•MgO*2SiO2
Ferguson J'B., Merwin H.E.Am.J.Sci., 1919, 48. 284,
118
~ ' ...........^v^'***'#'*
. Au(mtpp) 'Пэисрмр-р) <
г ДицпОр-р)
_i___।----i----1---1---
50 70 CaMjSLjOt
CoMgStjOs, Bee. %
Фиг. 589. Пересмотренная диаграмма системы диопсид
(CaMgSi2O^)—энстатит (MgSiO^) в части, богатой диоп-
сидом
Kushiro L, Schairer ].F. Camegie Inst. Washington,
Year Book 62 (1962-63), 1963, p. 98
157
CaO—MgO—SiO2
2Z00[
/ООО F
MOOb
10001
Ж +Mep. *[Jep.
0 To Mg2SiOv To To
Са2$Юц Мол. % СадМд5120в
Фиг. 590. Диаграмма фазового равновесия вдоль соеди-
нительной линии Ca2SiQ|*CaMgSiO4 в системе СаО~
—MgO—SiO?
Т= Са^ yMgQ. 3 SiO4
Schlaudt C.Mt Roy D.M. J. Am. Ceram. Soc., 1966, 49,
8, 431
CflOSi
644
I960'
JCaOZSiO,
ZCaOSiO,
~?uoe r
Фи г. 592. Пересмотренная и построенная Муаном и Ос-
борном диаграмма фазового равновесия CaO—MgO“SiO2»
с учетом литературных данных. Osborn E.F., Muan А.
" Phase Equilibrium Diagrams of Oxide Systems" , Pla —
te 2, publ. American Ceramic Society and the Edward
Orton, Ir., Ceramic Foundation 1960. Использованная ли-
тература:
A.L.Day, E.S. Shepherd and F.E. Wright, Am. J. Sci.
(4th Series), 22» 265—302 (1906).
J.H.Welch and W. Gutt, J. Am. Ceram. Soc., 11-15
(1959).
F .Troland K.Konopicky, Radex Rundschau, 4, 161-62
X.L.Bowen and Olaf Andersen, Am. J. Sci. (4th Series),
J7, 487-500 (1914).
N.L.Bowen, Am. J. Sci. (4th Series), 38, 207-64 (1914).
CQ.JSLO5
00
«ППНГ /
отношения co-
*00
Фиг. 591. Пересмотренные солидусные
существующих фаз в части, богатой известью, в систе-
ме
CaO-MgO-SiOj
1 - максимальные пределы твердых растворов
Schlaudt С.М., Roy D.M. J.Am. Ceram. Soc., 1966, 49,
432
8,
SUb
JCaOSiO
Фо
JoONgO-StOj
UMecmth
CaO
-2570*
2MgOSiOi
1900'
1660е
Ю.
J.B. Ferguson and H.E. Merwin, Am. J. Sci. (4th Series),
4§, 81-123 (1919).
J.W. Creig, Am. J. Sci. (5th Series), 13. 1-44; 133-54
(1927).
J.F. Schairer and N.L. Bowen, Am. J. Sci., 240. 725-42
(1942).
E.F. Osborn, Am. J. Sci.,240, 751-88 (1942).
E.F. Osborn, J.Am. Ceram. Soc.,.26, 321-32 (1943).
R.W. Ricker and E.F. Osborn, J.Am. Ceram. Soc. 37,
133-39 (1954).
F.R. Boyd and J.F. Schairer, Carnegie Inst. Wash. Year
Book, §6, 223-25 (1957).
Диаграмма взята из:
Levin E.M°, Robbins C.R., McMurdie H F. Phase
Diagrams for Ceramists, 1964, p. 210
158
CaO-MnO-SiO2
Фиг. 593. Диаграмма фазового равновесия для систе-
мы Ca2SiO4—Mn2$iO4
Бинарные отношения показаны более толстыми сплошными ли-
ниями, небинарные отношения - более тонкими сплошными линия-
ми. Штриховые линии указывают, что отношения определены при-
близительно. Вертикальная пунктирная линия определяет состав
глаукохроита
Glasser F.P., Am. J. Sci., 1961, 259, 1_, 51
Co.0 Вес. MnO
Фиг. 596. Поверхность ликвидуса, показывающая поля
первичных фаз и составы изученных смесей (черные
точки)
1 - граница области 2 - две жидкости
Glasser F.P., J.Am.Ceram. Soc., 1962. 45. 5, 245
°C
900’
AMn.Silh,
о
735е -
700 -
7С(цВ10ч (mA р-р)
500-
°л'щ№^(т8.р-р) / °
*уЩиЬ&р-рр/
/ о
/ ^CatStO4 (тАр-р)
✓ * MngSiOa, (т&р-р)
о о
Мпг$Юч
(mlp-p)
cojSioh ю го зо
Вес. %> Мп2810ц
40
иг. 594. Субсолидусные отношения между CaoSiCL и
In_SiO 4 4
2 GtesserF.P. Am. J. Sci.. 1961. 259. 1. 57 .
Фиг. 597. Поверхность ликвидуса, показывающая изо-
термы.
Glasser F.P. J.Am. Ceram. Soc.,1962, 45. 5, 245
Фиг. 595. Диаграмма фазового равновесия для частно-
го разреза CaSiOj—MnSiO^
Небинарные отношения показаны тонкими линиями. Пунктирные
линии указывают приблизительное положение фазовых пограничных
кривых. На фиг. не показан состав иоганнсенита, CaMiKSiO,^»
диопсидоподобной фазы, которая не стабильна по отношению к вол-
ластонитовому твердому раствору, в пределах показанных темпера-
тур. Температуры: АВ • 1270°,С= 1265°»_ДЕ « 1270°
Glasser F.P. J.Am. Ceram. Soc., 1862, 4g, 5, 244
159
CaO- MnO-WO3
Фвг. 588. Фазовые отношения в системе CaWO^-MnWO^
Chang Lute L.P. Аш. Min.. 1967. 52. 3-4, 428
Фиг. 600. Часть фазовой диаграммы состояния ЗСаО-
• Р2О5 -2CaO»SiO2 -CaO-SiO2
Barak Wojciechovska J. Roczniki Cheroii, 1856, 30,
3, 759
CaO-Na ,0- W0o
— о
Фиг. 599. Диаграмма плавкости системы Na2WO4-CaWO4
Кисляков И.П,t Смирнова И Л. Изв. АН СССР, не-
орг. матер., 1968, 4, 6, 1001
ЗСа0 Р205 бес,%
20 40 60 80
CaOSio2 ___ ЗСаОР2О5
* ОСС.
Фиг. 601. Частное сечение CaO*SiO2-ЗСаО*Р2О5 в
системе CaO-P2O5-SiO2
W ojciechowaka J,, Berak J. Trzebiatowski Ж. Rocz—
niki Chemii, 1956, 30, 3» 750
160
Фиг. 602. Часть фазовой диаграммы, ЗСаО«Р2О5-СаО«
•SiO2-SiO2 системы CaO-SiO2-P2 05
Wojciechowska J., Berak J,, Tnebiatowski Ж.
Roczniki Chemii, 1956, 30. 3, 751
CaO - Si02- Ti02
Фиг. 604. Предполагаемая фазовая диаграмма равнове-
сия системы CaO-SiO2—TiO2
Жирные пунктирные линии указывают границы области существова-
ния двух жидкостей; Ас^ 1670 ; В - I8600; £<z\ 1670°; 0- 1000°;
Е - 1403°; F - 1388°; G - 1425°; Н - 1348 ; I - 1363°; J - 1318°:
К - 1373°; L - 1365°; М - 1470 ; N-N* - 1535°; О - 1375°;
Р - 1365°; Q - 1375°. Точки Он Q даны по Fukusima М., (Kinzo—
ku Kenkyu, Tokyo, 11,428-40,377-85,590-600 (1834)
DeVries R.C., Roy R., Osborn E.F. J. Am. Ceram. Soc.,
1955, 38. 5, 161
Фиг. 603. Фазовые отношения в системе CaWO4-PbWO4
Chang Luke L.Y.Am. Min., 1967, 52. 3-4, 431
Фиг. 605. Диаграмма фазового равновесия для системы
CaSiO^—СаТЮ^
DeVries R.C., Roy R.t Osborn E.F. J. Am. Ceram. Soc.,
1955, 38, 5, 162
« 21
161
CaO - SiO2 - ZnO
DeVries R.C., Roy R., Osborn E.F. J. Am. Ceram.
Soc., 1055, 5, 162
^e^mr Е.Л. J. Am. Ceram. Soc., 1954. 37.
Бережной A.C, Огнеупоры, 1950, №10, 447
Фиг. 609. Диаграмма плавкости системы CaO—Z1O2-
-SiO2
Эвтектики: Э. - 1455°; Эо - 1486°; Эо - 1675°; Эл - 2300°:
1 z о 4
Э_ - 2270°; ЭА - 2066°; Э_ - 1400-1420°
5 п /
Бережной А.С., Кор дюк Р.А. Огиеупоры, 1062, № 2, 86
162
Фиг. 610. Диаграмма состояния системы SiC^—СаО-
•Si02—Z1O2, построенная по фазовым диаграммам би-
нарных сечений (тонкие линии) внутри системы
Штриховая кривая показывает область двух жидкостей.
А - 1462+ 5°С; В - 1460 + 5°С; С - 1450+ 5°С; D - 1550 + 5°С;
Е - 1440 + 5°С; F - 1430 + 5°С; G - 1425 + 5°Cj Н - 1570+ 5°С;
1 - 1465 + 5°С; J - 1645+5°С; К - 1590 + 5°С; L - I860 + 5°С;
М -1662 + 5°С; N - 1662 + 5 С; 0 - 1662 + 5°С; Р - 1667 + 5 С
Qureshi М.Н., Brett N.H, Trans. British Ceram.
Soc., 1968, 67, 6, 211
Фиг. 612. Треугольники составов в системе CaO-Zri^-
—8Ю2»отражаюшие фазовые равновесия в пределах
1500-2000°С
Qureshi М.Н., Brett N.H. Trans. British Ceram.
Soc., 1968, 67, 6, 219
Фиг. 611. Диаграмма состояния системы СаО-2СаО«
•Si02-Zi02» построенная по бинарным сечениям (тон-
кие линии)
1 - 2000+25°С; 2 - 1975 + 25°С; 3 - 1925+ 25°С; 4 - 2025 +
+ 25 С; 5 - 1960+25 С; 6 - 2050 + 25 С; 7 - 20В0+ 25°С; 8 - 2070 +
t,25°C "
Qureshi М.Н., Brett N^H. Trans. British Ceram.
Soc., 1968, 67, 6, 216
613- Диаграмма состояния системы CaO-SiO -
—Z1O2 . 2
A - 1667 + 5°Cj В - 1850+ 5°Cj C- 1450+5°C; D - 1425+ 5°C*
E - 1465+5°C; T - 1460 + 5°C; F - 1510+ 5°C;G - 1635+ 500 ’
H - 1455 + 5°C; I - 1445 + 5°C; J - 1975 + 25°C; К - 1960"+ 25°C
L - 2025 + 25 С; M - 1925+^°C; N - 1975 + 25°C; P - 2O70 + 25bC-
0 - 2050 + 2SOC» Q - 1464 + 5 C; R - 1460 + 5°C; S - 1436 + 5°C
Qurrshi M.H., Brett N.H’. Trans. British Ceram.
Soc., 1968, 67. 6, 218
163
CaO-SiO2- ZrO2
Silfe
/7/5*
CaO - SrO - W03
°C
1000
CoO’ZrOfc
Фиг. 614. Диаграмма состояния системы CaO-SiC^-
-ZiO2
Matsumoto Kuniharu, Sawamoto Tsuneo, Koide Shigeaki.
Asahi Garasu Kenkyu Hokoku, 1954,^,2,8
Фиг. в1в. Фазовые пре-
вращения в системе
Ca3WO6-Sr3WO6
1 - кубический твердый раст-
вор; 2 - некубический твердый
1200
1000
раствор; 3 - температуры пръвра-дпп _
щения, определенные ДТА
Chant L.L.Y., Phillips В.
J. Am. Ceram. Soc., 1Я87
50, 8, 435
600
000 -
• 1
о 2
О J
80 Sr3W0G
CttjWOg
чо
Мал. %
CaO - SnO 2 - TiO 2
CaO -U02- ZrO2
Ti02
CgS OS bnllg
Фиг. 615. Теоретически выведенные области твердых
растворов в системе оСаО—SnO2—TiO2, в пределах
температур 1300-1550 С
1 - однофазная область; 2 - двухфазная область; 3 - трехфаэная
область
Coughanour L.W,, Roth R,S., Marzullo S.,Sennett F.E.
U.S. Nation. Bur. Stand. J. Research, 1955, 54, 3, 155
Фиг. 617. Границы твердого раствора флюоритового
типа, для системы UjOg-ZrC^-CaO. Смеси обжига-
лись в водороде при 1750 С, 6 час. и охлаждались в
печи. Заштрихованная область—тв.р—ры флюоритового
типа
Handwerk J.H,, White G»D* Hill D.C», J. Am. Ceram.
Soc., 1963, _46, 1, 31
Ш
Сг2О3 - Cu2O - CuO
Фиг. 618. Границы твердых растворов, типа флюорита,
для системы U^CL-ZrOj-CaO. Смеси обжигались
на воздухе при 1450°С, 6 час; охлаждались в печи
Handwerk J.H.,White G.D., Hitt D.C. J. Am. Ceram.
Soc., 1963, 46. 1, 31
1500
1300
1100
900
Ci-zOj и СцгО*Сгг03
Сгг0з а ЦцО- Сгг03
Iff
Сиг0*Сгг0,
Co0-Fe304 -SiO2
И.
I CuO*Cr^O3
и -Цг°
Сиг0-Сг203 и CuO
1130
1026
Сгг0з 20
; ; ~оду
/ СиО-Сг^Оз и СиО
-J---1£-1--1---. .
40 60 80 СиО*^СигР
Фиг. 620. Квазибинарное изобарическое сечение тройной
системы при давлении кислорода в 0,2 атм (верхняя
диаграмма) и при 1,0 атм (нижняя диаграмма); (в
моль. %).
Gadalla А.М.М., White J. Trans. British Ceram.
Soc., 1964, 63, 10, 548
Cr,O_ - FeO - Fe,O„
АО A О
Фиг. 619. Поверхность ликвидуса в системе окись ко-
Фиг. 621. Диаграмма показывает равновесные отноше-
ния между полутораокисыо и шпинельными фазами.
Штриховые линии определяют пути диссоциации; сплошные линии
являются соединительными линиями.
Richards R.G., White Trans. British Ceram.
Soc., 1054, 63, 7, 430
бальта - окись железа - кремнезем на воздухе
Штриховые линии указывают на неопределенность
Masse D.P., Миап A. J. Am. Ceram. Soc., 1965, 48» 9,
468
165
Cr2°3-FeO“Fe2O3
•fl-----------
230fk о 1
Фиг. 622. Диаграмма фазовых отношений в системе
окисел железа-СГ2О3 на воздухе. Для простоты показана
диаграмма системы в виде проекции на плоскость
Fe2O3-Cr2O3
1 - полутораокись, тв. р-р; 2 - полутораокись, тв. р-р + шпи-
нель, тв. р-р; 3 - шпинель, тв. р-р + жидкость; 4 - жидкость;
5 - полутораокись, тв. р-р + жидкость. В нижней части показана
тройная диаграмма, отображающая приблизительные составы кон-
денсированных фаз. Составы полутораокионых твердых растворов
представлены соединительной линией Fe^Oj-C^O^; составы шпи-
нельных твердых растворов - штриховой линией а-b и составы жид-
кости - штриховой кривой с— d—Сг2<->3
Миап A., Somiya Sh. J. Am. Ceram. Soc., 1960, 43,
4, 207
СГ2^3 Fe2^3 MgO фиг. Q24, Температуры плав-
ления шпинелей в системе
М gO* М gO*C Г2 о3
El—Shahat R.M., White J, Trans.
British. Ceram.Soc., 1966, 65. 9,
497-519
Фиг. 623. Графическое представление равновесия,
полученного для смесей, расположенных внутри треу-
гольника FeO—Ре20з—С12О3 при 1300 С.
Обозначения, соответствующие различным давлениям кислорода:
1 - 20-Ю-2; 2 - 70-Ю-3; 3 - ЗТ-Ю-4; 4 - 21-Ю-7; S - 63-Ю-9;
6 - 12-Ю"9 7 - 10-’10"10; 8 - 21-10"11; 0 - 15-10-11
Katsura Takashi, Миап A. Trans. Met. Soc. AIME,
1964,222» h 80
Фиг. 625. Диаграмма равновесия системы Mg0~Cr90q-
НРИ 1300°C на воздухе
1 - твердый раствор; 2 - соединительные линии; цифрами пока-
заны значения параметров элементарной ячейки
Ulmer G.C., Smothers W.J. J. Am. Ceram. Soc., 1968,
51, 6, 316
166
Сг2О3 ~ ^е304 -SiO2
Фиг. 628. Фазовая диаграмма системы Сг2O3~MgO~S i 02
Штриховые линии - изотермы (выше 1850°С их положение пред-
полагается или взято из литературных данных). Оттененные линии
показывают границы области 2 жидкостей
Keith M.L. J. Am. Ceram. Soc., 1954, 21, 10, 491
Фиг. 626., Система окисел
железа - Cr2O3-SiO2 на
воздухе
Штриховой пунктир, оттененный
с одной стороны, ограничивает об-
ласть двух жидких фаз. Пунктир-
ными линиями показаны отношения
в части системы, в кото}юй экспе-
риментальные данные недостаточ-
ны или отсутствуют. Ниже дает-
ся в увеличенном виде часть
диаграммы, прилегающая к углу
SiC>2
Миап A.,Somiya Sh. J. Am.
Ceram. Soc., 1960, 43, 10,
533
Cr2O3-Mg°-SiO2
C^Og-MgO-ZrOj
Фиг. 627. Диаграмма состояния системы MgO-C^Qj”
"Si02
Лю двинский А,И, Научные труды Днепропетровско-
го металлургического института. Вопросы черной ме-
таллургии, 1958, 36, 82
Фиг. 629. Диаграмма проекции поверхности ликвидуса
Эниилейн РЛСальдау ПЛ. Зап. Ленинградского
горн, ин-та, 1956, 32. 3, 301
167
Cf2O3 - NiO - ZrO2
Фиг. 630. Фазовый состав продуктов нагревания ге*-
лей в системе Ni O-Cr2O3“ZrO2 при Э00 С (по
рентгенографическим данным)
Milligan W.O., Watt L, Merten. J. Phys. Colloid Chem.,
1948, .52,1, 232
CrO3 - K20 - Na2O
Фиг. 632. Диаграмма состояния системы РЬСгО 4~РЬМо04
Jaeger F.M., Germs H.C. Z.s. anorg. allgem. Chem., 1921,
119, 2, 169
Фиг. 631. Диаграмма
-К2СгО4
состояния системы Na2CrO4-
CrO3_ PbO - wo3
Jaeger F.M., Germs H.C. Zs. anorg. allgem.Chem.
1921, 119. 2, 171
Amadori М, Atti reale institute VenetoSci.,
1913, 72. 11, 921
168
Cu 20 - CuO - MgO
Фиг. 634. Квазибинарные изобарические сечения че-
рез тройную систему при давлении кислорода 0,21 атм
(верхняя диаграмма) и давлении кислорода 1,0 атм
(нижняя диаграмма)
Г- промежуточная фаза - гю г генит
Gadalla А.М.М., White J. Trans. British Ceram.
Soc., 1964, £2, 3, 132
Cu2O - CuO - SiO2
•c
CltO Si02
Фиг. 635. Изобарические сечения через тройную систе-
му CuO-*Cu2O*-SiO2 при давлении кислорода в 0,21,
0,5 и 1,0 атм (в вес. %)
Gadalla А.М.М., Ford W.F., White J. Trans. British.
Ceram. Soc., 1963, 62. 1, 65
Фиг.636. Изобарическая фазовая диаграмма системы
CuO ~С Si02
0,5 атм (в вес. %)
при парциальном давлении кислорода
Пути диссоциации показаны тонкими непрерывными линиями;
изотермы составов - непрерывными линиями, с указанными вдоль
них температурами; изобара ликвидуса показана штрих - пинией
Gadalla А.М.М., Ford W.F., White J, Trans. British Ceram.
Soc.,1963, 62. 1, 62
Фиг. 637. Изобарическое сечение фазовой диаграммы
системы CuO~Cu2O““TiO2 при 1,0 атм кислорода
А — система Cu0~l/2 Cu-0~Ti0?; Б - псевдобинарная систе-
ма 1/2Си2О“ТЮ2 (в мол. %;
Gadalla А.М.М., White J. TransBritish Ceram. Soc.,
1966, 65, 3, 162
22
169
FeO - Fe2O3 -JtfgO
CuO
20 90 r60 80
[eC] Cu20, %
fOOO- К
Ж. и TiOz(/7rfpp){
%cu2o
[6]
M и Cu20
1OOO?T
-Ku CuO
960-
лиге]
I
CuO и 1\Лг(тО.р-р.)\
920 -
CuO
//2 Сиг0
90 00 ТЮ2
TiO2,%
Фиг, 638. Изобарическое сечение фазовой диаграммы
системы CuO^Ci^O—ТЮ2 на воздухе
А - система СцО—— Ci^O-TiOj; Б - псевдобинарная система
Ci^O-TK^b мол. %)
Gadalla A.M.M,, White J. Trans. British Ceram. Soc.,
1966,^,3,160
FeO - Fe2O3 - Gd2O3
Фиг. 640. Система MgO—FeO-Fe2O3 при 1300°C.
Жирные линии - фазовые границы; тонкие-изобары кислорода;
штриховые линии-изобары кислорода, с приблизительными значениями.
Составы твердого раствора магнеэиовюстита в равновесии с метал-
лическим железом, взяты по Hahn W.C., Ir., Muan A. (Trans. AIN1E,
224Д31, 116-20 (1962) )
Speidel D.H. J. Am. Ceram. Sex:., 1967, 50. 5, 245
Фиг. 641. Область феррита в системе MgO~TeO“
Ч'е^прн 1300°С.
Жирные линии - границы фаз; тонкие - изобары кислорода;
штриховые линии - изобары кислорода, с приблизительными значе-
Speidel D.H., J. Am. Ceram. Soc., 1967, JjO, 5, 245
Фиг. 639. Фазовые отношения в системе
~GdFeO3 на воздухе. Нижняя часть - псевдобинарная
система окись железа - GdFeO3; верхняя часть фи-
гуры - часть тройной системы: f^O^Fei jO2-GdFeO3
Тонкая прямая пиния со стрелкой - реакционная линия кислоро-
да (показывает отклонения в составах при потере кислорода). Пунк-
тирная линия дает тройные составы жидкостей; область, оконтурен-
ная штриховой линией и прилегающая к стороне 5O2
включает гранатовую и магнетитовую фазы
Van Hook H.J. J.Am. Ceram. Soc., 1902, 45. 8, 370
170
™ в*. % Fe’°'
Фиг. 642. Система MgO-FeO-Feot^ . при 1160°С.
Диаграмма построена по данным Katsura Takashi и
Фиг. 644. Фазовые отношения в системе FeO-Fe2Oj-
-MgO. Для удобства компоненты представлены в виде
FeO, РеОз/2и '^8^
Жирные линии, сплошные, - пограничные кривые; жирные штри-
ховые линии относятся к шпинельной фазе; тонкие штриховые линии -
изобары, с указанными значениями (-log Р). Шп - окисел, со струк-
турой шпинели; О - окисел, со структурой NaCI
Katsura Takashi, Kimura Shigeyuki. Bull. Chem.
Soc., Japan, 1965, £8, 10, 1666
Kimura Shigeyuki (Bull. Chem. Soc. Japan, 1965, & 10,
1664-1670; пересчет мол.% в вес.%)
Жирные линии - фазовые границы; тонкие - изобары кислорода;
штриховые линии - изобары кислорода с приблизительным значени-
ем. Пограничная кривая: магнезиоферрит-магнезиоферрит + гема-
тит - дана приблизительно
Speidel D.H. J. Am. Ceram. Soc., 1967, 50. 5, 246
Фиг. 643. Фазовые отношения при 1400°С. Точки соста-
вов приведены по Brynestad J.h Flood H.(Z.Electrochem.,
1958, ^2, 9, 953 - 58)
Жирные сплошные линии - пограничные кривые; тонкие линии -
изобары; цифрами указана летучесть кислорода (fan). Наблюдаемый
состав магнезиовюстита при (точка 0), отличается
от состава, предсказанного в настоящей работе (точка Р), А -
стабильный состав магнезиоферрита при fo2 10
Speidel D.H. J. Am.Ceram.Soc., 1967, 50, 5, 247
MgO
Фиг. 645. Схема изотермического разреза системы
MgO-FeO - F?03
Олейников Н.1:., Саксонов Ю.Г., Третьяков Ю.Д.
Изв. АН СССР, неорг.матер., 1966, 2, I, 246
171
FcO-Fe2O3-MgO
FezDj, молу»
Фиг. 646. Изотермический разрез системы MgO-FeO-Fe2O3
при 1400°С; изобары: I -Ро^= 10 атм, 2 - Ро^ -
_2
2.10 атм, з _ ро = 0,21 атм, 4 - Ро2 = 0,66 атм,
5 - Ро2 = 1атм 2
Олейников HJL, Саксонов ЮД\, Третъяков Ю.Д.
Изв. АН СССР, неорг.матер., 1965, 1>2, 249
Фиг. 648. Квазибинарная си-
стема MgO- Fe2O3(FeO].
Штриховыми линиями пока-
заны границы по Phillips В.,
Somija Sh.,Muan A., J.Am. Ce-
ram. Soc., 1961, £4, p.167) в
местах, где они отличаются
от границ, выявленных в на-
стоящей работе
Willshee J.С.,White ]. Trans.
British Ceram.Soc., 1967, 66,
11, 551
Фиг. 647. Изобарическое сечение тройной фазовой диаг-
раммы системы MgO - FeO -F2O3 на воздухе при
температуре до 1750°С
Willshee J.C., White J., Trans. British Ceram. Soc.,
1967, 66, 11, 548
Фиг. 649. Фазовые отношения в системе при темпера-
турах до 1650 С.
Пути диссоциации показаны штриховыми линиями. Жирные линии-гра-
KHI1|i'oodhoose D., White J. Trans. British Ceram. Soc.,
1955, 54,6, 365
172
Фиг. 650. Изотермические сечения, отражающие фазовые
отношения при 1400, 1500, 1600, 1700 и 1800°С в системе
MgO—FeO—Fe ^0^
Пунктирные линии - изобары кислорода. Точки представляют сос-
тавы смесей, изученных в лэ стоящем исследовании; другие символы
обозначают фазы, наблюдавшиеся в этих смесях после равновесия.
Пересечение воздушных изобар взято по: B.G.Richards и J .White
(Trans.British Ceram. Soc., 1954, 53, 7, 422-59) и Woodhouse D. и
White J.(Trans. Brit. Ceram. Soc.,t 1955, 54. 6, 333-66) и представ-
ляет составы, определенные термогравиметрически. Другие изобары
кислорода показаны Brynesiad J. u Flood Н. (Zs. Elektrochem.,1958,62,
9, 953-58)
Phillips В., Миап 4. J. Am. Ceram. Soc., 1962, 45, 12, 590
MgO
1697* У0 60 80 Вес. %
F80 (Яершпект) Fe3O4 Fez03
16Я* 1870* 1730*-Ц2ат0г
Фиг. 652. Фазовые поля в системе MgO-FeO -F2O3 .
Заштрихованы области твердых растворов, часть из ко-
торых распадается при охлаждении:
I - твердые растворы (Mg,Fe)Fe?O4 в (Mg, Fe)O;
II - твердые растворы Fe3O4 в (Mg.Fe) Fe2O4; III - Fe2O3
Бережной АКСЧ Кор дюк Р,А, Сборник научных трудов,
Украинского НИИОгнеупоров, 1962, 53.6.69
Вес. %
Фиг. 653. Система MnO - FeO - Ре20з при 1600°С
Gurry Я.Ж., Darken L.S. J. Am. Chem. Soc., 1950, 72,9, 390
I
Фиг. 651. Диаграмма, приблизительно показывающая по-
верхности ликвидуса в системе MgO -FeO -Рв20з * по-
строенная по данным настоящего исследования и литера-
турным данным ( Phillips В., Muan A., J.Phys. Chem.,
1960, 64. р. 1451-53). Участок в углу FeO, отмечен-
ный точками, определяет область экстремальных соста-
вов, где присутствуют две несмешивающиеся жидкости
(металл и окисел)
Phillips B.t Миап A. J. Am. Ceram. Soc., 1962, 12, 591
173
-ре,О4(Фаялит_магнвтит)'
OcapoecK»i И.А., Ольшанский ЯЛ. ДАН СССР, 195в,
107, в, 882
FeO—Fe 0„—TiO,
£ о »
Фиг. 656. Штриховые линии связывают точки составов об-
разцов, нагретых в газе заданного состава (фиксировано
давление кислорода).
Значения давления кислорода приводятся на каждой изобаре, в
виде log -давления кислорода (в атм). Положение фазовых границ
(сплошные линии) выведено по изломам кривых на изобарических
линиях. 1 - воздух; 2 - кислород.
Taylor R.W. Am. Min.,1964, £9, 7-8, 1021
Фиг. 655. Диаграмма состояния системы FeO - SiO2 -
-Fe2O3
Muan A. J; Metals, 1955, 7; Trans. Am. Inst. Mining Met.
Engrs., 1955, 203, 972
Т10г
Bee. %
Фиг. 657. Фазы в системе FeO - Fe2O3- TiO2 при
1300° C o
Область вюстита при 1300 указана скобками на линии FeO -
-Fe2O3
Taylor R.W.Am. Min., *864. 49- 7-8, 1026
174
FeO — Fe2O3 — TiO2
Фиг. 858. Фазовые отношения для частного разреза
окись железа - Т/О2 на воздухе.
Верхняя часть фигуры - псевдобинарный разрез, нижняя-диаграм-
ма состояния системы FeO -Ре20з - Т1О2 • Сплошная кривая
abcde изображает составы жидкостей вдоль ликвидусной поверхнос-
ти на пряду хе. Кристаллические фазы имеют составы, приблизитель-
но изображенные на части разрезов FeO.Fe2Oj - 2FeO.TiO2;
Fe20j-FeO.TiO2 и F^OyTiOz-FeO^TiC^.Черные кружочки - составы
жидкостей по химическим анализам. Тонкие сплошные и пунктирные
линии показывают гримерное положение линий, соединяющих точки
составов жидко/, и кристаллической фаз, сосуществующих на воздухе.
MacChesney Миап A. Am.Min., 1959, 44, 9, 938
Фиг. 659. Возможная форма поверхности сольвуса в сис-
теме Fe2TiO4 -РезО4 (измененная после Vincent Е.А.,
Wrigh J.В., Chevaliier R., Mathieu S., Min. Mag., 1957, 31* p.624
В a ata E. N. Jb. Min. Abhandl, 1960, ££, 2, 4017-1048
Фиг* 660* Приблизительные температуры ликвидуса (С°)
в системе FeO-FcgCh- ТЮ2
Жирная пунктирная линия, оттененная точками в поле железа,
показывает границы области двух жидкостей (жидкий окисел и жид-
кий металл).
Taytor R.W. J. Am. Ceram. Soc., 1963, 46, 6, 278
FeO -Fe2O3 _ Y203
Фиг. 661. Система Ре2О3-¥РеОз иа воздухе
Nietaen J.W., Dearborn E.F. Phys. a. Chem. So-
lids, 1958, 3, 202
175
Фиг. 662. Фазовые отношения в системе РеО-Ре2Оз-УРеОз
в атмосфере воздуха.
Верхняя диаграмма показывает тройные составы жидкостей (пун-
ктир тире-две точки) и кристаллические гранатовую и магнетито-
вую фазы (участки, заполненные точками). Тонкие линии, заканчи-
вающиеся стрелками, являются линиями реакции с кислородом.
Van Hook H.J. J. Am. Ceram. Soc., 1962, 45, 4, 163
Фиг. 664. Фазовые отношения в системе FeO—РезОз—
—УГеОз в атмосфере COg. Сечение некточно изобариче-
ское. Обозначения, как на фиг. 662, 663
Van Hook H.J. J.Am. Ceram. Soc., 1962, 45, 4, 164
Фиг. 663. Фазовые отношения в системе FeO—Fe90o —
УРеОз® атмосфере кислорода.
Кислородные изобары (пунктир тире-две точки) дают составы
жидкостей, а линии, заканчивающиеся стрелками^ являются линия-
ми реакции с кислородом.
Van Hook H.J. J. Am. Ceram. Soc., 1962, 45 , 4, 163
Фиг. 665. Диаграмма, суммирующая отношения в систе-
ме ЕеО-РегОз -УЕеОз на основании трех изобарических
сечений
Пунктирные линии (тире-две точки) показывают пересечение
изобар с поверхностью ликвидуса. Точки U и V являются эвтекти-
ческой и перитектической, соответственно.
Van Hook H.J. J. Am. Ceram. Soc., 1962, 45 , 4, 164
176
FeO- MgO- SiO2
Фиг. 666. Частное сечение системы I^O^SiC^ —FeO—SiC>2
Штриховые линии - линии равного содержания Ре20зв образцах,
закаленных от температур ликвидуса; точечные линии - прибли-
зительные изофракты
Roedder Е. Am. J. Sci., 1952, Bowen Vol., 1952, pt 2,
p.443
5t Oj
MgO 20 00 SO 80 FeO
Bee. %
Фиг. 668. Диаграмма равновесия системы MgO-FeO-
—Si02« (Небольшое количество РегОз присутствует во
всех жидкостях)
Bowen N.L., Schairer J.F. Am. J. Sci., 1935, 29, 170,159
FeO — MgO — MnO
Фиг. 667. Диаграмма состояния системы закись мар-
ганца - закись железа - окись магния и схематиче-
ские изотермические сечения *
SchenchH., F г oh berg M.G. Nunn in gh off. Arch. EisenhOt-
tenwesen, 1964, 35, 4, 269—277
Фиг. 669. Диаграмма равновесия системы MgO-FeO-
SiO2, с изотермами
Bowen N.L., Schairer J.F. Am. J. Sci., 1935. 29, 170,160
23
177
Фиг. 670. Диаграмма равновесия системы Mg2SiO4-
—Fe jSiO4
Bowen N.L., Schairer J.F. Am. J. Sci., 1935, 29, 170, 163
Фиг. 671. Диаграмма равновесия системы MgSiOo—
*FeSiO3
Жирные линии относятся к бинарному равновесию, тонкие - к
Bowen N.L., Schairer J.F. J .Am.Sci., 1935, 29, 170,165
FeO - MnO -SiO2
178
FeO-MnO-SiO2
5i0j
Фиг. 677. А. Частная система 2FeO*SiO2 — 2MnO*SiO2.
Б. Частная система "FeO»SiO2" -MnO«SiO2
FeO 80 60 40 20 MnO
Фиг. 673. Изотермы в системе FeO—SiO^MnO
Haddocks W.R. Iron, a Steel Inst. Carnegie Scholarship
memoirs, 1935, 24, p. 61
Фиг. 674. Твердые растворы в системе 2FeO*SiO2—
—2MnO*SiO2
Carter P.T., Murad A.B., Hay R. J. West Scotland Iron
a. Steel Inst., 1953, 60, 450, 123-133
White.J. J.Iron. Steel Inst.(London ), 1943, 148, 2, 586
Фиг. 678. Диаграмма фазовых отношений в системе
FeO*SiO? -MnO’SiO9
Riboud Р. V., Миап A. Trans. Met.Soc. AIME, 1962, 224,
1, 28
Фиг. 679. Температуры ликвидуса и солидуса для сме-
сей, составы которых расположены вдоль пограничной
кривой между областями первичных фаз: оливина и ро-
донита - в системе FeO-MnO-SiO2
Riboud P.V., Миап A. Trans. Met.Soc.AIME, 1962, 224.
1, 30
Фиг. 675. Одна из возможных диаграмм системы
2FeO«SiO2-2MnO SiO2
Carter Р.Т., Murad А.В,, Hay R., J.West.Scotland Iron. a.
Steel Inst., 1953, 60, 450, 123-133
Фиг. 676. Поверхность ликвидуса в системе FeO-
-2FeO-SiO2-2MnO«SiO2-MnO
Carter Р.Т., Murad А.В., Hay R. J.West Scotland Iron,
a. Steel Inst., 1953, 60. 450, 123-33
179
Фиг. 680. Проекция поверхности ликвидуса в части
системы FeO—MnO—S1O2 в атмосфере СО2/Н2 s
Riboud P.V. Миап A. Trans. Met. Soc.,AIME, 1962, 224,
1, 30
310г
Фиг.. 681. Соединительные линии, показывающие отно-
шения жидкой и кристаллической фаз, сосуществующих в
равновесии в системе FeO-MnO-SiO?
Riboud P.V., Миап A. Trans. Met. Soc. AIMЕ,1962, 224, 1,
31
SiOz
MnO
Si02
1180°C
MnOSiOz
0Л
MB* Ox
MnO
Тр*Роо
Тр*0л*Р
Род*Ол
Тр*Ж
FeOSiOt
Ж
2FeOSiO2
iff1/
FeO
SiO,
1W*
MnOSiO?
Тр*Ж
MnOSiO?
MnO
Feo
0л*М8*Ж
MB* On
Тр*РоВ
Tp*M
Род* On
0л*Ж
FeOSiOz
Ж
ZFeO-SiOz
MnO-SiOz
ж
Feo
Si02
1240'C
FeOSiOz
ZFeOSi
Тр* Ж
Род*Ж
Тр*Род*Ж
Тр*Ро8
Род*Ол
( 0л*М6
МО^Ж }^0л+М0*Ж
Feo мпо Feo
Фиг. 682. Изотермические сечения, показывающие фазовые отношения при 1170, 1180, 1185,
1240, 1270 и 1300 С в системе FeO—MnO—SiC^B атмосфере, состоящей из равных количеств
(4^2 и Н?
Штриховыми линиями указаны возможные фазовые отношения, не изученные в настоящем исследовании
Riboud P.VМиап A. Trans.Met.Soc.AIME, 1962, 224, 1, 32
Mn0-5i0z
MnOSiOz
ZFeOSi
1270eC
Tp*PoB
MnOSiOt
FeOSiOt
Род* Ж
ж
0л*МВ*Ж
мв*ж
Тр*Ж
Тр*Род*Ж
FeOSiOt
ZFeOSi
MnOSiOz
5i0i
1300*0
MnOSIOj
гмпо-щ
Тр*Ж
ж
on* ж
--------~0Л*М8*Ж
Мд* Ж
MnO
\±~0л*М8
МпО Feo
180
FeO—SiO -ZnO
FeO-MnO-TiO2
TiO, U*uiei600'C)
1370'c Bee. % 17854
Фиг. 683. Поверхность ликвидуса в системе MnO-
-FeO-TiO2
Grieve J., White J., J. Royal Technical College. 1940,
4Д, 665
Фиг. 685. Фазовая диаграмма системы ZnnSiOx-
-Fe2SiO4 2 4
Добро цвело в Б,Л., Богословская Е Л ,,Собелъман ЕЛ,
ДАН СССР, 1964, 158, 1, 191
Фиг. 686. Диаграмма состояния псевдоравновесной
системы FeO-ZnO-SiO2
Области: А - фаялит, тридимит и магнетит, Б - фаялит, вилле-
мит, тридимит и магнетит, В - виллемит и магнетит, Г - фаялит и
магнетит. Тройное соединение типа xFeO«ySiO2’nZnO
Чижиков Д.М., Г у ля ни цк ая 3,Ф,, Счастливый В,П,,
Петрова РЛ,, Блохина ЛЛ,,. Дейне к а С.С. Сб. 'Физ,
химия распл, солей и шлаков', М., Металлургиздат,
1962, с.433
Фиг. 684. Распределение фаз в системе MnO-FeO-
TiO2
Grieve J., White J,J, Royal Technical College, 1940,
4,4, 665
181
Fe3O4-Mn3O4-SiO2
Fe2°4-K20-Si02
z з z &
0 2 4 6 8 10 12 14 16 18 20 22 24 26
7®Fe203
Фиг. 687. Температуры ликвидуса в сечении : желе-
зистый ортоклаз -K2O«6SiO2 (стекло)
Faust G.T. Am.Min., 1936, 21, 12, 735-764
Fe,OA Ю 20 30 40 50 60 70 00 90 Mn 0
Bec.% 3*
Фиг. 690. Система окись железа - окись марганца -
кремнезем в атмосфере воздуха
Линии, оттененные с одной стороны, - границы поля двух жид-
костей. Тонкие прерывистые линии - изотермы, проведенные по не-
полным данным
Миап A., Somiya Shigeyiki.Am.Min., 1961, 4Q, 3-4, 364-
Фиг. 688. Диаграмма состояния квазибинариой системы
PbO-MgFe2O4
Bununi Л'М,, Хомяков К .Г. Вестник Моск, ун-та,
1963, Ц, 5, 39
378
Фиг. 689. Диаграмма равновесия бинарной системы
Na2O‘Fe2O^ 4SiO2 (акмит) -Fe2Oj (гематит)
Bowen N.L., Schairer J .F., Willems /f.W.V.Am.J. Sci.,
1930, Ж, 120, 427
Фиг. 691. Диаграмма равновесия в системе окисел же-
леза - TiO2-SiO2 на воздухе
Оттененные с одной стороны линии указывают границы сущест-
вования двух жидкостей. Средние линии - разделительные кривые.
Штриховые линии и буквы А,В,С показывают путь равновесной
кристаллизации.
MacChesney LB., Миап A. J.Am. Ceram.Soc., I960, И?
586-591
182
Fe3O4 - SiO2 - ZrO2
Ge02- MgO- SiO2
Фиг. 692. Проекция поверхности ликвидуса для сис-
темы окисел железа - ZrC^-SiC^ на воздухе
Jones T.S., Kimura S., Миап A. J. Am.Ceram. Soc., 1967,
50, 3, 139
Фиг. 694. Субсолидусные равновесия в части системы
М gGeO^ -М gSiO^
Sarver J.F., Hummel F. A. J.Electrochem.Soc.,1963, 110,
7, 728
Фиг. 693. Фазовые отношения в частя системы оки-
сел железа - Z1O2—SiO? ПРИ Давлении кислорода в
1 атм '
Jones T.S., Kimura S., Kuan A. J .Am.Ceram. Soc., 1967,
50, 3, 141
Фиг. 695. Изотермы в части системы I^O-TiC^-V^О5
Голованова Т.Г, Материалы 3-й научной конферен-
ции аспирантов Ростовского ун-та, 1961, с. 215
183
MgO—MnO—S iO 2
°C
1600
Оливин, (тв.р-р.)< Ж
Оливин, (тв.р-р)*В- Тэнс, (тв.р-р.) < Ж
^Оливин (твр-р.) * Ров. (тв.р-р.) +Ж
1500
ZW
г
B-r 1
Энс
(mS.p-p.)t Pag,(mHp-p,)
a
a
ЛХЙ7 ~РаИ.(тв.р-р)\\
MgSiOj 20 00 SO 80 MnSiO3
Энстатит gec % Мг| Районит
Фиг. 696. Схема возможных фазовых отношений в
системе MgSiOj— МпБЮз .А - 1595°; В - 1557°: С,
D,E- 1538°;F,G - 1533°; Н - 1425 ; J. К - 1333°
L - 1291°
Glasser F., Osborn E.J.Am. Ceram.Soc., I960, 43Л. 133
5l02
-1090
/Тр*Ж
(Ров
Ж
Mn2SiO$
1315
в
Знс
1557
MgsiOj
'''Окцсь(тЦр-р).
1470 ..
MnSiOi
1291 J
1251
-2900
м9° бес,% МпО
Фи г. 698. Изотермическое сечение, иллюстрирующее фазовые отношения
вблизи соединительной линии между метасиликатами при 1533 С
Glasser F., Osborn Е. J.Am.Ceram.Soc., 1960, 43, 3, 136
-1050
MnO
MgO-Na ,O-P,°J NaO-PO-ZnO
Z Z о Z Zu
Фиг. 697. Фазовая диаграмма системы N^SiO^— Mr^SiO^
Glasser F., Osborn E. J.Am. Ceram.Soc., I960, 43, 3, 135
1 - данные визуальных наблюдений; 2 - эндоэффекты яа кри-
вых нагревания оттожженных сплавов; 3 - несплавленных смесей;
4 - экзоэффекты на кривых нагревания несплавленных смесей
Берулъ С.И., Воскресенская Н.К. Изв. АН СССР,
неорг, матер., 1968. 4. 12, 2131
184
Фиг. 700. Приблизительная псевдобинарная диаграмма
фазового равновесия вдоль соединительной линии
Ni2 S i O4-Mg2$ i04 в системе NiO-MgO-SiO2
Ring Hood A.E..,Geoch.Cosm.acta, 1956. 10, 5/6, 298
MgO-Р O,-ZnO
А О
1400
1300
1100
900
1000
ж
>*п3(И>4)г
трОне
расяО)-,
fi-ZjP(aO.p-p)-
a-Z3P(n>Opph-
*MsP(Mp-p)
0
WjG’o,),
Щ/Щ/тОр-рн)
S ЙГ95
MM.y.MgJ(P0«)t
100
Фиг. 702. Фазовые отношения для разреза Zn3(PO4)2 -
Mg3(PO)2
Sarver J., Katnack F., Hummel F.J.Electrochem. Soc.,
1959, 106, 11, 961
Фиг. 701. Фазовые отношения в системе
MgO-3MgO-P2O5-SiO2
Р= Р2с-
Wojciechowska ],, Berak J, Roczniki Chemii, 1959,
33,1-2, 27
Фиг. 703. Диаграмма плавкости системы MgO-TiO2-SiO2
Бережной А.С. Огнеупоры, 1950, ЛЬ 10, 449
?4
185
MgO-SiO9-ZrO9
Л л
Фиг. 705. Диаграмма состояния системы Mg2$iO4-
-Zn2SiO4
Штриховые линии показывают изменение показателей прелом-
ления фаз, составы которых достигают максимальных границ твер-
дого раствора.
Segnit E.R., Holland 4.Е. J .Am.Ceram. Soc., 1965, 48,
8, 412
Zr 02 Вес. % MgO
Фиг. 706. Плавкость (в °C) в системе MgO—ZrC^
-Si02
Бережной А.С,, Карякин J1.//. Огнеупоры, 1952,
№ 3, 119
Фиг. 707. Диаграмма плав-
кости систем;
I - ZrO2-\lg2SiO4; 2 _ ZrSiO4_M ?2>iO4
Бережной 4.С., Карм-
кин J1.И. Огнеупоры, 1952,
№ 3, 120
186
MgO-SiO2-ZrO2
Фиг. 708. Вероятное строение диаграммы состояния
системы MgO— Zr2O-SiO2
Бережной А .С,, Карякин Л .И, Огнеупоры, 1952,
№ 3, 123
Фиг. 710» Проекция поверхности ликвидуса части
системы MnO—М112О3—Si02
Пунктирные линии - изобары кислорода. Оттененная штрихами ли-
ния определяет границу области двух жидкостей.
Morris А.Е.,Миап A. J.Met., 1900, 18, 8, 900
Фиг. 709. Фазовые отношения в системе окислы мар-
ганца - Si02 на воздухе. В верхней части снимка -
псевдодинарная система М113О4—Si02
Миап A. Am. J. Sci., 1959, 257, 4 , 297-315
Фиг. 711. Проекция поверхности солидуса системы
MnO-Mi^O^-SiO^
Morris А.Е., Миап A. J.Met., 1900, 18, 8, 900
187
Фиг. 712, Предполагаемые субсолидусные отношения
в системе ZnO-MnO-Mr^O^. За исключением незна-
чительных отклонений в данных по пределам раство-^
римости, диаграмма имеет значение в пределах 1000 С-
1300°C. Оттененные штрихами линии указывают соот-
ветственно: протяженность твердого раствора МпО в ZnO;
ZnO в MnO; известны непрерывные твердые раство-
ры между ZnMn2O4 и гаусманитом
White W.B., Mcllvried K.W. Trans. British Ceram.
Soc., 1965, 64, 10, 526
Фиг. 713. Частный разрез МпЗЮз-МпТЮз
а - жидкость; 0 - жидкость + тв.р-р MnSiO3~MnTiO3; FH-
кристаллизация эвтектики из MnSiO3 и твердого раствора с
предельной концентрацией в 38,3 мол. % MnTiO3 *. D.E. - линия
распада твердых растворов; область у - гомогенные твердые ра-
створы MnTiO j-MnSiO3; 5 - область распада этих твердых
растворов
Смоленский С. Zs.anorg.Chem., 1912, 73, 3, 299
Фиг. 714. Плавкость двойной системы Na2Mo04~Pb0
Беляев И.Н., Волохович Ч.Л., Баркова Г.В, Журн.
общ. хим., 1954, 24, 2, 214
Фиг. 715. Частная система PbMo04-PbW04
М|-РЬМо04; м2_ры\о4
Jaeger F.M., Germs H.C. Zs. anorg. allgem.Chem., 1921,
119, 2, 172
Фиг. 716. Диаграмма состояния частного разреза
3PbO«2SiO2-Na2SiO3 в системе - Na2O-PbO-SiO2
Кракау К.А. Изв. Сектора фнз.-хим. анализа, 1936,
8. 345
188
Фиг. 717. Диаграмма состояния частного разреза
2PbO«SiO2-Na2SiO3 системы Na2O-PbQ-SiO2
Кракау К,А, Изв. Сектора физ.-хим. анализа» 1936»
8» 337
N^O - PbO - WO3
----------------------------------------------1900°
800 -! \ o
Lo O . -----о---------о о-------IW
г~1 1. I-1-J--------1---------1— -------
5 /5 25 50 75 PbO
№гМ0ч
Фиг. 719. Плавкость двойной системы Na2WO4~PbO
Беляев ИЛ,, Иолохович МЛ., Баркова ГЛ,
Жури., общ. хим.» 1954 » 24, 2» 215
SiO2-ThO2-UO2
PbO, мол %
Фиг. 718. Диаграмма состояния частного разреза
PbSiO^— Na2SiO^ системы PbO—Na2O—SiO2
Кракау К.А, Изв. Сектора физ.-хим. анализа, 1936,
349
Фиг. 720. Диаграмма состояния системы 1Ю2—SiO2— ThO2
Lungu S, J.NucL Mater.» 1965, 19, 2» 158
SiOrThO2-IJO2
1350 вы-
Фиг. 721, Возможный вариант системы при
ше возможного 'сольвуса* в системе ThO2~UO2. Сос-
тав твердого раствора UO2-ThO2, находящегося в равно-
весии с S1O2 и ThSiO4 (твердый раствор) ие ясен. Про-
веденные линии являются гипотетическими.
Mumpton F,, Roy R. Geoch.Cosm.acta, 1961» 21, 3-4, 235
189
Фиг. 722. Система дана при температурах субсоли-
дуса (300 -1400°С). Количества ZrSiO4 и ThSiO4
в торите и цирконе (6^2 и. 4^2 в мол.%, соот-
ветственно) несколько преувеличены для на-
глядности
Mumpton F., Roy A.Geoch.Cosm.acta, 1961, 21, 3-4, 230
Фиг. 724. McTaggart G.D., Andrews A.I. J.Am. Ceram.
Soc., 1957, 40. 5, 168
Фиг. 723. Схема изотермического сечения при 1400°С
системы TiO2-SiO2—ZrO2
1 - трехфазная область; 2 - двухфазная область
Cocco A.t S ch готе к N. Chimica e industria (Milan),
1960, 42; 5, 480
Фиг. 725. Диаграмма фазового равновесия системы
Т i02 —S i02 —Z гО2
Sowman H.G., Andrews A.I. J.Am. Ceram.Soc., 1951, ^4,
10, 301
190
Четырехкомпонентные
Al2O3“B2O3“jCaCUSi()2
Фиг. 726. Диаграмма фазовых равновесий псевдобинар-
ной системы СагА^БЮу—Ca2B2Si(>7
Гел. тв. р-р - геленитовый твердый раствор; X - неидентифицирован-
ная фаза; CaSiOСВ=СаВ2О4
Bauer Н. ALjb.Min.Monatsh., 1962, № 6, 136
Al,0„ - CaO - Fe,O„ - Na,0
Z & £ & £
Фдг. 729. Область пересечения плоскости С -C4AF-
(NA3) с объемом первичной фазы NCjg A3
F-Fe2O3
Eubank W.R., Bogue R.H. U.S. Nation Bur. Stand., J.Re-
search., 1948, 40, 3, 227
Фиг. 727. Стабильные отношения AI2O3, УзА^О^и
YA1O3.
1 — А12О3 ; 2 — Yj AljOj^ 3 — Y3 Al^Oj2 + A12O3 ; 4 — Y^AI^O^*
+YA103; 5 - YAIO3; 6 - Al2 O3 + Y3 Al5 Oj2 + YAl O3
Linares R.C. J. Am.Ceram.Soc., 1962, 45, 3, 119
Фиг. 730. Диаграмма, показывающая пять изученных
сечений (плоскостей) внутри тетраэдра СаО—FeO—А^О^-
-SiO2 (система четверная, только в случае, если не-
большое количество присутствующей в жидкости Fe2O3,
трактовать как FeO)
Schairer J.F» J .Am.Ceram.Soc., 1942, 25, 10, 248
A12O3- BaO-MgO-SiO2
A^-ZSLO,
Фиг. 728. Поля первичных фаз в частном разрезе BaS^O^-
MgSiO3-Al2Si2O7
Yasuno Fukutaro.J. Ceram. Ass ос. J a pan, 1960, 68,770. 53
191
Aip3-CaO-FeO-SiO2
Анортит
Фиг. 731. Диаграмма равновесия для сечения S1O2 -
анортит - FeO. Цифры при точках - температуры ликви-
дуса
Schairer J.f. J. Am.Ceram. Soc., 1942, 25, 10, 252
Анортит
Стабильный милее 775125
Фиг. 733. Диаграмма равновесия для сечения CaSiO^-
анортит - FeO
Schairer J.F. J.Am.Ceram. Soc., 1942, 25, 10, 256
Фиг. 732. Диаграмма равновесия для сечения анортит-*
А12О3- FeO
Schairer J,F. J.Am.Ceram. Soc., 1942, 25, 10,254
1590*2
1280 1280
Фиг. 734. Диаграмма равновесия для сечения геле-
нит-анортит - FeO
Schairer J'.F. J.Am.Ceram. Soc., 1942, 25. 10,260
192
А1„ОЧ—CaO—FeO—SiO„
>6 о
Фиг. 735. Диаграмма равновесия для сечения CaSiO^—
- геленит - FeO
Schairer J.F. J.Am.Ceram. Soc., 1942, 25, 10, 263
Фиг. 737. Диаграмма равновесия для сечения СаА^О^
—Са2 A l2SiO y-MgA 12О4
Rao М.Ramakrishna.J.Am.Ceram.Soc., 1968, 51. 1,52
ALO,-CaO-MgO-SiO„
Co ALq-O^
Фиг. 736. Диаграмма равновесия сечения СаAl4O7 —
-Ca2Al2SiO7 -MgAl2O4
RaoM. Ramakrishna.,J. Am.Ceram.Soc., 1968, _51_, 1, 51
Фиг. 738. Развертка тетраэдра в четверной системе
Са A12O4-CaA14O7-Ca2A12SiO7-MgA12O4
Pj-P2 - псевдоинвариантная точка (точка протыкания);
Di 02 - пересечение с инвариантными поверхностями
RaokL.Ramakrishna.J.Am.Ceram.Soc., 1968, 51.» 1, 52
25
198
СаО ВО 60 40 20 С5Л3
Фиг. 739. Плоскость, выше которой MgO становится
первичной фазой.
Цифры при пунктирных кривых - концентрации MgO
McMurdie H.F ,,lnsleyH, U.S. Nation. Bur. Stand., J .Re-
search, 1936, 16, 5, 472
Фиг. 740. Поверхность ликвидуса
частной системы 3CaO»MgO»2SiO2
—MgO» AI2Q3 —2Са6* А^О^ Si02 в
системе СаО—AI2O3—Si02—MgO
Цифры означают температуру ликвидуса
Gutt W., J.lron. a. Steel Inst., 1964,
202. 9, 774
ЗСаО MgOZSi
ZMgOSiO,
169Z
2135
1566
17 • • • • ' < Лэ
1677
г 1538
Мервинит
1480 *^1516 .
/ 15545011580^80^810 80 2040
2Са0А1203-SiO2 Са0-2А1г03 Са0-6А1203
ZCaO-StD2
ZCaO-SiO2 20
Шпинель (MgO'Al^
1463
1433
6ес.°/о
Фиг. 741. Поверхность ликвидуса частной системы
2CaO»SiO2-2MgO»SiO2—АкОз в системе СаО—S1O2—
—AI2O3—MgO
Цифры при точках - температуры ликвидуса.
Gutt IF., J.lron. a.Steel Inst., 1963, 201, 6, 534
'2и3
1965
АЦО.
Фиг. 742. Диаграмма равновесия частного сечения
геленит (Са2А^Ют) - окерманит (Ca2MgSi20y )
Штриховая линия - кривая солидуса, дана по Ferguson и U'iddint»
ton (Am. J.Sci., 1921, 5Q. 296, 131)
Osborn E.F., Schairer J.F. Am. J.Sci., 1941, 239, 10,
724
194
МдОА1г03
Фиг. 743. Бинарная система шпинель-двухкальциевый
силикат
Prince АЛ. J.Am. Ceram.Soc., 1951, 34, 2, 44
Фиг. 746. Тройная система шпинель-двухкалышевый
силикатг-геленит.
Prince АЛ. J.Am.Ceram.Soc., 1951, 34, 2,50
Фиг. 744. Бинарная система геленит—шпинель
Prince АЛ., J.Am.Ceram.Soc., 1951, ^4, 2, 50
Фиг.- 747. Фазовые поля и инвариантные точки в плос-
кости сечения MgO—AI2O3— 2CaO«SiO2
Prince А.Т. J.Am. Ceram.Soc., 1951, 3£» 2, 50
Фиг. 745. Часть тройной системы периклаз-двухкаль-
циевый силикат-шпинель, в увеличенном масштабе
Prince АЛ. J.Am.Ceram^oc., 1951, 34, 2, 47
195
Al2O3-CaO-MgO-SiO2
Ъ
(CMS) Kp (MAS)
(470° Пи (470е
, ТР
(MAS) Kp (CAS)
(470е Му Л (470е
(CMS) Волл
(ЗЗб^пЯолл/
ГРВолл
Пволл
Ан
Тр
(CAS)
Н65*л Пволл
Ан
)Тр
G Волл
Ан
&
(CMS)
/ЗЗОЧоВалл
Пи
'Тр
к
(CMS)
(37SU ‘
Ан
l3HC
Ди
Тр
Волл
Пволл
Волл
Пи
Тр
Ан
Ан
Пи
(200е Тр/
Ан
Энс
ЗнеДц
(CMS)/uTp 1
(3№е 9^/
(MAS)
(355°о3нс
[Корд
Ан1&
I я-
(МАЗ)^Уяа
(460еГи
Шп .
(MAS) Корд .
(CASL (453 е Сап/
(345^Мрл Af^p
Ан сап -г -
n'ygHtipU /Пп Мул
нт К Ан
tp
4245е
Ан
(СМЗ)^П6олл А Волл а
' *Мел*
Ан 'Пволл Ан
Волл
(360е Мел/
Воля
Пволл. _
Мел (CAS)
(265е
Ан
4236е
Э Ан^
*' Мел(1
_ Ли
‘'Волл
Мел
•Пи
Волл
Мел
Пи (CMS)
(350е
Морд
Сап
. Шп
ММул (MAS)
Сап (482е (СAS)
Мул 1ЯХМКор
Корд Мул
/w°c
Фо+ЗнсЪога-
тый Пи +Ж
Анортит
Са0А1203 ZStO2
во
Энстатит 20
MgO-SiOg
80 Диопсид
CaO'MgO’ZSiO
40 60
вес. %
Дн+Ж
Мул
Ан Кор
L Мул (MAS)
An Шп / Шп 1575°
Шп l£ *°f>
агЬтр/ корд/ Кира / ah Шп / L
Я* HL, Hw *" .Шп W k
'is
/б(ГФо/\Фо Кордл Шп (370е
/2бМФо/\Фо .
Ли а/ кнорд
'ан, (Srbnso*
Корд
нора
Шп
С
Фо Пи
Пи . Мел
Мел (CMS)
(375е
Пи .
Фо
Мел
Шп (ЗИОе
Ан
Фо
Шп_______
4320е
р Ан
? ' Мел
Фо
Шп
Ah
*0
Шп n Мел
Мел
Фиг. 748.
ленькие черные кружки) в пограничных системах с ин-
вариантными линиями и четверными инвариантными
точками (большие черные кружки) внутри системы
СаО—MgO—А ^Оз- SiO^ в части, богатой кремне-
земом. Линии и точки не лежат в одной плоскости
Chinner G.A., Schairer J.F. Am. J.Sci., 1962, 260, 8,
619
Связь тройных инваринатных точек (ма-
1400°) раз-
Фиг. 750. Частный изотермический (при
рез: анортит-энстатит-диопсид.
Hytdnen Kai, Schairer J.F. Carnegie Inst., Washing-
ton, Year Book, 60
(1960-61), 127
Z
Анортит
Анортит
CqO'A1203-ZSl02
Фо +,Ди (тв.р~руЭнс-6ог Пи+Ж
Фиг. 751. Частный изотермический (при 1380°) разрез:
анортит-энстатит-диопсид.
Hytdnen Kai, Schairer J.F. Carnegie Inst., Washing-
ton, Year Book, 60 (1960-61), 128
Ф»г. 749. Частный изотермический (при 1500°) разрез:
анортит-экс татит-диопсид.
Hytdnen Kai, Schairer J.F. Carnegie Inst., Washington,
Year Book,60 (1960-61), 127
196
Al 0 -CaO-MgO-SiO
2 3 *•
Анортит
Ca0-Al203* 2 SiO2
Энс-Ъог Ли+Ж Фо+Ди (тв.р-р)+ Ди, тв. р-р+Энс бог Пи
*Энс-Ъог Ли+Ж
Фиг. 752. Частный изотермический (при 1350°) раз-
рез: анортит-енстатит-диопсид.
Hytonen Kai, Schairer J.F,, Carnegie Inst., Washing-
ton, Year Book, 60 (1960-61), 128
Анортит
СпП-А1 n n
Анортит
Фиг. 754. Частный изотермический Дпри 1273 ) раз-
рез: анортит-энстатит-диопсид.
HytQnen Kai, Schairer J.F. Carnegie Inst., Washington,
Year Book, 60 (1960-61), 130
Анортит
Ca0-Al203*ZSi02
Энс+Ъог Пи+Ж
Фо+Ди (тв.р-р) +Энс$ог Пи+Ж
Ди (тв.р-р) +Знс~Ъог Пи+Ж
Фиг. 755. Частный изотермический (при 1260°) раз-
рез: анортит-энстатит-диопсид.
HytGnen Kai, Schairer J.F. Carnegie Inst., Washington,
Year Book, 60 (1960-61), 131
+Эис-Ьог Пи+Ж
Фи г.753. Частный изотермический (при 1280°) разрез:
анортит-энстатит-диопсид.
Hytbnen Kai, Schairer J.F. Carnegie Inst., Washing-
ton, Year Book, 60 (1960-61), 130
197
A1203-Ca°-Mg°-Si02
Фиг. 756. Частный изотермический (при 1235°)раз-
рез: ан ортит-онстат ит-диопсид.
Hytonen Kai, Schairer J,F. Camegie Inst., Washing-
ton, Year Book, 60 (1960-61)* 131
Зно-Ъог Пи+Крист
H90°C
Ан+Ди+Ж
Анортит
CaO.ALO,.2SiO.
60
Ан+Ди (mti.p-p)+
+3нс-5ог Пи
'^+Ди(тв.р-р)-
Чс-бог Пи+Крисп\
^рист^80^r hu^+Kpucm 1
ZZZ3Z (тд.р-р)+
Зис-бог /Ziz+d^ у -*---у м— +ж
+Крист ЭнЪтат 60 80 Диопсид
MgO.SiC Вес.°/о \CaO.MgD.2SiO2
Ди(тдр~р)+ Ди(т8р-р)+ЭнсЪогПи+ Ди(тб.р-р)+
+Энс-Ъог Пи+Крист + Крист +Ж + ЗнсЬог Пи+Крист
Фиг. 758. Частный изотермический (при 1190°) раз-
рез: анортит-енстатит-диопсид.
Hytdnen Kai, Schairer J.F., Camegie Inst., Washing-•
ton, Year Book, 60 (1960-61)* 132
Ah
CttO’AljOj'ZStO^
MgO SiOa , CaO MgO-2StO
Фиг.757. Частный изотермический (при 1220°) разрез:
анортит - энстатит - диопсид
Hytonen Кац Schairer J.F. Camegie Inst. Washington,
Year book, 60, (1960- 61), 132
Ш5°С
Знс-Ъог Z
+Крист
Анортит
CaO-AkO • ZSiO
Ан+Ди (т6.р-р)+
+Энс-Ъог Пи
40
• /. • • V
£^Ан+Ди (тв.р~р)^
//
/
Ди(тдр-р)
\Kpucm
.ик______у.--it---
Энстатит 20 \ 40 60 80 Диопсид
MgO-SiOj \ Вес.% CaO-MgO-ZSiD2
Ди(тд.р-р) -^Энс-Ъог Пи+Крист
Фиг. 758. Частный изотермический (при 1135°) раз-
рез: анортит-енстатит-диопсид.
HytBnen Kai, Schairer J.F. Camegie Inst., Washington,
Year Book, 60 (1060-61), 134
198
Al 0,-CaO-MgO-SiO
2 3 л
Ан
Шпинель
Mg-нолекуло
Mg0AI203Si02
Пироп
ЗМдОАЗД-ЗОД
SO
\ \Са-молекула Черный
CaOAIjQjSiOt
CJYSCaO-Al^aSSiOg
фора^"п, г Tfe*'
О 40 ^ 60V# Волластонит
Диопсид CaOMgO-2$iO2 \ CaO SiO2
toMjnbf-p
Фиг. 760. Частное сечение энстатит-глинозем-вол-
Энстатит
Mg0-Si02
Фиг. 762. Тетраэдр форстерит - CaOA^OySiC^
(молекула Чермака кальциевая) - диопсид-кремнезем.
Неопубликованная диаграмма Yoder и Tilley для демон-
страции отношения некоторых гроссуляр-пироповых гра-
натов и тремолит-чермакитовых амфиболов к энстатитным
и диопсидовым пироксенам в области составов, относящих-
ся к базальтам.
1 - плоскость - ниже критического насыщения кремнеземом; II -
плоскость насыщения кремнеземом.
Hytonen Kai, Schairer J.F. Carnegie Inst., Washington,
Year Book, 60 (1960-61), 139
ластонит.
Черные точки - изученные составы. Пунктирные лании-данные;
1) Osborn Е.Е., DeVries R.C., Gee К.G«, Kroner H.M.(J.Meta Is, 1954, в,
3-15); 2)Segnet E.H.(Min.Mag., 1957, 3j, 255-64); 3) Prince A.T.
(J.Am.Ceram.Soc., 1954, *J7, 402-8). Пироп и гроссуляр нанесены
условно.
ffytdnen Kai, Schairer /.F. Carnegie Inst. Washington,
Year Book, 60 (1*960-61), 135
Ъа-Молекула 20 40 60 80
Чермака. Ан Вес. % SiO,
CaO Al2O3-SiO2 Ca0Al203 ZSiO2
Фиг. 761. Частный изотермический (при 1135°) раз-
рез: ।диопсид-молекула Чермака, кальциевая (СаО-
A^O^-SiC^) - кремнезем.
HytBnen Kai, Schairer J.F. Carnegie Inst., Washing-
ton, Year Book, 60 (1960-61), 137
о
К четверной звтетошт 1300* Ли
Валл+Ли+Ан+Тр+Ж «I»
РАн
Энс,
Au
Щ0 3нс
Фо
Выше 1300 ”С
точно т-ра
не известно
'.Энс
Ди
Тр
<150*КГ
н у A* if?* * четвернойэвтектике
' Jtae ' Ан+Знс+Корв+Тр+Ж
\ Ан
Знс
Ди1150=«Г
* ** ffl^* * чет6еРн°Л инваре-
Знс j антной точке
ди Фо Аи+Фо+Знс+Корд+Ж
Ан
Фо
К четвертной, инвариантной,
точке
Ан*Фо *Пи *Нел *М
Фил. 763. Отношение тройных инвариантных точек (ма-
ленькие черные кружки) в пограничных системах к мо-
новариантным линиям, двум инвариантным четверным
точкам (большие черные кружки, обозначенные Y и X )
в объеме энста^ят-анортит-диопсид-кремнезем (фиг.
782) и к некоторым другим четверным инвариантным точ-
кам в системе AJ2O3-CaO-MgO-SiO2
Hytonen Kai, Schairer J.F. Carnegie Inst., Washington,
Year Book, 60, (1960-61), 140
199
AL0,-Ca0-Mg0-Si0o
o Z
Фиг. 764. Поверхности ликвидуса для плоскости се-
чения, содержащей 10% А120з
Osborn E.F., DeVries R.C., Gree К.Н., Kroner Н.М.J.Me-
tals, 1954, 6, 1 ,38
Фиг. 766. Поверхности ликвидуса для плоскости се-
чения, содержащей 20% AUCU, в системе АЦО^-СаО-
— MgO—SiO2
Osborn E.F., DeVries R.C., Gree K.H., Kroner H.M.J.Me-
tals, 1954, 6, 1, 38
Фиг. 765. Поверхности ликвидуса для плоскости се-
чения, содержащей 15% А120з
Osborn E.F,, DeVries R.C., Gree К.Н„ Kroner H.M.J.Me-
tals, 1954, 6, 1, 38
Фиг. 767. Поверхности ликвидуса для плоскости се-
чения содержащей 25% А12О3,в системе А^О^ - СаО—
-MgO-SiO2
Osborn E.F,, DeVries R,C,, Gree K.H., Kroner H.Af.J.Me—
tals, 1954 , 6, 1, 38
200
А1203- СаО-MgO-SiO2
Фиг. 768. Поверхности ликвидуса для плоскости се-
чения, содержащей 30% А ^О^, в системе А ^О^—
—СаО—MgO—SiO2
Osborn E.F.t DeVries R.C., Gree K.H., Kraner H.W.J.Me—
tals, 1954, 6, 1,39
Фиг. 770. Диаграмма равновесия системы анортит
МдО (CaAl2Si20p) - диопсид (CaMgSi2O6) - окерманит
(Ca2MgSi20p, с нанесенными пограничными кривыми
и изотермами.
De Wys Е.С., Foster JTK.Min.Mag., 1958, 31, 240, 741
20 40 60 65
CaO Вес. °/o MgO
Фиг. 769. Поверхности ликвидуса для плоскости се-
чения, содержащей 35%А120з, в системе AI2O3—
СаО-MgO -Si02
Osborn E.F., DeVries R.C., Gree K.HKraner H.M. J .Me-
tals, 1954 , 6, 1, 39
Фиг. 771. Диаграмма равновесия системы
CaMgSi20g—CaA12Si20g
Osborn E.F, Am.J.Sci., 1942, 240, 11, 758
26
201
Al2O3-CaO-MgO-SiO2
Фиг. 774, Фазовые отношения в сечении CaA12Si20g~
-MgA)2O4. Бинарные отношения существуют в областях
ниже жирных пограничных линий,
DeVries R.C., Osborn E.F, J .Am.Ceram.Soc., 1957, 40.
1. 8
Фиг,772, Диаграмма равновесия системы CaSiOo-
CaA^Si^Og — CaMgSi206.
Точки представляют составы изученных смесей; тонкие линии -
изотермы; жирные линии - пограничные кривые.
Osborn E.F. Am.J .Sic., 1942, 240, 11, 751
Фиг. 775, Фазовые отношения в сечении CaAl2Si20g—
—MgO. Бинарные отношения существуют в областях ни-
же жирных пограничных линий.
DeVries R.C., Osborn E.F. J.Am.Ceram.Soc.,1957, 40.
1» 8 ““
Фиг, 773, Сечение CaSiC^-MgSit^-A^C^,показываю-
щее поля первичных фаз, изотермы ликвидуса, твердые
растворы пироксена и изученные составы.
Segnit Е. Min. Mag., 1956, 31. р. 234
202
203
A12° з-CaO-MgO-SiO 2
Анортит
CaAl^SigOg
1553
Геленит 1527 Шпинель
МдАХД
Фиг. 779. Диаграмма равновесия для системы
Са2А1г SiO7-MgA% О <-CaAl2Si2O8
DeVries R.C., Osborn E.F. J.Am.Ceram.Soc., 1957, 40
1, 10
Фиг. 781. Диаграмма фазового равновесия для сис-
темы анортит-окерманит.
De Wys E.C.tFoster W.R. J.Am.Ceram.Soc., 1956, 39,
11, 375
2133
Фиг. 780. Диаграмма равновесия для системы
Ca2A)2SiO7-MgAl2O4-Al2O3
DeVries R.C., Osborn E.F.J.Am.Ceram.Soc., 1957, 40,
1, 13
Форстерит Вес. °/o Анортит
Фиг. 782. Диаграмма равновесия системы форстерит-
анортит; представляет собой измененную диаграмму
Андерсена, чтобы показать субсолидусные отношения.
Osborn E.F., Tait D.B. Am. J .Sci., Bowen Vol., 1952,
p. 2, 418
204
A 1,0 CaO—MgO—SiO ,
• Z •» &
CaMgSi2061387° 20 40 60 80 MgaSiOs
Диопсид ' Вес. % Форстерит
Фиг. 783. Диаграмма равновесия системы диопсид-
форстерит-анортит
Osborn E.F., Tait D.B. Am.J.Sci., Bbwen Vol., 1952,
p. 2, 419
Фиг. 785. Изотермы в системе 2CaO«A12O^«SiO2-
-ЗСаО-А12О3 •3SiO2-2CaO’MgO’2SiO2
Buddington Л, F. Amer. J. Sci., 1922, 3, 13, 48
Фиг. 784. Схема, иллюстрирующая равновесные фа-
зовые отношения в системе диопсид-форстерит^анор-
тит-кремнезем. Система представлена в виде правильного
тетраэдра с удаленной передней гранью. Последняя по-
казана справа в уменьшенном размере. Показаны по-
ложения соединений и пограничных кривых на гранях.
Внизу схематично представлены три моновариантные
линии, которые проходят через тетраэдр, с тремя крис-
таллическими фазами, которые находятся в равнове-
сии с жидкостями вдоль линии. Температура 1200 ,
заключенная в скобки, определяет приблизительно ме-
тастабильную эвтектику: кристобалит, диопсид, анор-
тит по Грейгу.
Osborn E.F,, Tait D.B, Am.J.Sci., Bowen Vol.,1952, p. 2,
246
Фиг. 786. Частная система Mg2SiO^ —CaAl2Si20g-SiO2
Andersen O.Am.J. Sci., 1915, 39, 232, 440
205
Al О —CaO—MgO—SiO
2 3 Z
ZCaO-SiO2
1350°
2CaO-SiO
MgO
1315°
Sio2 90°/o
MgO /0%
2 жидкости.
Тридимит
ПОолл
npucm
Шпинель
Известь \периклаз
LS
MgO
Фиг. 787. Диаграмма для частного разреза 2СаО«
•SiO2— MgO—5СаО-ЗА)2Оз» показывающая поля,в которых
каждый компонент выделяется как первичная фаза.
Hansen W.C. J.Am.Chem.Soc., 1928, 50,
8, 2157
1380°
5СаО- 3А1203 СаО Р0% д^о ддо/о
MgO/0% MgO j0°/o
Фиг. 789. Плоскость сечения с 10%MgO в системе
А)2О3-СаО-MgO-SiO2
Prince А.Т. J.Am.Ceram.Soc., 1954, 37, 9, 406
Фиг. 788. Сечение, соответствующее 5%MgO
Lea F.M. "The chemistry of cement and concrete" исп-
оавленное издание of Lea F.M. и Desch C.H.,London,
1956, p.71. Перевод на русск.: Ли Ф.М. 'Химия цемента
и бетона*. М., Госстройиздат, 1961
CclSlOj 20
1W0°6O
Bee. °/o
80 Ca MgSt.O7
6 w 6 l
Окерманит
Фиг. 790. Диаграмма равновесия для частного раз-
реза псевдоволластонит - окерманит (Ca2MgSi2O? )—
геленит (Ca2AI2SiO?)
Штриховая линия показывает приблизительное положение оси,
проведенной через поверхность ликвидуса. (Цифра 1310 вблизи
тройного минимума относится к изотерме, а не к температуре
тройного минимума, которая равна' 1302 )
Osborn E.F., Schairer J.F. Am. J.Sci., 1941, 239, 10,
726
206
Фиг. 701. Частное сечение 2CaO»SiO2-2MgO«SiO2—5СаО«
• ЗА^Оо четверной системы.
Segnit E.R., Weymouth J.H. Trans. British. Ceram.
Soc., 1957, 56, 5, 254
Фиг. 793. Фазовые отношения в системе CaSiO^—
-CaA12Si2Og-NaAlSiO4 с различными полями и изотер-
мами, нанесенными через 50 . Положение смесей да-
ется кружочками, включая составы, лежащие на по-
граничных системах* определенных в других работах.
Gummer W.K. J.Geol., 1943, 51, 8, 514
Фиг. 792. Положение сечения гроссуляр-пироп и фаз,
присутствующих в части системы CaO-MgO-A^C^-
"SiO2, богатой кремнеземом.
Chinner G.A., Schairer J.F. Am.J .Sci., 1982, 260, 8,812
Фиг. 794. Фазовые отношения в системе СаЗЮз—
-CaA12Si2Og-NaAlSiO4.
Gummer W.K.J.Geol., 1943, 51, 8, 515
207
Фиг. 795. Диаграмма равновесия системы CaAl2Si20g-
-JZ^A^SiOy-NaAlSiC^ с нанесенными на ней изо-
термами.
Goldsmith Julian R. J.Geol., 1947 , 55, 5, 389
P0Ca2Al2SiO7
Фиг, 797. Диаграмма равновесия для частного сече-
ния CaSiO-j—Са2А1NaAlSiC^—СаА12$120д,при 10%
СаА12§120д, с нанесенными на ней изотермами.
Yoder H.S.Jr. J.Geol., 1952, 60, 6, 591
Фиг. 796. Диаграмма равновесия системы CaAI2Si2O8”
-Ca^A^SiO^-NaAlSiO^ с указанием фаз.
Goldsmith Julian R* J.Geol., 1947 , 55, 5, 389
Фиг. 798. Диаграмма равновесия для частного се-
чения CaSiOз-Са2А1 ^iOY-NaAlSiO4-CaA12Si2C^ ,
при 10% CaA12Si20g
Yoder Н-S., Jr. J.Geol., 1952, 60, 6, 591
208
ALO —CaO—Na_O—SiO,
4 0 *• *
Вес. °/о
Фиг. 799. Диаграмма равновесия системы NaAlSiO^—
—CaSiO3—N828iC>3 с нанесенными на ней изотермами.
Spivak Joseph,J.Geol., 1944 , 52, 1, 33
Фиг. 801. Диаграмма равновесия системы CaSiO —
-NaAJSiO4 3
Foster W.R. J.Geol., 1942, 50, 2, 160
Фиг. 802. Диаграмма равновесия системы
-CaSiO^
Foster W.R. J.Geol., 1942, 50, 2, 162
Фиг. 800. Сечение, показывающее фазовые отноше-
ния в системе волластонит - анортит - иефелин-
метасилцкат натрия. Треугольник не равносторонний,
поскольку составы даны в весовых процентах окислов.
Spivak Joseph, J.Geol., 1944 , 52, 1, 35
NaAlSi3Cfe -
Фиг. 803. Диаграмма равновесия системы NaAlSi^Og-
- ( aSiO3 -NaAlSiO^ с нанесе нными на ней изотермами.
Foster W.R. J.Geol., 50, 2, 165
27
209
Фиг. 804. Диаграмма равновесия для системы NaAlSioO.-
-CaSiO3-NaAlSiO4 8
Foster W.R. J. Geo)., 1942, .50, 2, 165
геленит
1 - неразложившийся мелилит; 2 - гидрогранат. Кривые соли-
дуса и ликвидуса даны по Goldsmith J.B.(J.Geo)., 1948, 56, 37 -
477), кривая сольвуса - (распад твердого раствора) - по Chri-
stie O.H.J. (1962). Внутри области А образуется кс см отлит. От-
ношения при плавлении даны при атмосферном давлении.
Christie Norsk Geologisk Tidsskrift (Oslo),
1962, 42, 1-2, 41
Фиг. 805. Диаграмма равновесия для системы
NaAlSiO^—Ca^^SiO^
Smalley R.G. J.Geol., 1947, 55, 1, 29-31
Фиг. 807. Частное сече,
ние Ca2Al2SiO7
РастворимостьNa2Si30? -
молекулы в гелените при
различных температурах.
Christie О lav H.J. Norsk
Geologisk Tidsskrift (Oslo),
1962, 42, 1-2, 14
5 10 15 %
Фиг. 808. Диаграмма равновесия для плагиоклазов.
Субсолидусные отношения показаны условно.
Tuttle O.F., Bowen N.L, J.Geol., 1950, 58, 5, 582
Альбит 20 40 60 80 Анортит
Вес. %
210
А1,0_ - CaO - Р О-— SiO,
Al,0,—CaO-SiO -TiO,
Z О *
Фиг. 809. Диаграмма состояния системы Са^РО^-
—Са A ^2^*2 ^8
Pierre Sr. J.Am. Ceram. Soc., 1956, 39, 4, 149
Анортит
SiOt 7, 20 40 60 Тг 1373’2 CaO-
/72в°С CtpeH,6ec. % -Т10г-
•Si02
&382’2]
Фиг. 811. Тройная система анортит - сфен - кремнезем
Agamawi Y.M., White ], Trans. British Ceram.Soc., 1954,
53, 1, 23
Фиг. 810. Диаграмма состояния системы СаА12$12О8""
-(.а^(РО^) 2—5^2
Pierre St, J.Am.Ceram. Soc., 1956, 39, 4, 149
Фиг. 812. Тройная система метасиликат кальция -
анортит - сфен.
Agamawi Y.M,, White J, Trans. British Ceram. Soc.,
1954, 53, 1, 26
211
Фиг. 813. Четверная система метасиликат калышя-анор-
тит-с фен-кремнезем.
Agamawi Y.M., White J. Trans. British Ceram. Soc.,
1954, 53, 1, 35
Анортит
[[382 °C]
Фиг, 815. Тройная диаграмма системы анортит -
сфен - кремнезем, с изотермами на поверхности
ликвидуса
Agamawi У.М , White J. Trans. British Ceram.Soc.,
1953, J52, 6, 296
Фиг. 814. Распределение твердых фаз при вершине
четверной системы, с высоким содержанием кремнезема
е - эвтектика.
Agamawi Y.M», White J< Trans. British Ceram. Soc.,
1953, 52, 6, 272
Фиг. 816. Диаграмма состояния частного сечения
сфен (CaSiTiO5) - анортит (CaA12Si20e )
Prince А.Т. J.Geol., 1943, 51^, 1, 4
212
А1,0_—СаО—SiO ,-TiO
л о ** **
А1о0 Q—?CaO—SiO ZnO
z о &
Тр + Анл Тр+Ган
Вилл+Ан
илл+Ган
Волл+Ан
Мел + Ган
Крист
1341Г
1460
1497
Мел
1523
Ган
4470 4445 13461283^ 1350 4400 4480
Cd-SiO
1300
ZnO
1400
1500
Вес. %
Р2%СаО
92°/о ZnO
А °C
1200
92°А>ЫЗЪ
Мул
1360
1343
1312
1372
1417
1458
Фиг. 819. Частное сечение в плоскости, содержа-
щей 8% Al 2O3. Прямые сплошные линии представ-
ляют следы пересечения тетраэдра составов с этой
плоскостью. Соответствующие инвариантные точки
от А до F на диаграмме вверху, слева, представ-
ляют собой пересечения плоскости с бинарными
соединительными линиями
1283°
Фиг. 817. Диаграмма состояния системы CaO*TiO2*
•SiO2~СаО. SiO2~Ca’А^Оз^ЗК^ (в вес.%).
Т - СаО .TiO2 • SiO2; W - CaO.SiO2; A - CaO. A120j «2SiO2
Iwase K., Nisioka U, Sci. Rept. Tohoku Imperial
University, Ser. 1, Honda, Anniv. vol., 1936» p. 1—10
CaOAlO-ZSiO, CaO-TUL
Z 3 Z _ Z
Bee. %
Фиг. 818. Диаграмма состояния системы СаО*
•Al2O3*2SiO2- СаО- TiO2
Iwase К., Nisioka U. Sci. Rept. Tohoku Imperial
University, Ser. 1.Honda, Annv.vol., 1936, p.1—10
Ь9$+Ган
Ган+Цн
Са„ Si _0
Segnit E.R. J.Am.Ceram. Soc., 1962, 45, 12,602
Фиг. 820. Частное сечение в плоскости, содержа-
щей 10% AI2O3
Прямые сплошные линии представляют следы пересечения тетра-
эдра составов с плоскостью. Инвариантные точки от А до F ука-
заны на фиг. 619 (вверху слева).
Segnit E.R.J. Am.Ceram.Soc., 1902, 45, 12, 002
213
Фиг. 821. Частное сечение в плоскости, содержа-
щей 15%А12О3
Прямые сплошные линии представляют следы пересечения тетра-
эдра составов с плоскостью. Инвариантные точки от А до F ука-
заны на фиг. 819 (вверху, слева).
Segnit E.R. J. Am.Ceram.Soc.^ 1962, ^,12, 602
Фиг. 823. Бинарная система окерманит—геленит
(сплошные линии) и гардистонит - геленит (штри-
ховые линии).
Segnit E.R. J.Am.Seram.Soc., 1962, 45. 12, 605
Система
C-Z-S
Z-A-S C-Z-S
C-Z-S
C-A-S C-A-S
Мел, CaS
Ган. ZnO
Мел, Ган, ZnO
Мел
C.S
Мел
C,S
ZnO
Ган
ZnO
Ган, Ан
Мел
Ган
Ан
Тр
Ган
Ан
Фиг. 822. Связь между тройными инвариантными
точками, четверными моновариантными линиями и
четверными инвариантными точками.
Segnit E.R. J.Am.Ceram. Soc., 1962, 45, 12, 602
Тр
\олл
ПВолл, Meg
л Система
i C-A-S
4220 ±5°^
/5%АЬгОа
70%А12О3
8°/о AU0
CQgZnSigOy
Zn2StO4
Фиг. 824. Система гардистонит ( Ca9ZnSi20-j)—
ганит (ZnA^O^) - виллемит (Zn2SfO4)
Segnit E.R., J.Am.Ceram.Soc., 1962, 4§, 12, 605
Ви л, Ган
Система
Z-A-S
214
Al О —Cr 0_—MgO—SiO- (A),
Z О Z О A
А12°з - Cr2O3 - MgO - TiO2 (В),
Al О —Сг О —MgO—Zr02( В)
А
Сг2О3
MgCr^O,
MgSiOj
AljOj МдА1гОч МдО
Mg4A\oSt2023 Мд2 АЪЦ St б 0нв
В
А1203
Б
СгД
Cp2T4°7
TiO2
Al203 МдАг.Д
MgAl 0,
Сг2О3 МдСг20ч МдО
Фиг. 825. Элементарные тетраэдры в системе
MgO-Ci^Qз-А120з-8Ю2 (А), в системе MgO— Сг^СХ —
-Al2O3-TiO2(B) и в системе MgO-C^O^-A^O^-ZrO^B)
A12°3-Fe0-Fe^3-Si02
SiO2
20
MgO
MgTi (L
МдП03
M^to4
40
02-
Муллит
Фиг. 827. Фазовые отношения в системе РеО»Ре2Оз—
-AI2O3—SiO2 на воздухе. Линией тире - точка по-
казаны примерные кривые равных отношений (в вес.%)
Fe2O3/FeO вдоль ликвидус ной поверхности. Линия, от-
тененная с одной стороны, ограничивает область двух
жидких фаз.
______________idj
FeO-Fe^lO 20 JO 40 SO SO 70 80 90
Bee. %,
0,4-
-0,6—
& -1,0
-1,2—
7 i ' \
Шпинель (mlp-p] \
Бережной А»С.,Гулъко H.В» ДАН СССР, 1965,
164, 2, 385
Al^-Fe^-J^-Lip
Фиг. 826. Схематическая диаграмма, иллюстрирующая
поведение смесей в сочетаниях фаз Pe^O^—LiAi^Og,
Fe3Р4—LiFe5Og и Ре20з—LiFesOg. Смеси первых
двух сочетаний показаны как окисляющиеся до различ-
ных пределов при 1400 С.
Strickler D.W., Roy R. J.Am. Ceram. Soc., 1961, 44, 5,
229
А4О5 SiOz
JO
JAlzOsZMz
20
127
Muan A. J.Am.Ceram. Soc., 1957, 40, 4
Фиг. 828. Диаграмма показывает фазовые отношения
при температурах ликвидуса в системе окислы железа-
-Al2O3^SiO2 при 1 атм давления 02.
Жирные линии-пограничные кривые со стрелками, указывающими
направления падения температуры. Тонкие линии - изотермь- ликви-
дуса; оттененная точечным пунктиром линия указывает границу двух
жидкостей. *
Milan A. J.Atn.Ceram.Soc., 1957, 40, 12, 424
215
Фиг. 829. Фазовые отношения в системе FeO—Рв2Сз~
—AI2O3—SiO 2»
Фиг. 831. Диаграммы качественно показывают воз-
можные изменения в фазовых отношениях в системе
FeO-Fe2O3-A12O3-SiO2 в зависимости от изменения
давления при сильно восстановительных условиях.
Обозначения линий те же, что и на фиг. 830. Цифры ука-
Пограничные кривые показаны тонкими линиями в пограничных
тройных системах. Четверные моновариантные линии, проникающие
в тетраэдр из пограничных тройных систем, показаны толстыми
линиями. Оттененные линии указывают границы области двух жид-
костей
Миап A.J. Am. Ceram. Soc., 1957, 40. 12, 425
зывают температуру соответствующих метастабильных
инвариантных точек и инвариантных точек ликвидуса
IV и V. Диаграммы показывают в соответствующем
порядке фазовые отношения по мере понижения давле-
ния О2, приблизительно от 10“^ атм (а) доЮ~13атм
02(e). Диаграмма (е) дана по Schairer и Vagi
Миап A. J.Am. Ceram. Soc., 1957, 40. 12, 428
Sio2
5Юг
SiO.
Шп.
(тВ.р-р
(V
StO,
ai2o3
Гт.
Шп.
(тб.р-р')
кор.
Гт
Шп
(m&p-p
At;o3
SiO.
Al,03 FeOFe2O3 (Ъ)
SiO,
кор.
Гт
Шп
(тб.р-р
AIOS ftOFe^ (в)
SiO,
Fe0-Fe203 ( e J
SiO,
А1г03
Фиг. 830. Диаграммы, показывающие изменения в фа-
зовых отношениях в системе FeO—Рв20з—А^О^-
—SiO2, в зависимости от давления кислорода.
Средние линии-фазовые границы; линии, оттененные с одной сто-
роны - границы нес меси мости жидкостей; цифры указывают темпера-
туры соответствующих метастабильных инвариантных точек и инва-
риантных точек ликвидуса I, II, III. Диаграммы расположены (от а
Шп
(тв.р-р)
Fe0 Fe303 (dj AljO,
Si°Z
Шп
Нор.
ф/Мил.
кор.
до и) по степени уменьшения давления С^. Диаграммы отображают
фазовые отношения: а) при достаточно высоком давлении С^, чтобы
сохранить все железо в окисной (Ьорме; б) при несколько понижен-
Шп.
Hop .\mS ^£
FeOFetD3 (mJ А1Д FeO FetO3 (з) Alt03 Fe0 Fet03 (и/А1г03
ном давлении О2; в) при давлении С^в 1 атм; г-з) при давлении
О2 в 0,9; 0,8; 0,5; 0/4 L и 0,2, соответственно; и) приблизительно,
при давлении О2 в 10"3 атм.
Muan A./.Am. Ceram, Soc., 1957, 40. 2, 425-428
216
Al203-Fe°_Fe203-Y203
A12O3-FeO-K2°L-SiO2
Ч°з 1469*1555* YFeO,.
Мол. %
Ye03 системы лейцит-фаялит-двуокись кремния. Заштри-
хованы поля некоторых кристаллических фаз и
пересечение области несмесимости жидкостей с
Фиг. 832. Фазовые отношения в системе
—FeO—Al2^ на воздухе. Потеря кислорода из жидкой
и твердой фаз не показана.
Van Hook H.J. J.Am.Ceram.Soc.,1963, 46, 3, 122
Корунд (тв.р-р)
Гранат (тв. р-р)
1,25^3
Шпинель (твр-р)
+ Ж
АЧ°з
\зЗАЧ,67°3
Корунд (тв. р-р)
+Ж
£__
Гранат (е
+Корунд (d
Ж(с)
Шпинель (а)
+Kopynd(dt
+Ж(Ь)
FeA
Фиг. 833. Фазовые отношения при изобарическом
сечении на воздухе, при 1550 С. Потеря кислорода
из различных фаз не показана
Van Hoolr Н./. J.Am.Ceram.Soc., 1963, 46, 3, 123
поверхностью ликвидуса. В области АА’СА две жидкости
находятся в равновесии с минералами двуокиси крем-
ния. В области A A’DBA две жидкости находятся в рав-
новесии с кристаллами фаялита. На линии АА’ две жид-
кости (А и А’) находятся в равновесии друг с другом
и с кристаллами двуокиси кремния и фаялита. Все рас-
плавы содержат Fe^O^ в количестве, соответствующем
равновесию с чистым металлическим, железом. Прибли-
зительные значения температур в точках: А и А' -
1440 , В и В’ - 1150 , С - 1270 , Д - 1100°
Roedder Е. Am.Min., 1951, 36, р. 283
А1203-FeO—MgO- SiO2
°с
1500
500
1000
20 40 60 80
Фиг. 835. Диаграмма равновесия системы
Mg2A14Si5Oi8-Fe2AI4Si5Oi8 (На анаграмме ие пока-
заны отдельно высокотемпературная и низко-
температурная модификации).
Miyashiro A. Am.J.Sci. 1957 , 255. 1, 58
8 28
217
Al,0_- FeO-Na,О-SiO,
4 О 4 4
Фиг. 836. Диаграмма равновесия системы альбит-
фаялит
Bowen N.L., Schairer J.F Proc. Nation. Acad. Sci.(U.S.)
1936,22» 6, 349
Фиг. 837. Диаграмма равновесия системы NaAlSiC^—
FeO-SiO2« Равновесия в области герцинита - не тройные
Bowen N.L. Am. J. Sci., 1937, 33. 193, 9 у
Вес. °/o
Al2°3-Fe2O3-Na2°-SiO2
Фиг. 838. Псевдобинарная диаграмма для се-
чения нефе лин-акмит.
1 - данные Yagi К. (Camegie Inst. Washington, Year
Book, 61 ,(19C 1 -1962) » p99); 2 - новые результаты
Bailey D.K., Schairer J.F. Camegie Inst., Washin-
gton, Year Book 62 (1962-63), 1963, p. 125
218
А1,0 ,,-F е ,0 ..-Na ,0-S i0
L о л •» &
Фиг.839. Диаграмма путей
I
5.
(N^O-A^Oj-SiOj)
С'а-З
760*5°
£^816*5° E*800*5° fl732*5<
*54’8 I Am lAS
/еф] Нс Негт5:1:8 Ami Неф
G *740*5°
I KO
AS U5 M
Amklc Am
—<£? <•£, (Na20-Fe203-Si0p
(NOjO-AIjOj-SiOT)
He<pFin5*5*
Карн
Гт Нс
Карн
Нс~~
'Неф
5-1-8
Нс
Ас
Гт
Гт
Негр
Нс
548
Гт
809*5°
$
Гт
Гт
Нс
Карн
Нс
nc Am l Am
Неф 5"fQ 5:1:8 5:Щ 54:8
UM“ ^$15*5°
пвф
Am
54 8
Л Ac
-778*5°
Неф
Am
54: в
W*5*Xc [ Х/с 76ff*5*
Ат
AS
Негр
Ат
« &
AH Ac
Am >P
"b »9t (NB.O-Fe.tL-SiOJ
867*3 г
I
-ГМу?
1м
9*955*5°
(Het0-Fe20j-Si0p
(No,0-Al20,-Si0p (NajO-Fe.Oj-Stiy
M 11050*10° 9,11970*10°
кристаллизации для части
системы Na2O—А)20з-Ре20з—
—SiO2, показывающая моно-
вариантные линии, соединяьт-
щие различные тройные точ-
ки (маленькие кружочки ) и
четверные точки (квадратики).
На диаграмме показаны толь-
ко фазовые отношения (без
учета масштаба). Часть, изо-
браженная штриховыми лини-
ями, не изучалась н пред-
ставляет вариант, когда воз-
можны только ограниченные
твердые растворы между ге-
матитом и корундом.
5:1 :8 5Na2O-Fe/)3.8SiO2
Bailey D.K., Schairer J.F,
Carnegie Inst., Washington,Year
Book 62 (1962-63), 1963, p. 128
Гт .
Неф
л» *’“*
гт I
неф
Am
i \Ггп
-AS
^Негр
^стХает
(Маг0-А1г03-510р
““’Ч'^неф
R *1270*10°
(Na20-Al,0<SiOp
Гт
Неф
<Е
45 ’ Хл
4«W
Гт
AS
-+-
Hop
Гт
---(Al^Oj-Fe^-SiOp
Мцл\*p
KoA
Hop T Hop
N H04±10°
(Na^O-Al^Oj-SiOp
Акмит С Na^O - a^20j~ SiOp
(NazO MSiOp
Hem
Нефелин
Жадеит
Фиг. 840. Фазовые отношения в части диаграммы нефе-
лин-жадеит-акмит - (Na2O«4SiO2), показывающие бли-
зость расположения четверной реакционной точки Д (аль-
бит + нефелин + акмит + гематит + жидкость) к трой-
ной реакционной точке (нефелин + акмит + гематит +
жидкость). Фазовые границы на поверхностях фигуры по-
казаны тонкими линиями (штриховые линии на двух 'не-
видимых* гранях). Моновариантные кривые, соединяю-
щие грани тетраэдра, показаны толстыми линиями
A10-K0-Mg0—SiO
£ а £
А1А
вес. %
Фиг. 841. Штриховые линии на диаграмме по-
казывают положение пяти трехфазных ассоциа-
ций в тетраэдре, представляющем четверную си с-
тему K2O-MgO-Al/)3-SiO2 .Три грани тетраэдра
лежат в горизонтальной плоскости основания.
Schairer J.F. J.Am. Ceram. Soc., 1954, 11, 505
Bailey D.K., Schairer J.F. Carnegie Inst., Washington,Year
Book 62 (1962-63), 1963, p. 131
219
А1Рз-К20^М^°-8Ю2
Орт Лц Сан Тр, Крист
Фиг. 842. Диаграмма состояния системы
KAISiO4-Mg2SiO4-SiO2
Слева, вверху проведены показатели светопрелом-
ления стекол.
Luth Ж.С. J.Am. Ceram. Soc., 1967, 50, 4, 174
Фиг. 843. Схематическое изображение диаграммы
системы в виде тетраэдра, несколько искажен-
ного, чтобы показать положения двух меньших тетраэд-
ров: лейцит-корунд-шпинель-кремнезем и лейцит-форсте-
рит—шпинель—кремнезем, и положение двух пограничных
поверхностей: лейцит-корунд-шпинель и лейцит-форстермт-
шпинель, соответственно
Schairer J.F. J.Am. Ceram. Soc., 1955, 38, 5, 153
(MgO-AlgOj-SiOp
C
*146Qot5”
(MgthMA-SiOJ
(K20-Al20fSi0p
ь •—-—
а 1453*5" Шп.
<4315*10*
Лц.
Кор.
Мул
Мул Мул
Корд. Шп
Сапгр. Сапгр
Корд
в Сапу. <м90-А1г0э-5г(Ц
' * Шп 1482*3#
Лц
. Шп
Д> <|>
Лц-Шп-Кор Кор
Лц
Шп
Мул
КорЛц
Мул.
ШгГ
Мул Лц
Корд Шп
Шп Мул
C"
Мул
Корд
>1140*20°
К^пш. *~пш
Мал
\мУл/п^а.
К-п.ш
Мрл.
Корд.
П
(Mg0-Al203-5ity
Кор.
Мул.
Шп.
(>1575*5'
к —
ШцгФо-ШпУШп.
Лц. Лц
1318*3*-^°#
Лц.
Фо. *
Шп. 4?
Корд.
Фо
Шп. 3
(NgQ-Al-O.-SiO,) **
’ 21 2 Пэнс В
1360*5* Корд
Корд.
(MgO-Alft-SiOp
Лц Фо
Фо Пэнс
Цорд Лц
Лц.
К-п.ш.
Корд.
1 '-1130*20°
Пэн^
Корд
Фо
Пэнс
I <Лц
71200*20°
1Лц-Фо~^\С^\
(MgO-Al.O,-SiOJ
F
• 1443*5°
970*20
Корд. К-п.ш
Мул. Корд
Тр Мул.
, Гр. (K.tni.a.-sn.i
Мул 985*20^
Корд. Энс
К-пш. £
Гп Тр
Тр к-п.ш.
Корд.
К-п.ш.
Пэнс.
Корд.
/Пэнс
К-п.ш^
41 Корд^
Лц.
Пэнс.
лК п.ш
: 71140*20°
{ЛЦ-Фп-SiC^
Крист
Тр
Энс.
К-п.ш.
Корд
Эн
Тр
Корд
Пэнс
Энс
К-п.ш
j^Kopd Пэнс
г Энс
Корд
Пэнс
Энс
К-п.щ
S
Крист
1470*10° Тр 1470*10° 1470*10° Ур 1470*10°
•т п» •
Мул ПЭНС
(MgO-AlO-SiOf (К O-Al^Of SiOp (Mg0-Alt03-Si0p (K20-Mg0-Si0г1
Пэнс
Энс
Тр
Корд
/ Пэнс
Энс
Тр
* Пэнс.
Тр
Корд
<1345*5° .
h
(МдО-АЪг03-8<021
Фиг. 844. Диаграмма, по-
казывающая моновариантные
линии и их отношение к трой-
ным инвариантным точкам
(небольшие черные точки и
буквы от а до.о) в погра-
ничных системах и к чет-
верным инвариантным точ-
кам (большие черные точки
и заглавные буквы). Все
моновариантные линии явля-
ются кривыми линиями, но
для простоты показаны в
виде прямых. Эти линии и
точки не лежат в одной
плоскости.
Schairer J.F. J. Am.Cr—
ram. Soc., 1955, ЗВ, 5, 151
220
221
222
А|,О3-К2О - MgO - Sio2
Муллит
3Al„(k-ZSiO
Корина
60SM630*20°
1550
1478*3
/ 1550
--4-—
Кордиерит 20 1460*10 40 60 Шп. 80 Пол.шп.
ZMgO-ZAX2O^5StO2 Вес. % 1370*10° K20-AX203*6Si02
Фиг. 852. Диаграмма равновесия для частного сечения
кордиерит - муллит - калиевый полевой шпат.
Schairer J.F. J.Am.Ceram. Soc., 1954, 37. 11, 522
1470*10°
1460*10°
80
990*20°
1150*20°
ЛЦ
1686*5°
Ъ-П.Щ.
40
1062*3°
40
A12O3"K2O~Na2O-SiO2
SiO.
1713*5°
20 1404*5° 40
Карн
K,NaAlSiOM
фб.р-рц
^l-n.LU.
1118 3
60
1068*5
80
1280*
1526*2° _
NaAlSiO,
No,К Нефелины
0-рамо
20
1615*10°
Вес. %
1750°
601588*5° 80 КАШ°ч
Фиг. 853. Исправленная диаграмма равновесия системы
NaAJSiO^—KAlSiO4—Si02 » показывающая положения
разреза щелочных полевых шпатов.
Schairer J.F. J. Geol., 1950, 58, 5, 514
Фиг, 854. Разрез для щелочных полевых шпа-
тов: KAlSi3O8-NaAlSi3O8.
Яйрные сплошные или штриховые кривые относятся к
бинарному равновесию. Тонкие сплошные или штриховые
кривые относятся к тройному равнош»опг>
Schairer J.F. J. Geol., 1950, _§8, 5, 515
223
Al2O3-K2O-Na2O-SiO2
A1„O„—Li 0—MgO—SiO
Фиг. 855. Пре а полагаемая фазовая анаграмма равнове-
сия оля щелочных полевых шпатов (альбит - ортоклаз),
построенная на фазовых отношениях, наблюдаемых в
естественных породах.
Smith J,V. Report of the Twenty-First Session,
Norden, 1960, part. XXI, p. 190
25% MgO
Фиг. 857. Температуры ликвидуса и первичные фазы
в сечении, содержащем 75% кремнезема в тетраэдре
составов Li2O-MgO-Al2O3-SiO2
Prokopowicz T,l.t Hummel F.A., J.Am. Ceram. Soc.,
1956, *£9, 8, 270
1600
1200
800 к
400 -
20
KAIS1O4
40
Вес. %
NaAISIO4 # 60
Na3KAI4Si4016
Фнг, 856. Фазовая диаграмма для частного разреза
NaAISiO^-KAlSiO^. Диаграмма представляет попытку
определения поля стабильности для .новой фазы тетра-
кальсилита (Кс^)
О| -орторомбический кальсилит
55% MgO
\4443
(s 1351 \ W
1083'\1025 1039 "«50 1279
35 °/oUzD
35%AIJ33
g 1234 1331 \ 1391 X
«29 «95 1306\ 1365 \
1039 1078 «60 1273\1292 1
1089 )020 1089 1211 1328 131$'
\
Z Н70 1137 1091 \1039 1156 1285 1390
* • • • । • • • •
/ fi- Сподумен
Tuttle O.F., Smith J.V. Am. J. Sci., 1958, 256. 8,
573
Фиг, 858^ Температуры ликвидуса и первичные фазы
в плоскости сечения, содержащей 65% кремнезема в
тетраэдре составов I^O-MgO-A^Oj -Si02
Prokopowicz TJ., Hummel F.A. J.Am. Ceram. Soc.,
1956, 39, 8, 271
224
Фиг. 859. Тетраэдр составов, с частными тетраэдра-
ми внутри его.
Prokopowicz ТЛ; Hummel F.A. J. Am.Ceram. Soc.,
1956,_39,8,274
Фиг. 861. Диаграмма состояния системы
Mg^SiO4 -LiAJSiO4
Dittler Е., Hoffmann A.Chem. Erde, 1937 11 2
°C
1500
1300
900
a
7
100 00 60 .00 20 0
Кордиерит gec Сподумен
Фиг. 860. Сечение кордиерит-сподумен
Область А, делится на две части: 1) содержит а-кордиерит,
тв. р-р; муллит; шпинель; 2) содержит те же фазы + жидкость.
Область В делится на пять подобластей: 1) жидкость, муллит,
шпинель, корунд; 2) жидкость, муллит, шпинель, р = сподумен;
3) шпинель, р = сподумен, корунд; 4) муллит, шпинель; р = спо-
думен; 5) шпинель; р = сподумен. Область С состоит из: а =
кордиерит; р =сподумен; шпинель.
Karkhanavala M.D., Hummel F»A, J.Am. Ceram. Soc.,
1953, 36, 12 , 394
Фиг. 86Эь Системы
Mg2Si2O6-LiAlSi2O6,
N^SiO^—LiAlSiO^
Dittler E.t Hoffmann A.
Chem Erde, 1937,11, 2,
276
29
225
Al203-Mg°-Na20-Si02
Al2O3-MnO-SiO2-Y^ 03
°C
1700
1500
1300
1110^3°
1100
Форстерит +Ж
27. ।
Фиг. 864. Частный
разрез альбит (NaA lSi30g)
- форстерит ( Mg2SiO4)
Schairer ]. F.t Yoder H.S.
Jr. Carnegie Inst., Washington,
Year Book 60,(1960-61)»
143
H03tZ°
Аб'Фо
1050*20'
Альбит It <0 ft 80 Форстерит
Na^AI&KiOi tec. % ZMgO SiO,
Bee. °/o
Фиг. 866. Диаграмма равновесия для системы
A12°3-M8°-SiO2- Zr02
Фиг. 865. 'Отношения твердых фаз в системе
Z -ZrO2
Herold P.G., Smothers W.J. J. Am. Ceram
3 MnO - A 12O 3-3S i 0^-3 Y2 O3-5 A12O3 •
Yoder H.S.Jr., Keith M.L. Am. Min.1951, 36, 7-8, 524
CaO- Cr2O3 -CrO3-MgO
Soc., 1954, 37 , 8, 353
Фиг, 867. Сечения в четверной системе
MgO—CaO—Сг20з— СгОз;
А - при температурах до 800°С; Б - при температурах от 800
до 1000 на воздухе
Ford.W., Rees Г. Trans. British Ceram. Soc., 1949, 48,
8, 308
226
CaO - Cr2 O3- CrO3 -MgO
°C
2200
2000
1800
>1600
14оо'—1—±
20
МдСггОч
Шп+Ж
Ж
1590*104 Шп+ЪЛ+Ж
1610*104_______,
Mi+М+МяЬ+Ж j
1490*104 V
Шп + СН56
_Сг$+МдО+Ж
$+МдО^
HLMSj-W
w 6
40 60
вес. °/о
80
ЗСаО-MgOZSiO.
(с3му
Фиг. 868. Сечения в четверной системе;
А - при температурах выше 1000 на воздухе; Б - в вакууме
Ford Ж., Rees Ж. Trans. British Ceram. Soc.,
1949, 48. 8» 308
Фиг. 870. Фазовая диаграмма системы МвСгэОи-
СазМ^Ой.
El-Shahat RJi., White j; Trans. British Ceram.
Soc., 1968, 9, 497-519
CaO—Cr2 0 MgO—S iO 2
20 40
Фиг. 869. Фазовая диаграмма системы MgC^O^— СаО*
•MgO’SiOn как частное сечение тройной системы
MgO—С г JDq—CaO-SiOn •
El-Shahat R.M., White J. Trans. British Ceram.
Soc., 1966, 6, 321
1760*10°
МдСгД
Вес. %
60 80 Монтичеллит
(CMS)
227
Фиг. 871. Приблизительные составы конденси-
рованных фаз в системе СаО—MgO- окислы
железа на воздухе при 1500°С.
Johnson R.E., Миап Л. J. Am. Ceram. Soc., 1965, 4S,
7, 363
СаО-FeO-Fe2O3-SiO2
Фиг. 873. Диаграмма фазовых отношений при темпера-
турах ликвидуса в системе окись кальция - окисел же-
леза-кремнезем на воздухе. Линии, оттененные с одной
из сторон, приблизительно показывают границы области
двух жидкостей. Пограничные кривые и изотермы лик-
видуса проведены штриховой линией в областях, где их
положение является неопределенным.
Phillips В., Миап A. J. Am. Ceram. Soc., 1959, 42, 9, 417
Фиг. 872. Приблизительные составы конденсированных
фаз в системе СаО—MgO - окислы железа при Pqq =
10~9 атм и 1500°С.
Johnson R.E., Миап A. J.Am. Ceram. Soc., 1965, 48,
7, 364
Si02
CaOTe203
Фиг. 874. Диаграмма, иллюстрирующая положение изо-
барической плоскости при 0,21 атм Qg, внутри тетраэд-
ра системы CaO-FeO-Fe2Q3-SiO2.
Жирные сплошные и штриховые линии - пограничные кривые; ли-
нии, оттененные с одной стороны, - область двух жидкостей, и тон-
кие пунктирные линии приблизительно проходят через точки поверх-
ности ликвидуса, имеющие постоянное отношение Fe2+/Fe^+, как
показано над каждой кривой.
Phillips В., Миап A. J. Am. Ceram. Soc. t 1959, 42. 9, 417
228
CaO -FeO-Fe2O3-SiO2
7J°C
1800
Ж
1600
*
*
1400
3CaO-2StO2+
CaOSi02*3CaOZSiO£
ICaOZSiOg+Z
CaO-SiOg+ЗСаО-
•2SiO+Гт.
1200
/ \
CaO-StO.+W / \
I X
I 2CaOSiO2+W \
3CaO-2SiO.*2CaO SUb
Sity-Гт+Ж
iQZFe'O-ZCaO-
•stp^w /
Ca0-Fe203+
. 2CaO-$iO2+
• +Ж
2Ca0-Fez0/
•Ca0-Fe203+
ZCflO-SiO,
20 40 60
CaO*SiO2 /Вес °/о ZCa0 Fe203
CaO- Z Fe203+ fm+ZCaO-StOg Ca0fe203+ CaO- ZFe2O3+
+2 CaO-SiO.
Фиг. 875. Фазовые равновесия в сечении CaO’SK^—
—2CaO*Fe2O^ для системы CaO - окисел железа -
кремнезем на воздухе.
Жирные линии показывают отклонение от бинарных отношений в
результате присутствия небольших количеств Fe^ в жидкой фазе;
тонкие линии используются для показу той части, где составы кри-
сталлических фаз нельзя выразить в виде выбранных компонентов
Phillips В», Миап A. J. Am. Ceram. Soc., 1959, 42,
9, 421
CaO—FeO—MgO—SiO 2
Фиг. 876. Диаграммы фазовых отношений при темпера-
турах субсолидуса в системе СаО - окисел железа -
кремнезем на воздухе
а - диаграмма показана для температуры несколько выше 1155°С,
б - диаграмма для температуры немного ниже 1155°С.
Phillips В., Миап A. J. Am. Ceram. Soc., 1959, 42.
9, 422
Фиг. 877. Диаграмма, показывающая положения
составов и схематическое представление инва-
риантных точек ликвидуса в системе CaO—MgO—
-FeO-SiO2
А - 1100°С; Б - 1125°; В - 1160°; Г - 1175°; Д - 1180°; Е - 1200°;
Ж - 1450°С. Диаграмма дана noRickerR.W. ('Phase Equilibria in
the Quaternary System CaO-MgO-FeO-SiO2. Ph.D, dissertation
the Pennsylvania State Univ., 1952) и модифицирована Osborn E.F.
(Regional Tech. Nettings, Am.'Iron. a. Steel Inst., 1954, 145-177).
Osborn E.F., Muan A. Physical Chemistry Steel
plant refractory. Electric furnace Steelmaking, 1963, v. II, p. 274
229
CaO_FcO-MgO-SiO2
Монтичеллит (CaOMgO'SiOj)
FeO
«70 °C*
CaO *SiO2
1305
80
20 12034 40 00
Fe-Окерманит Fe -Монтичеллит
(ZCaO FeO ZSUy (CaO-FeO SiO^
1400°V^M L/370*
I
1452\i353\J^
1355
1345
1345
Мербинит
(3CaOMgO2SiOa\
Окерманит
(ZCaOMgOZStO^
14544
1310
I
I
>1313}
4298
Фиг. 878. Диаграмма равновесия области СаО*
•SK^—монтичеллит-FeO как частное сечение
системы CaO*SiO2-MgO-FeO
Scftafrer /.F.rOsbom E.F. J. Am.Ceram. Soc.,
1950, 33, 5, 164
aCaO SiOai- Ж
1383
1370
14004
40
1345
ч>
c=
<3.
L
1200
Окерманит (ZCaQ-МдО- 2 Stop
14544
1 /
<3
800 f
20
1449
428
1370
1305
80
£
CaO*$lOt
/5W°C
1353 ^281^
/ 1313 ji3ft
/ I J1318 / I
1498^ \l 1285^0
1523 /
20 \ 1203°^l0 60
Vz-Окерманит Ve-Монтичвллит
12084
Bee. °/o
1355
1345
Фиг. 879. Диаграмма равновесия области СаО*SiO2-
-окерманит-FeO как часть диаграммы CaO*SiO2 -мон-
тичеллит-FeO, в увеличенном масштабе
Schairer J.F., ОзЪот E.F. J. Am. Ceram. Soc., 1950, 33,
5,165 ~
° /£>‘4 ,
g \ /«’ж jF /
'ur CaO'SiO>/lM*0»
!
<> |CO X J
s
§ \^1
/
2CaO-FeO-ZSiOz 20
{Vt-окер манит)
FeO
13704
40
60
80 ZCaO*MgO*ZSiO£
Окерманит
Фи г.880. Предварительная диаграмма равновесия для
мелилита (2CaO*FeO*2SiO2-2CaO*MgO*2SiO2)
Жирные штриховые линии относятся к бинарному равновесию;
тонкие штриховые линии оконтуривают области, в которых есть
фазы иного состава, чем мелилит. В жидкости присутствует не-
которое количество Диаграмма подвергается пересмотру
для получения сведений по стабильным отношениям окерманита
примерно ниже 1325°С
Schairer J.F», Os bom E.F. J. Am. Ceram. Soc., 1950,
33. 5, 167
230
СаО-FeO -MgO-SiO2
1389°
Волл.
1540°
1285°
<1370
Тс
] ИллиТ"]
020‘j •1310°\l305°\^
1485° \
1525
Пволп
'<00
woo*
1250
/
Волл.-53,64
Энс. -46,36 *u'
1391,5'
1577
Энс.
1368°
1358°
j,—'321
ч\.Х» \ У^пир^>-/^
\ \ /\ ,3!° / 1450J
.>4t'_
1400 1470
гд Волл-4682
Tc- 53,18
1208*
1160°
Фиг. 1881. Поверхности ликвидуса в системе CaSiCL-
—MgSiO^—FeSiO^, построенные по системам: Boyd F.R.,
Schairer J.F., (Camegie Inst., Washington. Year Book 61
(1961-1962), Bowen N.L.,Schairer J.F., Posnjak E. (Am.
J. Sci., 1933, 26, 193-284); Bowen N.L., Schairer J.F.(Am.
J Леи, I 1935,29, 151—217); Tumock A.C. (Camegie Inst.,
Washington, Year Book61(1961-1962); Schairer J.F.,
Yoder H.S. (1961-62).Все фазы находятся в равновесии
с чистым железом. Поскольку Рф меняется, содержа-
ние Fe2O3 в жидкости является неопределенным.
Yoder H.S., Jr., Tilley С.Е., Schairer J.F. Camegie Inst.,
Washington, Year Book 62 (1962-1963), 1963, 121
1470°
Около 1400
3 CqO* Р|0$
40
£ /У7
СаО-FeO-MnO -P 0
2 5
FeO* MnO
40 60
CaO, to, %
80
CaO
•V
’S' n
3lFeO.MnO)-V,
Kn.nu.
Onu
0л
A
Клпи+Опи
+ 0л+Ж
В
Клпи
Omt
3( Клпи+Ол+Тр+Ж
С •Кл пи
Вцл
v+lp+Ол+Ж CFS
1W5°
ж
<1093°G
1386Л
MFS
Кл пи
Волл
ил
К л пи
Мел
Волл
Кл пц+Мел+Волл+
+Ж
1170*
Клnu+Мел+Ол+Ж
Волл
М^л
Ол
й
Фиг. 883. Разрыв смесимости в системе при
содержании Мп О примерно до 10% (применялся
железный тигель)
Oelsen W., Maetz Н. Mitteilungen Kaiser—Wil-
helm Institut fur Eisenforschung, Diisseldorf.1941,
23, 12, 225
Фиг. 882. Предполагаемая диаграмма фазовых отношений
для части системы СаО—MgO—FeO—SiC^. Указанные
температуры даны по Bowen N.L. и Schairer J.F. (Am.J.
Sci., 1935, 29, 151-217); no Bowen N.L., Schairer J.F.,
Posnjak E. (Am.J.Sci., 1933, 26,-193—289); Schairer J.F.,
Osborn E.F. (J. Am. Ceram. Soc., 1950, 35Д60-167); Ku-
shiro I., Schairer J.F. (Camegie Inst., Washington, Year
Book 62 (1962-63), p. 95).
Точки А, В, С - метастабильные инвариантные точки.
Точки Д, Е, F - четверные инвариантный точки; G -
четверная точка минимума.
Yoder H.S., Jr., Tilley С.Е., Schairer J.F. (Camegie Inst.,
Washington, Year Book 62; (1962-63), p. 87
231
Фиг. 884. Фазовая диаграмма квази-бинарной системы
MgFe2O4-Ca2SiO4 на воздухе
El—Shahat R.M., White I. Trans. British Ceram. Soc.,
1964, 63» 6, 323
Фиг. 886. Система трехкальциевый фосфат - метасили-
кат магния-кремнезем (ЗСаО«Р2О ^-^MgChSiO ^-SiC^)
Sata T.t Bull. Chem. Soc. Japan, 1958, 31, 4, 408-412
CaO-MgO—P2O5- SiO2
Фиг. 885. Система трехкальциевый фосфат - метаси-
ликат магния, ЗСаО'Р^О^— MgO-SiC^
Sata Т., Bull. Chem. Soc., Japan, 1958, 31» 4, 408—412
CaO-MgO- SiO2-TiO2
Mg0-Ti02 20 40 60 80 CaO-TiO2SiO2
CaO-SiO2TiO2,5ec. %
Фиг. 887. Диаграмма состояния системы
MgO-TiO2-CaO-TiO2-SiO2 (в вес. %)
Iwase К., Nisioka V. Sci. Rept. Tohoku
imperial University, 1938, ser. 1, .26., 4, 715
232
CaO-MgO- SiO2- TiO2
Фиг. 891. Фазы, находящиеся в равновесии в системе
CaO-MgO-TiO2-SiO2
Бережной А. С. Огнеупоры, 1950, № 10, 450
Фиг. 888. Диаграмма состояния системы CaO*MgO*2SiO2-
-CaO*TiO2 (в вес. %) *
Iwase К., Nisioka U. Sci. Rept. Tohoku Imperial Univ.,
1938,ser. 1, 26, 4, 715
СаО-MgO- SiO2-ZrO2
Фиг. 889. Диаграмма плавкости сечения системы СаО—
MgO-TiO2-SiO2 плоскостью CaTiO^-^^SiO^MgO
Бережной А,С, Огнеупоры, 1950, № 10, 451
Фиг. 892. Равновесные фазы в системе
CaO-MgO-ZrO2-SiO2
Бережной А,С,, Кордюк Р,А. Огнеупоры, 1962,
№2, 89
Фиг. 890. Диаграмма плавкости сечений системы СаО—
MgO-TiO2—SiO? плоскостями CaTiO^—Ca2SiO4-Mg2SiO4
и СаТ10з—Mg2^iO4—Mg2TiO4
Бережной AX, Огнеупоры, 1950, №10,451
30
233
CaO-MnO-SiO -TiO
2 2
Фиг. 893. Диаграмма состояния системы CaO*TiO2eSiO2-
-MnOTi02 (в вес. %)
1 - термический анализ; 2 - а + MnO»TiO2; 3 -MnO.TiO2 +
стекло; 4 - а тв. р-ры; 5 - а + стекло; 8 - только стекло
/vase К., Nisi ok a U. Sci. Rept. Tohoku Imperial Univer-
sity, Ser. 1, 1936» 25» 504
Фиг. 895. Диаграмма фазовых отношений в системе MgO-
-FeO—РезОз—SiO2 на воздухе. Для простоты диаг-
рамма представлена в виде тройной системы MgO-
—FeO*Fe2O3~SiC^. Тонкие линии с тремя точками явля-
ются кривыми, приблизительно проходящими через точки
равных отношений Fe2 O^/FeO при температурах лик-
видуса. Средние линии, оттененные с одной стороны,
указывают границы области существования двух жид-
костей
Миап A., Osborn E.F. J. Am.Ceram.Soc., 1956, 3J, 4,127
Cr2O,-MgO-TiO,-ZrO,
£ О X 4b
Фиг. 894. Элементарные тетраэдры в системе MgO-
-С12О3 -Z1O2 -ТЮ2
Бережной А.С., Гулько Н.В.
Honoeiai АН УРСР, 1965, № 12, 1593
Фиг. 896. Диаграмма, иллюстрирующая фазовые отно-
шения в системе при постоянном отношении смеси
СО2/Н2= ^2* Значения различных линий на диаграмме
те же, что и на фиг. 895,
ktuan A., Osborn E.F. J. Am. Ceram. Soc., 1956, Д2, 4,
129
234
Фиг. 899. Диаграмма фазовых отношений в системе
MgO—SiOn—FeO—FenOj при постоянном отношении
смеси QO2/H2 = J0
Значение различных линий в системе то же, что и на фиг. 805
Muan A., Os bom E.F. J.Am. Ceram. Soc., 1956, 39.
4, 132
Фиг» 897» Диаграмма фазовых отношений в системе
MgO-SiC>2-FeO- РегОз при постоянном отношении сме-
си СОо/Н2= 40
Значения различных линий на диаграмме те же, что и на фиг. 895.
Muan A., Osborn E.F. J. Am. Ceram. Soc., 1956» 39, 4,
130
sto.
SiO,
Si02
MgOSlOg
MgO
2MgO*SiO2
MgO
20
1543
1557
Пи.
1861
80 Fe0-Fe20j
40 60
8ес.°/о
1170
118
1410
г FeO-Fe^Oj
Пи
1861
1370
MgO
д FeOFiBjOj
1543
1144
Фер.
Пи
1861
мв.
MgO
FeO
1178
1177
Фиг» 900. Диаграммы фазовых отношений в системах
MgO-SiO2-FeO-Fe2O3, MgO-Fe2O3-SiO2, MgO-FeO-
SiO2 ПРИ P®37™™01*1 давлении кислорода. '
Цифры указывают температуры инвариантных и псевдоинвариаит-
ных точек; а - диаграмма показывает фазовые отношения при до-
статочно высоком давлении кислорода, в результате чего по сущест-
ву все железо находится в окисном состоянии; б - диаграмма отра-
• жает фазовые отношения на воздухе; в»г,д - диаграммы показывают
Фиг» 898,Диаграмма фазовых отношений в системе
MgO-SiC^—FeOFeoO^ при постоянном отношении
смеси СО2/Н2 “ 24
Значения различных линий на диаграмме те же, что и на фиг.
895.
Пат Л., Oebopt E.F. J. Am. Ceram. Soc., 1956, J,
фазовые отношения при постоянных значениях отношения СО2/Н?
равных 40, 24, и 19, соответственно; е - диаграмма соответствует
сильно восстановительным условиям плавления в контакте с метал-
лическим железом, по Bowen N.L., Schairer J.F.( Am. J. Sci., [5th
Series] , 29, 151-217 (1985); Ceram. Abstr., 15(91,288 (1936))
Muan A., Osborn E.F. J. Am. Ceram. Soc., 1956.
22» 4, 133
4, 130
235
236
FeO—Fc О -SiO-ZrO
2 3 2 2
Фиг. 904. Элементарные тетраэдры в системе
F e2O3-ZrO2-T i02 —S i02
Бережной A.C.,Гулько H.В,' Доповш! АН УРСР, 1966,
N 2, 201
б) Системы, включающие окислы и другие соединения
CaO-CaF2
Фиг. 905. Диаграмма плав-
кости системы CaO—CaF2,
выполненная с помощью на-
гревательного микроскопа
Bartenew G.M., Rasumow—
skaja I.W.9 Sanditow D.S.
Silikat technik, 1969. 20,
3, 94
Фиг. 906. Диаграмма плав-
кости системы CaF2 —CaO
Bartenew G.M; Rasumow—
skaja I.W., Sanditow D.S
Silikat technik, 1969, 20,
3, 94
237
CaO-CaF2
Фиг. 907. Диаграмма фазовых равновесий в системе
СаО-Сар2
1 - состав температура, при которых не подтвердилось
расслоение жидкости. (Tryggve Ваак, Acta Chem. Scand., 8(9]
1727(1954)).
Hukerji Joyder J. Am. Ceram. Soc., I960, 48,
4, 212
Фиг. 910. Фазовая диаграмма бинарной
системы MgO-MgF2
Hinz W., Kun th P.O. Am.Min
I960. 45. 11-12, 1214
Фиг. 908. Линии ликвидуса и солидуса
в системе СаО—CaF2
Будимое ПЛ., Тресвлисмб С.Г.
ДАН СССР, 1953, §9, 3, 1428
МдО, дес, Чо
Фиг. 911. Фазовая диаграмма системы
MgO-MgF2
Berak J., Tomczak I. Roczniki Chemii,
1965, 39. 4, 521
Фиг. 909. Диаграмма фазового равно-
весия для системы MgO-MgF2
Tomlinson J.W., Welch В.J Anorg.
nucl. Chem., 1966, & 10, 2134
238
соли
Введение
Плавление солей в природных условиях наблюдает-
ся сравнительно редко, поэтому диаграммы плавкости
солевых систем мало используются в геологии. В на-
стоящем справочнике из большого числа изученных
солевых систем отобраны лишь самые необходимые.
Они могут представлять интерес в связи с изучени-
ем минералогии контактов солевых толщ и извержен-
ных пород или солевых минералов в областях высо-
ких ступеней регионального метаморфизма.
Пути кристаллизации из расплавов солевых систем
мало отличаются от описанных выше путей кристалли-
зации в многокомпонентных силикатных и окисных си-
стемах. Основное отличие состоит в том, что среди
солевых равновесий нередко встречаются системы,
включающие несколько катионов и несколько различ-
ных анионов, называемые взаимными. Силикатные и
окисные системы содержат, как правило, единствен-
ный простой анион О и поэтому взаимные системы
среди них не рассматриваются.
Взаимные системы являются частными сечениями
систем более высокой компонентности, например трой-
ная взаимная система NaF-KF—NaCl-KCl (или Na,
K/F.C1) может рассматриваться как плоское сечение
в тетраэдре четырехкомпонентной системы Na—К—F—С)
(фиг. I )•
В простейшем случае, когда одна из диагоналей
квадрата составов тройной взаимной системы являет-
ся температурным барьером, его можно рассматри-
вать как два треугольника составов двух независи-
мых тройных систем, сложенных вместе обшей сто-
роной. В качестве примера можно привести диаграмму
плавкости системы K,Na//F,CJ (см. фиг.961).
Точкой конечной кристаллизации всех составов,
попадающих в треугольник KF-NaF—КС1 является е р
а для треугольника NaF— NaC] — КС! точка в2- Таким
образом, пути кристаллизации никогда не пересекают
диагонали NaF—КС] (называемой стабильной диаго-
налью), и рассмотрение последовательностей фазовых
изменений при кристаллизации или плавлении можно
проводить раздельно для треугольников NaF—КF—КС 1
и NaF—NaCl—КС] так, как это описано выше. Систе-
мы такого типа носят название необратимо-взаимных.
Несколько более сложным является случай, когда
ни одна из диагоналей квадрата составов не является
температурным барьером. Пример такой системы изо-
бражен на фиг. II. Точкой конечной кристаллизации
для составов, попадающих в любой из треугольников
является е. Рассмотрим, например, путь кристалли-
зации исходного расплава.
Первой кристаллической фазой, выделяющейся из
этого расплава, является АХ, при этом состав распла-
ва изменяется вдоль отрезка прямой I—II. При дости-
жении жидкой фазой состава точки II вместе с кристаля-
лами АХ начинают выделяться кристаллы ВХ и при
дальнейшем понижении температуры состав расплава
изменяется вдоль линии П-р. При достижении соста-
вом жидкой фазы точки р в равновесии с расплавом
могут находиться три твердых фазы АХ. ВХ и AY. В
этом случае может начаться реакция [AXJ+ Lp=[A]+[BX]>
где квадратные скобки обозначают кристаллические фа-
зы, a L - жидкость, отвечающая точке р.
В случае кристаллизации по равновесному пути весь
расплав остается в зоне реакции, которая потекает при
постоянной температуре вплоть до израсходования жид-
кой фазы, после чего в системе остаются три твердые
фазы: AY, АХ и ВХ. В случае кристаллизации по фрак-
ционному пути жидкая фаза удаляется из зоны реакции
и при дальнейшем ее охлаждении произойдет совмест*-
ная кристаллизация AY и ВХ, при этом состав распла-
ва будет изменяться вдоль линии ре. Точка е является
тройной эвтектикой, в которой при постоянной темпе-
ратуре происходит совместная кристаллизация фазАУ,
ВХ и BY вплоть до исчезновения расплава.
Таким образом, для систем подобного типа харак-
терно пересечение путями кристаллизации обеих диа-
гоналей квадрата составов.
Во взаимных системах, как и в обычных, возможно
образование конгруэнтно и неконгруэнтно плавящихся
соединений и твердых растворов. Рассмотрение путей
кристаллизации в этих случаях в принципе ничем не
отличается от систем невзаимных.
Для изображения диаграммы состояния четырехком-
понентных систем используется треугольная призма
(см. фиг. Ш)* Подобные призмы разбиваются плоскос-
тями, проходящими через точки составов равновесно
сосуществующих соединений на отдельные тетраэдры,
в пределах которых рассмотрение путей кристаллизации
в принципе не отличается от обычных четырехкомпонент
ных систем.
238 а
Отложение природных солей протекает, как правило,
в результате испарения воды из рассолов в сравнитель-
но узком температурном интервале. Поэтому наиболь-
шее значение для физико-химического анализа галогене-
за приобретает использование диаграмм изотермической
растворимости водно-солевых систем при 0 и 25 С.
Фиг. III
Для их изображения предложено несколько различных
способов. Наиболее удобно изображение солевого со-
става в виде отрезка прямой для тройных систем тре-
угольника (для невзаимных) и квадрата (для взаимных)
четырехкомпонентных систем и пространственных фи-
гур для пятикомпонентных систем. Содержания воды
при этом изображаются таким же образом, как темпе-
ратура на диаграммах плавкости: по оси, перпендику-
лярной оси состава для тройных систем, в виде линий,
равных содержаний воды или поверхностей для четы-
рех - и пятикомпонентных систем соответственно (см.
фиг. IV).
Фиг. IV
Рассмотрение путей кристаллизации при испарении
воды по таким диаграммам в принципе ничем не отли-
чается от выяснения путей кристаллизации при охлаж-
дении по диаграммам плавкости. Например, при испа-
рении воды из раствора с солевым составом, изобра-
жаемым точкой X (см. фиг. V), первой кристалличес-
кой фазой, выпадающей из раствора, является соль 2.
Фиг. V
В ходе выделения этой твердой фазы солевой состав
раствора изменяется вдоль линии XY, являющейся от-
резком прямой, соединяющей точку X с вершиной гсоль
2". После достижения точки Y начинается одновремен-
ная кристаллизация твердых фаз гсоль 1г и гсоль 2Г
(состав раствора при этом изменяется вдоль линии
Хе). В точке е происходит одновременная кристаллиза-
ция всех трех солей вплоть до полного исчезновения
раствора.
Особое значение для минералогии природных солей
имеет пятикомпонентная взаимная система Na, К,
// С1+ S04+ Н2О. Для полного изображения солевого
состава растворов этой системы требуется треуголь-
ная призма (см. фиг. VI).
КС1
Фиг. VI
Обычно пользуются проекцией поверхностей совмест-
ной кристаллизации различных кристаллических фаз с
галитом на диагональную плоскость Na2SO4—КС1—
MgC^ (см. фиг. 1050, 1051). Эта диаграмма позволяет
проследить пути кристаллизации при испарении раство-
ров, близких по составу к морской воде. При испаре-
нии океанической воды (точка ОК, фиг. 1050) при рав-
новесной кристаллизации из раствора выпадают следую-
щие фазовые ассоциации: галит---галит + астраханит —
галит*- эпсомит—галит+эпсомит+каинит---галит+гекса-
ги дрит+каинит — галит*-кизерит+каинит галит+карнал-
лит+кизерит---галит+карналлит+кизерит*-бишофит.
Исследованиями Н.С. Курнакова установлено, что
при испарении морской воды ряд кристаллических фаз,
которые должны выпадать в случае равновесной кри-
сталлизации, вследствие влияния кинетических факто-
ров, не выделяются из раствора. В результате вместо
равновесной фазовой диаграммы (4иг. 1050) следует
пользоваться метастабильной гсолнечнойг диаграммой
Н.С. Курнакова (фиг. 1051), Согласно этой диаграмме
при испарении морской воды должны появляться сле-
дующие ассоциации кристаллических фаз: галит—га-
лит + эпсомит галит + гексагидрит галит + гексагид-
рит +карналлит — галит + гексагидрит + карналлит + би-
шофит.
Фиг. VII
Кроме описанных выше диаграмм для изображения
фазовых равновесий в тройных водно-солевых систе-
мах, в настоящем справочнике широко использованы
диаграммы весовых процентов обеих солей, нанесен-
ные на треугольные'координаты. Фактически такие ди-
аграммы ничем не отличаются от концентрационных
диаграмм в виде прямоугольных треугольников, широ-
ко применяемых при физико-химическом анализе па-
рагенезисов минералов (Коржинский, 1957) (см. фиг.VII).
Для целого ряда водно-солевых систем, имеющих
второстепенное значение, приведение графического ма-
териала оказалось нецелесообразным. Данные по раст-
воримостям для этих систем приведены в виде таблиц.
В случае неббходимости читатель без труда может
сам построить соответствующие диаграммы.
238 6
Карбонаты
BaCO.-CaCO,
CaCO,—MnCO,
<э .*
Фиг. 912. BockeH.E, Nat иг. forsch. Ges. Halle
a.d.s., 1911, J
Фиг. 915. Goldamith J,R,,
Graft D.Le Geoch. Cosm.
Acta, 1957, 11, 321
Cs£O3-K2CO3
Фиг. 913. Kroger C., I liner K.W., Glaeser V. Z.
anorg. alJgem. chem., 1943, 251. 271
Фиг. 916. Nitfli P. Z.anorg. allgem. chem., 1919,
106, 131
Нитраты
CaCO3-MgCO,
KNO3-NaNO3
Фиг. 914.War*er R.I., Tuttle O.F. Am. J. Sc»., 1855,
253, 279
Фиг. 917. Kottar Л.
Mantsh. Chem.,
1955, 86, 646
239
Фосфаты
А ЦО 3-SiO2-P2O.-Na2O-CaO
CaO-CaF2-P9O5
Фиг. 918. Мелентьев Б.Н., Ольшанский Я.И. ДАН
СССР, 86, 1126, 1952
C3P CaF2,flec.% —► CaF2
Фиг. 921. BerakJ. Hoczniki chem., 1962 , 36, 3, 403
Фиг. 922.Trome! G.f Hill Ж.Е., Faust G^Tm, Rey-
nolds D.S. Am. J. Sci., 1944, 242, 469
ДЗСа0Р205+«2Са0-Р20,
CaO-CaCl 2-CaF2-P2O5
Фиг. 920. Точки Е, е., е , eQ - эвтектики, Р- пере-
1 л О
ходная
Nacken R. Min, Geol., Palaontol., 1912, 545
CaO-P.,0.- SiO
Фиг. 923. Pierre S. J. Am. Ceram. Soc., 1956, 39 4, 148
240
Na20—Р О —SiO
£ С О Z
Ag2SO4-Na2SO4
Фиг. 924. Tmkdogan Е.Т., Haddocks W.R. J. Iron
Steel Inst., 1952, 18
Фиг. 926. Nacken R. N.Jb. Min. Geo)., Palaontol. Beil.,
Band, 1907, 24, 1
Сульфаты
AglSO4-K2SO4
Фиг. 925. Nacken R. N. Jb. Min. Geol.Palaontol.
Beil., Band, 1907, 24, 1
CaO-SO,-Na„0 -SiO
3 Z *
Фиг. 927. Kordea E., Z&elt Be, Prog er H, Z. anorg. Chem.,
1961, 264, 267
241
Фиг. 928. Muller Н. NJb. Min.Geo!., Palaontol.Beil.
Band, 1910, 30, 1
CaSO4-Na2SO4-MgSO4
NajSO^SMgSO.,
Фиг. 930. Точки: Е - эвтектика, Р - переходная
Мукимов С.М., Филиппов З.И. Тр. Ин-та там— АН
Уэб. ССР, в.2, 123 (1949)
CaSO,-Na,SO
4 2 4
CaSO4-K2SO4-Na2SO4
Фиг. 929. Точки: Е-эвтектика; Р-переходиая
Верная А.Г.ВАН СССР, 38, 32Р (1943)
Фиг. 031. Точка Е - эвтектика; точка е - эвтектоидное
твердофазовое превращение
Bellanca Л. Periodic© di Min. (Roma), 1022, 13, 21
242
к 2SOj-MgSO4
K2SO4- Na2SO4
Фиг. 932. Wacken R. Nachrichten Ges. Wise. Gottingen Mit.
Math.—phys. KI., 1807, 602
♦"7 ?* *-'*•» «• NJb« Mi"- Geol-, Palaontol. Beil.,
Band, 1807, 24, 1 9
K,SO.-PbSO,
L 4 4
Фиг. 933. Marota D., Galacagni G. Gazz. chim.itaL, 1819,
4611, 375
Фиг. 835, GraAaenn W. Z.anorg. Chem.,1813, 81, 285
243
Фиг. 836. Nackrn R. Nachrichten, Ges. Wiss. Gottingen Math,
phys. KI. 1907, 602
НМЛ гм oammen G-> Oetaen *• Z- anor8- allgem. Chem.,
A oOV| 1Уи, □
Хлориды
Na,SO.- PbWO ; NaSO-NaWO,;
PbSO,—Na.WO ; Na W04-PbW0.
4*4 л. 4
Фиг. 937. Na2WO4-PbWO4; Na2SO4-PbWO4; Na2WO4-Na2SO4;
Na2WO4-PbSO4
Веллее ИМ, Жури, обшей хим., 1952, 22, 10
Фиг. 939. Landsberry Н., Page R.A.,1957, J. Soc. Chem.
Industr., 1920, 39, 40 T
FeCl2- KC1
Фиг. 940. Pinch H.L., Hirson J.M. J.Am.Chem.Soc., 1957 , 79,
23
244
FeCl3-NaCI
MgCl2-NaCl
Фиг. 941. Морозов И .С., Топтыгин Д,Я. Журн. неорг. хим.,
1957, 2, 2133
Фиг. 944. Klemm W., Weiss P. Z. anorg.allgem.Chem., 1940,
2j. 245, 281
Фиг. 942. Klemm IN., Z4 anorg.Chem., 1948, 256, 1
Мол. °fo
Фиг. 945. Fedotieff P.P., Iljinskiy W.P. Z. anorg.'a 11 gem.
Chem., 1923, 121, 106
KCl-NaCl
AlF3-LiF-NaF
Фиг. 943. Tamman G., Ruppelt A. Z. anorg. allgem. Chem.,
1931, 197, 65
Фиг. 946. Ichaque M. Com pt. rend., 232, 1485, 1951. Drop-
lock P. Z.Elektrochem. Angew., Phys. Chem., 1936, 42, 2, 65
245
AlF3-NaF
CaF2-MgF2
Фиг. 947. Fedotieff P.P., lljinskiy W.P., Puahin N.A.,
Baskow A.V. Z.anorg.Chem., 1913, 80. 121, 1913, 81, 350
Фиг. 949. Beck £.,Metal)urge, 1908, 5, 504
CaF2-VF3
CaF2-KF-NaF
Фиг. 948. Точки: Е — эвтектика, Р — переходная
Si lbw Р., I cheque H.,C.R. (Paris), 1951, 232, 1485
Фиг. 950. Vogt Th. N.Jb.Min., Geo)., 1914, £, 12
MgF2-NaF
Фиг. 951.Костиков А,А., Карнов А.Б,Электрометаллургия
цветных металлов. - Тр. Л ПИ, 1957, 188
246
Смешанные галоиды
CaCl2-CaF2
\gBr-AgCl
Фиг. 952. Мопкетеуег К, NJb. Min. Geo].,1906, 22, 29
AgBr-AgI
Фиг. 953. Мопкетеуег K.N.Jb.Min. Geol., 1906, 22, 30
Фиг. 955. Точки: в - эвтектика, с - переходная
Plato Ж. Z.Phys.Chem., 1907, 58, 350
Фиг. 954. Кувакин М.А., Кусакин П.С, Журн. неорг. хим.,
1959, 4, И
Фиг. 956. Стабильное частное
сечение CaF2- KCI - NaCl
Палкин АЛ.Тр. Воронежско-
го ун-та. 23, сб. работ хим. фак.,
1952, 3
CaCl 2-CaF2-NaCl-NaF
(NaCV)2
Знвив. %
(NqF)2
Фиг. 957. Точки: Ej, Е2 - эвтектики, Р- переходная
Ichaque М. .Bull. Soc. Chim.France,1952, 1-2, 127
247
KBr-KCl-KF-NaBr-NaCl-NaF
KCl-KF-NaCl-NaF
Фиг. 958. Поляков В.Д.Изв. СФХА, 1940, 13, 299
Фиг. 961. Поляков В.Д. Иэв. СФХА, 1938, И, 201
Фиг. 959.Радищев В.П. Журн. обшей хим., 1935, 5, 455
Фиг. 962. Радищев В.П. Жури, обшей хим., 1933, 3, 843
KBr-KF-Kl-NaBr-NaF-Nal
Фиг. 960. Домбровская Я.С.ДАН СССР, 1943, 39, 57
NaCl-NaF
Фиг. 963. Plato Ж. Z.Physik.Chem.,1907, 58, 364
248
NaCl—NaF-Nal
NaF
Фиг. 964.На«ориы< ГЛ. Изв. СФХА, 11. 281,1935
Фиг. 96в. Holm J.L. Tiddsk. Kjemi berg.met., 18в2, 22, 9
Галоиды—окисли
A1F,-Al,О,-CaF- NaF
о £ О
Фиг. 965. Pascal F.Z.Elektrochenia,1913, 19, 612
AIF3-A12°3-NaF-Na20-SiF4-S«02
Фиг. 967. Когарко ЛМ,, Рябчиков Я. Д. Геохимия 12, 1969
32
249
X12°3-CaF2
Al2O3-NaCl-Na2O-SiO2
zooo
ТО. р-р Л=УУА1?0,
ТВ. р-р B=S S
CaF^A^O,/
1800
1600
Тв.р-р В+Ж II
1500
1300
1200
1118*3
1100
900
-1465°
(i°Kun3fatV\
800
U°nnu8 NaCl)
20 40 60 80
вес. °/o
NaCl
T8.p-p в
Фиг. 971. Делицын БЛ. Уеленяъев.ДАН СССР. 1968,
180. в, 1460
1200
T&p-p А+Жjj
1400
20
J6.p-p А
Тб.р-р А+тВ.р-р В
CoFj
_1______L
60
100
Фиг. 868. Pascal V. Z.Electrochem, 1818, 18, 612
CaF2-CaO
А1,О_—SiO —RF,( R » Ca, Mg. Sr, Ba)
z о z **
Фпг. 969. Ершова 3,П, Геохимия, 1957, 4, 303
Al2O3-LiF-Na2O-SiO2
Фиг. 970. Беленяъев БЛ в/ Делицын Л,М,, Меленяъев Г .Б, ДАН
СССР, 1967, 175, 1
.Фиг. 972. Будников П,,Тресвляский СССР,
1953, 89. 481
Фиг. 973.Кerji J.M. J.Amer.Ceram. Soc., 1965, 48, 4,
210-213
250
Фиг. 874. Ерлов a 3J1., О л ьжаксхмй Я, И, Геохимия, 1958,
2, 146
MgF2-NaF-SiO2
Фиг. 877. Epuota ЗЛ.,Ол»«оисси< Я.И.Геохимия, 1868
2, 148
CaFf-N«jO“SiO2
Фиг. 875. Ерлова 3Jh,0льланский Я,И, Геохимия, 1958,
2, 145
NaCl-Na,O-SiO2
£ *>
MgF2-MgO-SiO2
Фиг. 978. Рябимо»И.Д. ДАН СССР, 160, Б, 148 (1863)
251
NaF-Na2O-SiO2
KCI-KF-K SO -NaCl-NaF-Na SO
2 4 2 4
Фиг. 979. Booth H.S., Starss B.A., Bahnaen B.J. J.Phys.
Chem., 1933, 37, 1106
Фиг. 982. Вукимов С.В. ДАН Узб. ССР, 1948, 10, 14
Г алоиды —Сульфаты
Фиг. 980. Точка Е - эвтектика
Палкин АЛ. Тр. Воронеж, ун-та, 1952, 23, хим.
KCl-K^SO.
2 4
Фиг. 983. Janecke E.Z.physik.chem., 1908, 64, 343
КС1-KF-K2SOt
КС1-K2SO4- NaCl-Na2SO4
(KCU2
775°
Фиг. 981. Му кимов С .В. Изв. СФХА, 1940, 22, 19
Фиг. 984. Акопов E .К..Бергман А.Г. ЖОХ, 1954, 24,
1524
252
Фиг. 885. Janecte E.Z.physik. chem., 1812, 80, 60
NaCl-Na2SO4-PbCl2-PbSO4
Фиг. 988. Точки: P-переходная, X - xPbSO4*yNa2SO4
Бергман А.Г.Сообщ. о научно-техн, работах, 1932
NaCl-NaF-Na2S04
(NaCl)2
800°
NaF-Na2SO rPbF2-PbSOt
ЗкВив.°/о
Фиг. 886. Мукимов C.M. Изв. СФХА, 1840, 12, 18
Фиг. 989. Точки: ЕрЕ2,Е3 - эвтектики, РрР^з - пере-
ходные B=PbF2‘ 3Nal • 2PbSO4
Г ладу ценно В.А.,Бергман А.Г., Журн. общей хим.,
1955, 25, 1651
NaF—NaoS0
2 1
Фиг. 987. Федоров П.И.,Большаков К.А, Журн. неорг.
хим., 1959, 4, 893
253
Галоиды—карбонаты
ВаС О ч-ВаС 1 -Na2 С О ^-NaC1
К 2С О 3-КС 1-Na 2СО3-ХаС1
Фиг. 991. Беляев ИМ ,,И о лоховин MJL Сб. статей
по обшей химии. Изд-во АН СССР, 1953, 1134
Зкбив. °!о
Фиг. 994. Радищев ВМ, Ж урн. обшей хим., 1933, 3,
852
Фиг. 992. Е - эвтектика, Р - переходная линия,
n\n,s- граница составов твердых растворов на поверх-
ности ликвиден, линия г<^ - граница составов, кипя-
щих при 900 с образованием Са О и СО2
Niggti Р. Z.anorg.allgem.Chem., 1919, 106, 126
Фиг. 005. Точки: Е-эвтектика; Р _ переходная
Волков И.Н., Бергман Л.Г. ДАН СССР, 1040, 27, 067
К 2CO;t-KF- Na 2CO3-NaF
Фиг. 993. Amadori Atti reale accad.Lincei.sez. И,
1913, 22, 372
Фиг. 906. Точки Ер Е2 - эвтектики; Р- переходная
Волков Н Л..Бергман А.Г. ДАН СССР, 1042, 35, 50
254
Бораты
\a.,CO3-NtiCI Na2CO -NaCI-NaF
A,2°3“B2O3“SiO2
Фиг. 997. Niggli P. Z. anorg. allgem.Chem., 1919, 106,
136
Фиг. 1001. Gielisse P.],t Foster WJi, Quart. Progr. Rept.
The Ohio State Univ. Res .Foundation 6, oct. (1961)
Фиг. 998. Волков HJHU Бергман А.Г, ДАН СССР, 1940,
27, 967
B.,O3-NaF-Na2O
Na2CO3-NaF
Фиг. 999. Amadori M. Atti
reale accad.Lincei.Sez 11 •
1913, 22, 368
Фиг. 1002. King B,W»
J. AmertCeram.Soc.,
1954, 3.7, 5
KBF. -K.,B 0^-NaBF4-Na.,B t0,
l 2 I 4 4 2 4 4
A,2°3-B2°3
°C ~
2000-
Жидкость
4600
4Z00
800
B2°3
^——•*** Корунд+Ж
f Корунд
'9А120}-2ВД+Ж *
гАгдвдш^гу.
" 2А1Д ^0,+Ж ( “
20 90 60 / 80 ]
Alz°3
ZALO/ВД 9AIA2BA
Фиг. 1003. Пинаевекал E.H., Чазова 3.A. Тр. Ураль-
ского научно-исслед. хим. ин-та, 1954, 1, 77
Фиг. 1000. KimКЛ., Ишшпе! F.A., Levin.Е. Phase diagrams
for ceramists, 1964
255
К,,B ,0_—KC1—Na,B ,0_—NaCl
1 4 ‘ 2 4 ‘ HaCVNa-BX
/ Na^O,
800° 732° 1699°
Ч /I/ 79Z°
(NaCUs
800°T~~
___ISO'
^и^Р“Й°₽в ^инимцт)
658°
Область 11
расслаивания • I
--------750 - ' '
77.Г»1 763°
763° /
(KCl\
Твердые растворы o.
KCl-NaCl 3кВиВ /o
¥рв5°‘
J/L^
r/W
1790°
KCIZK^Q, к2вчо7
Фиг. 1004. Точки Ер Е2,Е^- эвтектики, Р- переход-
ная
Бергман А.Г.^Никонова ИЛ. Жури, общей хим.,
1942, 12, 460
К В .О_—KF—Na,В ,O_-NaF
L 4 i 2. 4 «
(NoF)2
995°
770°
852
Na2B4°i
В
666°
-г8»
KF ZK2BMO7
Эквив. %
Фиг. 1005. Точки EjE^E^- эвтектики
Бергман А.Г.,Никонова ИМ. Жури, общей хим.,
1942, 12, 449
Cr O3-K2O
Хроматы
CaO-Cr.,O3- CrO3
600 - CaO +CaO04 Cr2O3+CaCrOM
___________I___I_____Ll________I---I----------
ZO W 3=1 2=1 60 1=1 80 100
CaO Bec.°/O Cp203
Фиг. 1006. Ford W.F.,White J. Trans.Brit.Ceram. Soc.,
1949, 48, 423
СаО-Cr03-Na2CO3
Твердые растворы
СаСгОь в Na.CrO,.
Na2CrO.
792°
Твердые растворы
СаС03в Na2CO3
Na.CO3
856°
875°
40 &
740°
60 -
872°
20
786*
Na2C03CaC03
813°
850—
80 ~
4001-----L
0 ZO
CaCrOu
60
МОЛ. ° fa
100
CaC03
Фиг. 1007. Точки. EpE2,E3- эвтектики
Вилънянский Я,Е,,Пудовкина ОМ. Жури, прикл.
химии. 1948. 21. 1242
Фиг. 1008. Groshuff E.Z. anorg.
Chem., 1908, 58, 111
256
Cr03-Mo03-Pb0
CrO3-PbO-HO3
Жидкость
,-^S ZZ
Z vJ
- z
Z
fc^-- / 838°
7gg>
Wj*/^PbOCrO5)+
®£ч
700F^r-M,
о гоу so
PbO-OOj \ Мол.°!о
<'(«PbO-Cr’O3)+M2
1000
900
800
1055°
Mz
100
PbO-MoOj
Фиг. 1009./aeger F.M., Germs H.C. Z.anorg.aiigem. Chem.,
1921, 119
CrO3-PbO
Фиг. 1010. Jaeger F.M., Germs H.C. Z.anorg.allgem.Chem.,
1921, 119, 169
Фиг. 1011.Jaeger F.M., Germs H.C. Z.anorg.aiigem.Chem.,
1921, 119, 171
Вольфраматы
Bi2o3-wo3
Фиг. 1012. Levin E.M.,
Roth R.S., J.Research
Nat ion. Bur.
Stand. 1964, 68A, 2, 202
Na2O-PbO -SO3-WO3
Фиг. 1013. E - эвтектика
Беляев ЯЛ.Журн. общей хим., 1952, 22, 1746
33
257
Титанаты
PbO-SO..-WO..
<5
CaO-TiO2
Фиг. 1014. Jaeger F.M., Germs H.C. Z.anorg. all gem. Chem.
1921, 119, 167
Фиг. 1016. Roth R.S. Nation.Bur.Stand. J .Research U.S.,
1958, 5, 440
FeO-Fc2O3_TiO2
PbO-WO3
Фиг. 1017.MacChesney J.B.,Muan A, AmerJdin., 1959, 44,
938
Фиг. 1015. Jaeger F.M., Germs H.C. Z. anorg.allgem. Chem.,
1921, 119, 162
FeO-TiO2
Фиг, 1018. Grieve J., White J,, J. Roy Tech. Co)l.(Glasqow),
1939, 4, 444 4
258
Ванадаты
CaO-V,O.
2 a
MoO- PbO—SO.
* 3
Фиг. 1019. Морозов А. И. Металлург, 1938, 13, 12, 24
Молибдаты
°C
1150
то
1065
1050
1000
950
900
650
100 80 60 40 20
Мол. %
Фиг. 1022. Jaeger F.M., Germs H.C. Z.anorg. allgem.Chem.,
1921, 119, 172
MoO ,-PbO-WO,
J J
0 Z0 40 60 80 100
PbO-MoO, Мол.°/о PbO-WO,
° 3
Фиг. 1023. Jaeger F.M., Germs H.C. Z.anorg. allgem. Chem.,
1921, 119, 165
Фиг. 1020. Е - эвтектика
Беляев ИМ. Журн.общей хим., 1952, 22, 1319
Фиг. 1021. Jaeger F.M.,Germs H.C. Z.anorg.allgem.Chem.,
1921, 119, 172
259 - 260
Двухкомпонентные системы
СаСО-НО
О £
Таблица 1
°C Концентрация по данным ав- торов, г/л Твердая фаза
0 0,081 СаСО3
25 0,056 СаСО3
Системы с водой
СаС12-Н2О
Таблица 2
K2CO3-H2°
°C Твес.% | Твердая фаза
0 Т 37,3 1СаС12.бН2О
25 45,3 СаС^* 6Н
Табл. 1.Же//« ЯЛ. /.Washington J. Acad.Sci^ 1915, 203, 775
Табл. 2.Basset Н.,Do des M.C.K.(Paris), 1936, 5, 617
Фиг. 1025. Справочник по растворимо-
сти солевых систем, т. III. Госхими»-
дат, 1961
Фиг. 1026. Справочник по растворимо-
сти солевых систем, т. Щ Госхимиэ—
дат, 1961
К2в4°7-н2о
Таблица 3
°C Вес.% г/100 г Н20 Твердая фаза
35 17,55 21,3 к2в4а,-4Н2о
KHC0,-H,0
Таблица 5
Табл. З.Теер/е J.E. The industrial development of Searles
Lake Brines, 1929
kf-h2o
Таблица 4
°C Вес.% г/л Твердая фаза
0 - 380 КЕ-2Н20
25 48,90 - КГ-21120
Вес. %
Концентра-
ция, по
данным ав-
торов
Твердая
фаза
01 18,69 1 2,115 1КНС03
25 26,72 6,16 мол. % КНСО3
Табл. 4. Новоселова А.В.,Тамм Н ,С ^Воробьева О.А.
Химия редких элементов, 1955, 2, 6
Табл. 5. Богоявленский П .С .,Мананникова А,С, Сб. Тр.
Львовск. вет.-зоот. ин-та, 1953, 6
261 - 262
H2o-K2so4
H2o-Na2CO3
Фиг. 1027. Справочник
по растворимости солевых
систем, т. III. Госхимиэдат,
1961
Фиг. 1029. Справочник по раст-
воримости солевых систем, т. III.
Госхимиэдат, 1961
H2O-MgCl2
H2O-MgSO4
Н20-NaCl
Таблица 7
Таблица 6
°C Вес.% Твердая фаза
0 34,5 1
25 38,2 -
25 26,7
Твердая фаза
Табл. 6. Seidell A. Solubility of anorganic,metallorganic .
and organic compounds,1940, 3, Ed.,N4
Табл. T.Seidelt A, Silubility of anorganic, metallorganic
compounds, 1940, 3, Ed. 4
h2O-n.2b4o7
Фиг. 1028. Справочник по растворимости
солевых систем, т. III. Госхимиэдат, 1961
Фиг. 1030. Справочник по
растворимости солевых сис-
тем, т. III. Госхимиэдат, 1961
h2o~n«f
Таблица 8
H2O-NaHCO3
Таблица 9
0 3,99
20 4,10
Твердая фаза
N?F
NaF
°C Вес.% г/100 г Н20 безводная соль Кристалло- гидрат
0 7,34 Г 7,92 8,95
20 8,96 9,84 1115
Табл. 8. Новоселова А,В, Жури, общей хим., 1934, 4,
1207
Табл. 9. Poggiale .Ann.chim. phys., 1843, 3, 8, 468
263
H,0-Na „SO
t 2 4
СаСО3-Н2О -К2СО3
Фиг. 1031. Справочник по
растворимости солевых сис-
тем, т. III. Госхимиэдат, 1961
°C Жидкая фаза Твердая фаза
вес.% г/100 г Н2О
К2СО3 СаСО3 К2СО3 СаСО3
19 37,21 - 59,25 не указано К2СО3.СаСО3+СаСО:
Табл. 12. Barre М., C.R.(Paris), 1912, 154, 280
CaCO3-H2O-MgCO3
Трехкомпонеитные системы
CaCl —СаСО„—Н О
Z О Z
Таблица 10
°C Жидкая фаза Твердая фаза
вес.% г/1000 г Н20
СаС12 СаСО3 СаС12*Н2О СаО
0,139 0,0015 2,75 0,0084 (СаСОз-х^О)
0,056 0,0015 1.1 0,0084 (СаСО3.хН2О)
0,028 0,0016 0,55 0,0090 (CaCOyxl^O)
0 0,0031 0 0,0174 (СаСО3-хН2О)
Таблица 13
°C Жидкая фаза Твердая фаза
вес.% г/л Н20
MgCO3 CaCO, MgCO3 СаСО3
0,0150 0 0,1505 0 MgCO3
17 0,0095 0,0095 0,0948 0,0953 MgCO3+MgCO3-CaCO3
0,0009 0,0634 0,0093 0,6339 MgCO3.CaCO3+CaCO3
0 0,10 0 1,00 СаСО3
Табл. 13. Ваг О. Central. Min. А., 1932, 53
Табл. 10. Gothe F. Chem. Ztg., 1915, 39, 48, 307
СаСО3-Н2О -Na2CO3
CaC03- CaSO4-H2O
Таблица 14
Таблица 11 °C Жидкая фаза вес.% Твердая фаза
°C Жлд1 кая фаза, вес.% Твердая фаза Na-СО, СаСО3
CaSO^ СаСО3 25 22,64 Очень N з £O340-H2O+Na2CO3-CaCO3-5ll2O Nа2( 10 3«ОС03«2Н20 ( мет) Na^OjCaCO^I^O+CaCO-j (мет)
18-19 0,200 0,175 0,0048 0,0038 СаСО3 СаСО3 21,14 20,52 малые коли- чества
0,150 0,0038 СаСО3 20,30 Na2CO3.CaCO3-5H2O
0,125 0,0045 СаСО3• 15,81 Na2CO3-CaCOj-5fl2O +СаСО3
0,100 0,0054 СаСО3 22,63 СаСО3
0,075 0,0048 СаСО3 6,86 СаСО3
0,050 0,0058 СаСО3
Табл. 14. Bury С., Redd K.J.Chem.Soc., 1933, 1161
Табл. 11. Страхов Тр. Ин-та геол, наук АН СССР,
1951, в. 124, 45. Справочник растворимости солевых
систем, т. I, стр, 456. Госхимиэдат, 1958.
264
CaCl2-CaSO4-H2O
Таблица 15
CaSO4-H2O-K2SO4
Таблица 18
°C Жидкая фаза Твердая фаза
CaCI 2 вес% CaSO4
25 38,91 33,87 27,53 26,51 20,30 2,99 0,008 0,011 0,021 0,018 0,031 0,112 CaSO4-H2O CaSO4-H2O CaSO4-H2O CaSO4-H2O CaSO4-2H2O
Табл. 15. Свешникова ВЛ. Иэв. СФХА АН СССР 17,
347 (1048)
СаС12-Н2О-КС1 Та6лиц,
°C Жидкая фаза Твердая фаза
вес.% M/1000MH20
KCI СаС12 2KCI CaCI2
0 22,19 0 34/45 0 КС!
12,19 10,93 19,15 23,08 KC1
5,08 23,53 8,56 53/49 KC1
2,52 34,65 4,81 89,52 KCI
2A2 37,00 4,82 99,14 KCI+CaCI2-6H2O
0 37,57 0 97i68 CaCI 2-6H2O
25,1 26,74 0 44,1 .0 KCI
17,63 8,53 28,85 18,76 KCI
7,52 23,15 13,1 54,20 KCI
3,15 37,82 6,45 104/) KCI
3,13 44,70 7,25 139,1 KC'+CaCI 2«6H2O
0 /45,06/ 0 /133,1/ CaCI2’6H2O
Табл. 16. Заславский АЛ. Тр. ГИПХ, 1935, в. 23, 72
СаС12-Н2О-MgCl2
Таблица 17
°C Жидкая фаза Твердая фаза
вес.% M/1000 мнр
MgCl2 । CaCI2 MgCI2 CaCI2
0 34,80 0 101,0 0 1 MgCl2-6H2O
23,50 14,00 71,1 36/4 MgCl2-6H2O+CaCI2-6H2O
18,50 18,50 55,6 47,7 CaCI2-6H2O
0 37,26 0 96/4 CaCI2 -6H2O
25 36,35 0 108 0 MgCI2-6H2O
14,9 30,45 51,5 90,5 MgCJ2.6H2O+2MgCl-CaC^12H2O
9,7 38,7. 35,5 121,5 2MgCl2-CaCI2-12H2O+CaCl2-6H2O
0 45,0 0 133 CaCl2-6H2O
Жидкая фаза
вес.% M/1000 mh2o
k2so4 ' CaSO4 k2so4 CaSO4
Твердая фаза
0 2fiD 0,129 2,11 0,174 K2SO4-CaSO4 H2O+CaSO4-2H2O
25 10,39 0,030 112,87 0,330 K2SO4 -CaSO4-H2O
3,17 0,155 32,47 1,582 K2SO4-CaSO4-H2 O+CaSO4 -2H2O
3,01 0,153 30,83 1,565 CaSO4-2H2O
Табл. 18. Bane M.,C.R.(Paris), Cameron F,,
Breazeale J. J. Phys.Chem., 1904, 8, 337
Фиг. 1032. Справочник по растворимости солевых сис-
тем, т. I. Госхимиздат, 1953
CaSO4-H2O-Na2SO4
Таблица 19
°C Жидкая фаза Твердая фаза
вес.% M/1000 MH2O
Ni^SO4CaSO4 Na2SO4 CaSO4
Ю <? 8 4,57 0,134 21,21 0,21 12,83 0,196 4,44 0,159 1/40 0,137 0,24 0,165 6,09 34,24 18,71 5,90 1,80 0,31 0,188 0,37 0,30 0,22 0,19 0,21 Na2SO4-10H2O+CaSd4.2H2O Na2SO4-10H2O+CaSO4«2H2O CaSO4-2H2O CaSO4 -2H2O CaSO4-2H2O CaSO4-2H2O
Табл. 19. Cameron F.,Breazeale J, J.Phys.Chem., 1904, 8/
340; Bane M. Ann.Chim.Phys., 1810, 6, 24
H2O-K2B4O7-KC1
Таблица 20
°C Жидкая фаза Твердая фаза
вес.% m/iooomh2o
KCI К2В4°Г 2КС1 К2В4°7
35 28,05 0 47,1 0 Ktl
28,00 4,1 45/) 4,5 KCI+K^Of^ 0
0 17,55 0 16,4 K2B4O7-4H2O
Табл. 17. Янаяъева О.К. Журн. неорг. хим., 1946, 19,
7, 713'
Табл. 20. Teeple J.E. The industrial Development of Searles
Lake Brine,1929, 134
В 34
265
Н2О-КВГ-КС1
Таблица 21
°C Жидкая фаза Твердая фаза
вес.% М/1000 мн2о
КС1 КВг ксГ | КВг
0 21,025 , 0,539 68327 1352 К(С1,Вг)
18,048 8Л&4 59,118 16,793 К(С1,Вг)
12,480 19,519 44346 43,447 К(С1,Вг)
11348 22,310 40356 50,674 К(С1,Вг)
8,106 28,247 29,846 60,522 К(С1,Вг)
4Д73 30304 17320 71,121 К(С1,Вг)
25 28/16 0 4,1731 0 КС1
28,28 0,731 4,1630 03726 К(С1,Вг)
24 35 336 ЗЗН4 03088 К(С1,Вг)
20,14 11,29 33638 1,1811 К(С1,Вг)
12,13 25,73 2,1473 2,8523 К(С1,Вг)
10,25 28 /4 8 1,8307 3,1881 К(Вг,С1)
8,28 3138 1/4923 33112 К(Вг,С1)
5,10 34,84 03201 33743 К(Вг,С1)
3,23 37,13 03892 4,2453 К(Вг,С1), либо КВг
0,528 4036 0,0974 4,6275 К(Вг,С1), либо КВг
0 40,54 0 4,6862 КВг
Табл. 2 1. Шлезингер Н .А,,3оркнн Ф,П,Л Ноеоженоеа Л,В.
Жури, прикл. химии, 1938, И , 9; Foci A., Z.Kryst. Min.,
1897, 22 J, 360
H 20-К2С03-КС1
Таблица 22
°C Жидкая фаза Твердая фаза
вес.% М/1000 ГН2О
КС1 к2со3 КС1 к2со3
0 213 0 68,2 0 КС1
17/4 938 56/4 16,64 КС1
730 28,40 30,48 54,9 KCI
231 40,40 10,88 102,6 КС1
036 48/10 438 124,7 КС1
0,79 49/40 3,70 129,2 КС1
0,76 5038 3,82 137,8 КС1+К2СО3-^O
0 51,7 0 140,2 К2СО3-2Н2О
25 27,00 0 44,62 0 KCI
037 5232 2,50 144,16 КС1+К2СО3-1,5Н2О
0 53,18 0 11337 К2СО3- 1,5Н2О
Табл. 1 22. Бызова Е.At Ученые записки Ленингр. пед.
ин-та им. Герцена 1937, 6, 6
Н20-К2С03-КНС03
Таблица ^3
°C Жидкая фаза
вес.% Твердая фаза
кнсо3 к2со3
26,55 0 кнсо3
19,31 юзо кнсо3
15/45 1638 кнсо3
12,19 23,36 кнсо3
2J > 7,35 34,71 кнсо3
4/44 43,88 кнсо3
2,21 51,79 khc.o^k/x^-i.s^o
0 52,74 К2СО3-1,5Н2О
Табл. 23. Hill A., Hill D.J.Amer.Chem. Soc., 1927, 49, 968
H2o-K2co3-K2so4 Та6лица *
°C Жидкая фаза Твердая ф1за
вес.% М/1000 г н2о
K2SO4 К£03 k2so4 к2со3
0 6,78 0 836 0 K2SO4
4,71 6,88 5,48 10,07 k2so4
3,33 11,66 4,20 И32 K2SO4
0,15 45,60 0,28 110/4 K2SO4
Следы i 51,30 Следы 137,3 K2SO4+K2CO3-2H2O
0 51,7 0 140,2 K2CO3-2H2O
25 10,7 0 12,4 0 K2S°4
6,5 5,5 7,6 8,1 K2SO4
43 9,4 S3 14,3 «2^4
23 16,4 3,6 26,5 K^
13 23,2 2,1 40,2 k2so4
0,3 35,0 0,5 703 k2so4
038 45,1 0,2 107,2* K2SO4
озз 48,6 0,06 123,3 K2 so4
озз 52,8 0,066 145,8 K2SO4+K2CO3-lpH2O
0 52,8 0 145,8 K2CO3-1,5H2O
Табл. 24. Бызова Е.А, Ученые зап. Лен. пен. ин-та,
1937, 6, 154
Н20-K2CO3-Na2CO3 Таблица 25
°C Жидкая фаза Твердая фаза
вес.% г/100 г М/1000 м н2о индексы
Na2CO3 к2со3. Na2CO3 к2со3 Na£03 к2со3 Na2CO3 н2о
25 . 2235 0 28,78 0 50,63 0 1003 1975 Na2CO3-10H2O
2335 12,26 35,63 1836 60 30 24,70 71,01 1174 Na2CO3-10H p+Na2CO3-H2O
21/42 1836 35,57 30/48 60/40 39,70 60 34 999 Na £0 3-7H2O+NaKCO3-6H2O
1635 22,11 27,82 36,28 47,25 47,25 50,00 1058 NaKCO3-6H2O
536 48/44 1039 104,18 18,50 135,70 12,00 649 NaKCO3-6H2O+K2CO3-l ,5H2O
0 53,18 0 11337 0 14733 0 676 K£O3-1,5H2O
Табл. 25. В las dale Ж. J.Am.Chem. Soc., 1923, 45, 2938
266
H2O-KC1-KF
Таблица 26
H2O-KCl-NaCl
•
°C Жидкая фаза Твердая фаза
вес.% г/100 г Н20
KF 1 КС) KF 1 КС1
25 4835 1 0 883 1 0 KF-2H2O
4830 озз 1013 1,88 KF .2Н*КС1
4830 0335 983 1,78 KF-2H/HKCI
4430 1,48 8330 2,77 КС)
ззз 332 5230 835 КС)
П.1 1133 2330 1630 КС)
835 17,70 12,80 2430 КС)
3,13 2230 4,225 3130 КС)
1,86 24,60 238 33,6 КС)
0,77 26,10 135 35,8 KCI
0 26,60 0 36,2 KCI
Табл. 26. Campbell A.J.,Campbell АЛ. Trans.Faraday Soc.,
1939, 35, 243
Н,О-КС1-КНСО, Z О Таблица 27
°C Жидкая фаза Твердая фаза
вес.% г/100 гН2О
КС) кнсо3 КС) кнсо3
20 2537 0 3435 0 KCI
23,67 3,72 32,60 5,12 КС)
2030 1038 29,70 15,18 КО
20,48 1030 29,68 15,22 ко+кнсо3
17,18 12,23 2434 17,33 КНСО3
14/44 1337 20,14 1935 кнсо3
11,16 1634 1533 22,03 кнсо3
7,42 18,72 1035 25,34 кнсо3
0 2539 0 33,48 кнсо3
Табл. 27. Paris R., Mondain—Monyal P.Bull.Soc.Chim.,
1938, 5, 8-9
Фиг. 1034. Справочник по растворимости солевых сио-
тем, т. I. Госхимиэдат, 1953
H„O-KHCOQ-K9SOA
L 3 £ 4
Таблица 28
°C Жидкая фаза Твердая фаза
вес.% М/1000 мн2о
K2SO4 кнсо3 k2so4 2КНСО3
25 530 ' 13,37 634 14,74 k2so4
433 1638 5,27 1831 k2so4 + кнсо3
Tbor, 1M7G7R G" DiSaert' 0berMa^esiu"^bonate,NaUm_
иигБ> 1 *» »О
Фиг. 1озз.ijmmiih м.и.,
Харчуч О.С.Ипатьева О.К.
ДАН СССР, 1850, 73, 3
H2O-K2SO4-MgSO4
Фиг. 1035. Справочник по растворимости
тем, т. I. Госхимиэдат, 1953
солевых сио-
267
Таблица 31
H 0-K SO -Na SO
2 2 4 2 4
H2O-MgCO3-Na £O3
Фиг. 1036. Справочник по
растворимости солевых сис-
тем, т. I. Госхимиэдат, 1953
H2O-K2SO4-SrSO4
Таблица 29
°C Жидкая фаза Твердая фаза
вес.% г/100 г Н20
K2S°4 SrSO4 k2so4 SrSO4
11.5 l,ZJ 0.01 1,20 0.01 K2SO4-SrSO4+SrSO4
Табл. 29. Bane М. C.R.(Paris), 1909, 149, 292
H2O-MgCO3-MgCl2
Таблица 30
°C Жидкая фаза Твердая фаза
вес.% г/100 г HjO
MgCI2 MgCO3 MgCl^eH2O MgCO3
0 0,119 0,0035 2,55 0,0353 (MgCO3-x»2O)
0,049 0,0039 1,05 0,0395 (MgC03.xH20)
0,024 0,0047 0,51 0,0470 (MgCO^xI^O)
0 0,0094 0 0,0944 (MgCO3*xH £)
Табл. 30. Gothe F.Chem.Ztg., 1915, 39, 48, 307
°C Жидкая фаза Твердая фаза
вес* % г/1000 гН2Э
Na2CO3|MgCO3 Na2CO3 | MgCO3
0 0,26 0,0016 2,65 0,0157 ' MgCO3-H2O
0,10 0,0053 1,06 0,0535 MgCO3-H2O
0,05 0,0099 0,53 0,0986 MgCO3-II2O
0 0,0094 0 0,0944 MgCO3-H2O
25 3,06 0,034 31,60 0,340 Mg5(CO3)-(OH)2-4H2O
1,01 0,034 10,20 0,34
Табл. 31. Gloss G.t Dissert» Uber Magnesiumcarbonate,
Naum burg, 1937-1938; Gothe F. Chem.Zthg., 1915, 39, 48
H2O-MgCl2-MgSO4
Фиг. 1037. Справочник по растворимости солевых сис-
тем, т.«1. Госхимиэдат, 1953.
Фиг. 1038. Справочник по растворимости солевых сис-
тем, т. 1 Госхимиэдат, 1953
268
H2O-Na2B4O7-Na2SO4
Таблица 34
Фиг. 1039. Справочник по растворимости солевых сио-
тем, т. I. Госхимиэдат, 1953
Н20-Na 2®4^7“"^а2^^3 Таблица 32
°C Жидкая фаза Твердая фаза
Na2COjj вес.% Na^C^
35 20,46 17,32 14,02 10,47 8,41 3,27 0 3,28 3.30 3,19 3,40 3,41 3,33 4,84 Na^O^lO^O Na2B4O7-10H2O Na2B/Y10H2O Na2B4O7-10H2O Na2B/)7 *10H20 Na2B407-10H20 Na2B4O7-10H2O
Табл. 32. Hill A. J.Amer.Chem.Soc., 1945, 477
Н20-Na2B4O7- NaCl
Таблица 33
°C Жидкая фаза Твердая фаза
вес.% M/1000 mh2o
NaCl Na2B4O7 2NaCI Na2^O7
26,20 0 54,67 0 NaCl
25,88 0,35 54,03 0,42 NaCl+Na2B407-10H20
0 1,09 0 0,99 Na2B4O7-10H2O
25 26,43 0 55,32 0 NaCl
26,04 0,74 54,76 0,90 NaCl + Na2B4O7*10H2O
0 3,08 0 2,85 Na2B/yi()H2O
Табл. 33. Sborgi U,,Franco C.Gaz.Chim. hal., 1921, 51
°C Жидкая фаза Твердая фаза
вес.% M/1000 мн2о
Na2SO4 Ча2в,р7 Na2SO4 [Na2BA
0 4,76 0 6,337 0 S04-10H2 0
4,71 0,94 6,335 0,895 Na2SO4-l()H /3+Na2B4O7-10H2O
0 1,09 0 0,989 Na2B4O7-10H2O
25 21,90 0 1,974 0 Na2SO4-10H/3
2131 0,326 1,983 0/)208 Na2SO440H2O
21,93 1,131 2306 0,0729 Na2SO4-10H2O +Na2B4O7-10H2O
17,38 1,220 1,502 0,0743 Na2B407-10H20
12,66 1,300 1,036 0/3749 Na2B£7-10H2O
9,645 1,442 0,7636 0,0804 Na2B4O7-10H2O
3,220 2,057 0,2392 0,1077 Na2B4°7*10H2°
1,187 2,62В 03868 0,1354 Na2B4O7-10H2O
0 3,087 0 0,1580 Na2B4Oyl()H2O
Табл. 34. Sborgi U., Bovalini E., Cappellini L.Gaz.Chim.
ital., 1924, 54, 936
H2O-NaBr- NaCl
Таблица 35
°C Жидкая фаза Твердая фаза
вес.% M/1000 mh2o
NaCl | NaBr NaCl | NaBr
0 26,2 0 109,4 1 0 NaCl-2H2O
14/3 213 663 58,0 Na(CI,Br)+Na(CI.Br)*2H2O
11/3 26,6 543 74,6 Na(Cl,Br)-2H2O
0,3 30,0 47,2 86,5 Na(Cl,Br)*2H2O
73 32,8 38,7 96,2 Na(Cl,Br)-2H2O
5,7 35,8 30,1 107,1 Na(Cl,Br)-2H2O
2,8 40,8 153 126,6 Na(Cl,Br)-2H2O
03 43,7 5,0 138,1 Na(C!,Br)-2H2O
0 443 0 139,2 NaBr2H2O
25 26,48 0 1113 0 NaCl
21,90 7,8 963 19,40 Na(Cl.Br)
1733 16,6 783 43,8 Na(Cl.Br)
11,5 26,5 57,2 743 Na(Cl.Br)
8,65 323 453 96,7 Na(CI,Br)
5,20 39,8 29,1 126,7 Na^Cl.Br)
33 44,6 20,2 150,1 Na(Cl,Br)+Na(CI,Br)-2H2O
1,8 46,3 10,6 156,2 Na(Cl,Br)-2H2O
13 47,6 63 162,1 Na(CI,Sr)-2H2O
0 48,6 0 1653 NaBr-2H2O
Табл. 35. Власов М.А.,Бергман А.Г. ДАН СССР, 38,
1* 5-6 (1943). Изв. СФХА АН СССР, 1949, 17, 319
269
H2O-Na2CO3-NaCl
H,O-NaCl-NaHCO„
* о
Фиг. 1040. Справочник по растворимости солевых сис-
тем, т. I. Госхимиздат, 1953
Фиг. 1041. Справочник по растворимости солевых сис-
тем, т. I. Госхимиздат, 1953
Фиг. 1042. Справочник по
растворимости солевых сис-
тем, т. I. Госхимиздат, 1953
Н20-NaCl—Na2SO4
H2O-NaCl-NaF
Таблица 36
°C Жидкая фаза Твердая фаза
вес.% г/100 гН2О
NaF NaCl NaF NaCl
-0.06 0,19 26,25 - - NaF + NaCl + NaCI-2H2O
25 3,77 0 3,92 0 NaF
2,97 134 3,11 1.41 NaF
137 8,6 1,63 9,55 NaF
1.38 21,2 1,85 343 NaF
1,06 26,6 137 36,7 NaF + NaCl
0,865 26,5 1,19 35,3 NaF + NaCl
0,505 263 0,815 363 —
0357 26,6 0,628 36,4 —
0 26,7 0 36,5 NaCl
Фиг. 1043. Справочник по растворимости солевых сис-
тем, т. I . Госхимиздат, 1953
Табл. 36. Campball A.J.,Campball A.N. Trans.Faraday.Soc.,
1939, 35, 243; Foote H.t Shairer /.J. Amer.Chem. Soc.,
1930, 52, 4207
270
H2O-NaHCO3-Na^O4 Таблица 37
°C Жидкая фаза Твердая фаза
вес.% М/1000 МН20
Na2SO 4РаНСО3 Na2SO4 NaHCO3
0 4,65 0 6,19 0 Na2SO4-10H2O
2,57 5Л2 3,56 13,62 Na2SO4.10H2O+NaHCO3
138 5,88 2,17 13,63 VaHCO3
0 6/45 0 14,91 NaHCO3
25 21,90 0 35,56 0 Na2SO4-10H2O
20,80 3,77 34,97 10,72 Na2SO4-10H2O
20,68 4,16 34,89 11,87 Na2SO4-10H2O + NaHCO3
20,59 4,15 34,69 11,83 Na2SO4 • 10H2O + NaHCO3
11,14 8,03 17,06 15,81 NaHCO3
9,87 5,75 14,83 14,61 NaHCO3
0 9,39 0 22,22 NaHCO3
Табл. 37. , Макаров С.З., Ваксберг Н.М., ЖРФХО, 1930.
62, в. 8-9
Системы четырехкомпонентные и выше
СаВ .0_—CaSO _-H,O-Na,B .O,-Na,SO.
47 4 £ £ 4 7 Z 4
Таблица 38
°C Жидкая < £аза Твердая фаза
вес.% М/л
Na^Oy CaSO4 Na234O7
25 1,95 0,232 0,1 CaSO4 • 2Н2О
0,80 0,253 0,01 CaSO4-2H2O
0,67 0,244 0,033 CaSO4•2H2O
0,40 0,246 0,02 CaSO4 • 211^
0,20 0,238 0,01 Ca£O4-2H2O
Табл. 38. Sborgi U. Atti Soc.Toscana Mem., 1926, 37, 183
CaCO3-CaCl2-l -k2co3-kci Ta 6 I2o- CaCO3-CaCl2-H2O- -MgCO3-MgCl2 лица 39 Таблица 40
°C Жидкая фаза, вес.% °C Твердая Жидкая фаза, вес.% Твердая фаза
KCI 1 CaC03 фаза MgCl2 СаСО3
25 26,00 0,0060 13,82 0,0072 3,90 03078 0,150 0,00320 0,0187 0,00170 0,00/5 0,00143 ' СаСО3 16-18 CaCQj СаСОз CaCO, СаСОз CaCC^ 20 15 8 3,5 1 0,0330 0,0330 ОД) 27 8 0,0228 0,0205 СаСО3 CaCO^ СаСОз СаСОз СаСОз
СаСО -CaCL-Ho0-NaoC0 -NaCl
О £ £ ли
Таблица 41
°C Жидкая фаза Тпоплда Жа
вес.% г/1000 г Н20 А ВВрдаж фпоа
NaCl СаСО3 NaCl СаСОз
(01 0,292 0,117 0,058 X) 03056 03044 0,0036 0,0031 233 1,17 0,585 0 0,0311 03849 0,0200 0,0174 CaCO,3 СаСОз СаСОз СаСОз
°< С Жидкая фаза
вес.% Твердая фаза
NaCl Na2CO3 СаСО3
25 27,37 25,69 (2730) 2638 25,75 2531 24,28 10,13 10,27 7ДХ) 2,60 0 0,64 138 (038) 1.П 1,18 2,28 1,25 3,86 4,40 7,00 10,6 113 0,01 0 31 031 031 031 0,01 031 0,01 0,01 0,01 031 031 NaCl + СаСО3 СаСОз NaCl +Na2CO^CaCO3-5H2O+CaCO3 NaCl+Na2CO3-CaCO^5H2O+CaCO3 NaCl+N^ СОз’СаСО3’5Н2О+СаСО3 NaCl+Na2CO3-CaCO3-5H2O+CaCO3 Na2CO3*CaCO3*5H2O Na2CO3-CaCO3-5H2O+CaCO3 Na2CO3-CaCO3’5H2O+CaCO3 Na2CO3-CaCO3* 5H2 O+CaCO3 Na2CO3-CaCO3’5H2O +CaCO3 Na2CO3-CaCO3-5H2O+CaCO3
Табл. 41. В аллшко М.Г., Петров а Е ,Н. Тр. ВНИИГ, 1952,
в. 23, 162-163
СаСО -CaSO .-Н ,0-К СО -К ,S0
О *9 £ & Ъ & *9
Таблица 42
°C Жидкая фаза Твердая фаза
вес.%
k2so4 СаСО3
25 10,48 0,0188 СаСО3
10,18 0,0182 СаСО3
8,88 03182 СаСОз
7,85 03188 СаСО3
636 0,0148 СаСО3
4,73 03132 СаСО3
3,15 03118 СаСО3
1,60 03104 СаСО3
Табл. 42. Cameron F.K.,Robinaon Ж.О.J.Phys.Chem.II. 11.
1903, 578
Табл. 39. Cameron F.K.,Robinson W.O. J.Phys.Chem J 907,
11, .578; Aakew H. Trans, and Proc.New Zeal.Inst., 1923,
54, 791
Табл. 40. Страхов Тр. Ин-та геол, наук АН СССР
1951, в. 124, 45; Справочник по растворимости солевых
систем II, стр. 1077, Госхимиздат, 1954
271
Таблица 43
СаСО CaSOН ,0-М gCO „-М gS О,
О *9 £ О 4
°C Жидкая фаза Твердая фаза
вес.% 0,001 М/1000 г раствора индексы
MgSO4 MgCOj CaS04 СаС03 Mg2* Са2+ so24- 2НСО3 Са2+ 30^- HjO
25 (1.708) (0,081В) - (153,04) (6,01) (147,90) (11,15) ' (3.78) (92,99) (34240' MgCO3+CaSO4-2H fi
0.0164 0,1345 0,2870 - 17,31 21,08 22,44 15,95 54,87 58,50 144000 MgCO3+MgCO3<aCO3+CaSO4-2H2O
0,0636 0,2317 । 0,0456 7,54 21.5& 17,02 12,10 74,11 58,45 190000 MgCO, -CaCOj +CaSO4-2H2O
0,0090 0,1789 । 0,0797 1,07 21,10 13,14 9,03 95,17 59,27 250000 MgCO3,CaCO3+CaSO4-2fi2O+CaCO3
Табл. 43. Янатъева O.K. Изв. СФХА АН СССР, 1950, 20, 262
CaCl2-CaS04-H20-KCl-K2S04
Таблица 44
°C Жидкая фаза Твердая фаза
вес.% r/100 rH2O
KCL k2so4 CaCl2 CaSO4 KCI k2so4 CaCl2 CaSO4
25 26,05 0,75 - 0,03 35,60 1,02 - 0,04 1 KC1+K2 SO4+K2 SO4-CaSO4-H2O
25,12 - 0,62 0,13 33,88 - 0,83 0,17 KCI+K2SO4-CaSO4-H2O
21,74 (22,23) - 3,16 (4,19) 9,34 0,10 (0,13) 28,99 (30,26) - 4,21 (5,705) 0,13 (0,174) KC[+K2SO4-CaSO4-H2O KC1+K2 SO4-CaSO4 0<-CaS04-2H20
14,76 - - 0,04 19/46 - 12,31 0,05 KCI +CaSO4-2H2O
13,08 - 10,86 0,03 17,20 - 14,29 0,04 KC]+CaSO4. 2H2O
15,12 2,21 - 0,02 18,30 2,68 - 0,025 K2SO4+K2SO4-CaSO4-H2O
7,57 4,79 - 0,02 8,64 5,47 - 0,020 K2SQj +K2SO4,CaSO4,H2O
(0,20) (2,85) - (0,17) (0,209) (2,95) - (0,175) K2SO4-CaSO4-H2O+CaSO4-2H2 0
(2,39) (1,48) - (0,24) (2,487) (1,54) - (0,247) ^SO4-CaSO4-H2O+CaSO4- 2И2О
(8,50) - (0.37) (0/48) (9,38) - (0,404) (0,533) K2SO4-CaSO4 -r^O+CaSO^ 2H2O
0,075 - - 0,225 0,075 - - 0,226 CaSO4*2fl2O
0,149 - - 0,239 0,150 - - 0,240 CaSO4’2H2O
0,449 - - 0,308 (0,452) - - (0,310) CaSO4-2H2O
0,598 - - 0,320 0,604 - - 0,323 CaSO4-2H2O
0,895 - - 0,375 0,907 - - 0,380 CaSO4.2H9O
Табл. 44. Свешникова ВЛ. Изв. СФХА АН СССР, 17, 348, 1940
CaCl 2-CaSO4-H2O-MgCl2-MgSO4
Таблица 45
°C Жидкая фаза Твердая фаза
вес.% г/100 г H20
MgCI2 CaS04 MgCI2 CaSO4
25 35,77 0,082 - - MgC)2-6H2O+CaSO4-2H2O
26 33,39 0,105 50,200 0,1577 CaSO4-2H2O
26,99 0,258 37,090 0,3553 CaSO4-2H2O
17,79 0,564 21,790 0,6913 CaSO4-2H2O
11,01 0,782 12/480 0,8867 CaSO4-2H2O
4/47 0,727 4,717 0,7674 CaSO4-2H2O
1,94 0,558 1,986 0,5724 CaSO4-2H2O
0,84 0,422 0,853 0,4273 CaSO4-2H2O
0 0,208 0 0,2086 CaSO4-2H/)
Табл. 45.Свтегол O.F., Seidell A. J.Phys. Chem., 1901
S, 645
272
CaCl -CaSO. —Н 2 4 ,O-NaCl-Na,SO Таблица 46
°C Жидкая фаза
вес.% M/1000 MH20
Твердая фаза
\aC) Na2SO4 CaSO4 2NaCI Na2SO4 CaS04
-3 25,62 0,460 53,5 - 0,823 NaCI-2H2O+CaSO4-2H2O+ лед
25,67 0,673 0,235 53,9 0 1,16 0,423 NaC|.2H2O+Na2SO440r^O+CaSO4-2H2O
17,85 0*405 0,480 33,80 0,633 0,780 Na2SO4-10H2O+CaSO4-2H2O
12,87 0,500 0,486 23,00 0,735 0.746 Na2SO4-10H2O+CaSO4-2H2O
4,25 1*448 0,214 6,95 1,95 0,30 Na2SO4-10H2O+CaSO4-2H2O + лед
4,90 0,532 737 - 0,744 CaSO 4*2H2O + лед
25 25,85 0 0,4666 54,07 0 0,8380 NaCI+CaSO4-2H2O
23,87 3,90 0,0644 50,96 6,86 0,1153 NaCI+3Na2SO4-2CaSO4+CaSO4
22,21 5,66 - 47/16 9,96 8Na2SO4-2CaSO4+CaSO4-2H2O
19,57 737 - 41,28 12,80 3N^ SO4-2CaSO4+CaSO4-2H2O
17,43 9,00 - 36,52 1532 3Na2SO4-2CaSO4+CaSO4-2H2O
15,26 11,00 - 31,88 1831 3N’a2SO4-2CaSO4+CaSO4-2H2O
12,88 13,41 - 2632 23,08 3Na2SO4-2CaSO4 +CaSO4-2H2O
12,89 13*47 - 26,97 23,20 3Na2SO4-2CaSO4 +CaSO4*2H2O
22,71 6,70 0,0220 49,59 12,05 03413 NaC)+Na2SO4+3Na2SO4-2CaSO4
18,88 9,58 03228 40,68 1730 0,0422 Na2SO4+3Na2 S04 -2CaSO4
16*42 12,15 0,0223 35*44 21,59 0 3414 Na2SO4+3Na2SO4 -2CaSO4
13,63 15*45 0,0251 29,63 27,64 03468 .Na2SO4+Na2 S04 •10H2O+3Na2SO4’2CaSO4
11,78 14,4 2 0,0256 24,59 24,78 0,0459 Na2SO4-10H2O+3Na2SO4-2CaSO4+CaSO4-2H2O
7,64 10,16 0,1353 15,49 26,96 0,2359 Na2SO4-10H2O+CaSO4-2H2O
4,58 18,06 0,1570 9,14 29,67 0,2690 S04-l 0H2O+CaSO4-2l^ 0
2,29 19,74 0,1795 4,55 32,18 0,3054 Na2SO4-10H2O+CaSO4-2H2O
Табл. 46. Королев В.Ф. Тр. Солян. лабор. АН СССР, 1937, в. 15, 28-33
СаС12-КС1 -H2O-MgCi2 Таблица 47
°C Жидкая фаза Твердая фаза
вес.% мол.%
KGI MgCI2 CaCl2 KCI MgCI2 CaCI2
0 2,13 26,7 8 0 0,34 6,63 0 KCI+KCI-MgCI2-6H2O
2,02 6,55 27,66 0,35 1,78 6,44 KCI+KCI-MgCI2-6H2O
1,87 330 3339 0,33 032 8,01 KCI+KCbMgCJ2. 6H2O+CaCl2-6H2O
1,82 238 33,84 0,33 0,83 8,12 KCI+CaCI2 -6H2O
1,96 0 37,27 035 0 9,02 KCI+CaCI2-6H2O
1,88 3,68 3239 034 133 7,91 KC]-MgCI2-6H2O+CaCI2-6H2O
0,036 23,97 14,04 0,0064 6,59 3,31 KCI-MgCl2-6H2O+CaCI2-6H2O
0,028 2930 6,88 0,0048 7,87 1,58 KCI-MgC]2-6H2O+MgCI2-6H2O
0,021 34,68 0 0,0040 9,13 0 KC].MgC^-6H2O+MgCI -6H2O
0,019 23,88 14,01 0,0034 6,56 3,30 MgCI 2-6H2O+CaCI2-6H2O
0 2334 14,00 0 638 3,30 MgCI2-6H2O + CaCI2-6H2O
°C Жидкая фаза
вес.% M/1000 М Н20 Твердая фаза
KCI MgC)2 CaCI2 2KCI MgCl2 CaCI2
25 0,25 14,8 30,5 0,5 51,5 91 MgCI2-6H2O+2MgCI2-CaCI 2-
•12H2O+KCI-MgCI2.6H
Табл. 47. Igelsrund L., Thompson Th. Amer.Chem.Soc., 1936, 58, 2004, Vant Hoff, Sitzungs ber. preuss. Aka d.,
№ 155, 1905, 5, 252
15
273
СаС12-Н20-KCI-NaCl
Таблица 48
CaS04-H 2О-К 2SO4-MgSO4
°C Жидкая фаза Твердая фаза
вес.% M/1000 A ih2o
NaCl KCI CaCI2 2NaCI 2KCI CaCl2
0 ИД 53 13,69 2436 8,60 3135 NaCl + KCI
1.8 2,51 31,10 4,29 4,69 78,15 NaCl + KCI
0,66 2,01 36,0 1,66 3,96 95,27 NaCl+KCI+CaCI2-6H2O
25 12,60 8,62 10,63 2849 15,28 25,32 NaCI+KCI
3,98 5,08 25,50 937 938 63,24 NaCI+KCI
0,34 3,08 4438 130 7,13 1383 NaCI+KCI+CaC)2-6H2O
Табл. 48.Лукьяновd Е.И.ДИойхем Тр. ГЙПХ, 1940,
в. 34, 16-17
СаС12-Н2О- MgCl2- NaCl
Фиг. 1044. Гап Klooster H.S. J.Phys.Chem.Ithaca, 1917,
21, 6, 517
°C Жидкая фаза Твердая фаза
вес.%
NaCl MgC>2 CaCl2
-03 03 183 18,6 3,95 337 335 337 NaCl+NaCl’2H2O NaCl
°C Жидкая фаза Твердая фаза
вес.% M/1000 мн2о
NaCl | MgCl2|caCl2 2NaC12|MgCl2|caCl2
25 0,32 07,70 110Д4 0,32 19,15 23/40 038 1435 30,50 0,30 936 38,83 0,85 1В535 1 27,5 0,86 63,4 66,5 1 52,2 90,6 038 34.52 121,7 NaCl+MgCl2-6H2O NaC J+MgCl2-6H2O NaCl+MgCl2-6H2O+2MgCl2' •CaCl2.12H2O NaCI+2MCl2-CaCI2- •12 FfeO+CaCl ^6H?Q
Табл. 49. Курнаков Н .С.,Николаев А,В, Йзв. АН СССР
сер. хим. 2,404, 1938; Лужная И,П.^Верещагина И.П.
Жури, прикл. хим., 1946, 19, в. 7, 727-731
Н О-К В О -KCl-Na В .0_ -NaCl
& & 4 I 2 4 7
Таблица 50
°C Жидкая фаза Твердая фаза
вес.% M/1000 MH20
NaCl Na2B4O7 KCI 2NaCl Na2B/)7 2KCI
25 20,01 1,05 11,OS 45,4 1,39 19,6 N aC 1+N a ^4O7-101120+
+ KCI
Табл. 50. Van'Hoff, Btasdale W.C. Situngsberg.preuss.
Akad. Wiss., 1805,-1088
H2O-KBr-KCl-NaBr-NaCl
Таблица 51
°C Жидкая фаза Твердая фаза
вес.% M/1000 M h2o
NaCl । NaBr KCI ' KBr NaCl NaBr । KCI | KBr
25 26,45 1 _ 1 1103 - 1 . NaCl
23,25 038 - 835 105,8 0,2 - 20,0 NaCl
20,86 - 5,77 7,64 97,8 - 21,2 17,6 Na(CI,Br) + K(CI, Br)
11,72 10,49 - 18,19 60,8 30,8 - 46,2 Na(CI,Br) + K(C1, Br)
430 38,25 - 837 24,8 134,8 - 24,6 Na(Cl, Br) + NaBr-2H2O+K(CI,Br)
4,10 39,80 -• 535 25,0 137,8 - 16,6 Na(Cl,Br)+Na(Cl,Br)+NaBr2H2O
138 41,22 - 8,38 10,0 147,8 - 263 NaBr2H2O + K(C1, Br)
- - 26,70 - - - 88,0 - KCI
- 0,17 2538 0,39 - 0,4 853 0,8 K(C1, Br)
- 25,88 13,12 4,58 - 80,3 56,2 123 K(Cl,Sr)
- - - 40,58 - - - 103,4 KBr
137 1.09 - 3743 10,2 3,2 - 95,2 K(Br,CI)
Табл. Бергман А.Г., Домбровская H.C. СТЭ, 7,212/1931; Бергман А.Г.,Власов М.А., Изв. СФХА АН
СССР, 1949, 18, 213
274
H2O-K£O3-KC1-K2SO4
Таблица 52
°C Жидкая фаза, вес.% Твердая фаза
KCI k2so4 к2со3
35 13 Следы 52,3 ' kci+k2so4+k2co3-i,5H2o
Табл. 52. TeepleJ.E. The industrial Development of Searles
__________________________________________ Lake Brine, 1829, 72-75
H 0-K CO -KCl-MgCO -MgCl Табли ца 53
£ & & & £
°C Жидкая фаза Твердая фаза
вес.% М/1000 г н2о
КС1 к2со3 MgCO3 КО K2Mg(CO3)2.4H2O
17 20,08 0,153 0,083 3,38 0,01386 IK£O3-MgCO3-4H2O
14,03 0,224 0,136 2,365 0,0101 K2CO3-MgCO3-4H р
9,85 0332 0,202 1/190 0,0268 K2CO3-MgCO3-4H fi
5,52 0,456 0,278 0,790 0,0352 I К £O34!gCO3-4H2O+MgCO3-3H2O
138 0,512 0,312 0,274 0,0381 1 MgCO3-3H2O
Табл. 53. НаПа F.Z.Ahorg. Chem., 1956, 226
Н 0-K СО —KCI—Na CCL-NaCl
i Z 3 £ &
°C Жидкая фаза Твердая фаза
вес.% М/1000 МН20
NaO Na2CO3 КО K2CU3 2NaO Na2CO3 2КО К2СО3
20 । 1 1036 17,47 8,77 - 24,33 46,61 16,64 - NaCl+Na2C0340H20 +КС1
- 24/И 13,72 - - 65,63 26,64 - Na£03-10H20 +КО
6,48 16,53 - 15,78 16,30 45,90 - 33,60 Na2CO340H2O+Na2CO3-7H2O+KCl
5,15 16,76 - 1731 13,17 47,33 - 38,79 Na2CO3-7H2O+NaKC0 3-6Н2О+КС)
- 15,24 5,77 10,87 - 43,80 11,80 43,80 NaKCO3-6H2O+KCl
- 5,11 0,85 47,58 - 18,72 2,22 133,50 NaKCO3-6H2O+KCl+K2 COj 4,5H20
Табл. 54. Btasdate IP.C.J.Amer.Chem.Soc., 1923, 45
H 0-K CO -KHCO -Na,CO —NaHCO
Л £ Ц *> £ о о
Таблица 55
°C Жидкая фаза Твердая фаза
вес.% M/1000 mh2o
NaHCO3 Na2CO3 кнсо3 K2co3 NaHCO3 Na2CO3 2KHCO3 K2CU3
25 - 8/18 11,17 19,92 - 23,88 16,64 4238 1,378 NaHC03 + KHCO3
1,36 1,93 25,68 - 235 4,62 3233 - 1 ,208 NaHCO3 + KHCO3
4,38 15,98 - 3,96 6,21 35,89 - 6,82 1,236 NaHCO3 + Tp*
738 4,83 - 26/10 1438 1330 - 56,61 1,375 NaHCO3 * Tp
8,53 3,74 - 2833 15/10 10,70 - 62,18 1,300 NaHCO3+Tp+KHCO3
8,08 4,01 - 2832 14,71 1136 - 63 32 1,381 Tp+KHCO3
4,58 4,78 - 37,06 0,10 15,17 - 00,18 1/162 Tp+KilCO3
1,79 22,03 - 138 238 50,46 - 3/18 1,262 Tp+Na2CO340H2O
0,61 22,50 - 11,24 130 5836 - 2235 1,347 Tp+Na2CO340H2O
0,47 22,68 - 11,60 0,78 50,20 - 23/10 1,358 Tp+Na2C0340H2ONa2C03-7H20
0,40 22,78 - 12,63 0,82 60/10 - 25,68 1,365 Tp+Na2CO3+7H£)
0,30 22,67 - 14,25 031 61,37 - 29,59 1,381 Tp+Na2CO3 + 7H2O
0,21 22,33 - 1633 037 61,77 - 3431 1386 Tp+Na£O3 7H2O+(NaK)2-CO3-6H
275
Продолжение таблицы 55
°C Жидкая фаза
вес.% M/iooo МН2О Твердая фаза
NaHCO3 Na2CO3 КНСО3 к2со3 NaHCO3 Na2CO3 2КНСО3 к2со3
0,30 22,00 - 16,35 0,52 60,95 - 34,74 1,403 Tp+tNa/OjCOj^O
3,54 6,13 - 36,32 7,03 19,27 - 87,65 1,458 Tp+(Na,K)2CO3-6H2O
4,02 4,90 - 38,73 8,23 15,90 - 96,45 1,481 Tp*(Na,K)2C034)H/)+KHC03
3,78 4,28 - 40,47 7,87 14,13 - 102,5 1,490 (Na,K)2CO3-6H p+KHCO3
3,55 4,12 - 41,37 7/46 13,73 - 105,8 1,496 (Na,K)2CO3-6H2O+KUCO3+N
3,24 4,05 - 41,99 6,85 13,57 - 107,9 1,497 (Na,K)2CO3-6II2O+N
1,95 4,06 - 44,82 4,25 14/13 - 118,8 1,521 (Na,K)2CO3-6H2O+N
1,80 4,15 - 45,12 3,94 14,42 - 120,2 1,524 (Na,K)T:O3-6!i2O+N
0,89 4,40 - 47,85 2,04 15,96 - 133,1 1,550 (Na,K)2CO3-6H2O+\
0,72 4,52 - 48,68 1,68 16,66 - 137,7 1,563 (Na ,K)2CO3.6H2ChN+K2C03-l,5H20
0,99 3,18 - 49,76 2,30 11,73 - 140,8 1,560 N + K2CO3-1,5II2O
1,38 2,00 - 50,59 3,22 7,38 - 143,3 1,560 N + K2CO3-1,5H2O
2,02 0,36 - 51,72 4,71 1,35 - 146,9 1,559 n+k/:o3-i,5H2o ♦ khco3
3,50 3,98 - 41,66 7,38 13,30 - 106,8 1,501 N <• KHCO3
2,79 0,69 - 49,42 6,35 2,49 - 136,8 1,543 N + КНСОз
- 1,14 2,41 50,59 - 4,22 4,73 143,8 1,56 khco3+k2co3.i,5H2o
*Тр - трона.
Табл. 55. Hill A. Smith S.J. Amer.Chem. Soc., 1929, 51 , 1630
H20-K/:03-K2S04-Na2C03-Na2S04
Таблица 56
°C Жидкая фаза Твердая фаза
вес.% M/1000 M H2O
Na2SO4 Na2CO 3 K£O4 k2co3 Na^ Na2CO3 k2so4 k2co3
25 16,41 16,81 - 2,31 32,28 44,30 - 4,67 Na2S04401i20+NaK3(S04)2+Na2C03-10H20
2,20 23,26 8,10 - 4,20 59,50 12,60 - NaK3(SO4)2+\a2CO3-!0H2O
- 22,88 4,27 5,00 - 57,30 6,50 9,60 NaK3(SO4)2+Na2CO3-10H2O+K2SO4
- 22,89 0,93 11,89 - 60,50 1,50 24,10 Na2CO3-10H ^Na^O3-7li2O+K2SO4
0,62 21,62 - 16,56 1,28 60,04 - 35,26 Na2CO3-7H p+NaKCO3-6H2O+K2SO4
- 16,68 0,59 21,75 - 46,50 1,00 46,50 NaKCO3-6H2O+K2SO4
- 5,02 0,63 48,02 - 18,40 1,40 135,10 NaKCO3-6H2O+K £O4+K2CO3-1,5H2O
Табл. 56. Blasdale Ж.С. J.Amer. Chem. Soc., 1923, 45,2944
H2O-KC1-K .^-MgCl^-MgSO *
H-O-KCl—KHCO —NaCl—NaHCO,
£ Л 3
Таблица 57
Фиг. 1045. Справочник по растворимости солевых сис-
тем, т. П. Госхимиэдат, 1954
°C Жидкая фаза Твердая фаза
вес.% M/1000 M h2o
NaCl KCI KHCO3 NaCl KCI KHCO3
20 20,75 8,15 9,56 12,15 0,92 11,81 : 13/) 27,1 33,6 42/0* 2,4 30,4 NaC]+NallCO3+KCI NaHCO3+KCI+KHCO3
Табл. 57. Schutze H. Piechowicz T., Pustelnik W.,
Helvetika Chim. Acta, 1943, 26, 238
276
Таблица 58
H2O-KC'l-K2SO4-NaCl-Na2SO4
H2O-MgCO3-MgCl2-Na2CO3-NaCl
Фиг. 1046. Справочник по раство-
римости солевых систем, т. II.
Госхимиздат, 1954
H2O-KCl-MgCl2-NaCl
°C Жидкая фаза
вес.% г/1000 г Н20 Твердая фаза
NaCl MgCO3 NaCl MgCO3
0 0,292 0,0121 2,93 0,1210 (MgCOj.xH/))
0,117 0,0134 1,17 0,1344 (MgCO3-xH2O)
0,0585 0,0128 0,585 0,1283 (MgCOyxH 0)
0 0,0094 0 0,0944 (MgCO3-xH2O)
23 27,63 0,0244 331,4 0,293 MgCO3
23,32 0,0336 272,9 0,383 MgCO3
20,23 0,0403 231,1 0,460 MgCO3
13/47 0,0497 147,4 0,544 MgC03
9,93 0,0546 106,3 0,585 MgCO3
5,72 о дав 59,5 0,527 .MgCO3
2,75 0,0411 28,0 0,418 MgCO3
0 0,0177 00 £ 0,176 MgCO3
Фиг. 1047. Справочник по растворимости
солевых систем, т. II. Госхимиздат,
1954
Табл. 58. Cameron F., Seidell A. Phys.Chem., 1903, 7, 585;
Gothe F., Chem. Ztng.,1915, 39, 48, 306
H2O-MgCO3-MgSO4-Na2CO3-Na2SO4
Таблица 58
°C Жидкая фаза Твердая фаза
вес.% г/1000г h2o
Na2SO4 MgCOj Na2SO4-10H2O MgCO3
(0) 0,178 0,0150 4,03 Ь,1507 (MgCO3 -xH/))
0,071 0,0162 1,61 0,1620 (MgCO3-xH2O)
0,035 0,0145 0,805 0,1450 (MgCO -xH2O)
0 0,0094 0 0,0944 (MgCO3-xH2O)
H2O-K2SO4-MgSO4-Na2SO4
°C Жидкая фаза
вес.% г/л Твердая фаза
Na2SO4 MgCO3 Na2SO4 MgCO3
23 24,57 0,112 305,10 1,388 MgCO3(?)
22,7b 0,109 278,50 1,338 MgCO3 (?)
21^1 0,111 254,60 1,338 MgCO-p)
16,58 0,111 191,90 1,280 MgCO3(?)
14,18 0,108 160,80 1,230 MgCO3(?)
8,85 0,094 85,68 1,020 MgCO3(?)
5,23 0,079 54,76 0,828 MgCO3(?)
2/46 - 0,057 25,12 0,586 MgCO3(?)
0 0,022 0 0,216 MgCO3(?)
Табл. 59. Cameron F.K., Seidell 4. J. Phys. Chem., 1903, 7,
587
Фиг. lOAS.flнатъева 0.К. Изв. СФХА
АН СССР, 1938, 17, 373
277
H2O-MgCl 2-MgSO4-NaCl-Na2SO4
н 90-Na, В .0 - NaCl—NaHCCL
Z Z 4 / J
Таблица 60
- M9"
Фиг. 1049. Справочник по растворимости солевых сис-
тем, т. П. Госхимиэдат, 1954
c Жидкая фаза Твердая фаза
вес.%
NaCl | NaHCO3 | ^2B4°7
0 25,75 0,35 0,48 NaCI+NaHCO3+Na2B4O7- • юн2о
25 25,30 0,7 1,2 NaCI+NallCO3+Na2B4O7- •loh2o
3,26 1,13 NaHCO3 + Na2B4O7-10H2O
Табл. 60. Грушвицкий В ,E ,,Ф ле римская В.М. ВНИИГ,
1932
HO_Na„B1O_-NaHCO„-Na^O Z Z 4 < о Z 4 Таблица 61
°C Жидкая фаза
вес.% г/100 г солей Твердая фаза
Na2SO4 NaHCO3 Na^Oj Na2SO4 NaHCO3 Na^O,
0 2,63 5,28 0,36 31,8 63,85 4,35 Na2S04-10H20+NaHC03+Na2B407-10Hp
25 20,97 3,20 130 82*4 12,5 5,1 Na2SO4-10H2O + NaHCO3
20,65 3,35 1,72 80,3 133 6,7 Na2S04-10H20+NaHC03
20,94 2,88 2,46 78,6 11,0 8,4 Na2SO4-10Hp +NaHCO3
21,17 2,31 232 80.20 8,75 11,05 Na^O^O^O+NaHCO^Na^O-y-lOHjO
20,0 2,09 138 8535 8,55 6,10 Na2S04-10H20 + Na2B407-10H20
2137 1,93 2,28 8338 730 8,42 Na2SO4-10H2O+NallCO3+Na2B4O7-10H2O
11,5 4,7 2,55 613 253 13,7 NaHC03+Na2B407-10H20
5,1 6,51 2,72 35,7 45,5 18,8 NaHC03+Na2B407*10H20
3,6 737 23 27,0 55,7 17,3 NaHC0q+Na7BA07 • 10H2O
Табл. 61. Грушвицкий B.E., Флеринскал Е.М, ВНИИГ, 1932:
Н „0—Na „С0-—NaCl—NaHCO.
2 2 3 3 Таблица 62
Жидкая фаза
С вес. % M/1000 MH2O ~ Твеодая (Ьаза
NaCl NaHCO3 Na2CO3 NaCl NaHCO3 Na2CO3
0 25,05 0,73 1,30 105,8 2,15 3 33 NaCl+NaHCO3
23,87 0,84 ’ 2,75 101,6 2,78 6,45 NaCl+NaHCO3 + Tp*
23,86 0,73 2,88 1013 2,16 7,02 NaCl + Tp + Na2CO3-10H2O
22,84 1,11 2,77 8636 3,25 6,42 NaHCO3 + Tp + Na2CO3*10H2O
21,32 0,82 2,63 87*46 2,63 5,85 NaHC03+Na2C03*10H20
15,14 2,14 2,38 5830 5,71 536 NaHC03+Na2C03-10H20
9,53 2,83 2,88 34,66 7,16 5,80 NallC03+Na2C03’10H20
4,81 3,51 3,78 16,87 836 7,31 NaHCO3+Na2COyl0H2O
25 23,97 1,38 2,55 102,5 4,10 6,01 NaCl + NaHCO3+Tp
15,04 1,95 6,65 60,71 5,48 14,80 Na’ICO3+Tp
7,57 230 11,35 28,84 735 24,67 NaHCO3+Tp
21,35 0,53 7,28 82,80 1,60 17,47 NaCl + Tp
17,72 0,61 13,28 79,86 131 3330 NaCl + Tp
15,28 0,34 17,28 70,19 1,08 43,77 NaCl + Tp + Na2CO3«7H2O
12,84 0,53 18,36 5737 1,66 45,71 Tp + Na2CO3-7H2O
11,38 0,80 18,99 5036 2,48 46,88 Tp + Na2CO3’7H2O+Na2CO3-10H2O
11,08 0,76 18,88 49,4 2 2,36 46,67 Tp + Na £O3*10H2O
5,01 134 18,84 20,92 3,88 45,68 Tp + Na £O3’10H £
Табл. 62. Freeth F.A. Phil. Trans. Roy. Soc.London, 1927, 223, 8087
*Tp - трона
278
Таблица 63
H,0-Na,СО NaHCO,—Na,SO
2 2 3 3 2 4
°C Жидкая фаза Твердая фаза
вес.% М/1000 м н2о
Na^ NaHCO3 Na£O3 N»2SO4 NaHCOj Na2CO3
0 2,27 4,42 3,14 3,10 10,50 5,92 Na^SO^ 10H2O+NaHCO3
2,12 4,37 5,13 3,04 10,60 9,87 Na2SO4 • 1 OHj O^aHCD/Na^* lOt^ 0
2,29 2,30 5,32 3,22 5,48 10Д4 Na2SO4-10H 0 + Na2CQj*10H
0*49 4,33 5,46 0,69 10,35 10,34 NaHCO3+Na2CO3-10H2O
15 8,80 4,08 4,27 13,47 10,60 8,76 Na2SO4-10Hp*-NaHCO3
8,08 3,57 8,25 12,79 9,56 17,51 Na2SO440H2O +NaIICO3
7,57 3,17 11,96 12,42 8,79 26,30 Na2SO4,10H2O + NaHCO3+Na2CO3 -10H2O
7,57 2,32 11,98 12,29 6,37 26,06 Na £O4-10H2O + Na2CO3*10H2O
5,40. 3,26 * 12*43 8,68 8,86 26,77 NaHC03+Na2C03-10H20
2.49 3,79 12,92 3,91 10,06 27,18 NaHCO3+Na/:O3-10H2O
Табл. 63. Макаров С.З.,Косман О.М. СТЭ, 1831, 7, в. 16, 19 234
H2O-NaCl-NaF-Na2SO4
Таблица 64
°C Жидкая фаза, вес.% Твердая фаза
NaF । NaCl I Na2SO4
25 0,31 25,93 0,38 NaF + NaF .Na2SO4+NaCl
Следы 23,61 5,23 NaF-Na2SO4+NaCI
0,10 22,74 6,95 NaF-Na2SO4+ NaCl + Na^
Следы 19,29 9,72 NaF «Nfi^SO4+N^SO4
Следы 13,78 14,75 NaF • Na2SO4+Na2 SO^Na^-l 0H2O
0,60 21*48 4,35 NaF-Na2SO4
• Следы 18*41 4*47 NaF *N^SO4
0, 77 14,35 4,60 NaF «Na2SO4
0,69 6,98 7,71 NaF -NazSfy
Табл. 64. Foote Ж., Schairer J.E. J.Amer.Chem.Soc., 1930,
52, 4211
H2( )-NaCl-NaHCO3-N a2SO 4 Таблица 65
°C Жидкая фаза Твердая фаза
вес.% M/iooo м h2o
NaCl n^so4 NaHCOj NaCl Na2SO4 NaHCO, i
0 25,30 1,22 0,66 107,04 2,13 1,95 1 | NaCl+Ne^SO4*10H2O+ +NaHCO3
20,15 1,16 1,02 80,04 1,90 2,84 Na2SO4-10H/H +NaHCO3
4,94 1,78 4,10 17,07 2,53 9,86 Na2S0^10H20«-NaHC03
25 24*43 3,23 1,11 : 105,70 5,86 3,34 NaCl+NaHtoj
22,85 6,62 1,25 ; 108,90 12,01 3,87 NaCl+Na2SO4+ +NaHCO3
16,87 11,31 1,30 73,74 20,26 3,97 Na2SO4+NaHCO3
13,22 14,71 1*47 57,71 26,31 4*46 N^ SO4 +Na2SO4- 10Ц CXNaHCO3
4,97 17*40 3,48 20,67 29,64 1,01 Na2SO4 • 10H2O^NaHCO3
Табл. 65. Макарова C.3., Букина В,В,,Валлшко М.Г,
СТЭ, 1931, 7, 234
Таблица 66
Na, Ca, Mg,IICl,CO3. HC03, SO *
°C Жидкая фаза Твердая фаза
вес.% M/1000 г раствора
NaCl MgSO4 MgCO3 CaSO4 CaCO3 2NaCl Mg2* Ca2* SO42“ 2HCO3H
25 2,000 0 (0,2576) 0 (0,0777)0,17105 (0,03055) (0,00776) 0 (0,03831) 2,000 0 0,0551 0 0,0641 0,17105 0,00654 0,00640 0 0,01294 2,000 0 0,0062 0 0,1453 0,17105 0,00074 0,01452 0 2,000 (1,0984) - • (0,0112) (0,1738) 0,17105 (0,09124) (0,01818) (0,09206) (0,01736) 2,000 {0,1772) - (0,2555) (0,1448) 0,17105 (0,01472) (0,03324) (0,03349) (0.01447) 2,000 0,0135 - 0,3660 0,1181 0,17105 0,00112 0,03868 0,02800 0,01180 0 (1,7804) (0,0433) - (0,0601) 0 (0,15304) (0,00601) (0,14790) (0,01115) 0 0,2084 - 0,0698 0,1596 0 0,01731 0,02108 0,02244 0,01595 0 0,0908 - 0,1291 0,1211 0. 0,00754 0,02158 0,01702 0,01210 0 0,0129 - 0,1643 0,0904 0 0,00107 0,02110- 0,01314 0,00903 ' MgCOj+MgCOjCaCQj MgCo3*CaC03 MgCOj’CaCQj+CaCQj (MgCO3+CaSO4-2H2O) (MgCO ^MgCOyCaCOj +CaSO4«2H2O (MgCy MgCO3CaCO3+CaSO4-2H2O) MgCO 3+CaCO3+CaSO4-2H2O+CaCO3 MgCO 3+CaCO 3-MgCO3+CaSO4-2H2O MgCO 3+CaCO3+CaSO 4«2H MgCO 3-CaCO3+CaSO4-2H2O+CaCO3
Табл. 66. Янаяъева О.К. ДАН СССР, 1949, 673
279
Ca. Na//СО,, Cl, SO, ° 4 Таблица 67
Жадкая фаза
вес.% иа100% солей Твеоаая Лаэа
NaCl 1 Na2SO4|Na2CO3 | CaC03 NaCl Na2SO4 NafO3
25 23,05 6,53 0,71 0,01 75,84 21,82 2,34 NaCI+CaC03
23,01 4,60 1,40 0,01 79,07 16,12 4,81 NaCI+CaCO3+Na £03 • CaCO3*5H2O
22,87 5,53 1,23 0,01 77,19 18,66 4,15 NaCI+CaCO3+Na2CC5 -CaCO3-5H2O
21,53 6,39 2,84 0,01 60,90 20,77 0,24 NaCI+Na^C^-CaCO3*5H2O
18,58 10,71 1,51 0,01 60,33 34,77 4,90 Na2SO4+CaCO3
13,75 13,20 2,29 0,01 47,03 45,14 7,83 Na ^O4+CaCO3+Na2CO3-CaCO3’5H2O
13,35 13,12 2.25 0,01 46*48 45,68 7,84 Na^O^aCO/Na^OyCaCtySI^O
18,86 10,73 2,25 OjOl 59,23 33,70 7,07 Na2SO4+Na2CO3-CaCO3’5 H2O
5,34 16,54 2.19 0,01 22,19 68,71 9,10 Na£04-10H2O+CaCO3
4,70 17,71 2,16 0,01 10,43 71,32 8,75 Na^O^lOl^ OCaC03
4,62 17,96 2,59 0.01 18.36 71,35 10,29 Na2SO4-10H2O+CaCO3
1,88 17,25 2,57 0,0 1 8,66 70,50 11,84 Na2S04*10H20+CaC03
10,62 15,02 2,07 0,01 38,33 54,20 7,47 Na2SO4-lOl^O+Ca^+Na^C^ -СаСО3’5Н2О
10,10 13,35 2,17 0,01 30,64 51,02 8*44 Na2SO4-10H2O+CaCO3+Na2CO3-CaCO3’5H2O
0,05 15,37 2*41 0,01 33,73 57,29 8,98 Na2SO4-10H20+CaC03+Na2C03-CaC03«5ll20
5,00 16,92 2,88 0,01 21,01 65,89 12.10 SO4‘ 10ll2O+CaCO3+N^CO3«CaCO3-5H2O
4,82 17,18 3,65 0,01 18,70 66,98 14,23 Na 10Н20+СаС03^а2С03«СаС03-5Н20
8,80 15,52 5,52 0,01 29.70 51,86 18*44 Na ^O4«10H2O+Na2CO 3-CaCO3*5H2O
8,87 13,58 4,14 0,01 33,36 51.07 15,57 Na2S04’10H20+Na2C03-CaC03-5H20
4,31 17,19 3,00 0,01 16,91 67,44 15.65 Na2S04*10H p+Na^OyCaCOj-oU^
7Д7 11,73 3.01 0,01 33,63 52,82 13,55 Na2CO3-CaCO3-5H2O
2,06 16,01 2,84 0,01 9,85 76,57 13,58 Na £O3+CaCO3-5H2O
21*43 4,42 1,17 0,01 79,31 16,36 4,33 CaCO3+Na2CO3-CaCO3‘5H2O
8,03 3,93 4,77 0,01 48,00 23,50 28,50 CaCO3+Nr2CO3-CaCO3*5ll2O
Табл. 67. Валя щко М.Г., П втрое а Е.М. Тр. ВНИИГ, 1952, в. 23, 167-168
Са, К, Na Ц Cl, SO.
4 Таблица 68
Жидкая фаза
вес.% М/1000 МН2О Твердая фаза
NaCl KCI CaCI2 CaSO4 NaCl KCI 1/2 CaCI2 l.'2CaSO4
0 16,59 10,32 0,063 0,513 70,32 34,32 0,335 1,869 NaCI+KCI+CaSO4-xll £
25 19,63 11,06 0,253 0,391 88,93 4 2,39 1.211 1.519 NaCl+KCl+CaS04-xHo0
Табл. 68. Палкин А.П., Брикман Н.М. Тр. ГИПХ, 1932,
Са, Na, К, Mg//Cl Таблица 69
° с Жидкая фаза
вес.% M/1000 М Н2О Твердая фаза
NaCl KCI MgCI2 CaCI2 2NaCI 2KCI MgCI2 CaCl2
25 0,33 3,89 1,28 43,98 1 9,3 4,8 141,3 NaCI+KCHKP+CaCI2«6ll2O
0,33 0,89 9,30 38,30 1 2,1 34,4 121,5 NaCI+Kp+Tx+CaCI2’6ll2O
0,35 0,67 14,4 8 30,25 1 1,5 50,5 90,5 NaCI+Kp+TxMlgCI2*6H2O
Табл. 69. Van Hoff,Lichtenstein, Z.ahorg. Chem., 1905, 47. 252
280
Таблица 70
к. Na//B.O_, Cl, SO,
t 4 4
°C Жидкая фаза M/1000 MH20
NaCl I N32SO4I Na2B4O7| KCI 2NaCI Na2SO4 | Na2B4°7 2KC1 Твердая фаза
25 1 19,0 7,7 1 0,9 5,0 43,5 14,5 1 1,2 9,0 19,5 2,4 1,1 0,2 45,0 4,5 1,5 18,5 NaCl+Na2SO4+Na2B4O7-10H2O+Na2SO4«3K2SO4 NaCl+Na2B4O7-l0H2O+KCH-NaSO4-3K2SO4
r
Табл. 70. Van't Hoff. Zur.Bild.Salzablag, 1909, 2, 48
K. Mg//C0 . Cl. hco3
Таблица 71
°C Жидкая фаза Твердая фаза
вес.% M/1000 mh2o
KCI кнсо3 MgCI2 Medico, )2 2KC1 2KHCO3 MgCl2 Mg(HCO3)2
25 15,71 - 8,80 1,14 24,48 - 22,23 1,87 KHCO3-MgCO3-4H2 O+MgCO3-3H £
9,38 - 5,31 1,77 13,55 - 12,01 2,61 KHCO3-MgCO3+4H2O+MgCO3-H2O
ззз 1,30 1,23 2,14 4,51 1,27 2,54 2,87 KHCO3-MgCO3MH2O+MgCO3-3H/)
1,88 2,06 0,58 2,14 2,01 2,21 0,62 2,29 KHCO3-MgCO3+4H2CHMgCO3-3H2O
1,07 2,58 0,27 2,14 1,38 2*47 0,55 2,81 KHC03-MgC034-4H2OrMgC03-3H2 0
- 3,04 - 2,40 - 2,89 - 3,11 KHCO3-MgCO3+4H2CH-MgCO3-3H2O
1,89 1,34 30,09 - 3,59 1,81 85,49 - KCl-MgCl26H ^MgCl2MgCO3-6H2O+MgC(^-3H2O
Табл. 71. Gloss G., Dissert. Uber Magnesiuncarbonate Naumburg,74, 1937-38
K. Mg//C0.}, hco3, so4
°C Жидкая фаза Твердая фаза
вес.% M/1000 M h2o
k2so4 кнсо3 MgSO4 Mg(HCO3)2 k2so4 2KHCO Mgso4 Mg(HCO3)2
25 10,70 1,68 - 2,69 13,12 1,79 3,93 K2SO4+KHCO3-MgCO3-4H /)
9,95 0,70 12,34 2,14 13,74 0,81 24,66 3,52 K2SO44-K2SO4-MgSO4-6H2O+KHCO3-.MgCO3-4H2O
8,23 0,82 14,57 2,14 11,45 1,00 29,38 3,55 K2SO4-MgSO4-6H />KHCO3-MgCO3-4H2 O+MgCO3-3H2l
(8,43) (0,81) (14,87) (2,14) (11,82) (0,99) (30,17) (3,57) K2SO4-\1gSO4-6H2O+KHCO3-MgCO3-4H2O+MgCO3-3H2(
6,24 1,04 18,37 2,14 8,93 1,30 38,07 3,64 K2SO4-MgSO4-6H2O+MgC(^ -3H2O
5,73 0,88 19,31 2,14 8,23 1,10 40,17 3,66 K2SO4-MgSO4-6H2O+MgCO3-3H2O
4,03 - 25,75 1,73 6,08 - 56,27 3,11 K2SO4-.MgSO4-6H2O+MgSO4-7^O+MgCO3-3H2O
6,67 1,82 8,67 2,14 8,55 2,03 16,08 3,26 KHC03-MgC03-4H2OMgC03-3H20
1,05 2,74 1,41 2,14 1,17 2,83 2,27 2,84 KHCO3-MgCO3-4H2O+MgCO3-3H2O
- 2,96 0,63 2,14 - 2,86 1,00 2,79 KHCO^gCO^^MgCOySH^
Табл. 72. Gloss G., Dissert Uber Magnesiumcarbonate Naumburg.75-76, 1937-38
8 36
281
K.Na//CO3, Cl, S04
2NaCl—Na2S04-2K2C03 = 2Na2CO3- 2KC1-K ^04-6H 20 таблица 73
°C Жидкая фаза Твердая фаза
вес.% M/1000 мн2о
NaCl Na2S04 Na2C03 KCI к2со3 2NaCl Na2SO4 Na2COj 2KCJ К2СОз
20 20,05 7,7 1,65 - 4,3 46,6 14,8 4,2 - 8,5 NaCl+Na2SO4+ Бр + Гз
18,8 7,2 4,8 - 0,9 42,5 13,4 12,0 - 1,7 \aCl+Na2SO4+ Бр+Га
17,7 8,0 2,25 4,7 - 40,5 15,1 5,7 8,4 - NaCJ+Na2SO4+ Га + Гз
17,15 1.7 9,15 - 7,8 41,2 3,ч 24,2 - 15,9 NaCI+Na2CO3-7H ^D+KC)+ Гз
16,3 3,75 10,2 - 5,25 38,9 7,4 26,8 - 10,6 NaCl+Na£O3-7H2O +Гз + Бр
16,9 4,3 8,8 - 5,2 40,1 8,4 23,1 - 10,4 NaCI+ Гз + Бр+Га
Бр - беркеит (2Na2SO4’ Na2CO3); Га - ганксит (9Na2SO4« 2Na ,jCO3« КС); Гэ - глазерит (Na2SO4*3k2SO4)
Табл. 73. Teeple J• Е. The industrial development of Searles Lake Brines,!929
K, Mg. Na//Cl, S04
К, Mg, Na//Cl, S04
Фиг. 1050. Путь кристаллизации солей при изотерми-
ческом испарении из морской воды (25 С)
Ванп-Гофф* Исследования условий образования океани-
ческих солевых отложений, 1936
Фиг. 1051. Путь кристаллизации солей из морской во-
ды в естественных условиях, 'солнечная диаграмма'
Н.С.Курнакова
В,И'Николаев Изв. Ин-та физ.-хим.анализа АН
СССР, 1930. т. I V, в. 2
Mg, Na//B4O7,Cl, S04
Таблица 74
°C Жидкая фаза Твердая фаза
вес.% М/1000 мн2о
NaCl Na2B ^0у MgSO4 2NaCI Na2B4O7 MgSO4
35 25,98 1,42 0 54,96 1,60 0 NaC)+Na2B/)7-10ll2O
25,05 2,14 1,34 53,97 2,66 2,79 NaC>Na2B4O7-10iI2O
24,10 3,10 2,69 52,89 3,93 5,61 NaC)+Na2B4O7-10U
23,17 3,76 3,82 51,52 4,83 8,22 NaCl+Na2B4O^-10H2O
22,14 4,68 5,03 50,03 6,11 10,99 NaC)+Na2B4O7-10H2O
20,92 5,83 6,00 47,91 7,71 13,29 NaCI+Na2B4O7’10H2O
/ 0 5,00 0 0 4,57 0 Na2B4O7-10H2O
Табл. 74. Влезингер Н.А., Спирягина А.И. ДАН СССР, 1938, 20, № 2-3
282
Таблица 75
Mg,Na//CO , Cl, HCO„
<5 •>
С Жидкая фаза Твердая фаза
вес.% м/iooo мн2о
NaCl NaHCO3 MgCl2 Mg(HCO3)2 2NaCl 2NaHCO3 MgCl2 Mg(HCO3)2
25 25.51 1,06 1,72 0,15 54,88 1,59 5,53 0,25 NaCl+NaHCO3+MgCCy3H2O
21.32 1,06 1.18 0,29 43,15 1,49 2,93 0/П NaHCO3+MgCO3-3H2O
19.61 1,06 0,92 0,54 38,30 1,46 2,23 0,85 NaHCO3+MgCO3-3H2O
0 9,26 0 0,86 0 . 11,04 0 1,18 NaHCO3+MgCO3-3H2O
Табл. 75. Gloss G.,-Dissert. Ober Magnesiumcarbonate, Naumburg. 75-76,1937-38
Na // B40_, Cl, HC03, SO4
Таблица 76
C Жидкая фаза Твердая фаза
вес.%
NaCl Na2SO4 NaHCO3 ^a2®4^7
0 25,25 1,32 0,32 0/И NaCI+Na2S04-10H20+NaHC03+Na2B/)7-10H20
25 21,46 7,53 Следы 3,55 NaCl+Na2SO4+NaHCO3+Na2B4O7-10H2O
Табл. 76. Грушвицкий B.E., Флеринскал ЕЛ., ВНИГ (1932)
283
СИСТЕМЫ, НЕ СОДЕРЖАЩИЕ ЛЕТУЧИХ КОМПОНЕНТОВ
ПРИ ВЫСОКОМ ДАВЛЕНИИ
САМОРОДНЫЕ ЭЛЕМЕНТЫ
Al, Sb, Zn, Pb, Cd, TI. Sn, Cu
Фиг. 1054. Кривые плавления мышьяка и антимонита
1 - данные Бутузова В.П. (Крист. 1957. 2. 536); 2 - данные
Newton R.C., Kennedy G.C. (Solids under Pressure, McGraw — Hill Rook
Company Inc. New Y.1963; 3 - данные автора
Klement W Jr.Jayaraman A..Kennedy G.C.Phys.liev.,
1963, 131. 2,635
Фиг. 1052. Зависимость температуры плавления металлов
от давления
Бутузов В.П. Кристаллография 1957, 2, 541
Фиг. 1053. Зависимость температуры плавления золо-
та от давления
Decker D.S., Vanfleet Н.В.Phys.Rev., 1965, 138, (I А), 132
Фиг. 1055. Фазовая диаграмма висмута. Пунктирные
линии указывают фазовые переходы по данным Brid-
gman P.W.(Pi\)c.Am.Acacl.Arts Sci., 1952 . 81.228; The
Physics of High Pressure, G. Bell and Sous, Ltd., London,
1949; Proc. Am. Acad. Arts Sci., 1942, 74, 438
Bundy F.P.,Phys. Rev., 1958, 110, 36
284
Фиг. 1056. Фазовая диаграмма висмута. Температу-
ры, полученные и при нагревании и при охлаждении,
указаны для перехрда III—IV
1 - данные Kennedy G.C. и др.(J.Geophys. Hes.. 1962. 67.851):
2 - данные автора
Klement WJr., Jayaraman 4., Kennedy G.C. Phys. Rev.,
1963, 13J, 2, 633
700
Фиг. 1058. Предполагаемая фазовая диаграмма угле-
рода. Показаны также точки Alder B.J.,Christian R.H.
(Pnys. Rev. Letters, 1961, _7, 367), De Cadi, Ja-
mieson J.C.(Sci., 1961, 133, 1821)
Bundy F.P. J.Chem. Phys., 1963, 38, 643
4000
Линия
Деления графц*^
-^о о
Графитизация алназа
1000
0
- Обдаешь /
стабильности
графита
Ж
пла&~
'Мния^Ц^
Область
стабильности
алмаза
Давление * к б ар
Давление,кбар
Фиг. 1057. Температура плавления графита как функция
давления. Показаны также линия плавления алмаза, ли-
ния равновесия графит/алмаз и тройная точка графит/
алмаз/жидкость
Bundy F.P. J.Chem. Phys., 1963, 38, 628
Фиг. 1060. Фазовая диаграмма железа. Эксперимен-
тальные результаты по точке плавления были полу-
чены до давления 96000 атм и по Р — у - пере-
ходу до 76000 атм
Strong Н.М. Nature,1959, 183, 1381
Фиг. 1059. Фазовая диаграмма железа
Strett K.F.,Klement W., Kennedy G.C. J .Geoph .Res.,
1965, 70, 8, 1979
. 285
Fe
°C
3000
О 1000
2000
3000
3500 Км
2000
Ге
Жидкость
H'Fe
Г-Ц куб
Фиг. 1063. Температура плавления свинца под давле-
нием
Бутузов В.П., Гоникберг М.Г. Журн. неорг. хи-
мии, 1956, 1, 1546
1000
О
2000
/ гексагон.
/№ мотн Упаковка
/У*
500 1000 1500
Да Олекие, кбар
Фиг. 1061. Расширенная фазовая диаграмма железа и
проекция ударной волны "Hugoniot" (Al'tshuler L.V.,
Krupnikov К., Ledenev B.N., Zhuchikhin V.I.,Brazhnik
M.(.Soviet Phys. (Engl. Transl.), 1958, 34, 874. Рас-
считанная граница между у — и е - фазой почти
параллельна проекции ударной волны "Hugoniot”
и простирается до РТ - условий внутри ядра Земли
Takahashi Т., Bassett Ж.А .Science, 1964, 145, 3631,
485
Фиг. 1062. Кривые плавления и ударные адиабаты для
Ni,Си, РЬ с г = 1(1); ударные адиабаты в области
твердой фазы (3); изоэнтропа (4); * перегретая*
твердая фаза(пунктир)
Урлин В.Д. Журн. эксперим. и теор. физ., 1965, §
49, 2, 490
Фиг. 1064. Кривая плавления свинца
McDaniel М.L., Babb S.E>, Scott G.J J.Chem. Phys.,
1962, 37 , 4, 827
Фиг. 1065. Диаграмма состояния серы при высоком
давлении
1 - данные авторов; 2 - данные Susse С.. Epain В., Vodar B.(C.R.,
1964 . 258, 18, 4513); 3 - данные Та пипа пп G.(WilcL Annal., 1899, 6g,553)
Пауков И.Е., Тонков Е.Ю., Миринский Д.С. ДАН СССР,
сер. хим., 1965, 164. 3, 588
286
s
Фиг. 1066. Фазовая диаграмма серы в области высокого
давления
1 - кубическая сера; 2 - ромбическая сера; 3 - жидкость
Ва&к Т Science,1965, 148, 1220
_____x I i_____
0____10 20____30 42
Давление, кбар
Фиг. 1068. Суммированные данные по S до 40 кбар.
и 500 С (ниже 350 С диаграмма может быть рас-
ширена до 100 кбар). Символами обозначены переходы,
определенные следующими методами с использованием
различной аппаратуры:
v- объемный (простой поршень - цилиндр); d - оптический
(система алмазных наковален); е - электрическое сопротивление
( Ni—S смеси). Пунктиром показаны границы, требующие уточнения.
Числа в скобках в каждом поле - межллос костные расстояния глав-
ных дифракционных линий для закалочных продуктов опытов
Vezzoli G.C, Dachille F.,Roy R.Sci., 1969, 166, 3902,
219
Фиг. 1067. Эксперименты, проведенные с помощью
ДТА при высоком давлении в контейнерах в виде
золотых трубок на сере высокой чистоты, указы-
вают инвариантную точку при 107 С и 2,5 кбар, где
стабильны орторомбическая сера, моноклинная сера
и жидкость. На температуру плавления орторомби-
ческой серы давление влияет слабо, ^аже при 20 кбар
плавление происходит только при 112 С
1 - хромель-алюмелевая дифференциальная термопара; 2 - хромель-
константан овая дифференциальная термопара; 3 - платино-платиноро-
диевая ( Rh 10%) дифференциальная термопара
Bell Р.МEngland J L., Kullerud G. Camegie lost.
Washington Year Book, 1965-1966, 65. 356
Se
Фиг. 1069. Кривая плавления селена
Deaton В.С., Blum F.A.Phys. Rev., 1965,137,A 1133
287
Фиг. 1070. Фазовая диаграмма олова. Данные по плав-
лению Kennedy G.C., Newton R.C. (Solids Under Pressure,
editor by Paul W., Warschauer D. New.Y., 1962); их
граница белое олово - Sn II продолжена до отсут-
ствия непрерывности сопротивления, обнаруженного
Stager В.Л.(J.Chem. Phys., 1962, 21» 1154). Границы
фазы серого олова расчетные.
Jayaraman А , Klement W. Jr., Kennedy G C Phys. Bev.,
1963, 130, 545
Те
Фиг. 1071. Фазовая диаграмма Те до 33000 кг/см2
Сяишов С.У,, Тихомирова Н,А. Журн. эксперим.
и теор. физ., 1965, 49, 2, 619
Fe-Ni
Фиг. 10'/ 2. Рассчитанная фазовая диаграмма железо-
никель при 50 кбар.
Ringwood А.Е., Kaufman L.Geoch.Cosm.Acta, 1962, 26.
1002
Фиг. 10/0А. Кривая плавления олова. Dudley J.D.,
Hall Н.Т., Phys. Rev., i960, 118. 1215. Давление в атм
Фиг. 1073. Рассчитанная фазовая диаграмма железо-
никель при 100 кбар
Ringwood А Е.,Kaufman L.Geoch. Cosm.Acta, 1962, 26.
1002
288
КАРБИДЫ
Фиг. 1074. Предварительные результаты эксперимен-
тального определения изобарической проекции (34J00 атм)
системы железо-углерод.
Пунктиром показаны фазовые границы при атмосферном давлении
Hilliard JE, and Cahn J.W. Program. Very high Pressu-
re Res., Proc., International Conference, Bolton Landy,
Lake George, N.Y.,1960, 118
Фиг. 1076. Исправленная фазовая диаграмма сис-
темы железо-углерод ( 0,8 вес.%С). Поле ста-
бильности цементита сокращено до области CJD
(см. фиг. 1075)
Lipschutz М.Е., Anders Е. Geoch. Cosm. Acta, 1964,
28, 5, 704
0 200 400 000 800 °C
•1 Q2 &6
C-C, C—Mn
100
80-
60-
Предел насыщения углерода марганцем
Ирибая плавления Мп /область спонтанного
Мп3С Мп. роста алмаза
Фиг. 1075. Фазовая диаграмма системы железо-угле-
род (0,8 вес.% С); а—у эвтектоидная кривая - по
данным Claussen W.F. (High Pressure Measurement Eds.
A.A.Giardini, E.C. Lloyd. Butter worths Washington, D.C.
1963). Метастабильные фазы, образующиеся при разло-
жении Fe^C, показаны в скобках. Цементит стабилен
только в поле CHBJ, но может образовываться мета-
стабильно везде слева от поля у-железа. Точки -
экспериментальные определения разложения Fe jC (Lip—
schutz M.E., Anders. E.,Science, 1961, 134 , 2095-99)
1 - интенсивная графитизация; 2 - частичная графитизация; 3 -
аморфный углерод, выделяющийся при растворении образца в кис-
лоте; но этот углерод может образоваться скорее в процессе раство-
рения, чем в процессе тепловой обработки. Разложение цементита в се-
редине поля его кажущейся стабильности показывает, что истинное
поле стабильности должно быть меньше, чем показано на диаграмме
(см. фиг. 1076)
Lipschutz М.Е., Anders Е. Geoch. Cosm. Acta, 1964,
28, 5, 703
I
§
40-
20-
(Berman-Simon)
Рассчитана
----по данным
----Линейная
экстрам^
Эвтектическая кривая
Мп-С \
Область стабильности алмаза
для системы углерод-углерод
- Кривая равновесия графит-алмаз
flHxt u
"Л ®
Область стабильности
графита для системы С-С
0 400 800 1200 1600 2000 2400 °К
Фиг. 1077. Сложная РТ - диаграмма для систем
углерод-углерод и марганец-углерод. Значения дав-
ления относятся к переходам висмута при 25,4; 26,9;
и 90 кбар и бария при 60 кбар. Температура была
измерена термопарой.
Оцененная ошибка экспериментальных данных: температура; +5%
до 1500° К; +£% до 2000 К, давление: +)% до 30 кбар; +3% добОкбар;
+Р% до 70 кбар. Кривая Berman R., Simon F., Zeit Electrochem., 1955, 59,
333-338) +2 - +$% no экстраполяции
Giardini A.A.,Ту dings J.E. Am. Min., 1962, 47,
11-12, 1409
8 37
289
C—Ni
Фиг. 1078. Предполагаемое изобарическое (54 кбар)
сечение фазовой диаграммы системы Ni—С
Strong НМ., Наппетап R.E. J.Phys. Chem.Solids,Sup. 1
1967, 580
НИТРИДЫ
Фиг. 1079. Кривая плавления нитрида бора
Wentorf R.H. J.Phys. Chem., 1959, 63, 11, 1939
290
СУЛЬФИДЫ, ТЕЛЛУРИДЫ И СЕЛЕНИДЫ
As—S
Cu—S
Фиг. 1080» Фазовая диаграмма трисульфида мышьяка.
Киркинский В,А,, Ряпосов А,П9, Якушев В.Г.
Из в. АН СССР, неорг. материал, 1967, 3, 10, 1932
Фиг. 1082. Кривые, схематически показывающие инва -
риантную точку, где устойчивы четыре фазы Ci^S*
+CU9S5 + жидкость + пар.
Kullerud G. Carnegie Inst. Washington,Year book.,1958,
57, 217
Cd-S
Фиг. 1081. P-T диаграмма системы CdS
I - CdS co структурой вюртцита; И - CdS co
структурой NaCl; III - область CdS с неизвестной
структурой, не сохраняющейся при 1 атм.
Miller R.O., Dachille F., Roy R. J.Appi. Physics, 1966,
37, 4913*4918
Фиг. 1083. P-T кривая превращения ковеллин
дигенит + жидкость (газ). Настоящие данные
для CuS получены методом ДТА в одноступенча-
том аппарате типа цилиндр-поршень.
Kullerud G., Bell Р.М., England J.L, Carnegie Inst..
Washington, Year book, 1966-67, 66, 442. Cm. Kulle—
rud G., Carnegie Inst. Washington,Year book., 1956-57,
56. 196
291
I'e-S
Фиг. 1084. Влияние давления на переход сверхструк-
турный . нормальный гексагональный троилит
(FeS, кривая А) и пирротин ( Fej_xS, содержащий
36,7 вес.% S, кривая В). Данные ДТА (хромель-
алюмелевая термопара).
Kullerud G., Bell Р.М., England J.L. Carnegie Inst.,
Washington,Year book, 1964-65, 64. 198
Фиг. 1086. Так называемая конденсированнная диа-
грамма системы Fe—S. Пар присутствует во всех
ассоциациях, давление в системе непостоянно.
Kullerud G , Yoder U.S, Carnegie Inst. Washington
Year book, 1956-57, 56, 190
Фиг. 1085. T-X диаграмма системы Fe—S при дав-
лении ₽2 , равном нескольким тысячам атмосфер.
Kullerud G., Yoder H.S Carnegie Inst. Washington,
Year book, 1956-57, £6, 190
292
Fe—S
°C
1200
1000
800
600
455
200
0
50 45 42 38 34 30 Атомн.,% Fe
ii । i i । i । । t । —— i । । । i
B5fi3 50 56 52 W Ы Bee;% Ft
ЪПр+Ж
- 1 743°G
-Д фпр(Пт] УПр+Пт+Ж
VomfrOp)’'
^УПр*Пт
Пт(Ж)
°С
400
300
: Шй nmla®
*X cfOp+flm
200
FeS
Фиг. 1087. Экспериментальная равновесная диаграмма
системы FeS- S при давлении 30 бар. Кружками обо-
значены составы пирротина, спроектированные на это
изобарическое сечение, а Пр (Пт) - линия равно-
веского сосуществования а -пирротина и пирита.
Границы полей, показанные сплошными линиями,
определены; тонким пунктиром - предполагаемые и
более жирным пунктиром - по данным прежних работ
Kullerud G., Yoder U S. Carnegie Inst., Washington
Yearbook, 1956-57, 56, 192
800
600
400
Fe^xS+FeSi
в в в
Fei-xSM 755 °
220°
1ИЯ
2551
a a
r tfws *rt7s7”
Fes' 1 Fe7Se45 ‘ 4ff\ 35 FeSt
fe73e+offtjS» _Fe,am.% aFe3S^FeSt
90°
0,
T-7
в
Фиг. 1088. Фазовая диаграмма^состояния системы
FeS-Fe$2 ПРИ Р в 1000 кг/см . Верхний предел су-
ществования пирита по Kullerud G., Yoder H.S. (Econ.
Geol., 1959, §&9 533-572), граница, пирит-пирротин
no Arnold R.G.(Econ. Geol., 1962, SL 1» 72-90), грани-
ца Fe?Sg—Еез54 no Berner R.A.(J. Geol., 1964, 72. 3)
Удодов ШМ. Автореф. канд. дисс. Новосибирск,
1969.
Фиг. 1091. Моновариантная кривая реакции
FeS2^
*^Fei_xS+ Ж, которая оканчивается в точке с Дко-
ординаты: 743°C и приблизительно 10 бар)
Kullerud G., Yoder H.S. Econ.Geol., 1959, 54, 4, 554
о
I 2А,6С
'/М,2С I 2А.4С
Э ООО
2 А ,30
Пр*2А+4С
Пр+2 А ,30
ПР*2/Щ
Немагнитный -ф- Магнитный
Л_________I___I—-—I--1-----I—
49 48 47 Fe^ 46
48 47 Fe.s
—— Ев}ат.°/о
Фиг. 1089. Фазовая диаграмма состояний пирротина при
Р = 1000 атм. V3A, 2С; 2А, 4С; 2А, ЗС; 2А, 6С -
типы сверхструктур пирротина.
Удодов Ю.Н. Автореф. канд. дисс. Новосибирск, 1969
Фиг. 1090. Кривые, показывающие влияние давления
(меньше 1, 1000 и 2000 бар) на состав пирротина при
равновесии с пиритом
Kullerud G., Yoder H.S, Carnegie Inst. Washington, Ye-
ar book, 1956 -57,56, 194
-90.4'
45
293
Фиг. 1092. Кривые верхнего предела стабильности пи-
рита. Расчетные кривые при парциальном давлении се-
ры (Ps)> равном 0,1 и 1 бар, показаны пунктиром.
Оценочная кривая при Р$« 1000 бар также показана
пунктиром. Кривая при Pg “ Р^щ определена и пока-
зана сплошной линией. Эти кривые сопоставлены с
кривой минимального плавления гранита ( Tuttle OF,.
Bowen N.L.,Carnegie Inst., Washington, Yea г book, 1952-
53, 52. 39-96) и кривыми начала плавления амфибо-
лита и толеитового базальта, насыщенных Н2О при
РН£Г (Yoder H.S., Tilley С.Е., Geol. Soc.America,
Bull.(abst.), 1956, g7, 1746)
Kullerud G.,Yoder H Л.Econ.Geol., 1959, 54, 4, 567
Фиг. 1094. Сжимаемость сухого, ненасыщенного газо-
образного H2S
1 - интерполяция по данным Reamer !1.Н. и др. (Industr.a.Engin.
Chem., 1950, 42, 140-43); 2 - экспериментальные точки с линиями,
показывающими точность измерений
Barnes H.L. Carnegie Inst., Washington. Year book
1958-59,^8, 164
Ю0
50
20
+ Fc52
00 60 100
Давление, атм
Фиг.1093. Результаты изучения изменений аморфного
Fe2S3,PH2S ’ 10 атм-
Плотностью штриховки показана масса кристаллического продукта.
Schrader R.t Pietzsch С. Zs. Chem., 1968, 8, 154
Фиг. 1095. Поле стабильности полидимита в коор-
динатах Р-Т.
Kullerud G.. Carnegie Inst. Washington, Year book
1967-68, 67, 18
294
Pb-S
As—Fe—S
W WO 600 800 1000 1200 1400 1600 1800 2000 °C
Фиг. 1096. Схематическая P-T диаграмма системы Pb-S
Pj - около 1 бар; ₽2 - несколько сотен бар; - несколь-
Фиг. 1098. P-T - кривая разложения арсенопирита.
Кривая не является верхним пределом устойчи-
вости арсенопирита и, вероятно, связана с каким-то
ко 'тысяч бар
Kullerud G. Amer* J.Sci.,Schairer vol., 1969, A 267.
233-256
эвтектическим или подобным явлением в системе
золото-железо-мышьяк-сера
Кларк Л, Проблемы эндогенных месторождений,
1966, вып. 3, 161-250
ZnS
0,50 ОМ) Ц50 (120 Ц1О О
"FeS
Фиг. 1097. Состав сфалерита**в равновесии с другими
фазами при Р “ 1000 атм. Изо концентраты Fe в
пирротине (штрих - пунктирные линии со значениями
N^p ) построены с поправкой на давление для
Fe о
t>500 .
Горизонтальными отрезками показаны экспериментальные данные,
относящиеся к ассоциации сфалерит + пирротин + пирит; 350, 400 в
500° - опыты авторов; 555 - 700° - опыты Barton Р.В., Той Im in P.(Econ,
Geol., 1966, 61, 5, 815) с поправкой на давление; в обоих случаях
длина отрезков соответствует экспериментальной погрешности. Пунк-
тирная линия - экстраполяция кривой трехфазного равновесия в сред-
нетемпературную область по данным Barton P.B.,Toulmin Р. Границы
поля жидкой серы по данным Barton Р.В., Toulmin Р.
Чернышев Л .ВАнфилогов В.Н, ДАН СССР, 1967,
176. 4, 927
Фиг. 1099. Р-Т кривая верхнего предела устойчивости
ассоциации пирит-арсенопирит, определенная в при-
сутствии избытка золота.
Пунктир - эона, в пределах которой обратная реакция не могла
быть проведена.
Кларк Л .Проблемы эндогенных месторождений,
1966, вып. 3, 161-250.
295
Cd-Mn—S
Fe-Cr-S
25кбар
1
I
Фиг. 1102. P-T кривая структурного перехода типа
шпинель (а-фаза)- арсенид никеля (0 ^аза) ДЛЯ
FeCrjS^ 1 - из исходной а-фазы образуется
0 -фаза; 2 —а-фаза не изменяется; 3 - из исход-
ной p-фазы образуется а -фаза ( 0 «фаза
получена при 500 С и 40 кбар); 4—0 - фаза не из-
меняется; 5 - из исходной 0 - фазы образуется
а -фаза после гидротермальной обработки ( 0 -фаза
получена при 40 кбар и 400 С); 6 - точка перехода
по данным ДТА
Abbers Г., RooymanB J.M. Solid State Communica-
tions, 1965, 3, 12, 418
•с ГТ
ш-
WO
- Ят+Ш
-
Mns MS
Фиг. 1100. Изобары 10, 15, 20 и 25 кбар системы
CdS*-MnS
1 - твердый раствор со структурой вюртцита; II - твердый раствор
со. структурой NaCIJII- незакаливающаяся фаза неизвестной структу-
ры: m - фазы, богатые марганцем; с - фазы, богатые кадмием. Сос«
тавы даны в мол.%
Milter R.O., Dachille F., Roy R. J. Appl.Physics,1966,
3L 4913-4918
Fe-Ni-S
* О фазовых переходах в CdS при высоких дав-
лениях см. Jiro Osugi., Nippon Kagaku Zasshi, 1967,
88. 8, 813-18
(U
600-^
Пипротин * а Хизлевудит
<о
Пентландит^рв—#**0*^^
500
Пирротин ^ХизлевудитУ
Cu-Fe-S
Ошибки поТиР
WL
да
1Z .18 1
Давление, кбар
Фиг. 1103. Влияние давления на разложение пентлан-
дита Fe4 5Ni4 5Sg (кривая 1 и III.) и на а-0
превращение хизлевудита (кривая II).
Bell Р.М., England J.L.t Kullerud G. Carnegie Inst.
Wash in gton, Year book, 19Й, 63 , 206-207
Влияние давления на превращение тет-
Фиг. 1101. ...
рагональный-кубический халькопирит состава CuFeS]^
по данным ДТА (хромель-алюмелевая термопара)
Kullerud G., Bell Р.М., England J.L. Carnegie Inst.
Washington,Year book, 1964-65. 64. 197.
296
Fe—S—ОН
Sb—S, Sb—Se
Z000
1500
1000
500
200
О
Марказит +
пирит
Пирит
о
300 350 WO WO 500 'С
Фиг. 1104. Кривая верхнего предела стабильности
марказита в системе Fe-S—ОН. Кривая начинается
в точке С, где давление оценено равным 150 бар,
и определена до 2000 бар.
Kullerud G. Camegie Inst. Washington. Year book,
1965-66, 65, 253
Фиг. 1107. Зависимость температуры плавления от
давления
1 - St^Se^' 2 - Sb2 S^; 3 - эвтектика между SbSe2
Sb2S3
Киркинекнй В.А., Яку шее В.Г., Рлпосов А.П,
Изв. АН СССР, неорг. материалы, 1968, IV, 4
Fe—0—Si—S фиг' U0S. Фазовые отно-
шения в системе Fe—S—О—Si02
SiO,
[e2°3
SOZ
в интервале темпера-
тур 560-875°С и 2000 бар.
Для простоты твердые раст-
воры не показаны, например,
F«l-xS
Kullerud G., Г Oder U.S. Car-
fixity negie Inst.Washington, Year
ВоокДОбЗ. 62, 215-^218
FeO
S
0
s
S02
Am. %
Фиг, 1106. Фазовце отно-
шения в системе Fe—S—О—
-Si02 при 800°С и 2000 бар.
Твердые растворы не пока-
заны.
FeSLOi G., Yoder H.S. Car-
negie Inst. Washington, Year
Book,1963, 62, 215-^218
FCjSLOif
Feo
Fe^o^
0
Фиг^ 1108. Растворимость аурипигмента при 100 и
200°C и 750 барах в зависимости от. концентрации
Na2S
Wei as berg B.G., Dickson F.W., Tunell George,Geoch.,
Cosm.Acta, I960, 30, 8, 819
38
29/
Фиг. 1100. Растворимость аурипигмента в растворе
М&2§ концентрации 3,43 вес.% при давлении 100,750
и 1500 бар в зависимости от температуры.
Weiaaberg B.G., Dickson F.W., Типе!! George,Geoch.
Cosm. Acta4, 1966, 3Q, 8, 822
Фиг. 1111. P -T проекция системы ZnS-H9S-H90
ООЩ. c
Фазовые границы и контуры концентраций (моль/л)
H2S в воде (Жн2с) интерполированы по данным Seleck
F.T. и др.(Industr.a. Engin. Chem.,1952; Ц, 2219-2226)
. для системы Н 2S-~H2O
Определения растворимости H2S в ЖН2О (выраженные в м/л) обоз-
начены 1, Экспериментальные точки, показанные знаком 2, определены в
условиях насыщения ZnS в тройной системе; Ж s - сульфидная жид-
кость; Тв - твердый гидрат, возможно, H2S «6Н2О
Barnes Н.L.Camegie Inst. Washington,Year book, 1958-
-59, 165
Фиг. 1110. Растворимость аурипигмента в растворе
Na2S 'концентрации 1,24 вес.% при 750 барах в за-
висимости от температуры.
Weiaaberg B.G., Dickaon F.W., Tunell George, Geoch.
Cosm.Acta, 1966, 30. 8, 822
Теллуриды, селениды
Фиг. 1112. Кривые плавления Bi2Te3 и Sb£e3 до
25000 кг/см2
Спи шов С,М„ Тихомирова Н,А, Жури, эксперим.
теор. физики, письма в редакцию, 1965, № 1, 21
298
Bi Те
2 3
CdTe, CdSe, CdS
Фиг. 1113. Зависимость точки плавления Е^Тез от дав-
ления. Верхняя кривая определена по измерениям сопро-
тивления образца при непрямом нагревании* каждый из
пяти опытов показан различными символами.
Пунктирная линия* начинающаяся из точки плавления (585 ) при
1 атм, - начальный наклон кривой плавления* рассчитанный по урав-
нению Клапейрона - Клаузиуса. Нижняя кривая получена при прямом
нагревании образца, изолированного от термопары периферической
изоляцией
Ball D.L. Inorg. Chem., 1962* 1* 808
Фиг. 1114. Кривые плавления CdTe и CdSe, определенные
методом ДТА* и переходы в твердой фазе для CdTe,
CdSe и CdS, определенные по скачку объема
Jayaraman A., Klement Ж. Jr., Kennedy G.C. Phys. Rev.,
1963* 130, 2279.
HgTe, HgSe
Фиг. 1115. Кривая плавления HgTe, определенная мето-
дом ДТА, и фазовые границы* определенные по скачку
объема* протянуты до тройной точки. Нанесена также
фазовая граница для HgSe, установленная по скачку
объема
Jayaraman A., Klement Ж. Jr,., Kennedy G.C.Phys. Rev.
1963, 130, 2279
299
СИСТЕМЫ ИЗ окислов
Однокомпонентные
50
40
30
20
Давление, к fap
Фиг. 1118. Схема фазовой диаграммы НЮ2
Бенде ли ан и Н.А., Попова С.В., Верещагин Л.Ф.
Геохимия 1967, 6, 681
10
О
юо гоо зоо
Фиг. 1116. Моновариантная кривая для перехода арсе-
нолит-клодетит
1 - исходный материал - арсенолит, продукт - арсенолит; 2 -
исходный материал - арсенолит, продукт - клодетит; 3 - исходный
материал - клодетит; продукт - арсенолит; 4 - исходный материал -
клодетит; продукт - клодетит; 5 - опыты, в которых использован
сдвиг
White WB., Dachille F , Roy R., Zs.Krist. 1967, 125, 1-3,
455
Фиг. 1117. P-T соотношения для Давление одно-
осное. Сплошная линия - моновариантная равновесная
кривая перехода гексагональный плотный В2О3.
Пунктирная кривая отделяет Р-Т область наличия
третьей фазы (возможно, еще одной модификации З2О3).
Вследствие медленности протекания рекаций и плохой
воспроизводимости результатов в этом низкотемпера-
турном интервале можно заключить, что третья фаза
растет метастабильно. Полагается, что эта фаза ста-
бильна, и пунктирная линия представляет 2 части моно-
вариантной кривой, ограничивающей поле третьей моди-
фикации
1 - новая плотная фаза; 2 - гексагональная фаза; 3 - метаста-
бильная фаза
Dachille F.f Roy R. J. Am.Ceram.Soc., 1959, 42 . 2, 79
РЬО
Фиг. 1119. Моновариантная Р-Т кривая реакции глёт
zxtz массикот построена по гидротермальным данным
и данным одноосевого сжатия
Исходный материал Конечный продукт
1 - смесь глёт+массикот массикот
2 - смесь глёт* массикот глёт
3 - массикот массикот
4 - массикот глёт
5 - нагрето без воды до Т;
затем поднимается Р
6 - поднимается Р, затем на-
грет до Т
7 - опыты с одноосевым
сжатием
White W.B., Dachille Roy R. J. Am.Ceram. Soc.,
1961, 44, 4, 172
300
Фиг. 1120. Моновариантная Р-Т кривая реакции РЬО^-1
=₽РЬ02— П (по данным одноосевого сжатия)
1 _ РЬО2-П; 2 - РЬО2 - 1; 3 " РЬО2 - 1 + Р^О,
White W.В.,Dachille F., Roy R. J.Am.Ceram. Soc., 1961,
44, 4, 173. О плавлении окиси свинца при Р до 40 кбар
см. Tomonari Т. Nippon Kagaku Zasshi 1963, 84, 4, 311-313
Фиг. 1122. Моновариантная РТ - кривая для перехода
сенармонтит валентинит
Исходный материал Конечный продукт
1 - смесь сенармонтит + сенармонтит
валентинит
2 - смесь сенармонтит валентинит
валентинит
3 - сенармонтит сенармонгит
4 - сенармонтит валентинит
White W.B., Dachille F.,Roy R. Zr.Krist. 1867, 12g, 1-3,
453
Фиг. 1121, Моновариантная Р-Т кривая реакции
РЬ^Од^ РЬО + Р^Оз
1- PbO + PbjO^; 2-РЬ3О4;3 - точки, в которых реакция обра-
тима
White W.B., Dachille F., Roy R. J. Am. Ceram. Soc., 1961,.
44, 4, 174
Фиг. 1123. Сводная Р-Т диаграмма кремнезема по
экспериментальным данным Boyd F. England J. (Carne-
gie Inst., Washington Year Book 195S»59,58.). И.А.Остров-
ского и др. (Сб. 'Физ.-хим. пробл. формир. горн, пород
И РУДГ, т. 1, Изд-во АН СССР, 1961). Показаны линии
превращения по С.М.Стишову (1), Ю.Н.Рябинину * (2)
и по данным настоящей работы (3) и (За). Кривая (За)
проведена в соответствии с новой. международной шка-
лой давления (1969), согласно которой переход Bi про-
исходит при 77 кбар, причем равновесие коусит-стишо-
вит выражается так: Ркб = 73 + 0,0241 Т (°C)
I - коусит; II - стишовит; III - точка Рингвуда; IV - точка
Стишова
ОсяровскиЛ И.А, Иав. АН СССР, сер, геол., 1965,
10, 134
Так называемая РТ - диаграмма кварца Рябинина Ю.Н. и др.
(Изв. АН СССР, сер. геол., 1063, 8, 3), помешенная во II томе
справочника 'Минералы' Изд-во 'Наука', 1966 на стр. 138, фиг.
60, по свидетельству самих авторе», построена по неравновесным
данным. Поэтому ею не следует пользоваться для суждения об
областях стабильности модификаций SiO 2
301
Si°2
Фиг. 1124. Линии равновесия в системах
. 1 - коусит - рутилоподобный кремнезем; 2 - форстерит - шпи-
нель; 3 - форстерит - периклаз + рутилоподобный кремнезем
Стишов С.М. ДАН СССР, 1963, 148, 1187. О влия-
нии давления на параметры стишовита см. Ida J9Syono J.,
AkimotoS. Earth. Planetary Sci, Letters, 1967, 3, 3,
216-218
Фиг. 1126. Переход кварц - коусит
Boyd F.R , England J.L. Camegie Inst. Washington.Year
book 1958-59, 58. 88. Данные разных авторов о P-T
полях стабильности кварца и коусита сопоставлены в
работе Holm ]L., Kleppa О J.. Geoch.Cosm. Acta, 1967, 31,
2304
Фиг. 1125. Рассчитанные по термодинамическим дан-
ным Р-Т поля стабильного равновесия коусит - сти-
шовит и метастабильного кварц - стишовит
Стабильные равновесия: 1 - коусит - стишовит, с поправкой;
2 - коусит - стишовит, без поправки; 3 - коусит - стишовит. Сти-
шов (см. фиг. 1124). Метастабильные равновесия: а-а кварц -
стишовит, с поправкой, в-в кварц - стишовит без поправки
Holm J.L., Kleppa O.J.Geoch.Cosm.Acta, 1967, _31, 2305
Фиг. 1127. Экспериментальные данные для инверсии
высокотемпературный - низкотемпературный кварц.
Данные Gibson R.D. (J.Phys.Chem.1928, 32, 1197 - 1205)
и Yoder H.S.Jr.(Trans.Am. Geoph. Union. 1950, 31, 827 -
835) интерполированы. В данной работе каждый символ
представляет отдельное определение
1 - хромель-алюмель; 2 - платинель D; 3 - Pt—Pt + 10% Hh
Cohen L.H.'Klement Ж.Jr.J.Geoph.Res. 1967, 72, 16,
4246
302
SiO2
ZrO2
Фиг. 1128. Моновариантные Р-Т кривые полиморфных
переходов для разных веществ, изоструктурных с кремне-
земом
Давление, к fap
Фиг. ИЗО. Схема фазовой диаграммы Z1O2
Бзнделиани Н .А „Попова С .В .Верещагин Л.Ф Гео-
химия, 1907, 0, 681
Dachille F., Roy R.Zs.Krist. 1959, 111, 455
ZnO
//75
о
100
95
90
-ZnO(NaCl) °/znO(Вюргпцшп)
°/'o
0/0
°/°0
- A 0
/
о
—I_____I_____I_____L
100 Z00 500 400 500аС
Фиг. 1129. Р-Т условия образования модификации ZnO
типаNaCl. Пунктирная линия нанесена приблизительно
Bates С.Н., White W. В., Roy R. Science, 1962, 137, 993
Двухкомпонентные
Фиг. 1131. Смесимость корунда с СгоО^ в гидротер-
мальных экспериментах при 480 —800 (2 и давлениях
около 2000 атм
Neuhaus A.t Y umpertz Е., Brenner Р. Fortschr. Min., 1962,
40, 60
Al2O3-SiO2
Фиг. 1132. Рассчитанная Р-Т диаграмма системы
AI2O3— SiO2 в сравнении с данными Bell P.M.(Science,
1963, 139. 1055-1056) в области высоких температур
и давлений;
Сплошные линии - расчетные кривые; данные Белла: 1 - кианит,
2 - андалузит, 3 - силлиманит, 4 - предварительные результаты
Holm J.L., Kleppa O.J. Am. Min., 1966, gL И/12,
1620. См. также Anderson P.A.M., Kleppa O.J.Am. J.Sci.,
1969,267, 3, 285-290
303
Фиг. 1133. Р-Т координаты опытов, в которых реакция
протекает с заметной скоростью:
1 - кианит растет из андалузита; 2 - андалузит растет из киа-
нита; 3 - андалузит растет из силлиманита; 4 - силлиманит растет
из андалузита; 5 и 6 - Р-Т координаты опытов при исследовании
перехода кианит - силлиманит в газовой аппаратуре (Richardson S.W.,
Bell Р.М., Gilbert М.С., Am. J.Sci.4968, 266. 7, 513-541)
Richardson S.W., Gilbert M.C.f Bell P.M. Am. J Sci.,
1969, 267. 3, 266. См. также: Пугин В.А., Хитаров И,И,
Геохимия, 1968, 2, 162; Newton, R.C,Science, 1966, 153.
3732, 171
Дабле нив, к fap
Фиг. 1135. Р-Т проекция для состава Са SiO-j.
1 - расплав; 2 - волл ——- пволл; 3 - пволл - * волл; 4 - волл.
не изменяется
Kushiro I. Carnegie Inst.Washington,Year book, 1963-
64, 6£, 84. О структуре модификации CaSiO3 при высо-
ких давлениях см. Trojer F J.Naturwissenchaften, 1968,
Н9, 442
CoO— SiO2
Фиг. 1134. 'Равновесная' диаграмма A^O^—SiO2
De Vries R.C., J.Am.Ceram.Soc.,1964, 47. 5, 236
1 - оливин + кремнезем —- ортопироксен; 2 - оливин + кремне-
зем —» ортопироксен + клинопироксен; 3 - оливин + кремнезем ——
клинопироксен; 4 - оливин + кремнеземорто пироксен + оливин +
кварц; 5 - оливин ♦ кремнезем —«—оливин + кварц-
Akimoto S.t Katsura T.t Syono JFujisawa H., Komada E.
J.Geoph.Res.1965, 70, 20, 5276
304
Фиг. 1137. PT - диаграмма, определяющая область
синтеза РЬСгО^ методом закалки из смесей PbWCrO2
DeVries R. С., Roth W.L. J. Am.Ceram.Soc., 1968, 51.,
2,72
Fe3°4-Fe2°3
°C
1600
1500
1000
1300
1200
Fe304 20 40 60 80
Вес. %
Фиг. 1138. Диаграмма фазовых отношений в системе
Fe^O^—Fe2O^ (по литературным данным при давлениях
кислорода до 1 атм) и по данным авторов при давле-
ниях кислорода приблизительно до 45 атм
Изобары показаны штрих - пунктирными линиями. Результаты
Геофизической .лаборатории показаны символами: 1 - пограничная
кривая магнетит - магнетит + гематит (с пределами ошибки), 2 -
пограничная кривая гематит - магнетит + гематит, результаты
Darken L.S.,Gurry R.W.,(J.Am.Chem. Soc. 1945,§7, 1398); 3 - погра-
ничная кривая магнетит - магнетит + гематит; 4 - ликвидус; 5 -*
солидус. Результаты авторов: 8 - жидкость; 7 - магнетит; 8 - ге-
матит *
Phillips В.,Миап A. J.Phys.Chem. 1960, 64. 1452
FeO-SiO2
Фиг. 1139. P-T проекция системы FeO-SiO? в равгн
новесии с металлическим железом. Вюстит и расплавы
содержат некоторое количество Fe^Go и, следователь-
но, будут бинарными только, если г е20^ рассчитывает^-
ся как FeO. Кривые для модификаций кремнезема даны
по Бойду и Ингленду (Boyd F.R., England J.L., Camegie
Inst. Washington .Year book, 1958-1959, 58. 86). Кривые
для состава FeSi03 определены ранее (Lindsley D.H.,
Camegie Inst.Washington. Year book, 6$. 149). Длинно-
пунктирные линии (кривые или части кривых) экспери-
ментально не определялись, короткопунктирные — мета-
стабильные продолжения. Составы фаз в инвариантных
точках показаны в частной системе Fe2SiO4-SiO2;
равновесие вырождено, когда 2 или более фаз имеют
одинаковый состав
Lindsley D.H. Camegie Inst. Washington. Year book,
1965-66, 65. 228
Фиг. 1140. P-T диаграмма частного сечения FeSiOo
(в системе Fe2SiO4-SiO2)
1 - фт + кремнезем — ОФс; 2 - Фт + кремнезем —ОФс + КФс;
3 - Фт + кремнезем — КФс; 4 - Фт + кремнезем — -ОФс + Фт + Кв;
5 - Фт + кремнезем —•- Фт + Кв; в - Шп + коус — ОФс; 7 - Шп +
коус —КФс; 8 - ОФс не изменяется; 9 - ОФс — КФс; 10-ОФс—
— Фт+Кв; 11 - КФс — ОФс, 12 - КФс не изменяется
Akimoto S.t Katsura T.t Syono J., Fujisawa H,, Кота da E.
J.Geoph.Res.1965, 70. 20, 5272
39
305
Фиг. 1141. Диаграммы стабильности FeSiC^ в области
высоких давлений и температур. Знаком ж показаны
опыты, в которых в качестве исходных веществ были
взяты эквимолекулярные смеси фаялита и аморфного
кремнезема. В остальных опытах исходный материал -
ортоферросилит
Akimoto S., Syono J. Phys Earth P]anet.Interiors,1970,
3, 187
Фиг. 1143. Кривая плавления фаялита
1 - продукт закалки-стекло; 2 - продукт закалки-кристаллы;
3 - неизмененный фаялит
Нзи L.C.J.Geoph. Res., 1967, 72. 16, 4242
FeO-SiO2-O2
W то япп
Фиг. 1142. Равновесная кривая для перехода оливии-
шпинель в Fe2SiO^
1/Т * WD0, 9К
Фиг. 1144. f02 - Т диаграмма, показывающая опыты,
определяющие ход кривой реакции 3FeoSi0A+0o ^2Feo6
z ч z j 4
S1O2
1 - Символы для Р 800 бар; 2 - для 2000 бар. Откры-
тые символы обозначают преимущественный рост Fe3O4+SiO2,
сплошные - Fe2SiO^. Для стандартного состояния твердой фазы
принято Р - 1 бар, Scherdtfeger К., Muan A. (Trans. Am. Inst. Mining,
met.engrs., 1966, 2^6, 201-210), Schenk R., Franz H., Leymann A.(Zr.
Anorg. Allgem. Chem. 1932, 206. 12&-151)
Won es D.K., Gilbert Carnegie Inst. Washington.
Year book, 1966-67, 66, 403
Ол --- Шп
Шп — Ол
(1 - Шп
2 - Шп « Ол
3 - Ол не изменяется
4 - Ол
1 5 - Шп + On
в - Шп не изменяется
Akimoto S.,Fujisawa Н.,Katsura Т.J.Geoph. Res. 1965,
70, 8, 1974
306
Фиг. 1145, Диаграмма фазовых превращений Mn2GeO4
в области высоких давлений и температур. Знаком *
отмечены опыты с исходным веществом |3-Mn2GeO4,
знаком ** показаны опыты с использованием 5 —
Mn2GeO4 как исходной шихты, В остальных опытах
исходный материал - оливиновая полиморфная модифи-
кация Mn2 GeO4 (a -Mn2 GeO4)
Akimoto S. Phys. Earth Planet. Interiors, 1970, J, 191
Фиг. 1147. Фазовая диаграмма энстатита MgSiO3
Boyd F.R., England J.L. Carnegie Inst. Washington.
Year book,1964-65, 64, 118
Фиг. 1146. Р-Т диаграмма, иллюстрирующая отноше-
ние рассчитанного хода кривых реакций к диапазону
температур в Земле по оценке Clark S.P.Jr., Ring-
wood А.Е. (Rev.Geoph. 1964, 2t “35-88). Корреляция
глубина-давление по данным Birch F.(J.Geoph. Res.
1964, 69, 4377-88)
r
Ahrens T.J., Syono J., J.Geoph. Res. 1967, 72. 18,
4186
Фиг. 1147А. Схематическая Р-Т диаграмма энстатита
Sarver/., F., Hummel F.A. J.Amer. Cer. Soc.,
1962, 45, 4, 152
307
MgO-SiO2
°G
2200
L III_________L _J___L_J___I___I__
to ZO 30 40 50
Давление, кбар
Фиг. 1146. Плавление форстерита Mg2SiO^ при давле-
ниях до 47 кбар.
Davis England J.L. Camegie Inst. Washington.
Yearbook, 1962-63, 62. 121
Фиг. 1150. Схематическая фазовая диаграмма бинарной
системы MgO—SiC^ при давлении около 160 кбар
Matsumoto Tv Upper Mantle Symposium. New Dehli,India,
1964, публ. 1965, 119
Нд,510и 510,
Мал. %
Фиг. 1149a. Бинарная система N^SiO^—SK^ при
давлении около 90 кбар
Фиг. 11496. Бинарная система Mg2SiO^.-SiO2 при
давлении около 110 кбар
Matsumoto Т. Upper Mantle Symposium. New Dehli,India,
1964, публ. 1965, 117
Фиг. 1151. Рассчитанная кривая равновесия оливино-
вой и шпинелевой модификаций Mg2SiO^
Ringwood А.Е. Geoch.Cosm.Acta, 1958, 15, 22
308
Фиг» 1152. Кривая равновесия оливиновой и шпинеле-
вой модификаций Ni2SiO4
Akimoto S., Fujisawa H., Katsura T. J.Geoph.Res.,1965,
70, 8, 1976
Трехкомпонентные
Фиг. 1154. Поле устойчивости пироксена Са ALSiQe
Z о
1 - Пи — Ан + Гел + Кор; 2 - Ан + Гел + Кор —— Пи; 3 -
Гросс* Кор —Пи; 4 - Пи —— Гросс + Кор; 5 - Пи — Кор + Ж
Hays J.F. Carnegie Inst. Washington. Year book, 1965-66
65, 236
Фиг. 1153. Р-Т диаграмма ThSiO^ получена при ис-
пользовании исходного материала геля в статических
опытах и в опытах со сдвиговыми напряжениями
Dachille F., Roy R., J.Geoh, 1964-, 72, 2, 245
Фиг. 1155. Экспериментальная кривая реакции
2CaA)2Si^0g (анортит) + 2Са2А12$Юу (геленит
Ca^A^Si^O^ (гроссуляр) + ЗСаА^ЗЮ^ (пироксен)
и рассчитанная кривая реакции СаА]2$120д (анортит) +
+ CaA^SiOy (геленит)з±Са ^A^Si^Oj 2 (гроссуляр) +
А12О3 (корунд)
1 - Гросс* Пи— Ан+Гел; 2 - Ая+Гел — Гросс*Пи
Hays J.F. Carnegie Inst. Washington. Year book, 1965-66
65, 236
309
А12О3-СаО- SiO2
Давление, кбар
Фиг. 1156. Поля устойчивости гроссулярита и ассоци-
ации гроссуляритч-кварц
1 -Тросс-^Ан+Гел+Волл; 2 - Ан+Гел+Волл-^Гросс; 3 - Гросс+Кв-*-
Ан+Волл; 4 - Ан+Волл-^Гросс+Кв; 5 - стекло-*Гросс; в - Гросс -*
Гел+Ж (+?)
Hays J.F, Carnegie Inst. Washington. Year book, 1965-66,
£5, 239.
Фиг. 1158. Поле устойчивости анортита при высоких
давлении и температуре
1 - Ан — Гросс + К + Кв; 2 - Ан —•- Са-Чер + Кв; 3 - Кор +
расплав —•- Ан; 4 - Ан —•— Кор + расплав; 5 - Ан —•— расплав;
6 - Ан не изменяется; 7 - растут продукты реакции; 8 - растут
исходные продукты в реакции Ан Гросс + К + Кв; 9 - Са-Чер +
Кв —*- Ан; 10 - Гросс + К + Кв —Са-Чер + Кв; 11 - Ан ——
Са-Чер + Кор + расплав
Hariya J.f Kennedy G.C. Am.J. Sci., 1968, 266. 3, 199
Фиг. 1157. Кривая реакции анортит гроссуляр +
кианит ** кварц
1 _ Ан Гросс + К + Кв; 2 - Гросс + К + Кв —*• Ан; 3 -
реакции нет. Нижняя прямая - данные Hays J.F.(Camegie Inst. Wa-
shington Yearbook 1985-68, 240)
Hariya J.t Kennedy G.C> Am. J.Sci, 1968, 266, 3, 198
Фиг. 1159. Влияние температуры на границу образова-
ния твердых растворов в ряду шпинели (магнетит и гер-
цинит). Изобарическое сечение. = 2000 бар
1 - одна фаза; 2 - тв. р-р; 3 - распад тв. р-ра; 4 - рост из
смеси окислов
Титоск А,С, Carnegie Inst. Washington. Year book
1958-59, 5g, 135
310
Al2O3-FeO-Fe2O3
Титоск А.С. Camegie Inst. Washington, Year book,
1958-59, 58. 137
Фиг, 1162. P—T диаграмма плавкости для состава
KAJSijOa 1 - В-т санидин ——- Ж; 2 - стекло + лей-
цит - Ж; 3 - стекло —— Ж + лейцит; 4 - В-т сани-
дин —— Ж + лейцит; 5 — стекло —- &-т санидин; 6 —
стекло —*- Ж + лейцит + В-т санидин. Размер симво-
лов указывает пределы ошибок измерения температуры
и давления в каждом эксперименте. Символы обозиача-
ют направление реакции, но не обязательно соответст-
вуют полному ее протеканию. Данные для I атм по
Schairer J.F., Bowen N.L.,(Am.J.Sci, 1955, 253, 681-746.
Кривая лейцит + жидкость * жидкость моновариантна
только для состава KAlSi^O^; две другие кривые точно
моновариантны в бинарной системе лейцит - кремнезем
Lindsley D.H.Am. Min., 1966, 51., 11/12, 1797
Фиг. 1160. Фазовая диаграмма в области субсолидуса
системы FeO-FejO^—Alj O^. Сечение при постоянной
теспературе (900° и 700°С) и давлении (Робщ.-» 2000
бар)
Фиг. 1161. Предварительная кривая равновесия реакции
альмандин = герцинит + железистый кордиерит ** фаялит.
Крестики означают гранат, кружки продукты распада
или их аналоги
Yoder H.S. Camegie Inst. Washington Year book, 1954-55,
54, 98
Фиг. 1163. P-T проекция части системы кальсилит -
(КAlSiO4) кремнезем. Данные для 1 атм Schairer J.F.,
Bowen N.U'AmJ.Sci, 1955, 253. 681-746). Все пока-’
занные данные для состава лейцита (KAJSi^Og). Крес-
ты - точки на кривой Лц = Кс + Сан пб данным
bcarfe С.М., Luth W.C.,and Tuttle 0.,Program, 1965
Annua] Meeting, Geol. Soc. Am., 144-45, 1965. Пунктир-
ные кривые или части кривых экспериментально не
определены
1 - Лц — Ж; 2 - Ли + стекло — Ж + Сан; 3 - Сан + Кс —
Ли; 4 - Лн — Сан + Кс; 5 - Ли —Ли; в - стекло — Лц.
Размеры символов указывают на неопределенность
в- измерении Р и Т. Sp So " сингулярные точки; 1 -
инвариантная точка
Lindsley D.H. Camegie Inst. Washington Year
book, 1965-66, 65, 246
311
A,203-K20_Si02
(Фиг. 1164. Диаграмма
температура - состав
системы KAlSi3O8-SiO2
при постоянном дав-
лении, равном 1 атм,
(показано сплошной
линией), 20 кбар (ли^
нией-------), 10 кбар
(линией —-------).
Ж (крист), Ж (Тр),
Ж (Кв), 5Ж (Сан),
Ж (Лц) - кривые лик-
видуса при каждом из
указанных давлений
Символы для 20 кбар:
1 - стекло, 2 - стекло +
- кварц, 3 - стекло + сани-
дин; для 10 кбар: 4 - стек-
ло, 5 - стекло + кварц, 6 -
стекло + санирин, 7 - стек-
ло + лейцит
Lytfi Ж.С, Carnegie
Inst. Washington, Year
book, 1966-67, 66, 482
•c
*450
'Л^гсптв>
1000^
_ ко 1
* I
- Кварц
/w
ООО
600
400
Al2O3-Li2O-SiO2
Фиг. 1165. Р-Т диаграмма сечения Li20*A)^03*4Si02
1 - p - Сп — стекло; 2 - в - Эв — r Эв +
тв.р-р Н тв.р-р
стекло; 3 — В — Сп —в -Эв ; 4 - Сп — в - Эв ;
г тв.р-р н тв.р-р
5 - Стекло —В - Сп; 6 - в - Эв — в - Сп;
н тв.р-р Р '
[Р - Эв —— р Сп + В Эв
7J тв.р-р r г тв.р*-р
|р - Сп —— в Сп + в Эв
I тв.р-р н тв.р-р Р тв.р-р
8 - р - Эв — Сп
тв.р-р
Размеры символов соответствуют неопределенности
в измерении Р и Т
Munoz J.L. Carnegie Inst. Washington Year book, 1966-67,
66, 372
ft-Cn+Ж ЖЧ1А150в
? А'бОтДр.р+Ж
fi'Mтв.р-р
2m0pp
$
§
Петалигв^а-Оп *ft -On щ
-Петалит н-ПпЛп n r
Петалшп+сс-Сп
LifOALfOf
_ -6M0.
I \ §
I 4
i \
l^~oo p_^
/ V
\
a-oo+a-cn
00 75 70 65 60 55 50
U,O Al,0<6Si07 SiO,, Oec.%
а а Ъ L 4
Фиг. 1166. Диаграмма фазовых равновесий в сечении
эвкриптит (Li^D* А120у 2SiO2)- кремнезем (SiO2).
Более высокотемпературная часть диаграммы - по дан-
ным Hatch R.A.(Am.Min.,1943, 28. 471-96) в несколько
измененном виде. В нижней части диаграммы показаны
фазовые равновесия при давлении около 680 атм по
данным авторов
Roy R,, Roy D«t Osborn E.F, J. Aril. Ceram.Soc,, 1950, 3$,
5, 156
Фиг. 1167. Р-Т поле стабильности пиропа. Для всех
опытов (за исключением показанных открытыми круж-
ками на кривой А) в качестве исходного материала
был взят синтезированный пироп. Пунктирная кривая
Н - граница образования зародышей из стекла или
кристаллических исходных материалов. В Р-Т поле
между кривыми А и Н зародышевые кристаллы пиропа
не образуются (о проблеме возникновения зародышей
см. Boyd a.England,(Year book 58)«
Boyd F.R.Jr,, England J.L, Carnegie Inst. Washington
Yearbook, 1961-62, 61., 110
312
A12O3—MgO—SiO2
Фиг. 1168. Система энстатит - пироп при давлении
30 кбар.
1 - А1-энстатит кристаллизуется из стекла; 2 - А1 -энстатит
образуется из смеси энстатит mjpon; 3 - смесь энстатит + пи-
роп не гомогенизируется; 4 - пироп растет из гомогенного А1-эн-
статита; 5 - закалочные кристаллы
Boyd F.R., England J.L. Carnegie Inst. Washington,Year
book, 1963-64, g3, 158
Фиг. 1170. Изобары границы области несмесимости в
системе энстатит - пироп. Небольшие кружки - точки
при 1500 С и 50,40 и 30 кбар по данным MacGregor I.D.
Ringwood А.Е.,(Carnegie Inst. Washington, Year book,
1963-1964, 63, 157), в которых они использовали сме-
си природных энстатита и пиропа. Boyd F.R., England J.L.,
Camegie Inst. Washington,Year book, 1963-64, 63. 160
20
Давление, кбар
Фиг. 1169. Изотермические проекции границы области не-
смесимости в системе энстатит - тпфоп. Два малень-
ких кружка в разрезе 30 кбар обозначают изобаричес-
кие точки на фиг. 1168. Кружки - закалочные опыты
для 1600 С; квадраты - для 1100°С
Boyd F.R., England J. L, Camegie Inst. Washington,Year
book, 1963-64, 63. 159
Фиг. 1171. Кривая зависимости от давления реакции:
обогащенный А1 - энстатит ~=*~ бёдный А1 - энста-
тит + гранат при 1500 С.-------------Равновесная кри-
вая при использовании природных смесей.-------------Рав-
новесная кривая при использовании синтезированных
смесей по данным Boyd F.R., England J.L.,(Camegie
Inst.Washington, Year book, 1963-64, 63, 157)
MacGregor I.D., Ringwood A.E. Camegie Inst. Washington,
.Yearbook, 1963-64, (8, 162
I 40
313
Фиг. 1172. Р-Тфазовая диаграмма сечения мольного
состава 1 форстерит + 1 пироп
1 - жидкость; 2 - жидкость +• форстерит; 3 - жидкость + фор-
стерит + шпинель; 4 — 4 энстатит + шпинель; 5 - форстерит + пи—
^"llacGregor I.D. Camegie Inst. Washington, Year book,
1863-64. 63. 156
Фиг. 1174. Разрез форстерит - пироп при 40 кбар
Davis В,Т.С. Camegie Inst. Washington, Year book,
1963-64, 166
Фиг. 1175. Диаграмма, показывающая сдвиг границы
ликвидуса Фо-ЭНс с давлением в системе MgoSi0.-
о/ 4
MgAl2O^SiO2. Сплошная линия Ц и точка Р* - соот-
ветственно кривая ликвидуса и инвариантная точка, при
1 атм, по Rankin G.A.,Merwin Н.Е., (Am.J.Sci, 1918, 45,
301). Пунктирная линия L2 и точка ₽2 - кривая ликви-
дуса и оценочная инвариантная точка при давлении 35
и 40 кбар. Построение сделано на основе эксперимен-
тов Boyd F.R., England J.L., MacGregor I.D., Davis В.Т.С.
(Carnegie Inst. Washington, Year book, 1963-1964, gJJ)
Kushiro J.,J .Geoph.Res. 1968, 73, 2, 630
Фиг. 1173. Изобарические разрезы системы MgO—
А12О3-Si02
Boyd F.R., England J.L. Camegie Inst. Washington, Year
book, 1962-63, 6jL 122
314
A12O3-Na2°”SiO2
Фиг. 1176. Т-Р проекция системы нефелин-кварц
1) и I2 - бинарные инвариантные точки. В верхнем левом углу
диаграммы показаны детали, относящиеся к двум сингулярным точ-
кам Sj и S2
Bell РАК,Roseboom E.H.Jr. Carnegie Inst.Washington,
Year book, 1964-65. 6f, И1
Фиг. 1178. Экспериментальная P-Tдиаграмма для
жадеитового состава
Bell Р.П. Carnegie Inst. Washington,Year book, 1963-64,
6g. 172
Лйу ЛД* Кб
V H50 JM
1350
1250 ~нец J_ \ *Ъжд*АН
1150 1050 -жд ’ Ж0+К5 J t
Hep ЖО АН Ид
10/ffap
Aff+Ж
~Hep<Aff\ Aff+rtO'
неф Жд АО Ид
Нвф /НО АН НО
Неф Жд АО Ад
Фиг. 1177. Диаграмма температура - состав для раз-
личных давлений. Пунктиром показаны подразумевае-
мые фазовые границы. Диаграмма для Р ж 1 бар дана
по Greig J.W., Barth T.F. W.,(Am.J.Sci, 1938, ^gA, 93-112)
Bell P.M. Carnegie Inst. Washington,Year book, 1963-64,
173
Фиг. 1179. Результаты экспериментов по определению
стабильности жадеита в системе NaAJSiO^-SK^-b^O.
Опыты обозначены прямоугольниками, размеры которых
показывают неопределенность при измерении температу-
ры и давления о - инвариантная точка 14 по Boet-
tcher A.L. Wyllie P.J.,(Nature, 1967, 216. 512-573)
Boettcher A.L., Wyllie P.J. Geoch.Cosm. Acta,1968, 32,
9, 1002
315
Фиг. 1180. Фазовые отношения при плавлении альбито-
вого состава в интервале 36 - 43 кбар. Равновесная
кривая кварц-коусит Boyd F.R.,(Science, 1964, 145.
13-20), кривая плавления альбита по данным Boyd F.R.,
England J.L.JJ.Geoph.Res. 1963, 68, 311-323), кривая
равновесия альбит - жадеит + кварц экстраполирована -
по данным Robertson Е.С. et al., (Am.J.Sci, 1957, 255.
115-137)
Bell P.M., Roseboom E.H.Jr. Camegie Inst. Washington,
Year book, 1964-65, 64, 140
Фиг. 1182. Плавление альбита под давлением. Показа-
на также кривая, определенная Birch F. LeComte P.,(Am.J.
Sci, 1960, 258, 209)
BoydF.R., England J- L. J. Geoph .Res. 1963, 68.318
Фиг. 1181. Исправленная P-T равновесная кривая раз-
ложения альбита при высоком давлении. Часть кривой
ниже 500 С основана на данных по теплоемкости Ке1—
l?XcK»K«>Todd S.S., Огг R.L., King E.G., and Bonnickson K.R.,
(U.S.Bur.Mines Rept. Invest. 19оЗ, 49о5). Кривая Birch
F.,LeComte P.(Am.J.Sci, 1960. 258, 209)
Newton R.C., Smith J.F.J.Geol., 1967, 75, 3, 281
Фиг. 1183. Диаграмма температура - состав системы
NaAlSi3Og-SiO2nP11 постоянном давлении, равном 1 атм
(показано сплошной линией по данным Schairer J.F. Bo-
wen N.L.), 8 кбар (линия ----------), 12,3 кбар (ли-
ния --------------------------------), 20 кбар (линия-), Ж (крист),
Ж (тр), Ж (кв), Ж (Аб) - кривые ликвидуса при каж-
дом из указанных давлений
Символы для 8 кб: 1 - стекло, 2 - стекло + кв, 3 - стекло +
Аб; для 12,3 кб: 4 - стекло, 5 - стекло + Кв, 6 - стекло + Аб,
для 20 кб: 7 - стекло, 8 - стекло + Кв, 9 - стекло + Аб
Luth W.C. Camegie Inst.Washington,Year book, 1966-67,
66, 483
NMlfyfy 20
¥0 60
вес. К
60 SLQg
316
А10 ,-Na O-SiO„, A1„O, —K_0—SiO„
£ О £ X £ О & С
Фиг. 1184. Диаграмма давление - состав (А) и давле-
ние - температура (В) части систем NaAlSi30g—Sip2
и KAlSi jOg—Si02« На диаграмме А показаны составы
моновариантных жидкостей, сосуществующих с санидином
и лейцитом - Ж (Сан, Ли), санидином и кварцем - Ж
(Сан, Кв) и альбитом и кварцем - Ж (Аб, Кв) по экспе-
риментальным данным (фиг. 1183). Составы моновариан-
тных жидкостей, сосуществующих с тридимитом и аль-
битом - Ж (Тр, Аб) и с тридимитом и санидином Ж
(Тр, Сан) - подразумеваемые. На диаграмме В: кри-
вая плавления Аб по данным Boyd F.R., England J.L.
(фиг. 1182), кривая реакции Сан = Лц + Ж по данным
Lindsiey D.H. (фиг. 1182) кривая перехода кв » тр -
по Kennedy G.C.(Am.J.Sci, 1962, 260, 7, 501). Инвари-
антные точки Тр + Кв + Аб + Ж и Тр + Кв + Сан + Ж
показаны предположительно
Luth W.C. Camegie Inst. Washington,Year book, 1966-67,
66, 484. См. также Luth W.C. Am.J.Sci, 1969, 267A, 331
CaO—FeO—SiO2
Фиг. 1186. Сечение геденбергит - ферросилит. Тонкие
линии - данные по фазовым равновесиям при 1 атм.
Bowen N.L., Schairer J.F.,Posnjak Е. (1933, р. 213) в
равновесии с металлическим железом; в расплаве со-
держатся небольшие .количества Fe2O^. Жирные линии -
гидротермальные данные для 1 и 2 кбар. Кривые, по-
казываю щие состав геденбергита, сосуществующего с
фаялитом и кремнеземом, нанесены по данным (1) Bo-
wen N.L., Schairer J.F.,Posnjak E.(Am.J.Sci, 1933 5th ser.
26, 193-281). (2) Ernst W.G.(Am.J.Sci, 1966f 264. 37-65).
(3) авторов,, Lindsiey D.H. Munoz J.L. (Camegie Inst.
Washington, Year book, 1966-67, 66. 365). См. также
Lindsiey D.H., Munoz J.L.(Am. J. Sci, 1969, 267A, 304).
Буфер Буфер
Мт-Кв—Фт Мт—Вюс
Гед + Фт + Кв-*»Гед
тв.р-р 1 2
Обогащенный Фс тв. р-р 3 4
геденбергита-*-бедный Фс
тв.р-р геденбергита + фт+кв.
Lindsiey D.H., Munoz J.L. Camegie Inst. Washington.Year
book,l 966-1967, 66, 365
W 20 0
саЗЮ„х«Я
__________6_
15кбар*
______о I 0. Ф Ф Ф О
1
~№кйр
Г KlWlt
HnupW
плпар ПрГЧП'М AJ
Цмир*0я*М
' L Ф I H H
W 20 0
CaFeSi*°‘ CaSiO5,^»
20
Фиг. 1185. Диаграмма температура - состав в сечении
геденбергит-ферросилит при постоянном давлении
а - 5 кбар; 6-7 кбар; в,- 10 кбар; г - 15 кбар. Ромбами
отмечены изученные составы. Во всех экспериментах было равно-
весие с металлическим железом. Жирные линии - бинарные равно-
весия; более тонкие - тройные
Lindsiey D.H. Camegie Inst. Washington, Year book,
1965-66, 65, 234
317
СаО-FeO—SiO„
2
FezSiO3, mon. °/o
50 60 70 60 90 700
°C
1100
1000
900
800
700
CaFeSizOs W 50 20 10 FeSlO3
CoSlOj, мол. %
A
Фиг. 1189. Диаграмма температура — состав для сече-
ния MgSiO^— CaMgSi20g. Опыты в субсолидусной обла-
сти проводились как при атмосферном давлении без во-
ды, так и в гидротермальных условиях. В исследован-
ных частях диаграммы давление не оказывает сущест-
венного влияния на равновесие
1 - данные закалки, Р - 1 атм; 2 - данные закалки по Боуэну
(1914), Р = 1 атм; 3 одна фаза в опыте, Р= 1 атм; 4 - одна
фаза в опыте, Pf^O = 500 бар; 5 - одна фаза в опыте, Р^О =
1000 бар; 6 - две фазы в опыте, РЦ2О ~ 1000 бар. Точки на кряк-
вой распада твердых растворов обозначены: 7 - получены при Ря
1 атм, 8 - получены гомогенизацией пироксенов при Р я 1 атм;
9 - получены при Pf^O = 500 бар
Boyd F.R., Schairer J.F. J .Petrology, 1964, 5, 2, 280
Fcfl В Фс Гев В Фс
Фиг. 1187. А. Фазовые отношения в сечении геденбер-
гит - ферросилит при давлении 20 кбар.
1 - однофазный клинопироксен распадается на 2 пироксена; 2-
реакдия двухфазной смеси Г ед + Фс; 3 - составы гомогенных сме-
сей 2 клинопироксенов Фс^ Волл^ + ФСдд Волл^ Основание тре-
угольников показывает направление достижения равновесия; раз-
мер воображаемого прямоугольника, включающий треугольник,
соответствует точности измерения Р и Т при определении состава
пироксена. Б и В - схематическая интерпретация поля 2-пироксе-
нов, обнаруженного при 20 кбар в сечении Гед - Фс. Клпир - клино-
пироксен с пространственной группой С 2/с или Р2|/с; опир - орто
фетв р-р* Жирные линии - экспериментально определенные границы
поля 2-Пироксенов. Тонкие линии - элементы равновесия, которые
можно вывести по диаграмме
Lindsley D.H., Munoz J.L.,AmJ.Sci, 1969, 267A, 308
4
1700
мп — Г
Ж
Ъъ^рУ*
/500-
H ^um(Lfp
/300 - J
MC/ntp-p fAumtp-p
MgSiO3 20 . 40 60
Bsc. %
Фиг. 1190. Равновесная диаграмма системы диопсид
(CaMgSi2O6) - энстатит (MgSiO^) при давлении
20 кбар (без воды)
Кushiro 1. Am.J.Sci, 1969, 267А. 275
00 CaMgS^O,
Фиг. 1188. Плавление диопсида под давлением
Boyd F.R., England J.L.J.Geoph.Res, 1963, 321
318
CaO_MgO-SiO2
°C
1600
1500
1000 {
1300
1200
1100
1000
и 3HCm6.p-p* Au тб.р-р
!^знстрр.р+Ди тб.р-р
ю is го
Дабление, кбар
Фиг. 1191. Р - Т проекция для состава
(в вес. %)
1 - пижонит образуется из Энс + Ди
тв.р-р тв.р-р
+ Ди ; 2 - пижонит + Энс образуется из
> тв.р-р тв.р-р
Ди или клиноэнстатит •+ Ди ; 3 - пн-
тв.р-р тв.р-р тв.р-р
жонит не изменяется; 4 - пижонит + Энс^ образуется из пи-
жонита; 5 - Энс__ + Ди__ образуется из клиноэнстати-
Ди20Эис80
или клиноэн-
статит
Энс
или клиноэнстатит
Фиг. 1193. Сечение диопсид - форстерит при 40 кбар
1- Ж; 2-Фо ; 3 - клтпцэ _________
тв.р-р тв.р-р
Davis В.Т.С. Camegie Inst.. Washington, Year book,
1963-64, 63. 168
жонита; 7 - опыты, продукты которых интерпретированы неудовле-
творительно. Линия А А1 - нижний предел стабильности пижонита,
определенный Brown J.M.(Carnegie Inst. Washington, 66» 347-353).
Kushiro I., Yoder H.S. Camegie Inst. Washington, Year
book, 1968-69, 68, 227
Фиг. 1192. Диаграмма температура - состав для сече-
ния Mg2Si20g-CaMgSi2O6 при давлении 30 кбар
I - закалочные кристаллы; 2 - твердый раствор энстатита; 3 -
твердый раствор диопсида; 4 - твердый раствор энстатита с нара-
станиями твердого раствора диопсида; 5-2 пироксена получены в
присутствии F^O. 6 - рентгеновское определение границы твердого
раствора диопсида; исходный материал гомогенизируется в течение
опыта; 7 - рентгеновское определение границы твердого раствора
диопсида; исходный материал не смешивается в течение опыта
Davis В.Т.С.,Boyd F.R.J. Geoph. Hes.1966, 71. 5, 3571
CiiMgSigO6, Bee %
Фиг. 1194. Диаграмма фазовых равновесий в системе
диопсид (CaMgSi2O6) - форстерит (Mg2Si Ол) при 20 кбар*
Диаграмма при 1 атм по данным Kushiro I, Schairer J.F.,
(Y.b, 62, 96)
Kuahiro I. Camegie Inst. Washington, Year book, 1963-64,
63, 102. См.также Kuahiro Z.Am.J.Sci., 1969, 269A, 273
О схематических фазовых диаграммах системы
Mg2SiO4-3iO2-CaMgSi2O6 при давлениях в интервалах
6-26; 26-31; 89-92; 92-140 кбар и свыше 140 кбар
Matsumoto Т. Upper Mantle Symposium. New Dehli, India,
1964, 112-26, публ. 1965
319
Mg^iOu MgSiOj StO2
°C
1600
/Ш
Фиг. 1195. Предварительная диаграмма системы
диопсид (CaMgSi2O^)- форстерит (MgSiO^)-энста-
тит (MgSiO^) при 20 кбар. Диаграмма системы диоп-
сид-форстерит-кремнезем при 1 атм, по данным Bo-
wen N.L. (Am. J. Sci, 1914, 38)» Schairer J.F. and Yo-
der H.S., (Year book £1,76 ) и Kushiro I. and Schairer J.F.,
Year book,62,100). А, В, С относятся к диаграмме
при 1 атм
Kushiro I. Camegie Inst. Washington, Year book,
1963-64,^3, 106
~*В*етОрр*Ж
К I
Jt—”
- ^э^тЛр-р
\^cmAp-p *
- 1 *Дит&р-р
MgSL03
20
Ж
•\"
\l ДипЛр-р
К
ПОолЛцрля
ПОолл^ 7*
/- +ОпВоЛЛт*Гр
I Аит&р-р * ВоллmCf-p
40 СаМд$1г0в
СаЫ03, Вес. %
"^МГР
\ +
B/u,J,mtp-p
80 СаЫ03
Фиг. 1197. Равновесная диаграмма системы энстатит
(MgSiO^) - волластонит (CaSiO^) при 20 кбар
Kuahiro I, Camegie Inst.Washington,Year book, 1963-64,
63, 104
Caftl^SiOg CaflL^SljOg SiO2
Фиг. 1198. Субсолидусные фазовые отношения в се-
чении диопсид-анортит (CaA^S^ 08) при 1350 и 1150°С.
Нижняя левая диаграмма показывает субсолидусные
фазовые отношения' в тройной системе диопсид -
CaAl2SiOg - кремнезем при более низких давлениях
Kushiro I. Camegie Inst. Washington,Year book, 1964-65,
64, 116
Фиг. 1196. Диаграмма, показывющая перемещение в
зависимости от давления границы ликвидуса форстерит-
пироксен и изобарической инвариантной точки, включак>-
щей форстерит и пироксены в системе Mg2SiO4-CaMgSiO4-
-SiO2. Сплошная линия и точка Pj - кривая ликвидуса
и инвариантная точка при 1 атм по определениям Bo-
wen N.L.(Am.J.Sci., 1914, 38, 207), Schairer J.F,Yoder H.S.,
(Camegie Inst.Washington,Year book, 1962, 61, 75), Ku-
shiro I, Schairer J.F.,(Camegie Inst.Washington,Year book,
1962-1963, 62, 95). Пунктирные линии L2 и L3 и точ-
ки Р2 и Р3 - кривые ликвидуса и инвариантные точки
соответственно при 20 и 30 кбар, построенные по эк-
спериментам Kushiro /., (Camegie Inst.Washington Year book,
63,101) и Davis B.T.C., (Camegie Inst.Washington, Year book,
1962-63. 63. 103)
Kushiro I., J.Geoph. Res. 1968,73, 2, 624
320
CaO- MgO-SiO2
Давление, кбар
Фиг. 1199. Р-Т диаграмма для сечения монтичеллит
(CaMgSiO4), 80, диопсид (CaMgSi2O6) 20 вес. %. Не-
большие квадраты обозначают опыты, проведенные в
газовой аппаратуре. В нижней части диаграммы пока-
заны ко иноды в сечениях ларнит-форстерит и волласто-
нит - энстатит для различных Р-Т условий. Крестика-
ми отмечены изученные составы
Kushiro/., Уoder Н.S., Jr. Camegie Inst. Washington Year
book, 1963-64, 6S, 82
CdjSlOii CQjMgSl^Og СйМдЗъОц
Da Mg St0ц f мол. %
Фиг. 1201. Диаграмма фазовых равновесий в области
субсолидуса прй давлении воды 136 атм
1 - Мер; 2 - Монт; 3 - у Са25Юд;4 - a* Ca2SiO4 (переходит в
pr-форму при комнатной температуре); 5 - гидрат.
Roy D.Min. Mag., 1956, 233, 187-194
CoO-MgO-SiO2
Давление, кбар
Фиг. 1200. Р-Т диаграмма для'окёрмаиитового
(Ca2MgSi20j) состава
1 - стекло; 2 - Мер + стекло; 3 - Окм; 4 - Мер + Ди + Окм;
5 - Мер + Ди. Для состава Ди__. Монтвл: 6 Окм + Мер + Фо ;
20 80 г тв.р-р’
7 - Мер + Ди + фо + Окм. Точки А и В нанесены по дан-
тв.р-р
ным Osborn Е.F.,Schairer J.F.,Am.J. Sci., 1941. 239. 715-763) и
Harker R.I.,Tuttle O.F., Am.J. Sci., 1956, 254. 468-478) соответст-
венно
Kushirol. Camegie Inst. Washington Yearbook, 1963-64,
6£, 85
Фиг. 1202. Диаграмма фазовых превращений в системе
Mg2SiO4— Co2Si04 в области высоких давлений при 800,
1000, 1200 С
Akimoto S. Phys. Earth Planet.Interiors. 1970, 3, 192
I 41
321
Co 0—MgO—SiO 2
Фиг. 1203. Фазовые отношения в системе Mg2SiO4—
Со25Ю4при 60-170 кбар, 1000°С
1 - оливин ТВ.Р-р; 2 - шпинель тв. р-р; 3 - р фаза; 4 - а + у;
5 —а+р ; в —а+р+у ; 7 — у + Р
Ringwood 4.Е., Major 4. Phys. Earth Planet Interiors.,
1970, a. 103
Фиг. 1205. Фазовые отношения в системе Mg?SiO4—
Fe2SiO4 при 50 - 200 кб и 1000°С
1 - оливин (а); 2 - шпинель (у); 3 - Р-фаза; 4 -а+у; 5 - а+
+р;8 -а+р+у
Ringwood А.Е., Major A. Phys. Earth Planet. Interiors,
1970, 2, 102
Фазовые отношения в системе Mg^SiO4—
FeO —MgO—SiO
£
Фиг. 1204. P-T-X диаграмма системы MgjSiC^FejSiC^;
a,b,c - изотермические сечения при 800, 1000 и 1200°С; d -
кривая равновесия оливиновой и шпинелевой модификаций
e-FeoSiO^. Кривые плавления MgnSiO^Fe^SiO^f и g. Данные Da-
vis В.Т.С., England J. L.(J .Geoph .Res., 1834,5?, Ш8) и Akimo-
to S. et.al.(J.Geoph. Res., 1967, 7g, 679) пересчитаны с учетом
шкалы давлений no NaCl. Кривые солидуса (О - кбар) h и лик-
видуса i в системе форстерит - фаялит по данным Bowen,N.L.Schai-
гег J.F.(Am. J.Sci., 1935, 29. 151)
Akimoto S.,FujisawaH. J.Geoph. Res., 1968, 73, 4,
1477
100
Шпинвлъ (mO. p-p)
Стишовит
80 \___
100 ,
~80 ' MgSiij
FeStO3 ,Мол %
Фиг. 1206. Фазовая диаграмма системы FeSiO^-MgSiO^
при 800 ± 10 С в области высоких давлений. Точкой
намечена граница, определенная по составу шпинели,
исходя из параметров решетки
Akimoto S,, Sy on о J, Phys. Earth Planet. Interiors,
1970, & 188
322
FeO—MgO—SiO2
Фиг. 1207. Фазы в системе FeSiO^—MgSiOo при давле-
нии до 200 кбар и температуре около 1000°С
1 - полное превращение в шпинель + стишовит; 2 - граница,
определенная по составу шпинели, полученному из параметров ре-
шетки; 3 - направление эксперимента в трех-фдзовом поле, в кото-
ром определен состав шпинели; 2 3 “ точки на границе поля ста-
бильности пироксена * ’
Ringwood А.Е., Major A. Earth Planet Sci., Letters,
1968, 5, 76-78
Фиг. 1209. Экспериментальные результаты £ля орто-
пироксена и смесей оливин + кварц при 900 С и высо-
ких давлениях
1 - опир, реакции нет; 2 - опир — опир + ол + SiO2J 3 -
опир —— ол + SiO2; 4 - ол + SiO2, нет реакции; 5 - ол + Si02~*“
опир + ол + SiO?
Smith D. Camegie Inst. Washington,Year book, 1968-69,
68, 231
TfC
1000
900
800
0,6 Ц7 08 09 Ю
Fe/(Fe*Mg)~**
Fe2O3-Na2O-SiO2
Мал Ош
Фиг. 1210. Кривая плавления акмита состава Na^O*
•FeoOo^SiC^non давлением. Опыты проводились в
Pt-yR п з капсулах
1 - акмит; 2 - акмит + гематит (+ магнетит) + жидкость; 3 -
гематит (+ магнетит) + жидкость; 4 - жидкость. Символы с индек-
сом Гем обозначают опыты с избытком гематита
Gilbert М.С. Camegie Inst. Washington. Year book,
1965-66, 65, 243. См’, также Gilbert M.C.Am.J.Sci,
1969, 267A, 150
Фиг. 1208. Экспериментальные результаты, получен-
ные для ортопироксена и смесей оливин + кварц при
низких давлениях. Эксперименты проводились при
800 С и J кбар, при 900 и 950°С и давлении 0,3 кбар,
при 1000 С - в вакууме в кварцевых пробирках. Сте-
пень зачернения символов приблизительно пропорцио-
нальна количеству оливин + кремнезем в продуктах
реакции. Переходы кварц - тридимит и ортопироксен -
протопироксен не учитывались при построении диа-
граммы
1 - опир, реакции нет; 2 - опир — опир + ол + SiO 3 -
опир —— ол + SiO2; 4 - ол + SiO2, HGT реакции; 5 - ол +SiO2 —
опир + ол + Si02
Smith D. Camegie Inst. Washington. Year book, 1968-69,
68, 230
323
Фиг. 1211. Температура плавления акмита в функции
сжимаемости силиката при комнатной температуре. На
вставке показана аналогичная зависимость для других
силикатов. Данные по сжимаемости суммированы в
работе Birch F., (GeoLSoc. Am. Mem., 1966, 97, 97-173).
Точками на кривых на вставке отмечен интервал дав-
ления в 10 кбар
Gilbert it,С, Camegie Inst. Washington.Year book,
1967-68, 67, 101
FeO—SiO9—TiO
a z
FeO
SIOZ 30кбар 710г
Фиг. 1213. Система FeD-SiC^-TiC^npH 1130°С и раз-
личных давлениях
Реакции : А - 2Fe21'iO4+SiO2'*’2FeTiO3+Fe2SiO4;
В - FeTi2O5-*FeTiO3+TiO2; С-Fe^SiO^SiOg — 2FeSiO3;
D - Fe2TiO4-*FeTiO?+FeO
Lamprecht A, Woermann. Naturwissenschaften, 1970, H.
4, 191
Fe2O3-Na2O-SiO2
°c
Фиг. 1212. Предварительные PT - кривые стабильности
акмита при Pq^ буферных смесей никель - окись нике-
ля Ni-NiO (кружки) и магнетит-гематит Мт-Гт (квад-
раты). Треугольниками нанесены результаты Ernst W.G.
(персональное сообщение) с буфером Мт-Гт
Bailey D.K, Camegie Inst. Washington, Year book,
1962-63, 62. 132. О стабильности акмита с изменением
Робщ.’ РО ’ Т’ См‘ Bailey D K* Am* SciЛ969- 267A.
1-16 ’ 2
Фиг. 1214. Фазы в системе MgGeO з-MgSiOj при давле-
нии до 170 кбар и температуре около 1000°С
1 - гомогенные твердые растворы типа ильменита; 2 - двух-
фазовое поле ильменит + твердые растворы пироксена; 3 - твердые
растворы пироксена
Ringwood А.Е., Major A, Earth Planet Sci. Letters,!968,
5^76-78
324
GeO MgO-SiO,
& I
Фиг. 1215. Система Mg2GeO4-Mg2SiO..Изотермическое
сечение при 542° (одноосное давление)
1 - граница по рентгеновским определениям; 2 - следы водной
фазы; 3 ~ шпинель; 4 - оливин
Dachille F., Roy R. Am. J.Sci, 1960, 258, 4, 235
Фиг. 1216. Диаграмма давление - температура - со-
став системы Mg2GeO4—Mg2$iO4
а,б,в,г - изобарические сечения, соответственно, при 680, 3740,
13600 и 39440 атм, Р-Х 542 С - изотермическое сечение при 542°С
(см. фиг. 1215)
Dachille F., Roy R. Am.J.Sci, 1960, 258. 4, 236
MgO-SiO 2-TiO2
MgSiO3 Tt02
2000
20 00 60 80 20 00 60 80
Мд^Юц TiOz MgSty MgTi2O$
Фиг. 1217. Плавление в бинарных и псевдо-
бинарных сечениях системы MgO—SiO2-TiO2npn
10 и 20 кбар. Все составы нанесены в вес. %;
сплошными линиями показаны полученные дан-
ные; пунктирными - интерпретация
MacGregor I.D. Camegie Inst. Washington,Year
book, 1964-65, 64, 137. См. также MacGregor I.D,
Am.J.Sci, 1969, 267A, 348
20 00 60 80
MgSlO3 TiO2
Фиг. 1218. Изобарическое бинарное сечение
при 40 кбар тройной системы MgO-SiO2— ТЮ2
MacGregor I.D.Am.J.Sci, 1969, 267A. 350
325
MgO-SiO2-TiO2
Фиг. 1219. Проекции ликвидуса при 1 атм. (А), 10 кбар
(В) и 20 кбар (С) в поле M^SiO^MgSiO^-Mgl^C^-TiC^
системы MgO-SiOj-TiOj.
Д - проекция составов минимальной плавкости для модели пери-
дотитового состава. Кружки - составы с минимальной температурой
плавления при указанных выше давлениях; сплошная линия - направ-
ление изменения состава минимальной плавкости с давлением. Со-
ставы выражены в вес. %
MacGregor LD. Camegie Inst. Washington, Year book,
1964-65, 64, 138. См. также Mac-Gregor I.D. 'Am. J.
Sci, I960, 267A, 352
Фиг. 1221. Р-Т проекция моновариантных равновесий
для реакций 1 - Энс + Кт Фо + Рут (Ж); 2 -
Ж^ Фо + Энс + Кт; 3 - Ж^ + Фо Кт + Энс
(Рут); 4 - Ж4 Кт + Энс + Рут (Фо); 5 - Ж5 +
Кт Фо + Рут (Энс); 6 - Жо^?г Фо + Энс + Рут
о
(Кт); 7 - Ж? =& Рут + фо + Кт. Стабильные участки
кривых показаны сплошной линией, метастабильные
пунктиром; штрих - пунктирной линией показаны реак-
ции 2 и 7, кривые которых не пересекаются в инвари-
антной точке. Экспериментальные данные обозначены
символом 1, интерполированные - 2. При 1700 С пока-
заны ошибки измерений давления
MacGregor LD.Am.J.Sci, 1969, 267А. 358
/W
1200
10 20 30
ДаВление, к fap
Фиг. 1220. Экспериментальная Р-Т кривая реакции
MgSiO3+MgTi2O5=Mg2SiO4+TiO2 в области субсолидуса
MacGregor I.D.Am.J. Sci, 1969, 267a. 346
326
Четырехкомпонентные
A12°3-CaO“M^°’"SiO2
СаЯЦОц
Фиг. 1222. Диаграмма, показывающая сдвиг границы
ликвидуса Фо - Энс под давлением в системе
тв.[>-р
N^SiC^-CaA^C^-SiC^ Сплошная линия Lj и точка
Pj - граничная кривая ликвидуса и инвариантная точка
при 1 атм по Andersen O.,(Am.J. Sci, 1914, 38. 407).
Пунктирные линии и - граничные кривые ликви-
дуса Фо - Энс при давлениях около 20 и 30 кбар
ТВ.[>-р
соответственно по экспериментам авторов и О Нага M.J.,
(Camegie Inst. Washington. Year book, 1962-63, 62. 116).
Точки P2 и P3 - оценочные псевдоинвариантные точки,
в фазовые равновесия которых входят оливин и энста-
тит тв. р-р, соответственно, при 20 и 30 кбар
Kuahiro I. J.Geoph. Res., 1968, 7£, 2, 628
Фиг. 1224. Фазовые равновесия, включающие гранат и
пироксены, в области субсолидуса в части системы
CaSiO3—MgSiO3—AI2O3 при 20, 40, 70 кбар и около
1400 С. Интервал твердого раствора энстатита в сече-
нии энстатит-пироп основан на измерениях Boyd F.R.,
England J. L. (Camegie Inst. Waschington Year book,
1963-1964, 63, 157), твердых растворов диопсида и эн-
статита в сечении диопсид-энстатит - на измерениях
DavisB.T.C., Boyd F.R.(J.Geoph.Res. 1966, 71, 3567).
Точка A - изученный автором состав.
K'uahiro I. Earth a.Planetary Sci. Letters, 1967, 2, 5,
463
Гроссуляр
Л форстериту к форстериту
Диопсид 20 40 №90*00 80 Пироп
CaMgSLz06 Вес. %
Фиг. 1223. Поверхность ликвидуса в системе диопсид-
форстерит - пироп при давлении 40 кбар
Davis В.Т.С., Schairer J.F. Camegie Inst. Washington,Year
book Д 964-65, 64. 124
flupon
♦
№/f*C
Гросс *Клпир*
Гросс * Копир +0nup
Копир
Диопсид
Копир* Олар \
Копиров
Фиг. 1225. Изотермические разрезы для части системы
CaSiO3—MgSiO3—А^Озпри 30 кбар. Данные для 1600°С
показаны точками. Фазовые отношения в разрезах 1615
и 1630 С выведены из равновесий в сечении диопсид -
пироп.
O'Hara MJ- Camegie Inst. Washington Year book,
1962-63, 62, 117
№00°C
Энстатит
Пироп
Knnup
Диопсид
Энстатит
fpocc*mmu
+0пир
J^pcc*jjnmijtjK__
Клпир*0пир
Al 0 —CaO—MgO—SiO
Z «5 &
Фиг. 1226. Диаграмма фазовых соотношений в системе
CaSK^-MgSK^-Al^Oj при 1200°С и 30 кбар
BoydP.R. Camegie Inst. Washington, Year book,1968-
69, 68, 216
°C
1600
1000
1Z00
Фиг. 1227.P-T проекция для состава 2 энстатит
(MgSiQ? ) ♦ анортит (Са)
^тв.р р (ПРН давлении» меньшем 25 кбар обозначается
Клпиртв.р_р + Опир^р^р» при давлении, большем 25 кбар -
Клпир ) может быть метастабилен
*тв.р—р
.Kushiro Yoder H.S. Jr.t Camegie Inst. Washington.
Yearbook, 1963-64, 63, 112
Фиг. 1230. P-T проекция для состава анортит - фор-
стерит (молекулярное отношение 1:1).
1 - гр + клпир, образующиеся из Ан + Фо; 2 - Клпир + Опир +
Ан + Шп, образующиеся из Ан + Фо; 3 - Гр + Клпир, образующие-
ся из Ан + Фо с зернами малых количеств Гр + Клпир; 4 - Клпир +
Опир + Ан + Шп, образующиеся из Ан + Фо с зернами малых коли-
честв Гр + Клпир; 5 - Ан + Фо не изменяются; в - Гр устойчив;
7 - Гр не устойчив
Kushiro L, Yoder U.S,Jr. Camegie Inst. Washington.
Yearbook, 1964-65, 64, 90
°C
Wl_______I_____I____I_____L!___I____I_____I____I_____i -
Диопсид ZO 00 R o/ 60 80 Пироп
CaMgSizOg □; af иj at Mg3fl48t30iz
Фиг. 1228. Сечение диопсид-пцроп при 40 кбар
3 - клинопироксен ;
тв. р-р
Davis В.Т.С., Camegie Inst. Washington. Year book,
1963-1964, 63, 167
Фиг. 1229. P-T диаграмма для состава диопсид 35 -
пироп 65 (вес.'%h Кружки для 30 кбар - данные
O’Hara M.J.,(Cam.Inst.Washington.Year book, 1962-63,
62, 76-77)
Kushiro I. Camegie Inst. Washington. Year book,
1964-65,64, 105
/
2
3
0
5
6
7
328
Al/),-CaO-MgO-SiO 2
Фиг. 1231. Р-Т проекция для состава анортит -
форстерит (молекулярное отношение 1:2).
1 - Гр + Фо + К л пир, образующиеся из Ан + Фо; 2 - Клпир +
Опир + Фо + Шп, образующиеся из Ан + Фо; 3 - Гр + Фо + Клпир,
образующиеся из Ан + Фо с зернами небольших количеств Гр + ФО
Клпир; 4 - Клпир + Опир + Фо + Шп, образующиеся из Ан + Фо с
зернами небольших количеств Гр + Фо + Клпир; 5 - Ан + Фо не
изменяются.
Kushiro Yoder H.S.Jr. Camegie Inst. Washington.
Фиг. 1233. Т-Р граница между 2 ассоциациями: фор-
стерит * глиноземный энстатит + глиноземный диоп-
сид + шпинель (полые прямоугольники) и форстерит +
глиноземный диопсид + гранат * шпинель (сплошные
прямоугольники). Цифры справа от линии равновесия-
размеры элементарной ячейки граната в А
А - состав А (диопсид/энстатит 25/75); В - состав В (диоп-
сид/энстатит 75/25)
MacQregor I.D. Camegie Inst. Washington. Year Book,
1964-65, 64. 128
Year book.1964-65, 64. 91
Фиг. 1232. Ассоциации фаз в части системы CaO-MgO-
A12Oj-SiO2 при 4 различных Р-Т условиях, показанных
в верхнем правом углу Р-Т диаграммы.
Фиг. 1234. Р-Т гранила между 2 ассоциациями: форсте-
рит + глиноземный диопсид + шпинель (полые символы)
и форстерит + глиноземный- диопсид + гранат + шпинель
(сплошные символы); цифры справа (со стороны боль-
ших давлений) от кривой равновесия обозначают разме-
ры элементарной ячейки граната, в Я; цифра слева (со
стороны меньших давлений) обозначают содержание
А^Оз в вес. % в диопсиде, горизонтали со стороны
меньших давлений кривой равновесия - изоплеты (вес.%)
А^Оз
Исходные материалы; 1 - стекло, 2 — (форстерит + глиноземный
диопсид + гранат + шпинель) + стекло; 3 - (форстерит + глинозем-
ный диопсид + гранат + шпинель) + (форстерит + мелилит + анор-
тит)
MacGregor I.D. Camegie Inst. Washington, Year book,
1964-65, 64, 129
Между III и IV областями должна быть промежуточная ступень,
где сечение Дитв>р-р-Энств>р_р-Шп еще устойчиво, а Ан-Энс^.-
сечение замешается сечением Гр-Кв. Стадии I, II, III и IV могут
быть названы соответственно базальтовой, пироксенитовой, гранули-
товой и эклогитовой
Kuahirol., Yoder U.S. Camegie Inst. Washington.
Year book, 1964-65, 64. 93
42
329
Фиг. 1236. Р-Т- диаграмма для валового состава анор-
тит 60 вас. % - акерманит 50 вес. %
Yoder H.S.Jr. Camegie Inst. Washington. Year book,
1967-68, £7, 106
Фиг. 1237. Плавление полевых шпатов при 1 атм., 10
и 20 кбар. Пунктирная кривая для 1 атм - по данным
Bowen N.L.,(Am.J.Sci, 1913, 35. 577-590),
Продукт
Ж
Ж+ Пл
Пл (<1% стекла)
Пл ♦ Ж ♦ Кор.
Ж + Кор.
Стекло Пл
1 6
2 7
3
4 8
5 8
Высота символов соответствует точности измерения темпера-
туры
Linds ley D.Н.Camegie Inst. Washington Year Book,
1965-66, 65. 205
AL0_—CaO—Na.O-SiO-
Z о • A
J0000
8000
-X------xr
о
Натребуй мелилит
Мел'К
I
x //
I I
N Nr
———f*?
^***•4^
w
2000
H'tmlp-p'8™
ЛОолл'К
1200
♦JT
X 1
2
0 3
а 6
<4
* 7
98
600
800
1000
’C
Фиг. 1236. Диаграмма, показывающая (по предвари-
тельным результатам) поле стабильности натрового
мелилита (NaCaA^Oy)
1 -Na -Мел; 2 - Na-Мел + Ж; 3 - Ж; 4 - Неф + Волл;
*тв.р-р
5 - Na -Мел + Неф + Волл + Ж; 6 - Na -Мел + Пволл + Ж;
тв.р-р
7 - Неф * Пволл + Ж; 8 - Пволл + Ж. Отрицательный наклон
тв.р-р
кривой реакции в твердом состоянии, вероятно, обусловлен неравно-
вескостью
Yoder H.S. Jr. Camegie Inst. Washington. Year Book,
1963-64, 63. 88
330
Фиг. 1238. Часть тройной диаграммы NaAlSiO^-
-RAlSiC^-SiO** Показана гРаница твердого раствора
нефелина при 700°С и давлении воды 1020 атм. Пунк-
тирная линия соединяет состав Неф_о _ Кс^ _ Кв. Л
(где 'изменяется наклон кривых зависимости 20 от
состава) и МазКАЦБцО^ (Неф?2 g Kc27i^
1 - твердый раствор нефелина; 2 - нефелин + полевой шпат;
3 - нефелин + лейцит; 4 - нефелин + лейцит + кальсилит; 5 - не-
фелин * кальсилит
Hamilton D.L., Mackenzie Ж.S. J.Petrology, I960,
1, 61
ВВС. %
Фиг. 1239. Ориентировочное видоизменение диаграм-
мы фазовых равновесий для щелочных полевых шпатов
Боуэна и Татла в свете* настоящих экспериментальных
данных
Фиг. 1240.
А. Кривые сольвуса для щелочных полевых шпатов как
функция давления при 650% в системе альбит-ортоклаз (пунктирная
кривая) в присутствии избытка щелочи (пунктирно-точечная кривая)
и в присутствия избытка ALQ, (пунктирная кривая с двумя точка-
ми).
Б. Сольвус щелочных полевых шпатов. Кривая получена путем
крйсталлязации дегидратированного геля состава Аб^ °РТ40
при давлении 2 кбар и различных температурах
Luth W.C., Tuttle O.F. Am. Min., 1806, 51. 9-10, 1371
Mackenzie Ж.5.Am.J.Sci., 1952, Bowen vol. 2, 338
331
Al,O,-MgO—Na,0—SiO,
а Э & L
GeO2-MgO-NiO-SiO 2
*c
2000
1800
1600
1ЧОО
1200
fOOO
VO ZO 40 60 80 Ab
dec %
Фиг. 1241. Система форстерит - альбит при 1 атм по
данным Schairer J.F.» Yoder H.S., (Camegie Inst. Washing-
ton Year book, 1960-61, 60). исправлена лишь темпера-
тура плавления форстерита. Пунктирной кривой показана
интерпретация (при допущении, что энстатит метаста-
билен) предварительных результатов по системе форсте-
рит - альбит при 9 кбар. Стрелками отмечены изучен-
ные составы
Yoder H.S.Jr., Camegie Inst. Washington. Year book,
1963-64, 6& 99
Фиг. 1243. Фазы, присутствующие в псевдобинарной
системе ^GeOj-Mg^SiOjnpn 600 С в интервале дав-
лений 0-90 кбар
1 - Шп; 2 - Ол; 3 - Шп. + Ол; 4 - Шп + Ол + Серп;
/Шп + Серп - 600°С
° 1Шп + Ол - 650°С
Ringwood А.Е., Seabrook М. J. Geoph.Bes.fi962 , 67. 5,
1982
Фиг. 1242. Диаграмма, показывающая сдвиг границы
ликвидуса Фо - Энс под давлением в системе
тв.р-р
Mg2SiO4-NaA)SiO4-SiO2 Сплошная линия Ц - гранич-
ная кривая ликвидуса; точка Р| - инвариантная точка
при 1 атм (данные Schairer J.F., Yoder H.S., Camegie Inst.
Washington .Year book, 1960-61, 60, 141). Пунктирные
линии граничные кривые ликвидуса Фо -
Энс при давлениях около 10, 20 и 30 кбар соот-
тв.р—р
ветственно (по экспериментам авторов). Точки Р2, Р3
и Р4 - оценочные инвариантные точки, в фазовые рав-
новесия которых входят Фо и Энс соответствен-
тв-р-р
но при 10, 20 и 30 кбар.
Kushiro /.J. Geoph. Res. 1968, 73, 2, 625
332
CaO-FeO—MgO—SiO 2
Фс Q (моль %), пижонитового пироксена из интрузии
Bushveld. Пересчет с исключением Са дает состав
Энс4о Фс^о (в вес. %). Исходный материал (обозначен-
ный опир/для перехода в высокотемпературную фазу
брался в форме орторомбического пироксена с пластин-
ками авгита. Фаза, обозначенная клпир, рассматривает-
ся здесь как вероятная высокотемпературная стабиль-
ная клинопироксеновая фаза
I - жидкость; 2 - жидкость + клпир; I
3 - клпир; 4 - клпир + опир; 5 - опир; J ИЭ огшр
6 - опир + клпир; J из клпир
7 - опир;
Brown GM. Camegie Inst. Washington .Year book, 1966-
1967, 66, 350
Фиг. 1246. Равновесная диаграмма системы окерманит
(Ca2MgSi^D?) натровый мелилит (CaNaAISi20j) при дав-
лении 20 кбар
КизЫго I. Camegie Inst. Washington. Year book, 1963-64,
63, 91
Поликомпонентные
Al2O3-CaO-MgO-Na2O-SiO2
^e/}m&p-p
^елпЛр-р
\
I Ди
\ -
\
\
Фиг. 1245. Диаграмма температура - состав для сис-
темы жадеит-диопсид при постоянном давлении 30 кбар
Belt Р.М., Davis В.Т.С.,Camegie Inst. Washington.Year
book, 1964-65, 64. 121. О диаграмме при 40 кб. см.
'Belt Р.М.,Davis В.Т.С., Am.J.Sci, 1969, 267A. 17-32
T4OOO*C -
1
CaNaALSi,O7 SO CaMgSlz07
мол. %
Фиг. 1247. Диаграмма, показывающая предположительно
поле твердого раствора мелилита в системе окерманит
(Ca2MgSi? О?) - натровый мелилит (CaNa A lSi20y ) при’
1000°С. Построено по данным Schairer J.F., Yoder H.S.,
(Carnegie Inst. Washington, Year book,1963-64, 63).
Yoder H.S., (Camegie Inst.Washington. Yearbook, 1963-1964,
63» 101) и автора
Kushiro I. Camegie Inst. Washington.Year book,1963- 64,
63, 92
333
Al 20 3-CaO-MgO-Na 2O-SiO 2
Фиг. 1248. Диаграмма фазовых отношений в области
субсолидуса в сечении диопсид (CaMgSioOg) - альбит
(NaAJSi^Og) при 1350, 1250 и 1150°С. На нижней пра-
вой диаграмме показаны субсолидусные фазовые равно-
весия в тройной системе диопсид-жадеит (NaA)Si2ty) -
кремнезем
Kushiro I. Camegie Inst. Washington. Year book, 1964-
65, 64. 113
ме CaMgSioO^—CaAUSioO», К lark S.P., Schairer J.F., De
Neufville J., (Camegie Inst. Washington Year book, 1961-
62. 61. 67), и экспериментах с составом, обозначенным
буквой А
Lindsley D.H.t Emslie R.F. Camegie Inst. Washington.
Year book, 1968-67, 66. 479
Фиг. 1250. Результаты экспериментов, проведенных
при высоких давлениях и температурах с составом
диопсид + альбит + магнетит
1 - Гр + Клпир + Мт + Кв; 2 - Клпир ♦ Мт + Кв; 3 - Пл +
Мт + Клпир + Кв; открытые символы - опыты с участием воды
Banna S., Green D.ff.Chem. Geol., 1868, J, 1, 26
334
РАЗНЫЕ ВЕЩЕСТВА
Эклогит-базальт
Фиг. 1251. Предварительная диаграмма вероятных
соотношений плавкости между природными эклогитом
и базальтом. Длинным пуктиром показан переход ба-
зальт-эклогит по предположению Lovering (Trans.Am.
Geoph. Un ion; 1958, 39, 947. Показаны также опыты с
природным базальтом (Boyd, England, Camegie Inst.
Washington, Year book, 1953-59, Si» 88; Kennedy, пер-
сональное сообщение)
Yoder H.S., Tilley C.E., Camegie Inst. Washington,Year
book, 1960-61, 60. 109
Фиг. 1253.P-T диаграмма для толеита, B3PI, обога-
щенного оливином. Состав (в вес. %):Si02 “ 48,90;
А12О3 - 13,08; FeO - 10,34; MnO - 0,17; MgO - 16,09;
СаО - 7,44; Na2O - 2,23; К20 - 0,30; Р2О5 -0,15;
TiO2 - l,U;Cr2O3 - 0,12; NiO -0,07
1 - Ж; 2 - Ол; 3 - Опир; 4 - Клпир; 5 - Пл; в - Шп; 7 - Гр
Ito Keisuke, Kennedy G.C. Contrib. Min. Petrol., 1968,
U, 3, 185
Пикрит
Фиг. 1262. P—T диаграмма для пикрита BIPI. Состав
(в вес.%): SiOo - 47,88; AUO. - 9,40; FeO - 9,27;
MnO - 0,17; MgO - 24,60; CaO - 5,55; Na,0 - 1,54;
K20-0,23; F^Os - 0,ll;Ti02 - O,88;Cr2O3 -0,24;
NTO- 0,13
1 - Ж; 2 - Ол; 3 - Опир; 4 - Клпир; 5 - Пл; в - Шп; 7 - Гр
Ito Keisuke, and Kennedy G.C. Contrib. Min. Petrol.,
1968, 19. 3, 184
1 Примечание. В этой, а также в фиг. 1253, 1254,
1257, 1258 правильнее Р-Т сечение.
335
Фиг. 1254А. PT - диаграмма для щелочного базальта
I. Состав (в вес. %) SiO2 - 45,0; AJ2O3 - 14,7;
Fe2°3- 5,1; FeO _ 7,4; MnO - 0,2; MgO - 7,5;
CaO- 8,1; N^O - 4,2; K20 - 2,3; P2O5 - 1,1;
TiO2 — 3,4 и для щелочного базальта, обогащенного
оливином. П. Состав (в вес. %); SiC^ - 45,4; Д12О3 -
8,4;Fe/)3 - 2,6; FeO - 7,3; MnO - 0,2; MgO -24,6;
CaO - 5,4; Na2O - 2,2; K2O - 1,2; P2O5 - O,6;TiO2-
1.8; Cr2O3 - 0,2; NiO - 0,1.
1 . Ж; 2 - ОЛ; 3 - Клпир; 4 - Гр
Ito Keiauke, Kennedy G.C. Con trib. Min. Petrol., 1968,
19. 3, 186
Базальт-перидотит
Фиг. 1255. Фазовые отношения в области расплав -
кристаллы для сечения базальт NM5 (B) — КА64 —16
перидотит (Р) при давлениях 1 атм, 10, 20 и 30 кбар.
B3PI и BIPI - составы пикрита и толеита (см. фиг.
1252, 1253)
Ito Keiauke, Kennedy G.C. Contrib. Min. Petrol., 1968,
19, 3, 203
Оливин-Si 02-Жадеит + молекула Чермака-даопсид
Фиг. 1256. Фазовые отношения в области радплав - кристаллы
при 1 атм, 13, 22, 30 и 140 кбар в системе оливин - SiO2 -
жадеит + 'молекула Чермака' - диопсид. Нижний уровень
объема, занимаемого первично кристаллизующимися клинопи-
роксенами, ^проектирован на основание тетраэдра из вершины
диопсида
Обозначения для первичных фаз: 1 - Ол, 2 - Пл, 3 - Клпир, 4 - Опир,
5 ~ Гр. Стрелками показано предполагаемое направление понижения температуры
Ito Keiauke, Kennedy G.C.,Contrib. Min.Petrol.1968, 19, 3, 205
Фиг. 1254Б. Р—Т сечение для базальта | NlМ,5
Cohen L.H., Ito Keiauke, Kennedy G.C»
Am. J.Sci., 1967, 265, 6t 496
336
Перидотит
Гл рол ла, ли
50 100 150 ZOO
40
30
□ / вуув
aZ Ол^Опцр^лпир^р/^Ол^пигГр^
s 3 // /
И 4 // J
°O
1500
^zo
а 6
~Ол+Олир+Кл
Шп+Гр в
I
в
Ол+Опцр+Ж
1000
8/ 8 8/ 880
\Ол+ОлирП
_Ол+Олир+/ ОЛ+Олир+ I
Клпир+Шл/ Шл+Ж I
/ /у
ол+ж
? ж
500
?
Ол+А1~Опир\
AL- KnnupJ^p^/^
1\
I \f '' А
I > Ол*Олир+Клпир + Гр
• /\ /\'/ранап7оОь/й лиролил?
\j /)Ол +А I - Опир + At -Клпир +Шп
У / [Пироксенооый пиролип?
ЛОл +Опир * Клпир +Пл
р1лапиоллазо6ь/й лиролит
2а_в__я а4 /
1ZOO 1400 1600 1800 гооо °C
Фиг. 1257. Р—Т диаграмма для природного перидотита,
КА64-16
1 - стекло; 2 - Ол; 3 - Опир; 4 - Клпир; 5 - Шп; 6 - Гр
Ito Keisuke, Kennedy G.C. Am.J.Sci, 1967, 265, 6, 526
ZO 40 60
ДаОление, лОар
Фиг. 1259. Диаграмма, показывающая P—T поля различ-
ных минеральных ассоциаций для состава пиролит III
(см. фиг. 1258). Цифры 1% А]2О^, 2% А120з и т.д. по-
казывают содержание А >263 в ортопироксене при равно-
весии с гранатом в поле гранатового пиролита
Green D.H., Ringwood А.Е. Earth a Planetary Sci.,Letters,
1967, 3, 2, 155
Пиролит
Фиг. 1258., Р—Т диаграмма, построенная по эксперимен-
там с составом пиролита III. (в вес. %: SiO2 “ 45,2;
TiO2 - 0,71; А12О3 - 3,54;Сг2О3 - 0,43; Fe2O3 -
0,48; FeO - 8,04; MnO -0,14; NiO -0,20; MgO -
37,48; CaO - 3,08; Na2O - 0,57; K^0 - 0,13; атомн.
отнош. 1??^++ ~ 89,2) *Пиролит* обозначает сред-
Mg^Fe
ний недифференцированный состав верхней мантии
Обозначения для фаз, сосуществующих с жидкостью: 1 - Гр, 2 -
Клпир, 3 - Опир, 4 - Ол; для субсолилусных ассоциаций: 5 - Ол +
Опир + Клпир + Гр, 6 - Ол + Опир + Клпир, 7 - Ол + Опир + Клпир +
Шп
Green D.H., Ringwood А.Е. Earth a. Planetary Sci,Letters,
1967, 2, 153
43
337
Толеит
Гранат и омфадат
Фиг. 1260. РТ зависимость появления граната и ис-
чезновения плагиоклаза при экспериментах с кварцевым
толеитом. Первое появление граната в кварцевых толей-
100 Мн
тах с отношением —-------- ® 61 отмечается только
(M^Fe2+)
со стороны больших давлений от линии АВ. Линиями G
и F помечено первое появление граната в кварцевом
100Мя
толеите соответственно с отношением ——„ Л ° 10
(Mg*Fe2+)
и 90. Плагиоклаз отсутствует со стороны больших дав-
лений соответственно от линии CD при экспериментах
с кварцевым толеитом состава В и от линии Е при
экспериментах с кварцевым толеитом состава А. Линия
BD - приблизительно кривая солидуса кварцевого толеи-
та состава В в сухих условиях
1 - Пи + Пл; 2 - Гр + Пи + Пл; 3 - Гр + Пи + Кв. Открыты-
ми символами показаны опыты только с кварцевым толеитом A J
двойные символы указывают на присутствие стекла
Green D.H., Ringwood А. Е. Geoch. Cosm. Acta, 1967, 31
5, 798 ~
Фиг. 1261. Интерпретация результатов опытов при
30 кбар на смесях граната и омфацита из эклогита. От-
ношения в субсолидусной областй не бинарные, и грани-
ца поля твердого раствора клинопироксена основана от-
части на оценке количества граната, присутствующего
в опытах
(У Hara M.J. Camegie Inst. Washington,Year book, 1962-
1963, 6£, 76
соли
Арсенаты, ванадаты, вольфраматы
Галогениды
Ag Br,
AgCl
Фиг. 1262a. Моновариантная
PT кривая равновесия моди-
фикаций типа монацита и
шеелита для NdAsO^
Stubican V.S., Roy R.,Zs.
Krist, 1963. 119. 1/2. 95
Фиг, 12626. Моновариантная
РТ кривая равновесия моди-
фикаций типа ксенотима и
шеелита для H0VO4
Stubican V.S., Roy R.,7s.
Krist., 1963. 119, 1/2, 95
Фиг. 1264. Кривые плавлекия АяС1н AgBr. Сплошные
кривые рассчитаны по уравнению Симона
Daaton В.С. J. Appl.Phys. 1968, 4, 1800
Na WO.
2 4
Фиг. 1263. Фазовая диаграмма Na2WO4 при температу-
ре до 1200°С и давлении до 45 кбар. В правом нижнем
углу показаны фазовые отношения при низких давлени-
ях по данным Goranson R.W., К race k F.C.(J.Chem.Phys.,
1935, J, 87)
1 - данные ДТА настоящей работы; 2 - данные Goranson R.W.,
Kracek F.C. Pistorius C.W.F.T., J.Chem. Phys., 1966, 44.
12, 4534
KBr
Фиг. 1265. Кривая плавления К Вт под давлением до
36 кбар
Piatoriua C.W.F.T. J. Phys.Chem.Solids, 1965, 9,
1548
339
NaBr, NaCl, Nal, NaF
Agl
•c
Давление, кбар
C/ari S.P. Jr. Camegie Inst. Washington. Year book,
1957-58, 57, 176
Фиг. 1268. Р-Т фазовая
диаграмма Agl. Сплош-
ная кривая рассчитана
по уравнению Симона
Обозначения фаз: I — разу-
порядоченый баэопентр. куб;
II - смесь гексагонального
вюртцита и кубического суль-
фида цинка; III - г-ц куб;
JV - орторомб.
Deaeon B.C.J.Appl.
Phys., 1965, Зв: 4, 1500
Дабмиие, я fap
Фиг. 1267. Фазовая диаграмма Agl, частично по дан-
ным Bridgman P.W.(Proc. Am. Acad.arts a.Sci, 1915, 51.55-124)
Фаза '
KI
11
Структурный тип
Объемно-центрированный (В23)
Тип вюртцита (В4)
Тип сфалерита (ВЗ)
Тип галита (В1)
Орторомбический
Тип CsCl(B2)
Фиг. 1269. Кривая
плавления КI под
давлением до 41 кбар
• Pistorius C.IF.F.T.
J.Phys. Chem. Solids,
1966,26, 9, 1546
111
1У
У
Символы, используемые в Struckturberichte, v. 1,3.
Adams L.N., Davis В. L. Am. J.Sc tl965ч 263, 4, 372
Agl—Cui
Фиг. 1270. Диаграмма состояния бинарной системы
Agl-Gil при давлении до 20 кбар (при комнатной тем-
пературе); у - модификации, устойчивые при нормаль-
ном давлении; hi, 112,Ьз - модификации CuJ под дав-
лением; Н],Н2,пз - модификации Agl под давлением;
1 - по измерению объема; 2 - по измерению электро-
проводности.
Neuhaus А.Е., Hinze E.f Вег. Bunseges. Phys Chem.,
1966,10,9-10,1079
I
§
i
15
F 20 40 00 00 1OO
CUJ of NOA.% AgJ
A10
340
Фиг. 1271, Кривая плавления KF под давлением до
41 кбар
Pistorius C.W.F.T. J. Phys. Chem.Solids, 1965*
0, 1544
КС1
Фиг. 1272. Кривые плавления щелочных хлоридов
1 - LiCl;- 2-NaCl, 3 - KCI; 4 - RbCl; 5 - CsCl
C/ari&P. Jr. Camegie Inst. Washington. Year book,
1857-58. 57. 175. О константах ионизации KCI и NaCl
в зависимости от температуры и плотности см. Bar-
nes H.L., Ernst. W.G, Am J. Sci, 1963, ifil, 129-50
Фиг. 1273. Кривая плавления KCI под давлением до
41 кбар
, Pistorius C.W.F.T. J.Phys. Chem. Solids, 1965, ^6,
9, 1545
Фиг. 1274. Фазовая диаграмма KCI, показаны резуль-
таты измерении температур ударно сжатых ионных
кристаллов KCI; обозначении те же, что на фиг. 1275,
но кривая 2 по данным Альтшулер Л.В., Павловский М.Н.,
Кулешова Л.В., Симаков Г.В. (Физика твердого тела.
1963, £, 279)
Кормер С,Б,, Синицын М,В„ Кириллов Г.А,, Ур-
лин В.Д., Ж урн. эксперим. и теор. физ. 1965, 48. 4,
1040
341
фиг. 1275. Фазовая диаграмма NaCl, показаны резуль-
таты измерения температур ударно сжатых ионных кри-
сталлов NaCl
а - пре А - 4780 Arf б - пре 6280 А; 1 - якстрнмелшный уча-
сток кривой плавленая; расчетные данные: 2 - Корнер С.Б., Сжив-
пын М.В., Фунтиков А.И., Урлнн В.Д., Блинов А.В., (Журн. экпернм.
я теор. Физ. 1864. Ц, 1202). 3 - рассчитано в настоящей работе,
4 - (Lindemann F.A.,Phys.Zs., 1810, IL «»), .8 - экстраполяция
данных Clark S.,(J .Chem. Phys., I860, 3L 1526) « - рассчитано no
уравнению Симона
Кормер C,B,t Скякяыя И.В., Кириллов Г.А., Ур-
лии В.Д. Журн. эксперям. и теор. физ., 1985, $£, 4,
1040
Фиг. 1277. Фазовая диаграмма части системы CaCOp
Кривая перехода кальцит I - арагонит проходит через
точки авторов и точку К,Ф, определенную Crawford W.’A.,
Fyfe W.S.,( Science 1984, 144. 1569-70). Переход каль-
цит I - кадышт II зафиксирован Boeke H*.E.(Neues Jahrb.
Miner. u.Geologie, 1912, L 91-212) в точке В и как
метастабильный - в точках Бр. Bridgman P.W.(Am.J.Sci,
1939, 237. 7-18)
Boettcher A.L., Wyllie PJ.J. Geol., 1968, Ifi, 3, 324
Карбонаты
Фиг. 1276. P-T кривая равновесия орторомбической и
разупорядоченвой ромбоэдрической модификаций для
ВаСОз при давлении до 36 кбар
Rapoport E.t Pistorius C.W.F.T., J. Geoph. Res.,
1967, 72, 24, 6355
Фиг. 1278. А. Термическое разложение М^Оз MgO+ CO^
По полученным данным для открытой системы (1 - MgCO^;
2 - MgOCOj) проведена пунктирная кривая. Сплошной линией
показаны данные Harker R.I.,Tuttle O.F. (Am J.Sci, 1955,
253. 21)
Goldsmith J. R.,Heard H.C., J.Geol., 1961, 69
Б. Pqq^-T диаграмма термического равновесия
для реакции MgC03^^MgO+СО2
Harker R.l. Am.J .Sci, 1958, gg, 133
342
Rb2C03
Фиг. 1281. Кривые полиморфных превращений
при давлениях до 30 кбар
Pistorius C.W.F.T.tClark J.B. Zs. Phys.Chem.,
1969, 6g, H 3-6, 161
фиг. 1279. Равновесная термическая кривая реакции
разложения МпСОз«=£ МпО+СО2
1 - опыты без разложения; 2 - опыты, в которых наблюдается
некоторое разложение
Goldsmith J.R., Graf D.L., Geoch. Cosm.Acta, 1857,
11. 313
N^CO,
Фиг. 1280. Кривая плавления Na2CO3 получена
методом термического анализа
1 - плавление; 2 - кристаллизация
Koster Van Groos A.F., Wyllie P.J. Am. J .Sci,
1966, 264. 3, 243
Фиг. 1282. Р-Т кривая равновесия орторокйической и
разупорядоченной ромбоэдрической модификаций SrCO^
до 40 кбар
Rapoport Е.» Pistorius C.W.F.T. J.Geoph.Res.,1967,
72, 24, 6354
343
CaCO3-FeCO3
Фиг. 1285. Фазовые отношения в области субсолидуса
при давлении от 3604 до 1972 атм в системе СаСО.3—b'eCO^
1 - фазы, синтезированные из конечных членов; 2 - составы
фаз при распаде твердых растворов, полученных при более высоких
температурах
Rosenberg Р.Е. Am. J.Sci., 1963, 261. 687
Фиг. 1283. Фазовая диаграмма TI2CO3 при давлении
до 40 кбар
Piatorius C.W.F.T., Clark J.fl. Zs.Phys. Chem., 1969,
6g, H. 3-6, 163
CaC03-MgC03
Фиг. 1284. Влияние давления на неупорядоченность
баритокальцита
Chang L.L.F. J.Geol., 1965, 73. 2, 364
Фиг. 1286. Термическое разложение доломита в коор-
динатах log Р и I/Т. Показаны опыты, проведенные
в открытой системе (1 - нет разложения, 2 - разложе-
ние). Более ранние данные Graf D.L., Goldsmith J.R.
(Geoch.Cosm.Acta, 1955, 7, 109-128) хорошо согласуют-
ся с полученными результатами
Goldsmith J., Heard H.C. J.Geol., 1961,1, 45-74
344
Фиг. 1287. Фазовая диаграмма системы CaCOj—MgCO3
под давлением (2-15 кбар). Пунктирной линией ограни-
чена область доломита
2 - в опытах получена одна фаза; 1 - две фазы. Goldsmith G ,
Heard Н.С., J.GeoL, 1981,88.1,45-74.0р-т-Х равновесия в
системе CaCO3-MgCO3 при высоких Р и Т. см. также
Goldsmith J.R.t Newton R.C.Am.J .Sci, 1989,
180-190
Фиг. 1289. Моновариантные РсО2“Т кривые диссоци-
ации кальцита, доломита и магнезита. Треугольники по-
казывают фазы, стабильные в дивариантных полях меж-
ду Р-Т кривыми (без учета образования твердых рас-
творов)
Harker R. J., Tuttle O.F. Am. J.Sci, 1955, 253, 221
CaCO3 -SrCO3
Фиг. 1288. Границы твердых растворов в'системе
СаСОз-МвСОз в температурном интервале 500-900 С.
Давление 2040-2720 атм
Мол. 7o -+-/-o-2uJ Мол. %
Фиг. 1290. Система СаСОз—5гСОзпри 560 и 655°С
1 - исходный материал кальцит + SrCO3; 2 - исходный материал
Арагонит +SrCO3; 3 - данные Clark S.P.,(Am.Min., 1957, 42. 564);
пунктирные кривые - данные Chang L.L.,(J. Geol., 1965, 73. 346)
Fro.se £., Winkler H.G.F. Canad.Min., 1966, 5, 559
Harker R.J.,Tuttle O.F. Am.J. Sci, 1955, 2§&, 5, 279
44
345
MgCO3 -NiCO3
Фиг, 1201. Система MgCCL-NiCO- под давлением 15-
30 кбар
1 - тв. р-р никелиевого магнезита; 2 - двухфазовая ассоциация
никелиевого магнезита и магнезиального карбоната никеля
Goldsmith J.R., Northrop D.A. J.Geol., 1965, 73, 6,
824
Фиг. 1293. Система CaCO^-MgCOjCoCO^ при 750 С;
под давлением 15. кбар
1 - однофазные; 2 - двухфазные; 3 - трехфазные продукты ре-
Goldsmith J.R., Northrop D.A. J.Geol., 1965, 7£» 6,821
CaCO —CoCCL—MgCOq
О «S О
CaCO_—FeCO,-MgCO,
3 <3 <3
Фи г. 1292. Система CaCO^-MgCO^-CoCO^ при 600° под
давлением 15 кбар
1 - однофазные; 2 - двухфазные, 3 - трехфазные продукты ре-
акции. Сечение CaMg(CO 3)2-СаСо(СОз>2 показано тонким пунктиром;
более толстой пунктирной линией показаны экспериментально не
определенные поля
Goldsmith J.R., Northrop D.A., J. Geol., 1865, 73. 6,
820
CdCOj
Фиг. 1294. Система CaCO^-MgCO^-FeCO3 при 600° C
под давлением 15 кбар
1 - одна фаза; 2 - две фазы; 3 - три фазы
Goldsmith J.R., Graf D.L., Witters J., Northrop D.A.
J.Geol., 1962, 70 . 670
346
Фиг. 1295. Система СаСО j-MgCO3-FeCO3 при 800°С под
давлением 15 кбар. Пунктирная линия-верхняя гранила
CaC0o-MgC0Q-NiC0Q
ООО
Фиг. 1297. Система СаСО3— MgC03—NiCO3 при 700°
под давлением 15-20 кбар
1 - однофазные; 2 - двухфазные; 3 - трехфазные продукты ре-
акции
Goldsmith J.R., Northrop D.A. J. Geol., 1965 . 73, 6, 825
нижнего двухфазного поля при условии, что двухфазовая
ассоциация, полученная из смеси Са^оМфЕезз дей-
ствительно образуется
1 - 1 фаза; 2-2 фазы
Goldsmith J.R.> Graf D.L., Witters J., Northrop D.X.J.
Geol., 1952. 70. 666*
В работе приведены диаграммы системы СаСС^—MgCO^—
ЕеСОз при 650, 700 и 750 С под давлением 15 кбар.
CaCOQ—MgCOQ—SrCOQ
О о о
СаСО ^gCO3-MnCO3
CaCOj
100 80 60 40 20 О О 20 40 60 60 100
мдсо3,нол%
SrС0^, мол %
Фиг. 1298. Часть системы СаСО^-БгСОз-МвСОз . По-
казаны 2 плоскости призмы, в основании которой - тре-
угольник составов, а по вертикальным осям - давление.
Кружками обозначены данные Clark S.P.,(Am.Min.,
1957, 42, 564); пунктиром - данные Goldsmith J.Налич-
ное сообщение). Состав кальцита в равновесии с доло-
митом показан согласно данным Goldsmith J.H.,Heard Н.С.,
1961 (см. фиг. 1287)
Froese Е., Winkler H.G,F. Canad.Min., 1966, 8, 5, 564
MgCOj MnCOj
Фиг. 1296. Фазовые отношения в системе CaCO^-MgCO^
МпСОз пре 800°С и 10 кбар в области субсолидуса
1 - одна фаза; 2-2 фазы; 3-3 фазы. В двухфазных полях
проведены конноды
Goldsmith J.R. Graf D.L. J.Geol., 1960, 68, 3, 329*
* В работе приведены диаграммы состояния системы
СаСОз-MgCO3-МпСОзпри 500, 600,. 700 С и давлении
15 кбар.
347
Молибдаты
Na2MoO
°C
1200
1000
800
600
ЧОО
40
О
Фиг. 1301. Кривые плавления щелочных нитратов. Кривая
плавления KNO^ получена ранее (Babb S.E.Jr.,Chaney P.S.,
and Owens B.B., J.ChemPhys., 1964.141, 2210); RbNO^(llI) -
модификация ВЬМОз
Owens B.B. J.Chem. Phys., 1965, 4g, 7, 2259
10 20 30
Давление, к0ар
Фиг. 1299. Фазовая диаграмма Na2Mo04 при темпера-
турах до 1200 С и давлении до 40 кбар
Pistorius C.W.F.T., J. Chem. Phys., 1966, 4£ 12, 4535
Фиг. 1300. Кривая плавления AgN03
| - данные Pistorius C.W.F.T.(Zs.Krist., 1961, 115. 291)
Owens B.B. J.Chem. Phys., 1963, 39. 4, 1054
K№3
ДаОление, кбар
Фиг. 1302. Фазовая диаграмма KNO3
1 - опыты в капсуле АП; 2 - опыты в капсуле Al II; 3 -
данные Bridgmann P.W.(Proc.Am. Acad.Arts. Sci, 1916, 5£, 582);
4 - данные Babb S.E.и др., ( J.Chem.Phys., 1964, 41. 2210)
Rapoport E., Kennedy G.C. J.Phys.Chem.Solids, 1965,
26, 12, 1996
348
NaN03
CuSO.
4
Фиг. 1303. Фазовая диаграмма NaN03 при давлении
до 40 кбар
1 - данные Owens В.В. (см. фиг. 1301); 2 - опыты в ампулах
из AI; 3 - опыты в ампулах из Ni; 4 - опыты в стальных ампу-
лах
Rapoport Е. J.Phys. Chem. Solids.Pergamon Press.,
1966, 27, 1352
Фиг. 1305. Фазовая диаграмма C11SO4 в интервале
100-540°С до 40 кбар
Pistorius C.W.F.T. Zs. Krist., 1861, Ug, 238
MnSO.
4
Сульфаты
CoSO.
4
Фиг. 1304. Фазовая диаграмма CoSCL в интервале
350-750°С до 120 кбар
Pistorius C.W.F.T. Zs. Krist., 1961, 116. 231
Фиг. 1306. Фазовая диаграмма MnS04 в интервале
300-700°С и 0-120 кбар
Pistorius C.W.F.T. Zs. Krist., 1861, 116.226
349
Na SO.
Z 4
ZnSO,
4
Фиг. 1307. Фазовая диаграмма N82864 в интервале
температур 100 - 450 С и давлении до 45 кбар
80
^50
300
400 500 600 700*0
х/ о/ р
Фиг. 1309. Фазовая
диаграмма Z11SO4 в ин-
тервале температур
300-700°С и давлении
до 110 кбар
1 - опыты, в которых был
получен ZnSO, И; 2 - опыты,
в которых ZnSO. II не полу-
чен в продуктах4закалка;* 3 -
необратимые опыты
Pistorius С.Ж.F.T.
Zs. Krist., 1961. 116.
242
Фиг. 1308* Фазовая диаграм-
ма N1SO4 в температурном
интервале 300-750°С и дав-
лении до 140 кбар
Pistorius C.W.F.T., Zs.
Krist., 1961, 116, 235
Pistorius C.W.F.T., J.Chem. Phys., 1985, 4& 8,2896
NiSO
140
120
100
80
I
40
20
0
300 400 500 600 700 *C
Фиг. 1310. Фазовая диаграмма ZnSO4 в области темпе-
ратур 700-850 С и давлений До 20 кбар
Pistorius C.W.F.T. Zs. Krist., 1961, lift 243
350
Хроматы
Cd £rOx, CdCrOx, CdCr.£x
K9CrO
L 4
4000
2000
1000
ООО
ООО
200
100
00
VO
20
10
О
V
2
500 500 700 800 900*0
Фиг. 1313. Фазовая диаграмма К2СгО4 при давлениях
от 20 до 100 кбар и температурах от 0 до 600 С
Pistorius C.W.F.T. Zs.Phys. Chem., 1962, 119
500 500 700 800 900*0
Фиг. 1311. Диаграмма фазовых
равновесий для валового сос-
тава Cd^CrO^A), CdCrOx(B)
CdCr2°/B>
Muller О., Roy R., Wl 'te W.B.
J.Am.Ceram. Soc., 1968.51. 12,
696
Фиг. 1312.P-T кривая равновесия CrO4иp«K2CrO4
при давлении до 20 кбар
Pistorius C.W.F.T. Zs. Phys. Chem., 1962, 35. 116
Фиг. 1314. Фазовая диаграмма K2Cr^Oy в интерва-
ле давлений от 0 до 100 кбар и температур от 100 до
650 С. Pistorius ( JCF.T., Zs.Phys. Chem., 1962, 35,119
351
Фиг. 1315. Фазовая
диаграмма Na2CrO4
при давлении до 45 кбар
и температуре от 250
до 1250 С.
Pistorius C.W.F.T.
J.Chem. Phys., 1965,
43, 8, 2897
MgCrOx,MgC^Ox
чооо
2000
I woo
600
- ООО
r? 200
£ 100
* 60
§• 00
§ 2
4 1
500 600 700 800 9DOT
Фиг. 1316. Диаграмма фазовых равновесий для вало-
вого состава MgCrOx (А) и MgCr2Ox (Б), Mul-
ler 0., Roy R., White W.B., J. Am. Ceram. Soc., 1968, 51,
12,695
NiCrOx, NiCr2Ox
500 600 700 800 BOOT
Фиг. 1317. Диаграмма фазовых равновесий для вало-
вого состава NiCrOx (А) и NiCisOx(B). Muller 0.,
Roy R., White W.B., J. Am. Ceram. Soc., 1968, y, 12
500 600 700 800 900T
352
СИСТЕМЫ С ЛЕТУЧИМИ КОМПОНЕНТАМИ ПОД ДАВЛЕНИЕМ
ФАЗОВЫЕ ДИАГРАММЫ ЛЕТУЧИХ КОМПОНЕНТОВ
со2
Фиг. 1318. Диаграмма состояния (схематическая) ар-
гона.
ТО - кривая сублимации твердого аргона; ТМ - кривая плавления;
ТС - кривая испарения; Т - тройная точка, где давление и темпера-
тура равны -189,22°С и 0,68 атм; С - критическая точка; параметры
ее -122,3°С и 48,3 атм. Изменение температуры и давления вдоль кри-
вой плавления ТМ дано в таблице:
Температура, °C Давление, атм
-113 3850
-73 6250
-43 8000
Hallett А.С.Н. Argon, helium and the rare gases, 1961, L 322
-80 -80-40-20 0 20 40 SO BOIDOSOSO °C
Фиг. 1319. Фазовая диаграмма С02»
для наглядности кривая сублимации по-
казана в правой части диаграммы в
увеличенном масштабе.
Cramer F. Chem. Ing. Tech., 1955, 27» 491
Фиг. 1318Аъ Изотермические (150°С и 500°С) кривые
сжимаемости аргона. Более тонкой линией показаны дан-
ные Michels А. и np.,(Physica 1949, 1Д, 627-633), круж-
ками и более толстой линией нанесены данные настоящей
работы.
Greenwood H.J. J. Geqph. Res.,1961, gg, 3935. О мольных
объемах Ar при P 10 ОСЮ атм и Т до 400°С см. Поляков ЕВ.,
ЦкклисД.С. Журн. Физ. Химии, 1967, XVI, вып. 9
45
353
Фиг. 1320. Кривая плавления СО2 при давлении до
12000 кг/см^
1 — пАичмя Bridgmann P.W.,(Phys.Rev. 1914, 3, 126, 153); 2 —
аанные Michels A.,Blaisse B.Jiojogschagen J.,(Physica, 1942, .£,
865); 3 - данные Tammann G,(Wied.Ann, 1899, fig, 572).
Cramer F„ Chem. Ingin. Technology, 1955, JJ, 487
Фиг. 1322. Диаграмма ( Py)~ p углекислоты;
П-18,264 кгм/кг°С RT
1 - аанные авторов настоящей работы; 2 - аанные Michels А.,
(Proc. Roy Soc.A.,1935, Xgg,201); 3 - аанные MacConnack К.Е.,
Schneider W.G., (J .Chem. Phys., 1960, 18, 1269); 4 - аанные Ken-
nedy G.C.,(Am J. Sci, 1954, Jgg, 225)
Врпаловпч МД.'Аллу*** BJhТеплоэнергетика, 1059,
11, 64
Z00 300 400 500 600
С02 =1 бар.
Результаты даны в сравнении с литературными данными: 1 -
Lamure J„ (C.R. 1953, 236, 926-927); 2 - Peretti Е.А., (J. Am. Ceram.
Soc., 1957,4Q, 171-173); 3 - Gam P.D., Kessler J.E., (Ann.Chem.,
1960, 32, 1563-1565); 4 - Warne S.St., Bayliss R., (AmJiin., 1962, £_>
1011.-23); 5 - Glasner A., Hodara I., (Bull. Res. Council Israel, 1958,
1A, 66-73)
Griaate D.A., Vhite V.B. Am. Min., 1954, 49, 9/10, 1193
1323. Коэффициенты летучести COj в темпера-
турном интервале 50-200°С и давления до 100 атм
1 н 2 - данные Mac Connack К.Е., Schneider W.G.,(J.Chem. Phys.,
1950, Jg, 1269); 3 н 4 - аанные Kennedy G.C., (Am J.Sci, 1954, 252.
225).
Segnit E.R., Holland H.D., Bia car di C,G., Geoch. Cosm. Acta,
1962, 2fi* 1320. О термодинамических свойствах C02
в интервале 20-1000°С и 10-600 бар см. Карпов И.К.,
Каяшп 0.А. Геология рудных м-ний, 1968, 1
354
Давление, атм
H20
Фиг. 1326. Изобарическая зависимость удельного объема
воды от температуры. Числа у кривых - давления в барах.
Kennedy G.C. Am. J. Sci., 1950, 248, 7 , 548
Фиг. 1324. Изотермы сжимаемости водорода при 200°С
V- мольный объем; Т - температура; Р - давление; R - га-
зовая постоянная. 1 - Ama gat ЕЛ. (1893) 200,25°С; 2 -Holbom L.
(1924), 200°С; 3 -Bartlett и др. (1928), 198,9°С; 4 -Wiebe R.
(1938), 200°С; 5 - уравнение Shaw H.R., Wooes D.R., (Am. J^ci,1964,
2fi£. 918-929), 200°C; 8 - данные настоящей работы, 200°C.
Preanall D.C. Camegie Inst. Washington. Year book,
1965-66, 65, 417
200 400 000 000 /ООО /200 /400 /ООО /ООО
Давление, атм
Фиг. 1325. Изотерма сжимаемости водорода при 300°С
1 -Bartlett и др. (1928), 299,1°С; 2 -Wiebe R.(1938), 300°С;
3 -' уравнение Shaw H.R. Wooes D.R.,(Am.J.Sci,1984, 282. 918-929),
Э00°С; 4 - данные настоящего исследования.
Preanall D.C. Camegie Inst. Washington. Year book,
1965-66,65, 417
Фиг. 1327. Кривые удельных объемов воды в координатах
Р-Т
Kennedy G.C. Am.J.Sci., 1950, 248. 7. 549. Об удельных
объемах Н20 см. Burnham C.W., Holloway J.R., Davia N.F.
Thermodynamic properties of water to 1000PC and 10000 bars.
The geological Society of America, Special Paper, number 132
См. также Вукаловчч Н.П. и др. Теплоэнергетика, 1962,
9, 1, 49-51; 1981, 8, 10, 79, 88; 1965. 12, 9. 67-71; 1968,
13, 3, 77-82
355
н20
Фиг. 1328. Фазовая диаграмма воды в области образования
новых твердых фаз при высоких давлениях. Крестики - оп-
ределения кривой плавления льда VI , выполненные в 1912.
(Bridgman P.W., Proc. Am. Acad., 1912, tf, 585)
Bridgman P.W. J. Chem. Phys., 1937, §, 965 См. также
фиг. 1351
Фиг* 1329. Удельные объемы воды в области, близ-
кой к критической точке, по экспериментальным данным.
Фиг. 1328А. Р-Т диаграмма воды в интервале 50-450°С и
давлениях до 200 кбар.
Pistorius C.W.F.T., Pistorius If.С. Blakey J. P., AdmiraalL.J.
J.Chem. Physics, 1963, 3$, 600
Ривкин С.Л., Трояновская Г .В. Теплоэнергетика, 1964,
Ц» Ю» 72* См. также Nowak E.C.,Grosh R.J., Liley Р.Е.
J.Heat Transfer, 1961, 83, 10
0 2 4 6 В 10
ДаВлеиие, кВар
Фиг. 1330. Расчетные величины коэффициента лету-
чести Н20
Anderson G.M. Geoch.Cosm. Acta, 1964, 28, 5, 714
356
нг°
2
Jg\-------1-------1------1-------1------1-------1------L
О 700 200 300 400 300 000 700 °C
Фиг» 1331» Ионное произведение Kw воды в зависи-
мости от температуры, плотности и давления. Kw =
= (а0Н -МаН+)» активности выражены в единицах мо-
ляльности (по данным Barnes H.L., Kullerud G.,Econ.
Geol., 1961, 56, 648-688)
70000
9000
0000
* 7000
§ 6000
I 5000
4000
3000
zooo
1000
0 50 100 150 ZOO Z50
PVt лат/моль
Фиг. 1333. Сжимаемость кислорода
1 - литературные данные
Цикмс Д.С., Кумюова АЛ. ЖФХ, 1965, 39. 7, 1754
Hames H.L., Ernst W.G. Am.J.Sci, 1963, 221» 129-150.
О ионизации H?0 под давлением при комнатной тем-
пературе см. Xown D.A., Thirsk H.R.f Lord Wynne—J ones
Trans.Faraday Soc, 1968, gj. p.8, 548, 2073, при тем-
пературах до 1000°C и P до 100 кбар - см.
Holzapfel Ж., Franck E.U. Ber.Bunsenges. Phys.Chem.,
1966, Zfl, 9-10, 1105-12
Аг-Н2О
Фиг. 1332. Кривая плавления азота по литературным
данным.
Din F. Termodynamic functions of gases, 1961,& 94
Фиг. 1334. Летучесть 1^0 в системе Ь^О—Аг при 500°С
Greenwood Н .J. J. Geoph. Res. 1961, 66, 3939
357
Ar— H20
2000
1800
1600
ZW
1200
1000
. 800
Jj 600
W
200
ip
Ht0
Ofi 0,4
Мол. боля H20
Лг
Фиг. 1337. Критическая кривая в системе Аг-Н2О
D - двойная гомогенная точка »
Цкклке Д.С.,Прохоров В.М.Журн. Физ, Химии, 1966,
40. 9, 2336
Фиг. 1335. Изоплеты постоянной молярной плотности в
системе Н20—Аг при постоянной температуре 500<>С
Greenwood Н.J. J. Geoph. Res., 1961, 66, 3935
Ar-H2O,N2-H2O, СН^О
О v 02 ЦЗ Op H5 0.8 0,7 op OP ip
Мол. доля аргона
Фиг. 1336. Равновесия жидкость - газ и газ-
газ в системе Аг-Н2О
1 - 350; 2 - 360; 3 - 360; 4 - 385; 5 - 400°С
Дкклке Д.С„ Прохоров Я.М.Журн. Физ. Химин.
1966, 40. 9, 2335
Фиг. 1338. Кривые гидратов Аг, N2, СН*
Marshall D.R., Shozaburo К obey ahi R,
Am. Inst. Chem. EngrsJ. 1964, IQ, 2, 204
.358
Молярный процент,^
Фиг. 1339. Общая диаграмма системы Н2О-СО2
Салимин С.Д., Геохимия, 1959, 3, 241
Фиг, 1341. Схематическая проекция системы Н2О-СО2
Н - гидраты СО^; S - твердый СО2; Л - лед; 1 - 1^0;
2 -СО2
Takenouchi S., Kennedy G,C. Am.J.Sci., 1964, 262,
1055-74
Мол. % C02
Фиг. 1342. Изобары с критической кривой для системы
н2о-со2
Takenouchi S.t Kennedy G.C. Am. J. Sci, 1964,262,9,1062
Фиг, 1340. Изотермы состава газовой и жидкой фаз в
системе Н2О-СО<
Т akenouchi S., Kennedy G.C. Am. J.Sci., 1964, 262,1061
359
Фиг, 1343. Р-Т проекция критической кривой в системе
Н2О-СО2
Takenouchi S.t Kennedy G.C. Am. J. Sci, 1964, 262. 9»
1069
Фиг. 1345. P-T-X диаграмма системы Н20—С02 (участка-
ми дана схематично). Жирными линиями показаны поверх-
ности равной летучести С02
Walter L.S. Am. J. Sci, 1963, 261, 2, 155
Фиг. 1346. Изотермическая (650°) зависимость сжимаемо-
сти смеси СО9+Н0О от состава. Цифры у кривых - давление
(бар)
Greenwood Н.J. Am. J.Sci, 1969, Shairer Vol., 267А. 207
Фиг. 1344. Изотермы равновесных сос-
тавов в системе С02—Н20
Von К. Todheide, Franck E.U. Вег. Dtsch.
Keram.Ges., 1964, <1, H2, 62
360
Фиг. 1347. Изотермическая (450°С) зависимость сжимаемо-
сти смесей СО2 + Н2О от состава. Цифры у кривых - давление
(бары)
Greenwood H.J. Am. J. Sci, 1969, 26ZA,2O2
Фиг. 1349. Давление при диссоциации гидрата
Н2О при низких давлениях. Точками обозначены дан-
ные Villard М.Р., (Ann. Chem. Phys., 1897, Ц. 7, 353-
360).H—СО2’5<^ H2Q Г - газ, Л - лед, Ж| - жидкость,
почти чистый С0£,Ж2 - жидкость, почти чистая Н~ О-
•QpQ2 тРо®ные точки. 2
Takenouchi S., Kennedy G.C. J. Geol. 1965, 73,2,384
Фиг. 1348. Изотермы растворимости CCL в воле под
давлением
Зе льве некий Я.Д. Жури. хим. промышленности 1937,
И» 1253
Takenouchi S., Kennedy G.C. J. Geol. 1965, S,2, 387
I 46
361
Фиг. 1351. Фазовая диаграмма Н20, СО2иСО2 «5 — Н20
кр.т. - критическая точка; к.п. - кривая плавления; т.т. -
тройная точка, остальное - как на фиг. 1349. Римскими цифрами
обозначенье поля устойчивости модификаций льда
Фиг. 1353. Равновесие
газ-газ и жидкость-газ
в . системе Не-СС^
Циклис Д,С„ Рояя Л.А.
Успехи Химии, 1967, вып.5,
878
Takenoychi S., Kennedy G.C., J.Geol., 1965,73' 2, 387
NH3-H2O
О QJ О? QJ 0,4 Of Ц6 0,7 ЦВ Ц9 1Р Ц
Мол. доля аммиака
Фиг. 1352. Изобарическое (100, 500, 1000, 1400 бар)
изменение моляльного объема смеси жидкий аммиак -
вода в зависимости от мольной доли аммиака при 0°С
Sourirajan S., Kennedy G.C.. J. Geoph. Res. 1963, fifl,
13, 4154
Фиг. 1354. Критическая кри-
вая в системе гелий-двуокись
углерода
Цаяме Д.С.,Роая Л.Л .Успе-
хи химии, 1967, вып. 5, 876
362
363
nh3-n2
Фиг. 1359. Критическая кривая в системе аммиак-аэот
Цкхлмс. Д.С .,Ро9тЛ,А. Успехи химии, 1967, 36. вып.5,
877
t^l3^’,rVaCTBOP“MOCTbC°2 в Р«створе. соаержащем
к.т. - критическая точка
Takenouchi Kennedy G.C, Am. J. Sci, 1965. 263.5. 449
Фиг. 1361. Растворимость С0« в растворе, содержащем
20 вес.% NaCl
Takenouchi S., Kennedy G.C. Am. J.Sci, 1965. 263. 5. 450
364
СИСТЕМЫ, ВКЛЮЧАЮЩИЕ САМОРОДНЫЕ ЭЛЕМЕНТЫ, ПОД ДАВЛЕНИЕМ Н2,О2, И 0,+Н,0
Фиг» 1362» Изотермы в системе Pd +водород. Линейные
низкотемпературные изотермы определены Перминовым П.С.
и др», (ДАН СССР, 1952, §4, 749)
Levine P.L., Waale К.Е. Trans. Faraday Soc, 1960,56» 360
Фиг. 1364. Кривые равновесия реакций восстановле-
ния минералов железа окисью углерода (СО). В левой
части изображена диаграмма tx (температура - сос-
тав равновесного газа); справа - диаграмма tp (тем-
пература - общее давление газа) с кривыми равнове-
сия четырех фаз (двух соединений железа, газовой
смеси и твердого углерода), соответствующего точ-
кам пересечения кривых левой диаграммы с изобара-
ми реакции Будуара.
Fe-Ni-H2-H2O
Беяехаин А,Г, Иэв. АН СССР, сер. геол. 1949, № 3
-Jt0 -
-12\----1---I----1--1----l----1---1----
300 400 500 690 700 ODD 900 JOOO T
Фиг. 1363. Log [Ph2q/Ph^для ряда сплавов Fe-Ni в рав-
новесии с вюститом или магнетитом
О/sen Е. Am. J. Sci, 1963» 261» 10, 954
а —
Фиг. 1365. Плавление серебра под давлением кисло-
рода
1 - остановки на термических кривых по данным Allen N.P.,
(J. Inst .Met. 193Й, 317); 2 - остановки на термических кри-
вых по данным настоящей работы; 3 - плавление полоски Agno
данным настоящей работы
Baker E.H.t Johnstone l.K. Nature, 1965» 205» 65
365
с-о2
100 200 300 400 500 №0 700 800 300 /ООО °C
Фиг. 1366. Летучесть кислорода(fQj) в буферной
смеси графит + газ как функция температуры для выб-
ранных величин Ргаз = РС02+РсО- Кривые графит + газ
показаны сплошными линиями; величины Ргаз приве-
дены в скобках. Пунктирными кривыми показаны ве-
личины Для Других буферных смесей (Eugster Н.Р.,
Wones D.R., ^.Petrology, 1962» i, 82-125), рассчитан-
ных, при Ргаз=1 бар, влияние общего давления на эту
группу буферов незначительно
Гт-Мт (гематит + магнетит); Ni—NiO (никель+бунзенит), Кв-
Фт-Мт (кварц+фаялит + магнетит); Мт-Fe (магнетит + железо);
Мт-Вюс (магнетит+вюстит); Вюс- Fe(вюстит + железо)
French В.У,, Eugster Н.Р. J. Geoph. Res. 1965» 70> 6»
1533
Ж Ж 500 700 .300'0
Фиг. 1368. Изобарическое сечение поля гт.б.т.^^,
сидерит* газ при Робщ=1000 бар. В' этом сечении оп-
ределены инвариантные точки Си+Гт+Мт+Г и Си+Мт+
+ ГФт+Г.
Frenc* В.И., Eugster Н.Р. J. Geoph. Res., 1965 , 70. 6,1536
Фиг. 136У.А. Реакция 2MnO3= 2Mn3O4 + 1 /202
Б. Реакция 2МпО2= Мп2О3+ 1/2О2
л*ПпзЬет* С" Ruatwa R°y- J- Am. Ceram. Soc.,
1960,43, 12,620 ’
Фиг. 1367. Летучесть окиси углерода (fCQ) как функ-
ция температуры в атмосфере СО2+СО для нескольких
кислородных буферных смесей. Данные для графитового .
буфера рассчитаны в данной работе; другие данные -
по Eugster Н.Р.,Wones D.R. (J.Petrology 1962, £, 82-
125). Обозначения буферных смесей см. фиг. 1366
French В.М., Eugster Н.Р. J. Geoph. Res. 1965, 70, 6,
366
Mn-O—H20
Fe—0-SiO 2
Фиг. 1372. Т - fo2 проекция части системы Fe-O—SiO2,
параллельная оси давлений. Летучесть в точках 1,
2 и наклоны кривых реакций Фт+5Ю2 = Фс +Мт и Фт+Фс=
= SiO2+Feрассчитаны поданным Eugster Н.Р., Wones D.R.
(J.of Petrology 1962, 90). Наклоны других кривых
подразумеваются. Инвариантная поверхность Фт- SiO2 -Фс
(разлинована на диаграмме) строго параллельна оси
fo2; каждая линия-пересечение изобарических разре-
зов с поверхностьюФт-8Ю2—Фев пространстве Р—Т—
Lindsley D.H., Speidel D.H. Nafziger R.H.A^. J. Sci,
1968. 266. 5. 355
Фиг. 1370. А. Кривая реакции пирохроит-манганозит.
1 - Мп(ОН)2; 2 - МпО
Б. Кривая реакции манганит-биксбиит.
1 — Мп2ОуН2О, 2 — Мп2О^
К tins berg С., Roy R. Am. Min., 1959, 44, 7/8, 829
Fe-0-Si02
Фиг. 1371. P-T проекция части системы Fe—O-SiO2
А. Схематическое изображение составов фаз в точке Фт-$Ю2~Фс
-Fe_ ж(1) в сечении Fe—Рв20з—SiC^
В. Схематическое изображение составов фаз в точке Фт-51О9-Фс-
-Фо-Мт-ж (2).
С. Р-Т проекции кривых, исходящих из точек (1) и (2). Кри-
вая Фт+$(02 =Фс на этой проекции вырождена и в действительности
состоит из 3 наложенных кривых. Кривые, показанные длинным пунк-
тиром, экспериментально не определены.
Lindsley D.H., Speidel D.H., Nafziger R.H. Am. J. Sci,
1968 , 266, 5,352
367
Fe-MgO-O-SiO2
Фиг. 1373. Фазовые соотношения в части системы Fe—
—О—MgO—Si02 под °бщим давлением 15 кбар.
А - схематическое изображение фазовых равновесий при плав-
лении; Б - некоторые пограничные кривые в координатах 1/Т -
log foj. Инвариантные точки при Р©бш. ”15 кбар отмечены штрихом
(в отличие от аналогичных точек пли 1 атм). Большими буквами
показаны твердые фазы в равновесии с четверной жидкостью; ма-
ленькими буквами - твердые фазы в системе Fe-O—SiO2. Заштри-
хована область Фт-S iO?—Fe.
Speidel D.H., Nafziger R.H. Am. J. Sci, 1968, 266, 5, 372
V 1 1
—1—10*
6 тек)
Фиг. 1374. Фазовая диаграмма части системы
Fe-O-MgO—SiO^ при общем давлении немного вы-
ше 17,5 кбар. Диаграмма аналогична изображен-
ной на фиг. 1373
Обозначения, как на фнг. 1373
Speidel D.H., Nafziger R.H. Am. J. Sci, 1968,266,
5,377
368
Fe-H2O-K2O-O2_SiO2
Фиг. 1375. Робщ.”Т- fo2 Диаграмма^фазовых рав-
новесий, включающих феррианнит К Fe32 Fe+^Si 0 (ОН)2
Wones D.R. Am. J.’Sci, 1963, 261, 6, 594
Фиг. 1377. Изобарическая (Робщ = 2070 бар) Т- f02
диаграмма фазовых отношений для валового соста-
ва аннит + 3 кварц (+пар);Н, D,N,E - эксперименталь-
ные точки. Показаны кривые давления кислорода бу-
феров КВ—Фт— Fe,Bioc— Fe, Мт—Fe, Мт-Вюс, Кв-^Фт—
MT,Ni—NiO, Рр-Мт
Eugster Н.Р., Wones D.R. J. Petrology, 1962,2, Ю5
Al 0Fe-H„O—K,0—O„-SiO,
A О A A • A A
Фиг. 1376. Робщ-Т fQg диаграмма фазовых отно-
шений, включающих аннит (+пар). Тонкими линия-
ми показано давление кислорода буферных смесей
Eugater Н.Р. Wones D.R., J. of Petrology, 1962, 3,
Фиг. 1378. Кривые реакции аннит^гКс+Лц+Фт + П (1);
аннит+квч±Сан+Фт+П (2), кв-фт-мт буфер, и (3), мт-
вюс, мт-Fe буфер) в координатах log летучести- Н20-
обратная температура. Вюс-Fe, Мт-Fe, кв-фт-Fe,
кв-фт-мт- кривые давления 02 для соответствующих
буферов при общем давлении 2070 и 1035 бар
Eugater Н.Р., Wones D.R. J. Petrology, 1962,3, ИЗ
47
369
Alo0-Fe-H-K0-Na0-0-Si0
£ о 4 &
°C
800
700
700
050
600
Foto-Zxbp
п.шп+фт+лц*П
-гкшп*(рт+не(р+П
4/7*" п.шп+би
ir
1
I 2плт*ит*П
2п.шп+би
< 2пшп+мт*Л
V Л
20 *0 SO80
100
20 40 60 80
уП.ШП ^яя 9,
100
Фиг. 1379. Данные по равновесию биотит - полевой
Фиг. 1380. Данные по равновесию биотит - полевой
_ п.шп.
шпат в проекции Т-Х q Для системы
KA)S3O8 -NaA)Si3O8 -SiO2 - Fe-О - Н-Р^г кбар
1 - опыты при летучести кислорода графит - метанового буфера;
2 - кварц-фаялит-магнетитового; 3 -Ni-NiO. Зачерненные символы
обозначают стабильность биотита; светлые - показывают, что ста-
бильны безводные Фазы; зачерненные наполовину - опыты на реакци-
онной поверхности. Крестиками отмечены пересечения графит-метаново-
1Ю буфера с изобарической моновариантной кривой. Контуры фикси-
рованных Гц (C2-A-B-P,D-D'-D" ,N-N'-N*) на изобарических ди-
вариантных поверхностях суммируют данные. Линия сольвуса щелоч-
ных полевых шпатов показана по данным Orville P.M.AmJ^ci.,
1963, 261.201-37). Координаты С2 и N из статьи Eugster, Wones (J.
Petrology, 1962, 3. 82-125). Пунктиром показаны линии, соединяю-
щие пары сосуществующих твердых растворов полевых шпатов
1 - опыты при летучести 02 графит-метанового буфера; 2 -
кварц-фаялит-магнетитового; 3 - Ni-NiO—буфера; 4 - магнетит-
Fe^O^—Fe-буфера. Зачерненные символы обозначают стабильность
биотита, полые символы - стабильность безводной фазы; наполо-
вину зачерненные символы показывают опыты на реакционной
поверхности
RutherfordM.J. J. Petrology, 1969, 10, 3, 401
Rutherford M.J. J.Petrology, 1969,10, 3, 393
Фиг. 1381. log “^"^KAlSi^Og Диаграмма рав-
новесий биотит-полевые шпаты
Реакции: 1 - П.шп. + Биз±П.шп. + Мт+ П; 2 - П.шп. + БизвП.шп. +
Фт+Лц+П; 3 - П.шп. + Бич*П.шп. + Фт+Ж + П; 4 - Би^сП.шп. + Фт+
Неф+П. Реакции 1-4 изучены с использованием составов в системе
КAISi^Og-NaAISijOg-Fe-O-H.C/.C^M.P. - изобарические инвариант-
ные точки. Реакции Мт + Сан^Фт + Лц + П (6) и Аннит^вМт + Лц+
Фт + П (7) показаны по Eugster Н.Р., Wones D.R. (J. Petrology,
1U62, 3, 82-125). Робш.в2 кбар
Rutherford U.J., J. Petrology, 1969, 10, 3, 395
370
Al,0 „-Fe- H,0 -K„O-NaO _0, -SiO, A.12°3-Fe ~H2 0 “K2°- MgO-О,-SiOt
Z о *• Z Z L Z
Фиг. 1383. Влияние возрастающего парциального дав-
ления кислорода при температуре 700°С- и давлении во-
дяного пара 2048 бар в системе ^O’A^C^’bSiC^—MgO-
F е—О2 —Н2
Давление кислорода: а - 1020,5 g^ g _ jq-16,8 g^,
в - 10-И ,3 бар, г _ н)-9,9 g^
Ж ones D.R., Eugster Н. Р. Camegie Inst. Washington.
Year book, 1958-1959,52, 130
SiO2-Fe- 0-H
Rutherford M. J,t J. Petrology, 1969, 10» 3, 402
Al20;l-Fe - H20-K2O-Mg0-02-SiO2
Фиг. 1384. Фазовые отношения, включающие биотит, в
сечении флогопит - аннит при постоянном давлении
(робщ.вРн2О+рН2 “2000 бар). Фл (Гт, Сан) - геомет-
рическое место точек всех флогопитов в равновесии с
гематитом и санидином и т.д. Показаны только поверх-
ности, представляющие слюды в равновесии с другими фа
зами (I-V).
Титоск А.С., Eugster И.Р. Camegie Inst. Washington.
Year book, 1957-1958, 57, 192
371
СИСТЕМЫ ИЗ ОКИСЛОВ ПОД ДАВЛЕНИЕМ Н2О ИЛИ Н2О
ПРИ ЗАДАННОМ ПАРЦИАЛЬНОМ ДАВЛЕНИИ О2(Н2)
Двухкомпонентные
Фиг. 1385. Поле равновесия и поле кристаллизации
диаспора и корунда.
Фиг. 1387. Диаграмма фазовых равновесий в систе-
ме А120^—Н20
Ervin G., Osborn E»F, J.Geol., 1951, 59» 381—394
Исходные вещества
1 - Гйббсит »
2 - Гйббсит ------
3 - Корунд —»
4 - Диаспор ---—
Продукты
корунд
диаспор
диаспор
корунд
Matsushima S., Kennedy G.C., Aketta J,t Hay garth J.
Am J.Sci.. 1967. 265. 1, 34. См. также Кеплеф G.C.,
Am. J.Sci, 1959, 257,8, 565, 568
Фиг. 1386. Система A^O^-^O по данным Torkar К.,
Krischner H., (Mitt. Mh Chem. 1960,91, 766)
Neuhaus А.л Heide H. Ber. Dtsch. Keram. Ges., 1965,
42, 5, 172
Фиг. 1388.P-T кривая реакции Ca(OH)2^*CaO+H2O
(гидратация - дегидратация). Часть кривой ниже4 кбар -
по данным Majumdar A.J., Roy R., (Am.Ceram. Soc. J*,
1956, 434-442)
1 - опыты, дающие только портландит; 2 - опыты, в которых
имела место дегидратация.
Pistorius C.W.F.T. Am.J.Sci., 1963, 261. 1, 81
372
CaO-H2O
CdO-H2O
Фиг. 1389. Изобарическая равновесная диаграмма сис-
темы СаО—Н2О при 1000 бар. Пар - почти чистая Н20,
но эта часть диаграммы. искажена для того, чтобы по-
казать фазовые отношения
Wyllie P.J.t Tmttle O.F. J. Petrology, 1960, 1, 16
Фиг. 1391. P-T равновесная диаграмма системы CdO—Н20
1 - CdfOH)?; 2 -CdO; 3 - хорошо закристаллизованные октаэд-
ры CdO
Glasser L.S.D., Roy R. J. Inorg. Nucl. Chem., 1961, 17,
1-2,100
Фиг. 1390. PT проекциямоновариантных равновесий в
системе СаО—Н2О. Четыре моновариантные кривые пере-
секаются в инвариантной точке Q1 . Фазовые отношения
вблизи инвариантной точки схематически представлены
в увеличенном виде на вставке. Кривая Са(ОН)2 = Ж с
вырожденной моновариантностью исходит из сингулярной
точки М. Эта кривая почти совпадает с кривой СаО+.
+Са(0Н)2+Ж
Fe2O3-H2O
2009
Ч
1509
- а о« №^п ,,
- 0 в/" °«'7 о „
"th
— .л FeO* ОН .л?
*Л ’ДЛ
I I I 1 I 1 I I I I i 1 I 1 I I I I I I I I
О W 1000 1500 2000
атм
Фиг. 1392. А. Температура разложения гетита в кон-
такте с водным раствором при 1-2 атм в зависимости
от кислотности-щелочности раствора (по литературным
данным и экстраполяции данных авторов в область низ-
ких давлений).
Б. Пограничная кривая поля стабильности гематит -
гетит в 0,1 мол. растворе NaOH в зависимости от тем-
пературы и давления
Smith F.G., Kidd D. J.Am. Min., 1949, 34, 403-413
Wyllie P.J., Tuttle O.F. J. Petrology, I960, 1, 32
373
Фиг. 1393. Р-Т кривая реакции периклаз* вода -обру-
сит. Пунктирная линия соотвествует кривой дегидра-
тации брусита
Исходные материалы: 1 -MgO, химически чистый тонко измель-
ченный, 2 -MgCO3, нагретый при 1400°С в течение 4,5 часов, 3 -
MgCO3, нагретый при 900°С в течение 2 часов, 4 -Mg(OH)2, нагре-
тый при 600°С в течение 5 часов, 5 - MgO из прокаленного метал-
лического Mg. Продукты: светлые символы - брусит, заполненные
символы - периклаз
Meyer J.V., Julie Chi-Sun rant. Am. j. Sci., 1962, 2£P,
9, 716
Фиг. 1394. P-T кривая иля реакции брусит«периклаз+Н20
1 - брусит, 2 - периклаз ( + брусит, образующийся при закалке);
данные Roy R., Roy D.M., Osborn E.F.(Am.JjSci,1953, 251» 337-51);
t - закалка, 3 - брусит, 4 - периклаз (в смеси с бруситом, образую-
щимся при закалке), 5 - периклаз (большие кристаллы неразрушен-
ные иля слегка разрушенные) ( данные авторов; t-закалка); 6 -
брусит (или разложившийся брусит, обезвоженный при закалке), 7 -
периклаз (данные авторов; Р—t закалка)
Rar DM., Rar R. Am. J. Sci., 1957, 255.8, 579
Фиг. 1395. Изобарические кривые»растворимости
Kermedr G.C. Econ.Geol., 1950, |J,7, 639
Sl0t-H20
$1,4 $ $ 2fl 2$ 2fi 2fi 2f Sfl 3$ # 3,6 3JS 4fl
Удельный объем Ht0, см*/»
Фиг. 1396. Изотермы растворимости в системе
SiO2_H2O
Kennedy G.C. Econ. Geol., 1950, 45, 7, 644
374
SiO 2-H2O
H20 Мол. % SiOf SIO2
Фиг, 1397. Система SiC^—показывающая верхнюю
и нижнюю трехфазовые области
Kennedy G.C., W аз з er burg G.J., Heard H.C,,Newt on R.C.
Am. J.Sci., 1962. 260,7. 516
Фиг. 1399. Состав вдоль верхней трехфазной кривой
в системе SiC^-I^O
Kennedy G.C., W аз з er burg G.J,, Heard H.C. Newton R.C.
Am. J. Sci., 1962, 260, 7 , 511
Фиг. 1398. Плавление Si02 под давлением H2O, или
Р-Т проекция моновариантной равновесной кривой в сис-
теме Si02~Н20
1 - ж; 2 - кв; 3 - тр.
Kennedy G.C., Wasser burg G.J., Heard Н.С., Newton R.C.
Am. J. Sci, 1962.260.7. 503
Фиг. 1400. Проекция температура - состав верхней
трехфазной области в системе SiO2-H2O
Kennedy G.C., Waeserburg GJ; Heard H.C., Newton H.C.
Am.J. Sci., 1962, 260. 7, 515
375
SiO2-H2O
Давление, кбар
Фиг, 1401, Изотермическая растворимость кварца в
воде в зависимости от давления. Зачерненные кружки
обозначают опыты с падением давления
Anderson G,M>i Bumham СAm, J.Sci., 1965* 263» 6»
494-512
Фиг. 1403, Зависимость растворимости кварца от тем-
пературы при давлениях между равновесным давлением
Н20 и давлением 4000 бар. Цифры у кривых - давленир
в барах
1 - данные Kennedy G.C.,(Econ.Geol., 1950, 4§, 7, 629); 2 - дан-
ные Хитарова Н.И. (Геохимия, 1956, № 1, 55-61); 3 - данные Morey G.W.,
Hesselgesser J.M.(Econ.Geol., 1951, 46,821-835); 4*- данные автора
Weill D.F., Fyfe W.S. Geoch.Cosm., Acta, 1964, 28, 8, 1250
Фиг. 1402. Растворимость кварца в воде в координа-
тах log (растворимости)-1/Т°К. Числа у кривых -
давление,бары.
1 данные Kennedy G.C.(Econ. Geol., 1950, 45. 7, 629); 2 - данные
Morey G.W., Fournier R.O., Rowe J.J.,(Geoch.Cosm.Acta, 1962 , 26, 1029);
3 - данные автора; 4 - данные Kennedy G.C., Wasserburg G.J.,Heard H.C.,
(Am. J. Sci., 1962 , 7, 501)
Давление, бар
Фиг. 1404. Изотермы растворимости кварца при дав-
лениях 1000-4000 бар
1 - данные Morey G.W., Hesselgesser J.M.(Econ. Geol., 1951, 46.
821, 835); 2 - данные автора
Weill D.F., Fyte W.S. Geoch. Cosm. Acta, 1964, 28, 8,1249
Anderson G.M., Bumham C.W. Am. J. Sci., 1965, 263. 6, 500
376
SiO2-H2O
Островский И.A., Geol.J., 1966, jj, 1, 131
SnO2-H2O
Фиг. 1405. Изобарические сечения РТХ диаграммы
системы Si02~Н2ОП0 данным Островского И.А., Ми-
шиной Г.П., Повилайтиса В.М. (ДАН СССР 1959, 126.
3) и Kennedy G.C., Wasserburg G.J., Heard Н.С. (Am.
J .Sci., 1962, 260,7 , 501
Фиг. 1407. Изобары (а) и изотермы (б) растворимости кас-
ситерита в воде
1,2,3 - для 700, 1000 и 500 кг/см2; 4,5 - для 900 и 1000°
Сыромятников Ф,В., Иванов И,И,, Макарова А.П.Сб. 'Экспе-
римент. исслед. в области глубинных процессов'. Изд-во
АН СССР, 1962, с. 155
Фиг. 1406. ОбщаяР-Т схема системы SiOo—HoO по дан-
ным Kennedy G.C., Wasserburg G.J., Heard Н\С. (Am. J.
Sci., 1962, 260, 7 , 501), Yoder H.S., Boyd F.R., England J.L.
(Camegie Inst. Washington. Year book 58),
Островского И.А., Мишиной Г.П., Повилайтиса B.M. (ДАН
СССР, 1959, 126. 3). Уравнение линии равновесия коусит-
стишовит: Ркбар = 73+0,0241 Т°С в соответствии с но-
вой международной шкалой давления, см. фиг. 1123
Островский И,A,t Geol.J. 1966, 5, pt.l, 133
Фиг. 1408. Кривая превращения анатаз - рутил. Опыты про-
водились в присутствии Н2О; длительность опытов несколько
дней.
1 - опыты, в которых Т1О2 оставалась в форме анатаза;
2 - опыты, в которых анатаз превращался в рутил (Неопуб-
ликованные данные Tu К.С., Osborn E.F.) *
Osborn E.F. J. Am. Ceram. Soc,, 1953,36». 5,147
48
377
Трехкомпонентные
А1203- СаО-Н2О
Фиг. 1409. Р-Т кривые двух реакций дегидратации в систе
ме AI2O3— CaO—Н jO. Выше около 3060 атм возможно пере-
сечение
Фиг. 1411.Р-Т кривая реакции Дегидратации 4СаО*
•ЗА^ОуЗ^О. Пунктиром показаны данные Majumdar A.J.,
Roy R., (J.Am.Ceram. Soc.» 1956,32» 12, 440)
Pistorius C.W.F.T. Am. J. Sci., 1962.260, 3, 223
Majumdar A J., Roy R. J.Am. Ceram.Soc., 1956,39, 12, 440
Фиг. 1410. Р-Т кривая реакции дегидратацииЗСа0«
•А)2О3«6Н2О
Majumdar AJ., Roy R. J. Am. Ceram. Soc., 1956,22» 12, 441
Фиг. 1412. Диаграмма фазовых равновесий в систе-
ме А12Оз^Са2О3-Н2О, В опытах давление было пере-
менным до 14)0 атм. Левая часть диаграммы дейст-
вительна только для давлений свыше 150 атм
Hill V.G., Roy R. Osborn E.F.t J. Am. Ceram. Sos., 1952,
35, 6, 139
378
Фиг. 1413. Диаграмма температура - состав для сис-
темы MgOT-Al2O3-H2O при давлении Н20 340 атм. Круж^-
ки указывают на состав и температуру опытов
Roy D.M., Roy R.t Osborn E.F, Am. J. Sci., 1953» 251,5,
347
Ai2O3-Si°2-H2O
Давление, атм
Фиг. 1415. Кривые дегидратации и кривые равновесия
каолинита
1 - экспериментальная кривая по максимумам; Iх _ эксперимен-
тальная кривая по началу эндоэффекта; 2 - кривая равновесия (рас-
четная) без учета теплоемкости; 2' - то же, с учетом теплоемкости
Лебедев В,Jf.Tp. V совещания по эксперим. и техн,
минералогии и петрографии. Изд-во АН СССР, 1958, 132
Фиг. 1416. Определение фазовых границ и тройной точки
1 - образование андалузита; 2 - образование силлиманита; 3 -
образование кианита; смешанные обозначения - или установилось рав-
новесие, или нет ощутимой реакции
Clark S.P.(Am. J. Sci., 1961, 259, 641-659); Clark S.P.
et al.(Am. J. Sci., 1957, 255, 628-640) Evans B.W. Am. J.
(Sci.,1965, 263, 647-667) Weill D.F.(Geoch. Cosm. Acta,
1966,30,*223-238) Althaus E. Contrib. Min. Petrol., 1967,
16,1,35
Фиг. 1414. Треугольники составов в системе
MgO-Al2O3-H2O
Roy D.K., Roy R., Osborn E.F. Am. J. Sci., 1953, 251, 5,
351
379
Фиг. 1417. Границы стабильности пирофиллита при разных
давлениях F^O в зависимости от и Т
Althaus Е. Neues Jb.Min.Monatsh., 1968, 9, 293. См. также
Carr R.M. Fyfe W.S. Geoch. Cosm. Acta, I960, 21, 1-2, 101, 102
Фиг. 1418. Система A^Oj-SiC^-l^O при высоких давле-
ниях и температурах
Kennedy G.C. Advances in Geophys., 1961,7, c. 320
Фиг. 1419. Равновесная фазовая диаграмма, показывающая
отношения между полиморфами алюмосиликата и Верхним
пределом стабильности пирофиллита.
Заштрихованная область изображает неопределенность в поло-
жении тройной точки. Реакция: AI2S14Ojq(OH)2= A^SiOj*
+3SiO2+H2P. Пунктирная часть кривой этой реакции-экст-
раполяция. J
Kerrick D* Am. J« Sci., 1968, 266,3, 211
Фиг. 1420. Давление пара для некоторых реакций в.
системе
Kennedy G.C., Aw. J.Sci., 1959, 257, 563-73
Фиг. 1421. Реакции: пирофиллит = кианит + кварц (коусит) +
вода; пирофиллит + корунд = кианит <
Исходные вещества Продукты
1 - пирофиллит ----кианит + кварц
2 - кианит + кварц пирофиллит
3 - пирофиллит* корунд ---кианит
4 - кианит ----пирофиллит + корунд
Matsushima S., Kennedy.G.С., Akella j., Haygarth J-,
Am. J.Sci., 1967.265,1. 40
380
A12O- SiO2—Н20
Ba О-SiO2-Н2О
кб
кд
кв
HgO
Бе кор н20
кв 2
V. 405-420°
175-280'
100 -
30
80
HjO В Кор Н20
Н«0 гиб Бё кор
кв
’\ IV. 280-405°,
пирф
мул
Кор
Мул
Кор
У1.420-450°(~) в.
>8
70
60
50
40
А+коус
С+коус+Н20
Н20
VIL-45O-575*
кор ш
ко
УШ. >575'
мул
30
20
А+кб
В+Н2О
Л+кв+НгР
Кор Н20
Кор
10
1
*
Фиг. 1422. Треугольники составов в системе А^О^—
SiO?-Н £ О для разных температур при давлении около
680 атм. Треугольники, ограниченные сплошными ли-
ниями, определены экспериментально. Пунктирные л&-
нии указывают на вероятные отношения
700 °C
О ---------1--------1---------1—
300 400 500 600
Фиг» 1424. Приближенные фазовые отношения в час-
ти системы BaO—SiC^—Н20, богатой кремнеземом. А,
В,С фазы не установлены
Roy R.t Osborn E.Fс Am. Min., 1954, 39, 11—12, 875
Pistorius C.W.F. Neues Yb. Min. Monatsh., 1963, 2—3,
c. 49
Фиг. 1423» Моновариатные кривые в системе А^О^—
-SiO2-Н2О Номера с треугольниками в областях меж-
ду кривыми относятся к треугольникам на фиг. 1422
Вдоль кривых имеют место следующие реакции: I - гиббситу
ббмит + I^O. П -энделлит»»галлуазит+ Н_О, III-бёмит** диаспор; IV *
диаспора корунд+Н2 О и каолинит»*гицральсит+ пирофиллит + монт-
мориллонит; V-монтмориллонит<апирофиллит + гидральсит+ Н20,
VI-пирофиллит^ муллит (или андалузит) + кварц +Н2О
Roy R.p Osborn E.F. Am. Min., 1954» 39, 11—12, 876
Фиг. 1425. Моновариантные Р-Т кривые для реакций
тоберморнт = ксонотлит + Н?0 (или = к со нот лит + труско-
тит+ Н20) и ксонотлит = p-CaSiO3+H2O
1 - тоберморит; 2 - ксонотлит; 3 - CaSiO3
Buckner D.A., Roy D.M., Roy R. Am. J.Sci., 1960, 258,
2, 134
381
CaO-SiO., -H 2O
Фиг. 1426. P-T диаграмма, показывающая ступени
дегидратации следующих рядов
I - CaO«SiO2*H£HSiO2= гяролит+ Н20;11-гяролит+кварц-труо-
котит + Н20; Ш-гиролит« тоберморит+трускотит-»- Н20; I V-гшзолит-
ксонотлит + трускотит+Н20; V -тоберморит ксонотлит + Н20; VI.-трус-
котит = ксонотлит+кварц + Н20; VII-ксонотлит- волластонит +Н20; 1 -
трускотит+Н20; 2 - гиролит+SiO2+H2O;3 - гиролит + Н20;4 - трус-
котит + ксонотлит + Н20; 5 - ксонотлит + SiO2+НоО;6 - тоберморит+
+Н20; 7 - ксонотлит+Н ^0; 8 - волластонит+Н2О; с- CaO*SiO2«H2O
Harker R.l. J. Am. Ceram. Soc., 1964, 74, 10, 527
фиг. 1428. Фазовые отношения в системе CaSiO,-H,O
в области температур 350-500ОС при давлениях до 54 кбар
1 - опыты, дающие только ксонотлит; 2 - опыты, дающие fl-вол-
ластонит; 3 - опыты, дающие новую фазу высокого давлении, но
без Р-во1тастонита. Часть кривой ниже 3 кбар - данные Buck-
ner D. A., Roy D.M., Roy R. (Am. J. Sci., 1960, 258, 132-147)
Pistorius C.W.F.T. Am. J.Sci., 1963, 261,1,83
Фиг. 1427. P-T равновесные кривые для реакций в
системе CaO-SiC^—H20j Кривая ксонотлит^воллас-
тонит.+Н90 по даннымВискпег D.A.Jloy D.M. (Bull.
GSA., 1955,66^1536)
С—СаО; S-SiO2; H-Hj O;X-C8S3H3; Y-C6S3H;
Z-C9S6H
Roy D.H. Am. Min., 1958 , 43, 11-12, 1017
680
340
То&рморит лсо+р+нго
/ •
✓ •
J----------1----------1__________L
260 280 300 320 °C
Фиг. 1429. P-T кривая реакции тоберморит таксонот-
лит+трускотит + Н20
Spealman К. Ph. D. Min. Mag., 1968, 36, 284, 1097
382
CaO—SiO,—Н „О
z z
“C
1200
ю 20 x 40 а во to so x
СоОД Вк.% 015(ОД(ОН)г CdjSiQ*
Фиг. 1430. Изобарическая диаграмма бинарной сис-
темы Са(ОН)2—Ca2SiO^ при 1000 атм
Harker R.I., Roy D.M., Tuttle O.F. J. Am. Ceram. Soc.,
1962, 45, 10, 473
Фиг. 1431. Треугольники
составов в системе СаО—
—SiO2-H2O для температур и
температурных областей при
давлениях насыщенного пара
(пунктирные линии) и при
высоких давлениях около
1020 атм (сплошные линии).
Треугольник 1 В показывает
наиболее водные (низкотем-
пературные) известные
кристаллические фазы. Пунк-
тирные линии указывают на
некоторую неопределенность
в равновесии
С- CaO;S-SiO2;H-H2O
Taylor H.F.W. Chem. of
cement. Proc. Fourth Inter-
nationa] Simposium W. I960,
c, 198, 199
Co0-Si02-H20
MgO-SiO2-H2O
Фиг. 1432. Фазовые отношения в части системы
СоО—SiO2—Но О богатой кремнеземом при темп^
ратуре до 9(Л)ОС и давлении водяного пара до
40 кбар
1 - переход а—Р —кварц (Yoder H.S. Jr. Trans. Am. Geoph. Union,
1950, 21, 827-835); 2 - переход кварц-коусит(MacDonald, G.J.F.
Am.J. Sci., 1956 , 254, 713-720
Pistorius C.W.F.T, Neues J b.Min.Monatsh., 1963,
2-3,34
Фиг. 1434. P-T кривые (I—V) моновариатных рав-
новесий в системе MgO—SiO2—Н20
Bowen N.L., Tuttle O.F. Bull. Geo). Soc. Am.,1949,
£0,3, 447
Фиг» 1433» Изотермы кристаллизации
Morey G.W. J, Soc. Glass Technology, 1922,6, 25
Фиг» 1435. Фазовая граница, соответствующая реак-
ции брусит + серпентинз^форстерит + пар при давлениях
до 50 кбар
1 - опыты, где нет форстерита» Горизонтальные линии - данные
Bowen N.L., Tuttle O.F. (Bull. Geol. Soc. Am., 1949, 60,3, 447)
Pistorius C.W.F.T. Neues Jb. Min.Monatsh., 1963,11, c. 285
384
MgO-SiO2-H2O
Фиг, 1436* Некоторые фазовые равновесия в системе
MgO-SiO^-Но О Реакция 5 (кварц* коусят) - данные
Kitahara S., Kennedy G.C.,(J.Geoph. Res., 1964, 69.5395-
5400). Реакция 6 (антифиллит^энстатит+кварц+пар)
данные Greenwood H.J.(J.Petrology, 1963, 4, 3, 325).
Стрелки показывают направление, откуда приближа-
лись к равновесию. Зачерненные области символов
показывают приблизительный процент продуктов сле-
ва. Маленькие символы показывают результаты опы-
тов из смеси окислов. Сплошные линии - данные ав-
торов. Пунктирные - данные Bowen N.L., Tuttle O.F.,
(Bull. Geol. Soc. Am., 1949, 60, 3, 447)
Kitahara 5., Takenouchi S., Kennedy G.C,, Am. J. Sci.,
1966, 264,3, 228
Фиг. 1438. Фазовая граница, соответствующая реак-
ции серпентину форсетерит + тальк + пар
1 - опыты, гае нет талька или форстерита. Горизонтальные линий -
данные Bowen N.L., Tuttle O.F.(Bull. Geol3oc.Am., 1949, £0,3, 447)
Piatoruia C,W,F,T, Neues. Yb. Min. Monatsh, 1963,11, 287
Фнг, 1437. Обобщенная Р-Т равновесная диаграмма,
показывающая предел стабильности атп^офиллита при
высоких давлениях и инвариантные | течки. Экспери-
ментально определенные участки кривых показаны
сплошной линией, экстраполяционные и рассчитанные-
прерывистыми линиями, метастабильные продолжения
кривых - пунктиром
Greenwood Hj. J. Petrology, 1963,4,3, 332
49
385
MgO-SiO2-H2O
Фиг. 1439. Моновариантные равновесные кривые, оп-
ределяющие стабильность антофиллита при избытке
Н20 Стрелки указывают направление, откуда прибли-
жались к равновесию
Фиг. 1441. Плавление MgSiCkB условиях насыщения
водой. Верхний предел поля фо+Ж+П является проек-
цией ликвидуса при содержании Н20 меньше 50 вес.%.
Соотношения при плавлении в безводных условиях по
данным Boyd F.R.,(J.Geoph. Res., 1964, J&, 2101). Точ-
ка инверсии между ортоэнстатитом и протоэнстатитом
при 1атм по данным Atlas L. (J. Geol., 1952,60, 125)
Kuahiro J., Yoder H.S.Jr., Niahikawa Ы., Geol. Soc. Am.
Bull., 1968,79, 12,1690
Номера кривых соответствуют реакциям: 1-4 форстерит+9 тальк-*
*5 антофиллит*4 Н2О;2 - антофиллит* форстерит —9 энстатит +Н20;
3-7 тальк—3 антофиллит+4 кварц+4 Н2О; 4 - антофиллит—7 энста-
тит* кварц* Н2О
Greenwood H.J. J. Petrology, 1963,4, 3, 325
°C
1500
1400
1300
1200
1600
йЪмС ’ Ж+0ф+Ж0 i l_ 1— Ж+П Л-~Фо+Ж в ® д аФо+Ж+П
в
-ан ОЭНС+ФО+П в
- в 1 1 L_
вал
азнс+п
Фо+П
ж+п
Н2О
п
SiO2
а+ж
20
BX.%
30
Н20
Фиг. 1440. Фазовые отно-
шения в системе MgSiO3-H2O
при давлении 10 кбар
1 - ортоэнстантнт чистый или
с небольшой примесью форстерита
и стекла, образовавшихся при за-
калке из пара; 2 - ортоэнстатит
и форстерит с закалочными крис-
таллами (и стекло); 3 - форсте-
рит с закалочными кристаллами
и стекло; 4 - форстерит с зака-
лочными кристаллами и стекло; *
5 - закалочные кристаллы и стек-
ло (включающее закалочный пар);
6 - закалочные кристаллы и стекло
Kuahiro I,, Yoder H.S.Jr,,
Niahikawa Ы, Geol. Soc. Am.
0 Ю
Mgsio3________________________
|.7 Д2 вЗ ш4 b5 ~O6] Bull., 1968, 79,12, 1687
Фо+П
03№
(BHC +
WC
Ж+
ОЭНС+М+Ж
03HC
1500*0
Фо+П
Ж+П
Фо+йЗНС+Ж09***
Si02
rf+ж
^У'оэнс+ж
Фо-нвнс+Ж
SiO^
кО+Ж
Фиr. 1442. Иэотермально-иэобарические сечения сие-
темы M^SiO4-SiO2-H2O при 1300, 1400, 1500°С и
10 кбар
Kuahiro I., Yoder H.S.Jr., Niahihava It. Geo). Soc. Am.
Bull., 1968, 79, 12, 1690
386
MgO-SiO2-H2O
Na2O-SiO2-H2O
Фиг. 1443. Кривая плавления форстерита в условиях на-
сыщения Н2О. Кривая плавления в сухих условиях - по
данным Davis, England J.L., фиг. 1148
Kuahiro Yjoder H.S. Jr. Camegie Inst. Washington.
Year book, 1967-68, SL 155
Фиг. 1445. Система H2O—Na20—S1O2 HP11 250°C*
Friedman I., Econ. Geol., 1949, 8, 743
Фиг. 1444. Проекция системы форстерит (MgjSiO.) -
кремнезем - вода при давлении воды 20 кбар. Фазовые
равновесия при 1 атм по данным Bowen N.L., Ander-
sen 0. (Am.J .Sci, 1914, 37, 487-500 и Greig J.W. (Am.
J. Sci, 1927, 13, 1-44Г"
Kuahiro I. Camegie Inst. Washington, Year book,
1967-68, 67, 159
Фиг. 1446. Полибарические отношения в условиях насы-
щения при 400 в системе HjO—NajO—SiC^. Стекла, со-
став которых лежит в плоскости А-В-С- D - твердые,
хрупкие и растворимы в воде. (Пунктиром показаны ли-
нии, не определенные экспериментально.
Friedman L J. Am. Chem. Soc., 1950, 7& 10, 4572
387
388
NiO-SiO2-H2O
SiO2-ZnO-H2O
40
Пимелит
Ni-Ta+H20
Бу*лкв+Н$
I < /
0-
Г
/ьу+ркб+Н20
°2Ю
400
600
800
Фиг. 1451. Приблизительные фазовые отношения в бо-
гатой кремнеземом части системы NiO-SiO2—Н20 при
температурах до 950 С н давлениях водяного пара до
40 кбар.Кривая а-0 перехода в кварце (Yoder H.S. Trans.
Am. Geoph. Inion 1950, £1, 827-835)
Piatoriua C.W.T. N.Jb. Min., 1963, 2-3, 41
Ю00°С
Фиг. 1453. Моновариантаная Р-Т кривая для реакции
гемиморфит виллемит+вода при давлениях до 100 кбар.
Кривая Pistorius C.W.F.T. - кривая плавления льда VII
при давлениях до 200 кбар. (Zs. Phys. Chem., в печати)
Piatoriua C.W.F.T. N.Jb. Min., 1963, 2-3, 53
Na20- Ti02- H20
Фиг. 1452. Система Ti02-Na2O-H2O-, продолжительность
опытов 300-500 часов
1 - ругал. 2 - брукит, 3 - анатаз; 4 - N а - титанат.
Keeamann I. Zs. Anorg. Allgem. Chem., 1966, 346, 35
Фиг. 1454» Моновариантные P-T кривые в системе
ZnO-SiO2-H2O
Кривая 1:1- соконят, 2 - кремнезем*гемиморфит (или мета-
стабильный виллемит); кривая Ц: 3 - гемиморфит, 4 - виллемит;
кривая Ш: 5 -Zn(OH)2; в - ZnO
Roy D.M., Numpton F.A. Econ. Geol., 1SS6» 211
389
Фиг. 1455. Треугольники состава для системы ZnO-SiO2-
-Н20 при давлении 1360 атм. Внутренние треуголь-
ники - экспериментально определенные комбинации трех
совместимых фаз. Пунктирные линии указывают вероят-
ные группы при недостатке Н20
Roy D.M., Humpton F.A., Econ. Geol., 1056, 51, 5, 437
A12O3-“BeO-’SiO2-H2°
Al2°3 (e) Л (f) SiO2
Фиг. 1457. Возможные субсолидусные фазовые отношения
в системе BeO-Al2O3-SiO2-H2O при 1020 атм
Gang.-Jf Dibyendu, Saha. Trans. Indian Ceram. Soc.,
1967, 26, 4, 106
Четырехкомпонентные
A10—BaO—SiO,—H,0
Фиг. 1456. Поле стабильности кимрита - цельзиана и
ассоциация минералов, образовавшихся при химической
реакции 2 кимрят^± цельзиан+санборнит+2 кварц* Н20.
Цифры обозначают продолжительность опытов в часах
Seif Y., Kennedy G.C. Am. Min., 1954, 49, 9-10, 1412
Фиг. 1458. Возможная PJ-кривая для реакции берилл* Н_0
бертрандит * пирофиллит 2
Ganguli Dibyendu, Saha Р. Trans. Indian Ceram.Soc., 1967,
26, 4, 108
390
Al„O-CaO-SiO-H„O
£ Л £ £
20
15
10
5500 600 700 800 900 1000 °C
Фиг. 1459. Соотношение гроссуляр - гидрогроссуляр при
высоких температурах и давлениях водяного пара
Kennedy G.C. Advances in Geoph., 1961, 7, 317
£
I ie
Фиг. 1460. Экспериментальная кривая реакции клино-
цоизит + кварц и рассчитанные кривые для разных ус-
ловий, при которых ₽Н2О < робщ
1 - равновесные точки, данные автора; 2 - предельные условия,
при которых Merrin S (ms) (Ph. D. thesis, College of Mineral Industries,
The Pennsylvania State University 1962) обращал гроссуляр-
анортит в клиноцоизит-кварц. Кривая эпидот - кварц является
приблизительной кривой минимумов
Holdaway M.J. Am. J. Sci., 1966, 264, 8, 660
22
20
14
12
10
в400 500 600 700 800 900 °C
Фиг. 1461. Р-Т диаграмма, построенная на эксперимен-
тах при использовании исходного материала состава
CaO-A12O3«2SiO2-SiO2-H2O. Пунктиром показаны
данные Kennedy G.С. (Am. J.Sci, 1959, £57» 563—573) и
Yoder H.S. (Am.«'Geoph. Union Trans., 1950,31,827-835)
Pistorius C.W.F.T., Kennedy G.C., Sourirajan S. Am. J.
Sci., 1962, 260. 1, 48
9000 -
8000 -
7000 -
6000 -
§ 5000-
4066 - Истинной (разовая
3600-
2000
1000-
Пале-ан+гросс* Н20
§
800 °C
400 500 600 700
Фиг. 1462. Фазовая граница цоизит + кварц “ анортит +
гроссуляр + HjO при высоких давлениях и температурах
Winkler H.G.F', Nitsch КМ. Naturwis., 1962, 49, 24, 605
391
Al2O3-CaO-SiO 2-Н2О
30
28
26
24
Дя+юр+Н20
Фиг. 1483. Экспериментальная
Р-Т диаграмма, построенная
при использовании исходного
материала состава CaO*ALOq«
•SiO2-Al2O3-H2O
Piatoriua C.W.F.T,, Kenne-
dy G.C., Sourirajan S. Am.J. Sci.!
1962, 260, 1, 47
| 18
I®
14
12 [ Аи+Д+Н2О
10 -
W
600
700
800
900
1000 °C
Ю
9
8
7
5
4
3
Ан
В
Цо+К
+К6
2
1
0
11
10
9
8
<7
is
5 s
^4
3
2
1
\
\ •••
\
Fe
j 2
Г"'
3l
Лав
Лом
200
□
300
Цо
Фиг. 1465. Образование
лавсонита
Nitach K.H. Naturwis.,
1968, 55, 8, 388
400 500%
°C
1500
___J_____I----1---1----1----1--- .
too 200 300 400 500 600 700%
Некоторые граничные отношения, касающиеся
определенные экспериментально и оцененные
1400
1343*5*
1300
ж+г
Р^2000йр
1500
1400
Фиг. 1464.
лавсонита,
A - В - лавсонит-анортит*вода (Crawford W.A., Fyfe W.S. Am.
J. Sci., 1065, 263, 3, 262); C - D - лавсонит - анортит + вода («же-
нено Newton R.C., Kennedy G.C. J.Geoph. Res., 1963, Qg, 2967-
2983); D - E - лавсонит-цоизит* кианит* кварт* во да (Newton R.C.,
Kennedy G.C. J. Geoph. Res. 1963, 68, 2967-2983); D - F - цоизит*
кианит* кварц-анортит* вода (NewtonR.C., Kennedy G.Q. J. Geoph.
Res. 1963, 68, 2967-2983); G - H - лавсонит*кварц*вода-ломонтит
(оценено Fyfe W.S. ); 1 - J - арагонит-калыцгт (Clark, & Р., Jr.Am.
Min.,' 1967, gL >564-666;Crawford, W.A., Fyfe, W^., Science,
1964, 144, 1569-1670; Jamieson, J.C., Chem. Phys., 1963, 21, 1385-
1390; MacDonald G.J.F., Am. Min., 1956, 41, 744-756); К “ и
К7- I*нкадепт*кварт-альбит (Fyfe W.S., Valpy G.W. Am. J. Sci,
1959, 267, 318-320)
Crawford W.A., ».S. Am.J. Sci., 1886, 2SS, 3,
265
1200
1100
1000b
900
1300
АН+Ж+Г
1200
1130*5°
-*1100
» »«
ди+рдЛ+Г
J_l__I_***'______I__I_L.
Гя,1Щп ю 20 30 40 50 60 70 * 90 cm
GaAlgS^Og % oiUg
Фиг. 1466. Проекция тройной системы CaA12Si20g—
—SiO2—H20 при давлении водяного пара 2000 бар
Stewart D.B. Camegie lost. Washington. Year book,
1956-1957, 56, 215
1000
322i3°
900
800
392
Al,O_—CaO—SiO,—Н,0
£ a £ £
250 300 350 400 450 °C
Фиг. 1467.P-T диаграмма, показывающая вероятные
фазовые группы, стабильные в дивариантных Р-Т по-
лях и моновариантные Р-Т кривые
Koi хит i И., Roy R. J. Geol., 1960, gg, 1, 51
Фиг. 1468. Р-Т проекция части системы
CaO-Al2O3-SiO2-H2O
Boettcher A.L. J. Petrology, 1970, 11. 2, 356
Фиг. 1469. Верхний предел стабильности муско-
вита. Робщ-В сравнении с кривой автора
приведены кривые Crowley M.S., Roy R., (A'm.Min.,
1964, $g, 3-4, 354) и Yoder H.S., Eugster H.P.,
(Geoch. Cosm. Acta., 1955, §. 5-6, 242)
Velde B. Camegie Inst. Washington. Year book,
1963-1964, 142
Фиг. 1470. Схематическая Р-Т проекция части системы
I^O-SiO^A^Oy-l^O, показывающая связь между
стабильностью мусковита и реакциями плавления в
системе
А - условия первичной кристаллизации мусковита из расплава в под-
системе Opr-Ka-Koyc-HgOi В - условия кристаллизации мусковита из
расплава в присутствия только санидина (других кристаллических
фаз нет) в подсистеме Opr-Koyc-HgO
Lambert LB., Robertson J.K., Wyllie P.J. Am. J. Sci.,
1969, 232» 622
3 50
393
А12О3-К20-SiO2-H2O
- * » । । I । । । । i i । » । I । I । । I i > । i Lii । i
SOO 550 600 650 700 TSO 800 °C
Фиг. 1471. P-T условия стабильности мусковит+кварц.
Робщ-РйзО
1 - стабилен мусковит; 2 - стабильны К—полово! шпат и
A^SiOg ; 3 - реакция не идет с заметной скоростью; 4 - обраэова-
Altbaua Е., Karotke Е„ Nitacb К.Н., Winkler H.G.F. N.
J. Min. Monatsh., 1870, H. 7, 328
Segnit R.E., Kennedy G.C. Am. J. Sci., 1861, 258, 284
Фиг. 1472. Реакции в смеси каолин* аморф-
ный кремнезем в гидротермальных опытах
Segnit R.E., Kennedy G.C. Am. J. Sci., 1961, 2ЭД 282
Фиг. 1474. Реакции c K2O-3Al2O3-6SiO2+12SiO2
Segnit R.E., Kennedy G.C. Am.J.Sci., 1961, 259, 286
394
Al2O3-K2O-SiO2- H20
Давление, кбар
Фиг. 1475. Кривые кристаллизации в системе ортоклаз +
вода в Р-Т проекции
1 - лейцит + пар; 2 - лейцит* жидкость* пар; 3 -ортоклаз *пар
Goranson R.W. Am. J. Sci., 1938, 35A, 89
Фиг. 1477. Отношения при плавления в системе
KA)Si3O8-H2O
Seki Y., Kennedy G.C. Geoch. Cosm. Acta, 1965, 29. 9,
1079
Фиг. 1476. Экспериментальные данные по Р-Т условиям
плавления в системе KAlSiO^—SiO2—Н20
1 - результаты авторов; 2 -Spengler C.J. (Ph.D.thesis Dept.
Geochem. and Mineral., College Mineral Industries, The Pennsylvania
State University, 1965); 3 - Goranson R.W. (Am. J. Sci., 1938, 35,
71-91); 4 - Yoder H.S.,Stewart D.B., Smith J.R. (Camegie Inst. Wa-
shington, Year book, 1956-1957, 56, 206-214)
Scarfe C.M., Luth M.C., Tuttle O.F. Am. Min. 1966, 51,
5-6,733
Фиг. 1478. Экспериментальные результаты, полученные
для санидина с составом Орт95 А65 в присутствии из-
бытка Н2О. Размер символов соответствует точности
измерения Р и Т
Lambert L.B., Robertson J.К., Wyllie P.J. Am. J. Sci.,
1969, 267, 615
Фиг. 1479. Эксперимен-
тальные результаты,по-
лученные для смеси са-
нидин (Ортдд Абд) +15
вес.% кварца в присут-
ствии избытка Н2О
Размеры прямоугольников
соответствуют точности изме-
рения Р и Т
Lambert L.B., Robert-
son J.K., Wyllie P.J. Am.
J. Sci., 1969,267,617
395
А1,0 —К 0—Si0_-H,0
4 О л X л
Фиг. 1480. Диаграмма, показывающая поля стабильно-
сти лейцита, санидина+гексагон. кальсилита и
КА iSij 0g + гексагон. кашсилита, определенные
посредством простого сжатия в присутствии Н2О
1 - лейцит* вода-- лейцит* вода; 2 - санидин*гексагон. каль-
силит + вода — лейцит + вода; 3 - лейцит + вода—- санидин* гексаген,
кальснлит + вода; 4 - KAlSi^Og’HnO + гексагон. кальснлит-- сани-
дин + гексагон. кал ьсилит+во да; 5 - лейцит+вода—KAlSi^Og’h^O +
гексагон • кальснлит.
Self К., Kennedy G.C. Am. Min., 1964, 9-Ю» 1271
Фиг. 1482. Диаграмма, показывающая поля стабильно-
сти природного ортоклаза, санидина+жадеита*кварца,
санидина*жадеита*коусита и KA)SijOg«H^O + жадеита*
* коусцта, определенные простым сжатием. В качестве
исходного материала использовался природный ортоклаз
и вода. 1 - ортоклаз*вода—орктоклаэ* вода; 2 - орто-
клаз * вода—“ сани дин* жадеит* кварц* во да; 3 - орто-
клаз + вода-- санидин + жадеит+коусит^ 4 - ортоклаз +
+вода--КА151д0д* Н2О * жадеит * коусит. Ренгеновские
данные (порошкограммы) некоторых из этих опытов
указывают на присутствие кристаллов санидина, а так-
же и KAlSi^Og* Н2О. Это, по-видимому, обусловлено
или недостатком вЪды иль незаконченностью химиче-
ской реакции
Seki У.., Kennedy G.C, Am. Min., 1964, 4S& И-12,
1698. См. также: Seki Y.,'Kennedy G.C, Am. Min.,
1964, 49, 11-12, 1700
Фиг. 11481.1 Диаграмма, показывающая поля кристалли-
зации санидина н KAlSi^Og«H2O/ определенные про-
стым сжатием
сан+кб+Г
6001___।____।___।___।---1___।—-I----1----1---
«-ад 80 №ввс.% 40 20 «Ь
1 - санкции * вода-»> К AlSuOg'^O; 2 - сани дин + вода-^санидин +
*вода. Рентгеновские данные (порошкограммы) часто указывают на
присутствие небольших количеств санидина в ассоциации с кристал-
лами KAlSi^Og* Н20. Присутствие санидина должно быть обуслов-
лено или недостатком воды в этих опытах или незаконченностью
химической реакции.
Seki Y„ Kennedy G.C. Am. Min., 1964, n49, 11-12,
1693. См. также: Seki Y.,t Kennedy G. C, Am. Min.,
1964, 49, 11-12, 1697
Фиг. 1483. Проекции насыщенных ликвидусов при 500,
1000, 2000 и 4000 бар в системе KAlSigOg-SiC^-^O.
Сечение KAlSi^Oo-SiC^. ' Данные при 1 атм взяты из
роботы Schairer J.F., Bowen N.L.(An). J. Sci., 1955,
681-746); данные для KAISigOg—H2O - из работы
Goranson R.W. (Am. J.. Sci., 1938, mA, 71-91) и для
Si02~H2O - из работ Stewart D.B. (Geo). Soc. Am. Bull.
1958, Qg, 1648) и Tuttle O.F., England J.L.CGeol.
Soc. Am. Bull., 1955, 66, 149-152). Отсутствуют экспе-
риментальные данные для составов, координирующих
точки санидин * лейцит* жидкость* газ и кварц* тридимит*
жидкость* газ.
ShawH.R., Am. Min., 1963, 4g, 7-8, 893
396
А1,0,—KO—SiO,—Н,0
- л £, А А
ЮОО
Фиг. 1484. Р-Т проек-
ции моновариантных
кривых саЬш дин'+ кварц
♦ жидкость + газ и сани-
дин ♦ тридимит ♦ жид
кость♦газ в системе .
KAlSi3O8-SiO2-H2O
1 - кристаллы; 2 - жид-
кость+крнсталлы. Кривая пе-
реходаа—ркварп по данным
Yoder HjS. (Am. Geoph. Union,
Trans., 1950,IL 827-835)
кривая перехода кварц-три-
димит - по данным Tuttle 0.
F., England J.L. (Geol. Soc.
Am. Bull., 1955. & MS-152
Shaw H.R. Am.Min.,1963,
48, 7-8, 894
1200 °C
A10_—MgO—SiO-HO
A О £ 4
Фиг. 1485. Верхние пределы стабильности магнезиаль-
ных хлоритов. Заметим, что состав хлорита изменяется
с давлением. Ниже кбар хлорит имеет прибли-
зительно состав клинохлора (SMgO'A^OySSiC^), но
приРн20 кбар он содержит больше AJ2O3 (между
1 и 2 молями AI2O3 )• Ниже Рн?0*2 кбар кривая взята*
по данным Yoder H.S. Jr. (Am. J. Sci., Bowen Vol., 1952.
569-627), точка А по данным Rankin G.A., Merwin H.E.
(Am.J.Sci., 1018, 45, 301)
Светлые значки - синтез минералов из стекол или смесей
окислов; черные значки указывают проврапюпие из одного мине-
рала или минеральной группы в другие; 1 - хлорит; 2 - форстерит
энстатит, шпинель; 3 - форстерит, кордиерит, шпинель; 4 - кристал-
лы +жидкость.
Фиг. I486. P-T диаграмма кристаллизации алюминиево-
го серпентина - клинохлора. Кривая показывает Р-Т пре-
делы кристаллизации клинохлора в аппаратуре поршень-
наковальня, нижняя часть кривой построена по гидротер-
мальным данным Yoder H.S., (Am.J. Sci., Bowen Vol.,
1952, 569-627), пунктирные границы - подразумеваемые
1 - А) -серпентин; 2 - смешанные фазы; 3 - клинохлор; 4 - тальк ♦
♦ форстерит ♦ шпинель * пар
Segnit E.R. Am. Min., 1963, 48, 9-10, 1084
°C
650
600
550
SOO
450
400
350
7MgO8SiO2 6MgO AfeOjTSIOj 5МдООД0з6$|‘О2
___ MgSi-^AIAI
Фиг. 1487. Разрез температура - состав вдоль линии
антофиллит (7MgO«8Si02*2H20) - магнезиальный гед-
рит (5MgO«2Al2O3«6SiO2*2H2O) при Рн2О“2 кбар.
Данные по нижнему пределу стабильности кордиерита
(кор ди ерит-*пирофиллит+хлорит) взяты из работы
Schreyer W„ Yoder H.S. (N.Jb. Min., 1964, 101. 3, 271)
Fawcett J.J., Yoder H.S. Am. Min., 1906, 51. 3-4, 361
Fawcett J.J.9 Yoder H.S. Am. Min., 1966, Sb 3-4,
372
397
Al^-MgO-SiOj-HjO
Различные H-T \
продукты \
разрушения i
Пироп
• -/
o-2
□ -3
oc4
Различные H-P
продукты
разрушения
51—।—।—i—।—।—i—i—i—i—i—i—i—i—i i „
400 SOO 600 700 800 900 1000 1Ю0 1200 %
Фиг. 1488. PT диаграмма системы Mg - кордиерит -
Н20 дли РНг0.
1 - рост кордиерита; 2 - кордиерит превращается в пирофиллит +
♦ амезит; 3 - пирофиллит* хлорит + алюмосиликат; 4 - главным образом
хлорЯт* кварц* алюмосиликат (* некоторое количество кордиерита
вследствие близости инвариантной точки);5 - группы, содержащие
монтмориллонит; 6 - хлорит*кварц*'силлиманит' (-метастабиль-
ный корунд* кварц); 7 - продукты инконгруентногб плавления * жид-
кость* кордиерит; 8_- продукты инконгруентного плавления*жид-
кость; 9 - жидкость.'Во всех этих группах присутствует пар. При-
близительные координаты инвариантной точки (равновесие кордие-
рит* хлорит + пирофиллит*кварц*алюмосиликат*пар) - 5000 бар и
550°С
Schreyer W.,, Yoder H.S. N.Jb.Min., 19$4,101, 3, 293
Фиг, 1490, Предварительная Р-Т диаграмма стабильно-
сти пиропа в присутствии воды* построенная на опы-
тах с использованием синтетического пиропа
1 - рост пиропа; 2 - разрушение пиропа в низкотемпературные
группы; 3 - разрушение в группы низкого давления; 4 - незначи-
тельная реакция пиропа. Маленькими символами обозначены данные
Boyd F.R., England J.L., (Camegie hat. Washington. Year book,
1858-1958, 58, 84); сплошная линия - кривая разрушения по их дан-
ным
Schreyer Ж. Camegie Inst. Washington. Year book*
1966-1967* 66* 383
Фиг. 1489, Предварительная Р-Т диаграмма стабиль-
ности Mg - ставролита. Построена при использовании в
опытах синтетического Mg - ставролита
1 - рост Mg - ставролита; 2 - разрушение до низкотемператур-
ных групп; 3 - превращение в высокотемпературные группы; 4 -
незначительная реакция Mg - ставролита.
Schreyer Ж. Camegie Inst. Washington. Year book*
1966-1967, 62* 382
Фиг. 1491. ПредварительнаяР-Т диаграмма стабильно-
сти кордиерита при высоких давлениях в присутствии
воды* построенная на опытах* использующих кордиерит
и различные возможные группы продуктов разрушения
1 - рост кордиерита; 2 - разрушение кордиерита в различные
группы.'Сплошная кривая* обозначенная S* 7(1064) - данные
Schreyer W., Yoder НЛ. (N.Jb. Min., 1884, Ifib 3. 271): пумтар-
ные кривые, а также положение инвариантных точек I2 ” Ig 11/11
точно неизвестны, или умозрительны.
Schreyer Ж. Camegie Inst. Washington. Year book*
1966-1967* 66* 388
398
A12O3-MgO-SiO2-H2o
Фиг. 1492. Предварительная Р-Т диаграмма поля ста-
бильности йодернта. Исходный материал - синтетиче-
ский йодерит
1 - рост йодернта; 2 - разрушение йодернта в низкотемператур-
ные продукты; 3 - превращение йодернта в высокотемпературные
продукты; 4 - йодерит реагирует незначительно
Schreyer Ж., Toder H.S., Camegie Inst. Washington
Yearbook, 1966-1967, ££, 379
Фиг. 1494. Фазы, устойчивые в присутствии избытка
водяного пара в значительных температурных интерва-
лах и при 1020 атм в системе Al^^—MgO—SiC^—Н2О
Yoder H.S. Am. J. Sci., Bowen Vol., 1962, ч.2, 601
Фиг. 1493. Некоторые РТ-кривые (I—IX) моновариант-
иых равновесий в системе AI2O3—MgO—Si02—t^O
Кривые: I - Серп+БР^еФо+П, II - БР+А]-Серп^ФО+Шп + П,
III- Серп#ФО+ТА + П, IV - Пнрф^±Мул + Крист+ П, V - Кхл+ТА^
^ФО+Корд+П, VI - Фо+ТА^ЭНС+П, VII - Бр^Пер+П.УШ- Кхл^
Фо+Корд + Шп+ПДХ - ТА;#Эис+Кв + П. Совокупность фаз, устойчи-
вых в дивариантных попах между кривыми, дана на фиг. 1494.
Yoder H.S. Am. J. Sci., Bowen Vol., 1962, 2, 600
SiO,
Фиг. 1496. Группы, по-видимому, стабильных минералов
в системе А^О^—MgO -SiO2-Н26 при избытке воды
(сплошные и длинно пунктирные линии) и недостатке воды
(коротколунктирные линия) при 600 С и 1020 атм
1 - избыток Н2О; 2 - недостаток Н2О; 3 - водные
минералы
Yoder H.S. Am. J. Sci., Bowen Vol., 1952, ч. 2, 613
399
A12°3’Mg°-SiO2-H2O
бМдОЧЯОг 51^ А1ДЗЯ% 4MgO2AlfOy2Si02
Фаг. 1496. Предпочтительный вариант диаграммы состав-
температура при давлении 1000 атм для разреза хри-
зотил-амезит. Нижняя часть диаграммы - двойной разрез,
при более высоких температурах равновесие становится
четверным, и диаграмма показывает только стабильные
твердые фазы при различных составах как функцию
температуры. Точность таких диаграмм низка (-15°С),
особенно для областей твердых растворов (которые рас-
падаются на другие твердые растворы). Предпочтительный
вариант показывает в виде заштрихованной площади
интервал РТ, гд© 7 X - септохлориты образу-
ются и остаются метастабильными (?) в течение продол-
жительного времени. Отметим также двухфазную область
хрозотил - хлорит, соответствующую разрыву в твердых
растворах на *разрезе хлорита*.
В - возможное видоизменение диаграммы А (в качестве стабиль-
ной низкотемпературной полшорфиой формы хлоритов взяты септо-
хлориты)
Nelson B.W. Roy R. Am. Min., 1958, ^3, 7-8, 718
Фиг. 1497. Изотермические проекции системы MgO—
-Al2O3-SiO2-H2O при Рн2О"2 «бар/Привлечены дан-
ные Yoder НЛ. (Am. J. Sci., 1952, 569); Roy D.M..
Roy R. (Am. Min., 1955, £}, 3-4, 147); Schreyer W.,
Yoder H.S. (N. Jb. Min., 1964, 101, 3, 271)
Fawcett /.J., Yoder H.S. Am. Min., 1966, ££, 3-4, 376
Фиг. 1498. Группы, стабильные при**400°С и 2000
бар в сечении 2MgO«A]2O3«SiO2-A]2O3«4SiO2-H2O
Твердый раствор магнезиального монтмориллонита
не учитывали
1 - гипотетический состав 2MgO»2Al p3«5SiO2-H2O. Части
треугольника, ограниченные пунктирными линиями, содержат
дополнительные фазк в системе MgO-AIjO3—SiO2—Н20, не
иэображеяше в этом сечении. Область с дефипитом Н ^0
выделена точками
ScArey.r W., Yoder H,S. Camegie Inst. Was
hington, Year book, 1967-1968, 57. 197
400
Al2°3“MgO”-SiO2'“l,2°
Фиг. 1499. Треугольники составов в
системе A^Os-MgO-SiC^-f^O при
Р - 680 атм. Треугольник 17 -
"сухое* равновесие при атмосферном
давлении
(См. Foster W.R. J. Am. Ceram. Soc.,
1950, 33, 73-84). Для простоты в тре-
угольниках 9-14 состав тв. р-ра хлори-
та 14 X показан точкой хлоритового
состава
Roy D.M., Roy R. Am. Min., 1955, 40,
3-4, 162-163
Bp
серп
Фо
кв
ЮА-500П
mp
шп
кв
кв
1f.<S30°C
TA
гид,А
мул
кор
шп
кв
Bp
12.<575°C
BP
шп
кв
кор
13. <640°C
TA
Фо
кор
Фо
nep шп
кв
16. >78О°С
nep
urn
14.<690°0
TA
wo
кор
ТА
Фо
12а.<635Ъ
Bp
nep
шп
кв
15. <7Q0°C
nep
ШП
mp
17.-1300*0
ПЭНС
Фо
Фиг. 1500. Изотермальный разрез при 900°С и
Pr2O системы MgO-AJ2O3-SiO2-H2O, спроектиро-
ванный из вершины Н20 четверной системы
Fawcett J.J., Yoder НА. Camegie Inst. Washington.
Year book, 1962-1963, §& 144
кор
кв+сил+ж
СШ1+Ж
КОрд+Ж
Форстерит
MgO
энстатит
SiOg
«W“'4>+“/W
AljO,
Sec. %
---v
шпинель
/tf+знс^+ж
9НСт0.р<
энс^+кор+ж
Фо+знс^ип^
корд torn + ж
кор+корд+ж
tKpp+canty
кор+сап^ко#
10 кбар
51
401
\l,0- Mg0-Si0,-H,0
Фйг. 1501. Р-Т проекция фазовых отношений с участи-
ем кианита в системе MgO—А12О3—SiO?—HnQ ПРИ
давлениях 8—11 кбар и температуре 650-820 С. Нуме-
рация инвариантных точек (I^, 1g и т.д.) произволь-
ная* Кривые реакций, не включающих кианит, не пока-
заны* Относительное расположение инвариантных точек
и одновариантных кривых определено по правилу
Скрейнемд^р^г точное их положение экспериментальво
получено ие во всех случаях* Для упрощения ие учиты-
вали тальк с малым содержанием А1
Schreyer W.t Seifert F. Am. J. Sci, 1969, 2^, 3, 374
400 500 600 700 °C
Фиг. 1502. Р-Т решетка стабильных реакций в части
системы MgO-A]2O3-SiO2-H/). Поля устойчивости
полиморфных модификаций силикатов алюминия даны
по результатам Richardson S.W., Gilbert М.С., Bell P.M.
(Am. J. Sci., 1968, 266. 513-541)
Фиг. Ц5ОЗ. Треугольники составов в системе А12О3-
—MgO—SiO2—Н20 для различных давлений и температурь
Отношения вблизи угла MgO диаграмм ие исследовались
автором* Возможная нестабильность сапфирина при
Р“20 кбар и температурах выше 775 С не принимается
в расчет
Seifert F,, Schreyer Ж. Contr. Miner. Petrol.
1970, 27, 3, 236
Schreyer Ж. Camegie Inst. Washington, Year book,
1966-1967, 66, 390-391
402
ме альбит - вода на плоскость температура - концентра-
ПИЯ
Goranson R.W. Am. J. Sci., 1938, 35A. 5 сер., 85
Давление j кбар
Фиг. 1505. Растворимость воды в альбитовом расплаве
в температурном интервале от 900 до 1200°С
Goranson R.W. Am. J.Sci., 1938, 35А, 5 сер., 78
Фиг. 1507. Р-Х проекция политермических трехфазных
(тв.«-ж + п) кривых в системе NaAlSiO4—SiO 2-Н2О.
Показана растворимость Н20 в расплаве и растворимость
твердой фазы в сосуществующем паре. 1 - растворимость
Н20 в расплаве NaAlSi30o при давлении ниже 10 кбар
по данным Bumham C.W., Jahns R.H. (Am.J. Sci, 1982,
260, 721-745) и выше 10 кбар по данным авторов; 2 -
состав газовой фазы в системе NaAlSi^Og-Н20 (Bum-
ham C.W. в книге Claik S.P. Handbook of physical con-
stants: Geol. Soc. America Mem., 1966, • 97, 587);
3 и 4 - растворимость в системе SiO2—Н20 (Kennedy G.C.,
et al. Am. J. Sci, 1962, 2flQ, 501-521); К - вто-
рая критическая точка; 5 - растворимость в системе
NaAlSi04-H«0 (по данным авторов); 6 - растворимость
в системе NaAlSi2€L-H2O выше 10 кбар по данным
авторов, ниже 10 кбар по данным Peters Т. et al (Am.
Min., 1966, 51, 736-753). причем состав моновариантной
жидкости в пересчете на безводный расплав изменяется
от Аб-g Неф24 при ] атм до приблизительно Аб^ Неф^
при 10 кбар, а состав жадеита NaAlSi20g соответствует *
Абб5 НвФзб» Знаком X отмечены составы инвариантной
жидкости и пара в точке I5 на фиг. 1506. Зачернен-
ными символами обозначены экспериментально установ-
ленные пределы растворимости воды в расплавах.
Boettcher A.L., Wyttie PJ. Am. J. Sci., 1969, 67, 900
Фиг. 1506. P-T проекция системы NaAlSiO4-SiO2-H2O
Для системы NaAlSiO4—Si02 использованы данные
Bell P.M., и Roseboom E.H.Jr. (Camegie Inst. Washing-
ton, Year Book 1964-65, 64, 139-141). Кривая солидуса
в системе Si02—Н20, оканчивающаяся во второй кри-
тической точке К2» показана по данным Kennedy G.C.,
(Am.J.Sci., 1962, 260, 501-521)
IjSj — моновариантная линия Жд Аб+Ж; - моновари-
аитная линия Жд+Аб jfc Ж; - моновариантная линия Аб 3* Жд+
+ Ж; выше 12 - моновариантная линия Жд+Кв и» Ж. Инвариантная
точка I9 и кривые, выходящие из при низких температурах
показаны схематически
Boettcher A.L., Wyllie Р. Am. J.Sci., 1969, 267, 899.
403
NaAlSiO —SiO„—Н О
4 Z L
НгО
Фиг. 11508. Схематичные изобаро-политермические диаг-
раммы системы NaAlSiO^—Si02—Н2О в вес.%. Систе-
ма рассматривается как тройная, хотя составы жидко-
Фиг. 1510.1 Превращение синтетического стекла жадеи-
тового состава. • *Теоретическая* кривая отмеченная
как равновесная кривая для реакции аб + неф“2 жд,
согласно расчетам Kelley К.К. et al., U.S. Bur. Mines
Rept. In vest.J953, 4955)
1 - жадеит; 2 - жадеит + альбит + нефелин; 3 г альбит + нефелин;
4 - жидкость
Robertson E»C,t Birch F,t MacDonald G.J.F» Am.J. Sci.,
1957, 255, 2, 125
сти и пара могут отклоняться от этой системы, особен-
но к линии NaAlSiO4-H2O
К - тройная критическая точка^ а, б, с, и т.д. - моновариантные
(изобарически инвариантные) точки. Точечные линии Алькемаде.
представляют максимумы температур и соединяют составы кристал-
лических фаз и сосуществующих жидкости и пара. Пунктирные линии -
изотермические границы полей
Boettcher A.L., Wyllie PJ. Am. J.Sci., 1969, 267. 902
Давление, кбар
Фиг. 1509. РТ-проекция кривой кристаллизации альбита
в системе альбит - вода
Фиг. 1511. Стабильность анальцима в присутствии во-
ды, насыщенной NaAlSi206, ^^О^общ
1 - смесь окислов+Н20—альоит + нефелин + Н20; 2 - смесь окяс-
лов + Н2О-^анальцим; 3 - анальцим—альбит +нефелин + Н20; 4 - аль-
бит + нефелин + Н2О-«>аиаль&им
Greenwood Н J. Geoph. Res., 1961, 2S, 3931
Goranson R.W. Am. J. Sci., 1938, 35A. 5 серия, 89
404
AIO—Na„O—SiO„—НО
Z, & L CL
Фиг. 1512. Стабильность анальцима при q
равновесн. при 500 С • *
Greenwood H.J. J. Geoph. Res., 1951, fig, 3141
Фиг. 1514. Суммированная диаграмма фазовых отно-
шений в системе состава анальцима (Boettcher, Wyl-
lie - см. фиг , 1506).
Manghnani М, Phys. Earth Planet Interiors, 1970, fi, 460
Фиг. 1513. Фазовая диаграмма системы NaAlSi^Og—Н2О
Показаны 2 возможные кривые для реакции жа-
деита по данным Fyfe W.S., Valpy G.W. (Am. J. Sci.,
1959, 257, 316). Пунктирная линия - геотерми-
ческий градиент, 20 /км
Campbell A.S., Fyfe W.S. Am. J. Sci., 1965, gfifi,
9, 807-816
Фиг. 1516. Фазовые равновесия в системе нефелин -
альбит - вода при Р^О “1000 кг/см^.
Edgar A.D. J. Geol., 1964, 72, 4, 451
Фнг. 1515. Система NaAlSiO^— Н2О
1 - нефелин; 2 - нефелин водный I,; 3 - нефелин
водный I + парагонит; 4 - анальцим + цеолит "В"; 5 -
цеолит*В" + разновидность " Y" ; 8 - продолжительность
опытов в днях
Saha Р. Am. Min.,1961, 46, 7-8, 868
Ю 20 30 40 50 60 70 80 SO
Нефелин Вес.% Альбит
405
AI2O3-Na2O-SiO2-H2°
Фиг. 1517. Бинарная система NaAlSiOj-NaAlSi^Og
при различных давлениях. Диаграмма для 1 бар по
Greig J.W., Barth T.F.W. (Am. J. Sci., 1938, 35-A.
5 cep., 93-112). Отношения в области ликвидуса боль-
шей частью гипотетические
Robertson Е.С., Birch FMacDonald G.J.F. Am. J. Sci.,
1957, 255, 2, 133
600 650 700 750 °C
Фиг. 1519. Инвариантная точка в системе NaAlSiO4~
-NaAlSi30g-4l20,rae сосуществуют твердый раствор
анальцима, твердый раствор нефелина, альбит, жидкость,
пар. Показаны кривые соответствующих моновариантных
равновесий
Peters Т., Luth W.C,, Tattle O.F. Am. Min., 1966, §1,
5-6, 742
H&p H?p
Фиг. 1518. а. Состав моновариантной жидкости в нача-
ле плавления. Экспериментальные данные показаны пря-
моугольниками. Цифры у прямоугольников - давление
в кбар. Линия Е - Е' данные Edgar A.D. (J. Geol.,
1984, 72. 448-460) при 1 кбар.
б. Политермо-полябарическая диаграмма составов
для моновариантной и инвариантной жидкостей. Кривые
АБ и П - схематические.
в. Изобарически - политермальная диаграмма для
возможных фазовых отношений при 10 кбар. Понижение
температуры вдоль граничных кривых показано стрел-
ками. Изображение схематическое.
Peters Tj., Luth W.C., Tuttle O.F. Am. Min., 1966, £],
5-6, 7*5
нар.Мн.1
нар.
'•S*
^0
Нвф
(а)200°-370°С
нар.водн.1
нар.№н.1+
нг° **
7v.p-p
а>ш*.р-р*п”
нар
(Ь)370°-380°С
Фиг. 1520. Изобаро (1020 атм) - изотермальные се-
чения для системы NaAlSiC^-NaAlSi-^Og-Н2О Составы
в мольн. %
Saha Р. Am. Min., 1961, 46, 7-8, 873
нар.МШ
нар.додн.1+
*"яГв.р/П
ШЮЛ/Ар-р+Аб+П
миЛр/п
"РЛр-р™
«Щрр-р+П
(б)440°-530Ъ
(03X6-440^
*fap-p+n
"ЧН-р-р*
Н*° / аналл.р.р+Аб+п
OHUrirfn
неч>лр-р+п. №Ч>
нар
(в) 530°-560°С
мр-Ару*
+анал+П
(f)560°C
Н,0 / Аб
анал+Аб+п
м***™™^ (д) 560°-600°С
н-о / ,Аб
^т6.р^^п
406
Al О —Na_O—SiO,—H_O
* О £ £ £
Фиг. 1521. Фазовые отношения в системе NaAlSi^Og—
-SiO2-H2O
А. Политермо-полибарическая диаграмма составов,
показывающая изменение состава моновариант-
ных жидкостей в равновесии с альбитом, кварцем и
парообразной фазой. От 1 до 4 кбар - данные Tuttle O.F.,
Bowen N.L. (Geol. Soc., Am. Mem., 1958, 74, 1-
153); or 5 до 10 кбар - данные Luth W.S., Jahns RJi.,
Tuttle O.F. (J. Geoph.Res., 1964, 69, 759-773). Точка
для 1 атм - Schairer J.F., Bowen N.L. (Am. J. Sci.,
1956, 254, 129-195) - относится к равновесию, включаю-
щему тридимит, а не кварц.
Б. Изобарическая (Р“ 10кбар) политермическая диаг-
Фиг. 1522. А. Кристаллические фазы в системе А^О^—
—Na2O-SiO2— Н20 Составы спроектированы на безводное
основание. Звездочки указывают дополнительные синте-
тические составы, приготовленные и исследованные.
Б. Треугольники стабильности, показывающие трехфаз-
ные кристаллические ассоциации в равновесии с водной
фазой при Рн90 = 1020 атм и 250°С. Неясен интервал
стабильного состава для монтмориллонитов; возможно,
что зачерненные области слишком большие. Треуголь-
ники слегка искажены от соотношений фиг. А.
Sand L.В., Roy R.t Osborn E.F., Econ. Geol., 1957, 52,
2, 170
рамма составов, показывающая изменение состава ди-
вариант ных жидкостей в равновесии с Аб, П; Кв, П н Аб,
Кв. Допускается, что давление влияет на равновесие толь-
“10кбар) диаграмма составов, аналогичная Б, но совпа-
дающая с имеющимися данными
Luth W.C. Am. J. Sci., 1969, 267A, 333
Фиг. 1523. А. Треугольники составов для интервалов
температуры 290-400 и 400-420°С при 1020 атм.
Б. Треугольники стабильности для интервалов тем-
пературы 420-460 и 468-480°С при 1020 атм.
SandL.B.t Roy R., Osborn E.F., Econ. Geol., 1957,
2, 173
407
Al2O3-Na2O-SiO2-H2O
Фиг. 1524. А. Треугольники стабильности для интервалов
температуры 480-525 и 525-580 С при 1020 атм.
Б. Треугольники стабильности для интервадов тем-
пературы 580-625 и 625—700°С при 1020 атм.
Sand L.В., Roy R.t Оз bom E.F. Econ. Geol., 1957, 52,
2, 174
Na2O
Фиг. 1526. Полибарические равновесные соотношения
в системе Н20—Na2O—SiO2— А^О^при 450 С. Проекция
на тройную плоскость сечения 1.5-6% AI2O3 тетраэдра
H2O-Na2O-SiO2-Al2O3 при 450°С. Поле I - поле фазы
X или Y, в зависимости от отношения SiO2— А 1^0^.
По мере приближения к углу SiO2 возрастает вероят-
ность стабильности X. Поле II занято X при высоком
давлении Н20 и при низком давлении только раствором.
Поле III при промежуточном давлении - поле альбита и
при низком давлении - поле раствора. По-видимому,
это будет поле анальцима при очень высоких давлениях.
Поле IV - поле альбита
Na^O
Фиг. 1525. Полибарические равновесные соотношения в
системе A^Oj—Na2O—SiQ—Н20 при 300°С. Про^к’шя на
тройную плоскость сечения тетраэдра
“АЬО^при 800 С. Проекция сечения с содержанием
А120з в интервале 1,2-1,7%.
Friedman Z.J. Geol., 1951, 59. 1, 24
Фаза о/ /о О/ /0
X Y
Na2O 25,6 25,4
AI0Q3 27,5 32,0
SiO2 38,6 36,8
H2d 6,8 6,6
Общее 98,5 100,8
Friedman I. J. Geol., 1951, 59, 1, 26
CaO-MgO-SiO2-H2O
Давление,1 кбар
°C
300
800
700
°C
900
800
700
10 20 30 40
Mg$i03 I
DGC.%
10 20 30 40 50
Ca(0H)2 Mg2SiO4
Фиг. 1527. Фазовые поля на линии составов Са(ОН)2 —
-MgSiC^ и Ca(OH)2-Mg2SiO4 при Р=1 кбар
Franz G.W., Wyllie P.J. Geoch. Cosm. Acta.,
1966, 30, 1, 16
408
CaO- MgO-SiO2- H2O
Фиг. 1528. Схематическая диаграмма системы CaO—
-MgO-SiOz-f^Onpn давлении 1 кбар.
ABC - поверхность насыщенного паром ликвидуса; пунктир ХУВ -
линия температурного максимума на этой поверхности. Фазовые от-
ношения выше ХУВ приняты аналогичными таковым в безводной
системе CaO—MgO- SiO2, ниже - основаны на экспериментальных
результатах. В скобках - предполагаемые температуры; 2Ж - область
иесмесимости жидкостей, Wj - эвтектическая точка с составом
жидкости: Са(ОН)2 - 98,7%; CaSiO4 - 4,3%; MgO - 2,5%; Н20 - 0,5%;
W2 - перитектическая точка с составом жидкости Са(ОН)2 - 62,1%;
Ca2SiO4 - 25,6%; MgO - 11,3%; Н20 - 1,0%
Frans G.W., Wyltie P.J. Geoch. Cosm. Acta, 1966, 30,
1, 19
Фиг. 1529. Диаграмма плавкости в системе форстерит -
диопсид - кремнезем при давлении воды 20 кбар. Проек-
ция из вершины Н2О четверной системы форстерит -
диопсид - кремнезем -
Kushirol. Am. J. Sci., 1969, 2SZA, 283
Фиг. 1530. Равновесные РТ-кривые для реакции диссо-
циации брусита, антофиллита, тремолита
Weeks W.F. J. Geol., 1956, 64. 5, 468
Фиг. 1531. РТ - диаграмма для состава Ca2Mg$i2O?,
представляющая главным* образом окерманит или близ-
кий к нему состав, в присутствии избытка воды. Семь
более мелких значков между 2 и 4 кбар показывают
опыты Harker R.I. Tuttle O.F. (Am. J. Sci., 1956, 2S1»
468-478)
Yoder H.S. Camegie Inst. Washington, Year book,
1966-1967, fig, 473
52
409
CaO-MgO-SiO2-H2O
12
11
10
1400 T
1300
° 1200
10 20
Деление, кбар
Фиг. 1533. А. Зависимость температуры плавления диоп-
сида от давления HjO
1 - данные автора; 2 - данные Yoder H.S. (Camegie
Inst. Washington Year book 1965-1966, 65, 269 в Camegie
Inst. Washington. Year book 1984-1965, 82).
Б. Зависимость от давления разности температур плавления
диопсида в 'сухой* системе и в присутствия водяного пара (Л Г)
1 - по данным BoydF.R., England J.L. (Camegie Inst.
Washington. Year book, 1957-1968, 57, 173), Yoder H.S. ( 1966);
2 - по данным автора и Boyd F.R., England J.L. (1958).
Рябчиков И.Д. ДАН СССР, 1968, 181. 1, 208
pl-----1---1--fj----1----1----1---1----U---1---
600 700 800 900 Ю00 1100 1200 1300 1400 1500 1800%
9
8
7
6
4
3
2
1
Фиг. 1532. РТ-диаграмма для состава диопсид 20, мон-
тичеллит 80 вес.% в присутствии избытка воды ниже
начала плавления системы, насыщенной водой, и без
воды - выше. Мелкие значки относятся к опытам Ku—
shiro 1., Yoder H.S. (Year book 63) на аппаратуре с
твердой средой, передающей давление. Walter L.S.
(1963) - по данным Walter L.S., (Am. J. Sci., 1963, gfiL
488-500)
Yoder H,S. Camegie Inst. Washington Year book
1966-1967, 66, 475
Фиг. 1534. Изобарно-изотермический разрез системы ^O-MgO-SiC^-^O, спроектированной на безводное
основание (М - конечный член)
Seifert F., Schreyer Ж. Вег. Bunsenges. Phys. Chem., 1966, 70, 9-10, 1048
410
Системы из 3-х окислов под давлением НгО
и контролируемым парциональным давлением Н2Ю2)
7
400 500 600 500 600 700
стМ+
- +Кв QJH+ЩЛ+кб
I
□ м
- л
----1---1--1___L
3
7
5
3
1
600 700 800 °C
Фиг» 1537. РфТ - проекции экспериментально наблюдав-
шихся реакций
1 — рост низкотемпературных групп; 2 - рост высокотемпературных
групп. Все эксперименты содержали избыток флюида при использовании
буфера кварц-фаялит-магнетит.
Richardson S.W. Camegie Inst. Washington. Year book,
1966-1967, jg, 399
500 1000
общее давление f кг/см2
Фиг. 1535. РТ-Диаграмма равновесных состо-
яний для приближенно-тройного сечения: Fe2SiO^—
-Na2Si3O7-H2O/H2. Составлена по экспе-
ркментальным данным
1 - расплав (стекло); 2 - кристаллы; 3 - кристаллы и
стекло
Островский И.А. Тр. ИГЕМ АН СССР, 1956,
вып. 1,146
Al203-Fe0-Sl02-H20-02
11
10-
9 -
8 -
* 6
5
4
3
2
1
O’---------i-
600 700
Cmd+n
7
• 2
o3
o4
05
\
\
+Ж+Л
><9-М"тв.р-р+
+Сил+П
500
600
700 °C
Фиг» 1538. Log fo2—T
диаграмма (при общем
давлении 10 кбар) для ча-
сти системы FeO—А^О^—
-S i02 —Н2 О—^показываю-
щая вероятный интервал
взаимодействия Хлд+О25±
Став+Мт+Кв»
Ganguly J., Newton R.C.
J. Petr., 1968, & 3,
448» См. также Gan-
gufy J, Am. J. Sci., 1968,
4, 287
Фиг. 1536. РТ-крнвая верхнего предела стабильности Fe - ставролита
до давления 10 кбар; летучесть кислорода задана кварц-фаялит-магнети-
товым буфером. В капсулах избыток воды. Исходные материалы - син-
тезированные кристаллические фазы с валовым составом 4FeO*9Al9Oq*
•8SiC^ 2 J
1 - из исходного ставролита образуются продукты распада; 2 - исходные
альмандин-герцийит-силлиманит с зародышами ставролита не реагируют с за-
метной скоростью; 3 - из исходной смеси альмандин-герцинит-силлиманит с
зародышами ставролита растет ставролит; 4 - из исходной смеси с зародышами
ставролита над кривой распада при соответствующем давлении растет ставро-
лит; 5 - исходный ставролит ие реагирует.
Richardson S.Ж., Camegie Inst. Washington. Year book, 1965-66, 65, 249
800
900 Ю00 Ъ
О кривой верхнего предела стабильности см» также Hoschek Gert. Na—
turwiss., 1968, 5S, 5, 226-227
411
Al £ 3-FeO-SiO2-H 20-02
Фиг. 1539. Равновесная P-T коивая реакции 54Хлд+
*8О2-12Огав+10Мт4вКв+48Н2О
Ganguly J. Newton R.p. J. Petrology, 1068, fi, 3, 463
мандина при летучести кислорода железо-вюститового
буфера.
Или L. J. Petrology, 1968, 9, 60
Фиг. 154О.РфЛюад-Т диаграмма стабильности альмандина
при летучести кислорода железо+кварц - фаялитового
буфера
дина при летучести кислорода фаялит - магнетит + квар-
цевого буфера.
Hen L. /.Petrology, 1968,9, 59
Hsu L. /.Petrology, 1968,2, L 61*
412
А10,—FeO—SiO—H O-O„
£, Л L &
3500
3000
О МО □ □ □ X □
-2500
кв+Ъ-ХЛ+Мт+Ф
2000
1500
1000
500
кв +reprf'p.p
+Мтте.р-р+ф
□
усв+Ир-МпнФ
О ------1-----1-----1-----1-----1-----
400 500 600 700 600 900 Ю00°С
Фиг. 1543. Рфлюид “ Т диаграмма стабильности аль-
мандина при летучести кислорода никель-бунэеиитового
буфера
вого валового состава при летучести кислорода буфер-
ных смесей магнетит-вюстит и магнетит - железо.
И«в L. J. Petrology, 1968,5, 1, 63
Ernst W.G. Am. J. Sci., 1966 » 264> 1» 56
вого валового состава при летучести кислорода буфера
магнетит + кварц - фаялит.
Фиг. 1644. P, - T диаграмма для валового состава
флюид
спессартина. Летучесть кислорода не фиксирована.
Л — равновесие, 2 — рост фаз или группы фаз из смесей.
Н.п L. J. Petrology, 1968, b 73
Ernst W.G. Am. J. Sci., 1966, 264, 1, 57
413
CaO-HeO-SiO2-H2O-O2
FeO—MgO—SiO,—НО—О,
Л 4 £
3500
3000
В- 2500
>8
♦
*
$ .
?’ /
/
/
/
/
/
/
1*®
- □□
1500
мт+кв+гедпц+Ф
Ю00
500* •
al-------1-----1------1------1------
350 400 450 500 550 600 °C
Фиг. 1549. Предварительная fQ^ - Т 'проекция поверх-
ности стабильности оливина при давлении 2000 бар (по
предварительным результатам) •
Фиг. 1547. Отношения Рф^вд - Т фврротремолито-
вого валового состава при летучести кислорода, опреде-
ляемой буфером бунзенит - никель.
Ernst V.G. Am. J.Sci., 1966, 264,1, 58
Фиг. 1548. f — Т диаграмма при давлении флюида 3000 бар;
______ °2
пунктирные границы полей рассчитаны или подра-
зумеваются.
Кривые 1,4, 8 - изобарические моновариантные рав-
новесия, соответственно, гематит-магнетит, магиетит +
+ кварц - фаялит, фаялит - кварц + железо.
Цифрами обозначены реакции: 1 - Опир + Мт Ол ♦ Кв + О_;
2 - Амф + ,Ол + Мт - Опир + Oj + FLO; 3 - Та + Ол + Мт Амф +
♦О2 +Ц^О; 4 - Та + Мт - Ол + Кв + О2 + Н^О; 5 - Амф + Мт -
Ол+Кв+Ог+ н2°. Кривые реакций 1 - 5 (проекции граней поверхности
стабильности оливина) показаны толстыми линиями: в - Амф+ Мт “ Опир+
+ КВ+О2+Н2О; 7 - Та+Мт = Амф+Кв+О^+НгО; 8 - Кв+Та+Ол-Амф+
+ Н2О; 9 - Кв+Ол+Амф-Опир+Н2О. Кривые реакций 6-9 (вне поверх-
ности стабильности оливина} показаны тонкими линиями. Стрелками по-
казано направление реакции, обозначенной соответствующей цифрой, в
эксперименте. Состав силикатов на диаграмме вверху слева показав
схематически. Масштаб температуры линейный по отношению к 1 /Т •
Буферы: Мт - Гт (Fe^-Fe^), Мп MnO(MnO-Mn3O4),Ni NiO(Ni-NiO)
Fisher G.W. Camegie Inst. Washington. Year book
1965-66,65,214
Фиг. 1550. 1A — рассчитан|ная кривая равновесия фор-
стерит (90) +пар +кислород-серпентин + брусит + магнетит.
IIд - рассчитанная кривая равновесия форстерит (90) +
+ тальк + кислород + пар - серпеитит+ магнетит.
Olsen Е.. Am. J. Sci., 1963, ggj, 10, 949
Entst W.G., Am. J.Sci., 1966, 264, 1, 59
414
FeO-NajO-SiOj-H 2O-O2
Пятикомпонеятные
о
°C
-5000бар
1300
2000
1500
1100
1000
500
900^
500 600 700 800 300°C
Фиг. 1551. Стабильные фазовые ассоциации в координа-
тах f_ - Р - Т для валового состава Na?O *5FeO •
°2 флюид z
*8SiO2+ избыток Н^О. Инвариантные поверхности ста-
бильности показаны буквами: Т " Т СС' X* (фаяИит +
+ кварц + акмит + рибекит - арфведсонит + жидкость);
Т'" U"z IT (фаялит + кварц + рибекит - арфведсонит +
+ жидкость + флюид); Тz/z Т " X' (кварц + энигматит +
+ акмит + рибекит - арфведсонит + флюид); Т*" X* Y *
(фаялит + кварц + энигматит + акмит + жидкость);
T*z Ur U*Y (фаялит + кварц + энигматит + жидкость +
+ флюид); Тн* Т* Y (кварц + энигматит + акмит + жид-
кость + флюид); Т* т" Т' Z* U* (кварц + эниг-
матит + рибекит-арфведсонит + жидкость + флюид);
А А* А** А* (гематит + кварц + акмит + рибекит +
+ флюид); АСС'А* (магнетит + кварц + акмит + рибе-
кит - арфведсонит + флюид); СТ Т** X' С (фаялит +
+ кварц + акмит +рибекит - арфведсонит + флюид); (JZZ*
U* (железо + кварц + рибекит - арфведсонит + жид-
кость + флюид); FF* G'u (гематит* кварц + акмит+
+ жидкость + флюид); FF*Н* Н (магнетит + кварц + ак-
мит + жидкость + флюит); HTT* Y * Н’ (фаялит +
+ кварц + акмит + жидкость*флюид); AA’F'" F" (бу-
фер гематит-магнетит); ССЛ Н/м Ня (буфер магие-
тит + кварц - фаялит); UU* U’W' W (буфер фаялит - же-
лезо + кварц); Т,м инвариантная точка (при наиболь-
шем Рп ), где сосуществуют фаялит + кварц + энигма-
2
тит + акмит + рибекит - арфведсонит, жидкость и флюид.
Ernst W.G. J. Geol., 1962, Ifi, 6, 728
Al o0 -CaO-К 9O-SiO 9-H „0
О £ £ £
700 |r
KAlSl,Oe 20
80 СаА^М
40 60
Вес,9/,
Фиг. 1552. Проекция тройной системы KAlSLCL-CaALSLCL-
-Н20 при Рн 0 « 5000 бар. 6 °
Yoder H.S., Stewart Y.R. Camegie Inst. Washington. Year
book, 1956-1957, $6, 207
A1203 _CaO-MgO-SiO2 -H 20
100 80
60 40 20
% okh Омел
Фиг. 1553. Низкотемпературные отношения при разру-
шении смешанных кристаллов безнатрового окерманита -
геленита при q от 4,8 до 6,7 кбар
Christie О. Norsk.Geol. Tidsskrift, 1961, 41, 257
415
Al 20 3_CaO-MgO-SiO 2-H 20
Фиг. 1554. Проекция системы диопсид-анортит - вода
приРн о= 5 кбаР
Yoder H.S. Camegie Inst. Washington. Year book,
1964-1965, 64, аз
Фиг. 1556. Границы ликвидуса форстерит-ортопироксен
в системе форстерит - CaA^SiOg - кремнезем - Н^О
при 20 кбар в условиях насыщения водой и без Н^О.
Граница в условиях насыщения Н^О спроектирована из
вершины на плоскость форстерит - CaA^SiO^ -
кременезем
Kashi го I. Camegie Inst. Washington, Year Book, 1968—
1969, 242
Диопсид Вес,9/о Анортит
Фиг. 1555. Проекция системы диопсид-анортит- вода
приР„ гГ 10 кбар
Н2°
Yoder H.S. Camegie Inst. Washington.Year book, 1964-
1965, 64, 84
Нг0
Диопсид Анортит
Вес>7,
Фиг. 1557. Система диопсид-анортит-Ъода при 1110°С
и Р ° 10 кбар. Соединительные линии с диопсидом
общ
схематичны, так как в этой плоскости не могут быть
показаны твердые растворы. Допускается некоторое
распространение поля газа. Поля Ди + Г и Ан +
тв.р-р
+ Г, соседние с частями разрезов диопсид - Н^О и анор-
тит - Н^О, соответственно, не показаны из-за их огра-
ниченности и неопределенности размеров
Yoder H.S. Camegie Inst. Washington. Ydar book, 1964-
1965, 64, 85
416
Al /^-CaO-MgO-SiOz-HjO
Фиг. 1558. Проекция трехфазных кривых в системах
диопсид - вода и анортит - вода наряду с четырехфаз-
аой кривой в системе диопсид - анортит - вода.
Yoder H.S. Camegie Inst. Washington. Year book, 1964—
1965, 87
Фиг. 1559. PT - диаграмма системы анортйт-форстерит-
вода, в которой отношение анортита к форстериту равно
1/1 (в молях). Величины для 1 атм - по данным Schai-
rer J.F., Yoder H.S. (Camegie Inst. Washington. Year book,
1965-66, 55). Плавление при 10 кбар - по данным
Yoder H«S.,Chinner G.A. (Camegie Inst. Washington. Year
book, 1959-1960, 59, 71-81)
Yoder H.S. Jr. Camege Inst. Washington. Year book,
1965-66, 65, 276
ec
ФиГ. 1560. По предварительным
данным сечение гроссуляр -
пироп—Н2О при 10000 бар
1 - жидкость + пар; 2 - кристал-
лы + жидкость + пар; 3 - кристаллы +
+ пар. Поверхность ликвидуса и пер-
вичных кристаллов, определенная при
1 атм Schairer,Chinner (Year book
1900-1960, 09. 73), показана в верхней
Yoder H.S. Jr., Chinner G.A.
Camegie Inst. Washington. Year
book, 1959-1960 59. 79
1400
1200
Шп
1000
Ъ*Шп*Ж*П
WO
Шп'К'П
й ум'Шг^П х
SOO
.Жц^и^Ок-ЧМ
^яй^^К'П
K4f3Mmirfton'K'n
J№vlfy1jt'AMp
JHCfrfp-p +Лир*Сан+П
Хл+Та'Сап+П
Лл*1а+Амдг*Сап*П
-Л*Ф*ЭНСаЛ„*сви+Шп*П
ух ^|«\>r=?
J—__I____I___
600 I 1 । » । । ।
Гроссуляр 20 40 60 80 „Пироп"
ЗСоО-АЦОз’Шг о/ • £ xj ЗМдОАкО5-3$1Ог
53
417
A1„O—CaO—Na„O—SiO—Н„0
Z о Z Z Z
1234* Фиг. 1563. Fe - хлорит стабилен внутри объема с за-
СаЛЦ$120в штрихованными сторонами.
ВвС,7,
1ВО, „ Титоск Л.С. Camegie Inst. Washington. Year book.
Фиг. Предварительная проекция на безводное ос- 1959—1960 59 99
нование системы альбит- анортит - кварц - вода при ’ ’
Р = 5 кбар.
Yoder. Я.S. Jr. Camegie Inst. Washington. Year book,
1966—1967, 66,478
Фиг. 1564. Предварительные фазовые отношения в сис-
теме А^О^—FeO—Fe2O^-SiO2~H2O. Pq^ изобаричес-
кое сечение при Р^ в 2000 бар
1 - известные границы полей; 2 - подразумеваемые границы
полей; 3 - буферные кривые
Титоск А.С Camegie Inst. Washington. Year book,
1959-60, 50, 103
Фиг. 1562. Проекция тройной.системы NaAlSi^Og—
—CaAl2Si20g—l^O. P^Q =$000 бар
Yoder H.S., Stewart D.B., Smith Y .R. Camegie Inst.
Washington. Year book, 1956-1957, 56» 46
418
+ / о 2 хЗ ей Мол/7о
Фиг. 1565. Опыты по синтезу в системе KAJSijOg-
KFeSi3Og-H2O при 1400 бар.
1 - микроклин; 2 - санидин; 3 - две фары разного состава;
4 - смесь микроклиновой и санидиновой моцн4*и^дий.
Eberhard Е. Mjperalogische Petrograph is ch е Mitteilungen
1965, Ifl, 1-4, 403
Фиг. 1566. Пунктирные кривые - изобары (цифры около
кривых - давление, кбар), указывающие грубые при-
ближения к максимальной- стабильности твердых раство -
ров альмандин-пироп. Гранат стабилен ниже изобар;
гранат + продукты разрушения стабильны непосредст-
венно выше изобар. Сплошная кривая - эксперименталь-
но определенный максимум твердого раствора граната
при более высоких температурах для 10 кбар. Гранат
стабилен только ниже кривой; гранат + продукты раз-
рушения стабильны непосредственно выше кривой. То-
чечно-пунктирная кривая дает максимум твердого раст-
вора граната при более низких температурах для 10 кбар.
Гранат стабилен выше кривой; гранат + амфиболсодер-
жащие группы стабильны непосредственно ниже кривой.
Точка А - максимум твердого раствора граната, пред-
сказанный для 925 С и 10 кбар.
Yoder H.S. Jr., Chinner G.A. Camegie Inst. Washington.
Year book, 1959-1960, 59, 83
20 3"Fe 2° 4“N a 2°“S i02-H 2°
4 *> 4 •> 4 4 4 ’
Фиг. 1567. Изобарическая равновесная диаграмма для
части системы NaAlSiO^— NaFeSi20g— Н20 при Р^ О =
= 1000'^2 , включающая данные для атмосферного дав-
ления в системе NaAlSiO^—NaFeSi2O^ Yagi К. (Camegie
Inst. Washington. Year book, 1962, £1, 98—9)
1 - трехфазное поле; нефелин + акмит + пар; 2 - пятифазное
подр, нефелин + акмит + магнетит + жидкость + пар; 3 - четырех-
фазные поля, акмит + магнетит + жидкость + пар и нефелин * маг-
нетит + жидкость + пар; 4 - трехфаэное поле, магнетит + жидкость +
+ пар.
Nolan J. Quart J. Geol. Soc., London. 1966, 122.125
Фиг. 1568. Изобарическая равновесная диаграмма для
системы NaAlSiqOQ-NaFeSi9O<-H9OnpHP = 1000
3 8 262 Н2О СМ4
1 - трехфазное поле, альбит + акмит + пар; 2 - пятифазное по-
ле, альбит + акмит + магнетит + жидкость + пар; 3 - четырехфазные
поля, акмит + магнетит + жидкость + пар и альбит + магнетит +
жидкость + пар; 4 - трехфазное поле, магнетит + жидкость + пар.
Nolan J. Quart. J. Geol.Soc., London., 1966, 122.130
419
AI О —Fe „О —N a ,O-S iO ,-H .,0
NaJUSiO,
NaALSl3Of 20 40 60 30 NaFeSltO6
Bea, */o
Фиг. 1569. Изотермы (цифры на кривых - температура,
С) для части поверхности 'ликвидуса', определенные
в системе NaA^Cfe -NaAISiC^-NaFeSioCfe -Н20 при
Р»_| q = 1000 —j • Термин 'ликвидус^ использован
1 2 см
для обозначения граничной поверхности, отделяющей фа-
зовый объем жидкость + магнетит от фазовых объемов
альбит + жидкость + магнетит, нефелин + жидкость +
+ магнетит, акмит+жидкость + магнетит»
Nolan J» Quart. J. Geol.Soc., London, 1966, 122.135
A12O3-K 2O-MgO-SiO2 -Нд 0
. m woo noo т
Фиг. 1570. Кривая разложения флогопита.
Y а Е, 1054 - данные Yoder H.S., Eugster Н.Р. (Geoch. Cosm. Acta,
1954, & 157-1R5),
Данные Y a E, 1054 Данные авторов
Флогопит 1 4
Флогопит + форстерит, ,
лейцит, о—ромб KAlSiO* 2 5
Форстерит + лейцит,
о-ромб KAlSiO* 3 в
Цифры у символов - продолжительность опыте» в часах
Crowley M.S.,Roy I?. Am. Min.; 1964, 49, 3—4, 356
Al^-KnO-MgO-SiC^-H^; Ga2O3-K2O-MgO-SiO2-H2O;
Фиг. 1571. Кривые стабильности флогопит^.
1 - кристаллы Ga - флогопита; 2 - продукты разложения Ga
флогопита; 3 - кристаллы Ni- флогопита, 4 - продукты разложе-
ния Ni - флогопита
Klingsberg С., koy R. Am. Min., 1957,42, *9-10, 633
См. также Жопеа D.R. Geoch’. Cosm. Acta, 1967, 3_L,
И, 2252
6000
0120 -
5440
4700
£
| 4000
| 3400
§
? 2720
Ч
2040
Флогопит
Фо+ЛЦ+
★Оромо КС*
*/7
1360
660
0
200 300 400 500 600 700 000 900 Ю00 1100 120013009С
Фиг. 1572. Верхний предел стабильности синтетического
флогопита. Каждая точка соответствует температуре
и давлению одного или более опытов.
Yoder H.S., Eugster Н.Р. Geoch. Cosm. Acta., 1954,6, 4,
163
420
Фиг. 1575. Псевдотройное сечение при Ро^щ -10 кбар
и 1225°С системы Фо - Н^О - Лц: Кс (1:1, моль-
ное отношение). Исследованные составы, отмеченные
точками лежат в сечении К O*6MgO‘Al2O^‘6SiO2—1^0
и взяты за основу при построении этой схемы.
Yoder H.S. Jr., Kushiro I. Am. J.Sci., 1969, 267A.577
Фиг. 1573. Р-Т диаграмма составов в сечении К20«
•6MgO-Al2O3-6SiO2-H2O
1 - инвариантная точка 1 и две сингулярные точки II , III; 2 -
кристаллы + газ; 3 - кристаллы + жидкость + газ, 4 - данные по
плавлению фл Luth W.C. (J. Petrol. 1967, 372); символы отно-
сятся только к кривым А (кривая верхнего предела стабильности
флогопита в присутствии газовой фазы) hD (кривая очень близка
к минимуму плавкости в присутствии газовой фазы). Кривая В -
начало плавления ассоциации Фл + Фо + Кс (или о-ромб Кс). + Ж
без газовой фазы; кривая С - кривая верхнего предела стабильнос-
ти флогопита без газовой фазы.
Yoder H.S. Jr., Kushiro I.. Am. J. Sci., 1969, 267A. 573
9C
1500
\
\
M \
1400
1300
1200
1 X
г
J Фо*Ж \\
|| \1
Фд+Фо+Лц+Кй
Фл*Фо*Г
Р=10кб
Фо*Ж*г
Фл+Фо+Ж
УШ----и---1---1---1----1--1----1---
О 5 10 15 20 25 30 35 40
Фяозопит Вео,7о нго
Kz0 6l1gOAltOj6SiOt'
Фиг. 1574. Изобарическая Т-Х проекция богатой крем-*
неземом части разреза I^O^MgOA^O^SiC^—1^0 при
давлении 10 кбар.
Yoder H.S. Jr., Kushiro 1. Am. J.Sci., 1969i 267A, 576. •
Фиг. 1576. Возможное поле
стабильности природного
флогопита для условий
Р = Р
Н2О общ.
1 - температура в центре капсул; 2 - температура солидуса.
установленная по шлифам пробы. Вертикальные линии - ин-
тервалы температуры опытов (из-за. температурного градиента и
ошибки измерения температуры); X - неидентифицируемые мине-
ралы; А - кривая разрушения синтетического флогопита по данным
Yoder H.S., Eugater Н.Р. (Geoch. Cosm. Acta, 1954, ф, 167); В -
континентальная геотерма, по расчетным данным ClarkS.P., Ring-
wood А.Е., (Rev. Geoph. 1964, £, 35)
Kushiro I., Sy on о J., Akimoto S. Earth a. Planetary
Sci., Letters, 1967, J, 3, 202
421
ALO -К O-MgO-SiO -НО
* з * 2 2
к*
Фиг. 1577. Проекция фазовых отношений на диаграмме
к _ А|3+ -Mg2*, иллюстрирующая отношения между
твердым раствором мусковита, твердым раствором хло-
рита, флогопитом и калиевым полевым шпатом при 450°С
и Р„ „ = 2 кбар. Твердые растворы флогопита также
встречаются, но выпущены здесь для простоты и из-за
отсутствия точных данных, касающихся линии флогопит-
истонит в этой системе. Проекция предполагает избы-
ток водяного пара и избыток Si02
точки - составы исходных материалов, и протяженность твердого
растворё мусковита по данным Velde В. (Camegie Inst. Washington.
Year book. 1963-1964.63)
Fawcett J J, Camegie Inst. Washington. Year book, 1963—
1964,63,141
500 550 600 650 700 *0
Фиг. 1579. Сводная диаграмма важных реакций в систе-
ма А К F , основанная на изучении авторов и данных
Fawcett J.J., Yoder H.S. Jr. (Am. Min., 1966, 5L» 353—80)»
Поля стабильности полиморфных модификаций силикатов
алюминия взяты у Richardson S.W. et al. (J. Petrology,
1968, 9, 467 , 88; Am. J. Sci., 1968, 266. 513-41. Am. J.
Sci., 1969, 267 . 259-72). Кривая реакции кор-
диерит + мусковит = флогопит + Al - силикат + кварц*
+ пар оканчивается в инвариантной точке при 700°С и
5 кбар, не показанной на фиг.
Seifert F. J. Petrology, 1970,11., 1, 93
Фиг. 1578. Р-Т проекция, показывающая фазовые отно-
шения в обогащенной SiC^ части системы ^0—MgO—А^О^
-SiO^H2О,включающей силикаты алюминия:кианит, сил-
лиманит, андалузит при давлении в интервале 4-8 кбар
и температуре 600 - 720 С. Даны только инвариантные
точки и кривые реакций с участием свободного кварца.
Экспериментальные данные показаны сплошными линия-
ми, пунктирные линии проведены с учетом правила Скрей-
немакерса и данных по объему фаз. Фазовые границы
в системе A^SiO^ - по данным Richardson S.W.,Bell Р.М.,
Gilbert М.С. (Am. J. Sci., 1968, 266 . 7 , 513-541)
Schreyer W., Seifert F., Am. J. Sci., 1969. 267. 3. 382
422
А,2°3-К2°-Mg°-SiO2-Н2°
Фиг. 1580. PT- проекция выведенных инвариантных и
моновариантных равновесий в системе KAlSiO^—Mg^SiOjj—
-Si09-H90
1 - четверные инвариантные точки, где сосуществуют шесть фаз
разного состава; 2 - четверные инвариантные точки, где сосуществу-
ют полиморфы KAlSiO^, MgSiC>2, SiC^; 3 - предполагаемые сингу-
лярные точки; 4 - экспериментальные данные авторов. Римские пиф-
ры - инвариантные точки, арабские цифры - кривые реакций в соот-
ветствии с прилагаемой таблицей:
(1)Фл + Фо + О - ромб Кс + Лц + Ж + П
1 Фо + Лц + П » Ж; 2 Фо + Ли + О - ромб Кс + П - Ж; 3
Фл = Фо + О - ромб Кс + Лц + П; 4 Фл « Фо + О - ромб Кс +
Ж + П; 5 Фл + О - ромб Кс + П я Фо + Ж; 6 Фл - Фо + Ж + П;
7 Фл + О - ромб Кс + ЛЦ + П » Ж; 8 Фл + Лц 4 П « Фо + Ж;
9 Фл + Лц ♦ Фо + П - Ж; 10 Фл + Ж - Фо+ Лц+ П; 11 Фл+Лп +
П Ж; 29 Фл + Лц Фо + О - ромб Кс + Ж, (II) Фл + Фо+К-п.шп +
♦ Лп+Ж+П
12 К п.шп + Фо + П “ Лц + Ж; 13 Фл + К п.шп Фо + Лц + П;
14 К щшп + Фл + П = Лц + Ж;
15 К-пдпп + Фл + Лд + П я Ж; 16 К - п.шп + Фл + П я Ж;
17 Фл + Ж я К - пиши + Фо + П; 10 Фл + Ж « Фо + Лц + П;
31 Фл + К-п.шп ” Лц + Фо + Ж.
(Ill) фл + Фо + Энс + К-п.шп + Ж + П
18 К-п.шп + Энс + П я Фо + Ж; 19 Фл + Энс • К-п.шп + Фо + П;
20 Фл + Эре я Фо + Ж + П; 21 Фл + Ж я К-п.шп + Энс + П;
17 Фл + Ж ' К-п.шп + Фо + П; 32 Энс + К-пдип + Фл я Фо + Ж.
(IV) Фо + Лц + К-п.шп + Энс + Ж + П
22 Лц + Энс + П я Фо + Ж; 23 К-пддп. + Энс + П я Лц + Ж;
12 К-П.шп + Фо + П я Лц + Ж: 18 К-п.шп + Энс + П я Фо + Ж;
30 К-п.шп + Фо я Лц + Энс.
(У)Фл + К-п.шп + Кв + Энс + Ж + П
24 К-п.шп + Энс +уКв + П я Ж; 25 Фл + Квя К.п.шп + Энс + П;
25 Фл + Кв К-п.шп + Энс + П; 26 Фл + К.п.шп + кв + П я Ж;
27 Фл + Кв + П - Энс + Ж; 21 Фл + Ж я К-п.шп + Энс + П;
28 Фл + Кв - К-п.шп + Энс + Ж;
(VI) Энс + П энс + Лц + Фо + Ж + П
33 Энс я Пэнс; 22а Лц * Энс + П я Фо + Ж; 22в Лц + Пэнс +
+ П-Фо + Ж.
(VII) Энс+ Пзяс + Лц + К-п.шп + Ж + П
33 Энс Пэнс; 23а К-пднп + Энс + П я Лц + Ж; 23в К-п.шп +
+ Пэнс+ П я Лц + Ж.
(VIII) Кв+Тр+ К-п.шп + Энс + Ж + П
34 Кв - Тр; 24а К-п.шп + Энс + Кв + П - Ж; 24в К-п.шп + Энс +
+ Тр + П«Ж.
(1Х)О-ромб Кс + Кс + Фл + Лд + Ж + П
35 Кс + О-ромб Кс; 7а Фл + о-ромб Кс + Лц + П Ж; 7в Фл +
+ Кс+ Лц+П«Ж;
Luth W.C., J. Petrology, 1967, 3, 393
Фиг. 1581. Полибарически - политермальная проекция
инвариантного и моновариантного ликвидуса. Меняющий-
ся валовый состав моновариантных жидкостей с давле-
нием и температурой указан арабскими цифрами, а ин-
вариантные жидкости показаны римскими цифрами. Диаг-
рамма в большей части схематична.
Luth W.C. J. Petrology, 1967, 8, 3, 400
Фиг. 1582. Гранины трехфазных полей
Горизонтальная штриховка Вертикальная штриховка
а - Фо + Лц + П
б - Орт + Фо + П
в - Фл + Кв + П
ФЛ + ж + п
Luth V C. J. Petrology, 1967,g, 3, 402
Орт + Фл + П;
Фл + Энс + П;
Орт + Энс + П
423
Al 203_K 2O-MgO-SiO2-H 20
Фиг. 1583. Границы
четырехфаэных полей
Штриховка по вертикали
Фл*Фо*Лп*П; горизонтали
Фл+Орт+Кв+П; точки - Фл+
+Орт+Ф<я-П; сетка - Фл+Энс*
+Орт+П.
Luth W.C. J. Petro-
logy, 1967, Д, 3, 403
Фиг. 1585. Диаграмма фазовых равновесий для части сис-
темы NaAlSiO^-KAlSiO^-SiOj-l^O при Рн2О“1000 кг/см2,
спроектированная на безводное основание
А1 „О., _К „О—Na ,0-SiO ,-Н „О
L 3 — t. & £
1 - температуры ликвидуса, по данным автора; 2 - температуры
ликвидуса, определенные Fudali R.F. или Tuttle O.F., Bowen N.L
Кор
Аб
Аб
(Geol. Soc. Am. Mem. 1958,74h m минимум щелочного полевого
шпата; М - температурный минимум в системе NaAJSi3Ob-KA]Si3Ob-
—NaAlSiO4—KA]SiO4. Состав М - НЕФддКс.дКв„.. Температура М "
ж7кпкто Плппшама ль потя твердых растворов
не определено.
Mag., 1965, 31, Tilley
-NaAJSiO4-KAJSiO4. Состав M - НЕФ Кс JG
"750*7°. Положение границы, разделяющей :
нефелина и твердых растворов кальсилита,
Hamilton D.L., MacKenzie IF.S. Min.
vol., 216
Орт 7z>7ZT
Kop
ПорЫгпОм'Кор
НУтСр-р*>1ШПтер-в
0pm 670^7^060
MpaPpfKop
Париmprfity
★Afappifip
Орт Tz=080'
Kop
яЛ^Лариял^к^
tnA^Kop
Аараг
★ЛорвяАрр*
Mmtp-p
ItynatfAhty
А&т6.р-р
МУяЛрр*
Кп-ВЧайр-р
Oopotmlpp ★-Admtp-p
Мутбр-р *Лора1пЛрр
Х^Абщерт,
0pm | Tr 500* Аб
Фиг. 1584. Минеральные ассоциации в системе альбит-
SiOt
90
90
30
10
Na А 131,0.
50 70 90
Вес,7. KAL3ijOe
Фиг. 1586. Изобарическая проекция (р " 1000 бар)
"2°
на плоскость NaAlSi^Og—KAlSijOg—Si02 поверхности лик-
видуса в система NaAlSi^Og-KAlSi^Og-Sit^-^O. Изо-
термы и положение границы поля кварц-полевой шпат по
данным Carmichael I.S.E., MacKenzie WJS. (Am. J. Sci.,
калиевый полевой шпат - корунд - вода при разных тем- 1963,261. 382-396). Соединительные линии полевой
пературах и 2040 атм. Водные фазы проектируют- шпат - жидкость, определенные автором, показаны сплош-
2 ными линиями; эти же данные Tuttle O.F., Bowen N.L.
ся на плоскость альбит-калиевый полевой шпат - корунд.(Geol.Soc. Am. Mem., 1958, 74,153) показаны пунктиром
Eugster Н.Р., Yoder H.S. Camegie Inst. Washington. Year o -шсд tc -
Book, 1954-1955, 54, 127 6 Thompson R.N., MacKenzie W.S., Am. J.Set.. 1967.285.8.720
424
A120 3-K 20-N a 20-S iO 2-H 2O
90
957.SiOt
5%NatSL03
ПИа,Я», ,"7^
10 30 50 70 90
HaAlSl3O8 Вес,7О KALSi3O9
Фиг. 1587. Диаграмма плавкости в псевдотройном
речении при РН2ОвЮ00 бар. Составы в этом
сечении соответствуют альбиту, ортоклазу и квар-
цу с добавкой к ним 5% Na2SiO^. Составы пер-
вичных полевых шпатов лежат вне этой плоскос-
ти и представлены на отдельной базисной линии
NaAlSi^Og-KAlSi^Og. Знак + или - около отмечен-
ных на диаграмме валовых составов относится к
цифре разности отношения I^O.’NagO в составе пер- q
вичных полевых шпатов и жидкости * * 38
Thompson R.N., MacKenzie ЖЛ. Am. J. Sci., 1967,
957.KALSl30t
5 Vo NQgSlQj
57,KtSiO3
957.SiOt
J%KfSiOj
Фиг. 1589. Диаграмма ликвидуса для псевдотройного се-
чения при q= 1000 бар. Составы были составлены из
альбита, ортоклаза и кварца с добавкой к ним 5% K^SiOj.
Диаграмма построена при использовании тех же условий,
что и на фиг., 1587.
Thompson R.N., MacKenzie ЖЛ. Am. J.Sci., 1967.265. 8,723
J5%MtSi30e
57.KtW>3
10 30 50 70 90
NaALSljOg tec,7o KAtSi3Oa
#5, 8, 721
95%SiOt
57.NaFeSlfQe
Фиг. 1590. Диаграмма ликвидуса для псевдотройного се-
чения при Р - 1000 бар. Составы в этом сечеиии
были составлены из альбита, ортоклаза, кварца с добав-
кой 5% NaKSiO j Диаграмма построена при использова-
нии тех же условий, что и на фиг. 1587.
Thompson R»NМ acKenzie Ж.8. Am. J. Sci., 1967«265.8*724
9S%SiOt I
5%NaKSiOf
SSXNaMSljO,
5%,NaFe$itOe
10 30 SO 70
NaAlSi.,0, Bee,%
Фиг. 1588. Диаграмма плавкости в псевдо-
тройном сечении при Р^О8 1000 бар. Сос-
тавы в этом сечении: альбит, ортоклаз, кварц
с добавкой к ним 5% NaFeSi2O$. Диаграмма
построена при использовании тех же условий,
что и на фиг. 1587. Заметим, что. эта "по-
верхность ликвидуса" приложима только к
кварцу и полевому шпату, так как небольшие
количества магнетита остаются в большинстве 957oNaALSi,30
из получаемых стекол 57»NaKSlO3
Thompson R.N., MacKenzie Ж.5. Am. J. Sci.,
1967,8, 722
90
90
КА13Ц0
957o KALSlgOg,
SKHtfeSi'Os
70
NaALSi3O
50
Bee, 7.
95%KALSi30e
5 7a Na К SIO3
90
KALSi30s
54
425
Фиг. 1591» Пересмотренная диаграмма фазовых равнове-
сий для щелочных полевых шпатов при 5 кбар в услови-
ях насыщения водой
Фиг. 1594. Разрез системы NaAlSi3Ofi(A6)-KAlSiqCL
(Орт)-Н20 при 710°С и 5000 бар 6
Morse S.A. Camegie Inst. Washington. Year book, 1967-68,
£7,121
Yoder H.S., Stewart D.B., Smith Y.R. Camegie Inst.
Washington. Year book, 1956—1957, 56. 209
7?
1100
~ЛеиципХ пСухой
900-
1000-
Ойин П.Ш.П
Р^ЮОО kz/gm1
Лейцит
k 1000-
Рн^ОООкг/с^
'Лейцит
900-
700 -
500
800-
Двап.шп\
40 80
800-
00ин п.шп
^^oo_
/Д0ап.шп\
' 40 80\
Один п. шп 700-
'Два(1.тп\
40 80
KAL3jOB NaALSl^ KALSijOg NaAL5iyOs KALSiyO8 . NaALSiyO,
Bee, 7O Bee, % Bee, 7.
Фиг. 1592. Изобарические диаграммы фазовых равновесий
для полевых шпатов в безводных расплавах и под дав-
лением Н^О, равном 1000 и 2000 кг/см2
‘Bowen N.L., Tuttle O.F. J. Geol., 1950 , 58, 5, 489-511
Н20
Аб
Ро5иС50°0бар
Т-720°С
П.шп^/К
П.шп * Ж Вес,9/*
Орт
Фиг. 1595. Проекция равновесных отношений в системе
LiAlSiO4-NaAlSi3Og-H2O при рн q s 2000 бар
1 - одни кристаллы; 2 - одно стекло; 3 - кристаллы и стекло.
Пунктирные линии предполагаемые границы
Stewart D.B. Internationa) Geol. Congress, Rept. 21st Ses-
sion Copenhagen, 1960,17, 23
Фиг. 1593. Разрез системы NaAlSi^Og(A6)—KAJSi^Og
(Орт)—Н20. Разрез при 720°С и Р = 5000 бар
Yoder H.S., Stewart D.B. Smith Y.R. Camegie Inst.
Washington. Year book, 1956-1957 , 56. 209
426
A12O3_MgO-Na 2O-Si 02-Н 20
Фиг. 1596. PT - диаграмма для состава
Na2O-3MgO*A12Oy8SiO2 + избыток HgO.
Разделенные символы опытов указывают
на присутствие следов низкотемператур-
ной группы. Положения кривых при 1 атм.
(точки А и Е) были определены Schairer J.F.,
Yoder H.S., (1960 и персональное сооб-
щение)
Ernst W.Q. Am. J.Sci., 1961, 259.10, 747
Фиг. 1597. PT - диаграмма для состава N^O’.SMgO*
•A12O310SiO2 + избыток Н^О, Смешанные символы опы-
тов указывают на присутствие следов низкотемператур-
ной группы. Положения кривых при 1 атм. (точки В, М
и N) были определены Schairer J.F., Yoder H.S. (1960
и персональное сообщение)
Ernst W.G. Am. J. Sci., 1961,259. 10, 748
Фиг. 1598. Поверхности ликвидуса в системе 2МдО
•SiCk’NajO-A^Oo^SiC^-SiO2- Н2О при давлениях
-1 атм Да); Рп = 450 бар (б); Рп = 2000 бар. (в);
Вершина Н^О обращена к читателю, и поверхности
ликвидуса проектируются на грань 2MgO*SiO2~ Na^O*
• AI2O3-6Si02 —Si02- Предварительные результаты,
полученные при Р^ 1 атм. Schairer J.F., Yo-
der Н. S. ( I960, и персональное сообщение), являются
основанием для фиг. а. Детали перехода протоэнстатит -
ортоэнстатит и положение области двух жидкостей при
значениях, богатых кремнеземом, опущены для просто-
ты. Об отношениях ликвидуса при повышенных давлениях
пара сделано заключение из последовательности крис-
таллизации и обработки инвариантных точек для сос-
тавов Na2O’3MgO*A12Oy8SiO2+H2O( обозначенных +) и
Na2O*3MgO«A12O3 lOSiC^+^O (обозначенных х). Глауко-
фан становится стабильным в присутствии расплава
при 858 С и Р "660 бар (Фиг. 1597, точка В*); с
увеличением дАвйения пара первоначальное поле крис-
таллизации амфибола расширяется и достигается сос-
тав четверной точки реакции (фиг. 1596, точка ЛГ )при
867 С и 1500 бар
Ernst Ж.С. Am. J. Sci., 1961, 259.10, 751
Seo, %
Фиг. 1599. Границы ликвидуса форстерит - ортопироксен
в системе форстерит - нефелин - кремнезем - HgO в
условиях насыщения Н2О под давлением 20 кбар и 17,5
кбар и без воды при 20 кбар. Границы в условиях насы-
щения водой спроектированы из вершины Н^О на плос-
кость форстерит - нефелин - кремнезем. Точкой Ж пока-
зан состав безводного глаукофана
Kushiro I. Camegie Inst. Washington, Year book, 1968—69,
68, 241
427
А1203-MgO-Na2O-SiO2-H2O Неф Kc л. л / / У/ 950" ж\ жл - Фо Эос SiOt Фо Энс SiOz Са-нолекила Черпака (Гресс) л сп w X 111 /\ 1 Фе Эн(прп) SLOt Фир Вес, % (0) Фиг. 1600. Соединительные линии стабильных фаз в системе нефелин - форстерит - SiC>2 при 1 атм (сплош- 195( ные линии) по данным Schairer J.F., Yoder H.S., (Camegie Inst. Washington. Year book, 1960-61, gQ, 142) и при 30 кбар (пунктирные линии) вблизи солидуса (а) Соединительные лийии стабильных фаз в системе каль- *силит— форстерит - SiO2 при 1 атм (сплошные линии) 950 по данным Schairer J.F., (J. Am. Ceram. Soc., 1954, । 37, 501-53) и около 30 кбар (пунктирная линия) вблизи солидуса (б). Соединительные линии стабильных фаз (в) и ~ в системе Са-молекула Чермака - форстерит - SiO2 । при 1 атм (сплошные линии) по данным Andersen 0. (Am. J. Sci., 1915, 39 г 407) и Hytdnen K-, Schairer J.F., (Camegie Inst. Washington. Year book, 1960-61, 60, 125-141) j и при 30 кбар (пунктирная линия) в более общей проек- gpQL ции из вершины А120^ по данным Chinner G.A., Boyd F.H., England J.L., (Camegie Inst. Washington. Year book, 1959—60,3J) Yoder H.S. Jr., Tilley C.E. Camegie Inst. Washington 9 Year book, 1960-61, gO, 107 фиг та. £ F e 0 -M gO—Na 90-S iO 9-H 90! 1)001 4 «5 £ £ £ 1Г »/>r
•s t£*-10 -15 -9П 1 1 Гт^Ол^Отц НаенееаориЛкцт 1 *^*0 ! fjL— *0мр * 'Asl/A- J 1 1 и 950 - 900 ' 850- 800- 0
Ы Фиг. 1601. F •Fe2Oy8SiO, Ernst W.G< 850 900 950 *C ’ T “ диаграмма состава Na2O*3MgO* 2 ? с избытком воды при PnaDa я 2000 бар та> j, > Geoch. Cosm. Acta., 1960, 19* 1» 25 Et 1956
\ Mm+On+NaiQ-SttgO IZSlOi+M+n 1- Мт*Ол+Гип*Ж*П А 1Ч.Ч, % - 1 |
\ 7 - о 5 8 у3 ° ° n r A g о Рибекит+П^ 1 ° "A. Mm *0л ♦ Na,e-5 MgO12SiOt> NotO-ZHgO-eSiO^n 1 * 1 1 1
0 500 1000 1500 Z000 ДаОлвние Hz0f5ap ir. 1602. Pj^qT " диаграмма магнезиального рибеки- . Использован буфер магнетит-фаялит-кварц Ernst IF.G. Camegie Inst. Washington. Year book, 56-57, .§6, 229
' , ^rm*Mm^*o(?)i-N}tO-5MgO-1lSlOe)t(*n i \ a Гт*Мт*Фв(?)*Энс*>К*П - S'—-—<
jxJL. -8- *° 8 5 Ри(екит*П •У ° О ° • о -Ai ° ° * 1 *Нт *Фо(Г)+Маг0-5Мд1Мг510г*ат 41 । । ।
0 500 1000 1500 1000 ДаВлвние Hf0,5ap г. 1603. ОТ - диаграмма магнезиального рибеки- . Использован буфер гематит-магнетит Ernst W.G. Camegie Inst. Washington. Year ok, 1956-1957, 56,229
i \ Мт*вюо(?)*0л*Маг0-5Мд0-11510г*)К*П - Мт^Вюс(?)^Ол^Гип^П \ S V,*;»—s „т 1 ° 0 Vo ^NazO^MgOnsiO^NaiO-ZHgOSSiO^O La о Рибекит+П -I O / J , .
0 500 1000 1500 2000 Давление ht0,5ap '. 1604. P _T - диаграмма магнезиального рибеки- н2° Использован буфер магнетитнвюстит. Ernst W.G. Camegie Inst. Washington. Year book, 6-1957,.§6,229
428
Поликомпонентные
Фиг. 1605, РфЛЮИд” Т кривая дегидратации ферропарга-
сита при летучести кислорода железо-вюститового буфе-
ра. Исходная шихта - смесь окислов.
1 - образуется преимущественно амфибол; 2 - образуется ам-
фибол и продукты реакции; 3 - образуются продукты реакции; 4 -
обратимая реакция амфибол - продукты реакции; 5 - амфибол + про-
дукты реакции (в качестве исходной шихты) не изменяется
Gilbert М.С* Am. J. Sci., 1966, 264, 9, 725»
О стабильности ферропаргасита в нейтральных хлорид-
яых растворах см. Малиновский И» Я. ДАН СССР,
1968, 178. 3, 690-93.
Фиг. 1607.
флюид
- Т кривая дегидратации ферропар-
гасита при летучести кислорода фаялит - магнетит +
кварц буфера.
Обозначения при использовании смеси окислов в качестве исход-
ной шихты: 1 - образуется преимущественно амфибол, 2 - образуют-
ся амфибол и продукты реакции, 3 - образуются преимущественно
продукты реакции, 4 - обратимая реакция амфибол -продукты реак-
ции, 5 - амфибол + продукты реакции (в качестве исходной шихты)
не изменяется.
Gilbert M.Ch. Am. J. Sci., 1966, Ж. 9, 727
Фиг. 1606.- Рфдюид - Т кривая дегидратации ферро-
паргасита при летучести кислорода вюстит - магне-
титового буфера.
Обозначения при использовании смеси окислов как исходной ших-
ты: 1 - образуемся преимущественно амфибол, 2 - образуется ам-
фибол и продукты реакции, 3 »- образуются преимущественно про-
дукты реакции, 4 - обратимая реакция амфибол-продукты реакции,
5 - амфибол*продукты реакции (в качестве исходной шихты) не
изменяется
Gilbert М. Ch. Am. J. Sci., 1966, 264. 9, 726
Фиг,
1608. РА - Т
флюид
кривая дегидратации ферропарга-
сита при летучести кислорода Ni—NiO буфера.
Символы - см. на фиг. 1607.
Gilbert M.Ch. Am. J.Sci., 1966, 20. 9, 729
429
A1 .,0 —CaO—К ,0-Na ,O-SiO -H 20
2 3 & л *
M 635° Bee, % 0Pm
Фиг. 1609. Проекция четверной системы NaA)Si^0g(A6)
-KA)SijCL(OpT)-CaA]2Si20A(AH)-H20npH давлении воды,
равном 5000 бар.
Ah
Фиг. 1611. Проекция системы NaA)Si3O^A6) —KAlSi30g
(Орт ) — CaAl2Si20g( Ан) —H20 при 720°C и давлении Н20,
равном 5000 бар. Показаны фазовые равновесия, вклю-
чающие газ.
Yoder H.S., Stewart D.B., Smith J.R. Camegie Inst. Wa-
shington. Year book, 1956-57, 56, 212
Yoder H.S;, Stewart D.B., Smith Y.R., Camegie Inst.
Inst. Washington. Year book, 1956—57 , 56-. 211
Фиг. 1610. Проекция системы NaAlSiqO^(A6)-KAlSi30g
(Орт) -CaAl2Si2O8 (Ан)- H20 при770°С и давлении F^O,
равном, 5000 бар. Показаны фазовые равновесия, вклю-
чающие газ.
Yoder Н-S., Stewart D-В., Smith J.R. Camegie Inst.
Washington. Year book, 1956 —57 . 56.211
Фиг. 1612. Экспериментально определенные соедини-
тельные линии полевых шпатов в равновесии с жид-
костью и газом.
Yoder H*S., Stewart D.B., Smith J.R. Camegie Inst.
Washington.Year book, 1956-57,5g, 212
430
A12O3 -CaO-MgO-Na2O-SiO2 -Н, О
Фиг. 1613. Поле стабильности магнезиального рогово-
обманкового паргасита.
Boyd F.R. Camegie Inst. Washington. Year book,
1955-56 F 5g, 199
Bee. Vo
Фиг. 1615. Система альбит-диопсид-вода при давлении
1 бар, по данным Schairer J.F., Yoder H.S. (Am. J. Sci.,
1960, 258. 273-283) в сравнении с системой аль-.
бит-диопсид - вода при давлении 2 кбар.
Yoder Н.Sc Jr. Camegie Inst. Washington. Year book,
1965-66, 6g, 274
Фиг. 1614. Изотермы ликвидуса для экспериментально
изученной части системы CaMgSi20^ (диопсид) -
NaAlSiO^ (нефелин) - NaAISi^Og (альбит) - Н2О
при давлении Н2О 1000 кг/см2
Edtfar A.D. Am. Min. 1964,49, 578
Фиг. 1616. Граница ликвидуса форстерит-ортопироксен
в системе форстерит - нефелин -CaA^SiOg - крем-
незем - Н~О под давлением 20 кбар в условиях насы-
щения Н2СГ и без воды. Точечной линией показан след
пересечения плоскости MgSiCh-CaAUSioOg-NaAISioOg
в объеме A-Q-U-S—T-V-R—B
Kushiro / о, Camegie Inst. Washington,Year book, 1968-69,
68, 244
431
A120 3-FeO-K2 O-MgO-SiO 2-H 2O
.1 .2 .3 .4 .5 .8 .7 .8 .9
Мусковит Селадонит
Мол. доля ККМ^ЗЦО^ОН)^
I
.1 .2 3 .4 .5 .6 .7 .в Д
Мусковит Селадонит
Мол. доля К[(А1М9)ЗЦ01В(0Н)г]
.4 2 .3 .4 .5 .6 .7 .8 .9
Мусковит Селадонит
Мол. доля KUMgAL)Sb4Ow( ОН )ъ]
1
Давление 4.5 кбар
Давление 2кбар
А
°2
.1 Я J .4.5 .6 .7.6 J
Мусковит Селадонит
Мол. долл KUMgFe*’)
Б I
Давление 4.5квар
§
39в 500 700 900 1100 *0
Фиг. 1617. Состав биотита, сосуществующего с калие-
вым полевым шпатом и магнетитом, как функция тем-
пературы и парциального давления кислорода при пос-
тоянном давлении водяного пара 2046 бар
Wones D.R., Eugster Н.Р, Camegie Inst. Washington.
Year book, 1958-1959, 58.129
А1,0 ,-Ь е .,0 ..-К ,O-MgO-S iO_ -Н „О
ел • > i Л & i L
Давление 2 кбар
.1 2 .3 Л .5 .6 .7 Д .9
Мусковит Селадонит
.1 .2 .3 .4 .5 .6 .7 .8 .9
Мусковит Селадонит
Мол. долл К[(Мд1 0 " Мол доля КНИд^е*} А^ЗцО^ОНу
I В л
Мусковит
Ровщ" 4,5 кбар
НдМ*
Селадонит
Фиг. 1618. Диаграмма, показывающая область твердых
растворов для составов московит-селадонит, получен-
ная для температуры 300 С и давления 4,5 кбар
Velde В. Am. J.Sci., 1965, 263.10, 896
Давление 2кбар
•С |-------------------
700
600^ 2Сл + П.щп.
500-
300<P'Hium
loV
Фенгит
С:
ШГТ
Z
Мусковит .25 .5 .75 Селадонит
Мол.,%
.1 2 Д .4 .5 .6 .7 .8 Д
Мусковит Селадонит
Ни. АгмК[(Ге^Н<|лА1)$ЦОп(ОН)г]
/’
°C Давление 2кбар
700г-----------------------
д00\
500 ~ итлКв
300 ~гилР\ о
200-
Давление 4.5кбар
700?
600-
500-
400
300-
2Сл +fluin.+K8
Фении
.1 2 .3 .4 .5 .6 .7 .8 Д
Мусковит Селадонит
Мол доля KUFepMgjAL) 3i40w (0H)tl
г Л
Давление 4.5кбар
°C Г
7001
воо^
500-
400-
300-
2Сл+П.щпЖ0
.1 .2 .3 .4 .5 .6 .7.д .9
Мусковит Селадонит
2слюды+
*к-п.шп*кв
б
4
.1 .2 .3 .4 .5 .6 .7 .0 Д
Мусковит Селадонит
Ми-бмя KUAl5M9/e7feJ)Sm,(e«W '
I А Л
Фиг. 1620. Диаграммы показывают экспериментально
определенные стабильные фазовые равновесия между
фенгигами и продуктами их распада при Р
оощ HgV
Стрелками показано наблюдаемое направление реакции
1 - фенгит; 2 - слюды + полово! пшат + кварц или другие фазы.
Фиг. 1619. Р-Т-Х фазовые равновесия в .сечении муско- Кривая для 10 кбар на фиг. А П показана пунктиром, так как ОС-
ВИТ — Селадонит. Р =» р кована на 1 опыте. О данных по обратимо! реакции мусковит**
HgO общ. санидин + корунд + вода см. Velde В. (Фиг. 1468)
Velde В. Am. J. Sci., 1965,896 Velde d. Am. J.Sci., 1965, 263. 10 , 894-95
432
Фиг. 1621. Изобарическая проекция (Ри ~ = 1000 кг/см4
Н2°
из вершины X поверхности ликвидуса для разреза 4,5%
акмита + 4,5% метасиликата Na в системе NaAlSijCk —
-KA)Si3O8-SiO2-X, где X (Н2О +Na2SiO3+NaFeSi2O6J.
Показаны соединительные линии для сосуществующих в
равновесии с полевыми шпатами жидкостей и два трех-
фаэных треугольника, которые определяют положение
минимума температуры ликвидуса на этой плоскости.
CarmichaelI.S.E., MacKenzie IF.S. Am. J. Sci., 1963» 261_,
4, 385
A120 3-Fe()-K2O-MgO-SiO2-H 2O-O2
Fe/Fe+Mg
Фиг. 1623. Кривая равновесия биотит-санидин - магне-
тит - газ при общем давлении 1035 бар в зависимости
от температуры и отношения Fe/Fe+Mg. Давление кис-
лорода задано буферными смесями
1 - биотит + санидин + магнетит; 2 - биотит; 3 - биотит + са-
нидин + гематит; 4, 5, в - состав биотита в равновесии с санидином
и магнетитом: 6 - результаты опытов с высокой степенью на-
дежности, 5 - с менее высокой степенью надежности; 4 - с низкой
степенью надежности
Wones D.R., Eugster Н.Р. Am. Min., 1965, 50, 9, 1241
2
Фиг. 1822. Изобарическая проекция (Р„ ~ - 1000 кг/см )
Н2°
из вершины X поверхности ликвидуса для разреза 8,3%
акмита + 8,3% метасиликата Na в системе NaAlSijO^
- KAlSi3O8-SiO2— X,meX(H/)+Na2SiO3+NaFeSi2O6)
Carmichael I. S.E., MacKenzie W.S. Am. J. Sci., 1963, 261.
4, 388
I 55
433
А12()b eO-K 2O-MgO-S iO 2-H 20-0 2
°c
1000
800
600
Фиг. 1624. Кривая равновесия биотит-санидин-магнетит
газ при общем давлении 2070 бар. Давление кислорода
задано буферными смесями
1 - биотит + санидин + магнетит; 2 - биотит; 3 - биотит + са-
нидин + гематит; состав биотита в равновесии с санидином и маг-
нетитом показан символами: 4 - низкая степень надежности; 5 -
менее высокая степень надежности , 6 - высокая степень надежности
Жones D.R., Eugster Н.Р. Am. Min. 1965, §0. 9, 1242
Al О„—CaO—FeO—MgO—Na„O—SiO _H О
* *» z £ £
Фиг. 1627. Фазовая диаграмма для части системы
NaA)Si3O8-NaAISiO4-NaFeSi2O6-CaMgSi2O6 -Н2 О
под давлением воды, равном 1000 кг/см ?
Заштрихованная, область - объем .пироксенов, определен-
ный в системе NaAlSijOg-NaAlSiO^—NaFeSi20g— CaMgSi20g —Н2О.
Показаны также проекции пограничных поверхностей, разделяющих
фазовые объемы в изученных сечениях при постоянных составах,
Р - псевдоинвариантная точка (715 С), состав Аб^Неф^д Ат,^.;
R- псевдоинвариантная точка (885 С), состав Аб^дНеф^д Д^.,
Notan J. Quart. J. Geol. Soc., London, 1966,122,141
Фиг. 1625. Кривые реакций окисления биотит + корунд жл
магнетит + мусковит и биотит + A^SiC^sz? магнетит +
мусковит + кварц при изменении летучести кислорода и
температуры.
Кружками обозначены пересечения данных для аннита Eugs- .
ter Н.Р., Wooes D.R. (J. Petrology, 1962, 2» 82—125) с данными для
мусковита Velde В., (Camegie Inst. Washington. Year book,
1963-1964 , §2» 141-142). Треугольниками показаны пересечения fy»”-
цых для аннита с данными для мусковит ♦ кварц Segnit E.R., Kenne-
dy G.C, (Am. J. Sci., 1962, 259. 280*287), Сплошными линиями
показаны границы между окислами железа и фаялитовыми ассоциа-
циями. Три пунктирных кривых рассчитаны: 1 - аннит 5 + A] SiO +
+ мусковит + кварц + магнетит, 2 - аннит 1,0 + Al2SiO5 + мусковит +
+ кварц + магнетит. 3 - аннит + корунд + мусковит* магнетит
Жones D.R., Eugster Н.РК Am. Min., 1965» 50. 9, 1252
Фиг. 1626. Кривая Г - зависимость 'минимальной Т
плавления гранита' - от летучести воды по определению
Tuttle O.F., Bowen N.L. (Geol.Soc. Am.Mem., 1958» 74)
Кривая 1 показывает стабильность биотита с содержанием 0,15
мольной доли К Ке^A ISi^O(ОН)^ сосуществующего с магнетитом
и гематитом. Кривая 2 показывает стабильность биотита с содер-
жанием 0,25 мольной доли KFe.AlSi О (ОН) , сосуществующего
с кварцем, магнетитом и фаялитом 3 10 2
Жones D.R., Eugster’H*P» Am. Min., 1965. 50. 9. 1265
Al203- СаО-FeO—Mg0-Nao0-Si0„-H_0
— Z Z
NaAUlO,
434
РАЗНЫЕ ВЕЩЕСТВА ПОД ДАВЛЕНИЕМ Н2О
Фиг, 1628. Изобарическая растворимость корунда в за-
висимости от концентрации КОН при 6 кбар.
Anderson G.M,, Burnham C,W>, Am. J.Sci., 1967* 265.
1, 18.
Фиг. 1631. Р-Т диаграмма для лерцолитовых вклю-
чений из туфа Солт Лейк, Гавайи в присутствии избыт-
ка воды. Солидус в сухих условиях и часть кривой со-
лидуса в присутствии избытка ILO показаны по данным
Kushiro 1., Syono J., Akimoto S. (J.Geoph.Res. 1968, 73,6023—
-6029)
1 - оливин + ортопироксен +клинопироксен + амфибол ± гранат;
2 - оливин + ортопироксен + клинопироксен 1 гранат; 3 - оливин +
+ ортопироксен •+• клинопироксен + закалочные кристаллы и стекло.
Kushiro Л Camegie Inst. Washington. Year book, 1968-69,
68. 244
NaAlSiO Ca, [F(PO X ]-H .0
4 a 13 2
°C
1200
1000
800
CarfPOjgF 12 10 8 6 k 2 NoMSiO*
Rec, %
Фиг. 1629. Диаграмма плавкости нефелин - апатит -
вода при Рн2О = 2000 атм.
1 — в поле апатита; 2 - в поле расплава; 3 - в поле нефелина;
4 - ниже солидуса; I - состав апатитоносной интрузии.
Когарко Л.Н., Лебедев Е.Б., Геохимия, 1968, 3, 376.
Грану лит -Н20
Гранит-Н20
Фиг. 1630. Изобарическая диаграмма зависимости раст-
воримости воды в гранитном расплаве от температуры
при 3000 атм.
Сплошная кривая (1 ) дана по экспериментальным данным Ост-
ровского И.А. и Орловов Г.П. Сплошные кружки - равновесия, дос-
тигнутые 'снизу', полые кружки - 'сверху'. Для сравнения приве-
дена пуктиром избара 3000 (2) по Хитарову Н.И. и др. (Геохимия,
1965, 10).
Островский И,А,' Орлова ГЛ. Изв.АН СССР сер.
геол., 1968, 9, 28.
Фиг. 1632. Условия образования гранулита при Рц q =
1000 бар 2
Моновариантные кривые реакций: 1 - дистен силлиманит,
2 -.мусковит + кварц -полевой шпат +Al2Si05+H20 , Рн q= р
2а - реакция 2 при Ри q ж 1000 бар, 3 - жедрит + кварц ₽а?гипер- '
стен + кордиерит + НгО, РН2О“робщ
За - реакция 3 при Pj^Q ° 1000 бар. 4 - роговая обманка —^эн-
статит + анортит + диопсид + Н20; Р^О “Робщ- 4а " реакция 4
ПРИ РН ^0 “ 1000 баР- 5 - нижняя граница анатексиса при Pjj О =
РовШ' ** • То же "Р" РН20" 1000 бар. 2
Althaus E.N. Jb. Min. Monatsh,1968, 1.9, 301
435
Г ран у,лит-Н20
MgO-NaOH-Н2О
500 700 800 вС
Фиг. 1633. Условия образования гранулита при Pu q
2000 бар 2
Моновариантные кривые реакций: 1 - дистен силлиманит 2 -
мусковит + кварц а=* К-полевой шпат + A^SiO^-^O, Рц2О = Робщ.
2а - то же при Р^^О=2(ХХ) бар, 3 - жедрит + кварцзг гиперстен+
+ кордиерит* Н2О,Рн2Оя Робш>^а-Реакдия 3 при РН20“2000 бар,
4 - роговая обманка -► энстатит + анортит* диопсид* Н2О; Pf^jO®
= РобЛ, 4а - то же при Рн 0 ш 2000 бар, 5 - нижняя ганица анате-
ксиса при Р|^ q *Робщ» 5а - то же при РнгО ” 2000 бар,
Althaus E.N. Jb. Min. Monatsh., 1968, н. 9, 303
Температура
Фиг. 1635. Ассоциации фаз в системе MgO-NaOH-H2O
при 500-700°С и давлении флюида 250 - 2000 бар. Сос-
тавы в мол.%.
Поля: 1-периклаз + твердый NaOH + флюид, 2 - периклаз + флю-
ид, 3 - брусит + периклаз + флюид, 4 - брусит + флюид. Кружками на
стороне НцО-NaOH показаны составы флюидов, использованных в экспе-
риментах^Р фгаоад - Т проекции равновесных кривых для сосуществую-
щих MgO,M&OH)2H каждого из этих флюидов показаны (по мере возраста-
ния содержания NaOH) А А,' ВВ' и СС' . (Фазовые равновесия,
включающие твердую NaOH, не определялись)х
Barnes H.L., Ernst W.G. Am. J. Sci., 1963, 2Й1. 137
Фиг. 1634. Рфлюид " т Диаграмма для равновесия круп-
нозернистый брусит - тонкозернистый периклаз - флюид.
Кривые А А* В В* и СС,' - соответственно для рановеснй брусит -
— периклаз -Н20 , брусит - периклаз- 5,0 моляльный раствор
NaOH и брусит - периклаз - 12,5 моляльный раствор NaOH.
Barnes H.L., Ernst Ж. G. Am. J. Sci., 1963, 261., 133
Ca(OH) 2-CaF2
Ca(OH),-CaF„— H,0
GF 5 25 35 У5 55 Bec% CF5 15 25 35 У5 55 Bec%
О/ •3 qV of еЗ иУ
Фиг. 1636. Разрез Са(ОН)2—CaF2 пр#Рж ЮООбар.
Данные авторов показаны сплошной линией, пунктир - данные
Gittins J., Tuttle O.F., (Am. J . Sci., 1964, 66). Реакция
Ca(OH)o+CaF2 —•’Ж протекает при 687° С, состав образующейся
жидкости, E4,[Ca(OH)2l70[CaF2]30; 1 - Ж; 2 -Са(ОН^ + Ж;
3 - CaF2 + Ж; 4 - область субсолидуса, Ca(OH)2+CaF2
Biggar G.M* Min. Mag., 1967, 36. 280, 544.
Фиг. 1637. Разрез Са(ОН)2—Сар2—H2О (содержание
Н20 50%) при Р « ЮООбар. Реакцияо('а(ОН)2 +
+ CaF+ П —г* Ж, Е7, протекает при 675 С:
1 - Ж + П; 2 - Са(ОН)2+ Ж ♦ П; 3 - WF2 +Ж+П; 4-область
субсолидуса, Са(ОН)2 + CaF2+n
Biggar G.M. Min. Mag., 1967 , 36 . 280, 544
436
Ca(0H)2-CaF2-Ca3(P04)2
! » * ~ 1 ' 7 " . 1 IT g i L : l---------------l.
Ca(OH)^ 80 t 60 t 40 t 20 Ca(0H)z IS 55 t 3f
CaFz 15 35 55 75 CaFz 15 35 55
Ca(0H)2 60 40 Ca(0H)2 50 30
_______i i______i i______i_____ ________i i_______i i—
CaFz____20________40________CaFz___________20__________40
Bec.%
о / A 2 93 ▲ 4
Фиг. 1638. Сечение Са(ОН)2-СаИ2-5% Саз(РО4)2 при
давлении 1ООО бар
1 - Ж; 2 - Ап + Ж; 3 -CaF2 + Ж; 4 - Са(ОН)2 + Ж; 5 - об-
ласть субсолидуса, Ca(OH)2++CaF2 ♦ Ап ♦ П; Ап(0Н - апзо
F—Ап^ф)- твердые растворы апатита известного состава.
Biggar G.M. Min. Mag., 1967, 36, 280, 548
Фиг. 1639. Сечение Ca(OH)2-CaF2 - .10%,Сд3(Р04)2
при давлении 1000 бар.
Обозначения как на фяг. 1638. _
Biggar G.M. Min. Mag., 1967 , 36, 280, 518
Фиг. 1640. Сечение Са(ОН)2 - CaF2 - 20% Саа(РО4)2прй
давлении 1000 бар.
Обозначения, см. на фиг. 1638
Biggar G.M. Min.Mag.. 1967, 36-, 280, 548
Фиг. 1641. Сечение Са(ОН)2 — <'а1г2 ~ 30%Саз (РО4)2
давлении 1000 бар;
Обозначения, см. на фнг. 1638.
Фиг, 1642. Изотермические сечения для разреза Са(ОМ)2
—CaF2 —F An—ОНАп при давлении 1000 бар. Экспери-
ментальные точки показаны знаком X только на фиг,Б,
Поля обозначены цифрами: 1-Ж; 2-Ап + Ж; 3 - CaF2 * Ж;
4 - Са(ОН)2 + Ж; 5 - CaF2 + Ап + Ж; 6 - Са(ОН)2 + Ап + Ж;
7 - Са(ОН)2+ CaF2 + Ж; 8 - Са (ОН)2+ CaF2 + Ап; 8 - Са(ОН)2 +
+ Ап; 10 - CaF2 + Ап. Реакция Са(ОН)2 + CaF2 + Ап _ Ж, Eg
показана на фиг.Д. и Е, состав жидкости Eg: Са(ОН)2 73% CaF2 24%
Са^(РО^)23%. Точки Р4 Q, R являются вершинами трехфазных
треугольников и отвечают составу твердого раствора апатита, ко-
ПрИ торый находится в равновесии с другими двумя фазами при темпе-
ратуре иэотермального сечения.
Biggar G.M., Min. Mag., 1967 , 3&, 280, 549
Biggar'G.M. Min. Mag., 1967, 36, 280, 548
Ca(OH) —CaF, _Са„(РО.),-Н 0
А £ О *Г & &
Фиг. 1643. Сечение Ca(OH)2 —CaF2 —10% Са^(РО4)2 —
—50% H2O при 1000 бар.
1-Ж+П;2-Ап + Ж+П; 3 - CaF2 * Ж + П; 4 - Са(ОН)2+
+ Ж + П; 5 - область субсолидуса, Са (0Н)2+ CaF2 + Ал + П.
Biggar G.M., Min. Mag., 1967, ££, 280, 557
Фиг. 1644. Изотермическое сечение для постоянного
(50%) содержания Н2Одля разреза Са(ОН)2 —CaF2 —
-F Ап-ОНАп-Н2О при давлении 1000 бар. Мас-
штаб искажен.
Знаком X показаны экспериментальные точки. Скобки показыва-
ют, что в составе соединений в вершинах треугольника содержится
80% Н20
Biggar G.M»» Min. Mag., 1967 , 36, 280, 557
CflF2*M*/7
CaFz 5 25 45
о/ Af DJ A4 И5
50% Нг0 Сс?з(РЛ.)г1
F-An
10%
WHh] » CeFj-W [Cali]
Wf!
437
Фиг. 1645. Разрез Са(ОН)2 — CaF2 — Fan —ОНап—Цп0
при давлении 1000 бар. Показаны границы поля жид-
кости и (в искаженном масштабе) границы двух (из
3-х существующих) полей пара. Линии-------соеди-
няют сосуществующие фазы: жидкость и пар или жид-
кость и твердый раствор апатита. Составы жидкостей:
Ej Са(ОН)2 - 96%; Са3(РО4)2 - 4%; Е2 Са(ОН)2 -
-95%;Н2О-5%; Е3 Са(ОН)2 - 92%; Са3(РО4)2 -4%;
Н2о - 4%; Е4 Са(ОН)2 - 70%; CaF2 - 30%; Е5 не-
известен; Е6 Са(ОН)2 - 73%, СаБ> - 24%,Саз(РО4)2 -
- 3%; Е7 Са(ОН)2— 69%, CaF2 - 26%, Н2О -5%; Е8-
Са(ОН)2 - 70%, CaF2 - 22%, Са3(РО4)2 - 3%,Н2О-5%.
Температуры: Е| - 765^, Е2~ 785°С; Е3~735°С;
Е4-687°С; Е5- неизвестна; - 675°С; Е? - 675°С.
Е8 665°С.
Biggar G.M. Min. Mag. 1967, 36. 280, 558
Са(ОН)2-CaF2
Фиг. 1646. А.Р-Т кривые реакций Са(ОН>2 + Сар2 >
-» Ж и Са(ОН)2 + CaF2 + П -» Ж при давлениях от
250 до 4000 б ip.
Б.Р-Т кривые реакций Са(ОН)2 + CaF2 + Ап -» Ж
я Са(ОН)2 + CaF2 +Ап + П - Ж.
Biggar G.M. Min. Mag. 1967 , 36 , 280, 560
Фиг. 1647. Жирная линия - солидус биотитового гранита
Dinkey Lakes, определенный при избытке воды.
Опыты показаны прямоугольниками. Кружки при Ь 2 и 3 кбар
определение солидуса для той же породы Piwinskii A. J., (персо-
нальное сообщение, 1967). Для сравнения тонкими лилиями показа-
ны экспериментальные кривые моновариантных реакций в системе
NaAlSiO4 -SiOn -НпО при избытке SiO2 (Boettcher A.L., Wyllie
P.J., Program. AnnualMelting. Geol. Soc. America, New Orleans, 1967,
p. 17)
Boettcher A.L., Wyltie P.J. J. Geol., 1968» 76, 2,238. О
плавлении гранита по данным электропроводности см.Ле-
бе дев Е.Б, Сб. Теохимяческие исследования в области
повышенных давлений и температур*, 1965, 29-39
Гранодиорит - Н2О
Фиг. 1648. Р-Т-Х диаграмма, показывающая прибли-
зительно конфигурацию объема Тв - Ж - П в системе
гранодиорит - вода.
Поверхность А ВВ*А’ - равновесия при начале плавления и 0 СС
0 - приблизительно равновесия при полном плавлении в условиях
избытка Н2О. . Проекция поверхности ABCD на плоскость Р-Х дает
кривую растворимости воды, ad-be. Проекция поверхности А*В* С* D’
на плоскость Р—X дает кривую a'd—b e, общей растворимости си-
ликата в водной фазе, сосуществующей с гранодиоритовой магмой
в Р-Т условиях внутри объема Тв - Ж - П.
Burnham C.W., Geoch. Hydrothermal ore deposits,
1967, 38
438
Базальт - андезит - Н2О, альбит - 1^0,
пегматит - Н2О
9 t----------------------------
х НгО,0вс7.
Фиг. 1649. Р - X кривые максимальной растворимости
воды (в вес.% )в расплавах состава:
1 - базальт Columbia River, при 1100°; 2 - андезит Mt. Hood,
при 1100 С; 3 - Na'AlSigOg в интервале температур 68О°-87О°С;
4 - пегматит Harding в интервале температур 600-720°С
Burnham Q.W., Geoch. Hydrothennal ore deposits.
1967, 37
Разные вещества -
Фиг.1650. Давление пара II О для некоторых
нералов
водных ми-
ЛС ennedy С. С., Advances in Geoph. 1961, 7, 315
Гранит - H2O
Si.0%
Фиг. 1652. Изобарическая (10 кбар) диаграмма равно-
весий в гранитной системе, показывающая составы
жидкостей, насыщенных 1^0 (проекция на безводное
основание тетраэдра)
Luth W.C,, Jahns R.H., Tuttle O.F. J. Geoph. Res.,
1964, ££, 4, 766
Фиг. 1653. Диаграмма-, показывающая сдвиг четверного
изобарического минимума (знак +) и четверной изоба-
рической эвтектики (знак о) в гранитной системе с
увеличением
рн2о
, границы полей указаны для давле-
ний 0,5 и 10 кбар
Luth W.C., Jahns R.H., Tuttle O.F., J. Geoph. Res.,
1964, 69, 4, 766
Фиг.1651. Изобарическая (5 кбар) диаграмма равнове-
сий в гранитной системе, показывающая составы жид-
костей, насыщенных Н О (проекция на безводное ос-
нование тетраэдра)
Luth W.C., Jahns R.H., Tuttle O.F., J. Geoph. Res.
1964, £2, 4, 765
439
Фиг. 1654. Измеренные температуры плавления пород
под давлением воды.
Заштрихованная полоса - интервал начала плавления 5 образцов
глинистых сланцев. Для сравнения показаны кривая начала плавле-
ния Westerly гранита Tuttle О. F., Bowen N.L.,(GeoLSoc.Am.Mem., 1958,
74,) и кривые солидуса и ликвидуса толеитового базальта Yoder
H.S., Tilley С.Е., (Camegie Inst. Washington. Yearbook, 1955-56, 5S»
169, 171).
Wyllie P.J., Tuttle O.F.f Geol. Mag. 1961,'££ 58
Фиг. 1655. Сводная диаграмма кривых силикатного лик-
видуса и солидуса исследованных базальтов и кривых на-
чала плавления гранита, сиенита и нефелинового сиенита
1 - оливиновый базальт; 2 - высокоглиноэемистый базальт; 3 -
- щелочной базальт; 4 - окисленный гавайит. Участок сплошной кри-
вой для гранита проведен по данным Tuttle O.F., Bowen N.L.(Geol.
Soc. Am. Mem., 1958, 74. 153), пунктирная часть - по результатам
данного исследования. Кривая сиенитов основана на точке минимума
в системе Орт - Аб - Н2О (Tuttle O.F., Bowen N.L., Geol. Soc. Am.
Mem., 1958, 74, 153; Yoder II. S, Stewart D.B., Smith J.R., Camegie Inst.
Washington. Year book, 19p7, 56, 206—14). Кривая нефелиновых сиенитов
проведена приблизительно параллельно кривой, установленной при изу-
чении систем |4еф - Аб - HnO (MacKenzie W.S., неопубликованные дан-
ные) и Неф - НоО ( Yoder Н/S., Camegie Inst. Washington. Year book,
1957-1958, 57. 189-91) с использованием в качестве исходной точки
минимума в системе Аб - Орт - Неф - Кс (Schairer J.F., J. Geol.1950,
58, 512-7)
Yoder- H.S. ]г.Tilley C. E.t J. Petrology, 1962, 3, 463
SiO2-KCl_HCl
Полярность HCl
Молярность HCL
Фиг. 1656. Изобарно-изотермическая растворимость квар-
ца в растворах К Cl и НС1 в зависимости от концентра-
иИИ*Anderson G.M., Bumham C.W. Am. J. Sci., 1967,
1, 17. О растворимости кварца в растворах щелочных
солей выше критической температуры См. Wyart J., Sa-
batier G. С. R. 1955, 240, 2158
Фиг. 1657. Предварительная Р-Т диаграмма системы
драйкт - вода
Boyd F.R., England J.L., Carnegie Inst. Washington,
Yearbook, 1961-62. £1, 108
Al 0 -K_0-Mg0-Si02-H20-HCl
Фиг. 1658. Предварительная диаграмма некоторых фазо-
вых отношений в системе K^O-MgO — А^О^ — SiC^npu
500°С и общем давлении 10(Ю бар в присутствии кварца.
<еуег СА., Halmtey J.J. Geochem. Hydrotluonr Dep. 1967,
216
440
A1,0 .-Na ,0-Si0, -H ,0-HCl;
£ 49 & L Л»
NaAlSLO -Na„CO-HO
.5 о Z <> Z
Фиг.1659. Некоторые фазовые отноше-
ния в системе Na«O —'ALOo — SiO2 — Н20
(сверху) и ^0-A12O3-SiO2— Н2О (снизу)
в среде хлористых электролитов. Общее
давление 1020 атм, присутствует кварц.
Пунктирные кривые: а - равновесие К-полевой
шпат - слюда при 340 атм; б - при 2040 атм; в -
- отрезок кривой разложения анортита с образова-
нием кальциевого монтморилонита в растворах хло-
рида кальция.
Meyer Ch., Неш/еу J J. Geochemistry of
Hydrothermal ore deposits., 1967 , 212
/7
W
W
700
067g (Na2C03)25 ^♦/йм*МагС03-*/7
Na2C03*M,*^*/7
С03*М,*Л
НагС^^/7
Ж^Жг'П
8
^+Na2C03+Mr/7
м*кан*м ж^п
П
OOgg (На3С03)цо
ж^п
Уа^Ж^П \
Нг0
Фиг. 1660. Изобарические T-X сечения в системе NaAlSi^Og —Na2СО3—Н20
при давлении I кбар.
Более жирными линиями показано пересечение с солидусом, Ж - жидкость, обога-
щенная кремнеземом; - жидкость, обогащенная №2603
Koster Van Groos A.F., Wyllie P.J., Am. J. Sci.,1968, 2fe6. 10, 955
Фиг. 1661. Фазовые поля, пересекаемые разрезом
NaAlSi^Og — NaF в присутствии 5 вес. % Н2О
Koster Van Groos A.F., Wyllie'P.J., J. Geol., 1968,
76,1 , 57
Фиг. 1662. Фазовые поля, пересекаемые концентрацион-
ным разрезом Na Al Si ^0g-NaF в присутствии 10 вес.% H2O
Koster Van Groos A.F.,Wyllie P.J. J. Geol., 1968,
Zb I, 57
56
441
NaAlSi„0o—NaF—Н„0
О О —
Фиг.1663. Фазовые поля, пересекаемые концентрацион-
ным разрезом NaAlSi О -NaF в присутствии 25 вес.% Н20
Koster Van Groos А.г., Wyllie P.J. J. Geol., 1968
Ж 1. 58 .
850 -
800
750
700
650\-
30
Ht0
10 10
AOgfNaFff
Фиг.1664. Оценка содержания HoO в тройной жидкости
Е. Проекция границы поля Ж (Аб, NaF ) на плоскость
сечения ^35 NaF вдоль линии, параллельной
стороне Аб -NaF. Кривая Ж ;Аб, NaF) пересекает
четырехфазовую изотерму в точке Е (проекция тройной
жидкости Е на фиг. 1665 и 1666 ).Е содержит 30 вес.%
1^0 . Крестик на горизонтальной линии показывает
минимальное содержание Н20 в жидкости Е по оценке
потери веса при прокаливании.
Koster Van
7g, 1 , 59.
Groos A.F.JNyllie P.J. J. Geol., 1968,
Hz0
Изотерма
875°C
Аб+Ж'П
NaF
Аб*Ж*0
Аб
Hz0
Изотерма
688°
NaF
NaF+Ж+П
Аб+Ж+Л
A6*NaFW
Аб
H?0
Изотерма
775°
NqF+Ж+Л
Аб
Изотерма
650 ° О
4d+NaF*/7
Аб
вес, %
NaF
mog
Фиг. 1666. Равновесная диаграмма системы NaAlSi^Og-
NaF -H2O при давлении 1 кбар. Поля жидкости с первич-
ной кристаллизацией альбита и вильомита заканчивают-
ся в точке Е. Температура в скобках оценена. Поверх-
ность пара и границы поля схематичны.
Koster Van Groos A.FWyllie P.J, J.Geol., 1968,
76, I, 62
600 700 800 900 °C
Фиг. 1667. Кривая начала плавления в системе NaAlSi^O -
NaF-F^O в сравнении с кривой начала плавления в
системе NaAlSLOR-H„O (по данным Bumham G.W., Jahns.,
Am. J.Sci., 1962, 2&0, 10,721
Koster Van Groos A.F., Wyllie P.J. J.Geol.,
1968, 7& I, 65
Фиг. 1665. Ряд изобарно-изотермических сечений систе-
мы NaAlSi30g -NaF-Нрпри давлении 1 кбар. Состав
пара-, конноды и некоторые границы поля жидкости схе-
матичны.*
Koster Van Groos A.F., Wyllie P.J. J. Geol., 1968, 7g,
1, 60
442
NaA IS i308—NaF-H 20
NaAlSi 0 -H„O-X(X—SO , P,O_,HC1, HF, NH.()
•» О fc •> £ J • >
Фиг. 1668. Система NaAlS^Og-NaF-HjO при давле-
нии 4 кбар.
А - фазовые поля, пересекаемые разрезом, содержащим 50 вес.%
^0 ; Б - схематическая равновесная диаграмма. Состав паровой
фазы Е"показан по положению точек Р и В на фиг. А, содержание
воды в жидкости Е'оценено. В скобках указаны оценочные темпе-
ратуры.
Koster Van Groos A.F., Wyllie PJ. J. Geol.,
1968, 76. I j 66
компонента в растворе
Фиг. 1670. Кривые
HgO-X>rfle X —SOq Pq0^, НС1, Hf UP« посте
яниом давлении Z75O бар. Смеси содержали 50 вес.%
альбита и 50 вес.% раствора (Н?О + Х)
Wyllie P.J., Tuttle О. F. Am. J. Sci., 1964, 262. 931
начала плавления в системе NaAlSLO -
или NH3, при посто-8
Гранит - H2O-X(X-SO3, Р20г>, HC1, Li20. HF, NH.})
Ф и r.l 671. Кривые начала плавления в 'системе " гранит - Н 0-Х
где X-SO^,^2^5’ НС1, Li20. HF, NH^ при постоянном2
давлении 2750 бар. Смеси содержали 50 вес.% гранита
и 50 вес.% раствора ( Н^0 + X)
Wyllie P.J., Tuttle О. F. Am., J. Sci. 1964, 262, 936
Фиг. 1669. Фазовые отношения в системе гранит - HF-H2O
при 1000 кг/см2. Состав гранита: Na О *
-4,19;К2О -4,59; А^03 - 11,98; SiO2 2 - /6,78;
^Ca,Mc,Fe)O - 2,10 вес.%.
Ж. - силикатный расплав, - фторидный расплав; X - фаза X;
Ф - флюид, ш. п. ш. - щелочной полевой шпат.
Анфилоюв ВЛ., Глюк Д.С., Труфанова Л.Г. (в печати)
443
Al2O,t-Na2O-SiO2-NaCl-H2O
Габбро* H20
Фиг. 1672. Политермическая - изобарическая ,(Р =1 кбар)
Фиг. 1674. P - T проекция фазовых границ для высоко-
глиноземистого толеитового габбро в присутствии от 25
до 35 вес.% Н2О. Данные при давлении ниже 10 кбар
Yoder H.S., Tilley С.Е. (J, Petrol. 1962, 3, 342)
Lambert I.В., Wyllie P.J. Phys. Earth Planet. Interiors,
1970, Д, 317
проекция равновесий с участием кристаллических сили-
катов для псевдотройной системы Аб
59
Кв41
- NaCl -
Н2О (эвтектика альбит + кварц при РЦ-0 = 1 кбар
рассматривается как один компонент). Часть диаграм-
мы, прилегающая к стороне NaCl—F^ О для наглядно-
сти изображена вне масштаба.
Рябчиков И. Д., Хамилтон Д. Л. ,ДАН СССР (в печати)
A190Q_K _ 0—N a QO-S iCL -КС l-N aC l-H 90
Тоналит — н2о
Фиг.1673.Р - Т проекция фазовых границ для тоналита
в присутствии от 25 до 35 вес.% F^O. Данные ниже
10 кбар - экстраполированные результаты опытов с той
же самой породой при 1,2,3 кбар. Piwinskii'A.J. (J.Geol.,
1968, 7& 548)
Lambert I.В., Wyllie P.J. Phys. Earth Planet. Interiors,
1970, 3, 318
Фиг. 1675. Диаграмма, показывающая (приблизительно)
насыщенный Н^О ликвидус в системе Na'AlSi^Og -
KAlSi3O8-NaAlSiO4-KAlSiO4-NaCl -КС1 при P -
= 2000 бар с нанесением оценочных границ поля пер-
вичного содалита как функции х^люид в сосуществую-
Н2О
щем в&дном Флюиде. (Показаны ликвидусы по данным
Clark S.P. (Mem. Geol. Soc. Am. 1966, 97, 345,70).PeterS
T.J., Luth W.C., Tuttle O.F. (Am. Min. 1966, £1, 736-54),
Tuttle 0. F., Bowen N. L. (Mem. Geol. Soc. 'Am., 1958, 74>
153).
Wellman Т.Н., J.Petrology. 19.70, 11, 1. 63.
444
A l203-K 20-Na 20-SiO2-KCI-NaCl-H 20
Фиг. 1677. Составы сосуществующих фаз в ассоциации
содалит-нефелин - 2 полевых шпата - водный флюид
как функция температуры при давлении флюида, равном
2000 бар.
Wellman T.R. J. Petrology, 1970, 11, 1, 68.
X fr"?™ для вод-
ti OU
Фиг. 1876. Диаграмма X 1“’?РИП —
KCI
ныл флюидов в равновесии с содалит + нефелин + 2 по-
левых шпата при различных температурах и давлениях.
Граница поля анальцима неизвестна и ею пренебрегли.
Содалит устойчив ниже, а нефелин - выше каждой изо-
бары.
Wellman T.R. J. Petrology, 1970, 11, 1,67.
ОКИСНЫЕ СИСТЕМЫ ПОД ДАВЛЕНИЕМ СО2
Двухкомпонентные
ласти плавления
1 - визуальные определения; 2 - термогравиметрические опре-
деления, 3 - определение капиллярного подъема
Фиг,1680. Р-Т диаграмма системы СаО^СО^ в облас-
ти плавления
1 - CaCOo "Anala R. 2 - исландский штат; 3 - исландский
штат в опытах Smith F.H., 'Adams L.H. (J. 'Am. Chem. Soc.,1823, 45»
1167
Baker E.H. J. Chem.Soc. 1962, 467
Baker Е.Н. J.Chem.Soc., 1964, (Feb), 701
Фиг. 1679. Диаграмма температура - состав в эвтекти-
ческой области.
Baker Е.Н. J. Chem. Soc., 196 4, (Feb), 703
Фиг. 1681. Диаграмма температура - состав в эвтекти-
ческой области. Кривые Е и F - изобары при 56 и 100
атм, соответственно:
1 - экстраполированные составы; изобарические сос-
тавы: 2 - определены закалкой; 3 - определены тер-
могравиметрически. Составы в равновесии с твердой
фазой находятся при различном давлении.
Baker Е.Н. J. Chem. Soc., 1962, 468
446
Фиг. 1682. Термическое разложение кальцита ( СаСОз
9=2 СаО + С0„) в координатах log Р и I /Т*10^
Все опыты проводились в запаянных трубках. Показаны г
также кривые Harker R. I., Tuttle О. F. (Am. J. Sci 1965,
253. 209-224) и Smith F.H., Adams L.H.(J. Am. Chem.
Soc., 1923, 45, 1167)
Goldsmith Heard H. C. J.Geol., 1961, £2, I,
73
Фиг. 1684. Кривые равновесий 3 (РЬСОз) = (2РЬСОз*
РЬО) + СО^Пи 2(2РЬСО3-РЬО) = (РЬСО3« РЬО)+СО2(2)
Д.А. Грисаффа и В.Б. Уайта (см. фиг. 1685), с нанесе-
нием экспериментальных данных автора
1 - церуссит; 2 - церуссит + ( 2РЬСО3.РЬО); цифры около то-
чек - номера опытов
Остапенко Г. Т, Геохимия, 1968, 1, 1311
Фиг.1683. Изобарическая равновесная диаграмма для
системы СаО-СО? при Р - 1000 бар. Пар - почти чис-
тый С02,. во эта часть диаграммы искажена, чтобы
показать фазовые отношения
Wyllie P.J.t TuttleO.F. J .Petrology, 1960,1 » 10
Фиг. 1685. Р-Т проекция системы РЬО—С02:
1 - РЬСО3; 2 - 2РЬСО3 • РЬО; 3 - 1РЬС03 -ЗРЬО;4-
РЬСО3 • РЬО; 5 - РЬСО3 • 2РЬ0; 6 - РЬО; 7 Ж
Grisafe D.A., White W.B. Am. Min., 1964, 49, 9/10,1191
447
Трехкомпонентные
Фиг. 1686. Кривая равновесия реакции спёррит (Ca.SLOg
•Са€0^)+волластонит(€а8Ю3) = 3 ларнит (Ca2SiO4J тССС
1 - 3 - опыты с гелевыми смесями; 4 - 6 - опыты с ларнитом
в качестве исходного материала; 1,4- ларнит; 2,5 - спёррит +
+ волластонит; 3,6 - равновесие не достигнуто, присутствуют три
фазы. Точки, соединенные перемычкой, указывают на проведение
опытов при одинаковых параметрах, определяемых положением геле-
вой точки, с разными смесями
Фиг. 1688. РСО2—Т моновариантная кривая реакции каль-
цит + кварц — волластонит +СО2
1 - калыхит + кварц; 2 - волластонит + С02
Harker R.I., Tuttle О. F. Am. J. Sci1956, 254. 249.
Ямулович КЛ, ДАН СССР, сер.геол. 1967, 177, 4, 905
Фиг. 1687. P^q^—T кривые, ограничивающие поле ста-
бильности ассоциации тиллеит+ССк.
2
Квадраты - эксперименты с природным тиллеитом, кружки - экспе-
рименты с аналитическими реактивами. .
Мол. дол я COz
Фиг. 1689. Влияние состава флюидной фазы на темпера-
турное равновесие в системе кальцит - кварц - воллас-
тонит при Р - 1000 и 2000 бар.
Von К. Todheide, Franck E.V. Вег. Dtsch. Ke ram. Ges.
1964, 41, н 2, 62
Harker R.l. Am. J. Sci., 1959, 257, 9, 660
448
Фиг.1690. PCCh -Т моновариантная кривая реакции
ЗСаСОз+2СаЗЮ3»г гСа^Ю* СаСО3 + С02
Tuttle O.F. Harker r, /. Am. J. Sci., 1957, 255, 228.
Четырехкомпонентные
Na AlSi 0«-Na,CO.-CO,
3 £ it z
Фиг. 1692, Сечение NaAlSi3O8-Na2CO3 в присутствии
избытка СО £ ИР11 давлении I кбар
>Kj- жидкость, обогащенная NaAlSi,0o » Ж - жидкость, обога-
щенная Na^CO^ 38 2
Koster Van Groos A.F., Wyllie P.J. Am.J.Sci, 1966,
264. 3, 245
MgO-SiO2-CO2
Фиг. 1691. Равновесные PT - кривые реакций, протекаю-
щих при метаморфизме кремнистых магнезитов; кривая
И - для реакции MgCO3 + SiO ? —*MgSiO 3+ СО?, К —
2MgCO3+SiO^Mg^iO^ 2С0^;Л -MgCGj^MgO+ С02
Weeks W.F. J.Geol., 1956, 64, 258
Фиг. 1693. Кривая равновесия реакции окерманит + каль-
цит ss мервинит+СО?
1 - мервинит+СО2 ; 2 - окерманит + кальцит
Лмулович К. ИДАН СССР, сер.геол. 1969, 184, 5,
1178
57
449
CaO-MgO-SiO2-CO2 A12O3- ATgO-SiO^H^
Фиг. 1694. P-T кривые реакций
I - Ka + Ди Окм +co2; II - Ka + Ди + Фо дк Монт
+ С02 ; III - Дол в Ка + Пер + С02; IV- Ма -* Пер +
С02; V - Кв + Ka Волл + С02» V1 - Кхл длв Фо + Корд +
+ Шп + Н20, VII- Волл 4- Монт з=* Окм. Кривая Ш при дав-
лениях ниже 204 атм проведена по данным Graf F., Goldsmii.i J.R,
(Geoch. Cosm. Acta, 1855. 7 . 100)
Harker /?./., Tuttle 0. F. Am. J. Sci, 1956, 221. в. 474
Фиг. 1696. Экспериментальные P-T кривые реакций
группа А: (Окм J 2 Ka + I Фо + I Ди - 3 монт +
+ 2СО2 ; (Монт) (Фо) Ка + Ди- Окм + СО 2. Группа В:
(Монт) (ФО) Ка 4 Ди - Окм + С02;(Дн)Ка + Фд +
+ Окм- 3 MoHT+fco2. Группы С и Ь: (Ka) (С0_) 3
Монт + Ди - 2 Окм + Фо. Кривая реакции (Мот*)
(Фо) оканчивается в инвариантной точке при^720°С
и Р - 01 атм. При температурах ниже этой точки каль-
пит и диопсид реагируют с образованием монтичеллита,
волластонита и СО». Реакция, представленная кривой
D , не протекает в присутствии газообразного СО^
Walter L.S. Am. J. Sci., 1963,221. 5, 493
Ш0 - w
СаО-MgO-SiO2- С02
Фиг. 1695. Экспериментальная моновариантная Р-Т кри-
вая реакции: форстерит + кальцит » монтичеллит + пе-
риклаз + €0?
Walter L.S. Am. J. Sci, 1963, 221. 8, 774
Фиг. 1697. Кривые равновесного давления для реакций
(Ак), (Монт), (Фо) и (Ди).
Walter L.S. Am. J. Sci., 1963, 261, 8, 777
450
СИСТЕМЫ ИЗ ОКИСЛОВ ПОД ДАВЛЕНИЕМ Н2О+СО2
Фиг. 1699. Изобарические политермические диаграммы
для системы СаО — Ср2~ ^0 • Температуры в скоб-
ках - оценочные
X на фиг. Б - состав, использованный в экспериментах при 25 кбар;
В и Г - гипотетические диаграммы; на фиг. В - вторая
критическая точка Ж - П| [ Арат, Са(ОН)_ ]; ин. несм - интервал
несмесимости
Wyllie P.J., Boettcher A.L. Am.J. Sci., 1969, 267 A. 502.
Фиг. 1698. Р-Т проекции моновариантных кривых в сис-
теме СаО — СО2 —Н2О (частично даны схематически ).
Реакции обозначены цифрами: 1 - калышт Г е* арагонит, 2 -
кальиитП арагонит; 3 - кальцит! кальцитII; 4 -СаСО3 +
♦CaCOHL + П Ж; 5 - СаСО3 + Са(ОН)2 Ж; 8 - Са(ОН)2 +
+Й=*Ж; 7 - Са(0Н)2 + СаО ₽ Ж; 8 - СаСО3 + 11 Ж;
Са(ОН)2 Ж. 9 - СаСО3 + СаО Ж; 10 - СаСО3« Ж;
Qj-Qii - нварнартные точки.
Фиг. 1698 A. P-T проекции инвариантных кривых в систе-
ме СаО—СО 2—^0 (частично, особенно в области высо-
ких давлений, даны схематично).
QZ, Q* ,Q - инвариантные точки в системах СаО— 1^0, СаО-СО2
CaO-OOj-t^O соответственно.
Wyllie P.J.t Tuttle O.F. J. Petrology , I960, L. 39
Фиг. 1700. Изобарно-изотермические диаграммы системы
СаО-СО 2 - Н2О - при давлении 1000 бар. Плоскос-
ти при последовательно понижающихся температурах ил-
люстрируют смещение трехфазных треугольников по ТХ -
призме. Пунктирные линии, показанные в двухфазной
области Ж < П экспериментально не определены. Чтобы
показать фазовые соотношения, область пара дана в
более крупном масштабе.
I- СаО + Ж +СаС0^2 -СаСО^- Ж + П; 3 - СаО + Ж +Са(0Н)2
4 -Са(ОН)2 + Ж + П; S'- СаСО3 + Са(0Н)2 + Ж; 6 - СэО+СаС03+Са(ОН)2;
7 -СаСО, + Са(ОН)2 + П; 8 -СаО+ Ж; 9 - Ж + П; 10 - СаСО +
+ П; 11 -СаСО3 + Ж; 12 - Са(ОН)2+ Ж; 13 - Ж; 14 - П 3
Wyllie P.J., Tuttle O.F. j. Petrology, I960, L 25
45.1
CaO—CO, -H,0
A A
Фиг. 1701. Перспективные TX проекции системы СаО-
-СО2—Н2О при Р=1000 бар. Границы полей спроекти-
рованы в призме ТХ на 3 поверхности призмы. Напри-
мер, фиг. В показывает ДОЛ10Н2О и С02 в жидкости или
паре на границе поля при различных температурах и не
показывает концентрации СаО . Доля СаО может быть
оценена по фиг. А и С. Точечные линии на фиг. А и С
отделяют бинарные фазовые поля, соответственно, в
системах СаО— и СаО - С0? . Линия FZ - грани-
ца поля пара в субсолидусной области, дающая (схема-
тично) состав пара, который может сосуществовать с
СаСО3 + Са(ОН)2
Wyllie P.J., Tuttle О. F. J. Petrology, 1960,1, 30.
MgO-CO2-H2O
Фиг. 1702. Область устойчивости магнезита.
Shloemer Н. N.Jb. Min.Monatsh,1952, 135. О термо-
динамических расчетах равновесий в системе MgO—СО*
-FtaOcM. Metz Р., Graef М., Johannes Ж. N.Jb. Min. Mo—
nalsh . 1968, 1-2, 1-15
500
°C
900
800-
700
600 \
х1 o2 аЗ
Фиг. 1703. Изобарические сечения вдоль линии соедине-
ния MgC03-Mg(0H)9 в призме Т-Х • системы MgO-
i^O-CO/
А- при Р - 1000 бар; В - при Р - 4000 бар; 1 - MgO + П; 2 =
MgOHQCOf+n, 3= Mg(OH)2, 4= Mg(OH)2 +MgCO3
Walter L.S., Wyllie P.J., Tuttle O. F., J. Petrology, 1962»
3? 53
H2O Bee,% НдСОз
Фиг. 1704. Сечеиие магнезит - вода при Р = 1000 бар.
Слева вверху на диаграмме показаны ( в увеличенном,
искаженном масштабе) фазовые равновесия в части
системы, обогащенной водой.
Walter L.S., Wyllie P.J., Tuttle О. F., J. Petrology, 1962,
a, 54
Фиг. 1705. Состав пара при Р = 1000 бар (сплошная ли-
ния) и Р » 4000 бар (пунктирная линия; в равновесии с
Mg (ОН)^и MgCO^( вдоль ab и a' bz), с MgO и MgCO^
(вдоль dc и b* с) и с MgO и MgfOH) 2 (вдоль bd и Ь' а/,'
Точки Ьи К- изобарические инвариантные температура
и состав пара, при которых сосуществуют MgO, Mg(0H)2
MgCO3 и пар
Walter L.S., Wyllie P.J. Tuttle О. F. J. Petrology, 19Q2,
3. 61
452
Четырехкомпонентные
A,2°3-MgO-CO2_H2O
Фиг.1706. Треугольники составов - проекции на осно-
вание тетраэдра из вершины F^O
Roy D.N., Roy R., Osborn E.F.Am. J. Sci.. 1953. 251.
Lj______i_________u
H20 5 C02
Состав пара, вес. %
5, 352
CaO- MgO-C02-H20
Фиг. 1707. Распад доломита при 2000
рах 440, 460 и 510 С в зависимости
4 держания воды в исходной смеси. В
кривых (при малых реликтовых количествах доломита)
равновесие не было достигнуто
MetzP.W., Winkler H.G.F. Geoch. Cosm. Acta, 1963, 27
5. 445
сог
H20 5
CaO —
Фиг. 1709. Система
-MgO—CC>2—F^O. Схемати-
ческое изобарическое сечение
петрогенетической модели
при Р = 500 бар.
А - изображено в масштабе,
фазовые соотношения вблизи вер-
шины Н?0 неразличимы; В я С -
- альтернативное расположение
кривых реакций вблизи вершины
HL 0; Е| и Е - температуры ми-
нимального плавления соответст-
венно в системах СаО-С0_-1L0 и
CaO-MgO-СО2-Н2О 2 4
Wyllie P.J.J. Petrology ,
1965, 6,1,107
атм и темпера ту-
от повышения со-
области пунктирных
^Wep]
Фиг.1710. Система CaO-MgO-CO?—Н2О* Изобарно-нэо-
термическое сечение при Р= I кбар и 770°С, показыва-
ющее три четырехфазовых тетраэдра.
WyHie P.J. J. Petrology , 1965, g. 1, 109
Фиг. 1708. Область устойчивости доломита.
Schloomer H.N. Jb. Min. Motatsh, 1952,134
453
80 W СаСОз 80
toc.%Ca(OH)a
W CttCOj
Фиг.1713. Система CaO—SiO -COz РЦОпри P - 1 кбар.
Фазовые поля пересекаются концентрационными разре-
зами 5% и 10% Si0_ в плоскости СаСО - Са(ОН)2 - (SiO2 +
+4,3% HQO). Горизонтальными линиями показаны реакции
Ка+ Са(0Н)2 + Кх + П 5= Ж (Efi) 637°, Ка + Кх +
+ Па=»Ст + Ж (Р ) 677°С, Ст + Kx=s=^€a2SiO4 + Ж
(Р_) + П 860°С. Точки X и У. отвечают точкам на гра-
О
ницах между полем жидкости,насыщенной паром, и облас-
тями первичной кристаллизации Кх, Ст и Ка (слева
направо на диаграмме).
Wyllie P.J. Haas J.L. Jr. Geoch. Cosm. Acta, 1965, 2J,
8, 881
Фиг.1711. Фазовые стабильные соотношения между каль-
цитом, кварцем и волластонитом в надкритических сме-
сях Н^О и СО^.
Верхняя кривая - для Р « 2 кбар; 1 - Волл; 2 - Ка + Кв; ниж-
няя кривая - для Р » I кбар; 3 - Волл, 4 - Ка + Кв. Общее дав-
ление равно давлению флюида, состав газа определяется мольной
долей СО 2. Кривые рассчитаны при допущении идеального смешения
СО? и Н?0 . Точки для чистого СО?- данные Harker R.I. Tuttle O.F.
(Am. J. Sci.,1956, 251 238 - 256.
Greenwood H.J,, Am. Min., 1967, £2, 11/12, 1672.
Фиг. 1712. Система CaO-SiO2-COj H20 ПР« 1 кбар; схема-
тическая равновесная диаграмма/
A BCD - насыщенная паром поверхность ликвидуса, точки 6,7,8 -
- изобарические инвариантные жидкости Eg, Р? и Р„ соответствен-
но (см. фиг.1714). Точки N,M обозначают то же, что и на фиг.1714.
Линия ХУ термически разделяет поле Са2§Ю^ на область ликвиду-
са, насыщенную паром (выше линии), в которой при кристаллиза-
ции образуются только силикатные фазы и пар, и область ликвиду-
са (ниже линии), в которой при кристаллизации образуются водные
и карбонатные фазы наряду с паром.
Wyllie P.J., Haas J. L. Jr. Geoch.Cosm. Acta, 1965, 22, 8,
890
CazSiD*
Фиг.1714. Система CaO-SiO2-CO2-H2O прн 1 кбар. Про-
екция поверхности ликвидуса, насыщенного паром на
плоскость Ca2SiO4- СаСО3 - Са (ОН)2* Проектируемые точ-
ки отмечены буквами с двумя штрихами. Температура
Р3 955°С. Точечная линия MON - пересечение насыщен-
ной паром поверхности ликвидуса с плоскостью СаССК-
- Са(ОН) 2- Са2 SiO.
Wyllie P.J., Haas J.L. Jr. Geoch. Cosm. Acta, 1965, 22>
8, 886
454
CaO-SiO2-CO2 -H20
Фиг. 1715. Изобарическое сечение петрогенетической мо-
дели, иллюстрирующее точное положение одной дивари-
антной реакции плавления и одной дивариантной реакции
декарбонизации. Граница поля СаСО_ Ж + П в
тройной системе СаО —СС^—Н20 оканчивается в эвтек-
тической точке Е|, где сосуществующая газовая фаза -
- почти чистая Н20 ( по Wyllie P.J., Tuttle О. F.,
фиг. 1701 )• Влияние Н20 в газовой фазе на температу-
ру реакции декарбонизации рассчитано
Wyllie P.*J., Haas. J. L. Jr., Geoch. Cosm. Acta, 1966, _3Q,
5, 528
Фиг. 1717. Изобарическое (Pe 1 кбар) сечение петроге-
нетической модели, показывающее субсолидусные реак-
ции в системе CaO-SK^-CK^-H^.
А - схематическая диаграмма, иллюстрирующая реакции в облас-
ти, обогащенной парами Н О; В - полная диаграмма, искаженная
около для ясности; 2масштаб - см. фиг. 1715
Wyllie P.J., Haas J.L. Geoch. Cosm. Acta, 1966, 30.5.
530
Состав пара Ввс,7о
Фиг. 1716. Изобарическое (P = 1 кбар) сечение петроге-
нетической модели, показывающее реакции на поверх-
ности ликвидуса в равновесии с' паром для системы
CaO_SiO2 _ ,120.
А - схематическая диаграмма, иллюстрирующая реакции в облас-
ти, обогащенной парами Н2О;В - полная диаграмма, искаженная
около Н2О для ясности; масштаб см. фиг. 1715.
Wyllie P.J., Haas J.L. Geoch. Cosm. Acta, 1966, 5, 530
Фиг.1718. Расположение моновариантных кривых вокруг
инвариантной точки.
Wyllie P.J., Haas J.L. Geoch. Cosm. Acta, 1966, 30. 5,
536
455
K,O_SiO, -CO„-H2O
Z A A **
Фиг. 1719. Состав пара в зависимости от увеличения
давления Н?0. Ki, К2СО3 + K^SioOc (отнош.К^О : SiO2 в 1);
Ко, КНСО3?SiO2 Готнош. КД:SiO2 = 3). Несколь-
< ко кривых Kj и К3 характеризуют разное парциальное
давление Н£)
Morey G.W., Fleischer М. Dull. Geol. Soc. Am., 1940, 2b
1035-58
Фиг. 1721. Равновесный состав флюидной фазы в зависи-
мости от температуры при постоянном общем давлении
(^общ)» Равном 2 кбар.
В поле Т - XqQj показаны фазовые границы:а - Фо+ Н?0 + СОо^
Серп + Ма; Ь~Фо + HoO + COoF^Ta + Ма; с—Серп+Си? 1® +
+ Ма + Н20 ; d-Ta + □,?== Кв + Ма + Н9О; е-Серп—Фо+Та + Н_О;
f- Серп + С025=* Кв +^Ma + H20l;zX - Серп + Кв^е Та +1^0.
Пунктирные кривые X и f экспериментально не определены. Рав-^
новесные поля получены при экспериментах с составом 2Mg0: Si02
Johannes Ж. Contrib. Min. Petrology, 1907/ 15. 244
Пягикошюнецтные
CaO—MgO—SiO_—C0o -H90
A Z *
Фиг. 1720. Распределение H20 между паром и жидкостью
в зависимости от давления при постоянной температуре
1 - К 1, KHCO.fSiO^ - К 1, K9C0q + K9Si90<,
3 - К 3, КНСО3 + Si02 2 3 2 2 5
Morey G.W.t Fleischer М. Bull. Geol. Soc. Am., 1940. 51
о----о 1 -----2 МОЛ.дОЛЯ ХСОг
1035-58
Фиг. 1723. Изобарическая равновесная кривая реакции 5
диопсид + ЗСО2 + Н20 2=5 тремолит + 3 кальцит + 2
кварц
^COj’ мольная доля С02 в флюидной фазе, состоящей из С02 и
Н20. Общее газовое давление 1000 атм. 1 - экспериментальная кри-
вая; 2 - расчетная кривая.
Metz Р, Вег.Bunsenges.Phys. Chem. 1966, 70. 9-Ю,
1044
Фиг. 1722. Изобарическая равновесная кривая реакции
ЗСО2 + Н2О+5 диопсид г=± тремолит + 3 кальцит + 2 кварц
XrfY - мольная доля С02в флюидной фазе, состоящей из €С2И
Н20/^ Общее газовое давление 500 атм 1 - экспериментальная
кривая; 2 - расчетная кривая.
Metz Р. Вег. Bunsenges.Phys. Chem. 1966, 20» 9-Ю.
1043
456
Поликомпонентные
CaO-MgO-SiO2- CO2-H2O
СаО-FeO—MgO—SiO2 -CO2-H2O
Фиг. 1724. Изобарическая диаграмма летучий компонент-
- температура для реакций в кварцево-карбонатных по-
родах. Обшее давление газа 1000 бар.
Melson JF.G. Am. Min.,1966, §1., 3-4, 412
Фиг.1726. T - X ( X' - Fe/Fe+Mg,Mon %) диаграмма для
ряда тремолит - ферроактинолит при постоянном дав-
лении водяного пара 1000 бар и давлении СО 2 около
50 бар.
Hellner Е.> Schumann K.J. Geol., 1966, 74_, 3, 326
Фиг. 1725. Изобарические равновесные кривые реакций
1. 2, 3, 4, 5.
Хс02” мольная доля С02в флюидной фазе, состоящей изС02
нЬ^О. Общее газовое давление 1000 бар. Реакции: 3 доло-
мит + 4 кварц + I Н20 ±=г I тальк + 3 кальцит + ЗСОгО);
5-тальк + 6 кальцит + 4 кварц 3 тремолит + 6 С02+ 2Н 0(2):
3 тальк “Я- 3 кальцит I тремолит + I доломит +1С02 + 1Н2О(3);
5 доломит + 8 кварц + I Н20 I тремолит + 3 катщит + 7СО2(4);
2 доломит + {тальк + 4кварц {тремолит + 4С02(5)
Metz P,t Puhan D., Winder H. Q. F,, Naturwissenschaften,
1968, H5, 225
Фиг. 1727. Фазовые отношения в системе СаО—MgO-
-FeO-H2O с избытком Si02 при 450°С и Ри •-= ЮООбар,
4 "2°
Ре© " 50 бар
Hellner Е., Schumann К, J. Geol., 1966 , 74, 3, 328
58
457
CaO- FeO-MgO-SiO,-CO„-H,O
& & A
Фиг. 1728. Фазовые отношения в системе СаО—MgO—FeO-
-Н20 с избытком SiOn при 350°С и P^q - 50 бар,
Рн о - 1000 бар. ‘ 2
2 Hetlner Е. Schumann K.J. GeoL, 1966, 74» 3, 327
Фиг. 1729. Изобарическая равновесная кривая реакции
ортоклаз + доломит + вода флогопит + калыхит +
+ 002* Обшее давление равно I кбар.
Пунктирные линии, пересекающие кривую, обозначают опыты, в
которых присутствуют все 4 твердые фазы.
bailey O.K. Camegie Inst. Washington. Year book,
1963-84, 63. 80
РАЗНЫЕ ВЕЩЕСТВА ПОД ДАВЛЕНИЕМ Н2О + СО2
CaO-CaF2-CO2 -Н2О
Са(0И)2
Стекло +
кристаллы
Фиг. 1732. Р-Т кривые начала плавления гранита Wester-
ly под давлением смеси водяного пара и углекислоты
Кристаллы ~
| Фиг. 1730. Изобарическое сечение при Р - 1000 бар
тройной системы СаС0«-CafOH)? - CaF2
Gittins J.t Tuttle О. F. Am. J. Sci ., 1964, 262. 73
C02+<
0,05
0,1
0,2
3
см
см3
3
см
н2о
н2о
н2о
2
5
6
3
пара в смеси (увеличение парциального
При уменьшении водяного
давления С02) температура начала плавления растет
Wyllie P.J. and Tuttle О. F. Am. J.Sci., 19S9 , 257. 9,
650
Фиг. 1731. Р-Т диаграммы, показывающие начало плав-
ления в тройной системе Са€О3 - Са(ОН)2 -€aF2
А - без избытка водяного пара. Б - с избытком
водяного пара.
Gittins J., Tuttle О. F.t Am. J. Sci., 1964, 262» 74.
A,/):rK20"M8°-Si02 -С02 _f,2°
КгО-6МдОМД65ь Ox
I Фиг. 1733. Сечение K20«6MgO-AUOy 6SiO j-H-O-CO, пока-
зывающие изученные составы вдоль 3 концентрацией-
I ных разрезов
I Voder U.S. Camegie Inst. Washington. Year book. 1968-
169, 238.
459
Аб70 -ОРт30-Н2О-СО2
Фиг. 1734. Системы альбит-вода—углекислота (а) и
Аб_п Орт„п - вода - углекислота (в). Предваритель-
ные°Р-Т кривые плавления синтезированных полевых
шпатов под давлением смеси водяного пара и углекис-
лоты. При добавлении углекислоты к водяному пару '
при постоянном общем давлении температура плавления
повышается. В бинарных системах полевой шпат - во-
да (Аб^ Орт-д - состав минимального плавления в
системе альбит - ортоклаз) плавление при постоянном
давлении происходит полностью при одной температуре.
В тройных системах полевой шпат - вода - углекисло-
та полевые шпаты имеют интервал плавления в изоба-
рических условиях.
Wyllie P.J., Tuttle О. F. Am. J. Sci., 1859, §7, 9. 652
ВОДНО-СОЛЕВЫЕ СИСТЕМЫ ПОД ДАВЛЕНИЕМ
СаСО3-Н2О
Фиг,1735. Растворимость кальцита в водных и водно-
-солевых растворах (0,98 N СаС^ ) в зависимости
от давлений Малинин С.Д. Геохимия, 1963, 7, 634
1 - данные настоящей работы; 2 - данные Ellis A.J. (Am. J. Sci.,
1959. 257. 354-365); 3 - данные Miller J.P. (Am. J. Sci., 1952. 25CL
161-203).
Segnit E.R., Holland H. 0., Bi scar di C.G. Geoch. Cosm.
Acta, 1962, 1306
Фиг. 1738. Растворимость кальцита при 200°С.
1 - Данные настоящей работы; 2 - данные Ellis A.J. (Am. J. Sci.,
1959. 2>L 354.
Segnit E.R.t Holland H. D.t Biscardi C. G., Geoch. Cosm.
Acta, 1962, 2& 1308
461
СаС03_н20
Фиг. 1739. Изобарическая (1000 бар) диаграмма фазо-
вых равновесий в сечении СаСО^ — Н2О. Система не би-
нарна.
Wyllie P.J., Tuttle O.F. J. Petrology , I960, 1. , 20
NCL2CO3 Sec, %
Фиг. 1741. Фазовые равновесия в системе №82^3 —1^0
Проекция на плоскость давление - состав. Числа у кривых - тем-
пература, в °C; X- определено методом Р — V кривых.
Равич МЛ, Геохимия, 1966, II , 1283
Фиг. 1740. Изобарическая (1000 бар) проекция диаграм-
мы системы CaCOj — Са(ОН)£ КальцитII может быть
устойчив выше 945 С. Система бинарна при этом дав-
лении (исключая поле, где присутствует пар).
Wyllie P.J., Tuttle O.F. J. Petrology, I960, X, 19
Фиг. 1742. Растворимость ангидрита в воде. Показаны
сечения Р-Т-Х поверхности насыщения плоскостями
постоянных содержаний CaSO4.
Dickson F.W., Blount C.W., Tunell G., Am. J. Sci., 1963,
261.1. 75
462
CaSO.—H,O, Na,SO.-НО
4> Z Z 4 л
CuSO4-H2O
мо/кг
10е г
10s /
10"
103
102V\
101 -
10е-
Ю' -
1О'г-
103-
10'"-
10'3г
Вода твсаль (Иаг50ч)
хдакритаческая
* область
\ггокг1с*
Са5Оч2НгО
ь
Вода-m! соль '
(CaSO,)
। Перегретый тр-
^-твердая соль
IS
,_____________________________
О 100 200 300 100 500 °C
Фиг. 1743. Диаграмма фазового равновесия систем NanSCh
-Н2О и CaSC^-HnO
Старикович М,А., Хайбуллин И.Х., ДАН СССР, 1956,
109. 964-
Фиг. 1745. Фазовые границы при разложении брошантита:
1 - опыты без образования антлерита; 2 - опыты, в которых
был получен антлерит.
Pistorius С. IF. F. Т. Bull. Soc. Chim. Beiges., 1962,
71, 3-4, 219
CaS04- Н2О
Фиг. 1744. Р-Т равновесная диаграмма системы CaSO^ -
Н2О (стрелками показано направление достижения рав-
новесия)
Jamamoto Н., Kennedy G. С., Am. J. Sci., 1969, 267 А, 555
5Н90 под давлением до 40 кбар.
Pistorius C.W.F. Т. Zs. Phys. Chem (Frankfurt am
Main), N.F., 1967, 55, 1/2, 81
463
CuS0,-H,0
4 Z
Фиг.1747. Кривая плавления эвтектики CuSO^’S^O -
лед VI ( VII). Пунктирные линии - часть фазовой диаг-
раммы чистой Н20.
Pistorius C.W.F.T., Clark J. В. Zs.Phys. Chem.(Frank-
furt am Main), N.F. 1967, 55, 82
Фиг.1749. Фазовая диаграмма CuSO^’t^O под давлением
до 40 кбар.
Pistorius C.W.F.T., Clark J. В. Zs. Phys. Chem. (Frank-
furt am Main), N.F. 1967, 55,1/2, 85
Фиг. 1748. Кривая инконгруэнтного плавления C u SO 4 *3H9O
под давлением до 40 кбар. я 2
Pistorius C.W.F.T., Clark J. В, Zs. Phys. Chem.(Frank-
furt am Main), N. F., 1967, 55,1/2, 84
K2SO4-H2°; Li2S04-H2°; Na2SO4_H2O
Фиг.1750. Проекция на плоскость давление - темпера-
тура кривых трехфазного равновесия и критических кри-
вых, исходящих из точки Q
а - система L^SO^-l^O ; б - система Na2SO4-H2O; в - сис-
тема ^2^4"^ 2^’ 1 - трехфазное равновесие; 2 - критические
точки.
Равич М.И. Геохимия 1966, 11, 1282
464
Na2S04-H20 .
Фиг. 1753. Зависимость температуры плавления глаубе-
ровой соли от давления.
Данные: 4 - Tamman G. (Zs. Phys. Chem., 1903, 64, 818), 2 -Tam-
ilian G. (Zs. Anorg. Allgem. Chem. 1929, 170, 186), 3 - Geller A.,
(Zs. Krist. 1924, gQ, 415), 4 - Adams L.N., Gibson Н.ЩСпоавоч-
ник для геологов по физическим константам,ИЛ, 1949, стр.184), 5 -
Крюкова П. А., Манихина В. И.
Крюков П.А., Манихин В.И,, Изв. АН СССР, Отд.
хим.наук, 1960, 2242
Ut$04Vto.*4
Фиг. 1751. Фазовые равновесия в системе L^SQ^ —Н2О
Проекция на плоскость давление - состав. Числа у кривых -
- температура, в С.
Равич М,И. Геохимия, 1966, И, 1283
Ъъг30и, вес. °fo
Фиг. 1752. Фазовые равновесия в системе L'^SO^ —
Проекция на плоскость температура - состав. Числа у кривых -
- давление, в кг/см2
Равич МЛИ, Геохимия, 1966, 11, 1284
Na г50ц, вес. °/о
Фиг.1754. Фазовые равновесия в системе
Проекция на координатную плоскость давление - состав . Числа у
кривых - температура, в С; X - определено методом кривых Р - V
Равич М,И. Геохимия, 1966, 11, 1276. См. также
фиг. 1750.
59
465
Ne^ _Н20
<§
IfflP
1600
1400
8 1200
1000
400-
200-
380
370*
600/
w
Ht0 20 40 60
Вес.%
Фиг. 1755. Перспективное изображение пространственной
модели системы Na2SO4—^0.
. Равин МЛ, Боровая ФЛ, Журн. неорг. химии,
1964, 4,972
ООО - ^20
600-
2^0 кГ/см
800 >_4:
Вес. Ъ
Фиг.1757. Проекции изобар насыщенных растворов на
координатную плоскость Na2SO4— NaOH -1. Числа у изо-
бар-давление, в кг/см^.
Равин МЛБоровая ФЛ. Иэв. Сектора физ.-хим.
анализа Ин-та обшей и неорг. химии АН СССР, 1955,
26. 240
Na_SO.-Н,0- NaOH
Я 4 *
ВаС12- Н20
•С
нхо
Фиг. 1756. Проекции изобар насыщенных растворов на
треугольник состава Na ^О4—И2О —NaOH
Числа у изобар- давление, в кг/ом^.
Равин И,И,, Боровая ФЛ, Иэв. Сектора физ.-хим.
.анализа Ин-та обшей и неорг. химии АН СССР, 1955,
239
О 10 20 30. 40
Давление, кбар
Фиг.1758. Фазовые границы в системе ВаС12 -Н2О при
давлениях до 40 кбар.
Pistorius C.W.F.T. Zs. Phys.Chem., N.F. 1968, fiQ, 118
466
120
467
Фиг. 1763. Критические давления ненасыщенных водных
растворов NaCl
Sourirajan S., Kennedy G. C. Am. J. Sci1962, 260. 2,
136
Фиг. 1765. T - P - X модель системы l^O-NaCl
Sourirajan S., Kennedy G.C. Am. J. Sci., 1962, 2, 137
Фиг. 1764. Изобары в области газ-жидкость в системе
Н20-NaCl
1 - состав газа; 2 - состав жидкости; 3 - критические точки.
Числа у кривых - давление в барах.
Sourirajan S., Kennedy G.C. Am. J. Sci., 1962, 20Qi 2, 139
Фиг.1766. Зависимость константы фазового равновесия
Кр системы NaCl—НоО от давления и состава.
Сяырикович N.A., Хайбуллин ИЛ. ДАН СССР, 1956,
109. 962.
468
NaCl-H20
Фиг. 1767. Диаграмма фазового равновесия системы
NaCl-H2O
Сяырикович М.А., Хайбуллин ИЛ. ДАН СССР, 1956,
109.963
Фиг* 1769. Проекции избар насыщенных растворов на
координатную плоскость KCl-K2SO4-t
Числа у изобар - давление, в кг/см^.
Равич МЛ., Боровая Ф.Е., Кеякович ВЛ. Изв. Секто-
ра. физ-хим. анализа. Ин-та общей и неорг. химии АН
СССР, 1953 , 22. 225-39
KC1-K2SO4-H2O
ВаСО,-Н2О
Н20
Фиг. 1788. Проекции изобар насыщенных растворов на
треугольник состава KCl-J^O-Kj^O*
Числа у изобар - давление , в кг/см .
Равич МЛ., Воровал ФЛ., Келкович ВЛ. Изв. Сек-
тора физ.-хим. анализа. Ин—та общей и неорг.химии
АН СССР, 1953, 2Й. 225-39
Фиг. 1770. Растворимость витерита в водных растворах
углекислоты в зависимости от давления.
Малинин С.Д. Геохимия 1967, 7, 639-
469
ВОДНО-СОЛЕВЫЕ СИСТЕМЫ С СОг ПОД ДАВЛЕНИЕМ
СаСО3- СО2- Н2О
Фиг. 1772. Раствори-
мость кальцита при
200°С вдоль кривой на-
сыщения в системе со2
_н2о
1 - данные настоящей ра-
боты; 2 - Ellis'A. J.(Am. J. Sci.,
1963, 261. 299-67); 3 -
- Segnit Е.Н.и др. (Geoch.Cosm.
Acta, 1962, Jgg, 1301);
4 - Morey G.W.,(Am. Min., 1962,
4Z, 1466.)
Sharp W.E., Kennedy G.C.
J. Geol., 1965, 73, 2, 399
ФиГ.1771. Система СаСО 3 -СО2 -Н2О в температур-
ном интервале 0 - 100°С под давлением СО2 от 0,00035
до 100 бар
Vi//erJ.P. Am.J.Sci., 1952, 3, 192
Фиг. 1773. Изобарическая растворимость кальцита при
содержании СО2 около 0,4 вес.%. Интервал давления ра-
вен 200 бар
Sharp W.E., Kennedy G.C. J. Geol., 1965, 21,2, 399
470
Фиг. 1774. Изобарическая растворимость кальцита при
200 С
Растворимость показана вдоль кривой насыщения С2О — Н^О. Чис-
ла у кривых - давление, в барах; интервал давлений - 200 оар.
Sharp W.E., Kennedy G.C., J.Geol., 1965 7& 2, 400
Фиг.1775. Изобарическая растворимость кальцита при
300 С
Растворимость показана вдоль кривой насыщения <20^ _ЬСО ;
числа у кривых - давление, в барах. Интервал давлений равен 200бар'.
Sharp W.E.t Kennedy G.C. J.Geol., 1965, 73. 2, 398
471
УКАЗАТЕЛЬ СИСТЕМ
Ag-As 1
Ag-As-Cu-S 249
Ag^As-S 57, 58
Ag—Bi 2
Ag-Bi-H-S 250
Ag-Bi-Pb-S 251-254
Ag-Bi-S 59-61
Ag-Bi-S-Se 255
Ag-Cd-S 62
Ag-Cq-S 63-65
Ag-Cu-S-Sb 256
Ag-G-e-S 66
Ag-O2 1365
Ag^Pb-S 67, 68
Ag-Pb-S-Sb 257
Ag-S 17
Ag-S-Sb 69-72
Ag-S-Si 73
Ag-S—Sn 74
Ag-S-Ti 75
AgBr 1264
AgBr-AgCl 952
AgBr-AgJ 953
AgCl 1264
AgCl-AgBr 952
Agl 1267, 1268
Agl-AgBr 953
Agl-Cul 1270
AgNO3 1300
AS2SO4“K2SO4 925
Ag2SO4‘Na2S°4 926
Al 1052
Al-Fe-Mg-O2 361
A1-Fp-O2 322-327
AICl3-AlF3-NaCl-NaF 954
AlF3-AlCl3-NaCl-NaF 954
AlF3-Al2O3-CaF2-NaF 96 5
AlF3-Al2C>3-NaF 966
AlF3-A12O3-NaF-bJa2O-SiF4-SiO2 967
A!F3-CaF2-NaF 945
AlF3-LiF-NaF 946
AlF\3-NaF 947
A12O3-AlF3-CaF2-NaF 96 5
Al2O3-AlF3-NaF 966
Al2°3~AlP3"NaF“Na2O"SiO4-SiO2 937
A12O3—B2O3 1000
A12O3-B2O3-CaO-SiO2 726
A12O3-B2O3-H2O-MgO-Na2O-SiO2 1657
A12O3-B2O3-PbO-Y2O3 727
Al2O3-B2O3-SiO2 1001 '
Al2O3-BaO-H2O-SiO2 1456
Al2O3-BaO-MgO-SiO2 728
AI2O3-BeO 364, 365
A12O3-BeO-H2O-SiO2 1457, 1458
A12O3-BeO-MgO 477
А12Оз-ВеО-ТЮ2 478
Al2O3-BeO-ZrO2 479
A12O3-CO2-CaO-H2O-K2O-MgO-SiO2 1729
Al2O3-CO2-H2O-K2O-MgO-SiO2 1733
Al2O3-CO2-H2O-MgO 1706
Al2O3-CaF2 968
Al2O3-CaF2-SiO2 969
А12Оз-СаО 415
Al2O3-CaO-FeO-H2O-MgO-Ma2O-SiO2 1627
A12O3-CaO-FeO-H2O-Na2O-SiO2 1605-1608
Al2O3-CaO-FeO-SiO2 730-735
Al2O3-CaO-Fe2O3 480-482
Al2O3-CaO-Fe2O3-Na2O 729
Al2O3-CaO-Fe3O4-MgO-Na2O-SiO2 1250
Al2O3-CaO-H2O 140 9-1411
A12O3-CaO-H2o-K2o-Na2O'SiO2 1609“1612
Al2O3-CaO-H2O-K2C-SiO2 1552
A12°3”CaO*,H2o-MSO-Na2O-SiO2 306, 1613-
1616
Al2O3-CaO-H2o-Mgo-Si°2 1553-1560
Al2O3-CaO-H2O-Na2O-SiO2 1561-1562
Al2Q3-CaO-H2O-SiO2 1459-4 468
Al2O3-CaO-MgO-Na2O-SiO2 1245-1249
Al2O3-CaO-MgO-SiO2 736-792, 1222-1235
Al2O3-CaO-Na2O-P2O5-SiO2 918
Al2O3"CQO"NQ2O“SiO2 793~808» 1236-1237
Al2O3-CaO-P2O5-SiO2 809, 810, 919
Al2O3-CaO-SiO2 483-489, 520, 1154-1158
Al2O3-CaO-SiO2-TiO2 811-818
Al2O3-CaO-SiO2-ZnO 819-824
Al2O3-CeO2 417
Al2O3-CoO-SiO2 490-491
-S72
Al2°3“Cr2°3 36G’ 1131
Al2O3-Cr2O3-Pe2O3 492-494
AI2°3“Cr2°3“MS° 495“497
Al2°3"Cr2°3"MgO"SiO2 825
A12O3“Cr2°3“MsO"TiO2 825
AloO3-Cr2O3-MgO-ZrO2 825
Al2°3"Cr2°3“Si°2 498"501
A12O3-CuO 367
Al2C3-Cu2O 367
A12°3"Pe“H2“K2O"MeO"°2"SiO2 1383
Al О -Fe-H _0-Kn0-Mg0-0_-Si0„ 1384
2 3 2 2 2 z
A12O3-Fe-H2O_K2O-O2-SiO2 1376-1378
A12O3-Fg-H-K 2O-Na2O-O-SiO2 1379-1382
Al2O3-Fe-O2 328-329
Al2O3-FeO 368-369
Al2O3-FeO-Fe2O3 502-508, 1159-1161
Al2O3-FeO-Fe2O3-H2O-SiO2 1563, 1564
Al2O3-FeO-Fe2O3-SiO2 827-831
Al2O3-FeO-Fe2O3-Y2O3 832-833
Al2O3-FGO-H2O-K2O-MgO-O2-SiO2 1624-1626
Al2O3-FeO-H2O-K2O-MgO-SiO2 1617, 1623
Al2O3-FeO-H2O-K2O-SiO2 1565
Al2O3-FeO-H2O-MgO-SiO2 1566
Al2O3-FeO-H2O-O2-SiO2 1536-1543
Al2O3-FeO-K2O-SiO2 834
Al2O3-FeO-MgO-SiO2 835
Al2O3-FeO-Na2O~SiO2 836, 837
Al2O3-FeO-SiO2 509-511
Al2O3-Fe2O3 370
Al2O3-Fe2O3-Fe3O4-Li2C 826
Al2O3-Fe2O3-H2O-K2O-MgO-SiO2 1618-1620
Al2O3-FG2O3-H2O-K2O-Na2O-SiO2 1621*1622
Al2O3-Fe2O3-H2O-Na2O-SiO2 1567-1569
Al2O3-Fe2O3-Na2O-SiO2 838-840
Al2O3-G-a2O3-H2O 1412
Al2O3-HCl-H2O-K2O-MgO-SiO2 1658
Al2O3-HCl-H2O-K2O-SiO2 1659
Al2O3-HCl-H2O-Na2O-SiO2 1659
А12Оз-Н2О 1385-1387
Al2O3-H2O-KCl-K2O-NaCl-Na2O-SiO2 1675-1677
A12O3-H2O-K2O-MgO-SiO2 1570-1583
Al2O3-H2O-K2O-Na2O_SiO2 1584-1594
Al2O3“H2°"K2O"NiO"SiO2 1571
Al2O3-H2O-K2O-SiO2 1469-1484
Al2O3-H2C-Li2O-Na2O-SiO2 1595
Al2°3-H2o-MgO 1413,1414
Al2O3-HoO-MgO-Na2O“SiO2 1596-1600
Al2°3-H2°-MgO-SiO2 1485-1503, 1694
Al2O3-H2O-MnO-SiO2 1544
Al2O3-H.?O-NaCI-Na2O-SiO^ 1672
Al2O3-H2O-Na2O-SiO2 1504, 1505, 1509-1526
60
A12°3“H2o“Sio2 1415-1423
AI2O3-K2O-MgO-SiO2 841-852
Al2O3-K2O-Na2O-SiO2 853-856, 1238-1240
Al2Q3-K2O-SiO2 512-517, 1162-1164^ 1184
A12°3"KOH
A12O3-LiF-Na2O-SiO2 970
Al2O3-Li2O-MgO-SiO2 857-863
A12O3“bi2O"Si°2 518» 519* 1165, 1166
AI2O3-MgO 371-373
A12°3“MgO-Na2O-SiO2 864, 1241, 1242
A12O3-MgO-SiO2 520-526, 1167-1175
Al2O3-MgO-SiO2-ZrO2 865
Al2O3-MnO 374
Al2°3-Mn°-SiO2 527-529
A12O3-MnO-SiO2—^2O3 866
A12°3-Mn2O3 375
Al2O3-NaCl-Na2O-SiO^ 971
Al2O3-Na2O-SiO2 530, 531-533, 1176-1184
Al2O3-NiO 376
Al2O3-NiO-SiO2 524
Al2O3-SiO2 377-384, 1132-1134
Al2O3-SiO2-ZnO 535
Al2O3-SiO2-ZrO2 536-537
Al2O3-SnO2 385
Al2O3-TiO2 386, 387
Al2O2-ZnO 388
Al2O3-ZrO2 389-390
Ar 1318, 1318A
Ar-H2O 1334-1338
As 1054
As-Ag 1
As-Ag-Cu-S 249
As-Ag-S 57, 58
AS-Co-Fe-Ni-S 314
As-Cu-Ni-S 258
As-Fe-S 76, 77, 1098, 1099
As-Ni-S 78-82
As-Pb-S 83
As-S 18-20, 1080
As-S-Tl 84
As2O3 1116
As2S3-H2O-Na2S 1108, 1109, 1111
Au 1053
Au-Bi 3
Au-Cu 4, 5
Au-Pt 6
Au-Rh 7
Au-S 21
B.C-SiC 16
4
BN 1079
B2O3 1117
В2О3-а12Оз 1000
473
В2Оз-А12Оз-СаО-51О2 726
® 2 Оз-А12Оз-Н2О-^ёО-Ка2О-51О2 1657
B2O3-Al2O3-PbO-Y2P3 727
B2O3-Al2O3-SiO2 1001
B2O3-CaO 391
B2°3-CaO-SiO2 538
B2O3-H2O-WO3 403
В2О3-МбО 392
B2O3-MgO-SiO2 539.
B2O3-NaF-Na2O 1002
B2O3—SiO2 393
P C-SiC 16
4
Ba-S-Sn 85
BaCO3 1276
BaCO3-BaCl2-Na2CO3-NaCl 991
ВаСОз-СаСО3 912, 1284
BaCO3-I-i2O 1770
BaCl2-BaCO3-Na2CO3-NaCI 991
BaCl2-D2O 1759
BaCl2-H2O 1758
BaO-Al2O3-H2O-SiO2 1456
BaO-Al2O3-MgO-SiO2 728
BaO-CO2 1678, 1679
BaO-CaO-WO3 540
BaO-H2O-SiO2 1424
BaO-MgO-SiO2 541-542
BaO-SiO2 394
BqO-A12O3 364-365
BeO-Al2O3-M2O-SiO2 1457, 1458
BeO-Al2O3~MgO 477
ВеО-А12О3-<Г1О2 478
BeO-AI2O3-ZrO2 479
BeO-CeO2 417
BeO-MgCMTiO2 543
BeO-PuO2"<rhO2 544
BeO-SiO2 395, 396
BeO-TiO2 397-398
Bi 1055, 1056
Bi-Ag 2
Bi-Ag-H-S 250
Bi-Ag-Pb-S 251-254
Bi-Ag—S 59-61
Bi-Ag-S-Se 255
Bi-Au 3
Bi-Co-H-S 259
Bi-Cu-S 86-89
Bi-Fe-S 90-92
Bi-H-Ni-S 260
B^-Mo-S 93, 94
Bi -Ni-Ph-S 261
Bi-Pb-S 95, 96
Bi-Pb-S-Se 262-263
3i-Pb-S-Tl 264
474
Bi-S 22
Bi-S-Sb 97
Bi-S-Se 98-101
BbS-Te 102
We 8
Bi2O3-Fe2O3 399
Bi2O3—MOO3 400
Bi2°3“MoO3"'PbO 545“546
Bi2O3-PbO 400, 403
Bi2O3-PbO-WO3 403, 547
Bi2O3-SiO2 401
B12O3—V2O5 4Q2
D12O3-WO3 403, 1012
Bi2Te3 1113
C 1057, 1058
C-C 1077
C-Fe 13, 1074-1076
C-FeO-O2 1368
C-Mn 1077
C-Ni 1078
C-O2 1366, 1367
C-Si 14, 15
CH4-H2O 1338
CH -NH„ 1357
4 3
CO2 1319-1323
CO2~A12O3-CaP-H2o-K2O-MgO-SiO2 1729
CO2"A12O3'"H2°‘‘K2O'MgO'SiO2 1733
CO2-Al2O3-H2O-MgO 1706
CO2-BaO 1678, 1679
CO2-CaCO3-H2O 1771-1775
CO2-CaO 1680-1683
CO2-CaO-CaFp-H2O 1730, 1731
£O2-CaO-b4?O-H2O-MgO-SiOn 1726-1728
CC>2-CaO-H2O 1698-1701
CO2-CoO-T i2O-\)gO 1707-1710
CO2-CaO-H2O-MgO-SiO2 1722-1725*
CO2-CaO-H2O-SiO2 1711-1718
CO2-CaO-MeO-SiO2 1693-1697
CC>2-CaO-SiO2 1686-1690
CO2—Fe-Fe3O4 1364
CO2-H2O 1339-1351, 1357
CO2-H2O-K2O-S’O2 1719, 1720
ГО2-Н2О-М.§О 1702-170 5
C02-H20-Mg0-Si02. 1721
COo-H2O-NaCl 1360, 1361
CO2-H2O-Ab70 - Орт30 1734
С О 2-H2O - гранит 1732
CO2-He 1353, 1354
CO2-MgO 1278
CO2-MgO-SiO2 1691
CO2-MnO 1279
CO2- NaAlSi3O8-Na2CO3 1692
GO2-PbO 1684, 1685
Ca-O-S-Si 265
CaB4O7-CaSO4-H2O-Na2B4O7-Na2SO4 A38( t. )
СаСОз 1277
CaCOrBaCO3 912, 1284
CaCO3-CO2-H2O 1771-1775
CaCO3-QaCl2-Ca(HCO3 ) 2-CaSO4-h’2O-MgCO3-
MeCl2-Mg(HCO3)2-MgSO4-Na2CO3-NaCl-
NaHC03-Na2S07 66 (TJ
CaCO3-CaCl2-CaSO4-H2O-Na2CO3-NaCl-Na2SO4_
67 ( t.)
CaCO3-CaCl2-H2O 10 ( t. )
СаСОз-СаС12-Н2О-К2СО3-КС1 39 (т. )
CaCO3-CaC12-H2C-MgCO3-MgCl2 40(т. )
CaCO3-CaCl2-H2O-Na2CO3-NaCl 41(т. )
CaCO3-CaCl2-Kia2CO3-NaCl 992
СаСОз-Са(ОН) 2 l?40
CaCO3-CaSO4-H2O 11 ( t. )
CaCO3-CaSO4-H2O-K2CO3-K2so4 42 (t..)
CaCO3~CaS.O4-H2O-MgCO3-MgSO4 43 ( t.. )
CaCO3-CoCO3-MgCO3 1292, 1293
СаСОз-РоСО3 1235
СаСОз-РеСОз-МдСОз 1294, 1295
CaCO3-H2O 1(т-), 1735-1739
СаСОз-Н2О-К2СОз 12(т.)
CaCO3-H2O-MgCO3 13 (т. )
CaCO3-H2O-Kia2CO3 14(т. )
СаСО3-К2СОз 913
CaCO3-K2CO3-Na2CO3 916
CaCO3-MgCO3 914, 1286-1289
CaCO3-MgCO3-MnCO3 1296
CaCO3^7£?cO3-NiCO3 1297
CaCO3-MgCO3-SrCO3 1298
CaCO3-MnCO3 915
CaCO3-SrCO3 1290
C aC L 2-C aC O3 -C.a ( HC O3 ) 2~C aS О 4-H2O-MgC O3 -
-MgCl2-Mg( HCO3 ) 2-MgSO4-Na2CO3-NaCl-NaHCO3-
-Na2SO4 66(t. )
CaC 12-CaCO3-CaSO4-H2O-Na2CO3-NaCl-Na2SO4
67( t. )
CaC12-CaCO3-H2O 10 (T«)
CaCI2-CaCO3-H2O-K2CO3-KCl 39(т. )
CaC12-CaCO3-H2O-MgCO3-MgCl2 40(т. )
CaCl2-CaCO3-H2O-Na2CO3-NaCl 41 (т.")
CaC42-CaCO3-Na2CO3-NaCl 992
CaCl2-CaF2 955
CaCl2-CaF_-CaO-P0Oc 920
CaCl2-CaF2-KCl-KF-NaCI-NlaF 956
CaCl2-CaF2-NaCl-NaF 957
CaCl2-CaSO4-H2O 15(t?)
CaCl2-CaS04-H20-KCl-K2S04 44(t.)
CaCl2-CaSO4-H2O-KCl-K,2SO4-NaCl-Na2SO4 68(t.)
CaCl2-CaSO4-H2O-MgCl2-MgSO4 45( T. )
CaCl2-CaSO4-H2O-NaCl-Na2SO4 46(t. )
CaCl2-CaSO4-NaCl-Na2SO4 980
CaCl2-H2O 2(t. )
CaCl2-H2O-KCl 16(t. )
CaCl2-H2O-KCl-MgCl2 47 (t.)
CaCl2-H2O-KCl-MgCl2-NaCl 69(т.)
CaCl2-H2O-KCl-NaCl 48(t. )
CaCl2-H2O-MgCl2 17 (t.)
CaCl2-H2O-MgCl2-NaCl 49( t. )
CaCl2-H2O-NaCl 1032
CaCl2-KCl-NaCl 939
CaF2-AlF3-Al2O3-NaF 965
CaF2-AlF3-NaF 945
CaF2-Al2O3 968
CaF2-Al2C>3-SiO2 969
CaF2-CO2-CaO-H2O 1730, 1731
CaF2-CaCl2 955
CaF2—CaCl2”CaO—P2Og 920
CaF2-CaCl2-KCl-KF-NaCl-NaF 956
CaF2-CaC12“NaClrNaF 957
CaF2-CaO 905-908, 972
CaF2-CaO-P2O5 921
CaF2-CaO-SiO2 973
CaF2-Ca(OH)2 1636, 1646
CaF2-Ca(OH) 2-Ca3(PO4) 2 1638-1642
CaF2-Ca(OH)2-Ca3(PO4)2-H2O 1643-1645
CaF2-Ca(OH)2-H2O 1637
CaF2-KF-NaF 948
CaF2-MgF2 949
CaF2-NaF-SiO2 974
CaF2-Na2O-SiO2 975
CaF2-YF3 950
Cas .[f(PO4)3] -H2O-NaAlSiO4 1629
С a ( НС O3 ) 2-C aC O3-C aC 12-C aS О 4-H 2 O-MgC O3-
-MgC12-Mg(HQO3) 2-M^SO4-bJa2CO3-NaCl-
-NaHCO3-Na2SO4 66(t. )
! CaO-Al2O3 415
CaO-Al2O3-B2O3-SiO2 726
CaO-A12O3-CO2-H2O-K2O-MgO-SiO2 1729
CaO-A12O3-FeO-H2O-MgO-Na2O-SiO2 1627
CaO-A12O3-FeO-H2O-Na2P-SiO2 160^-1608
CaO-Al2O3-FeO-SiO2 730-735
CaO-A12O3-Fe2O3 480-482
CaO-A12O3-F©2O3.-Na2O 729
CaO-Al2O3-F'e3O4-MgO-Na2O-SiO2 1250 v
CaO-Al2O3-H2O 1409-1411
CaO-A12O3- H2O-K2O-Na2O-SiO2 1609-1612
CaO—A12O3—H2O—К 2O—SiO2 1552
CaO-Al2O3-H2O-MgO-Na2O-SiO2 1613-1616
CaO-Al2O3-H2O-MgO-SiO2 1553-1560
CaO-AlnO^— H2O-Na2Q-SiO2 1561, 1562
CeO-Al2C3-H2O-SiO2 1459-1468
CaO-Al2O3-MgO-Na.2O-SiO2 1245-1249
CaO-Al2O3-MgO-SiO2 736-792, 1222-1235
Ca0-Alo03-Na.20-P205-S1C2 9^3
475
CaO-Al2O3“NA2O-SiO2 793-808,- 1236, 1237
Ca0-A1203-P205-S102 809, 810, 919
CaO-Al2O3-SiO2 483-489, 1154-1158, 520
C ^0-Al203-Si02-Ti02 811-813
Ca0-Al203-Si02-Zn0 819-824
CaO-B2O3 391
CaO-B2O3-SiO2 538
cao-Bao-wo3 54()
CaO-CO2 1630-1683
CaO-CO2-CaF2-H2° 1730, 1731
CaO-CO2-FeO-H2O-MsQ-SiO2 17 26-1728
CaO-CO2-H2O 1698-17Q1
Ca0-C02-H2O-MgO 1707-1710
CaO-CO2-H2O-MgO-SiO2 1722-1725
C&O-CO2-H2O—SiO2 1711-1718
CaO-CO 2-MsO-SiO 2 1693-1697
CaO-CO2-SiO2 1686-1690
CaO-CaCl2-CaPo-PoOK 320
2 2 5
CaO-CaF2 905-908, 972
CaO-CaF2-P2°5 921
CaO-CaP2-SiO2 973
CaO-CeO2 417
CaO-CrO3-Cr2O3-MgO 867-868
CaO-CrO3-Na2co3 1007
CaO-Cr2O3 415, 1006
CaO-Cr2O3-MgO 548-550
CaO-Cr2O3-MgO-SiO2 869-870
CaO-Cr2O3-SiO2 551-553
CaO-CuO-Cu2O 554-555
CaO-FeO-Pe2O3-M.gO 871, 872
CaO-PeO-Pe2O3-SiO2 873-876
CaO-FeO-H2O-O2-SiO2 1545-1548
CaO-FeO-MgO 556
CaO-.FeO-MgO-SiO2 877-882, 1244
СаО-РеО-МпО-Р2Об 883
CaO-PeO-SiO2 557, 559-570, 1185-1187
CaO-FeO-WO3 571
CaO-Fe2O3 404, 405, 4-15
CaO-Fe2O3-MgO 572
CaO-Fe2O3-MgO-SiO2 884
CaO-Pe2O3-SiO2 558
CaO-GeO2-SiO2 573-574
Ca0-H2O 1388-1390
CaO-H2O-MgO-SiO2 1527-1533
CaO-H2O-SiO2 1425-1431
CaO-MgO-MnO 575
CaO-MgO-P2O5-SiO2 885-886
CaO-MgO-Si02 576-592, 1188-1201
CaO-MgO-SiO2-TiO2 887-891
CaO-MgO-SiO2-ZrO2 892
CaO-MoO3 462
C’aO-MnO 406
CaO-MnO-SiO2 593-597
CaO-MnO-SiO2-TiO2 893
CaO-MnO-WO3.j598
CaO-Mn2O3 407
CaO-Na2O-SO3-SiO2 927
CaO-Na2O-WO3 599
CaO-NiO 408.
CaO-P2O5 409, 410., 922
CaO-P2C>5-SiO2 600-602, 923
CaO-PbO-WO3 603
CaO-SiO2 411-412, 1135, 415
CaO-SiO2-TiO2 604-607
CaO-SiO2-ZnO 608
CaO-SiO2-ZrO2 609-614
CaO-SnQ2-TiO2 615
CaO-SrO-WO3 616
CaO-TiO2 413, 415, 1016
CaO-UO2-ZrQ2 617-618
CaO-V2O5 1019
CaO-WO3 414
CaO-ZrOp 415
Ca(OH)2-CaCO3 1 740
Ca(OH)2-CaF2 1636, 1646
Ca(OH)2-CaF2-Ca3(PO4)2 1638-1642
Ca(ОН) 2-CaF2-Ca3( po4) 2-h2° 1643-1645
Ca(OH)2-CaF2-H2O 1637
CaSO.-CaB 0_-Ho0~Na_B O_-Na_SO„ 38 (t.)
4 472 247 24
CaSO^-CaCO3— СаС12—Са(НСОз ) 2-H2O-MgCO3-
-MgCl2-Mg(HCO3) 2- MgSO4-Na2CO3-NaCl-
-NaHCO3-Na2SO4 66(t.)
CaSO4-CaCO3-CaCl2-H2O-Na2CO3-NaCl-Na2SO4 67 (T.)
CaSO4-CaCO3-H2O 11 (t.)
CaSO4"CaCO3-H2O-K2CO3-K2SO4 42 (t.)
CaSO4—CaCO^—H2O—MgCO^—MgSO4 43 (t*)
CaSO4-CaCl2-H2O 15 (t.)
CaSO4-CaCl2-H2O-K.Cl-K.2SO4 44 (t.)
CaSO4-CaCl2-H2O-KCl-K2SO4-NaCl-Na2SO4 68 (t.)
CaSO4-CaCl2-H2O-MgCl2-MgSO4 45 (t.)
CaSO4-CaCl2-H2O-NaCl-Na2SO4 46 (T. )
CaSO4-CaC12-NaCl-Na2SO4 980
CaSO4-H2O 3(T.) 1742-1744
CaSO4-H2O-K2SO4 18(T.)
CaSO4-H2O-K2SO4-MgSO4 1044
CaSO4-H2O-Na2SO4 19(T.)
CaSO4-K2SO4 928
CaSO4-K2SO4-Na2SO4 929
CaSQ4-MgSO4-Na2SO4 930
CaSO4-Na2SO4 931
CeO2-Al2O3 417
CeO2-BeO 417
CeO2-CaO 417
CeO2-Cr2O3 417
CeO2-F'e3O4 416, 417
CeO2-MgO 417
CcO2-Mn3O4 416, 417
CeC2~TiO2 416
CoO2-ZrO2 417
Cd 1052
Cd-Ag-S 62
476
Cd-Fe-S-Zn 266 Сг2о3-Сио-Сиго 62o
Cd-Mn-S 103, 104, 1100 CroO-^-FeO 419
Cd-Mn-S-Zn 267 Cr2O3-FeO-Fe2O3 621-623
Cd-S 1081 Cr2O3-Fe2O, 420, 421
CdCrOx 1311 Cr2O3-Fe2Oj-MgO 624, 625
CdCr2Ox 1311 Cd2CrOx 1311 Cr2O3-Fe3O4-SiO2 626 Cr2O3-K2O 1008
CdO-H2O 1391 CdS 1114 Cr2O3-MgO 422, 423 Cr2O3-MgO-SiO2 627, 628
CdSe 1114 Cr2O3-MgO-ZrO2 629
CdTe 1114 Co-As-Fe-Ni-S 314 Cr2°3-Mgo-Tio2-ZrO2 894 Cr2O3-Mn2O3 424
Co-Bi-H-S 259 Cr2O3-NiO-ZrC>2 630
Co-Fe-Ni-S 209-272 Cr2O3-PbO 1010, 1137
Co-Fe-O2 330-331 Cr2O3-SiO2 425, 426
Co-Fe-O-S 268 Cr2O3-TiO2 427
Co-Fe-S 105-108 CsCl 1272
Co-H-S 109 CsNO3 1301
Co-H-S-Sb 273 Cu 1052, 1062
Co-Ni-S 110 Cu-Ag-As-S 249
Co-S 23 Cu-Ag-S 63-65
Co-S-Sb 111 Cu-Ag-S-Sb 256
CoC03-CaC03-MgC03 1292, 1293 Cu-As-Ni-S 258
Co0-Al203-Si02 490-491 Cu-Au 4, 5
Co0-Fe304-Si02 619 Cu-Bi-3 86-89
Co0-H20-Si02.1432 CoO-MgO-Si02 1202, 1203 CoO-Si02 H36 Cu-Fc 9 Cu-Fe-Ni-S 274-277 Cu-Fe-O2 335-338
CoO-ZnO 418 Cu-Fe-O-S 278
C0SO4 1304 CsCl 1272 Cu-Fe-Pb-S 279-293 Cu-Fe-S 113-134, 1101
Cr-Fe-O2 332, 333 Cr-Fe-S 112, 1102 Cu-Fe-S-Zn 294 Cu-Fe-ZnS 13 5
Cr-O2-V 334 Cr-S 24 Cu-Oe-S 136, 137 Cu-H-S-Sb 295
CrO2-PbO 1137 CrO3-CaO-Cr2O3-MgO 867, 868 Cu-Mn-O2 339, 340 Cu-Mo-S 137
СгО3-СаО-Ма2СО3 1007 CrO3-K2O-Na2O 631 Cr03-Mo03-Pb0 632, 1009 CrO3-PbO-WO3 633, 1011 Cr2O3-Al2O3 366, 1131 Cr2O3”Al2°3"Pe2°3 492"494 Cr2o3-A12o3“MS° 495-497 Cr2O3-Al2O3-MgO-SiO2 825 Cr2O3-Al2O3-MgO-TiO2 825 Cr2O3-Al2O3-MgO-ZrO2 825 Cu-Ni-S 139-147 Cu-O2 316 Cu-Pb-S 148-154 Cu-S 25-29, 1082, 1083 Cu-S-Sn 154 Cu-S-Zn 155-156 Cu-Sb 10 CuI-AgI 1270 CuO-A12O3 367 CuO-CaO-Cu2O 554, 555
Cr2O3-Al2O3-SiO2 498—501 Ci^O^-CaO 415, 1006 Cr2O3-CaO-CrO3-MgO 867, 868 Cr2O3-CaO-MgO 548-550 Cr2O3-CaO-MgO-SiO2 869—870 Cr2O3-CaO-SiO2 551-553 Cr2°3~CeO2 417 CuO-Cu2O-Cr2O3 620 CuO-Cu2O-MgO 634 CuO-CuoO-SiO2 63 5, 636 CuO-Cu2O-TiO2 637, 638 CuO-MgO 428 CuO-SiO2 429 CuoO-A12O3 367
477
C.u2O-CaO-CuO 554, 555
Cu2O—CuO—Cr2O3 620
Cu2O-CuO-MgO 634
Cu2O-CuO-SiO2 554, 555, 635, 636
Cu2O-CuO-TiO2 637-638
CuSO4 1305
CuSO4-H2O 1745-1749
D2O-B‘aCl2 1759
Fe 1059, 1060, 1061
Fe-Al-Mg-O2 361
Fe-Al-O2 322-327"
Fe-Al2O3-H2-K2O-MgO-O2-SiO2 1383
Fe-Al2O3-H2-K2O-Na2O-O2-Si°2 1379-1382
Fe-A12O3-H2O-K2O-MgO-O2-SiO2 1384
Fe-Al2O3-H2O-K2O-O2-SiO2 1376-1378
Fe-Al2O3-O2 328, 329
Fe-As-Co-Ni-S 314.
Fe-As-S 7.6, 77, 1098, 1099
Fe-Bi-S 90-92
Fe-C 13, 1074-1076
Fe—CO2~ Fe3O4 1364
Fe-Cd-S-Zn 266
Fe-Co-Ni-S 269-272
Fe-Co-O2 330, 331
Fe-Co-O-S 268
Fe-Co-S 105-108
Fe-Cr-O2 332, 333
Fe-Cr-S 112, 1102
Fe-Cu 9
Fe-Cu-Ni-S 274-277
Fe-Cu-O2 335-338
Fe-Cu-O-S 278
Fe-Cu-Pb-S 279-293 .
Fe-Cu-S 113-134, 1101
Fe-Cu-S-Zn 294
Fe-Cu-ZnS 135 .
Fe-Ge-S 158-160
Fe-H2-H2O-Ni 1363
Fe-H-S 161
Fe-H2O-K2O-O2-SiO2 1375
Fe-MgO-O-SiO2 1373, 1374
Fe-Mn-O2 341-344
Fe-Mn-O-5-Si 315
Fe-Mn-S-Zn 296
Fe-Mo-02 345
Fe-Mo-S 162-165
Fc-Ni 1072, 1073
Fe-Ni-O2 346-347
Fc-Ni-S 166-195, 1103
Fc-O2 317-319.
pc-О—S 196—204
Fe-O-S-Si 297-303, 1105, 1106
Fc-O2-Si 348-350
r/,_Oj-SiO2 1371, 1372
478
’ре-Ог-Т! 3 51-3 54
Fe-OH-S 1104
Fe-Pb-S 205-210
Fe-Pb-S-Zn 304-310
Fe-Pt 11
Fe-S 30-41, 1084-1093
Fe-S-Sb 211-215
Fe-S-Sn 216-217
Fc-S-W 218-224
Fe-S-Zn 225-233
FeCO3-CaCO3 1285
FeCO3-CaCO3TMgCO3 1294, 1295
FeCl3-KCl 940
FeCl3-NaCl 941
FeO-A12O3 368, 369
FeO-Al2O3-CaO-H2O-MgO-Na2O-SiO2 162.7
FeO-Al2O3-CaO-H2O-Na2O-SiO2 1605-1608
FcO-A12O3-CaO-SiO2 730-735
FeO-Al2O3-Fe2O3 502-508, 1159, 1160
FeO-Al2O3-Fe2O3-H2O-SiC>2 1563, 1564
FeO-Al2O3-Fe2O3-SiO2 827-831
FeO-A12O3-Fe2C>3-Y2O3 832-833
FeO-A12O3-H2O-K2O-MgO-O2-SiO2 1624-1626
FcO-Al2O3-H2O-K2O-lVlgO-SiO2 1617, 1623
FeO-A12O3-H2O-K2O-SiO2 1565
FeO-Al2Oc-H2O-MgO-SiO2 1566
FeO-AI2O3-H2O-O2-SiO2 1536-1543
FeO-A12O3-K2O-SiO2 834
FeO-A12O3-MgO-SiO2 835
FeO-A12O3-Na2O-SiO2 836, 837
FeO-Al2O3-SiO2 509-511, 1161
FeO-C-O2 1368
FeO-CO2-CaO-H2O-MgO-SiO2 1726-1728
FeO-CaO-Fe2O3-MgO 871-872
FeO—CaO—Fe2O3-SiO2 873-876
FeO-CaO-H2O-O2-SiO.2 1545-1548
FeO-Al2O5H2O-MgO-SiO2 1566
FeO-CaO-MgO 556
FeO-CaO-MgO-SiO2 877-882, 1244
FeO-CaO-MnO-P2O5 883
FeO-CaO-SiO2 557, 559-570, 1185-1187
FeO-CaO-WO3 571
FeO-Cr2O3 419
FeO-Cr2O3-Fe2.O3 621-623
FeO-Fe2O3 430
FeO-Fe2o3-Gd2O3 639
FeO-Fe2O3-MgO 640-652
FeO-Fe2O3-NTgO-SiO2 895-901
FeO-Fe2O3-MnO 653
FeO—Fe2O3-SiO2 654, 655
FeO- .Fe2O3-SiO2-TiO2 9.02
FeO-Fe2O3-SiO2-ZrO2 903
FeO-Fe^O3-TiO2 656-660
FeO-Fe2O3-Y2O3 661-665
FeO-H2-H2O-Na2O-SiO2 1535
FeO-H2O-MgO-O2-SiO2 1549, 1550
FeO-I i2O-Na2O-O2-SiO2 1551
FeO-K2O-SiO2 666
FeO-MgO 431, 432
FeO-MgO-MnO 667
FeO-MgO-SiO2 668-671, 1204-1209
FeO-MnO 433, 434
PeO-MnO-SiO2 672-682
FeO-MnO-TiO2 683-684
FeO-Na2O-SiO2 1211
FeO-O2-SiO2 1144
FeO-SiO2 435, 436, 1139-1143
FeO-SiO2-TiO2 1213
FeO-SiO2-ZnO 685-686
FeO-TiO2 437-440, 1018
Fe2O3»A.12O3 370
Fe2O3-A.l2O3-CaO 480-482
Fe2O3-A12O3«CaO-Na2O 729
Fe2O3—АЛ203-ег2^з .492—494
Ре2О3~А12О3“РеО 502-508’ 1159, 1160
Ре2Оз“А12°з“РеО“н2о-31О2 1563» 1564
Fe2O3-Al2O3-FeO-SiO2 827-831
Fe2O3“A12°3’'F'eO“Y2°3 832-833
Fe2O3-Al2O3-Fe3O4-Li2O 826
Pe2O3‘Al2°3"K2O“K2O‘MgO“SiO2 l618~1620
Pe2°3“Al2o3“H2O-K2°“Na2O-SiO2 1621, 1622
Fe2O3-Al2O3-H2O-Na2O-SiO2 1567-1569
Fe9O -Al О -Na00-Si0o 838-840
Fe2O3-Bi2O3 399
Ре2°3"СйО 4°4’ 405’ 415
Fe2O3-CaO-FeO-MgO 871, 872
Pe2°3"CaO’‘PeO"Si°2 873“876
Pe2°3"CaO"MS° 572
Pe2°3"CaO"MgO“Si°2 884
Fe2O3-CaO-SiO2 .558
Fe9O3-CroO3 420, 421
Fe9C3-Cr2O3-FeO 621-623
Fe2O3-Cr2O3-M*O 624, 625
Fe2O3-FeO 430
Pe2°3"PeO"G'd2°3 6-39
Fe2O3-FeO-MgO 640-652
Fe2O3-FeO-MgO-SiQ2 895-901
Fe2O3-FeO-MnO 653
r c2O3-FeO-SiO2 654, 655
Pe2°3“PeO“3iO2“TiO*5 902
Fe2O3-FeO-SiO2-ZrO2 903 .
Fe2O3-FeO-TiOQ 656-660, 1017
FcoO3-FeO-Y2C3 661-665
P°2°3"Pe3C4 1138
Fe2O3-H2O 1392
Fe2O3-H2O-MgO-Na2O-SiO2 1601-1604
Fe2O3-K2O-SiO2 687
Fe2O3-MgO 441
Fe2O3-lVigO-PbO 688
Pe2°3-1VIn2O3 442
Fe2O3-Na2O-SiO2 689, 1210, 1212
Pe2°3-Sc2°3 443
Fe2O3-SiO2-TiO2-ZrO2 904
Fe2O3-TiO2 444
Fe2O3-ZnO 445
Fe О -ALO -CaO-MgO-Na.O-SiO, 1250
Fe О -Al О -Fe9O-LiQO 826
0 4 с* О о
Fe3O4-CO2-Fe 1364
Fe.O.-CeO, 416, 417
3 4 2
Fe3O4-CoO-SiO2 619
Fe3O4-Cr2O3-SiO2 626
Pe3O4~Pe2O3 1138
Fe_O-MnO 446, 447.
3 4 3 4
Fe,O .-Mn,O -SiO- 690
3 4 3 4 2
Fe3O4-O2-UO2 355
Fe3O4-SiO2-TiO2 691
Fe3O4-SiO2-ZrO2 692, 693
Ga-S 42
Ga—S-Zn 234
Ga2O3-Al2O3-H2O 1412
Ga2O3“H2O"K2O_MsO~SiO2 1571
Ge-Ag-S 66
Ge-Cu-S 136, 137-
Ge-Fe-S 158-160
G-eO2 362 .
GeO2-CaO-SiO2 573, 574
GreO2-MgO-NiO-SiO2 1243
G-eO2-MgO-SiO2 694, 1214-1216
GeO2-MnO 1145
Gd О -FeO-Fe9O 639
H2 1324. 132=-
H-Ag-Bi-S 250
H2-Al2O3-Fe-K2O-MgO-O2-SiO2 1383
H,-Al,O,-Fe-K,O-Na O-O.-SiO, 1379-1382
H-Bi-Co-S 259
H-Bi-Ni-S 260
H-Co-S 109
H-CoS-Sb 273
H-Cu-S-Sb 295
H2-Fe-H2O-Ni 1363 /
H2-Fe-S* 161' /
H2-FeO-H2O-Na2O-SlQ2 1535 /
H2-Pd 1362 /
HCl-Al2O3-H2O-K2O-MgO-SiO2 1658
HCl-Al2O3-H2O-K2’O-SiO2 1659 \
HCI-A12O3-H2O'-Na2O-Si.O2 16 59 \
HCl-H2O-NaAlSi3O8 1670 \
HCl-KCl-SiO2 1656
HF-H2O-NaAISi3O8 1670
H2O 1326-1331
H2O-A12O3 1385-1387
H„O-A1 О -B-O -MgO-Na„O-SiO„ 1657
H2O-Al2O3-BaO-SiO2 1456
H2O-Al2O3-BeO-SiO2 1457, 1458
479
H2O-Al2O3-CO2-CaO-K2O-MgO-SiO2 1729
H2O-Al2O3-CO2-K2O-Mg0-SiO2 1733
H2°"A12°3"CO2"MgO 1706
H2O-Al2O3-CaO 1409-1411
H 2O-AI2O3-C aO-FeO-MgO-Na2O-SiO 2 1627
HgO-AlgOg-CaO-FeO-NagO-SiOg 1605-1608
H2O-Al2O3-CaO-K2O-Na2O-SiO2 1609-1612
H2O-Al2O3-CaO-K2O-SiO2 1552
H2O-Al2O3-CaO-MgO-Na2O-SiO2 1613-1616
H2O-Al2O3-CaO-MgO-SiO2 1553-1560
H20-Al203-Ca0-Na20-Si02 1561, 1562
H2O-Al2O3~CaO-SiO2 1456-1468
H2O-Al2O3-Fe-K2O-MgO-O2-SiO2 1384
Н2°"А12О3"Ре_К2О_О2"51О2 1376~1378
Н20_А1203"Ре0_Ре203“ЗЮ2 15б3> 1564
H20-Al203-Fe0-02-Si02 1536-1543
H2O-Al2O3-FeO-K2O-SiO2 1565
H2O-AI2O3-FeO-K2O-MgO-O2-SiO2 1624-1626
H2O-Al2O3-FeO-K2O-MgO-SiO2 1617, 16 23
H2O-Al2O3-FeO-MgO-SiO2 1566
H2O-Al2O3-Fe2O3-Na2O-SiO2 1567-1569
H2O“AI2O3_*'e2O3_K2O-IVlgO_SiO2 1618-l620
H2O-Al2O3-Fe2O3-K2O-Na2O-SiO2 1621, 1622
H2O-Al2O3-Ga2O3 1412
H2O-AIoO3-HCl-K2O-MgO-SiO2 1658
H2O-Al2O3-HCl-K2O-SiO2 1659
H2O-Al2O3-HCl-Na2O-SiO2 1659
H 2O-A12O3-KC1-K 2O-NaCl-Na2O-SiO 2 1675-1677
H2O-Al2O3-K2O-MgQ-SiO2 1570-1583
H2O-Al2O3-K2O-Na2O-SiO2 1584-1594
H2O-Al2O3-K2O-NiO-SiO2 1571
H2O-Al2O3-K2O-SiO2 1469-1484
H2O-Al2O3-Li2O-Na2O-SiO2 1595
H2O-Al2C3-MgO 1413, 1414
H2O-Al2O3-MgO-Na2O-SiOo 1596-1600
H00-Al203-Mg0-Si02 1485-1503, 1694
H9O-A)2O3-MnO-SiO2 1544
H2O-Al2O3-NaCl-Na2O-SiO^ 1672
H2O-Al2O3-Na2O-SiO2 1504, 1505, 1509-1526
H2O-Al2O3-SiOQ 1415-1423
H2O-Ar 1334-1338
H2O-As2S3-Na2S 1108-1110
H2O-BaCO3 1770
H2O-BaCl9 1758
H2O-BaO-SiO2 1424
H2O-CH4 1338
H2O-CO2 1339-1351, 1357
H2°-C°2- A670- °PT30 1734
H2O-CO2-CaCO3 1771-1775
H2O-CO2-CaO 1698-1701
H2O-CO2-GaO-CaF2 1730, 1731
H 2O-C О 2-C aO-FeO-MgO-SiO 2 1726-1728
H2O-CO2-CaO-MgO 1707-1710
H2O-CO2-CaO-MgO-SiO2 1722-1725
H2O-CO2-CaO-SiO2 1711-1718
H2O-CO2-K2O-SiO^ 1719, 1720
H2O-CO2-MgO 1702-1705
H2O-CO2-MgO-SiO2 1721
H2O-CO2-NaCl 1360, 1361
H2O-CaB4O?-CaSO4-Na2B4O7-Na2SO4 38 (t.)
H2O-CaCO3 (t. ) 1, .1735-1739
H2O-CaCO3-CaCl2 10 ( t.)
H 2O-C aC O3-C aC 1?-C a ( HC C>3 ) 2~C aS О 4~MgC O3~
MgCl,-Mg(HCO_ ) ,-MgSO .-Na,CO,-NaCl-
NaHCO3-Na2SO4 66 ( t.)
H O-CaCO -CaCI -CaSO -Na9CO -NaCl-Na SOA
67
H2O-CaCO3-CaCl2-K2CO3-KCl 39 ( t. )
H2O-CaCO3-CaCl2-MgCO3-MgCl2 40 ( t.)
H2C-CaCO3-CaCl2-Na2CO3-NaCl 41 ( t. )
H2O-CaCO3-CaSO4 11 ( t. )
H2O-CaCO3-CaSO4-K2CO3-K2=O4 42 ( T.)
H20-CaC03-CaS04-MgC03-MgS04 43 ( T.)
H2‘O-CaCO3-K2CO3 12 ( t. )
H2O-CaCO3-MgCO3 13 ( T.)
H2O-CaCO3-Na2CO3 14 ( T.)
H2O-CaCl2 2 ( t.)
H2O-CaClo-CaSO4 15 ( t. )
H2O-CaCl2-CaSO4-KCl-K2SO4 44 ( T.)
H2O-CaCl2-CaSO4-KCI-K2SO4-NaCl-Na2SO468 ( t. )
H2O-CaCl2-CaSOa-MgCl2-MgSO445 ( T. )
H2O-CaCl2-CaSO4-NaCl-Na2SO4 46 ( T. )
H2O-CaCl2-KCl 16 ( t. )
H2O-CaCl9-KCl-MgCl9 47 ( t.)
H2O-CaCl2-KCl-MgCl2-NaCl 69 ( t.)
H2O-CaCl2-KCl-NaCl 48 ( t.)
H2O-CaCl2-MgCl2 17 ( t.)
H2O-CaCl2-MgCI2-NaCl 49 ( t. )
H2O-CaCl2-NaCl 1032
H2O-CaF2-Ca(OH)2 1637
H,O-CaF,-Ca(OH) „-Ca, ( PO„ ) „ 1643-1645
Н2О-Са5[Р(РО4)^ -NaAlSiC>4 1629
H2C-CaO 1388-1390
H2O-CaO-FeO-O2-SiO2 1545-1548
H2O-CaO-MgO-SiO2 1527-1533
H2O-CaO-SiO2 1425-1431
H2O-CaSO4 3 ( t. ), 1742-1744
H2O-CaSO4-K2SO4 18 ( t. )
H2O-CaSO4-MgSO4-K2SO4 1044
H-O-CaSO -Na„SO . 19 ( t. )
d 4 2 4 '
H2O-CdO 1391
H2O-CoO-SiO2 1432
H2O-CuSO4 1745-1749
H2O-Fe-H2-Ni 1363
H2O-Fe-K2O-O2-SiO2 1375
480
H2O-FeO-H2-Na2O-SiO2 1535
H2O-FeO-MgO-O2-SiO2 1549, 1550
H2O-F'eO-Na2O-O2-SiO2 1551
H2O-Fe2O3 1392
H2O-Fe2O3-MgO-Na2O-SiO2 1601-1604
H2O-G-a2O3-K2O-MgO-SiO2 1571
H2O-HCl-NaAlSi3 O8 1670
H2O-HFSNaAlSi3O8 1670
H2O-H2S-ZnS 1511
H2O-K2B4O? 1024
H2°“K2B4°7"KCl 20 ( t.)
H2O-K2B4O7"KC1-Na2B4O7 50 ( T’)
H2°-K2B4O7-KCl-K2SO4-Na2B4O7-KaCl-
Na2SO4 70 ( t.)
H2O-KBr-KCl 21 ( T, )
HgO-KBr-KCl-NaBr-NaCl 51 ( T.)
h2°-K2CO3 1025
H2O-K2CO3-KC1 22 ( t. )
H„O-KoCO,-KCl-KHCO,-MgCO,-MgCL-
Mg(HCO3)2 71 ( T.)
H2O-K2C63-KC1-K2SO4 52 ( t. )
H,.O-K,CO -KCl-K.SO -Na,CO,-NaCl-Na,SO,
73 ( t.)
HoO-K2CO3-KCl-MgCO3-MgCl2 53 ( t. )
H O-K2CO„-KCl-Na2CO3-NaCl 54 ( t. )
H2O-K2CO3-KI-1CO3 23 (t. )
H2O-K2CO3-KHCO3-K2SO4-MgCO3-Mg(HCO3) 2 -
MgSO4 ) 72 ( t.)
H,O-K CO -KHCO_-Na_CO„-NaHCO_ 55 ( T. )
H2O-K2CO3-K2SO4 24 ( T. )
H,O-K,CO -K =O.-Na,CO,-Na,SO, 56 ( t. )
H2O-K2CO3-Na2CO3 25 (t. )
H2O-KCl 1026
H2O-KCl-KF 26 ( T.)
H2O-KC1-KHCO3 27 ( t. )
H2O-KCl-KHCO3-N<?Cl-NaHCO3 57 ( t.)
H2O-KC1-K2SO4 1033, 1768, 1769
H2O-KCl-K2SO4-MgCl2-MgSO4 1045
H..O-KC1-K _SО .-MgC 1--MgSO .-NaCI-Na_SО.
£ 4 с. 4 i 4
1050. 1051
H„O-KCl-KSO-NaCl-NaSO 1046
2 2 4 2 4
H2O-KCl-MgCl2-NaCl 1047
I-I2O-KCl-NaCl 1034
HjO-KF 4 ( t. )
H2O-KHCO3 5 ( T.)
H20-KHC03-K2S04 28 ( T.)
H2O-K2O-MgO-SiO2 1534
H2O-K2O-SiO2. 1433
H2O-K2SO4 1027, 1750
K2O-K2SO4-MgSO4 1035
H2O-K2SO4-MgSO4-Na2SO4 1048
H2O-K2SO4-Na2SO4 1036
HnO-K.SO.-SrSO, 29 ( T.)
J 2 4 4 '
648 Jfc61
H2O-Li2SO4 1750-1752
H,O-MgB .O -MgCl -MgSO -Na-BO -NaCl-Na SO.
74 (’•)
H2O-MgCO3-MgCl2 30 (t.)
H,O-MgCO -MgCl,-Mg(HCO_)o-Na,CO_-NaCl-
NaHCO3 75 ( t. )
H2O-MgCO3-MgCl2-Na2CO3-NaCl 58 ( t. )
H2O-MgCO3-MgSO4-Na2CO3-Na2SO4 59 ( T. )
H2O-MgCO3-Na2CO3 31 ( t. )
H2O-MgCl2 6 ( t. )
H2O-MgCl2-MgSO4 1037
H2O-MgCl2-MgSO4-NaCl-Na2SO4 1049
H2O-MgCl2-NaCl 1038
H2O-MgO 1393, 1394
H2O-MgO-SiO2 1434-1444
H2O-MgSO4 7 ( T.)
H2O-MgSO4-Na2SO4 1039
H2O-Mn-O 1370
h2°-N2 1338
H2O-NH3 1352
H2O-NH3-NaAlSx3O8 1670
H2O-NaAlSiO4-SiO2 1506-1508
H2O-NaAlSi3O8-Na2CO3 1660
H2O-NaAlSi3Og-NaF 1661-1668
H2O-NaAlSi3O8-P2O5 1670
H_O-NaAlSi_Oe-SO_ 1670
H2O-Na2B4O7 1028
H2O-Na2B4O7-Na2CO3 32 ( t.)
H2O-Na2B4O7-NaCl 33 ( t.)
H2O-Na2B4O?-NaCl-NaHCO3 60 ( t.)
H2O-Na2B4O?-NaHCO3-Na2SO4 61 ( t. )
H2O-Na2B4O7-Na2SO4 34 ( t.)
HgO-NaBr-NaCl 35 ( t. )
H2O-Na2CO3 1029, 1741
H2O-Na2CO3-NaCl 1040
H2O-Na2CO3~NaCl-NaHCO3 62 ( t.)
,H20-Na2C03-NaHC03-Na2S04 63. ( t.)
H2O-Na2CO3.-Na2SO4 1041
HgO-NaCl 1030, 1760-1767
H2O-NaCI-NaF 36 ( t.)
H2O-NaCl-NaF-Na2SO4 64 ( t.)
H2O-NaCl-NaHCO3 1042
H2O-NaCl-NaHCO3-Na2SO4 65 (t.)
H2O-NaCl-Na2SO4 1043
HgO-NaF 8 ( t. )
H2O-NaHCO3 9 ( t. )
H2O-NaHCO3-Na2SO4 37 ( t. )
H2O-Na2O-SiO2 1445-1450
H2O-Na2O-TiO2 1452
H2O-NaOH-MgO 1635
H2O-NaOH-MgO-Mg(OH)2 1634
H2O-NaOH-Na2SO4 1756, 1757
H„O-Na„SO, 1031, 1743, 1750, 1753-1755
2 2 4
481
H2O-NiO-SiO2 1451
H2O-SiO2 1395-1406
H 2O-SiO 2-ZnO 1453-1455
H2O-SnO2 1407
H2O-TiO2 1408
H2S 1094
H2S-H2O-ZnS 1111
He-CO2 13 53, 13 54
He-N2 1355, 1356
HfO2 1118
Hg-S 44, 45
Hg-S-Se 235
Hg-S-Se-Te 311
Hg-S-Te 236
HgSe 1135
HgTe 1115
HoVO. 1262Б
4
In-S 43
Ir-Pt 12
KBP4-K2B4O7-Ne2B4O7 1003
K2B4°7"H2° 1024
к’в‘о7-КВЕ4-Ыа2В.407 1003
k2b4o7-h2c-kci 20 (T-)
K2B4.O7-H2O-KCl-K2SO4-Na2B4O7-NaCI-Na2SO4
70 ( T’) , 4
К„в О -H.O-KCl-Na В О 50 ( т-)
(
К B^-KCl-Na^O^NaCl 1004
K2B4O7-KF-Na2B4O7-NaF 1005
KBr-H,O-KCl 21 ( t. )
KBr-H2O-KCl-NaBr-NaCl 51 ( t.)
KBr 1265
KBr-KCl-NaBr-NaCl 959
KBr-KCl-KF-NaBr-NaCl-NaF 958
KBr-KP-KI-NaBr-NaF-Nal 960
K2CO3-CaCO3 913
K2CO3-CaCO2-CaCl2-KCl-H2O 39 ( t. )
K,CO.<aCO -CaSO -K„SO -H О 42 ( »• )
K^-CaCO^O 12 ( т.)
K2CO3-CaCO3-Na2CO3 916
K2CO3-H2O 1025
K2CO3-H2O-KCl 22 ( т. )
K_CO,-H,O-KCl-KHCO,-MgCO,-MgCl,-
Mg(HCO3)2 71 ( ’•)
K2CO3-H2O-KCl-K2SO4 52 ( т. )
К 2С О3-Н2О-КС I-К 2SC^-Na2C Oj-NaC l-Na2SO4?3(r.)
K2CO3-H2O-KCl-MgCO3-MgCl2 53 (т. )
K2CO3-H2O-KCl-Na2CO3-NaCl 54 ( ». )
K2C03-H20-KHC03 23 ( т«)
К.СО.-Н O-KHCO,-K,SO .-MgCO--Mg(HCO-) о-
MgSO4 72 (т.)
K„CO„-H„O-KHCO_-Na_CO_-NaHCO_ 55 ( *• )
4» О «3 • w J
К2СО3-Н2О-К2ЗО4 24 ( т.)
К,СО,-Н О-К SO -Na СО -Na,SO. 56 ( т. )
K2CO3-H2O-Na2CO3 25 ( т.)
К2СО3-КС1 993
K2CO3"KC1'"Na2CO3“NaC1 994
K2CO3-KF-Na2CO3 -NaF 996
KCI 1272-1274
KCI—A.I-O--H O-K O-N'aCl-Na О—SiO- 1675-
2 3 2 2 2 2»
1677
KCl-CaCO3-CaCl2-H2O-K2CO3 39 ( t. )
KCl-CaCl2-CaP2-KF-NaCl-NiaF 956
KCl-CaCl2-CaSO^-H2O-K2SO^ 44 ( T« )
KCI-CaCl -CaSO -H O-K SO -NaCl-Na_SO
£ 4 2 2 4 2 4
68 ( t.)
KCl-CaCl2-H2O 16 ( t. )
KCl-CaCl2-H2O-MgCl2 47 ( t.)
KCl-CaCl2-H2O-MgCl2-NaCl 69 ( t.)
KCl-CaCl2-H2O-NaCl 48 ( t.)
KCl-CaCl2-NaCl 939
KCl-FeCl2 940
KCl-HCl-SiO2 1656
KC1-H2O 1026
KC1-H2O-K2B4O7 20 ( t.)
KCl-H2O-K2B4O7-K2SO4-Na2B4O?-NaCl-
Na2SO4 70 ( t. )
KCl-H2O-K2B4O?-Na2B4O7 50 ( t. )
KCI-H2O-KBr 21 ( t. )
KCl-H2O-KBr-NaBr-NaCl 51 ( t. )
KCl-H2O-K2CO3 22 ( t.)
KC1-H O-K CO_-KHCO_-MgCO--MgCl--
J J 3 2
Mg(HCO3)2 71 (t. )
KCl-H2O-K2CO3-K2SO4 52 ( t.)
KCI-H O-K CO -K SO -Na„co„ -NaCl-
л J 2 4 2 3
Na2SO4 73 ( t. )
KCl-H2O-K2CO3-MgCO3-MgCl2 53 ( T.)
KCl-H2O-K2CO3-Na2CO3-NaCl 54 ( t. )
KCI-H2O-KF 26 ( t.)
KC1-H2O-KHCO3 27 ( t.)
KCl-H2O-KHCO3~NaCl-NaHCO3 57 ( t. )
KCl-H2O-K2SO4 1033, 1768, 1769
KCl-H2O-K2SO4-MgCl2-MgSO4 1045
KCl-H2O-K2SO4-MgCl2-MgSO4-NaCl-Na2SO4
1050-1051
KCl-H2O-K2SO4-NaCl-N.a2SO4 1046
KCl-H2O-MgCl2-NaCl 1047
KCl-H2O-NaCl 1034
KCl-K2B4O7-Na2B4O7-NaCl 1004
KCl-KBr-KF-NaBr-NaCl-NaF 958
KCl-KBr-NaBr-NaCl 959
KC1-K2CO3 993
KCl-K2CO3-Na2CO3-NaCl 994
KCI-KF-KoSO 981
2 4
KCl-KF-K2SO4-NaCl-NaF-Na2SO4 982
KCl-KF-Na2CO3 995
482
KC1-KI -NaCl-NaF 961
KC1-K..SO. 983
2 4
KCl-K2SO4-NaCl-Na2SO4 984
KCl-MgCl2 942
KCl-NaCl 943
KCl-MaCl-H2O 1034
K„CrO 1312, 1313
2 4
K2Cr2°7 1314
KF 1271
KF-CaCl2-CaF2-KCl-NaCl-NaF 956
KF-CaF-NaF 948
KF-H2O 4 ( T-)
KF-K,B4O7-Na2B4O?-NaF 1005
KF-KBr-KCl-NaBr-NaCl-NaF 958
KF-KBr-KI-NaBr-NaF-Nal 960
KF-K2CO3-Na2COrNaF 996
KF-KC1-H2O 26 ( t. )
KF-KC1-K.SO, 981
2 4
KF-KCl-K.SO -NaCl-NaF-Na.SO, 982
2 4 2 4
KF-KCl-Na2CO3 995
KF-KCl-NaCl-NaF 961
KI 1269
KI-KBr-KF-NaBr-NaF-Nal 960
KHCO3-H2O 5 ( t. )
KHC03-H20-K2C03 23 ( T. )
KHCO -H O-K.CO -KCl-MgCO,-MgCl,-Mg(HCO,),
71 ( T-)
KHCO -H O-K CO -K so,-Mgco -Mg(HCO,) _-
MgSO4 72 (T. )
KHCO.-H.O-K.CO^-Na.COo-N'aHCC. 55 ( t. )
О м м О w О О
KHCO3-H2O-KC1 27 ( Т. )
KHCO3-H2O-KCl-NaCl-NaHCO3 57 ( т- )
KHCO3-H2O-K2SO4 28 ( т.)
KNO3 1301, 1302
KNO3-NaNO3 917
K2O-Al2O3-CO2-CaO-H2O-MgO-SiO 1729
K20-Al203-C02-H20-Mg0-Si02 1733
K20-Al203-Ca0-H20-Na20-S102 1609-1612
K2O-Al2O3-CaO-H2O-SiO2 1552
K2O-Al2O3-Fe-H2-MgO-O2-SiO2 1383
K2O-Al2©3-Fe-H2O-MgO-O2-SiO2 1384
K2O-Al2O3~Fe-H2-Na2O-O-SiO2 1379-1382
K2O-Al2O3-Fe-H2O-O2-SiO2 1376-1378
K2O-Al2O3-FeO-H2O-MgO-O2-SiO2 1624-1626
K2O-AI2O3-FeO-H2O-MgO-SiO2 1617, 1623
K2O-Al2O3-FeO-H2O-SiO2 1565
K2O-Al2O3-FeO-SiO2 834
K2O_A12O3_Pe2O3_H20“MsO_SiO2 1618-1620
K2O“AI2O3“Pe2O3~H2O_Na2O-SiO2 1621- 1622
K2O-Al2O3-HCl-H2O-MgO-SiO2 1658
K2O-Al2O3-HCl-H2O-SiO2 1659
K,O-A1 О -HO-KCl-NaCl-Na.O-SiO„ 1675-
л 3. 2 2 2
1677
K2O-Al2O3-H2O-MgO-SiO2 1570-1583
K2O-Al2O3-H2O-Na2O-SiO2 1584-1594
K2O^AI2O3-H2O-NiO-SiO2 1571
K2O-Al2O3-H2O-SiO2 1469-1484
K2O-Al2O3-MgO-SiO2 841-852
K2O-Al2O3-Na2O-SiO2 853-856, 1238, 1239,1240
K2O-Al2O3-SiO2 512-517, 1162-1164
K2O-CO2-I<2O-SiO2 1719, 1720
K2O-CrO3-Na2O 631
K2O-Cr2O3 1008
K2O-Fe-H2O-O2-SiO2 1375
K2O-FeO-SiO2 666
K2O“Pe2O3-SiO2 687
K2O_Ga2O3_H2O"MgO"SiO2 1571
K2O-H2O-MgO-SiO2 1534
K2O-H2O-SiO2 1433
K2O-SiO2 448
K2O-TiO2-V2O5 695
KOH-A12O3 1628
K2so4-Ag2SO4 925
K2SO4-CaCO3-CaSO4-K2CO3-H2O 42 ( t. )
K2SO4-CaCl2-CaSO4-KCl-H2O 44 ( t. )
К SO -CaCI -CaSO -KCl-NaCl-Na SO -H,O
2 4 2 4 2 4 2
68 ( T. )
К SO-CaSO, 928
2 4 4
K2SO4-CaSO4-H2O 18 ( t. )
K2SO4-CaSO4-MgSO4-H2O 1044
K„SO„-CaSO -Na =O, 929
2 4 4 2 4'
K2SO4-H2O 1027, 1750
K2S°4-H2O-K2B4°7-K2SO4-Na2B4O7-I’aCl-
Na2SO4 70 ( T-)
K2SO4-H2O-K2CO3 24 (t.)
K2SO4-H2O-K2CO3-KC1 52 ( t.)
К SO -H O-K CO -KCl-Na CO -NaCl-Na„SO -
2 tL 2 2 J 2 3 4
H2O 73 ( T. )
K2SO4-H2O-K2CO3-Na2CO3-Na2SO4 56 ( T>)
K2SO4-H2O-K2CO3-KHCO3-MgCO3-MgHCO3-
MgSO4 72 ( T.).
К SO -H C-KCl 1033 ( T-), 1768-1769
K2SO4-H2O-KCl-MgCl2-MgSO4 1045
K2SQ4-H2O-KCl-MgCl2-MgSO4-NaCl-Na2SO4
1050-1051
K2SO4-HoO-KCl-NaCl-Na2SO4 1046
K9SO -H O-KHCO 28 ( T.)
2 4 2 3
К so -HnO-MgSO4 1035
2 4 2 ^4
K2SO4-H2O-MgSO4-Na2SO4 1048
К SC -HrO-Na SOz 1036
2 4 2 2 4
K,?SO4-HoO-SrSO4 29 ( T. )
K„SO -KCI 983
2 4
К SO -KC1-KF 981
2 4
K,SO -KCl-KF-NaCl-NaF-Na0SO^ 982
<- 4 2 4
К JO -KCl-NaCl-Ма SO 984
/ 4 2 4
K2SO4^MgSO4 932
KoSO -MnSO. 933
2 4 4
61
433
K2£O4-Na2SO4 934
K,SO-'PbSO4 935
2 4 4
LiCl 1272
LiF-AlF3-NaF 946
LiF-Al2O3-Na2O-SiO2 970
LiNO3 1301
Li2O-Al2O3-Fe2O3-Fe3O4 826
Li2O-AlQO3-H2O-Na2O-SiO2 1595
Li2O-Al2O3-MgO-SiO2 357, 358-863
Li2O-Al2O3-SiO2.518, 519, 1165, 1166
Li2SO4-H2O 1750-1752
Mg-Al-Fe-O2 361
MgB4O7-H2O-MgCl2-MgSO4-Na2B4O7-NaCl-
Na^O^ 74 ( t.)
MgCO3-CaCO3 914, 1286-1289
MgCO3-CaCO3-CaCl2-Ca(HCO3)2-CaSO4-
Mg(HCO3) 2-H2O-MgS О4-MgCl2-Na2C O^
NaHCO3-Na2SO4-NaCl 66 ( t. )
MgCC>3-CaCO3-CaCl2-H2O-MgCl2 40 ( t. )
MgC03-CaC03-CaS04-H20-MgS04 43 ( t. )
MgCO3-CaCO3-CoCO3 1292, 1293
MgCO3-CaCO3-FeCO3 1294, 1295
MgCO3-CaCO3-H2O 13 ( t. )
MgCO3-CaCO3-MnCO3 1296
MgCO3-CaCO3-NiCO3 1297
MgCO3-CaCO3-SrCO3 1298
MgCO3-H2C-K2CO3-KCl-MgCl2 53
MgCO,-H,O-K CO,-KCl-MgCl -Mg(HCO,),
71 ( т. )
MgCO,-H,O-K,CO,-KHCO,-K SO -MgHCO -
MgSO4 72 ( T.)
MgCO3-H2O-MgCl2 30 ( t,)
MgCO,-H„O-MgClo-MgHCO.-Na,CO,-NaCl-
NaHCO3 75 ( t. )
MgCO3-H2O-MgCl2-Na2CO3-NaCl 58 ( t. )
MgCO,-H O-MgSO,-Na,CO,-Na SO 59 .( t. )
MgCO3-H2O-Na2CO3 31 ( T.)
MgCO3-NiCO3 1291
MgCl2-CaCO3-CaCl2-Ca(HCO3)2-CaSO4-H2O-
MgCO -Mg(HCO K-MgSO -Na CO -NaCl-
О О м О
NaHCO3-Na2SO4 66
MgCl2-CaCO3-CaCl2-H2O-MgCO3 40 ( т.)
MgCl2-CaCl2-CaSO4-H2O-MgSO4 45 ( т.)
MgCl2-CaCl2-H2O 17 ( т.)
MgCl2-CaCl2-H2O-KCl 47 ( т.)
MgCl2-CaCt2-H2O-KCl-NaCl 69 ( т. )
MgCl2-CaCl2-H2O-NaCl 49 ( т.)
MgCl2-H2O б ( т.)
MgCl -Н О-К СО -КС1-КНСО -MgCO -MgHCO
£ £ £ 3 kJ kJ kJ
71 ( т. )
MgCl2-H2O-K2CO3-KCl-MgCO3 53. ( t. )
MgCl2-H2O-KCl-K2SO4-MgSO4 1045
MgCl -H O-.KCl-K.SO .-MgSO,-NaCl-Na„SOл
2 2 24 4 24
1050, 1051
MgCl2-H2O-KCl-NaCl 1047
MgCb-H O-MgB О -MgSO .-NaoB О -NaCl-
Na2SO4 74 ( T.)
MgCI2-H2O-MgSO4 1037
MgCl2-H2O-MgSO4-NaCI-Na2SO4 1049
MgCl2-H2O'-NaCl 1038
MgCl2-KCl 942
MgCl2-MgCO3-H2O 30 ( T.)
MgCK-MgCO -MgHCO -Na.CO-NaCl-NaHCO-
Л «5 О £, J 3
H2O 75 ( T.)
MgCl2-MgCO3-Na2CO3-NaCl-H2O 58 ( t.)
MgCl2-MgSO4 985
MgCl2-NaCl 944
MgCrOx 1316
MgCr2Ox 1316
MgF2-Ca?2 949
MgF2-MgO 909-911
MgF2-MgO-SiO2 976
MgF2-NaF 951
MgF2-NaF-SiO2 977
Mg(HCO3) 2-CaCO3-CaCl2-Ca(HCO3) 2-CaSO3-
H2O-MgCO3-MgCl2-MgSO4-Na2CO3-NaCl-
NaHCO3-Na2SO4 66 ( t. )
Mg(HCO ) -H O-K CO,-KCl-KHCO,-MgCO,-
MgCl2 71 ( t.)
Mg(HCO ) -H O-K.CO -KHCO.-K.SO.-
kJ kJ^<L
MgCO3-MgSO4 72 ( t.)
Mg(HCO ) -H O-MgCO_-MgCl--Na„CO_-NaCl-
NaHCO 75 ( t.)
MgO-AloO3 371-373
MgO-Al-O -В О -H O-Na O-SiO 1657
kJ «J 2 2
Mg0-Al,0o-Ba0-Si02 728
MgO-Al2O3-BeO 477
MgO-AloO3-CO2-CaO-HoO-K2O-SiO2 1729
MsO-Al О -CO -H О 1706
' 2 3 2 2
MgO-Al2O3-CO2-K2O-HoO-SiO2 1733
MgO-Al9O3-CaO-FeO-H2O-Na2O-SiO2 1627
MgO-Al2O3-CaO-Fe3O4-Na2O-SiO2 1250
MgO-Al2O3-CaO-H2O-Na2O-SiO2 1613-1616
MgO-Al2O3-CaO-H2O-SiO, 1553-1560
MgO-Al2O3-CaO-Na9O-SiO2 1245-1249
MgO-Al2O3-CaO-SiO2 736-792, 1222-1235
MgO-Al2O3-Cr2O3 495-497
Mg0-Al203-Cr203-Si02 825
MgO-Al2O3-Cr2O3-TiO2 825
MgO-Al2O3-Cr2O3-ZrO2 825
MgO-Al2O3-Fe-H2-K2O-O2-SiO2 1383
M«O^I2O3-Fe-H2O-K2O-O2-SiO2 1384
M8O- Al2O3-FeO-H2O-K2O-O2-SiO2 1624-1626
Mg0-Al2O3-FeO-H2O-K0O-SiO2 1617, 1623
MgO-Al2O3-FeO-H2O-SiO2 1566
MgO-Al2Q3-FeO-SiO2 835
MgO-Al O -Fe O -H O-K O-SiO 1618-1620
& 23232 2 2
MgO-Al2O3-HCl-H2O-K2O-SiO2 1658
MgO-Al2O3-H2O 1413, 1414
MgO-Al2O3-H2O-K2O-SiO2 1570-1583
MgO-Al2O3-H2O-Na2O-SiO2 1596-1600
MgO-Al2O3-H2O-SiO2 1485-1503, 1694
MgO-Al2O3-K2O-SiO2 841-852
MgO-Al2O3-Li2O-SiO2 857-863
MgO-Al2O3-Na2O-SiO2 864, 1241, 1242
MgO-Al2O3-SiO2 520-526, 1167-1175
MgO-Al2O3-SiO2-ZrO2 865
MgO-B2O3 392
MgO-B2O3-SiO2 539
MgO-BaO-SiO2 541-542
MgO-BeO-TiO2 543
MgO-CO2 1278
MgO-CO2-CaO-FeO-H2Q-SiO2.1726-1728
MgO-CO2-CaO-H2O 1707-1710
MgO-CO2-CaO-H2O-SiO2 1722-1725
MgO-CO2-CaO-SiO^ 1693-1697
MgO-CO2-H2O 1702-1705
MgO-CO2-H2O-SiO2 1721
MgO-CO2-SiO2 1691
MgO-CaO-CrO3-Cr2O3 867-868
MgO-CaO-Cr2O3 548-550
MgO-CaO-Cr2O3-SiO2 869-870
MgO-CaO-FeO 556
MgO-CaO-FeO-Fe2O3 871, 872
MgO-CaO-FeO-SiO2 877-882, 1244
MgO-CaO-Fe2O3 572
MgO-CaQ-Fe2O3-SiO2 884
MgO-CaO-H2O-SiO2 1527-1533
MgO-CaO-MnO 575
MgO-CaO-P2O5-SiO2 885-886
MgO-CaO-SiO2 576-592, 1188-1201
MgO-CaO-SiO2-TiO2 887-891
MgO-CaO-SiO2-ZrO2 892
MgO-CeO2 417
MgO-CoO-Si02 1202, 1203
MgO-Cr2O3 422, 423
MgO-Cr2O3-FeoO3 624, 625
MgO-Cr2O3-SiO2 627, 628
MgO-Cr2O3-TiO2-ZrO2 894
MgO-Cr2O3rZrO2 629
MgO-CuO 428
MgO-CuO-Cu2O 634
MgO-Fe-O-SiO2 1373, 1374
MgO-FeO 431, 432
MgO-FeO-Fe2O3 640-652
MgO-FeO-Fe2O3-SiO2 895-901
MgO-FeO-H2O-O2-SiO2 1549,1550
MgO-FeO-MnO 667
MgO-FeO-SiO2 668-671, 1204-1209
MgO-Fe2O3 441
MgO-Fe2O3-H2O-Na2O-SiO2 1601-1604
MgO-Fe2O3-PbO 688
MgO-Ga2O3-H2O-K2O-SiO2 1571
MgO-GeO2-NiO-SiO2 1243
MgO-GeO2-SiO2 694, 1214-1216
MgO-H2O 1393, 1394
MgO-H2O-K2O-SiO2 1534
MgO-H2O-NaOH 1635
MgO-H2O-NaOH-Mg( OH) 1634
MgO-H2O-SiO2 1434-1444
MgO-MgF2 909-911
MgO-MgF2-SiO2 976
MgO-MnO 449, 450
MgO-MnO-SiO2 696-698
MgO-Na2O?P2O5 .699
Mg0-Ni0-Si02700
MgO-P2O5 451
MgO-PoO_-SiO- 701
2 5 2
MgO-Р O_-ZnO 702
2 5
MgO-SiO2 452-455, 1146-1151
MgO-SiO2-TiO2 703, 1217-1221
MgO-SiO2-ZnO 704, 705
MgO-SiO2-ZrO2 706-708
MgO-TiO2 456
MgO-UOQ 457
MgO-ZnO 458
Mg(OH)2-H20-Na(OH)-MgO 1634
MgSO4-CaCO3-CaCl2-Ca(HCO3 ) 2-CaSO4-l’2O-
MgCO3-MgCl2-Mg(HCO3) 2-Na2CO3-NaCl-
NaHCO,-Na2SO4 66 (T. )
MgSO4-CaCO3-CaSO4-H2O-MgCO3 43 (T. )
MgSO4-CaCl2-CaSO4-H2O 45.(t.)
MgSO.-CaSO.-H,O-K,SO, 1044
4 4 2 2 4'
McSO -CaSO -Na SO, 930
4 4 2 4
MgSO4-H9O 7 (T- )
MgSO -H9O-K CO -KHCO -KSO -MgCO .-
Mg(HCO3)2 72 (T. )
MgSO4-H2O-KCl-K2SO4-MgCl2 1045
MgSO -H O-KC1-K SO,-MgCl„-NaCl-Na„SO,
i ^4 £ 2 4
1050, 1051
MgSO4-H2O-Kn = O4 1035
MgSO4-H2O-K2SO4-Na.SO4 1048
MgSO4-H2O-MgB4O7-MgCl2-Na2B4O7-NaCl-
Na2SO4 74 ( t. )
MgSO -H O-MgCO~-N*_CO_-Na9SOA 59 ( t. )
MgSO4-H2O-MgCl2 1037
MgSO4-H2O-MgCl2-NaCl-Na2SO4 1049
MgSO4-H2O-Na2SO4 1039
MgSO^KnSO„ 932
MgSO4-MgCl2 985
MgSOrNacSO, 936
4 " 2 4
Mn-C 1077
Mn-Cd-S 103, 104, 1100
Mn-Cd-S-Zn 267
Mn-Cu-O2 339-340
Mn-Fe-O2 341-344
Mn-Pe-O-S-Si 315
Mn-Fe-S-Zn 296
Mn-H2O-O 1370
Mn-O2 320, 321, 1369
Mn-O-S 237
Mn-O -Si 3 56
2
Mn-O2-Zn 357
Mn-S-Se 238
MnCO3-CaCO3 915
MnCO^-CaCO3-MgCO3 -1296
MnO-Al2O3 374
MnO-Al2O3-H2O-SiO2 1544
MnO-Al2O3-SiO2 527-529
MnO-Al_O_-SiOo-Y9O_ 866
MnO-CO2 1279
MnO-CaO 406
MnO-CaO-FeO-POC) 883
2 5
MnO-CaO-MgO 57 5
MnO-CaO-SiO2 593-597
MnO-CaO-SiO2-TiO2 893
MnO-CaO-WO3 598
MnO-FeO 433, 434
MnO-FeO-Fe2O3 653
MnO-FeO-MgO 667
MnO-FeO-SiO2 672-682
MnO-FeO-TiO2 683, 684
MnO-GeO2 1145
MnO-MgO 449, 450
MnO-MgO-SiO2 696-698
MnO-Mn2O3-SiO2 709-711
MnO-Mn2O3-ZnO 712
MnO-O-S 237
MnO-SiO2 459
MnO-SiO2-TiO2 713
IWnO-ZnO 460
Mn2°3-Al2O3 375
Mn2O3-CaO 407
^г^з^^з 424
Mn2O3-Fe2O3 442
Mn2O3-MnO-SiO2 709-711
Mn2O3-MnO-ZnO 712
Mn O<eOn 416, 417
3 4 2
Mn-O.-Fe-O, 446, 447
3 4 3 4
Mn3O^-Fe3O^-SiO2 690
МгцО -SiOn 461
3 4 2
MnSO, 1306
4
MnSO -К_ЗОЛ 933
4 2 4
Mc-Bi-S 93, 94
Mo-Cu-S 138
Mo-Fe-O2 345
Mo-Fe-S 162-165
Mo03-Bi203 400
MoO3~Bi2O3—PbO 545, 546
McO3-CaO 462
MoQ3-CrO3-PbO 632, 1009
Mo03-Na20-Pb0 714
McO3-Na2O-PbO-SO3 1020
MoOyPbO 462, 1021
MoO3-PbO-WO3 715, 1022
Mo03-Th02 463, 464
MoO3-ZnO 462
N2 1332
N2-H2O 1338
N2-He 1355, 1356
N2-NH3 1357-1359
N2-S°2 1357
NIL-CH, 13 57
3 4
NH3-H2O 1352
NH3-H2O-NaAlSi3OR 1670
NII3-NO 1357-1359
NaAlSiO - fCa_ • F( РОЛ ) _ 1 -H„O 1629
4 L о 4 4 3J 2
NaAlSiO4-H2O-SiO2 1506-1508
NaAlSi3O8-CO9-Na2CO3 1692
NaAlSi3O8-HCl-H2O 1670
NaAlSi Og-HF-HgO 1670
NaAlSi3OR-H2O-NH3 1670
NaAISl30R-Ho0-Na2G03 1660
NaAlSi3O8-II2O-NaF 1661-1668
NaAlSi3O8-H2O-P2O5 1670
NaAlSi3O8-H2O-SO3 1670
NaBF4-KBF4-K2B4O7-Na2B4O7 1003
Na2B4O7-CaB4O7-CuSO4-H2O-Na2SO4 38 ( t.)
Na2B4O7-H2O 1028
Na2B4°7“H2°-K2B4°7"KC1 50 ( T< >
Na2B4O7-H2C'K2B4O7“KC1~?;2SO4"NaC1“Na2SO4
70 ( t. )
Na2B4O7-H2O-MgB4O7-MeCl2-MgSO4-NaCl-
Na2SO4 74 ( t.)
Na2B4O7-H2O-Na2CO3 32 ( t. )
Na2B4O7-H2O-NaCl 33 ( t. )
Na2B4O7-H2O-NaCl-NaHCO3 60 ( ». )
Na2B4O7-H2O-NaCl-NaHCO3-Na2SO4 76 (t. )
Na2B4O7-H2O-NaHCO3-Na2SO4 61 ( »•)
Na2B4O7-H2O-Na2SO4 34 ( t. j
NaBO-KBF-KBO-NaBF 1003
247 4247 4
Na2B4O7-K2B4O?-KCl-NaCl 1Q04
Na2B4O7-K2B4O?-KF-NaF 1005
NaBr 1266
NaBr-H2O-KBr-KCl-NaCl 51 ( t. )
NaBr-H2O-NaCl 35 ( T.)
NaBr-KBr-KCl-KF-NaCl-NaF 958
NaBr-K0r-KCl-NaCl 959
NaBr-KBr-KF-KI-NaF-Nal 960
NaBr-NaCl-Nal 962
Na2CO3 1280
Na2CO3-BaCO3-BaCl2-NaCl 991
Na2CO3-CO2-NaAlSi3O8 1692
Na2C O3-CaCO3-CaCl2-Ca(HCO3 ) 2~CaSO4-H2O-
MgCO3-MgCl2-Mg(HCC>3) 2-MgSO4-NaCl-
NaHCO3-Na2SO4 66 ( t. )
Na„CO,-CaCO,-CaCl -CaSO -H O-NaCl-Na SO
67 (’•)
Na2CO3-CaCO3-CaCl2-H2O-NaCl 41 ( T-)
Na2CO3-CaCO3-CaCl2-NaCl 992
Na2CO3-CaCO3-H2O 14 ( T. )
Na2CO3-CaCO3-K2CO3 916
Na CO -CaO<rO, 1007
2 3 3
NanCO -H О 1029, 1741
2 3 2
Na2CO3-H2O-K2CO3 25 ( T.)
Na2CO3-H2O-K2CO3-KCl-K2SO4-NaCl-Na2SO4
73 ( t. )
Na2CO3-H2O-K2CO3-KCl-NaCl 54 ( t. )
Na CO,-H2O-K2CO3-KHCO3-NaHCO 55 ( t. )
Na,CO,-H,O-K ,CO,-K,SO -Na SO 56 ( t. )
Na2CO3-H2O-MgCO3 31 ( t. )
Na,CO,-H O-MgCO_-MgCl -Mg(HCO ) -NaCl-
4* о 4* kJ Ju
NaHCO3 75 ( t.)
Na2CO3-H2O-MgCO3-MgCl2-NaCl 58 ( t.)
Na,CO_-H,.O-MgCO,-MgSO -Na SO 59 ( t. )
Na2CO3-H2O-NaAlSi3Oa 1660
Na2CO3-H2O-Na2B4O7 32 ( t. )
Na2C03-H20-NaCl 1040
Na2CO3-H2O-NaCl-NaHCO3 62 ( t. )
Na„CO -H O-NaHCO -Na0SO 63 ( t. )
Na2CO3-H2O-Na2SO4 1041
Na2CO3-K2CO3"KC1“NaCI 994
Na2CO3-K2CO3-KF-NaF 996
Na2CO3-KCl-KF 995
Na CO -NaCl 997
2 3
Na2CO3-NaCl-NaF 998
Na2CO3-NaF 999
NaCl 1266, 1272, 1275
NaCl-AlCl3-AlF3-NaF 954
NaCl-Al2O3-H2O-KCl-K2O-Na2O-SiO2 1675-
1677
NaCl-Al2O3-H2O-Na2O-SiO2 1672
NaCl-Al2O3-Na2O-SiO2 971
NaCl-BaCO3-BaCl2-Na2CO3 991
NaCl-CO2-H2O 1360, 1361
NaCl-CaCO3-CaCl2-Ca ( HC©3 ) 2~CaSO4-H2O-
MgCO3-MgCl2-Mg(HCO3)2-MgSO4-Na2CO3-
NaHCO,-Na„SO, 66 ( t. )
3 2 4 '
NaCl-CaCO3-CaCl2-CaSO4-H2O-Na2CO3-
Na2S°4 67
NaCl-CaCO3-CaCl2-H2O-Na2CO3 41 ( t. )
NaCl-CaCO3-CaCl2-Na2CO3 992
NaCl-CaCl2-CaF2-KCl-KF-NaF 956
NaCl-CaCl2-CaF2-NaF 957
NaCKaCL-CaSO -H O-KCl-K SO -NaSO
2 4 2 2 4 2 4
68 ( T. )
NaCl-CaCl2-CaSO4-H2O-Na2SO4 46 ( t. )
NaCl-CaCl_-CaSO .-Na„SO . 980
2 4 2 4
NaCl-CaCl2-H2O 1032
NaCl-CaCl2-H2O-KCl 48 ( t.)
NaCl-CaCl2-H2O-KCl-MgCl2 69 ( t. )
NaCl-CaCl2-H2O-MgCl2 49 (t. )
NaCl-CaCl2-KCl 939
NaCl-FeCl3 941
NaCl-Н О 1030, 1760-1767
NaCl-HO-KBO-KCl-KSO -NaBO-
2 247 24 247
Na2SO4 70 (t. )
NaCl-H2O-KBr-KCl-NaBr 51 ( t. )
NaC 1-H 2 O-K 2C O3-K С1-K 2S O4~N a2C °з“
Na2S°4 73 <T-)
NaCl-H2O-K2CO3-KCl-Na2CO3 54 ( t.)
NaCl-Ho0-KCl 1034
NaCl-H2O-KCl-KHCO3-NaHCO3 57 ( t. )
NaCl-H.O-KC 1-K SO -MgCk-MgSO -Na SO
2 2 4 2 4 2 4
1050, 1051
NaCl-Н O-KCl-K-SO -Na SO, 1046
2 2 4 2 4
NaCI-Ho0-KCl-MgCl2 1047
NaCl-Н O-MgB О -MgCl -MgSO -Na.BO-
Na2SO4 74 ( t.)
NaCl-Н O-MgCO.-MgCi -Mg( HCO, ) ,-Na.CO,-
kJ 4* J kJ
NaHCO3 75 ( t. )
NaCl-H2O-MgCO3-MgCl2-Na2CO3 58
NaCl-H9O-MgCl2 1038
NaCl-H2O-MgCl2-MgSO4-Na2SO4 1049
NaCl-H2O-Na2B О 33 ( т. )
NaCl-H2O-Na2B4O?-NaHCO3 60 ( т.)
NaCl-H2O-Na2B4O7-NaHCO3-Na2SO4 76 ( т. )
NaCl-H2O-NaBr 35 ( т. )
NoCl-H2O-Na2CO3 1040
NaCl-H2O-Na2CO3-NaHCO3 62 ( t. )
NaCl-HgO-NaF 36 ( t. )
NaCl-H_O-NaF-Na_SO. 64 ( t.)
2 2 *4 v '
NaCl-H2O-NaHCO3 1042
NaCl-H2O-NaHCO3-N?2SO4 65 ( .
NaCl-П O-N'a„SO„ 1043
2 2 4
NaCl-K2B4O7_KCl-Na2B4O7 1004
\.\Cl-KBr-KCl-KF-NaBr-NaF 9 58
Na( l-KBr-KCl-NaBr-H2O 51 ( T. )
NaCl-К CO -KCl-Na_C00 994
2 3 2 3
NaC 1-KCl 943
NaCl-KCl-KF-K SO -NaF-Na„SO 982
2 4 2 4
487
NaCl-KCl-KF-NaF 961
NaCl-KCl-K _SO -Na_SO . 984-
2 4 2 4
NaCl-MgCl2 944
NaCl-NaBr-Nal 962
NaCl-Na2CO3 997
NaCl-Na2CO3-NaF 998
NaCl-NaF 963
NaCI-NaR-Na^SO, 986
2 4
NaCl-NaF-Nal 964
NaCl-Na2O-SiO2 978
NaCl-NanSO, 987
2 4
NaCl-bJa2SO4-PbC!2-PbSO4 988
Na2CrO4 1315
NaF 1266
NaF-AlCl -AIF -NaCl 954
3 3
NaF-AlF3 947
NaF-AlF3-AIoO3 966
NaF-AlF3-Al2O3-CaF2 965
NaF-AlF3-Al2O3-Na2O-SiF4-SiO2 967
NaF-AIF3~CaF2 945
NaF-AlF3-LiF 946
NaF-B2O -Na О 1002
NaF-CaCl2-CaF2-KCl-KF-NaCl 956
NaF-CaCI -CaF -NaCl 957
2 2
NaF-CaF2-KF 948
NaF-CaF2-SiO2 974
NaF-H2O 8 ( T.)
NaF-H2O-NaAlSi3O8 1661-1668
NaF-H2O-NaCl 36 ( t. )
NaF-H2O-NaCl-Na2SO4 64 (
NaF-K2B4O7-KF-Na2B4O? 1005
NaF-KBr-KCl-KF-NaBr-NaCl 958
NaF-KBr-KF-KI-NaBr-Nal 960
NaF-K2CO3-KF-Na2CO3 996
NaF-KCl-KF-K0SO -NaCl-Na SO 982
2 4 2 4
NaF-KCl-KF-NaCl 961
NaF-MgF2 951
NaF-MgF2-SiO2 977
NaF-Na CO 999
NaF-Na2CO3-NaCl 998
NaF-NaCl 963
NaF-NaCl-NaT 964
NaF-NaCl-Na2SO4 986
NaF-Na2O-SiO2 979
NaF-Na2SO4 990
NaF-Na2SO4-PbF2-PbSO4 989
Nal 1266
Nal-KBr-KF-KI-NaBr-NaF 960
Nal-NaBr-NaCl 962
Nal-NaCl-NaF 964
NaHCO3-CaCO3-CaCl2-Ca(HCO3)2-CaSO4-
HcO-MgC00-MgCl2-Mg(HCO ) 2-N7gSO -
Na2CO3"-Nacl-Na2So4 66 ( t. )
NaHCO3-H2O 9 ( T.)
NaHCO3-H2O-K2CO3-KHCO3-Na2CO3 55 ( t. )
NaHCO3-H2O-KCl-KHCO -NaCl 57 (T. )
NaHCO.-H^-MgCO -MgCL-Mg(HCO_) -
Ofc О fc О fc
Na2CO3-NaCI 75 ( T. )
NaHCO3-H2O-Na2B4O7-NaCl 60 ( T. )
NaHC03-H20-Na2B407-NaCl-Na2S04 76 ( t. )
NaMCO3-H9O-Na,B4O7-Na2SO4 61 ( t. )
NaHCO3-H2O-Na2CO3-NaCl 62 ( t. )
NaHC03-H20-?la2C03.-Na2S04 63 ( T. )
NaHCO3-H2O-NaCl 1042
NaHCO3-H2O-NaCl-Na2SO4 65 ( t. )
NaHCC3-H2O-Na2SO4 37 (t. )
Na„iVIoO4 1299
Na.NO3 1301, 1303
NaNO3-KNO3 917
Na.O-Al.O-AIR -NaR-SiO -SiR 967
2 2 3 3 2 4.
Na20-AloO3-D203-H20-Mg0-SiO2 1657
Na20-Al003-Ca0-Fc?0-H00-Mg0-Si02 1627
Na2O-AloC3-CaO-RcO-H2C-SiO9 1605-1608
Na О-Al О -СаО-Fe O„ 729
2 2 3 2 3
Na20-Al203-Ca0-Reo04-Mg0-Si02 1250
Na2O-Al.>O3-CaO-H2O-K9O-SiO2 1609-161 >
Na2O-Al9O3-CaO-H2O-MgO-SiOc 1613-161 5
Na.,O-Al2O3-CaO-H2O-SiO2 1561, 1562
Na9O-Al2OQ-CaO-MgO-SiO2 1245-1249.
Na2O-Al9O3-CaO-R2O5-SiO2 918
Na9O-Al9O3-CaO-SiO9 793-808, 1236, 1237
Na2O-Al2O3-Fe-H9-K2O-O-SiO2 1379-1382
Na2O-Al9C3-FeO-SiO2 836-840
Na О-Al О -Fe О -H O-K O-SiO„ 1621, 1622
& do ~ 3 2 2 fc.
Na2O-Al2O3-Fe2O3-H2O-SiO2 15(57-1569
Na2O-Al2O3-Fe2O3-SiO2 838-840
Na2O-Al2O3-HCl-H2O-SiO2 1659
Na O-AI О -H O-KC1-K O-NaCl-SiO 1675-1677
fc fc О fc fc fc
Na2O-Al2O3-H2O-K2O-SiO2 1584-1594
Na2O-Al2O3-H2O-Li2O-SiO2 1595
Na2O-Al2O3-H2O-MgO-SiO2 1596-1600
Na2O-Al2O3-H2O-NaCl-FiO2 1672
Na2O-Al2O3-H2O-SiO2 1504, 1505, 1509-1526
Na2O-Al2O3-K9O-SiO2 853-856, 1238-1240
Na2O-Al2O3-LiF-SiO2 970
Na2O-Al2O3-MgO-SiO2 864, 1241, 1242
Na2O-Al2O3-NaCl-SiO^ 971
Na2O-Al2O3-SiO2 530-533, 1176-1184
Na2O-D2O3-NaF 1002
Na2O-CaF2-SiO2 975
Na2O-CaO-SO3-SiO2 927
Xa2O-CaO-WO 599
Xa2C-CrO3-K2O 631
Na2O-FeO-H9-H2O-SiO2 1535
Na O-F<?O-H 0-0 -SiO„ 1551
2 2 2 2
Na O-ReO-SiC) 1211
2 2
Na2O-Fe2O3-H2O-MgO-SiO2.1601-1604
NanO-Fe2b3-SiO2 689, 1210, 1212
Na2C-H2O-SiO2 1445-1450
Ka00-Ho0-Ti0n 1452
2 2 2
Xa2O-MgO-P2O5 699
Xa2O-MoO3-PbO 714
Na9C-Mo03-Pb0-S03 1020
Na2C-NaCl-SiO2 978
Na2O-NaF-SiO2 979
Na2O-P2Op-SiO2 924
Na2O-P2OP-ZnO 699
Na9O-PbO-SO3-WO3 1013
Na _O-PbO-SiO _ 716-718
2 2
Na2O-PbO-WO3 719
Na2O-SO3-SiO2 938
Na2O-V2O5 46 5
NaOH-H O-MgO 1635
NaOH-H2O-MaO-Mg(CH)2 1634
NaOM-H2O-Xa2SO4 1755, 1757
NanS-AsoS -HnO 1108-1110
2 2 3 2
Na2SO4 1307
Na2SO4-Ag2SO4 926
Na2SO4"CaB4O7"CaSO4“H2°"Na2E!4O7 38 (T‘ >
Na2SO4-CaCO3-CaCl2-Ca(HCO )2-CaSO4-
H2O-Na2CO3-NaCl-NaHCO3-MgCO -MgCl2-
Mg(HCO3)2-MgSO4 66 (T. )
Na„SO .-CaCO -CaCI -CaSO -H O-Na9CO -
NaCl 67 ( t. )
Na,SO -CaCI -CaSO -H O-KC1-K SO -NaCl
68 ( t.)
Na2SO4-CaCl2-CaSO4-H2O-NaCl 46 ( t.)
Na SO -CaCI -CaSO -NaCl 980
2 4 2 4
Na0SO„-CaSO„ 931
2 4 4
Na2SO4-CaSO4-H2O 19 ( t. )
Na2SO4-CaSO4-K2SO4 929
Na2SO4-CaSO4-:MgSO4 930
Na2SO4-H2O 1031, 1743, 1750, 1753-1755
Na2SO4“H2-O"K2B4°7“KC1"K2SO4-Ka2B4O7-
NaCl 70 ( T. )
Na.SO -H O-K CO -KC1-K SO -Na.CO -
*X 4» 4» О tL’ vJ
NaCl 73 ( T- )
Na2SO4-H2O-K2CO3-K2SO4-Na2CO3 56 (t. )
Na„SP,.-H„0-KCl-K,SO -MgCL-MgSO -NaCl
242 24 2 4
1050, 1051
Na„SO -HnC-KCl-KnSO -NaCl 1046
2 4 2 2 4
Na2SO4-H2O-K2SO4 1036
Na2SO4-H2O-K2SO4-MgSO4 1048
Na SO -HO-MgB О -MgCL-MgSO -Na^B.O -
— (
NaCl 74 ( t.)
Na2SO4-H2O-MgCO3-MgSO4-Na2CO3 59 ( t. )
Na2SO4-H2O-MgCl2-MgSO4-NaCl 1049
Na2SO -H2O-MgSO 1039
Na2SO4-H,,O-NaoB О ЗИ ( т. )
Na,SO -H,O-Ka,B О -МаИСО361 ( т. )
Na<,SO4-HnO-NaoB4O^-NaHCO,J-NaCl 76 (
Na=O -H-O-Na„CC 1041
2 4 2 t- 3
Na9S04-H90-NaoC03-NaHC03 63 ( T* )
Nao5O -H()O-NaCl 1043
Na2SO4-H2O-NaCl-NaR 64 ( T. )
Na2SO4-H2O->4aCl-NaHCO36 5 ( t. )
N^SO^O-NaHCO 37 ( t. )
NanSO -HnO-NaOH 1756, 1757
2 4 2 ’
Na(1SO -KC1-KP-K_SO -NaCl-NaP 982
2 4 2 4
NaoSO4-KCl-KQSO -NaCl 984
Na SO -ICSO, 934
2 4 2 4
Na S О , -IM gS О , 93 6
Na9SO4-№Cl 987
Na2SO4-NaCl-NaP 986
Na SO -NaCl-PbCl -PbSO„ 988
2 4 2 4
Na2SO4-Nar 990
Na2SO4-NaP-NaCl 986
Na2SO4-NaF-PbF2-PbSO4 989
Na0SO -Na MoO -PbMoO ,-PbSO4 1020
2 4 2 4 4 4
Na2SO -Na2VVO4 937
Na0SOrNa0WO -PbSO -PbWO, 987, 1013
2 4 2 4 4 4
Na0SO-PbSO, 937
2 4 4
Na WO, 1263
4
Na,WO -TJa„SO„ 937
^424
Na2WO4-PbSO4 937 1013
Na2WO4-PbVVO4 937
NdAsO, 1262 A
4
Ni 1062
Ni-As-Co-Fe-S 314
Ni-As-Cu-S 258
Ni-As-S 78-82
Ni-Bi-H-S 260
Ni-Bi-Pb-S 261
Ni-C 1078
Ni-Co-Fe-S 269-272.
Ni-Co-S 110
Ni-Cu-Fe-S 274-277
Ni-Cu-S .139-147
Ni-Fe 1072, 1073
Ni-Fe-H2-H2O 1363
Ni-Fe-O2 346, 347
Ni-Fe-S 166-195, 1103
Ni-O2-Zr 358
Ni-S 46-48, 1095
Ni-S-Sb 239
NiCO3-CaCO3-MgCO3 1297
NiCO3-MgCO3 1291
NiCrO 1317
x
NiCr2Ox 1317
NiO-AI2O3 376
NiO-AI2O3-H2O-K2O-SiO 1571
NiO-Al2O3-SiO2 534
489
NiO-CaO 408
NiO-Cr2O3-ZrO2 630
NiO-aeO2-MgO-SiO2 1243
MiO-H2O-SiO2 1451
NiO-MgO-SiO2 700
NiO-SiO2 1152
NiO-ZnO 466
NiSO^ 1308
O2 1333
O2-Ag 1365
O2-Al-Fe 322-327
O2-Al-Fe-Mg 361
°2"Al2°3"FG 328’ 329
°2"Al2O3"Fe“H2"K2O“MS°"SiO2 1383
O2"A12O3"Fe“H2"K2O“Na2°"SiO2 1379“1382
O2"A12O3“Fe"H2O"K2O"MS°“SiO2 1384
O2-Al2O3-Fe-H2O-K2O-SiO2 1376-1378
O2"Al2O3"FeO"H2O"K2°“MgO“SiO2 1624“ 1626
O9-A1 0a-Fe0-Ho0-Si0o 1536-1543
O2-C 1366, 1367
O2-C-FeO 1368
Oo-Ca-S-Si 265
O2-CaO-FeO-H2O-SiO2 1545-1548
O2-Co-Fe 330, 331
O-Co-Fe-S 268
O2-Cr-Fe 332, 333
O2-Cr-V 334
O2-Cu 316
O2-Cu-Fe 33 5-338
O-Cu-Fe-S 278
O2-Cu-Mn 339-340
O2-Fe 317-319
O2-Fe-H2O-K2O-SiO2 1375
O-Fe-MgO-SiO2 1373, 1374
O2-Fe-Mn 341-344
O-Fe-Mn-S-Si 315
O2-Fe-Mo 345
O2-Fe-Ni 346, 347
O-Fe-S 196-204
O-Fe-S-Si 297-303, 1105, 1106
O2-Fe-Si 348-3 50
O-Fe-SiO2 1371, 1372
O2-Fe-Ti 351-354
O2-FoO-H2O-MgO-SiO2 1549,1550
O2-FeO-H2O-Na2O-SiO2 1551
O2-FeO-SiO2 1144
°2"Fe3°4"UO2 355
O-H2O-Mn 1370
On-Mn 320, 321, 1369
CyMn-Si 356
O2-Vin-Zn 357
O-MnO-S 237
O2-Ni-Zr 358
O2-Pb 316
O-S-Sb 245
O2-Ta-Ti 359
O2-Ta-Zr 360
OH-Fe-S 1104
P2O5-Al2O3-CaO-Na2O-SiO2 918
P2O5-Al2O3-CaO-SiO2 809-810, 919
P2O5-CaCl2-CaF2-CaO 920
P Oe-CaF_-CaO 92.1
2 5 2
P.O.-CaO 409, 410, 922
2 5
P.O.-CaO-FeO-MnO 883
2 D
P2O5-CaO-MgO-SiO2 885, 886
P2O5-CaO-SiO2 600-602, 923
P O.-H,O-NaAlSi,0o 1670
2 э 2 о o
P „О.-MgO 451
2 5
P2O5-MgO-Na2O 699
P„0_-MgO-Si00 701
2 5 2
P2°5“MS°“2nO 702
P2°5"Na2°“SiO2 924
P.O -Na.O-ZnO 699
2 5 2
Pb 1052, 1062, 1063, 1064
Pb-Ag-Bi-S 251-254
Pb-Ag-S 67, 68
Pb-Ag-S-Sb 257
Pb-As-S 83
Pb-Bi-Ni-S 261
Pb-Bi-S 95, 96
Pb-Bi-S-Se 262, 263
Pb-Bi-S-Te 264
Pb-Cu-Fe-S 279-293
Pb-Cu-S 148-154
Pb-Fe-S 205-210
Pb-Fe-S-Zn 304-310
Pb-O2 316
Pb-S 49, 50, 1096
Pb-S-Sb 240
Pb-S-Se 241
Pb-S-Se-Te 312, 313
Pb-S-Te 242
Pb-S-TI 243
Pb-S-Zn 244
PbCL-NaCl-Na^SO.-PbSO, 988
2 2 4 4
PbF2-NaF-Na2SO4-PbSO4 989
PbO 1119
PbO-Al.O.-B O -Y,O, 727
PbO-Bi2O3 400, 403
Pb0-Bi203-Mo03 545, 546
PbO-Bi2O3-WO3 403, 547
PbO-CO2 1684, 1685
PbO-CaO-WO3 603
PbO-Cr2O2 1137
PbO-CrO3 1010
PbO-CrO3-MoO3 632, 1009
490
PbO-CrO3-WO3 633, 1011
PbO-Cr2O3 1100
PbO-Fe^-MgO 688
Pb0-Mo03 462, 1021
PbO-MoO3-Na2O 714
PbO-MoO3-Na2O-SO3 1020
Pb0-Mo03-W03 715, 1022, 1023
PbO-Na2O-SO3-WO3 1013
PbO-Na2O-SiO2 716-718
PbO-Na2O-WO3 719
PbO-SO3-WO3 1014
PbO-SnO2 467
PbO-WO o 403, 468, 1015
PbO2 1120
Pb3Q4 1121
PbSO -KCSO? 935
4 2 4
PbSO -bJanSO„ 937
4 2 4
PbSO4-Na2SO4-NaCl-PbCl2 988
PbSO4-NaF-Na2SO4-PbF2 989
Pd-H2 1362
Pt-Au 6
Pt-Fe 11
Pt-Ir 12
PuO2-BeO-ThO2 544
RbCO3 1281
RbCl 1272
RbNO3 1301
Rh-Au 7
S 1065-1068
S-Ag 17
S-Ag-As 57, 58
S-Ag-As-Cu 249
S-Ag-Bi 59-61
S-Ag-Bi-H 250
S-Ag-Bi-Pb 251-254
S-Ag-Bi-Se 255
S-Ae-Cd 6 2
S-Ag-Cu 63-65
S-Ag-Cu-Sb 256
S-Ag-Стe 66
S-Ag-Pb 67, 68
S-Ag-Bi-Pb 2 51-254
S-Ag-Pb-Sb 257
S-/Xg-Sb 69-72
S-Ag-Si 73
S-Ag-Sn 74
S-/\g-TI 75
S-/\s 18-20, 1080
S-.\--Co-Fc-Ni 314
r-.As-Cu-Ni 258
S—As—Fc 76, 77, 1098, 1099
S-As-Ni 78-82
S-As-Pb 83
S-As-TI 84
S-Au 21
S-BS-Sn 85
-S-Bi 22
S-Bi-Co-H 259
S-Bi-Cu 86-89
S-Bi-Fe 90-92
S-Bi-H-Ni 260
S-Bi-Mo 93, 94
S-Bi-Ni-Pb 261
S-Bi-Pb 95-96
S-Bi-Pb-Se 262, 263
S-Bi-Pb-TI 264
S-Bi-Sb 97
S-Bi-Se 98-101
S-Bi-Te 102
S-Ca-O-Si 265
S-Cd 1081
S-Cd-Fe-Zn 266
S-Cd-Mn 103, 104, 1100
S-Cd-Mn-Zn 267
S-Co 23
S-Co-Fe 105-108
S-Co-Fe-O 268
S-Co-Fe-Ni 269-272
S-Co-H 109
S-Co-H-Sb 273
S-Co-Ni 110
S-Co-Sb 111
S-Cr 24
S-Cr-Fe 112, 1102
S-Cu 25-29, 1082, 1083
S-Cu-Fe 113-134, 1101
S-Cu-Fe-Ni 274-277
S-Cu-Fe-O 278
S-Cu-Fe-Pb 279-293
S-Cu-Fe-Zn 294
S-Cu-Ge 136, 137
S-Cu-H-Sb 295
S-Cu-Mo 138
S-Cu-Ni 139-147
S-Cu-Pb 148-154
S-Cu-Sn 155
S-Cu-Zn 156-157
S-Fe 30-41, 1084-1093
S-Fe-Ge 158-160
S-Fe-H 161
S-Fe-Mn-O-Si 315
S-Fe-Mn-Zn 296
S-Fe-Mo 162-165
S-Fe-Ni 166-19 5, 1103
S-Fe-O 196-204
491
S-Fe-O-Si 297-303, 1105, 1106
S-Fe-OH 1104
S-Fe-Pb 205-210
S-Fe-Pb-Zn 304-310
S-Fe-Sb 211-215
S-Fe-Sn 216, 217
S-Fe-W 218-224
S-Fe-Zn 225-233
S-Ga 42
S-Ga-Zn 234
S-Hg 44, 45
S-Hg-Se 235
S-Hg-Se-Te 311
S-Hg-Te 236
S-In 43
S-Mn-Se 238
S-MnO-O 237
S-Ni 46-48, 1095
S-Ni-Sb 239
S-O-Sb 245
S-Pb 49, 50, 1096
S-Pb-Sb 240
S-Pb-Se 241
S-Pb-Se-Te 312, 313
S-Pb-Te 242
S-Pb-TI 243
S-Pb-Zn 244
S-Sb 51, 1107
S-Sb-Sn 246
S-Se-Sn 247
S-Sn 52-55
S-Sn-Te 248
S-Ti 56.
S-Zn 1097
SO2“N2 1357
SO3-CaO-Na2O-SiO2 927
SO3-H2O-NaAlSi3O8 1670
SO3-MoO3-Na2O-PbO 1020
SO3-Na2O-PbO-WO3 1013
SO3-Na2O-SiO2 938
SO3-PbO-WO3 1014
Sb 1052
Sb-Ag-Cu-S 256
Sb-Ag-Pb-S 257
Sb-Ag-S 69-72
Sb-Bi-S 97
Sb-€orH-S 273
Sb-Co-S 111
Sb-Cu 10
Sb-Cu-H-S 295
Sb-Fe-S 211-215
Sb-Ni-S 239.
Sb-Pb-S 240
Sb-O-S 245
Sb-S 51, 1107
Sb-S-Sn 246
Sb-Se 1107
Sb2OQ 1122
SboS3 1054
Sb2Te3 1112
Sc2°3“Pe2°3 443
So .1069
Sc-Ag-Bi-S 255
Se-Bi-Pb-S 262, 263
Se-Bi-S 98-101
Se-Hg-S 23 5
Se-Hg-S-Te 311
Se-Mn-S 258
Sc-Pb-S 241
Se-Pb-S-Te 312, 313
Se-S-Sn 247
Se-Sb 1107
Si-Ag-S 73
Si-C 14, 15
Si-Ca-O-S 265
Si-Fe-Mn-O-S 315
Si-Fe-O2 348-350
Si-Fe-O-S 297-303, 1105, 1106
Si-Mn-O2 356
SiC-B C 16
4 .
SiF -A1F -Al О -NaF-Na_O-SiO_ 967
4 3 2 3 2 2
SiO2 363, 1123-1128
SiO2-AlF3-Al2O3-N!aF-N'a2O-SiF4 967
SiO2-Al2O3 377-384, .1132-1134
SiO2-Al2O3-B2O3 1001
SiO2-Al2O3-B2O3-CaO 726
SiO -A1O -B O -H O-MgO-NaoO 1657
2 23232 2
SiO2-Al2O3-BaO-H2O 1456
SiO2-Al2O3-BaO-MgO 728
SiO2-Al2O3-BeO-H2O 1457, 1458
SiO2-Al2O3-CO2-CaO-H2O-K2O-MgO 1729
SiO2-Al2O3-CO2-H2O-K2O-MgO 1733
SiO2-Al2O3-CaF2 969
SiO2-Al2O3-CaO 483-489, 520, 1154-1158
SiO2-Al2O3-CaO-FeO 731-735
SiO2-Al2O3-CaO-FeO-H2O-MgO-Nia2Q 1627
SiO2-Al2O3-CaO-FeO-H2O-Na2O 1605-1608
SiO2-Al2O3-CaO-Pe3O4-MgO-Na2O 1250
SiO2-Al2O3-.CaO-H2O 1459-1468
SiO2-Al2O3-CaO>-H2O-K2O 1552
SiO2-Al2O3-CaO-H2O-K2O‘-Na2O 1609-1612
SiO2-Al2O3-CaO-H2O-MgO 1553-1560
SiO2-Al2O3-CaO-H2O-MgO-Na2O 1613-1616
SiO2-Al2O3-CaO-H2O-Na2O 1561, 156 2
SiO2-Al2O3-CaO-H2O 1459-1468
SiO2-Al2O3-CaO-MgO 736-792, 1222-1235
SiO2-Al2O3-CaO-MgO-Na2O 1245-1249
'.92
SiO2-Al2O3-Ce.O-Na2O 793-808, 1236, 1237
SiO2-Al2O3-CaO-Na2O-P2O5 918
SiO2-AI2O3-CaO-P2O5 809, 810, 919
SiO2-AI2O3-CaO-TiO2 811-818
SiO2-Al2O3-CaO-ZnO 819-824
SiO2-Al2O3-CoO 490, 491
SiO2-Al2O3-Cr£O3 498-501
SiO2-Al2O3-Cr2O3-MgO 825
SiO2-Al2O3-Fe-H2-K2O-MgO-O2 1383
SiO2-Al2O3-Fe-H2-K2O-Na2O-O 1379-1382
SiO2-Al2O3-Re-H2O-K2O-MgO-O2 1384
SiO.2-Al2O3-Fe-H2Q-K2O-O2 1376-1378
SiO2-Al2O3-FeO 509-511, 1161
SiO2-AI2O3-FeO-Fe2O3 827-831
SiO2-Al2O3-FeO-Fe2O3-H2O 1563, 1564
SiO2-Al2O3-FeO-H2O-O2 1536-1543
SiO2-Al2O3-FeO-H2O-K2O 156 5
SiO2-Al2O3-FcO-H2O-K2O-MgO 1617, 1623
SiO2-Al2O3-FeO-H2O-K2O-MgO-O2 1624-1626
SiO2-Al2O3-FeO-H2O-MgO 1566
SiO2-AI2O3-FeO-K2O 834
SiO2-Al2O3-FeO-MgO 835
SiO2-Al2O3-FeO-Na2O 836-837
SiO2-Al2O3-Fe2O3-H2O-K2O-MgO 1618-1620
SiO2-Al2O3-Fe2O3-H2O-K2O-Na2O 1621, 1622
SiO2-Al2 O3-Fe2O3-H2O-Na2O 1567-1569
SiO2-Al2O3-Fe2O3-Na2O 838-840
SiO2-Al2O3-HCl-H2O-K2O 1659
SiO2-Al2O3-HCl-H2O-K2O-MgO 1658
SiO2-Al2O3-HCl-H2O-Na2O 1659
SiO2-Al2C3-H2O 1415-1423
SiO9-/Xl2O3-H2O-KCl-K2O-NaCl-Na2O 1675-
1677
SiO2-Al2O3-H2O-K2O 1469-1484
SiO2-Al2O3-H2O-K2O-MgO 1570-1583
SiO2-Al9O3-H’2O-K2O-Na2O 1584-1594
SiO2-Al2O3-H2O-K2O-NiO 1571
SiO2-Al2O3-M2O-Li2O-Na2O 1595
SiO2-Al2O3-H2O-MgO 1485-1503, 1694
SiO2-Al2O3-H2O-MgO-Na2O 1596-1600
SiO2-Al2O3-H2O-MnO 1544
SiO2-Al2O3-H2O-NaCl-Na2O 1672
SiO2-Al2O3-H2O-Na2O 1504, 1505,1509-1526
SiO2-Al2C 3-K2O 512-517, 1162-1164
SiO2-AI2 33-K2O-MgO 841-852
SiO2-Al^O3-K2O-Na2O 853-856, 1238, 1239,
1240
Si0o-AI203-LiF-Na20 970
SiO2-Al2O3-Li2O 518, 519, 1165, 1166
SiO2-Al2O3-LiO2-MgO 857-863
SiO2-Al2O3-MgO 520-526, 1167-1175
SiO2-Al2O3-MgO-Na2O 864, 1241, 1242
SiO2-Al2O3-MgO-ZrO2 865
SiO2-Al2O3-MnO 527-529
SiO2-Al2O3-MnO-Y2O3 866
SiO2-Al2O3-NaCl-Na2P 971
SiO2-Al2O3-Na2O 530-533, 1176-1184
SiO2-Al2O3-NiO 534
SiO2-Al2O3-ZnO 53 5
SiO2-Al2O3-ZrO2 536, 537
SiO2"B2°3 393
SiO2-B2O3-CaO 538
Si°2-B2O3-Mg° 539
SiO2-BaO 394
SiO2-EJaO-H2O 1424
SiOQ-BaO-MgO 541, 542
SiO2-BcO 395, 396
SiO2-Bi2O3 401
SiO2-CO2-CaO 1686-1690
SiO2-COo-CaO-FeO-H2O-MgO 1726-1728
SiO2-CO2-CaO-H2O 1711-1718
SiO2-CO9-CaO-H2O-MgO 1722-1725
SiO2-CO2-CaO-MgO 1693-1697 .
SiO2-CO2-H2O-K2O 1719, 1720
SiO2-CO2-H2O-MgO 1721
SiO2-CO2-MgO 1691
SiO2-CaF2-CaO 973
SiO2-CaF2-NaF 974
SiO2-CaF2-Na2Oj 975
SiO2-CaO 411, 412, 415, 1135
SiO2~CaO-Cr2O3 551-553
SiO2-CaO-Cr2O3-MgO 869-870
SiO2~CaO-FeO 557, 559-570, 1185-1187
SiO2-CaO-FeO-Fe2O3 873-876
SiO2-CaO-FeO-HQO-O2 1545-1548
SiO2-CaO-FeO-MgO 877-882, 1244
SiO2-CaO-Fe2O3 558
SiO2-CaO-Fe2O3-MgO 884
SiO2-CaO-GeO2 573-574
SiO2-CaO-H2O 1425-1431
SiO2-CaO-H2O-MgO 1527-1533
SiO2-CaO-MgO 576-592, 1188-1201
SiO2-CaO-MgO-P2O5 885, 886
SiO2-CaO-MgO-TiO2 887-891
SiO2-CaO-MgO-ZrO2 892
SiO2-CaO-MnO 593-597
SiO2-CaO-MnO-TiO2 893
SiO2-CaO-Na2O-SQ3 927
SiO2-CaO-P2O5 600-6P2, 923
SiO2-CaO-TiO2 604-607
SiO2-CaO-ZnO 608
SiO2-CaO-ZrO2 609-614
SiO2-CoO 1136
SiO.,-CoO-Fe^O, 619
2 о 4
Si02-Co0-H20 1432
SiO^-CoO-MgO 1202, 1203
SiOn-Cr2O3 425, 426
SiO <r9o -Fe_O. 626
— 2 3 3 4
SiO2-Cr2O3-MgO 627, 628
Si02-CuO 429
SiO2-CuO-Cu2O 635, 636
SiO2-Fe-H2O~K2O-O2 1375
SiO2-Fe-MgO-O 1373, 1374
SiO2-Fe-O 1371, 1372
SiO2-Fe0. 435, 436, 1139-1143
SiO2-FeO-Fe2O3 654, 655
SiO2-FeO-Fe2O3~MgO 895-901
SiO2-FeO-Fe2O3-TiO2 90.2
SiO2-FeO-Fe2O3-ZrO2 903
SiO2-FeO-H2-H2O-Na2O 1535
SiO2-FeO-H2O-MgO-O2 1549, 1550
SiO2-FeO-H2O-Na2O-O2 1551
SiO2-FeO-K2O 666
SiO2-FeO-MgO 668-671, 1204-1209
SiO2-FeO-MnO 672-682
SiOn-FeO-Na2O 1211
SiO2-FeO-O2 1144
SiO2-FeO-TiO2 1213
SiO2-FeO-ZnO 685, 686
SiO2-Fe2O3-H2O-MgO-Na2O 1601-1604
SiO2-Fe2O3-K2O 687
SiO2-Fe2O3-Na2O 689, 1210, 1212
SiO2-Fe2O3-TiO2-ZrO2 904
SiO„-P^O -Mn О 690
2 3 4 3 4
SiO2-Fe3O4-TiO2 691
SiO2-F®3O4-ZrO2 692, 693
SiO2-Ga2O3-H2O-K2O-MgO 1571
SiO2-CieO2-MgO 694, 1214-1216
SiO2-C?eO2-MgO-NiO 1243
SiO2-HCl-KCl 1656.
SiO2-H2O 1395-1406
SiO2-H2O-K2O 1433
SiO2-H2O-K2O-MgO 1534
SiO2-H2O-MgO 1434-1444
SiO2-H2O-Na2O 1445-1450
SiO2"H2°“NiO 1451
SiO2-H2O-ZnO 1453-1455
SiO2-K2O 448
SiO2-MgF2-MgO 976
SiO2-MgF2-NaF 977
SiOQ-MgO 452-455, 1146-1151
SiO2-MgO-MnO 696, 697, 698
SiO2-MgO-NiO 700
SiO2-MgO-P2O5 701
SiO2-MgO-TiO2 703, 1217-1221
SiO2-MgO-ZnO 704, 705
SiOQ-MgO-ZrO2 706-708
SiO2-MnO 459
3iO2-MnO-Mn2O3 709-711
. iOo-MnO-TiO2 713
FiOo-Mn О 461
' 494
SiO2-NaAlSiO4-H2O 1506-1508
SiO2-Na2O-NaCl 978
SiO2-Na2O-NaF 979
SiO2-Na2O-P2O5 924
SiO2-Na2O-PbO 716-718
SiO2-Na2O-SO3 938
SiO2-NiO 1152
SiO2-SnO 469.
SiO2-ThO2 470, 471, 1153
SiO2-ThO2-UO2 720, 721
SiO2-ThO2-ZrO2 722
SiO2-TiO2-ZrO2 723-725
SiO2-ZnO 472
SiO2-ZrO2 473-475
Sn 1052, 1070, 1070 A
Sn-Ag-S 74
Sn—Ba—S 85
Sn-Cu-S 155
Sn-Fe-S 216, 217
Sn—S 52-55
Sn-S-Sb 246
Sn-S-Se 247
Sn-S-Te 248
SnO2-Al2O3 385
SnO2-CaO-TiO^ 615
SnO2-H2O 1407
SnO2-PbO 467
SnO-SiO2 469
SrCO3 1282
SrCO3-CaCO3 1290
SrCO3-CaCO3-MgCO3 1298
SrF2-Al2O3-SiO2
SrO-CaO-WO3 616
SrSO4-KgSO4-H2O 29 ( t. )
Ta-O2-Ti 359
Ta-Oj-Zr 360
Те 1071
Te-Bi 8
Te-Bi-S 102
Te-Hg-S 236
Te-Hg-S-Se 311
Te-Pb-S 242
Te-Pb-S-Se 312, 313
Te-Sn-S 248
ThO2-BeO-PuO2 544
Th02-Mo03 463, 464
ThO2-SiO2 470, 471, 1153
ThO2-SiO2-UO2 721, 720
ThO2-SiO2-ZrO2 722
ThO2-UO2 478
Ti-Pe-O2 351-354
Ti-O2-Ta 359
Ti-S 56
TiO2-Al2O3 386, 387
TiO2-Al2O3-BeO 478
TiO2-Al2O3-CaO-SiO2 811-818
TiO2-Al2O3-Cr2O3-MgO 825
TiO2-BeO 397, 398
TiO2-BeO-MgO 543
TiO2-CaO 413, 415, 1016
TiO2-CaO-MgO-SiO2 887-891
TiO2-CaO-MnO-SiO2 893
TiO2-CaO-SiO2 604-607
TiO2-CaO-SnO2 615
TiO -CeO„ 416
2 2
TiO2-Cr2O3 427
TiO2-Cr2O3-MgO-ZrO2 894
TiO2-CuO-Cu2O 637, 6?8
TiO2-F'eO 437-439, 440, .101$
TiO2"^'eO-Fe2O3 656-660, 1017
TiO2-FeO-Fe2O3-SK>2 902
Ti62-FeO-MnO 683, 684
TiO2-FeO-SiO2 1213
TiO2-Fe2O3 444
TiO2-Fe2O3-SiO2-ZrO2 904
TIO2-Fe3C>4-SiO2 691
Ti O2-H2O 1408
TiO2-H2O-Ma2O 1452
TiO2-K2O-V2O5 695
TiO2-MgO 456
TiO2-MgO-SiO2 703, 1217-1221
TiO2-MnO-SiO2 713
TiO2-SiO2-ZrO2 723-725
TI 1052
TI-Ag-S 75
TI-As-S 84
TI-Bi-Pb-S 264
Tl-Pb-S 243
TI2CO3 1283
UO2-CaO-ZrO2 617, 618
UO2"Pe3O4"O2 355
UO2-MgO 457
UO2-SiO2-ThO2 720, 721
UO2-ThO2 476
V-Cr-O2 334
V2°5-Bi2°3 402
V2O5-CaO 1019
V2°5"K2Q"Ti°2 695
VCO -NanO 465
2 5 2
W-Fe-S 218-224
WO3-BaO-CaO 540
WO3-Bi2O3 403, 1012
WO3-Bi2O3-PbO 403, WO3-CaO 414 547
WO3-CaO-FeO 571 WO3-CaO-MnO 598 WO3-CaO-Na2O 599 WO3-CaO-PbO 603, 1 L011
WO3-CaO-SrO 616 WO3-CrO3-PbO 633, 1011
WO3-MoO3-PbO 715, WO3-Na2O-PbO 719 1022, 1023
WO3-Na2O-PbO-S O3 1013
WO3-PbO 403, 468, 1015
W03-Pb0-S03 1014
YF3-CaF2 950
Y,O,-A1 О -B,O,-PbO 727
О о о
YoO -Al_O^-FeO-FeoO^ 832, 833
Y2O3-Al2O3-MnO-SiO2 866
Y2O3-FeO-Fe2O3 661-665
Zn 1052
Zn-Cd-Fe-S 266
Zn-Cd-Mn-S 267
Zn-Cu-Fe-S 294
Zn-Cu-S 156, 157
Zn-Fe-Mn-S 296
Zn-Fe-Pb-S 304-310
Zn-Fe-S 225-233
Zn-Ga-S 234
Zn-Mn-O 357
Zn-MnO-Mn2O3 712
Zn-S 1097
ZnO 1129
ZnO-Al2O3 388
ZnO-Al2O3-CaO-SiO2 819-824
ZnO-Al2O3-SiO2 535
ZnO-CaO-SiO2 608
ZnO-CoO 418
ZnO-Cr2O3-MgO 629
ZnO-FeO-SiO2 685, 686
ZnO-Fe2O3 445
ZnO-H2O-SiO2 1453-1455
ZnO-MgO 458
ZnO-MgO-P2O5 702
ZnO-MgO-SiO2 704, 705
ZnO-MnO 460
ZnO-MnO-lVjn2O3 712
Zn0-Mo03 462
ZnO-NaO-PO 699
z э
ZnO-NiO 466
Zrt-Pb-S 244
ZnO-SiO2 472
ZnS-Cu-Fe 135
495
ZnS-H2O-H,S ИЦ
ZnSO4 1309, 1310
Zr-Ni-Oc 3 58
Zr-O2-Ta 360
ZrO2 1133
ZrCo-AlcC3 389-390
ггО2-А1оО3-ВеО 479
Zv0o-Aln0_-Cr203~Mg0 825
ZrO9-Al^O3-MgO-SiO2 865
ZrO2-Al2O3-SiO2 536-537
Zi'Og—OixO 415
ZrC-. -CaO-MgO-SiQ, 892
ZrC 2-CaO-SiO2 609-614
ZrO2 JOaO-UO, 617-618
ZvO2-CeO2 417
ZrO2-Cr2O3-MgO 629
ZrO2-Cr2O3-MgO-TiQ2 894
ZrO2-Cr2O3-NiO 630
ZrO2-FeO-Fe2O3-SiO2 903
ZrO2-Fe2O3-SiO2-TiO2 904
ZrO2-Fe3O4-SiO2 .692,. 693
ZrO2-MgO-SiO2 706-708
ZrO2-SiO2 473-475
ZrO2-SiO2-ThO2 722
ZrO2-SiO2-TiO, 723-725
A<570-OpT30-CO2-H2° 1734
Альбит - H2O 1649
Андезит - H2O 1649
Базальт 1254 Б
Базальт щелочной —Н^О 1254А.
Базальт - HgO 1649
Базальт-эклегит 1251
Базальт—перидотит
Габбро - ЫоО 1674
Гранат-омфацит 1261
1255
Гранит - СО2-Н2О .1732
Гранит - Н2О 1630, 1647, 1651-1653
Гранит - Н2О-НС1 1671
Гранит - H2O-HF1669, 1671
Гранит - НоО-Ы2О 1671
Гранит - H2O-NH^ 1671
Гранит - Н2°"Р2°5 1671
Гранит - ri2O-SO^ 1671
Гранодиорит - Н2О 1648
Гранулит - 1"12О 1632, 1633
Диоисид-жадеит-молекула Чермака-оливин
Лерцолит - Н9О 1631
Нефелиновый сиенит - Н2О 1655
Перидотит 1257
- sio2
Перидотит-базальт 1255
Пикрит 1252
Пиролит 1258, 1259
Разные вещества - Н2О 1650, 1654, 1655
Толеит 1253, 1260
Тоналит - Н2О 1673
Эклогит-базальт 1251
1256
УКАЗАТЕЛЬ МИНЕРАЛОВ И ПОРОД*
.Аваруит 176-179, 275
Авогадрит 1003
Адуляр 517
Азот 1332, 1355-1359
Акантит 17, 57-60, 61 а, б, в, г; 63, 66,67, 68а, б; 70-72,
249, 250, 253 , 254 а, б, в; 256
Акмит 689, 838-840, 1210-1212.1551, 1567-1569, 1603,
1627
Актинолит 1726-1728
Алабандин 103, 104, 267, 1100
Аламозит 717, 718,
Альбит 530, 531, 532 , 533, 802-804, 808, 836, 837,
839, 840, 855, 864, 970, 971, 1176-1179, 1180. 1181.
1182, 1183, 1184, 1211, 1237, 1239, 1240А, 1240Б,
1241».1242, 1248, 1249, 1250, 1379-1382, 1464-1479,
1504. 1505. 1506-1508, 1509. 1510—1514, 1516-1521,
1525, 1526, 1561, 1562,’ 1568, 1569, 1584, 1586-1590,
1591-1598, 1600, 1609-1612, 1614-1615, 1627, 1647,
1649, 1651, 1652, 1659, 1661-1668, 1670. 1672, 1677,
1692, 1734
Алит 558, 602, 612, 739, 764-768, 891
Алмаз 1057. 1058. 1075-1078
Альмандин 509, 1161. 1536-1538, 1540-1542. 1566
Алтаит 242, 312, 315
Алюминиевый геденбергит 1605-1608
Алюминиевый диопсид 1233, 1234, 1613
Алюминиевый клинопироксен 1259
Алюминиевый монтмориллонит 1497, 1499
Алюминиевый ортопироксен 1259
Алюминиевый селадонит 1600
Алюминиевый серпентин 1486, 1493, 1494, 1499
Алюминиевый энстатит 1167-1171', 1233
Амезит 1488, 1496, 1497, 1498, 1499
Аммиак 1352, 1357-1359
Амфибол 1535, 1549, 1559, 1560, 1631
Амфиболит 1092
Анальцим 1506, 1508. 1511-1514.1515. 1518-1520, 1525,
1526,
Анатаз; анатаз, тв.р-р 351-354, 359, 427, 444 , 637,
638, 695, 825, 894, 902 , 904, 1408, 1452
Ангидрит 11 (т.), 66 (т.), 928, 980, 1024, 1044, 1650,
1742, 1743, 1744
Англезит 929, 930, 931, 935 , 937, 988,989, 1013, 1014,
1020, 1022
Андалузит 1132. 1133. 1416. 1417, 1419, 1422, 1423,
1494, 1495, 1497, 1499, 1502, 1564, 1578, 1579
Андезит 1649
Андрадит 1460, 1548
Аннит 1376-1378, 1381, 1382, 1384, 1617, 1625
Анортит 483, 485, 486, 488, 730-734, 748-763,
765-779, 781-784, 786, 789, 792-798, 800, 808-819,
820-822, 855, 919, 1154-1156, 1157. 1158. 1198, 1227,
1230-1232, 1235, 1237, 1249, 1459, 1460-1464, 1466-
1468, 1552, 1554, 1555, 1557, 1558.1559, 1560-1562,
1600, 1609-1612, 1613, 1632, 1633, 1659
Примечание. Подчеркнуты номера основных фазо- ч
вых диаграмм соответствующего ми-
нерала (для раздела ГБГ)
Анортоклаз 855
Аносовит 359
Аносовит, магнезиальный 891
Аносовит, железистый 658
Антимонит 70, 71, 97, 111, 211-215, 239, 256, 273,
1054, 1107
Антлерит 1745
Антофиллит 1436. 1437. 1439. 1487, 1495. 1530. 1534,
1727, 1728
Апатит 920, 1629, 1638-1646
Арагонит 1277, 1290, 1298, 1464, 1698. 1698А, 1699
Аргентит 17, 57-60, 61 а, б, в, г; 63, 66, 67, 68а, б; 70-
72, 250, 253, 254 а, б, Ъ; 256
Аргиродит 66
Аргон 1318. 1318А. 1334-1338
Арканит 24 , 28 , 44, 52 , 56, 72 (т.), фиг. 925 , 929,
932-935, 981-984, 1027, 1033, 1035, 1036, 1044-
1046, 1048, 1750, 1768, 1769
Арсенолит 1116
Арсенопирит 76, 77, 1098, 1099
Арфведсонит 1551
Астраханит 1039, 1048-1050
Аурикуприд 4, 5
Аурипигмент 18, 19, 20, 57 , 84, 1108-1110
Афвиллит 1427, 1431
Бадделеит; бадделеит, тв. р-р 358, 360, 389, 390,415,
417, 473-475, 479, 536, 537, 609-611, 613, 614,617,
618, 629, 630, 692 , 693 , 706-708, 723 , 724 , 725,
825, 865, 892 , 894 , 903, 904, ИЗО
Базальт 1251, 1254А,ь, 1255, 1649, 1655
Базальт толеитовый 1092, 1654
Барисилит 716
Баритокальцит 1284
Бассанит 1024, 1744
Баумгауерит 83
Бейделлит 1467
Бёмит 1386. 1387, 1412-1414. 1422, 1423. 1499, 170».
Берилл 1457, 1458
Беркеит 1041, 1122
Берлинит 1128
Бертрандит 1457, 1458
Бесхлорный шайрерит 986 , 989, 990
Биксбиит (син. партриджит) 342, 343, 442, 1370Б
Биотит 1379-1384, 1617, 1623. 1624. 1626
Бисмит 399-403, 545, 1012
Бишофит 17, 45, 47,49,69 (т.), 1037, 1045, 16ч/, 1049
1050
Бонаттит 1746, 1748
Боразон 1079
Борнит ИЗ, 115, 116-122, 135, 274, 275, 276а, б; 281 -
286, 294
Бравоит 110, 176-179, 182, 183, 188, 189, 272
Браунмиллерит; браунмиллерит, тв. р-р 430-432,4ВО-
482, 729,
Браунит 356, 1369А
Бредигит; бредигат, тв. р-р 411, 412, 484, 486, 490,
538, 553 , 557, 558, 560-567, 576, 578 , 579, 585,
593,594,596,597, 600, 602, 604 , 607, 608, 609,611-
497
614, 619, 739-743, 745-747, 764-769, 787-789, 791,
820, 822 , 870, 873-877, 881, 884, 891, 892
Бреди гит-мер винит (тв.р-р) 576
Бредигит-тефроит (тв.р-р) 594
Бромаргирит 1264
Бромеллит 365,395-397,398,417,477-479,543,544,1457
Бромирит 952, 953
Брошантит 1745
Брукрт, брукит (тв. р-р) 351-354, 359, 427, 444, 637,
638, 695, 825, 894, 902, 904,1452
Брусит 1393. 1394. 1413, 1414^ 1434-1436. 1493, 1494,
1495, 1497, 1499, 1530, 1534, 1550, 1634. 1635,
1702-1705, 1706, 1708, 1709
Буланжерит 240
Бунзенит, бунзенит тв. р-р 346, 347, 376, 408, 466,
534, 630, 700, 1317, 1366, 1377-1379, 1382, 1451
Бура 32,33,34,50,60 (т.) 61,70,74,76, (т.); фиг. 1028
Бустамит, тв. р-р 595
Вайкарит 1467
Валентинит 245, 1122
Ванадиевая охра 334, 402 , 465
Вантгоффит 930, 936, 1039
Ваэсит 78-82, 47, 48, ПО, 140-145, 146а,б; 174, 175,
180, 186, 187, 194, 195, 274, 275, 276а, б
Везувиан 1553
Вилламанинит 140-144, 275
Виллемит; виллемит (тв.р-р) 472, 535, 608, 685, 686,
704, 819, 820, 822, 824, 1453-1455’
Виллемит-форстерит (тв. р-р) 705
Виллиамит 273
Виллиомит 8, 36 (т.); 945, 947, 948, 951, 954, 957,
958, 960, 961, 963, 964, 979, 982 , 986, 989,
990, 996, 998, 999, 1002, 1005. 1266, 1661-1668
Виоларит 180, 275
Висмут 2, 3, 8; 61а, б, в, г; 99, 100, 250, 253, 254а,
б, в; 1055, 1056
Висмутин 60, 61а, б, в, г; 97-102 , 250, 253, 254 а, б, в
Витерит 912, 991, 1276. 1678, 1679, 1770
Витлокит 409, 410, 600, 601, 602 , 809, 810, 883, 885,
886, 919-923
Вода* 1326-1331, 1334-1352, 1357
Водород 1324, 1325
Волластонит; волластонит тв. р-р 483, 485-487, 538,
552, 557, 559-568, 570, 574, 582-584, 592, 595,596,
597, 600-602, 605, 607-610, 612-614, 726, 730,733,
748, 760, 763, 764, 772 , 773, 793, 797, 799-804,
813 , 817 , 819 , 873-877 , 880-882, 1135, 1156
1185, 1197, 1199, 1200, 1226, 1232, 1235, 1236,1244,
1247, 1426-1428. 1431, 1459, 1468, 1497-1509, 1511-
1516, 1518-1522, 1525-1536, 1538, 1539, 1549, 1550,
1551, 1553, 1686, 1687, 1688. 1689.1690. 1694,1696,
1711. 1712, 1715, 1717, 1718, 1724
Вольфрамит 571
Вульфенит 462 , 545, 546, 632 , 715, 1009, 1020-1022
Вюртцит 225, 227, 231, 1111
Вюстит; вюстит, (тв. р-р) 196-204, 268, 300-303,317,
319, 323-327, 329-333, 335, 345, 349, 351, 352-354,
361, 368, 419, 430, 434-440, 504-510, 557, 621,623,
652 , 653, 655-657, 660, 665-667, 672, 673, 731-735,
829, 831, 837, 883, 901, 903, 1105, 1106, 1139,1160,
1213, 1363, 1364, 1366, 1367, 1377, 1378, 1381,
1382, 1383, 1604
Габбро 1674
Гавайит 1655
Галаксит 374, 379. 528, 529
^Примечание. На подавляющем большинстве диаг-
рамм вода представлена водяным па-
ром; содержанием в паре прочих ве-
ществ обычно можно пренебречь.
Галенит 49, 50, 95, 96 а, б, в; 68 а, б; 148-154, 205-210,
240-244, 251, 254 а, б, в; 257, 262-264, 280-287, 289-
293, 304-310, 1096
Галеновисмутит 95, 96а, б, в; 254а, б, в, 262, 263
Галиевый флогопит 1571
Галит 939, 941, 943, 944, 954,956-959,961-964,971,978,
980, 984, 986-988, 991, 992 , 994,997,998,1004,1030,
1032, 1034, 1038, 1040, 1042, 1043, 1046, 1047, 1049,
1050, 1051, 1266, 1272, 1275, 1760, 1761, 1762. 1763,
1764-1767; табл. 33, 35, 41, 46, 48-51,54,57-60,62,
64, 65, 67-70, 73, 74, 75, 76
Галлуазит 1422, 1423
Ганит 388, 535, 819, 820, 821, 822 , 824
Ганксит 73 (т.)
Гардистонит фиг. 608, 823, 824
Гаусманит; гаусманит (тв.р-р) 320, 321, 341, 342,
343, 356, 375, 407, 416, 417, 424, 446, 447,450,461,
690, 709-712, 1369 А
Гаусманит-магнетит (тв.р-р) 446, 447
Геденбергит; геденбергит (тв.р-р) 559, 567, 570, 1186,
1187, 1545-1548, 1605-1608, 1726
Геденбергит, алюминиевый 1605-1608
Гейкилит 456, 543, 703, 887, 891, 894, 1219
Гейландит 1465, 1467
Гейлюссит14, 41, 67 (т.)
Гексагидрит, сакиит 1045, 1049, 1050, 1051
Геленит; геленит, тв. р-р 483, 484, 486, 487, 726,
730, 734, 735-738, 740-742 , 744, 746, 747, 779,780,
•785, 788, 790, 792-798, 805, 806, 807, 823, 826,
1154-1156, 1468
Геленит-окерманит (тв.р-р) 742 , 790, 1553
Геленит, натриевый 806
Гелий 1353-1356
Гематит; гематит (тв. р-р) 202-204, 317, 318, 322,
323-325, 329, 330, 332, 333, 335-338, 341-343, 345-
351, 353-355, 370, 372, 399, 404, 405, 415, 421,
430, 441, 442, 444 , 445, 482, 492, 493 , 494 , 502-507,
621-623 , 639 , 640, 641, 644-646 , 650-653 , 655,
658, 660-666, 687 , 689 , 691, 693 , 828-830, 838, 840,
873-875, 876, 883 , 900, 903 , 904, 1105, 1106, 1138,
1160. 1210, 1212, 1364, 1366-1368, 1371, 1375-1377,
1383, 1384, 1392, 1460, 1538, 1548, 1551, 1564, 1567,
1601, 1603, 1617, 1623, 1624-1626
Гематит-корунд (тв.р-р) 502,503
Гематит-эсколаит (тв.р-р) 333, 421
Гемиморфит 1453-1455
Герсдорфит 78-82, 313
Герценбергит 53, 54, 155, 216, 217, 246-248, 881
Герцинит; герцинит, (тв. р-р) 323-329, 368, 369,493,
502-505, 507-509 , 511, 731-734 , 829 , 837, 1159,
1160, 1161, 1536, 1540-1543, 1564, 1605
Гетеролит 712
Гётит 1392
Гиббсит 1385-1387, 1413, 1414, 1420, 1422, 1423. 1499,
1650
Гидральсит 1422, 1423, 1499
Гидрат Аг 1338
Гидрат СН. 1338
4
Гидрат С02 1341, 1349, 1350, 1351
Гидрат N2 1338
Гйдрогалит-бигидрат 35, 36, 46, 49 (т.); 1030, 1032,
1034, 1038, 1040, 1042
Гидрогранат 806, 1553
Гидрогроссуляр 1459
Гидромагнезит 1706, табл. 31
ГИдрооксид 916
ГИдроталькит 1706
Гиллебрандит 1427, 1431
Гиперстен 1604, 1632, 1633
Гипс 1024, 1044, 1650, 1744 табл. 15; 18, 19, 38, 43,
44, 45, 66
ГИролит 1426, 1431
Глазерит 934-1036, 1046, 1048, 1050, 1100, 1119, 1122
498
Глауберит 1753
Глаукодот 313
Глаукофан 1596, 1597, 1598
Глёт 316, 400, 403, 467, 468, 545, 688,714.719, 1010,
1015, 1021, 1119
Глинистый сланец 1654
Глинозем^—р, щелочной или натриевый 793-796, 800
Глиноземистый базальт 1655
Гранат 727 , 832, 833, 1171, 1174, 1198, 1223, 1224,
1226, 1227-1235, 1250, 1252, 1253-1258, 1259-1261,
1556, 1558, 1566, 1576, 1606-1608, 1631
Гранат, иттриево-железистый 661-665
Гранит 1092, 1626, 1630, 1647, 1651-1653, 1654, 1655,
1669, 1671, 1732
Гранодиорит 1648
Гранулит 1632, 1633
Графит 13-15, 1057.1058.1075, 1076, 1077, 1078, 1367,
1368, 1379, 1381, 1382,
Гринокит 103, 104, 267, 1081. 1100, 1114
Гроссуляр 483, 489, 760, 762 , 773, 785, 792, 1154,1155,
1156. 1157, 1158, 1225, 1226, 1459, 1460, 1462,1468,
1560, 1600
Грюнерит 672, 673
Гуанахуатит 99, 100, 101, 262 , 263
Гунгаррит 95, 96 а, 966, 96 в, 254а, 2546,254в, 262,263
Гюбнерит; гюбнерит (тв. р-р) 598
Гюггенит 428
Данбурит 538
Двуокись церия 416
Двуокись углерода 1278А, Б, 1279, 1286, 1289, 1319-1323.
1339-1351, 1353, 1354, 1357, 1360, 1361, 1364, 1366,
1367
Двухкальциевый силикат 486, 491, 1527, 1528, 1712—
1714, 1716, 1717
Двухкальциевый феррит 405, 558
Делафоссит 335
Джайпурит 23, 259, 268, 273
Джарлеит 65 а, б, в, г; 25, 26, 27, 115, 126, 140, 148,
149
Диаспор 1385-1387. 1412-1414. 1420-1423. 1457, 1463,
1494, 1496, 1497, 1499, 1650, 1706
Дигенит 25, 26, 27, 65 а, б, в, г; 114-118, 126, 129, 130,
136, 138, 140-145, 146а, б; 148, 149-153, 155, 157а,
157 6, 274, 275, 289, 1082, 1083
Дикит 1422
Диопсид; диопсид (тв. р-р) 580, 582 , 584, 586, 587, 588,
589, 592, 748, 749, 750-756, 757-761, 762, 763 , 770-
773 , 783 , 784 , 789 , 792, 881, 888, 891, 1188, ,
1190, 1191. 1192-1195, 1195-1200, 1211, 1223-1225,
1228-1229, 1232-1234, 1245-1250, 1256, 1528-1533,
1554, 1555, 1557. 1558. 1560, 1613, 1614, 1615,
1627, 1632, 1633, 1694, 1696, 1722. 1723, 1724,
1726-1728
Диопсид алюминиевый 1233, 1234, 1613
Дискразит 69, 72
Дистен 1632, 1633
Дититанит железа 438
Добреелит 112 а, 112 6, 1102 ; 43, 66 (т.)
Доломит; доломит (тв. р-р) 914, 1286, 1287-1289, 1292-
1298, 1694, 1707. 1708-1710.1724. 1725, 1729, 13 (т.)
Дравит 1657
Дюфренуазит 83
Жадеит 840, 1176, 1177, 1178. 1179, 1180, 1181, 1211,
1242, 1245, 1248, 1256, 1464, 1482, 1506-1508, 1510.
1514, 1517, 1600, 1647
Жедрит 1491, 1632, 1633
Железистый волластонит 1186
Железистый кордиерит 829, 831 г 835, 1161, 1540, 1541,
1564
Железистый монтичеллит 559 , 561-567 , 733 , 735
Железистый окерманит 733, 735
Железистый полевой шпат 1375
Железистый ставролит 1536, 1537
Железистый хлорит 1540-1543, 1563
Железистый хлоритоид 1537
Железо-никелевые сплавы 1365
Железо 9,11, 13,31-33, 76, 77,90-92,112а, 1126,113,114,
116-122, 123а, 1236, 129-134, 146а, 1466, 146в, 158,
162-165, 167, 168, 176-179, 185-194, 196-204, 217-224,
226-230 , 233 , 274 , 275 , 276а, 2766 , 278, 289 , 293,
294, 317, 319, 323-326, 329, 332, 348, 349, 351,352,
361, 430, 508 , 623 , 640 , 642, 644 , 650 , 651, 655,
657 , 660, 1059, 1060. 1061. 1072-1074, 1075, 1076,
1085, 1086, 1160, 1364, 1366, 1367, 1371-1384,
1548, 1551
ч
Зигенит ПО
Золото 3, 4, 6, 5, 7, 1053, 1098
Золото,платинистое (тв.р-р) 6
Идаит 113, 114, 116, 117, 118, 129, 130, 275, 289, 290,
292, 293
Ильменит 353, 354, 437-440, 656, 657, 658, 660, 683, 684,
1018, 1213, 1214
Ильменит-пирофанит (тв. р-р) 683, 684
Ильме нит -ульвошпине ль (тв. р-р) 438
Индиалит 522, 835
Иоганнсенит 595
Иодирит 953
Иорданит 83
Иоцит; иоцит (тв.р-р) 196-202 , 268, 299-304, 317,
324-326 , 327 , 330 , 331, 333 , 335 , 345 , 348, 349,
353 , 368, 369 , 430, 431, 433-440 , 504-508, 621,
665, 667, 730, 837, 1018
Иридий 12
Исландский шпат 1680
Истонит 1577
Иттрофлюорит 950
Йодаргирит 1267, 1268, 1270
Йодерит 1491, 1492. 1501, 1503
Кадмоселит 1114
Каинит 1045, 1050, 1051
Калиевый полевой шпат 512, 513,517,834,841, 844,1471,
1577, 1578, 1579, 1580, 1584, 1617, 1619, 1632,
1633, 1658, 1659, 1677
Калиевая селитра 917
Калиевая слюда 1658, 1659
Калиофилит 512, 515, 516, 853 , 856
Калицинит 5,23, 27, 28 (т.)э55. 57 (т.)
Калушит-сингенит 18 (т.)
Кальсилит 856. 1163, 1238, 1376, 1378, 1383, 1476,
1480, 1570, 1572, 1573, 1574-1576, 1580, 1585,
1600, 1675, 1733
К аль силит-нефелин (тв. р-р) 856, 1675
Кальциборит 726
Калышооливин; калышооливин (тв.р-р) 573
Кальциостронцианит 1290, 1298
Калышохондродит 1431, 1527, 1528, 1712-1714,1716-1718
Кальцит; кальцит (тв. р-р) 1, 11-13, 14, 39-43, 66,
67 (т.); 912-916 , 992, 1007, 1277, 1285, 1287, 1288,
1289, 1290, 1292-1298, 1464, 1680. 1681-1683. 1687,
1688-1690, 1693-1697. 1698-1701. 1708-1710, 1711-
1718, 1722-1731, 1735-1740, 1771-1775
Кальцоксид-известь, кальцоксиц (тв. р-р) 391, 404-409,
411, 413-415 , 417 , 480 , 482 , 486,538,548,549-551
553-558,572, 575, 608, 611. 613-615, 617 , 618,
729,730,764-769,788,789,867,868,871,873,874,
876, 891, 892, 905-908, 922. 969 , 972, 1006, 1016,
1289, 1388-1390, 1409. 1427, 1680, 1681-1683,
1698-1701.
Канфильдит 74
Каолинит 1415. 1417, 1418, 1420, 1422, 1423. 1457, 1463
1494, 1497, 1499, 1650, 1659
499
Карналлит 47, 69,71(т); 1045,1047,1050,1061
Карнегиит 530,533,793-798,799,800,801,803,804,805,837,
839, 853, 856, 1177
Кароббиит 1271
Каруит 456,703,894,1217,1218,1219,1220,1221,
Касситерит; касситерит(тв.р-р) 385,467,469,615,1407
Каттьерит 23,109,110
Киари 363,393,415,429,448,452, 469,475,512,530,666,
671-673 , 706, 708, 762, 825, 839 , 840, 1123.
1126. 1127, 1128. 1139, 1140, 1144,
1156, 1157, 1158, 1164,1166,1173, 1176, 1177, 1179,
1180,1181,1183,1184,1185,1186,1198,1208,1209,
1213, 1227, 1248,1250,1260,1366,1367,1377,1378,
1380,1382,1395. 1396. 1397-1406.1416-1424.1426,1432,
1434, 1436, 1437, 1439, 1442, 1444, 1445-1449, 1451,
1456, 1457, 1459-1462, 1464, 1468, 1470-1474, 1479,
1482-1484, 1487, 1488, 1491, 1493, 1494, 1495, 1497,
1499, 1500-1503, 1506, 1508, 1513, 1521, 1529, 1530,
1534, 1537-1549, 1551, 1561, 1564, 1580, 1582, 1583,
1586-1590, 1597, 1598, 1619, 1620, 1625, 1626, 1632,
1633, 1647, 1650, 1651, 1652, 1656. 1658, 1669, 1672,
1688, 1689, 1694, 1711, 1717, 1721, 1722, 1723, 1724,
1725, 1726
Кернит 1028
Кёхлинит 545
Кианит 1132. 1133. 1134. 1157, 1158, 1173, 1198, 1416,
1418, 1421. 1461, 1463, 1464, 1468, 1470, 1491, 144,
1495, 1501-1503, 1538, 1578, 1579, 1650
Кизерит 1035, 1037, 1039, 1050
Килхоанит 486,551, 558,596, 597, 600, 602, 604, 607,
608,612-614,819, 820, 873, 874, 876, 877, 891
Кимрит 1456
Киноварь 44, 45, 235, 236, 311
Кислород 1333.1365, 1366, 1371, 1372-1384, 1538-1551
Клаусталит 241, 262, 312, 315
Клинопироксен 671, 881,882, 1136, 1185, 1187, 1190,
1193, 1206. 1207. 1223, 1224, 1227-1231, 1235, 1244,
1250, 1252-1259, 1261, 1553, 1559, 1631
Клинопироксен,кобальтовый 1136
Клиноферросилит 511, 678, 680-682, 1139, 1140. 1141
Клинохлор 1485, 1486, 1493, 1494, 1495, 1499, 1694
Клиноцоизит 1460, 1461, 1559
Клиноэнстатит; клиноэнстатит (тв.р-р) 453, 455, 539,
580, 581, 584, 627 , 694, 703 , 706, 708, 784, 786,
825, 885, 886, 976, 1146, 1147. 1147А
Клодетит 1116
Кобальтин 313
Ковеллин 25, 29, 65а, 656, 65в, 65г, 113, 114,
116-119, 129, 130, 140-144, 157 , 256, 275, 276а,
2766, 289, 292, 293, 1083
Когенит 13, 1074-1076, 1364
Козалит 254 а, 2546, 254 в, 236, 311
Колорадоит 1115
Кордиерит 521, 522, 523,527, 528,728, 748, 763, 766,
767, 768, 789, 792, 825, 835, 841, 844 , 849, 850,
851, 852, 858-860, 1173, 1485, 1486, 1487. 1488.
1491. 1493, 1494, 1495, 1496, 1497, 1498, 1499,
1500-1502, 1536, 1537, 1560, 1564, 1578, 1579, 1632,
1633, 1694
Кордиерит, железистый 509, 510, 511, 1537, 1564
Кордиерит, марганцовый 527, 528, 529,
Кордиерит-сподумен (тв.р-р) 860
Корунд*; корунд (тв.р-р) 322-327, 329, 364-370,
372-390, 415, 417, 477-479, 482, 486, 490-494, 497-
506, 509, 510, 512, 514, 516, 518-523, 530, 532,
534, 535, 537, 727, 730, 732, 741, 748, 760, 773,
774, 776, 777, 779, 780, 789, 825, 827-829, 832,
833, 839 , 843, 844, 846, 852, 885, 968, 1000, 1001,
1131, 1134, 1154, 1155, 1158, 1160, 1173, 1226, 1237
1385-1387. 1413, 1414, 1421г1423, 1457, 1463, 1468,
* Синоним а—
1469, 1473, 1494, 1495-1497, 1499, 1500, 1501, 1506,
1508, 1517, 1564, 1584, 1625, 1628, 1650
Корунд-гематит (тв.р-р) 502, 503
Котоит 392, 539
Котуннит 988
Коусит 1123. 1124. 1125. 1126. 1128. 4139, 1146,
1149А, 1149Б, 1150, 1173, 1176, 1180, 1406, 1418,
1422, 1424, 1432, 1461, 1468, 1470, 1482, 1650
Креднерит 339
Кремнезем 265, 298, 300-303, 348, 356, 363, 395, 401,
425, 469-471, 473 , 474 , 491, 510, 519 , 522, 535,
537, 539 , 558, 560, 581, 602, 635 , 636, 693 , 701,
730, 784 , 813 , 829-831, 848, 850, 865, 891, 901-904,
919, 923 , 924 , 969 . 975, 976, 977, 1001, 1222, 1256,
1371-1374,1476, 1507, 1585, 1616
Кремний 14, 15
Криолит 945, 946, 947, 954, 965, 966
Криолитионит 946
Кристобалит; кристобалит (тв. р-р) 350, 363, 377-379,
382-384 , 393 , 425, 426 , 429 , 435 , 448, 452-454,
459,461,471-475,486,488,490,498-500,509,512,513,
518, 523 . 528, 530, 531, 534 , 536 , 542, 551, 557.
559, 570, 584,592,596, 597,604, 614, 619, 626-628,
655, 668, 671, 672 , 677 , 687 , 690-692, 698, 704,
709 , 710, 724 , 725, 731,758, 759 , 761, 764 , 765,
789 , 811, 815 , 819 , 820, 825, 827 , 828, 834 , 837,
839 , 842 , 848 , 850 , 853 , 857 , 873 , 874 , 881. 886,
895, 896, 897-900, 1123. 1126, 1128. 1139, 1164,
1183. 1397-1400.1405, 1406, 1444, 1493, 1528, 1598
Крокоит 632, 633, 1009, 1010, 1011
Ксантоконит 58
Ксенотим 1262 а
Ксонотлит 1425-1428. 1429, 1431, 1553
Кубанит 113, 116, 117, 118, 119, 125, 275
Куприт 316, 335, 336, 337, 339 , 340, 367, 429, 554,
620, 634 , 635, 636-638
Курнакит, курнакит (тв.р-р) 321, 340, 342 , 343, 357,
375, 424, 428, 442,461, 710-712
Кутногорит 1296
Лавсонит 1461, 1464, 1465
Лайтакарийт 99, 100, 101, 262, 263
Лангбейнит 932, 1035, 1044
Ларнит; ларнит (тв.р-р) 411, 412 , 484, 490, 538, 551,
557 , 558, 560-567 , 569 , 578, 579 , 590, 600 , 602, 604,
607-609, 611-614, 619, 739-741, 743, 745-747, 764-’
769 , 787-789 , 791, 819 , 820-822, 870, 873-877 , 881,
884 , 889 , 890-892, 1199, 1430, 1686, 1745
Лёвеит 1039
Леа 1-УЦ 1328, 1328А, 1341, 1349, 1351, 1453, 1745,
1747
Лейцит 512-515, 558, 619, 626-628, 834, 841-855. 1162.
1163, 1164, 1184, 1238, 1376, 1378, 1379, 1381, 1384,
1475, 1477, 1480, 1483, 1570, 1572, 1574, 1575, 1576,
1582, 1583, 1585, 1592, 1600, 1675, 1733
Лейцит, железистый 687
Леонит 1035, 1045, 1050
Лерцолит 1631
Лёллингит 76, 77, 1098
Лиллианит 95, 96 а, 96 6, 96 в, 254 а, 254 6, 254 в, 262,
263
Линиеит 23, 109, 259, 273
Ломонтит 1464, 1465, 1467
Лопецит 1314
Лоренсит 940
Маггемит 442, 653
Магнезиальный жеарит 1487
Магнезиовюстит; магнеэиовюстит (тв. р-р) 431, 432,
441, 556, 572, 640, 641, 642, 647-651, 668, 871,
872, 877 , 878, 879 , 884 , 895-001, 1601
Магнеэиорибекит 1601, 1603, 1604
500
Магнезиоферрит; магнезиоферрит (тв. р-р) 441, 572,
624 , 625, 640-652, 688 , 871, 872, 895-899 , 901,1601
Магнезиохромит; магнезиохромит (тв. р-р) 422 , 423,
495^497 , 548, 549 , 550 , 624 , 625,. 628 , 629 , 825,
867 , 868 , 869 , 870 , 894, 1316
V п незит; магнезит (тв. р-р) 914, 1278А.Б, 1287,
1288, 1289, 1291-1298, 1393, 1691. 1702-1705, 1706,
1709, 1710, 1721, 1733, табл. 13, 43, 58, 59
Магнетит; магнетит (тв. р-р) 200-204, 317-319,
323-326 , 328-333 , 335 , 337 , 338, 341, 344-351, 353-
355, 361, 404-406, 416, 417,- 430, 443, 446, 493,
502-508, 621-623, 626, 639, 640-646, 649г656, 658-
660, 662, 663-665, 686, 690-693, 826-829, 871-874,
895-903, 1017, 1105, 1106, 1138, 1144, 1159, 1160,
1210,1212,1250,1363,1364,1366-1368,1371-1384,1536,
1538, 1539, 1541-1543, 1547-1551, 1564, 1567-1569,
1603, 1604, 1606-1608, 1617, 1623, 1624-1626.
Магнетит-гаусманит (тв. р-р) 446, 447
Магнетит-кобальтовый 330, 331
Магниевый кальцит 1286
Магниевый ставролит 1489
Манганит 1370Б
Мангановюстит; мангановюстит (тв.р-р) 431, 432, 680,
682
Манганозит; манганозит (тв. р-р) 237, 320, 340, 341,
374 , 406 , 433 , 434 , 449 , 459 , 460 , 556 , 575 , 653,
667 , 672 , 673 , 709-712 , 883, 1279, 1370А
Манганозит-вюстит (тв. р-р) 672, 673, 676
Манганозит-периклаз (тв. р-р) 449, 698
Манганокальцит 915
Манганолангбейнит 933
Марганцовый хлорит 1544
Марказит 1104
Маршит 1270
Массикот 316, 400, 403, 467, 468, 545, 688, 714, 719,
1010, 1015, 1021, 1119
Матильдит 59, 60, 61 а, 61 б, 61 в, 61 г, 251, 255
Маухерит 78-82, 258, 1694
Медь 4, 5, 9, 10, 28, 86-89, 113, 114, 116-122, 123а,
1236, 123в, 129-134, 136-138, 140-145, 146а, 1466,
146в, 147, 149, 150-153, 157а, 1576, 258, 274, 275,
276а, 2766 , 277-289 , 292 , 293 , 316 , 340, 1052, 1062
Мейонит 480, 481, 482 , 486, 729, 739, 788, 791
Мелилит 733, 735, 740, 741, 748, 760, 763, 764, 765,
769, 768, 773, 789, 805, 806, 819, 820, 821, 822,
877 , 878 , 879 , 880, 882, 1533, 1560
Мелилит натровый 766, 767, 796, 798, 800, 1235, 1236,
1246, 1247
Мервинит 576-578, 579, 585, 590, 592 , 740, 741, 764,
765 , 766 , 789 , 870, 877 , 878 , 890 , 891, 892, 1199,
- 1200, 1201, 1246, 1247, 1527, 1528, 1531, 1532.1693
Мервинит-бредигит (тв.р-р) 576
Метан 1357, 1379, 1381, 1382
Метасиликат лития 857-85?"
Метасиликат натрия 530, 799, 800,; 839
Метациннабарит 44, 45
Миаргирит 70-72, 256, 257
Микроклин 1565
Микроклин, железистый 1565
Миллерит 46, 78-82, 140-145, 180, 239, 258, 260, 274
Мирабилит 1031, 1036, 1039, 1041, 1043, 1046, 1048,
1048, 19 , 34 , 37 , 46 , 56, 62, 63 , 64 , 67(т.)
Молибденит 83, 94, 162-165
Молибдит 845, 400, 462-464
Монацит 1262 6
Моноалюминат кальция 480, 482, 788
Монтепонит 1311, 1391
Монтичеллит 585, 590, 591, 592 , 764, 869, 877, 878,
890, 891, 892, 1199, 1200, 1201, 1531, 1532, 1694,
1695, 1696, 1697
Монтичеллит, железистый 568, 569» 577, 877-879, 882
Монтмориллонит 1422, 1423. 1487, 1488, 1494, 1497,
1498, 1499, 1522, 1523, 1659
Монтмориллонит, магнезиальный 1499
Морденит 1467
Муассонит 14, 15, 16
Муллит; муллит (тв. р-р). 377-384, 486, 490,
491, 498-501, 509-512, 518, 520-523, 527-529, 530,
534-537, 728, 748, 765-769, 789, 792 , 814 , 819-821,
825, 827-831, 839, 841, 844, 849-852 , 857-860, 865,
1001, 1134, 1173, 1418, 1422, 1423, 1457, 1472, 1493,
1499, 1564
Мусковит 1469-1474, 1477.1577, 1578, 1579, 1584, 1618,
1619. 1620, 1625, 1632, 1633
Мышьяк 1, 20, 76-82, 1054
Накрит 1422
Натровая селитра 917
Натрон, сода 25(т.)
Нахколит 9, 37, 55, 57, 60, 61, 62, 63 , 64 , 65 , 75,
76(т.) фиг. 1042
Нейборит 951
Некоит 1431
Несквегонит 53, 71, 72 , 75, 76(т.) 1702
Нефелин; нефелин (тв. р-р) 530, 533, 793-801, 803-805,
837, 838-840, 853, 856, 1176, 1177, 1178, 1179, 1236,
1238, 1242-1247, 1248, 1379, 1506-1508, 1510-1512,
1514, 1515, 1516, 1517-1520, 1567, 1569, 1585, 1600,
1605-1608, 1613, 1614, 1616, 1627, 1629, 1675, 1676,
1677
Нефелин, водный 1515, 1520
Нефелин—кальсилит (тр. р-р) 856
Нефелиновый сиенит 1655
Никелии 78-82, 258
Никель 1062. 1078, 1366, 1377, 1379, 1380
Никель-железо 1072, 1073
Никелевый магнезит 1291
Никелевый флогопит 1571
Нитрокалит 1301, 1302
Нитронатрит 1301, 1303
Нонтроит 1547, 1548
Норбергит 976
Окенит 1431
Окерманит 578, 579, 583, 584, 586, 591, 592 , 742,
770, 781, 785, 790, 792 , 823, 877, 878-880, 891,
892, 1199, 1200. 1235, 1246, 1247, 1531.1532, 1693,
1694, 1696
Окерманит, железистый 568, 878, 879, 880
Окерманит-геленит (тв.р-р) 742, 790, 1553
Окись углерода 1364, 1366, 1367
Оксиапатит 400
Оливин кобальтовый 1136, 1‘203, 1432
Оливин, оливин (тв.р-р) 534, 557, 559, 561-567, 569,
570,619,668,670,671,677-682,696-698,700,735,878-
882.895-901.1136.1142, 1145.1149Б.1150.1151.1152,
1185, 1186, 1204.1205. 1215, 1216, 1223, 1243, 1252-
1259, 1384, 1549, 1576, 1601, 1604, 1631, 1726-1728
Оливиновый толеит 1253
Оливиновык базальт 1655
Оливин, германиевый 1215, 1216
Олово 265, 1062. 1070. 1070А. 1203, 1208, 1209
Ольдгамит 53, 55, 155, 217
Омфацит 1248, 1261
Ортоклаз 517, 842, 855, 1239, 1240А, 1240Б, 1379-1382,
1470, 1475, 1477-1479.1482.1577. 1582, 1583, 1586-
1590, 1591, 1592, 1593, 1594, 1609-1612, 1651, 1652,
1729, 1734
Ортоклаз, железистый 687
Ортопироксеи 671, 881, 882, 1136, 1187, 1208. 1209.
1224, 1227-1231, 1244, 1252, 1253, 1255, 1256-1259,
1549, 1556, 1559, 1601, 1616, 1631
Ортопироксен, кобальтовый 1136
Ортоферросилит 1139, 1140
Ортоэнстатит 1440, 1441, 1442, 1444
648 63
501
Палладий 1362
Пальмьерит 935
Парагонит 1515, 1584, 165п
Парамонтрозеит 334
Парараммельсбергит 78, 7Н
Паргасит 1605-1608, 1613
Паргасит, магнезиальный, роговообм.шковый 1613
Паркерит 261
Партриджит (см. Биксбиит)
Пегматит 1649
Пентасоль, гергейит 1044
Пентландит 172, 173, 176, 177, 178, 179, 181, 182, 274,
275, 1103
Перидотит 1255, 1257
Периклаз; периклаз (тв.р-р) 371, 373, 392, 417, 422,
423 , 428, 431, 449 , 450, 451-453 , 456-458, 477,
797 , 523 , 525, 526, 539 , 543 , 548-550, 575, 576,
577 , 579 , 590, 592, 625, 627 , 628 , 629,634 , 652,
667 , 699 , 701, 704 , 706, 708, 740, 741, 745 , 764-
769 , 775 , 776 , 778, 787 , 789 , 791, 825 , 843 , 865,
867-870, 889 , 891, 892, 894 , 901, 909,910,911,969,
976, 1124, 1146, 1150, 1173, 1278А, 1278Б, 1286,
1289, 1316, 1373, 1374, 1393, 1394, 1413, 1414,
1434, 1493, 1494, 1495, 1499,1500-1503,1527,1528,
1530, 1534. 1634, 1635, 1691, 1694, 1695, 1697,
1703. 1704, 1705, 1709, 1710
Периклаз—манганозит (тв.р-р) 698
Перовскит; перовскит (тв.р-р) 413, 604, 605, 607, 615,
814 , 818, 888 , 889, 890, 891, 1016
Петалит 518, 519, 863, 1166
Пижонит 1191
Пираргирит 69-72, 256
Пикрит 1252
Пикрохромит (см. магнезиохромит)
Пимелит 1451
Пирит 30-32; 34-40,76,77, 113-122, 125, 129, 130, 158,
161-165, 174, 175, 179, 181, 182 , 272 , 275, 289, 290,
292, 1085, 1086, 1087, 1088, 1090, 1091, 1092, 1093,
1097, 1098, 1099, 1104, 1105
Пироксен; пироксен (тв.р-р) 668 , 671, 680, 681, 748,
763, 764-766, 784, 877, 895-901, 1136, 1154. 1155,
1196, 1214, 1227, 1245, 1260, 1627
Пироксен, богатый энстатитом 749-759
Пироксен, германиевый 1214
Пироксен, кобальтовый 1136
Пироксеноид 1185
Пиролит 1258, 1259
Пиролюзит 1369Б
Пироп 760, 762, 773, 792, 1.167,1168, 1169, 1170,
1172-1174, 1223-1226, 1228, 1229, 1490, 1495, 1560,
1566, 1600
Пирофанит 683, 684, 713, 893
Пирофанит-ильменит (тв.р-р) 684
Пирофиллит 1416.1417.1418.1419.1420. 1421. 1422. 1423.
1457, 1458, 1461, 1463, 1487, 1488, 1491, 1496,
1494, 1497, 1498, 1499, 1500, 1502, 1503, 1564,
1650, 1658, 1659
Пирохроит 1370А
Пирротин 30-32, 34-41, 76, 77, 106-108, 113, 114, 116-
122, 125, 129-133, 135, 158-165, 172, 180-182, 185-
191, 194, 196, 197-201, 203, 204, 206-217, 225-233,
274, 277, 284-287, 289, 293 , 294, 297-299, 304-310,
1084-1091, 1097, 1098, 1103, 1105, 1139
Пирсеит 249
Пирсонит 14(т.)
Плагиоклаз 796, 802-804 , 808, 1237,1248, 1249, 1250,
1252, 1253, 1254Б, 1255, 1256, 1259, 1260, 1561,
1562.1605-1608. 1615, 1627, 1631
Платина, самородная 6, 12
Платина, ири ди стая (тв.р-р) 12
Платтнерит 1120
Пломбьерит 1431
Повеллит 462
V Полевой шпат 808, 853, 854, 1238. 1239. 1240А. 1240Б,
1379-1383, 1552, 1584, 1586-1590, 1591. 1592. 1593,
\ . 1594, 1609-1612, 1620, 1627, 1669, 1675-1677
Полевой шпат натриевый 853 , 854
\/ Полевой шпат калиевый 512, 841, 844, 848, 850, 852,
853, 1383, 1577, 1578, 1579, 1580, 1584, 1617, 1619,
1632, 1633, 1658, 1659, 1677
Полевой шпат, щелочной 1669
Полигалит 1044
Полидимит 47, 48, 140-142, 176, 180, 1095
Поликсен 11
Портландит 1388-1390. 1409, 1410, 1427, 1430, 1431,
1527, 1528, 1636-1646, 1698-1701, 1709, 1710, 1712,
1713, 1714, 1716, 1717, 1730, 1731, 1740
Протоэнстатит; протоэнстатит (тв.р-р) 452, 455, 523,
580, 589, 592, 628, 694, 704, 728 , 841, 842 , 844,
848, 851, 857 , 858, 859, 1147, 1147А.1173. 1189,
1191, 1195, 1441, 1444, 1499, 1589
Прустит 57, 58
Псевдобрукит; псевдобрукит (тв.р-р) 354 , 437, 439,
444 , 657 , 658 , 660, 691, 904, 1017, 1213
Псевдоволластонит*; псевдоволластонит (тв.р-р) 483,
485-487, 538, 551-553, 557, 558 , 559-568, 570, 574
582, 583, 584, 592, 595-597, 600-602, 604-605, 609,
610, 612, 613, 730, 733, 735, 748, 760, 764, 765, 772,
773, 789, 790, 792 , 793, 794, 797-802, 812, 813, 817,
820-822 , 873-881, 891, 1135, 1197, 1236, 1425,
1427, 1428, 1528
Пухерит 402
Пятикальциевый трехалюминат 787
Раммельсбергит 80-82 , 258
Рамсделлит 1369Б
Ранкинит 486, 538, 551, 553, 557, 558, 560, 561, 562,
563-567 , 592, 596 , 597 , 600, 602, 604 , 608, 609,
764 , 819 , 820 , 873 , 874 , 876 , 877 , 891, 1199, 1427,
1431
Распит 403 , 468, 547, 715, 937, 1011, 1013, 1015, 1023
Ратит 83
Реальгар 19, 20
Рибекит 1551, 1601, 1603, 1604
Роговая обманка 1632, 1633
Родит (тв. р-р)-родистое золото (тв.р-р) 7
Родонит; родонит (тв.р-р) 356, 459, 461, 527-529,
595-597 , 672, 673 , 677-680-682, 696, 698, 690, 709-
711, 713
Родонит-энстатит (тв.р-р) 698
Родохрозит 915, 1279, 1296
Ртуть 44
Русселит 1012
Рутил; рутил (тв.р-р) 351-354, 359, 387, 397, 398,
413 , 415 , 416 , 427 , 437-440, 444 , 456, 478, 543,
604 , 607 , 615, 637 , 638 , 657 , 658, 660, 691, 695,
703,723,724,725,891,894, 1016, 1017, 1018,
1213, 1217-1221, 1408, 1452
Сакиит, гексагидрит 1035, 1037, 1039
Санборнит 541, 542 , 728, 1456
Санидин 517, 842, 855, 1162.1163.1164. 1184, 1211,
1376-1379, 1381, 1382, 1384, 1469-1472, 1473, 1478.
1479, 1480-1484, 1552, 1565, 1577, 1585, 1600, 1623,
1624, 1733
Сапфирин 521, 523, 748, 769, 841, 844, 849, 851, 1167,
1173, 1499, 1500, 1503, 1560
Сарторит 83
Свинец 253, 254 а, 254 6, 316, 1052. 1062. 1063, 1064.
1096
Селадонит 1577, 1600. 1618, 1619, 1620
*Синоним ₽> -волластонит
502
Селадонит, алюминиевый 1600
Селен 1069
Селлаит 909, 910, 911, 949, 951, 969, 976
Сенармонтит 245, 1122
Септехлориты 1496
Сера 1065-1068. 1096, 1097
Серебро 1, 2, 17, 61а, 616, 61 в, 61 г,63,72,250,253,
1365
Сернистый газ 1357
Серпентин 1243, 1434-1436. 1438, 1493, 1494, 1497,
1499, 1550, 1721
Серпентин, кобальтовый 1432
Сидерит 1285, 1294, 1295, 1368
Сиенит 1655
Силикоглазерит 573, 576
Силленит 402
Силлиманит 828, 829.1132.1133.1134. 1167, 1173, 1416.
1418-1421, 1461, 1463, 1468, 1470, 1473, 1474, 1488,
1494, 1500, 1502, 1536, 1537,1578, 1579, 1632. 1633,
1650
Сильвин 16, 20, 21, 22, 26, 27, 44, 47, 48, 50, 51, 52,
54 , 57 , 68, 69 , 70, 73(т.); 939, 940, 942, 943, 956,
958, 959 , 961, 981, 982, 983 , 984, 993, 994, 995,
1004, 1026, 1033, 1034, 1045, 10-16, 1047, 1050,
1051, 1272, 1273, 1274. 1768, 1769
Сигенит-калушит 18(т.), 1044, 1087
Ситапарит-биксбиит 442
Сколецит 1467
Слюда рсалиевая 1658, 1659
Смайтит 1085, 1086, 1088, 1093
Смитит 57, 58
Сода 14, 54, 55, 56, 63(т.); 1029, 1040, 1041
Содалит 1029, 1675, 1G76, 1677
Соконит 1454, 1455
Спессартин,иттриевый 866
Спессартин 527, 528, 529, 866, 1544
Сперрит 1686, 1687. 1690. 1712-1718
Сподумен; сподумен (тв. р-р) 518, 519 , 857 , 858,
859, 860, 861, 863 , 920, 1165, 1166
Сподумен-кордиерит (тв.р-р) 860
Ставролит 1489. 1536. 1537, 1538, 1539
Стишовит 1123. 1124. 1125. 1141, 1146, 1149Б, 1150,
1206, 1207, 1406, 1647
Стронцианит 1282, 1290, 1298
Суанит 539
Сурик 1121
Сурьма 10, 51, 71,72, 111, 211-215, 239, 273, 295,
1052
Сфалерит 156, 157 а, 157 6, 225, 227, 228, 230, 232, 233,
234, 266, 296, 1097, 1111
Сферокобальтит 1292, 1293
Сфен 604, 606, 607, 811-817, 887, 891, 893
Тальк 1434, 1436, 1437, 1438, 1486, 1487, 1491,
1493-1496, 1497, 1499, 1501, 1503,1534,1449,1550,
1560, 1578, 1579, 1721, 1725-1728
Тальк, кобальтовый 1432
Тальк, никкелевый 1451
Танталовая охра 359, 360
Тарапакаит 631, 1008, 1312, 1313
Тахигидрит 17, 47, 49, 69(т.)
Теллур 8, 1071
Теллуробисмутит 8, 102
Тенардит 46 , 64 , 65 , 66 , 67 , 69 , 73 (т.), 926 , 929,
930, 931. 934 . 936, 937 . 938. 980. 984 . 986-988.
989 , 990, 1013, 1020, 1031, 1036, 1039, 1041,
1043, 1046, 1048, 1050, 1307, 1750, 1<754, 1755
Теннантит 249
Тенорит; тенорит (тв. р-р) 335-340, 367, 428, 429,
554 , 555 , 620, 634-638, 1745
Термонатрит 1029
Тетрадимит 102
Т етракальсилит 856
Тетраэдрит 256, 295'
Тефроит; тефроит (тв.р-р) 356, 459, 161. 62'. 52>,
529, 593 , 594 , 596, 597 , 672 , 673 , 676 , 677 , 686-
682, 690, 697, 698, 709, 710, 711
Тефроит-бридигит (тв.р-р) 594
Тефроит-форстерит (тв.р-р) 698
Тефроит- -двухкальциевый силикат (тв. р-р) 594
Тефроит-фаялит (тв.р-р) 672-676,
Тиллеит 1687
Тиманнит 235, 311, 1115
Тинкалконит 1028
Титанат натрия 1452
Титанит 887, 893
Титаномагнетит 659
Тоберморит 1425. 1426, 1427, 1429, 1431
Толеит кварцевый 1260
Тоналит 1673
Торианит 463, 464, 470, 471, 544
Торианит-уранинит (тв.р-р) 476
Торит 470, 471, 720-722, 1153
Тортвейтит- Mg - пирофосфат (тв. р-р) 451
Треворит 347
Тремолит 762, 1530. 1722-1726
Тридимит; тридимит (тв.р-р) 300-303, 350, 363,
378, 393, 394, 429, 435, 448, 452,459,461,472,474.
475, 486 , 488, 490 , 509 , 512 , 513 , 518, 523 , 528, “
530 , 531, 534 , 542 , 551, 553 , 557 , 559 , 570 , 584,
592 , 595 , 596 , 597 , 604 , 606 , 608, 614 , 619 , 626,
655, 668, 671, 672, 677, 678, 680-682, 686, 687,
690-692, 696, 698, 709, 710, 731,748, 763-766,
789, 811, 815, 819г821, 822, 825, 827, 828, 834,
837 , 839 , 842 , 844 , 848 , 850 , 853 , 857 , 858 , 873,
874 , 876 , 877 , 881, 882 , 895-899, 1123. 1126,
1139, 1164, 1166, 1173, 1183, 1184, 1186, 1213,
1397-1400, 1405.1406, 1483, 1484, 1494, 1499,1521
1528, 1580, 1597-1598
Троилит 30-40, 76 , 77,90-92,106-108,113,114,116-122,
125, 129-134, 158, 161, 167, 168, 176-180,185,188,
196-204, 211-216, 218-233, 268, 289-293, 297-310,
1084, 1085. 1086, 1088, 1097, 1105, 1106
Трона 1040, 1041
Трускотит 1425, 1426, 1429
Тунгстенит 218-223
Уваровит 553
Углерод 1057 1058, 1075, 1077, 1078, 1364
Ульвит 35d, 440 , 656-659 , 660 , 683 , 684, 1213
Ульвошпинель, 354, 438, 439
Ульвошпинель-ильменит (тв.р-р) 438
Ульманнит 239
Уранинит; уранинит (тв.р-р) 355. 457,617, 618
Уранинит-торианит (тв.р-р) 476
Ураноторит 721
Фаматинит 256, 295
Фаялит; фаялит (тв. р-р) 297-303 , 314 , 348,349 , 435,
436 , 509-511, 557 , 561, 562-567 , 569 , 654 , 655,
666 , 669 , 672 , 673 , 676 , 677 , 680-682 , 685 , 686,
731, 829 , 831, 834 , 836 , 837 , 901, 903,
1105, 1106, 1139, 1140, 1143, 1144, 1161, 1186,
1211, 1213, 1366, 1367, 1371-1382, 1535, 1540,
1541, 1545, 1546, 1548, 1551, 1605, 1625, 1626
Фаялит-тефроит (тв.р-р) 672-676
Фенакит 396, 1457
Фенгит 1619, 1620
Феррианнит 1375
Феррит меди 335
Ферроактинолит 1726
Ферропаргасит 1605-1608
Ферросилит 509, 881, 1105, 1106, 1139, 1186, 1187, 1213,
1371-1374
Ферротремолит 1545-1548
Ферручит 1003
503
Ферчилдит 12 (т.); 913, 916
Филлипсит 1467
Флогопит, галиевый 1571
Флогопит, никелевый 1571
Флогопит 1384, 1570, 1571. 1572. 1573, 1574, 1576-1580,
1582, 1583, 1600, 1617, 1658, 1729, 1733
Флюорит 905-908, 920, 921, 945, 948, 949, 950, 955,
956, 957, 965, 968, 969, 972, 975, 1636-1646, 1730,
1731
Форстерит; форстерит (тв.р-р) 452, 453, 521, 523-526,
539, 541,542, 577, 581,584, 585, 537-590, 592, 627,
628, 668 , 669 , 697 , 698, 701, 7Q3, 704 , 706, 707,
708, 728, 741, 750-755, 760, 762, 763 , 764 , 765,
766 , 773 , 775 , 777 , 778 , 782-784 , 786 , 791, -792,
815 , 841-844 , 847^849 , 851, 858, 859 , 861-865, 877,
885 , 886 , 890, 891, 892, 895-899 , 901; 976, 1124,
1146, 1147, 1148, 1149А, 1149Б, 1150, 1172, 1173,
1174, 1175, 1189, 1193, 1194-1196, 1199, 1200, 1211,
1217-1223, 1227, 1229-1234, 1241-1243, 1244, 1434-
1443-1444. 1485, 1486, 1493-1496, 1497, 1499, 1500,
1503, 1527, 1528, 1529, 1532, 1534, 1550, 1556, 1559,
1560, 1570, 1572-1575, 1580, 1582, 1583, 1596-1600,
1603, 1613, 1616, 1691, 1694, 1695
Форстерит-виллемит (тв.р-р) 705
Форстерит-тефроит (тв.р-р) 698,
Фошагит 1431
Фторапатит 921
Фтористый калий 948, 958, 960, 961, 981, 995, 996,
1005
Халипит 13
Халькантит 1746, 1747
Халькозин 25-28, 63, 35 а, б, 86-89, 113-119, 123 а,
1236, 123в, 127, 130-134, 138, 140-145, 146а, 1466,
148-153, 155, 157а, 1576, 256 , 258 , 274 , 275, 289,
295 1082
Халькопирит’113, 114, 116-122, 125, 128, 129-134, 135,
274, 275, 273 а, 280-287, 289-294, 1101
Халькоцианит 1305
Ханлеит 551, 552
Хаттонит 1153
Хедлиит 1109ж 1112, 1113
Хизлевудит 46, 78-82, 140-144, 169, 172, 176, 177, 239,
258, 260, 274, 277, 1103
Хиолит 945, 947, 954
Хлорапатит 920
Хлораргирит 952, 1264
Хлорит 1485. 1487, 1488,1491, 1496, 1499, 1501-1503,
1540-1544, 1559, 1560, 1561, 1564, 1577, 1578, 1579,
1658
Хлоритоид 1538, 1539
Хлормагнезит 6(т.), 942 , 944, 985
Хондродит 973
Хризоберилл 364, 365, 477, 478, 1457
Хризотил 1496
Хромит; хромит (тв.р-р) 419, 493 , 622, 023
Целестин 29 (т.)
Цельзиан 728, 1456
Цементит 1074, 1075, 1076
Цеолит 1515
Церианит 416, 417
Церуссит 1684, 1685
Цинк 1052
Цинкенит 240
Цинкит; цинкит (тв.р-р) 357, 388, 418, 445, 458, 460,
466 , 472 , 535 , 608 , 699 , 704 , 712 , 819 , 820 , 821,
1129, 1454, 1455
Цинкозит 1309, 1310
Циркон 473-475, 536, 537, 609-614, 692, 693, 706-708,
722 , 723 , 892, 903 , 904
Цоизит 1461-1465, 1468, 1559
Цирконат кальция 892
Чермака молекула кальцевая 760, 761, 762, 1158, 1256,
1600
Чермака молекула магнезиальная 760
Чиллагит 1023
Шаннонит 593, 787
Шеелит; шеелит (тв.р-р) 414, 540, 571, 598,599, 603,
1262а, 12626
Шёнит, пикромерит 1035, 1045, 1048, 1050 табл. 72
Шортит 992
Шпинель; шпинель (тв.р-р) 322-326,328, 333,338, 339,
346 , 347 , 352, 357 , 368 , 370-373 , 375 , 376, 407 , 41Ц,
420, 424, 450, 477, 490^492, 495-497 , 502 , 503 , 507,
508 , 510, 521-524 , 526 , 534 , 619 , 621-623 , 625-627.,
645 , 647-649 , 657 , 659 , 690 , 736-738 , 740, 741, 743-
748 , 765-769 , 773-780 , 782-784 , 788 , 789 , 792, 825-
829 , 830-832,841, 843-847 , 849-852, 860, 863 , 865,
869 , 870, 884 , 891, 903, 1124, 1141, 1142. 1146, 11496,
1150, 1151, 1152, 1167, 1168, 1172, 1173, 1204, 1205.
1206, 1207, 1215. 1216, 1227, 1229-1234, 1243, 1252,
1253, 1255-1259, 1261, 1413, 1414, 1485, 1486, 1493,
1494, 1495, 1496, 1497, 1499, 1500, 1503, 1559, 1560,
1613, 1694, 1706
Шпинель, германиевая 1215, 1216
Шпинель-магнетит (тв.р-р) 1159
Шпинель, магнезиально-кобальтовая 1203
Шпинель, марганцово-железистая 342 , 343, 690
Шпинель, титано-железистая 351, 352,
Шпинель, хромовая 493-497
Штольцит; штольцит (тв.р-р) 403, 468, 547, 603, 715,
937, 1011, 1013, 1014, 1015, 1023
Штромейерит 63, 256
Щелочной базальт 1655
Эвкриптит; эвкриптит (тв.р-р) 518, 519, 861, 863,
1165, 1166, 1595
Эвлитин 401
Эклогит 1251, 1261
Энделлит 1422, 1423
Энигматит 1551
Энстатит; энстатит (тв.р-р) 452, 455, 542, 580,
668, 669, 694 , 696, 698, 701, 704 , 748-760^
762, 763, 773, 792, 844, 848, 862, 863, 865, 877,
881, 891, 892, 895-899. 1147. 1147А. Ц49А, 1149Б,
1171. 1172, 1173, 1175, 1189, 1190-1192, 1195,
1196, 1197, 1211, 1217, 1218-1222, 1224-1227,1232,
1233, 1241, 1242, 1244, 1434, 1436, 1437, 1439,
1485, 1486, 1491, 1493, 1494, 1495, 1496, 1499,
1503, 1527-1530, 1534, 1556, 1580, 1582, 1583,
1596, 1597, 1598,1599,1600,1603,1632,1633,1691
Энстатит-родонит (тв.р-р) 698
Эпидот 1460
Эпистильбит 1467
Эпсомит-рейхардит 72(т.); 1035, 1037, 1039, 1045,
1048, 1049, 1050, 1051
Эсколаит; эсколаит (тв.р-р) 332 , 334 , 366, 415, 417,
419 , 420-422 , 424 , 425 , 426 , 427 , 492-494 , 497,
548-553 , 620, 621, 623 , 627-630, 825, 865, 894,
1131, 1341, 1316, 1317
Якобсит 342-343, 344
Ялпаит 63
АВТОРСКИЙ УКАЗАТЕЛЬ
Абрикосов Н.Х. 8
Аветисян Х.К. 244, 304, 305-310
Акопов Е.К. 984
Алтунин В.В. 1322
Альтшулер Л.В. 1061, 1274-
Анишева Н.А. 269-271
Анфилогов В.Н. 1097, 1669
Арнольд Р. 34
Балакирев В.Ф. 361
Банкина В.Ф. 8
Барзаковский В.П. 384
Баркова Г.В. 714, 719
Бартон П.Б. 39, 40, 226-231, 233
Байкова А.И. 481
Белов Б.Ф. 327, 369
Беляев И.Н. 400, 402 , 403 , 545, 714,
719, 937, 991, 1013, 1020
Беляевская Л.В. 462
Бенделиани Н.А. 1118, ИЗО
Бергман А.Г. 929, 984, 988, 989, 995 , 996
998, 1004, 1005; 35, 51(т.)
Бережной А.С. 607, 609, 652, 703,
706, 707, 708, 825, 889-892 , 894, 904
Беруль С.И. 699
Бессонов А.Ф. 429
Бетехтин А.Г. 1364
Блинов А.Б. 1275
Блохина Л.И. 686
Богословская Е.И. 685
Богоявленский П.С. 5(т.)
Большаков К.А. 90, 91, 92, 211-215,987
Большакова К.Ф. 51
Боровая Ф.Е. 1755-1757, 1768, 1769
Бражник М.Я. 1061
Брикман Н.М. 68(т.)
Будников П.П. 378, 396, 457, 537, 908, 972
Букина В.В. 65(т.)
Бутузов В.П. 1052, 1054, 1063
Бызова Е.А. 22, 24(т.)
Ваксберг Н.М. 37 (т.)
Валяшко М.Г. 41, 65, 67(т.)
Вант-Гофф 1050
Ванюков А.В. 170, 171, 193
Ванюков В.А. 170, 171, 193
Василевская И.Н. 51, 90, 92, 211- 215
Верес Г.И. 262, 263
Верещагин Л.Ф. 1118, ИЗО
Верещагина И.П. 49(т.)
Вертман А.А. 13
Ветренко Е.А. 107, 108
Вильнянский Я.Е. 1007
Витинг Л.М. 688
Власов М.А. 35, 51 (т.)
Волков Н.Н. 995, 996, 998
Воробьева О.А. 4(т.)
Воскресенская Н.К. 699
Вукалович М.П. 1322, 1327
Галахов Ф.Я. 365, 384, 474, 511,520, 520
Гл а дущенко В. А. 989
Глазов В.М. 64
Глюк Д.С. 1669
Гнатышенко Г.И. 244, 304, 305-310
Годовиков А.А. 99-101
Голованова Т.Г. 695
Гоникберг М. Г. 1063
Гордеев И.В. 341
Горох А.В. 374
Гребенщиков Р.Г. 394, 573, 574
Григорович В.К. 13
Грушвицкий В.Е. 60, 61, 76(т.)
Гузенко Г.Ф. 427
Гулько Н.В. 825, 894 , 904
Гуляницкая З.Ф. 467, 686
Делицин Л.М. 970, 971
Дейнека С.С. 686
Диев Н.П. 107, 108
Дмитриева А.В. 23
Доброцветов Б.Л. 685
Домбровская Н.С. 960; 51 (т.)
Елисеев А.А. 23
Еременко В.Н. 56
Ершов В.В. 277
Ершова З.П. 9G9, 974, 975, 977
Жугихин В.Н. 1061
Зарубицкая А.Н. И(т.)
Заславский А.И. 16(т.)
Зеликман А.Н. 462
Зельвенский Я.Д. 1348
Зоркин Ф.П. 21(т.)
Иванов И.П. 1407
Илларионов В.В. 465
Ильяшева Н.А. 99- 101
Йодер X. 31
Кано С. 35
Караханова М.И. 52
Карнов А.Б. 951
Карпов И.К. 1323
Карякин Л.И. 706, 707, 708
Кашик С.А. 1323
Кеткович В.Я. 1768, 1769
Кильдишева Е.В. 465
Кириллов Г.А. 1274, 1275
Киркинский В.А. 18, 1080, 1107
Кисляков И.П. 599
Кларк Л.А. 76, 77, 1098, 1099
Когарко Л.Н. 967, 1629
Комаров В.Ф. 344
Кордюк Р.А. 609, 652 , 892
Корнеев Ю.А. 961, 361
505
4<ормер С.Б. 1274, 1275
Королев В.Ф. 46 (т.)
Косман О.М. 63(т.)
Костюков А.А. 951
Кракау К.А. 716-718
Крестовников А.И. 64
Крупников К.К. 1061
Крюков П.А. 1753
Кувакин М.А. 954
Кузнецов В.Г. 23
Кулешова Л.В. 1274
Куликова А.И. 1333
Куллеруд Г. 20, 31
Кунев Д.К. 462
Курнаков Н.С. 49(т.); 1051
Курцева Н.Н. 384
Кусакин П.С. 107, 108, 269-271, 954
Кушаковский В.И. 378, 457
Лапин В.В. 384
Лайнер Ю.А. 159, 160
Лебедев В.И. 1415
Лебедев Е.Б. 1629, 1647
Леденев Б.Н. 1061
Ленев ЛиЧ. 374, 440
Лепин Б.В. 147
Лисговничий В.Е. 56
Литваковский А.А. 537
Лужная М.П. 49(т.)
Лукьянова Е.И. 48(т.)
Людвинский А.И. 421, 627
Макаров С.З. 37, 63, 65(т.)
Макарова А.П. 1407
Малевский А.Ю. 234 - 236, 262 - 264, 311-313
Малинин С.Д. 1339, 1735, 1770
Малиновский И.Ю. 1605
Мананникова А.С. 5(т.)
Манихин В.И. 1753
Мардахаев Б.Н. 42
Мелентьев Б.Н. 918, 970, 971
Мелентьев Г. Б. 970
Менделевич А.Ю. 64
Миринский Д.С. 1065
Миткина Г.Д. 401
Мишина Г.П. 1405, 1406
Молева Н.Г. 107, 108
Морозов А.Н. 1019
Морозов И.С. 941
Мукимов С.М. 930, 981, 982 , 986, 990
Нагорный Г.И. 964
Намбу М. 35
Насиров Я.Н. 248
Недумов Н.А. 13
Никитин В.Д. 453
Никифоров Л.В. 159, 160
Николаев А.В, 49(т.); 1051
Никонова И.Н. 1004, 1005
Новоженова Л.В. 21 (т.)
Новоселов С.С. 135, 156, 294
Новоселова А.В. 52; 4, 8(т.)
Новохатский И.А. 327, 369, 374, 440
Ногинов Н.Н. 154, 280-288
Озеров Р.П. 465
Олейников Н.Н. 344, 645, 646
Ольшанский Я.И. 201, 265, 298, 299,
454, 654, 918, 974, 975, 977
Орлова Г.П. 1630
Остапенко Г.Т. 1684
Островский И.А. 654, 1123, 1405, 1406 1535, 1630
Павловский М.Н. 1274
Палкин А.П. 956, 980; 68(т.)
Палкина К.К. 23
Пауков И.Е. 1065
Пашинкин А.С. 52
Перминов П.С. 1362
Петрова Е.М. 41, 67(т.)
Петрова Р.Н. 686
Пинаевская Е.Н. 1003
Повилайтис В.М. 1405, 1406
Поляков В.Д. 958, 961
Поляков Е.В. 1318А
Попова Г.Б. 277
Попова С.В. 1118, ИЗО
Прохоров В.М. 1336, 1337
Пугин В.А. 1133
Пудовкина О.И. 1007
Пушкарева А.Н. 216
Равич М.Н. 1741, 1750-1752, 1754- 1757, 1768, 1769
Радищев В.П. 959, 962, 994
Ривкин С.Л. 1329
Рихтер Т.Л. 262, 263
Роде Е.Я. 399
Ротт Л.А. 1353, 1354, 1358, 1359
Рудницкий А.А. 7
Рустамов П.Г. 42
Рябинин Ю.Н. 1123
Рябчиков И.Д. 967, 978, 1533, 1672
Ряпосов А.П. 18, 1080, 1107
Савинская А.А. 374, 440
Саксонов Ю.Г. 341, 344 , 645, 646
Сальдау П.Я. 629
Самарин AJ4. 13
Сафаров М.Г. 42
Сафронов Г.М. 401
Серебряная Н.Р. £43
Симаков Г.В. 1274
Синицин М.В. 1274, 1275
Свешникова В.Н. 15, 44(т.)
Скориков BJ4. 399, 401
Смирнова И.Н. 599
Смоленский С. 713
Смолянинов Н.П. 400, 402, 403, 545
Собельман Е.И. 68Й
Соколова А.М. 23, 46
Сперанская Е.И. 399, 401, 467
Спирягина А.И. 74 (т.)
Стишов С.М. 1071, 1112, 1123, 1124, 1125
Страхов Н.М. 11, 40(т.)
СтыриковичМ.А. 1743, 1766, 1767
Судакова Л.П. 429
Счастливый В.П. 686
Сыромятников Ф.В. 1407
Такэноути С. 125
Тамм Н.С. 4 (т.)
Таращук Н.Т. 170, 171, 193
Тихомирова Н.А. 1071, 1112
Тонков Е.Ю. 1065
Топтыгин Д.Я. 941
Торопов Н.А. 384, 474, 481, 520,573, 574
Тресвятский С.Г. 457, 908, 972
Третьяков Ю.Д. 341, 344, 645, 646
Трояновская Г.В. 1329
Труфанова Л.Г. 1669
Тулмин П. 39, 40, 226-231, 233
Удодов Ю.Н. 1088, 1089
Уразов Г.Г. 51, 90-92, 154, 211-215, 280-288, 467
Урлин В.Д. 1062, 1274, 1275
Устьянцев В.М. 429
Федоров П.И. 51, 90-92, 211-215, 987
Фейзиев Я.С. 248
506
Филлипов З.И. 930
Флоринская Е.М. 60, 61, 76(т.)
Фудаики И. 125
Фунтиков А.И. 1275
Харчук О.С. 1033
Хайбулин И.Х. 1743, 1766, 1767
Хитаров Н.И. 1133, 1403, 1630
Хотинская А.Н. 7
Хомяков К.Г. 688
Циклис Д.С. 1318А, 1333, 1336, 1337, 1353, 1354,
Чернышев Л.В. 1097
Чжун-Цзя-жун 235, 236, 311
Чижиков Д.М. 159, 160, 68и
Чижов С.И. 9
Чуфаров Г.И. 361
Ширвинская А.К. 573, 574
Шитова В.И. 573, 574
Шлезингер Н.А. 21, 74(т.)
Шмулович К.И. 1686, 1693
Шойхет Д.Н. 48(т.)
Шолохович М.Л. 714, 719, 991
Шпак З.С. 23
Шульгин М.И. 1033
Щепочкина Н.И. 438
1358, 1359
Энштейн Р.Я. 629
Якушев В.Г. 18, 1080, 1107
Янатьева О.К. 17(т.); 1033; 43(т.);
1048; 66(т.)
Abbers W. 1102
Adams L.H. 1680, 1682
Adams L.N. 1267, 1753
Admiraal L.J. 1328
Agamawi Y.M. 811-815
Ahrens T.J, 1146
Akella J. 1385, 1420, 1421
Akimoto S. 1124, 1136, 1140-1142, 1145,
1152, 1202, 1204, 1206, 1576, 1631
Alder B. 1058
Albers W. 53, 54, 247
Allen N.P. 1365
Allen W.C. 436
Alper A.M. 371, 423
Althaus E. 1416, 1417, 1471, 1632, 1633
Amadori M. 631, 993, 999
Amagat E.H. 1324
Anders E. 1075, 1076
Andersen O. 452, 786, 1222, 1444, 1600
Anderson G.M. 1330, 1401, 1402, 1628, 1656
Anderson P.A.M. 1132
Andrew J.H. 237, 297, 315, 434
Andrews A.I. 724, 725
Aramaki S. 380, 381, 383, 522
Arnold R.G. 1088
Asanti P. 106, 268
Askew H, 39 (t. )
Atlas ЦМ. 323, 324-326, 452,. 507, 508,
580, 1441
Baak T. 1066
Babb S.E. 1064, 1301, 1302
Bahnsen M.J. 979
Bailey D.K. 838-840, 1212, 1729
Baker E.H. 1365, 1678-1681
Ball D.L. 1113
Banno S. 1250
Bar O. 13 ( t. )
Baran W. 397
Barczak V.J. 385
Barloga A.M. 33
Bdmes H.L. 1094, 1111, 1272, 1331, 1634, 1635
Barre M. 12, 18, 19, 29 ( t. )
Bars tad J, 71
Bartels F.T.C. 15
Bartenew G.M. 905, 906
Barth T.F.W. 533, 1177, 151?
Bartlett 1324
Barton P. B. 1097
Baskow A.V. 947
Basset IL 2 ( t. )
Basset W.A. 1061
Basta E. 659
Bates C.H. 418, 445, 460, 466, 1129
Balti P. 482
Bauer H. 382, 726
Bayliss P. 1321
Beall G.H. 383
Beck E. 949
Becker K. 345
Bell P.M. 1067, 1083, 1084, 1101, 1103,
1132, 1133, 1176-1178, 1180, 1245,
1502, 1506, 1578
Bellanca A. 931
Belos Louis 386
Bonnett H.E. 5
Berak J. 451, 600-602, 701, 911, 921
Berman R. 1077
Berner R.A. 1088
Biggar G.M. 1636-1646
Biltz W. 109
Birch F. 1146, 1181, 1182, 1211, 1510, 1517
Biscardi C.G. 1323, 1736-1738
Blaisse B. 1320
Blakey J.P. 1328
Biasdale W. 25, 50, 54, 56 (t.)
Blount C.W. 1742
Blum F.A. 1069
Bock K.R. 33
Воске H.E. 912, 1277
Boettcher A.b 1179, 1277, 1468, 1506-1508,
1514, 1647, 1698, 1699
Bogue R.H. 729
Bonnickson K.R. 1181
Boorman R.S. 23 2
Booth H.S. 979
Bovalini E. 34 (T« )
Bowen N.L. 377, 431, 435, 436, 452, 512-517,
530-532, 559-570, 581-583, 587, 668-671,
689, 808, 836, 837, 1092, 1162, 1163, 1183,
1186, 1189, 1195, 1196, 1204, 1237, 1239,
1249, 1434-1436, 1438, 1444, 1483, 1521,
1585, 1586, 1592,1626, 1654. 1655
Bowman G.P. 546, 808, 836, 837
Boyd F.R. 1123, 1126, 1139, 1147, 1167-1171,
1173, 1175, 1180, 1182, 1184, 1188, 1189,
1192, 1224, 1226, 1251, 1441, 1490, 1533,
1600, 1613, 1657, 1675
Breazeale LJ. 18, 19 ( t. )
Bredig M.A. 585
Brenner P. 1131
Brett N.H. 536, 610- 613
Brett P.R. 115, 126-128, 206-210
Bridgmann P.W. 1055, 1267, 1277, 1302, 1320,1328
Bright N.F. H. 351, 352
Brown G.M. 1191, 1244
Buckley R.A. 11
Buckner D.A. 1425, 1427, 1428
Biddington A,F. 785
Bundy b'.P. 1055, 1057, 1058
Bunting E.N. 366, 388, 426, 472, 535
Burdeso A. 334
507
Burdick M.D. 558
Burgmann W. 38
Burnham C.W. 1327, 1401, 1402, 1507, 1628,
1648, 1649, 1656, 1667
Bury C. 14 ( t. )
Buseck P.R. 41 ”
Butrymowicz D.B, 359, 360
BuHermann W.C. 475
Cahn J.W. 1074
Calcagni G. 933
Cambie L. 249
Cameron F. 18, 19, 34, 42, 45, 58, 59 ( T. )
Campbell A.N, 26, 36 ( t. )
Campbell A.J. 26, 36 (t.)
Campbell A.S, 1513
Canneri G. 84
Cappellini L. 34 ( t. )
Carlson E.T. 391
Carmichael I.S.E. 1621, 1622
Carpenter R.H. 37
Carr .R.M. 1417
Carter P.T. 674-676
Cassedanne J. 443
Cevales Gr. 390
Chang L.L.Y. 414,540,598,603,616,1284,1290
C hanсу P. S. 1301
Cbaklader A.C.D. 367
ChinneT G.A. 748, 792, 1559, 1560, 1566,1600
Christian R.H. 10 58
Christie Olav H.J. 806, 807, 1553
Clark J.B. 1281, 1283, 1747-1749
Clark L.A. 174. 175, 187, 194, 195
Clark S.P. 186, 1146, 1249, 1266, 1272,* 1275,
1290, 1298, 1416, 1420,1464,1507,1576,1675
Claussen W.F. 1075
Cocco A. 723
Cohen UFu* 1127, 1254 Б
Colgrove G.L.* 167-169
Cook W.R. 103
Coughanour L.W. 456, 615
Craig J.R. w59, 61, 68, 95, 96, 148-153, 157,
176, 180,' 254, '274-276, 279, 28.9-293
Cramer F. 1319, 1320
Crawford W.A. 1277, 1464
Creamer A.S. 477, 479
Crowley M.S. 1469, 1570
Cubicciotti D.j. 22
Dachille" F. 104, 1068, 1081, 1100, 1117, 1119-
1122,1128, 1153, 1215, 1216
Darken L.S, 317, 348, 349,’ 653, 1138
Darrow M.S. 242
Davis B.L. 1267
Davis H.M.* 392
Davis B.T.C.* 1148, 1174, 1175, 1192, 1193,
1196. 1204, 1223, 1224, 1228, 1245, 1443
Davis N.F. 13 27
Dayal R.R. 490, 491
Dearborn E.F. 661
Deaton B.C. 1264, 1268
De Carli 10 58
De Cesaris P. *246
Decker D.S. 1053
Delafosse D. 110
DeProsse V.A. 456
Desch C.H. 788
Desborough G-.A. 37"
DeVries R,S.‘ 413, 604-606, 764-769, 774-780,
1134, 1137
De Wys E.C, 770, 781
Dickson F.W. 45, 1108-1110, 1742
Din F.“ 1332
Dittler E. 861, 862, 863
Dittrich H. 258
Dodes M. 2 ( t. )
Doe B.R. 41
Doman R.C, 371, 423
Doy R. 372
5 US
Dowell J.F. 383
Downey J.W, 3 58
Driessens F.C.M. 339, 340, 357
Droplach P. 946
Drys M. 397
Dudley J.D. 1070 A
Duncan J.M.^ 43
Du Preez J.W. 261
Eade G.A." 1
Eberhard E.^ 1565
Eckhardt кГ 416, 417
Edgar A.D. 1516, 1518, 1614
El Goresy A. 24, 157
Elli M. 249
Ellis A.J. 1772
El-Shahat R.M. 495, 624, 869, 870, 884
Ems lie R.F. 1249
England J.L. 1067, 1083, 1084, 1101, 1103,
1123, 1126, 1139, 1147, 1148, 1167-
1171, 1173, 1175, 1180, 1182, 1184,1188,
1204, 1224, 1251, 1443, 1483, 1484,
1490, 1533, 1600, 1657
Ensio P.J. 436
Epain R. 1065
Ernst W.G. 1186, 1212, 1331,* 1545-1548,
1551, 1596-1598,1601-1604,1634, 1635
Ervin G. 1387
Eubank W.R. 729
Eugster H.P. 328, 1366-1368, 1372, 1376-
1379, 1381, 1383, 1384, 1469, 1570,
1572, 1576, 1584, 1617, 1623-1626
Evans B.W. 1416
Evans W.D.J. 3 55
Faivre R. 4
Faust G.T, 687, 922
Fawcett J.J. 1485, 1437, 1497, 1500, 1577,
1579
Fedotieff P.P. 945, 947
Ferguson J. B. 586
Fernandes L. 84
Fillimore C.L. 387, 398, 478
Fischer W.A. 368
Fischer G.W. 1549
Fleischer M. 1719, 1720
Flint E.P. 538
Fock A. 21 (t.)
Foote H.W. 36, 64 (t. )
Ford W.F. 548, 549, 550, 635, 636, 867
868, 1006
Forestier H. 386, 443, 447
Forst P. 239, 260
Foster* W.R." 364, 393, 412, 452, 475, 486
770,781, 801-804, 1001, 1499
Fournier R.O. 1402
Fowler E.A. 237, 315
Franck E.U. 1331, 1344, 1357, 1689
Franco 33 (t. )
Franz H, 1144,’ 1527, 1528
Freeth F./X. 62 ( t. )
Freundlich William 463, 464,
French В.М» 1366-1368
Friedman^l. 144 5-1449, 1525, 1526
Friedrich K. 139, 205
Froese E. 1290,' 1298'
Frohberg M.G. 38, 406, 449, 575, 667
Fudali R.F. 1585
Fujisawa H. 1136*, * 1140, 1142, 1152, 1204
Fulling W. 196-200
Fyfe W.S-. 1277, 1403, 1404, 1417, 1464, 1513
Galacagni G. 933
Gadalia A.M.M. 336, 337, 338, 428 554
555. 620, 634-638
Ganguli Dibyendu 1457, 1458
Ganguly J. 1538, 1539
Garn P.D. 13 21
Gaudin A.M. 256
Gebhardt E. 316 *
Goo C.V 370, 502, 503
Goiter A. 1753
Geller R.F. 477, 479
Gentile A.L, 486
Gerlach J. 258
Germs H.C*. 468, 632, 633, 715, 1009-1011,
1014, 1015, 1021-1023
Giardinl A. A. 1077
Gibson R.D. 1127, 1753
Gielisse P.J. 1001
Gilbert M.C. -1133,- 1144, 1210, 1211, 1502,
1578, 1605-1608.
Gittins J.* 1730, 1731
Glaeser 913
Glasner A. 1321
Glasser F.P.’ 425, 452, 459, 473, 498-501, 551-
553, 593, 594, 595, 596, 597, 696, 697, 698
Glasser LS.D. 1391
Glatz A.C. 102
Gloss Gr. 28, 31, 71, 72, 75 ( t. )
Goldsmith J.R. 795, 796, 915, 1278 A, 1279,
1286, 128^, 1291-1298, 1682, 1694
Goranson R.W. 1263, 1475, 1476, 1483,
1504, 1505, 1509
Goresy A. 112
Gorochov O. 66, 73, 74
Gothe F. IO,’30, 58 ( t. )
Graef M. 1702
Graf D.L. 1279, 1286, 1294-1296
Graf F. 1694
Graft D.L. 915
Grahmann W. 93 5
Gree K.H. 764-769
Green D.K. 1250, 1258-1260
Greenwood H.J. 1318 A, 1334, 1335, 1346,
1347, 1436, 1437, 1439, 1511, 1512,- 1711
Greig J.W. 131? 319, 377, .452, 533,1177,1444,1517
Grieve J. 437, 683, 684, 1018
Grisafe D.A. 1321, 1684, 1685
Grosh R.J. 1329
Groschuff E. 1008
Grover B.N. 138
Grubb P.L.C. 571
Gummer W.K. 793, 794
Gunzel F.H. 476
Gurry R.W. 317, 653, 1138
Guriock W; 105
Gutc W. 409, 411, 576, 740, 741
Haas C. 247
Haas J.Lw 1712-1718
Hagenmuller P.* 85
Hahn W.C. 320,-321
Hall H.T. 36, 1070 A
Halla F. 53 (t.)
Hallett A.C. H. 1318
Hamilton D.L. 1238, 1585, 1672
Hangwerk J.H. 617, 618
Hansen W.C. 787“
Hanneman R.E. 1078
Hariya J. 1157, 1158
Harker R.L 914,. 1200, 1278, 1288, 1289,
1426, 1430, 1531, 1682, 1687, 1688,
1690, 1694, 1711
Harris L.A. 471
Hatch R.A. 1166
Hawley J.E. 167-169
Hay R. 319,674-676
Haygarth J. 1385, 1420, 1421
Hays J.F. 1154-1157
Heard H.C. 1278 A, 1286, 1287 1298,
1397-1400, *1402, 1405, 1406, 1682
Heide H. 1386
Hellner Е/ 1726-1728
Hemley J.J. 1658, 1659
Hennig U. 258
Herold P.G. 865
Herty C.H. 433
Herviov M. 85
Hesselgesser J.M. 1403, 1404, 1450
Hill A. 23, 32, 55 ( t. )
Hill D. 23 (t. )
Hill D.C. 617, 618
Hill J.L.E. 13 55, 1356
Hill V.G. 1412
Hill W.E. 922
Hilliard J.E. 1074
Hinz W. 910, -976
Hinze E. 1270 -
Hirson J.M. 940
Hoch M. 359, 360
Hodara L 1321
Hoffmann A. 368, 861-863
Hoffmann J. 295
Holbom Lu 1324
Holdaway M.J. 146b
Holland H.D. 1323, 1736-1738
Holland A.E. 458, 704, 705
Holloway J.R. 1327
Holm J.L.' 966, 1125, 1126, 1132
Holzapfel W? 1331
Hoogschagen J. 13 20
Hoschek G. 1536
Hough A. 544
Howard D.F. 546
Howat D. 434
Hsu L.C. 1143, 1540-1544
Huber H. 75
Hulsmann O. 109
Hume-Rothery W.Z. 1, 11
Hummel F.A.' 3-9-5, 410, 455, 518, 694, 702, 857-
859-860, 1000, 1147 A
Hutta J.J. 376, 534
Hytdnen Kui 749-763, 1600
Ichaque M- 946, 948, 957
Ida J. 1124
litsuka D. 240
Igelsrund J. 47 (t.)
lljinskiy W.P. 945, 947
Hiner K.W. 913
Insley H. 739
Insley R.H. 385
lohansen F. 28
Ito K. 1252-1257
Iwase K. 817, 818, 887, 888, 893
Jaeger F.M.- 57, 4^8, 63*2, 633, 715, 1009,-
1010, 1011, 1014, 1015, 1021-1023
Jager W. 345 -
Jahns R.H. 1507, 1521, 1651-1653, 1667
Jamamoto H. 1744
Jamieson J.C. 10 58, 1464
Janecke E. 983, 985
Jayaraman A. 1054, 10.56, 1070, 1114, 1115
Jensen E. 70, 131
Johannes W. 1702, 1721
Johnson R.E. 490, 491, 556, 572, 871, 872
Johnstone J.K. 1365
Jones T.S. 692, 693, 903
Jonker W.P, 19
Julie Chi-Sun Yahg 1393
Junge H. 521
Kameda Mitsuo 278
Karkhanavala M.D. 444, 499, 860
- Karotke Е/ 1471
Katnack F. 702
Katsura T. 623, 644, 1136, 1140, 1142, 1152
Kaufman L. 1072, 1073
Keesmann L 1452
Keihn F.G. 423
Keith M.L. 426, 447, 628, 866
Kelley K.K. 1181, 1510
Kennedy G.C. 1054, 1056, 1059, 107n, 111*4,
1115, 1157, 1158, 1184, 1251-1257, 1302,
18 64
50 9
1322, 1323, 1326, 1327, 1340-1343, 1349-
1352, 1360, 1361, 1385, 1395-1400, 1402,
1403, 1405, 1406, 1418, 1420, 1421, 1436,
1456, 1459, 1461, 1463, 1464, 1472-1474,
1477, 1480-1482, 1506, 1507, 1625, 1650,
1744, 1760-1765, 1772-1774
Kerji J.M. 973
Kerrick D. 1419
Kessler J.E. 1321
Keyssclitz B. 469
Kidd D.J. 1392
Kim K.H. 1000
Kimura S. 389, 644, 692, 693, 903
King B.W. 1002
King E.G. 1181
Kitahara 5» 1436
Klement W. 1054, 1056, 1059, 1070, 1114,
1115, 1127
Klemm D.D. 272, 314
Klemm W. 942, 944
Kleppa O.J. 1125, 1126, 1132
Klingsberg C, 1369, 1370, 1571
Knepper W, 295
Knight M.A. 392
Kobayshi R. 1338
Kohlmeyer E.J. 106, 268, 469
Koido S. 614
Koizumi M. 1467
Kcrnada E. 1136, 1140
Konopicky K. .382
Kordes E. 927
Koster Van Groos A.F. 1280, 1660-1668, 1692
Kotler А» 917
Kracek Б.С. 17, 12$3
Kroner H.M. 764-769
Kreidler E.R. 410
Krischer H. 1386
Kroger C. 913
Krhgei' F.A. 267
Kullerud G. 24, 32, 41,44, 47, 48-50, 112, 114,
116-124, 129, 130, 132-134, 140-146, 148-
153, 157, 162-166, 172-179, 181-192, 194,
195, 202, 206-210, 226, 231, 274-276, 279,
289-293, 335,1067, 1082, 1083-1088,
1090-1092, 1095, 1096, 1101, 1103-1106, 1331
Kunth P.O. 910, 976
Kushiro L 588, 589, 1135, 1190, 1191, 1194-1200,
1222, 1224, 1227, 1229-1232, 1242, 1246-1248,
1440-1444, 1529, 1532, 1556, 1573-1576, 1599,
1616
Kutoglu A. 83
Kuzel Hans-Jurgen 539
Landsberry H. 939
Lang S.M. 387, 398, 478
Lange W, 111
Lambert LB. 1470, 1478, 1479, 1673, 1674
Lambertson W.A 476
Lamprecht A, 1213
Lamure J. 1321
Laudise R.A. 58
Lea F.M. 788
LeComte P. 1181, 11822
Leider M. 2, 3
Levin E.M. 408, 557, 592, 1000, 1012
Levine P.L. 1362
Leymann A. 1144
Liley P.E. 1329
Linares R.S. .727
Lindemann F.A. 1275
Lindsiey D.H. 328, 329, 1139, 1162,1163,
1184-1187, 1237, 1249, 1371, 1372
Lipschutz M.E. 1075, 1076
Lombard R.H. 113
Love ring J.F. 1251
Lown D.A. 1331 ’
Lungu S. 470, 720
Luth W.C. 842, 1163, 1164, 1183, 1184, 1240, 1477,
1518, 1519, 1521. 1580-1583. 1651-1653, 1675
MacChesney J.B. 353, 439, 658, 691, 902, 1017
MacCormack K.E. 1322, 1323
MacDonald G.J.F. 1432, 1464, 1510, 1517
MacDowell J.F. 383
MacGregor I.D. 1170-1172, 1175, 1217-1221,
1233, 1234
MacKean B.E. 375
MacKenzie W.S. 1238, 1239, 1585-1590, 1621,
1622, 1655
Maddocks W.R. 237, 297, 315, 434, 672, 673,
924
Maetz H. 883
Major A. 1203, 1205, 1207, 1214
Majumdar A.J. 1388, 1409-1411
Manghnani M.H. 1514
Marota D. 933
Marples J.A.C 544
Marshall D.R. 1338
Marzullo S. 615
Mason B, 430, 442
Massazza F. 543
Masse D.P. 350, 619
Matsumoto K. 614
Matsumoto T. 1149, 1150, 1194
Matsushima S. 1385, 1420, 1421
Mauer F.A, 446
Maxwell L.H. 387, 398, 478
McDaniel M.L. 1064
McGlashan D.W. 256
Mcllvried K.W. 712
McMurdie H.F. 408, 446, 480, 557, 592, 739
McNally R.N. 371, 423
McTaggart G.D. 724
Mehta J.M. 238
Meis el К» 109
Melson W.G. 1*724
Merrin S. 1460
Merwin H.E. 113, 131, 319, 373, 432, 586, 1175
1485
Metz P.W, 1702, 1707, 1722, 1723, 1725
Meyer Ch. 1658, 1659
Meyer J.W. 1393
Michels A. 1318A, 1320, 1322
Miller J.P. 1736, 1737, 1771
Miller R.O. 104, 1081, 1100
Milligan W.O. 319, 630
Misra S.K. 367
Miyashiro A. 835
Moh G.H. 29, 55, 140—146, 155, 217
Momin A.C. 444
Mondain-Monyal P. 27 (t.)
Мопкетеуег К. 952, 953
Moreau J. 136, 137, 153, 158
Morey G,W. 1402-1404, 1433, 1450, 1719, 1720,
1772
Morgan R.A. 39*5
Morris A.E. 710, 711
Morse S.A. 1591
Muan A. 320-322, 342, 343, 350, 353, 356, 370-
375, 404, 405, 407, 419, 420, 424, 439, 441,
450, 461, 490-494, 502, 503, 510, 556, 572,
619, 622, 623, 626, 650, 651, 655, 658, 678-
682, 690-693, 709-711, 827-831, 871-877,
895-903, 1017, 1138, 1144
Mueller M.H. 476
Mukerji J. 907
MUller H. 928
Muller O. 1311, 1316, 1317
Mumpton F.A. 721, 722, 1454, 1455
Munoz J.L. 1165, 1186, 1187
Munster A, 6
Murad A.B. 674-676
Murthy M.K. 518
Myers J.R. 546
Nacken R. 920, 925, 926, 932, 934. 936
Nafziger R.H. 1371-1374
Naldrett A.I. 176, 181, 182, 203, 204
Nally R.H. 371
Nathan M.W. 2,3
510
Nelson B.W. 14 96
Noufville J. 1249
Neuhaus A, 1131, 1270, 1386
Neumann G. 98
Nevitt M.V. 3 58
Newton R.C. 1054, 1070, 1133, 1181, 1287, 1397-
1400, 1420, 1464, 1538, 1539
Nielsen J.W. 661
Niggli P. 916, 992, 997
Nishikawa M. 1440-1442
Nisioka U. 817, 818, 887, 888, 893
Nitsch K.H. 1462, 1465, 1471
Nolan J. 1567-1569, 1627
Northrop D.A. 1291-1295, 1297
Nowak E.C. 13-29
Nunninghoff R. 406, 449, 575
Obrowski W. 316
Obst K.H. 382
O’Hara M.J. 1222, 1225, 1229, 1261
Oelsen W. 883, 938
Ober H. 247
Olsen E. 1363, 1550
Orr R.L. 1181
Orville P.M.’ 1379
Osborn E.F-. 372, 413, 452, 487, 498-501, 551-
553, 577-579, 584, 604-606,696, 697, 698, 742,
764-769, 771, 772, 774-780, 782-784, 790,
877-880, 895-901, 1166, 1200, 1387, 1394,
1408,1412-1414, 1422, 1423, 1522-1524, 1706
Qsugi J. 1100
Owens В.Б, 1300, 1301, 1303
Page R.A. 939
Paladino A.E. 331
Paris R. 27 (t.)
Parlee N. 33
Parravano N. 246
Pascal V. 965, 968
Patzak I. 382
Peretti E.A. 1321
Perez G. 85
Peters T.J. 1507, 1518, 1519, 1675
Phillips B. 376, 404, 405, 441, 414, 534, 616,
650, 651, 873-876, 1138
Pianelli A. 4
Pidgeon L.M. 105
Piechowich T. 57 (t.)
Pietzsch C. 1093
Pierre St. 488, 809, 810, 919, 923
Pinch H.L. 940
Pistorius C.W.F.T, 1263, 1265, 1269, 1271, 1273,
1276, 1281-1283, 1299, 1300, 1304-1310,
1312-1315, 1328A, 1388, 1411, 1424, 1428,
1432, 1435, 1438, 1451, 1453, 1461, 1463,
1745-1749, 1758, 1759
Pistorius M.C. 1328A
Piwinskii A. 1647, 1673
Plato W.Z. 12, 955, 963
Poggiale 9 (t.)
Posnjak E. 319, 559-570, 1024, 1186
Presnail D.C. 1324, 1325
Prince A.T. 484, 485, 743-747, 789, 816
Proger H. 927
Prokopowicz T.L 857-859
Puhan D. 1725
Pushin N.A. 947
Pustelnik W. 57 (t.) .
Quercigh E. 245
Qureshi M.H. 536, 610-613
Rahmel A. 345
Raj da B. 10
Ranganathan T. 375
Rankin G-.A. 373, 377, 1175, 1485
Rao M. Ramakrishna 736-738
Rapoport Е» 1276, 1282, 1302, 1303
Rasumowskaja LW. 905, 906
Raub E. 12
Reamer H.H, 1094
Redd R. 14 (t.)
Reeds W. 548, 549, 550
Rees W.J. 422, 496, 497, 867, 868
Reusch H.J. 367. 415
Reynolds D.S. 922
Ribbe P.H. 371
Riboud P.V. 407, 419, 450, 678-682
Richards R.G. 327, 328, 420, 504, 621
Richardson S.W. 1133, 1502, 1536, 1537, 1578,1579
Ricker R.W. 577
Rieck G.D. 339, 340, 357
Riewald P.G. 238
Rince J. 45
Ringwood A.E. 700, 1072, 1073, 1146, 1151,
1170, 1171, 1203, 1205, 1207-1214, 1243,
1258-1260, 1576
Robbins C.R. 408, 557, 592
Robertson E.C. 1180, 1510, 1517
Robertson J.K, 1470, 1478, 1479
Robinson W.O. 39, 42 (t.)
Roboud P.V. 450
Rockett T.J. 393
Roedder E.W. 666, 834
Roeder P.L. 498-501
R’offdieter G. 21
Roiter B.D. 331
Rooymans J.M. 1102
Roseboom E.H. 25, 26, 27, 114, 129, 130,
1176, 1180, 1506
Rosenberg P.E. 1285
Rosenquist T. J. 30, 109, 161
Rosenthal W. 110
Roth R.S. 615, 1012, 1016
Roth W.L. 1137
Rowe J.J. 1402
Roy D.M. 372, 489, 524-526, 590, 591, 1166.
1201, 1394, 1413, 1414, 1425, 1427, 1428,
1430, 1454. 1455,- 1497. 1499. 1706
Roy R. 104, 242, 372, 380, 381, 383, 413, 415,
118, 425, 460, 445, 466, 473, 489, 522, 604-
606. 721. 722, 826, 1068, 1081, 1100, 1116,
1117, 1119-1122, 1128, 1129, 1153, 1166,
1215, 1216, 1262, 131.1, 1316, 1317, 1369,
1370, 1388, 1391, 1394, 1409-1414, 1422,
1423, 1425, 1428, 1467, 1469, 1496, 1497,
1499, 1522-1524, 1570, 1571, 1706
Royal H.F. 364
Ruppelt A. 943
Rutherford M.J. 1379-1382
Saalfeld H. 519, 521
Sabatier G. 1656
Saha P. 1457, 1458, 1515, 1520
Sand L.B. 1522-1524
Sandltow D.S. 905, 906 •
Saran E. 415
Sarver J.F. 362, 455, 694, 702, 1147A
Sata T. 885, 886
Savel K. 6
Saxer R.K. 546
Sawamoto T. 614
Sborgi U. 33, 34, 38 (t.)
Scace R.L 14
Scarfe C.M. 1163, 1476
Schafer M.W. 346, 347
Schairer J.F. 431, 435, 436, 487, 509, 512-
517, 523, 530-532, 581-583, 559-570, 588,
589, 668-671, 689, 730, 731-735, 742, 748,'
763, 790, 792, 831, 836, 838, 839-841, 843-854,
864, 878-880, 881, 882, 64 (t.), 1162, 1163,
1183, 1186, 1189, 1194-1196, 1200, 1204. 1223,
1241, 1242, 1247, 124^, 1483, 1521, 1559,
1560, 1596-1598, 1600.1615. 1655
Scheidegger R, 98
Schench H. 406, 449, 575, 667
Schenck R. 72, 239, 250, 259, 260, 273, 295,
1144
511
Schlaudt C.M. 524-526, 590, 591
Schlegel H. Ill
Schmahl H.G, 318
Schneider W.G. 1322, 1323
SchodderG.F, 247
Schol K. 53, 5*4
Schrader R. 1093
Schreyer W.' 523, 1487-1492, 1497, 1498, 1501-
1503, 1534, 1578
Schromek N. 723
Schuhmann 436
Schumann K, 1726-1728
Schutze H. 57. (t.)
Schufle J. A. 43
Schwordtfcger K. 1144
Scinner B.J. 266
Scott G-.J. 1064
Scroger M.G. 414
Seabrook M. 1243
S ecrist D.R, 16
Segnit E.R. 458, 608, 704, 705, 773, 791, 819-
824, 1323, 1625, 1736-1738, 1772
Segnit R.E. 1472-1474, I486
Seidell A. 6, 7, 45, 58, 59 (t.)
Seifert F. 1501, 1502, 1534, 1579
Seki Y.“ 1456, 1477, 1480-1482
Seleck F.T. 1111
Sennelt F.E.' 615
Seybolt A.U. 332
Shairer J, 36 (t.)
Sharp W.E.~ 1772-1775
Shaw H.R.' 1324, 1325, 1483, 1484
Shepherd 377
S hie ver J.W. 58 *
Shloemer H? 1702, 1708
Shozaburo S. 1338
Silber P. 948
Sirr.cn F. 10?7
Simpson D.R. 241
Skinner B.J. 17, 63, 65, 296
Slack G.A. 14
Smalley r/g; 805
S milt ens J. 330
Smith D, 1208, 1209
Smith Y.R. 1476, 1562, 1593, 1594, 1609-1612,
1655
Smith J.V. 855, 856, 1181
Smith F.G- 1392
Smith F.H, 1680
Smith S. 55 (t.)
Smothers W.J. 62 5, 865
Snow R^B. 436, 527, 528
Somanchi S. 69 .
Bomiya S, 342, *343, 420, 441, 461, 492, 493
494, 622, 626, 690
Sosman R.B. 319, 363
Sourirajan S. 1352, 1461, 1463, 1760—1765
Sowman H.G.4 725
Speakman K. 1429
Speidel D.H. 424, 6.40, 641-643, 1371-1374
Spengler O.J. 1476
Spivak J. 799-800
Stager R.A. 10?0
Starrs B.A. 979
Steierman B.L. 477, 479
Stemprok M. 93, 94
Stewart D.B. 1466, 1476, 1483, 1562, 1593-1595,
1609-1612, 1655
Stewart Y.R. 1552
Streett W.B. 1355, 1356
Strett K.F. 1059
Strickler D.W. "826
Strong H.M. 1060, 1078
Stubbs M.F. 43
Sfubican V.S/ 1262
Sullivan B.M. 446
Susse C. 1065
Sumida W.K. 323-326, 507, 508
Suzuki H. 389
Syono J. 1124, 1136, 1140, 1141, 1146, 1206,
1576, 1631
Tait D.B. 782-784
Takahashi T.‘ 1061
Takahashi Y. 97
Takenouchi S, 1340-1343, 1349-1351, 1360, 1361
1436
Tamman G. 938, 943, 1065, 1320, 1753
Taylor H.F, 1431
Taylor R.W. 656, 657, '660
Teeple J.E. 3, 20, 52, 73 (t.)
Thirsk H.R. 1331
Thompson A.J. 43
Thompson R.N. 1586-1590
Thompson Th.* 47 (t.)
Thoret Joan 463, 464
Tikkanen M.H. 408
Tilley C.E. 881, 882, 1251, 1600, 1654, 1655
Todd S.S. 1181
Todheite K.Von 1344, 1357, 1689
Tomczak I. 911
Tomonari T, 1120
Tomlinson J.W. 909
Torkar K.‘ 1386
Toulmin P._ 1097
Trofften P.F. 41
Trdjer F.J. 1135
Trdmel G. 382, 922
Trzebiatowski W, 397, 600-602
Tu K,C. 1408
Turkdogan E.T. 924
Tunnel G, 45, 1108-1110, 1742
Turnock A.C, 329, 1159, 1160, 1384, 1563,
1564
Tuttle O.F. 80-8, 856, 914, 1092, 1163, 1200,
1239, 1240, 1278A, 1288 1289, 1389, 1390,
1430, 1434, 1435, 1436, 1438, 1448, 1449,
1476, 1483, 1484, 1518, 1519, 1521, 1533,
1585, 1586, 1592, 1626, 1651-1655, 1670,
1671, 1675, 1682, 1683, 1688, 1690, 1694,
1698A, 1700, 1701, 1703-1705, 1711, 1730-
1732 1734, 1739, 1740
Tydings J.E. 1077
Ulmer G.C. 625
Urbain G. 38
Valpy G.W. 1464, 1513
Vanfleet H.B. 1053
Van Hoff 47, 50, "69, 70 (t.)
Van Hook H.J. 60, 67, 252, 253, 447, 639, 662-
665, 832, 833
Van Klooster H.S. 57, 1044
Van Vlack L.H, 238
Velde B. 1469, 1577, 1618-1620, 1625
Verkaeren J, 136, 137
Vezzoli G.C. 1068
Viaene W. 136, 137, 158
Villard M.P. 1349
Vincent F.A, 354
Vodar B. 1065
Vogel R. 21, 86-89, 196-200, 218-224, 300-303
Vogler H. 295
Vogt Th. 950
Vollmer H. 28
Waale К.Ё. 1362
Walter L.S. 1345, 1532, 1695-1697, 1703-1705
Warne S.St. 1321
Warshaw L 376, 425, 473, 534
Washington J. 1 (t.)
Wasscher J.D. 247
Wasserburg G.J. 1397-1400, 1402, 1405, 1406
Wartenberg H, v, 367, 415, 416, 417
Watt L.M. 630
Webster A.H.* 351, 352
Weeks W.F. 1530, 1691
V’ehmeier F.H; 58
Weill D.F? 1403, 1404, 1416
Weisenkom H.H. 218-224
Weiss P, 944
512
Weissberg B.G-. 1108, 1109, 1110
Welch B.J. 909
Welch J.1L 379, 409, 411
Wellman T.R. 1675-1677
Wells R.G. 1(t. )
Wells L.S. 538
Wontorf R.H. 1079
Wcrnick J.II. 251z 255, 257
Weymouth J..H, 791
White W.B. 242, 418, 445, 460, 466, 712,
1116, 1119-1122, 1129, 1311, 1316, 1317,
1684, 1685
White Gr.D. 617, 618
White J. 319, 321, 328, 333, 336-338, 355, 370,
420, 428, 432, 437, 495, 504, 505, 506, 554,
555, 620, 621, 624, 634, 635-638, 647-649,
677, 683, 684, 811-815, 869, 970, 884, 1006,
1018
Wiebe R. 1324, 1325
Wiesenkom H.H. 218-224
Wilde W.T. 422, -496,- 497
Willshee J.C, 370, 505, 506, 647, 648
Willems H.W.V. 689
Winkler H.G-.F. 1290, 1298, 1462, 1471, 1707,1725
Witters J. 1294, 1295
Wojciechowska J. 600, 601, 602, 701
Wollast R. 448
Wones D.R. 328, 1144, 1324, 1325, 1366, 1367,
1372, 1375-1379, 1381, 1383, 1571, 1617,
1623-1626
Woodhouse D. 333, 432, 649
Woodbury II.H. 62
Weight W.V. 15, 377
Wyart J. 1656
Wyllie P.J. 1179, 1277, 1280, 1389, 1390, 1470,
1478, 1479, 1506-1508, 1514, 1527, 1528,
1647, 1660-1668, 1670, 1671, 1673, 1674,
1683, 1692, 1698-1701, 1703-1705,- 1709, 1710,
1712-1718, 1732, 1734, 1739, 1740
Wynne-Jones 1331
Yagi K. 509, 831, 1657
Yamada H. 389
Yamauchi T. 389
Yasuno F. 541,’ 542, 728
Yavorsky P.J. 477, 479
Yoder H.S., Jn 32, 483, 797, 798, 864, 866, 881,
882, 1085, 1086, 1087, 1088, 1090-1092, 1105,
1106t 1127, 1161, 1191, 1195, 1196, 1199, 1227,
1230-1232, 1235, 1236, 1241, 1242, 1247, 1251,
1432, 1440-1443, 1451, 1461, 1469, 1476, 1484-
1488, 1491-1495, 1497, 1498, 1500, 1531-1533,
1552, 1554, 1555, 1557-1562, 1566, 1570, 1572-
1576, 1579, 1584, 1593, 1594, 1596-1598, 1600,
1609-1612, 1615, 1654, 1655, 1733
Yozawa Zkkira 278
Yumpertz E. 1131
Yund R.A, 36, 47, 48, 78-82, 115-122, 124, 335
Zambonini F. 547
Zofelt B. 927
Zurbrigg H.F, 167-169
СОДЕРЖАНИЕ
Предисловие 3 Карбиды 289
Словарь важнейших терминов 4 Нитриды 290
Типичные сокращения в списках литературы 8 Сульфиды, теллуриды, селиниды 291
Список принятых сокращений 9 Системы из окислов 300
Системы при атмосферном или меньшем давлении 11 Рднокомпонентные 300
Двухкомпонентные 303
Системы, включающие самородные элементы 11 Т рехкомпонентные 309
Системы с карбидами 14 Четырехкомпонентные 327
П оликомпонентн ые 333
Сульфидные системы 15
Разные вещества 335
Двухкомпонентные 15
Т рехкомпонентные 25 <>оли 339
Четырехкомпонентные 72 Арсенаты, ванадаты, вольфраматы 339
Поликомпонентные 88 Галогениды 339
Системы металл-кислород, включающие элементы Карбонаты 342
с переменной валентностью 89 Молибдаты 348
Нитраты 348
Двухкомпонентиые 89 Сульфаты 349
Т рехкомпонентные 91 Хроматы 351
Четырехкомпонентные 103
Системы с летучими компонентами под давлением 353
Окисные системы 104
Фазовые диаграммы летучих компонентов 353
Системы, включающие только окислы 104
Системы, включающие самородные элементы,
Однокомпоиентиые 104 под давлением Н2, О2 и О2 + Н2О 365
Двухкомпоиентные 104
Т рехкомпонентные 130 Системы из окислов под давлением Н2О или П2О
Четырехкомпонентные 191 при заданном парциальном давлении Н 2) 372
Системы, включающие окислы и другие со- Двухкомпонентиые 372
единения 237 Т рехкомпонентные 378
OQQ а Четырехкомпонентные 390
Соли 2ооа Системы из 3 окислов под давлением Н2О
Введение 238а и контоолируемым парциальным давлением
Карбонаты 239 * н 2(02) 411
Нитраты 239 П ятикомпонентные 415
Фосфаты 240 П ол икомпонентные 429
Сульфаты Хлориды 241 244 Разные вещества под давлением Н2О 435
Фториды 245 Окисные системы под давлением СО 2 446
Смешанные галоиды 247 о л о Двухкомпонентные 446
Галоиды - окислы Т рехкомпонентные 448
Галоиды - сульфаты 252 пел Четырехкомпонентные 449
Галоиды - карбонаты 254
Бораты 255 Системы из окислов под давлением Н2О + СО2 451
Хроматы 256 OR *7 Т рехкомпонентные 451
Вольфраматы 25< ORQ Четырехкомпонентные 453
Титанаты 200 П ятикомпонентные 456
Ваданаты 259- 260 П оликомпонентные 457
Молибдаты 259- 260
Разные вещества под давлением Н2О + С02 459
Системы с водой 261-262
Водно-солевые системы под давлением 461
Двухкопонентные 261-262
Т рехкомпонентные 264 Водно-солевые системы с СО2 под давлени-
Системы четырехкомпонентные и выше 271 нием 470
Указатель систем 472
Системы, не содержащие лутучих компонентов при
высоком давлении 284 Указатель минералов и пдрод 497
Самородные элементы 284 Авторский указатель 505
МИНЕРАЛЫ. Справочник
ДИАГРАММЫ ФАЗОВЫХ РАВНОВЕСИЙ
Выпуск 1
Фазовые равновесия, важные для природного
минералообразования
Утверждено к печати
Институтом геологии рудных месторождений,
петрографии, минералогии и геохимии
Редактор Г.Х. Ян.
Редактор издательства И.А. Клинцова
Художественный редактор С.А. Литвак
Технический редактор Л.М. Сурикова,
В.И. Дьяконова
Подписано к печати 6/XI - 73 г. Т - ()1>н71
Усл.печ.л. 64,5. Уч.-изд.л. 70,17
Формат 60 х 90 1/8. Бумага офсетнлн Ы» I
Тираж 3000 экз. Тип. 'зак. 648
Цена 5р. 34к.
Книга издана офсетным способом
Издательство "Наука*, 103717 ГСП, Меж жва. J
Подсосенский пер., 21
1-я типография издательства 'Наука', 100014
Ленинград, Б-34, 9-я линия, 12