Текст
УДК 655.642
Получение водорода и водородсодержащих газов / А.В.Степанов. -
Киев : Наук.думка, 1982. - 312 с.
Представлены теоретические основы и технология производства
технического водорода и синтез-газов для получения аммиака,
метанола и других продуктов, а также заменителя природного газа.
Рассмотрен способ паровой каталитической конверсии углеводородов в
трубчатых печах и очистки конвертированных газов. Описаны
конструкции трубчатых печей. Даны основы математического моделирования
процессов конверсии, адиабатических реакторов и трубчатых печей.
Приведены сведения о катализаторах для всех описываемых
процессов и современные технологические схемы получения водорода и
синтез-газов.
Для научных и инженерно-технических работников химической
промышленности.
Ил.95. Табл.24. Библиогр.: 125 назв.
Ответственный редактор A.B.Волынский
Рецензенты И.Н.Карп, Р.Ф.Іаврентович
Редакция химической литературы
с 2803020000-593 445-82 (с) Издательство "Наукова думка",1982
М221@4)-82 ч-/
ВВЕДЕНИЕ
Водород в современной технике является одним из основных
химических продуктов и используется для синтеза аммиака, метанола,
высших спиртов и других органических продуктов, для процесоов
гидрирования в нефтепереработке, в качестве топлива для ракет, как
восстановительный агент в металлургии и во многих других облаотях.
В 1915 г. мировое производство водорода составило около
3150 т/год, в 1925 г. - 135 тыс. т/г., а в 1940 г. - ІІЗІ тыс.
т/год /%/. После второй мировой войны производство водорода
развивалось еще более высокими темпами и к 1970 г. достигло 18 млн. т/год','
а в 1980 г. составило около 22 млн. т/год.
- В настоящее время водород стал настолько широко применяемым
продуктом, что от разработки экономичных способов его производства
зависит дальнейший прогресс таких отраслей промышленности, как
химическая, нефтеперерабатывающая и нефтехимическая,
металлургическая, пищевая, машиностроительная и ряд других [2].
В промышленности водород получают и используют как в чистом
виде, так и в смеси с другими газами, например в виде азотоводород-
ной смеси для синтеза аммиака или смеси Н„, СО и СО„ для синтеза
метанола.
і
В пятидесятых годах до 8O5S производимого водорода
расходовалось на синтез аммиака. В дальнейшем быстро развивалось
потребление водорода в нефтепереработке и в нефтехимии, и доля его для
синтеза аммиака значительно сократилась.
Производство аммиака. Возникнув перед второй мировой войной,
производство синтетического аммиака превратилось в крупную отрасль
современной химии ^уступает по общему тоннажу только производству
серной кислоты. Технология синтеза аммиака является показателем
научно-технического уровня промышленности, так как создание мощных
аммиачных комплексов является результатом достижений металлургии,
машиностроения, энергетики, приборостроения, вычислительной
техники и других отраслей промышленности. Бурное развитие азотной
промышленности диктуется необходимостью удовлетворения населения
земли продуктами питания. На производство удобрений (включая сам ам-
3
миак) расходуется около 80-85/I всем произведенного аммиака, 15-
20JS используется в промышленности для других целей /3,4/.
Мировое производство аммиака в I960 г. составило 13,2 млн.т,
в 1970 - 49,9 млн.т, в 1975 - 58,6 млн.т и в 1980 г. - 80 млн.т.
Следует отметить, что аммиачное производство в 70-х годах в
основных капиталистических странах практически не увеличивало выпуск
продукции. Мировое производство аммиака значительно возросло,в
основном, за счет высоких темпов его роста в социалистических и
развивающихся странах. По выпуску аммиака СССР занимает ведущее место
в мире.
Производство аммиака сосредоточено в настоящее время на
крупных установках производительностью 200-500 тыс.т/год, или 36 -
90 тыс. т/год по водороду.
Производство аммиака отличается большой энергоемкостью. На
современных установках с паровой конверсией природного газа для
получения одной тонны аммиака необходимо 35,6-41,9 млн. кДж тепловой
анергии при теоретическом расходе энергии 18,5 мли.кДд. Это
достаточно высокая эффективность использования сырья (природного газа).
Но она может быть еще повышена иутеы разрайотки более экономичных
энерготехнологических схем, новых конструкций машин и аппаратов и
внедрения более совершенных катализаторов;
В настоящее время наиболее распространенным является
аммиачный комплекс, построенный по знерготехнологическому приншшу и
включающий в себя многорядную труочатую печь паровой конверсии под
давление 3,5-4,0 МПа, шахтный реактор вторичной паровоздушной
конверсии, двухступенчатую конверсию окиси углерода, очистку от
двуокиси углерода, агрегат синтеза и турбокомпрессорнув
установку,работающую на собственном паре. Мощность агрегата I000fI500 т/сутки
аммиака. Такая мощность была достигнута к 1970 г., и в дальнейшем
(до 1980 г.) наращивание единичных мощностей установок не
наблюдалось, хотя полностью разработаны проекты установок до 3000
т/сутки. Строительство их отложено, так как, несмотря на некоторую
экономию капитальных вложений и рост производительности труда,
возникают трудности при эксплуатации.
Производство метанола и других органических продуктов. По
объему производства и многообразию областей применения метанол
является одітім из основных продуктов органического синтеза. Он
служит сырьем для получения большого количества соединений,
содержащих метальные группы: аминов, эфиров, галогенопроизводных и др.
/5/. Половина выпускаемого метанола расходуется для производства
4
формальдегида, на основе которого вырабатываются синтетические
смолы и пластмассы. До 5-10$ его приходится на выработку диметилтере-
фталата, метилметакрилата, уксусной кислоты, растворителей.
В будущем возможно более широкое использование метанола в
органическом синтезе и химической промышленности в целом, а также
применение его в качестве топлива, источника водорода, в
микробиологическом синтезе, для очистки сточных вод и других целей. В
химической промышленности большое значение имеет синтез высших спиртов,
альдегидов, кетонов, кислот и углеводородов на основе водорода и
окиси углерода. Производство этих продуктов потребляет более 5%
водорода и в дальнейшем доля водорода для них будет возрастать.Таким
образом, наряду с синтезом аммиака синтез органических продуктов
является крупнейшим потребителем водорода.
Мировое производство метанола к концу 1980 г. составило около
13 млн.т и по оценкам экспертов будет возрастать на 7—1056 в год,ее- '
ли не произойдет спада в экономике основных капиталистических стран.
Примерно по четверти указанного количества метанола приходится на
СССР и США и 50$ - на все остальные страны, но в настоящее время
уже наметились тенденции к перераспределению производства метанола.
Оно более интенсивно развивается в странах, обладающих большими
сырьевыми и энергетическими ресурсами. В связи с этим повышается
роль нефте- и газодобываюших стран, и международная торговля
метанолом будет расти высокими темпами. СССР становится одним из
основных экспортеров метанола.
Установки по производству метанола являются
энерготехнологическими и могут выдавать тепловую энергию в виде пара на сторону.
В настоящее время строятся метанольные комплексы
производительностью от 300 до 2500 т/сутки C8-250 т/сутки по водороду), т. в.
крупнее, чем аммиачные. Разработаны проекты производства мощностью
до 5000 т/сутки метанола, но строительство их пока проблематично.
В СССР строятся метанольные комплексы мощностью 750 тыс.т/год или
2400 т/сутки, признанные для условий нашей страны наиболее
оптимальными. ¦*
Процессы нефтепереработки и нефтехимии. Водород используется
в процессах гидроочистки от сернистых соединений нефтяный фракций,
гидрокрекинга, гидрирования бензола, гидродеалкилирования,
гидростабилизации пиробензинов и многих других. Особенно быстро
развиваются процессы гидроочистки и облагораживания сернистых нефтей в
целях предотвращения.загрязнения воздушного бассейна. До
недавнего времени для этого на большинстве заводов было достаточно тех-
нического водорода, получаемого в качестве побочного продукта
процессов расщешіения углеводородов и главным образом
каталитического реформинга бензиновых фракций. В настоящее время необходимо
строительство специальных водородных установок.
Значительно возрастает потребление водорода с углублением
переработки нефти: большие количества его необходимы для
гидрокрекинга тяжелых нефтепродуктов с целью получения моторных топлив.Во
всем мире спрос на светлые нефтепродукты растет быстрее, чем доби-
ча нефти. Это обусловливает развитие производства водорода в
нефтеперерабатывающей промышленности.
В настоящее время на основе синтез-газа разрабатываются
промышленные способы получения этилена, этанола, бензина, низших
ароматических соединений^ зтиленгликоля, уксусного ангидрида, ацего-
нигрила. Промышленное внедрение производства названных веществ
будет зависеть главным образом от их экономичности и
конкурентоспособности с традиционными процессами.
Потребление водорода в процессах нефтехимии такхе
увеличивается, но доля его, расходуемая для этих производств, не будет
превышать 10—15/5.
Металлургия и металлообработка. В металлургии широко
применяются восстановительные газы, состоящие из водорода и окиси
углерода, иногда используется технический водород. Замена части кокса в
доменной печи на восстановительный газ увеличивает ее
производительность и приводит к экономии кокса.
Большое количество восстановительного газа требуется при
бездоменном производстве губчатого яелеза. Водород необходим для
получения многих редких и цветных металлов, широко используется в
порошковой металлургии.
Для предохранения металла от окисления в процессах его
переработки применяются защитные среды, содержащие большое количество
водорода. Безокислительный нагрев стали получает все более широкое
распространение.
Водород - моторное топливо и универсальный энергоноситель,
В настоящее время водород в качестве горючего применяется в
ракетных двигателях межконтинентальных и космических рахет.'Адею
использования лсг :,;сого водорода в качестве топлива для ракет высказал
К.Э.Циолковский. Реализация ее содействовала выдающимся успехам в
освоении космоса.
Жидкий водород - превосходное топливо. Удельные тяговые
усилия двигателя на водороде выше, чем на других видах горючего, и
он имеет максимальную мощность на единицу веса. Продуктом его
сгорания является только вода, имеющая малую молекулярную массу.
Благодаря этим свойствам водород, по-видимому, будет широко
использоваться в авиационных реактивных двигателях.
По программе КАСА (США) в 80-х годах для космических
исследований и разработок будет ежегодно расходоваться около 10 тыс.т
водорода. По имеющимся уже проектам в середине 80-х годов должны быть
созданы авиационные водородные двигатели и в конце 80-х годов -
экспериментальные самолеты. Фирма "Локхид" (США) намерена
использовать самолеты с водородными двигателями для рейсов США - Европа -
Ближний Восток.
В настоящее время ведутся работы по использованию водорода
как топлива для двигателей внутреннего сгорания с целью снижения
токсичности выхлопных газов. Фирма "Даймлер Бенц" разработала
проект городского автобуса с запасом водорода в гидридах металлов на
400 км пробега. В Канаде намечается пустить трансконтинентальный
экспресс на водородном топливе.
С экологической точки зрения водород - идеальное
топливо,способное заменить любой вид топлива в энергетике, промышленности, на
транспорте и в быту. Он может быть использован как на небольших
передвижных и на крупных энергетических установках. Во многих
случаях водород способен заменить электроэнергию, кроме того, транспорт
его может быть экономичнее, чем передача электроэнергии. Поэтому
водород может стать основой энергетики будущего /В/.
Сырье и способны получения водорода. Практически весь
получаемый в промышленных масштабах водород образуется в результате
реакций окисления углеводородов или углерода связанным или свободным
кислородом. Не более 2% водорода получается в результате электро- ¦
лиза воды и другими методами. Промышленными способами получения
водорода являются следующие: I) паровая каталитическая конверсия
легких углеводородов с подводом тепла; 2) автотермическая
каталитическая конверсия легких углеводородов; 3) высокотемпературная
кислородная конверсия различных типов углеводородного сырья;
4}кислородная или парокислородная газшіикация твердого топлива;
5)термоконтактные методы разложения углеводородов; 6) электролиз воды;
7) извлечение водорода как побочного продукта процессов нефтерере-
работки и нефтехимии.
Выбор того или иного метода производства водорода и водород-
содержащих смесей зависит от наличия источников сырья и.
экономичности процессов.
В 20-х - 40-х годах основным источником получения водородсо-
держащих газов служили уголь, кокс и коксовый газ;до 18$
водорода производилось электролизом воды. Наряду с этим в 40-х годах
начали применять природный газ и жидкое топливо. В настоящее
время получают из углеводородного сырья примерно 90#
водорода,около 8% - из твердого топлива, а остальное - электролизом воды и
другими способами. Однако в связи с дефицитом углеводородного
сырья процессы газификации твердого топлива снова начинают
привлекать внимание.
Газификация твердых тошшв. Процесс осуществляется в
газогенераторах с неподвижным или движущимся слоем мелкозернистого топлива
(угля, слайда, торфа). В нижнюю пасть аппарата подается воздушное,
кислородное, паровоздушное или парокислородное дутье. Газификация
происходит при температурах 1300-2000°С. В зависимости от состава
дутья и температуры получают газ с различным соотношением .^.Л7/
; Щ : СН^ ¦ Np _ Процессы гаэификащи были разработаны в 30-40-х
годах, они осуществлялись при низком давлении, и для настоящего
времени являются малоэффективными. К началу 70-х годов процессы
газификации были усовершенствованы я построено несколько крупних
заводов для получения искусственных газов, аммиачных и метанольных
установок на угле.
Современные процессы газификации твердого топлива
осуществляются под давлением до 40 ат и являются непрерывными. Освоены
надежные методы золоудаления и очистки газов от пыли. Перерабатываться
могут практически любые виды углей с энергетическим коэффициентом
полезного действия до 90$. Эти процессы находят практическое при-'
мзнение в странах, где отсутствуют источники углеводородного сырья,
в частности в Индии и Юкной Африке. По прогнозам, газификация
твердых топлив к концу двадцатого столетия получит широкое развитие.
Высокотемпературная конверсия углеводородов. Процесс
представляет собой неполное окисление углеводородов с образованием СО и Н^.
Существует несколько разновидностей процесса. Конверсия монет
проводиться кислородом,воздухом,обогащенным кислородом и парокислород-
ной смесью. Реакции протекают в свободном объеме при темпештуре
1300-Т500°С. В связи с практически полным превращением
углеводородов при таких температурах давление процесса можно поднять до 80-
90 ат. Жидкое сырье, которое не может быть испарено, распыляется
в полый газификатор форсунками с помощью парокислородной смеси.
Особенностями процесса, влияющими на технико-экономические
показатели, являются: необходимость использовали технически
чистого кислорода при получении водорода; высокая температура газов
8
на выходе, требующая высокотемпературных установок для
использования тепла газов; в процессе неизбежно образуется casa, и требуются
аппараты очистки; не накладывается ограничений на содержание серы
в исходной сырье. В качестве сырья для высокотемпературной
конверсии могут быть применены любые углеводороды, начиная ст метана
и кончал высокосернястыми мазутами f[/.
Способы высокотемпературной конверсии пригодного газа и
мазута при давлении 3,0 МПа получили некоторое распространение в
промышленности. Перспективной является газификация этим способом
сернистых мазутов в нефтяных остатков, так как легкие углеводороды
могут конвертироваться более экономичными каталитическими сшосо-
йами.
Автотермическая каталитическая конверсия углеводородов. Этим
способом перерабатываются природный, коксовый и некоторые другие
газы. Процесс осуществляется в шахтном реакторе с неподвижным
слоем никелевого катализатора, куда подается предварительно
перемешенная смесь газа, пара и кислорода. Разработанные в 50-х годах
процессы проводятся под давлением до 60 ат при температуре на
выходе из реактора 800-860°С. В зависимости от назначения получают
газовую смесь, состоящую из Но, СО, СО„, сн, и ^ в различных
соотношениях.
Этот вид конверсии получил довольно широкое распространение
в промышленности и оыл в Советском Союзе до середины 70-х годов
основным для получения аммиака и метанола.
Паровая конверсия в трубчатых печах. Этим способом
конвертируются природный газ, сжиженные газы и бензиновые фракции с
температурой кипения до 200°С.
Смесь углеводородов и паров воды подается в реакционные
трубы, находящиеся в топке печи и воспринимающие от нее тепло.Процесс
ведется под давлением до 4,0 МПа при температуре газа на выходе
760-900°С в зависимости от требуемого состава газовой смеси. В
аммиачном производстве конвертированный газ из трубчатой печи
поступает в шахтный реактор на вторичную паровоздушную конверсию.
Процессы проводятся на никелевых катализаторах.
Этот способ конверсии развивается, начиная с 1930 г., к
настоящему времени он достиг значительного совершенства и является
преобладающим во всем мире.
Термоконтактные методы получения водорода. Сущность методов
заключается в том, что при температуре порядка 1300°С на инертной
насадке или при 900-950о0 на катализаторах протекает термическое
разложение углеводородного сырья до углерода и водорода. Внедрен-
9
ний в промышленность процесе двухетадиен: на первой стадии
протекает распад углеводородов, на второй - сжигание выделившегося на ка-
гализаторе кокса и разогрев его /I/. Метод достаточно экономичен,
но процесс является периодическим и распространения не получил.
Электролиз вода. Это единственный промышленный способ
получения водорода, не основанный на использовании топлива; электролиз
вода выгодно отличается от других методов получения водорода
простотой и надежностью технологической схемы, для его осуществления
требуется только электрическая энергия, но он отличается большой
энергоемкостью. В наиболее современных методах электролиза под
давлением требуется 55-65 тыс. квт»ч электроэнергии на І т водорода,
В настоящее время ведутся интенсивные работы по
совершенствованию электролиза. Разрабатываются новые типы электродов и
высокотемпературные схемы с парофазной реакцией в твердой пористой
матрице. Твердые полимерные электрода позволяют повысить термический
коэффициент полезного действия (к.п.д.) процесса до 90$ (вместо
обычного для электролиза 60-70$), общий термический к.п.д. может
достигать 32%. При мощности производства до 3 млн. т/год капитальные
затраты на электролиз ниже, чей на паровую конверсию метана, и в
ряде случаев электролиз может быть более экономичным. Водород иа
базе гидроэнергии получают в Норвегии, Исландии, Индии и некоторых
других странах. Но для крупномасштабных произвоедтв электролиз
может быть конкурентоспособным с другими методами только при дешевой
электроэнергии, что может быть возможно в будущем при развитии
атомной или других видов энергетики.
Выделение водорода как побочного продукта. Во многих
процессах нефтепереработки и нефтехимии имеются отходящие газы со
значительным содержанием водорода. В настоящее время уделяется
серьезное внимание этому источнику водорода. Разрабатываются экономичные
системы низкотемпературного разделения газов и выделения водорода
адсорбционным' методом, с помощью полупроницаемых мембран и др.
В процессе каталитического реформинга образуется водород в
количестве 0,7-2,3 мас.$ от исходного сырья. При производстве
ацетилена на т т его получается II000 -i- 14000 м3 газа, состоящего в
основном из водорода и окиси углерода /7/. В этиленовом
производстве получают метан-водородную фракцию с содержанием водорода
J0-952 /|/. . . ¦
Разрабатываемые способы получения водорода. Исследуется
способ получения водорода путем диссоциации паров вода с твердой
икисью циркония в качестве электролита в обращенном топливном эле-
менте. На катоде такой электролитической ячейки происходит
выделение водорода. На аноде в зависимости от разновидности процесса
выделяются кислород или вода и двуокись углерода при реакции гидро-
ксила с горючим газом. -
Продолжаются исследования металлопарового способа получения
водорода на железном и других контактах. Разрабатываются
непрерывные процессы с движущимся и кипящим слоем контакта в аппаратах
высокого давления.
Представляет значительный интерес термохимическое разложение
воды, протекающее при температуре 8OOt9OO°C. Расщепление воды на
водород и кислород осуществляется по сложному циклу с помощью
введения в него на определенных стадиях восстановителей или
окислителей. Предполагается, что источником тепла для термохимических пик-
лов будет служить атомный реактор ?j. Термохимические циклы
трудно реализуемы из-за протекания побочных реакций.
Дальнейшим усовершенствованием являются комбинированные циклы,
включающие термохимические стадии и электролиз. Для
крупномасштабного производства водорода из воды термохимическими способами
необходим высокотемпературный ядерный реактор. Преспективным для этих
целей считается реактор с движущимся теплоносителем в виде
керамических зерен, нагреваемых до 950°С. Важнейшей задачей является
повышение общего коэффициента полезного действия получения водорода
из воды.
Оценка экономической эффективности способов получения водород-
содержащих газов. Способы оцениваются по затратам энергии и
капитальным вложением на единицу произведенной продукции.
Природный газ может конвертироваться до водорода любым из
рассмотренных выше способов. Сравнение расходных коэффициентов
показывает, что самой экономичной по расходу энергии является паровая
конверсия под давлением в трубчатых печах. Дяя получения 1 т водорода
требуется 3,5-4,S т E,0-6+6 тыс.м3) природного газа в зависимости
от производства (аммиак, метанол, водород), технологической схемы
и других факторов. Общие энергетические затраты составляют 180,0-
230,3 млн. кДа или 6,1-8,0 т условного топлива на І т водорода.
Дяя парокислородной каталитической конверсии природного газа
под давлением энергетические затраты составляют 213,5-272,2 млн.кДж,
т.е. выше приблизительно на 20#. Примерно такие же затраты и при
высокотемпературной копверсии. Но в этих процессах несколько ниже
удельные капитальные вложеквд.
II
Технико-экономический анализ показывает, что наиболее
экономичным является способ паровой конверсии. Несколько хуже, но в
некоторых случаях вполне приемлемы показатели каталитической пароки-
слородной конверсии. Другие способы значительно менее экономичны.
Рассмотрим экономические показат&ли процессов получения водо-
родсодержащих газов из различного сырья: природного газа, нафты,
мазута и угля. Первые два вида сырья подвергаются паровой
конверсии, а последние два - парокиелородной газофикапии. Если за
единицу принять капитальные вложения и энергетические расходы
переработки природного газа, то показатели других процессов будут следующие:
Показатель Газ НаФта Мазут Уголь
Капитальные вложения I 1,2 1,5 2,0
Энергетические затраты I 1,05 1,1 1,5
Эксплуатационные расходы I 1,1 1,3 1,8
По всем показателям самым экономичным сырьем является
природный газ, несколько уступает ему нафта (нефтяные фракции,
выкипающие до 200° С) /9/. Но на выбор сырья оказывают влияние его
запасы и стоимость.
В настоящее время около 80$ водорода (включая синтез - газы)
получают паровой конверсией природного газа и нафты. Но
сокращение мировых запасов иефти и газа и дифивдт их в ряде стран
вынуждают использовать твердое топливо.
В настоящее время в Советском Союзе свыше 90$ аммиака и
метанола производится из природного газа, и в дальнейшем доля его-еще
несколько увеличится. На нефтеперерабатывающих заводах
используются также нефтяные газы.
В связи с быстрым ростом производств, требующих водород,
необходимо разрабатывать новые, более экономичные методы его
получения. Но в настоящее время наиболее актуальным является
усовершенствование и повышение экономичности производств, основанных на
каталитической конверсии природного газа и легких нефтяных фракций-
Этим способам посвящены последующие разделы монографии.
Глава I
СШИОМЕТРИЯ И ТЕРМОДИНАМИКА РЕАКЦИЙ КОНВЕРСИИ
ОТШОМЕТРИЯ ОСНОВНЫХ РЕАЩІЙ
При повышенных; температурах все углеводороды реагируют с водяным
паром, кислородом, двуокисью углерода и водородом по сх.еиам
Спл/гл +O2 — »2 + COrCO2 r M4<-//?u+Ct A.2)
Ооразование углерода (твердой $ььн) происходит только при он
ределенных условишс, которые оудут рассмотрены нияе. В болышнст--
ве случаев конверсия углеводородов происходит б области, где
выпадение углерода термодинамически невозможно, но могут быть
исключения.
Для углеводородов, которые тяжелее метана (.у *¦ 1), эти
реакции необратимы и идут практически до конца. В зависимости от вида
окислителя и условий процесса суммарная реакция монет быть как эк
эотермическои, так и эндотермической. Продукты реакций и водяной
пар взаимодействуют между собой и при достижении равновесия дгшт
состав газа, определяемый только соотношением С:Н:О в реагирующей
смеси и параметрами процесса, состав исходных углеводородов
значения не имеет.
Наряду с образованием газообразных продуктов при некоторых
условиях могут протекать реакции образования высокомолекулярных
соединений, обедненных водородом (смол)
Из условий термодинамики ооразование смол маловероятно
(вероятность близка к нулю), но при низкотемпературной конверсии в не-
13
больших количествах смолы образуются. Основная масса сырья
реагирует по реакциям (I.I - 1.4), а незначительная часть его по A.5).
Образовавшиеся смолы, как и другие углеводорода, газифицируются по
(I.I), но если реакции газификации медленнее реакций уплотнения,
возможно закоксовывание катализатора.
При низких температурах ( t< 400°C) и повышенных давлениях
выход продуктов сильно смещен в стороны образования Щ и СО2 и
результирующую реакцию газофикации можно ставить в виде
(f +iL)^ + (f-f И«
f
т.е. продуктами реакции являются только метан и двуокись углерода.
Стехиометрическое количество воды для реакции и
образовавшихся СН. и Ce?2 зависит от отношения водорода к углероду в сырье
в-~ . Вводя это обозначение, можно написать
Отсюда видно, что пщ ниэких температурах метан с водой
реагировать не бедут (I-? = 0) и COq не образуется.
С уменьшением Н:С для реакции A.6) требуется большое
количество вода
С2Н6 +О^Н2° ~ ;'7/<^ + 0,25СОг
АН = - 237 кДж,
С7Ми + 3,0Н2
АН = -88,7
CaH6 + 4,5 Я20 -^ 3,75 Щ* 2,25С02
АН - '760,9
Практически эти реакции имеют место при температурах не выше 500-
550°С.
Из уравнений A.6) и A.6*) можно вывести ряд важных величин,
которые представлены в табл.1. Теоретический (предельный) выход
метана из различных углеводородов определяется по формуле
дл +2т в+ 23
Ьсн = /2л * m = 12+В ' A.7)
где п и m - индексы в формуле соединения; 3= т:п.
14
При высоких температурах ( е =- 120О°С) реакции практически
идут до образования только /? и СО
2 )//2. A.8)
С уменьшением отношения т: п в сырье образуется
относительно большее количество СО и меньшее /%
Щ + Н2О —СО+ ЗНг дН = +2О6, 4
С2Н6 2 2
CsHs+6H20^6CU+9/t2 i*=+704,9
Теоретический (предельный) выход продуктов из различных
углеводородов составляет
% Л {«г/*г ?„»„], A.9)
28п ,
$СО '- f2„+m С«г/кг Сл »ml- AЛ0)
Соотав газа и выход продуктов дан в таол.1. Максимальный
выход водорода 37,5 кг) получается при конверсии метана. Из
бензиновых фракций образуется около 30 кг водорода на 100 кг сырья.
Дополнительное количество водорода может быть получено путем
конверсии имевшейся в смеси СО до ЛЯ, водяным паром. Реакция
конвероии СО идет до конца только при низких температурах, и
тогда получки суммарную реакцию
птг^г
пСО +7i/f2O-^ пСО2 + пн9 (t<2М>°О
?„Нт * 2'* Л
\O-nCBL +Bп+%)»2-
Для индивидуальных углеводородов получаем
ные реакции:
Щ +2*2°
СгП6 +4fy
с7н№ + м.
С?Не + /2 А
Предельный выход
—•- Щ + 4^2 &н
0 — 2СО2 * 7Н2 лМ
tyu—- 7С0^ + iify 4"
<jO—•~SC02+t5rt2 u/V
водорода определяется по
Vu* m Ч + В
следующие
= +164,9
= +264,9
= +818,5
= +457,7
формуле
CI.II)
суммар-
кДж,
кДх,
кДх,
кДх
15
При конверсии метана он составляет 50 кг на 100 кг ^ ,а при
конверсии бензиновых фракций - 43-44 кг. Следовательно наиболее
предпочтительным сырьем в производстве водорода является метан,но
и жидкие углеводороды дают достаточно высокий выход /?.
Для получения газа требуемого состава, например для синтеза
метанола, в сырье вводится углекислый газ и осуществляется процесс
параутлекислотной конверсии. В этом случае кроме реакции A.8)
протекает реакция
nm2~2»CO+ft/2. Q.I3)
Как и при паровой конверсии, реакция (I.I3) с метаном обратима,
остальные углеводороды конвертируются полностью
СИ^ * Cu2 =*= 2СО +2Нг &N = +247,3 кДк,
C2Hg + 2CU2 —- 4CU + Щ Art = +429,7 вДж,
7C0Z ~~ Г*Са *SHZ л// - +1395
ff 2 Г2С0 +Srt2 a M = +952
Сравнивая реакции A.8) и (I.I3), видим, что при утлекислот-
яой конверсии водорода образуется значительно меньше, чем при
паровой.
Для осуществления автотермичности процесса и для получения азо-
товодородной смеси для синтеза аммиака проводят парокислородную и
царо-кислородо-воздушную конверсию углеводородов или газов
конверсии из трубчатой печи. Кислород реагиреет с углеводородами до
образования СО, СО2, #2 и 'Н2О
Т^ (І-І4)
т 22^н2О. A.15)
Реакция (І.І4) и (І.І5) практическж необратимы и протекают
одновременно, преобладание той или иной зависит от количества
окислителя и параметров процесса. Реакции высоко экзотерничны и могут
служить источником энергии для осуществления эндотермических
реакции, например A.8) и (І.ІЗ). Для индивидуальных углеводородов
имеем
О,5Ог —- СО + 2Н2 АА/= -35,6
202 —- СОг * 2Н2О &Н= -318,7 кДі,
+ On —•- 2С0 + 3#2 а# - -303,9 дДж,
+ 5,5О2 —¦ 2СО2 * 3ft2O aH = ,702,3 дДд.
16
Таблица I. Предельный выход продуктов при конверсии углеводородов и углерода
Сырье
їизкотемпературная конверсия
Состав
смеси.
сн4 со2-
Расход
?Е_ кг
100
водорода
Выход
продуктов
кг/100 кг
углеводорода
сн4
со2
Высокотемпературная конверсия
A.8)
Состав Расход
смеси, НоО,
об.* J _
сн4
С02^°
дорода
Выход
продуктов,
кг/100 кг
углеводорода
CHg
Н2
Суммарная конверсия
Состав
смеси,
со2
Расход
ST-кг
100
углеводорода
Выход
продуктов,
кг/100 кг
утлеводо-
пола
Н2
сн.
С4НЮ
С5Н12
С6Н14
С7Н16
С6Н12
100 0 0 100 0 25,0 75,0 112,5 175,0 37,5 20,0 80,0 225,0 275,0 50,0
87.5 12,5 30,0 93,3 36,7 28.6 71,4 120,0 186,7 33,3 22,2 77,8 240,0 293.4 46,6
83,3 16,7 41,0 91,0 50,0 30,0 70.0 122.8 191,0 31.8 23,0 77.0 295,6 300,0 45,6
'81,3 18,7 46,5 89,656,8 30,8 69,2 124,0 183,031,023,576,5 248,0 303,2 44.8
80,0 20,0 50,0 89,0 61,2 31,3 68,7 125,0 194,4 30,6 23,8 76,2 250,0 305,6 44,4
79,2 20,8 52,4 88,4 63,9 31,6 68,4 125,6 195,4 30,2 24,0 76,0 251,2 307,0 44,2
78.6 21,4 • 54,0 88,0 66,0 31,8 68,2 126,0 196,0 30,0 24,1 75,9 252,0 308,0 44,0
75,0 25,0 63,4 85,7 78,6 33,3 66,7 128,6 200,0 28,6 25,0 75,0 257,2 314,2 43,0
62,5 37,5 104,0 76.9127,0 40,0 60,0 138.5 215,4 23.128.6 71,4 277,0 338,6 38,4
50,0 50,0 150,0 66,718аЗ 50,0 50,0 150,0 233,3 16,7 33,3 66,7 300,0 366,7 33,3
?6H6+7,302—~SCO2*3H20 ufi-- -2443,9 кДд,
C?HJ6 *3,5O2^7CO +dfi2 &M = -585,7 кДд.
^7^ * /?02 ~~ Щ *~OH'tu afi = -2566.7 йД*.
Предельный выход водорода при кислородной конверсии
составляет
% 7г^ AЛ6)
Например, для метана он равен 0,25, а для гептана 0,16 кг/кг сырья,
что значительно меньше, чем при паровой конверсии.
Если образовавшуюся по реакции (I.I4) CD подвергнуть затем
низкотемпературной конверсии водяным паром, то предельный
суммарный выход водорода
Обычно в сырье для конверсии добавляется водород, кроме того,
он образуетсяпо реакциям A.8), (I.I3) и (I.I4). В этих случаях
кроме перечисленных выше реакций происходит конверсия
углеводородов водородом, или гидрокрекинг
Спнт + Bn-j)Hz - пСН^. (I.I8)
Например,
С1Н6 + "г ~~~ 2Cfi4 &/i = -65,3 кДх,
С6/іц + 5H2—~-SCfy й/і = -281,6 йД»,
С Hg +9М2 ——6СН, uH = -531,7 кДж.
Реакции гидрокрекинга идут с большим выделением тепла.
При низких температурах и повышенном давлении из СО и /?
могут образовываться сложные органические соединения, главным
образом метанол и формальдегид
СО + Н„ =г=т СН2О.
Но в процессах конверсии эти реакции почти полностью сдвинуты
влево, и в некоторых случаях можно обнаружить только следы
органических кис.^ родео держащих соединений.
При высоких температурах ( t * 1300°С) становится заметной
диссоциация молекул. Возможно также образование окислов азота. Но
при каталитической конверсии ( t < 1200°С) эти реакции не имеют
существенного значения.
18
Рассмотренная стехиометрия реакций позволяет найти предельно
возможные выходы продуктов. Действительный состав продуктов
конверсии определяется термодинамическим равновесием и кинетикой процесса.
ТЕРМОДИНАМИЧЕСКИЕ УСЛОВИЯ ВЫПАДЕНИЯ
СВОБОДНОГО УГЛЕРОДА
Образование свободного углерода приводит к зауглероживанию
катализатора. Поэтому процессы конверсии углеводородов необходимо вести
в области параметров, при которых термодинамическое образование
углерода невозможно.'
Углерод может образовываться по следующим реакциям:
С +C0, АН = -172,5 КДж, (I-19)
2СО
CH^zs^ с + 2М2 ьн = 74,8 КДж, A.21),
а также в результате термического пиролиза углеводородов по схеме
Сп »т * "г + С»4 + Z €п' "m' + С' <1-22)
Термодинамическая возможность выпадения углерода
определяется знаком свободной энерпш реакции
aF-.RTlr,^- , A.23)
где Л - константа, определяемая подобно к , но по
действительному составу смеси.
При &F<0 возможно выпадение углерода, при uF^u углерод
не выделяется; uF ~0 соответствует граничным условиям.
Константы равновесия реакций (I.I9)~(I.2I) представлены на
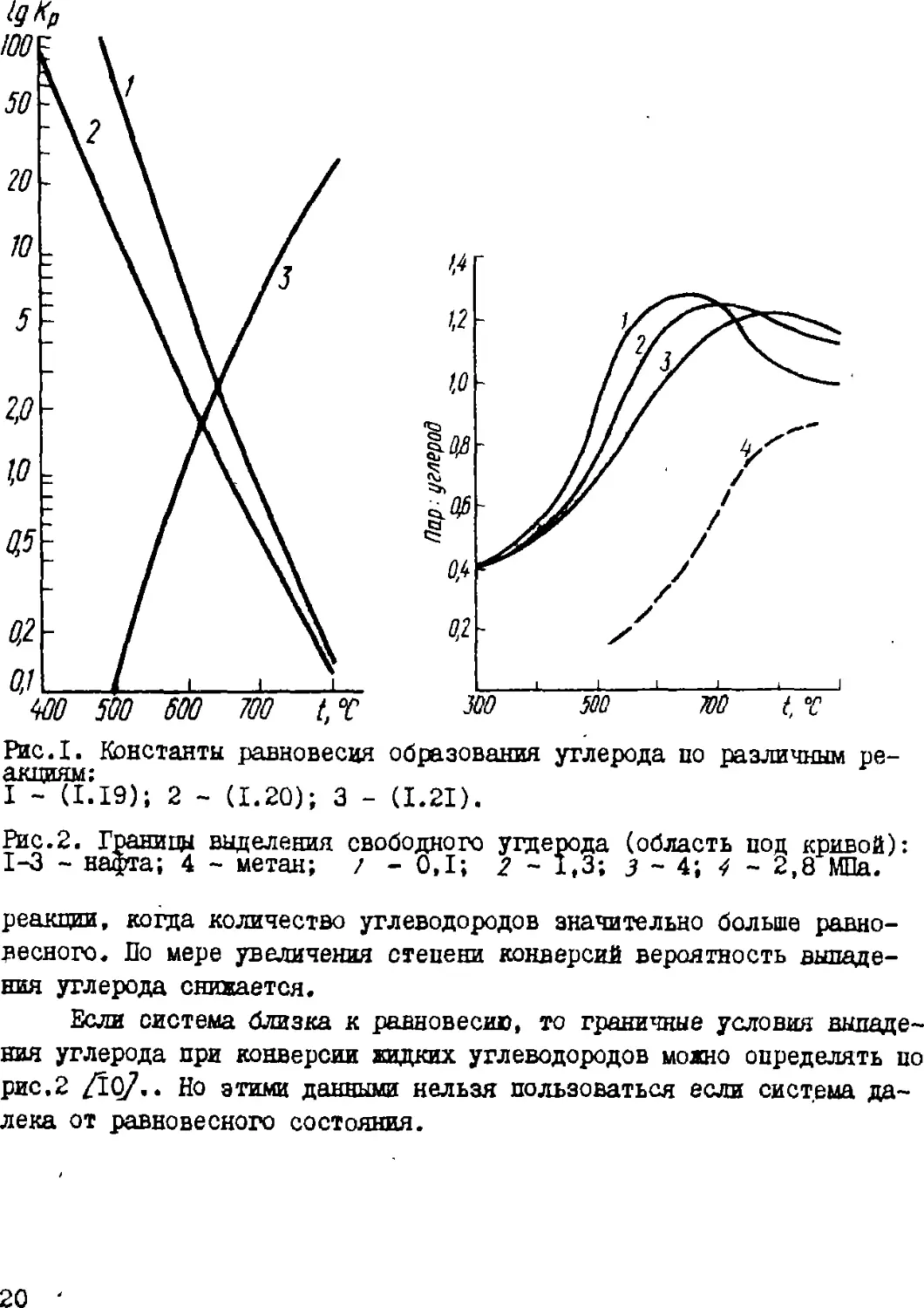
рис. ІДО/. При конверсии метана водяным паром при атмосферном
давлении граница выделения углерода {&Р=& ) соответствует
отношению СН^ : НгО = 1,1, в исходной смеси при 727°С, 1,0 при 827°С и
0,9 при Ю27°С.
Из возможных реакций (І.І9)-(І.2І) наибольшее значение с
точки зрения термодинамики шлеет реакция (І.І9), так как она быстрее
других достигает равновесия. И если РСд .• Ррд меньше
равновесного значения,то неизбежно отложение углерода /II/.
При конверсии углеводородов тяжелее метана должна
рассматриваться также реакция-A,22). Как следует из уравнения A.23),
наибольшая вероятность выпадения углерода будет в начальной стадии
19
г
W 500 600
300
500
t, Г
Рис.1. Константы равновесия образования углерода по различным ре-
I - (ІІІ9); 2 - A.20); 3 - (І.2І).
Рис.2. Границы выделения свободного угдерода (область под кривой):
1-3 - нафта; 4 - метан; / - 0,1; 2 ~ 1,3; з ~ 4; 4 ~ 2,8 МПа.
реакции, когда количество углеводородов значительно больше
равновесного. Do мере увеличения степени конверсии вероятность
выпадения углерода снижается.
Если система близка к равновесию, то граничные условия
выпадения углерода при конверсии жидких углеводородов можно определять по
рис.2 /10/.. Но этими данными нельзя пользоваться если система
далека от равновесного состояния.
20 '
МЕТОДЫ РАСЧЕТА РАВНОВЕСНЫХ СОСТАВОВ
Равновесие в реагирующей системе щ-^о-^-^-
вается в результате следующих суммарных реакций:
устанавлиa.)
і)
и2о-
со +зн2 ,
конверсия метана двуокисью углерода
С)
СО2
2CU
2/tg\
конверсия СО паром
d) CO ¦
образование углерода из СО
є) 2СО
Н20
СО2 +
СО» + С-,
A.24)
образование углерода из метана
f.) СМ^ zf=~ С + 2Н2;
газификация углерода паром
о) С + н20 == СО + А
Зависимости констант равновесия реакций а, Ъ, с и d от
температури, представлены в табл.2, а реакций e,f и ? - на рио.1.
Состав конвертированного газа при достижении равновесия
определяется соотношением С:Н:О в паросырьевой смеси, температурой и
давлением в реакторе. Предполагается, что азот в реакции не
вступает и рассматривается как инертный газ-разбавитель. В основе всех
методов расчета равновесного состава газа лежит решение системы
уравнений равновесия и материального баланса химических элементов
(О, С, Н).
Рассмотрим наиболее общий метод расчета равновесных продуктов,
состоящих из семи компонентов: /?# ^2> ^4» ^' ^2' *2 ' **'
Шесть компонентов газообразных, а углерод образует твердую фазу.
Азот может включать в себя другие инертные газы, что учитывается
его молекулярным весом. Для расчета состава записывается система
из шести алгебраических уравнений. Количество инертного компонента
(азота) в равновесной смеси известно, так как он переходит из сырья
полностью. ¦ . .
Для составления уравнений равновесия можно взять любые
равновесные реакции, но чтобы в них содержались все шесть реагирующих
компонентов ( Н2, СЯ^, Н2О, СО, CO2<t с).
Возьмем реакции.а, с я f.
21
Т а б л и
і.*
200
250
300
350
400
450
500
550
600
625
650
675
700
725
750
775
800
825
850
875
900
925
950
¦ 975
1000
u
a 2. Константы равновесия реакции a, i,
V
4,614-IO2
8,379 -ПГ10
6.378-I0-8
2,483-IO
5,372-IO
8.7І4-ПГ4
9.442-I0
7,741-10
5,029- IO1
1,189
2,626
5,821
I,214-10
2,442'I0
4,753'I0
8,968-10
I.644-I02
2.933-I02
5.I0I-I02
8,666-IO2
1,440-IG3
2,342-I03
3,736-I03
5,850'IO3
8,314-Ю3
10,52 -ПГ10
72,98-КГ9
25,01-І0
5,050'ПГ5
6,285-Ю
63,71-Ю
46.06- ПГ3
26,58-10
12,71-Ю
2,615
5,050
9,931
1,844-10
3,324-10
5,837-10
9,981-10
І.669-І02
29,11-10
43,62'10
68,47-10
І0.55-І02
І5.97-І02
23,81-І02
34.93-І02
47.ІІ-І02
! V
і
2,025-ПГ14
0,966- КГ11
1,626-Ю~9
1,221 -ПГ7
4,591 Ю
1,192 -Ю
1,936-КГ3
2,254-10-2
1,990 -ПГ1
0,540
1,366
3,421
7,002
1,794 10
3,871 -10
8,058-10
І.620-І02
2.955-I02
5.964-І02
10,97-І02
19,65-Ю2
34,33 -І02
58,63-І02
97,97-Ю2
146,7 -І02
V
2.279І02
8,6910
3,922 10
2.034-Ю1
І,І70-І0
7,311
4,878
3,434
2,527
2,199
1,923
1,706
1,519
1,301
1,228
1,113
1,015
9,925-Ю
8,552-Ю
7,901-Ю
7,328-Ю
6,822-Ю
6,372-Ю
5,971-Ю
5,666-Ю
Предполагая, что смесь продуктов конверсии является идеальным
газом, запишем выражения для констант равновесия через парциальные
давления компонентов
5
р р ¦
ра
гсн.
н2о
A.25).
Р*' рСОрНгО Ц.26)
Pf' рсн ' A.27)
Рассмотрим общий метод расчета, пригодный для всех видов
конверсии и любого состава сырья. Запишем уравнение конверсии в виде
спнт+"го+сог
2 4г2 '/У2. A.28)
Сырьем служит любая смесь углеводородов или углерод. Индексы
могут быть целыми, дробными или равными нуле. Обозначим количество
молей вещества до реакции H , а после реакции - / .
Баланс по углероду
ZCH4 + ZCO2 +ZCO+ZC" п\*„ +*СО2 + "СО- A.29)
Баланс по водороду
Баланс по кислороду
В уравнениях A.29) - (I.3I) правые части являются
постоянными, величинами, обозначим их через А, в и С. В выражениях для
констант равновесия A.25) - A.27) от парциальных давлений перейдем
к числу полей компонентов. Получим следующую систему уравнений:
а)
С) ziZZj "V
23
+ZC
e>
(где
р
- общее
Zzi-z/
о + 2гсо.
давление
% +zc^ -
]? + ZCO ''
газовой
смеси)
гсог +
2
Константы равновесия (Kfia, крс, Кр; ) являются
функцией температуры и известны достаточно точно (см.таол.2). Но для
расчетов на ЭВМ рационально пользоваться зависимостью лр - f ( т>-
Удовлетворительные результаты дают уравнение
г9' кра"~ '2- °956 ~20- *J3J'ю~Эт+86, /J33 ю ~6г2 -
р
- 70,5М6- Ю Г 3+ /3,33/3-/U Г4 ,
Iff Кpd =9,58424 -25,5aM-fO~37* 27,4439-X?~*r2- (I-33)
-/І/SSU-/u'CT 3* 2,3572 -ю'*2T 4',
ta К = -// зт2 + 45, /5ua-7u ¦ т - A.34)
У pf
-6 2 -9 ч
-M,06/7 -70 T +2Г.2437-/О T -
A.35)
где T - температура в градусах Кельвина.
Решив систему и определив количество молей продуктов
конверсии, находим состав газовой смеси в объемных процентах
Z/ • ЮО
A.36)
При решении системы уравнений A.32) может оказаться, что
Zc <. О ¦ Это значит, что при заданных условиях углерод не.
образуется. Получаемое отрицательное число показывает, сколько грамм-
атомов углерода нужно добавить в систему до граничных условий
выпадения уїлерода.
Если zc <0 , то из системы исключаем уравление A.32с), а
из уравнения A,32 дО член Zc и решаем систему пяти уравнений
с пятью неизвестными.
24
Существует довольно много методов расчета равновесного
состава. В качестве искомых неизвестных могут быть взяты парциальные
давления углеводородов. В этом случае уравнений будет на одно больше,
так как в результате изменения объема смеси меняется парциальное
давление компонентов и в том числе инертного (Рм ).
Например, дри кислородо-воздушной конверсии или горении
нетана без образования углерода можно записать систему уравнений fl2j
С) Рл/і + Р„л + А, * А, + Рли +Ри п -Р*
bun Си Пл nfc &'% ' "лі/ т / т orj \
dJ{i-2*)Pa — -
С/ ?г /*/) ' /*/}
где кр0[ и А - константы равновесия реакций A.24У) и
A.24 с), р. - парциальное давление компонентов, Р - общее
давление;, а - козф|ЕЦнент избытка (недостатка) окисления; А - доля
кислорода в окислителе.
Практически решение систем уравнений A.32) и A.3?) возможно
только численными методами на ЭВМ. Применимы итерационные методы,
метод Ньютона - Рафсона и др. Универсальная методика решения
системы нелинейных алгебраических уравнений заключается в
следующем.Система линеаризуется путем логарифмирования уравнений. Неизвестными
становятся 1пР{ и уравнения разлагаются в ряд Тейлора до методу
Ньютона. Членами разложения, содержащими производные второго и
высших порядков, пренебрегают. Полученная линейная система
алгебраических уравнений относительно іпР^ может быть решена с помощью
стандартных программ для ЭВМ.
При температурах ниже 1300°С, имеющих место в промышленных ад-
варягах, реакционная смесь состоит практически из пяти или шести
компонентов: Н20, СН^ СО, Д2,, /? и иногда /И, , свободный
углерод не выделяется. В зтом случае расчет равновесного состава можно
существенно упростить. Расчет проводим на один грамм-атом углерода.
За неизвестные примем: л - степень конверсии нетана (отношение
количества углерода, содержащееся в СО и СО2 к общему количеству
углерода) и U - степень конверсии СО (отношение количества
углерода), содержащегося в СО^, к количеству углерода, содержащегося
25
в СО и СО. .Формула любого углеводорода или смеси записывается в
виде СИп , где S = м-, с . Количестве продуктов конверсии будет
равно
/у = 1-х, /?# - Зх +у + 0,5а - 2,
»со --*-У' "Щ = У'
Всего молей: 2х * R + 0,58 +А -1,
где R - числе молей воды на един грамм-атсм углерода (т.е. моль
СИ а ); А - число молей энертнего газа на I грамм-атсм углерода.
В уравнениях A.24# и 1.24 d) вместе парциальных давлений
подставляем мольные доли компонентов и общее давление и получаем
следующую систему уравнений:
(
Ра ~ A)(fi)B+ROa3+AtJ ' A-39)
Значения констант равновесия Кра и к„^ берут из табл. 2
или находят по уравнениям A.33) и A.34).
Приведенная система уравнений легко решается. Уравнение A.40)
является квадратный относительно у
2 2
CKpl R +3х+0,55-2)tVdfoШ- Зху-0,58-2)г -H^pg-'K^X-K^ • л*)'
ht
рь
Задавшись каким-либо значением х@ <х< і) , находим у
.Берется только вещественный положительный корень в пределах о<у*?.
Полученное значение подставляется в уравнение A.39) и
определяется х . Новое значение х подставляется в уравнение A.40) и
находится новое значение у . Расчет продолжается до тех пор, пока
последующие значения х и у не будут совпадась с предыдущими с
заданной степенью точности. Таким способом рассчитывались
равновесные составы даже без применения ЭВМ. В настоящее время система
уравнений A.39) и A.40) решается обычно на мини-ЭВМ различными
способами. Объемная концентрация компонентов
i Зх +у + 0,58 +А -
26
(I.4I)
Таблица 3. Характеристика газов конверсии углеводородов
Исходная смесь
Пар
вер
етры
кони
Состав сухого газа, об.?
/>,МПа
ЛК
CU
}:!
Y
4
4
4
2
°зб
3
3
0,4
2:1
1:1
3:1
4:1
4:1
2:1
2,2:1
2'aif
4:1
6:1
3:1
6:1
6:1
6:1
2,5:1
5:1
5:1
4:1
1,5:1
H
8:8
зо
2,0
2,0
4.0
4,0
30,0
30,0
10,0
10,0
I.О
4.0
30.0
0,05
a,о
4,0
600
600
800
900
1300
800
II00
1300
II00
1300
1200
II00
1000
1300
1200
1000
1200
900
ПОО
900
21,92
1,08
40,51
70,17
76,77
18,63
61,24
68,77
72.13
76,46
69,81
52,47
54,23
70,94
65,67
53,94
65,10
75,98
61,08
16,86
0,03
0,02
0,61
5,05
16,09
1,24
19,46
18,45
10,01
15 87
7 83
4,54
4,94
14,23
13,21
6,90
9,27
7,18
14 53
6 33
5,46
24,98
9,67
13,76
7,13
28,14
12,34
12,73
10,53
7,21
11,62
9,71
27,01
14,33
21,10
14,07
13,68
16,61
21,88
36,88
72,59
73,92
49,21
11,12
0,01
52,00
6,96
0,06
7,33
0,46
10,57
33,28
13,82
0,50
0,02
25,09
11,95
0,23
2,51
39,92
Для примера в табл.З дянн равновесные составы конверсии
некоторых углеводородов.
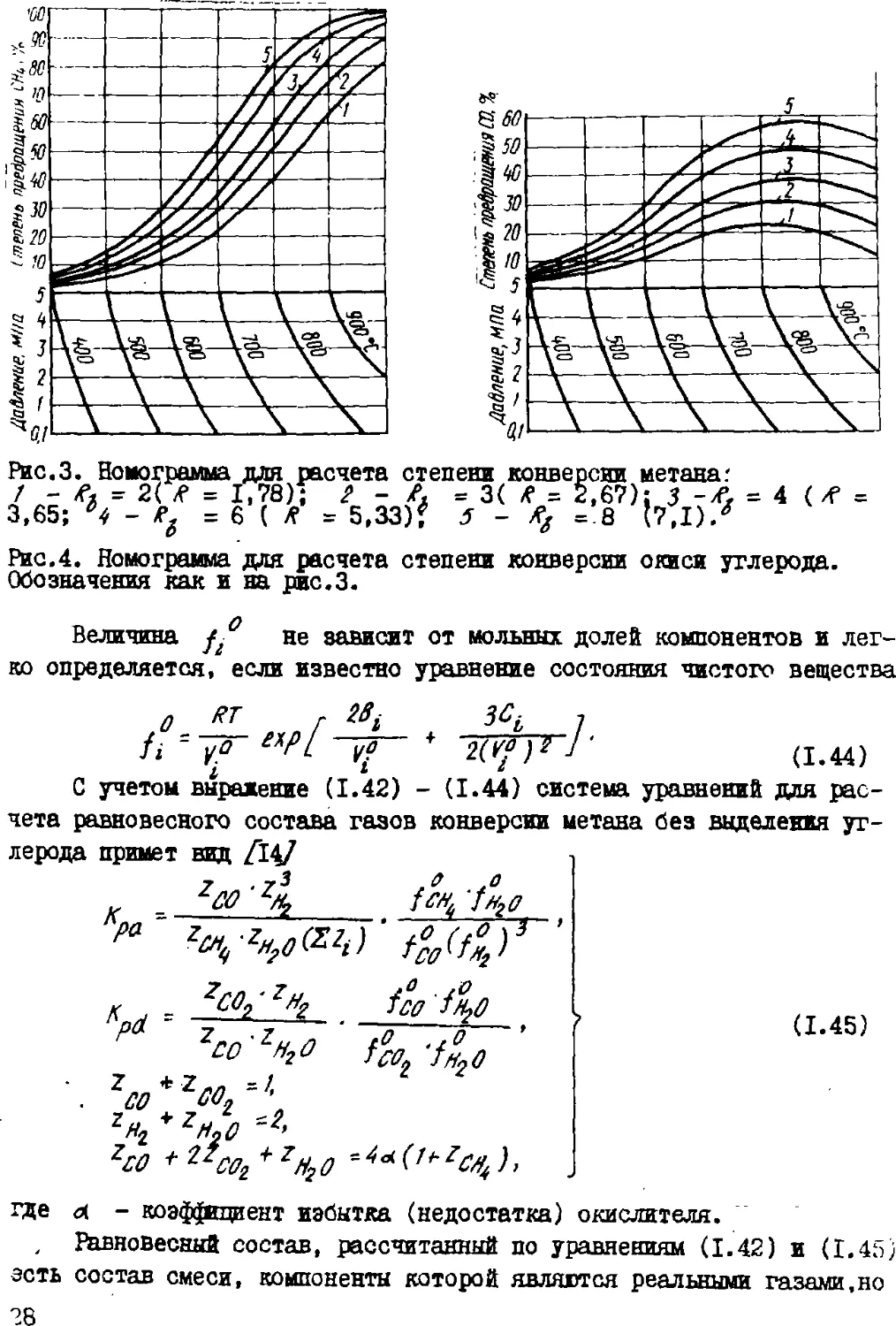
Для расчетов,не требующих высокой точносте, х zy маяно
определять по номограммам, представленным на рис. 3 и 4. По найденный
значениям х и из выражений A.38) и (I.4I) находится число нолей
продуктов конверсии и объемный состав газа.
При давлении выше 10,0 МПа и невысоких температурах свойства
парогазовой смеси уже отличаются от свойств идеального газа. При
расчете равновесного состава необходим учет этих отклонений.
Во всем диапазоне возможных параметров процесса конверсии
овойотва газов достаточно точно описываются уравнением оо вторым и
третьим вириадьными коэффициентами fuj
^ )
Смесь газов можно считать идеальным раствором, и для расчета
летучести компонентов использовать зависимость
f. -. fu-
A.43)
27
•№\
Рис.3. Номограмма для расчета степени конверсии метана :
/ - Л = 2( R = 1,78); / - /, = 3( /f = 2,67): J -/f. = 4 ( /Р =
3,65; 'f - eg = 6 ( Л- = 5,33)? J - *, =8 І7.І)/
Рис.4. Номограмма для расчета степени конверсии окиси углерода.
Обозначения как и на рис.3.
Величина f? не эависит от мольных долей «оппонентов и
легко определяется, если известно уравнение состояния чистого вещества
о RT r
і і --же*РІ vc
2*і
A.44)
С учетом выражение A.42) - A.44) система уравнений для
расчета равновесного состава газов конверсии метана без выделения
углерода примет вид /14/
7 .-гЗ О .0
гсо9 ' zh2
2со'гнго
fco
zco*zco2-!-
? +7 — О
'¦со
A.45)
где л - коэффициент избытка (недостатка) окислителя.
Равновесный состав, рассчитанный по уравнениям A.42) и A.45)
зсть состав смеси, компоненты которой является реальными газами,но
взаимодействие между молекулами различных компонентов отсутствует,
т.е. объемы аддитивны. Решение системы уравнений A.45) на ЭВМ
производится указанными выше методами.
Учитывать свойства реальных газов необходимо, например, при
расчете низкотемпературной C00-500°С) конверсии бензиновых
фракций под давлением выше 7,0 МПа и высокотемпературной G50-900°С)
конверсии под давлением выше 15,0 МПа.
РАВНОВЕСНЫЕ СООТНОШЕНИЯ И СОСТАВУ ГАЗОВЫХ СМЕСЕЙ
Процесс конверсии на катализаторе можно условно разбить на три
области: высоко-, средне- и низкотемпературную (рис.5). При низких
100
Рис.5. Зависимость
равновесного состава газа
конверсии бензиновых фракций
от температуры (^=3,0МПа,
к =1,6)i
1,П и Ш - области
низкотемпературной , среднетемпе-
ратурной и
высокотемпературной конверсии.
200
температурах (до 500-550°С) образуются в основном Щ и UO2
.конверсия метана незначительна. В этой области ведут конверсию
сжиженных газов и жидких углеводородов с целью получения
высококалорийного метансодержащего газа и чистого метана - замевителя
природного газа (ЗЇЇГ).
С повышением температуры в конвертированном газе
увеличивается содержанием водорода и окиси углерода, а метана в двуокиси уг-
29
лерода снижается. При среднетемпературной конверсии получают газ
средней калорийности типа "городского". Этот интервал в настоящее
время имеет ограниченное применение.
При высоких температурах G50-П00°С) основными продуктами
конверсии являются /?, и СО . Это область получения
технологических газов для синтеза аммиака, метанола, высших спиртов и
других продуктов и производства технического водорода.
Основным сырьем высокотемпературной конверсии является природ-'
ный газ с высоким содержанием метана, но используются также
сжиженные газы и бензиновые фракции. Обозначенные на рис.5, области
условны, так как при изменении давления и отношения C'-O-./f они
смещаются. При низком давлении или большом избытке водяного пара (или
инертного компонента) границы сдвинуты влево, а при высоком
давлении и малом количестве разбавителя - вправо.
В табл.3 приведены составы конвертированного газа при широком
изменении параметров и соотношении С:О:Н. Более подробные данные о
равновесных составах даны в литературе /I5/. Степень конверсии
метана возрастает с повышением температуры,снижением' давления и
увеличением отношения пар: сырье. Для получения одной и той же
степени конверсии метана с увеличением давления необходимо повышать
температуру или степень разбавления сырья паром. Степень конверсии СС
с повышением температуры и давления снижается, а при увеличении
отношения HcO •¦ СИ, - возрастает (см.рис. 3 и 4).
Чем выше температура, тем меньше влияние на степень конверсии
метана оказывают давление и разбавление паром. При температурах
выше 1200°С метан конвертирует практически полностью, даже при
давлении в 10,0 МПа.
С повышением температуры (рис.6) степень конверсии метана
возрастает, что приводит к снижению содержания в смеси реагентов {Щг
и НпО ) и повышению выхода восстановителей ( /? и Л? ).
При паровой конверсии метана в зависимости от условий
отношение И^-СО лежит в пределах B:1)-(8-1). Для уменьшения его в
сырье добавляется СО« и отношение л?.-Л7 можно снизить (см.табл.
3), при этом степень конверсии метана лишь незначительно
уменьшается.
В промышленных установках процесс конверсии контролируется
содержанием метана в конвертированном газе. На рис.7 представлены
зависимости равновесного содержания метана от t , Р , R в широком
диапазоне параметров. Например, для получения конвертированного
газа с 7,5% СИ при давлении 0,1 МПа и R = 4 необходима темпера-
30
80
5.20
\М
500
700 goo 600 воо
а 5
Рис.6. Равновесный состав газа при конверсии:
а - паровой, Р = 3.0 МПа; Л = 4; 5 - парауглекислотной, р = 2,0 МПа;
Л=0; CU2 Ц=0 2; о -паровоздушной, ,0-3,0 МПа; /? = 4:1;
воздух : СНц = 1,43.
СНч,о6.Х
їв- ¦ ¦
Рис.7. Зависимость равновесного
содержания метана от отношения НоО--Сн„
при температуре 827 ( ) и 727°с
тура 550°С, а при давлении 3,0 МПа - 800°С. При Р = 5,0 ^Иa и
t = 800°С заданное содеряание метана G,5#) получается прл Я -Ь,
а при Р - 10,0 МПа R должно быть равно 8.
Опытные исследования паровой конверсии природного га;;а п-:д
давлением 5,0-10,0 ЫПа и при температурах 50O-'J0O°C пошзг^і, что
результаты расчета равновесного состава по уразнешмм A.32), U ,39)
A.40) для идеального тока практически полностью совпадают с
действительными значениями /I3/.
В промышленных установках конверсии действительные составы
газов близки к равновесным, и определение равновесного состава
является осязательным при проектировании реакторов конверсии и расчета
технологических схем.
Состав конвертированного газа должен удовлетворять
определенный требованиям, так как в результате его дальнейшей переработки
необходимо получить водород,технологический шіи топливный газ
заданного состава. Конвертированный газ характеризует стехеометриче-
ским показателем конверсии 5 , который различен для производств:
ВОДОрОДа S'(ff2 +&): (Щ * Cty'S, 5^ ГО,
аммиака s = (м2 * со}-. #2 = з, 05г д /,
метанола . %; (нг-щ): (щ+со)= 2,0 + 2,2,
ВЫСШИХ СПИРТОВ S - /I„ : СО = 0,7' т- 1,0\
заменителя природного газа s- н2 ¦. см^ ' u,u7-ru,3,
углеводородов 5= Н}: СО = 1,2 т 2,2.
В производстве водорода желательна высокая степень конверсии
метана и минимум его в продуктах реакции. Этим достигается более
высокая степень чистоты водорода.
Достаточно строго стехиометрический показатель должен
выдерживаться для технологических газов. Азотоводородная смесь для
синтеза аммиака должна иметь соотношение н2 •¦ М^ =3:1. При
двухступенчатой паровоздушной или одноступенчатой паро-кислородо-воздуш-
ной конверсии стехиометрический показатель должен быть равен 3,05-
3,1, что дает после конверсии окиси утдерода стехиометрический
состав азотоводородной смеси /I6, 17/.
В процессе синтеза метанол образуется как из ?a , так и из
Cuj . Конечно, наличие в газе СО предпочтительнее, но при S =
-Сн2-С0)і(?О*СОА = 2 г 2,2 получается наиболее высокая степень
использования мощности установки /I8/.
При получении ЗПГ желательна минимальная степень конверсии
метана, т.е. минимум водорода в газах конверсии. Необходимо
стремиться к уменьшению значения S ив крайнем случае не превышать 0,3.
Несмотря на существенно различные требования к
конвертированному газу, все его разновидности могут быть получены путем
каталитической конверсии углеводородов с водяным паром, двуокисью
углерода, кислородом и воздухом.
Глава 2
КАТАЛИЗАТОРЫ. МЕХАНИЗМ И КИНЕТИКА РЕАКЦИЙ КОНВЕРСИИ
Реакции конверсии углеводородов, а также реакции гидрирования
окислов углерода относятся к гомолитическим, сопровождающимся
разделением электронов в электронных парах молекул, т.е. имеет место оки-
елительно-восстановйтельный, или "электронный" катализ /19/.
Катализатором являются a-металлы, главным ооразом УШ группы
периодической системы химических элементов Д.И.Менделеева. Ряд активно- .,
сти металлов для конверсии метана с паром следующий:
Fe < Со < Mi < %и < R?> < Pt < Pd.
Высокой активностью обладают кобальт, никель и благородные
металлы. Но все применяемые в настоящее время промышленные
катализаторы в качестве активного компонента содержат никель. Катализаторы
для различных процессов должны удовлетворять специфическим
требованиям и имеют сильно отличающиеся друг от друга свойства. Ниже
рассмотрены некоторые типы промышленных катализаторов.
КАТАЛИЗАТОРЫ ВЫСОКОТЕМПЕРАТУРНОЙ КОНВЕРСИИ ПРИРОДНОГО ГАЗА
И ЖИДКИХ УГЛЕВОДОРОДОВ
Паровую конверсию проводят в реакционных трубах небольшого
диаметра с внешним обогревом. И в большинстве случаев лимитирующими
факторами являются подвод тепла через стенку и гидравлическое
сопротивление слоя катализатора. Поэтому применение катализаторов с очень
высокой активностью не увеличивает скорость процесса. И к
чрезмерному увеличению активности этих катализаторов стремиться не
следует.
Состав, структура и свойства катализаторов. К катализатору
высокотемпературной конверсии предъявляются жесткие требования по
термической, химической и механической прочности. Оцениваются они
по совокупности свойств: активности, прочности, гидравлическому
сопротивлению, устойчивости при длительной эксплуатации, стоимости
и др.
33
Кроме активного компонента, заданные свойства катализатору
придают носитель, промоторы и различного рода добавки. Очень важны
физические свойства катализатора. Их комбинация должна быть
такой,чтобы катализатор обладал высокой прочностью в течение нескольких лет
работы. Минимально допустимым сроком работы является два года.
Хороший катализатор должен работать не менее пяти лет.
Никелевые катализаторы приготовляются, в основном,двумя
способами /I6/:
1. Каталитические вещества наносят на сформированный и
прокаленный носитель двух-четырехкрагаой пропиткой его раствором солей
никеля и промоторов.,
2. Соосавдение соединений никеля (гидроксидов, карбонатов),
промоторов и порошкообразного носителя. Образующуюся при этом
однородную массу формуют либо в мокром виде выдавливанием
(экструзией) , либо в полусухом и сухом состоянии таблетированием.
После формования катализатор, независимо от способа его
приготовления, прокаливают при температуре 400-600°С для перевода
солей никеля (например, M ( W^ ) ) в форму окислов. В таком
виде катализатор загружается в реакционные трубы и аппараты.
Катализаторы выпускаются в виде колец и таблеток диаметром и '
высотой от 8 до 20 мм. Так как процесс протекает в диффузионной
области ( t = 700-900°С), то скорость реакции пропорциональна
внешней поверхности. Следовательно, уменьшение размера зерен
увеличивает скорость процесса на единицу объема катализатора, но в то же
время приводит к возрастанию гидравлического сопротивления слоя.
Поэтому наиболее целесообразно применять зерна в виде колец Рашига
с минимальной толщиной стенки кольца, допустимой с точки зрения
прочности и технологии приготовления. ¦
Важной проблемой является обеспечение оптимальной пористой
структуры катализатора. Катализатор высокотемпературной конверсии
с тонкопористой структурой и большой удельной поверхностью не
является оптимальным. Во-первых, мелкопористая структура не обладает
достаточной стабильностью при високих температурах. Во-вторых, при
малых размерах пор имеет место Кнудсеновская диффузия, которая
лимитируется размером пор. При относительно низких давлениях @,1-
0,5 МПа) положительный эффект дает создание бидасперсной
структуры /20/ катализатора. Радиусы пор должны быть такими, чтобы в них
имела место объемная диффузия. При высоких давлениях (выше 2,5 МПа)
это условие почти всегда выполняется, а радиус пор выбирается обцч-
,но по условиям термостабильности. При 900°С такому условию
удовлетворяют поры размером 1000 X /20/.
34
Указанным выше требованиям удовлетворяют носители из окислов
алюминия, кальция, магния, кремния и некоторых других элементов.
Наиболее эффективными носителями являются плавленная окись
магния (периклаз) и окись алюминия в л -модификации (<*- Л1г{?3)
/16/.
В условиях паровой конверсии возмоаша коагуляция никеля,
находящегося на поверхности носителя в виде мелких кристаллов. Для
предотвращения этого явления в состав катализатора вводят
промоторы. Наиболее часто применяемыми промоторами является окислы
алюминия ( f-M2°3 )• магния, бериллия, кальция и других металлов.
Эти трудновосстанавливаемые окислы проявляют структурирующее
действие по отношению к никелю. По данным В.В.Веселова /30/, промоторы
образуют следующий ряд эффективности
ВаО « Sru « СаО < С г О. < 8еО < AfyO < f-Al? О,.
Механизм структурирующего действия промоторов состоит, вероятно,
в том, что высокодисперсные частицы промотора покрывают частицы
металла слоем, проницаемым для молекул газа, но препятствующим
контакту никелевых частиц. Это предотвращает их спекание в
относительно крупные агрегаты, имеющие малую удельную поверхность /20/.
Добавки окислов кальция и магния и специального цемента
значительно увеличивают механическую прочность носителя.
В некоторые катализаторы добавляются щелочные металлы -
натрий и калий, хотя они могут несколько снизить активность
катализатора в отношении конверсии метана, но интенсифицируют реакции
газификации углерода.
В Советском Союзе, начиная с 50-х годов, широкое
распространение имел катализатор ГИАП-3 низкотемпературный и
высокотемпературный. Он выпсукался в виде гранул (колец Рашига) серого цвета
размером 15x15 мм. Свойства его представлены в табл.4. Катализатор
готовился пропиткой гранул из окиси алюминия (л-м?^) смесью
водных растворов солей алюминия и никеля.
В настоящее время широко используются катализаторы ШАЇЇ-І6 и
КСН, а из импортных С-П-2,57-1 и др. (тайл.4).
Для высокотемпературной паровой конверсии сжиженных газов и
бензиновых фракций необходимы катализаторы, стойкие к закоксовыва-
нию вследствие реакций крекинга углеводородов и разложения их на
элементы. Применяет никелевые катализаторы со щелочными добавками
(например, катализатор фирмы ICI ( 46-1 ). В этом катализаторе калий
35
Таблица'4. Химический состав (мае. %) и основные свойства промышленных катализаторов
версии углеводородов
кон-
Марка
катализатора
ГИАП-3
РЛАП-3-6И
ГИАЇІ-5
ГИАП-І5
ГИАП-І6
ГИАП-І2-2
КСН
С-ІІ-2
С-ІІ-4
С-ІІ-9
57-1
46-1
54-2
Размер, мм
ІІхІІхЗ 95
15x5x5 95
20x20x7 95
8x9 86
12x12 86
10x10x4 24-30
14x14x6 24-30
19x19x8 24-30
12x12x6 88-92
15x17x11 46
19x19x8 70-75
19x19x5 60
16x10x6 49
19x19x7 60-68
16x8x6 65
17x17x7 54
17x17x7 ¦ 32
17x17
67
то
4,5
4,5
4,5
7
7
23-26
23-26
23-26
6-Ю
25
18
12-15
23
17-21
13-17
32
21
18
ДО
_
-
-
-
-
10-15
10-15
10-15
-
-
II
3,0
10
8,8
од
14
II
15
М/С
_
-
- .
-
-
11-17
11-17
11-17
-
-
-
1,0
0,5
1,5
-
ІЗ
_
Прочие
компоненты,%
_
-
-
-
-
ГіОг - 1-2
$iu2 - 18-25
Fe2O} - 2-4
ПО, - 1-2
L
-
-
-
-
-
sa. - од
fyO - 0,7, 54-О2
5*4- 0.1
Пористость,
_
-
35-50
33
-
-
ЗІ
25
33
35-40
23
- 37
30-40
30-36
-
-
Удельная
поверхность,
м2/г
_
-
4-40
8
-
-
30-50
0,5
44
50-60
5-10
67
30-70
7,6
-
-
Насыпная
плотность,
кг/л
_
-
1,2-1,6
1,65
-
-
0,8-0,9
1,2
1,0-1,1
0,9-1,0
0,9-1,1
0,8-0,9 -
0,90-0,95
1,2
1,1
1,15
1.0
Механическая
прочность.
¦gr/zur
-
300-600
900
-
-
500
550
600-700
600-700
450
450
600-650
880
-
-
і.таол.4) химически связывается с алюмосиликатами, образуя
комплексные соединения, например KAlSiO^. В условиях процесса под
действием водяного пара и двуокиси углерода эти соединения
медленно разлагаются с образованием небольших количеств карбоната калия,
который предотвращает образование углерода, однако он летуч и
постепенно выносится из реактора, может осаждаться на стенках труб.
Карбонаты щелочных металлов ускоряют реакцию газификации углерода
/10, 21/.
Очень жесткие требования по термостойкости и термостабильно-
сти предъявляются к катализаторам вторичного реформинга
(паровоздушной конверсии газа из трубчатой печи). Они должны быть
механически прочными и не терять активности до П00-1200°С. При рабочих
температурах (900-И00°С) скорость реакции очень высокая и процесс
идет в глубокой диффузионной области. В этих условиях высокая
активность катализатора не является главным фактором качества
катализатора. Первостепенную роль играют его механические свойства.
Специальными катализаторами вторичного реформинга являются,
например, 54-2 (фирма ICI) и С-П-4, выдерживающие температуру до
1300°С при 30 ат. В СССР в реакторах вторичного реформинга
применяют катализаторы ШАП-16,ГИАП-3-6Н,КСН, которые выдерживают
температуру выше ПО0°С.
Восстановление и регенерация катализаторов. В
свежеприготовленном катализаторе никель находится в форме оксидов, алюминатов
никеля и других соединений. В таком виде он и загружается в
аппараты. Перед началом работы катализатор должен быть восстановлен.
Одновременно из него могут удаляться вредные примеси, например,сера.
Восстановление оксидов никеля может осуществляться водородом
или окисью углерода по реакциям:
2 ** Мі *Я2° • ^'^
МО + СО =*«= Mi + СОг . B.2)
Твердый раствор оксидов никеля начинает восстанавливаться при
температуре около 120°С, а чистая закись никеля - при 230°С
водородом и при 340°С окисью углерода.
При восстановлении катализатор нагревается потоком сухого
газа до тех пор, пока температура его не превысит точку конденсации
пара. Затем добавляется пар и начинается нагревание до рабочей
температуры. В это же время вводится водород. Отношение н^о: #2 по
мере подогрева снижается примерно от 20 до 7. Пар предотвращает
чрезмерное повышение температуры и способствует удалению серы.Зос-
37
становление обычно заканчивается при t х 850°С, но в
значительной степени зависит от состава катализатора и температуры
прокалки. Чистый водяной пар окисляет никель до /Vio при температурах
ниже 650°С, поэтому необходимо присутствие восстановительных
компонентов.
Конверторы метана можно пускать и на чистом природном газе
без добавки н2 и СО. Термический крекинг метана или его
гомологов даст некоторое количество водорода, который йудет восставливать
никель. Для начала гетерогенной реакции конверсии метана
достаточно наличия на поверхности катализатора очень незначительного
количества металлического никеля. По мере развитая конверсии
образуются /? и СО , под действием которых алюминаты и окислы никеля
постепенно восстанавливаются. Газ подается с небольшой скоростью при
двойном против нормального отношении пар : газ. При таком способе
восстановление начинается в конечной зоне и труднее всего
восстанавливаются первые слои катализатора.
Катализаторы высокотемпературной конверсии работают в
условиях, при которых отложение углерода термодинамически невозможно.За~
коксовывание может происходить только при нарушении
технологического режима. При сильном закоксовашш происходит разрушение
катализатора, и он не пригоден для дальнейшего использования.
Если степень зауглероживания незначительна и механические
свойства катализатора не изменились, возможна его регенерация,
отложения могут быть удалены либо одним паром при прекращении
подачи сырья, либо смесью пара и воздуха. Регенерация паром происходит
в течение от 6-12 ч до нескольких суток при рабочей температуре
процесса G80-860°С). Регенерация паровоздушной смесью протекает
значительно быстрее, но более опасна вследствие возможности перегрева
труб. Поэтому воздух добавляют в небольшом количестве до 1-3%, что
контролируется по содержанию ЛЯ, на выходе. Осуществляется также
непрерывный визуальный контроль труб, чтобы во время заметить и
устранить любой местный перегрев.
В процессе регенерации катализатор может несколько дезактиви-
зироваться вследствие окисления никеля, но быстро восстанавливает
свою активность при подаче сырья, и специального восстановления
обычно не требуется.
КАТАЖЗАТОРЫ НИЖОТМПЕРАТУРНОЙ КОНВЕРСИИ
Катализаторы низкотемпературной конзерсии должны удовлетворять
следующим специфическим требованиям:
высокая активность в реакциях газификации, гидрогенолиза,
конверсии со и метанирования; стойкость к спеканию; низкая
активность в реакциях образования смол и кокса; стойкость к отравлению
и примесям в сырье; низкое сопротивление диффузии при высокой
активности; активирование реакций газификации кокса.
Катализаторы, в значительной мере удовлетворяющие
перечисленным выше требованиям, выпускаются в промышленных масштабах в
странах, производящих ЗПГ /112, II3J.
Do всех промышленных катализаторах в качестве активного
элемента используется никель.
Носителями могут служить оксиды алюминия ( f-.4t203 ), хрома,
кремния и некоторые др. В качестве промотирующих добавок вводят
окислы щелочных и щелочноземельных металлов, а также марганца,
титана и меди. Все катализаторы имеют высокое содержание
никеля,составляющее 45 - 75 мае. %. Катализаторы приготовляются методами
совместного осаждения, осаждения на носителе и пропиткой гранул
носителя. При всех методах стремятся достичь максимальной
поверхности активного металла. Максимальная никелевая поверхность
достигается при содержании его в катализаторе 40-60$. Взаимосвязь
концентрации никеля и удельной активной поверхности иллюстрируется
следующими данными /II2, 113/:
Содержание Mi, Удельная поверхность
в катализаторе, ыас.% никеля, муг
5 I
17 14
30 25
53 52
75 43
Контакты с ооляшой удельной поверхностью и высоким
содержанием никеля склонны к спеканию и коагуляции малких частиц металла.
Поэтому в них вводят стабилизаторы, предохраняющие кристаллиты
никеля ai спекания в процессе работы, которыми слузат оксида
алюминия, хрома, магния и другие огнеупоры, состоящие из мелких
кристаллитов /II4_/. Стабилизирующее влияние оказывает и носитель, в
качестве которого применяют огнеупорные окислы. К выбору носителя
подходят с большой осторожностью, так как условия эксплуатации ка-
тализатора таковы, что носитель может подвергаться гидратации.
Поэтому желательно применять негидратирующиеся соединения или
избегать условий, приводящих к гидратации.
Одним из важнейших свойств катализатора является его стойкость
к закоксовыванию. Предполагают, что реакцию углеродоооразования
катализируют центры, обладаицие кислотными свойствами. Поэтому в
качестве носителей рекомендуется применять окислы амфотерного или
основного характера. Однако в условиях конверсии при высоком
парциальном давлении водяного пара амфотерные окислы приобретают
кислотный характер и, следовательно, каталитические свойства к реакциям
углеотложения. Поэтому в некоторые катализаторы вводят щелочные
добавки, которые блокируют кислотные центры в случае их
возникновения на поверхности носителя, а также интенсифицируют реакции
газификации углерода, которые могут возрасти в их присутствии на
несколько порядков. Щелочные добавки вводят в виде легкодиссопиируе-
мых солей щелочных и з щелочноземельных металлов.
В табл.5 представлено несколько катализаторов,
запатентованных иностранными фирмами, и применяемых в процессах получения
заменителя природного газа из сжиженных газов и бензиновых фракций
/II4/- В°е эти катализаторы могут работать при температурах не
выше 400-500°С.
При более высоких температурах контакты подвергаются спеканию,
приводящему к значительному сокращению как общей, так и активной
никелевой поверхности.
Высокое содержание никеля в контактах обеспечивает его
высокую активность, но в то же время способствует спеканию. Поэтому
повышение активности с увеличением содержания никеля происходит
только до определенного предела F0-65$).
Существенное значение имеют промотирующие добавки. Окислы
щелочных металлов повышают стойкость катализатора к закоксовыванию;
окислы титана, циркония и кремния повышают его термостойкость.
Незначительная добавка @,01-0,1$) металлов платиновой группы
заметно повышает активность и стабильность катализатора.
Восстановление и регенерация катализаторов. Катализаторы
низкотемпературной конверсии и метанирования активируются обычно
водородом. Аппарат продувается вначале азотом или азотоводородной
смесью, затем разогревается до 200°С со скоростью 20-50%. При
200°С начинается восстановление. Как только в процессе
восстановления произойдет образование металлического никеля, начинаются
реакции метанирования, которые приводят к возрастанию температуры.
40
Таолица 5. Катализаторы низкотемпературной конверсии
углеводородов
Страна
Состав катализатора
Нь, мае.
Носитель
Промотор
США
англия
ФРГ
Япония
45,6
75,0
47,7
46,5
66,0
75,0
30-45,0
53,0
м2о3
Al2°i
5iu2
Cr2°i
Att#}
Щ°з
Al2Ui
AloO, Л
Sa
Л
l'uO,
/с, Л>а
л/а. Щ0, ?<*&
Crguy М„О
Поэтому газ, используемый для восстановления, должен содержать
возможно меньше СО и Cu2 - в сумме не более 1% /JOj.
Термическая дезактивация высокопористых алюмоникелевых ісатали •
заторов начинается приблизительно при 5ОО-550°С. Поэтому
температура в процессе восстановления не должна подниматься выше 400 С,
максимум 450°С. Для достижения такой температуры может оказаться
необходимым несколько увеличить содержание СО во входящем газе,но
должен осуществляться строгий контроль количества СО и COc , так как
на каждую 0,1% С0„ и СО увеличение температуры катализатора
будет составлять соответственно 6° и 7,4°С. Полное восстановление
обычно достигается при 400°С. В начале восстановления скорость
процесса очень высокая, но постепенно замедляется, и для полного
восстановления катализатора при указанных температурах требуется
ориентировочно 16-24 ч.
При низконизкотемпературной конверсии углеводородов
происходит медленное, но непрерывное закоксовывание катализатора. Так как
нагревать катализатор до высоких температур нельзя, то регенерация
его затруднена. В начальных стадиях образования кокса отложения
сравнительно легко гидрируются и могут быть уделены водородом или
отпаркой водяным паром в отсутствие сырья. Но следует помнить, что
пар может привести к спеканию катализатора. После образования
стабильной структуры полимера удалить его очень трудно. Поэтому
регенерация водородом возможна только при условии проведения ее с
непродолжительными интервалами. В противном случае дезактивация
прогрессирует, и регенерация может рассматриваться как временная
аварийная мера.
41
Никелевые катализаторы в восстановленной форме являются пиро-
рорными - при контакте с воздухом разогреваются вследствие
быстрого окисления никеля. Чрезвычайно пирофорны высокоактивные
катализаторы низкотемпературной конверсии и метанирования. Контакт их с
воздухом недопустим. Перед вскрытием ампарата они должны быть
пассивированы. Для пассивации катализатор продувается азотом с
незначительной примесью кислорода. Предварительно он охлаждается до
температуры 30-50$ С. Пассивация начинается при концентрации кис
дорода в азоте около 50 см3/м3. По мере пассивации и при
отсутствии разогрева концентрация кислорода в газе повышается путем
дозировки воздуха в азот. Процесс заканчивается при содержании кислоро
да в азоте около 500 см/м3 /887. После пассивации катализатор
продувают воздухом.
В случаях, когда возможен контакт катализатора с воздухом в
течение небольшого промежутка времени (ремонт,
перегрузка),возможна пассивапия углекислотой. Адсорбированная на поверхности
контакта и находящаяся в порах углекислота предохраняет в течение
нескольких часов катализатор от воздействия кислорода воздуха.Но
затем катализатор постепенно разогревается /88/.
ШАЛИТИЧЕСКИЕ ЯДЫ И ДЕЗАКТИВАЦИЯ КАТАЛИЗАТОРОВ
Катализаторы, активными компонентами которых являются металлы
переходной группы, склонны к дезактивации химическими веществами.спо
собными отдавать электроны на незаполненные д'-арбитали металла.
Никелевые катализаторы очень чувствительны к встречающимся в сырье,
вдам: сере, галогенам, фосфору, мышьяку, свинцу. Некоторые из них
приводят к необратимому отравлению катализатора, при отравлении
другими каталитическая активность восстанавливается до нормального
уровня, если снова обеспечивается чистота исходного сырья.
Сера. Отравление никелевого катализатора серой обусловлено хи
икческим взаимодействием серы с активной никелевой поверхностью
хЛ +rt2S •*= MijS +я2, B.3)
с интервале температур 600-1100°С константа равновесия реакции к -
' DHs рн увеличивается с 3,3-10~3 до 8,5-10 . Вследствие сдві:
:а равновесия с увеличением температуры в сторону образования
металлического никеля отравление катализатора с повышением темпера-
гурн уменьшается. На рис.8 дана взаимосвязь равновесных
концентраций 'HjS и Н'2 в газе, при которых начинается образование суль-
никеля. Но на практике образование сульфидов на поверхности
w
1,0
0,5
02
0,1
0,05
002
0,01
от
0,0025
/
/
/ У
/ s
/ s
/
1 'Iі 1
5 Ю 20 50 100
Рис.8. Взаимосвязь равновесных
концентраций л?5 и /? в газе,
при,- которых начинает
образовываться сульфид никеля: I - при
600*С, 2 -при 800°С.
никеля и отравление катализатора наолвдаются при значительно
меньших концентрациях /^5 , чем это требуется для образования
равновесной фазы сульфида никеля. Колзгчество серы и никеля, которые
реагируют друг с другом, очень малы. Например, катализатор конверсии,
который содержит 15$ Ні и работает при 775°С на выходе из
реактора, отравляется, когда он содержит только 0,005$ серы, хотя при
этом сульфидируется всего 0,06/2 никеля. Это эквивалентно
отравлению всех атомов никеля на поверхности сфер диаметром I мк.
Низкотемпературный катализатор дезактивируется при
концентрации серы на порядок ниже, чем при указанных условиях.
Следовательно, при низкотемпературной конверсии в начальной
зоне реакционных труб печи, где температура 400-550°С, часть
катализатора может сульфидироваться плохо очищенным от серы сырьем.Но
это не сказывается на работе реактора, поскольку количество
отравленного катализатора обычно не превышает 2%. Но при проскоке серы
сульфидная зона будет перемещаться вниз по слою катализатора и со
временем его работа ухудшится.
Отравление катализатора при температурах, не превышающих 600°С,
труднообратимо. Лишь длительная обработка водородом при 600 С
позволяет полностью восстановить его начальную активность.
Отравление при температурах 700°С и более высоких практически обратимо.
43
іфи прекращении подачи сернистого сырья катализатор регенерирует-
ел сырьем, в котором всегда содержится некоторое количество
водорода. Но регенерированный катализатор становится более
чувствительным к содержанию в сырье серы, что, по-видимому, свидетельствует о
неполном освобождении никеля от серы.
Отравление серой при прочих одинаковых, условиях усиливается с
увеличением объемной скорости газа. Это объясняется уменьшением
:иощади незанятых серой активных участков никеля вследствие
увеличения общего количества серы, поступавшей с газом, и улучшением мае
¦лобмева между катализатором и потоком.
Отравляющее действие органических сернистых соединении на ни-
«еляЕый катализатор аналогично действию сероводорода, так как в
процессе конверсии метана органические соединения серы превращают-
:л в сероводород по реакциям
Большинство катализаторов содержит некоторое количество серы
ь виде сульфидов кальция, магния, натрия, которые при высоких
температурах разлагаются с выделением сероводорода. Эта сера
удаляется из катализатора во время восстановления и в начальный период
'jro работы.
В зависимости от состава катализатора и параметров процесса
допустимое количество серы в сырье лежит в следующих пределах
(мг/м3):
¦їаровоздушная конверсия газа трубчатых печей при 950°С 10430
ііароокислительная конверсия при 850°С 8-^15
ІІаровая конверсия в трубчатых печах при
500-850°С 34-5
400-750°С 0,5тЗ
¦іизкотемиературная паровая конверсия при 350-400°С 0,2-Ю,Ь
¦іетанирование со и Cfy 0,3f0,5
Низкотемпературная конверсия СО при 220°С 0,Зт0,5
Галогены. Действие галогенов на никелевые катализаторы подоб-
...) действию серы, и концентрация их в сырье должна быть ограничена.
Содержание хлора в бензиновых фракциях может достигать не-
г-ольких миллионных долей. Находится он в виде хлористого водоро-
да, образовавшегося путем гидролиза хлоридов кальция и магния в
процессах переработки нефти.
Отравление никелевых катализаторов їлором обратимо.
Производительность катализатора, отравленного сырьем, содержащим \рр*>хлора,
возвращается к первоначальной при возобновлении работы на чистом
сырье без специальной регенерации. Медьсодержащие катализаторы при
отравлении галогенами частично разрушаются и не могут быть полностю
регенерированы.
Мышьяк. Сильным каталитическим ядом, имеющим практическое
значение, является мышьяк. Он может попадать на катализаторы при
нарушении нормального режима работы мышьяково-содовой очистки газов
от С02 и /i2s.
Отравление мышьяком является необратимым процессом и он будет
накапливаться в катализаторе при любой его концентрации в сырье.
Поэтому допустимая концентрация его в реагентах очень низка
( < 0,1 мг/м3). Действие мышьяка в никелевом катализаторе
становится ощутимым, когда концентрация А$2 ^ достигает 50/>/>ж Образцы
отравленного катализатора паровой конверсии содержат до 0,1^ As2u5'
Как и в случае серы мышьяком отравляются первые по ходу газа слои
катализатора, и катализатор может нормально работать, пока не
потеряет активность значительная часть ею. Это будет заметно по
увеличению содержания метана на выходе и перегреву труб, особенно в
верхней части. При конверсии жидкого сырья в газе будет
увеличиваться также содержание ароматических соединений и этана.
Металлы. Активность никеля снижается многими металлами.В
промышленном сырье могут встретиться соединения свинца, меди и
ванадия, отравление которыми необратимо и реагенты практически не
должны содержать их. Концентрации свинца до 2ррт могут быть допустимы
в течение только нескольких суток.
Специальной очистки от металлов не требуется, так как свинец
хорошо адсорбируется никель-молиоденовим катализатором
гидрирования.
4. МШШ?,Ч И КЖЕТИКА ПАРОВО Л
КОНВЕРСИИ МЕТЛ!!А
Механизм конверсии метала изучался многими авторами, имеется
несколько аргументированных схем процесса. М.И.Тешсилым предложен
стадийшй механизм с образованием промекуточного хемсороированно-
го радикала СНОН /22, 23/:
45
Реакция
} * '
з) геном
il) zCO = z -і- CO
5) HjO * Z «s
S) zu +CU =c=
О
О
Маршрут
* B)
О
О
О
B.7)
Л<2} C0+ H.O = CO.
Буквой / обозначаем свободное место на поверхности никеля,
принимаемого двухвалентным Аи м соответственно первый и
второй маршруты реакции.
Стадии 1-4 воспроизводят механизм гетерогенно-каталитиче-
ской реакции Щ с нг0 , а стадии 5-6 - со с нго .
Сложением уравнений стадий, умноженных на число столбцов /Га> или Л(г\
получаем итоговые уравнения.
Принимая, что поверхность однородна, из схемы B.7) можно
получить следующие уравнения для скоростей элементарных реакций
стадий 1-4:
r7 = k_t ?гЩ],
B.8)
где /; и к_ - константы скоростей прямых и обратных реакций
элементарных стадий; [z]~ доля свободных мест поверхности, fzCfy],
[zCHOH], [zCO] - доля мест, занятых соответственно Л? и т.д.
Доли покрытия поверхности промежуточными веществами связаны
друг с другом балансовым уравнением:
-- f.
B.9)
46
Авторы /22, 23/ считают, что маршрут м <2) -
равновесный,откуда следует
= К
S A,
B.10)
где лу - константа равновесия стадии 5.
На основе приведенного механизма получено полное кинетическое
уравнение для скорости реакции по маршруту /rf/) без каких-либо
упрощений з
Скорость реакции по уравнению B.II) является суммарной
скоростью прямой (метана с водяным паром) и обратной (гидрогенизации
окиси углерода) реакции
си = <у++й>_. B.12)
При равновесии <w+ = oj _ и суммарная скорость ш
становится равной нулю.
Прямая и обратная скорости реакции измерялись в проточно-
циркулярной системе при давлении I ат на никелевой фольге. В
результате экспериментальных иоследований и теоретической сценки
предэкспоненциальных множителей получены следующие выражения для
констант уравления B.II):
іг--а,і2ю3-т~3
RT
'[*«'],
не *ST0°
Если P
Н20
п5 '¦
Pu
1/2 є'
- величины одного порядка или
B.13)
Рм 0
то членам ( /+ Ks ¦ Рм0/рн ¦ ) в уравнении (I.II) можно пренебречь,
так как соотношение /г/ %?.. << ; . Это означает, что
степень покрытия поверхности втомами кислорода очень мала,и реакция
происходит на практически свободной поверхности.
Для практических расчетов можно применять несколько
упрощенное уравнение /22, 24/
47
V ('~ «P r
Уравнения B.II) и B.14) получены при атмосферном давлении
и надежны только при низких давлениях. С повышением давления
действительная скорость реакции оказывается нияе, чем рассчитанная по
этим уравнениям /24, 25/. Предполагается, что механизм конверсии
остается неизменным. Следовательно, не меняется и форма уравнений
B.II) и B.14), а изменяется только константа скорости *,. Так,
значения kpj B.I5) при 2,1 и 4,1 МПа и 800°С составляют
соответственно НО и 19 дЛг-ч-ат.
Зависимость А„ от огіщего давления Р удовлетворительно
аппроксимируется эмпирическим уравнением /24/:
При температуре порядка 800°С <ля 0,05. Зная лр7 , т.е. кон-
отанту при Р = I ат, легко вычислить ее значение *р2 при Рг .
Но следует учитывать, что приведенные результаты были получены при
разбавлении реагируицей смеси азотом. Вероятно, что азот активно
влияет на соотояние катализатора /25/ и в определенной степени
тормозит реакции. Поэтому значение * должно быть уточнено в
экспериментах без инертного газа.
По-видимому, порядок реакции п метана с паром лежит в
пределах I+2. При значительном избытке водяного пара, по мнению
многих авторов, реакция имеет первый порядок по метану и практически
не зависит от концентрации нг0 . Поэтому в узких пределах
изменения параметров процесса и в области, далекой от
равновесия,иногда используют простое уравнение /16/ '
*=*Ч- B.17)
В.И.Атрощенко и Г.І. Звягинцев /26, 27/ предложили следующий
механизм реакции:
;; /Vi + H2U ===== Pia+ft2 -275.1
2) t/iO+CH^^^ И/ViOC^ +175,0 кДж, B.I8J
3) H/ViOCM3 =s=>? СО * 2f/9 +#i - m,
CH^ f H2O =*== СО + Щ - 27U, i
43
Скорость процесса контролируется взаимодействием метана с
адсорбированным на катализаторе кислородом и тормозится десорбирую-
щимся водородом. Стадия (I) не является лимитирующей. Окисление
активных центров происходит быстро с образованием промежуточного
соединения, обладающего слабыми основными свойствами. Между
подвижным водородным атомом метана и промежуточным соединением ftA/iu?/t}
устанавливается водородная связь. Вследствие большого сродства
водорода к никелю протон, принимающий участие в водородной
связи.смещается к атому никеля. В результате разрядки протона на поверхности
кристаллического никеля образовавшийся комплекс атомов разлагается
на окись углерода, водород и окись никеля. Распад промежуточного
соединения не является стадией, контролирующей скорость процесса,
о чем свидетельствует большой экзотермический эффект его
образования /27/.
На скорость конверсии метана тормозящее действие оказывают
продукты реакции и в первую очередь водород. Поэтому предложено
уравнение скорости /27/
"со '4
BЛ9)
А= 2,03-10° е *т [am /с] при НгО--С02=2. B.20)
Константа скорости , h незначительно меняется ари изменении
отношения пар : метан.
Например, при t = 700°С и Р = 2,6 МПа при R = 2
величина к = 31,8, при R = 0,6 А .= 23,0, при R = 4,0 к = 32,0.
Приведенная константа скорости справедлива для катализатора
ІШП-3, содержащего около Ъ% никеля, нанесенного на окись алюминия.
Тормозящее действие водорода отражено в кинетическом
уравнении /16/
Р О
Исследования, проведенные на никелевом катализаторе,
активированном окисью хрома (носитель - шаммот) при времени контакта
т = 0,008-0,06 с, дали следующие значения константы окорости для
уравнения B.21): .
t 400 500 600 700
А 5,7 40- .230 1200
49
В работе /28/ учтено также тормозящее действие СО:
ш~ Uotfl /р . /IP ' B.22)
При 800°С на никелевой фольге л = 51, ы = 0,5 и і = 2,0 аг,
а при 900°С а = 64, « = 0,2 и і = 0, энергия активации / -
=31 ккал/моль.
При большом отношении пар:сырье и температурах ниже 700°С
равновесие сдвигается в сторону образования некоторого количества
NiQ, и активность катализатора снижается, т.е. наблюдается
торможение реакции водяным паром. ¦ ¦ .
Анохин с сотрудниками /29/, используя понятие адсорбционного
потенциала и уравнение Лэнгмюра для многослойной адсорбции,
получили кинетическое уравнение
Хр - X ' ЯГ
--k(K+i)e , B.23)
где 'я и хр - текущая и равновесная степени" конверсии метана;
/? - отношение HjO-.c/fc ; (р - адсорбционный потенциал.
Величина / = ~ в температурном интервале 500-800°С
аппроксимируется уравнением
Интегрирование уравнения B.23) приводит к следующему
выражению: . 2І
Х- р * * ¦ B.24)
f
Как видно, при больших значениях т х-*-хр , а при г —<? м—о.
Авторы /29/ демонстрируют хорошее совпадение
экспериментальных и расчетных данных.
Исследования кинетики реакции в проточно-циркуляционной
установке, отличающиеся высокой точностью, показали, что при
повышенных парциальных давлениях метана (свыше 0,2 МПа) порядок по
метану становится меньше единицы /25/. С повышением давления
усиливается также тормозящее действие водорода и других
компонентов.Вследствие этого производительность слоя катализатора не очень сильно
зависит от давления. При давлении до 4,0 МПа производительность
единицы объема катализатора зависит от давления примерно в
степени 2/3 и описывается уравнением
; ?/«J. B.25)
где S/ - производительность при атмосферном давлении.
50
Таким образом, при увеличении давления в десять раз объемную
скорость реагентов можно увеличить в три раза. Но следует еще раз
отметить, что в трубчатых печах производительность катализаторов
определяется в значительной степени не их активностьв, а
условиями тепло- и массоперенооа.
МЕХАНИЗМ И КИНЕТИКА КОНВЕРСИИ И ГИДР0ГЕН0МЗА
ВЫСОКОМОЛЕКУЛЯРНЫХ УГЛЕВОДОРОДОВ ¦
Механизм и кинетика реакций углеводородов с числом углеродных
атомов больше одного, с водяным паром и водородом являются еще более
сложными, чем для метана.
В работе /3Q/ предложен следующий механизм реакций, кажущийся
нам наиболее вероятным. Первоначально углеводороды адоорбируются
на никелевой поверхности, где происходит их разрыв на отдельные
фрагменты, состоящие из одного или, возможно, двух углеродных
атомов ( с#х ), затем эти фрагменты реагируют с адсорбированным
паром. Вероятно, пар адсорбируется на активных местах, отличных от
тех, на которых адсорбируются углеводороды, и происходит миграция
одного или обоих реагентов по активной поверхности, приводящая к
юс столкновению. В результате происходит химическое взаимодействие.
Продуктами реакции являются водород и молекулы, содержащие один
углеродный атом ( СН, ( СО, Сґ?г ). Продукты десорбируются и переходят
в газовую фазу. Образовавшаяся смесь термодинамически не
равновесная. Поэтому продукты снова частично адсорбируются на
катализаторе и вступают во взаимодействие с сырьем и между собой. В
результате при достаточно большом времени контакта образуется равновесная
газовая смесь.
Р(с) ==* Сп ~~ (СНх)п / М20 — Проаукт ~= tyotytn, (zv) B.26)
объем ? 2 поверхность объем
При конверсии нормальных парафинов лимитирующей стадией
процесса является реаішия адсорбированных углеводородных фрагментов
и молекул вода. В случае разветвленных углеводородов лимитирующей
стадией может стать разрыв углеводородной цепи на С»х
-фрагменты. Іри этом могут десорбироваться не полностью распавшиеся
части молекул, и в газовой смеси находятся более легкие углеводороды,
чем компоненты смеси. При конверсии Н-парафинов таких продуктов не
обнаруживают.
51
Авторы /ЗО, ЗІ/ предполагают, что после разрыва С-С-свяэи
образуются фрагменты ?#г< и реакция на никеле, нанесенном на оксид
алюминия, идет по следующей схеме:
"*н ни он
С 0 -—с * fi — СО +#-*~СО +н, . B 27)
і і j І газ га} \<-.^П
J
Дня химического взаимодействия вещества, адсорбированные на
различных местах катализатора, должны быть подвижными.
Предполагается, что достаточно подвижной является группа он , которая
передвигается к атомам никеля; и реакция происходит или на металле,или
на границе между двумя фазами катализатора.
Известно, что реакции конверсии могут протекать на чистом
никеле, а чистый AtgO3 их не ускоряет. По-видимому, на чистом
никеле будет несколько другой механизм реакций.
По данным различных авторов, кажущийся порядок реакции по
углеводороду лежит в пределах 0-1. Эти результаты в общем
соответствуют механизму и кинетике Лзнгмюра.
к а, Ру
аг+а/ t/'k B.28)
где в - доля покрытия поверхности; Ру - парциальное давление
углеводородов, а} и а2 - адсорбционные константы.
Кажущийся порядок реакции падает от единицы до нуля с
увеличением покрытия поверхности [(аг *Л ) *<а,Р„]. По-видимому,
порядок реакции, близкий к единице, получается также из-за наличия
диффузионных эффектов.
Порядок реакции по водяному пару близок к нулю и, по данным
различных измерений, лежит в пределах от -0,15 до +0,07. Многие
авторы считают, что он имеет небольшую отрицательную величину. По
углеводородам, определяемый экспериментально порядок лежит в области
0 -г 0,3. Таким образом, при расчетах и моделировании реакторов
можно считать общий порядок реакции нулевым, если конвертируются
бензиновые фракции и более тяжелые углеводороды. Изменение константы
скорости с температурой подчиняется закону Аррениуса, м можно
записать
<u-k=Aff-e . B.29
52
Например, для конверсии пропана на катализаторе AM-I
константа скорости имеет вид /32/
4
к/егя>
в ,
а при конверсии п-гептана, п-октана и ^-декана ва
катализаторе ІИАП-5 получены следующие значения /со и ? /33/:
Н-С7ММ, *0 = 50.8.I03, S = 10930;
»-?sH/8, /г0 = 19,1-Ю3, / = 10140;
Н- СюН22' kO = 6'3 'I03' ? = 915°-
Из всех углеводородов (исключая метан) наиболее устойчивым и
реагирующим с минимальной скоростью является этан, кинетика и гид-
рогенолиз которого на никелевых катализаторах рассмотрены в
работах /34, 35/.
С2#6 ~=*= C2»f (ад) + Н'(ад),
l B.30)
2х
Адсорбция этана сопрововдается диссоциацией С-м -связи с
образованием C2MS , который затем быстро дегидрирует в С2н^ ,и
устанавливается равновесие меящу С2М} и СгНх на активной поверхности.
В химсорбированном СгН'х разрывается С-С -связь, и получаются
моноуглеродные фрагменты, 'которые быстро взаимодействуют с
сорбированными молекулами воды и образуют СО и ?0г > или ~ с водородом
и образуют СН^.
Высказано предположение /36/, что имеет место полное
разложение углеводорода на углерод и водород, и затем следует окисление
углерода до СО . Но образование углерода как промежуточного
продукта при паровой конверсии мы считаем мало вероятным, так как
скорость разложения углеводородов до углерода и водорода при
отсутствии воды намного ниже, чем реакция любого углеводорода (включая
метан) с водой.
А.А.Баландиным* [Z\J по мультиплетной теории были произведены
расчеты последовательности разрыва различных связей на никеле, из
которых следует, что первой стадией мультиплетной адсорбции этана
должно выть активирование до полного разрыва с-н -связи, так как
для этого процесса требуется преодолеть меньший энергетический
барьер, чем для диссоциативной адсорбции С-С -связи. Следовательно,от
этана должно отщепиться два атома водорода (а в этилене произойти
раскрытие двойной связи),и на никеле остается адсорбированным fy/V,-
53
комплекс
Причем угол в равен нормальному тетраэдрическому углу 109 28'.
Полный механизм паровой конверсии этана на никеле
представляется следующей схемой
a) C2/i6
I) ZC2%
C) Zfyfy
d) 7c//2
e) H20
со**
+ 2 —
* Zrt ^
+z*
t- 2 ~
чнго
- ZC2N} *
= 2СЛ
=t ZZCfy
= Z + ?O2
=: ZO +H2
^.
>
7*2,
B.31)
где 7 - место на поверхности никеля.
Стадия d является суммой нескольких простых стадий,
механизм которых, как считают авторы /34/, несущественен, поскольку
стадия равновесна. Но экспериментально установлено, что среди
первичных продуктов реакции имеется СО , которая присутствует и в
равновесной смеси даже при низких температурах. Это является
слабым местом рассматриваемой схемы.
Предполагая, что поверхность однородна и доля
поверхности,покрытой атомами кислорода ( 20 ), сравнима по величине с долей
свободной поверхности ( Z ), а покрытие поверхности всеми другими
частицами пренебрежимо мало; имеем
[z] + [zo] = 1 B.32)
Стадия в равновесна, и константа равновесия
B.33)
B.34)
B.35)
Скорость процесса лимирируется необратимой стадией а,
B.31) и равна
Из уравнений 2.33-2.34 получаем*
54
Экспериментальные исследования, проведенные на мелкозернистом
(О,85-1,00мм ) никель-хромовом катализаторе в интервале температур
300-360°С и давлении I ат, показали, что к в исследованном
интервале температур меняется незначительно и можно принять ке =0,644.
Мэнстанта скорости реакции к описывается уравнением
*?-, B#36)
где к - имеет размерность (л/г-ч-атм) и значение ее нельзя
перенести на катализаторы других геометрических размеров и пористости.
Скорость гидрогенолиза, по данным /35/', соответствует скорости
разрыва связи с-с и образования фрагментов Cfl^ и описывается
уравнением
ІГ О
1 С M
где а= (S-x)/2, B= k1jk3, к2 и к3 - скорости прямой и обратной
реакций B.31) стадии а, л - число атомов водорода во фрагменте
fytff, к? - константа равновесия стадии і уравнения B.30).
Если х ^4 /34/, то а - 1. По данным /35/, при адсорбции
на никеле л =2, тогда а= 2.
Следовательно, при гидрогенолизе углеводородов наблюдается
сильное торможение водородом. Например, Тейлором предложено
уравнение і
?2Ha СЛ Н2 B.38)
а Т.А.Словохотовой /36/
Торможение водородом набліщается и при паровой
конверсии.Механизм торможения, по-видимому, заключается в том, что при
большом покрытии поверхности водородом расщепление связи C-/V
затруднено, так как отщепляющийся водород должен притягиваться
участками поверхности, которые уже заняты водородом.
Выражение аналогичное B.38) и B.39) получено и для гидро-
генолиза пропана /32/
щ
3 S ¦ 3 3 ^fe f
Для катализатора ЇИДІІ-І2 величина k'r,24-!O exp GSuu/*r)
/кмоль/м3-ч/.
55
Вопрос о том, какие продукты являются первичными при
конверсии высокомолекулярных углеводородов, окончательно не решен.По
приведенному выше механизму /34/, первичными продуктами являются cu
е Ц . Другие исследователи /31, 37/ считают, что первичными
продуктами есть CU и /#> , а Щ образуется на втором этапе путем
окисления ?u.
Экспериментально доказано /30, 37/, что при малой степени
конверсии углеводородов метана в продуктах конверсии очень мало. И
многие авторы считают это доказательством того, что метан
образуется только путем гидрирования С0 и С0? . Однако авторы /37/
считают, что кажущееся отсутствие метана в продуктах при мылых степенях
конверсии ничего не говорит о механизме его образования.
Действительно, низкое содержание метана при малой степени
конверсии доказывается путем рассмотрения термодинамических условий.
Можно предположить, что равновесные реакции между со, *г, Щ-
Н20 и COf более быстрые по сравнению с первичным разложением
сырья. Тогда неразлохившееся сырье можно считать инертным
веществом по отношению к равновесным реакциям; на этом этапе достаточно
высокое и парциальное давление пара. Следовательно, равновесие
сдвинуто в оторону образования Щ Щ и /? , а равновеоная
концентрация ?N, незначительна. В этом случае общий эффект реакций -
зндотермичеокий.
При углублении конверсии углеводородов парциальное давление
сырья Е пара падает вследствие расхода их на реакции и разбавления
их продуктами, так как реакции идут с увеличением объема.Таким
образом, доля образовавшегося метана прогрессивно растет, а водород
расходуется.
По данным Зилшшса /3Q/, при разложении гептана содержание
С0г, СО и н2 больше равновесного, щ - несколько меньше
равновесного. Но из этих данных нельзя однозначно сказать, какие
продукты являются первичными.
Расомотрям теперь конверсию смеси углеводородов, что обычно
имеет меото на практике. Например, при конверсии природного газа
о небольшим оодержанием гомологов метана тяжелые углеводороды
покрывают незначительную долю активной поверхности, и порядок
реакции их о иаром близок к первому.
Допустим, что в природном газе, кроме метана, имеются более
высокомолекулярные углеводорода А и / . Скорость реакции для
них запишется следующим обравомі
56
~ ¦¦ L О В -¦ ¦ ¦= - - it 0
dr aa A dz *SHO ¦ B.41)
Так как время контакта у них одинаково, то
АА Вв
Если принять п = I, то получим /3Q7
где рол и РОд - парщшльние давления углеводородов А и s До
начала реакции.
' При конверсии смеси близких по свойствам углеводородов
(например, бензиновых фракций) они взаимно влияет на скорости конверсии
друг друга. Рассмотрим это на примере конверсии эквимолярной смеси
я-гексана и я-гептана /32/.
Применив Лэнгмюрову кинетику к смеси углеводородов, запишем
уравнения скоростей реакций
*****
dt »WA7P7 B.44)
aP7 _ *7 А7 Р7
где Р? и Pj - парциальные давления н-С{Нц и ^-^7^№
в сшей; Ag и Ay - адсорбционные константы; As и к? -
константы скоростей реакций.
Отношение скоростей реакций конверсии чистого гексана и в
смеси с гептаном выражается уравнением
' ' ' л B.45)
te
Относительная скорость реакций этих компонентов в смеси
*7М к7Л7Р7гм
ш ' к А Р ' B.46)
6 см *6*ереш
Такое отношение скоростей реакций подтверждено
экспериментально /30/.
57
Глава 3
БЩРОДИНАШКА И МАКРОКИНЕТИКА ПРОЦЕССОВ
В ЗЕРНИСТОМ СЛОЕ КАТАЛИЗАТОРА
Процессы каталитической конверсии углеводородов являются гетеро-
генно-каталитическими и состоят из следующих эталов, имеющих физи--
ческую и химическую природу:
1) подвод исходных веществ к поверхности катализатора;
2) диффузия реагентов в порах катализатора;
3) химические превращения из активной поверхности,
включающие : адсорбцию исходных веществ поверхностью катализатора,
поверхностные химические реакции, десорбцию продуктов реакции;
4) диффузия продуктов реакции из пор катализатора;
5) отвод продуктов реакции от поверхности зерен в поток;
6) подвод или отвод тепла от зерен катализатора.
Скорость суммарного процесса, протекающего в реакторе,
зависит от скоростей протекания элементарных процессов, т.е.
химической реакции,диффузии в порах, тепло- и массобмена между гранулами
и потоком. Кинетика реакций рассмотрена в предыдущем разделе,в
настоящей главе рассмотрены процессы гидродинамики и переноса,
имеющие место в промышленных реакторах конверсии.
ГВДРОДШІАМИКА ЗЕРНИСТОГО СЛОЯ
Процесс каталитической конверсии углеводородов осуществляется е
промышленности преимущественно в 'неподвижном слое катализатора.
Поэтому кратко рассмотрим течение газа сквозь стационарный
зернистый слой.
Поток газа в зернистом слое обтекает зерна катализатора и
протекает в каналах мевду ними. Следовательно, течение газа сквозь
зернистый слой нельзя отнести ни к внутреннему, ни к внешнему
обтеканию. Течение сквозь зернистый слой является смешанной задачей.
Выбор характеристического размера может оыть произведен различно
в зависимости от того, как подходить к рассматриваемой задаче /40/.
В качестве такового мокно взять диаметр шара или эквивалентный ди-
58
аметр частицу неправильной формы ( c/v ) при сведении задачи к
внешней. Рассматривая течение слоя как внутреннее, можно ввести
эквивалентный диаметр канала между гранулами а^.
Распределение скоростей газа по радиусу реактора имеет
своеобразный характер. Гранулы катализатора у стенок располагаются не
так, как в остальной части слоя: они укладываются более регулярно
и с большим числом каналов.
В зависимости от плотности и структуры упаковки зерен
скорость вблизи стенки трубы может быть либо выше (для частиц с
шероховатой поверхностью), либо равна (для гладких шаров) средней
скорости по сечению трубы. В трубах с промышленными катализаторами
скорость газа вблизи стенки на 30-70? выше, чем в средних слоях
при Re < 40 и на 10-20$ выше при te, > 800 /40/.
0,9
0,2 0,4
0.6
OJB
Рис.9. Радиальный профиль
скорости потока:
/ - aa = 3,2;
2 - с/н = 6,4 мм.
Очевидно, у самой стенки скорость падает до нуля
(рис.9).Максимум скорости наблюдается приблизительно на расстоянии около двух
диаметров зерна от стенки реактора.
Гидравлическое сопротивление слоя определяется по средней
скорости Ы , исходя из основного уравнения гидродинамики
C.1)
где д - коэффициент трения; d - гидравлический диаметр; у -
плотность газа.
Для насадки из шаров или цилиндров в пределах /UO < #е < 4uuu
можно пользоваться формулой /41/
59
C-2)
где 5 - Поверхность Ртдтпшпр объема катализатора, м^м3, fv - объем
v
частицы; /^ - поверхность частиц; е - порозность слоя.
Более точные результаты для реакционных труб печей конверсии
дает формула
где ? - массовая скорость, i?/vr-ч.
Формулы C.2) и C.3) дают погрешность, не превышающую 15$.
ШЛО- И МАССОПЕРШОС МВДУ ГАЗОВЫМ ПОТОКОМ
И СЛОЕМ КАТАЛИЗАТОРА
Газовая смэоь течет по каналам между гранулами катализатора.
При этом происходит тепло- и массоперенос между частицами и
потоком. В ядре потока массо- и теплообмен осуществляются, главным
образом, за счет конвекции, так как поток обычно
турбулентный.Вблизи поверхности имеется ламинарный пограничный слой, скорость газа
в котором падает до нуля у поверхности гранулы. Транспорт
реагентов и продуктов реакции через него в направлений, нормальном к
поверхности, осуществляется путем молекулярной диффузии, а тепла -
теплопроводностью. Перенос тепла может происходить также
посредством теплопроводности от частицы к частице через поверхность
контакта и излучением между частицами.
Перенос массы и тепла описывается следующими уравнениями:
ИГ****- C.4)
Ш*ерРилт'. C.5)
где /V - массовый поток, моль/с-*г; Л, - эффективный
коэффициент диффузии; С - концентрация реагента; и^ - составляющая
скорости потока в направлении х; q - тепловой поток (ккал/м2о),
Ср - теплоемкость; ? - плотность; Т - температура.
Основные физико-химические свойства компонентов
конвертированного газа даны в табл. 6.
60
Таблица 6. Физико-химические свойства основных компонентов
конвертированного газа при нормальных условиях
Показатель
Молекулярная масса
Плотность, кг/м*
Мольный объем, мз
Температура
плавления, *С
Температура
кипения, 'С
Критические пара-
иртпи*
метры. Q
температура, С
давление, МПа
объем, м^/кг
Теплотворная
способность,кДа/м
низшая
высшая
Теплоемкость,
кДн/кг-град
Теплопроводность,
м .ч-град
Коэффициент
динамической вязкости*
'Ю7, г/сМ'С
16,043
0,717
22,38
-182,5
-161,6
-82,1
4.58
0,0987
37055
39860
2,164
0,0317
1028
Теплота образования,
вдк/моль -74.86
Температура
самовоспламенения, 'С
в смеси с
воздухом
в смеси с
кислородом
645
550
"і
2,016
0,09
22,41
-259,2
-252,5
-239.9
0,0650
10760
12770
1,632
0,178
840
0
510
490
28.01
1,250
22,36
-205
-191,3
-140,3
3,05
0,0331
12645
12645
1,038
0,024
1662
-110,62
610
500
а*
44.01
1,977
22.62
-57,5
-78,3
+31,0
7 29
о,оэ4о
-
—
0,816
0,0151
1367
-393,79
—
-
18.014
IOOO(X)
22,40
0
+ 100 -
+374.2 -
21.83
О.ОбеО (
—
—
1,859
0,016 (
883
-242,01
—
—
28,013
1,251
1,251
-210
-195,8
-147.0
3.35
3,0501
—
—
1,030
3,0251
1665
0
-
—
Величина эффективного коэффициента теплопроводности А3 в
направлении, перпендикулярном потоку жидкости в зернистом слое,
через который течет газ (жидкость), определяется физико-химическими
свойствами слоя и потока, а также степенью турбулизации потока:
A z ? (А - 't'A *A )t[f~?)A-A C.6)
где Аг и А . - соответственно коэффициенты теплопроводности
газа и частиц зернистого слоя; л - коэффициент, учитывающий
перенос тепла турбулентной диффузией; Ли,л - коэффициент, учитывающий
передачу тепла излучением от частицы к частице.
Излучение частиц в плотном стационарном слое обычно не
играет существенной роли. Но в процессах каталитической конверсии при
температурах свыше 700°С лучистую составляющую А можно учесть
61
упрощенной формулой /41/: 3
где а - 4,9-Ю~8кяал/м4-ч-(°КL - коэффициент лучеиспускания
абсолютно черного тела.
Коэффициент теплопроводности слоя
v
Лм" 2Jv+*a<, ' C.8)
где xv - теплопроводность частиц; * - коэффициент теплоотдачи
от потока к частице, л имеет значение только для металлических
зерен.
Коэффициент А.
ЯГ-' C'9)
где if - массовая скорость; Ре -критерий Пекле
/>_-_?_, C.10)
D3 - эффективный коэффициент диффузии.
В промышленных аппаратах конверсии составляющая
теплопроводности, вызванная турбулизаодей потока Л . , имеет определяпцее
значение.
Вследствие значительного термического сопротивления
зернистого слоя всегда имеется градиент температуры по радиусу трубы. Это
лимитирует диаметр реакционных труб с внешним обогревом.
Геометрическая форма каналов меаду гранулами катализатора
достаточно сложная, поэтому расчет массо- и теплообмена
производится по полуэмпирическим зависимостям.
Массовый поток реагента к грануле или продукта в поток может
быть определен из уравнения массобомена
f
где ? - коэффициент массообмена; cs, с, - концентрации
компонента на поверхности в ядре потока.
Для газового потока концентрации могут быть заменены
парциальными давлениями компонента Р. и Ps :
Коэффициент массообмена я определяется из критериальных
уравнений
32
Sfizf (/ее, 5с ),
- критерий Шервуда (диффузионный
критерий Ыуссельта);
\ C.13)
- —j— - критерий Рейнольдса;
д —jr- - критерий Шмидта (диффузионный
критерий Прандтля).
Здесь a3 - эквивалентный размер канала; // - яоэффищент
вязкости.
Критерий Шервуда моает быть определен из уравнения
Sh--A-Ke Se . C.14)
Коэффициент А по различным данным леяит в пределах 1-1,15 /41/.
Уравнение C.14) справедливо в пределах: 40 < fie <: 4000, \< se*
<4000 и порозности слоя 0,25 < с < 0,50.
Удовлетворительные результаты дает уравнение /40/:
-//? -f/3 г ,7/2
Sb-te Se =u,9i?s-47S(/-?)(t-42)] . C.15)
Формулы C.14) и C.15) наилучшие результаты дают для
сферических частиц. В этом случае эквивалентный диаметр равен диаметру
шара d3 - ay.
Точность уравнений при другой конфигурации частиц Судет
зависеть от того, насколько удачно определен a3.
Например, для цилиндрического катализатора с внутренним
отверстием (колец Рашига) или без него эквивалентный диаметр
определяется по формуле
Г, 279
a3 C /C J.279 '
0,304у1 * -д- C.16)
где fy - поверхность частицы; vv - объем частицы; ?fi - диаметр
реактора.
Сорозность слоя і находится из соотношения:
tf- +4,373)+І7-(о,Шу-+а,373)](-^) , C.17)
где dff и ац - наружный и внутренний диаметры цилиндрической
гранулы.
63
Предложено много формул для определения d4 и б , но
приведенные выше A6) и A7), по-вилимому, наиболее обоснованные.
Тепловой поток от гранулы катализатора к газу (или в
обратном направлении) зависит от гидродинамики потока, массообмена и
теплофизических свойств смеси:
1-{<**?9%Г +(o + 6)pLі. ¦§-}, (ЗЛ8)
где ( - коэффициент вихревой диффузии; D - средний коэффициент
диффузии; У - энтальпия; у - весовая доля компонента.
Второй член в правой части уравнения есть составляющая
теплового потока, обусловленная массообменом реагентов и продуктов
реакции. Составляющая теплового потока, вызванная разностью концент¦
раций, может значительно превооходить составляющую, обусловленную
разностью температур (первый член в правой части). Наличие
массообмена значительно интенсифицирует теплообмен между катализатором
и газом.
Тепловой поток от гранул катализатора к газу (или в обратном
направлении) можно находить как
If), C.I9J
где d - коэффициент теплоотдачи; Т$ и Г. , /s и /. -
температура и энтальпии газа у поверхности частицы и в ядре потока.
КоэфЗищеит теплоотдачи находится из критериальных уравнений
типа
где /Vu =—р— - критерий Нуссельта;
/С/ j
Pr =-p?-j- - -J - критерий Прандтля.
Здесь ъ * коэффициент температуропроводности.
Показатель w лежит в пределах 0,5 + 0,8; п = І/З; А =
0,6 г 1,8 в зависимости от порозности катализатора с и других
факторов.
Ориентировочно, не принимая во внимание геометрию частиц при
аорозности порядка с = 0,5, теплообмен при конверсии можно
рассчитать по формуле
Здесь N - скорость потока, рассчитанная на полное сечение реактора
. »-&• . C.22)
где с - расход газа; f - площадь поперечного сечения реактора;
р- плотность газовой смеси.
При экзотермической реакции температура катализатора выше,чем
температура потока, а при эндотермической - ниже. При конверсии
имеют место оба случая. Е&ачителышй перегрев катализатора может иметь
место при гидрогенолизе. Температуру наружной поверхности зерна
можно найти из теплового баланса частицы или слоя катализатора:
(тгг/)- C'23)
где &н - теплота реакции; $#(С/,) - расход реагентов на одну ча-
стичу или слой; Ру(?Л) - соответственно поверхность частицы или
слоя. Толщина слоя долина выбираться такой, чтобы температуру газа
в нем т, можно было считать постоянной.
В трубчатых печах конверсии основным фактором, лимитируицим
скорость процесса, является теплоотдача от внутренней поверхности
трубн к потоку газа. При исследовании переноса в зернистом слое
можно пользоваться как коэффициентом теплопередачи, так и
эффективный коэффициентом теплопроводимости слоя, рассмотренным выше.
В отличие от полых труб в реакторах с насадкой сопротивление
теплообмену нельзя принимать сосредоточенным лишь в пристенном слое.
Термические сопротивления пограничного слоя у стенки трубы и между
зернами катализатора одного порядка.
Предложено большое число формул для определения пристенного
коэффициента теплоотдачи /40, 41/. Для реакционных труб при
каталитической конверсии мы рекомендуем формулы
(f(}T C.24)
(//ы л^ - вязкость и теплопроводность при температуре стенки
реактора);
р . C.25)
( А ~ удельная поверхность катализатора, м /м3, ^ - массовая
скорость, ijr/м3 • ч).
Эквивалентный диаметр частиц для этой формулы определяется с
учетом диаметра трубы по соотношению C.16). Формула C.24) не
учитывает влияния теплопроводности зернистого слоя на коэффициент
теплопередачи. Учитывать J необходимо только для металлических ча-
65
стиц. Численное значение, полученное по формуле C.24), надо до-
иножить на коэффициент, который приблизительно равен 1,2 для
железа и никеля, 1,25 - для цинка, 1,35 - для алюминия, 1,47 - для
меди. Для большинства промышленных катализаторов конверсии формула
C.24) справедлива без поправок.
ДИФФУЗИЯ В ПОРАХ КАТАЛИЗАТОРА
Перенос вещества в порах осуществляется только путем ыилеку-
лярной диффузии по закону Фика:
Г-^< C.26;
где х - расстояние от устья вдоль поры.
При конверсии углеводородов в зависимости от размеров пор я
параметров процесса диффузия может быть объемная и
кнудсеновская.многие катализаторы конверсии состоят из макро- и микропор. В
макропорах при любых режимах работы наблюдается объемная диффузия. В
микропорах (радиус 10-100 A) диффузия может быть объемной и кнудсенов-
ской. Переход от кнудсеновской к объемной диффузии осуществляется
при давлении около 2,5 МБа. При атом давлении средняя длина
свободного пробега молекул одного порядка с диаметром пор.
Кинетическая теория газов дает выражения для коэффициентов
объемной S , и кнудсеновской Dk диффузии.
L)//Z
т) ' C.27)
2 flhL Л 1/г
Вк'~Ъап\.хт I • C.28)
где л - средняя длина свободного пробега молекул; Л -
постоянная Больцмана; ^ - диаметр поры; m - масса молекулы. Массу
молекулы можно выразить через ее молекулярную массу; тогда
получаем удобную для расчета формулу для кнудсеновсксй диффузии
Определение коэффициентов взаимной диффузии в
многокомпонентной смеси при паровой конверсии затруднено, так как состав газа и
параметры гчоцесса в реакторе переменны. Но молекулярная масса
продуктов реакции, состоящих из Л?, СО, /?<7, Crt^ ¦ мг ,
изменяется незначительно (М = 15^-20).
Поэтому составом смеси можно пренебречь и пользоваться данными
•по диффузии углеводородов в воздух, азот, кислород, метан или водя-
66
ной пар. Зависимость коэффициента диффузии от температуры и
давления можно находить по приближенной формуле
л~-ао^ 273 ) Р ¦ C.30)
Значения Do и п для газов, которые встречаются в процессах
конверсии углеводородов, представлены в табл.7.
Таблица 7. Бинарные коэффициенты диффузии в воздух Эа при
273 С и показатели п
Газ
"г
СО
сог
н2о
»2
С2НЪ
A, а?/о
0,68 -
0,20
0,14
0,22
0,19
0,20
0,114
1,80
1,80
1,70
1,80
1,80
1,69
1,70
Газ
СгМ*
C3ttg
?4*10
CaHS
Cg*/8
С ГО #22
п пит /п
V
0,148
0,120
0,090
0,064
0,078
0,054
0,046
/7
1,64
1,60
1,60
1,60
1,89
1,60
1,60
В процессах конверсии газовая смесь многокомпонентна. Поэтому
необходимо определять средний коэффициент диффузии для смеси. .
С достаточным приближением можно пользоваться простой
формулой, полученной из уравнения многокомпонентной диффузии /42, 43/:
Z ».
где /^ - мольные доли компонентов в смеси;
C.31)
- коэффициент
диффузии бинарных систем.
В области, где средняя длина свободного пробега молекул и
диаметр пор соизмеримы, коэффициенты диффузии в поре следует находить
по формуле гармонического среднего
/ / /
или по формуле
, V4tf ,
D-DgoA-e ¦ ) . C.33)
Максимальное расхождение коэффициентов, полученных по этим
формулам, не превышает 3QS8. В области, более близкой к
молекулярной, лучшие результаты дает формула C.33), а в области,близкой ко
кнудсеновской, предпочтение следует отдавать формуле C.33).
Коэффициенты диффузии в порах всегда меньше, чем D^ и J?
67
При давлениях, близких к атмосферному, преобладающей в
процессах конверсии углеводородов является кнудсеновская диффузия. С
повышением давления наблвдается постепенный переход к объемной
диффузии. Для большинства катализаторов диаметр пор равен среднему
пробегу молекул - примерно при 2,5 МПа. Следовательно, можно, считать,
что диффузия в микропорах катализатора лежит в переходной области
для всех режимов конверсии.
Перенос вещества внутри пористого зерна катализатора
характеризуется эффективным коэффициентом диффузии D* . В реальном зерне
катализатора поры извилисты, неодинаковы по диаметру и длине.имеют
разную шероховатость, могут образовывать замкнутую сеть каналов и
каверны различной формы. Поэтому будем рассматривать пористое
зерно как кваэигомогенную среду и характеризовать скорость диффузии
реагентов эффективным коэффициентом диффузии D* /I9, 43-45_/.
Диффузия в порах катализатора является одним из механизмов
переноса тепла. Тепловой поток возрастает, что учитывается
эффективным коэффициентом теплопроводности Л* , который можно определять
как
** = Л3 *Гср**' C.34)
где Л^ - теплопроводность материала зерна; у - плотность газа.
Ориентировочно можно принимать
Л* = &¦¦*, C.35)
где Л - тешюпроводнооть газовой смеси.
Связь эффективного коэффициента диффузии 2* с коэффициентам
диффузии в капилляре выражается с помощью коэффициента
проницаемости /7
D* = ПП . C.36)
Коэффициент проницаемости есть функция коэффициентов
пористости ? , формы а , извилистости $, , шероховатости т , т.е.
геометрических характеристик пористой структуры
п 6°
1 Z* C.37)
Коэффициент ? определяется легко, но установить значения е-,
? и і - весьма сложная задача. По грубым оценкам
t. = 1,4т2; г = I,5f2; о = 0,6*0.7.
Коэффициент проницаемооти П обычно определяется экспериментально.
Наиболее часто встречающееся значение его лежит в пределах 0,03т-0,2.
Многие катализаторы конверсии имеют крупные транспортные поры
я узкие капилляры. При таком резком различии в размерах понятие эф-
68
фективного коэффициента теряет определенность. В этом случае
необходимо применять "двойную" диффузионную модель, вводя отдельные
эффективные коэффициенты диффузии для транспортных макропор и для мик-
ропор /43/.
МОДЕЛИРОВАНИЕ ПРОЦЕССА КОНВЕРСИИ МЕТАНА
НА ЗЕРНЕ КАТАЛИЗАТОРА
При одновременном протекании в зерне катализатора химических
превращений и массопереноса в нем возникают градиенты концентраций и
температур. При анализе процессов используются капиллярная,
квазигомогенная и глобулярная модели пористого тела /42-45/. С точки
зрения описания процесса все эти модели идентичны. Мы будем
пользоваться квазигомогенной моделью.
Математически процесс на пористом зерне катализатора описыва- •'¦
ется системой уравнений диффузионного типа /43/:
D* vC = ш(с,т), C.38)
А*, Т-»(Є.Т)-Ak. (a>3g)
В этих уравнениях принято, что концентрации реагентов
невелики и можно пренебречь потоками, возникающими из-за изменения объема
реакционной смеси и различных коэффициентов диффузии.
В процессе конверсии углеводородов водяным паром происходит
изменение числа молей веществ в результате реакции.
Следовательно.возникает гидродинамический (стефановский) поток. Вклад в стефановский
поток вносит также значительное различие (более чем в три раза)
коэффициентов диффузии реагентов. С учетом гидродинамического потока
процесс на сферическом зерне катализатора описывается системой
уравнений:
C.40)
C.41)
C>42)
(при г-- R Г=Г$, C-Csl
69
с граничными условиями
где из і - скорость расходования і -го компонента; J- поток
вещества; / - теплосодержание.
Ю.Л.Вяткиным и др. /46 - 48/ проведено моделирование
процесса паровой конверсии метана в изотермическом шаровом пористом
зерне катализатора, т.е. изменение температуры по радиусу не
учитывалось и уравнение C.41) опускалось.
Для решения системы уравнений C.40) и C.42) она была
преобразована в следующему виду
C.40')
C.42')
граничними усло
при ?-
при ps, л. =^ ,
где х- - мольная доля *-го компонента в реакционной смеси;
p=Q- относительный радиус; D* - эффективный коэффициент диффузии
г -го компонента; Уг- - стефановский поток /-го
компонента.Индексы 1,2,3,4,5 и 6 присвоены соответственно Щ, сог, //г0, <?&, ty
N2.
Концентрация шестого компонента (инертного) находилась как
6 i*1 * C.43)
и поток его • j
J'-k?MiJ'*- C.44)
Стефановский поток выражался следующим образом:
„ ід
Vr Л ? Dtk • C.45)
где Dl- бинарный коэффициент объемной диффузии. D* -
находился по формуле C.32).
Система уравнений C.40) решалась методом перехода к
нестационарной задаче с использованием неявной сеточной схемы. Все
нелинейные члены д*, V. t dB*/d?, aVL /dp, ил рассчитывались на
предыдущем временном шаге. Решение осуществлялось методом прогонки,
йистема C.42) является задачей Коши.
70
Скорость конверсии метана ю1 рассчитывалась по урванению
B.14) и было сделано предположение, что реакция конверсии Л?
достигает равновесия. Поэтому для расчета скорости конверсии tufefy)
выбрано уравнение
,., _ к р /,_ ' РО>г Р*2 )
ш2-к2УС0у, К^ ¦ р^р^ )¦ C.46)
При расчетах коэффициент *, принимался настолько большим,
что маршрут
J2)
реакции B.7) получался равновесным. Для этого до-
100 *
статочно было принять 7
Расчеты выполнялись для катализатора ІИАП-3 с удельной
никелевой поверхностью 0к65 v?/t. Средний радиус пор в этом
катализаторе составляет 600-2000 A и диффузия в них протекает в переходной
области при атмосферном давлении и в молекулярной области при ЗОат.
В расчетах принимался радиус, равный 1000 К. Коэффициент проницав- '
мости оказался равным п - 0,06-0,07.
На рис.10 показан пример распределения концентраций в зерне
размером 12 мм при отношении пар : газ /г = 4,5, />= 30 ат и t =
800°С. Уже на глубине 1,2 мм смесь находится практически в равнове-
W , 0,9
Рис. 10. Распределение
концентраций реагентов и продуктов
реакции в зерне катализатора: /-
сии. Степень использования внутренней поверхности f, при этом
равна 0,35. Для сложной_многомаршрутной реакции ^ имеет смысл только
для исходного компонента, который находится в недостатке.
71
Реакция конверсии метана сопровождается заметным изменением
объема (примерно в 1,5 раза), а коэффициенты диффузии в смеси
различаются более чем в три раза. В этих условиях возникает
гидродинамический стефановский поток. Оценка вклада его в обший поток
компонента показала, что при р< 0,5 МПа он составляет до 10$
диффузионного. С увеличением давления вклад qxt уменьшается и при
3,0 МПа не превышает 2-3$. Степень использования внутреннего
объема катализатора не зависит от вклада стефановского потока, при /° =
0,1 МПа и t = 700°С величина р = 0,189, а при р = 3,0 МПа и
700°С р = 0,07. Практически для конверсии метана под давлением
rc xt можно пренебречь.
Наблвдаемая скорость реакции определяется как среднеинтеграль-
ная скорость на зерне.
Для шара
CU - 2 I &J ( ? ^' I ^* ^f г \ О • 4 I /
к О
Степень использования внутреннего объема катализатора или
коэффициент (фактор) эффективности есть отношение наблюдаемой и
кинетической скоростей реакции
со*
?" со ' C.48)
В результате расчетного исследования /48/ установлено,что при
атмосферном давлении и температуре 700-800°С наблвдаемая реакция
имеет первый порядок по метану и не зависит от концентрации других
компонентов. Для tfj = 12 мм наблвдаемая скорость описывается
уравнением /48/
°> СН^У1'Т~^) I"л 4/iZ'> C>49)
г /45OU / і і \ 7
к=4,О5 expl j— \jr - fft)\
Опытные данные аппроксиммируются уравнением C.49) достаточно
хорошо, несмотря на то что исходное уравнение B.14) получено в
интервале температур 430-700°С, так как структура его выведена на
основе детального механизма реакции. При Р =3,0 МПа и t. = 800°С
наблюдается торможение реакции водородом, но в меньшей степени,чем
в кинетической области, и результаты аппроксимируются уравнением
к-1,51
72
C.50)
Это выражение, близкое по форме к уравнению B.14), может быть
использовано при обработке экспериментальных дяяянт при
температурах 700-900°С и повышенных давлениях.
В процессе конверсии прямая и обратная реакции имеют первый
порядок, и коэффициент эффективности может быть определен для
сферического зерна как
где у - модуль Тиле - Зельдовича,
Л* ' C.52)
Используя модифицированный модуль Тиле для реакции первого
порядка
" П
3y C.53)
и выражение р для плоской пластины, получим
_L /ИГ
ї~ у' У к^к2 C.54)
где к - константа скорости суммарной реакции; Ау - прямой
реакции; *2 - обратной реакции.
В центре зерна катализатора состав газовой смеси достигает
почти равновесного значения. Коэффициент эффективности при равновесной
реакции всегда ниже, чем при необратимой. Дня грубой оценки можно
положить, что при паровой конверсии метана А=Л,=*^ .
Следовательно, коэффициенты эффективности будут приблизительно в VIT раза
меньше, чем при необратимой реакции первого порядка.
Для гранул катализатора, применяемых в промышленных печах,на-
блвдаемую скорость конверсии метана водяным паром рекомендуем
рассчитывать по уравнению
F,
CykI>*{ilK) "C.55)
где Кр - константа равновесия; л - константа, вычисляемая
аналогично Кп но по действительному составу газа.
В работе /49/ оценены фактор эффективности ^ и глубина
проникновения реакции внутрь зерна катализатора. Исследования
проводились на промышленном катализаторе ІИАП-3 и лабораторном,
состоявшем из чистой ы= Ato& , на которую нанесено 3,9 никеля.
73
Для ІМАП-3 с размером зерна а/с, = 1,15 мм при 900 С использу-
аіггя около 18^ объема зерна, что соответствует эффективной толши-
не работающего слоя S = 0,035 мм. Для лабораторного катализатора
с dy = 1,2 мм используется примерно 20? объема и S = 0,04 мм.С
уменьшением температуры глубина проникновения реакции быстро
возрастает, и при температуре порядка 650°С процесс переходит в
кинетическую область.
Используя для реакции первого порядка безразмерный критерий
Вайса, равный квадрату модуля Тиле,
Ф= D**s ' C.56)
авторы /49/ определили коэффициент эффективности (использования
внутренней поверхности) катализатора р для различных температур
процесса и размеров зерен катализатора, р изменяется в пределах 0,03-
0,75 (табл.8). Как видно из представленных данных, с уменьшением
зерна катализатора коэффициент эффективности значительно
возрастает, увеличивается и'константа скорости реакции в расчете на
единицу массы катализатора. Величина А в данном случае является
константой скорости уравнения
гщ
Таблица
метана
8. Кинетические характеристики паровой конверсии
Катализатор
і, мм
t,'c
к, л/ат- і
ІИАП-3
Лаборатор—
TTTjft Ч Off А/і
на d ' At2 ь ^
4,50
2,40
1,14
2,40
2,40
1,90
1,90
5,40
2,85
1,86
1,20
5,40
1,86
1,86
1,20
7,2
13,5
28,4
13,5
13,5
7,8
14,5
22,5
34,5
34,5
22., 5
22,5
34,5
900
900
900
850
800
800
700
900
900
900
900
800
800
700
800
0,27
0,53
0,53
0,60
0,50
1,90
3,40
0,46
0,32
0,34
0,51
0,40
0,40
0,90
0,30
95,9
128,0
238,0
66,7
50,0
33
13
134
300
301
486
67,7
133,0
41,6
272,5
—
-
-
81,2
81,2
76,2
86,2
-
-
_
_
75,4
80,4
80,4
74,5
295
112
47
43~0
17,8
6,7
136
84
36
24
64,0
14,9
4.9
14,0
0,3
0,08
0,18
_
0,19
0,49
0,60
0,07
0,10
0,23
0,32
0,13
0,43
0,75
0,44
По данным работы /50/, эффективный коэффициент диффузии для
катализатора ІИАП-3-6 при температуре 700-800°С оценивается величиной
D*_ = 0,003 vt/а. Наблвдаемая скорость реакции при 600°С с увеличе-
74
ниєм диаметра зерна с 1,5 до 11,3 мы падает от 1,46 до 0,21 л/т-ч.
До диаметра 2,5 мм процесс протекает в кинетической области. На
гранулах промышленного размера, даже при такой низкой температуре,
реакция протекает во внутридиффузионной области. Для зерна с a =
1,5 мм при t = 600°С величина -> = 0,80-0,95, при г" = 700°С
р= 0,7-0,8, а при t = 800°С ^ = 0.15-0,20.
Таким образом, при условиях, имеющих место в реакционных
трубах печей и других аппаратах, процесс на промышленных
катализаторах (размер зерна больше 5 мм) протекает в диффузионной области.
При температурах 650-Ю00°С эффективная глубина проникновения
реакции внутрь зерна катализатора составляет 0,02-1,00 мм. С
увеличением температуры до 750-800°С процесс смещается в глубокую
диффузионную область, т.е. толщина эффективного работающею слоя очень мала
по сравнению с размерами гранулы, и скорость реакции становится про
порциональной наружной поверхности катализатора.
Для катализатора ІИАП-3 получено следующее кинетическое
уравнение /їб/:
І94О0
R1
" ''¦ '" " " PC*J r-vJ' C.57)
где 4,смг/г- удельная геометрическая поверхность гранулы
катализатора.
При паровой конверсии в труочатых печах при р =3,0 МПа
фактор эффективности в зависимости от температуры и размера зерна
катализатора мокно ориентировочно оценить по рис.II.
Диаметр зерна, мм
12
Рис. П. Зависимость дактора
эффективности от диаметра зерна
и температуры процесса: 1-600;
2 - 700;3 - 800 °С.
По данным /437, величина модуля Тиле (см.уравнение 3.53) при
900°С и атмосферном давлении составляет ^=30 (промышленный
катализатор). С увеличением температуры и давления значение ^ возра-
75
стает. По нашої расчетам, при р = 4,0 МПа и т - 1073 к
величина ц> = 350, а при Р=. 0,1 МПа и 71 = 873К у - 20. Для
катализатора в виде колец Рашига размером aH » dg * h - 15/5,0^15 мм и
кинетических параметрах f = 92,95 кДк/моль и *0 - 5,54-10 1/с,
Фактор эффективности определялся как
«P . C.58)
Значения его лежат в области 0,1-0,002, т.е. в промышленных
условиях процесс протекает в диффузионной области.
Другим важным параметром, характеризующим процесс в
зерне,является /43/
э p RJ TT - ^aal C.59)
где A&=-^?-L- -^-я - адиабатический разогрев; л - эффективная
Lp RT
теплопроводность; аэ - температуропроводность зерна катализатора:
6 - теолоемкостъ, Qp - тепловой эффект реакции. Для
реакции конверсии метана с водяным паром Q -205163 кДж/кмоль;
Е = 167480 кДя/кмоль.
При Т = 1173 К и Р « 0,1 Mfla.no данным /43/, вэ = 0,018 м?'/ч,
Лэ = 0,2 м-ч-град; ла^ = -27,8; ПдСр/ла = 0,036; a$ = -І.О.Ццесь
AU отрицательна, так как реакция эндотермична.
Значение ла невелико, но при детальном моделировании
процесса паровой конверсии метана на зерне необходимо учитывать
градиент температур по радиусу зерна. Это может изменить фактор
эффективности до 20-3055 в сторону уменьшения.
Выше было рассмотрено моделирование процесса внутри пористого
зерна при известных концентрации и температуре на его поверхности.
В общем случае даны температура и концентрация веществ в газовом
потоке. Процессы переноса вещества и тепла описываются уравнением:
s, Ts) , Ci60)
(Ct.TSl C.61)
где to* - наблвдаемая скорость реакции, отнесенная к единице
наружной поверхности зерна катализатора; ?,, Т, - концентрация и
температура в ядре потока.
, Обычно в промышленных реакторах конверсии решающее значение
имеет внутридиффузионное торможение, но при температурах выше 850-
900 С существенную роль начинает играть внешний тепло- и массооб-
76
мен. Поэтому необходимо решать общую задачу, учитывающую перенос
тепла и вещества как внутри зерна, так и в газовом потоке.
Если не учитывать стефановский поток в зерне, который
составляет несколько дроцентов от диффузионного, то систему уравнений,
описывающую процесс в зерне, можно представить в виде
C.62)
A* {EIL +±..EL\ = 4toj(c, r) C.63)
dr2 r dr '
с граничными условиями
при u
лри
Коэффициенты ? и & рассчитываются ло формулам C.14), C.15) и
C.21).
Для решения системы уравнений C.62) - C.63) полно применить
несколько отличающийся от рассмотренного выше метод. Уравнение C.62)
записывается только для метана. Из решения системы находим его
концентрацию и степень конверсии. Реакцию конверсии СО паром считаем
равновесной и методами, описанными в главе I, находим состав
газовой смеси. Уменьшение числа дифференциальных уравнений сокращает
время счета, но алгоритм расчета несколько усложняется.-
Значительное внешнедиффузионное торможение наблюдается в
реакторах паровоздушной конверсии, где процесс протекает при
температуре 900-1000°С и наблюдаемая скорость реакции на зерне достаточно
высокая, хотя процеос идет в глубокой диффузионной области.
МОДЕЛИРОВАНИЕ ПРОЦЕССА КОНВЕРСИИ ЩДКИХ УГЛЕВОДОРОДОВ
Как было показано в главе 2, можно считать, что реакция
газификации имеет нулевой порядок, незначительный тепловой эффект и
необратима. Следовательно, процесс на зерне однозначно описывается одним
уравнением материального баланса конвертируемого сырья
,/ а*С г d.c і
C.64)
77
Ш - к -кое
•¦ граничными условиями
при г- u -znr -О,
При г- R С - Cs<
cs? С - концентрация конвертируемого (или ключевого)
компонента; к - конотанта скорости реакции нулевого порядка.
Уравнение C.64) имеет аналитическое решение /44/:
гдн ш = R-\f?-jr~ - модуль Тиле - Зельдовича для реакции нулевого по-
Для реакции нулевого порядка скорость превращения не зависит
л концентрации реагента. Следовательно, если при г=р
концентрация имеет конечное значение, фактор эффективности равен единице.
Для любого значения г><7 концентрация реагента становится равной
НУЛЮ При Некотором крИТИЧеСКОМ ЗНачеНИИ Г, ЕСЛИ у< -/<?sr2,45,TO Г =
I и со* - со .
При f^ffi (диффузионная область) коэффициент эффективности .>
и наолвдаемая скорость реакции ш* определяется из соотношений
/ Vb ' kv C.66)
"із ' v °s ' C.67)
.де к у ~ константа скорости, отнесенная к единице общего объема
гранулы катализатора.
Для колец Рашига отношение геометрической поверхности к
объеду гранулы есть
з '{"н аЛ' ч° tri сгл
где /, аи и dg - висота, наружный и внутренний диаметр кольца.
:Ъ'ж концентрация реагента становится равной нулю при некотором уя-
гкусе гКс (критический радиус), то работает только шаровой елоЯ
.олпиной 'S: rs -г и % <; , т.е. имеет место диффузионный реи:
Степень эффективности (использования объема дерна катализаао -
^) можно определять двумя путями:
. }уТ і ! I » ...
и ,- A s ~ */>
-r\:i = ~~~Ъ ¦ C.70;
Значения а , рассчитанные по формулам C.69) и C.70), не
идентичны, но расхождения не превышают ЗС# /118/.
Наблкщаеідая скорость реакции определяется как
**=$к. C.71)
Рассмотрим более подрооно процесс в поре катализатора при ре-
diuatii нулевого порядка. Ьез диффузионных помех на единице активной
поверхности катализатора реагирует к i's мол/с исходного
вещества. При наличии диффузионного торможения суммарная скорость процес
са пропорциональна величине (rk„#sI>*5s) U, где г - радиус
поры, і - длина поры, пропорциональная диаметру частицы /52/.Наличие
диффузии изменяет порядок реакции. В кнудсеновской области
коэффициенты диффузии не зависят от давления и кажущийся порядок реакции
будет 0,5. При объемной диффузии Д* обратно пропорционален
давлению и кажущийся порядок реакции будет нулевым.
На большинстве катализаторов процесс вдет в переходной области
и кажущийся порядок реакции будет между 0 и 1/2, кажущаяся энергия
активации меньше истинной и находится в пределах ? - 10т-20ккал/моль
При протекании реакции в порах градиент концентрации вдоль по
поре можно выразить уравнением /527:
L-,,2f_L .L(JLJ 1 C.72)
С, L а 2 \ і ' J '
где k- uBKqtislrll*?5I''2; х - расстояние вдоль поры от входа.
Если h <уТ из-за малого размера частицы или высокой
концентрации С5 , то С'0 при а-і и реакция нулевого порядка
протекает при полной скорости, пропорциональной fy/ifa, и не завивит от
размера частиц, так как над всей активной поверхностью имеется
концентрация реагирующего вещества.
Когда h достигает значения /~2* (вследствие увеличения
размера частиц или снижения us\ при х-1, с^О , т.е. в центре
зерна концентрация реагента падает до нуля. И если fi^fe
концентрация падает до нуля на некотором расстоянии от поверхности.
Внутренняя часть зерен не работает и концентрация реагента падает вдоль
поры в соответствии с уравнением
h-x \2 7
C.721)
Концентрация становится равной нулю при м = т/ТГ/л . В этом слу-
79
Рис.12. Распределение
концентрации гептана с7 //Г( в зерне
катализатора при различных
температурах ( <*= 5 мм, /Р/ =2, Р =
4,0МПа): „ '
1 - 300; 2 - 350; з - 400:V
450; і - 500; *Г - 550; 7-6OO°C.
O? 0,8 r/R
Л
ao
15
¦Ю
О
РисЛЗ. Распределение концентрации гептана в зерне катализатора при
различных давлениях ( ї = 350 С, R, = 4,0, ^, = 5 мм):
/ - 4; 2 - 3; 3 - 2; *- I МПа. ^
Рис.14. Зависимость толщины работающего слоя ( 8* кл - r
лизатора от температуры при различных R, -,
і - 2\ I - 4; J - 6. 6
ВО
)
катачае работает только длина поры -г* = Y? /л . В пределе при очень
быстрой реакции ( а„ /?, — <- ) кр~ о . Когда глубина ее
проникновения сравнима с диаметром пор, работает только внешняя поверхность
частицы, и скорость реакции пропорциональна внешней поверхности
гранул катализатора.
Нами были проведены расчеты процесса паровой конверсии
различных углеводородов.
Например для катализатора ПШІ-5 при отношении пар : сырье,
равном 2 кг/кг и Р = 4,0 МПа, получено распределение концентрации
гептана по радиусу гранулы диаметром 5 мм, представленное на рис.
12. При 300 и 380°С наблюдается кинетический режим, а при более
высоких температурах - внутридиффузионный режим. Интересно отметить,
что при диффузионном режиме изменение давления не сказывается на
доле работающего катализатора. Как видно из рис.13, при температуре
350°С критический радиус равен 0,4 при любых давлениях и p(P)=?o*st!'
Это объясняется тем, что с увеличением давления концентрация
реагента возрастает, а эффективный коэффициент диффузии падает
примерно в равной степени, так как он определяется в данном случае
коэффициентом объемной диффузии. Толщина работающего слоя зерна очень
сильно завиоит от температуры в области низких температур ( до
300°С) и очень слабо в области температур выше 400°С, где
толщина работающего слоя менее Ъ% радиуса зерна (рис.14).
На высокоактивных катализаторах низкотемпературной конверсии
процесс протекает в диффузионной области уже при температурах 300-
350°С и коэффициент использования внутреннего объема лежит в
пределах ь = 0,2тО,5.
Глава 4
ПОДГОТОВКА СЫРЬЯ К КОНВЕРСИИ.
ОЧИСТКА ОТ СЕРНИСТЫХ СОЕДИНЕНИЙ
ТРЕБОВАНИЯ К СЫРЬЮ И СПОСОБЫ ЕГО ОЧИСТКИ
Сырье для каталитической конверсии углеводородов должно
удовлетворять ряду требований. Сырьем могут служить природные газы
различного состава, сжиженные углеводороды, газы и бензиновые фракции с
температурой кипения до 200°С, газоконденсат, прямогенны.е бензиновые
фракции (нафта), бензины-рафинаты, бензины крекинга и
гидрокрекинга. С повышением температуры кипения сырья возрастает опасность
отложения полимерных соединений. Это главным образом относится к
низкотемпературной конверсии. Присутствие в сырье олефиновых и
ароматических углеводородов также увеличивает склонность к
полимеризации. Олефанов в сырье должно содержаться не более 1%. При более
высоком содержании их необходима очистка сырья, например
гидрированием непредельных соединений. Но на практике это встречается очень
редко, и поэтому очистку от непредельных соединений рассматривать не
будем.
В природном газе и бензиновых фракциях практически всегда
присутствует некоторое количество сернистых соединений и других ве -
ществ, являющихся каталитическими ядами. В первую очерь к ним
относятся хлор, свинец и мышьяк.
Природный газ, содержащий сернистые соединения в количестве,
превышающем I г/м3, подвергается сероочистке на головных
сооружениях и ГПЗ. Обычно применяется моноэтаноламиновая очистка, обеспе-
чивашцая остаточное содержание hqs менее 10 мг/м3. Поэтому
поступающий на химические предприятия газ не содержит большого
количества серы. Небольшое количество серы содержится и в бензиновых
фракциях, так как основное ее количество извлекается в процессах
нефтепереработки. Тем не менее имеющееся в сырье количество серы
часто превилет предельно допустимое.
Современные установки по производству аммиака и водорода
включают процессы низкотемпературной конверсии СО и метанирования на
-активных низкотемпературных катализаторах. Поэтому содержание серы
'82
в сырье не должно превышать 0,5 мг/м , учитывая увеличение объема
газа при конверсии. Примерно такое хе содержание серы допустимо
и при низкотемпературной конверсии бензинов или гомологов метана
в природном газе. Установка с парокислородной конверсией нриродно-
го газа и высокотемпературной конверсией СО могут работать при
наличии серы до 10 мг/м3.
При значительном содержании сероводорода в сырье могут быть
применены абсорбционные способы очистки с утилизацией серы,
например мшпьяково-содовый, который дает серу чистотой 98,6-99,6^.
Разработана схема гидроочистки бензинов с утилизацией элементарной
серы, предусматривающая гидрирование сероорганических соединений на
никель-молибденовом-катализаторе и затем отпарку #2S из
гидрированного бензина с последующим получением элементарной серы.
В США, Канаде и некоторых других странах широко
распространены методы очистки от серы на активированном угле с получением серы
высокой степени чистоты.
Из абсорбционных методов для глубокой очистки от серы подходит
пожалуй только щелочная очистка, получившая некоторое
распространение и имеющая перспективы дальнейшего развития.
На современных установках конверсии наибольшее распространение
имеет адсорбция серы твердыми поглотителями. В качестве
поглотителей применяют окись цинка, редко окись железа. Некоторые
органические соединения серы плохо сорбируются указанными поглотителями и
поэтому в систему очистки включается реактор гидрирования их до
сероводорода.
Система сероочистки обычно очищает газ и от других
каталитических ядов и дополнительная очистка не требуется.
ЩЕЛОЧНАЯ ОЧИСТКА
Достаточно эффективным и экономичным способом удаления сернистых
соединений является щелочная очистка. Она широко используется в
нефтеперерабатывающей и нефтехимической промышленности. Меркаптаны
поглощаются щелочью:
На он + HSH a fiaRS -+н2о, D л )
где R - углеводородный радикал.
При продолжительном контакте со щелочью, особенно в
присутствии кислорода и двуокиси углерода, меркаптаны могут окисляться до
дисульфидов и полисульфидов, плохо растворимых в щелочи
83
2 — 2X -S-S -К і- 2#гО. D.2)
При дальнейшем окислении меркаптанов могут образовываться
сульфокислоти и тиокарбоновые кислоты.
Низшие меркаптаны хорошо растворимы в щелочах, но с
увеличением молекулярной массы их растворимость уменьшается. Растворимость
их удовлетворительно описывается законом Генри.
где л f s - мольная доля меркаптана в растворе; Pfi/fl -
парциальное давление меркаптанов над раствором щелочи.
Коэффициент Генри кг для этилмеркаптана с достаточной
точностью описывается уравнением /53/
r = !O,3a-O,S87 ЧСЛат -2690/Г.
где Кг - мм, рт.ст/мол.доля; с#аМ - концентрация едкого
натг
ра, г-экв/л.
Растворимость резко уменьшается с ростом температуры,
следовательно десорбцию меркаптанов можно производить нагреванием.
Теплота растворения этилмеркаптана 12,3 ккал/моль E1,6 кДц/моль).По
условиям равновесия при р = 1,0'МПа и / = 20°С для практически
полного извлечения этилмеркаптана из 1000 нм3 газа необходимо лишь
0,04 м3/ 5/S-Horo раствора /іаОН.
Исследования кинетики абсорбции показали, что вследствие малой
концентрации меркаптанов скорость абсорбция практически полностью
лимитируется сопротивлением в газовой фазе. Изменение температуры,
концентрации щелочи и плотности орошения практически не влияют на
коэффициент массопередачи /537.
Щелочь хорошо поглощает и двуокись углерода
tla№+ ?u2 = #a*cu3 . D.4)
Поэтому щелочная очистка природного газа экономична лишь при
содержании в нем CD« не более 0,2-0,3$.
Щелочами абсорбируются также сероуглерод, сероокись углерода
и другие соединения:
D.5)
CS„ + 2ЛаОН — CuS+ЩS *¦ ft2u, D.6).
Cas
'84
Эти реакции необратимы, но протекают медленно, поэтому процесс
необходимо вести при температуре 60-80°С - горячая промывка.
Поскольку скорость гидролиза cst примерно на три порядка
ниже, чем COS , для ее извлечения требуется продолжительное время
контакта газа с раствором /ta он.
Оптимальными условиями селективной абсорбции меркаптанов яв-
ляптся условия, при которых обеспечивается наименьшая степень
извлечения двуокиси углерода, так как для абсорбции СО2 требуется
большое количество щелочи. Кроме того, в присутствии образовавшейся
соды несколько снижается растворимость меркаптанов.
В условиях равновесия <?Л, вытесняет меркаптаны из раствора.
Однако при концентрации ее более 0,1$ скорость абсорбции Л2, в
значительной мере лимитируется процессами в жидкой фазе. Это позволяет
путем подбора условий абсорбции достичь высокую степень извлечения
меркаптанов (95+99$) при извлечении СО2 на 35-40$ и резко
сократить расход щелочи.
Скорость газа из условий уноса капель жидкости не должна быть
более 0,3-0,4 м/с при Р = 10 ат. Оптимальные условия достигаются
при малой плотности орошения и невысокой концентрации щелочи E-6$
Л/а О H ) и низкой температуре. В результате общий раоход щелочи
при содержании в газе '0,1-0,3$ составляет 1-3 кг на 1000 мэ
газа. Наиболее благоприятное давление очистки 10-20 ат,поэтому
при конверсии под высоким давлением ее желательно производить
перед последней ступенью компрессии.
Поскольку отношение жидкость : газ очень мало, используются
аппараты с колпачковыми или клапанными тарелками.
Регенерация отработанного щелочного раствора (десорбция
меркаптанов) осуществляется в насадочных или тарельчатых колоннах паром
при нагреве до IOOfII0°C, воздухом или другим газом при 80-90°С.
Концентрация серы в регенеративной щелочи снижается до 10-30 мг/л,
что обеспечивает остаточное содержание серн в очищенном газе не
более 0,1-0,5 мг/м3. Расход пара на регенерацию составляет около 200кг
на I г регенерируемого 5$-ного раствора щелочи.
При наличии в газе различных сернистых соединений необходима
двухступенчатая (холодная и горячая) очистка, технологическая
схема которой дана на рис.15. В конкретных случаях может
устанавливаться одна- из ступеней и отсутствовать система регенерации щелочи.
Газ с примесью различных типов сернистых соединений поступает
в абсорбер холодной рчистки / ; нижняя часть его орошается
отработанным раствором из колонны горячей промывки для более полной ути-
85
Еве.15. Технологическая схема двухступенчатой щелочной очистки
газа:
; - абсорбер холодной очистки; 2 - подогреватель; j -
абсорбер горячей очистки; 4 - охладитель; 5- насос; е- теплообменник;
7 - десорбер; в- кипятильник; 9 - (|ильтр.
I - сырой газ, П - очищенный газ; Ш - газы регенерации; ІУ -
свежая щелочь; У -регенерированный раствор, УТ - крепкий раствор
A2-18%) щелочи; УІГ- частично отработанный раствор; УШ -
насыщенный раствор; IX - отработанный раствор; X - вода.
лизавди щелочи. Верхняя часть орошается регенерированным раствором.
8 абсорбере поглощаются меркаптаны и частично двуокись
углерода.Затем газ подогревается и поступает в абсорбер горячей очистки 3 для
удаления /^5, C$2, CCS . Здесь применена двойная циркуляционная
система. Газ проходит ншпшо часть колонны, где контактирует с
частично использованным раствором Mau// . Крепкий раствор A2-18$) с
добавкой свежей щелочи циркулирует через среднюю часть колонна.
Некоторое количество этого раствора подается в нижний циркуляционный
контур. Верхняя часть колонны орошается водой для удаления следов
щелочи из іаза. При такой схеме возможна высокая степень
утилизации щелочи. Отработанный раствор, содержащий Щї, #асо3, Ла#са3і
небольшое количество NaOH и примеси других соединений,
отводится из куба абсорбера 1 .
'86
Со средней части колонны / насыщенный меркаптанами раствор
подогревается в теплообменнике б и поступает в десорбер 7.
Раствор подогревается в кипятильнике S до температуры ІОО-ІІО°С.В куб
колонны подается также острый пар для отдувки меркаптанов. В
дефлегматоре пары охлаждаются до 60°С; флегма возращается в верхнюю часть
десорбера, а газы, содержащие 20-25^ меркаптанов, 12-11% ?Ц, Л^>
и ^2 ' отводятся на сжигание. Состав отдувочного газа выбирается
таким, чтобы не возникало трудностей его сжигания вследствие
большого количества меркаптанов. Регенерированный раствор с добавкой
свежей щелочи охлаждается до 30-35°С и подается в абсорбер
холодной очистки /.
Комбинированная (холодная и горячая) щелочная промывка
обеспечивает высокую степень очистки газа от серы в виде сероводорода,
меркаптанов, сероуглерода, сероокиси углерода и некоторых других
соединений, но плохо очищает газ от дисульфидов и тиофенов. Это не-''
сколько ограничивает ее применение. Основным преимуществом
щелочной очистки является непрерывность процесса при высокой степени
очистки.
ОЧИСТКА ГАЗА НА АКТИВИРОВАННОМ УГЛЕ
Очистка заключается в каталитическом окислении сероводорода
кислородом до элементарной серы
Нд5+О,5#2 ~fyO +S t53 /г^ал B77 *Дж). D.8)
Избыток кислорода по сравнению со стехиометрическим количеством
должен соответствовать концентрации Ое на выходе газа не более
0,1 %.
Для протекания реакции с достаточной скоростью при нормальной
температуре к газу добавляется аммиак в количестве 0,2 г/м3,
который поддерживает необходимую щелочность поверхности
активированного угля. Сера адсорбируется на угле и затем извлекается.при
регенерации. В промышленных реакторах рекомендуется применять зерна угля
размером 1-2 мм.. Высота слоя - около 100 мм. Влажность
поступающего на очистку газа должна быть около 100/8. Применяются специальные
сероемкце угли, характеризующиеся развитой системой переходных пор
радиусом 3-Ю~^-3,4-10 м, объем которых превышает 0,5-Ю м3/кг.
Сероемкость таких углей составляет 100-140$ от массы угля или 470-
520 кг/м3 угля.
Регенерацию углей производят раствором сернистого
-аммония,включающего II0-I20 кг/м3 аммиака и 75-80 кг/м3 сульфидной серы. В цро-
87
цессе регенерации сернистый аммоний превращается в (Щ J sn.
который разлагается затем острым паром при температуре 125-130°С
Получаемая в жидком виде сера отделяется от раствора
вследствие разности плотностей и имеет чистоту 99,9-99,97$.
Эффективность очистки зависит от типа сернистых соединений и
от концентрации высших углеводородов в газе. Низкокипящие
сернистые соединения адсорбируются неустойчиво, при наличии
конденсирующихся углеводородов происходит быстрое насыщение адсорбента и
степень очистки может снизиться. В этом случае целесообразно
установить на линии очищенного газа аппарат, заполненный окисью цинка,
что гарантирует проскок серы. Перед входом в адсорбер в газовый
поток дозируется воздух или кислород и аммиак. Смесь подогревают
паром для просушки угля в начальный период работы адсорбера после
экстрагирования серы. По мере накопления серы пропускная способность
адсорбера снижается, так как сопротивление слоя угля возрастает;при
этом увеличивается содержание H2S в газе. Через несколько суток
адсорбер отключают и производят регенерацию угля, которая
продолжается около суток в одну или в несколько стадий. Иногда экстракция
производится вначале полисульфидными растворами, а затем раствором
сернистого аммония. Регенерированный уголь пропаривают и охлаждают
газом. Вследствие циклической работы устанавливается несколько
адсорберов.
При нормальной температуре химическому превращению на угле
подвергаются тайке сероокись углерода и некоторые другие соединения.
Основная масса сероорганических соединений может быть удалена
физической адсорбцией на активном угле. Процесс циклический, состоит иэ
чередующихся фаз. Десорбция сернистых соединений производится паром,
после чего уголь просушивается газом. Преимуществом этого способа
является возможность полной очистки газа от тиофена.
Сочетая способы каталитического окисления и физической
адсорбции, на угле можно осуществить тонкую очистку газа от всех
сернистых соединений. Недостатком угольной адсорбции есть цикличность
процесса и сложность технологической схемы. При большой мощности
современных установок синтеза аммиака и метанола оборудование узла
сероочистки становится очень громоздким. Все это делает
проблематичным развитие этого способа, хотя в настоящее время он имеет
широкое распространение в ряде стран.
88
ОЧИСТКА ОКСИДАМИ ЖЕЛЕЗА
Окись железа легко реагирует с сернистыми соединениями с
образованием сульфида железа
(
Цри температурах 340-400°С основным адсороентом является
образующаяся из ?е2О3 по реакции
Реакции D.10) и D.II) обратимы и с помощью окиси железа
можно достичь содержания серы в очищенном газе около 10 мг/м3 (рис.16)
По;.
17
15
13
II
/
Lg К,
-28
-24
-20
-16
-8
Рис.16. Константы равновесия ре-
/7 акций:
І-(ІУ.П); ^-(ІУ.І2); J-
(іу.ІЗ); 4 - (ІУ.І9).
Преимуществами использования окиси железа являются ее легкая
регенерация, низкая стоимость и простота аппаратурного
оформления процеоса. Поэтому если удовлетворяет степень очистки,
достигаемая на окиси железа, то может быть отдано предпочтение этому
процессу. Но для большинства современных производств достигаемая сте-
89
пень очистки недостаточна. Поэтому иногда за аппаратами с окисью
яелеза устанавливается поглотитель с окисью цинка.
Недостатком очистки оксидами железа является легкость
восстановления сульфидов по реакции
Ге5ФИ2=^= Fe + »?S. DЛ2)
Рановесная концентрация сероводорода при температуре 400°С
составляет около 20 мг/м3, поэтому очень глубокая очистка в
присутствии водорода невозможна (рис.16).
ОЧИСТКА ОКИСЬЮ ЦИНКА.
Большинство современных установок паровой конверсии природного
газа и жидких углеводородов в трубчатых печах снабжается системой
очистки поглотителями на основе окиси цинка в сочетании с каталитиче-
• им гидрированием (гидрогенолизом) сероорганических соединений.
Принцип очистки. Поглощение сероводорода и сероорганических
соединений окисью цинка описывается следующими уравнениями:
Н2І + ZnO — ZnS +/i20, D.13)
C$2 + 27»О ~ 2 7лS +CO2, D.14 )
Z„S+UO2, D.15)
ZnS + C2Hs0", D.16)
25~ СгЦ + #Я0. D.17)
При температурах 300-500°С константы равновесия этих реакций
(Ад) лежат в пределах 10 г 10 и происходит практически полное
связывание серы.
В присутствии водорода могут протекать реакции типа
2 ?2//g +/f2u. D.18)
Органическая сера в виде меркаптанов, сульфидов и дисульфидов
поглощается по реакциям D.12) - D.15). Тиофены и тиоэфиры
медленно реагируют на окиси пинка и, если они имеются в сырье,
необходимо предварительное гидрирование их.
При нагреве сырья до температуры сероочистки C50-400°С)
может протекать термическое разложение некоторых сероорганических
соединений, главным образом меркаптанов с четырьмя - шестью
углеродными атомами. Происходит превращение одних сернистых соединений в
90
другие. Это необходимо учитывать при проектировании аппаратов
сероочистки.
На окиси пинка возможна очень глубокая степень очистки от
серы, так как реакция
г/iS * rf2^-г» +/t2s D.I9)
щ-акгичєски полностью сдвинута влево (см.рис. 16). Например, при
370°С равновесная концентрация H2s составляет 10 ррт.
Хемсорбенты. В СССР в промышленности широко используются
поглотители на основе окиси цинка ІИАП-І0 и 481-//7,ГИАЛ-Ю
выпускается в виде таблеток диаметром и высотой 5 мм; кажущаяся плотность
гранулы 2,4-2,5 г/см3, общая пористость 45-5ОД, сероемкость 25-28/8.
При температурах 350-400°С очистку можно вести при объемных
скоростях до 1500 ч.
Окись цинка можно регенерировать путем окисления ее
кислородом при температуре 5ОО-55О°С. Но при невысоком содержании серы в
сырье и, следовательно, длительном сроке работы поглотителя
регенерация его обычно не предусматривается. Сульфид цинка
отправляется на предприятия цветной металлругии.
Ддя тонкой очистки газов служит поглотитель ГИАП--І0-2 на
основе окиси цинка с активирующей дооавкой окиси меди.
Предварительно катализатор должен быть восстановлен водородом или окисью
углерода до металлической меди. Кроме реакции D.13) на этом
катализаторе происходит также необратимое связывание серы медью:
Си + M,S — Си s + //Sl
1С* + ф ~ "г* + »г- ' D.20)
Процесс ведут при температуре 280-300°С, что способствует глубокой
очистке - до 0,02 мг/м3. Регенерация цинк-медных катализаторов
невозможна.
Подобные поглотители выпускаются многими зарубежными фирмами.
Они состоят из чистой окиси цинка или включают в себя добавки
других металлов. Например, в поглотитель $ирмы ОШ (Франция)
входит 2% молибдена и 1% меди. Катализаторы выпускаются в виде
таблеток и шарикон диаметром 3-Ю мм. Обычно сероемкость катализаторов
лежит в пределах 18-25?, но японский поглотитель № 741 имеет
емкость 30$.
Сероемкость катализаторов зависит от рабочей температуры.Так,
чистая окись цинка при температуре 400°С имеет сероемкость около
20$ при начале проскока серы, а при 200°С эта величина порядка 12$.
91
Следовательно, высокотемпературные контакты более емки, а
низкотемпературные обеспечивают более глубокую очистку.
Процесс на зерне поглотителя. Поглощение серы гланулами окиси
цинка - типичный нестационарный процесс. В начальный момент
времени вся гранула состоит из ZnO , а в конечный момент - из ZnS.
Реакция начинается с поверхности зерна и заканчивается в центре.
Процесс лимитируется диффузией сернистых соединений через слой
сульфида цинка. Только в начальный момент времени, пока не
образовался слой ZnS , процесс определяется скоростью подвода веществ
к поверхности гранул.
Химическая реакция протекает на поверхности окиси шнка и на
скорость ее влияет только концентрация сероводорода
п
Порядок реакции можно принять равным единице. Скорость реакции
увеличивается с температурой, но чтобы свести к минимуму крекинг
углеводородов, температуру поддерживают не выше 400°С.
В идеальном случае сера должна адсорбироваться каждым слоем
гранулы последовательно и наблюдаться резкая граница между znu и
ZnS . в действительности реакция идет с конечной скоростью,
следовательно будет наблюдаться промежуточный слой, состоящий из ZnS
и ZnO . Кроме того, имеет место миграция ионов сульфида внутрь
кристаллов окиси и миграция окиси в наружный слой znS.
Но существенные свойства процесса будет отражать модель
сферического зерна, состоящего из двух слоев: наружный кольцевой слой -
инертная пористая масса, внутренний шаровой объем-активный
катализатор. Математическое описание со.стоит из уравнений, описывающих
процесс в неактивной (I) и активной (П) зонах:
a°J =»*(. а*?* + 1.I?l) D.22)
at ( ar* r fr '•
J*?l_ 7)*( a CU : 2 aCf )-u)(C) (і ?Ч)
Процесс образования слоя сульфида цинка на зерне относител!.
не медленный, поэтому можно допустить, что он проходит через серию
стационарных состояний при каждом значении граничного радиуса гг
меаду слоями /775 и 2пО . В этом случае переходим к
стационарной задаче с граничными условиями
при г - fy С2 = Cc.
92
при р = 0 aCg/ar = u.
Концентрации и псток вещества на границе двух участков {г= ,г )
непрерывны, следовательно
j r
где Сj- и С? - концентрации н^$ в неактивной ?nS и
активной in О зонах.
Получено аналитическое решение системы уравнений D.22) и
D.23)
ffi-О-?)]. D.24)
D-25)
где 9
При температуре процесса C70-400°С) скорость адсорбции
высока, и можно сделать допущение, что концентрация tyS на границе
раздела фаз Znu и ?л5 равна нулю /53/, а концентрация в
ядре потока равна концентрации на поверхности зерна ( Cs - 6> ) т.е.
скорость хемсорбции и внешнего массообмена значительно больше
скорости диффузии через слой ZnS . В этом случае концентрация /%S
в неактивной зоне изменяется по радиусу следующим образом:
(>-¦?)¦ ' D.26)
Как указывалось, процесс адсорбции нестационарный. Граница
меаду ZnO и /л 5 будет меняться во времени. Скорость изменения
drr/dT можно вычислить, если известен массовый поток /V2S. Пусть
за время dt отработанная зона зерна переместится на <г> .Тогда
в слое д> прореагировало 4xr2rf1 dr молей zno , но за
время dv на зерне прореагировало" D(-^r)r=rr-^xr2dz молей
Н23 .Из условия стехиометрии реакции D.13) эти количества равны
и следовательно
dt '-" (dr fr-.rr7T' D.27)
где м, и fi -молекулярная масса и кажущаяся плотность
зерна.Градиент концентрации на сфере раздела находим, продифференцировав ви-
93
ражение D.26)
D.<ioJ
И окончательно скорость изменения граничного радиуса во
времени
CSD* м3
. (r _JjL\ D.29)
В начальный момент времени при rr=R? это уравнение
показывает, что скорость изменения радиуса бесконечно велика. На самом
деле скорость будет ограничиваться внешним массообменом и скоростью
химической реакции. Но затем процесс переходит в диффузионную
область и становится справедливым уравнением D.29). Интегрированием
этого уравнения в пределах от гг = R до гг = о находим время
полной обработки зерна
' D.30)
Такой приближенный анализ вполне достаточен для расчета
промышленного реактора.
Наблюдаемую скорость процесса поглощения *2S на сферическом
зерне можно определить из величины диффузионного потока через
наружную поверхность зерна:
ЗВ* dCr
Ro dr
3D*С, г,
'S'r
=*0
г=
D.31)
Как и уравнения D.29) и D.30), выражение D.31) справедливо при
диффузионном процессе при z*o и гг < gg.
При более строгом анализе процесса на зерне необходимо
учитывать скорость химической реакции, т.е. использовать уравнения D.22)
в D.23) ели D.25) и D.26), а также массообмен: между потоком и
гранулой катализатора/
Процесс в слое поглотителя. Процесс поглощения сернистых
соединений осуществляется в неподвижном слое катализатора. Процесс
нестационарный и описывается уравнением
дС ЗС , ,
і— - M тг - ш ( г.ъ ?' /
sz ol ' D.32)
где с - концентрация сероводорода. Наблюдаемая скорость процесса
поглощения ( ш* ) переменна по длине слоя и во времени, и функция
jj*(l,z,C) неизвестна. Поэтому уравнение D.32) без дополнительных
.гведений не может быть использовано для расчета реактора.
JO:
110-
0,25
0,5
0,751
Рис.17. Провяль поглощения серы
(I) и хлора B) слоем окиси
цинка
Экспериментальные исследования показывают, что в первых слоях
поглотитель насыщается серой практически полностью (рис.17), затеи
следует резкое падение доли ?п5 в поглотителе, В конечных
слоях должна быть только zno . Кривая концентрации #2S в газе
будет приблизительно зеркальным отображением кривой адсорбции (рис.
17,7 ). На этой же рисунке дана кривая насыщения сорбента хлором.
Разница заключается в той, что существует равновесная концентрация
хлора над Znu и полностью хлор не поглощается. Подобным способом
идет поглощение и некоторых других каталитических ядов /547.
При подходе границы даже частично отработанного поглотителя к
выходному сечению будет наблюдаться проскок сернистых соединений.
КАТАЛИТИЧЕСКОЕ ГИДРИРОВАНИЕ СЕРООРГАШЧЕСКИХ СОЕДИНЕНИИ
Химизм и термодинамика процесса. Содержащиеся в сырье сернистые
соединения, недостаточно полно удаляемые с помощью
поглотителей,должны быть переведены в сероводород. Для этого служит процесс
гидрирования на катализаторах, соедржащих окислы железа, кобальта, никеля,
меди, цинка.
Сероорганические Соединения конвертируются в сероводород по
реакциям
D.33)
95
Реакции являются экзотермическими. Но в связи с
незначительным содержанием серы в очищенном газе процесс можно считать
изотермическим.
Константы равновесия реакций
гидрирования (рис.18) достаточно
высокие. И равновесие практически
полностью сдвинуто в сторону
образования сероводорода До/, но
степень гидрогенолиза
определяется кинетикой процесса.
Кинетика гидрирования.
Механизм и кинетика гидрирования се-
роорганических соединений
различных классов существенно
различаются. Сульфиды и дисульфиды
вначале гидрируются до меркаптанов,
которые затем превращаются в
сероводород. Тиофен через ряд
стадий превращается в бутан, бутены
и сероводород. Порядок реакций в
присутствии углеводородов лежит
в пределах 0,5-1 по серусодержа-
шим соединениям и 0,4-0,9 по
водороду. Энергия активации в
интервале 20-30 ккал/моль.С
увеличением общего давления скорость
lg Kb
50
40
JO
20
10
Рис.18. Константы равновесия
гидрогенолиза сероорганических
соединений:
/ - диметилдисульфид; / - тиофен;
і - диэтилсульфид; f - тетро-
гидротиофен; 5- метилмеркаптан ;
6 - фенилмеркаптан.
реакции возрастает
приблизительно пропорционально -/Р'.
Исходя из этих приближенных
зависимостей, скорость реакции рекомендуется рассчитывать по
уравнению flOj:
о= h
D.34)
где р - общее давление; Ps, Р# , ??# - парциальные давления
сернистого соединения, водорода, углеводородов. Для тиофена и тетра-
гидротиофена п = 0,5, для меркаптанов, сульфидов, и дисульфидоы
7 =0,25. Константы скоростей реакций л гидрирования сернистых
36 ,
соединений при наличии гептана даны в табл.9. Если не имеется
более точных констант, ими можно пользоваться для расчета скоростей
при очистке и других углеводородов. Но следует иметь в виду, что
с уменьшением молекулярной массы углеводородов их ингибирующай
эффект снижается и скорость реакции будет несколько выше, так как
понижается показатель степени при Рс/1 до -0,05* -0,1.
Таблица 9. Константы скоростей реакций гидрирования
соединений при очистке гептана, моль/Чг-ч-ат4-' )
Температура,
RSSR
Тетшгвд-
ротиофен
Тиофен
200
250
300
350
400
4,2-Ю 1,8-КГ2 0,9-Ю 3,7-Ю 5,0-Ю'
1,0-10"
1,7-Ю'
2,6-10
,-1
5,7-Ю~2 3,1 -Ш
1,2-Ш
6,3-10
2,1-Ю 1,1-Ш
,-2
Г2
,-I
1,8-10
4,8-10'
I,I-10'
,-2
,-I
3,7-КГ1 3,6-ІСГ1 1,4-КГ1 2,2-Ю
1,7-KP3
3,6-ICT3
7,1-Ю
1,2-Ю
Скорость гидрирования соединений серы возрастает в следующей
последовательности: тиофен, меркаптаны жирного ряда, сероуглерод,
меркаптаны бензольного ряда, сероокись углерода. Наблюдается
значительная разница между скоростями гидрирования тиофена и других
соединений.
Процесс гидрирования ведут при температуре 30О-400°С,объемной
скорости газа до 5000 ? ~1 и давлении, цри котором проводится
процесс конверсии B0-45 ат). Для гидрирования в поток дозируется от
1-2 до 10$ водорода. Гидрирующая водородная фракция не должна
содержать более 5% окислов углерода, так как они могут гидрироваться
до метана, что вызовет увеличение температуры в реакторе и
опасность спекания катализаторов.
Катализаторы гидрирования. В промышленности используются
наносные кобальт-молибденовые и никель-молибденовые катализаторы на
носителе из активной окиси алюминия. Они содержат до Ь% СоО и 15$
Mouj или до 1055 f/%0 и 10$ МоО^ . Катализаторы выпускаются как
в таблетированном, так и в формованном виде.
Сосяав катализаторов гидрирования и, следовательно, их
активность и другие свойства определяются содержанием в реакционной
смеси сернистых соединений и водорода,, так как они независимо от исход-
97
ного состава оульфидируются в процессе работы. В результате
взаимодействия сернистых соединений газового потока с компонентами
катализатора образуются сульфиды Fes, Ре$2, fas, M3s2, со9і8, cas
и др. Кроме того, в сульфидах металлов растворяется сера.
Активность катализаторов зависит от наличия в них сульфидов и
растворенной серы. Поэтому при очень низком содержании серы в
очищаемом газе необходимо специальное сульфидирование катализаторов.
В первый период очистки не полностью сульфидированные катализаторы
поглощают почти всю содержащуюся в газе серу. Процесс сульфидирова-
ния обратим, и состав катализатора определяется условиями
равновесия систем Me -S- н2 или МеО s - //2 . Активный катализатор
должен содержать 1-А% Со9$3 и Ме$2 • Такой катализатор
осуществляет гидрирование соединений серы путем реакции преимущественно на
двух типах кислотных точек, одни из которых сильнокислотные,другие -
очень слабокислотные /53/. Сероводород и сераорганические
соединения прочно адсорбируются на сильнокислотных точках, обладающих
некоторой бктявяостью гвдрогеяолиэа. Но главную роль играют
слабокислотные точки. Они могут отравляться сильными основаниями,в том
числе аммиаком, часто присутствующим в водородной фракции.Поэтому
концентрация аммиака должна контролироваться.
В процессе работы катализаторы постепенно накапливают
углеродистые отложения, которые приводят к прогрессирующему снижению
активности. Отложения содержат высокомолекулярные полимерные
отложения и возможно некоторое количество свободного углерода.
По-видимому, отложения образуются из промежуточных соединений, образующихся
в результате термического и каталитического крекинга. Поэтому для
каждого вида сырья должны быть даны рекомендации по максимальной
температуре процесса и минимальному парциальному давлению водорода.
Наутлероженный катализатор может быть регенерирован путем
выжига углеродистых отложений. Регенерацию ведут пропусканием
инертного газа с регулируемым количеством кислорода при температурах не
выше 550°С во избежание спекания и потери молибдена.
ОДНОСТУПЕНЧАТАЯ ОЧИСТКА НА КАТАЖЗАТОРАХ-ХЕМСОРБШТАХ
Двух- или трехступенчатую схему сероочистки путем гидрирования
сернистых соединений и поглощения Л^5 окисью цинка можно заменить
одноступенчатой, если на одном контакте будет происходить процесс
гидрирования и поглощения серы. Ряд катализаторов обладают такими
свойствами. Авторами работ /55,56/ исследованы бифункщональные ка-
98
талиааторы-хемсорбенты для одноступенчатой тонкой очистки газов
от серы. Свойствами катализатора гидрирования и сорбента обладают
катализаторы низкотемпературной конверсии окиси углерода. В
частности, хорошие результаты показал промышленный катализатор КС-4.
Он эффективно работает при температуре 250-!т30оС даже без
дозировки в очищаемый газ водорода. При этом протекают каталитические
реакции типа
Сера поглощается окисью цинка по реакциям D.ІЗ)-D-І7).
Разработан специальный хемсорбент-катализатор ГИАП-ЭЭЗН,
получаемый нанеоением 20-40$? активной окиси цшша на носитель с
развитой поверхностью. Исследования на модельных установках показали '
его высокую эффективность. Еще большей активностью обладают ката-
лизаторы-хемсорбенты, промотированные никелем и молибденом.
АППАРАТУРНО-ТЕХНОЛОПИВСКОЕ ОФОРМЛЕНИЕ
ПРОЦЕССА ОЧИСТКИ НА ХЕМСОРБЕНТАХ
В промышленности применяются двухступенчатые и трехступенчатые
схемы очистки. На большинстве современных установок подогрев газа
перед сероочисткой осуществляют в отдельном огневом подогревателе.
Это дает возможность легко регулировать температуру нагрева и
производить пуск установки при работающей системе сероочистки.В
двухступенчатой схеме (см.рис.77) природный газ или жидкие
углеводороды смешиваются с водородосодержащим газом и поступают в трубчатый
подогреватель / , где нагреваются до 370-400°С. В аппарате 2 на
кобальт-молибденовом ктаализаторе производится гидрирование сероорга-
нических соединений. Затем газ поступает в один из аппаратов з с
поглотителем. Аппараты обвязаны таким образом, чтобы любой из них
можно было отключить для перегрузки поглотителя. Аппарат со свежим
поглотителем включается последовательно за уже работавшим
аппаратом по ходу газа. Возможно также включение аппаратов в
параллельную paoqry.
.Аппараты гидрирования и поглощения однотипны и представляют
собой двухполочные реакторы (рис.19). Возможно также применение
радиальных реакторов.
99
Рис. 19. Реактор для
поглощения и гидрирования сернистых
соединении:
I - теплоизоляция; 2 - корпус;
3 - катализатор гидрирования
или поглотитель; 4 - стакан с
отверстиями и сеткой; 5 -
боковые люки; 6 -
приспособление доя выгрузки катализатора.
При очиотке оырья о
различными сернистыми соединениями при-
оутствив болев реакционной серы
снижает скорооть гидрирования тио-
фена. В этом случае целеоообразно
применять трехступенчатую схему.
В начале ставитоя аппарат,
заполненный поглотителем (например,
ГИАП-Ю) и в нем производится
очистка от реакционноспособной
оеры, затем включается реактор
гидрирования, где гидрируются
тиофен и другие устойчивые серни-
отые соединения. Образовавшийся
сероводород поглощается в третьем
аппарате на поглотителе (например,
ГИПА-Ю-2).
Тонкая очистка углеводородов
от сернистых соединений
поглотителями на основе окиси цинка очень
проста в эксплуатации и получила
широкое раопроотранение.
Глава 5
АВТОТЕРМИЧЕСКАЯ КОНВЕРСИЯ УГЛЕВОДОРОДОВ
Процесс конверсии углеводородов протекает автотермически, т.е. за
счет энергии самой реакционной смеси, если в ней содержится
кислород. Автотермичность процесса достигается при соотношении кислород:
метан - 0,50 : 0,65 в зависимости от условий. Процесс ооуществляют
без подвода тепла идвне в адиабатических реакторах шахтного типа.
Автотермический метод конверсии нашел широкое промышленное
применение, но в настоящее время по технико-экономическим показателям он
уступает процессу паровой конверсии с подводом тепла, осуществляв- '
мому в трубчатых печах.
Вторичная паровоздушная конверсия газа после трубчатых печей
является основным процессом для получения азотоводородной смеси для
синтеза аммиака.
Автотермическим является также процесс паровой
низкотемпературной конверсии углеводородов,применяемой как первая стадия
высокотемпературной конверсии и для получения высококалэрийных метансодерка-
ших газов.
РАЗВИТИЕ АВТОТЕРМИЧЕСКОГО СПОСОБА КОНВЕРСИИ
Получение технологического газа для синтеза аммиака и метанола
путем конверсии метана парокислородной смесью в промышленном
масштабе начало осуществляться в Германии перед второй мировой войной по
способу Заксе. Смесь углеводородного газа с водяным паром и
кислородом сжигалась в верхнем пустом объеме реактора, после чего
газовая смеоь с остаточным содержанием метана около Ъ% поступала на
никелевый катализатор, где при 900°С достигалась практически полная
конверсия метана.
Горение в пустом объеме при недостатке окислителя сопрсвовда-
ется термической диссоциацией метана с образованием тснкодисперс.ио-
го углерода. Заметим, что неполное окисление метана является одним
из промышленных способов получения саки.
Образование свободного углерода при получении технологических
газов является очень •нрз'.слателышм явлением. Поэтому при
промышленной разработке истодов основной задачей било создание условии,пред-
101
отвращающих образование сажи. Такой реактор был создан в Советском
Союзе в конце 30-х годов /16/. Углерод не образуется, если процесс
протекает только на катализаторе без предварительного воспламенения.
Промышленные установки с беспламенным окислением начали
строиться в конце 40-х годов. Вначале предварительный подогрев
реагентов не применялся. Но с 1953 г. во Франции и Италии (фирма Фаузер -
Монтекатини) появилась установка с нагревом реагентов (природного
газа, водяного пара, воздуха и кислорода) до 400-500°С. Реагенты
подавались на катализатор после тщательного перемешивания при
давлении, близком к атмосферному.
Установка с высокотемпературным нагревом реагентов (до 600°С)
с беспламенным окислением метана без образования сажи была пущена
фирмой БАСФ (ФЕГ) в 1954 г. Реактор шахтного типа загружался (по
ходу газа) слоем инертного огнеупорного материала, затем слоями
платинового и никелевого катализаторов. Платиновый катализатор служил
форконтактом для быстрого развития реакций при большой объемной
скорости. Температурный максимум приходится на первые сантиметры этого
катализатора, а никелевый служит в основном для эндотермических
реакций. Слой инертного материала предотвращает проскок пламени в
объем над катализатором. Давление в реакторе близко а к
атмосферному. Несмотря на высокотемпературный нагрев F00°С) реагентов
(метана, пара и кислорода), горения в свободном объеме и образование
сажи не наолвдалось. Впоследствии аналогичный метод дорма бАСФ
применила для конверсии бензинов при атмосферном давлении.
В Советском Союзе метод автотермической конверсии природного
газа был внедрен в 1955 г. в период становления газовой
промышленности и начала использования природного газа как сырья для
химической промышленности. В Государственном институте азотной
промышленности (ГИАЛ) были разработаны методы парокислородной и паро-кисло-
родо-воздупшой конверсии при давлении 0,17-0,19 МПа с нагревом
реагентов до 500-600°С. В смесителе специальной конструкции
обеспечивается поступление на катализатор хорошо перемешанной смеси
однородного состава, что полностью исключает образование сажи. Этот
метод получил в СССР широкое распространение.
Следующим этапом развития автотермического процесса было
освоение повышен;..)го давления. Первые установки с автотермической
конверсией под давлением появились в конце 50-х годов. Наибольшее
распространение получили реакторы TOPSOESSA, Конверсия
углеводородов от метана до легких бензиновых фракций производится в шахтном
реакторе на никелевом катализаторе. Реагенты предварительно
нагреваются до 5Ю-570°С и подаются в реактор под давлением 1,7-
2,0 МПа.
102
В СССР процесс автотермической конверсии под давлением 20 ат
был внедрен в 1963 г. в результате проведенных в ІМАП
научно-исследовательских и инженерно-конструкторских работ /I6/.
ПРОЦЕСС В ШАХТНОМ РЕАКТОРЕ
Рарокислородная и паро-кислородо-воздушная конверсия. На
катализатор в современных реакторах подается гомогенная смесь реагентов при
температуре 450-600°С. Необходимо обеспечить условия, при которых
эта горючая смесь не воспламеняется до подачи на катализатор.
В процессе работы передние слои катализатора находятся в
невосстановленном состоянии и могут рассматриваться как инертная
насадка. Смесь на передних слоях катализатора не реагирует.
Проходя через катализатор, она постепенно разогревается. Затем
температура очень резко поднимается до 950-И00°С. В этой зоне
катализатор находится в восстановленном состоянии, что обусловливает
большую скорость реакций. Протяженность зоны, в которой расходуется
весь кислород, составляет всего несколько сантиметров. Далее по
слою преобладающими являются эндотермические реакции конверсии
метана с СО„ и
Н2°'.
ния равновесной.
ом
Глубина слоя, м
Рис.20. Распределение
температуры в слое катализатора при
парокислородной (I) и паро-ки-
и температура постепенно снижается до достиже-
На рис.20 показаны
температурные профили в реакторе низкого
давления A,7 ат) при
парокислородной С СООТНОШеНИеМ СНц-. Н20 :О2 =
1:1:0,6 и паро-кислоро.цо-воздуш-
ной конверсии с соотношением ?Ц ••
Н2О-.О2: #2 = 1:1:0,6:0,9. Смеси
подаются на катализатор с
температурой около 400°С. За счет тепла
низлежащих слоев катализатора смесь
подогревается до 50О-550°С,а затем
скачком до IOO0-IO50°C. При паро-
кислородо-воздушной конверсии
протяженность зоны подогрева больше,
слородо-воздушной B) конверсии что, по—видимому, связано с необ—
метана. ходимостью подогрева также
инертного компонента (азота). Температуры в последнем случае несколько
выше, что, вероятно,-связано с различием в разности скоростей
экзотермических и эндотермических реакций. С повышением объемной скоро-
103
сти протяженность зоны подогрева исходной смеси до температуры
начала реакции увеличивается, и температурный пик перемещается в
глубь слоя катализатора.
На невосстановленном катализаторе начало реакции метана с
кислородом начинается при температурах 390-530°С (табл.10) /58/. С
увеличением давления температура начала реакции несколько
снижается, но уменьшается и период индукции воспламенения. На окиси
алюминия реакция начинается при температурах 470-500°С, а при
содержании в контакте 7,6$ NtO температура начала реакции снижается на
70-Ю0°С, что свидетельствует о некотором каталитическом действии
невосстановленного катализатора. Температура воспламенения в
значительной степени зависит от состава и способа приготовления
катализатора.
Таблица 10. Зависимость температуры
начала реакции метана с кислородом от давления на
невосстановленном никелевом катализаторе C,8%
МгО )
Давление,
ат
2
II
21
Объемная
скорость,
Ч
1100
2200
5300
15000
25000
30500
5000
15000
25000
32500
Время
контакта,
с
0,23
0,12
0,05
0,18
¦ о.п
0,09
0,92
0,31
0,19
0,15
Температура,
°С
400
460
530
450
430
440
400
410
390
390
Скорость реакции метана с кислородом с увеличением давления
резко возрастает, это особенно заметно при 500-700°С /58_/.
Например, при 500°С и давлении 0,21 и 2,т МПа количество вступившего в
реакцию кислорода составляет соответственно 5,95 и 100%.При 0,2 МПа
кислород полностью вступает в реакцию лишь при 700 С. . '
С повышением давления температура начала восстановления
катализатора под действием юбочей смеси понижается. Для давления 1,1 МПа
она соста&г :ет 600°С, а для 2,1 МПа - 500°С. Объясняется это
понижением темпеттуры начала решщии метана с кислородом, при которой
ооразуются восстановители СО та Ну • Минимально необходимые для
восстановления катализатора СО и /#> ооразуются при степени конверсии
метана 35-ЛбЯ /Дб, 58/.
104
Для данного катализатора каждому значению давления
соответствует температура предварительного нагрева реагентов, ниже которой
процесс не развивается и кятялизатор не восстанангщвяется. На
высокоактивных восстановленых катализаторах процесс развивается
при подаче реагентов без подогрева.
При увеличении давления резко сокращается время индукции.Так,
для смеси СНц + о,аО2 при возрастании давления с 0,4 до 3,7 Ша
(начальная температура подогрева 420°С) период индукции
уменьшается с 7 до 0,06 с /58/. Период индукции горючей смеси резко
сокращается с повышением температуры нагрева. В пустом объеме или на
инертной насадке он составляет 3 с при 400 и 0,4 с при 500°С
(давление 1,0 МПа). Из приведенных данных видно, насколько сложной
является проблема предварительного нагрева реагентов. Но несмотря на
технические трудности, созданы реакторы, работающие под давлением
до 2,0 МПа при нагреве реагентов 600°С.
В природном газе всегда присутствуют гомологи метана и другие
высокомолекулярные углеводороды. Они являются менее термостойкими и
более реакдионноспособными, чем метан. Следовательно, при
увеличении в газе гомологов метана сокращается время индукции, и реакции
начинаются при более низких температурах. Возможно также их
термическое разложение с выделением сажи и кокса. В отдельных случаях
требуется очистка метана от его гомологов, например методом
низкотемпературной конверсии.
Состав газа на выходе из промышленного шахтного реактора
близок к равновесному. Но вследствие ограниченного времени контакта и
неравномерности скоростей и температур по слою катализатора, он
несколько отличается от равновесного. Параметры и составы газов при
различных видах автотермической конверсии представлены в табл.11.
Паро-кислородо-углекислотная конверсия. Паро-кислородо-углеки-
слотная (ПКУ) конверсия применяется для получения технологического
газа для синтеза метанола и высших спиртов. При замене 0,3 объема
водяного пара углекислым газом степень превращения метана и
содержание его в сухом конвертированном газе практически не меняются.Но
равновесие сдвигается в сторону образования СО. И если при низких
температурах происходит конверсия СО, образовавшейся из метана, то
при высоких температурах протекает конверсия COg с получением
дополнительного количества СО.
При конверсии исходной смеси состава Щ : И^О ¦. ог'• СО/ = 1:0>?:
0,6:0,3 раз с отношением Н2 ¦ СО * 2:1, необходимым для синтеза
метанола, получается при температуре 820-840°С во всем применяемом
105
Таблица II. Примеры состава конвертированного газа, получаемого автотермической
конверсией природного газа (98% Сп нт ) в промышленных условиях
Конверсия
Парояислородная
Паро-кислородо-уг-
лекислотная
Оаро-кислородо-
воздушная
Р, МПа
0,17
0,17
2,0
2,0
2,5
2,5
2,5
0,17
0,17
0,19
т
-вых,
°С
850
780
820
950
800
825
850
850
850
850
I
I
I
I
I
I
I
I
1:(
I:]
Состав сухого газа,
»2 І С02
I : 0,6 66,5 7,2
I : 0,52 67,0 9,7
2 : 0,61 "бб,? 12,90
I : 0,63 65,1 7,6
2,7 : 0,62 67,6 14,3
2,66 : 0,63 68,0 14,0
2,63 : 0,64 67,33 14,4
0,7 : 0,6:0,3 62,2 9,1
3,57:0,7:0,3 58,0 11,0
[.-0,67:0,9
51,9 6,9
СО
24,4
20,5
17,90
25,90
13,85
14,3
15,64
27,1
25,9
17,9
Щ
0,5
2,0
2,0
0,5
1,88
1,60
0,90
0,50
0,50
0,50
/Иг+Ar
1,4
0,8
1,5
1,5
2,4
2,10
2,56
1,12
1,0
22.8
интервале давлений iI-40 ат). Изменяя соотношение /?<?.<r<^ в
исходной смеси можно получить конвертированный газ с любым требуемым
отношением нг:СО (см. табл.П).
Добавка в сырье двуокиси углерода не сказывается заметно на
температурном режиме реактора. Температурные профили аналогичны
представленным на рис.20.
Воздушная конверсия. В некоторых металлургических процессах
в качестве восстановительного агента можно использовать продукты
воздушной каталитической конверсии природного газа. Газы воздушной
конверсии характеризуются большим содержанием восстановителей {н2 '
+ CU) и низким содержанием окислителей (#^ + н2о ), они могут
применяться, в частности, для получения активного никелевого
порошка, восстановления оловосодержащих руд, магнетизирующего обжига и
др.
В табл.12 представлены результаты воздушной конверсии в
опытно-промышленном реакторе /59/, Эксперименты проводились при
холодном и нагретом до 500° воздушном дутье при различных коэффициентах
расхода воздуха ( <*. =0,46 + 0,33). Содержание саки в продуктах
конверсии было во всех режимах незначительным и не превышало
0,17 г/м3 сухого газа. Во многих режимах сажа совсем не
обнаруживалась. Предотвращалось выделение сажи также добавкой небольшого
количества пара (пар : газ = 0,1 + 0,13). Применение специальной
горелки позволяет вести процесс как с очагом горения, так и без
него. Работа с очагом горения применяется также при разогреве
катализатора. Измерение концентрации продуктов сгорания, поступающих в
слой катализатора, показывает, что в факеле взаимодействуют 1Ь%
кислорода и 50$ метана. В этих продуктах содержится вдвое больше
водяного пара, чем на выходе из слоя катализатора.
При таком режиме процесса не наблюдается пик температуры в
верхнем слое катализатора.
Максимальный выход восстановителей при холодном дутье лежит в
области коэффициента расхода воздуха л = 0,39. Нагрев воздуха до
500°С сдвигает область максимума в сторону меньших его расходов
( о( = 0,34), в результате чего концентрация восстановительных
газов повышается на 2-3$.
При холодном воздушном дутье коэффициент расхода воздуха оС
необходимо поддерживать в пределах 0,38-0,42; дальнейшее его
уменьшение ведет к увеличению остаточного метана в продуктах конверсии
и падению выхода восстановительных газов. Концентрация
восстановителей достигает 40$, а окислителей - 8,5 об.#. Подогрев воздушного
107
Таблица 12. Параметры и состав газа воздушной конверсии природного газа в
опытно-промышленном реакторе
Температура, ос
воздуха
лизатора
конвертированного
газа
Объем
конвер-
ванного
газа,
м3/м3
Щ
• Состав влажного газа, ой.%
СО
С0о
0,360
0,385
0,400
0,414
0,375
0,400
0,340
0,360
0,375
20
20
20
20
326
320
500
500
500
648
693
887
892
858
887
674
700
823
615
650
705
750
730
770
705
750
780
5,47
5,90
5,76
6,16
5,88
6,05
5,34
5,52
5,56
23.1
24,5
24,9
23,6
26,6
25,2
25,8
25,2
24,0
14,85
15,40
14,10
15,15
15,90
15,15
18,20
17,90
16,50
1,85
0,97
0,37
0,57
0,66
0,28
0,98
0,59
0,38
2,92
3,04
2,86
2,85
2,66
2,87
1,93
2,20
2,38
0,57
0,22
0,50
2,01
0,04
0,57
0,57
0,0
0,74
6,23
5,50
5,30
5,50
5,10
6,05
4,02
4,70
4,74
50,48
50,37
51,97
51,48
49,04
29,88
48,50
49,41
51,26
дутья до 500 С способствует повышению концентрации восстановителей
до 44 об.?. Следует отметить, что эти результаты относятся к
реактору с тепловыми потерями, достигающими 10% /59/. В промышленных
реакторах условия будут ближе к адиабатическим, и выход
восстановителей будет несколько выше.
Вторичная паровоздушная конверсия. При производстве аммиака
практически полная конверсия метана и получение азотсодержащего
газа осуществляются путем вторичной паровоздушной конверсии в шахт-
Рис.21. Соотношение параметров
газа на выходе из трубчатой
печи И ОТНОШеНИЯ ЪО : СЦ , при
которых получается аэотоводород-
ная смесь заданного состава и
содержание метана после
шахтного реактора 0,3 ( ) и 0,5 об.%
Давление, МПа: / - 1,4; 2 - 2,45;
750 800 850 900 t,°C 3 - 3,5; 4 - 4,9.
них реакторах. Для того чтобы получился газ с отношением {fy+ca );
: N„ = 3,1:3,5, необходимо строго определенное соотношение
параметров газа первичной конверсии и состава исходной смеси. Эти
зависимости представлены на рис. 21.
РАСЧЕТ И МОДЕЛИРОВАНИЕ ПРОЦЕССОВ И РЕАКТОРОВ
АВТОТЕРШЧЕСКОИ КОНВЕРСИИ
Механизм парокислородноа конверсии углеводородов весьма слоиен и в
литературе не представлена достаточно обоснованная теория этого
процесса. Поэтому предполагаем, что в реакторе протекают следующие
четыре реакции, приводящие к образованию всех продуктов конверсии
* Н20
CO
E.1)
E.2)
E.3)
E.4)
109
Реакции E.1) и E.4) идут до конца, а реакции E.2) и E.3) -
до состояния равновесия. Можно допустить, что реакция E.1) имеет
первый порядок по кислороду. Кинетика реакций E.2) и E.3)
рассмотрена выше. Реакция E.4) идет только при значительной
концентрации кислорода.
В качестве модели шахтного реактора можно принять однопарамет-
рическую диффузионную модель с продольной теплопроводностью и
диффузией
jzr _ ас,
E.5)
E.6)
E.7)
і краевые условия
„j, ,., я^ .„(c.-cj. л^-
где Cj, С?, ?j - концентрации кислорода, метана и окиси углерода;
D, - коэффициент продольного перемешивания; л^ - коэффициент
продольной теплопроводности (с учетом перемешивания); ff - средняя по
длине реактора скорость потока; ш*,ait, alt - наблвдаемые скорости
реакции 1,2 и 3;-. і - текущая длина; і - полная длина (высота)
слоя катализатора; Т - температура.
В рассматриваемом случае наблвдаемые скорости реакций являются
функцией не только концентрации компонентов и температуры,но и
степени вссстановленносги катализатора х
<u**f(CJ.X).
Степень восстановленности в овою очередь зависит от концентрации
восстановителей со, /? и температуры. Причем функция z (fcej,
L'tyj', T) неизвестна. По-видимому, моделирование реактора парокис-
яородной конверсии может быть осуществлено только после
экспериментального нахождения зависимости х- от концентраций реагентов и
параметров процесса.
ПО
При моделировании шахтный реактор следует рассматривать как
совокупность двух или трех аппаратов: I) смесителя, в котором
получается гомогенная газовоздупшая смесь; 2) полого реактора, в
котором происходит сгорание части метана с кислородом (при вторичной
конверсии); 3) реактора конверсии с неподвижным слоем катализатора.
Температура газовой смеси, поступающей на горение находится
из теплового баланса смешения
, -*r%r'r**i*pm,<, E.9)
Ш (*г **,>%<*
где Q r и G g расходы сырья или конвертированного газа из труб
чаюй печи и воздуха; tpi t^ - температуры газа и воздуха.
Для определения Срт см необходимо знать температуру
образовавшейся смеси t„M. Поэтому сначала следует задаться ^см и
определить Ср см . Для точного определения ^см необходимы две-
три итерации.
Для целей расчета и оптимизации промышленного реактора
иногда применяют более простую "равновесную" модель, устанавливавдую
связи между входными и выходными параметрами процесса. Но такая
модель ничего не может сообщить о развитии процесса внутри реактора.
Предполагается, что на выходе из реактора достигается
равновесие. Тогда температура и состав газовой смеси находятся путем
совместного решения уравнений равновесия, материального баланса
элементов и теплового баланса. Кислород в процессе расходуется полностью
и расчет равновесия производится по уравнениям E.2) и E.я).Но
температура на выходе из реактора неизвестна, поэтому они решаются
совместно с уравнением теплового баланса
*,+*р=в2 '««or. E.I0)
где Qj и 42 - физическое тепло парогазовой смеои на входе и
выходе; О.р - теплота реакции; QnffT - тепловые потери.
Уравнение E.10) можно представить в виде
Точное значение температуры на выходе *2 не может быть
непосредственно определено путем решения системы уравнений A.39) - A.40)
и уравнения E.IT), так как входящая в уравнение теплоемкость
зависит от температуры. Поэтому необходим итерационный расчет.
Сначала задаются температурой на выходе и определяют теплоемкости.Затем
находят температуру на выходе и уточняют теплоемкости, по которым
III
находят уточненную температуру. Обычно требуется не более двух-
трех итерация.
Задача значительно упрощается, если теплоемкости на выходе
считать известными. Для паровоздушной конверсии чистого метана
уравнения равновесия A.39) и A.40) можно записать в виде /60/
кра
E.13)
где /Г и / - доля вступивших в реакцию ^ и со ;
R = Н20: СНц ; і = Ог : Щ ; а1 = (А/2 * Ar h ^ !
С - Cu2 : Щ
в исходной смеси.
Решив уравнение E.II) относительно ?, с учетом принятых
обозначений имеем
4141с
p peр
где Ср - средние объемные теплоемкости при р = const. Индексы
соответственно обозначают: I - Щ t 2 - ty, 3 - /$<? 4 - COgt 5 - нг,
5 - CO, 7 - JVp+Ar. верхний индекс С) относится к условиям на входе..
Система трансцендентных уравнений E.12)-E.14) была решена ав
торами /60, 61/ на аналоговой вычислительной машине "Катализ" путем
сведения ее к системе дифференциальных уравнений. В результате при
различных составах и температурах исходной смеси определялись
равновесная температура и состав смеси. Некоторые результаты расчета
парокислородной конверсии при Р = 1,7 ат представлены в табл.13.
Взаимосвязь параметров процесса и равновесного состава смеси была
рассмотрена ранее (гл.1). Проанализируем влияние температуры
подогрева сырья на показатели процесса. Повышение температуры подогрева
приводит к сокращению расхода кислорода (рис.22). Так, увеличение
температуры исходной смеси с 350 до 500°С приводит к уменьшению рас
хода кислорода на 6-9$ в зависимости от отношения ЦО'-Щ .при
заданной температуре нагрева ( х - const ) увеличение разбавления
сырья водяным паром не приводит к повышенному расходу кислорода,так
как заданная степень конверсии метана достигается при более низкое
температуре. При фиксированном отношении й, :СН^ температура на
выходе зависит от температуры смеси на входе (рис.23).
112
Таблица 13. Равновесная температура и состав газов конверсии системы Л?
при давлении 1,7 ат и различных температурах предварительного нагрева
1,0
Д.О
1.5
1.5
1.0
1.0
1.5
1.5
1.0
1,0
1.5
1.5
1.0
1,0
1,5
1.5
0,561
0,519
0,561
0,516
0,588
0,555
0,585
0,551
0,534
0,494
0,529
0,485
0,558
0,525
0,551
0,516
775
723
745
700
812
751
780
¦ 725
779
725
748
701
817
755
785
730
Состав газа, об.%
сог
9,53
10,35
12,43
13,30
7,47
7,90
9,80
10,34
8,87
9,68
11,73
12,60
6,78
7,32
9,08
9,66
СО
350°
21,59
19,64
17,70
15,65
400°
17,45
16Р28
14,4
13,22
450(
21.92
20,03
17,99
15,97
500°(
17,18
16,60
14,76
13,53
*
п
66,98
66,66
68,01
67,75
52,44
52,92
53,71
54,20
3С
67,37
67,00
68,49
68,20
52,61
53,09
53.91
54,40
0,5
2.0
0,5
2,0
0,1
0,5
0,1
0,5
0,5
2,0
0,5
2,0
0,1
0,5
0,1
0.5
1,40
1,35
1,36
1,30
22,54
22,32
21,97
21,74
1,34
1,29
1,29
1,23
22,71
22,49
22,15
41,91
0,043
0,043
0,043
0,043
0,906
0,906
0,908
0,908
0,043
0,043
0,043
0,043
0,925
0,925
0,930
0,930
Влажность,
м3/мэ
газа
0,264
0,249
0,376
0,360
0,220
0,200
0,308
0,286
0,250
0,236
0,358
0,343
0,209
0,188
0,293
0,271
Выход
конного газа
м3/м3
4,02
3,92
4,52
4,42
4,90
4,87
4,41
5,37
4,02
3,92
4,52
4,41
4,92
4,89
5,43
5,39
ОгЩ
0Д\
0,58
фч
0,50
Щ
зоо
400
500 t,°C
m
300 350
tOO
taf,T
Рис.22. Зависимость требуемого отношения 02-сн от температуры
подогрева исходной смеси при парокислородаой ( ) и паро-кислородо-
воздупшой ( ) конверсии ( H2u : сщ =1:1; р - 1,7 ат):
7 - остаточное содержание метана:0,1%\ 2 - 0,5%; 3 - 2%.
Рис.23. Зависимость температуры на выходе из реактора и от темиера-
¦ " '¦ ...'-« рокислородо-воз-
=1).
гии.^о. оа±)ииимисть темиературы на иилиде и;
туры исходной смеси для парокислородной ( / ) и паро-кислородо-воз-
душной B ) конверсии метана ( й, •• 2^ = 0,546; " ""
о ¦¦
Удельный расход кислорода зависит в основном от температуры
смеси на выходе (рис.24). При /2-a>/rs/ с увеличением избытка
водяного пара расход кислорода возрастает, но при этом достигается
более высокая степень конверсии метана.
С увеличением t„ удельный выход водорода проходит через
максимум, соответствующий 740°С при Я - 1,5 и 800°С при R =0,5.
Наличие максимума можно объяснить тем, что с увеличением
температуры растет и отношение /2, •• ?/it но вначале количество водорода растет
вследствие развития реакций E.1)-E.3), но затем начинает
преобладать расход водорода по реакции E.4). Увеличение избытка водяного
пара при tn- canst способствует повышению выхода водорода.
JI4 •
Рис.24. Зависшлость отношения ?>г-.щ
от температуры на выходе для парокио-
лородной конверсии ( ff.OT =200 кДж/м3,
t 400 °С )
050
ttx
дной кор
= 400 °С ) :
° ¦¦ Щ = 0>5:
WO 750 800 850 OOO <__
Для получения азотоводородной смеси с отношением
3 -
=3:1
необходимо, чтобы в газе после конвертора метана соблюдалось
соотношение (Cu*^:<v2 = 3Д : !• Это требование можно выразить урав- ''
вением /61/:
4/ -23
d = 5'Л E.I5)
Совместное решение системы уравнений E.12)-E.15) дает
равновесные температуру и состав при заданном соотношении (СО+н2)-.#2.
Результаты расчета для исходного газа, содержащего 98$ CHj,
0,5$ СОу, 1,5$ #2 и техішческого кислорода, содержащего 95$ ^
и Ъ% #2 + Ar , представлены в табл.13. Тепловые потери принимались
равными 210 кДж/м3.
Приведенные данные показывают, что для получения газа с
одинаковым содержанием метана при паро-кислородо-воздушной (ПКВ)
конверсии требуется более низкая температура, чем при парокислородной (ПК]
конверсии. Так, например, чтобы получить газ с концентрацией метана
0,3 об.# при tt = 400°С и R - 1:1 в случае
паро-кислородо-воздушной (ПКВ) конверсии необходима равновесная температура 770°С,
а в случае ПК-конверсии - 795°С. Объясняется зто разбавлением
конвертированного газа азотом, что приводит к снижению парциального
давления метана. Разбавление сырья азотом и паром эквивалентно
снижению давления. '
Количество технического кислорода, необходимого для ПКВ-кон-
версии,значительно меньше, чем для ПК-конверсии, так как часть
кислорода вводится с воздухом. Так, при tgx = 400°С и R = 1 для
получения газа с содержанием метана 0,3$ в случае ПК-конверсии на
I м3
требуется 0,585 м3 95%-ного кислорода, а в случае ПКВ-кон-
3
версии - 0,351 м3, т.е. на 40$ меньше /61/.
115
Общее количество кислорода (с учетом кислорода воздуха), необ-
юдимого для достижения одинаковой температуры на выходе, при ПКВ-
конверсии несколько больше вследствие необходимости нагревать азот.
Например, температура на выходе tAix = 800°С ( . t^ = 400IC, /?=l)
достигается при расходе общего кислорода в ПКВ-конверсии 0,583 м3,
а в Ж-конверторе 0,557 м3 на I м3 r/J . Но поскольку для заданной
степени конверсии метана температура при ПКВ-конверсии более
низкая, то действительный перерасход кислорода незначителен. Например,
для получения газа с 0,3$ Щ при указанных условиях общий
расход кислорода составляет для UKB- и ПК-конверсии соответственно
0,566 и 0,555/м3^.
При ПКВ-конверсии, как и в случае ПК-конверсии, выход
водорода проходит через максимум при повышении температуры на выходе. Он
лежит в области 725°С при /? = 2,5 ( р = 0,17 МПа) и 785°С при
R =0,5, что приблизительно на 15° ниже, чем при
ПК-конверсии.Максимальный удельный выход водорода при ПКВ-конверсии несколько выше,
чем при ПК-конверсии.
Аналогичная картина наблвдается и при других значениях
давления в реакторе и температуры нагрева исходной смеси.
Конвертированный газ, используемый в дальнейшем для синтезов
или получения чистого водорода, должен содержать в завиоимости от
методов дальнейшей очистки от 0,1 до 2% СНц.
Из приведенных данных видно, что для достижения заданной
степени конверсии с увеличением давления необходимо повышать
температуру или увеличивать разбавление сырья водяным паром.
С увеличением отношения /? от І до З необходимая температура
конверсии снижается на 75°С при давлении 0,1 МПа и на I00-II5 С при
давлении .4,0 МПа.
Для получения азотоводороднои смеси стехиометрического
состава для синтеза аммиака на стадии конверсии в I м3 конвертируемого
метана добавляй! около 0,9 м3 азота или 1,14 м3 воздуха. Это
позволяет сократить расход технического кислорода на 32-34$ (с учетом
затрат тепла на подогрев вводимого с воздухом азота). Как
указывалось, степень конверсии метана при разбавлении азотом
увеличивается, притом тем больше, чей ниже температура, выше давление и
меньше избыток водяного пара. Например, при /? = I : I / = 827°с
и р = 4,0 !Л1а степень конверсии метана кислородовоздушнси смесью
составляет 74,7$, а одним кислородом - 11,1%- При высоких
температурах -(вше 1000°С) степень конверсии метана очень высока при лкь
¦бых давлениях (до 4,0 МПа)', поэтому наличие разбавителя ( Н20,М2)
здесь почти не сказывается.
116
Рис.25. Зависимость выхода восстановителей ( со* и2 ) от отношения
On --СНь для парокислородной конверсии метана при t.- 350°C и И=2,Ъ.
Штриховые линии - линии постоянного содержания un, в сухом
конвертированном газе: / - 1,1: 2 - 1,6; 3 - 2,1; 4 - 2,6; s -
3,1 МПа.
Рис.26. Номограмма для определения концентрации метана после
вторичной паровоздушной конверсии.
Объемное отношение пар : газ на входе: /-2,5; 2 - 3; з - 3.5;
Ч - 4,0; 5- 5,0; 6- 6,0.
В производстве восстановительных газов для металлургическюс
процессов важно добиться максимального выхода восстановителей при
минимальном расходе сырья (природного газа, кислорода, водяного
пара) . Выход воостановителей {со, ^ ) зависит от состава исходной
смеси и параметров процесса. При одинаковом остаточном содержании
метана в конвертированном газе выход восстановителей тем выше, а
расход кислорода тем меньше, чем ниже давление процесса и
отношение водяной пар:метан в исходной смеси и чем выше ее температура.
На рис. 25 представлены завиоимости выхода восстановителей в
процессе парокислородной конверсии от отношения о. -.СЦ /62/.
При вторичной паровоздушной конверсии определение температуры
омеси поеле горения (связывания кислорода) затруднено, так как
точно неизвестен состав образовавшихся продуктов. Если нет
дополнительных сведений, то можно предположить, что суммарная реакция
связывания кислорода будет идти по уравнению
II?
o2 +0,667 cfy —- о.es7со +
b/i^-162,5 кАле/мом. E.16)
Из условия, что на каждый моль кислорода выделяется 182,5 кДк
тепла, рассчитывается температура смеси на входе в катализатор /
В агрегатах высокого давления на I моль кислорода приходится
приблизительно 1,2 моля метана в конвертированном газе.
Следовательно, сгорает около ЪЪ% метана. Оставшаяся его часть реагирует
я водяным паром на катализаторе до достижения
равновесия.Безусловно, частично сгорает и водород, но он также образуется при
неполном горении метана. В первом приближении считаем, что эти реакции
компенсируют друг друга и на суммарной реаісши E.16) не
сказывают ся.
Температура смеси на входе в катализатор определяется из
теплового баланса
' E.17)
Как и при расчете смешения, сначала задаются ? для
нахождения Срт0 , и затем после нескольких итераций определяется
действительное значение ig.
Заполненную катализатором зону модно рассматривать как
адиабатический реактор идеального вытеснения, но для исследования работы
реактора при изменении условий на входе достаточно использовать
равновесную модель, так как степень приближения к равновесию на
выходе достаточно высока.
Расчет реактора проводится на ЭВМ но следующей схеме:
I) задаемся температурой газа на выходе из реактора t\ ; d );
2) по t', находятся константы равновесия реакций A.24а) и A,24
3) по уравнениям (I.38-I.41) находим равновесный состав продуктов;
4) определяются теплоемкость смеси на виходе по t'fr и теплота
реакции; 5) по уравнению, анологичному E.17), находится температура
смеси на выходе /' ; 6) если ^ и ?'м не совпадают с
заданной степенью точности, то проводится новый цикл рассчета; 7) при
соблюдении условия li.-t'jtc расчет заканчивается. Полученные
равновесный состав и температура считаются действительными.
На современных аммиачных установках после шахтного реактора
второй ступени конверсии получают конвергированный газ следующего
состава (об.$):
,118
Нг СО СОг Щ Аг Л2
57-60 10,5-12,5 7,5-8,5 0,1-0,35 0,28-0,30 21-23
Остаточное содержание метана определяется по номограмме (рис.
26) как функция давления, температуры и отношения пар:газ перед
конверсией, которое составляет примерно 0,65-0,75. На выходе из
реактора это соотношение падает до 0,50-0,65.
КОНВЕРТОРЫ ПРИРОДЮГО ГАЗА
Конструкции шахтных реакторов принципиально одинаковы. Они
представляют собой вертикальные цилиндрические аппараты, в верхней
части которых установлены газокислородные смесители. Шахта аппарата
заполнена слоем катализатора, на который поступает гомогенная газо-
паро-кислородная смесь. Вследствие высокой температуры процесса (до..
П00°С), давлении до 4,0 МПа и взрывоопасное™ реакционной смеси к
конструкции конверторов предъявляются высокие требования в
отношении надежности в работе и техники безопасноти.
На отечественных заводах в схемах с низким давлением конверсии
устанавливались конверторы с объемом катализатора от 16 до 48 м3,
производительностью по природному газу 4,6 и 10 тыс. м3/ч, рабочим
давлением 1,7-1,9 ат, объемной скоростью 220-300 ч . Наружный
диаметр аппаратов 3,8; 4,4 и 5,2 м, высота 7,0; 9,6; 10,4 м.
Аппарат оборудовался вертикальным смесителем, обеспечивающим
удовлетворительное смешение потоков. Кислород шш
кислородо-воздушная смесь подается по трубкам, а паро-газовая смесь - по
межтрубному пространству. На выходе потоки достаточно быстро перемешиваются.
Распределение температуры в таком реакторе при загрузке его
катализатором ІМАП-3 дана на рис. 20. Производительность реактора
ограничивается давлением кислорода шш кислородовоздушной смеси,
создаваемым стандартной кислорододувкой. Активность катализатора
позволяет работать с более высокими объемными скоростями /16,62,637«
Более совершенными аппаратами являются конверторы, работающие
при повышенном давлении. Реактор конструкции ГИАЇЇ /I6, 62, 64/
работает под давлением 20 ат. Он представляет собой вертикальный
футерованный огнеупорным материалом цилиндр, в одном корпусе которого
совмещены катализаторное пространство и увлажнитель (для аммиачной
схемы) или котел-утилизатор (для метанольной схемы). На крыше
конвертора установлен смеситель. Кислород в нем движется по трубам, а
парогазовая смесь - Ьо межтрубному пространству. Смешиваются они в
119
канале металлического диффузора с углом раскрытия не оолее
10°.Диффузор заглублен в катализатор. Максимальная скорость во входном
сечении диффузора не превышает 25 м/с. Скорость перед слоем
катализатора лежит в пределах 3-6 м/с и не зависит от усадки слоя, так как
происходит автоматическое пополнение катализатора в случае его
усадки за счет резервного слоя катализатора (около I мэ), находящегося
в пространстве меаду футеровкой конвертора и диффузором смесителя.
Благодаря равномерному распределению газовой смеси по сечению и
постоянству ее скорости в верхнем слое катализатора, снижается
вероятность оайпасирования газа через неплотности в футеровке.Смеситель
позволяет применять бескалориферный разогрев конвертора. Для
элементов смесителя обычно применяется сталь марки XI8HI0T.
Внутри аппарат имеет футеровку, которая предназначена для
теплоизоляции катализаторного пространства и защиты металлического
корпуса от действия высоких темпиратур, развивающихся в реакторе.
Промышленные реакторы имеют следующие основные характеристики:
Характеристика 1 2 3
Производительность по природному газу,м3/ч 4500 7500 12000 ¦
Рабочее давление, МПа, 2,4 2,0 2,0
Объем катализатора, м 2,7 9,0 13
Объемная скорость, г~' 1600 1000 1000
Общая высота, м 5,75 8,78 14,1
Наружный диаметр,м 2,0 3,0 2,9
Повышение давления способствует увеличению производительности
аппарата. Объемная скорость при осуществлении процесса под
давлением 20 ат в четыре-пять раз выше, чем при давлении 1,7 ат /I67.
Реактор фирмы "Лурги" выполнен совместно с
котлом-утилизатором (рис.27). Объем конвертора 2,6 мэ,объем катализатора 2,2 мэ.
Нагрузка конвертора по природному газу составляет 3300-4800, по
кислороду 2100-3000, по водяному пару 7000-ГІ2000 м3/ч.Температура в
средней части конвертора 800-1000°С. Парогазовая смесь подается с
температурой 460°С, а кислород - 30°С. Рабочее давление в реакторе
2,3-2,5 МПа; давление насыщенного пара в котле-утилизаторе 2,8 МПа
/65, 66/.
- Смеси'г ель парогазовой смеси и кислорода представляет собой
аппарат типа труба в труое, по межтрубному пространству движется
парогазовая смесь, а кислород поступает по внутренней трубе и через
сопла вводится в смесительное пространство, образуемое труоой
диаметром 115 мм и конусной решеткой, приваренной к трубе. Смеситель
120
25 мч
Рис.27. Конвертор природного газа $ирмы "Лурги":
/ - смеситель; 2 - корпус котла-утилизатора; 3 - корпус
реактора; 4 - футеровка; 3 - газораспределительное устройство; tf - во-
доналравляющий стакан; 7 - трубки котла-утилизатора; s -
внутренняя обечайка.
Рис.28. Схема многоэлементного смесителя:
і - корпус; 2 - сопло; з ~ смесительная трубка; 4 - диффузор; j -
футеровка; 6 - решетка.
погружен в слой катализатора на 1,2 м. Гомогенная смесь через
решетку поступает на катализатор, и при нормальном реяиме работы смесь
воспламеняется только на катализаторе.
Реактор состоит из двух корпусов. Внутренний корпус
(непосредственно реактор) имеет футеровку. Кольцевое пространство меяду
корпусами представляет собой пароводяную рубашку. Трубки для отвода
121
конвертированного газа проходят через сферическое приварное днище
внутреннего корпуса и служат теплообменной поверхностью
котла-утилизатора.
В нижней части реактора имеется распределительное устройство,
предохраняющее забивку трубок котла-утилизатора. Вокруг
распределительного устройства загружается бой огнеупорного материала,
например шамоточного кирпича (объем 0,4 м3), поверх которого засыпается
катализатор.
Питательная вода подается в нижний патрубок, проходит по
кольцевому зазору между направляющим стаканом и внутренней обечайкой и
поступает в мектрубное пространство котла-утилизатора.
Пароводяная эмульсия проходит по кольцевому зазору между наружным и
внутренним корпусом, который также является силовым и отводится через
патрубок в верхней части реактора.
Стандартный смеситель реактора не всегда обеспечивает
надежную работу аппарата. На некоторых режимах, особевно при жирном
газе, наблюдаются вспышки в смесители, что ведет к их прогару. На Не-
винномысском производственном объединении "Азот" в цехе синтеза
аммиака по схеме "Лурги" установлена новая конструкция смесителя
(рио.28) /66/.Он оостоит из 19 смесительных элементов,имеющих в
нижней части форму диффузора.Кислород поступает по трубкам в
центральные сопла диаметром 5 мм и выходит из них со скоростью
140 м/с.Парогазовая смесь подается из камеры по кольцевым зазорам
со скоростью 80 м/с. Нижний терец смесителя отделен от
катализатора решеткой со щелями 10 мм. Скорость парогазовой смеси по длине
диффузора снижается до 40-50 м/с. Соотношения скоростей потеков и
размеры элементов подобраны таким, образом, чтобы обеспечивалось
полное смешение.
Смеситель такой конструкции работает устойчиво при
значительном изменении нагрузки. Измерение температуры по высоте конвертора
показало, что ее максимум находится всего на несколько миллиметров
ниже среза смесителя. Однако проскок пламени в смесительные каналы
не наблюдается.
ЭКСПЛУАТАЦИЯ РЕАКТОРОВ
Разогрев реактора осуществляется дымовыми газами, получаемыми в
специальной камере разогрева (конвертор низкого давления) /677 или
непосредственно в самом конверторе, используя рабочий паро-газо-
кислородный смеситель как горелку.
В агрегатах, работающих при повышенном давлении,
восстановление катализатора совмещают с предпусковым подъемом давления в кон-
122
векторе. Давление поднимают равномерно в течение 4-5 ч подачей хо-
лодного конвертированного газа снизу вверх через разогретый до 850°
катализатор, который при этом восстанавливается. Газ сбрасывается
через свечи, расположенные перед парогазовым смесителем.
В реакторах с водяной рубашкой разогрев осуществляют
установленными в верхней части корпуса горелками для сжигания природного
газа с воздухом. Горение протекает на катализаторе. Конвертор
разогревается в течение 24 ч до 800-900°С. После этого проводят пуск
конвертора при атмосферном давлении. Набор давления производится
после разогрева и восстановления катализатора в конверторах Cu.
При нормальной работе реактора в нем устанавливается
температурный режим, подобный приведенному на рис.20. Температура и состав
газа на выходе приближаются к равновесным. Медленное понижение
температуры в нижних слоях катализатора связано в основном с тепловыми
потерями через стенку реактора.
В конверторах низкого давления возможны случаи постепенного
перемещения зоны начала реакции в глубь конвертора и затем проскок
метана. Основными причинами такого нарушения работы являются
недостаточный предварительный нагрев реагентов и отравление
катализатора серой.
При осуществлении процесса конверсии под давлением скорость
реакции метана с кислородом настолько велика, что требуется примь -
нение специальных мер для некоторого заглубления горячей зоны.
В случае повреадения футеровки конвертора часть регищионний
смеси проходит через неплотности в футеровке мимо катализатора.Это
приводит к увеличению содержания метана в конвертированном газе и
резкому повышению температуры отдельных участков корпуса
конвертора.
Значительные нарушения в работе конвертора вызывает
воспламенение газа перед катализатором, происходящее, как правило,
вследствие значительного увеличения концентрации кислорода в исходной
смеси и уменьшения ее линейной скорости. Причиной загорания моает
быть также повышение локальной концентрации кислорода при
нарушении работы смесителя.
При нормальной остановке агрегат отключают от
коллектора.прекращают подачу кислорода и заменяют его на азот, газ сбрасывается
на свечу. Далее последовательно прекращают подачу природного газа,
пара, сброс давления производится со скоростью 4-5 ат/ч. После
этого прекращают подачу азота..
123
При аварийной остановке автоматически срабатывают отсекатели
на линиях кислорода и природного газа, потоки которых переводятся
на свечи, а в агрегат подается азот /62/.
ШАХТШЕ РЕАКТОРЫ ВТОРИЧНОЙ КОНВЕРСИИ
Реактор вторичной конверсии представляет собой вертикально
расположенную металлическую обечайку (шахту) из малоуглеродистой
котельной стали. Обечайка заполнена никелевым катализатором.В
верхней полой части ее находится смеситель газа и воздуха (рис.29,30).
Ковертированный газ при температуре 750-850°С из трубчатых
печей по футерованному газоходу (коллектору) поступает в смеситель
шахтного реактора. Ввод газа осуществляют обычно тангенциально, а
воздуха с температурой 500-550°С - черев специальные
распределители, дробящие воздушный поток на отдельные струи. Скорость движения
газа в цилиндрической части смесителя 6-20 м/с, а истечения воздуш -
ных струй 10-60 м/с.
После смешения в конусной части реактора происходит сгорание
части воздуха и метана, при втом связывается практически весь
кислород воздуха. Вследствие хорошего перемешивания и высокой турбу-
лизации потока факел получается коротшім и горение заканчивается в
свободном объеме до слоя катализатора.Тепловое напряжение в
свободном объеме верхней части реактора составляет от 3 до 30 млн.ккнл/м3
а средняя температура над катализатором 1200-1300°С.
Шахта реактора засыпается катализатором в виде колец Рашига
диаметром 14-20 мм. Сверху катализатор,_ как правило, защищен слоем
огнеупорного материала высотой 400-1000 мм. Сопротивление слоя
катализатора составляет не более 0,5-1,0 ат. В слое катализатора в
адиабатических условиях протекает эндотермическая реакция
оставшегося метана с водяным паром. Температура газа при этом снижается
До 950-1000°С. Состав газа близок к равновесному; при давлении око
ло 30 ат остаточное содержание метана составляет 0,2-0,356. В
процессе работы должен поддерживаться неизменным стехиометрический
показатель конверсии - {СО'^-н^): #„ - 3,05-3,10. Это
достигается при количестве остаточного метана в конвертированном газе 8-
10 об.% (в пересчете на сухой газ).
Внутри реактор футерован высокоглиноземистыми огнеупорными
блоками или жаростойким бетоном. Толщина футеровки, составляет 270-
450 мм". К химическому составу футеровки, особенно бетону,
предъявляются специфические требования - минимальное содержание двуокиси
124
Рис.29. Шахтный реактор вторичной паровоздушной конверсии
установки "Келлог":
/ - корпус; 2 - водяная рубашка; з - распределитель воздуха; 4 -
(футеровка из жаропрочного бетона; 5 - катализатор; a - шары из
окиси алюминия; 7 - кладка свода.
Рис.30. Реактор вторичной паровоздушной конверсии установки "ЭНСА":
1 - смесительная камера; 2 - водяная рубашка; з - корпус реактора;
4 - защитный слой; 5 - катализатор; rf-свод для вывода
конвертированного газа.
кремния, так как при высокой температуре и повышенном
давлении,имеющим место в реакторах, SiO2 образует с водяным паром летучие
гидраты кремния. Эти летучие соединения при снижении температуры
конденсируются на тешюобменных поверхностях котлов-утилизаторов
и катализаторах конверсии СО в виде твердой 5гО2 , резко ухудшая
125
работу этих аппаратов. Ьиутреннпй слой футеровки не должен
содержать более 1-3/6 S»<?2. Футеровка должна быть плотной и не
допускать просачивания через нее газа, минуя катализатор.
Днище камеры представляет собой сферическую, коническую или
плоскую решетку из высокоглиноземистнх фасонных кирпичей,
предназначенную для поддержания катализатора.
Исходя из условий безопасности, большинство 'конструкций
реакторов имеют наружную водяную рубашку.
Обычно в трубчатых печах выход конвертированного газа
осуществляется из низа реакционных труб. Поэтому с точки зрения
конструктивного оформления агрегата конверсии наиболее удобны реакторы
вторичной конверсии с восходящим потоком газа.Подача газа снизу дает
возможность создания единого конструктивного комплекса печл -
реактора с малой длиной соединительного трубопровода.В этом случае
может применяться выносная топка.
Шахтный реактор паровоздушной конверсии агрегата мощностью
Є00 т аммиака в сутки (рис.30) имеет внутренний диаметр dgH = 2790 мм,
наружный 3300 мм. Ввод газа осуществляется тангенциально, а воздух -
через радиальные патрубки (фурмы). Объем катализатора - 20 м3.Кор-
иус выполнен из углеродистой стали и футерован жаропрочным бетоном.
Температура смеси после процесса горения достигает 1280°С, после
прохождения слоя катализатора она снижается до 990°С.
Объемная скорость по оухому газу на входе в реактор при
рабочем давлении 26-28 ат равна около 3000 ч .
Шахтный реактор установки мощностью 1360 т/год #н3 (рис.29)
оборудован смесителем корпусного типа, из которого воздух подается
в поток газа через ряд сопел небольшого диаметра. Внутри аппарат
футерован жаропрочным бетоном, а снаружи имеет водяную рубашку. На
нижний овод реактора засыпается три слоя шаров из глинозема
диаметром 75 мм, два слоя - 50 мм и три слоя - 25 мм. Общая высота
слоя шаров около 460 мм. На шары насыпается слой кускового шамота
и на него слой высокоактивного никелевого катализатора из шариков
диаметром 19 мм или колец Рашита. Объем этого катализатора 32 м3.
В верхнюю часть шахты засыпается защитный слой из
высокотемпературного алюмохромового катализатора в виде колец 19x19 мм;
объем его 6,5 мз. Общая высота слоя катализатора - около 3600 мм
при диаметре 3730 мм. При рабочем давлении 3,0-3,2 МПа объемная
скорость по сухому газу на входе в реактор составляет порядка
1000 ч.
126
ПАРОВАЛ НИЗКОТЕМПЕРАТУРНАЯ КОНВКРСИЯ
Прицесс низкотемпературной конверсии применяется как первая стадия
высокотемпературной конверсии и для получения высококалорийных ме-
тансодержащих газов - так называемых заменителей природного газа
(ЗПГ). Особенность процесса паровой низкотемпературной конверсии
заключается в протекании реакции с некоторым выделением тепла, йн-
тальлия суммарной реакции проходит через нуль при 420-560°С в
зависимости от состава сырья и параметров процесса (рис. 31). Поэтому
в качестве реакционных аппаратов применяют адиабатические шахтные
реакторы. Вследствие сравнительно низкой температуры процесса в
промышленных условиях необходимо использовать высокоактивные
катализаторы с большой удельной поверхностью. Создание таких
катализаторов привело к широкому промышленному внедрению процесса.
Техноло500
t.-с
25 50 75 WO
Степень разложения гептана, %
Рис.31. Зависимость знталыши суммарной реакции паровой конверсии
нафты от температуры при //,<? ¦ с =2 кг/кг;
/-6; 2-1,1; /- 1,6; 4 - 2,0 МПа.
Рис,32. Экспериментальное и расчетное распределение продуктов
конверсии гептана при t = 450 С, Р - 1,47 МПа:
/ - водород; 2 - метан; з - С02 ; 4 - СО.
гический процесс паровой газификации бензиновых фракций очень прост
в аппаратурном оформлении и имеет высокий энергетический коэфгмци-
ет полезного действия, т.е. теплотворная способность продуктов и
сырья близки.
127
ПРОЦЕСС ПАРОВОЙ КОНВЕРСИИ В АДИАБАТИЧЕСКОМ РЕАКТОРЕ
При контакте сырья с катализатором в начальный момент времени
протекают реакции расщепления молекул углеводородов водой с
образованием в основном Н2 и С(>2 (рис.32) ^30/. При низкой степени
конверсии сырья в смеси находится незначительное количество
газообразных продуктов реакпии при наличии относительно высокого
парциального давления водяного пара. Вследствие этого равновесие
сдвинуто в сторону образования СО„ и fy . При этих условиях сумирная
реакция эндотермична, и температура в слое катализатора в
адиабатическом реакторе падает. Например, при 450°С и конверсии гептана 5%
реакция газификации имеет приблизительно такой вид /II5/
С7 Hf6 +8Н2О— 4СО2 + ЭС*4 * Щ + 356 хД* ¦
При углублении конверсии парциальное давление водяного пара
уменьшается из-за расхода его на взаимодействие с углеводородами,
а также разбавления его газовыми продуктами реакций, идущими с
увеличением объема. Вследствие этого равновесие сдвигается в сторону
образования метана, и выход его растет, а водород расходуется на
реакпии меташровання
со + щ = Щ + "го,
Развитию этих реакций способствует также понижение
температуры в реакторе вследствие эндотермического эффекта. Тепловой
эффект суммарной реакции снижается, проходит через ноль и
становится отрицательным. В результате температура вначале снижается,
достигает минимума в термонейтральной точке и начинает
увеличиваться (рис.33) /II6/. Повышение температуры идет до полного
разложения сырья. После окончания реакций и установления
термодинамического равновесия температура остается неизменной во всем
расположенной ниже слое катализатора.
Температурный минимум в адиабатическом реакторе является
типичным, но он имеется не во всем диапазоне температур
предварительного нагрева сырья. Как видно из рис. 34, он исчезает для дднннт
условий при температуре около 400°С. Первичные эндотермические
реакции не всегда дают значительное падение температуры; это зависит
от количества образовавшихся окислов углерода, водорода и
температуры, при которой достигается равновесие. Чем выше температура,тем
128
о
m
о
025
0,75 l/L
25 50 75
ітепень конверсии, % О
Рис.33. Зависимость температуры реакционной смеси от степени
конверсии гептана и начальной температуры нагрева (Р * 2,5 tffla,/f =
^2): ; - 600; 2 - 550; 3 - 500; Ч - 450; S - 400; a - 350 С.
Pue.34, Температурные профили по длине реактора в зависимости от
температуры предварительного нагрева (л j и давления (<^).
а: К = 2,0 кг/кг; ^=„2,5 МПа; v = 0,062 м3/кг; г - 550; 2 -
500; 3 - 450; 4 - 400°С. 2
б: іл = 450ОС; К = 2 кг/кг;
3 - 2.,Ь\ Ч - Ь\ 5 - 1 МПа.
3
= 0,062 м3/кг; / - 0,5; 2 - 1,0;
пиже равновесная концентрация СН. , и при образовании его
выделяется меньшее количество тепла. Поэтому при повышенных температурах
D50-550°С) в области малых степеней конверсии @-26^) общий
эффект реакций эндотермический.
При низких температурах предварительного нагрева равновесная
концентрация метана более высокая, реакции метанирования идут
интенсивнее и полностью компенсируют эндотермический эффект реакций
конверсии сырья. В проточном реакторе степень конверсии сырья
изменяется »по его длине. Следовательно, по длине реактора меняются
состав реагирующей смеси и температура потока.
Температурные профили в адиабатическом реакторе зависят от
многих факторов: состава сырья, активности катализатора, темпера-
129
туры нагрева, давления, отношения пар : сырье, добавки видородсо-
деряащего газа /III, II6/.
При низкой температуре предварительного нагрева (рис.34)
после небольшой изотермической зоны происходит подаем температуры. С
повышением tQ образуются эндотермическая зона и температурный
экстремум (минимум). Затем температура повышается и достигает
равновесной. Если при t0 - ЗЮ°С превышение конечной темпераіурн над
начальной лі достигает 90°С, то при / = 550°С разогрева смеси
почти не происходит, а при дальнейшем повышении t0 величина At
будет отрицательной.
При низкой температуре скорость реакции меньше, поэтому
кривые более пологие, и равновесная температура достигается на
большей длине реактора.
Повышение давления сдвигает равновесие в сторону образования
метана. Поэтому при t0 = const увеличение давления приводит к росту
конечной температуры t^.
Увеличение отношения пар : сырье эквивалентно снижению
давления. С повышением R снижаются температурный минимум и
температура на выходе
Существенно изменяют температурный профиль дабавка к сырью
газа, содержащего водород. Реакции гидрогенолиза идут с большим
выделением тепла. Поэтому увеличение отношения водород : сырье
значительно поднимает температуру процесса.
При эксплуатации реактора свойства катализатора со временем
меняются. Это приводит к изменению скоростей реакций, а
следовательно и степени конверсии сырья в данной точке реактора. Темпера-
турыне профили деформируются (рис.35) и меняется режим работы
реактора. Имеется три главные причины дезактивации катализатора:
отравление каталитическими ядами, спекание и образование полимеров
Діб/. Рассмотрим механизмы дезактивации.
Отравление катализатора ядами. Основными ядами никелевого
катализатора, которые могут находиться в сырье, являются: сера,хлор,
свинец, кислород и азот. Наиболее сильным, часто встречающимся в
сырье ядом является сера. Если она присутствует в сырье g
значительных количествах (более Ъ.Ьррт), то катализатор быстро
отравляется и работа реактора невозможна.
.Для покрытия всей активной поверхности катализатора
необходимо около 1% серы от его веса. Однако вследствие геометрических осо-
беннестей активных центров на поверхности, существенная
дезактивация происходит уже при содержании серы около 0,1$.
130
550
500
Y 2.
w
i',0
WO
550
WO
<i5Q
и/
o
1 у V
/
!
0,25 0,5 0,75 l/L
250 500 150
Время, и
Рис.35. Изменение температурных профилей в реакторе во времени:
; - свежий катализатор; г - катализатор в середине периода
эксплуатации; J- катализатор в конце эксплуатации;
а - при отравлении серой; о, f - прі дезактивации медленным закок-
совыванием.
Рис.36. Уменьшение общей {1-4) и никелевой ( 7'-Vі ) удельных
поверхностей катализатора во времени при обработке пароводородной
смесью под давлением 2,5 МПа: „
'¦ - 400; 2 - 500; і - 600 ;4 - 700°С.
Если после сероочистки в реактор газификации попадает сырье
со следами серы (не более 0,2 ррт), то сера адсорбируется в узкой
зоне на входе в слой катализатора, количество адсорбированной серы
зависит от температуры нагрева. Слой отравленного, катализатора
постепенно увеличивается. За этим слоем расположен активный
неотравленный катализатор. Таким образом, реакционная зона сдвигается вниз
по катализатору. Температурные профили остаются практически
неизменными, іно сдвигаются к выходному концу реактора (рис.35).
Спекание катализатора. Катализаторы низкотемпературной
конверсии имеют развитую поверхность и, большое содержание никеля.
Такого типа контакты подвержены спеканию во время работы,, при этом
ІЗІ
изменяются свойства как активного компонента, так в носителя.В
сведем алюмоникелевом катализаторе окись алюминий находится в виде
J-- Al2uj с примесью p-Alcuj и образует оидисперсную
структуру, имеицую иикропоры с размерами 15-100 A я макропорц C00-
10000 8). Под действием высоких т.емперат$р D50-500°С) и водяного
пара образуется л-Аі^о^. При этом разрушается структура
носителя, удельная поверхность его уменьшается, происходит "захлошва-
ыие" микропор. Пропорционально общей уменьшается и никелевая
поверхность катализатора. Уменьшение поверхности происходит в
основном в первые часы работы катализатора, а затем
стабилизируется.Изменение активности очень невелико в течение длительното периода
эксплуатации лри нормальных условиях, Jla рис.ЗВ даны результаты экспе-
ментального исследования спекания катализатора при обработке его
смесью водяного пара и водорода в объемном отношении 9:1. при
давлении 2,5 МПа /52, 117/. Температура процесса имеет Сольшое значение,
с повышением ее удельной поверхность катализатора значительно
сокращается.
В свежем катализаторе никель распределен по поверхности
носителя в виде мелких частиц размером менее 100 к. Под действием
высокой температуры частицы слипаются. После 1000 ч работы при 500°С
размер их, по данным /II?/, увеличивается до 300-3000 JL Это
приводит к уменьшению активной поверхности.
Наряду с температурой ускорения спекания катализатора
способствует водяной пар. При действии на катализатор с.общей
поверхностью 95 м" и никелевой поверхностью 27 ц смеси пара и водорода
в течение 250 ч при 500°С и 2,5 МПа наблюдается следующее
уменьшение поверхности:
Отношение НгО/Нг , 1/2 1/2 1/2 9/1
Оби'дя удельная поверхность,м 79 7Є В5 52
Никелевая поверхность, м 22 22 15 13
При эксплуатации реактора и особенно при его пуске и
остановке необходимо избежать подачи в него пара или смеси с большим
содержанием водяных даров. Общее давление не оказывает заметного
влияния на спекание.
Из-Е?; потери активности в результате спекания в одинаковой
степени замедляются все реакции, поэтому реакционная зона
растягивается. Хотя спекание и вносит свой вклад в перемещение реакционной
зоны, но скорость этого перемещения, исключая начальный период
работы, невелика, если строго соблюдается технологический режим.
132
Катализатор теряет активность при длительном воздействии
водяного пара вследствие окисления никеля. В условиях
низкотемпературной конверсии соотношение между окислителем (водяным паром) и
восстановительными компонентами ( СО и /К, ) таково, что никель
находится в восстановленном состоянии. В верхнем слое катализатора,
где восстановительных компонентов мало, возможно окисление никеля,
и катализатор полностью теряет свою активность /21/. Это, подобно
отравлению серой, сдвигает начало реакции вниз по
катализатору.Окисление никеля во всем катализаторе может произойти из-за
прекращения или значительного снижения подачи сырья при сохранении расхода
водяного пара или при попадании в реактор воздуха или кислорода с
сырьем или паром.
Закоксовывание катализатора. Главная причина дезактивации
катализатора - это отложение субмолекулярного слоя полимерных
органических соединений на активных центрах ??j. Полимеры образуются,
по-видимому, путем конденсации ароматических колец. Отношение
водорода к углероду в них менее двух (Л'/У<2) и можно считать,что они
представляют собой конденсированные ароматические кольца.Скорость
образования полимеров сильно зависит от температуры процесса и
углеводородного состава оырья.Большой склонностью к образованию
полимеров обладают ксилолы,полициклическая ароматика и линейные
парафины с чиолом атомов более десяти.При низкой температуре C50°С)
скорость реакций газификации некоторых углеводородов, имеющихся в
сырье, низкая, и образуется заметное количество полимеров (кокса).
Вследствие постепенного закоксовывания температурный профиль в
реакторе деформируется (рис.35), снижается минимальная температура,
увеличивается температурный провал. Для поддержания необходимой
скорости реакции и обеспечения нормальной эксплуатации реактора
постепенно поднимают начальную температуру нагрева t0 , чтобы
поддерживать минимальную температуру на заданном уровне (рис.35).При
такой эксплуатации установки, термический коэффициент полезного
действия ее несколько падает, но загрузка катализатора
газифицирует максимальное количество сырья.
Точный механизм коксообразования неизвестен. Предполагается,
что на активных местах катализатора происходит расщепление
молекулы углеводорода на фрагменты СНК, которые затем претерпевают
изменения и превращаются в ?Н Последние реагируют с водяным паром и
дают газообразные продукты. Параллельно некоторая часть фрагментов
СНп реагирует с молекулами углеводородов и образует соединения -
предшественники кокса, состоящие из шестичленних колец/Кольца те-
133
ряют водород и ковденоируш'ся. Сконденсированная ароматика,
вероятно, с примесью дисперсного углерода и образует кокс.
Экспериментальным путем установлены следующие количественные
зависимости коксоотложения. Скорость заяоксовывания увеличивается
при снижении температуры; почти не зависит ог давления;
приблизительно пропорциональна отношению сырье:пар; почти не зависит от
объемной скорости сырья.
Углеродистые полимеры,оорьзовакные при низких температурах,
удаляются при регенерации водородом оэлее легко и полно, чем
образованные при повышенных температурах. Поэтому возможна работа
катализатора при 380-400°С в циклическом режиме конверсия -
регенерация.
РАСЧЕТ И МОДЕЛИРОВАНИЕ НИЗКОТЕМПЕРАТУРНОЙ КОНВЕРСИИ
Экспериментальным путем установлено, что состав конвертированного
газа зависит главным образом от степени разложения сырья и
термодинамических параметров процесса.
Приближенно состав газовой смеси можно рассчитать следумцим
образом. Предполагаем, что в любой момент протекания реакций все
неразложившиеся углерода (кроме метана) можно рассматривать как
инертный газ, а продукты реакция достигают равновесия. Безусловно,
такое предположение не совсем корректно (см.рис. 32); /удержание
водорода и окислов углерода может быть выше равнаы;.ж>го,а метана -
ниже. Но предположение о достижении равновесия дает возможность
приближенно рассчитать состав газа, не рассматривая механизм и
кинетику довольно сложны* реакций. Полученный состав гааовой смеси
дает незначительную ошибку в тепловом балансе, и рги.считанные
простили температуры хорошо согласуются с экспериментальными данными
/30 7.
Как. было показано (глава 2), порядок реагдіїи по углеводороду
лежит в пределах 0 ~ (+0,3),а по водяному пару-0,15 + (+0,07).При
моделировании процессов конверсии жидких углеводородов можно
считать общий порядок реакции нулевым; тогда скорость реакции'
- JL
oj=.k -- k?e *r . E.18)
В промышленном шахтном реакторе продольным перемешиванием
можно пренебречь и считать его реактором вытеснения, процесс в
котором описывается системой дифференциальных уравнений
134
'- »ЇС-ь). E.19)
dl s ц ta (S-2I>
с начальными условиями
при е=о c.*coi, г ~т0, Р *ро.
В системе уравнений E.19)-E.21), кроме основных переменных
ст и р , по длине реактора изменяются также ш*, h/,/, лл, Ср .
Поэтому система решалась интервалыю-итерационным способом. Peaic-
тор разбивался на ряд участков длиной &1, на которых можно
было принять постоянными теплофизические свойства смеси и скорости
потока.. Можно применять и другие методы решения. После нахождения
концентрации сырья на выходе из рассматриваемого участка
определяется, степень конверсии сырья
?& ' . E.22)
где v0 и v - удельный объем смеси на входе в реактор и в конце
рассматриваемого участка.
Считаем, что образовавшаяся в результате конверсии
углеводородов смесь находится в состоянии термодинамического равновесия.
Состав смеси находится по уравнениям A.38) - (I.4T).
При температурах ниже 400°С и особенно при повышенных
давлениях содержание в равновесной смеси окиси углерода никтожно мало.
Поэтому можно считать, что после протекания реакции A.6) состав
газа устанавливается в результате равновесной реакции
Степень конверсии метана л рассчитывается из уравнения
равновесия
KD-- 4, : Я ,
t r A+R + Ncq + А + 2*г(К-2и)гA-»,) ¦ E.23)
где Л'м - число молей углекислоты до реакции; л - число молей
метана, вступивших в реакцию (степень конверсии метана); .с -
количество молей воды ца один грамм-атом углерода сырья. Расчет
ведется на I моль метана.
135
Исходное количество молей углекислоты, приходящееся на I моль
метана, находится из уравнения
E.24)
Количество инертных компонентов определяется как
-nTiTwr • E_25)
где z - степень конверсии сырья; А'- количество инертных газов
( ^2 • Аг ) аа один моль сырья.
При конверсии углеводородов гомологического ряда С„ ^2п +2
расчет можно упростить, используя полученное авторами /57/
уравнение для теплоты реакции
Q - S2? + 2730л - S, 67п ¦
" **»»+>' E.26)
где D - отношение сн, к ?Пм2л+2 моль/моль.
В остальных случаях тепловой эффект находится по закону Гесса
после расчета состава конвертированного газа.
Были промоделированы реакторы с катализаторами различной
активности. Например, при конверсии гептана под давлением р = 40ат
и R = 2 кг/кг нулевой тепловой эффект наолюдается при 590°С. С
повышением температуры подогрева (t^) реакции идут быстрее и
требуется меньшая длина реактора. Но при eo =» 500°С сокращение зоны
реакции очень незначительное. C увеличением расхода сырья длина
реакционной зоны растягивается.
Длине реактора, м
Рис.37. Распределение продуктов
конверсии по длине реактора при
температуре-смеси на входе в
реактор 500 С:
По длине слоя катализатора происходит изменение состава
потока, как это показано на рис.37 для гептана. При начальном нагреве
136
t0 - 500 С после завершения реакций температура становится
равной tk = 549°С и газ имеет следующий состав: Щ - 63, <^, - 21,
/^ - 15, СО - I об./6 в переочете на сухой газ. Такой газ
является хорошим сырьем для высокотемпературной конверсии. Отсутствие
тяжелых углеводородов и наличие значительного количества водорода
благоприятно сказываются на сроке службы катализатора.
При получении высококалорийного (богатого метаном) газа
желательно держать минимально возможную температуру процеоса. Но, как
показывают результаты моделирования, процеос при температурах
ниже 370°С идет медленно даже на высокоактивных катализаторах,и
нужна большая длина реактора. Малая скорость газификации жидких
продуктов благоприятствует реакциям уплотнения, ведущим к образованию
смолистых веществ и кокса. Таким образом, для существующих
катализаторов минимальной температурой сырья на выходе следует считать
380-390°С.
г лава
ПАРОВАЯ КОНВЕРСИЯ В ТРУБЧАТЫХ ПЕЧАХ
ОСОБЕННОСТИ ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА И КОНСТРУКЦИЙ ПЕЧЕЙ
Паровая в пароуглекислотяая конверсии углеводородов являются
эндотермическими процессами с большим тепловым эффектом и
осуществляются в реакционных трубах с внешний обогревом. Другие способы
подвода тепла, например с циркулирующим гранулированным
теплоносителем, промышленного применения не получили.
Первая промышленная установка для получения водорода паровой
каталитической конверсией природного газа была пущена в США в
1930 г.
Однако широкое распространение этот метод получил только пос -
ле второй мировой войны, когда был освоен выпуск труб из
жаропрочных сталей с высокими технологическими свойствами.
В СССР метод паровой конверсии в трубчатых печах был внедрен
в азотяуг промышленность в 1955 г. Вначале конверсия проводилась
под давлением, близким к атмосферному @,17 МПа). В настоящее врч-
мя давление конверсии легат в пределах 2,0-4,0 МПа.
В аммиачном производстве широко применяется двухступенчатая
конверсия. Вначале проводится паровая конверсия в трубчатых, печах.
при которой метан конвертируется на 65-70$, и остаточное
содержание его в конвертированном газе составляет 7-9%. Оставшееся
количество метана подвергается паровоздушной коявероии а образуется
газ с отношением { нг + СО )\ /v « 3:1, из которого затем
получают азотно-водородную смесь заданного состава для синтеза аммиака.
Разработаны процессы двухступенчатой (паровой и парокислородной)
конверсии для производств метанола ж водорода, но промышленного
развития они не получили.
Несмотря на сложность аппаратурного оформления, паровая (пар'
/тлекислотная) каталитическая конверсия углеводородов в трубчатых
чечах на сегодняшний день является наиболее экономичным способом
толученкл технологического газа и водорода. Производительность
установок с трубчатой печью достигает 1600 т/сутки для агрегатов
:;4iTi:<4 аммиака, 2500 т/сутки - метанола, 300 т/сутки - водорода.
I; I
і
77777,
І
і
V
r
і /
/
/
і v/////
/
С
(\
2)
>
>
¦ /
\ і
IT
V/////{
О
о
2 o»,
о
o° \O\
°o 2
о
.ft й
4
Ж
/I
,ш
\
Y
1
\
Pec. 38. Конструктивные схемы печей конверсии:
а - цилиндрическая; б - с угловым вкранои; о - с пристешшы
рядныш экраном; г - с излучающими стенками топки и центральным
экраном; А - террасного тала; е - многорядная с факельным ооогревом,
/ - реакционные срубы; 2 - горелки.
139
шрокое распространение получили энерготехнологические схемы,
в которых механическая анергия, необходимая для привода
компрессоров, вырабатывается непосредственно на установке. Достигнута
высокая степень утилизации тепла.
Процесс паровой конверсии углеводородов ведут в вертикальных
реакционных трубах,заполненных каталиаатором, и размещенных в печи
для обеспечения внешнего обогрева. Трубчатая печь конверсии
является наиболее сложным и дорогим агрегатом всей технологической
линии. Вследствие жестких условий работы надежность ее часто бывает
ниже, чем других аппаратов. Вследствие этого к конструкциям печей
предъявляются высокие требования.
Конструктивное оформление печей весьма разнообразно (рис.38),
что обусловлено различной мощностью, применением разнообразного
углеводородного сырья,температурным уровнем процесса,неодинаковыми
требованиями к металлоемкости, сроку службы и тепловой
экономичности агрегата, патентно-лицензионными требованиями и другими
факторами. :
Парогазовая смесь поступает в реакционные трубы после
предварительного нагрева в конвективной зоне печи или специальных
теплообменниках. Обогрев труб осуществляется от раскаленных продуктов
сгорания или излучающих стен топки. В печах обычно используется
газообразное топливо и чаще всего смесь природного газа, являющегося
и сырьем для конверсии, и различных продувочных гааов.
Печи различаются по параметрам (давлению и температуре)
процесса конверсии, форме топочных камер, наличию или отсутствию
конвективных камер, числу, конвективных змеевиков, форме топочных
камер, способу обогрева, конструкции газоотводящих труб, способам
компенсации термических удлинений реакционных труб, форме
газоотходов, схемам движения реагирующей смеси и топочных газов.
По форме топочной камеры печи разделяются на цилиндрические
и прямоугольные. Цилиндрическая (или кольцевая) форма печи может
применяться при небольшой проиаводительности, когда требуется
установить не более 30-40 реакционных труб. В этом случае печь
получается компактнее прямоугольной. Трубные экраны компануются в
радиальные или круговые ряды. Горелки находятся в подовой части печи
между экранами. Прямоугольные печи с угловым экраном также
используются на установках небольшой мощности (рис. 38,6).
Печи, в которых движение топочных газов в парогазовой смеси
направлено в одну сторону, называются прямоточными, если же газы
движутся в противоположных направлениях, - противоточными.
140
Существенными характеристиками печей являются способ передача
тепла к реакционным трубам и размещение экранов. Вначале
конверсионные печи проектировалась по типу нефтеперегонных с пристенным
экраном и факельными горелками по центральной оси каперы (рис. 38,в).Та
кого типа трехеекционные печи, состоящие из трех разделенных
перегородками камер, были установлены в 50-х годах в СССР на нескольким
предприятиях. Производительность их по газовому сырье составляет
2000-6000 ны3/ч flij'. Эти печи имеют большой объем и вес на единицу
вырабатываемой продуыдаи и неравномерный по окружности ооогрев труо.
Поэтому в настоящее время такие печи не строятся.
Значительно лучшими технике-экономическими показателями
обладают печи со стенками из излучающих чашеобразных или панельных горелок
и центральным однорядным или двухрядным экраном (рис.38,г,д).
Освещение труб здесь значительно равномернее. Снииены габариты и вес ne
чи. Печи такого типа с чешеобреэными горелками разработаны фирмой
"Селас" и с короткофакельными панельными горелками - в Советском О,.»,
ЗЄ. НеДОСТаТКОМ ЭТИХ Печей ЯВЛЯеТСЯ ООЛЬШОе КОЛИЧеСТВО (H2CKOJILK.J
сотен) горелок, чте не характерно для печей с излучающими стен&лш
террасного типа. Горелки устанавливаются на террасах и плаыя
стелется по стене, раскаляя ее. Техкико-эконоиические показатели
террасных печей при средних мощностях установки достаточно высокие.
Противоточше печи такого типа созданы фирмой "Фостер Уиллер"
и нашли широкое промышленное применение.
Печи с налучающиш стенами имеют один существенный недостаток,
заключавшийся в том, что трубы в топочной камере могут быть
размещены только в один или два ряда и, следовательно, мощность одной
камеры ограничена. Поэтому такие печи применяются на установках
небольшой и средней мощности.
Наименьшей удельной материалоемкостью обладают многорядные
печи (рис.38,е ), в которых меаду рядами труб расположены ряды
газовых факельных горелок. При строительстве крупных производств
обычно выбирают печи такого типа, поскольку они наиболее компактны и
требуют меньших капиталовложений, хотя представляют собой слошше
агрегаты с жесткими условиями работ реакционных труб и других
элементов. Б химической промышленности наибольшее распространение
получили прямоточные печи уирма "Келлог".
Некоторые печи по схеме (рис.38,а-г) не имеют конвективных
камер. Тепло дымовых газов используется в отдельно уотановленных
котлах - утилизаторах или подогревателях сырья. В современных
крупных печах устанавливается общая конвективная камера на все радиапт-
141
яне камеры, в которой размещены трубные пучки для нагрева
парогазовой смеси, технологического воздуха, питательной воды, топлива,
перегрева пара и др. Коэффициент полезного действия печи с
развитыми теплообменными поверхностями достигает 90%. Для уменьшения
тепловых потерь топочное пространство и газоходы печей футеруют
несколькими слоями огнеупорных и теплоизоляционных
материалов.Снаружи печь обшивается металлическими листами толщиной 3-5 мм,
температура обшивки во время работы не должна превышать 60°С.
Основными элементами печей всех типов являются: радиационная
и конвективная камеры, реакционные трубы, подводящие и отводящие
трубки, коллекторы, горелки.
Кроме указанных элементов, трубчатые печи оборудуются
смотровыми окнами, люками-лазами, взрывными панелями, запальными лючками,
площадками для обслуживания, системой подачи топливного газа и т.д.
Эксплуатируемые и строящиеся в настоящее время печи имеют
следующие основные характеристики:
Нагрузка по сырью (природному газу), нмэ/ч До 80 000
Тепловая мощность, млн.Вт До 480
Число реакционных труб, шт. 30-600
Характеристика труб
внутренний диаметр, ми 70-150
длина трубы, м т 8-14
Объемная скорость по сухому газу, ч 200-2000
Общая высота печи, м 15-30
Давление на входе в трубы, ат 0 4-40
Температура конвертированного газа на выходе, С 730-900
Трубчая печь является основным агрегатом, от экономичности и
надежности которого в большой степени зависит экономика
производства.
РЕАКЦИОННЫЕ ТЕГШ
Реакционные трубы являются важнейшими элементами печей. Каждая
труба представляет собой заполненный катализатором реактор вытеснения
с поперечным подводом тепла через стенку. Тепловой поток
составляет 30-80 тыс. ккал/м^ч. Чтобы обеспечить температуру
конвертированного газа на выходе 800-830°С (производство аммиака),
температура стенки трубы должна быть 900-930°С. Для получения газа с
температурой 870-900°С (производство водорода и метанола) температура
стенки трубы должна быть 950-1000°С. Давление в реакционных трубах
лимитируется в основном эксплуатационной стойкостью труб. Пробег
труб должен быть не менее 80-100 тыс.ч, т.е. труба должна зксцлуа-
U2
Рис.39. Реаіщионше трубы с внутренним отводом-
конвертированного газа:
а - без теплообменника; S - с теплообменником;
' - наружная жаропрочная труба; 2 - внутренняя
труба, з - катализатор: « - катализаторная
решетка; S - иод топочной камеры; ? - свод
топочной камеры; 7 - теплообменник.
J - парогазовая смесь; » - конвертированный газ.
тяіюваться около десяти лет. Этим обусловливается выбор марки ста-
ля и давления процесса.
При tCJ = 90О-930°С заданный пробег труо из стали типа Х25Н20
достигается при давлении до 40 ат. При более высокой t?T ограничи-
таются давлением до 25 ат B,5 МПа).
Применяются реакционные трубы различных конструкций. Различны
также способы крепления труб в пета и компенсации их
температурного удлинения.
В печах низкого давления некоторое распространение получили
трубы большого димметра (I6Of250 мм) с центральной газоотводящей
трубой (рис.39}. При этой достигается более эффективное
использование кнтализатора. Исходная парогазовач смесь проходит сверху вниз
по заполненному катализатором кольцевому пространству между
наружной и внутренней трубами. Конвертированный газ при температуре 750-
800°С поступает в нижнюю часть внутренней труоы и, поднимаясь по
ней вверх, прогревает катализатор и проходящую через него
реакционную смесь. Температура отводимого из внутренней трубы газа ниже,чем
при использовании прямоточных труо /IG,17/.
Для процесса пароутлекислотной конверсии применялись также тру
бы со встроенным теплообменником. Отводимый по внутренней трубе
конвертированный газ поступает в трубки встроенного в верхнюю часть
реакционной трубы теплообменнкка, где проходящая-по межтруоному
пространству парогазовая смесь нагревается с 250 до 600°С. При такой
конструкции хорошо используется тепло конвертированного газа.Но
вследотвие сложности конструкции ( теплообменник в каждой трубе)
ж нарушения технологичеокого режима в случае выхода m строя да
« одной из трубок вотроенного теплообменника такая конструкция
реакционных труб распространения не получила.
В новых печах устанавливаются, как правило, трубы прямоточного
гипа, При низком давлении наружный диметр труб 150-170 мм, толщина
;тенки G-O мм (например, диаметр ІП2 X 8 или 168 х 7). Трубы с
больший диаметром не применяжчсл из-за невозможности поддерживать высо-
17» температуру катализатора в центре трубы. Вследствие низких ко--
'¦Іфпуіетов теплоотдачи и низкой теплопроводности гатализатора и
газового слоя перепад температур по сечению труб указанных выше
тааметров достигает 100-150°с.
При рабочей давлении 20*40 ат применяются трубы с наружным
;ягметром 100-140 мм и тс.шздной стенки I6f2I мм (ряс.40). Верхняя
;эсть трубы,^вступающая над топочной камерой, имеет фланец для эа-
:у'ки катализатора и патрубок для ввода парогазовой смеси. Патру-
И4
Ф250
Рис.40. Реакционные
прямоточные трубы:
а - печи "Фостер -
Уиллер" {&*=¦ 3,2МПа);
о - печи "Келлог"
(?,/ = 3,7 МПа).
/ - рабочая часть
реакционной трубы,
заполняемая
катализатором; г- верхний
тонкостенный участок
трубы; 3-
секционный коллектор; # -
фланец; S - низкняя
опора; ? - фланец;
7 - бобышка для
приварки трубы к кол-'
лектору; <г -
теплоизоляционный блок
из бетона; 9 -
бобышка к газоотводя-
щей трубе; ю-
планки для распределите-
тей (оепараторов)
трубного экрана; // -
опорный стакан ката-
лизаторной решетки;
г2 - коническая ката-
лизаторная решетка;
із - бобышка к гаво-
подводящей трубке;Ц -
опора для труоной
подвески; if -
верхний фланец; дґ- верх-
ныя крышка; '7 -
серьги для подвески
трубы; is - уплотняющие
кольца; 19 -
теплоизоляционный блок.
145
бок может находиться и в крышке фланда. Грізний фланец иногда
снабжают теплоизоляционной вставкой. Обогреваемая часть трубы
заполнена катализатором, который снизу опирается на специальную решетку
/17.7.
Одна из конструкций прямоточной тру1ы, работающей при
давлении 3,0-3,5 Ш1а, показана на рис. 40,а . Труба постоянного
диаметра имеет верхний и нижний приварные фланцы с крышками. Уплотнение
фланцев осуществляется металлическими кольцами либо специальными
плоскими асбоцементными прокладками. Верхняя и нижняя бобышки у и
13 соединены с газоподводящей и газоотводящей трубками на сворке.
Установленный на нижнюю крышку трубы опорный стакан // и
приваренная к нему опорная коническая катализаторная решетка из
жаропрочной стали /2 предназначены для отвода конвертированного газа. Из
стакана газ выходит через боковое окно в его стенке. Нижняя часть
опорного станана заполнена теплоизоляционным бетоном для защиты
нижней крышки трубы от высокой температуры.
Выше газоотводящего штуцера к наружной стенке реакционной
трубы приварены четыре планки Ю для крепления сепараторов,
фиксирующих интервалы между реакционными трубами. К нижнему фланцу приварен
стержень (палец), которым реакционная труба свободно опирается на
несущую балку. К верхнему фланцу приварены две серьги 77 для иод-
вески к траверсе с противовесом, воспринимающей около 95 вес.%
четырех, труб, загруженных катализатором.
В современных многорядных печах с давлением процесса 3,7+
4,0 МПа применяются трубы сложной формы (рис.40,/). Верхняя
тонкостенная часть трубы / , которая находится над сводом реакционной
камеры, имеет длину 1250 мм и изготовлена из стали І5Ш. Верхняя
кришка трубы защищена теплоизоляционным стаканом .V от
воздействия високих температур. Уплотняются фланцы металлическими
кольцами или специальными асбометалляческими прокладками. Верхний
боковой штуцер приваривают к газоотводящей трубке. Нижняя часть
реакционной трубы приварена к секционному коллектору. Опорой для слоя
катализатора служит стенка коллектора с просверленными
отверстиями fnj.
!.іатіЗ[;;іал реакционных труб. При проведении процесса
конверсии nix \..:епенных те;дієратура"х"'GЬи-80С0(;) и низком давлении @,2-
0,4 i.Cia), когда температура стенки не превышает 900-Э20°С,
применяют катанные трубы из стали X2K1L8. Эта сталь довольно технологична,
не недостаточно яаростоііка и молоустойчива просив сульфидной кор-
рсзил. Топливный газ обычно не очищается от с^шстых соединений
и коррозия окислами сери сокращает срок слукоы труб.
1-і G
u большинстве современных печей как при низком, так и при
высоком давлении применяют стали типа Х25Н20 с содержанием хрома 24-
27/f, никеля І8-2ІЯ, марганца 1,Ь%, кремния 1,2-3,0^. Содержание
углерода в зависимости от марки около 0,2 или 0,4$.
Тонкостенные трубы из стали Х25Н20С2 изготовляются
вальцеванием листа с последующей сваркой продольного шва или методом
горячего прессования. Сталь Х25Н20С2 относится к классу труднопрошивае-
мых, поэтому вначале способом центробежного литья отливают полную
заготовку, которую подвергают механической обработке с целью
удаления дефектов с поверхности, а затем на установке горячего
прессования получают трубу длиной 5-8 м.
Толстостенные реакционные трубы изготавливают из стали
45Х25Ы20С2(НК-40) методом центробежного литья, так как эта сталь
мадошшстична. Заготовки длиной 2-4 м после механической обработки
сваривают электродуговым методом и получают трубу длиной ІОт-14 и.
Может применяться также сталь 45X2QH35, но она значительно дороже.
К сварным швам предъявляются очень высокие требования.Металл шва
должен иметь длительную прочность, только на 2(# уступающую
прочности основного металла; исключаются трещины, пористость,непровар.
При таких условиях труба с кольцевыми сварными стыками обладает не
меньшей прочностью, чем цельная без сварных швов. Это объясняется
тем, что в трубах, нагруженных внутренним давлением, кольцевые
напряжения вдвое больше осевых. Из-за незначительной протяженности
сварного шва в направлении оси трубы прилегающие с двух сторон
участки основного металла удерживают кольцевой сварной шов от
увеличения диаметра в результате ползучести.
При длительной эксплуатации в реакционных трубах могут
возникать трещины по образующей трубы. Трещины могут соединяться в
большую щель, но олучаев разрыва труб не наблвдалооь. Выходящий через
щель газ воспламеняется, и трубу необходимо отсоединить. Для этого
необходима краткосрочная остановка печи, что нежелательно. На
некоторых конструкциях печей трубу можно отсоединить в "горячем
состоянии" , пережимая специальным прессом подводящие и отводящие трубки.
Эффективность работы трубчатой печи зависит в основном от
температуры реакционной трубы и давления в ней. Ограниченные
возможности .материала труб сдерживают рост давления процесса. В печах
водородных установок оно не превышает 20-22 ат, а в печах
установок синтеза аммиака 40т42 ат. Зависимость срока службы труб из
сплава НК-40(Х25Н20С2) от давления в трубе и температуры металла по
данным $ирмы ICI представлена на рис. 41 /G8/. Как видно, эта сталь
147
50
га
to
0,1
0,1
im чоо
Рис.41. Длительность
эксплуатации труо из сплава НК-4О в
зависимости от температуры стенки
я давления в реакционной трубе:
/ - I; 2 - 1,5; 3 - 2,5;
4 - 4 МПа.
Повышение температуры на 50
то
t.'C
весьма чувствительна к перегреву,
снижает срок службы трубы приблизительно в пять раз. Если же
проектировать трубу на повышенную на 50° температуру при неизменной
сроке службы, то допустимое напряжение должно быть снижено и гол-
шина стенки увеличена на 40$.
Резко сокращается продолжительность раооты трубы с повышением
давления. Так, при t = 1000°С с повышением давления от 5 до 40 ат
она сокращается с 20 до 0,2 года.
Срок службы труб зависит также от тешюнапряжения. Поэтому
фірма TBC рекомендует пределы безопасности разбить на две
категории: а) нормальная работа трубы при среднем тешюнапряхении
48000 ккал/мч; й) трубы с нарушением потока (снижение или
отсутствие теплового потока вследствие закупорки, местный
перегрев).Пределы безопасности работы по категории а % S даны в табл.14. Как
видно, для сплава НК-40 для обеспечения длительной эксплуатации не
рекомендуется превышать температуру 982°С.
Т а б л и ц а 14. Предельно допустимая температура (°С) длительной
безопасности работы труб по категориям ала
Показатель
38 ат
32,6 ат
27,4 ат
Для труб со средним
сроком службы
100 000 ч 958
С минимальным
сроком службы
100 000 ч 925
Со средним сроком
службы 25 000 ч 982
С минимальным сроком
службы 25 000 ч 966
982 977
982
982
982
950
982
982
935
982
982
966
982
982
264
982
982
982
982
982
148
С экономической точки зрения процессы конверсии желательно
проводить при более высоком давлении и в некоторых случаях при
более высокой температуре. Поэтому в настоящее время ведутся
разработки и освоение новых более жаропрочных сплавов. Осваиваются опла-
ш Super -22\,M0-RB'1,Sxpart/ierm,Hanaxrfte и другие, превосходящие
сплав НК-4О, являющийся основным материалом труб. Использование
новых сплавов приведет к увеличению стоимости печей, но позволит
поднять давление и температуру конверсии, а также повысить их
надежность /69/.
МОДЕЛИРОВАНИЕ РЕАКЦИОННОЙ Т1УБЫ
Процессы паровой и пароуглекислотной конверсии проводятся в
реакционных цилиндрических трубах с неподвижным слоем катализатора.
Реакционные трубы являются реакторами вытеснения в общем случае с
продольной и поперечной диффузией и теплопроводностью, и процесс
конверсии в них описывается системой дифференциальных уравнений в
частных производных
§4 ^-'ФЧ^Ф^1""'"¦"¦"' (ел,
дт , 3 ат д дт эт v #
к-ТТГ^гТГ^ТгЬаТГ^»**"^ **"> - F.2)
где .' и і - текущие радиус и длина реактора; »v - скорость потока;
2г - время, л и л, - эффективные теплопроводности в поперечном и
продольном направлении; Dr и D? - аффективные коэффициенты
диффузии в поперечном и продольном направлениях; ш* - наблюдаемая
скорость реакции.
Число независимых уравнений F.1) п - I, где л - число
компонентов газовой смеси. Проверка показала /46/, что в промышленных
аппаратах ( i/a х. I00fI50) продольный перенос вещества и тепла не
существенен и его можно не учитывать. Для стационарного режима
процесс конверсии в обогреваемых снаружи трубах описывается системой
уравнений . - .
дг2 г дг I р ffl ' » F.4)
ар s&1 i'-f.
dl ~ * 2c fV ' F.5)
с граничными условиями
149
при г-* ^-.
при г---о —^~ = І1. -.
При 1--0 Т-То, ?г¦ -- С , Р -- Р
Для паровой конверсии (/= 1,2)достаточно двух уравнений (УІ.З)
для расчета концентраций Щ и Щ-ZafaJi суммарный тепловой эффект
реакции; «' - коэффициент теплоотдачи от внутренней поверхности
труоы и потому с учетом теплового излучения.
Коэффициенты в уравнениях F.3) - F.5) являются переменными,
что затрудняет решение системы.
Скорость потока изменяется по длине вследствие уменьшения
молекулярной массы смеси, повышения температуры и падения давления
' F.6)
где if - расход газа, кг/с; f - площадь поперечного сечения; z ~
коэффициент сжимаемости; & - порознооть слоя.
Исходные Ванные
Со D.I. Т,,Ро,Г№, Tg
Моделиродание
процесса на зерне @
печать результатов
u/r,o,T(rjj,u,T,P
Рис.42. Блок-схема расчета
реакционной труСы.
Скорость переменна и по радиусу реактора (см.рис,9), но для
практических целей можно считать. W(r ) ' cens*.
150
Основа расчета - это решение системы дифференциальных
уравнений F.3)-F.5), описывающих процесс в реакторе (рис.42). Но для
решения ее необходим большой объем данных, которые рассчитываются
в отдельных блоках. Исходными данными для расчета являются: расход
сырья и его состав, отношение пар: сырье, параметры потока на
входе, температура внутренней или наружной поверхностей
трубн,геометрические размеры реактора и другие величины. Вначале (блок 7)
производится расчет величин, являющихся постоянными для данного
набора исходных параметров, площадь поперечного сечения ( / ), массовая
скорость (у ), порозность слоя ? и другие величины.
Определяются теплофизические свойства смеси (блок і1 ). На
первом этапе расчета они находятся по начальным параметрам, т.е.
параметрам на входе в реакционную трубу. Параллельно (блок,/)
рассчитываются кинетические параметры - константы скоростей и окорости
химических реакций.На основе гидродинамики потока и его теплофизи-
ческих свойств рассчитываются коэффициенты переноса А^,^, р (блокV).
Используя данные по кинетике и массообмену, моделируется
процесс конверсии на зерне катализатора (блок 5); находятся
наблюдаемая скорость реакции и коэффициент эффективности катализатора. Для
вычисления степени приближения к равновесию может быть введен блок
расчета равновесного состава смеси. Методики всех этих расчетов
представлены в главах 1-3.
В процессе решения системы дифференциальных уравнений (блок
6 ) производится обращение к блокам /-/ . Так как коэффициенты
уравнений являются переменными, то необходимы специальные методы
решения. Можно применить следующий метод. Реактор по длине разбивается
на ряд участков длиной al таким образом, чтобы скорость,
теплофизические свойства газовой смеси и катализатора маяно было считать
постоянными.
Следовательно, постоянными будут и коэффициенты переноса.
Находим среднеинтегральную по сечению наблюдаемую скорость реакции
ш* с учетом порозности слоя катализатора. После этих
преобразований получаем систему дифференщальных уравнений с постоянными
коэффициентами, которая сравнительно легко макет быть решена
численными методами. Находятся среднеинтегралыше температура и наблюдаемая
скоростьіреакции в объеме рассматриваемого участка, а также средняя
скорость и теплофизические свойства по средней температуре.По этим
уточненным значениям т, Р, ы,ш* снова производится решение системы
уравнений. Результаты второго решения считаются достаточно точными.
Находится средняя по радиусу концентрация метана на длине і и сте-
151
пень конверсии его в данном сечении. Величины, полученные на
выходе из рассматриваемого участка, являются исходными данными для
расчета следующего участка. Расчет продолжается до тех пор, пока не
будет достигнута заданная степень конверсии метана (находится длина
трубы ) или длина реакционной трубы (находится степень конверсии).
Алгоритмы решения систем параболических уравнений в чаотных
производных даны в работе /70/. Метод решения заключается в
переходе к нестационарной задаче с последующей прогонкой. В данной
задаче роль временной переменной играет і . Последовательность ра-
очета следующая. Задается распределение концентраций ^ и
температуры в начальном сечении ( / = u ). Производятся расчет теплофизи-
ческих свойств смеси по радиусу и прямая прогонка (счет /*/V/ и
О.ф! ). Используя граничные условия, рассчитываем с{- и г по
радиусу при г+лі ; далее вся процедура повторяется до /=/
включительно.
Достаточно точное решение (при L =8-14 М) достигается при
числе шагов по длине около 200 и числе точек по радиусу ( г0 « 100 мм)
порядка 20-30.
При определении теплового потока можно пользоваться
коэффициентом теплоотдачи конвекциейd , но рассчитываемым с учетом
радиационной составляющей. Методически более правильно вклад излучения
учитывать отдельно
/TC/ I too I y too і J' F.7)
где s - эффективная степень черноты системы стенка - катализатор;
Тк - температура зерен катализатора у стенки трубы; т -
температура потока, ТСГ0 - температура внутренней поверхности стенки трубы.
При моделировании печи более удобно расчет вести по
температуре нарувиой поверхности трубы Tfft// , тогда температура на
внутренней поверхности определяется из равевства тепловых потоков через
стенку (Г _ .
———qjjArj—
Br-ha)tn-e~- ¦ F.8)
и от стенки к потоку газа F.7)
"я/ ;"/'*/ \ioelJ- F.9)
Сделав допущение, что Т = т , получаем уравнение четвертой
степени относительно тсг л , которое может быть решено методом
половинного давления
152
Можно пользоваться и более простым выражением
T?rtf =7' Ua'jr ' F.10)
вполне приемлемым для промышленных реакционных труб.
Во многих случаях можно использовать модель реактора
идеального вытеснения с передачей тепла через стенку /71, 72, 73, 74/.
Система уравнений значительно упростится и примет вид
F.12)
F.13)
с начальными условиями
при 1=0 <*--?, Г= ГОі Є. =<7Л. .
Коэффициент 4/d есть отношение боковой поверхности
(поверхности нагрева) к объему в цилиндрическом реакторе; fM ~ массовая
скорооть.
Можно предположить, что с конечной скоростью идет реакция
взаимодействия метана с водяным паром, а реакция водяного газа
(конверсия СО) достигает равновесия. В этом случае для расчета состава сме
си достаточно записать одно уравнение материального баланса F.12)
для метана, т.е. і - I.
Для более точного расчета состава смеси можно использовать
эмпирическую зависимость отношения количества ?О„ к <&> от
действительной к и равновесной *. степеней конверсии ПХІ-
R (хр -ж)
где А - мольное отношение со} к СО ; Ар - то же для равновесного
состава; R - мольное отношение пар : метан.
Рассмотрим методику и порядок расчета реактора при конверсии
природного газа.
Основными исходными данными для расчета реактора являются
следующие:
Состав сырья: N^, /^,, ..., $,..., #п
Расход сырья fyc
Объемное отношение пар : газ Ro
і&вление на входе Р^
153
Температура на входе ?
Наружный и внутренний диаметр труб ^, <?#„
Идина реакционной зоны /,
Температурный профиль наруаной поверхности трубы 7^.т
Дифференциальные уравнения F.II)-16.13) могут быть заменены
у[)аннениями в конечных разностях и тогда рассматривается изменение
параметров на участке длины &1 . Приращение длины йі выбирается
таким образом, чтобы тешюфизические свойства и другие величины мок
но было считать на ней постоянными.
Считаем, что на первом расчетном участке реактора все углеводо
роды, тяжелее метана, разлагаются по уравнению A.6) до метана и
углекислоты. Это близко к действительности, так как. скорость их
разложения в условиях реакционной трубы достаточно высока.
Метан, поданный с сырьем и полученный по уравнению
A.6),взаимодействует с паром на катализаторе. Скорость реакции рекомендуется
записывать уравнениями вида
»¦''V'i'-*''¦?>• C6.IS)
на которое не накладывается никаких ограничений, необходимо только
иметь зависимость констант А, а, ъ и с от параметров
процесса.Например, модно использовать уравнения B.14) и B.20).
По уравнению C.55) находим наблюдаемую скорость реакции СО и
затем количество прореагировавшего за секунду метана на участке
¦ J- F.16)
где f - площадь поперечного сечения; ? - порозность слоя
катализатора.
Определяется количество оставшегося метана
M =ми - am, F.I7)
ї.ц мн - количество метана на входе в рассматриваемый участок.
Степень конверсии метана
Лг Мд ' F.18)
где '. - общий "метановый эквивалент" сырья, определяемый как
ty^ntf, ¦ F.19)
где /V. - мольная доля компонентов сырья; ^ - количество атомов
гглерода в молекуле газа.
154
Рассчитывается равновесный состав смеси при температуре на
входе в участок. По л и хр находят отношение А - Щ •• cu по формуле
F.14) и затем действительную степень конверсии окиси углерода у
.- Ах
? Г-А F.20)
По известным х и у рассчитывается состав газовой
смеси,используя зависимости A.38).
Далее определяются теплофизические свойства газовой смеси -
Ср. л, ?i и затем коэффициент теплоотдачи к потоку.
Коэффициент теплопередачи от наружной поверхности трубы к
потоку есть
<*. л' F.21)
где і - толщина стенки труоы; л - теплопроводность металла.
Среднее по окружности теплонапряжение трубы
Максимальная температура наружной поверхности труоы может
заметно отличаться от средней и должна проверяться по формуле
K(f F.23)
Коэффициент неравномерности нагрева ср лежит в пределах от
V = 0,9 для экрана двухстороннего облучения о шагом з=зам до Сг=
= 0,55 для двухрядного экрана двухотороннего облучения с 5=2dH$/.
Подведенное на участке і і тепло
л^ =у-йГ, ¦ F.24)
где і F - наружная поверхность участка трубы.
Теплота разложения сырья
где а. и а., - весовое содержание компонентов в начале и конце
учаотка.
Приращение температуры на участке
аГ- с C ¦ F.26)
Падение давления на-участке находится по уравнению F.13), а
время контакта как
ь*--^ ¦ F.27)
В конце рассматриваемого участка имеем:
155
тк-тн+*т,
F.28)
Расчет продолжается до тех пор, пока не будет достигнута
конечная длина реакционной трубы.
Иногда используют термодинамическую или "раввовесяую" модель,в
которой используется гипотеза, что состав газовой смеси является
равновесным в каждой точке реактора. Как будет показано ниже,
"равновесная11 модель является весьма приближенной и неприемлема в
области низких температур, область применения ее ограничена. В работе
/75/ рассмотрена "равновесная" модель в сочетании с моделью
реактора идеального вытеснения. Указывается, что длина реакционной трубы,
рассчитанная по этой модели, является минимально необходимой и
может служить эталоном для оценки совершенства реального реактора.
"Равновесная" модель использовалась для расчета и оптимизации
технологических схем производства аммиака.
"В работах /26, 76/ представлен упрощенный метод расчета
трубчатого реактора, который сведен к расчету изотермического
реактора. Дан метод определения среднеинтегральной температуры, по
которой необходимо производить расчет. Из условий кинетики находятся
объемная скорость газа и требуемый объем катализатора. Такой метод
расчета необходимой точностью не обладает, но он достаточно прост
и может быть использован для приближенных оценок.
НЕКОТОРЫЕ РЕЗУЛЬТАТЫ МОДЕЛИРОВАНИЯ ТРУБ
Авторами /46, 71-74/ были промоделированы трубы печей конверсии
аммиачных, метанольных и водородных установок.
При исследовании реактора были выявлены большие градиенты
температур по радиусу трубы (до I0OfI20°C) /46/. На рис.43 видно, что
при давлении 3,0 МПа радиальные градиенты температуры значительно
меньше. Это вызвано тем, что при высоком давлении значительно
выше объемная скорость 25 mVcm2 против 2,5 mVcm2 при 0,17 МПа
(объем газа приведен к нормальным условиям).
Расчеты показали, что вклад излучения стенки в общий тепловой
поток, передаваемый газовому потоку, изменяется от 20# при
объемной скорости 3,33 нм3/с*г до 5% при 20 hmVcm2. Следовательно, при
высоких нагрузках вкладом излучения можно пренебречь /46/.
156
t.x
700
600
500
R
Рис.43. Радиальные пробили тш-
пературы при давлении ОД1? (—)
и 3,0 НПа Т- - -) для наружного
диаметра труаы 152 мм.
S to 0 1
Длина реакционной труНы, н
и, МО/
/
u/H 'С
> "
І0С0
(IUU
sa)
s
3 9,6
iuu
Рис.44. Изменение параметров процесса по длине реакционной труоы
при конверсии чистого метана (а ) и природного газа E ).
г~г - температура наружной поверхности стенки трубы; г-
температура потока; ш - окорость конверсии метана; х - степень конверсии.
157
Рассмотрим теперь изменение параметров процесса вдоль реак-
пеонной трубы при паровой конверсии чистого метана и природного
газа. Приводятся среднеинтегральные по сечению параметры и составы
газового потока.
На рис.44 представлены результаты моделирования конверсии
метана в реакционной трубе <^, = 100 мм и длиной Юме
температурой стенки tCT = 1000°С при расходе метана 345 нм3/ч и Л1 = 3,27;
параметры на входе t? = 527^С, Р = 3,5 МПа. На начальном участке
скорость реакции мала и происходит нагрев смеси практически без
разложения метана. Постепенно температура потока возрастает и
скорость реакции увеличивается.Появление водорода (в небольших
количествах) также способствует увеличению скорости реакции
B.II).Начинает резко возрастать степень конверсии х • Увеличивающийся
расход тепла на реакции резко замедляет рост температуры потока.
Скорость реакции проходит через максимум и начинает снижаться
вследствие уменьшения концентрации компонентов сырья. Для сравнения на
рис.44 представлена равновесная степень конверсии метана хр при
среднеинтегральной по сечению температуре /I4/.
В результате химического взаимодействия изменяется состав
продуктов, как это показано на рис. 45. Штриховими линиями обозначены
равновесные концентрации продуктов. Как видно из рис. 44 и 45, в
первой половине змеевика х имеет совершенно другие значения, чем
Хр , и соответственно сильно различаются действительный и
равновесный составы. Значительная степень приближения к равновесию
наблюдается только в конце реактора.
Несколько изменяется картина конверсии, если в качестве сырья
подается природный газ с гомологами метана, который смешивается с
рециркуляционным потоком, содержащим водород, азот и аргон. В
качестве примера приведем результаты моделирования реакционной трубу
печи конверсии ППР-І360 со следующими характеристиками:
Диаметр трубы,
Толщина стенки
Длина трубы, заполненной катализатором
Расход сырья
Отношение пар:сырье
Температура на входе
Давление на входе ¦? =3,8 МПа
Состав сырья, об.?: С0г - 0,05; Нг - 10,70; N2+Ar- 7,85;
Щ - 75,38;^- 4»12»0^- 1.26;^уА
0,44; СгН5 - 0,20.
і 58
"fi
і
L
Q
/
r
= 104
= 16
= 9,6
=78,3
= 3.9
= 525
MM
MM
M
нм3/ч
°С
g-ЮІ кВт/м! сх,НЮ;вт/м град
О ' f S 8
Длина труоы, м ~ длштржткю1зоны,~н
Рис.45. Состав газового потока по длине реактора при конверсия
природного газа. ,
/ -ff - действительный состав; /'-f - равновесный состав;
Рис.46. Изменение тепловых характеристик по длине реактора:
а - коэффициент теплоотдачи; к - коэффициент теплопередачи от
наружной поверхности труби; q - теплонапряяение.
Температура наружной поверхности труоы, замеренная на
промышленной печи, аппроксимируется уравнением
где і - текущая длина трубы (слоя катализатора).
При температуре сырья на входе в реактор E25°С) на
катализаторе реагируют в основном гомологии метана с образованием <г^,й?и
СО , а скорость конверсии метана очень мала (рис. 44,^ ). Так как
затраты тепла на реакции невелики, температура потока резко воэра-
159
стает. При t к. 650°С скорость реакции метана с водяным паром
становится значительной, и быстро увеличивается степень конверсии х.
Расход тепла на реакции замедляет рост температуры. Более
медленный подъем температуры на рис. 44, a по сравнению с 44, а
.объясняется пониженной температурой стенки трубы.
На первом участке реактора расходуется вода и образуется
дополнительное количество метана (рис. 45,^) по реакции A.6). В
дальнейшем вода реагирует с метаном и концентрация его снижается.
Степень приближения к равновесию, как и в предыдущем примере,
высока только на выходе из реактора. В среднем состав газа в
реакционной трубе далек от равновесного. Из этого следует, что при моде-
чировании реакторов конверсии пользоваться гипотезой о достижении
равновесия в каждой точке реактора ("равновесной" моделью)
необходимо с остроожностью.
Тепловые характеристики реакционной трубы диаметром 104x16 мм
показаны на рис.46. Форма кривой теплонапряжения обусловливается в
основном изменением разности температур стенки трубы и потока л Г
(см.рис. 44,/) и коэффициента теплопередачи к. Вначале лт
уменьшается и ? падает, несмотря на увеличение к . Затем в зоне
быстрого протекания реакций конверсии метана &т возрастает, что
ведет к увеличению ч . На конечном участке ^ снова падает
вследствие уменьшения іТ в. К. При других соотношениях параметров форма
кривой теплонапряжения будет другой, но всегда в начале
реакционной трубы ? более высокое, чем на конечном участке.
В результате расчета реакционной трубы печи ППР-І360
получены следующие параметры на выходе из нее*.
.Удельный объем газа с = 0,18 мэ/кг
Скорость потока »V = 5,83 м/с
Время контакта г = 2,18 с
Степень конверсии метана .. х = 0,63
Степень конверсии СО и - 0,33
Молекулярная масса смеси .. it - 13,5
Температура t = 810° С
Давление Р - 3,6 МПа
Подведенное тепло Qn= 21I670 Вт
Теплота конверсии А - 155840
Состав газа, об.% Р
Влажный газ Сухой газ
Н2 .. . . 1,50 А? 2,64
Нг. .. . 38,30 //g 67,30
CO.. . • 5,14 СО ¦ ¦ . ¦ 9,02
НгО... ¦ 43,10 НгС- ¦¦ -
СНЦ.... 6,33 ^ .... II,I
160
Примерно 75/5 подведенного тепла идет на компенсацию
эндотермического эффекта реакций конверсии и около 2Ъ% - на нагрев
газовой смеси.
Рассмотрим теперь, как изменяются параметры потока и состав
газа конверсии при изменении условий в реакторе.
С увеличением расхода сырья при неизменном профиле
температуры стенки трубы температура потока падает, несмотря на увеличение
коэффициента теплоотдачи к потоку газа, но в замедляющем
темпе.Соответственно уменьшается степень конверсии и изменяется состав
газовой смеси (рис.47). Гидравлическое сопротивление реактора резко
« m во too im
Расход сырья, нм3/ч
Рис.47. Зависимость параметров процесса и состава газа на выходе
от расхода сырья: / - Р; 2-х-, 3-т; *-/?; s-e»4f 6-Ms; 7-cu.
Рис.48. Зависимость параметров процесса и состава газа на выходе
от температуры отенки трубы: 7-Х; і- т; з - си.,- 4 - ty' •?- Щ'1
6 - СО. ¦
¦
возрастает. С увеличением расхода, падение температуры потока
замедляется вследствие интенсификации теплообмена. При этом равно- ,
весная степень конверсии практически не изменяется, но может
даже несколько возрастать вследствие резкого падения давления. Ско-
161
рость реакции возрастает. Это вызвано тем, что с увеличением
расхода повышенная концентрация метана достигает зоны более высоких
температур. Но все-таки увеличение скорости реакции полностью не
компенсирует увеличение подачи сырья, и степень конверсии падает
почти по линейному закону.
Соответственно изменяется и состав газовой смеси: растет
доля неразложившегося метана, выход водорода снижается. Количество
подведенного тепла возрастает вследствие увеличения средней
разности температур стенки трубы и потока и интенсификации теплообмена.
Протекание процесса конверсии в реакторе определяется в
значительной степени температурой стенки трубы, а изменение ее
оказывает сильное воздействие на процессы в реакторе. С увеличением
Т возрастает теалонапряжеіше поверхности трубы и увеличивается
количество подведенного тепла. Вследствие этого возрастает
температура потока и, соответственно, скорость химической реакции, что
приводит к увеличению степешш конверсии и перераспределению продуктов
реакции (рис.48).
При заданной степени конверсии метана (или остаточном
содержании его в конвертированном газе) кавдому расходу сырья
соответствует определенная температура стенки трубы. В нашем примере,если
заданная степень конверсии х =0,63, то для расхода сырья $? =
78,3 нм3/ч величина Т?т = 940°С, для расхода $с = 100 нмэ/ч -
°
0°С
Т?т
?т с
Тст - 950°С. Расход сырья лимитируется температурой стенки
трубы или падением давления в реакционной трубе.
Анализ результатов моделирования показывает, что при
увеличении длины трубы можно увеличить массовую скорость без повышения
температуры стенки. В свою очередь увеличение гег дает
возможность значительно увеличить массовую скорость. Так, повышение
максимальной температуры стенки Г™* с 940 до 950°С позволяет
увеличить расход сырья приблизительно на 30$. Поэтому печь
необходимо проектировать таким образом, чтобы трубы работали на режимах,
близких к предельно допустимым для заданного срока службы.
Оправдано применение более жаростойких и дорогих труб, так как вес их
на единицу расхода сырья сильно снижается.
Трубы малого диаметра работают лучше, так как в них меньший
радиальный градиент температур. Но, например, для аммиачных печей
вместо труб с afa =72 мм и длиной около 10 м более рационально
применять трубы с а-* - 80-90 мм длиной 12-14 м, что дает возмояС-
ность увеличить нагрузку на каздую трубу в 2,0^-2,2 раза, что сде-
'лает печь более компактной и более надеашой в работе.
162
ПРИНЦИПЫ ПРОЕКТИРОВАНИЯ РЕАКЦИОННЫХ ТРУБ И КАМЕР РАДИАЦИИ
Высокая стоимость реакционных труб обусловливает жесткие
требования к их проектированию. Необходимо стремиться к минимальной
стоимости металла на единицу выпускаемой продукции. Стоимость металла
зависит от основных размеров трубы: внутреннего диаметра, длины и
толщины стенки. Эти параметры должны определяться с учетом многих
факторов. Рассмотрим основные из них.
Необходимо добиваться, чтобы разность между температурой
потока на выходе и стенкой трубы была минимальной. Этому
благоприятствуют уменьшение диаметра и увеличение длины трубы. С уменьшением
диаметра увеличивается поверхность нагрева на единицу катализатора
или расхода сырья (при постоянной массовой скорости) и уменьшается
радиальный градиент температур. Но уменьшение объема требует
увеличения числа труб. Наиболее часто применяются в трубы с внутренним '
диаметром 75-115 мм.
Увеличение длины трубы, а следовательно и объема
катализатора, позволяет сократить числе труб и уменьшить температуру
стенки, но сопряжено с трудностями. Потеря давления в трубе не должна
превышать 3-3,5 ат шш 8-12^ от начального давления, но обычно это
не является лимитирующим фактором.
В печах с потолочными горелками в параллельным движением газов
трубы (рабочая часть) обычно не делаются более 10 м из условий
интенсивности теплообмена. В двухъярусной печи длина труб может
достигать 15 м, а в печах с иалучапцими горелками фактор
интенсивности подвода тепла не является лимитирующим.
Серьезным ограничением является термическое удлинение труб,
составляющее около 12 мм на ияяднй метр длины, т.е. 15-метровая
труба удлиняется приблизительно на 180 мм, что делает работу газо-
подводящих я газоотводящих трубок очень напряженной. Исходя из этих
условий, длину 15 и ножно считать предельной.
Толщина отеики трубы рассчитывается из условий длительной проч-
нооти о учетом ползучести материала. В расчетах принимается
прочность материалов после 100 000 ч работн.Например, для сплава НК-40
допуокаемое напряжение на разрыв в зависимости от температуры
таково: •
t, % 900 950 1000 1050
er, кг/ом2 140 100 75 48
163
Запас прочности берется в пределах 4-6 ч. .Расчетное давление
должно быть на 10?! выше, чем рабочее на входе в трубу. Расчетная
температура принимается на 28-30°С выше максимальной температуры.
Пропорционально диаметру трубы возрастает.напряжение в
металле, что требует увеличения толщины стенки. Последнее приводит к
возрастанию термичеокого сопротивления и повышению температуры
наружной поверхности трубы, что требует дальнейшего увеличения
толщины стенки. Это показывает, насколько сложна взаимосвязь
размеров трубы. Практически толщина труб из сплава НК-40 лежит в
пределах 16-25 мм.
Несмотря на то, что основным лимитирующим фактором является
теплопередача через стенку трубы, желательно применять
высокоактивный катализатор конверсии для достижения высокой степени
приближения к равновесию при большой массовой скорости. Это дает
возможность снизить температуру стенки трубы на 10-20°С или увеличить
производительность печи.
Большое влияние на температуру поверхности, и, следовательно,
срок службы трубы оказывают средняя величина и распределение
теплового потока по окружности и длине трубы. Среднее тешюналряжание
труб в современных печах около 50000-55000 ккал/ігч. Но тепловой
поток нужно распределить таким образом, чтобы температура трубы
приближалась к постоянной.
Большое значение имеет равномерность обогрева труб по
окружности. Поэтому в печах конверсии применяются только однорядные
или двухрядные экраны двустороннего облучения. Неравномерность
нагрева зависит также от шага между трубами. Удовлетворительную
равномерность дает однорядный экран с шагом труб S =га^ .
Увеличение шага мезду трубами приводит к увеличению габаритов топки и
3 * 2,5 aM применяется редко. Применяются экраны и с малым
шагом S = І.ЗгІ.5^,.
Если обеспечить равномерный тепловой поток по длине трубы, то
температура стенки будет непрерывно возрастать и труба будет
работать неэффективно. Оптимальной является постоянная температура
стенки трубы. Для этого профиль теплонапрякения должен бить таким,
как это показано на рис.46. Безусловно, в реальных конструкциях
печей такої« профиль выдервать невозможно, но достаточное приближение
к нему осуществимо.
Наиболее четко регулирование теплового потока осуществимо в
печах с излучающими горелками. Например, в печах "Селас"
выдерживается почти постоянная температура стенки по длине,исключая на-
164
участок, где температура ниже. Требуемый тепловой поток
поддергивается зонным регулированием.
Удовлетворительное распределение теплового потока
достигается в прямоточных печах с хорошо сконструированными потолочными
горелками. Создается факел с параметрами, обеспечиващими такую
интенсивность подвода тепла, что температура стенки изменяется
незначительно, т.е. на каядом участке трубы подается почти
оптимальное для ведения процесса количество тепла (см.рис. 46,/).
Необходимые длина и угол раскрытия факела определяются расчетным путем
и затем- уточняются по результатам работы промышленных печей.
В печах с настильным пламенем излучающая стена одним рядом
горелок раскаляется-до высоты 6-8 м. Следовательно, для более
длинных труб печь должна быть двух- или трехъярусной.
КОНСТРУКЦИИ ТРУБЧАТЫХ ПЕЧЕЙ ПАРОВОЙ КОНВЕРСИИ
Трубчатые печи с излучающими стенками топки. В печах этого типа
тепло к реакционным трубам передается излучением от радиационных
горелок.Горелки могут быть чашеобразные,плоскопламенные,панельные,
короткофакельные. При таком способе подвода тепла возможно
осуществить регулирование теплового потока по высоте реакционной трубы.
На рис.49 представлена печь, применяемая в агрегатах синтеза
аммиака и метанола производительностью по природному газу (сырью) .
до 4000 М3/ч. Объемная скорость по исходному газу дс 500-550 ч ,
давление в тдебах 0,2-0,6 МПа.
Печь в плане представляет собой прямоугольник, вдоль большой
оси которого расположены реакционные трубы в один или два ряда.На
рис. 49 показана печь с двухрядным экраном из реакционных труб о
отводом конвертированного газа по внутренним трубкам (см.рио. 39).
Трубы установлены на верхней жесткой опоре. Расстояние горелок
до трубного экрана 600-800 мм.
Печь оборудована системой коллекторов парогазовой омеси и
конвертированного газа с газоподводшцими и газоотводяшиш
трубками,газоходами для отвода дымовых газов и коллекторами отопительного газа.
Тепловое раоширение труб компенсируется свободным опусканием
их вниз. Рабочая Температура стенки 900-980°С. Футеровка печи
выполнена из шамотного кирпича класса А или Б и облицована красным
кирпичей.
Были выпущены печи производительностью от 1500 до 3000 ни/ч
по природному газу о числом реакционных труб от 32 до 64.
165
ш
2570
Рис.49. Печь с панельными горелками и двухрядным экраном из труб
низкого давления:
а - поперечный разрез; а - разрез в плане.
/ - газоподводящая трубка;2 - газоотводящая трубка; 3 -
коллектор парогазовой смеси; 4 - коллектор конвертированного газа;
J - реакционные трубы с внутренним отводом конвертированного
газа: 6 - панельные беспламенные горелки; 7 - подводящие трубки
отопительного газа; в - смотровые окна; 9 - люк-лаз; /о - газоход.
Печь фірми "Селас" обогревается беспламенными чашеобразными
радиационными горелками, расположенными на вертикальных стенках в
шахматном порядке по обеим сторонам центрального двухрядного
экрана. Печи "Селас" получили распространение для производства водорода.
Применение излучающих горелок позволяет точно регулировать
тепловой поток и температуру по высоте труб, т.е. осуществлять
дифференцированный подвод тепла для достижения оптимального режима ра-
166
боты реакционных труо. Благодаря интенсивному теплообмену
излучением, удельная производительность печи достаточно высока и уступа-
пает по этому показателю только многорядным печам.
Трубы могут быть оборудованы встроенными теплообменниками, где
подогревается паро-газо-углекислотная смесь, поступающая на
катализатор (см.рис.39).
Природный газ, пройдя сероочистку с температурой около 200°С,
подается в коллектор ПГС, свда же поступают углекислота и водяной
пар. После смешения ПГС с давлением около 6 ат поступает в межтруб-
ное пространство четырехзаходного змеевикового теплообменника,
расположенного над реакционной зоной, и затем в кольцевой канал трубы,
имеющей размеры 152 х 8 мм, с заполненным катализатором. После
конверсии с температурой 800°С газ поступает во внутреннюю трубу
диаметром 45*3 мм и далее в трубки теплообменника, где
конвертированный газ охлаждается до 340-360°С. Давление газа на выходе из печи
0,11-0,12 МПа. Максимальная температура реакционной трубы
достигает 940°С.
Многорядные прямоточные печи (рис.50). Печи этого тина
устанавливаются на большинстве современных производств аммиака,
метанола и водорода большой мощности. Это обусловлено тем, что в одной
топочной камере можно установить практически любое количество
реакционных труб. Печь состоит из трех блоков: топочной
радиационной камеры, блока использования тепла дымовых газов (камеры
конвекции) и вспомогательного котла.
В топочной камере / установлено 12 параллельных секций,
состоящих из 42 реакционных труб 2 , диаметром 114 х 21 мм или 104х
16 мм (см.рис. 40), нижнего коллектора з и секционной газоотводя-
щей трубы 4 . Высота реакционной трубы II м, а длина обогреваемой
части около 9,3 м. Трубы введены в нижний секционный коллектор о
шагом 230 мм. диаметр коллектора 142 х 19 мм. Он футерован блоками
из жаропрочного бетона. Реакционные трубы подвешены к несущим
балкам на пружинах. Секции труб свободно висят в топочной
камере.Кольцевые зазоры между реакционными трубами и сводом топочной камеры
уплотнены огнеупорными сальниковыми устройствами /I7/.
Парогазовая смеоь, выходящая из конвективной зоны, поступает
в двенадцать коллекторов ^установленных на пружинных опорах,а из
них распределяется между реакционными трубами 2 с помощью газопод-
водшще трубок S . В реакционных трубах протекает процесс
конверсии. Конвертированный, газ собирается в секционные коллекторы 3 и
поднимается по секционным газоотводящим трубам ^ в общий газосбор-
167
18350
OOOO OOOO V
oooooooo
900000000
OOOO OO О О
oo ooooooo
OO О OOO OO
20
ный коллектор 7 , футерованный теплоизолящонкым оетоном и домыцен-
шій в водяную рубашку. По газосборному коллектору конверсированный
газ направляется в шахтный реактор паровоздушной конверсии.
Топочная камера футерована двумя слоями легковесного шамота
оощей толщиной 150 мм. Огнеупорные блоки свода подвешены на
металлических шарнирных крюках. Камера сваблена смотровыми окнами и лю-
камя-лазами ; снаружи она облицована стальным сварным кожухом
толщиной 5 мм. Топка снабжена факельными инжекционными
горелками,расположенными в своде топочной камеры между секциями реакционных труо.
В каждом ряду устанавливается 21 горелка; всего в печи 273 горелки.
Производительность горелки по природному газу - 150 м3/ч.
Коэффициент избытка воздуха поддерживается в пределах ы. =
1,1-1,15.Поступающий на горелки газ имеет температуру около 150°С. При нормальной
работе горелки диаметр образующегося конусоооразного факела не
более I м, длина 1,2-1,5 м в зависимости от состава топливного газа.
Дымовые газы отводятся через газоходы, расположенные меаду
секциями реакционных труб в нижней части печи и при температуре примерно
1030°С поступают в конвективную камеру. В торцевой стене каждого
газохода имеются дополнительные горелки /4.
Распределение температуры дымовых газов, стенки реакционных
труб и парогазовой смеси в слое катализатора (рис.51) показывают,
что прямоточная схеиа движения і'азов благоприятна для работы труб.
Блок использования тепла дымовых газов (камера конвекции)
имеет Д-образную форму. В нем размещены (по ходу дымовых газов)
подогреватель парогазовой смеси, подогреватель паровоздушной
смеси,пароперегреватель, меаду первой и второй ступенями которого
расположены горелки, экономайзер, подогреватель топливного газа. Основные
характеристики конвективных пучков даны в табл.15.
Верхняя часть П-образного блока использования тепла
соединена с газопроводом 13 вспомогательного котла. Производительность
его 60-150 т/ч пара под давлением 10,7 МПа, температура пара - 314°С.
< Рис.50. Многорядная трубчатая печь типа "Келлог":
/ - топочная (радиационная) камера; 2 - реакционная труба; з -
нижний коллектор; 4 - секционная газоотводящая труба; s - газопод-
водящий коллектор; 6 - газоподводящая труба ; 7 - газосборный
коллектор; 8 - сводовая инжекционная горелка; g - система пругзшной
подвески; ю - футеровка; п - газоход; >2 - конвекткшоя
камера; /5 - газоход вспомогательного котла; /^ - дополнительные
горелки; !5 - подогреватель парогазовой смеси; /а - подогреватель
паровоздушной смеси; /7 - первая ступень пароперегревателя; /s -
вторая ступень пароперегревателя; /9 ~ экономайзер; 20 -
подогреватель топливного газа.
160
На установках производства метанола и водорода вспомогательные
котлы не устанавливаются.
Основными преимуществами мно-
гсрядных печей являются их
компактность, высокая
производительность и хоропвя тепловая
экономичность. Крупным недостатком пе-
ти данной конструкции является
невозможность отключения одной или
нескольких реакционных труо при
их аварийном состоянии без
остановки всего агрегата.
Печи террасного противоточ-
зого типа. Печи этого
типа,вперше созданные фирмой "Фостер -
Уиллер", имеют наклонные стенки,
обогреваемые дымовыми газами (рио.
52). Реаквдонные трубы
воспринимают тепло от раскаленных излуча-
вдех стен. Стены топки
расположены ступенчато в два или три яруса.
На горизонтальных террасах распо-
чожены горелки. Факел горелок
направлен вверх под углом к наклон-
t,V
то
ноо
зон
дОО
700
sou
500
о
6
ной огнеупорной стене, которая
іасеяляется до температуры 1000-
1200°С.
Расстояние от oepxa тру5и, м
Рис.51. Распределение
температур реакционной смеси ( / ),
наружной поверхности трубы \г )
и дымовых газов (j ) по выооте
печи типа "Келлог".
Печь состоит из двух секций
а общей конвективной
камерой,расположенной сверху. В каждой секции установлено по 100 реакционных
труб диаметром 136 х 16 мм и длиной 14 м, расположенных в один ряд
с шагом 184 мм. Однорядное расположение труб обеспечивает
удовлетворительную равномерность распределения теплового потока по
окружности трубы. Трубы имеют нижнюю опору и систему подвеоки с
противовесами, воспринимающую до 95 % веса труб.Кольцевые зазоры между
реакционными трубами и сводом, а также между трубами и подом
топочной камеры уплотнены с помощью специальных сальниковых устройотв.
Парогазовая смесь из коллекторов 6, установленных на пружинных
опорах,-равномерно распределяется между реакционными трубами 3. Га-
опроводящие трубки /2 служат одновременно для компенсации
неравного
Таблица 15. Характеристика трудных пучков конвективной зоны ыногорядной печи Келлог
Назначение
трубного
пучка
Число
труб в
пучке
Наружный
диаметр
труб, мы
Марка
стали
Давление
на входе,
ат
Температура. °С
продукта
дымовых газов
вход выход вход выход
Поверхность
тепло-
Подогреватель
парогазовой смеси
Подогреватель
паровоздушной смеси
Пароперегреватель
первая ступень
вторая ступень
Подогреватель
котловой воды
(экономайзер)
Подогреватель
топливного газа
40
24
264
276
200
12
140
140
73
76A02)
102A40)
140A64)
I5XM
15ХЫ
I5XM
15ХЫ
Сталь 2
Сталь 2
39 250
35 220
105 314
112 102
б,б 20
510
482
480
297
150
1070
960
896
420
208
960
896
420
267.6
163,5
938,3
4561,5
208 Ш23
196 361,4
Примечание.В скобках дан диаметр трубы с ребрами для оребренных труб. Длина пучка
труб равна примерно 15,2 м.
Рис.52. Террасная
двухъярусная печь с
излучающими стенами:
/ - горелка; і - из-
лучаищая стена; 3 -
реакционная труба;4-
зона предконвекции;
5 - конвективная,
зона; S - коллектор ПГС;
7 - система подвески
реакционных труб;<9 -
каркас печи; g -
паросборник; 70 -
дымовая труба; п -
дымосос; 12 - газоподзо-
дящая труба; /3-
лестница; ц - площадка
обслуживания; if-
смотровое окно; 76 -
коллектор
конвертированного газа; п - общий
футерованный коллектор;
iff - дополнительная
горелка.
мерности линейных удлинении реакционных труб. Конвертированный газ
по газротводящим трубкам направляется в секционные коллекторы /?,
установленные на пружинных опорах, по которым поступает в
футерованный коллектор (газоход) 7 и по нему - шахтный реактор.
Топочная камера футерована двумя слоями высококачЪотвенного
легковесного огнеупора общей толщиной 250 мм. Свод камеры подвешен
на металлических шарнирных крючках. В камере имеются смотровые окна,
взрывные панели и монтажные люки-лазы. Топка оборудована дифїіузион-
172
Таблица 16. Характеристика трубных пучков конвективное зоны двухъярусной печи
„
трубного
пучка
Число
труб
в
пучке
Наружный
диаметр
труб, мм
стали fia входе,
! МПа
Тмепература. °С
продукта |дымовых газов
вход
выход | вход
1
выход
Поверхность
обмена,
м2
Вторичный
подогреватель парогазовой
смеси (из двух
пучков) 16x2
Подогреватель
технологического
воздуха (из двух
пучков) 8x2
Парогенератор 32
Первичный
подогреватель парогазовой
смеси 16
Подогреватель
природного газа 16
Основной экономайзер 40
Дополнительный
экономайзер 16
Примечание .
труб 14,9 м.
XI8HI2T 3.5
114
114
114
114A40)
114A40)
114A66)
114A66) Сталь 20 0.5
В скобках для оребренных труб д
364
527
1067 950
XI8HI2T
Сталь
Сталь
I5XM
Сталь
20
20
20
3.4
4.1
3.4
3.6
4.0
НО
250
277
ПО
по
500
250
363
380
250
950
865
730
655
600
865
730
655
650
210
ЮОх.
240
216
710
3340
70 ПО 260 295 1440
диаметр трубы с ребрами. Длина пучка
ными горелками 1 с принудительной подачей воздуха, установленными
на террасах вдоль основания каждого яруса. Пламя настилается на
наклонные боковые стенки печи. Большая часть тепла F0-70$)
передается реакционным трупам радиацией от раскаленных до 1000-1200°С стен.
Дымовые газы поднимаются вверх и при температуре 1000-1070°С
поступают в конвективную зону, отдельную для каждой камеры (зона пред-
конвекции). Затем дымовые газы из двух камер направляются в общую
конвективную камеру, в нижней части которой установлено десять
дополнительных горелок /а . Характеристика трудных пучков дана в табл.
16. Пройдя трудные пучки конвективной камеры, дымовые газы
дымососом п направляются в дымовую трубу /о и выбрасываются в атмосферу
при температуре 160°С. Для обеспечения большей надежности работы
дымососы печи имеют разные приводы - электродвигатель и паровую
турбину. Дымососы создают разряжение в 8-Ю мм у свода печи и 3-5 мм
у пода /17/.
На агрегатах синтеза аммиака мощностью 600 т/сутки
устанавливаются два печных олова, имеющих по 200 реакционных труб каждый.
К преимуществам таких печей относится простота конструкции и
обвязки, но однорядное размещение труб в радиантной камере ограничивает
их мощность.
Рис.53, ^определение
температур реакционной смеси (/ ),
наружной поверхности стенки
трубы (?) и излучающей стены 13)
по высоте террасной печи.
Расстояние m
Экспериментальные исследования работы печи дали распределение
температур дымовых газов, стенки и реакционной омеси,
представленное на-рис. 53.
174
ТЕПЛОВОЙ РАСЧЕТ ТРУБЧАТОЙ ПЕЧИ
Труочатые печа конверсни углеводородов являются аппаратами,
элементы которых работают в жестких температурных условиях при высоких
механических нагрузках. Поэтому расчет печи должен проводиться с
высокой точностью. Это позволяет сделать разработанный в последние годы
зональный метод расчета топок. Тепловой расчет печи состоит из
расчетов: I) процесса горения топлива; 2) теплообмена в радиантной
камере; 3) теплообмена в конвективных зонах; 4) общего теплового
баланса и коэффициента полезного действия печи. В этом разделе оудут
кратко рассмотрены методы и алгоритмы расчетов на ЭВМ.
Расчет процесса горения. В печах конверсии применяется iqjioko
газообразное топливо, поэтому для расчета должны быть известны его
состав Nl , а также коэффициент избытка <* и температура псдавао-
мого в горелки воздуха тм.
Основные расочитываемые величины:
низшая теплотворная способность топлива
теоретический расход сухого воздуха
LT 'LMi^i /й3 /м8 топлива (или кг/кг топлива)/;
действительный расход влажного воздуха
(где big - количество водявого пара в воздухе);
объемы продуктов сгорания на I км3 топлива
va *
v
вес продуктов сгорания
калориметрическая температура сгорания;
где / - энтальпия исходных продуктов (топливного газа и
воздуха).
175
Расчет радиавтной камеры. Суммарная теплопередача в
топке,температура газов на выходе из топочной камеры, расход топлива и
среднее теплонапряжение реакционных труб могут быть определены
методами Н.И.Белоконя, Ц.А.Бахшияна или критериальным методом /79/.
Расчет суммарного теплообмена основан на определении
радиационного и конвективного теплообмена между топочной средой (или
излучающими стенами) и тепловосприниыапцими поверхностями.
Применительно к печам конверсии этот метод имеет существенный
недостаток, заключавшийся в том, что он не дает возможности
получить с достаточной степенью точности продли теплонапряжения и
температуры поверхности трубы, что очень важно для высокотемпературных
процессов.
Этих недостатков лишен зональный метод расчета теплообмена в
топочной камере. Сущность зонального метода заключается в том, что
внутреннее пространство топки разбивается на конечное число
объемных и поверхностных зон, каждая из которых считается оптически и
термически однородной (ячеичная модель). Зональный метод позволяет
получить детальную картину распределения тепловых потоков и
температурное поле в топке.
В модификации метода, разработанного В.М.Седелкиныы,для
каждой зоны с номером / , записывается уравнение теплового баланса в
алгебраической форме /79.8Q7.
VV'v'V« F.30)
где Qp, at, QT - соответственно результирующие радиационный,
конвективный и турбулентный переносы тепла; $п - источники
(стока) тепла в зоне. Аналогичные уравнения записываются для всех #
зон; Qp - разность поглощенной (ff/ier) и собственной
радиационной (g , ) составляющих
. . С fy'*~J -*«*/• F-31)
**rj*?,v*'*O- F'32)
где ці* - приведенный разрешающий угловой коэффициент,
определяющий долю энергии собственного излучения зоны /' , поглощаемую
зоной j , о учетом многократных отражений поверхностными и
поглощений объемными зонами.
Собственное излучение объемной зоны
*<*і=4**'Лг/' F-33)
а поверхностной зоны
<U-^4f^ ¦ F-34)
[76
где +* ~ интегральный коэффициент собственного излучения
объемной зоны і , м, F6 и vt¦ - поверхность и объем излучающей зоны
і ; /с - степень черноты зоны; Т - аффективная температура
излучения зоны.
Результирующий перенос тепла конвекцией определяется для
объемных зон
// - F.35)
и для объемной и поверхностной зон
vi/vV''^-' F.36)
где ymi. и д^ t-, ¦* средняя массовая скорость газов на
поверхностях раздела г-у и j-j' ; <*i . - коэффициент теплообмена меа-
ду зонами j и /, m, п, і - число объемных зон соответственно, из
которых масса вносится в зону J , в которые масса выносится из
зоны j , соприкасающихся в поверхностной зоной j .
Результирующий перенос тепла турбулентной диффузией мевду
зонами прямого и обратного тока
где /. и i.j/ - средние по поверхности раздела зон; г у ъ/-/' -
коэффициенты турбулентного переноса.
Источниками (стоками) тепла являются химическое
тепловыделение ( Q'fUM ); физическое тепло, вносимое в печь топливом и
воздухом ( Q ), потери тепла через кладку печи ( <3ХЛ ) и передача
тепла через теплообменные поверхности, т.е. стенки змеевиков и трус
( Sпол ) (полезное тепло)
% = e + e * SKAj * enoAj - Kj вв„ ' в.; tt Cpm. t
j/9s/e8«' F.38)
где К - коэффициент теплоотдачи от наружной поверхности трубы к
потоку продукта; о - потери на излучение; *.- - доля топлива,
сгоревшая в j -зоне.
Выражения для Q ^у,^ ¦ и Qn- подставляем в уравнение
F.30) и получаем систему нелинейных алгебраических уравнений
зонального теплообмена в камере. Уравнения для зон: факельных
потухших продуктов сгорания, поверхности нагрева и поверхности кладки
несколько отличаются друг от друга. Путем объединения уравнений
для всех зон и введения л -символов Кронекера получаем слудующув
универсальную расчетную систему уравнений /79, 8Q7:
177
тав Sy Sj j - символы Кронекера
f fi-У' /"У' f/s - *i> f2-- ' Л
v vv ¦'¦
ЕДесь P, k,D - коэффициенты радиационного обмена, конвектквного и
туроулентного переносов меаду зонами.
В уравнениях F.39) первый член выражает результирующий
перенос тепла радиацией, второй - конвекцией и перемешиванием, третий -
химическое тепловыделение и результирующий перенос тепла через
поверхности.
Расчет теплообмена в топке можно разбить на два крупных этапа:
I) вычисление обобщенных угловых коэффициентов излучения медцу
зонами, коэффициентов теплопередачи через стенки труб и кладку печей,
коэффициентов теплоотдачи соприкосновением меаду зонами,
тепловыделение по длине факела и другие величины; 2) решение системы
уравнений теплового баланса зон и нахождение распределения температур и
тепловых потоков в радиационной камере.
Сложным и трудоемким этапом расчета является определение
обобщенных угловых коэффициентов. Для расчета их разработаны
специальные алгоритмы, основанные на методе Монте - Карло (методе
статистических испытаний) /79, 8Q/.
Топочная камера разбивается на зоны, исходя из следующих
соображений. Все зоны подразделяются на объемные и поверхностные.
Объем топки делится на две части: прямой ток, в котором газы
имеют преимущественное направление движения от горел_чЕ к выходу из
топки, и обратный ток, в котором газы перемещаются в
противоположном направлении. В качестве объемной зоны выделяется часть прямого
или часть обратного тока, кроме того,в отдельные зоны выделяются
объемы, в которых происходит горение топлива (факельные
зоны).Геометрия печей конверсии довольно простая, но для точного
определения теплонапряжения и температуры отдельных участков поверхности
рекомендугтся разбивать радиационную камеру на 30-60 зон.
При расчете собственного излучения объемных зон различают
зоны, занятые светящимся факелом, зоны несветящегося факела и зоны,
заполненные смесью потухших продуктов сгорания. Расчет может про-
178
изводиться по "серой" модели, предполагающей равенство нзлучатвль-
ной г- ж поглощательной А, способностей зоны, и по "несерой"
модели, учитывающей неравенство ?¦ ж Aj .
При расчете обмена между зонами прямого и обратного тока
учитывается турбулентный перенос тепла. Длина газового факела
рассчитывается в зависимости от типа газогорелочного устройства и затем
определяется интегральный химический необжог по длине факела /79/.
Для решения системы уравнений зональных тепловых балансов
F.39) необходимо привести ее к рабочему виду. В качестве искомых
переменных вводятся величины #i - т^гооо. Лучистые и конвективные
тепловые потоки от зон с заданными температурами должны быть
подсчитаны и отнесены к свободному члену. Коэффициенты перед
неизвестными в четвертой и первой степенях выражаются следующим образом:
После преобразований система E.39) принимает, вид
І A./tZ B^ -I Bjrf + *, '-*¦ F.40)
Модифицированный свободный член D- представляет собой
выражение м s
»273 + ?j]?O*'.
Отбрасывая уравнения тепловых балансов для зон с заданными
температурами, получаем систему 5-уравнений с S -неизвестными.
Для ее решения использован метод покоординатной релаксации.
Результатом решения системы являются значения осредненных по
зонам температур. Тепловые потоки к поверхностям нагрева находятся
путем подстановки найденных значении температур в уравнения
зонального теплообмена для зон поверхности нагрева /?9/.
По температуре газа на выходе из радиантной камеры
определяется расход топлива
-, пол г у -,
*~6 (Г t ь С1 t 1 /"А7< F*41 >
где ^вдх ~ температура дымовых газов на выходе из радиантной
камеры; с и С„т - теплоемкости продуктов сгорания при ?тл
и t/ш, Ь - 0,99-0,97 - коэффициент полезного действия
радиантной камеры.
Еолезное тедло LQno/t )• т.е. тепло, переданное через
поверхности нагрева, берется из расчета реакционных труб. В некоторых
179
печах в конвективной зоне сжигается дополнительное количество
топлива для регулирования температуры перегрева пара, это учитывается
при расчете соответствующих зон печи.
Расчет конвективной зоны печи. Б конвективной зоне печи
конверсии размещаются змеевики для нагрева парогазовой смеси,
технологического воздуха, питательной вода, топлива, перегрева пара и др.
Бее они омываются дымовыми газами, выходящими из камеры сгорания и
пол/ .ешшми от вспомогательных горелок. Васчег нагревателей
производится последовательно по ходу дымовых гааов.
Но назначению расчеты подразделяются на проектные и
поверочные. При проектных расчетах основной задачей является определение
поверхности нагрева, при поверочных - тепловой мощности
существующей (запроектированной) поверхности и температур нагрева потоков и
уходящих дымовых газов.
Для расчета конвективной зоны применяют два основных
уравнения:
теплового баланса
#к " 3*фсг*Р>* (іп* -*<»)-в--*' F.42)
и теплопередачи
aKz:Kritep' Fl43)
где Sк - тепло, переданное в конвективной зоне; t,,f , t/W -
конечная и начальная температура нагреваемого лотоіса.
Расчет ведется на основе средних показателей: среднелогариф-
мического температурного напора itcp и среднего коэффициента
теплопередачи к (отнесенного к единице внутренней поверхности)
ГТ ' F'44)
*,*„ *2 2Л *3
где t*i ж <*2 - коэффициенты теплоотдачи от .дымовых газов к тру-
оам и от труо к нагреваемой среде; А ж J^ - коэффициент
теплопроводности металла (стенки труоы) и загрязнений.
Этот так называемый интегральный подход дает хорошие
результаты при теплообмене потоков со слаоо меняющимися
характеристиками. В частности он вполне приемлем для расчета конвективных зон
печей конверсии.
Боле'., точные результати дает решение системы интегро-дифферен-
циальнкх уразнеїшй, описывающих теплооомен и гидродинамику потоков
/79, ai/. Этими уравнения-ми могут оыть описаіш люо'ие слоїмнє
случаи теплообмена. Процессы, протекающие в конвективной секции,
описываются моделью идеального вытеснения. Такой подход позволяет оп-
180
ределить локальные характеристики процесса в каждой точке
нагревателя.
Исключая испарительные змеевики, устанавливаемые в некоторых
печах, потоки в конвективной зоне печи конверсии являются
однофазными без химических превращений. В этом случае при поперечном омы-
вании пучков труб, если считать, что коэффициенты теплоотдачи <*г
и d2 ,а также тешгофизичеокив свойства потоков постоянны в одном
ряду, то система уравнений, описивающих процессы в зоне конвекции
Имеет иид
dT KXdg„ 2t *f
l -as' F-45)
. F.46)
dT
dTr
Начальные
при 1=0
при
Т и
S-- 0
'2'KL
условия
Г =
гЛ. 2К
т
'О'
температура продукта г
где т и тг - температура продукта и дымовых газов; ? ^
массовая скорость продукта и дымовых газов; і - длина труб,
рассматриваемого ряда; I - расстояние вдоль продукта; 3 - расстояние
вдоль движения дымого газа.
Решение системы имеет вид
F.47)
F.48)
Где твР =т1 Tdl и Trcp '-a^rl '"" TrdS ~ °Реяние темпе-
ратуры продукта и дымовых газов. Для определения т и гг в
литературе /79, &Х/ даны аналитические выражения.
Падение давления в трубах определяется из уравнения
L )
¦ dl * ( daff + L ) 2fp ' <6-49)
Интегрирование его для идеального газа и несжимаемой жидкости
проводится независимо от уравнений F.45) и F.46).
Коэффициенты теплоотдачи с*7 и <*п находятся известными
методами, изложенными в курсах теплопередачи.
Общий тепловой баланс и коэффициент полезного действия печи.
Для печи конверсии общий тепловой баланс можно записать" в
следующем виде:
181
3% ' '% 'Ч ) - ар * Z Q<^ * *,А * ^ ' % - F.50)
іде Qp г- низшая теплопроводная способность тошшьа;^^, , л/т ~
разность энтальпий воздуха и топлива между температурами входа в
топку и наружного воздуха (на I кг топлива); #, - тепло,
переданное в радиальной камере; Z<2 , - суммарное тепло, переданное
всем конвективным змеевикам; u„x - потери с уходящими газами; <9„еа
потерн из-за недожога; Q - потери на излучение.
Правая часть уравнеїшя (?.50) - располагаемое количество
тепла ( GpuM ). Самыми существенными являются потери с уходящими ды-
14ЭВЫМИ гааами, которые определяются как
%х 'sup ~Іке)=**»/>'г!ул~лулігс/т */ F.51)
где А и J'xg - ааталыпш уходящих продуктов сгораниа и наруяЕо-
го холодного воздуха. Коэффициент изоытка воздуха <* уХ берется на
виходе из печи после всех поверхностей нагрева. Температуру воздуха
tg иогно пркмепять равной нулю, тогда вто^юй член справа в
уравнении F.51) пропадает. Обычно t„x - 160-280°С и зависит от
конкретных условий.
Потери тепла от неполноты сгорания &^а незначительны а их
»toXHG не учитывать.
В современных печах на излучение от нагретых стен теряется от
3 до 5% внесенного в печь тепла,
J3. F<52)
Коэффишент полезного действия печи есть отношение полезно
использованного тепла к внесенному в печь
•3)
Используя понятие относительных количеств тепла (по отношению
к внесенному) .
можно записать
q 4W ші F.55)
Коэффициент полезного действия печи будет находиться как
t^'-^gJt^MSa^UJA^ F.56)
В -современных печах конверсии ?д составляет величину O.SOf-
'+0,90.
182
МОДЕЛИРОВАНИЕ ПЕЧІЇ КОНВЕРСИИ
Трубчатые печи для процессов конверсии углеродов - это сложные аг—
регаты, в которых протекает ряд взаимосвязанных физико-химических
процессов; химические превращения в реакционных трубах; горение
топлива, передача тепла излучением и конвекцией к трубам; нагрев
парогазовой смеси и других потоков в конвективной зоне печи.
Поскольку эти процессы взаимосвязаны, создание математических моделе;
пригодных для использования при оптимальном проектировании агрега—
та, - достаточно сложная задача.
Наиболее рационален следующий принцип построения
математической модели: моделируются отдельные процессы или элементы агрегата.
1
Г/
Блок А
Моделирование
реакционной
трибы
Химическая
кинетики
Козффициен
ш переноса
проиесс
на зерне
катализатора
"^
Исходные данные
Г
t
Расчет
процесса
горения
і
Блок С
Моделирование
радиационной
камеры
і
Результаты моделирования
fi,7ff/f В
Расчет
конвективной
зоны печи
\
Влок Е
Расчет
азроШнами-
' ческою
тракта печи
]
Рис.54. Блок-схема моделирования печи
конверсии.
а исходными данными для их расчета являются результаты моделирова—
ния других процессов и элементов, то есть модель состоит яз отдалі,
ных достаточно жестко связанных мевду собой блоков (расчетных
модулей) (рис.54) /827. Преимуществом такого метода моделирования являг
ется то, что модель состоит из относительно простых блоков и при
изменении модели или метода расчета одного из элементов печи
заменяется один блок без нарушения модели в целом. Модели отдельных
элементов печи были представлены выше. Рассмотрим объединение их в
общую модель.
183
Вначале моделируется реакционная труба (йлок А). Для
организации счета задается температура сырья на входе t? и стенки трубы
tст , которая s первом цикле расчета принимается постоянной по
всей длине трубы.
При позонном ыетоде расчета радиационной камеры определяется
тепловой поток q к отдельным участкам реакционных труб. Используя
температуру потока, определяемую в блоке А, находим температуру
наружной поверхности стенки на каждом участке реакционной трубы
где
- коэффициент теплоотдачи от "наружной поверхности трубы к потоку.
Значения t^. м передаются в блок А и снова производится
расчет реакционной трубы уже при переменной температуре стенки tcr„ =
= j(i). При новом значении t?T н в каадой поверхностной зоне
реакционной трубы производится новый цикл расчета радиационной
камеры. Процесс повторяется до тех пор, пока тепловые потоки и
температура стенки трубы, определенные в предыдущем и последующем
расчетах, не совпадут с заданной степенью точности /83, 84/.
Основными величинами, определяемыми в блоке С , являются
расход топлива и температура газов на выходе из радиационной секции.
Результаты расчета передаются в блок D для расчета конвективной
зоны печи, где первым по ходу дымовых газов находится змеевик
подогрева парогазовой смеси (ПГС). В результате определяются
температура ПГС на входе в реакционные трубы и температура дымовых
газов после рассчитываемого трубного пучка. Если tg не совпадает
с t' при которой первоначально производился расчет реакционных
труб, то в блок А вводится полученное значение t? и начинается
новый цикл расчета до совпадения температур fy x. tj с
заданной степенью точности. Таким образом, увязываются материальные и
тепловые балансы всех потоков.
Полученная в результате расчета степень конверсии метана х-^
или температура ПГС на выходе tK не будут соответствовать
заданным. Чтобы добиться заданных tK или t/ci необходимо
увеличивать илк уменьшать получешшй расход топлива в . Расход топлива
подбирается таким, чтобы обеспечить заданное значение хк
или tK.
184 '
После этого производится расчет следующих змеевиков:
подогрева технологического воздуха, пара, питательной воды, топлива и
затеи аэродинамического тракта печи (блок Е) и коэффициент полезного
действия печи.
Пример моделирования печи. В качестве примера приводны
результаты моделирования печи паровой конверсии (первичного реформинга)
природного газа ПИР-І360 для агрегата синтеза аммиака
производительностью 450 тыс. т/год. Номинальный расход сырья составляет
37000 нмэ/ч, отношение пар:сырье - 3,7:1 по объему. Высота слоя
катализатора в трубах принята равной 9,3 м. В радиантной камере іієчь
размещено 504 трубы диаметром 114/72 мм.
При изменении нагрузки, давления и заданной степени конверсии
параметры процесса довольно резко меняются. Ниже представлены
основные характеристики работы печи при различных нагрузках по сырью
при степени конверсии метана х = 0,67; давлении на входе Р =40 ai
и объемном отношении пар:сырье = 3,7:1:
Нагрузка печи по сырью, нм /ч 25000
Расход пара, т/ч ч 75
Расход топливного газа ( QH =7238),нм°/ч 18300
Тепловая мощность печи, млн. Вт 160
Тепловая нагрузка радиантной камеры,тыс.кВт 74,4
Температура дымовых газов на перевале, "С 980
исход ПК! через одну реакционную трубу,
кг/ч 186,1
Температура ПГС на входе в реакционные
трубы, °С 444
Температура конвертированного газа на
выходе иэ труб, С 830
ііремя контакта, с .2,84
Тепператруа стенки трубы на длине 8 м, С 880
Средняя теплонапряженность наружной
поверхности реакционных труб, кВт/м5 '
Коэффициент теплоотдачи от стенки
реакционной трубы к потоку raya, Вт/м2- град
Потеря давления в змеевике, Mua o С,14
Температура уходящих дымовых газов, С 248
Коэффициент полезного действия печи 0,836
37000
НО
28200
245
107,0
1044
273,5
475
839
1,87
e7
46000
138
36900
320
131,4
1088
J42.4
500
647
1,45
43,03
756
71,69 /5,59
1063
0,30
298
0,812
1284
0.46
340
0,79о
Как видно из представленных данных, повышение натрузки по
сырью влечет за собой рост температуры конвертированного газа,так
как необходимо увеличить скорость реакции и сохранить заданную сть
пень конверсии метана. Соответственно повышается и температура
стенки трубы, несмотря на увеличение коэффициента теплоотдачи. С ростом
нагрузки температура уходящих дымовых газов повышается и тепловая
экономичность агрегата падает.
Очень сильно меняются параметры процесса при изменении
степени конверсии метана. Если степень конверсии увеличить с 67 до 75%,
185
та при номинальной нагрузке температура потока долина возрасти до
875°С, а стенки трубы - до 972°С. Изменение давления на входе и
отношение пар:сырье влияют на параметры процесса в значительно
меньшей степени.
Моделирование трубчатой печи на ЭВМ дает возможность построить
ее рабочие характеристики и определить диапазон безопасной работы.
Расчеты на ЭВМ значительно сокращают время и улучшают качество
проектирования печей /82, 83, 8^7.
ЭКСПЛУАТАЦИЯ АГЕЕГАТОВ КОНВЕРСИИ
Пуск агрегата. Перед пуском агрегата производятся сушка футеровки
печи и шахтного реактора и загрузка в них катализатора. Загрузка
катализатора в трубы осуществляется с помощью специальных
приспособлений для предохранения его ст механических разрушений.
Гидравлическое сопротивление каждой трубы не должно откланяться более
чем на 10$ от среднего значения для всех труб /I6, 17/.
После заполнения пароводяной системы химически очищенной водой
или конденсатом производится разогрев печи. При достижении
температуры дымовых газов на перевале до 250-300°С в реакционные трубы и
подогреватель ПГС начинают подавать воздух или азот.
Когда температура газа на выходе из шахтного реактора
достигнет 150°С, через подогреватель ПГС начинают подавать пар,
постепенно увеличивая его расход. Разогрев реакционных труб ведут со
скоростью 30-50° в час.
После разогрева печи постепенно увеличивают расход пара,
прекращают подачу воздуха (азота) и начинают постепенно подавать
природный газ с азотоводородной смесью в подогреватель и на сероочист
ку; после адсорбера газ сбрасывают на свечу. После достижения
удовлетворительного качества сероочистки газ начинают подавать в
паровой поток, идущий через трубы печи; на выходе из реакционных труб
температура должна быть около 650°С. Постепенно температуру ПГС
доводят до максимальной рабочей температуры и даже несколько выше,
При этой температуре (800-850°С) делают выдержку в течение 36-48 ч
для снятия температурных напряжений, и затем снижают температуру
до рабочей.
Восстановление скисных никелевых катализаторов производится
природным газом с добавкой ABG. Содержание водорода не должно
превышать 2-3%. Процесс идет при температуре 700-750°С. По мере
восстановления никеля начинается конверсия метана, которая приводит к
166
увеличении восстановителей в смеси. Это ускоряет процесс
восстановления, начинающийся в нижню, слоях катализатора и по мере повышения
температуры поднимающийся вверх по слою. Восстановление
катализатора до степени, обеспечивающей нормальное ведение конверсии,
заканчивается за 15-20 мин. Однако полное восстановление и стабилизация
физико-химических свойств катализатора происходят в течение сотен
(асов.
После восстановления катализаторов и увеличения нагрузки по
природному газу начинают плавный подъем давления до рабочего со
скоростью 0,3-0,4 МПа/ч. Когда температура газа на входе в шахтный ре -
;іктор достигнет 650 С, пускают турбокомпрессор воздуха и поднимают
давление его до рабочего. При получении конвертированного газа за-
цанного состава его направляют в агрегат синтеза аммиака.
.Особенности эксплуатации печей. При нормальной эксплуатации,
когда колебания состава сырья и параметров процесса лежат в
пределах нормы, механически прочный катализатор конверсии может
работать несколько лет без ухудшения его свойств. Но при ухудшении
процесса сероочистки происходит частичное отравление
катализатора,особенно в верхней части реакционных труб. Частично отравленный
катализатор восстанавливается при ликвидации проскока серы. При
сильном отравлении катализатор начинает зауглероживаться вследствие
полной дезактивации и затем разрушаться. Зауглероживание может быть
также следствием повышения концентрации непредельных углеводородов
в сырье и при снижении отношения пар:газ ниже допустимого.
Катализатор может разрушиться вследствие теплового удара,т.е.
резкого изменения температуры, что обычно наблюдается при
попадании парового конденсата на поверхность раскаленного катализатора.
Сопротивление тепловому удару различно у разных катализаторов и за-
вксит от их состава, способа приготовления, размера гранул, их
пористости и т.д.
При резком падении давления ПГС возникает большой перепад
давлений между свободным объемом и порами катализатора. Разность
давлений приводит к разрыву и растрескиванию гранул, и катализатор
может превратиться в порошок.
Отрицательно сказываются на работу агрегата частые остановки
к пуски. При разогреве трубы ее диаметр увеличивается на несколько
десятых долей миллиметра. Но при остывании такое уменьшение
диаметра сжимает катализатор, высота которого за время работы несколько
уменьшается. Сжатие катализатора во время остановок постепенно
приводит к его разрушению.
187
ВО время padOTH ПРОИСХОДИТ Непрерывное Изменение фИЗИЧвСКИХ
и химических свойств катализатора даже при стационарном режиме его
работы. Происходят фазовые превращения в катализаторе,например бн?
частично переходит в Cafort)^, изменяется состав некоторых цементов.
В незначительной степени, но все-таки имеет место унос
никеля,двуокиси кремния и некоторых других компонентов.
Таким образом, срок действия катализаторов конверсии даже
теоретически ограничен, но может быть достаточно длительным и
достигать десяти лет.
Наиболее слабыми местами в трубчатых печах являются
реакционные трубы, разрыв которых происходит главным образом из-за местных
перегревов. Довольно часто наблвдаются разрушения газоподводящих и
особенно газоотводящих трубок и коллекторов конвертированного газа
вследствие ползучести металла труб и нарушения термоизоляции. Если
разрывы реакционных труб не приводят к тяжелым последствиям,то
разрывы газоотводящих и коллекторных труб сопровождаются опасными
покарами и даже могут привести к взрывам.
Вышедшая из строя труба, если позволяет конструкция печи,
отключается и оставляется в печи до капитального ремонта. Отключение
нескольких труб практически не сказывается на работе всего агрегата.
По данным /85/, 53$ всех остановок вызывается появлением
свищей, трещин и разрывов в реакционных трубах. Из 32 обследованных
установк /697 У І4/С печей разрыв труб наблюдался после двух лет
работы, у 56JE - после пяти лет,ж у 78>{ - после шести и более лет.
Значительное количество аварии происходит вследствие разрыва
компенсаторов и коллекторов конвертированного газа.
Современные крупные производства оборудованы управляющими
вычислительными машинами, работающими в настоящее время главным
образом в режиме советчиков.
Это дает возможность обслуживающему персоналу оперативно
находить оптимальные режимы работы агрегата конверсии как с точки
зрения минимума эксплуатационных затрат, так и максимальной
продолжительности безаварийной работы.
Глава
КОНВЕРСИЯ И МЕТАНИРОВАЕИЕ ОКИСІШ УГЛЕРОДА
В газах каталитической конверсии углеводородов содержится в
зависимости от параметров процесса и сырья 6-25% окиси углерода. В
производствах, где окись углерода не требуется, производится ее
конверсия в СО„ водяным паром. При этом получается дополнительное
количество водорода, эквивалентное содержанию в газе со . Различают
среднетемпературную t350-450°C) и низкотемпературную A80-250°С)
конверсию. В первом случае остаточное содержание со составляет
несколько процентов, а во втором - доли процента.
После абсорбции двуокиси углерода оставшиеся в газе <¦'& и ля,
удаляются гидрированием их на катализаторе при температуре 250-
450°С. В этом диапазоне температур равновесие сдвинуто в сторону
образования метана, и достигается очень глубокая очистка от
кислородсодержащих соединений.
ТЕРМОДИНАМИКА, МЕХАНИЗМ И КИНЕТИКА РЕАКЦИИ ОКИСИ УГЛЕРОДА
С ВОДЯНЫМ ПАРОМ
Каталитическая конверсия окиси углерода водяным паром проводится
на окисних катализаторах, которые не ускоряют реакции конверсии и
гидрирования углеводородов, а также гидрирования со и Щ до
метана. Таким образом, протекает только одна реакция
СО+Щ =^= СОг + *2 + 41,2 кДж/моль. G.1)
Константа равновесия реакции (табл.17)
рсо2 рм2 ссо2 ?м2
ЪАУсо%о
определяется как функция температуры по уравнению A.34) или по
уравнению /63/
Обычно известны состав оухого газа, поступающего на конверсию
СО, и содержание водяных паров в газе. Вводим следующие обозначения
начальных концентраций компонентов: а-СО, і -/?, c-Cfy, d-#t-,
R - объемное отношение пар : газ. Равновесные концентрации соответ-
189
Таблица 17. Константы равновесия реакций
гидрирования со и со,
t.'с
200
220
240
260
280
300
320
340
360
380
400
420
440
460
480
500
520
540
560
580
600
отвенно будут .
СО - и.
2,1547 -I010
2,3473 -I010
3,0353 Ю9
4,5626 Ю8
7,8369-Ю7
1,5161-Ю7
3,2635-Ю6
7,7355 Ю5
2,0004 Ю5
5,6011-104
1,6862-Ю4
5,4247 I03
I.8550-I03
6,7099-IO2
2,5564 I02
1,0219 -I02
4.27ПМ01
I.8605I01
8,4234
3,9532
1,9186
9,4748 -I08
?р.
d„
1,5588 Ю8
2,9435-Ю7
6,2607-Ю6
I.4863-I06
3,8747-Ю5
І.І00І-І05
3,3737 Ю4
j.,1094-104
3,8882-Ю3
1,4442-Ю3
5,6582 -Ю2
2,3282-I02
1,0023 -I02
4,4995-I01
2,0997-10
1,0157-10
5,0814
2,6225
1,3936
0,7610
равновесная степень превращения
При достижении равновесия системы концентрации компонентов во
влажном газе определяются из следующих соотношений:
а -аи
окись углерода
водород
двуокись углерода
азот
водяной пар
G.3)
вид /7/
С учетом пршитых обозначений уравнение равновесия принимает
/ )
ay) (с + ai/)
G.4)
Решив уравнение относительно у , по соотношениям G.3)
определяем концентрации компонентов равновесной смеси.
С понижением температуры равновесие реакции G.1) смещается
вправо, и, следовательно, необходимо стремиться к осуществлении
процесса конверсии со при пониженных температурах. Степень конверсии
резко возрастает с увеличением отношения пар : газ (рис.55).
Оптимальное отношение R в промышленных условиях лежит в пределах 0,55-
1,2, что соответствует 1,5-3-кратному избытку пара по сравнении ее
стехиометрическим количеством.
70
2,5 R
Рис.55. Зависимость равновесной степени
превращения окиси углерода у от
объемного отношения пар : газ при начальном со- .
ставе газа:
а - 0,2, 6 = 0,52, с = 0,07 (см.текст;
стр. 191); п
/ - 200; 2 - 300; 3 - 400; і - 500°С.
Реакция конверсии СО является экзотермической, и процесс в
адиабатическом реакторе сопровождается повышением температуры,
которое может быть определено из выражения
, Af/ay
(frK)C i ' G.5)
prn
где aH - тепловой эффект реакции; р = 0,87-0,98 - коэффициент,
учитывающий потери тепла через наружную поверхность реактора. Как
видно из формулы, лі уменьшается с увеличением разбавления
газовой смеси паром.
Тепловой эффект реакции несколько изменяется в зависимости от
температуры. Эта зазискгдость аппроксимируется уравнением
191
/= (9420 * і, /Є T - д, 3/4 -ГО~ Г2 * ft /7- /u ~
Величина аМ с повышением температуры снижается; с ра-
тет, следовательно &t уыеньшается.
Каталитическая конверсия окиси углерода водяным паром
проводится на ояисных катализаторах, которые не ускоряют реакции
конверсии и гидрирования углеводородов, а также метанирования ее и cug
Шким образом, при конверсии СО паром протекает только одна
реакция.
Механизм и кинетика реакции изучались многими
исследователями. В работе /§6/ представлен следующий механизм:
H20 + Cz) = ft} + (O)
CO + @) = C02 + Cz)
CO +ff„O -C0„ / Л,
G.7!
где {u ) - атом кислорода на поверхности окисла; {г ) - вакантное
место на поверхности, возникающее при удалении атома
кислорода.Согласно схеме G.7), реакция протекает путем попеременного
окисления и восстановления частично восстановленной поверхности окисла
(без возникновения новой фазы).
Катализатор может также ускорять
окислительно-восстановительные реакции, если абсорбированные на поверхности вещества
реагируют между собой. В этих представлениях механизм конверсии л? опи-
иется следувщей реакцией /IOj:
a) cu + z^= со,
G.8)
і) НгО + z ~±
c) zCO +гН2О ^=
d) zCO}^z г f. Сі
Є) 7*2^ z+#r J
00а приведенные выше механизма реакции приводят к похожим
кинетическим уравнениям. Согласно схеме G.8), получено кинетическое
уравнение ДО/:
атом лимитирующей является стадия с G.С).
Используя окислительно-восстановительный механизм (схема G.7),
получено кинетическое уравнение /86/
где А - константа скорости реакции ат -с ; а -
константа,зависящая от температуры, л» Ао ехр(-?л /хт), ?^ =36,8 кДж/моль.
Для окисного железо-хромового катализатора ( 93? ^2^3
+'?%?%(?) энергия активации составляет s = 142,8 кДж/моль. На
катализаторе с удельной поверхностью 20,8 tr/r (гранулы 0,5-1,0 ни)
получена следующие значения констант
t.'c к.іь А
390 0,17 0,265
420 0,50 0,354
450 1,10 0,464
В работе [21] установлено, что на высокотемпературном железо-
хром-магниевом катализаторе скорость реакции описывается уравнением
* РИг ' G. Il)
где Pegu) - равновесное парциальное давление СЛ
Температурная зависимость константы скорости для этого урав-
НЄШМ
_
К-19І-»5* *Т ?ат**.С-']. (?Л2)
Для железо-хромового катализатора получено уравнение /26/
скорости реакции:
"кРіїР
где М(х) - фактор, учитывающий скорооть ооратной реакции,
зависящей от степени конверсии
Порядок реакции по СО близок к единице ( /7= I). Порядок реакции
по углекислоте зависит от температуры процесса, и при повышении ее
с 380 до 500°С изменяется от -. 0,56 до -0,3 ( г = -
@,56+0,3).Суммарный порядок реакции mtr -z. 0,5. Изменение порядка реакции по
00^ объяЬняется уменьшением тормозящего действия Coc при
повышенных температурах. Порядок реакции по СО. можно определять по
эмпирической формуле .'
" ,-26,62 Ю3
193
Авторы считают, что водород и водяной пар не влияют на скоресть в
реакция по ним имеет нулевой порядок. Замедление реакции с
уменьшением количества /t2u связано с уменьшением равновесной степени
превращения.
Рис.55. Зависимость степени пре-
3 J; пар
11 ' л
газ = 2.
= 2,82; 2,2' -
02 0} Oh
Время контакта. ;
Qa 0,1
Иа рис. 56 видно, влияние температуры к количества С0г на
скорость реакции /26/7. Если при температуре 380°С состав приолнжается
к равновесному через 0,8 с, то при 500°С он становится..равновесным
уже при 0,2 с. При времени контактирования 0,17 с и 500°С разница
в степени превращения для газов с содержанием углекислоты 2,8 и
40$ равняется 7%, тогда как при J80°C она составляет 22$.
Для практических расчетов уравнение G.13) можно упростить и
в интервале температур 350-500°С пользоваться зависимость!; J2'l]
= А
Константа скорости
ШАЛИЗАТОШ KuHBfiraili СО
G.15)
находится по уравненш,- GЛ4).
Для среднетемперэтурной конверсии применяется в основном железо-
хромовые катализаторы. Активным элементом является /v- ^ .
Добавка скисе хрома Ct-pO, замедляет рост кристаллов во время работы.
Большинство железо-хромовых катализаторов, выпускаемых в разншс
странах, близки по активности при работе в кинетическом режиме.
Удельная поверхность их после начального периода работы
становится равной 25-UC м^/г, что и обусловливает их одинаковую
активность. Не при работе в диффузионной области активность
катализаторов различается в десятки раз. Важно, чтобы катализатор обладал
оптимальной пористой структурой, обеспечивающей высокий коэдйвдиент
использования объема.
194
В СССР выпускаются формованный катализатор марки 84", таб-
летированный - марки 82-М". Катализаторы содержат 80-90% г*г?3
и 7-7,5$ С'~2% • Примесь сернистых соединений не должна превышать
0,4-0,7$ (в пересчете на soi ). Насыпная плотность формованного
катализатора - 1150 кг/м3, а таблетированного 1500-1600 кг/м3 /537.
Срок службы катализатора определяется в основном его
механической прочностью; в процессе работы он постепенно разрушается, что
приводит к увеличения) гидравлического сопротивления.
Железо-хромовый катализатор малочувствителен к отравлению
сернистыми соединениями, но содержащаяся в нем или поглощенная ари
взаимодействии о водородом сера образует сероводород, который
может вызвать отравление катализатора низкотемпературной конверсии.
При атмосферном давлении 95-98%-ная степень приближения к
равновесию в интервале температур 350-50О°С достигается при объемной .
скорости 400-1000 ч~*. а при повышенном давлении - при 2000-3000 ч .
Перед работой катализатор восстанавливают рабочим газом, со-
стояпщм тизСО^Щ и Н20. В процессе восстановления /*><%
превращается в активную Fe^Oc . Дальнейшее восстановление до
металлического железа недопустимо, так как оно катализирует реакции мета-
нирования. Восстановленный катализатор является пирофорным, и
перед выгрузкой его необходимо окислить.
Высокоактивные низкотемпературные катализаторы позволяют зе-
сти процесс при 180-250°С. Высокая активность обусловлена
наличием в них металлической меди. Кроме того, в них входят окислы
цинка, алюминия и иногда хрома. Содержание окиси меди (в
невосстановленном катализаторе) колеблется от 20 до 50%. Окислы цинка и
алюминия стабилизируют свойства активной меди, т.е. препятствуют зе
спеканию при рабочих температурах.
Отечественный низкотемпературный катализатор марки НТК-4
выпускается в виде таблеток 5x5 или 4 х 6 мм, он содержит з
пересчете на окись 50-55$ меди.
Исследовали свойств катализатора НТК-4 показало, что его
активность пропорциональна величине поверхности, содержащей медь.
Чем выше дисперсность окиси меди, содержащейся в исходном
(невосстановленном) катализаторе, тем больше поверхность меди в восста-
новленном<контакте и выше его активность. В катализаторе НТК-4
дисперсность образующейся меди такая же, как и у окиси /53/.
ГЬзработан новый более активный катализатор НТК-8 /87_/,
приготовляемый осаждением оксалатов медп и цинка из смеси раствора
их азотнокислых солей и гидроокиси алюминия с последующим термиче-
195
ским разложением оксалатоа до окислов. Катализатор содержит 30-35?
меди, но активность его в 1,5 раза выше, чем у НТК-4. Дисперсность
окиси меди и стабилизирующей комплексной медь-цинк-алюыиниевой
шпинели колебалась от 70 до 100 I.. Насыпная плотность катализатора
невысокая и составляет 1,1-1,2 кг/л, что является его значительным
преимуществом.
Сравнительные характеристики катализаторов НТК-4 и НТК-8
представлены ниже:
Показатель НТК-4 НТК-8
Насыпная плотность, кг/д 1,75 1,2
Удельная поверхность, М7г o 65 80
Механическая прочность, кг/см"
средняя 400 260
минимальная 250 200
Каталитическая активность в
кинетической области, см3/см3-с 13,0 18.0
Термоустойчивость, °С 450 500
Пористость, % 45 65
При работе катализаторов под давлением 20-30 ат и температуре
200-250°С 90-95#-ное приближение к равновесию достигается при
объемной скорости 2000-3000 ч.
Восстанавливаются низкотемпературные катализаторы водородом
или окисью углерода. До свободного металла восстанавливается
только медь; окиси цинка и алюминия не восстанавливаются. Температура
восстановления не должна превышать 230-250°С. Восстановленный
катализатор пирофорен. Окисление его сопровождается большим тепловым
эффектом, и пассивация его должна проводиться очень осторожно.
Основными ядами катализаторов являются сера н хлор, к которым
они очень чувствительны. В процессе работы происходит
рекристаллизация катализатора, а также медленное отравление ядами. Вследствие
отравления зона реакции постепенно перемещается в направлении
движения газового потока. Срок службы катализаторов составляет обычно
полтора-два года.
В цинк-медных катализаторах с серой взаимодействуют оба ком-
понента Си* Ці
2
При 2гО°С константы равновесия этих реакций равны
соответственно 7,8; 1,2-ЮЬ; 7,9-Ю'', т.е. практически отравление серой
необратимо, и для нормальной работы катализатора требуется очень
высокая степень очистки сырья или газов конверсии.
196
МЕХАНИЗМ И КИНЕТИКА РЕАКЦИЙ ГИДВ1Р0ВАНИЯ (МЕТАНИРОВАНИЯ)
ОКИСЛОВ УГЛЕРОДА
Конвертированный газ после низкотемпературной конверсии окиси
углерода и очистки от двуокиси углерода имеет остаточное количество
СО @,2-0,85?) и СО2 @,01-0,55?) в зависимости от способа очистки.
Полная очистка от примесей со и со„ проводится
гидрированием их на катализаторе до метана и воды по реакциям:
СО v-J/?:== щ + н2о + 206 кДд,
Щ * 4нг u щ * 2*2о + 165 кДж.
Эти реакции являются обратными реакциями конверсии метана,
термодинамика которых была рассмотрена в главе I, константы равновесия
их представлены в табл. 17.
Преимущество очистки газа ыетанированиеы оостоит в том, что
достигается глубокая очистка и для проведения процесса не
требуется вводить дополнительные вещества - имеется избыток водорода.
Кроме того, если газ содержит примеси кислорода, то последний
полностью гидрируется по реакции
Ыетанирование проводится при 300-370°С и большом избытке
водорода. При этих условиях окислы углерода гидрируются практичеоки
полностью (рис.57) /63/. Поскольку реакции экзотермические,
происходит повышение температуры в реакторе. Для типичного состава
газа для синтеза аммиака увеличение температуры составляет 74 и 60°С
на 1% гидрируемых СО и с&2 соответственно.
Согласно принципу детального равновеоия, механизм прямой и
обратной реакции, должен включать одни и те же стадии, лишь
проходимые в противоположных направлениях.
В.Ы.Власенко /88/ считает наиболее вероятной следующую схему
механизма восстановления окиси углерода в метан на никелевых
катализаторах:
2) lz] + CO -є' — UV] f
3) [СОҐ
4)
197
6)
¦С#4
G.16)
Окись углерода на поверхности никеля адсорбируется в виде
молекул. Установлено существование пяти форы связи Cu с поверхность!)
никеля, различных по структуре и силе связи, зависящих от
кристаллической структуры никеля и условий процесса. Экстремально большая
сорационная емкость никеля, по-видимому, свидетельствует о
двухслойной адсороции СО . Исследования контактной разности потенциалов
показали, что окись углерода в интервале температур 75-250°С
снижает работу выхода на катализаторе, т.е. слой хемсороированного газа
в условиях протекания процесса гидрирования со заряжен
положительно. Это подтверждается стадией 2 G.16) /88/.
СсмУм'
200
СО (,'-4 )
в азо-
Рис.57. Равновесные концентрации
то водородной смеси: %,, ч
1-С =100 смУм3 и а = 0,1 МПа; 2- С = 100 см3/м , ^ =, ,
30,0 МПа; Ь- С = 100 см Ум*. Сгн. Ч/ = 5000 см3/м3, ^^ =5и00см3/м3
и Р = 0.1 МПа; ^ - <Г = IUOCTcWm3, Л, "" - -
Р =
Наличие окиси углерода на поверхности никеля изменяет его
адсорбционные свойства в отношении водорода. На катализаторе после
предварительной адсороции СО водорода адсорбируется примерно
вдвое больше, чем на чистом контакте. Поглощение водорода, видимо,
обусловлено переходом мостиковой формы связи СО в линейную с
образованием комплексов, состоящих ъъ СО и /^ и адсорбцией на ос-
Ґ98
вободнвшихся центрах никеля молекулярного водорода. Таким образом,
наличие адсорбированной со подавляет диссоциацию водорода в
процессе адсорбции его на никеле, т.е. наиболее вероятна адсорбция по
стадии /.
Противоположно заряженные адсорбированные на поверхности
никеля молекулы водорода и окиси углерода взаимодействуют между собой,
т.е. реакция протекает по механизму Лэнгмюра. Первичным продуктом
такого взаимодействия являются адсорбционные комплексы типа еноль-
ной формы формальдегида [=с^?„ J, которые затем восстанавлива-
ип
ются до метиленовых радикалов и далее гидрируются в метан.
При большом избытке водорода, как это имеет место при очистке
газа, для синтеза ашиака наблюдается нулевой порядок реакции как
по /с, , так я по со.
Предполагается, что суммарная скорость процесса определяется .
скоростью взаимодействия [СО] и [fyJ в адсорбированном сдое G.16,
стадия 3 )¦
Кинетическое уравнение гидрирования СО на никель-хромовом
катализаторе представляется в виде
*'к=когхр[-п-]- GЛ7)
Энергия активации составляет ? =16,2 ккал/моль; *7 = 24 моля
СО/с-см3 катализатора с поверхностью никеля 25 м /г C2,2 аг/см3).
Для этого катализатора можно записать
3,54-Ю3
lcfoj-1,18- -— ¦
Замечено некоторое тормозящее влияние СО и продуктов
реакции ( CHc и Н2& ) на ее скорость, но в большинстве случаев ш
можно пренебречь /88/.
В работе /89/ дан иной механизм гидрирования СО без
образования сложных комплексов, включающий приведенные ниже стадии:
1. Адсорбция Su и /f„t при которой оба атома находятся на
поверхности.
2. Образование слабых овязей оо омежныи водородом
С -О
. / V
3. Реакция комплекса с адсорбированным водородом (все атоми
на поверхности)
199
4. Насыщение ыетшшновой грушш другой адсорбированной
молекулой водорода
"^ 1
с + \ — m.
Л"" Н *
Предполагается, что лимитирующей является стадия 3.
При метанировании СО с целью получения высококалорийного
газа в интервале температур 300-350°С на восстановленной никелъ-ки-
аельгуровоы катализаторе скорость образования метана можно
находить по уравнению /897
Р Р3
ш _ & Н2 г кмолб і
)* 1 ~ 'аТ ''
94 G.18)
Козф(|ицнентц А, в, a, S слабо зависят от температуры и в указанном
температурном интервале можно брать следующие их значения: а =1,26;
В = -I; 2> = 0,5; ё = 2,57.
Образовавшийся при метанировашш или имеющийся в смеси
водяной пар реагирует о СО по реакции водяного газа, скорость которой
при рассматриваемых условиях
В монографии /2jJ приведено следующее уравнение скорости
реакции метанирования СО при отсутствии Cuc
t>i>s
РЩ G.20)
По тгяииим /I0/, реакция имеет первый порядок по окиси углерода.
Каталитическое гидрирование двуокиси углерода изучено в
меньшей степени. Это связано с тем, что синтез метана из углекислоты
не имеет практического значения, а очистка газов, содержащих Cug,
в промышленности осуществляется абсорбционными методами.
Большинство авторов считают, что механизм гидрирования Cfy и
СО отличен. По Пихлеру, превращение Uu2 протекает на
поверхности катализатора через следующие стадии:
0
0H
С +\-~с —- +„ —С#гО#-*-Щ+*?О. G.21)
H \ ffn\
о н °*
200
В.М.Власенко /88/ считает, что cot в присутствии водорода
не адсорбируется на поверхности никеля. Следовательно, различные
стадии превращения СО2 протекают либо в объеме, либо на
поверхности катализатора при очень малой концентрации промежуточных
соединений, т.е. при очень малой продолжительности жизни этих
соединений в адсорбированном состоянии. Более вероятным является
превращение фенольних комплексов, как к прж гидрировании окиси
углерода в метиленовые радикалы См' . Поэтому предложена слудухцая
схема механизма гидрирования двуокиси углерода:
2) 2[HJ * СОг -~
он
+ 2е,
- G.22)
* он
H
s)
В приведенной схеме, начиная со стадии 4, дальнейшие
превращения аналогичны стадиям гидрирования окиси углерода с той
существенной разницей, что при восстановлении СО^ эти превращения
происходят не на поверхности катализатора, а в объеме.
В соответствии с приведенной схемой предполагается, что
лимитирующей стадией процесса является образование диоксиметиленового
радикала (стадия 2).
Для никель-хромового катализатора уравнение скорости реакции
имеет вид
' ехр{-
G.23)
По дашшм других нсследователей, реакция имеет нулевой порядок.
В промышленных условиях одновременно проводится гидрирование
как окисн, так и двуокиси углерода. Гидрирование СО не зависит от
концентрации в смеои СО,. Однако наличие CU в газе препятствует
гидрированию Щ.
201
Метанирование ?0. практически приостанавливается, если
концентрация СО в газе превышает 200-300 см3/м3. Таким образом,если
на ітщрирование подается смесь окислов, то сначала гидрируется СО,
и после практически полного завершения реакции начинает
гидрироваться еог ¦
В промышленных реакторах процесс гидрирования окислов
углерода протекает во внешнедиффузионной области. В этом случае скорость
гидрирования Л?,, практически не зависит от концентрации cu в
очищенном газе, так как скорость обеих реакций лимитируется
диффузией СО и С0„ из потока к зернам катализатора. С увеличением
давления скорость гидрирования возрастает.
Скорость процесса гидрирования кислорода на никелевых
катализаторах при большом избытке водорода можно приближенно выразить
уравнением реакции первого порядка
'""*%¦ G.24)
Энергия активации составляет около 42 кДж/моль. Следует отметить,
что на активность и другие свойства катализатора оказывает большое
влияние состав реакционной смеси, поэтому скорость реакции будет
зависеть от состава очищаемого газа. Так же как и при
гидрировании окислов углерода в промышленных аппаратах, процесс
гидрирования кислорода протекает во внешней диффузионной области.
Необходимый объем реакторов метанирования определяется из ус-
яевий массооомена.
КАТАЖЗЛТОШ МЕТАНИРОВШЯ
Катализаторы, применяемые в процессах метанирования, должны
обладать высокой активностью, так как процесс ведут при относительно
низких температурах B70-350°С). Активность катализатора
характеризуется температурой и объемной скоростью, при которых
достигается заданная степень приближения к равновесию газовой смеси, В то
ке время катализатор должен обладать значительной термостойкостью.
В период пуска и остановки агрегата, а также при нарушении
технологического режима концентрация окислов углерода в газе может
увеличиться до нескольких процентов, что приведет к увеличению
температуры катализатора. Поэтому необходимо, чтобы катализатор
выдерживал температуру до 500°С.
Необходимо, чтобы катализатор обладал устойчивостью ко всем
сзновным компонентам газовой смеси и присутствующих в ней примесей.
202
При температурах до 450-500°С не должны происходить спекшше и
рекристаллизация.
Распространение получили катализаторы, активными компонентами
которых являются железо, никель и металлы платиновой группы.
Железные катализаторы применяются в старых производствах в аппаратах при
Аудирующего и непродувдрупцего предкатализа.
В настоящее время выпускаются в основном никелевые
катализаторы, обладающие высокой активностью. Носителями являются окислы
алюминия и хрома. Наши применение также рутеновые катализаторы,
работающие при 200-250°С и объемных скоростях до 30000 ч.
В СССР для очистки синтез-газа от Л? и <й^ путем метанирова-
ния применяют никель-хромовый катализатор, имеющий следующие
характеристики:
Содержание никеля 60-70 mc.JE
Содержание окиси хрома 30-35 мас.%
Содержание гранита До 5 мас.%
Пористость 60-65?
Кажущаяся плотность 1,0 г/смаР
Насыпной вес 1,08 т/сиг
Удельная поверхность ~170 м;/г
Никелевая поверхность ~ 25 м /г
Структура катализатора бидиоперсная. Распределение объема пор по
величине радиусов характеризуется наличием двух максимумов.В иола-
сти мелких пор максимальный объем приходится на поры радиусам 15 A,
a в области крупных пор - на поры радиусом 450 і /887.
Промышленный никель-хромовый катализатор является весьма
пористым низкотемпературным контактом с высокоразвитой внутренней
поверхностью никеля и окиси хрома и может применяться для
контактных процессов при температурах до 300-320°С.
Катализатор метанирования ici II-3 сохраняет активность
до 450°С /10/ и позволяет работать с объемной скоростью 4000 -
4500 1/ч при температуре газа на выходе из реактора 364°С.При этом
сумма окислов углерода ( СО ¦»• Щ ) за реактором - пять миллионных
долей.
При метанировании газов низкотемпературной конверсии для
получения ЗПГ используют те же катализаторы, что в реакторах
газификации, иногда даже частично отработанные. Это связано с тем,что
условия работы в реакторах метанирования более мягкие, чем в реакторах
газификации. В частности, вероятность закоксовывания катализатора
очень мала. Поэтому катализаторы низкотемпературной конверсии
углеводородов пригодны для процессов метанирования.
Никель-хромовый катализатор выпускается в виде таблеток
размерами 4*4 или 5*5 мм. В восстановленном состоянии объем зерен ка-
203
тализатора примерно на 18^ меньше, чем в окисленном, что
необходимо иметь в виду при загрузке катализатора. Катализатор выпускают
на заводах-изготовителях в восстановленном состоянии,
восстановление проводят водородсодержащим газом при 300-350°С. Но
восстановленный катализатор пирофорен, поэтому его пассивируют при
комнатной температуре продувкой азотом с постепенно возрастающей
добавкой кислорода. При этом на поверхности никеля образуется пленка
хемсорбированного кислорода, которая предохраняет контакт от
глубокого окисления. Пассивацию можно проводить и двуокисью
углерода, адсорбирующейся на никелевой поверхности и предохраняющей ее
от контакта с воздухом.
Активность пассивированного катализатора восстанавливается в
результате пропускания через него водорода при температуре 200°С.
Дія полного фэрмированяя его структуры и свойств нагрев
увеличивают до температури 300°С.
Недостатком никель-хромового катализатора являются относитель
но низкая механическая прочность и малая термостойкость.
Катализатор начинает спекаться уже при 325-340°С и не выдерживает
температуры выше 350°С. Следовательно, его можно применять только при
малом содержании окислов углерода в газе во избежание значительного
подъема температуры. Катализатор очень чувствителен к сернистым
соединениям, допустимое содержание которых составляет всего 1мг/мэ
Кроме того, при содержании в газе более 1% СО образуются летучие
карбоншш никеля, являющиеся весьма токсичными веществами.
Постепенно содержание никеля в катализаторе уменьшается и активность
снижается.
В настоящее время применяются катализаторн повышенной
стабильности и термостойкости, стабилизированные окисью алюминия. По
активности они могут уступать никель-хромовому, но имеют более
высокие механические свойства. Так, в агрегатах синтеза аммиака на
базе паровой конверсии в трубчатой печи применяют алюмо-никелевые и
алюмо-хромоникелевые катализаторы различных марок (AM, HKM, ТО).
Выпускаются они как в таблетированном, так и в формованном виде.
Размер гранул 4-10 мм. Содержание никеля в никель-алюминиевых
катализаторах - 20-40/5, большая часть которого находится в окисной
форме. Катализаторы работают при температуре 300-400°С и объемной
скорости 4000-10000 ч~*. Суммарное остаточное содержание окислов
углерода не солее 20 смэ/м3,а свежий катализатор обеспечивает
очистку до 3-5 см3/мэ при 300°С. Однако по мере эксплуатации
активность катализатора постепенно снижается, что приводит к необ-
204
ходимости повышения температуры газа на входе в реактор.
Максимально допустимая температура в аоне катализа 450 f 550°С.
Никель-алюминиевые катализаторы перед эксплуатацией
восстанавливают с помощью рабочего газа с малым содержанием со и со^ во
избежание перегрева. Процесс восстановления начинают при температуре
200°С л заканчивают при 380-400°С с выдержкой при этой температуре
6-Ю ч.
Несколько большей активностью обладают никель-адшохромовые
катализаторы (например, марка ТО) при термостойкости до 600°С.
Содержание никеля в них составляет 15-3556. Они могут работать уже
при 250 С и обеспечивать более глубокую очистку.
Восстанавливаются эти катализаторы при 400-420°С в течение 20-30 ч.
Обычно срок службы катализаторов метанирования составляет два-
три года. Основными причинами снижения активности являются
отравление и спекание. Происходит также разрушение таблеток в результате
чрезмерно быстрого сброса давления и других нарушения
технологического режима.
ПРОЦЕССЫ НА ЗЕРНЕ И В СЛОЕ КАТАЛИЗАТОРА
Конверсия СО . В промышленных реакторах процессы как среднетемпера-
турной, так и низкотемпературной конверсии со протекают в
диффузионной области. Поэтому наблюдаемая скорость реакции и коэффициент
эффективности определяются иэ уравнений, описывающих процесс на
зерне катализатора. В данном случае протекает одна реакция,поэтому
уравнение материального баланса можно записать только для
ключевого компонента (окиси углерода), а концентрация основных компонентов
определяется из уравнения диффузионной стехиометрии
где С, - концентрация компонента в потоке; і - стехиометриче-
ский коэффициент, положительный для исходных веществ и
отрицательный для продуктов реакции.
Эффективная теплопроводность таблеток промышленных
катализаторов достаточно высокая,- А*/С„>>!)*' и можно считать, что зерно
работает в изотермическом режиме. Следовательно, распределение
концентрации окиси углерода в сферическом зерне описывается
уравнением /90/
П*(с'/Л^)-ш(С.і)'О G-26)
205
о граничными условиями
при р = О С,'=0,
при р=я fi(C-Cf)'B*c', «(t-tf)=-4D*Cj/*r
Расчеты процеоса на зерне, произведенные с учетом химической
кинетики по уравнению G.10), внутренней и внешней диффузии,
показали, что лимитирующей стадией является внутренняя диффузия.
Влияние внешней диффузии на коэффициент эффективности не превышает 55?
и может не приниматься во внимание. Например, при концентрации ?0
в потоке 5,5#, tc = 380°С, V, = 3000 ч и d} - 8 мм
коэффициент эффективности р равен 0,118. Без учета внешней диффузии он
составил бы 0,124. Из зависимости /> от размеров зерна
катализатора (рис.58), видно, что даже при диаметре зерна 2 мм процесс
лимитируется диффузией в зерне.
k 6 8 I0u,,mm
Рис.58. Зависимость
коэффициента эффективности от размера
зерна катализатора.
Ыатешатичеокое описание полочных я радиальных реакторов
дано в работе /90/. Для полочного реактора система уравнений имеет
вид
G.27)
G.28)
ж -*-•(¦<>¦>
начальными условиями
при' I - О
t - I
о>
где v - расход газовой смеси, кыол/ч; * - радиус реактора; і ¦¦
текущая длина; ш* - наолвдаемая скорость реакции; z - мольная
доля компонента.
Рассмотрение полочного реактора как аппарата идеального
вытеснения оез учета поперечного и продольного перемешивания,
по-видимому, оправдано.
Если не учитывать перемешивание в радиальном реакторе, то он
описывается системой уравнений:
v і dz, .
1--г іг"»<',.<>->• G.29)
с вачлттмм условиями
при r.rM,i=za. і -?0.
где г - текущий радиус; г^ - начальный радиус. Знак минус
относится к случаю подачи сырья из центра к периферии, шлю - для
противоположного направления.
Концентрация других компонентов газового потока находится из
уравнения
*Г-*/+у<*Г*)- G.31)
Для примера на рис.59 представлены результаты моделирования
полочного и радиального реакторов с железо-хромовым катализатором
при следующих исходных данных:
аэ = 10 мм; Р = 10 ат; ? = 380°С;
для радиального реактора и = 12,6 м; а^а„- 4 м; a^ =1,2 м;
VKaT = 144 м3; h.' = 3035 ч-, состав газа на входе (об.іб): а?-
5,5; H2U = 52,5; СО2 - 4,0; Н2 - 27,3; ^ - 10,7;
для полочного реактора H = 12,6 м; d =¦ 2,56 м; *кат =
= 13,4 мэ; »v = 3500 ч; состав газа на входе (об./6): СО - 12,5,
Н2О - 56,2, С02 - 1,8, Н2 - 25,2. /Г? - 1,6.
Из рис. 59 видно, что при принятых объемных скоростях
практически равновесная концентрация СО достигается ухе в средних слоях
катализатора, и возможна нормальная работа реакторов при частичной
дезактивации катализатора. Более быстрая конверсия ЛР в полоч-
реакторе обусловлена только более высоким содержанием й? в
исходном газе /9Q7.
Вследствие изменения температуры по слою катализатора,
меняется и коэффициент эффективности. В рассмотренных примерах он падает
207
от 0,25 до 0,17 в радиальном реакторе и от 0,20 до 0,08 в полочном
реакторе. С уменьшением а, до 4-5 мы можно поднять коэффициент
эффективности приблизительно в два раза. Но более мелкие таблетки
для промышленных реакторов непригодны. И единственный путь
увеличения /> - создание оптимальной пористости зерна.
Падение давления в радиальном реакторе описывается уравнением
1 dr
k-2 dz
-7-Ц---4 G.32)
J (b-zJ
« =/><? % ZA
ГДЄ к.гм/(гм-Га
В уравнение G.32) достаточно подставить температурный профиль,
чтобы после интегрирования найти гидравлическое сопротивление ката-
лизаторного слоя реактора.
~0,%
(.°С
ш
m
m
m
co,%
12 \
в
\
j
0
2^
(
0,5 I?
Длина
1,5 2,0
реактора, м
5
-,
-
-
-
2.5
t.°С
W
504
4?C
420
W
12 15 2,0 " 2,5 3,0 3,5
Радиус реактора, м
a
Рис. 59. Распределение концентрации Cu ( ;) и температуры ( г ) по
радиусу в радиальном (г?) и длине в полочном (<?) реакторах.
Величина Ь в уравнении G.32) представляет собой
коэффициент трения в зернистом слое, отнесенный к единице удельной
поверхности слоя. Эта величина связана с коэффициентом сопротивления *
соотношением /4Q/
1--JIL
G.33)
-Ю6
Влияние температурного профиля на гидравлическое
сопротивление каталиэаторного слоя сравнительно слабое, и расчет можно вести
без учета градиента, приняв по всему слою среднюю или конечную
температуру потока. Ошибка в расчете t Р не превысит 5%.
Гидрирование со и COg . Как уже отмечалось, в большинстве
случаев процессы каталитического гидрирования вследствие низкой
концентрации реагентов и высокой наблюдаемой скорости реакции на зерне
протекают во внешнедиффузионной области. Некоторое влияние
оказывает внутридиффуэионное торможение. Уравнение переноса веществ с слое
катализатора в предположении, что реакции гидрирования Л? в С0г
идут до конца и не зависят друг от друга имеют вид
-2. -4-3- +М-ЇГ *?fu, = U
і tu? аг ; J і G#34)
с граничными условиями
при' 1-0 ? = с
при і - ?
где f - поверхность зерен на единицу объема слоя, ыг/и ; уз -
коэффициент массообмена; Du - коэффициент продольного перемешивания;
м - скорость потока.
Решение этого уравнения приводит к следующему распределению
концентраций по длине слоя катализатора /53/:
_ - 3~ G.35)
Авализ уравнения и его решения показывает, что для процесса
гидрирования при заданном объеме катализатора увеличение линейной
скорости и уменьшение диаметра аппарата в определенных пределах
благоприятно сказываются на степени превращения. Но если із, велик
или быстро возрастает с увеличением линейной скорости, то степень
превращения после достижения максимального значения начинает
уменьшаться. Это возможно в тех случаях, когда нарушается гомогенная
структура слоя катализатора.
209
АППАРАТУШО-ТЕХНОЛОгаЧЕСКОЕ ОФОРМЛЕНИЕ
В современных схемах производства аммиака конверсии окиси углерода
проводят в две ступени на среднетемпературном и низкотемпературном
катализаторах в адиабатических реакторах под давлением 20-35
ат.Поступающий на конверсию газ имеет приализительно следующий состав
(об.*):
54f57 I2fI3 7,5fI2 0,20^-0,35 2Іг27 0,20-0,25
Содержание водяных паров составляет O,55fO,75 м3 на I м8 газа.
Рис.60. Схема конверсии и метанирования окислов углерода
аммиачного производства:
./ - увлажнитель; 2 ~ среднетемпературный конвертор со
первой ступени; 3 - котел-утилизатор; 4 - теплообменник; 5 -
низкотемпературным конвертор СО второй ступени; 6- установка очистки от
двуокиси углерода; 7 - подогреватель; S - метанатор; 9 -
теплообменник; ш - воздушный холодильник; п - сепаратор;
I - конвертированный газ; П - газ после первой ступени конвер-
сии СО; Ш - газ после второй ступени конверсии СО; 1Y - неочищенная
,АВС; У - ABC на компримирование;¦ УІ - питательная вода; УН - пар
высокого давления; УШ - конденсат.
210
Схема узла конверсии и метанирования аммиачной установил
показаны на рис.60. В увлажнителе / происходит донасыщение газа
водяным паром путем впрыска конденсата, подачей которого
регулируется также температура на входе в конвертор. Обычно она
поддерживается равной 380°С. Объемная скорость газа ооставляет 20ОО-300Оч~.
В конверторе 2 в результате конверсии газ нагревается до 400-450 С,
Газ охлаждается в котле-утилизаторе 3 , где вырабатывается пар
высокого давления, и затем в теплообменнике * до 20О-250°С. На входе
в конвертор СО второй ступени содержание со в газе не
превышает 2,5f3,0#. После конверсии на низкотемпературном катализаторе
остаточное содержание СО соотавляет 0,3-0,6$. Температуру газа на
входе во вторую ступень регулируют путем байпасирования части газа
мимо теплообменника 4 ели впрыском конденсата.
Иногда предусматривается дополнительная очистка газа от соеди-.
нений серы и хлора перед низкотемпературной конверсией. Очистку
осуществляют в специальных аппаратах или на дополнительных слоях
сорбента в самом конверторе.
После реактора второй стеши S газ направляется в
установку очистки от двуокиси углерода 6.
В схемах получения подорода выоокой степени частоты двуокись
углерода удаляется после реактора среднетемпературной конверсии и
уже очищенный от СОг газ поступает на низкотемпературную
конверсию СО.
В качестве реакторов применяют аппараты полочного и
радиального типов. В полочных реакторах катализатор расположен слоями на
полках, помещенных в цилиндрическом корпусе. Колосниковая решетка
покрывается металлической сеткой с ячейками несколько меньшего
размера, чем зерно катализатора. Поверх сетки насыпают слой насадки,
препятствующий забиванию сетки таблетками катализатора, и затем
загружают катализатор. Сверху вновь укладывают темаллическую сетку,
над которой размешают слой насадки. На этой насадке отлагаются
соли, которые могут содержаться в паре» Она выполняет также
распределительную функцию, выравнивая скорость потока по сечению аппарата,
В верхней части аппарата устанавливается
распределитель.назначение которого - создать равномерный поток по сечению аппарата.
В радиальных реакторах (рис.61) катализатор размещают в
корзинах, образованных коаксиально расположенными перфорированными
центральной трубой и наружной обечайкой. Поверхности корзины со
стороны катализатора покрыты сеткой. Между корпусом реактора и
наружной обечайкой корзины имеется зазор, по которому вводят сырье
или отводят продукты реакции.
211
Рис.61. Полочный конвертор окиси
углерода:
/ - корпус реактора; 2 -
катализатор; з - внутренняя перфорированная
труба; 4 - катализатор для компенсации
усадки и затвора; 5 - наружная
перфорированная обечайка.
Эффективность работы радиального реактора сильно зависит от
распределения потока сырья по высоте слоя катализатора. Поэтому
должны быть точно рассчитаны геометрические размеры аппарата. По
сравнению с полочным радиальный реактор имеет значительно меньшее
гидравлическое сопротивление, что дает возможность использовать
мелкозернистые катализаторы и работать с высокими объемными
скоростями.
Гидрирование окислов углерода является заключительным
процессом перед компримированием водорода или азотоводородной смеси. В
старых производствах,где конверсия окиси углерода осуществляется
на среднетемпературном катализаторе, а остатки ее удаляются медно-
аммиачным раствором, работают аппараты продуцирующего и непродуци-
рующего предкатализа при высоком давлении C00 ат).
В производстве аммиака с очисткой конвертированного газа от
окиси углерода жидким азотом установка предкатализа расположена
после блоков промывки. Процесс проводят при среднем давлении B8-
30 ат), температуре 150°С и объемной скорости 10 000 ч на никель-
хромовом катализаторе. Азотоводородная смесь содержит
соответственно до 20 ; 5 см3/м3 CU и Cu„. Вследствие малого содержания
кислородсодержащих примесей аппарат гидрирования обычно включают только
во время увеличения их концентрации в смеси.
В современных схемах производства аммиака с конверсией
природного газа в трубчатой печи установку метанирования располагают пос-
212
ле очистки газа от двуокиси углерода. Установка (см.рис. 60)
состоит из метанатора в , подогревателей и охладителей газа.Газ после
очистки от двуокиси углерода проходит через сепаратор, где
отделяется от капель абсорбента, подогревается в двух последовательно
расположенных теплообменниках 7 и * и направляется в метанатор в.
В азотоводородной смеси, поступающей на метанирование, содержится
около 0,5-0,7$ Со и до 0,1$ СОг . После метанирования остаточное
содержание суммы со и со^ не превышает 20 см3/м3. В схемах
производства водорода, где требования к наличию окислов углерода
менее жесткие, суммарное содержание их может достигать 0,2-0,3$.
Процесс метанирования осуществляется на никель-алюминиевом
катализаторе в адиабатических полочных или радиальных
реакторах,которые по своему устройству аналогичны реакторам конверсии СО (см.рис.
61). Температура на входа в реактор поддерхиваетоя равной 380-
420°С, а на выходе не должна превышать 450°С. При давлении
20-30 ат поддерживается объемная скорость 4000-5000 ч . Линейная
скорость в аппарате составляет 0,3-0,4 м/с.
В приведенной схеме (см.рис. 60) газ перед метанированием
подогревается конвертированной парогазовой смесью после первой
ступени конверсии и котла-утилизатора. Возможен подогрев после
метанатора, имеющими температуру около 320-350°С. В этом случае очищенный
газ поступает в аппарат сверху, проходит по кольцевому
пространству между корпусом и кожухом изоляции катализаторской коробки и
теплообменника, расположенных внутри аппарата, и попадает в межтрубное
пространство теплообменника, где нагревается за счет тепла
конвертированного газа. Из теплообменника газ проходит по центральной трубе,
дополнительно подогревается (если необходимо) электроподогревателем,
поступает на катализатор и проходит через него в радиальном
направлении. Очищенный газ поступает в трубки теплообменника, где отдает
часть своего тепла холодному газу, поступающему на очистку /53_/.
Глава 6
ОЧИСТКА КОНВЕРЖРиВАШіОГО ГАЗА ОТ ДВУОКИСИ УГЛЕРОДА
ХАРАКТЕРИСТИКА ПРОМШШШНІІХ СПОСОБОВ ОЧИСТКИ ОТ СО.
Для получения чистого водорода, азотоводородной смеси, газов для
синтеза спиртов и заменителя природного газа необходима очистка
газовой смеси от двуокиси углерода. Применяются абсорбционные и реже
адсорбционные способы очистки: I) водная очистка под давлением;
2) поглощение a?>2 водными и другими растворами зтаноламинов; 3)фи~
зическая абсорбция органическими растворителями при обычной и
низкой температуре; 4) очистка горячими растворами карбонатов; 5)
адсорбция с десорбцией сбросом давления.
Способ очистки во многом определеется общей технологической
схемой производства. В старых производствах, основанных на паро-
кислородной и других видах автотермической конверсии, применялась
и эксплуатируется в настоящее время водная очистка. Основной ее
недостаток - большой расход электроэнергии вследствие невысокой
растворимости COc в воде. Селективность вода такке недостаточна, что
приводит к потерям водорода. Обычно после водяной промывки
требуется доочистка газа другими способами, например раствором щелочи.
Сейчас применяются более емкие и селективные хемсорбенты
(поташ, моноэтаноламин). Но процессы, основанные на хемсорбции,имеют
принципиальный недостаток, заключающийся в том, что расход тепла
на I м3 очищаемого газа довольно значительно увеличивается с
повышением концентрации СО„ в исходном газе. Поэтому на некоторых
установках используются для абсорбции со2 органические
растворители. В качестве растворителей применяются: пропиленкарбонат ("Флю-
ор-процесс"), /V -метилпирролидон ("Пуризол"), даметиловый эфир
("Селексол"), захоложенный метанол ("Ректизсл").
В связи с тем что растворы алканоламинов в воде имеют малую
концентрацию активного компонента (поглотителя) в растворе, были
разработаны и внедрены процессы очистки растворами алканоламинов
в органических растворителях. Нашли применение следующие
композиции: Раствор ДЭГ и ЫЭА в метаноле (процесс "Амизол"), раствор МЭА
или другого алканоламина в сульфолане ("Сульфинол").
214
Все перечисленные способы с успехом могут применяться для
очистки газов от Л|. Но в связи с технологическими
характеристиками современных установок паровой конверсии в трубчатых печах и
из экономических соображений наиболее широкое распространение в
последние 10-15 лет получили процессы очистки от 60g растворами мс-
ноэтаноламина (МЭА) и потята ( <¦? ?03 ). Поэтому эти процессы
будут рассмотрены более подробно. .
ЙЇЗИК0-ХИШЧЕСКИЕ ОСНОВЫ ОЧИСТКИ
ВОДНЫМИ РАСТВОРАМИ ЭТАНОЛАМИНОВ
Этаноламины (аминоспирты) представляют собой вязкие бесцветные
жидкости, смешивающиеся с водой во всех отношениях. Для очистки в
промышленных условиях используют водные растворы концентрацеи 12-
35 мае./5. Основные свойства зтаноламинов представлены в табл. 18.
Таблица 18. Основные свойства зтаноламинов
Свойства
Молекулярная масса „
Температура замерзания, С
Температура кипения (С)
при давлении, мм рт.ст.
10
100
760 q
Плотность, кг/м о
Давление паров при 38 С,
мм вед.ст.
Щелочность, мл кислоты
на I г ЭА
Теплоемкость 2ш водных
растворов,ккал/кг ¦ град
Парциальное давление
паров 2,5/Ь-ных водных
растворов ЭА (мм рт.ст.) при
температуре°с
30^5
50
100 ^
Теплопроюдность 20%-ноіч
раствора (ккал/мчград)
температуре °с
30
70
Теплота поглощения СО3 ,
ккал/кг поглощенных -
газов
МЭА
61,08
10.5
64
114
171
1022
21,2
16,39
0,75
0,03
0,10
1,26
при
0,362
0,455
458
ДЭА
105,14
18
150
205
27Г
1097
0,07
9,50
0,90
0,003
0,010
0,150
362
ТЭА
149,19 .
21
193
266
разлаг.
1124
0,05
6.70
0.003
0,010
0.130
350
2II
Растворы зтанолаыинов являются поверхностно-активными веществами;
обладают значительной вязкостью, увеличивающейся с возрастанием
их молекулярной массы. Кинематическая вязкость 15?-ного раствора
МЭА лежит в пределах 2,5-A0°С)-0,6 ест (сантистоясов) при 70°С,
а Зонного раствора - от 5A0°) до 0,9 ест при 70°С.Вязкость
растворов можно вычислять по формуле
00 o,t?) {ел]ш
где <* - степень карбонизации; 3? - концентрация ЭА, кмоль/иэ;
і - температура; Ь = 0,0836 для МЭА и і = 0,173 для ДЭА.
Уравнение справедливо в пределах 30 = 0^5; <* = 0-4; / =
15440°С.
Лучшим считается абсорбент, обладающий наибольшей
поглотительной способностью и минимальным давлением паров над раствором и,
следовательно, минимальными потерями. Максимальной поглотительной
способностью обладает ЫЭА, но он имеет и наибольшую летучесть.
Несмотря на 8Т0Т недостаток, МЭА получил наиболее широкое
распространение для абсорбции С02.
Химизм процесса поглощения кислых газов можно представить в
виде следующих суммарных уравнений:
СОг * 2ХМ2 + цо = (*ЩJ со$, C.2)
Щ * (ЯЩJ u?^y^= 2/tMj щ, (8.3)
где R -группа tficMjCHj.
Теоретически при полном смещении равновесия вправо степень
карбонизации (отношение числа молей ?Og , поглощенных раствором,
к общему числу молей МЭА) равна единице, т.е. I кмоль МЭА может
поглотить 22,4 м3 CU.. Практически в производственных условиях степень
карбонизации насыщенного раствора МЭА при атмосферном давлении
составляет ы. = 0,4гО,5 и при давлении 25-30 ат а. = 0,60-0,75.
Абсорбционная способность раствора является суммой
абсорбционных способностей его отдельных компонентов, т.е. воды и этанол-
амина. Практически в зависимости от концентрации МЭА, парциального
давления С02 в очищенном газе и температуры абсорбции І м МЭА
поглощает xJ-45 мэ Su*. Температура поддерживается обычно в
пределах 38^i5uC, a давление зависит от схемы производства и находится
в пределах 13-35 ат. Данные о растворимости oup в растворах МЭА
приведены на рис.62. Взаимосвязь.равновесного давления Л? и сте-
'пени карбонизации 20^-ного раствора МЭА представлена на рис.63.
216
ос, моль/ноль
12
МЭА,№Ь/Л
Рис.62. Зависимость растворимости Cu. от
концентрации МЭА при л, = 3 ат и
различных температурах: г
/ - 25; V^- 50; .3 - 75°С.
,шрт.ст.
і
0,1 0Z 0,3 Off 0,5 OS 0,7
а,тпь СОг/мольm
Рис.63. Зависииость равновесно-
давления <% от степени кароо-
низации годного раотвора МЭА
при различных тмшадатдах:
4 _ ^0;~/- eof 7 - 4O-. ?"- гоЧі
в растворах этанолами-
Интегральная теплота растворения ^
нов вычисляется по уравнению ^
и лешт в пределах 37,7-79,6 кДж/моль.
При повышении давления равновесная растворимость й| в
растворах ЭА возрастает частично за счет увеличения его растворимости
217
н воде. В действительности растворимость Л^ с увеличением
давления возрастает слабо вследствие уменьшения скорости химических
реакций с повышением степени карбонизации раствора /53, 63/.
Поглотительную способность раствора данной концентрации можно
представить как разность между конечной <*2 и начальной *г сте
сенями карбонизации, так как раствор, направляемый после
регенерации снова на абсорбцию, всегда содержит некоторое количество <Л?,
равное <*2 - <*1 кмолей С0$ на I кмоль МЭА. Конечная степень
карбонизации определяется условиями абсорбции. Помимо
термодинамических условии она в значительной степени зависит от условии массооо
мена и продолжительности контакта между газом и раствором.Начальная
степень карбонизации <*; , при которой раствор МЭА поступает в аб-
сорбер после регенератора, определеется требуемой степенью очистки
конвертированного газа и расходом тепла на регенерацию раствора.Дж
грубой очистки газа под давлением величина «? лежит в пределах
0,I5f0,20; для осуществления тонкой очистки конвертированного газа
ы-i уменьшается до- 0,1 и ниже.
Б процессе очистки газа, кроме указанных выше, протекает ряд
побочних реакций с кислородными и сернистыми соединениями, а также
материалом аппаратуры. По сравнению со скоростью основных реакций
скорость из невелика, однако при длительной циркуляции раствора в
системе накапливаются побочные продукты; и во избежание нарушения
технологических процессов состав раствора должен поддерживаться
стабильным.
Побочные реакции сводятся к минимуму при соблюдении сдедупцшс
условий работы:
снижение температуры теплоносителя, подаваемого в кипятильник
но 140-150°С; уменьшение концентрации МЭА до 15$; снижение степени
карбонизации насыщенного раствора до 0,35-0,45; введение
ингибиторов типа NaOHt fco», Уа2со3 . Однако зти меры приводят к увеличению
таркуляции раствора и расхода тепла и не обеспечивают полного устра
аения побочных реакции. Поэтому необходимым условием нормальной экп
плуатапии является вывод из цикла продуктов побочных, реакций путем
іазгонки или фильтрации раствора, либо сочетанием этих методов.
Основными энергетическими затратами при моноэтаноламиновой
чистке является расход тепла на регенерацию сорбента,который равен
в'***>*»+*<,*+**• • (8.4)
¦'Де Sjec - тепло десорбции Cu2 ; <?„ - тепло на нагрев сорбента;
"эта ~ тепло, затраченное на образование отдувочного пара, уходя-
;їго через верх регенератора; ^ _ тепловые потери.
Тепло десорбции
^^"^W^ (8.5}
Все тепло подводится в кипятильники на температурном уровне
140-150°С и отводится в холодильниках при температуре 10-90°С.
Можно записать следующий тепловой баланс простейшего десорбе-
ра (с одним потоком раствора):
вохл+<іА0»*іл*-лй*іСРл'т**яі'і'А**і>іо'іі'"Ф*в''1 (8.6)
где #т и $KW - тепло, отведенное в холодильниках и
конденсаторах; Ф^Р#20/РСй - флегмовое число; йх = х2 -к, - реальная
поглотительная способность раствора.
Ориентировочно расход тепла на десорбцию составляет 20-30$,
па нагрев 30-60$, отдувку н2о 10-30$.
С целью увеличения тепловой экономичности в промышленности на
шли применение схемы с раздельными потоками регенерированного и
насыщенного сорбента, увеличивающие обратимость процесса. Давление
регенерации обычно поддерживается равным 0,17-0,25 МПа.
Растворы атаноламинов вызывают коррозионное действие на медь,
цинк и их сплавы. В кипттрт водных растворах МЭА малоуглеродистые
стали также подвергаются коррозии под действием Л^, и Л,Х
Присутствие примесей увеличивает скорость коррозии, поэтому
необходимо применять возможно более чистый МЭА и систематически подвергать
очистке поглотительный раствор путем фильтрации и перегонки его в
присутствии щелочи.
ТЕХНОЛОШЧЕСКИЕ СХЕМЫ И АППАРАТУРНОЕ ОФОРМЛЕНИЕ
МОНОЭТАНОЛАМИНОВОИ ОЧИСТКИ
Особенности технологической схемы зависят в значительной мере от
общего схемы производства. В современных производствах аммиака и
водорода с низкотемпературной конверсией СО производится очистка
от СО2 под давлением 10-30 ат до остаточного содержания
углекислоты 0,01-0,1$ с последующей тонкой очисткой от остатков со и д^
метанированием.
В технологических схемах парокислородной каталитической
конверсии при атмосферном давлении с последующей промывкой газа жидким
азотом необходима предварительная тонкая очистка от двуокиси
углерода. В этом случае применяют двухступенчатую моноэтаноламиновую
очистку с низким давлением в первой ступени и 25-30 ат во второй
219
ступени. Таким способом газ очищается до содержания в нем со2 не
более 4-5 см3/м3.
При конверсии под давлением с промывкой газа жидким азотом
также применяют двухступенчатую очистку, но при одинаковом давлении
газа в обеих ступенях.
Рис.64- Схема моноэтаноламиновой счистки природного газа от щ
(процесс МЭА - ПЇАЇЇ): '
/ - абсорбер; 2 - регенератор; 3 - теплообменник; 4 -
воздушный холодильник; s - насос; S - дроссель; 7 - кипятильник; 8 -
смоловыделитель;
- I - конвертированный ras; П - очищенный газ; Ш - тонкорегене-
рированный раствор МЭА; ІУ - груборегенерированный раствор ВІЗА; У -
напыщенный раствор МЭА; 71 - углекислый газ; УП - теплоноситель;
If - пар; IX - кубовый остаток.
В современных схемах при тонкой очиотке газа процесс
осуществляют в одном колонном ашшрате абсорбцией двумя потоками растворов
МЭА с различной степенью регенерации. Такая схема использована в
агрегате синтеза аммиака мощностью 1360 т/сутки (процесс МЭА - ПІАЛ)
(рис.64) /53/. Абсорбция осуществляется 20%-ным раствором МЭА в аб-
тораенте I, оборудованном свтчатыми тарелками с высоким барботахным
'слоем, иод давлением 26-29 кг/см2. В нижней части абсорбера
проводится предварительная очистка (до 1-2# СО2 ) груборегенерированным
раствором ( d = О,ЗтО,35). Тонкая очистка (не выше 0,01$)
осуществляется тонкорегенерированным раствором ( а = 0,1). Соотношение
потоков регенерированного раствора 1:1. Еа 1000 м3 газа, содеряаще-
го118$ СОр подается 5,4т5,6 и3 раствора при 40°С. Степень
карбонизации насыщенного раствора около 0,65.
Насыщенный раствор разветвляется на три потока: первый -
холодный поток (около 10/5) - направляется на одну из верхних
тарелок (холодный байпас); второй поток ( ~ 45$) нагревается до 90-95°0
и направляется в среднюю часть регенератора; третий поток
дополнительно нагревается до 104-Ю7°С и подается еще ниже. Парогазовая
сиесь ( со2 у- #2 о ) выходит из генератора при температуре около вО0^
давлении 0,17 ЫПа и поступает в конденсатор воздушного охлаждения.
Полученная двуокись углерода имеет чистоту 98-99$; содержание
водорода в ней \-2%.
Десорбция ct?2 из раствора происходит за счет снижения
давления и понышения температуры раствора в теплообменниках и за счет
тепла парогазовой смеси, поступающей из нижней части регенератора.
Окончательная десорбция Л^ из раствора происходит при кипячении
его в кипятильнике 7 , обычно обогреваемом конвертированным газом.
Для регулировки процесса может быть дополнительно установлен
паровой кадятильник. Небольшая часть МЭА поступает в специальный
аппарат смоловыделитель 8 , где при постепенном повышении температуры
до І40-І96°С в присутствии острого пара производится отгонка МЭА
от образовавшихся в процессе работы высокомолекулярных смолистых
веществ.
При аппаратурном оформлении теплообменников, обеспечивающем
испарение без образования газовых мешков и выполненных из
нержавеющей стали, дросселирование раствора можно проводить сразу после
абсорбции, как это показано на схеме. Это увеличивает коэффициенты
теплоотдачи. В противном случае насыщенный раствор надо
дросселировать непосредственно перед регенератором. Насыщенный раствор должен
направляться в теплообменники по трубному пространству снизу вверх,
а в верхних точках аппаратов должны предусматриваться продувочные
линии.
Если необходимо получать чистую двуокись углерода, например
для синтеза карбамида, то схема очистки несколько видоизменяется.
Вводится промежуточная десорбция примесей. Например, раствор из
абсорбера направляется в емкость, где при 60-70°С происходит отдув-
221
ка азотом горючих примесей, и концентрация их сшивается до 0,007-
О.ОЦв. Другой вариант получения чистой со2 заключается в отдувке
примесей двуокисью углерода или промежуточной десорбции части Cut,
загрязненной примесями. Можно производить отгонку примесей в
десорбере. Тогда с верхней части колонны уходит часті cuc с примесями,
а со второй-третьей тарелки отбирается чистая двуокись углерода.
Абсорберы. В качестве абсорбера используются как насадочные,
так и тарельчатые колонные аппараты. Абсорберы должны обеспечивать
высокую отепень извлечения с<?2 (близкую к теоретической) и иметь
незначительное гидравлическое сопротивление при высокой пропускной
способности по газу и жидкости. Этим требованиям в значительной
мере удовлетворяет насадочный абсорбер с тремя слоями насадки высотой
3,5-4,5 м каждый; нижний слой -'полипропиленовые кольца Палля;
последующие слои - керамические седла типа Инталокс /53/.
В связи с невысокой скоростью химических реакций, идущих при
поглощении C0t , требуются аппараты с большим количеством
удерживаемой жидкости. Поэтому иногда применяют аппараты с частично
затопленной насадкой. Нижняя часть аппарата работает в барботажном
режиме, а верхняя - в пленочном. Высокая интенсивность работы аппаратов
с нерегулярной насадкой позволяет применить для агрегатов синтеза
аммиака 1360 т/оутки колонну диаметром около 3,8 м с общей высотой
слоя насадки - 18 и, работающую под давлением 2,5-3,0 Ша.
Регенераторы. Ранее на отечественных заводах широко применя-
лись регенераторы с кольцевой керамической насадкой. Но в процессе
эксплуатации насадка разрушалась и эффективность регенераторов
сильно снижалась. Поэтому насадочные регенераторы могут быть
перспективными только при повышении механической прочности насадки.
В настоящее время используются в основном тарельчатые
регенераторы с ситчатыми тарелками, тарелками провального типа и др.
Количество тарелок определяется кинетикой процесса.
Скорость процесса регенерации зависит от следующих
последовательных стадий:
разложение карбонатов и карбаматов; диффузия молекул cu2 в
жидкости к поверхности раздела фаз; переход молекул С02 ъ <*г0 ъ
парогазовую фазу; диффузия молекул С0^ в основную массу газа.
Процесс контролируется главным образом диффузией в газовой фазе, а
также химическими превращениями в растворе.
В агрегатах синтеза аммиака мощностью 1360 т/сутки установлен
регенератор с 22 ситчатыми тарелками и 3 колпачковыии в верхней
части диаметром 4,5 м. Регенератор обеспечивает производительность
222
•по раствору до 1200 м3/ч в верхней секции и до 600 м3/ч в нижней
секции. Скорость парогазовой смеси в барботажной части тарелки 1,0-
1,7 м/с. Коэффициент полезного действия тарелок уыеньшается по
мере снижения степени карбонизации от р = 0,25-0,40 при л - 0,4-
0,5 до ^ : 0,15-0,25 при а. = О,25гО,3. Скорость жидкости -
40i-50 м3/ч, высота пены около 200-250 мм. Объем парогазовой смеси
изменяется по высоте аппарата более чем в дяя раза.
Регенератор имеет два выносных кипятильника, обогреваемых
конвертированным газом с температурой примерно 176°С и паром с
температурой около 223°С. Из кипятильников пар и кипящий раствор
подаются в куб регенератора; регенерированный раствор выводится из
аппарата, а пар поступает под глухую тарелку, барботирует через
раствор, находящийся на тарелке, и поднимается вверх по регенератору.
В верхней части регенератора расположен распределитель
орошения и тарелки (копачковые) для промывки газа флегмой от паров и
брызг ЫЭА.
Аппараты для разгонки JMgA.. Установки моноэтанолашшовсй
очистки обязательно снабжаются аппаратами для разгонки МЭА в
присутствии щелочи, что является главным фактором снижения химических
потерь амина и уменьшения коррозии. Разгонку проводят в специальных
аппаратах под вакуумом или при давлении регенерации с подачей пара
в присутствии щелочи. На разгонку поступает небольшая часть
раствора; чистые пары МЭА отводят в куб регенератора, а продукты
побочных реакций накапливаются в аппарате. Ваэгонка под давлением
регенерации осуществляется в аппарате, снабженном паровым нагревателем.
Она проводится в две стадия (полунепрерывный процесс).Вначале
разгонка идет с подачей МЭА, с добавкой 3% щелочи (первая стадия 12-
15 суток). По мере отгонки МЭА и воды в аппарате накапливаются вы-
сококипящие примеси и температура повышается. При температуре 140-
146°С подпитку прекращают и начинают вторую стадию - выщелачивание
амина при непрерывной подаче пара (двое суток). После того как
содержание амина в паре снизится до 0,5%, разгонку прекращают.
Кубовый остаток удаляют промывкой водой.
Очистку раствором МЭА проводят также фильтрацией его через
угольные или другие фильтры. На фильтрацию направляют от I до 25$
раствора. Кроме улавливания взвесей, адсорбция на угле позволяет
значительно снизить концентрацию растворенных примесей.Уголь
полностью отрабатывается примерно за два месяца.
Экономическая эффективность МЭА окистки. Основной статьей
расхода являются затраты тепловой энергии, которые сильно колеблются
223
в зависимости от схемы процесса, состава газа, степени
очистки,давленая и других факторов. При абсорбции при атмосферном давлении
расход тепла составляет около Ц700 кДж/м3 Cu2 ; при абсороции под
давлением по двухпоточной схеме 7955-9210 кДж/м3.
Многодоточная схема (см.рис. 64) дает возможность снизить
расход тепла до 5200-5500 кДж/м3 СОг • т-е> в Д^1 ^аза по сравнению
с простейшей схемой при низком давлении. Причем утилизируется тепло
конвертированного газа.
Расход электроэнергии невелик и составляет 5-8 квт.ч/1000 ш3
очищаемого газа.
Практически расход МЭА составляет О,1С-МЗ,Г2 кг на I0O0 м3
газа, но при хорошей эксплуатации установки он может быть снижен до
0,05 кг/1000 м3 газа. Потери МЭА обусловлены уносом его с газом и
расходом на побочные необратимые реакции. МЭА является недефицит-
ным и недорогим абсорбентом.
Количество отходов (газовых сдувок и смол после разгонки МЭА)
незначительно и не оказывает заметного влияния на общие выбросы
предприятия.
Таким образом, с механической, экономической и экологической
точек зрения процесс моноэтаноловой очистки приемлем для
использования его на современных предприятиях.
ОЧИСТКА ГАЗОВ РАСТВОРАМИ КАРБОНАТОВ
Процесс основан на абсорбции кислых гааов водными растворами
карбонатов натрия и калия с активирующими добавками окислов
поливалентных металлов (As, Se, Те, st) или некоторых органических
соединений. Процесс основан на протекании обратимой реакции
При нагревании реакция сдвигается влево и возможна регенерация
раствора.
Давление углекислоты над раствором раосчитывается по
эмпирическому уравнению
?n.
h kr(,-x)(B-t) ' "'•«¦'. (8.8)
где к„ - коэффициент Генри для системы Щ-ЦЯ ; х - степень
превр и:ения в бикарбонат; t - температура; я - концентрация
карбоната, г-зкв/л. А и В - коэффициенты, имеющие значения для соды;
А - 76, В = 185 и для поташа; А = 25 и S = 150. Значения Рс0 =f(x)
.олл 1-н. раствора к2сдъ даны на рис. 65.
<2А
і,, мм pm.cm.
Рис.65. Зависимость парциального давления са2 над 1-н. водным
раствором к*со3 при различных температурах от степени превращения
карбоната в бикарбонат: „
/ - 0; ? - 10; 3 - 20; 4 - 30; /-40°С.
Рис.66. Растворимость
кой ДЭА 5%.
СО2 в Зонном растворе
с добав-
Скорость аосорбции практически полностью лимитируется
скоростью реакции в жидкой фазе
Cu2 * 0/t~ = мсо}
и не зависит от процессов в газовой фазе.
Коэффициенты массопередачи ледат в пределах 0.7-2,5 кмол/м3 ч;ко-
эффициент полезного действия барботажных тарелок порядка 0,07-0,1.
Скорость процесса десорбции лимитируется в основном скоростью
разложения бикарбоната, а также скоростью обназования пузырьков в
жидкой фазе. Поэтому для десорбции предпочтительны тарельчатые
колонны.
Карбонаты и особенно бикарбонаты натрия и калия имеют
недостаточно высокую растворимость при обычных температурах;мала также
скорость взаимодействия углерода с карбонатами. Поэтому в настоящее
время широкое распространение получила очистка горячими растворами
карбонатов, активированными различными добавками, несмотря на
повышение парциального ^давления щ над раствором. При повышенных
225
температурах становится приемлемой скорость гидратации /"^ и
процесса абсорбции в целом.
Теплота растворения Щ в поташных растворах примерно в 2,5
раза меньше, чем в растворах МЭА и равна 603 кДж/кг СОг
.Следовательно, растворимость углекислого газа с повышением
температуры изменявтоя медленнее, чем в МЭА, но в большей степени зависит
от давления (рис.66). Поэтому при снижения давления С0г де
сорбируется в значительной степени. Эти особенности раотворов
карбонатов позволяют осуществить процесс очистки, в котором
абсорбция и регенерация проводятся при близких значениях температур, но
абсорбция протекает при повышенном давлении, а десорбция - при
низком.
Процесс очистки при повышенной температуре лучше согласуется
с процессами конверсии г метанирования. Меньшая степень
охлаждения перед очисткой и затем меньшая степень нагрева перед метени-
рованием позволили резко снизить затраты на тедлообменную
аппаратуру и снизить энергетичеокие раоходы.
Очистка горячим раствором поташа, активированным ДЭА. Широкое
распространение получила очистка газов от Лг, горячими
растворами поташа с добавками диэтаноламина (ДЭА). Например, в процессе
"Кароол" абсорбентом является 25-28$6-ный раствор к2соз с
содержанием в нем 1,8? ДЭА. В раствор добавляется также ингибитор коррозии
(пятиокись ванадия) в количестве 0,4? и антивспениватель
(силиконовые масла) /53/.
Очистка способом "Карсол" проводится по схеме, показанной на
рис.67. Абсорбция осуществляется по двухпоточной схеме. Большая
часть (80$) раствора после грубой регенерации подается в среднюю
часть абсорбера / при 100-103°С, другая часть - в верхнюю часть
абсорбера. Это позволяет снизить содержание Л^, в газе до 0,05-
0,156.
Абоорбцшо ведут в насадочных аппаратах, состоящих из верхней
и нижней секций с насадкой из керамических седел "Инталокс".
Насыщенный раствор при 106-П0°С поступает в гидравлические турбины 3
и после снижения давления - в регенераторы ¦# . Грубо
регенерированный раствор (80$) отбирается после верхней секции регенерации и
подается в н^йиою секцию абсорбера. Тонко регенерированный раствор
из куба колонны охлавдается в холодильнике / и подается в верхнюю
часть абсорбера. Около 2% от общего потока раствора проходит
непрерывную' фильтрацию на активированном утле..
< Во многих агрегатах синтеза'аммиака мощностью 1360 т/сутки
осуществляется очистка от С#2 по рассмотренной схеме.Параллельно уста-
226
Рис.67. Схема очистки газа от со. горячим раствором поташа
(процесс "Карсол"):
/ - абсорбер; 2 - сепаратор; з - гидравлическая турбина; 4 -
регенератор; 5 - теплообменник; 6 - воздушный холодильник; 7 -
кипятильник; 6 - наоос; 9 - фильтр;
/ - конвертированный газ; / - очищенный от Cuo газ ; «> - тон-
корегенерированный раствор; у - груборегенерированный раствор; / -
насыщенный раствор; к' - углекислый газ; t" - теплоноситель.
навливаются два абсорбера высотой 58 м и диаметром верхней части
2,2 ы, нианей 3,4 и и два регенератора высотой 65 м и диаметром
верхней части 4,5 м, низшей 3,7 м. Концентравдя сог в очищенном
газе 0,05-0,1?.
Очистка мышьяковисто-поташным раствором. Достаточно активным
катализатором реаквдй, протекашшх при абсорбции СО2 поташем и
десорбции из раствора, являются соединения трехвалентного мышьяка.
Процесо поглощения СО2 мокно представить следупцей схемой:
-t SCO2
(8.9)
227
В промышленных установках процесс ведут при температуре 60-
65 С с использованием раствора примерно следующего состава: I7uf
г200 г/л н2о и I2CK-I50 г/л As2 0j , что соответствует отношению
мышьяка и калия [М ] : [к] = 0,145. Скорость реакций поглощения
Ct?2 в таком растворе примерно в два с половиной раза выше, чем
в растворе поташа. В результате этого в промышленных абсорберах
достигается степень насыщения раствора, составляющая 85-90$ от
равновесной. При абсорбции под давлением поглотительная емкость
растворителя близка к емкости растворов МЭА и колеблется в
пределах 20-35 м3 С0г /м3.
При мышьяково-поташной очистке содержание ?uz в очищенном
газе рационально поддерживать в пределах 0,1-0,6/6. Может быть
достигнута степень очистки и до 0,05/S, но при этом возрастает расход
пара на регенерацию раствора.
Принципиальная схема очистки дяня на рис. 68.
Конвертированный газ при давлении 26-30 ат и температуре Ю0-120°С поступает в
абсорбер / , орошаемый сверху тонко регенерированным раствором с
температурой 65-70°С. Нижняя часть абсорбера орошается груборегене-
рированным раствором. Пройдя двухступенчатую очистку, газ имеет
остаточное содержание СО^ 0,05-0,25$, в зависимости от требований.
Насыщенный раствор поступает на расширение в гидравлическую
турбину агрегата мотор - насос - турбина 5 и вырабатывает энергию
для привода насоса (может быть установлен и обычный дроссель).
Затем парожидкостная смесь подогревается в теплообменнике 4 и
поступает в емкость 3 для отдувки углекислоты. Продувка производится
инертным газом или воздухом. Можно обойтись и без продувки,но
уменьшится степень регенерации раствора. Из куба емкости 3 большая часть
груборегенерированного раствора через воздушный холодильник 6
подается на орошение части абсорбера. Оставшаяся доля раствора подается
на более полную регенерацию в регенератор 2 . Верхняя часть его
может орошаться небольшим количеством воды, сконденсировавшейся в
холодильнике-дефлегматоре. Куб колонны подогревается
конвертированным газом. Регенерированный раствор с содержанием бикарбоната не
более 2,0$ при температуре П0-120°С проходит через теплообменник •
и холодильник S и подается на орошение верхней части абсорбера.В
этой cxev. при продувке воздухом получается около 25-40$ чистой
углекислоты, остальная часть смешивается с продувочным газом и
выбрасывается в атмосферу.
228 ' ¦
Рис.68. Схема очистки газа от л^ мышьяково-поташным раотвором:
/ - абсорбер; 2 - регенератор; з- отдувочная емкость; 4 -
теплообменник; 5 - агрегат мотор - насос - турбина; а - воздушный
холодильник; 7 - кипятильник; 3- насос; 9 - сепаратор;
/ - конвертированный газ; / - очищенный газ; і - тонкореге-
нерированный раствор; \у - груборегенерированный раствор; / -
насыщенный раствор; v - углекислый газ; к* - теплоноситель; і*-
газы продувки.
На очистку 1000 м3 газа расходуется примерно 0,06-0,07 кг ^s2o3;
0,16-0,17 кг кон и около 18 квт-ч электроэнергии.
Рассмотренный процесс достаточно экономичен, но существенным
недостатком его является сильная токсичность мышьяка.
Общая оценка очистки газа растворами карбонатов и МЭА. Из
рассмотренных процессов можно сделать вывод, что очистка газов от сог
горячими растворами поташа имеет ряд положительных особенностей,
позволяющих существенно снизить расход тепла. При моноэтаноламино-
вой очистке 40-60$ тепла расходуется на подогрев раствора
вследствие недорекуперации в теплообменниках. При очистке растворами
поташа расход тепла на нагрев раствора значительно меньше.Кроме того,
при моноэтаноламиновой очистке 25-30$ тепла расходуется на
разложение соединений МЭА с СО. . При поташной очистке эта величина умень-
229
лается в два о половиной раза; пар расходуется в основном лишь на
отдувку Сог в десорбере и на покрытие тепловых потерь в окружаю-
щув среду.
Но, если сравнить два широко распространенных процесса МЭА-
ІМАП и "Карсол", то оказывается, что расходы тепла в них
различаются незначительно, но все-таки в последнем он несколько ниже.Очистка
мышьяковисто-поташным раствором по схеме, представленной на рис.68,
требует примерно вдвое меньших затрат тепла, но связана с токсичным
соединением.
При МЭА-очистке значительно меньшая (почти в два раза)
циркуляция раствора. Благодаря этому, а также вследствие более высокой
скорости абсорбции габариты абсорберов и регенераторов значительно
меньше, чем в процессе "Карсол"; ниже также расход электроэнергии
и выше степень очистки. Более высокая степень очистки сникает
потери водорода на стадии метанироваыия и с продувочными газами на
стадии синтеза аммиака.
При поташной очистке требуется значительно меньше теплообмен-
ной аппаратуры. Раствор поташа не образует смолистых
высокомолекулярных соединений и менее вязок, чем растворы МЭА. Кроме того,
поташ более дешев, чем МЭА. Это является преимуществом поташной
очистки.
Если сравнивать эксергетический коэффициент полезного действия
процессов, то получается, что он более высок при мышьяковисто-поташ-
ном способе, ниже в процессе "Карсол" и еще ниже в процессе МЭА-ПШ1.
Можно сделать заключение, что все рассмотренные способы
очистки конкурентоспособны. Выбор оптимального процесса очистки может
быть сделан только после детального технико-экономического анализа.
В настоящее время наиболее широкое распространение получили
процессы очистки поташом с добавкой ДЭА, но широко используются и
процессы моноэтаноламиновой очистка,
АБСОРБЦИЯ С02 ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
И РАСТВОРАМИ В НИХ АЖАНОШМНОВ
Процессы очистки, основанные на хемсорбпии, имеют общий недостаток,
заключающийся в том, что на регенерацию растворов требуется
значительное количество тепла, а растворимость в них Л>2 с ростом
давления повышается медленно.
В современных установках, раоотаюших под давлением 20-35 ат,
эффективны процессы физической абсорбции при нормальной и
пониженной температурах. Рассмотрим основные из них.
230
АБСОРБЦИЯ МЕТАНОЛОМ ПРИ ОТЙЩАТЕЛШЫХ ТЕМПЕРАТУРАХ
(ПРОЦЕСС "РЕКТИЗОЛ")
При снижении температуры происходит резкое увеличение растворимости
iuc в метаноле и возрастает селективность абсорбции. Десорбция
осуществляется путем снижения давления Оез подогрева. Теплота
растворения СОг в метаноле составляет 16,55 кДж/моль D,5 ккал/моль).
Зависимость растворимости от давления выражается уравнением
-= 0,425 f-
о
(8.10)
где
? - давление паров чистой сжиженной C0g ; х — мольная доля
A?2 в растворе.
Очень велика растворимость в метаноле сероводорода и серооргани-
ческих соединений, что обусловливает возможность комплексной
очистки газа.
N
Рис.69. Схема двухступенчатой очистки синтез-газа от сернистых
соединений и двуокиси углерода захоложенным метанолом (процесс "Рек-
тизол"):
/ - теплообменник; 2 - аммиачный холодильник; 3 - абсорбер
сернистых соединений ( fys, ?0S ) ; 4 - холодильный блок; s -
абсорбер Щ ; S - регенератор сернистых соединений; 7- регенератор Л?г ;
/ - газы конверсии углеводородов; / - свежий метанол, w -
очищенный газ: Гг - Cuo ; j-COo+fy ; с' -'технически^азот; t* -
сернистые газы \7t,S, COS ); и» - амшак-хладоагент; // - водный раствор
метанола.«
Скорость абсорбции метанолом достаточно велика. По сравнении с
абсорбцией СО^ водннми растворами этот процесс имеет то
преимущество, что отсутствует медленная стадия гидратации двуокиси углерода.
231
Скорость процесса зависит лишь от скорости диффузии газа в жидкость,
которая относительно медленно уменьшается с понижением температуры.
Технологические схемы очистки газов метанолом обычно
достаточно громоздки, но за последнее время они значительно упрощены и
выгодны при комплексной очистке газов. Одна из таких схем
представлена на рис. 69 /92, 93/.
Конвертированный гав, насыщенный парами воды, охлаждается
холодным потоком очищенного газа в теплообменнике / и кипящим
аммиаком в холодильнике 2 до температуры 20f25°C. Замерзание
аппаратуры предотвращается впрыском метанола. В абсорбере 3 , который
орошается частично регенерированным от Л2, метанолом, извлекаются
сульфосоединения. Очищенный газ направляется на конверсию uu
.Конвертированный газ охлаждается в холодильном блоке 4 ,
холодильнике 2 и поступает в абсорбер Щ S , где очищается от Д% при
температуре около - 50°С и через холодильный блок 4 выходит из
установки. Насыщенный сорбент из абсорбера 3 после дросселирования и
нагрева полноотью регенерируется в регенераторе a за счет подвода
тепла. Регенерированный сорбент смешивается с сорбентом,
регенерированным в регенераторе 7 и подается в верхнюю часть абсорбера s.
В среднюю часть его подается полурегенерированный раствор иа
середины десорбера 7 , насыщенный сорбент из абсорбера f регенерируется
в аппарате 7 путем сброса давления и продувкой азотом. Охлаадение
потоков осуществляется за счет абсорбционной аммиачной холодильной
установки.
Расход тепла и механической энергии в процессе "Ректизол"
сравнительно невелик. Особенно эффективен он в тех случаях,
когда в технологическую схему входит стадия глубокого охлаждения,
например при промывке газа жидким азотом. Сочетание комплексной
очистки метанолом со стадией умеренного охлаждения позволяет создать
экономичную в целом аммиачную установку.
Абсорбция /-метилпирролидоном ( М-МП ) (процесс "Пуризол" ).
В качестве растворителя используется
Ж-метилпирролвдон,обладающий высокой поглотительной способностью и сравнительно легкой
регенерацией. Бри атмосферном давлении и 20°С в І м3 А/-Ш
растворяется 4 м3 сог и 12 м3 H2S . Ж-МП нетоксичен, не обладает
коррозионной активностью, но стоимость его довольно высокая.
Насыщенный водой конвертированный газ поступает в абсорбер,
где вначале осушается насыщенным N-Ш., а затем из него
извлекается СО« регенерированным Ж-МП. В верхней части абсорбера име-
232
етея секция для водяной промывки уходящего газа. При хорошей
конструкции прошвателя и правильной эксплуатации пары и брызги /С-МД
извлекаются практически полностью при очень малом расходе воды на
орошение.
Насыщенный сорбент вначале регенерируется путем
двухступенчатого сброса давления до атмосферного. Поглощенные #2 и Cu
выделяются при относительно высоком давлении и подаются рециркуляционным
компрессором в очищаемый газ. Оставшаяся после сброса давления Л?
отгоняется из /У-МП продувкой воздухом иди азотом. Отходящий газ
промывается водой.
Часть раствора /У-МП непрерывно отводится в колонну 3 на
ректификацию. Обезволенный M-МП отводится из нижней части
колонны, а водяные пары в смеси с газом - с верхней. В этой же колонне
М-Ш извлекается из газов второй ступеня сброса давления.
Обезвоженный Л'-МП подается в среднюю часть десорбера. При хорошем
улавливании /f-МП процесс "Пуриэол" является достаточно экономичным.
Абсорбентом может служить диметиловый эфир полиэтиленгликоля
(процесс "Селексол"). Но этот растворитель имеет высокую стоимость
и де<{ицитен.
Абсорбция растворами МЭА и ДЭА в метаноле (процесс "Амизол"^
Недостатком процесса "Ректизол" является абсорбция при отрицательных
температурах, а растворы МЭА в воде имеют слабую концентрацию и
соответственно низкую поглотительную способность. На регенерацию их
требуется большое количество тепла. Для устранения этих недостатков
были разработаны методы очистки растворами алканоламинов в
органических растворителях.
В процессе "Амиэол" абсорбентом служит раствор алканоламинов
(МЭА и ДЭА) в метаноле. Абсорбция осуществляется при нормальной
температуре, а регенерация раствора - при температурах не выше Ю0°С.
Поступающий на очистку газ промывается в абсорбере. Насыщенный
сорбент без подогрева направляется в регенератор, работающий при
почти атмосферном давлении, где кислые газы отгоняются иэ
растворителя вместе с парами метанола. Регенерированный сорбент после
охлаждения подается в абсорбер. Газ из верхней части регенератора
поступает ъ водяной холодильник, в котором конденсируется метанол,и
подается на орошение регенератора. Остаточное количество метанола
отмывается иэ газов водой в промывочной колонне. Смесь метанол - вода
разделяется в дистилляционной колонне.
Для регенерации сорбента требуется ниэкопотенциальное тепло,
которое в достаточном количестве имеется на аммиачных и Бодородшх
233
установках. В настоящее время процесе "Амизол" имеет ограниченное
применение /92, 93_/.
В процессе "Сульфинол" в качестве абсорбента используется
раствор алканолашша в двуокиси тетрагидротиофена или вдклотетраме-
тиленсульфоне (сульфолане) /53_/. Примерный состав абсорбента: 30$
ДЭА, 645? сульфолана, 6% воды. Такой абоороент хорошо поглощает с&2.
cs., COS и меркаптаны, абсорбция проводится при нормалыюй
температуре, а десорбция - при температуре 65°с и пониженном давлении.
В силу ряда недостатков широкого распространения при очистке
конвертированного газа этот процесс не получил.
ОЧИСТКА ВОДОРОДА МЕТОДОМ К0РОТК0ІЩІ0В0Й АДСОРБЦИИ
С ДЕСОРБЦИЕЙ СБРОСОМ ДАВІШИЯ (КЦАДСД)
Процесс основан на адсорбции цеолитами всех имеющихся в смеси
газов {СО, СО2, Cfy, H20, ttc ), кроме водорода. Через поры цеолитов,
размер которых соизмерим с размерами молекул, проходят, не
задерживаясь, только молекулы водорода, имеющие относительно меньшие
размеры, более крупные молекулы остаются на поверхности пор.На
адсорбцию молекул влияют также их форма и свойства.
Процесс адсорбции осуществляется в аппаратах с неподвижным
слоем адсорбента и является циклическим с регенерацией сорбента
сбросом давления без дополнительного нагрева. Адсорбция производится
под давлением 12-40 ат при температуре газа от 4 до 30°С. Все
примеси, содержащиеся в водороде, удаляются в одной ступени, и
получается водород чистотой до 99,999$ /34, 95/, Количество поглощенного
вещества и скорость адсорбции зависят от парциальных давлений уда-
ляешх компонентов, поэтому адсорбцию ведут при повышенном давлении.
Регенерация осуществляется путем сбросе, давления до 1-4 ат и
последующей продувкой газом, который не поглотился адсорбентом. По
такой схеме цикл состоит из стадий: адсорбции, сброса
давления,продувки и подъема давления. Стадии чередуются с периодами в несколько
минут, поэтому процесс получил название короткопикловой адсорбции
без затраты тепла.
Адсорбционный метод очистки конвертированного газа заменяет
три стадии: низкотемпературную конверсию ?0 , абсорбцию cu^ и ме-
танирование остатков СО и Cu„.
Для непрерывной подачи водорода необходима система из четырех
адсорберов. В одном из них идет адсорбция с получением чистого
водорода; в другом - десорбция сбросом давления; в третьем - продуві»;
?34
в четвертом - подъем давления. Сокращая время продувки и подъема
давления, можно обойтись гремя адсороерами. В начальный период
Сороса давления из аппарата выходит газ с высоким содержанием
водорода, поэтому он подается компрессором в адсорбер, подготовленный
к стадии адсорбции, что позволяет сократить потери водорода с
отходящими газами регенерации. Обычная степень извлечения водорода
составляет 80-90/6.
Применяются системы адсорберов, состоящие из четырех - десяти
аппаратов /9^/. Это обусловлено цикличностью работы адсорберов.
На установках большой мощности предпочтительной является
система с 10 адсорберами, которая дает следующие преимущества:
примерно на 10? увеличивается полнота выделения
водорода;практически исключаются колебания расходов, присущие циклическому
процессу; повышается надежность, поскольку можно работать при
сниженной нагрузке, используя лишь часть установленных аппаратов.
На установке с десятью адсорберами водород улавливается на
нескольких ступенях выравнивания давления; причем водород, выделянций
ся при сбросе давления, используется для повышения давления в
продутых адсорберах. Кроме того, водород, находящийся в системе,использу
ется для продувки очередного адсорбера. Таким образом, часть
водорода репиркулирует в системе, а не удаляется с отходящим газом. Этим
достигается высокая степень извлечения его.
Все отходящие газы в процессе КЦАДСД должны полностью
использоваться в качестве топлива для печей конверсии, так как они имеют
низкое давление и умеренную теплоту сгорания, а их качество и коли--
чеотво колеблются в течение рабочего цикла. Это затрудняет
использование газа на других установках. На долю отходящих газов
приходится 70-90/Е всего потребляемого установкой тепла. Поэтому колебания в
расходе и составе газа должны быть незначительны (+1$), чтобы не
оказывать отрицательного влияния на срок службы реакодонных труб и
катализатора конверсии.
Выравнивание состава и расхода отходящего газа в системе из
десяти адсороеров осуществляется следующим образом. Процесс ЛДСД
проводится в двух параллельных цепочках со сдвигом на полпериода
цикла (рис. 70). В значительной степени колебания расхода и
состава выравниваются объединением потоков из двух адсороеров,
находящихся в разных фазах десорбции. Остаточные колебания выравниваются
применением двухаппаратной системы. Первый аппарат действует в
качестве буферного, второй - в качестве смесителя, выравнивающего
состав. Буферний аппарат заполняется в начале заключительной фазы
235
сброса давления, когда из адсорбера удаляются большие количества
rasa. Затем, при меньшем выходе газа, он направляется
непосредственно в смесительный аппарат, где поддерживается постоянное низкое
давление. Таким образом, расход, давление и состав топливного газа
поддерживаются практически постоянными.
Основой надежной работы установки является безотказная
работа приблизительно 50 клапанов (при 10 адсорберах), переключающих
потоки по восемь раз в течение одного часа. Клапаны должны
обеспечивать полное закрытие на протяжении длительного периода
эксплуатации. Переключение клапанов управляется программным реле на
транзисторах, которые контролируют также положение всех клапанов. В слу-
"чае выхода иа строя одной технологической цепи, она автоматически
отключается, а вторая продолжает работать с производительностью
50-60/S от полной.
0,5 1,0
Фазы циклод
Еис.70. Зависимость расхода отходящего
из адсорберов газа от фазы цикла:
/ и S - соответственно первая и
вторая технологические цепочки.
Типичная чистота получаемого водорода 99,999-99,99. Увеличение
полноты извлечения водорода за счет снижения его чистоты не
эффективно. И эти параметры (чистота и степень извлечения) практически
не регулируются.
По сравнению с классическим методом получения водорода
(конверсия метана и СО , метанирование) адсорбционный способ имеет
следующие преимущества: получение водорода высокой степени чистоты,
меньшее гидравлическое сопротивление системы, снижение себестоимости.
236
Недостатком являются цикличность работы в сложная система
переключения клапанов, невысокая степень извлечения водорода. В
результате применения описанной технологии очистки стоимость водорода
может быть снижена на 8+10%.
ВЫДЕЛЕНИЕ ВОДОРОДА С ПОМОЩЬЮ ПОЛУПРОШЦАШй МАТЕРИАЛОВ
Для чистого водорода могут применяться мембраны, проницаемые для
водорода и непроницаемые для других газов. Промышленное приыенсшие
нашли способы, основанные на проникновении водорода через пленку ша-
ладия толщиной 0,02-0,1 мм при температурах 200-700°С. Таким ыдиео-
оом получается сверхчистый водород. Но мембраны из палладмевых
сплавов не выдерживают давления и постепенно разрушается в среде ведоро
да. Поэтому в крупнотоннажных производствах падладаевые мембраны не
применяется.
Более технологичны полимерные мембраны, пропускающие водород и
задерживающие другие газы. В промышленности нашш применение иуети-
телые полиэфирные волокна. Движущая окла разделения - разность
давлений онаружи и внутри волокон.Водород и гелии проникают
внутрь,волокон значительно быстрее,чем остальные газы,и можно
получить водород ЭЭ^-ноя чистоты /йЛ
Фирма "Монсанто11 разработала ашіарат для выделения водород;.,
названный призм-сепаратором. По конструкции призм-сепаратор (ри~.
71) напоминает кожухотрубчатыи теплообменник. В нижней
распределительной решетке закреплен пучок из 10-100 тыс.волокон наружным
диаметром 800 мкм (внутренний диаметр - 400 мкм). Волокна изготовлены
из полисульфона со специальным покрытием. Верхние концы волокон
заглушены. Пучок вместе с заглушкой и решоткой вмонтирован в трубную
оболочку диаметром 100 или 200 мм, длина волокна 3-6 м.
Разделяемая газовая смесь поступает в кожух снизу и проходит вдоль волокон
вверх. Проникший внутрь волокон водород отводится через коллектор,
а оставшаяся газовая смесь выходит с верха аппарата. Давление в
аппарате может быть до 2,5 МПа, температура - до 40 С.
Промышленные установки с призм-сепараторами работают в
промышленности с 1977 г. Например, фирмой "Монсанто" на установке по
производству оксо-спиртов они используются для получения синтез-газа
с соотношением н* ¦. СО = 3,1м : I. Давление смеси в аппарате 2,3 МПа,
а в полооти волокон - 0,73 МПа, чистота извлекаемого водорода - 96$.
237
ш
me.71. Аппарат (призи-сепаратор) для
разделения с помощью полупроницаемых
полых волоков:
/ - заглушка для волокон; 2 -
пучок полых волокон; 3 - корпус, f -
решетка;
/ - вход газовой смеси; / - выход
проникающих компонентов D« #е )\ 9 -
выход непроникавдюс компонентов смеси.
Описанный способ выделения водорода достаточно экономичен
конкурентоспособен о другими методами при концентрации /^ в ис
ной смеси не менее 3($.
Глава 9.
ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ ПРОИЗВОДСТВА.
РАСЧЕТ, АНАЛИЗ И ОПТИМИЗАЦИЯ
В предыдущих главах рассмотрены отдельные процессы производства:
очистка от сернистых соединений, конверсия углеводородов, очистка
конвертированного rasa от окиси и двуокиси углерода. Приведены
детальные схеыы этих процессов. В этой разделе будут рассмотрены
полные технологические схемы производства синтез-газа и водорода, а
такке схемы производства ыетанола-сырца и аммиака. Приведенные
схемы являются принципиальными, но они компонуются из схем отдельных
процессов, и при необходимости может быть синтезирована более
подробная схема указанных производств. Основное внимание уделено
современным технологический схемам с паровой конверсией в трубчатых печах
но приведены также схемы производств, построенных в предыдущие годы
и находящихся сейчас в эксплуатации.
СХЕШ ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗОВ
МЕТОДАМИ АВТОТЕРМИЧЕСКОЙ КОНВЕРСИИ
Получение технологического газа методами автотермической парокисло-
родной и паровоздушной конверсии природного газа широко'
распространено в СССР и некоторых других странах. Одно из преимуществ этого
метода - универсальность. Получение различных по назначению
технологических газов и применение в качестве исходного сырья
углеводородных газов различного состава не требует существенного изменения
технологической схемы и ее аштратурного оформления /ie/. До начала
строительства крупных аммиачных комплексов (середина 60-х годов) в
Советском Союзе значительная доля аммиака производилась парокисло-
родной и паро-кислородовоздушной конверсией природного газа. В
настоящее время еще значительная часть аммиака и метанола
производится этим способом.
Схемы получения технологического газа для синтеза аммиака и
метанола при низком давлении. Разработанные в СССР схеми получения
газов для синтеза аммиака и метанола при давлении около 0,17 МПа
имеют много общего и состоят в основном из однотипных элементов.
239
Вис.72. Схема получения технологических газов для синтеза аммиака
при низком давлении:
/ - сатурапионная оашня; 2 - теплообменник, совмещенный с
увлажнителем; 3 - байпасный клапан; * - конвертор метана; s -
конвертор окиси углерода; 6 - нагнетатель кислородо-воэдушнои смеси; 7 -
котел-утилизатор; g - водонагревателышй теплообменник; 9 - насос;
/о - конденсационная башня; // - теплообменник; Г2 - абсорбер cty '•
ІЗ - брызгоотделитель; г4 - регенератор; /S - скруббер-охладитель;
re - теплообменник;
/ - природный газ; / - углекислый газ; * - пар; (f -
конденсат; / - кислород; 0 - воздух; и» - конвертированный газ; к* -
очищенный конвертированный газ; /х - абсорбент; / - питательная
вода.
Поэтому рассмотрим их совместно. На схеме рис.72 представлен
аммиачный вариант схемы. С давлением 0,17-0,19 МПа газ поступает в ниж--
нию часть сатурационной башни / для насыщения параш воды. Если
вырабатывается газ для синтеза метанола, то на входе в башню
подается определенное количество двуокиси углерода, рассчитанное,
исходя из заданных составов исходного и конвертированного газов с уче-
гом параметров процесса конверсии. Обычно отношение со^ к природ-
240
ному газу составляет @,ЗСН-0,33) : I. Источником двуокиси углерода
на большинстве заводов являются газы после регенерации растворов-
поглотителей aag. Например, газы регенерации раствора МЭА
содержат свыше 99/? COq с примесями U0 я /fy-
Парогазовая смесь после сатурационной башни поступает в мея-
трубное пространство кожухотрубного теплообменника 2 ,
совмещенного с увлажнителем, куда подают также водяной пар для получения
смеси с отношением пар:газ = I. Парогазовая смесь, нагретая в
теплообменнике до 50О-600°С за счет тепла конвертированного газа,
поступает в межтруоное пространство смесителя реактора 4 , в трубки
которого подают кислород или кислородо-воздуишую смесь при
температуре 50-60°С.
При паро-кислородо-воздушной конверсии перед нагнетателем S
технический кислород смешивают с воздухом. Концентрацию кислорода
в кислородовоздушной смеси (в пределах 40-45/?) и количество смеси
устанавливают из условия достижения заданной температуры процесса
конверсии и получения технологического газа с отношением (л^у-л?):
:#г « 3,1 Лб, 62/.
Реакционная смесь подготавливается в смесителе и поступает на
катализатор конвертора 4. С температурой 750-850°С (в зависимости
от допустимой остаточной концентрации метана) конвертированный газ
поступает в увлажнитель, совмещенный с теплообменником 2 , где
быстро охлаждается до температуры 6ОО-650°С за счет испарения
впрыскиваемого парового конденсата. В увлажнитель подают также
определенное количество водяного пара для точного регулирования заданного
соотношения пар:газ, необходимого для нормальной работы первой
ступени конверсии СО. Конструктивно увлажнитель может быть совмещен с
теплообменником, как это показано на схеме, или оформлен в виде
отдельного аппарата.
Из увлажнителя конвертированный газ направляется в трубки
теплообменника, охлаждается там до 400°С и поступает в конвертор окиси
углерода 5. Для точного регулирования температуры предусмотрена бай-
пасная линия, по которой часть газа может быть отведена из
увлажнителя помимо теплообменника. Отношение пар:газ на входе в конвертор
СО составляет примерно 0,4 при паро-кислородо-воздушной и 0,62-
0,65 при парокислородной конверсии природного газа /І6/.
. Конверсия СО осуществляется на железо-хромовом катализаторе
в первой ступени до содержанияЛ? в газе 5-9/? и затем, после
охлаждения за счет испарения конденсата, во второй ступени - до со-
241
дергания СО 2-3,5?. При температуре 350-400°С конвертированный
гаа направляется в котел-утилизатор 7 для производства пара
давлением 0,5-0,8 ЫПа. Пар используется для конверсии нетана, окиси
водорода и для регенерации раствора МЭА. Излишки, пара подаются в
заводскую сеть. Газ с температурой около 200°С из
котла-утилизатора поступает в водонагревательный теплообменник S , где
нагревается до 85 С вода, поступающая в сатурационную башню / . Количество
испарившейся в оашне воды компенсируется добавлением химически
очищенной воды. Газ с температурой около 80°С поступает в
конденсационную оашню Ю для окончательного охлавдения водой до 30-35°С.
Схема конверсии газа для получения метанола отличается тем,
что отсутствует конвертор окиси углерода. Гааовая смесь, состоящая
из Cty, C&2 и нг0 в соотношении приблизительно 1:0,35:0,33, при
температуре 75-85°С поступает в межтрубное пространство колухотрубно-
го теплообменника 3 ; сюда подают также дополнительное количество
пара, необходимое для получения отношения пар:гаа = 0,68:1.
Парогазовая смесь нагревается до 450-500°С за счет тепла
конвертированного газа.
Из теплообменника парогазовая смесь поступает в смеситель
реактора 4 для смешения с кислородом, концентрацией не менее 98?.
Перемешанный газ со скоростью 40-80 м/с поступает в конвертор ^
на слой никелевого катализатора. Конвертированный газ при
температуре 850-900°С направляется.по футерованному газоходу в
котел-утилизатор 7 для получения пара под давлением 6-8 ат. Далее газ при
температуре около 600°С поступает в трубки теплообменника 2 , где
отдает свое тепло исходной парогазовой смеси, и при температуре
около 300°С направляется в теплообменник в , где подогревает
воду,поступающую в сатурационную башню 1.
Очиотка газов от двуокиси углерода как в аммиачном, так и в
метанольном вариантах осуществляется чаще всего абсорбцией моноэта-
ноламшюм (МЭА). Поглощается COg в абсорбере 12 12-15#-шм
раствором МЗА. Насыщенный раствор регенерирует в десорбере /4 при
ІІ5-І20°С. Парогазовая смесь прн 100-Ю5°С поступает в
скруббер-охладитель IS, где конденсируется избыток водяного пара; охлаждение
проводится циркулирующим конденсатом. При производстве метанола
выделенная CU. подается в поток природного газа перед сатурацион-
ной башней / . Материальный баланс паро-кислородо-углекислотной
конверсии представлен в табл. 19, а соотав газа на различных учаот-
ках схемы производства аммиака - в табл. 20.
242
Таблица 19. Материальный баланс паро-кислородо-углекислот-
ной конверсии (на 1000 м 3 природного газа)
Компонент
M,,
C2HS
C3Hg
со2
Cu
Л2 + Ar
°2
Н2О
Всего
Природный газ
м3
917,7
37,8
16,9
3,5
-
-
24,1
-
-
1000
%
91,77
3,78
1,69
0,35
-
-
2,41
-
. -
100
cu , u2.
м3
Сухой
конвертированный
м3
16
-
-
162 293
876
2015
11,0 34
547
920,0
1640
3234
газ
%
0,50
-
-
9,06
27,08
62,30
1,06
-
-
100
Газ на
м3
15,8
-
-
29,3
863,4
1985
33,7
-
-
2927
синтез
%
0,54
-
-
1,00
29,50
67,81
1,15
-
-
100
Таблица 20. Состав газа на различных с талиях производства
аммиака автотермичєской конверсией природного газа
СО,
со
Компонент
€О2
СО
н2
»г
Ar
сн.
С2 + аь/сш
ог
нго
Природный
газ
Паро-
газо-
кисло-
родная
смесь
Газ после
конвертора
влажный
сухой
Газ после кон-'
вертора Cu
влажный
сухой
Паро-кислородо-воздушная конверсия
( СН^ : Н2
0,5
-
-
1.5
-
97,6
0.4
-
( L
0 : О2 : ВОЗДУХ =
0,2 5,01
14,60
42,19
25,6 18,34
0,4 0,30
28,3 0,41
ОД
16,3
29,1 18,55
1:1:0,33:1,1; р = I,'
6,90
17,90
51,88
22,45
0,37
0,50
-
-
¦-
13,8 18,0
3,7 4,0
44,0 57,6
15,0 19,7
0,2 0,3
0,3 0,4
- -
-
23,0
Паро-кислородная конверсия
0: 3-1:1
,05:0,
53; Р -
После
очистки 0Т<2>
7 ат
1,5
4,8
69,2
23,6
0,4
0,5
-
-
=1,7 ат )
7,86 ' 9,70 15,55 22,80 0,01
16,62 20,50 2,05 3,00 3,90
54,18 66,97 48,77 71,80 93,00
243
Окончание таил. 20
Компонент
Ar
Природ-'
ный газ
_
-
96,5
3,5
-
-
Парокислородная
Cu2
СО
/i2
#e
Аг
02
H>0
0,5
-
-
1.5
-
97,6
0.4
-
Паро-
газо-
кисло-
родная
смесь
0,1
1,0
37,1
1,3
20,1
40,4
Газ после
конвертора
влажный
0,07
0,60
1,62
-
-
19,05
Конверсия (^ :
0,1
_
-
0,5
0.8
27,0
0,1
16,2
55,3
7,99
11,08
40,67
0,37
0,56
1,24
-
-
38,09
сухой
0,08
0,75
2,00
-
-
-
Н2О:Ое -.
12,90
17,90
65,58
0,60
0,92
2,00
-
-
_
Газ после кон- '
вертора <
влажный
0,05
0,43
1,15
-
-
32,0
сухой
0,07
0,63
1,70
-
-
= 1:2:0,59;/?=20
12,47
1,26
36,00
0,27
0,41
0,89
-
-
48,70
24,30
2,46
70,18
0,52
0,80
1,74
-
-
-
После
очистки от
0,09
0,82
2,18
-
-
ат)
0,01
3,25
92,71
0,68
1,50
2,30
-
-
-
Компримирование сшітез-газа до 320 ат производится
компрессорами различных типов и производительности. Аммиачіше установки по
рассматриваемой схеме имеют небольшую производительность ( до
360 т/сутки М$ ), и для сяатия газа применяются поршневые
компрессоры мощностью до 4000 кВт с электрическим приводом, В метанольных
агрегатах мощностью 40-45 тыс.т метанола в год компримирование син-
тен-газа производится 6-ступенчатыми опдозитными компрессорами.
Сейчас такие установки не строятся, но сыграли большую роль в
азотной промышленности и продолжают работать на некоторых заводах.
Схемы получения газа для синтеза аммиака при давлении 2,0-
2,5 МПа. Работа конверторов и других аппаратов под повышенным
давлением позволяет снизить себестоимость аммиака и метанола
вследствие снижения энергетических затрат на сяатие синтез-газов.Но с
повышением давления равновесие сдвигается в сторону меньшей степени
244
zr/
Рис.73. Схема получения технологического газа для синтеза аммиака
"Лурги":
; - кислородный компрессор; 2 - конвертор метана,
совмещенный с котлом-утилизатором; 3 - теплообменник для нагрева
парогазовой смеси; 4 - паросборник-сепаратор; s - увлажнитель; ? -
конвертор со ; ? - скруобер-охладитель; в - аммиачная абсорбционная
холодильная установка; g - конденсационная колонна; /о -
установка "Ректизол": а7 - установка отмывки со и cfy жидким азотом; л? ~
циркуляционный насос; /з - холодильник;
./ - природный газ; / - кислород; /// - азотоводородная смесь;
// - пар 30 ат; / - конденсат.
конверсии метана, поэтому процесс проводят при значительном
разбавлении паром (пар.таз = 2,5-г2,7).
По схеме "Пурги1* Срис.73) процесс конверсии осуществляется в
аппарате 2 , представляющем собой конвертор, совмещенный с котлом-
утилизатором. Природный газ с давлением около 27 ат поступает в
теплообменник 3 , непосредственно присоединенный к
котлу-утилизатору. В теплообменник подается такие насыщенный пар. Проходя по
межтрубному пространству, газ смешивается с паром, подогревается
газами конверсии до 425-470°С и поступает в смеситель реактора і\ Свда
же компрессором / подается кислород под давлением около 3,0 МПа.
Парогазовая смесь поступает на катализатор и осуществляется
конверсия метана. Объем катализатора для реактора производительностью
4000 нм3/ч по природному газу составляет 2,6 м3.
Конвертированный газ охлаждается во встроенном
котле-утилизаторе и затем в теплообменнике 3 до 430°С и поступает в
увлажнитель 5 , где регулируется его температура перед входом в конвер-
245
тор cu C80-400 С). После двухступенчатой конверсии Л? газ при
температуре 400 С поступает ? скруббер-охладитель / и,
охладившись до 180-190°С, поступает ? аммиачную холодильную установку,где
используется тепло конденсации пара. С температурой 150-170°С
конвертированный газ поступает в конденсационную колонну C , середина
которой охлаждается горячим конденсатом (90-97°С), а верх -
холодным B5-35°С). С температурой 40-43°С газ поступает на установку
"Ректизол" для отмывки со^ захоложенным метанолом и затем на
установку отмывки СО и cq жидким азотом и получения азотоводородной
снеси.
Азотоводородная смесь сжимается до 550 ат и идет в агрегат
синтеза аммиака, где осуществляется синтез при давлении 500 ат. Аммиак
выдается в охлажденном виде. Состав газа в различных точках схемы
приведен в табл.20.
По схеме, разработанной в ІИАП, процесс конверсии протекает
при 1,9-2,0 МПа. Природный газ подогревается до 400°С в отдельном
теплообменнике газом, выходящим из конвертора окиси
углерода.Реактор совмещен с увлажнителем, где температура снижается с 830-050 до
420°С, что обусловливает более низкую степень рекуперации тепла,чем
в схеме "Лурги".
При использовании конвертированного газа для синтеза метанола
процесс парокислородной конверсии ведут при 870-950°С. При этих
параметрах остаточное содераание метана не превышает 0,552. Отношение
H2-СО составляет около 3,8:1. Для повышения содержания ?О до
требуемого при оинтезе конвертированный газ смешивают с
газом,полученным методом высокотемпературной конверсии метана при 2,0 МПа с
отношением H 2 ¦¦ СО -1,7:1.
Рассмотренные выше схемы являются чисто
технологическими.Энергия для сжатия газов и других целей подводится со стороны. Более
экономичными являются энерготехнологические схемы. При получении
синтез-газов методом автотермической конверсии такие схемы могут
быть легко осуществлены. В качестве примера на рис.74 представлена
энерготехнологическая схема производства аммиака паровоздушной
конверсией природного газа, разработанная в Институте газа АН УССР.
Нагрев парогазовой смеси, технологического воздуха и перегрев
энергетического пара осуществляются в огневом подогревателе
высокого давления /, являющемся и генератором рабочего тела для газовой
турбины под давлением 0,8-1,2 МПа.
'Подогретые до 500-550°С парогазовая смесь и воздух поступают
в смеситель конвертора метана 2 . Давление в конверторе 3,5-4,2МПа;
246
II
Рис.74. Энерготехнологическая схема паровоздушной конверсии метана:
' - огневой подогреватель высокого давления; /- конвертор
метана; 3 - котел-утилизатор; 4 - конвертор со ; s - абсорбционная
холодильная машина; 7 - абсорбер С02 ; S - газовая турбина; 9 -
воздушный компрессор; 7О - подогреватель питательной воды; >t -
дымовая труба; /? - холодильник; /3 - осушитель; /t - блок глубокого
охлавдения и очистки синтез-газа; tf - паровая турбина; -V -
компрессор азотоводородной смеси; /7 - агрегат синтеза аммиака.
1 - природный газ; в - топливный ra3j m - насыщенный пар
высокого давления; w - питательная вода; / - воздух, t> - дымовые
газы; tji - перегретый пар высокого давления; *»' - технологичеокий
пар; Гх - конвертированный газ; / - азотоводородная смесь; л? -
поглотитель С02 ; $ - аммиак.
Щ : воздух = I : B,8СК2,86); Нг0:С^х2 : I. После смешения
образуется смесь примерно следующего состава: Щ •¦ нг0 ¦ о2 s Mg -
= 1:2:0,6:2,2. При температуре на выходе из конвертора метана 850°С
получается газ следующего состава (об.% в пересчете на сухой газ):
Нг - 37,6; СО - 3,4; Л? - 8,8; (*г *Аг ) - 43,2.
Конвертированный газ охлаждается в котле-утилизаторе э ' до 420-450°С ж
поступает в конвертор окиси углерода А . В данной схеме
достаточно иметь одну ступень конверсии со на среднетемпературном
катализаторе, чм упрощает эксплуатацию. Остаточное содержание СО затем
извлекается в блоке глубоко охлавдения. После конвертора CU газ
снова поступает в котел-утилизатор. В котлах-у.тилизаторах выраба-
247
тывается насыщенный пар высокого давления ( Р - 10,0-12,0 МПа).
Конвертированный газ направляется в адсорбционную холодильную ыа-
шину S , где используется значительная доля тепла конденсации
пара. Очистка от COj проводится в абсорбере 7 горячим раствором
потош или МЭА (см.рис. 64 и 67).После охлавденкя до +18°С и
сепарации влаги газ поступает на осушку молекулярными ситами в
осушитель із . Отношение /? .- мг в конвертированном газе равно
примерно 1:1. Лишнее количество азота удаляется в с блоке глубокого ох-
лавдения его частичной конденсацией. Одновременно извлекаются
также имеющиеся в газе ео и ?^ . Смесь jft,co в щ добавляется
в топливный газ. Очищенная азотоводородная смесь сжимается в
компрессоре /f . Привадим компрессора является паровая турбина с
противодавлением, работающая на паре высоких параметров ( t = 550°С;
Р =12,0 МПа). Отработанный пар с давлением 35-45 ат
используется ДЛЯ КОНВерСИИ СНц И СО.
Сяатая азотоводородная смесь поступает в агрегат синтеза
аммиака 17. Продувочные и танковые газы используются как топливо.
Воздушный компрессор 9 служит для создания давления в
подогревателе / и сжатия технологического воздуха. Приводом
компрессора служит газовая турбина 8. Отработанные газы после выхода из
турбины отдают тепло питательной воде и через дымовую трубу
сбрасываются в атмосферу.
По данной схеме на I т аммиака расходуется около 1200 ы3
природного газа; при этом полностью удовлетворяются энергетические
потребности установки.
Создание подогревателя высокого давления принципиальных
трудностей не представляет, ^гак как подобные аппараты (парогенераторы
высокого давления) уже внедрены в промышленность и используются на
парогазовых электростанциях. Подогреватель под давлением может быть
заменен обычным и установлена газовая турбина со стандартной
камерой сгорания. При этом тепловая экономичность установки несколько
снизится, но останется достаточно высокой.
ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ ПРОИЗВОДСТВА АММИАКА
С ДВУХСТУПЕНЧАТОЙ КОНВЕРСИЕЙ
В настоящее время аммиачные производства, использующие в качестве
сырья природный, нефтезаводской газ или бензиновые
фракции,строятся по следующей схеме: сероочистка—•-• паровая конверсия——
паровоздушная конверсия—«- среднетешературная конверсия и низкотеше-
248
І7
Рис.75. Схема агрегата конверсии природного газа фирмы "ЭНСА".
і - сепаратор; 2 - турбокомпрессор природного газа; з - аидо
греватель питательной вода; і - экономайзер; S - подогреватель
природного газа; S - первичный подогреватель парогазовой смеси;?
испаритель; S - подогреватель воздуха; 9 - вторичный
подогреватель парогазовой смеси; tu - радиантная камера печи; я ~
реакционные трубы; 72 - футерованный коллектор; п - шахтный реактор;
/¦ -• котел-утилизатор; ts - адпараты сероочистки; /S - смеситель,
1? - дымососы; /g - деаэратор; /3 - насос; го - паросборник; г/~
воздушный фильтр; 22 - воздушный коьшрессор; 23 - смеситель-
дегазатор;
/ - природный газ; й - воздух; '7/ - конвертированный газ; W-
тошшвный газ; і - продувочный газ;" V ~ конденсат; «S" - азото-
водородная смесь; юн - питательная вода; /J - пар 40 ат; / -
пар 13 ат; а'/ - питательная вода; xl/ - дымовые газы.
ратурная конверсия СО —— очистка от СО2 -*¦ метанирование окислов
СО СО„ •- компримирование ABC —•- синтез аммиака. Давление
газа в начале технологической цепи 3,8-4,5 МПа. По-видимому, такая
схема наиболее оптимальна так как альтернативы ей пока нет. Все
строящиеся производства однотипны. Различия состоят в основном в
некоторых вариациях мощности технологических параметров,
конструктивного оформления оборудования и применяемых конструкционных мате-
249
риалов. Возможны также не принципиальные изменения технологической
схемы.
В процессе разработки находятся охемы о внсоконалорным
трубчатым реактором и парогазовым энергетичеоким циклом, с криогенной
очисткой ABC и некоторые др.
Технологические схемы ^ирмы "ЭНСА" (рис. 75. 76). Достаточно
надежной и экономичной схемой производства аммиака двухступенчатой
конверсией природного газа является схема французской фирмы "ЭНСА".
Несколько таких уотановок мощностью 600 т/сутки -f/^ работает в
Советском Союзе.
Схема не является энерготехнологической. В
котлах-утилизаторах получают пар среднего давления D0 ат), идущий в основном на
конверсию в трубчатую печь. Сжатый до 3,8-4,0 МПа природный газ
вмешивается о азотоводородной смесью и поступает в конвективную
зону печи, где нагревается до 380°С и затем направляется на очистку
от сернистых соединений. Система очистки аналогична описанной выше.
Очищенный газ смешивается с водяным паром ( ( s 3,7:1) и
направляется в конвективные змеевики нагрева парогазовой смеси (см.рис.75),
При температуре 520-540°С газ поступает в реакционные трубы //, где
конвертируется 90-92^ метана. Остаточный метан конвертируется в
конверторе /3, куда компрессором 22 подается воздух, подогретый
до 500°С в конвективном змеевике в печи. Из нижней части реактора
конвертированный газ при температуре 960-Ю00°С и давлении 26-28 зт
поступает в котел-утилизатор /4 и охлаждается в нем до 5Ю-520°С.
Природный газ после сепаратора смешивается с продувочными
газами отделения синтеза аммиака в обогреваемом смесителе 23 и идет
на сжигание. Дымовые газы о температурой около 180°С выбрасываются
в атмосферу дымососами, один из которых имеет турбинный, а другой -
электрический привод.
Питательная вода из цеха водоподготовки проходит
подогреватель 3 и направляется в колонну деаэратора г» , куда поступает
также конденсат технологичеокого пара. Пар вырабатывается в котле-
утилизаторе /4 ив специальном і рубчатом пучке 7 в конвективной
зоне печи. Последний может быть совмещен с экономайзером.
Конверсия з трубчатой печи 2 проводится іюд давлением 3.2-
3,6 МПа (см.рис.76). После вторичной конверсии в шахтном реакторе
5 конвертированный газ охлаждается в котле утьлизаторе s и эа-
гем в теплообменнике 5 до 380-430°С. Регулировка температуры на
зходе-в конвертор СО осуществляется впрыском конденсата и доддер-
гаваетая на уровне 375-ЗЭ0°С. На выходе из первой ступени конверсии
250
Рис.76. Схема производства аммиака фирмы "ЭНСА":
/ - компрессор природного газа; 2 - печь конверсии; 3 - аппараты серноочистки; 4 -
воздушный компрессор; J - реактор паровоздушной конверсии; 6 - котел-утилизатор; / -
теплообменник: б - конвертор окиси углерода; 9 - испаритель; /о - кипятильник раствора МЭА; // -
холодильник; /2 - aocopoep сог ; /^ - реактор метанирования; /f- регенератор МЭА; /s
-многоцелевой кошрессор; /7 - аг егат синтеза аммиака;
¦~ч охлаждается в испарителе 10 за счет испарения конденсата и с
температурой около 230°С подается на вторую низкотемпературную
зтупень конверсии, после которой содержание в газе СО не
превышает 0,5%. Конвертированный газ охлаждается в кипятильнике II и за-
*ем Е холодильнике 12 до 40°С и поступает в абсорбер С0?, орошае ¦
><чй раствором МЭА. Очищенный газ подогревается в теплообменнике
9 до температуры 320° газом, выходящим из котла-утилизатора, и
поступает в реактор метанирования 14, где пароисходит гидрирование
остаточного количества СО и COg. Азотоводородная смесь сжимается в
компрессоре Io и поступает в агрегат синтеза аммиака 17. Нродувст-
гіне и танковые газы агрегата синтеза используются как топливо.
Особенностью схемы моноэтаноламиновой очистки является то, ти
кипятильник МЭА раствора работает за счет тепла конвертированного
! >ar>fi после второй ступени конверсии СО.
Вырабатываемый в котле-утилизаторе пар средних параметров
A0 ат) используется в основном как технологический для конверсии
четача; избыток его направляется в заводскую сеть. Сжатие азотово
породной смеси с 2,3 до 37,0 МПа проводится в многоцелевом
поршневом компрессоре с электрическим приводом. Имеется три ступени ежа
тия с промежуточным охлаждением газа. На одну тонну аммиака расходу
ется около 1080 іґ природного газа и 800 кВт-ч электроэнергии; при
этом выдается на сторону около 0,55 Гкал тепла в виде
40-атмосферного пара.
Состав газа на различных стадиях производства представлен в
табл.21.
'г а Г> л и у а 21. Состав газа на различных стадиях производства
аммиака (#1 - Кб)
Компонент
СО
»7
N2
Ar
CHO
-, r abCuA
I j 2
3
Установка
0,5 10,0
10,0
69,0
1,5 2,3
-
Ь8,0 8,7
10,0
4
"ЭНСА"
7,5
12,5
57,0
22,5
0,20
0,3
_
5
6
, 600 т/сутки
16,0 17,9
2,5 0,3
61,2 61,5
19,8 19.8
0,2 0,2
0,3 0,3
_
7
0,01
0,36
74,70
24,30
0,25
0,38
_
8
Следы
Следы
74,50
24,55
0,25
0,70
_
¦::-2
Окончание табл.21
компонент
I
сог
со
»2
Ar
1,5
-
-
2,5
-
89,0
¦а. 7,0
Установка "Пульман келлог",
1,26
-
10,69
5,73
0,04
76,09
6,00
10,21
9,67
69,09
1,81
0,01
9,21
_
7,88
12,36
57,06
22,07
0,28
0,35
_
15,03
3,65
60,40
20,35
0,25
0,32
_
1360 т/сутки
17,55
0,55
61,58
19,76
0,25
0,31
_
0,01
0,67
74,68
23,97
0,30
0,38
_
Следы
Следы
74,26
24,37
0,30
I.U7
_
Примечание. Ноыера столбцов соответствуют точкам
схемы; I - природный газ на входе; 2 - газовая сыесь на входе в
трубчатую печь; 3 - конвертированный газ после трубчатой печи; 4 -
конвертированный газ после конвертора второй ступени; 5 - газ после первой
ступени конверсии СО; 6 - газ после второй ступени конверсии СО; 7 -
неочищенная аэотоводородная сыесь после абсорбера С02; 8 - аэотоводс
родная смесь после ыетанирования.
Знерготехнологическая схема "Пульман - Келлог" (рис. 77, /8).
Аммиачные комплексы, разработанные и спроектированные компанией
"Келлог", производительностью от 600 до 1500 т/сутки аммиака,
получили наиболее широкое распространение во всем мире. По этой схеме вира
батывается не менее половины мирового производства аммиака /92, 937.
Природный газ, идущий на конверсию, смешивается с азотоводород-
ной смесью (ABC : газ - 1:10), дожимается в компрессоре 20 до
давления 40-46 ат и подается в огневой подогреватель I, где нагревается от
130-140 до 370-400°С. В реакторе проводится гидрирование серооргани-
ческих соединений до сероводорода на алюмо-кобальт-молибденовом
катализаторе, а в аппарате 3 - поглощение сероводорода сорбентом на
основе окиси цинка. Обычно устанавливаются два абсорбера, которые могут
соединяться или последовательно, или параллельно - один из них может
отключаться на перегрузку сорбента. Содержание серы в очищенном газе
не должно превышать 0,5 мг/м^ газа. Газ смешивается с водяным паром
в отношении пар : газ =3,5+4,0: I и парогазовая смесь поступает
в конвективную зону печи конверсии 6. Работа печи детально
рассмотрена выше. Конвертированный газ с температурой 800-850°С и
давлением около 30 ат поступает в смеситель шахтного реактора 12. Сюда же
компрессором 23 подается технологический воздух, нагретый в
конвективной эоце печи до 480-500°С. В реакторе конвертируется оставшийся
253
после печи метан (около 8 + 10%) до содержания его в газе не более
0,3 - 0,35^. При этом получается технологический газ с отношением
(СО + Н2) : М? , равным 3,05 + 3,10. При температуре около Ю00°С
газ поступает в котлы-утилизаторы 13 и 14 первой и второй ступеней.
Первая (высокотемпературная) ступень состоит из двух аппаратов,
расположенных симметрично по отношению с шахтному реактору 12. На
выходе из нее газ имеет температуру около 600°С. Аппараты 12 и 13,
а также коллектор II снабжены водяной рубашкой. После первой
ступени конверсии СО установлен еще один котел-утилизатор 16.
Природный газ, предназначенный для сжигания в печи, огневом
подогревателе, вспомогательном и пусковом котлах, поступает в
дегазатор 26, в который сбрасывается также газовый конденсат из
сепаратора и промежуточных холодильников компрессора. Легкие фракции
конденсата испаряются и обогащают топливный газ. Часть топливного
газа, идущая на сжигание в печь, нагревается в конвективной зоне ее
до 150°С. Дымовые газы с температурой 160-200°С выбрасываются в
атмосферу двумя дымососами 5 через дымовую трубу.
Приводом всех основных компрессоров, насосов и дымососов
являются паровые турбины, пар для которых получается непосредственно на
установке следующим образом. Питательная вода подвергается тонкой
очистке на механических и ионообменных фильтрах и под давлением 120-
160 ат подается в змеевик-подогреватель конвективной зоны печи; при
температуре 2Ь0-300°С она поступает в общий барабан-паросборник 13,
который соединен со вспомогательным котлом 7, котлами-утилизаторами
13, 14, и 16, в которых вырабатывается насыщенный пар под давлением
106—110 ат. Насыщенный пар перегревается в пароперегревателе, встро-
¦<Рис.77. Схема агрегата конверсии аммиачного производства с печами
типа "Келлог":
I - огневой подогреватель; 2 - реактор гидрирования сернистых
соединений; 3 - адсорбер #2S ; 4 - смеситель; 5 - дымосос с
паротурбинным приводом; 6 - конвективная зона трубчатой печи конверсии; 7 -
вспомогательный котел; 8 - радиационная зона печи; 9 - реакционные
трубы; 10 - подъемные трубы; II - паросборник; 12 - шахтный
реактор; 13 - котел-утилизатор первой ступени; 14 - котел-утилизатор
второй ступени; 1Ь - конвертор СО первой ступени; 16 -
котел-утилизатор; 17 - увлажнитель: 18 - конвертор СО второй ступени; 19 -
конденсационная турбина; 20 - компрессор природного газа; 21 -
сепаратор; 22 - воздушный конденсатор; 23 - компрессор технологического
воздуха; 24 - воздушный фильтр; 25 - испаритель-сепаратор:
I - природный газ; П - перегретый пар высокого давления; Ш - пар при
Р = 40 Ша после основной турбины компрессора синтез-газа; ІУ -
конвертированный газ на охлаждение и очистку от С0?; У - питательная
вода; УІ - технологический воздух; УП - азотоводородная смесь; УШ -
топливный(газ; IX - паровой конденсат,
255
. пС.,7и. Схема установки производстве аммивка "Пульман - Келлог":
І - реактор десульфирования; 2 - трубчатая печь конверсии; 3 - ре~
• гупени)
-іаратор; ^,
•гф; 12,13 - сепараторы.
Г. - углеводородное сырье; П - питательная вода; Л - углекислота;
1> -¦ технологический воздух; У - технологический пер; УІ - топлив-
'•пй газ; УП - пер высокого давления; УШ - жидкий аммиак; IX - про-
ігувочнне гаэн.
еином в трубчатую печь, до 480°С (на ряде агрегатов получают пар с
? = 14,0 МПа и t= 530-560°C). Перегретый пар направляется в
основную турбину компрессора синтез-газа, работающего с противодавлением.
slap после этой турбины (Р = 41,5 et, t= 370°) используется как
технологический для конверсии и для питааия турбин среднего давления -
»¦онденсационннх и с противодавлением. Мощность основной турбины
высокого давления - около 35000 кВт, а турбин среднего давления - до
<'-> тыс. кВт. Буфером для компенсации изменений технологических
параметров агрегата может служить небольшой турбогенератор на паре сред-
Mfro давления (Р = 4,0 МПа). Из общего количества газа,
потребляемого установкой, приблизительно 60% идет на конверсию и 40% - на сжи~
• чние.
После котла-утилиэатотэа газ при давлении 2,8-3,5 МПа с темпера-
ґ.-.-рой около 400°С поступает в конвертор СО первой ступени, после кз-
: 'рой'также установлен котел-утилизатор. После низкотемпературной
•1С
конверсии СО и охлаждения газ поступает на очистку от двуокиси
углерода. Тепло конденсации водяных паров часто используется в
абсорбционных аммиачных холодильных Машинах.
Отмывка С02 может проводиться карбонатами, МЭА и другими
растворителями. После очистки от COg неочищенная азотоводородная
смесь нагревается и подается в метанатор. Очищенная ABC
поступает в отделение компрессии и затем в агрегат синтеза аммиака.
Давление в колонне синтеза на различных установках неодинаково и
лежит в пределах 14,0 - 32,0 Ш1в.Состав газа в различных точках
схемы установки 1360 т/сутки Щ представлен в табл.21.
Схема энерготехнологическая (см. рис. 78), пар для
паротурбинного привода компрессоров вырабатывается за счет тепла газов
конверсии и во вспомогательном котле. На технологические нужды
пар берется после расширения в цилиндре высокого давления паровой
турбины. По рассмотренной схеме могут быть созданы однопоточные
аммиачные комплексы производительностью до 3000 т/сутки аммиака.
Стема фирмы "Браун" (рис.79^. Схема основана на
двухступенчатой каталитической конверсии газообразных и жидких углевородов.
Отличительной особенностью является то, что газ после первичного
реформинга содержит до 2<3% непрореагировавшего метана, а
температура на выходе из реакционных труб равна 720-730°С, т.е. режим
работы печи более мягкий.
На вторичный реформинг подается воздуха на 30-50^ больше, чем
это требуется для получения азотоводородной смеси в соотношении
t*2 •¦ Яр =3:1, необходимом для синтеза аммиака. Температура на
выходе из шахтного реактора около 900°С Полученный газ проходит
двухступенчатую конверсию окиси углерода в аппаратах 6 и 7 и
поступает в абсорбер 8 для очистки от С02 раствором карбоната калия или
органическими растворителями. Затем газ подогревается до 320°С и
поступает в метанатор 10. После охлаждения водой и хладоагентом
газовый поток проходит через осушители II, заполненные цеолитами.
Затем газ, состоящий из 60-70^ /К, ( 30-40 #2 , 2-356 Щ и 0,5^
Ar , поступает на установку криогенной очистки 12. Сырье
охлаждается примерно до -176°С и ректифицируется. Верхним продуктом является
газ с соотношением Н?'.¦ М% =3:1, примесью аргона около 0,2% и
следами метана. Нижний продукт - метан с избыточным азотом и
следами окисло! углерода.
Очищенная азотоводородная смесь сжимается в компрессоре 13,
смешивается с рециркуляционным газом и подается в колонну синтеза
257
Рис.79. Схема аммиачной установки "Браун":
I - десульфоризатор; 2 - воздушный компрессор; 3 - газовая
турбина; 4 - трубчатая печь конверсии; 5 - шахтный реактор
паровоздушной конверсии: 6,7 - высоко- и низкотемпературный конверторы СО;
8 - десорбер С02; 9 - абсорбер СО^; Ю - метанатор; II -
осушители; 12 - установка криогенной очистки; 13 - компрессор азотоводо-
родной смеси; 14 - колонна синтеза аммиака; Id - аппарат отмывки
МНч из продувочных газов ; 16-17 - сепараторы аммиака;
I - газовое сырье; П - технологический пар; Ш - неочищенная ABC:
ІУ - ABC на синтез; У - жидкий аммиак; УІ - продувочные газы; УП -
конденсат; УШ - пар высокого давления; IX - двуокись углерода.
аммиака 14. Готовый продукт отводится из сепаратора 17 в жидком
виде. Из продувочных газов аммиак отмывается водой, а газ,
содержали значительную долю аргона, частично подается на вход осушителя.
Подача избытка воздуха нв вторичный реформинг обеспечивает
гибкость силового цикла. Компрессоры криогенной очистки и сжатия
азотоводородной смеси имеют привод от паровых турбин, а воздух для
вторичной конверсии сжимается в компрессоре, приводимом газовой
турбиной. Продукты сгорания турбины 3 подаются в печь конверсии 4.
Установка может быть спроектирована как сбалансированной по пару,
так и с потреблением или выдачей пара на сторону /92, 93_/.
, По описанной схеме построено несколько установок мощностью
от 750 до 1Ь00 т/сутки нн, в США и Голландии.
258
ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ ПРОИЗВОДСТВА СПИРТОВ G КОНВЕРСИЕЙ
В ТРУБЧАТЫХ ПЕЧАХ
Ранее на базе парокислородной конверсии строились установки по
производству метанола мощностью 35-50 тыс. т/год. За последние
годы значительно усовершенствованы все стадии производства метанола.
Синтез метанола ведется непосредственно из газов конверсии. На
активных катализаторах, кроме синтеза из СО, осуществляется синтез
метанола из СО^ по реакциям
?0 +2/B =
Синтез метанола из смеси СО и COg значительно упрощает
технологическую схему, что повышает технико-зкономические показатели,
несмотря на разбавление метанола водой.
Газ для синтеза должен удовлетворять следующим требованиям:
высокое содержание в газе СО; соотношение (^-СО?): (?u + sa2).=
= 2,1:2,2; содержание инертных компонентов (Щ, ^ и Ar)
должно быть минимальным; газ не должен содержать каталитических
ядов. Газ, удовлетворяющий этим требованиям, легко получается в
трубчатых печах пуп ем подбора нужного соотношения С мт ¦ //20:я??
/18/.
Наряду с использованием давления 300-320 ет многие установки
работают при среднем A00-150 ет) и низком D0-6U ат)
давлении /96J.
Установка BASF (ФРГ) производительностью 7U0 т/сутки (рис.80).
В качестве сырья используется легкий бензин каталитического
крекинга, который испаряется в перегревается до 350-370°С в испарителе I.
Лройдя аппараты сероочистки 2 и 3, пары бензина смешиваются с
водяным паром и направляются в конвертор низкотемпературной конверсии 4,
где при температуре на выходе около 450°С получается газ,
содержащий около Ь2% щ . Этот газ подвергается вторичной паровой
конверсии на другом катализаторе при 8с0-870°С в трубчатой печи Ь.
Полученный газ пригоден для синтеза метана без последующей обработки.
В печи сжигаются продувочные и танковые газы. Тепло
конвертированного газа иЪпользуется для выработки naps высокого давления,
дополнительно пар получают и в конвективной зоне печи.
После охлаждения и выделения воды конвертированный газ подает-
259
w
Рис.ВО. Схема производства метаноле под высоким давление« фирмы
"БАСФ" :
I - испаритель и подогреватель сырья; 2,3 - аппараты сероочистки;
4 - низкотемпературный конвертор; & - трубчатая печь; 6 - котел-
утилизатор высокого давления; 7 - турбокомпрессор; 8 -
котел-утилизатор; 9 - колонна синтеза; 10 - теплообменник; II - воздушный
холодильник, 12 - сепаратор;
I - сырье; ЇЇ - водород; Ш - технологический пар; ІУ -
конвертированный газ: У - топливный газ; УІ - конденсат-сырец; УП -
продувочные газы; УШ - метанол-сырец.
ся в турбокомпрессор 7, четвертая ступень которого служит также
для компримирования рециркуляционного газа. Через теплообменник II
оиятез-газ подается в колонну синтеза 9. На выходе из колонны
установлен котел-утилизатор 8, после которого контактный газ
охлаждается дополнительно в воздушном холодильнике II и, освободившись от
метанола в сепараторе 12, подается на четвертую ступень
компрессии. Синтез метанола осуществляется при 25,0-32,0 МПа и 300-Э80°С.
Встроенный энергетический цикл сводит к минимуму потребление
электроэнергии /96/.
Схема производства метанола при низком давлении E,0-6,0 iiUIa)
(рис. 81, 82). В последние годы получили широкое распросвтранение
схемы синтеза метанола на низкотемпературных катализаторах при
давлении 5,0-6,0 МПа. Низкотемпературные медьсодержащие катализаторы
весьма чувствительны к соединениям серы; поэтому природный газ (или
жидкое сырье) должен очищаться до содержания серы не более I мг/м .
Очистка проводится путем гидрирования сернистых соединений с
последующей адсорбцией окисью цинка. Очищенный газ смешивается с водяным
паром в отношении 1:3 и с температурой 340-350°С направляется н
подогреватель парогазовой смеси I, находящейся в конвективной зоне
печи. Нагретая до 5Ю°С парогазовая смесь поступает в реакционные
260
їх
Рис.81. Схема агрегата конверсии природного газа метанольной установки:
I - сепаратор; 2 - компрессор природного газа; 3 - огневой подогреватель; 4 - аппарат
гидрирования сернистых соединений; 5 - поглотители H2S ; 6 - радиантная камера печи; 7 - реакционные
трубы; В - горелки: 9 - защитный котел; 10. II - секции пароперегревателя; 12 - подогреватель
парогазовой смеси; 13 - котел-утилизатор; 14 - воздухоподогреватель; 15 - паросборник-сепаратор; Id -
воздуходувка; 17 - дымосос; IB - котел-утилизатор на конвертированном газе; 19 - теплообменники;
20 - сепараторы; 21 - воздушный холодильник; 22 - водяной холодильник; 23 - отпарная колонна;
I - природный газ; П - продувочные газы; Ш - топливный газ; ІУ - воздух; У - технологический пар;
УІ - конденсат; УП - перегретый пар высокого давления; Ш - питательная вода; IX - конвертирован-
ный газ.
w
Рис.82. Схема производства метанола при низком давлении:
I - огневой подогреватель; 2 - аппаратура сероочистки; 3 -
трубчатая печь конверсии; 4 - котел-утилизатор; 5 -
паросборник-сепаратор; 6 - система рхлаждения конвертированного газа: 7 - сепаратор;
8 - паровая турбина; 9 - компрессор синтеэ-газа; 10 -
теплообменник; II - огневой подогреватель; 12 - колонна синтеза; 13 -
воздушный холодильник; 14 - сборник метанола-сырца;
I - природный газ; П - перегретый пар высокого давления ( г - ПО ат,
t - 540°С); Ш - пар среднего давления (Р - 40 ат); ІУ - конденсат;
У - питательная вода; УІ - синтез-газ; УП - двуокись углерода; УШ -
метанол-сырец.
трубы V. Конвертированный газ с температурой 8Ь0-660°С и давлением
I,8 МПа направляется в котел-утилизатор 18 для охлаждения до 380°С.
Дальнейшее охлаждение осуществляется в теплообменниках (рекуперация
низкопотенциального тепла) и затем в воздушном и водяном
холодильниках.
Особенностьо конструкции печи является наличие защитного котла
9 на входе j конвективную камеру, предохраняющего от перегрева
трубный пучок пароперегревателя 10. Температура перегрева пара
регулируется впрыском питательной воды между секциями 10 и II
пароперегревателя.
262
Температура дымовых газов на входе в конвективную секцию
около 990°С, а после пароперегревателя - 693°С. В котле-утилизаторе 13
температура дымовых газов снижается с 500 до 390 С. В
воздухоподогревателе 16 газы отхлаждаются до 120°С, воздух при этом
нагревается до 350°С и подается в горелки радиантной зоны. Благодаря высокой
степени утилизации тепла тепловой коэффициент полезного действия
печи превышает 9Оу6.
На установках фирмы /С/ производительностью 750 тыс. т/год
метанола устанавливается два таких агрегата по 1250 т/сутки метанола.
Сухой очищенный газ при t = 35 + 40°С и Р = 1,Ь МПа поступает в
центробежный компрессор (рис. 82), где сжимается до 5,5 - 7,0 МПа.
Приводом служит паровая турбина, работающая на паре высокого
давления A00 - 120 ат). Отработанный в турбине пар при давлении 3,5 -
4,0 МПа направляется на смешение с сырьем и затем на конверсию.
Смесь свежего и циркуляционного газов нагревается в
теплообменнике 10 до температуры 220-230°С и поступает е колонну синтеза
метанола 12. В период пуска и выхода на режим синтез-газ нагревается в
огневом подогревателе II. Газовая смесь после адчонны синтеза
охлаждается в теплообменнике 10 и затем в воздушном холодильнике 13.
Продувочные газы добавляются в топливо; циркуляционный газ
направляется на последнюю ступень компрессора 9 или в специальный
циркуляционный компрессор с приводом от турбины среднего давления.
Сконденсировавшийся метанол-сырсц отвадится из сборника 14. .
Эта знерготехнолсгическая схема синтеза метанола является
наиболее экономичной из внедренных в промышленность /"I?, 9o у*.
Дальнейшее повышение экономичности может быть достигнуто путем
разработки "бескоюір>.ссис.нннх" схем, в которых конверсия проводится
при давлении синтеза 50-70 ат. Особенно это выгодно при конверсии
жидких углеводородов, так как упраздняется компрессор природного
газа f°nj.
Чтобы обеспечить необходимую глубину конверсии метана при более
высоком давлении, необходимо повышенное разбавление сырья паром или
применение вторичного парокислородного конвертора. Тепло
конденсации пара может иечол*зеваться в абсорбционной холодильной млшине.
Схема производства газа для оксосинтеза (рис. 83). Синтезы на
основе окиси углерода приобретают все большее значение; Синтез-газ
получают Чіарруглекислотной конверсией углеводородов. Отношение СО :
Hg в синтез-газе должно быть около I; это обусловливает особенности
в технологической cxej*e. Необходимо работать при малом отношении
263
Рис.83. Схема производства газа для оксосинтеза из бутана и нафты:
I - огневой подогреватель; 2 - система гидродесульфоризации; 3 -
реактор низкотемпературной конверсии; 4 - трубчатая печь конверсии;
5 - сепаратор; 6 - абсорбер GOoj 7 - регенератор; 8 - сепаратор; 9 -
IU - котел-утилизатор; II - кипятильник;
рр; р
циркуляционный компрессор;
12 - холодильник;
I
2 олодильник;
I - углеводородное сырье; П - топливный газ; Ш - углекислота: ІУ -
питательная вода; У - конденсат; УІ - технологический пар; УП -
синтез-газ.
пар - углеводороды и при высоких температурах для получения
высокого выхода СО. При конверсии жидких углеводородов это может вызвать
отложение кокса на катализаторе. Поэтому сжиженные газы и нафта
(прямогонные бензиновые фракции) предварительно конвертируют в
адиабатическом реакторе при 400-500°С с относительно небольшим
количеством пара. Образовавшийся метансодержащий газ направляется на
высокотемпературную конверсию в трубчатую печь. Двухступенчатая
конверсия полностью устраняет отложение углерода на катализаторе
трубчатой печи.
По схеме фирмы "Кагакуе койо" (рис.83) /92/ углеводородное
сырье (бутан или нафта) испаряются и подогреваются до температуры
360-380°С в огневом подогревателе I. После очистки от сернистых
соединений газ поступает в реактор низкотемпературной конверсии 3,
где образуется газ, состоящий в основном из ?j и Cff^ . В этот
газ дозируются дополнительно водяной пар и ЛЯ, . Общее отношение
Нг0: С равно 2,4 моля на I г/атом углерода. Газовая смесь
подвергается высокотемпературной конверсии в трубах печи и при
температуре 800-850°С поступает в котел-утилизатор 10. Дальнейшее охлаждение
газа проису.дит в кипятильнике II и холодильнике 12. Далее газ
поступает на очистку от СО2 • В°я извлеченная двуокись углерода ре-
циркулирует с помощью компрессора 9 в трубчатую печь. Для обеспече-
264 -
ния заданного отношения СО'- Н% = * необходима добавка СО7 от
постороннего источника.
Очищенный от CU2 газ поступает на установку оксосинтеза. Часть
газа рециркулирует в реактор 2 для процесса гидрирования сернистых
соединений.
По такой схеме построены установки производительностью от 70
до [50 тыс. м /сутки синтеа-гааа.
ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ ПРОИЗВОДСТВА ВОДОРОДА
Наиболее распространенным и экономичным способом получения водоро-
дь является паровая каталитическая конверсия легких углеводородов
(С] - С7 ) в трубчатых печах. Усовершенствовании схем паровой
конверсии и аппаратуры для ее осуществления придается первостепенное
значение /987.
Для получения водорода чистотой 95-98^ используются процессы
конверсии углеводородов, конверсии СО, отмывки &>2 и метанировакия
остаточного содержания этих окислов. 99/?-кый водород получают
методом криогенной очистки. Если необходим водород высокой степени
чистоты (99, 99?), то после стадии конверсии газ поступает на
адсорбционную очистку, где из него удаляются практически все примеси. Вса
три типа установок широко применяются в промышленности. Рассмотрим
их более подробно.
Схемы получения 9Ь-98%-ного водорода (рис.Н4). В зависимости
от конкретных условий нодород получают под различным давлением от
1,0 до 4,2 Ш1а. Сырье (природЛый гаа или легкие нефтяные фракции)
подогревается до 3bu-400°C в конвективной зоне печи 2 или
теплообменнике и поступает в аппараты десульфирования I. Конвертированный
газ из печи 2 охлаждается в котле-утилизаторе, где вырабатывается
пар требуемых параметров. Обычно выработка пара превышает расход
его на турбокомпрессорный агрегат для сжатия исходного газа или
водорода, и установка выдает пар на сторону.
После ступеней высокотемпературной и низкотемпературной
конверсии СО газ поступает на абсорбцию COg и затем на метанирование
остаточных окислов. Б результате получается водород 9о-9В,!3%-ной
чистоты с содержанием в нем метана 1-Ь% и следов СО и COg.
Некоторые печи конверсии имеют воздухоподогреватели для
нагрева воздуха до 300-400°С и лучшей утилизации тепла, тогда в схему
включается воздуходувка. В связи с дефицитом углеводородного сырья
и топлива такие печи, по-видимому, получат широкое распространение.
265
Рис.В4. Схема типовой водородной установки:
I - реактор десульфирования; 2 - трубчатая печь конверсии; 3 -
котел-утилизатор; 4а, 46 - среднетемпературный и низкотемпературный
конверторы метана; 5 - абсорбер С0?; б - регенератор;? - метанатор;
I - углеводородное сырье; II - технологический пар; Ш - питательная
вода; ІУ - пар высокого давления; У - двуокись углерода; УІ - водо
род; УП - топливный газ; ли - воздух.
Сырье может подогреваться в теплообменнике конвертированным
газом, выходящим из котла-утилизатора 3. В параллельно
установленной (по конвертированному газу) теплообменнике получают
технологический пар. После смешения парогазовая смесь подается сразу в
реакционные трубы. По схеме на рис. 84 сырье и пар подогреваются в кон-
вентивной зоне, после чего смешиваются, и парогазовая сиесь
подается в реакционные трубы при температуре 450-530°С.
Для абсорбции (Х>2 применяют рассмотренные выше способы
абсорбции горячим раствором ноташа и рвствором ионоэтаноламина.
Б табл.22 приведен состав газа на различных стадиях
производства водорода из природного и нефтезаводского газов при давлении
2,2 Ша.
Установки с криогенной очисткой водорода. Водород с чистотой
Э9,С%иожно получать очисткой конвертированного газа путем сжижения
всех компонентов, кроме водорода, с последующей ректификацией ;
одновременно получают и чистую окись углерода /92,- 93/.
266
Таблица 22. Состав га
дорода при р = 2,2 МПа (об.!
за на разных стадиях производства во-
Компонент
со2
CO
»2
сн^
C^+da/cw.
cu2
со
нг
С^ + бысш.
сог
CU
»г
СНь
Сырье
-
-
47,5
27,7
24,8
-
-
32,8
20,2
47,0
0,1
-
-
93,0
6,9
После
конверсии
углеводородов
После
первой
ступени
конвер
сии СО
Нефтезаводской газ,
10,1
10,7
75,9
3,4
-
16,6
2,4
77,7
3,1
Нефтезаводской газ.
12,0
П,2
74,4
2,4
Природный
10,5
11,9
76,0
1,6
_
18,5
2,9
76,4
2,2
газ,
17,7
2,9
77,9
1.5
_
[Іосле
второй
ступени конвер-
зии СО
і = 830°С
18,5
0,4
78,1
3,1
і = 850°С
20,6
0,3
77,0
2,1
? = 880°С
19,8
0,3
78,4
1.5
_
После
очистки
от С02
0,7
0.4
95,1
3,7
-
0,6
0,4
96,4
2,5
-
0.6
0,4
97,2
1,8 ¦
-
После
метани-
рования
0,3
0,1
95,0
4,6
-
0,1
0,1
96,3
3,5
0,1
0,1
97,1
2,7
_
По схеме "Линде" (рис. 85), как и в описанных выше схемах,
конверсию природного газа, сжиженных газов или нафты проводят в
трубчатой печи 2. Затем после охлаждения в системе регенерации тепла
конвертированный газ поступает на абсорбцию С0? любым из растворителей,
например, растворами карбонатов, как показано на схеме. Полученная
в десорбере 5 углекислота рециркулирует в поток сырья для
увеличения выработки окиси углерода. После абсорбера СО2 6 газ попадает в
осушитель 7, заполненный цеолитами, где одновременно с парами воды
поглощаются и остатки двуокиси углерода.
Газ, содержащий Нг , СО и СЦ , поступает в холодильный
блок 8. После охлаждения до 90 К газ подается в скрубберную
колонну 9 для промывки жидким метаном. Верхним продуктом является чис-
267
ш ш
гкс.85. Схема установки "Линде" для получения чистых водорода и
окиси углерода:
I - реактор десульфирования; 2 - трубчатая печь; 3 -
котел-утилизатор; 4 - водородный компрессор; 5 - десорбер СОр; 6 - абсорбер С0.; ;
! - осушитель; В - холодильный блок; 9 - скруббер для промывки
кидким метаном; 10 - ректификационная колонна; II - компрессор СО:
I - сырье; П - пар; ill - водород; ІУ - окись углерода; У - вода;
У1 - дымовые газы; УП - пар высокого давления.
тый водород. Нижний продукт, состоящий из смеси С0 , Cfy и /? .
расширяется в детандере, при этом из него выделяется водород.
Смесь СО и СН^ подогревается и подается в качестве питания я
ректификационную колонну II. Жидкий метан откачивается из куба яо-
лонны, переохлаждается и снова используется как промывочный агент
в колонне 9. Газообразная окись углерода отводится сверху колонны,
проходит систему регенерации холода и поступает на сжатие в комлрр-;
гор П. Колонна, разделенная 00 - СН^, работает по принципу открыт-;
го рецикла 00, что обеспечивает необходимые нагрев и охлаждение.
Холод, необходимый для низкотемпературной сепарации, получается путем
иэоэнтропического расширения Н2 и СО.
По этой схеме для получения 1м H2+CU требуется U,46 кг прч
родного газа или 0,47 кг нафты и 0,125 - 165 яВ-ч электроэнергии,
при этом вырабатывается 0,47 - 0,67 яг пара.
Схемы получения водорода высокой степени чистоты. В настоящее
¦¦^рсмя широкое распространение находят установки для получения водп
педа высокой степени чистоты на базе паровой конверсии
углеводородов и адсорбционного разделения конвертированного газа (процесс
л'ІАДСДI (рис. 86) /92 - 95/.
Как и в описанных схемах, сырье подогревается, очищается от
Короткоцикловая адсорбция с десорбцией и сбросом давления
ш
n
I
•4
w
1 1
л
П
J
f<
ID
Рис.86. Схема установки для получения водорода высокой степени
чистоты:
I - реактор десульфирования; 2 - печь конверсии; 3 -
котел-утилизатор; 4 - барабан-паросборник; 5 - реактор среднетемпературной
конверсии СО; 6 - сепаратор; 7 - адсорбер; 8 - смесительная
емкость:
I - углеводородное сырье; П - питательная вода; Ш - пар на
сторону; ІУ - газовый конденсат; У - чистый водород.
серы и направляется в печь конверсии, откуда при температуре около
850 С конвертированный газ идет в котел-утилизатор, затем
дополнительно охлаждается в теплообменниках и поступает в конвертор СО.
В отличие от предыдущих схем конверсия СО здесь одноступенчатая.
Газовая смесь, состоящая и /J , ^ , fj , у и небольшого
количества СО, охлаждается для удаления воды и направляется в
адсорбционные аппараты (Union Carbide Swing Abaorptian Unit).
Устанавливается от трех до десяти адсорберов, заполненных цеолитами. Все
примеси адсорбируются в одну ступень при температуре окружающей среды.
Очищенный водород может иметь степень чистоты 99,99$. Процесс
является циклическим (см. гл.8). Регенерация сорбента проводится путем
сброса давления и последующей продувкой. Отходящие при регенерации
газы имеют переменный состав, и поэтому они направляются в
смесительную емкость, где выравнивается их состав, а затем используются
как топливо. По приведенной схеме работают установки фирм "Селас"
и "Линде".
Давление получаемого водорода равно 1,5-2,0 МПа. Если не тре-
269
буется его дальнейшее компримирование, то установив вырабатывает
на сторону значительное количество пара A,3 - 1,7 кг на 1000 нг
водорода . Экономичность установки зависит от степени утилизации
тепла.
При высокой степени утилизации тепла отходящих газов себе-
стокмость водорода несколько ниже, чем на традиционных установках,
несмотря на то, что степень извлечения водорода не превышает 90% и
требуется несколько более мощное оборудование. По-видимому,
установки с КЦАДСД получат дальнейшее развитие.
АГРЕГАТЫ ДЛЯ ПОЛУЧЕНИЯ ВОССТАНОВИТЕЛЬНЫХ ГАЗОВ
Восстановительный газ для металлургических процессов должен иметь
не менее 90/6 восстановителей (СО + Hg) и высокую температуру.
В рассмотренных выше видах паровой конверсии при пар : газ > 2
получается газ со значительным содержанием HgO и COg. Для
получения восстановительного газа заданных параметров конвертированный
газ необходимо охладить, отделить от водяного конденсата и отмыть
от ОСр, а затем снова нагреть. Естественно, такая технология
получении восстановителей для металлургического производства будет
малорентабельной /51/.
Фирмой "Kailog" /78/ разработан метод получения горячего
восстановительного газа при стехиометрическом количестве водяного
пара на никелевом катализаторе, активированном щелочными металлами.
Этот газ прямо вдувается в доменную печь или агрегат прямого восста
новления руды.
На обычных катализаторах при стехиометрическом расходе HgO
отлагается углерод. Разработанный фирмой "Keilog" катализатор марки
nKat4lco 22-6" позволяет вести процесс без заметного выделения
кокса. Предлагается верхнюю часть трубы, где степень конверсии
невысокая, загружать катализатором ICI 53-3 или 46-1, а нижнюю часть
трубы - катализатором "Katalco 522-6". Отношение пар: углерод
поддерживается равным 1,0 «- 1,1; давление на входе в трубу 5 ат,
температура конвертированного газа на выходе 930 - 990°С.
Основное отличие агрегата конверсии от рассмотренных выше
состоит в том, что отсутствует котел-утилизатор на линии
конвертированного газа, так как охлаждение газа не нужно. Температура
дымовых газов на выходе из радиантной зоны выше П50°С, и большая
тепловая нагрузка приходится на конвективную зону. Избыточное тепло
иопольэуется для выработки пара. Желательно также устанавливать
подогреватели воздуха.
270
ш
Рис.87. Gxeua энерготехнологического агрегата для получения всл-ета•-
новительного гаэа:
I - абсорбер сернистых соединителей; 2 - радиантная зона печи
конверсии; 3 - реакционные трубы; 4 - первая конвективная зона; I ¦¦
подогреватель парогазовой смеси; 6 - подогреватель природного газа;
7 - парогенератор; 8 - паровой котел; 9 - паросборник; 10 - вторая
конвективная зона; II - пароперегреватель; 12 - экономайзер; 13 -
подогреватель воздуха; 14 - дымовая труба; 15 - паровая турбина;
16 - конденсатор; 17 - конденсатный насос; 18 - отделение водоподго-
товки; ІУ - турбовоздуходувка;
I - природный газ; И - восстановительный гаэ; Ш - воздух; 1У -
топливный газ; У - питательная„врда; УІ - перегретый пар высокого
давления (Р = 100 МПа, t = 500°С); УП - пар на конверсию (Р = 0,5 МЛа);
УШ - оборотная вода; IX - воздух к горелкам; X - дымовые газы.
Высокозкономичныы будет знерготехнологический агрегат,
обеспечивающий металлургические процессы восстановительным газом и
воздухом (рис.87).
Природный гаэ перед конверсией очищается от сернистых
соединений. Содержание серы допускается до 0,05^, поэтому можно применить
адсорбцию на активированном угле или абсорбционные методы.
Очищенный газ поступает в подогреватель 6, расположенный в первой
конвективной зоне печи 4. Затем он смешивается с паром, отбираемым из тур-
271
бины 15, и поступает в подогреватель 5, где смесь нагревается до
500 - 550°С и затеи направляется в реакционные трубы 3,
расположенные в радиантной капере 2. В агрегате использована многорядная
прямоточная печь типа показанной на рис.50. Трубы нагреваются до
П00°С, поэтому для юс изготовления нужны особо жаропрочные
сплавы типа "Supertherm" /78/.
Температура газа на выходе иэ реакционных труб
поддерживается в пределах 970-990°С; при давлении 4-5 ат количество
восстановителей (СО + Н2) в газе не менее 92%. Например, при t = 980°С, Р г
= 4,5 ат и If = 1,1 получается равновесный газ следующего состава
(об. %): Н2 - 72,40; СО - 23,30; С02 - 0,56; Н20 - 2,90; СН4 -0,85.
Применение высокоактивных катализаторов позволяет достичь
высокой степени приближения к равновесию при объемной скорости до
2000 ч по природному газу, приведенному к нормальным условиям.
Продукты сгорания поступают в первую конвективную зону 4, где
отдают тепло природному газу, парогазовой смеси и испарительному
пучку 7. Для выработки необходимого количества пара высокого
давления (Р = 10,0 - 14,0 МПа) устанавливается котел 8. Дымовые газы
иэ первой конвективной зоны и котла поступают во вторую
конвективную зону 10, где расположены трубные пучки пароперегревателя II,
экономайзера 12 и воздухоподогревателя 13.
Перегретый пар высокого давления направляется в турбину 15,
служащей приводом турбовоздуходувки (турбокомпрессора), которая
подает воздух в доменный или другой металлургический агрегат.
Подача в доменную печь восстановительного газа указанного
выше состава позволяет увеличить ее производительность на 20-2516 и
снизить суммарные затраты на топливо на
ОСНОВЫ ПРОИЗВОДСТВА ЗПГ МЕТОДАМИ КАТАЛИТИЧЕСКОЙ КОНВЕРСИИ
Во многих странах мира в связи с дефицитом природного газа
возникла проблема производства искусственных газов по свойствам,
приближающимся к природному, так называемых заменителей природного газа
(ЗПГ). Сырьем служат уголь и нефтяные фракции /II3, 1147.
Способами низкотемпературной паровой конверсии можно получит!:
ЗПГ из сжиженных нефтяных газов, газового конденсата и прямогонных
бензинов (нафты) с температурой конца кипения 200-2Ю°С.
Промышленную проверку проходит конверсия керосиновой фракции с пределами
кипения 170-240°С.
. Спрос на ЗПГ и относительная дешевизна нефтяных фракций в 60-х
?;72
годах привели к созданию и широкому распространении заводов по
производству ЗПГ.
Все разработанные процессы (?tff Британской газовой
корпорации, ММ Японской кампании "Джепен газолин" и "Gaeynthen"
немецких фирм "Лурги" и BASF) однотипны и отличаются
непринципиальными различиями в технологических схемах и фирменными
катализаторами. Процесс производства ЗПГ состоит из следующих технологических
стадий: тонкая очистка сырья от серы и других каталитических ядов,
паровая конверсия на катализаторе, метанирование газа конвер. *и,
очистка газа от углекислоты. Кроме того, должно быть организовано
снабжение или получение водорода или водородоодердащего газа для
гидрообессеривания сырья.
Применяются несколько разновидностей процесса, но все они
могут быть сгруппированны в две основных схемы: I) осуществляется
одноступенчатая паровая конверсия, а образующийся газ подвергается
метанированию в две ступени; 2) осуществляется двухступенчатая
конверсия, при которой половина сырья смешивается с паром и подается на
на первую ступень конверсии, затем в газы конверсии добавляется
вторая половина сырья и происходят процессы гидрогазификации и
конверсии; дачее следует метанирование в одну степень /III, ИЗ, 116, 120,
121 7.
Схема с гидрогазификацией несколько экономичнее, так как
отношение пар : сырье можно снизить с 2 до 1,1 - 1,5 кг/кг. Но
получаемая экономия незначительна (около 4%), и применяются обе
разновидности процесса.
Процесс в гидрогазификаторе экзотермический; повышение
температуры в адиабатическом реакторе достигает at = 130°С,
температурного провала не наблюдается. Все это дает возможность вести
процесс при более низкой температуре на входе-350°С и на выходе
450-490°С.
Для того, чтобы превратить низкокалорийные газы в метан,
окислы углерода должны быть прогидрированы-водородом. Условия процесса
значительно отличаются от представленных в главе 7, где
рассмотрена глубокая очистка технологических газов от СО и С0?. Очистка
газов от окислов углерода в аммиачном производстве характеризуется
наличием большого избытка водорода при незначительном содержании
СО и СС>2 и малым количеством паров воды.
Процесс метанирования газов низкотемпературной конверсии с
целью получения ЗПГ протекает при высоком.содержании окислов угле-
273
рода и главным образом С02, а также паров воды. В результате
гидрирования поглощается почти весь водород и остается непрогидрирован-
ной значительная часть COg, которая потом удаляется абсорбцией /89/.
Метанирование проводится на катализаторах такого же типа, как
и низкотемпературная конверсия, т.е. на высокоактивных никелевых
катализаторах. При выборе их необходимо учитывать избирательную
активность в отношении окиси и двуокиси углерода. Если в газе много
COg, то в этих условиях желательно применять катализатор,
обеспечивающий метаниривание всей СЮ без существенной конверсии (Х^. Однако
если в газе имеется много водороде и небольшое количество СО и СО-,,
то следует выбирать катализатор, который гидрирует окислы углерода
более или менее одинаково. Ь производстве для метанировакия часто
применяются те же катализаторы,-что и для конверсии и гидрогазифи-
кации.
На метанирование поступает газ после одноступенчатой или
двухступенчатой конверсии, соответственно состав геза будет
приблизительно следупщий (об. %):
Газ Одноступенчатая Двухступенчатая
СН4 53-69 70-75
Н2 12-2Ь 15-12
СО 0,5 - 0,8 0,3 - 0,6
С02' 20-23 20-23
Температура газа на входе в метакатор поддерживается в
пределах 250-300°С. В процессе гидрирования окислоб углерода температура
в реекторе повышается на 40-50°С, и чтобы получить газ с малым
содержанием водорода необходимо промежуточное охлаждение, т.е.
двухступенчатое матекирование или применять реактор с. внутренним
охлаждением.
Существует две разновидности процессе - "влажное" и сухое"
метанирование. В первом случае процесс проводится при имеющемся на
выходе из реактора газификации количестве водяного пара; во втором -
прр пониженной влажности после конденсации большей части водяного
пара.
Одноступенчатый процесс влажного метанировения дает
возможность снизить содержание водорода б газе дс 2-4 об./6. При
двухступенчатом влажном ыетаяировании количестве Еодорода снижается до 2%.
Если такое содержание водороде не удовлетворяет предъявляемым
к гагу требованиям, то не второй, ступени осуществляет "сухое" мете-
274
нирование, и остаточное содержание водорода мокло снизить до 1% и
даже ниже, "сухое" метанирование может производиться как перед иг--
влечением С0?, так и после него. Опыт эксплуатации таких метанато-
ров показывает, что, несмотря на низкое содержание пара, при
рациональном режиме эксплуатации срок службы катализатора достигает
нескольких лет.
После двухступенчатого метанирования газ имеет следующий
состав: СН4 - 74-ТН, С02 - 22,0-22,2; Н2 - 0,6-4,0; СО - 0,02-0,07.
После извлечения С02 газ будет состоять на 97-99? из метана.
ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ ПРОИЗВОДСТВА ЗПГ
И ОЧИСТКИ ПРИРОДНОГО ГАЗА
Гвз, используемый в качестве топлива, должен быть дешевым.
Поэтому право на существование имеют только относительно простые техно- ¦
логические установки с недорогим оборудованием.
На рис.88 представлена технологическая схема установки по
способу сяс /116/. Жидкое сырье под давлением 42 ат смешивается с
водородсодержащим газом (или техническим водородом), нагревается и
испаряется в печи I, откуда пары с температурой 350-390°С
поступают в реактор сероочистки 2. Процессы сероочистки аналогичны
описанным в главе 4.
Вследствие применения высокоактивных чувствительных к
отравлению катализаторов остаточное содержание серы не должно превьшать
0,2 мг/кг. Это обеспечивается гидрированием органической серы до
Мг5 и поглощением последнего окисью цинка.
К очищенному сырью добавляется водяной пар, смесь нагревается
в печи 3 до 450-46()о0 и поступает в реактор газификации 4, где
осуществляется паровая конверсия .углеводородного сырья. Газ с
температурой 480-530°С охлаждается в котле-утилизаторе 5, вырабатывающим
пар для процесса газификации, до ?.80-300°С и поступает в реактор
метанирования первой ступени. В кем водород взаимодействует с СО и
С02, образуя дополнительное количество метана. Далее газ
охлаждают в следующем котле-утилизаторе о и теплообменнике 8, чтобы
сконденсировать и удалить часть водяного пара. Затем смесь снова
нагревают в печи 9 приблизительно до ЭЕ5°С и направляют в реактор
метанирования второй ступени 10, где происходит дальнейшее превращение
Н2, СО и С02 в метан. Выходящий из реактора газ представляет собой
смзоь в основном двух компонентов -'СН4 и С02 (СН4 ~ Г(Г?Ї Н2 " 1;
СО - 0,05; С02 - 22 об.%).
275
Рис.88. Технологическая схема производства ЗПГ по методу ?Rf :
І - огневой подогреватель-испаритель; 2 - аппараты сероочистки; 3 - огневой подогреватель; 4 -
реактор газификации; 5 - котлы-утилизаторы; 6 - реактор метанирования первой ступени; 7 -
десорбер COgj 8 - теплообменники; 9 - подогреватель сырья на метанирование; 10 - реактор метанирования
второй ступени; II - воздушный холодильник; 12 - сепаратор; 13 - абсорберы СО2; 14 - холодильник
ЗПГ; 15 - осушитель; 16 - трубчатая печь паровой конверсии; 17 - конверторы окиси углерода; 18 -
компрессоры;
vt" жиДДое 9;*ІРАе' П -водород; Ш - водяной пар; ІУ - конденсат; У - метано-водородная фракция;
Л - углекислый газ; УП - заменитель природного газа-
Двуокись углерода удаляется в абсорбере 13 водным раствором
поташа. Образовавшийся раствор бикарбоната регенерирует отдувкой
водяным паром в отпарной колонне 7. ЗПГ охлаждается в
холодильнике 14 и проходит осушку обычными способами на установке осушки 15.
Водород, необходимый для обессеривания сырья, получают на
специальной установке путем конверсии метана водяным паром при
температуре около 790°С с последующей конверсией СО и удалением С0?
абсорбцией. Полученный газ, содержащий около 90^ водорода и 10%
метана, компрессором I8 подают в сырьевой поток перед входом в
испаритель I.
Применяется разновидность представленной схемы, в которой
используется процесс г-идрогазификации. Сырье после сероочистки
делится на две примерно равные части. Одна часть сырья, как и по
описанному методу, направляется в подогреватель 3 и реактор конверсии 4.
Газ после реактора смешивается со второй половиной сырья и подается
в реактор гидрогаэификации. Имеющийся в газах первого реактора
водород вступает в реакчии с сырьем и осуществляется процесс
гидрогазификации. Этот процесс идет при более низкой температуре и
получается газ, более богатый метаном. Остальные части технологических схем
идентичны.
На ряде заводов водородная установка не предусмотрена.
Подпитка водородом осуществляется следующим образом (этот способ показан
на рис.88 штриховыми линиями). После реактора газификации 4
отбирается часть газового потока, из которого конденсируется водяной пар
и удаляется С0?. Метановодородная смесь компрессором 18 подается на
вход установки. Преимуществом такого способа получения водорода, по
сравнению с водородной установкой, является упрощение
технологической схемы, а недостатком - большой рецикл газа, так как содержание
водорода в нем всего около 1856. Этот способ более экономичен при
конверсии малосернистого сырья.
На рис.89 приведена технологическая схема получения ЗПГ по
процессу MR4 из сернистого сырья /I2I/. Пары сырья после печи I
поступают в реактор гидросероочистки 3, после которого снова
конденсируются. Непрореагировавший водород рециркуляционньм компрессором 2
подается в сырье. Сероводород отпаривается в десорбере 4, и иэ него
на специальной установке 9 получают элементарную серу.-При
малосернистом сырье, как и в других процессах, /fyS поглощают окисью цинка.
Паровая конверсия сырья происходит в реакторе 5, верхняя часть
его является реактором конверсии водяным паром, а нижняя -
реактором гидрогазификации. Для обогащения метаном газ проходит одну сту-
277
IX
Рис.89. Технологическая схема производства ЗПГ по методу MRQ :
I - нагревательная печь; 2 - циркуляционный водородный компрессор;
3 - реактор обессеривания; 4 - десорбер сероводорода; Ь - реактор
газификации; б - реактор метанирования; 7 - десорбер двуокиси
углерода; 8 - абсорбер СС^; 9 - сепаратор;
I - сырье (прямогонный бензин); П ~ добавочный водород; ul -
циркулирующий водород; ІУ - топливный газ; У - элементарная сера; УІ -
газы регенерации; УП - водяной пар; УШ - двуокись углерода; IX -
продуктовый газ на осушку и сжатие,
пень метанирования. Содержание водорода в нем будет около 3%. Если
необходимо еще снизить концентрации водорода, то устанавливается
вторая ступень метанирования.
Как видно схемы процессов ?ЯС и ШС отличаются очень
незначительно. Основное отличие - в аппаратурном оформлении и применении раз-
личных запатентованных фирмами катализаторов.
Фирмы Лурги и BASF разработали несколько вариантов процесса
"Совупуівш" с одной ступенью газификации и одной или двумя
ступенями метанирования /Мі/. По одному из вариантов (рис.90) сырье
испаряется в темплообменнике 3 и поступает в реактор десульфирования I и
затем в реактор паровой конверсии 2. Сюда же подается перегретый в
перегревателе 4 водяной пар. Температура пара такова, чтобы
температура смеси была равна примерно 400°С. Полученный газ направляется
затем на метанирование в одну или две ступени и очистку от С02-
Применяются схемы с двухступенчатой конверсией
(гидрогазификацией) и одной ступенью метанирования. Несколько отличен от других
процессов вариант, сочетающий одноступенчатую газификацию с одной
ступенью метанирования и рециркуляцией получаемого газа с низким
содержанием двуок.іси углерода (рис.91) /III/. Этот вариант требует
минимального расхода водяного пара (около 0,7 кг/кг сырья) и обеспечивает
высокую эффективность. После реактора конверсии газ охлаждается в
холодильнике 2 прямым контактом с жидкостью. В абсорбере 3 из газа иэ-
278
Ш
Рис.90. Технологическая схема процесса Gasynthen:
I - реактор десульфирования; 2 - газификатор; a - теплообменник;
4 - перегреватель водяного пара; 5 - метанатор; Ь - абсорбер UJ^;
7 - котел-утилизатор;
I - сырье; П - перегретый пар; Ш - ЗПГ; ІУ - питательная вода;
У - сорбент.
Рис.91. Схема процесса Osgynthen: с рециркуляцией газа: ,
I - реактор газификации; 2 - контактный холодильник; 3 - абсорбер
С02; 4 - сатуратор; 5 - реактор метанирования; 6 - циркуляционный
компрессор ;
I - сырье; П - перегретый пар; Ш - ЗПГ,
влекается С0? и он поступает в реактор метанирования 5, после
которого получается стандартный ЗПГ. Часть газа компрессором 6 подается
в сатуратор 4, где он насыщается парами воды, затем поступает в
реактор конверсии. Охлажденная в сатураторе 4 вода подается в
холодильник 2. Эта схема оригинальна и экономична. Но после разработки
нового высокоактивного катализатора, который позволяет проводить
процесс при более низкой температуре и меньшем отношении пар : сырье,
фирмы пришли к выводу, что рациональнее применять схему стандартного
варианта (рис. 90), так как она наиболее проста.
Термический коэффициент полезного действия установки
заменителя природного газа зависит от сырья, технологической схемы и
параметров процесса и равняется 90-95^.
Следовательно, процессы получения ЗПГ значительно превышают
к.п.д. процессов получения других видов искусственного топлива.
По рассмотренным технологическим схемам возможно получать газ
с содержанием метана 98-9956 ( Н2 - 0,7 + 2,5; Щ - 0,2 + 1,0: СО -
следы) и низшей теплотворной способностью 35170 - 35690 кДк/м^, Это
полноценный заменитель природного газа. Но если требуется газ с
более высокой теплотворной способностью, то этого добиваются
добавлением к нему сжиженного газа. Добавка 4% пропана позволяет повысить
теплотворную способность газа до 37680 кДк/м .
В настоящее время методами низкотемпературной паровой конвер-
279
m
Рис.92. Принципиальная
схема установки
каталитической очистки природного
газа от газового конденсата:
I - установка
низкотемпературной сепарации газа; 2,3-
теплообменники; 4 -
аппаратура сероочистки; 5 -
реактор паровой конверсии
конденсата; 6 - паровой котел;
7 - система очистки от CUj и
осушки газа; 8 - система
химводоочистки;
I - сырой газ из скважин; П -
частично отсепарировакный
газ; Ш - газовый конденсат;
ІУ - водяной пар; У - газ в
магистральной газопровод;
УІ - вода.
сии производится около 80 млрд.м год заменителей природного газа.
8 связи с удорожанием нефтепродуктов производство искусственных
газов в последующие десятилетия, по-видимому, будет базироваться на
твердом топливе.
Каталитическая очистка природного газа от газоконденсата. Все
больше вновь открываемых месторождений природного газа являются
газоконденсатними. Основное количество конденсата выделяется на
промыслах в системах ігизкотемпературной сепарации, но всегда
значительная часть его в капельно-лидком состоянии уносится вместе с
газом в магистральный газопровод, что снижает его пропускную
способность. Создание условий транспорта бесконденсатного газа является
одной из актуальных проблем транспорта газа на далекие расстояния.
Остаточный или весь конденсат может быть конвертирован в метан.
В отдельных случаях низкотемпературной конверсии могут быть
подвергнуты нефтезаводские газы со значительным содержанием водорода,
малопригодные для дальнейшей переработки и сжигания в печах /98, 122,
123 7.
Очистка природного газа от газового конденсата может
производиться методом паровой каталитической конверсии по принципиальной
технологической схеме, приведенной на рис.92. Газ после
низкотемпературной сепарации с давлением 6,0 - 8,0 Ша поступает в
теплообменник 2, где нагревается до 280-300°С, затем он проходит реактор серо-
очитски 4 и, смешиваясь с перегретым водяным паром из котла б
поступает в реактор паровой конверсии 5. Конвертированный газ
охлаждается в теплообменниках 2 и 3, при этом происходит конденсация паров
воды, и направляется в систему осушки и очитски от С0? /124/.
і
280
Каталитическая очистка позволяет получить "сухой" газ, но
является довольно сложной для условий головных сооружений магистральных
газопроводов и может найти только ограниченное применение, она
может быть целесообразна на газоггромыслах, где нерентабельно
организовывать сбор и транспорт газового конденсата.
МОДЕЛИРОВАНИЕ И ОПТИМИЗАЦИЯ ТЕХНОЛОГИЧЕСКИХ СХЕМ
Работу химико-технологической схемы (ХТО нельзя рассматривать как
совокупное действие отдельных аппаратов. Сложная ХТС обладает
новыми качествами, не присущими отдельным аппаратам. Поэтому
эффективность работы ХТС не,определяется только эффективностью работы
отдельных аппаратов. Вследствие этого в настоящее время не
останавливаются на расчете отдельных аппаратов, а переходят к расчетному
исследованию ХТС, в которых аппараты взаимосвязаны друг с другом /§9/.-
При этом часто приходится либо упрощать модели отдельных аппаратов,
сохраняя всю сложность структуры схемы, либо брать достаточно
полные модели аппаратов, но упрощать их связи в технологической схеме. '
В отдельных случаях удается построить математическую модель не очень
сложной ХТС, не прибегая к указанным упрощениям. Моделирование и
оптимизация ХТС производства аммиака представлены в работах /100-110/.
Расчет сложных ХТС производств водорода, аммиаке и метанола с
достаточно полным описанием аппаратов и других элементов схем
позволяет найти не только оптимальные инженерные решения и уменьшить
время проектирования новых установок, но и существенно улучшить
технологические и экономические показатели действующих производств.
Возможность учитывать в расчетной программе конкретные эксплуатационные
характеристики рассматриваемого производства (активность
катализаторов, состояние теплообменных поверхностей и футеровок, состояние
рабочего аппарата турбомашин и др.) позволяет выбрать индивидуальный
оптимальный режим для каждой промышленной установки flQlJ.
В настоящее время крупные производства аммиака, метанола и
водорода строятся по энерготехнологическим схемам. Расчет ЭТС
значительно усложняется, так как добавляются блоки расчета генераторов
пара высокого давления, паровых турбин и компрессоров, которые
жестко связаны с технологическими блоками.
Для нахождения точки глобального экстремума в пространстве
варьируемых параметров при оптимизации ЭТС рекомендуется применять
методы направленного перебора, позволяющие рассчитывать совокупность
благоприятных вариантов ", из которых с помощью конкретного 'анализа техно-
281
логических и технико-экономических показателей выбирается
оптимальный вариант /101/. Поскольку использовать очень частые сетки
затруднительно, найденный оптимальный вариант может заметно отличаться от
истинного оптимума, однако ато несущественно, так как функции
критерия оптимальности в окрестности экстремальной точки, как правило,
весьма пологие, а для практических целей нужна не экстремальная
точка, а экстремальная область.
Необходимо также учитывать уровень сложности математических
моделей аппаратов, входящих в схему. Как видно из приведенных выше
моделей аппаратов, они могут быть весьма сложными и при реализации на
ЭВМ требовать больших затрат машинного времени. Одним из способов
преодоления этого затруднения является построение приближенных ап-
проксимационных моделей на основе достаточно большого количества
расчетов по исходной модели в предполагаемой области изменения
параметров. Однако точность аппроксимационной модели трудно оценить и
необходимо следить, чтобы все параметры лежали в заданной области.
Для уменьшения затрат машинного времени целесообразно также
изыскивать эффективные методы расчета каждой конкретной схемы и
разрабатывать алгоритмы, в которых сводится к минимуму общее число
итераций и, главное, число итераций, в которых участвуют трудоемкие
блоки.
РАСЧЕТ И ОПТИМИЗАЦИЯ СХЕМЫ АВТОТЕРМИЧЕСКОЙ КОНВЕРСИИ
ДЛЯ АММИАЧНОГО ПРОИЗВОДСТВА
Исследована схема отделения конверсии (см. рис. 72), включающая
аппараты 2,4, 5, 7 (вариант A) /I0Q/. Ни условно считалось, что схема
состоит их семи аппаратов, так как теплообменник вместе с
увлажнителем 2, рассматривались как два аппарата, а конвертор СО 5 - как
три аппарата: конвертор первой ступени, испаритель, конвертор
второй ступени. Теплообменник подогрева сырья рассматривается как
комбинированный аппарат, где природный газ, насыщенный на 30-50$
парами воды, нагревается, смешивается с водяным паром и вновь
нагревается. Состав кислородоводородной смеси подбииается таким, чтобы было
неизменным отношение Л/„ : И2 = 3 или в конвертор подается кислород,
а необходимее количество азота дозируется при промывке газа жидким
азотом. В программе для ЭВМ это представляется как частный случай
кислородовоэдушной конверсии (/Y? ¦' #2 z ^ • Рассмотрим моделирование
этой схемы достаточно подробно, так как основные принципы построения
модели* оправедливы и для других схем.
'282
Так как цель работы - определение оптимального
технологического режима отделения конверсии на действующем производстве без его
реконструкции, то в качестве критерия оптимизации приняты затраты
на сырье, необходимые для получения І т аммиака
(9.1)
- разность стоимостей потребляемого и получаемого в
- стоимость
поp - объем
где л с,
котле-утилизаторе пара, руб/ч; с#
требляемых кислорода, конденсата и природного газа;
продувочных газов, м /ч (при нормальных условиях): ^ , ^
объемы водорода и азота на выходе из отделения, м /ч; А -
теоретический расход азото-водородной смеси на I т.
Води
Рис.93. Расчетная схема отделения конверсии:
I - первый теплообменник; 2 - смеситель; 3 -
второй теплообменник; 4 - конвертор метана;
5 - увлажнитель; б - конвертор СО первой
ступени; 7 - испаритель; 8 - конвертор СО второй
ступени; 9 - котел-утилизатор.
Расчетная схема (рис.93) несколько отличается от
технологической, так как в качестве расчетного блока не всегда удобно брать
отдельный аппарат или стадию процесса. В частности, вместо
комбинированного аппарата 2 приходится брать три расчетных блока: первый
теплообменник; смеситель; второй теплообменник. Расчетная схема имеет
две обратные связи (штриховые линии), наличие которых затрудняет
определение последовательности расчета и требует больших затрат
машинного времени. Поэтому связи условно разрываются, а в местах
разрыва задаются начальные приближения'по входящим в аппарат
переменным ^"и W*. ¦ ' 283
Анализ схемы позволил на порядок сократить затраты машинного
ьреыени за счет ликвидации обратных связей в расчетной схеме. Если
заданы температура газа Т^ в точке *f, и суммарный расход
влаги C . , то всю схему можно рассчитать в порядке 1-2-3-4
5-6-7-8-9. При этом повторных итераций не требуется и в
результате расчета каждого блока однозначно определяются выходные
параметры: состав, расход и температура технологического потока.
Инверсия входов и выходов некоторых расчетных блоков в ряде
случаев может значительно облегчить расчет сложной схемы.
Затруднения в расчете по указанной последовательности состоят в том, что
вначале бля блоков 1,2 и 3 неизвестен расход и состав газа в точке
w, . Но весовой расход газа определяется как сумма исходного
расхода газа в точке \и0 и расхода влаги, задаваемого до расчета.
Состав смеси необходим лишь для расчета физических свойств смеси в
теплообменнике и может быть взят приблизительно, что практически не
влияет на конечный результат. Поскольку Тш и ?^ являются
варьируемыми переменными, т.е. величинами, однозначно задаваемыми
перед каждым вариантом расчета схемы, итераций по ним проводить не
требуется. К моменту расчета блока 5 известны температуры т„ и
Тм , поэтому для него по заданному fg определяются количества
подаваемого пара и конденсата в отдельности.
В работе /I00/ использовали "равновесную" модель конверсии
метана, т.е. предполагалось, что состав газа на выходе является
равновесным при некоторой температуре Тр , которая определялась как
Г -Г -ЛГ (9.2)
р к
где т - температура на выходе из конвертора; аТ -
экспериментальная поправка, учитывающая, что на выходе из конвертора
равновесие не достигается. Обычно лТ лежит в пределах 10 - 25°С.
Более достоверные результаты может дать кинетическая модель
конверсии при рассмотрении конвертора 2 как реактора идеального
вытеснения.
Температура газа на выходе Т определяется из уравнения
теплового баланса
?*ф(Т0) - L ^ *¦, ('„) + *а> ' (9.3)
где v^ и fj - расходы /'-го компонента на входе и выходе;
Qn ^тепловые потери; /? - полная знтальная /-го компонента
(с учетом теплового эффекта образования вещества из элементов).
284
^.инверторы оО Ь и 8 рассчитываются по приведенной выше
модели (і л. 7) с учетом диффузионной кинетики на зерне катализатора. По
заданной температуре и составу газа на входе определяются состав и
температура на выходе.
Расчет теплообменникоь производился по уравнениям теплового
баланса
атг к
~W7~ ~- л г (тг' гмУ (9.4)
*" Р» (9.5)
с начальными условиями
где т и Тм - температуры входа; Гр/ , гм/ - температуры
выхода соответственно греющего и нагреваемого потоков; ? - расход;
К - коэффициент теплопередачи. Индекс г относится к греющему
потоку; а индекс /У - к нагреваемому потоку.
Если принять теплофизические свойства постоянными,
аналитическое решение уравнений дает
r„ -T„o*T{TrtT„*H»'b (9.6)
ГАе A'"t^' *•*?•• А^-А2' Р-
полная поверхность теплообмена.
Смеситель 2, увлажнитель 65 и испаритель ? рассчитываются по
уравнениям материального и теплового балансов. При расчете котла-
утилизатора 9 задают на входе температуру получаемого пара іл
и входящего конвертированного газа t, . Паропроизводительность
$п определяют по уравнениям:
285
гц? f - расход конвертированного газа; <л и
ггии конденсате и пара.
Корректировка модели осуществлась по результатам исследований.
Ке?уіьтать! расчетов согласовывали ? действительными режимами, зада-
пая поправку на неравновесность а Т для конвертора метана, констан-
¦ч скоростей реакций ( к(У) для конверторов СО, коэффициент загряз -
M":;ия (постоянный множитель при коэффициенте теплопередачи) для. теп--
'"Хренников и котла-утилизатора.
Вначале находились оптимальные значения температур на входе в
прррую и вторую ступени конверсии СО с учетом ограничений. Дальней-
пая оптимизация велась по трем варьируемым параметрам F , v0 ,
¦S. . С уменьшением R затраты на сырье снижаются, но R не мож?т
'іьггь менее 0,9, так как возможно <:я>геобразов8ние. В исследованном
гшяпзэонр с увятечением расхода кислорода К снижается, поскольку
увеличивается гтецень конверсии С^ . Если взять более широкий диапэ-
чіп измечсч>!Я К^) (в сторону увеличения), то будет найден экстремум
^миї'имуу) К. Однако с увеличением V^ растет температура, которая
чс. долгие превышать предельно допустимой. Кроме того, увеличивается
количество окислившегося водорода. Максимальный выхад водорода
достигается при значении Vq - 395 + 398 м на ГСОО м' газа.
Как видно из сказанного выше, оптимизация схемы реального
производства наталкивается на значительные трудности, связанные с ограни
чением большинства параметров. Кроме того, во многих случаях требует.
¦:я поддерживать заданную или максимально возможную прсизводительност1
вгрегата по целевому продукту, несмотря на повышенные
эксплуатационные расходы. Тем не менее оптимизация дает ощутимый эффект. Например,
счбзта отделения конверсии метана Черкасского химкомбината в опти-
еалыюм режиме G0-е голы) дает годовой эффект десятки тысяч рублей
о. год. Средняя экономия от оптимизации составляет I руб./т аммиака/!
¦Г.ЖВДРОВагМЕ.ШНОЛОгаЧЕСКИХ И ЭНЕРГЕТИЧЕСКИХ <;ХЕМ
ТОИЗЕОДСТЬА АШИАКА С ДВУХСТУПЕНЧАТОЙ КОНВЕРСИЕЙ УГЛЕВОДОРОДОВ
-йссмотрим рвсчет технологической схеми получения синтез-газа (конрер-
.-ия cHc и /'(? ) аммчйчного комплекса мощностью 600 т/сутки Л'/г.
¦¦ррп?тазлечпг:й на рис. "Ъ и ?6.
Естественно начинать расчет с трубчатой печи, являющейся узпо-
Рис.94. Расчетная схема получения синтез-газа:
I - трубчатая печь; 2 - шахтный реактор; 3, 7 и 8 - подогрсьа-.<:ль
паригазовой смеси; 4 - подогреватель воздуха; 5 - смеситель с
горелками; 6 и II - котлы-утилизаторы; 9 - смеситель природного іазч
и пара; 10 - экономайзер; 12 и 13 - конверторы СО первой и второй
ступеней; 14 - блок для расчета метанатора и критерия
оптимальности; С - точка сходимости, Р - пробная точка.
вьш аппаратом /I0I/. В результате будут определены параметры кон
вертированного и дымового газов на выходе. Они являются главпыми
потоками и образуют две последовательности: I - 2 - II—12—13 и 1-3-4-
5-6-7-8-9-10 (рис.94). Если принять такую схему в качестве расче-гной,
то наличие четырех обратных связей В-9-7, 7-3 и 10-6 приводит к
слишком большим затратам времени на расчет одного варианта.
Для сокращения цикла обратных связей был использован способ пе-
реыены точки сходимости, особенно эффективный в случае
последовательных обратных связей. Первые три из указанных обратных связей
последовательные. По принятому методу выбирается так называемый пробный
поток, которым в рассмотренном случае является поток 3-1. Считая его
известным и производя расчет схемы в обе стороны от пробной точки Р,
можно заметить, что при дальнейшем инвертировании потоков 7-3 и 9-7
соответственно на 3-7 и 7^-9 число обратных связей уменьшается на две.
Обратная связь 10-6 в инверсии не участвует. Поток 9-С и поток,
полученный в результате инверсии 7-С, называются особыми. В
разработанном методе они сводятся в так называемую точку сходимости С, раз-
287
ность it в которой устраняется с помощью итеративного поиска з>:'і-
чения пробного потока в точке Р по формуле
*р'' Г*Р *"**•
где ti - температура в пробной точке на /-ой итерации; at =
=» t7 - tg - разность температур, определенных в блоках 7 и 9;
а - константа.
В силу особенностей расчета шахтного реактора, для которого
определяется необходимый расход воздуха при поиске температуры на
входе в конвертор, возникает расчетный поток 2-4, Таким образом,
схема расчета упрощается. Использование метода перемены точки
сходимости позволило уменьшить число обратных связей до двух: С-Р и 4 ¦
Для действующих схем в качестве критерия оптимальности может
быть принята себестоимость аммиака с учетом условно-постоянных
затрат, обусловленных капиталовложениями в оборудование
где сг , с, и с соответственно стоимость природного газа,
электроэнергии и конденсата; ср - стоимость выданного с установки
пара; v^ - объем продувочных газов цикла синтеза аммиака,
используемых как топливо, м°/ч; ско - капиталовложения, руб.; А -
теоретический расход азотоводородной смеси на I т /*^ , м /v; ^ и
Vfi/ - расходы водорода и азота на выходе из отделения конверсии :?
учетом затрат водорода на стадии метанирования, м /ч.
Для расчета отдельных блоков применимы приведенные nwnie модели
отдельных аппаратов. В работе Д01/ использованы равновесные модели
конверсии метана в трубчатой печи и шахтном конверторе. Топка печи
рассчитывалась по упрощенным зависимостям, полученным из данных по
эксплуатации промышленных аммиачных агрегатов. Поэтому такая модель
должна корректироваться для каждого отдельного агрегата. Методы
корректировки аналогичны приведенным выше для схемы паро-кислородо-воз-
душной конверсии.
Определение оптимальной области работы технологической схемы
весьма сложно вследствие большого числа взаимосвязанных параметров,
подлежащих оптимизации, и трудности обоснования выбора ограничений.
Проведенный авторами работы /101/ выбор оптимального режима
аммивчуого агрегата показывает, что оптимальные параметры процесса
значительно отличаются от проектных, что видно из следующего сравнения:
288 ..
Проектный
режиы
3,82
815
375
257
25,22
721
Оптимальный
режиы
4,30
780
370
240
25,60
711
Показатель
Соотношение пар: газ
Температура, °С
на выходе из
реакционных труб
на входе в реактор
конверсии СО первой ступени
на входе в реактор
конверсии СО второй ступени
Выход аммиака, т/ч
Удельный расход газа, м^/т *
Критерий оптимальности, J
руб./т т3 44,42 44,12
Большую значимость на критерий оптимальности имеют отношение
аар + газ и температура газа перед первой и второй ступенями
конверсии СО.
При работе на рекомендованном режиме выход аммиака возрастает
на 0,38 т/ч, а себестоимость его снижается на 0,3 руб/т по
сравнению с проектным режимом. По-видимому, этот режим не является
действительно оптимальным. Сложность и большая размерность задач
оптимизации схем требует разработки специальных методов оптимизации
производства аммиака, метанола и водорода. Это сложная задача, но она
оправдана огромными масштабами производства этих продуктов.
Один из возможных специальных методов оптимизации
энерготехнологических схем (ЭТО намечен в работе /102/. Он основан на разбиении
схеыы на укрупненные блоки. Но как и в предыдущих работах /100, 101/,
оптимальный режим (вернее наиболее рациональный с точки зрения
авторов) выбирается из сравнения многих вариантов расчета. До
математической задачи оптимизации метод не доведен, но заслуживает внимания.
Анализ схем конверсии производства аммиака позволяет выявить
основные технологическиа и энергетические связи отдельных стадий и
аппаратов. Отличительной особенностью схеыы является строгая
энергетическая сбалансированность выработки и потребления пара,
получаемого при утилизации тепла дымовых газов и технологических потоков.
Важнейшими связями являются: а) зависимость содержания инертов в свежем
газе на входе в компрессор синтез-газа в зависимости от условий
конверсии; б) зависимость соотношения М2 '¦ ty в циркуляционном газе от
условий процесса паровоздушной конверсии. Дополнительные связи
объясняются рециклом части азотоводородной смеси (ABC) в аппараты
сероочистки, сжиганием в печи продувочных и танковых газов, подогревом
ABC, идущей на метанирование, конвертированным газом.
Расчетная схема (рис.95) содержит четыре так называемые расчет-
289
ные обратные связи, вызванные ограничениями, характерными для
производства аммиака. Так, обратная связь 4 обусловлена тем, что сте-
хиометрическое соотношение и :Hf =3 : I перед синтезом
обеспечивается соответствущнм расходом воздуха в реактор паровоздушной
конверсии. Ввиду того, что расчет трубчатой печи, определяпцей
параметры технологического воздуха, производится перед шахтным
реактором, возникает обратная связь. Расчетная обратная связь 2 вводит -
ся для упрощения расчета энергетической части, о чем будет сказано
ниже. Оставшиеся пять обратных связей обусловлены особенностями
технологии.
Расчет по схеме, представленный на рис. 95, настолько велик
по объему, что ресурсы ЭВМ второго поколения не могут обеспечить
решение задачи. Метод декомпозиции в данном случае неприменим, так
как обратные связи охватывают всп цепь аппаратов и нельзя снизить
размерность задачи.
Упрощение модели, связанное с линеаризацией, может привести к
неправильным качественным результатам, так как зависимости,
характерные для экзотермических обратимых процессов, носят экстремальней
характер. /
Применяя схемы с использованием физических моделей, основная
проблема сводится к поиску наиболее экономичной по затратам времен'-«
я памяти схемы с анализом особенностей первоначальной.
Анализ расчетной схемы показал, что она может быть
представлена в виде трех взаимодействующих частей, включающих следующие смо
яупности аппаратов: I (получение ABC) - аплераты I, II, 22, 24, <Ъ,
26; П (синтез аммиака) - аппараты 14, 15, 16, 19, 20; Ш (теплоио-
пользование) - аппараты I - 10, 12, 13, 18, 21, 23. Блоки I, П и Ь
связаны последовательным расчетом, а такжр имеют обратные связи г
между блоками Ш и I и 8 между блоками П и I (номера связей
соответствует таковым на рис. 95).
Преимущество такого разбиения состоит не только е облегчении
расчета и лучшей обозримости всей схемы, но и в учете того факта,
что обратные связи 6 и 8 являются слабыми, а потому могут быть
выведены во внешние итеративные циклы, а не рассматриваться
равноправно с остальными. Таким образом, объем вычислений может быть
уменьшен в несколько раз. Важным преимуществом разбиения на подсхемы яв
ляется возможность более экономного использования памяти ЭВМ.
Следует отметить, что расчленение схемы на указанные крупные
блоки удалось достичь не только путем анализа расчетных связей меж
ду аппаратами, но и целесообразным выбором исходных данных для вы-
Рис.95. Расчетная схема энерготехнологического аммиачного комплекс.
I - трубчатая печь; 2,6 - дополнительные горелки; 3 - теплообменник
нагрева сырья; 4 - подогреватель воздуха; 5,9 - пароперегреватели:
/, 17, 23 - паровые котлы; 8 - смеситель дымовых газов; 10, 13, IO
теплообменники для подогрева котловой воды; II - шахтный конвеьтор,
12 - паросборник; 14 - колонна синтеза аммиака; 16 - продувка ABC;
20 - испаритель аммиака; 22, 24 - реакторы конверсии СО; 25 - очип:
ка от COg; 26 - метанатор; 27 - главный компрессор ABG.
Обозначения: Р - реакторы; M - массообменные аппараты; т/о -
теплообменники; СМ - смесители; К - котлы; комп - компрессоры.
числительных блоков. Например, температура на входе в конвертор СО
первой ступени задается как исходная величина. Это является
оправданным с точки зрения технологии, поскольку выбор температуры
определяется состоянием катализатора. В то же время указанный прием по
зволил развязать технологический и тепловой блоки. Эта же
температура для котла-утилизатора 21, стоящего перед реактором 22, становите*
входным параметром, а определяемым выходным параметром будет часть
газа, проходящая мимо котла.
Следовательно, упразднив обратную связь б, удалось произвести
декомпозицию, но не с точки зрения формального объединения блоков в
независимые комплексы, а по принципу разделения расчетов на
тепловой расчет (блок Ш) и расчет материального баланса всей схемы (I и
Л блоки).
Расчет энергетической части цикла (блок Ш), состоящего из трех
котлов-утилизаторов (двух типов), имеющих общий паросборник, водо-
подогревателей и вспомогательного котла с топкой, значительно упро-
291
щеется, если выходным параметром котлов будет не количество паре
заданных параметров, пак принято обычно, а тепдосъем, и выходом
расчетного блока подогревателя взять лі? - разность между
рассчитанным теплосодержанием подогретой и насыщенной C14°С1 воды,
которая может быть как отрицательной, так и положительной. Это приводит
к разрыву двухсторонних связей котлов с паросборником 12, что
делает однозначным расчет двух котлов и двух подогревателей при
введении лишь одной обратной связи 2 /I02/.
Ход расчета таков. Задаваясь необходимым расходом пера не
турбину и вычислив его теплосодержание на входе в первую ступень
пароперегревателя, сравниваем это с суммой тепловосприятий котлов-ути-
лизеторов и величин &Q водоподогревателей. Разность теплосодеряа
чий определяет погрузку по пару вспомогательного котла с топкой,
т.е. в этом расчете он играет роль компенсаторе невязки перового
баланса.
Все описанные выше приемы в сумме позволили значительно
сократить время счете и.дали возможность выполнить многовариантные pec-
четы и анализ существупцих и проектируемых схем производства аммиа
ка. Для определения критерия оптимальности (например, себестоимости
аммиеке или приведенных зетрат) можно использовать методы планирове-
ния расчетов, аналогичные методам планирования экспериментов. Это
дает возмоашость найти оптимальный режим (или оптимальную область
режимов) с минимальными затратами машинного времени.
ТЕРМОДИНАМИЧЕСКИЙ АНАЛИЗ СХЕМ
Одним из основных факторов, определяющих себестоимость продуктов, нч-
ляется тепловое совершенство технологического комплекса. Поэтому в?е
современные производства аммиака, водорода и метанола строятся пс
энерготехнологическоиу принципу. Механическая энергия, необходимая
для сжатия синтез-гаэа, воздуха, сырьевого газа и других целей,
вырабатывается в самом энерготехнологическом агрегете.
Энерготехнологический принцип использования сырья предуматри-
вает комплексную перереботку его в целевые химические продукты и
энергию, вырабатываемую при утилизации сгорения топлива, физического
тепла технологических потоков и тепла экзотермических реакций.
Многие суммерные химические процессы являются слабо экзо- или
эндотермические. В этом случае для их осуществления почти не
требуется подвода тепла, а иногда даже необходимо отводить его. Но если
температурный уровень, при котором осуществляются превращения, вы-
392
сок, то для доведения реагирупцих веществ до заданной температуры
требуется значительный расход высокопотенциального тепла /І04/.
Например, при производстве аммиака по схеме с двухступенчатой
конверсией природного газа суммарный тепловой эффект паровой и паровоздушной
конверсии метана, конверсии окиси углерода, метанирования и синтеза
аммиака экзотермический. Однако вследствие высокого температурного
уровня паровой конверсии, превышающего уровень реакций конверсии СО
и синтеза аммиака, ее осуществляют за счет высокопотенциального
тепла сжигания топлива.
Использование высокопотенциального тепла продуктов реакции
(например, тепла газов конверсии) для технологических целей
затруднительно: усложняется аппаратурное оформление и трудно достичь высокой
степени рекуперации тепла. Лучший эффект достигается при
комбинировании технологических и энергетических процессов. В рассматриваемых
производствах высокопотенциальное тепло продуктов сгорания
используется для процесса паровой или пароуглекислотной конверсии метана, а
основная часть энергетического пара высокого давления
вырабатывается за счет тепла продуктов конверсии. Низкопотенциальное тепло всех
потоков используется в основном для подогрева питательной воды
котлов и технологических целей.
Единого метода оценки эффективности и термодинамического
совершенства схем не существует. Поэтому рассмотрим несколько подходов к
решению этой задачи.
Энергетический коэффициент полезного действия схемы. Исходя из
общего определения, коэффициентом полезного действия технологической
установки будем считать отношение полученной полезной энергии к
затраченной. Здесь термин "энергия" понимается в широком смысле, вклю-
чапцем в себя энергию сырья, из которого были получены целевые и
побочные продукты. То есть, мы рекомендуем пользоваться энергетическим
коэффициентом полезного действия, который представляет собой
отношение теоретической энергии, необходимой для получения продукта, к
действительной
, А С
h ' (9.10)
где Л, л' - теоретически необходимое и действительное количество
сырья; QH - его теплотворная способность; В и (jpg - расход
топлива и его теплотворная способность; QT - тепло, подведенное
(или отведенное) энергоносителями; 4ЗЛ - расход (выработка)
293
электроэнергии на единицу продукта; рм - коэффициент полезного
действия (к.п.д.) преобразования тепловой энергии в электрическую
о учетом к.п.д. электропередачи и других потерь.
Энергетическим к.п.д. очень удобно пользоваться при
использовании в качестве сырья углеводородов и угля, которые являются и
энергетическим топливом, т.е. для процессов нефтехимии, производств
аммиака, водорода и метанола.
Теоретически необходимое количество сырья определяется по сум-
черной стехиометрической реакции. Например, для производства
водорода, аммиака и метанола в трубчатых печах имеем;
0,25 С»і + 0,5 ч2О — »2 * °-2} cut л" = * 4l 3
O + о, /зз 0г *
+ О, Ш Cu{ аН = - 39, і
0,15 CHt !¦ U,J fijO * U,Z5 CO2 —
На І моль Нг , Щ и SH3Ofi требуется, согласно
стехиометрии, соответственно 0,25; 0,442 и 0,75 молей метана. Аналогичные уряп
нения легко написать для любого состава сырья. Расчеты обычно
проводят на I т продукта, тогда имеем А# ~ 2000 кг/т; А^ -415 кг/т;
соответственно.
Если сырьем я топливом является одно и то же горючее, как это
имеет место при конверсии природного газа, и дополнительная тепловая
энергия (в вяде пара) не подводится, то формула для $у еще более
упрощается
"•"'
Энергетические затраты (теоретические и дейстаителъные,
чян. ккал/т) и коэффициент полезного действия для современных энер-
гіітехнояогических установок для получения аммиака и метанола ;таеют
кладущие значения:
Вещество Теоретические Действительные р,
Аммиак 4,95 9,5 - 11,0 4.5 -'52
«етанол 4,50 7,2-8,1 50 - 62
Если неизвестно точное значение ?w , то его можно рассчи-
Г'іть как отношение стоимостей одного кВ«ч (или мегокалсрий) тепла,
полученного аа счет сжигания топлива, используемого на установке, к
электроэнергии
с
?зл~ сіл ¦ (9.12)
Такой подход правомерен и при получении электрической энергии
на гидравлических, атомных и других электростанциях.
Эксергетический анализ технологических схем. При исследовании
химико-технологической (ХТО и энерготехнологической схемы (ЭТО
хорошие результаты дает применение эксергетического метода
термодинамического акели.эа, который позволяет учитывать как количество, тая
и качество произведенных и затраченных потоков вещества и энергии.
Эксергетический анализ дает возможность рассчитать степень
термодинамического совершенства процесса, основные источники потерь и
возможности их устранения /І04, Ю8_/. Эксергия, или техническая
работоспособность, характеризует максимальную полезную работу (т.е.
работу, получаемую в обратимом процессе), которая может быть получека
при переходе рабочего тела от параметров системы к параметрам
окружающей среды.
Е качестве степени термодинамического совершенства процесса
используется эксергетический коэффициент полезного действия
(9.13)
где ?gx и ?^ш - эксергия входящих Е систему и выходящих из
системы потоков. Для энерготехнологической схемы производства аммиака
(9Л4)
где Е^н , Есо , ?м , ?^дш - эксергия аммиака, двуокиси
углерода, метана и воздуха; ? - эксергия электроэнергии; Z?, -
сумма эксергий вторичных энергоресурсов.
Авторами работы /І04/ были внполнены расчеты экснергетических
к.п.д. для различных схем производства аммиака (табл.23): схемы I к
2 - парокислородная конверсия без давления, 3 - паро-киспородо-воэ-
душная конверсия; 4 и 5 - паровоздушная двухступенчатая конверсия
в пече.х и шахтных реакторах; 6 - энерготехнологическая схема на
базе двухступенчатой конверсии. При расчете схем эксергия химических
продуктов вычислялась по методу Шаргута.
295
Таблица 23. Расходные показатели и эксергетические к.п.д.
различных схем производства аммиака
Схема І Схема 2 І Схема 3 Схема 4 Схема 5 Схема
Показатель
Расход на І т л?#3
природного
газа, м3 917
пара Р = 40 ат.м3 -
электроэнергии,
кВт-ч
Количество отходов
пара, м^
продувочных
газов, м^
75
825
1016 1489
ПО
двуокиси
углерода, м3
53,8
47,1
576
57,4
47,0
854
1618
1042
280
58,0
47,2
1064
2674
967
626 734
1244 1200
1025
62
50,5
47,1
596
57,7
52,4
590
54,2
53,7
Без учета коэффициента полезного действия выработки
электроэнергии наибольшим значением j?^ обладают кислородные процессы.
Это объясняется тем, что кислородные процессы, если их рассматривать
изолированно, потребляют меньше природного газа и больше
электроэнергии, чем процессы с' внешним подводом тепла. Эксергетическая оцен
ка электроэнергии через тепловой эквивалент работы не учитывает
действительный расход тепла на получение этой электроэнергии на
тепловых станциях. Если рассматривать технологический процесс и процесс
получения электроэнергии с учетом к.п.д. преобразования энергии
топлива в электричество, то формула расчета эксергетического к.п.д.
комбинированной системы будет иметь вид
*'*'
(9.15)
де Ict ~ общий к.п.д. электростанции и системы электропередачи.
Приведенные в табл. 24 результаты при %сг = 4056. При этом
условии наивысшее значение ^ имеет энерготехнологическая схема
чр. базе двухступенчатой конверсии. По мере увеличения ^
эффективность энерготехнологического комбинирования снижается; при $ -
- -Ш. более выгодным (по сравнению со схемой рис.78) является приме-
•іяниє' чисто технологической схемы рис. 76 /Ї04/. По-видимому, энер-
готехнологические схемы потеряют смысл при переходе на ядерную или
другой вид энергетики, не потребляющей органическое топливо.
ОЦЕНКА ЭФШСГИВНОСТИ ЭНЕРГОТЕХНОЛОГМЧЕСКОГО КОМБИНИРОВАНИЯ
Эффективность энерготехнологического комбинирования можно оценить
с помощью термического к.п.д. системы /І04/. Сравниваются к.п.д.
ЭТС и энергетического парового цикла.
Для оценки различных технологических процессов за их
характеристику принимают температуру реакции г. . Тогда термический
к.п.д. технологического процесса
• и Тт " Т" (9.16)
а энергетического цикла
л - Т> " Т° , (9.17)
где Т - температура рабочего тела; Т - температура окружающей
среды.
Если при раздельном проведении этих процессов требуется расход
тепла на технологию QT и энергетику Q} , то в иомбинированной
?хеме доля тепла на каждый процесс определяется как
(9Л8)
Суммарный к.п.д. комбинированного процесса определяется как
оумма произведений
Чем более удачно будут скомбинированы отдельные
технологические процессы и энергетические циклы, тем будут меньше суммарное
Qr и выше степень использования топлива. рл - характеризует
в основном энергетическую сторону ЭТС, но не дает возможности
судить об общем ее совершенстве.
Коэффициент полезного действия технологической схемы можно
выразить уравнением /104/:
>> = -*— , (9.20)
297
где QTfi - полезно использованная энергия на технологические
цели, определяемая из условий теоретического расхода энергии на
различные процессы; Qg - энергия вторичных ресурсов, выданных с
установки; л - экономически целесообразная степень использования
вторичных ресурсов; #м - энергия, подведенная энергоносителями;
ST0/J - энергия топлива; g - энергия экзотермических реакций;
^7 - энергетический к.п.д. добычи, переработки и транспорта
топлива; h - к.п.д. производства энергоносителей.
Использование уравнения (9.20) для анализа знерготехнологиче-
ских схем затруднено из-за сложности оценки полезности вторичных
энергоресурсов. Применение принципа замены тепла вторичных
энергоресурсов через эквивалентную выработку электроэнергии трудно
реализуемо при анализе из-за таких косвенных факторов, как термический
к.п.д. цикла, относительный внутренний к.п.д. турбины и др.
В схемах производства аммиака, метанола и водорода вторичные
знергоресурсы можно подразделить на высокопотенциальные ( t ъ 400+
450 ) и низкопотенциальные ( t< 4000) /I09/. К высокопотенциальным
относятся ресурсы, с помощью которых можно получать энергетический
пар высокого давления ( Р = 100 - 140 ат). Потоки с температурой
ниже 450°С могут быть использованы только для получения пара
низкого давления и технологических нужд. С учетом такого разделения
вторичных энергоресурсов тепловой баланс схемы можно записать в
следующем виде:
где S г - суммарное количество тепла, подведенное в схему;
Qr - тепло, затраченное на проведение технологических процессов
с учетом сжатия потоков; Sм - избыточное низкопотенциальное
тепло; Qj - избыточное высокопотенциальное тепло; Q^ -
тепловые потери.
В установках производства аммиака требуется большое
количество механической энергии для сжатия азотоводородной смеси до
давления в несколько сот атмосфер. Поэтому там могут быть полностью
использованы высокопотенциальные вторичные знергоресурсы (потоки
конвертированного газа) для выработки энергетического пара. Таким
образом,полное использование низкопотенциального тепла
затруднительно, вывод его из цикла не рационален, если нет близко
расположенных потребителей. Утилизировать ниэкопотенциальное тепло
иногда удается повышением его потенциала (температуры), что достигается
вводом некоторого количества высокопотенциального тепла и сжиганием
29Э
дополнительного количества топлива. Таким путем можно получить
количество механической энергии, полностью удовлетворяющее нужды
аммиачного комплекса или водородной установки.
При производстве метанола при низком давлении энергетические
потребности установок значительно ниже и использование вторичных
знергоресурсов, особенно низкопотенциального тепла, затруднительно
Возможны производство значительного количества пара среднего
давления D0-18 ат) для заводских нужд или организация
энерготехнологической схемы, вырабатывающей электроэнергию на сторону. В обоих
случаях надо затрачивать дополнительное количество топлива для
поднятия потенциала низкопотенциального тепла. В этом случае тепловой
баланс схемы можно выразить как /IU9/
«•«т***4*9!***- (9.22)
Получаемая за счет теплоиспользования электрическая (или
механическая) энергия распределяется между потреблением в самой
установке и выдачей на сторону. Выдача электроэнергии на сторону
экономически оправдана, если приведенные затраты на единицу вырабатываемой
энергии будут ниже, чем на современных электростанциях. Это может
быть достигнуто только при значительной мощности турбогенератора,
которая может быть оценена в 50 - 100 мВт.
Энергетический к.п.д. для энерготехнологической схемы,
производящей электроэнергии, будет
,
(9.23)
где л в - дополнительный расход топлива.
Введенный нами энергетический к.п.д. обладает большой общностью.
Как было показано, он справедлив для технологических установок. Для
чисто энергетических установок A, A1, Q м равны кулю и он
вырождается в обычный к.п.д. электрической станции
_
Кэ~~ s'a" ' (9-24)
р
где в' * расход топлива на производство электроэнергии.
Действительный расход топлива В определяется при детальном
расчете всей технологической схемы. Но для термодинамического анали-
299
за 8 ножно определять из теплового и энергетического балансов
установки /103/:
где Qgx и 4^х - сукыарное физическое тепло компонентов на входе
в систему и выходе из нее; tfx - тепло, отведенное в
промежуточных холодильниках, например в процессе сжатия газа и воздуха; 2л^ -
механическая энергия, вырабатываемая за счет утилизации тепла и
отпущения на сторону; Qorn - количество тепла, отпущенное стороннему
потребителю; Е#к - суммарная мощность компрессоров; Л и N -
мощности, вырабатываемые паром, не участвующем и участвующем в
технологическом процессе; Nгт - мощность газовых турбин.
В современных установках механическая (электрическая) энергия
на сторону не выдается и газовые турбины не устанавливается; в этом
случае Qom +Z*„+#r7 ~-O.
Для энерготехнологической установки с паротурбинным циклом
совместное решение уравнений (9.25) и (9.26) дает следующее выражение
для определения расхода топлива /JL02J:
где 2п - к.п.д. печи; ^ - к.п.д. энергетического цикла; л^
мощность, которую можно получить при расширении технологического
пара в конденсационной паровой турбине.
Одним из путей повышения эффективности производства аммиака,
метанола и водорода является применение энерготехнологических схем
с парогазовым циклом, в котором в качестве рабочего тела
используется не только водяной пар, но и продукты сгорания топлива /16, 103,
109, ІЮ7. Такая схема применительно к паровоздушной конверсии была
рассмотрена выше (см. рис. 74). При паровой конверсии в
высоконапорной камере располагаются реакционные трубы, заполненные
катализатором. Это значительно усложняет конструкцию аппарата. Более сложной
становится и вся схема. По-видимому, это является причиной того, что
схемы с парогазовым циклом в промышленность не внедрены. Но
энергетический к.п.д. такой схемы примерно на 10^ выше /16, 109/, чем схе-
300
мы с использованием только парового цикла, и это побуждает искать
пути реализации парогазового цикла. По результатам работы /І09/,
экономичность энерготехнологических схем на базе паро-кислородо-воздуш-
ной и паровой конверсии природного газа приблизительно одинакова.
Поэтому промышленное использование парогазового цикла следует
начинать в сочетании с автотермическими процессами конверсии, что
технически реализуется значительно проще.
СПИСОК ЛИТЕРАТУРЫ
Гамбург Д.Ю., Семенов В.П. Современное состояние пройдеш
вило рода. - Хим. технологія, 1972, № 2, с. 3-Ю.
Назаров Э.К., Семенов В.П. Промышленная схема производства
водорода. - Каталит.конверсия углеводородов, Киев, 1974, вып. I,
с. 9-тЗ.
Бабкина A.JL , Брагинский O.E., Щукин Е.П. Экономические
проблемы перспективного развитии нефтехимической промышленности. -
М. : Химия, 1973. - 181 с.
Гамбург Д.Ю., Семенов В.П. Современное состояние проблемы
синтеза аммиака. - Хим.технология, Т973, № I, с. 3-9.
Ермакова И.П. Современное состояние и тенденции развития
производства метилового спирта в капиталистических странах. - Хим.
пром.-сть за руоеазм, 1979, вып.7, с. ІТ-4І.
Іамбург Д.Ю., Семенов В.П. Химическая технология и экоэнергети-
ка (обзор). - Хим.технология, 1975, № 5. с.З-П.
Курс технологии азота / Под оед. В.И.Атрощенко, М. : Химия,
1969. - 384 с.
Степанов A.B. Производство низших олеЗинов. - К. : Наук.думка,
1978. - 248 с.
Зуппон Т.А.,Буйвадс Л.Д. Сыоье для произовдства аммиака. - Нефть
газ и не^ехимйя, 1979, J* 9, с. 134-137.
Справочное руководство по катализаторам для производства
аммиака и водорода / Пер.с англ. под ред. В.П.Семенова. - Л.
Химия, 1973. - 246 с. „, u
Schulz G., Hiller H. Verfahren zur Erzeugung von synthetischen
Erdgea. - Erdol und Kokile-Erdgae-Fetrochem., 1973, H.1, S. 11-16.
Карп И.H., Сорока B.C. Кислородная и воздушно-кислородная
конверсия метана. - Киев : Наук.думка, 1977. - 64 с.
Шумилина 3.<Ь,, Ягодкин В.И., Шполянский М.А.. и др.
Экспериментальное исследование паровой конверсии природного газа под
давлением до 100 ат. - Каталит. конверсии углерода, 1975, вып. 2,
Стежинский АЛ'., Семерина С.Д., Праженник Ю.Г. Расчет процесса
высокотемпературной конверсии метана с помощью ЭВМ. -
Алгоритмизация расчета процессов и аппаратов на ЭВМ, 1969, вып. Б,
с. 8-Т7.
Веселов В.В., Рафал А.Н. Состав газа конверсии углеводородов.-
Киев : Наук.думка, 1976. - 188 с.
Производство технологического газа / Под ред. А.Г.Дейбуш. -
\? : Улиті, І97І. - 288 с.
Вакк Э.Г., Семенов Б.П. Каталитическая конверсия углеводородов
в труочагшс печах. - Ы. : Химия, Т973. - 192 с.
СелицКииЛ А.П. Методы получения технологическою газа для
синтеза метанола. - Газ.пром-сть, Т975, & 10, с. 728-731.
Иофіїе И.И., Письмен Ї.М. Инженерная хшлия гетерогенного
катализа. - Л.. : Химия, 1972. - 462 с.
Веселов В.В. Пути усовершенствования высокотемпературных
катализаторов конверсии углеводородов. - Каталит. конверсия
углеводородов, 1975, вып. 2, с. 54-70.
302
<¦!. Письмен М. К. Производство водорода в нефтеперерабатывающей
промышленности. - М. : Химия, 1976. - 208 с.
22. Хоменко A.A., Апельбаум Л.О., Шуб Ф.С. и др. Кинетика реакции
конверсии метана водяным паром на поверхности никеля. -
Кинетика и катализ, 1971, 12, вып.2, с. 423-430.
23. Темкин М.И., Шуб Ф.С., Хоменко A.A., Опельбаум Л.О. Кинетика
конверсии метана на никелевом катализаторе. - В кн.: Научные
основы каталит.конверсии углеводородов. Киев : Наук, думка,
1977, с. 3-27.
24. Агранат Б.Д., Лейбуш А.Г., Семенов В.П. Кинетика конверсии
метана водяным паром при повышенном давлении. - Кинетика к
катализ, 1976, 17, вып.5, с. I24I-I245.
-25. Агранат Б.Д77 Бесков B.C., Семенов В.П. и др. Влияние давления
на скорость реакции конверсии метана водяным паром. - Каталит.
конверсия углеводородов, 1979, вып. 4, с.62-64.
'.'О. Кинетика гетерогенно-каталитических процессов под давлением /
Под ред. В.И.Атрощенко. - Харьков : Вища школа,1974.- 168 с.
27. Атрощенко В.И., 'Лобойко А.я., Юрченко А.П., Звягинцев Г.Л.
Изучение кинетики конвеосии метана и окиси углерода под
давлением. - В кн.: Научные"основы каталитической конверсии
углеводородов. Киев : Баук.думка, 1977, с. 233-241.
?8. Бодров И.М., Апельбаум Л.О., Темкин М.И. Кинетика реакции
метана с водяным паром на поверхности никеля. - Кинетика и катализ,
1964, Д. вып.4, с. 696-705.
?9. Анохин В.И., Дерюжкина В.И., Перегудов В.А., Меньшов В.Н.
Катализаторы и кинетика конверсии метана с водяным паром. - В кн.:
Научные основы каталитической конверсии углеводородов. Киев :
Наук.думка, 1977, с.ВЗ-83.
30. Phillipe T.R., Mulhflll J., Turner G.H. The kinetics and
mechanism of the reaction between steam and hydrocarbons ove nickel
cataliats. - J. Catal., Pt 1, 1969, 151 S 3, p. 233-244; 1970,
11, Я 1, p. 28-3*, Pt. 2.
JI. Балашова O.A., словохотова Т.А., Балашшн A.A. Механизм и
кинетика конверсии. - Вестн. МГУ, Сер. хим., 1966, ?1, 0.108-118.
32. Горячев O.A.. Исследование процессов низкотемпературной паровой
каталитической конверсии и каталитического гидрогенолиза смеоей
Углеводородных газов: Авторе*, дис. ,..канд.техн.наук. - М.,
975. - 16 о.
ЗУ. Головин Г.С. Исследование процесса паровой каталитической
конверсии жидких углеводородов: Автореф.дис. ...канд.хим.наук. -
М., 1974. - Т6 с.
34. Мешенко Н.Т., Веселов В.В., Шуб Ф.С., Темкин М.И. Кинетика
низкотемпературной паровой конверсии этана на никелевом
катализаторе. - Кинетика и катализ, 1977, 18, вып. 4. а. 962-967.
35. Slnfelt J.H. Kinetics of ettwne hydrogenelysla. - J.Catal., 1972,
12.'H 3.
36. Словохотова Т.А., Баландин A.A., Петров Э.П., Шолин А.Ф.
Каталитический гидрогенолиз этана и пиклагенсана на катализаторе
Hi -аизельгур. - Изв. АН УССР. Сер.хим., 1965, * 5,0.785-792.
37. Bhatta К.Б.lt., Dixon G.M. Catalytic steam reforming of
n-butane at high pressure. - Trana. Faraday Soc., 1967,63, Ft. 9,
p. 2217-2224.
38. Баландин A.A., Словохотава Т.А., Шолин А.Ф., Угольдева Л.А.
Пиролиз этана в проточной системе на никелевых катализаторах.-
Кинетика и катализ, 1965, т.6, вып.1. с. II5-I20.
39. Арис Р. Анализ процессов в химических реакторах. - Л, :
Химия, 1967. - 328 с.
10. Аэров М.Э., Тодес О.М. Гидравлические и тепловые основы работы
аппаратов со стационарным и кипящим зернистшл слоем. — JT. :
Химия, 1968.
303
Дйдушинский Я. Основы проектирования каталитически! реакторов -
Й7: Химия, 1972. - 376 с. * j~
Франк-Каменепкий Д. А. Диффузия и теплопередача в химической
кинетике. - М. : Наука, 1967. - 492 с.
Малиновская O.A., Бесков B.C., Слинько M.T. Моделирование
каталитических процессов на пористых зернах. - Новосибирск : Нау-
Саттерфилд У.Н. Массопередача в гетерогенном катализе. - М. :
Химия, 1976. - 240 с.
Бесков B.C., Малиновская O.A. Устойчивость и чувствительность
процессов на пористом зерне катализатора. - В кн.: Пористая
структура катализаторов и процессы переноса в гетерогенном
катализе. Новосибирск : Наука, 1970.
Вяткин Ю.І., Бесков B.C., Засмолин A.B. и др. Моделирование
процесса паровой конверсии метана в трубчатом реакторе. - В кн.:
"Химреактор-б" : (Тез.докл.). Уфа, 1974. с.227-231.
Бесков B.C., Вяткин Ю.Л., Малиновская O.A. Исследование
каталитического процесса в пористом зерне катализатора. -
Теоерт.основы хим.технологии, 1975, $., Л 2, с.285-290.
йяткин Ю.Л., Бесков B.C. Моделирование процесса паровой
конверсии метана в зерне катализатора. - Теорет.основы хим.технологии,
1975,Д. И, с, 535-540.
БодровИ.М., Апельбаум Л.О., Темкин М.И. Кинетика реакций
метана с водяным паром, катализируемой никелем на пористом
носителе. - Кинетика и катализ, 1967, JL вып.4, с. 821-828.
Агранат Б.Д., Лейоуш А.Г. Конверсия метана водяным паром при
повышенном давлении на никелевом катализаторе. - Хим.пром-сть,
1975, & 7, с. 488-490.
Альтшулер B.C. Получение газов-восстановителей из природного
газа. - М., 1977. - 68 с. - (сер.: Использ. газа в нар.хоз-ве
ВНИИЭгазпром).
Moaaley Г., Stephens R.W., Stewart K.D., Wood J. The poisoning
of a eteam hydrocarbon caaification cataliat. - J. Catal.,1972,
2І, Ы 1, p. 18-39.
Очистка технологических газов / Под ред. Т.А.Семеновой, К.Л.
Лейтеса. - М. : Химия, 1977. - 488 с.
Технология связанного азота. - М. : Химия, 1974. - 464 с.
Данциг М.Л., Штейнберг Б.И., Козлов Л.И. и др. ІЬзработка и
внедрение хемсорбентов и катализаторов для тонкой сероочистки
углеводородных газов. - Каталит.конверсия углеводородов,1974,
вып.1, с; 129-133.
Данциг М.Л., Жаркий Г.А., Данциг Г.А. Промотировашше
цинк-алюминиевые катализаторы-хемсорбенты для тонкой очистки
многосернистых газов. - В кн.: Получение водорода из углеводородного
сырья. Киев : Наук.думка, 1979, с. 3-13.
Целевич A.A., Волынский A.B. Термодинамика процесса
низкотемпературной конверсии углеводородов в присутствии водорода с
учетом теплового аффекта. - В кн.: Процессы получения сырья
для нефтехимии. М. : ШИИТЭНЕ»ТЕХИМ, 1980, с. 61-68.
Лейбуш А.Г..Шорина Е.Д. Исследование начальной стадии конверт
сии метана при повышенном давлении. - Хим.пром-сть, 1962, № 3,
с. 159-165.
Лавров Н.В., Жебрак Ю.А., Голгер СП. Результаты научения
воздушной каталитической конверсии природного газа на
опытно-промышленной установке. - Каталит.конверсия углеводородов, 1975,
вып. 2, с. 5-8.
Огадианов Г.А., Крайнов В.Н., Лейбуш А.Г., Бесков B.C.,
Вяткин Ю.Л. Оптимизация агрегата каталитической конверсии метана
и окиси углерода. - Хим.пром-сть, Т968, № I, с. 129-137.
Ы. Сігадяанов Г.А., Крайнов R.H. и др. Моделирование
каталитической паро-кислюродо-воздушной конверсии метана. - Хим.проы-сть,
62. Гущин А.2!, Семенов В.П. Каталитическая конверсия природного
газа. - В. : Химия, 1970. - 112 с.
6J. Справочник азотчика. - М. : Химия, ТЭ67. - Т.І. 492 с.
64. Волынский A.B., Целевич A.A., Кириченко H.A. Расчеты основних
параметров и характеристик газовых потоков каталитических
стадии процесса производства водорода. - Процессы получения сыры
шм нефтехимии, 1980, вып.35, с.68-78.
65. Еизяев В.М., Гаретша В.В., Королев и др. Результаты раооты
катализатора КСН в промышленных агрегатах. - Каталит. конверсия
углеводородов. 1975, вып.2, с. 74-78.
66. Стадник В.Ф., Королев А.Д., Ильенко Б.К. Смесители конверторов
метана. - Каталит.конверсия углеводородов, 1978, вып.З, с.94-9Ь
6/. Ведерников М.И. Производство аммиака из природного газа. -
Киев : Техніка, ПРО. - 232 с.
68. ioung R.J, Development of tjie ateam-naphtha reforming proсвви
for tbe production of hydrogen. - Cbem. Age. Indie, 1966, Г7,
Ы 5, p. 373-360.
69. Ильенко Б.К. Современное состояние паровой конверсии
углеводородов. - Хим.технология, 1979, Ja 5, с.29-34.
70. Метода моделирования каталитических процессов на аналоговых а
цифровых вычислительных машинах / М.Г.Слинько, В.Л.Бесков и
др. - Новосибирск : Наука, 1972. - 152 с.
71. Hymen H.H. Simulate methan reformer reactions. - Hydrocarbon
Proeee., 1968, 7, p. 131-137.
72. Grover S.S. Optimize hydrogen production by model. - Ibid.,1970,
4, p. 1О9-Ш.
73. Живаго Б.А., Каеаров В.В., Деров В.Д. и др. Исследование,
процесса двухступенчатой конверсии метана агрегата АМ-600. - Хим.
технология, 1977, J* 2, с.39-42.
74. Степанов A.B., Кадыгроб Л.А., Безуглый Ю.К. Математическое
моделирование реактора паровой каталитической конверсии природно
го газа. - Каталит.конверсия углеводородов, 1978, вып.3,с.67-71.
75. Семенов В.П., Сосна М.Х., Соколинский Ю.А. Термодинамическая
модель процесса конверсии метана в трубчатом реакторе. -
Алгоритмизация расчета процессов и аппаратов хим.пр-в, 1969, вып.5,
76. Атрощенісо В.И., Звягинцев Г.Л., Серовский Л.А. Расчет отималь-
ного трубчатого реактора для паровой конверсии природного газа
под давлением. - Хим.пром-сть, 1972, № II, с.853-056.
77. Эавелев Е.Д., Вакк Э.Г, Исследование динамики процесса
каталитической конверсии природного газа. - Азот.пром-сть, 1979,
вып. 3, о. 15-22.
78. Finneren J.A., Ja гае J.C., Green H.J. Low coat reducing gaa. ~
J.Metala, 1972, 24, I 2, p. 35-41.
79. PTM: Нормативная методика теплового расчета трубчатых печей.-
М.:ВНИИНБФТЕМАШ, 1978. - 645 с.
80. Седелкин В.М., Паимов A.B. Исследование сложного теплообмена
в трубчатых печах. - Теория и практика сжигания газа, 1975, Jj
с. 244-252.
81. Шапошникова Г.А., Рауд Э.А., Бутовский В.А. и др.
Математическая модель конвективной секции реакционной трубчатой печи. -
Нефтепереработка и нефтехимия, 1976, вып.12, с.83-96.
82. Степанов A.B. Методика моделирования печей конверсии. -
Каталит. конверсия углеводородов, I98I, вып.6.
83. Степанов A.B., Сульжик Н.И. Математическая модель трубчатой
печи каталитической конверсии углеводородов. - Хим.пром-сть,
1980.
305
Степанов A.B., Махорин K.E., Паимов A.B., Вяткин Ю.І.
Моделирование процессов и аппаратов высокотемператусной переработки
углеводородов. - Хям.технология,1982,& 2,с,22-24.
СіпГгейа А.Н., Qreen В.H, Hydrogen plant Bhoud down redueed,-
Hydrocarbon Ргооєв., 1972, 51, H 5, p. 113-П7.
Шибря Г.Г., Морозов Н.М., тёмкин М.И. Кинетика и механизм
каталитической реакции окиси углерода с водяным паром. Реакция
на окисном желеэохромовом катализаторе. - Кинетика и катализ,
1965, 6., вып.6, с. I057-T068.
Анохина A.C., Черкасов Г.П., Семенова Т.А. Высокоактивный медь
содержащий катализатор низкотемпературной конверсии окиси
углерода. - Хим. пром-сть, 1978, № 4, с. 286-288.
Зласенко В.М. Каталитическая очистка газов. - Киев : Техніка,
1973. - 200 с.
, Seglin L., Geoaita R. Survey of methanation chemistry and
processes. - In: Methanation Bjnth. gaa., 19761
Раскин А.Я., Соколинский Ю.А. Математическое описание и расчет
реактора конверсии окиси углерода - Хим.пром-сть, 1969, а т.
Адинберг Р.З., Генкин B.C., Диламан В.В. и др. Гидродинамика
промышленного радиального реактора конверсии окиси углерода, ¦-
Хим.пром-сть. 1976, № 6, с. 446-449.
, Petrochemical handbook іваие. - Hydrocarbon Proces. , 1969, H 1'.
р. 187t 1971, H 11, p. 164, 178; 1972, H 11, p. 222* 1973, «II
p. 137! 1975,H 11, p. 111T 112.
Gsa processing handbook. - Ibid.,1979,H 4-, p.165, lob, 163.
. Кор Ф., Дропп Ф., Рудолыдторфер Э. Производство водорода
высокой частоты. - Нефть, газ и нефтехимия, 1979, № 3, с.95-99.
, лек Дк.Л., Иогансен Т. Новый процесс промышленного
производства водорода. - Химия н переработка углеводородов, 1978, № 1..
с. 32-36.
, Караваев М.М., Мастеров А.П. Производство метанола. - М. :
Химия, 1973. - 160 с.
. І^мбург Д.Ю., Семенов В.П. Современное состояние проблемы
синтеза метанола. - Хим.технология, 1980, № 6, с.3-13.
, Волынский A.B., Целевич A.A. Паровая и пароуглекислотная
конверсия нефтеэаводских газов. - В кн.: Научные основы
каталитической конверсии углеводородов. Киев : Наук.думка, 1977,
с. 242-273.
, Островский Т.М., Волин Ю.М. Моделирование, сложных
химико-технологических схем. - М. : Химия, 1975. - 312 с.
, Егерев В.В., Раскин А.Я., Соколинский Ю.А. и др. Расчет и ov ¦
тимизация сложной ХТС отделения совмещенной конверсии
производства аммиака. - Хим.пром-сть, 1975, Ik 10 с. 761-765.
. Кгерев В.В., Раскин А.Я., Сосна М.Х. и ад. Расчет и онтимиза
ция действующей энерготехнологической схемы производства at-1.
миака. - Там же. Т977, Jfc .1, с. 50-53.
. Егерев В,В., Pacvwi А.Я., Ооколинский Ю.В. и др. Математкчз- ,
ские модели и проі'раммн расчета ХТС аммиачных производств
оольшой мощности с конверсией природного гапа и нефти. - Ка-
талит.конверсия углеводородов, 1979, вып.4, с. Э8-103.
. Арсеньев Л.В., Семенов В.П., Потанин А.П. и др.
Термодинамический анализ анерготехнологическшс процессов производства л~і
шака. - Хим.пром-сть. 1978, № 2, с. Ї2І-І23.
. Семенов В.П., Сосна МЛ., -їадеева С.Н., Лейтес И.Л. Оценка
эффективности энерготехнологического комбинирования с помощью
аксергетического метода. - Гам же, 1975, № 5, с.359-362.
.'Щук E.G., Тесленко В.М., Исследование математических моделей
отделения конверсии метана производства аммиака. - Там же,
Т974, * 7, с. 4§7-500.
life. Черноморда* Л.И., Потанин A.D., Іамбург Д.В.
Термодинамический анализ процессов производства аммиака. - Там же, 1974,
№ I, с. 47-48.
ШУ. Кафаров В.В., Беров В.Д., Иванов В.А. и др. Влияние состава
сырья на технологические режими агрегатов производства ашиа-
ка. - Таы де, 1976, * 7, с. 517-519.
10Я. Ерандт Б.Б., Лейтес И.Л., Цоловинюш В.А. Методика анализа
материальных потоков в агрегатах синтеза аммиака. - Там же,1979.
* 107с 624-625.
¦09. Лапидус A.C., Лобанова И.А. Пути оптимизации
энерготехнологических схем производства аммиака. - Там же, 1972, № 5, с.383-
386.
[10. Сосна М.Х., Нгынтинский Б.В., Соколинский U.A. и rv.
Конвективная трубчатая печь конверсии углеводородов и ее математике
екая модель. - Химия и технология топлив и масел, 1974, u 12,
С.36--40.
111. Joohel H., Tribelrorn В.Б. Gaayntiian prooeea for SHQ. -
Hydrocarbon Process., 1973, 52, N 1, p. 93-98.
112. Ричардсон Д. Т. Технология производства катализатора для
получения заменителя природного газа. - Инженер-нефтяник, 1973,
* 13, с. 90-96.
[13. Лом У.Л.. Уильяме А.Ф. Заменители природного газа. - М. :
Недра, 1979, - 248 с.
114. Развитие производства заменителя природного газа. - М. ,197с.¦¦
24 с. - (Сер. Переработка газа и газового конденсата / ВНИИ-
ЭГАЭ1Р0М).
115. Groesland 3. Proceea liquida to SBG. - Hydrocarbon Procea.,
1972, 51, H 4, p. 94-96.
116. Davlee H.S., Lacey J.A. CRU prooeaa la an ideal route to 3HQ.-
Patroleum end Petrochem. Intern., 1973, Ці Я 2, p. 5O-60; H 4,
р. 50-60. ,
117. Williame A., flutler U.A., Hammonda J. Sintering of nlokel-aluLt
catalysts. - J. Catal., 1972, U, Я 2, p. 352-355.
[18. Степанов A.B. Моделирование адиабатического реактора
низкотемпературной паровой конверсии углеводородов. - Хим.технология,
1980, & 4, с.^8-30.
[19. Мешенко Н.Т., Рафал А.II., Ъеселов В.В. Расчет равновесного
состава продуктов низкотемпературной конверсии гомологов
метана. - Нефі, и газовая пром-сть, Киев, 1974, с. 35-38.
[20. Schulz u., Hiller H. Verfahren zur Erzeugung von ainthetiacheu
Erdgaa. - Erdol und Kohla-Erdgae-Petroohemie, 1973, M 1, S. 11-
[21. Thornton O.P., Ward O.J., Erikeon R.A. MRG procese for S1IG. -
Hydrocarbon Proceea, 1972, N 8, p. 81-84.
[22. Целевич A.A., Волынский A.B., Якоачев B.C. Автотермическая
паровая конверсия ^-гексана. - Каталит.конверсм
углеводородов, 1975, вып.2, с. 16-20.
[23. Макаров В.К., Волынский A.B., Гусеза И.Н., Целевич A.A.
Получение синтез-газа методом пароуглекислотной каталитической
конверсия нефтезаводских газов. - Каталит.конверсия
углеводородов, 1978, аып.З, с.86-90.
[24. ЇаврєнтовйЧ Р.Ф., Степанов A.B., Макаров И.А., Клшешсо A.D.
Каталитическая очистка природного газа от газоконденсата. -
Там же, 1973, вші.З, с. 96-99.
!25. Кореиьков Г.Л^, Тихонова P.A. Потребление энергоресурсов в
промышленности азотных удоореїшй. - Хим.пром-сть за рубежом,
1980, вид. II, с. І-ІЗ.
307
СОДЕРЖАНИЕ
ВВЕДЕНИЕ 3
ГЛАВА I. СТЕХИОМЕТРИЯ И ТЕИ1СДИНАМИКА, РЕАКЦИЙ 13
Стехиометрия основных реакций 13
Термодинамические условия выпадения свободного углерода 19
Методы расчета равновесных составов 21
Равновесные соотношения и составы газовых смесей 29
ГЛАВА П. КА.ТАЛИЗАТ0РЫ. МЕХАНИЗМ И КИНЕТИКА РЕАКЦИЙ КОНВЕРСИИ 33
Катализаторы высокотемпературной конверсии природного газа и
жидких углеводородов
Катализаторы низкотемпературной конверсии 39
Каталитические яды и дезактивация катализаторов 42
Механизм и кинетика паровой конверсии метана 45
Механизм и кинетика конверсии и гидрогенолиза
высокотемпературных углеводородов 51
ГЛАВА 3. ГИДРОДИНАМИКА И МАКРОКИНЕТИКА ПРОЦЕССОВ В ЗЕРНИСТОМ
СЛОЕ КАТАЛИЗАТОРА 58
Гидродинамика зернистого слоя 58
Тепло- и массоперенос между газовый потоком и слоем
каталізатора 60
Диффузия в порах катализатора 66
Моделирование процесса конверсии метана на зерне катализатора 69
Моделирование процесса конверсии жидких углеводородов 77
ГЛАВА 4. ПОДГОТОВКА СЫРЬЯ К КОНВЕРСИИ. ОЧИСТКА ОТ СЕРНИСТЫХ
СОЕДИНЕНИЙ. 82
Требования к сырью и способы его очистки 82
Щелочная очистка 83
Очистка газа на активированном угле 87
Очистка оксидами железа 89
Очистка оксидом цинка 90
Каталитическое гидрирование серороганических соединений ...... 95
Одноступенчатая очистка на катализаторах-хемсороентах 96
Аяпаратурно-технологическое оформление процесса очистки на
іемсороентах 99
308
ГМНА 5. АВТОТЕРШЧИСКАЯ КОНВЕРСИЯ УГЛЕВОДОРОДОВ 1J1
Развитие автотермического способа конверсии -. ЮІ
Процесс в шахтном реакторе . 103
Расчет и моделирование процессов и реакторов автотермкческоі
конверсии 109
Конверторы природного газа 119
Эксплуатация реакторов . , 122
Шахтные реакторы вторичной конверсии '24
Паровая низкотемпературная конверсия » 127
Процесс паровой конверсии в адиабатическом реакторе '28
Расчет и моделирование низкотемпературной конверсии 134
ГЛАВА 6. ПАРОВАЯ КОНВЕРСИЯ В ТРУБЧАТЫХ ПЕЧАХ I38
Особенности технологического процесса и конструкций печев 138
Реакционные трубы 142
Моделирование реакционный трубы '49
Некоторые результаты моделирования труб '56
Принципы проектирования реакционных труб и камер радияпии ....163
Конструкции трубчатых печей паровой конверсии '65
Тепловой расчет трубчатой печи 175
Моделирование печей конверсии 'S3
Эксплуатация агрегатов конверсии '86
ГЛАВА 7. КОНВЕРСИЯ И МЕТАНИРОВАНИЕ ОКИСЛОВ УГЛЕРОДА 189
Термодинамика, механизм и кинетика реакции окиси углерода с
водяным паром '89
Катализаторы конверсии СО '94
Механизм и кинетика реакций гидрирования (метанирования)
окислов углерода 197
Катализаторы иетанирования , .202
Процессы на зерне и в слое катализатора 205
Адпаратурно-технологическое оформление 210
ГЛАВА 8. ОЧИСТКА КОНВЕРТИРОВАННОГО ГАЗА ОТ ДВУОКИСИ УГЛЕРОДА 214
Характеристика промышленных способов очистки от СО^ 214
Физико-химические основы чистки водными растворами этанол-
аминов 215
Технологичеокие схемы и аппаратурное оформление моноэтанолами-
новой очистки 219
Очистка газов растворами карбонатов 224
Абсорбция CU? органическими растворителями и растворами в
них алканоламинов -230
309
Абсорбция метанолом при отрицательных температурах (процесс
"Ректизол") 231
Очистка водорода методом короткоцикловой адсорбции с
десорбцией сбросом давления (КЦАДОД) 23^
Выделение водорода с помощью полупроницаемых материалов гз 7
ГЛАВА 9. ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ ПРОИЗВОДСТВА. РАСЧЕТ, АНАЛИЗ
И ОПТИМИЗАЦИЯ 239
Схемы получения синтез-газов методами автотермической конверсии 239
Технологические схемы производства аммиака с двухступенчатой
конверсией 24 ';
Технологические схемы производства спиртов с конверсией в тру?-
9RQ
чатых печах 1* '
Технологические схемы производства водорода 265
Агрегаты для получения восстановительных газов 270
Основы производства ЗПГ методами каталитической конверсии .... g^2
Технологические схемы производства ЗПГ и очистки природного
газа ......„, ^75
Моделирование и оптимизация технологических схем ?81
Расчет и оптимизация схемы автотермической конверсии для
аммиачного производства ? ¦'*•
Моделирование технологических и энергетических охем
производства аммиака с двухступенчатой конверсией углеводородов ... ?-Г:
Термодинамический анализ схем <>9<;
Оценка эффективности знерготехнолпгического комбинирования ... <-"
Список литературы , г';>
Анатолий Васильевич Степанов
ПОЛУЧЕНИЕ ВОДОРОДА
И ВОДОРОДСОДЕРШЩ ГАЗОВ
Утверждено к печати ученым советом
Института газа АН УССР
Редактор H.A.Ласкавая
Обложка художника Д.Д.Грибова
Художественный редактор Н.М.Абрамова
Технический редактор Т.М.Зубрицкая
Корректоры Л.Н.Якута С.В.Лисицына
Информ. бланк * МОЗ
Пода, к печ. 22.10.82. БЬ 01824. Формат 60x84/16. Бумага офс.,«1.
Эфе. печ. Уол.печ.л. 18,4. Усл.кр.-отт. 18,63, Уч.-изд.л. 18,35.
Тираж 800 экз. Заказ* ¦!;" Цена 2 р. 30 к.
/Іздательотво "Наукова ду\гкй*. 262601 Киев, ШП, Решша, 3.
;іиевгкая книжная типография нчучной книги.2520A4 Киев-а.Репин1) ,4.
АКАДЕМИИ НАУК УКРАИНСКОЙ ССР
ИНСТИТУТ ГАЗА
А.В.СТЕПАНОВ
ПОЛУЧЕНИЕ
ВОДОРОДА
И ВОДОРОД-
СОДЕРШАЩИХ
ГАЗОВ
КИЕВ НАУКОВА ДУМКА 1982