Текст
К. К. АНДРЕЕВ и А. Ф. БЕЛЯЕВ
ТЕОРИЯ
ВЗРЫВЧАТЫХ ВЕЩЕСТВ
Допущено
Министерством высшего и среднего специального образования РСФСР в качестве учебника для химико-технологических специальностей вузов
ГОСУДАРСТВЕННОЕ
НАУЧНО-ТЕХНИЧЕСКОЕ ИЗДАТЕЛЬСТВО
ОБОРОНГИЗ
Москва 196 0
В книге рассмотрены основные физико-химические свойства взрывчатых веществ, существенные для их производства, а также применения, теория медленного термического превращения, горения и детонации взрывчатых веществ и разрушающее действие взрыва.
Книга предназначена для студентов соответствующих факультетов химико-технологических вузов, а также для работников заводов и научно-исследовательских институтов.
Рецензенты: докт. техн, наук проф. К. К. Сиитко и канд. хим. наук доцент Д. С. Аванесов Редактор докт. техн, наук А. И. Гольбиидер
Зав. редакцией инж. С. Д. Красильников
ПРЕДИСЛОВИЕ
Курс теории взрывчатых веществ входит в учебные планы соответствующих специальностей химико-технологических вузов и военных академий.
Книги Н. А. Соколова «Курс теории взрывчатых Ееществ» и К. К. Снитко «Теория взрывчатых веществ», изданные в 1936—• 1937 гг., достаточно полно и глубоко отражали состояние этой области науки.
За годы, прошедшие со времени издания этих учебников, и особенно на основе опыта Великой Отечественной войны наука о взрывчатых веществах и взрыве обогатилась новыми данными и получила широкое развитие.
В то же время как в нашей литературе, так и за рубежом эти достижения обобщены и освещены недостаточно. В особенности это относится к литературе учебного назначения.
Авторы попытались восполнить этот пробел по вопросам теории взрывчатых веществ применительно к программам химико-технологических вузов.
В соответствии с этим основным назначением книги вопросы, связанные с действием взрыва, в частности, взрыва боеприпасов, освещены относительно сжато. В этой части курс является кратким. Вместе с тем, чтобы дать возможность читателям несколько расширить и углубить свои знания, в некоторых разделах мелким шрифтом даны сведения, выходящие за рамки обязательного минимума, предусмотренного учебной программой. Этой же цели служат приведенные в конце книги в виде приложения справочные данные.
Книга состоит из 10 глав.
Во введении кратко рассмотрены главные области использования энергии взрыва в технике, а также задачи теории ВВ.
В гл. I приведены основные определения явления взрыва в различных его формах и те условия, ври которых химическое превращение может принимать характер взрыва.
Глава II посвящена простейшей из трех основных форм протекания химической реакции во взрывчатых веществах — медленному химическому их превращению.
В гл. III рассмотрен важный для техники вопрос — стойкость ВВ, в частности, методы ее экспериментального определения.
4
Предисловие
В гл. IV дано описание основных форм самораспространяюще-гося химического превращения — горения и детонации, на использовании которых основано применение взрывчатых веществ. В этой же главе рассмотрена теория этих явлений.
Глава V посвящена описанию возбуждения горения и детонации ВВ при различных воздействиях на них.
В гл. VI рассмотрены основные закономерности распространения в воздухе и в других средах ударных волн, которые возникают при взрыве и определяют его разрушающее действие.
Глава VII посвящена вопросу о составе продуктов взрыва и факторах, которые в различных условиях могут влиять на этот состав.
В гл. VIII рассматриваются методы определения теплоты, температуры и объема газов при взрыве, т. е. тех характеристик, от которых зависит его разрушающее действие. Основные формы это1 го действия, методы их оценки и связь этих форм со свойствами взрывчатого вещества описаны в гл. IX.
Последняя, глава X книги посвящена теории воспламенения метано-воздушных и пыле-воздушных смесей от взрыва ВВ. Эта теория является основой для' создания специальных предохранительных взрывчатых веществ, предназначенных для угольных шахт, и разработки других мер, обеспечивающих безопасность взрывных работ в этих шахтах.
Главы VI и IX книги, а также разделы гл. IV, посвященные теории детонации в газах (стр. 223—243), экспериментальным методам определения скорости и давления детонации (стр. 210—222 и 247—249), а также критического диаметра (стр. 196—198), написаны А. Ф. Беляевым, остальные главы — К. К. Андреевым.
Авторы выражают искреннюю признательность товарищам по специальности Д. С. Аванёсову, А. Я. Апину, А. И. Гольбиндеру, Л. В. Дубнову, А. А. Зайцеву, А. М. Ломовой, К. К. Снитко, И. В. Тишунину и Н. А. Холево за ценные замечания и рекомендации, сделанные при просмотре и обсуждении рукописи.
ВВЕДЕНИЕ
§ 1. ОСНОВНЫЕ ОБЛАСТИ И УСЛОВИЯ ПРИМЕНЕНИЯ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
По мере развития человеческого общества физический труд человека все в большей степени заменяется работой машин'. Машина не только облегчает труд человека, но и расширяет его возможности. С помощью машин можно быстрее передвигаться, возделывать больше земли, перевозить большие тяжести, обрабатывать самые твердые материалы и т. д.
Однако не всегда машина является наиболее эффективной заменой труда человека. Работу разрушения при добыче полезных ископаемых и других горных и строительных работах, а также на войне производят при помощи взрыва.
Взрыв представляет собой крайне быстрое выделение потенциальной энергии, содержащейся во взрывчатом веществе. В результате большой скорости выделения энергии при взрыве развивается чрезвычайно высокая мощность. Получение такой мощности с помощью обычных машин потребовало бы применения громоздких и дорогостоящих механизмов, использование которых во многих условиях практически невозможно.
Взрывчатые же вещества (ВВ) являются таким средством выполнения работы, которое позволяет получать высокую мощность при минимальном его весе и объеме. Это свойство ВВ и определяет целесообразные условия применения их в военном деле и народном хозяйстве.
В военном деле ВВ, которыми снаряжают боеприпасы различных видов, являются главным средством поражения живой силы, разрушения боевой техники и военной промышленности противника. При взрыве заряда ВВ боеприпасов образуются газы, находящиеся под огромным давлением, разрушающим все, что находится в контакте с зарядом. Кроме того, газы создают в окружающем воздухе (или иной среде) ударную волну, которая, встречая на своем пути какое-либо препятствие, производит цо нему сильный удар, а воздух, вовлекаемый в движение волной, довершает разрушение, начатое ударом. На этом основано действие так называемых фугасных боеприпасов.
6
Введение
В боеприпасах осколочного действия взрыв дробит металлический корпус и сообщает большую скорость его осколкам, которые, разлетаясь, поражают цель.
В военных целях ВВ используют в снарядах реактивной и ствольной артиллерии, авиабомбах, минометных и противотанковых минах, в морских минах заграждения, торпедах и глубинных бомбах.
Для того чтобы заряд ВВ произвел боевой эффект, он должен быть доставлен к цели либо заложен на пути движения боевых машин и живой силы противника, В большинстве случаев ВВ приходится перебрасывать к месту его действия, т. е. к цели, В этом но существу и состоит задача основных видов вооружения: артиллерии всех родов, бомбардировочной авиации, подводных лодок, танков и т. д.
Переброску ВВ к месту их действия иногда производят только с помощью движущихся боевых машин (самолеты, подводные лодки, торпедные катера и т. д,).
Однако наиболее распространенным средством переброски В В к цели служат взрывчатые вещества особого рода — пороха. Реактивный снаряд или артиллерийское ствольное орудие являются пороховыми двигателями для переброски боевого заряда ВВ к цели.
Пороховой двигатель может развивать очень большую мощность. Это необходимо, чтобы сообщить снаряду большую скорость, которая требуется для переброски его на дальнее расстояние или для поражения быстродвижущихся целей. При этом пороховой двигатель компактнее и легче, двигателей других типов равной мощности, что и обусловливает его широкое применение.
Для сгорания порохов не требуется доступа воздуха, поэтому они могут гореть с большой скоростью в замкнутом пространстве. Кроме того, время горения порохов можно регулировать в достаточно широких пределах. Эти свойства, несмотря на относительно небольшую энергию горения л дороговизну, делают современные пороха основным видом горючего в огнестрельном оружии реактивного и ствольного типа.
Главным потребителем ВВ в народном хозяйстве является горная промышленность. Взрывчатые вещества применяют для вскрытия месторождений, проходки подготовительных выработок и откола полезных ископаемых в шахтах, рудниках и на карьерах.
В настоящее время только очень мягкие породы, например песок или глину, добывают без применения ВВ, с помощью экскаваторов, скреперов и других машин. Сравнительно слабые породы, например некоторые виды каменного угля, также можно отделять от пласта при помощи отбойного молотка, экскаватора, комбайна, врубовой машины и т. п., не прибегая к ВВ. Разработка же более крепких пород требует наряду с машинами применения более сильных воздействий, которые и получают с помощью взрывчатых
§ I. Основные области и условия применения ВВ
/
веществ. На каждую тонну добытого каменного угля расходуется, например, в среднем более 100 г взрывчатых веществ.
Если учесть огромные масштабы добычи угля, то можно под
считать, что одна лишь угольная промышленность во всем мире ежегодно потребляет сотни тысяч тонн взрывчатых веществ. В частности, только в США в 1950 г. на добычу угля было израсходовано 150 000 т взрывчатых веществ. Относительно еще больше ВВ требуется при добыче более твердых пород: различных металлических руд, строительного камня, а также минералов, служащих сырьем для химической промышлен
ности, и т. п.
Применение в горных работах взрывного метода резко снижает трудоемкость и значительно их ускоряет.
Эффективность применения ВВ можно показать на следующем примере. В Петербурге на площади перед Зимним Дворцом была установлена в свое время Александровская колонна. Работы по вырубке этой колонны из каменной глыбы должны
Фиг. 0. 1. Дробление глыбы породы накладным зарядом с забойкой, /—взрывчатое вещество, 2—огнепроводный шнур, 3—забойка, 4—капсюль-де-токатор.
были выполняться с большой осторожностью, чтобы не расколоть ее; поэтому они велись вручную. Этим делом было занято в течение двух лет 600 человек. Объем колонны в необработанном виде составлял
700 м3; на каждый кубический метр породы было затрачено 228 человеко-дней. При современных же способах взрывания затрата труда на 1 м3 добытой породы может быть снижена до 0,008 чело
веко-дня.
Способы ведения взрывных работ разнообразны. При простейшем из них, а именно способе накладных зарядов, ВВ помещают на поверхности тела, которое надо разрушить, например валуна, большой глыбы породы и т. п. Такой способ прост п быстр в исполнении, но требует большого расхода ВВ, примерно в 10—15 раз большего, чем при других способах, когда заряд помещают внутри разрушаемого объекта. Этот недостаток сохраняется в известной степени и в том случае, если накладной заряд покрывают забойкой (фиг. 0.1)—куском сырой глины или другого материала, чтобы замедлить скорость расширения газообразных продуктов взрыва и усилить таким образом их действие на разрушаемый объект.
Более распространены способы взрывания, при которых в разрушаемом объекте делают углубление, обычно цилиндрической формы. После введения в него заряда ВВ свободную часть углубления заполняют забойкой, которая преграждает газам взрыва выход наружу (фиг. 0.2). В этом случае взрыв происходит в замкнутом пространстве и разрушающее его действие сильно возрастает. Углубление, высверливаемое в разрушаемой породе для размещения заряда ВВ, в зависимости от его размеров называют шпуром (диаметр до 50 мм, глубина до 5 м) или скважиной (диаметр до 300 мм, глубина от 5 до 50 м и более).
a
Введение
Шпуровой способ взрывных работ широко применяют при подземных подготовительных работах и для откалывания добываемой породы, особенно в тех случаях, когда мощность (толщина) ее пластов незначительна. Недостатком это-
Фиг. 0.2. Шпур с зарядом взрывчатого вещества.
Г—патроны взрывчатого вещества, 2—капсюль-детонатор.
3—забойка, 4—огнепроводный шнур.
го способа является большая затрата труда и средств на бурение шпуров. Чтобы смягчить этот недостаток, применяют способ котловых зарядов (фиг. 0.3). Донную часть обычного шпура путем одного или нескольких последовательных взры-
Фиг. 0. 3. Способ котловых зарядов.
1—небольшие заряды для образования котла, У—взрывчатое вещество основного заряда, 3—забойка, а, б, в, г и о—последовательные стадии образования и заряжания котла.
вов небольших зарядов ВВ расширяют в виде котла. Затем образовавшийся котел и часть шпура заполняют взрывчатым веществом; в остальном способ котловых зарядов аналогичен шпуровому.
§ 1. Основные области и условия применения ВВ
9
Для разрушения горных пород обычно взрывают одновременно или с небольшими интервалами несколько шпуров, что дает лучшее разрушение породы. При этом важное значение имеет взаимное расположение шпуров, расстояние от зарядов до обнаженной поверхности породы и последовательность их взрывания.
Наиболее распространенным полезных ископаемых как на
способом добычи руд и других поверхности, так и под землей
является метод массовых обрушений взрывами с размещением зарядов ВВ в скважинах. На фиг. 0.4 показана схема взрывных работ в карьере этим методом. Парал-
лельно бровке разрабатываемого уступа породы бурят ряд вертикальных скважин на глубину, несколько большую высоты уступа. Скважины заряжают сплошными или прерывными зарядами ВВ, величина которых достигает сотен килограммов, и взрывают их одновременно или в определенной последовательности. Такой способ отличается большой производительностью, причем правильным расчетом величины зарядов и их расположения соответственно крепости породы обеспечивается нужная степень дробления ее, удобная для погрузки экскаватором и дальнейшей переработки.
При некоторых видах взрывных работ применяются большие заряды ВВ весом в десятки, сотни, а иногда и тысячи тонн.
Такие заряды часто используют при
Фиг. 0.4, Схема взрывных работ на карьере способом скважин.
/—взрывчатое вещество, 2—забойка.
так называемых массовых взрывах на выброс для получения выемок. Этим способом делают выемки в горных перевалах для прокладки дорог, вскрывают неглубо. ко расположенные пласты полезных иско-
паемых для последующей их разработки
открытым способом, прокладывают каналы, преграждают реки.
устраивают искусственные водоемы.
При одном из крупнейших взрывов, произведенных на Урале близ Коркино 16 июня 1936 г. по проекту инженеров Папоротского и Селевцева, было взорвано одновременно 1800 т взрывчатых веществ. Взрыв должен был сбросить породу, расположенную над мощным пластом бурого угля, залегавшего на глубине около 20 м. Было заложено 36 зарядов на глубине 13—18 м и на расстоянии друг от друга до 30 м. Взрыв всех зарядов был произведен одновременно. После включения рубильника взрывной сети на фронте шириной 900 м в воздух поднялась стена земли. Вслед за тем с огромной силой вырвались взрывные газы, увлекая с собой размельченный грунт. Через 3—4 сек. образовавшееся при взрыве облако газа и пыли покрыло площадь до 2 к.и2 и двинулось по ветру. Высота облака достигла около 400 лг, высота выброса грунта доходила до
10
Введение
625 м. Взрывом была образована траншея длиной 900 м, шириной 85 м и глу-•биной до 20 м, при этом было выброшено 800 000 ж3 грунта. Разрушительное действие образовавшейся взрывной волны, несмотря на большую величину заряда, было сравнительно незначительным: кирпичные и деревянные строения, находившиеся на расстоянии 350—400 м, не были повреждены. Разброс грунта не превышал 450 м. Колебания почвы были зарегистрированы сейсмическими станциями Свердловска, Москвы и Пулкова.
Большие взрывы также для вскрытия залежей полезных ископаемых были произведены в 1952 г. на территории СССР и в 1956 г. на территории Китайской Народной Республики.
В первом случае было взорвано 1200 т ВВ, причем наибольший вес отдельного заряда достигал 600 т, а линия наименьшего сопротивления составляла 42 м. Проведение этого взрыва позволило ввести в эксплуатацию рудник на 3 года раньше срока, предусмотренного при обычном способе разработки. На основе полученного опыта в следующем году на том же руднике был произведен взрыв еще больших масштабов: расход ВВ составил 1814 т, а наибольший вес заряда в одной камере достигал 1640 т.
В Китайской Народной Республике руд при взрыве, подготовленном и проведенном совместно советскими и китайскими специалистами, было разрушено 9 млн. м3 горных пород, из которых полезный сброс составил 2,3 млн. м3. Для выполнения этой работы было израсходовано 15,5 тыс. т ВВ, взорванных 10 сериями, причем наибольшее количество ВВ, взрываемое в одной серии, составило 4800 т.
При массовых взрывах иногда целесообразно выбросить породу преимущественно в какую-либо одну сторону. В таких случаях применяют направленный взрыв.
При этом способе закладывают два ряда зарядов. Один ряд состоит из -более слабых зарядов; его взрывают первым для дробления и поднятия на воздух части грунта. Спустя 1—3 сек. взрывают второй ряд, который состоит из более сильных зарядов. Действием этого взрыва грунт, поднятый на воздух взрывом первого ряда, отбрасывается в нужную сторону от места расположения второго ряда зарядов. Направленности действия взрыва здесь способствует также то обстоятельство, что второй ряд зарядов взрывается при наличии дополнительной обнаженной поверхности, образованной взрывом первого ряда зарядов.
Массовые взрывы для преграждения русла рек применяют главным образом при сооружении временных перемычек, например, при строительстве плотин, а иногда и для других целей.
Так, массовым взрывом были предупреждены разрушения от необычно бурного паводка на реке Ангрен в Узбекистане в 1948 г. Весной мощный поток воды хлынул в прилегающие арыки и овраги, переполняя их и вызывая обрушение берегов. В одном из ущелий глубиной до 25 м обрушился берег арыка •и перекрыл его русло. Вода, переливаясь через берег арыка, попадала в овраг, перегороженный в нижней части защитной дамбой. У дамбы образовался большой водоем, уровень которого стремительно повышался. Меры по наращиванию дамбы оказались недостаточными, и перед ней скоро накопилось 12 млн. м3 воды. Прорыв ее привел бы к затоплению многих селений и обширных посевов ценных культур. Катастрофа была предупреждена при помощи
§ 1. Основные области, и условия применения ВВ
II
взрыва. Для этого выше дамбы по течению было выбрано место, благоприятное для создания перемычки,—крутой берег в месте изгиба русла. В этом береге заложили 12 зарядов ВВ общим весом 50 г. Взрыв этих зарядов перекрыл русло арыка, вода из реки перестала в него поступать и угроза наводнения была предотвращена.
Десятки озер были созданы взрывным способом в районах
освоения целинных земель.
Фиг. 0. 5. Прокладка взрывным способом дороги через болото.
Чтобы вырыть котлован одного степного озера длиной свыше 100 м шириной 30 м и глубиной 15—20 м, потребовалось только три дня, причем всю работу выполнил один взрывник с небольшой группой помощников. При взрыве было израсходовано около двух вагонов взрывчатых веществ, которые были размещены в девяти камерах, на глубине 6,5—7 м. Сами камеры были подготовлены последовательными взрывами небольших зарядов, что очень ускорило и удешевило работы.
Взрывчатые вещества используют в народном хозяйстве не только для откола, дробления и выброса породы, но и для многих других целей. Взрывным способом прокладывают дороги через болота, на которых жидкий грунт не выдерживает тяжести землеройных машин.
Работы начинают с разрыхления взрывами верхнего растительного покрова болота. Затем на разрыхленную трассу дороги укладывают плотный грунт, образующий насыпь. Под собственной тяжестью насыпь медленно опускается в болото, но не доходит до его дна. При определенной глубине погружения насыпи под нею взрывают небольшие заряды взрывчатого вещества. Взрыв вытесняет полужидкую массу земли из-под насыпи, которая опускается на плотное дно болота. После этого насыпь расширяют и дополнительно взрывают заряды по бокам ее (фиг. 0.5). Этими взрывами полужидкая масса земли вторично вытесняется по обе стороны полотна, основание которого принимает более широкую, устойчивую форму,
В торфяной промышленности применение взрывчатых веществ дает возможность значительно увеличивать добычу этого топлива.
Торфяной массив можно размывать гидромониторами только после оттай-
12
Введение
вания, которое протекает медленно (2—2,5 месяца), поэтому самый лучший для добычи — весенний — период не используется в полной мере.
С помощью взрывчатых веществ смерзшийся торф дробят на куски, которые оттаивают за 2—3 дня.
В нефтяной промышленности ВВ применяют для прострела обсадных труб, торпедирования скважин, при ликвидации аварий в скважинах и т. д.
После бурения нефтяной скважины в нее опускают стальные трубы, которые затем цементируют. Для того чтобы нефть могла поступать из пласта в скважину, нужно пробить ряд отверстий в трубе и окружающем ее цементном кольце. Такие отверстия получают путем взрыва маленьких кумулятивных зарядов ВВ, а также выстрелом пулями или снарядами из специальных огнестрельных орудий, называемых перфораторами.
Взрывы зарядов ВВ в скважине (торпедирование) образуют в породе систему трещин, сообщающую пласт со стволом скважины. Это повышает приток нефти или газа из пласта.
Взрывчатые вещества используют также для поисков новых месторождений нефти и других полезных ископаемых методом сейсморазведки.
Для этого заряд ВВ располагают в скважине небольшой глубины. При взрыве такого заряда в земле распространяются волны, подобные тем, которые возникают при землетрясениях. Встречая на своем пути слои различных пород, волны отражаются от них. Отраженные волны возвращаются на поверхность земли и записываются чувствительными приборами. По характеру этих записей можно судить о структуре пластов пород на больших глубинах, что помогает быстрее находить месторождения нефти.
В металлургической промышленности к взрывчатым веществам прибегают в тех случаях, когда в доменных печах при нарушении нормальной работы образуются «козлы» — глыбы застывшего металла.
В этом случае в еще не остывшем металле бурят углубления, куда помещают и взрывают один за другим маленькие заряды взрывчатого вещества. Заряды берут такой величины, чтобы сила взрыва их была достаточна только для откола кусков металла и не повреждала бы самой печи.
Разрушение каменных строений, предназначенных к сносу при реконструкции городов, также быстро и безопасно производят взрывным способом. В этом случае при правильном расчете веса и размещении зарядов ВВ исключаются повреждения соседних зданий и разлета осколков не бывает.
Сравнительно недавно ВВ получили применение в промышленности для клепки взрывным способом. Особое значение этот способ имеет в авиационной промышленности, в которой при изготовлении авиационных конструкций приходится устанавливать большое количество заклепок.
При этом способе в стержне заклепки просверливают небольшой канал, в котором помещают маленький заряд специального ВВ. После того как заклепка вставлена на место в склепываемых листах, к головке ее прикладывают нагретый металлический стержень. Стержень разогревает заклепку, что и вызывает взрыв заряда. При взрыве конец заклепки расширяется и она прочно соединяет детали (фиг. 0.6).
£ 1. Основные области и условия применения ВВ
13
Взрывные работы применяют и в сельском хозяйстве.
Известно, какую тяжелую и трудоемкую работу представляет корчевка пней. При взрывной корчевке пня в. почве бурят углубление так, чтобы его конец оказался под пнем (фиг. 0.7).'Затем в углубление вводят заряд взрыв-
чатого вещества, взрыв которого вырывает пень из земли и расщепляет его.
При помощи взрывчатых веществ разрыхляют почву для садов и виноградников. Деревья, посаженные в ямки, полученные взрывным способом., растут быстрее, так как взрыв хорошо разрыхляет почву и, кроме того, некоторые продукты взрыва играют роль удобрения.
Взрывным способом можно быстро рыть канавы для орошения полей и осушки болот. Осушать болота можно также путем пробивания взрывом водонепроницаемого слоя, задерживающего сток грунтовых вод.
Не менее важно применение ВВ в борьбе с лесными пожарами. Взрывами валят деревья, чтобы быстро проложить просеку, преграждающую путь огню.
Фиг. 0. 6. Клепка взрывным способом.
1— взрывчатое вещество, 2—нагреватель.
При сплаве леса взрывным способом устраняют заторы льда и леса и ускоряют задержавшийся в верховьях рек ледоход.
С помощью ВВ расчищают русла рек также от камней, мешающих сплаву.
Взрывчатые вещества используют в Арктике для преодоления ледяных полей, преграждающих путь судну, для дробления больших льдин при сжатии
Фиг. 0. 7. Корчевка пней взрывным способом, /—огнепроводный шнур, 2—забойка, 3—взрывчатое вещество.
затертого во льдах корабля. В последнем случае подушка из мелкого льда вокруг корпуса корабля, образованная взрывами, смягчает давление льдов и распределяет его более равномерно по корпусу, уменьшая опасность раздавливания корабля.
14
Введение
В целом роль ВВ в горном деле и в некоторых других отраслях народного хозяйства так велика, что трудно представить себе, как без них был бы достигнут современный уровень материальной культуры.
§ 2. ЭНЕРГИЯ И МОЩНОСТЬ ВЗРЫВА
Разрушающее действие ВВ, как было указано, может быть очень большим, что определяет целесообразность и даже необходимость их применения в ряде случаев. Возникает естественный вопрос: чем же обусловлено это разрушающее действие?
Нередко приходится встречаться с мнением, что основной при-чиной разр'ушаюifl^ro действия~'взрыва~ ’ яв^1яётся~~огромнь1й~запас эйёрхии^дкоторыи якобы содержится _во взрывчатом вёществег ' Однако простой расчёт’Показывает? что“такоё" объяснение в корне ошибочно."' .
В табл. 0. 1 приведены количества энергии, выделяющейся при сгорании различных видов топлива и при взрыве различных ВВ.
Таблица 0.1
Вещество Теплота сгорания 1 кг ккал Теплота взрыва 1 кг ккал
Топливо
Дерево 4500 —
Антрацит 8 000 —
Бензин 10000
Взрывчатое вещество
Дымный порох 700
Тротил —. 1 000
Нитроглицерин — 1 500
Сравнивая данные, приведенные в этой таблице, мы видим, что при взрыве 1 кг нитроглицерина выделяется энергии в пять раз, а при взрыве 1 кг тротила даже в восемь раз меньше, чем при сгорании 1 кг угля.
Однако при таком сравнении мы несколько несправедливы по отношению к ВВ. Мы берем теплоту горения для 1 кг топлива, не учитывая того количества кислорода, которое необходимо для сгорания. Взрывчатое же вещество не требует для своего взрыва дополнительного кислорода, так как он содержится в самом ВВ. Поэтому правильнее и теплоту горения топлива рассчитывать на 1 кг его смеси с нужным для горения количеством кислорода. Такое сопоставление дано в табл. 0. 2.
Хотя разница в величинах теплот горения топлив и теплот взрыва ВВ в этой таблице стала меньше, однако и при таком
£ 2. Энергия и мощность взрыва
15
Таблица 0. 2
Вещество 1 Теплота сгорания i в ккал на 1 кг смеси топлива с кислородом Теплота взрыва в ккал на 1 кг
Топливо
Дерево | 1900 —
Антрацит i 2200 —
Бензин | 2300 —
Взрывчатое вещество 1 1
Дымный порох 1 700
Тротил ! — 1000
Нитроглицерин 1 — 1500
сравнении количество выделяющейся энергии у топлив больше,, чем у В В,
Следовательно, огромное разрушающее действие взрыва нельзя охце®Т]ОЙГсчё^^ Действительн ая
его причина заключается в том, что энерцщшди-азрыве выделяется крайне быстро. Если 1 кг бензина сгорает в двигателе автомашины заО^ТГмин., то взрыв 1 кг взрывчатого вещества происходит в течение 1—2 стотысячных долей секунды. Энергия при взрыве выделяется в десятки миллионов раз быстрее, чем при горении. Кроме того, в случае жидких и твердых ВВ энергия концентрирована в весьма малом объеме. Сравнение теплбт горения-! л смеси топлива с необходимым количеством газообразного кислорода и теплот взрыва 1 л ВВ приведено в табл. 0. 3.
Таблица 0.3
Вещество Теплота сгорания в ккал 1 л смеси топлива с кислородом Теплота взрыва в ккал на 1 л
Топливо
Дерево 4.7 —
Антрацит 4,3
Бензин 4,2
Взрывчатое вещество
Дымный порох — 630
Тротил (прессованный) — 1550
Нитроглицерин — 2400
If)
Введение
Если допустить, что вся энергия, выделяющаяся при взрыве, превращается в работу и что время совершения этой работы равно времени прохождения взрыва в ВВ. то легко подсчитать, какая мощность может быть достигнута при взрыве патронов обыкновенного аммонита, ежедневно применяемых в шахтах десятками тысяч. Диаметр патрона 30 мм, длина его 25 см, вес 200 г. Если возбудить взрыв с торца патрона, то он будет распространяться со скоростью около 0,25
5000 м/сек и длительность взрыва составит д—- — 5- 10'5 сек.
5000
При взрыве 1 кг аммонита выделяется 1000 ккал; 200 г аммонита дают 200 ккал, или в единицах механической работы 200.427=85 400 кгм. Разделив работу на время и на 75, получим мощность в лошадиных силах, равную 85 400
————- «23 000 000 л. с.
5-10—"-75
Допущения, которые мы сделали при этом расчете, не вполне точны. Время совершения работы разрушения больше времени протекания взрыва, а коэффициент полезного действия значительно меньше единицы. Если мы допустим, что по этим причинам фактическая мощность взрыва будет в 15 раз меньше, то и в этом случае она составит 1,5 млн. л. с., что больше мощности крупнейшей американской гидроэлектростанции Боулдер-Дем.
Понятно, что использование энергии взрыва не может заменить работу электростанций и других силовых установок. Громадная мощность взрыва обусловлена, как мы видели, в первую очередь чрезвычайно малым временем выделения энергии; сама же энергия отнюдь не чрезмерно велика.
Отсюда следует, что взрывчатые вещества целесообразно применять только в тех случаях, когда необходимы очень кратковременные воздействия чрезвычайно большой мощности. Для получения таких воздействий в течение длительного времени потребовались бы громадные количества ВВ. Так, чтобы получить в течение трех суток мощность взрыва патрона аммонита, потребовалось бы взорвать около 1 млн. т взрывчатых веществ — больше, чем все годовое потребление взрывчатых веществ в горном деле во всем мире.
Таким образом, ВВ не заменяют других источников энергии; они позволяют лишь концентрировать энергию во времени и в пространстве в такой степени, в какой это недостижимо иными путями. Ни одна машина не может при равном весе и размерах дать такую колоссальную мощность, какую дают взрывчатые вещества, и там, где эта мощность необходима, взрывчатые вещества — единственное и незаменимое средство (если не считать атомного взрыва) ее получения.
Большая мощность характерна для взрывчатых веществ также в случае применения их как средства метания в виде порохов.
Рассмотрим в качестве примера выстрел из тяжелого орудия, снаряд кото-торого весит 917 кг и имеет начальную скорость 523 м/сек. Энергия снаряда при вылете из ствола составляет 12 770 000 кгм. Эту энергию снаряд получает за время около 0,01 сек. Отсюда мощность выстрела составит 12 770 000 : 0,01 = = 1 277 000 000 кгм/сек, или около 17 млн. л. с.
Высокая мощность в артиллерийском орудии сочетается с большим коэффициентом полезного действия: доля энергии пороховых газов, переходящая в энергию движения снаряда, достигает 35%,
§ 3. Основные задачи теории взрывчатых веществ
17
что гораздо больше, чем в паровой машине, и столько же, сколько в двигателе внутреннего сгорания.
Однако получение такой огромной мощности сопряжено с быстрым износом двигателя и обходится очень дорого. Подсчет показывает, что стоимость работы, получаемой при помощи орудия, во много раз выше, чем при ее получении с помощью паровой машины или двигателя внутреннего сгорания.
Поэтому использование ВВ для метания, так же как и для взрыва, целесообразно только в тех случаях, когда необходимо получить огромную мощность, хотя бы и ценой высокой стоимости энергии.
§ 3. ОСНОВНЫЕ ЗАДАЧИ ТЕОРИИ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
Ввиду относительно высокой стоимости энергии взрыва важно, особенно при широком промышленном применении ВВ, чтобы эта энергия была использована наиболее эффективно. Эта задача не простая. Области применения ВВ, как мы видели, чрезвычайно разнообразны. Соответственно должны быть разнообразны и взрывные свойства ВВ. Для пробивания брони, для подрыва твердой породы Ч1еобходимы ВВ, обладающие максимальной резкостью действия. ^Напротив, для работы на выброс в мягком грунте такое резкое ^действие является излишним и даже вредным.
) Число химических соединений, применяемых в качестве ВВ или •входящих в состав различных взрывчатых смесей, невелико. Поэтому необходимо уметь из немногих компонентов готовить ВВ с весьма широким диапазоном взрывных свойств, отвечающих различным требованиям взрывной техники. Для этого надо знать, как зависит взрывное действие ВВ от состава, от энергетических, физико-химических и физико-механических свойств компонентов и их смесей, в частности, от степени измельчения каждого из компонентов, характера их смешения, от плотности порошкообразного ВВ, формы и размеров заряда и т. д.
Большое значение имеет возможность управления взрывом, в частности, возможность концентрации или, наоборот, рассредоточения его действия. В первом случае может быть существенно усилено пробивное, раскалывающее действие взрыва; во втором — предотвращается излишнее дробление подрываемого материала. Это требует знания закономерностей протекания взрыва и его механического действия в различных условиях.
Существенную, а иногда решающую роль для возможности применения ВВ играет его чувствительность. ВВ может обладать наилучшими показателями взрывного действия, но если оно взрывается от легкого удара, слабого трения или небольшого нагрева, то такое вещество не может получить технического применения.
Большое практическое значение имеют также вопросы стой-косКак правило, взрывчатое вещество применяют' не в день изготовления, а спустя более или менее дли
18
Введение
тельный срок, в некоторых случаях измеряемый многими годами. Поэтому ВВ должно быть способно выдерживать длительное хранение без существенного изменения своих свойств.
Одной из основных характеристик ВВ, определяющих его стойкость, является скорость и характер медленного химического превращения, которому в большей или меньшей мере подвержены все ВВ. Скорость этого превращения в сильной степени зависит от температуры вещества; при нагревании ВВ оно ускоряется и может приводить к воспламенению и горению.
Горение ВВ имеет самостоятельный интерес, поскольку на его использовании основано применение ВВ (порохов) для целей метания.
Кроме того, в определенных условиях горение может переходить во взрыв. Чтобы исключить возможность такого перехода при горении пороха в огнестрельном оружии, нужно знать и уметь регулировать устойчивость горения, а для предупреждения разрушительных взрывов на заводах и складах ВВ, кроме того, необходимо предотвращать возможность возникновения горения.
ПримерохМ того, к каким тяжелым последствиям может привести недостаточная изученность условий возбуждения взрыва, является грандиозная катастрофа, которая произошла в 1921 г. в Германии.
На заводе в Оппау производилась лейна-селитра — удобрительная смесь, содержащая приблизительно ио 50% нитрата и сульфата аммония. Как продукт сезонного потребления, она накапливалась ня заводских складах в больших количествах и за время длительного хранения слеживалась в сплошную камнеобразную массу. Дробление этой массы механическими средствами оказалось затруднительным, и было решено прибегнуть к взрывному методу. Для выяснения способности лейна-селитры к взрыву предварительно были поставлены опыты, которые дали отрицательный результат. После этого рыхление взрыванием применяли длительное время — всего было произведено без каких-либо недоразумений около 20 000 подрывов,— пока, наконец, утром 21 сентября 1921 г. склад лейна-селитры, а вместе с ним и завод не взлетели на воздух. На месте склада образовалась воронка длиной 165 м, шириной 96 м и глубиной 18,5 м (фиг. 0.8). При взрыве было убито свыше 500 человек и тяжело ранено около 2000.
Основной причиной этой крупнейшей в истории химической промышленности катастрофы была неправильная оценка чувствительности лейна-селитры к взрыву.
Важнейшей задачей техники безопасности применения ВВ в угольных шахтах является предотвращение взрывов метановоздушных и пыле-воздушных смесей при взрывных работах. Одним из основных путей, обеспечивающих решение этой задачи, является применение специальных так называемых предохранительных ВВ, обладающих относительно низкой способностью воспламенять метано-воздушные и пыле-воздушиые смеси.
Таким образом, для эффективного и безопасного изготовления и применения ВВ нужно знать:
1. Связь между составом ВВ, его физико-химическими, физико-механическими свойствами, размерами и формой заряда, с одной стороны, и его взрывным действием — с другой.
£ 3. Основные задачи теории взрывчатых веществ
19
2, Закономерности механического действия взрыва на окружающую среду.
3. Условия и механизм возникновения горения и взрыва при различных воздействиях на ВВ.
4. Стойкость ВВ при хранении.
Фиг. 0.8. После взрыва в Оппау.
5. Механизм и главные характеристики трех основных режимов превращения ВВ: медленного химического превращения, горения и взрыва.
6. Условия воспламенения взрывчатых газо- и пылевоздушных смесей при взрывных работах.
Изучение этих вопросов и составляет предмет теории взрывчатых веществ.
Глава I
ОБЩАЯ ХАРАКТЕРИСТИКА ВЗРЫВЧАТЫХ ВЕЩЕСТВ
§ к ЯВЛЕНИЕ ВЗРЫВА
Существуют разные виды взрывов и соответственно различные определения понятия «взрыв».
В наиболее широком смысле слова взрывом называют физическое или химическое превращение вещества, сопровождающееся крайне быстрым переходом его энергии в энергию сжатия и движения исходного вещества или продуктов его превращения и окружающей среды.
Явление взрыва в принципе включает две стадии: 1) стадию превращения энергии того или иного вида в энергию сильно сжатого вещества и 2) стадию расширения сжатого вещества. В процессе расширения потенциальная энергия сжатия обычно переходит в механическую работу. Эта работа приводит окружающую среду в движение, которое может вызвать ее разрушение, если возникшие напряжения превосходят предел прочности.
Таким образом, крайне быстрое появление или, точнее, проявление действия давления, как правило, очень большого, представляет собой основной характерный признак взрыва. Следствием быстроты возникновения давления и его большой величины и является та исключительная мощность, которая свойственна взрыву.
Возможны различные виды исходной энергии взрыва: электрическая, кинетическая, тепловая, энергия упругого сжатия, атомная, химическая.
Так, взрыв может произойти при сильном искровом разряде, например под водой, или при пропускании тока большой силы через тонкую проволочку; при этом электрическая энергия переходит в энергию нагретого и сжатого воздуха и паров воды или металла.
При ударе движущегося с большой скоростью тела о прочную преграду его кинетическая энергия переходит в тепловую; при достаточной величине энергии могут образоваться сильно сжатые газы. Взрывы такой природы имеют место при падении крупных метеоритов.
£ 1. Явление взрыва
21
Известны случаи взрыва баллонов со сжатыми газами, возникающие или вследствие чрезмерного повышения давления, например, от случайного разогрева, или вследствие уменьшения прочности стенки в результате коррозии, механических повреждений и т. п. Эти взрывы происходят за счет тепловой энергии сжатых газов. К такому же типу относятся взрывы паровых котлов, сопровождающиеся быстрым превращением перегретой воды в пар. При перегреве воды в котле выше нормы давление пара возрастает до величины, превышающей сопротивление стенок котла. После разрыва котла имевшийся в нем пар, а также пар, образовавшийся из перегретой воды вследствие падения давления, быстро расширяясь, производит работу разрушения.
Примером взрыва за счет энергии упругого сжатия может служить большинство землетрясений. Возникающие в отдельных участках земной коры напряжения могут охватывать весьма большие объемы; в них накапливаются, а затем при землетрясении внезапно освобождаются огромные количества энергии. Энергия сильнейших землетрясений оценивается в 1023—1025 эрг, т. е. превосходит энергию взрыва миллионов тонн обычных взрывчатых веществ.
Взрывы подобного типа можно воспроизвести и в малых масштабах. Так, если замораживать воду в прочной стальной бомбе, целиком ею заполненной, то может произойти взрыв. Вследствие расширения воды при превращении ее в лед давление в бомбе возрастает и может, наконец, превысить сопротивление стенок, в результате чего произойдет разрыв бомбы. Потенциальная упругая энергия сжатой воды переходит при этом в механическую работу разрушения бомбы.
Любопытный случай взрыва такого типа произошел на одной из железнодорожных станций в Восточной Сибири, где хотели запасти лед на лето, замораживая зимой воду в огромном ящике емкостью более тысячи кубических метров. Это привело к тому, что ящик взорвался со страшным грохотом; огромные глыбы льда летели при этом по воздуху более 20 м.
Еще сильнее был взрыв наледного бугра на реке Онон в Восточной Сибири. Бугор взорвался, разбросав в стороны громадные глыбы льда и грунта, самая большая из них была размерами 19X5X2 м, а общий вес пяти выброшенных глыб достигал 453 т. При взрыве из бугра вырвалось огромное количество воды, отнесшее некоторые глыбы на 120 м; при этом был уничтожен небольшой мост на дороге.
В обоих этих случаях роль оболочки играл ледяной футляр, окружающий жидкое ядро.
Атомный взрыв происходит в результате цепной реакции быстрого деления некоторых тяжелых атомных ядер, при которой внутриядерная энергия переходит в кинетическую энергию осколков ядра. При термоядерном взрыве энергия выделяется за счет образования из ядер атомов легких элементов, в частности, дейтерия и трития, ядер элементов большей массы. Так как энергия, выделяющаяся при атомном и термоядерном взрывах на единицу массы вещества, на несколько порядков больше, чем при химических реакциях, то и сила взрыва соответственно несравненно больше.
22
Гл. I. Общая характеристика ВВ
Наконец, взрыв может произойти за сзЕдипотенциальщш-кими-чдской энергии, которая превращается в энергию сжатых газов вГрезультатё~~бяет^оттг~П’рбтекания химичеткой~реакции.
эпоху доатомной энергетики этот тип взрыва имел преобладающее значение при использовании явления взрыва как в промышленности, так и в военном деле и сохраняет в основном это значение и до настоящего времени.
В настоящем курсе главное внимание будет уделено именно этому типу взрыва (взрыву взрывчатого вещества), которому можно дать следующее определение:
Взрывом ВВ называют его быстрое химическое превращение, протекающее с выделением большого количества тепла и образованием газов.
Взрыв ВВ может протекать в двух различных формах: 1) гомогенного и 2) самораспространяющегося превращения.
Гомогенный взрыв. Будем постепенно нагревать сосуд, наполненный взрывчатым веществом. Соответственно повышению температуры ВВ скорость реакции его превращения будет возрастать. Так как превращение протекает с выделением тепла, то температура ВВ будет повышаться не только за счет внешнего разогрева, но и за счет теплоты реакции. Этот саморазогрев в известных условиях становится самоускоряющимся, что в свою очередь приводит к резкому ускорению реакции, в результате которой ВВ быстро превращается в сильно сжатые газы.
Это — гомогенный химический взрыв, практически не имеющий применения во взрывной технике.
По принципу своего развития гомогенный химический взрыв сходен с атомным взрывом, основанным на делении ядер. В случае ВВ развитие химической реакции стимулируется выделяющимся при ней теплом; в случае атомного взрыва происходит ядерная реакция, развитие которой стимулируется образующимися при ней нейтронами.
С а мо р а с пр остр а в яющий ся взрыв. Возникновение и развитие химического взрыва возможно и в другой форме. Представим себе, что в небольшой части заряда ВВ путем сильного разогрева вызвана быстрая химическая реакция. При известных условиях эта реакция будет самопроизвольно распространяться с большой скоростью от места ее возбуждения до границ заряда. На использовании именно такого — самораспространяющегося—взрыва основана вся современная взрывная техника.
Способность химической реакции в определенных условиях к неограниченному самораспространению является существенной особенностью данной формы взрыва. В соответствии со сказанным этой форме взрыва ВВ можно дать следующее определение.
Взрывом ВВ называют самораспространяющееся с большой скоростью химическое превращение, протекающее с выделением большого количества тепла и образованием газов.
§ 2. Условия протекания реакции в форме взрыва 23
Вслед<*гвие быстроты, с которой реакция проходит по В В, образующиеся газы, даже при отсутствии прочной оболочки, имеют высокое давление и производят сильный удар по окружающей среде, разрушающий и разбрасывающий ее, а также вызывающий в ней ударные волны.
§ 2. ОСНОВНЫЕ УСЛОВИЯ ПРОТЕКАНИЯ РЕАКЦИИ В ФОРМЕ ВЗРЫВА
Из определения, приведенного в конце § 1, вытекают четыре основных условия, которым должна удовлетворять химическая реакция для того, чтобы она могла протекать в форме взрыва:
1) экзотермичность;
2) образование газов;
3) большая скорость;
4) способность к самораспространению.
Все эти условия не являются абсолютными и независимыми друг от друга. Так, большая скорость реакции определяется не только величиной константы скорости, но и температурой, достигнутой при реакции, иначе говоря, тепловым эффектом последней. Точно так же способность реакции к самораспространению в сильной мере зависит от скорости ее протекания и теплового эффекта. Отсутствие или наличие газов в продуктах реакции тоже в известной степени обусловлено тепловым эффектом. Наконец, сам. тепловой эффект может изменяться в зависимости от условий протекания реакции, в частности, от давления и температуры.
Четыре условия в своем сочетании определяют не только возможность самораспространения химической реакции в форме взрыва, но и механическое действие последнего. Рассмотрим их значение в том и другом отношении.
1. Экзотермичность, скорость и образование газов как факторы, определяющие возможность взрывного распространения химического превращения
Экзотермичность превращения ВВ. Экзотермичность превращения ВВ в продукты взрыва может иметь разные причины. Так, если химическое соединение эндотермично, т. е. образовалось из элементов с поглощением тепла, то при обратном процессе — распаде соединения на элементы — соответствующее количество тепла выделяется. Примером может служить хлористый азот, разлагающийся со взрывом по реакции
NCl3->-|-N2+1-|с12 + 56 ккал.
С другой стороны, атомы, содержащиеся в молекуле ВВ, могут образовывать с выделением тепла другие соединения. Это имеет
24
Гл. I. Общая характеристика В В
место, например, при взрыве нитроглицерина, теплота образования которого из элементов положительна, но гораздо меньше, чем суммарная теплота образования тех соединений (Н2О, СО2), которые образуются при взрыве. Известны ВВ (например, гремучая ртуть, гексоген, тетрил), тепловой эффект взрыва которых определяется одновременно и их эндотермичностью и образованием при взрыве сильно экзотермичных соединений.
Экзотермичность превращения определяется тем, что прочность связей между атомами в продуктах превращения значительно больше, чем в самом ВВ. Отсюда ясно, что способность к экзотермической реакции зависит от химической структуры вещества.
Первые попытки систематизации данных по этой зависимости принадлежат Байеру и Вант-Гоффу.
Байер пришел к заключению, что эндотермичность, обусловливающая способность к взрыву, а также высокая чувствительность ацетилена и полиацетиленовых соединений связаны со значительным внутренним напряжением в тройных углеродных связях, в которых углы между валентными связями испытывают наибольшее отклонение от нормальной величины 109,5°.
По Вант-Гоффу химическая инертность углеродной связи делает возможным существование термодинамически неустойчивых соединений, образование которых из элементов связано со значительной затратой энергии; поэтому эти соединения способны распадаться с выделением тепла.
Еще большее значение имеет возможность образования сильно экзотермических соединений из элементов, входящих в состав В В. Способность к экзотермической реакции и является по Вант-Гоффу главным условием взрывчатости.
Эндотермические соединения могут быть получены при разных сочетаниях атомов элементов в молекуле. В частности, эндотермическими оказываются некоторые соединения, в которых друг с другом связаны атомы одного и того же элемента. Такими являются, например, соединения, содержащие группировку — О—О—, вроде озона или перекиси водорода. Другим примером могут служить соединения, содержащие группировку —N = N—. В качестве третьего примера можно привести группировку —С=С— в ацетилене и его производных.
С поглощением энергии образуются также некоторые соединения, включающие атомы различных элементов, таких, как азот и кислород (например, NO, N2O), хлор и кислород (например, С1О2).
Относительно малая прочность связей N—О и С1—О сохраняется в нитросоединениях, нитритах и нитратах, соответственно также в хлоратах и перхлоратах. Аналогичными свойствами обладает также связь углерода с азотом.
Совокупность группировок, присутствие и накопление которых в молекуле может сообщать веществу взрывчатость, приведена в табл, 1. 1.
§ 2. Условия протекания реакции в форме взрыва
25
Таблица 1.1
Атомные группировки, сообщающие соединению взрывчатость
(по Вант-Гоффу)
0—0 N=N c=c O-Cl
Н—Sb H-As 0—N
N—Cl N—S N-Se
C-S C-N C—Ag
Главное практическое значение в современной взрывной технике имеют органические вещества, содержащие NOa, — группу, связанную с углеродом непосредственно (нитросоединения), через азот (нитрамины) и через кислород (нитроэфиры). Основная часть теплового эффекта при взрыве таких соединений получается за счет окисления углерода и водорода, содержащихся в их молекулах, кислородом нитрогруппы.
Соображения Вант-Гоффа в общем правильны, поскольку он подчеркивал значение экзотермичности как необходимого условия взрыва и указывал два возможных источника выделения тепла при химической реакции: распад эндотермических и образование экзотермических соединений. Однако этот фактор не определяет еще однозначно взрывчатость вещества.
Скорость реакции и способность ее к самораспространению. Характерной (хотя часто недостаточно подчеркиваемой) особенностью ВВ является способность вызванной в них локальной химической реакции в известных условиях к неограниченному самораспространению. Это самораспростране-ние происходит в результате распространения по ВВ тепловой волны, передаваемой тем или иным путем, например теплопроводностью, ударной волной и т. д., и вызывающей при своем прохождении химическую реакцию. Тепловая волна в свою очередь поддерживается химической реакцией, которую она вызывает.
Существенным фактором, определяющим возможность возникновения и распространения самоподдерживающейся тепловой волны, является ее интенсивность, т. е. температура, в ней достигаемая. Эта температура определяется прежде всего тепловым эффектом реакции. Однако столь же существенным фактором является скорость химической реакции превращения ВВ при данной температуре. Чем больше константа скорости реакции, тем меньшая температура достаточна для получения определенной скорости превращения в том слое ВВ, через который проходит в данный момент тепловая волна. Кроме того, при большой скорости реакции меньше ее продолжительность, соответственно меньше теплопотери и выше температура, фактически достигаемая при прохождении реакции. Таким образом, наряду с экзотермичностью определенную роль
26
Гл. 1. Общая характеристика ВВ
при самораспространении реакции играет также устойчивость молекулы, точнее, ее реакционная способность, характеризуемая в первую очередь энергией активации — минимальной энергией, которую должна получить молекула, чтобы прореагировать.
При этом дело не в абсолютной величине энергии активации, а всоотношении между теплотой реакции и энергией активации. При малой энергии активации достаточно небольшой теплоты реакции, чтобы вещество было способно к взрыву; однако вещество может быть способно к взрыву и в том случае, если экзотермическая реакция его превращения имеет большую энергию активации или по каким-либо другим причинам (например, вследствие гетерогенности системы) протекает с относительной малой скоростью. В этом случае необходимо только, чтобы тепловой эффект реакции был соответственно больше.
Вещество может быть очень неустойчивым и в то же время не быть взрывчатым, если тепловой эффект реакции мал. Точно так же вещество может быть очень устойчивым и одновременно способным к взрыву, если теплота реакции велика по сравнению с энергией активации.
Можно привести много примеров, когда вещество неустойчиво, но тем не менее не является взрывчатым. Так, углекислый аммоний разлагается с большой скоростью уже при 60°, закись ртути распадается на элементы при 1003. Оба эти вещества не взрывчаты, хотя устойчивость их гораздо меньше, чем типичных ВВ вроде тротила или пикриновой кислоты. Объясняется это тем, что процессы распада углекислого а.ммония и закиси ртути протекают с поглощением тепла и поэтому не могут привести к разогреву соседних слоев вещества и возбуждению в них химической реакции.
Можно представить себе неустойчивое вещество, разлагающееся при нагреве с выделением некоторого количества тепла, но тем не менее не способное к взрыву в обычных условиях протекания последнего. Таковы, например, по данным II. Ф. Блинова, комплексные соединения некоторых ароматических ннтроди-азосоединений с хлористым цинком; они имеют низкую температуру вспышки и дают большую частость взрывов при ударе, превосходя в этом отношении такое чувствительное взрывчатое вещество, как тэн. В то же время они не детонируют от капсюля-детонатора даже в широкой (диаметром 40 мм) стальной трубке.
Другим примером может служить хлорат калия, распад которого на хлористый калий и кислород слабо экзотермичен (~10 ккал/мол) и протекает в обычных условиях без взрыва. Известен, однако, сильный взрыв хлората калия при пожаре. Его можно объяснить тем, что большие массы хлората расплавились, запас энергии возрос при этом настолько, что стал возможен взрыв.
Таким образом, взрывчатость может быть достигнута как за счет большой экзотермичности реакции, так и за счет малой устойчивости молекулы. Обычно стремятся использовать насколько возможно первый фактор потому, что величина теплового эффекта реакции определяет и действие взрыва, а также потому, что малая устойчивость молекулы обычно приводит к низкой химической стойкости и к высокой чувствительности ВВ, что увеличивает опасность производства и применения.
В соответствии со сказанным современные ВВ в большинстве своем являются сравнительно устойчивыми соединениями; они относительно трудно воспламеняются и взрываются. Для иллюстрации
S' 2. Условия протекания реакции в форме взрыва
27
можно напомнить, что пикриновую кислоту применяли как краску в течение 100 лет, прежде чем выяснилось, что она является сильным взрывчатым веществом. Тротил поджечь гораздо труднее, чем бумагу, а тем более бензин; аммиачную селитру или ее смеси с тротилом спичкой поджечь не удается и при низких давлениях и комнатной температуре они в малых количествах вообще не горят.
Теоретически можно представить себе ВВ с таким большим отношением теплоты реакции к энергии активации, что самораспро-странение взрывного превращения будет возникать уже при распаде одной единственной его молекулы. Однако простой расчет показывает, что такое вещество полностью разложилось бы за короткое время и реально не могло бы существовать.
В то же время вещество* в котором распад одной молекулы не приводит к самораспространению реакции, может быть к нему способно, если в одном месте и одновременно распадается не одна молекула, а значительное их число. В самом деле, выделяющаяся при распаде энергия передается соседним молекулам. У одной молекулы число этих соседей велико; кроме того, если соседняя молекула, получив энергию, не распалась, то она быстро передает ее дальше. Значительной и длительной концентрации энергии не возникает.
В. случае распада группы молекул число соседей на каждую прореагировавшую молекулу меньше и рассеяние энергии происходит медленнее, так как отвод энергии за пределы очага компенсируется ее поступлением из внутренних слоев очага.
Из сказанного следует, что способность реакции превращения ВВ к самораспространению зависит не только от термохимических и кинетических характеристик вещества (теплоты и скорости реакции), но определяется также возможностью воссоздания высокой концентрации энергии в слоях ВВ, соседних с первоначальным очагом реакции.
Эта возможность зависит, как было указано, в частности, от размеров первоначального очага реакции. Играют роль и другие факторы, влияющие на развитие реакции и рассеивание энергии (давление, наличие и прочность оболочки, физико-механическая структура ВВ и т. д.). Они будут подробно рассмотрены в § 12, гл IV. В частности, при цилиндрическом заряде самораспространение оказывается невозможным, если диаметр его меньше определенной для данного ВВ величины.
Таким образом, само понятие взрывчатости не имеет абсолютного характера и является не качественным, а количественным *.
Нельзя безотносительно к характеристикам заряда говорить, что данное вещество взрывчато. Необходимо указать условия,
* Речь идет о веществах, способных к экзотермической реакции. Если вещество такой способностью не обладает, то его заведомо можно считать не способным к взрыву.
28
Гл. I. Общая характеристика В В
при которых оно является взрывчатым. Если же эти условия не оговорены, то это означает лишь, что вещество, о котором идет речь, взрывчато при тех обычных условиях (размеры заряда, плотность и др.), которые характерны для его технического применения.
Можно говорить также, что одно вещество более взрывчато, чем другое, если одно способно к взрыву при таких условиях, при которых другое к нему еще не способно.
Как было указано выше, самор аспространяющееся превращение ВВ не может быть вызвано распадом одной его молекулы. Каковы размеры необходимого для этого очага распада, точно не установлено. По-видимому, они весьма значительны и измеряются многими миллиардами молекул, по крайней мере для ВВ той степени устойчивости, какие применяются в технике *. При столь больших критических размерах очага самораспространяющейся реакции вероятность его самопроизвольного возникновения при обычных, низких температурах практически равна нулю и взрыв может быть вызван лишь достаточно интенсивным внешним воздействием.
Роль внешнего воздействия сводится, как правило, к созданию во взрывчатом веществе очага разогрева, из которого и начинается самораспространяю-щаяся реакция. Такой очаг разогрева может образоваться и в результате медленного термического разложения ВВ, если это экзотермическое разложение разовьется до большой скорости.
Из сказанного ясно, что способность химической реакции к самостоятельному распространению в форме взрыва является принципиальной характеристикой взрывчатых веществ, определяемой соотношением основных параметров химической реакции и условий рассеяния энергии при ней.
Образование газов. Кроме энергетических и кинетических характеристик вещества, возможность и особенно скорость са-мораспространения реакции зависят также от условий передачи энергии.
Если вся энергия выделяется в виде тепла, то передача ее происходит только путем относительно медленного процесса теплопередачи; соответственно скорость распространения реакции мала. Этот случай имеет место при горении взрывчатого вещества. Повышение давления при отсутствии оболочки будет очень мало и механическое действие продуктов реакции незначительно.
Если же при местном прохождении химической реакции с тем же энергетическим эффектом возникает большое давление,.то передача энергии в известных условиях может осуществляться путем распространения скачка давления, так называемой ударной волны. Скорость передачи энергии таким путем несравненно больше скорости теплопередачи, соответственно быстрее распространяется и химическая реакция. Повышение давления при ней весьма велико.
* Как известно, к взрыву способны и механические смеси таких твердых компонентов, которые сами по себе не взрывчаты; при этом каждая из частиц компонента состоит из огромного числа молекул. Это обстоятельство также указывает на то, что минимальные размеры очага реакции, приводящие к возникновению взрыва, очень велики по сравнению с размером молекулы.
§ 2. Условия протекания реакции в форме взрыва 29
равно как и обусловленное им разрушительное действие. Это детонация взрывчатого вещества.
Необходимым условием такого режима распространения реакции является наличие среди ее продуктов (при соответствующей температуре) газов. В этом и заключается значение образования газов как условия возможности детонационного самораспростране-ния химической реакции.
Из сказанного ясно, что одно и то же химическое превращение может протекать совершенно различно в отношении скорости его распространения и характера внешнего механического эффекта в зависимости от того, каков механизм передачи энергии от продуктов реакции непрореагировавшему веществу. Сами по себе характеристики химической реакции превращения ВВ —ее энергия, энергия активации, агрегатное состояние продуктов реакции — не обусловливают неизбежно взрывной характер превращения. Это видно хотя бы из того, что ВВ могут не только детонировать или гореть, но способны и к медленному химическому превращению.
2. Экзотермичность, образование газов, скорость химического превращения и способность его к самораспространению как факторы разрушающего действия взрыва
Экзотермичность реакции. Образующиеся при взрыве сильно сжатые газы высокого давления производят внешнюю работу, которая совершается за счет энергии, выделяющейся при реакции. Поэтому ясно, что превращение, протекающее хотя бы и с выделением газов, но с затратой тепла [например, распад карбоната аммония (МН4)2СОз = 2МНз + Н2О(Газ)+СО2—47 ккал] не может иметь характера взрыва.
Значение теплового эффекта как фактора, определяющего действие взрыва, можно пояснить таким примером.
Представим себе две прочные стальные бомбы емкостью по 10 л, содержащие по 5 кг первая — жидкой углекислоты, а вторая— смеси углерода (например, сажи) с жидким кислородом. Если в каждую бомбу ввести электродетонатор и взорвать их, то в первом случае стальная оболочка останется целой, во втором она будет разорвана на мелкие куски. В обоих случаях после взрыва получим равные количества одного и того же вещества — углекислоты. Разница в действии обусловлена лишь тем, что во втором случае при образовании углекислоты на каждый килограмм ее выделилось свыше 2000 ккал. За счет этой энергии и произведена работа дробления бомбы.
Ясная зависимость между тепловым эффектом реакции и способностью вещества к взрыву выявляется при сравнении свойств оксалатов различных металлов. Эти соединения имеют по Бертло сходное уравнение распада, образуя при разложении металл и угле
30
Гл. I. Общая характеристика ВВ
кислоту, но различаются по термическому эффекту этой реакции (табл. 1. 2).
Таблица 1.2
Теплота разложения и наличие взрывчатых свойств у оксалатов различных металлов (по Бертло)
Вещество и уравнение разложения* Тепловой эффект ккал\мол Наличие взрывчатых свойств
ZnC2O4 -» 2СО2 + Zn —49,1 Не взрывчат
РЬС2О4- 2СО2+РЬ —16,7 То же
C11C2O4-* 2СОд 4- Си +5,9 Взрывчатость сомнительна
HgC2O4- 2CO2 + Hg + 17,3 Взрывчат
Ag.2C2O4-> 2СО2 + 2Ag +29,5 •
Опыты показали, что только оксалаты ртути и серебра, разлагающиеся со значительным выделением тепла, обладают взрывчатыми свойствами. Оксалаты цинка и свинца, теплота разложения которых отрицательна, к взрыву не способны.
Когда вещество в зависимости от условий способно разлагаться по различным направлениям, только те из них могут сопровождаться взрывом, которые связаны с выделением значительного тепла.
Так, аммиачная селитра, согласно Бертло, разлагается при различных условиях по следующим уравнениям **:
NH4NO3 HNOg + NH3 — 40,8 ккал. (1)
Эта реакция происходит при более низкой температуре, чем какое-либо другое разложение, и является эндотермической.
NH4NO3 N2O + 2Н2О + 10,3 ккал. (2 >
Разложение с образованием воды и закиси азота протекает при осторожном нагревании н температуре около 200° С.
NH4NO3 — N2 + 2Н2О + NO2 + 28,1 ккал. (3)
4 2
Образование двуокиси азота наблюдается при быстром нагреве аммиачной селитры до 400—бОО3 С, например, если бросить кристалл аммиачной селитры в раскаленную докрасна пробирку.
NH4NO3 -> Nj -у 2Н2О + О2 + 30,2 ккал. (4>
* Приводимые Бертло уравнения распада имеют приближенный характер; в действительности образуются также окислы металлов и окись углерода.
** Тепловые эффекты реакций даны при постоянном объеме.
£ 2, Условия протекания реакции в форме взрыва
31
Эта реакция наблюдается при действии мощного начального импульса, например взрыве капсюля-детонатор а в сочетании с промежуточным детонатором.
Понятно, что реакция (1) ни при каких условиях не может идти со взрывом, в то время как при распаде по уравнению (4) аммиачная селитра дает такой сильный взрыв, что он может быть использован для выполнения взрывных работ.
В кажущемся противоречии с первым условием возможности взрыва (экзотермичность превращения) находится одна реакция — реакция взрыва азида бария. Если принять, что подобно другим азидам он разлагается при взрыве на металл и азот, то теплота такого разложения составит по термохимическому расчету —6,32 ккал. При отрицательной теплоте распада азид бария не должен быть взрывчатым. В то же время, как показывают соответствующие опыты, азид бария обладает слабыми взрывчатыми свойствами; в частности, он дает отчетливую вспышку при нагреве, а также обнаруживает значительную чувствительность к удару.
Исследования показали, что в действительности при нагреве только часть азида бария распадается на элементы, большая же часть бария переходит в нитрид — соединение со значительной положительной теплотой образования. Суммарная реакция может быть выражена уравнением
4BaNG-» ВаBa3Na + 11N2 4-71,0 ккал.
Тепловой эффект этой реакции положителен, чем и объясняется взрывчатость азида бария.
Образование газов. Значение этого фактора для действия взрыва можно пояснить таким примером. Представим себе два закрытых сосуда емкостью по 2 л, содержащих по 1 л твердых или жидких веществ Л и В. Оба эти вещества способны к экзотермической реакции, дающей одинаковое повышение температуры, например до 2730° К. Вещество А дает при этих условиях только жидкие или твердые продукты, вещество В — только газы. Если воздух из сосудов был предварительно выкачан, то в случае А продукты реакции не будут оказывать на стенки сосуда заметного давления, их действие будет только термическим. В случае В даже при изотермическом переходе вещества в газы создается давление около 500 ат, так как плотность газа при нормальных условиях примерно в тысячу раз меньше плотности конденсированного вещества. Если учесть также повышение температуры, то при расчете по закону Клапейрона получим давление 5000 аг, фактически давление будет еще больше в силу того, что законы идеальных газов в данном случае неприменимы.
Таким образом, образование газов делает возможным взрыв, т, е, резкое повышение давления и переход потенциальной энергии взрывчатого вещества в механическую работу. Это определяется, во-первых, тем, что газы имеют значительно меньшую плотность, чем твердые или жидкие вещества, так что переход твердого или жидкого вещества в газы в постоянном объеме дает сильное повы-
32
Гл. I. Общая характеристика ВВ
шение давления; во-вторых, тем, что газы имеют значительно больший коэффициент объемного расширения, чем твердые или жидкие вещества. Благодаря этим двум особенностям газы и являются тем непосредственным физическим агентом, который, расширяясь, производит работу взрыва.
Даже сильно экзотермические, но не образующие газов реакции не могут идти со взрывом. Например, термитная реакция
2А14-Ре2Оз-> А1гОз4-2Ре4-201 ккал, несмотря на большое количество выделяющегося при ней тепла, не дает взрыва *.
Были известны, однако, две реакции, идущие со взрывом, при которых газы, казалось, не образуются. Так, ацетиленистое серебро разлагается по уравнению
AgaC2 —> 2Ag + 2С + 84 ккал.
Из уравнения видно, что газы не образуются, но тем не менее происходит сильный взрыв. Исследованиями установлено, что взрыв ацетиленистого серебра связан с содержанием в нем примесей (азотнокислое серебро и окись серебра), сопутствующих ему при обычном способе получения. При распаде ацетиленистого серебра эти примеси разлагаются за счет выделяющегося тепла и образуют газы, необходимые для взрыва. Если изменять способ получения ацетиленистого серебра так, чтобы получался более чистый продукт, то чем меньше он будет содержать примесей, тем слабее будет выражена его взрывчатость. Совершенно чистое ацетиленистое серебро дает при поджигании на воздухе глухой звук, связанный с быстрым разогревом прилегающих слоев воздуха, в вакууме же оно разлагается без всяких признаков взрыва.
Вторая реакция подобного типа выражается уравнением
2А1 + КС1О3-> А12О3 + КС1 +410 ккал.
Смесь ЗГ части алюминия и 69 частей бертолетовой соли, отвечающая этому соотношению, при соответствующих испытаниях отчетливо обнаруживает способность к взрыву. В то же время в правой части уравнения газов нет.
Однако в момент взрыва газы все же имеются, так как температура продуктов реакции этой смеси очень высока (по расчету более 4000°) и хлористый калий, кипящий при 1415°, может переходить в газообразное состояние**. Это допущение подтверждается характером изменения давления при взрыве в замкнутом пространстве (бомба Бихеля). Обычные взрывчатые вещества показывают повышение давления с последующим падением его до некоторого конечного значения, соответствующего давлению газообразных продуктов взрыва при комнатной температуре (бомба перед взрывом эвакуируется). Смесь алюминия и хлората калия точно так же дает подъем давления (указывающий на образование газов), но затем давление падает до нуля, так как газообразный хлористый калий, конденсируясь, переходит в твердое состояние, в котором упругость его паров практически равна нулю. Таким образом, и в обоих рассмотренных случаях взрыв связан о наличием газов.
Большая скорость реакции. Именно большая скорость реакции обеспечивает ту огромную мощность, которая является характерным признаком взрыва. Поэтому если даже выполняются
* Если термит содержит воздух или примеси, образующие газы, то он может давать взрыв, в известных условиях даже довольно сильный.
** По Апину образование газов при взрыве рассматриваемой смеси может происходить также вследствие того, что разложение бертолетовой соли с выделением кислорода несколько опережает окисление алюминия.
2. Условия протекания реакции в форме взрыва 33
первые два условия, но скорость реакции мала, то взрыва не происходит.
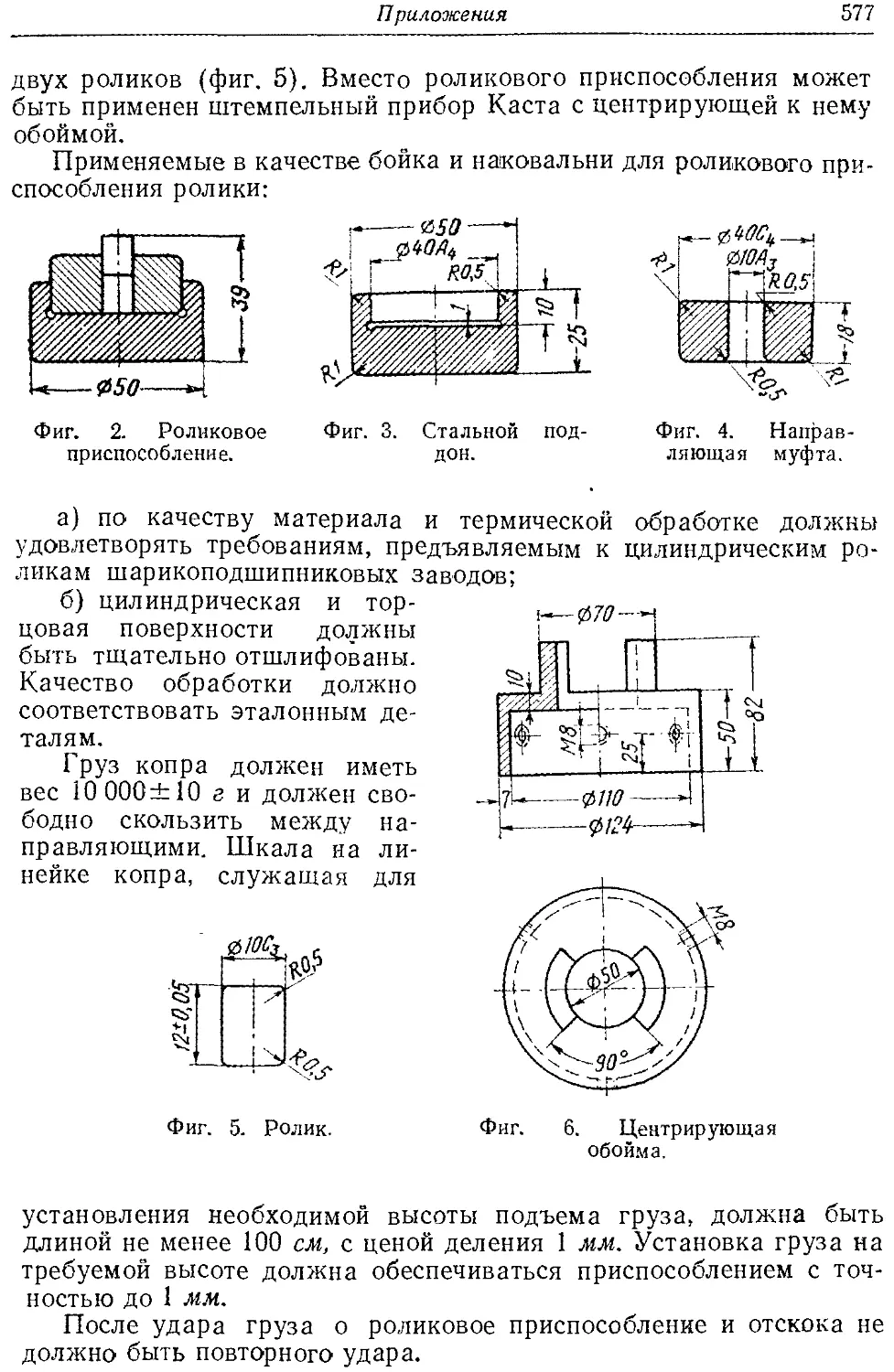
Фнг. 1.1. Деформация свинцовых цилиндриков при детонации нитроглицерина с большой (а) и малой (б) скоростью.
механический эффект взрыва,
Так, уголь горит на воздухе без всякого взрыва. При этом выделяется много тепла и газов, но скорость реакции мала, так как она протекает лишь на поверхности контакта воздуха с горящим материалом, а эта поверхность невелика. Если ее увеличить, например, измельчить уголь и перевести угольную пыль во взвешенное в воздухе состояние, то эта взвесь взрывается; сила взрыва такой смеси небольшая из-за малой ее плотности и соответственно малого давления, достигаемого при сгорании.
Если повысить плотность этой смеси, а следовательно, и ее объемную мощность, применив воздух или кислород не в газообразном, а в жидком виде, то получится оксилик-вит — одно из сильнейших ВВ.
Изменение скорости при прочих равных условиях сильно сказывается на действии взрыва. Так, нитроглицерин в зависимости от некоторых условий может взрываться с различными скоростями: около 8000 и около 2000 м!сек. Соответственно
например обжатие им свинцового цилиндрика, сильно изменяется (фиг. 1. 1).
Способность химического превращения к самораспространению. В условиях применения ВВ химическое превращение возбуждают в какой-либо небольшой части заряда, после чего оно распространяется по всему заряду. Например, если взрыв вызывают зажиганием ВВ, то непосредственному воздействию пламени подвергается только небольшая часть вещества. Вызванная в этой части вещества местная химическая реакция должна быть способна самостоятельно и быстро распространяться по всему остальному веществу. При отсутствии способности химического превращения к такому самораспространению или при утрате ее ВВ не может быть применено на практике.
Так, например, если слишком сильно уменьшить диаметр цилиндрического заряда ВВ, если ввести в вещество слишком много инертных добавок, если чрезмерно уплотнить аммонит, а также если произошло старение желатин-динамита, то способность взрывной реакции к самораспространению уменьшается. Если это уменьшение значительно, то ВВ становится непригодным для практического применения.
Таким образом, способность химического превращения к самостоятельному распространению является важнейшей характеристи
34
Гл. I. Общая характеристика ВВ
кой ВВ также и с точки зрения реальной возможности его технического применения.
§ 3. ОСНОВНЫЕ ТИПЫ ВЗРЫВЧАТЫХ ВЕЩЕСТВ ПО СОСТАВУ И КЛАССИФИКАЦИЯ ИХ ПО ПРИМЕНЕНИЮ
В принципе взрывчатым веществом может быть любая смесь горючего с окислителем. Старейшее взрывчатое вещество — черный (дымный) порох — и является смесью двух горючих (уголь и сера) и окислителя (калиевая селитра). Другой вид подобных смесей — оксиликвиты — представляет собой тонкодисперсное горючее (сажа, мох и т. п.), пропитанное жидким кислородом.
Наиболее широко применяемым видом взрывчатых смесей являются аммониты — смеси аммиачной селитры с взрывчатыми (например, тротил) или невзрывчатыми (например, торф) горючими. Аммиачная селитра содержит избыток кислорода в нитратном остатке и является окислителем; одновременно она содержит горючие элементы (водород аммониевой группы) и способна поэтому сама по себе к экзотермической реакции, которая может протекать и в форме взрыва.
Однако теплота взрыва аммиачной селитры мала; одновременно она обладает низкой чувствительностью к детонации. Если же к аммиачной селитре добавить горючее, а тем более горючее, обладающее взрывчатыми свойствами, то возрастают и теплота взрыва и чувствительность к детонации.
В качестве окислителей во взрывчатых веществах, помимо нитратов, могут быть использованы и другие соли, например, хлораты, перхлораты и др.
Для того чтобы из твердых окислителя и горючего получить ВВ, их необходимо сильно измельчить и тщательно смешать. Химическая реакция вначале протекает только на поверхности частиц и проходит тем быстрее, чем больше эта поверхность. Однако как бы сильно ни были измельчены твердые составные части смеси, невозможно добиться такой равномерности состава, при которой рядом с каждой молекулой горючего находилась бы молекула окислителя. Поэтому в механических смесях скорость реакции при взрыве не достигает своего наибольшего значения.
Этот недостаток отсутствует во взрывчатых химических соединениях, в молекулу которых входят и горючие элементы (углерод и водород) и кислород. Понятно, что в молекуле такого вещества атомы кислорода должны быть соединены с атомами горючих элементов не прямо, а через посредство атомов таких элементов, как азот или хлор, которые относительно инертны и к кислороду и к углероду и водороду, В противном случае при образовании молекулы выделялось бы много тепла, горючие элементы частично «сгорали» бы уже при этом образовании и потенциальная энергия ВВ соответственно бы уменьшилась.
§ 3. Типы В В по составу и классификация их по применению
35
Некоторые взрывчатые химические соединения, кроме того, имеют большую плотность, превосходящую плотность взрывчатых смесей, и большую способность взрываться при такой плотности. Благодаря этому плотность энергии (энергия единицы объема) у них больше, чем у смесей, что обусловливает большее разрушающее действие взрыва,
К взрывчатым химическим соединениям, в которых сочетаются горючие элементы и кислород, относятся вещества ряда классов. Основными из них и имеющими практическое применение являются сложные азотнокислые эфиры многоатомных- спиртов и углеводов, называемые обычно нитроэфирами, и нитросоединения ароматических углеводородов.
Наиболее широко применяются следующие нитроэфиры: глицеринтринитрат, обычно называемый нитроглицерином, СзН5(ОМОа)з; этиленгликольдинитрат, или нитрогликоль, C2H4(ONO2)2; дигликольдинитрат CH2(ONO2)CH2—О—СН2— —CH2ONO2; пентаэритриттетранитрат (тэн) C(CH2ONTO2)4; нитроклетчатка [С6Н2О2 (ОН)з-п(ОНО2)л]х.
Из нитросоединений в первую очередь следует назвать тринитротолуол СбН2(ЫО2)зСН3 (тротил); поли (ди- и три-) нитронафталины СюНб(ЬЮ2)2, Ci0H5(NO2)3; тринитроксилол С6Н(МО2)3(СН3)2 (ксилил); тринитрофенол СбН2(ЬЮ2)зОН (пикриновая кислота).
Применяются также нитрамины — тринитрофенилметилнитра-мин С6Н2(МО2)зМСНзЬЮ2 (тетрил); циклотриметилентринитрамин (CH2NNO2)3 (гексоген) и циклотетраметилентетранитрамин (CH2NNO2)4 (октоген). В последнее время значительное внимание уделяется нитропроизводным и нитраминам жирного ряда; из последних можно назвать этилендинитрамин C2H4(NHNO2)2 (эдна), метилендинитрамин CH2(NHNO2)2 (медика) и динитрат диокси-этилнитрамина O2NN(CH2CH2ONO2)2 (дина).
У нитроэфиров и нитросоединений все тепло или основная часть тепла при взрыве выделяется в результате окисления горючих элементов кислородом. Применяются также ВВ с отрицательной теплотой образования, распадающиеся при взрыве на элементы с соответствующим выделением тепла, например азид свинца PbNe.
Взрывчатые вещества, принадлежащие по своей химической структуре к определенному классу соединений, обладают некоторыми общими свойствами и особенностями. Так, общей для нитроэфиров особенностью является более высокая чувствительность к нагреву и удару, чем у нитросоединений ароматического ряда; многие из них имеют большую теплоту взрыва вследствие большего содержания кислорода, чем у обычных ароматических нитросоединений, содержащих три нитрогруппы в бензольном кольце.
Однако и в пределах класса различия между отдельными представителями могут быть значительными, тем более, что некоторые взрывчатые свойства сильно зависят не только от собственно химических, но и от физических свойств, а также от физико-механиче
36
Гл. I. Общая характеристика ВВ
ской структуры ВВ. Все эти свойства учитываются при выборе ВВ для той или иной конкретной цели.
Помимо классификации по принадлежности к определенному, классу химических соединений, ВВ по степени устойчивости горения и обусловленным ею возможностям применения могут быть разделены на три основных класса: инициирующие, или первичные, вторичные (называемые также бризантными, или дробящими) и метательные (пороха).
Главной особенностью инициирующих ВВ является то, что их горение очень легко и быстро переходит в детонацию. Горение вторичных взрывчатых веществ обычно устойчиво и переходит в детонацию лишь при некоторых особых условиях (пористая структура, жидкое состояние, большая масса, высокая температура и др.); поэтому детонацию вторичных ВВ вызывают не поджиганием, а другими способами. Горение метательных ВВ наиболее устойчиво и не переходит в детонацию даже при тех условиях, при которых этот переход имеет место для вторичных ВВ.
В соответствии со сказанным характерным режимом превращения при техническом применении, инициирующих и вторичных ВВ является детонация, а метательных ВВ — горение.
Различия в устойчивости горения ВВ разных классов имеют большое практическое значение. Вторичные взрывчатые вещества изготовляют и применяют в огромных количествах. При этом, как показывает практика, иногда может происходить воспламенение ВВ. Если бы воспламенение приводило каждый раз к взрыву, то производство ВВ было бы исключительно опасным и практически трудно осуществимым в больших масштабах.
С другой стороны, поскольку вторичные ВВ в обычных условиях не способны взрываться от поджигания, необходим иной простой и удобный для практического применения способ возбуждения их взрыва. Этот способ был найден около ста лет тому назад; он заключается в использовании капсюля-детонатора.
Капсюль-детонатор в простейшем виде представляет собой гиль-зочку с запрессованным в нее маленьким зарядом инициирующего ВВ. Для возбуждения взрыва заряда вторичного ВВ в него помещают капсюль-детонатор и поджигают инициирующее ВВ при помощи огнепроводного шнура или электрического тока. Инициирующее ВВ взрывается и возбуждает взрыв вторичного ВВ.
Инициирующие ВВ значительно опаснее, так как они взрываются при поджигании, и, вообще говоря, гораздо чувствительнее к трению и удару, чем вторичные ВВ, но Потребные количества их несравненно меньше. Кроме того, инициирующие вещества большую часть производственного процесса проходят в увлажненном состоянии, в котором многие из них мало чувствительны к удару, трудно воспламеняются и не дают перехода горения во взрыв. Все это сильно снижает опасность взрыва в производстве инициирующих В В.
$ 3. Типы ВВ по составу и классификация их по применению 37
Наконец, высокая устойчивость горения порохов обеспечивает возможность применения их в огнестрельном оружии. Понятно, что в таких условиях возникновение взрыва совершенно недопустимо.
В отношении химического состава пороха не отличаются от вторичных ВВ. Современный нитроглицериновый порох состоит в основном из двух типичных вторичных В В — нитроглицерина и нитроклетчатки. Высокая устойчивость горения порохов обусловлена в первую очередь отличием их от вторичных ВВ в отношении физических свойств — вязкости, газопроницаемости (пористости) и прочности пороховых элементов (частиц).
Глава II
МЕДЛЕННОЕ ХИМИЧЕСКОЕ ПРЕВРАЩЕНИЕ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
§ 1. ОСНОВНЫЕ ФОРМЫ ХИМИЧЕСКОГО ПРЕВРАЩЕНИЯ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
Химическое превращение взрывчатых веществ может протекать в различных формах, основными из которых являются: 1) медленное химическое превращение; 2) горение и 3) детонация.
Медленное химическое превращение характери-
зуется тем, что все разлагающееся вещество находится при одинаковой температуре, практически равной температуре окружающей ds среды. Скорость реакции
= (—dnijdt—-производная коли-
Продукты превращения
P,?J
Зона химического превращения
чества реагирующего вещества по времени) соответствует этой температуре и во всех точках одинакова *. Закономерности медленного химического превращения ВВ принципиально не отличаются от закономерностей превращения веществ невзрывчатых.
Фиг. 2.1. Схема самораспространяющей- Иначе обстоит дело при г о-ся химической реакции. рении и детонации
Здесь в обоих случаях имеется фронт химического превращения —- относительно узкая зона, в которой происходит интенсивная химическая реакция, — распространяющийся по веществу с некоторой скоростью. Впереди этой зоны находится исходное ВВ, позади нее — продукты превращения (фиг. 2. 1). Температура Т впереди фронта, позади него и в самой
зоне реакции существенно различается, имеет место также меньшее или большее неравенство давления р и плотности р.
* Исключение составляет случай, когда образуются твердые автокаталнза-торы, на поверхности которых скорость реакции гораздо больше, чем в объеме.
if 1. Основные формы химического превращения ВВ
39
Скорость реакции, точнее линейная скорость перемещения фронта процесса (dsfdt — производная пути, пройденного фронтом, по времени), зависит в основном не от начальной температуры вещества (окружающей среды), а от количества выделяющейся при реакции энергии, условий ее передачи непрореагировавшему веществу и кинетических характеристик возникающего в нем при этой передаче химического превращения. Так как механизм передачи энергии при горении и детонации различен, то скорость распространения также различается и при горении не превышает (для газов) десятков метров в секунду, а при детонации составляет километры в секунду.
Медленное химическое превращение, горение и детонация являются основными формами химического превращения взрывчатых веществ. Они могут переходить одна в другую. Так, например, медленное химическое превращение может приводить к возникновению горения, горение может переходить в детонацию. Возможны также промежуточные по скорости распространения режимы, обычно переходные и неустойчивые. Для некоторых ВВ, например дымного пороха, известны горение со скоростью в несколько сантиметров в секунду и распространение со скоростью около 400 м!сек, слишком малой, чтобы этот режим распространения можно было считать детонацией.
В соответствии с различием в скорости распространения возможное механическое (разрушающее) действие разных форм превращения ВВ существенно отличается.
Медленное превращение само по себе может только в замкнутом объеме привести к повышению давления вплоть до разрыва оболочки.
Горение также может привести к значительному повышению давления лишь в замкнутом или полузамкнутом объеме. Соответственно оно используется в тех случаях, где слишком большое давление нежелательно (заряды огнестрельного оружия).
Детонация, вследствие большой скорости ее распространения, дает максимальное давление (измеряемое сотнями тысяч атмосфер), практически не зависящее от наличия или отсутствия оболочки. Соответственно она применяется тогда, когда надо получить максимальное разрушающее действие.
Изучение основных форм протекания химических реакций во взрывчатых веществах начнем с рассмотрения медленного химического превращения. Эта форма превращения, будучи простейшей, является в то же время одной из стадий процессов горения и детонации ВВ. Вместе с тем изучение медленного химического превращения представляет значительный интерес для решения проблем химической стойкости ВВ.
Как уже было указано, медленное химическое превращение ВВ протекает по тем же законам, которые характеризуют течение ре
40
Гл. II. Медленное химическое превращение ВВ
акций и в невзрывчатых системах. Поэтому прежде чем рассматривать результаты, полученные при исследовании ВВ, напомним основные положения современной кинетики химических реакций. Эта кинетика наиболее полно разработана в отношении газов, дающих простые и наглядные закономерности, которые и будут рассмотрены ниже.
§ 2. ЭЛЕМЕНТЫ КИНЕТИКИ ПРОСТЫХ ГАЗОВЫХ РЕАКЦИИ
1. Механизм химической реакции и зависимость скорости реакции от температуры
Положим, что мы имеем газ или смесь газов, способных к бимолекулярной реакции, например смесь паров иода с водородом. Для того чтобы молекулы иода и водорода прореагировали, они должны столкнуться друг с другом. Однако столкновение не является еще достаточным условием для наступления элементарной реакции.
Среднее время между столкновениями имеет для газов при атмосферном давлении порядок 10~10 сек цсли бы каждое столкновение приводило к элементарной реакции, то просто нельзя было бы получить смесь способных к реакции газов. Они прореагировали бы в процессе смешения.
Как известно, при обычной температуре кислород с водородом практически не реагируют. Если также при комнатной температуре смешать кислород с окисью азота, то смесь быстро буреет в результате образования двуокиси азота. Число столкновений между молекулами в обоих случаях примерно одинаково. Резкое различие в скорости реакции показывает, что она определяется не только вероятностью встречи реагирующих молекул.
В настоящее время общепринятой является гипотеза Аррениуса, согласно которой реакция между молекулами происходит лишь в том случае, если они являются активными, т. е. обладают при столкновении некоторой избыточной энергией. Такое допущение вполне естественно, так как реакции должно предшествовать ослабление или разрушение внутренних связей реагирующих молекул, без чего невозможна перегруппировка атомов, приводящая к образованию молекул продуктов реакции.
В соответствии с гипотезой Аррениуса скорость бимолекулярной реакции, т. е. число элементарных реакций, происходящих за 1 сек., должна равняться числу столкновений между активными молекулами, если допустить в простейшем случае, что каждое их соударение приводит к реакции.
Согласно. кинетической теории газов число активных молекул в единице объема равно их общему числу, умноженному на выражение е~ERT, где Е— избыточная энергия активной молекулы. Таким образом, если реакция протекает по схеме например,
HJ+HJ=H2+J2,
и если концентрацию молекул М обозначить через {Л1], то общее число соударе-
£ 2. Элементы кинетики простых газовых реакций
41
кий 2, между этими молекулами согласно кинетической теории определится выражением
/2 -
Z*= —— т.^и [М]2, (2.1)
где о,—диаметр молекулы М;
и — средняя скорость ее движения.
Обозначим через [Л11] число молекул М, обладающих энергией, превышающей некоторую величину Очевидно, что
... . г... -EJRT
Соответственно
. ,, , . ... —EtJRT
рИ21 = 1Л1]е 2' .
Положим, что Ei+E^E, где Е — энергия активации данной реакции; тогда число столкновений между молекулами, удовлетворяющими этим условиям,
— V2* —
2j = [Alii [Afo] — я’2и [Af]2 e~EIW.
Таким образом, число столкновений, при которых сумма энергий сталкивающихся молекул равна или превосходит энергию активации, равно общему числу соударений между молекулами реагентов, умноженному на дробь е~Е^г.
При указанном выше допущении скорость реакции w (число молекул, реагирующих за 1 сек. в 1 см3) равна удвоенному числу столкновений, при которых суммарная энергия сталкивающихся молекул превышает энергию активации
[Л1]2 е~Е1КГ. (2.2)
Выражение (2.2) можно переписать в следующем виде:
w = K[M]2, (2.2а)
где
^ = /2^6?-^.
Если произведение первых четырех множителей, не зависящих или слабо зависящих от температуры, обозначить В, то
K = Be-W. (2.3)
Величина К есть константа, характеризующая зависимость скорости реакции от температуры, определяемую величиной Е. Чем больше энергия активации, тем сильнее увеличивается скорость реакции при повышении температуры.
Соответствие этой формулы опытным данным можно проверить-следующим путем.
Логарифмируя выражение (2.3), получим
1пК=—-|2_ + 1п5. (2.4)
-42
Гл. If. Медленное химическое превращение ВВ
можно переписать в следующем
Так как второй член правой части в первом приближении от температуры не зависит, то (2.4) виде:
1 iZ £
In К—--------
R
- + const. т
(2. 4а)
Следовательно, логарифм скорости должен быть связан с обратной абсолютной температурой линейной зависимостью. Постро-
ив по опытным данным график In К—
,мую. Эта зависимость выполняется для большинства реакций
Фиг. 2.2. Зависимость константы Д' скорости термического распада этилендиаминдинитрата от температуры Т.
мы должны получить пря-(см., например, фиг. 2.2).
Рассмотрим коротко вопрос о природе активных молекул. Активными могут быть, во-первых, просто быстрые молекулы. имеющие кинетическую энергию, равную или 1 10з превышающую энергию Т активации Е..
Силы, возникающие в момент столкновения таких молекул, преодолевают их относительную
устойчивость и делают возможной реакцию. На ослабление первоначальных связей между атомами в исходных молекулах, а также на преодоление отталкивания между сближающимися молекулами должна быть затрачена энергия независимо от того, является реак-
ция экзотермической или эндотермической.
Поясним роль активации следующей аналогией. Предположим, что на горке стоят салазки в положении а (фиг. 2.3). Хотя на уровне b положение салазок было бы устойчивее в соответствии с более низким уровнем потенциальной энергии, уменьшившейся на теплоту реакции Q, они все же не скатываются. Горка ас не позволяет им съехать вниз и делает их положение относительно устойчивым Необходим толчок, который поднял бы энергию салазок на величину Е до уровня с, после чего они сами скатятся вниз. Кинетическая энергия и может играть роль этого толчка при взаимодействии молекул
Помимо быстрых, возможны и другие виды активных молекул. В известных условиях (поглощение света, удар электрона или мо-.лекулы) энергия, полученная молекулой, может затрачиваться на перевод одного из периферических электронов с нормальной орбиты на орбиту, соответствующую большей потенциальной энергии относительно остальной части молекулы. В таком состоянии молекулы называют возбужденными; как показывает опыт, они могут быть активными в смысле гипотезы Аррениуса.
$ 2. Элементы кинетики простых газовых реакций
Наконец, существует третий вид активных частиц: свободные атомы или радикалы. Распад молекулы на атомы или радикалы связан с более или менее значительной затратой энергии, которая в потенциальном виде (в форме г
химической энергии) содержится в образовавшихся осколках молекулы и обусловливает их повышенную реакционную способность. Такие частицы, имеющие неспаренный электрон, характеризуются ненасыщенностью валентности и легко, с очень низкой энергией активации, вступают в реакции присоединения.
В качестве примеров можно привести реакции атомарного водорода с галогенами:
Н 4- С12 = НС1 4- С1 + 45,0 ккал;
Н 4- Brj = НВг + Br-f-40,5 ккал;
Н 4-J2= HJ + J 4-33,7 ккал. фиг- 2- 3- Схема энергетических уровней молекулы до активации (а), Эти экзотермические реакции требу- после активации (с) и после реак-ют очень небольших энергий активации Чии W-
(соответственно 0,3; 0,1 и 0,0 ккал/мол).
Даже при комнатной температуре замещение происходит практически при каждом столкновении атома водорода с молекулой галогена. Реакции молекулярного водорода с галогенами протекают несравненно труднее: например, реакция между водородом и иодом имеет энергию активации 40 ккал; соответственно скорость ее при комнатной температуре практически равна нулю.
2. Зависимость скорости реакции от концентрации (давления); изменение скорости во времени
Скорость реакции, как мы видели, пропорциональна числу столкновений между активными молекулами. Число же столкновений пропорционально произведению концентраций веществ, участвующих в реакции, т. е., если реагируют газы, произведению их парциальных давлений.
В общей форме для реакции, идущей по уравнению
П\А • • —
где X — продукт реакции, зависимость скорости от концентраций реагентов можно записать следующим образом:
^=Kai'a^\ (2.5)
dt
44
Гл. II. Медленное химическое превращение ВВ
где концентрации реагирующих веществ обозначены через Яь а? и т. д„ а конечного продукта — через х.
Зависимость (2.5) определяет также изменение скорости во времени, если концентрации реагентов меняются по мере течения реакции. Последнее условие выполняется для реакций в газовой фазе и в растворах. Концентрации реагирующих веществ со временем уменьшаются и скорость реакции падает. Это падение происходит по-разному, в зависимости от числа молекул, участвующих в реакции.
В том случае, если пх=1, а «г, пз . = 0 (реакция первого порядка), выражение (2.5) примет вид
(2.6) dt
Если начальную концентрацию исходного вещества обозначить через а, то
аг—а~х и
-^ = /<(а-х)*. (2.7)
Разделяя переменные и интегрируя, получим
1п(2.8) а — х
или
/С = --1п—. (2.9)
t а — х
Константа скорости К имеет размерность Z-1, и величина ее зависит только от выбранной единицы времени. Если оно, как обычно, выражено в секундах, то размерность константы — обратные секунды (сек.-1).
Зависимость концентрации х прореагировавшего вещества от времени найдем из выражения (2.8):
(2.10)
Дифференцируя уравнение (2. 10), получим зависимость скорости реакции от времени:
^L. — aKe~lct. (2.11)
* Соотношение (2.7) выполняется также в случае, когда жидкое или твердой вещество, реагируя, полностью превращается в газы. В этих условиях концентрация исходного вещества не изменяется, но скорость газовыделения со временем уменьшается по уравнению реакции первого порядка. В данном случае выполнение уравнения (2.7) указывает лишь на то, что скорость распада пропорциональна количеству наличного вещества и ничего не говорит о порядке реакции.
§ 2. Элементы, кинетики простых газовых реакций
45
Графически эти соотношения изображены кривыми на фиг. 2.4 и 2. 5.
Отметим еще одно соотношение, часто используемое для установления порядка реакции.
Из выражения (2.8) определим период полураспада , т. е. время, в течение которого прореагирует половина исходного вещества (х~а/2);
= (2.12)
Л
Таким образом, для мономолекулярных реакций время превращения половины (или любой иной доли) вещества не зависит от его начальной концентрации.
Для реакции второго порядка (и = 2), в которой участвуют две молекулы (бимолекулярные реакции), дифференциальное кинети-
Фиг. 2.4. Зависимость количества х прореагировавшего вещества при мономолеку-лярной реакции от времени t.
Фиг, 2.5. Зависимость скорости dx/dt мономолекулярной реакции от времени t.
ческое уравнение (при равных начальных концентрациях обоих реагентов) имеет следующий вид:
(2 13)
dt
После интегрирования получим
- Л7. (2.14)
а [а — х)
Величина константы скорости К, в отличие от реакции первого порядка, зависит от единицы измерения концентраций. Если концентрации выражать в молях на литр, а время в секундах, то К будет иметь размерность лмол~1 сек~'.
Из выражения (2. 14) находим
t,, (2.15)
'г /< a
46 Гл. II. Медленное химическое превращение ВВ
В данном случае период полураспада зависит от начальной концентрации, а именно, обратно пропорционален ей.
Реакции первого и второго порядка охватывают практически все реальные процессы; реакции третьего, а тем более высших порядков встречаются крайне редко *.
Множитель В в уравнении (2. 3) в случае бимолекулярных реакций численно равен удвоенному количеству соударений между молекулами за 1 сек. в единице объема; при концентрациях реагентов, в 1 моль/л этот множитель согласно расчету равен ~10!|.
Известен ряд реакций, для которых получается хорошее соответствие значений скорости реакции, определенной экспериментально, и скорости, рассчитанной по уравнению (2.2). Однако в некоторых случаях фактическая скорость реакции гораздо меньше расчетной, и в выражение константы скорости (2.3) необходимо ввести поправочный множитель Р, так называемый вероятностный фактор, величина которого находится в пределах от 1 до 10~7. Величина Р может зависеть от целого ряда причин: например, от влияния геометрии молекул на эффективность столкновений, от того, что богатые энергией молекулы продуктов сильно экзотермических реакций могут распадаться прежде, чем они потеряют эту энергию,, от того, что длительность соударений может быть недостаточной для перераспределения энергии, и т. д.
Менее ясен вопрос о механизме мопомолекулярной реакции и о физическом смысле предэкспоненциального множителя В в этом случае.
Основная трудность заключается в следующем. Для того чтобы произошла элементарная мономолекулярная реакция, вступающая в нее молекула должна получить энергию активации. Эту энергию молекула получает в результате обмена энергией при соударениях с другими молекулами. Число активирующих соударений пропорционально общему числу соударений, т. е, квадрату концентрации. Таким образом, число активных молекул, образующихся в единицу времени, пропорционально квадрату концентрации. В то же время число распадающихся молекул (скорость реакции) пропорционально первой степени концентрации.
Это кажущееся противоречие объясняется следующим образом. Активированная в результате соударения молекула распадается не сразу. Если время ее существования Т велико по сравнению со временем между столкновениями т0, то большая часть активных молекул дезактивируется при последующих столкновениях прежде, чем молекула успеет распасться. В результате дезактивации устанавливается равновесие между активными и неактивными молекулами, иными словами, устанавливается некоторая определенная для данной температуры концентрация активных молекул. Число распадающихся молекул пропорционально концентрации активных молекул и, следовательно, концентрации вещества в первой степени.
Согласно этому объяснению скорость реакции должна оставаться пропорциональной первой степени концентрации только тогда, когда т > То. Если же мы
* Это не значит, что зависимость скорости реакции от концентрации всегда выражается ее пропорциональностью первой степени или квадрату (произведению) концентрации. Во многих сложных реакциях суммарная скорость процесса пропорциональна концентрации исходных продуктов в степени, отличной от 1 или 2.
§ 2. Элементы кинетики простых газовых реакций
47
уменьшим при данной температуре число соударений, например уменьшая давление газа, то можно настолько увеличить время Го между соударениями, что-все активированные молекулы будут успевать распадаться прежде, чем они подвергнутся дезактивирующим соударениям. Тогда скорость реакции станет пропорциональной числу активирующих соударений, т. е. квадрату концентрации.
Обозначив исходные молекулы через А, активные молекулы через А' и продукт реакции через X, можно написать:
A'i
А + А ХА. А Т* А'. А2 И3
В состоянии равновесия
d ГЛ']
—;~~ = А, [Л]2 - А-2 [А' ] ]А] - К3 [А' ] = О, dt
откуда
гл,1==_ЛтМЕ_
А2]Л] + к3
Скорость образования продукта реакции X равна У<3[Л'], поэтому
dx К3К 1 [Л]2 7d7 = к2[л] + /<3 ’
Если [Л] велико и Ку [Л]>К3, то--^-[Л], т. е. скорость реакции-
dZ К 2 пропорциональна первой степени концентрации.
dx
Если [Л] мало и ^2lД]CA’з, то -= Ку [Л]2, т. е. скорость реакции про-
dt порциональна квадрату' концентрации.
Эти теоретические выводы подтверждаются опытом. При понижении давления-ниже известного предела скорость мономолекулярных реакций перестает изменяться пропорционально первой степени давления (концентрации) и при достаточно малых значениях последнего точно следует уравнению реакции второго порядка.
Рассмотренное объяснение находится в соответствии с тем фактом, что обычно к мономолекулярному распаду способны только сложные молекулы, состоящие из нескольких атомов. В них имеется значительное число связей, по которым может распределяться общий запас энергии. Для того чтобы энергия сконцентрировалась на одной из связей в количестве, достаточном для ее разрыва, должно произойти перераспределение энергии между связями. Процесс перераспределения энергии требует некоторого времени т, определяющего длительность жизни активной молекулы. Очевидно, т не может быть меньше периода внутримолекулярных колебаний, имеющего порядок 10~12—10~!4 сек. Величина предэкспоненциалыюго множителя В, представляющего собой вероятность распада активированной молекулы, равна обратной величине т и не может, таким
48
Гл. II. Медленное химическое превращение В В
образом, превосходить 1012—1014. Согласно уточненной теории для молекул с большим числом степеней свободы возможны также несколько большие значения множителя В.
§ 3. САМОУСКОРЯЮЩИЕСЯ ХИМИЧЕСКИЕ РЕАКЦИИ
Скорость реакции в рассмотренных выше случаях падает со временем соответственно уменьшению концентраций или количества реагирующих веществ. Известны, однако, такие реакции, скорость которых со временем возрастает, несмотря на падение концентраций исходных веществ. В некоторых случаях ускорение реакции может стать очень большим и может быть достигнута очень большая скорость ее. Если реакция экзотермична, то при большой ее скорости в единицу времени выделяется много энергии. Потери энергии во вне за малое время реакции становятся относительно незначительными, и практически вся энергия непосредственно после прохождения реакции оказывается сосредоточенной в ее продуктах.
Концентрация энергии может при этом стать очень большой. Если реакция протекает в какой-либо части объема, занятого ВВ, то за счет передачи выделившейся энергии соседним слоям вещества в них также может быть возбуждена быстрая реакция. Такая самораспространяющаяся реакция может протекать, как мы видели, в форме горения и в форме детонации.
Для понимания механизма самораспространения экзотермической реакции необходимо рассмотреть простейший случай само-ускоряющейся реакции — случай макрогомогенного ее течения*. Самораспространяющуюся реакцию можно рассматривать как последовательное прохождение в смежных слоях вещества макрого-могенной самоускоряющейся реакции, происходящей в условиях получения энергии от предыдущего реагирующего слоя и отдачи ее последующему слою.
Рассмотрим три основных механизма самоускорения реакции: тепловой, автокаталитический и цепной.
1. Тепловое с а м о у скорей и е происходит вследствие саморазогрева системы за счет выделяющегося при реакции тепла,
2. А в т о к а т а л и т и ч е с к о е, или, точнее, а в т о ката л и-т и ч е с к и-т е п л о в о е, с а м о у с к о р е н и е происходит в результате накопления продуктов реакции, катализирующих превращение исходного вещества. Когда достигается перевес теплоприхо-да над теплоотводом, наступает тепловое ускорение, закапчивающе
* Макрогомогенным мы называем такое течение реакции, когда средняя ско рость превращения в некотором не слишком малом элементе объема одинакова. Для самораспространяющейся реакции, при которой поверхность, точнее зона фронта, делит весь объем на две части — непрореагировавшее вещество и продукты реакции,—это условие не выполняется. Макрогомогенная реакция может быть микрогетерогенной, как это имеет место, например, при топохимической реакции в твердом веществе, где химическое превращение начинается в отдельных точках, из которых оно распространяется в виде растущих зародышей.
§ 3. Самоускоряющиеся химические реакции
49
еся взрывом. Сюда же относится самоускорение реакции в результате накопления промежуточного продукта при протекании распада в несколько последовательных стадий.
3. Цепное самоускорение реакции при постоянной температуре происходит в результате превышения разветвления над обрывом цепей.
Во многих случаях развития цепных реакций теплоотдача может быть недостаточной для отвода всего тепла реакции; тогда к цепному ускорению присоединяется тепловое и самоускорение становится цепи о-т е п л о в ы м: на начальное увеличение скорости реакции, происходящее вследствие разветвления цепей, накладывается тепловое ускорение; совместное действие обоих механизмов приводит к взрыву.
Для газовых экзотермических реакций реальны и изучены все три механизма самоускорения. Для конденсированных взрывчатых систем несомненно существование автокаталитически-теплового, а по-видимому, также и чисто теплового самоускорения. Бесспорных экспериментальных доказательств цепного механизма медленного предвзрывного химического превращения, а следовательно, и цепного механизма возникновения взрыва для конденсированных систем пока не получено.
Возможно, что наличие цепей значительной длины при обычных или умеренно повышенных температурах было бы связано с очень большой легкостью возникновения взрыва, большей, чем даже, например, у хлористого азота, для которого цепная реакция и цепной взрыв (в парах) установлены экспериментально *. Такие ВВ из-за их чрезмерной взрывоопасности вообще почти не изучены.
1. Тепловое самоускорение реакции (тепловой взрыв) в газах
Тепловое ускорение реакции и возникновение взрыва происходят в результате повышения температуры реагирующего вещества за счет теплоты самой реакции.
Качественная картина теплового ускорения реакции и возникновения взрыва сформулирована в 1884 г. Вант-Гоффом следующим образом (фиг. 2. 6).
Если в некоторой точке инертной среды вызвать местный разогрев (например, пропусканием электрической искры), то тепло будет распространяться от слоя к слою, причем в каждом следующем слое максимальная температура будет ниже, чем в предыдущем (фиг. 2.6, а).
Если умеренный разогрев создан в среде, способной к экзотермической реакции, то также будет наблюдаться падение температуры,
* Отметим, что для цепной реакции распада хлористого азота наблюдается верхний предел по давлению, т. е. взрыв прекращается при повышении концентрации паров до относительно небольших значений, гораздо меньших, чем концентрация вещества в жидком хлористом азоте.
50
Гл. II. Медленное химическое превращение ВВ
но более медленное, так как теплопотери каждого слоя в некоторой мере будут компенсироваться выделением тепла при реакции (фиг. 2.6, б).
При сильном разогреве скорость реакции может стать столь большой, что за счет выделения тепла реакции температура от слоя к слою будет не падать, а возрастать и произойдет воспламенение (фиг. 2.6,в).
Минимальная температура Т3 (фиг. 2.6,а), начиная с которой это происходит, и является своего рода пределом, отделяющим область воспламенения от области мед-
ленной затухающей реакции в данных условиях ее проведения. Это и есть температура воспламенения взрывчатой системы.
Если воспламенение возникает без поджигания извне, а за счет повышенной температуры, до которой равномерно нагрета вся система, то мы говорим о самовоспламенении или вспышке.
Простейший метод определения температуры самовоспламенения газов, предложенный Ле Шателье, состоит в том, что исследуемый газ впускают в эвакуированный сосуд, предварительно нагретый до определенной температуры. Повышая при последовательных опытах температуру сосуда, устанавливают то минимальное ее значение, начиная с которого наблюдается воспламенение газа. К недостаткам этого метода относятся: возможность заметного изменения состава газа за счет реакций, проходящих во время его прогрева до температуры сосуда, и протекание гетерогенных реакций на горячей стенке.
В методе коаксиальных трубок Диксона, разработанном для определения температуры самовоспламенения смесей, каждый из газов, проходя по трубке, предварительно нагревается
Расстояние от точки рззогреЗа
Фиг. 2.6. Схема теплового вос-
пламенения по Вант-Гоффу. и они смешиваются в горячем состоянии.
В методе, предложенном Нернстом, разогрев газа производится его адиабатическим сжатием. Так как сжатие происходит быстро и стенки сосуда первоначально холодные, то предпламенные и гетерогенные реакции сводятся к минимуму.
В табл. 2. 1 приведены температуры самовоспламенения некоторых горючих газов в смеси с воздухом при атмосферном давлении.
Количественная теория теплового самовоспламенения была разработана в 1928 г. Н. Н. Семеновым, который, как и Вант-Гофф, исходил из представления о медленно протекающей экзотермической реакции, ускоряющейся с повышением температуры.
Рассмотрим взрывчатый газ (или смесь газов), находящийся в сосуде. При некоторых значениях начальной температуры и дав
ления теплота, выделяющаяся при медленной реакции, не успевает
в данных условиях теплоотвода отводиться через стенки сосуда
§ 3. Самоускоряющиеся химические реакции
51
Таблица 2.1
Температуры самовоспламенения смесей некоторых газов с воздухом
Газ Температура самовоспламенения °C Газ Температура самовоспламенения °C
Водород 530 Этилен 540
Окись углерода 610 Пропилен 455
Метан 645 Бутен 445
Этан 530 Ацетилен 335
Пропан 510 Сероуглерод 290
Бутан 490 Светильный газ 560
и нагревает газ. Вследствие этого нагрева реакция ускоряется, ускорение реакции увеличивает нагрев, что еще более ускоряет реакцию и т. д. Таким образом, идут прогрессивный саморазогрев смеси и самоускорение реакции, приводящие к самовоспламенению.
Допустим, что сосуд имеет постоянную температуру Та. Очевидно, чем больше будет давление (точнее, концентрация) газа или смеси газов, тем больше будет скорость реакции, а следовательно, и приход тепла в единицу времени. Скорость же отвода тепла от давления не зависит. Поэтому при достаточно' малых давлениях теплоприход не может стать больше теплоотвода и реакция будет протекать при практически постоянной температуре, близкой к температуре сосуда. По мере повышения давления впускаемого в сосуд газа скорость реакции и теплоприход растут, теплоотвод же остается постоянным. Очевидно, что для заданной начальной температуры существует минимальное давление, при котором теплоприход становится равным теплоотводу. При более высоком давлении теплоприход превосходит теплоотвод; температура впущенного в сосуд газа в этом случае непрерывно растет, что приводит к самовоспламенению.
Аналогичным образом для данного давления газа существует некоторая минимальная температура сосуда, ниже которой химическое превращение протекает в форме медленной реакции, а выше — приводит к самовоспламенению.
Задача сводится к определению минимальной температуры для давления рр, т. е. зависимости между давлением газа и минимальной температурой, приводящей к самовоспламенению.
Поясним сказанное графиком. Нафиг. 2.7 кривая дает теплоприход q} как функцию температуры при данном давлении р0. Прямые 1,2 и 3 дают соответственно для трех разных температур сосуда То, То и То теплоотвод д2, который, как было указано, от давления не зависит.
Посмотрим, как будет протекать реакция" при различных температурах сосуда. Холодный газ, впущенный в сосуд с темпе
52
Гл. П. Медленное химическое превращение ВВ
ратурой Та, нагреется до этой температуры. Так как при 7'0 теплоотвод равен нулю, а теплоприход имеет некоторое конечное значение q\, то газ будет продолжать нагреваться до температуры 1\.
При температуре Т[ теплоприход и теплоотвод равны между
собой. Нетрудно показать, что это равновесие является устойчивым. Действительно, если по какой-либо причине температура газа подни-
мется выше Т/, то теплоотвод станет больше теплоприхода и темпе-
ратура будет падать до 7Y. Таким образом, реакция будет протекать без ускорения при температуре Г/.
Если сосуд имеет более высокую начальную температуру, например То", то прямая 3 теплоотвода целиком лежит ниже кривой теплоприхода. Повторяя то же рассуждение, мы убедимся, что температура газа, впущенного в сосуд, будет непрерывно расти и опыт закончится самовоспламенением.
Фиг. 2.7. Тепловой взрыв по Семе- Температура То сосуда пред-Н0ВУ- ставляет пограничный случай
между медленной реакцией и самовоспламенением. Прямая 2 теплоотвода в этом случае только касается кривой теплоприхода, и достаточно очень малого изменения температуры сосуда в ту или иную сторону, чтобы произошел или взрыв, или тихая беспламенная реакция. Эта температура То и будет, очевидно, минимальной температурой, приводящей к взрыву
при данном давлении р0 газа.
Математическую связь между минимальной температурой и давлением находят следующим расчетом.
Если в газовой фазе протекает реакция со скоростью w, измеряемой числом молекул продукта, появляющихся в 1 сек. в единице объема, то количество тепла, ежесекундно выделяемого во всем объеме v сосуда, равно
(2.16)
Здесь Q —теплота, выделяемая при образовании 1 г-мол продукта; N — число Авогадро.
Скорость реакции как функция температуры Т и числа молекул исходного вещества в единице объема а в начальной стадии равна: для мономолекулярных реакций
w1 — Blae~EIKT’,
§ 3. Самоускоряющиеся химические реакции
53
для бимолекулярных реакций
w2=B2a2e-E^T.
Считая в первом приближении, что температура газа во всех точках внутри сосуда одинакова и отвод тепла во вне обусловлен теплопередачей от газа к стенкам сосуда, можно определить количество тепла <?2, отводимое в 1 сек. из реакционного пространства:
q2 = а (Т— Го) S. (2.17)
Здесь а — коэффициент теплопередачи;
Т — температура реагирующего газа;
То— температура стенок сосуда, равная температуре внешней среды;
S — поверхность сосуда.
Зависимость (2. 17) выразится прямой линией, одинаковой для разных давлений, если считать, что а не зависит от давления.
Как видно из фиг. 2.7, если температура сосуда равна То, то кривая теплоприхода касается прямой теплоотвода. Математически условие касания можно записать как равенство в точке касания ординат кривой и прямой и их производных:
1г=г,~^21г=г,’ (2-^8)
. (2.19)
ат |r=rJ dT |г=г,
Подставив выражения для ql и <?2 в уравнения (2.18) и (2. 19), получим для мономолекулярной реакции
= а (у’2 _ то) 5; (2. 18а)
_^__e-r/«rs==a5. (2.19а)
В эти уравнения, кроме известной температуры То, входит температура Т%, соответствующая точке касания, которую при обычной постановке опыта мы непосредственно не определяем.
Более детальным анализом Семенов показал, что при тех значениях энергии активации и температуры самовоспламенения, которые характеризуют взрывы газовых смесей, Т2 очень близка к Тй. Поэтому полагаем в знаменателе уравнения (2.19а) 7'|=аТо; в показательной функции (е~Е1КГ) учет того, что 7’2>7’0, приводит к появлению перед этой функцией множителя е.
Таким образом, условие самовоспламенения получим в виде
— \ (2.20)
NRT'faS
54
Гл, II. Медленное химическое превращение ВВ
Число молекул а в единице объема связано с давлением р следующим соотношением;
aRT дин
'"n см2
10~6 мегабар— 10 6 750 мм рт. ст.,
где 7? = 8,314 • 107 эрг!град и (V = 6,023 • 1023.
Отсюда давление, выраженное в миллиметрах ртутного столба,
откуда
р^аТ-Ю"19, rz^^-1019.
т
(2.21)
Подставляя выражение (2.21) в (2.20), получим связь между давлением р0 газа и минимальной температурой самовоспламенения:
Qt>Bpo£e-.lO19. Е!пта _ j (2. 22) NRT^S ’ v ’
ИЛИ JQ_— eE/RTa 73 QvBEe-lW
откуда . Po Elge 1 < . NRaS 5 T30 R To QvBEeAW ’
или + (2.23) 7о Jo
где A=^-^=Q,217E~, R B = -NRaS & QvBEe-lW
Для бимолекулярной реакции аналогичным выводом получаем
= (2.24)
' 0
где Д=0,11£’.
Так как возможны различные механизмы самоускорения реакции до взрыва, то при исследовании конкретной системы необходимо установить, какой именно механизм является для нее определяющим. То обстоятельство, что найденные при опыте значения минимального давления и абсолютной температуры самовоспламенения удовлетворяют соотношениям (2.23) или (2.24), еще не может служить безусловным доказательством тепловой природы самовоспламенения данной системы. Как показывает более подробное рассмотрение, и в случае самоускорения реакции по другим механизмам (цепному, автокаталитическому, см.
§ 3. Самоускоряющиеся химические реакции
55
ниже) получается такая же или близкая к ней зависимость между минимальным давлением и начальной температурой, необходимой для самовоспламенения.
При тепловом самовоспламенении минимальное давление должно зависеть от диаметра сосуда, так как с уменьшением диаметра отношение поверхности сосуда к объему, а следовательно, и отношение теплоотвода к теплоприходу возрастают. Однако и эта зависимость не является характерной только для теплового самовоспламенения. Как мы увидим ниже, уменьшение диаметра и при цепном развитии реакции может привести к уменьшению ее скорости, хотя и по другой причине.
Единственным надежным путем установления теплового механизма самовоспламенения для данной реакции, по Семенову, является следующий. Нужно изучить кинетику медленной реакции и определить коэффициент теплоотдачи при разных давлениях и температурах. Подставив полученные зависимости в уравнение
р Л
1g ~fn ~~=: + В, 7 о 7 о
можно определить значения А к В. Если эти значения совпадут со значениями, полученными при непосредственных взрывных опытах, то это указывает на реальность теплового механизма самовоспламенения для данного случая.
Тепловой механизм установлен для самовоспламенения ряда газов и газовых смесей при нагреве (азометан, метилнитрат, закись азота, сероводород с кислородом). В этих случаях выполняется зависимость
р А
1g “ у' + В
7о 7 о
и значения А и В, найденные при опытах со взрывом, хорошо согласуются с вычисленными по кинетическим данным для медленной реакции.
О степени этого соответствия можно судить, сопоставляя минимальные температуры самовоспламенения, полученные расчетным и опытным путем (табл. 2. 2).
Таблица 2.2
Расчетные и наблюденные температуры самовоспламенения азометана, метнлнитрата, смеси сероводорода с кислородом и закиси азота
Азометан (CHaloNa — C2HgN2
р мм рт. ст. 18 22,5 28 31 38 55 67 102 191
^расч ° К 656 653 649 647 644 638 635 629 619
Гиабл ° к 659 651,2 644,9 643,4 636,4 630,7 626,3 620 614
Метилнитрат 2CH3ONO3-. СН3ОН + СН2О + 2NO2
р мм рт. ст. 4,2 5,5 8,5 12, 16,5 33,5 45,4 87,0 107,0 163,0
^"расч ° К 590 586 578 572 566 556 551 541 538 531
^набл °К 597 584 567 553 546 534 529 522,5 521 519,5
56
Гл. 11. Медленное химическое превращение ВВ
Смесь сероводорода с кислородом 2H2S + ЗО2-* - 2Н2О + 2SO2
Робт мм рт. ст. 244 400 745
Рн3з мм 98 160 298
т*я ° к 544 523 499
^набл ° К 578 552 525
Продолжение табл. 2.2
Закись азота 2N2O-* 2N2 + О2
р мм рт. ст. 170 330 590
^расч ° К 1255 1175 1110
^набл ° К 1285 1195 1100
При впуске газа в сосуд самовоспламенение происходит с некоторой задержкой. Для газов, приведенных в табл. 2.2, было установлено, что величины этой задержки при разных температурах и давлениях согласуются с тепловой теорией.
2. Тепловое самоускорение реакции в конденсированных ВВ
При рассмотрении теплового самовоспламенения в газах предполагалось, что передача тепла происходит только путем конвекции. Для твердых веществ, а в известной степени также и для жидкостей это предположение неприменимо.
Франк-Каменецким рассмотрено тепловое самоускорение реакции и самовоспламенение в случае, когда тепло передается только путем теплопроводности. Уравнение теплового баланса для стационарного состояния бесконечно протяженного плоского слоя В В толщиной 2d при температуре окружающей среды Т° К имеет вид
+ (2.25)
\dx2 ]
где х— координата, отсчитываемая от плоскости симметрии слоя; т] — теплопроводность;
q — теплота реакции на единицу объема ВВ;
О — разность температур ВВ и окружающей среды.
На поверхности слоя, т. е. при x~±d, эта разность принимается равной нулю. В середине слоя, т. е. при х = 0, величина 0 имеет наибольшее значение.
Франк-Каменецкий показал, что устойчивое равновесие между теплоприходом и теплоотводом становится невозможным при условии, если безразмерный параметр
^(-L\Be-Ei^ — >Q,88. (2.26)
\ V] J ЦТ2
§ 3. Самоускоряющиеся химические реакции
57
Для цилиндра критическое значение этого параметра составляет 2,00; для шара 3,32.
Для твердых ВВ соотношения (2.26) приложимы непосредственно; в жидких ВВ теплопередача осуществляется частично конвекцией, относительная роль которой зависит от вязкости, а также от размешивания жидкости пузырьками выделяющихся газов. Соответственно увеличению эффективного коэффициента теплопередачи критическое значение параметра Франк-Каменецкого будет в этом случае больше, чем при передаче тепла только теплопроводностью.
Проверка этих представлений была проведена Ридилом и Робертсоном на примере нитроклетчатки, гексогена и тэна. Слой нитроклетчатки толщиной 0,5 леи между двумя медными пластинками воспламеняется, начиная с 213°. Принимая на основании данных по теплоте и скорости медленного разложения нитроклетчатки скорость тепловыделения при 213° равной 8,25 кал/см.3 сек, энергию активации 47 000 кал/мол и положив п=3- 1(Н кал/см сек град, получаем параметр Франк-Каменецкого равным 1,7, т. е. только вдвое больше теоретического значения. Это может быть обусловлено неточностью некоторых данных, использованных для расчета.
Для слоя гексогена толщиной 0,4 мм температура вспышки составила при атмосферном давлении 260°. Если принять константу скорости распада =1018’se“47 5OO|,f?7'1 теплоту реакции (по составу продуктов распада) равной 191 ккал/мол, или 1000 кал/см3, плотность 1,2 г/см3 (с учетом наличия пузырьков) и значение т] равным теплопроводности жидкого ВВ (3-10-4 кал/см сек град), то критический параметр будет равен 12, т. е. значительно больше теоретической величины. Таким образом, следует допустить, что за счет конвекции и размешивания скорость передачи тепла увеличивается в 13 раз по сравнению со скоростью передачи теплопроводностью.
Для тэна аналогичный опыт при толщине слоя 0,13 мм дал температуру вспышки 240°; при теплоте реакции 74 ккал/мол это дает значение критического параметра, равное 2,2, т. е. еще ближе к теоретическому, чем для гексогена.
Таким образом, экспериментальные данные по самовоспламенению некоторых конденсированных ВВ при нагреве в общем удовлетворительно согласуются с теорией теплового взрыва.
3. Автокаталитическое ускорение реакции (автокаталитический взрыв)
Как известно, катализатором называют вещество, изменяющее скорость реакции, но остающееся после реакции в том же количестве, что и до нее.
Наиболее простое и общее объяснение гомогенного катализа заключается в том, что катализатор вступает с катализируемым веществом в промежуточные реакции, которые протекают значительно быстрее некатализируемой реакции. Если вещество X катализирует реакцию А-^В, то течение реакции в присутствии катализатора можно представить как совокупность двух последовательных реакций:
А+Х-уАХ и АХ-^ В + Х,
58
Гл. II. Медленное химическое превращение ВВ
Фиг. 2. 8. Изменение скорости автокаталитической реакций во времени.
\ К; \К>
кривые: 1) =0; 2) — =1;
/Л] /Л]
идущих с меньшими энергиями активации, чем некатализированная реакция. Во многих случаях ничтожные концентрации катализатора вызывают весьма значительное изменение скорости реакции.
Если катализатор является продуктом реакции, конечным или промежуточным, то такую реакцию называют автокаталитической. Скорость реакции в этом случае увеличивается по мере ее течения в результате накопления катализатора, проходит через максимум и начинает понижаться вследствие уменьшения количества исходного вещества, когда влияние этого уменьшения уже не компенсируется ростом концентрации катализатора. Величина скорости на максимуме зависит от соотношения констант скорости. Если первичная реакция является мономолекулярной и константа ее К\, а скорость автокаталитической реакции пропорциональна концентрации продуктов реакции в первой степени и константа ее ЛЧ, то при различных отношениях К.2 к К\ кривые изменения скорости цо времени имеют вид, приведенный на фиг. 2. 8.
Когда автокаталитическая реакция протекает в твердой фазе, течение ее отличается некоторыми особенностями, обусловленными неподвижностью твердых продуктов, катализирующих процесс. Процесс в этом случае подчиняется или общим зависимостям, свойственным цепным реакциям, или специфичным закономерностям (топохимические реакции), которые будут рассмотрены в следующем разделе этого параграфа.
автокатализ конечными продук
тами.
При гомогенном автокатализе в жидкой фазе суммарную скорость реакции w можно представить в виде
W — Wi-]-W2,
Рассмотрим гомогенный
где to’i—скорость реакции, не зависящей от концентрации катализатора, например мономолекулярной;
©2— скорость автокаталитической реакции.
В простейшем случае скорость автокаталитической реакции пропорциональна первой степени концентрации автокатализатора.
$ 3. Самоускоряющиеся химические реакции
59
Если общее количество жидкой фазы в ходе процесса не изменяется и концентрация катализатора х пропорциональна образовавшемуся его количеству, то для этого случая можно написать
^-^К^а-х^К^а-х). (2.27)
Из соотношения (2. 27) видно, что если речь идет о небольших изменениях доли распавшегося вещества, когда уменьшением (а—х) можно пренебречь, и катализатор обладает большой эффективностью, то скорость распада приближенно определяется соотношением
а ее зависимость от времени — показательным уравнением
— extt dt
Напротив, если распад протекает при большой концентрации катализатора, то скорость распада будет падать по мономолекулярному закону, но константа ее — есть константа каталитической реакции.
Из выражения (2.27) легко получим
(2.27а)
G4 \ t\ 2 /
Обозначая отношение констант скорости мономолекуляриой и автокаталитической реакции KJKi через К, из (2. 27а) после интегрирования получим
— in — /f (а 4-/С)= const. (2.28)
t К (а — х)
Определим время, по истечении которого скорость автокаталитической реакции достигает максимума. Для этого дифференцируем выражение (2.27) по t и приравниваем производную нулю:
-^-= [К. (а - 2х) - KJ ^0. (2.29)
Г- ат.
Отсюда для максимума скорости
AT2(rz —2х) — — 0, или а— К
X— ------.
2
Подставляя это значение х в выражение (2.28), получим выражение для /шзх — времени достижения максимума скорости:
= ----— In--. (2.30)
/<2 «-(-/< /<
60
Гл. II. Медленное химическое превращение ВВ
Второй и третий множители слабо по сравнению с первым зависят от температуры. Поэтому приближенно приняв их постоянными и положив К‘2 — К.ое~Е1ПТ> получим
или
где
---к__)пЛ
Ко а + К К
ln/ = ~—— 4-5,
КТ
(2.31)
5 = in
1 1 , а \
------------1 п I
Ко а 4- К К)
Таким образом, при гомогенном автокатализе конечными продуктами логарифм времени достижения максимальной скорости линейно связан с обратной абсолютной температурой. Время достижения максимальной скорости превращения можно определить экспериментально по близкому к нему времени задержки самовоспламенения. Соотношение (2.31) позволяет по зависимости задержки вспышки от температуры приближенно определить энергию активации автокаталитической реакции.
Следует указать, что сама по себе линейная зависимость между логарифмом задержки вспышки и обратной абсолютной температурой не является еще доказательством того, что самовоспламенение имеет автокаталитическую природу.
Известное внешнее сходство с автокаталитическим течением процесса наблюдается в некоторых условиях протекания последовательных реакций. Как пример рассмотрим простейший случай: превращение вещества А в конечный продукт С происходит в результате двух последовательных необратимых моно-молекулярных реакций
Пусть начальное количество вещества А равно а молей, количество прореагировавшего вещества А к моменту времени t равно х. Тогда зависимость количества непрореагировавшего вещества от времени выразится соотношением мономоле, кулярной реакции
а — х — ae~Kit. (2. 32)
Обозначив количество конечного продукта в момент времени I через у, получим количество промежуточного продукта в этот момент х—у и скорость образования конечного продукта равной
— = К2(х — у), at
После интегрирования получим
у =«
1
^2 „-KJ , -АГ,/
К2 — Ki " К2-К1
(2.33)
(2.34)
На фиг. 2.9 показано изменение во времени количеств исходного вещества А (кривая 1), промежуточного продукта В (кривая 2) и конечного продукта С (кривая 3].
§ 3. Самоускоряющиеся химические реакции
61
Количество промежуточного продукта, равное вначале нулю, увеличивается со временем, проходит через максимум и уменьшается до нуля. Количество ко-
нечного продукта увеличивается, как и при автокаталитической реакции, вначале все быстрее и быстрее, соответственно накоплению промежуточного продукта; в момент, когда количество промежуточного продукта проходит через максимум, на кривой 5 наблюдается перегиб, соответствующий максимуму скорости образования конечного продукта.
При определенных соотношениях и абсолютных значениях обеих констант может наблюдаться также и индукционный период: скорость образования конечного продукта длительное время остается очень малой, в особенности, когда процесс включает несколько ступеней.
При формальном сходстве протекания последовательные и автокаталитические реакции можно различить разными методами, в частности, выделив промежуточный продукт и установив, ускоряет ли он распад исходного вещества. Отсутствие ускорения исключает автокатализ.
Фиг. 2.9, Изменение количеств исходного вещества (/), промежуточного (2) и конечного (5) продуктов при последовательных реакциях.
4. Цепное самоускорение реакции (цепной взрыв)
Общие представления теории цепных реакций
Теория цепных реакций имеет свои истоки в работах А. Н. Баха (1897 г.) и Н. А. Шилова (1905 г.). Основное развитие эта теория получила за последние десятилетия в первую очередь в работах акад. Н. Н. Семенова и его школы, особенно в приложении к газовым взрывам.
Сущность цепной теории заключается в следующем.
По теории Аррениуса скорость реакции однозначно определяется числом молекул, обладающих энергией, равной или превосходящей энергию активации. Это число активных молекул определяется Максвелл-Больцмановским распределением, соответствующим данной температуре. Однако необходимо учесть, что при каждой элементарной реакции выделяется энергия, равная E + Q (Е — энергия активации, Q — теплота реакции). Непосредственно после прохождения элементарной реакции выделившаяся энергия сосредоточена в сравнительно небольшом числе частиц ее продуктов. Такие частицы при столкновении с нормальными молекулами могут за счет своей большой энергии активировать их или даже вступить с ними в реакцию, которая в свою очередь создает новые активные молекулы и т. д. Таким образом, сама реакция будет создавать активные молекулы, причем в некоторых случаях число их может стать значительно больше числа активных молекул, возникающих в результате Максвелл-Больцмановского распределения энергии. Другими словами, одна первичная элементарная реакция может создать цепь вызывающих друг друга реакций. Длина цепи (т. е.
62
Гл. II. Медленное химическое превращение ВВ
число элементарных реакций в ней) может быть очень велика. В этом случае общая скорость реакции определится не столько числом активных молекул, возникающих в результате Максвелл-Больцмановского распределения, сколько условиями развития цепей.
Таким образом, цепными называются такие реакции, при которых имеет место регенерация активных частиц.
Существенным для цепной теории является вопрос о том, какой тип активных частиц определяет возможность возникновения длинных цепей реакции. В обычных условиях относительно медленного течения реакций активация за счет избыточной кинетической энергии частиц не может дать цепей заметной длины, так как такая энергия быстро рассеивается при столкновениях. То же относится и к энергии возбуждения. Напротив, частицы, активные за счет химической энергии (атомы, свободные радикалы), не могут, как правило, отдавать при столкновениях с любой частицей избыточную энергию, содержащуюся в них в скрытом виде, и поэтому легко сохраняют ее до встречи с той частицей, с которой они способны реагировать.
Продукт взаимодействия радикала с валентнонасыщенной молекулой неизбежно представляет собой радикал. Таким образом, свободная валентность, которую имела частица, вступающая в реакцию, не исчезает, а сохраняется в одной из частиц продуктов реакции, т. е. регенерируется при реакции.
Новый радикал опять вступает в реакцию, вновь приводящую к образованию радикала, обычно того же, с которого началась цепь, и цикл реакций вновь повторяется.
Исчезновение радикалов (обрыв цепи) может произойти вследствие соединения их друг с другом, сопровождающегося взаимным насыщением валентностей, что возможно лишь при некоторых особых условиях, характеризующихся обычно гораздо меньшей вероятностью, чем продолжение цепи (эти условия будут рассмотрены ниже).
В силу этих свойств радикалы и свободные атомы являются по Семенову основным типом активных частиц в цепных реакциях.
Исторически представление о цепях возникло для объяснения аномально больших квантовых выходов некоторых фотохимических реакций. Известно, что световая энергия поглощается отдельными порциями — квантами. Поэтому естественно было ожидать, что число молекул, прореагировавших при фотохимической реакции, будет равно числу поглощенных квантов света, т. е. квантовый выход (отношение числа прореапгровавших молекул к числу поглощенных квантов) будет равен единице.
Оказалось, однако, что лишь в очень немногих случаях квантовый выход равен единице. Происходит это потому, что продукты первичной реакции вступают во вторичные реакции. Иногда эти вторичные реакции легко учесть. Например, в случае фотохимического распада йодистого водорода квантовый выход равен двум. Конечные продукты при распаде йодистого водорода— иод и водород. Поглотившая квант света молекула HJ распадается на Н и J. Атом водорода реагирует с другой невозбужденной молекулой йодистого водорода
H+HJ=H2+J.
$ 3. Самоускоряющиеся химические реакции
63
Атомы иода, соединяясь, образуют молекулу иода. Таким образом, каждый поглощенный квант вызывает распад двух молекул.
Однако для некоторых фотохимических реакций квантовый выход необычайно велик, достигая миллиона молекул на квант. Классическим примером такой реакции является фотохимическое соединение хлора с водородом с квантовым выходом около 10s. Для объяснения аномально большого квантового выхода и была предложена цепная схема реакции.
Первичной реакцией возникновения цепи является распад молекулы хлора на атомы при поглощении кванта света:
Cl2+hv = Cl+Cl. (а)
Атом хлора реагирует с молекулой водорода, образуя атом водорода п молекулу НС1:
С1+Н2 = НС1+Н. (б)
Атом водорода, образовавшийся при реакции (б), реагирует с молекулой хлора, регенерируя атом хлора и т. д.:
Н+С1-=НС1+С1. (в)
Таким образом, образование одного атома хлора вызывает целый ряд реакций, который прекращается лишь тогда, когда в результате рекомбинации или реакции с примесью исчезнет атом водорода или хлора.
Различные элементы рассмотренной цепной схемы данной реакции были подтверждены экспериментом. Большой квантовый выход реакции образования НС1 является естественным следствием цепного механизма реакции.
Цепная теория позволила дать правильное толкование также многим случаям положительного и особенно отрицательного катализа, когда ничтожнейшие, иногда неизмеримо малые количества примесей оказывают сильнейшее влияние на скорость реакции. Если положительный катализ еще можно понять, допустив, что реагирующие молекулы одна за другой попадают на катализатор, то гораздо труднее понять отрицательный катализ, когда ничтожная примесь катализатора может почти полностью прекратить реакцию, идущую в его отсутствии со значительной скоростью. Радиус действия силового поля молекулы имеет порядок ее диаметра, тем не менее присутствие молекулы отрицательного катализатора влияет на частицы, находящиеся от нее на гораздо больших расстояниях.
В качестве примеров можно назвать сильное снижение температуры воспламенения многих газовых смесей (водород с кислородом, окись углерода с кислородом, метан с кислородом и воздухом и др.) при добавке ничтожных количеств (0,05%) двуокиси азота, противоположное влияние примесей металлоорганических соединений, ускоряющее и тормозящее влияние различных примесей в процессах полимеризации и др.
Так, примесь кислорода уже в количестве 0,lfl/o сильно тормозит фотохимическую реакцию взаимодействия водорода и хлора. Пары иода, притом в еще меньших концентрациях, сильно тормозят окисление водорода кислородом. Тот же иод ускоряет разложение ряда органических соединений. Примесь малых количеств перекисей резко ускоряет окисление углеводородов. Примесь азометана на 200° снижает температуру разложения ацетальдегида. Добавка 1% муравьиной кислоты снижает температуру самовоспламенения метано-воздушной смеси с 590 до 320°; так же действуют аммиак, этилгидроперекись, диазометан к др_. Напротив, бромпроизводные углеводородов, а также взвеси некоторых солей сильно тормозят возникновение и распространение пламени в данной смеси.
64
Гл. II. Медленное химическое превращение ВВ
Цепная теория объясняет эти явления следующим образом: положительный катализатор — это вещество, создающее начальные центры цепи.
Для объяснения отрицательного катализа достаточно допустить, что реакция, на скорость которой влияет катализатор, цепная. Отрицательный катализатор тем или иным образом дезактивирует одну из частиц — участников цепи, предотвращая все те реакции, которые имели бы место при продолжении данной цепи. Если цепь очень длинная, то одна молекула отрицательного катализатора может таким образом уменьшить число реагирующих молекул на сотни и тысячи.
Наконец, на основе цепной теории получила объяснение еще одна большая группа фактов, противоречащих теории Аррениуса,— явление верхнего и нижнего пределов давления при самовоспламенении многих газовых смесей в области малых давлений.
По теории Аррениуса, с повышением давления скорость газовой реакции должна монотонно увеличиваться. Фактически же, если впускать способную к воспламенению газовую смесь в нагретый эвакуированный сосуд при очень низком давлении (миллиметры ртутного столба) и от опыта к опыту повышать это давление, то можно наблюдать явления пределов: при некотором давлении нельзя еще обнаружить никаких признаков реакции, а при незначительном повышении давления уже наблюдается самовоспламенение.
Давление, при котором происходит переход от крайне малой скорости реакции к самовоспламенению, называют нижним пределом цепногб взрыва по давлению.
С дальнейшим повышением давления выше известного предела наблюдается резкое уменьшение скорости реакции, проявляющееся в прекращении вспышки. Давление, при котором это происходит, называется верхним пределом цепного взрыва по давлению.
Прежде чем перейти к объяснению явлений верхнего и нижнего пределов, остановимся на условиях возникновения и обрыва цепей,
а также их разветвления.
Возникновение цепей, т. е. образование начальных центров цепи, может происходить разными путями. Каждая молекула, получившая энергию, равную или превышающую энергию активации, может начать цепь реакций. Активация молекулы может произойти за счет перераспределения энергии при соударениях или в результате действия внешнего агента (например, света, удара электрона, а-частицы и др.).
Сложнее вопрос о механизме обрыва цепи. В рассмотренной выше цепной реакции водорода с хлором активными центрами являются атомы Н и С1. Казалось бы, обрыв цепи возможен по СХеме СН-С1 = С12
или
Н4-Н=Н,.
$ 3. Самоускоряющиеся химические реакции
65
Легко убедиться, однако, что такая рекомбинация атомов чрезвычайно мало вероятна. Для того чтобы из молекулы образовались два атома, она должна получить энергию, равную или превышающую энергию диссоциации. Эта энергия в потенциальном виде содержится в образовавшихся свободных атомах. Представим себе, что такие атомы встретились и соединились в молекулу. Очевидно, что энергия колебаний атомов в полученной молекуле будет равна или больше энергии диссоциации. Такая молекула не может существовать — она немедленно вновь распадется на атомы.
Соединение атомов в молекулу возможно в следующих случаях. Допустим, что одновременно сталкиваются два атома и третья (безразлично какая) частица А. Кинетическая энергия, которая создается за счет потенциальной при сближении атомов и мешает им соединиться, передается частично молекуле А. В этом случае атомы разойтись не могут и образуют молекулу
С14-С14-Д = С134-А
Стрелки над CU и А показывают, что обе молекулы обладают после столкновения значительно возросшей кинетической энергией, так как теплота ассоциации, выделившаяся при реакции, перейдет именно в кинетическую энергию образовавшейся молекулы и третьей частицы.
Сказанное относится и к рекомбинации радикалов, по крайней мере таких, которые состоят из малого числа атомов, например СНз. Если радикалы состоят из большого числа атомов, то рекомбинация может произойти и при двойном соударении, без участия третьей частицы. В этом случае избыточная энергия, выделяющаяся при рекомбинации, распределяется по многим связям и оказывается недостаточной, чтобы разорвать одну из них.
При низких давлениях число тройных ударов очень мало и скорость рекомбинации атомов в объеме поэтому также мала. В этих условиях рекомбинация атомов или радикалов происходит на стенке. Твердая стенка, особенно металлическая, очень хорошо адсорбирует свободные атомы и радикалы. Можно считать, что практически вся поверхность твердого тела покрыта ими. Поэтому, когда атом или радикал, находящийся в объеме, попадает на стенку, он обычно встречается с другим атомом или радикалом, адсорбированным на поверхности, и легко с ним соединяется, так как любая ближайшая молекула вещества стенки может сыграть роль третьей частицы А. Таким образом, обрыв цепи происходит или на стенке, или при тройном соударении в объеме.
Зависимость скорости цепной реакции от времени
Цепная реакция, в которой имеют место только два процесса — продолжение и обрыв цепей, отличается от нецепной реакции в двух отношениях. Во-первых, скорость цепной реакции (чис
66
Гл. II. Медленное химическое превращение ВВ
ло молекул, реагирующих в единицу времени) больше, чем это соответствует числу активных частиц, возникающих в единицу времени по Максвеллу — Больцману, так как каждая активная частица вызывает цепь реакций. Во-вторых, скорость реакции в начальной стадии повышается со временем, стремясь к своему максимальному значению. В начальный момент времени скорость реакции определяется, очевидно, числом образующихся по Максвеллу — Больцману активных частиц; по мере развития цепей число их, т. е. скорость реакции, быстро увеличивается и достигает постоянного значения; при этом число обрывающихся цепей становится равным числу возникающих цепей.
Однако при цепных процессах могут происходить не только реакции продолжения цепи, при которых образуется столько же активных частиц, сколько их вступает в реакцию, и реакции обрыва, при которых активные центры превращаются в стабильные молекулы. Может также иметь место разветвление цепи, когда реакция, в которую вступает одна активная частица, приводит к появлению большего числа активных частиц, т. е. одна цепь на некотором звене дает начало новым цепям.
За счет этого разветвления, если оно получает значительное развитие, может совершенно измениться характер реакции; из реакции обычного типа со скоростью, падающей во времени вследствие уменьшения концентраций реагентов, она становится самоускоряю-щейся. Это происходит тогда, когда разветвление столь значительно, что оно не только компенсирует обрыв цепей и убыль концентрации реагентов, но и приводит к непрерывному увеличению числа активных частиц. Для простейшего случая, когда мы не учитываем изменение концентраций исходных реагентов во времени, указанное условие выполняется, если разветвление происходит чаще, чем обрыв цепи. Е этом случае число возникающих активных частиц в любой момент времени будет больше, чем число исчезающих вследствие обрыва, и поэтому число цепей, т. е. скорость реакции, будет непрерывно расти. Это и есть условие возникновения цепного взрыва (вспышки).
Напишем в общем случае выражение для изменения концентрации ведущих активных частиц, определяющих скорость наиболее медленного звена цепного процесса, а следовательно, и всего процесса в целом, в следующем виде:
+ (2.35)
* Если реакции разветвления и обрыва происходят по схемам
n+Mi -> и
п+М2 -*
(здесь п — ведущий радикал; Мх и Mi— другие участники реакций} и константы скорости этих реакций соответственно 7<i и то f—Ki[Mi] и g=K.z[Mz].
§ 3. Самоускоряющиеся химические реакции
67
где п — концентрация ведущих активных частиц;
fug — кинетические коэффициенты* реакций разветвления и обрыва цепей (отношения скоростей соответствующих реакций к концентрации ведущего радикала);
Wo— концентрация активных частиц, образующихся в единицу времени за счет Максвелл — Больцмановского распределения энергии.
Интегрируя и полагая, что п = 0 при /—0, получим
(2.36)
g — f
Скорость реакции w равна произведению кинетического коэффициента а, характеризующего реакцию продолжения цепи, на концентрацию п активных центров:
w — an.
Когда f<jg, т. е. разветвлений значительно меньше, чем обрывов, то уже при небольших значениях t последним членом выражения (2.36) можно пренебречь и написать
/г=—(2.37) g — f
и
g— f
Изменение скорости реакции со временем в случае f <g соответствует кривой 1 на фиг. 2. 10.
Если f=g, то
dnldt=wo,
откуда
п—wot. (2.38)
Скорость реакции w = an=awot будет линейно увеличиваться со временем (фиг. 2. 10, кривая 2).
Если f^>g, то интеграл уравнения (2. 35) имеет вид
п=_Ло_(е(7-^-1), (2.39)
f—g
а скорость реакции
^=“^-(^7-^-1), (2.40)
или, для не слишком малых I, когда
ш=Ае*‘, (2.41)
где
А = а^..-f—g ’
68
Гл. II. Медленное химическое превращение ВВ
Таким образом, если f>g, то скорость процесса неограниченно увеличивается со временем по показательному закону (фиг. 2.10, кривая 5). При этом чем больше разность f—g, тем быстрее увеличивается скорость. Условие и представляет собой условие ВОЗ-
Фиг. 2.10. Изменение скорости цепной реакции во времени.
никновения цепного взрыва.
Из уравнения (2.41) формально следует, что при /->оо скорость реакции становится бесконечной; физически это, конечно, не так: наряду с увеличением концентрации активных частиц быстро уменьшается источник этих частиц — исходные вещества. Повышение скорости реакции замедляется, она проходит через максимум с последующим понижением. Однако максимум может быть очень велик и может соответствовать прохождению практически всей реакции в малые доли секунды, что мы и называем цепным взры-
вом.
Границей между цепной реакцией с конечной скоростью и цепным взрывом является, как видно, равенство скоростей разветвления и обрыва цепей. Когда скорость появления активных частиц становится больше скорости обрыва цепей, наблюдается переход от медленной цепной реакции к вспышке.
Объяснение нижнего и верхнего пределов цепного взрыва по давлению
Явление пределов рассмотрим на примере смеси водорода и кис-
лорода.
На фиг. 2. 11 показано изменение скорости реакции w в зависи-
мости от давления. Здесь р\— нижний предел цепного взрыва по давлению, р2— верхний предел. Цепной взрыв наблюдается в заштрихованной области давлений — между pi и р2.
Отсутствие реакции при давлении ниже pi объясняется следующим образом.
Длина цепи при малых давлениях мала потому, что велика вероятность обрыва, который в данных условиях происходит практически только на стенке, так как в объеме
Цадление р
Фиг. 2.11. Зависимость скорости взаимодействия водорода с кислородом от давления.
§ 3. Самоускоряющиеся химические реакции
69
число тройных соударений по сравнению с числом двойных будет ничтожно мало. При малом давлении длина свободного пробега велика и цепь, возникшая в объеме, быстро, через несколько звеньев, попадает на стенку, где и обрывается. Если скорость возникновения начальных центров мала, то при коротких цепях скорость реакции может быть столь низкой, что ее нельзя обнаружить обычными методами.
По мере увеличения давления скорость обрыва цепей на стенке уменьшается или остается постоянной, а скорость разветвления цепей повышается пропорционально давлению. Поэтому эффективная длина цепи увеличивается сначала очень медленно, а затем, как показывают опыт и расчет, чрезвычайно резко. Достаточно изменить давление на доли миллиметра ртутного столба, чтобы практически незаметная реакция начала протекать с очень большой скоростью и приняла характер взрыва.
Правильность рассмотренного объяснения нижнего предела pi можно проверить следующими путями.
1. Чем больше диаметр сосуда, тем труднее цепи попасть на стенку и вспышка в сосуде большего диаметра должна быть возможна при меньшем давлении, т. е. нижний предел будет снижаться с увеличением диаметра сосуда. Такое влияние диаметра сосуда наблюдается в действительности.
2. Если при постоянном диаметре сосуда добавлять в него инертный газ, то попадание цепи на стенку затрудняется и при известных условиях длина цепи возрастает. Можно получить парадоксальное явление: впуск инертного газа в сосуд со смесью газов, способных к цепной реакции, скорость взаимодействия которых при температуре и давлении (p<pi) опыта практически равна нулю, вызовет вспышку. Другими словами, присутствие инертного газа будет снижать нижний предел (в данном случае под нижним пределом подразумевается парциальное давление смеси реагирующих газов); при этом влияние инертного газа будет тем больше, чем меньше его коэффициент диффузии, т. е. чем больше молекулярный вес. Такое влияние инертных газов подтверждается опытом.
3. Величина нижнего предела сильно зависит ог материала и состояния стенок сосуда. Это объясняется тем, что различные материалы в разной степени способны обрывать цепи. Так, стенки из металла или графита обрывают цепь при каждом попадании на них атома водорода. Напротив, для стеклянных стенок вероятность обрыва при попадании цепи на стенку очень мала, но сильно возрастает при промывании сосуда раствором хлористого калия.
Роль материала стенки при обрыве цепей наглядно иллюстрируется следующим опытом Налбандяна. Если в стеклянный сосуд со смесью водорода и кислорода при 440° С (нижний предел в этих условиях 0,94 мм) вставить тонкий металлический стержень, то нижний предел повышается до 7 мм. При быстром выдергивании стержня можно наблюдать интенсивную вспышку, сопровождающуюся выгоранием смеси до предела, отвечающего стеклянному сосуду без стержня.
Отметим, что стенки иногда могут выполнять функцию не только обрыва цепей, но и их инициирования.
Верхний предел согласно Семенову определяется следующим механизмом.
С повышением давления число тройных столкновений, ведущих к обрыву цепи в объеме, которое пропорционально кубу давления, возрастает сильнее, чем число двойных соударений, пропорциональное квадрату давления. При давлении, соответствующем верхнему
70
Гл. П. Медленное химическое превращение ВВ
пределу, скорость реакции обрыва цепей становится больше скорости реакции разветвления. В результате при давлениях больше р2 самовоспламенения не происходит.
Это объяснение находится в согласии со следующими опытными данными: 1) верхний предел не зависит от диаметра сосуда;
2) примесь инертного газа снижает верхний предел;
3) от состояния стенок и его случайных изменений верхний предел, в противоположность нижиему, не зависит.
Фиг. 2. 12. Области медленной реакции и самовоспламенения водородо-кислородной смеси
Наряду с давлением на возникновение воспламенения влияет температура. На фиг. 2. 12 в координатах давление — температура приведены опытные данные для смеси водорода с кислородом. Справа от кривой ABCD находится область воспламенения, слева — медленной реакции. АВ — нижний предел, ВС — верхний предел. При температурах ниже ti воспламенения не наблюдается, Выше С воспламенение имеет место, причем интервал давления между верхним и нижним пределом тем шире, чем выше температура. Когда температура превышает t2, верхнего предела не наблюдается. Влияние температуры опре
деляется тем, что ее повышение увеличивает скорость реакции разветвления цепей и притом в большей степени, чем скорость реакции обрыва.
Механизм цепной реакции между водородом и кислородом
Для конкретизации изложенных выше общих представлений цепной теории рассмотрим химический механизм взаимодействия водорода с кислородом, протекающего в определенных условиях как сплошь разветвленная цепь.
На основании работ Семенова, Кондратьева, Воеводского, Налбандяна и других для этой реакции принимается следующий механизм: внутри области вспышки реакция должна следовать механизму разветвляющихся цепей. Общая схема такого процесса имеет вид
X+A — Y+Z,
где X, Y, Z — активные центры реакции;
А — молекула исходного вещества (Н2 или О2).
С этим процессом конкурируют процессы, обрывающие цепи и таким образом тормозящие развитие реакции.
Совокупность элементарных реакций имеет следующий вид:
I. Н2 + О2 = 2ОН
II. Н2 + Л1 = 2Я4-Л1
зарождение цепи.
III. О2 О2 = О -j- О3
§ 3. Самоускоряющиеся химические реакции
71
Здесь М — любая молекула.
IV. ОНН2 = Н2ОН продолжение цепи.
V. Н + О2 = ОН + О
VI. О + Н2 = ОН + н
разветвление цепи.
VII. Н стенка == '/2^2
VIII. ОН стенка = V2H2O2
обрыв цепей на стенке.
—->
IX. Н 4-О2 + М — НО2М обрыв цепей в объеме.
С последующими реакциями
X. НО2 стенка
’7sH2O2 4- V2O2.
1/2Н2О + з/4О2.
XI. НО2 + Н2 = Н2О2 4- Н I продолжение цепи через
XII. НО2 4~ Н2 = Н2О + ОН J малоактивный радикал НО2.
При воспламенении и горении в области между нижним и верхним пределом основную роль играют реакции разветвления цепи V и VI. Обрыв цепи идет главным образом на стенке по реакции VII.
При повышении давления увеличивается число тройных соударений, ведущих к обрыву цепи по реакции IX с образованием малоактивного радикала НОз, который разлагается на стенке по реакциям X.
Косвенным доказательством правильности рассмотренного механизма является совпадение получающихся теоретических закономерностей на пределах воспламенения и зависимостей индукционного периода (влияние размеров сосуда, материала стенок, состава смеси, примесей инертных газов и др.) с опытными данными. Для медленного окисления при давлениях выше верхнего предела значение отдельных реакций уже иное, чем в пламени.
Роль реакции V, протекающей, через двойные соударения, уменьшается по сравнению с реакцией IX. Концентрация атомарного водорода уменьшается потому, что реакция VI становится относительно редкой. Разветвления цепи начинают играть второстепенную роль, и вместо воспламенения происходит медленная реакция. Повышение общего давления затрудняет диффузию и гибель на стенке радикала НО?, который теперь может реагировать в объеме, в частности, по реакции XI (образование перекиси водорода при медленном окислении водорода в этой области давлений).
Концентрация гидроксила в зоне медленной реакции также гораздо ниже, чем в разреженных пламенах. Ведущей при достаточно больших давлениях (выше верхнего предела) становится последовательность реакций IX, XI и X.
Таким образом, одна и та же совокупность элементарных реакций определяет механизм и медленного окисления и воспламенения, но роль отдельных реакций в этих двух процессах существенно изменяется.
Прямым доказательством рассмотренного механизма медленного окисления и горения водорода явилось непосредственное обнаружение гипотетических промежуточных веществ и определение их концентрации.
В. Н. Кондратьевым и его учениками при помощи специальных спектроскопических методов была измерена абсолютная концентрация гидроксила в разреженных водородо-кислородных пламенах. Эта концентрация оказалась в тысячи раз больше концентрации гидроксила, которая могла бы установиться при температуре и давлении пламени за счет равновесия
н2о н 4- он.
Таким образом было установлено химическое (а не термическое) происхождение гидроксила в пламени и его активная роль в механизме окисления водорода.
72
Гл. II. Медленное химическое превращение ВВ
На основе принятого механизма процесса можно вычислить также концентрацию атомарного водорода. Такие расчеты дают парциальное давление атомов Н порядка 10% от общего давления. Столь высокие концентрации атомов Н облегчают задачу его непосредственного обнаружения. Однако в отличие от гидроксила спектроскопический метод здесь оказался неприменимым, так как линии поглощения атомов Н перекрываются интенсивной полосой поглощения водяного пара.
Кондратьев и Кондратьева решили эту задачу термоэлектрическим методом. В зону пламени водорода были введены две тонких термопары, защищенных от непосредственного воздействия пламени тонкостенными кварцевыми трубками. Кончик защитной трубки одной из термопар был покрыт ZnOCr2Os, защитная же трубка второй термопары промыта горячей азотной кислотой. Поверхность, покрытая ZnOCfaOs, оказывается чрезвычайно эффективной в отношении рекомбинации атомов Н. Выделяющееся при этом тепло разогревает термопару, что не имеет места для контрольной термопары так как поверхность кварца, промытого азотной кислотой, в отношении рекомбинации очень мало эффективна. Поэтому в присутствии атомов Н между обеими термопарами устанавливается определенная разность температуры Л Г, величина которой зависит от концентрации атомов. Результаты определения этой концентрации хорошо согласуются с теоретическим расчетом.
Цепные реакции с вырожденными разветвлениями (цепно-тепловое возникновение взрыва)
Скорость разветвляющейся цепной реакции согласно (2.41) экспоненциально увеличивается со временем.
Расчет показывает, что возрастание скорости при обычном разветвлении, связанном с реакциями свободных радикалов, должно происходить сравнительно быстро. Между тем известны реакции, например окисление многих углеводородов, скорость которых возрастает по закону (2.41), но очень медленно, в течение минут, часов и даже дней. Для объяснения такого замедленного развития реакции Семенов допускает существование цепей с «вырожденными разветвлениями».
Развитие цепи в этом случае сопровождается образованием сравнительно устойчивого молекулярного промежуточного продукта. При превращении этого продукта образуются радикалы, т. е. происходит разветвление цепи. Однако скорость превращения гораздо меньше, чем скорость, с какой вступают в реакцию продукты радикального типа, и поэтому <р мало. Разветвление происходит, как правило, спустя значительное время после того, как цепь реакции, породившая молекулярные промежуточные продукты, развилась и оборвалась.
В качестве примера цепной реакции с вырожденными разветвлениями можно привести окисление метана, играющее важную роль в процессах воспламенения газа в шахтах (см. гл. X).
Согласно Семенову оно протекает следующим образом. При относительно высоких температурах первичным продуктом, определяющим вырожденное разветвление, является, по-видимому, формальдегид, реагирующий по уравнению
НСНО+СЧ- НСО+НО2—32 ккал.
§ 3. Самоускоряющиеся химические реакции
73
Энергию активации этой реакции можно приближенно принять равной ее тепловому эффекту.
Реакция первичного зарождения свободных радикалов из исходных веществ, например
СН.+О2-> СНз+НО2—55 ккал.
происходит значительно труднее.
В начале реакции, когда альдегидов еще мало, скорость реакции зарождения будет
55 000
®сн( = /<а[СН.}][О2]~ 10-ю е RT [СН4] [О2].
По мере накопления альдегидов радикалы начнут зарождаться по реакции
НСНО+Ог-*• НСО-рНОг—32 ккал со скоростью
32 000
®нсно = /<г[НСНО][О2]^10-10в [НСНО][О2].
Обозначив через а отношение
WHCHO = К, (НСНО] [О2] = [НСНО]
®сн4 Ка(СН4][О2] е [СН4] ’
найдем, что при Т = 700° К
а==107.15[НСНО1,
[СН4]
Это означает, что в исходной смеси метана с кислородом скорость зарождения первичных радикалов при 423° С будет в 14 000 раз меньше, чем в этой же смеси, содержащей 0,1°/о НСНО.
Таким образом, по мере хода реакции и накопления альдегида скорость процесса, вначале часто неизмеримо малая, самоускоряется вследствие развития реакции НСНО+Ог — НСО+НОа—32 ккал, что и определяет наблюдающийся период индукции, типичный для цепных реакций с вырожденными разветвлениями.
Реакции развития цепи окисления метана на начальной его стадии при температурах выше 300—350° С могут быть представлены следующей схемой:
а) СН4 + О2 -> СН3 + НО2
зарождение’цепи;
б) сн3+о2 -» сн2о + он
в) ОН + СН4-»СН3-|~Н2О
продолжение цепи;
г) СН2О + о2 -» нсо + но2 д) нсо + о2 -» со + но2 е) НОз 4* СН4 —> Н2О2 4“ СН3
вырожденное разветвление;
стенка ж) ОН --------
з) СН2О
стенка
обрыв цепи.
Последняя реакция учитывает возможность гетерогенного окисления формальдегида на стенках сосуда.
Приведенная схема не учитывает реакции между ведущими цепь радикалами и альдегидом (например, ОН+СН2О-» Н2О-}-НСО). Это положение справед-
74
Гл. II. Медленное химическое превращение В В
лнво лишь для самой начальной фазы превращения. По мере накопления в ходе превращения альдегида эти реакции начинают играть все более существенную роль, и, если рассматривать дальнейший ход превращения, то приведенную выше схему окисления метана необходимо было бы дополнить реакциями радикала ОН с альдегидом, а также реакциями НСО и НОа.
Развитие цепи при вырожденных разветвлениях может проходить весьма медленно. Зависимость скорости реакции от времени изображается (при постоянстве температуры) кривой, имеющей максимум (фиг. 2. 13), время
Фиг.
2. 13. Цепно-тепловой взрыв по Семенову.
достижения и абсолютная величина которого зависят от ряда условий. Реакция идет, са-моускоряясь, но вследствие медленности развития цепи максимум скорости наступает тогда, когда исходное вещество уже в большей или меньшей степени исчерпалось; в результате максимум оказывается относительно низким.
Допустим, однако, что при развитии реакции скорость ее достигнет такого значения, при
котором теплоприход становится больше теплоотдачи. Тогда
на медленное изотермическое ускорение цепной реакции накладывается быстрое тепловое ускорение. Сочетание обоих механизмов ускорения в определенных усло-
виях температуры и теплоотвода может привести к возникновению цепно-теплового взрыва (кривая 4). Цепные процессы типов, изображаемых кривыми 1, 2 и 3, Семенов называет вырожденными взрывами.
Условие взрыва можно сформулировать как достижение некоторой критической для данных условий опыта скорости реакции, соответствующей превышению теплоприхода над теплоотводом:
щ=Ае?‘=wK = const, пли приближенно
<pr=const, (2.42)
где т—время от впуска газа в сосуд до возникновения взрыва. Так как
<р — Се~Е^т, то
Ce~EiRrz~ const
и
- — const еЕЩТ С
§ 3. Самоускоряющиеся химические реакции
75
ИЛИ
откуда
1П? = АХ + 1П£. (2.43)
Таким образом, и при цепно-тепловом взрыве логарифм времени задержки взрыва линейно связан с обратной абсолютной температурой. Это соотношение позволяет установить энергию активации реакции превращения промежуточного продукта, определяющей развитие цепей с вырожденными разветвлениями.
Цепные реакции при распаде твердых веществ
В ряде случаев самоускоряющееся разложение твердых веществ следует закономерностям цепных реакций с вырожденными разветвлениями. Распад ускоряется со временем по закону при
этом рост скорости при умеренных температурах идет довольно медленно, т. е. <р мало. Наблюдается индукционный период и задержка вспышки, величины которых изменяются с температурой в соответствии с цепной теорией.
Согласно Семенову такие превращения в твердой фазе представляют собой действительно цепные реакции с вырожденными разветвлениями, причем промежуточные продукты обладают значительной устойчивостью при комнатной температуре.
Начальные центры реакции возникают обычно на поверхности кристалла, реже — в объеме и, прореагировав, создают промежуточные продукты, менее устойчивые, чем исходная молекула. Эти продукты превращаются в конечные продукты реакции, и при этом превращении активируются соседние молекулы непрореагировавшего вещества, что приводит к их переходу в промежуточные продукты и т. д. В результате повторения этой последовательности реакций от одного активного центра начинает расти в толщу кристалла нить реакции. Изредка промежуточный продукт вызывает распад двух соседних молекул и тогда от основной нити начинает расти побочная нить — происходит разветвление цепи. Таким образом, реакция развивается в виде неправильного «дерева», ветви которого врастают в толщу кристалла.
Если прервать реакцию, охладив сосуд, и затем вновь продолжать ее, то реакция будет протекать с той же скоростью, как если бы перерыва в ее течении не было. Этот факт показывает, что при комнатной температуре промежуточный продукт достаточно устойчив.
По мере разрастания дерева реакции чем большее пространство внутри кристалла занимают нити частиц конечного продукта реакции, тем уже делаются прослойки непрореагировавшего вещества. Пространство, в котором развиваются цепи, все сужается. Если конечный продукт обрывает цепи, то разветвление происходит отно
76 Гл. II. Медленное химическое превращение ВВ
сительно все реже и, наконец, цепи в большем числе начинают обрываться, чем разветвляться, <р из положительного делается отрицательным и скорость реакции, плавно пройдя через максимум, начинает падать.
Следует указать, что выполнение экспоненциального закона увеличения скорости реакции со временем возможно не только при цепных процессах. Такой закон будет наблюдаться во всех случаях, когда скорость реакции по тем или иным причинам оказывается пропорциональной количеству прореагировавшего вещества.
Так, Гарнер для объяснения указанного закона первоначально принимал, исходя из представлений Смекала о структуре кристаллов*, что зародыши реакции возникают в отдельных кристаллитах и могут от них переходить на соседние кристаллиты по мостикам аморфного вещества.
Другое объяснение этого закона было выдвинуто Проутом и Томпкинсом. Эти авторы полагают, что первоначально в результате реакции на поверхности кристалла образуется скопление молекул продукта, которое создает боковые напряжения, приводящие к образованию трещины. У устья этой трещины реакция происходит легче и по стенкам проникает внутрь трещины. Образовавшееся на стенках трещины скопление молекул продуктов приводит к образованию новых трещин, идущих нормально к поверхности первых и т. д. По мере раз вития процесса разветвление трещин замедляется, так как они все чаще и чаще встречаются с поверхностями, где вещество уже прореагировало, и скорость реакции, пройдя через максимум, начинает падать.
Уравнение, выведенное Проутом и Томпкинсом для описанного процесса, аналогично обычному уравнению цепной реакции, но учитывает не только вероятность разветвления, но и вероятность обрыва цепей, которая принимается увеличивающейся пропорционально x/xt, где xi — количество прореагировавшего вещества в момент максимума скорости. Для распада ряда твердых веществ (КМпО*, AgMnOj, РЬСаОз, NH4CIO4 и др.) это уравнение выполняется для большей доли прохождения реакции, чем простая экспоненциальная зависимость. Представления Проута и Томпкинса согласуются с тем, что при термическом распаде (а также при горении) многих твердых ВВ наблюдается растрескивание кристаллов на части.
Топохимические реакции при распаде твердых веществ
Если цепная реакция в твердой фазе характеризуется большой скоростью разветвления цепи, то математические закономерности ее течения принимают несколько необычный вид. В этом случае активный центр уже на ранних этапах процесса вызывает реакцию всех прилегающих к нему молекул вещества. Тогда реакция распространяется уже не в виде ветвистого дерева, а сплошным фронтом, позади которого все вещество прореагировало.
В большинстве случаев превращение включает три этапа: 1) начальную реакцию, происходящую на поверхности кристаллов с выделением газов, 2) образование зародышей новой фазы и 3) реакцию, протекающую на поверхности раздела фаз.
Начинающаяся на поверхности кристаллов реакция может протекать различно: она может быть ограничена поверхностным слоем или распространяться диффузно внутрь кристалла. Энергия акти-
* Согласно гипотезе Смекала кристаллы имеют мозаичную структуру. Ульт-рамикроскопические трещины разделяют кристалл на очень маленькие отдельные кристаллиты, цементированные аморфным веществом.
£ 3. Самоускоряющиеся химические реакции 77
вации этой реакции, как правило, больше, чем энергия активации последующей реакции роста зародышей (для азида бария, например, значения Е составляют соответственно 37 и 23 ккал/мол). Зародыши, образующиеся в результате поверхностной реакции, обычно трехмерные, и поверхность их растет пропорционально квадрату времени. Следует отметить, что в начальный, период роста зародыши новой фазы могут расти как медленнее, так и быстрее, чем в дальнейшем, когда линейная скорость их роста становится постоянной.
Вопрос о том, как возникает зародыш и как ои развивается иа раииих стадиях своего существования, еще ие вполне выяснен, В некоторых случаях возникновение зародышей обусловлено поверхностной реакцией, образующей пустые узлы в кристаллической решетке обычно анионного характера. Эти пустоты могут быть как неподвижными, так и обладать подвижностью на поверхности или проникать внутрь кристалла. Агрегация этих пустот, когда оиа достигает определенных размеров, становится неустойчивой и приводит к образованию зародыша новой фазы; если число их ие слишком велико, то через некоторое время можно наблюдать образование макроскопических дискретных зародышей реакции. При этом реакция протекает практически целиком иа поверхности контакта ее продуктов с исходным веществом. Закономерности превращения в этом случае такие же, как при реакции, протекающей в твердой фазе и катализируемой конечными продуктами.
Если исходные вещество и катализатор газообразные или жидкие, то последний равномерно распределяется во всем объеме и скорость каталитической реакции пропорциональна его количеству (в простейшем случае в первой степени). Если же катализатор и исходное вещество находятся в твердом состоянии, то контакт между ними возможен только на поверхности раздела неподвижных частиц продуктов реакции и непрореагировавшего вещества; в этом случае скорость каталитической реакции изменяется пропорционально величине этой поверхности. Такие реакции называют топохимическими.
При топохимических реакциях разложение начинается обычно на поверхности кристалла, в отдельных точках которой возникают зародыши из продуктов реакции; раз образовавшись, эти зародыши быстро врастают внутрь кристалла. Скорость реакции определяется, таким образом, скоростями двух процессов: 1) образования зародышей и 2) их роста.
Учет одновременного протекания этих процессов приводит к довольно сложной зависимости скорости реакции от времени. Гораздо более простые закономерности получаются в частных случаях, когда скорость процесса образования новых зародышей можно считать или практически равной нулю, или очень большой. Последнее наблюдается, когда энергия активации поверхностной реакции, приводящей к образованию зародышей, и энергия активации реакции их роста близки. Эти случаи мы и рассмотрим.
Закономерности топохимической реакции в случае, когда скорость образования зародышей практически равна нулю
В этом случае число зародышей можно считать постоянным и скорость реакции определяется скоростью роста зародышей, пропорциональной их поверхности.
78
Гл. II. Медленное химическое превращение ВВ
(2.44)
Для одного зародыша можно написать
dt
где S—часть поверхности зародыша, находящаяся в контакте с неразложив-шимся веществом;
Kt—коистаита скорости реакции.
Если принять, что зародыш, возникший иа плоской поверхности кристалла (фиг. 2, 14, а), имеет форму полусферы, то S=2rtr2, где г — радиус зародыша.
Зародыши
реакции
Градусы реакции
Продукт реакции
НепрореагироВаВшее Вещество
t§[Henpopea-\ p&upoSaSmee \лвещестдо/
5)
6)
Фиг. 2. 14. Схема развития топохимического превращения.
Если вес прореагировавшего вещества, образующего зародыш, обозначить через х, а плотность продуктов реакции через d, то объем зародыша
х 2
— — — кгЗ,
d 3
откуда
Г -1-
I V-3 •
(2. 45)
или
где
где
Подставляя (2.45) в (2.44), получим
2 2
Интегрирование дает
их dt
dx к "Г РГ = Кх
(2.46)
2
(2-47)
Зх3 =A74-const-
Если х=0 при /—0, то уравнение примет следующий простой вид: х = (2. 47а)
$ 3, Самоускоряющиеся химические реакции 79
Дифференцируя (2.47а) по t, получим скорость как функцию времени
dx
(2.48) at
где К3=ЗК2.
Если будем рассматривать не один, а п одновременно возникших зародышей, то очевидно, что скорость реакции и количество прореагировавшего вещества как функции времени будут выражаться теми же формулами, ио-кои-стаиты будут в п раз больше.
Понятно, что установленные закономерности будут выполняться лишь до тех пор, пока отдельные зародыши ие соприкоснутся друг с другом, после чего скорость реакции будет увеличиваться медленнее и наконец начнет падать.
Закономерности топохимической реакции в случае, когда скорость образования зародышей очень велика
В этом случае зародыши быстро покрывают поверхность кристалла-(фиг. 2.14,6), который скоро оказывается как бы в оболочке из продуктов реакции (фиг. 2.14, в). Скорость реакции при этом пропорциональна поверхности иеразложившейся части кристалла. Если допустить, что кристалл имеет форму сферы и количество иеразложившегося вещества обозначить через (а—х), то можно показать, что скорость реакции будет пропорциональна количеству иеразложившегося вещества в степени г/3:
г/х т-
~~ = К(а-х)3. (2.49>
dt
После интегрирования, положив, что при /—О и х~0, получим
- - 1
а3 — (а— х)3 = — Kt. (2.50)
О
4
Топохимические реакции как частный случай цепных реакций
Сопоставляя математические закономерности цепной и топохимической реакций (для случая, когда развивающиеся зародыши ие мешают друг другу), нетрудно констатировать их сходство.
Если скорость реакции разветвления и число цепей малы, то скорость цепной реакции пропорциональна, как легко показать, первой степени количества прореагировавшего вещества:
dx
(2.51).
dt
Для зависимости скорости реакции от времени имеем
4“=^- (2.52)
dt
Если скорость реакции разветвления так велика, что распад молекулы вызывает распад всех прилегающих к ией молекул, то отдельные нити реакций, сливаясь, образуют сплошной сферический фронт и скорость реакции возрастает по топохимическому закону
2
-^- = /(3х3, (2.53)
80
Гл. II. Медленное химическое превращение ВВ
смысл которого заключается в том, что в отношении возможности продолжения и разветвления цепей эффективны только частицы продуктов реакции, находящиеся иа поверхности зародыша. Зависимость скорости реакции от времени выражается, как было показано, соотношением (2.48)
В промежуточных случаях показатель степени при х в (2. 53) изменяется от Vs до 1 и соответственно показатель при I в выражении (2. 48) изменяется от 2 до больших значений.
§ 4. МЕДЛЕННОЕ ХИМИЧЕСКОЕ ПРЕВРАЩЕНИЕ КОНДЕНСИРОВАННЫХ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
1. Общая характеристика медленного химического превращения взрывчатых веществ
Приложение рассмотренных основных закономерностей химической кинетики к медленному химическому превращению жидких и твердых взрывчатых веществ, происходящему при температурах ниже температуры вспышки, затрудняется сложностью протекающих в этом случае реакций. Как правило, химическое превращение ВВ включает не одну, а несколько последовательно или параллельно идущих реакций, причем в зависимости от условий роль каждой из них может быть различна.
На стр. 30 было приведено несколько уравнений, по которым может идти разложение аммиачной селитры при разных температурах.
Подобное же изменение состава продуктов разложения с изменением температуры установлено для термического распада нитроглицерина и нитроклетчатки (табл. 2.3).
Таблица 2.3
Состав (в % по объему) газообразных продуктов распада (без воды) нитроглицерина и нитроклетчатки при различных температурах
Разлагающееся вещество Температура разложения °C Продукты распада в И по объему Объем газов см31г Потеря в весе к концу опыта %
со2 СО NO n2 4- n2o
Нитроглицерин 95-98 34 6 52 8 — —
165 30 22 37 11 — —
Нитроклетчатка 120 30,2 17,4 21,4 31,0 156,5 48,6
145 35,7 16,8 29,6 18,5 280 65
§ 4. Медленное химическое превращение конденсированных ВВ
81
Из табл. 2.3 видно, что для обоих ВВ при изменении температуры опыта содержание отдельных газов сильно изменяется. Для нитроклетчатки были измерены также потеря в весе и объем образовавшихся газов. При повышении температуры потеря в весе и объем газов увеличиваются, что указывает на более глубокое превращение исходного вещества.
Даже такие простые соединения, как азиды, дают при разных температурах различные продукты распада: азид кальция (CaNg), например, при низких температурах (100—150° С) превращается в вещество, соответствующее эмпирической формуле (CaN)„, в то время как при вспышке образуются нитрид (Ca3N2) и металл.
Для многих В В разные продукты распада получаются не только при различных температурах; состав продуктов может изменяться также в ходе одного и того же опыта, проводимого при постоянной температуре.
По данным Сапожникова, содержание соединений азота (в грамм-атомах) в газообразных продуктах начальной стадии разложения нитроклетчатки при температурах, близких к температуре вспышки, в 61/2 раз превышает содержание соединений углерода; в конце опыта содержание азота только в Р/2 раза больше содержания углерода.
В начале разложения некоторых жидких иитроэфиров (нитроглицерин, иитрогликоль, метилиитрат) в эвакуированной и запаянной ампуле при различных температурах от 70 до 240° С газовая фаза сильно буреет в результате образования двуокиси азота. Затем интенсивность окраски газов уменьшается и в конце опыта они становятся бесцветными; анализ обнаруживает при этом значительное содержание окиси азота. Естественно предположить, что обесцвечивание газов происходит в результате окисления двуокисью азота органических продуктов начальных стадий распада, а возможно, и исходных иитроэфиров.
Таким образом, даже при неизменной температуре опыта распад ВВ представляет собой сложную совокупность реакций. При изменении температуры могут существенно изменяться удельный вес отдельных реакций, а иногда и характер течения распада, что еще более усложняет картину.
Несмотря на это, в сложном комплексе последовательных и параллельных реакций медленного химического превращения ВВ можно выделить два типа процессов. Как показывает опыт, термический распад ВВ начинается первичной реакцией, протекающей для изученных в этом отношении веществ по закону реакции первого порядка. Первичная реакция является самой медленной из возможных реакций распада данного ВВ. Скорость первичной ре-, акции зависит только от природы вещества, его агрегатного состояния и температуры. Кинетические характеристики (энергия активации Е, предэкспоненциальный множитель В) первичной реакции для ряда ВВ приведены в табл. 2.5 на стр. 101.
По мере накопления продуктов первичной реакции развиваются вторичные, обычно самоускоряющиеся, реакции. Природа и величина ускорения могут быть различны и зависят от условий протекания превращения. Ускорение может быть вызвано продуктами
82
Гл. II. Медленное химическое превращение ВВ
распада, промежуточными или конечными, в результате их каталитического действия, а также взаимодействием этих продуктов друг с другом или с неразложившимся веществом. Скорость образования конечного продукта может увеличиваться и в том случае, если превращение идет по типу последовательных реакций *.
Скорость первичной реакции обычно относительно мала и уменьшается со временем соответственно уменьшению количества непрореагировавшего вещества. Эта скорость может также возрастать во времени, но лишь в том случае, если первичная реакция идет с выделением тепла, а теплоотвод затруднен и температура В В не остается постоянной.
Напротив, развитие самоускорения вторичных реакций не обусловлено необходимостью саморазогрева и скорость их растет даже в том случае, если температура остается постоянной. Вначале скорость мала, так как отсутствуют причины ускорения, но затем более или менее быстро увеличивается со временем. Если ускорение вторичных реакций идет быстрее, чем падение скорости первичной реакции, то суммарная скорость превращения ВВ увеличивается. Именно поэтому во многих случаях термический распад ВВ является самоускоряющимся процессом.
В случаях, когда ускорение суммарной экзотермической реакции велико, скорость ее может достигнуть столь больших значений, что равновесие между теплоприходом и теплоотводом нарушается и происходит тепловое самовоспламенение. Таков обычный механизм вспышки ВВ, возникающей при нагреве после некоторого (иногда длительного) времени.
Эту общую картину протекания процесса поясним на примере распада нитроэфиров, нитросоединений и некоторых ВВ, распадающихся в твердом состоянии.
2. Медленное химическое превращение нитроэфиров
Разложение нитроэфиров с низкой температурой кипения (метилнитрат 66,5°, этилнитрат 87°) изучалось только в парах; с более высококипящими нитроэфирами (нитрогликоль 200°, нитроглицерин 2450) исследования проводились как в парах, так и в жидком состоянии; разложение нитратов клетчатки исследовалось в твердом состоянии.
Распад простейшего эфира азотной кислоты — метилнитрата (CHsONO2) Апин, Тодес и Харитон изучали манометрическим методом. При 210—320° разложение идет со значительной скоростью, которая не зависит от начального давления паров метилнитрата,
* Протекание превращения как ряда последовательных реакций особенно вероятно в случае ВВ, содержащих несколько одинаковых групп, с которых начинается распад молекулы,— полииитратов многоатомных спиртов, полииитро-соедииеиий и т. п. Естествеиио, что первичным процессом в этом случае является реакция одной группы, которая не обязательно должна сразу привести к полному разрушению молекулы.
§ 4. Медленное химическое превращение конденсированных ВВ 83
т. е. является реакцией первого порядка. Заполнение сосуда стеклянными трубками, что увеличивало отношение поверхности к объему в несколько раз, не изменило скорости реакции. Это указывает на гомогенное течение распада метилнитрата в условиях данных опытов. Скорость реакции не изменилась и при добавлении к ме-тилнитрату продуктов распада. Это означает, что автокатализа не наблюдается. По величине константы скорости и ее зависимости от температуры были рассчитаны (в предположении, что реакция является мономолекулярной) кинетические коэффициенты: энергия активации Е (39 500 кал/мол) и предэкспоненциальный множитель В (10!4>4). В отношении химизма распада метилнитрата авторы предположили по аналогии с распадом метилнитрита, что первая стадия процесса представляет собой отщепление двуокиси азота с образованием алкоксирадикала.
Более полное представление о механизме разложения алкилмононитратов было получено Леви при изучении распада этилнитрата. Применение новых методов исследования — Инфракрасной спектроскопии и газовой хроматографии — позволило обнаружить и количественно определить такие промежуточные продукты распада, которые ранее ускользали от внимания исследователей.
Распад этилнитрата является сложным процессом и представляет собой в основном последовательность таких реакций:
C2H5ONO2 C2H5O + NO2;
C2H5O+NO ±5 C2H5ONO;
C2H5O + NO -» CH3CHO + NOH;
C2H5O -> CH3 + CH2O;
2NOH -> N2O4-HjO;
(a)
(6) (в) (r) (Д)
CH3CHO, CH2O4-NO2-> NO, CO, CO2, H2O и др. продукты, (e)
Обоснованием отдельных этапов указанной последовательности реакций являются следующие данные.
При добавлении двуокиси азота скорость распада уменьшается. Замедление распада при малых содержаниях двуокиси азота* тем больше, чем больше ее добавлено. Этот факт свидетельствует о том, что реакция (а) является обратимой. Реальность обратной реакции (QHsO + NCh -» QHsONOs) подтверждается также опытами по разложению этилиитрита в присутствии NOa, при которых наблюдалось образование значительных количеств этилнитрата. Это показывает, что этоксил-радикал, образующийся при распаде этилиитрита,
C2H5ONO-> CsHsO+NO,
(ж)
в присутствии NO2 образует этилнитрат:
C2H6O-|-NO2- сдцоко-.
(3)
При разложении этилнитрата наблюдается образование больших количеств этилиитрита (до 70% от разложившегося нитрата), объясняемое реакцией (б).
Добавление больших количеств NO2 приводит к ускорению реакции.
84
Гл. II. Медленное химическое превращение ВВ
Участвующая в этой реакции окись азота получается за счет восстаиовлеиия NOa образующимися альдегидами.
Добавление к этилиитрату окиси азота приводит к ускорению распада. Это следует объяснить ускорением реакции (б), что в свою очередь вследствие уменьшения концентрации этоксильных радикалов замедляет обратный этап реакции (а). При этом выход этилиитрита (разумеется, это справедливо лишь для умеренных времен реакции, при большей ее длительности этилнитрит также распадается), как и следовало ожидать, повышается, при умеренных степенях распада даже до 100%. То же относится и к выходу двуокиси азота.
Добавление ацетальдегида аналогично окиси азота ускоряет распад этил-нитрата. Ацетальдегид быстро реагирует с двуокисью азота, уменьшая ее концентрацию и тормозя вследствие этого реакцию соедииеиия этоксила с двуокисью азота — обратную реакцию этапа (а).
Ввиду сложности процесса распада этилнитрата обычные расчеты (по манометрическим кривым) константы скорости К, а по ее зависимости от температуры — энергии активации Е и предэкспо-ненциального множителя В не являются обоснованными.
Можно, однако, создать такие условия, при которых скорость распада будет действительно определяться скоростью ее первого этапа — отщеплением NO2. Это достигается проведением разложения в присутствии окиси азота и ацетальдегида. Окись азота быстро реагирует с этоксильными радикалами, ацетальдегид — с двуокисью азота. Таким образом, снижается концентрация продуктов реакции (а), подавляется обратная реакция и скорость распада этилнитрата в этом случае определяется течением реакции (а) слева направо. В этих условиях константа скорости реакции определяется выражением
— 41 230
К— Ю16-25 -е сек-1.
Величину Е—41 230 кал!мол можно рассматривать как энергию разрыва связи между кислородом и NOs-группой в этилнитрате.
Для исследования механизма распада алкилмононитраты удобны как относительно простые соединения. Однако как ВВ они по разным причинам не применяются. Наибольшее практическое значение имеют нитраты многоатомных спиртов — нитроглицерин, нитрогликоль и другие.
Распад нитроглицерина как в парах, так и в жидком состоянии изучали по росту давления газообразных продуктов С. 3. Рогинский и другие исследователи.
Имеется ряд вариантов манометрического метода. Простейший из приборов — пробирка с ВВ, соединенная с ртутным манометром. Такой метод применим (и то с ограничениями) только для нелетучих ВВ, так как летучие ВВ, а также летучие продукты распада перегонялись бы в холодные части прибора, особенно если начинать опыт в вакууме. Кроме того, в этом варианте манометрического метода реакционный сосуд неизбежно был бы наполнен парами манометрической или запорной жидкости.
Все эти недостатки устранены в стеклянном манометре типа Бурдона (фиг. 2.15). Манометр представляет собой тонкостенную
§ 4. Медленное химическое превращение конденсированных ВВ
85
стеклянную мембрану 4 серповидного сечения, заканчивающуюся стрелкой 6. Реакционный сосуд 1, в который помещают навеску исследуемого ВВ, сообщается с внутренним пространством мембраны. Образующиеся при разложении ВВ газы давят на мембрану, вследствие чего она выгибается и стрел-на отклоняется от первоначального положе-| ния. В трубку 5, окружающую мембрану,
год впускают воздух до возвращения стрелки в Т нулевое положение. Давление впускаемого
IL-s
5s
Фиг. 2. 16. Изменение во времени давления газообразных продуктов и скорости распада нитроглицерина в парах при 140° С.
Фиг. 2. 15. Стеклянный мембранный манометр.
1—реакционный сосуд. 2--отросток для эвакуации, 3—отросток для введения навески. 4-—стеклянная
.мембрана. 5—компенсационный сосуд, 6—стеклянная стрелка. 7—к шлифу.
1) Р=ПО. 2) Др/ДГ=ф(П.
воздуха отсчитывают по жидкостному манометру; за положением стрелки следят при помощи микроскопа.
Течение распада нитроглицерина в значительной мере зависит от степени заполнения им сосуда д (д есть отношение объема нитроглицерина к объему сосуда), определяющей, с одной стороны, долю нитроглицерина, находящегося в виде паров, а с другой — давление газообразных продуктов распада. Сильное влияние на течение превращения может оказывать также присутствие воды. Соответственно рассмотрим распад нитроглицерина при малых, умеренных и больших д, а также в присутствии воды.
Распад нитроглицерина при достаточно малых д, т. е. в парах, протекает подобно распаду метилнитрата со скоростью, уменьшающейся во времени, по закону, близкому к закону реакции первого порядка (фиг. 2. 16). Как это и должно быть при мономолекулярной реакции, скорость роста давления не зависит от концентрации паров нитроглицерина. Однако в сосуде, на
86
Гл. II. Медленное химическое превращение ВВ
полненном стеклянными трубками, скорость больше, что указывает на наличие гетерогенной реакции на поверхности стекла, протекающей наряду с гомогенной реакцией.
Распад нитроглицерина при умеренных б, когда большая часть его находится в жидком состоянии, протекает иначе, чем в парах (фиг. 2. 17). Во-первых, скорость распада в жидком состоянии значительно меньше, во-вторых, она не умень-
Фиг. 2. 17. Изменение во времени скорости газообразования, выраженной в нормальных см^ в минуту на 1 г вещества при распаде жидкого нитроглицерина при 140° С и умеренных 3, соответственно равных: 1—30 • 10~»; 2—12-10~4;
3—3- 10-4.
шается, а вначале несколько растет со временем, причем максимум скорости тем меньше, чем больше д. Если опыт вести в струе инертного газа так, чтобы им удалялись газообразные продукты, то скорость распада от этого существенно не изменяется. Это показывает, что в данных условиях газообразные продукты распада не оказывают на его течение заметного ускоряющего действия. Третьей особенностью распада нитроглицерина в этих условиях является сильная зависимость скорости от температуры; при повышении температуры на 10° скорость возрастает приблизительно в 4 раза.
Исследования распада нитратов ряда многоатомных спиртов в жидком состоянии [триметиленгликольдинитрат CHsONOaCHaCHaONCh, пропиленгликольди-нитрат CH3CHONO2CH2ONO2, нитрометантриметилолтринитрат NO2C(CH2ONO2)3, нитроманнит CHzONOilCHONOai-iCI-hONOa, пентаэритриттетранитрат CfCHaONO»)*] показали, что на начальных стадиях разложение протекает без существенного ускорения. При этом чем длиннее цепь углеродных атомов полностью этерифицированного многоатомного спирта, тем быстрее он разлагается. Так, скорость распада нитроглицерина больше, чем нитрогликоля, а нитроманнита больше, чем нитроглицерина. Для нитроклетчатки скорость распада возрастает с увеличением содержания азота.
§ 4. Медленное химическое превращение конденсированных ВВ
8?
Как и в случае нитроглицерина, при разложении некоторых нитроэфиров наблюдается сильная зависимость скорости распада от температуры. При расчете кинетических констант это приводит к большим значениям энергии активации Е, а также предэкспоненциальиого множителя В в выражении для константы мономолекулярной реакции. Так, для нитроманнита В=1020-б, для тэна В=10‘».8, в то время как для обычных мономолекулярных реакций в соответствии с теорией В не превышает 1014 сек-1.
Фиг. 2. 18. Изменение во времени скорости распада жидкого нитроглицерина при 100° С и больших 3, соответственно равных: 1) 44- КН; 2) 59- 1(Н; 3) 77- 10-4; 4) 83- 10-4; 5) Ю2- 10~4; 6) 106- К)-4;
7) 212- IO'4; 8) 280 • КН; 9) 700- 10~4.
Если разложение тэна вести не в состоянии расплава, а в состоянии разбавленного раствора в инертном растворителе, то температурный коэффициент скорости реакции оказывается значительно меньше. Скорости распада при умеренных температурах практически одинаковы для расплава и раствора, а при высоких температурах расплав разлагается значительно быстрее. Возможно, что здесь играет роль саморазогрев или же увеличение с повышением температуры удельной роли реакции в парах *. Во всяком случае, это наблюдение показывает, что чрезмерно большие температурные коэффициенты скорости, о которых шла речь выше, могут быть обусловлены побочными причинами.
Распад нитроглицерина при больших б протекает существенно иначе (фиг. 2. 18). Вначале разложение идет обычной малой и слабо увеличивающейся со временем скоростью. Затем, когда давление газообразных продуктов распада и соответственно их концентрация в жидком нитроглицерине достигают некоторого критического значения, разложение значительно ускоряет
* Скорость распада тэна в парах, как и для нитроглицерина, значительно больше, чем в жидкой фазе.
88
Гл. II. Медленное химическое превращение ВВ
ся. При этом скорость распада быстро возрастает во времени соответственно росту давления и может стать очень большой — в сотни и тысячи раз больше, чем в начале распада. Чем больше д, тем раньше достигается критическое давление и начинается быстрое ускорение распада. Чем выше температура, тем меньше растворимость газообразных продуктов в жидкости и тем больше критическое давление.
Фиг. 2.19. Изменение во времени давления при распаде жидкого нитроглицерина в присутствии небольших количеств воды при 10(ГС. Числа у кривых показывают начальное давление паров воды в мм рт. ст.
Фиг. 2.20. Изменение во времени объема газообразных продуктов распада жидкого нитроглицерина при 100" С в присутствии паров воды (8«6- 10-3).
Давление паров воды в мм: I) 0: 2) 116; 3) 328; 4) 447; 5) 467; 6) 471.
Если сосуд заполнен нитроглицерином почти целиком и газообразные продукты распада не имеют возможности удаляться из жидкости, то резкое ускорение распада при 100°С наступает уже приблизительно через 10 час., при 80° С через 70 час. и при 60° С спустя 620 час.
Распад нитроглицерина в присутствии воды имеет своеобразный характер (фиг. 2. 19 и 2.20). Когда содержание воды в нитроглицерине мало (см. фиг. 2. 19), распад в начале идет быстрее и стадия резкого ускорения наступает раньше. Если воды больше, то давление некоторое время остается постоянным, затем вследствие перехода паров воды в жидкую фазу резко падает, после чего начинает более или менее быстро повышаться (см. фиг. 2. 20, кривые 2—5).
Следует полагать, что в присутствии воды происходит гидролиз нитроглицерина; судя по характеру кривой изменения давления, он
§ 4. Медленное химическое превращение конденсированных ВВ
89
протекает сложным путем и является самоускоряющимся, очевидно, в результате каталитического действия образующихся при гидролизе летучих кислот и последующего развития окислительных реакций. Если эти кислоты нейтрализовать (например, соединяя сосуд с нитроглицерином и сосуд с содой), то ускорения распада не наблюдается. Большие количества воды также задерживают наступление ускорения (см. фиг. 2. 20, кривая 6)\
Общее время от начала опыта до наступления резкого ускорения в присутствии умеренных количеств воды гораздо меньше, чем в ее отсутствии. По-видимому, и в случае распада сухого нитроглицерина гидролиз тоже играет некоторую роль, но вода (так же как и катализатор гидролиза — кислоты) образуется в самом ходе разложения; более позднее наступление ускорения следует объяснить тем, что первоначально отщепляется двуокись азота, а вода образуется в результате вторичных окислительных процессов относительно медленно.
Описанный характер распада нитроглицерина, состоящего из двух стадий — медленной реакции вначале и очень сильно ускоряющихся гидролитической и окислительной реакций, наступающих после накопления продуктов распада, — типичен и для многих других нитроэфиров многоатомных спиртов, например нитрогликоля, динитроглицерина, тэна, а в известных условиях и нитроклетчатки. К Термический распад нитроклетчатки отличается некоторыми особенностями. Нитроклетчатка как высокомолекулярное вещество находится при обычных температурах разложения в твердом состоянии; наряду с этим она обладает физически сложной структурой, обычно очень развитой поверхностью, и не представляет собой, как правило, химически однородного соединения. Наконец, при получении нитроклетчатки образуются различные, часто малостойкие, трудно удаляемые полностью примеси, способные ускорять ее распад. Все эти обстоятельства существенно усложняют течение распада.
Разложение нитроклетчатки при повышенных температурах всегда протекает с ускорением. Характер и величина этого ускорения в сильной степени зависят от условий. Ускорение, хотя и относительно небольшое, наблюдается даже в том случае, если вести распад в вакууме с непрерывным откачиванием образующихся газов. Это видно из кривой, изображающей скорость убыли веса нитроклетчатки при термическом распаде в вакууме, полученной при помощи весов Мак-Бена (кривая 4 на фиг, 2.21): в начале опыта скорость убыли в весе растет. Если определить отдельно скорость образования газов, которые конденсируются в ловушке с жидким азотом, и газов, которые проходят через нее, не конденсируясь, то оказывается, что первая из них падает со временем, а скорость образования неконденсирующихся газов сильно увеличивается. Это говорит о том, что ускорение при термическом распаде нитроклетчатки в вакууме имеет сложный характер: происходят по край
90
Гл. II. Медленное химическое превращение ВВ
ней мере две реакции, причем скорость вторичной реакции сильно возрастает со временем; скорость же первичной реакции повышается слабее, или даже — при высоких температурах — не показывает роста, но падает с самого начала опыта.
Влияние на разложение нитроклетчатки газообразных его продуктов можно устранить не только путем проведения распада в вакууме, но и осуществляя опыт в токе инертного газа, как это делается при определении стойкости нитроклетчатки по пробе Билля
Фиг. 2.21. Изменение во времени скорости разложения нитроклетчатки при 145° С.
а) в вакууме при откачке газов: /—неконденсирую-щиеся газы, 2—конденсирующиеся газы. 3—суммарное количество газов, 4—потеря в весе, б) при квазипоетоянном давлении (10 мм)—5.
в) без откачивания газообразных продуктов распада (давление при достижении максимальной скорости ~500 мм)—6.
По оси ординат отложена для кривых 1, 2, 3, 5 и 6 скорость газообразования в см^/час. а для кривой скорость потери ₽ весе в г]час на 1 г исходного вещества.
Фиг. 2.22. Зависимость от времени количества разложившегося вещества (отщепившегося азота) при разложении нитроклетчатки в токе инертного газа по Биллю.
(см. ниже стр. 116). Количество отщепленного азе та возрастает в этих уело-
виях пропорционально абсолютная скорость от-
времени
(фиг. 2.22). Это означает, что
щепления азота постоянна, а относительная — возрастает.
Если вести разложение в эвакуированном сосуде, по не отводить образующиеся газы, то скорость газообразования растет сильнее, чем при постоянном отводе газов. Это ускорение обычно приписывают каталитическому действию газообразных продуктов распада. Такому объяснению противоречит, однако, относительно малая величина ускорения и слабая его зависимость от давления (см. фиг. 2.21, кривая 6). Кроме того, ускорение наблюдается и при непрерывном откачивании газов, и при некотором постоянном (сред
§ 4. Медленное химическое превращение конденсированных ВВ
91
нем) давлении газообразных продуктов распада, которое поддерживалось их периодическим откачиванием (см. фиг. 2. 21, кривая 5). Поэтому следует полагать, что влияние газообразных продуктов распада в этих условиях в основном не каталитическое, а определяется взаимодействием их реакционноспособных компонентов друг с другом, с конденсированными продуктами распада и, возможно, с непрореагировавшим веществом.
Фиг. 2. 23. Изменение объема газообразных продуктов при распаде нитроклетчатки (при 120°С) в присутствии воды и кислорода. Числа при кривых дают давление паров воды и кислорода в мм рт. ст. при температуре опыта.
Разложение нитроклетчатки в отличие от нитроглицерина слабо ускоряется парами воды (фиг. 2.23). Если, однако, одновременно с водой присутствуют кислород или кислоты, то через некоторое время после начала опыта наступает резкое ускорение газообразования. Действие кислорода заключается в окислении окиси азота до NO2; последняя с водой образует кислоты, вызывающие гидролитический распад нитроклетчатки.
Отличие распада нитроклетчатки в присутствии паров воды от распада нитроглицерина может быть связано с разной скоростью восстановления первично образующейся двуокиси азота. При распаде нитроглицерина эта скорость мала, при распаде нитроклетчатки — велика, и необходимо добавление кислорода, чтобы перевести окись азота в двуокись.
Если в реакционный сосуд ввести непосредственно двуокись азота или азотную кислоту, то распад нитроклетчатки ускоряется.
92
Гл. II. Медленное химическое превращение ВВ
Наибольшее ускоряющее действие оказывает кислота средней концентрации; слабая и концентрированная кислоты дают меньшее ускорение.
Из совокупности рассмотренных данных следует заключить, что распад нитроклетчатки представляет собой сложную реакцию, включающую даже при откачивании газообразных продуктов распада по крайней мере две ступени. В присутствии газообразных продуктов распада реакции протекают еще сложнее. Более того, есть основания полагать, что при распаде нитроклетчатки проявляются и топохимические эффекты. Установлено, что скорость распада зависит от величины частиц нитроклетчатки. Чем меньше частицы, т. е. ч’ем больше удельная поверхность вещества, тем больше скорость распада. Этот факт показывает, что реакция на поверхности частиц идет быстрее, чем в объеме, что характерно для топохимических реакций. Далее установлено, что при разложении нитроклетчатки под слоем инертной жидкости, например ксилола, парафина, в воде при 130—'135° С под давлением, в присутствии жидких нитросоединений ароматических углеводородов, скорость распада меньше, чем в отсутствии жидкости. Такое влияние покрытия поверхности твердого вещества слоем жидкости также указывает на топохимический характер процесса (см. стр. 97).
При удалении газообразных продуктов распада скорость его сильно зависит от температуры: при повышении температуры на 10° она возрастает в 3,6—4 раза. На скорость разложения, протекающего без удаления газообразных продуктов, температура влияет слабее.
3. Медленное химическое превращение нитросоединений и нитраминов
Термический распад нитросоединений и нитраминов (тринитротолуол, тринитрофенилметилнитрамин, циклотриметилентринитрамин, этилендинитрамин и др.), как и в случае нитроэфиров, начинается с малой скоростью, которая сначала возрастает, а затем падает вследствие уменьшения количества непрореагировавшего вещества (фиг. 2.24). Константа начальной скорости распада в случае полинитросоединений ароматического ряда и гексогена гораздо меньше, чем для нитроэфиров. Другие нитрамины близки в этом отношении к нитроэфирам (см. табл. 2. 5).
Нитросоединения и нитрамины отличаются от нитроэфиров по характеру протекания разложения, а также по величине самоускорения реакции. В первом случае ускорение обычно начинается с начала распада, развивается постепенно и не так велико, как при распаде нитроэфиров.
Для ряда веществ (тетрил, тротил, гексоген) установлена автокаталитическая природа ускорения; добавление продуктов реакции к чистому В В приводило к значительному увеличению скорости разложения. Катализаторами являлись при этом не газообразные,
$ 4. Медленное химическое превращение конденсированных ВВ
93
а конденсированные вещества. Вследствие этого изменение 8, если исключен саморазогрев, не оказывает на течение распада такого сильного влияния, какое наблюдалось для некоторых нитроэфиров.
Для тротила установлено, что чем выше температура опыта, тем больше максимум скорости и тем быстрее он достигается (фиг. 2. 25). Было исследовано влияние различных добавок на распад тротила; ни одна из них не оказывала замедляющего действия, наоборот, многие добавки ускоряли
Фиг. 2.24. Изменение скорости газообразования при распаде жидкого тетрила при 140 и 150° С.
распад, а при высоких температурах, когда разложение заканчи-
валось вспышкой, сокращали период
Фиг. 2. 25. Влияние температуры на ход раз-
ложеиия тротила.
задержки до вспышки. Наиболее сильное ускоряющее действие оказывали гопкалит *, комплексное соединение а-нитро-зо-Р-нафтола с железом, перекись марганца и дифениламин. Обычно вспышка тротила при нагреве возникает тогда, когда накопится определенное содержание автокатализирующих продуктов, что требует некоторого времени. Однако четыре добавки (гопкалит, бихромат аммония, окись железа и гидроокись бария) вызывали вспышку при 300° С сразу без заметного предшествующего разложения. Причину этого следует искать в энергичной экзотермической
реакции между тротилом и добавкой.
* Смесь окислов марганца, меди, кобальта и серебра, применяемая в качестве катализатора реакции окисления окиси углерода при низкой температуре.
94 Гл. 11. Медленное химическое превращение ВВ
В парах тротил в противоположность нитроглицерину разлагается значительно медленнее, чем в жидком состоянии.
Разложение жидкого или растворенного гексогена при 200— 300° С протекает по закону реакции первого порядка с развивающимся по мере накопления продуктов распада автокаталитическим ускорением. При низких температурах автокатализ выражен сильнее, чем при высоких. Как и в случае тэна, в разбавленном растворе скорость распада гексогена меньше, чем при расплаве; эта разница мала при относительно низких температурах (2009С), но возрастает с температурой. Иными словами, температурный коэффициент скорости для расплава больше, чем для раствора. Это приводит к значительно большей энергии активации для расплава, а также к повышенному значению множителя В.
Разложение тетрила было изучено Хиншельвудом. Как было установлено опытами по разложению тетрила при 150° С в расплаве и в тротиловых * растворах, скорость его распада не зависит от концентрации (табл. 2.4). Наряду с мономолекулярной проте-
Таблица 2.4
Зависимость скорости распада тетрила от его концентрации
Время час. Число молей газа на 1 моль тетрила
Чистый тетрил 33%-иый раствор в тротиле 16,6%-иый раствор в тротиле
1 0,18 0,23 0,19
2 0,49 0,63 0,54
3 0,86 1,00 0,84
4 1,19 1,28 1,09
5 1,46 1,50 1,30
6 1,64 1,65 1,43
кает автокаталитическая реакция; согласно Хиншельвуду автокатализатором является образующаяся при распаде пикриновая кислота. Изменение скорости во времени хорошо согласуется с выражением (2. 28) для автокаталитической реакции. При 140° С константа скорости автокаталитической реакции в 5,35 раза больше, чем константа мономолекулярной. Опыты по разложению тетрила с заранее добавленной к нему пикриновой кислотой сразу показали большую скорость, которая соответствовала ожидаемой по расчету.
Каталитическое действие пикриновой кислоты на распад тетрила было подтверждено Рогинским и Лукиным, которые определяли время задержки вспышки тетрила в запаянных ампулах. Чи
* Тротил при этой температуре разлагается чрезвычайно медленно по сравнению с тетрилом, и его можно рассматривать как инертный растворитель.
£ 4. Медленное химическое превращение конденсированных ВВ
95
стый тетрил давал вспышку (при 156° С) через 29 мин., при добавлении 5 и 20% пикриновой кислоты — через 21 мин. и 13,5 мин.
Распад тетрила изучали при температурах как выше, так и ниже температуры плавления. При этом было обнаружено, что скорость распада жидкого тетрила в 50—100 раз больше, чем твердого. Кроме того, ускорение распада твердого тетрила гораздо больше, чем жидкого. В процессе разложения образуются конденсированные продукты; растворяясь в тетриле, они понижают его температуру плавления и часть твердого вещества переходит в жидкое состояние. Так как жидкость разлагается быстрее, ускорение распада происходит в этом случае по двум причинам: вследствие постепенного перехода твердого тетрила в жидкий и вследствие накопления автокатализатора.
4. Взрывчатые вещества, разлагающиеся в твердом состоянии
В предыдущих разделах мы рассмотрели законы распада тех ВВ, которые (за исключением нитроклетчатки) при температурах опыта находятся в жидком состоянии. Для многих ВВ (преимуще-
ственно соли тяжелых металлов) температура плавления лежит выше температуры вспышки, для других — температура плавления достаточно высока, и они разлагаются со значительными скоростями ниже этой температуры, в твердом состоянии.
Как было установлено выше, самоускоряющийся распад твердых веществ может быть сведен к двум случаям: топохимическому и цепному. Топохимический распад
Фиг. 2.26. Термический распад азида кальция.
1— под слоем парафина, 2— без парафина.
в свою очередь протекает по-раз-иому в отношении зависимости
скорости реакции и количества прореагировавшего вещества от
времени. Один тип распада на-
блюдается при малом и постоянном числе зародышей, другой — при
большом числе зародышей.
Топохимический распад. Примером топохимического распада первого типа может служить разложение азида кальция CaN6 при нагреве.
Как показало манометрическое исследование, при температурах 100—140° кривые, изображающие изменение во времени давления азота, образующегося при распаде, имеют S-образную форму (фиг. 2.26). Процесс разложения азида кальция можно разделить
на три этапа:
96
Гл. II. Медленное химическое превращение В В
1) индукционный период с очень малой и практически постоянной скоростью (участок АВ на кривой У);
2) резкое увеличение скорости распада (участок ВС) и
3) падение скорости (участок CD).
Индукционный период в случае азида кальция обусловлен в значительной мере действием примесей, уничтожающих зародыши реакции и препятствующих таким образом ее развитию. Исчерпание этих примесей делает возможным рост зародышей, и скорость реакции начинает быстро расти.
Фиг. 2. 27. Зависимость скорости распада азида кальция от количества разложившегося вещества.
Фиг. 2.28. Термический распад три-иитротриазидобеизола.
В периоде ускорения скорость реакции хорошо следует топохимическому закону для случая постоянного числа зародышей. Практически этот случай реализовали путем предварительного нагрева азида при более высокой температуре для того, чтобы образовались зародыши. Затем температуру понижали и разложение проводили при этой температуре, когда новые зародыши практически не образовывались, а происходил лишь рост зародышей реакции *, возникших во время предварительного нагрева. Особенно наглядно можно установить выполнение уравнения (2.46), строя график lg w—1g х. При этом должна получиться прямая с тангенсом угла наклона, равным 2/3. На фиг. 2. 27 приведена полученная при опытах прямая, причем tg а—0,65. Последний период —- падение скорости —- математически подчиняется мономолекулярному закону.
Вычисление энергии активации показало, что в интервале температур 80—-100° С £—20 000 кал/мол. Интересно, что при повышении температуры энергия активации не остается постоянной, а возрастает, достигая 34 000 кал/мол при 140° С.
* Образование зародышей черного цвета, хорошо видимых на фоне белых кристаллических агрегатов, можно было наблюдать визуально даже при небольшом увеличении.
§ 4. Медленное химическое превращение конденсированных ВВ
Введение в пробирку с азидом кальция парафина таким образом, чтобы кристаллы находились под слоем жидкости, приводит к резкому торможению распада (см. кривую 1, фиг. 2.26). Тормозящее действие парафина наблюдается и в том случае, когда его вводят во время уже протекающей реакции: скорость сразу становится в 40 раз меньше. Аналогичное влияние парафина было позже установлено также при разложении оксалата серебра и при термическом распаде формиата никеля.
Механизм действия парафина не вполне ясен. Наиболее вероятной причиной торможения реакции является дезактивация парафином какого-либо из промежуточных продуктов реакции, ускоряющих процесс. Это влияние имеет, по-видимому, общий характер и может быть использовано как один из критериев для установления топохимического механизма реакции.
Гарнер и Ривз изучали влияние ультрафиолетового облучения на последующее термическое разложение азида кальция. Облучение сильно сокращает индукционный период и увеличивает скорость распада. Степенной закон роста скорости сохраняется.
Сходно с азидом кальция по типу распада разлагаются многие другие взрывчатые и невзрывчатые вещества: оксалат серебра, гремучая ртуть, окись серебра, азид бария, азид стронция.
По второму типу топохимического распада (когда число зародышей велико и продукты реакции быстро покрывают поверхность кристалла), по-видимому, разлагается тринитротриазидобензол. При низких температурах (100° С и ниже) распад протекает согласно уравнению
Сб(МО2)з(Н3)з=Сб(МО)б+ЗМ2
с образованием гексанитрозобензола и азота. Зависимость количества прореагировавшего вещества от времени приведена на фиг. 2. 28. Анализ кривой показал, что разложение очень близко следует уравнению (2.50). Отклонения константы, вычисленной для этого уравнения по опытным данным, от среднего значения не превышают 1,5%.
Сопоставление значений константы скорости при разных температурах (20—100° С) дает энергию активации распада твердого тринитротриазидобензола, равную 32 300 кал/мол.
Цепной распад. Характерным для топохимического процесса является наличие участка ускорения, на котором скорость возрастает со временем по степенному закону, обусловленному ростом трехмерных зародышей реакции.
Для некоторых твердых веществ (взрывчатых и невзрывчатых) также наблюдается значительный период ускорения, но скорость растет со временем не по степенному, а по показательному закону (~=Ае1\, характерному для цепных реакций. В качестве при-\dt )
98
Гл. I/. Медленное химическое превращение ВВ
мера можно привести разложение тринитрорезорцината свинца СбН(НО2)зО2РЬ • Н2О (фиг. 2.29). При нагреве этого вещества в вакууме до 120° С прежде всего теряется кристаллизационная вода, причем дегидратация не вызывает изменения формы и прозрачности кристалла. За дегидратацией следует термическое разложение, и, если температура выше 225°, оно закапчивается взрывом. Аналогичный характер кривых для участка ускорения наблюдался
Время в мин
Фиг. 2.29. Термический распад тринитрорезорцината свинца по Хейлсу.
1)р=/(0; 2)
при разложении оксалатов некоторых тяжелых металлов и перманганатов.
Результаты исследования распада твердых ВВ, ускоряющегося по показательному закону, как показал Семенов, хорошо согласуются с цепной схемой развития реакции. Эта схема позволяет количественно объяснить наличие и продолжительность индукционного периода, влияние измельчения, зависимость задержки взрыва от температуры и т. д.
Остановимся здесь только на индукционном периоде, механизм которого в этом случае иной, чем при топохимическом распаде азида кальция. В последнем случае индукционный период обусловлен присутствием примесей, тормозящих автокаталитическую реакцию. При цепном же распаде Семенов считает индукционный период кажущимся, получающимся в результате медленности развития цепи. Сначала, когда давление очень мало и изменение его не может быть измерено применяющимся прибором, создается впечатление отсутствия реакции. На самом же деле реакция протекает, ускоряясь по одному и тому же закону с самого начала и до конца периода ускорения, но мы начинаем замечать ее только с того момента, когда давление образовавшихся газов достигает не
§ 4. Медленное химическое превращение конденсированных ВВ 99
которого значения зт. Подтверждением этой точки зрения служит тот факт, что произведение величины индукционного периода на ф всегда сохраняет постоянное значение, как этого в соответствии с выражением (2.41) требует цепная теория.
5. Общие закономерности медленного химического превращения взрывчатых веществ
Химическое превращение ВВ при повышенных температурах начинается, как указывалось, с первичной реакции, которая является мономолекулярной или по крайней мере протекает по закону реакции первого порядка. Характеристики этой реакции можно установить, изучая начальные стадии процесса, когда концентрация продуктов превращения мала и они еще не оказывают существенного влияния на его ход.
Если продукты разложения газообразны, их влияние можно уменьшить, проводя распад при небольших степенях заполнения сосуда, в токе инертного газа или в вакууме, с откачиванием образующихся газов. При этом давление продуктов распада над жидкостью мало и, если их растворимость в конденсированном ВВ невелика, то концентрация продуктов в нем будет низкой.
Влияние реакционноспособных продуктов первичной реакции на течение превращения ВВ можно предотвратить также, добавляя к нему такие вещества (стабилизаторы), которые быстро взаимодействуют с продуктами реакции, образуя соединения, не оказывающие влияния на распад.
Изучая температурную зависимость скорости мономолекулярной реакции, можно установить ее кинетические константы: энергию активации и предэкспоненциальный множитель В.
Впервые такой анализ кинетики распада ВВ провел Рогинский на основании своих экспериментальных данных и материалов предшествовавших работ. Этот анализ обнаружил некоторые кинетические особенности первичного распада ВВ.
В В распадаются с заметной, измеримой скоростью при умеренно повышенных температурах (100—200° С), т. е. константы скорости их распада довольно велики. В то же время этот распад характеризуется большим температурным коэффициентом скорости: при повышении температуры на 10° скорость распада для многих изученных ВВ увеличивается в 4 раза. Такой большой температурный коэффициент скорости неизбежно означает большую энергию активации.
В самом деле, при температуре Т2 константа скорости реакции:
а при Г, та же константа
100
Гл. 11. Медленное химическое превращение ВВ
Отсюда температурный коэффициент скорости
Кг _ е~Е1ЕГ’
Ki е~Е^ '
(2.54)
Логарифмируя, получим
A'l КТ2 RTi
или
откуда
1п Е T^-TR
К\ R TtT2
E—R
TvT2 t2-t\
In
К2
Ki ‘
(2.55)
Таким образом, если при данном значении произведения T2Ti отношение К21К\ велико, то значение Е должно быть велико. С другой стороны, поскольку уже при умеренно высокой температуре константа К. значительна, то при большой энергии активации Е предэкспоненциальный множитель В, равный произведению KeE,Rr, должен быть также большим.
Действительно, как видно из табл. 2. 5, для многих В В энергия Е велика, находясь в пределах 40 000—60 000 кал/мол- то же относится и к величине В, лежащей между 1018 и 1028.
То, что энергия активации ВВ велика, само по себе не было бы удивительным. Способность к взрыву не обязательно предполагает, как мы видели (стр. 26), неустойчивость молекулы. Эта способность определяется соотношением энергии реакции распада молекулы, возбуждающей превращение соседних молекул, и энергии активации, измеряющей устойчивость молекулы по отношению к энергетическим воздействиям.
Иначе обстоит дело с большими значениями множителя В. Согласно теории В не может быть существенно больше частоты внутримолекулярных колебаний, т. е. должен быть в пределах 10!2— 10!4. Поэтому установление Рогинским гораздо больших значений В вызвало значительный интерес. Можно было допустить, что эта закономерность является принципиальной характеристикой ВВ.
Предположение о наличии длинных цепей, состоящих из 106 — 107 звеньев, объяснило бы большие значения В. Однако поставленные' в связи с этим опыты по разложению нитроглицерина в растворах не подтвердили данного предположения. Дальнейшие исследования показали, что большие значения В не являются неизбежной особенностью ВВ.
Для ряда ВВ, в том числе и для некоторых нитроэфиров спиртов, были установлены умеренные значения Е и нормальные значения В. Далее, для одного из нитроэфиров (тэн) и одного нитрамина (гексоген), дающих при разложении в чистом виде большие
§ 4. Медленное химическое превращение конденсированных ВВ
101
Таблица 2. 5
Кинетические характеристики первичной реакции распада различных взрывчатых веществ
Взрывчатое вещество Интервал температуры °C Энергия активации Е кал/мол 1g В Период полураспада* при температуре 120° С час. Приме- чание
Метилнитрат 212—239 39 500 14,4 7120
Этилнитрат 161—181 140—170 41230 35 700 16,25 921 По дан-
Нитрогликоль (в парах) 14,3 69 ным раз-
Нитрогликоль 95—105 39 000 15,9 119 ных работ
Нитроглицерин (в парах) 150—160 36 000 15,5 6,4
Нитроглицерин 125-150 45000 19,2 129 По данным раз-
Нитроглицерин 90—125 43 700 18,64 89
Нитроглицерин 75—1(5 40 300 17,1 40 ных ра-
Пропиленгликольдинитрат 80—100 37400 15,2 77 бот
Триметиленгликольдинит- 85—110 38100 15,2 188
рат
Нитрометаитриметилолтри- 75-95 36 400 15,3 17
нитрат Тэн 145—171 39 000 15,6 240 По дан-
Тэн 160—225 47000 19,8 420 ным разных работ
Тэн в растворе 171—238 39 500 16,1 142
Этилендиаминдинитрат 230-357 40 000 13,1 2,7-Ю5
Нитрат амония 243—361 40 500 13,8 105
Пироксилин № 1 (13,35% N) 135—160 43400 17,5 836
Этилеидинитрамин 184—254 30 500 12,8 2,8
Тротил 220—270 53 500 19,0 5,8-105
Пикриновая кислота — 57 500 23,0 1,8-105
Гексоген 213—299 47 500 18,5 1,6-104
Гексоген в растворе мм 41000 15,46 4,2-103
Октоген — 52 700 19,7 7.8-105
Тетрил жидкий 129,9-138,6 60 000 27,5 142 По дан-
Тетрил жидкий — 55500 24,5 447
Тетрил жидкий 211—260 38 400 15,4 174 ным разных работ
Тетрил твердый — 52 000 22,5 505
Тетрил твердый — 36600 12,7 8700
♦ Период полураспада при 120° С рассчитан по значениям Е и В, полу* ченным в интервале температур, указанном во второй колонке таблицы, для того агрегатного состояния, в котором ВВ находится в этом интервале температур.
102
Гл. II. Медленное химическое превращение ВВ
Продолжение
Взрывчатое вещество Интервал температуры °C Энергия активации Е кал/мол 1g В Период полураспада при температуре 120° С час. Примечание
Азид кальция 80—100 20 000 —
Тринитротриазидобензол 20—100 32300 — —
а-Азид свинца 245-275 55000 — —
f-Азид свинца 237—252 40 000 — —
Тринитрорезорцинат свинца 225—255 46 700 — —
Пикрат калия 270-296 42 000 — —
Гремучая ртуть 100-115 30 000 — —
значения В, при разложении в растворе предэкспоненциальный множитель В имеет нормальную величину. Все это указывает на то, что большие значения множителя В не представляют собой характеристики мономолекулярной реакции, но обусловлены некоторыми особенностями течения реакции распада отдельных ВВ.
Одной из таких особенностей может быть увеличение объема газообразных продуктов, образуемых единицей массы ВВ, при повышении температуры распада. Если при этом отношение скоростей при двух температурах характеризовать отношением абсолютных объемов газов, выделенных в единицу времени единицей веса ВВ, без учета указанного изменения объема, то получится завышенное значение температурного коэффициента скорости. При расчете по формуле (2. 55) это приведет к завышенным значениям величины Е, а следовательно, и В.
Другой причиной получения больших значений В может быть то, что реакция распада состоит из двух ступеней: эндотермического и обратимого перехода исходного вещества А в промежуточный продукт С и необратимой реакции распада последнего на конечные продукты D:
A^±C->D.
Тогда при повышении температуры суммарная скорость реакции возрастает по двум причинам: вследствие повышения концентрации промежуточного продукта С и вследствие увеличения скорости перехода его в конечный продукт D. В итоге, проводя расчет для одноступенчатой первичной реакции, получим завышенное значение температурного коэффициента, а следовательно, и большие значения Е и множителя В.
§ 4. Медленное химическое превращение конденсированных ВВ
103
Возможны и другие механизмы, приводящие к завышенным температурным коэффициентам. Так, если при разложении имеются короткие и поэтому трудно обнаруживаемые цепи, длина которых возрастает с температурой, если имеет место саморазо-грев, растущий с повышением температуры, если при повышении температуры возрастает удельный вес более быстрой реакции в газовой фазе, то все эти факторы могут привести к повышенным значениям величин Е и В.
Уточнение этих вопросов для конкретных ВВ должно быть предметом дальнейших экспериментальных исследований.
Во всяком случае, многие типичные ВВ не показывают в отношении характеристик мономолекулярной реакции каких-либо существенных отличий от невзрывчатых веществ.
Более характерным для В В является их самоускоряющееся превращение, развивающееся по мере накопления продуктов распада. Это превращение протекает со скоростями, гораздо большими, чем первичная реакция, является суммарно экзотермичным и может приводить к тепловому возникновению взрыва. Самоускорение реакции зависит не только от свойств вещества, но и ог условий, в которых протекает его распад. Мы видели, что нитроглицерин в парах или при малых степенях заполнения сосуда разлагается без существенного ускорения и только при больших степенях заполнения сосуда и особенно в присутствии небольших количеств воды наблюдается резкое ускорение процесса. В случае нитроклетчатки для наступления резкого ускорения требуется не только вода, но и кислород.
Механизм самоускорения может быть, как уже отмечалось, различным: автокаталитическим (например, тротил, тетрил, гексоген), гидролитически-автокаталитическим (например, нитроглицерин), цепным (например, тринитрорезорцинат свинца), топохимическим (например, азид кальция); ускорение может быть также обусловлено протеканием последовательных реакций, или прогрессивным расплавлением.
Важными характеристиками самоускоряющегося распада ВВ являются; величина максимальной скорости и время ее достижения.
Практическое значение медленного химического превращения заключается в том, что оно определяет химическую стойкость ВВ. При хранении ВВ, которое может быть очень длительным, или при технологических процессах его обработки, если они производятся при повышенных температурах (сушка, вальцевание порохов, формование зарядов и др.), в некоторой степени может происходить разложение ВВ. Если процесс разложения ограничивается при этом стадией первичной реакции, то степень разложения обычно бывает невелика, так как для применяемых в технике ВВ константы скорости этой реакции невелики. Иначе обстоит дело, если успевает развиться самоускоряющийся процесс. Когда максимальная скорость реакции велика и достигается быстро, то разложение ВВ мо-
104
Гл. II. Медленное химическое превращение ВВ
Фиг. 2. 30. Изменение во времени скорости распада нитроглицерина (/) и гремучей ртути (2) при 80° С и тетрила (3) при 140° С,
Верхняя шкала времени относится к тетрилу, нижняя — к нитроглицерину и гремучей ртути. Скорость
выражена через отношение Ф-----»
шнач причем для гремучей ртути за начальную скорость принята скорость при ^—50 час.
жет пройти в значительной степени, существенно ухудшающей его последующее действие. В условиях затрудненного теплоотвода при сильном самоускорении разложение может закончиться взрывом.
В отношении характеристик самоускорения распада ВВ различного химического строения сильно отличаются друг от друга.
Так, нитросоединения и нитрамины разлагаются с относительно малым ускорением. Поскольку одновременно с этим константы скоростей первичной реакции распада этих В В также невелики, то стойкость их достаточно велика и определение ее не предусматривается в числе стандартных испытаний. Напротив, для нитроэфиров в некоторых практически реальных условиях, когда газообразные продукты превращения накапливаются в В В, ускорение распада может стать очень большим и максимальная скорость может в сотни и тысячи раз превосходить начальную скорость разложения. Так как наряду с этим и первичная реакция при распаде нитроэфиров протекает с большей скоростью, чем нитросоединений, то максимальная скорость и по абсолютному значению может становиться очень большой даже при низких температурах. Это может приводить к глубокому разложению вещества, а при больших количествах и к тепловому самовоспламенению. По этим причинам проблема химической стойкости нитроэфиров остается актуальной.
Значительное ускорение наблюдает
ся также в случае некоторых твердых ВВ, разлагающихся по топохимическому или цепному закону. Однако эти ВВ применяются лишь в виде маленьких зарядов в капсюлях-детонаторах и для теплового возникновения взрыва такие условия не являются благоприятными. Поэтому вопрос о стойкости этих ВВ не стоит столь остро, как в случае нитрбэфиров.
Для иллюстрации этих соотношений на фиг. 2.30 показано изменение скорости распада во времени для тетрила, нитроглицерина и гремучей ртути. По оси ординат отложено отношение скорости в момент времени t к ее начальному значению.
В тех случаях, когда ускорение распада очень велико, т. е. когда очень малые количества продуктов распада или примесей сильно
§ 4. Медленное химическое превращение конденсированных ВВ
105-
увеличивают скорость разложения, ускорение можно предотвратить. Это достигается добавлением к ВВ малых количеств таких веществ, которые быстро реагировали бы с ускоряющими примесями или продуктами распада. Такие вещества называют стабилизаторами; их широко применяют в современных бездымных порохах.
Выше при рассмотрении разложения тетрила было отмечено значительное (в десятки раз) увеличение скорости при переходе от твердого к жидкому агрегатному состоянию. Такое влияние агрегатного состояния имеет общий характер и наблюдалось для всех изучавшихся в этом отношении взрывчатых (и невзрывчатых) веществ (тетрил, тэн, гексоген, тринитрооксифенилметилнитрамин и др.). Оно приводит к тому, что ускорение разложения многих твердых плавящихся ВВ оказывается больше, чем при разложении тех же ВВ в жидком состоянии. Это наблюдается в том случае, когда образуются конденсированные конечные или промежуточные продукты распада, которые, растворяясь в исходном веществе, прогрессивно переводят его в жидкое состояние. Отсюда следует, что если по условиям работы важно обеспечить возможно большую стойкость В В, то не нужно приближаться к температуре его плавления,, а тем более переходить ее или добавлять к ВВ примеси, снижающие эту температуру. Если по условиям работы температура высока и не может быть понижена, то целесообразно применять ВВ с температурой плавления, лежащей выше температуры применения.
Влияние агрегатного состояния на скорость распада ВВ следует учитывать и при выборе температуры для сравнительного испытания различных ВВ на стойкость. Представим себе два ВВ, распадающиеся с одинаковой скоростью и в твердом и в жидком состоянии, но имеющие разные температуры плавления, например 130 и 140° С. Если проводить испытание при температуре 135° С, лежащей между температурами плавления этих ВВ, так, что одно вещество останется твердым, а другое будет жидким, то для жидкого получим гораздо большую скорость и будем считать его менее стойким. Этот вывод окажется ошибочным, так как при обычных температурах хранения оба В В будут находиться в твердом состоянии и скорость их распада будет одинаковой.
Именно в этом и заключается причина ошибочного заключения о меньшей стойкости сплавов тэна с тротилом, сделанного рядом исследователей, сопоставлявших скорость распада тэна (температура плавления 140° С) и указанных сплавов (температура плавления <130° С) при 135° С. Поэтому сравнительное испытание на стойкость следует проводить при такой температуре, при которой испытуемые В В находятся в одинаковом агрегатном состоянии. В частности, если сравнивать скорость распада тэна и его сплава с тротилом при температуре, лежащей выше температуры плавления, то оказывается, что тротил, как и следовало ожидать, не влияет отрицательно на скорость распада тэна.
Глава III
СТОЙКОСТЬ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
Стойкость взрывчатого вещества определяется скоростью изменения его физических и химических, а следовательно, и взрывчатых свойств с течением времени. Чем меньше эта скорость, тем больше стойкость ВВ и наоборот.
Различают два рода стойкости: физическую и химическую.
Физическая стойкость зависит от склонности взрывчатого вещества к физическим изменениям, происходящим под влиянием различных причин.
Химическая стойкость характеризуется скоростью изменения взрывчатого вещества в результате химических превращений, которые в нем происходят.
§ 1. ХИМИЧЕСКАЯ СТОЙКОСТЬ
1. Теория химической стойкости
Наибольшее практическое значение имеет химическая стойкость ВВ при сравнительно низких температурах, соответствующих обычным температурам хранения. Продолжительность ' хранения может быть очень большой и, если скорость или ускорение реакции велики, то ВВ может измениться в значительной степени, а при больших количествах разложение может даже привести к взрыву.
Различные процессы, происходящие при медленном химическом превращении ВВ, как было показано, можно свести к двум основным:
1) первичному распаду, скорость которого однозначно определяется химической природой вещества и температурой и не зависит от примесей и внешних условий;
2) самоускоряющемуся превращению.
Скорость первичного процесса, которая при данной температуре уменьшена быть не может, определяет максимальную возможную стойкость ВВ. Эту скорость в принципе можно рассчитать, если известны кинетические константы распада. Скорость первичной реакции сильно зависит от температуры, и при низких температу-
§ 1, Химическая стойкость
107
pax она обычно очень мала. Так, например, если принять для нитроглицерина по данным Робертсона в уравнении Аррениуса для константы скорости первичной мономолекулярной реакции
K=Be-EiRr. B==10i8,s4. £=43700 кал’моль,
то можно рассчитать период полураспада:
= —1п2.
11 К
Значения К и /7, при разных температурах приведены в табл. 3.1.
Таблица 3.1
Константы скорости К и периоды полураспада нитроглицерина
Температура °C Константа скорости А" сек.-1 Период полураспада лет
0 Ю-16,34 4,8-108
20 —13,95 2-106
40 1Q—10.93 1870
60 Ю-9.20 35
Нитроглицерин по сравнению с многими другими ВВ характеризуется относительно большой константой скорости мономолекуляр-ного распада. Несмотря на это, как видно из табл. 3. 1, даже для нитроглицерина эта скорость при обычных температурах хранения так мала, что сама по себе не может иметь практического значения.
Первичный процесс может, однако, играть косвенную роль, если и поскольку его продукты вызывают самоускоряющуюся реакцию.
Основным фактором, определяющим химическую стойкость, является возможность протекания и характеристики самоускоряю-щихся реакций. Скорость этих реакций зависит от температуры в меньшей мере, чем скорость первичной -реакции. Поэтому их удельный вес растет с понижением температуры. Наряду с этим скорость самоускоряющихся реакций в значительной мере может зависеть, как мы видели, от некоторых условий распада.
В принципе, зная скорость вторичных самоускоряющихся реакций при высоких температурах, можно было бы рассчитать ее величину и для низких температур. Однако практически такой расчет не реализован потому, что характеристики вторичных реакций и влияние на них различных факторов количественно еще недостаточно изучены. Вследствие этого о скорости вторичных реакций при
108
Гл. Ill, Стойкость взрывчатых веществ
хранении различных В В обычно судят на основании сравнительного экспериментального определения суммарной скорости распада при температурах, возможно близких к температурам хранения.
В отличие от первичной реакции на скорость вторичных самоус-коряющихся реакций можно влиять. Это достигается очисткой ВВ от примесей, способствующих развитию вторичных реакций, и введением в ВВ таких веществ, которые связывают продукты, ускоряющие распад.
Известны и широко применяются на практике два способа обеспечения максимальной стойкости нитроэфиров. Один из этих способов заключается в тщательной очистке нитроэфира от остатков кислотной смеси, применявшейся при нитрации, а также от нестойких примесей, которые могут образоваться при нитрации в результате побочных реакций. Нестойкие примеси, разлагаясь быстрее нитроэфира, образуют окислы азота, которые с водой дают азотную и азотистую кислоты. Эти кислоты, так же как остатки нитрующей смеси, не отмытые от нитроэфира, ускоряют его распад, особенно, если в нитроэфире присутствует вода и возможен гидролиз.
Второй способ обеспечения стойкости, дополняющий первый, заключается в добавлении к ВВ небольших количеств стабилизаторов— таких веществ (дифениламин, алкил-арил-мочевины и др.), которые в состоянии быстро реагировать с образовавшимися окис-лами азота н, связывая их, предотвращать образование кислот. В этом случае ускоряющееся разложение не наступает до тех пор, пока не исчерпается стабилизатор.
В результате освобождения В В от примесей, способствующих самоускорению распада, и устранения при помощи стабилизаторов тех продуктов распада, которые это ускорение вызывают, общая скорость распада может быть уменьшена до минимума. Этот минимум соответствует скорости первичной мономолекулярной реакции при данной температуре.
62. Общая характеристика методов экспериментального определения химической стойкости
Ввиду сложной зависимости суммарной скорости распада ВВ от температуры для характеристики стойкости было бы желательно определять эту скорость непосредственно при низких температурах. Однако такое определение затрудняется тем, что скорость превращения при низких температурах крайне мала и быстро измерить ее затруднительно. Поэтому для установления стойкости обычно определяют скорость распада при повышенных температурах, при которых распад происходит быстрее. Кроме того, для сокращения времени испытания ограничиваются определением скорости только начальной стадии превращения. По температурной зависимости скорости можно путем экстраполяции рассчитать ее значение при любой интересующей исследователя температуре.
§ 1. Химическая стойкость
109
Достоверность такого метода оценки стойкости существенно снижается двумя обстоятельствами. Как было отмечено выше, изменение температуры превращения может сопровождаться изменением не только скорости, но и направления реакции. Поэтому простейший способ экстраполяции, основанный на обычной зависимости константы скорости от температуры K—Be~EIRT, оказывается мало надежным, особенно в тех случаях, когда экстраполируют на большие изменения температуры.
Второй слабой стороной оценки стойкости по начальной скорости превращения является то, что при этом не учитывается характер его дальнейшего течения. В то же время для разных ВВ превращение может сильно различаться, как мы это видели на примере нитроглицерина и нитраминов, в первую очередь по величине самоускорения и по влиянию на это ускорение некоторых условий распада и примесей. Чем больше эти различия, тем затруднительнее при сопоставлении начальных скоростей превращения судить о дальнейшем его течении, в частности, о соотношении максимальных скоростей и времен их достижения.
В силу этих причин для надежного определения стойкости ВВ необходимо знать кинетику превращения на всем его протяжении или, по крайней мере, на значительной его части и притом при температурах и условиях, возможно близких к температурам, которые имеют место на практике. Это в особенности относится к новым по химической структуре ВВ, тип распада которых неизвестен. Зная скорость превращения как функцию времени, можно определить, какая часть вещества разложится за время, в течение которого должно храниться В В, и установить, когда В В придет в негодность. Существенно также, чтобы при хранении не были достигнуты такие большие скорости превращения, при которых взрыв может возникнуть по тепловому механизму.
К сожалению, реализовать такое определение стойкости очень сложно, так как испытания при низких температурах требуют большого времени. Поэтому в условиях производства и применения обычно удовлетворяются быстрыми, но менее надежными пробами, характеризующими количественно, а иногда даже только качественно начальную скорость химического превращения ВВ.
Для повышения надежности испытания стремятся насколько возможно снизить температуру, при которой оно проводится, приближая ее к температурам хранения. Однако здесь мы встречаемся •с уже отмеченным выше затруднением: количество вещества, разлагающегося за небольшой интервал времени, по которому можно судить о скорости распада, становится очень малым, трудно доступным измерению и характеризует только самый начальный этап распада.
В силу изложенных причин в практике определения стойкости проявляются противоположные тенденции:
по
Гл. III. Стойкость взрывчатых веществ
Фиг. 3. 1. Два типа развития распада ВВ во времени.
1) проведение опыта при высокой температуре, далекой от обычной температуры хранения и применения ВВ, что позволяет сравнительно быстро достигнуть значительных степеней распада, соответствующих реально опасным, например проба на вспышку или на появление бурых паров при нагревании иитроэфиров при 132РС;
2) применение низкой температуры, в связи с чем для обеспечения малой продолжительности испытания пользуются очень чувствительными методами, позволяющими обнаружить ничтожные количества продуктов распада, например испытание нитроэфиров при 65—80Q С на образование окислов азота, обнаруживаемых иодокрах-малыюй бумажкой.
В обоих приведенных примерах испытание по существу является качественным или, точнее, полуколи-чественным, так как хотя мы и фиксируем время достижения той или иной степени распада, но эта степень определяется качественно и в большинстве случаев субъективно, на глаз — по изменению цвета реактивной бумажки или газа над веществом и т. п.
Этот недостаток в известной мере устранен в тех
методах, где степень распада определяют количественными физическими или химико-аналитическими методами (например, описанная ниже проба на отщепление окислов азота, иногда называемая пробой Бергмана — Юнка).
Существующие методы определения химической стойкости могут быть разделены на две группы. В методах первой группы стойкость характеризуют только одной точкой кривой, изображающей ход реакции во времени. При этом определяют или время tt, необходимое для образования определенного количества Xj продуктов распада (фиг. 3. 1, а) или количество х2 продуктов распада, образующихся по истечении определенного времени t2 (фиг. 3. 1,6). В методах второй группы количественно прослеживают течение распада от его начала до достижения некоторой более или менее значительной степени разложения и получают часть кривой, изображающей ход реакции во времени.
Большинство применяемых на практике как полуколичествен-ных (пробы с реактивными бумажками), так и количественных
§ 1. Химическая стойкость
Ш
(проба па отщепление окислов азота, проба в сосуде Дюара и др.) проб на стойкость принадлежит к первой группе. Это определяется в первую очередь большей простотой таких методов. Вместе с тем методы первой группы имеют существенные недостатки, особенно когда речь идет об определении самых начальных ступеней распада. В этом случае обычно нельзя установить происхождения продуктов распада — получились ли они от распада взрывчатого вещества или от распада нестойких примесей, а также судить об их влиянии на дальнейшее течение распада и о том, насколько он будет практически опасен.
Для иллюстрации сказанного на фиг. 3. 1 приведены реально возможные кривые течения распада двух взрывчатых веществ. Если в качестве меры стойкости мы будем определять количество вещества, разложившегося за некоторый промежуток времени t2, то придем к выводу, что более стойким является вещество I, в то время как действительное соотношение стойкостей, как показывает дальнейший ход распада, обратное.
Поэтому гораздо более надежными являются методы второй группы. Однако количественное изучение хода распада сопряжено со значительными трудностями. Основная из них заключается в том, что нужно надежно устанавливать количество распавшегося вещества. Химико-аналитические методы применительно к большинству ВВ, представляющих собой более или менее сложные органические соединения, не разработаны. При количественном же определении какого-либо из газов распада нет уверенности, что количество этого газа является мерой количества разложившегося вещества. Точно так же отсутствует эта уверенность при использовании общего количества образующихся газов в качестве характеристики течения распада, как это делается в манометрических методах.
При изменении условий распада (температуры, стадии распада) может изменяться, как мы видели, состав газов, а следовательно, могут изменяться и реакции, их производящие. Поэтому итоговое количество газов, являясь результатом весьма сложной совокупности реакций, не всегда может служить простой кинетической характеристикой течения распада. Если все же количество газов, образующихся за определенное время при данной температуре, широко используют как меру химической стойкости ВВ не только на практике, но и при научных исследованиях, то это объясняется прежде всего простотой и универсальностью метода, так как все взрывчатые вещества при разложении образуют газы.
Следует добавить, что обычно по тем же соображениям упрощения методики количество газов определяют по повышению их давления, проводя опыт при постоянном объеме сосуда; это, несомненно, хуже объемного определения, так как изменение давления во многих случаях оказывает влияние на скорость распада вследствие автокатализа газообразными продуктами реакции или взаимодей
112
Гл. III. Стойкость взрывчатых веществ
ствия их с конденсированным веществом; на практике же разложение обычно протекает без повышения давления.
До сих пор, говоря о химическом превращении ВВ в связи с его стойкостью, мы имели в виду распад ВВ. Однако химические превращения ВВ при хранении не обязательно связаны с распадом его молекулы. Они могут представлять собой и другие типы реакций, например реакции обменного разложения.
Так, в предохранительных аммонитах, содержащих наряду с аммиачной селитрой хлористый натрий, происходит взаимодействие этих солей согласно уравнению
NH4NO3+NaCl^NH4Cl + NaNO3,
•особенно быстрое, если ВВ содержит влагу. В результате этого аммиачная селитра частично превращается в хлористый аммоний, что приводит к изменению взрывчатых свойств аммонита и, в частности, его предохранительных свойств.
В заключение добавим, что вопрос химической стойкости особенно актуален в.случае бездымных порохов. Это обусловлено рядом причин. Во-первых, основные составные части этих порохов — нитроклетчатка и жидкие нитраты многоатомных спиртов — по своей химической природе обладают ограниченной стойкостью, причем нитроклетчатка как высокомолекулярное твердое неплавя-щееся вещество естественного происхождения с трудом поддается очистке от примесей, понижающих ее стойкость. Во-вторых, характер распада нитроэфиров — резко самоускоряющийся, особенно при низких температурах, так что разложение больших масс порохов может развиться до самовоспламенения и взрыва. В начале широкого применения бездымных порохов ряд таких случаев имел место (катастрофы на броненосцах французского флота «Иена» и «Либерте» и др.). В-третьих, бездымные пороха имеют военное назначение, поэтому они подлежат длительному хранению в виде мобилизационного запаса. Наконец, от порохов (в отличие от взрывчатых веществ) требуется строгое баллистическое постоянство действия, разложение же может значительно отразиться на тех свойствах пороха, которые определяют это действие, в первую очередь на скорости горения.
Методов определения химической стойкости порохов предлагалось и применялось очень много. Это связано с большим значением вопроса и со сложностью явлений, определяющих стойкость. По мере того как выяснялась недостаточная надежность существовавшего метода, разрабатывался новый, казавшийся более достоверным. В настоящее время насчитываются десятки предложенных методов, но ни один из них нельзя считать вполне удовлетворительным, универсальным и бесспорным.
Ввиду отсутствия единого надежного метода обычно в ответственных случаях применяют не один, а несколько методов испыта-
$ 1. Химическая стойкость
113
ния и по совокупности результатов составляют суждение о стойкости.
Описание и анализ всех методов не входят в нашу задачу, поэтому ниже рассмотрим лишь некоторые наиболее распространенные пробы на стойкость.
3. Основные методы (пробы) для определения химической стойкости
1. Проба на вспышку характеризуется наиболее высокой
по сравнению с другими температурой нагрева взрывчатого вещества и поэтому малой продолжительностью. Эта проба выполняется в двух вариантах. По первому варианту небольшую навеску ВВ
(0,1—0,5 а) нагревают в пробирке, помещенной в бане с жидкостью, температуру которой повышают с определенной скоростью. Устанавливают ту температуру бани, при которой происходит вспышка. По второму варианту навеску взрывчатого вещества выдерживают при постоянной температуре и устанавливают время задержки вспышки, иногда при нескольких температурах.
Результаты этого испытания дают возможность судить о стойкости лишь в том случае, если температура вспышки или время задержки ее оказываются меньше, чем для чистого, заведомо стойкого (стандартного) вещества. Это означает, что испытуемый образчик обладает пониженной стойкостью. Если же различия при определении температуры вспышки не получается, то это еще не позволяет заключить, что стойкость испытуемого и стандартного вещества одинаковы.
При испытании разных ВВ проба может обнаружить только резкие различия в стойкости.
2. Проба на появление бурых па-
ров также характеризуется высокой температурой нагрева: 132 или 135° С. Определенную навеску вещества нагревают в неплотно закрытом стаканчике или длинной пробирке, закрытой стеклянным колпачком (фиг. 3.2), в контакте с воздухом до появления видимых на глаз бурых паров (двуокись азота). Пироксилиновые пороха со стабилизатором выдерживают пробу при 132° С в
Фиг. 3.2. Пробирка для пробы , на появление бурых паров.
/—пробирка, 2—порох, 3— стеклянный кол-
пачок.
течение 5—6 час.;
нитроглицериновые пороха без стабилизатора дают бурые пары через 20—30 мин.; такие же пороха, содержащие 1 % централнта,— не менее чем через 30 мин.; нитроглицериновые пороха с 3% центра-: лита выдерживают пробу в течение 4—6 час.
К недостаткам этой пробы следует отнести ее ограниченную
чувствительность и плохую воспроизводимость результатов. Проба
114
Гл. III. Стойкость взрывчатых веществ
плохо моделирует условия хранения; в частности, из-за высокой температуры опыта и негерметичности сосуда влага удаляется из пороха; вследствие этого не проявляется ее возможное гидролитическое действие; кроме того, если порох содержит такие добавки,' которые связывают окислы азота только в присутствии воды, то действие этих добавок не проявится. Наконец, при испытании некоторых низкокалорийных порохов концентрация бурых паров нарастает очень медленно и окраска долгое время остается очень слабой.
По всем этим причинам проба на бурые пары в ее первоначальном- виде в настоящее время исключена у нас из числа проб, предусматриваемых соответствующими стандартами.
Вариантом пробы на бурые пары является проба Власова. В отношении условий выполнения (размеры стаканчика, навеска пороха, температура испытания) эта проба аналогична лакмусовой пробе Вьеля (см. ниже), но отличается тем, что в крышке стаканчика имеется отверстие диаметром 2 мм. Назначение отверстия — обеспечить возможность удаления летучих продуктов распада, при том в такой степени, в какой это имеет место при повторной пробе Вьеля.
Испытание по пробе Власова для артиллерийских баллистит-ных порохов производится при If 5° С. При этом пороха не должны давать бурых паров ранее чем через 35 час.
Минометные баллиститные пороха испытывают по пробе Власова при 106,5° С, причем они должны выдерживать испытание не менее 25 час. При этой температуре артиллерийские баллиститные пороха дают бурые пары через 120—160 час.
Для испытания ВВ проба на бурые пары применяется под названием железнодорожной пробы. Это название она получила в связи с тем, что в Германии к перевозкам по железным дорогам допускают только вещества, выдержавшие пробу на бурые пары.
Испытание состоит в том, что навеску 10 г динамита или иного азотсодержащего- В В нагревают в неплотно закрытом стаканчике в термостате при 75° С в течение 48 час.; при этом бурых паров окислов азота появляться не должно.
3. Проба на отщепление окислов азота (проба Бергмана—- Юнка) производится при 132F С. Степень разложения по истечении определенного промежутка времени определяется методами количественного анализа.
Навеску пироксилина (2 г) или пороха (5 г) нагревают в течение 2 час. в пробирке с притертой пробкой, снабженной насадкой, содержащей воду для поглощения окислов жазота (фиг. 3.3). После опыта при охлаждении трубки вода засасывается внутрь пробирки. Затем в пробирку доливают воду до определенного объема, тщательно взбалтывают, отфильтровывают и определяют в определенной части фильтрата количество связанного азота в виде
§ 1. Химическая стойкость
115
NO газово-объемным методом *. Допустимым пределом для пироксилина № 1 считают 3,5 см3 окиси азота на 1 г, для коллоксилина
2,5 и коллодионного хлопка 3 см‘)г. Для порохов (при продолжи-
тельности нагрева 5 час.) количество окнслов азота составляет G—7 см3]г (артиллерийские баллиститные пороха) и 5—9 см3!г (минометные баллиститные пороха).
4. Лакмусовая проба (проба Вьеля) выполняется при 106,5° С, реже при 115° С и заключается в нагреве навески пороха, помещенной в термостат в герметически за--П-| крытом стаканчике со стандартной синей
/ к лакмусовой бумажкой (фиг. 3. 4). Наблюде-
\ / ние за изменением цвета бумажки ведется
через стеклянное окно термостата каждые полчаса. Обычно в термостат устанавливают несколько стаканчиков с образчиками. Для обеспечения одинаковой температуры
Фиг. 3. 3. Пробирка для пробы Бергмана—Юнка на
отщепление окис-лов азота.
Фиг. 3. 4. Стаканчик для лакмусовой пробы с навеской пороха п индикаторной бумажкой.
всех образчиков этажерка, в отверстие которой вставлены стаканчики, приводится во вращение. Раньше эту пробу применяли также для испытания пироксилина. Удовлетворительный по стойкости пироксилин давал фиолетовое окрашивание не ранее чем через 2 часа, розовое—через 4—5 час., красное—через 6—7 час.
* В усовершенствованном варианте пробы применяют такую форму пробирки, чтобы капли конденсирующейся в верхней части воды не могли попасть на горячее испытуемое ВВ; помимо этого, объем пробирки увеличен, чтобы кислорода воздуха хватало для окисления окислов азота до NO2; наконец, определение смеси азотной и азотистой кислот в воде производят более простым иодид-иодатным способом.
116
Гл. III. Стойкость взрывчатых веществ
По истечении 7 час. испытание прекращали. Баллиститные артиллерийские и минометные пороха выдерживают испытание по этой пробе не менее 7 час.
Помимо описанной простой лакмусовой пробы, для испытания порохов применяют еще так называемую повторную лакмусовую пробу до 1 часа. Особенностью ее является последовательное применение в течение ряда дней навески вещества, подвергавшейся испытанию накануне. Испытание продолжают до тех пор, пока время до покраснения лакмусовой бумажки не уменьшится до 1 часа. Сумма часов, полученных при всех испытаниях, служит мерой стойкости пороха.
Стойкие пороха дают при повторной лакмусовой пробе следующие времена: баллиститные артиллерийские 130—180 час., пироксилиновые— не менее 90—Г10 час. в зависимости от марки.
При сокращенном варианте повторной лакмусовой пробы не доводят испытание до 1 часа, а ограничиваются десятью повторными испытаниями *. Баллиститные артиллерийские пороха по повторной сокращенной лакмусовой пробе должны давать суммарное время не менее 65 час., баллиститные минометные — не менее 30 час.; пироксилиновые артиллерийские — не менее 60 час., пироксилиновые пористые — не менее 50 час.
Лакмусовая проба в настоящее время является у нас основной для испытания на стойкость как пироксилиновых порохов, так и порохов баллиститного типа. Ее использование осложняется рядом осо. бенностей порохов на труднолетучем растворителе: появление красного окрашивания бумажки происходит очень постепенно и нерезко, зерна или частицы пороха склонны склеиваться при повышенных температурах по мере разложения, перегонка летучих иногда окрашенных составных частей в верхнюю часть сосудика затрудняет наблюдение за изменением цвета бумажки и др.
5. Проба Билля заключается в нагреве образчика испытуемого вещества в масляной бане, имеющей температуру 135° С, с непрерывным пропусканием углекислоты, следовательно, при удалении летучих продуктов распада (фиг. 3.5). Углекислоту с продуктами распада пропускают затем над раскаленной восстановленной медью. Окислы азота восстанавливаются при этом до элементарного азота. После пропускания над нагретой окисью меди (окисление СО и пр. до СО2) газы собирают над раствором щелочи, которая поглощает углекислоту. Объем азота периодически измеряют; он и служит мерой количества прореагировавшего вещества.
6. Проба на потерю в весе в различных вариантах, отличающихся главным образом температурой опыта (от 115 до 50°, обычно 95 или 75°), состоит в нагреве навески пороха в термостате в открытом стахсанчике для взвешивания. Через определенные интервалы времени (например, через 10 суток при 75°, через
* Если время окрашивания лакмусовой бумажки сократится до 1 часа ранее десятого дня, то испытание на этом заканчивают.
§ 1. Химическая стойкость
117
сутки при 95°) порох взвешивают и строят график, откладывая по оси абсцисс время, а по оси ординат — убыль веса в процентах.
Фиг. 3. 5. Схема испытания по пробе Билля.
Испытание заканчивают при наступлении резкого увеличения по-
тери в весе, выражающегося в отчетливом изменении наклона кри-
вой (фиг. 3.6). Продолжительность нагрева служит мерой стойкости. По варианту пробы, при котором навеска пороха нагревается в сосуде, сообщающемся с атмосферой капилляром диаметром 1 мм, при температуре 95° это время должно быть не менее 8—10 суток (в зависимости от марки пороха).
7. К числу манометрических проб принадлежит проба О б ер м юл л ер а, при которой
Фиг. 3.7. Прибор для пробы Обер мюллера.
1—стеклянная пробирка со шлифом, 2—изогнутая трубка со шлифом,
3—ртутный манометр, 4—кран к вакуум-насосу, 5—уравнительная груша, баня.
Фиг. 3.6. Кривая потери в весе пороха при иагреве.
ртутным манометром непосредственно измеряют давление газообразных продуктов разложения навески ВВ (2 г), разлагающегося
118
Гл. III. Стойкость взрывчатых веществ
в постоянном объеме. Прибор показан на фиг. 3. 7. Реакционный сосуд перед опытом откачивают. Кривая, изображающая давление газообразных продуктов разложения как функцию времени, служит характеристикой стойкости.
Вакуумная проба, применяемая в США, по условиям проведения опыта близка к пробе Обермюллера. Образчики по 5 г ВВ (для очень чувствительных или мощных ВВ берут 1 г и меньшее время нагревания) нагревают параллельно при температуре 100, 120 и 150° в течение 40 час. в откачанных (остаточное давление 5 мм) пробирках, соединенных с капиллярными ртутными манометрами. Количество выделившихся газов и изменение этого количества в зависимости от температуры характеризуют стойкость ВВ. Если количество выделившихся газов в ходе опыта достигнет 11 см3, то испытание прекращают. Данные, полученные при таком испытании для ряда ВВ, приведены в табл. 3. 2.
Таблица 3. 2
Характеристика химической стойкости некоторых ВВ по вакуумной пробе
Взрывчатое вещество На- веска Показатели химической стойкости по вакуумной пробе
с л/3 час. см3 час. СМ3 час.
ЮС )° с I2C ° с 15С ° с
Аммиачная селитра 5,0 — — 0,3 40 0,3 40
Этилендинитрамин 3,0 0,5 40 1,5 40 11 24
Нитрогуаиидии 5,0 0,4 40 0,5 40 — —
Диэтилеигликольдииитрат 1,0 0,8 40 1,3 8 — —
Нитроглицерин 1,0 11 16 — —
Эритриттетранитрат 1.0 11 16 — - —
Тэн 5,0 0,5 40 н 40 — —
Дипентаэрнтритгексапитрат 5,0 3,7 40 П 16 —
Маннитгексаиитрат 1,0 11 16 — --
Нитроклетчатка (13,3% N) 5,0 0,9 24 и 16 —
Гексоген 5,0 0,7 40 0,9 40 2,5 40
Октоген 5,0 •“-* 0,4 40 0,6 40
Тротил 5,0 0,1 40 0,4 40 0,7 40
Пикриновая кислота 5,0 0,2 40 0,5 40 —— ——
Пикрат аммония 5,0 0,2 40 0,4 40 0,4 40
Тетрил 5,0 0,3 40 1,0 40 11 12
Гексил 5,0 — 0,4 40 *—
£ 1. Химическая стойкость
119
Проба Талиани также является видоизменением пробы Обермюллера. Основное отличие пробы Талиани заключается в том, что эвакуацию сосуда перед опытом не производят; кроме того, прибор имеет парафиновый затвор, предотвращающий диффузию газообразных продуктов разложения в холодные части измерительной системы (фиг. 3. 8). Обычно разложение ведется до давления 100 мм рт. ст. Время, необходимое для этого, рассматривают как меру стойкости.
Вариант манометрической пробы был разработай Хайдом, Бекером и Дитмаром. Особенностью метода является применение низкой (73; С) температуры иагрева. Чтобы получить при этом в течение ие слишком большого промежутка времени изменение давления, достаточное для точного измерения, сосуд н соединенную с ним манометрическую трубку берут малого объема, а навеску испытуемого взрывчатого вещества — большую: 42 г. Отсчет давления, как правило, производят ежедневно. Характеристику стойкости удается определить за несколько педель. На фиг. 3.9 показаны кривые, полученные при испытании нитроклетчатки и пороха по этому методу, а на фиг. 3. 10— тэна и гексогена. В случае нитроклетчатки (кривая 1 на фиг. 3. 9) сначала наблюдается некоторое понижение давления, очевидно, за счет взаимодействия ВВ с кислородом воздуха; затем идет участок медленного изменения давления, после чего наступает резкое ускорение, типичное для азотнокислых эфиров спиртов и углеводов. Для пороха (кривая 2) начало ускоренного разложения наступает позже, так как задерживается со
держащимся в нем стабилизатором. Ускорение разложения совпадает с появлением видимых на глаз бурых паров.
Большая стойкость тэна при низкой температуре испытания подтверждается этими опытами (см. фиг. 3.10). Кривая для гексогена (см. фиг. 3.10) идет высоко, ио ускорения в пределах 100 дней не наблюдается. Образовавшиеся газы являются, по-видимому, результатом разложения примесей, пе ускоряющих распад основного вещества. Нитросоединения ароматических углеводородов дают ничтожное выделение газов, в случае тротила за 100 дней давление достигает всего 20 мм рт. ст.
8. Определение концентрации водородных ионов является сравнительно новой пробой, применяемой в тех случаях, когда при разложении образуются кислые продукты. Испытание выполняют следующим образом.
Девять образчиков ВВ помещают в специальных пробирках в термостат, имеющий повышенную температуру (обычно 110°С). Через каждый час после начала нагрева вынимают по одной пробирке. После 30 мин. охлаждения на воздухе содержимое пробирки взбалтывают с дистиллированной водой, в которой после доведения до метки определяют количество кислых продуктов разложе-
Фиг. 3. 8. Прибор для пробы Талиани.
/—пробирка для ВВ со шлифом, 2—кран для выхода воздуха при нагреве, 3—парафиновый затвор, 4—ртутный манометр-
120
Гл. III. Стойкость взрывчатых веществ
ния по концентрации водородных ионов. Мерой стойкости является изменение pH. Автор пробы Ганзен рекомендует для характеристики стойкости пороха применять сумму pH всех девяти проб, которая для стойкого пороха должна быть не меньше 30.
Фиг. 3.9. Изменение давления со временем при испытании нитроклетчатки (/) и пироксилинового пороха (2) по Хайду, Бекеру и Дитмару.
9. Иодокрахмал ь пая проба (проба Абеля) является одной из старейших проб на стойкость; ее применяют главным образом для контроля производства нитроглицерина и нитроглицериновых взрывчатых веществ. Проба основана на реакции между окис-
Фиг. 3. 10. Изменение давления со временем при испытании т->на и гексогена.
лами азота, образующимися при распаде ВВ в контакте с воздухом, и иодистым калием, которым совместно с крахмалом пропитана индикаторная, так называемая иодокрахмальная бумажка.
Навеску нитроглицерина (3,2 г—2 см3) помещают в пробирку определенных размеров. Пробирку закрывают резиновой пробкой, через которую проходит стеклянная палочка с платиновым или стеклянным крючком. На крючок подвешивают полоску стандартной иодокрахмальной бумажки. Перед введением в пробирку ниж-
£ 1. Химическая стойкость
121
Фиг. 3. 11. Пробирка (а) и баня (б) для испытания ВВ на стойкость по иодокрахмальиой пробе.
нюю половину индикаторной бумажки смачивают раствором глицерина в воде. Пробирку ставят в водяную баню, в которой поддерживают температуру 75° С (фиг. 3. 11). При разложении нитроглицерина в этих условиях образуется двуокись азота, которая реагирует с иодистым калием, выделяя свободный иод, дающий с крахмалом на границе смоченной и несмоченной частей бумажки буроватую полоску.
Нитроглицерин, предназначенный для приготовления динамитов, считают выдержавшим испытание, если полоска на индикаторной бумажке появляется не ранее чем через 15 мин. К нитроглицерину, применяемому для изготовления порохов, предъявляются более жесткие требования: он должен выдерживать испытание по иодокрахмальиой пробе при 72° С в течение 30 мин.
Испытание желатии-дииамитов отличается предварительной подготовкой, заключающейся в том, что навеску ВВ осторожно растирают с тальком. Если применять динамит в виде сплошного куска, то окис-лы азота, выделяющиеся внутри желатины, будут очень медленно диффундировать через слой динамита в воздух и испытание покажет преувеличенную стойкость. При растирании же с тальком динамит получает порошкообразную структуру, выделяющиеся окислы азота попадают иепосредствеиио в воздух и могут воздействовать иа бумажку. Динамит считается выдержавшим испытание? если полоска иа бумажке появляется не ранее 10 мин.
Основное преимущество иодокрахмаль-ной пробы заключается в простоте и быстроте выполнения. В то же время результаты этой пробы довольно субъективны и в зна
чительной степени зависят от летучести и влажности вещества, от примесей *, а также от целого ряда трудно контролируемых факторов (условия хранения бумажки, погода, величина смоченной части бумажки, чистота воздуха в отношении окислов азота и др.).
На той же реакции между иодом и крахмалом, сопровождающейся синим окрашиванием, основана проба Янова, предназначенная для быстрой оценки степени разложения пороха. Пробу выполняют следующим образом.
К навеске 20 г пороха добавляют 50 мл дистиллированной воды и сосуд с порохом и водой помещают на определенное время (от 5 до 15 мин. в зависимости от размеров частиц) в баню с кипящей водой. После нагревания содержимое взбалтывают, затем 10 мл его помещают в пробирку, добавляют туда растворы йодистого калия
* Например, образчик гексогена, кривая испытания которого манометрическим методом (стр. 120) свидетельствует о высокой стойкости, давал при испытании по иодокрахмальиой пробе малое время до появления полоски. Это обусловливалось наличием примесей, так как после нагрева гексогена в течение некоторого времени при ЮЩ'С показания иодокрахмальяой пробы резко увеличились.
122
Гл. III. Стойкость взрывчатых веществ
п крахмала и в течение 5 мин. наблюдают за изменением цвета; окрашивание содержимого пробирки в синий цвет указывает на нестойкость пороха.
10. Проба нагреванием навески пороха. Приме няемая в Англии проба нагреванием навески пороха (50 г) в со суде Дюара при 80° С занимает особое положение по способу оцен ки хода разложения. В сосуд вставляют термометр, шарик кото рого помещают в середине навески пороха. Вследствие экзотерми
Давление NO Злгхрт.сг.
Фиг. 3. 12. Зависимость времени полного расплавления .метилендинитрамина без добавок (7) и с добавкой 2,6% пикриновой кислоты (2) от температуры.
Фиг. 3. 13. Влияние инертного газа СО2 на оптическую плотность окиси азота.
1—оптическая плотность окиси азота без добавок, 2—оптическая плотность окиси азота после добавления углекислого газа под давлением
I ат.
чности реакции разложения температура пороха поднимается. Когда повышение температуры достигает 2°, испытание прекращают; время нагрева служит мерой стойкости пороха. Хороший кордит выдерживает эту пробу в течение 500—600 час.
11. Определение времени полного расплавления. Для твердых ВВ, разлагающихся с заметной скоростью вблизи температуры плавления и образующих при этом конденсированные продукты распада, растворимые в исходном веществе, американские исследователи предлагали характеризовать стойкость и действие стабилизирующих добавок по времени полного расплавления. Пробу ВВ (около 2 мг) помещают в обогреваемый столик микроскопа и при определенных температурах, лежащих ниже температуры плавления, устанавливают время полного расплавления (исчезновения кристаллов). Стабилизирующие добавки повышают это время. Чем больше повышается время, тем сильнее стабилизирующее действие добавки. В качестве примера на фиг. 3.12 приведена зависимость времени полного расплавления
<j I. Химическая стойкость
Фиг. 3. 14. Прибор для испытания стойкости по Ламбрею.
1, 2—трубки, 3—кварцевые окошечки,
4— кран.
от температуры для чистого метилендинитрамина (кривая 1) н для метилендинитрамина с добавкой 2,6% пикриновой кислоты (кривая 2), которая как кислота способна стабилизировать нитрамины алифатического ряда.
12. Проба Ламбрея. Как было указано ранее, существенным недостатком всех проб на стойкость является необходимость применения высоких (по сравнению с обычной температурой хранения) температур испытания. Отсюда понятно стремление исследователей к возможному снижению температуры испытания. Попытка разработки такой пробы была осуществлена Ламбреем, который использовал для определения стойкости предложенную им методику определения оптической плотности окиси азота при очень малых давлениях (до 0,015 мм рт. ст.). Кроме того. Ламбрей установил, что оптическая плотность окиси азота сильно возрастает при добавлении ших количеств инертных например, углекислого (фиг. 3.13). Благодаря явлению можно с большой
боль-газов, газа
этому
точностью измерять незначительные
концентрации окиси азота.
Для проведения пробы Ламбрея взрывчатое вещество в количестве около 8,5 г помещали в трубку 1 (фиг. 3. 14), которая плоским шлифом соединена с трубкой 2 длиной 60 мм с кварцевыми окошечками 3. Соединения трубок и присоединение окошечек герметизировали при помощи пицеина. Кран 4 закрывал всю систему. Перед испытанием систему откачивали в течение 120 час. для удаления газов, адсорбированных в значительном количестве, особенно в случае пироксилина, частицами ВВ. Затем кран 4 закрывали и прибор помещали в термостат на необходимое время, по истечении которого фотографировали спектр поглощения газов, содержащихся в трубке 2, предварительно добавляя в случае необходимости углекислоту. Полученные для различных образчиков нитроклетчатки при трех температурах кривые приведены на фиг. 3. 15.
Из кривых видно, что сначала образование окиси азота происходит сравнительно очень быстро, а затем замедляется. Начальное быстрое разложение Ламбрей связывает с присутствием в нитроклетчатке незначительных примесей (полное разложение этих примесей дает 0,435 мг NO на 1 кг нитроклетчатки). Возможно, однако, что начальное быстрое выделение окиси азота происходит за счет продуктов разложения, абсорбированных нитроклетчаткой. Разложение, протекающее в дальнейшем, представляет собой, по
124
Гл. III. Стойкость- взрывчатых веществ
мнению Ламбрея, разложение самой нитроклетчатки. При 43° С количество образуемой окиси азота имеет порядок 0,65 мкг в день на 1 кг нитроклетчатки, что соответствует распаду 2,4- 10“® вещества. Для распада 0,1% нитроклетчатки при такой скорости потребуется 1140 лет. Для тэна скорость разложения при 43° находится на пределе возможности измерения.
Результаты испытаний по пробе Ламбрея, как он и сам указывает, нельзя считать вполне надежными, так как при определении
Фиг. 3. 15. Образование окиси азота при нагревании нитроклетчатки по Ламбрею.
столь малых количеств окислов азота большую роль могут играть всякие побочные факторы, как например поглощение окиси азота пицеином и смазкой крана, абсорбция их пироксилином и т. д.
Несомненный интерес для изучения стойкости ВВ представляет применение радиохимических методов, которые дают возможность с большой точностью определять ничтожные количества вещества. Применение таких методов позволило бы проводить определение скорости распада ВВ при столь низких температурах, при которых распад не может быть прослежен иными применявшимися до настоящего времени методами.
Определение стойкости радиохимическими методами можно в принципе осуществить, приготовив соответствующее ВВ, например нитроэфир, меченый долгоживущим радиоуглеродом С!4; активность такого ВВ будет иметь порядок 2- 108 импульсов/лшм г. Если при распаде ВВ образуются углеродсодержащие легко летучие промежуточные продукты, то после их отделения и сжигания получим углекислый газ С‘4О2, который легко перевести в карбонат бария ВаС14О3. Активность карбоната может быть определена при помощи торцевого счетчика. 1 мкг вещества будет обладать активностью порядка 200 импульсов в минуту. Счетчик позволяет надеж
§ 2. Физическая стойкость
125
но определить в 20 раз меньшую активность. Скорость термического распада нитроглицерина, рассчитанная путем экстраполяции, составляет, как мы видели, при 40° около микрограмма на грамм в сутки и может быть доступна измерению за сравнительно короткие сроки.
Радиоуглерод может быть введен также в стабилизатор типа централита, который при взаимодействии с продуктами распада В В образует углекислый газ С14О2; скорость его образования будет в таком случае служить показателем скорости распада ВВ.
§ 2. ФИЗИЧЕСКАЯ СТОЙКОСТЬ
Физическая стойкость характеризуется склонностью ВВ к физическим изменениям, самопроизвольным или происходящим под влиянием внешних причин. Природа и механизм этих изменений для разных ВВ могут быть различными. Приведем некоторые примеры.
Оксиликвиты физически нестойки вследствие быстрого испарения содержащегося в них жидкого кислорода.
Черный порох, содержащий водорастворимую калиевую селитру, нестоек по-отношению к воде.
Нитроглицериновый порох при очень низких температурах приобретает хрупкость; это приводит к растрескиванию или дроблению пороховых элементов при выстреле и, как следствие, к резкому повышению давления, иногда вызывающему разрыв ствола оружия или камеры реактивного снаряда.
Ограниченную физическую стойкость имеют также шашки реактивных порохов больших размеров; при длительном хранении они склонны к образованию трещин; это влечет за собой незакономерное увеличение поверхности горения и соответственно давления при выстреле.
Физическая стойкость пироксилиновых порохов ограничена из-за возможности испарения остаточного летучего растворителя и влаги, что приводит к увеличению скорости горения и максимального давления при выстреле. Так как пироксилиновые пороха обладают заметной гигроскопичностью, они могут не только отдавать влагу, но и поглощать ее при повышенной влажности воздуха. Чтобы уменьшить колебания влажности и связанные с этим колебания баллистических свойств пироксилиновых порохов, стремятся снизить их гигроскопичность путем введения специальных добавок и хранят пороха в герметичной укупорке.
Разрывные заряды, изготовленные из тротила с низкой температурой плавления, могут при хранении выделять легкоплавкие эвтектические сплавы в виде маслообразной жидкости. При вытекании жидкости в заряде образуются пустоты, что уменьшает его стойкость к сотрясению при выстреле. Кроме того, взрывчатая жидкость может попадать в резьбу корпуса и также способствовать преждевременным разрывам. Поэтому, особенно в тех случаях.
126
Гл. III. Стойкость взрывчатых веществ
когда боеприпасы предназначены для длительного хранения, применяют тротил или другие В В высокой чистоты.
Мы не будем останавливаться на конкретных методах определения различных видов физической стойкости и рассмотрим более подробно лишь физическую стойкость аммонитов — основного класса смесевых ВВ промышленного и военного назначения.
1. Физическая стойкость аммонитов
Аммониты обладают ограниченной физической стойкостью. Они склонны к слеживанию и увлажнению при контакте с водой в виде паров или в капельно-жидком состоянии. Слеживание и увлажнение аммонитов, нередко происходящие уже после непродолжительного хранения, ухудшают их взрывчатые свойства (способность к передаче детонации на расстояние, восприимчивость к детонации) и приводят к увеличению количества ядовитых газов, образующихся при взрыве. Слежавшийся аммонит часто приходит в такое состояние полной утраты сыпучести, что его нельзя вновь обратить в порошок обычным разминанием в руках и требуются измельчение и перепатронировка. Однако даже и в этом случае обычно первоначальные показатели взрывчатых свойств полностью не восстанавливаются.
Причины и последствия еле ж и в а и и я аммонитов и способы его предотвращения
При хранении порошкообразного аммонита происходят самопроизвольное укрупнение и агломерация кристаллов окислителя, ведущие к уменьшению их суммарной поверхности. В присутствии влаги этот процесс идет гораздо быстрее, чем в сухом веществе. Возможно, что играет роль также изменение характера пор: некоторые из них становятся замкнутыми. Это изменение физической структуры порошкообразного ВВ приводит к ухудшению его взрывчатых свойств. Уменьшается эффективная поверхность горения чг1-стиц при детонации и, возможно, затрудняется проникание газов из зоны реакции в непрореагировавшее вещество.
Основными факторами, благоприятствующими слеживанию, являются увлажнение аммиачной селитры и последующее подсыхание, а также сдавливание вещества.
Ухудшение взрывчатых свойств при хранении наблюдалось также у смесей на основе других водорастворимых окислителей. Так, Вандоии наблюдал утрату способности к передаче детонации при хранении взрывчатого вещества Р (перхлорат аммония, натровая селитра и парафин); несмотря иа наличие парафинированной оболочки патронов, ВВ несколько увлажнилось и кристаллы солей укрупнились — доля частиц, проходящих через сито с определенными размерами ячейки, уменьшилась с 35 до 11%.
Известно, что наибольшей слеживаемостью обладают материалы, хорошо растворяющиеся в воде. Поглощенная таким продуктом влага образует пленку насыщенного раствора вокруг каждой частицы. При подсыхании, а для некото-
$ 2. Физическая стойкость
127
рых веществ и при понижении температуры из раствора выделяются новые кристаллики, связывающие между собой ранее свободные частицы в прочный конгломерат. Сдавливание способствует слеживанию, так как оно уменьшает промежутки между частицами гидрофильного вещества, увеличивает поверхность их контакта и облегчает сцепление частиц при подсыхании. По этой последней причине мелкозернистое вещество слеживается сильнее, чем крупнозернистое.
Поскольку слеживанию способствует чередование подсыхания и увлажнения, то в наибольшей мере склонны к слеживанию те-соли, гигроскопическая точка * которых близка к обычной влажности атмосферы в данной местности. Это условие для климата центральной части нашей страны выполняется для аммиачной селитры, гигроскопическая точка которой при 20° равна 67%.
Понижением увлажняемое™ можно понизить и слеживаемость.. Уменьшения увлажняемое™ можно достигнуть покрытием бумажных оболочек патронов полихлорвиниловым или иным труднопроницаемым для влаги лаком, а также применением оболочек из. пластиков, не пропускающих пары воды (полиэтилена, полихлорвинила и др.). Радикальным, но трудно осуществимым способом предотвращения увлажнения аммонитов является поддержание-малой влажности воздуха в помещении, лежащей ниже гигроскопической точки аммиачной селитры.
Действенным способом снижения слеживаемости аммонитов,, помимо предотвращения увлажнения, является введение в их состав небольших количеств некоторых веществ: стеаратов кальция, цинка и особенно железа, красителей — фуксина и амаранта, некоторых алифатических аминов, органических волокнистых веществ, и др. Действие некоторых из этих добавок связано с их влиянием на структуру кристалликов селитры, выпадающих из раствора. В частности, присутствие фуксина приводит к тому, что выделяющиеся пластинчатые кристаллики очень хрупки и образующиеся агломераты частиц аммиачной селитры оказываются весьма непрочными. Отрицательным свойством стеаратов является их способность сильно снижать передачу детонации на расстояние и критическую плотность.
Стойкость аммонитов по отношению к жидкой воде
Намокание ВВ в воде' сильно затрудняет ведение взрывных работ в обводненных условиях, так как за время от начала заряжания шпура (скважины) до момента взрыва патроны успевают увлажниться до такой степени, что дают неполные взрывы, сопровождающиеся образованием повышенного количества ядовитых газов, или даже отказы.
Из отечественных промышленных ВВ наиболее водоустойчивыми являются 62%-ный желатин-динамит, динафталит № 1, аммониты,
* Гигроскопической точкой вещества называется отношение упругости паров иад его насыщенным раствором к упругости паров воды при той же температуре
128
Гл, III, Стойкость взрывчатых веществ
изготовляемые на так называемой ожелезненной аммиачной селитре, водоустойчивые аммоналы и аммонит В-3. Водоустойчивость динамита обусловлена его плотной желатинообразной структурой в сочетании с очень малой растворимостью нитроглицерина в воде. Водоустойчивость аммонитов имеет другую физическую основу.
Водоустойчивость порошкообразного вещества, содержащего гидрофильные частицы, может быть достигнута созданием в нем гидрофобной решетки — пространственной сетки капилляров, стенки которых состоят из тонкого слоя гидрофобного вещества. Если бы такая решетка состояла из гидрофильного вещества, то вода сама бы втягивалась в капилляры; в гидрофобных же капиллярах силы поверхностного натяжения в зоне контакта их стенки и воды препятствуют ее вхождению в капилляр и для преодоления этих сил требуется соответствующее внешнее избыточное давление. Гидрофобная' решетка может быть получена двумя путями: обволакиванием гидрофильных частиц пленкой легкоплавкого гидрофобного вещества или опудриванием этих частиц тонкораздробленным твердым гидрофобным веществом. На этом последнем механизме основана, в частности, водоустойчивость аммонитов, содержащих стеараты. Опудривание частиц аммиачной селитры тонким порошком стеарата, затрудняя проникание воды в капилляры, образуемые порами порошка, приводит к малой смачиваемости этого состава.
Если гпдрофобизация аммонита производится нанесением на поверхность частиц аммиачной селитры несмачиваемого водой вещества вроде парафина, стеариновой кислоты или асфальтита, то такое вещество должно обладать высокой вязкостью, чтобы прочно удерживаться на поверхности твердого тела и не вытесняться водой.
Ранее полагали, что водоустойчивость дииафталита зависит также от его зернистой структуры, достигаемой путем бегуииой обработки состава. Исследованиями Воронова установлено, что зернение аммонита является мерой только против слеживания. Бегуииая же обработка смеси придает водоустойчивость дииафталиту № 1 потому, что она обеспечивает исключительно тонкое измельчение гидрофобного компонента и образование мелкой иесмачиваемой решетки из технического дииитроиафталииа. Для обеспечения водоустойчивости обязательно тщательное «натирание» гидрофобизирующего компонента на поверхность частиц аммиачной селитры, что и достигается при бегуиной обработке.
Наконец, водоустойчивость аммонита может быть достигнута введением в его состав примесей, набухающих при поглощении воды и затрудняющих вследствие этого ее проникновение в глубь патрона.
Испытание на водоустойчивость производят путем выдерживания патронов аммонита весом 200 г в течение 1 часа в воде в вертикальном положении, причем высота столба воды над верхним торцом патрона должна составлять 1 я. Извлеченные из воды патроны подвергают испытанию на передачу детонации; для водоустойчивых ВВ расстояние, на которое передается детонация, ие должно быть значительно меиьще, чем до выдержки в воде, и во всяком случае ие меньше 2 см. Степень намокания можно оценить также по внешнему виду ВВ, разрезав патроны.
.$ 2, Физическая стойкость аммонитов
129
Физические изменения зарядов аммонитов в боеприпасах
Ограниченной физической стойкостью аммониты обладают не только в порошкообразном виде при малой плотности (как они применяются в промышленном взрывном деле), но и в виде зарядов значительной плотности в боеприпасах.
При хранении боеприпасов, снаряженных амматолами й; методом шнекования, наблюдается в большей или меньшей степени усадка, а иногда и рост заряда. Развитие обоих этих явлений зависит от технологии снаряжения и условий хранения.
Основной причиной усадки амматоловых шнекованных зарядов является самопроизвольное слипание и укрупнение кристаллов аммиачной селитры, сопровождающееся уменьшением объема заряда подобно тому, как это происходит при слеживании промышленных аммонитов. Укрупнению кристаллов способствует повышенная влажность амматола и переходы аммиачной селитры из одной модификации в другую; усадка наступает легче, если амматол при шнеко-вании имел температуру выше 32? С; малая плотность зарядов также благоприятствует усадке.
Если при хранении боеприпасов температура часто поднимается выше 32° С, то наблюдается рост зарядов, так как переход через указанную температуру приводит к модификационным превращениям аммиачной селитры, связанным с увеличением объема.
Увлажнение амматоловых зарядов нежелательно не только потому, что оно способствует усадке, но и потому, что при этом уменьшается их восприимчивость к детонации; кроме того, при взаимодействии влажной аммиачной селитры с металлом корпуса боеприпаса может выделяться аммиак, который, реагируя с тротилом, образует соединения (тротилаты), обладающие повышенной чувствительностью к тепловым и механическим воздействиям. Для повышения стойкости разрывных зарядов принимают меры к предотвращению указанных явлений. В частности, при снаряжении амматолами поверх заряда обычно помещают пробку из негигроскопического литого тротила.
* В военной технике аммониты иа основе тротила принято называть амматолами.
Глава IV
САМ0РАСПР0СТРАНЯЮ1ЦЕЕСЯ ХИМИЧЕСКОЕ ПРЕВРАЩЕНИЕ ВО ВЗРЫВЧАТЫХ СИСТЕМАХ
(горение и детонация газообразных и конденсированных взрывчатых систем)
Теория самораспространяющихся процессов во взрывчатых системах развита значительно меньше, чем теория их медленного химического превращения, и не все закономерности этих процессов имеют строгие теоретические объяснения. Поэтому в настоящей главе мы рассмотрим в первую очередь экспериментальный материал, В разделах, посвященных теории распространения, будут приведены объяснения тем экспериментальным закономерностям, которые в настоящее время их имеют.
Скоростью распространения взрывного превращения называется линейная скорость перемещения его фронта *.
В общем случае скорость распространения взрывного превращения определяется двумя независимыми факторами: скоростью химической реакции во фронте превращения и скоростью передачи энергии этой реакции следующему слою. В некоторых случаях второй фактор получает преобладающее, а иногда н решающее значение. Тогда мы можем встретиться с тем парадоксальным явлением, что при уменьшении скорости химической реакции, например в результате добавления инертного газа к взрывчатой газовой смеси, скорость распространения взрывного превращения тем не менее будет увеличиваться за счет увеличения скорости передачи энергии реакции.
Рассмотрим сначала горение и детонацию в газах, а затем те же. процессы в конденсированных системах.
* Для характеристики самораспростраияющегося превращения применяют также массовую скорость, равную произведению линейной скорости иа плотность вещества; массовая скорость представляет собой количество вещества, реагирующего при самораспростраияющемся процессе за единицу времени иа единицу площади сечения заряда. Если размерность линейной скорости Д<~], то размерность массовой скорости
,<j> I. Горение газов. Пределы горючести
131
§ 1. ГОРЕНИЕ ГАЗОВ. ПРЕДЕЛЫ ГОРЮЧЕСТИ
Встречающиеся в технике взрывчатые газы представляют собой, как правило, смеси, содержащие один или несколько горючих газов и воздух или кислород. Горение в таких смесях способно распространяться не при любом соотношении компонентов, а лишь в определенных пределах состава, называемых концентрационными пределами горючести. Минимальное содержание горючего газа, при котором еще возможно горение, называют нижним пределом горючести, максимальное содержание — верхним пределом. Эти пределы не являются абсолютной константой смеси данных газов, но в значительной мере зависят от условий.
Так как возможность горения обусловлена скоростью химической реакции и скоростью передачи энергии пепрореагировавшему веществу, то все факторы, которые влияют на скорость реакции и передачу энергии, будут соответственно отражаться и па возможности горения.
Непосредственной причиной, обусловливающей невозможность распространения горения очень разбавленных и поэтому медленно горящих смесей, являются по Зельдовичу потери тепла термическим излучением.
Точное знание пределов горючести для конкретных условий имеет большое практическое значение с точки зрения техники безопасности. Зная пределы, можно, строго ограничивая содержание горючего газа, предотвратить возможность образования опасных смесей. Таким образом, например в газовых угольных шахтах, не допускается образование метано-воздушной смеси, содержащей более 1% метана (нижний предел горючести 5%). Если же такая смесь образовалась, в шахте запрещается заряжать шпуры, а тем более взрывать пх до тех пор, пока содержание метана не станет ниже 1%.
Помимо горной промышленности (угольные шахты, калийные и другие рудники, нефтяные промыслы и др.), взрывчатые газовые смеси встречаются также на металлургических, коксохимических, нефтеперерабатывающих и газовых заводах н во всех химических производствах, где применяются летучие растворители.
Рассмотрим основные факторы, влияющие на пределы горючести газов.
Некоторые примеси, замедляющие реакции гор е-н и я, оказывают сильное влияние на пределы горючести. Наиболее активны галоидопроизводные углеводородов, которые уже при небольшом содержании делают негорючими смеси окиси углерода, водорода или углеводородов с воздухом. Тепловые свойства смесей при таких добавках изменяются мало и основную роль играет значительное уменьшение скорости реакции, а следовательно, и скорости распространения горения, приводящее к увеличению тепло-потерь. Так, влажная смесь 2СО + О2 горит со скоростью 90 см/сек,.
132
Гл. IV. Самораспространяющееся превращение в ВВ
после добавления 1,8% четыреххлористого углерода скорость горения уменьшается до 40 см)сек, а вблизи предела при содержании 4,5% СС14 составляет только ~4 см!сек.
Добавление инертных газов сужает пределы и в конце концов делает смесь негорючей. Это влияние в общем пропорционально теплоемкости инертной добавки. На фиг. 4. 1 показано влияние азота и углекислого газа на пределы горючести сме-
Фиг. 4.1. Пределы горючести смесей водорода, окиси углерода и метана с воздухом при добавлении различных количеств азота или углекислого газа.
сей водорода, окиси углерода и метана с воздухом. Как видно, углекислый газ снижает горючесть сильнее, чем азот, добавленный в тех же количествах.
Добавка, способная реагировать с поглощением тепла, оказывается более эффективной в отношении понижения горючести. Так, если стехиометрическую смесь метана с воздухом разбавлять азотом или метаном, то оказывается, что метана достаточно добавить в 5 раз меньше, чем азота, чтобы сделать смесь негорючей. Эффективность метана объясняется тем, что при высокой температуре он вступает с продуктами горения в эндотермические реакции (например: CH4—J— СО2 rrt2CO4-2H2 — 56 ккал).
Пределы горючести зависят также от направления распространения пламени. При распространении пламени снизу вверх пределы шире, чем при распространении в горизонтальном направлении или сверху вниз.
Увеличение ди а м етр а сосуда, как правило, расширяет пределы горючести, особенно заметно при малых (до 5 см) диаметрах. Это влияние, по-видимому, следует связать с охлаждаю
§ 1. Горение газов. Пределы горючести
133
щим действием стенок, которое становится относительно меньше при увеличении диаметра сосуда.
На охлаждающем действии отверстий малого диаметра основано устройство безопасной лампочки Дэви. Ячейки в металлической защитной сетке этой лампочки столь малы, что пламя не может проникнуть через них. На этом же принципе основана конструкция взрывобезопасной электроаппаратуры. Аппарат заключают в прочный металлический кожух с фланцами; зазоры между этими фланцами должны быть настолько малыми, чтобы пламя, если оно возникнет в аппарате, не могло бы проникнуть за его пределы.
Фиг. 4. 2. Влияние давления на концентрационные преде-' лы горючести смеси окиси углерода с кислородом. Заштрихована область горючести.
Фиг. 4.3. Пределы горючести смесей водорода, окиси углерода и метана с воздухом при давлениях выше атмосферного.
Пределы горючести не зависят от д л и н ы трубки при открытых ее концах, увеличение длины в закрытых трубках сужает пределы.
Влажность воздуха, входящего в состав смеси, оказывает слабое влияние на пределы горючести. Верхний предел для метано-воздушной смеси в присутствии воды несколько снижается, так как пары воды замещают часть кислорода, необходимого для сгорания метана; для сухой смеси предел составляет 14,02%, а для влажной 13,54%. Особое положение занимает окись углерода. Для этого газа влияние влажности более значительно. При распространении пламени снизу вверх в трубке диаметром 5 см нижний предел составлял для насыщенной водой смеси 13,1%, для сухой 15,9%.
Изменение давления в пределах нормальных колебаний атмосферного давления не влияет на пределы горючести. При больших изменениях давления пределы горючести изменяются, хотя и не одинаково для различных смесей. Вообще говоря, уменьшение давления ниже атмосферного сужает пределы; поэтому при некотором достаточно низком давлении верхний и нижний пределы совпадают; при меньшем давлении смесь любого состава не способна к
134 Гл. IV. Само распространяющееся превращение в В В
распространению пламени. Эта зависимость схематически показана на фиг. 4. 2 для смеси окиси углерода с кислородом.
Повышение давления выше 1 ат зачастую, хотя и не всегда, расширяет интервал горючести (фиг. 4.3). Для некоторых смесей, например водорода с воздухом, пределы горючести при повышении давления от 1 до 125 ат не зависят от давления.
Для смеси СО с воздухом при повышении давления пределы даже несколько сужаются. Сужение пределов при повышении дав
Фиг. 4.4. Влияние начальной температуры на пределы горючести смеси метана с воздухом.
Содержание горючего газа д %
Фиг. 4.5. Зависимость минимальной мощности воспламеняющей искры (силы тока в первичной цепи) от состава для смесей метана, пропана и гексана с воздухом.
ления объясняется уменьшением содержания паров воды, оказывающей сильное влияние на скорость горения данной смеси.
Для метано-воздушных смесей нижний предел практически не зависит от давления при изменении давления от Г до 400 ат, тогда как верхний предел резко возрастает (от 15 до 46%). Это влияние давления на верхний предел метано-воздушной смеси объясняется тем, что при высоких давлениях метан становится термодинамически устойчивым и ие вступает в эндотермические реакции, протекающие с увеличением числа молекул. Поэтому при повышении давления флегматизирующее влияние избытка метана ослабляется. Помимо этого, высокое давление увеличивает скорость реакции, положительно влияя, таким образом, на ее способность к самораспространению.
Повышение температуры расширяет, как и следовало ожидать, пределы горючести, В координатах «процентное содержание горючего газа — температура» это расширение выражается прямыми (фиг, 4,4). По Уайту при 20° С смесь водорода с воздухом способна гореть при содержании Н2 от 9 до 72%, при 400° С пределы горючести составляют соответственно 6,3 и 82%.
Перемешивание несколько расширяет пределы, как это было установлено при опытах со смесью эфира с воздухом, и снижает нижний предел метано- и этано-воздушной смесей.
1. Горение газов. Пределы горючести
135
Нижний предел смеси с кислородом для большинства газов тот же, что и смеси с воздухом. Верхний предел для кислородной смеси всегда значительно больше, чем для воздушной.
При экспериментальном определении пределов горючести необходимо учитывать изменение воспламеняемости смеси в зависимости от ее состава. Количественной характеристикой воспламеняемости может служить минимальная величина энергии поджигающего импульса, достаточная для возбуждения горения. Для смеси данного горючего газа с воздухом при прочих равных условиях существует некоторый оптимальный состав, при котором воспламеняемость ее наибольшая. При отклонении от этого состава в сторону меньшего или большего содержания горючего воспламеняемость уменьшается. Это соотношение иллюстрируется фиг. 4. .5, па которой приведена зависимость минимальной мощности воспламеняющей искры от состава для смесей метана, пропана и гексана с воздухом. Поэтому если для определения пределов применять воспламеняющие импульсы различной интенсивности, то при слабых импульсах интервал между пределами горючести окажется уже, чем при сильных импульсах.
Очевидно, однако, что для смеси данных газов существуют и абсолютные пределы горючести, не зависящие от интенсивности инициирования. За этими пределами пламя утрачивает способность к самораспространению при любой интенсивности начального импульса. Для метана с воздухом, например, эти пределы составляют 5 и 14%.
Для смеси, содержащей несколько горючих газов, предел горючести можно подсчитать по формуле Ле Шателье, основанной на предположении об аддитивности горючести газов:
n_i 4.
N2
где Afb N2,.. ., М — пределы горючести (в %) для каждого горючего газа в отдельности;
п2,.. „ Пк — процентное содержание каждого горючего газа в смеси, соответствующей пределу.
Путем простого преобразования формулу можно привести К ВИДУ
£ =__________-------------, (4.1)
mi , "*2 , . mk
Ni ''' ‘ ’'~Nk
где — процентное содержание каждого горючего в исход-
ной смеси горючих газов; Sm=100;
L — суммарное процентное содержание горючих газов в смеси их с воздухом, соответствующее пределу.
Во многих случаях (например, для смесей водорода, окиси углерода и метана) формула выполняется довольно точно (лучше для нижнего предела, хуже — для верхнего); в других случаях, особенно когда один из компонентов является паром, наблюдаются значительные отклонения.
136
Гл. IV. Самораспространяющееся превращение в ВВ
В качестве примера применения формулы Ле Шателье рассчитаем нижний предел для природного газа следующего состава (в %):
метан.................. 80 (нижний предел 5,3%)
этан................... 15 (нижний предел 3,22%)
пропан.................. 4 (нижний предел 2,37%)
бутан................... 1 (нижний предел 1,86%)
= 4,55%.
100 Д~ 80 15__4 1
5,3 + 3,22 + 2,37 + 1,86
Данные о пределах горючести газов и паров приведены в Приложениях 1 и 2.
§ 2. СКОРОСТЬ ГОРЕНИЯ ГАЗОВ. ПЕРЕХОД ГОРЕНИЯ В ДЕТОНАЦИЮ
1. Методы определения скорости горения
Скоростью горения («нормальной» скоростью горения) называют скорость перемещения фронта реакции относительно несгоревшего газа, отсчитываемую в направлении нормали к поверхности фронта.
Для определения скорости горения газов Бунзен применял следующий метод: газовую смесь выпускали через узкое отверстие горелки и определяли ту максимальную скорость выхода газа, при которой пламя держалось как раз у отверстия, но еще не проскакивало внутрь. Очевидно, что эта скорость газа равна скорости горения. Для гремучего газа Бунзен нашел таким способом скорость горения, равную 34 м]сек, для смеси окиси углерода с кислородом 1 м/сек.
Оригинальный метод определения скорости горения применял В. А. Михельсон. Он фотографировал конус пламени, образующийся при горении. Произведение площади боковой поверхности конуса на скорость горения равно объему газа, вытекающего в единицу времени; отсюда легко рассчитать скорость горения.
В дальнейшем для определения скорости горения широкое применение получили фотографические методы. В случае достаточной актиничности пламени, например, для смесей окиси углерода или углеводородов с воздухом, его можно непосредственно фотографировать; в противном случае, например, для пламени водорода, может быть использовано изменение оптической плотности во фронте горения при переходе от несгоревшего газа к продуктам сгорания, которое можно фотографировать специальными методами.
При распространении горения газовой смеси в трубке или в сферическом сосуде обычно фотографируют перемещение фронта пламени на фотопленке! закрепленной на вращающемся барабане, ось которого параллельна направлению распространения горения (фиг. 4.6). Зная линейную скорость движения пленки, можно по
$ 2. Скорость горения газов и переход его в детонацию
137
наклону полученного изображения пламени рассчитать скорость его распространения в трубке.
Следует учитывать, что определяемая этими способами скорость распространения пламени относительно неподвижного сосуда, как правило, не равна нормальной скорости горения, так как в обычных условиях опыта (горение в закрытом сосуде) несгоревший газ также приходит в движение вследствие возрастания давления. В этом случае скорость распространения пламени равна сумме скорости горения (распространения пламени относительно несгоревшего газа) и скорости движения газа. Кроме того, поверхность
Фиг. 4. 6. Схема фотографического определения скорости распространения пламени (а) и образцы снимков горения (б), 1—барабан; 2—линза; 3—трубка с газом.
фронта пламени обычно не является плоской и может изменять свой форму в ходе горения. Поэтому при подсчете нормальной скорости горения по полученным фотографическими методами значениям скорости распространения пламени необходимо учитывать и форму фронта пламени, определяющую поверхность горения, и скорость движения несгоревшей части газа, если она не равна нулю. Форму фронта пламени можно определить по мгновенным снимкам пламени на неподвижной пленке.
Зная диаметр трубки d и скорость ир распространения пламени, можно рассчитать объем газа V, сгорающего в единицу времени:
В свою очередь этот объем очевидно равен произведению поверхности фронта пламени на нормальную скорость горения и„. Имея эти данные, можно рассчитать нормальную скорость горения.
138
Гл. IV. Самораспространяющееся превращение в В В
В качестве примера в табл. 4. 1 приведены результаты расчетов нормальной скорости горения метано-воздушной смеси (10:90) в трубках различных диаметров. При значительных колебаниях скорости распространения пламени значение нормальной скорости горения получается практически достоянным.
Таблица 4.1
Скорость распространения пламени смеси метана с воздухом в трубках различных диаметров и рассчитанная из этих данных нормальная скорость горения
Диаметр трубки см Наблюдаемая скорость ' распространения пламени см/сек Площадь фронта сл<2 Нормальная скорость горения см'(сеК
10 ПО 300 29
10 71 J 189 29
5 92 i 66 27
5 61,5 48,5 25
2,5 71,5 12,6 28
2,5 63 11,0 28
2,5 59 i 10,4 28
2. Факторы, влияющие на скорость горения
Нормальная скорость горения зависит от состава смеси, давления, начальной температуры и наличия примесей.
Если изменять состав смеси, то при некотором содержании горючего газа, обычно большем того, который соответствует полному сгоранию, скорость горения проходит через максимум. По мере приближения к пределам скорость падает, но и на пределах не равна нулю, а имеет некоторые конечные значения. На фиг. 4. 7 представлена зависимость нормальной (слева) и массовой (Справа) скоростей горения смеси водорода с воздухом от состава.
В табл. 4. 2 приведены величины максимальной скорости горения для смесей ряда газов с воздухом.
Повышение давления может по-разному влиять иа скорость горения различных смесей. Часто наблюдается понижение скорости. Так, например, при повышении давления от 1 до 4 ат нормальная скорость горения метано-воздушной смеси понижается вдвое; в случае смеси окиси углерода с воздухом скорость также падает (0,42 и 0,24 м/сек соответственно). Во втором случае наблюдается максимум нормальной скорости горения при давлении около 300 мм рт. ст.
В топливо-воздушных смесях линейная скорость горения уменьшается с повышением давления, по слабее, чем возрастает
$ 2. Скорость горения газов и переход его в детонацию
139
Фиг. 4. 7. Зависимость нормальной (слева) и массовой (справа) скоростей горения водородо-воздушной смеси от состава.
Содержание водорода в °,С
Таблица 4. 2
Максимальная скорость горения различных горючих газов в смеси с воздухом
Горючий газ Скорость горения ин max см 1 сек Содержание горючего газа в по объему
в смеси, имеющей максимальную скорость горения в стехиометрической смеси
Водород 267 42 29,5
Ацетилен 131 10 7,7
Этилен 63 7,0 6,5
Сероуглерод 48,5 8,2 6,5
Пропилен 43,5 4,8 4,5
Окись углерода -;-1,2% Н2О ' 41,5 53 29,5
Бензол -f-0,5% Н2 38,5 3,0 2,7
Этиловый эфир 37,5 4,5 3,4
Метан 37,0 10.5 9,5
Циклогексан 35,0 2,5 2,3
н. Пентан 35,0 2,9 2,6
н. Гексан 32,0 2,5 2,2
Ацетон 31,8 6,0 5,0
140
Гл. IV. Самораспростроняющееся превращение в ВВ
плотность; другими словами, массовая скорость горения увеличивается.
Кислородные смеси дают иную зависимость скорости горения от давления, чем воздушные. Их нормальная скорость горения не зависит от давления, как это показано для смеси окиси углерода с кислородом на фиг. 4. 8. Соответственно массовая скорость возра-
стает пропорционально давлению.
Повышение температуры увеличивает скорость горения, хотя и
| 80
| 50 ~ ito% СО
? чо-
§ ---I---I--1---1--L
I. ОД 1 2 3
§ Давление р ат
Фиг. 4. 9. Влияние добавки азота на нормальную скорость горения смесей окиси углерода и кислорода. Числа у кривых означают отношение содержаний азота и кислорода в смеси (по объему).
Фиг. 4. 8. Нормальная скорость горения смесей окиси углерода с кислородом при различных давлениях.
относительно слабо. Так, при повышении температуры смеси окиси углерода с воздухом от 20 до 460° С нормальная скорость горения возрастает от 0,42 до 0,85 м)сек. Для метано-воздушной смеси при переходе от 20 к 430° С нормальная скорость горения увеличивается от 0,31 до 0,64 м!сек.
Инертные примеси уменьшают скорость горения. В качестве примера на фиг. 4. 9 показано влияние примеси азота на нормальную скорость горения смесей углерода с кислородом.
Активные примеси, которые влияют на скорость химического превращения не только в результате разбавления реагентов, иногда даже при малых содержаниях сильно изменяют скорость горения. На фиг. 4. 10 приведена зависимость нормальной скорости горения «н смеси окиси углерода с кислородом от содержания воды. В присутствии воды реакция протекает по иному, более быстрому, пути, чем без нее. Тщательно высушенная смесь вообще не может
§ 2. Скорость горения газов и переход его в детонацию
14!
Фиг. 4.10. Зависимость скорости горения смеси окиси углерода с кислородом от содержания воды.
быть воспламенена. Уже очень малое содержание паров воды сообщает смеси способность к горению. Увеличение содержания воды до 9% (при атмосферном давлении) приводит к увеличению скорости горения; при еще большем содержании воды скорость горения падает, так как разбавляющее действие воды начинает преобладать. Горение данной смеси ускоряет не только вода, но и другие водородсодержащие газы (например, гексан), хотя сами по себе эти газы в смесях с кислородом горят медленнее, чем слегка влажная смесь окиси углерода.
3. Переход горения в детонацию
Медленное равномерное распространение горения устойчиво лишь в том случае, если оно не сопровождается повышением давления, например, если горение происходит в трубке, открытой с одного конца, при зажигании у этого конца. Когда горение происходит в замкнутом пространстве или выход газов затруднен, продукты реакции не только нагревают прилегающий к фронту пламени слой несгоревшего газа путем теплопроводности, но и, расширяясь за счет высокой температуры, приводят несгоревший газ в движение. Торможение слоя газа, прилегающего к стенкам, ведет к неравномерности скорости движения но сечению трубки; пламя вытягивается в направлении распространения, в результате чего увеличивается поверхность фронта горения и количество газа, сгорающего в единицу
Фиг. 4.11. Мгновенная фотография фронта пламени при горении газовой смеси в горизонтальной трубке.
времени. Наряду с этим поверхность фронта (в случае горизонтальной трубки или при горении снизу вверх) возрастает также вследствие конвекции, а при соответствующих аэродинамических уело-
142 Гл. IV. Само распространяющееся превращение в ВВ
ниях и вследствие турбулизации несгоревшего газа. Типичная форма фронта пламени показана на фиг. 4. 11.
Ускорение распространения пламени вследствие перечисленных причин усиливает сжатие несгоревшего газа перед фронтом пламени. Это сжатие распространяется по несгоревшему газу в виде последовательных слабых ударных волн. Каждая последующая волна идет со скоростью, большей, чем предыдущая, и соответственно догоняет ее На некотопом расстоянии перед фронтом пламени совокупность ударных волн соединяется в одну мощную удар
Фиг. 4. 12. Схема распространения ударных волн при ускоряющемся горении и возникновения детонации.
Фиг. 4. 13. Возникновение детонации при горении газовой смеси (пламя распространяется справа сверху).
ную волну. Возникновение такой волны приводит к сильному сжатию и разогреву газа. Когда температура в ударной волне станет достаточно высокой, возникает новый устойчивый режим распространения реакции —детонация, при которой передача от слоя к слою энергии, вызывающей химическую реакцию, осуществляется не путем медленного процесса теплопроводности, а путем распространения ударной волны. Скорость детонации измеряется тысячами метров в секунду, в то время как нормальная скорость горения не превосходит 10 — 15 я!сек, обычно же бывает значительно меньше.
Описанный механизм перехода горения газов в детонацию объясняет, почему возникновение детонационной волны происходит па некотором расстоянии перед фронтом пламени, раньше, чем пламя подойдет к этой точке. Схематически этот процесс показан на фиг. 4. 12.
£ 2. Скорость горения газов и переход его в детонацию
143:
Путь ускоряющегося пламени в координатах «время—расстояние вдоль оси трубки» представлен кривой OD. Последовательно отходящие ударные волны показаны линиями ОА, NtA, NZA и т. д. Детонация возникает в точке А тогда, когда фронт пламени находится в точке Е; вправо от точки А распространяется детонационная волна АВ, влево — также детонационная волна AD, превращающаяся после встречи с фронтом пламени в ударную (так называемую ретонационную) волну DC, распространяющуюся по продуктам горения.
Фотография процесса перехода горения газовой смеси в детонацию приведена на фиг. 4. 13.
Одной из характеристик склонности горения газовой смеси к переходу в детонацию может служить величина преддетонационного участка — расстояния от места воспламенения до места возникновения детонации. Это расстояние зави сит от ряда факторов. Так, при увеличении начального давления преддетонаци ониый участок сокращается. Для смеси 2Н--1О2 при повышении давления от 1 до 6,5 ат длина преддетонационного участка уменьшилась с 70 до 27 с.и. При увеличении длины трубки преддетонацнонный участок возрастает. Существует, однако, некоторая минимальная длина трубки, при уменьшении которой детонация не возникает.
С увеличением диаметра трубки возникновение детонации затрудняется. Так же влияет и повышение начальной температуры. При объяснении этого явления следует иметь в виду, что повышение температуры при постоянном давлении означает уменьшение плотности газа, т. е. уменьшение концентраций реагентов.
Шероховатость стенок трубки сильно сокращает нреддетонационный участок и расширяет концентрационные пределы перехода горения в детонацию. Имеются смеси (например, бензол-|-воздух), сгорающие без перехода в детонацию в труб ках с гладкими стенками и детонирующие в трубках с шероховатыми стенками.
Разбавление смеси инертными газами или большой избыток одного из компонентов увеличивают преддетонацнонный участок. Для смесей ацетилена с кислородом, окисью азота н закисью азота зависимость величины преддетонационного участка от состава (по данным Ле Шателье) приведена в табл. 4. 3.
Таблица 4. 3
Зависимость величины преддетонационного участка от состава газовой смеси
Состав смеси 4 i О : д' о" со -1 X Г4 д' + г' сч д‘ ОМ9 + 5НЪ СгН2 + 2N2O С2Н2 4- 6N2O
Преддетонацнонный участок в ем 100 | 5 15 80 20 50 100 10
Существуют известные критические значения состава и давления, ограничивающие область, вне которой самопроизвольный переход горения в детонацию невозможен. Интервал между этими концентрационными пределами уже, чем интервал горючести. Для некоторых смесей значения указанных пределов (которые иногда называют «взрывными пределами») приведены в табл. 4. 4.
144
Гл. IV. Самораспространяющееся превращение в В В
Таблица 4, 4
Концентрационные пределы способности некоторых смесей к переходу горения в детонацию при атмосферном давлении
Смесь Содержание горючего газа по объему в %
Нижний предел Верхний предел
Н5 + воздух 27 35,5
О2 23 85
СО 4- О2 60 72
СН4 4“ ^2 10 60
C-jHo 4- воздух 6,6 15,3
На длину преддетонационного участка существенно влияет характер начального импульса. От взрыва капсюля-детонатора детонация газов начинается практически мгновенно. При воспламенении же электрической искрой возникает горение, которое лишь после сравнительно большого участка разгона может перейти в детонацию.
В заключение заметим, что возможен не только описанный выше переход горения в детонацию, но и обратный процесс— переход детонации в горение, иногда приводящий даже к полному затуханию взрывного превращения. Такие явления наблюдались, например, при подрыве ацетилена в узкой длинной трубке. В опытах Лафита переход детонации в горение имел место при внезапном увеличении диаметра трубки, содержащей газовую смесь.
§ 3. ДЕТОНАЦИЯ ГАЗОВ
Детонация газовых смесей была открыта Бертло и Вьелем и одновременно Малляром и Ле Шателье в последней четверти прошлого века. Эти авторы разработали новую технику эксперимента и исследовали основные характеристики явления детонации.
Приведем кратко условия и результаты опытов Бертло и Вьеля со стехиометрической смесью водорода и кислорода. Опыты ставили в резиновой трубке диаметром 5 мм и длиной 40 м. Для возбуждения детонации применяли электро-детонатор с прессованной гремучей ртутью. При распространении детонации происходил обрыв двух полосок из оловянной фольги, включенных в электрическую цепь хронографа. По величине промежутка времени между разрывами рассчитывали среднюю скорость детонации.
Опыты показали, что скорость детонации (~2810 м)сек) не зависит ни от расположения трубки (вертикально, горизонтально или параллельными рядами), ни от ее длины. Материал трубки (резина, стекло, свинец) также не влияет иа скорость детонации. При изменении диаметра трубки скорость детонации остается постоянной при условии, что диаметр не уменьшается ниже некоторого предела, равного для данной смеси 1—-2 мм. В стеклянных трубках диаметром 1,5 мм скорость детонации уменьшилась до 2341 м/сек. В трубках с закрытыми
.§ 3. Детонация газов
145
или открытыми концами скорость детонации оказалась одинаковой. Величина инициирующего заряда гремучей ртути также не отражалась на скорости детонации.
Дальнейшими иследованиями была установлена зависимость скорости детонации от соотношения компонентов газовой смеси, от наличия инертных и катализирующих примесей, от давления и температуры.
Фиг. 4. 14. Зависимость скорости детонации смеси пропана с кислородом от состава.
При изменении состава газовой смеси скорость детонации изменяется. Для каждой смеси существует некоторый состав, дающий максимальную скорость детонации. В качестве примера на фиг. 4. 14 приведен график зависимости скорости детонации D от состава в случае смеси пропана с кислородом. Из фиг. 4. 14, в частности, видно, что способность к детонации сохраняется в определенном интервале состава смеси, так что можно говорить о концентрационных пределах детонационной способности подобно тому, как выше была речь о пределах горючести или пределах перехода горения в детонацию. Интервал детонационной способности по составу уже, чем интервал горючести, но шире, чем интервал, в котором наблюдается самопроизвольный переход горения в детонацию.
Инертные примеси уменьшают, вообще говоря, скорость детонации газовых смесей (табл. 4. 5), поскольку они снижают температуру, достигаемую при детонации. Однако в тех случаях, когда наличие примесей уменьшает средний молекулярный вес продуктов взрыва, это оказывает обратное действие, которое в известных условиях может стать преобладающим.
Как видно из табл. 4. 5, химически инертные газы, обладающие одинаковой теплоемкостью, — аргон и гелий — оказывают при небольших содержаниях разное действие на скорость детонации смеси водорода с кислородом: аргон (атомный вес 39) уменьшает скорость детонации, а гелий (атомный вес 4)—увеличивает. Аналогично гелию влияет водород (молекулярный вес 2). При очень
146 Гл. IV. Самораспространяющееся превращение в ВВ
Таблица 4.5
Влияние инертных примесей на скорость детонации газовых смесей
Состав смеси Скорость детонации л [сек
‘2Н3 + О2 2819
2Нг + О2 + 1,5 Аг 1950
2Hg -f- Од 4~ ЗАг 1800
2Hg -f- О2 4~ 5Аг 1700
2На + О2 + 1,5Не ЗОЮ
2На + О2 -|- ЗНе 3130
2Hg -f- Og + бНе 3160
2Н‘> -f- О2 4~^2 2407
2Н2 + О2 + 3N2 2055
2H2 + O24-5N2 1822
большом содержании добавки преобладает ее влияние в смысле снижения температуры и скорость детонации уменьшается в присутствии как аргона, так и гелия. Азот из-за большей, чем у инертных газов, теплоемкости и значительного молекулярного веса уменьшает скорость детонации водородо-кислородной смеси как при больших, так и при малых содержаниях.
Для некоторых газовых смесей установлено положительное влияние добавления сравнительно небольших количеств веществ, участвующих в реакции взрыва.
В качестве примера можно привести смесь окиси углерода с кислородом. Присутствие в водородсодержащих примесей.
этой смеси паров воды или других
например сероводорода, аммиака, этилена и т. п., значительно увеличивает скорость детонации (табл. 4. 6).
Таблица 4.6
Влияние паров воды на скорость детонации смеси окиси углерода и кислорода
Скорость детонации D в лГсек
смеси, высушенной над при содержании в смеси паров воды в % объемн.
Р2О5 H2SO4 1,2 2,3 3,7 5,6 9,5 15,6 24,9 38,4
1264 1305 1676 1703 1713 1738 1693 1666 1526 1266
Повышение давления несколько увеличивает скорость детонации. Это влияние давления, по-видимому, связано с уменьшением диссоциации продуктов реакции в результате повышения конечного давления при взрыве, как это более подробно будет показано ниже.
Согласно Куку при давлениях от < I ат до 50—100 ат скорость детонации смесей Нг—Оз—Ns, На—О-—Аг, С-1Ъ—Оз и других, как правило, возрастает с давлением по уравнению
(4. 2)
$ 3. Детонация газов
147
Фиг. 4. 15. Зависимость скорости детонации смесей водорода с кислородом различного состава от давления (плотности) газа.
На фиг. 4. 15 показано изменение скорости детонации в зависимости от давления для смесей водорода с кислородом в различных соотношениях, а также в присутствии аргона и азота.
В табл. 4. 7 приведены значения констант уравнения (4. 2) для некоторых смесей.
Таблица 4. 7
Константы уравнения (4.2) для некоторых газовых смесей
Смесь Ро кг < см2 Dp ‘о MjCeK Micf'.K
6Н2 + Ю2 0,7 3800 —
4Н, + Ю2 0,7 3220 325
ЗН2 + Ю2 0,7 3100 250
2Н2 4- 1О2 0,7 2850 160
1Н2 + 1О2 0,7 2300 100
1Н24-2О2 0,7 1920 10
п-ь + зсь 0,7 1890 —240
2Н2 + Ю2+ ’Мг 0,7 2460 130
2Нг + Ю2 + 1N-, 0,7 2420 60
2Н2 + Ю2 + 2М2 0,7 ; 2220 50
148
Гл. IV. Самораспрост роняющееся превращение в ВВ
Продолжение
Смесь ДО кг) см2 DPp .и) сек V Mjceic
ЗС2Н2 + 1О2 1,05 2520 0
2С2Н2 + Юг 1,05 2660 45
1С2Н2 + Ю2 1,05 2920 160
2CgHg 30g 1,05 2720 150
1С2Н2 + 9О2 1,05 2200 120
Примечание. 3 соответствует приросту скорости при десятикратном увеличении давления.
Повышение температуры при постоянном давлении незначительно уменьшает скорость детонации (табл. 4. 8).
Таблица 4.8
Влияние температуры на скорость детонации газовых смесей
Начальная температура °C Скорость детонации D в м)сек для смеси
Водород + кислород Этилен + кислород
10 2821 2581
100 2790 2538
§ 4. ГОРЕНИЕ И ВЗРЫВ ПЫЛЕ-ВОЗДУШНЫХ СМЕСЕЙ
Подобно газовым смесям могут воспламеняться и взрываться также смеси горючих пылей с воздухом или кислородом. Практически любой горючий материал, взвешенный в воздухе в тонкоиз-мельченном виде, может дать при поджигании пылевой взрыв.
Известны взрывы, в которых в виде пылей участвовали следующие материалы: уголь, сажа, древесина, бумага, пробка, дубильная кора, отруби, мякина, солод, крахмал, сахар, декстрин, пшеница, шерсть, пакля, алюминий, магний, смола, сера, нафталин, мыло и др. По данным статистики, в США до 1946 г. произошло (не считая угольной и военной промышленности) 888 пылевых взрывов, при которых погибло 575 человек; материальный ущерб оценивается в 80 млн. долларов.
Скорость распространения пылевых взрывов обычно меньше, чем газовых, так как поверхность контакта реагентов меньше. Хотя вследствие этого тепловые потери больше, давление, достигаемое при пылевых взрывах, имеет тот же порядок, что и при газовых, поскольку теплота горения на единицу объема пыле-воздушной смеси обычно больше.
ji 4. Горение и взрыв пыле-воздушных смесей 149
Разрушающее действие пылевого взрыва в значительной степени определяется достигаемым при нем максимальным давлением и скоростью его нарастания.
Легкость воспламенения частиц пылевой взвеси, а следовательно, и ее взрывоопасность зависит от ряда факторов, частично взаимно связанных: химического состава пыли и газовой фазы, формы, структуры и удельной поверхности частиц, их размеров, температуры воспламенения, необходимого для воспламенения количества энергии, начальной температуры и давления.
Как и в случае газовых смесей, существуют нижний и верхний пределы горючести пыле-воздушных смесей по концентрации. Точное определение этих пределов, в особенности верхнего, осложняется трудностью создания пылевого облака определенной и постоянной концентрации, а также зависимостью пределов от размеров частиц, равномерности распределения частиц, примесей, интенсивности и характера воспламенителя и длительности его действия.
Так, при действии непрерывной электрической искры (слабая дуга) взвесь тонкоизмельченной угольной пыли воспламенялась лишь при концентрации выше 35 г/.и3, а при действии более эффективного воспламенителя из нитроклетчатки воспламенение наступало при концентрации, в 7 раз меньшей.
Относительная взрывоопасность пылей разных материалов может быть характеризована минимальным количеством инертной пыли, которую нужно добавить к горючей, чтобы предотвратить распространение пламени при определенных условиях воспламенения. Чем интенсивнее воспламенитель, тем больше необходимая добавка инертной пыли.
Данные для некоторых пылей приведены в табл. 4. 9. В первом столбце таблицы указана температура нагретой трубки, через которую пропускалась пыле-воздушная смесь, а в последующих столбцах — минимальные содержания инертной пыли для разных горючих пылей.
Химический состав газовой фазы, в особенности содержание в ней кислорода, сильно влияет на возбуждение и распространение пылевых взрывов. Опыт показывает, что при уменьшении содержания кислорода в газовой фазе температура воспламенения пыле-воздушной смеси возрастает. Эта зависимость для тонкоизмельченной угольной пыли показана на фиг. 4. 16. На фиг. 4. 17 изображена зависимость минимальной энергии, необходимой для воспламенения взвеси алюминия электрической искрой, от содержания кислорода в газовой фазе.
Форма, структура и площадь поверхности частиц пыли играют роль, поскольку горение происходит на их поверхности. Эти факторы влияют на величину минимальной энергии, необходимой для воспламенения, на давление пылевого взрыва и скорость его нарастания. В табл. 4. 10 приведены значения
150
Гл. IV. Самораспространяющееся превращение в ВВ
Таблица 4.9
Относительная воспламеняемость железной, магниевой, цинковой и угольной пылей при различной интенсивности инициирования (температуре трубки)
Температура трубки °C Минимальное содержание инертной пыли в % для
железа, восстановленного водо- родом магния измель- ченного порошка цинка угольной пыли
315 с*
350 25
400 43
500 58
570 67 0*
600 70 60 0*
610 72 68 3 0*
650 77 80 13 45
700 83 90 23 65
750 90 >90 35 80
* Нулевые значения относятся к температурам воспламенения чистых веществ, без добавки инертной пыли.
1100
1000
300
800
СодеоЛание нислоаода д г'ааобой разе 6 %
Фиг. 4. 17. Зависимость минимальной энергии искры, необходимой для воспламенения алюминиево-воздушной смеси, от содержания кислорода в газовой фазе.
'Нет воспламенения
600 - х
50°0 20 ~W 60 80~~ЮР
Содержали? кислорода, в газовой разе в “/о
Фиг. 4. 16. Зависимость температуры воспламенения тонкоизмель-ченной угольной пыли от содержания кислорода в газовой фазе,
этой энергии, давления и скорости его нарастания для трех сортов магниевого порошка: 1-й сорт состоял из частиц приблизительно сферической формы, 2-й — неправильной угловатой формы и 3-й —
£ 4. Горение и. взрыв пыле-воздушных смесей
151
из плоских тонких частиц; ситовый состав для всех трех сортов был приблизительно одинаковым.
Таблица 4.10
Минимальная энергия искры, необходимая для воспламенения магниевых пыле-воздушных взвесей
Сорт магние- Энергия искры дж Максимальное давление KZjcM2 Скорость нарастания давления кг1см2еек
вого порошка Средняя Максимальная
1-й 0,24 4,0 53 102
2-й 0,08 4,4 92 183
3-й 0,08 5,1 102 337
Средний диаметр частиц в мм
Фиг. 4. 1& Зависимость минимальной энергии искры, необходимой для воспламенения взвеси пыли ацетилцеллюлозы в воздухе, от размеров частиц.
Из табл. 4. 10 видно, что частицы с наиболее развитой поверхностью воспламенялись легче всего и давали большее давление и большую скорость его нарастания.
Размеры частиц влияют на взрывоопасность пыли по ряду причин. Мелкие частицы легче диспергируются, дольше остаются во взвешенном состоянии и быстрее сгорают. Опыты показали, что при уменьшении размеров частиц энергия, необходимая для воспламенения, уменьшается (фиг. 4. 18), нижний концентрационный предел снижается, а максимальное давление и скорость его нарастания возрастают. При очень мелких частицах дальнейшее уменьшение их размеров уже не влечет за собой увеличения максимального давления.
Свойства различных пылей, характеризующие их взрывоопасность, приведены в табл. 4. 11.
Взрывоопасность угольной пыли возрастает с увеличением содержания летучих веществ в угле. Пыль углей, содержащих летучих веществ меньше 10%, считается практически невзрывчатой.
Как указывалось выше, для всех горючих
мость сильно падает с увеличением содержания инертной пыли. Это действие инертной пыли используют различными способами для борьбы с распространением пылевых и газовых взрывов в угольных шахтах, в частности, путем устройства заслонов из инертной пыли, помещаемой в легко опрокидывающихся емкостях на пути возможного распространения взрыва. Облако инертной пыли прерывает распространение взрыва. Для той же цели приме-
пылей воспламеняе-
152
Гл. IV. Самораспространяющееся превращение в В В
Таблица 4
Характеристика взрывоопасности некоторых пылей
Вещество пыли Температура воспламенения пылевой взвеси °C Минимальная энергия искры, необходимая для воспламенения взвеси, в мдж Нижний предел г]мй Максимальное давление взрыва кг 1см2 Скорость нарастания давления кг[см% сек Предельное содержание кислорода, исключающее воспламенение пылевой взвеси электриче-; ской искрой**, в %
Средняя Максимальная
Цирконий Магний Алюминий Титан Канифоль Феноловые смолы Полиэтилен Аллилоспиртовые смолы Пропионат целлюлозы п-Оксибензаль-дегид Уголь Сера Феиотиазин Крахмал Мыло Стеарат алюминия * 520 645 480 390 500 450 500 460 430 610 190 540 470 430 400 15 80 50 10 10 80 20 60 15 40 15 40 60 15 40 20 25 45 15 25 25 35 25 20 35 35 15 45 45 15 3,5 5,1 6,3 3,7 3,9 4,3 5,8 4,8 4,6 4,1 3,2 2,9 3.0 5,1 4,2 4,4 102 309 151 53 88 95 28 123 95 151 25 49 42 74 46 53 352 334 401 116 211 221 88 250 165 221 56 137 102 151 91 148 ** ** 3 ** 14 14 15 16 11 16
* В некоторых условиях распыления в воздухе цирконий воспламенялся при комнатной температуре, по-видимому, в результате электрического разряда между частицами пыли.
* * Уменьшение содержания кислорода достигалось добавлением к воздуху СОо. Взвеси циркония, магния, титана и некоторых сплавов магния с алюминием воспламенялись в чистом углекислом газе.
няется осланцевание выработок (покрытие их стенок инертной сланцевой пылью), а также «внешняя» забойка шпуров из инертной пыли: пыль помещают перед устьем шпура, и она при взрыве рассеивается вырывающимися из шпура газами.
Содержание горючих газов в воздухе может увеличивать взрывчатость пыли. Так, неспособные к взрыву взвеси с ма
§ 5. Горение конденсированных взрывчатых систем
153
лым содержанием сажи или древесной пыли становились взрывчатыми при добавлении в смесь светильного газа в количествах меньше нижнего предела в данных условиях.
Взрыв пыле-воздушной смеси может быть вызван нагревом от пламени открытой лампы, зажженной спички, папиросы, от лопнувшей электролампы, от трения, от электрической дуги при коротком замыкании и т. д. Возможно также воспламенение электрической искрой, образующейся в результате самопроизвольной электризации пыли и возникновения разряда при ее движении, например, при пневмотранспортировке.
Механизм взрыва пыле-воздушных смесей не вполне выяснен. Обычно принимают, что в случае органических пылей первой фазой процесса является выделение пылью под влиянием разогрева газообразных горючих веществ; во второй фазе эти газы в смеси с воздухом взрываются; продукты взрыва сжимают и разогревают прилегающий слой пыле-воздушной смеси, вызывая в нем выделение газов из пыли и т. д. Так как разогрев и газификация частиц пыли требуют некоторого времени, то воспламенение пыле-воздушной смеси происходит с задержкой подобно тому, как это наблюдается, например, в случае метано-воздушной смеси. В связи с этим при возбуждении взрыва пыле-воздушной смеси важную роль играет не только высокая температура источника воспламенения, но и достаточная продолжительность его действия.
Описанный механизм не может быть общим хотя бы потому, что к взрыву способны также пыли, не образующие летучих горючих веществ. Разница между газо-воздушной и пыле-воздушной смесью заключается только в степени дисперсности горючего. В принципе возможен взрыв взвешенной в воздухе пыли любого горючего вещества независимо от его способности выделять при нагреве газообразные продукты. Для возможности взрыва необходимы лишь достаточно тонкое измельчение горючей пыли, определенная концентрация ее в воздухе и достаточно большие размеры сосуда (например, диаметр трубы), в котором находится пыле-воздушная смесь.
§ 5. ГОРЕНИЕ КОНДЕНСИРОВАННЫХ ВЗРЫВЧАТЫХ СИСТЕМ
Горение конденсированных систем используется главным образом в огнестрельном оружии для метания пуль и снарядов. Поэтому до последнего времени изучали почти исключительно горение порохов и притом в условиях, близких к условиям практического применения (манометрическая бомба). В таких условиях зачастую нельзя было выяснить зависимость параметров горения, в частности, его скорости от физических и физико-химических характеристик пороха.
Эти исследования проводили по новой методике — в бомбах постоянного давления при горении цилиндрического заряда с торца и фотографической регистрации через прозрачные окна характера и скорости горения; применялось также определение средней скорости горения по интервалу времени между перегоранием двух тонких проволочек, пересекающих цилиндрический заряд на определенном расстоянии друг от друга.
154
Гл, IV. Самораспространяющееся превращение в ВВ
За последние два десятилетия было начато также изучение горения ВВ, которое дало как фактическую картину этого явления, так и его теоретическое толкование.
1. Поверхностное распространение горения
Говоря о скорости горения, необходимо различать два явления: собственно горение, т, е. распространение горения внутрь сплошной массы ВВ по нормали к ее поверхности, и поверхностное распространение горения, т. е. более быстрое распространение горения по касательной к поверхности заряда, по границе ВВ — окружающий газ. При горении на воздухе скорость поверхностного распространения горения определяется в значительной степени взаимодействием продуктов
Фиг. 4. 19. Схема (а) и фотографии шашки пороха до поджигания (б) и при горении на воздухе (в).
Г—продукты горения (пламя), 2—порох.
горения (если они включают горючие газы) с кислородом воздуха. Это взаимодействие происходит на границе, где соприкасаются ВВ, продукты горения и воздух (линия АБ на фиг. 4. 19). Догорание горючих продуктов неполного сгорания за счет кислорода воздуха приводит к повышению температуры и, как следствие, вызывает ускоренное распространение горения по поверхности заряда. В результате этого торец подожженного сверху цилиндрического столбика ВВ принимает форму конуса.
При больших скоростях горения более быстрое распространение пламени по поверхности заряда может, согласно Беляеву, происходить и независимо от взаимодействия с кислородом воздуха. Вследствие местного повышения давления в зоне горения происходит не только отток газов по нормали к поверхности ВВ, но и расширение их вдоль этой поверхности. Газы приходят в контакт с соседними участками поверхности заряда, нагревают и воспламеняют их.
2. Предельные условия горения (диаметр заряда, давление, начальная температура, плотность)
Опыты показали, что при зажигании с торца ВВ, помещенного в цилиндрическую трубку, равномерное устойчивое горение будет лишь в том случае, если диаметр заряда превосходит некоторое
£ 5. Горение конденсированных взрывчатых систем
155
минимальное значение. Этот предел не является абсолютной характеристикой ВВ, но зависит от условий горения: давления, начальной температуры и др. Чем выше давление и температура, тем меньше при прочих равных условиях величина критического диаметра. В свою очередь для данного диаметра существуют предельные значения давления и температуры, ниже которых горение затухает.
Критическое значение одного из названных трех параметров при постоянном значении двух других и определенных условиях опыта (материал и толщина оболочки) может служить сравнительной характеристикой способности ВВ в горению.
В качестве примеров можно привести следующие данные. Литой тротил при комнатной температуре и атмосферном давлении не горит в стеклянной трубке диаметром 24 мм и устойчиво горит, когда диаметр трубки увеличен до 27—28мм. Тетрил в литом виде при тех же условиях горит лишь в трубках диаметром более 6 мм. Нитроглицериновый порох с 28о/о нитроглицерина в виде сплошных цилиндрических шашек в обмотке из асбестового шнура горит при атмосферном давлении и обычной температуре лишь в том случае, если диаметр шашки не менее 20 мм; при температуре 65° устойчиво горят шашки диаметром даже 5 мм. С увеличением давления до 5 ат шашки этого диаметра горят даже при температуре ниже нуля.
Своеобразное влияние на возможность горения оказывает плотность * порошкообразных В В. В случае плавящегося В В вроде тетрила при уменьшении плотности ниже некоторого значения горение не распространяется. Наоборот, для неплавящихся ВВ вроде нитроклетчатки наблюдается максимум плотности, выше которого горение прекращается. Существование всех этих взаимно связанных пределов объясняется следующими причинами.
Горение происходит в результате передачи соседнему слою тепла, выделившегося в реагирующем слое. Одновременно с выделением тепла происходят потери его во вне через стенки трубки. Горение идет стационарно лишь в том случае, если количество тепла, отдаваемое соседнему слою, и теплопотери во вне уравновешиваются теплоириходом за счет реакции. Если суммарная тепли-
* В технике взрывчатых веществ часто приходится иметь дело с твердыми веществами в виде порошка или пористого тела. Плотность такого вещества, т. е, масса ВВ, приходящаяся на единицу объема, занимаемого его частицами и воздухом, заключенным между ними, может изменяться в широких пределах. Верхним из этих пределов является, очевидно, плотность ВВ, не содержащего пор.
Плотность порошкообразного ВВ является его важной характеристикой. Для обозначения этой плотности в науке о ВВ применяли различные термины: кубическая плотность (соответствующий немецкому термину «kubische Dichte»), плотность заряда (соответствующий французскому термину «densite de charge»), не получившие общего признания. Поэтому для краткости мы будем обозначать указанную величину условно просто словом «плотность».
В этой связи следует добавить, что термином «гравиметрическая плотность» принято обозначать массу порошкообразного ВВ или пороха (в кг), занимающую при определенных условиях насыпания объем в 1 л; плотностью заряжания называют отношение массы ВВ или пороха к объему сосуда, замкнутого или полузамкнутого, в котором они заключены.
156
Гл. IV. Самораспространяющееся превращение в ВВ
отдача становится больше, чем теплоприход, то горение оказывается невозможным.
При уменьшении диаметра заряда количество тепла, выделяемого в единицу времени, уменьшается пропорционально квадрату диаметра. Теплоотдача также уменьшается, но медленнее — она пропорциональна поверхности теплоотвода, т. е. первой степени диаметра. При некотором значении диаметра теплоприход не может компенсировать теплопотерь и горение затухает. Если . при этом диаметре повысить давление, под которым идет горение, то скорость химической реакции возрастает, а теплопотери не изменяются и горение вновь становится возможным. Аналогичное влияние оказывает повышение начальной температуры.
Затухание горения на обоих пределах плотности — нижнем для плавящихся и верхнем для неплавящихся порошков — имеет одну и ту же причину: чрезмерное увеличение теплоотвода при горении.
В случае плавящегося ВВ и малой плотности порошка зазоры между частицами относительно велики. Расплав В В, образующийся на его поверхности при поджигании, под действием силы тяжести слишком глубоко проникает в порошок. Жидкость приходит в соприкосновение с таким большим количеством твердого ВВ, которое она не в состоянии нагреть до температуры интенсивной реакции. Теплоотдача от расплава в глубь ВВ и во вне превышает теплоприход от продуктов горения, температура падает и горение не распространяется. Понятно, что все факторы, которые уменьшают теплопотери во вне, например, увеличение диаметра заряда, снижают предельную плотность.
Увеличение плотности неплавящихся В В, как например пироксилина, увеличивает теплопроводность порошка. При некотором значении плотности теплоотвод вглубь и теплопотери во вне могут стать настолько большими, что теплоприход за счет протекающей реакции не может их компенсировать, в этом случае горение затухает. Приведенными соображениями не исчерпываются условия, при которых горение становится невозможным. Однако причина невозможности горения во всех случаях одна и та же: чрезмерно большой теплоотвод во вне и в глубь вещества, не компенсируемый теплоприходом за счет реакции.
3. Стационарное горение взрывчатых веществ
При тех значениях диаметра заряда, давления и температуры, при которых горение возможно, оно распространяется с постоянной скоростью. Эта скорость не зависит от диаметра заряда, оставаясь постоянной при изменении последнего в несколько раз. Для нитрогликоля это было установлено при изменении диаметра от 2 до 24 мм, для тротила—от 27 до 45 мм. При значительно больших диаметрах (80 мм и выше) для тротила наблюдалось некоторое увеличение скорости горения.
$ 5. Горение конденсированных взрывчатых систем
157
Скорость горения возрастает с увеличением давления и температуры. Зависимость скорости горения от давления в определенном интервале изменения последнего для многих изученных в этом отношении В В может быть выражена соотношением
и = А + Вр,
(4.3)
где и—скорость горения; А, В—постоянные.
Фиг. 4.20. Зависимость скорости горения желатинированного нитрогликоля от давления.
значение члена А близко к нулю, для не-
В случае летучих В В
летучих—этот член того
Так, для летучего нитрогликоля состоянии) «м=0,075-4-0,0315р (фиг.
же порядка, что и В.
ксилина № 1 «м=0,0907+0,0405 р (в обоих случаях скорость выражена в г!см2сек, давление — в кг1см?).
Для нитроглицериновых порохов в области умеренных (до ~300 ат) давлений скорость горения как функция давления (экспериментальные данные приведены на фиг. 4.21) может быть выражена соотношениями
(в слабо желатинированном 4.20), для нелетучего пиро-
Давление р кг/смг
Фиг. 4.21. Зависимость ско-
рости горения нитроглицеринового пороха от давления.
или
и = Д + Вр’, (4.3а)
(4.4)
и=^В'у',
причем постоянные v и v' меньше единицы.
В баллистике полузамкнутого объема обычно пользуются уравнением (4.4), поскольку оно приводит к более простым соотноше ниям между давлением и параметрами заряжания.
158
Гл. IV. Самораспространяющееся превращение в ВВ
При больших давлениях скорость горения бездымных порохов линейно растет с давлением, и в баллистике ствольного выстрела часто, пренебрегая членом А, принимают скорость горения прямо пропорциональной давлению:
и = ихр, (4.5)
где — та скорость, с которой происходило бы горение пороха при 1 ат, если бы указанная зависимость выполнялась при всех давлениях.
Зависимость скорости горения ВВ от начальной температуры может быть выражена эмпирическим соотношением
гдеЛ!,В1 — постоянные.
При повышении начальной температуры на 100° скорость горения различных В В увеличивается в 1,5—2 раза.
Скорость горения нитроглицериновых порохов при низких давлениях (1—10 ат) сильнее зависит от температуры, чем при высоких, Скорость горения черного пороха и других порохов смесевого типа обычно меньше изменяется с температурой, чем в случае бездымных порохов на основе нитроэфиров.
Линейная скорость горения порошкообразных ВВ уменьшается при увеличении плотности. При этом массовая скорость горения обычно остается постоянной. Так, для пироксилина № 1 увеличение плотности от 0,24 до 0,58 г/см3 вызывает снижение линейной скорости горения с 0,61 до 0,26 см/сек, массовая же скорость горения составляет 0,145 и 0,148 г!см2 сек соответственно.
§ 6. ТЕОРИЯ СТАЦИОНАРНОГО ГОРЕНИЯ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
1. Горение газов и летучих взрывчатых веществ
Построение теории горения конденсированных ВВ в общем случае, когда экзотермические реакции происходят и в конденсированной фазе и в образующихся газах, представляет очень сложную и до сих нор нерешенную задачу.
Теория горения газов была создана Я. Б. Зельдовичем и Д. А. Франк-Каменецким в 1938 г. Тогда же Беляевым было показано, что эта теория приложима и к горению летучих конденсированных ВВ.
Беляев обратил внимание на то, что многие В В являются летучими и при умеренных температурах, когда скорость реакции во ВВ еще мала, скорость испарения может быть значительной. В результате этого при быстром нагреве очередного слоя ВВ в процессе горения сначала происходит испарение ВВ, а химические реак
$ 6. Теория стационарного горения взрывчатых веществ
159
ции протекают целиком в парах. Для условий, в которых это утверждение справедливо (малое внешнее давление, высокая летучесть ВВ в сочетании с малой константой скорости реакции в конденсированной фазе), горение ВВ можно рассматривать просто как горение газа (пара) с той лишь разницей, что этот газ образуется в процессе самого горения путем испарения конденсированной фазы.
Фиг. 4.22. Схема распределения температуры и протекания реакции при горении летучих ВВ по Беляеву.
/—исходное ВВ. //—прогретый слой конденсированного ВВ.
///—зона прогрева паров ВВ, /Г—зона химической реакции в парах, V”—зона продуктов горения.
Рассмотрим стационарное горение, летучего BB в трубке постоянного сечения. Ведущей стадией процесса в этом случае является распространение экзотермической химической реакции в парах. Тепло, передаваемое от зоны реакции к поверхности BB, заставляет его испаряться со скоростью, определяемой скоростью подвода тепла. В конденсированной фазе химические реакции нс-происходят, а имеет место лишь нагрев вещества от его начальной температуры До температуры кипения.
Распределение температуры в пространстве показано на фиг. 4.22. 70 —начальная температура BB, Тк — температура кипения, Тт— максимальная температура, достигаемая при горении. Горение распространяется слева направо. Поверхность BB в рассматриваемый момент времени находится в плоскости АА. Плоскость АА, отделяющая конденсированное BB от его паров (а по
160
Гл. IV. Самораспространяющееся превращение в ВВ
скольку мы рассматриваем стационарный процесс, то и все остальные зоны), перемещается со скоростью и слева направо.
Будем рассматривать процесс в системе координат, движущейся вместе с фронтом горения. В такой системе плоскость АА неподвижна, а взрывчатое вещество будет втекать в нее справа налево со скоростью и, равной скорости горения. Превратившись в пары, В В будет течь со скоростью, во столько раз большей, во сколько раз плотность паров меньше плотности конденсированно-ного вещества. По мере разогрева паров за счет передачи тепла из соседних слоев и выделения тепла при химической реакции, протекающей в них, скорость движения будет расти и после завершения реакции достигнет своего максимального значения. При этом поскольку процесс стационарен, массовая скорость (up), т. е. масса вещества, протекающая через каждую зону в единицу времени, одна и та же.
К плоскости АА прилегает прогретый слой взрывчатого вещества ААСС. За толщину его АС математически удобно принимать участок, на котором разогрев ВВ уменьшается в е раз.
(та-т^с\ \Tc—Tq ) •
Пары, текущие справа налево, нагреваются за счет поступления тепла путем теплопроводности из зоны высокой температуры, а также за счет выделения тепла химической реакцией. При этом до точки перегиба кривой T—f(x) градиент температуры растет (по абсолютному значению), в точке перегиба градиент проходит через максимум, а затем падает, достигая нуля при Т=Тг. Соответственно изменяется и баланс потока тепла; справа от точки перегиба элемент объема получает больше тепла от горячих слоев, чем отдает его холодным; слева от точки d элемент объема движущихся газов отдает тепла холодным слоям больше, чем получает его от горячих. Это, конечно, не означает, что запас тепла и температура элемента объема в этой зоне понижаются, наоборот, они растут вследствие того, что по мере повышения температуры резко возрастает скорость выделения тепла химической реакцией.
Уравнение теплового баланса для элемента объема реагирующего газа (пара), расположенного на некотором расстоянии от плоскости АА, можно написать в виде
дТ дТ , дЧ
с„р ——исор—-4- т]-
р dt Р дх дх2
(4.7)
где Ср, р, ^ — соответственно теплоемкость при постоянном давлении, плотность и теплопроводность газа, которая предполагается не зависящей от температуры;
F— количество тепла, выделяемого реакцией в единице объема в единицу времени (объемная скорость тепловыделения).
$ 6. Теория стационарного горения взрывчатых веществ 161
Это уравнение показывает, что изменение тепловой энергии элемента объема происходит по трем причинам:
1) в результате движения газа со скоростью и; 2) за счет чистой теплопроводности; 3) за счет выделения тепла при протекании химической реакции.
Так как свежая смесь всегда поступает из более холодной части объема, то первое слагаемое правой части уравнения всегда отрицательно и уменьшает количество тепла в данной точке.
Второй член, равный ц —, представляет собой изменение теп-дх"
ловой энергии элемента объема за счет теплопроводности и может быть как больше, так и меньше нуля. При низких температурах (фиг. 4.22, участок cd — выпуклость обращена вниз) он положителен, а при высоких температурах (участок de — выпуклость кривой обращена вверх)—отрицателен.
Третий член выражает тепловыделение за счет идущей реакции, скорость которой зависит от концентраций реагентов и от температуры.
Поскольку речь идет о стационарном процессе и принимается, что зона горения неподвижна, то распределение температуры, изображенное на фиг. 4.22, не меняется во времени и в выражении (4.7) можно принять dTjdt=0 и заменить частные производные полными. Тогда это уравнение принимает вид
dT d2'l । г? л /л о\
р + т] 4-? =0. (4.8)
р dx dx2
Если рассматривать ту зону, где температура и скорость химической реакции, а следовательно, и тепловыделения так малы, что тепловыделением можно пренебречь, то, полагая Е=0, выражение (4.7) можно написать в виде
dT d'-T
ср?и + rt = 0. (4.9)
dx dx2
dT
Введя переменную у = ---, получим
dx
dy
ср?и? + ц-~- = 0 dx
или
d'-f Срри
---= — ------d х,
? 'Л
откуда после интегрирования находим
CpftUX
In <р =------+ Ср
162
Гл, IV. Самораспространяющееся превращение в ВВ
Так как
СрР 1
---- = — , 7]--7.
где х — температуропроводность, то
=йС)(?-плг/« (4,10)
dx
откуда
Т—ес' — е~ах!' + С2. (4.11)
и
Постоянные интегрирования Ci и Сг определяем из условия, что при Л= оо
Г-7'о, а при х=0
г=гк;
тогда С2=Т0 и
„ и
₽С’ = —(Тк-Т0).
X
Подставив эти постоянные в выражение (4. 11), получим зависимость температуры Т от расстояния х, измеряемого от плоскости с температурой Тк, в виде
и
Т=То-}-(Тк-То)е~~Х. (4.12)
Это соотношение применительно к горению было впервые выведено Михельсоном; оно справедливо для зоны, в которой тепловыделением протекающей химической реакции можно пренебречь.
В той области температур, где тепловыделение за счет реакции становится существенным, член F в выражении (4. 7) сохраняется. Это уравнение можно преобразовать следующим образом.
Скорость тепловыделения F зависит от концентрации реагирующих веществ и от температуры. Связав концентрацию с температурой, можно выразить скорость реакции и скорость тепловыделения как функцию одной температуры. При этом получается уравнение второго порядка, нелинейное ввиду нелинейной зависимости F(T').
Для решения этого уравнения Зельдович использовал то свойство закона Аррениуса, что скорость реакции сильно зависит от температуры, если, как обычно, выполняется условие
(4. 13)
Зависимость скорости тепловыделения реакций нулевого, первого и второго порядков от температуры для типичных условий горения (70 = 300° К; Т'г=1900°К; Е = 50 ООО кал/мол) приведена на фиг. 4. 23.
Когда выполняется условие (4. 13), можно считать, что пракги-
$ 6. Теория стационарного горения взрывчатых веществ
163
чески вся реакция протекает в узком температурном интервале 9, т. е. между температурами ТГ—9 и Тг, причем
е«(Л-П).
Поскольку этот интервал узок, то для тепла на нагрев реагирующего вещества положить
зоны реакции расходом можно пренебречь, т. е.
Но
единицах» принято первого
По оси ординат отложена скорость в условных максимальное значение скорости для каждой из кривых за единицу. О—реакция пулевого порядка. 1—реакция порядка. 2—реакция второго порядка.
ат дТ дТ с „о——с „о----испо —
at р dt р' дх
л дТ
Поскольку Срр-
дТ дТ
- также равно нулю, то и 11СрР~^т будет равно нулю. Тогда уравнение теплового баланса примет вид
d^T п---
1 dX2
(4.14)
Уравнение (4.14) означает, что в зоне реакции отвод тепла теплопроводностью равен теплу, выделяющемуся при химической реакции.
При помощи уравнения (4. 14) можно определить величину потока тепла
ат
164
Гл. IV. Самораспространяющееся превращение в ВВ
Снова вводим переменную <р=~—. Очевидно, что
<Г‘Т dtf
—— = и —I— .
rfx= dT
Подставляя это значение в уравнение (4. 14), получим
^ + г==0
dT
ИЛИ
Tjtprfcp— —F dT.
Интегрируя по зоне реакции, получим
’’г"8 то тс
С -FdT^{— FdT~{FdT,
2 J J J
Tr TT t,
откуда градиент температуры на границе зоны реакции приближенно равен:
— {FdT, у 1 J Г Т’о
ИЛИ / FT
/ ^{FdT. (4.15)
dx Г I
В выражении (4. 15) интеграл скорости выделения тепла по температуре берется по всей области, в которой скорость реакции отлична от нуля. Вследствие быстрого уменьшения скорости реакции при падении температуры основное слагаемое дает сравнительно узкий интервал температуры, примыкающий к температуре горения.
Поскольку расходом тепла на нагрев реагирующего газа мы пренебрегли, допустив, что оно целиком отводится теплопроводностью, то поток тепла, очевидно, можно приравнять общему количеству тепла, выделяющемуся в зоне горения в единицу времени, т. е. произведению количества сгоревшего вещества на его теплотворную способность Q:
dT
dx
Подставляя это выражение в формул}: (4. 15), получаем;
(4. 16)
$ 6. Теория стационарного горения взрывчатых веществ
165
Так как F = wQ, где w— объемная скорость реакции, то
и
wdT.
(4.16а)
скорость горения возрастает скорости реакции при темпе-горения пропорциональна не
Это выражение показывает, что с увеличением теплопроводности и ратуре горения. При этом скорость первой степени, а корню квадратному из скорости реакции.
Физический смысл этого вывода заключается в том, что при увеличении скорости реакции одновременно пропорционально росту скорости горения уменьшается толщина реагирующего слоя. Таким образом, если скорость реакции увеличится в m раз, а толщина слоя уменьшится в Дm раз, то скорость горения увеличится также в Vш раз. Это можно пояснить еще следующими соображениями.
Количество вещества, сгорающего в единицу времени, равно uSp, где S — площадь сечения заряда. С другой стороны, если обозначить толщину реагирующего слоя й и учесть, что объемная скорость реакции w и скорость тепловыделения Р связаны простым соотношением w~F№, то количество вещества, реагиру-
FSh
ющего в единицу времени, очевидно, будет равно ——— . Приравнивая оба
Чг .
выражения, получим
откуда
FSh uSo ~, Q
, Qu?
(4.17)
Но так как из выражения (4. 16) и со р, то
(4.18)
т. е. толщина реагирующего слоя h обратно пропорциональна корню квадратному из скорости реакции.
Подставляя в формулу (4. 16) вместо F его выражение через концентрации реагентов, пропорциональные давлению в степени, соответствующей порядку реакции, и учитывая, что к моменту достижения максимальной температуры часть вещества уже прореагировала и оно уже несколько разбавлено продуктами реакции, Зельдович получил для массовой скорости горения следующее выражение:
, Z 2n / FT г \n+i
«м=1/ л IT/ (Л —Ъ'гт, (4.19) г Q \ Е / ‘
где «„ — массовая скорость горения;
Е— энергия активации реакции горения;
« — порядок реакции;
«у — скорость реакции при температуре горения.
166
Гл. IV. Самораспространяющееся превращение в ВВ
Формула (4. 19) позволяет найти зависимость скорости горения от давления и начальной температуры. В эту формулу давление входит в скрытом виде, поскольку от давления зависит скорость реакции в газовой фазе. Обозначив через В произведение всех входящих в (4. 19) величин, не зависящих от давления, можно написать
мм = Вдаггг-
Как известно, зависимость скорости газовой реакции n-го порядка от давления имеет вид
<WTr~kpn,
где k — коэффициент пропорциональности.
Отсюда
11^Вгр*1\ (4.20)
1
где B^Bk-.
Таким образом, при мономолекуляриой реакции горения скорость его должна быть пропорциональна корню квадратному из давления; при бимолекулярной реакции скорость горения должна быть пропорциональна первой степени давления.
Физический смысл влияния давления заключается в том, что при большем давлении скорость реакции выше и зона, в которой она происходит, — зона высокой температуры — придвигается ближе к поверхности ВВ. Количества передаваемого тепла, а следовательно, и испаряющегося ВВ, возрастают соответственно увеличению скорости химической реакции.
Зависимость скорости горения от начальной температуры ВВ определяется в первую очередь зависимостью скорости реакции от температуры горения:
™Тг^Ае-Е1КТг.
Температура горения Tr=7’0 + Q/cp (здесь с?— средняя теплоемкость продуктов горения при постоянном давлении). Таким образом, чем выше начальная температура, тем выше температура горения, тем больше скорость реакции и соответственно скорость горения.
В формуле (4. 19) температура горения в явном или скрытом виде входит еще в ряд множителей: Q~Tr, т) растет с температурой, концентрация в выражении для скорости реакции обратно пропорциональна температуре. Зависимость от температуры всех множителей, входящих в выражение (4. 19) (кроме е г), можно представить в виде
/(?;)= 7П
где у включает все множители, не зависящие от температуры.
$ 6. Теория стационарного горения взрывчатых веществ 167
Суммарную зависимость скорости горения можно выразить приближенным соотношением
и^^е~Е12^
от температуры
(4-21)
или
и
т*
* г
г.
Логарифмируя, получим
1п £.2/?Tr-pin-,
т; г
Таким образом, в координатах In --------—зависимость скорости
7',, Тт
(4.22)
горения летучих ВВ от максимальной температуры горения должна изображаться прямой линией, причем тангенс угла ее накло-
на равен Е/27? (фиг. 4. 24).
От плотности порошка скорость реакции в газовой фазе, естественно, не должна зависеть, поэтому массовая скорость горения не должна изменяться при изменении плотности. Отсюда следует, что линейная скорость горения должна изменяться обратно пропорционально изменению плотности.
Беляев применил рассмотренные зависимости к анализу закономерностей горения нитрогликоля. Он рассчитал абсолютную величину скорости горения, приняв, что скорость реакции равна числу соударений между активными молекулами, т. е. что вероятностный множитель Р = 1, и получил
Фнг. 4.24. Зависимость скорости горения летучих ВВ от температуры горения по теории Беляева.
очень хорошее соответствие с опытными данными. Точно так же со-
гласуется с опытом и зависимость скорости горения от температуры. Количественное соответствие опыта и расчета в обоих случаях получается, если энергию активации принять равной 35 000 кал/мол. Такое же значение энергии активации было получено и по температурной зависимости медленного распада нитрогликоля.
Однако последующими исследованиями было показано, что указанное соответствие получается лишь в том случае, если принять температуру горения, равной 1650° К, как рассчитал Беляев на основе приближенного анализа состава продуктов горения. Если взять результаты точного анализа, то температура горения окажется выше и для достижения соответствия опыта с теорией необходимо принять гораздо большее значение энергии активации, чем установленное для медленного термического распада. Расче
168
Гл. IV. Самораспространяющееся превращение в ВВ
ты энергии активации по температурной зависимости скорости горения для ряда других нитроэфиров также приводят к значениям энергии активации, значительно превышающим установленные для медленного распада.
Помимо этого, первоначальное предположение Беляева о том, что течение горения и медленного гомогенного распада определяется одной и той же реакцией, нельзя считать правильным. Дело в том, что, по крайней мере для нитроэфиров, первичная стадия термического распада, определяющая скорость его течения, представляет собой отщепление группы NO2 от молекулы эфира и является очень слабо экзотермичной. Такая реакция не может быть ведущей при горении, которое распространяется именно за счет выделяемого реакцией тепла, вызывающего разогрев близлежащего слоя вещества/Ведущей при горении является та экзотермическая реакция, при которой выделяется основная часть тепла и которая при достигаемой за счет этого тепла температуре протекает с наибольшей скоростью. В случае нитроэфиров ведущей реакцией при низких давлениях, возможно, является взаимодействие двуокиси азота с формальдегидом или другими альдегидами, образующимися при распаде молекулы. Расчет скорости горения метилнитрата по кинетическим характеристикам реакции между формальдегидом и двуокисью азота приводит к удовлетворительному соответствию с опытом в отношении численного значения скорости.
Такого соответствия между расчетом и экспериментом, однако, не получается для температурной зависимости скорости горения. При выводе выражения (4.21) мы учитывали только влияние начальной температуры на температуру горения. Однако с начальной температурой ВВ существенно изменяется и его вязкость, которая, как показывает опыт, влияет на скорость горения. В результате этого температурный коэффициент скорости получается завышенным и при расчете по формуле (4. 22), не учитывающей влияния вязкости, могут получаться чрезмерно высокие значения энергии активации.
Предположение о ведущей роли первичной мономолекулярной реакции противоречит также установленной опытами пропорциональности скорости горения первой степени давления. Если бы ведущей была реакция первого порядка, то скорость горения по выражению (4.21) изменялась бы пропорционально корню квадратному из давления. Изменение скорости горения пропорционально давлению в первой степени согласуется с предположением о ведущей роли реакции между кислородсодержащими продуктами первичного распада вроде NO2, с одной стороны, и продуктами, содержащими избыток водорода и углерода, с другой. Такая реакция должна идти через столкновения между указанными частицами, и скорость ее поэтому может быть пропорциональна произведению парциальных давлений реагентов, т. е. квадрату общего давления. Соответственно скорость горения ц'ХЖ'рсо р.
§ 6. Теория стационарного горения взрывчатых веществ
169
Таким образом, представления Беляева о механизме, горения летучих ВВ могут быть согласованы с фактическими закономерностями. Численные расчеты скорости, правда, пока не проведены, так как неизвестны конкретные участники ведущей реакции и температура ее протекания.
Само представление о том, что первым этапом горения летучих ВВ является превращение их в пары, совершенно бесспорно и даже неизбежно в случае таких веществ как, например, метилнитрат, кипящий при 66° без заметного разложения, или, тем более, растворы сжиженных газов, кипящие при очень низких температурах. Такой стадийный механизм горения реален, как показал Беляев, и для
веществ со сравнительно высокими температурами кипения, таких,
как нитрогликоль, нитроглицерин, тэн, тетрил и др. В условиях горения скорость прогрева вещества столь велика, что оно испаряется прежде, чем в заметной степени пройдет химическая реакция.
2. Горение взрывчатых веществ при наличии экзотермической реакции в конденсированной фазе
Температура кипения возрастает с увеличением давления. Чем выше давление, под которым происходит горение летучего ВВ, тем до более высокой температуры нагревается слой вещества, прилегающий к поверхности. Когда давление достаточно высоко, температура прогретого слоя может подняться настолько, что скорость реакции разложения ВВ в конденсированной фазе станет заметной по сравнению со скоростью испарения. Это должно привести к увеличению скорости горения, так как часть тепла, выделяемая в конденсированной фазе, будет передаваться соседним слоям теплопроводностью непосредствен-
Фиг. 4.25. Схема горения иитроклет-
но по жидкости или твердому телу, а не через слой паров, как это имеет место в условиях, когда реакция и выделение тепла происходят только в газовой фазе. В случае нелетучих ВВ типа нитроклетчатки реакция в конденсированной фазе происходит и при низких давлениях. Некоторые закономерности горения ВВ при наличии экзо-
чатки или пороха.
/—зона экзотермических реакций в конденсированной фазе,. 2—зона беспламенных экзотермических реакций в газовой фазе. 3—зона пламени
термической реакции в конденсированной фазе отличаются от тех.
которые дает рассмотренная выше теория.
Процесс горения нитроклетчатки, а также порохов на ее основе можно представить себе в следующем виде (фиг. 4.25).
170 Гл. /V. Самораспространяющееся превращение в ВВ
Первым этапом являются слабоэкзотермические реакции, протекающие в конденсированной фазе с образованием газообразных продуктов (зона /). Скорость реакций в конденсированной фазе, а если они в данных условиях являются ведущими, то и скорость горения, не должны зависеть от давления. Действительно, как показал П. Ф. Похил, скорость горения пироксилинового и нитроглицеринового порохов при очень низких давлениях (до 40 мм рт. ст.) от давления не зависит*.
Газообразные продукты реакций первого этапа вступают во взаимодействие друг с другом (зона 2). Реакции этого второго этапа, по-видимому, бимолекулярные, протекают также с выделением тепла и также приводят к образованию реакционно-способных промежуточных веществ, но относительно труднее вступающих во взаимодействие (NO, СО и др). Так как реакции в зоне 2 экзо-термичны, то температура, достигаемая в ней, выше, чем при реакциях в конденсированной фазе. Продукты реакций первого этапа обладают высокой реакционной способностью, поэтому реакции второго этапа проходят с малой энергией активации, иными словами, скорость их слабо зависит от температуры.
В этом заключается существенное отличие процесса горения нитроклетчатки, порохов на ее основе и других нелетучих ВВ от того процесса, который рассматривается в теории Беляева—Зельдовича для летучих веществ. В последнем случае принимается, что энергия активации ведущей реакции E^>RT. Это допущение приводит к тому, что реакция протекает в основном в узкой зове при температуре, близкой к максимальной. Здесь же реакции второго этапа растянуты на всем протяжении зоны 2 (см. фиг. 4. 25). Основным фактором, влияющим на их прохождение, является давление.
Наконец, при повышенных давлениях начинают протекать сильно экзотермические реакции третьего этапа, сопровождающиеся •появлением пламени, при которых окись азота восстанавливается до элементарного азота (зона пламени 3).
При стационарном горении скорости всех трех этапов, очевидно, одинаковы.
Скорость реакции в конденсированной фазе зависит от температуры, при которой она протекает. При очень низких давлениях эта температура определяется только тепловым эффектом реакций данного этапа. Если давление выше, то зона 2 становится уже, так как скорость реакций второго этапа возрастает; они протекают тогда ближе к поверхности конденсированной фазы и тепло их частично передается конденсированной фазе, увеличивая ее разогрев. Это увеличивает скорость реакций первого этапа, а следовательно, и скорость горения. Таким образом, в той области давлений, в
* Опыты производили с сильно нагретыми порохами, так как в обычных условиях (небольшие диаметры шашки, комнатная температура)) пороха при •столь низких давлениях вообще ие горят.
£ 6. Теория стационарного горения взрывчатых веществ 171
которой тепло, выделяющееся в зоне 2, заметно повышает температуру конденсированной фазы, скорость горения становится зависящей от давления.
Если давление еще выше, то идут и пламенные реакции (зона 3). В зоне пламени температура сильно повышается и соответственно тепло из нее может передаваться в зону реакций второго этапа и даже дальше — в зону реакций первого этапа. Температура конденсированной фазы повышается и соответственно ускоряется течение реакций.
Влияние реакций третьего этапа на скорость горения зависит от давления. При том давлении, при котором только появляется пламя, влияние пламени на скорость горения еще не проявляется. Это объясняется тем, что расстояние между пламенем и поверхностью ВВ велико и тепло от пламени практически до нее не доходит. При дальнейшем повышении давления зона 2, отделяющая поверхность ВВ от пламени, становится уже и чем выше будет давление, тем больше тепла будет передаваться из зоны 3 в зону 2, а из нее — в зону 1. При больших давлениях влияние реакций третьего этапа становится преобладающим. В этих условиях проявляется зависимость скорости горения пороха от его теплоты сгорания.
Таким образом, при низких давлениях ведущей является реакция в конденсированной фазе, при высоких — пламенная реакция, при промежуточных давлениях скорость горения определяется совокупностью реакций всех трех этапов.
Описанную схему горения нитроклетчатки следует рассматривать как простейшую. В действительности, как это предполагалось ранее, а Похилом показано экспериментально, при горении, по крайней мере в области низких давлений, происходит диспергирование горящего вещества. Оно обусловлено тем, что разложение в поверхностном слое конденсированной фазы происходит неравномерно и образующиеся отдельные пузырьки газа отрывают и увлет кают с собой частицы вещества. При давлении около 2 мм пироксилиновый порох только на 30% превращается в газы, а 70% его превращается в дым, представляющий собой практически не изменившийся порох. При горении под более высокими давлениями (до 100 мм) количество дыма уменьшается, изменяется и его состав в сторону обогащения углеродом и обеднения азотом и кислородом.
3. Горение быстрогорящих взрывчатых веществ
Механизмы горения некоторых быстрогорящих ВВ, например гремучей ртути, и летучих веществ качественно различны. В первом случае в еще большей степени, чем для нелетучих вторичных ВВ, имеет место диспергирование поверхностного слоя вещества и оно уносится в виде пыли потоком газов от поверхности конденсированной фазы, продолжая реагировать. Реакция завершается, по крайней мере при низких давлениях, на значительном расстоянии
172
Гл. IV. Самораспространяющееся превращение в ВВ
от фронта. Поскольку поверхность теплообмена между продуктами
горения и диспергированным веществом очень велика, количество тепла, получаемого веществом в единицу времени, гораздо больше,
чем в рассмотренных выше случаях, когда диспергирования нет или оно мало и поверхность теплообмена близка к площади попе-
речного сечения цилиндрического заряда. Соответственно гораздо
больше (в десятки раз) и скорость
Фиг. 4. 26. Зависимость скорости горения гремучей ртути и пикрата калия от давления.
горения.
Зависимость скорости горения от давления (при низких давлениях) имеет тот же вид, что и при горении ВВ обычного типа.
Однако при повышении давления зависимость скорости горения от давления изменяется (фиг. 4.26). В случае гремучей ртути рост скорости замедляется, н в широком интервале давления скорость выражается уже не линейной функцией давления, а соотношением
zz=4-j-Bp’,
где Д = 1; В=1,04, v=0,5 (и выражена в см/сек\ р—в кг/см2).
Еще более резко изменяется зависимость от давления скорости горения пикрата калия: до 4 кг/см2 скорость быстро возрастает, а затем в большом интервале измене-иия давления остается постоянной *. Слабая зависимость скорости горения от давления иаблюда-
строгорящих и медлеиногорящих ВВ.
лась и для некоторых других бы-Так, по данным Светлова и Фогельзанга
для сильно спрессованного стифиата свинца, скорость горения которого весьма велика, она почти не растет с давлением, оставаясь практически постоянной (33—34 см/сек) при его изменении от 150 до 400 кг/см2. При понижении давления от 150 кг)см2 до 15 мм рт, ст. скорость горения уменьшается очень мало — приблизительно до 25 см/сек.
Независимость скорости горения от давления, по-видимому, связана с тем.
что в соответствующих условиях наиболее быстрой из последовательных стадий и поэтому ведущей становится экзотермическая реакция в коидеисироваииой фазе. Скорость же этой реакции может не зависеть от давления.
§ 7. НЕУСТОЙЧИВОЕ ГОРЕНИЕ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
1. Газодинамические условия устойчивости горения
Опыт показывает, что горение вторичных ВВ сохраняет равномерный характер и постоянную скорость только при определенных условиях. Так, равномерность горения порошкообразного ВВ ма-
* Как показали новейшие исследования, зависимость скорости горения пикрата калия от давления сложнее: от 4 до 60 кг'см? наблюдается значительное уменьшение скорости; при дальнейшем увеличении давления до 400 кием2 она остается постоянной.
$ 7. Неустойчивое горение взрывчатых веществ
173
лой плотности нарушается при повышении давления. Начиная с некоторого давления, зависящего от плотности и свойств ВВ, горение резко ускоряется, становится пульсирующим и может даже переходить в детонацию.
Сходное поведение показывают жидкие ВВ. Начиная с некоторого предельного давления, различного для разных жидкостей и условий, горение также утрачивает равномерность, становится пульсирующим и резко ускоряется.
Особенно склонны к неустойчивому горению с переходом в детонацию инициирующие ВВ. Одни из них, например азид свинца, при всех изученных условиях неуловимо быстро переходят от горения к детонации, другие, как, например, гремучая ртуть, хотя и способны в некоторых условиях (большая плотность порошка, горение шашки без оболочки) к стационарному горению, но при большинстве условий, в которых вторичные ВВ горят устойчиво, также быстро переходят от горения к детонации.
Характеристику устойчивости горения можно дать на основе следующих соображений. При горении ВВ превращается в газы. Так как плотность газов, особенно при высоких температурах горения, очень мала по сравнению с плотностью твердого вещества, то продукты горения сильно расширяются, приходя при этом в движение. Очевидно, что газы приходят в движение за счет некоторого повышения давления над поверхностью горящего ВВ. Однако возникновение повышенного давления приводит к увеличению скорости горения, что в свою очередь ускоряет движение газов.
Чтобы установить конечный итог этих двух явлений, необходимо рассмотреть их взаимодействие количественно.
В качестве простейшего случая рассмотрим горение с одного открытого торца цилиндрического заряда ВВ, находящегося в прочной трубке сечением 1 см2 при внешнем давлении ро. Образующиеся газы оттекают в направлении, противоположном направлению распространения горения, со скоростью, зависящей от скорости их образования (фиг. 4.27). Представим графически процессы образования газов при горении и истечения их из трубки в зависимости от давления внутри трубки.
На фиг. 4. 28 по оси абсцисс отложено давление у поверхности ВВ. По оси ординат отложены значения: т\ — количества газов, образующихся при данном давлении за 1 сек. с 1 см2 поверхности фронта (массовая скорость горения), и т* — количества газов, вытекающих за единицу времени при давлении внутри трубки р и внешнем давлении р0 через каждый квадратный сантиметр сечения трубки (газоотвод).
Очевидно, что по закону сохранения количества движения
р„р0 = /П1«г.
174
Гл. IV. Самораспростроняющееся превращение в ВВ
Здесь иг — скорость истечения газообразных продуктов горения, причем
где рг — плотность газов.
Тогда
/п?
Р-Рр— -
Рг
Линия газоотвода т2 в зависимости от давления имеет, как известно из газодинамики, вид, изображенный на фиг. 4.28. При
Фиг. 4.27. Схема оттока газов при горении ВВ в трубке.
Фиг. 4.28. Зависимость газопри-хода mi при горении и газоотвода т2 от давления.
Р — Ро, т. е. когда давление над поверхностью ВВ равно внешнему давлению, отвод газа равен нулю. По мере повышения давления отвод газов увеличивается, причем вначале это увеличение идет по кривой *, а затем, начиная с давления, приблизительно в два раза превышающего внешнее, отвод газов т2 возрастает прямо пропорционально давлению:
т2--Кр, (4.23)
где К — постоянная, зависящая от температуры, плотности и теплоемкости газов.
* Уравнение этой кривой имеет вид
где а — сечение отверстия для выхода газа; k — показатель адиабаты;
рг— плотность газа при давлении р.
£ 7. Неустойчивое горение взрывчатых веществ
175-
Линия газоприхода в наших условиях есть по существу линия, изображающая массовую скорость горения как функцию давления:
Полагая в соответствии с данными эксперимента, что
+ (4.24>
построим на фиг. 4. 28 для пгх две прямые соответственно разным значениям В; прямую I для случая, когда В<_К, и прямую II— когда В^>К.
В случае, когда В<К, линия газоприхода пересекает линию га-зоотвода и горение, как легко показать, будет устойчивым. В самом деле, если мы зажжем взрывчатое вещество при р», то при этом, давлении газоотвод равен нулю, а газоприход изображается ординатой щ/(см. фиг. 4.28). За счет разности газоприхода и газоот-вода давление у фронта горения будет возрастать до тех пор, пока, не будет достигнуто давление р>, при котором газоотвод становится равным газоприходу. При В<% давление дальше возрастать не-может, так как при p1>pi расход газа больше газоприхода. Поэтому если бы давление по какой-либо случайной причине и увеличилось,, например до значения р?, оно неизбежно затем должно было бы снизиться до значения рг.
Путем аналогичного рассуждения легко показать, что при В^>К (прямая И на фиг. 4. 28) давление в трубке будет непрерывно возрастать, что при соответствующих условиях может привести к возникновению детонации.
Таким образом, возможность устойчивого горения при данном давлении определяется соотношением между скоростью горения (точнее, скоростью газообразования) и скоростью отвода газов, при этом давлении или, правильнее говоря, соотношением между скоростью роста газоприхода и скоростью роста газоотвода с давлением.
Если при равенстве газоприхода и газоотвода первый растет с давлением быстрее, чем второй, то горение неустойчиво, и, наоборот, если газоприход растет медленнее, чем газоотвод, то будет иметь место устойчивое горение. Устойчивость горения должна определяться соотношением величин: К — тангенса угла наклона
.. п ciUyt dtn ] о
прямой газоотвода и о =—— — производной скорости горения dp dp
(точнее, скорости газообразования) по давлению. Граница между областями устойчивого и газодинамически неустойчивого горения определяется условием
В -^К при тх = т2.
Поскольку те или иные параметры (например, давление, температура, плотность ВВ) влияют на величины В или К, они будут влиять и на устойчивость горения.
176
Гл. IV. Самораспространяющееся превращение в ВВ
На основе этих общих газодинамических соображений об условиях устойчивости горения рассмотрим имеющиеся данные применительно к конкретным ВВ и условиям горения.
Рассчитаем сначала значение К — коэффициента пропорциональности между газоотводом и давлением. Из газодинамики известно, что ____
К=офтахт/ (4.25)
V PoTi где о — сечение отверстия для выхода газов;
1 ________
, / 2 V-i, Г k , , ,,
бтах=[-—Н 1/ > ПРИ «==1,41 для двухатомных газов
=0,484;
Ро — плотность продуктов горения при нормальных условиях;
7\ — температура газов.
Из выражения (4. 25) видно, что коэффициент К не является строго постоянной величиной для всех ВВ, а может изменяться соответственно различным возможным значениям теплоемкости, температуры и плотности газообразных продуктов горения.
Рассчитаем значение коэффициента К, приняв для простоты, что температура горения равна 2730° К, а плотность газов 1,25-10-3 г/см2 (окись углерода и азот). При этих условиях коэффициент К-^17,4: г/см? сек: кг/см2.
Для оценки устойчивости горения нужно сравнить это значение diitt
1\ со значением--— из выражения зависимости скорости горения
dp
от давления (ия=А~}-Вр). Поскольку эта зависимость, как показывает опыт, в определенных условиях горения является линейной, производная —d—-- есть постоянная величина, которую мы обозна-dp
чили В. Значения величины В приведены в табл. 4. 12.
Как видно, для всех изученных вторичных ВВ значения величины В в 50—200 раз меньше, чем значение К. Таким образом, способность вторичных ВВ к устойчивому горению теоретически вполне естественна.
Те из инициирующих ВВ, которые в прессованном до очень высокой плотности состоянии способны устойчиво гореть, дают линейную зависимость скорости горения от давления, как и вторичные вещества, но значения В для них гораздо больше, чем для вторичных, и приближаются к предельному. Можно предполагать, что тс инициирующие ВВ, для которых не удалось экспериментально наблюдать устойчивого горения, характеризуются еще большими значениями величины В*, что и должно приводить к нарушению рав-
* Возможен случай горения с очень большой скоростью и при слабой зависимости скорости горения от давления (в формуле иы^=А+Вр величина А очень велика, а В — мала). В этом случае при поджигании может возникнуть большое динамическое повышение давления, так же как при большом В.
$ 7. Неустойчивое горение взрывчатых веществ
177
Таблица 4.12
Значения коэффициента В в формуле а Вр для различных ВВ
ВВ Интервал давления am Значения величины В zjcM2 сек: кг^см?
Тротил 40-1000 0,00675
Пикриновая кислота 40—1000 0,00786
Тетрил 200—1000 0,0101
Гексоген 30—500 0,0270
Коллоксилин 5—30 0,0162
Пироксилин № 1 3—12 0,0405
Тэи 15—500 0,0193
Метилнитрат жидкий 0.2—1,5 0,133
Нитрогликоль жидкий 1—12 0,0390
Нитрогликоль желатинированный .1—150 . 0,0315
Нитроглицерин желатинированный 0,5—2,2 0,146
Гремучая ртугть До 1 4,18
Тринитротриазндобепзол До 1 0,85
новесия между газоприходом и газоотводом, иначе говоря, к невозможности устойчивого горения.
Таким образом, один из фундаментальных фактов — устойчивость горения вторичных ВВ и неустойчивость горения инициирующих В В — объясняется теорией.
Известно, однако, что вторичные ВВ, горящие в большинстве случаев стационарно и устойчиво, в некоторых условиях горения (например, при значительной пористости или в жидком состоянии) дают переход горения в детонацию. Точно так же и те инициирующие ВВ, которые согласно теории должны гореть устойчиво и действительно горят так в определенных условиях (например, в сильно спрессованном состоянии, в вакууме), в других условиях (например, при меньших давлениях прессования) дают быстрый переход горения в детонацию.
С точки зрения теории переход горения в детонацию в обоих случаях должен быть истолкован как следствие изменения зависимости скорости газоприхода от давления в сторону увеличения ——. Возникает вопрос: почему и как осуществляется это измене-dp
ние? Для ответа на этот вопрос рассмотрим экспериментальные данные по горению порошкообразных и жидких ВВ в тех условиях, когда нарушается стационарное течение процесса, и теоретическое истолкование этого нарушения.
178 Гл. IV. Самораспространяющееся превращение в В В
2. Неустойчивое горение порошкообразных взрывчатых веществ
Горение твердых порошкообразных ВВ идет равномерно и устойчиво не при всех условиях. Если давление превосходит некоторый предел, величина которого зависит от различных факторов и в первую очередь от плотности, то зависимость скорости горения от давления изменяется. Так, для пироксилина № 1 при плотности 0,37—
0,45 г/см? линейный закон
Фиг. 4.29. Зависимость скорости горения пироксилина № 1 малой плотности
ст давления.
роста скорости с давлением выполняется только до давления -^З кг/см2
(фиг. 4.29). При давлениях от 3 до 4 кг/см2 скорость растет несколько быстрее, но горение еще сохраняет равномерный характер. Начиная с давления около 4 кг/см2, горение становится толчкообразным, пульсирующим, общее время сгорания участка данной длины резко уменьшается.
Естественно предположить, что изменение режима горения при увеличении давления обусловлено проникновением газообразных продуктов горения в толщу порошка. Последствия этого явления зависят от скорости проникновения газов. Если скорость проникновения газов не превосходит заметно скорости горения, то время, необходимое для проникновения газов сквозь слой данной тол-
щины, и время сгорания этого
слоя близки между собой.
Влияние проникновения газов в этом случае ограничивается лишь
некоторым увеличением поверхности горения без явного нарушения его равномерности. Так как глубина проникновения газов увеличи-
вается с ростом давления, то и скорость горения при наличии этого явления возрастает с давлением быстрее, чем в его отсутствии.
При большой скорости и глубине проникновения газы обгоняют фронт горения и охватывают слой порошка заметной толщины. Этот слой затем быстро сгорает, особенно, если частицы перед воспламенением успели прогреться. Оттекающие при этом газы могут увлекать непрореагировавшие частицы ВВ. Такому сгоранию, сходному со вспышкой, сопутствует некоторое повышение давления, усиливающее проникновение газов в глубь порошка. Развитие этого явления может привести к возникновению детонации.
$ 7. Неустойчивое горение взрывчатых веществ
179
Возможен, однако, и такой случай, когда за повышением давления вследствие выгорания прогретого слоя следует его падение, которое в некоторых условиях приводит даже к затуханию. В других условиях горение не затухает, а лишь замедляется, затем вновь ускоряется за счет проникновения газов в поры ВВ и цикл повторяется. В этом случае амплитуда колебаний давления не достигает предела, ведущего к возникновению детонации. Горение продолжается, до конца, но на пульсирующем режиме.
Фиг. 4. 30. Влияние давления на устойчивость горения порошкообразных ВВ.
Самоускоряющееся горение пористого ВВ можно представить графиком (фиг. 4.30). Вплоть до давления р{, величина которого зависит от плотности и размеров частиц порошка, скорость горения и, следовательно, газоприход медленно и линейно растут с давлением, причем тангенс угла наклона прямой газоприхода меньше, чем прямой газоотвода.
При дальнейшем повышении давления производная--------L воз-
dp растает, линия газоприхода отклоняется вверх за счет проникновения газов в глубь порошка и при давлении р2 вновь пересекает прямую газоотвода. В точке В производная газоприхода _ dm< - dmo „ dm-, dm->
по давлению -—L <.—а в точке D производная — dp dp dp dp
В обеих точках газоприход и газоотвод находятся в равновесии, однако легко показать, что в точке В это равновесие устойчиво, а в точке D — неустойчиво и малейшее повышение давления вызовет превышение газоприхода над газоотводом и дальнейшее прогрессивное возрастание давления и скорости горения.
Таким образом, само по себе наличие пористости, точнее газопроницаемости, не обязательно ведет к нарушению устойчивости горения. Горение становится неустойчивым, когда давление превосходит предел, величина которого при прочих равных условиях тем
180
Гл. IV. Самораспространяющееся превращение в ВВ
больше, чем меньше газопроницаемость вещества. Так, горение порошкообразной нитроклетчатки даже при малой плотности может при низких давлениях протекать параллельными слоями и с той же скоростью, как горение изготовленного из нее пороха.
Основной причиной проникновения газов в глубь порошка, несомненно, является динамическое повышение давления Др у фронта горения, соответствующее тому количеству движения, которое получают оттекающие газы. Значение Др растет с повышением давления, поскольку при этом скорость горения увеличивается. Поэтому влияние проникновения газов в поры может отсутствовать при горении под малыми постоянными давлениями и проявляться при больших давлениях.
Еще более благоприятные условия для проникновения газов имеются при горении в замкнутом объеме под возрастающим давлением. Опыты показали, что в этих условиях уменьшение плотности порошкообразного ВВ резко усиливает склонность горения к переходу в детонацию. Так, гексоген с плотностью, равной 0,9 удельного веса, не детонирует при горении даже в прочной оболочке (давление разрыва 700 кг/см2), в то же время в виде порошка малой плотности гексоген дает переход горения в детонацию уже в оболочке, разрывающейся при 45 кг/см2.
3. Неустойчивое горение жидких взрывчатых веществ
Горение всех изученных в этом отношении жидкостей — метилнитрата, нитрогликоля, нитроглицерина, дигликольдинитрата — происходит равномерно лишь при определенных условиях. Основными из этих условий являются давление, температура и вязкость жидкости. Вне области «нормального» горения линия, выражающая скорость горения как функцию давления, изгибается вверх подобно тому, как это наблюдается в случае порошкообразных ВВ (см. фиг. 4. 30).
Изменение характера горения жидких ВВ при определенных условиях было предсказано Л. Д. Ландау. Он показал, что нормальный «теплопроводностный» режим горения, заключающийся в испарении жидкости, прогреве и химической реакции в парах, является, вообще говоря, неустойчивым. Случайное возмущение поверхности горящей жидкости стремится возрастать по амплитуде во времени. Чем больше скорость распространения, тем меньше устойчивость плоского фронта горения. Факторами, стабилизирующими поверхность жидкости и препятствующими искривлению фронта, являются сила тяжести, поверхностное натяжение и вязкость жидкости. Стабилизация горения может обеспечиваться также малым диаметром трубки.
Нарушения нормального режима горения жидких ВВ выражаются в турбулизации фронта горения, ведущей к увеличению количества вещества, сгорающего в единицу времени, на единицу площади сечения столбика жидкости.
$ 7. Неустойчивое горение взрывчатых веществ
181
Максимальная предельная скорость, при которой горение может еще оставаться невозмущенным, определяется, согласно Ландау, с учетом стабилизирующего влияния сил тяжести и поверхностного натяжения уравнением
«м max = (4aKgp=P»)’/S (4. 26)
где «мтах—- предельная массовая скорость горения в г[см2сек;
ак— поверхностное натяжение между жидкостью и ее насыщенным паром при температуре кипения;
рг—-плотность газообразных продуктов горения;
Рж—-плотность жидкости.
Согласно В. Г. Левину в случаях, когда вязкость жидкости велика или поверхностное натяжение мало, стабилизирующее влияние вязкости преобладает. Предельное значение скорости горения определяется в таких случаях соотношением
«мтзх=(з/Зё-7]?Лр^)'\ (4.27)
где т] — вязкость жидкости.
Выражение (4.26) можно преобразовать, воспользовавшись приближенным соотношением для парахора Р
(4.28)
Рж
где М — молекулярный вес ВВ.
Тогда для предельной массовой скорости получим
йМШах=7,91-£-Р» (4.29)
Использование этой формулы (хотя и несколько менее точной) для характеристики устойчивости горения особенно удобно потому, что парахор может быть рассчитан по структурной формуле вещества и не меняется в зависимости от температуры в широком интервале изменения последней. Кроме того, формула позволяет оценить влияние химической структуры жидкого взрывчатого вещества на устойчивость горения и показать, что значение предельной скорости для различных взрывчатых веществ изменяется в очень узких пределах.
В самом деле, множитель Р/М физически соответствует удельному объему вещества при температуре, при которой ак = 1, и величина его колеблется для разных ВВ в довольно узких пределах. То же относится и к другим величинам, входящим в правую часть формулы, которую можно рассматривать как приближенно постоянную величину. Как показывает расчет, эта величина составляет около 0,25 г!ся& сек. при атмосферном давлении.
Поскольку предельная скорость для разных ВВ приближенно одинакова, устойчивость нормального горения может быть характеризована величиной фактической скорости горения при данных условиях давления и температуры.
182 Гл. IV. Самораспространяющееся превращение в ВВ
Формулы (4.26), (4.27) или (4.29) дают зависимость предельной скорости от давления, под которым происходит горение. При изменении давления в правой части формул меняется в основном только плотность газов, пропорциональная давлению. Учитывая эту зависимость, получим
«мтаХ = ₽Х/’» (4-30)
где £?«0,25, если р выражать в кг/см2, а ии—в г/см2 сек.
Таким образом, условие устойчивости нормального горения жидкости можно сформулировать следующим образом: если скорость горения при данном давлении больше ftp'1*, то горение неустойчиво и наоборот.
Так как скорость горения, как мы видели, с увеличением давления растет пропорционально р, а предельная скорость согласно (4.30) увеличивается пропорционально р'11, то очевидно, что с повышением давления устойчивость горения уменьшается.
Рассмотренные соотношения сохраняют свою справедливость только до тех пор, пока давление, под которым происходит горение, не слишком близко к критическому давлению, а температура кипения соответственно — к критической температуре для данного вещества. При критических условиях поверхностное натяжение жидкости становится равным нулю, а согласно выражениям (4.26) или (4.29) также должно упасть до нуля и значение предельной скорости. Поскольку критическое давление органических жидкостей, как показывает опыт, около 50 ат, то отсюда можно сделать вывод, что нормальное горение жидкостей выше 50 ат невозможно, если только их вязкость недостаточна для того, чтобы стабилизировать горение согласно выражению (4.27),
Поэтому если при повышении давления приближаться к критическому давлению, то скорость горения должна за счет эффекта Ландау расти быстрее, чем при меньших давлениях; кроме того, должна появляться пульсация. Эти обстоятельства не исключают, впрочем, возможности сохранения в переходной области характера горения, а при малом периоде пульсации — даже кажущейся его равномерности.
Формула (4.29) дает также влияние начальной температуры ВВ на устойчивость его нормального горения. Предельная скорость горения почти не зависит от температуры, точнее, очень мало уменьшается с увеличением температуры соответственно уменьшению плотности жидкости. В то же время скорость горения возрастает с температурой; это значит, что устойчивость нормального горения должна уменьшаться с повышением начальной температуры.
Однако во влиянии давления и температуры существует разница. Давление можно повышать неограниченно, вплоть до значений, соответствующих нарушению нормального режима горения любой жидкости; возможность же повышения температуры ограничивается температурой самовоспламенения вещества. Поэтому не для всякого жидкого ВВ можно путем повышения температуры прийти к нарушению устойчивости горения.
Сопоставление экспериментальных данных по предельному давлению, при котором нарушается режим равномерного горения для ряда ВВ, показало хорошее согласие с теорией- Для нитроглицерн-
$ 7. Неустойчивое горение взрывчатых веществ
183
на это давление около 0,5 ат, для метилнитрата — около 2 ат, для нитрогликоля — около 20 и для дигликольдинитрата — около 50 ат.
Изучалось также (на желатинированных жидкостях) влияние вязкости на устойчивость горения; установлено, что стабилизирую-
Фиг. 4.31, Влияние давления на скорость горения нитрогликоля.
щее влияние вязкости количественно соответствует теоретическому.
Следует добавить, что переход в неустойчивую область обычно приводит к горению на пульсирующем режиме, идущему со ско-
Фпг. 4.32. Фотографии на движущейся пленке горения при 16 ат нитроглпколя желатинированного (а) и неже-латшшрованного (б).
ростыо, в несколько раз превышающей скорость невозмущенного горения. На фиг. 4.31 показано изменение скорости горения нитрогликоля при давлениях, лежащих ниже и выше границы перехода в область неустойчивого режима. В обоих случаях скорость растет с давлением линейно, но в последнем случае — гораздо быстрее.
На фиг. 4. 32, а приведена фотография на движущейся пленке горения желатинированного нитрогликоля при 16 ат. Горение идет равномерно, и на снимке отчетливо видны два пламени; первичное—
184
Гл. IV. Самораспространяющееся превращение в ВВ
в виде узкой полоски и на некотором расстоянии от него — широ-
кое яркое вторичное пламя.
Горение жидкого нежелатинированного нитрогликоля (фиг. 4. 32, б) при тех же условиях идет с интенсивной пульсацией. Вторичное пламя в виде отдельных языков временами подходит к поверхности жидкости и затем отбрасывается от нее. След первичного, слабо различимого на позитиве, пламени соответствует прямой, соединяющей нижние концы языков вторичного пламени.
В известных условиях возникновение пульсирующего режима может приводить к переходу горения в детонацию.
Фиг. 4.33. Влияние давления на устойчивость горения различных ВВ.
4. О физической основе различия между инициирующими, вторичными и метательными взрывчатыми веществами
Анализируя особенности процесса горения применительно к рассмотренным выше условиям (горение в цилиндрической трубке по торцу, см. фиг. 4. 27), можно построить общую схему влияния различных факторов, в первую очередь давления, на устойчивость горения твердых (пористых или непористых) и жидких ВВ. Рассмотрим для этого различные возможные соотношения газоприхода и газоотвода (фиг. 4. 33, а, б, в).
Начиная с некоторого давления производная количества оттекающих газов по давлению есть
величина для данного ВВ (точнее, для данного состава продуктов горения и их температуры) постоянная. Если пренебречь начальным участком в области малых динамических повышений давления, то линия газоотвода может быть представлена прямой, продолжение которой проходит через начало координат (ОВ).
В области малых давлений линия газоприхода представляет собой прямую как для непористых, так и для пористых и жидких ВВ. Однако при повышенных давлениях только для непористых твердых веществ (линия /) она остается прямой и сохраняет свой наклон к оси абсцисс. Если при этом прямая газоприхода имеет наклон меньше, чем прямая газоотвода, то давление у поверхности фронта остается при данном внешнем давлении постоянным и лишь немно
7. Неустойчивое горение взрывчатых веществ
185
го превышает последнее. Соответственно постоянной остается скорость горения, которое является устойчивым. Вещества с такими характеристиками скорости горения — вторичные взрывчатые вещества (см. фиг. 4. 33, а). Если угол наклона прямой газоприхода к оси абсцисс (линия 3) больше угла наклона линии газоотвода, то давление у фронта возрастает и горение может ускоряться вплоть до детонации. Вещества с такими характеристиками скорости горения— типичные инициирующие взрывчатые вещества (см. фиг. 4.33,6), сохраняющие эти свойства даже при максимальной возможной плотности заряда.
Для пористых веществ устойчивость горения зависит от их газопроницаемости: начиная с некоторого давления pi, зависящего от плотности и свойств вещества, скорость газоприхода начинает возрастать вследствие проникновения газов в глубь ВВ и притом тем резче, чем выше давление (кривые 2 и 4). При некотором давлении р2 линии газоприхода и газоотвода пересекаются, причем —1 О —2 . Давление у поверхности горящего ВВ, которое до dp dp этого было лишь немногим больше внешнего давления, начинает быстро повышаться, в результате чего горение ускоряется и может даже перейти в- детонацию.
Если р2 меньше 1 ат, то мы относим ВВ к числу инициирующих (кривая 4). При р2, большем 1 ат,—к числу вторичных (кривая 2).
Различие в поведении вторичных и инициирующих веществ обусловлено тем, что скорость горения инициирующих веществ так велика, что в случае свободного горения при атмосферном давлении повышение давления у поверхности горящего ВВ достаточно для того, чтобы газы могли проникнуть в поры и устойчивое горение стало невозможным. Скорость горения вторичных веществ при атмосферном давлении для этого недостаточна и указанный эффект не наблюдается; он проявляется при горении под возрастающим или под постоянным, но достаточно высоким давлением.
Газодинамическое повышение давления во фронте растет со скоростью горения, которая быстро возрастает с давлением. Отсюда следует, что чем выше давление, при котором идет горение, тем больше повышение давления во фронте. Когда внешнее давление становится выше определенной величины (которая зависит, в частности, от размера пор), начинается проникновение газов в глубь вещества.
В случае жидких взрывчатых веществ (см. фиг. 4. 33, в) ускорение газоприхода при повышении давления происходит по достижении некоторого критического значения скорости горения вследствие появления эффекта Ландау. Когда наклон кривой газоприхода (линия 5) становится больше наклона прямой газоотвода, наступает ускорение горения при благоприятных для этого условиях вплоть до детонации. При отсутствии таких условий горение сохраняет устойчивость и при больших давлениях (линия 6).
186
Гл. IV. Самораспространяющееся превращение в В В
Если критическая скорость и скорость, соответствующая условию >К., достигаются при давлении меньше атмосферного, то dp
жидкое взрывчатое вещество является инициирующим. Примером таких ВВ могут служить хлористый азот и азотистоводородная кислота. Если критическая скорость достигается при давлении выше атмосферного, то жидкое взрывчатое вещество является вторичным. Примером таких жидких ВВ могут служить метилнитрат и нитрогликоль.
Таким образом, понятия «инициирующее ВВ» и «вторичное ВВ» являются условными. Основным параметром для разделения этих классов ВВ является скорость горения при атмосферном давлении. Если эта скорость достаточно мала, чтобы эффект проникновения газов в глубь вещества отсутствовал, то такое вещество причисляют к вторичным; наоборот, если это проникновение выражено так сильно, что горение очень быстро переходит в детонацию, то вещество относят к инициирующим.
Эти соображения объясняют и явление «перепрессования» инициирующих ВВ, заключающееся в более или менее полной утрате ими способности давать быстрый переход горения в детонацию.
Явление перепрессования наблюдается для таких инициирующих ВВ, для которых величина В в уравнении (4. 24) хотя и велика, но меньше критического значения. Скорость горения при атмосферном давлении соответственно велика, что приводит к заметному динамическому повышению давления у фронта. Однако при отсутствии пор или незначительной пористости, остающейся в сильно спрессованном ВВ, это повышение давления дает лишь некоторое увеличение скорости горения сверх того значения, которое соответствует внешнему давлению. Если же вещество имеет значительную пористость, как это обычно бывает при техническом применении умеренно спрессованных инициирующих ВВ, то под влиянием повышения давления во фронте газообразные продукты горения проникают в глубь вещества, фактическая поверхность горения увеличивается и скорость газообразования на единицу площади сечения заряда становится больше предела, допускающего устойчивое горение. В этих условиях возникающее при зажигании горение даже при атмосферном давлении очень быстро переходит в детонацию, что и требуется от инициирующих ВВ, Поэтому в капсюлях-детонаторах гремучую ртуть и подобные ей инициирующие ВВ прессуют только под умеренными давлениями, которые дают плотность, составляющую лишь около 2/з удельного веса.
В свете новейших исследований рассмотренную газодинамическую трактовку перехода горения инициирующих ВВ в детонацию следует считать правильной, но не исчерпывающей явления.
Новейшие исследования показали, что скорость горения гремучей ртути и ряда других быстрогорящих ВВ сильно растет с давлением лишь при относительно малых давлениях; при дальнейшем повышении давления рост скорости замедляется или даже прекращается, что делает горение газодинамически устойчивым, Кроме того, повышение давления вследствие превышения газоприхода над газоотводом может быть, по-видимому, сравнительно медленным и вряд ли в состоянии привести к возникновению резкого скачка давления, характерного для детонации.
Можно представить себе иной путь возникновения скачка давления. При поджигании ВВ в результате диспергирования образует
7. Неустойчивое горение взрывчатых, веществ
187
ся слой пыле-газовой взвеси из частиц ВВ и газообразных продуктов неполного сгорания.
Для того чтобы первоначально образовавшиеся пылинки ВВ сгорели, требуется некоторое время, тем большее, чем больше размер частиц. За это время диспергирование продолжает распространяться и толщина слоя взвеси увеличивается. Когда толщина слоя достигнет некоторого критического значения, в нем в результате динамического повышения давления * или по тепловому механизму ** возникает взрыв. Взрыв достаточно толстого слоя взвеси вызывает детонацию ВВ. Естественно, что малая плотность ВВ, облегчающая проникновение в него газообразных продуктов горения, способствует образованию слоя пыле-газовой взвеси критической толщины.
Мы установили сущность различия между инициирующими и вторичными ВВ.
Рассмотрим отличительные особенности метательных ВВ, или порохов.
Пороха по своей химической природе представляют собой вторичные ВВ, ио такой физической структуры, что устойчивость горения их значительно выше, чем вторичных ВВ в их обычном состоянии — жидкости или кристаллического порошка.
Мы видели, что вторичные ВВ с их малым коэффициентом ускорения горения В, вообще говоря, должны гореть устойчиво без перехода горения в детонацию. Если, однако, вторичное ВВ пористое или жидкое, то в определенных условиях при повышении давления возникает возможность дополнительного ускорения горения вследствие увеличения его эффективной поверхности. За счет этого ускорения горение может стать газодинамически неустойчивым. Чтобы обеспечить максимальную устойчивость горения, нужно устранить обе возможности ускорения горения: обусловленную жидким агрегатным состоянием и обусловленную пористостью.
Наглядной иллюстрацией этих закономерностей является получение нитроглицеринового пороха из нитроглицерина и нитроклетчатки. Оба эти вещества, являющиеся сами по себе типичными вторичными взрывчатыми веществами, в сочетании дают типичный порох, устойчиво горящий и весьма трудно детонирующий. Каждое из этих веществ в отдельности обладает структурой, обусловливающей возможность проявления одного из рассмотренных выше механизмов ускорения горения.
Нитроклетчатка является твердым веществом, но в обычных условиях имеет значительную пористость, обусловливающую при
* Сечение трубки, через которое оттекают газы, остается постоянным, а эффективная поверхность горения возрастает.
** Если частицы при образовании взвеси успели достаточно прогреться, то после их воспламенения реакция будет идти не только в форме горения на поверхности частиц, но и в их объеме; при достаточной толщине реагирующего слоя частиц это может привести к тепловому возникновению взрыва в нем.
188
Гл. IV. Самораспространяющееся превращение в В В
горении под возрастающим давлением ускорение процесса из-за проникновения газов в поры. Нитроглицерин — непористое жидкое вещество — дает ускорение горения вследствие неустойчивости поверхности горящей жидкости (эффект Ландау). В нитроглицериновом порохе (равно как и во всех современных порохах коллоидального типа), непористом и нежидком, оба указанных выше механизма ускорения горения невозможны и переход горения в детонацию не имеет места по крайней мере до давлений в несколько тысяч атмосфер.
Таким образом, вторичные ВВ при использовании их в качестве порохов не должны быть жидкими и пористыми. Однако не всякое непористое вещество с малой скоростью горения *, являющееся вторичным ВВ, представляет собой порох. При горении под быстро возрастающим давлением, например в замкнутом пространстве, устойчивое горение возможно лишь в том случае, если под влиянием резкого подъема давления, а также температуры не нарушается сплошность вещества.
Кристаллические ВВ, отличающиеся малой механической прочностью, могут при указанных условиях горения разрушаться. Разрушение сплошной структуры приводит к увеличению поверхности горения; поэтому ВВ, состоящие из непрочных частиц, могут давать переход горения в детонацию. Чтобы избежать, когда это необходимо, возможности такого перехода, вторичные ВВ при помощи высокополимеров переводят полностью или частично в аморфное состояние, в котором они приобретают большую механическую, прочность, а главное, утрачивают способность дробиться при воздействии быстро возрастающего давления и резких перепадов температуры и сохраняют при горении как под постоянным, так и под возрастающим давлением первоначальную форму своих частиц. В таком состоянии вторичные ВВ являются порохами.
Сохранение частицами пороха своей формы при горении позволяет на основе одного и того же состава изготовлять заряды с различной продолжительностью горения. Если сделать частицы пороха тонкими, то они будут сгорать быстро. Заряды из такого пороха будут пригодны для оружия, которое имеет короткий ствол (пистолет) или ствол, рассчитанный на малые давления (дробовое охотничье ружье, миномет). Заряды из пороха с частицами большой толщины смогут при том же давлении сгорать за соответственно большее время и будут пригодны для оружия с длинным стволом. Наряду с этим, придавая частицам пороха различную форму, можно обеспечить различные законы изменения их поверхности в процессе горения, а следовательно, и скорости газообразования во времени. Так, поверхность частиц, имеющих форму шара или куба, быстро уменьшается по мере сгорания; в случае тонких пластинок это уменьшение поверхности происходит гораздо
* Точнее, с малым ускорением горения с давлением.
,<? 8. О практическом значении закономерностей горения порохов
189
медленнее, при лентах или трубках, особенно длинных,—еще медленнее, а при горении многоканальных трубок поверхность не только не уменьшается, но даже растет. *
Все это дает возможность обеспечить наиболее целесообразное с точки зрения баллистики изменение давления при выстреле. Применение частиц относительно хрупких или жидких вторичных ВВ, даже тех, которые при высоких давлениях горят без перехода в детонацию, не дает возможности регулировать газообразование тем простым путем, которым это позволяют делать современные бездымные пороха.
§ 8. О ПРАКТИЧЕСКОМ ЗНАЧЕНИИ ЗАВИСИМОСТЕЙ
СКОРОСТИ ГОРЕНИЯ ПОРОХОВ ОТ ДАВЛЕНИЯ И ТЕМПЕРАТУРЫ
Сильная зависимость скорости горения пороха от давления нежелательна. Такая зависимость приводит к дегрессивности горения порохового заряда, увеличивая при выстреле отношение максимального давления к среднему. Желательно также, чтобы скорость горения пороха возможно меньше зависела от начальной температуры. Если эта зависимость велика, то отношение максимальных давлений при стрельбе в летнее и зимнее время увеличивается.
Особенно сильно сказывается зависимость скорости горения от давления и от температуры при использовании порохового заряда в реактивном двигателе. Если скорость горения прямо пропорциональна давлению, то такой порох вообще не может быть применен в реактивном двигателе. Этот вывод вытекает из уравнения баланса газообразования за счет горения порохового заряда и оттока газа через сопло. Весовое количество qi газов, образующихся в единицу времени, составляет
= (4.31)
где «м — массовая скорость горения пороха;
S— поверхность порохового заряда.
Расход газов q2 через сопло в единицу времени составляет
q., = A?p, (4.32)
где А— коэффициент расхода;
а —минимальное сечение сопла;
р—давление в камере сгорания.
Зависимость скорости горения от давления и начальной температуры пороха может быть выражена общей формулой.
U-., —-------- .
ы А-ВЛ
* Если по мере сгорания общая поверхность частицы пороха уменьшается, то такую форму частиц называют дегрессивной. Прогрессивными называют такие формы пороховых зерен, при которых в процессе горения поверхность увеличивается.
190
Гл. IV. Самораспространяющееся превращение в ВВ
Подставив эту формулу в выражение (4.31) и приравнивая приход и отвод газов, получим
..в£^^Ара
Ai-B.To
откуда
/ BS
О— --------
XA^-BJq)
(4.33)
Из выражения (4. 33) видно, что характер зависимости величины равновесного давления от параметров заряжания и двигателя в сильной мере определяется величиной v. Если v>-l, то равновесие между газоприходом и газоотводом вообще невозможно. При v<l это равновесие устойчиво; при этом чем ближе v к единице, тем сильнее равновесное давление зависит от параметров заряжания и от начальной температуры.
Изменение равновесного давления с изменением начальной температуры пороха определяется не только зависимостью скорости горения от температуры, но и ее зависимостью от давления. В самом деле, из выражения (4. 33) следует, что
dp 1 1 Bi
dT0 р 1—-v Ai — BiTo
(4.33а)
т. е. относительное изменение равновесного давления при изменении начальной температуры пороха определяется как влиянием температуры на скорость горения (через второй множитель), так и зависимостью скорости горения от давления (через первый множитель) .
Поэтому если мы имеем два пороха, скорость горения которых возрастает в одинаковое число раз при данном изменении температуры, то давление будет возрастать неодинаково, если величина v для этих порохов различна. Чем меньше V, тем меньше возрастает равновесное давление с увеличением температуры. Если зависимость давления от параметров заряжания и от температуры велика, то это заставляет делать камеру сгорания с большим запасом прочности, т. е. утяжелять ее, что, как понятно без пояснений, нежелательно.
Современные нитроглицериновые пороха характеризуются сравнительно большими значениями V. около 0,7. Поэтому для зарядов из этих порохов показатель степени в выражении (4.33) довольно велик; при v—0,67 он равен трем, при v—0,75 — четырем.
Значительна и зависимость скорости горения от температуры. При повышении температуры от —18 до -)-60Р скорость горения возрастает в 1,3—1,5 раза.
Введением каталитических добавок в состав порохов удается влиять на зависимость скорости их горения от давления таким об-
,\S‘ 8. О практическом значении закономерностей горения порохов
191
Фиг. 4. 34. Влияние катализаторов на зависимость от давления скорости горения нитроглицеринового пороха в области умеренно повышенных давлений.
разом, что при рабочих давлениях, характерных для ракетных камер, скорость горения медленнее возрастает с давлением (фиг. 4. 34).
Каталитические добавки ослабляют также зависимость скорости горения от температуры.
Скорость горения смесевых порохов, состоящих из твердых окислителя (кислородсодержащие соли, например, перхлорат аммония) и горючего (синтетический каучук, смолы и т. п.), как правило, слабее зависит от давления и температуры. В этом отношении сме-севые пороха заслуживают предпочтения в качестве топлива для ракет перед нитроглицериновыми порохами.
Следует добавить, что баллистические, физические и технологические свойства смесевых ракетных порохов сильно зависят от размеров частиц окислителя и распределения их по размерам. Изменяя эти характеристики, можно существенно изменить не только скорость горения, нои характер ее зависимости от давления, как это иллюстрируется фиг. 4. 35, показывающей зависимость скорости горения от давления ряда образчиков смесевого пороха одного и того же химического
состава, но с различными размерами частиц окислителя.
Некоторые из смесевых порохов имеют еще то преимущество, что они способны гореть устойчиво и с полным выделением энергии при более низких давлениях, чем пороха баллиститного типа. Благодаря этому можно уменьшить толщину стенок, а следовательно, и вес ракетной камеры и за счет этого увеличить или вес боевой головки снаряда, или дальность его полета.
Ракетный заряд обычно состоит из нескольких пороховых трубок или стержней. Образующиеся при горении газы движутся вдоль горящей поверхности со скоростью, возрастающей по мере приближения к соплу. Если эта скорость велика, то течение газов увеличивает скорость горения пороха. Вероятной причиной увеличения скорости горения является повышение теплопередачи от движущегося газа к поверхности пороха. В начале горения, когда свободная от пороха площадь сечения камеры мала, скорость движения газов наибольшая. Если она превышает некоторый предел, то газообразование увеличивается настолько, что давление в начале горения сильно возрастает по сравнению с равновесным его значением. Это уже само по себе нежелательно, а, кроме того, часто приводит к неравномерному горению с периодическими подъемами и падениями давления и образованием продуктов незавер-
192
Гл. IV. Самораспространяющееся превращение в В В
шейного химического превращения, в частности, окислов азота. Чтобы избежать этих нарушений нормального режима горения, приходится ограничивать отношение начальной поверхности газообразования к свободному сечению камеры. Это достигается или
пороха от давления при различных размерах частиц окислителя.
а—содержание (а % по весу) частиц различных размеров в окислителе, о—зааисимость скорости горения от давления для образчиков пороха, изготовленного на окислителе разной степени измельчения.
применением пороховых трубок с каналом достаточно большого диаметра, или частичным бронированием поверхности заряда, или приданием заряду умеренно прогрессивной формы.
При горении в ракетной камере в известных условиях наблюдались внезапные резкие и кратковременные повышения давления.
§ 9. Детонация конденсированных взрывчатых веществ
193
Опыты по прерыванию горения показали, что одной из причин возникновения пиков давления является образование прогаров на пороховой шашке. Причины образования прогаров точно не установлены. Американские исследователи связывают это явление с действием излучения пороховых газов на горение пороха и, чтобы предотвратить образование прогаров, вводят в состав пороха добавки, окрашивающие его в черный цвет (сажа, нигрозин и т. п.).
( § 9. ДЕТОНАЦИЯ КОНДЕНСИРОВАННЫХ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
В практических условиях детонацию инициирующих ВВ возбуждают путем поджигания их или резкого накола жалом; возникающее при этом горение быстро переходит в детонацию. Детонацию вторичных ВВ обычно возбуждают капсюлем-детонатором; в случае малочувствительных ВВ применяют ступенчатое инициирование: капсюль-детонатор в сочетании с промежуточным детонатором — небольшим зарядом более чувствительного к детонации ВВ.
В теории ВВ и в практике их применения исключительно важ-. ное значение имеет величина скорости детонации.
С одной стороны, скорость распространения является важнейшей характеристикой процесса детонации, определяющей ряд свойств последнего; изучение скорости детонации и ее зависимости от условий взрыва и свойств заряда позволяет сделать важнейшие выводы о механизме процесса, об уравнении состояния продуктов взрыва и пр. С другой стороны, как раз скорость в отличие от некоторых других характеристик детонации является такой величиной, которую можно сравнительно просто измерить с большой точностью п надежностью.
Для разных ВВ скорость детонации лежит в пределах от 1000 до 9000 М'сек. Значения скорости детонации для ряда ВВ приве-' дены в табл. 4. 13.
В третьей колонке табл. 4. 13 указаны значения скорости детонации при плотности заряда, приведенной во второй колонке. Для твердых органических ВВ, состоящих из С, Н, N и О, при плотностях от приблизительно 0,5 г!см3 до максимальной скорость детонации линейно связана с плотностью:
DP(4-34)
Используя приведенные в табл. 4. 13 значения коэффициента Л4, можно по уравнению (4. 34) рассчитать скорость детонации при плотностях, отличных от плотности, указанной во второй колонке.
Мартин и Яллои установили простые полуэмпирические соотношения, связывающие скорость детонации органических ВВ в жидком, литом или прессованном состоянии с их кислородным балансом и плотностью заряда. Опыт показал, что при данной плотности скорость детонации органических ВВ, имеющих отрицательный кислородный баланс, линейно зависит от него, принимая максималь-
194
Гл. IV. Самораспространяющееся превращение в ВВ
Таблица 4.13
Скорость детонации некоторых ВВ (по Куку)
ВВ Плотность р0 г} см% Скорость детонации Do 0 MjCCK Коэффициент Л1 м!сек'.г'см3
Тротил 1,0 5010 3225
Тэн 1,0 5550 3950
Пентолит 50/50 (тэи—тротил) 1,0 5480 3100
Г ексоген 1,0 6080 3590
Тетрил 1,0 5600 3225
Тетритол 65;35 (тетрил—тротил) 1,6 7300 3400
Пикриновая кислота 1,0 5255 3045
Этилендинитрамин 1,0 5910 3275
Пикрат аммония 1,0 4990 3435
Нитрогуанидин 1,0 5460 4015
Азид свинца 4,0 5100 560
Гремучая ртуть 4,0 5050 890
Амматол 50/50 1,0 5100 4150
Содатол 50/50 (NaNO3—ТНТ) 1,0 4100 2580
Дина (динитрат диоксиэтилиигра.мииа C.jHaN4O8) 1,0 5950 2930
Нено (динитрат диоксиэтилдинитрокса-мида СбН8О12Н6) 1,0 5530 3680
Нитроглицерин жидкий 1,59 7800 —
Нитроглицерин—динитротолуол 60/40 1 1,50 7000 —
ное значение, когда кислородный баланс становится равным нулю. Это не представляется удивительным, так как от кислородного баланса в этих ВВ существенно зависит и энергия, выделяющаяся при детонации, и состав продуктов. Однако обычное выражение для кислородного баланса не учитывает того обстоятельства, что атомы кислорода в молекуле ВВ в нитрогруппе, в СО-груипе и др. энергетически неравноценны; учитывая это, авторы выражают кислородный баланс й формулой
(г — 1х —у/2) 100 100те>
п п
(-1.35)
где г, х, у — числа атомов кислорода, углерода и водорода в молекуле; п — общее число атомов в молекуле; поправку w рассчитывают, суммируя числа атомов кислорода с различными коэффициентами; для атомов кислорода нитрогруппы берут коэффициент, равный нулю; для атома кислорода, соединяющего нитрогруппу с углеродом, — коэффициент, равный 1; для С=О-группы — коэффициент 1,8 и для С—ОН-группы — коэффициент 2,2. Знак поправки соответствует
§ 9. Детонация конденсированных взрывчатых веществ
195
знаку первого слагаемого. Зная кислородный баланс, можно с ошибкой, не превосходящей 2%, выразить скорость детонации при р =1,6 г/см3 соотношением
£> = 8578 4-33,742.
(4.36)
При учете зависимости скорости детонации от плотности получают соотношение
D = 2509 + 13,252 + 3793р + 12,812р.
(4.37)
Еще лучшее соответствие расчетных п экспериментальных данных получается в том случае, если принимать во внимание теплоту образования ВВ. Тогда
D = 2590 + ll,972j — 0,706Н 3764р 4- 13,67p2t 0,108рН, (4. 38)
где Н — теплота образования ВВ в ккал!кг; кислородный баланс рассчитывают, принимая в данном случае несколько иные значения коэффициентов при числах атомов кислорода, чем указано выше, а именно: для иитрогруппы — 0. для С—О—N—0,5 и для С=О и С—О—Н-групп—1. Если теплота образования Я
неизвестна, то ее можно рассчитать по теплоте сгорания и структурным характеристикам молекулы соединения (см. стр. 420).
Скорость детонации данного ВВ при выполнении известных условий является его константой. Для заряда обычной цилиндрической формы, детонация которого возбуждается с одного из торцов, такими условиями являются максимальная плотность и диаметр, превышающий некоторую определенную величину, так называемый предельный диаметр dm, (фиг. 4. 36).
Если брать диаметр заряда меньше предельного, то и скорость детонации будет также меньше. Однако ниже некоторого минимального, так называемого
Фиг. 4.36. Зависимость возможности и скорости детонации ВВ (амматол 50 : 50 при плотности 1,53 г/с.ч3) от диаметра заряда.
^—критический диаметр, dnp—предельный диаметр.
критического диаметра dK, детонация ио заряду устойчиво распространяться не будет. При диаметрах ниже предельного скорость детонации зависит от наличия и характеристик оболочки заряда, от размеров частиц ВВ (особенно в случае смесей) и от его физической структуры. Эти факторы влияют также на величину критического диаметра. Кроме того, на скорость детонации и на критический диаметр оказывает влияние плотность заряда.
Ниже мы рассмотрим основные результаты экспериментальных исследований ио влиянию различных факторов на возможность детонации и скорость ее распространения для разных ВВ.
196
Гл. IV. Самораспространяющееся превращение в ВВ
1. Критический диаметр заряда и его зависимость от различных факторов
Известно, что разные вещества, будучи взрывчатыми, отличаются по своей способности к взрыву. Мерилом этой способности (взрывчатости) может служить, как было установлено Ю. Б. Харитоном. критический диаметр заряда: чем больше взрывчатость, тем соответственно меньше критический диаметр.
Величина критического диаметра характеризует скорость химического Превращения при: взрыве. Эта скорость, однако, определяется не только энёрУией активации или константой скорости, как это имеет/место для простых химических реакции. Химическое превращение при взрыве конденсированного ВВ имеет сложный характер ш обычно, протекает в форме горения множества отдельных частиц. Это смогут быть исходные частицы ВВ или частицы, которые образовались в результате миКрогетерогениого возникновения и развития в нем реакции. Существенно влияют на ход превращения и его скорость также температура и давление, достигаемые при взрыве. Поэтому скорость превращения зависит от его теплового эффекта, а также от наличия и сопротивления оболочки, затрудняющей расширение газообразных продуктов реакций. В силу всех этих причин взрывчатость определяется не только химико-кинетическими и термическими характеристиками ВВ, но и его физико-механическими свойствами, а также внешними условиями, от которых зависят образование и размеры горящих частиц. Интегральное выражение все эти факторы получают в величине критического диаметра. Понятно, что критический диаметр не является неизменным для данного ВВ безотносительно к условиям его взрыва. При изменении этих условий критический диаметр может изменяться в широких пределах.
Критический диаметр практически определяют следующим образом: взрывают цилиндрические заряды данного ВВ разного диаметра и определяют каждый раз, прошла ли детонация до конца заряда или затухла, что можно установить путем фоторегистрации или по состоянию подкладки, на которой был расположен заряд. Наименьший диаметр заряда, при котором еще возможна устойчивая (без затухания) детонация, и принимают в качестве критического.
При опытах необходимо следить за тем, чтобы затухание детонации было связано именно с достижением критических размеров, с неспособностью системы к распространению детонаций, а не со слабостью инициатора. Стандартный капсюль-детонатор № 8 может обеспечить детонацию порошкообразных ВВ только в случае, если dK<15—20 мм, и литых ВВ, если dK<5—10 мм; в противном случае необходим промежуточный детонатор.
Подчеркнем еще раз, что критический диаметр зависит не только от химических свойств ВВ, но и от его физического состояния и условий взрыва (агрегатное состояние ВВ, его плотность, размер частиц, характер оболочки и пр.).
§ 9. Детонация конденсированных взрывчатых веществ
197
В табл. 4. 14 приведены ориентировочные данные о критических диаметрах некоторых ВВ при возможно сходных условиях взрыва и возможно близком физическом состоянии (порошкообразные ВВ при одинаковой плотности 0,9—1,0 г/с,и3, близких размерах кристаллов 0,05—0,2 мм и одинаковом характере оболочки—стеклянная трубка), т. е. в условиях, когда различия в величине критических диаметров определяются в наибольшей степени химическими факторами.
Таблица 4.14
Критический диаметр некоторых порошкообразных ВВ
ВВ Критический диаметр ММ
Азид свинца 0,01—0,02
Тэн 1,0—1,5
Гексоген 1,0—1,5
Пикрат свинца 2-3
Пикриновая кислота 6
Тротил 8—10
Аммонит № 6 (21% тротила и 79% аммиачной селитры) 10—12
Смесь 20% алюминия и 80% аммиачной селитры 12
Смесь 10% тротила и 90% аммиачной селитры 15
Аммиачная селитра 100
Из табл. 4. 14 видно, что при близких физических условиях значения критических диаметров (важнейшей характеристики взрывчатости) различаются весьма сильно: для крайних представителей (азид свинца и аммиачная селитра) в пять-десять тысяч раз.
Сопоставление критических диаметров для различных химически однотипных ВВ показывает, что этот диаметр тем меньше, чем больше теплота взрыва. Однако часто наблюдаются исключения из этого правила. При сопоставлении ВВ, резко отличающихся по химической структуре, вроде азида свинца и тротила, однозначной связи между теплотами взрыва и критическим диаметром не наблюдается.
В табл. 4. 15 приведены значения критического диаметра некоторых жидких ВВ при взрыве в стеклянных трубках или тонкостенных капиллярах.
Интересно, что критический диаметр жидких ВВ, как это установлено на примере тротила, нитрометана, и нитроглицерина, значительно увеличивается с понижением температуры.
Обратимся теперь к данным о влиянии отдельных физических параметров и условий взрыва на величину критического диаметра.
198
Гл. IV. Самораспространяющееся превращение в В В
Таблица 4. 15
Критический диаметр некоторых жидких ВВ
ВВ или смесь Критический диаметр dK мм
Тетранитрометан/бензол (87,5/12,5) <0,1
Азотиая кислота,'нитробензол (72/28) 0,5
Нитроглицерин 2,0
70%-ная азотная кислота/метиловый спирт (70/30) >10
Тротил жидкий при 81е С 62
Тротил жидкий при 240° С 6,0
Зависимость критического диаметра от физического состояния вещества может быть иллюстрирована данными Апина и Боболева на примере тротила (табл. 4.16), полученными при взрыве зарядов в стеклянных трубках внутренним диаметром 10 мм. Литой тротил был получен медленным застыванием расплава и состоял из сросшихся крупных кристаллов.
Таблица 4. 16
Способность тротила в различном физическом состоянии к детонации
Физическое состояние тротила Плотность г/елг3 Температура в °C Инициатор Результаты опыта
Жидкий 1,46 Ч-юо 20 г прессованного тэна Отказ
Прессованный порошок 1,46 —180 Капсюль-детонатор № 8 Полная детонация, Z)=660C м\сек
Литой в крупнокрис-таяли ческом состоянии 1,64 + 20 20 г прессованного тэна Отказ
В то время как тротил в виде прессованного порошка детонирует даже при —180° от сравнительно слабого инициатора (капсюль-детонатор № 8), жидкий и литой тротил не могут детонировать в этих условиях. Иными словами, критический диаметр для прессованного порошка менее 10 мм, а для литого или жидкого тротила — значительно выше. Дальнейшие опыты показали, что литой тротил может детонировать при диаметре заряда не менее 32 мм, порошкообразный же мелкокристаллический тротил той же плотности детонирует, когда диаметр заряда составляет
;S 9. Детонация конденсированных взрывчатых веществ
199
всего 2,1 мм. Таким образом, критический диаметр литого тротила е 15 раз больше, чем порошкообразного.
Особенно наглядно влияние физической структуры на способность к детонации проявляется на примере нитроглицеринового пороха. Оба его компонента (нитроглицерин и нитроклетчатка) сами по себе детонируют очень легко — при малых диаметрах заряда. В порохе же, по-видимому, из-за чрезвычайно большой его
вязкости и отсутствия пор возникновение и распространение дето
нации очень затруднено (см. стр. 187), и он детонирует лишь при гораздо больших диаметрах заряда.
Для порошкообразных индивидуальных ВВ (тротил, пикриновая кислота," тэн, гексоген, пикраты калия и свинца) и их смесей критический диаметр, по данным Боболева, зависит отплотности и размеров частиц следующим образом; чем больше плотность ВВ и меньше размеры его частиц, тем больше детонационная способность и меньше критический диаметр. На фиг. 4. 37 показана зависимость критического диаметра заряда от плотности для
Фиг. 4.37. Зависимость критического диаметра заряда тротила с разными размерами частиц от плотности.
крупнокристаллического и мелко- /_чаС11ШЫ ра5мсром o.oi-o,os мм-. п-кристаллического тротила. Влияние ™ ке о.ог-о.с мм.
________ _ « 4- »— детонация, «—»—отказ, размеров частиц на критический
диаметр для разных ВВ показано в табл. 4. 17 (опыты в стеклян-
ных трубках).
Аналогичное влияние плотности на критический диаметр наблюдалось и для желатинообразного ВВ — гремучего студня. Лишенный пузырьков воздуха гремучий студень, имеющий плотность 1,59 г/см3, детонировал даже в заряде диаметром 3 мм, в то время как при плотности 1,48 г,'см? детонация имела место лишь в зарядах диаметром нс менее 7 мм, а при диаметре 5 мм всегда получа
лись отказы.
Для аммиачно-селитренных смесей па основе невзрывчатого горючего (торф) влияние размеров частиц компонентов, плотности и оболочки было изучено Беляевым. Он показал, что чем тоньше измельчение компонентов торфяного динаммона (12% торфа, 88% аммиачной селитры), тем больше его детонационная способность; следовательно, в этом отношении смеси ведут себя аналогично индивидуальным ВВ. В отношении влияния плотности картина получается обратная. Чем выше плотность, тем больше критический диаметр изученных смесей (табл. 4. 18).
Из данных табл. 4. 18 видно, что заряд динаммона тонкого измельчения детонирует при плотности, равной 1 г!см?, еще при диа-
200
Гл. IV. Самораспространяющееся превращение в ИВ
Таблиц а 4.17
Влияние размеров частиц на критический диаметр заряда
ВВ Размеры частиц мм Критический диаметр dK в мм * Плотность О г\см^
Тротил 0,01—0,05 4,5—5,4
0,07—0,2 10,5—11,2 J 0,85
Пикриновая кислота 0,01—0,05 2,08-2,28 0,8
0,05—0,07 3,6—3,7 0,7
0,1—0,75 8,9—9,25 0,95
Пикрат калия 0,04—0,15 5,5—6,0 0,75
Пикрат свинца 0,01—0,05 1,45—1,53 0,75
Тэн 0,025—0,1 0,70—0,86
0,15—0,25 2,1—2,2 | 1,0
Гексоген 0,025—0,15 1,0—1,15 1.0
I >
* Первое число означает диаметр, при котором детонация уже не распространялась, второе—при котором еще имело место распространение детонации.
Таблица 4.18
Зависимость критического диаметра торфяного динаммона от степени дисперсности компонентов и от плотности
Плотность динаммона из компонентов различного измельчения г [см3 Критический диаметр dK
тонкого | среднего | грубого ММ
0,91 — и
1,00 0,71 — 15
1,08 0,80 — 20
1,12 0,87 25
1,16 0,93 — 30
1,19 0,99 0,70 35
1,22 1,03 0,77 40
— . 1,10 0,85 50 .
— 1,17 62,5
§ 9. Детонация конденсированных взрывчатых веществ
201
метре 15 мм; чтобы получить детонацию динаммона среднего измельчения при той же плотности, требуется уже диаметр 35— 40 мм. Если плотность динаммона тонкого измельчения увеличить от 1,00 до 1,22 г!см3, то критический диаметр возрастает от 15 до 40 мм, т. е. почти в три раза.
Различие между индивидуальными ВВ и смесями рассмотренного типа * можно объяснить следующим образом. При повышении плотности уменьшаются размеры газовых включений в порошке и его газопроницаемость. В результате этого должно затрудняться воспламенение частиц В В как в случае, если опо происходит вследствие сжатия и разогрева газовых включений, так и в том случае,, если его вызывают горячие газы, проникающие, в поры между частицами. Воспламеняемость частиц смесей, состоящих из невзрывчатых или слабовзрывчатых компонентов, или слабых индивидуальных ВВ, относительно мала и воспламенение их при больших плотностях может быть затруднено настолько, что в заряде малого диаметра детонация становится невозможной. Наряду с этим в случае смесей слишком большое давление, возникающее при детонации ВВ большой плотности, может замедлять развитие реакции, которое включает не только реагирование отдельных частиц, как в индивидуальных ВВ, но и смешение продуктов реакции частиц различных компонентов. Основное количество энергии выделяется именно после смешения — при взаимодействии продуктов реакции отдельных компонентов.
Опытами по влиянию оболочки показано, что ее наличие облегчает распространение детонации, снижая критический диаметр как для смесей, так и для индивидуальных ВВ.
Согласно Беляеву наличие оболочки в первом приближении эквивалентно увеличению диаметра заряда и вопрос о влиянии массивной оболочки на устойчивость детонации может быть сведен к вопросу о влиянии диаметра заряда. Действие оболочки определяется прежде всего ее массой, а не прочностью. Соответственно свинцовые оболочки более эффективны, чем железные. Применением толстой оболочки можно очень сильно снизить критический диаметр. Даже такое малочувствительное к детонации ВВ, как аммиачная селитра, детонирует при диаметре всего 7 мм в том случае, если ее поместить в стальную оболочку толщиной 20 мм.
2. Зависимость скорости детонации от диаметра заряда, размеров частиц ВВ и характера оболочки
. При увеличении диаметра заряда выше критического-скорость детонации возрастает, асимптотически приближаясь к
* По данным И. Ф. Блинова, аналогично рассмотренным смесям ведут себя н слабые индивидуальные ВВ, например дийитросоединения ароматических, углеводородов.
202
Гл. IV. Самораспространяющееся превращение в.В В
своему предельному значению. Для сплошных ВВ относительное увеличение скорости детонации при переходе от критического диаметра к предельному невелико (Йкр—0,9-4-0,95£>тгп), для порошкообразных ВВ малой плотности оно больше (£>кр~0,4-4-0,5Dm:o:). При этом относительная величина скорости детонации (D/Dm3X) приближенно определяется отношением диаметров зарядов d/d^,. В соответствии с этим скорость детонации быстро — при незначи-
Фиг. 4. 38. Зависимость скорости детонации гексогена умеренной плотности от диаметра заряда.
тельном увеличении диаметра— возрастает у ВВ, имеющих малый критический диаметр. Так, гремучий студень большой плотности, не детонировавший в заряде диаметром 2 мм, в заряде диаметром 3 мм детонировал со скоростью 7600 м/сек', при диаметрах 4 и 5 мм скорость была одна и та же: 7800 м/сек. По данным Боболева, в случае гексогена (фиг. 4. 38) уже при диаметре около 2 мм практически достигается постоянная максимальная (для данной плотности около 1,0 г/см*) скорость дето-
нации. У тротила возрастание скорости детонации происходит мед-.леннее, причем играют роль размеры кристаллов (фиг. 4.39). Ско-
рость детонации в случае мелкокристаллического порошка
Диаметр d заряда в мм
Фиг. 4. 39. Зависимость скорости детонации тротила (р =0,85 г!смМ} от диаметра заряда.
'(0,01—0,05 лш) быстрее приближается к предельному значению, чем в случае крупнокристаллического (0,07—0,2 мм), когда она еще продолжает расти вплоть до наибольшего испытанного диаметра — 30 мм.
Из сказанного следует, что при диаметрах заряда меньше предельного скорость детонации зависит от размеров частиц-, скорость
£ 9. Детонация конденсированных взрывчатых веществ
может быть заметно больше для мелкокристаллического вещества. При больших диаметрах заряда скорость детонации, по-видимому, одинакова для порошков с разными размерами частиц.
В случае таких трудно детонирующих ВВ, как аммиачная селитра, особенно в виде гранул, скорость детонации может быть далека от максимальной даже при значительных диаметрах заряда: 300—320 мм.
Выше было отмечено положительное влияние оболочки на возможность детонации. Аналогичное влияние оболочка оказывает также на скорость детонации (табл. 4. 19). Как видно, при диаметрах заряда меньше предельного наличие оболочки из материалов большой плотности и прочности заметно повышает скорость детонации. Особенно значительно это влияние оболочки (для индивидуальных ВВ) при средних плотностях; при больших плотностях оно отсутствует, при малых — проявляется гораздо слабее.
Если диаметр заряда больше предельного, то наличие и характер оболочки не изменяют скорости детонации, как это показывает табл. 4. 20.
Таблица 4.19
Влияние оболочки на скорость детонации ВВ
ВВ Материал оболочки Диаметр заряда в мм Толщина стенок оболочки в мм Плотность Р | г/с.ч3 Скорость детонации D м)сек
Тротил Стекло Сталь 25/1 27/4 0,250 2363 2478
Стекло 16/0,8 0,832 3308
Медь 15/1 4100
Тетрил Бумага Стекло 5/0,08 5/1 0,240 2605 2900
Тэн Стекло Медь 16/0,8 15/1 0,300 3419 3548
3/1 1900
Метилпнтрат Стекло 3/2 — 2200
3/4,5 — 2480
204 Гл. IV. Самораспространяющееся превращение в ВВ
Таблица 4. 20
Влияние оболочки на скорость детонации взрывчатых веществ
ВВ Диаметр заряда в мм Толщина стенок оболочки в мм Скорость детонации D М;сек
Тротил литой Сталь
21/3 6555-6700
29/10 6700
75/14,5 6595
160/25 6690
220/50 6675
300/50 6710
Тетрил (р=1,69 г/сл3) Медь
7/0,23 7622
21,2/0 7625
3. Зависимость скорости детонации от плотности заряда, начального импульса, примесей, температуры и давления
Повышение плотности увеличивает скорость детонации индивидуальных мощных ВВ. Для тэна и пикриновой кислоты это влияние иллюстрируется кривыми фиг. 4.40, на которой по оси
Фиг. 4. 40. Зависимость скорости детонации индивидуальных МОЩНЫХ В В от плотности.
абсцисс отложена «относительная плотность» p/d, т. е. отношение плотности заряда к удельному весу ВВ.
§ 9. Детонация конденсированных взрывчатых веществ
205
Для смесей, компоненты которых сами по себе не взрываются или представляют собой малочувствительные к детонации ВВ, при повышении плотности скорость детонации возрастает в области умеренных плотностей, проходит через максимум и затем падает.
На фиг. 4.41 приведены результаты опытов Дотриша по определению скорости детонации шеддита* при различной плотности.
Платность о г/см3
Фиг. 4.41. Зависимость скорости детонации шеддита от плотности при различных диаметрах заряда d.
U 6000
« цооо
I
90/1МС-МТ 90/lOAC-At,
&2000 -
ё п ___________I______i------1
0,8 1,0 1,2 1,4
Плотность р г!су.3
Фиг. 4.42. Зависимость скорости детонации смесей аммиачной селитры (90%) с динитротолуолом (10%) или алюминием (10%) от плотности при малом (10 см) диаметре заряда.
На фиг. 4.42 показана по Куку зависимость скорости детонации смесей аммиачной селитры с динитротолуолом и с алюминием от плотности. Такая зависимость характерна, по-видимому, не только для смесей указанного типа, но, по Блинову, и для индивидуальных ВВ, отличающихся малой детонационной способностью, вроде аммиачной селитры, динитротолуола, динитрофенола и т. п. Положение максимума скорости зависит, однако, от диаметра заряда; чем больше этот диаметр, тем выше плотность, при которой скорость детонации проходит через максимум. Аналогичное влияние оказывает оболочка. Поэтому, применяя достаточно большие диаметры и толстые оболочки, можно переместить положение максимума до плотности, равной удельному весу ВВ. В этих условиях для смесей тип кривой D—f(p) будет соответствовать тому, который наблюдается для мощных индивидуальных ВВ.
Из сказанного следует, что повышение плотности в определенном ее интервале в случае смесей при небольших диаметрах заряда уменьшает ие только возможность, но и скорость детонации.
Представим себе, что мы взяли, например, тротил, детонация которого облегчается при увеличении плотности во всем ее возможном интервале, и стали смешивать его с аммиачной селитрой.
Шеддит — взрывчатая смесь на основе хлората калия.
206
Гл. IV. Самораспространяющееся превращение в В В
Очевидно, что при небольших диаметрах зарядов мы должны наблюдать при каком-то содержании селитры переход от типа влияния плотности, характерного для тротила, к типу, характерному для смесей, Боболев, изучая амматол 50 : 50, установил весьма интересный факт: для одной и той же смеси можно наблюдать два
типа зависимости — в зарядах умеренного диаметра детонация
Фиг. 4. 43. Зависимость критического диаметра амматола 50:50 от плотности.
«+»—детонация; «—»—отказ.
возможна при малых и при больших плотностях, но не распространяется при промежуточных. В области малых плотностей критический диаметр возрастает с увеличением плотности, как это должно быть для смеси, а в области больших плотностей диаметр убывает, как это типично для индивидуального ВВ (фиг. 4. 43).
Влияние силы начального импульса на скорость детонации отмечалось еще Дотришем для пикриновой кислоты. Взрывчатое вещество взрывали при плотности 1,73—1,74 г /см3 в бу
мажных патронах диаметром
20 мм. С инициатором в виде 0,5 г гремучей ртути и 15 г динамита скорость детонации составляла 7280 м/сек, а при увеличении заряда динамита до 80 г — 7650 м/сек. Однако в этом и аналогичных случаях речь идет не об увеличении стационарной скорости детонации, как таковой, а о сокращении при сильном импульсе участка ускорения. В условиях данных опытов, когда определяли среднюю скорость детонации на сравнительно коротком участке вблизи инициатора, указанное обстоятельство обусловило кажущееся увеличение скорости. Аналогичное явление наблюдается в том случае, если ВВ с малой скоростью детонации инициировать мощным инициатором;
тогда иа начальном участке скорость детонации окажется выше нормальной, по с расстоянием будет убывать, приближаясь к ней.
Иное влияние начального импульса на скорость детонации трудно и допустить, так как его роль сводится только к возбуждению взрыва, в дальнейшем же инициатором для каждого последующего слоя служит предыдущий слой ВВ.
Исключение представляют те условия, в которых некоторые ВВ могут детонировать с различными скоростями. Это явление давно было обнаружено у нитроглицерина и динамитов, а позже установлено и у других жидких нитроэфиров. Оно наблюдалось также у порошкообразных вторичных ВВ (тротила, тетрила, пикриновой кислоты, тэна и гексогена), хотя в этом случае различие в скоростях детонации не так велико, как у жидких ВВ, и проявляется не столь четко. Даже инициирующее ВВ — гремучая ртуть —
§ 9. Детонация конденсированных взрывчатых веществ
207'
в сильно спрессованном (давление прессования 4200 кг/см2) виде способна детонировать при диаметре заряда 4 мм с малой скоростью, лежащей в пределах от 1200 до 1700 м!сек.
Существенным фактором, обусловливающим возникновение малой или большой скорости детонации, является сила начального импульса. Для нитроглицерина в стеклянных трубках различного диаметра при возбуждении взрыва разными инициаторами были получены скорости детонации, приведенные в табл. 4.21.
Таблица 4.21
Скорость детонации нитроглицерина в различных условиях
Диаметр , заряда j мм i i Скорость детонации D при инициировании капсюлем-детонатором MjceK
№ 2 грему-чертутным 6 гремуче-ртутным № 8 грему-чертутным № 8 азидотетриловым
6 890; 950 810; 890; 1030 ! 1350 8130*
12 2530 1940; 2090 1780 8700
18 2130 1970; 2030 1750 8250;.8390
25 2190 j 2020; 2030 — 8130
32 1760 : 1780; 2010 i — । 8140
38 — i 1910 1 — i
Примечание. Заряд капсюля-детонатора № 2 составляет 0,4, № 6 — 1,0 и № 8 — 2,0 г гремучей ртути.
* Эти скорости были определены по методу Дотриша (см. § 10); судя поданным новейших исследований, они несколько завышены.
При увеличении диаметра трубки от 6 до 12 мм малая скорость детонации возрастает; при дальнейшем увеличении диаметра наблюдаются сильные колебания результатов и малая скорость детонации не изменяется. В случае применения азидотетрилового детонатора при всех диаметрах от 6 до 30 мм детонация распространяется с большой скоростью, превышающей малую приблизительно-в 4 раза.
В длинных зарядах гремучего студия, в особенности при большом их диаметре, обычно на некотором расстоянии от инициатора малая скорость детонации скачком переходит в большую; если применять промежуточный детонатор, то-всегда сразу получается большая скорость. Детонации с большой скоростью способствует также по Демпстеру введение в динамит небольшого количества мелких (0,5—10 мк) частиц некоторых инертных тяжелых (о >2,8 г/см3) веществ. (BaSOi, ВаСОз, SiC, тальк и др.). Сенсибилизирующее действие примесей согласно Авогадро увеличивается также с твердостью вещества, которая может в известной мере компенсировать влияние недостаточно высокой плотности.
Для тротила при соответствующих условиях (размеры частиц, плотность, диаметр заряда и др.) малую и постоянную скорость-детонации можно наблюдать на значительной длине заряда.
•208
Гл. IV. Самораспространяющееся превращение в ВВ
С более мощным инициатором в тех же условиях получается большая скорость.
Так, чешуированный тротил * при плотности 1,0 г/см? и диаметре заряда 21 мм детонировал со скоростью 1120 м/сек при инициировании азидотетриловым капсюлем-детонатором № 6; с промежуточным детонатором в виде тетриловой шашки весом 12,5 г скорость составляла 3660 м/сек. Для тэна при малом диаметре заряда Апин и Боболев наблюдали скачкообразное уменьшение скорости детонации от 4100 до 2500 м/сек.
Примеси инертных веществ к ВВ, вообще говоря, понижают скорость его детонации и способность к ней. Так, скорость детонации нитроглицерина 7430 м/сек; скорость детонации смеси из 75% нитроглицерина и 25% кизельгура составляет 6630 м/сек.
Некоторые инертные примеси относительно слабо влияют на •способность ВВ к детонации. Например, смесь нитроглицерина с бикарбонатом натрия, содержащая всего 10% нитроглицерина, оказывается способной к детонации. Вообще говоря, влияние твердых инертных примесей зависит от размеров их частиц, которые определяют удельную поверхность примеси и соответственно скорость поглощения ею энергии взрыва. По-видимому, также играет роль взаимное распределение взрывчатого и инертного компонентов.
В некоторых случаях, однако, инертные примеси увеличивают скорость детонации. Так, по Абелю, влажный пироксилин детонирует со скоростью 6100 м/сек вместо 5300 м/сек для сухого пироксилина. Сжорость детонации флегматизированной парафином гремучей ртути больше, чем нефлегматизированной. Такое действие воды и парафина на пироксилин и гремучую ртуть связано с изменением состава продуктов взрыва.
Было изучено влияние температуры взрывчатого вещества на скорость детонации ряда порошкообразных взрывчатых веществ, которые взрывали в тонкостенных свинцовых трубках диаметром 12,5 мм при температурах +25, —80 и —183“ С (табл. 4. 22).
Результаты опытов показывают, что даже очень сильное охлаждение не оказывает определенного влияния на скорость детонации. ‘Однако колебания скорости при низких температурах больше, чем при обычной температуре.
Отсутствие влияния температуры на скорость детонации следует объяснить тем, что изменение температуры было ограниченным и соответствовало незначительному по сравнению с теплотой взрыва изменению теплосодержания ВВ. Помимо этого, следует учитывать, что при понижении температуры плотность ВВ увеличивается и это может в известной мере компенсировать влияние понижения теплоты и температуры взрыва на скорость детонации.
* Применялась фракция, проходящая через сито с 8 отв/см и остающаяся «а снте с 12 отв!см.
!? 9. Детонация конденсированных взрывчатых веществ
209
Таблица 4.22
Зависимость скорости детонации некоторых ВВ от температуры
ВВ Плотность zjcM3 Скорость детонации D в Mjcefc при температуре
4-25° С —80° С —183° С
Гремучая ртуть 1,69 3330 3200 3260 Ср. 3260 3060 2960 3270 Ср. 3100 3150 3170 Ср. 3160
Пикриновая кислота 0,98 4750 5000 5150 Ср. 4970 4390 4600 4130 Ср. 4370 4750 4840 Ср. 4800
Пикрат аммония 0,86 4110 4100 3850 Ср. 4020 4240 3960 3980 Ср. 4060 3920 4110 Ср. 4020
Тротил 0,90 4310 4460 4580 Ср. 4450 4800 4230 4250 Ср. 4430 4550 4570 4800 Ср. 4640
Для некоторых литых ВВ при понижении начальной температуры скорость детонации несколько возрастает, что, несомненно, связано с увеличением плотности. В случае жидкостей, плотность которых более сильно1 зависит от температуры, чем плотность твердых ВВ, скорость детонации заметно увеличивается с понижением температуры. Так, нитрометан при -[-60? С детонировал со скоростью 6100 м/сек; при — 20° С скорость детонации увеличилась до 6400 м/сек. Увеличение скорости детонации при понижении температуры наблюдается, по данным Беляева и Курбангалиной, также и для нитроглицерина.
Опыты над порошкообразными взрывчатыми веществами, а также над желатинами, содержащими пузырьки воздуха, показали, что их детонационная способность и скорость детонации существенно снижаются при повышении давления, под которым находится ВВ. Так, по опытам Боудена, в тонком слое порошкообразного тэна детонация распространялась, притом с малой скоростью, если давление газа, под которым находился тэн, составляло 1 ат. При давлениях выше 30 ат скорость детонации быстро убывала, а при давлении 50 ат и более высоких распространение детонации
210
Гл. IV. Самораспространяющееся превращение в В В
прекращалось вскоре после ее начала или она не возникала совсем. Аналогичное влияние давления на распространение детонации было отмечено также для тетрила, тротила и нитрогуанидина.
Эти наблюдения могут быть объяснены тем, что в условиях указанных опытов большую роль при распространении детонации играло сжатие газовых включений во ВВ; достигаемая при этом сжатии температура тем выше, чем меньше начальное давление газа.
§ 10. МЕТОДЫ ОПРЕДЕЛЕНИЯ СКОРОСТИ ДЕТОНАЦИИ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
Рассмотрим кратко современные методы определения скорости детонации. Большинство применявшихся ранее способов (хронографы Меттеганга, Боаса, конденсаторные хронографы и пр.) требовало проведения испытаний на зарядах значительной длины и,, несмотря на это, опыты отличались малой точностью измерения. Из этих старых методов мы рассмотрим лишь метод детонирующего шнура (метод Дотриша), который также обладает невысокой точностью, но исключительно прост и поэтому применяется и в настоящее время.
1. Метод Дотриша
Сущность метода состоит в том, что неизвестная скорость детонации заряда сравнивается с известной скоростью детонации детонирующего шнура.
На фиг. 4. 44 приведена схема испытания. Отрезок детонирующего шнура 2 произвольной длины укладывают так, чтобы концы его соприкасались с зарядом, а середина находилась на свинцовой пластинке 3, как показано на фиг. 4. 44. Если заряд состоит из порошкообразного ВВ со сравнительно малой скоростью детонации, то концы шнура необходимо' несколько углубить в ВВ (оба на одинаковую глубину). Расстояние между концами шнура I является базой для определения скорости детонации и должно быть точно измерено. Распространяющаяся по заряду детонация вызывает последовательно детонацию сначала левого, а затем правого конца шнура. Таким образом, в шнуре возникнут две детонационные волны, движущиеся навстречу друг другу. В некоторой точке шнура эти волны столкнутся. При столкновении детонационных волн давление значительно возрастет (более чем в два раза) и на свинцовой пластинке, в соответствующем месте, получится характерная метка — углубление. * Если бы детонация левого и правого концов шнура началась одновременно, то столкновение волн (и соответственно метка) получилось бы в точке 5 точно на середине отрезка шнура. В действительности же в левом конце шнура детонация на-
* Метка получается более четкой, если шнур приподнят над пластинкой на несколько миллиметров.
£ 10. Методы определения скорости детонации ВВ
211
пинается раньше, чем в правом, поэтому место столкновения волн сдвинется вправо и будет находиться в точке 6, где и получится метка. Обозначим через А/г расстояние между серединой отрезка шнура и местом столкновения волн. Очевидно, что время распространения детонации по левой части шнура tn до момента столкновения равно времени распространения детонации по заря-
Фиг. 4. 44. Схема определения скорости детонации по Дотришу.
/—испытуемый заряд ВВ, 2—отрезок детонирующего шнура, 3~свинцовая пластинка, 4~капсюль-детонатор, 5—середина отрезка шнура, 6—метка на пластинке после взрыва.
ду /зарна длине I плюс время распространения детонации по правой части шнура ta до места столкновения:
^зар “И
Обозначим через L длину отрезка шнура, а через £>ш скорость его детонации.
Пусть D — неизвестная скорость детонации заряда. Тогда
и
Поскольку
получим
_ Z./2 ДА .
t за₽ D
LI2 Mi
А/2 . ДА Z , Z./2
ДА
/ -4-1
4 л 4зар '
212
Гл. IV. Самораспространяющееся превращение в ВВ
откуда
Dm D ’ или
D = DW —. (4.39)
Для определения неизвестной скорости D необходимо и достаточно знать величины I, &h и скорость детонации шнура £>ш. Значение можно определить одним из описанных ниже методов. Понятно, что детонирующий шнур должен обладать высоким постоянством скорости детонации для разных отрезков одной и той же партии.
При определении скорости детонации этим методом обычно используют заряды общей длиной 30—40 см с длиной базы I—20— 25 см. При этих условиях ошибка однократного измерения составляет 3—5%.
Несмотря на невысокую точность, получаемую к тому же для зарядов значительной длины, метод Дотриша широко используется в современных исследованиях. Особенно ценным является возможность применения этого метода в полевых условиях, где не всегда можно использовать методы, требующие точной электронной или оптической аппаратуры. В лабораторных условиях метод Дотриша вытесняется другими, более точными методами.
2. Фотографический метод
Наиболее распространено фотографирование свечения, сопутствующего распространению детонации по заряду ВВ. Для фотографирования применяют приборы, называемые фоторегистрами, или фотохронографами. Существует два типа фоторегистров: 1) фоторегистры (фотохронографы) с барабанной разверткой и 2) фоторегистры с зеркальной разверткой.
Приборы барабанной развертки начали применять еще в конце прошлого века; в настоящее время эти приборы повсеместно вытесняются приборами зеркальной развертки, имеющими ряд существенных преимуществ и прежде всего большее разрешение во времени.
На фиг. 4. 45 приведена принципиальная схема фоторегистра барабанного типа. На барабане 1, который может с большой скоростью вращаться вокруг вертикальной оси, закреплена фотопленка. Между зарядом ВВ 2 и объективом 3 обычно расположена узкая вертикальная щель 5. Обозначим через К отношение величины объекта к величине изображения, т. е. степень уменьшения фотографической системы. Если заряд имеет длину /, то длина изображения заряда 11!3 на пленке будет /в3= —.
К
$ 10. Методы определения скорости детонации ВВ
213
На фиг. 4.46 приведена схема записи. Предположим, что движение пленки происходит слева направо со скоростью цпл. Если заряд стоит вертикально и скорость детонации D, то изображение свечения детонации будет перемещаться также по вертикали (на
D „
фиг. 4.46 показано сверху вниз) со скоростью-—. В результате К
сложения двух взаимно-перпендикулярных перемещений получим
Фиг. 4.46. Схема записи распространения детонации на фоторегистре барабанного типа.
Фиг. 4.45. Схема фоторегистра барабанного типа для определения скорости детонации.
/—барабан с фотопленкой, 2—заряд ВВ. 3—объектив фоторегистра, 4-капсюль-детонатор. 5— щель.
наклонную линию. Зная опл, можно по углу наклона этой линии <р определить значение D. В самом деле,
D/K . ----= tg<?, ^пл
ИЛИ
(4.40)
Удобнее и точнее измерять не угол ср, а непосредственно длины проекций на вертикальную У и горизонтальную X оси:
, К
tg<p«—-
и
(4.41)
Л
Таким образом, для измерения скорости детонации этим методом необходимо знать: длины проекций Y и X (определяются путем обработки фотографий с помощью фотоувеличителя, микроскопа или другого устройства), значение К (определяется путем фотографирования на заданном расстоянии масштабной рейки) и скорость движения пленки олл, которая может быть оценена путем
214
Гл. IV. Самораспространяющееся превращение в В В
нанесения на движущуюся пленку изображений вспышек известной постоянной частоты (метки времени).
Существуют разнообразные методы получения меток времени. Весьма распространен метод измерения, при котором взрыв производят при некотором постоянном числе оборотов N*. В этом случае
где L — длина окружности барабана. Постоянное число оборотов получают или используя синхронный мотор, или же, например, на основе стробоскопического эффекта.
Если на вал барабана насадить кружок с одной радиальной чертой, то при освещении неоновой лампой или даже обычной лампой со сравнительно слабым накалом, питаемой от сети переменного тока 50 гц, этот кружок будет казаться неподвижным, если число оборотов Л'* равно 6000 об/мин (т. е. 100 об/сек —частота 50 гц дает 100 вспышек в 1 сек.), а также 12 000 об/мин и т. д. Когда число оборотов немного ниже 6000 в минуту, то будет казаться, что кружок медленно вращается в сторону, противоположную направлению истинного вращения; если вал делает немного более 6000 об/мин, то будет казаться, что кружок медленно вращается в сторону истинного вращения. Регулируя число оборотов мотора, в момент кажущейся остановки производят взрыв заряда.
У фоторегистра барабанного типа скорость движения пленки обычно ограничена значением twClOO м/сек; при большей скорости пленка, укрепленная снаружи барабана, разрывается. Несколько большую скорость записи можно осуществить, если укрепить пленку на внутренней поверхности барабана, применяя зеркало или призму для направления лучей из объектива на пленку. Однако уже при окружной скорости 200—250 м/сек возможен разрыв самого барабана. Именно ограниченная скорость пленки и является важнейшим недостатком фоторегистров с вращающимся барабаном. Для исследования процессов детонации конденсированных ВВ эта скорость недостаточна.
Анализ условий измерения с помощью фоторегистра барабанного типа показывает, что наибольшая точность получается при у = 45°, т. е. когда D
—— ^=г’пл. Если угол (р значительно отличается от 45° и, в частности, если
•~~^>цпя. то точность измерений резко К
снижается. Допустим, что необходимо
измерить скорость детонации порядка 8000 м/сек. чение цпл=г100 м/сек, то для соблюдения условия
Так как максимальное зна-
=гт-пл нужно брать К.
порядка 80, т. е. получать изображение, почти в 80 раз меньшее, чем объект. На практике обычно используют такие расстояния и объективы, что К =г20—30; это значит, что заряд длиной 20—30 см будет спроектирован на пленку как отрезок всего в 1 см. Вдобавок при большой скорости детонации испытуемого заряда угол у получится большим и даже для зарядов значительной длины точность будет невелика.
Практически для зарядов длиной 40—50 см ошибка отдельного измерения может составлять 2—5%, т. е. по существу мы получим точность того же порядка, что и по методу Дотриша. Серьез-
§ 10. Методы определения скорости детонации ВВ
215
ным преимуществом фоторегистра барабанного типа перед методом Дотриша является то, что если скорость детонации переменна, то это легко установить на фотоснимке по искривлению изображения. Принципиально возможно, проводя касательные, рассчитывать скорость детонации на отдельных участках; однако если эти участки в соответствии с характером изменения скоростей будут короткими, то результат измерений будет крайне ненадежным. Таким образом, если барабанный фоторегистр можно весьма успешно использовать для определения, например, скорости горения, то для
Фиг. 4. 47. Схема фоторегистра с зеркальной разверткой.
J—заряд ВВ, 2 и 4—объективы, 5—щель, 5—зеркало, б—пленка, /-—направление вращения зеркала, 8—направление перемещения изображения по пленке.
исследования детонации его разрешающая способность недостаточна.
На фиг. 4. 47 приведена принципиальная схема фоторегистра с зеркальной разверткой, Заряд ВВ 1 расположен перпендикулярно к плоскости чертежа; объектив 2 дает уменьшенное изображение заряда в плоскости щели 3; объектив 4 с помощью зеркала 5 проектирует это изображение на пленку 6. Изображение на пленке обычно несколько уменьшено по отношению к натуральной величине заряда. В приборе зеркальной развертки пленка закреплена неподвижно. Поэтому если детонация заряда будет распространяться перпендикулярно плоскости чертежа, то при неподвижном зеркале на пленке получится изображение в виде полоски, также перпендикулярной плоскости чертежа. Если зеркало вращается в направлении, указанном цифрой 7, то изображение будет перемещаться в направлении, указанном цифрой 8, что и дает развертку явления во времени. Так же, как и в случае фоторегистра барабанного типа, получим два взаимно-перпендикулярных перемещения, которые дадут на пленке наклонную линию. Только теперь пленка неподвижна, а движется изображение из-за поворота светового луча, вызываемого вращением зеркала. На фиг. 4. 48 показан образец снимка, полученного с помощью фоторегистра зеркального типа.
216
Гл. IV. Самораспространяющееся превращение в В В
Если обозначить через п число оборотов зеркала в секунду, а через R расстояние от зеркала до пленки, то линейная скорость развертки v„ будет равна
Vj, = 2 2 — 4^ Rn.
Дополнительный коэффициент 2 входит в выражение для ся потому, что угловая скорость вращения луча вдвое выше угловой скорости зеркала. Таким образом, скорость развертки определяется числом оборотов зеркала и расстоя
Фиг. 4. 48. Образец снимка на фоторегистре зеркального типа. Наклонная светлая полоса — свечение детонации; полосы слева — свечение расширяющихся продуктов.
нием от зеркала до пленки.
С первого взгляда кажется, что наиболее простым методом увеличения является максимальное увеличение R, однако это не так. Приборы с большим оптическим плечом неудобны в работе и, главное, ухудшается четкость изображения, поэтому величину R обычно берут умеренной. Так, в фоторегистре зеркального типа СФР, разработанном в Институте химической физики АН СССР, величина R около 24 см. Число оборотов небольшого по размерам легкого зеркала может быть очень большим. Например, в приборе СФР л=1000 об/сек, что при R —
= 24 см дает о— 3000 м/сек. Эта скорость развертки намного превышает максимально достижимую скорость для фоторегистра барабанного типа. Скорость детонации вычисляют по формуле, аналогичной (4.41)
= (4.41а)
X X
. D
Для того чтобы удовлетворить условию — = ия — условию наи-К
меньшей ошибки (это условие относится к фоторегистрам как барабанного, так и зеркального типа) даже при измерении наивысших скоростей детонации порядка 8—8,5 км/сек, достаточно иметь К-^3. Это позволяет уменьшить длину испытуемых зарядов и резко увеличивает точность измерений на отдельных отрезках в случае детонации с переменной скоростью.
Оптическая система прибора, включающая два объектива, позволяет получать относительно малые уменьшения (К=3-5-б) при значительном расстоянии между зарядом и объективом (в противном случае защита объектива была бы трудной; при значительном расстоянии объектив надежно защищается плоскопараллельным оптическим стеклом в стенке взрывной камеры).
$ 10. Методы определения скорости детонации ВВ 217
Система двух объективов удобна еще и потому, что вертикальную щель можно располагать не вблизи заряда, а в фокальной плоскости первого объектива.
Для определения существуют разные методы. Наиболее точный заключается в следующем. Создают электрический контур, в котором вращение зеркала вызывает колебания с частотой, равной частоте вращения. Эти колебания складывают с колебаниями кварцевого генератора строго постоянной частоты. В зависимости от соотношения частот на экране электронно-лучевой трубки по-
фиг. 4.49. Образец снимков детонации, полученных с помощью СФР-2 в варианте лупы времени.
Заряд в форме параллелепипеда 30 X 76X120 мм. К объективу обращена сторона 30Х~6. Снимки производились через 2 мксек. Отпечатки приведены для моментов 8, 16, 24, 32, 48, 64, 80, 96 мксек от начала взрыва. Инициирование сверху (в середине). Внизу масштабная линейка. Крупное деление (светлый отрезок наибольшей длины) 150 мм.
лучают разные фигуры, например эллипс с разным числом зубцов; определенное число зубцов соответствует фиксированному значению v:i. Вблизи от этого значения зубцы вращаются в ту или иную сторону (так же, как при стробоскопическом эффекте). Остановка движения на экране означает, что достигнута строго определенная скорость вращения зеркала и, следовательно, строго определенная ил. В этот момент производят взрыв.
Большинство приборов зеркальной развертки требует специального синхронизирующего устройства для того, чтобы момент взрыва совпадал с определенным положением зеркала. Из схемы фиг. 4.47 видно, что далеко не при всяком положении зеркала свечение будет зафиксировано на пленке. Необходимость синхронизации момента взрыва с определенным положением зеркала вносит некоторое осложнение, но оно не имеет существенного значения по сравнению с темп преимуществами, которые дает прибор. При использовании, например, прибора СФР можно измерять скорость детонации на базе 10—12 см с точностью отдельного измерения около 1%. Некоторое видоизменение прибора позволяет получать вместо непрерывной развертки во времени серию отдельных снимков (кадров), следующих друг за другом с частотой до 2- 10е кадров/сек. Образцы таких снимков (увеличенные) показаны на фиг. 4.49.
218 Гл. IV. Самораспростроняющееся превращение в ВВ
Фоторегистр зеркального типа является в настоящее время основным прибором для точного измерения скорости детонации.
3. Осциллографический метод
Сущность метода заключается в следующем. В заряде ВВ располагают два (или более) искровых промежутка, на которые подано определенное напряжение. ВВ в исходном состоянии (литые, прессованные, порошкообразные, жидкие) обладают весьма малой
-Фиг. 4.50. Схема осциллографического метода определения скорости детонации.
О—нулевой провод, 1, 2— искровые промежутки, 3, 4—конденсаторы, 5, 6, 7—сопротивления,
8—источник постоянного напряжения.
проводимостью, и ток через искровые промежутки не проходит.
В детонационной волне продукты взрыва сильно ионизированы, сопротивление их невелико (для продуктов взрыва типичных ВВ сопротивление составляет около 10—20 ом/мм), в результате при прохождении детонационной волны искровые промежутки последовательно замыкаются, в них возникает ток, что и фиксируется катодным осциллографом
Существует много схем, которые можно использовать. На фиг. 4. 50 дан один из возможных простейших
вариантов метода.
В заряде ВВ находятся две проволоки, оканчивающиеся остриями, которые с заземляемым проводом О образуют искровые промежутки 1 и 2, находящиеся на расстоянии L друг от друга. Электрическая схема включает конденсаторы малой емкости 3 и 4, весьма большие сопротивления 5 и 6, сопротивление 7 и источник напряжения 8.
Перед проведением опыта конденсаторы заряжены от источника 8 через сопротивления 5 и 6 и сопротивление 7. Предположим, что детонация распространяется сверху вниз. При замыкании промежутка 1 конденсатор 3 начнет разряжаться через сопротивление 7 и промежуток Г, в цепи возникнет ток малой длительности
* Во многих старых методах моменты прихода детонационной волны фиксировали по разрыву проволок, находящихся в заряде. Для измерений большой точности этот метод не рекомендуется. Возникновение тока в искровом промежутке при приходе детонационной волны фиксируется значительно точнее, чем прекращение тока при разрыве проволоки.
$ 10. Методы определения скорости детонации ВВ
219
(из-за малой емкости конденсатора). Через некоторое время замкнется промежуток 2, начнется разрядка конденсатора 4 и возникнет второй импульс тока.
Таким образом, с помощью данной схемы (или других более сложных схем) при распространении детонации в электрической
Фиг. 4.51. Схема электронно-лучевой трубки.
/—катод, ‘2—сетка, 3—аноды, 4—-пластины, отклоняющие луч в вертикальной плоскости, о~пластины, отклоняющие луч в горизонтальной плоскости, 5—экран.
цепи получаются два последовательных импульса тока, вызываю-щие соответствующие скачки напряжения, которые и фиксирует катодный осциллограф.
Основой катодного осциллографа является электронно-лучевая трубка
(фиг. 4.51). В левой части трубки находится устройство, состоящее из катода,
сетки и двух анодов, образующее тонкий электронный луч (показан на фиг. 4.51 пунктирной линией). Падая на экран, электронный луч вызывает его свечение в виде точки, если луч неподвижен, и в виде кривой, если луч отклоняется и движется по экрану трубки. При движении луча свечение в каждой точке экрана весьма кратковременно, ио достаточно для того, чтобы заснять его с помощью фотоаппарата. Электронный луч внутри трубки проходит между двумя парами пластин. Первая пара пластин 4 при подаче на них напряжения отклоняет электронный луч в вертикальной плоскости; вторая пара пластин 5 отклоняет луч в горизонтальной плоскости. Предположим, что на одну пару пластин по
фиг. 4. 52. Изображе-
ние на пленке при осциллографическом определении скорости детонации (схема).
дается напряжение, изменяющееся со временем по закону, близкому к линейному, тогда луч будет перемещаться по экрану с постоянной скоростью. Таким простейшим методом мы обеспечим временную развертку. Если
на другую пару пластин подать, например, скачки напря-
жения, получающиеся в схеме фиг. 4. 50, то скачки эти будут развернуты во времени. При фотографировании экрана осциллографа на неподвижную пленку мы получим запись типа, изображенного на фиг. 4. 52. Часто для таких записей применяют двухлучевые осциллографы; второй луч (ннжиий луч на фиг. 4.52) используют для нанесения меток времени. Для этого на развертку второго луча, движущегося с той же скоростью, что и первый, подают сигналы строго постоянной частоты, например, от кварцевого генератора.
Электрическая схема имеет устройство для запуска развертки осциллографа, что может осуществляться с помощью вспомогательного датчика, расположенного впереди основных рабочих датчиков.
220
Гл. IV. Самораспространяющееся превращение в В В
Сравнивая расстояние между двумя скачками напряжения с метками времени, можно с большой точностью определить интервал времени t между скачками, который в соответствии с изложенным выше равен интервалу времени между приходом детонационной волны к промежуткам 1 и 2 соответственно (см. фиг. 4.50). Если расстояние L было измерено заранее, то
(4.42>
Применение катодного осциллографа позволяет с высокой точностью определять время t, поэтому также с высокой точностью-необходимо измерять расстояние L (вплоть до применения изме-
Фиг. 4. 53. Запись на пленке при определении скорости детонации на осциллографе
рительного микроскопа).
В простейшей схеме, показанной на фиг. 4. 50, имеются только два искровых промежутка. Несколько усложняя схему, можно ввести много таких промежутков и измерить скорость детонации на нескольких отрезках заряда, что очень важно для неустановившейся детонации, идущей с переменной скоростью. (Для получения п баз измерения, очевидно, необходимо иметь п+1 промежутков).
На фиг. 4. 50 показана лишь принципиальная схема ионизационных датчиков в виде искровых промежутков. На практике в каче-
стве ионизационных датчиков используют раз-ные конструкции (торцовые, игольчатые, фольговые и т. д.) в зависимости от состояния заряда ВВ (жидкий, литой, прессованный, порошкообразный).
Точность измерения скорости детонации зависит от времени
со спиральной разверткой (схема).
/—первый отброс, 2—второй отброс.
развертки катодного осциллографа. Если, например, воспользовать-
ся для измерения скорости детонации осциллографом ОК-17, разработанным Институтом химической физики АН СССР, у которого минимальное время развертки 3 мксек (т. е. за 3 мксек электронный луч пробежит весь экран), то при базе измерения в 2 см (в случае мощных ВВ большой плотности такое расстояние будет пройдено детонационной волной приблизительно за 2,5 мксек) ошибка будет порядка 1%.
Еще большую точность можно получить, применяя осциллограф со спиральной разверткой, примером которого может служить осциллограф ОК-15, также разработанный в Институте химической физики АН СССР. Пример записи приведен на фиг. 4. 53. Развертка идет по спирали: скачки напряжения вследствие последовательного замыкания ионизационных промежутков детонационной волной дают отбросы в радиальном направлении. В этом случае
§ 10. Методы определения скорости детонации ВВ
221
также можно производить измерение на нескольких последовательных базах.
У осциллографа ОК-15 полный оборот
2к
луча происходит за 1 мксек', угол , который можно еще точно измерить, соответствует времени 10~8 сек. При помощи осциллографа ОК-15 можно измерять скорость детонации на базе нескольких миллиметров с ошибкой около 1%. В случае необходимости можно даже производить измерения на базе в несколько десятых миллиметра, но точность при этом снизится,-
Использование катодного осциллографа для исследования детонационных процессов и, в частности, для измерения скорости детонации еще не нашло широкого применения, но имеет исключительно большие перспективы. А1етод катодного осциллографа в отношении разрешения во времени превосходит фоторегистр зеркального типа. Это особенно существенно при изучении неуста-новившегося режима детонации (вблизи от инициатора, при передаче детонации), разлета продуктов взрыва вблизи от заряда, начального движения среды, контактирующей с зарядом, ее начальной массовой скорости и т. д. Кроме того, возможность измерения скорости детонации на малых базах резко уменьшает расход ВВ и облегчает лабораторные исследования.
Есть основания предполагать, что при дальнейшем развитии и усовершенствовании указанный метод заменит фотографический и станет основным методом определения скорости детонации.
Своеобразным соединением фотографического и осциллографического методов является описанный в литературе способ измерения скорости детонации и исследования взрывных явлений при помощи электронно-оптического преобразователя, схема которого
Фиг. 4. 54. Схема определения скорости детонации при помощи электронно-оптического преобразователя.
/—заряд, 2—объектив, 3— щель, 4—промежуточное изображение в плоскости щели 5—второй объектив, 6—трубка электронно-оптического преобразователя, 7—магнитная линза, 8—второе изображение иа светочувствительном катоде, 9—отклоняющие обмотки, дающие развертку во времени, 10—электронное изображение на экране преобразователя, 11—объектив фотоаппарата,
12—изображение на фотопленке.
приведена на фиг. 4. 54, Электронно-оптический преобразователь представляет собой катодный осциллограф, в принципе аналогичный упомянутому выше, но с электронно-лучевой трубкой, имеющей светочув-
ствительный катод. При освещении какой-либо точки светочувствительного катода из нее начинает выходить поток электронов, который ускоряется и фокусируется соответствующими устройствами внутри трубки и попадает на ее флуоресцирующий экран, где возникает светящаяся точка. При освещении поверхности катода вдоль линии 8 на экране появляется светящаяся линия 10. Если между системой, фокусирующей поток электронов, и экраном создать электрическое или магнит
222
Гл, IV. Самораспространяющееся превращение в ВВ
ное поле, то можно отклонить электронный луч и изменить положение линии 10. Создав на пути электронов поле, линейно изменяющееся во времени, получим равномерную временную развертку. Когда по линии 8 перемещается изображение светящейся точки (свечение детонации, распространяющейся по заряду), то на экране получается наклонная прямая (при постоянной скорости детонации) или кривая. Фотографируя экран на неподвижную пленку обычным фотоаппаратом, получают запись. Угол наклона прямой (или угол наклона касательной к данной точке кривой) является мерой соотношения скорости движения светящейся точки по катоду и скорости временной развертки. Если последняя известна, а также известны оптические данные системы, то можно с большой точностью определить скорость детонации. По опубликованным данным, такие приборы позволяют получить разрешение во времени порядка 10~9 сек. и менее и определять скорость детонации на участках в несколько десятых долей миллиметра. Видоизменение этого прибора позволяет получать серию отдельных кадров, снятых с интервалом IO-6—10”7 сек,
§ 11, ТЕОРИЯ ДЕТОНАЦИИ ГАЗОВ
1. Общие сведения
Первой гипотезой, выдвинутой для объяснения детонации в 1869 г., была «теория синхронных колебаний» Абеля, Абель полагал, что при взрыве в окружающей среде возникают колебания определенной для каждого ВВ частоты. Эти колебания распространяются во все стороны и, если на их пути встречается ВВ. то молекулы последнего, резонируя, начинают колебаться. Эти колебания приводят к возникновению реакции и взрыва. Таким образом Абель объяснял передачу детонации на расстоянии. Гипотеза Абеля прилагалась и к объяснению распространения детонации в сплошной массе ВВ. В этом случае молекулы, реагирующие в результате резонанса, находятся в непосредственном контакте. Экспериментальные исследования, поставленные для проверки гипотезы Абеля, в итоге своем не подтвердили ее.
В частности, было показано, что передача детонации на расстояние между зарядами из разных ВВ часто происходит легче, чем между зарядами одного и того же ВВ; помимо этого, при возбуждении или передаче детонации большое значение имеет величина возбуждающего заряда. Наконец, было установлено много случаев, когда вещество А хорошо (на большое расстояние) передает детонацию веществу Б, а от Б к А детонация передается плохо.
Эти и другие факты, противоречащие гипотезе Абеля, заставили отказаться от нее. На смену гипотезе Абеля появилась в 1883 г. «теория взрывной волны» Бертло.
Мы видели, что распространение горения ВВ происходит в результате передачи от слоя к слою энергии реакции в виде тепла путем теплопроводности, К процессу детонации эти представления не приложимы, так как скорости распространения порядка тысяч метров в секунду, характерные для детонации, как полагают, не могут быть обеспечены передачей энергии путем теплопередачи. Поэтому для детонации Бертло принял в своей теории другой механизм передачи энергии от слоя к слою, который может обеспечить несравненно более быстрое распространение превращения.
£ 11. Теория детонации газов
223
Согласно Бертло при действии начального импульса, вызывающего непосредственно детонацию, например капсюля-детонатора, иа взрывчатую газовую смесь первым этапом является сжатие слоя смеси в результате удара продуктов взрыва капсюля, находящихся под большим давлением. Вследствие быстрого сжатия слой газа адиабатически разогревается до очень высокой температуры. Высокая температура в свою очередь обусловливает большую скорость реакции. Так как реакция экзотермична и продуктами ее являются газы, то в результате быстрого превращения возникает резкое повышение давления в реагирующем слое. Это давление, действуя на соседний слой, вызывает его сжатие с последующим разогревом и быстрой химической реакцией и т. д. Таким образом, реакция распространяется от слоя к слою путем тройного цикла явлений: механических (сжатие), термических (разогрев) и химических (реакция). Поскольку передача энергии путем ударного сжатия происходит гораздо быстрее, чем теплопередачей, то процесс в этом случае распространяется со скоростью, во много раз большей, чем при горении.
Количественная теория распространения детонационной волны была разработана преимущественно французскими и советскими исследователями и известна под названием гидродинамической теории детонации.
Распространение детонации эта теория рассматривает как распространение скачка давления (ударной волны). При этом предполагается, что распространение скачка давления вызывает во взрывчатой системе быструю экзотермическую реакцию, энергия которой в свою очередь поддерживает стационарное распространение ударной волны. Таким образом, скорость детонации отождествляется со скоростью ударной волны в данной системе. Поэтому рассмотрение гидродинамической теории детонации мы начнем с гидродинамической теории ударной волны. Здесь мы рассмотрим ударные волны и детонацию преимущественно в газообразных системах- Теория детонации конденсированных ВВ изложена в § 12.
2. Гидродинамическая теория ударной волны
Излагая элементарные основы гидродинамической теории, мы будем пользоваться наиболее простым методом вывода основных соотношений, примененным Я. Б. Зельдовичем и А. С. Компаней-цем.
Предположим (см. фиг. 4. 55), что в трубе сечением S, заполненной газом, движется поршень с постоянной скоростью w. Под действием поршня в газе возникает ударная волна — область сжатия, распространяющаяся в невозмущенный газ. На переднем фронте ударной волны происходит скачкообразное изменение давления, плотности и температуры газа. Сжатый поршнем газ будет двигаться со скоростью поршня, т. е. со скоростью wt фронт ударной
224 Гл. IV. Самораспространяющееся превращение в ВВ
волны (передняя граница области сжатия) будет распространяться в невозмущенный газ со скоростью D, большей, чем w, что в дальнейшем будет обосновано. Допустим, что в начальный момент поршень находился в плоскости А; через промежуток времени t поршень будет находиться в плоскости В. Фронт ударной волны в начальный момент также находился в плоскости А; в момент t он находится в плоскости С. Обозначим через р0, р0 и То соответ-
ственно давление, плотность и температуру газа в исходном состоя-
Фиг. 4.55, Пояснительная схема к выводу основных уравнений гидродинамической теории.
нии, а через pi и Ti — давление, плотность и температуру газа, сжатого ударной волной. Из фиг. 4. 55 следует, что если за время t поршень прошел расстояние wt, то ударная волна прошла расстояние Dt-, расстояние же между поршнем и передним фронтом ударной волны стало (D—w)/.-Отсюда объем сжатого газа равен (£)—w)tS, а первоначальный объем того же количества газа был DtS, Масса сжатого газа
равна р](£)—w)tS, а масса газа перед сжатием равна poDtS. Так
как в процессе сжатия масса вещества не изменяется, то
Ро DtS—pl(D — та») tS,
или
P0D=P1.(D—та»).
(4.43)
Уравнение (4. 43) представляет собой закон сохранения массы при сжатии.
Сжатый газ движется со скоростью к» и, следовательно, при сжатии масса paDtS приобретает количество движения p^DtSw. По второму закону Ньютона изменение количества движения равно импульсу силы, т. е. произведению силы на время ее действия. Результирующая сила, действующая на газ между поршнем и плоскостью С, равна (pi—po)S, а импульс ее за время t равен (Pi—Po)St. Приравнивая изменение количества движения величине импульса, получим
(Pi— p^St=p0DtSw,
или
Pl— Po=Po0w- (4.44)
Уравнение (4. 44) представляет собой закон сохранения количества движения при сжатии.
§11. Теория детонации газов
225
Напишем теперь уравнение сохранения энергии при сжатии. Полагаем, что при сжатии газ не отдает и не получает тепла извне, поэтому изменение его полной энергии должно равняться произведенной над газом работе. В свою очередь, полная энергия складывается из внутренней (тепловой) энергии и кинетической энергии движущегося газа. Обозначим через е0 и начальную и конечную удельную внутреннюю энергию (т. е. внутреннюю энергию единицы массы); кинетическая энергия единицы' гг<2
массы сжатого газа, очевидно, равна — . Гак как масса сжатого газа p0DtS, то полное изменение энергии газа при сжатии составит Работа внешней силы над газом есть
работа поршня, действующего на газ с силой p}S на пути wt. Приравнивая изменение энергии работе силы и сокращая на tS, получим
P0O^i —s0 + —А®7- (4.45)
Уравнение (4.45) по существу представляет собой закон сохранения энергии при сжатии.
Присоединяя к трем написанным уравнениям сохранения (4.43) — (4. 45) уравнение состояния газа, можно определить любую из пяти величии р, р, Т, w и D, если одна из них задана и известны исходные параметры газа ро, р0 и То.
Выше мы дали наиболее простой вывод основных уравнений гидродинамической теории ударной волны с использованием движущегося поршня. Но п не прибегая к этому приему, уравнения можно вывести просто из законов сохранения массы, количества движения и энергии при переходе через фронт ударной волны. При таком выводе весьма удобно использовать координатную систему, движущуюся со скоростью D, т. е. систему, в которой фронт ударной волны неподвижен. В такой координатной системе невозмущеииый газ будет втекать в передний фронт ударной волны со скоростью D и вытекать из него со скоростью D—w.
Приравнивая втекающий и вытекающий потоки вещества, количества движения и энергии, получим соотношения, аналогичные уравнениям (4.43), (4.44) и (4.45).
Так, например, в передний фронт ударной волны втекает количество вещества Drja, а вытекает (D—гд)р1. Из закона сохранения массы мы прямо получим соотношение (4.43).
До сих пор речь шла об ударной волне, но все изложенное относится также и к детонационной волне, представляющей собой ударную волну, которой сопутствует быстрая химическая реакция.
Уравнения сохранения массы и количества движения для ударной и детонационной волн совершенно одинаковы. При составлении уравнения сохранения энергии в случае детонационных волн к тепловой части внутренней энергии необходимо добавить q—удельную теплоту взрыва, т. е. потенциальную химическую энергию, вы-
226
Гл. IV. Самораспространяющееся превращение в ВВ
деляющуюся во фронте детонационной волны. Так, для идеального газа в случае ударной волны
Со = Су ТЬ, а в случае детонационной волны
Ео ~ СуТ<г\~Я-
При выводе уравнений обычно предполагают, что основные параметры ударной волны за фронтом сохраняют постоянные значения. В действительности, как мы увидим далее для реальных ударных волн взрыва, давление, температура, плотность и скорость потока за фронтом быстро падают. В случае таких ударных волн выведенные уравнения справедливы по отношению к значениям соответствующих параметров (р, р, Т) на фронте волны. Чтобы подчеркнуть это обстоятельство, в технической литературе соответствующие величины часто снабжают индексом «ф»(Рф,рф,7ф); мы же будем по-прежнему пользоваться принятыми обозначениями pt, pi, Tj, относя эти значения к фронту ударной волны.
Рассмотрим основные выводы, следующие из двух первых законов сохранения (закона сохранения массы и закона сохранения количества движения). Эти законы одинаковы и для ударных и для детонационных волн при любом уравнении состояния, поэтому выводы из них являются универсальными.
Прежде всего непосредственно из уравнения сохранения массы (4.43) получим для скорости потока
® = (4.46)
Pi
Так как вещество в ударной волне сжимается (ps > р0), то ®>0 и направлена в ту же сторону, что и D. С другой стороны, и w<^D. Таким образом, следствием закона
Pi
сохранения массы при сжатии в ударной волне является возникновение потока вещества за фронтом ударной волны, движущегося в направлении распространения волны.
Исключительно важно соотношение (4.44), согласно которому избыточное давление на фронте ударной волны равно произведению начальной плотности среды, скорости распространения фронта ударной волны и скорости потока вещества непосредственно за фронтом волны. Это соотношение, базирующееся на фундаментальном законе механики, справедливо как для ударных, так и для детонационных волн. В последнем случае р0 представляет собой начальную плотность ВВ, a D — скорость детонации.
Для весьма сильных ударных волн (и практически всегда для детонационных волн) pt^>po, поэтому значением ро можно пренебречь. Тогда
pt = p0Dw.
(4.44а)
§11. Теория детонации газов
227
Именно соотношения (4.44) и (4.44а) дают возможность опытным путем оценить величину давления на фронте детонационной волны (см. стр. 247). Определить р о весьма просто. С большой точностью можно также определить D— скорость детонации. Скорость потока за фронтом волны w определить значительно труднее. Однако за последнее время в литературе указан ряд методов, решающих и эту задачу и дающих надежную оценку значения величины w. Согласно некоторым из этих методов скорость продуктов детонации измеряют непосредственно, согласно другим — оценивают величину w косвенно по характеру воздействия детонационной волны на среду в непосредственной близости от поверхности ВВ.
Отметим одно обстоятельство, которое нам потребуется в дальнейшем. Из общих физических соотношений вытекает, что размерность давления и размерность энергии единицы объема
одинаковы:
ЛШ-2 = ML4-2 = м,-Ч-2.
L2 А3
их численные значения отличаются на безразмерный коэффициент. В случае идеального газа его внутренняя энергия
k — 1 ’
где
Ср
Отсюда внутренняя энергия единицы объема
Р k— 1
Таким образом, зная давление детонации (Pi= Ро-Оау), можно оценить также величину внутренней энергии единицы объема в детонационной волне. Для этого необходимо значение давления умножить на коэффициент —-.
k—1
Выведем еще некоторые соотношения, которые нам понадобятся в дальнейшем. Из основных уравнений (4. 43) и (4. 44) можно получить выражения для Си®, подставив в них объем единицы массы
1
-о— —:
Р
D _ D — w _
— *
Dw
Pi—Po — —— ^0
Из (4.47) можно получить
„ — Г]
w=D ——— vo
(4.47)
(4.48)
(4.47 а)
228
Гл. IV. Самораспространяющееся превращение в ВВ
ИЛИ
Z)—-9—w. (4.476)
г0 - vt
Подставляя эти значения D или w в (4.48), получим
£>2^^Ру-ДЩ. (4.49)
vo~ «Д
А)(^о-^)- (4.50)
Найдем теперь соотношение между давлением и удельным-объемом в ударной волне. Для идеального изэнтропического процесса связь между давлением и объемом дается уравнением адиабаты Пуассона
pv’: = const, где
C-v
Это уравнение, предполагающее постоянство энтропии, к ударной волне неприменимо: одним из важнейших свойств ударной волны является то, что в ней из-за необратимых потерь энергии при переходе через скачок энтропия возрастает тем значительнее, чем сильнее волна.
Из уравнения (4.45), заменив р0 на получим
«-’о
D / , к12 \ /л ci \
— ei-So + ДГ = Piw- (4-51)
г-0 \ 2 /
Подставив в это уравнение значение D из (4.49) и значение w из (4. 50), после несложных преобразований находим
S!„So=£l±£o (^o_^). (4.52)
Если термодинамические свойства вещества известны, то можно выразить удельную энергию как функцию давления и объема единицы массы
^=f(pi, Wi) и
eo=f(po, »о).
Подставляя эти значения в (4.52), получим уравнение некоторой кривой, проходящей через точку р0, и0 и дающей .искомую связь р и V. Эту кривую называют ударной адиабатой или динамической адиабатой, или адиабатой Гюгоньо.
Рассмотрим случай идеального газа с постоянной теплоемкостью, для которого
ср
k =---= const.
Су
§ ]1. Теория детонации газов
229
Внутренняя удельная энергия такого газа
Pi»i PqVq е1==-_и ео = —
Подставив эти значения в уравнение (4.52), после несложных преобразований получим
Pi = Ро = (6 —1)Р14~(6+ 1)Ро t>o pf (А 4-1 )/>] + (£ — 1)Ро
или
Pl _
Ро (^ + 1) Ро — —1)Р1
Еще раз подчеркнем, что уравнение динамической адиабаты в виде (4.53) или (4.53а), дающее однозначную связь между значениями р и v (или р и р), выведено для идеального газа в предположении, что £=const. Если pi > ро, то, пренебрегая в уравнении (4.53) значением ро по сравнению с pi, получим предельное увеличение плотности в сильной ударной волне
Pi __~Ь 1
Ро
(fe 4~ 1) Pi — (fe — 1) ро
(4. 53a)
или
k— 1
(4. 54)
Фиг. 4. 56. Сравнение адиабаты Пуассона (/) и адиабаты Гюгоньо (2).
k—1 k+ 1 ’
На фиг. 4.56 приведена
р— v для изэнтропы (адиабата Пуассона, кривая /) и динамической адиабаты (кривая 2) при условии одинакового начального состояния рс> ?’о и А =1,40 (такое значение k имеет воздух при умеренных сжатиях). Как видно, динамическая адиабата идет круче, чем из-энтропа: при одинаковом уменьшении объема по ударной адиабате давление возрастает в более значительной степени. В случае изэнтропы бесконечно большое давление достигается при бесконечно малом удельном объеме (т, е. при бесконечно большой плотности). В случае динамической адиабаты бесконечно большое давление получается при значении щ =---------~vq (показано
k 4- 1
пунктиром). Выражение для предельного значения объема единицы массы при
V1
v0
(4.54a)
диаграмма
Р1-;>о°
k — 1
k 4- 1 г'°
можно использовать для вывода некоторых важных соотношений, справедливых для сильных ударных волн. Подставляя это выражение в формулу (4.49): и пренебрегая величиной ро по сравнению с pi, получим
k 4- 1
Z)2= pi vQ.
230
Гл. IV. Самораспространяющееся превращение в ВВ
Произведя аналогичную подстановку в (4.50), находим, что
W2 =
2
Отсюда непосредственно следует, что
w =-------D.
k + 1
Применив соотношение (4.44а), легко получим
2
Pi = ~7
K-f- 1
(4.55)
(4.56)
Подчеркнем еще раз, что уравнения (4.53)—(4.56) относятся к сильным ударным волнам в идеальном газе.
Не следует думать, что при сжатии в ударной волне от ро, v0 до некоторого состояния pit vi проходятся все промежуточные точки на динамической адиабате; в действительности вещество внезапно скачком переходит из состояния рй, щ в состояние pi, Vi. Волна с другим давлением также внезапно переведет вещество в другую точку ррТ»']. Кривая динамической адиабаты представляет собой
геометрическое место точек, отвечающих состояниям, получающимся из данного исходного состояния при однократном сжатии ударными волнами разной интенсивности.
Фиг. 4. 57. Изменение состояния на диаграмме р—v по мере прохождения реакции.
/—ударная адиабата для исходного ВВ, У—то же. для состояния, когда часть ВВ уже прореагировала.
3. Гидродинамическая теория детонационной волны
До сих пор мы рассматривали выводы гидродинамической теории в основном применительно к ударной волне. Остановимся теперь на выводах, специально относящихся к детонационной волне.
Рассмотрим случай, когда ударная волна распространяется по системе, способной к крайне быстрой реакции под действием скачка давления (взрывчатая газовая смесь, взрывчатое вещество). Исходное состояние системы
характеризуем (как и раньше) начальным давлением Ро и начальным удельным объемом Vq. Под действием ударной волны состояние исходного вещества скачком
изменяется и соответствует точке pi, динамической адиабаты (фиг. 4. 57). Скорость изменения состояния в сильной ударной волне
§ Л. Теория детонации газов
231
так велика, что приближенно переход из состояния ро, Vo в состояние Pi, Vj можно считать мгновенным.
В сжатом веществе начинается химическая реакция, которая проходит, хотя и весьма быстро, но не мгновенно. Реакция может возникнуть, например, из-за интенсивного разогрева, вызванного сжатием. По мере прохождения реакции свойства вещества будут изменяться и будет выделяться тепло.
Предположим, что через некоторое время прореагировала часть вещества и выделилось определенное количество тепла Ар. При этом состояние системы будет описываться уже не адиабатой для исходного вещества, а некоторой другой адиабатой. Поскольку в системе выделилось тепло, эта адиабата будет лежать выше адиабаты исходного вещества (пунктир на фиг. 4.57). Изменение состояния при переходе от адиабаты для исходного вещества к пунктирной адиабате является не произвольным, а строго определенным. Если процесс детонации стационарен, то переход от исходной адиабаты к пунктирной адиабате должен совершаться по прямой линии, соединяющей точки pi, Vi и ро, v0 так, как показано стрелкой на фиг. 4. 57. Чтобы доказать это, обратимся к выражению (4. 49) для скорости ударной волны в функции от давлений и удельных объемов:
%о —V]
Отметим, что отношение Pi р0 представляет собой tgty- тан-«о — «1
гене угла наклона прямой, соединяющей точки plt Vj и р0, т>0. Таким образом, скорость детонации пропорциональна Каждой прямой, проведенной из точки р0, ф0, будет соответствовать своя скорость детонации. На пунктирной прямой фиг. 4.57 скорость будет больше, чем на сплошной.
Состояние pi, Vi на диаграмме фиг. 4. 57 отвечает фронту ударной волны и распространяется по веществу со скоростью D. Очевидно, что при стационарной детонации с такой же скоростью должны распространяться и все другие промежуточные состояния, соответствующие выделению той или иной доли полной энергии реакции. Это значит, что изменение состояния в процессе химической реакции должно происходить по прямой, соединяющей точки pi, Vi и ро, v0; только на этой прямой все промежуточные состояния распространяются по веществу с той же скоростью D, что и фронт волны. В противном случае мы пришли бы к положению, при котором головная часть детонационной волны (передний фронт ударной волны) распространялась бы с одной скоростью, а та зона детонационной волны, где происходит реакция, — с другой скоростью. Очевидно, при этом процесс не может быть устойчивым. Отметим, что на диаграмме р—v прямая равных скоростей распространения.
232
Гл. IV. Самораспространяющееся превращение в ВВ
по которой совершается переход с одной адиабаты на другую, описывается уравнением
/’ = А + -^(г’о-г') г’о
(4.57)
и называется прямой Михельсона.
Рассмотрим теперь условия перехода от адиабаты Гюгоньо для исходного вещества к адиабате для конечных продуктов, соответ-
ствующей
Объем v
Фиг. 4.58. Переход от адиабаты исходного вещества к адиабате продуктов детонации.
0—6—1—3—адиабата Гюгоньо для
исходного вещества. 5—2—4—'го же. для конечных продуктов реакции, точка 0—состояние исходного вещества.
полному завершению реакции и выделению полного тепла (фиг. 4.58). Для ясности изложим сначала фактическое положение вещей, т. е. без доказательства покажем, каким именно образом происходит переход от адиабаты исходного вещества к адиабате продуктов. Доказательство того, что другой переход невозможен, будет приведено ниже.
В случае устойчивой нормальной детонации в результате сжатия исходного вещества в ударной волне состояние его будет соответствовать точке 1 (см. фиг. 4. 58), для которой прямая Михельсона, проведенная между точками pi, vr и ро, v0, касается адиабаты продуктов реакции. По мере прохождения реакции состояние вещества изменяется по этой прямой 1—2—0. Точка касания 2 отвечает конечному состоянию продуктов детонации после завершения химического превращения и выделения полного тепла. Точку касания часто называют точкой Жугэ.
Как уже было отмечено, высказанное утверждение нуждается в доказательстве. Очевидно, что исходное вещество не может быть сжато до состояния, лежащего на адиабате 0—1—3, ниже точки Г. соответствующая прямая Михельсона (например, прямая 0—6), по которой, как мы видели, должно изменяться состояние, не попадает на адиабату конечных продуктов. Казалось бы, однако, что исходное вещество может быть сжато до любого состояния, отвечающего точкам, расположенным на адиабате выше точки 1, например до состояния 3, и переход с адиабаты исходного вещества на адиабату продуктов может, помимо касательной, осуществляться бесчисленным количеством прямых Михельсона, являющихся секущими адиабаты конечных продуктов, одна из которых (прямая 3—4—5—0) проведена на фиг. 4. 58. Каждой секущей соответствует
§ 11. Теория детонации газов
233
своя скорость детонации (напомним еще раз, что скорость распространения пропорциональна тангенсу угла наклона соответствующей прямой). Таким образом, казалось бы, что возможно бесчисленное множество устойчивых скоростей детонации. Между тем опыт показывает, что в действительности устойчивой является единственная скорость, характерная для данной системы. Из всех возможных скоростей нужно произвести отбор единственной реализуемой скорости. Отметим, что из всех прямых типа 3—4—5—О касательная имеет наименьшее значение тангенса и, следовательно, переход по касательной соответствует наименьшей скорости распространения детонации. В начальный период развития гидродинамической теории фактически и было постулировано, что из всех возможных скоростей детонации в действительности осуществляется наименьшая скорость, соответствующая переходу по касательной. В настоящее время существует строгое доказательство этого постулата, данное Зельдовичем, которое будет кратко изложено в дальнейшем.
Остановимся теперь на некоторых важных свойствах точки касания. Состояние, соответствующее точке касания, будем обозначать индексом «2» (р2, р2, Это состояние, в котором нахо-
дятся продукты взрыва тотчас же после завершения химической реакции, существенно отличается от состояния исходного вещества, сжатого ударной волной (точка 1 на фиг. 4.58). Непосредственно из фиг. 4. 58 видно, что
р2</?! и
Процесс химического превращения в детонационной волне сопровождается расширением вещества и падением давления. Наиболее высокое давление достигается в исходном веществе; по мере прохождения реакции и выделения тепла давление падает и после завершения реакции оказывается значительно меньшим, чем в сжатом исходном веществе. К этому важному и несколько неожиданному выводу гидродинамической теории мы еще вернемся.
В точке касания мы попадаем на адиабату Гюгоньо для продуктов, соответствующую полному выделению тепла. Состояния, отвечающие точкам, расположенным на касательной между 1 и 2, вообще говоря, будут описываться другими адиабатами, соответствующими меньшему выделению тепла. Однако нужно подчеркнуть следующее. При бесконечно малом перемещении по прямой вблизи от точки касания прямая отстоит от кривой на бесконечно малые 2-го порядка. Из этого следует, что при таких перемещениях тепловой эффект также бесконечно мало отличается от полного теплового эффекта (достигаемого на кривой). Но это значит, что энтропия, увеличивающаяся по мере перемещения по прямой ,/—2 и достигающая максимума в точке касания, при бесконечно малых перемещениях вблизи точки касания также не изменяется. А это в свою очередь значит, что вблизи точки касания адиабата Гюгоньо'
234 Гл. IV. Самораспространяющееся превращение в ВВ
совпадает с изоэнтропой (т. е. с адиабатой Пуассона). Это обстоятельство приводит к весьма важному выводу. Условие касания можно записать в следующем виде:
Pi—Po __ ( dp\
v0~v2 \ dv )2'
Поскольку в точке касания адиабата Гюгоньо совпадает с из-энтропой
(dp\ \
\ dv Jo \ dv Js
/ dp \ / др\
где (——) и —) —соответственно углы наклона касательных \ д» /2 \ &V 'S
в точке 2 к адиабате Гюгоньо и изоэнтропе; следовательно,
. (4.58)
Vq —Vo \ dv Js
Используя выражение (4.49), для скорости детонации получим
t’o — vi
Г0 — «2
Из уравнения сохранения массы (4.43)
цп=-------г»,,
0 d~w2 2
где wz — относится к точке 2 на фиг. 4. 58.
следует, что
Исключая v0,
получим
Величина
D — w2=v2
Р2 — Р0 _г.
ГО— Vo
представляет собой
звука в продуктах
k р2-.
(4.59)
скорость звука с2, т. е. скорость в точке касания, тотчас после завершения реакции.
Таким образом,
D — w2=c2,
ИЛИ
местную взрыва,
(4.60)
(4.60а)
Напомним, что величина D—W2 представляет собой скорость, с которой распространяется детонационная волна относительно продуктов взрыва, которые сами движутся со скоростью w%.
$ И. Теория детонации газов
235
Согласно выражению (4.60), являющемуся следствием условия касания, скорость распространения детонации относительно продуктов равна местной скорости звука в продуктах реакции.
Теперь можно в виде краткой схемы изложить соображения Зельдовича, согласно которым точка касания действительно соответствует единственно устойчивому режиму.
Предположим снова, что переход от адиабаты для исходного вещества к адиабате для продуктов совершается по прямой 3—4. Можно показать, что в точке 4 так же, как и в любой точке, лежащей выше точки касания, местная скорость звука c^D—W4. Однако вслед за детонационной волной идет волна разрежения, которая, как и все волны разрежения, распространяется с местной скоростью звука, т. е. в данном случае со скоростью С4. Так как C4^>D—W4, то волна разрежения догонит детонационную волну, ослабит ее, уменьшит давление и уменьшит скорость распространения; поэтому режим, соответствующий состоянию в точке 4, не может быть устойчивым. Если бы даже нам и удалось, например, при помощи весьма сильного инициатора создать в веществе детонационную волну, распространяющуюся со скоростью, большей, чем присущая ему устойчивая скорость детонации, соответствующая касательной, то скорость быстро упала бы до этого нормального значения.
Секущая пересекает адиабату продуктов также в точке 5. Однако легко показать, что состояние, соответствующее точке 5, не может быть достигнуто. Дело в том, что в точку 5 можно попасть, лишь спускаясь сверху по секущей, начиная от точки 3 через точку 4. Но точка 4 уже соответствует полному выделению тепла. Так как ниже точки 4 секущая лежит вправо от адиабаты продуктов, то для перехода из точки 4 в точку 5 по прямой потребовалось бы сообщить продуктам дополнительное количество тепла, сверх того полного тепла, которое выделяется при химическом превращении. Это и показывает, что осуществление режима, соответствующего точке 5, невозможно.
Таким образом, лишь состояние, достигаемое в точке 2, в точке касания, соответствующее минимальной скорости детонации, является устойчивым. В точке касания c — D—w волна разрежения распространяется по продуктам взрыва с той же скоростью, что и детонационная волна относительно продуктов. При этом волна разрежения будет идти как раз за состоянием, отвечающим точке 2, не опережая его и не отставая.
Точка, отвечающая состоянию вещества, сжатого ударной волной, должна лежать на одной прямой Михельсона с точкой касания. Очевидно, что этому условию отвечает точка 1. В процессе распространения устойчивой детонационной волны как раз устанавливается такой режим, при котором исходное вещество сжимается до состояния в точке 1, а затем, по мере развития реакции, по прямой (касательной) переходит в состояние, соответствующее точке 2.
236
Гл. IV. Самораспространяющееся превращение в ВВ
В результате отбора из бесчисленного ряда скоростей единственной реальной скорости мы по существу получили пятое уравнение (в дополнение к трем уравнениям сохранения и уравнению состояния). Это уравнение может быть использовано как в виде условия касания (4.58), так и в виде следствия этого условия (4.60).
Наличие пяти уравнений позволяет однозначно определить пять неизвестных величин (pa, Pa, w п D) при условии, что задано исходное состояние и удельная теплота взрыва. Приведем выражение для скорости детонации в двух вариантах.
Прежде всего согласно (4. 58) имеем
= _(дР \ (4. 58а)
г'о — г-9 \ до /S г-2
В случае детонационных волн р2^>р0- Если пренебречь рс по сравнению с р2, то
Р2 £ £2
1’0 — V? ”2
ИЛИ
1 k
Vo - v2 отсюда
Ца=-А-Цо. (4.61)
«т 1
Подставляя (4.58а) в (4.49), находим
«2 ИЛИ
D — ~V kv2 р2.
«2
По уравнению состояния идеального газа
p2v2~nRT2,
где «—число молей на единицу веса.
На основании (4.61)
vo__£ -{- 1
V2 k откуда
D = Ш VknRT2. (4.62)
$ 11. Теория детонации газов
237
Вместо величины п можно ввести средний молекулярный вес 1
продуктов взрыва р — — ; тогда п
(4.62а) k у
Из уравнений (4.62) и (4.62а) следует, что скорость детонации при прочих равных условиях должна быть пропорциональна корню квадратному из температуры детонации Т2 и числа газовых молей на единицу веса п (или обратно пропорциональна корню квадратному из среднего молекулярного веса). Для вычисления D выражения (4.62) и (4.62а) неудобны, так как в них входит Т2— температура детонации, которая не равна температуре мгновенно-
го превращения при постоянном объеме Т— . Из-за дополни-
•тельного разогрева при сжатии в детонационной волне Тг^>
Ср
Для определения скорости детонации можно вывести соотношение, в которое будет входить только удельная теплота q и величина k= С этой целью введем в рассмотрение энтальпию Я, Ср
или тепловую функцию, задаваемую соотношением
Н^срТ.
Для идеального газа
//=сТ=-2-рт.
р k—V
Поскольку внутренняя энергия
E=cJ = -^—pv, к— 1
ТО
H=E-±pv. (4.63)
Для разности удельных внутренних энергий двух состояний согласно выражению (4.52) имеем
Соответственно для разности энтальпий, учитывая (4.63), получим
(4-64)
238
Гл. IV. Самораспространяющееся превращение в В В
Энтальпия исходного состояния с учетом удельной потенциальной химической энергии q, выделяемой при реакции в виде тепла, равна
~ т~т Ро^о + <7 • к— 1
Энтальпия продуктов детонации (состояние в точке 2) равна т г k
Согласно выражению (4.64) должно соблюдаться равенство
ИЛИ
k k ^2 + z \ i Л
~ о ~ Po> (4- 65>
k— 1 k— 1 2
Отметим, что в случае реальных детонационных процессов химическая потенциальная энергия q значительно превышает величину
k _
Так как
k— i и одновременно
k >> k
то в уравнении (4.65) величиной —рот»о можно пренебречь;
k— 1
точно так же можно пренебречь величиной р0, малой по сравнению с р2. Тогда
(4.66)
Проведя простые преобразования и сокращения в выражении (4.66), с учетом (4.61) получим
№=2(й-1)?. (4.67)
Ранее мы видели, что
D2 = k-v^ = k—pt-v0.
^2 ^2
$ 11. Теория детонации газов
239
Заменяя = и p2'vo — 2 (k — 1) q, получим fe2 k
D2=2(k2-l)q, или
D = /2 (k2 — V)q. (4.68)
В формуле (4. 68) скорость детонации выражена в функции только удельной теплоты взрыва q и величины k. Этим выражением пользоваться значительно удобнее, чем формулами (4. 62) или (4.62а). Удельная теплота взрыва является основной характеристикой ВВ. Правда, точный расчет значений k с учетом изменения теплоемкости в зависимости от температуры и давления не является простой задачей. Нужно, однако, учитывать, что величина k— — для практически используемых ВВ и газовых смесей из-меняется в небольших пределах.
При температурах, характерных для детонации, & = 1,17, если продукты взрыва состоят целиком из трехатомных молекул (СО2, Н2О) и &=1,28, если продукты взрыва состоят из двухатомных молекул (СО, N2 и т. д.). Обычно продукты взрыва представляют собой смесь трехатомных и двухатомных молекул, и значение k колеблется в пределах от 1,20 до 1,25. Если в продуктах больше двухатомных молекул, то k—1,25 (гексоген); если в продуктах больше трехатомных молекул, то &=1,20 (нитроглицерин).
Приведем в качестве примера расчет скорости детонации газовой смеси состава 2Н2+О2. Отметим, что если в формулу (4.68) подставить значение удельной энергии в эрг/г, то значения скорости детонации получим в см/сек. Для того чтобы получать значения скорости детонации в м/сек, при подстановке q в обычных тепловых едйницах (кал/г или ккал/кг) необходимо ввести множитель 64,6:
D — 64,6 У 2 (А2—1)7 м/сек. (4.68а)
Уравнение реакции
2Н2 + О2 = 2Н2О + 115 ккал.
Отсюда на единицу веса
<7=3200 ккал/кг.
Примем А=1,17; тогда
D = 64,6 /2 (1,172 —1)3200 = 3150 м/сек.
Опытное определение скорости детонации дает значение 2830 м/сек.
Расхождение вычисленного и опытного значения скорости детонации легко объяснимо. Дело в том, что при детонации водородо-кислородной смеси развиваются весьма высокие температуры, при которых происходит диссоциация воды по уравнению
2Н2О 2Н24-О2
и даже диссоциация водорода
Н2 Н + Н.
Если учесть диссоциацию, то суммарное уравнение реакции будет иметь вид.
2Н2+О2=1,54Н2О+0,23О2+0,ЗЗН2+0,26Н+75,0 ккал.
240
Гл. IV. Самораспространяющееся превращение в ВВ
Это дает на единицу веса 9=2080 ккал/кг.
Следует учесть не только изменение удельной теплоты взрыва, но и изменение р. Теперь продукты взрыва лишь на 2/3 состоят из трехатомных молекул, поэтому примем А=1,21. Тогда
D = 64,6 /2(1,212—1)2080 = 2840 м/сек, что практически совпадает с опытным значением 2830 м/сек.
Выше, в § 3, было отмечено, что прибавление к гремучей смеси гелия или дополнительного количества водорода, являющихся в энергетическом отношении балластом, снижающим теплоту и температуру детонации, не уменьшает, а увеличивает скорость детонации, Это обстоятельство полностью объясняется теорией. Из уравнения (4, 62 или 4. 62а) видно, что скорость детонации при этом возрастает, так как введение гелия или избыточного водорода значительно снижает Т2, но одновременно увеличивает п (уменьшает ц). а также k.
В качестве примера рассчитаем скорость детонации по формуле (4.68а) для смеси 2Н2+О2+4Н2 без учета диссоциации. Удельная теплота взрыва смеси равна~2600 ккал/кг. В продуктах взрыва 2Д составит водород, к тому же температура будет ниже, что способствует увеличению k. В данном случае k нужно брать не ниже 1,26. Тогда получим
D = 64,6 /271,26^1)2600 = 3600 м/сек.
Расчетное (без учета диссоциации) значение скорости детонации (3600 м/сек) -оказалось значительно выше рассчитанной таким же образом скорости детонации гремучей смеси, не разбавленной водородом (3150 м/сек). Учет диссоциации должен несколько снизить скорость детонации, однако в смеси с избытком водорода это снижение будет небольшим: разбавление водородом снижает температуру и уменьшает поэтому диссоциацию. В итоге получаем скорость детонации около 3500 м/сек, т. е. значительно больше, чем в случае неразбавленной смеси.
Таким образом, в некоторых условия.'; изменение состава и свойств продуктов (увеличение значения k) может с избытком компенсировать уменьшение теплоты взрыва. По-видимому, именно поэтому у гексогена (/г =1,25) скорость детонации выше, чем у нитроглицерина, имеющего большую теплоту взрыва, но меньшее значение k, равное 1,20.
Необходимо еще раз отметить, что формула (4.68), согласно которой скорость детонации является функцией только удельной теплоты q и k, справедлива лишь для продуктов взрыва, подчиняющихся уравнению состояния идеального газа, В формулу не входит начальная плотность детонирующей системы. Между тем для ВВ при тех плотностях, которые используются иа практике, скорость детонации зависит от начальной плотности. Это говорит о том, что уравнение состояния идеальных газов, пригодное для газовых смесей малой плотности, неприменимо для конденсированных ВВ. Данный вопрос подробнее будет рассмотрен ниже.
Уже было отмечено, что в некоторых случаях скорость детонации практически не зависит от диаметра заряда, характера оболочки и пр. В других же случаях зависимость скорости детонации от таких факторов весьма существенна. Наличие такой зависимости
§ 11. Теория детонации газов
241
свидетельствует о том, что в данных условиях (диаметр заряда, оболочка и др.) за время реакции происходят существенные потери в боковых направлениях и неполное выделение тепла. Поэтому состояние продуктов взрыва будет описываться не адиабатой Гюгоньо, соответствующей полному выделению тепла, а промежуточной адиабатой. Переход на эту адиабату должен также совершаться по соответствующей касательной; в результате скорость детонации снизится.
Выведем теперь некоторые важные соотношения для параметров детонационной волны.
Прежде всего получим связь скорости детонации D и скорости потока продуктов взрыва в точке Жугэ. Согласно выражению (4.50)
= (Р2 “Ро)(^о- ^2) ~ Pi (г’о - ^г)
О k
Заменив в этом выражении v2 отношением ——— von учтя, что й-)-1
согласно (4.67) р2о0 = 2(/г—l)q, получим
2(й2—1) 7 = -------’-а.
’ (й + I)2 7
(4.68), непосредственно находим:
D
9 л Й 1
-да2—2----
2 k+1
Сравнивая это выражение с
(4.69)
(4-70)
w2
Согласно выражению (4. 44а)
p = p0Dw,
следовательно,
Т’а—ь , Ро^2-
(4.71)
Напомним (см. стр. 230), что на фронте сильной ударной волны
и
Таким образом, в исходном ВВ, сжатом ударной волной, давление и скорость движения вещества вдвое выше, чем давление и скорость движения в продуктах тотчас же после завершения реакции.
Представим себе систему, в которой химическое превращение происходит сразу во всех точках. Назовем условно такое превра
242
Гл. IV. Самораспространяющееся превращение в В В
щение мгновенным взрывом. Обозначим через р' давление, развивающееся при мгновенном взрыве. Для мгновенного взрыва, пренебрегая тепловой частью начальной внутренней энергии, получим или
p’v0=(k-i)q.
Как мы видели выше [см. (4. 67)],
^ = 2(^-1) 7; отсюда р2=2р' и р1 = 2р2=4р',
т. е. давление в детонационной волне (в точке Жугэ) оказывается вдвое выше давления при мгновенном взрыве, а давление на фронте ударной волны вчетверо выше давления мгновенного взрыва.
Плотность при мгновенном взрыве, очевидно, равна плотности исходного вещества р'=ро; в детонационной волне, как мы видели,
или
В соответствии с большим давлением в детонационной волне возрастает и энергия единицы объема по сравнению с энергией единицы объема при мгновенном взрыве. Увеличенные значения давления, плотности, энергии единицы объема продуктов детонации в точке Жугэ по1 сравнению со значениями этих же величин при мгновенном взрыве являются результатом движения вещества во фронте детонационной волны, результатом перераспределения, «перекачки» вещества и энергии из тыльных частей детонационной волны в головную часть. В тыльной части детонационной волны соответствующие параметры имеют меньшее значение, чем при мгновенном взрыве.
Остановимся еще на вопросе о зоне химической реакции при детонации. Идеальная кривая изменения давления со временем в детонационной волне приведена на фиг. 4.59. В соответствии с изложенным выше и, в частности, с условиями перехода от адиабаты для исходного ВВ к адиабате для продуктов (см. фиг. 4. 58) в момент прихода ударной волны давление в исходном веществе р0 скачком повышается до значения рр Вслед за этим в веществе начинается реакция. По мере прохождения реакции и выделения теп-
§11. Теория детонации газов
243
ла происходит расширение продуктов взрыва и снижение давления. Через промежуток времени х реакция завершается и давление снижается до значения р2 (давление в точке Жугэ). В дальнейшем
давление продолжает падать, но несколько медленнее, чем в зоне химической реакции. В соответствии с видом кривой p(t) область
реакции, характеризующуюся повышенным давлением, часто называют «химическим пиком». Отметим, что в точке 2 (см. фиг. 4. 58), как уже отмечалось, c2~D—W2', в зоне же химического пика c'^>D—w, поэтому выделение энергии, происходящее в этой зоне,
оказывает влияние на передний фронт. По существу условие c>D—w представляет собой условие поддержки фронта ударной волны теплотой реакции, что в конечном итоге препятствует затуханию и дает распространение с постоянной скоростью. Существование химического пика — это один из важнейших теоретических выводов гидродинамической теории детонации, сделанный и четко сформулированный Зельдовичем. Этот вывод дале-
Фиг. 4. 59. Зависимость дав-
ления от времени в детонационной волне.
ко не тривиален. В самом деле, без указаний теории трудно было бы представить. что наиболее высокое давление развивается в исходном веществе до начала
реакции. Для газовой
детонации наличие химического пика установлено экспериментально. Что касается конденсированных ВВ, то еще до недавнего времени существовали сомнения в том, соответствует ли действительный ход кривой p(t) (см. фиг. 4.59) теоретическому и, в частности, существует ли химический пик. Лишь в последнее время применение тонкой методики эксперимента позволило и в случае ВВ обнаружить в головной части детонационной волны область значительно повышенного давления. Кривая давление — время ня границе этой области имеет довольно резкий перелом. Таким образом доказано существование химического пика, подобного предсказываемому теорией. Это обстоятельство лишний раз подчеркивает значение гидродинамической теории детонации, важность и эффективность ее основных выводов.
Возможность экспериментального обнаружения химического пика имеет исключительно важное значение и позволяет оценить время реакции во фронте детонационной волны. Это время равно времени от момента сжатия исходного вещества ударной волной до момента перелома кривой давления в функции времени, соответствующего достижению точки Жугэ и переходу от реагирующего ВВ к продуктам полного превращения. Из всех возможных оценок времени реакции при детонации ВВ оценка по длительности химического пика является в настоящее время наиболее надежной. Некоторые данные по этому вопросу будут изложены в дальнейшем.
244 Гл. IV. Самораспространяющееся превращение в В В
§ 12. ТЕОРИЯ ДЕТОНАЦИИ КОНДЕНСИРОВАННЫХ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
1. Зависимость параметров детонации от плотности взрывчатого вещества. Уравнение состояния продуктов взрыва
В принципе гидродинамическая теория приложима и к детонации конденсированных ВВ. Однако расчет скорости и других параметров детонации в этом случае затруднен отсутствием надежного уравнения состояния для тех чрезвычайно плотных газов, какие образуются при детонации. Вторая существенная трудность заключается в том, что неясен механизм возбуждения химической реакции во фронте детонационной волны, так как разогрев вследствие сжатия в случае жидких и твердых веществ относительно мал даже при очень больших давлениях.
При рассмотрении теории детонации газов мы видели, что скорость детонации однозначно определяется теплотой взрыва и составом его продуктов:
О=/2(й2-1)<7.
Это соотношение справедливо лишь при условии, что плотность газообразных продуктов невелика и они подчиняются законам идеальных газов. Для взрывчатых газообразных систем при малых начальных давлениях это условие выполняется и скорость их детонации зависит от плотности лишь постольку, поскольку плотность оказывает влияние на состав продуктов и теплоту взрыва.
Для конденсированных ВВ даже при малых начальных плотностях газообразные продукты слишком плотны, чтобы их состояние можно было описывать уравнением, справедливым для идеальных газов. Были попытки использовать в качестве уравнения состояния продуктов детонации упрощенное уравнение Ван-дер-Ваальса
p(v-a.)=RT, (4.72)
которое с успехом применяют во внутренней баллистике для расчета давления при горении пороха в замкнутом объеме. Однако в последнем случае максимальное давление не превосходит 4000— .6000 ат. В случае детонации уравнение (4. 72) может быть использовано лишь при очень малых плотностях ВВ, которые намного ниже встречающихся на практике. Плотности органических ВВ в условиях применения находятся между 1 и 2 г1см\ при этом достигаются давления, измеряемые сотнями тысяч атмосфер. Плотность •газов при детонации получается больше плотности самого ВВ и может превышать плотность жидких газов более чем в 2 раза. Для этих условий, когда объем, приходящийся на одну молекулу, срав-«им с ее собственным объемом, уравнение (4.72), исходящее из постоянства объема, занимаемого молекулами, заведомо неприменимо.
§ 12. Теория детонации конденсированных ВВ
245
Таким образом, во фронте детонационной волны реализуется совершенно своеобразное, не достижимое иными способами, состояние, Поэтому, чтобы установить уравнение состояния для этих условий, пришлось идти обратным путем — исходить из экспериментальной зависимости параметров детонационной волны и на этом основании выводить справедливое для нее уравнение состояния, Ландау и Станюкович, следуя по этому пути, впервые уподобили состояние продуктов во фронте детонации состоянию кристаллической решетки твердого тела. Как известно, энергия твердого тела имеет двоякое происхождение: она складывается из упругой энергии, обусловливаемой силами взаимодействия между молекулами, и из тепловой энергии колебаний частиц около их положения равновесия.
Ландау и Станюкович показали, что в условиях детонации можно, не совершая существенной ошибки, считать упругую энергию и упругую часть давления преобладающими.
Допустив таким образом, что в продуктах взрыва при плотности больше единицы давление зависит только от плотности ВВ, но не от температуры, можно по экспериментальной зависимости D — =f(po) установить уравнение состояния р—Цр).
Из выражения (4.49), пренебрегая ро, которое мало по сравнению с р2, получим *
p2 = D2-^^-. (4.73)
го
Выражая удельные объемы через соответствующие плотности, находим
р2 e D2 ?o(p?.-go) . (4. 73aj
Рз
В уравнении (4. 73а) скорость детонации D есть известная из опыта функция начальной плотности ВВ. В пределах плотностей 1 —1,7 г/см2 сугубо приближенно можно считать, что D прямо пропорциональна ** Ро:
D—Ap0. (4.74)
Константа А в грубом приближении составляет для типичных индивидуальных ВВ 4,5-Ю5 см^/г сек, что дает скорость детонации 4500 м/сек при ро= 1 г/см2 и 7200 м/сек при Ро= 1,6 г/см3.
В выражение (4.73а) для рг входит также рг — неизвестная плотность продуктов взрыва во фронте детонации. Допустим, что эта величина пропорциональна начальной плотности ВВ, т. е. Р2 = /гр0.
* Индексом «0» обозначены значения соответствующих величин для исходного вещества, а индексом «2» — те же значения во фронте детонационной волны, точнее, в точке касания (точке Жугэ).
** В действительности скорость детонации несколько слабее зависит от начальной плотности: тем не менее обычно пользуются соотношением прямой пропорциональности, которое приводит к более удобным для практических расчетов уравнениям газодинамики.
246
Гл. IV. Самораспространяющееся превращение в В В
Подставляя в (4.73а) вместо D и р? их выражения через ро, получим
р Д2р2МАрог1Ро1 = Л2А2=1рз (4.75)
и Лрд h
Обозначив А2————^^=с> можно написать h
А=срЗ. (4.75а)
Далее из выражения (4.75) имеем
А2 ЛЗрЗ = А2 рз, (4.76)
или
А=^рЗ, (4.76а)
где
В == А2 .
Таким образом, из того экспериментально установленного факта, что скорость детонации приближенно пропорциональна начальной плотности ВВ, следует, что давление во фронте детонации пропорционально кубу плотности ВВ (а также кубу плотности продуктов взрыва).
Константу h можно определить из выражения для D, находя его минимум, так как точке касания соответствует минимальная из возможных скоростей детонации.
Из (4.73а) и (4. 76а) найдем
£)2=-..- 2---. (4.77)
РО (Р2 — Ро)
Чтобы найти то значение р2, при котором D имеет минимум (при данных значениях В и ро), продифференцируем D2 по рз и приравняем производную нулю:
dD* _Ро(Р2—Ро)4р2—р1?о _ ---_ &-----—--------- — U.
Ро(р2—ро)2
Так как знаменатель не может быть равен бесконечности, то Ро(Р2~ Ро) 4рЗ — г4р0 = О или
3?2 = 4р0, откуда
р2=4-ро- <4-78>
О
т. е.
$ 12. Теория детонации конденсированных ВВ
247
Для давления из (4.73а) получим
Р?— ^КРо^2,
(4.79)
а для скорости движения газов позади фронта на основании (4.47а) после замены v на 1/р находим
(4. 80)
Таким образом, при детонации мощного ВВ, как например, тетрила (£>=7200 м/сек, плотность 1,6 г/см3), давление во фронте детонационной волны достигает 200 000 кг /см2, плотность продуктов взрыва равна 2,13 г/см3 и скорость движения газов 1800 м/сек. Уравнение состояния продуктов взрыва таких ВВ согласно (4. 76а) имеет вид
р2 = 20000рЗ, (4.81)
или
р..^=20000,
(4.81а)
где р2 выражено в кг/см2, р2 —в г/см3 и u2 —в см3/г.
Более точный расчет, учитывающий тепловую компоненту дав-
ления взрыва, не приводит к существенному изменению уравнения
состояния, которым и надлежит пользоваться при расчетах, не забывая о его приближенном характере, а также о том, что в действительности часть (около 1/я) давления — теплового происхождения и что уравнение приложимо лишь при плотности ро, большей 1—1,3 г/см3.
Недавно опубликован экспериментальный метод измерения давления в детонационной волне, базирующийся на основном соотношении (4.44) для ударных и детонационных волн: p—p0Dw. Несмотря на косвенный характер определения, метод надежен. Со-
гласно приведенным в литературе данным этот метод применяется
к ВВ большой плотности, с большой скоростью детонации. При взрыве таких ВВ давления особенно велики и возможность их измерения наиболее ценна.
Фиг. 4.60. Схема экспериментального определения давления детонации, /—заряд ВВ, 2— металлическая пластинка.
Приведем краткое описание сущности метода. На фиг. 4. 60 показан заряд ВВ, по которо-
му распространяется детонация.
К правому торцу заряда плотно прижата тонкая металлическая пластинка. В результате воздействия детонационной волны в пластинке начнет распространяться ударная волна. Когда ударная волна в металле достигнет правой (свободной) поверхности пла-
248
Гл, IV. Самораспространяющееся превращение в В В
стинки, эта поверхность начнет двигаться с начальной скоростью он, которую точно измеряют. Для металлов хорошо выполняется
— . Таким образом,
соотношение
измерив начальную ско-
рость он движения поверхности, мы определим — скорость потока вещества за фронтом ударной волны в металле пластинки. Определение v„ нужно производить на малой базе (время измерения должно быть меньше удвоенного времени прохождения ударной волны по пластинке). Далее определяют величину £>м —' скорость ударной волны в металле. Значение DM может быть вычислено, если известна связь DM и wM (уравнение динамической адиабаты металла), или измерено непосредственно. Определив wM, DM и зная начальную плотность металла рОм, можно вычислить давление ударной волны в металле:
Рм РОм •
В общем случае рм не равно рл — давлению детонации в точке Жугэ (т. е. в точке завершения химического превращения) в свободно распространяющейся детонационной волне, без отражения от пластинки. Отношение давлений рд/рм зависит от соотношения величин роО (здесь Ро — плотность ВВ, D — скорость детонации) и ром£>м (произведение ?D называют акустической жесткостью).
Если Р0мОм>РоО, то рм>А-
Если РомОм<р0О, то рм<рл.
Простая связь между рд и рм дается приближенной формулой
р = />м А I Ро° \
2 X Ром^м /
Судя по литературным данным, в качестве материала для пластинок обычно используют алюминий, для которого приведенная выше формула дает достаточно хорошие результаты; толщину пластинок для мощных ВВ обычно берут порядка 1—2 мм.
В литературе приведены результаты измерения давлений детонации (в точке Жугэ) некоторых ВВ.
Приведем соответствующие данные и сравним их с теоретическими значениями, вычисленными по формуле (4.79). Для гексогена (ро=1,785 г/см3) измеренное давление 338-103 ат; вычисленное 346- Ю3 ат. Для тротила (р0 = 1,64 г/см3) измеренное давление 189- 103 ат; вычисленное 200- 103 'ат.
Если учесть приближенный характер расчетной формулы, то согласие следует признать вполне удовлетворительным. Полученные экспериментальные значения могут быть использованы для уточнения теоретического расчета.
Используя весьма тонкие пластинки (несколько десятых миллиметра), можно фиксировать повышенное давление в зоне химиче
$ 12. Теория детонации конденсированных ВВ
249
ского превращения. Проведя серию опытов с пластинками разной толщины, можно получить полное представление о ширине зоны химического пика и изменении давления в ней.
Таким образом, изложенный метод дает экспериментальное доказательство наличия химического пика, а также возможность наиболее надежной оценки времени реакции во фронте детонационной волны (по перелому кривой давление в функции времени) для мощного, полноценно-детонирующего ВВ с весьма большой скоростью химического превращения.
Из изложенной выше принципиальной сущности метода следует, что к измерительной аппаратуре должны быть предъявлены очень высокие требования: необходимо измерять с большой точностью начальные скорости движения поверхности пластинки на весьма малых отрезках (базах) вплоть до десятых долей миллиметра (а также в некоторых случаях и скорости распространения ударных волн — также на малых базах). Существующие возможности и, в частности, использование катодных осциллографов с большим разрешением во времени полностью удовлетворяют этим требованиям,
2. Механизм возбуждения и развития реакции при детонации
При обычных в практике условиях взрыва скорость химического-превращения достаточно велика для того, чтобы все ВВ успело прореагировать в детонационной волне (в промежутке от передней границы фронта до точки Жугэ). В этих условиях теплота реакции выделяется достаточно быстро, чтобы поддерживать распространение ударной волны, определяющей скорость детонации. Скорость детонации в таком случае не ограничивается скоростью химического превращения и последнюю можно не учитывать, что-мы и делали до сих пор. Однако это далеко не всегда так. Мы видели, что в ряде условий, например при диаметрах меньше предельного, возможность и скорость детонации существенно зависят от факторов, влияющих на протекание химического превращения: от диаметра заряда, его оболочки, размеров частиц, наличия инертных примесей и т. д.
Чтобы понять влияние этих и аналогичных факторов, следует рассмотреть химико-кинетическую сторону явления детонации. Необходимо выяснить, каким образом вызывается реакция во фронте ударной волны, как она развивается и доходит или не доходит до конца.
Возбуждение реакции
Прохождение ударной волны по ВВ сопровождается резким повышением давления в нем. Можно было бы предположить, что это сжатие непосредственно является причиной быстро протекающей реакции, но против такого допущения говорят результаты исследований влияния очень больших давлений (несколько десятков тысяч атмосфер) на термический распад ВВ, которые не обнаружили значительного изменения скорости реакции. Опытами Брид
250
Гл. IV. Самораспространяющееся превращение в ВВ
жмэна установлено, что сжатие ВВ даже до 100 000 ат не приводит к взрыву.
В связи с отсутствием экспериментальных данных, говорящих в пользу непосредственного возбуждения химической реакции сжатием ВВ во фронте ударной волны *, в настоящее время принимается, что возбуждение реакции является тепловым, т. е. что достигаемая при сжатии ВВ температура достаточно высока, чтобы вызвать быструю химическую реакцию.
Конкретный механизм разогрева, вызывающего химическую реакцию, может быть различным.
В жидких ВВ, не содержащих газовых пузырьков, или в гомогенных твердых ВВ, детонирующих с большими скоростями, сжатие ударной волной во фронте детонации, по-видимому, может вызвать достаточный для возбуждения быстрой реакции разогрев. Такой механизм возбуждения следует считать возможным при -скоростях детонации порядка 6000—8000 м/сек. Для нитроглицерина, например, по расчетам, приближенным вследствие неточного знания уравнения состояния взрывчатого вещества при высоких давлениях, температура во фронте ударной волны не меньше 1000° С. При низких (~2000 м/сек) и средних скоростях детонации повышение температуры за счет сжатия конденсированного вещества незначительно (порядка десятков градусов) и не может само по себе обеспечить нужную для стационарной детонации скорость химического превращения.
Недавно Кук выдвинул новую гипотезу о механизме возбуждения химической реакции при детонации. Исходя из того экспериментально установленного факта, что прохождение ударной волны по веществу вызывает его сильную ионизацию, Кук заключает, что соответственно должна возрастать и теплопроводность, причем в такой степени, что скорость распространения тепла от зоны химической реакции может значительно превосходить скорость ударной волны. Таким образом, основная роль ударной волны сводится к тому, что, ионизируя вещество, она прокладывает путь для распространения тепловой волны, которая, разогревая ВВ, вызывает его быстрое химическое превращение.
Основным аргументом в пользу этой точки зрения являются опыты по передаче детонации через пластинку инертного материала. Скоростная фотография показывает, что вхождение ударной волны в пассивный заряд не приводит сразу К возбуждению его детонации и последняя возникает лишь на некотором значительном расстоянии и обычно распространяется от точки возникновения не только вперед, но и назад.
Задержку возникновения детонации Кук объясняет тем, что через инертную пластинку проходит в основном только ударная, но не тепловая волна. Сама же по себе ударная волна быстрой химической реакции вызвать не может и послед-
* Следует, однако, отметить, что давления, экспериментально изученные в отношении влияния их на скорость химических реакций, все же намного ниже тех, которые имеют место при детонации. Помимо этого, в свете рассмотренных выше соображений о преимущественно упругом происхождении давления во фронте детонационной волны остается неясным, достаточна ли сама по себе достигаемая при сжатии температура, чтобы вызвать крайне быструю реакцию. При оценке температуры следует, правда, учитывать, что доля упругой энергии значительно меньше, чем доля упругого давления.
$ 12. Теория детонации конденсированных ВВ
251
няя возникает в этом случае после некоторого периода развития в момент, когда ударная волна уже успела пройти вперед, Когда тепловая волна (в нитрометане скорость ее по Куку достигает 35 000 м/сек) догоняет ударную волну, возникает
детонация, сопровождающаяся, как обычно, интенсивным свечением, регистрируемым па фотографии.
На фиг. 4.61 показаны последовательные снимки (в отраженном свете) передачи детонации через преграду из органического стекла общей толщиной 6,3 см. Кадры 1—5 показывают распространение ударной волны в стекле, на кадре 7 волна доходит до поверхности пассивного заряда. Кадры 9—15 показывают распространение ударной волны в пассивном заряде, не сопровождающееся реакцией. Эта волна видна по изменению окраски, обусловленному возникающей шероховатостью поверхности заряда, отчетливо заметной па оригинальной цветной фотографии. Между кадрами 15 и 17 начинается детонация, распространяющаяся, как видно на кадрах 17 и 19, в обоих направлениях.
Следует указать, что эти наблюдения, составляющие экспериментальную основу гипотезы Кука, могут получить и иное толкование.
Наряду с гомогенным механизмом разогрева возможен и иной, когда реакция начинается в отдельных точках ВВ, где возникли местные разо-гревы, подобно тому, как это происходит при возбуждении взрыва механическим ударом (см. гл. V).
Местные разогревы могут образоваться раз
Фиг. 4.61. Возникновение и развитие детонации при передаче ее через инертную преграду.
ными путями.
Если ВВ механически неоднородно, то при прохождении ударной волны частицы или слои его приходят в движение с разной скоростью и между ними возникает трение. Кроме того, при механической неоднородности ВВ неравномерен и разогрев, вызываемый ударной волной. Неравномерность же разогрева благоприятствует
252
Гл. IV. Самораспространяющееся превращение в В В
возникновению очагов реакции в участках, где температура оказалась выше.
Механическая неоднородность ВВ может возникать от различных причин, например, вследствие наличия в ВВ маленьких включений (пузырьков) газов или паров. Влиянию пузырьков может способствовать чрезвычайно высокая температура, достигаемая при их сжатии. Значительное повышение детонационной способности наблюдается и при введении в желатины на основе нитроглицерина и нитроклетчатки небольших количеств тонко измельченных инертных тяжелых примесей. Наконец, местный поверхностный разогрев может возникать также вследствие проникновения струй горячих газообразных продуктов взрыва в поры между частицами ВВ. Мож. но представить себе также комбинированный механизм, включающий возникновение горения в пузырьках и распространение его по порам, имеющимся или образующимся в результате повышения давления в очаге реакции. Сжатие пузырьков газов как причина возникновения местного разогрева очень вероятна в случае желатин, содержащих пузырьки воздуха. Проникновение струй газов в поры может иметь место в случае порошкообразных ВВ.
В связи с вопросом о механизме возникновения местных разо-гревов при детонации следует напомнить о сильной зависимости детонационной способности твердых веществ от физико-механической структуры заряда. Чем больше гомогенность ВВ, тем труднее оно детонирует. Крупнокристаллические и особенно литые заряды детонируют гораздо труднее, чем мелкокристаллические. По-видимому, несмотря на чрезвычайно большие давления, которым подвергается вещество при прохождении детонационной волны, дробление частиц не успевает произойти достаточно быстро и химическая реакция возникает и развивается в первую очередь на той поверхности, которая предсуществует в заряде.
Физико-механическая структура заряда определяет не только возможность распространения, но также и легкость возникновения детонации. Одним из вероятных факторов, определяющих это влияние, являются размеры пузырьков газа, разогрев которых приводит к образованию очагов реакции.
Вообще говоря, можно представить себе некоторые оптимальные размеры пузырьков. При больших пузырьках достигается более высокая температура, но удельная поверхность, на которой возникает и происходит горение, мала. Если пузырьки малы, то разогрев их меньше из-за большего теплоотвода в конденсированную фазу. Если он, однако, еще достаточен для воспламенения ВВ, то возникшее горение в целом из-за большей удельной поверхности развивается интенсивнее. Для разных ВВ с их различной воспламеняемостью и зависимостью скорости горения от давления оптимальный размер пузырьков может быть различен.
Точно так же играет роль и то, какой газ заключен в пузырьках. Так, замена воздуха в порошкообразном тротиле газом с
$ 12. Теория детонации конденсированных ВВ
253
меньшей теплоемкостью (аргоном) привела к увеличению скорости детонации от 1380 до 1580 м!сек; увеличение скорости детонации наблюдалось и в случае смеси аммиачной селитры с алюминием. Эти факты подтверждают допущение о том, что при распространении детонации играет роль#не только неоднородность, создаваемая газовыми включениями, но и разогрев их ударной волной. Разогрев, естественно, тем больше, чем больше величина k ^равная соответствующего газа. Сжатие пузырьков газа имеет место и при детонации с большой скоростью; достигаемая в них температура при сжатии может превышать 10 000° С, но в этом случае сжатием может быть сильно разогрета даже конденсированная фаза и воспламенение ВВ может происходить как в массе, так и на поверхности раздела газ — твердое ВВ (или жидкость). При низких же {~2000 м,!сек) и средних скоростях детонации повышение температуры в конденсированной фазе незначительно, в то время как повышение температуры в газовых пузырьках все еще очень велико и при обычных условиях может вызвать крайне быстрое воспламенение на поверхности раздела конденсированной и газовой фаз.
Повышение начального давления в пузырьках должно уменьшать температуру местных разогревов и затруднять таким образом возникновение и распространение детонации,
ли, что повышение давления над порошкообразным ВВ понижает низкую скорость детонации и может привести даже к ее прекращению.
Чрезвычайно высокие температуры, достигаемые при сжатии газов ударной волной, убедительно подтверждаются результатами опытов Мюраура, который установил, что интенсивность свечения (так называемое пламя взрыва) при взрыве заряда ВВ в окружении некоторых газов может быть очень велика. Наряду с этим она сильно зависит от того, какой газ окружает ВВ. Одноатомные газы, у которых k велико, дают гораздо более интенсивное свечение, чем газы, молекулы которых состоят из многих атомов.
Новейшими исследованиями было установлено, что при детонации порошкообразных ВВ не только внешние световые эффекты обусловливаются быстрым сжатием атмосферы, окружающей ВВ, но что большая часть света от самого ВВ также излучается сжатыми газовыми включениями.
Оказалось, что свечение при взрыве порошкообразного ВВ зависит от природы газа, заполняющего промежутки между частицами. На фиг. 4.62 приведена
Фиг. 4. 62. Детонация заряда зерненого тэна, составленного из трех частей.
В части а промежутки между частицами заполнены бутаном, в части б—воздухом, в части в—аргоном. Снимок сделан через узкую щель.
Г—детонатор, 2—тэн, 3—водяная рубашка, 4—перепонки.
Действительно, опыты показа-
254
Гл. IV. Самораспространяющееся превращение в В В
Фиг. 4. 63. Фотография слоистого заряда, показывающая интенсивное свечение в зонах расположения соли.
фотография детонации заряда тэна, в котором воздух был заменен бутаном в одной части заряда и аргоном в части заряда с другого конца; в средней части заряда оставался воздух. Интенсивность свечения наибольшая на участке с аргоном и наименьшая при бутане. Так и должно быть, поскольку адиабатическое сжатие аргона дает гораздо более высокую температуру, чем сжатие до того же давления бутана, имеющего большую теплоемкость; воздух занимает промежуточное положение.
Было показано также, что интенсивное излучение получается от гранулированной поваренной соли, если поместить ее в виде прослойки в очень плотном пластичном В В и этот слоистый заряд подорвать в воде (фиг. 4.63). ВВ, почти не содержавшее воздуха, испускает очень мало света и оставляет лишь слабый след на фотопленке-(свечение воздуха, примыкающего к ВВ извне, было устранено окружением заряда водой). Это доказывает, что газовые вклю-
чения, даже если они находятся не во взрывчатом, а в инертном порошке, сильно разогреваются при прохождении ударной волны.
Развитие реакции
Каким бы из рассмотренных механизмов ни была вызвана химическая реакция во фронте детонации, ее дальнейшее развитие, по-видимому, всегда происходит неравномерно, что очень существенно для понимания влияния различных факторов на течение процесса.
Вполне естественно микрогетерогенное протекание реакции, возникшей путем местных разогревов. Начавшись на поверхности частицы, реакция распространяется в глубь ее в форме своеобразного быстрого горения со скоростью, определяемой давлением и температурой газов. Этот процесс во фронте детонационной волны напоминает горение заряда мелкозернистого пороха в огнестрельном оружии с той лишь разницей, что давление при детонации на несколько порядков больше. Рассчитать время горения частицы ВВ затруднительно, во-первых, из-за своеобразного характера горения. При малой толщине частиц относительно велико время нестационарного режима при воспламенении и в конце горения частицы. Во-вторых, зависимость скорости горения от давления определена лишь в узком интервале последнего — при относительно низких давлениях. Если все же эти данные экстраполировать на давление порядка 100 000 ат, то время сгорания частицы размерами в несколько десятых миллиметра должно быть достаточно малым (порядка 1 мксек) для того, чтобы частица успела сгореть в детонационной волне.
Как другую возможность, помимо горения частиц ВВ с поверхности, можно было бы рассматривать относительно более медлен
§ 12. Теория детонации конденсированных ВВ
255
ную реакцию в м а с с е частицы. Однако чтобы роль такой реакции была существенной, температура частицы должна быть повышена до уровня, при котором реакция проходила бы с очень большой скоростью. Достаточное повышение температуры частицы в принципе могло бы быть вызвано сжатием в ударной волне; если интенсивность последней для этого недостаточна, то единственный иной возможный путь повышения температуры частицы заключается в ее разогреве путем теплопроводности. Расчет показывает, однако, что повышение температуры внутри частицы диаметром всего в 0,1 мм, находящейся в горячих газах, становится значительным не ранее чем через Ю-4 сек. В действительности же времена-реакции гораздо меньше. Таким образом, с экспериментальными данными по возникновению и развитию реакции при детонации ВВ с умеренными и малыми скоростями согласуется только механизм возникновения реакции на поверхности и распространения ее в глубь частиц путем быстрого горения.
Следует добавить, что при детонации порошкообразного ВВ частицы не обязательно должны сгорать полностью. Иллюстрацией может служить следующий опыт.
Заряд диаметром 50 мм из маленьких прямоугольных пластинок бездымного-пороха (1X1X0,323 .ч.и) был взорван при плотности 0,77 г/см3, причем скорость-детонации составляла 2300 м/сек, что значительно меньше скорости, рассчитанной по гидродинамической теории. При взрыве наблюдались остатки неполностью сгоревших зерен. Некоторые из них были измерены, и средняя толщина их оказалась равной 0,271 мм вместо 0,323 мм. Взвешивание показало, что при детонации прореагировало только около 30% ВВ.
Представления о возникновении реакции при детонации в результате разогрева газовых включений и последующем ее протекании как горения иа их поверхности трудно приложить к детонации с высокой скоростью, наблюдающейся в зарядах гремучего студня малого диаметра, инициируемых мощными детонаторами. Так же трудно их применить для объяснения очень быстрой реакции в жидких и некоторых твердых ВВ, где возможная поверхность газовых включений, а следовательно, и горения, не может быть много больше поверхности фронта ударной волны.
В этих случаях следует допустить, что реакция возбуждается в массе ВВ в результате его разогрева, вызванного сжатием ударной волной. Как эта реакция развивается дальше, не вполне ясно. Можно представить себе гомогенное ее развитие. Вероятнее, однако, что и в рассматриваемом случае развитие реакции имеет локальный характер. После разогрева, даже если он был равномерным по всей массе ВВ, не все молекулы реагируют одновременно, а сначала лишь те, энергия которых превышает энергию активации. В результате экзотермичности реакции в месте ее возникновения температура повышается еще больше, образуется очаг реакции в виде пузырька чрезвычайно разогретых газов, от которого горение распространяется во все стороны. Можно представить себе начальную стадию образования очага реакции и как цепной процесс,
256 Гл. IV. Самораспространяющееся превращение в ВВ
возможный при тех очень высоких температурах ВВ, которые достигаются сжатием его ударной волной.
Таким образом, по-видимому, и в этом случае реакция, вызванная ударной волной, протекает в ВВ неравномерно, и главное отличие заключается в механизме возникновения очага реакции: здесь — в результате гомогенного разогрева конденсированной фазы, а в рассмотренном выше случае — в результате разогрева газового пузырька. Как видно, гетерогенность протекания реакции возможна и при «гомогенном» ее возбуж
Фиг. 4.64. Снимок на фо-
торегистре перехода детонации с малой скоростью в детонацию с большой скоростью (6000 м1сек.) для нитроглицеринового ВВ.
дении.
Когда ВВ способно детонировать с двумя различными скоростями, естественно допустить, что малая скорость детонации обусловлена возбуждением реакции в газовых пузырьках, а большая — гомогенным инициированием. Детонация, вызванная с малой скоростью, может самопроизвольно перейти в детонацию с большой скоростью. Этот переход может происходить как в форме относительно медленного ускорения, так и внезапного изменения скорости (фиг. 4. 64).
При возбуждении медленной детонации давление во фронте ударной волны невелико и реакция нередко не доходит до конца; она начинается в сжатых пузырьках и распространяется путем поверхностного горения частиц с последую-
щими вторичными реакциями продуктов распада в газовой фазе. При повышении давления и скорости детонации частицы ВВ подвергаются сжатию с соответ-
ствующим повышением их температуры.
Это повышение температуры приводит к дополнительному увеличе
нию скорости горения. При определенном давлении сжатие частиц
становится столь большим, что начинает играть роль и реакция в объеме. Возможно, что в некоторых режимах реакция возникает параллельно на поверхности частиц и внутри их. При дальнейшем
увеличении давления внутричастичное возникновение реакции получает преобладающую роль. В этом случае наличие газовых пузырьков не может существенно влиять на стационарное распростра-
нение процесса, хотя может, несмотря на это, оказывать значительное влияние на его возникновение (чувствительность ВВ).
Рассмотренные представления приложимы не только к химически однородным ВВ, но и к смесям, состоящим из компонентов разной реакционной способности, например из детонирующих ВВ, окислителей и невзрывчатых горючих. В этом случае поверхностное
$ 12. Теория детонации конденсированных. В В
257
горение частиц различных компонентов данного слоя ВВ происходит с разной скоростью и потому неодновременно. Путем диффузии и микроперемешивания газы, получившиеся при распаде отдельных компонентов, смешиваются и реагируют.
Весьма убедительной иллюстрацией возможности двух различных механизмов детонации для одного и того же ВВ дают описанные ранее опыты Боболева, который для амматола 50/50 при небольшом диаметре заряда наблюдал устойчивую детонацию при малых и больших плотностях, в то время как при промежуточных значениях плотности детонация не распространялась. По-видимому, при малых плотностях имело место «пузырьковое» (или струйчатое) возникновение детонации, при больших же плотностях детонация возникала гомогенно в сжатом ВВ. Подтверждением этого объяснения является и тот факт, что в области малых плотностей выполнялись зависимости (влияние плотности на критический диаметр), типичные для детонации смесей, при больших же плотностях — зависимости, свойственные индивидуальным мощным ВВ. В области промежуточных плотностей пузырьковый (или струйчатый) механизм уже не в состоянии обеспечить быструю реакцию, а гомогенный еще не может этого сделать; в итоге детонация оказывается невозможной. Не противоречит этому объяснению и возможность детонации при промежуточных плотностях в условиях больших диаметров заряда, когда для устойчивого распространения детонации оказываются достаточными даже те пониженные скорости химического превращения, которые обеспечиваются при этих плотностях отдельными механизмами или их совокупным действием.
Механизм влияния различных факторов на возникновение и распространение детонации.
Принцип Харитона
Как мы видели, постоянная скорость детонации наблюдается лишь в том случае, если диаметр цилиндрического заряда ВВ превосходит некоторый, характерный для данного вещества, предел. При уменьшении диаметра заряда, начиная от предельного, скорость детонации уменьшается'и при некотором минимальном критическом диаметре детонация не распространяется. Харитон, установивший существование критического диаметра, сделал из этого факта фундаментальные выводы принципиального значения. Существование критического диаметра согласно Харитону связано с тем, что скорость химического превращения при детонации не бесконечна, а имеет определенные конечные значения.
При детонации по взрывчатому веществу идет ударная волна. Сжатие приводит по тому или иному механизму к возбуждению в ВВ химической реакции. Одновременно высокое давление в ежа-
258
Гл. IV. Самораспространяющееся превращение в В В
том веществе вызывает радиальное расширение его, ведущее к падению давления, к разбросу реагирующего вещества.
Как правило, разбросу подвергаются не только газообразные продукты неполной реакции, но и не успевшие сгореть частицы конденсированного ВВ. Давление способствует протеканию химического превращения, расширение препятствует ему.
Максимальное возможное давление определяется потенциальной энергией ВВ, его составом и плотностью и является определенной для каждого вещества величиной. Протекание разброса зависит от характеристик заряда, в первую очередь от его радиуса, так как падение давления в результате расширения начинается с периферии и распространяется от нее к оси заряда. Это падение давления, иначе говоря, волна разрежения, распространяется с определенной скоростью, равной скорости звука в среде, в которой происходит распространение. Время 9, за которое волна разрежения d/2
достигает оси заряда, равно отношению — — радиуса заряда с
к скорости волны разрежения, равной скорости звука. Если это время больше, чем время, необходимое для завершения химического превращения, то разброс не может отразиться на протекании детонации в осевой части заряда; в этом случае детонация распространяется с максимальной, свойственной данному ВВ, скоростью. Если волна разрежения успевает дойти до оси заряда раньше, чем закончится реакция, то она в большей или меньшей мере уменьшает полноту превращения и снижает максимальное давление, достигаемое при детонации. Когда это снижение невелико и давление в реагирующем слое достаточно, чтобы сжать следующий слой В В и вызвать в нем быструю реакцию, то детонация распространяется устойчиво, но со скоростью, меньшей, чем максимальная.
Если снижение давления, вызванное волной разрежения, велико, то замедление химического превращения может стать столь большим, что распространение его прекратится. Диаметр заряда, при переходе через который это происходит, и представляет собой критический диаметр детонации данного ВВ.
Время, необходимое для завершения реакции, связано со свойствами ВВ и его состоянием. Это время может изменяться в очень широких пределах и именно оно в основном определяет детонационную способность вещества. Так, например, время реакции азида свинца при прочих равных условиях в десятки раз меньше, чем гексогена. В свою очередь время реакции гексогена примерно в 300 раз меньше, чем аммиачной селитры.
Время реакции, естественно, зависит не только от химической природы ВВ, но и от его физической структуры, в частности, от размеров частиц, которые его составляют или образовались под действием ударной волны. Чем мельче эти частицы, тем быстрее проходит их сгорание во фронте детонационной волны.
$ 12, Теория детонации конденсированных. ВВ
259
Время разброса определяется как давлением, развивающимся во фронте детонационной волны, так и диаметром заряда, а также массой и прочностью оболочки. Время разброса весьма мало отличается в различных веществах соответственно сравнительно небольшим различиям в скорости детонации. Можно считать, что для разных ВВ (при данном диаметре заряда) оно отличается всего лишь в 2—3 раза.
Чем меньше диаметр заряда, масса и прочность оболочки, тем меньше и время разброса. Из этих соображений следует, что возможность детонации определяется не каким-либо абсолютным значением скорости превращения или времени его протекания. Она зависит от соотношения между этим временем и временем, предоставляемым для протекания реакции, которое ограничивается разбросом вещества.
Отсюда следует, в частности, что детонировать должно всякое вещество или смесь, в которой механическое и тепловое действия продуктов химического превращения ускоряют его, каковы бы ни были механизм и длительность самого превращения. Иначе говоря, всякая система, способная к экзотермическому превращению, в принципе является взрывоспособной. При этом чем больше .продолжительность превращения, тем больше должен быть диаметр заряда, при котором может иметь место стационарная детонация. Многие вещества и смеси, которые в обычных условиях не считаются взрывчатыми, могут стать взрывчатыми, если размеры заряда достаточно велики и применено достаточно сильное инициирование.
То, что химическое превращение при детонации ВВ, в том числе и индивидуальных химических соединений, проходит в течение заметного времени путем постепенной газификации, видно прежде всего из опытов, в которых заряд ВВ детонировал в окружении тонкоизмельченного инертного материала. При таких опытах удавалось получать не только значительные количества газообразных продуктов неполного превращения, но и много неразложившегося конденсированного ВВ, что можно объяснить быстрым охлаждением и снижением давления газов взрыва при их контакте с инертным материалом. Чем тоньше измельчены компоненты смеси (если взрывают многокомпонентную смесь), тем полнее цри прочих равных условиях протекает превращение.
Уменьшение критического диаметра заряда индивидуальных мощных ВВ при увеличении плотности следует объяснить тем, что возрастание давления, к которому приводит повышение плотности, ускоряет протекание реакций в детонационной волне в большей степени, чем оно ускоряет разброс.
В случае смесей, как мы видели, повышение плотности приводит к увеличению критического диаметра. Это следует объяснить замедлением развития химических реакций между продуктами газификации компонентов при больших плотностях. Такое влияние
260 Гл. IV. Самораспространяющееся превращение в ВВ
обусловливается затруднением проникновения газов в суженные поры, а также замедлением смешения продуктов реакции при повышенных давлениях, получающихся при больших плотностях. Возможно также, что в случае смесей (или слабых индивидуальных ВВ) оптимальный размер пузырьков больше, чем в случае мощных индивидуальных ВВ, а с возрастанием плотности размер пузырьков газа уменьшается.
Массивная оболочка благоприятствует детонации; это проявляется, в частности, в снижении критического диаметра и объясняется тем, что оболочка затрудняет и замедляет разброс; при этом время превращения не изменяется или даже уменьшается. В очень прочных, не разрывающихся при детонации оболочках разброс практически подавляется и критический диаметр резко снижается. То, что он все-таки существует, объясняется потерями тепла на разогрев оболочки, которые начинают сказываться при очень малых диаметрах. Охлаждение реагирующего ВВ тормозит его превращение.
Теория Харитона позволяет понять также влияние инертных примесей из возможность и скорость детонации. Инертные примеси обычно уменьшают скорость детонации, а при больших содержаниях делают ее распространение невозможным. Главную роль здесь опять-таки играет то обстоятельство, будут ли частицы инертных примесей просто разбросаны или же они примут более или менее значительное участие в обмене энергией с реагирующим ВВ и продуктами его распада. В последнем случае присутствие инертных примесей; будет существенно затруднять детонацию ВВ, в первом — оно будет проявляться гораздо слабее. Важными факторами являются размеры частиц ВВ и примеси: чем меньше частицы, т. е. чем больше поверхность, на которой происходит отдача энергии взрывчатым веществом частицам примеси, тем больше она будет поглощать энергию и тем сильнее будет ее влияние. Играет роль также скорость химической реакции ВВ, разбавляемого инертными примесями. Чем скорость больше, тем меньше будет относительное влияние инертной примеси.
Однако инертные примеси могут не только затруднять распространение детонации, но и облегчать его. Это наблюдается в том случае, когда частицы ВВ сравнительно крупные, а присутствие примеси увеличивает среднюю плотность порошкообразного вещества. При крупных частицах удельная поверхность теплообмена их с инертной примесью невелика, а увеличение плотности повышает инерционное сопротивление разбросу. В этих условиях действие «тяжелых» примесей в известной мере аналогично действию внешней оболочки.
Принцип Харитона позволяет дать и ориентировочную оценку времени реакции в детонационной волне, исходя из экспериментально легко определимой величины критического диаметра. Для критических условий время разброса 0 равно времени реакции г. Время разброса приближенно равно времени прохождения звуковой волны до оси заряда, т. е.
0
2с
Из (4.60) следует, что c^=D—w, а согласно формуле (4.80)
w — lj4D, (4.82)
$
12. Теория детонации конденсированных ВВ
261
поэтому
D
4
И
*=0=2/3~-. (4-83)
Для порошкообразного тротила при плотности 1 г/сл3 критический диаметр равен 0,8 см, а скорость детонации 5000 м/сек. Отсюда
*=2/зг4~10~6 сек. 1 мксек.
5 • 105
Подобным же расчетом для азида свинца получаем, что т заключается в пределах от 3 • 10“3 до 6 • 10-3 мксек. Для гексогена и аммиачной селитры время реакции составляет соответственно 0,1 и 30 мксек. Таким образом, время реакции в детонационной волне у азида свинца в несколько тысяч раз меньше времени реакции аммиачной селитры, что, впрочем, видно прямо из сравнения критических диаметров (различия в скоростях детонации невелики).
Как было указано (стр. 249), для зарядов большой плотности имеется более прямой экспериментальный метод оценки времени реакции. Зависимость давления от времени в детонационной волне имеет резкий излом в точке Жугэ, т. е. в точке завершения химической реакции. Времена реакции, полученные исходя из этой зависимости, оказываются во много раз меньше, чем рассчитанные из принципа Харитона. Это различие объясняется следующим.
При детонации зарядов большого диаметра вдали от критических условий давление во фронте велико, соответственно велика и скорость реакции. При детонации вблизи критического диаметра велики потери, давление ниже, соответственно меньше скорость реакции и больше время ее протекания. Иначе говоря, при диаметре, равном критическому, т. е. в случае детонации заряда, едва способного взрываться, время реакции, находящейся на грани затухания, значительно больше, чем при большом диаметре, когда давление из-за разброса не падает и реакция протекает с максимальной скоростью.
Гидродинамическая теория детонации, как уже было указано, в ее общих положениях приложима и к случаю детонации конденсированных ВВ. Как же отражается явление разброса, сопутствующее прохождению детонации, на механизме, который принимает гидродинамическая теория? Гидродинамическая теория исходит из того, что на переднем крае фронта детонации идет ударная волна, распространяющаяся со скоростью детонации, но при гораздо большем давлении, чем это соответствует точке касания на кривой Гюгоньо. После сжатия, тем или иным путем вызывающего химическое превращение ВВ, одновременно с этим превращением происходит расширение по прямой 1—2—0 (см. фиг. 4.58), переводящее параметры ВВ из состояния, соответствующего исходному веществу, в состояние, соответствующее продуктам реакции.
Количественная теория показывает, что во всех состояниях, лежащих между точкой 1 и точкой касания 2, скорость распространения состояния меньше, чем сумма скорости звука, соответствующей данному промежуточному состоянию реакции и скорости движения вещества w. Поэтому всякое возмущение, возникшее на этом этапе расширения и распространяющееся в реагирующем движущемся
262
Гл. IV. Самораспространяющееся превращение в ВВ
веществе со скоростью звука i, догоняет фронт ударной волны и влияет таким образом на давление в ней и скорость ее распространения. В точке касания скорость детонации равна сумме скорости звука и скорости движения среды; ниже точки касания скорость распространения состояния меньше суммы скоростей звука и среды. Поэтому никакие изменения, происходящие позади фронта детонации, после перехода вещества в состояние, отвечающее точке 2, ие могут догнать фронт волны и отразиться на его распространении.
Таким образом, если реакция успевает завершиться до достижения точки касания, то последующее неизбежное расширение газообразных продуктов реакции не может влиять на скорость распространения, величина которой определяется координатами точки касания. При диаметрах заряда больше предельного это условие выполняется. Если диаметр заряда меньше предельного, то за время реакции из-за разброса успевает произойти дополнительное расширение и давление в точке касания будет уже меньше, чем оно было при больших диаметрах заряда, при полном выделении энергии. Соответственно и скорость распространения будет меньше. Снижение давления за счет разброса отрицательно отражается на прохождении реакции, неполнота ее увеличивается, что в свою очередь еще больше тормозит реакцию. В итоге при критическом диаметре заряда сжатие вещества в обусловленной детонацией ударной волне оказывается недостаточным для возбуждения быстрой химической реакции и детонация прекращается.
В случае ВВ, детонирующих по «газовому» (гомогенному) механизму, прекращение детонации наблюдается при сравнительно высоких скоростях детонации, так как для разогрева конденсированного ВВ необходимы большие давления; распространение «пузырьковой» детонации можно наблюдать и при относительно малых скоростях.
1 Т. е. распространяющееся в неподвижной системе координат с общей скоростью, равной сумме скорости движения вещества и скорости распространения в нем звука.
Глава V
ВОЗБУЖДЕНИЕ ГОРЕНИЯ И ДЕТОНАЦИИ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
(Начальный импульс и чувствительность ВВ)
Наличие взрывчатых свойств у того или иного вещества определяет лишь потенциальную возможность взрыва. Для того чтобы эта возможность реализовалась, необходимо произвести на ВВ воздействие, способное вызвать взрыв. Такое воздействие называют начальным импульсом.
Опыт показывает, что для возбуждения взрыва одних ВВ достаточно слабого воздействия, для других — требуются более сильные воздействия. Например, подпетый азот взрывается от прикосновения к нему бородкой птичьего пера, а тротил не взрывается даже при ударе винтовочной пули. Иначе говоря, различные ВВ обладают разной чувствительностью к внешним воздействиям. Чувствительность есть способность ВВ реагировать на внешние воздействия возникновением горения или взрыва; чувствительность ВВ характеризуют минимальной величиной начального импульса, необходимой для возбуждения взрывного превращения ВВ.
Следует указать, что чувствительность данного ВВ к начальному импульсу определенного вида не является постоянной, а зависит от условий, в которых действует импульс, и от характеристик заряда. В случае удара, например, она зависит от толщины заряда, размеров частиц, агрегатного состояния ВВ и др.
Чувствительность ВВ, в особенности к механическим и тепловым воздействиям, является одной из основных характеристик, определяющих возможность его технического использования. Химия знает много ВВ, обладающих высокими показателями взрывного действия, но одновременно и чрезмерно большой чувствительностью, которая исключает применение их в технике. Таковы, например, азид меди, хлорноватокислые эфиры глицерина и других спиртов.
В процессе производства, перевозки и применения ВВ неизбежно подвергается толчкам и ударам. Так, заряд ВВ в снаряде в момент выстрела испытывает сильный толчок вследствие своей инерции; при большой чувствительности ВВ это может привести
264
Гл. V. Возбуждение горения и детонации ВВ
к преждевременному взрыву заряда взрывчатого вещества в стволе орудия. При ударе снаряда или авиабомбы о землю, броню или другую преграду резкое торможение движения корпуса приводит к быстрому и сильному сжатию заряда в головной части, которое также может вызвать преждевременный взрыв. По этим причинам для снаряжения артиллерийских снарядов и даже авиабомб не применяют нитроглицерин или гремучий студень, которые обладают большой чувствительностью, хотя взрывное действие их значительно больше, чем, например, тротила.
В производстве нередко приходится нагревать ВВ, иногда в больших количествах. Если при этом не исключена возможность местного перегрева и ВВ обладает большой чувствительностью к теплу, то, как показывает опыт промышленности, может происходить воспламенение. Возникшее горение может перейти во взрыв. Если бы такой переход всегда имел место, то ВВ просто нельзя было бы изготовлять и снаряжать в тех масштабах, которых требует современная техника. Именно поэтому в качестве основных ВВ, изготовляемых и применяемых в больших количествах в промышленности и военной технике, используют такие вещества, которые обладают относительно низкой чувствительностью к теплу и к удару и не взрываются, как правило, от зажигания. Последнее обстоятельство снижает опасность взрыва при случайном воспламенении ВВ или при пожаре.
Малая чувствительность ВВ не служит препятствием к возбуждению взрыва при их применении, когда детонацию вызывают с помощью капсюля-детонатора. Так как капсюль-детонатор может быть введен в ВВ только намеренно, то способность вторичных ВВ взрываться от этого импульса не создает опасности случайного взрыва; те же механические воздействия, которым ВВ может подвергаться в обычных условиях производства и применения, значительно слабее, чем действие капсюля-детонатора, и, как правило, к взрыву не приводят.
Если чувствительность ВВ не должна быть слишком большой из-за опасности их производства и применения, то она не должна быть и слишком малой. В реальных условиях возможны изменения ВВ, сопровождающиеся снижением их чувствительности, например, в случае аммонитов — их увлажнение или слеживание; в случае динамитов — их старение и т. п. Необходимо, чтобы ВВ обладало известным «запасом чувствительности» и взрывалось бы от обычного импульса даже и при этих неблагоприятных изменениях.
Для некоторых видов применения бывает необходимо понижать чувствительность— флегматизировать ВВ или повышать чувствительность — сенсибилизировать ВВ. Так, для бронебойных снарядов тротил флегматизируют добавкой парафина, воска или других примесей. В ударные составы вводят иногда порошок стекла для повышения чувствительности к удару.
Возможность возникновения взрывного превращения в результате воздействия на ВВ того или иного начального импульса зави
$ 1. Начальный импульс и механизм возбуждения взрыва
265
сит от общего количества энергии, переданной веществу, и от ее концентрации в некотором объеме. Поясним роль этих двух факторов.
Чтобы вызвать реакцию взрывного превращения, молекулам В В необходимо сообщить энергию активации. Энергия начального импульса переходит прямо в энергию активации лишь в редких случаях, например при облучении смеси водорода с хлором светом короткой длины волны. Как правило, энергия начального импульса воспринимается ВВ прямо или косвенно в виде тепла и только некоторая часть ее переходит в энергию активации, т. е. непосредственно приводит к возбуждению химической реакции. Эта часть тем больше, чем выше температура. В самом деле, скорость химической реакции пропорциональна e~E!lir, а эта величина быстро возрастает с повышением температуры. Поэтому при возбуждении взрыва, например нагревом, данное количество тепловой энергии тем эффективнее и дает тем больше активных молекул, чем в меньшем количестве ВВ оно сосредоточено, чем выше концентрация энергии, иначе говоря, чем выше достигаемая температура.
Однако и абсолютная величина энергии также имеет значение. В любом ВВ, даже при комнатной температуре, несомненно, происходит распад отдельных молекул. Однако этот распад не приводит к взрыву потому, что энергия элементарной реакции рассеивается в большом числ'е окружающих молекул. Необходимо образование некоторого достаточно большого числа активных молекул в одном месте для того, чтобы могло возникнуть самораспространяющееся превращение.
Оба эти параметра возбуждения взрыва взаимно связаны: чем больше концентрация энергии и соответственно скорость вызванной ею реакции, тем меньше могут быть минимальные размеры очага реакции, приводящего к возникновению взрыва, тем соответственно меньше может быть общая энергия начального импульса.
Сказанное о тепловой энергии относится и к энергии удара, так как возбуждение взрыва ударом происходит в результате создаваемых им местных нагревов, приводящих к образованию очагов реакции. Оценивать эффективность удара только по его общей энергии трудно еще и потому, что в зависимости от условий удара и свойств вещества доля энергии, поглощенная ВВ, а также ее распределение, могут изменяться в очень широких пределах.
Перейдем к рассмотрению различных видов начального импульса.
§ 1. НАЧАЛЬНЫЙ ИМПУЛЬС И МЕХАНИЗМ ВОЗБУЖДЕНИЯ ВЗРЫВА
Для возбуждения взрыва можно применять разнообразные воздействия: тепловое, механическое, электрическое, химическое, взрывное, облучение и т. д. Если эти начальные импульсы характеризовать по их энергии, то оказывается, что между величинами
266
Гл, V. Возбуждение горения и детонации ВВ
энергии в различных формах обычной эквивалентности в отношении способности вызывать взрыв не наблюдается. Взрывчатые вещества избирательно чувствительны к отдельным видам воздействия.
Это обстоятельство объясняется тем, что способность воспринимать энергию в данной ее форме различна у разных ВВ в зависимости от их физических свойств и условий, в которых производится воздействие.
Так, при нагреве нелетучего и неплавящегося ВВ вся сообщаемая ему тепловая энергия затрачивается на повышение температуры. Если же подводить тепло к летучему ВВ, то по достижении температуры кипения дальнейший подъем температуры приостанавливается до тех пор, пока все вещество не превратится в пары. Если, однако, то же летучее ВВ нагревать под высоким давлением, то температура кипения повысится, переход ВВ в парообразное состояние, будет затруднен и сообщенная ему энергия может быть в большей степени использована для активации молекул.
Результат действия лучистой энергии будет зависеть от коэффициента поглощения ВВ в данной области спектра и, кроме того, от соотношения величины кванта света данной длины волны и энергии активации реакции превращения ВВ.
В случае удара доля механической энергии, поглощаемая веществом, может быть очень различна в зависимости от свойств ВВ и условий удара; при ударе по жидкости, например, она может просто выдавливаться в стороны без заметного поглощения энергии.
С другой стороны, существенно, как распределяется поглощенная энергия: равномерное распределение ее невыгодно для возбуждения взрыва.
Наконец, при ударе развитие вызванной им реакции происходит под давлением, что благоприятствует возникновению горения и взрыва. Этого нет при обычных условиях разогрева. В последнем случае в свою очередь более благоприятны условия для развития химического самоускорения реакции, так как нагрев более продолжителен, чем действие удара.
Таким образом, при сообщении ВВ определенного количества энергии степень поглощения ее веществом и характер ее распределения в нем могут в сильной мере зависеть от свойств ВВ и условий, в которых производится воздействие.
Поскольку эти свойства, вообще говоря, различны, то для разных ВВ одинаковые условия воздействия не являются равными, чем и объясняется избирательный характер чувствительности ВВ. Изменяя условия воздействия, можно соответственно изменять как абсолютную, так и относительную чувствительность взрывчатых веществ, т. е. их расположение в шкале чувствительности к данному виду импульса.
Следует подчеркнуть, что избирательность чувствительности отнюдь не является абсолютной и никоим образом ие дает оснований сделать заключение о принципиальном различии в механизме возбуждения взрыва при различных воздействиях.
Приведем несколько примеров, иллюстрирующих избирательную чувствительность ВВ к различным видам начального импульса.
§ 1. Начальный импульс и механизм возбуждения взрыва
267
Азид свинца имеет более высокую температуру вспышки (~330°), чем тротил (~300°), но к трению тротил гораздо менее чувствителен, чем азид свинца.
Смесь, содержащая 60% хлората калия и 40% железистосинеродистого калия, взрывается при падении груза в 5 кг с высоты 25 см и имеет температуру вспышки 310° С. Смесь из 60% хлората калия и 40% гипосульфита натрия имеет меньшую чувствительность к удару — взрывается при падении груза с высоты 100 см, но более чувствительна к нагреву — дает вспышку уже при 155°.
Об отсутствии параллелизма между чувствительностью к удару и к нагреву говорит также тот факт, что температуры вспышки ВВ, применяемых в технике, различаются не более чем в два раза, в то время как по энергии удара, вызывающего взрыв, те же ВВ различаются приблизительно в 90 раз. Это объясняется в первую очередь существенным различием условий возникновения взрыва при медленном нагреве (вспышке) и ударе. Если сравнивать с чувствительностью к удару не температуру вспышки, а воспламеняемость и притом под высокими давлениями, то между этими характеристиками наблюдается более близкое соответствие.
Несоответствие в чувствительности наблюдается и по отношению к другим видам начального импульса. Так, черный порох имеет более высокую температуру (~315°С) вспышки, чем бездымный порох (~200q С). Однако лучом огня черный порох воспламеняется гораздо легче, чем бездымный.
Разные виды начального импульса отличаются также тем, какую форму химического превращения ВВ они вызывают. Воспламенение всегда первоначально вызывает горение ВВ, устойчивое или неустойчивое, переходящее в детонацию. У некоторых ВВ, примером которых может служить азид свинца, этот переход происходит крайне быстро, так что стадию горения уловить не удается. Капсюль-детонатор в противоположность тепловому импульсу вызывает детонацию; к ней же приводит в конечном счете и действие удара. Эти обстоятельства следует учитывать при выборе начального импульса для тех или иных условий применения.
Рассмотрим несколько примеров.
Если зажечь пламенем открыто расположенную шашку тротила, то происходит горение без заметного механического эффекта. Если же в ней возбудить реакцию взрывом капсюля-детонатора, то происходит детонация с сильным разрушительным эффектом.
Если железный цилиндр плотно набить черным порохом и поджечь порох бикфордовым шнуром, то заряд сгорает, а цилиндр остается целым. Если же для возбуждения реакции применить капсюль-детонатор, то порох взрывается и цилиндр разлетается на большое число кусков.
Медленный нагрев аммиачной селитры при умеренных температурах приводит к спокойному ее разложению на аммиак и азотную кислоту, протекающему с поглощением тепла и не могущему поэтому дать взрыва. При действии сильного детонатора аммиачная селитра детонирует с распадом на азот, воду и кислород с большим выделением энергии.
Основными видами начального импульса являются:
268
Гл. V. Возбуждение горения и детонации ВВ
1) тепловой импульс (разогрев и поджигание ВВ);
2) механический импульс (удар и трение);
3) сотрясение при выстреле и при ударе о препятствие;
4) взрывной импульс;
5) действие на ВВ ионов, электронов, нейтронов, ядерных осколков и ультразвука.
1. Возбуждение взрывного превращения тепловым импульсом
Возникновение вспышки ВВ при постоянной температуре или медленном нагреве
Если поместить ВВ в термостат с постоянной или медленно возрастающей температурой, то через некоторое время можно наблюдать вспышку. Механизм возникновения вспышки в таких условиях, когда вся навеска ВВ нагревается медленно и поэтому равномерно,
Фиг. 5. 1. Соотношение между теп-лоприходом и теплоотводом при нагреве ВВ.
1—теплоприход, 2 и 3—теплоотвод.
в основных чертах близок к механизму теплового взрыва, рассмотренному выше (см. стр. 51).
Допустим (фиг. 5. 1), что при медленном нагреве достигнута температура термостата, равная Го-Температура ВВ будет несколько выше за счет саморазогрева, обусловленного экзотермическим химическим превращением ВВ и уравновешиваемого теплоотводом от ВВ термостату. Из фиг. 5. 1 видно, что равновесие теплоприхода q (кривая 1) и теплоотвода (прямая 2) наступит при температуре ВВ Т2. С возрастанием То скорость химического превращения и теплоприход
быстро возрастают и выше некоторого значения ТО~Т'О кривая теплоприхода 1 при всех температу-
рах, которые принимает ВВ в результате саморазогрева, лежит выше прямой теплоотвода <3; теплоотвод теперь уже не может компенсировать теплоприхода, наступает быстро прогрессирующий саморазогрев ВВ, приводящий к резкому ускорению его превращения,—возникает воспламенение. Минимальную температуру термостата, при которой, наступает воспламенение, называют температурой вспышки ВВ; эта температура может служить одним из показателей чувствительности ВВ к действию тепла.
Таким образом, температура вспышки есть та минимальная температура, начиная с которой кривая теплоприхода за счет экзотермического превращения ВВ идет выше прямой теплоотвода.
§ I. Начальный импульс и механизм возбуждения взрыва
269
Если при одинаковой постановке опытов определять температуру вспышки разных ВВ, то условия теплоотвода для них будут различаться мало. Основными характеристиками ВВ, определяющими температуру вспышки в рассмотренных условиях, являются скорость реакции и ее тепловой эффект. Существенное значение имеет также развитие химического ускорения реакции; если это ускорение велико, то минимальная температура вспышки может сильно уменьшаться при увеличении продолжительности нагрева. Развитие химического самоускорения реакции обусловливает явление задержки вспышки, которая в данном случае, в отличие от того, что имеет место при тепловом самоускорении, может быть очень большой.
Температура вспышки зависит от размеров заряда. Если определять эту температуру, последовательно уменьшая навеску ВВ, то, начиная с некоторой минимальной навески, разложение при прочих равных условиях будет проходить без вспышки. Это объясняется тем, что теплоприход пропорционален объему ВВ, а теплоотвод — его поверхности. Отношение же поверхности к объему тем больше, чем меньше при данной форме заряда навеска ВВ.
На температуру вспышки влияет также скорость на гр е-в а. Если нагревать ВВ медленно, то вспышка возникает при более низкой температуре. Это обусловлено тем, что при увеличении времени нагрева до некоторой данной температуры реакция распада успеет произойти в большой степени, выше будет концентрация продуктов распада, ускоряющих реакцию, и соответственно больше скорость последней. Если, однако, вести нагрев слишком медленно, то вспышки может совсем не произойти, так как большая часть ВВ успеет разложиться в области низких температур; по достижении высокой температуры количество (или концентрация) ВВ будет уже так мало, что взрываться окажется нечему.
Влияние условий развития химического самоускорения объясняет и парадоксальное явление разложения без вспышки некоторых ВВ при быстром нагреве до высокой температуры, превышающей обычную температуру вспышки. Так, если нитроглицерин вводить в пробирку, нагретую до 205—210° С, то происходит резкий взрыв, дробящий пробирку на мелкие кусочки. При температуре 230° С или выше возникает только быстрое разложение с едва слышным звуком Сходные явления наблюдаются и для тротила. Если маленькую навеску тротила (0,05 г) бросать в пробирку, нагретую до 320° С, то при каждом опыте происходит вспышка. Если же повысить температуру пробирки до 380° С, то вспышка наблюдается не при каждом опыте, а при 400° С все опыты дают беспламенное разложение. Эти явления объясняются следующим образом. При быстром достижении высокой температуры, превышающей температуру кипения ВВ, оно превращается в пары, вспышка которых соответственно их меньшей плотности и меньшему самоускорению распада возникает труднее, чем вспышка жидкости. При более медленном нагреве, еще до достижения температуры кипения, ВВ в заметной степени разлагается; в этом случае концентрация ускоряющих реакцию продуктов значительна, в результате чего наступает вспышка. Большую роль играет летучесть ВВ, точнее, соотношение между летучестью и скоростью химической реакции в жидкой фазе. Если летучесть велика, а скорость химической реакции мала, то при сильном нагреве ВВ быстро, прежде чем в жидкости успеет развиться химическая реакция, превращается в пары. В этом
270
Гл. V. Возбуждение горения и детонации ВВ
случае возникновение вспышки обусловлено целиком химическим' превращением в газовой фазе.
Если же летучесть мала, то развитие химических реакций всегда начинается в конденсированной фазе и оказывает определяющее влияние на возникновение вспышки. В соответствии со сказанным у труднолетучих ВВ, например тетрила, описанного явления, называемого иногда «верхним температурным пределом вспышки», не наблюдается.
Таким образом, температура вспышки не является константой ВВ, но зависит от всех факторов, влияющих на теплоотвод (величина и форма заряда ВВ, теплопроводность, толщина оболочки и т. д.) и скорость реакции (давление, точнее, концентрация в случае взрывчатых газов, условия развития самоускоряющейся реакции и др.). Поэтому сопоставление чувствительности ВВ к нагреву по температуре их вспышки возможно лишь в том случае, если эту температуру определяют при одинаковых условиях для всех сравниваемых ВВ.
Характер вспышки у разных ВВ различен: азид свинца и некоторые другие инициирующие ВВ дают детонацию; сходный характер вспышки наблюдается и у нитроглицерина и динамитов; вспышка большинства других нитроэфиров и нитросоединений имеет менее резкий характер.
Эти различия обусловливаются следующими причинами. По существу вспышка представляет собой горение ВВ. Отличив от обычных условий горения заключается в том, что при вспышке ВВ загорается в результате самовоспламенения, а не от внешнего зажигания, что горит ВВ, нагретое до высокой температуры и, наконец, в том, что горит не чистое вещество, а более или менее разбавленное продуктами распада, в частности, теми, которые ускоряют распад. Характер вспышки зависит от того, насколько устойчиво горение в этих условиях. Если горение устойчиво, то вспышка не сопровождается взрывом. При резкой неустойчивости горения интенсивность вспышки существенно возрастает, в пределе до возникновения детонации. Если ВВ имеет большую вязкость, стабилизирующую горение, то на характер вспышки влияет также возможность снижения этой вязкости в результате повышения температуры и протекания химических процессов. По этой причине желатины из нитроглицерина и нитроклетчатки с содержанием последней меньше 60%, весьма устойчиво горящие при обычной температуре, при определенных условиях медленного нагрева дают очень резкую вспышку.
Возникновение горения ВВири его поджигании (воспламеняемость ВВ)
Если к поверхности АВ летучего ВВ (фиг. 5. 2) поднести пламя, то температура его Т будет быстро повышаться и скоро достигнет температуры кипения Гк; образуются пары. Дальнейший нагрев приведет к воспламенению паров, от горения паров начнется горение ВВ. Однако не при всех условиях воспламенения паров достаточно для того, чтобы В В загорелось и продолжало гореть после удаления поджигающего пламени. Температура поверхностного слоя ВВ после удаления внешнего пламени будет определяться двумя процессами: сообщением тепла от воспламенившихся паров
§ 1. Начальный импульс и механизм возбуждения взрыва
271
и теплоотводом в глубь вещества. Теплоприход при данном давлении — величина постоянная, теплоотвод же определяется градиентом температуры вблизи поверхности ВВ. Если нагрев ВВ происходит очень быстро, то кривая температуры падает в глубь вещества круто (фиг. 5. 2, а) и теплоотвод будет больше. Теплоотвод может оказаться больше теплоприхода, тогда поверхность АВ будет охлаждаться и горения ВВ от воспламенения паров не возникнет. Если нагрев ВВ происходит медленнее, то к моменту достижения на его поверхности температуры кипения Тк вещество успеет прогреть-
АВ — поверхность ВВ.
а—градиент температуры больше, чем при стационарном горении, б—градиент температуры, соответствующий стационарному горению, о—градиент температуры меньше, чем при стационарном горении.
ся на достаточную глубину (фиг. 5.2, б), кривая изменения температуры станет более пологой и теплоотвод будет как раз равен тепло-приходу. Таким образом, если нагрев ВВ происходит с той же скоростью, с какой он идет при стационарном горении, то воспламенение сразу приводит к устойчивому горению с нормальной для данных условий (давление и начальная температура) скоростью. В случае, когда нагрев поверхности происходит еще медленнее, градиент температуры в ВВ в момент воспламенения будет меньше, чем при стационарном горении (фиг. 5. 2, в); теплоотвод в глубь ВВ будет меньше, теплоприход же останется прежним и горение соответственно будет идти быстрее. За счет этого кривая изменения температуры в ВВ будет становиться круче и примет форму, соответствующую стационарному горению; скорость горения уменьшится при этом до ее стационарного значения.
Если в прогретом слое химической реакции не происходит, то при стационарном горении температура на расстоянии х от поверхности ВВ определяется [см. формулу (4. 12)] выражением
-г ч (5-1)
Т=Т0+(Тк-Т0)е \ k 7
где и — скорость горения; Тк— температура на поверхности ВВ; в случае летучих ВВ Тк есть температура кипения; х — температуропроводность ВВ.
Условие нормального воспламенения можно рассматривать как. образование внешним источником тепла прогретого слоя ВВ с указанным выше распределением температуры. Запас тепла Q, кото
272
Гл. V. Возбуждение горения и детонации ВВ
рый надо сообщить ВВ для создания такого прогретого слоя, может быть мерой воспламеняемости ВВ. Чем меньше этот запас, тем легче воспламеняется ВВ, тем больше его воспламеняемость. Запас тепла рассчитывают по уравнению
Q = ]cpp{T-7Q)dx. (5.2)
О
Подставив значение Т из (5.1) и имея в виду, что х=—9-, cpf после интегрирования получим
(5.3)
где tj, сР, р — соответственно теплопроводность, теплоемкость и плотность ВВ.
Нельзя, как это иногда делают, принимать за характеристику воспламеняемости температуру вспышки ВВ. Эта температура, как мы видели, не является постоянной и более или менее отличается от Тк. Далее, как видно из формулы (5. 3), величина Q зависит не только от Тк, но и от теплопроводности ВВ и скорости его горения, которые для разных ВВ могут быть существенно различны. Для одного и того же ВВ (в порошкообразном состоянии) теплопроводность изменяется также в зависимости от плотности, причем с уменьшением плотности увеличивается скорость горения, входящая в знаменатель выражения (5. 3) для запаса тепла. По этим причинам воспламеняемость относительно быстро горящего черного пороха (и1ат^1 см)сек) значительно больше, чем бездымного («1ат ^0,1 см!сек), хотя температура вспышки черного пороха (~300°С) значительно выше, чем бездымного (~200°С). Точно так же пироксилин и другие порошкообразные ВВ в прессованном виде воспламеняются значительно труднее, чем те же ВВ в рыхлом порошкообразном состоянии. По тем же причинам воспламеняемость влажного пироксилина меньше, чем сухого; напротив, воспламеняющее действие влажного пироксилина больше, чем сухого.
Формула (5.3) показывает, что воспламеняемость зависит от начальной температуры ВВ: с ее увеличением необходимый запас тепла линейно уменьшается. Воспламеняемость увеличивается с давлением: запас тепла приближенно обратно пропорционален давлению, так как скорость горения, стоящая в знаменателе выражения (5.3), приближенно пропорциональна ему.*
* Эта последняя зависимость объясняет парадоксальное явление затухания горения при резком падении давления, например при вылете горящих пороховых зерен из ствола орудия при выстреле. Запас тепла в прогретом слое, имеющийся при горении под большим давлением, оказывается недостаточным для того, чтобы горение продолжалось под атмосферным давлением, хотя порох при этом давлении способен гореть.
§ 1. Начальный импульс и механизм возбуждения взрыва
273
Воспламеняемость является весьма важной характеристикой ВВ, во многих случаях, например, в условиях возбуждения взрыва ударом, более существенной, чем температура вспышки.
Существующие экспериментальные методы определения воспламеняемости (см. ниже стр. 328) имеют качественный характер и не могут быть признаны удовлетворительными.
Разработка научно обоснованного количественного метода определения воспламеняемости представляет собой одну из актуальных задач теории ВВ.
Одним из возможных путей в этом направлении является определение критического диаметра для горения; величина этого диаметра зависит от тех же параметров, что и воспламеняемость; критический диаметр нетрудно определить не только при атмосферном, но и при повышенных давлениях разными методами, например, используя конические заряды и устанавливая тот диаметр, при котором прекращается горение заряда, воспламененного с более широкого торца.
2. Возбуждение взрывного превращения механическим импульсом
Механизм возникновения взрыва при ударе и трении
Процесс возбуждения взрыва механическим импульсом значительно сложнее, чем тепловым. Были выдвинуты две основные точки зрения на механизм этого процесса. Одна из них допускает, что удар по ВВ приводит к его разогреву, который и возбуждает распад ВВ. Сторонники другой точки зрения полагают, что взрыв при ударе по ВВ возникает непосредственно в результате его сжатия. Деформация молекул или кристаллической решетки ВВ вызывает химическое превращение подобно тому, как его вызывает разогрев.
В подтверждение второй точки зрения приводились те факты, что повышение давления может влиять на скорость химической реакции не только в газах, но и в конденсированных веществах, что во многих случаях параллелизма между чувствительностью ВВ к удару и температурой вспышки нет, что, наконец, оказалось возможным (в 70% опытов) вызвать взрыв йодистого азота (по данным Эггерта), подвергая его статическому сжатию давлением в 5000 ат. В качестве дополнительного аргумента в пользу этих взглядов было указано, что энергия удара, возбуждающего взрыв, в некоторых случаях недостаточна для разогрева ВВ до температуры вспышки.
Однако результаты экспериментальных исследований последнего времени говорят против гипотезы непосредственного возбуждения взрыва ударом Так, Рябинин, а позже Боуден изучали действие высоких давлений на термический распад ряда взрывчатых
274
Гл. V. Возбуждение горения и детонации ВВ
веществ и установили, что давление, как правило, не только не ускоряет, но в ряде случаев заметно замедляет распад.
Так, при давлении 45 000 ат азид бария разлагается в 58 раз медленнее, чем при атмосферном давлении. Точно так же уменьшается с повышением давления скорость распада азида свинца и тэна. Опыты с тринитрорезорцинатом свинца показали, что распад его несколько ускоряется при высоком давлении; скорость разложения гремучей ртути при высоком давлении в начале распада больше, а затем становится меньше, чем при атмосферном давлении. В общем даже такое высокое давление как 45 000 ат слабо влияет на скорость распада и к тому же по большей части в сторону ее уменьшения.
Еще более убедительными являются результаты опытов Бриджмэна, который подвергал взрывчатые вещества (тринитротолуол, нитрогуанидин, пикрат аммония) сжатию статическими давлениями до 100 000 ат, т. е. близкими к давлениям, имеющим место при детонации; ни для одного из этих ВВ такие давления даже при наличии некоторой деформации сдвига не приводили к взрыву.*
В своем первоначальном виде гипотеза о разогреве ВВ, вызываемом непосредственным переходом всей энергии удара в тепло, как причине возникновения взрыва также не является обоснованной. Эта гипотеза не выдерживает даже такой элементарной проверки, как расчет соответствия энергии удара, достаточной для возбуждения взрыва, количеству тепловой энергии, необходимому для разогрева ВВ до температуры вспышки.
Для некоторых малочувствительных ВВ, правда, энергия удара оказывается сопоставимой с необходимой затратой тепла для нагрева ВВ до вспышки. Так, тротил взрывается, по Холево, при падении груза в 5 «г с высоты 50 см, т. е. при энергии удара 2,5 кгм (навеска тротила равна 0,03 г, теплоемкость его — 0,3 кал!г град). Энергия удара составляет 2,5-1000
--------- = 5,85 кал\ за счет этой энергии тротил мог бы разогреться на
М = 5^85--=650°.
0,03-0,3
Температура же вспышки тротила в обычных условиях ее определения составляет около 300° С. Таким образом, если допустить, что энергия удара целиком используется для нагрева ВВ, то этой энергии хватило бы в данном случае для достижения температуры вспышки. Если, однако, такой расчет произвести для гремучей ртути (или других, близких ей по чувствительности, ВВ), которая может взрываться при падении груза в 2 кг с высоты 2 см, то возможный разогрев составит всего 24°, т. е. будет совершенно недостаточен для достижения температуры вспышки (160—170°С). Помимо этого, опыт показывает, что только небольшая часть энергии удара поглощается ВВ, а остальная ее часть поглощается металлом наковальни, ударника, затрачивается на отскок ударяющего груза и т. д.
Кроме того, продолжительность удара гораздо меньше продолжительности нагрева, необходимого для возбуждения вспышки тротила или гремучей ртути при указанных выше температурах. При малой же продолжительности нагрева температура, необходимая для получения вспышки, еще выше.
* При давлении 50 000 ат были испытаны и, как правило, не взрывались, даже при наличии деформации сдвига, а-тринитротолуол, пикриновая кислота, тетрил, гексоген, тэн, а- и р-нитрогуанидины
$ 1. Начальный импульс и механизм возбуждения взрыва
275
Несоответствие между количествами энергии, необходимыми для возбуждения взрыва ударом и для нагрева ВВ до температуры вспышки, можно было бы обойти, допустив, что при ударе разогревается не вся масса ВВ, а только тонкий его слой, на который непосредственно действует удар. Для проверки этого предположения
Фиг. 5. 3. Зависимость чувствительности гремучей ртути к удару от температуры по Тэйлору и Уилю.
1—прямая, соответствующая условию Я=Яф(/в—/), 2—кривая, построенная по экспериментальным точкам.
Тэйлор и Уиль изучали влияние начальной температуры ВВ на его чувствительность. Действительно, если бы роль удара заключалась только в разогреве всей навески ВВ или его тонкого слоя до температуры вспышки, то, очевидно, должна была бы наблюдаться прямая пропорциональность между разностью
t
(где / — температура ВВ; /„— температура вспышки) и необходимой работой удара. Иначе говоря, зависимость необходимой для возбуждения взрыва работы удара Н от температуры ВВ t выражалась бы прямой вида
я=я0(/в-О
(фиг. 5.3, прямая /). Результаты же опытов указанных исследователей дают эту зависимость в виде кривой (см. фиг. 5. 3, кривая 2), что, по их мнению, исключает возможность объяснить местным разогревом ВВ возникновение взрыва при ударе.
Однако этот вывод нельзя считать правильным. Результаты опытов Тейлора и Уиля показывают лишь, что действие удара нельзя
276
Гл. V. Возбуждение горения и детонации ВВ
рассматривать просто как непосредственный переход энергии падающего груза в разогрев ВВ.
В настоящее время наиболее обоснованной гипотезой, объясняющей возбуждение взрыва при ударе и трении, является гипотеза местных разогревав, возникающих в ВВ при этих воздействиях. Если размеры очага разогрева и достигнутая в нем температура достаточно йелики, то происходит воспламенение ВВ. Возникшее горение может перейти во взрыв.
Пути образования очагов разогрева при механическом воздействии на взрывчатое вещество
Механизмы возникновения очагов разогрева могут быть различны. Основными из них являются:
1) трение между частицами или слоями ВВ при смещении их относительно друг друга, вызванном нормальным или скользящим ударом;
2) трение между металлическими (или иными) твердыми поверхностями, между которыми находится тонкий слой ВВ; разогрев металла, обусловленный этим трением, вызывает разогрев в ВВ;
3) трение между твердыми и тугоплавкими частицами, если они присутствуют в ВВ, при смещении их относительно друг друга, вызванном нормальным или скользящим ударом. Разогревы могут возникнуть также от трения указанных частиц о металл; нагрев частиц вызывает разогрев в ВВ;
4) сжатие пузырьков газов или паров, содержащихся в В В, при ударном сжатии последнего.
Рассмотрим каждый из указанных механизмов возникновения очагов разогрева и соответствующие условия возбуждения взрыва.
Возникновение очагов разогрева за счет трения между частицами или слоями ВВ при его течении. Общая картина возникновения взрыва при ударе по такому механизму образования очагов разогрева была развита Н. А. Холево.
Возбуждение взрыва ударом по тонкому слою ВВ, заключенному между плоскими поверхностями наковальни и ударника, включает несколько стадий. Первой является сжатие ВВ. Если сжатие достаточно велико, не является всесторонним и взрывчатому веществу есть куда течь, то наступает его течение. Скорость течения разных слоев сжимаемого заряда ВВ различна. Слои вещества, прилегающие к наковальне и ударнику, не движутся; быстрее всего движется наиболее удаленный от них слой. Вследствие различия в скорости течения между слоями ВВ возникает трение и соответственно разогрев. Наибольший разогрев, очевидно, возникнет там, где существует максимальный градиент скорости течения.
§ 1. Начальный импульс и механизм возбуждения взрыва
277
Помимо градиента скорости течения, величина разогрева определяется также коэффициентом внутреннего трения ВВ, который в свою очередь зависит от давления и возрастает с его увеличением.
Все эти факторы в своей совокупности дают своеобразную картину поведения ВВ с разными физическими свойствами и при различных условиях удара. Для иллюстрации рассмотрим результаты испытания чувствительности ВВ к удару в приборчиках разной конструкции. Методика этих испытаний будет подробнее описана
7
а) 6) 6) г)
Фиг. 5. 4. Приборчики для определения чувствительности ВВ к удару падающим грузом.
а—приборчик № 1 (по Холево), б—приборчик № 2, s—приборчик для испытания по ГОСТ 2065—43, г—приборчик по Касту.
1—стальные ролики диаметром 10 мм, 2—ВВ, 3—канавка, 4—направляющая обойма, 5—поддон, 6—штемпель-наковальня, диаметр рабочей поверхности 8 мм, 7—штемпель-боек диаметром 8 мм.
ниже (см. стр. 311). Эскизы приборчиков представлены на фиг. 5. 4.
Сравним результаты испытаний в приборчиках № 1 и 2 по Холево (фиг. 5. 4, а и б). Приборчик № 2 отличается от приборчика № 1 наличием в направляющей обойме канавки на уровне стыка торцов обоих роликов, облегчающей вытекание ВВ при ударе. В приборчике же № 1 ВВ может вытекать только в зазоры между роликами и направляющей обоймой. Так как эти зазоры обычно очень малы, то возможность вытекания ВВ в приборчике № 1 гораздо меньше, чем в приборчике № 2.
Представим себе два взрывчатых вещества, сильно отличающихся по текучести, для которых возникновение взрыва происходит при одинаковых характеристиках местного разогрева. Если испытывать более текучее ВВ в приборчике № 2, то оно легко, при небольшом давлении, будет вытекать в канавку. Коэффициент внутреннего трения не будет возрастать, так как при течении не возникнет высокого давления. Вследствие этого, хотя скорость истечения и ее градиент будут велики, разогрев будет незначительным. Если это же ВВ испытывать в приборчике № 1, то узкие зазоры между роликами и обоймой будут ограничивать течение вещества, при ударе в ВВ возникнет большое давление, коэффициент внутреннего трения повысится и, хотя скорость истечения будет меньше, разогрев будет больше, чем в приборчике № 2, и соответственно частость взрывов также будет больше.
278
Гл. V. Возбуждение горения и детонации ВВ
Если же испытывать в приборчике № 2 труднотекучее ВВ, то оно будет вытекать в канавку, а так как коэффициент внутреннего трения велик, то и разогрев, а следовательно, и частость взрывов будут велики. Если это же вещество испытывать в приборчике № 1, то оно течь не будет, а без течения не будет разогревов, а следовательно, и взрыва.
Таким образом, два вещества с одинаковыми кинетическими и термохимическими свойствами, но различающиеся по текучести, могут в различных условиях испытания вести себя по-разному. Наи-
Фиг. 5.5. Схема опыта Холево по возбуждению взрыва гре мучей ртути ударом.
меньший разогрев и наименьшая частость взрывов будут наблюдаться в двух крайних случаях: когда скорость течения велика, но давление мало, и когда скорость течения очень мала, хотя и велико давление. Наибольшая же частость взрывов получится при некоторых промежуточных условиях, когда и скорость течения значительна и давления не слишком малы. Оптимальный режим течения будет различен для разных ВВ, если и поскольку текучесть их существенно различна *.
В табл. 5. 1 (составленной в основном по данным Холево) приведены результаты сравнительных испытаний различных ВВ в приборчиках № 1 и 2, показывающие отчетливое влияние различий в текучести на частость взрывов.
Так, нитроглицерин в приборчике № 2 в определенных условиях испытания не дает взрывов, в приборчике же № 1 частость взрывов равна 100%.
Напротив, пироксилин в приборчике № 1 (при энергии удара 1,2 кгм) не дает взрывов, а в приборчике № 2 получается 80% взрывов; стифнат свинца в приборчике № 1 не дает взрывов, а в приборчике № 2 дает 100% взрывов.
Особенно наглядно значение течения вещества как необходимого условия возникновения взрыва при ударе видно из опыта Холево,
* Большое влияние на эффективную текучесть ВВ при ударе может оказывать способность вещества плавиться без сильного разложения; переход вещества, даже частичный, в жидкое состояние резко увеличивает его текучесть.
§ 1. Начальный импульс и механизм возбуждения взрыва
279
Таблица 5. 1
Результаты испытаний в приборчиках № 1 и 2 различных ВВ в чистом виде и с примесями, изменяющими текучесть
ВВ Энергия удара кгм Частость взрывов в %
Приборчик № 1 Приборчик № 2
Нитроглицерин 2,0 100 0
Пироксилин № 2 1,2 0 80
Пироксилин Ks 2 2,5 30 1С0
Пироксилин № 2 с парафином (95 : 5) 2,5 100 0
Стифиат свинца 2,0 0 100
Азид свинца 5 0 4
Смесь азида свинца с парафином (97:3) 5 16 56
Тротил 4 30 0
Тротил 1 0 0
Смесь тротила с окисью кремния (70:30) 1 80 0
Смесь тротила с окисью кремния (50:50) 1 0 70
Трииитроксилол 4 70 0
Тринитроксилол 1 0 0
Смесь тринитроксилола с окисью кремния (70:30) 1 20 30
Смесь тринитроксилола с окисью кремния (50:50) 1 0 100
Г ексоген 4 100 100
Гексоген 1 30 40
Смесь гексогена с окисью кремния (70:30) 1 20 100
Смесь гексогена с окисью кремния (50:50) 1 0 60
Тетрил 4 95 0
Черный порох 4 35 70
280 Гл. V. Возбуждение горения и детонации ВВ
схема которого показана на фиг. 5.5. В медное кольцо была запрессована небольшая навеска такого чувствительного ВВ, как гремучая ртуть. При последовательных ударах грузом в 10 кг, падающим с высоты 10; 25; 50; 75 и 100 см, по прибору, собранному, как показано на фиг. 5. 5, а, взрыва не происходило. После последнего удара ролики с обоймой переворачивали и обойму передвигали вниз, в результате чего кольцо с гремучей ртутью оказывалось против канавки и при ударе могло выдавливаться в нее (фиг. 5.5,6). Подготовленный таким образом прибор подвергали удару с высоты 15 см; при этом неизменно возникал взрыв.
Выше мы рассматривали поведение ВВ, текучесть которого мала, но еще достаточна для того, чтобы оно текло в тех облегченных условиях течения, какие созданы в приборчике № 2.
Однако можно представить себе ВВ со столь малой текучестью, что оно не будет течь не только в приборчике № 1, но и в приборчике № 2. Именно так ведет себя азид свинца (см. табл. 5. 1). То, что отсутствие взрывов обусловлено именно низкой текучестью, видно из результатов испытания смеси азида с небольшим количеством парафина (3%), когда при тех же условиях испытания частость взрывов, особенно в приборчике № 2, значительно возросла.
Этот результат с первого взгляда противоречит опыту промышленности. Как известно, в технике для понижения чувствительности к механическим воздействиям широко применяют парафин и подобные ему вещества *, покрывающие кристаллы ВВ инертной пленкой и смягчающие трение между ними. Однако это противоречие кажущееся. Удары, которым может подвергаться ВВ в практических условиях, являются, как правило, не нормальными, а в большей или меньшей мере скользящими. При скользящем же ударе смещение частиц ВВ относительно друг друга или относительно ударника возникает принудительно и не ограничивается уже текучестью ВВ. Парафин, обволакивая частицы ВВ, уменьшает коэффициент трения и поэтому затрудняет возникновение местных разогревов при смещении частиц.
Действительно, опыт показывает, что присутствие парафина, повышающего частость взрывов при ударе на копре, приводит к существенному уменьшению этой частости в условиях трения.
Холево показал, что аналогичное изменение чувствительности к удару наблюдается при добавлении парафина ко многим труднотекучим ВВ; при этом частость взрывов в приборчике № 1 обычно увеличивается, а в приборчике № 2 понижается. Такое влияние парафина и подобных ему флегматизаторов наблюдается в том случае, когда текучесть чистого ВВ меньше оптимальной в условиях приборчика № 1 и больше оптимальной в условиях приборчика
* Из таких веществ, кроме парафина, используют воск, церезин, вазелин, камфору, жирные масла, особенно касторовое. Чувствительность ВВ снижается также водой, ацетоном и другими невзрывчатыми жидкостями.
§ 1. Начальный импульс и механизм возбуждения взрыва 281
№ 2. Если же имеется вещество с относительно большой текучестью, то в этом случае добавление парафина может уменьшать чувствительность не только к трению в приборчике № 2, но и в приборчике № 1.
Решающее значение имеет влияние текучей примеси на коэффициент внутреннего трения, который она понижает. Если это понижение благоприятствует возникновению очагов воспламенения, то чувствительность ВВ повышается и наоборот.
Помимо влияния вязких примесей на коэффициент внутреннего трения, следует учитывать и то обстоятельство, что, покрывая поверхность кристаллов инертной пленкой, примеси затрудняют не только возникновение очагов воспламенения, но и развитие их, а также передачу воспламенения от одной частицы к другой.
Сказанное относится к примесям, повышающим текучесть ВВ, Естественно, что на чувствительность могут влиять также примеси, уменьшающие текучесть ВВ.
Известно, что примеси малых количеств твердых частиц тугоплавких минеральных веществ, например кремнезема, глинозема, окиси магния и т. п., увеличивают частость взрывов многих ВВ при испытании на копре. Холево показал, однако, что если эти примеси вводить в тонкодисперсном виде и в значительных количествах так, чтобы текучесть вещества сильно уменьшалась, то частость взрывов может не только повышаться, но и уменьшаться и притом в разной степени для разных ВВ и условий испытания. Так, если к тротилу, не дающему (при определенных условиях испытания) взрывов в приборчике № 1, добавить 30% тонкодисперсной окиси кремния, то частость взрывов возрастает до 80%; при 50% добавки частость взрывов вновь падает до нуля. В приборчике же № 2 частость взрывов при 0 и 30% добавки равна нулю, при 50% она возрастает до 70%.
Напротив, менее текучий гексоген в приборчике № 2 при отсутствии примеси давал 40% взрывов, при 30% примеси 100% взрывов, а при 50% частость взрывов уменьшилась до 60 % •
Выше мы указывали, что давление, возникающее при ударе в ВВ, влияет на коэффициент внутреннего трения и скорость истечения, которые определяют возможность возникновения местных разогревов. Однако давление оказывает большое влияние и на дальнейшую судьбу возникшего разогрева. Как мы видели в § 1, воспламеняемость ВВ в значительной мере зависит от давления. Чем больше давление, тем меньше запас тепла в прогретом слое, начиная с которого может распространяться горение. Действие местного разогрева, возникшего в результате трения, наиболее близко соответствует условиям воспламенения ВВ кратковременным внешним нагревом. Поэтому давление в ВВ, достигнутое при ударе, длительность его существования и быстрота падения оказывают большое влияние. Они определяют, приведет ли местный разогрев
282
Гл. V. Возбуждение горения и детонации В В
к воспламенению ВВ, вызовет ли это воспламенение горение и перейдет ли горение во взрыв. Если давление, созданное ударом, кратковременно и падает слишком быстро, то возникшее горение может затухнуть. Запас тепла в прогретом слое, достаточный для горения при высоком давлении, может оказаться недостаточным для того, чтобы горение продолжалось при низком давлении. Опытами Боудена показано, что иногда горение, возникшее при ударе, затухало, не распространяясь на все ВВ. Видимо, по той. же причине при испытаниях на копре часто наблюдается распространение возникших очагов горения только на небольшую часть навески ВВ.
Таким образом, давление оказывает троякое действие на возникновение взрыва при ударе: оно вызывает течение вещества, изменяет коэффициент внутреннего трения и влияет на судьбу возникшего при течении очага химической реакции. В настоящее время нельзя без эксперимента установить, какое из двух последних влияний имеет в том или другом случае первенствующее значение.
Во всем предыдущем рассмотрении возбуждения взрыва ударом основное внимание было уделено роли физических свойств ВВ и условий испытания. Это отнюдь не означает, что химическая структура ВВ, определяющая скорость протекающих в нем реакций и их тепловой эффект, не имеет значения. Напротив, как указывает Холево, если бы физические свойства сравниваемых ВВ были совершенно одинаковы, то частость взрывов при испытании на копре определялась бы только химической структурой. Так как в действительности эти свойства различны, то частость взрывов является функцией как химических, так и физических свойств ВВ. Нельзя, например, судить о влиянии химической структуры, не зная количественно влияния физических свойств. Это тем более справедливо, что влияние физических свойств ВВ и условий испытаний, как явствует из приведенных выше примеров, может быть весьма значительным. Поэтому следует считать ошибочными попытки некоторых исследователей рассматривать химическую структуру как единственный фактор, определяющий чувствительность ВВ.
Одновременно следует иметь в виду, что химическая структура и обусловленные ею термохимические и кинетические свойства вещества связаны с ним неотъемлемо. Поэтому их влияние будет проявляться во всех условиях воздействия, в то время как влияние физических свойств может изменяться в широких пределах, например в зависимости от внешних условий.
При многообразии факторов, влияющих на чувствительность ВВ, оценка ее безотносительно к условиям испытания или воздействия весьма затруднительна. Эта трудность усугубляется еще следующим обстоятельством. Обычно при экспериментальном определении чувствительности ее характеризуют энергией удара, при которой получается определенная частость взрывов. Как справед-
§ 1. Начальный импульс и механизм возбуждения взрыва
283
либо указал Холево, этот критерий нельзя считать обоснованным по ряду причин.
Прежде всего при ударе по ВВ в обычных условиях испытания лишь небольшая часть энергии удара поглощается самим ВВ, причем доля поглощенной энергии удара очень сильно зависит от физических свойств вещества. Так, по опытам Холево, при испытании в приборчике № 1 тротил поглощал около 80% энергии удара, гексоген в тех же условиях — не более 12%; особенно мало энергии поглощали неплавкие порошки, например уголь, песок и пр.
Поглощение энергии зависит также от условий удара. Если, например, ударник производит удар по капле воды, лежащей на плоской наковальне, то очевидно, что вода будет просто выдавлена с большой скоростью, причем затрата энергии на выдавливание будет малой, также мало будет давление, возникшее в воде при ударе. Если удар производится по свинцу, то давление в нем будет больше, скорость течения меньше, но затрата энергии удара на выдавливание — больше. Наконец, при ударе по стали напряжения будут наибольшими, а скорость деформации — наименьшей. В свою очередь, если капля воды находится в цилиндре под хорошо пригнанным поршнем, то давления, возникающие в воде при ударе, будут гораздо больше, чем в рассмотренных выше условиях.
Помимо количества поглощенной энергии, существенное значение имеют скорость ее поглощения и распределение во ВВ. Чем быстрее поглощается энергия и чем менее равномерно она распределяется, т. е. чем больше будет ее локальная концентрация, тем легче возникает взрыв.
Общая энергия удара не может однозначно характеризовать возбуждение взрыва, как это видно хотя бы из того, что иногда при увеличении энергии удара (повышении высоты падения при данном грузе) частость взрывов не возрастает или даже падает, что, очевидно, связано с менее благоприятными условиями поглощения энергии и развития взрыва.
Величина поглощенной энергии, по данным Холево, сильно колеблется от опыта к опыту, что, по-видимому, и определяет относительно очень большие колебания результатов, наблюдающиеся при экспериментальном определении чувствительности к удару.
Возникновение местных разогревов при трении твердых поверхностей, между которыми находится ВВ. Боуден экспериментально показал, что при трении металлического стержня о стеклянный диск возникают локальные кратковременные, но сильные разогревы, которые можно фотографировать. Повышение температуры можно обнаружить и измерить также по появлению термоэлектродвижущей силы, если трение осуществляется между двумя различными металлами. Кривая изменения термоэлектродвижущей силы (фиг. 5. б) представляет ряд последовательных пиков, амплитуда которых показы-
284
Гл. V. Возбуждение горения и детонации ВВ
вает, что при трении тугоплавких металлов могут достигаться очень высокие температуры. Опыт показал, что разогревы такого типа наблюдаются и в том случае, когда трущиеся поверхности смочены жидкостью. В свете этих наблюдений естественно предположить,
Фиг. 5. 6. Запись катодным осциллографом термоэлектродвижущей силы, возникающей между ползуном из константана и полированной стальной поверхностью. Нормальное давление 500 г; скорость скольжения 300 см!сек; подъемы температуры значительны и весьма кратковременны.
что если между трущимися поверхностями находится ВВ, то взрыв его, возникающий при трении, обусловлен именно указанными
разогревами.
Возникновение очагов нии инородных твердых
Таблица 5.2
Влияние содержания песка на чувствительность тротила к удару Груз 10 кг, высота падения 25 см
Содержание песка в % Частость взрывов в %
0,01—0,05 6
0,1-0,15 20
0,2—0,25 29
разогрева при тре-частиц, содержащихся во взрывчатом веществе. Разогревы по этой причине могут возникать при скользящем, а также при нормальном ударе, когда он вызывает течение ВВ, содержащего твердые примеси. Известно, что даже небольшие количества некоторых твердых примесей могут сильно повышать чувствительность к удару.
В качестве иллюстрации этого влияния можно привести данные К. К. Снитко о зависи-
мости частости взрывов тротила при ударе от содержания в нем песка (табл. 5.2). Именно поэтому к ВВ, применяемым для снаряжения боеприпасов, предъявляют жесткие требования в отношении отсутствия в них песка или других твердых примесей. Так, согласно
§ 1. Начальный импульс и механизм возбуждения взрыва
285
стандарту в тротиле допускается содержание минеральных примесей не более 0,10%; в более чувствительном ВВ — тетриле — допускается содержание минеральных примесей не более 0,05%, причем кремнезема (песка) не должно быть больше 0,015%.
В вопросе о том, какие характеристики твердых частиц определяют их сенсибилизирующее действие, до недавнего времени не было ясности. Обычно полагали, что решающую роль играет твердость частиц. Однако опыты Боудена показали, что основным свойством твердых частиц, определяющим их сенсибилизирующее действие, является не твердость, а температура плавления. Частицы веществ, имеющих температуру плавления ниже 400° С (например, кристаллы нитрата и бихромата калия, ацетата натрия), не повышают чувствительность вторичных ВВ к удару и трению. Существенным фактором является также теплопроводность тугоплавких частиц: чем выше теплопроводность, тем меньше сенсибилизирующее действие. Именно высокой теплопроводностью объясняют относительно слабое сенсибилизирующее действие поваренной соли, температура плавления которой (804° С) лежит значительно выше указанного предела (400°С).
Возникновение очагов разогрева при быстром сжатии содержащихся в ВВ пузырьков газа или пара. Сжатие и адиабатический разогрев пузырьков воздуха или иного газа при ударе может быть основной причиной появления очагов разогрева, особенно в жидких ВВ. Роль газовых пузырьков при ударе объясняют тем, что вследствие большего коэффициента сжимаемости газов при сжатии их достигается гораздо более высокая температура, чем в конденсированной фазе. Поэтому газовые включения и являются очагами возникновения горения ВВ, переходящего в условиях высокого давления при ударе во взрыв.
Наиболее убедительной иллюстрацией роли воздушных включений являются результаты опытов Боудена, когда капле нитроглицерина, расположенной на наковальне, придавали форму кольца, что резко увеличивало чувствительность к удару. Еще более резкое снижение энергии удара, необходимой для получения взрыва, наблюдалось в том случае, когда в плоской поверхности ударника делали небольшое углубление. Взрыв нитроглицерина в этих условиях происходил уже при энергии удара 0,0002 кгм, в то время как при отсутствии пузырька воздуха для этого требуется энергии 1— 10 кгм, т. е. по крайней мере в 5000 раз больше. Влияние воздушных включений может проявляться и при плоском ударнике. Если перед ударом торец такого ударника находится на некотором расстоянии от поверхности жидкого ВВ, то при одинаковой энергии удара частость взрывов гораздо больше, чем в случае, когда ударник соприкасается с В В. Это объясняется тем, что в первом случае на поверхности ударника при ударе захватываются пузырьки воздуха, разогрев которых поджигает ВВ.
286
Гл. V. Возбуждение горения и детонации ВВ
Подобное же влияние проявляется и в случае азида свинца и некоторых других легко воспламеняющихся ВВ. Это можно объяснить следующим. Высокая температура достигается при сжатии газа уже до небольших давлений. В адиабатических условиях при повышении давления всего до 20 ат температура повышается почти до 500° С.
Если воспламеняемость ВВ велика, т. е. если запас тепла в прогретом слое при горении невелик и ВВ способно гореть при небольшом давлении, то возникновение горения и взрыва возможно от разогретого газового пузырька. Если же воспламеняемость мала, то пузырьковый механизм возникновения взрыва при ударе не реализуется и взрыв возникает лишь при гораздо больших давлениях, когда наступает течение твердого ВВ.
Дополнительное подтверждение роли газовых включений при возникновении взрыва дают опыты, при которых каплю нитроглицерина в форме кольца подвергали удару при разных начальных давлениях газа, окружающего это ВВ. В тех условиях, когда в азоте при давлении в 1 ат получали 100% взрывов, при давлении в 25 ат частость взрывов падала до нуля.
Однако опыты в вакууме даже при ничтожно малых остаточных давлениях (10~5 мм рт. ст.) не показали снижения чувствительности, хотя в этих условиях сжатие пузырьков воздуха не могло играть роли. Боуден и его сотрудники полагают, что в данном случае сжатию подвергались пары ВВ, а это приводило к их разогреву и воспламенению, передававшемуся массе жидкого вещества.
Как подтверждение этого допущения они рассматривают результаты опытов, при которых в нитроглицерин были искусственно введены включения взрывчатых (метилнитрат) или невзрывчатых паров (СС14 и др.), что также приводило к повышению чувствительности к удару. То, что взрыв при ударе по жидкости, содержащей газовый пузырек, возникает именно там, где он находится, было показано Боуденом при помощи фотографирования развития взрыва (через прозрачную наковальню или ударник) на движущуюся пленку *.
Если жидкость полностью освобождена от включений газов или паров, то разогревы при ударе могут возникать в результате быстрого ее течения между соударяющимися поверхностями. Однако в этом случае требуются во много раз большие энергии удара, чем для взрыва жидкости, содержащей газовые пузырьки.
Таким образом, переход ВВ в жидкое состояние может приводить в известных условиях удара к очень большому увеличению чувствительности из-за возможности возбуждения взрыва сжатием газовых пузырьков.
* Интересно отметить, что у всех изученных ВВ, кроме азида свинца, первой стадией является более или менее быстрое горение; после сгорания некоторой части заряда горение переходит в детонацию.
§ 1. Начальный импульс и механизм возбуждения взрыва
287
3. Возникновение взрыва заряда в корпусе снаряда от сотрясения при выстреле или от удара о препятствие
Разрывной заряд артиллерийского снаряда должен обладать определенной стойкостью к сотрясениям при выстреле и при ударе о преграду. Для характеристики этой стойкости обычно исходят из тех напряжений, которые возникают в разрывном заряде при выстреле под действием сил инерции. Если напряжения достаточно велики для того, чтобы вызвать быстрое смещение и трение заряда относительно корпуса или частей заряда относительно друг друга, то при этом могут возникнуть местные разогревы, воспламенение и взрыв.
В простейшем виде расчет инерционных напряжений производят на основании второго закона Ньютона
•Е max = W^maxi (5.4)
где Рщах—максимальное значение силы, с которой пороховые газы давят на дно снаряда;
т — масса снаряда, равная GJg— весу его, деленному на ускорение силы тяжести;
amaI — максимальное ускорение, которое получает снаряд.
Так как
nd2
Рmax — Ршах >
4
где Ртах — максимальное давление пороховых газов,' dc—диаметр снаряда,
то
PmaxPd^g
Z’max’c^c
Обозначив —-----— через п, получим
4ОС
Ящах = ng, (5. 6)
где п — так называемый коэффициент перегрузки, показывает, во сколько раз максимальное ускорение снаряда превосходит ускорение силы тяжести.
Сила инерции Р, возникающая в заряде при ускорении движения снаряда, очевидно достигает максимума в донной части заряда и равна
Р — атахСз/^ (5-7)
или
F — ngG3/g = пО3, (5.8)
где О3 — вес заряда.
Напряжение f, возникающее в ВВ, равное силе, отнесенной к единице площади сечения заряда, составляет
где d3 — диаметр заряда.
288
Гл. V. Возбуждение горения и детонации ВВ
Формулу для расчета напряжений, возникающих в заряде при ударе снаряда в преграду (например, в броню), можно вывести аналогичным путем, если известна скорость снаряда в момент удара и закон его торможения в преграде.
Формула (5.9) дает правильную величину напряжения лишь в том случае, если заряд имеет форму цилиндра и скрепление его со стенками камеры снаряда, равно как и пластическая деформация при сжатии, отсутствуют.
При склеивании заряда со стенками корпуса снаряда напряжения в заряде уменьшаются, при прочном скреплении — в несколько раз. Точно так же уменьшаются напряжения в донной части заряда по сравнению с рассчитанными по формуле (5.9), если камера имеет форму усеченного конуса. Если заряд под влиянием возникших в нем напряжений расширяется в радиальном направлении и прижимается к стенкам корпуса, то это увеличивает трение между зарядом и стенками и также уменьшает напряжения в донной части заряда.
Из дефектов заряда, которые способствуют его деформации при выстреле и могут привести к преждевременным разрывам, следует указать на неравномерную плотность разрывного заряда, наличие в нем пустот и трещин, а также участков крупнокристаллического строения. Преждевременным разрывам способствует также наличие зазора между дном корпуса снаряда и разрывным зарядом. Этот зазор обычно образуется у снарядов, наполняемых заливкой через головку, вследствие уменьшения размеров заряда при его остывании. Зазор делает возможным смещение заряда при выстреле; взрыв может возникнуть также в результате быстрого сжатия находящегося в зазоре воздуха или смеси воздуха с парами летучих растворителей, на которых был изготовлен лак для покрытия внутренней поверхности корпуса снаряда.
Практикой и исследованиями установлено, что заряды из разных ВВ обладают различной стойкостью к сотрясениям при выстреле или при ударе о прочное препятствие (броня, бетон и др.). Это определяется, с одной стороны, различием в механических свойствах и физико-механической структуре зарядов из разных ВВ, вследствие чего при действии одинаковых инерционных сил деформация получается различной. Величина деформации зависит также от прочности корпуса снаряда. С другой стороны, важным фактором являются различия в чувствительности разных ВВ, в способности их взрываться под влиянием местных разогревов, возникающих при сдвигах. Практически принято характеризовать чувствительность различных ВВ к сотрясениям при выстреле (или при ударе о преграду) наибольшим напряжением в опасном сечении разрывного заряда, при котором еще не возникает взрыв. Эти наибольшие напряжения называют критическими.
Следует подчеркнуть еще раз, что само по себе напряжение (давление), даже очень высокое (см. § 1, разд. 2), не может вызвать взрыва. Взрыв возникает лишь в том случае, если под действием напряжений в заряде происходят деформации (сдвиги, удары), при которых могут образоваться очаги разогрева. При высоком давлении воспламенение, возникшее в очаге разогрева, легко переходит во взрыв. Возможность возникновения взрыва определяется поэтому не только тем, из какого ВВ состоит заряд и какие
1. Начальный импульс и механизм возбуждения взрыва
289
напряжения в нем возникают, но также качеством снаряжения, формой заряда, прочностью скрепления его с корпусом и т. п. Критические напряжения являются характеристикой не одного только ВВ, из которого состоит заряд, но также конструкции заряда, технологии снаряжения и других факторов. Практическое значение этих напряжений заключается в том, что они указывают опасную границу для определенных конструкций разрывного заряда и способов снаряжения, для которых были проведены соответствующие испытания.
При проектировании снарядов допустимые напряжения, естественно, берут ниже критических, чтобы обеспечить полную безопасность от возникновения преждевременных взрывов. Имеющиеся в литературе данные по допустимым напряжениям для некоторых ВВ приведены в табл. 5. 3.
Таблица 5.3
Допустимые напряжения для некоторых взрывчатых веществ
ВВ Допустимое напряжение кг/сл2
Тротил Пикриновая кислота Сплав пикриновой кислоты и динитронафталина 80/20 Черный порох Амматол 80/20 1100 500 600 150 1000
При пользовании табл. 5.3 следует помнить, что эти данные по существу характеризуют свойства системы, включающей корпус снаряда, устройство заряда и чувствительность ВВ, из которого состоит этот заряд. Если характеристики корпуса и заряда будут изменены, то значение критического напряжения данного ВВ также может измениться.
4. Действие взрывного импульса на ВВ
Взрыв заряда взрывчатого вещества может быть возбужден взрывом другого заряда. В частном случае, когда заряды находятся на некотором расстоянии друг от друга, это явление носит название передачи детонации на расстояние. Заряд, который взрывается первым, называют активным, или инициирующим, зарядом; заряд, который взрывается под влиянием взрыва активного заряда, называют пассивным, или инициируемым, зарядом.
290
Гл. V. Возбуждение горения и детонации ВВ
Обычно за меру инициирующего действия или, иначе говоря, способности данного ВВ вызывать взрыв других ВВ, принимают величину минимального активного заряда, необходимого для возбуждения взрыва в определенных условиях.
В случае инициирующих ВВ взрыв активного заряда обычно возбуждается поджиганием.
Зависимость инициирующего действия инициирующих ВВ от их химических или физических свойств непосредственно не установлена. Ниже приведены некоторые фактические данные об инициирующем действии разных ВВ.
Взрыв одинаковых зарядов пироксилина возбуждали различными инициирующими ВВ; в свою очередь, взрыв этих ВВ вызывали поджиганием. В этих условиях минимальные активные заряды, называемые также предельными зарядами, оказались равными: для гремучей ртути 0,3 г, для хлористого азота 3,25 г, йодистого азота более 6,5 г.
Для возбуждения взрыва пикриновой кислоты достаточно 0,024 г азида свинца или 0,25 г гремучей ртути; в то же время взрыв заряда в 0,5 г сернистого азота или азотнокислого диазобензола не вызывает взрыва пикриновой кислоты.
Количество энергии, выделяющейся при взрыве 0,25 г гремучей ртути, заведомо больше, чем при взрыве 0,024 г азида свинца; больше и скорость детонации гремучей ртути, а также объем образующихся при взрыве газов. Точно так же гораздо больше энергия и количество газов, образующихся при взрыве 6,5 г йодистого азота по сравнению с 0,3 г гремучей ртути.
Для объяснения этих наблюдений следует согласно Велеру допустить, что при зажигании инициирующие ВВ дают детонацию не сразу, а лишь после некоторого периода горения. При этом длина участка горения для различных инициирующих веществ различна. Способность вызывать взрыв обусловлена в основном ударом, который продукты взрыва активного заряда производят по пассивному заряду, т. е. величиной давления, а также скоростью его нарастания. Так как сила и резкость удара определяются прежде всего скоростью распространения процесса, то ВВ, имеющее кратчайший участок преддетонационного горения, будет при прочих равных условиях вызывать взрыв лучше других. Иначе говоря, предельный заряд этого ВВ будет меньше, чем остальных веществ.
Приведенные соображения можно пояснить следующим графиком (фиг. 5.7), где по оси абсцисс отложено расстояние от места воспламенения заряда инициирующего ВВ, поджигаемого с торца, по оси ординат — скорость распространения процесса и, достигаемая ь данном сечении заряда. На графике схематически показаны соотношения, имеющие место для азида свинца и гремучей ртути На фиг. 5. 7 видно, что скорость детонации гремучей ртути больше, чем азида свинца, но она имеет более длинный участок горе
§ 1. Начальный импульс и механизм возбуждения взрыва
291
ния. Поэтому при малых зарядах инициирующее действие гремучей ртути будет меньше, чем азида свинца.
График фиг. 5. 7 не вполне точно отображает явление, так как, по-видимому, переход горения в детонацию в действительности происходит не путем постепенного увеличения скорости распространения, а скачкообразно (см. стр. 186). Именно поэтому можно наблюдать резкий переход от инициирования к отказам при снижении величины заряда ниже предельного.
Даже современные методы не позволяют еще с достаточной
точностью измерить скорость детонации на очень коротких участках, для того чтобы дать прямое экспе-
риментальное подтверждение рассмотренной гипотезы. Однако косвенные подтверждения ее имеются: для ряда инициирующих ВВ (гремучая ртуть, тринитрорезорцинат свинца, цианурт-риазид) участок горения при возбуждении взрыва ударом, накаленной проволокой или искрой удалось наблюдать экспериментально (фотографирование на движущуюся пленку). В тех же условиях и даже при большей разрешающей способности аппаратуры (электронно-оптический преобразователь) не
Фиг. 5.7. Развитие детонации при поджигании инициирующих ВВ по Велеру.
удалось отметить участок горения в ;_азнд свияца. 2_гремучая ртуть, азидах свинца или серебра. В качестве
косвенного доказательства гипотезы Велера можно привести также результаты весьма простых опытов. Если поджечь несколько миллиграммов азида свинца на твердой подкладке, например на стекле, то происходит взрыв с резким звуком и сильным механическим эффектом; в стекле обычно получается отверстие без радиальных трещин. При аналогичном опыте с гремучей ртутью даже при навеске в несколько десятков миллиграммов происходит почти беззвучная вспышка без механического эффекта. Если же добавить к гремучей ртути очень маленький кристаллик азида свинца, который сам по себе не производит почти никакого механического действия, то при поджигании гремучая ртуть взрывается, пробивая стекло. В послед.
нем случае под влиянием взрыва азида свинца участок горения гремучей ртути сильно сокращается и горение ее успевает перейти во взрыв. Добавление азида свинца резко увеличивает также инициирующее действие гремучей ртути в малых зарядах.
В технике взрывной импульс осуществляют главным образом при помощи капсюля-детонатора, который является основным средством возбуждения взрыва вторичных ВВ, как в горном, так и в
военном деле.
В своем первоначальном виде капсюль-детонатор представлял собой металлическую гильзочку, содержащую небольшой заряд:
292
Гл. V. Возбуждение горения и детонации ВВ
I—2 г инициирующего ВВ. При поджигании или наколе инициирующего ВВ быстро возникает детонация. Детонация капсюля-детонатора, помещенного в заряд вторичного ВВ, надежно возбуждает взрыв последнего. Изобретение капсюля-детонатора в 1864 г. составило эпоху в развитии применения ВВ. Многие вещества и смеси, не взрывающиеся при действии других импульсов, оказались способ
ными детонировать от капсюля-детонатора.
Чем же определяется высокая эффективность капсюля-детонатора как средства возбуждения детонации? При взрыве капсюля чрезвычайно быстро образуются газы, имеющие очень высокие температуру и давление; эти газы производят резкий удар по ВВ, в которое введен капсюль-детонатор. Такой удар и является основным фактором, обусловливающим возбуждение взрыва; температура газов имеет значение лишь постольку, поскольку с ней связано достигаемое давление. Поэтому при выборе ВВ для снаряжения капсюлей-детонаторов обычно ориентируются на высокобризантные ВВ с большой скоростью детонации и плотностью, создающие при взрыве резкий и большой подъем давления.
Фиг. 5.8. Устройство Эти соображения определили современное капсюля-детонатора. устройство капсюлей-детонаторов, в которых большая часть заряда инициирующего вещества заменена вторичным ВВ большей бризантности — тетрилом, тэном, гексогеном и т. п. Дело в том, что гремучая ртуть при детонации в максимально спрессованном состоянии (р «4,4 г/щи3) обладает большой бризантностью; однако в этом виде ее нельзя приме-
нять в капсюлях-детонаторах, так как она оказывается запрессованной «намертво» и большая часть заряда выгорает, не детонируя. Поэтому гремучую ртуть запрессовывают в капсюли-детонаторы под умеренным давлением (300—350 ат), дающим небольшую плотность (2,8—3,0 г/щи3). В таком виде гремучая ртуть дает быстрый переход горения в детонацию, но имеет малую бризантность и относительно слабое инициирующее действие. Кроме того, гремучая ртуть относительно дорога и в сухом виде опасна в обращении.
По всем этим причинам в современных капсюлях-детонаторах заряд гремучей ртути уменьшен и составляет обычно не более 0,5 г, а вместо нее в нижнюю часть гильзы запрессовывают до большой плотности вторичное ВВ обычно в количестве 1 г (фиг. 5.8). Такой комбинированный заряд общим весом 1,5 г оказывает не меньшее, а даже несколько большее инициирующее действие, чем 2 г гремучей ртути при умеренной ее плотности. Чтобы ускорить переход горения гремучей ртути в детонацию, поверх ее запрессовывают металлическую чашечку с небольшим центральным отвер
§ 1. Начальный импульс и механизм возбуждения взрыва
293
стием, через которое происходит зажигание. Наличие этой чашечки затрудняет отток газов, способствуя повышению давления и соответственно ускорению горения. Кроме того, чашечка защищает поверхность инициирующего ВВ от трения при введении в гильзу огнепроводного шнура и поэтому уменьшает опасность обращения с капсюлями-детонаторами.
Вместо гремучей ртути применяют также азид свинца. В этом случае поверх слоя азида запрессовывают небольшое количество трииитрорезорцииата свинца— ВВ, обладающего слабым инициирующим действием, ио хорошей воспламеняемостью. Такая конструкция заряда обеспечивает безотказное воспламенение от огнепроводного шиура или электровоспламеиителя. Без трииитрорезорцииата свинца надежное действие капсюля обеспечить трудно, так как азид свинца отличается сравнительно низкой воспламеняемостью.
Капсюли-детонаторы, содержащие азид свинца, имеют гильзы из алюминия, так как предполагается, что в присутствии шахтного воздуха, содержащего много углекислоты и паров воды, возможен гидролиз азида и образование нерастворимого карбоната свинца. При этом освобождаются заметные количества азотисто-водородиой кислоты, которая в контакте с медью может образовывать очень чувствительный и поэтому опасный азид меди.
За последние десятилетия у иас в горном деле в целях экономии меди значительное применение получили гремуче-ртутио-тетриловые капсюли-детоиаторы в дешевой бумажной (картонной) гильзе.
5. Действие на В В ионов, электронов, ядерных осколков, а-частиц, лучей Рентгена и ультразвука
Действие электронов на различные взрывчатые вещества было изучено впервые Рогинским, а затем и другими исследователями. Установлено, что электроны вызывают медленное разложение ВВ. Взрыв возникает лишь в том случае, если при длительном действии мощного потока электронов происходит сильный разогрев ВВ.
Так, Боуден и Синг наблюдали взрывы азидов свинца, серебра и кадмия, йодистого азота и ацетиленистого серебра при интенсивной бомбардировке их электронами. Заменяя ВВ калиевой селитрой (точка плавления 334° С) в тех же условиях действия электронов, они наблюдали плавление селитры, что и указывает на высокую достигаемую температуру.
Действие ионов, в особенности тяжелых (Ar, Hg), может, по данным опытов Кальмана и Шренклера, вызывать взрыв. При этом общая, необходимая для взрыва энергия уменьшается с повышением напряжения поля, определяющего энергию отдельного иона.
Однако согласно Беляеву взрывы в этих опытах возникали не непосредственно от действия ионов, а в результате образования значительной разности потенциалов между подкладкой, на которой помещали ВВ, и отрицательно заряженными частями прибора с последующим проскакиванием электрической искры. При позднейших опытах Беляева и Харитона, проведенных в условиях, исключающих воспламенение искрой, взрывов при действии потока ионов на различные ВВ не наблюдалось.
294 Гл. V. Возбуждение горения, и детонации ВВ
Медленные нейтроны (число нейтронов на 1 см2 в 1 сек. составляло для разных ВВ от 106 до 108) не приводят к взрыву азидов кадмия, лития, серебра и свинца, ацетиленистого серебра и йодистого азота даже при длительном (до 1 часа) облучении.
Бомбардировка ядерными осколками U235 азидов свинца и кадмия также не приводила к взрыву как при обычной, так и при повышенных (до 290° С) температурах. Йодистый азот в этом случае дает взрыв. Смесь йодистого азота с окисыо урана самопроизвольно детонирует без облучения нейтронами после двадцатиминутного высушивания, в то время как сам иодистый азот в тех же условиях не дает взрыва в течение многих часов. При действии нейтронов (6000 в сек.) время до возникновения взрыва сокращается вдвое. Другие изучавшиеся взрывчатые вещества — нитродиазобензол, перхлорат, гексаметилентрипероксиддиамин, тринитротриазидобен-зол и гремучая ртуть не детонировали в этих условиях опыта.
Действие а-частиц, точнее говоря, всего излучения, даваемого радием, изучалось Гарнером и Мюрауром. В случае азида бария облучение при комнатной температуре не вызывает разложения и не отражается на характере и скорости последующего термического распада. Облучение при высокой температуре ускоряет разложение. Однако вопреки ожиданию действие облучения проявляется, главным образом, не в увеличении числа образующихся зародышей реакции, а в повышении скорости роста 'этих зародышей. На разложение гремучей ртути излучение радия влияния не оказывает. Ни при одном из исследованных взрывчатых веществ, даже иодистом азоте, взрыва получить не удалось.
Предварительное облучение тепловыми нейтронами, по Боудену и Сингу, вдвое сокращает индукционный период при термическом распаде азида лития и значительно увеличивает скорость распада. В случае азидов свинца и кадмия также наблюдается некоторое, но более слабое, чем у азида лития, ускорение распада. На разложение азида серебра (в расплавленном состоянии) предварительное облучение нейтронами не влияет.
При действии лучей Рентгена на азиды бария, свинца и серебра наблюдается медленное разложение даже при комнатной температуре, но взрыва не наступает.
Убедительным и наглядным доказательством того, что отдельные элементарные частицы даже при весьма большой их энергии не в состоянии вызвать взрыв ВВ, является сам факт существования радиоактивных ВВ, например азида радия, полученного еще в 1910 г. Это ВВ по свойствам, в частности, по устойчивости, сходно со своим аналогом — азидом бария; непрестанное действие всех видов излучения, возникающего при распаде атомов радия, не оказывает существенного влияния па свойства азида радия как ВВ.
Все эти опытные данные согласуются с современными представлениями о том, что для возникновения взрыва необходимо образо
§ 1. Начальный импульс и механизм возбуждения взрыва
295
вание очага распада, состоящего из весьма большого числа молекул; поэтому нет оснований ожидать возникновения взрыва от удара отдельных элементарных частиц даже при очень большой их энергии. Как показывают опыты, действие ядерных осколков распада урана, несущих очень большую энергию, во много миллионов раз превышающую обычные энергии активации, не вызывает взрыва при прохождении через азид свинца, хотя при этом на пути частицы, несомненно, активируется и распадается большое число отдельных молекул ВВ. Даже если предположить, что энергия частицы не непосредственно используется на активацию молекул, а превращается в тепло, нагревающее ВВ до 400° С, то объем такого очага разогрева ВВ составит около 3 • 10~и см3, т. е. будет включать миллиарды молекул.
Таким образом, возбуждение взрыва связано с возникновением большого (по сравнению с размерами молекулы) очага распада. По данным Харитона и Беляева о передаче детонации между кристаллами азида свинца, диаметр быстролетящей частицы, способной вызвать детонацию пассивного кристалла, имеет порядок 1 мк. На основании опытов по возбуждению взрыва ударом Боуден оценивает размеры очага разогрева, необходимого для возникновения взрыва, в 10-5—10~3сл!. Естественно, что эти размеры зависят от природы ВВ и его температуры. Боуден и Синг определяли наименьшие размеры кристалликов некоторых инициирующих ВВ (азиды свинца, кадмия и серебра), достаточные для получения взрыва при нагреве. При температуре 300—400° С эти размеры составляют 20—60 мк, что хорошо согласуется с другими оценками, полученными применительно к условиям удара.
Ультразвук с частотой колебаний 106 в сек., но опытам Маринеско, вызывает взрыв йодистого азота, гремучего серебра и других высокочувствительных соединений; если ВВ сплавлено или пропитано парафином, то взрыва не получается. Действие ультразвука объясняется тем, что он создает на своем пути повышенное давление (в условиях данных опытов до 8 ат), разогревающее воздух, заключенный между частицами ВВ, до температур, превышающих температуру вспышки. Однако Харитон наблюдал при действии ультразвука взрыв хлористого азота, т. е. жидкого ВВ, где этот механизм непосредственно как будто исключается.
В заключение следует упомянуть об интересном явлении, открытом Харитоном и Беляевым в Советском Союзе и Гарнером в Англии. Если при обычной комнатной температуре откачивать сосуд, в котором находится йодистый азот, то при достижении давления 0,1 мм рт. ст. происходит взрыв. Таким образом, в этом случае начальным импульсом служит вакуум. Действие откачивания английские исследователи объясняют тем, что при этом с поверхности частиц йодистого азота удаляются адсорбированные газы (в первую очередь аммиак), тормозящие его распад.
296
Гл. V. Возбуждение горения и детонации ВВ
В свете этих данных вероятно, что взрыв йодистого азота при прикосновении к нему бородкой птичьего пера также вызывается образованием обнаженной поверхности.
Возникновение взрыва при откачивании воздуха наблюдалось Апиным и для жидкого хлористого азота; оно связано в этом случае с развитием цепной реакции в парах при понижении давления над жидкостью. По аналогии Апин объясняет и возникновение взрыва при эвакуации сосуда с иодистым азотом.
Следует отметить также открытое Майльсом самопроизвольное возникновение взрыва p-форм азидов свинца и ртути, происходящее при образовании их кристаллов из водных растворов азида натрия и азотнокислого свинца или ртути, и самопроизвольные взрывы азида двухвалентной ртути при охлаждении ее разогретых кристаллов. Значение и интерес этих фактов заключаются в том, что они показывают возможности возникновения взрыва, не связанные непосредственно с повышением температуры ВВ *.
§ 2. ЧУВСТВИТЕЛЬНОСТЬ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
1. Связь между химической структурой и чувствительностью В В
Несомненно, что химическая структура ВВ —состав молекулы, характер и энергия связей между атомами, их взаимное расположение и влияние, определяющие и физические и химические свойства вещества, обусловливают скорость его химического превращения при нагреве и тепловой эффект соответствующих реакций, а следовательно, и чувствительность.
Рассматривая чувствительность ВВ к нагреву, мы установили, что одной из главных ее характеристик является скорость термического распада ВВ. Однако связь даже между этой простейшей характеристикой и химической структурой оказывается очень сложной.
Правда, различия между разными классами ВВ в целом довольно определенны. Так, нитроэфиры спиртов и углеводов распадаются с большей скоростью при нагреве и более чувствительны к теплу и удару, чем нитросоединения углеводородов бензольного ряда; ароматические нитрамины занимают промежуточное положение. Однако в рамках веществ одного и того же класса, с одинаковыми типами связей, обнаруживаются очень большие различия в отношении реакционной способности. Так, например, введение четвертой нитрогруппы в бензольное кольцо, не меняющее типа связей, настолько понижает стойкость при нагреве (особенно в присутствии влаги), что тетранитросоединения до настоящего времени не полу
* Как на одну из таких возможностей можно указать на возникновение электрических зарядов при разломе кристалла ВВ на части. При образовании значительной разности потенциалов электризация может привести к проскакиванию искры и воспламенению ВВ.
§ 2. Чувствительность взрывчатых веществ
297
чили практического значения, несмотря на то, что по силе взрыва они превосходят тринитросоединения.
С другой стороны, некоторые структуры приводят к существенному уменьшению реакционной способности. Так, например, пентаэритриттетранитрат (тэн) значительно более стоек при нагреве, а также при ударе, чем большинство нитроэфиров, близких ему по энергии взрыва. Однако новейшие исследования показывают, что эти особенности пентаэритриттетранитрата обусловлены его твердым состоянием при обычной температуре. В жидком состоянии по скорости термического распада тэн близок к нитрогликолю и нитроглицерину. Таким образом, в этом случае влияние химической структуры проявляется не прямо, а косвенно — через ее влияние на температуру плавления вещества. Тринитротриазидобензол имеет значительно большую стойкость при нагреве, чем динитро-триазидобензол, в то же время по содержанию энергии он существенно превосходит динитротриазидобензол. Особенно низкую скорость термического распада имеют циклотриметилентринитрамин (гексоген) и циклотетраметилентетранитрамин (октоген), по химической стойкости близкие к тротилу, а по энергии взрыва сильно его превосходящие. Стойкость же ароматического нитрамина — тетрила гораздо меньше. Очень низкой чувствительностью к детонации обладают сильно эндотермичные синильная кислота и некоторые ее соли.
Все эти факты следует объяснить взаимным влиянием атомов и групп, которое может существенно изменять устойчивость молекулы. К сожалению, это влияние пока недоступно полному учету и важная для техники задача — изыскание более эффективных, но умеренно чувствительных ВВ —решается лишь путем эксперимента.
Следует добавить, что отрицательное значение большой чувствительности к действию тепла может усугубляться резко выраженным самоускоряющимся характером распада. В этом случае самовоспламенение и взрыв могут наступать даже при относительно низких температурах, вплоть до обычных температур хранения при условии, что толщина слоя ВВ и продолжительность его пребывания при такой температуре велики.
Количественная характеристика самоускорения распада ВВ также не может быть в настоящее время достоверно предсказана. К тому же в различных условиях для одного и того же ВВ самоускорение может проявляться в разной степени. В итоге в большинстве случаев нельзя иначе как по аналогии предвидеть, как велика будет скорость медленного распада того или иного нового взрывчатого соединения, хотя ее величина, определяющаяся в первую очередь энергией активации, наиболее простым образом связана с химической структурой ВВ.
Еще менее созревшим для научного анализа является вопрос о связи между химической структурой и чувствительностью ВВ к другим технически важным видам начального импульса — удару, трению, капсюлю-детонатору и пр. Возбуждение взрыва в этих случаях может в решающей степени зависеть, как мы видели, от физических свойств ВВ и условий воздействия. Отсутствие парал
298
Гл. V. Возбуждение горения и детонации ВВ
лелизма между чувствительностью к различным видам начального импульса подчеркивает сложность явления, которое нельзя считать зависящим только от химической структуры ВВ как таковой, вне взаимосвязи с комплексом его физических свойств и условий испытания.
Легко показать на ряде примеров, что химическая структура сама по себе является лишь одним из факторов, определяющих чувствительность ВВ. Так, некоторые вещества (например, бертолетова соль и красный фосфор), не взрывчатые сами по себе, дают механические смеси, обладающие чрезвычайно большой чувствительностью. Добавление к ВВ небольших количеств химически инертных веществ, не изменяющее его химической структуры, может, как мы видели, в значительной степени изменять чувствительность к механическим воздействиям. Наконец, чувствительность к удару может изменяться при изменении условий испытания, что также нельзя объяснить непосредственным влиянием химической структуры.
С первого взгляда может показаться странным, что для возникновения при ударе химического процесса, каковым является взрыв, решающим фактором могут быть не химические силы, связывающие атомы в молекулы, а более слабые силы взаимодействия между молекулами, определяющие текучесть вещества. Однако это противоречие только кажущееся. Первой стадией возникновения взрыва при механических воздействиях является локальный разогрев, возникающий от трения, т. е. зависящий от текучести ВВ. Влияние химико-кинетических факторов может проявиться только после этого и лишь постольку, поскольку возник первичный разогрев; развитие химического процесса может играть решающую роль лишь в дальнейшем. Именно в этом смысле межмолекулярные силы могут иметь определяющее значение при возникновении взрыва от удара.
Поясним сказанное такой аналогией. Представим себе шашку чувствительного ВВ, лежащую на полке, расположенной над стальной плитой. Если шашку столкнуть с полки, то она упадет на плиту и взорвется. Ясно, что сила, которую нужно приложить, чтобы сдвинуть шашку и вызвать этот взрыв, определяется коэффициентом трения между ВВ и материалом полки, а не непосредственно химической структурой ВВ.
Все это показывает, что химическая структура соединения является отнюдь не единственным фактором, определяющим его чувствительность. Не имея возможности количественно учитывать другие факторы, мы при рассмотрении вопроса о связи между чувствительностью и химической структурой вынуждены ограничиваться накоплением, описанием и систематизацией фактов, не всегда давая ответ на вопрос о конкретных причинах тех или иных экспериментально установленных закономерностей.
§ 2. Чувствительность взрывчатых веществ
299
Одной из первых работ в этом направлении являются исследования Холево, установившего, что вопреки ожиданию более слабые (по энергии взрыва) ксилил и тринитромезитилен гораздо более чувствительны к удару, чем тротил (см. табл. 5.4).
Более подробное исследование чувствительности к удару различных ароматических нитросоединений было проведено Велером и Венцельбергом. Их опыты (навеска 0,02 г ВВ была под давлением 1000 ат запрессована в латунный колпачок от капсюля-воспламенителя и закрыта сверху листком станиоля) показали, что закономерность, установленная Холево для метильных производных тринитробензола, может быть распространена и на другие заместители, входящие в нитросоединения бензола. Общий вывод этих авторов заключается в том, что чувствительность к удару взрывчатых ароматических нитропроизводных определяется прежде всего общим числом заместителей, входящих в бензольное кольцо. Вид и положение заместителей не оказывают при этом большого влияния. Поэтому ВВ с различными заместителями, но при их одинаковом общем числе обладают приблизительно одинаковой чувствительностью.
Эти выводы могут быть проиллюстрированы табл. 5. 4, в которой показано повышение чувствительности к удару с увеличением числа метильных групп, гидроксилов, галоидов и нитрогрупп в бензольном ядре. Чувствительность выражена через работу удара (энергия падающего груза за вычетом энергии отскока — см. стр. 311), необходимую для получения 50% взрывов и отнесенную к 1 см2 площади заряда.
Данные табл. 5. 4 находятся в некотором противоречии с общими соображениями относительно факторов, определяющих взрывчатость и чувствительность. При введении энергетически «инертных» заместителей, например галоидов или метила, чувствительность повышается так же, как и при введении таких заместителей, как NO2, увеличивающих теплоту взрыва. Однако, во-первых, как уже было отмечено, неизвестно, каковы тепловой эффект и скорость тех реакций, которые непосредственно приводят к возникновению взрыва при ударе,во-вторых, неясно, что и в какой мере определяет в данном случае различия в чувствительности, — только ли различия в химическом составе изучавшихся нитросоединений или же играют роль также различия в их физикомеханических свойствах (текучести, температуре плавления и др.). Таким образом, дать достоверное объяснение полученных закономерностей пока не представляется возможным.
Не имели успеха и другие попытки установить и теоретически обосновать связь между химической структурой и чувствительностью ВВ к удару, хотя они и дали ценные фактические сведения по чувствительности различных ВВ, а также показали условность некоторых выводов Велера и Венцельберга,
300
Гл. V. Возбуждение горения и детонации ВВ
Таблица 5.4
Чувствительность к удару нитропроизводных с различным числом заместителей (по Велеру и Веицельбергу)
ВВ Число 1 заместителей еч* 2 сч 5 о АО «я сЧ 60 Си ВВ Число I заместителей сч ча АО ГЗ СЧ 60 а,
Влияние СНд-группы: Влияние атомов Вт:
Динитробензол 2 19,5 Динитробензол 2 19,5
Динитротолуол 3 18,9 Бромдинитробензол 3 13,9
Динитроксилол 4 14,6 Дибромдинитробензол 4 12,5
Динитромезитилен 5 13,8 Трибромдинитробензол 5 7,7
Тринитробензол 3 12,1 Влияние ЬЮ2-группы:
Тринитротолуол 4 11,4 Динитробензол 2 19,5
Тринитроксилол 5 5,7 Тринитробензол 3 12,1
Тринитромезитилен 6 5,9 Динитротолуол 3 18,9
Влияние ОН-группы: Тринитротолуол 4 11,4
Динитробензол 2 19,5 Динитроксилол 4 14,6
Динитрофенол 3 12,7 Тринитроксилол 5 5,7
Динитрорезорцин 4 10,3 Динитромезитилен 5 13,8
Тринитробензол 3 12,1 Тринитромезитилен 6 5,9
Тринитрофеиол 4 8,2 Динитрофенол 3 12,7
Тринитрорезорцин 5 4,0 Тринитрофенол 4 8,2
Влияние атомов С1: Динитрорезорцин 4 10,3
Динитробензол 2 19,5 Тринитрорезорцин 5 4
Хлор динитробензол 3 12,0 Хлординитробензол 3 12
Дихлор динитробензол 4 10,2 Хлортринитробензол 4 11,3
Тринитробензол 3 12,1
Хлортринитробензол 4 11,3
Так, по исследованиям Ф. А. Баума, проведенным в приборчи-
ках, отличных от приборчиков, примененных Велером и Венцель-бергом, различные заместители далеко не равноценны в отношении характера и степени их влияния на чувствительность нитропроизводных ароматического ряда. Накопление электроотрицательных заместителей в молекуле нитросоединений приводит, по Бауму, к расшатыванию связей между атомами; электроположительные заместители, находящиеся между двумя нитрогруппами, расположенными в мета-положении друг к другу, оказывают обратное действие.
§ 2. Чувствительность взрывчатых веществ
301
Этими соображениями Баум объясняет наблюдавшуюся при опытах более высокую чувствительность тринитропроизводных фенолов (пикриновой кислоты, тринитрорезорцина, тринитрофлороглюцина) по сравнению с чувствительностью тринитропроизводных соответствующих метилбензолов (тротила, ксилила, тринитромези-тилена). Еще большее влияние оказывает аминогруппа, имеющая по сравнению с метильной группой более выраженные электроположительные свойства (табл. 5.5). :
Таблица 5. 5
Чувствительность к удару различных тринитросоединений ароматического ряда (по Бауму)
ВВ Частость взрывов при стандартных условиях испытания в % Энергия удара, при которой частость взрывов составляет 50% кгм\см2
а-тринитротолуол 4 —
7-тринитротолуол 16 .—
Тринитрофенол 18 2,40
Тринитроксилол 22 2,30
Тринитрокрезол 34 2,14
Тринитроаминофенол 24 *’—
Тринитрорезорции 64 1,34
Тринитромезитилен 36 1,95
Тринитрофлороглюцин 100 —
Введение в бензольное кольцо аминогруппы приводит к весьма значительному снижению чувствительности, что особенно отчетливо проявляется при сравнении пикриновой кислоты и тротила с тринитроанилином и тринитрорезорцина с тринитроаминофенолом. Чувствительность к удару исследованных ароматических нитроаминов — тринитроанилина и тринитрофенилендиамина — оказалась настолько низкой, что при испытании в стандартных приборчиках и высоте падения не только 25, но и 50 см (груз 10 кг) в 25 опытах не было получено ни одного взрыва.
С увеличением числа групп СН3 и ОН чувствительность соответствующих нитросоединений последовательно возрастает, с увеличением же числа NH2-rpynn чувствительность, напротив, падает.
На основании соображений об энергии связи атомов в кристаллической решетке Баум объясняет также различия в чувствительности азидов разных металлов. Он рассчитал относительные величины энергии решетки различных азидов и, сопоставив их с частостью взрывов при испытании на копре, пришел к заключению, что
302
Гл. V. озбуждение горения и детонации ВВ
по мере уменьшения этой энергии чувствительность к удару возрастает. Так как энергия кристаллической решетки тесным образом связана с энергией взрыва, которая в свою очередь является существенным фактором взрывчатости, вывод Баума является в принципе вполне обоснованным.
Для установления зависимости между строением взрывчатых органических соединений и чувствительностью Л. И. Багал определил чувствительность к удару ряда нитропроизводных ароматических углеводородов с нитрогруппой в ядре и в боковой цепи, нитрогалоидопроизводных ароматических углеводородов, нитропроизводных одно- и многоатомных фенолов, нитропроизводных ароматических аминов, аминофенолов и карбоновых кислот, ароматических азидов, диазосоединений и их нитропроизводных. На основании полученных результатов Багал, как и Баум, пришел к выводу, что чем больше число непрочных связей в молекуле, тем выше чувствительность ВВ к удару. При введении в молекулу заместителей на чувствительность оказывает влияние не только их природа, но и положение, а также возможность размещения в плоскости бензольного ядра. В солях ароматических диазосоединений в отличие от всех других нитропроизводных ароматического ряда нитрогруппа понижает чувствительность к удару; это влияние Багал объясняет ионным характером рассматриваемых соединений. Чувствительность к удару по Багалу возрастает также в том случае, если возможно образование межмолекулярной или внутримолекулярной водородной связи.
Общим недостатком работ Баума и Багала является то, что они не учитывали влияние на чувствительность изучавшихся соединений физико-механических, а отчасти и термо-химических факторов, которое могло быть весьма существенным.
2. О влиянии на чувствительность физических характеристик В В
Выше было отмечено большое влияние на возникновение взрыва при ударе таких характеристик ВВ, как текучесть (коэффициент внутреннего трения) и температура плавления. Влияние твердых инертных примесей при значительном их содержании определяется, как мы видели, прежде всего вызываемым ими изменением текучести; в зависимости от свойств вещества и условий удара одна и та же примесь может как повышать, так и понижать чувствительность.
В настоящем разделе мы рассмотрим влияние на чувствительность к удару еще некоторых физических характеристик ВВ, таких, как размеры кристаллов, агрегатное состояние, полиморфная форма, температура и плотность. Влияние этих характеристик не всегда может быть объяснено теоретически, и рассматриваемые закономерности в главной их части имеют эмпирический характер. Следует добавить, что значительная часть соответствующих иссле
§ 2. Чувствительность взрывчатых веществ
303
дований была проведена в то время, когда еще отсутствовали даже общие представления о конкретном механизме возбуждения взрыва при ударе. Поэтому опыты ставили обычно без учета тех экспериментальных условий, которые могут играть решающую роль.
Размеры кристаллов
Обычно большим кристаллам ВВ приписывали чрезвычайно повышенную чувствительность. Так, Бруисвиг отмечает, что с увеличением кристаллов азида свинца неизменно возрастает и его чувствительность к удару; большие кристаллы (длиной 3 мм и толщиной 0,25 мм) взрываются в момент излома или от прикосновения бородки пера подобно иодистому азоту; между тем более мелкие кристаллы (0,1 мм в поперечнике) взрываются лишь от удара при падении груза с высоты 65 мм, а очень мелкокристаллический порошок даже только с 200 мм. При этом высокую чувствительность больших кристаллов объясняли якобы существующими в них повышенными напряжениями, которые в некоторых случаях могут приводить даже к самопроизвольным взрывам.
Представления о резко повышенной чувствительности ВВ в больших кристаллах возникли в результате работ Велера над азидами, в частности, над азидом свинца.
Азотистоводородная кислота и ее соли были открыты Курциусом в 1891 г. Вскоре после этого германским военным ведомством а секретном порядке были поставлены исследования с целью практического применения азидов. Однако эти опыты сопровождались несчастными случаями с человеческими жертвами и были прекращены. Не зная об этих работах, Велер предпринял аналогичные исследования, которые точно так же сопровождались неожиданными взрывами, но закончились успешно. Велер установил, что самопроизвольные взрывы наблюдаются только при определенном режиме кристаллизации, а именно, когда получаются крупные кристаллы. Разработав соответствующие условия кристаллизации, Велер добился относительной безопасности технологического процесса получения азида, обеспечившей его широкое применение.
Таким образом возникла гипотеза об исключительной опасности больших кристаллов. В настоящее время наблюдения Велера следует толковать несколько иначе (см. ниже), и они не могут служить основой для решения вопроса о зависимости между величиной кристаллов и чувствительностью к удару.
То, что азид свинца в кристаллах больших размеров не обязательно обладает приписываемой ему в этом состоянии исключительно высокой чувствительностью, видно из следующего опыта. Между двумя дисками из мягкой стали помещали крупный кристалл азида (a-форма). При падении груза весом в 10 кг с высоты 50 см кристалл дробился в мелкий порошок, но взрыва при этом не наблюдалось, хотя сила удара была столь велика, что на поверхности верхнего диска в месте нахождения кристалла образовалась вмятина.
Другие экспериментальные данные о влиянии размеров кристаллов на чувствительность носят довольно разноречивый характер.
304 Гл. V. Возбуждение горения и детонации ВВ
Так, в одной из позднейших работ Велер указывал, что между образчиком азида свинца с крупными кристаллами, проходящими через сито, имеющее 400 отверстии на 1 см2, и не проходящими через сито с 1600 отверстиями, и образчиком азида свинца с мелкими кристаллами (отобраны между ситами с 6400 и 10 000 отверстий на 1 см2) различия в чувствительности к удару не наблюдается. Образчики гремучей ртути с короткими кристаллами (0,015 мм) и длинными (0,117 мм) также показывают одинаковую чувствительность. Не наблюдалось разницы также между крупнокристаллическими (проходившими через сито с 169 и остававшимися на сите с 400 отверстиями на 1 см2) и мелкокристаллическими (проходившими через сито с 6400 и остававшимися на сите с 10 000 отверстиями на 1 см2) образчиками ряда нитросоединений (тротил, пикриновая кислота, тринитротрихлорбензол, а-динитрофенол).
С другой стороны, имеются и противоположные данные. Так, Ленце установил, что мелкокристаллическая пикриновая кислота взрывается от удара при падении груза в 10 кг с высоты 16 см, в то время как крупнокристаллическое вещество не взрывается даже при падении груза с высоты 20 см. Наоборот, в случае нитроглицерина большие кристаллы значительно более чувствительны, чем мелкие. Так, мелкокристаллический нитроглицерин при грузе в 2 кг и высоте падения 20 см из 10 опытов дал 10 отказов, в то время как крупнокристаллический нитроглицерин при тех же условиях дал 6 взрывов и 4 отказа.
Противоречивость данных по влиянию размеров кристаллов на чувствительность ВВ к удару можно объяснить тем, что опыты производили над различными ВВ и в разных приборах. В то же время для разных ВВ это влияние может проявляться в различной степени и при разных интервалах размеров кристаллов. Следует учесть, что в случае больших кристаллов физическая неоднородность ВВ, подвергающегося удару, больше. Кроме того, здесь возможна и химическая неоднородность: при медленной кристаллизации, применяемой для получения больших кристаллов, примеси располагаются преимущественно на их поверхности, где и происходит в первую очередь трение кристаллов друг о друга при сдвиге. Если примеси обладают высокой чувствительностью, то они будут повышать чувствительность ВВ и наоборот.
Для практической работы с ВВ особенно важно учитывать возможность повышенной опасности в обращении высокочувствительных ВВ в виде крупных кристаллов. В силу своей большой чувстви. тельности такие ВВ опасны и в мелкокристаллическом состоянии. Если же чувствительность возрастет еще за счет больших размеров кристаллов, то эти вещества могут стать особенно опасными.
В случае малочувствительных ВВ влияние размеров кристаллов может сказываться в меньшей степени, так как при сильном ударе,
§ 2. Чувствительность взрывчатых веществ
305
который необходим для возбуждения взрыва таких веществ, большие кристаллы будут дробиться и разница между образчиками с кристаллами разных размеров будет выравниваться.
Приведенные данные характеризуют чувствительность к механическим воздействиям. Я. И. Лейтман установил, что с увеличением степени измельчения вторичных ВВ их чувствительность к взрывному импульсу сильно возрастает.
При опытах испытуемое ВВ (1 г) запрессовывали в гильзу капсюля-детонатора под давлением 500 ат, поверх него запрессовывали заряд азида свинца. О полноте взрыва судили по пробиванию свинцовой пластинки, на которой взрывали капсюль-детонатор. Устанавливали минимальный заряд азида свинца, при котором получался полный взрыв заряда вторичных ВВ. Эти ВВ применяли двух степеней измельчения: 1) ВВ, измельченное до прохождения через сито с 2500 отверстиями на 1 см2 и остающееся на сите с 10 000 отверстий на 1 см1; 2) ВВ, полученное осаждением водой или другим растворителем из ацетонового раствора и полностью проходящее через сито с 10 000 отверстий на 1 см.2 (размеры частиц 1—4л1к).
В табл. 5. 6 приведены основные из полученных результатов для тринитросоединений с одним, двумя и тремя заместителями.
Таблица
Зависимость чувствительности ВВ к взрывному импульсу от степени измельчения
ВВ Минимальный заряд азида свинца в г
Умеренное измельчение Сильное измельчение
Тринитробензол 0,19 0,06
Тринитрохлорбензол 0,14 0,05
Тринитроанилин 0,13 0,05
Тринитротолуол 0,10 0,04
Тринитробензойная кислота 0,10 0,04
Тринитрофенол 0,08 0,03
Т риннтробензальдегид 0,05 0,02
Тринитрометаксилол 0,34 0,08
Тринитромезитил ен 0,43 0,13
Тринитрорезорцин 0,04 0,02
Тринитрофлороглюцин 0,04 0,02
Трипитродихлорбензол 0,18 0,06
ТринитротрихлорбенЗол От 1 г неполная детонация 0,29
306
Гл. V. Возбуждение горения и детонации ВВ
Из данных табл. 5. 6 видно, что увеличение степени измельчения *, в изучавшихся пределах в 2—4 раза уменьшает минимальный заряд инициатора, необходимый для возбуждения взрыва. На чувствительность тринитросоединений, содержащих различные заместители, влияет характер и число заместителей.
Агрегатное состояние
Вопрос о влиянии агрегатного состояния на чувствительность исследован мало. В то же время этот вопрос представляет не только теоретический, но в известной мере и практический интерес. Вскоре после начала широкого применения нитроглицериновых взрывчатых веществ в Западной Европе было сделано наблюдение, что в зимнее время число несчастных случаев возрастает. Так как динамиты зимой могут замерзать (точка плавления нитроглицерина Н-13°С), то увеличение числа взрывов можно было бы объяснить повышенной чувствительностью замерзшего динамита. Вопреки этому предположению лабораторные исследования показали, что замерзшие нитроглицерин и динамит менее чувствительны, чем незамерзшие. Так, по Биллю, жидкий нитроглицерин взрывается при падении груза в 1 кг с высоты 10 см, в то время как замерзший — только при высоте 40 см. Точно так же незамерзший и замерзший гурдинамит взрываются при высоте падения груза (2 кг) соответственно 7 и 20 см. В дополнение к испытанию на копре Билль провел ряд испытаний с замерзшим динамитом, соответствующих действительным возможностям при перевозках и применении: бросание на камни с высоты 10 м ящиков, содержащих 5, 10, 15 и 25 кг гурдинамита или желатиндинамита, быстрое вбивание гвоздей в замерзший динамит, резкое переламывание патронов и т. д. Нп при одном из этих опытов взрыва не наблюдалось.
Противоречие между результатами лабораторных исследований и практическим опытом, по-видимому, может быть объяснено различием условий замерзания в обоих случаях и связанной с этим разницей в чувствительности замерзшего нитроглицерина.
В табл. 5. 7 приведены сравнительные данные по чувствительности жидкого и твердого нитроглицерина при различных условиях. Все опыты были выполнены при одинаковой температуре 14-5° С. Удар производили грузом в 2 кг при высоте падения 20 см.
Как видно из табл. 5. 7, замерзание нитроглицерина не обязательно приводит к уменьшению его чувствительности. Сильное влияние на чувствительность оказывает температура, при которой
* Некоторое влияние на результаты опытов могли иметь также различия в плотности заряда, поскольку прессуемость умеренно и тонко измельченных порошков не одинакова и при одном и том же давлении прессования (500 ат), достигнутая плотность могла быть различной.
§ 2. Чувствительность взрывчатых веществ
307
Таблица 5.7
Чувствительность нитроглицерина к удару при различных условиях замораживания
Состояние нитроглицерина Температура замораживания в °C Число из 10 взрывов опытов
Замерзший нитроглицерин -11 0
То же 0 2
я +ю 6
Жидкий нитроглицерин — 4
происходила кристаллизация нитроглицерина. При высокой температуре ( + 10° С) нитроглицерин замерзал медленно, при этом образовались крупные кристаллы с высокой чувствительностью; при низкой температуре (—11° С) получались мелкие кристаллы с относительно пониженной чувствительностью.
Испытание 93%-ного гремучего студня показало, что температу. ра замораживания не оказывает заметного влияния на его чувствительность. Однако такое влияние может проявиться, если динамит эксудирует *. Поэтому причину повышенной чувствительности замерзшего динамита следует искать в замерзании его при относительно высокой температуре и притом в эксудирующем состоянии
Нужно учитывать также, что в практических условиях механические воздействия в случае незамерзшего динамита смягчаются из-за его пластичности; замерзший динамит становится твердым и уже не смягчает удара. В условиях обычного лабораторного испытания на чувствительность к удару это различие не сказывается. Однако если сравнивать чувствительность замерзшего и незамерзшего динамита иначе, например сбрасывая шарик динамита весом 100 г на стальную плиту, то влияние агрегатного состояния наблюдается отчетливо: замерзший динамит оказывается более чувствительным и взрывается при высоте падения 7,5 м, в то время как незамерзший динамит в таких условиях взрыва не дает.
По данным американских исследователей, чувствительность тротила, находящегося в замкнутом объеме, сильно возрастает при переходе от твердого состояния к жидкому (табл. 5.8). В этих опытах мерой чувствительности считали минимальную высоту 7/ падения груза в 2 кг, при которой в определенных условиях получался хотя бы один взрыв из десяти опытов.
Таким образом, имеющиеся о нитроглицерине данные не позволяют ответить на вопрос о том, в каком агрегатном состоянии он более чувствителен, так как чувствительность твердого нитроглице-
* Эксудацией называется выделение капель жидкого нитроглицерина из динамита.
308
Гл. V. Возбуждение горения и детонации ВВ
Таблица 5. 8
Чувствительность тротила к удару при разных температурах
Температура °C Состояние тротила Высота Н падения груза см
—40 Твердый
20 » 36
80 Жидкий 18
90 » 8
105—110 я 5
рина может изменяться в очень широких пределах при изменении температуры замораживания (размера кристаллов); тротил в жидком состоянии имеет более высокую чувствительность.
По теоретическим соображениям, изменение агрегатного состояния может влиять на чувствительность, так как оно сильно изменяет текучесть вещества. Однако связь изменений текучести и чувствительности не однозначна. Так, при переходе от твердого вещества к жидкому чувствительность может повышаться или понижаться в зависимости от условий, в которых проводится испытание. Если изменение текучести приближает к оптимальным условиям возникновения местных разогревов, то чувствительность повысится и наоборот.
Полиморфная форма
Многие ВВ, например азиды свинца и ртути, нитроглицерин, дигликольдиннтрат, дина, октоген, гексоген, тринитробензол, тринитротолуол и др., могут существовать в различных кристаллических модификациях. Исследование взрывчатых свойств, в частности, чувствительности модификаций, проведенное для некоторых ВВ, показало значительные различия между ними.
Так, для нитроглицерина стабильная модификация, кристаллизующаяся в ромбической системе, обладает заметно большей чувствительностью, чем лабильная форма, кристаллизующаяся в триклинной системе. С грузом в 2 кг первая дает 50% взрывов при высоте падения 15—20 см, а вторая при высоте 20—30 см. В отношении капсюля-детонатора лабильная форма также менее чувствительна, хотя при этом сильное влияние оказывают условия замораживания.
Майльсом в 1931 г. были описаны две формы азида свинца: а-форма — устойчивая и р-форма — неустойчивая.
а-азид принадлежит к орторомбической системе, плотность его кристаллов составляет 4,71 г/см?.
§ 2. Чувствительность взрывчатых веществ
309
а-азид получают в обычных условиях осаждения; в больших кристаллах он может быть получен путем медленной кристаллизации азида, растворенного в 15®/о-ном растворе уксуснокислого калия, p-модификация кристаллизуется в моноклинной системе в виде игл, имеет плотность 4,93 г/см3 и получается при медленной диффузии растворов азида натрия и свинцовой соли навстречу друг другу.
Майльс получал для обеих модификаций кристаллы длиной до 3 см и более, причем эти кристаллы отнюдь не обладали в сухом виде приписывавшейся им чрезвычайно высокой чувствительностью. При работе над получением модификаций Майльс установил весьма любопытное явление: очень часто при получении p-формы во время кристаллизации азид самопроизвольно взрывается. * Эту склонность р-азида к спонтанным взрывам нельзя объяснить его малой устойчивостью, так как сухие кристаллы не дают таких взрывов и могут сохраняться годами, не изменяясь. Хотя р-кри-сталлы несколько более чувствительны к удару и теплу по сравнению с a-формой, но разница между ними не слишком велика.
В свете исследований Майльса действительной причиной несчастных случаев, имевших место при первых опытах по получению азида свинца, были, вероятно, не большие кристаллы, как предполагалось ранее, а образование неизвестной еще тогда р-формы, приводившее к самопроизвольным взрывам.
Для кристаллов р-азида ртути HgN0 склонность к взрывам при кристаллизации выражена еще более, причем они очень чувствительны даже в сухом виде. Самопроизвольные взрывы азида ртути наблюдались не только при образовании кристаллов из растворов, но и в иных условиях. Так, в одном опыте, при котором в пробирке разлагали кристаллы а-азида ртути в вакууме и некоторое количество его возогналось и конденсировалось в холодной части прибора, взрыв произошел после снятия печи с пробирки, т. е. во время охлаждения ВВ. Аналогичное явление описывает Мюраур. Он нагревал азид ртути в вакууме с помощью проволочки, накаливаемой током. При нагреве азид ртути не взрывался, но отбрасывался газами, выделяющимися за счет разложения. Вокруг проволочки образовывалась полая оболочка азида, частично оплавившаяся с внутренней стороны. После выключения тока, иногда с задержкой до 30 сек., наступала детонация. Мюраур полагает, что причиной взрыва является растрескивание сплавившейся массы при охлаждении.
Для других исследованных азидов (серебра и закисной ртути) существования модификаций не обнаружено.
Для октогена по американским данным существуют четыре полиморфные формы, сильно различающиеся по чувствительности к удару.
* Взрывы происходят иногда и при получении больших кристаллов а-формы азида свинца.
310
Гл. V. Возбуждение горения и детонации ВВ
условиях взрывается 0,2 кгм, при 94°—-0,1
Фиг. 5.9. Изменение чувствительности желатин-динамита к удару с температурой (по Биллю).
Высота падения груза 2 кг, начиная с которой происходят взрывы.
Температура
По данным Кронквиста, для возбуждения взрыва капли нитроглицерина, помещенной между стальными пластинками, при 15° необходима энергия удара 0,8 кгм, при 30° энергия 0,6—0,7 кгм. По опытам других исследователей, нитроглицерин в несколько иных и 16°, когда энергия удара составляет t, а при 182° для возбуждения взрыва достаточен самый легкий удар.
Повышение чувствительности к удару желатин-динамита в зависимости от температуры выражается, по Биллю, кривой, приведенной на фиг. 5. 9.
По данным Тейлора и Уиля, чувствительность гремучей ртути растет с температурой несколько иначе (см. фиг. 5. 3). Эта зависимость может быть выражена формулой
BK + Ae~EIRr = k, (5.Ю)
где К—работа удара;
k. В, А, Е — константы; другие буквы имеют свое обычное значение.
Интересно отметить, что для гремучей ртути величина Е, определенная из опыт-
ных данных по выражению (5. 10), оказалась того же порядка (16,8 ккал), что и энергия активации медленного термического разложения.
Изучалось также влияние температуры на чувствительность к взрывному импульсу, для чего устанавливали предельный заряд гремучей ртути при обычной температуре и при температуре —110° С. В первом случае минимальный заряд для пироксилина, пикриновой кислоты и шеддита оказался равным 0,25 г, а для гремучего студня — меньше этой величины. При температуре —110° С предельный заряд для гремучего студня увеличился до 1 г, остальные же ВВ не удалось взорвать даже зарядом гремучей ртути весом 2 г. Таким образом, с понижением температуры значительно снизилась чувствительность и к взрывному импульсу. При оценке этих данных следует, однако, иметь в виду, что они отражают не только уменьшение чувствительности с понижением температуры, но также и возможное влияние температуры на инициирующее действие гремучей ртути.
Во всех приведенных примерах ВВ оказывались более чувствительными при более высокой температуре. Этого можно было ожи
§ 3. Методы характеристики чувствительности ВВ и начального импульса 311
дать, так как повышение начальной температуры уменьшает количество тепла, необходимого для нагрева ВВ до такой температуры, при которой может возникнуть очаг горения. Следует, однако, учитывать, что изменение начальной температуры меняет также текучесть ВВ. Если текучесть изменяется так, что условия образования очагов местных разогревов при ударе становятся менее благоприятными, то возникновение взрыва может затрудняться, чувствительность станет меньше.
Действительно, Васильев в лаборатории Холево установил, что при испытании в приборчике № 1 с определенным зарядом тротила максимальная частость взрывов наблюдается при комнатной температуре; при понижении и повышении температуры частость падает. Для труднотекучих ВВ — тэна, гексогена и тринитромези-тилена при повышении температуры, начиная от —100° С, частость взрывов возрастает и ее максимум лежит вблизи температуры плавления. Наоборот, в приборчике № 2 для тэна, гексогена и трп-нитромезитилена частость взрывов при повышении температуры от —100° С понижается.
Плотность
По Тэйлору и Уилю, с повышением плотности чувствительность к удару изучавшихся ими порошкообразных ВВ уменьшалась. По отношению к капсюлю-детонатору, как мы видели, с повышением плотности заряда все ВВ показывают 'уменьшение чувствительности. Точно так же увеличение плотности пассивного заряда уменьшает расстояние передачи детонации (при неизменной плотности активного заряда).
§ 3. ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ ОЦЕНКИ ЧУВСТВИТЕЛЬНОСТИ ВВ И ЭФФЕКТИВНОСТИ НАЧАЛЬНОГО ИМПУЛЬСА
1. Чувствительность ВВ к механическим воздействиям
Чувствительность к удару
Определение чувствительности к удару обычно основано на том, что грузу дают падать с некоторой высоты на взрывчатое вещество, помещенное на наковальне. Чем больше высота падения и вес груза, при которых еще не возникает взрыва, тем меньше чувствительность испытуемого ВВ.
В некоторых работах в качестве характеристики индивидуального опыта принимают не высоту падения груза, а разность между этой высотой и высотой отскока груза после удара, мотивируя это тем, что указанная разность является мерой энергии, поглощенной при ударе. При этом исходят из предположения, что часть энергии, израсходованная на остаточную деформацию системы —
312
Гл. V. Возбуждение горения и детонации ВВ
ударник—ВВ—наковальня, определяет возникновение взрыва. Однако при взрыве от удара существенна не только энергия, затрачиваемая на остаточную деформацию, но и энергия упругой деформации системы, так как давление, под которым находится ВВ при ударе, влияет на величину коэффициента внутреннего трения, а также на развитие первоначального очага реакции и, в частности, на переход начавшегося горения во взрыв. Кроме того, в общем случае нелегко установить, как именно распределяется поглощенная энергия между отдельными частями системы, участвующими в ударе, и какая ее доля определяет возникновение очагов разогрева в ВВ. Поэтому использовать вместо высоты (работы) падения груза разность высот падения и отскока груза нет достаточных оснований.
Чувствительность разных В В может очень различаться. Вследствие этого при испытании с одним и тем же грузом пришлось бы применять или очень высокий копер, или очень малую высоту падения. Поэтому обычно работают с разными грузами. При этом возникает вопрос, как сравнивать результаты таких определений. Можно было бы ожидать, что удар малого груза при одинаковой энергии будет более эффективен в отношении возбуждения взрыва, чем удар большого груза, так как скорость падения груза в момент удара, а следовательно, и резкость удара, в первом случае больше. С другой стороны, однако, при большой скорости падения груза длительность удара меньше и возникшие очаги взрыва могут не успеть развиться. Какой из указанных факторов будет преобладать в том или ином конкретном случае, количественно оценить затруднительно. Некоторые исследования (табл. 5.9) показывают, что
Таблица 5.9
Зависимость эффективности удара от веса груза (по данным Тэйлора и Уиля)
Вес падающего груза G г Гремучая ртуть Состав с тринитрорезорцина-том свинца
Критическая* высота падения И см Произведение GH гем Критическая высота падения Н см Произведение GH гем
14 35,6 500 45,7 640
28 18,0 500 22,9 640
57 8,9 500 11,9 680
85 5,8 495 7,9 670
113 4.3 485 5,8 655
1 Высота падения, при которой получается 50% взрывов и 50% отказов.
§ 3. Методы, характеристики чувствительности ВВ и начального импульса 313
влияние скорости падения груза, по крайней мере при небольших изменениях ее, не проявляется и за характеристику чувствительности можно принять полную энергию удара (т. е. произведение веса груза на высоту его падения).
Однако в других работах наблюдалась зависимость энергии удара, необходимой для возбуждения взрыва, от высоты падения груза. Так, по данным Кенена и др. (см. Приложение 3), при увеличении высоты падения груза энергия удара, начиная с которой наблюдались взрывы, существенно уменьшалась.
Если постепенно, например через 1 см, увеличивать высоту падения груза и при каждой высоте производить определенное число опытов (например десять), то при малой высоте все десять опытов дадут отказ, после чего получится один взрыв из десяти, затем два, три и т. д. и наконец все десять опытов дадут взрыв. При этом нередко интервал высот падения груза — от высоты, при которой не получается ни одного взрыва, до высоты, при которой все опыты дают взрыв, — бывает значителен.
В этом отношении определение чувствительности к удару отличается от определения температуры вспышки, при котором переход от 0% вспышек к 100% происходит при относительно небольшом изменении температуры.
В связи с такой нечеткостью границы между областью высот падения груза, приводящих к отказу при всех опытах, и областью высот, дающих взрывы при всех опытах, возникает вопрос, какую же высоту падения груза следует считать характеристикой чувствительности ВВ?
Этот вопрос в разных странах и в различных исследовательских учреждениях этих стран решался по-разному.
В Горном бюро США и в Германии при каждой высоте падения груза делают 6 (иногда 10) опытов. Характерной для данного ВВ считают максимальную высоту падения груза, при которой не получается ни одного взрыва. Для установления этой высоты, естественно, необходимо определить также ближайшую большую высоту, при которой получается хотя бы один взрыв из шести опытов. Таким же методом испытывают у нас согласно ГОСТ 4545—48 промышленные ВВ, применяя груз в 2 кг и определяя минимальную высоту падения груза из 6 опытов.
Для ВВ иного назначения согласно ГОСТ 4545—48 производят 25 опытов при постоянных высоте и грузе (обычно 25 см и 10 кг) и устанавливают процент взрывов, который и служит сравнительной характеристикой чувствительности.
Этот метод оценки чувствительности ВВ наиболее распространен в наших научно-исследовательских учреждениях, хотя его нельзя считать наиболее целесообразным и точным, особенно в тех случаях, когда процент взрывов близок к нулю или к 100.
314
Гл. V. Возбуждение горения и детонации ВВ
Наконец, можно определять всю кривую, дающую процент взрывов, как функцию высоты падения, но этот метод требует большого числа опытов и, кроме того, остается все же неясным, какую точку кривой следует принимать за характеристику чувствительности ВВ.
Ф. Ф. Яковлев и Б. Л. Кондрацкий пытались дать ответ на этот вопрос при помощи следующего рассуждения.
Допустим, что колебания результатов, когда при одной и той же высоте падения груза получаются то взрыв, то отказ, обусловлены случайными влияниями, как, например, неоднородностью пробы и ее распределения на наковальне, возможностью перекоса при падении груза и т. д. Если представить себе идеальный копер, при испытании на котором все эти влияния исключены, то на этом копре мы должны получить какую-то критическую высоту, ниже которой будет 100% отказов, а выше— 100% взрывов. Представим себе теперь, что после установления критической высоты идеальный копер стал реальным, т. е. начали действовать все случайные влияния. Очевидно, что поскольку эти влияния случайны, они будут действовать в равном числе как в сторону, благоприятствующую взрыву, так и в сторону, не благоприятствующую ему. Поэтому при высоте падения груза, дававшей на идеальном копре 100% взрывов, мы получим теперь 50% взрывов и 50% отказов. Другими словами, работая на реальном копре и устанавливая высоту, соответствующую 50% взрывов, мы определим «идеальную» критическую высоту, которая и является наиболее правильной характеристикой чувствительности испытуемого ВВ.
Следует отметить, что приведенное рассуждение предполагает случайный характер влияний, определяющих результат опыта на копре. Такое предположение требует подтверждения. В одной из английских работ исследователи сравнили опытную кривую зависимости частости взрывов высокочувствительного неплавкого ВВ от высоты с теоретической, полученной из закона Гаусса. Все экспериментальные точки хорошо легли на теоретическую кривую, что подтверждает допущение о подчинении явления законам случайности.
В других исследованиях для иных ВВ полученные кривые распределения существенно отличаются от кривой, вытекающей из вероятностного закона. Холево объяснил эти отклонения. Он показал, что энергия удара, дающая 50% взрывов, не может, вообще говоря, служить истинной мерой чувствительности ВВ, так как возникновение взрыва определяется не просто величиной этой энергии, а зависит от нее более сложным образом.
Рассуждения Яковлева и Кондрацкого в принципе правильны лишь для того случая, когда в качестве характеристики эффективности удара берется тот его параметр, который непосредственно определяет образование локальных разогревов (скорость поглоще
$ 3. Методы характеристики чувствительности ВВ и начального импульса 315
ния энергии). К сожалению, количественное определение этой характеристики практически не реализовано; поэтому мы вынуждены в качестве показателя эффективности удара пользоваться его энергией. В этом случае, т. е. если характеризовать чувствительность ВВ к удару работой (высотой падения) груза, дающей определенный процент взрывов, целесообразно, если частость взрывов закономерно растет с высотой до единицы, брать этот процент равным 50. В последних работах обычно и пользуются этой характеристикой.
Экспериментальные методы определения чувствительности к удару довольно разнообразны в отношении конструктивного оформления копров. У нас наиболее распространена модель копра, разработанная Кастом, а для определения чувствительности инициирующих ВВ — копер Велера. Копер Каста (фиг. 5. 10) состоит из массивной наковальни, укрепленной на фундаменте, и двух направляющих рельсов, между которыми, свободно скользя, падает груз, производящий удар по ВВ. Груз закрепляется на необходимой высоте при помощи держателя, снабженного спусковым приспособлением. Копер имеет устройство для улавливания груза при отскоке. Видоизмененная В. С. Козловым конструкция копра Каста показана на фиг. 5. 11.
Если ВВ помещать непосредственно на наковальню копра, то трудно обеспечить постоянство толщины слоя ВВ и площади, на которую распределяется энергия удара, а также параллельность поверхностей ударника и наковальни. Поэтому навеску ВВ (0,02—0,05 г) обычно помещают в специальный штемпельный приборчик (см. фиг. 5.4), который при помощи металлической обоймы центрируется на наковальне. В качестве поршеньков в настоящее время применяют ролики от подшипников, отличающиеся высокой степенью постоянства механических свойств и точностью размеров.
В приборчике возможность перекоса поршенька при ударе сведена до минимума; площадь удара и толщина слоя ВВ постоянны, и воспроизводимость результатов опытов гораздо лучше, чем при испытании без штемпельного приборчика.
Штемпельный приборчик существует в двух основных вариантах (см. фиг. 5. 4, а и б). Если ролики в приборчике № 1 точно пригнаны к каналу и не имеют фасок на торцах, то при ударе ВВ с малой текучестью будет только сжиматься, но не сможет течь. Если при этом ВВ не содержит пузырьков воздуха, то разогревов и соответственно взрыва не возникнет, даже если для возбуждения взрыва данного ВВ достаточен незначительный разогрев, легко достигаемый при трении. Чтобы обнаружить высокую чувствительность ВВ в условиях его течения, следует проводить испытание также в приборчике № 2, отличающемся наличием канавки в обойме на уровне расположения ВВ. Опыт показывает, что труд
316
Гл. V. Возбуждение горения и детонации ВВ
нотекучие ВВ, не взрывающиеся в приборчике № 1, могут при прочих равных условиях давать высокую частость взрывов в при-
Фиг. 5.10. Копер Каста для определения чувствительности к удару вторичных ВВ.
1—наковальня. 2~ приборчик. 3—груз, 4~держатель груза. 5~направляющие рельсы, 6—зубчатая рейка, 7—зуб для закрепления груза на рейке при отскоке.
Фиг. 5.11. Копер Козлова.
/—направляющие, 2—дер*-жатель груза, 3—груз, 4—наковальня.
борчике № 2 и в соответствующих условиях практического применения.
Применяемый по ГОСТ 2065—43 приборчик (см. фиг. 5.4, в) занимает промежуточное положение между приборчиками № 1 и 2. Ролики стандартного приборчика имеют фаски, которые образуют кольцевой зазор, в известной мере выполняющий роль канавки приборчика № 2.
$ 3. Методы характеристики, чувствительности ВВ и начального импульса 317
Фиг. 5. 12. Копер Велера.
1—груз. 2—сбрасыватель, 3—стойка с капсюлем, бойком и защитной скобой.
При испытании на копре Каста применяются грузы от 2 до 20 кг в зависимости от чувствительности ВВ. Ввиду плохой воспроизводимости результатов испытание на чувствительность к удару, как правило, ведут параллельно со стандартным ВВ, близким к испытуемому по чувствительности (тротил, тетрил, пироксилин и т. п.). Рекомендуется также вести испытания методом «переменных ударов», чередуя •опыты с испытуемым и стандартным ВВ. Такой прием имеет целью устранить влияние тех неконтролируемых изменений условий опыта, которые могут иметь место на протяжении каждой серии испытаний.
Для определения чувствительности инициирующих ВВ обычно применяют копер Велера, устройство которого видно на фиг. 5. 12. Испытуемое инициирующее ВВ запрессовывают в количестве 0,02 г в латунный колпачок от капсюля-воспламенителя и покрывают кружком из медной фольги. При каждой высоте подъема маятника производят по пять опытов. Обычно при испытании
устанавливают так называемые верхний и нижний пределы чувствительности. Первый из пределов соответствует минимальной высоте, при которой все пять опытов дают взрывы, второй — максимальной высоте, при которой все опыты дают отказы.
Характеристика чувствительности к удару ряда ВВ приведена в табл. 5. 10 и 5. 11 для вторичных ВВ и в табл. 5. 12 и 5. 13 — для инициирующих ВВ. Табл. 5. 10 и 5. 12 составлены по данным, приведенным Кистяковским в американской «Энциклопедии химической технологии». В одной из последних работ по чувствительности ВВ к удару и методике ее определения дана наиболее полная сводка данных по чувствительности большого числа ВВ. Эти данные содержатся в Приложении 3. Следует подчеркнуть еще раз, что данные всех таблиц как в отношении абсолютных значений приводимых величин, так и их относительных значений имеют весьма условный характер. Причина этого в том, что чувствительность
318
Гл. V’. Возбуждение горения и детонации. ВВ
сильнейшим образом зависит от многих условий удара, которые у разных исследователей, так же как в практике, не одинаковы. Эта особенность чувствительности ВВ к механическим воздействиям, открытая и объясненная работами Холево, имеет большое практическое значение. Установив по какому-нибудь одному методу, например по ГОСТ 4545—48, малую чувствительность ВВ, мы не можем быть уверены, что в иных условиях воздействия, которые могут иметь место на практике, абсолютная и относительная чувствительность ВВ не окажется гораздо больше и не приведет к взрыву. Поэтому для оценки опасности ВВ в производстве и применении особенно важно определять чувствительность в различных условиях, возможно ближе отображающих условия механических воздействий, имеющие место в практической работе. Эти условия разнообразны, и их не всегда можно легко воспроизвести в лаборатории. В качестве простейших примеров можно привести раскалывание, сверление, обработку поверхности заряда, разбуривание заряда ВВ в шпуре. Производя такие и подобные им испытания на форсированных режимах и сравнительно с другими технологически известными ВВ, можно получить представление о возможности и допустимой интенсивности тех или иных способов обработки применительно к новым ВВ, для которых отсутствует непосредственный производственный опыт.
Таблица 5.10
Чувствительность вторичных ВВ к удару по данным испытаний по методу Горного бюро США*
ВВ Тринитробензол Тринитротолуол Пикриновая кислота Пикрат аммония Тетрил Г ексил
Высота падения груза f/raill СМ 46 100 82 100 не взрывается 26 Прод< 327 элжеяие
ВВ Нитрогуанидин Гексоген Октоген Этилендинитрамин Тетра-нитро-мегаи Тэн
Высота падения груза Яш1п см 47 18 32 43 100 не взрывается 17
* При испытаниях устанавливали минимальную высоту, при которой получался хотя бы один взрыв из десяти опытов. Навеску ВВ (0,02 г) помещали на стальной наковальне слоем в виде круга диаметром 1 см. Удар груза (2 кг) передавался ВВ через поршень, наконечник которого диаметром 1 см предварительно прижимали к поверхности ВВ.
$ 3. Методы характеристики чувствительности ВВ и начального импульса 319
Продолжение
ВВ Дипен-таэрит-ритгек-санитрат Эритриттетранитрат Г екса-нитроманнит Нитрогликоль Динитродигликоль Нитроглицерин
Высота падения груза 7/min СМ 14 10 8 56 1С0 не взрывается 15
Таблица 5.11
Чувствительность некоторых вторичных ВВ к удару*
ВВ Частость взрывов %
Тротил 4—8
Амматолы 20—30
Пикриновая кислота 24—32
Тетрил 50—60
Гексоген 70—80
Тэн 100
Бездымный порох 70—80
Таблица 5. 12
Чувствительность инициирующих ВВ к удару
ВВ Гремучая ртуть Азид свинца декстри-ниро-ваниый Азид серебра Диазо-динитро-фелол Тринит-роре-зорци-нат свинца Дини-трозоре-зорци-нат свинца Серни стый азот
Высота падения груза* ** 7/min см 5 11 6 5 8 68 20
* Груз 10 кг, высота падения 25 см; испытание проводилось в приборчиках по ГОСТ 2065—43.
** Минимальная высота падения груза в 2 кг, при которой возникает хотя бы один взрыв из десяти опытов.
320
Гл, V. Возбуждение горения и детонации ВВ
Таблица 5.13
Чувствительность к удару некоторых инициирующих ВВ по данным испытания на копре Велера (диаметр бойка 1,5 мм)
ВВ Вес груза кг Высота падения груза, при которой получалось пять взрывов/пять отказов см
Гремучая ртуть 0,69 8,515,5
Тетразен 0,69 12,5/7
Азид свинца 0,98 23/7
Стифнат свинца 1,43 25/14
Чувствительность к трению (скользящему удару)
Как мы видели, возникновение взрыва при ударе обусловливается обычно трением, которому подвергается сжимаемое и текучее вследствие этого ВВ. Однако чувствительность к трению не тождественна чувствительности к удару. С одной стороны, истечение ВВ при ударе, как правило, происходит под более или менее высоким давлением. Это отражается и на коэффициенте внутреннего трения ВВ и особенно на развитии возникшего воспламенения. С другой стороны, ВВ может обладать столь малой текучестью, что оно не будет течь не только в приборчике № 1, но даже в приборчике № 2. В таком случае высокая чувствительность к трению, если она свойственна испытуемому ВВ, не проявится при испытании на чувствительность к удару. Чтобы обнаружить эту чувствительность и таким образом полнее характеризовать те условия механических воздействий, в которых ВВ может быть опасным, испытания на чувствительность к удару в приборчиках № 1 и 2 дополняют испытаниями на чувствительность к трению или, точнее, скользящему удару.
В литературе имеется описание трех основных методов определения чувствительности ВВ к трению: 1) при помощи фрикционного маятника (метод Горного бюро США), 2) растиранием в фарфоровой ступке и 3) на приборе Боудена-Козлова.
Фрикционный маятник состоит из стальной наковальни, на которой помещают испытуемое ВВ (7 г), и маятника длиной 185 см в виде прочного стального стержня с укрепленным на его конце башмаком (фиг. 5. 13). На башмаке в случае необходимости можно закреплять дополнительный груз. На наковальне имеются три поперечные канавки, в которых удерживается ВВ при прохождении над ней башмака маятника. Башмаки применяются двух видов: стальной и с поверхностью из твердой фибры. Испытание заключается в том, что башмак маятника, поднятый и закрепленный держателем на определенной высоте, спускают при помощи шнура. При прохождении башмака маятника над наковальней ВВ подвергается трению между поверхностью наковальни и поверхностью башмака; силу трения можно регулировать изменением высоты подъема маятника, веса добавочного груза и применением башмаков с трущей поверхностью из различных материалов. ВВ считается выдержавшим испытание на
§ 3. Методы характеристики чувствительности ВВ и начального импульса 321
применение в горном деле, если оно в десяти опытах при башмаке с поверхностью из твердой фибры с дополнительным грузом 20 кг и высоте подъема груза 1,5 м не дает ни взрыва, ни горения, ни отчетливого треска. Для сохранения фибровой поверхности, которая при таких опытах быстро приходит в негодность, испытание обычно начинают с более устойчивым стальным башмаком.
Фиг. 5. 13. Фрикционный маятник для определения чувствительности
ВВ к трению.
Если в десяти опытах взрыва не возникает, то испытание считают законченным. В противном случае испытание производят с башмаком, имеющим фибровую поверхность; результат такого испытания является окончательным. Результаты сравнительного испытания некоторых индивидуальных ВВ по этому методу при стальном башмаке приведены в табл. 5. 14.
Таблица 5.14
Чувствительность ВВ к трению по данным испытания на фрикционном маятнике
ВВ Динитробензол Тринитробензол Тринитротолуол Пикрат аммония Тетрил Гексил
Число взрывов на десять опытов 0 1 о ! i 0 0 0 0
Продолжение
ВВ Нигрогуа-нидин 1 Гексоген ' Октогеп Этилен-дннитр-амин Тетра-нитрометан Тэн
Число взрывов на десять опытов 0 2 1 2 о 2 5
322
Гл. V. Возбуждение горения и детонации ВВ
Продолжение
ВВ Ди пента-эритритгек-санитрат Нитрогликоль Динитрогликоль Нитроглицерин 1
Число взрывов на десять опытов 10 7 10 10
По второму методу чувствительность к трению определяют растиранием 0,05 г ВВ в неглазурованной фарфоровой ступке негла-зурованным пестиком. Понятно, что такое испытание носит качест
венный и весьма субъективный характер. Результаты испытаний различных В В по этому методу приведены (по Касту) в табл. 5. 15.
Боуден и Гартон для определения чувствительности ВВ к трению разработали прибор, показанный схематически на фиг. 5. 14.
При испытании на этом приборе тонкий слой ВВ помещают на верхней поверхности прямоугольного стержня 2 и прижимают к стержню стальным роликом 4. Завинчиванием болта 5 можно создать необходимое давление на ВВ. Это давление можно определить или измерением прогиба перекладины 6, или применением вместо нее нагруженного
Фиг. 5. 14. Прибор Боудена для определения чувствительности ВВ к трению.
1—груз маятника, 2— прямоугольный стальной стержень, 3—неподвижный стальной блок,
4—стальной ролик, 5—нажимной болт, 5’— перекладина, 7—ВВ.
плеча рычага.
Груз маятника 1 поднимают на определенную высоту и затем дают ему упасть и ударить по стержню 2, скользящему по смазанной
поверхности неподвижного блока 3. Таким образом, ВВ подвергают действию быстрого сдвига.
В. С. Козлов видоизменил этот прибор. Во-первых, он применил для подачи давления на ВВ гидравлический пресс, во-вторых, существенно изменил устройство, в котором помещается ВВ (фиг. 5. 15). Навеска ВВ сжимается между двумя роликами диа-
§ 3. Методы характеристики чувствительности ВВ и начального импульса 323
Таблица 5.15
Чувствительность различных ВВ к тренню по данным испытания в фарфоровой ступке
ВВ Поведение ВВ при растирании
Черный порох Пироксилин Тротил Аммонит Пикриновая кислота Тетрил Желатин-динамит Шеддит Пикрат свинца Не реагирует То же я Издает слабый запах гари Издает слабый треск Взрыв я
метром 10 мм. Удар маятника передается верхнему подвижному ролику 1, который перемещается при этом между расположенным над ним неподвижным упором 2 и нижним роликом 3, закреплен
ДаВление прижатия в кг/смг
Фиг. 5. 16. Изменение частости взрывов в зависимости от давления прижатия при испытании ВВ на чувствительность к трению по Козлову.
J—тротил, 2—динитроиафталин, 3—тринитробензол, 4—тетрил, 5—гексоген, 6—тэи, 7—пироксилин, 3—азид свинца, S—гремучая ртуть.
Фиг. 5. 15. Узел прибора Боудена—Козлова для определения чувствительности ВВ к трению.
1—подвижный ролик, 2—упор, 3—неподвижный ролик, 4—BB, 3—поршень для передачи давления пресса на ролик 3. 3—муфта, 7—стержень с головкой, передающий удар.
ным в муфте 6. Недостатком этого варианта прибора является то, что сила сопротивления может быть не одинаковой на торцах переметающегося ролика 1. На верхнем торце она определяется коэффициентом трения стали о сталь, а на нижнем — коэффициентом внутреннего трения ВВ или коэффициентом внешнего трения
324
Гл. V. Возбуждение горения и детонации ВВ
ВВ о сталь. Вследствие этого обычно имеет место некоторый перекос ролика при ударе. Фактически при испытании в данном приборе мы можем иметь дало не с трением, а с сочетанием трения и удара края верхнего ролика 1 о торец нижнего 3.
Изменение частости взрывов при постоянной энергии удара маятника в зависимости от давления прижатия для ряда изученных ВВ показано на фиг. 5. 16.
Характеристикой чувствительности при этом испытании может служить давление прижатия ВВ, при котором получается 50% или другая определенная частость взрывов.
Чувствительность к прострелу пулей
Взрывчатые вещества, применяемые для военных целей, подвергают обычно испытанию на прострел пулей. В одном из вариантов это испытание выполняется следующим образом. Кусок чугунной трубы диаметром и длиной 5 см наполняют испытуемым ВВ, закрывают с обеих сторон крышками на резьбе и простреливают из винтовки с расстояния 9 м, приняв соответствующие меры предосторожности против осколков.
В табл. 5. 16 приведены результаты испытания этим способом некоторых ВВ.
Таблица 5.16
Результаты испытания ВВ иа прострел пулей -
ВВ Тротил Пикриновая кислота Пикрат аммония Тетрил Гексил Нитрогуанидин
Число взрывов на 10 опытов 0,5 5 1 7 0 Пр 0 одолжение
ВВ Этилендинитрамин Г ексоген Тэн Нитроглицерин Аммиачная селитра
Число взрывов на 10 опытов 0 10 .0 0
Бюрло изучал факторы, обусловливающие возникновение детонации при простреле пулей ВВ, помещенных в деревянные ящики. Он установил, что пикриновая кислота детонирует, если скорость пули* в момент удара превышает 400 м/сек. Для возбуждения детонации зерненого пироксилинового пороха скорость пули должна
« В качестве пули применяли каменный шарик весом около 4 г.
$ 3. Методы характеристики чувствительности ВВ и начального импульса 325
быть не меньше 1100 м]сек. Остальные вторичные ВВ занимают в отношении скорости пули, необходимой для возбуждения детонации, промежуточное положение. Пули с плоским наконечником легче вызывают детонацию, чем конические. Инициирующая способность возрастает с увеличением веса пули при постоянной ее скорости.
2. Чувствительность ВВ к термическим воздействиям
Для определения чувствительности ВВ к термическому импульсу существует ряд методов. Рассмотрим наиболее употребительные из них.
Определение температуры вспышки
Наиболее распространены два варианта определения температуры вспышки. При первом варианте баню, наполненную обычно легкоплавким металлом или маслом с высокой точкой кипения, нагревают до 100° С. В момент достижения этой температуры в баню вставляют пробирку с навеской испытуемого ВВ (обычно 0,5 г; для ВВ, дающих детонацию, 0,1 г) и дальнейший нагрев производят со скоростью 20° в минуту. Отмечают температуру бани при вспышке н характер разложения, изменяющийся для разных ВВ от собственно вспышки со слабым, часто шипящим звуком до детонационно-подобного взрыва. Иногда вместо вспышки происходит более или менее бурное разложение ВВ, не сопровождающееся, однако, пламенем, иногда разложение протекает спокойно; в этом случае нагрев обычно производят до 36СР С и отмечают отсутствие вспышки.
При втором варианте баню поддерживают при постоянной температуре и в предварительно вставленную в нее нагревшуюся пробирку вводят навеску ВВ.
Фиксируют задержку вспышки, т. е. время т между моментом введения ВВ и моментом вспышки. Целесообразно определять также минимальную температуру вспышки, т. е. такую температуру, ниже которой разложение протекает без вспышки. Эта температура зависит не только от свойств вещества, но и от условий опыта: количества ВВ, формы дна пробирки, теплопроводности ее материала, состава газа, наполняющего пробирку, и т. д.
Зависимость между задержкой вспышки и температурой выражается кривыми, подобными кривой фиг. 5. 17, построенной для гремучей ртути. Интересно отметить, что в координатах 1g т и-^-зависимость между задержкой вспышки и температурой для многих ВВ оказывается линейной.
Как было показано выше (гл. II, стр. 60 и 75), именно к такой зависимости должны приводить автокаталитическое и цепное развитие реакции, завершающиеся тепловым возникновением взрыва.
326 Гл. V. Возбуждение горения и детонации ВВ
В табл. 5. 17 приведены значения температуры вспышки для различных ВВ, полученные по более употребительному первому методу.
Таблица 5.17
Температура вспышки различных ВВ
ВВ Температура вспышки °C ВВ Температура вспышки °C
Черный порох 310—315 Дияитробензол Не дает
Натровый минный по- 305—315 ВСПЫШКИ
рох Тринитрохлорбензол 395—397
Пироксилин 195—200 Тринитротолуол 295—300
Коллоксилин 204—205 Тринитроанизол 290—296
Бездымные пороха 180—200 Гекса нитродифенил- 248-252
Нитроглицерин 200—205 амин 190—194
Тэн 205—215 Тетрил
Г урдинамит 195—200 Хлоратное взрывчатое вещество (шед- 258—265
Гремучий студень 202—208 дит)
Желатин-динамит 180—190 Амматол 80/20 300
Гексоген 215-230 Азид свинца 325—340
Пикриновая кислота 300—310 Гремучая ртуть 170—180
Тринитрокрезол 270—276 Т ринитрорезорцинат 270—280
Тринитробензол Не дает вспышки свинца
Фиг. 5.17. Зависимость задержки вспышки гремучей ртути от температуры.
§ 3. Методы характеристики чувствительности ВВ и начального импульса 327
В табл. 5. 18 указаны значения температуры вспышки, полученные несколько отличным методом. Навеску ВВ (0,02 г) в медной гильзе от капсюля-детонатора помещали в баню со сплавом Вуда и устанавливали температуру, при которой вспышка или бурное разложение происходили через 5 сек. Из-за меньшей навески и большей теплопроводности стенок гильзы по сравнению со стеклом значения температуры вспышки, полученные этим методом, значительно выше, чем приведенные в табл. 5. 17. Сопоставление данных табл. 5. 17 и 5. 18 и табл. 2. 1 показывает, что вспышка конденсированных ВВ происходит, вообще говоря, при более низких температурах, чем газовых смесей.
Таблица 5.18
Температура вспышки различных ВВ
в В Температура вспышки СС ВВ Температура вспышки СС
Г ликольдинитрат 257 Тринитротолуол 475
Диэтиленглико ль ди- 237 Пикриновая кислота 322
нитрат Пикрат аммония 318
Нитроглицерин 222 Тетрил 257
Эритриттетранитрат 225 Гексил 325
Тэн 225 Гремучая ртуть 210
Дипентаэритритгексанитрат 255 Гремучее серебро 170
Маннитгексанитрат 205 Азид свинца кристаллический 345
Нитроклетчатка (13,3°/» N) 230 Диазо динитрофено л 180
Этилендинитрамин 190 Тринитрорезорцинат свинца 265
Нитрогуанидин 275 Динит розорезорцинат 265
Г ексоген 260 свинца
Октоген 335 Тетразен 154
Трннитробензол 550 Гексаметилеитрипе-роксиддиамин <149
Поведение ВВ при бросании в раскаленную железную баню
Дно железной бани нагревают сильной горелкой докрасна и на середину его бросают (приняв соответствующие меры предосторожности) маленькую пробу ВВ (0,1—0,2 г), последовательно увеличивая ее до 5 г. Поведение ВВ при этом испытании (интенсивность горения, возникновение или отсутствие взрыва) характеризует сте
328
Гл. V. Возбуждение горения и детонации ВВ
пень опасности ВВ в условиях внезапного контакта с нагретым до высокой температуры металлом. Такой контакт может иметь место в случае пожара при производстве, перевозке или хранении ВВ.
Поведение ВВ по отношению к лучу бикфордова шнура (определение воспламеняемости ВВ)
Пробу ВВ весом 0,1—1,0 г помещают в пробирку, в которую вводят отрезок бикфордова шнура таким образом, чтобы он касался поверхности вещества. Приняв меры для защиты от осколков в случае взрыва, шнур зажигают сверху и наблюдают поведение ВВ при действии на него луча огня шнура. В зависимости от свойств ВВ в этих условиях может дать детонацию (инициирующие ВВ), взрыв или вспышку (черный порох, пироксилин), горение (тетрил, динамит) или не воспламениться (нитросоединения, аммониты) .
При другом варианте этого испытания шнур помешают на некотором расстоянии от поверхности ВВ и последовательными опытами определяют, на каком максимальном расстоянии еще происходит воспламенение.
Проба на костре
Ящик кубической формы (сторона 10 см) из листового железа толщиной 1 мм с прочно вставленной крышкой наполняют испытуемым ВВ. Разводят сильный костер из сухих дров и на него из-за прикрытия опускают ящик с ВВ. Отмечают характер разложения ВВ и степень деформации ящика. Проба имеет целью воспроизвести поведение ВВ, находящегося в металлической всесторонней оболочке, в условиях пожара.
3. Чувствительность ВВ к детонационному импульсу
Чувствительность к капе юл ю-д етонатору
Чувствительность характеризуется минимальным зарядом капсюля-детонатора, при котором ВВ дает полный взрыв. Испытание производят, определяя действие ВВ одним из принятых для этой цели методов, например в бомбе Трауцля, на свинцовом цилиндрике по Гессу или на бризантометре (см. гл. IX, стр. 466). При этом сначала применяют капсюль-детонатор с зарядом, заведомо недостаточным для получения полного взрыва испытуемого ВВ. Соответственно получают пониженное расширение бомбы или обжатие цилиндрика при определении бризантности. Последовательно увеличивая при дальнейших опытах заряд капсюля-детонатора, подходят к пределу, начиная с которого дальнейшее увеличение заряда не влечет за собой заметного возрастания действия взрыва.
$ 3. Методы характеристики чувствительности ВВ и начального импульса 329
Этот предел, выражаемый номером капсюля-детонатора или количеством гремучей ртути, составляющим заряд капсюля-детонатора (или эквивалентным этому заряду), и характеризует чувствительность ВВ к данному виду начального импульса. В качестве примера можно привести результаты исследования хлоратита № 3, представляющего собой смесь хлората калия, древесной муки (3%) и керосина при содержании последнего 0; 2; 5 и 10%. Значения обжатия, полученные на бризантометре с капсюлями-детонаторами различной силы, приведены в табл. 5. 19.
Таблица 5.19
Результаты испытания иа чувствительность к капсюлю-детоиатору хлоратита № 3
Обжатие медного цилиндрика на бризантометре в мм
содержание Капсюль-детонатор* Порошкообразная пикриновая кислота капсюль-детонатор К» 8
керосина % № 5 № 6 № 7 № 8
0 — — — 0,1 0,3
2 0,3 0,2 2,4 0,2 2,8)„ „ ’ 2,9 3,0) 2,9) 2,8}2’9 2,9) ’ 2,9 2,9/
5 0,3 0,4 4,2) 4,8) „ , >4,6 4,4) 4>:)4.4 4,3/ 4,4) 4,4 4,4/
10 — — — 0,7 0,2 4,7) „ ’ 4,7 4,6/
* Заряды капсюлей-детонаторов эквивалентны: № 8—2 г гремучей ртути; № 7 — 1,5 г; №6 — 1,0 г и № 5 — 0,8 г.
Из данных табл. 5. 19 видно, что чувствительность хлоратита; при увеличении содержания керосина до 5% возрастает. Дальнейшее увеличение содержания керосина до 10% снижает чувствительность и ВВ не взрывается даже от капсюля-детонатора № 8.
Практический критерий отсутствия способности к взрыву
С определением чувствительности ВВ к капсюлю-детонатору тесно связана н по существу и методически задача установления отсутствия способности к взрыву того или другого вещества. Прак-
330
Гл. V. Возбуждение горения и детонации ВВ
тпчески этот вопрос нередко получает большое значение, в особенности при установлении условий технической обработки и хранения вновь вводимых материалов. Степень взрывоопасности лимитирует интенсивность допустимых в процессе обработки воздействий на материал и определяет необходимые меры предосторожности. Более того, в некоторых случаях, например при выборе состава удобрительных смесей, включающих азотнокислые соли, одним из существенных требований является отсутствие способности к взрыву.
Наиболее интенсивным из практически реальных импульсов является действие на вещество взрыва заряда бризантного ВВ. Поэтому практическое решение вопроса о взрывчатости вещества сводится к определению его поведения при действии взрыва капсюля-детонатора или большего заряда ВВ. Если при этом присутствие испытуемого вещества не увеличивает действие взрыва, то такое вещество считается невзрывчатым.
Более сложным является решение вопроса о взрывчатости в том случае, когда увеличение эффекта взрыва наблюдается, так как это еще не дает оснований считать, что испытуемое вещество безусловно взрывчато. В самом деле, допустим, что это вещество не способно к взрыву, но в состоянии, как например сульфат аммония, под действием высокой температуры продуктов взрыва инициирующего заряда и создаваемой им ударной волны разлагаться с образованием газов. Присутствие такого вещества может привести к некоторому увеличению действия взрыва. Еще более отчетливым будет это увеличение, если взять невзрывчатую смесь сульфата аммония с каким-либо взрывоспособным веществом, например аммиачной селитрой. Однако в обоих случаях будет отсутствовать важнейший признак взрывного процесса — способность его к неограниченному самораспространению. В этом легко убедиться, применив для опыта при том же инициаторе возрастающие количества испытуемого вещества. Начиная с некоторого предела увеличение общего эффекта взрыва перестанет наблюдаться. Следовательно, распространения взрыва на всю массу вещества, подвергнувшегося действию инициатора, происходить не будет. Практически это означает, что в производственных масштабах усиление эффекта не будет превышать по порядку величины силу взрыва примененного инициатора.
Серьезным осложнением при таких испытаниях является то обстоятельство, что способность к взрыву, отсутствующая при малых размерах инициатора и заряда испытуемого вещества, может проявляться при их больших размерах. Вследствие этого полученным при испытании предельным условиям взрывоспособности нельзя придавать значения абсолютных характеристик вещества.
Методика испытания в значительной степени определяется характером инициатора. Если для испытания вещества на взрыво-
$ 3. Методы характеристики чувствительности ВВ и начального импульса 331
способность применяют капсюль-детонатор, то обычно пользуются пробой Трауцля (см. ниже стр. 466), при которой прочная оболочка в виде стенок свинцовой бомбы и песочной забойки благоприятствуют взрыву. Если при таком испытании исследуемое вещество дает расширение не больше, чем сам капсюль-детонатор или точнее, чем капсюль-детонатор в сочетании с веществом, заведомо невзрывчатым, то испытуемое вещество также считается не способным к взрыву.
В качестве примера можно привести смесь аммиачной селитры с хлористым калием. В соотношении 95: 5 такая смесь дает в бомбе Трауцля значительное расширение: 165 слг"; при соотношении 85: 15 расширение 135 см3. В то же время смеси калиевой селитры и хлористого аммония, имеющие тот же самый элементарный состав, но сами по себе пе способные к взрыву в этих условиях, дают расширение всего 4—5 см".
Испытание в бомбе Трауцля с капсюлем-детонатором не может считаться окончательным. Отсутствие заметного дополнительного расширения бомбы может быть вызвано не тем, что испытуемое вещество вообще не способно взрываться, а тем, что оно испытывается в заряде, диаметр которого значительно меньше критического. Как следует из принципа Харитона (см. гл. IV, § 12, разд. 2), при увеличении размеров заряда ВВ может оказаться способным к устойчивой детонации. Поэтому опыты в свинцовой бомбе дополняют обычно испытанием больших зарядов, применяя одновременно более мощный начальный импульс, чем капсюль-детонатор, и прочную оболочку. Наибольший размер испытуемого заряда определяется практическими задачами испытания. Иногда приходится испытывать на способность к взрыву те или иные вещества в виде очень больших зарядов (ящики, барабаны, бочки заводской укупорки, штабели и т. п.).
При испытании, например, технического нитрата кальция, содержащего 13,2% воды и минеральное масло, был применен следующий метод определения зависимости между взрывчатыми свойствами и содержанием масла и воды. Вещество помещали в стальные трубки диаметром 10 см, закрытые с обоих концов, и инициировали при помощи взрыва заряда прессованной пикриновой кислоты весом 100 г. При опыте с кальциевой селитрой, содержавшей только влагу (13,2%), трубка была разорвана и развернута лишь в верхней части, а нижняя часть осталась совершенно целой (фиг. 5. 18, а). Взрыв пе распространился по селитре.
При содержании во влажной селитре 4% масла разложение распространилось на несколько больший участок, как это показывает фиг. 5. 18,6, но часть селитры не взорвалась и нижний конец трубки остался целым.
При третьем опыте была взята сухая селитра и содержание масла доведено до 9%. Вся трубка (см. фиг. 5. 18, в) была разорвана на большое количество кусков с рваными краями, что указывало на наличие взрыва. В этих условиях смесь селитры с маслом следует считать способной к взрыву.
Дальнейшие опыты показали, что способность к взрыву сухой селитры проявляется лишь при содержании масла более 5%.
Большое практическое значение в разных условиях применения имеет также количественная оценка взрывчатости тех веществ,
332
Гл. V. Возбуждение горения и детонации ВВ
которые способны к взрыву. Такую оценку производят путем определения критического и предельного диаметров (см. стр. 196),
Фиг. 5. 18. Железные трубки после подрыва в них кальциевой селитры.
а—с влажностью 13,2%, б—с влажностью 13.2 % и содержанием масла 4% , в—сухая селитра с содержанием масла 9 % .
испытания на полноту детонации удлиненного заряда и на передачу детонации в различных условиях (см. стр. 365).
4. Эффективность начального импульса
Определение инициирующей способности инициирующих взрывчатых веществ
Это определение обычно выполняют, устанавливая предельный заряд испытуемого вещества по отношению к какому-либо вторичному ВВ. Методика определения заключается в следующем.
В гильзу капсюля-детонатора запрессовывают при определенной плотности заряд вторичного ВВ, например тротила, тетрила, пикриновой кислоты и т. п, Поверх этого заряда запрессовывают заряд испытуемого инициирующего вещества. Действие изготовленного таким образом капсюля-детонатора определяют одним из принятых для этой цели методов (см. ниже). Увеличивая или уменьшая при последовательных опытах количество инициирующего ВВ, устанавливают его предельный (минимальный) заряд по отношению к данному вторичному ВВ. Значения предель
f 3. Методы характеристики чувствительности ВВ и начального импульса 333
ных зарядов для некоторых инициирующих ВВ по отношению к тротилу, тетрилу, пикриновой кислоте и тринитроанизолу приведены (по данным Велера) в табл. 5. 20.
Таблица 5.20
Предельные заряды (в г) различных инициирующих взрывчатых веществ
Вторичное ВВ_____
Инициирующее ВВ Тетрил |Пикриновая 1 кислота Тротил Тринитроанизол
Азид кадмия CdNG 0,01 i 0,02 0,04 0,1
Азид серебра AgN3 0,02 0,035 0,07 0,26
г\зид свинца PbN6 0,025 0,025 0,09 0,28
Азид меди CuNc 0,025 0,045 0,095 0,375
Азид ртути HgNg 0,045 0,075 0,145 0,55
Азид таллия T1N3 0,07 0,115 0,335 —
Гремучий кадмий Cd(ONC)? 0,008 0,05 0,11 0,26
Гремучее серебро AgONC 0,02 ; 0,05 0,095 0,23
Гремучая медь CuONC 0,025 ! 0,08 0,15 0,32
Гремучая ртуть Hg(ONC).. 0,29 i 0,30 0,36 0,37
Гремучий таллий T1ONC 0,36 i 0,43 1 —
Приведенные в табл. 5. 20 значения предельных зарядов нельзя, однако, рассматривать как абсолютные константы соответствующих инициирующих ВВ. Так как величина предельного заряда определяется главным образом длиной участка, на котором горение инициирующего ВВ ускоряется до детонации, то она зависит от формы первичного заряда. По существу правильнее говорить о предельной (минимальной) высоте заряда инициирующего ВВ, достаточной для перехода его горения в детонацию, а не о предельном весе заряда.
Испытание инициирующего действия капсюле й-д етонаторов
Различные методы испытания капсюлей-детонаторов можно по способу оценки инициирующего действия разделить на две группы: косвенные и прямые методы. При косвенных методах суждение об инициирующем действии составляют обычно по механическому действию взрыва капсюля.
К косвенным относятся следующие методы.
Испытание в свинцовой бомбочке. В цилиндрическую свинцовую бомбочку высотой и диаметром 100 мм с цилин
334
Гл. V. Возбуждение горения и детонации ВВ
дрическим каналом диаметром 7 мм и глубиной 55 мм вводят капсюль-детонатор с огнепроводным шнуром. Расширение, образованное взрывом, характеризует действие капсюля-детонатора. Результаты опытов для капсюлей-детонаторов с зарядами в 2 г из различных В В приведены в табл. 5. 21.
Таблица 5.21
Расширение в свинцовой бомбочке капсюлей-дето-иаторов с зарядами из различных инициирующих ВВ
ВВ Расширение СМ3 Предельный заряд по тротилу г
Гремучая ртуть 26,0 0,36
Азнд свинца 33,0 0,09
Азид серебра 22,6 ! 0,07
Диазобензолнитрат 43,1 ! >0,5
между инициирующим наблюдается. Расшире-
Фиг. 5. 19. Схема испытания капсю-
Из табл. 5. 21 видно, что соответствия действием и расширением в бомбочке не ние определяется в основном теплотой взрыва ВВ, но не ускорением его горения при поджигании и бризантностью, определяющими инициирующий эффект.
Испытание на свинцовых пластинках (фиг. 5.19). Испытание производят путем взрывания капсюля-детонатора, вертикально установленного на пластинке из листового свинца толщиной 4 или 5 мм. Размеры образующегося углубления или отверстия характеризуют действие капсюля-детонатора. Наряду с этим показателем инициирующего действия считают (в случае капсюлей-детонаторов с металлической оболочкой) тонкость лучей, образуемых на поверхности пластинки осколками оболочки (фиг. 5.20). Иногда определяют также убыль веса пластинки. Эта проба является наиболее распространенной и достаточно оправдала себя в применении к текущему контролю качества капсюлей-детонаторов, определенного типа и проверке их состояния
ля-детонатора на свинцовой пластинке.
J—электродетонатор, 2—свинцовая пластинка, 3—отрезок стальной трубы. 4—защитный кожух.
во время хранения на складе.
Гвоздевая проба. Капсюль-детонатор привязывают к гвоздю; при взрыве гвоздь изгибается (фиг. 5.21). Угол изгиба гвоздя и служит характеристикой действия капсюля-детонатора. Проба проста в выполнении, но ввиду неоднородности гвоздей дает при параллельных испытаниях большие колебания.
§ 3. Методы характеристики чувствительности ВВ и начального импульса 335
Песочная проба. Капсюль-детонатор взрывают в специальной стальной бомбе, заполненной песком с определенными размерами зерен. Количество-раздробленного при взрыве песка, определяемое после опыта ситовым анализом, характеризует действие капсюля-детонатора.
Фиг. 5. 20. Вид пластинки после опыта.
а—нормальное действие капсюля-детонатора, б—неполный азрыв.
Основным слабым местом всех косвенных методов испытания капсюлей-детонаторов является то, что об инициирующем действии
приходится судить по механическим эффектам: пробиванию пластинки, изгибу гвоздя, дроблению песка и т. п. В то же время нельзя считать доказанным, что инициирующее действие однозначно определяется этими эффектами. Более того, в известных случаях это заведомо не так. Например, при испытании капсюлей-детонаторов в металлической гильзе с вдавленным дном пробивное действие на свинцовой пластинке получается гораздо больше, чем в гильзах с плоским дном. Инициирующее же действие, определенное прямым методом, при этом не увеличивается.
По этой причине косвенные методы можно считать приемлемыми лишь для контроля качества капсюлей-детонаторов одной и той же конструкции, но не для сравнения разных типов капсюлей-детонаторов, и с зарядами из различных ВВ. Для последней цели
Фиг. 5.21. Испытание капсюлей-детонаторов по гвоздевой пробе.
а—гвоздь с капсюлем-детонатором перед взрывом, б—гвозди после-взрыва различных капсюлей-детонаторов.
следует применять один из вариантов прямого метода.
Прямым методом определяют непосредственно инициирующее действие испытуемого капсюля-детонатора по отношению к флег-
336 Гл. V. Возбуждение горения и детонации ВВ
матизированному стандартному ВВ. Максимальное содержание флегматизатора, при котором капсюль-детонатор еще вызывает полный взрыв, служит мерой инициирующего действия. Различные варианты метода отличаются в отношении выбора флегматизируе-
мого ВВ, флегматизатора и метода установления полноты взрыва.
Автор прямого метода Эзоп (1899 г.) пользовался пикриновой кислотой, флегматизируя ее хлопковым маслом. Заряды флегма-тизированной пикриновой ки-
0 1 1 3 4 5 6 7
Содержание флегматизатора S %
Фиг. 5.22. Зависимость потери в весе свинцовой пластинки при взрыве флег-матнзированного тротила от содержания флегматизатора.
жание флегматизатора — потеря
слоты он взрывал на свинцовых цилиндриках и о полноте взрыва судил по величине полученного обжатия. В позднейших работах применяли кристаллический тротил, флегма-тизированный парафиновым маслом (2—9%). Заряд весом в 2 а запрессовывали в медную гильзу. Гильзу с зарядом и капсюлем устанавливали на свинцовой пластинке. Потеря в
весе пластинки после взрыва указывала,' произошел ли взрыв тротила и был ли взрыв полным. Нанося результаты на график в координатах содер-в весе пластинки, можно легко
установить максимальное содержание парафинового масла, при котором еще получается полный взрыв флегматизированного тротила (фиг. 5. 22).
В дальнейшем было предложено в качестве флегматизатора применять тальк. Преимущество талька заключается в том, что флегматизированный им тротил не изменяет своей чувствительности при хранении, в отличие от того, что наблюдалось при флег-матизации парафиновым маслом или парафином. С другой сто
роны, введение парафинового масла ограничивается некоторым пределом (9%), выше которого масло выступает на поверхности
заряда при прессовании; для талька же как твердого вещества это ограничение не имеет места. Наконец, так как тальк флегма-тизирует тротил в меньшей степени, то его приходится применять в больших количествах, так что возможные ошибки при дозировке имеют в этом случае меньшее значение, чем при парафиновом масле. Некоторым недостатком применения талька является большая трудность его равномерного распределения в тротиле сравнительно с жидким флегматизатором.
Для установления полноты взрыва Хайд взрывал прессованные шашки флегматизированного тротила на свинцовых плитках; размеры и характер выбоин служили характеристикой взрыва. Этот
3. Методы характеристики чувствительности ВВ и начального импульса 337
метод был проверен у нас в Артиллерийской академии и дал положительные результаты. Поэтому заслуживает сожаления, что он не получил до сих пор практического применения. Нужда же в надежном методе особенно велика, в частности, для правильной оценки влияния на эффективность капсюля-детонатора ряда осуществленных или предложенных нововведений (капсюли-детонаторы в бумажных оболочках, с углублением в нижней части и без него, снижение требований к влагоустойчивости капсюлей-детонаторов и т. д.).
Глава VI
УДАРНЫЕ ВОЛНЫ
§ 1. ОСНОВНЫЕ СВОЙСТВА УДАРНЫХ ВОЛН И МЕХАНИЗМ ИХ ВОЗНИКНОВЕНИЯ
Как уже отмечалось выше, ударная волна — это область сжатия. с резким скачком давления, плотности и температуры на переднем фронте, распространяющаяся в среде со сверхзвуковой скоростью.
Ударные волны возникают при взрыве и могут распространяться в любых средах: воздухе, воде, грунте, бетоне, металле и пр. Наиболее важным практически и поэтому наиболее изученным является случай ударной волны в воздухе. Воздушную ударную волну иногда называют также взрывной волной. Далее мы будем иметь в виду прежде всего именно воздушную среду. Ударные волны в воде и грунте будут кратко рассмотрены в конце главы.
При взрыве сферического заряда ВВ в неограниченной однородной среде область ударной волны (область сжатия) представляет собой шаровой слой, центр которого совпадает с центром взрыва, а радиус непрерывно растет со временем.
Из-за возникновения ударных волн разрушающее действие взрыва может передаваться через окружающую среду на значительные расстояния, намного превышающие те, на которых еще могут непосредственно действовать расширяющиеся продукты взрыва. По мере развития военной техники непрерывно возрастает роль ударных волн как поражающего фактора. При разрыве крупных боеприпасов (авиабомбы большого калибра), взрывах больших зарядов, а также при ядерных взрывах именно ударная волна производит разрушение на значительных расстояниях и является основным поражающим фактором. Если еще в начале нашего столетия ударная волна представлялась не более как любопытным физическим феноменом, то в настоящее время ударные волны имеют важнейшее практическое значение.
На фиг. 6. 1 показана типичная кривая изменения давления во времени p(t) в некоторой точке пространства при прохождении ударной волны, вызванной взрывом. Кривая такого типа может быть записана экспериментально, например с помощью пьезоэлектрического датчика и осциллографа.
§ 1. Основные свойства ударных волн
339
В момент прихода ударной волны в данную точку пространства давление скачком повышается от значения ро (исходное давление среды) до значения р\ на фронте ударной волны (точка А на фиг. 6. 1). Насколько резким является этот скачок видно из того, что у весьма сильных ударных волн переход от Ро к р\ совершается на расстоянии нескольких длин свободного пробега молекул. За фронтом ударной волны давление быстро падает и по прошествии времени t.T от момента прихода ударной волны становится ниже
Фиг. 6. 1. Изменение давления во времени при прохождении ударной волны взрыва.
исходного давления р0; в точке Б фаза сжатия сменяется фазой разрежения. Во фронте ударной волны вещество в данной точке пространства начинает двигаться со скоростью w в направлении распространения волны. Возникновение своеобразного «ветрового» потока — характерная особенность ударных волн. За фронтом волны скорость потока снижается. Характер изменения w(t) за фронтом, так же как и характер изменения плотности p(t), схож с характером изменения p(t).
Передний фронт ударной волны распространяется со скоростью D, которая, как мы видели, превышает скорость потока вещества (Р>да), а также скорость звука в среде (£)>с0), В отличие от с0 скорости D и w являются переменными; по мере распространения и ослабления ударной волны они снижаются. В пределе, на очень больших расстояниях от очага взрыва ударная волна превращается в акустическую; скорость распространения стремится к скорости звука, а скорость потока стремится к нулю.
В начале данного параграфа мы определили ударную волну как область сжатия. В действительности мы видим, что ударная волна состоит из фазы сжатия и следующей непосредственно за ней фазы разрежения. Тем не менее данную выше формулировку можно сохранить. Дело в том, что разрушающее действие ударной волны определяется именно фазой сжатия; фаза разрежения в этом отношении несущественна, и ее разрушающее действие обычно не учитывают, за исключением некоторых частных эффектов. Основной характеристикой фазы сжатия, определяющей разрушающее действие, является избыточное давление на фронте ударной волны:
340
Гл. VI. Ударные волны
В дальнейшем мы, правда, увидим, что в некоторых условиях разрушающее действие определяется величиной удельного импульса * фазы сжатия:
7= | Ьр (/) di, о
тем не менее величина избыточного давления на фронте Др является важнейшим параметром ударной волны **.
Вблизи от очага взрыва давление на фронте ударной волны достаточно велико и измеряется десятками и даже сотнями атмосфер; однако по мере распространения волны и увеличения расстояния от очага давление быстро падает. Не следует думать, что для практики интерес представляют лишь сильные ударные волны с давлением в десятки и сотни атмосфер. В действительности весьма важны также относительно слабые ударные волны с давлением всего лишь в несколько десятых атмосферы. Дело в том, что если воздушная ударная волна вызвана взрывом большой мощности, например взрывом атомной бомбы, то она еще при избыточном давлении на фронте 0,2—0,3 кг!см2 способна причинять сильные разрушения большинству городских построек — кирпичным и деревянным домам; при избыточном давлении 0,6—0,7 ка/с.и2 разрушаются сооружения со стальным каркасом и легкие бетонные здания; избыточное давление в 1,0 кг!см2 приводит к полному разрушению всех строений, кроме прочных железобетонных сейсмостойких конструкций; приблизительно это же давление в случае ударных волн мощного взрыва, имеющих большую длительность, вызывает смертельные поражения живых организмов *** .
Вблизи от очага взрыва, там, где давления измеряются атмосферами и десятками атмосфер, разрушения весьма интенсивны, по охватывают малую площадь. Напротив, умеренные давления, будучи еще достаточными для серьезных разрушений, охватывают весьма большие площади. Примем за 100% площадь круга, внутри которого давление ударной волны при наземном взрыве не менее 0,2 кг/см2. Тогда площади действия ударных волн с разными давлениями будут следующими:
от 0,2 до 2 кг]см2............................ 92%
от 2 до 20 кг1см2............................. 6,7%
от 20 кг)см2 и выше........................... 1,3%
* Удельным импульсом называют импульс сил давления, приходящийся на единицу площади; применяемая обычно в технике .размерность удельного импульса кг сек/м2.
** Значок Д обычно применяют для обозначения малых разностей. К принятому в теории ударных волн обозначению Др как избыточного давления это не имеет отношения: разность Др обычно или ие слишком отличается по порядку величины от ро или даже во много раз превосходит последнее.
*** Приведенные цифры (0,2—1,0 кг! см?) кажутся малыми из-за того, что давления отнесены к малой поверхности (1 см?). Напомним поэтому, что давлению 0,2 кг;см2 соответствует 2 т/.и2.
§ 1. Основные свойства ударных волн
341
Мы видим, что на большей части области разрушений действуют сравнительно слабые волны.
Возникновение и распространение ударной волны в воздухе можно представить на примере простой модели, изображенной на фиг. 6. 2, которой мы уже пользовались при выводе основных уравнений гидродинамической теории детонации.
В трубу, заполненную воздухом с постоянной скоростью w, вдвигается поршень; с этой же скоростью начнет двигаться приле-
Фиг. G. 2. Образование ударной волны движущимся поршнем.
а- схема трубы с поршнем, б—распределение давления по длине трубы в некоторый момент, в—изменение давления со временем в некоторой точке внутри трубы.
тающий к поршню воздух. В воздухе возникнет уплотнение со скачком давления на переднем фронте, который будет распространяться со скоростью D>w. Таким образом, движение поршня приведет к образованию ударной волны, правда, несколько отличной по характеру от типичной ударной волны взрыва. Изменение со временем давления ударной волны, образованной поршнем, движущимся с постоянной скоростью в трубе, в условиях, когда образуется не сферическая, расходящаяся, а плоская одномерная ударная волна, изображено на фиг. 6.2, в. На переднем фронте ударной волны давление (а также плотность, температура, скорость потока) меняется скачком, а затем сохраняет постоянное значение (у типичной ударной волны взрыва оно быстро уменьшается за фронтом).
Для того чтобы движущийся поршень мог создать ударную волну, скорость его должна быть достаточно большой, но не обязательно сверхзвуковой. Если скорость поршня будет порядка скорости звука (в воздухе), то избыточное давление на фронте ударной волны будет порядка нескольких атмосфер; при скорости поршня 50 м/сек избыточное давление на фронте ударной волны будет порядка 0,25 кг/см2. Как уже отмечалось, такого давления достаточно для разрушения многих городских построек. Даже при
342
Г л. VI. Ударные волны
скорости поршня всего около 10 л/сек Api«0,05 кг/см2; ударная волна с таким давлением может вызвать легкие разрушения, в частности, разрушить застекление. Подчеркнем, что здесь всюду идет речь об ударной волне, возникшей при движении необтекаемого поршня. Если 'в воздухе движется хорошо обтекаемое тело (например, самолет или снаряд), то сколько-нибудь значительные скачки давления возникнут лишь при скоростях полета, близких
Фиг. 6. 3. Образование ударных волн поршнем, который ускоряется толчками.
Вверху — изменение давления во времени в некотором сечении трубы. Внизу — а, б и о—кривые распределения давлений по длине трубы в последовательные моменты времени.
к звуковым.
Рассмотрим теперь разные режимы движения поршня. Предположим, что его движение ускоряется толчками. Тогда запись p(t) в каком-либо сечении трубы будет иметь вид, показанный на фиг. 6. 3 сверху, и состоять из ряда ступенек, каждая из которых соответствует скачкообразному увеличению скорости поршня. Распределение давлений по длине трубы в некоторый момент показано в нижней части фиг. 6. 3, на графике а. Весьма важным является
следующее обстоятельство: динамически сжатый газ нагревается, и скорость распространения возмущений в нем увеличивается. Поэтому даже в случае, когда р2—P\=Pi—Ро, скорость D2 волны, идущей по сжатому разогретому газу, будет больше, чем — скорость волны, идущей по невозмущенному газу. В свою очередь скорость D3 волны по двукратно сжатому газу будет больше скорости D.2. Поскольку D2>D2>Dlt задние скачки будут догонять передние. Распределение давлений вдоль оси трубы в последующий момент показано на графике б фиг. 6. 3. В конце концов, все скачки сольются в одну мощную ударную волну, показанную в нижней части фиг. 6. 3 на графике в.
Предположим теперь, что возмущение вначале имеет плавный фронт (фиг. 6.4, а); отметим, что такой фронт может быть получен при плавном ускорении движения поршня. Скорость распространения возмущений в гребне волны будет больше, чем у подошвы. В результате фронт волны будет быстро трансформироваться, становясь все более крутым (см. фиг. 6.4, а, бив). Таким образом, волна сжатия конечной амплитуды, вызывающая при своем прохождении значительный разогрев среды, может устойчиво распространяться только в виде ударной волны со скачком давления на
§ 1. Основные свойства ударных волн 343
переднем фронте; плавный фронт неустойчив и превращается в скачок.
Возвратимся снова к поршню, движущемуся равномерно, и предположим, что поршень начал замедляться или даже остановился. За время движения поршень произвел работу и сообщил воздуху определенное количество энергии; за счет этой энергии распространение ударной волны будет продолжаться и после прекращения движения поршня: теперь сама ударная волна с потоком вещества за ее фронтом будет в известной мере играть роль поршня
Фпг. 6. 4. Трансформация плавного фронта волны сжатии в ударную волну.
по отношению к невозмущенному воздуху. Профиль ударной волны [кривая р(0] после остановки поршня должен существенно измениться. Поскольку воздух будет продолжать двигаться, то в области, прилегающей к поршню, возникнет относительное разрежение.
Таким образом, в результате остановки поршня кривая p(t) на фиг. 6.2 преобразуется и становится схожей с кривой р(/) на фиг. 6. 1 для типичной ударной волны взрыва с характерным быстрым спадом давления за фронтом. Для такой типичной ударной волны нужно отметить следующее важное обстоятельство: передний фронт ее распространяется со скоростью D; тыльная же часть (та часть, где давление становится близким к р0) распространяется со скоростью, близкой к скорости звука в исходном состоянии с0. Поскольку £>>со, головная часть ударной волны распространяется быстрее, чем ее тыльная часть. По мере распространения ударной волны она будет непрерывно растягиваться во времени.
Рассмотренная выше схема образования ударной волны движущимся поршнем может быть применена и к механизму образования ударной волны при взрыве. Сжатые до высокого давления, газообразные продукты взрыва играют роль своеобразного поршня, воздействующего на окружающую среду во всех направлениях и вызывающего в ней ударную волну. Продукты взрыва—этот трехмерный поршень, движущийся от центра взрыва к периферии, в начальный момент имеют наибольшую скорость разлета; по мере расширения скорость разлета падает вплоть до нуля, после чего газы получают некоторое перемещение в обратном направлении.
344
Г л. VI. Ударные волны
Таким образом, при взрыве мы имеем дело как бы с воздействием поршня, который внезапно начинает двигаться с большой скоростью, затем замедляется и останавливается. Поэтому кривая p(t) ударной волны взрыва уже вблизи от очага имеет вид, показанный на фиг, 6. 1, и характеризуется быстрым снижением давления за фронтом.
Для решения некоторых задач важно знать, до какого расстояния (от центра сферического заряда) продолжается поршневое действие продуктов взрыва, или, иначе, на каком расстоянии ударная волна отрывается от подпирающих ее продуктов взрыва и начинает «самостоятельное» существование с тем запасом энергии, который был ей сообщен в процессе расширения продуктов взрыва. Точно определить расстояние отрыва ударной волны от продуктов взрыва трудно, тем более, что этот отрыв происходит не внезапно, а постепенно. Обычно принимают, что при взрыве сферического заряда в воздухе ударная волна отрывается от продуктов взрыва на расстоянии порядка 8—15 радиусов заряда; в среднем можно принимать расстояние отрыва равным 12 радиусам заряда. Давление на фронте ударной волны на этом расстоянии от центра взрыва еще достаточно велико: около 10—20 кг/см2-, скорость распространения волны при этом £>?«1000—1400 м/сек и скорость потока за ее фронтом w~800—1200 м/сек.
По мере распространения ударной волны давления на фронте, так же как и скорости D и w, быстро падают, что обусловлено несколькими причинами.
Если волна сферическая (расходящаяся), то по мере распространения энергия распределяется на все большую поверхность. В результате энергия, приходящаяся на единицу поверхности ударной волны, должна уменьшаться даже при отсутствии потерь. Снижение энергии на единицу поверхности приводит к уменьшению давления.
Далее, как уже отмечалось выше, по мере распространения ударной волны она растягивается во времени, что даже при постоянном импульсе должно приводить к снижению давления.
Кроме того, при распространении сильной ударной волны температура воздуха, по которому она прошла, даже после прохода волны оказывается несколько выше начальной температуры («тепловой след» ударной волны); на этот нагрев тратится часть энергии, что также вызывает падение давления.
Все перечисленные факторы действуют в одном направлении и быстро, особенно в случае сильных сферических волн, снижают давление на фронте ударной волны по мере ее распространения.
Рассмотренные выше основные свойства ударной волны позволяют сформулировать важнейшие различия в характере ударной и акустической волн.
1. Изменения давления, плотности и температуры среды, по ко
1. Основные свойства ударных волн
3-15
торой проходит акустическая волна, ничтожно малы по сравнению с исходными давлением, плотностью и температурой; акустическая волна представляет собой устойчивую форму распространения весьма слабых возмущений.
На фронте ударной волны происходит конечное п притом скачкообразное изменение давления, плотности и температуры; ударная волна представляет собой форму распространения сильных возмущений, когда изменения параметров среды при сжатии не могут рассматриваться как ничтожно малые по сравнению с исходными их значениями.
2. Скорость распространения звука в данной однородной среде при заданных начальных условиях является константой.
Скорость распространения фронта ударной волны не является постоянной величиной и зависит от интенсивности скачка давления; как правило, ударная волна распространяется со скоростью, большей скорости звука.
3. При распространении акустической волны происходит колебательное движение частиц среды; конечное перемещение среды практически отсутствует.
При распространении ударной волны за ее фронтом возникает поток вещества тем более сильный, чем сильнее волна. В фазе сжатия поток движется в сторону распространения ударной волны; в фазе разрежения возникает более слабое (с меньшей скоростью) движение в противоположную сторону. В итоге происходит конечное перемещение вещества среды в направлении распространения волны.
По мере распространения ударной волны она ослабевает: ее избыточное давление уменьшается до ничтожно малого; скорость распространения уменьшается и в пределе стремится к скорости звука; скорость потока уменьшается вплоть до нуля. На достаточно большом расстоянии от источника взрыва ударная волна превращается в обычную акустическую волну.
Из всего изложенного выше следует, что не существует резкой границы между слабой ударной и сильной акустической волнами. Существуют возмущения такой интенсивности, которые можно-с одинаковым успехом называть и слабыми ударными волнами и сильными акустическими. Граница между ними условна и зависит от обстоятельств, характера поставленной задачи, необходимой точности и пр.
В теории ударных волн иногда различают сильные и слабые волны. Сильной ударной волной (сильным взрывом) называют волну со столь большим давлением на фронте, что по сравнению с ним начальное давление весьма мало и им можно пренебречь. Очевидно, что граница между сильной и слабой ударными волнами еще менее определенна, чем граница между ударными и акустическими волнами.
•346
Г л. VI. Ударные волны
§ 2. НЕКОТОРЫЕ КОЛИЧЕСТВЕННЫЕ СООТНОШЕНИЯ МЕЖДУ ОСНОВНЫМИ ПАРАМЕТРАМИ ВОЛНЫ
Основными параметрами ударной волны, подлежащими определению, являются следующие пять величин: давление на фронте р}, плотность pi и температура Ti вещества во фронте волны, скорость распространения фронта D и скорость потока вещества за ним w. Как было показано в гл. IV при рассмотрении гидродинамической теории детонации,- уравнения сохранения массы, количества движения и энергии при сжатии, а также уравнение состояния сжимаемого волной вещества дают четыре соотношения между указанными пятью параметрами. Задав один из них, можно определить все •остальные, установив однозначную их связь с заданной величиной, •а также с параметрами, характеризующими исходное состояние среды,
Выберем в качестве задаваемой практически наиболее важную величину Др, равную рг—р0, и установим связи
™ = ? = f3^P) и Г=/4(Др).
Из закона сохранения количества движения (4.44) следует
Др —р0Рда. (6. 1
Из уравнения сохранения массы (4. 43) получаем
₽Ц. (6.2)
\ ?! /
Следовательно,
др-poWi-M (б.з)
\ Р1 /
Подставляя в формулу (6.3) значение Po/Pt из формулы динамической адиабаты для идеального газа (4. 53)
_?о _ — 1)Р1 + (^ + 1)ро
Pl (k + 1)рJ -(- (k—1)/’о
производя простейшие преобразования и заменяя А—- величи-₽о
ной с‘, получим
Ap^l^2-^), (6.4)
откуда .
<6-5’
§ 2. Количественные соотношения между параметрами ударной волны 347
Далее, из (6. 1) получаем _____________________________________________
Ро° . / <fe4- 1)ЛЛРо , 2
I/ 2 ' "Г ° °
Из уравнения (4. 53) непосредственно следует
Pi = U + 1)(Др + д0) + (fe- 1)ро
Ро (&—1)(Ар + ро)Ч~(£ 4* Про
Для соотношения температур получим _7i _ ?L 2Д То Ро vo
Учитывая, что
^1 __ Ро
v0 Pl
(6.6)
(6-7)
(6.8)
и подставляя в (6.8) значение pi/po из формулы (6.7), получим
71 / + ро \ Г (£ — 1) (Др 4~ро) -ф (£ + 1)Ро
\ Ро Л (^4-1)(^р4*Ро)4*(^ — Нро
(6-9)
Вводя новую величину' — местную скорость звука С! во фронте ударной волны (т. е. скорость, с которой будут распространяться малые возмущения в воздухе, имеющем то же состояние, что и на фронте ударной волны), мы вместе с тем вводим новое соотношение:
с1== | /k ^ -1/(6.10) Г Pi I Pi
Заменяя в (6.10) значение pi из уравнения (6.7), получим
с i/~Д1^рЗ~Ро) —1)(^р+ро)4~Ч~ 1)Ро zg ц\
Т Ро ~Ь 1) (Др +Ро) 1)Ро
В табл. 6. 1 даны значения D, w, clt —, —- в функции Др, рассчн-Ро 7'„
данные по формулам (6.3—6. 11) для значений ро, ро, То, с0, соответствующих международной стандартной атмосфере. Расчет выполнен с переменным значением k, т. е. с учетом изменения теплоемкостей. Значения k оценены по величине внутренней энергии газа при соответствующих температурах и давлениях. Данные, стоящие ниже черты, т. е. данные, относящиеся к давлениям от 30 до 100 кг/см'2, мало надежны. Если необходим расчет параметров при ДД>100 кг 1см2, то нужно учитывать не только изменение теплоемкости воздуха, но также его частичную диссоциацию и ионизацию, происходящие при высоких температурах.
Данные табл. 6. 1 нанесены на графиках фиг. 6. 5 и 6. 6.
348
Гл. VI. Ударные волны
Таблица 6.1
Параметры фронта ударной волны в воздухе
Ро = 1,033 кг/см2; ро = 1,25-Ю'-3 г/см3; 7’0 = 288°К; <?о==34О м!сек
&р в кг) см2 D в м[сек w в ‘сек ct в MfceK Pi/Po Г1/Го
0,05 347 11,5 342 1,034 1,014
0,10 354 22,6 345 1,068 1,028
0,15 361 33,3 347 1,101 1,040
0,20 367 43,6 349 1,134 1,053
0,25 374 53,5 351 1,167 1,064
0,30 379 63,4 353 1,200 1,076
0,40 393 81,4 357 1,262 1,100
0,50 405 98,7 360 1,324 1,121
0,70 428 131 367 1,442 1,164
1,00 461 174 377 1,606 1,226
1,40 501 223 388 1,811 1,301
2,0 560 288 408 2,083 1,409
3,0 636 375 428 2,47 1,58
4,0 707 453 450 2,785 1,75
5,0 778 514 469 3,06 1,91
6,0 831 578 489 3,295 2,07
7,0 887 632 508 3,48 2,23
8,0 938 682 524 3,67 2,38
9,0 986 729 544 3,82 2,54
10,0 1034 771 556 3,95 2,705
12,0 1122 856 585 4,21 3,00
15,0 1242 966 626 4,51 3.44
20,0 1418 1128 686 4,895 4,16
30,0 1715 1400 784 5,465 5,50
40 1965 1630 864 5,89 6,75
50 2192 1825 936 6,20 7,97
70 2566 2182 1050 6,74 10,21
100 3040 2630 1180 7,42 13,20
$ 3. Разрушающее действие ударных волн
349
Фиг. 6.5. Параметры ударных воли в воздухе при значениях Др до 2 кг/см*.
Фиг. 6.6. Параметры ударных волн в воздухе при значениях Др от 2 до 30 кг]с.ч*.
§ 3. ОСНОВНЫЕ ФАКТОРЫ РАЗРУШАЮЩЕГО ДЕЙСТВИЯ УДАРНЫХ ВОЛН И ЭЛЕМЕНТЫ ЗАКОНА ПОДОБИЯ ПРИ ВЗРЫВАХ
Для полной оценки разрушающего действия взрыва необходимо знать характер нагрузки и свойства сооружения, на которое эта нагрузка действует. Наиболее полная характеристика нагрузки дается заданием p(t) —избыточного давления в функции времени.
В некоторых случаях можно существенно упростить задачу и полагать, что разрушающее действие ударной волны определяется либо избыточным давлением на ее фронте
— Ро, либо величиной удельного импульса фазы сжатия: '+ о
Ударная волна весьма мощного взрыва, например взрыва атомной бомбы, взрыва' крупного склада боеприпасов и т. д., достаточно интенсивна на больших расстояниях и имеет большую протяженность во времени. Время действия t+ фазы сжатия такой ударной волны обычно превосходит период Т собственных колебаний элементов сооружений
Если t+^>T, то разрушающее действие в основном определяется величиной избыточного давления. В этом случае время существо-
1 Для типичных строительных сооружений, зданий и их частей величина Т составляет несколько сотых или несколько десятых секунды.
350
Гл. VI. Ударные волны
вания избыточного давления в волне (Д) в характеристику разрушающего действия непосредственно не входит. Этого времени хватает с избытком: если давление достаточно велико, то сооружение
деформируется и разрушится за такое время (порядка——I), за которое давление в ударной волне не успеет упасть сколько-нибудь значительно. Если давление недостаточно и вызванная им деформация сооружения с самого начала не приведет к его разрушению, то сооружение не разрушится и в последующие моменты, когда давление начнет падать.
Этот случай, когда разрушение определяется избыточным давлением (ударная волна весьма мощных взрывов), часто условно называют статическим действием ударной волны.
Если ударная волна вызвана взрывом малой мощности (взрыв обычных одиночных боеприпасов: артиллерийских снарядов, фугасных авиабомб малого и среднего калибра и т. д.), то на тех расстояниях, где ударная волна еще является достаточно интенсивной, длительность фазы сжатия tj. меньше периода собственных колебаний Т типичных сооружений или их частей. В случае когда давление за фронтом упадет за столь короткий промежуток времени, что сооружение практически еще не успеет сдвинуться с места. Однако под действием импульса фазы сжатия сооружение приобретет некоторое количество движения и будет в дальнейшем разрушено, если это количество движения окажется достаточным, чтобы вызвать некоторую предельную деформацию; разрушение в этом случае произойдет уже после того как фаза сжатия пройдет.
Таким образом, если Т, то разрушающее действие определяется сообщенным сооружению импульсом фазы сжатия. Этот случай часто называют условно импульсивным действием ударной волны.
Если Ц по порядку величины не слишком отличается от Т, то характер действия ударной волны будет в известной мере промежуточным между чисто импульсивным и статическим. Разрушающее действие в этом случае нельзя оценивать ни по величине избыточного давления, ни по величине удельного импульса: оно будет определяться некоторой головной частью импульса. В таких случаях для оценки разрушающего действия нужно знать всю кривую p(t).
Для оценки разрушающего действия ударной волны взрыва фундаментальное значение имеет закон подобия при взрыве, элементы которого будут изложены ниже.
Закон подобия позволяет оценивать и сравнивать величины избыточных давлений и импульсов ударных волн, вызванных взрывами зарядов различного веса и даже совершенно различной природы. Эта возможность исключительно важна. Почти все эмпирические формулы, применяемые для оценки разрушительного действия удар
3. Разрушающее действие ударных волн
35 Г.
ных волн, по существу являются частными приложениями закона подобия. На этом законе, в частности, основана возможность, моделирования сверхмощных взрывов.
Наиболее просто формулируются выводы закона подобия для избыточного давления. Величину избыточного давления ударной волны взрыва можно оценить, если известно расстояние 7? от центра заряда и дана характеристика самого взрыва. Чтобы полностью характеризовать взрыв, нужно, как мы увидим далее, знать полную его энергию и начальное давление воздуха. В некоторых случаях достаточной характеристикой является вес заряда или даже его линейные размеры.
Прежде чем переходить к основным выводам закона подобия,, необходимо указать на некоторые существенные условия успешного-его применения.
Представим себе, что в однородной среде взрывается заряд ВВ-сферической формы. Тогда ударная волна будет расходиться одинаково во все стороны и ее последовательные положения будут-представлять ряд сфер с общим центром, совпадающим с центром заряда. Поле давлений будет центрально симметричным, и для оценки избыточного давления достаточно задать расстояние до-центра взрыва, не указывая направления: все направления в данном случае равноценны. Возможность использования закона подобия в таком случае сферической симметрии существенно облегчена.
Значительно сложнее решить вопрос, если форма заряда отличается от сферической (например, кубическая, цилиндрическая,, и др.). Поверхность ударной волны взрыва таких зарядов, особенно вблизи от центра взрыва, не является сферой и величина давления иа одинаковых расстояниях будет различной для разных направлений.
Дело в том, что в начальный момент продукты взрыва движутся в направлениях, перпендикулярных поверхностям заряда. Если, например, взорвать заряд в виде куба, то продукты вначале будут-двигаться в направлениях, перпендикулярных его сторонам, и давления в этих направлениях на одинаковых расстояниях от центра будут больше, чем в направлениях диагоналей. Возникшая при таком взрыве ударная волна на одинаковых расстояниях от центра будет иметь большую скорость распространения и соответственно-большее давление в направлении сторон заряда, чем в направлении его диагоналей. Лишь на некотором расстоянии от центра взрыва поверхность ударной волны становится сферической, практически такой же, как от сферического заряда. Это расстояние достаточно велико: для зарядов, форма которых не слишком отличается от сферы (куб, цилиндр с высотой, равной диаметру, и т. д.), различие параметров ударной волны в разных направлениях еще заметно па расстоянии в несколько десятков радиусов заряда; для зарядов, форма которых резко отличается от сферы (удлиненный цилиндр,.
352
Гл. VI. Ударные волны
диск и т. д.), различие еще заметно на расстоянии 100—150 радиусов (наименьших размеров) заряда.
Если заряды не являются сферическими, то для не слишком больших расстояний при использовании закона подобия должны быть соблюдены следующие дополнительные условия:
1. Сравнение должно производиться для зарядов подобной формы.
2. Должны сравниваться эффекты для подобных направлений (т. е., например, в случае цилиндра или в направлении оси, или в направлении, перпендикулярном ей, или в направлении углов. Сравнивая два заряда, нельзя для одного определять эффект в направлении боковых сторон, а для другого — в направлении оси цилиндра)..
В дальнейшем отсутствие специальных указаний о направлении и задание только величины расстояния будет означать, что рассматривается простейший случай — сферической ударной волны, образованной взрывом сферического заряда, или же расстояния столь велики, что и несферический заряд на таком расстоянии уже дает сферическую волну.
Простейшим случаем закона подобия при взрывах является так называемый геометрический закон подобия, согласно которому расстояние Д, на котором наблюдается некоторое определенное значение Api*, пропорционально радиусу г заряда Ч
/?(Ц)=аг’ (6Л2)
Если, например, заряд радиусом rt дает давление Apt* на расстоянии /?!, то заряд радиусом г2 даст такое же давление Apj* на расстоянии /?2> причем
/?2 С>
(6.13)
Если Api не задано будет наблюдаться на закону подобия
и нам необходимо определить, какое Api расстоянии R, то согласно геометрическому
4Л=/(т)-
(6.14)
Вид функции f должен быть установлен из опыта.
Весьма простой геометрический закон подобия имеет, однако, крайне ограниченное применение. В изложенной выше форме он может быть применен только к зарядам из одного и того же ВВ и при одинаковой плотности. Если мы будем брать заряды одного и
1 Здесь и далее мы будем писать Др), чтобы подчеркнуть, что речь идет об избыточном давлении на фронте волны.
§ 3. Разрушающее действие ударных волн
353
того же ВВ, но разной плотности, соотношения (6. 12) —(6. 14) применять нельзя.
В более общем случае — различных плотностей — вместо радиуса заряда в качестве основного параметра принимают величину з____
У С, где С — вес заряда. Закон подобия в этом виде можно назвать обобщенным геометрическим законом подобия. Согласно этому закону
= ai (6.15)
Если, например, заряд весом Cj создает давление Дрр* на расстоянии 7?i, то другой заряд весом С2 создаст это же давление иг расстоянии Rp, при этом
* =-Г/о .
Л2 |/ с.
(6.16)
Если решается более общая задача зависимости Api от расстояния, то согласно обобщенному геометрическому закону подобия
/ з _\
• (6-17)
\ К /
Вид функции / определяется из опыта. В дальнейшем этот вил будет приведен.
Величину
(6.18)
Ус
называют приведенным расстоянием; в соответствии с (6. 17) величина Api есть однозначная функция приведенного расстояния. При расчетах приведенного расстояния, так же как и в вычислениях по уравнению (6. 17), применяют техническую систему единиц и подставляют R (а также г) в метрах и С в килограммах.
Если сравнить выражения (6. 14) и (6. 17), то очевидно, что ве-з________
личина У С как бы заменяет собой радиус заряда. Дадим чис-з_____________________________________
ленную связь между величинами г и УС при плотности заряда Р = 1,0 г'см‘. Очевидно, что
Г='У Ы
где 8 — удельный вес ВВ.
354
Гл. VI. Ударные волны
При использовании технической системы единиц плотности р — 1,0 г/см" будет соответствовать удельный вес 8=103 кг!»?. При этом
. 3 _ 3 _
г= ~У С, или УС*= 16г.
16
3 _
Следовательно, если о = 1,0 г!смъ, то величина ]/ С, используемая в качестве «приведенного» радиуса заряда, примерло в 16 раз больше обычного радиуса заряда.
Раньше было установлено, что отрыв ударной волны от продуктов происходит на расстоянии 10—15 радиусов заряда. Из этого следует, что приведенное расстояние R~ 1 несколько больше расстояния отрыва ударной волны. При /?<1 на окружающую среду действуют ударная волна и продукты взрыва; при R^-1 объект подвергается воздействию только ударной волны.
Обобщенный геометрический закон подобия, в который входит з _
параметр ]/С/R вместо параметра r/R, может применяться более широко и, в частности, для зарядов разной плотности. Однако возможности этого закона также ограничены. Опыт показывает, что если взять заряды различных ВВ равного веса, но развой энергии, то заряд с большей энергией окажет на одинаковом расстоянии более сильное действие. Это совершенно естественно: энергия ударной волны, с которой связано ее разрушительное действие, должна зависеть не от веса заряда С, а от энергии взрыва E — CQ.V, где Скудельная теплота взрыва. Таким образом, в самом общем случае основным параметром закона подобия при взрывах должен слу-з___________________ з _
жить не параметр ]/С/R, а параметр У E/R.
Этот вариант, развитый в работах Л. И. Седова и М. Л. Садовского, носит название энергетического закона подобия при взрыве. Энергетический закон можно применить не только для сравнения зарядов разных ВВ, но также для сравнения взрывов существенно разной природы, например взрывы ВВ с одной стороны, и взрывы электрические, атомные, вулканические и т. д. Для успешного сравнения этих взрывов достаточно знать выделившуюся в каждом случае энергию. Здесь, правда, нужно сделать некоторую оговорку.
з __
Дело в том, что по существу в параметр У Е/R должна входить не полная энергия взрыва Е, а энергия ударной волны, составляющая некоторую долю полной энергии взрыва £'в=г|£', где г]<1. Если сравниваются взрывы разной природы, то величина ц может несколько различаться, но нужно подчеркнуть, что это различие невелико. Для ВВ изменением ц можно пренебречь и с достаточной
§ 3. Разрушающее действие ударных волн
355
з__
для практических целей точностью подставлять в критерий V E/R полную энергию взрыва.
3 _
Можно использовать критерий VC/R, в который входит вес заряда С, таким образом, что он по существу станет энергетическим. Для этого необходимо в качестве веса заряда подставлять его энергетический эквивалент, т. е. вес такого заряда стандартного ВВ (обычно тротила), энергия которого равна энергии взрыва данного заряда.
В первом приближении можно полагать, что
С = С-<3-, эк Отит
где С — вес взятого заряда; Сэкв— его тротиловый эквивалент; Q— его удельная теплота взрыва; QTHT — удельная теплота взрыва тротила.
В качестве последней величины обычно берут округленное значение QTHT=1000 ккал!кг. Это значение относится к тротилу большой плотности (прессованному или литому). Тротил малой (насыпной) плотности имеет меньшую теплоту взрыва. Отметим, далее, что аммонит № 6 имеет теплоту взрыва, близкую к 1000 ккал/кг, поэтому тротиловый эквивалент заряда практически равен его эквиваленту по аммониту № 6.
Для примера возьмем 1 кг нитроглицерина; теплота его взрыва '—-'1500 ккал, т. е. в полтора раза выше, чем у тротила. Предположим, что нам нужно определить Ар1 на некотором расстоянии R с помощью формулы (6. 17)', причем вид функции f установлен для тротила. Применяя эту функцию для нитроглицерина, в качестве С нужно подставлять не 1 кг, а эквивалентный вес по тротилу, т. е. Сэкв=1,5 кг.
При использовании тротилового эквивалента формула (6. 17) является по существу энергетической, хотя непосредственно в нее входит вес заряда. Она позволяет сравнивать не только взрывы зарядов разных ВВ, но и взрывы различной природы. Можно применять формулу (6. 17) с численными коэффициентами, установленными для тротила, к взрывам атомным, вулканическим и т. д., только в качестве С нужно подставлять вес заряда тротила, эквивалентный по энергии данному взрыву.
По существу, при использовании в расчетах эквивалентных тротиловых зарядов вес тротила играет роль своеобразной энергетической единицы:
1 кг тринитротолуола.............................103 ккал
1 т . 106 ,
1 кт (103т) » 109 „
1 Мт (1С6г) , 1012 Я
В дальнейшем, в гл. IX, мы увидим, что правильнее было бы подставлять не весовой эквивалент по энергии, а весовой эквивалент по полной работе. Впрочем, это замечание имеет скорее принципиальное, чем практическое значение.
356
Гл. VI. Ударные волны
Приведем данные о виде функции f в формуле (6. 17). В результате обширных исследований, проведенных М. А. Садовским, вид этой функции точно установлен для тротила и. следовательно, для любого вида взрыва при использовании тротилового эквивалента. Из иностранных работ по этому вопросу следует отметить работу Стонера и Бликнея. Для давления воздушной ударной волны от взрыва заряда сферической (или близкой к ней) формы, распространяющейся в свободном воздухе без взаимодействия с земной поверхностью, имеем *
,, 0,84 , 2,7 , 7,0
Др,—-^.-4- —+
71 R 1 /?2
(6.19)
Если взрыв происходит на поверхности земли и ударная волна распространяется вдоль поверхности, давления будут несколько большими:
ДР!
1,06 ,4,3 14
R + ' Р3
(6. 20)
Формулы (6. 19) и (6. 20) выведены для диапазона изменения R от 1 до 10—15. При /?<Я эти формулы могут дать существенную ошибку. В табл. 6. 2 даны значения Apj, вычисленные по формулам
Таблица 6.2
Избыточные давления Д/ц воздушной ударной волны в зависимости от приведенных расстояний R
IcoS-II IQ? Apinos KZjCM2 возд кг) см2 /с' кг] см- &Р1 возя KZICM2
15 0,094 0,07 3,0 1,35 0,85
12 0,126 — 2,75 1,63 —
10 0,163 0,118 2,50 2,00 1,21
9 0,19 — 2,0 3,35 1,99
8 0,227 0,161 1,8 4,21 2,50
7 0,281 — 1,6 5,75 3,29
6 0,36 0,247 1,4 7,94 4,52
5 0,496 0,332 1,3 9,73 5,43
4,5 0,602 — 1,2 12,00 6,60
4,0 0,743 0,488 1,1 15,00 8,20
3,5 0,981 — 1,0 19,4 10,1
* Напомним еще раз, что при вычислении приведенного радиуса R по формуле (6.18): расстояния надо подставлять в метрах, а веса зарядов в килограммах
§ 3. Разрушающее действие ударных волн
357
(6.19) и (6.20). Первая колонка значений Арш»— распространение по поверхности от наземного взрыва; вторая колонка Арв03Д— распространение в свободном воздухе.
Данные табл. 6. 2 нанесены на графике фиг. 6. 7. Верхняя кривая соответствует случаю распространения ударной волны по поверхности. нижняя — распространению в свободном воздухе. Поль, зуясь графиком и зная R, можно определить Apt или решить обрат
ную задачу.
Рассмотрим пример. Пусть заряд гексогена весом 2,5 т взрывается на поверхности земли; требуется определить давление на фронте волны иа расстоянии R= ---50 м. Примем теплоту взрыва гексогена равной 1300 ккал/кг; тогда эквивалентный по энергии тротиловый заряд равен
Фиг. 6. 7. Избыточное, давление Apt иа фронте сферической ударной волны взрыва в функции приведенного расстояния R.
/—взрыв на поверхности земли, 2—взрыв в воз-духе.
Сэкв — Стеке
Отеке Qtht
= 2500™ = 3250 кг. 1000
Приведенное расстояние
= 3,4. /3250
Находим для поверхностного заряда при 7?=3,4
Д/>1 = 1,05 кг)см2.
Решим обратную задачу: на поверхности земли взрывается заряд аммонита общим весом 10 т, или 104 кг; теплота взрыва аммонита равна теплоте взрыва тротила. Требуется определить, на каком расстоянии от центра взрыва избыточное давление будет равным 0,25 кг/с.и2. Находим, что давлению Apt = 0,25 кг;слд-соответствует 2?=7,5; отсюда искомое расстояние
_ 3 _ 3 __
=7? /С = 7,5 /104 160 м.
Наконец, если известно Ар] и R, аналогичным образом можно определить Сэкв. Далее в главе о работе взрыва мы увидим, что на этом основан один из методов оценки работоспособности ВВ.
Напомним, что если для заряда с тротиловым эквивалентом С, известно давление Api на расстоянии Ri, то легко можно определить, на каком расстоянии Rz заряд с тротиловым эквивалентом даст то же значение Apr, это может быть сделано с помощью урав
358
Гл. VI. Ударные волны
нения (6. 16) без использования формул с конкретными коэффициентами, таблиц или графиков.
Остановимся очень коротко на вопросе о величине импульса ударной волны взрыва.
Использование закона подобия и опытные исследования, впервые проведенные М. А. Садовским, показывают, что на расстояниях Д>0,5 величина удельного импульса ударной волны взрыва может быть оценена следующей простейшей формулой:
I А --- = A кг сек'лА. (6.21)
R R '
Некоторые данные о значении коэффициента А будут приведены в дальнейшем. _
Вблизи от заряда (/?<Д,25) величину удельного импульса обычно оценивают формулой иного вида:
(6.22)
Наконец, для времени действия фазы сжатия t+ М. А. Садовским предложена формула
е__ _
/+»/СУ>-10~3 сек. (6.23)
Приведенные выше формулы для давления относились к случаю распространения сферической ударной волны. При распространении ударных волн по трубам и каналам стенки препятствуют расхождению ударной волны и она превращается в плоскую; законы изменения давления с расстоянием при этом существенно меняются. Если пренебречь трением ударной волны о стенки, то импульс ударной волны практически остается постоянным; давление по мере распространения снижается, но значительно слабее, чем в случае сферической ударной волны. У сильных плоских волн давление снижается с расстоянием по закону
у слабых волн
§ 4. ИЗМЕНЕНИЕ ДАВЛЕНИЯ В УДАРНОЙ ВОЛНЕ ВО ВРЕМЕНИ
Для полной оценки разрушающего действия ударной волны нужно знать изменение давления в функции времени.
Подчеркнем, что знание кривой p(t) позволяет определить избыточное давление на фронте Api, величину удельного импульса и ряд
§ 4. Изменение давления в ударной волне во времени
359
других величин. Поэтому в данном курсе мы не приводим данных о методах и приборах, определяющих только Api или только I, и ограничиваемся кратким изложением методов записи p(t).
На фиг. 6. 8 дана схема записи ,p(f) для ударной волны, распространяющейся в однородной воздушной среде; эта запись имеет нормальный «классический» вид. Избыточное давление на фронте Api определяют непосредственно измерением максимальной ординаты; масштаб давлений по оси ординат устанавливают из тариро-
Фиг. 6. 8. Схема записи изменения избыточного давления в ударной волне взрыва со временем.
вочных опытов. Непосредственным измерением абсциссы определяют /+ — время действия фазы сжатия; система меток времени дает масштаб для оси абсцисс.
Аналогичным образом могут быть определены Ар.. — избыточное давление в фазе разрежения (p<J>o, поэтому величина р—ро отрицательна) и t~ — время действия фазы разрежения.
Удельный импульс фазы сжатия 1+ пропорционален площади S, заштрихованной на фиг. 6. 8 двойной штриховкой. Если площадь S определена (что обычно выполняют графически), то для вычисления импульса нужно знать масштабы осей, т. е. связи Api=f (у) и /+=ф(.г). Если давление и время есть линейные функции соответствующих координат \р\~Ьу, t+—ax, то
/+ = abS.
Если давления измеряют в кг!см2 и время — в секундах, то размерность удельного импульса получится кг сек!см2-, на практике обычно измеряют импульс в кг сек/м-.
Импульс фазы разрежения (одиночная штриховка на фиг. 6. 8) может быть вычислен аналогичным образом.
К приборам, записывающим p(t) для ударных волн взрыва, предъявляются высокие требования в отношении разрешения во времени. Период их собственных колебаний Т должен быть значительно меньше времени действия волны t+.
360
Гл. VI. Ударные волны
Если Т лишь немного меньше t+ (или даже T>t.<r), то запись будет сильно искажена; такой случай изображен на фиг. 6. 9, а, где сплошной линией показана истинная кривая p(t), а пунктиром — ее запись прибором с относительно большим Т. Передний фронт волны оказывается «заваленным», значение Apt получается значительно меньше действительного; попросту говоря, прибор с малой собственной частотой не успевает записать «пиковое» давление. Этот же прибор может быть успешно использован для записи p(t) более растянутой волны (фиг. 6.9, б). В этом случае фронт
Фиг. 6. 9. Записи кривой p(t) приборами с недостаточно высокой собственной частотой.
а—волна мало’П длительности, о—волна значительной длительности, /—истинная кривая, 2—запись, полученная прибором.
также «завален», но общая форма волны искажена гораздо меньше. Зафиксированное значение Api практически не отличается от истинного. Ориентировочно следует полагать, что собственный период колебаний прибора Т должен быть таким, чтобы за это время давление уменьшалось не более чем на 2—5%.
Опишем схематически метод записи р(/), основанный на использовании пьезоэлектрического эффекта. Если из кристаллов некоторых веществ — пьезоэлектриков— вырезать определенным образом пластинки, то при воздействии на них ориентированных по некоторым направлениям сил на гранях пластинок появляются электрические заряды, пропорциональные приложенной силе.
Если F— приложенная сила и Q — заряд, то
Q-KF,
где К.—пьезоэлектрический модуль — константа для данного вещества.
Появление заряда Q приводит к возникновению электрического напряжения, которое обычно усиливают специальным устройством и подают на шлейфный или катодный осциллограф, вызывая отброс луча. Наличие развертки луча во времени дает запись p(t). Для оценки изменения давления Ар по отклонению луча предварительно проводят тарировочные опыты. Тарировку осуществляют разными методами: статическим давлением с последующим учетом так называемого коэффициента динамичности, подсчитываемого для данных условий; тарируют устройствами, имитирующими динамическое действие ударной волны; в частности, на практике широко применяют тарировку ударными волнами с известными значениями Apb
4. Изменение давления в ударной волне во времени
361
Кроме того, применяется следующий метод тарировки. Выше мы видели, что избыточное давление на фронте Api и скорость распространения ударной волны D связаны зависимостью (6.4). Если на небольшой базе точно измерить скорость распространения ударной волны (база должна быть такой, чтобы скорость, распространения на ней менялась бы весьма мало), то применив формулу (6.4), легко найти величину Лщ, а затем сравнить ее с показаниями пьезометода. При этом только пьезодатчики должны обладать достаточно высокой собственной частотой f или, следовательно, малым периодом собственных колебаний Т
чтобы за время Т давление в волне упало не более чем на 2—5Л/о.
Несмотря на то, что принцип работы пьезодатчиков весьма прост, конструирование надежных, полноценных приборов было связано с преодолением значительных технических трудностей. В настоящее время существуют вполне надежные конструкции, с высокой собственной частотой, превышающей 50— 100 кгц. Такие датчики позволяют получать записи р(/) от взрыва зарядов весом в 10—20 г и даже в 1 г (длительность фазы сжатия 10“4 сек.).
В качестве пьезоэлектриков, кроме кварца, обладающего большой прочностью и высоким постоянством пьезоэлектрических свойств, используют турмалин; перспективным материалом является также титанат бария.
В полевых условиях при взрыве сравнительно крупных зарядов, обычно применяют наиболее простые методы записи p(t). С одной стороны, в полевых условиях не всегда можно применить методы, требующие сравнительно сложной аппаратуры; с другой стороны, более глубокие ударные волны с большим t+ успешно могут быть, зафиксированы с помощью простых методов. В качестве примера можно указать на тензодатчики, принцип действия которых заключается в том, что при деформации стальной мембраны с наклеенной на ней определенным образом тонкой проволокой электрическое сопротивление последней меняется, что и фиксируется осциллографом. Для очень глубоких волн, вызванных сверхмощными взрывами, кривая p(t) может быть с достаточной точностью записана простыми механическими приборами.
Зависимость от времени изменения давления и других параметров — плотности, температуры, скорости потока за фронтом ударной волны —- можно получить не только экспериментально, но и из теоретических расчетов. Такие расчеты весьма сложны и доведение их до численного результата стало возможным лишь с появлением современных быстродействующих электронных вычислительных машин.
На фиг. 6. 10 показано в безразмерных координатах изменение давления за фронтом, вычисленное теоретически. По оси абсцисс отложено время t в долях полного времени действия фазы сжатия t/t+; по оси ординат отложено отношение текущего значения давления к пиковому давлению волны. Каждая кривая соответствует определенному значению приведенного расстояния и избыточного давления на фронте. Из графика видно, что чем больше избыточное давление на фронте, тем относительно быстрее оно падает за фронтом.
Нужно иметь в виду, что на фиг. 6.10 в качестве абсциссы фигурирует неабсолютное, а относительное время. Возьмем, например, две ударных волны:
362
Гл. VI. Ударные волны
одну с давлением на фронте Api=2,0 кг)си? (кривая 3), имеющую весьма большую длительность t+ =0,1 сек., и другую — с меньшим давлением Api = =0,17 кг/см2 (кривая 5), но с общим временем действия 0,01 сек. При одинако-
Фиг. 6. 10. Расчетные кривые изменения давления за фронтом ударной волны. Каждой кривой соответствует определенное значение .приведенного расстояния R и избыточного давления на фронте Др.
кривой
1 2
3 4 S
« i 4Z4 кг;см-
0,79 1 20,00
1.20 6,28
1,91 ! 2,04
3,30 | 0,68
7,9 1 0,17
вом относительном времени снижение давления будет большим у первой волны. Если отнести падение давления к одинаковому абсолютному времени, то результат окажется обратным. Возьмем, например, время 5 мсек. Тогда во втором случае
t 5
-- =-•=— :=0,5;
/+ 10
из графика видно, что давление при этом упадет более чем наполовину. Для первой волны
t 5
--= — = 0,05, *4-100
т. е. давление снизится примерно на 15%.
При помощи кривых, изображенных на фиг. 6. 10, можно заранее оценить время, в течение которого давление упадет на 2—5%, и таким обра
зом определить, пригоден ли прибор с данным собственным периодом колебаний для неискаженной записи р(0 данной ударной волны,-
§ 5 РАССТОЯНИЯ, БЕЗОПАСНЫЕ ПО ДЕЙСТВИЮ УДАРНОЙ ВОЛНЫ
Задача определения расстояния, безопасного по действию ударной волны, имеющая большое практическое значение, может быть решена методами теории подобия. Вид расчетной формулы зависит от того, чем в данном случае определяется разрушение интересующего нас объекта — максимальным давлением или импульсом волны (см. стр. 349). Если разрушающее действие определяется избыточным давлением на фронте ударной волны, то безопасным считают то расстояние /?без, на котором Api не превышает некоторого значения АрН, уже недостаточного для разрушения определенного сооружения. Избыточному давлению Api* соответствует определенное значение R *. В свою очередь
§ 5. Расстояния, безопасные по действию ударной волны.
363
г;* ^беЭ К 3 ' > /с
или
3 _
R6ea^R*VC=K£\ (6.24)
где значение Кл определяется свойствами разрушаемого объекта.
Аналогичным образом можно показать, что если разрушения определяются величиной импульса, то
/?бе3=/<2СЧ (6.25)
В «Единых правилах безопасности при ведении взрывных работ» расстояния, безопасные по действию ударной волны, рекомендуется вычислять по формуле
R^K(R'\ (6.26)
Показатель степени при С в формуле (6.26) является промежуточным между показателями формул (6.24) и (6.25). Это более или менее естественно, если учесть широкие возможности изменения обстановки при взрывах, а также то обстоятельство, что в условиях практики трудно решить, давление или импульс определяют разрушающее действие, особенно принимая во внимание, что зачастую Т того же порядка, что и t+.
Значения коэффициента К в формуле (6. 26) зависят от условий взрыва и характера разрушений. В табл. 6. 3 приводятся некоторые значения К, рекомендуемые «Едиными правилами безопасности при ведении взрывных работ».
Т а б л и ц а б.З
Значение коэффициента К в формуле /?без= КС'\
(С — в кг, Я — в м)
Возможные разрушения Значение коэффициента К
Открытый заряд Заряд, углубленный на свою высоту
Лолиое разрушение застекления, частичное повреждение рам, дверей, нарушение штукатурки и внутренних легких перегородок 5—8 2—4
Разрушение внутренних перегородок, рам, дверей, бараков, сараев и т. п. 2—4 1,1—1,9
Разрушение малостойких каменных и деревянных зданий, опрокидывание ж. д. составов, повреждение линий электропередачи 1,5—2,0 0,5—1,0
364
Гл. VI. Ударные волны
На основании данных таблицы можно сделать заключение, что при взрыве открытого заряда безопасное расстояние 1 до населенного пункта
Более детальные сведения о безопасных расстояниях приведены в «Единых правилах безопасности при ведении взрывных работ».
Подчеркнем, что в случае сверхмощных взрывов, например атомных, взрывов весьма крупных складов ВВ и т. д., когда разрушающее действие определяется избыточным давлением, расчет безопасных расстояний по формуле (6.26) дает заведомо завышенные результаты. В этом случае расчет нужно вести по формуле (6.24), где значения К\ также зависят от характера возможных разрушений.
В табл. 6.4 приведены ориентировочные данные о значениях Л/ч*, при которых возникает определенный вид разрушения, и соответствующее значение R* для наземного взрыва.
Таблица Б. 4
Значения избыточного давления на фронте Ад* и соответствующие значения R* = в формуле (6.24) для сверхмощных взрывов на поверхности
Избыточное давление Дд! кг/сл2 Приведенное расстояние R* Вид разрушения
0,1—0,2 15—10 Частичное разрушение сооружений
0,2—0,3 9-7 Значительное разрушение больших городских сооружений
0,6—0,7 4,5—4,0 Разрушение зданий со стальным каркасом и легких железобетонных сооружений
1,0 3,5 Полное разрушение всех зданий, кроме железобетонных сейсмостойких конструкций
1,5—2,0 2,8-2,5 Разрушение и серьезное повреждение железобетонных сейсмостойких конструкций
2,0—3,0 2,5—2,0 Сдвиг стальных балочных мостов
Отметим, что данные табл. 6. 3 позволяют рассчитать расстоя-
ния, на которых определенный вид разрушения практически уже не происходит, тогда как табл. 6. 4 дает расстояния, на которых определенный вид разрушения еще возникает. Поэтому расчет безопасных расстояний с использованием данных табл. 6. 4 (для сверхмощ-
_ 3___
ных взрывов) нужно вести по формуле R&3>R*V С. Практически _ з____________
величину R* р'С нужно увеличивать в 1,5—2,0 раза.
1 Без учета разлета осколков.
§ 6. Расстояния, безопасные по передаче детонации 365
§ 6. РАССТОЯНИЯ, БЕЗОПАСНЫЕ ПО ПЕРЕДАЧЕ ДЕТОНАЦИИ
После рассмотрения вопроса о расстояниях, безопасных по разрушающему действию ударной волны, уместно кратко остановиться на определении расстояний, безопасных по передаче детонации.
Явление передачи детонации состоит в том, что при взрыве одного заряда может взорваться другой, находящийся на некотором расстоянии. Это явление иногда называют также детонацией через влияние (см. гл. V).
На практике расстояние передачи детонации экспериментально определяют по схеме, приведенной на фиг. 6. 11. О результате обыч-
Фиг. 6. 11. Схема опытного определения расстояния передачи детонации.
Л—активный заряд. Z7—пассивный заряд, Л—подкладка— «свидетель».
но судят по состоянию металлической, например латунной, подклад-ки — «свидетеля». Если пассивный заряд детонировал, на подкладке под ним получается вмятина. Нужно иметь в виду, что явление передачи детонации, во всяком случае при передаче через воздух, носит вероятностный характер, так же как, например, возникновение взрыва от удара. Поэтому на каждом расстоянии обычно проводят несколько опытов и за характерную границу принимают то расстояние, на котором вероятность передачи детонации составляет 50%. Явление передачи детонации весьма сложно, особенно если учесть, что оно практически может происходить через разные среды (воздух, вода, грунт, металл п т. д.). В данном курсе мы ограничимся рассмотрением передачи детонации через воздух, где расстояние передачи на порядок выше, чем в других средах. Мы рассмотрим лишь случай свободного расположения зарядов (см. фиг. 6.11). Отметим, что при канализированной передаче, когда, например, оба заряда соединены трубкой, расстояния передачи детонации существенно возрастают.
При передаче детонации через воздух на пассивный заряд обычно непосредственно воздействуют продукты взрыва активного заряда; лишь в редких случаях. когда детонация передается на значительное расстояние, действует только ударная волна, а продукты взрыва перестают играть роль. Далее, если при взрыве возникают осколки (например, при взрыве заряда в оболочке), то удар даже одного осколка независимо от действия ударной волны может передать детонацию на значительное расстояние.
Из всего этого видно, что включение раздела о передаче детонации в главу об ударных волнах является условным. Вместе с тем нужно отметить, что в не-
366
Гл. VI. Ударные волны
которых случаях могут быть такие условия, когда передача детонации через воду, металл и т. д. будет осуществляться заведомо только ударной волной.
Дальность передачи детонации зависит от характеристик как активного, так и пассивного зарядов. При этом для активного и пассивного зарядов важны разные свойства. Для активного заряда решающим является его вес и удельная энергия, т. е. по существу величина тротилового эквивалента, а также форма заряда и его расположение по отношению к пассивному заряду. Если, например, взят цилиндрический заряд, то вдоль оси его расстояние передачи будет иным, чем в боковых направлениях. Существенно также значение скорости детонации и плотности активного заряда. Для пассивного заряда важнейшими свойствами, определяющими дальность передачи детонации, являются: чувствительность ВВ, зависящая от его химической природы, плотность ВВ, размер кристаллов, а также структура заряда и его геометрия. Чем выше чувствительность ВВ, чем меньше плотность и размер кристаллов, тем на большее расстояние (при одинаковом активном заряде) передается детонация. Существенное значение как для активного, так ч для пассивного заряда имеет характер оболочки.
Для оценки расстояний, безопасных по передаче детонации, применяют формулу того же вида, что и при расчете расстояний, безопасных по разрушающему действию ударной волны:
. ^з.пер^^иерС’Ч- (6.27)
здесь С — вес активного заряда в кг. Величина Каер определяется преждевсего чувствительностью пассивного заряда, а также мощностью активного заряда.
В табл. 6.5 приведены выборочные данные о значении коэффициента /Спер, взятые из «Единых правил безопасности при ведении взрывных работ».
Таблица 6.5
Значение коэффициента А'пер в формуле (6.27) для расчета расстояний, безопасных по передаче детонации, для открытых зарядов
Активный заряд Пассивный заряд
Аммониты 40%-ный динамит Тротил
Аммониты 0,25 0,35 0,40
40%-ный динамит 0,50 0,70 0,80
Тротил 0,80 1,00 1,20
Если применяются вещества, более мощные и чувствительные, чем ВВ, приведенные в табл. 6.5 (тетрил, тэн, гексоген), то коэффициент нужно увеличивать.
Вопрос о передаче детонации и расчетных формулах, несомненно, нуждается в дальнейшей разработке. В этом отношении можно указать, например, что
§ 7. Взаимодействие ударных волн с препятствием
367
данные о коэффициентах, приводимые в «Единых правилах безопасности при ведении взрывных работ», хотя и являются «официальными», недостаточно, обоснованы и несколько противоречивы. Более того, некоторые сомнения вызывает даже сам вид формулы (6.27). Разведочные опыты, проведенные Беляевым,. Садовским и Тамм, показывают, что если для активных зарядов сосредоточенной формы (сфера, куб, цилиндр с высотой, равной диаметру) соблюдать подобие как по форме, так и по направлению и отсчитывать расстояния от центра активного заряда, то расстояния передачи детонации следует определять по формуле
^беэ.пер А^Пер С' ’ • (6. 28)<
Если в качестве С подставить вес эквивалентного тротилового заряда, то для сферических активных зарядов коэффициент Л'11Ср будет определяться только чувствительностью пассивного заряда. Выше мы уже видели, что зависимость, вида (6. 28) получается из закона подобия для давления на фронте. Из этого можно сделать вывод, что расстояние передачи детонации данному пассивному заряду определяется прежде всего величиной избыточного давления на фронте. Формула (6.28) была проверена в лабораторных условиях для сравнительно, малых зарядов. Есть указания, что она справедлива и для крупных зарядов.
В зависимости от чувствительности пассивного ВВ, его плотности и структуры заряда давления на фронте волны, достаточные для передачи детонации, измеряются тысячами, сотнями или даже всего лишь десятками атмосфер. Такие давления заведомо недостаточны для того, чтобы путем сжатия самого конденсированного ВВ вызвать в нем сколько-нибудь значительные разогревы. Поэтому при передаче детонации возбуждение реакции, несомненно, должно, осуществляться путем сжатия и разогрева воздуха, находящегося в порах пассивного заряда, или слоев воздуха, граничащих с зарядом, нагревом теплопередачей от продуктов, а также, возможно, путем трения частиц. Устойчивый режим детонации в пассивном заряде возникает не сразу, а с некоторой задержкой, которая составляет обычно несколько микросекунд. Во время этой задержки возникшее в пассивном заряде быстрое горение ускоряется в условиях повышенного давления и переходит в детонацию.
Интересно отметить, что в определенных условиях детонация в пассивном заряде возникает не на его поверхности, а на некоторой, глубине, что также указывает на сложный характер явления.
§ 7. ВЗАИМОДЕЙСТВИЕ УДАРНЫХ ВОЛН С ПРЕПЯТСТВИЕМ
До сих пор мы рассматривали распространение ударной волны или в свободном воздухе или вдоль поверхности. На практике весьма часто ударная волна наталкивается на различного рода препятствия. Характер ее действия при этом меняется: давление и импульс,, сообщаемые препятствию, увеличиваются по сравнению с давлением и импульсом свободно распространяющейся ударной волны.
На фиг. 6. 12 показаны графики распределения давления в зависимости от расстояния при отражении ударной волны. График а соответствует моменту, когда волна подходит к препятствию. Этим
368
Гл. VI. Ударные волны
препятствием может быть вертикальная стенка при распространении ударной волны вдоль поверхности земли или сама поверхность земли, если ударная волна подходит сверху. Предполагается, что препятствие имеет неограниченные размеры (в боковых направлениях) и не разрушается.
Для упрощения мы предполагаем, что подходящая к стенке ударная волна (ее обычно называют идущей волной) имеет за фронтом постоянные значения: давления pi, плотности рь температуры 7\.
Фиг. 6. 12. Схема отражения ударной волны от препятствия.
а~распределепие давлений в пространстве в момент, предшествующий подходу фронта к препятствию, б—то же, после отражения волны от препятствия.
скорости потока w. В момент, когда ударная волна натолкнется на стенку, ее передний слой затормозится и скорость потока в этом слое станет равной нулю. За счет этого торможения произойдет дополнительное повышение давления до значения р0Т1>.
Напомним, что давление, испытываемое сооружениями при ураганном ветре, возникает исключительно за счет торможения потока воздуха. При ураганных ветрах скорости потока достигают нескольких десятков метров в секунду. Ясно, что при торможении «потока» ударной волны, зачастую имеющего скорости в сотни метров в секунду, может возникнуть весьма значительное дополнительное повышение давления. В следующий момент очередной слой ударной волны натолкнется на заторможенный слой и затормозится сам. Таким образом, торможение будет охватывать один слой за другим, и по идущей (падающей) волне в направлении, противоположном ее движению (т. е. от стенки), пойдет волна дополнительного поджатия, которую обычно называют отраженной волной (фиг. 6. 12, б).
Применяя к границе между идущей и отраженной волной законы сохранения вещества, количества движения и энергии, а также учитывая, что в отраженной ударной волне <®=0, можно вычислить /Л)тр, Ротр> 7"отр и — скорость, с которой распространяется граница дополнительного поджатия. Эта задача была впервые решена Крюссаром.
§ 7. Взаимодействие ударных волн с препятствием
369
Приведем без вывода выражение для избыточного давления отражения Аротр» поскольку именно эта величина наиболее ва.жна для оценки разрушающего действия
ЗА —1
'Y'Z'i" (Дд 1 + ро)—ро
ДРотр^(A/’i +ро) ~-----------------Ро- (6- 29)
(Дд1 + До)+ 7 7 РО к. — 1
где Api — избыточное давление на фронте идущей волны.
Полагая ро=1 кг/сл2 и Р=1,4, получим
дрОТр=(ДА+1) 1 • (6.30)
Дд1 + 7
Для весьма сильных ударных волн, когда Api^Po,
Дротр — Здр!.
Если учесть, что для весьма сильных ударных волн значение А снижается, то в пределе
Дротр«(10-4-11) ДрР
Согласно Б. А. Олисову выражение для АрОтр может быть также записано следующим образом:
Дротр==2Др1 + (А + 1)^. (6.31)
Выражение (6.31) является некоторым приближением к точному выражению (6.30); практически, однако, они близки. Выражение (6.31) в некотором отношении удобнее, так как'оно наглядно показывает, что полное давление отражения состоит как бы из двух членов: удвоенного давления идущей волны и «ветрового» давления, определяемого скоростным напором. У слабых ударных волн «ветровой» член не имеет существенного значения; в пределе, для акустических волн, происходит удвоение давления; напротив для сильных волн «ветровой» член весьма существенен. В табл. 6.6 приведены значения Дротр , вычисленные по формуле (6. 30).
Рассмотренные выше условия отражения идеализированы. При расчете были сделаны следующие упрощающие допущения:
1. Предполагалось, что отражается ударная волна с постоянными значениями pi, pj, Л за фронтом; у реальных волн параметры за фронтом быстро падают.
2. Предполагалось, что направление распространения ударной волны является нормалью к поверхности препятствия; в действительности падение волны может происходить под разными углами к отражающей поверхности.
370
Гл. VI. Ударные волны
Таблица 6.6
Давления в отраженной ударной волне в зависимости от давлений в идущей волне (k~ 1,4)
hpi кг 1см2 кг 1см- Дд! кг)см2 к г} см2
0,1 0,21 1,2 3,45
0,2 0,43 1,5 4,59
0,3 0,67 2,0 6,67
0,4 0,93 2,5 8,95
0,5 1,20 3,0 11,4
0,6 1,49 4,0 16,7
0,7 1,78 5,0 22,5
0,8 2,10 7,0 35,0
1,0 2,75 10,0 55,3
2
1,
Фиг. 6. 13. Схема записи кривой p(t) в идущей ударной волне.
/--датчик, направление распространения волны, «З—кривая p(f).
отражений не возникнет и датчик.
3. Предполагалось, что отражающая плоскость имеет неограниченные размеры; в действительности преграды имеют конечные размеры, часто меньшие, чем длина самой ударной волны.
Рассмотрим теперь отражение ударных волн в реальных условиях, без перечисленных выше ограничений.
Предположим, что вдоль поверхности земли распространяется ударная волна обычного профиля (фиг. 6. 13). При прохождении ударной волны никаких заделанный в землю, запи
шет р(1) идущей волны; эта запись дана в верхней части фиг. 6. 13. Предположим теперь, что эта же ударная волна наталкивается на стенку и отражается (фиг. 6. 14). Если датчик вделан в стенку или находится в земле, но у подошвы стенки, то теперь он запишет p(t) отраженной ударной волны; соответствующая запись приведена в верхней части фиг. 6. 14.
Как видно из рассмотрения фигур, профиль отраженной ударной волны схож с профилем идущей волны, только давление на фронте значительнее и падает оно быстрее; длительность фаз сжатия идущей и отраженной ударных волн практически одинакова. Важно отметить следующее: выведенные ранее формулы (6.29) —
§ 7. Взаимодействие ударных волн с препятствием 371
(6.31) справедливы для фронта отраженной ударной волны. Если, следовательно-, вычислить давление отражения, то для реальной волны со снижающимся давлением полученное значение будет давлением на фронте отраженной ударной волны.
На фиг. 6. 15 дана запись p(t) в том случае, .когда датчик заделан в землю на некотором расстоянии х от отражающей поверхно-
Фиг. 6. 14. Схема записи кривой p(t) в ударной волне при отражении ее от стенки.
/—датчики, 2—направление распространения идущей волны, 3—стенка, 4—кривая р(0 в от раженной волне.
Фиг. 6. 15. Схема записи кривой p(t) при отражении ударной волны прибором» находящимся на некотором расстоянии от стенки.
1—датчик, 2— направление распространения падающей ударной волны, 3—стенка, кривая p(t), запи-
санная датчиком, расположенным на расстоянии х от стенки.
сти; датчик сначала фиксирует идущую ударную волну; второй пик соответствует приходу к датчику отраженной ударной волны. При этом пиковое давление меньше, чем Аротр на стенке. На этом же графике пунктиром даны кривая p(t) идущей волны и кривая pit') отраженной волны непосредственно у стенки. Чем меньше расстояние х, тем ближе величина давления во втором пике к идеальному давлению отражения.
Поскольку реальные ударные волны имеют конечную длину (хотя она может быть и очень значительной), то через некоторое время отражающаяся ударная волна оторвется от стенки и превратится в волну, аналогичную идущей, но ее распространение и поток вещества в ней будут направлены противоположно идущей, т. е. от стенки. Такую волну также называют отраженной; чтобы не было путаницы, ее, может быть, лучше называть отразившейся волной.
372
Гл. VI. Ударные волны
При отражении ударной волны возрастает не только давление, но и величина импульса. Импульс при отражении можно также оце-ыивать по формуле (6.21) I—A кг сек/м2. В случае тротила /?
коэффициент А в формуле (6. 21) составит 50—60 при условии, что С выражается в кг и R в м. Формулу для тротила можно использовать
2
Область Область
регулярного нерегулярного
отражения отражения
Фиг. 6. 16. Схема отражения ударной волны, падающей на плоскость под различными углами.
А—точка, в которой произошел взрыв, ср—угол падения ударной волны, Й—фропт идущей волны, О—фронт отраженной волны, Г—-фронт головной
волны.
/-—кривая p{t), записанная датчиком под точкой 3, 2—то же, над точками Д и Е над пунктирной линией, 3—то же, над точками Д и Е под пунктирной линией.
и для других ВВ, подставляя в качестве С значение тротилового эквивалента.
Рассмотрим теперь отражение ударной волны под углом. Предположим, что в точке А (фиг. 6. 16) происходит взрыв; отражающей плоскостью является поверхность земли. В различных точках этой поверхности отражение происходит под разными углами ср. Если <р = 0°, то отражение нормальное; если, напротив, <p = 9Q°, волна, не отражаясь, скользит вдоль поверхности. При малых углах падения (точки В, Ж) идущая от центра взрыва ударная волна И, отражаясь от поверхности, дает отраженную волну О. Если уцарная волна является слабой, близкой к акустической, то имеет место как бы оптическая аналогия отражения от зеркала и отраженная ударная волна как бы распространяется из точки Б, являющейся зеркальным
£ 7. Взаимодействие ударных воЛн с препятствием
373
отражением точки А, точки действительного взрыва. Если над поверхностью (над точкой В) расположить датчик, то характер записи будет таким, как показано в квадрате 1; первый пик записи соответствует идущей и второй — отраженной волне. Такой тип отражения называют регулярным. При увеличении угла <р (точка Ж) угол между идущей и отраженной волной уменьшается, соответственно уменьшается расстояние между пиками на записи p(t), но общий характер записи остается прежним.
Начиная от некоторого угла, зависящего от интенсивности ударной волны, характер отражения существенно меняется. Отраженная волна, движущаяся по поджатому идущей волной разогретому воздуху, распространяется по нормали к фронту со скоростью, большей скорости идущей ударной волны. В результате при некотором значении угла ср часть фронта отраженной волны настигнет идущую. Эти две волны, как бы сливаясь, образуют новую волну, которую в нашей литературе обычно называют головной ударной волной; в иностранной литературе ее часто называют маховской волной. Кривая p(t) для головной волны показана в квадрате 3 на фиг. 6. 16.
Над точкой Д поверхности налицо тройная конфигурация: идущая И, отраженная О и головная Г ударные волны, которые пересекаются в одной точке, называемой тройной точкой. При дальнейшем возрастании угла ср область, охватываемая головной волной, увеличивается, как показано пунктиром на фиг. 6.16. Отражение при больших углах ср, когда возникает головная волна, называют нерегулярным отражением.
По мере увеличения угла ср давления снижаются из-за того, что волна падает под большим углом, а также вследствие увеличения расстояния. В пределах величин угла от 0° до 10—20р уменьшение невелико и давление отражения близко к идеальному при нормальном падении. При дальнейшем увеличении угла давление падает быстрее. В зоне образования головной волны происходит некоторое относительное увеличение давления, особенно заметное в случае слабых волн: давления при этом могут получаться большими, чем от поверхностного взрыва (т. е. взрыва, произведенного на поверхности под точкой Л), хотя расстояние в последнем случае несколько меньше.
Рассмотрим взаимодействие ударной волны с препятствиями ограниченных размеров и, в частности, с препятствием, размер которого меньше протяженности ударной волны. В этом случае возникает явление обтекания препятствий ударной волной. Явление обтекания было установлено опытным путем М. А. Садовским, элементарная теория явления была предложена Ю. Б. Харитоном и Т. В. Захаровой.
Предположим, что ударная волна отражается от препятствия ограниченных размеров (фиг. 6. 17), В начальный момент практиче-
374
Гл. VI. Ударные волны
ски на всей отражающей поверхности возникает давление, равное идеальному давлению отражения (фиг. 6. 17, а)-, область, где существует это давление, граничит с областью более низкого давления
Фиг. 6, 17, Схема обтекания препятствия ударной волной.
в идущей ударной волне. В результате от краев преграды к середине пойдет волна относительного разрежения (см. фиг. 6, 17, б), распространяющаяся со скоростью звука в поджатом воздухе, Че-
Фиг, 6.18, Идеальная кривая p(t) при обтекании препятствия ударной волной.
ре.з некоторое время волна относительного разрежения достигнет середины преграды (см. фиг. 6. 17, в) и давление (в середине) упадет от значения Лротр до некоторого значения Лробт. Время от начала отражения до начала установления режима обтекания можно ориентировочно считать
I
равным t— — где I — расстояние
от края преграды до центра и с — местная скорость звука.
Согласно Харитону и Захаровой после установления режима обтекания давление обтекания для любого момента времени ориентировочно равно половине давления отражения
* 1 Л
^Робт ~ 2
(6, 32)
Идеальный ход кривой р(1) в середине преграды при наличии обтекания показан на фиг. 6. 18; пунктиром на этом же рисунке показано р (у) при отражении от бесконечной преграды (отсутствие
$V 8. Ударные волны в воде
375
обтекания). На практике переход от отражения к обтеканию происходит не скачком, а более плавно.
Если размер препятствия не велик и за время установления обтекания падение давления за фронтом мало, то, применив формулы (6.31) и (6.32), можно оценить величину максимального давления при обтекании:
Мотр в + (А 4-1) ;
поскольку £4-1^2, то
АРобт ~ г/2 ДРотр ~ . (б- 33)
Такое давление будет действовать на переднюю, т. е. обращенную к волне, площадку препятствия. После полного погружения препятствия в ударную волну на заднюю площадку будет действовать давление порядка Арь Результирующее воздействие на препятствие при этом окажется равным ~ — , т. е. приблизительно будет равно величине скоростного напора. Отметим, что этот вывод является сугубо приближенным.
Изложенные кратко вопросы взаимодействия ударной волны с препятствиями имеют большое практическое и научное значение.
Итак, в зависимости от условий и обстановки разрушение может определяться следующими факторами:
1. Избыточным давлением на фронте, импульсом (или некоторой частью импульса) идущей ударной волны.
2. Избыточным давлением на фронте, импульсом или частью импульса отраженной ударной волны.
3. Давлением, импульсом или некоторой частью импульса о б-т е к а н и я.
4. Скоростным напором или импульсом скоростного напора (или некоторой его частью).
В усложненных условиях взаимодействия ударных волн с препятствиями при наличии столкновения отраженных ударных волн кривые p(t) могут иметь весьма сложный характер. Теоретический расчет в таких случаях затруднен до крайности. В таких сложных условиях возможность получить достоверную экспериментальную запись р (0 особенно важна для правильной оценки разрушающего действия.
§ 8. УДАРНЫЕ ВОЛНЫ В ВОДЕ
В результате взрыва заряда ВВ в однородной водной среде (далеко от дна и от поверхности) в воде возникнет пузырь из нагретых сжатых газов, давление которых будет значительно выше давления в окружающей среде. Расширяясь, газы образуют в воде ударную волну, так же как это имеет место в воздухе. Понятно, что свойст
376
Гл. VI. Ударные волны
ва ударных волн и их характеристики должны зависеть от свойств среды.
По мере расширения пузыря давление в нем будет быстро падать. В некоторый момент времени давление в газовом пузыре сравняется с давлением в окружающей среде, но расширение на этом не закончится: вода, примыкающая к газовому пузырю, имея значительную скорость, некоторое время будет двигаться по инерции, растягивая пузырь. После того как движение воды прекратится, давление в пузыре будет меньше, чем давление в окружающей среде; газовый пузырь начнет сжиматься, опять пройдет положение равновесия и, таким образом, будет некоторое время пульсировать. Такую пульсацию можно заметить также при взрыве в воздухе, однако в воде из-за большей плотности и больших сил инерции это явление особенно рельефно. Пульсирующий пузырь начинает двигаться вверх, как бы «всплывая» в воде.
Для воды характерно сравнительно высокое значение скорости звука со^1500 м]еек. Скорость ударной волны в воде, уменьшаясь по мере распространения, быстро достигает значения скорости звука и волна приобретает «акустический» характер, хотя давления в ней еще могут быть значительными.
Так, если рассмотреть ударную волну в воде с чрезвычайно большим давлением на фронте pi = 5000 кг!см2, то за фронтом такой волны будет поток воды со значительной скоростью w=250 м!сек. Волна будет распространяться со скоростью £>=1975 м!сек, значительно превышающей скорость звука. Но если давление на фронте ударной волны в воде снизится до величины 250 кг!см2, которая еще весьма значительна, то такая волна будет иметь скорость потока за фронтом всего лишь ®=15 м]сек и скорость ее распространения окажется практически равной скорости звука. Вследствие того, что ударная волна в воде быстро принимает квазиакустический характер, а также и из-за иных условий отражения на твердой поверхности, эффекты отражения, направленности выражены слабее, чем в случае воздушной ударной волны; действие ударной волны в воде по своему характеру близко к гидростатическому давлению, действующему одинаково по всем направлениям.
Затухание ударных волн в воде происходит медленнее, чем в воздухе, поэтому при одинаковых приведенных расстояниях как дав. ления, так и импульсы ударной волны в воде значительно больше, чем на воздухе.
Так, например, давление отражения в воде может быть приближенно оценено по формуле
^итр = 5|). (6.34)
4\
_ _
где/?=—з-------. Для А?=2 — 3 давление отражения в воде в
§ 9. Ударные волны в грунте
377
десятки раз выше, чем давление отражения на воздухе; при давление отражения в воде примерно в 150—160 раз больше, чем на воздухе.
Величина импульса отражения ударной волны в воде может быть подсчитана по приближенной формуле
930-^ кг сек]м2. (6.35)
С~
Поскольку на воздухе /—50 — 60-—, то при одинаковых R и С9кВ импульс в воде примерно в 15—20 раз больше, чем на воздухе.
Приведенные выше формулы относились к однородной водной среде. Если заряд находится неподалеку от поверхности воды, то значения давления и импульса могут существенно снизиться.
При взрыве заряда неподалеку от поверхности воды на ней образуется купол и затем происходит выброс, причем может сформироваться водяной столб значительной высоты. Исследованиями установлено, что образование купола и выброс связаны преимущественно с воздействием газового пузыря.
Основные методы исследования подводного и воздушного взрыва аналогичны. Для исследований подводного взрыва также целесообразно пользоваться методом, дающим запись p(t), особенно в сложных условиях, при взрыве близ поверхности воды и т. д. Для записи p(t) также используют пьезоэлектрические датчики; естественно, что конструкция их несколько отличается от воздушных. При определенных условиях для исследования поведения газового пузыря могут быть использованы оптические методы.
Вопрос о разрушительном действии ударных волн в воде достаточно сложен, особенно если речь идет о действии взрыва на корабли: ударная волна в воде действует на стену, за которой находится не вода, а воздух. Теория действия ударной волны для таких случаев весьма сложна.
§ 9. УДАРНЫЕ ВОЛНЫ В ГРУНТЕ
Исследование взрыва в грунте осложняется тем, что структура л свойства грунтов (горных пород) меняются в широких пределах. Грунты могут быть сыпучими, пластичными, хрупкими; их удельный вес и особенно прочность существенно различаются.
Специфические трудности возникают также при экспериментальном определении параметров ударной волны в твердой среде. Для
378
Гл. VI. Ударные волны
того чтобы характеризовать ударную волну в грунте, также нужно знать величины Ар, I, t+, которые с наибольшей надежностью могут быть получены из кривой р (t); в данном случае возможность экспериментальной записи р (0 особенно важна: ударные волны в грунте могут иметь несколько необычный профиль и, в частности, пологий фронт. Скорости распространения в грунте могут быть меньше звуковых*. Помимо продольных волн, возникающих в воздухе и в воде, в твердой среде возникают также
волны поперечного сдвига, которые обычно распространяются со скоростями, несколько меньшими продольных. Наконец, на поверхности раздела возникают и распространяются своеобразные поверхностные волны.
Запись p(t) в грунте может быть получена с помошью пьезодатчиков или тензодатчиков, однако применять их надо с особым вниманием и осмотрительностью. При введении датчиков в грунт, связанном с нарушением его
Фиг. 6. 19. Схема расположения зон действия взрыва в грунте, /—зона вытеснения, 2—зона раздавливания. 3~зона разрывов, 4—зона сотрясения.
сплошности, при плохом контакте дат-чнков со средой (в случае воздушной или водной среды этот контакт всегда обеспечен) запись p(t) может быть настолько искажена, что станет совер-
шенно непохожа на ударную волну, идущую по сплошному грунту. Перечисленные трудности, так же как и многие другие, здесь не упоминаемые, были успешно преодолены, и сейчас существуют надежные методы записи p(t), особенно в сыпучих и пластичных грунтах.
Помимо параметров &px,I, t+, а также скорости распространения волны D, в условиях грунта часто очень важно знать скорость перемещения среды w и величину смещения среды е. Для измерения этих параметров разработаны специальные приборы, которые здесь не
р асе м а гр ив а ются.
Рассмотрим взрыв в грунте заряда, который был заложен на значительной глубине, так что на поверхности грунта не наблюдается каких-либо эффектов (такой заряд называют зарядом камуфлета).
Результат действия взрыва на среду обычно принято описывать тремя зонами: зоной вытеснения, зоной разрушения и зоной сотрясения.
* Тем не менее нет оснований отказываться в данном случае от термина «ударная волна»: налицо главный признак — конечное повышение давления, плотности и других параметров в зоне, охваченной возмущением, а также поток вещества за фронтом.
§ 9. Ударные волны в грунте
379
Зона вытеснения (или зона сжатия) —это область, из которой продукты взрыва высокого давления полностью вытеснили грунт, образовав полость (так называемый «котел»). Зона разрушения — это сфера, в которой под действием взрыва грунт разрушен, растрескан, нарушены связи между частицами среды. Зона сотрясения — это область, в которой ударная волна, распространяющаяся от центра взрыва, настолько ослабела, что уже не в состоянии нарушить связь между частицами грунта и производит лишь более или менее сильное сотрясение, ослабевающее по мере распространения.
Разрушение среды может иметь различный характер в зависимости от вида напряженного состояния, которое испытывает порода в области действия взрыва. Дело в том, что горные породы значительно легче разрушаются от растщжения, чем от сжатия, тем более, что в сплошном массиве сжатие в ударной волне является всесторонним. Вместе с тем возникающее труднее (при более высоких напряжениях) разрушение от сжатия является более радикальным и обычно имеет характер сплошного раздавливания, тогда как под действием растяжения появляется лишь более или менее густая сеть трещин.
Более детальное рассмотрение вопроса о разрушении горной породы взрывом приводит к заключению (Г. И. Покровский) о наличии двух различающихся по характеру зон разрушения: зоны раздавливания и зоны разрыва. Таким образом, можно различить четыре зоны воздействия взрыва на горную породу: зону вытеснения, зону раздавливания, зону разрыва и зону сотрясения (фиг. 6. 19).
Зона раздавливания — это пронизанная поверхностями скольжения зона, в которой грунт интенсивно раздроблен и раздавлен в результате воздействия волны сжатия.
Зонаразрыва — это область, в которой ослабевшая ударная волна уже не в состоянии раздавить породу сжатием. Однако вещество среды получает значительное радиальное смещение (от центра взрыва), В результате в среде возникают растягивающие усилия; если они превосходят временное сопротивление растяжению, то это приводит к появлению радиальных трещин. Последующая разгрузка обусловливает образование кольцевых тангенциальных трещин.
Размер каждой зоны можно оценить по закону подобия; Предположим, что при взрыве заряда весом С в определенном грунте расширение полости прекращается по достижении давления р\ (понятно, что для разных грунтов значения /ц будут различны). Поскольку давление есть функция приведенного расстояния (это справедливо для ударных волн в любых средах), значению рх должно —
соответствовать приведенное расстояние 7?i= —, где /?ВЬ1Т—-
Vc
радиус зоны вытеснения,
380
Гл, VI, Ударные волны
Предположим, далее, что раздавливание грунта прекращается, когда давление упадет до значения р2", этому давлению будет соответствовать приведенное расстояние
— Яразд
Л2— 3 »
/С
где /?разд — радиус зоны раздавливания. Аналогичные выражения могут быть написаны и для остальных зон. Из них легко получить формулы для определения радиусов соответствующих зон:
/?ВЫТ = ДГС; (6.36)
Яразд^/С; (6.37)
(6.38)
Коэффициенты Ri, R2, Rs — те приведенные расстояния, которым соответствуют значения pi, р2, р?. и т. д. для каждого вида грунта, — должны быть определены опытным путем.
Действие взрыва зависит не только от свойств грунта, определяющих величины Р\, р2 и т. д., но и от свойств ВВ и прежде всего от удельной теплоты взрыва. Учет свойств ВВ проще всего произвести, если в качестве С подставлять эквивалентный вес тротила (большой плотности) или эквивалентный вес аммонита № 6. Если значения R заданы, то значения весов зарядов определяют по формулам
(6-39)
Сразд^^зд’ (6.40)
Сразр = *3^азр, (6-41)
где
Как было отмечено выше, размеры зон зависят от свойств грунта. В пластичных грунтах объем сферы вытеснения в десятки и даже в сотни раз (в пределе в 200 раз) может превосходить объем заряда.
До сих пор мы рассматривали взрыв, происходящий глубоко под землей. Начнем теперь приближать заряд к поверхности грунта или увеличивать его вес. Тогда зона разрушения начнет приближаться к поверхности земли; в результате отражения ударной волны от поверхности грунта характер воздействия и его эффект могут существенно измениться: значительно возрастет область, в которой растягивающие напряжения достаточно велики для разрушения.
§ 9. Ударные волны в грунте
381
т. е. возникнет явление множественного откола. Зона, где грунт будет интенсивно дробиться в результате разрыва, весьма существенно увеличится и, следовательно, в конечном счете возрастет обший объем разрушения. В пределах данного курса нет возможности подробно останавливаться на теории множественного откола. Отметим лишь следующее.
Выше было указано, что когда воздушная ударная волна отражается от более плотной, в частности, твердой поверхности, происходит дополнительное поджатие. Существенно иначе происходит отражение ударной волны, идущей в твердой среде, от поверхности раздела с воздухом. На границе раздела при отражении волны сжатия возникает волна растяжения, которая начинает распространяться в обратном направлении (от плоскости отражения). Эта волна растяжения будет алгебраически складываться с «хвостовой» частью волны сжатия п даст результирующее растягивающее напряжение, возрастающее по мере распространения отраженной волны в глубь среды. Когда суммарное напряжение достигнет некоторого критического значения <т№ (зависящего от свойств среды), произойдет откол. Оставшаяся часть волны сжатия отразится от вновь образованной поверхности, в результате чего произойдет новый откол и т. д.
Ориентировочно количество отколов можно полагать равным ,
°кр где Отах—максимальное напряжение на фронте ударной волны.
При отражении ударной волны от свободной поверхности растягивающие напряжения, достаточно большие для разрыва горной породы, возникают на значительно большем расстоянии от центра заряда, чем в случае взрыва в сплошной среде (заряд на большой глубине). В итоге не только существенно увеличивается объем области разрушения, но и изменяется ее форма.
Представим себе, что заряд находится в грунте на расстоянии R' от свободной поверхности, причем R' несколько превосходит ^разр — радиус зоны разрывов сплошной среды в случае взрыва вдали от свободной поверхности. В области, примыкающей к поверхности, из-за отражения ударной волны возникнут интенсивные растягивающие усилия, кроме того, облегчится (по сравнению со случаем глубокого заложения заряда) движение среды, что дополнительно будет способствовать появлению растягивающих сил. В результате, если в сплошной среде на расстоянии R' грунт остается целым, то вблизи свободной поверхности он будет интенсивно разрушен. Далее, если в сплошной однородной среде область разрушения имела вид сферы, то при наличии вблизи от очага взрыва свободной поверхности область разрушения, называемая в этом случае воронкой рыхления, получает вид, показанный на фиг. 6. 20.
Здесь на сферу (образующуюся при взрыве в сплошной среде) накладывается воронка — область действия интенсивных растягивающих напряжений^ связанных с наличием свободной поверхности.
382
Гл. VI. Ударные волны
При наличии двух или более свободных (обнаженных) поверхностей вблизи от заряда объем разрушения возрастет еще более.
Если заряд, образующий воронку рыхления (фиг. 6.20), приб-
лизить к поверхности или увеличить его вес, то часть разрушенного грунта будет приведена в движение и выброшена. Явление выброса широко используется в горном деле, строительстве и пр. Основы расчета зарядов выброса будут даны в гл. IX.
Ударная волна является важнейшим фактором разрушающего действия взрыва, однако при оценке разрушения и дробления среды, непосредственно прилегающей к заряду, и особенно при расчете выброса, нельзя ограничиться только учетом действия ударной волны. Весьма важную роль играет движение • разрушаемой
Фиг. 6.20. Схема воронки рыхления среды в результате поршневого в грунте. действия газов взрыва, возникаю-
щее после прохождения ударной волны. Для изучения и расчета движения грунта под действием газов взрыва также применим закон подобия.
Обратимся теперь к упругим колебаниям зоны сотрясения, кото-
рая начинается там, где разрушения среды кончаются.
Совокупность упругих волн в грунте называют сейсмическими волнами. Последние возникают при землетрясениях и взрывах: фактически взрыв в грунте вызывает искусственное землетрясение, распространяющееся на некоторый объем, зависящий от выделившейся при взрыве энергии. Механизм распространения сейсмических волн значительно сложнее, чем механизм воздушных ударных волн. Очень существенно то, что на поверхности грунта возникают
и распространяются поверхностные волны, внешние схожие с волнами на поверхности воды, но распространяющиеся с несравненно большими скоростями.
По сравнению с воздухом колебания в грунте затухают медленнее и распространяются на большие расстояния. Это особенно относится к поверхностным волнам, которые даже иа больших расстояниях имеют значительную амплитуду и период колебаний, близкий к собственному периоду колебаний зданий и сооружений. На сейсмограмме фиг. 6. 21 волна сжатия зафиксирована в самом начале («вступление»). Последующие же колебания большой амплитуды и значительного периода — это и есть колебания поверхности грунта, приходящие позднее, но имеющие наибольшую интенсивность.
В результате на больших расстояниях именно эти поверхностные волны являются наиболее опасными, наиболее действенными в отношении разрушения сооружений на поверхности грунта. Расстоя
§ 9. Ударные волны в грунте
383
ния, на которых колебания грунта, вызванные взрывами, становятся безопасными для зданий и сооружений обычного типа, могут быть оценены по формуле
_ з
^сейем^А’с/С. (6.42)
В табл. 6. 7 приведены значения коэффициента в формуле (6.42), заимствованные из «Единых правил безопасности при ведении взрывных работ».
Таблица 6.7
Значения коэффициента Rc в формуле для расчета сейсмически безопасных расстояний
Вид грунта, на котором стоит сооружение Коэффициент Яс
—— ———— Г-
Гранит, гнейс Кварциты Известняк Песок плотный Растительная земля Свеженасыпаиная земля Плывун, торфяник 1,5 3,0 5,0 8,0 10,0 15,0 20,0
Использование этих коэффициентов предполагает, что заряд взрывают под землей.
Следует отметить, что формула (6.42) является сугубо приближенной и относится к зарядам весом в десятки, сотни и тысячи +лД/\/\/х^“
Фиг. 6.21. Типичная сейсмограмма взрыва.
тонн. Для мелких зарядов она дает завышенные значения безопасных расстояний. Даже при небольшом заглублении заряда воздушная, ударная волна резко ослабляется, и в большинстве случаев ее действием по сравнению с сейсмическим можно пренебречь. Напротив, если заряд расположен на поверхности, то сейсмическое действие взрыва весьма слабое и его можно не учитывать.
Глава VII
НАПРАВЛЕНИЕ РЕАКЦИИ ВЗРЫВНОГО ПРЕВРАЩЕНИЯ
(Состав и объем продуктов взрыва)
§ 1. МЕТОДЫ УСТАНОВЛЕНИЯ СОСТАВА ПРОДУКТОВ ВЗРЫВА
Конечный итог реакций взрывного превращения выражают обычно уравнением, связывающим химическую формулу исходного ВВ или состав его (в случае взрывчатой смеси) с составом конечных продуктов взрыва. Понятно, что такое уравнение не может дать представления о сложном комплексе элементарных процессов, протекающих параллельно и последовательно при взрыве, но дает лишь их конечный результат.
Знание уравнения химического превращения при взрыве существенно в двух отношениях. С одной стороны, по этому уравнению можно рассчитать теплоту и объем газообразных продуктов взрыва, а следовательно, и температуру, давление и другие его параметры. С методами таких расчетов мы познакомимся в следующей главе. С другой стороны, состав продуктов взрыва получает особое значение, если речь идет о ВВ, предназначенных для взрывных работ в подземных выработках. В этом случае продукты взрыва попадают в атмосферу выработки и должны удаляться рудничной вентиляцией, которая должна быть рассчитана так, чтобы исключить возможность отравления рабочих. К таким ВВ предъявляют требование, чтобы количество ядовитых газов — окиси углерода и окислов азота — в продуктах их взрыва не превосходило определенного предела.
Знание формулы взрывчатого химического соединения или элементарного состава взрывчатой смеси не позволяет еще однозначно определить уравнение химического превращения при взрыве.
Наиболее доступным для расчета является тот случай, когда реакции при взрыве протекают до конца и в продуктах взрыва устанавливается химическое равновесие. Тогда, зная теплоту образования ВВ, число грамм-атомов каждого элемента в нем и константы равновесия различных реакций, которые могут происходить при взрыве, можно рассчитать состав продуктов (количество грамм-атомов или грамм-молей каждого из элементов и их соединений, содержащихся в продуктах). Расчет, однако, осложняется тем, что константы равнове-
§ 1. Методы установления состава продуктов взрыва
385
сия известны лишь для относительно низких давлений, когда продукты взрыва подчиняются уравнению состояния идеальных газов. В этом случае, если числа молей в правой и левой частях уравнения одинаковы, константа равновесия КР зависит только от температуры, но не от давления. При взрыве конденсированных ВВ возникают очень высокие давления и свойства продуктов, сжатых до таких давлений, могут значительно отличаться от свойств идеального газа. Изменение свойств газа и связанное с ним отклонение значений констант равновесия от величин, соответствующих идеальному равновесию, не зависящему от давления, количественно не всегда можно установить.
Далее, положение равновесия тех реакций, которые идут с изменением объема, зависит от давления. Давление же в момент взрыва, особенно при больших его значениях, также не всегда можно точно определить.
При взрыве далеко не всегда устанавливается химическое равновесие. Во многих условиях взрыва, чаще, чем это думали раньше, химические реакции не успевают доходить до конечных стадий, соответствующих равновесном)' состоянию. В продуктах взрыва тогда содержатся в больших или меньших количествах промежуточные соединения, через которые идет превращение ВВ в конечные продукты, а иногда и частицы непрореагировавшего ВВ. Согласно принципу Харитона незавершенность химического превращения при взрыве обусловлена тем, что для прохождения реакций требуется некоторое конечное время, в течение которого должно поддерживаться достаточно высокое давление. Если давление падает слишком быстро, то течение реакций вообще, а реакций сгорания частиц ВВ в особенности, замедляется вплоть до полного их прекращения. Состав продуктов взрыва в этих условиях, когда он определяется не только термодинамикой равновесия, а в значительной мере кинетикой химических реакций и газодинамикой расширения вещества, сжатого до очень высоких давлений, недоступен пока расчету.
В тех многочисленных случаях, когда расчет не позволяет надежно установить итоговое уравнение взрывного превращения, естественно обратиться к эксперименту. Экспериментальное определение состава продуктов в момент взрыва также встречает серьезные трудности, которые могут быть преодолены лишь частично. Это относится и к случаю, когда при взрыве успевает установиться химическое равновесие. Между соединениями, содержащимися в продуктах взрыва, и на стадии охлаждения и падения давления последних происходят химические реакции. Поэтому состав холодных продуктов более или менее отличается от того, который они имели в момент максимума температуры и давления. Для того чтобы уменьшить это изменение состава, опыт ставят в таких условиях, в которых газы взрыва за счет теплоотдачи или совершения работы быстро охлаждаются. При большой скорости охлаждения последующие стадии реакций не успевают пройти в значительной степени и состояние,
386 Г л. VII. Направление реакций взрывного превращения
достигнутое в момент взрыва, «закаливается». Однако даже при быстром охлаждении нельзя избежать рекомбинации валентноненасыщенных частиц (атомы и свободные радикалы), которая идет с очень большой скоростью. Поэтому хотя в продуктах взрыва при высокой температуре могут содержаться атомы и свободные радикалы, обнаружить их после охлаждения не удается.
Таким образом, и расчетный и экспериментальный методы определения состава продуктов взрыва в ряде важных случаев встречают серьезные трудности и могут дать лишь приближенные результаты. Ниже мы последовательно рассмотрим способы расчета уравнений взрывчатого превращения и экспериментального определения состава продуктов взрыва.
§ 2. РАСЧЕТ СОСТАВА ПРОДУКТОВ ВЗРЫВА
Органические ВВ, как правило, состоят из углерода, водорода, кислорода и азота. Соответственно в продуктах взрыва могут содержаться следующие газообразные и твердые вещества: СО2, Н2О, N2, СО, Оо, Н2, СН4 и другие углеводороды, NH3, C2N2, HCN, NO, N2O, С. Если в состав ВВ входят сера или хлор, то в продуктах взрыва могут содержаться соответственно SO2, H2S, НС1 и Cl2. В случае, когда ВВ содержат металлы (например А1) или их соли (например, нитраты, хлораты, перхлораты), то в продуктах взрыва встречаются окислы, карбонаты, бикарбонаты, цианиды, сульфаты, сульфиты, сульфиды, хлориды и другие соединения металлов.
При определении состава продуктов взрыва расчетным путем ВВ делят на две основные группы;
группа I — взрывчатые вещества с положительным кислородным балансом;
группа II — взрывчатые вещества с отрицательным кислородным балансом.
Кислородный баланс характеризует соотношение между содержанием во взрывчатом веществе горючих элементов и кислорода. Вычисляют кислородный баланс обычно как разность между весовым количеством кислорода, содержащимся во взрывчатом веществе, и количеством кислорода, потребным для полного окисления горючих элементов, входящих в его состав. Расчет ведут на 100 г ВВ, в соответствии с чем кислородный баланс выражают в процентах.
Если ВВ содержит как раз столько кислорода, сколько нужно для полного окисления входящих в его состав горючих элементов, то кислородный баланс его равен нулю. В том случае, когда кислород содержится в избытке против указанного количества, кислородный баланс положителен, а при недостатке кислорода — отрицателен.
В качестве примера рассчитаем кислородный баланс нитроглицерина СзН5(ЬЮз)з. Согласно формуле в грамм-молекуле нитроглицерина (227 г} содер-
§ 2. Расчет состава продуктов взрыва
387
жится 9 грамм-атомов, или нитроглицерина составляет
144 г кислорода. Количество кислорода в 100 г
144 X 100
= 63,43 г.
227
Для полного окисления 3 грамм-атомов углерода и 5 грамм-атомов водорода требуется 8,5 грамм-атомов кислорода или 8,5X16=136 г; на 100 г нитроглицерина необходимо кислорода
136 X юо
227
= 59,91
г.
Разность количеств имеющегося 63,43—59,91 S3,5 г; следовательно, по вен +3,5%.
и потребного кислорода составляет определению, кислородный баланс ра-
В качестве второго примера рассчитаем кислородный баланс алюминия. Содержание кислорода равно нулю. Для окисления (до Л120з) на 100 г металла требуется кислорода
48 X 100
54
88,89
г.
Следовательно, кислородный баланс равен —88,9%.
Кислородный баланс является аддитивной характеристикой взрывчатой смеси, поэтому его легко рассчитать, если известен кислородный баланс каждого компонента смеси. Значения кислородно. го баланса наиболее употребительных компонентов взрывчатых смесей приведены в таблице, помещенной в Приложении 4.
В качестве примера рассчитаем, пользуясь этой таблицей, кислородный баланс предохранительного аммонита Ш/1, содержащего 56% аммиачной селитры, 9% тротила, 3% древесной муки и 32% хлористого натрия. По таблице Приложения 4 находим значения кислородного баланса: аммиачной селитры (+20%), тротила (—74%), древесной муки (—135%); кислородный баланс хлористого натрия равен нулю, так как он не содержит кислорода и не требует его для окисления.
Кислородный баланс смеси=0,56 • 20+0,09 (—74)+0,03 (—135)+0,32-0= = +0,9%.
1. Расчет состава продуктов взрыва ВВ с положительным кислородным балансом (группа I)
Для составления приближенного уравнения взрыва ВВ с положительным кислородным балансом руководствуются следующими простыми правилами: углерод окисляется до углекислоты, водород до воды, азот и избыток кислорода выделяются в элементарном виде.
Рассчитаем, например, уравнение взрыва амматола 80/20, содержащего 80°/п аммиачной селитры и 20% тротила. Для определения коэффициентов левой части уравнения обозначим число молей селитры (молекулярный в-’-с 80)' через а и число молей тротила (молекулярный вес 227) через Ь. Тогда
а-80 80 80-6-227
-----= —; а—------------= 11,356.
6-227 20 20-80
388 Гл. VII. Направление реакций взрывного превращения
Приняв число молей тротила Ь—1, получаем а=11,35. Таким образом, уравнение йзрыва амматола принимает вид
11,35NH4NO3 + C7HS (NO2)3 = 7СО2 4- 25,2Н2О 4- 12,85N2 + 0,425О2.
Экспериментальное определение состава продуктов взрыва различных ВВ с положительным кислородным балансом показывает отклонения от расчетных уравнений в двух направлениях: с одной сторо-
Фиг. сия
Кр —
7. 1. Зависимость константы равнове-реакций диссоциации: углекислоты
РсоРо1
------2— (кривая /), воды = Рсо,
p^p'qI ,
= —-----— (кривая 2) и реакции водяного
Тн,0
Рсо/Чо’ .
газа /<р —--------- (кривая 3) от темпе-
Pco^H, ‘ ратуры.
ны, при высокой температуре взрыва азот частично соединяется с кислородом, образуя окись азота; с другой — имеет место диссоциация углекислоты и воды: устойчивые продукты этой диссоциации (окись углерода, водород и кислород) обнаруживаются в продуктах взрыва.
Оба эти отклонения, однако, слабо отражаются на составе продуктов взрыва. Равновесная концентрация окиси азота даже при относительно высоких температурах сравнительно невелика. Так, при 1400° К она составляет 0,10%, при 2800° К — 4,48 %, при 3500° К — 9,23 %. Если принять во внимание, что применение ВВ с большим положительным кислородным балансом нецелесообразно и что, следовательно, концентрация кислорода в продуктах взрыва не может быть большой, то в них и не может образоваться
много окиси азота.
Точно так же в условиях взрыва конденсированных ВВ не получает существенного развития диссоциация углекислоты и воды. Степень диссоциации, правда, быстро растет с температурой, как это следует из температурной зависимости констант равновесия реакций
СО ’/гОг СО2
Н2 4- Н2О,
которая графически изображена на фиг. 7. 1.
§ 2. Расчет состава продуктов взрыва
389
При повышении давления степень диссоциации, однако, резко падает (фиг. 7.2 и 7.3) и при очень больших давлениях, характерных для взрыва, диссоциация весьма незначительна. В силу этого при расчете уравнения взрыва диссоциацией обычно пренебрегают тем более, что учет ее предполагает знание давления взрыва *, ве-
Фиг. 7. 2. Зависимость степени диссоциации углекислоты (а) от давления при разных температурах (по расчетам Шмидта).
* Например, для реакции диссоциации углекислоты по закону действующих масс имеем
.. /’co/’oj
Лр —
Рсо,
Обозначая степень диссоциации а и общее давление ps, получим
>/ аЧ’
КР^Р^ (e_j_2)*Z» (1 —а)‘
Таким образом, для расчета а, кроме величины Кр, определяемой температурой, нужно еще знать давление, под которым находятся продукты взрыва.
390
Гл. VII. Направление реакций взрывного превращения
личина которого при обычных, высоких, значениях плотности ВВ точно не известна.
Экспериментальные данные подтверждают обоснованность этих выводов. Так, для гремучего студня Шмидтом на основании анализа продуктов взрыва, возбужденного сильным инициатором, получено следующее уравнение взрыва по расчету на 1 кг взрывчатого вещества:
Cj4>13^22,8^12,8^39,3 == 13,27СО2 + 0,83СО%- 11,17Н2О +
+ 0,17Н2 + 0,03СН4 + 0.50NO +0,3002 + 6,15N2.
Фиг. 7. 3. Зависимость степени диссоциации водяного пара от давления при разных температурах (по расчетам Шмидта).
Несмотря на высокую температуру взрыва (свыше 4000° К), содержание окиси азота составляет только 1,5%, невелики также количества диссоциированной воды и углекислоты.
Для взрывчатых веществ с более низкой температурой взрыва, например аммонитов, влияние диссоциации и образования окиси азота еще меньше.
2. Расчет состава продуктов взрыва ВВ с отрицательным кислородным балансом (группа II)
В отношении методики расчета уравнения взрыва взрывчатые вещества группы II делятся на две подгруппы: 1-я — взрывчатые вещества, полностью превращающиеся в газы, и 2-я — взрывчатые вещества, образующие при взрыве элементарный углерод. Подразделение это1 несколько условно, так как наличие или отсутствие углерода в продуктах взрыва зависит от давления, при котором идет превращение. Поэтому, например, нитроклетчатка, сгорая в виде пороха в манометрической бомбе, не образует углерода; при детонации же, когда давление в несколько десятков раз больше, углерод выделяется.
$ 2. Расчет состава продуктов взрыва
391
1-я подгруппа. ВВ, полностью превращающиеся в газы при взрыве. Уравнение превращения в данном случае приближенно может быть написано следующим образом *:
CcHftOoN„=х СО + у СО2 + z Н2 + и Н2О + -- N2.
Соотношение между количествами окиси углерода, углекислоты, водорода и воды определяется равновесием реакции водяного газа
СО + Н2О^СО2 + Н24-9850 кал**.
Поскольку числа молей газов в правой и левой части уравнения одинаковы, то это равновесие не зависит от давления или от плотности ВВ, что значительно облегчает расчеты и делает их результаты более достоверными. Кроме того, вследствие сравнительно малого теплового эффекта реакции водяного газа константа равновесия относительно медленно растет с повышением температуры (см. фиг. 7. 1 или Приложение 7), что также упрощает расчет.
Приравнивая числа атомов отдельных элементов в правой п левой частях уравнения, получаем
Х—с — у;
и = о — (с —у) — 2у — о — с — у, z=^^h — u = y7;h — o^yyc.
Из выражения константы равновесия
,, их
гу или
К — (о —с — суЖ—-V) р (1/2Л — О +у 4-с)у
Таким образом, для определения четырех величин х, у, z и и име-„ ем систему из четырех уравнений. Они могут быть приведены к квадратному уравнению относительно у:
ay1 + by С = О или
(/<-l)y^ + [Kei2h-o + c) + o]y + c с — о)~-0, откуда
— [K(y2/g —о + с)4-о] ± ЖРГСМ — о 4-с) Ч~ о]2 ~ 4 (/< — 1)с(с-~ о)
У 2(.К— 1)
* Приближенность уравнения определяется, в частности, тем, что в нем не учитывается диссоциация молекул на атомы и радикалы, которая при высоких температурах приобретает заметное значение, особенно если давление невелико, как это имеет место, например, при горении в реактивной камере.
** Тепловой эффект при 18° С.
392
Гл. VII. Направление реакций взрывного превращения
Вычислив у, легко определяем значения х, и, z.
В качестве примера рассчитаем уравнение взрывчатого превращения «восьмиазотной» нитроклетчатки:
~ * 00 + У С02 + г Н2 + и Н20 + 4N2.
Неизвестные х, у, г и и связаны следующими очевидными соотношениями:
х + у — 24;
2г + 2и = 32;
х+2у + и = 36.
Допустим, что неизвестная пока температура взрыва* равна 2900°К.
' По таблице Приложения 7 для этой температуры Кр=6,95. Тогда мы можем написать
-1^211^=6 05
[СО2][Н2]
или при наших обозначениях
После элементарных преобразований эта система сводится к квадратному уравнению относительно у:
5,95у2 + 63,8у + 288 = 0.
Корень этого уравнения (очевидно, что физический смысл имеет только положительный корень) //=3,42, откуда легко найдем
х = 20,58; г =7,42; и = 8,58.
Уравнение взрывчатого превращения имеет следующий вид:
C24H32O36N8 = 20,58СО + 3,42СО2 + 7,42Н2 + 8,58Н2О + 4N2,
Зная конечный состав продуктов реакции, можно рассчитать теплоту взрывчатого превращения и температуру (см. гл. VIII). Если при этом мы получим ту температуру, которой задались при расчете, то расчет уравнения проведен правильно. В противном случае его необходимо повторить, задавшись другой температурой.
При расчете мы принимали, что равновесие реакции водяного газа зависит только от температуры. Это допущение правильно лишь в том случае, если давление не слишком велико. Когда давление велико, в выражение константы равновесия следует подставлять не парциальные давления реагентов, а их фугативности.. Фугативности по определению есть такие характеристики газов, при подстановке которых вместо парциальных давлений в выражение константы равновесия оно сохраняет свою справедливость и при больших давлениях. Есть различные способы расчета фугативности, в большинстве своем пригодные лишь для не слишком больших давлений, меньших, чем обычные давления детонации.
Один из этих способов заключается в следующем.
♦ О способе ориентировочной оценки температуры взрыва см. в гл. VIII.
§ 2. Расчет состава продуктов взрыва
393
Отношение фугитивности газа к его парциальному давлению называют коэффициентом активности. По определению
Т/ = ~, (7-1)
Pi
где 1», fi и pt—соответственно коэффициент активности, фугитивность и парциальное давление i-го компонента газовой смеси.
Как доказывается в курсах термодинамики,
р
lgT=-lg^7\adp, о
(7.2)
где а==иид —
^реальн
RT—pv Р
Легко показать, что
(7,2а)
Заменяя в выражении константы равновесия водяного газа дав-ления на фугитивности, с учетом (7.1) имеем
ICOPCQ^OPlifi ft gj 7со,/’со,Тн,/’н, ₽
или /’соАго г, ТсоЛн, /’СО,/’!!, 7соТн,о
Обозначив -7сР»Тн«- через <9, получим Тсо^н,о (7. 4) /7со,/’н,
Коэффициент активности каждого из газов может быть рассчитан из выражения (7. 2) или (7. 2а) и уравнения состояния, приложимого для высоких давлений.
Зная коэффициенты активности каждого из газов, можно рассчитать поправочный множитель G, входящий в уравнение (7. 4). Примерный расчет состава продуктов взрыва с учетом неидеальности газов мы рассмотрим в следующей главе в связи с расчетом давления при взрыве.
К веществам 1-й подгруппы группы II относятся также и современные бездымные пороха. При давлениях ствольного выстрела рас
394
Гл. VII. Направление реакций взрывного превращения
чет состава продуктов горения может быть произведен, как описано выше. Если нужно рассчитать состав продуктов горения в ракетной камере, где давление обычно гораздо ниже и иногда не превосходит десятков атмосфер, то необходимо принимать во внимание диссоциацию различных газов. Роль диссоциации увеличивается, если речь идет о порохе с большой теплотой горения.
Диссоциацию можно учесть, если, не ограничиваясь учетом равновесия реакции водяного газа, совместно решить уравнения равновесия следующих реакций, константы которых приведены в Приложении 7 (стр. 567):
О2 + О О3
С-Н/2О2?±СО
2О?±О2
2N^N2
2Н?±Н2
СО !/2О2<^ СО2 oh4-v3h2^h2o н2+>/2о2г±нао
NO + '/A^NO,
NO ^72o2+72n2
Из этих реакций преобладающее влияние на состав продуктов горения имеют процессы, ведущие к образованию гидроксила, атомарных водорода и кислорода, молекулярных кислорода и водорода и окиси азота. По расчетам Уимпресса, состав газов, который получается в результате горения типичного высококалорийного нитроглицеринового пороха при давлении 10 ат и температуре 3300° С, в процентах по объему следующий: СО2—9,4; СО—33,6; Н2О—13,8; N2—11,9; Н2—6,3; О2—3,2; 0—3,6; NO—1,4; N—0,2; Н—6,0; ОН—10,6. При 100 ат и той же температуре содержится гидроксила 6,1%, атомарного водорода 1,7%, атомарного кислорода 0,7% и молекулярного кислорода 1,3%.
2-я п о д г р у п п а. Во взрывчатом веществе кислорода недостаточно для полного превращения всех горючих элементов в газы. В этом случае часть углерода, содержащегося в ВВ, выделяется в элементарном виде.
Рассчитать количество выделившегося углерода можно на основе следующих соображений. Очевидно, что чем больше углерода содержится во взрывчатом веществе, тем больше должно получиться СО и тем меньше СО2. Однако отношение СО/СО2 не может пре
$ 2. Расчет состава продуктов взрыва
395
вышать некоторого максимума, определяемого равновесием так называемой реакции доменного газа
CO^1/2CO2 + ll2C + 2Q375 кал,
-15------L...... I -------1-
0 1000 2000 3000 Т°К
Фиг. 7. 4. Зависимость константы равновесия реакции доменного газа (А’р=/’со//’сд1) от температуры.
зависящим от давления и от температуры. Если отношение СО/СОг станет больше, чем допускается этим равновесием, то часть СО перейдет в СО2 с выделением углерода. Чем больше давление, тем меньше при данной температуре максимальная равновесная концентрация СО. В соответствии с этим опыт ’ показывает, что при большей плотно- р сти взрывчатого вещества отношение концентраций СО/СО2 в продуктах взрыва меньше. Так, для пикриновой кислоты при р = 1,0 отношение СО/СО2=4, при Р = 1,5 отношение СО/СО2=1,3.
Константа равновесия реакции доменного газа может быть выражена через парциальные давления следующим образом:
Зависимость ее от температуры изображается графиком фиг. 7. 4.
В свою очередь, парциальные давления могут быть выражены через общее давление и объемный процент данного газа в составе смеси:
/>s(0/0 СО) '’“““ТО™
(%СО2)
/7со’ = 100...
где рт.— общее давление.
Подставив эти значения в уравнение (7. 5), получим
(7.6) [%СО2] р Рт
Так как 7\:. возрастает с температурой, то содержание окиси углерода растет с температурой и, как видно из формулы (7.6), падает с давлением.
Расчет уравнения взрывного превращения можно вести следующим образом. Положим, что формула ВВ СсНЛОоМл. Рассчитываем уравнение взрывного превращения, как для вещества 1-й подгруппы,
396
Гл. VII. Направление реакций взрывного превращения
т. е. с учетом только равновесия реакции водяного газа. По результатам расчета вычисляем процентное содержание СО и СОг в составе продуктов взрыва. Подставляем эти величины в соотношение (7.6), задаваясь ориентировочно температурой и давлением взрывного превращения. Если левая часть уравнения (7. 6) оказывается меньше или равна правой, то углерода не выделится. Если же
[%сор^ юо [СО2] р Ts ’
то часть углерода выделится в элементарном виде. Положим, что углерода выделится а грамм-атомов. Тогда формулу превращающейся в газы части вещества мы можем написать в виде Cc_aHAOoNn.
Для этой формулы повторяем расчет по равновесию реакции водяного газа. Полученный состав газов вновь проверяем по равновесию реакции доменного газа (7.-6). Очевидно, что содержание СО теперь будет меньше, чем при первоначальном расчете, и левая часть уравнения уменьшится. Если все же левая часть еще будет больше правой, то задаемся большим значением а и повторяем расчет. Последовательные приближения продолжаем до тех пор, пока левая часть не станет равной правой.
Таким образом, расчет состава продуктов взрыва при выделении элементарного углерода в принципе возможен. Его нельзя, однако, рекомендовать для практического определения уравнения взрыва. С одной стороны, чтобы учесть влияние равновесия реакции доменного газа, необходимо знать давление взрыва, которое обычно точно неизвестно, с другой — твердому углероду в составе продуктов взрыва, как правило, сопутствуют соединения углерода и азота, образование которых мы не учитывали выше; ацетилен, циан, синильная кислота, аммиак и т. д. Учет соответствующих равновесных реакций, в принципе возможный, привел бы к чрезвычайно громоздким вычислениям, которые практически доступны лишь с применением электронных счетных машин. В этом случае обычно отказываются от теоретического расчета уравнения взрыва и прибегают к опытному определению состава его продуктов. Тем не менее изложенные соображения сохраняют свой интерес, поскольку они позволяют получить приближенное представление о составе продуктов взрыва и, не проводя расчета, исключить заведомо неправильные уравнения взрывного превращения, иногда приводимые в литературе.
Так, например, для пикриновой кислоты один автор привел следующее уравнение распада:
8С6Н2 (NO2)3 ОН == 28СО + 6СН4 -ф 12N2 + 7С2,
явно неправильное, так как при наличии углерода и окиси углерода в продуктах взрыва должна содержаться также углекислота, не говоря уже об отсутствии в уравнении водорода и воды.
§ 3. Экспериментальные методы определения состава продуктов взрыва 397
Ошибочным является и уравнение взрыва гексогена, приведенное другим автором:
C3H6N6O6 = 3CO + 3H2O + 3N2, не включающее водород и углекислоту, которые должны образоваться соответственно равновесию реакции водяного газа.
§ 3. ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ СОСТАВА ПРОДУКТОВ ВЗРЫВА
1. Общая характеристика методов и приборов
Фиг. 7. 5. Устройство бомбы Бихеля.
1—корпус бомбы. 2—крышка. 3—бол-ты, 4—электроизолированный ввод, 5—вентиль для откачивания бомбы и отбора газов после взрыва, 5-заряд ВВ.
Для экспериментального определения состава продуктов взрывного превращения применяют в основном два прибора: манометрическую бомбу, когда речь идет о горении ВВ под большими давлениями, и бомбу типа бомбы Бихеля для определения состава продуктов детонации.
Манометрическая бомба представляет собой толстостенную стальную трубку, закрывающуюся с обоих концов ввинчивающимися стальными пробками. Поскольку основное назначение бомбы — определение давления при горении в замкнутом пространстве, подробное описание ее будет дано в гл. VIII (см. стр. 442). Для нас пока существенны два момента: наличие в бомбе вентиля, позволяющего отбирать пробу продуктов горения после опыта, и малый объем бомбы (обычно 22 см3, максимум 200 см3), который не позволяет осуществлять в ней детонацию ВВ, требующих для ее возбуждения капсюля-детонатора.
Опыты в манометрической бомбе проводят обычно при плотности заряжания, не превосходящей 0,5 кг/л, что соответствует максимальному давлению около 4000 kzIcm3. В бомбах повы
шенной прочности можно проводить опыты при давлениях, достигающих 6000 кг/см2.
Бомба Бихеля * (фиг. 7. 5) представляет собой толстостенный стальной сосуд с внутренним диаметром 20 см, объемом около 20 л, герметично закрывающийся крышкой. В стенке или крышке бомбы имеется электроизолированный стержень, к которому присоединяют проводник электродетонатора. Другой проводник присоединяют к корпусу бомбы. Взрыв электродетонатора вызывает детонацию
* Вариантом, бомбы Бихеля является бомба Б. Е. Долгова, главное отличие «которой заключается в большем объеме (50 л).
398
Гл. VII. Направление реакций взрывного превращения
заряда испытуемого ВВ. Перед опытом, как правило, откачивают воздух из бомбы (до остаточного давления 50 мм рт. ст. или меньше). В противном случае воздух, оставшийся в бомбе, может, вступая в реакцию с продуктами взрыва, существенно изменить их состав. Заряд взрывчатого вещества (обычно 100 г) в заводской или стандартной бумажной оболочке подвешивают в центре бомбы и производят взрыв. Бомбу и находящиеся в ней продукты взрыва охлаждают до комнатной температуры, после чего измеряют давление в бомбе. Зная температуру Т бомбы в момент замера, измеренное давление р продуктов взрыва, объем бомбы v и давление насыщенного водяного пара при температуре Т, равное Ph.,q, рассчитывают объем газов (без воды) при нормальных условиях, образуемый одним килограммом ВВ.
v (р Ри.о)' ' ЮОО
где q — вес взорванного заряда в г.
Отбирая при помощи имеющегося в бомбе вентиля пробу газа и анализируя ее обычными методами, определяют содержание различных газов, входящих в состав продуктов взрыва. Количество' воды, образующейся при взрыве водородсодержащих органических ВВ, устанавливают по разности, так как оно не определяется при обычном газовом анализе. Его можно определить также пропусканием осушенного воздуха через бомбу и поглощением воды в трубочке с хлористым кальцием или другим поглотителем. ГК> данным газового анализа составляют уравнение взрыва с учетом воздуха, остававшегося в бомбе, кислород которого в случае ВВ с отрицательным кислородным балансом участвует в реакции.
Для ВВ, применяемых в подземных работах, подсчитывают, кроме того, условный суммарный объем ядовитых газов, образуемых 1 кг взрывчатого вещества. Для этого к объему окиси углерода прибавляют удесятеренный объем окислов азота (NO + NO2). Такой принцип подсчета, однако, не вполне обоснован, так как, во-первых, он предполагает, что токсическое действие окиси углерода и окислов азота суммируется, что, вообще говоря, не имеет места и, во-вторых, он исходит из преувеличенного соотношения токсичности окислов азота и окиси углерода 10: 1 *. К подземным ВВ предъявляют требование, чтобы определенный по описанному методу объем ядовитых газов не превышал 50 л на 1 кг ВВ.
2. Экспериментальные данные
Первоначально изучение состава продуктов взрыва вели исклю. чительно при помощи манометрической бомбы. Нобль и Абель исследовали таким образом образцы черного пороха различного соста.
* Поэтому в последнее время применяют также переводный коэффициент 6,5; 1.
§ 3. Экспериментальные методы определения состава продуктов взрыва 399
ва. Они установили, что' с повышением плотности заряжания, а следовательно, и давления, под которым идет горение, отношение СОг/СО возрастает.
Аналогичные результаты получили Сарро и Вьель при изучении продуктов горения пикриновой кислоты. Опыты ставили при различных плотностях заряжания в платинированной изнутри бомбе, наполненной азотом. Результаты их, сведенные в табл. 7. 1, показывают, что с ростом плотности заряжания количество СО2 возрастает, а количество' СО уменьшается в качественном соответствии с требованиями равновесия реакции доменного газа. Одновременно с ростом содержания СОг наблюдается значительное увеличение количества метана.
Т абл и ца 7.1
Зависимость состава газообразных продуктов горения пикриновой кислоты от плотности заряжания (по Сарро и Вьелю)
Газы (без Н2О) Содержание газа в % по объему
Плотность заряжания Д в кг'л
0,1 | 0,3 0,5
СО2 7,61 15,40 20,55
СО 61,56 54,34 48,80
сн4 1,19 5,75 7,83
н2 12,52 6,31 3,06
n2 17,12 18,20 19,76
Вопрос о том, на какой стадии взрыва образуется метан, был предметом дискуссии, имеющей принципиальное значение. Дело в том, что непосредственно после сгорания или взрыва газообразные продукты имеют высокую температуру и давление. В этих условиях скорость химических реакций велика. В дальнейшем газы охлаждаются за счет теплоотдачи в окружающую среду или расширения с совершением работы. Если это охлаждение происходит не слишком быстро, химические реакции между первоначальными продуктами успевают пройти в некоторой степени и поэтому состав охладившихся газов более или менее отличается от их состава в момент взрыва.
Сказанное может быть пояснено на примере взрыва стехиометрической смеси водорода с кислородом при атмосферном давлении. Известно, что в результате такого взрыва водород и кислород полностью превращаются в воду. В то же время доказано, что при высокой температуре и относительно небольшом давлении, достигаемом в момент взрыва, продукты его содержат, кроме воды, много молекулярного водорода и кислорода, гидроксила и даже атомарного водорода, превращающихся в воду лишь при охлаждении.
Сходное явление имеет место и в случае горения или взрыва конденсированных ВВ. Его изучение было первоначально проведено именно в связи с обнаружением метана при анализе продуктов взрыва в манометрической бомбе ВВ, имеющих отрицательный кислородный баланс. Сарро и Вьель образование метана при взрыве пикриновой кислоты объясняли реакциями
СО + Н2 1 /2 СО2 + 5/2 СН4
400
Гл. VII. Направление реакций взрывного превращения
и
со4-зн2?±н2о + сн4,
происходящими вмомент взрыва.
Поппенберг и Стефан, напротив, считали, что метан образуется не в момент взрыва, а при вторичных реакциях, идущих во время охлаждения газов в бомбе. _ [CO][H2OJ
В подтверждение этого они указывали на постоянство отношения -----
[ СО2]Н2] в составе газов, т. е. константы равновесия реакции водяного газа, наблюдающееся при опытах в бомбе для весьма отличающихся по составу и температуре взрыва ВВ и порохов при одной и той же плотности заряжания.
Они объясняли это постоянство следующим образом. Температура газов падает за счет теплоотдачи стенкам бомбы. Соответственно уменьшается константа равновесия реакции водяного газа. В начале, когда температура еще высока и скорость реакции велика, в соответствии с изменением константы успевает изменяться и состав газов. По достижении некоторой температуры, однако, скорость реакции становится столь малой, что изменение состава газов перестает следовать за дальнейшим понижением температуры — равновесие «закаливается». Поэтому в результате опыта в бомбе получаем состав газов, соответствующий не максимальной температуре, достигнутой при горении или взрыве, а температуре «закалки» равновесия. Решить этот вопрос теоретически не представлялось возможным. С одной стороны, казалось, что метан в момент взрыва образоваться не может, так как при высоких температурах он неустойчив. Так, по Бертло метан разлагается при нагревании в кварцевом сосуде до 1300° С: по Майеру и Альтмайеру, исследовавшим равновесие
С + 2Н25±СН4,
эта реакция дает почти полностью один метан при температурах не выше 250°; при 850° и 1 ат содержание метана составляет всего 1,5°/о.. Эти факты, однако, не исключают возможности образования метана даже при значительно более высоких температурах, если учесть высокие давления, возникающие в бомбе в результате горения или взрыва. Рост давления смещает равновесие в сторону образования метана.
Для выяснения механизма образования метана были поставлены также опыты, при которых в одном случае бомба находилась в кипящей воде, а в другом — в жидком воздухе. В последнем случае охлаждение газов происходило значительно быстрее и количество метана было существенно меньше. Аналогичные опыты были произведены Мюрауром с порохами. Порох сжигали в эрозионной бомбе так, что газы могли быстро охлаждаться, расширяясь при истечении из бомбы. Эти опыты тоже подтвердили, что метан образуется при вторичных реакциях, если они имеют возможность протекать в заметной степени.
Наконец, еще более отчетливо разрешает вопрос следующий опыт, поставленный Поппенбергом и Стефаном. Заряд прессованной пикриновой кислоты был помещен в свинцовую бомбу Трауцля, покрыт свинцовым кружком, песочной забойкой и поверх нее вторым свинцовым кружком. Свинцовую бомбу помещали в эвакуированную стальную бомбу и производили взрыв. Продукты весьма быстро охлаждались за счет совершения работы расширения свинцовой бомбы, и равновесие «закаливалось» при составе газов, близком к тому, который имел место в момент взрыва. Несмотря на большую плотность заряда пикриновой кислоты, содержание в продуктах метана, полученное при таком опыте, составляло всего 0,5%, в то время как в манометрической бомбе при значительно меньшей плотности (0,5 кг/л) Сарро и Вьель получили около 8% метана.
Таким образом, метан, обнаруживаемый при опытах в манометрической бомбе, образуется не в момент достижения максимального давления, а во время последующего охлаждения. Поскольку при охлаждении меняется соотношение и других составных частей про
§ 3. Экспериментальные методы определения состава продуктов взрыва 401
дуктов, то анализ охладившихся продуктов горения или взрыва в манометрической бомбе не отражает их первоначального состава.
Затормозить протекание реакций, идущих при охлаждении, можно, осуществляя взрыв в условиях совершения работы расширяющимися продуктами. Так как работа производится быстро, то охлаждение происходит столь быстро, что значительного смещения равновесия не наступает. Одним из методов, основанных на этом принципе, является описанный выше подрыв ВВ в бомбе Трауцля, помещенной в свою очередь в эвакуированную емкость.
Другой метод быстрого охлаждения продуктов взрыва основан на помещении заряда ВВ в оболочку из сыпучего тонкозернистого инертного материала, например кварцевого песка. Газы, образовавшиеся при взрыве, расширяясь, проникают через оболочку, приходят в контакт с ее материалом на большой поверхности и быстро охлаждаются-. Это прерывает течение химических реакций в продуктах взрыва. Опыт показывает, однако, что в указанных условиях развитие химических реакций может тормозиться так сильно, что химическое равновесие вообще не достигается. Тогда в продуктах обнаруживаются первичные и промежуточные соединения, образующиеся в ходе горения частиц при взрывном превращении, а иногда и частицы непрореагировавшего ВВ.
В свете сказанного экспериментальное определение состава продуктов взрыва, даже в случае химически однородных ВВ, представляет довольно сложную задачу, поскольку этот состав не является однозначной характеристикой ВВ, но изменяется в зависимости от условий взрыва.
В неблагоприятных условиях, например при малом диаметре заряда, крупнозернистой структуре ВВ, разброс исходного вещества при взрыве относительно велик и, если охлаждение происходит быстро, превращение не доходит до химического равновесия.
Если условия протекания реакций благоприятны, а разброс ВВ затруднен (например, при наличии сплошной металлической оболочки), то превращение протекает полнее и равновесие может быть достигнуто. Если к тому же последующее охлаждение происходит достаточно быстро (например, при взрыве небольшого заряда в большой емкости, т. е. при большой поверхности охлаждения), то равновесие не успеет существенно сместиться, особенно если конечное давление, а следовательно, и скорость реакции будут малы.
Равновесие достигается и в том случае, если ВВ взрывают без оболочки, но охлаждение протекает медленно, например при взрыве заряда в эвакуированной бомбе, где расширение происходит без совершения работы и газы достаточное время сохраняют повышенную температуру. Тогда реакции доходят до конца и не обнаруживается частиц ВВ или продуктов неполного превращения; однако в этом случае равновесие соответствует низкому давлению. Завершению реакций здесь может способствовать также сильное повышение
402
Гл. VII. Направление реакций взрывного превращения
температуры и давления расширяющихся газов при встрече их со стенками бомбы. Вследствие торможения движения газов их кинетическая энергия переходит при этом в тепло.
Наконец, если процесс идет при больших плотностях заряжания и в условиях медленного охлаждения, как это имеет место, например, в манометрической бомбе, то равновесие не только достигается, но и успевает сместиться при последующем охлаждении. Это смещение происходит в направлении, соответствующем более низким температурам, но относительно высоким давлениям, определяемым примененной плотностью заряжания.
Различия в составе продуктов взрыва наблюдаются не только при лабораторном определении, но и в условиях практического применения. Образование ядовитых газов (NO и СО) при взрыве аммонитов в сильной степени зависит от возможности быстрого охлаждения продуктов взрыва на ранних ступенях химического превращения, до того как достигнуто химическое равновесие. Охлаждение тормозит восстановление NO до азота и окисление СО в углекислоту.
Экспериментальные исследования по составу продуктов взрыва проводились различными методами.
Методом взрыва небольшого заряда В В в свинцовой бомбе, помещенной в эвакуированную емкость, Шмидт определил состав продуктов взрыва ряда ВВ при различных плотностях и условиях инициирования. В этих опытах старый гремучий студень, в значительной мере утративший свою первоначальную высокую чувствительность к детонации, взрывали относительно слабым капсюлем-детонатором (заряд 2 г слабоспрессованного азида свинца) и более сильным (0,3 г азида свинца и 1 г тэна). В последнем случае, по мнению авторов работы, быстрее достигается максимальная скорость детонации и соответственно' взрыв проходит при более высоком среднем давлении. Состав продуктов взрыва (на 1 кг ВВ) для первого и второго случаев может быть выражен числами молей, приведенными в табл. 7. 2. В случае гремучего студня состав газов почти не меняется, потому что при близком к нулю кислородном балансе состав продуктов не зависит существенно от давления.
Точно так же не меняется при изменении начального' импульса состав продуктов взрыва тэна. В данном случае состав газов определяется главным образом равновесием реакции водяного газа, на которое давление большого влияния не оказывает.
У ВВ с сильно отрицательным кислородным балансом, например у тротила, уравнение взрыва зависит от реакции доменного газа и состав продуктов (см. табл. 7. 2) изменяется при переходе от слабого к сильному инициатору. Это изменение происходит в направлении, соответствующем повышению давления: равновесие указанной реакции смещается в сторону увеличения количеств свободного углерода и углекислоты.
Таблица 7.2
Состав продуктов взрыва некоторых ВВ при различных условиях инициирования и плотности р (по данным Шмидта)
ВВ и его формула (на 1 кг) Условия взрыва Состав продуктов взрыва в г~мол!кг
С СО2 СО Н2О н2 СН4 СдаН/г NO ог N? HCN C3N3 NH3
Гремучий студень Сц, [ Н£2>8Оз9,(54Ь1! ?>8 Слабый импульс, Р = 1,45 кг!л — 13,09 0,98 11,13 0,21 0,03 0,70 0,15 6,05 — — —
Сильный импульс, р = 1,45 кг)л — 13,27 0,83 11,17 0,17 0,03 — 0,50 0,30 6,15 1 ~ —
Тэн С]5,КиНг;:,>ЗЙОЗЙ,(,М !5l5Ci Слабый импульс, р = 1,54 кг)л —• 9,18 6,64 10,97 1,69 — — 1,32 0,36 5,67 — — —
Сильный импульс, р = 1,54 кг]л — 9,34 6Д4 11,05 1,53 — — 1,0 0,40 5,82 — —
Нитроклетчатка (13,3^N) С21,1Н25,4Озб,6^9,6‘. Слабый импульс, р — 0,3 кг)л 0,5 7,74 12,58 8,40 4,14 0,05 0,03 —• 0,07 4,81 — — —
Сильный импульс, р ~ 1,3 кг]л 2,5 8,05 10,29 9,93 2,45 0,15 — — 0,14 4,81 — — —
Тетрил Сильный импульс, Р =5= 0,9 кг)л 0,3 3,02 18,83 3,03 3,64 0,48 0,02 — — 7,73 1,2 0,2 0,3
Сильный импульс, р = 1,56 кг/л 5,8 5,59 10,85 5,91 1,89 0,27 0,03 — — 7,82 0,6 0,58 —
Пикриновая кислота С‘26,2^ 13,1 0.30,6^13,1 Сильный импульс, Р = 1,0 кг/л 0,8 4,49 17,6 4,02 1,70 0,16 0,04 J — 1 — 5,02 0,66 1,22 0,1
Сильный импульс, Р = 1,45 кг)л 6,8 7,88 10,18 4,60 1,08 0,12 0,01 — — 5,81 0,33 0,4 0,3
Тротил С зо ,9 Has,0^26, 4N13,2 Слабый импульс, Р — 1,52 кг/л 6,6 1,78 18,63 4,25 5,34' 0,10 0,09 — ! 4,74 1,1 1,2 0,3
Сильный импульс, р = 1,52 кг[л 15 5,30 8,79 7,05 1,69 0,03j 0,05 j —• | — 5,2 I 1,4 0,1 0,9
$ 3- Экспериментальные методы определения состава продуктов взрыва 403
404
Гл. VII. Направление реакции взрывного превращения
При одинаковом, сильном, импульсе давление взрыва зависит от плотности заряда, именно поэтому с плотностью меняется состав продуктов взрыва пикриновой кислоты и тетрила, как это видно из табл. 7. 2.
Данные табл. 7. 2 относятся к случаю, когда химическое равновесие успевает установиться и, предположительно, не успевает сместиться при охлаждении.
При втором методе —взрыве заряда в оболочке из инертного порошка — состав продуктов существенно отличается от соответствующего равновесию.
С индивидуальными ВВ по этому методу проведено мало исследований, По данным Апина, при взрыве нитроглицерина в пробирке, окруженной кварцевым песком, образуются значительные количества окиси азота: от 3 до 11 %, в то время как без песка окиси азота вообще не получается.
В табл. 7.3 по данным этого исследователя приведен состав газообразных продуктов взрыва крупнокристаллического тетрила. Помимо изменения состава газов, при взрыве в песке увеличивается количество твердого остатка и соответственно уменьшается общий объем газообразных продуктов.
Таблица 7.3
Состав продуктов взрыва тетрила (по Апину)
Продукты взрыва Содержание компонентов продуктов в % по объему
Заряд свободно подвешен в бомбе Заряд окружен кварцевым песком
СО 52,90 46,36
со2 8,61 14,55
NO 0,15 0,51
н2 12,36 6,26
n2 23,5 25,7
сн4 1,10 1,18
HCN + C2N2 + NH3 1,40 5,42
Более подробно изучали состав продуктов взрыва, окруженных инертным материалом зарядов промышленных ВВ для подземных работ, в первую очередь аммонитов.
Как уже отмечалось выше, ВВ, предназначенные для взрывных работ под землей, допускают к применению в шахтах лишь в том случае, если количество ядовитых газов, образующихся при их взрыве, ограничено некоторым пределом. Этот предел у нас в свое время (1935 г.) был установлен следующим образом.
Были изучены методом взрыва свободно подвешенных зарядов в эвакуированной бомбе применявшиеся в то время ВВ, имевшие положительный или близкий к нулю кислородный баланс. В этих условиях они образуют небольшое
3. Экспериментальные методы определения состава продуктов взрыва 405
количество окиси углерода и очень мало окиси азота, в общей сложности в условном пересчете не более 50 л на 1 кг ВВ. Это число и было принято за норму *.
В дальнейшем эту норму использовали не только для оценки пригодности вновь разрабатываемых ВВ, но и при проектировании вентиляции шахт, так как не было известно, что состав продуктов взрыва может сильно зависеть от условий, в которых он происходит. Когда же были определены непосредственно в рудниках количества ядовитых газов, образующихся при взрывных работах, то выяснилось, что в забое таких газов, особенно окнслов азота, получается во много раз больше, чем в бомбе при взрыве свободно подвешенного заряда. Так, 62%-ный желатин-динамит, образующий в бомбе только следы окнслов азота, в шахте давал их 5 л на 1 кг ВВ; еще больше образовывалось окнслов азота при взрыве аммонита № 2 (12"/о тротила и 88”/о аммиачной селитры).
Последующие опыты, проведенные вначале в Макеевском научно-исследовательском институте главным образом с аммонитами, показали, что большие количества ядовитых газов могут быть получены также при взрыве в бомбе, если заряд окружить тонко измельченной нлн легко дробимой взрывом средой (кварцевый песок, уголь, руды, различные горные породы). Этн исследования показали, что вопреки распространенному в то время мнению положительный или нулевой кислородный баланс ВВ не является достаточным условием, чтобы в продуктах взрыва не содержалось окиси углерода.
Основным фактором, определяющим количество окнслов азота и окиси углерода, образующихся при взрыве аммонитов, является их детонационная способность. Эта способность обусловлена, с одной стороны, составом: чем больше содержит аммонит наиболее взрывчатого компонента и чем больше детонационная способность последнего-, тем меньше при прочих равных условиях образуется ядовитых газов. С другой стороны, детонационная способность связана со степенью измельчения и зависит от тщательности смешения компонентов. Чем тоньше они измельчены и чем лучше смешаны, тем выше детонационная способность и тем меньше образуется ядовитых газов.
Наконец, как показывает опыт, на образование ядовитых газов можно влиять, вводя в состав аммонита соли (например, KNO3, КС!, NaCl и т. п.), каталитически ускоряющие взаимодействие между компонентами ВВ и промежуточными продуктами их превращения.
Все эти закономерности можно объяснить исходя из следующего представления о процессе взрыва порошкообразных смесей.
Распространение химической реакции в этом случае происходит струйчатым (проникновение газообразных продуктов превращения в зазоры между частицами ВВ) или пузырьковым (сжатие газовых включений) путем. Горячие газы охватывают и воспламеняют частицы компонентов ВВ, вызывая их газификацию. Продукты газификации вступают между собой в последующие реакции. Промежуточными продуктами этих реакций в случае аммонитов являются, в ча
* Следует отметить, что эта норма является довольно жесткой. Для сравнения можно указать, что в США, например, лучшие по этому показателю предохранительные ВВ (так называемого I класса) могут образовывать до 78 л ядовитых газов на 1 кг. ВВ II класса, также допускаемые в шахты, могут образовывать до 156 л ядовитых газов на 1 кг.
406
Гл. VII. Направление реакций взрывного превращения
стности, окись азота и окись углерода. Чем меньше частицы, особенно частицы наиболее активного компонента, тем быстрее происходит их сгорание. Скорость горения частиц зависит также от давления, под которым оно1 идет. Наряду с этим играет роль теплота взрыва, определяющая температуру газов, в атмосфере которых происходит сгорание частиц. Катализаторы ускоряют взаимодействие между промежуточными продуктами превращения.
Совокупность этих влияний определяет, насколько успевают приблизиться к химическому равновесию продукты взрыва до того, как контакт с инертной средой и охлаждение при расширении затормозят дальнейшее развитие реакций.
Этн соображения могут -быть иллюстрированы следующими экспериментальными данными из опубликованных работ. На примере двухкомпонентных (тротил—аммиачная селитра) и трехкомпонентных (тротил—древесная мука—аммиачная селитра) аммонитов было изучено ' влияние состава аммонита, степени измельчения компонентов и введения в состав аммонита некоторых солей на образование окнси азота и окнси углерода при взрыве. Результаты этих опытов сведены в табл. 7. 4.
Увеличение содержания тротила, как показывают данные табл. 7. 4, сильно уменьшает количество образующейся окиси азота. Аммонит с 25% тротила образует при взрыве в 10 раз меньше окислов азота, чем аммонит с 12% тротила. Количество окиси углерода при увеличении содержания тротила возрастает всего лишь в 2 раза. Следует обратить внимание на то, что не только аммонит 75/25, имеющий отрицательный кислородный баланс, но и аммонит 88/12, содержащий избыток кислорода, образуют окнсь углерода в продуктах взрыва. Снижения количества окислов азота, образующихся при взрыве аммонита 88/12, можно достигнуть не только увеличением содержания тротила, но и введением древесной муки взамен части селитры. Теплота взрыва, а следовательно, и температура газов яри этом повышаются. Повышение же температуры ускоряет горение частиц, и они успевают в большей степени догореть до того, как будут разбросаны. Содержание окнси азота в продуктах взрыва может быть снижено также введением в состав аммонита калиевой селитры и некоторых других солей. Действие этих солей, по-видимому, определяется их каталитическим влиянием на горение разлетающихся частиц ВВ. Несмотря на некоторое снижение теплоты взрыва при добавлении калиевой селитры к аммониту с положительным кислородным балансом, полнота прохождения реакций увеличивается н количество окиси азота снижается. Влияние калиевой селитры проявляется, однако, в разной степени в зависимости от количества окружающего заряд инертного материала (ср. опыты № 7 н 8 табл. 7.4).
На образование окнслов азота сильное влияние оказывает также степень измельчения компонентов, определяющая суммарную поверхность н время сгорания. Увеличение степени измельчения тротила и аммиачной селитры в тройном аммоните (тротил—селитра—древесная мука) приводит к резкому уменьшению образования окиси азота. Опыты, в которых тонко измельчен был лишь одни из двух основных компонентов тройной смеси, показали, что измельчение тротила имеет большее влияние на образование окиси азота, чем измельчение селитры. По-внднмому, сгорание частиц тротила, имеющего большую калорийность (а следовательно, н температуру горения), сильнее стимулирует сгорание частиц аммиачной селитры, чем наоборот.
Использование рассмотренных закономерностей при построении состава аммонитов и технологии их изготовления не только приводит к резкому снижению количества ядовитых газов, образующихся при взрывных работах, но одновременно значительно усиливает дейст-
J 4. Объем продуктов взрыва
407
Таблица 7. 4
Влияние состава аммонита и степени измельчения его компонентов на образование окиси азота и окиси углерода при взрыве заряда в оболочке из кварцевого песка
№ Состав аммонита в % « я Количество газов л]кг
опыта аммнач- древес- калне- о ~ О. С5 о о сч о г Примечание
тротил ная ная вая ч СО
селитра мука селитра X Я о Z
1 12 88 — + 8,7 29 35
2 15 85 — — +5,9 19 35
3 21,3 78,7 — 0 8 48 Количество
4 25 75 — — -3,5 2,4 68 песка 230 г
5 12 84 4 — + 2,5 19 36
6 15 81 4 -0,3 10 48
7 12 73 — 15 + 11,6 0,1 15 Количество песка 1000 г
8 12 73 — 15 27 6 Количество песка 200 г
9 15(Я» 16)* 81(№ 16) 4(Ks 16) — 10 48
10 15(№49) 81(№ 49) 4(№ 16) — -0,3 0,15 40
11 15(№ 73) 81(№ 73) 4(№ 16) — 0 40
Количество
12 15(№ 16) 81(№ 16) 4(№ 16) — i 10 48 песка 230 г
13 I5(Ks 16) 81 (№ 49) 4(№ 16) — —0,3 | 7 . 42
14 15(№ 49) 81(№ 16) 4(№ 16) — 4 40
15 ] 15(№ 49) 81(№ 49) 4(№ 16) 0,15 40
* В скобках указан номер сита (число отверстий на 1 см), до прохождения через которое измельчен данный компонент.
вне взрыва; вследствие увеличения полноты протекания реакций
повышается эффективная теплота взрыва —- главный фактор, определяющий его работоспособность.
§ 4. ОБЪЕМ ПРОДУКТОВ ВЗРЫВА
Как уже отмечалось, газообразные продукты взрыва являются тем непосредственным агентом, при помощи которого выделяющаяся энергия превращается в работу. Наряду с этим знание объема и
408
Гл. VII. Направление реакций взрывного превращения
состава газообразных продуктов взрыва позволяет рассчитать ту максимальную температуру, которая модеет быть при нем достигнута.
Если известно уравнение химического превращения при взрыве, то расчет объема Ео продуктов взрыва, образуемых 1 кг ВВ при нормальных условиях, производят, пользуясь законом Авогадро. Воду при этом рассматривают как газ, твердые продукты, естественно, не учитывают, так как объем их пренебрежимо мал по сравнению с объемом газов.
Например, для амматола 80/20 уравнение химического превращения при взрыве
11,35NH4NO3 + С7Н5 (NO2)3= 7СО2 + 25,2Н2О +
+ 12,85N2 + 0,425O2 и
,, (7 + 25,2+ 12,85 + 0,425)22,4-1000 __я„й .
V л *----------------------------- — ОУО
° 227 + 11,35-80
В скобках стоит сумма чисел молей образовавшихся газов, а в знаменателе — вес веществ, стоящих в левой части уравнения, в граммах.
В общем виде для уравнения взрыва
+ /п2ТИ2+ . . . \-mkMk = nlNl-\-n2Ni+ . . . -\-npNp
объем газов Ео может быть выражен следующей формулой;
1/ _ ("i + "2+- • +Пр)22,4-1000 v А у • у
j-Л'Тj —/ПрЛЯу ’ • 4“
где Л11, Л12 . .. А2 и т. д. —- молекулярные веса соответствующих компонентов ВВ и продуктов взрыва, а т.2, п1у п2 и т. д.— числа молей соединений, входящих в состав взрывчатого вещества, и газообразных продуктов взрыва.
Для ВВ, продукты взрыва которых не содержат твердых вешеств, Ео обратно пропорционально среднему молекулярному весу газов, образовавшихся при взрыве. Чем меньше поэтому молекулярный вес газообразных продуктов взрыва, тем больше Ео, Самым легким из газов, образующихся при взрыве органических ВВ, является водород, самым тяжелым — угольный ангидрид. Если бы продукты взрыва целиком состояли из водорода, то Ео было бы равно И 130 л/кг; если бы они состояли только из угольного ангидрида, то Ео было бы равно 506 л/кг. Относительно большой объем газов образуют ВВ, содержащие много водорода, даже и в том случае, если он при взрыве окисляется до воды. Образование при взрыве твердых продуктов снижает Ео, поэтому для органических ВВ с сильно отрицательным кислородным балансом уменьшение плотности вс-
$ 4. Объем продуктов взрыва
409*
щества приводит к увеличению объема газообразных продуктов взрыва за счет смещения равновесия реакции
СО'^/гСОг + '/гС
влево, связанного с увеличением объема.
В табл. 7.5 приведены по опытным данным Апина и Беляева значения объема газобразных продуктов взрыва (при воде газообразной) для некоторых ВВ, а также отношения СО/СОг.
Таблица 7. 5
Объем газообразных продуктов взрыва некоторых ВВ (по Апину и Беляеву)
ВВ ? г) см3 Vo л’кг со/со..
Тротил 1,5 750 3,2
0,85 870 7,0
Г ексоген 1,5 890 1,68
0,95 950 1,75
1,68 800 2,4
1 ротил/гексоген (50/50) 0,9 900 6,7
1,5 750 2,1
Пикриновая кислота 1,0 780 4,0
Тетрил 1,55 740 3,3
1,0 840 8,3
Тэн 1,65 790 0,5—0,6
0,85 790
Нитроглицерин 1,6 690 —
1,3 890
Амматол 80/20 0,9 880 —’
Гремучая ртуть 3,77 300* —
* Для ртути в парообразном состоянии.
Глава VIII
ТЕПЛОТА, ТЕМПЕРАТУРА И ДАВЛЕНИЕ ВЗРЫВА
Механическую работу взрыва производят расширяющиеся газообразные продукты взрывного превращения, нагретые до высокой температуры за счет теплоты, выделившейся при этом превращении. Величина теплоты взрыва (а также объема образовавшихся газов) позволяет оценить возможную работоспособность (фугасное действие, см. стр. 445) ВВ. Знание теплоты взрыва с учетом плотности ВВ и скорости детонации позволяет в конечном итоге судить также о разрушающем действии взрыва на среду в непосредственной близости от заряда (так называемое бризантное действие, см. стр. 454). Для количественной характеристики метательного, дробящего, теплового и других видов действия продуктов взрывного превращения необходимо знать теплоту взрыва, температуру и давление его продуктов. Эти величины, как мы увидим, связаны между собой, и для расчетного определения последних двух необходимо знать теплоту взрыва. Дальнейшее изложение мы и начнем с методов определения теплоты взрыва.
§ 1. МЕТОДЫ ОПРЕДЕЛЕНИЯ ТЕПЛОТЫ ВЗРЫВНОГО ПРЕВРАЩЕНИЯ
Теплотой взрыва называют количество тепловой энергии, выделяющейся при взрывном превращении (горении или детонации) определенной массы ВВ. В технике за единицу массы при расчетах теплоты взрыва принимают 1 кг.
Для определения теплоты взрыва применяются два метода: расчетный и экспериментальный.
1. Расчет теплоты взрыва
Теплоту взрыва рассчитывают на основе закона Гесса. Этот закон, как известно, гласит, что тепловой эффект химического превращения системы зависит только от начального и конечного ее состояния и не зависит от промежуточных состояний, т. е. от пути перехода, В применении к термохимии ВВ мы можем закон Гесса записать в виде соотношения:
Qi—aH-Qs-a — Qi-з*
(8.1)
$ 1. Методы определения теплоты взрывного превращения
411
Индексы 1, 2 и 3 обозначают соответственно три состояния — начальное (1), промежуточное (2) и конечное (3;; Qj-a — есть теплота, выделяющаяся или поглощающаяся при переходе из состояния 1 в состояние 2; Q2-3 — теплота перехода от состояния 2 к состоянию 3 и Qi-з — теплота перехода из состояния 1 непосредственно в состояние 3,
В зависимости от того, какие термохимические характеристики ВВ (теплота образования, теплота сгорания, теплота взрывного превращения, тепловой эффект реакции получения ВВ и др.) известны, а какие требуется рассчитать, возможны три основные варианта расчетов.
Одним из них является расчет теплоты взрыва, причем исходными данными служат теплота образования BE и уравнение взрыва.
Для этого1 случая примем следующие обозначения б уравнении (8.1):
Состояние 1 — элементы в стандартных условиях *.
Состояние 2 — ВВ при стандартных условиях.
Состояние 3 — продукты взрыва при тех же условиях.
Тогда Qi-з — теплота образования взрывчатого вещества из элементов;
Q2-3 — теплота взрыва;
Qi-з — теплота образования продуктов взрыва из элементов.
Из уравнения (8. 1)
Q2-3=Qi—з— Qi-2.
Теплоты образования основных взрывчатых соединений, компонентов взрывчатых смесей и продуктов взрыва приведены в табл. 8. 1 и более подробно — в Приложении 5.
В качестве примера рассчитаем теплоту взрыва амматола 80/20, уравнение взрыва которого имеет вид
11,35NH4NO3 + С7Н5 (NO2)3 = 7СО2 4- 25,2H3G + 12,85N2 + 0,125Ог.
Теплота образования из элементов веществ, стоящих в левой части уравнения (см. табл. 8. 1), составляет
Рг_2 = 11,35-87,36Ч- 17,5 = 1009,04 ккал,
где 87,36 ккал/мол — теплота образования аммиачной селитры;
17,5 ккал/мол— теплота образования тротила.
* Стандартными для расчета термохимических величин разные авторы считают различные условия. Обычно стандартное давление 1 ата, а стандартную температуру принимают О’, 18° (как принято и в данной книге) или 25° С. Теплоту образования элементов в стандартных условиях принимают равной нулю.
412
Гл. VIII. Теплота, температура и давление взрыва
Таблица 8. 1
Теплоты образования некоторых ВВ и продуктов взрыва
Вещество Теплота образования в ккал 1 мол при 18° С и постоянном давлении
Тринитротолуол 17,5
Нитроклетчатка (12,00% N)* 683,3
Нитроглицерин 88,63
Днгликольдннитрат 104,2
Тэн 129,37
Гексоген —15,64
Диннтронафталин (1,5) —3,6
Аммиачная селитра 87,36
* В ккал{кг.
Вещество Теплота образования в ккал\мол при 18° С и постоянном давлении
Клетчатка 230,3
Вода (газ) 57,78
Вода -(жидкая) 68,37
Двуокись углерода 94,51
Окись углерода 26,88
Окись азота —21,6
Метан 18,3
Окись алюминия 399
Теплота образования продуктов взрыва из элементов
Qi-з = 7-94,51 + 25,2-57,78 = 2117,64 ккал,
где 94,51 н 57,78 — соответственно теплоты образования 1 г-мол углекислоты и газообразной воды из элементов;
О., о = 0, з — О, 9 = 2117,64— 1009,04= 1108,60 ккал.
Полученная величина представляет собой теплоту взрыва при постоянном давлении, т. е. при таком объеме газообразных продуктов взрыва, который они занимают при стандартных условиях (18°С и 760 мм рт. ст.). Эту величину обозначают Qp. Если реакция взрывного превращения, как это практически имеет место, например, при детонации, успевает завершиться до того, как продукты ее существенно расширятся, то считают, что реакция происходит без изменения объема, т. е. продукты взрыва по окончании реакции занимают тот объем, который имело исходное ВВ. Теплоту реакции при постоянном объеме обозначают Q,.. Нетрудно видеть, что Qp<Qf, так как в последнем случае не затрачивается часть энергии на работу расширения газов от объема ВВ до объема, соответствующего атмосферному давлению и данной температуре (18°С), т. е. до 23,9 л на каждый моль газов.
Чтобы перейти от теплоты взрыва при постоянном давлении к теплоте взрыва при постоянном объеме, мы должны прибавить к Qp величину q=0,58Az, где Л7 — число молей газообразных продук
$ 1. Методы определения теплоты взрывного превращения
413
тов взрыва (вода принимается за газ). Множитель 0,58 представляет собой выраженную в ккал работу расширения при постоянном давлении, равном 1 ат, одного моля газов от первоначального объема (принимаемого равным нулю) до объема, занимаемого газом при 18° С и давлении 760 мм рт. ст. *.
В нашем примере
7 = 0,58 (7+25,2+12,85+ 0,425) =26,38 ккал.
Соответственно
Qv=QT,+ q= 1108,60+ 26,38 = 1134,98 ккал.
Полученная теплота взрыва относится к количеству смеси, выражаемому написанным выше уравнением. Теплота взрыва на 1 кг ВВ при постоянном объеме составляет
~ 1134,98-1000 ,
Q„ — -----——«1000 ккал кг.
° 11,35-80-1-227 '
В случае взрывчатых смесей с положительным или слабо отрицательным кислородным балансом, при взрыве которых не выделяется элементарного углерода, приближенный расчет теплоты взрыьа может быть произведен по теплотам сгорания ** органических компонентов и теплотам превращения в конечные продукты, образующиеся при взрыве, минеральных солей, входящих в состав ВВ. Так, например, для нитроглицерина, тротила, аммиачной селитры, натровой селитры и клетчатки уравнения полного сгорания или превращения могут быть написаны соответственно следующим образом;
С3Н5 (NO3)3 = ЗСО2 + 2 -уН2О+1 -yN2 + -у О2;
С7Н5 (NO2)3 + 5 — О2 = 7СО2 + 2 -у- Н2О + 1 N2;
NH4NO3 = N2 + 2Н2О + О2;
3
2NaNO3 + СО2 = N2 + Na2CO3 + -у О2;
С6Н10О5 + 6OS -- 6СО2 + 5Н2О.
Для каждого из этих уравнений легко подсчитать количество выделяющегося или поглощающегося тепла, а также число молен каждого из продуктов реакции на килограмм соединения. Тепловой эффект вычисляют при постоянном объеме, считая, что вода образуется в жидком состоянии. Кислород или углекислота, необходимые для завершения реакции окисления горючего нлн превраще-
* q~p0Vt~— Л'', где р0— давление в кг{м2, 27—объем 1 моля газов при Е
температуре t° С в м5, а 1/5= 1/427—механический эквивалент теплоты
10333-0,02241-291
273-427 '
** Напомнила, что теплотой сгорания называют количество тепловой энергии, выделяющейся при реакции горения единицы массы вещества в кислороде, с образованием продуктов полного окисления (СО2, Н«О н т. д.)_
414
Гл. VIII. Теплота, температура и давление взрыва
ння нитрата металла в карбонат, естественно, выражаются отрицательными величинами, Они позволяют для смеси рассчитать теплоту взрыва и состав его продуктов простым суммированием:
Q = 2>,Q,; (8.2)
Г
pN — S wrPr, (8. 2а)
Г
где wr —процентное содержание (по весу) компонента г в составе ВВ, Qr и Р г —-константы для этого компонента, а Руу —содержание вещества в продуктах взрыва. Значения величин Qr и Р г приведены для типичных компонентов промышленных ВВ в табл. 8. 2.
Таблица 8. 2
Теплота и состав продуктов полного сгорания или распада некоторых компонентов взрывчатых смесей
Вещество нлн реакция Теплота полного сгорания Qr ккал 1кг (Н2ОЖ, u=const) Рг для продуктов в мол}кг
СО2 Н2О N, ! Прочие 2 । вещества
а. Неорганические окислители
Нитрат аммония 628 — 25,0 12,5 6,25 —
Нитрат барня (выше 1300° С) —389 — — 3,82 9,56 3,82ВаО
Нитрат барня (ниже 900° С) — 151 —3,82 3,82 9,56 3,82ВаСО3
Перхлорат калия +13 — — — 14,43 7.21КС1
Нитрат калня —268 — 4,94 — 4,94 12,36 4,94К2СО3
Нитрат натрия —267 —5,88 — 5,88 14,7 5,88Na2CO3
б. Органические соединения
Клетчатка 4 185 37,0 30,9 — —37,0
2,4-Днннтротолуол 4 660 38,5 16,5 5,5 -35,7
Манильская бумага 4 254 30,1 33,4 — —32,3 SiO2 1,8
Мононитротолуол (мета) 6 490 51,1 25,6 3,7 -56,6
Нитроклетчатка (12% N) 2 477 22,8 14,7 4,3 —12,1
Нитроглицерин 1 623 13,2 11,0 6,6 + 1,1
Ннтроглнколь 1 764 13,2 13,2 6,6
Парафин 11 120 70,5 74,1 — -107,5
Тротил 3 596 30,8 11,0 6,6 —23,1
Древесная мука 4 762 39,7 35,4 — -43,2
$ 1. Методы определения теплоты взрывного превращения
415
Продолжение
Вещество или реакция Теплота полного сгорания Qr ккал)кг (Н-,ОЖ, t-’=const) Рт для продуктов в мол\кг
со2 н2о n2 О-> ' Прочие вещества
в. Другие компо н е н т ы
2NaHCO3-> Na,CO3+ + Н2О+СО2" — 117 5,95 5,95 — 5,95Na2CO3
ВаСО3-> ВаО+СО2 —321 5,07 — — — 5,07ВаО
СаСО3-> СаО+СО2 —420 10,0 — — — Ю,0СаО
Na2B4O7 • ЮН2О-— Na2B4O7-f-10H2O —94 — 26,2 — — 2,62Na2B4Or
4Al-f-3Oj-»2Al2O3 7382 — — — —27,8 18,5А12О3
Для ВВ с нулевым илн положительным кислородным балансом полученный результат —• теплота полного сгорания — непосредственно равен теплоте взрыва. Для ВВ с отрицательным кислородным балансом в полученную теплоту полного сгорания необходимо внести поправку на неполноту окисления органических веществ. Теплоты окисления окиси углерода в углекислоту н водорода в воду (жидкую) при постоянном объеме и 0° С приближенно равны между собой (соответственно 67,3 и 67,5 ккал). Поэтому на каждый моль недостающего кислорода теплота взрыва оказывается приблизительно на 135 ккал меньше, чем теплота полного сгорания. Для ВВ с отрицательным кислородным балансом
2 135*1000 VI
WrQr + ' 100-32" й = i WrQr + 42,2й’ (8'2б>
где а — кислородный баланс в г на 100 г ВВ.
Изложенный метод позволяет получить в хорошем приближении теплоту взрыва наиболее простым путем. В связи с этим и рассчитывается теплота реакции с образованием жидкой воды Сг>(Н2Ож)- В действительности вода в момент взрыва будет, естественно, находиться в газообразном состоянии. Значение теплоты взрыва при образовании газообразной воды Qt,(H2or) получают вычитанием из Qj,(h2o ) теплоты испарения воды:
<?v(H2Or)= ^(Н2ОЖ) — 10>0!п' (8.3)
где п — число молей образовавшейся воды.
Проведем рассмотренным способом расчет для амматола 80/20. Теплоты полного сгорания аммиачной селитры и тротила в ккал/кг при постоянном объеме и воде жидкой составляют соответственно’ 628 и 3596 ккал/кг. Теплота взрыва на 1 кг амматола
80-628 20
Q m о ч=--------- 4- —3596 — 1222 ккал/кг.
х»<н=°ж) 100 100
416
Гл. VIII. Теплота, температура и давление взрыва
Число молей воды на 1 кг ВВ согласно табл. 8. 2 равно
п —
80-25 20-11
100 "Г 100
20 4-2,2 = 22,2.
После подстановки
) = 1222— 10,01-22,2= 1000 ккал/кг.
2. Расчет теплоты горения бездымных порохов
На том же принципе — аддитивности теплот химического превращения — основан способ расчета теплоты горения нитроглицериновых бездымных порохов, широко применяемый в пороходелии. Расчет исходит из допущения, что теплота горения пороха может •быть выражена как сумма произведений содержаний отдельных компонентов в порохе на термохимические константы, характеризующие каждый из этих компонентов:
k
+ . 4-otA = SwP- (8-4)
i
В выражении (8.4) -теплота горения пороха в ккал/кг при постоянном объеме и воде жидкой; mlt m2 и т. д.— содержания компонентов в %, a pi, р2 и т. д. — их термохимические константы.
Допущенью об аддитивности теплот горения справедливо при двух условиях:
1) если состав продуктов горения определяется только равновесием реакции водяного газа, т. е. продукты горения не содержат свободного кислорода или углерода;
2) если теплоту горения пороха рассчитывают при воде жидкой.
Тепловой эффект образования одного моля воды по реакции водяного газа отрицателен, а по абсолютной величине почти в точности равен теплоте конденсации одного моля водяного пара. Поэтому изменение теплового эффекта при смещении равновесия в ту или другую сторону компенсируется изменением суммарной теплоты конденсации водяного пара, число молей которого соответственно меняется. Иначе говоря, тепловой эффект горения пороха, рассчитанный для воды жидкой, является величиной постоянной, не зависящей от температуры, достигнутой при горении.
При выполнении указанных выше условий термохимическая константа каждого из компонентов пороха может быть рассчитана как теплота его превращения в СО, Н2О, Н2 и СОг- Если компонент содержит избыток кислорода, то- необходимый углерод и водород черпаются из других компонентов, причем взаимодействие кислорода с ними дает соответствующее количество тепла. Если компонент содержит избыток углерода, то необходимое для его окисления количество кислорода заимствуется из углекислого газа, получающегося
£ 1. Методы определения теплоты взрывного превращения
417
при горении других компонентов. Превращение углерода за счет кислорода углекислоты в окись углерода сопровождается соответствующим поглощением тепла.
Таким образом, для расчета р получаем следующее выражение: о__ПП1 (94’51 [СО2]4-26,88[СО]4-68,37[Н2О] —Qo6p
м
135,26 [Og] — 40,75 [С] + 0,58п) 1000 М
(8-5)
где [СОг], [СО], 1НгО], [Ог], [С] — количества молей соответствующих продуктов, образующихся при сгорании одного моля данного вещества за счет собственного кислорода;
Qoip — теплота образования вещества в ккал!мол при постоянном давлении и воде жидкой;
М — молекулярный вес вещества;
135,26 — теплота превращения моля кислорода в СОг за счет окисления СО (а приближенно и водорода);
40,75 — теплота окисления грамм-атома углерода в СО за счет кислорода СОг;
94,51, 26,88 и 68,37 — теплоты образования при постоянном давлении СОг, СО и НгО соответственно;
п— число молей газов (без воды и без кислорода), образуемых веществом при разложении и при последующем взаимодействии углерода с СО2; произведение 0,58п представляет собой разность между теплотой превращения при постоянном давлении и постоянном объеме;
множитель 0,01 означает, что расчет ведется для 0,01 кг вещества, т. е. для 1 % по отношению к 1 кг.
В качестве примера рассчитаем р для нитроглицерина и централнта.
Реакция распада нитроглицерина
C3HsN3O9 = ЗСО2 + 2,5 Н2О 4-1,5N2 + 0,25О2.
Согласно выражению (8.5) имеем:
(94,51-3 + 68,37-2,5 — 88,63 + 135,26-0,25 + 0,58-1,5)-1000
я 1—!-----'-------:----!---!------------------------= 17.7
Реакция разложения централнта
C17H20N2O = СО + 10Н2 + N2 + 16С;
, (26,88.1 -31,9 — 40,75.16 + 0,58.28) 1000
8 =0,01 155---------------тг2-----~------------- = — 23,9.
Р 268,35
Применение описанного метода расчета показало, что расчетные значения р не всегда дают правильную величину теплоты горения пороха, соответствующую результатам опытного определения. Это объясняют тем, что расчет р производится для химически чистых веществ, в то время как в технике применяют продукты, содержащие некоторое количество примесей. Поэтому при расчете теплоты горе
418
Гл. VIII. Теплота, температура и давление взрыва
ния пороха предпочитают пользоваться значениями р, определенными экспериментально для технических продуктов. Полученные таким образом значения р для ряда веществ приведены в табл. 8. 3.
Таблица 8.3
Значения термохимической константы р
Вещество Q Ропытн
Нитроглицерин 4-17,5
Днннтроднгликоль -1 10,5
Нитроклетчатка с содержанием азота №-4 1,3 N—6,7
Ннтрогуанндни +6,6
Днннтротолуол чистый —1,1
Днннтротолуол технический 0,0
Днннтроксилол (N=sl3,5%) -2,5
, (N=sl2,5%) -3,5
Диннтроаннзол 4-0,5
Днннтрофенетол —1,0
Тринитротолуол +5,5
Днннтроднметнл оксамид +8,7
Централнт № 1 (этиловый) —23,7
Централнт № 2 (метиловый) -22,9
Дифенил мочевина —20,5
Дифениламин -29,0
Диэтнлфталат —16,0
Днбутнлфталат —20,0
Диамнлфталат —19,5
Спирт этиловый —17,5
Ацетон —20,5
Камфора —28,0
Вазелиновое масло —31,9
Графит —30,0
Вода 0
В качестве примера рассчитаем теплоту горения пороха. Расчет оформим в виде таблички, в первом столбце которой приведен состав пороха (в °/о на сухое вещество), во втором — значения р для компонентов по табл. 8.3 и в третьем — произведения соответствующих величин из первых двух столбцов
Нитроклетчатка (N — 12,08%) 56
Нитроглицерин 36
Диамнлфталат 5
+ 9,0 + 17,5 —19,5
4-504 4-630 - 97,5
$ 1. Методы определения теплоты взрывного превращения 419
Централнт № 1 2 —23,7 — 47,4
Вазелиновое масло 0,7 —31,9 — 22,3
Графит 0,3 —30,0 — 9
958 ккал/кг
Если порох содержит 0,5% влаги (сверх 100%), то, учитывая, что р воды равно 0, окончательно получаем
958
' = T-Z77 = 953 ккал/кг.
1 ,vvO
Расчет теплоты горения по значениям (3 исходит из предположения, что химические реакции при горении доходят до равновесия. При этом не учитывается возможность диссоциации углекислого газа и водяного пара на свободный кислород, гидроксил и атомарный водород, а также возможность образования окиси азота. Не учтенные расчетом факторы получают тем большее значение, чем выше теплота горения пороха и чем ниже давление, при котором оно идет. Поэтому в условиях ствольного выстрела их значение невелико; при ракетном же выстреле оно мо,жет быть существенным.
3. Расчет теплоты образования взрывчатого вещества
Если известны из опыта теплота взрыва и состав продуктов взрыва, то теплоту образования ВВ можно- рассчитать следующим образом.
Сохраняя обозначения, принятые в 1-м варианте расчета (стр. 411), получаем по закону Гесса
Ql-2=«Ql-3 — Qs-3-
В качестве примера рассчитаем теплоту образования тэна. Теплота взрыва тэна равна (при постоянном объеме, вода жидкая) 1373,3 /скш/кг; уравнение взрыва для 1 кг ВВ имеет следующий вид:
3,162С (CH2ONO2)4=9,18СО2 + 6.64СО + Ю,97Н2О щ
+ 1,69Н2 +1,3NO + 0,36О2 + 5,67N2;
Qi-з — 9,18 • 94,51 + 6,64 • 27,17 + 10,97 • 67,50 -f-1,3 (-- 21,6) =
= 1760,4 ккал.
Теплота образования 1 кг тэна при постоянном объеме
Qi_2= 1760,4-1373,3 = 387,1 ккал.
Соответственно на 1 моль тэна теплота образования равна
387,1 ,оол
-----= 122,4 ккал.
420
Гл. VIII. Теплота, температура и давление взрыва
Теплота образования при постоянном давлении
Qp = 122,4 + 0,58 -12 =129,4 ккал,
где 12 — число молей газообразных элементов, необходимых для образования 1 моля тэна.
Во многих случаях расчет теплоты образования ВВ может быть упрощен, если вместо реакции взрыва пользоваться реакцией полного сгорания. В этом случае число соединений, входящих в состав продуктов превращения, значительно меньше, что облегчает количественный анализ последних и делает поэтому более надежным составленное на основании его результатов уравнение превращения.
Для расчетов принимаем следующие обозначения:
Состояние 1 —элементы.
Состояние 2 — взрывчатое вещество + кислород.
Состояние 3 — продукты полного сгорания.
Qi-2, Q2-3 и Qi-з — соответственно теплоты; образования ВВ, его сгорания и образования продуктов сгорания из элементов. По закону Гесса теплота образования
Ql-2=Ql-3—Q2-3.
В виде примера рассчитаем теплоту образования тротила, уравнение сгорания которого имеет следующий вид:
С,Н5 (МО2)з + 5,25О2 = 7СО2 + 2,5Н2О +1,5N2 4- 816,8 ккал
(при постоянном объеме, вода жидкая) ;
Q1_2== 7-94,51 4-2,5-67,50 —816,8 = 13,5 ккал!мол.
Теплоты сгорания ряда взрывчатых веществ приведены в Приложении 6.
Для нитросоеднненпй, теплота сгорания которых экспериментально не определена, ее можно приближенно рассчитать по методу Юнга, Кэйса и др. Они установили, что молярная теплота горения до углекислого газа, воды жидкой и азота линейно связана с числом атомов кислорода s, необходимым для горения (фиг. 8.1). Это справедливо для алканов (Qs,=52,48s+6, прямая А), для нормальных моноолефинов (Qt»=52,48s+20, прямая 5), для ацетиленовых углеводородов (Q г, = 52,48s4-43,3,прямая В), для аминов (Qv=51,8s, прямая Г), для соединений бензольного ряда (<+=52,4s, прямая Д). Аналогичное соотношение справедливо и для нитросоединеннй, если при расчете не принимать во внимание кислород, связанный с азотом в нитрогруппах. При этом Q»=50,3s, прямая Е.
Этот простой метод дает хорошее соответствие между экспериментальными и расчетными данными для нормальных нитроалканов и нитросоединений ароматического ряда. У соединений более сложной структуры, например циклотриметилентринитрамина и N-нитросукцинимида, наблюдаются большие расхождения. Точно так же сопоставление данных по соединениям с различным положением заместителя показывает, что ортопроизводные имеют большую теплоту горения, чем мета, а последние больше, чем пара, если только соединение не способно стабилизироваться путем образования водородной связи.
В качестве примера рассчитаем теплоту сгорания 2-4-6-тринитрофенола. Необходимое для горения число атомов кислорода s=12,5; Qv~50,3 • 12,5= =628,8 ккал/мол-, экспериментально определено QB=621,1 ккал! мол.
£ 1. Методы определения теплоты взрывного превращения
421
4. Расчет теплоты реакции получения взрывчатого вещества
Кроме теплоты образования ВВ и теплоты взрыва, важное значение для производства имеет тепловой эффект реакции получения взрывчатого вещества из исходных продуктов. Знание этой величины необходимо при тепловых расчетах аппаратов. Она может быть
Фиг. 8. 1. Зависимость молярной теплоты горения алканов (А), олефинов (Б), соединений бензольного ряда (Д)> ацетиленовых углеводородов (В), аминов (Г) и нитросоединений (£) от числа атомов кислорода, необходимого для горения.
рассчитана, если известны теплоты образования из элементов ВВ, сопутствующих ему продуктов реакции и исходных веществ.
Примем следующие обозначения:
Состояние 1 — элементы.
Состояние 2 — исходные вещества, вступающие в реакцию.
Состояние 3 — ВВ и другие продукты, образующиеся при реакции.
422
Гл. VIII. Теплота, температура и давление взрыва
Qi-2 при этих обозначениях будет теплота образования исходных веществ из элементов, Qi-з — теплота образования ВВ и других продуктов реакции из элементов, Q2~3 — тепловой эффект реакции получения ВВ. По закону Гесса
Q2-3—Q1-3— Q1-2 •
В качестве примера рассмотрим реакцию нитрации глицерина, выражаемую уравнением
С3НБ(ОН)3 + 3HNO3 = С3Н5 (ONO2)3 + ЗН2О + q2_3.
Q[_2 равна сумме теплот образования 1 моля глицерина и 3 молей азотной кислоты:
Q]._2 = 1-161,24-3-41,66 = 286,18 ккал.
Qi—з равна сумме теплот образования 1 моля нитроглицерина и 3 молен воды (жидкой):
Q[_3 = 1 -88,63 4- 3-68,37 — 293,74 ккал.
Теплота реакции 0?-3 =293,74—286,18—7,6 ккал на 1 моль глицерина. При практических расчетах не следует забывать, что выделяющаяся кода гидратирует кислоты нитрующей смеси со значительным тепловым эффектом, который в тепловом балансе процесса играет основную роль.
5. Экспериментальное определение теплоты взрыва
Теплоту взрыва можно определить опытным путем аналогично определению теплотворной способности горючих в калориметрической бомбе Бертло—Малера. В этом случае бомбу наполняют не кислородом, как обычно-, а азотом или же откачивают воздух и производят взрыв в вакууме. Повышение температуры воды в калориметре, умноженное на теплоемкость системы—бомба + вода + калориметрический сосуд, дает количество тепла, выделившегося при взрыве.
В бомбе Бертло—Малера для вторичных и метательных ВВ можно определить только теплоту горения; теплоту же взрыва определить в этой бомбе можно только для тех веществ, которые взрываются от накаленной проволочки, т. е. практически только для инициирующих ВВ и черного пороха. Использование капсюля-детонатора для возбуждения взрыва веществ, не детонирующих от простого нагревания, невозможно ввиду сравнительно малого объема бомбы и малой ее прочности, не допускающих применения больших зарядов.
Для непосредственного определения теплоты взрыва сконструированы бомбы больших размеров и прочности, позволяющие взрывать значительные заряды при помощи капсюля-детонатора или иным способом. Одной из таких конструкций является калориметрическая бомба, применяемая в английских лабораториях (фиг. 8.2). Емкость бомбы (124 с.и3) и большая ее прочность позволяют подрывать в ней заряды ВВ весом до 12,4 г. Инициирование можно про
$ 1. Методы определения теплоты взрывного превращения 423
изводить взрывом электролитического гремучего газа под давлением
2 ат, воспламеняемого в свою очередь накаленной проволокой. Бомбу помещают в калориметр и определяют повышение температуры.
Фиг. 8.2. Бомба для определения теплоты взрыва взрывчатых веществ.
После опыта определяют, кроме того, объем и состав продуктов взрыва.
Апин и Беляев применили для определения теплоты взрыва толстостенную бомбу (фиг. 8. 3) еще большего объема (4,75 л). В ней можно взрывать заряды значительного веса (до 50—100 г)
Фиг. 8.3. Бомба Апина и Беляева для определения теплоты взрыва взрывчатых веществ.
/—корпус бомбы, 2—втулка, 3—вентиль, 4—-отверстие для выпуска га* зов, 5—электроизолированный ввод. 5—медный уплотняющий конус.
/—корпус бомбы. 2—крышка. 3—заряд, 4—держалки для термометров. 5—вентиль для откачки и выпуска газов, б— деревянная подставка.
и притом в прочной оболочке, что приближает условия испытания к условиям практики. Другое отличие разработанной методики определения теплоты взрыва заключается в отказе от применения жидкостного калориметра; им служит сама бомба, причем температуру ее измеряют тремя термометрами, расположение которых видно'на фиг. 8.3, Бомбу калибруют как калориметр—сжиганием в ней определенной навески бензойной кислоты в атмосфере кисло
424
Гл. VIII. Теплота, температура и давление взрыва
рода. Через 30 мин. после сжигания тепловой эффект, рассчитанный по повышению температуры бомбы, составлял из-за теплопотерь в среднем 94% от теплоты сгорания. На этом основании при опытах с ВВ принимали, что повышение теплосодержания бомбы составляет также 94% теплоты взрыва. Общую ошибку определения авторы оценивают в 1—2%.
Значения теплоты, взрыва ряда ВВ, полученные таким методом при взрывах зарядов по 50 г в оболочке из свинца весом 0,5 кг, приведены в табл. 8. 4.
Таблица 8. 4
Теплота взрыва некоторых ВВ (по Апину и Беляеву)
ВВ t Плотность р г', см3 Теплота взрыва <?ин2о,) ккал'кг
Тротил 1,5 1010
0,85 810
Г ексоген 1,5 1290
0,95 1270
ТГ 50/50 (литой тротил-гексоген) 1,68 1140
То же 0,9 1030
Пикриновая кислота 1,5 980
То же 1,0 910
Тетрил 1,55 1090
То же 1,0 920
Тэн 1,65 1360
То же 0,85 1360
Нитроглицерин 1,6 1480
Тетраиитрометан-бензол (87, 5/12,5) 1,48 1650
Амматол 80/20 (80% аммиачная селитра, 20% тротил) 1,3 990
То же 0,9 980
Амматол 40/60 1,55 1000
Гремучая ртуть 3,77 410*
То же 1,25 380*
* Для ртути в парообразном состоянии.
Калориметрическая бомба, сконструированная Бихелем, имеет еще больший объем: 26 л. В ней можно производить при помощи
<J’ 2. Температура горения и взрыва
425
капсюля-детонатора детонацию зарядов ВВ значительного диаметра весом до 100 г; это в наибольшей степени приближает условия подрыва к практическим, особенно если помещать ВВ в прочную оболочку, замедляющую разлет продуктов. Воздух из бомбы перед опытом откачивают; она может быть также наполнена инертным газом. В остальном установка отличается от обычного калориметра лишь большими размерами. Методика определения также не имеет принципиальных отличий.
При оценке теплот взрыва, получаемых в калориметрических бомбах, необходимо' иметь в виду, что уравнение взрыва, а следовательно, и тепловой эффект его могут в сильной степени зависеть от условий, в которых происходит взрыв. Данные, полученные для свободно подвешенного заряда в калориметре, имеют лишь условное значение, так же как и данные, полученные при взрыве в оболочках, если не обеспечена «закалка» состава продуктов.
Аналогичные осложнения возникают при определении теплоты горения порохов в калориметрической бомбе, Даже в простейшем случае, когда состав продуктов горения определяется только равновесием реакции водяного газа, при охлаждении газов состав их меняется. «Закалка» равновесия зависит от скорости охлаждения, а последняя определяется рядом факторов — температурой, величиной внутренней поверхности и материалом бомбы, скоростью и температурой горения пороха, плотностью заряжания и др. О температуре «закалки» равновесия можно судить по составу газов. При. исследованиях в обычных условиях эта температура заключается между 1500 и 1650° С. Поскольку смещение равновесия при охлаждении идет с выделением тепла, то тепловой эффект, рассчитанный по реакции с образованием газообразной воды, зависит от того, при какой температуре наступила «закалка» равновесия.
Если рассчитывать теплоту сгорания при воде жидкой (так она и определяется при эксперименте), то, как было пояснено выше (см. стр. 416), величина ее не зависит от того, при какой температуре произошло «закаливание» равновесия реакции водяного газа. Именно по этой причине в пороходелии пользуются обычно для характеристики пороха теплотой сгорания при воде жидкой
§ 2. ТЕМПЕРАТУРА ГОРЕНИЯ И ВЗРЫВА
За счет тепла, выделяющегося при горении или взрыве, продукты их могут быть нагреты до некоторой температуры: эту температуру называют температурой горения (взрыва).
Знание температуры горения порохов существенно для расчета давления, развивающегося при выстреле в стволе или ракетной камере, для оценки возможности образования дульного пламени и для характеристики эрозионной способности пороховых газов. Темпера
-426
Гл, VIII. Теплота, температура и давление взрыва
тура взрыва является одним из основных параметров, определяющих опасность применения ВВ в угольных шахтах при наличии метано-воздушных или пыле-воздушных взрывчатых смесей. Наконец, по крайней мере в случае газовых смесей, знание температуры взрыва и состава газообразных продуктов его позволяет рассчитать скорость детонации.
Для определения температуры взрыва можно в принципе воспользоваться как опытным, так и расчетным методом. Опытное определение температуры взрыва, однако, сильно затрудняется двумя обстоятельствами: большими абсолютными значениями температуры (до 5000° С) и чрезвычайной ее кратковременностью. Первое •обстоятельство затрудняет выбор материала для измерительного прибора, тем более, что высокой температуре сопутствует при взрыве конденсированных ВВ чрезвычайно большое давление, к тому .же действующее в виде удара. В силу кратковременности существования максимальной температуры взрыва для ее измерения неприменимы обычные приборы, поскольку они обладают заметной тепловой инерцией. Поэтому основным методом определения температуры взрыва является пока расчетный.
1. Расчет температуры взрыва
Для расчета температуры взрыва применяли различные формулы. Так, Бунзен и Шишков в 1857 г. для расчета температуры взры-. ва черного пороха пользовались формулой
С
где Q — теплота взрыва, а с — теплоемкость продуктов взрыва, которую эти авторы считали постоянной. Позднее, когда стало ясно, что теплоемкость нельзя считать независимой от температуры, Мал-ляр и Ле Шателье приняли для температур выше 1000° С линейную зависимость теплоемкости от температуры
с—а + Ы,
тце с — средняя теплоемкость в интервале температур от 0° до t° С, а и b — коэффициенты, различные для разных газов.
В дальнейшем, по мере усовершенствования методики эксперимента и расчета, значения теплоемкостей и их зависимости от температур неоднократно пересматривали и уточняли. Сводка значений теплоемкости была опубликована Льюисом и Эльбе в 1951 г. Этими данными (см. Приложения 8 и 8а) мы и будем пользоваться для расчетов.
Поскольку в таблице Льюиса и Эльбе непосредственно приведены не теплоемкости, а изменения внутренней энергии газов в определенном интервале температур, расчет температуры взрыва целесообразно вести следующим образом.
$ 2. Температура горения и взрыва
427
Задаемся некоторым значением температуры взрыва. Подсчитываем изменение внутренней энергии всех продуктов взрыва при их нагревании от начальной температуры (291° К) до температуры взрыва, которой мы задались. Если полученная сумма совпадает с теплотой взрыва, то температура, для которой был проведен расчет, соответствует температуре взрыва. Если этого нет, то повторяем расчет, задаваясь соответственно измененным значением температуры.
Поясним сказанное на примере. Уравнение взрыва амматола 80/20 имеет, как указывалось выше, следующий вид:
11,35NH4NO3 + С7Н5 (NO2)3 = 7СО2 + 25,2Н2О -}-
4- 12,85N24-0,425O24-1135 ккаг.
Задаемся температурой взрыва 3200° К (2927° С). Изменение внутренней энергии ДЕ для продуктов взрыва от 291 до 3200° К составляет
СО2 = 33,998- 7 =237,99
Н2О = 26,655-25,2 = 671,70
N2= 18,217-12,85 = 234,09
О2 = 19,632-0,425 = 8,34
1152,1.
Поскольку значение ДЕ получилось больше, чем теплота взрыва, необходимо задаться меньшей, ближайшей по таблице, температурой (3000° К). Изменение внутренней энергии от 291° до этой температуры составляет
СО2 = 31,382- 7 = 219,67
Н2О = 24,466-25,2 =616,54
N2= 16,839-12,85 =216,38
02=18,112-о,425= 7,70
1060,3.
Изменение внутренней энергии при изменении температуры на 200° составляет 1152,1—1060,3=91,8 ккал. Разность внутренней энергии ДЕ при 3200°К и теплоты взрыва составляет 1152—1135=17 ккал. Считая приближенно, что при малых изменениях температуры ДЕ прямо пропорционально Д7, найдем, что
этой разности соответствует разность
17 температур 200^~^“37°. Таким образом,
температура составит 3200°—37°=3163° К, или 2890° С.
При расчете температуры взрыва ею приходится задаваться. Для предварительной оценки можно использовать то обстоятельство, что у ВВ разных типов температура взрыва связана с теплотой взрыва (при постоянном объеме и воде жидкой) приближенно линейным соотношением (табл. 8.5).
Если среди продуктов взрыва встречаются твердые при обычной температуре вещества, то их внутреннюю энергию берут по таблице Приложения 9, учитывающей теплоту плавления и испарения, если температура достаточно высока. Выше критической температуры
428
Гл. VIII. Теплота, температура и давление взрыва
Таблица 8.5
Формулы для приближенного расчета температуры взрыва (Q при постоянном объеме и воде жидкой в ккал1кг)
Тип взрывчатого вещества
Приближенная температура взрыва °C
Нитроглицериновые непредохранительные Нитроглицериновые предохранительные Тротиловые аммониты иепредохраннтельные Тротиловые аммониты предохранительные Баллнстнтные пороха
2.54Q+280 1,779+430 1,88(Н-560 1,740+470 2,104-697
теплоемкость пара принимают равной теплоемкости газа с тем же числом атомов в молекуле. Надежные данные по теплоемкостям, теплотам плавления и испарения твердых тел при высоких температурах имеются лишь для немногих веществ.
В табл. 8.6 приведены температуры взрыва некоторых ВВ, рассчитанные для уравнений взрыва, приведенных в гл. VII (стр. 403).
В заключение отметим, что расчеты температуры взрыва основаны на предположении, что теплоемкость продуктов взрыва не зависит от давления. Это предположение приближенно справедливо для умеренных давлений. Однако, как уже отмечалось в гл. IV, при тех чрезвычайно высоких давлениях, которые достигаются при детонации конденсированных ВВ большой плотности, значительная доля энергии взрыва представляет упругую часть энергии молекул высокоплотных продуктов взрыва. Тепловая часть энергии существенно меньше, чем для газов при умеренных давлениях, и температура соответственно ниже, чем ее значение, получаемое обычным расчетом.
Таблица 8. 6
Температура взрыва некоторых ВВ*
Взрывчатое вещество Температура взрыва °C
Тротил ЗОЮ
Пикриновая кислота 3410
Тетрил 3700
Нитроклетчатка (13,3% N) 3270
Тэн 4040
* Начальная температура ВВ принята равной 18° С, т. е. 291° К.
f 2. Температура горения и взрыва
429
2. Экспериментальное определение температуры взрывного превращения
Попытки измерить температуру горения порохов в манометрической бомбе при помощи термопары не дали надежных результатов. Для оценки этой температуры Нобль взрывал в манометрической бомбе пироксилин при большой плотности заряжания (0,28 г/см3). В заряде находилась маленькая связка осмиевой проволоки. После взрыва был снят слой металла с внутренних стенок бомбы, и в стружках был обнаружен осмий. По-видимому, при взрыве осмий частично превратился в пар, который под большим давлением диффундировал в сталь. Поскольку температура плавления осмия равна 2500° С, то Нобль полагал, что температура взрыва пироксилина была существенно выше 3200° С.
Сходный метод применял Мюраур. Для смеси аммиачной селитры и тротила он установил минимальное содержание последнего (7°/о), при котором получилось оплавление тонкой заостренной платиновой проволочки, помещенной в заряд. Для этой ,же смеси Мюраур определял давление взрывного горения и по величине давления, исходя из уравнения состояния, рассчитывал температуру газов. Сопоставляя температуру плавления платины (1750° С) и температуру, рассчитанную по давлению, с температурой, рассчитанной обычным путем, Мюраур пришел к выводу, что значения теплоемкостей Малляра и Ле Шателье слишком высоки, что и было подтверждено впоследствии другими исследователями.
А. Я. Апин и И. М. Воскобойников определили температуру детонации ряда взрывчатых веществ, используя цветовой оптический метод измерения температуры. Этот метод основан на том, что определяется распределение энергии по сплошному непрерывному спектру, характерному для детонации, или отношение яркостей при двух длинах волн (метод «красно-синего» сравнения).
Относительная спектральная яркость абсолютно черного тела Ьх т для длины волны X выражается формулой Планка
Ькт = Сх\-\ес^т-\)~\
где. Сх — 3,70 • 10~s эрг см2/сек;
С2—1,433 см-град.
В видимой части спектра при Г<6000°К и отношение
яркостей при двух длинах волн М и для данной температуры Т может быть выражено соотношением
1П -Ал = 5 in3?. 4- С2/Т ,
Т *1 *1*2
откуда *i —*з
т ~ *1*2_____
430
Гл. Vf/f. Теплота, температура и давление взрыва
Свечение взрыва цилиндрического заряда ВВ регистрировалось при помощи фотоумножителя, ток которого записывался на осциллографе. Перед фотоумножителем находилась система объектив—• щель, которая вырезала свечение ограниченного участка торца заряда, противолежащего тому торцу, с которого производилось инициирование. Взрывчатое вещество помещали или в плексигласовый стаканчик с прозрачным дном (в случае жидкостей), или в воду (в случае твердого ВВ), чтобы исключить свечение от сильной ударной волны в воздухе; по тем же соображениям ВВ применяли спрессованным до плотности, близкой к удельному весу. При помощи двух светофильтров вырезали определенные части спектра и определяли относительные яркости в соответствующих интервалах длин волн; по этим данным рассчитывали температуру во фронте детонации.
Измеренные температуры составляли (в °К) для гексогена (р = =1,80 г/см3) 3700°, для тэна (р = 1,77 г/см3) 4200°, для дины (р = = 1,70 г/см3) 3700°, для нитрометана (р—1,Г4 г/см3) 3700°, для метилнитрата (р = 1,21 г/см3) 4500°, для нитрогликоля (р—1,50 г/см3) 4400° и для нитроглицерина (р—1,60 г/см3) 4000°.
Сопоставляя данные, полученные для трех «жидких нитроэфиров, близких по теплоте взрыва, можно установить, что наиболее высокую температуру детонации имеет легкий (р = 1,21 г/см.3) метил-нитрат, а наименьшую — тяжелый (р—1,6 г/см3) нитроглицерин; это может быть связано' с тем, что при большей плотности больше давление детонации и большая часть энергии во фронте детонационной волны содержится в виде упругой энергии; соответственно меньше доля тепловой энергии и температура.
3, Выгорание ствола огнестрельного оружия при выстреле
С температурой горения тесно связано выгорание канала огнестрельного1 оружия. Потери металла, уносимого при выстреле нагретыми и сжатыми газами, весьма значительны. Так, по подсчетам Сиви, при выстреле из 28-сантиметровой пушки вместе с газами вылетает около V3 кг металла.
Выгорание обычно возникает в первую очередь на переходном конусе — части ствола, к которой снаряд примыкает ведущим пояском. Оно способствует тому, что конус и прилегающий к нему снаряд передвигаются все дальше к дулу и объем камеры сгорания увеличивается. Одновременно увеличивается диаметр канала ствола. Вследствие этого происходит понижение начальной скорости и уменьшение дальности стрельбы, а также увеличение рассеивания. Конечным результатом является сокращение баллистической жизни орудий. Некоторые мощные орудия вследствие выгорания теряют свои баллистические качества после нескольких сотен или даже десятков выстрелов.
$ 2. Температура горения и взрыва
431
Применение порохов с более низкой температурой горения приводит к уменьшению выгорания. Так, по Гальвицу, при переходе-от нитроглицеринового пороха с теплотой горения 950 ккал[кг к пороху с теплотой горения 820 ккал кг продолжительность жизни артиллерийских стволов увеличивается приблизительно в 1,5 раза, а при переходе от последнего к низкокалорийному (690 ккал/кг) дигликолевому пороху—• в 10 раз. Поэтому понижение температуры горения пороха изменением его состава или другими путями яв-
ляется основным средством увеличения срока жизни ствола орудий.
Основным фактором, обусловливающим выгорание, является согласно Д. К. Чернову температура, достигаемая при горении. Сильный и кратковременный разогрев поверхности канала ствола при многократном его повторении вызывает образование сетки трещин на ней, вследствие чего металл легко срывается движущимся снарядом и потоком газов. Повышение давления
Фиг. 8. 4. Эрозионная бомба.
/—пробка для воспламенения, 2—крешерная пробка, <3—пробка для цилиндрика испытуемого металла, 4—цилиндрик испытуемого металла с центральным каналом.
усиливает разогрев ствола газообразными продуктами горения п.
увеличивает вынос металла при выстреле.
На интенсивность разгара оказывает влияние также природа пороха. Нитроглицериновые пороха при равной калорийности дают-большее выгорание, чем пироксилиновые, что может быть, связано с различиями в составе промежуточных, а также конечных продуктов горения, вступающих во взаимодействие с металлом ствола.
В лаборатории исследование выгорания производят при помощи эрозионной бомбы (фиг. 8. 4). Эта бомба дополнительно к двум-пробкам обычной манометрической бомбы (см. стр. 442) имеет третью пробку, ввинчивающуюся в стенк'у. В этой пробке закрепляют металлический цилиндрик с узким центральным каналом, через который при опыте выходят нагретые газообразные продукты горения. Убыль в весе цилиндрика при опыте служит мерой выгорания. Прибор может быть применен как для характеристики эрозионной способности пороха, так и для характеристики устойчивости металла в отношении выгорания. Опыты показали, что величина выгорания существенно зависит от температуры горения. Так, максимальная потеря в весе цилиндрика наблюдалась при сжигании гремучего студня, нитроманнита и нитроглицериновых порохов обычного типа. Среднее место занимал пироксилиновый порох, и, наконец, минимальные потери веса цилиндрика дали черный порох и нитрогуани
432
Гл. VIII. Теплота, температура и давление взрыва
дин. В таком же порядке располагаются указанные взрывчатые вещества по убывающей температуре взрыва. Из различных металлов наименьшую потерю в весе цилиндрика дал наиболее тугоплавкий —• платина; максимальные потери показали легкоплавкие алюминий и цинк. Большую роль играет также возможность химического взаимодействия продуктов горения с металлом. Так, исследования К- К. Снитко показали, что гремучий газ при разбавлении стехиометрической смеси кислородом вызывает несравненно большее выгорание стали, чем если этот газ разбавить тем же объемным количеством водорода.
§ 3. ДАВЛЕНИЕ ВЗРЫВА
Необходимо различать два существенно отличные понятия: давление горения и давление детонации.
Давлением горения называют давление, создаваемое газообразными продуктами горения ВВ в частично или полностью замкнутой оболочке. Это давление равномерно действует по всем направлениям. Максимальное для данного ВВ и условий заряжания давление горения достигается тогда, когда последнее происходит в замкнутой оболочке и без потерь во вне.
Давление детонации — это направленный скачок давления во фронте детонационной волны. Величина скачка в пределе не зависит от наличия оболочки.
Представим себе два одинаковых открытых сосуда, наполненных наполовину •одним и тем же ВВ. Возбудим горение в первом сосуде соответствующим инициированием. Поскольку сосуд открыт, газообразные продукты горения будут удаляться и сосуд останется целым. Во втором сосуде возбудим детонацию ВВ. Та часть сосуда, которая находилась в непосредственном контакте с ВВ, будет мелко раздроблена, а верхняя часть, на которую не действовало непосредственно давление детонации, останется неповрежденной. При повторении опыта в замкнутых сосудах оба сосуда будут разорваны, но при горении дробление стенок будет равномерным в противоположность детонации, при которой сильнее будет раздроблена часть стенок сосуда, соприкасающаяся с ВВ.
Способ расчета давления детонации мы рассмотрели в гл. IV; методы его экспериментального определения тесно связаны с характеристикой разрушающего действия взрыва и рассматриваются в гл. IX. Здесь мы рассмотрим факторы, от которых зависит давление горения конденсированных ВВ и методы расчета и экспериментального его определения.
1. Давление горения
Давление горения в замкнутом объеме зависит от объема газообразных продуктов, образуемых ВВ, от их температуры г, от объема камеры, в которой заключен заряд, т. е. от плотности заряжания. Если камера целиком заполнена ВВ, то давление зависит от его гравиметрической плотности. Практически, ввиду сравнительной медленности процесса горения, давление связано также
$ 3. Давление взрыва
433
со скоростью горения: чем больше скорость, тем меньше время горения, а следовательно, и потери тепла теплопроводностью и излучением. При меньших теплопотерях выше температура газов и давление, ими развиваемое.
Чтобы приближенно оценить значение объема газов и температуры для давления горения, допустим, что продукты превращения подчиняются законам идеальных газов.
Из соотношения
Pjt'l _ РрУр
Тг То получаем
<8'6>
Здесь Vi —объем, занимаемый ВВ, v0— объем газообразных продуктов взрыва при нормальных условиях, То — 273° К и Л — температура, достигаемая при горении, р0— постоянная величина, равная 1,033 кг!см2.
Давление pi определяется произведением двух множителей: объемного множителя Цо/^i, представляющего изменение объема при взрыве, и теплового, или температурного, множителя T'i/7'o, характеризующего изменение температуры в результате химической реакции взрыва. В табл. 8. 7 приведены значения объемного и темпера-
Таблица 8. 7
Значения объемного и температурного множителей для некоторых взрывчатых веществ
Взрывчатое вещество л[кг Vo л\кг £о VI 71 °К 71 273 Произведение объемного и температурного множителей
Конденсированные В В Черный порох Гремучнй студень (92:8, трудно замерзающий) Амматол 80/20 Газообразные ВВ 2Н24-О2 2СО+О2 C2N2+O2 C2N2-F2N2O 0,59 0,65 0,95 1866 763,8 533,3 479,9 280 715 900 1244 509,2 800,0 799,8 470 1100 950 0,67 0,67 1,5 1,67 2650 5030 2890 От : 2700 до 4000 9,7 18,4 10,6 До 14,5 4 600 20 200 10100 От 9 до 25
434
Гл. VIII. Теплота, температура и давление взрыва
турного множителей для некоторых газообразных и конденсированных ВВ.
Из табл. 8. 7 видно, что значения температурного множителя для газов и твердых ВВ близки, объемный же множитель в последнем случае примерно в тысячу раз больше, чем для газов. Таким образом, давление газового взрыва по меньшей мере в тысячу раз ниже давления взрыва конденсированных ВВ; в соответствии с этим находится и разрушающее действие. Из этих соотношений следует также, что для увеличения действия газового взрыва до порядка величин, свойственных взрыву конденсированных ВВ, необходимо предварительное сжатие газа до давления приблизительно в 1000 ат. Применение для взрывных целей столь сильно сжатых газов в настоящее время еще не стало реальным.
Конденсированные ВВ, приведенные в табл. 8. 7, расположены в том порядке, в каком они в свое время были введены в практику взрывных работ. Мы видим, что развитие взрывчатых веществ ог черного пороха до аммонитов сопровождалось увеличением объемного множителя; одновременно с этим переход от динамитов к аммонитам означал некоторое снижение температурного множителя.
Абсолютные значения давления, достигаемого при взрыве в собственном объеме взрывчатых веществ, спрессованных до большой плотности, исключительно велики. Так. например, при взрыве гремучей ртути, если принять для него уравнение
Hg(ONC)2==Hg + 2CO + N2,
объем газообразных продуктов более чем в тысячу раз превышает начальный объем ВВ. Если представить себе, что продукты взрыва охлаждением до низкой температуры, например до —200° С, переведены в жидкое состояние, то и при этом они будут занимать объем больше, чем гремучая ртуть. Поэтому, чтобы довести жидкие продукты взрыва до первоначального объема ВВ, их необходимо сжать, что ввиду малой сжимаемости жидкостей потребует большого давления. Если учесть, кроме того, что при взрыве гремучей ртути газы имеют температуру нс —200° С, а около 4000° С, то можно представить себе, какое огромное давление они при этом будут производить. Расчет по уравнениям состояния реальных газов, обычно используемым для умеренно повышенных давлений, например по уравнению Ван-дер-Ваальса, дает давления, равные бесконечности при значительно меньших плотностях, чем реально применимые. По косвенным методам расчета давление горения теоретически может, как мы увидим ниже, превосходить 100 000 ат.
Горение используется в технике главным образом для сообщения снарядам кинетической энергии. В этом случае существенную роль играет не только величина давления, но и скорость его нарастания. При горении заряда ВВ в замкнутом объеме кривая давления как функция времени имеет в общем случае вид, изображенный на фиг. 8.5. В точке А газы дошли до стенки сосуда;
£ 3. Давление взрыва
435
затем следует ускоряющийся рост давления, в точке К (точка перегиба) переходящий в замедляющийся. В точке В давление достигло максимума и dpfdt=Q.
Резкость возрастания давления, выражаемая отношением
Л л
В В' ° DD Г?
или ——•’ характеризует действие ВВ. Если это отношение мало, АВ
Время
Фиг. 8. 5. Изменение давления во времени при горении ВВ в замкнутом объеме.
то действие преимущественно метательное: снаряд получает ускорение без заметной остаточной деформации. Если же указанное отношение очень велико, то скорость, полученная снарядом за время нарастания давления, будет меньше и, кроме того, если будет достигнуто очень высокое давление, может произойти дробление снаряда и ствола орудия.
Фиг. 8. 6. Кривые изменения давления при выстреле для порохов различной прогрессивности.
Чем более выражено метательное действие горения, тем выгоднее его баллистическое использование. Это понятно из диаграммы фиг. 8. 6, выражающей давление как функцию пути снаряда в канале орудия. Кинетическая энергия снаряда характеризуется площадью, ограниченной кривой LMV. Если давление быстро нара
436
Гл. VIII. Теплота, температура и давление взрыва
стает до максимального значения, например по кривой 2 или тем более по кривой 3, то при той же самой площади, ограниченной кривой, а следовательно, и энергии снаряда максимальное давление значительно больше. Идеальный, но практически нереализованный случай представляет прямая HF, дающая постоянное давление на всем пути движения снаряда. Такая зависимость предъявляет минимальные требования к прочности ствола орудия при данной энергии
снаряда.
Чтобы приблизиться к этой зависимости, частицам пороха придают специальную форму, чтобы их поверхность в процессе горения оставалась постоянной или даже возрастала (пороха с многоканальными зернами). Винтовочный порох, кроме того, обычно подвергают специальной обработке, которая в пороходелии называется флегматизацией и состоит во внесении в поверхностный слой порохового зерна примесей (камфора), замедляющих
Фнг. 8. 7. Зависимость максимального давления при горении дымного пороха от плотности заряжания.
рина
горение.
При горении заряда из флегматизи-рованного пороха после сгорания поверхностного слоя зерна скорость горения возрастает, и это в некоторой степени компенсирует уменьшение поверхности горения. Отношение максимального давления к среднему для флегма-тизированного пороха при прочих равных условиях получается меньшим, чем для нефлегматизированного.
2. Расчет давления горения
Экспериментальное изучение зависимости между плотностью заряжания А и максимальным давлением, достигаемым в замкнутом объеме, показало, что давление растет с плотностью заряжания, но не линейно, как этого требует уравнение состояния идеальных газов, а быстрее (фиг. 8.7). Аналитически получаемая из опыта зависи-
мость могла быть выражена соотношением для нитроглице-
9280Д
1 —0,723Д
и для дымного пороха
_ 2640Д'
Р~ 1 —1,06Д' ’
где А'— плотность заряжания, отнесенная к превращающейся в газы части пороха.
$ 3. Давление взрыва
437
Обозначив коэффициенты при А в числителе через f и в знаменателе через а, получим в общем виде
р=-^—. (8.7)
1 — аД '
К этому соотношению легко прийти и теоретически. Для газов большой плотности, образующихся при сгорании ВВ в замкнутом объеме, уравнение состояния идеальных газов pv=RT уже не применимо. В этом случае можно воспользоваться уравнением состояния реальных газов Ван-дер-Ваальса
(8.8)
в котором член a[v2 учитывает силы притяжения между молекулами, действующие как некоторое «внутреннее давление», сжимающее газ; член b (обозначаемый в теории взрывчатых веществ обычно буквой а и называемый «коволюм») учитывает собственный объем молекул Wo (как показывает теория, a?«4wo). Поскольку a[v2 быстро убывает с ростом температуры, можно этой величиной при расчете давления горения пренебречь и пользоваться уравнением реальных газов в упрощенном виде
p(v — a} — RT,
где R для 1 кг взрывчатого вещества равно .
273
через f и разделив эту величину на
(8.9)
Обозначив
273
(v — а), получим
Т
р —-----
V — а
Так как для 1 кг
1
V — —, д
то
и
Помножив числитель уравнение Нобля и Абеля
Р 1/Д —а ‘
знаменатель на А, получим окончательно
р=-^~
Г 1 — аД
(8.7)
Величину f иногда называют удельным давлением по следующим соображениям. Если допустить выполнение законов идеальных газов, т. е. принять ct=O, то при А=1 получим p=f. Следовательно, f численно совпадает с давлением, развиваемым 1 кг ВВ при сгорании в объеме, равном 1 л, при условии (фактически не
438
Гл. VIII. Теплота, температура и давление взрыва
реальном), что газы ведут себя как идеальные. Обычно же величину f называют в соответствии с ее размерностью удельной энергией ВВ * и рассчитывают из соотношения
лат'кг. (8.10)
Величину а обычно рассчитывают, пользуясь эмпирическим соотношением
а = 0,001^, (8.11)
где ио — объем газообразных продуктов взрыва 1 кг ВВ при нормальных условиях. Объем твердых продуктов, если они образуются, добавляют к этой величине. Этот объем можно рассчитать, зная число молей каждого из твердых продуктов, образовавшихся при взрыве 1 кг ВВ, и их молярные объемы (см. Приложение 10).
Обе величины а и f могут быть определены также экспериментально при помощи манометрической бомбы из системы двух связывающих их уравнений:
и
/До
Рг=-------—.
2 1 - аД2
Из уравнения (8.7) следует, что при Д*=1/а значение р = <х>. Для большинства взрывчатых веществ плотности Д& реально достижимы. Однако они имеют только математическое значение и отнюдь не приводят к бесконечно большим давлениям. Дело в том, что а нельзя считать не зависящим от давления и формула (8. 11) правильна только приближенно, до давлений, не превышающих несколь. ких тысяч атмосфер. Для больших давлений коволюм меньше; однако закон его изменения неизвестен, и применять формулу Нобля и Абеля в простом ее виде для этих условий нельзя.
Для давлений, превосходящих предел применимости уравнения Нобля и Абеля, предлагались различные эмпирические и полуэм-лирические уравнения состояния.
Тэйлор рекомендует для соответствующих расчетов уравнение Хнршфельда и Розевара с внрнальнымн коэффициентами следующего вида:
pv b № b3 Ь4
~7^ = 1+“ + 0*625 +0,287 ——4-0,193 —, (8.12)
nRT v t>2 v3 v4
где b—'второй вирнальный коэффициент при высоких температурах, рассчитанный исходя из определенных предположении об изменении энергии взаимодействия молекул с расстоянием между ними;
* Это название не вполне точно. Величина /, как легко показать, представляет собой не полную энергию ВВ, а лишь часть ее f~(k—1)£, где й =
cv
£ 3. Давление взрыва
439
v— объем газообразных продуктов взрыва;
п — число молей этих продуктов на 1 кг ВВ.
Значения Ь прн высоких температурах для разных газов, обычно входящих в состав продуктов взрыва, приведены в Приложении 11. Для газовых смесей второй вирнальный коэффициент приближенно может быть рассчитан суммированием молярных коэффициентов:
Ъ = 2
где п i — число молей г-го газа, входящего в состав продуктов взрыва; й,- — молярный коэффициент для этого газа.
Принимая /? = 0,0848 л ат град—1 .г:о.г“1 и обозначая плотность ВВ через р, a b/v через х, получаем
р=0,0848пТ'р (1+х+0,625х2+0,287х3+0,193х4). (8. 12а))
Если прн взрыве, кроме газов, образуются также твердые продукты, то, полагая нх несжимаемыми, следует объем, приходящийся на долю газов, уменьшить на величину объема а; твердых продуктов, получающихся при взрыве 1 кг ВВ.
Выражение (8. 12а) принимает тогда следующий вид:
р = 0,0848 — (1 + X! + 0,625 л? -ф 0,287 xf -ф- 0,193xf), (8.126)
1 — °iP
1000 где
b
Используя это выражение для давления, можно рассчитать также для равновесия реакции водяного газа значение G, коэффициента, учитывающего не-ндеальность газов:
(Xi + 0,625 л-2 4- 0,287 х? ф 0,193 xf). (8,13)
Рассмотрим примеры расчета давления н других характеристик взрыва описанными методами.
1, Рассчитаем давление, возникающее прн гореннн амматола 80/20 при плотности заряжания Д=0,25 кг/л. Учитывая, что плотность заряжания невелика, расчет ведем, пользуясь уравнением (8.7):
pnvQT 1,033-898-2890
—= -------------------= 9820 л ат!кг;
273 273
а = 0,001 г?о =0,001 -898 = 0,898 л\кг;
9820-0,25
р =------------— - = 3166 ат.
1 -0,898-0,25
2. Рассчитаем теплоту, температуру, объем газов н статическое давление прн адиабатическом превращении в собственном объеме аммонала, содержащего
аммиачной селитры 70%, тротила 15% и алюминия 15%, при плотности 1,20 кг/л. Принимая во внимание, что плотность значительна, расчет тепловых характери-
стик н давления ведем, учитывая влияние давления на равновесие реакции водяного газа.
440
Гл, VIII. Теплота, температура и давление взрыва
Начнем с приближенного расчета теплоты взрыва на 1 кг ВВ.
Продукты взрыва в молях (по табл. 8.2)
Компоненты ВВ со2 Н2О n2 о2 А12О3
Тротил 4,620 1,650 0,990 —3,465 —.
Аммиачная селитра — 17,500 8,750 4,373 —
Алюминий — — -4,170 2,775
4,620 19,150 9,740 —3,260 2,775
—3,260-32-100
Кислороднын баланс -------------- % =—10,43*».
ЮСО
Число молен газов л=33,51.
Объем газов при нормальных условиях г?0=22,4л=22,4-33,51=750,4 л]кг.
Теплоты полного сгорания при стандартных условиях (18°, постоянный объем, вода жидкая) по табл. 8. 2:
тротил 0,150 кг; q — 0,150-3596 = 539,4
аммиачная селитра 0,700 кг; q — 0,700-628 =439,6
алюминий 0,150 кг; 7 = 0,150-7382= 1107,3
2086,3.
Чтобы учесть неполноту окисления, вычитаем
135 (О2) = 135-3,26 =>440,1.
Теплота взрыва приближенно равна
2086,3 — 440,1 = 1646,2.
Температура взрыва приближенно равна
t = l,88Q + 560= 1,88-1646,24-560 = 3655° С, нлн ~ 3925° К. Числа грамм-атомов элементов:
с = (СО2) = 4,620;
Л = 2 (Н2О) = 38,300;
о =2 (СО2) + (Н2О) + 2 (О2) = 2 (4,620) + (19,150) + 2 (— 3,26) = 21,87.
Рассчитаем теперь Объем 1 кг ВВ: объем, занимаемый газообразными продуктами. 1000 1000 о„„ „ „ = = 833,3 см3. р 1,20
Объем Д120з: а, =2,775-25,5 = 70,9 см3.
где 25,5 — объем моля А120з в см\
Объем, занимаемый газами:
— — а, = 833,3 — 70,9 = 762,4 см3. ₽
§ 3, Давление взрыва
441
Доля объема, занимаемого газами:
1000 1000
Произведем учет нендеальностн газов: 2-й внрнальнын коэффициент b (с-из) уравнения состояния ориентировочно равен (см. Приложение 11)
ь ~ псо/со,+ ли2о*н2о+ ”n/n! =
= 4,62-37,0+ 19,15-7,9 + 9,74-34,0 = 653,4 см\
Для расчета G по формуле (8.13). вычисляем
Xj[cm. формулу (8.126)] и сумму его степеней;
b 653,4
х ---------------=—д-, = 0,8570;
/1000 \ 762,4
а1
\ Р /
*1 + 0,625/ + 0,287/ + 0,193/ =
= 0,8570 + 0,625-0,85702 + 0,287 • 0,85703 + 0,193 - 0,85704 = 1,6009.
4,38л „ - Й
lg О = ~— (х + 0,625/ + 0,287/ + 0,193/) X
4’.?в'33,51боод.о 915 = 0 3293.
1000/ 653,4
6 = 2,135-
Для принятой по ляет 0,916 н /<=8,24;
ориентировочной оценке температуры 3925° К 1g Л состав-с поправочным коэффициентом получаем:
К' = /<6 = 8,24-2,135= 17,60.
Находим коэффициенты уравнения для расчета состава продуктов взрыва (гл. VII, стр. 391):
Ь=К'
а = — 1 = 17,60 — 1 = 16,60;
)/38 30 + о = 17,60 (-у-+ 4,620 — 21,
+ 21,87 = 55,31.
С = с(с —о) = 4,620 (4,620 — 21,87) = —79,65;
-55,31+/ 55,312 + 4.16,60-79,65“
(СО2) = ----------------„ -- = 1
2-16,60
(СО) = с — (СО2) = 4,620 — 1,086 = 3,534;
(Н2) = —Л + с—о+ (СО2)= 19,154-4,620 — 21,87+ 1,086 = 2,986;
(Н2О) = о — СО2— с = 21,87— 1,086 —4,620= 16,164;
N2 = 9,740.
442
Гл. VIII. еплота, темпера!ура и давление взрыва
Теплота полного сгорания (u=const, НаОж) составляет 2086,3 ккал.
Поправка на СОг— СО составляет
3,534-67,34 = 238,0 ккал.
Поправка на 1+0— Нг составляет
2,986-67,50 = 201,6 ккал.
Теплота взрыва
2086,3 — 439,6= 1646,7 ккал.
Проверка справедливости принятого значения второго внрнального коэффициента:
ь ~ лсо,/со, + лсойсо + лн.ойн2о + =
= 1,086-37,0 + 3,534-33,0 + 2,986-14,0 + 16,164-7,9 4-9,74-34,0 = 657,5.
Зная состав продуктов взрыва, мы можем рассчитать температуру взрыва.
Разность внутренних энергий от 4000 до 291' К по расчету по данным Приложении 8 и 9 составляет:
СО2:1,086-44,62 = 48,5;
Н20:16,164(35,68+ 10,01) = 738,5;
СО'.3,534-24,00 = 84,8;
Н2:2,986-22,83 = 68,2;
N2:9,740-23,78 = 231,6;
А12О3: 2,775-181,3 = 503,1
1674,7 ‘
Разность внутренних энергий больше теплоты взрыва, поэтому рассчитываем эту разность для ближайшей табличной температуры 3800° К. Она составляет 1578,9 ккал. Таким образом, изменение внутренней энергии на 200° составляет 1674,7—1578,9 = 95,8 ккал. Принимая, что внутренняя энергия между этими температурами Меняется линейно, получаем для изменения внутренней энергии, равного теплоте взрыва (1646,7 ккал), температуру взрыва 3942°К, что всего на 17° выше той, которой мы задались в начале расчета. Поэтому нет необходимости повторять расчет, что следовало бы сделать в том случае, если бы разница между принятой и полученной температурой была значительной. Следует добавить, что в этой области температур константа равновесия водяного газа меняется очень слабо; поэтому прн небольших изменениях температуры очень мало изменяются также состав газов н тепловой эффект превращения.
Рассчитываем давление
р = .o..:.o848:.nZP.. (1+0,625х2 + 0 _287хз + 0 f j =
1 _ “1L 1000
0,0848-33,51-3942-1,20-2,601 _ опп , „
=------------------------------ = 38 200 кг см2.
i _70,9-1,20
1000
3. Опытное определение давления горения
Для определения давления горения в постоянном объеме применяют манометрическую бомбу. Первая конструкция такой бомбы была предложена Сарро и Вьелем. Эта бомба (фиг. 8. 8)
§ 3. Давление взрыва
443
представляет собой стальной цилиндр 1, имеющий центральный канал. Канал закрыт с обоих концов стальными втулками 2 и 3. Через втулку 2 проходит изолированный стержень 5, служащий для электровоспламенения заряда. Во втулке 3 имеется канал с поршеньком 6, через который давление пороховых газов передается медному крешерному цилиндрику 8, зажатому между головкой поршенька и пробкой 9, ввинчиваемой во втулку 3. При сгорании заряда пороха цилиндрик сжимается давлением продуктов горения,
Фнг. 8. 8. Манометрическая бомба Сарро и Вьеля.
и уменьшение его высоты служит мерой максимального давления в бомбе.
При помощи манометрической бомбы можно определять не только максимальное давление, но и изменение давления во времени. Для этого к головке поршня, передающего давление крешерному цилиндрику, прикрепляется стальное перо- 7, прикасающееся к закопченной бумаге, натянутой на барабан 4. Во время опыта барабан вращается с определенной скоростью. Эту скорость измеряют по синусоиде, вычерчиваемой на закопченной бумаге вторым пером, укрепленным на ножке камертона, дающего известное число колебаний. Благодаря вращению барабана обжатие крешерного цилиндрика записывается во времени. Полученные кривые (фиг. 8. 9) после вычерчивания при помощи компаратора в большем масштабе позволяют рассчитать все параметры горения пороха.
Для перевода полученных обжатий в давления пользуются гаражными таблицами. Эти таблицы составляют на основании результатов обжатия крешеров данной партии различными давлениями на прессе.
Исследования показали, что при постепенно нарастающем давлении зависимость между давлением и обжатием 8 крешера выражается линейным соотношением
р = До + Де, (8.14)
где До и Д для крешерного цилиндрика диаметром 8 мм и высотой 13 мм при опытах Сарро были равны 540 и 535 при поршне весом 60 г.
444
Гл. VIII. Теплота, температура и давление взрыва
Если давление возрастает практически мгновенно до своего максимального значения, то обжатие вдвое больше, чем при постепенном нарастании давления:
(8.15)
Для промежуточных случаев расчет поправочного множителя, учитывающего динамичность сжатия крешерного цилиндрика, сло-____________ ___ жен и его стремятся избе-I_~ ________£ жать.
t Увеличение обжатия при
з . / £
t
Фнг. 8. 9. Кривые обжатия крешерного цилиндрика при испытании взрывчатых веществ и порохов в манометрической бомбе, /—медленное горение (прессованный черный порох). 2—умеренно быстрое горение (зернений черный порох), 3—быстрое горение (пикрат калия), масштаб времени увеличен в 5 раз.
этому для промежуточных случаев
мгновенном приложении давления определяется тем, что в этом случае поршень получает некоторое ускорение за счет разницы между силой давления газов на поршень и сопротивлением крешера. Поэтому сжатие продолжается за счет инерции поршня и тогда, когда сопротивление поршня станет равным давлению газов. Чем меньше масса поршня, тем меньше будет инерционный эффект и наоборот. По-обычно стремятся, уменьшая
или увеличивая массу поршня, приблизиться к одному из крайних
случаев, дающих возможность рассчитывать давление по полному или половинному обжатию.
Другим методом уменьшения инерционного эффекта является предварительное обжатие крешерных цилиндриков таким образом, чтобы при измерении они обжимались только на 0,05—0,1 мм. Для этой же цели применялась замена крешерного цилиндрика пружиной, а также измерение давления по деформации стальной диафрагмы. Так как смещения деформируемых частей при этих методах весьма незначительны, то их приходится увеличивать путем от-
ражения зеркальцем падающего на него пучка света; запись производится фотографически.
Радикальное разрешение вопроса дает пьезоэлектрический метод измерения давления. Этот метод основан на измерении электрического заряда, появляющегося под влиянием давления на поверхности некоторых кристаллов (см. стр. 360). Измеримые заряды возникают уже при ничтожной деформации пьезокварца, так что инерционные эффекты в этом случае не играют роли.
Глава IX
РАЗРУШАЮЩЕЕ ДЕЙСТВИЕ ВЗРЫВА
§ 1. ОБЩИЕ ПОЛОЖЕНИЯ О РАБОТЕ ВЗРЫВА
Работа взрыва совершается за счет энергии (теплоты), выделяющейся при взрыве; именно поэтому общая энергия взрыва
Q = QoC (9.1)
где Qo — удельная теплота взрыва в ккал!кг\
С — вес заряда в кг,
является важнейшим параметром взрывчатой системы.
Если объем заряда v ограничен (например оболочкой или стенками шпура), то вес заряда
С— pv, откуда
Q = Qopv. (9.1а)
При фиксированном объеме заряда теплота взрыва пропорциональна удельной теплоте и плотности ВВ.
Нужно подчеркнуть с самого начала, что при взрыве, как правило, работа производится во многих формах. Среди них есть полезные формы—те, из-за которых собственно и производят взрыв, и формы, бесполезные, представляющие собой по существу потери; при изменении условий взрыва доля определенной формы работы может существенно меняться.
Для разъяснения сказанного рассмотрим взрыв заряда в грунте. В этом случае будут производиться следующие основные формы работы;
1. Интенсивное дробление и сильнейшая пластическая деформация среды, непосредственно примыкающей к заряду, и оболочки, если заряд находился в оболочке.
2. Сжатие, пластическая деформация, разрушение и дробление среды, не примыкающей непосредственно к заряду, но находящейся вблизи от него.
3. Образование и распространение в грунте упругих (сейсмических) волн.
4. Выброс части грунта и образование воронки выброса (если заряд не слишком углублен в грунт).
446
Гл. IX. Разрушающее действие взрыва
5. Образование и распространение воздушных ударных волн (если заряд достаточно близок к поверхности грунта).
Сумму всех работ, произведенных взрывом, называют полной работой. Полная работа составляет часть полной энергии (теплоты) взрыва *;
= А + ^2 + ^3+ • • • +^л—(9-2) где т|п — полный к. п. д. взрыва.
А
Далее будет видно, что значение т)п——“ довольно велико и со-
Е
ставляет 0,6 — 0,7. В то же время полезный к.п.д ^отношение полезной формы работы к теплоте 7^=-—-100^ часто составляет всего лишь несколько процентов.
При изменении условий взрыва полная работа обычно или не изменяется, или изменяется незначительно; частные же формы работы могут изменяться весьма существенно.
Так, например, если взрыв заряда произвести не в грунте, а на поверхности его, то полная работа практически остается прежней. При этом работа, идущая на образование воздушной ударной волны, весьма существенно увеличится; работа, идущая на разрушение и деформацию среды, значительно снизится; работа выброса и образования сейсмических колебаний станет практически несущественной.
В некоторых случаях, являющихся скорее исключением, чем правилом, работа взрыва производится только в одной определенной форме. Так, при взрыве в воздухе заряда без оболочки вся работа взрыва заключается в образовании воздушной ударной волны. Если такой же заряд снабдить оболочкой, то некоторая часть полной работы будет израсходована на разрыв и пластическую деформацию оболочки, а также на сообщение кинетической энергии разлетающимся осколкам.
Для оценки величины работы взрыва, реализуемой в какой-либо определенной форме, нужно знать полную работу взрыва и ту долю ее, которая в данных условиях может превратиться в интересующую нас форму.
Научно обоснованный метод оценки полной работы взрыва был предложен И. М. Чельцовым еше в конце прошлого века. Если газ, обладающий внутренней энергией U, расширяется, производя работу, то согласно первому закону термодинамики
—dU—dQ^-dA. (9.3)
* Здесь и в дальнейшем энергия взрыва обозначена буквой Q, когда эта величина выражена в тепловых единицах, н буквой Е, когда она выражена в единицах механической работы. Очевидно, что Е (кем)=427Q (ккал).
§ 1. Общие положения о работе взрыва
447
Уменьшение внутренней энергии dU равняется количеству тепла, сообщенного в процессе расширения окружающей среде dQ, и произведенной при этом работе dA. Процесс расширения газов взрыва происходит настолько быстро, что его можно считать адиабатическим, т. е. идущим без теплообмена со средой. В соответствии с этим Чельцов использовал для вычисления работы взрыва уравнение идеального адиабатического процесса расширения (заметим, что в действительности процесс расширения газов взрыва нельзя считать идеальным и обратимым). При этом предположении
dQ = 0 и dA = —dU——cvdT. (9.4)
Для конечной величины работы, соответствующей конечному изменению температуры, имеем
(9.5) г,
где Т{—начальная (максимальная) температура взрыва;
Г2 — температура газов к концу расширения;
с„— средняя теплоемкость в интервале температур от Т.2 до 7\.
Предположим, что Т2=() (в реальных условиях расширение до Т’2=0 неосуществимо); тогда полная максимальная работа Л* будет равна _ _
Д*=сг,Д = С2+4-290, (9.6)
где Q — теплота взрыва и с„-290 — внутренняя энергия газа при стандартной температуре калориметрических измерений (15 — 20°С или 290°К).
Величину Д„ — максимальную работу, которую могут совершить газы взрыва при условии, что в механическую работу превращается без остатка вся их внутренняя энергия,—называют потенциалом ВВ. Величину можно также представить в единицах кгм{кг, для чего нужно умножить выражение (9.6) на механический эквивалент тепла.
Отметим, что величина <?^-290 невелика по сравнению со значением теплоты взрыва Q; для обычных ВВ она составляет 3 — 5% от Д*; поэтому с точностью, достаточной для практики, можно пренебрегать членом cL-290 и полагать
A*n^Q. (9.6а)
Пренебрежение величиной с'~-290 возможно еще и потому, что в реальных условиях полная работа Дп всегда значительно меньше потенциала Д„ и даже значительно меньше теплоты взрыва Q.
448
Гл. IX. Разрушающее действие взрыва
Для полного начального запаса внутренней энергии п молей идеального газа, занимающих объем щ и имеющих давление рг и температуру Т\, мы имеем следующие выражения:
U^ncJ\- (9.7)
(9.7а)
k ~~~ 1
£7=--^., (9.76)
Выражения (9. 7) — (9. 76) равнозначны и приближенно могут быть приравнены теплоте взрыва Q.
Если внутреннюю энергию отнести к единице массы газа, то, обозначая количество молей в единице массы через пл и удельный объем
через v, получим (9.8) £7,=-^- =——• (9.8а) 1 k— 1 р(й— 1) ' (9.86)
Выражения (9.8) — (9.86) равнозначны и приближенно могут быть приравнены удельной теплоте взрыва Qq.
Выражение для работы адиабатического расширения п молей газа может быть записано следующим образом:
A=^(7’1-7’2) = nFo7’1(l —(9.9)
где Т\ и — температура продуктов взрыва до и после расширения.
Если Т2—Т\, т. е. газы не расширяются и потому не охлаждаются, то А=0. При взрыве заряда в прочной неразрывающейся бомбе (предполагая, что плотность заряжания невелика и заряд висит, не касаясь стенок) можно пренебречь работой образования ударных волн в оболочке бомбы. Тогда работа вне бомбы будет равной нулю; температура газа, расширившегося в бомбе, будет равна Ti —-начальной температуре взрыва; внутренняя энергия газа будет уменьшаться с течением времени только за счет теплоотдачи в стенки бомбы *.
* Это утверждение нуждается в пояснении. При расширении газов с совершением работы температура их падает. В данном случае в начальной стадии расширения температура продуктов взрыва действительно снизится; внутренняя энергия частично перейдет в кинетическую энергию движущихся газов. Натолкнувшись на стенки, газы затормозятся; их кинетическая энергия вновь превратится во внутреннюю энергию газа. Давление будет ниже, чем в начальный момент взрыва, но температура — той же, поскольку мы предположили, что работой деформации бомбы и образования ударных волн в ее стенках можно
$ 1. Общие положения о работе взрыва
449
В общем случае значение Тг трудно оценить хотя бы приближенно, поэтому выражение (9. 9) нельзя использовать для практических целей. Преобразуем его, введя вместо отношения температур отношение объемов. Из уравнения адиабаты
pvk = const
и уравнения состояния идеального газа получаем
Т2 / vi \4—1
Л \г>2/
(9.10)
Подставляя (9. 10) в (9.9), получим
А~Й„Т, [ 1 -(Ъ-у-1 1=<2 Г1 .
I \ v2 / 1 — 1 L \1'2 ' J L \v2 )
(9.11)
Именно в таком виде — явной функции соотношения начального (»1) и конечного (а2) удельных объемов — формула для работы газов взрыва и была дана И. М. Чельцовым.
Соотношение объемов практически удобнее, чем отношение температур; в ряде задач значения конечного объема и2 могут быть непосредственно определены или вычислены.
Для некоторых задач, однако, еще удобнее оперировать не отношением объемов, а отношением давлений. Из уравнения адиабаты и выражения (9. 10) легко найдем
следовательно,
(9.12)
(9.13)
Здесь р\ — начальное давление газов взрыва и р2 — их давление, когда они, расширившись, совершили работу А. Из выражений (9.2), (9. 11) и (9. 12) очевидно, что
k-i
(9- 14)
пренебречь. Представим себе, что вместо заряда, сосредоточенного в центре бомбы, мы взорвали такой же заряд, равномерно распределенный по всему объему, прн условии, что теплота взрыва при этом не меняется. Расширения в этом случае нет и температура газов равна начальной температуре взрыва. Конечное состояние продуктов взрыва сосредоточенного заряда (после торможения при условии, что выделялась одинаковая энергия) будет, очевидно, таким же, как и равномерно распределенного. Отсюда непосредственно следует, что после расширения и торможения Г^Твзр . Понятно, что если в бомбе перед взрывом находится газ, количеством которого нельзя пренебречь по сравнению с количеством газов, образующихся при взрыве, то температура после перемешивания Т1<ТВЗР
450
Гл. IX. Разрушающее действие взрыва
На фиг. 9.1 показана зависимость отношения полной работы к теп-
лоте взрыва
— =т)а от степени расширения при разных значениях k
(от 1,10 до 1,25). При беспредельном расширении (р2->0) кривые с разными показателями адиабаты асимптотически стремятся к одному пределу т]п->1,0; однако при некотором конечном значении pi/p2 величина т|„ тем больше, чем больше k. Отношение значе-
ний т]п для кривых с разными k при одинаковых степенях расширения тем больше, чем меньше значение р\1р2.
Величина
А
1,0
Фиг. 9. 1. Зависимость отношения полной работы к теплоте взрыва от степени расширения. Каждая кривая соответствует значению kt, указанному справа.
Су Су
зависит от свойств продук-тов взрыва. Если, например, в продуктах взрыва 2/3 молекул двухатомных (СО, N2, Н2) и Vs — трехатомных (СО2, Н2О), как, например, в продуктах взрыва гексогена, то £=1,25; если соотно
шение обратное, т. е. в продуктах 2/3 трехатомных и i/3 двухатомных молекул (нитроглицерин), то среднее cv будет большим и значение k снизится до 1,20. Если в про-
дуктах взрыва будет значительное количество четырехатомных или пятиатомных молекул, то значение k снизится еще больше и при данном pjp2 уменьшится т)л. К этому нужно добавить, что при одинаковой теплоте взрыва скорость детонации и начальное давление продуктов взрыва р\ будут больше у того ВВ, у которого эти продукты состоят из молекул с малым количеством атомов. Если расширение идет до одинакового значения р2, то отношение ррре у такого ВВ будет больше и работа несколько возрастет по сравнению с ВВ, образующим «многоатомные» продукты.
Особенно сильно уменьшается Tin (и, следовательно, при одинаковой энергии — работа), если в продуктах взрыва имеется конденсированная фаза (A12Os, NaCl, SiO2 и т. д.). При этом величина k может снижаться до значения 1,15; 1,10 и даже 1,05 (смесь КС1О3 + + 2А1 -* А12О3 + КС1). Величина iin будет соответственно значительно снижена.
$ 1. Общие положения о работе взрыва
451
Отметим, что еще в конце XIX столетия Бертло предложил оценивать величину работы взрыва на единицу веса так называемым характеристическим произведением QoVo, где Qo — удельная теплота взрыва и Vo— удельный объем газов. Фактически Бертло полагал, что вместо правильного соотношения
Нужно отметить, что если число атомов в молекулах продуктов взоыва уменьшается, то Vo обычно возрастает, но из этого правила есть существенные исключения (например, когда в продуктах взрыва содержатся тяжелые атомы: свинец, ртуть и т. д.) и, кроме того, характер увеличения Vo отличается от ха-
/ V] \fc-i
рактера увеличения 1— I — I. Поэтому иногда использование характернстц-\ v2 /
ческого произведения может дать грубое приближение к действительности, чаще же это приводит к ошибочной оценке работоспособности того или иного ВВ.
Для оценки работоспособности не следует также пользоваться так называемой «удельной энергией» — величиной
представляющей собой работу изотермического расширения газов взрыва; работу взрыва правильнее описывать адиабатическим процессом.
Вернемся к выражению для работы взрыва в виде (9. 13). Предположим, что взрыв происходит в воздухе, и оценим полную работоспособность, полагая, что расширение идет до атмосферного давления, т. е. до р2=1 кг/см2.
Тогда
= Q~7-
(9.15)
Разность Q—представляет собой то тепло, которое даже при идеальном ходе процесса остается в продуктах взрыва по достижении ими атмосферного давления. По существу q — потерянное тепло: им обладают газы, давление которых равно внешнему давлению; они уже не могут расширяться и совершать работу. Это остаточное тепло обусловливает свечение облака продуктов взрыва после их расширения. Расширившиеся продукты быстро перестают светиться из-за смешения и теплообмена с окружающим холодным воздухом.
Если взрыв происходит в сплошной среде со значительным сопротивлением, то расширение прекратится не при 1 кг)см2, а при более высоком давлении, зависящем от свойств среды. Предположим, что рг—100 кг)см2, тогда
A = Q 1 -
k—I-
100\~
Рх >
полная работа уменьшится, остаточное тепло 7 = Q — А.
увеличится.
452
Гл. IX. Разрушающее действие взрыва
В табл. 9.1 даны полные работы взрыва 1 кг некоторых ВВ при расширении до pz—l кг/см2, вычисленные по формуле (9. 15).
В дальнейшем полную работу, отнесенную к единице веса ВВ (удельную работу), мы будем называть работоспособностью. При вычислении работоспособности необходимо знать pi — максимальное давление взрыва. Поскольку выражение (9. 15) для расчета величины работоспособности связано с применением законов идеального газа, мы сочли возможным pi вычислять как для идеального газа, не вводя поправки на коволюм. При введении такой поправки Изменились бы значения k и т]п. Действительные значения т|п, по-видимому, ниже приведенных в табл. 9. 1.
Таблица 9. 1
Полная работоспособность некоторых ВВ при расширении до атмосферного давления
(ВВ расположены в порядке возрастания работоспособности)
ВВ или смесь Р Qo ккал)кг С2/ ’in % Дп ккал/кг Q А.
Qtht ДпТНТ
Азид свинца 3,8 360 1,19 77,6 280 0,36 0,33
Аммиачная селитра 0,9 380 1,30 86,2 327 0,38 0,39
Предохранительный аммонит № 8 1,0 710 1,20 77,5 550 0,70 0,65
Тротил (малая плотность) 0,9 830 1,24 82,5 685 0,82 0,82
Дипамон Д 1,0 920 1,24 83,6 770 0,91 0,92
Аммонит № 9 1,0 940 1,245 83,9 788 0,93 0,94
Тротил (большая плотность) 1,5 1010 1,23 83,3 840 1,00 1,00
Аммонит № 6 1,0 1030 1,24 83,7 850 1,02 1,01
Динамит 62% 1,45 1290 1,175 76,0 980 1,28 1,17
Алюмит № 1 1,00 1270 1,20 79 1000 1,26 1,19
Г ексоген (малая плотность) 1,00 1270 1,25 84,5 1070 1,26 1,28
Гексоген (большая плотность) 1,60 1300 1,25 86,6 1125 1,29 1,34
Тэн 1,60 1360 1,215 82,7 1125 1,35 1,34
Простейший аммонал (20% алюминия и 80% аммиачной селитры) 1,00 1580 1,16 72,4 1140 1,56 1,36
Нитроглицерин 1,60 1480 1,19 79,7 1180 1,47 1,40
Тетранитрометан/бензол (87,5/12,5) 1,48 1650 1,18 78,5 1310 1,63 1,56
$ 1. Общие положения о работе взрыва
453
Как следует из табл. 9. 1, для многих ВВ значение цп колеблется в пределах 83—85%, т. е. практически одинаково. Для таких ВВ (тротил, гексоген, аммонит № 6, аммонит № 9, динамон Д, тэн) отношение работоспособностей такое же, как и отношение теплот. В пределах данной группы ВВ работоспособность можно оценивать непосредственно по удельной теплоте взрыва. Однако у многих других ВВ свойства продуктов таковы, что для них значение т]п меньше (предохранительный аммонит № 8, динамит 62%, алюмит № 1, нитроглицерин, смесь тетранитрометана с бензолом и, особенно, простейший аммонал); относительная работоспособность таких ВВ меньше, чем относительная теплота взрыва.
Выше уже отмечалось, что тр, сильно снижается при наличии в продуктах взрыва конденсированной фазы *, поэтому в общем случае правильнее сравнивать эффекты взрыва не по отношению удельных теплот, а по отношению полных работоспособностей.
Приведенные в таблице значения т)п вычислены по теории расширения идеального газа с использованием идеальных значе-С р
ний k——-. При реальном процессе расширения показатель полит-
,, ср ,
ропы k <С - и значения работоспособности соответственно С27
меньше. Так, например, из ряда опытных данных (энергия ударной волны вблизи от заряда, величина работы в свинцовой бомбе) следует, что для таких ВВ, как тротил, гексоген, аммонит № 6 и т. д., полный к.п.д. (дп) при расширении до атмосферного давления составляет не 83 — 85%, а 65 — 75%; таким образом, в работу (в самых благоприятных условиях) может превратиться максимум 2/з или 3/4 теплоты взрыва; остальная энергия представляет собой тепловые потери — тепло отработавших газов.
Важно отмстить следующее: учет реальных условий приводит к снижению абсолютной величины работы, однако относительные зна-чения работоспособностей —— при этом меняются несуществен-АП тнт
но и этими относительными значениями, полученными из идеальной теории, можно пользоваться на практике для количественного сравнения действия взрыва отдельных ВВ.
Может показаться, что изложенная картина непрерывного расширения газов противоречит тому широко распространенному пред-
* Из этого общего правила есть исключения. В продуктах взрыва тротила находится конденсированная фаза (углерод); тем не менее для него значения k и т,п такие же, как для ВВ, продукты взрыва которых состоят полностью из газов. Дело в том, что газообразные продукты взрыва тротила состоят в основном из двухатомных молекул; если бы в их составе не было взвеси углерода, то значения k и для тротила были бы выше, чем для таких ВВ, как гексоген, аммонит и пр. Кроме того, углерод обладает низкой теплоемкостью.
454
Гл. IX. Разрушающее действие взрыва
ставлению, согласно которому продукты взрыва наносят по среде сильнейший удар; в действительности противоречия здесь нет, нужно лишь учесть, что расширение происходит со столь большими скоростями, что его можно рассматривать как удар. При расширении в воздухе в действительности наносится постепенно ослабевающий удар; при расширении в грунте можно' представить, что, многократно отражаясь от стенок взрывной камеры, газы взрыва наносят ряд ударов и их сложение в пределе дает тот же итог, как и работа непрерывного адиабатического расширения. Подчеркнем, что во всех условиях превращение исходной энергии химического превращения в работу происходит не мгновенно, а в течение некоторого, хотя и очень малого времени.
§ 2. ФОРМЫ РАБОТЫ И БАЛАНС ЭНЕРГИИ ПРИ ВЗРЫВЕ
Как уже отмечалось выше, работа взрыва обычно производится во многих формах. Естественно стремление объединить отдельные виды работ в группы.
В науке о взрыве уже давно установилось деление форм работы на общее, или фугасное, действие и бризантное (дробящее) действие взрыва. Это деление, будучи весьма условным и зачастую недостаточно определенным, вместе с тем имеет и существенное основание.
Величина работы в формах общего действия, проявляющихся на некотором расстоянии от заряда, определяется полным количеством энергии, выделившимся при взрыве.
Работа в формах бризантного действия совершается в непосредственной близости к поверхности заряда, ее величина определяется плотностью энергии во фронте детонационной волны, которая в свою очередь пропорциональна величине ро-D2, где ро — плотность заряда и D — скорость детонации.
Таким образом, основными параметрами, определяющими разрушающее действие взрыва, являются: для общего действия —- полная энергия взрыва Q, для бризантного действия — плотность энергии р0О2 (для некоторых задач, как будет видно далее, существенна величина p0D или CD, где С — вес заряда).
Понятно, что поскольку нет резкой границы между фугасным и бризантным действием, существуют формы работы с промежуточным характером зависимости от основных параметров.
Рассмотрим более подробно конкретные формы работы с точки зрения их зависимости от основных параметров. От полной энергии взрыва Е зависят (и, следовательно, являются формами работы общего действия) такие виды работы, как разрушения, производимые ударными волнами в воздухе, воде, грунте, а также движением значительных объемов среды, возникшим в результате взрыва. Количество энергии, выделившееся при взрыве, определяет как величину зоны разрушения, так и интенсивность разрушений на данном расстоянии. От полной энергии зависят также такие важные виды
§ 2. Формы работы и баланс энергии при взрыве
455
работы, как объем выброшенного грунта при взрывании на выброс, объем разрушенной (раздробленной) породы при взрывании зарядов в среде (в шпурах, камерах и т. д.), объем «котла» (расширения в среде, образованного газами взрыва).
Здесь нужно сделать оговорку, что в соответствии со сказанным в § 1 следовало бы пользоваться не полной энергией, а полной работой. Однако, как мы видели, у большинства используемых на практике ВВ свойства продуктов взрыва близки и полная работа составляет практически одинаковую долю полной энергии взрыва. Поэтому в дальнейшем мы будем в качестве основной характеристики использовать полную энергию или величину тротилового эквивалента по энергии, исключая тот случай, когда свойства продуктов взрыва заметно отличаются.
Что касается разрушающего действия ударных волн, то, как уже было сказано, основу теории представляет закон подобия при взрывах, исключительно широко проверенный на практике как в лабораторных опытах для модельных зарядов, так и в полевых условиях при использовании весьма крупных зарядов. В соответствии с законом подобия (см. гл. VI) расстояние /?, на котором получается некоторое фиксированное значение избыточного давления на фронте Др* (например, определяющее границы разрушения), определяется уравнением
з
R=R* /С8КВ, (9.16)
где R*— значение приведенного расстояния, соответствующее данному Др*.
При взрыве в однородной среде объем, охваченный разрушением определенной интенсивности, v~R3; из этого следует, что у^Сэ1(В — объем разрушений — пропорционален тротиловому эквиваленту взорванного заряда. Формула (9. 16) решает вопрос о границах разрушения, о пространстве, охваченном разрушением.
Если нас интересует вопрос об интенсивности ударной волны, о значении Др, то также по закону подобия при взрывах
*P=f(R)- (9.17)
Уравнения (9.16) и (9. 17) справедливы не только для воздуха (примеры применения закона подобия к воздушной ударной волне были рассмотрены в гл. VI), но и для других сред. Всюду основным параметром, определяющим разрушающее действие ударной волны, является полная энергия взрыва.
Рассматривая разрушающее действие ударной волны, часто исходят из неправильной предпосылки, пытаясь связать характеристики ударной волны непосредственно с параметрами детонационной волны, что заведомо’неверно. Параметры детонационной волны важны для бризантного действия, проявляемого на границе заряда в уело-
456
Гл. IX. Разрушающее действие взрыва
виях, когда на среду действуют именно продукты детонации. На некотором же расстоянии от заряда разрушения определяются ударной волной, ее энергией, давлением, импульсом и т. д. или движением среды. В свою очередь энергия ударной волны или энергия движения среды составляет некоторую долю полной энергии взрыва (понятно, что в зависимости от свойств среды, условий взрыва и т. д. эта доля может быть различной).
В случае взрыва в сплошной среде в формировании ударной волны принимают участие не только продукты той части заряда, которые контактируют со средой и сообщают ей «первый удар», но и продукты взрыва всего заряда, действующие на среду подобно своеобразному поршню. Именно поэтому энергия ударной волны составляет определенную долю полной энергии взрыва и основной параметр закона подобия при взрывах включает полную энергию взрыва, выраженную непосредственно или в виде тротилового эквивалента. В гл. VI было указано, что основной параметр закона подобия сохраняется также в случае взрывов иного вида, другой физической природы, чем взрыв ВВ. Мощная искра, например, образует ударную волну, характеристики которой (а следовательно, и разрушающее действие) определяются в основном количеством выделившейся в искре энергии. Если в случаях взрыва ВВ и искры энергии одинаковы, то в непосредственной близости от очага взрыва эффекты будут существенно различными (в частности, искра в воздухе будет обладать несравненно меньшим бризантным действием), но на некотором расстоянии ударные волны и производимые ими разрушения будут практически равноценными. Конечно, все сказанное выше справедливо в том случае, если выделение энергии при взрыве (в частности, в искре) происходит достаточно быстро. При слишком медленном выделении энергии ударной волны или не будет, или же она будет слабой, несоответствующей полному количеству выделенной энергии. В случае детонирующих ВВ скорость выделения энергии вполне достаточна и в общем не очень существенные различия в скорости детонации разных ВВ уже практически не сказываются на доле энергии, переходящей в ударную волну.
В случае таких форм работы, как расширение полости в среде или выброс породы, решающую роль играет не столько ударная волна, сколько возникшее при взрыве движение значительных объемов среды, которое также зависит от полной энергии взрыва. При увеличении последней будет возрастать как энергия ударной волны, так и энергия движения значительных объемов среды, возникающего обычно после прохождения ударной волны.
Как следует из соотношений (6. 38) — (6. 40), объем расширения в среде (объем котла) — v пропорционален весу заряда;
v=KC. (9.18)
При использовании разных ВВ под весом С нужно понимать величину тротилового эквивалента Сэкв.
$ 2. Формы работы и баланс энергии при взрыве
457
Аналогичная пропорциональность весу заряда имеет место и для объема выброшенной породы. Ввиду большой практической важности этого вопроса остановимся-на нем подробнее.
Изложим основы метода расчета зарядов выброса. При расчетах обычно предполагают, что воронка выброса представляет собой
конус, в вершине угла которого находился взрываемый заряд (фиг. 9.2). Воронку выброса характеризуют отношением ее радиуса г к глубине W, называемой также линией наименьшего сопротивления (ЛНС). Отношение
W называют показателем действия взрыва. Воронки, у которых
Фиг. 9. 2. Схема к расчету воронки выброса.
С—заряд BE, W—линия наименьшего сопро* тивления, г—радиус воронки.
называют воронками нормального выброса; воронки, у которых п>1, называют воронками усиленного выброса.
В расчете зарядов выброса исходной является воронка нормального выброса. Ее объем
(9.19)
Вес заряда, необходимый для того, чтобы при данной ЛНС получить воронку нормального выброса, равен
(9.20)
Уже просто из вида формулы (9. 20) следует, что эта старейшая формула взрывного дела, полученная в свое время эмпирически, по существу представляет собой частную формулировку закона подобия при взрывах. Коэффициент К (вес заряда, необходимый для выброса единицы объема грунта) зависит прежде всего от свойств грунта (а также от свойств ВВ) и определяется опытным путем. В табл. 9. 2 приведены значения К для некоторых грунтов и горных пород по данным Главвзрывпрома; эти значения относятся к определенному ВВ (аммонит № 9). При использовании другого ВВ величина С представляет собой эквивалентный вес аммонита № 9.
Для слабых грунтов на 1 кг ВВ приходится приблизительно кубометр выброса. При переходе от растительной земли к прочнейшему граниту К возрастает всего лишь в 2 раза, хотя разница в прочности и твердости огромна. Причина в том, что основная доля работы выброса расходуется на преодоление инерционных сил, определяемых удельным весом, который для разных грунтов отличается сравнительно мало.
458
Гл. IX. Разрушающее действие взрыва
Таблица 9. 2
Значения коэффициента К в формуле C=KWZ
Вид грунта Коэффициент К
Песок, растительная земля, торф 0,95
Глина, суглинок, гравий 1,10
Уголь, мягкий известняк, мел 1,25
Песчаник глинистый, сланцы 1,40
Известняк, песчаник 1,50
Доломит, известняк крепкий, мрамор 1,60
Г ранит крупнозернистый, доломит крепкий 1,70
Гнейс, известняк весьма крепкий 1,80
Г ранит среднезернистый, диабаз 1,90
Гранит мелкозернистый, диорит, кварц 2,00
Базальт, габбро-диабаз 2,20
Если по условиям работы не требуется выбрасывать грунт, а нужно лишь разрушить, разрыхлить породу, в объеме, близком к объему воронки нормального выброса, то для этого необходим меньший заряд, чем для выброса. Согласно опыту Главвзрывпрома заряд нормального дробления равен примерно г/3 заряда нормального выброса:
Сдроб=1/<и73. (9.21)
О
Формула (9.21) справедлива для зарядов близ поверхности и фактически учитывает отражение от поверхности; при взрыве заряда камуфлета объем разрушенной породы будет меньше. Во всяком случае, при разрушении значительных объемов среды, в сотни раз превосходящих объем заряда, величина разрушенного объема пропорциональна полной энергии взрыва; это подтверждается прямыми опытами.
Заряды усиленного выброса рассчитывают по формуле
С=/Ш3/(п). (9.22)
За основу берут заряд нормального выброса, который умножают на функцию показателя действия взрыва f (п). Согласно М. М. Борескову
f (n;=o,4+(W, следовательно,
C = /<IV/3(0,4 + 0,6n3). (9.23)
$ 2. Формы, работы и баланс энергии при взрыве
459
Формулу (9. 23) обычно называют формулой Борескова. Опыт массовых взрывов на выброс, при которых значения W достигают нескольких десятков метров, а веса отдельных зарядов измеряются сотнями тонн и более, показал, что при таких ЛНС формула Борескова дает заниженные значения С.
Г. И. Покровский справедливо отметил, что формулы (9. 20) — (9. 23) фактически учитывают только объем грунта, который нужно сдвинуть с места; именно объем пропорционален W3. При выбросе, однако, этот грунт должен быть поднят на высоту, пропорциональную ЛНС, т. е. W. Поэтому казалось бы, что при соблюдении подобия вес заряда, необходимый для создания воронки с заданным п, должен был бы выражаться формулой
C=K'W3Wf{n)~K’Wif(n). (9.24)
По Покровскому, при WS’20 м вес заряда выброса определяется формулой
C=K1TU/7/2(14-n2)2, (9.25)
где Ki — постоянный коэффициент и Y — удельный вес горной породы.
Отметим, что если в формулу Борескова ввести простой дополнительный коэффициент (0,95+0,051Г), то формула
С=К (0,95 + 0,05 W) 1^(0,44-0,6п3) (9.26)
дает удовлетворительные результаты и при малых и при значительных W. Правую часть (9. 26) можно представить в виде суммы двух членов. Первый из них, включающий W3, соответствует бесполезной для выброса работе пластической деформации, сотрясения и т. п. Второй член, содержащий W74, пропорционален собственно работе выброса. С ростом W доля работы выброса быстро возрастает.
Обратимся к формам бризантного действия взрыва. Здесь нужно с самого начала отметить, что если вопрос об оценке общего действия взрыва сравнительно ясен, то по отношению к бризантному действию полной ясности еще нет.
Можно лишь отметить, что работа в форме бризантного действия, т. е. работа, совершаемая на границе заряда, в начальный момент расширения продуктов взрыва должна быть пропорциональна не полной энергии заряда, а плотности энергии во фронте детонациой-ной волны. В свою очередь плотность энергии во фронте детонационной волны пропорциональна давлению детонации, т. е. приближенно пропорциональна произведению poD2. В самом деле, мы видели (стр. 241), что рДет= -р-°— . С другой стороны, согласно (9. 7а)
Й+1 внутренняя энергия сжатого газа
k — 1
460
Гл. IX. Разрушающее действие взрыва
Полагая у=1, получим для энергии единицы объема
К этому нужно добавить, что кинетическая энергия единицы объема движущихся продуктов детонации p0ffi>2/2 также пропорциональна выражению PqD2. Поэтому полная энергия единицы объема продуктов детонации, взаимодействующих со средой и, в частности, при их отражении, с учетом движения продуктов должна быть также пропорциональна величине poD2, которой пропорционально как давление идущей детонационной волны, так и давление отраженной волны
Лтр«2,35Лет. (9.27)
Сильнейшее дробление — основная форма бризантного действия — зависит не столько от приложенной энергии, сколько от величины действующей силы. В противоположность распространенному мнению доля энергии, затрачиваемая даже на сильнейшее дробление, невелика. Для того чтобы разорвать твердое тело, нужно приложить большую силу, но действует эта сила на весьма малом пути — порядка молекулярных размеров. Поэтому величина работы, равная произведению силы на путь, получается весьма умеренной (значительной может получиться работа пластической деформации, сопровождающая дробление). Именно поэтому дробящее действие определяется скорее величиной давления и общая энергия, уходящая на все формы бризантного действия, невелика. Если давление невелико, то дробящее действие будет весьма слабым, хотя бы среде была сообщена весьма большая энергия. Только что сказанное не противоречит приведенному выше положению, что бризантное действие определяется плотностью энергии в детонационной волне. Мы уже видели, что плотность энергии и давление, развиваемое при детонации, как в случае идущей детонационной волны, так и при ее отражении пропорциональны и различаются на величину постоянного коэффициента.
Таким образом, мы приходим к выводу, что величина работы в формах бризантного действия приближенно определяется соотношением
Д3р=--№РоГА (9.28)
Если нас интересует величина не работы, а импульса (или его части) или же значение скоростей движения среды, граничащей с зарядом, то в качестве критерия действия взрыва следует принять параметр p0D. Этот же параметр является основным для определения величины импульса, который сообщает подставке (подкладке) открыто стоящий заряд. Такой случай часто называют местным действием взрыва.
$ 2. Формы работы и баланс энергии при взрыве
461
(9.29)
П. Ф. Похил и М. А. Садовский рекомендовали следующую формулу для оценки величины импульса, производимого местным действием взрыва открытого заряда на подставку.
S + 1 Sn где | — постоянный коэффициент;
С — вес заряда;
g — ускорение силы тяжести;
D — скорость детонации;
k — показатель политропы продуктов детонации;
SK—площадь контакта заряда с подставкой;
5П — полная поверхность заряда.
Основной характеристикой заряда в данном случае служит произведение CD. Для зарядов постоянного объема роль основной характеристики будет играть, очевидно, произведение роП.
Таким образом, можно отметить, что если величина работы в формах общего действия взрыва не зависит непосредственно от скорости детонации, то бризантное действие, определяемое свойствами продуктов детонации, зависит от ее скорости.
До сих пор как для местного, так и для бризантного действия мы по существу рассматривали вопрос об интенсивности действия, о степени проявления той или иной формы работы на заданном расстоянии от заряда постоянного объема. Предположим теперь, что не меняя параметров р0, D, k и т. д,, мы будем увеличивать объем заряда при условии сохранения подобия формы. Тогда объем, охваченный дробящим или местным действием заданной интенсивности, будет возрастать пропорционально объему заряда, т. е. пропорционально его весу. Таким образом, в отношении объема среды, охваченного разрушением заданной степени интенсивности, и общее, и местное, и дробящее действие не различаются; объемы разрушения пропорциональны объему заряда или его весу; линейные же расстояния до границы соответствующих разрушений должны быть пропор-з
циональны VС.
Остановимся на одном способе оценки бризантного действия, который имел широкое распространение. В свое время Каст предложил оценивать бризантное действие величиной «мощности» взрыва. Для вычисления «мощности» единицы объема Каст рекомендовал следующую формулу:
г А"?о t
где Л" — величина, пропорциональная произведению niRT — «удельной энергии»; t — продолжительность взрыва.
Величину 1/f Каст предложил заменить пропорциональным ей значением скорости детонации D. В результате бризантность по Касту
B^A"?0D.
462
Гл. IX. Разрушающее действие взрыва
Снитко видоизменил формулу Каста, Введя вместо А" удельную теплоту взрыва Qv, и положил f = ~ — (где —длина заряда), получив таким образом Qvfo^ выражение —-— .
Для заряда постоянного объема получим критерий Q?t>D, который, конечно, предпочтительнее выражения Каста. Иногда пытаются построить критерий, по существу близкий к критерию Снитко, в который вместо Qv входит величина работоспособности, определенная методом свинцовой бомбы (см. далее).
Не исключено, что для некоторых форм работы вблизи от заряда критерий Снитко или какой-либо другой, близкий к нему, может дать неплохие результаты, хотя бы потому, что он в некоторой мере является промежуточным между основной характеристикой общего действия (Q=CQ0) и характеристикой бризантного действия, в которую входит скорость детонации. Не следует, однако, пытаться использовать в качестве универсального критерий QvРnD, так же как и критерий с работоспособностью вместо энергии взрыва. Опыт показывает, что для таких важнейших форм работы, как разрушения, производимые ударными волнами, разрушения, производимые движением среды, выброс, дробление значительных объемов среды, расширение полости в среде, т. е. для всех форм общего действия, величина работы не зависит непосредственно от скорости детонации.
Для оценки общего действия детонирующих ВВ важны не различия в скорости детонации, а различия в запасе энергии данных систем. Поэтому критерий Qv?oD для форм общего действия неудовлетворителен. Точно так же этот критерий не является удовлетворительным в случае резко выраженного бризантного действия.
Для оценки действия взрыва необходимо прежде всего представлять условия, знать, какая именно форма работы требуется от взрыва в данном случае.
Если требуется работа в виде общего действия взрыва (ударные волны, движение, деформация, разрушение значительных объемов среды, выброс среды) , то основным критерием должна служить полная энергия Q~CQo или полная работа взрыва. Если требуется работа в виде бризантного или местного действия взрыва, то основным критерием должно быть произведение poD2 или PoD.
Возвращаясь к критерию QvPqD, отметим еще следующее обстоятельство. При выводе формулы исходят из выражения для мощности -^—,т. е. работы единицы объема в единицу времени. Время t, входящее в выражение для мощности, по существу равно времени совершения работы. Когда же заменяют t величиной 1/D, то тем самым полагают, что время t—-есть время распространения детонации по заряду. В действительности время совершения работы не равно времени распространения детонации и в общем случае даже нет прямой пропорциональности между этими величинами. Время совершения работы есть переменная, трудно учитываемая величина, зависящая не только от свойств ВВ, но и от свойств среды, характера производимой работы, условий взрыва. Отождествление этого времени со временем распространения детонации неоднократно приводило к серьезным ошибкам. Так, например, иногда неправиль-
§ 2. Формы работы, и баланс энергии при взрыве
463
Фиг. 9. 3. Зависимость давления продуктов взрыва от времени вблизи от заряда.
но полагали, что если удлиненный заряд инициировать одновременно в нескольких точках, уменьшив тем самым в несколько раз время распространения детонации, то мощность должна в несколько раз увеличиваться, что должно привести к соответствующему увеличению разрушающего действия, включая действие ударных волн. Этот вывод заведомо неверен; нужно, конечно, только учитывать, что за счет перераспределения энергии могут существенно возрасти Локальные эффекты в местах столкновения отдельных волн.
Поэтому в общем случае для количественной характеристики действия ВВ не следует пользоваться выражением для мощности, подсчитываемым указанными выше методами.
Принципиально задачу о действии взрыва вблизи от поверхности заряда можно было бы решить следующим образом. Представим себе объем среды, граничащий с поверхности заряда. Во время взрыва на этот объем действует переменное давление, начинающееся от ртах и затем быстро падающее (фиг. 9. 3). Если характер производимой работы таков, что она продолжается до полного падения давления (например, случай баллистического маятника), то в конечном итоге действие взрыва будет определяться всей кривой p(t) или же в простых случаях полным импульсом волны сжатия. Однако в общем случае нужно полагать, что данная форма работы (дробление, пластическая деформация) практически прекратится, когда давление упадет до некоторого значения р*, которое будет достигнуто в момент времени t*. Для оценки взрывного действия в этом случае нужно знать ход кривой p(t) в интервале ртгх—р*, а также граничное значение р*. Имея такие данные для разных точек среды, принципиально можно получить полное представление о разрушающем действии взрыва, о работе, скоростях, деформациях, разрушениях в разных точках среды.
К сожалению, на практике такой метод трудно осуществим. Прежде всего отсутствуют простые и надежные методы определения р (/) вблизи от заряда; весьма трудно оценить также граничные значения р*. Наконец если кривые нагрузок , действующих в различных точках, и были бы получены, 'то переход от нагрузок к деформациям, разрушениям и т. д. также был бы достаточно труден.
Суммируя изложенное выше, можно заключить, что для ряда форм работы, составляющих большую часть полной работы взрыва (общее действие), основным определяющим параметром являете?
зарядом или находящийся вблизи от
464
Гл. IX. Разрушающее действие взрыва
суммарная энергия взрыва. Плотность заряда для этих форм работы существенна лишь в том случае, если суммарная энергия зависит от плотности. Это имеет место тогда, когда объем заряда v задан и ограничен, например, корпусом снаряда или стенками шпура. В этих условиях вес заряда
и полная энергия будет равна
Q — CQ0 = povQo.
Для других форм работы (бризантное действие), непосредственно связанных с воздействием продуктов детонации на среду, весьма существенна плотность энергии во фронте детонационной волны. Из этого следует важный вывод, что при выборе ВВ для определенной задачи нужно учитывать условия и характер той основной работы, которая должна быть произведена. ВВ, весьма хорошее для одной задачи, может оказаться неудовлетворительным для другой. Если требуется произвести большое общее действие (ударные волны, выброс, раздутие «котла», разрушение значительных объемов среды), то большой должна быть общая энергия, или, следовательно, при одинаковом весе заряда максимально большой должна быть удельная теплота взрыва (точнее полная работоспособность). Некоторые ВВ с большой удельной теплотой взрыва могут обладать слабым бризантным действием. В качестве примера можно привести алюминийсодержащие смеси, общее действие которых значительно (большая энергия взрыва), а бризантное действие относительно слабое (из-за относительно малой скорости детонации этих ВВ).
Если требуется максимальное бризантное действие, то следует использовать ВВ с максимально большим значением произведения
poDta^-i-po-D2. В этом случае давление детонации и плотность
энергии во фронте детонационной волны будут максимальными; работоспособность же (общее действие) может при этом оказаться умеренной.
Понятно, существуют ВВ, которые могут обеспечить и весьма высокое общее и весьма высокое бризантное действие одновременно.
Рассмотрим в заключение этого раздела схему баланса энергии при взрыве. Такая схема приведена на фиг. 9. 4 в виде поточной диаграммы. В качестве исходной величины взята потенциальная химическая энергия взрыва ВВ, т. е. та максимальная энергия, которая способна выделиться при полном, наиболее благоприятном ходе взрывчатого превращения. Из-за возможности разброса непрореагировавшего ВВ (см. стр. 257), недостаточной полноты взрывчатого превращения, или диссоциации фактическая теплота взрыва может быть несколько меньше потенциальной на величину «химических потерь».
$ 3. Экспериментальные методы определения работы взрыва
465
В свою очередь фактическая теплота взрыва не может быть полностью превращена в работу даже при идеальном ходе процесса расширения. Разность между фактической теплотой и полной рабо-
той уместно назвать «тепловыми потерями».
На фиг. 9. 4 полная работа произвольно разделена на ряд потоков, представляющих собой отдельные формы работы взрыва. При
изменении условий взрыва и свойств ВВ величина отдельных потоков может увеличиваться и уменьшаться, исчезать полностью и появляться вновь. Как уже отмечалось выше, большая часть полной работы взрыва проявляется в виде общего действия; что же касается бризантного действия, то оно даже в случае наиболее бризантных ВВ составляет меньшую часть полной работы взрыва. Тем не менее в некоторых случаях нужно учитывать долю энергии, уходящую на бризантное действие. Если, например, основной задачей взрыва является выброс или рыхление больших объемов по-
Потенциальная хими-
~чёсная энергия взрыба
Полная теплота.
Взры&а
\У~~ Химические х— потери
Формы общего Формы бризантного действия взрыба и местного действия Взрыва
Фиг. 9.4. Схема баланса энергии при взрыве.
роды, то использование чрезмерно бризантного ВВ (при той же общей энергии) может
настолько увеличить количество энергии, уходящее на бризантное действие (сильнейшее, ненужное для практики дробление, интенсивная пластическая деформация вблизи от заряда), что заметно уменьшится количество энергии, идущее на выброс, или рых-
ление.
§ 3. ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ ОБЩЕЙ РАБОТЫ ВЗРЫВА
Согласно рассмотренным выше теоретическим положениям работа в какой-либо форме общего действия взрыва пропорциональна полной работе взрыва:
^общ
Такая теоретическая оценка величины работы может быть весьма полезной, однако естественно стремление получить значение соответствующей величины из опыта. Существуют многочисленные экс
466
Гл. IX. Разрушающее действие взрыва
периментальные методы оценки как полной работы, так и отдельных форм работы общего действия взрыва.
В нашем курсе будут рассмотрены следующие основные методы:
а) метод свинцовой бомбы;
б) метод баллистического маятника;
в) метод баллистической мортиры;
г) метод выброса;
д) метод, основанный на измерении давления воздушной ударной волны.
Метод свинцовой бомбы
Испытание в свинцовой бомбе является старейшим методом оценки работоспособности ВВ. Оно, в частности, широко распространено в Советском Союзе.
Принятая на II Международном конгрессе прикладной химии в качестве стандартной бомба Трауцля представляет собой массивный
цилиндр высотой 200 мм и диаметром 200 мм, отлитый из рафинированного свинца. Бомба имеет с одной стороны отверстие диаметром 25 мм, идущее по оси цилиндра на глубину 125 мм. На дно отверстия помещают заряд ВВ (обычно Ю г) с электродетонатором. Верх-
нюю часть отверстия, не занятую зарядом, засыпают песком (фиг. 9.5, а). После взрыва заряда в свинце получается характерное грушеобразное раздутие (фиг. 9.5, б). Величина это
а) 5)
Фиг. 9.5. Схема испытания в свинцовой бомбе для оценки работоспособности ВВ. а) бомба с зарядом, подготовленным к взрыву, б) бомба после взрыва.
го расширения в кубических сантиметрах, за вычетом начального объема цилиндрического отверстия (61—62 см3) и расширения, производимого электродетонатором, и является мерой относительной работоспособности ВВ. Для наиболее распространенных ВВ расширение свинцовой бомбы составляет от 300 до 500 слг3.
Этот простой и широко распространенный метод оценки работоспособности ВВ имеет следующие принципиальные недостатки:
1. Величина работоспособности получается не в абсолютных единицах (ккал, кгм и т. д.), а в некоторых условных числах.
2. По величине расширения непосредственно нельзя количественно сравнивать ВВ; можно только расположить их в некоторой последовательности. Если, например, одно ВВ дает расширение 250 см3, а второе 500 <?л«3, то нельзя заключить, что истинная рабо-
$ 3. Экспериментальные методы определения работы взрыва
467
Фиг. 9. 6. Зависимость величины расширения свинцовой бомбы от веса заряда аммонита № 6.
Верхняя кривая — заряд с учетом эквивалентного веса электродетонатора (1,1 г).
тоспособность второго ровно вдвое выше: заряды работают при разной степени расширения в неодинаковых условиях.
Изложим кратко метод относительной оценки истинной работоспособности по данным расширения в свинцовой бомбе, предложенный Беляевым и Курбангалиной. Метод предполагает использование зарядов постоянного объема и по существу сводится к определению эквивалентного заряда аммонита № 6, производящего такое же расширение, как заряд данного вещества весом С г. Это определение производится с помощью графика фиг. 9. 6.
На графике по оси ординат отложены веса зарядов аммонита № 6, а по оси абсцисс — производимые ими расширения. Изменение веса зарядов достигалось путем изменения плотности: удельная энергия взрыва аммонита № 6 практически не зависит от плотности. Нижняя кривая построена без учета влияния электродетонатора. Специальными опытами было показано, что в отношении производимого им расширения электродетонатор эквивалентен 1,1 г аммонита № 6. Верхняя кривая дает связь расширения с весом заряда с учетом влияния электродетонатора. Так, например, стандартный заряд аммонита № 6 весом 10 г дает расширение 390 см3. Учитывая влияние электродетонатора,
получим, что в действительности это расширение соответствует весу заряда 11,1 г. Заряд в 10 г без детонатора дал бы меньшее расширение. При стандартном методе в качестве расширения, образованного электродетонатором, вычитают 30 см3, что дает значение 360 сл«3, соответствующее стандарту. В действительности из сравнения двух кривых видно, что вычитать нужно 45 см3, и расширение, соответствующее «чистым» 10 г, было бы 345 см3. Поправка на влияние электродетонатора несколько изменяется в зависимости от величины расширения.
Предположим, что заряд ВВ весом С и работоспособностью А дает некоторое расширение ДУ. С помощью графика фиг. 9.6 определяем вес заряда Сэкв аммонита № 6 работоспособностью Аа, дающий такое же расширение. Если расширения одинаковы, то одинаковы и работы:
ЛС=ЛаСэкв,
468
Гл. IX. Разрушающее действие взрыва
откуда
A __ б*ЭКВ
Да~ С
Это отношение и является мерой работоспособности испытуемого ВВ.
Рассмотрим конкретный пример. Заряд тротила весом 10 г (плотность 1,0 г/см3) вместе с электродетонатором дает расширение 305 <?лг3. С помощью нижней кривой (см. фиг. 9. 6) находим, чтс такое же расширение дают 8,0 г аммонита № 6*. Таким образом, 10 г тротила эквивалентны 8 г аммонита № 6, откуда
лтнт Сзкв 8 8
Да ^ТНТ Ю
В данном случае отношение истинных работоспособностей мало отличается от непосредственного отношения расширений (0,76— 0,77). ОднаКо при значительном отличии работоспособностей разница может получиться существенной.
Аналогичным образом можно определить относительную работоспособность любого ВВ, причем испытуемый заряд не обязательно должен весить 10 г. Важно только, чтобы объем заряда был постоянным и равным 10 сл«3.
В табл. 9. 3 приведены данные о величинах расширения в свинцовой бомбе для стандартных зарядов (10 г) некоторых ВВ, а также соответствующие значения эквивалентных зарядов аммонита № 6. ВВ расположены в порядке возрастания расширений. В этой же таблице приведены значения относительных работоспособностей по данным испытаний в свинцовой бомбе (столбец 4) и значения относительных «теоретических» полных работоспособностей (столбец 5), взятых из табл. 9.1. В обоих случаях работоспособность аммонита № 6 принята за 100.
При сравнении столбцов 4 и 5 можно видеть, что совпадения значений относительных работоспособностей, найденных расчетом, со значениями, полученными при испытании в свинцовой бомбе, в большинстве случаев являются хорошими. Значительные расхождения дают лишь алюмит № 1 и 62%-ный динамит, что может быть легко объяснено.
В заключение отметим, что путем проведения простых калориметрических измерений можно опытным путем определить абсолютную величину работы, производимой в бомбе. По данным Беляева и Курбангалиной, в зависимости от ВВ и степени расширения абсолютная величина работы, производимой в бомбе, составляет от половины до двух третей исходной энергии (тепл'оты) взрыва, что вполне согласуется с теоретическими расчетами.
* Электродетонаторы одинаковы; поэтому сравнение можно вести по нижней кривой Сез учета действия электродетонатора.
$ 3. Экспериментальные методы определения работы взрыва
469
Таблица 9.3
Величина расширений при взрыве зарядов весом 10 г в свинцовой бомбе для некоторых ВВ и эквивалентные заряды аммонита № 6
ВВ Расширение ДУ (полное, без поправок на электродетонатор) см3 Эквивалентный заряд аммонита № 6 г Относительная работоспособность по данным испытания % Относительная полная работоспособность по теоретическому расчету %
1 2 3 4 5
Предохранительный аммонит К» 8 270 7,2 72 65
Тротил (р=1,0) 305 8,0 80 81
Аммонит № 9 350 9,0 90 93
Динамон Д 350 9,0 90 91
Аммонит № 6 390 10,0 100 100
Тетрил 390 10,0 100 —
62%-ный динамит 410 10,4 104 115
Алюмит № 1 430 10,8 108 118
Гексоген (р = 1,0) 495 12,2 122 126
Тэн 500 12,3 123 —
Простой аммонал 540 13,2 132 134
Метод баллистического маятника
Основой баллистического маятника является груз на подвесах, обладающий значительным периодом собственных колебаний. При воздействии на маятник потока продуктов взрыва или ударной волны он получает некоторое количество движения и отклоняется на некоторый угол. Баллистические маятники всевозможных конструкций часто применяли для измерения импульса продуктов взрыва или ударной волны. Схема наиболее часто применяемой конструкции приведена на фиг. 9.7. Действие взрыва воспринимается торцом носка маятника; основная масса 1 защищена от непосредственного воздействия продуктов взрыва и ударной волны щитом 5. Заряд ВВ 3 взрывают на определенном расстоянии от торца носка маятника, а иногда прямо на носке.
Существует иная конструкция баллистического маятника (фиг. 9. 8). Взрыв заряда производят в массивной мортире, срез дула которой находится в непосредственной близости от корпуса маятника; отклонение маятника производится газами взрыва, выле-
170
Гл. IX. Разрушающее действие взрыва
Фиг. 9.7. Схема баллистического маятника для определения импульса продуктов взрыва или ударной волны.
/—груз маятника, 2—«носок» маятника,
3—испытуемый заряд ВВ. 4—устройство для измерения отклонения, 3—щит.
тающими из дула мортиры, (данное устройство не следует смешивать с баллистической мортирой, которая будет описана ниже).
При испытании некоторого ВВ обычно определяют такой его заряд, который дает то же отклонение, что и заряд некоторого стандартного ВВ весом 200 г. Достоинством метода является то, что испытываются значительные веса зарядов (около 200 г). Однако маятник такого типа не дает возможности оценить абсолютные значения работы, да и относительные значения из-за сложности условий, малой и неопределенной степени расширения продуктов взрыва могут отличаться от истинных.
Возвратимся к маятнику, схема которого изображена на фиг. 9.7. Если маятник под действием взрыва отклонится на угол ср, то величина импульса, воспринятого носком маятника, будет равна
(9.30)
где М — масса маятника;
I — длина подвеса;
g — ускорение силы тяжести.
Формула справедлива для углов д не более 15— 20°. Вместо измерения угла <р можно измерять
Фиг. 9. 8. Схема баллистического маятника для определения относительной работоспособности.
I—груз маятника, 2—подвесы, 3—мортира, 4—заряд ВВ, 5—устройство для измерения отклонений.
горизонтальное перемещение маятника х. Мож-но легко показать, что для малых углов импульс определится соотноше-
нием
2-т
(9.31)
где Т — период колебаний маятника.
§ 3. Экспериментальные методы определения работы взрыва
471
От значений импульсов можно в принципе перейти к значениям энергии на базе известного соотношения между энергией движения и величиной импульса:
2М ’
(9.32)
где /г — высота подъема маятника.
На основе выражения (9. 32) можно оценить энергию, передаваемую носку маятника, и отсюда вычислить суммарную энергию ударной волны. К сожалению, практическое использование этого метода требует преодоления многих трудностей; в частности, необходимо существенно уточнить вопрос о связи импульса при отражении с импульсом идущей ударной волны.
Метод баллистической мортиры
—в®
газы вна-не произ-занимают камеры.
Схема баллистической мортиры работоспо-
Баллистическая мортира (фиг. 9. 9) является разновидностью баллистического маятника; ее конструкция специально приспособлена для определения работоспособности. Массивный корпус мортиры подвешен на тросах в виде маятника. В корпусе имеется взрывная камера объемом пВЗр, в которой подрывается заряд, и «расширительная» камера объемом Ураош, в которой перед взрывом помещают массивный стальной поршень-снаряд. При детонации заряда (весом обычно 10 г) чале, практически водя работы, объем взрывной Давление их при этом существенно снижается, внутреннюю же их энергию и температуру, как мы видели, можно считать практически постоянными. Работа взрыва в условиях баллистической поршня-снаряда. Когда снаряд вылетит (т. е. когда его задний торец пройдет сечение среза мортиры), газы взрыва вырвутся на воздух и работа в системе мортира—снаряд прекратится.
Специальными измерениями было установлено, что от момента взрыва до момента вылета снаряда проходит 5—10 мсек; это время сравнительно велико; оно во всяком случае в 20—30 раз больше вре
Фиг. 9.9.
для определения абсолютной собности.
/_корпус мортиры. 2—поршень-снаряд. 3—взрывная камера с зарядом ВВ.
мортиры состоит в выталкивании
472
Гл. IX. Разрушающее действие взрыва
мени расширения продуктов взрыва заряда (весом 10 г) в воздухе до атмосферного давления.
Величина работы, произведенной в мортире, определится по формуле
а,- 41 -(—?—У'1]- (9-33)
L \ ^взр i ^расш / J
С другой стороны, значение Дм может быть определено из опытов по отклонению мортиры.
Суммарная механическая энергия Ем, полученная при взрыве системой мортира—снаряд, равна
ЕЧ==Х,4.£С=Е^1 +4\ (9.34)
\ /
где Ем — кинетическая энергия самой мортиры;
Ес —энергия снаряда.
Далее,
= (9.35)
где J — момент инерции маятника;
ю — угловая скорость маятника.
В свою очередь
Ес==-i-mzz2, (9.36)
где m— масса снаряда; и—скорость снаряда.
Определить опытным путем механическую энергию Ем' легче, чем энергию снаряда Ес, поэтому исключим Е„, приняв во внимание, что моменты количества движения мортиры и снаряда должны быть равны:
Jm—mtir, (9.37)
где г — расстояние оси взрывной камеры до точки подвеса.
Обычно мортиры конструируют так, что ось взрывной камеры проходит через центр тяжести маятника. Тогда г=1, где I — расстояние от центра тяжести до точки подвеса.
Из выражений (9. 35) — (9. 37) получаем
£с _ J
Е' тг2 ’ м
или
£«=£“(1+^>
(9.38)
§ 3. Экспериментальные методы определения работы взрыва
473
Очевидно, что
E^—Mgh, (9.39)
где h—высота подъема центра тяжести мортиры.
Если ф — угол отклонения, то
= — cos <?); (9.40)
E'M—Mgl(\ — cost?). (9.40а)
Следовательно, полная энергия системы
EK—Mgl(l +-“)(! ~cos?).
Обозначая
окончательно получим
Ам=Дм=Д0(1-соз?). (9.41)
Для мортиры заданной конструкции величина Ео является постоянным параметром.
Таким образом, при помощи баллистической мортиры можно определить абсолютную величину работы взрыва. Сопоставляя полученное значение с теоретическим [формула (9. 33)], можно уточнить отдельные параметры теоретической формулы, например величину 1г.
Если объем взрывной камеры достаточно велик и имеется устройство для улавливания снаряда (ящик с глиной), баллистическая мортира, не разрушаясь, может выдержать сотни взрывов. При строгом постоянстве условий отдельные опыты в мортире дают разброс результатов менее 1 %.
К сожалению, опыт применения баллистической мортиры показывает, что действительный характер работы взрыва в мортире, по-видимому, отличается от идеального. Перечислим некоторые «скрытые» недостатки мортиры, которые снижают ее ценность как прибора для определения абсолютной работы взрыва.
1. Объем взрывной камеры мортиры обычно довольно велик (по отношению к весу заряда) — в противном случае камера быстро
PTOnm.r _„ VB3p-p^P асш
разрушится. Поэтому степень расширения —-— ------- невелика
^взр
(обычно меньше, чем в свинцовой бомбе); давление даже в начальной стадии относительно мало.
2. При изменении расположения заряда в камере (прочие условия неизменны) величина отклонения маятника несколько меняется.
3. Алюминийсодержащие ВВ (а также, вероятно, и другие ВВ с аналогичными свойствами) дают в условиях мортиры явно’ зани
474
Гл. IX. Разрушающее действие взрыва
женные значения работы; это можно объяснить исходя из общих положений о работе взрыва с учетом того, что степень расширения в мортире относительно мала. Так, в баллистической мортире со степенью расширения
gB3p + Грает ~ g 25 ^взр
получено, что работоспособность простейшего аммонала (смесь порошка алюминия и аммиачной селитры) в условиях мортиры равна 334 ккал/кг, а работоспособность аммонита № 6 310 ккал)кг. Таким образом, по данным испытания в мортире работоспособность аммонала лишь в 1,08 раза выше работоспособности аммонита № 6. В то же время отношение энергий взрыва равно 1,53, а отношение расчетных полных работоспособностей (при расширении до атмосферного давления) около 1,34.
Кажущееся расхождение опытных и вычисленных значений легко объяснить: при малом расширении относительная работоспособность аммонала, обладающего низким значением k, значительно снижается (это обстоятельство непосредственно видно из графика фиг. 9. 1; чем меньше степень расширения, тем больше относительное различие значений A„/Q для разных k). Если подсчитать теоретическое отношение работоспособностей аммонала и аммонита № 6 при степени расширения 8,25, с учетом различия показателей адиабаты, то оно окажется равным ~ 1,10, т. е. практически совпадет с опытным значением. Таким образом, малые показатели аммонала при испытании в баллистической мортире просто объясняются малой степенью расширения газов взрыва, поэтому неправильно объяснять относительно малую работу аммонала в мортире медленным горением алюминия (а такие попытки иногда делались). Если данные, получаемые для аммонала при испытании в мортире, пересчитать на большие расширения (в частности, на расширения до атмосферного давления), то мы получим значение, соответствующее работоспособности, вычисленной из общих положений. Понятно, что необходимость такого пересчета несколько обесценивает метод баллистической мортиры.
Таким образом, хотя баллистическая мортира теоретически является идеальным прибором для измерения работы взрыва, ее практическое использование затруднено рядом указанных выше обстоятельств.
Оценка работоспособности по воронке выброса
Величина воронки, образованной взрывом в грунте, непосредственно определяет ту форму работы, которая называлась фугасным действием. Выше (см. стр. 457) было указано, что объем воронки выброса зависит от веса и расположения заряда, свойств ВВ и от свойств среды.
$ 3. Экспериментальные методы определения работы взрыва
475
Вес заряда C—Kvf(n), где Д’ зависит как от свойств среды, так и от свойств ВВ (v — объем выброса). Значение К в формулах (9.20) или (9.22), очевидно, представляет собой удельный расход ВВ, т. е. расход ВВ на единицу объема выброшенной породы, приведенный к п=1. Если взрывы производят с соблюдением подобия и при постоянстве свойств грунта, то изменение удельного расхода может быть вызвано лишь изменением работоспособности ВВ. Поэтому в том случае, когда для одного ВВ получено значение Ку, а для другого Дг. то ориентировочно отношение их работоспособностей “ Сравнение необходимо' проводить при возможно близ-
Л2 Ку ких значениях п.
Метод воронок ценен тем, что он позволяет испытывать заряды значительного веса в условиях практического использования.
Недостатки метода заключаются в плохой повторяемости и малой точности. При проведении опытов свойства грунта даже на соседних участках могут несколько различаться; существенным является изменение влажности и других трудноучитываемых факторов. Объем выброшенного грунта обычно определяют изменением линейных размеров воронки, а поскольку объем пропорционален кубу линейных размеров, то небольшая ошибка в их измерении может дать значительную ошибку в оценке объема. Так как ©•шибка отдельного опыта может быть значительной, необходимо проводить большое количество опытов, оформление которых сложнее, чем. проведение лабораторных испытаний. Поэтому метод воронок по существу является итоговым полевым испытанием; ему должны предшествовать предварительные опыты с использованием свинцовой бомбы или другого лабораторного метода.
Метод оценки работоспособности по воздушной ударной волне
Этот метод основан на измерении избыточного давления Apj, на фронте ударной волны и определении тротилового эквивалента по закону подобия. В гл. VI было указано, что для тротила установлена однозначная зависимость между величиной избыточного давления и приведенным расстоянием Ару-f(R). Вид функции f известен. Предположим, что мы взяли заряд ВВ весом С с неизвестной работоспособностью Ах. Предположим далее, что на расстоянии R мы измерили давление на фронте волны, равное Ар/. При использовании тротила это давление Ар/ на том же расстоянии R было бы достигнуто на приведенном расстоянии
j/^THT
476
Гл. IX. Разрушающее действие взрыва
Откуда
Ств'“(тУ-
Определив таким образом заряд тротила, который дает то же Др', что и испытуемый заряд весом С, мы можем определить работоспособность заряда:
Лл==Дтнт-£^1. (9.42)
Преимуществом этого метода, так же как и метода воронок, является возможность применения весьма крупных зарядов. Недостатки этого метода заключаются в необходимости весьма точно измерять Api! небольшая ошибка, допущенная при измерении Дрь может дать существенную ошибку в оценке Сэкв. Кроме того, при взрыве на воздухе небольших зарядов суррогатированных ВВ с малой скоростью химического превращения необходимо вводить поправку на разброс ВВ.
Можно отметить, что описанный метод оценки относительной работоспособности по воздушной ударной волне еще не является стандартным и распространенным методом, но его использование становится все более широким.
Все описанные методы оценки общего действия взрыва дают возможность оценить работоспособность ВВ, если даже измеряется только какая-либо частная форма общего действия взрыва (как, например, при методе выброса). При заданных постоянных условиях и соблюдении подобия величина работы в данной частной форме составляет определенную долю полной работы. Полученные значения относительных работоспособностей могут быть использованы для оценки полной работоспособности.
§ 4. ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ ОЦЕНКИ БРИЗАНТНОГО И МЕСТНОГО ДЕЙСТВИЯ ВЗРЫВА
1. Оценка импульса местного действия взрыва
Наилучшим методом оценки местного действия является метод баллистического маятника. При этом методе заряд, местное действие которого необходимо оценить, располагают непосредственно на носке баллистического маятника так, как показано на фиг. 9. 10. Экспериментальное значение импульса местного действия взрыва рассчитывают по измеренному отклонению по формулам (9.30) и (9.31).
В результате обширных исследований П. ф. Похил и М. А. Садовский установили связь между величиной импульса, фиксируемого по отклонению маятника, и основными характеристиками заряда и рекомендовали приведенную выше формулу (9.29) для оценки импульса местного действия взрыва.
$ 4. Экспериментальная оценка бризантного действия взрыва
477
Из этой формулы следует, что для получения максимального местного действия открыто стоящих зарядов величина SK/Sa — отношение поверхности заряда, примыкающей к разрушаемому объекту,
Фиг. 9. 10. Схема баллистического маятника для оценки местного действия взрыва.
/—носок маятника, 2—стальная пластинка, <?—заряд ВВ.
Фиг. 9.11. Форма зарядов, обеспечивающих увеличенное местное действие взрыва в направлении, показанном стрелкой.
/—точка инициирования.
ко всей поверхности заряда — должна быть возможно большей. Для получения максимального местного действия открыто стоящих зарядов уместно, в частности, придавать им формы, изображенные на фиг. 9. 11.
2. Оценка бризантного действия взрыва
Наиболее простым и распространенным методом испытания на бризантность является проба на обжатие свинцовых столбиков, или проба Гесса (см. ГОСТ 5984—51).
Для испытания применяют свинцовый столбик высотой 60 мм и диаметром 40 мм. На столбике помещают стальную пластинку толщиной 10 мм и диаметром 41 мм. На стальную пластинку ставят заряд ВВ. При стандартных испытаниях вес заряда составляет 50 г; навеску подпрессовывают в бумажном цилиндрическом патроне диаметром 40 мм: обычно подпрессовку производят грузом в 1 кг в течение 2 мин. При этом для разных ВВ получаются несколько различные плотности. Правильнее прессовать заряд до постоянной плотности, например р0=1,0. Одновременно с подпрессовкой формируют отверстие под капсюль-детонатор глубиной 15 мм. Для центровки капсюля-детонатора поверх ВВ обычно помещают картон ный кружок с отверстием. Свинцовый столбик с пластинкой и зарядом располагают на массивной стальной подставке.
На фиг. 9. 12 дана схема всего устройства, подготовленного ко взрыву. При взрыве свинцовый столбик деформируется, приобретая характерную грибообразную форму (фиг. 9, 13).
478
Г л. IX. Разрушающее действие взрыва
Мерой бризантности является обжатие столбика, т, е, разность между средними его высотами до и после взрыва, выраженная в мм. При стандартном испытании проба Гесса дает показания, приведенные в табл. 9. 4.
Нужно отметить, что обжатие столбика, особенно в случае аммонитов и динамоиов, сильно зависит от степени измельче
Фиг. 9. 12. Схема подготовки опыта для оценки, бризантного действия по обжатию свинцового столбика (проба Гесса).
/—свинцовый цилиндр, 2—стальная пластинка. 3—заряд ВВ с электродетонатором, 4—стальная подставка.
Таблица 9.4
Результаты испытаний по пробе Гесса
ВВ Обжатие в мм
Тетрил 20—22
Тротил 16
Аммонит № 6 14—15
Аммонит № 9 11—13
Динамоны 10—12
ния компонентов ВВ. При весьма тщательном измельчении динамона мо-
жет быть получено обжа-Фиг. 9.3. Фор- тие порядка 15—17 мм; ма свинцового напр0ТИВ грубо измель-столбика, об- v
жатого взры- ченныи динамон дает го-вом. раздо меньшее обжатие.
Исключительная просто-
та выполнения пробы Гесса обусловливает широкое ее использование в качестве испытательной приемочной пробы для смесей, особенно промышленных взрывчатых веществ. Аммонит № 6 (см. табл. 9.4) должен иметь бризантность по пробе Гесса 14—15 мм. Предположим, что, испытывая аммонит определенной партии, мы получили бризантность 10 мм. Очевидно, что данная партия не соответствует стандарту. Эта партия или была изготовлена с пониженными свойствами (например, из-за недостаточного измельчения и смешения), или же ухудшила свои взрывные свойства пли хранении (увлажнение, слеживание).
Проба Гесса, будучи незаменимой в качестве приемочной пробы, как метод оценки бризантности имеет существенные недостатки. Основные из них следующие.
1. Конечный результат дается не в единицах энергии или работы, например работы деформации свинцового столбика, а в единицах длины. При этом очень важно подчеркнуть, что по мере
$ 4. Экспериментальная оценка бризантного действия взрыва
479
обжатия сопротивление свинцового столбика возрастает и поэтому обжатие (усадка) столбика нелинейно связано с величиной работы деформации. Если обжатие возрастает вдвое (например, 20 мм вместо 10 мм), то работа обжатия возрастает не менее чем в 3 раза.
2. Обжатие в условиях пробы Гесса иногда в значительной мере определяется детонационной способностью ВВ, величиной его критического диаметра.
Сравним, например, гексоген и какой-либо промышленный аммонит. Обозначим максимальную скорость детонации, достижимую для данного ВВ при данной плотности, через D *. При сравнении гексогена и аммонита первый должен дать большее обжатие уже в силу того, что D *гекс >D *аммоиита . Однако в условиях пробы Гесса разница получится еще больше. Дело в том, что критический диаметр гексогена очень мал (1—2 мм) и поэтому заряд диаметром 40 мм детонирует со скоростью детонации, равной максимальной D =D * £-'гекс гекс *
Критический диаметр аммонита в зависимости от состава и степени измельчения может быть равен 10—20 мм, поэтому для заряда диаметром 40 мм скорость детонации аммонита будет меньше максимальной Г)аммоИ <£) *аммои; кроме того, аммонит будет иметь значительный участок «разгона» детонации. Поэтому сравнение эффектов открыто стоящих зарядов гексогена и аммонита диаметром 40 мм может дать неправильное представление об эффектах в других условиях. Так, например, в условиях шпура скорость детонации гексогена практически останется прежней, а скорость детонации аммонита может существенно возрасти. Конечно, и в условиях шпура гексоген будет давать больший бризантный эффект, чем аммонит, но разница между ними будет меньше, чем это получается при сравнении открыто стоящих зарядов.
3. Использование стандартной пробы Гесса возможно лишь при низких бризантностях. Если взять мощные полноценные ВВ (тэн, гексоген и т. д.), то применение пробы затруднительно уже при р — 1,0 и становится совершенно невозможным при значительных плотностях, т. е. как раз при тех плотностях, при которых бризантное действие проявляется с наибольшей интенсивностью и представляет особенно большой интерес. Дело в том, что при значительной бризантности стальная пластинка разрушается, что в свою очередь ведет к сильнейшему разрушению свинцового столбика, который превращается в изорванную бесформенную массу. Для того чтобы избежать этого, иногда берут более толстую пластинку (20 мм) или же две стандартных пластинки, или же вместо стандартного заряда весом 50 г берут заряд в 25 г. При этом обжатия, естественно1, получаются значительно меньше.
Рассмотрим вкратце некоторые вопросы, связанные с теорией и условиями работы свинцового столбика пробы .Гесса. Похилом
480
Гл. IX. Разрушающее действие взрыва
и Садовским было показано, что действительную работу деформации свинцового столбика можно приближенно оценить величиной
Дй Дй а =-------= —
й0—Дй йк
где Ай — общатие столбика;
й0 — начальная высота;
йк — конечная высота свинцового столбика.
(9.43)
Функция а возрастает быстрее, чем Ай, и учитывает увеличение
сопротивления
Фиг. 9.14. Схема подготовки опыта для оценки бризантного действия по пробе Каста.
/—медный крешер, 2-—подставка, 3~ направляющая муфта , 4—цил индрический поршень, 5~ стальная пластинка. 6—свинцовая пластинка, 7—заряд ВВ.
столбика по мере обжатия. Использование величины а в качестве показателя «истинной» бризантности более обосновано, чем непосредственная оценка ее по величине обжатия Ай.
Обратим внимание на то обстоятельство, что внешне один и тот же вид работы — пластическая деформация свинца в условиях бомбы Трауцля является характеристикой работоспособности, характеристикой общего действия, а в условиях пробы Гесса — характеристикой бризантности.
Иногда в случае ВВ с малой детонационной способностью, дающих отказ в условиях пробы Гесса, заряд помещают в стальную оболочку. При наличии такой оболочки величина обжатия определяет нечто промежуточное между общим и бризантным действием. В пределе, если поместить заряд в весьма массивную оболочку, т. е. в условия, когда отсутствует разлет продуктов в воздух и в системе выделится большая часть полной работы взрыва, величина обжатия свинцового столбика резко возрастет и будет определяться работоспособностью заряда.
В последнее время деформацию свинцовых столбиков часто используют для характеристики детонационной способности, характеристики мощности инициирующего импульса и т. п., при этом работают с зарядами, значительно более длинными, чем стандартные заряды пробы Гесса. Если даже заряд не способен к устойчивой детонации, то мощный инициатор способен «прогнать»
затухающую детонацию на большее расстояние, что весьма удобно и просто фиксируется обжатием столбика.
На фиг. 9. 14 дана схема другого метода определения бризантного действия с помощью бризантометра Каста.
Действие взрыва заряда через относительно массивный стальной поршень передается медному крешеру, вызывая его деформа-
£ 5. Кумулятивное действие взрыва
481
цию; величина обжатия крешера и является характеристикой бризантного действия. Так же как и в условиях пробы Гесса, по мере обжатия крешера сопротивление последнего возрастает. Поэтому с увеличением обжатия «истинная» бризантность возрастает быстрее, чем само обжатие.
При испытании используют заряды постоянного объема диаметром 21 мм и высотой 80 мм. С помощью бризантометра Каста можно измерять бризантность мощных ВВ высокой плотности.
Для оценки бризантного действия применяют также некоторые другие методы, кроме описанных выше. Из них можно отметить пробу на дробление оболочки. Заряд ВВ в оболочке (например, в корпусе артиллерийского снаряда) подрывают в песчаной яме. После подрыва собирают осколки и сортируют их по весу. Чем интенсивнее дробление, чем больше суммарный вес мелких осколков, тем более бризантным является заряд ВВ. Нужно отметить, что степень дробления существенно зависит от материала оболочки, поэтому если желательно данные испытания использовать для оценки свойств заряда, то испытание нужно проводить с оболочками строго постоянных свойств.
Оценку дробящего действия можно также получить из данных о величине вмятин в плитах, из данных по пробиванию стальных пластин и т. д. При условии стандартизации объемов зарядов, а также свойств и размеров используемых плит эти методы, являясь по существу сугубо качественными, несомненно, могут дать некоторые ориентировочные данные и для количественной оценки дробящего действия ВВ.
§ 5. КУМУЛЯТИВНОЕ ДЕЙСТВИЕ ВЗРЫВА
Выше были рассмотрены обычные формы работы, возникающие при взрыве практически любого заряда. Существуют, однако, специфические формы работы взрыва, получающиеся при детонации зарядов особого устройства. В качестве примера рассмотрим так называемое кумулятивное действие (от латинского слова cumula-tio — увеличивать, суммировать, накоплять). Сущность явления заключается в повышении действия взрыва заряда в определенном направлении.
В гл. VI было указано, что вблизи от заряда действие взрыва зависит от формы заряда. Так, в случае заряда кубической формы в направлении сторон куба действие значительно сильнее, чем в направлении углов. Уже на этом примере мы встречаемся с направленным взрывным действием, вызванным тем, что продукты взрыва в начальной стадии движутся перпендикулярно поверхностям заряда. В кумулятивном действии эффект направленности взрыва проявляется особенно сильно и рельефно.
На фиг. 9. 15, о изображен заряд в форме бутылки, поставленной на стальном цилиндре. Рисунок выполнен в масштабе, и основные
482
Гл. IX. Разрушающее действие взрыва
размеры указаны в мм. В качестве ВВ был использован пентолит
(сплав тротила и тэна); вес заряда 150 г. После взрыва (иницииро-
вание производили сверху) в стали образовалась вмятина, показанная на фиг. 9. 15, а (в разрезе) зачерненной областью.
На таком же стальном цилиндре взорвали заряд, имеющий коническую выемку, обращенную к поверхности стали (фиг. 9. 15, б). На-
ружные размеры заряда прежние, но вес его уменьшился до 115 г.
Фиг. 9. 15. Действие на стальную подставку сплошного заряда (а), заряда с кумулятивной выемкой (б) и заряда с кумулятивной выемкой при наличии облицовки (е).
1—заряд, 2—отверстие в стальной подставке, образованное взрывом, 3—стальная подставка, 4—металлическая облицовка.
Казалось бы, что действие такого заряда должно быть слабее, чем сплошного: вес заряда меньше, причем удалена именно та часть заряда, которая непосредственно примыкает к стальному цилиндру и. в случае взрыва сплошного заряда является наиболее активной. В действительности действие заряда с выемкой оказывается более интенсивным, как это можно видеть по вмятине (зачерненная область на фиг. 9. 15, б). После взрыва заряда с конической вы-
емкой глубина полученной вмятины примерно в 4 раза больше, чем от сплошного заряда. Такое усиление действия взрыва в заданном направлении, осуществляемое зарядом определенной формы, и называют кумулятивным действием, а соответствующие заряды — кумулятивными зарядами. Иногда термин «кумулятивное действие» применя-
ют также к эффектам, производимым комбинацией нескольких
зарядов.
Кумулятивное действие проявляется наиболее сильно, если на внутренней поверхности конической выемки поместить тонкий слой металла. На фиг. 9. 15, в показан результат аналогичного опыта с зарядом, кумулятивная выемка которого облицована сталью толщиной 0,6 мм. Пробоина в стали (показана в разрезе зачерненной областью) имеет несколько меньший диаметр, но глубина ее примерно в 4 раза выше глубины выемки от кумулятивного заряда без облицовки и, следовательно-, примерно в 16 раз больше глубины вмятины, полученной от сплошного заряда. Нужно отметить, что наибольшая глубина, в случае заряда с облицовкой, получается тогда, когда он расположен не на самой поверхности пробиваемой мишени, а на небольшом расстоянии, как показано на фиг. 9. 15, в.
Кумулятивные заряды с металлической облицовкой имеют исключительно большое практическое значение, поэтому как при экспериментальных, так и при теоретических исследованиях явления кумуляции основное внимание было обращено именно на эти за
ряды.
§ 5, Кумулятивное действие взрыва
483
На фиг. 9. 16 показаны последовательные стадии процесса обжатия детонационной волной металлической облицовки конической кумулятивной выемки. Детонационная волна распространяется слева направо. Под действием давления детонационной волны облицовка начинает двигаться к центру, как бы обжимаясь и смыкаясь. После смыкания вещество облицовки делится на две части, роль которых существенно различна. Слева от точки смыкания («узла») из наружных слоев облицовки образуется «пест» 2 (или стер,жень), в ко
Фиг. 9. 16. Последовательные стадии формирования кумулятивной струи. 1—положение фронта детонации, 2—пест, 3—струя.
торый переходит большая часть массы облицовки. Пест (стержень) не играет какой-либо роли в пробивающем действии. Справа от точки смыкания из внутренних слоев облицовки образуется кумулятивная струя 3 — струя металла, движущегося с большой скоростью направо. Именно, эта струя, несмотря на то, что ее масса невелика, обеспечивает пробивание преград значительной толщины.
На фиг. 9. 16 в кадрах а, б, в и г слева направо схематически показан процесс формирования струи и песта по мере распространения Детонации. На кадре а детонационная волна начала обжимать вершину конуса, на кадре в детонационная волна прошла конец заряда, на кадре г показано дальнейшее развитие явления, некоторое время спустя после того, как детонационная волна прошла конец заряда. Такие последовательные снимки процесса формирования кумулятивной струи могут быть получены (и неоднократно получались) при помощи импульсной рентгеновской съемки, т. е. установки, даюшей мощный весьма кратковременный импульс рентгеновского излучения. Если между рентгеновской трубкой и фотопластинкой находится изучаемый объект, то на пластинке будет запечатлено мгновенное распределение масс.
Проведя несколько подрывов совершенно аналогичных объектов, но снимая в разные моменты (от начала взрыва), можно получить полное представление о развитии явления во времени. Импульсная рентгеновская съемка весьма эффективна при исследовании таких явлений, как например, разрыв снаряда и начальная стадия разлета осколков, и особенно эффективна при исследовании явления кумуляции. Были использованы также разные оптические методы, но в данном случае их возможности ограничены.
484
Гл. IX, Разрушающее действие взрыва
Обратимся к теории явления. Разработана гидродинамическая теория кумулятивных зарядов с облицовкой, рассматривающая материал облицовки как идеальную несжимаемую .жидкость. Впервые решение задачи было дано М. А. Лаврентьевым; оно же является наиболее строгим. Несколько позднее вопросы теории кумуляции менее строго были рассмотрены рядом американских исследователей. Изложим вкратце некоторые основные положения и выводы гидродинамической теории кумуляции. На фиг. 9. 17, а дано сечение кумулятивного заряда с металлической облицовкой. Из этого сечения может быть получен клинообразный
Фиг. 9. 17. Схема кумулятивного заряда (а) и образования струи (б).
/—положение фронта детонации.
кумулятивный заряд — параллельным переносом перпендикулярно оси симметрии или конический — путем вращения сечения вокруг оси симметрии. Дальнейшие выводы, строго говоря, будут относиться к клинообразному заряду. К коническому заряду их можно применить лишь при условии, что толщина конической облицовки уменьшается от вершины конуса к основанию таким образом, что масса оболочки на единицу длины( вдоль оси симметрии) остается постоянной. Впрочем, с некоторой погрешностью изложенные ниже выводы могут быть применены и к коническому заряду с постоянной толщиной слоя
конической облицовки. Важной характеристикой облицовки являет-
ся угол а между стороной клина (образующей конуса) и осью сим
метрии.
На фиг. 9. 17, б схематически показан процесс разрушения облицовки кумулятивного заряда. Рассматривается простейший случай плоской детонационной волны. Под действием этой волны облицовка начинает двигаться к центру; угол 2(3 между движущимися стенками будет больше первоначального угла 2а между стенками оболочки. Слева от «узла» — точки О схождения стенок — находится пест, образующийся из наружных частей облицовки. Справа — кумулятивная струя, образующаяся из внутренних частей облицовки. По мере обжатия облицовки «узел» (точка О) будет передвигаться с некоторой скоростью слева направо, т. е. в направлении распространения детонации. Если ввести подвижную систему координат, скрепленную с «узлом», то в этой системе материал оболочки будет как бы втекать в узел с некоторой скоростью и' и с той же скоростью вытекать из узла направо — в струю и налево — в пест.
По отношению к неподвижной системе координат скорость струн «о—Иу-|-м'; скорость песта будет различной; если в подвижной системе координат он движется налево, то по отношению к неподвижной системе он будет двигаться направо, но со скоростью, значительно меньшей скорости струи ifa—иу—и'. Считая материал несжи
£ 5. Кумулятивное действие взрыва
485
маемым и применяя уравнение Бернулли, получим следующие соотношения:
ис=D ~~а). — 4- _2— 4- tg (9. 44)
------L_fgJLzzl\ (9.45)
cos a \ sin p tg ₽ 2 /
где D — скорость детонации ВВ.
Если m — масса материала облицовки, то массы вещества, образующие соответственно струю и пест, определяются следующим образом:
mc=-^(l-cos₽); (9.46)
//Xn-^d+cosp). (9.47)
Из этих отношений следует, что масса струи меньше массы песта, но обладает значительно большей скоростью; в результате пробивающее действие определяется именно струей. Чем меньше угол а, тем больше скорость струи. Для конуса (клина) с а—30° скорость кумулятивной струи должна быть близкой к скорости детонации и даже несколько превышать ее.
Если а->0, то по->2Д. Таким образом, максимальная теоретическая скорость струи в пределе равна удвоенной скорости детонации. Если использовано ВВ с достаточно высокой скоростью детонации (7,5—8,5 км/сек), то соответственно высокой будет и скорость струи. В результате столкновения с преградой такой струи, обладающей к тому же значительной плотностью, должны развиваться давления в сотни тысяч атмосфер. При таких давлениях даже прочные металлы должны течь, что и дает основание применять к металлу в струе уравнения гидродинамики.
Из теории также следует, длина струи Zo, длина песта 1п (стержня) и длина образующей клина (конуса) I должны быть равны между собой.
Нужно отметить, что выведенные соотношения дают правильные качественные зависимости, но в количественном отношении являются, несомненно, приближенными. Опытные исследования показывают, что действительное распределение массы облицовки в пест и струю несколько отличается от того, что- дает рассмотренная приближенная теория. Это же можно сказать и относительно скоростей и прежде всего в отношении скорости струи. Оказалось, что головная часть струи движется с большей скоростью, чем ее тыльная часть. Поэтому по мере движения струя растягивается и длина ее увеличивается. Кроме того, струя может еще выдавливаться после полного смыкания стенок, вследствие крайне высоких давлений, развивающихся
486
Гл. IX. азрушающее действие взрыва
Фиг. 9. 18. Схема кумулятивного заряда с цилиндрической выемкой и облицовкой.
1—детонатор. 2—экран из инертного материала, 3—фронт детонационной волны в некоторый промежуточный момент. 4—облицовка.
в осевой части песта. Поэтому теоретическое соотношение если и справедливо, то лишь в начале образования струи; в дальнейшем при ее движении 1^>1. Выше была рассмотрена схема простейшей теории. К настоящему времени развиты уточненные варианты теории.
Рассмотрим интересный случай кумулятивного заряда, сечение которого дано схематически на фиг. 9. 18. В данном случае полость представляет собой цилиндр и угол а=0. Кроме того, на пути распространения детонации находится массивная стальная пластина (экран), которую детонационная волна огибает. В результате распространение детонационной волны будет происходить под некоторым переменным углом у к направлению распространения
плоской волны. (Волна с '[ =0 является плоской, скользящей вдоль облицовки; волна с у =90° падает на облицовку нормально). Как мы уже видели, при а = 0 и 7=0.
uc — 2D.
Если у у- 0, то
•2D ис=------.
cos у
Наконец, если у ~>90°, то »со.
Нужно, однако, иметь в виду, что при у—>90° Одновременно и >0, а следовательно, и /ис—>0.
При устройстве, показанном на фиг. 9.18, угол распространения детонационной волны у является переменным. Вблизи от экранирующей пластины у близко1 к 90°, но затем уменьшается.
Изучая кумулятивные заряды типа снаряда, изображенного иа фиг. 9. 18, американские исследователи измерили скорости струи для облицовки из разных материалов. Эти скорости оказались тем больше, чем меньше атомный вес материала облицовки. Для облицовки из бериллия получено рекордное значение скорости струи 90 км!сек. Нужно-, правда, отметить, что такая скорость получена для струи, распространяющейся в вакууме. При этом масса и плотность струи весьма малы и пробивающее действие струи ничтожно; если вакуум ухудшается и давление достигает всего 0,1 мм рт. ст., то струя уже заметно замедляется. Из некоторых теоретических соотношений следует, что давление иа оси цилиндрической выемки (при ее обжатии и формировании кумулятивной струи) может достигать нескольких миллионов атмосфер.
$ 5. Кумулятивное действие взрыва
487
До сих пор мы рассматривали формирование кумулятивной струи и ее параметры. Обратимся теперь к взаимодействию струи с преградой. Встречая на своем пути преграду, кумулятивная струя дефор
мирует ее; материал преграды начинает растекаться в радиальных направлениях, образуя отверстие, которое углубляется с некоторой скоростью. Опять-таки из-за весьма больших скоростей движения струи взаимодействие ее с преградой можно рассматривать как взаи-
модействие идеальных жидкостей, применяя к ним уравнения гидродинамики, что и было предложено Лаврентьевым.
Предположим, что мы имеем кумулятивную струю ПЛОТНОСТЬЮ Ре, длиной /с, движущуюся со скоростью ис. На фиг. 9. 19 показано проникновение струи в преграду. Точка А (точка «удара») перемещается вглубь с некоторой скоростью до тех пор, пока струя не израсходуется. Стрелки наверху показывают
Фиг. 9. 19. Схема пробивания преграды кумулятивной струей.
действительные значения скоростей.
Перейдем теперь к координатной системе, движущейся вместе с точкой А. По отношению к этой системе координат материал преграды будет двигаться палево со скоростью им, а струя—направо со скоростью иа—иы. Эти скорости показаны стрелками на фигуре внизу. Для движущейся координатной системы мы имеем устано
вившееся движение и можем, считая жидкости несжимаемыми, применить уравнение Бернулли (p-f-ры2—const). Полагая давление р с обеих сторон поверхности соприкосновения струи и преграды (в точке А) одинаковым, получим
Рс(Мс — Мм)2==РмМм’
откуда
«м
«с —«м
(9.48)
Глубина полного проникания (глубина пробивания) L = uj, где t — время действия струи, равное
1=---ls--,
«с —«м
следовательно,
£ =—«м__ / =/с 1/"₽£ . (9.49)
«С — «м ' Рм
488
Гл. IX. Разрушающее действие взрыва
Фиг. 9. 20. Схема кумулятивного заряда с выемкой в виде полусферы.
/—детонатор, 2—заряд ВВ,
3—металлическая облицовка.
Таким образом, согласно гидродинамической теории глубина пробивания пропорциональна длине кумулятивной струи и корню квадратному из отношения плотностей струи и преграды. Эта глубина не зависит явным образом от иг чем больше скорость струи, тем быстрее она проникает, но вместе с тем она быстрее и исчерпывается.
Приведенная формула, конечно, идеализирована, но она в общем согласуется с опытом. Нужно только иметь в виду, что /< нельзя полагать равной начальной длине образующей конуса I. Если в формулу подставить величину /, то фактическая глубина пробития окажется в 2—-4 раза большей, чем по расчету. Дело в том, что, как уже отмечалось, кумулятивная струя растягивается при движении и Именно поэтому наибольшая глубина пробивания получается в том случае, когда преграда находится на некотором расстоянии от нижнего среза кумулятивного заряда; при этом струя успевает достаточно удлиниться. При дальнейшем увеличении расстояния струя теряет устойчивость, разрывается, расширяется и пробивающее действие ее резко падает. Отметим, что то расстояние от заряда до
преграды, на котором струя имеет наибольшую пробивную способность, иногда условно называют фокусным расстоянием кумулятивного заряда.
При дальнейшем уточнении теории пробивания необходимо учесть такие факторы, как прочность, сжимаемость материала струи и преграды, силы внутреннего трения и вязкости. Диаметр отверстия, образуемого при растекании вещества преграды, обычно значительно превосходит диаметр струи и зависит от значения энергии струи на единицу глубины проникания и от прочности и текучести материала преграды. Отверстия в свинце значительно шире, чем в стали, хотя глубины пробивания в обоих металлах близки.
Длина кумулятивной струи, от которой существенно зависит глубина пробивания, теоретически должна возрастать с увеличением высоты выемки, а также с увеличением диаметра выемки у ее основания. На практике обычно применяют конические выемки с диаметром, почти равным диаметру нцжней части заряда, и с высотой, равной одному-полутора диаметрам (угол а?«30-.-40'э). Заряды с выемкой большей высоты дают струю малой устойчивости. Конические выемки эффективны и удобны.
Иногда применяют кумулятивные выемки (с облицовкой) и другой формы. Выемки в виде полусферы (фиг. 9. 20) используют в тех случаях, когда максимальное разрушающее действие должно быть получено на большом расстоянии от нижнего среза заряда; у полусферических выемок фокус кумулятивной струи дальше отстоит
§ 5. Кумулятивное действие взрыва
489
от нижнего среза заряда, чем у зарядов с конической выемкой.
Свойства кумулятивной струи и, в частности, ее пробивающая способность зависят также от материала облицовки и ее толщины. Как слишком большая, так и чрезмерно малая толщина облицовки невыгодны. На практике применяют облицовки стальные, медные, алюминиевые и пр.; толщина их в зависимости от размеров и конструкции заряда меняется в пределах от 0,5 до 3 мм.
Свойства кумулятивной струи и, в частности, ее пробивное действие, зависят также от свойств ВВ. У веществ малой плотности и малой скорости детонации кумулятивный эффект проявляется слабо. Для того чтобы кумулятивные эффекты были выражены наиболее ярко, необходимо использовать ВВ с возможно' большей плотностью и скоростью детонации.
С помощью кумуляции можно эффективно управлять явлением взрыва, получать, хотя бы в малых объемах, концентрации энергии и давления, большие, чем в продуктах взрыва самого ВВ, получать направленный эффект взрыва, при котором действие в заданном направлении значительно усиливается на ограниченной площади. Все это делает проблему кумуляции весьма интересной как в научном, так и в практическом отношении. При дальнейшем развитии этого важного перспективного направления в физике взрыва следует ожидать новых весьма ценных результатов.
Глава X
ТЕОРИЯ ПРЕДОХРАНИТЕЛЬНЫХ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
§ 1. ТРЕБОВАНИЯ К ВВ ДЛЯ УГОЛЬНЫХ ШАХТ
Значительная часть каменноугольных шахт принадлежит к числу взрывоопасных, или, как их принято называть, — опасных по газу и пыли. При добыче угля в атмосферу таких шахт выделяются горючие газы, главной составной частью которых является метан, С воздухом метан образует взрывчатые, легко воспламеняющиеся смеси. При отбойке угля, его погрузке и транспортировке образуется угольная пыль. Взвешенная в воздухе, эта пыль тоже может взрываться.
Взрывы пыли нередко приобретают большие масштабы. Метан легко удаляется вентиляцией, и опасные концентрации его могут создаваться, как правило, лишь у забоя. Поэтому взрыв газа обычно имеет локальный характер. Угольная же пыль нередко, покрывает поверхность выработок почти на всем их протяжении, и, раз возникнув, взрыв пыли может распространиться по всей шахте.
Среди причин, вызывающих взрывы метана и пыли в шахтах, взрывные работы всегда занимали особое место главным образом по масштабам несчастных случаев. Электрическая искра, неисправность ламп и т. п, вызывают обычно лишь местные вспышки метана; при взрывах же зарядов ВВ в шпурах обнажаются большие поверхности угольного массива, часто с сильным газовыделением и значительными колебаниями давления; это ведет к смешению метана с воздухом, а также к подъему угольной пыли в воздух, в результате чего нередко возникали большие взрывы. Так, за 7 лет (1881—1887 гг.) во Франции произошло 95 взрывов газа и пыли в шахтах; из них только 36 от взрывных работ, однако число погибших при этих 36 взрывах в 6 раз превышало число жертв при всех остальных взрывах.
Для предотвращения газовых и пылевых взрывов эксплуатацию угольных шахт ведут так, чтобы исключить возможность скопления метана в опасной концентрации и уменьшить взрываемость угольной пыли или быстро прервать начавший распространяться взрыв. Этим целям служат вентиляция подземных выработок, выбор специальных систем разработки, уменьшающих или локализующих
§ 1. Требования к В В для угольных шахт
491
газовыделение и облегчающих проветривание, постоянный надзор за состоянием шахтной атмосферы, ограничение применения электроэнергии и взрывных работ в наиболее опасных условиях, уборка угольной мелочи и пыли, осланцевание и орошение выработок, устройство сланцевых заслонов и т, п.
Однако все эти меры не дают полной гарантии от возможности образования взрывоопасной газо-воздушной или пыле-воздушной смеси. Поэтому для взрывных работ в опасных по газу или пыли угольных шахтах разрешается применять только специальные так называемые предохранительные взрывчатые вещества * Главной отличительной особенностью этих В В "является пониженная способность вызывать взрыв метано-воздушных и пыле-воздушных смесей при взрывных работах.
Целесообразность разработки предохранительных ВВ стала ясной, когда было установлено, что такие ВВ, как черный порох или динамит, широко применявшиеся в свое время в угольных шахтах, сравнительно легко воспламеняют иыле-воздушную и особенно метано-воздушную смеси. Достаточно взрыва открытого заряда черного пороха весом менее грамма или нескольких граммов динамита, чтобы воспламенить газ. Точно также при взрыве в открытом канале стальной мортиры достаточно 100-граммового заряда указанных ВВ, чтобы воспламенить пыле-воздушное облако.
При взрыве заряда ВВ в шпуре, выбуренном в породе, наблюдается ряд явлений, воздействующих на окружающую газовую среду. Детонация, пройдя заряд ВВ, вызывает в свободной части шпура ** ударную волну, распространяющуюся со скоростью нескольких километров в секунду. Вслед за ударной волной из шпура вырываются и расширяются нагретые до высокой температуры и сильно сжатые газы. Эти газы смешиваются с окружающей газовой средой и нагревают ее. Ударная волна, проходя по воздуху, в результате сильного сжатия вызывает его свечение; светятся и газообразные продукты взрыва из-за своей высокой температуры, а также вследствие хемилюминесценции. Эти свечения в совокупности своей составляют так называемое пламя взрыва. Вместе с газами из шпура вылетают и твердые частицы различного характера: частицы инертных солей, входивших в состав ВВ или образовавшихся при реакции, частицы самого ВВ, не успевшие до конца прореагировать в шпуре и продолжающие гореть в полете. Следует добавить, что и газы, как правило, состоят не только из продуктов полного превращения ВВ, но содержат в зависимости от условий взрыва большие или меньшие количества промежуточных продуктов.
Все перечисленные явления могут в той или иной степени способствовать воспламенению метано-воздушной смеси взрывом. Мно
* Ранее в нашей литературе такие ВВ называли антигризутными, от французского слова grisou — метан,
** Здесь рассматривается простейший случай — взрыв ВВ в шпуре без забойки, не сопровождающийся разрушением массива породы.
492
Гл. X. Теория предохранительных взрывчатых веществ
гочисленность факторов, влияющих на возникновение взрыва газа, сложность учета их совокупного действия и возможность различных механизмов воспламенения в разных условиях взрывания обусловливают трудность создания теории предохранительных ВВ. Несмотря на то, что изучение этого вопроса ведут в разных странах в течение почти ста лет, такая теория все еще далека от своего завершения. Разные гипотезы приписывают решающую роль в процессе воспламенения отдельным факторам из числа указанных выше или совокупности некоторых из них. Прежде чем перейти к рассмотрению механизма воспламенения газа при взрыве, опишем экспериментальные методы оценки безопасности предохранительных ВВ.
§ 2. МЕТОДЫ ИСПЫТАНИЯ ПРЕДОХРАНИТЕЛЬНЫХ ВВ
В связи с недостаточной надежностью теоретической оценки степени безопасности предохранительных ВВ уже давно для этой цели стали применять экспериментальные методы. Наиболее распространенным является испытание в опытном штреке. Соображения, на основе которых были разработаны первые методики испытаний в опытном штреке, сводятся к следующему.
Температура продуктов взрыва применяемых в технике ВВ значительно выше, чем минимальная температура самовоспламенения метано-воздушной смеси. Поэтому любое ВВ может в принципе вызвать взрыв рудничного газа. Однако в реальных условиях взрыва газообразные продукты его охлаждаются как за счет совершения работы, так и за счет теплоотдачи вовне. Чем меньше заряд ВВ, тем относительно сильнее будет это охлаждение, тем, как предполагали, меньше будет опасность воспламенения метано-воздушной смеси при взрыве такого заряда. Отсюда был сделан вывод, что для каждого ВВ должна существовать некоторая минимальная величина заряда, некий предельный заряд. Взрыв зарядов меньше предельного не должен воспламенять метано-воздушную смесь. В качестве сравнительной характеристики свойств предохранительных ВВ была принята величина предельного заряда, установленная экспериментально. Предельный заряд определяли в опытном штреке, производя взрыв в условиях, по возможности сходных с условиями производственных взрывных работ.
Конструкции опытных штреков и условия испытания в них различаются в разных странах. Рассмотрим вначале опытный штрек Макеевского научно-исследовательского института по безопасности труда в горной промышленности (МакНИИ), где испытывают все отечественные предохранительные ВВ.
Опытный штрек МакНИИ (фиг. 10. 1) представляет собой цилиндрическую стальную трубу диаметром 1,65 м и длиной 15 м, закрытую с одного конца прочным днищем. Часть трубы у днища объемом около 10 м3, называемую взрывной камерой, перед опытом отгораживают диафрагмой из бумаги. Во взрывную камеру впуска-
,§ 2. Методы испытания предохранительных ВВ 493
ют метан в таком количестве, чтобы там образовалась наиболее взрывоопасная смесь его с воздухом (8—(10% СН4 по объему). Заряд ВВ в патронах диаметром 30—32 мм помещают в канал толстостенной стальной мортиры (фиг. 10.2), которая установлена на те-
Фиг. 10. 1. Опытный штрек МакНИИ для испытания предохранительных ВВ (схема).
1—мортира, 2—взрывная камера штрека, 3—мешалка, 4—вентиляционная труба. 5—полки для пыли, б—бумажная диафрагма. 7—днище штрека, 8—люк в днище штрека, 9—мортира для угольной пыли, 10—люки для наблюдения за пламенем.
11—подвод газа, 12—кольцо для закрепления бумажной диафрагмы.
лежке. Перед опытом мортиру подкатывают вплотную к специальной горловине в дне штрека. После того как в штреке создана метано-воздушная смесь нужной концентрации, заряд взрывают.
Для того чтобы установить предельный заряд, испытания начинали с заряда в 350 айв случае невосплвменения последовательно
увеличивали его при дальнейших опытах на 100 г, не превышая при этом 650 г, так как большие заряды сильно повреждают мортиру. Предельным считали максимальный заряд, не дающий воспламенения при 10 последовательных опытах. Предохранительными считали только те ВВ, у которых предельный заряд был больше 450 г.
При испытании на безопасность по
зов
Фиг. 10. 2. Мортира для испытания предохранительных ВВ в опытном штреке.
пыли, которая, как правило, воспламе-
няется взрывом труднее, чем газ, ее рассыпали по полкам, имеющимся для этой цели в штреке, а также разбрасывали по штреку *. В части опытов определенное количество пыли помещали в канал мортиры вместе с патронами ВВ. Для испытания применяют пыль определенного сорта угля и даже определенного пласта, измельченную до определенной степени. Общее количество пыли берут такое, чтобы на 1 м3 взрывной камеры штрека ее приходилось 350 г. В таких условиях определяли максимальный заряд, не вызывающий
* С 1954 г., чтобы обеспечить перевод пыли во взвешенное состояние, ее выбрасывают во взрывную камеру штрека за несколько секунд до взрыва испытуемого заряда. Это выбрасывание производится взрывом маленького заряда ВВ в специальной мортире, канал которой направлен к днищу штрека (см. фиг. 10.1).
494
Гл. X. Теория предохранительных взрывчатых веществ
воспламенения пыли при нескольких (обычно 5) последовательных опытах.
В последние годы в методику испытаний у нас внесены некоторые изменения (см. ГОСТ 7140—54). С одной стороны, существенно смягчены условия испытаний (применение небольшой забойки из глины при опытах по газу, уменьшение числа параллельных опытов при некоторых испытаниях и др.). С другой стороны, предельный заряд теперь не определяют и предохранительным считают ВВ, которое не вызывает воспламенения газа при взрыве с забойкой зарядов весом 600 г и пыли при весе заряда 700 г.
При разработке и введении метода оценки безопасности ВВ по газу и пыли в опытном штреке предполагалось, что условия испытания в нем воспроизводят наиболее опасные из возможных в практике условий взрывных работ. Заряд взрывается без забойки, канал мортиры не разрушается, поэтому газы взрыва поступают в метановоздушную смесь, не совершая работы, горячие. По этим соображениям считали возможным для взрывных работ в шахтах допускать применение зарядов большей величины, чем предельный заряд, установленный в опытном штреке.
Дальнейшие исследования показали, однако, что влияние различных факторов на возможность воспламенения метана при взрыве более сложно, чем предполагалось, а условия испытания в опытном штреке трудно сопоставимы с условиями взрывных работ в шахтах и отнюдь не всегда являются наиболее опасными.
Так, было установлено, что если в опытном штреке опасность воспламенения метана увеличивается с увеличением заряда, то в опытной шахте, где условия взрыва были максимально приближены к производственным, напротив, при больших зарядах опасность воспламенения меньше. Далее было показано, что вероятность воспламенения метано-воздушной смеси зависит от длины свободного пространства — расстояния от устья шпура до заряда. При этом для предохранительных ВВ класса аммонитов безопасными оказываются как малые, так и большие длины свободного пространства; для нитроглицериновых предохранительных ВВ, напротив, опасны лишь малые длины свободного пространства. В координатах «длина свободного пространства—величина заряда» опасные зоны по Бёй-лингу изображаются заштрихованными участками на фиг. 10. 3 и 10. 4.
Наконец, по элементарным соображениям, приведенным выше, предполагалось, что применение забойки может только уменьшать опасность воспламенения метана, так как на выброс ее затрачивается часть энергии и температура газов взрыва снижается. В действительности же в некоторых случаях применение небольшой забойки приводило к воспламенению метано-воздушной смеси в таких условиях, в каких оно без забойки не возникало.
К недостаткам испытания в опытном штреке относится также то, что по существу оно имеет качественный характер. По результатам
£ 2. Методы испытания предохранительных В В
495
испытаний можно сказать лишь, что данное ВВ удовлетворяет или не удовлетворяет некоторым установленным требованиям, но нельзя количественно оценить степень безопасности и сравнить в этом отношении различные ВВ- Чтобы устранить этот недостаток, Горным
О 5 10 15 10 25 30 35
Свободное пространство В см
Фиг. 10.3. Область воспламенения (заштрихована) для предохранительного аммонита в зависимости от числа патронов (величины заряда) и длины свободного пространства.
Свободное пространство в см
Фиг. 10.4. Область воспламенения (заштрихована) для предохранительного ВВ на основе желатинированного нитроглицерина в зависимости от числа патронов (величины заряда) и длины свободного пространства.
Бюро США был разработан метод характеристики предохранительных ВВ по так называемому «кислородному числу».
Было установлено, что при постоянном содержании метана (8%) в смеси его с азотом и кислородом на возможность воспламенения газовой смеси при взрыве заряда ВВ в опытном штрехе влияет содержание кислорода. Если оно выше некоторого предела, воспламенение наблюдается во всех опытах; при содержании кислорода ниже некоторого, меньшего, предела воспламенения не происходит. Между пределами оно наступает с некоторой вероятностью, зависящей от содержания кислорода в атмосфере опытного штрека. Чем опаснее ВВ, тем меньше кислорода должно содержаться в смеси для того, чтобы взрыв ВВ вызвал ее воспламенение.
Испытание производят с зарядами ВВ весом 3 г, которые запрессовывают в маленькие стальные мортиры длиной 12,5 см и диаметром 7,5 см; канал мортиры имеет диаметр 8 мм. Взрыв производят в небольшом штреке (0,9X0,9X1,5 м). Характеристикой ВВ считают содержание кислорода в смеси метан—азот—кислород, при котором частость воспламенений газа составляет 50%. Если ВВ дает взрывы с частостью, равной */2, при содержании кислорода меньше 18%, оно считается очень опасным, а если для этого требуется 30,5 и более процентов кислорода — малоопасным. Черный порох, динамит № 5 (50% нитроглицерина, 49% кизельгура и 1% мела) и тэн согласно этому испытанию являются наиболее опасными ВВ; кислородное число для них равно 15,5.
Способ оценки предохранительных ВВ по «кислородному числу» до настоя щего времени применения не получил.
496
Гл. X. Теория предохранительных взрывчатых веществ
В ходе исследований в Германии было установлено, что опасность воспламенения метано-воздушной смеси сильно возрастает в том случае, когда заряд ВВ взрывают не в канале мортиры, а открыто расположенным в метано-воздушной смеси. Эта опасность становится еще больше, если вблизи заряда есть преграда, на которой проис
ходит торможение расширяющихся продуктов взрыва. Поскольку такие условия могут возникнуть в шахтах, особенно при взрывных работах с электродетонаторами замедленного действия, представлялось целесообразным реализовать их и при испытании ВВ. Это было осуществлено в ФРГ, а затем и в Бельгии в виде испытания в мортире-желобе при наличии преграды. В качестве мор-
Фиг. 10. 5. Схема устройства для испытания предохранительных ВВ в опытном штреке с мортирой-желобом.
/—опытный штрек, 2—отражающая стенка. 3—мортнра-желоб. 4—заряд ВВ.
Расстояние от желоба до стенки в см
Фиг. 10.6. Способность различных предохранительных ВВ к воспламенению метано-воздушной смеси при испытании в мортире-желобе (наименьшее число патронов, приводящее к воспламенению при угле а—ОО9 и различных расстояниях d от края желоба до стенки).
/а—желатинообразные ВВ без предохранительной оболочки, 16—ВВ с большим содержанием соли, но без предохранительной оболочки, 2—ВВ с активной предохранительной оболочкой. 2—3—(переходный тип) ВВ с увеличенной активной предохранительной оболочкой, 3~ бикарбит или состав с 15 % нитроглицерина иа основе селективной детонации (воспламенения нет даже при заряде из 16 патронов).
тиры применяют стальной цилиндр диаметром 23 см и длиной 2 м с вырезом, образующим желоб, форма которого показана на фиг. 10. 5. В этом вырезе помещают испытуемый заряд. Мортиру устанавливают на определенном расстоянии от вертикальной стальной стенки; поворотом мортиры в подставке может быть изменен также угол а, образуемый плоскостью желоба со стенкой. Предельный заряд, определяемый в этих условиях, тем больше, чем больше расстояние d (см. фиг. 10. 5) и чем меньше угол а.
На основе этого метода испытания были установлены требования к ВВ, допускаемым к применению в настоящее время в ФРГ. Согласно этим требованиям предохранительные ВВ делят на три
§ 3. Механизм воспламенения метана при взрыве
497
класса. ВВ первого класса опаснее, чем второго, а второго — опаснее, чем третьего. К первому классу относят ВВ, которые выдерживают испытание по газу в опытном штреке при взрывании без забойки в канале обычной мортиры зарядов длиной до 50 см *. Кроме того, расширение в бомбе Трауцля не должно превосходить определенных пределов, зависящих от состава. В мортире-желобе ВВ первого класса дают взрыв газа уже при заряде в один патрон. Так же ведут себя предохранительные ВВ первого класса в обычных инертных предохранительных оболочках. ВВ второго класса подвергают испытанию в мортире-желобе. При расстоянии до стенки 65 см и угле а—40° они не должны воспламенять газ зарядом длиной 40 см. Предохранительные ВВ третьего класса не должны воспламенять газ зарядом максимальной длины (2 м), состоящим из 16 патронов (общий вес 2 кг}, при угле а=90° и расстояниях d от 15 до 75 см.
Результаты испытания ВВ различных типов приведены на фиг. 10.6. Характеристики этих составов будут даны ниже (см. стр. 512).
Причины существования предельного заряда при испытании в мортире-желобе авторам этого метода не ясны. Возможно, что по мере удлинения заряда усиливается эффект сложения ударных волн, образуемых взрывом последовательно расположенных патронов. При некоторой критической длине заряда давление у преграды и длительность его существования достигают величин, достаточных для воспламенения метано-воздушной смеси. Они могут влиять также кос-г.енно, усиливая разогрев продуктов неполного превращения, которые разлетаются при взрыве и тормозятся у стенки.
§ 3. МЕХАНИЗМ ВОСПЛАМЕНЕНИЯ МЕТАНО-ВОЗДУШНОЙ СМЕСИ ПРИ ВЗРЫВЕ ВВ
Из двух основных гипотез о механизме воспламенения метановоздушной смеси одна (назовем ее тепловой) рассматривает как главный фактор при воспламенении разогрев; другая гипотеза приписывает большую роль не только тепловой, но и химической стороне развития воспламенения.
I. Тепловая гипотеза механизма воспламенения
Первые исследования по разработке предохранительных ВВ были проведены во Франции Малляром и Ле Шателье, которые подошли к решению задачи следующим путем: они установили экспериментально, что самовоспламенение метано-воздушных смесей происходит со значительной задержкой. Наименьшая температура, при которой еще наблюдается самовоспламенение, равна 650° С и задержка составляет при этой температуре 10 сек. С повышением температуры задержка уменьшается; при 1000° С она равна 1 сек., а при
* При диаметре патронов 35 мм это соответствует весу заряда 600 г.
498
Гл. X. Теория предохранительных взрывчатых веществ
2200° С становится неуловимо малой. * Отсюда Малляр и Ле Шате-лье заключили, что безусловно опасными в смысле воспламенения рудничного газа будут те ВВ, температура взрыва которых лежит выше 2200° С. При более низких температурах возможность воспламенения метано-воздушной смеси определяется временем воздействия на нее высокой температуры. Если время воздействия больше задержки вспышки при этой температуре, то взрыв воспламенит газ. Отсюда становится понятной высокая воспламеняющая способность черного пороха; не будучи способен к детонации, он дает пламя очень большой длительности и поэтому легко воспламеняет газ.
При взрыве ВВ, особенно в условиях разрушения породы, газы очень быстро охлаждаются. Поэтому, как полагали Малляр и Ле Шателье, чтобы обеспечить практическую безопасность взрывных работ по углю, достаточно снизить температуру взрыва до 1500° С; при работах по породе, где, как предполагалось, вероятность образования взрывоопасных метано-воздушных смесей несколько меньше, допустимы ВВ даже с температурой взрыва до 1900° С.
В дальнейшем эти идеи получили развитие в работах французского исследователя Одибера. Он считал, что разогрев метановоздушной смеси происходит путем ее смешения с газами взрыва. По мере смешения содержание метана и кислорода в образующейся тройной смеси (метан—воздух—продукты взрыва) падает, а температура ее растет. Если в процессе смешения окажутся выполненными два условия: 1) содержание метана будет внутри интервала горючести; 2) температура будет выше минимальной температуры вспышки (эта температура практически не зависит от состава смеси и составляет около 650° С), то происходит вспышка. Одибер показал, что чем больше кислорода содержат продукты взрыва, тем меньше нужно добавить к ним метано-воздушной смеси, чтобы получить взрывоспособную смесь. Если газы взрыва не содержат кислорода, то для того’, чтобы произошло воспламенение по указанному механизму, йеплосоде'ржание их q в расчете на 1 моль газов доя ВВ обычного состава должно быть равно 21,5 ккал. При содержании в газах взрыва доли п кислорода необходимое для воспламенения теплосодержание снижается до
9=21,5—75п, (10.1)
где q в ккал!мол, ап — мольная доля кислорода на моль газообразных продуктов взрыва.
Таким образом, критерий безопасности ВВ с положительным кислородным балансом по Одиберу может быть представлен в виде
9<21,5—75п. (10. 1а)
* Следует указать, что, по новейшим опытам Одибера, задержка самовоспламенения метано-воздушной смеси Не является неизбежным спутником этого явления, а обусловлена состоянием стенок сосуда, в котором находится смесь. Если этот вывод будет подтвержден дальнейшими исследованиями, то придется существенно пересмотреть наши представления о механизме воспламенения метано-воздушной смеси при взрыве ВВ.
.3 3. Механизм воспламенения метана при взрыве ВВ
499
Поскольку для получения наибольшего1 взрывного эффекта .желательно, чтобы теплота взрыва была наибольшей, то целесообразно состав предохранительных ВВ рассчитывать на нулевой кислородный баланс (ц=0).
В связи с тем, что теплота взрыва применяемых в технике обычных ВВ значительно больше указанного предела, приходится доя превращения их в предохранительные искусственно уменьшать ее. Этого достигают разбавлением ВВ инертными, не участвующими во взрыве, примесями, из которых наиболее часто1 применяют хлористый натрий и хлористый калий. На нагрев примесей при взрыве расходуется часть тепла, за счет чего снижаются теплосодержание и температура газов.
Как показал опыт, содержащие хлористый натрий предохранительные ВВ, расчетное теплосодержание продуктов взрыва которых меньше, чем обусловлено уравнением (10, 1а), обладают высокой степенью безопасности. Поэтому применение данного1 метода для расчета составов предохранительных ВВ практически целесообразно. Однако теоретически его нельзя считать вполне обоснованным. При той температуре воспламенения, из которой исходит расчет, время задержки достигает 10 сек.; за это время газы будут продолжать смешиваться с метано-воздушной атмосферой и успеют охладиться много ниже минимальной температуры воспламенения. Вообще, если воспламенение метано-воздушной смеси взрывом ВВ происходит по механизму смешения и характеризуется значительной задержкой, то оно должно весьма сильно зависеть от быстроты и условий смешения. Далее опыты (Л. И. Гольбиндер) показали, что совсем не безразлично1, какая соль введена в. состав ВВ. Если заменить, например, хлористый натрий алюмокалиевыми квасцами, хлористым аммонием и др., то опасность воспламенения метано-воздушной смеси сильно увеличивается.
Подавляющее большинство ВВ, применяемых в опасных по газу и пыли угольных шахтах различных стран, не удовлетворяют критерию безопасности (10. 1а) и теоретически способны воспламенять метано-воздушную смесь, хотя и выдерживают испытание в опытном штреке *. Некоторые ВВ, которые по теоретическому расчету не должны воспламенять газ, фактически вызывают его воспламенение в определенных условиях, например при взрыве открытых зарядов.
2. Другие гипотезы о механизме воспламенения метановоздушной смеси при взрыве взрывчатых веществ
При взрыве заряда в мортире или в шпуре без забойки вместе с газами вылетает некоторое количествр неразложившихся частиц
* Одибер объясняет это тем, что при взрыве в мортире без забойки химические реакции идут не до конца, поэтому теплота и температура взрыва получаются ниже. Кроме того, особенно при малых зарядах, т, е, большом свободном пространстве, часть тепла отдается газами металлу и они выходят из канала мортиры уже несколько охлажденными,
500
Гл. X. Теория предохранительных взрывчатых веществ
ВВ. Немецкий исследователь Бейлинг защищал в связи с этим предположение о том, что решающим фактором, определяющим воспламенение метано-воздушной смеси, является попадание в нее горящих частиц ВВ. С этой точки зрения он объяснял закономерности, установленные при экспериментальных исследованиях воспламенения газа взрывом (фиг. 10.3 и 10.4). Роль величины заряда определяется по Бейлингу тем, что при взрыве большего заряда перед устьем шпура образуется облако газов больших размеров, пролетая через которое горящие частицы ВВ успевают сгорать прежде, чем они попадут в метано-воздушную атмосферу.
Своеобразное влияние свободного пространства в случае аммонитов Бейлинг объясняет тем, что эти ВВ в отличие от нитроглицериновых дают первоначально негорящие частицы, не могущие поэтому воспламенить метан. Лишь пролетев некоторое расстояние в шпуре в атмосфере горячих газов взрыва, частицы загораются и тогда становятся опасными. Аналогично объясняется и благоприятствующее воспламенению влияние небольшой забойки.
Соображения Бейлинга о возможности попадания в метано-воздушную смесь при взрывных работах разлагающихся частиц ВВ согласуются с современным представлением о механизме взрыва твердых, особенно порошкообразных веществ. По-видимому, справедливо также его предположение о большой эффективности горящих частиц ВВ, которые разлетаются при взрыве, в смысле возможности воспламенения ими метано-воздушной смеси. Однако роль этих частиц Бейлинг представляет себе слишком упрощенно.
На первый взгляд способность горящих частиц ВВ, летящих с большой скоростью, воспламенять метано-воздушную смесь легче, чем это делают газообразные продукты детонации, — непонятна. Очевидно, что температура продуктов горения не может быть больше температуры детонации. Во-первых, в детонационной волне развивается большое давление и реакции доходят до конца, чего может не быть при горении частиц под меньшими давлениями. Соответственно тепловой эффект детонации обычно больше, чем горения при умеренных давлениях. Во-вторых, детонация — чрезвычайно кратковременный процесс и можно допустить, что газы при ее прохождении не успевают отдать тепло инертным компонентам ВВ. При относительно медленном горении частиц условия для охлаждения газов гораздо более благоприятны и роль его относительно больше. Далее, при детонации температура газов, равная ~Qnetlcv, значительно выше, чем при горении, когда она равна ~ Qrop/c?, так как и cP>cv и QHeT>Qrop. Наконец, в случае быстролетящих частиц длительность действия высокой температуры столь мала, что трудно допустить возможность воспламенения ими метано-воздушной смеси, протекающего со значительной задержкой.
Какова же в действительности возможная роль летящих частин ВВ при воспламенении метана?
£ 3. Механизм воспламенения метана при взрыве ВВ 501
Чобы ответить на этот вопрос, рассмотрим детальнее процесс взрыва предохранительного ВВ и те явления, которые могут влиять на воспламенение метано-воздушной смеси.
Как было указано в гл. IV, химическое превращение при детонации протекает в некотором слое ВВ конечной толщины, Реагирующий слой включает конечные газообразные продукты реакции, находящиеся под большим давлением, и частицы ВВ, горящие в атмосфере <укатых и нагретых газов. Горение идет с образованием промежуточных продуктов. Вследствие большого давления, имеющегося в реагирующем слое, газы стремятся расшириться. Если условия (отсутствие толстой оболочки, малый диаметр заряда и др.) благоприятствуют расширению, то падение давления в реагирующем слое может стать столь значительным, что химические реакции, особенно в периферийных частях заряда, не смогут доходить до конца и в продуктах взрыва будет много промежуточных газообразных продуктов и даже частиц непрореагировавшего ВВ. Эти газообразные и твердые продукты и могут попадать в метано-воздушную смесь,
Чтобы правильнее оценить возможную роль горящих частиц ВВ, рассмотрим еще некоторые данные о роли тепловых и химических факторов в процессе воспламенения метана.
Из теоретических соображений и из практики разработки составов предохранительных ВВ вытекает, что температура продуктов взрыва является существенным, но не единственным фактором, обус* ловливающим возможность воспламенения метано-воздушной смеси взрывом ВВ.
Этот вывод может быть иллюстрирован следующими опытами Таффанеля и Дотриша Они взрывали в сосуде большого объема (в паровом котле) заряды тротила и нитроклетчатки. Оба эти вещества, имея отрицательный кислородный баланс, образуют при взрыве значительное количество горючих газов, главным образом СО и Н2. При смешении с воздухом продукты взрыва могут воспламеняться. Вспышку можно было наблюдать в данных условиях опыта по дополнительному повышению давления в сосуде за счет тепла, выделяющегося при сг орании СО и Н». По этому повышению давления и рассчитывали полный тепловой эффект взрыва и догорания продуктов его в воздухе. Результаты опытов приведены в табл, 10.1.
Из табл. 10.1 видно, что если взрывать тротил или нитроклетчатку в чистом виде, то реакции догорания проходят полностью. Если к ВВ добавить небольшое количество (1—3%) солей щелочных металлов, то реакции догорания отсутствуют. При добавке взамен указанных солей карбонатов щелочно-земельных металлов или азотнокислого свинца догорание происходит так же, как и без добавок. Несомненно, во-первых, что охлаждающее действие добавок вследствие небольшого их содержания невелико; во-вторых, такие богатые кислородом добавки, как КЙОз, скорее могут повышать температуру газов взрыва тротила и нитроклетчатки, а не понижать ее. В-третьих, ясно также, что добавка 10% MgCOs снижает температуру, во всяком случае сильнее, чем добавка 1% NaHCOs. В то же время вторая из этих добавок подавляет догорание, а первая — нет.
Опыты Таффанеля и Дотриша по воспламенению смесей окиси углерода и водорода с воздухом ясно свидетельствуют о том, что наряду с теплопоглощением некоторые «инертные» добавки играют
502
Гл. X, Теория предохранительных взрывчатых веществ
Таблица 10. 1 Влияние добавок к нитроклетчатке и к тротилу различных солей на догорание продуктов взрыва в воздухе (по опытам Таффанеля и Дотриша)
Выделившееся количество Рассчитанное количество
ВВ Добавка тепла на 100 г ВВ ккал тепла на 100 г ВВ ккал
Нитроклетчатка Без добавки 184 При детонации около
C24H30O40N10 0,5% N аНСО3 1% NаНСО3 2% NaHCO3 2% KNO3 3% K2SO4 2% СаСО3 4% MgCO3 10% MgCO3 3% Pb(NO3)2 146 88 89 88 79 152 152 140 140 96 ккал; при детонации и полном догорании ее прод)гктов за счет кислорода воздуха около 242 ккал
Тротил Без добавки 2% KNO3 3% KNO3 4% KNO3 5% KNO3 10% KNO3 6% Ba(NO3)2 10% Ba(NO3)2 250 117 96 82 66 66 187 175 При детонации около 66 ккал-, при детонации и полном догорании ее продуктов за счет кислорода воздуха 351 ккал
активную роль, тормозя развитие реакций между горючими газами и кислородом воздуха.
Имеются данные по влиянию различных инертных солей и на воспламенение непосредственно смесей метана с воздухом. В табл. 10. 2 приведены результаты опытов по определению минимального количества различных солей, которое необходимо смешать с метановоздушной смесью, чтобы предотвратить ее воспламенение в определенных условиях. Из таблицы видно, что эти количества сильно различаются, причем наиболее эффективно тормозят воспламенение метана галоидные соли щелочных металлов.
Упомянутые выше опыты А. И. Гольбиндера, а в дальнейшем опыты Л. В, Дубнова показали, что предохранительные ВВ с одинаковыми основными компонентами и одинаковыми расчетными температу-
§ -в. Механизм воспламенения метана при взрыве ВВ
503
Таблица 10. 2
Минимальные количества (в мг) различных солей, предотвращавшие _____________воспламенение метано-воздушной смеси____________
Вещество LiF — — —
Количество в мг <1 — — —
Вещество NaF NaCl NaBr NaJ
Количество в мг <1,5 <2 4—6 5—7
Вещество KF KC1 KBr KJ
Количество в мг 1—2 8-9 8—9 9—10
Вещество CaF2 Плавиковый шпат BaO BaCl2
Количество в мг 2—3 <1 23—25 35-38
Вещество Ва(МОз)2 BaSO4 Li2SO4 —
Количество в мг 35—38 38—40 40—42 —
рами взрыва оказываются безопасными, когда в качестве «инертной» добавки в них входят галоидные соли щелочных металлов, но воспламеняют метан при добавке эквивалентных по теплоемкости количеств Других солей.
Действие пыли щелочных галогенидов на воспламенение метановоздушных и других взрывчатых газовых смесей вполне объяснимо. Реакции окисления метана, приводящие к самовоспламенению, являются цепными, а на течение цепных реакций сильно влияет, как известно, твердая поверхность, особенно поверхность таких веществ, как галогениды щелочных металлов. На такой поверхности очень хорошо, т. е. с большой вероятностью, обрываются цепи многих реакций, дезактивируются, рекомбинируя активные центры этих реакций*.
* Естественно поэтому, что минимальное количество добавки, необходимое для предотвращения воспламенения, оказывается тем меньше, чем мельче ее частицы. Однако для разных веществ уменьшение размеров частиц по неизвестным пока причинам влияет количественно неодинаково; для калиевых солей относительно слабо, для натриевых — значительно сильнее; для A1»OS и S1O2 оно почти не проявляется.
г 04
Гл. X. Теория предохранительных взрывчатых веществ
В связи с тем, что введение в состав ВВ галоидных солей щелочных металлов снижает опасность воспламенения метано-воздушной смеси при взрыве гораздо сильнее, чем многие иные инертные соли, следует полагать, что воспламенение протекает по цепному механизму также и в данном случае.
Поскольку на развитие цепных реакций окисления до воспламенения сильно влияют активные промежуточные продукты, образующиеся в ходе этих реакций, то естественно предположить, что подобное же влияние могут оказывать активные продукты (или вещества, легко их образующие) и при введении их извне. Это подтверждается также прямыми опытами. Установлено, что на воспламенение смеси метана с воздухом при нагреве сильно влияют примеси ряда веществ. Так, добавка 2% муравьиной кислоты или диазометана снижает температуру самовоспламенения с 580 до 200°; аналогичное действие оказывают различные органические и минеральные перекиси (этилгидроперекись, двуокись азота, СЮг) и некоторые другие вещества (метиловый спирт, аммиак, этилен и т, д.). Некоторые примеси (например, диметилацетон с последующим облучением, вызывающим его распад) приводят к самовоспламенению смеси метана н воздуха даже при комнатной температуре.
На основании этих данных мо,жно предполагать, что основная роль горящих частиц ВВ состоит в том, что они являются источником промежуточных продуктов горения, непосредственно вносимых частицами при их полете в метано-воздушную смесь; это ускоряет реакции, ведущие к ее воспламенению.
Допущение о такой роли разлагающихся частиц ВВ имеет и прямые экспериментальные доказательства. Весьма убедителен в этом отношении один опыт Одибера, Он давал падать через метановоздушную смесь, нагретую до 375° С, маленькому кристаллику аммиачной селитры. Смесь при этом воспламенялась, хотя, как известно, минимальная температура ее самовоспламенения равна 650° С. Главное назначение предварительного подогрева смеси до 375° С заключалось в том, чтобы вызвать разложение аммиачной селитры. Присутствие продуктов этого разложения снижало температуру самовоспламенения метана почти на 300°.
Для проверки возможности воспламенения от горящих частиц других ВВ были поставлены прямые опыты, при которых небольшие навески различных ВВ воспламеняли в атмосфере метано-воздушной смеси. Если допустить, что горящие частицы ВВ при быстром полете через метано-воздушную смесь могут ее воспламенить, то тем более должны это делать неподвижные горящие частицы. Опыты показали, что частицы различных ВВ сильно отличаются по своей способности воспламенять метано-воздушную смесь. Так, детонирующий при зажигании азид свинца не воспламеняет газ даже при значительных зарядах (в прессованном виде — до 600 .иг); напротив, гремучая ртуть, в малых количествах только' сгорающая, дает воспламенение уже при навеске в 0,2—0,4 мг; легко воспламе
§ 3. Механизм воспламенения метана при взрыве В В
505
няет метан также черный порох (0,4—1,0 мг). Частицы веществ, которые входят в состав предохранительных ВВ (тротил, нитроклетчатка, нитроглицерин), в обычных условиях горения не воспламеняют метано-воздушную смесь даже при значительных навесках (до 1 г). Если однако, происходит не горение, а вспышка ВВ, то воспламенение наблюдается уже от навески, например, желатинированного нитроглицерина в 1 мг, в то время как в случае горения его не получается даже при наибольшей испытанной навеске этого ВВ — 130 мг. Наиболее вероятной причиной этого является возможность попадания при вспышке активных промежуточных продуктов непосредственно в метано-воздушную смесь; при обычном горении условия для смешения этих продуктов с окружающей средой менее благоприятны.
Таким образом, экспериментальные данные в согласии с теоретическими соображениями показывают, что разлагающиеся или горящие частицы ВВ при некоторых режимах горения могут быть причиной воспламенения метано-воздушной смеси *.
Особенно благоприятные условия для попадания разлагающихся частиц ВВ в окружающую метано-воздушную смесь создаются при взрыве открытых (полностью или частично) зарядов, когда разброс частиц, в первую очередь с периферии заряда, велик. Поэтому, хотя в этих условиях превращение идет не полно и теплота и температура продуктов взрыва относительно низки, опасность воспламенения метано-воздушной смеси оказывается значительно больше, чем при подрыве заряда ВВ в мортире.
Добавим, что исходя из гипотезы о роли горящих частиц, можно дать естественное объяснение многим частным зависимостям воспламенения. метана, установленным Бейлингом (влияние забойкч, расположения инициатора, величины заряда, величины свободного пространства и др.). Все факторы, способствующие завершению реакций взрыва до выхода продуктов его из шпура, уменьшают опасность воспламенения. Сюда относится в первую очередь применение забойки, тормозящей расширение газов взрыва и содействующей благодаря этому завершению реакций. Как показывает опыт, во многих случаях достаточна даже небольшая забойка, затрата энергии на выброс которой относительно мала. Поэтому опасность холостого взрыва не может быть объяснена только тем, что при нем газы взрыва поступают в. метано-воздушную атмосферу без совершения работы. Очень важную роль играет, несомненно, содержание активных промежуточных продуктов.
* Аналогичные опыты, проведенные с водородокислородной смесью, показали, что она легко воспламеняется азидом свинца, равно как и гремучей ртутью и тринитрорезорцинатом свинца. Относительно легко воспламеняют эту смесь также вторичные ВВ (гремучий студень, нитроклетчатка). Отличие водородной смеси от метановой определяется, по-видимому, не только более низкой температурой ее воспламенения, но в первую очередь значительно менее выраженной задержкой вспышки.
506 Гл. X. Теория предохранительных взрывчатых веществ
Какую же роль в свете рассмотренных представлений следует приписать «инертным» добавкам?
Эта роль троякая. Во-первых, частицы «инертных» добавок, нагреваясь за счет теплоты взрыва, снижают его температуру; во-вторых, при смешении продуктов взрыва с метано-воздушной смесью добавки тормозят, обрывая цепи, развитие реакций окисления метана, приводящих к воспламенению смеси. В-третьих, как показано новейшими работами, «инертные» добавки влияют на некоторые из реакций, протекающих при взрыве, способствуя более полному их завершению, и снижают таким образом содержание в продуктах взрыва активных промежуточных продуктов, предположительно способствующих воспламенению метано-воздушной смеси.
Вывод об этой третьей функции «инертных» добавок основан на опытах, которые показали, что такие вещества, как хлористый натрий или хлористый калий, являются положительными катализаторами горения некоторых ВВ, резко увеличивая скорость и способность к горению аммиачной селитры и ее смесей. Под влиянием таких добавок изменяется также состав образующихся газов: уменьшается содержание в них продуктов неполного горения, в частности, окислов азота. Аналогичное влияние добавок на состав продуктов реакции наблюдается и при взрыве.
Из этих данных и соображений вытекает дополнительный критерий пригодности того или иного вещества в качестве «инертной» добавки: такое вещество должно быть не только теплопоглотителем (этой способностью обладает, вообще говоря, любое вещество) и отрицательным катализатором реакций воспламенения метана, но п положительным катализатором реакций горения данного ВВ.
Применяемые добавки вроде NaCI и KCI оказываются эффективными во всех трех направлениях. Возможно, что существуют добавки, еще сильнее ускоряющие горение ВВ и в еще большей степени снижающие в сочетании с другими добавками опасность воспламенения метано-воздушных смесей.
Нужно, однако, иметь в виду, что влияние добавок, стимулирующих завершение горения ВВ, в известных условиях может сказываться на безопасности взрывных работ и отрицательно.
Представим себе возможный в практике случай, когда в детонационной волне химическое превращение затронуло только наиболее реакционноспособную часть компонентов ВВ, как это имеет место в составах, построенных по принципу селективной детонации (см. стр. 509). Достигаемая при этом температура настолько низка, что продукты взрыва не могут воспламенить метано-воздушную смесь, даже если они попадают в нее, не совершая работы. Если ВВ содержит добавки, способствующие «догоранию», то химическое превращение становится более полным, температура может сильно повыситься и создастся опасность воспламенения метана.
§ 4. ВОСПЛАМЕНЕНИЕ ПЫЛЕ-ВОЗДУШНЫХ СМЕСЕЙ ПРИ ВЗРЫВЕ ВВ
Воспламенение пыле-воздушных смесей при взрыве изучено^ гораздо меньше, чем метано-воздушных. Существенную роль в случае воспламенения пыли играет ударная волна и поток расширяющихся
$ 3. Принципы построения состава предохранительных ВВ
507
газов взрыва, способствующие подъему пыли и образованию пыле-воздушного' облака. Кроме того, вызывая сжатие (а следовательно, и разогрев) пыле-воздушной взвеси, они облегчают ее воспламенение.
Основным источником воспламенения угольной пыли считают горячие газы взрыва, особенно если реакции в них не успелм завершиться. Характеристикой опасности таких газов может служить величина и продолжительность пламени взрыва.
Пламя взрыва * разогревает пыле-воздушную взвесь, вызывая выделение из пыли горючих газов; смесь этих газов с воздухом дает вспышку, распространяющуюся затем от слоя к слою.
Очень опасными в отношении воспламенения пыли являются предохранительные ВВ с сильно отрицательным кислородным балансом, одно время применявшиеся в Германии. Такие ВВ, образуя при взрыве много окиси углерода и водорода, давали большое и длительное вторичное пламя, легко воспламенявшее пыле-воздушную смесь.
Особенно' опасны в отношении воспламенения возможные в практике взрывных работ случаи, когда угольная пыль находится в шпуре и непосредственно соприкасается с зарядом. В таких условиях пыль легко взаимодействует с. горячими продуктами взрыва. В результате образуются значительные количества горючих газов, что приводит к возникновению вторичного пламени, воспламеняющего пыле-воздушную смесь. Как показали испытания в опытном штреке, большую опасность в условиях контакта пыли с патронами представляют те ВВ. которые содержат значительные количества относительно медленно' разлагающихся нитратов калия или натрия.
Современные предохранительные ВВ, почти всегда имеющие кислородный баланс, близкий к нулю, если они удовлетворяют требованиям безопасности по воспламенению газа, оказываются, как правило, заведомо безопасными и в отношении пыли.
§ 5. ПРИНЦИПЫ ПОСТРОЕНИЯ СОСТАВА ПРЕДОХРАНИТЕЛЬНЫХ ВВ
Из рассмотренных соображений вытекают некоторые общие принципы построения состава предохранительных ВВ, которые (сознательно или эмпирически) получили свое отражение в практике.
Первое требование к таким составам заключается в ограничении энергии (теплоты) взрыва. * * * §
* Добавим, что раньше пламени взрыва приписывали большое значение также в отношении воспламенения метана. В дальнейшем было установлено, что величина пламени сильно изменяется в зависимости от условий взрыва, причем
нередко те условия, которые дают большое пламя, оказываются менее опас-
ными в отношении воспламенения газа. Более того, и сама природа свечения при детонации может быть различной. Поэтому в настоящее время пламя взрыва как критерий опасности воспламенения метана утратило приписывавшееся ему ранее значение. Более подробно вопрос о природе световых явлений при взрыве и связи их с предохранительными свойствами ВВ будет рассмотрен ниже (см.
§ 7, разд. 1).
508
Гл. X; Теория предохранительных, взрывчатых веществ
При большой энергии взрыва газообразные продукты его будут иметь более высокую температуру, которая может оказаться достаточной для воспламенения метана. Кроме того, при большой энергии ВВ обычно имеет и большую скорость детонации и соответственно вызывает мощную ударную волну в окружающей атмосфере, температура во фронте которой может быть гораздо более высокой, чем температура газов взрыва. В этом случае воспламенение метана может быть вызвано в результате сжатия и разогрева ударной волной.
Чтобы уменьшить энергию взрыва, в состав ВВ вводят инертные добавки. Однако добиваться понижения опасности воспламенения метано-воздушной смеси за счет одного только ограничения энергии взрыва практически невыгодно, так как эта энергия определяет также работоспособность ВВ. Поэтому для снижения температуры применяют не любые теплопоглотители, а такие, которые одновременно каталитически увеличивают полноту взрыва и затрудняют воспламенение метано-воздушной смеси. Оба эти обстоятельства резко снижают опасность воспламенения метана газами данной температуры по сравнению с тем случаем, когда взрыв и контакт с метаном протекают в отсутствии «инертных» добавок данного типа.
Следует добавить, что при достаточно низкой энергии взрыва целесообразно стремиться получить максимально возможную скорость детонации, так как при этом достигается наиболее полное превращение ВВ в конечные продукты и малая концентрация промежуточных активных продуктов в газах взрыва. Одновременно это означает повышение бризантного действия взрыва, что нередко желательно при работе по породам повышенной крепости.
Наконец, можно уменьшать опасность воспламенения газа также за счет неполноты превращения ВВ при взрыве, применяя компоненты пониженной реакционной способности, грубое их измельчение, большую плотность ВВ и т. д. Если при этом температура газообразных продуктов взрыва будет сильно снижена, то, несмотря на образование активных промежуточных продуктов превращения, воспламенения метано-воздушной смеси может не произойти.
Этот путь для большинства случаев нецелесообразен, поскольку он сопряжен с понижением работоспособности и, кроме того, ненадежен, так как среди разнообразных условий взрывных работ могут встретиться и такие, в которых превращение при взрыве будет полным и тогда произойдет воспламенение метана. Лишь в некоторых условиях взрывных работ, когда трудно обеспечить безопасность другими средствами, снижение опасности воспламенения за счет неполноты превращения ВВ оказывается эффективным средством и находит применение.
Вероятность воспламенения газа особенно велика в случаях, когда заряд ВВ частично или полностью обнажен и непосредственно соприкасается с метано-воздушной смесью. Такие случав могут иметь место либо когда шпуры пересекают трещины или щели в уголь
£ 5. Принципы построения состава предохранительных ВВ
509
ном пласте, либо когда ряд зарядов взрывают поочередно и действие одних зарядов может привести к обнажению других. Предохранительные ВВ обычного типа можно сделать безопасными в этих условиях, если вводить в них очень много «инертной» соли. При этом, однако, работоспособность ВВ становится крайне малой.
Решить задачу удалось путем создания так называемых селективно детонирующих ВВ, включающих компоненты резко различной реакционной способности. В таких ВВ первичное превращение наиболее реакционноспособных компонентов происходит при любых условиях взрывания (заряд открыт или замкнут в шпуре). Компоненты с меньшей реакционной способностью будут, однако, вступать во взаимодействие лишь в том случае, если превращение протекает в замкнутом объеме и давление, созданное первичным процессом, не падает слишком быстро. В этом случае газообразные продукты первичного процесса успевают передать избыток своего тепла менее реакционноспособным компонентам и вызвать их взаимодействие. Чем быстрее проходит первичная реакция и чем меньше при ней выделяется энергии, тем резче выражена селективность детонации, тем позже наступает (если она вообще происходит) реакция малореакционноспособных компонентов.
Таким образом, полная теплота реакции селективно детонирующих ВВ выделяется лишь тогда, когда есть сопротивление расширению газов, которое взрыв должен преодолеть. На преодоление сопротивления расходуется часть энергии, температура газов снижается и соответственно уменьшается возможность воспламенения ими метано-воздушной смеси. Если же заряд частично или полностью обнажен и газы могут поступать в атмосферу выработки без совершения работы, то и в этом случае они не представляют опасности, так как температура, достигаемая при превращении только наиболее реакционноспособных компонентов, слишком для этого низка, а остальная часть ВВ вследствие быстрого спада давления не будет реагировать, играя роль инертного теплопоглощающёго компонента.
Для обеспечения реальной безопасности селективность детонации должна быть велика. При ограниченной селективности возможно воспламенение метано-воздушной смеси в следующих условиях.
Представим себе, что газообразные продукты взрыва, расширяясь, движутся по трещине, имеющейся в угольном пласте, и увлекают с собой непрореагировавшие мало реакционноспособные компоненты ВВ. Пройдя некоторое расстояние по трещине, газы встречаются с какой-либо преградой, тормозящей их движение. Вследствие торможения кинетическая энергия газов переходит в тепло, температура и давление повышаются и, если реакционная способность разлетающейся части ВВ недостаточно мала, остатки его могут прореагировать и воспламенить метано-воздушную смесь. Такое поведение особенно типично для аммиачной селитры. Испытание
510
Гл. X. Теория предохранительных взрывчатых веществ
в мортире-желобе при наличии отражающей стенки и было введено, чтобы учесть опасность воспламенения при рассмотренном явлении.
Таким образом, основные принципы построения составов предохранительных ВВ заключаются в следующем:
а) ограничение температуры и теплоты взрыва, что обеспечивают введением иереагирующих солей;
б) применение таких нереагирующих солей, которые являются отрицательными катализаторами окисления метана;
в) применение такого соотношения компонентов, которое соответствует нулевому кислородному балансу, исключающему при полном превращении образование горючих газов и свободного кислорода;
г) использование принципа селективной детонации, уменьшающей опасность от взрыва обнаженных зарядов.
Поскольку желательно ограничить теплоту (температуру) взрыва, в качестве основного компонента предохранительных ВВ широко применяют аммиачную селитру. Смеси на ее основе имеют низкую теплоту взрыва *, поэтому первоначально во Франции, а затем и в России применяли предохранительные ВВ, состоящие просто из аммиачной селитры, сенсибилизированной добавкой горючего или более чувствительного ВВ. Таковы были гризутины пластовый (88% аммиачной селитры, 12% слабожелатинированного нитроглицерина) и породный (70—71% аммиачной селитры, 30—29% желатинированного нитроглицерина) и составы Фавье (80—95% аммиачной селитры и 5—20% ароматического нитросоединения — динитронафталина, динитробензола, тринитронафталина).
Однако применять все эти смеси, не содержащие «инертных» добавок, нерационально, так как опасность воспламенения газа при их взрыве уменьшается только за счет понижения энергии взрыва п остается еще довольно значительной; кроме того, они имеют свои частные недостатки. Так, гризутины имеют сильно положительный кислородный баланс; это приводит к тому, что энергия, которую можно получить за счет кислорода, выделяющегося при распаде аммиачной селитры, используется неполностью; наряду с этим содержание кислорода в газах взрыва, как указывалось выше, увеличивает опасность воспламенения. Составы Фавье с нулевым кислородным балансом имеют слишком высокую температуру взрыва и, кроме того, отличаются низкой восприимчивостью к детонации и значительной слеживаемостью.
Для смягчения присущих им недостатков современные предохранительные ВВ на основе аммиачной селитры строят так, чтобы они имели нулевой кислородный баланс и содержали наиболее эффективные из известных сегодня и доступных «инертных» добавок. Наряду с
* Теплота взрыва аммиачной селитры составляет всего 378 ккал/кг, теплота взрыва ее смеси с углеродом в отношении 93 : 7 (нулевой кислородный баланс)' также низка: 893 ккал/кг.
§ 5. Принципы построения состава предохранительных ВВ
511
этим они должны обладать достаточно высокой детонационной способностью, чтобы свести к минимуму количество частиц ВВ и продуктов неполного его распада, попадающих при взрыве в метано-воздушную смесь. Повышенная детонационная способность достигается тонким измельчением аммиачной селитры и горючих компонентов и тесным их смешением друг с другом.
Эффективным средством повышения детонационной способности аммонитов является введение в их состав небольших количеств высокочувствительных взрывчатых компонентов (жидких или твердых): нитроглицерина, нитрогликоля, тэна и т. п. Наряду с основными компонентами в состав аммонитов вводят добавки, предотвращающие слеживание (древесная мука, стеараты и т. п.) и снижающие ув-лажняемость.
Для повышения детонационной способности аммонитов можно также применять «инертную» добавку в виде частиц крупных размеров. В таком виде она в меньшей степени затрудняет прохождение детонационной волны; в то же время, дробясь при взрыве, добавка выполняет свои положительные функции: обеспечивает догорание ВВ и затрудняет воспламенение метано-воздушной смеси. Правда, здесь имеется известное противоречие: детонационная способность выше, когда «инертную» соль вводят в виде крупных кристаллов. Эффективность же соли в смысле предотвращения вспышки метана тем больше, чем тоньше она измельчена. Тем не менее разумное использование этого метода, например применение «инертной» добавки в виде комочков, состоящих из мелких частиц, позволяет существенно повысить детонационную способность составов с большим содержанием «инертной» добавки без ущерба для предохранительных свойств.
Как пример состава современных аммонитов можно привести аммониты Ш/1, ПЖВ-20 и III/2. Аммонит Ш/1 содержит 56% аммиачной селитры, 9% тротила, 3% древесной муки и 32% хлористого натрия. Аммонит ПЖВ-20 содержит 64% аммиачной селитры, 16% тротила и 20% хлористого натрия. Аммонит III/2 содержит 70% аммиачной селитры, 6% нитроглицерина, 2% дпнитротолуолз, 3% древесной муки и 19% хлористого натрия *.
Известны также и до сих пор еще применяются в зарубежных странах предохранительные ВВ, не содержащие аммиачной селитры. Основным их взрывчатым компонентом является желатинированный нитроглицерин; в качестве «инертной» добавки применяют тот же хлористый натрий, а также некоторые другие соли щелочных металлов. Некоторым преимуществом таких ВВ перед аммонитами является высокая детонационная способность и большая бризантность. Существенные их недостатки заключаются в повышенной опасности в обращении и высокой стоимости. Как пример таких веществ можно назвать английский состав, содержащий 57—58% нитрогли
* ВВ такого типа получили в дальнейшем название победитов.
512 Гл. X. Теория предохранительных взрывчатых веществ
церина, 3—3,5% коллодионного хлопка, 5% натровой селитры, 11% хлористого натрия, 21—22% буры.
Применяют также ВВ смешанного типа, содержащие значительные количестве и аммиачной селитры и нитроглицерина. В качестве примера можно указать немецкий нобелит В, содержащий 30% желатинированного нитроглицерина, 26,5% аммиачной селитры,
Фиг. 10. 7. Фотография взрыва в мортире-желобе взрывчатых веществ, содержащих: в—15% нитроглицерина и смесь натровой селитры и древесной муки; б—15% нитроглицерина и только инертные соли.
0,5% древесной муки, 3% водного 50%-ного раствора азотнокислого кальция * и 40% хлористого натрия.
По данным немецких исследователей, минимальной опасностью воспламенения метана отличаются ВВ, построенные по принципу селективной детонации. Такие ВВ содержат ограниченное количество (до 15%) компонентов высокой реакционной способности, например нитроглицерина, и смесь относительно крупнозернистых порошкообразных медленно реагирующих невзрывчатых компонентов, один из которых является носителем кислорода (например NaNO3), а другой — горючим (например, древесная мука). Взаимодействие последних двух компонентов происходит лишь при достаточно высоком давлении. Когда взрывается заряд без прочной оболочки, натровая селитра и древесная мука ведут себя как инертные компоненты. Наглядное доказательство этого дает сопостав-
* Для придания В В пластичности.
£ 6. Предохранительные оболочки и заменители ВВ
513
ление фотографий (см. фиг 10. 7) взрыва в мортире-желобе одинаковых зарядов ВВ с 15% нитроглицерина, содержащих смесь натровой селитры и муки (а) и только инертные соли (б). Полное сходство характера свечения убедительно говорит о том, что в указанных условиях взрыва натровая селитра и древесная мука ведут себя как «инертные» добавки. Еще более наглядно это подтверждают опыты, при которых собирали твердые остатки после взрыва в мортире-желобе. Эти остатки в значительной мере состояли из непрореагировавших древесной муки и натровой селитры, уцелевших при прохождении детонационной волны. То, что при наличии прочной оболочки они все-таки реагируют, показывает значительное взрывное действие ВВ в этих условиях. Правда, это действие не может быть определено обычными методами; в бомбе Трауцля расширение составляет для некоторых эффективных в условиях применения ВВ всего 100 см3; причина этого заключается в недостаточности сопротивления, которое оказывает песочная забойка для того, чтобы взаимодействие селитры и муки прошло до конца. Взаимодействие компонентов малой реакционной способности наступает лишь в прочной оболочке и с заметным запаздыванием. В случае низкопроцентных (по нитроглицерину) смесей скорость детонации при переходе от взрыва заряда без оболочки к взрыву в тонкостенной (3 мм) железной трубке возрастает лишь очень незначительно. Требуется толстостенная трубка, чтобы реакция между селитрой и мукой успела пройти полностью.
В другом варианте ВВ этого типа горючее частично заменено хлористым аммонием. Это дает то преимущество, что хлористый натрий образуется в ходе превращения в крайне тонком состоянии за счет реакции
NH.C14- NaNO3 NaCl + N2 %- 2Н2О + у-О2,
т. е. одновременно с экзотермическими реакциями разложения аммиачной селитры и взаимодействия образовавшегося при нем кислорода с горючим. Эти условия наиболее благоприятны для торможения хлористым натрием воспламенения метано-воздушной смеси.
§ 6. ПРЕДОХРАНИТЕЛЬНЫЕ ОБОЛОЧКИ И ЗАМЕНИТЕЛИ ВВ ПРИ ВЗРЫВНЫХ РАБОТАХ
В рассмотренных выше примерах «инертную» добавку, снижающую опасность воспламенения метано-воздушной смеси, вводили в состав ВВ. Этот способ применения добавки имеет тот основной недостаток, что за счет нагрева инертной соли, начинающегося на ранней стадии взрыва, понижаются температура и давление газообразных продуктов, а это затрудняет распространение взрыва. Целесообразно поэтому создать условия, при которых добавка вступала бы в действие с некоторым запозданием, после того как химические реакции в ВВ успеют завершиться.
514 Гл. X. Теория предохранительных взрывчатых веществ
Одним из путей, ведущих к этой цели, является применение «инертной» добавки в виде так называемых предохранительных оболочек. Само взрывчатое вещество при этом может содержать инертные добавки в умеренных количествах или даже совсем их не содержать. Патрон такого ВВ помещают в оболочку толщиной несколько миллиметров, содержащую значительные количества «инертной» добавки, обычно того же щелочного хлорида. При взрыве оболочка распыляется и получившаяся пыль способствует завершению реакций превращения ВВ, а затем и тормозит воспламенение метана.
Существует два типа предохранительных оболочек: инертные оболочки, не содержащие взрывчатых компонентов, и активные предохранительные оболочки, которые, помимо «инертной» основы, содержат небольшие количества высокочувствительного жидкого ВВ и представляют собой слабое по действию, но очень восприимчивое к детонации взрывчатое вещество. При взрыве патрона ВВ, помещенного в активную предохранительную оболочку, последняя также взрывается. Этим достигается более полное и тонкое распыление «инертной» соли, обеспечивающее максимальную ее эффективность, В качестве материала активной оболочки часто применяют составы типа бикарбитов — смесей, содержащих в качестве взрывчатого компонента нитроглицерин, а в качестве основной «инертной» добавки — бикарбонат натрия. Такое сочетание компонентов обеспечивает очень высокую детонационную способность: смесь, содержащая всего 10% нитроглицерина, надежно взрывается от капсюля-детонатора. Бикарбонат особенно пригоден как добавка, понижающая температуру продуктов взрыва, так как он поглощает тепло не только физически, нагреваясь, но и в результате эндотермического разложения. Обычно в состав бикарбитов входит также значительное количество хлористого натрия.
Будучи слишком слабыми для применения в качестве самостоятельного ВВ (расширение в свинцовой бомбе составляет всего несколько десятков кубических сантиметров), бикарбиты в качестве предохранительных оболочек резко снижают опасность воспламенения метано-воздушной смеси. Такие оболочки существенно превосходят в этом отношении инертные предохранительные оболочки также и потому, что последние окружают патроны ВВ только по боковой поверхности, активные же и со стороны торцов. Поэтому при активных оболочках газообразные продукты взрыва ВВ не могут непосредственно попасть в окружающую атмосферу, при инертных же для торцовой части заряда это не исключается.
Указанные различия наглядно видны на фотографиях взрыва свободно подвешенных зарядов в оболочках обоих типов (фиг. 10.8). При инертных оболочках на обоих концах заряда наблюдаются снопы пламени, при заряде в активной оболочке свечение более слабое п его контуры ограничены контурами заряда.
Наиболее распространенным из заменителей ВВ является кар-
£ 6. Предохранительные оболочки и заменители ВВ
515-
докс. Он состоит в основном из прочной стальной трубки, на один конец которой навинчивается разрядная, а на другой — воспламенительная головка (фиг. 10. 9). Разрядная головка закрывается стальным диском, который срезывается по достижении в трубке определенного давления (1300—2800 ат). Воспламенительная головка имеет вентиль для наполнения трубки жидкой углекислотой и вводы' для тока, при помощи которого воспламеняется невзрывчатый нагревающий состав, помещенный в бумажной оболочке. Снаряженный
Фиг. 10. 8. Взрыв свободно подвешенного заряда из двух патронов предохранительного взрывчатого вещества без оболочки (а), в инертной (б) и в активной (в) предохранительной оболочке.
кардокс вводят в шпур, выбуренный в угле или в породе. Нагревающий состав поджигается пропусканием тока, разогрев жидкой углекислоты повышает ее давление, диск срезается и вырывающиеся через, разрядную головку газы раскалывают окружающую среду. Трубка выдерживает большое число подрывов.
Фиг. 10. 9. Устройство патрона кардокс.
?—стальная трубка, 2—разрядная головка, 3—стальной диск, 4-—воспламенительная головка-. 5—вентиль для наполнения углекислотой, углекислота, 7—электрические вводы, 8—нагревающий состав.
Применение кардокса обеспечивает высокую безопасность от воспламенения метано-воздушной смеси и дает больший выход крупнокускового угля, но разрушающее его действие меньше, во многих случаях оно недостаточно' и обходится дороже обычных предохранительных ВВ. Кардокс применяют в ограниченных размерах в уголь
-516
Гл. X. Теория предохранительных взрывчатых веществ
ных шахтах некоторых стран. Так, в Англии число взрывов, произведенных кардоксом в 1953 г., составило около 3% общего их числа.
Гидрокс по своему устройству сходен с кардоксом. Основное отличие состоит в том, что вместо жидкой углекислоты он содержит заряд порошкообразного состава, способного к низкотемпературному горению, сопровождаемому образованием значительного количества газов. Этот состав включает около 55% нитрита натрия, 43% хлористого аммония, 1,5% окиси магния и образует (по весу) 47% хлористого натрия, 30% водяных паров и 23% азота. Преимуществом перед кардоксом является большая простота снаряжения.
Наконец, были попытки применить взамен ВВ сжатый до большого давления воздух, но такие способы тоже не получили значительного распространения.
§ 7 ПЛАМЯ ПРИ ВЗРЫВЕ И ВЫСТРЕЛЕ
1. Пламя при взрыве
: Как .мы видели, способность продуктов взрыва воспламенять метано-воздушную и пыле-воздушную смеси сильно зависит от их температуры. Температура может быть определена расчетом (см. гл. VIII). Расчет, однако, дает лишь возможное максимальное значение температуры при отсутствии теплопотерь и без совершения работы газами взрыва. Непосредственное экспериментальное определение температуры взрыва, как было отмечено, весьма затруднительно. В связи с этим для оценки температуры продуктов взрыва в качестве характеристики предохранительных свойств ВВ предлагали использовать пламя взрыва, полагая, что величина и продолжительность этого пламени тем больше, чем выше температура.
Величина и продолжительность пламени взрыва
Величину пламени легко определить, фотографируя взрыв на неподвижной пленке (фиг. 10. 10, а); продолжительность пламени можно установить, если получить такой снимок на пленке, движущейся с определенной скоростью (фиг. 10. 10, в).
Хотя в действительности, как мы увидим ниже, сьязь между величиной и продолжительностью пламени, с одной стороны, и температурой взрыва, с другой, сложнее, тем не менее долгое время пытались по характеристикам пламени количественно судить о степени безопасности предохранительных ВВ.
Опыты по определению величины пламени взрыва различных ВВ производили путем подрыва зарядов в воздухе на определенном расстоянии от открытого объектива фотоаппарата в темноте. Полученные снимки показали, что величина пламени находится в соответствии с теплотой взрыва. ВВ, имеющие большую теплоту взрыва, а следовательно, как правило, и более высокую температуру взрыва, например гремучий студень, желатин-динамиты, дают очень большое изображение пламени на фотографической пластинке.
§ 7. Пламя при взрыве и выстреле
517
ВВ со сравнительно малой температурой взрыва, например, предохранительные, дают пламя значительно меньших размеров. В отдельных случаях изображение пламени на фотопластинке вообще не обнаруживается.
Помимо свойств ВВ, на величину пламени влияют условия опыта. Так, например, с увеличением веса заряда, естественно, возрастает и величина пламени.
В некоторых случаях, однако, не наблюдается соответствия между теплотой взрыва и величиной пламени. Так, дымный порох при относительно малой теплоте взрыва образует большое пламя. Это объясняется тем, что дымный порох не детонирует, а лишь сгорает с большой скоростью; химическая реакция протекает сравнительно медленно и пламя имеет большие размеры и длительность. В итоге дымный порох оказывается одним из наиболее опасных ВВ в отношении воспламенения газо- и пыле-воздушных смесей.
Фиг. 10.10. Фотография взрыва желатин-динамита. а—иа неподвижной пленке, б—иа неподвижной пленке при наличии щели, а—на движущейся пленке.
Пример дымного пороха показывает, что продолжительность пламени определяется не только теоретической температурой взрыва, достигаемой при использовании всего тепла реакции на нагрев ее продуктов, но и характером протекания химического превращения. При детонационном превращении газы образуются под большим давлением; соответственно они быстро расширяются и охлаждаются, особенно если при расширении совершается работа. Если однако, мы имеем дело с ВВ, медленно детонирующим (большая толщина реакционной зоны), а тем более с ВВ, не детонирующим, а горящим, то охлаждение газов происходит медленнее. Оно обусловлено в этом случае главным образом теплоотдачей, особенно если сопротивление окружающей среды расширению газов незначительно.
Фактически достигнутая температура продуктов превращения может поэтому не соответствовать расчетной; различной может быть и длительность ее существования. В то же время, как мы видели, возможность воспламенения метано-воздушной смеси определяется не только температурой, до которой она нагрета, но и в сильной
518 Гл, X. Теория предохранительных взрывчатых веществ
степени длительностью пребывания при этой температуре. Поэтому при оценке теплового воздействия продуктов взрыва на окружающую атмосферу важно знать как температуру этих продуктов, так и длительность действия этой температуры. Эти характеристики оценивали по величине и продолжительности пламени при взрыве в некоторых определенных условиях.
Из различных методов, которые применяли для этой цели, опишем два.
1. По Меттегангу ВВ (100 а) взрывают в стальной мортире. Пламя взрыва фотографируют при помощи кварцевой линзы (пропускающей ультрафиолетовые лучи) на фотопленку, натянутую на быстровращающемся барабане. Между линзой и барабаном устанавливают экрай, имеющий щель, направление которой со
Фиг. 10.11. Фотография по методу Брун-свига пламени взрыва ВВ.
Фиг, 10. 12. Фотографии пламен различных ВВ. а—гремучий студеиь, б—предохранительное взрывчатое вещество.
впадает с направлением оси барабана. При неподвижном барабане высота изображения соответствует длине пламени, а ширина его — ширине щели. При вращении барабана изображение растягивается в ширину. Зная окружную скорость барабана, можно по растянутости изображения рассчитать продолжительность существования пламени, воспринимаемого фотопленкой.
2. В методе, предложенном Брунсвигом, фотопленка неподвижна; вращается перед ней алюминиевый диск, имеющий ряд прорезов. Ширина изображения прорезов на пленке служит мерой продолжительности пламени. Одновременно производится фотография пламени на неподвижной пленке, позволяющая измерить величину пламени (фиг. 10.11).
На основании результатов, полученных в определенных одинаковых условиях, в отношении продолжительности пламени ВВ можно было разделить на три группы:
1. Вещества, образующие большое и длительное (до 0,25 сек.) пламя. К этой группе относятся дымный порох, нитроглицерин, гремучий студень, т. е. ВВ, опасные по газу и пыли.
2. Вещества, образующие пламя малой величины, продолжительность которого ниже 0,002 сек. Ко второй группе принадлежат предохранительные ВВ (фиг. 10.12).
£ 7. Пламя при взрыве и выстреле
519
3. Вещества, образующие двойное пламя (фиг. 10.13). За небольшим по величине и продолжительности первичным пламенем, расположенным на снимке непосредственно у устья мортиры, появляется значительно большее, удаленное от устья, вторичное пламя, отделенное от первичного темным промежутком. Вторичное пламя возникает в результате воспламенения горючих газообразных продуктов взрыва после смешения их с воздухом. Вторичное пламя дают только ВВ с сильно отрицательным кислородным балансом (например, пикриновая кислота или тротил), образующие при взрыве много окиси углерода, водорода и метана. Добавление к таким ВВ пламягасителей, например 5% хлористого натрия, устраняет вторичное пламя (фиг. 10.13, в). Длительность вторичного пламени сравнительно очень велика. Для пикриновой кислоты она составляет
Фиг. 10.13. Фотографии двойного пламени при взрыве пикриновой кислоты и тротила.
а—пикриновая кислота, б—тротил, в—пикриновая кислота с 5% хлористого натрия.
около 0,01 сек.; промежуток времени между первичным и вторичным пламенем — около 0,001 сек. Вследствие большой продолжительности вторичного пламени образующие его взрывчатые вещества весьма опасны как по газу, так и по пыли.
В дальнейшем было выяснено, что величина пламени, установленная фотографически, зависит также от условий взрывания. В некоторых случаях менее опасные предохранительные ВВ и условия взрывания могут давать большее пламя и наоборот. Поэтому пламя взрыва заряда в канале мортиры не может служить характеристикой сравнительной безопасности различных предохранительных ВВ и способов взрывания.
Свечение, возникающее при взрыве, может, однако, дать правильную характеристику опасности испытуемого ВВ, если методику оценки этого свечения привести в соответствие с современными теоретическими представлениями о причинах и механизме воспламенения газа при взрыве ВВ. Так, при испытаниях в мортире-желобе (см. стр. 496) оказалось, что те ВВ, которые дают на фотографиях значительное свечение в желобе и особенно у отражающей стенки, лег
520
Гл. X. Теория предохранительных взрывчатых веществ
че воспламеняют газ. Особенно резким получается различие в размерах зоны свечения и его интенсивности при сравнении непредохра-вительных и предохранительных ВВ.
Однако различие можно установить и между предохранительными ВВ, отличающимися по степени опасности (величине предельного заряда в мортире-желобе). На фиг. 10. 14 приведены фотографии свечения при взрывах зарядов двух ВВ. Первое из них (верхний снимок) воспламеняло метано-воздушную смесь взрывом заряда в 10 патронов; второе ВВ не воспламеняло газ зарядом в 16 пат-
Фиг. 10. 14. Фотография взрыва в мортире-желобе двух предохранительных ВВ.
ронов — максимальном, который мог быть помещен в желоб. Добавим, что бризантность второго ВВ была даже несколько выше, чем первого, так что различие в интенсивности свечения не могло быть объяснено разной интенсивностью ударных волн, но, по-видимому, обусловлено догоранием продуктов взрыва при торможении у стенки.
Большое влияние на характер свечения оказывает распределение реакционноспособного компонента (жидкого ВВ) в инертной соли; при этом то распределение, которое приводит к сильному и длительному свечению, одновременно является опасным и в отношении воспламенения метано-воздушной смеси.
Влияние окружающей среды на свечение при взрыве
Световые явления, наблюдаемые при взрыве, до недавнего времени считали обусловленными только свечением продуктов взрыва твердых (если они образуются) и газообразных, нагретых за счет теплоты взрыва до высокой температуры. Работы французе-
§ 7. Пламя при взрыве и выстреле
521
ких исследователей Мюраура и Мишель-Леви показали, что излучение продуктов взрыва является не единственным, а зачастую и нс основным источником свечения при взрыве,
Мюраур установил сильную зависимость интенсивности свечения от свойств газа, в атмосфере которого находится взрываемый заряд. Опыты производили следующим образом: маленькие комочки азида свинца размещали на небольшом расстоянии друг от друга на куске стекла по сторонам равнобедренного треугольника. Комочек, расположенный у вершины (между равными сторонами), взрывали, нагревая его накаленной проволочкой. Детонация передавалась от одного комочка к другому. В середине основания треугольника ударные волны встречались. Стекло с азидом помещали под
Фиг. 10. 15. Свечение при взрыве азида свинца в различных газах. а — в аргоне, б—в азоте, в—в углекислоте, г—в бутане.
стеклянный колокол с плоской крышкой, через которую фотографировали световые явления. Колокол заполняли различными газами — аргоном, азотом, углекислотой, бутаном и др. (фиг. 10. 15). Оказалось, что интенсивность свечения при взрыве очень сильно зависит от природы газа, окружающего взрывчатое вещество. Наиболее-сильное свечение дает газ с минимальной теплоемкостью — аргон,, за ним следуют азот, углекислота и, наконец, бутан, имеющий максимальную теплоемкость.
Дальнейшие опыты показали, что интенсивность свечения зависит,,по-видимому, не только от теплоемкости, но и от плотности газа. Увеличение давления уменьшает интенсивность световых явлений во всех газах (фиг. 10. 16).
522
Гл. X. Теория предохранительных взрывчатых веществ
Продолжительность свечения в опытах Мюраура была крайне мала; при заряде 0,4 г ВВ (в этом опыте был применен тетранитрометан с толуолом) она меньше 5- 10~6 сек. Яркость свечения очень велика. По ориентировочным опытам и подсчетам Мюраура она превосходит яркость солнечного света.
Фиг. 10. 16. Зависимость интенсивности свечения при взрыве азида свинца от давления окружающего газа.
Казалось естественным приписать свечение газообразным продуктам детонации, имеющим высокую температуру. В этом случае, однако, оставалась бы непонятной зависимость свечения от природы окружающего газа. Кроме того, на стекле можно было обнару
Фиг. 10.17. Отложения свинца после взрыва цепочки комочков азида свинца на стекле.
Фиг. 10.18. Свечение при взрыве цепочки комочков азида свинца.
жить после взрыва вокруг места нахождения комочка азида отложения свинца, более или менее равномерные во всех направлениях (фиг. 10. 17). Резкое усиление этих отложений наблюдается только примерно посредине между комочками, где встречаются частицы продуктов взрыва соседних комочков. Максимальное свечение на
£ 7. Пламя при взрыве и выстреле
523
снимках соответствует, однако, не этой зоне, а зоне, непосредственно прилегающей к «пассивному» комочку, и кроме этого, имеет определенную направленность (фиг. 10. 18). Далее в газах с большой теплоемкостью свечение исчезает непосредственно у поверхности передающих комочков азида.
Наконец, если бы свечение испускалось газами взрыва, то следовало бы ожидать сильной зависимости интенсивности свечения от температуры взрыва. Опыты со смесями тетранитрометана и толуола с различной температурой взрыва (6000°С и 4500°С), но с приблизительно одинаковой бризантностью не обнаружили заметного различия в интенсивности свечения.
Все это очень трудно согласовать с допущением, что светятся газообразные продукты взрыва как таковые или в смеси с окружающим газом. Поэтому причиной свечения следует считать ударную волну, нагревающую газ, через который она проходит, до очень высокой температуры.
Расчет показывает, что если по воздуху, находящемуся под атмосферным давлением, распространяется ударная волна со скачком давления на фронте всего 400 ат, то в зоне сжатия может быть достигнута температура 10 500° С; для аргона при тех же условиях расчет дает 27 000° С. Разумеется, эти числа сильно завышены, так как они рассчитаны в предположении об отсутствии при прохождении волны какого-либо изменения среды, сопровождающегося поглощением тепла. На самом же деле, несомненно, происходит диссоциация многоатомных молекул на атомы
и интенсивная ионизация, которая и определяет наблюдаемое свечение.
Косвенное доказательство возбуждения свечения ударной волной Мюраур видит в том, что спектры свечения, полученные при взрыве ВВ с добавками взрывчатых металлических солей, не отличаются от спектров, полученных в отсутствии таких солей, и не обнаруживают ни одной линии спектра введенного металла. Если же металл ввести в газ, окружающий ВВ, то в пламени взрыва наблюдаются линейчатые спектры соответствующих металлов, заходящие далеко в ультрафиолетовую часть.
Свечение взрыва особенно усиливается, если происходит встреча ударных волн; оно появляется также и при отражении ударной волны даже от очень легкого предмета — листа бумаги (фиг. 10. 19), нитки и т. д.
По Мюрауру, пламя и ударная волна связаны следующим механизмом. Если интенсивность ударной волны достаточно велика, то
Фиг. 10.19. Свечение при отражении ударной волны от свободно подвешенного листа бумаги.
524 Гл. X. Теория предохранительных взрывчатых веществ
воздух, окружающий ВВ, адиабатически сжимается во фронте волны и, нагреваясь при этом до высокой температуры, ярко светится. Это и есть пламя взрыва. После прохождения ударной волны свечение не исчезает немедленно. Таким образом, за ударной волной следует светящийся воздух, движущийся с большой скоростью и не имеющий ничего общего с газообразными продуктами взрыва, непрозрачными, слабо светящимися и перемещающимися с относительно малой скоростью.
На некотором расстоянии от границы заряда интенсивность ударной волны падает до такой степени, что она перестает вызывать свечение, но активированные газы еще в течение некоторого времени следуют за ней с постепенно уменьшающейся интенсивностью свечения.
Мюраур полагает, что и то свечение, которое фиксируют при фотографировании взрыва, например в бомбе Трауцля, имеет своей причиной не светящиеся продукты взрыва, а ударную волну и зависит главным образом от бризантности ВВ. Действительно, соответствующие опыты с различными ВВ показали, что свечение исчезает в бутане и очень интенсивно — в аргоне.
2. Дульное пламя при выстреле
При стрельбе, особенно из орудий крупных калибров, кроме мало заметного пламени непосредственно у дула орудия, связанного с свечением продуктов горения пороха, иногда наблюдается образование большого пламени на некотором расстоянии от дула. Это пламя называют дульным пламенем. Образование дульного пламени нежелательно, потому что оно демаскирует, особенно при стрельбе ночью или в туманную погоду, местонахождение орудия и, кроме того, ослепляет артиллеристов, ведущих стрельбу. Дульное пламя образуется таким же образом, как вторичное пламя, при взрыве ВВ с отрицательным кислородным балансом.
Газообразные продукты горения пороха, содержащие значительные количества (до 60%) водорода, окиси углерода, а также метана, смешиваются с воздухом, образуя горючую смесь. Поскольку пороховые газы выбрасываются в атмосферу еще очень горячими, температура этой смеси может быть выше ее температуры вспышки; в этом случае происходит воспламенение. Доказательством этого механизма образования дульного пламени является, во-первых, тот факт, что пламя возникает только на некотором расстоянии от дула после того, как произойдет смешение газов с воздухом, причем не в середине газового облака, а в передней его части и, во-вторых, отсутствие дульного пламени при стрельбе в атмосфере азота или углекислоты.
Для устранения дульного пламени применяют механические и химические методы. Первые сводятся к использованию различного рода надульников и других насадок, обеспечивающих охлаждение вылетающих из ствола пороховых газов, прежде чем они смеша
§ 7. Пламя при взрыве и выстреле
525
ются с воздухом. Химические методы заключаются в введении в заряд пороха специальных добавок, так называемых пламегасителей. Основное назначение этих добавок состоит в том, чтобы понизить температуру горения пороха, а соответственно и температуру пороховых газов, вылетающих при выстреле из канала орудия, и таким образом затруднить их воспламенение. В качестве этих добавок в состав пороха вводят вещества с большим содержанием горючих элементов, например вазелин, канифоль, централит, дибутил-фталат, камфору, уменьшающие содержание кислорода в порохе и соответственно температуру горения. В принципе можно было бы применять также добавки, повышающие кислородный баланс, что уменьшало бы содержание горючих газов в продуктах горения. Практического применения, однако, этот путь борьбы с дульным пламенем не получил.
Пламягасящие добавки применяют также в виде дополнительного заряда, помещаемого впереди порохового заряда. В таком виде применяют главным образом соли калия — хлористый калий, сернокислый калий, кислый щавелевокислый калий и др. Действие этих солей в значительной мере не только термической природы. Калиевые соли в высокой мере обладают способностью обрывать цепи реакций воспламенения окиси углерода и водорода. Этим эффектом, очевидно, и определяется в значительной мере пламяга-сящее действие таких добавок, применяемых в количествах, не превышающих нескольких процентов от веса пороха.
3. Обратное пламя
После выстрела бездымным порохом иногда при открывании затвора орудия образуется пламя, выходящее из казенной части ствола, получившее название обратного пламени. Оно особенно опасно в танковых, самоходных и казематных орудиях. Обратное пламя связано с воспламенением горючих продуктов горения пороха, оставшихся после выстрела в канале орудия. При открывании затвора эги газы, смешиваясь с воздухом, образуют взрывчатую смесь. Температура пороховых газов к моменту открывания затвора обычно успевает значительно упасть. Соответственно температура образовавшейся газо-воздушной смеси слишком низка, чтобы могло произойти воспламенение. Смесь, однако, может воспламениться от тлеющих остатков картузной ткани или шнуров, которыми были связаны пороховые пучки, если они не сгорели полностью при выстреле. Поэтому особенно часто обратное пламя появляется при стрельбе из орудий большого калибра, где применяют картузное заряжание. В орудиях гильзового заряжания обратное пламя наблюдается при очень быстрой стрельбе. Наиболее опасно возникновение обратного пламени в момент введения в камеру орудия нового заряда, который может при этом воспламениться до закрытия затвора и вывести орудие из строя.
526 Гл. X. Теория предохранительных взрывчатых веществ
Образованию обратного пламени благоприятствует малая плотность заряжания, а также и малый вес заряда; в обоих случаях образуется больше горючих газов. Нитроглицериновые пороха, в продуктах горения которых содержится больше углекислоты, по сравнению с пироксилиновыми, менее склонны к образованию обратного пламени. Один из методов борьбы с обратным пламенем состоит в применении картузов из нитрованной ткани, целиком сгорающих при выстреле и не дающих тлеющих остатков, а также в использовании разного рода пламегасителей. Такими пламегасителями являются, в частности, продукты горения дымного пороха; поэтому применение воспламенителей из дымного пороха уменьшает вероятность возникновения обратного пламени.
Новейшие исследования показали, что причиной образования обратного пламени может быть также «проскок» дульного пламени в канал ствола орудия. Поэтому предотвращение образования дульного пламени или по крайней мере его проскока в ствол является одним из способов предупреждения обратного пламени.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Общая
Горст А. Г., Пороха и взрывчатые вещества, 2-е изд., Оборонгиз, 1957.
Будников М. А., Левк о вич Н. А., Быстров И. В., Сироти н-с к н й В. Ф. и Ш е х т е р Б. И., Взрывчатые вещества и пороха, Оборонгиз, 1955.
Яременко Н. Е. и Светлов Б. Я., Теория и технология промышленных взрывчатых веществ, Промстройиздат, 1957.
Вопросы теории взрывчатых веществ, кн. I, сб. статей под ред. Ю. Б. Харитона и С. Б. Ратнера, АН СССР, 1947.
Физика взрыва. Сборники научно-исследовательских работ в области физики взрыва, № 1—5, АН СССР, 1952—1955.
Баум Ф. А., Станюкович К. П. иШехтер Б. И., Физика взрыва, Фнзматгиз, 1959.
К главам II—IV
Кондратьев В. Н., Кинетика химических газовых реакций, АН СССР, 1958.
С е м е и о в Н. Н., О некоторых проблемах химической кинетики и реакционной способности, АН СССР, 1958.
Андреев К. К., Термическое разложение и горение взрывчатых веществ, Госэнергоиздат, 1957.
Зельдович Я. Б., Теория горения и детонации газов, АН СССР, 1947.
Зельдович Я. Б. и Компанеец А. С., Теория детонации, Гостехиздат, 1955.
Хитрин Л. Н., Физика горения и взрыва, Изд. МГУ, 1957.
High Speed Aerodynamics and Jet Propulsion. Vol. II. Combustion Processes, Editors B. Lewis, R. N. Pease and H. S. Taylor, Princeton University Press, 1956.
Cook. M. A. Science of High Exi losives, ACS Monograph No 139, Reinhold Publishing Corporation, New York, 1958.
Taylor J., Detonation in condensed Explosives, Oxford at the Clarendon Press, 1952.
К главе V
Боуден Ф. и Иоффе А., Возбуждение и развитие взрыва в твердых и жидких веществах, ИЛ., 1955.
Bowden F. Р. and Yoffe A. D. Fast Reactions in Solids, Butterworths Scientific Publications, London, 1958.
К главам VI и IX
Зельдович Я. Б., Теория ударных волн и введение в газодинамику, АН СССР, 1946.
Садовский М. А., Механическое действие воздушных ударных волн по данным экспериментальных исследований. Сборник «Физика взрыва» № 1, АН СССР, 1952.
Коул Ф„ Подводные взрывы, ИЛ, 1950.
Покровский Г. И., Федоров И. С., Действие удара и взрыва в деформируемых средах, Промстройиздат, 1957.
Барон Л. И., Докучаев М. М., Васильев Г. А., Дорониче-в а Л. А., Взрывные работы в горнорудной промышленности, Госгортехиздат, 1960.
Единые правила безопасности при взрывных работах, Металлургнздат, 1958.
К главе X
ГольбиндерА. И. и Андреев К. К., Антигризутные взрывчатые вещества, Углетехиздат, 1947.
Дубнов Л. В., Предохранительные взрывчатые вещества в горной промышленности, Углетехиздат, 1953.
ПРИЛОЖЕНИЯ
Приложение 7
ПРЕДЕЛЫ ГОРЮЧЕСТИ СМЕСЕЙ ГАЗОВ И ПАРОВ С ВОЗДУХОМ
Формула Пределы горючести (в И горючего газа по объему)
Вещество
Нижний Верхний
Парафины
Летай СН4 5,00 15,00
Этан сгн6 3,00 12,50
Пропан C3H3 2,12 9,35
Бутан С4Н]0 1,86 8,41
Изобутан С4Н10 1,80 8,44
Пентан CSH12 1,40 7,80
Изопентан CgHja 1,32 *—
2,2-Д имет илпр опан CsH12 1,38 7,50
Гексан CgHi4 1,18 7,40
Гептан с?н1в 1,10 6,70
2,3-диметилпентан с?н16 1,12 6,75
Октан СзНщ 0,95 *—
Нонан С9Н20 0,83 —
Декан С10Н22 0,77 5,35
Олефины
Этилен QH4 2,75 28,60
Пропилен С3Н6 2,00 11,10
Бутен-1 С4н8 1,65 9,95
Бутен-2 С4Н8 1,75 9,70
Амилен с5н10 1,42 8,70
Ацетилены
Ацетилен С2Н2 2,50 80,00
Приложения
529
Продолжение
Вещество Формула Пределы горючести (в % горючего газа по объему)
Нижний Верхний
Ароматические углеводороды Бензол СбНб 1,40 7,10
Толуол С7Н8 1,27 6,75
о-Ксилол СвНю 1,00 6,00
Циклические углеводороды Циклопропан С3Н6 2,40 10,40
Циклогексан С6Н12 1,26 7,75
Метилциклогексап С7Н14 1,15
Терпены Терпентин С1он1б 0,80 —-
Спирты Метиловый спирт СН4О 6,72 36,50
Этиловый спирт С2Н6О 3,28 18,95
Аллиловый спирт С3н6о 2,50 18,00
н-Пропиловый спирт с3н8о 2,15 13,50
Изопропиловый спирт С3н8о 2,02 11,80
н-Бутиловый спирт С4НюО 1,45 11,25
Изобутиловый спирт С4Н100 1,68 —
Амиловый спирт с5н12о 1,19 —
Изоамиловый спирт С5Н1;О 1,20 —
Альдегиды Ацетальдегид С2Н4О 3,97 57,00
Кротоновый альдегид С4Н6О 2,12 15,50
Фурфурол С5н4о3 2,10 —
Паральдегид CGH12O3 1,30 •
Простые эфиры Метилэтиловый эфир с3н8о 2,00 10,00
Диэтиловый эфир C4H]qO 1,85 36,50
Дивиниловый эфир С4Н6О 1,70 27,00
Кетоны Ацетон С3Н6О 2,55 12,80
Метилэтилкетон С4Н8О 1,81 9,50
Метилпропилкетон С5н10о 1,55 8,15
Метилбутилкетон с6н12о 1,35 7,60
530
Приложения
Продолжение
Вещество Формула Пределы горючести (в % горючего газа по объему)
Нижний Верхний
Кис Уот ы
Уксусная кислота С2Н4О2 5,40 .—
Синильная кислота HCN 5,60 40,00
Сложные эфиры
Метилформиат с2н4о2 5,05 22,70
Этилформиат С3НбО2 2,75 16,40
Метилацетат с3н6о2 3,15 15,60
Этилацетат С4Н8О2 2,18 11,40
Пропилацетат с5н10о2 1,77 8,00
Изопропилацетат СзНщОг 1,78 7,80
Бутилацетат СЙН12О2 1,39 7,55
Амилацетат С;Н;4О2 1,10 —
Водород
Водород Н2 4,00 74,20
Соединения азота
Аммиак NH3 15,50 27,00
Циан c2n2 6,60 42,60
Пиридин c5h5n 1,81 12,40
Этилнитрат c2h5no3 3,80 —
Этилнитрит c2h5no2 3,01 50,00
Окиси
Окись -углерода co 12,50 74,20
Окись этилена C2H4O 3,00 80,00
Окись пропилена c3H6o 2,00 22,00
Диоксан С4Н8О2 1,97 22,25
Диэтилперекись C4HI0O2 2,34 —
Сульфиды
Сероуглерод cs;; 1,25 50,00
Сероводород H2S 4,30 45,50
Сероокись углерода cos 11,90 28,50
Хлориды
Метилхлорид CH3Ci 8,25 18,70
Этилхлорид C2H5C1 4,00 14,80
Пропилхлорид C3H7C1 2,60 11,10
Бутилхлорид C4H9C1 1,85 10,10
Изобутилхлорид С4Н9С1 2,05 8,75
П риложения
531
Продолжение
Вещество Формула Пределы горючести (в % горючего газа по объему)
Нижний Верхний
Аллилхлорид с3н5С1 3,28 11,15
Амилхлорид с5нпС1 1,60 8,63
Винилхлорид С2Н3С1 4,00 21,70
Этилендихлорид С2Н4С12 6,20 15,90
Пропилен дихлорид С3Н6С12 3,40 14,50
Брониды
Метилбромид СН3Вг 13,50 14,50
Этнлбромид С2Н5Вг 6,75 11,25
Аллилбромид С3Н5Вг 4,36 7,25
А м я п ы
Метиламин ch5n 4,95 20,75
Этнламни c2h7n 3,55 13,95
Диметиламнн c2h7n 2,80 14,40
Пропиламнн c3h9n 2,01 10,35
Диэтиламин C4HhN 1,77 10,10
Триметиламнн C3HgN 2,00 11,60
Триэтиламин c6h15n 1,25 7,90
Приложение 2
ПРЕДЕЛЫ ГОРЮЧЕСТИ СМЕСЕЙ ГАЗОВ И ПАРОВ С КИСЛОРОДОМ
Вещество Формула Пределы горючести (в % горючего газа по объему)
Нижний Верхний
Водород н2 4,65 93,9
Дейтерий d2 5,00 95,0
Окись углерода СО 15,50 93,9
Метан сн4 5,40 59,2
Этан С2Н6 4,10 50,5
Этилен С2Н4 2,90 79,9
Пропилен С3Н6 2,10 52,8
Циклопропан С3Н6 2,45 63,1
Аммиак NH3 13,50 79,0
Диэтиловый эфир С4НюО 2,10 82,0
Дивиниловый эфир 1 С4Н6О 1,85 85,5
Примечание. Пределы горючести определены при атмосферном давлении и комнатной температуре (из-за низкой упругости некоторых паров их верхние пределы определены при несколько повышенных температурах) для рас-пространения пламени снизу вверх в трубке или бомбе диаметром 50 мм илк больше.
532
fl ра.гожения
Приложение 3 ЧУВСТВИТЕЛЬНОСТЬ ВВ ПРИ УДАРЕ1
Чувствительность выражена как минимальная энергия удара в кгм, при которой наблюдается хотя бы 1 взрыв при 6 параллельных опытах. Определения произведены при ударе между двумя стальными роликами диаметром 15 мм и диаметром 10 мм и при ударе между стальным роликом и стальной пластинкой размером 20x20X5 мм, имеющей насечку, как у напильника.
ВВ Размер частиц мм Чувствительность в кгм прн ударе, определенная
между стальными роликами 0 15х 15 и 0 10x10 лиг на пластинках с насечкой 20x20x5 мм с роликом 0 Юх 10 мм
Вес груза в кг
5 1 0,1 5 1 0,1 0,025
1 2 3 4 5 6 7 8 9
Хлорат калия/крас-ный фосфор 75/25 Ацетиленистое серебро (из азотнокислого раствора) Ацетиленистая ртуть Циануртриазид Ацетиленистое серебро (из нейтрального раствора) Ацетиленистое серебро (из аммиачного раствора) Азид свинца Ацетиленистая медь Перекись трицикло-ацетоиа Азид ртути HgN3 Г ексаметилентрипе-роксиддиамин Тринитрорезорцинат-свиица Гремучая ртуть белая Тетразен Гремучая ртуть серая 0,06—0,075 <0,001 Тонкозернистая 0,02—0,55 0,01 0,01—0,1 <0,07 Зернистый <0,1 0,05—0,2 0,05-0,8 0,003—0,1 0,05—0,8 1 1 1,5 1 1 0,5 0,2 0,1 1 i ! 1 о.» 0,003 0,06 0,04 0,08 0,01 0,03 0,01 0,06 1 0,003 0,003 0,003 0,003 0,003 0,003 0,003 0,003 0,003 0,003 0,003 0,005 0,005 0,005 0,005
1 По данным Кенена, Иде и Хауита, Explosivstofiе, 6,232 (1958).
Приложения
533
Продолжение
В В Размер частиц мм Чувствительность в кгм при з’даре, определенная
между стальными роликами 0 15x15 и 0 10Х 10 мм на пластинках с насечкой 20x20x5 мм с роликом 0 10X10 мм
Вес груза в кг
5 3 1 4 0,1 5 1 0,1 0,025
1 2 5 6 7 8 9
Щавелевокислая 0,06—0,5 3 0,02 0,008.
ртуть Эритриттетраннтрат 0,1—0,5 0,5 0,2 0,03 0,02
Тэн 0,1—0,5 0,5 0,2 0,05 0,02
Нитрил азоизомасля- 0,1—0,2 0,5 0,2 0,5 0,2
ной кислоты
Хлоратнт 1* ** Тонкозернистый 0,5 0,2
Тетрил <0.3 2,5 0,5 0,5 0,2
Нитроклетчатка Тонковолокнистая 0.5 0,3 0,2
13,4% N
Коллоксилин 12,2% N Тонковолокнистый 0,5 0,4 1 0,2
Гексанитроднфеннл- 0,1-0,5 0,5 0,2 0,5 0,3
аминкалий
Аммонжелит 1*** Желатинообразный 0,1* 0,5 0,4
Аммонжелит 3**** ***** Желатпнообразный 1 0,4
Г ексоген 0,1-0,5 1 О.з 0,4 0,1
Тринитробензойная <0,2 1 1 0,4
кислота
Донарит 1?“!:’-; Тонкозернистый 1 0,6 1.5 0,4
Дннитроортокрезолат 0,1—0,5 0.5 0,5 0,5 0,4
натрия Нитроглицерин 0,03* 0,5 0,5
Тринитрорезорцин 0,1-0,5 1 0,5 0,5
Г ексанитродифенил- 0,06—0,2 1 0.8 0,5 0,5
амин
’ Значения получены между стальными роликами 0 10X10 мм, помещенными в обойму.
** Хлорагит 1 состоит из КСЮз (88,5%), древесной муки (8,5%) и парафинового масла (3%).
*** Аммонжелит 1 состоит из аммиачной селитры (52,3%), нитрогликоля (37,7%), тринитротолуола (4%), коллодионного хлопка (1,8%), древесной муки (4%) и мумии (0,2%).
**** Аммонжелит 3 состоит из аммиачной селитры (55%), дигликольдинитрата (22%), тринитротолуола (5%) и динитротолуола (6%).
***** донар1гг 1 содержит аммиачную селитру (80 %), ароматические нит-росоедпнения (14%) и нитроглицерин (4%).
534
П риложения
Продолжение
Чувствительность в кгм при ударе, определенная
ВВ Размер частиц мм между стальными роликами 0 15X15 и 0 ЮХ 10 мм на пластинках с насечкой 20x20x5 мм с роликом 0 10X10 мм
Вес груза в /тг
5 1 1 1 0,1 | 5 i 1 I 0.1 0,025
1 2 з i 4 i 5 1 6 1 7 ' 8 9
Ннтроглнколь 0,05* 1 0,5
Пнкрнновая кислота 0,1-2,0 5 11 0,5
Азид кальция 0,1-0,5 5 2 0,6
Азнд стронция 0,1—0,5 3 !2 0,6 !
Азнд барня 0,1—0,5 1 1,5 0,8
Бнхромат аммония 0,1—0,5 1,5 1 0.8
Пороховая мякоть (75% KNO3) <0,5 1,5 1 1
Дннитрозопентамети-лентетрамнн 0,06—0,3 1 1
Перхлорат аммония 0,1—0,5 1.5 1
Тетранитрокарбазол 0,1—0,5 1 1
Этилен днамнндиин-трат 0,1—0,5 1.5 1
Трнннтронафталнн 0,1—0,5 1.5 1.5
Днннтроортокрезо-лат аммония <0,2 1,5 1.5
Пиротехнический состав** 0,5-1,0 I 2 1,5
Окснцианнд ртути 1 0,1—0,5 2 ! 1,5 t
Параннтрофеноля г натрия (безводный) 0,06—0,2 ! 2 : 2 i t 1 i
Трнннтроаинлии j 0,1—0,5 1 2,5 1
Щавелевокислое серебро i <0/2 5 4 1
* Значения получены между стальными роликами 0 10X10 мм, помещенными в обойму.
** Пиротехнический состав содержит нитрат барня (52%), железные опи л-кн (30%), декстрин (9%) и алюминий (7%).
П риложения
535
Приложение 4
КИСЛОРОДНЫЙ БАЛАНС НЕКОТОРЫХ ВЗРЫВЧАТЫХ ВЕЩЕСТВ И КОМПОНЕНТОВ ВЗРЫВЧАТЫХ СМЕСЕЙ
Вещество Формула Атомный нли молекулярный вес Кислородный баланс %
Алюминий А1 27 —89,0
Аммония карбонат (NH4)2CO3 96 —52,2
Аммония нитрат nh4no3 80 +20,0
Аммония оксалат (NH4)2C2O4-H2O 142 —45,1
Аммония перхлорат nh4cio4 117,5 + 34,0
Аммония пикрат NH4C6 H2(NO2)3O 246 -52,0
Аммония сульфат (NH4)2SO4 132 —36,4
Аммония хлорид nh4ci 53,5 —44,9
Антрацен С14Н10 178 —296,6
Барня нитрат Ba (NO3)2 261 +30,6
Барня хлорат Ba(C103)2-H20 322 +29,8
Барня хромат BaCrO4 253,5 +9,5
Барня перекись BaO2 169,37 +9,4
Бария силицид BaSi2 194 —41,2
Бериллии Be 9 -177,5
Бумага (оболочка патронов) —— — —130,0
Вазелин СщНзз 254 —347,0
Гексаннтроднфеннламин [C6H2(NO2)3]2NH 439 -52,8
Гексоген CsHgNgOg 222 —21,6
Глицерин C3H5 (OH)3 92 — 122,8
Г люкоза CgHI2Og 180 — 106,5
Гремучая ртуть Hg (CNO)2 284 — 11,3
Декстрин C6H10O5 162 — 118,5
Днннтробензрл C6H4 (NO2)2 168 -95,3
Днннтроглицериа C3H5 (ONO2)3 oh 166 —29,3
Днннтрокснло л C6H2(NO2),(CH3)2 196 -130,5
Дннитронафгалин CI0H6 (NO2)2 218 —139,4
Днннтрохлоргидрин C3HS (ONO2)2C1 200,5 -16,0
Днннтрофенол C6H3 (NO2)2 oh 184 —78,2
Диннтротолуол c6h3(N02).,ch3 182 —114,4
Дициандиамид (CN)2(NH2)2 84 —114,3
Калия бнхромат K2Cr2O7 295 + 16,3
536
Приложения
Продолжение
Вещество Формула Атомный или молекулярный вес Кнслород-ный баланс %
Калия нитрат KNO3 101 4-39,6
Калия хлорат ксю3 122,5 4-39,2
Калия перхлорат КС1О4 138,5 4-46,2
Калия пикрат С6Н2 (NO2)3 ок 267 -38,9
Кальция нитрат Са (NO3)o-4H»O 236 4-33,9
Кальция перхлорат Са (С1О4)2 239 +53,6
Кальция хлорат Са (С1О3)<> 207 +46,4
Кальция силицид CaSiz 96 -83,3
Камфора С10Н1бО 152 —284,2
Керосин — —343,0
Клетчатка С6Н10О3 162 —118,5
Крахмал С6Н10О5 162 —118,5
Магний Mg 24,3 —65,8
Манинт CeHg(OH)G 182 — 114,3
М оной и тро гл и цернп С3Н5 (ONO3) (ОН)» 137 —52,6
Моноиитронафталнн C10H7NO.> 173 —198,8
Мононитрохлоргндрин C3HS (ONO3)OHC1 155,5 -48,8
Мононнтротолуол C6H4 (NO2) CH3 137 -181,0
Монопптрофенол CGH4 (NO») OH 139 — 132,4
Мука злаков CI5H,.5OH 381 — 132,0
Мука древесная (очищенная) СщН^Ою 362 —137,0
Мука древесная (опилки) — -135,0
Масло растительное 424 —215,0
Натрия нитрат NaNO3 85 + 47,0
Натрия хлорат NaCIO3 106,5 +45,0
Натрия перхлорат NaC104 122,5 +52,2
Натрия пикрат C6H2(NO»)3 ONa 251 —41,4
Нафталин CioH8 128 —300,0
Нитробензол c6h5no2 123 —162,7
Нитроглицерин c3h5(0N0..)3 227 + 3,5
Нитрогуанидин cn4h4o» 104 —30,8
Нитрополнглицерин — +2,0
Нитроклетчатка (коллоди- c..4h3In9o3P 1053 —38,7
оиная)
П риложения
537
Продолжение
Вещество Формула Атомный или молекулярный вес Кислородный баланс %
Нитроклетчатка (пирокси- C24H09N11042 1143 -28,6
лип)
Нитрокрахмал — — —33,5
Нитроманиит C6HS(NO3)6 452 +7,1
Октоген C4HSN8O8 296 —21,6
Парафин СгтНдо 338,52 —346,0
Перекись водорода Н2О2 34 +47,0
Пикриновая кислота СЙН2 (NO2)3 ОН 229 -45,4
Сахар тростниковый bioO} | 342 —112,2
Сера S 32 —100,0
Свинца нитрат Pb (NO3).> 331 -724,2
Скипидар СщН] 6 136 —329,4
Стронция нитрат Sr(NO3). 211,5 +37,8
Сурьма сернистая Sb,S3 336 —42,9
Сурьма металлическая Sb 120 —20,0
Таннин C.4Hi0O9 322 —119,3
Тетранитроан плин С6Н (NH2) (NO2)4 273 -32,2
Тетранитродиглицерин (C3H5)2O(NO3)4 346 —18,5.
Тетранитродиметнлаии.тия C0H (NO2)4N(CH3)2 301 -61,2
Тетранптрометан C(NO2)4 196 + 49,0
Тетраннтронафтални C10H4(NO2)4 308 —72,7
Тетрил C6H3 (NO-.)4 NCH3 287 —47,4
Тринитроанилин C6H2(NO2)3NH2 228 -56,6
Тринитробензол C6H3 (NO2)3 213 —56,3
Тринитродиметпланнлии C6H2 (NO->)3 N (CH3)2 256 -87,5
Тринитрокрезол C6H-CH3 (NO2)3OH 243 -62,6
Трннитронафталин cI0H5 (NO2)3 263 -100,4
Тринитрорезорцин C6H (NO2)3 (OH)2 245 —35,9
Тринитротолуол C6H2(NO,)3CH3 227 —74,0
Тротиловое масло — — —84,0
Тринитроксилол C6H (NO2)3(CH3)2 241 -89,6
Тан C (CH2ONO2)4 316 —10,1
Уголь C 12 -266,7
Фенол CBH5OH 94 —238,3
Этиленднн ит рамин C2HGN4O4 150 —32,0
538
П риложения
Приложение 5
ТЕПЛОТЫ ОБРАЗОВАНИЯ РАЗЛИЧНЫХ ВЗРЫВЧАТЫХ ВЕЩЕСТВ, ИСХОДНЫХ ПРОДУКТОВ, КОМПОНЕНТОВ ВЗРЫВЧАТЫХ СМЕСЕЙ И ПРОДУКТОВ ВЗРЫВА*
(За стандартное состояние для углерода принят алмаз)
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал/мол
Азид** аммония NH4N3 —26,79
, бария BaNg 5,32
„ калия KN3 -0,33
„ кальция CaNg —11,03
„ лития LiN3 —2,58
» меди (закисной) CuN3 -67,23
, меди (окисной) CuNg —140,4
„ натрия NaN3 —5,08
„ ртути (закисной) Hg2Ns -141,5
, рубидия RbN3 0,07
„ свинца PbN6 —115,5
, серебра AgN3 —74,17
„ стронция SrN6 -1,72
. таллия T1N3 -55,78
» цезия CsN3 2,37
Азобензол (транс) C^HigNo —71,4
Азобензол (цис) C12H1QN2 -81,0
Акардит I (асимметрическая дифенилмоче вина) CjgH jo.ONs 32,6
Акардит II (М-метил-М'М'-ди-фенилмочевина) Ci4H;iON2 29,1
Акардит III (М-этил-М'Ы'-ди-фенилмочевина) CI5H16ON2 40,5
М-аллил-№№-дифенилмо е-вина CjgH^ONo 13,48
Аммиак (газ) NH3 11,0
Аммиак (раствор) NH3 19,35
Аммиачные квасцы NH4AI(SO4)2.12H2O 1417,6
* За основу приняты таблицы Медара [Mem. Art. franq. 28, 415 (1954)j, дополненные позднейшими данными Медара, Тавернье и других исследователей. К сожалению, таблицы Медара не свободны от неточностей и ошибок, устранить которые полностью не представилось возможным.
** Данные для азидов относятся к 25°.
П риложения
539
Продолжение
Вещество Формула । Теплота образования при 18° С и постоянном давлении ккал/мол
Ангидрид борный (стекловидный) в..о3 281
„ ванадиевый V2O5 373
. малеиновый (тв.) C4H3O3 114,1
„ мышьяковистый октаэдрический As2O3 154,1
» серный (тв, (З-.мо- дификация) SO3 105,2
„ сернистый (газ) so.. 70,92
, сернистый (рас- твор) SO.J 79,5
угольный (газ.) со; 94,51
„ фосфорный (аморф.) Р’Ог 367,0
„ фталевый (тв.) C3H4O3 114,1
„ хлорноватистый (газ.) С1.О — 18,64
„ хлорноватистый (раствор.) сь.о —9,90
„ хромовый СгО3 137,1
Ангидроэннеагептит CgHjgOg 30,7,0
Анизол С7Н8О 30,2
Анилин (жидк.) c6h7n -4,5
Антрацен (тв.) —24,2
N-Ацетилдифенилампн Ci3H13ON 13,99
N-Ацетилгексагидродифениламин C14H19ON 75,89
Ацетилен (газ) С,Но -53,3
Ацетиленистое серебро —83,6
Ацетилен димочевина c4h6o3n4 118,63
Ацетоацетилдифени ламин clgHl5o2N 58,57
Ацетон (жидк.) C-sHgO 60,9
Ацетонитрил (жидк.) c2h3n -12,9
Бензальацетон (тв.) С10Ч10О 28,3
Бензальдегид C7H6O 21,5
Бензилдифениламин Q()H17N -39,14
Бензол (жидк. ) C6H6 -8,3
540
П риложения
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал; мол
Бензофенон (тв.) C13H10O 14.1
Бикарбонат калия кнсо3 230,2
„ натрия NaffCOg 226,4
Биоксалат калия КНС2О4 255,3
, натрия (безводп.) NaHC.,O4 257,7
„ натрия (гидрат) NaC2O5H3 330,1
Бисдифенилмочевина C26H22O2N4 -6,51
Битетрил C14lfgOigNio -27,48
Бихромат аммония (NH4)2 Cr>O7 423,6
„ калия KsCroO7 483
„ натрия Na2Cr2O7 471
Борнеол CioHigO 92,8
н. Бутан (газ) C4H j 0 31,6
н. Бутан (жидк.) C4H|0 36,7
Бутадиен-1,3 (газ) C4H6 —24,9
Бутадиен-1,3 (жидк.) C4H6 -19,8
Бутаидиол-1,2 C4HI0O.> 126,1
Бутандиол-1,3 С.НюОо 124,1
Бутандиол-2,3 C4H10O, 130,4
Бутанол-1 C4H10O 81,5
Бутанон C4H8O 68,9
Бутен-1 (газ) c4h8 1,5
Бутен-2 (цис) С(П8 3,1
Бутен-2 (транс) C4H8 3,9
Изобутен (газ) C4H8 5,1
Вата гигроскопическая* — qv = 4120 кал!г
Винилхлорид (газ) C2H;jCl -9
Винилхлорид (жидк.) C2H3Cf -4,1
Вода (жидк.) H2O 68,37
Вола (газ) H,O 57,78
П риложенмя
541
Продолжение
Вещество Формула Ten при лота образования 18° С и постоянном давлении ккал/мол
Воск Канделильский* (т. пл. 64—66° С) ~~ qv == 10115 кал!г
Воск лигнитовый* (т. ИЛ. около 80° С) — q* = 10660
Воск пчелиный* (г. ил. около 75° С) qv = 11050
То же* (т. ил. около 60° С) — q v = 10250
н. Гексан (жидк.) С6н14 50,4
Гекса нитродифенила мин С12H5O12N7 -5,32
Гексаметилентетрамин (тв.) c6h12n4 —27,9
Гексаметилентрипероксид диамин C6Hi2N2O6 84,8
Гексахлорэтаи (тв.) С2С16 53,9
и. Гептан (жидк.) С7Н16 57,2
Гидразингилрат 57,9
Гидразин безводный (жидк.) N0H4 — 12,3
Глинозем АЬО3 399
Глицерин СзН8О3 161,2
люкоза . С6Н1»Об 307
a-rf-Глюкоза гидрат С6Н]4О7 378,2
Гремучая ртуть HgQANo -64,1
Гремучее серебро AgCON —42,8
Диуретан этилендиамина этиловый (жюинит) CH, — NH —COO СИГ 1 CHo —NH —COO C.H, 236,9
Двуаммониевый фосфат (NH4)2HPO4 372,8
Двуокись азота (газообр.) n2o4 | —3,1
Двуокись азота (жидк.) N.()4 ; —12,2
Двуокись хлора (газ) CIO-. i —23,5
„ (жидк.) CIO; ! — 17,0
Декагидронафталин (транс) СщНщ : 60,1
» (цис) C10H!8 i 58,0
Диазобензолпитрат C6H5N3O;i —42,3
Диамилфталат । C18H..6O4 219,4
п-Диаминобензол C6HSN.. +1,8
Диантрацен (тв.) СгаНд» —61,2
542
Приложения
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал/мол
Диацетат целлюлозы Сэ>8зН13,ss° 6-915 322,99
Диацетин С7Н12О5 269,68
Дибутилфталат С16Н22О4 207,2
Диэтиленгликоль с4н10о3 151,1
Диметиладипат (жидк.) С8Н14О4 213,4
Диметиламин (газ) C21T7N 8,2
„ (жидк.) CoH7N 14,7
Диметиланилин (жидк.) C8HnN 11,7
Диметилгидразин (симм.) c2H8N2 -11,5
. (асимм.) C?H8N2 —10,7
4,4' -Диметил дифениламин C14H15N 6,50-
Диметилдифенилмочевина (симм.) Cj5h16on2 21,5
Диметилолмочевина (тв.) c3h8o3n2 173,4
Диметилолнитропропан (Нитро-2-этил-2-нропан-диол-1,3) C5H11O4N 144,7
Диметилоксалат (тв.) C4H6O4 87,6
N-Диметилформамид C3H7ON 57,59
Дина (J4H8N4(J8 76,3
Динитрат дноксиэтилдинитро-оксамида C6ti8Oi2Ng 130,9
Динитрат диэтиленгликоля c4h8o7n3 104,2
» гексаметиленди ами- на (--бН181-,6^4 184.2
„ этиленгликоля C-H4N2Oe 59,25.
, 2-метил-2-нитропро-ландиола 1,3 C4H7O8N3 91,3
„ этилендиамина c2h10o6.n4 156,4
„ этилового диурета- на этилендинитрамина C8H i2N6O14 238,9
„ 2-этил-2-нитропро-пандиола 1,3 c5h908n3 88,6
2,4-Дипитроанилин c6h5o4n3 19,6
Динитроаминофенол C6H5N3O5 61,63
2,4-Динитроанизол C7HtiN2O5 46,42
2,6 C7HgN<O5 47,2
м-Динитробензол c6h4n2o4 8,6
2,4-Диннтро диметиланилин c8h9n3o4 10,75
Приложения
Продолжение
Вещество Формула Теплота образования при 18“ С и постоянном давлении ккал) мо л
Динитробутиленгликолъдиу-ретан CfiHi0OsN.4 200,71
2,1-Динитро дифениламин C|oH90,jN3 -2,59
2,4-Дипитрометаксилол C8H8N2O4 22,8
4,6- c8h8n2o4 26,7
1,6-Динитро-N-метиланилин C7H7O4N3 6,55
2,4-Динитронафтол-1 C10H6N2O5 45,4
2,4-Дииитронафтолат-1-суль-фонат-7-двукалиевый шестиводный Ci0H7O9,5N2SK2 488,3
1,5-Динитроиафталин CioHg04N2 -3,5
1,8- CioH604N2 -6,6
Динитрсзопентаметнлентетра-мин CjHi0O2Ng -52,0
2,6-Динитрофенил мети лнитра-М11Н СтНбОбК4 —6.10
2,4-Динитрофенил метили итра-мин C7H6O6N4 —0,7
4,6-Динитроортокрезол C7H6N2O5 69,78
2,6-Динитропаракрезол C7H5N2O5 60,23
1,1-Динитропропан (жидкий) СзНбМ2О4 41,5
1,3- , (жидк.) СзНб^2О4 54,3
2,2- „ (тв.) C8HgN2O4 45,6
2,4-Динитрорезорцин CgH4N2Og 162,1
4,6- CgH4N2Og 107,9
2,4-Динитротолуол C7H6N2O4 18,7
2,6- c7h6n2o4 4,7
2,4-Динитрофенол C6H4N2O5 56,4
2,6- C6H4N2O5 51,9
2,4-Динитрофенетол c8h8n2o5 56,0»
2,4-Динитрофеноксиэтилннтрат c8h7n3o8 70,1
2,4-Динитрофенилгидразин CgHbu4N4 —9,2
1,2-Диннтроэтан (тв.) c2h4n2o4 43,0
Динитроэтилбензол (жидк.)1 c8h8n2o4 22,4
* Смесь изомеров.
541
Приложении
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал/мол
Диоксан С4Н8О2 89,6
Дипентаэритрит С1оН2207 380,2
Дипентаэритритгексанитрат C10Hi6N6O19 238,6
Днпикриламин CI2HsO12N7 -5,32
Дифениламин (тв.) Ci2HhN —28,2
Дифенил с12н10 —19,2
Дифенилметан (жидк.) с13н12 —15,7
Дифенилмочевина (асимм.) cI3hi2on2 32,6
Дифенилнитрозамин C^HjoNgO —48,9
Дифенилуретан этиловый (тв.) c15h13no2 73,9
Дифен пл фталат C2oH]404 122,07
Дихлорметаи CH2Cl2 30,8
1,1-Дихлорэтан C2H4CI2 40,6
1,2- C2H4C12 40,5
Дицетил (тв.) И'згНбч 247,2
Дициандиамид c2h.4n4 —4,5
Диэтиламин (жидк.) C4HnN 27,2
Д иэт ил д ифенилмочеви н а C17H20ON2 31,9
(симм.)
Диэтиленгликоль C4H10O3 151,1
Диэтилфталат C12H14O4 189,5
н. Додекан (жидк.) C12H2G 89,36
Древесина дуба* —
СТВОЛ qv ~ 4622 кал)г
ветка — q 0 -- 4583
Древесина ольхи* —
СТВОЛ — qv — 4715
ветка — qv = 4500 „
Дульцит C6HI4O6 324,5
Закись азота (газ) n2o —19,65
Изоамилфталат CigHseO.i 229,51
Изобутан (жидк.) C4H10 38,0
i
Приложения.
545
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал/мол
Изобутен (газ) с4н8 5,1
Изопропилнитрат c3h7o3n 54,62
Калий железистосинеродистый K4Fe (CN)6 131,9
Калий железосинеродистый K3Fe (CN)6 48,5
Калий уксуснокислый KC2H3O2 174,7
Камфора натуральная (тв.) C10H16O 76,9
Карбазол C12H9N —26,84
Карбид алюминия АЦСа 50
. железа Fe2C —5,8
„ кальция СаСд 14,5
Карбонат бария BaCO3 290,9
„ калия K2CO3 274,46
, кальция (кальцит) CaCO3 289,5
„ магния MgCO3 266,5
„ натрия Na2CO3 269,89
_ свинца PbCO3 167,8
. стронция SrCO3 291,7
Касторовое масло* — qv = 9620 кал]г
Каучук натуральный* qv — 10700
Киноварь HgS 14
Кислота азотная (жидк.) HNO3 41,66
. . (газ) HNO3 34,4
„ „ азотистоводо- родная (жидк.)** HN3 —64,37
„ , азотистоводо- родная (газ)** HN3 —71,66
, „ бензойная C7H6O2 94,1
, „ виннокаменная (правая, тв.) C4H6O6 307,7
** При 25° С.
546
Приложения
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал1мол
Кислота муравьиная СН2О2 100,0
* иафтол-1-динитро-2,4-сульфоновая-7 (дигидрат) Cl0H10Oi0N2S 314,6
9 олеиновая С18Н34О2 149,2
* пикраминовая c6HsN3os 61,63
» пикриновая c6h3n3o7 54,4
» салициловая (тв.) С7Н6О3 146,2
» серная (жидк.) H2SO4 193,75
серная (гидрат жидк.) H2SO4-H2O 268,74
•> серная (разведенная, оэ Н2О) H2SO4 215,8
я синильная i HCN —30,7
я стеариновая c18H36o2 223,8
9 стифниновая c6h3n3o8 106,С6
п т ринитробензойная i C7H3OSN3 101,0
т> уксусная (жндк.) C9H4O2 117,7
фосфорная (тв.) H3PO4 303,37
я фталевая (тв.) C8H6O4 191,0
фтористоводородная (газообразная) HF 64,2
* фтористоводородная (раств. ) HF 78,75
фуран-3-карбоновая (ТВ.) C5H4O3 121,5
хлористоводородная (газообразная) HC1 21,9
» хлористоводородная (раств.) HC1 39,6
» хлорная (разб. водная) HCIO4 31,7
щавелевая (безводная, ТВ.) H2C2O4 197,3
щавелевая (гидрат, ТВ.) H2C2O42H2O 341,5
Клетчатка СбНюО5 230,3
К оке из ореховой скорлупы* — д,,-- 4637 кал}г
Приложения
547
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал! МОЛ
Крахмал СцНщОз 230,8
м-Крезол С7Н8О 48,3
Криолит калиевый K3A1F6 777,57
„ натриевый Na3AlF6 748,5
Ксилан* (из овсяной соломьт) — qrj — 3952 кал!г
Ксилолы
ортокснлол (жидк.) c8H10 10,4
метаксилол (жидк.) Cs^io 10,9
параксилол (жидк.) CgHjo 10,5
d-Ксилоза CgHio05 253,4
Купрен V‘(C2H2)« —8,6
Лигнин (из древесины ели)* — qv ~ 6277 кал)г
Лигнол (из овсяной соломы)* — gv 6076 к ал) г
^-Лактоза С12Н22О11 534,8
Маннитгексанитрат CgHsNfjOtg 162,6
Маннит C6H14O6 322,3
Меламин C3H6N6 17,98
Метан (газ) CH4 18,3
Метиламин (газ) ch5n 7,3
Метилгидразин ch6n2 — 12,4
а-Метилглюкозид C7H14O6 296,6
N-Метилдифениламин C13H13N —25,42
4-Метил дифениламин C-13H13N —8,27
N-Метил- N'N' -дифеннлмоче- C;4H14ON3 29,1
вина
М-Метил-2,4-динитроанилин c7h7n3o4 19,4
Метиленмочевина c2h4on2 78,60
548
Приложения
Продолжение
Вещество . , Формула Теплота образования при 18°С и постоянном давлении ккал! мол
Метилизобутилкетон сбн12о 94,26
Метилнитрат (жидк.) CH3NO3 37
(З-Метилнафталин СцН10 —2,5
Метилтетралин (жидк.) СцН14 19,6
К-Метилфеннл-М'-метилмоче-вина C9H12ON2 54,01
1\Т-Метилфенил-*Г - этилмочевн-на C10H14ON2 75,16
Метилфенилуретан этиловый (жидк.) CioH|3N02 96,6
?4-Метил-1Ч' -этил-NN' -дифе-нилмочевина c16h18on2 30,1
Метилхинолнн C10H9N —36,1
Метиленхлорид (жидк.) сн2сь 30,8
Мегилхлорнд (газ) CH3C1 20,1
Метилциклогексан (житк.) C7Hj4 49,7
Моноацетин C5H10O4 218,52
Мочевина CH4N2O 79,6
Мука древесная* — qv = 4690 кал)г
Мука пробковая* — qv = 6570
Мышьяковистый водород AsH3 —43,6
Мякина овсяная* — qv = 5052 кал!г
Натрий уксуснокислый C2HsO2Na 171,3
Нафталин C10H8 —15,0
^(а-Нафтнл)-№ -дифенилмо-чевина C23H18ON2 —12,65
а-Нафтол СюНаО 30,8
^-Нафтол СюН8О 32,9
Нафтол OS желтый CioH]oO]()N2S 314,6
Э-Нафтиламин (тв.) CjoHgN —8,2
Нено (динитрат диоксиэтил-диннтроксамида) СбНвО12Н6 130,9
Неопентан (тетраметилметан) (жидк.) C6H12 47,2
Приложений
549
Продолжение
Вещество Формула* i Теплота образования при 18° С и постоянном давлении ккал)мол
Нитрат аммония NH4NO3! 87,36
, анилина (тв.) CfiHgNnOg! 52,7
, бария Ba (NOg)^ 236,9
„ гидразина n2h5no3; 59,8
w гндроксиэтилметилни- C3H7OsN3 45,8
трамина
„ гуанидина СНб^Оз; 91,2
„ диметиламина C2H8O3N2* 80,0
„ 2,4-динитрофенокси- C&HyOgNg 67,44
этанола
ч диэтиламина 101,2
„ калия KNO3 : 118,09
„ кальция Ca (NOg)^ 224,04
„ метиламина CH6O3N2' 84,8
„ мочевины CN3O4H5: 134,84
натрия NaNO3 i 111,72
, бис (нитроксиэтил)ам- (CHjONCb—CH2)2NH- 137,6
мония •HNO3 :
„ нитроксиэтиламмония QH7N3O6! 112,8
. серебра AgNO3 28,9
„ свинца Pb (NO3)2; 106,89
„ стронция Sr (NO3K 233,2
„ тетра метиламмония C4H]2O3N2 80,8
„ триметиламина C3H]o03Nj 74,6
, 2, 4, 6-тринитрофеннл- C8H6Oi0N4 72,55
ГЛИКОЛЯ
триэтиламина CgHigC^Ng 100,4
„ этаноламина C,H8O4N2. 138,9
„ этнламина C2HgO3N2 88,0
„ этилоламина CH2OHCH2NH2HNO3 138,9
Нитрид алюминия (крист.) AIN , 80
„ магния Mg3N2 • 110,5
„ серебра Ag3N : -61
Нитрит аммония nh4no3! 61,5
„ натрия NaNO2 88,2
Нитроанилины -
ортонитроанилин (-4>Нб1-)2№2' 9,60
550
Приложения.
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал}мол
Нитроанилины метанитроанилии паранитроанилин М-Нитро-N' -аминогуанидин Нитробензол (жидк.) 1-Нитробутан (жидк.) 2-Нитробутан (жидк.) З-Нитробутанол-2 (жидк.) Нитродициандиамидин Нитроглицерин Нитрогуаиидин Нитрогуанилмочевина о-Нитро дифениламин Нитроизобутантриол (тв.) п-Нитрозо дифениламин Нитроклетчатка 11,50% N , 11,60% N 11,70% N 11,80% N » 11,90% N 12,00% N 12,10% N . 12,20% N . 12,30% N 12,40% N 12,50% N 12,60% N , 12,70% N . 12,80% N 12,90% N 13,00% N 13,10% N 13,20% N 13,30% N 13,40% N 13,50% N C6H6O2N2 C6H6O2N? CHsN5O.,' c6h5no, c4h9no2 C4H9NO2 C4H10O3N QH5O3N5 C3H5N3O9 CH4N4O2 C2HsN5O3 C12Hjo02N9 C4H9O5N C12H10N2O 10,10 12,0 -1,2 3,2 47,5 51,6 129 75,73 88,63 21,86 75,8 12,65 178,3 —45,4 692,3 £. 686,2 § 680,1 » 674,0 s 668,0 | 661,9 ° 655,8 g 649,7 § 643,7 § 637,6 s б31-5 в 625,4 § 619,4 2 613,3 3 607,2 'g 601,1 я 595,0 g 589,0 £ 582,9 576,8 570,7
П риложения
551
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал [мол
Нитрозодифениламин CijHioNjO —50,9
Нитрометан (жидк.) ch3no2 21,85
2-Нитро-2-метил-пропанол-1 c4h9o3n 99,8
(тв.)
2-Нитро-2-метил-пропандиол- C4H9O4N 138,3
1,3 (тв.)
Нитрометриол c5h9n3o9 107,88
Нитромочевина CH3O3N3 67,65
1-Нитронафталин C10H7O2N —7,3
5-Нитроортотолуидин C7H8O2N2 24,6
3-Ннтропаратолуидин C7H8O2N 2 20,0
Нитропентаглицерин C5H9N3O9 107,88
1-Нитропропан (жидк.) C3H7NO2 41,5
2-Нитропропан (жидк.) C3H7NO2 45,3
м-Нитротолуол C7H7NO2 10,7
Нитротолуидины
5-Нитроортотолуидин C7H8O2N2 24,6
З-Нитропаратолуидин c7h8o2n2 20,0
Нитрофенетолы
ортонитрофенетол (жидк.) c8h9no3 41,7
метанитрофенетол (тв.) c8h9no3 53,7
паранитрофенетол c8h9no3 56,9
Нитрофенолы
ортонитрофенол c6h5no3 50,5
метанитрофенол c6h5no3 53,2
паранитрофенол c6h5no3 49,6
Нитроэтан (жидк.) c2h5no2 34,4
2-Нитроэтанол c2hsno3 84,5
2-Нитро-2-этил-пропан диол-1,3 C5H11O4N 144,7
о-Нитроэтилбензол (жидк.) C8H9O2N 15,25
п-Нитроэтилбензол (жидк.) c8h9o2n 16,90
н. Нонан C9H2Q 69,8
Овсяная солома* — qv — 4208 кал!г
5 52
Приложения
Продолжение
. Вещество Формула Теплота образования при 18° С и постоянном давлении ккал)мол
Озон (газ) о3 —34,5
Озонид калия КО3 62
Окись азота (газ) NO —21,6
, алюминия (крист.) АЬО3 399
, бериллия (тв.) ВеО 147,3
» вольфрама wo3 200,2
, дифенила С12Н10О 13,2
Окись железа Fe,O3 198,5
То же Fe3O4 266,9
Окись кальция СаО 151,9
, кремния (кварц) (тв.) SiO> 208
, кремния (стекловидн.) (тв.) SiO, 205
„ магния MgO 143,9
„ меди CuO 38,5
, пропилена (жидк.) C3H6O 35,2
„ свинца (красная) PbO 52,46
. сурьмы (октаэдр.) Sb2O3 166,6
, углерода (газ) CO 26,88
„ хрома (зеленая) Cr2o3 269
, цинка (сплавл.) ZnO 83,4
. циркония (моноклин.) ZrO2 258,2.
, этилена (жидк.) С2Н4О 23,3
Октонитрат сахарозы 0 I 0 2; -CO 331,5
Оливковое масло* — qv = 9460 кал^г
Оксалат аммония безводный c2o4h8n2 267,2
. •. гидрат . .c2o6h10n2 341,5
. бария . BaC2C>4 327,6
. . калия KoC,O4 320,8
Приложения
553
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал! мол
Оксалат калия гидрат К2С2Н2О5 392,1
„ кальция СаС2О4 325,2
Оксалат натрия Na2C2O4 314,7
„ стронция SrC2O4 327,7
8-Оксихинолин c9h7no 24,6
н. Октадекан (тв.) С18Н38 144,5
Парафин*
твердый (т. пл. 52,5—53°) — qv = 11 190 кал[г
ЖИДКИЙ — 9о = 109С5 ,
Парафенилендиамин c6h8n2 1,8
п. Пентан (жидк.) . c5H12 44,0
Пентаглицерин C5H12O3 180,2
Пентаметилен динитрозотетра- c5h10n6o2 -52,5-
МИН
Пентанитрат ангидроэннеагеп- C9H13O16N5 194 ;о
тита
Пентахлорэтан (жидк.) CoHCl 5 49,2
Пентаэритрит С5Н12О4 222,3 '
Перекись бария BaO, 149
„ водорода (жидк.) Н2О2 44,1
„ марганца МпО2 123
„ «алия К2О2 117
„ натрия (тв.) Na2O2 124,04
, свинца PbO2 65,0; .... ;
„ "этила С4Н10О2 102,8 ’ ‘ '•
554
П риложения
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал/мол
Перманганат калия КМпО4 192,9
„ кальция Са (МпО4)2 362
„ 2 натрия NaMnO4 181
Пернитрид углерода (тв.) cn4 —92,6
Перхлорат аммония nh4cio4 70,2
„ бария Ba (C1O4)2 194,3
„ гидразина N2H5C1O4 42,0
. калия KC1O4 104,5
„ лития** LiClO4 91,70
„ натрия NaClO4 93
Перхлорэтилен СоСЦ 16,4
Пикрат аммония (красный или C6H6O7N4 95
желтый)
„ калия KcgH2N307 116,5
» натрия NaC6H2N3O7 111,5
Пиперидин C5HnN 20,6
М-Пиперидин-N' -дифенилмо- CisHsqONo 30,75
чевина
Пикрилхлорид C6H2O6N3C1 —7,0
Пиридин C5H5N —22,5
Поливинилацетат* qv = 5520 кал;г
Полиизобутилен (тв.) n (С4Нз)л 23,0
Полиоксиметилен V(ch2O)„ 42,5
Полистирол 4~ (C6H5C2H3)„ —4,4
Полиэтилен (тв.) — (C2H4)700 14,0
Пробка* — qv =6570 кал[г
Пропан (газ) C3H8 26,1
Пропан (жидк.) c3H8 29,9
Пропандиол-1,2 CsHgOo 120,4
** При 25° С.
Приложения
555
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал/мол
Пропандиол-1,3 С3Н8О2 124,9
и. Пропилхлорид (жидк.) С3Н7С1 39,8
н. Пропилбензол (жидк.) CgH12 13,8
Пропилен (газ) С3Н6 —3,4
Рами* Сажа* — q0 = 4190 кал/г
высуш. при 100° С — qv = 7810
обезгаж. при 1000° С — qv = 8270 .
Сахароза С12Н22О11 536,5
Сероводород (газ) H2S 4,8
Сероуглерод (жидкий) CS? —29,4
> (газообр.) cs2 —22
Силицид кальция CaSi2 161,8
То же CaoSfo 170,6
Солома злаков* — qv = 4214 кал!г
Спирт амиловый (н.) c5H12o 85,7
» бутиловый (н.) C4H10O 81,5
, гексиловый (н.) С6НИО 91,9
, гептиловый (н.) C7H16O 97,8
„ изопропиловый С3н8о 77,8
> метиловый СН4О 57,5
. октиловый (н.) СзНщО 103,9
. пропиловый (н.) С3Н8О 74,6
„ тетрагидрофурфуриловый С5Н10О2 104,9
, фуриловый (2-фурил-карбинол) С5Н6О2 68,5
, этиловый С2Н6О 67,1
Стеарат кальция СаС38Н7о04 662,6
Стирол (жидк.) С8Н8 —20,8
556
Приложения
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал/мол
Стифнат свинца (гидрат) C6H3N3O9Pb 204,1. >
Сукцинамид C4H8O2N2 139,98 у
Сульфат аммония (NH4)2SO4 281,40. . .
, бария BaSO4 349,4
, двойной кальция и Са (NH4)2(SO4)oH2O 694,5
аммония
> калия K2SO4 342,66
„ кальция CaSO4 340,7 .
„ свинца PbSO4 218,5 . .
„ стронция SrSO4 345,3 ...
„ натрия Na2SO4 330,48
Сульфид азота (тв.) NS — 31,9
, бария BaS 111,2
» железа FeS 23,1
„ , (пирит) FeS2 42,5 .
, , (маркассит) FeS2 36,9
, калия K3S 121,5
„ кальция CaS 113,4
„ магния MgS 82,2 "
„ мышьяка (тв., реаль- As2S3 20‘ '
тар)
> натрия Na2S 89,8,
, ртути (киноварь) HgS 14. .
» серебра Ag2S 7
, стронция SrS 113,1 ’
„ сурьмы (черный ) ' Sb2s3 35,8
„ цинка ZnS 44
„ фосфора (тв.) P4S3 77,5 '
» свинца PbS 22,38
Тартрамид C4H8O4N2 286,35
Терпентин* : — qv — 10790. кал]г
Тетраги дрок арбазолмочевина Ci3H[4ON2 261,96
1,2,3, 4-Тетрагидропафталип (жидк.) C10H12 19,5
Приложения
557
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал/мол
Тетрагидрохинолин C9HnN -2,9
Тетраметилолметан CsHi2O4 221,2
Тетралин ci0Hl2 19,5
Тетранитрат а-метил-^-глюко-зида C7Hio014N4 200,6
2,3, 4, 6-Тетранитроанилин CgHvOaNg —17,1
Тетранитрокарбазол C12H5O8N5 —1,69
Тетранитрометан (жидк.) C (NO2)4 —8,4
1,3, 6, 8-Тетранитронафталин C]oH4OgN4 —1,6
Тетранитросульфоксидифенил-амин Ci2HsO9N6S 114,95
Тетрахлорэтан (симм.) (жидк.) C2H2C14 50,7
Тетрахлорэтилен (жидк.) C2C14 16,4
Тетраэтилмочевина c9h20on2 134,22
Тетрил c7h.5nso3 —4,70
Тио дифениламин C12H9NS —12,42
Тиомочевина ch4n2s 18,7
Тиофен (жидк.) C4H4S —19,5
Толуол (жидк.) c7H8 +1.0
Толуидины' c7h9n 4-4,8
Торф* — qv = 5100 кал\г
Триацетат целлюлозы CH,786^15,786®7,893 373,40
Триацетин CgHi4O6 320,27
Трибензиламнн c?1h2In —29,09
Триметиламин c3h9n ' 9,3
1,3,5-Триметилбензол (жидк.) C9H12 19,8
Триметиленгликоль C3H8O2 124,9
Триметилмочевина C4H10ON2 79,75
Триметнлолметилметан (тв.) CsH12O3 180,2
Тримет,илолэтилметан (тв.) C6H14O3 181,0
Триметилолнитрометан c4h9o5n 178,3
Тринитрат диэтилоламина C4H]0O9N4 138,6
1 Приближенные средние данные; применимы для всех трех изомеров.
558
Приложения
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал[мол
Тринитрат нитроизобутилгли-церина C4H6N4Oh 56,03
„ триметилолэтилме-тана C6HiiO9N3 115,8
„ триметилолметил-метана C5H9N3O9 107,88
Трннитроапилин C6H4N4Og 20,07
2, 4, 6-Тринитроанизол C7H5N3O7 39,79
2,4,6-Тринитро-1,3,5-трис (ме-тилнитрамино) бензол C9H9OJ2N9 -26,8
1,3, 5-Тринитробензол СбН31\т3Об 11,40
2, 4,6-Тринитрокрезол C7HsN3O7 62,81
1,3,5-Тринитромезитилен c9h9n3o6 33,7
2,4,6-Трпнитрометаксилол C8H7N3O8 26,2
2, 4, 6-Тринитрометакрезол C7HgN3O7 62,81
Тринитрометан CH (NO2)3 19,1
1,3, 8-Тринитронафталип cloH5ogN3 -2,9
1,4,5- C10H5O6N3 -5,8
2, 4,6-Тринитрорезорцнн _ CgH3N3O8 106,06 ('
2,4,6-Тринитротолуол * <Гсн1..\\о,Г'~7
Тринитропентаглицерин ед«3о9 107,88
2, 4,6-Тринитрофенол CgH3N3O7 54,4
2, 4,6-Тринитрофенетол C8H7N3O7 51.00
бис-Тринитрофеиилэти лен динитрамин C)4H8Oi6N|0 —27,48
2, 4, 6-Тринитрофенилгидразин C-eHsOgNs —5,8
2,4,6-Тринитрофеноксиэтил-нитрат C8H6N4Oio 70,0
2,4, 6-Тринитрохлорбензол c6h2o6n3ci —7,0
1,3,5-Тринитроэтилбензол C8H7N3O8 20,0
2, 4,6-Тринитроэтилбензол CeHyNsOg 21,4
Тринитрофенилэтнлнитрамин C8H7N5O8 7,70
а-Т риоксиметилен ‘•3 (CHaO)3 41,9
Трифеяиламин (тв.) Ci8H!5N —57,8
Трихлорметан CHCl3 34,8
Трихлорэтилен c2Hci3 12,4
Приложения
559
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал\мол
Триэтиламин (жидк.) CgHigN 37,1
Триэтиленгликоль . С6Н14О4 193,7
Тэн C5H8N4O1= 129,37
Углекислый газ (газ) со2 94,51
Углерод аморфный* — qv — 8130 кал!г
Фенантрен (тв.) С14Н;0 —21,3
Фенетол CgHjoO 40,2
Фенол С6Н0О 40,9
Фенилбетанафтилампн C1(iH!3N -31,1
Фенилбетанафтилннтрозоамин C16H12N2O —69,7
Фосфористый водород (газ) РН3 2,3
Фурфурол С5Н4О2 49,0
Хинолин c9h7n —34,4
Хинальдин C!oH9N —36,1
Хлорат бария Ba (C1O3).> 176,6
калия KCfO3 93,2.
„ кальция Ca (C1O3)3 167
„ натрия NaClO3 83,60
„ стронция Sr(ClO3)2 171
Хлоргидрин гликоля C,H5OC 1 75
Хлорид алюминия AIC13 166,8
„ аммония NH4C1 74,95
, бария BaCb । 205,28
„ калия KC1 104,36
„ кальция (снлавл.) CaClo 190,6
„ магния MgCb 153,2
„ магния (гидрат) MgCl2H2O 231,9
„ натрия NaCl 98,33
„ свинца PbCl, 85,71
, стронция SrCL 197,87
„ цинка ZnCl2 99,55
Хлористый азот (раствор в СС14) NC13 -55,0
560
Приложения
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал} мол
Хлороформ (жидк. СНС13 34,8
Хлорэтилены:
газ С2Н3С1 —9
жидкость С2Н3С1 —4,1
Хромат аммония (NH4)2CrO4 276,9
„ калия К2СгО4 319,8
„ натрия N а2СгО4 308
Хлопок* — qv — 4160 кал1г
Цеитралит I CpH^NoO 31,9
II C18H!6ONo 21,5
III CigHigONj 30,1
Циан (газ) c2n3 —72,9
Цианамид ch2n2 —13,7
Цианид калия KCN 28,5
„ кальция CaC2N2 44,9
„ натрия NaCN 22,9
„ ртути HgQNs —61,8
Цпануртриазид C3N12 —219
Циклогексан (жидк.) c6h!2 41,0
Циклогексанол (жидк.) C6H12O 86,5
Циклогексилфталат C2oH2604 . 227,80
Циклогептан (жидк.) C7H14 40,5
Циклопентан (жидк.) CsHi0 27,9
Циклопентанол (жидк.) C6Hi0O 74,3
Циклотриметилентрииитрамин C3H6N6O6 —15,64
Циклотриметилентриннтроза- СгНдЦцОз —66,79
МИН
Четыреххлористый углерод CC14 33,0
(жидк.)
Шелк искусственный* — =4400 ч- 4440 кал!г
Шерсть сухая* qv = 5500
Приложения
561
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал[.мол
Эритрит С4Н!0О4 219,4
Этан (газ) С2Н6 21,1
Этиламин (газ) c>h7n 13,0
, (жидк.) c2h7n 19,6
Этилбензол (жидк.) ^8^ 10 7,9
Этилгидроперекись С2Н6О2 58,7
N-этил-М' М'-дифенилмочевина c!5h!6on2 40,5
Этилен С2Н4 —11,6
Этиленбис дифенил мочевина C‘8H26O2N4 54,01
Этиленгликоль С2Н6О2 108,7
Этилендинитрамин—аммоний C2H12N5O4 81,0
Этнлнитрамнн C2H5N2O2 21,3
Этилнитрат (жидк.) c2h5no3 46
Этиленхлорид (жидк.) С2Н4С12 40,6
Этилиденхлорид (жидк.) С2Н4С12 40,5
Этилтетрил CgHjNjOg 7,70
Этилфенилуретан этиловый Ci]HjgNO2 105,7
(жидк.)
Этилхлорид (жидкий) C2H5Cl 31,6
Эфир днметиловый (жидк.) CSH6O 49,6
„ диэтиловый (жидк.) C4H i0O 67,6
себациновокисло ди метиловый (жидк.) C12H22O4 247,6 t
„ сукциновокислодимети- СбНщО4 [ 200,8
ловый (жидк.) j
„ муравьинокислометило- C,H4O2 ; 92,4
вый 1
„ муравьинокислоэтило- С3Н6О2 j 96,6
вый
„ уксуснобутиловый С6Н!2О2 129,4
„ уксусноизоамиловый С7Н!4О2 j 138,3
„ уксусноизобутиловый с6н1202 131,4
, уксусноизопропиловый С5Н ]0Оо 125,3
562
Приложения
Продолжение
Вещество Формула Теплота образования при 18° С и постоянном давлении ккал]мол
Эфир уксуснометиловый С3Н6О2 98,3
„ уксуснопропиловый С5Н10О2 122,6
, уксусноэтиловый с4н8о2 114,6
Примечание. Уряда веществ естественного или искусственного происхождения, состав которых не является строго определенным, вместо теплот образования приведены теплоты сгорания при постоянном объеме в кал]г. В таблице эти соединения помечены звездочкой.
Приложение б
ТЕПЛОТЫ ГОРЕНИЯ НИТРОСОЕДИНЕНИЙ ДО СО2, Н2ОЖ, Ns ПРИ ПОСТОЯННОМ ОБЪЕМЕ И 25° С*
ВВ Формула Теплота горения ккал] мол
Тетранитрометан С (NO2)4 102,9
Тринитрометан CH (NO2)3 124,5
Нитрометан ch3no2 169,4
Нитроэтан C2H5NO 2 322,2
Метилнитроацетат C3H5O2NO2 343,18
Этилендинитрамин, ЭДНА (CH2NHNO2)2 370,9
N-Нитроэтиламин C2H5NHNO2 372,5
N-Нитросукцинимид (CH2CO)2NNO2 436,9
1,1-Динитропропан C3H6(NO2)2 446,3
2,2-Динитропропан C3H6(NO2)2 442,2
1 ,3-Динитропропан C3H6(NO2)2 433,6
Гексоген (CH2NNO2)3 503,4
Триметилолнитрометан (CH2OH)3CNO2 509,32
2-Нитропропан c3h7no2 477,4
Бис (тринитроэтил) нитрамин [(NO2)3 CCH2]2NNO2 486,0
N-(l, 1-Динитроэтил)-1-нитро- CH3CNO2:NOC (NO2)2 CH3 544,8
ацетальдоксим
2-Нитро-2-метилпропан диол- 1,3 C4H9O2NO 2 545
* По сводной таблице Юнга, Кэйса и др. в Industrial and engineering chemistry, 8, 1376 (1956).
Приложения
563
Продолжение
ВВ Формула Теплота горения ккал! мол
2,2,3,3-Тетранитробутан С4Н6 (NO2)4 586,1
2-Нитро-2-метилпропанол-1 c4h9ono2 585,59
З-Нитробутанол-2 c4h9ono2 590,36
Бистринитроэтилмочевина СО [NHC2H2(NO2)3]2 602,5
1-Нитробутан c4h9no2 637,6
2-Нитробутан c4h9no2 634,0
2, 4, 6-Тринитрофенол C6H2OH(NO2)3 621,1
2,4, 6-Тринитрохлорбензол C6H2C1(NO2)3 643,202
2. 4-Динитрофенол C6H3OH (NO2)2 648
Тринитроэтилтринитробутират CgHg (NO2)gO2 661,0
2-Нитро-2-этилпропандиол-1, 3 CgHnOsNOo 700,75
о-Нитрофенол CgHgONOg 689,1
.и-Нитрофенол C6H5ONO2 684,4
п-Нитрофенол CgHgONO» 686,2
1, 3, 5-Тринитробензол C6H3(NO2)3 663,7
1, 2,4-Тринитробензол C6H3(NO2)3 673,7
2-Амино-4,6-динитрофенол CgH2OHNH2 (NO2)2 676,877
2,3,4,6-Тетранитроанилин C6HNH2(NO2)4 655,036
2, 4,6-Тринитроанилин C6H2NH2(NO2)3 673,249
о-Динитробензол C6H4(NO2)2 703,2
м-Д инитробензол CgH4(NO2)2 694,7
п-Дннитробензол C6H4(NO2)2 692,0
о-Нитробензойная кислота c7h5o2n o2 729,8
.«-Нитробензойная кислота C7H5O2NO2 729,1
л-Нптробензойная кислота C7H5O2NO2 728,3
Нитробензол C6H5NO2 739,2
2-Метил-2,3,3-тринитробутан C5H9(NO2)3 700,46
2, 4-Динитроанилин C6H3NH2(NO2)2 718,859
2, 4,6-Тринитробензальдегид C6H2CHO(NO2)3 729,106
1 -Амино-2-нитробензол CgH4NH2NO2 765,8
1-Амино-З-нитробензол c6h4nh2no2 765,2
1-Амино-4-нитробензол C6H4NH2NO2 761,0 '
564
Приложения
Продолжение
ВВ Формула Теплота горения ккал} мол
Динитронеопентан C5H10(NO2)2 746,91
2,4, 6-Тринитро-ж-крезол С6НСН3ОН (NO2)3 770
ж-Нитробензальдегид c6h4chono2 800,4
2,4,6-Тринитроанизол С6Н2ОСН3 (NO2)3 784,399
2,4-Динитроанизол C6H3OCH3(NO2)2 827,98
2, 4,6-Тринитротолуол C7H5(NO2)3 816,9
Тетрил c7h5n (NO,)4 836,5
2-Нитро-2-пропилпропандиол- 1. 3 c6h13o2no2 858,91
2-Нитро-2-изопропилпропан-днол-1, 3 CgHi3O2NO2 859,36
2, 4, б-Тринитро-Ы-метилани-лин C6H,NHCH3 (NO2)3 857,9
3, 5-Динитротолуол C7H6 (NO?)3 853,0
2, 4-Динитротолуол C7H6 (NO2)a 849
2, 6-Динитротолуол C7H6 (NO2)2 863
2-хЧетил-2, 3, 3-тринитропен-тан C6Hu(NO2)3 872,4
о-Нитротолуол c6h4ch3no2 897,2
.«-Нитротолуол c6h4ch3no2 889,7
«-Нитротолуол CsH4CH3NO2 888,6
2, 1-Динитро-Н-метнланилин C6H4CH3N (NO2)2 884,5
2, З-Диметил-2, З-динитробу-тан C6Hi2(NO2)3 892,0
5-Нитро-о-толуидпн c6h3ch3nh2no2 910,4
З-Нитро-п-толуидин c6h3ch3nh2no2 915,1
л-Нитро-Н-метиланилин c6h4ch3nhno2 924,3
2, 4, 6-Тринитрофенетол C6H2OC2H5 (NO2)3 945
ж-₽-Динитростирол c8H6 (NO2)2 957,4
о-Нитроацетанилид c8h8nono2 973,9
ж-Нитроацетанилид c8h8nono2 969,5
п-Нитроацетанилид CgHgNONOg 968,2
Приложения
565
Продолжение
ВВ Формула Теплота горения ккал 1 мол
2, 4-Динитрофенетол С6Н3ОС2Н5 (NO2)2 950
о-Нитрофенетол c8h9ono2 1021,2
ж-Нитрофенетол c8h9ono2 1009,2
п-Нитрофенетол C3H9ONO2 1006,0
2, 4, 6-Тринитротолил-З-метил-нитрамна C8H7N (NO2)4 1009,3
о-Нитрокоричная кислота c9h7o3no2 999,0
.и-Нитрокоричная кислота C9H7O2NO3 995,6
n-Нитрокоричная кислота C9H7O2NO2 996,5
ш-Нитростирол C6H5CHCH (NO2) 999,3
2, 4, 6-Трипитро-ж-ксилол C6H(CH3)2(NO2)3 971,643
2, 4-Динитро-1, 3-диметилбен-зол C6H3(CH3)2(NO2)2 1005
2, 6-Динитро-1, 3-диметилбен-зол C6H2(CH3)2 (NO2)2 1000
1 -Фенил-2-нитропропен c6h5chcno2ch3 1150,5
Тринитронафталин C10H5(NO2)3 1109,275
1, 5-Динитронафталин Ci0H6(NO2)2 1154,641
Динитромезитилен c9h10(NO2)2 1175,7
Нитромезитилен C9HhNQ> 1204,7
Нитронафталин Ci9H7NO2 1190,546
2-Метил-2-нитро-1-фенилпро-панол-1 C4H8OC6HsNO2 1308,7
2-Метил-2-нитро-3-фенилпрота-нол-1 c4h8oc6h5no2 1301,47
а-Нитрокамфора CioHisON02 1371,1
Гексанитродифениламин C12H4NH(NO2)6 1317,628
4, 4-Динитрогидразобензол (C6H4)> (NH)2(NO:)2 1496,4
п-Нитробензил c14h9o2nh2 1600,9
М.М'ДГексанитродифенил)-этилендинитроамин Ci4H8N(0O|6 1624
1, 3, 5-Циклотриметиленнитро-замин (CH.NNO)3 555,3
566
П риложения
КОНСТАНТЫ РАВНОВЕСИЯ Кр ДЛЯ РАЗЛИЧНЫХ РЕАКЦИЙ И ТЕПЛОТЫ
Значения приведены в виде 1g Кр. Для ре
Рлрв
Ко — ’ где парциальные
РСР D
Если в реакции принимает участие конден
Сграфит+1/"Ог5±СО, то константа равно
Индекс ,г* обозначает (там, где
Температура °К На ci О О сч <м СЧ U "г X 8 сч & + ©3 о 4 ’ф сч 4- О U о + о со to СО 4-©1 о —S1 н со о 1 + sH5/i^N0H 085 ‘ 18 + + + г№/1-Ь no-h/2o2^± 5±NC>2 4- 12,775 NO5±i/2Qi4-4-1/2 N2 + 21,477 2N^±N2 4- 170,240 + rf CN *r* О <X. QO Hl X co О । 4- x 8 +
300 —16,591 -36,67 11,83 —28,29 —20,98 —6,42 —15,090 118,66 —24,68
400 —12,566 —26,08 — 7,16 -22,15 —15,21 -3,94 —11,156 —- 87,47 -15,60
600 - 8,524 —15,44 2,48 -15,98 9,55 —1,44 — 7,219 — 56,21 — 6,296 i
800 - 6,489 —10,07 — 0,13 -12,89 — 6,73 —0,18 — 5,250 — 40,52 — 1,507
1000 — 5,259 - 6,83 + 1,29 —11,03 — 5,04 4-0,57 — 4,068 — 31,084 4- 1,425
1200 — 4,436 — 4,66 + 2,24 - 9,79 — 3,92 4-1,08 - 3,279 — 24,619 + 3,395
1400 — 3,846 — 3,10 + 2,92 — 8,89 — 3,12 + 1,43 — 2,717 — 20,262 4- 4,S10
1600 — 1,93 + 3,42 — 8,22 — 2,53 +1,69 — 2,294 — 16,869 + 5,873
1800 — 1,02 + 3,82 — 7,70 — 2,07 4-1.89 - 1,966 — 14,225 + 6,70*
2000 — 0,28 + 4,15 — 7,29 — 1,70 4-2,07 — 1,703 — 12,106 + 7,35*
2200 + 4,41 - 6,95 +2,18 — 1,488 — 10,370 4- 7,89*
2400 + 4,63 — 6,66 +2,29 — 1,309 — 8,922 8,32
2600 + 4,81 — 6,42 4-2,39 — 1,157 — 7,694
2800 + 4,97 — 6,21 +2,48 — 1,028 —— 6,640
3000 + 5,11 — 6,03 +2,56 — 0,915 — 5,726
3200 + 5,23 - 5,87 - 0,817 — 4,925
3500 + 5,39 —' 5,68 — 0,692 — 3,893 j
4000 4" 5,60 — 5,40 — 0,526 2,514 |
4500 + 5,76 — 5,19 — 0,345 —* 1,437 1
5000 + 5,89 — 5,02 — 0,298 — 0,570 i i
* Экстраполировано.
Приложения
567
Приложение 7 РЕАКЦИЙ ПРИ АБСОЛЮТНОМ НУЛЕ (ДЕ° ВЫРАЖЕНО В ккал) акции А + В + ... > С + D + ... + AEq давления рл и т. д. выражены в ат.
сированная фаза, как например в случае весия выражается в виде Кр = УPoJPco это необходимо) газообразное состояние.
СОН-НгОг5±СО24-Н2 4“ 9 >660 W S-О + '** сч + 8 8 Н | Сграфит 4- */2 О2 S СО+ 27,202 Сг Сграфит + + 170 >390 J+ + О X Е ° U 1+ + О X и 2О^±О2 + 117,172 2Н^±Н2 4- 103.240 i Температура °К
-4,95 —44,74 -23,93 —117,12 —46,29 —39,79 -80,09 —70,74 300
—3,17 —32,41 —19,13 — 85,83 —33,91 —29,24 —58,51 —51,74 400
—1,44 —20,07 —14,34 — 54,49 —21,47 —18,63 -36,86 —32,63 600
—0,61 -13,90 —11,93 — 38,80 —15,22 —13,29 —25,99 —23,07 800
—0,139 -10,199 —10,48 — 29,38 —11,444 —10,060 —19,440 — 17,288 1000
+0,154 - 7,742 — 9,498 — 23,10 — 8,922 - 7,896 -15,062 —13,410 1200
+0,352 - 5,992 — 8,790 — 18,62 - 7,116 - 6,344 —11,932 -10,627 1400
+0,490 — 4,684 — 8,254 — 15,26 — 5,758 — 5,175 — 9,575 - 8,530 1600
+0,591 — 3,672 — 7,829 — 12,64 — 4,700 — 4,263 — 7,740 — 6,893 1800
+0,668 - 2,863 — 7,486 — 10,567 — 3,852 - 3,531 — 6,269 — 5,579 2000
+0,725 — 2,206 — 7,201 — 8,864 — 3,158 — 2,931 — 5,064 — 4,500 2200
+0,767 — 1,662 — 6,961 — 7,446 — 2,578 — 2,429 — 4.С55 — 3,598 2400
+0,800 — 1,203 — 6,759 — 6,248 — 2,087 — 2,003 - 3,206 — 2,833 2600
+0,831 — 0,807 — 6,577 — 5,223 — 1,670 — 1,638 — 2,475 - 2,176 2800
+0,853 — 0,469 — 6,418 — 4,334 — 1,302 - 1,322 - 1,840 — 1,604 3000
+0,871 — 0,175 — 6,273 — 3,561 — 0,983 — 1,046 - 1,285 — 1,104 3200
+0,894 + 0,201 — 6,094 — 2.561 — 0,577 — 0,693 — 0,571 — 0,458 3500
+0,920 + 0,699 — 5,841 — 1,239 — 0,035 — 0,221 + 0,382 + 0,406 4000
+0,928 + 1,081 — — + 0,392 + 0,153 + 1,125 + 1,078 4500
+0,937 + 1,387 — — + 0,799 + 0,450 + 1.719 + 1,619 5000
568 Приложения
Приложение 8
ИЗМЕНЕНИЕ ВНУТРЕННЕЙ ЭНЕРГИИ ГАЗОВ И ГРАФИТА ОТ 291° до Т° К в ккал!мол*
Температура в °K H8 o2 N3 CO NO OH CO2 H2O NH3 Г рафит С (тв.)
291 0 0 0 0 0 0 0 0 0 0
300 0,045 0,045 0,045 0,045 0,046 0,046 0,062 0,054 0,06 0,0188
400 0,541 0,557 0,544 0,545 0,561 0,558 0,804 0,667 0,75 0,2663
500 1,041 1,089 1,047 1,052 1,085 1,064 1,633 1,300 1,51 0,5845
600 1,542 1,646 1,562 1,573 1,624 1,572 2,534 1,958 2,34 0,962
700 2,046 2,226 2,090 2,111 2,281 2,079 3,494 2,649 3,25 1,386
800 2,553 2,825 2,635 2,666 2,755 2,592 4,504 3,368 4,23 1,846
900 3,065 3,440 3,196 3,239 3,347 3,112 5,554 4,114 5,27 2,334
1000 3,591 4,069 3,771 3,826 3,954 3,696 6,639 4,889 6,39 2,839
1200 4,648 5,358 4,964 5,039 5,203 4,732 8,893 6,712 8,78 3,894
1400 5,752 6,682 6,199 6,295 6,492 5,869 11,233 8,239 11,36 5.006
1600 6,896 8,034 7,467 7,579 7,809 7,045 13,624 10,054 14,12 6,164
1800 8,081 9,407 8,762 8,889 9,141 8,261 16,087 11,955 17,01
2000 9,302 10,803 10,076 10,218 10,491 9,509 18,570 13,924 20,01 8,544
2200 10,555 12,223 11,407 11,560 11,852 10,785 21,092 15,949 23,10
2400 11,837 13,664 12,751 12,915 13,226 12,088 23,635 18,020 26,26
2500 — — — — — — — — 27,86 11,614
2600 13,145 15,124 14,105 14,278 14,609 13,413 26,202 20,128 29,49
2800 14,477 16,608 15,469 15,649 16,001 14,758 28,786 22,267 32,77
3000 15,829 18,112 16,839 17,029 17,397 16,120 31,382 24,466 36,08 14,794
3200 17,200 19,632 18,217 18,414 18,799 17,497 33,998 26,655 39,45
3400 18,586 21,170 19,603 19,804 20,204 18,891 36,641 28,868 42,82
* Данные для аммиака взяты из книги Д. Тэйлора .Detonation in Condensed Explosives" (Oxford at the Clarendon Press, 1952).
Приложения
569
Продолжение
Температура в 0 К Н, о2 n2 СО NO ОН со2 н2о NH3 Г рафит С (тв.)
3500 — — — •—• — — — — 44,51 18,034
3600 19,987 22,725 20,993 21,199 21,614 20,299 39,294 31,114 46,22
3800 21,402 24,295 22,387 22,599 23,034 21,720 41,947 33,387 49,66
4000 22,828 25,874 23,783 24,003 24,458 23,150 44,615 35,679 53,10 21,364
4200 24,267 27,470 25,187 25,408 25,888 24,598 47,296 37,959 56,58
4400 25,714 29,078 26,595 26,818 27,324 26,054 49,991 40,243 60,05
4600 27,173 30,697 28,007 28,234 28,768 27,524 52,687 42,537 63,55
4800 28,640 32,318 29,418 29,657 30,219 29,009 55,379 44,839 67,05
5000 30,118 33,943 30,840 30,971 31,679 30,497 58,118 47,182 70,57
Приложение 8а
ИЗМЕНЕНИЕ ВНУТРЕННЕЙ ЭНЕРГИИ ГАЗОВ ОТ 291° до Г К в ккал1мол
Температура °К СН4 HCN С12 HCI
291 0 0 о 0
300 0,062 0,059 0,056 0,045
400 0,773 0,763 0,687 0,542
500 1,616 1,536 1,341 1,042
600 2,602 2,363 2,012 1,547
700 3,725 3,239 2,692 2,060
800 4,976 4,156 3,378 2,584
900 6,344 5,112 4,069 3,121
1000 7,818 6,102 4,765 3,671
1100 9,379 7,120 5,464 4,234
1200 11,030 8,167 6,166 4,811
1300 12,761 9,241 6,870 5,401
1400 14,553 10,339 7,575 6,001
1500 16,394 11,458 8,284 6,732
1600 — 12,592 —— —
2000 — 17,288 — —
570
Приложения
Приложение 9
ИЗМЕНЕНИЕ ВНУТРЕННЕЙ ЭНЕРГИИ ДВ НЕКОТОРЫХ ТВЕРДЫХ КОМПОНЕНТОВ ПРОДУКТОВ ВЗРЫВА ОТ 291° до Т° К в ккал)мол*
Температура °К A12O3 NaCl КС! N ЭдСОз К2СО3 MgO СаО ВаО TiO2 S
291 0 0 0 0 0 0 0 0 0 0
300 0,16 0,11 0,10 0,25 0,28 0,08 0,09 0,08 0,12 0,03
400 2,2 1,3 1,3 3,1 3,3 1.1 1,2 1,2 1,6 0,38
500 4,5 2,6 2,6 6,1 6,4 1,3 2,3 2,4 3,0 0,74
600 7,1 3,9 3,9 9,2 9,4 3,1 3,6 3,6 4,6 1,1
700 9,7 5,2 5,3 12,1 12,6 4,3 4,9 4,8 6,3 1,4
800 12,6 6,7 6,6 15,2 15,8 5,4 6,2 6,2 7,9 1,7
900 15,5 8,1 8,0 18,4 18,9 6,6 7,6 7,6 9,8 2,1
1000 18,5 9,6 9,4 21,6 22,3 7,8 9,0 9,0 11,7 2,4
1100 21,6 18,3 17,3 24,7 25,6 8,9 10,5 10,5 13,7 2,7
1200 24,7 19,9 18,9 35,0 36,8 10,1 12,1 12,0 15,7 3,0
1300 28,1 21,4 20,5 38,3 40,1 11,4 13,7 13,7 17,9 3,3
1400 31,5 23,1 22,0 41,6 43,5 12,6 15,3 15,3 20,0 3,6
1500 34,9 24,8 23,7 45,0 47,0 13,8 17,0 16,9 22,3 3,9
1600 38,5 26,5 25,4 48,4 50,6 15,1 18,8 18,8 24,6 4,2
1700 42,2 28,3 27,8 51,8 53,9 16,4 20,6 20,5 27,1 4,5
1800 45,9 32,1 32,8 55,1 57,4 17,7 22,4 22,3 29,6 4,8
1900 49,8 37,0 37,8 58,5 60,7 19,0 24,3 24,3 32,2 5,1
2000 53,8 42,0 42,9 61,8 64,0 20,3 26,2 26,1 34,8 5,4
2100 57,8 46,9 48,0 65,1 67,3 21,6 28,2 28,1 48,9 5,7
2200 61,9 51,8 53,0 68,5 70,8 22,9 30,3 41,5 51,7 6,0
2300 66,1 56,7 58,1 71,8 74,1 24,3 32,3 43,8 54,6 6,3
2400 96,4 61,7 63,2 75,2 77,4 25,7 34,5 47,2 57,6 6,6
2500 100,9 66,6 68,2 78,6 80,7 27,1 36,7 50,4 60,6 6,9
2600 105,4 71,6 72,0 81,9 84,2 28,4 38,9 53,8 63,7 7,2
2700 109,9 76,5 72,6 84,8 87,5 29,8 41,2 57,0 66,8 7,5
2800 114,5 77,2 73,4 87,8 90,4 31,3 43,5 60,2 70,1 7,8
2900 119,3 77,9 74,1 90,9 93,4 32,7 45,9 63,6 73,5 8,1
3000 124,1 78,6 74,8 93,9 96,5 52,6 60,5 66,7 76,9 8,4
3100 129,1 79,3 75,5 96,8 99,4 54,1 63,0 70,2 80,3 8,7
3200, 134,1 80,0 76,1 99,9 102,4 55,5 66,2 73,4 83,9 9,0
3300 139,5 80,7 76,9 102,9 105,5 57,0 69,5 76,6 88,1 9,3
* Таблица составлена по данным П. Тавернье (Memorial des poudres, 1957).
Приложения
571
Продолжение
Температура °К AI2O3 NaCl КС1 Na2CO3 К2СО3 MgO CaO BaO TiO3 S
3400 145,4 81,4 77,6 105,8 108,4 58,5 72,8 80,0 93,9 9,7
3500 151,4 82,1 78,2 108,9 111,4 60,0 76,1 83,2 99,8 9,9
3600 157,5 82,8 79,0 111,9 114,4 61,5 79,4 86,4 105,6 10,2
3700 163,4 83,5 79,7 114,8 117,5 63,0 82,8 89,8 111,4 10,5
3800 169,4 84,2 80,4 117,8 120,4 64,6 86,1 93,0 117,3 10,8
3900 175,4 84,9 81,1 120,9 123,4 66,8 89,4 96,4 122,2 11,1
4000 181,3 85,6 81,7 123,9 126,5 70,8 92,7 99,6 128,8 11,4
Приложение 10
МОЛЯРНЫЕ ОБЪЕМЫ НЕКОТОРЫХ ТВЕРДЫХ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ, ВСТРЕЧАЮЩИХСЯ В ПРОДУКТАХ ВЗРЫВА
Вещество Молярный объем v л/мол Вещество Молярный объем v л [мол
Бура (безводная стекловидная) 0,085 Углекислый калий 0,0569
Кремнезем (кварц) 0,0226 Углекислый натрий 0,0423
Окись алюминия 0,0255 Хлористый калий 0,0376
Окись бария 0,0278 Хлористый натрий 0,027
Окись кальция 0,0165
Окись магния 0,0109
Приложение 11
ЗНАЧЕНИЯ ВТОРЫХ ВИРИАЛЬНЫХ КОЭФФИЦИЕНТОВ b ГАЗООБРАЗНЫХ ПРОДУКТОВ ВЗРЫВА ПРИ ВЫСОКИХ ТЕМПЕРАТУРАХ
Газ Коэффициент b см^мол Г аз Коэффициент b см3\мол
Аммиак 15,2 Окись азота 21,2
Углекислота 37,0 Азот 34,0
Окись углерода 33,0 Закись азота 63,9
Водород 14,0 Кислород 30,5
Метан 37,0 Водяной пар 7,9
572
Приложения
Приложение 12
НЕКОТОРЫЕ МЕТОДЫ ИСПЫТАНИЯ ВВ И ПРИБОРЫ ДЛЯ НИХ, ПРЕДУСМОТРЕННЫЕ ГОСУДАРСТВЕННЫМИ ОБЩЕСОЮЗНЫМИ
СТАНДАРТАМИ
Определение химической стойкости нитроглицерина и нитроглицериновых ВВ по иодо-крахмальной пробе
Согласно ГОСТ 5772—51 испытания производят следующим образом.
В случае испытания нитроглицерина около, 5 мл фильтруют для удаления избытка воды через чистый нейтральный бумажный фильтр непосредственно в пробирки для испытания до метки 2 мл.
В случае пластичных нитроглицериновых взрывчатых веществ (динамитов) испытуемое вещество1 разрезают роговым ножом на небольшие кусочки, отвешивают 3,24 г с точностью 0,001 г и тщательно смешивают в фарфоровой (лучше деревянной) ступке деревянным пестиком с 6,48 г талька, затем берут навески в 3,24 г каждая с точностью до 0,01 г.
В случае порошкообразных нитроглицериновых взрывчатых веществ в фарфоровой (деревянной) ступке деревянным пестиком измельчают испытуемое вещество без талька и берут навеску в 3,24 г с точностью до 0,01 а.
Подготовленные навески испытуемого вещества наливают или высыпают через воронки в тщательно вымытые и высушенные пробирки, наблюдая за тем, чтобы капли или частицы вещества не попадали на стенки пробирок. Пробирки закрывают чистыми пробками с крючками, на которые предварительно подвешены иодокрах-мальные бумажки, нижняя половина которых увлажнена смесью глицерина с водой в соотношении 1 : 1 (по объему).
Подвешивание иодокрахмальных бумажек и смачивание их раствором глицерина производят следующим образом.
Иодокрахмальные бумажки вынимают из банки чисто вымытым и высушенным пинцетом, помещают на чисто вымытую стеклянную или пробковую пластинку, прокалывают отверстие шилом и при помощи пинцета подвешивают на крючок, придают листку иодокрах-мальной бумажки вертикальное положение и смачивают каплей раствора глицерина оба нижних угла листка бумажки. Бумажка должна равномерно впитать раствор глицерина на половину ее высоты, оставляя ясную линию между смоченной и сухой ее частью. Пробирку закрывают пробкой так, чтобы нижний край бумажки отстоял от дна пробирки на 76 мм.
Снаряженные пробирки помещают через отверстия в крышке бани в воду, нагретую до необходимой для испытания температуры, и одновременно с этим пускают секундомер или часы. Пробирку погружают в воду так, чтобы нижний край иодокрахмальной бумаж
П риложения
ки был на одном уровне с наружной поверхностью крышки бани. При установке в баню пробирок следят, чтобы бумажки находились в вертикальном положении и не касались стенок. В течение всего времени испытания в бане поддерживают постоянную температуру, перемешивая жидкость мешалкой.
Нормальный эталон окрашивания устанавливают в стандартной бане в специальном гнезде. Наблюдение ведут в отраженном свете.
Испытание считают законченным и производят засечку секундомера или часов, когда на линии, разграничивающей сухую часть иодокрахмальной бумажки от части, смоченной водным раствором глицерина, появится полоска, тождественная по степени окраски бурой черте нормального эталона окрашивания. Результаты испытаний выражаются в целых минутах (средний результат не выводят).
Иодокрахмальную пробу производят в специально отведенной комнате, хорошо* вентилируемой, свободной от лабораторных и заводских газов. Стены комнаты должны быть окрашены белой масляной краской. Комната должна быть светлой, защищенной от попадания прямого солнечного света, окна застеклены белыми матовыми стеклами или в крайнем случае завешены белой тканью.
Для нагревания пробирок с испытуемыми образцами применяют водяную баню, снабженную мешалкой и термометром. В крышке бани имеются отверстия для погружения термометра и пробирок в воду. Обогрев бани производят электрическим током при помощи закрытой электроплиты или вмонтированного в баню электронагревателя. При отсутствии электроэнергии разрешается обогрев бани производить при помощи пара или циркуляции воды, нагретой до требуемой температуры.
Баня должна иметь равномерный обогрев, обеспечивающий во время испытания наличие одной и той же температуры во всех пробирках с образцами; колебания температуры не должны выходить за пределы ±0,5° С. В бане должен быть постоянный уровень воды, который не должен доходить до краев на 6 мм.
Баню помещают так, чтобы во время испытания листки иодо-крахмальной бумажки были достаточно освещены естественным или искусственным дневным светом. Пробирки должны быть изготовлены из химически прочного бесцветного стекла, не содержащего в своем составе свинца, и не должны иметь камней и свилей.
Длина пробирки должна быть 130—140 мм, внутренний диаметр 16—18 мм, толщина стенок 1—1,5 мм. Пробки могут быть или стеклянные, хорошо притертые к пробиркам, с припаянными к нижней их части стеклянными крючками, или же резиновые со сквозными отверстиями по оси, в которые плотно вставлены стеклянные крючки.
Крючки для подвешивания иодокрахмальной бумажки имеют диаметр 4—5 мм; один конец их оттянут и загнут в виде крючка или же снабжен платиновой проволокой, изогнутой в виде крючка.
574
П риложения
Стандартные иодокрахмальные бумажки изготавливаются специальными организациями. Каждая партия должна иметь формуляр, в котором должен быть указан срок их годности. Иодокрахмальные бумажки следует хранить в банке из темного стекла с притертой пробкой. Во время хранения бумажки периодически испытывают на пригодность следующим образом. Чистой стеклянной палочкой наносят на иодокрахмальную бумажку одну каплю 10%-ного водного раствора уксусной кислоты. В случае немедленного появления бурого пятна (или синего) бумажки бракуют. Появление бурого пятна через минуту или более после нанесения капли раствора уксусной кислоты не служит поводом к забракованию бумажки, но указывает на необходимость использовать ее в кратчайший срок с проверкой пригодности перед каждым испытанием. Прикосновение руками к иодокрахмальной бумажке не допускается.
Иодокрахмальные бумажки необходимо защищать от действия дневного света, особенно прямого солнечного, так как чувствительность от этого резко меняется.
Тальк для испытания динамитов подготовляют следующим образом. Тальк медицинский высшего качества подвергают многократному промыванию водопроводной водой, потом дистиллированной, затем (3—4 раза) слабым раствором соды и, наконец, дистиллированной водой. Промывание ведут до тех пор, пока подсушенный, промытый тальк, помещенный в пробирку с иодокрахмальной бумажкой, при нагревании в течение 1 часа при температуре 75° С не будет давать положительной реакции (отсутствие бурой черты).
Определение чувствительности взрывчатых веществ при ударе
Методика определения и прибор для него описаны соответственно в ГОСТах 4545—48 и 2065—43.
Согласно стандарту чувствительностью взрывчатых веществ к удару называют их способность к разложению при действии свободно падающего с различной высоты груза определенного веса.
Критерием чувствительности служит как процент взрывов из 25 параллельных испытаний, так и минимальная высота падения груза, при которой происходит взрыв.
Копер, применяемый для испытаний ВВ на чувствительность к удару, роликовые и штемпельные приборы, а также грузы должны соответствовать ГОСТ 2065—43 «Прибор для определения чувствительности пиротехнических составов к удару».
Перед испытанием поверхность скольжения копра вытирают марлей, смоченной этиловым спиртом, смазывают тонким слоем машинного масла и проверяют ход груза копра по направляющим. Роликовые и штемпельные приборы промывают ацетоном или этиловым спиртом и насухо вытирают марлей.
П риложения
575
Испытания производят следующим образом. Навеску в 0,05 г испытуемого ВВ, взятую с точностью до 0,005 г, равномерно распределяют между ударными поверхностями наковальни и бойка роликового или штемпельного прибора, который затем при помощи центрующей обоймы помещают на наковальню копра.
Груз копра весом 10 кг устанавливают на высоте 250 мм и нажатием спускового механизма производят удар грузом по головке бойка роликового или штемпельного прибора. Это определение повторяют 25 раз, меняя каждый раз роликовый или штемпельный прибор.
Испытания производят при комнатной температуре.
Результат определения выражают в процентах взрывов из 25 проведенных параллельных испытаний.
Примечание. Если опыт сопровождается звуковым эффектом, вспышкой, дымообразованием или обугливанием испытуемого материала, считают, что произошел «взрыв». Если опыт не сопровождается перечисленными выше явлениями, считают, что произошел «отказ».
Если процент взрывов окажется равным 100, то груз копра весом 10 кг заменяют грузом весом 5 кг, устанавливают последний на высоте 250 мм и производят, как описано выше, также 25 параллельных испытаний. Результат выражают в процентах полученных взрывов.
Для проверки копра, роликовых или штемпельных приборов производят испытание эталонного взрывчатого вещества.
В качестве эталона при испытании с грузом 10 кг применяют тег-рил по ГОСТ 626—41, который дважды перекристаллизовывают из ацетона, причем кристаллы его должны проходить через сито № 25 (размер отверстий 0,28 мм) и задерживаться на сите № 32 (размер отверстий 0,20 мм по ГОСТ 4403—48 «Шелковые ткани для сит»). При этом процент полученных взрывов на роликовом приборе должен быть равным 48±4%.
В качестве эталона при испытании взрывчатых веществ с грузом в 5 кг применяют гексоген, дважды перекристаллизованный из ацетона, с величиной кристаллов, указанной выше для тетрила. При этом процент полученных взрывов на роликовом приборе также должен быть равным 48±4%.
Испытания взрывчатых веществ на чувствительность к удару считаются действительными только в том случае, если результаты испытаний эталонного взрывчатого вещества будут соответствовать указанным выше требованиям.
Чувствительность к удару промышленных ВВ определяют, применяя штемпельные приборы и груз весом 2 кг. Критерием чувствительности считают минимальную высоту падения груза, при котсь рой происходит взрыв. В качестве эталона применяют тротил ГОСТ 3471—46, при этом высота падения груза весом 2 кг должна быть равной 1000 мм.
576
Приложения
Фиг. 1. Копер Каста.
После окончания испытаний роликовые или штемпельные приборы промывают ацетоном или этиловым спиртом, насухо вытирают марлей и смазывают машинным маслом.
Если испытывают жидкое ВВ, навеску (2 капли) помещают не непосредственно в роликовый прибор, а в мельхиоровый капсюльный колпачок, имеющий следующие размеры: диаметр 5,95 мм, высоту ~3,75 мм и толщину стенок 0,15 — 0,20 мм. Колпачок помещают в роликовый прибор между бойком и наковальней. Испытания проводят так же, как для твердых В В.
Прибор для определения чувствительности- к удару состоит из копра Каста (фиг. 1) и роликового приспособления с центрирующей к нему обоймой. Груз копра, подвешенный на металлическом тросе, снабжен приспособлением, посредством которого он может быть установлен на заданной высоте, отсчитываемой по шкале.
Роликовое приспособление (фиг. 2), устанавливаемое на основание копра при помощи центрирующей обоймы (фиг. 6), состоит из стального поддона (фиг. 3), направляющей муфты (фиг. 4) и вставляемых в последнюю
Приложения
577
двух роликов (фиг. 5). Вместо роликового приспособления может быть применен штемпельный прибор Каста с центрирующей к нему обоймой.
Применяемые в качестве бойка и наковальни для роликового приспособления ролики:
Фиг. 2. Роликовое приспособление.
Фиг. 3. Стальной поддон.
Фиг. 4. Направляющая муфта.
а) по качеству материала и термической обработке должны удовлетворять требованиям, предъявляемым к цилиндрическим ро-
ликам шарикоподшипниковых заводов;
б) цилиндрическая и торцовая поверхности должны быть тщательно отшлифованы. Качество обработки должно соответствовать эталонным деталям.
Груз копра должен иметь вес 10 000± 10 г и должен свободно скользить между направляющими. Шкала на ли-
Фиг. 5. Ролик.
Фиг. 6. Центрирующая обойма.
установления необходимой высоты подъема груза, должна быть длиной не менее 100 см, с ценой деления 1 мм. Установка груза на требуемой высоте должна обеспечиваться приспособлением с точностью до 1 мм.
После удара груза о роликовое приспособление и отскока не должно быть повторного удара.
578
П риложения.
При установке роликового приспособления на основание копра должно быть обеспечено точное центрирование роликового приспособления по отношению к грузу.
Основание копра устанавливают на массивном фундаменте, а направляющие закрепляют неподвижно в вертикальном положении.
Определение скорости детонации ВВ по Дотришу
Согласно ГОСТ 3250—58 это определение производят следующим образом.
Испытуемое ВВ помещают в металлическую оболочку (трубку без шва), закрытую с обеих сторон навинчивающимися пробками, в одной из которых имеется отверстие для капсюля-детонатора. Металлическая оболочка для заряда должна быть изготовлена в соот-
Фиг. 7. Металлическая оболочка для заряда.
ветствип с фиг. 7, а пробки оболочки — с фиг. 8; при этом отверстие для капсюля-детонатора делается лишь в одной из пробок.
Плотность испытуемого взрывчатого вещества должна быть равномерной по всей длине заряда, заключенного в оболочку. Заряды малой плотности (р—1,1 и менее) готовят равномерной набивкой
Фиг. 8. Пробка оболочки.
испытуемого взрывчатого вещества в оболочку деревянным пуансоном, порциями по 40 г так. чтобы каждая порция укладывалась на одинаковую высоту трубки.
Высоту набивки одной порции вещества в трубке (Л) вычисляют по формуле
, 4-G-1000
л —---------,
ттЛ’р
где G — вес одной порции взрывчатого вещества в a; d — внутренний диаметр оболочки в мм-, р — требуемая плотность взрывчатого вещества в г/слс3. Заряды большой плотности
(р = 1,2 и более) составляют из отдельных прессованных шашек высотой 40 ±0,2 мм.
П риложения.
579
Вес G одной шашки в г вычисляют по формуле
q__ncPFip
~ 4-1000’
где d — внутренний диаметр прессформы в мм, который должен быть в пределах 29±0,2; h — высота шашки в мм\ р—требуемая плотность взрывчатого вещества в г/см3.
Плотность испытуемого взрывчатого вещества проверяют не менее чем для 20% шашек.
Примечание. Проверку плотности шашек производят с помощью денсиметра или расчетным путем по действительному весу шашки и данным обмера при условии, что шашка не имеет дефектов: сколов, трещин, глубоких борозд, лунок осыпания и т. п.
Для инициирования испытуемого ВВ применяют тетриловый детонатор, имеющий гнездо для капсюля-детонатора глубиной 15 мм и диаметром 7,5 мм. Плотность тетрилового детонатора должна быть 1,5—-1,6 г/см3, диаметр 29 мм и вес 30 г.
При снаряжении трубки тетриловый детонатор помещают впритык к срезу заряда, кладут на него картонные прокладки с отверстиями и навинчивают прижимную пробку (см. фиг. 8). Под навинчивающуюся на оболочку пробку без отверстия также помещают картонные прокладки.
Детонирующий шнур, применяемый при испытании, должен иметь равномерную скорость детонации. Скорость детонации шнура определяют при помощи осциллографа или фотохронографа, как среднее из четырех определений, для чего отбирают два образца с одного конца бухты шнура и два образца с другого конца ее.
Скорость детонации шнура должна быть не менее 6500 м/сек, разброс скоростей не должен превышать ±1,5%. средней величины.
При определении скорости детонации взрывчатых веществ, находящейся в пределах 2500 м/сек и выше, берут два отрезка детонирующего шнура — один длиной 1500± 0,5 мм, второй 1000 ±0,5 мм. Если ожидаемая скорость детонации испытуемого взрывчатого вещества менее 2500 м/сек, то необходимо уменьшить длину участка заряда, на котором определяется скорость детонации, до 200 мм или увеличить длинный отрезок детонирующего шнура до 2200 мм.
Пластину-фиксатор, отмечающую встречу ударных волн, проходящих по детонирующему шнуру, изготовляют из латуни в соответствии с фиг. 9, по 9-му классу точности. На пластине-фиксаторе на расстоянии 500 мм друг от друга проводят две линии А и Б.
Пластину-подушку, на которой закрепляют пластину-фиксатор, изготовляют из стали в соответствии с фиг. 10 по 9-му классу точности.
Защитную трубку, служащую для защиты фиксирующей системы от осколков при детонации заряда, изготовляют в соответствии с фиг. 11.
580
Приложения
Испытание проводят следующим образом: сверлом из цветного металла через два отверстия, расположенные в оболочке заряда, просверливают гнезда в заряде глубиной 15 ±1 мм и диаметром 6—6,5 мм.
От бухты детонирующего шнура отмеривают штангенциркулем отрезки и отрезают их острым ножом на Доске.
Фиг. 9. Пластина-фиксатор.
Фиг. 10. Пластина-подушка.
На пластину-подушку помещают пластину-фиксатор с нанесенными линиями А и Б. На последнюю укладывают отрезки детонирующего шнура так, чтобы один из концов короткого шнура строго совладал с линией А, а один из концов длинного шнура — с линией Б, как указано на фиг, 12,
Фиг. 11. Защитная трубка.
Всю систему скрепляют шпагатом или толстыми нитками.
Закрепленную таким образом фиксирующую систему вставляют в защитную трубку так, чтобы свободные концы детонирующего шнура выходили из нее по обеим сторонам (фиг. 12).
Конец длинного отрезка детонирующего шнура вставляют в первое (считая от детонатора) гнездо заряда, а короткого—во второе, на глубину 15 мм.
Защитная трубка и заряд должны располагаться так, чтобы детонирующий шнур не касался наружных стенок заряда и был плавно изогнут.
Примечание. При скорости детонации менее 2500 м!сек возможны отказы детонирующего шнура вследствие недостаточности инициирующего импульса. В этом случае на концы детонирующего шнура, вставляемые в гнезда заряда, привязывают нитками капсюли-детонаторы № 8, которые открытым концом вставляют в гнездо заряда испытуемого ВВ.
Приложения.
581
Общая схема сборки деталей и элементов, применяемых при определении скорости детонации взрывчатых веществ, указана на фиг. 12.
С помощью капсюля-детонатора № 8 с огнепроводным шнуром или при помощи электродетонатора, вставленного в детонатор заряда через отверстие в пробке, производят взрыв заряда.
Фиг. 12. Схема устройства для определения скорости детонации.
1—оболочка для заряда (трубка бесшовная 38X4), 2—пробка оболочки, 3—пластина-фиксатор. 4—пластина-подушка, 5—трубка защитная, t>—прокладка толщиной 1.5 мм, 7 — шнур детонирующий.
Взрыв производят в бронеяме, на полигоне или в грунте на глубине 1 м от поверхности. При этом соблюдают соответствующие правила техники безопасности.
После взрыва вынимают пластину-фиксатор из защитной трубки и измеряют при помощи штангенциркуля с точностью до 0,2 леи расстояние от центра полученной на ней отметки (точка встречи детонации) до линий А п Б.
Скорость детонации D в м)сек вычисляют по формуле
_ ДпИ * I — 12
где — скорость детонации детонирующего шнура в м!сеи\
I — длина участка заряда, на котором определяется скорость детонации (расстояние ВГ на фиг. 12), выраженная в лг, h — расстояние от центра отметки, полученной на пластине-фиксаторе, до начала длинного отрезка шнура (расстояние от центра отметки до точки А плюс длина отрезка АВ), выраженное в м;
582
П риложения
/2 — расстояние от центра отметки, полученной на пластине-фиксаторе, до начала короткого отрезка шнура (расстояние от центра отметки до точки Б плюс длина отрезка БГ), выраженное в м.
Для каждого исследуемого образца производят два параллельных определения, из результатов которых выводят среднее арифметическое.
Отклонение величин скоростей детонации отдельных определений от среднего арифметического не должно превышать ±1,5%.
Для контроля правильности определения периодически измеряют скорость детонации тротила (при плотности заряда 1,55), которая при соблюдении всех указанных выше условий испытания должна быть 6800 ±150 mJсек.
Определение фугасного действия ВВ в свинцовой бомбе
Свинцовая бомба согласно ГОСТ 4546—48 должна отвечать следующим требованиям:
а) иметь форму цилиндра с несквозным каналом по оси;
б) размеры бомбы должны быть;
высота.......................... 200 ±2 мм
диаметр......................... 200 ±2 ,
глубина канала ................. 125±2 ,
диаметр канала.................. 25±0,5„
в) бомбы отливают из свинца по ГОСТ 3778—56 или из свииц<1, колученного путем переплавления бомб, бывших в употреблении. Отливку бомб производят в один прием при температуре 390—400° С. Из бомб, отлитых из одной плавки свинца, формируют партию. Проверку качества партии свинцовых бомб производят на эталонном взрывчатом веществе — перекристаллизованном из спирта тротиле, имеющем температуру затвердевания до перекристаллизации не менее 80,2° С (ГОСТ 3471—46); при этом расширение должно быть в пределах 285 ±7 мл-, в противном случае бомбы этой партии к испытанию не допускают. Количество свинцовых бомб, подвергаемых проверке на эталонном взрывчатом веществе, должно быть не менее двух от каждой партии;
г) дно бомбы не должно иметь усадочной раковины, а поверхность должна быть монолитной, без отслоений. Раковины на внутреннем канале не допускаются;
д) готовые бомбы допускают к испытаниям не ранее как через 48 час. после отливки;
е) для каждого определения применяют свинцовую бомбу, не бывшую в употреблении.
Употреблявшиеся свинцовые бомбы допускают к переплавке не более 10 раз. При отливке бомб из свежего свинца допускается прибавление не более 50% свинца от бомб, бывших в употреблении.
П риложения
583
Кварцевый песок, применяемый для засыпки, должен быть воздушно-сухим и должен проходить через сито с сеткой № 07 и оставаться на сите с сеткой № 042 по ГОСТ 3584—53.
Патронную гильзу готовят из подпергамента, вырезанного по шаблону, соответствующему прямоугольной трапеции с размерами 150X120X70 мм. Вырезанный по шаблону лист навертывают на деревянный цилиндр диаметром 24 мм так, чтобы нижнее основание трапеции выступало над срезом цилиндра на 15—20 мм. Выступающую часть загибают и склеивают, образуя дно гильзы.
Для возбуждения взрыва применяют капсюль-детонатор № 8 гремучертутно-тетриловый в бумажной оболочке, соединенный с отрезком бикфордова шнура длиной 30—35 см или электродетонатор № 8.
Картонный пыж готовят из картона толщиной 1,0—1,5 мм; наружный диаметр пыжа 24 мм, диаметр отверстия 7,5 мм.
Испытание выполняют следующим образом. Навеску взрывчатого вещества 10±0,01 г помещают в гильзу. Поверх взрывчатого вещества вставляют картонный пыж. В специальной матрице диаметром 24,5±0,1 мм с помощью бронзового пуансона диаметром 24±0,2 мм, имеющего на конце выступ по форме капсюля-детонатора № 8 (диаметром 7 мм и длиной 12 мм), прессуют взрывчатое вещество до получения плотности, принятой в эксплуатационных условиях, а при сравнительных испытаниях—до плотности, равной 1 г!см3. В гнездо патрона вставляют капсюль-детонатор.
Подготовленный таким образом заряд вставляют в канал бомбы, объем которого предварительно измерен, и осторожно досылают его деревянной палочкой до дна. Оставшееся свободным пространство канала бомбы засыпают кварцевым песком (без уплотнения, до уровня верхнего среза канала бомбы). Затем производят взрыв.
После взрыва канал бомбы очищают волосяным ершом и содержимое удаляют перевертыванием бомбы. Расширение канала бомбы, произведенное взрывом, измеряют водой при помощи мерного цилиндра емкостью 500 мл. Разность между замеренным объемом канала бомбы после взрыва и объемом канала до взрыва выражает численное значение фугасного действия испытуемого ВВ.
Фугасное действие выражают как среднее арифметическое из двух параллельных определений, между которыми отклонения должны быть не более 10 мл.
Если испытания производят при температуре бомбы, отличной от '4-15° С, то в результат вводят поправку согласно следующей таб-
лице: +30
Температура бомбы в °C —30 | -25 “20 -15 -10 | -5 ! 0 | +5 | +10 + 15 + 20 Х25
Поправка в % от измеренного расширения 1 + 18 : +16 1 4-14 + 12 + 10 + 7 I +5 1 1 I +3,5 1 +2,0 ! i t 1 0,0 -4,0 -6,0
584
П риложения
Окончательный результат округляют до целого числа.
Определение бризантности взрывчатых веществ испытанием взрывом на свинцовом цилиндре
измерения
Фиг. 13. Схема свинцового цилиндра до взрыва (7) и после него (2).
Согласно ГОСТ 5984—51 свинцовые цилиндры отливают в металлических формах со шлифованной внутренней поверхностью из свинца по ГОСТ 3778—56. Каждый цилиндр отливают в один прием при температуре 400+10° С. Разрешается изготовление свинцовых цилиндров путем переплавки цилиндров, бывших в употреблении.
Торцовые поверхности свинцовых цилиндров должны быть параллельны и механически обработаны. Чистота обработки должна соответствовать V 4. Размеры свинцового цилиндра должны быть: высота 60 + 0,5 мм, диаметр 40±0,2 мм.
Свинцовые цилиндры изготовляют отдельными партиями. Партия может быть скомплектована только из цилиндров, отлитых из одной плавки свинца. Каждой партии присваивают очередной номер и составляют на нее формуляр с указанием всех характеристик.
Каждую партию цилиндров подвергают испытанию на жесткость свинца путем обжатия цилиндров при подрыве эталонного образца тротила. В качестве эталонного образца применяют тро
тил, удовлетворяющий требованиям ГОСТ 3471—46, и затем перекристаллизованный из этилового спирта с величиной кристаллов, проходящих через сито № 9 (размер отверстий 0,16 мм) и остающихся на сите № 21 (размер отверстий 0,08 мм) (ГОСТ 4403—56).
Для проверки жесткости свинца от каждой партии цилиндров отбирают не менее 2% цилиндров, но не менее 4 шт. при малых партиях.
Величину обжатия определяют путем измерения высоты цилиндров до и после испытания в четырех диаметрально противоположных местах с точностью до 0,1 мм, как указано на фиг. 13; за результат измерения цилиндра принимают среднее арифметическое из четырех измерений, округленное до 0,1 мм. Разность между начальной высотой свинцового цилиндра и высотой после обжатия, выраженная в миллиметрах, численно представляет величину обжатия.
Окончательный результат при обжатии свинцовых цилиндров, путем подрыва эталонного образца тротила выводят как средний арифметический из результатов испытаний четырех образцов данной партии,
Приложения
585
Партию цилиндров считают годной, если при испытании эталонного тротила, при плотности заряда 1 г! см\ обжатие свинцовых цилиндров составляет 16,5±0,5 мм.
Стальной диск, помещаемый при испытании поверх свинцового цилиндра, должен иметь следующие размеры: высота 10±0,2 мм, диаметр 41 ±0,2 мм. Обработка кругом V 6.
Твердость стали диака должна быть 150—200 по Бринеллю. Допускается повторное применение стального диска после контрольного промера на соответствие размерам.
Стальная плита, на которой проводят испытания, должна иметь толщину не менее 20 мм и диаметр или длину стороны не менее 200 мм. Обработка стороны плиты, на которую ставят свинцовый цилиндр, V 4. Плита должна иметь четыре крючка для крепления заряда.
Гильзу для ВВ готовят из листа плотной бумаги толщиной 0,15—0,20 мм, размером 65X150 мм. Из вырезанного листа бумаги склеивают цилиндр, имеющий внутренний диаметр 40 мм. К цилиндру приклеивают дно из той же бумаги, для чего вырезают кружок диаметром 60 мм, надрезают края кружка до диаметра 40 мм, загибают надрезанные края на наружную часть гильзы и приклеивают к ней.
Картонный кружок, которым закрывают заряд ВВ в гильзе, готовят из картона толщиной 1,3—2,0 мм. В центре кружка делают отверстие для введения капсюля-детонатора.
Наружный диаметр кружка должен быть 38—39 мм, диаметр отверстия в нем 7,5 мм.
Для центровки капсюля-детонатора допускается применение также фанерного кружка толщиной около 5 мм.
Определение выполняют следующим образом.
50±0,1 г испытуемого взрывчатого вещества помещают в бумажную гильзу и закрывают сверху картонным кружком.
В специальной матрице, имеющей фигурный пуансон, заряд доводят прессованием до плотности 1 г]см\ Промышленные взрывчатые вещества испытывают при плотностях, указанных в соответствующих ГОСТах или ТУ.
По оси заряда взрывчатого вещества должен быть канал под капсюль-детонатор (или электродетонатор) диаметром 7,5 мм и длиной 25 мм.
При приготовлении заряда к испытанию в гнездо под капсюль-детонатор вставляют деревянный цилиндр диаметром 7,5 мм и длиной 50 мм. Для производства подрыва применяют капсюль-детонатор № 8 гремучертутно-тетриловый или электродетонатор № 8 в бумажных оболочках. Капсюль-детонатор вставляют в гнездо патрона только на месте перед подрывом.
Взрыв производят либо зажиганием свободного конца огнепроводного шнура, либо' (в случае электродетонатора) при помощи электрического тока. Капсюль-детонатор № 8 соединяют с отрезком
586
Приложения
огнепроводного шнура длиной 30—35 см по существующим правилам техники безопасности. Капсюли-детонаторы рекомендуется применять той же партии, которая применялась при испытании партии свинцовых цилиндров.
Стальную плиту располагают горизонтально на бетонном фундаменте или на другом твердом основании. На плиту устанавливают свинцовый цилиндр, поверх которого помещают стальной диск. На диск ставят гильзу с зарядом испытуемого ВВ и вставленным в него капсюлем-детонатором.
Установленную систему центрируют и укрепляют на плите, после чего производят подрыв. Производят два параллельных испытания (взрыва), из результатов которых выводят средний арифметический.
Расхождение между параллельными испытаниями допускается не более 1,0 мм. При получении неудовлетворительных результатов производят повторные испытания трех новых образцов. При получении неудовлетворительных результатов при повторном испытании партию взрывчатого вещества считают не выдержавшей испытаний.
Испытание предохранительных взрывчатых веществ на безопасность их в отношении воспламенения метано-воздушной и пыле-воздушной смеси в опытном щтреке
Согласно ГОСТ 7140—54 испытание производят следующим образом.
Для испытания применяют предохранительные ВВ в патронах диаметром 31—32 мм и плотностью 1,0—1,15 г!см3. Испытание на безопасность в отношении воспламенения метано-воздушной смеси производят зарядом 600 г, а испытание на безопасность воспламенения каменноугольной пыли зарядом 700 г.
Испытание взрывчатых веществ производят в той же патрониров-ке, в которой они выпускаются заводом-изготовителем. Слежавшееся порошкообразное взрывчатое вещество в патронах перед испытанием должно быть размято.
Среднюю пробу взрывчатых веществ отбирают от 2% ящиков партии; при этом отбирают не менее одной пачки или пакета от каждого ящика. Пробы для испытания взрывчатых веществ на безопасность в отношении воспламенения метано-воздушной смеси и каменноугольной пыли отбирают от средней пробы. Общий вес пробы должен быть не менее 4 кг.
При испытании предохранительных ВВ на безопасность от воспламенения метано-воздушной смеси производят 3 опыта, а при испытании на безопасность от воспламенения каменноугольной пыли 2 опыта от каждой партии, из которых один опыт без засыпки
П риложения
587
угольной пыли в канал мортиры и один опыт с засыпкой 100 г пыли в канал мортиры. Основную массу угольной пыли помещают в свободном пространстве между зарядом и устьем мортиры.
В случае воспламенения метано-воздушной смеси или каменноугольной пыли производят повторные испытания.
При повторных испытаниях пробы отбирают от удвоенного количества ящиков и производят удвоенное количество опытов. Если при повторном испытании будут получены неудовлетворительные результаты хотя бы по одному показателю (по газу или пыли), испытания по другому показателю не производят, а партию бракуют.
Каждый завод-изготовитель не реже одного раза в год отправляют в Макеевский научно-исследовательский институт по безопасности работ в горной промышленности (МакНИИ) на контрольные испытания пробы от валовой продукции всех сортов выпускаемых предохранительных взрывчатых веществ в количестве не менее 60 кг каждой пробы.
Испытания опытных партий новых и опытно-валовых партий (штатных) предохранительных
взрывчатых веществ на безопасность от воспламенения метано-воздушной смеси в МакНИИ производят в количестве 10 опытов от каждой партии, а испытания на безопасность от воспламенения каменноугольной пыли — от опытной партии нового предохранительного взрывчатого вещества в количестве 10 опытов, из которых 5 опытов без засыпки угольной пыли в канал мортиры и 5 опытов с засыпкой 100 г угольной пыли в канал мортиры.
Испытания на безопасность в отношении воспламенения метана выполняют следующим образом. Вначале подготовляют глиняную забойку, для чего пластическую глину высушивают до содержания влаги не более 5% и готовят из нее массу для забойки путем смешения четырех весовых частей глины с одной весовой частью воды. Смесь тщательно перемешивают до получения однородной тестообразной массы.
50—55 г приготовленной глины с содержанием влаги 20—25% помещают в прибор для изготовления забойки (фиг. 14), состоящий из металлического цилиндра или слегка усеченного конуса (желательно из нержавеющей стали) 1, донышка 2 и деревянного пуансона 3. С помощью пуансона уплотняют глиняную лепешку до толщины 10+1 мм. При этом верхние края пуансона должны быть на уровне высоты цилиндра. Затем осторожно вынимают донышко из
588
Приложения
цилиндра и пуансоном выдавливают из него глиняную лепешку.
В случае прилипания глиняной массы к стенкам цилиндра его стенки предварительно слегка смазывают машинным маслом на высоту 1,5—2 см.
Испытание в опытном штреке производят следующим образом.
С помощью диафрагмы, изготовленной из материала, не пропускающего метано-воздушную смесь, отгораживают в опытном штреке
взрывную камеру емкостью 10—11 м3.
Патроны испытуемого взрывчатого вещества помещают в мортиру последовательно, один за другим, впритык в один ряд так, чтобы полученный заряд упирался в дно канала, а ближайший к устью мортиры
фиг. 15. Расположение патронов взрывчатого вещества в мортире.
J—корпус мортиры, 2—канал мортиры, 3—патроны ВВ, 4—забойка из глины, 5—электродетонатор.
патрон находился на расстоянии не менее 5 см от торца мортиры (фиг. 15).
В этот патрон вводят гремучертутно-тетр иловый
электродетонатор № 8 мгновенного действия в бумажной или медной оболочке, углубляя последний на всю его длину.
Электродетонатор донной частью должен быть направлен в сторону дна канала мортиры. Затем устье канала заподлицо закрывают внутренней забойкой из пластической глины, которую слегка придавливают к стенкам канала мортиры.
Заряженную мортиру подкатывают вплотную к люку взрывной камеры штрека так, чтобы не выпала забойка.
В камеру впускают газ, содержащий не менее 90% метана и не содержащий водорода, в таком количестве, чтобы концентрация метана составляла 8—10% (по объему). Перед взрыванием метано-воздушную смесь перемешивают вентилятором или мешалкой и определяют содержание метана с помощью пипетки Зегера или газоанализатора.
Температура метано-воздушной смеси в камере должна быть в пределах от —10 до -% 30° С.
Определение содержания метана в пипетке Зегера производят следующим образом. Пипетку Зегера, наполненную водой, подключают к штуцеру, находящемуся на трубе штрека, и открывают верхний краник; затем открывают нижний краник пипетки. Когда последняя капля воды в пипетке пройдет через отверстие нижнего краника, его закрывают, затем закрывают верхний краник пипетки. Сжигание газа производят от электрической искры.
Пипетку опускают в сосуд с 15—20%-ным раствором хлористого натрия таким образом, чтобы примерно одна пятая часть пипетки на-
Приложения
589
ходилась в растворе, затем открывают нижний краник пипетки. По истечении 10—15 сек. краник закрывают, вынимают пипетку из раствора, взбалтывают несколько раз и вторично опускают пипетку в сосуд. Непосредственно в растворе вновь открывают краник пипетки и устанавливают пипетку таким образом, чтобы высота раствора в пипетке была на уровне раствора в сосуде. Краник закрывают, вынимают пипетку из сосуда и замеряют объем раствора, вошедшего в пипетку, с помощью цилиндра с делениями.
Содержание метана X в процентах вычисляют по формуле
v t>-100 == -----
2-V!
где v — объем раствора, вошедшего в пипетку, в мл;
Vi — объем пипетки в мл.
Определение содержания метана с помощью газоанализатора производят по показанию на шкале газоанализатора.
Правильность показаний газоанализатора проверяют при помощи пипетки Зегера периодически, не реже 1 раза в неделю.
Испытуемые заряды предохранительных взрывчатых веществ взрывают только от взрывных машинок, разрешенных к применению в шахтах, опасных по газу и пыли.
Предохранительные взрывчатые вещества считают выдержавшими испытания на безопасность воспламенения, если заряд 600 г в указанных выше условиях не воспламенит метано-воздушную смесь. Вес заряда складывается из веса патронов, указанных в маркировке без дополнительного взвешивания. Если при испытаниях в канале мортиры или взрывной камере будут обнаружены остатки невзорвав-шегося вещества, оно считается не выдержавшим испытания, если даже воспламенения газа не происходит.
Испытание на безопасность в отношении угольной пыли выполняется следующим образом.
Применяемую для испытания угольную пыль получают измельчением угля из пласта «Макеевский» шахты «Южная Чайкино» с содержанием летучих 29—35%, золы не более 9%, влаги не более 2% или другого угля, содержащего такое же количество летучих, золы и влаги.
Уголь должен быть измельчен до такой степени, чтобы остаток на сите № 15 (по ГОСТ 4403—56, размер отверстий 0,5 мм) при испытании не превышал 10% и чтобы через сито № 76 (по ПОСТ 4403—56, размер отверстий 0,071 мм) проходило не менее 50% пыли.
Угольную пыль в опытном штреке распыляют при помощи распылительной мортиры с каналом длиной 500—700 мм и диаметром 150—220 мм. Мортиру устанавливают под углом 20° по отношению к горизонтальной оси штрека на расстоянии:
— 11,5 м от днища штрека при диаметре штрека 1500 мм-, — 10 м от днища штрека при диаметре штрека '1600 мм; — 8 м от днища штрека при диаметре штрека 1800 мм.
590
Приложения
В распылительную мортиру помещают заряд испытуемого ВВ весом 50±5 г с гремучертутно-тетриловым электродетонатором № 8 в бумажной или медной оболочке и поверх этого заряда засыпают 6±0,1 кг угольной пыли.
В мортиру помещают заряд испытуемого взрывчатого вещества весом 700 г, размещая патроны и электродетэнатор так же, как при испытании по метано-воздушной смеси.
В случае испытания ВВ в патронах весом 200 г для испытания берут половину патрона, которую помещают ме,жду первым и вторым патронами, считая первым патрон, расположенный ближе к устью мортиры. В случае испытания взрывчатых веществ в патронах весом 300 г берут одну треть патрона и помещают ее так же, как указано для патрона весом 200 г.
В первый патрон помещают гремучертутно-тетриловый электродетонатор № 8 в бумажной или медной оболочке на всю длину электродетонатора. Распыление угольной пыли из распылительной мортиры производят в направлении к днищу штрека за 5—10 сек. до взрыва испытуемого заряда взрывчатого вещества.
Предохранительные взрывчатые вещества считают выдержавшими испытания по каменноугольной пыли, если заряд 700 г в указанных выше условиях не воспламенит угольную пыль.
Если при испытаниях в канале мортиры или взрывной камере будут обнаружены остатки невзорвавшегося взрывчатого вещества, оно считается не выдержавшим испытания, даже если воспламенения пыли не произошло.
ОГЛАВЛЕНИЕ
Стр.
Предисловие ......................................................... 3
Введение ........ ..................................................... 5
§ 1. Основные области и условия применения взрывчатых веществ 5
§ 2. Энергия и мощность взрыва . ............................... 14
§ 3. Основные задачи теории взрывчатых веществ.................. 17
Глава I. Общая характеристика взрывчатых веществ...................... 20
§ 1. Явление взрыва.............................................. 20
§ 2. Основные условия протекания реакции в форме взрыва ... 23
1. Экзотермичность, скорость и образование газов как факторы, определяющие возможность взрывного распространения химического превращения......................................... 23
2. Экзотермичность, образование газов, скорость химического превращения и способность его к самораспространению как факторы разрушающего действия взрыва........................ 29
§ 3. Основные типы взрывчатых веществ по составу и классификация их по применению............................................ 34
Глава /]. Медленное химическое превращение взрывчатых веществ ... 38
§ 1. Основные формы химического превращения взрывчатых веществ 38
§ 2. Элементы кинетики простых газовых реакций.................. 40
1. Механизм химической реакции и зависимость скорости реакции от температуры.......................................... 40
2. Зависимость скорости реакции от концентрации (давления);
изменение скорости во времени ........................... 43
§ 3. Самоускоряющиеся химические реакции........................ 48
1. Тепловое самоускорение реакции (тепловой взрыв) в газах . 49
2. Тепловое самоускорение реакции в конденсированных ВВ . . 57
3. Автокаталитическое ускорение реакции (автокаталитический взрыв) ................................................ 57
4. Цепное самоускорение реакции (цепной взрыв).......... 61
§ 4. Медленное химическое превращение конденсированных взрывчатых веществ................................................... 80
1. Общая характеристика медленного химического превращения взрывчатых веществ........................................... 80
2. Медленное химическое превращение нитроэфиров............ 82
592
Оглавление
Стр.
3. Медленное химическое превращение нитросоединений и нитраминов............................................... 92
4. Взрывчатые вещества, разлагающиеся в твердом состоянии 95
5. Общие закономерности медленного химического превращения взрывчатых веществ......................................... 99
Глава III. Стойкость взрывчатых веществ............................. 106
§ 1. Химическая стойкость..................................... 106
1. Теория химической стойкости............................ 106
2. Общая характеристика методов экспериментального определения химической стойкости.......................... 108
3. Основные методы (пробы) для определения химической стойкости .................................................... 113
§ 2. Физическая стойкость............................... 125
1. Физическая стойкость аммонитов................... 126
Глава IV. Самораспространяющееся химическое превращение во взрывча-
тых системах (горение и детонация газообразных и конденсированных взрывчатых систем)........................................ 130
§ 1. Горение газов. Пределы горючести................... 131
§ 2. Скорость горения газов. Переход горения в детонацию .... 136
1. Методы определения скорости горения.................... 136
2. Факторы, влияющие на скорость горения.................. 138
3. Переход горения в детонацию............................ 141
§ 3. Детонация газов.......................................... 144
§ 4. Горение и взрыв пыле-воздушных смесей.................... 148
§ 5. Горение конденсированных взрывчатых систем............... 153
1. Поверхностное распространение горения.................. 154
2. Предельные условия горения (диаметр заряда, давление, начальная температура, плотность)........................... 154
3. Стационарное горение взрывчатых веществ................ 156
§ 6. Теория стационарного горения взрывчатых веществ.......... 158
1. Горение газов и летучих взрывчатых веществ............. 158
2. Горение взрывчатых веществ при наличии экзотермической реакции в конденсированной фазе .......................... 169
3. Горение быстрогорящих взрывчатых веществ............... 171
§ 7. Неустойчивое горение взрывчатых веществ.................. 172
1. Газодинамические условия устойчивости горения.......... 172
2. Неустойчивое горение порошкообразных взрывчатых веществ 178
3. Неустойчивое горение жидких взрывчатых веществ .... 180
4. О физической основе различия между инициирующими, вторичными и метательными взрывчатыми веществами............. 184
§ 8. О практическом значении зависимостей скорости горения порохов от давления и температуры.................................. 189
§ 9. Детонация конденсированных взрывчатых веществ............ 193
1. Критический диаметр заряда н его зависимость от различных факторов.............................................. 196
Оглавление
593
Стр.
2. Зависимость скорости детонации от диаметра заряда, размеров частиц ВВ и характера оболочки...................... 201
3. Зависимость скорости детонации от плотности заряда, начального импульса, примесей, температуры и давления . . 204
§10. Методы определения скорости детонации взрывчатых веществ 210
1. Метод Дотриша............................................ 210
2. Фотографический метод.................................... 212
3. Осциллографический метод . ............................ 218
§11. Теория детонации газов................................... 222
1. Общие сведения........................................... 222
2. Гидродинамическая теория ударной волны................. 223
3. Гидродинамическая теория детонационной волны......... 230
§12. Теория детонации конденсированных взрывчатых веществ . . 244
1. Зависимость параметров детонации от плотности взрывчато- 244 го вещества. Уравнение состояния продуктов взрыва . . .
2. Механизм возбуждения и развития реакции при детонации 249
Глава V. Возбуждение горения и детонации взрывчатых веществ (начальный импульс и чувствительность В В)............................ 263
§ 1. Начальный импульс и механизм возбуждения взрыва.......... 265
1. Возбуждение взрывного превращения тепловым импульсом 268
2. Возбуждение взрывного превращения механическим импульсом .................................................. 273
3. Возникновение взрыва заряда в корпусе снаряда от сотрясения при выстреле или от удара о препятствие............. 287
4. Действие взрывного импульса на ВВ...................... 289
5. Действие на ВВ ионов, электронов, ядерных осколков, а-ча-стиц, лучей Рентгена и ультразвука........................ 293
§ 2. Чувствительность взрывчатых веществ...................... 296
1. Связь между химической структурой и чувствительностью ВВ 296
2. О влиянии на чувствительность физических характеристик ВВ 302
§ 3. Экспериментальные методы оценки чувствительности ВВ и эффективности начального импульса................................ 311
1. Чувствительность ВВ к механическим воздействиям .... 311
2. Чувствительность ВВ к термическим воздействиям.......... 325
3. Чувствительность ВВ к детонационному импульсу........... 328
4. Эффективность начального импульса....................... 332
Глава VI. Ударные волны.............................................. 338
§ 1. Основные свойства ударных волн н механизм их возникновения 338
§ 2. Некоторые количественные соотношения между основными параметрами волны............................................... 346
§ 3. Основные факторы разрушающего действия ударных волн н элементы закона подобия при взрывах .......................... 349
§ 4. Изменение давления в ударной волне во времени............ 358
594
Оглавление
Стр.
§ 5. Расстояния, безопасные по действию ударной волны........ 362
§ 6. Расстояния, безопасные по передаче детонации............. 365
§ 7. Взаимодействие ударных волн с препятствием............... 367
§ 8. Ударные волны в воде..................................... 375
§ 9. Ударные волны в грунте................................... 377
Глава VII. Направление реакций взрывного превращения. (Состав и объем продуктов взрыва).............................................. 384
§ 1. Методы установления состава продуктов взрыва............. 384
§ 2. Расчет состава продуктов взрыва.......................... 386
1. Расчет состава продуктов взрыва ВВ с положительным кислородным балансом (группа I)......................... 387
2. Расчет состава продуктов взрыва ВВ с отрицательным кислородным балансом (группа II)........................ 390
§ 3. Экспериментальные методы определения состава продуктов взрыва ....................................................... 397
1. Общая характеристика методов и приборов................ 397
2. Экспериментальные данные............................... 398
§ 4. Объем продуктов взрыва................................... 407
Глава VIII. Теплота, температура и давление взрыва.................. 410
§ 1. .Методы определения теплоты взрывного превращения .... 410
1. Расчет теплоты взрыва.................................. 410
2. Расчет теплоты горения бездымных порохов............... 416
3. Расчет теплоты образования взрывчатого вещества .... 419
4. Расчет теплоты реакции получения взрывчатого вещества . 421
: 5. Экспериментальное определение теплоты взрыва ..... 422
§ 2. Температура горения и взрыва ............................ 425
1. Расчет температуры взрыва........................... . 426
2. Экспериментальное определение температуры взрывного превращения ................................................. 429
3. Выгорание ствола огнестрельного оружия при выстреле . . 430
§ 3. Давление взрыва.......................................... 432
1. Давление горения . .................................... 432
2. Расчет давления горения............................... 436
3. Опытное определение давления горения................... 442
Глава IX. Разрушающее действие взрыва.............................. 445
§ 1. Общие положения о работе взрыва.......................... 445
§ 2. Формы работы и баланс энергии при взрыве................. 454
§ 3. Экспериментальные методы определения общей работы взрыва 465
§ 4. Экспериментальные методы оценки бризантного и местного действия взрыва ................................................. 476
1. Оценка импульса местного действия взрыва............... 476
2. Оценка бризантного действия взрыва..................... 477
§ 5. Кумулятивное действие взрыва............................. 481
Оглавление 595
Стр.
Глава X. Теория предохранительных взрывчатых веществ................ 490
§ 1. Требования к ВВ для угольных шахт........................ 490
§ 2. Методы испытания предохранительных ВВ . ................. 492
§ 3. Механизм воспламенения метано-воздушной смеси при взрыве ВВ.......................................................... 497
1. Тепловая гипотеза механизма воспламенения .............. 497
2. Другие гипотезы о механизме воспламенения метано-воздушной смеси при взрыве взрывчатых веществ................... 499
§ 4. Воспламенение пыле-воздушных смесей при взрыве ВВ . . . . 506
§ 5. Принципы построения состава предохранительных ВВ .... 507
§ 6. Предохранительные оболочки и заменители ВВ при взрывных работах........................................................ 513
§ 7. Пламя при взрыве и выстреле.............................. 516
1. Пламя при взрыве........................................ 516
2. Дульное пламя при выстреле.............................. 524
3. Обратное пламя......................................... 525
Рекомендуемая литература....................................... 527
Приложения .................................................. 528
1. Пределы горючести смесей газов и паров с воздухом . . . 528
2. Пределы горючести смесей газов и паров с кислородом . . 531
5. Чувствительность ВВ при ударе......................... 532
4. Кислородный баланс некоторых взрывчатых веществ и компонентов взрывчатых смесей........................... 535
5. Теплоты образования различных взрывчатых веществ, исходных продуктов, компонентов взрывчатых смесей и продуктов взрыва ................................................... 538
6. Теплоты горения нитросоединений до COj, НзОж, N; при постоянном объеме и 25° С ................................ 562
7. Константы равновесия Кр для различных реакций и теплоты _ реакций при абсолютном нуле........................... 567
8. Изменение внутренней энергии газов и графита от 291° до
Т° К в ккал/мол......................................... 568
8а. Изменение внутренней энергии газов от 29Р до Т° К в ккал/мол............................................ 569
9. Изменение внутренней энергии ХЕ некоторых твердых компонентов продуктов взрыва от 291° до Т° К в ккал/мол . . . 570
10. Молярные объемы некоторых твердых неорганических веществ, встречающихся в продуктах взрыва.................... 571
11. Значения вторых вириальных коэффициентов b газообразных продуктов взрыва при высоких температурах.................. 571
12. Некоторые методы испытания ВВ и приборы для них, предусмотренные государственными общесоюзными стандартами 572'
38*
Константин Константинович Андреев и Александр Федорович Беляев
ТЕОРИЯ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
Издательский редактор Г. Ф. Лосева Техн, редактор Л. А. Карпухина
Т12631 Подписано в печать 7/X 1960 г. Учетно-изд. л. 38.47
Формат бумаги 60X92I/it>= 18,63 бум. л.—37,25 печ. л.
Пепа 14 р. 95 к. с 1 января 1961 г. цена 1 р. 50 к. Тираж 9000 экз. Зак. 193 1603
Типография Оборонгиза
Замеченные опечатки
Стр. Строка 1 Напечатано j Должно быть
10 19 сверху руд при взрыве dx , ' яри взрыве руд dx
80 5 сверху — = К3%- i at ~ = К& U.t
147 Табл. 4.7 в колонке 2 1 сверху 0,7 j 1 7,0
272 10 снизу линейно уменьшается 1 уменьшается
281 3 сверху к трению в приборчике ! с трению и в приборчике
283 439 4 сверху Формула (8.126) лишь небольшая часть ! I — giP i 1000 ! лишь часть пТ? 1— 1000
450 Подпись под фиг. 9.1 i 1 k
458 Шапка табл. 9.2 Коэффициент К j Qft>D ! Коэффициент К в кг /ж®
462 13 снизу t 1 Qfe i Г Qp®
462 12 снизу —— j Z ’ t
475 18 сверху изменением J
487 12 снизу {p -f- pa’ = const) i (p 4- p«J/2 = const)
539 В колонке 2 12 снизу Ci3HI3ON *
550 В колонке 2 7 сверху c4h?0o3n j C^HjOjN
153— Первый абзац на стр. 154 -следует читать непосредствен ио перед
154 текстом, напечатанным мелким шрифтом на стр. 153.