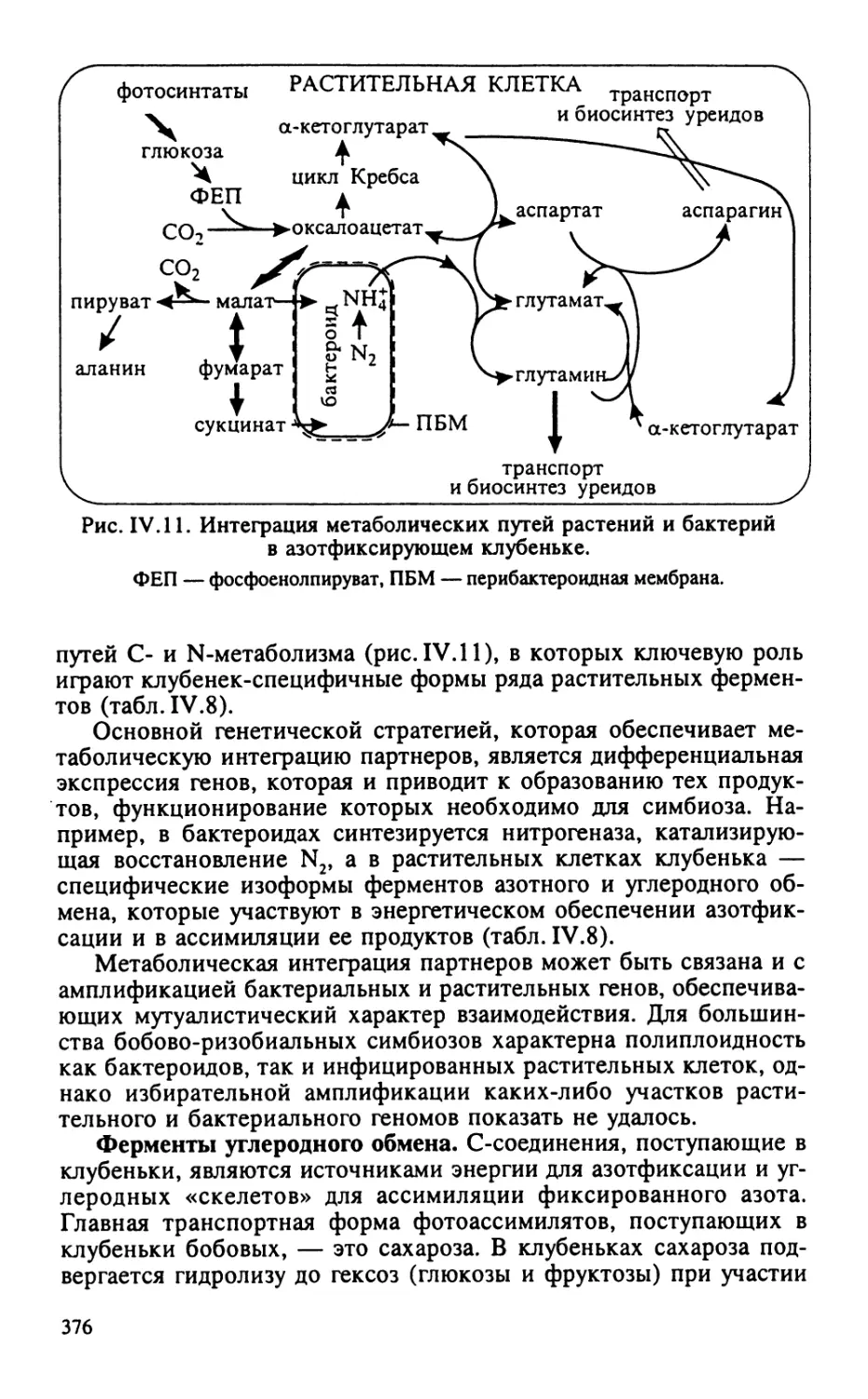
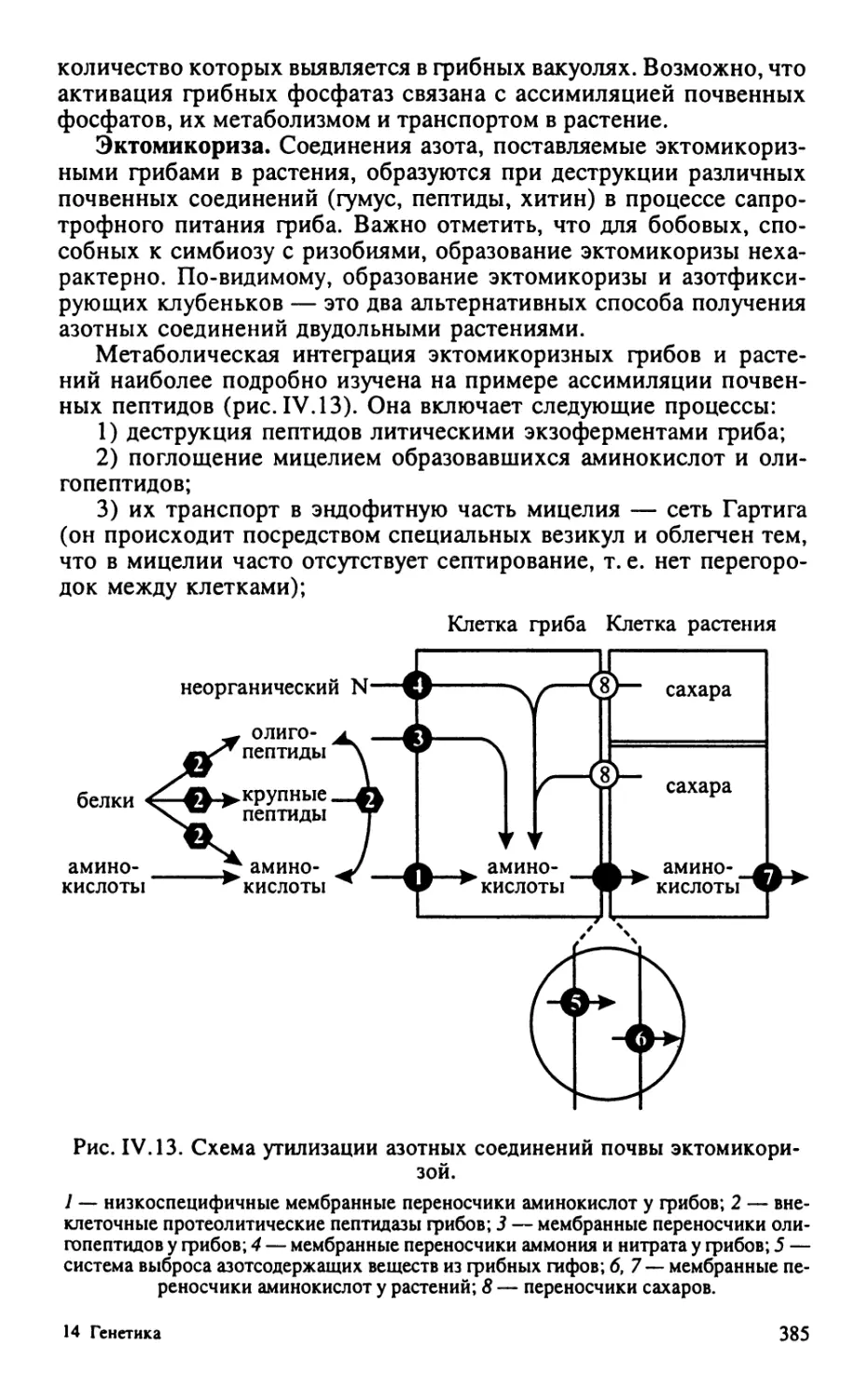
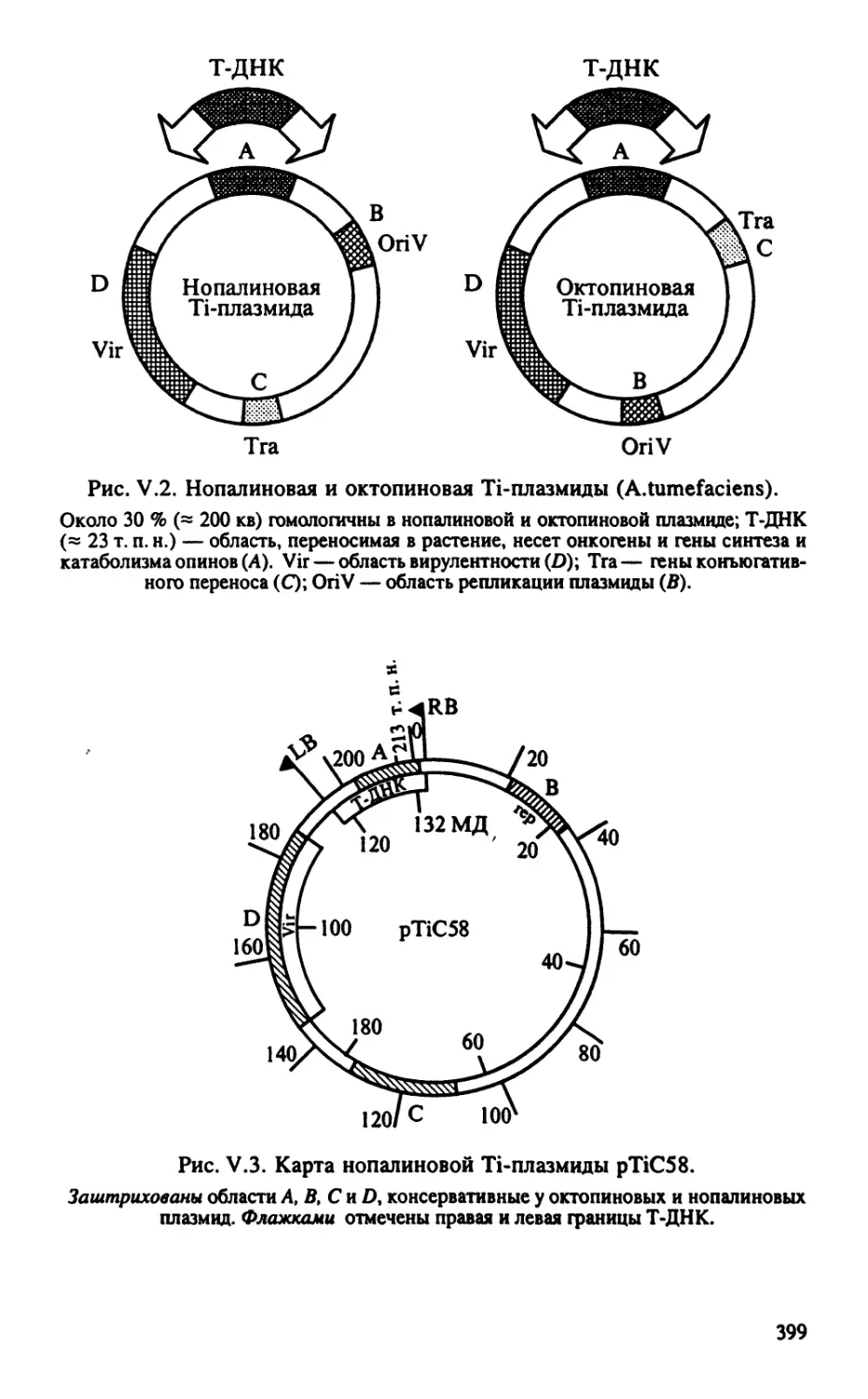
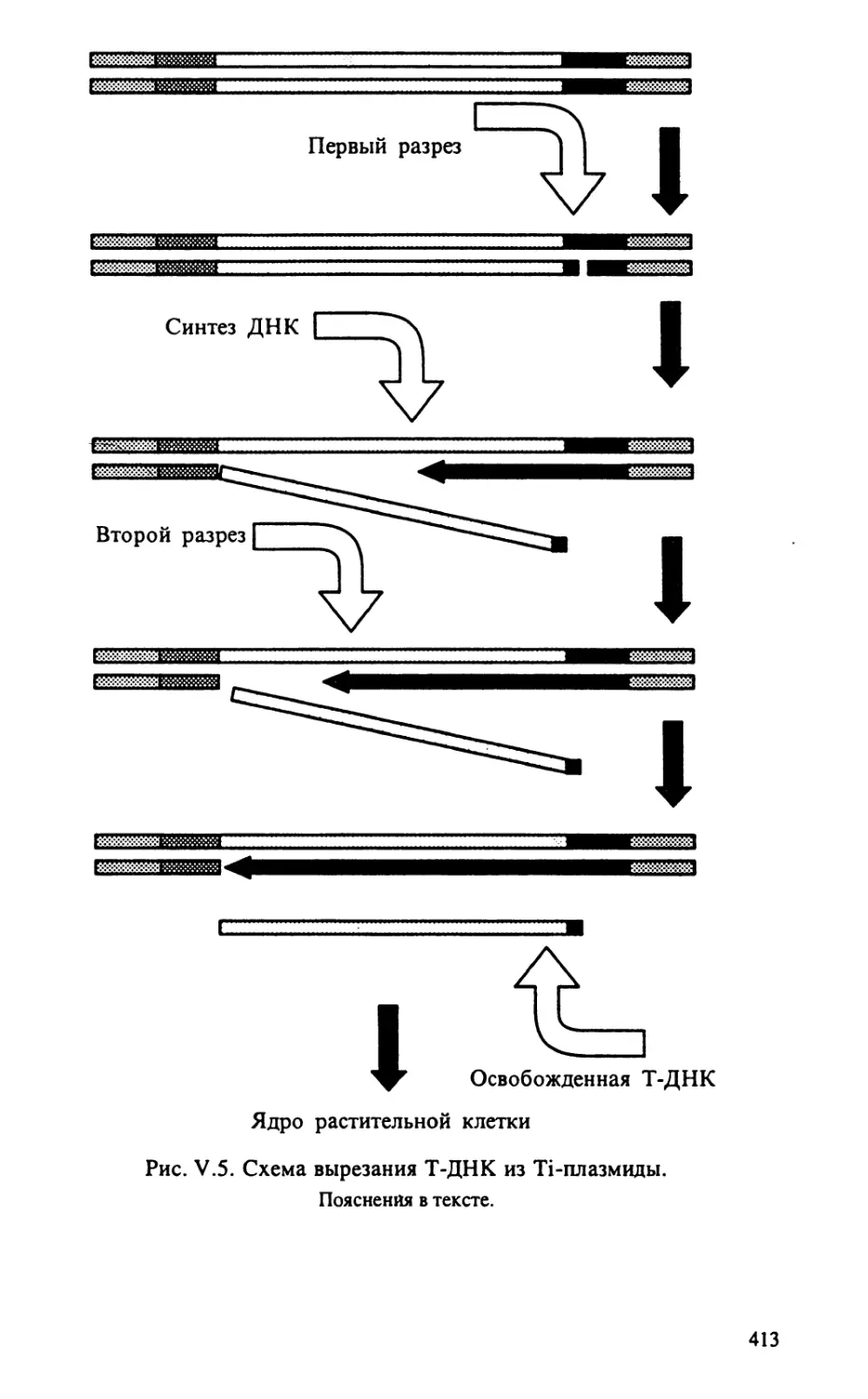
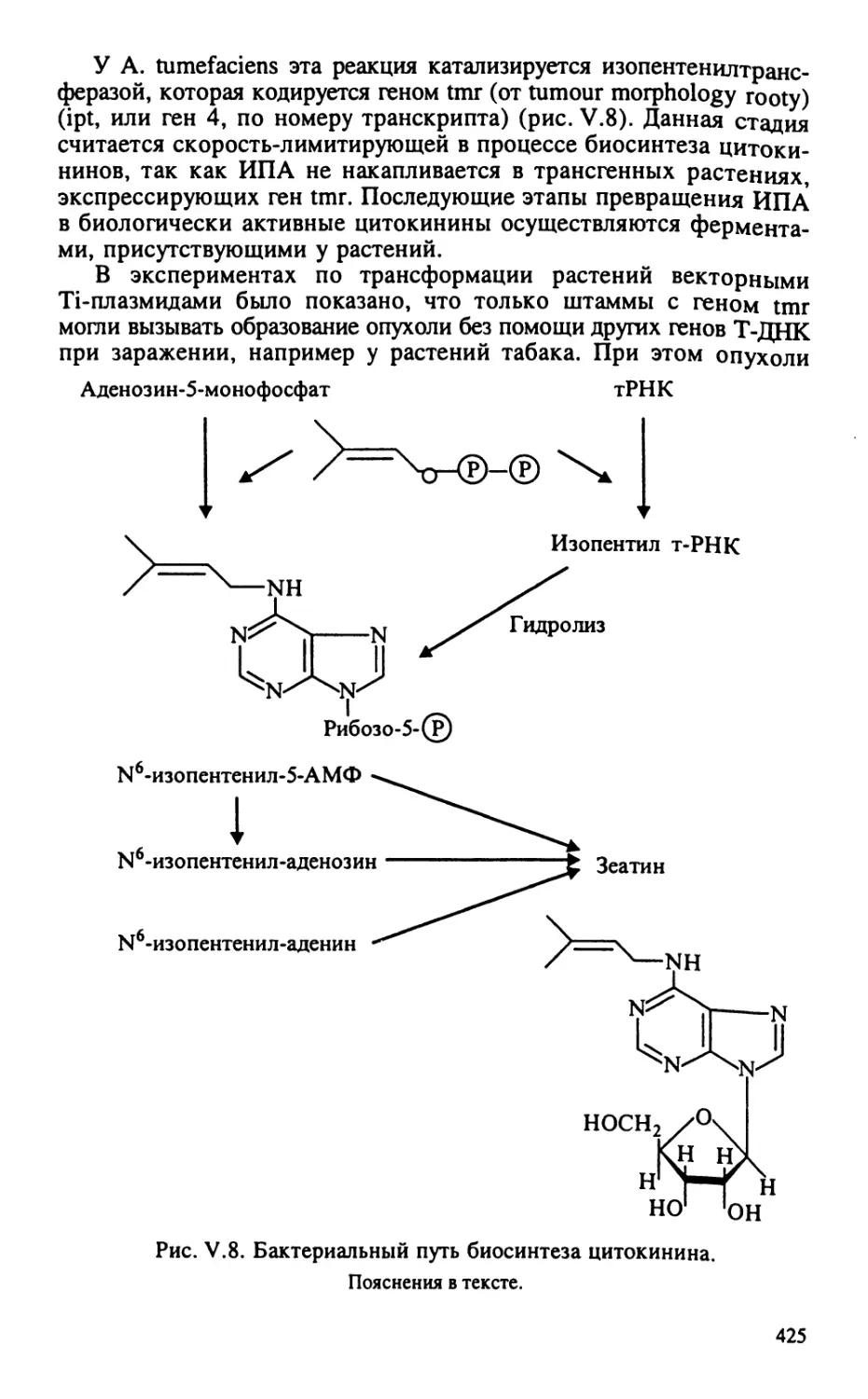
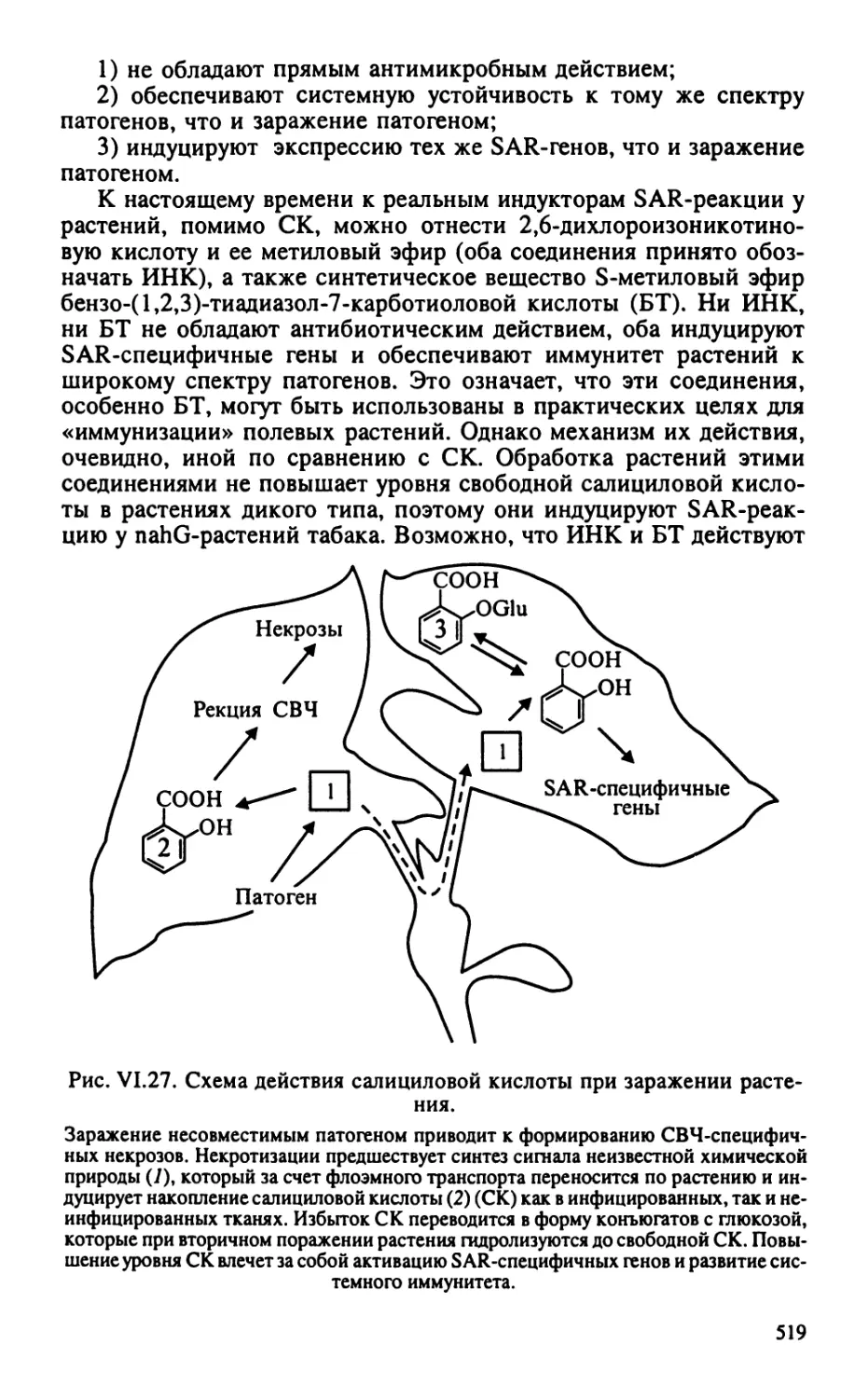
Автор: Тиходеев О.Н. Лутова Л.А. Проворов Н.А. Тихонович И.А. Ходжайова Л.Т. Шишкова С.О.
Теги: общая генетика общая цитогенетика иммуногенетика эволюционное учение видообразование филогенез ботаника растения
ISBN: 5-02-026136-Х
Год: 2000
ФЕДЕРАЛЬНАЯ ЦЕЛЕВАЯ ПРОГРАММА
«ГОСУДАРСТВЕННАЯ ПОДДЕРЖКА ИНТЕГРАЦИИ ВЫСШЕГО ОБРАЗОВАНИЯ
И ФУНДАМЕНТАЛЬНОЙ НАУКИ НА 1997-2000 ГОДЫ»
Л. А. ЛУТОВА, Н. А. ПРОВОРОВ, О. Н. ТИХОДЕЕВ,
И. А. ТИХОНОВИЧ, Л. Т. ХОДЖАЙОВА, С. О. ШИШКОВА
ГЕНЕТИКА
РАЗВИТИЯ
РАСТЕНИЙ
ФЕДЕРАЛЬНАЯ ЦЕЛЕВАЯ ПРОГРАММА
«ГОСУДАРСТВЕННАЯ ПОДДЕРЖКА ИНТЕГРАЦИИ ВЫСШЕГО ОБРАЗОВАНИЯ
И ФУНДАМЕНТАЛЬНОЙ НАУКИ НА 1997—2000 ГОДЫ»
Л. А. ЛУТОВА, Н. А. ПРОВОРОВ, О. Н. ТИХОДЕЕВ,
И. А. ТИХОНОВИЧ, Л. Т. ХОДЖАЙОВА, С. О. ШИШКОВА
ГЕНЕТИКА
РАЗВИТИЯ
РАСТЕНИЙ
Под редакцией чл.-кор. РАН
С. Г. Инге-Вечтомова
Рекомендовано Министерством образования
Российской Федерации в качестве учебника
для студентов высших учебных заведений,
обучающихся по специальностям «Ботаника»,
«Генетика»
в
Санкт-Петербург
“Наука”
2000
УДК 575.24 : 633.358, 575.16 : 581.462, 575.154, 631.847.21 : 576.6 + 575 + 631.52
ББК 28.54
Г 29
Лутова Л. А., Проворов Н.А., Тиходеев О. Н., Тихонович И. А., Ходжайова Л.Т.,
Шишкова С. О. Генетика развития растений / Под ред. чл.-кор. РАН С. Г. Инге-Веч-
томова. — СПб.: Наука, 2000. — 539 с.
ISBN 5-02-026136-Х
Настоящий учебник является первым пособием на русском языке, целиком посвя-
щенным генетике развития растений. В книге изложены современные представления о
закономерностях морфогенеза и клеточной дифференцировки растений. Материал
учебника представлен в виде 6 частей. Первая часть посвящена структурно-функцио-
нальным особенностям геномов растений. Во второй части подробно рассматривается
генетический контроль онтогенеза высших растений. Третья часть учебника посвящена
молекулярно-генетическим основам гормональной и световой регуляции развития расте-
ний. В четвертой части основное внимание уделено генетическим аспектам симбиоген-
ной регуляции развития, характерной для взаимодействия растений с азотфиксирующи-
ми бактериями и микоризообразующими грибами. Пятая часть учебника посвящена мо-
лекулярно-генетическим основам различных морфогенетических эффектов (в том числе
опухолеобразования), наблюдающихся при взаимодействии между растениями и агро-
бактериями. Наконец, в шестой части рассматриваются вопросы взаимодействия расте-
ний с фитопатогенными микроорганизмами. Учебник предназначен для студентов и ас-
пирантов биологических, педагогических и сельскохозяйственных вузов, а также для
научных сотрудников, интересующихся генетикой и биологией развития растений.
Ил. 156. Табл. 65.
Lutova L. A., Provorov N. A., Tikhodeev О. N., Tikhonovich I. A., Khodaiova L. Т., Shi-
shkova S. О. Genetics of plant development I Ed. Inge-Vechtomov. — St. Petersburg:
Nauka, 2000. — 539 p.
The present textbook is the first example of Russian educating literature especially
devoted to developmental genetics of plants. In this textbook, the modem views on basic
processes in plant morphogenesis and cellular differentiation are presented. The textbook is
subdivided into 6 parts. The first part is devoted to structural and functional specificities of
plant genomes. In the second part, the details of genetic control of plant ontogenesis are
observed. The third part of the textbook is devoted (o molecular genetic basis of hormonal
and light-induced regulation of plant development. In the forth part, the main attention is
paid to genetic aspects of symbiogenic development in cases of plant interaction with
nitrogen fixing bacteria and mycorrhiza forming fungi. The fifth part of the textbook is
devoted to molecular genetic basis of various morphogenetic events (including formation of
tumors) resulting from plant interaction with agrobacteria. Finally, in the sixth part, the
processes of plant interaction with phytopatogenic microorganisms are observed. This text-
book is devoted to graduate and PhD students of biological, pedagogical and agricultural
faculties as well as to all specialists interested in modem genetics and developmental biology
of plants.
Ill. 156. Table 65.
Рецензенты:
доктор биологических наук, профессор, зав. Лабораторией
НИИ физиологии растений О. Н. КУЛАЕВА,
чл.-кор. РАН, зав. каф. генетики МГУ С. В. ШЕСТАКОВ
Издание осуществлено при финансовой поддержке Федеральной целевой про-
граммы «Государственная поддержка интеграции высшего образования и фунда-
ментальной науки на 1997—2000 годы»
Без объявления
ISBN 5-02-026136-Х © Центр «Интеграция», 2000
ПРЕДИСЛОВИЕ
Генетика развития растений является одним из наиболее бурно
развивающихся направлений современной генетики, которое имеет
огромное фундаментальное и прикладное значение. В настоящее
время в ряде отечественных вузов биологического и сельскохозяй-
ственного профиля осуществляется подготовка специалистов для
работы в различных областях биологии и генетики развития рас-
тений, однако учебная литература на русском языке по данным
вопросам практически полностью отсутствует. Этим и объясняет-
ся выпуск учебника по генетике развития растений. Авторы пре-
красно понимают, что изложенный материал «устаревает» и каж-
дый день появляются все новые и новые факты. Однако авторы
считают, что изложенный в учебнике материал может стать осно-
вой для пополнения знаний в столь бурно развивающейся области
генетики.
Учебник подготовлен коллективом преподавателей, работаю-
щих в Санкт-Петербургском государственном университете. Авто-
ры учебника имеют большой опыт преподавательской и научно-
исследовательской работы в различных областях биологии и гене-
тики развития растений. В учебнике изложены современные
представления о закономерностях морфогенеза и дифференциров-
ки, о молекулярно-генетических механизмах развития растений.
Учебник состоит из шести частей.
В первой части («Особенности генетического материала расте-
ний») подробно рассмотрена структурно-функциональная орга-
низация генома растений: организация растительных генов, осо-
бенности их транскрипции и трансляции, дифференциальная ре-
гуляция генной активности. Достаточно подробно представлены
данные о структурных генах растений и генетических элементах,
обеспечивающих стабильность и динамику генома (т. е. центроме-
рах, теломерах, мобильных генетических элементах, сателлитных
ДНК и т. д.).
Вторая часть книги («Генетические основы развития растений
от семени до семени») посвящена генетике онтогенеза высших
растений. Рассмотрены закономерности эмбрионального развития,
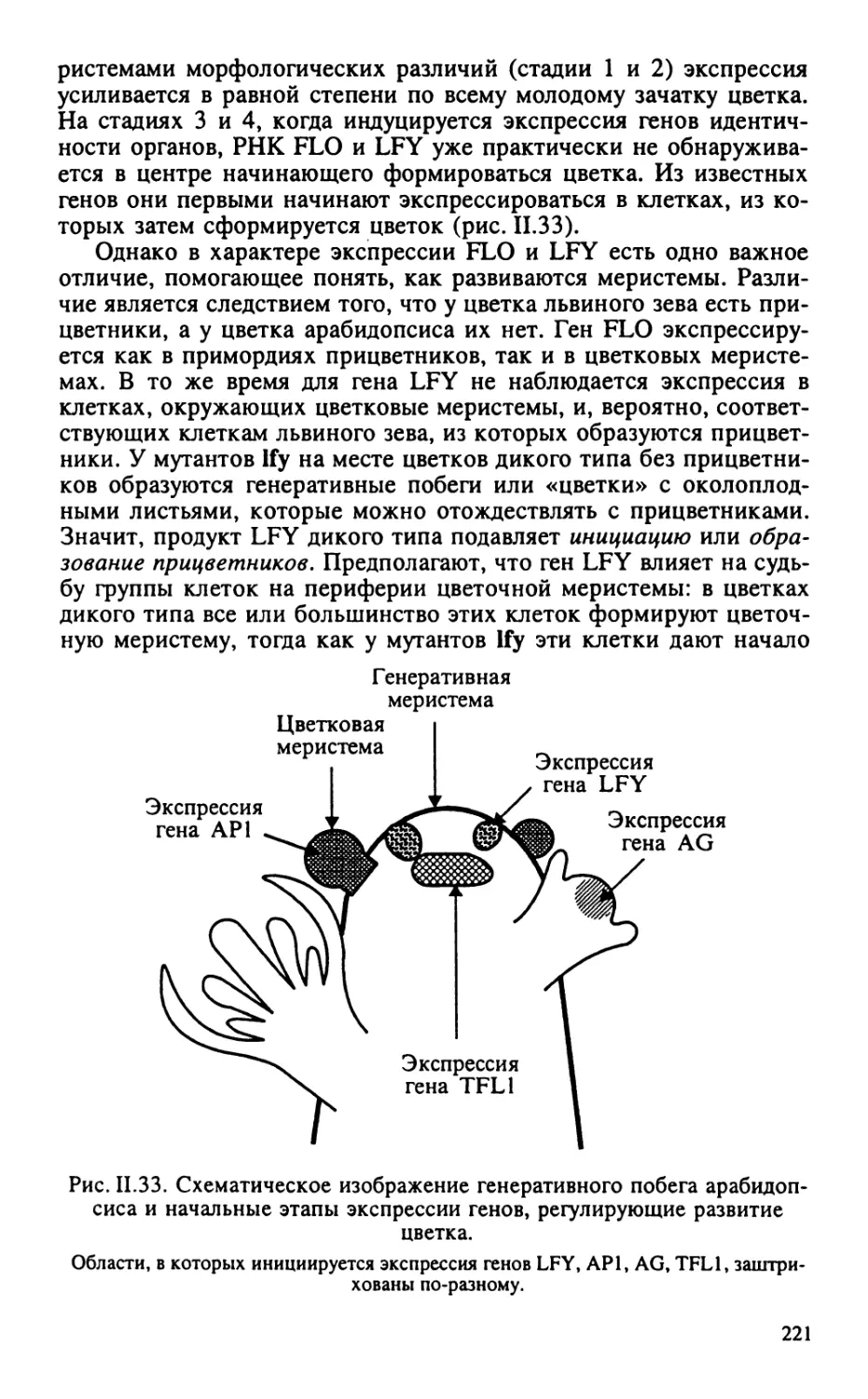
формирования меристем, морфогенез листьев, цветков и корней.
Подробно дана информация о растительных мутантах с нарушени-
3
ями развития различных органов. Большое внимание уделено раз-
витию цветка как наиболее полно разработанной модели генетики
развития.
В третьей части учебника («Сигнальная регуляция развития
растений») рассмотрена гормональная и световая регуляция раз-
вития растений. Описаны мутанты по синтезу и рецепции ос-
новных гормонов (ауксины, цитокинины, гибберелины, этилен),
обобщены сведения о структуре и механизмах экспрессии со-
ответствующих генов. Рассмотрен отдельно генетический конт-
роль трех программ биологического ответа на свет: фототро-
пизма, фотопериодизма и собственно фотоморфогенетического
ответа.
Четвертая часть книги («Мутуалистические симбиозы») посвя-
щена симбиогенной регуляции развития, которая осуществляется
при взаимодействиях растений с микроорганизмами. Включение
этого раздела в учебник по генетике развития растений вполне
оправдано, так как взаимодействия с микробами не только играют
огромную роль в жизни растений, но и открывают уникальные воз-
можности для разработки многих направлений их генетики. Сим-
биозы с микробами, как и система развития растений, базируются
на дифференциальной экспрессии растительных генов. Однако в
случае растительно-микробных взаимодействий эта экспрессия ре-
гулируется сигналами, поступающими в растения от партнера, а
значит, образование и действие сигналов могут быть относительно
легко изучены в лабораторных условиях.
В пятой части («Взаимодействие растений с агробактериями:
концепция генетической колонизации») описана хорошо изучен-
ная модель «агробактерия—растение», которая позволяет направ-
ленно изменять гормональный метаболизм растения и изучать
роль ауксина и цитокинина в развитии растений в целом, а также
экспрессию генов, регулируемых гормонами. Здесь рассмотрены
системы трансформации растений Ti- и Ri-плазмидами Agrobacte-
rium и особенности дифференциальной экспрессии бактериаль-
ных и растительных генов.
В шестой части учебника («Молекулярная генетика взаимодей-
ствия высших растений с фитопатогенными микроорганизмами»)
рассмотрены традиционные фитопаразитарные взаимодействия:
молекулярная генетика взаимодействия высших растений с фито-
патогенными микроорганизмами, механизмы устойчивости расте-
ний к патогенам, видовой иммунитет, специфическая устойчи-
вость и восприимчивость растений.
Учебник написан на основе курсов лекций, которые авторы
читают уже много лет на кафедре генетики и селекции СПбГУ.
Это «Генетика развития растений», «Симбиогенетика», «Эволю-
ционно-генетические аспекты микробно-растительных взаимодей-
ствий», «Молекулярная генетика растений», «Молекулярно-гене-
тические аспекты устойчивости растений к вредителям сельского
хозяйства».
4
Учебник предназначен в первую очередь для студентов и аспи-
рантов биологических факультетов, педагогических и сельскохо-
зяйственных вузов, а также для научных сотрудников, работающих
в области генетики растений.
Авторы будут весьма признательны всем, кто выскажет поже-
лания и критические замечания по содержанию этого учебника.
Авторы приносят особую благодарность И. М. Трифоновой и
3. А. Руденко за помощь при подготовке книги к печати.
ВВЕДЕНИЕ
Современное состояние биологии характеризуется бурным пе-
реходом от описательного отражения действительности к расшиф-
ровке конкретных закономерностей, лежащих в основе живой
природы. При этом традиционные биологические вопросы типа
«как выглядит объект?» и «что с ним происходит?» сменились
на совершенно новые — «почему он выглядит именно так?» и
«как он функционирует?».
Безусловно, попытки ответить на эти вопросы неоднократно
предпринимались и раньше. Однако по-настоящему возможным это
стало лишь с пониманием того, что каждое проявление жизни,
каким бы сложным оно не казалось, является в конечном итоге ре-
зультатом функционирования определенных молекул при всем мно-
гообразии их взаимодействий. Современная наука располагает всего
лишь двумя прямыми подходами, позволяющими исследовать био-
логические функции молекул. Первый подход заключается в анали-
зе последствий, вызванных инактивацией определенных молекул
организма (этого можно достичь, либо используя узко специфичные
ингибиторы, либо получая мутации, нарушающие нормальный био-
синтез именно данных молекул). Напротив, альтернативный подход
предполагает увеличение активности исследуемых молекул либо
при их добавлении извне, либо за счет усиления их биосинтеза in
vivo (например, в случае трансформации организма дополнительны-
ми копиями соответствующего гена). При этом, независимо от вы-
бранного подхода, основную роль в таких исследованиях играют ме-
тоды молекулярной биологии и генетики. Именно по этой причине
синтез молекулярно биологического и генетического подходов, по-
лучивший название молекулярная генетика, стал ведущей идеоло-
гией большинства направлений современной биологии.
Одним из таких направлений является биология развития. Если
в своем первоначальном виде эта наука сформировалась на стыке
эмбриологии, физиологии и цитологии, то именно использование
молекулярно-генетических подходов позволяет успешно расчле-
нять сложнейшие процессы развития на множество «элементар-
ных» стадий, каждая из которых обслуживается строго определен-
ными молекулами и контролируется особой группой генов. Так, в
последнее время достигнут впечатляющий прогресс в понимании
6
молекулярных механизмов развития многоклеточных животных. В
частности, уже сегодня эти успехи позволили решить центральную
проблему биологии развития: каким же образом многократное де-
ление всего одной исходной клетки (или нескольких клеток оди-
накового генотипа) приводит к формированию взрослого организ-
ма, обладающего сложнейшей системой взаимосвязанных тканей и
органов? Ответом на этот вопрос явилась концепция дифференци-
альной экспрессии генов, в соответствии с которой в различных
клетках развивающегося организма экспрессируются разные гены.
Именно дифференциальная экспрессия генов служит причиной
постепенного появления структурно-функциональных различий
между разными клетками одного и того же организма (данное яв-
ление принято называть клеточной дифференцировкой).
Не вызывает сомнений, что эта концепция полностью справед-
лива и в случае высших растений. Однако по сравнению с живот-
ными все высшие растения характеризуются целым рядом отличи-
тельных черт и в первую очередь наличием клеточных стенок,
обусловливающих относительную неподвижность организма. Дей-
ствительно, являясь прочной механической защитой, целлюлозные
клеточные стенки резко ограничивают подвижность каждой расти-
тельной клетки и вынуждают организм пассивно приспосабливать-
ся к условиям окружающей среды. Таким образом, в отличие от
животных, не защищенных клеточными стенками, но способных
активно реагировать на изменение внешних условий (например,
быстро «уходить» от неблагоприятного воздействия или, напро-
тив, нападать на его источник), растения избрали принципиально
иную жизненную стратегию. Одной из ярчайших сторон этой стра-
тегии служит высокая способность к регенерации, т. е. к восста-
новлению всего организма при утрате его значительных частей. В
основе подобного явления лежит целый ряд характерных особен-
ностей растений, в частности:
1. Каждое высшее растение представляет собой систему осевых
структур (корней и/или побегов), потенциально способных к без-
граничному росту. Эта способность обеспечивается апикальными
меристемами (т. е. группами интенсивно делящихся недифферен-
цированных клеток), располагающимися на вершине каждой из
осевых структур. Следует подчеркнуть, что при соблюдении бла-
гоприятных условий апикальные меристемы растения обеспечива-
ют не только постоянное удлинение соответствующих осевых
структур, но и надлежащий морфогенез (т. е. образование специа-
лизированных органов, таких как почки, листья, цветки, плоды,
семена, видоизмененные подземные побеги и т. п.).
2. По ходу своего развития каждое высшее растение формиру-
ет систему дополнительных меристем (в частности, пазушных,
вставочных и т. п.), временно находящихся на стадии покоя, но
способных преобразовываться в апикальные. Именно эти покоя-
щиеся меристемы обеспечивают высокую способность растений к
регенерации, а также к вегетативному размножению.
7
3. Наконец, некоторые дифференцированные клетки растений
могут опять превращаться в меристематические с последующим
образованием новых очагов деления и роста (данный процесс при-
нято называть дедифференцировкой). Таким образом, даже диффе-
ренцированная растительная клетка, как правило, не утрачивает
способности «возвращаться» к состоянию зиготы и в этом смысле
может считаться тотипотентной (т. е. сохраняющей потенции к
формированию всего организма). Между тем у высоко организо-
ванных животных исходная тотипотентность клеток обычно утра-
чивается уже на ранних этапах развития. Особенно ярко это про-
слеживается в случае организмов с детерминированным дроблени-
ем зиготы (в частности, у круглых червей и членистоногих).
Итак, учитывая значительное своеобразие высших растений,
правомочно поставить следующий вопрос: существуют ли некие
особенности клеточной дифференцировки или морфогенеза, ха-
рактерные только для данной группы эукариот? В этом плане мо-
лекулярная генетика развития растений несомненно представляет
не только фундаментальный, но и огромный практический инте-
рес.
За свою более чем 200-летнюю историю биология развития вы-
сших растений прошла через несколько этапов, отражающих по-
степенную эволюцию взглядов на существо изучаемой проблемы.
Так, на первом из этих этапов практически все внимание уде-
лялось лишь общему описанию развития высших растений приме-
нительно к конкретным видам или более крупным таксономичес-
ким единицам.
В дальнейшем, с началом второго этапа, основные интересы
исследователей были переключены на анализ разнообразных
внешних факторов (таких как освещенность, температура, хими-
ческий состав окружающей среды и т. п.), оказывающих сущест-
венное влияние на развитие растений.
Центральным событием третьего этапа стало обнаружение эн-
догенных соединений, осуществляющих регуляцию развития орга-
низма (в случае растений подобные вещества были названы фито-
гормонами). На этом этапе неоднократно предпринимались по-
пытки объяснить все закономерности развития растений именно
за счет особенностей функционирования фитогормональных сис-
тем.
Начало четвертого этапа было ознаменовано выявлением от-
дельных мутаций, не затрагивающих фитогормональную систему,
но заметно влияющих на процессы развития растения. Эти данные
убедительно свидетельствовали о том, что по меньшей мере неко-
торые процессы развития контролируются у высших растений не
только фитогормональной системой, но и определенными генами.
Впрочем, никаких представлений о конкретной роли подобных
генов еще сформулировано не было.
Наконец, современный (пятый) этап оперирует уже не отдель-
ными генами, а так называемыми генетическими программами
8
развития. Каждая такая программа представляет собой определен-
ную последовательность из многочисленных «элементарных» со-
бытий, лежащих в основе морфогенеза или же клеточной диффе-
ренцировки. При этом любое из рассматриваемых событий (други-
ми словами — любой молекулярный процесс в составе отдельной
программы развития) является закономерным результатом пре-
дыдущего и служит непосредственной причиной последующего.
Таким образом, каждую подобную программу можно рассматри-
вать в качестве конкретной причинной основы закономерного раз-
вития организма.
Концепция генетических программ развития тесно переклика-
ется с современными представлениями о молекулярных механиз-
мах биологического ответа. Действительно, каждая программа
развития запускается определенным сигналом и обеспечивает
адекватную реакцию организма (так, интенсивное формирование
листовых пластинок служит ответом на восприятие света красного
или синего диапазона). В соответствии с этим любая подобная
программа должна опираться на следующие компоненты.
1. Рецепторные молекулы, воспринимающие определен-
ный сигнал химической или физической природы. Подобными сиг-
налами могут служить наличие (или отсутствие) неких молекул или
ионов, повышенная или пониженная температура, наличие излуче-
ний конкретного диапазона, направление силы тяжести и т. п. Фун-
кцию рецепторных молекул обеспечивают особые белки, специфи-
чески распознающие именно данный сигнал (в некоторых случаях
такие белки содержат вспомогательные низкомолекулярные остат-
ки). При этом универсальным свойством всех рецепторных молекул
является их способность менять свою конформацию в ответ на вос-
приятие сигнала. Подобное изменение приводит к активации рецеп-
торной молекулы и запуску соответствующей программы.
2. Система передачи воспринятого сигнала. Чаще
всего рецепторные молекулы достаточно удалены от области реа-
лизации ответа, а потому передача воспринятого сигнала, как пра-
вило, осуществляется каскадной системой молекул-посредников.
Подобными молекулами могут служить определенные белки (на-
пример, протеин-киназы), некоторые низкомолекулярные соеди-
нения, а также ионы. Следует особо отметить, что в случае пере-
дачи сигнала на очень большие расстояния (например, от корня к
побегам или наоборот) наиболее удобными посредниками являют-
ся именно низкомолекулярные соединения, способные быстро
диффундировать или переноситься по соответствующим проводя-
щим пучкам. В частности, к числу таких соединений относятся и
все фитогормоны.
3. Молекулы, непосредственно обеспечивающие
реализацию ответа на сигнал. В реализацию любого био-
логического ответа, как правило, вовлечено большое разнообразие
молекул. Так, одним из ответов на интенсивное освещение являет-
ся биогенез хлоропластов с формированием широкого спектра
9
молекулярных комплексов, непосредственно обслуживающих про-
цесс фотосинтеза. Однако во многих случаях большинство соот-
ветствующих молекул пока остается неизвестным.
Рассмотрим более подробно основные закономерности заверша-
ющего этапа программы. Дело в том, что ключевая роль в реали-
зации любого биологического ответа принадлежит определенным
белкам, начинающим (или же прекращающим) функционировать
только при появлении определенного сигнала. В основе подобной
ситуации могут лежать два разных механизма. Так, если необходи-
мые для ответа белковые молекулы присутствуют у живого объекта
еще до поступления сигнала, то в этом случае они должны быть ис-
ходно неактивными. Между тем при восприятии сигнала происхо-
дит активация подобных белков (чаще всего за счет их специфичес-
кого фосфорилирования или же дефосфорилирования) с запуском
надлежащих ответных реакций. Следует подчеркнуть, что такие
процессы, связанные с модификацией уже имеющихся белковых
молекул, могут происходить очень быстро (например, всего за не-
сколько секунд), в результате чего рассмотренная нами схема полу-
чила название быстрого биологического ответа.
В альтернативном случае необходимые для ответа белки синте-
зируются в организме только при восприятии сигнала. В каждой
подобной ситуации происходит дифференциальная экспрессия генов,
которая у большинства эукариотических объектов (в том числе и
у растений) регулируется преимущественно на уровне транскрип-
ции. Между тем транскрипционная регуляция экспрессии требует
более длительных промежутков времени (нескольких минут, часов
или даже дней), а потому обусловливает медленные биологические
ответы. В соответствии со своей жизненной стратегией все вы-
сшие растения преимущественно используют именно этот меха-
низм. Таким образом, любая генетическая программа развития
включает у высших растений хотя бы несколько транскрипционно
регулируемых стадий.
Многие программы развития запускаются у высших растений
разнообразными внешними сигналами. Если одни из подобных
сигналов имеют абиотическую природу (например, свет, темпера-
тура, направление силы тяжести и т. п.), то другие обусловлены
взаимодействием с окружающими живыми объектами. Именно
последняя группа сигналов (и соответствующих программ разви-
тия) представляет особый интерес. Действительно, в этом случае
можно с уверенностью говорить о том, что каждая рассматривае-
мая программа развития контролируется генетическими системами
обоих взаимодействующих организмов. В частности, к програм-
мам такого рода следует отнести:
1. Опухолевую трансформацию растительных клеток в
результате их взаимодействия с агробактериями.
2. Стрессовую реакцию растения на разнообразные пов-
реждения, вызванные вредителями (членистоногими, нематодами и
т. п.) или патогенными микроорганизмами.
10
3. Формирование азотфиксирующих клубеньков в
случае взаимодействия бобовых растений с соответствующими
бактериями.
4. Образование арбускулярных микориз при взаи-
модействии растения с определенными грибами.
Таким образом, современная биология развития растений не-
посредственно связана с новым и весьма перспективным направ-
лением, получившим название экологическая генетика. При этом
особого внимания заслуживают генетические программы, обеспе-
чивающие образование симбиозов (в частности, микориз или азот-
фиксирующих клубеньков). Дело в том, что подобные программы
служат примерами тесной совместной эволюции, в результате ко-
торой представители различных царств (т. е. растения и микориз-
ные грибы или же растения и азотфиксирующие бактерии) полу-
чили возможность временно интегрировать свои метаболические
системы в новые надорганизменные структуры. Следует отметить,
что аналогичные процессы послужили основой симбиотического
происхождения эукариот. Таким образом, всестороннее развитие
симбиогенетики позволяет исследовать не только конкретные
программы развития, но и фундаментальные закономерности эво-
люционного процесса.
ОСНОВНЫЕ ТЕРМИНЫ и понятия
В ГЕНЕТИКЕ РАЗВИТИЯ РАСТЕНИЙ
Онтогенез (индивидуальное развитие, от греч. ontos — суще-
ство и лат. genesis — происхождение) растения — это естествен-
ный процесс с последовательной сменой нескольких возрастных
этапов, среди которых принято выделять:
1. Эмбриональный — от зиготы до созревания семени (вклю-
чительно).
2. Ювенильный — от прорастания семени до начала фор-
мирования репродуктивных органов.
3. Зрелость и размножение —закладка и развитие реп-
родуктивных органов, образование семян и плодов.
4. Старость и отмирание.
В онтогенезе реализуются потенции генотипа в определенных
условиях среды, в результате чего формируются растения опреде-
ленного фенотипа.
Онтогенез растения включает в себя два существенных аспекта:
собственно жизнь особи (она начинается со стадии зиготы и про-
должается вплоть до естественной смерти) и воспроизведение
новых особей (также начинается с зиготы, но заканчивается фор-
мированием гамет).
В процессе эволюции у высших растений произошло простран-
ственное совмещение гапло- и диплофаз в одном организме: гаме-
тофит развивается прямо на спорофите. Этот момент очень важен,
И
поскольку спорофит имеет собственную эффективную систему за-
щиты, за счет чего защищенным становится и гаметофит.
Понятие рост характеризует необратимые количественные из-
менения, происходящие во время развития организма. Однако в
процессе развития организма наряду с количественными измене-
ниями происходят и разные качественные, для описания которых
часто используют термин дифференцировка. Дифференцировка
может осуществляться на клеточном, тканевом и органном уров-
нях. В последнем случае принято говорить о явлении морфогенеза.
Морфогенез — это процесс формообразования, т. е. закладки,
роста и развития органов растения. Таким образом, дифференци-
ровка, рост и морфогенез являются тесно взаимосвязанными про-
цессами.
Известны многочисленные случаи, когда дифференцировка
приводит к необратимому изменению клеток. Этот процесс назы-
вают детерминацией.
ЛИТЕРАТУРА
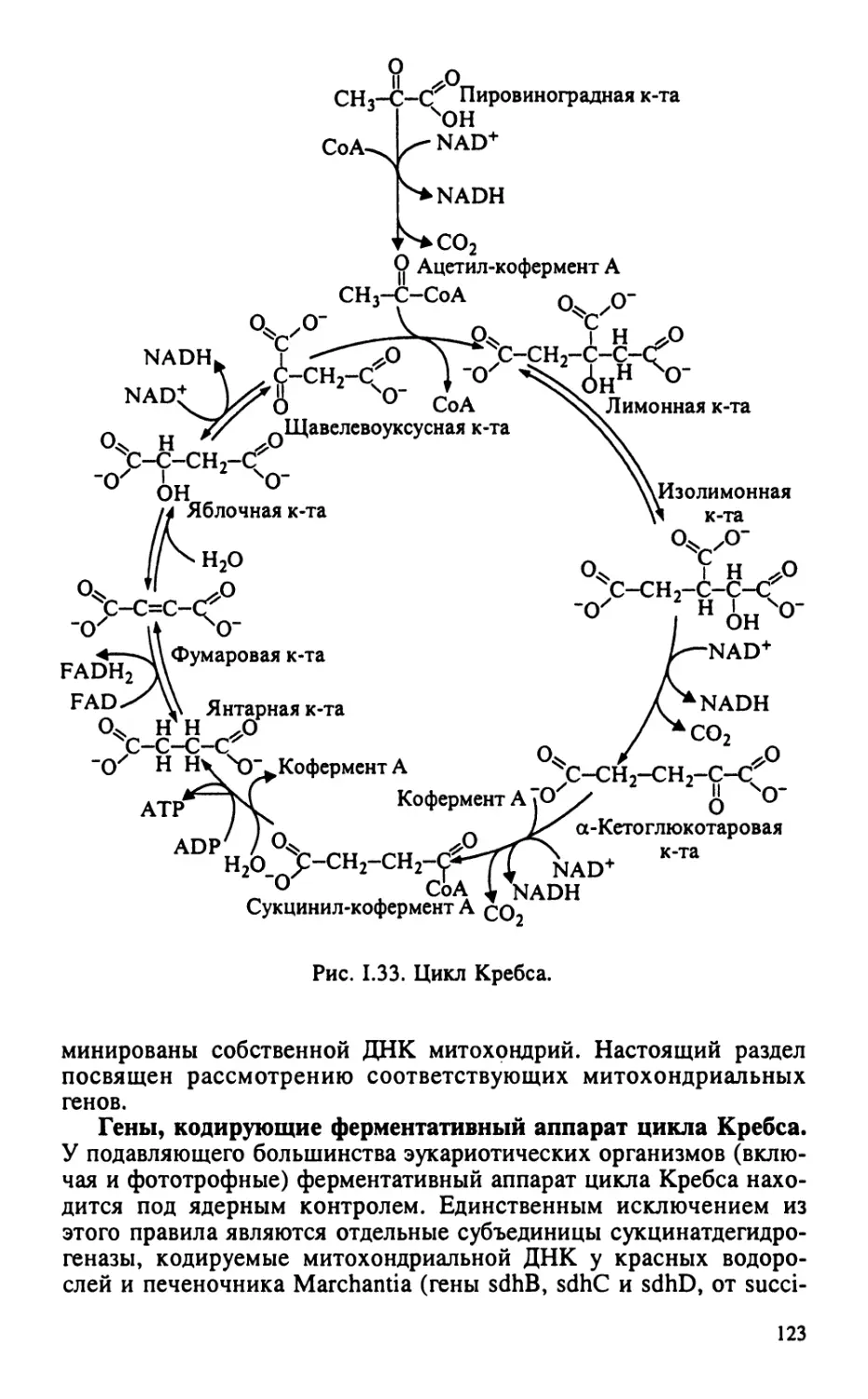
Биология развития (в трех томах). М.: Мир, 1994.
Инге-Вечтомов С. Г. Генетика с основами селекции. М.: Высшая школа, 1989.
592 с.
Льюин Б. Гены. М.: Мир, 1987.
Молекулярная биология клетки (в трех томах). М.: Мир, 1994. Т. 1. 516 с.; Т. 2.
540 с.; Т. 3. 504 с.
Полевой В. В. Физиология растений. М.: Высшая школа, 1989. 464 с.
Уоринг Ф., Филлипс И. Рост растений и дифференцировка. М.: Мир, 1984. 512 с.
ЧАСТЬ I
ОСОБЕННОСТИ ОРГАНИЗАЦИИ
И ЭКСПРЕССИИ ГЕНЕТИЧЕСКОГО
МАТЕРИАЛА РАСТЕНИЙ
Являясь в подавляющем большинстве фототрофными организ-
мами, растения содержат в своих клетках не только характерные
для эукариот ядро и митохондрии, но и пластиды — специфичес-
кий тип органелл, непосредственно участвующих в процессе фото-
синтеза. В соответствии с этим растительная клетка совмещает в
себе три относительно автономные генетические системы (хромо-
сомную, митохондриальную и пластидную ДНК), тесно взаимодей-
ствующие друг с другом в контроле обмена веществ. Подобная си-
туация отражает симбиотическое происхождение растительных
клеток по меньшей мере из трех исходно самостоятельных форм:
1) гипотетического «хозяйского» организма, генетический ап-
парат которого постепенно преобразовался в ядро;
2) гетеротрофной бактерии (по-видимому, родоспириллы),
послужившей предшественником митохондрий;
3) цианобактерии, ставшей родоначальником пластид.
Длительная совместная эволюция вышеперечисленных симби-
онтов привела к существенному перераспределению функций
между их генетическими системами и сопровождалась переносом
многих генов из митохондриальной и пластидной ДНК в ядро. В
результате этих процессов генетический аппарат ядра постепенно
приобрел ярко выраженные эукариотические особенности, в то
время как митохондрии и пластиды сохранили целый ряд черт,
свойственных исходным прокариотам. В соответствии с этим
краткий обзор генетического материала растительной клетки
будет проведен по отдельности для каждого из трех типов ее ДНК-
содержащих органелл.
13
Глава l.l
ЯДЕРНЫЙ ГЕНЕТИЧЕСКИЙ МАТЕРИАЛ РАСТЕНИЙ
Ядерная ДНК растений представлена линейными молекулами,
типичными для эукариотических хромосом. При этом размер ге-
нома (т. е. суммарное количество ДНК в составе одного гаплоид-
ного набора хромосом) может варьировать у растений в весьма
широких пределах (табл. 1.1). Сравнительный анализ этого пара-
метра в различных систематических группах не позволяет выявить
какую-либо четкую связь между размером генома и сложностью
организации объекта. Так, многие голосеменные и даже водоросли
характеризуются существенно большими размерами генома по
сравнению с цветковыми растениями. Кроме того, в пределах
одной и той же систематической группы (например, среди различ-
ных представителей цветковых) анализируемый показатель может
варьировать по меньшей мере на два порядка: от приблизительно
108 п.н. у арабидопсиса до 1.2 х 1011 п. н. у представителей рода
Fritillaria. Подобная ситуация, скорее всего, отражает различную
Таблица 1.1
Ядерные геномы цветковых растении в сравнении с другими организмами
Представитель Размер генома (п.н.) Количество хромосом
Бактерии
Escherichia coli Грибы 4.64 х 106 1 -
Saccharomyces cerevisiae | 1.21 х 107 1 x =17
Животные
Drosophila melanogaster 1.80 x 10’ 2x = 8
Homo sapiens 3.40 x 10’ 2x = 46
Водоросли
Cyanidioschyzon merolae 1.20 x 107 x = 15
Chlorella vulgaris 3.90 x 107 x = 16
Chlamydomonas reinhardtii 1.00 x 10’ x = 18
Coscinodiscus asteromphales 2.50 x IO10 x = ?
Мхи
Physcomitrella patens 1 6.00 x 10’ 1 x = ?
Голосеменные
Pinus resinosa 1 6.80 x IO10 1 2x = 24
14
Таблица 1.1 (продолжение)
Представитель Размер генома (п.н.) Количество хромосом
Цветковые р «астения
Arabidopsis thaliana (арабидопсис) 1.45 х 10’ 2х = 10
Prunus persica (персик) 2.62 х 10’ 2х = 16
Raphanus sativus (редис) 2.90 х 10’ 2х = 18
Cucumis sativus (огурец) 3.67 х 10’ 2х = 14
Citrus sinensis (апельсин) 3.67 х 10’ 2х = 18
Carica papaya (папайя) 3.76 х 10’ 2х = 18
Oryza sativa (рис) 4.15 х 10’ 2х = 24
Ananas bracteatus (ананас) 4.44 х 10’ 2х = 50
Cucumis melo (дыня) 4.54 х 10’ 2х = 24
Trifolium pratense (клевер красный) 4.68 х 10’ 2х = 14
Daucus carota (морковь) 4.73 х 10’ 2х = 18
Vitis vinifera (виноград) 4.83 х 10’ 2х = 38
Pyrus communis (груша) 4.96 х 10’ 2х = 34
Lycopersicon esculentum (томат) 4.99 х 10’ 2х = 24
Cucurbita pepo (тыква) 5.02 х 10’ 2х = 40
Brassica oleracea (капуста) 5.99 - 6.62 х 10’ 2х = 18
Phaseolus vulgaris (фасоль) 6.37 х 10’ 2х = 22
Sorghum bicolor (сорго) 7.48 х 10’ 2х = 20
Beta vulgaris (свекла) 7.58 х 10’ 2х = 18
Spinacea oleracea (шпинат) 9.89 х 10’ 2х = 12
Trifolium repens (клевер белый) 9.99 х 10’ 4х = 32
Glycine max (соя) 1.12 х 10’ 4х = 40
Brassica napus (брюква) 1.13 х 10’ 2х = 38
Petunia hybrida (петуния) 1.27 х 10’ 2х = 14
Asparagus officinalis (спаржа) 1.31 х 10’ 2х = 20
Solanum tuberosum (картофель) 1.60- 1.86 х 10’ 4х = 48
Crepis capillaris (скерда) 1.87 х 10’ 2х = 6
Nicotiana plumbaginifolia 2.29 х 10’ 2х = 24
Zea mays (кукуруза) 2.30 - 2.72 х 10’ 2х = 20
Lactuca sativa (латук) 2.64 х 109 2х = 18
Arachis hypogaea (арахис) 2.81 х 10’ 4х = 40
Helianthus annuus (подсолнечник) 2.87-3.19x10’ 2х = 34
Pisum sativum (горох посевной) 3.95 х 10’ 2х = 14
Nicotiana tabacum (табак) 4.22 - 4.65 х 10’ 4х = 48
Hogdeum vulgare (ячмень) 4.87 х 10’ 2х = 14
Triticum monococcum (пшеница) 5.75 х 10’ 2х = 14
Vanilla planifolia (ваниль) 7.67 х 10’ 2х = 32
Secale cereale (рожь) 9.50 х 10’ 2х = 14
Avena sativa (овес) 1.13 х Ю10 6х = 42
Allium сера (лук репчатый) 1.53 х Ю10 2х= 16
Triticum aestivum (пшеница мягкая) 1.60 х 10ю 6х = 42
Tulipa sp. (тюльпан) 2.47 - 3.07 х 1010 2х = 24
Lilium longiflorum (лилия) 9.00 х 10*° 2х = 24
Fritillaria assyriaca (рябчик) 1.24x10" 2х = 24
15
копийность повторяющихся последовательностей на фоне относи-
тельно постоянного количества уникальных генов.
Рассматривая вопрос о копийности тех или иных фрагментов
генома, традиционно вычленяют три типа последовательностей:
частые повторы, представленные многими сотнями или даже
тысячами копий;
средние повторы, насчитывающие от нескольких десятков до
нескольких сотен копий;
. так называемые уникальные последовательности, представ-
ленные всего лишь одной или несколькими копиями на
геном.
Несмотря на свою общепринятость, такое деление весьма ус-
ловно и не позволяет провести какой-либо четкой грани между
последовательностями разных типов. В соответствии с этим в ос-
нову рациональной классификации геномных последовательнос-
тей, по-видимому, должна быть положена не копийность, а струк-
турно-функциональные особенности тех или иных фрагментов
ДНК.
1.1.1. ГЕНОМНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ, ОБЕСПЕЧИВАЮЩИЕ
СТАБИЛЬНОСТЬ ХРОМОСОМНОГО НАБОРА
Любая хромосома содержит специфические нуклеотидные по-
следовательности, обеспечивающие ее стабильность и регулярное
воспроизведение в ряду клеточных делений. К подобным последо-
вательностям относятся:
теломерная ДНК, предотвращающая деградацию и слипание
концов хромосом и тем самым обеспечивающая их стабиль-
ность;
так называемые последовательности ARS (от autonomous rep-
lication sequence), служащие точками начала репликации хро-
мосомной ДНК;
. центромерная ДНК, обеспечивающая закономерное расхож-
дение хромосом при делении клетки.
В наиболее типичном случае теломерные районы хромосомной
ДНК представлены протяженными тандемными кластерами, образо-
ванными особым типом коротких прямых повторов. У растений таки-
ми повторами, как правило, служат гептануклеотиды TTTAGGG
(у хламидомонады — октануклеотиды TTTTAGGG), соответст-
вующие общей для всех эукариот консенсусной последовательно-
сти (T/A)1_4G1_g. Подобные последовательности являются субстра-
том для специфического нуклеопротеида, способного наращивать
концы теломерной ДНК и в связи с этим получившего название те-
ломераза. Теломеразная активность позволяет компенсировать кон-
цевые нехватки, регулярно возникающие при репликации линейной
ДНК, и тем самым предотвращает постепенную деградацию хромо-
сомных концов. Наличие теломеразной активности у растений под-
16
тверждено в суспензионных культурах быстро делящихся клеток та-
бака.
Размеры теломерных кластеров могут существенно варьировать
как между разными видами, так и между разными хромосомами
одного генома. В частности, у арабидопсиса, обладающего на-
именьшим геномом среди всех исследованных цветковых, длина
теломерных кластеров колеблется от 2 до 5 т. п. н. Между тем у
томатов эта величина составляет уже 20—50, а у табака — 60—
160 т. п. н. Таким образом, общее количество теломерных повто-
ров на растительный геном может варьировать от 5 тысяч копий у
арабидопсиса до нескольких миллионов — у табака.
К теломерным районам обычно примыкает так называемая суб-
теломерная ДНК, также организованная в виде прямых тандем-
ных повторов длиной около 150—200 п. н. Несмотря на высокую
гетерогенность, эти последовательности могут характеризоваться
существенной (до 75 %) гомологией у близкородственных видов.
Вместе с тем у представителей таксономически удаленных групп
структура субтеломерных повторов весьма различна. Как правило,
теломерный и субтеломерный районы отделены друг от друга
спейсерными участками длиной от нескольких нуклеотидных пар
до 150 т. п. н. При этом в отдельных случаях (например, в некото-
рых хромосомах табака) спейсерная ДНК может полностью отсут-
ствовать, в результате чего оба кластера непосредственно примы-
кают друг к другу.
Копийность субтеломерных повторов варьирует в широких
пределах. Так, если геном Nicotiana plumbaginifolia содержит при-
близительно 105 субтеломерных повторов, то у арабидопсиса подоб-
ные структуры отсутствуют, а их роль выполняют либо уникаль-
ные последовательности, либо (в случае хромосом 2 и 4) тандем-
ные кластеры рДНК. Наряду с этим, субтеломерным районам
свойственна высокая внутривидовая изменчивость, что облегчает
генетическое картирование и идентификацию разных хромосом
одного и того же генома.
Хромосомы некоторых однодольных (в частности, всех пред-
ставителей семейства луковых) характеризуются полным отсутст-
вием теломерных повторов TTTAGGG. В этих случаях концевые
районы хромосомной ДНК образованы тандемными кластерами
гетерогенных GC-богатых последовательностей, имеющих в длину
около 375 нуклеотидных пар. Следует отметить, что подобные
последовательности обычно тесно ассоциированы не только с кон-
цами хромосом, но и с районами прицентромерного и интерстици-
ального гетерохроматина, а потому вполне соответствуют понятию
сателлитная ДНК (см. с. 60). Несмотря на свою высокую гетеро-
генность в пределах одного и того же генома, сателлитные повто-
ры близкородственных видов могут обладать достаточно сущест-
венной (до 75 %) гомологией.
У некоторых представителей рода Allium (лук) в непосредст-
венной близости от концевого сателлитного района присутствуют
17
тандемные повторы рДНК, причем взаимное расположение обоих
кластеров может быть различным. При этом на противоположных
концах одной и той же хромосомы могут находиться теломерные
последовательности, существенно различные по своей структуре.
Так, судя по результатам флюоресцентной гибридизации in situ,
длинное плечо 6-й хромосомы Allium сера не содержит рДНК и
заканчивается типичным сателлитным кластером. Между тем ко-
роткое плечо той же хромосомы лишено концевых сателлитных
повторов и содержит в своем теломерном районе исключительно
рДНК.
Таким образом, теломерная ДНК растений может быть пред-
ставлена не только последовательностями TTTAGGG, но и раз-
личными тандемными повторами. В последнем случае стабиль-
ность хромосомных концов обеспечивается не теломеразной ак-
тивностью, а некими рекомбинационными или конверсионными
событиями, поддерживающими длину теломерных кластеров на
неком относительно постоянном уровне.
У высших растений хромосомные последовательности ARS ос-
таются практически неисследованными. В первую очередь это свя-
зано с отсутствием систем, позволяющих клонировать подобные
последовательности из генома растений. Действительно, тради-
ционный метод клонирования последовательностей ARS основан
на их способности обеспечивать in vivo автономное воспроизведе-
ние искусственно сконструированных нерепликативных плазмид.
Этот подход получил широкое распространение в молекулярной
генетике грибов. Между тем у высших растений (как и у живот-
ных) к настоящему времени неизвестны примеры стабильной реп-
ликации каких-либо естественных или искусственных ядерных
плазмид. В соответствии с этим вышеупомянутая эксперименталь-
ная схема пока не может быть применена непосредственно к рас-
тительным объектам. Предпринятые попытки клонировать расти-
тельные последовательности ARS по их функциональной актив-
ности в ядрах дрожжей позволили выявить несколько АТ-богатых
мотивов, гомологичных дрожжевым сайтам инициации реплика-
ции 5'-А/ТТТТАТРиТТТА/Т-3'. Тем не менее остается неясным,
являются ли эти последовательности функциональными реплика-
торами и в растительных клетках.
Те же причины определяют слабую изученность центромерной
ДНК растений. В связи с этим большое внимание уделяется после-
довательностям, локализованным в областях прицентромерного
гетерохроматина. У арабидопсиса данные области содержат протя-
женные кластеры (в среднем по 600 т. п. н. на каждую из пяти хро-
мосом), образованные высокогомологичными тандемными повтора-
ми длиной около 180 п. н. Подобные кластеры весьма напоминают
структуру 170-нуклеотидных альфоидных повторов, обнаруженных
в прицентромерной ДНК приматов. Существенное сходство органи-
зации прицентромерной ДНК у столь таксономически далеких объ-
ектов, по-видимому, свидетельствует о ее важной функциональной
18
роли. При этом наиболее значимыми являются размер и характер
расположения прицентромерных повторов, нежели их конкретные
нуклеотидные последовательности. Подобный вывод хорошо согла-
суется с результатами флюоресцентной гибридизации in situ, свиде-
тельствующими об отсутствии какой-либо гомологии между при-
центромерными повторами арабидопсиса и однодольных. Вместе с
тем конкретная роль прицентромерной ДНК в детерминации регу-
лярного расхождения хромосом остается неясной.
Характерной особенностью многих растений является высокая
степень плоидности, как правило связанная с гибридным проис-
хождением вида. Обилие полиплоидных форм наглядно свидетель-
ствует о пластичности полового размножения растений, а потому
представляет самостоятельный фундаментальный интерес. Однако
совместное функционирование разных геномов обычно сопровож-
дается разнообразными регуляторными дисбалансами, значительно
осложняющими генетический анализ объекта.
1.1.2. ЯДЕРНЫЕ ГЕНЫ
К настоящему времени точное количество ядерных генов не
установлено ни для одного вида растений. В первую очередь это
связано со сложностью секвенирования растительных геномов
ввиду их большого размера, а также обилия разнообразных повто-
ров. Имеющиеся данные позволяют лишь приблизительно оценить
количество ядерных генов у некоторых видов. В частности, судя
по результатам, полученным при секвенировании 15 % генома
арабидопсиса, примерное количество ядерных генов достигает у
этого объекта 21000 (подробнее см. раздел 1.1.5).
Всю совокупность ядерных генов растений можно подразде-
лить на 4 следующие группы:
1) гены, кодирующие структуру различных белков;
2) гены рибосомных РНК (рРНК);
3) гены различных транспортных РНК (тРНК);
4) гены разнообразных малых ядерных РНК (мяРНК).
Учитывая существенную специфику каждой из этих групп, мы
будем рассматривать их по отдельности.
Ядерные гены, кодирующие структуру белков. Для подавляю-
щего большинства ядерных генов, кодирующих структуру тех или
иных белков, показано типичное для эукариот строение, а именно:
. отсутствие оперонной регуляции;
соответствующая структура промоторов;
наличие интронов (до 42 в составе одной из открытых рамок
считывания у арабидопсиса);
присутствие сигналов полиаденилирования иРНК (подроб-
нее см. раздел 1.1.3).
Вместе с тем кодирующие области некоторых ядерных генов
имеют высокую гомологию (до 50 % на уровне белка) со своими
19
бактериальными эквивалентами. Такие гены, скорее всего, имели
пластидное или митохондриальное происхождение, но оказались
перенесенными в ядро в процессе эволюции растительных клеток
(см. гл. 1.4). В частности, это касается генов SIG, продуктами ко-
торых являются различные а-субъединицы собственной РНК-по-
лимеразы пластид (напомним, что ядерные РНК-полимеразы не
имеют в своем составе подобных субъединиц, а потому не нужда-
ются в соответствующих генах).
Конкретные растительные гены, кодирующие структуру бел-
ков, подробно описаны в последующих разделах.
Ядерные гены, кодирующие структуру рРНК. Подобно дру-
гим эукариотическим организмам, все высшие растения имеют 4
группы ядерных генов, кодирующих структуру рРНК. В соответст-
вии с коэффициентом седиментации своих продуктов данные гены
получили обозначение 5S, 5.8S, 18S и 25 (или 26)S. Три из них (а
именно 18S, 5.8S и 25S) организованы в единый оперон, представ-
ленный в геноме растений многочисленными тандемными повто-
рами. У большинства исследованных видов эти повторы разнесены
по нескольким крупным кластерам, как правило несцепленным
между собой. Впрочем, у некоторых растений (например, у куку-
рузы и ржи) имеется только по одному подобному кластеру. Гены
5S тоже представлены множественными тандемными повторами,
локализация которых обычно не связана с оперонами 18S—5.8S—
25S.
Количество индивидуальных повторов, присутствующих в каж-
дом из кластеров рДНК, может варьировать в очень широких
пределах. В соответствии с этим разные особи одного и того же
вида часто значительно различаются между собой по суммарному
количеству ядерной рДНК. Если у арабидопсиса эта величина при-
близительно оценивается в несколько сот копий (для каждого из
генов рРНК), то в случае кукурузы она составляет около десяти
тысяч.
Ядерная рДНК высших растений полностью лишена каких-
либо интронов. Эта же закономерность справедлива для большин-
ства исследованных водорослей. Впрочем, у некоторых видов в
составе гена 18S-pPHK присутствуют один или два протяженных
интрона.
Известно, что молекулы рРНК являются своеобразными карка-
сами при самосборке рибосомных субъединиц. Этот процесс про-
исходит непосредственно в ядре, а потому области транскрибиру-
емой рДНК тесно окружены формирующимися рибосомными
субъединицами и выглядят в течение интерфазы как одна или не-
сколько электронно-плотных структур. Такие структуры принято
называть ядрышковыми организаторами.
Ядерные гены, кодирующие структуру тРНК. Структурные
гены цитоплазматических тРНК изучены у растений недостаточно
подробно. Действительно, для многих тРНК соответствующие
гены еще не клонированы ни у одного растительного объекта.
20
Более того, к настоящему времени слабо изученными у растений
остаются и спектры самих тРНК (особенно это касается изоакцеп-
торных форм, т. е. различных тРНК, несущих одинаковые амино-
кислоты).
Судя по имеющимся данным, каждый тип цитоплазматических
тРНК кодируется у растений семейством идентичных или близких
друг другу генов. В частности, у табака Nicotiana rustica имеется
два варианта тирозиновых тРНК (тРНК1т*г и тРНК2т*г), отличных
друг от друга по одному положению в составе псевдоуридиновой
петли. При этом тРНК1Туг кодируется по меньшей мере четырьмя
ядерными генами, а тРНК2Туг — семью. Таким образом, в геноме
N. rustica присутствует не менее 11 генов тирозиновых тРНК.
Разные гены тРНК, принадлежащие одному и тому же семейст-
ву, как правило, не сцеплены между собой, а относительно равно-
мерно разнесены по геному. Ярким исключением из этого правила
служат структурные гены сериновых и тирозиновых тРНК, образу-
ющие протяженный кластер в геноме арабидопсиса. Данный клас-
тер состоит из приблизительно 20 тандемных повторов, в каждом
из которых локализованы три гена тРНК (один — сериновой и
два — тирозиновой тРНК). Кроме того, у желтого люпина выяв-
лен небольшой кластер генов глициновой tPHK(GGC).
У многих генов, кодирующих структуру тРНК, в пределах ан-
тикодоновой области находится по одному короткому интрону
размером от 10 до 21 н. п. В частности, этой особенностью обла-
дают все ядерные гены тирозиновых тРНК, клонированные к на-
стоящему времени не только у высших растений (включая цветко-
вые, голосеменные, папоротники и мхи), но также у красных, зе-
леных и бурых водорослей. Сходная ситуация прослеживается и в
случае структурных генов метиониновой тРНК. Между тем ни
один из исследованных генов сериновых тРНК не имеет у высших
растений мозаичной организации.
В каждом растительном геноме присутствуют не только функ-
ционально активные, но и мутантные копии генов тРНК. Чаще
всего такие мутантные копии характеризуются значительно ослаб-
ленной экспрессией и могут рассматриваться в качестве псевдоге-
нов. Однако у некоторых видов продуктами подобных копий явля-
ются супрессорные формы тРНК (например, аргининовая тРНК
пшеницы, эффективно транслирующая нонсенс-кодон UGA). На-
конец, разные копии одного и того же гена могут различаться
между собой лишь по размеру интронной области, а потому коди-
ровать полностью идентичные молекулы тРНК. Таким образом,
многие семейства ядерных генов тРНК характеризуются у расте-
ний высокой гетерогенностью.
Ядерные гены, кодирующие структуру мяРНК. Продукты
этих генов представляют собой своеобразную группу коротких ри-
бонуклеиновых молекул, участвующих в созревании (точнее — в
модификации и сплайсинге) широкого спектра транскриптов.
Судя по имеющимся данным, каждый из типов мяРНК кодируется
21
Рис. 1.1. Оперонная организация генов, кодирующих малые ядрышко-
вые РНК (мяРНК) растений.
Несколько генов мяРНК организованы в виде кластера, транскрибируемого с бли-
жайшего предшествующего промотора (горизонтальная стрелка слева). В дальней-
шем сквозной полигонный транскрипт подвергается эндонуклеазному расщеплению
с образованием самостоятельных молекул мяРНК (точки эндонуклеазных атак пока-
заны вертикальными стрелками).
у растений отдельным семейством генов, причем взаимная локали-
зация гомологичных копий, как правило, соответствует одной из
следующих схем:
разные копии, принадлежащие одному и тому же семейству,
обычно не сцеплены между собой и транскрибируются с соб-
ственных промоторов. Данная схема распространяется на гены,
кодирующие мяРНК типа Ul, U2, U4, U5 и U6 (все перечис-
ленные молекулы необходимы для сплайсинга ядерных тран-
скриптов, подробнее см. с. 32);
гомологичные копии организованы в несколько кластеров,
каждый из которых транскрибируется по оперонному прин-
ципу за счет какого-либо предшествующего промотора
(рис. 1.1). Продуктами таких оперонов являются короткие
рибонуклеиновые молекулы (например, U3, U14 и U51),
участвующие в модификации незрелой рРНК, а потому лока-
лизованные преимущественно в ядрышке. Подобные молеку-
лы обычно называют малыми ядрышковыми РНК,
Особого внимания заслуживает тот факт, что кластерирован-
ность генов, кодирующих малые ядрышковые РНК, типична для
растений, но не отмечена ни у животных, ни (за единичными ис-
ключениями) у грибов. Таким образом, присутствие подобных
кластеров является одной из отличительных черт растительного
генома.
1.13. ЭКСПРЕССИЯ ЯДЕРНЫХ ГЕНОВ
Известно, что высшие растения (кроме отдельных печеночни-
ков и мхов) весьма неудобны для интенсивного мутационного ана-
лиза. По этой причине большинство идентифицированных генов
растений выявлено с помощью методов «обратной» генетики или
же в ходе тотального секвенирования геномов (см. гл. 1.5). В част-
ности, использование данных подходов позволило клонировать
многие растительные гены, обеспечивающие (судя по своей нуклео-
тидной структуре) экспрессию ядерной генетической информации.
Однако в отсутствие соответствующих мутантов конкретные функ-
22
ции выявленных генов обычно остаются недоказанными. Таким
образом, большая часть современных представлений о механизмах
экспрессии растительных ядерных генов получена косвенным
путем и опирается на схемы, реально подтвержденные лишь для
животных и грибов.
Транскрипция ядерных генов. У высших растений, как и у
прочих эукариотических организмов, транскрипция ядерных генов
обслуживается тремя вариантами РНК-полимераз, а именно:
РНК-полимераза I обеспечивает транскрипцию оперонов
18S—5.8S—25S;
РНК-полимераза II транскрибирует структурные гены бел-
ков и некоторых мяРНК;
. РНК-полимераза III осуществляет транскрипцию генов, про-
дуктами которых являются транспортные, большинство малых
ядерных и 58-рибосомная РНК.
Каждый из этих ферментов представлен сложным мультисубъ-
единичным комплексом, включающим в себя около 10 различных
белков. Отметим, что некоторые субъединицы входят в состав
всех трех РНК-полимераз.
Транскрипция оперонов 18S — 5.8S — 25S. Каждая
копия рассматриваемого оперона содержит характерную промо-
торную область размером около 100 н. п. Судя по данным делеци-
онного анализа, в составе этой области присутствует несколько
консервативных мотивов, один из которых определяет начало
транскрипции (ТАТАТА, подчеркнуто положение +1), в то время
как остальные (например, TATGNXCAGG) являются сайтами свя-
зывания разнообразных белков.
Как уже было отмечено выше, транскрипция кластеров рДНК
приводит на стадии интерфазы к формированию видоспецифично-
го ядрышка. Между тем у большинства отдаленных гибридов на-
блюдается интересный эффект, получивший название ядрышковое
доминирование (в клетках гибрида образуется ядрышко только
одной из родительских форм; табл. 1.2). В основе такого эффекта
Таблица 1.2
Ядрышковое доминирование у растений
Гибрид
Видовая специфичность
доминирующего ядрышка
Triticum aestivum х Secale cereale
Т. aestivum х Aegilops umbellulata
Brassica nigra x B. oleracea
B. oleracea x B. nigra
B. nigra x В. rapa
B. rapa x B. nigra
B. rapa x B. oleracea
B. oleracea x B. rapa
T. aestivum
A. umbellulata
B. nigra
B. rapa
» »
» »
» »
» »
23
лежит избирательное подавление транскрипции за счет интенсив-
ного метилирования рДНК в одном из геномов гибрида. При этом
остается неясным, какие молекулярные механизмы участвуют в
распознавании геномов и обеспечивают избирательное метилиро-
вание рДНК.
Транскрипция генов, кодирующих белки. Обяза-
тельным компонентом каждого ядерного гена, кодирующего струк-
туру белка, является промоторная область, специфически распоз-
наваемая РНК-полимеразой II. В составе этой области обычно
присутствует олигонуклеотидный АТ-богатый мотив, получивший
название ТАТА-бокс и служащий сайтом присоединения РНК-по-
лимеразного комплекса. При запуске (инициации) транскрипции
непосредственно к ТАТА-боксу присоединяется мультисубъеди-
ничный фактор TFIID, состоящий из ТАТА-связывающего белка
(ТВР от ТАТА binding protein) и нескольких вспомогательных по-
липептидов. В дальнейшем ДНК-связанный фактор TFIID обеспе-
чивает последовательное присоединение белков TFIIB и TFIIF, а
также собственно РНК-полимеразы И, начинающей транскрипцию
на некотором расстоянии от ТАТА-бокса. В отдельных случаях
промоторная область содержит не один, а несколько ТАТА-бок-
сов, что обеспечивает возможность образования альтернативных
транскриптов, начинающихся с различных нуклеотидных положе-
ний.
Хотя описанная выше схема исходно разработана на генах мле-
копитающих, дрозофилы и дрожжей, молекулярный механизм
инициации транскрипции, по-видимому, сходен и у растений. Дей-
ствительно, у арабидопсиса выявлены высоко консервативные
белки TFIID и ТВР. Вместе с тем нельзя исключить, что отдель-
ные этапы инициации транскрипции у растений имеют некие су-
щественные особенности по сравнению с другими группами эука-
риот. Так, в отличие от млекопитающих, дрозофилы и дрожжей,
геном арабидопсиса содержит не одну, а две копии гена, кодирую-
щего белок ТВР. Биологический смысл этой дупликации пока ос-
тается неясным.
ТАТА-бокс сам по себе обеспечивает достаточно эффективную
и равномерную (конститутивную) транскрипцию генов. В неко-
торых случаях (например, для структурных генов актина или убик-
витина) такая экспрессия является нормальной. Однако для мно-
гих ядерных генов растений характерна неравномерная (диффе-
ренциальная) транскрипция, которая не может быть обеспечена
наличием лишь ТАТА-бокса. В промоторной области этих генов
наряду с ТАТА-боксом присутствуют разнообразные вспомога-
тельные последовательности, играющие ключевую роль в транс-
крипционной регуляции соответствующих генов. Такие последова-
тельности принято называть транскрипционными элементами.
Каждый транскрипционный элемент специфически распозна-
ется регуляторными белками, получившими название транскрип-
ционных факторов. В настоящее время у растений идентифициро-
24
вано несколько сотен подобных белков. Каждый из них способен
присоединяться к соответствующему транскрипционному элемен-
ту, тем самым облегчая или, напротив, затрудняя работу РНК-по-
лимеразы. В результате подобного взаимодействия происходит
либо усиление, либо ослабление транскрипции определенных
генов. Таким образом, любой транскрипционный фактор содер-
жит по меньшей мере два функционально значимых домена, а
именно — ДНК-связывающий и собственно регуляторный.
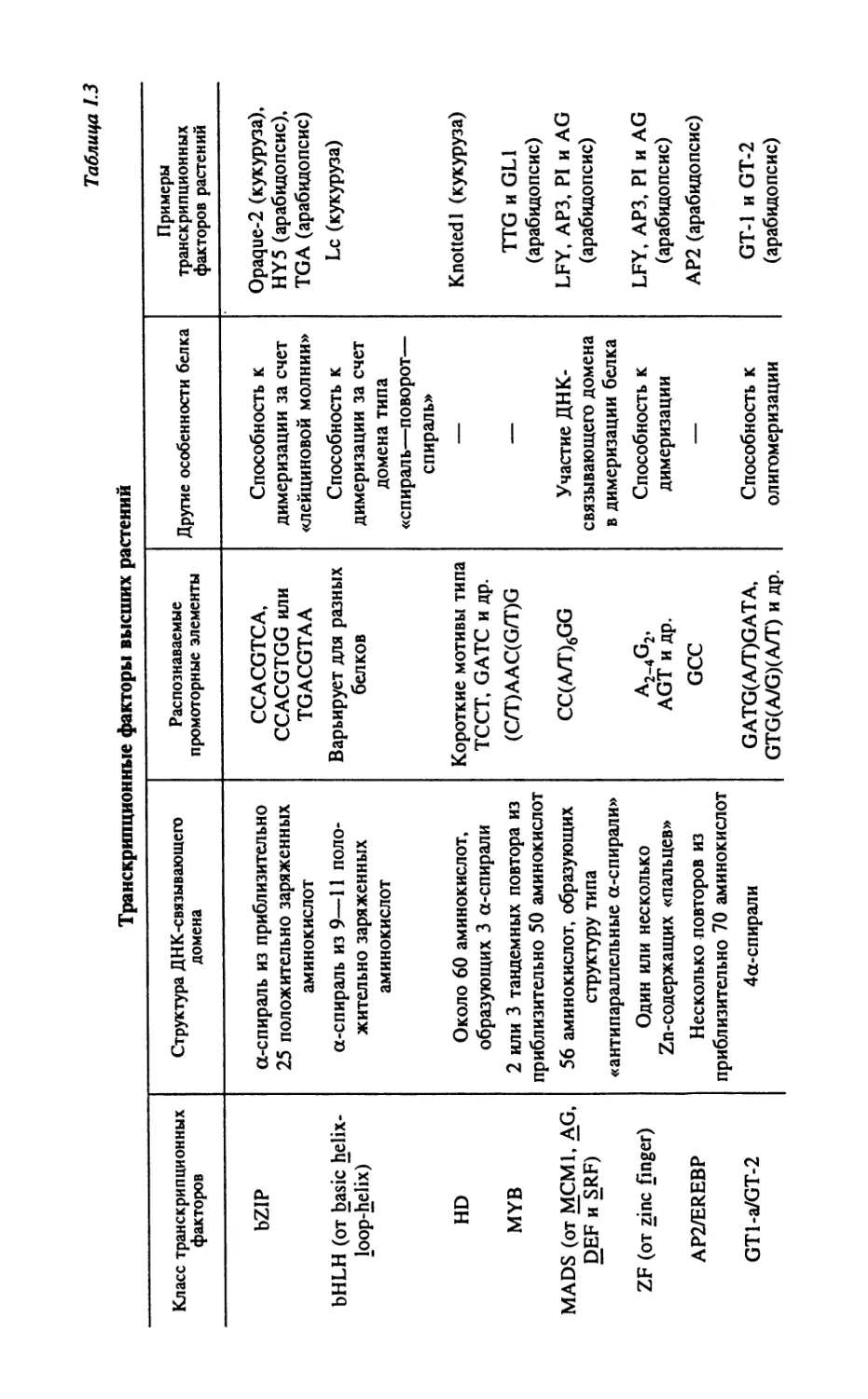
Современная классификация транскрипционных факторов ос-
нована на их структурно-функциональной организации. Следует
отметить, что для многих транскрипционных белков характерна
высокая консервативность не только среди растений, но и в пре-
делах других эукариот. В соответствии с этим транскрипционные
факторы эукариот принято подразделять на несколько классов,
различающихся между собой преимущественно структурой ДНК-
связывающего домена (табл. 1.3). На трех из перечисленных клас-
сов (а именно — на транскрипционных факторах типа bZIP, HD
и MADS) мы остановимся более подробно.
Белки типа bZIP (от basic leucine zipper) относятся к самому
многочисленному классу транскрипционных факторов растений.
Каждый из этих белков содержит консервативный ДНК-связываю-
щий домен, представленный а-спиралью из приблизительно 25
положительно заряжённых аминокислот. В большинстве случаев
подобные домены специфично взаимодействуют с мотивом ACGT,
находящимся в составе так называемого Hex-, G- или as-1-бокса
(нуклеотидные последовательности CCACGTCA, CCACGTGG и
TGACGTAA соответственно). Однако главной отличительной чер-
той bZIP-белков является характерная лейцин-богатая область
(лейциновая молния), обеспечивающая их способность к димери-
зации. Благодаря своей консервативной структуре, лейциновые
молнии факторов bZIP участвуют в образовании не только гомо-,
но и гетеродимеров. По этой причине даже из нескольких bZIP-
белков может сформироваться широкий спектр функционально
различных димерных молекул. Так, взаимодействие между шестью
белками TGA приводит у арабидопсиса к образованию 21 вариан-
та димеров (рис. 1.2).
Транскрипционные факторы еще одного класса (а именно —
гомеодоменсодержащие белки, HD) были исходно описаны у дро-
зофилы. Для каждого из этих белков характерен консервативный
ДНК-связывающий домен, способный распознавать короткие нук-
леотидные последовательности типа ТССТ, GATC и др. Ока-
залось, что подобные белки служат ключевыми регуляторами эм-
брионального развития дрозофилы, причем их дефектность часто
приводит к явлению гомеозиса (т. е. к превращению одних гомо-
логичных органов в другие, например, к замене антенн на ходиль-
ные ноги в случае мутантов по гену ANTENNAPEDIA). Именно от
термина гомеозис и происходит понятие гомеодомен. Однако у
высших растений ни один из исследованных гомеодоменсодержа-
25
Транскрипционные факторы высших растений
Таблица 1.3
Класс транскрипционных факторов Структура ДНК-связывающего домена Распознаваемые промоторные элементы Другие особенности белка Примеры транскрипционных факторов растений
bZIP а-спираль из приблизительно 25 положительно заряженных аминокислот CCACGTCA, CCACGTGG или TGACGTAA Способность к димеризации за счет «лейциновой молнии» Opaque-2 (кукуруза), HY5 (арабидопсис), TGA (арабидопсис)
bHLH (от basic helix- loop-helix) а-спираль из 9—11 поло- жительно заряженных аминокислот Варьирует для разных белков Способность к димеризации за счет домена типа «спираль—поворот— спираль» Lc (кукуруза)
HD Около 60 аминокислот, образующих 3 а-спирали Короткие мотивы типа ТССТ, GATC и др. — Knotted 1 (кукуруза)
MYB 2 или 3 тандемных повтора из приблизительно 50 аминокислот (C/T)AAC(G/T)G — TTG и GL1 (арабидопсис)
MADS (от MCM1, AG, DEF и SRF) 56 аминокислот, образующих структуру типа «антипараллельные а-спирали» CC(A/T)6GG Участие ДНК- связывающего домена в димеризации белка LFY, АРЗ, PI и AG (арабидопсис)
ZF (от zinc finger) Один или несколько Zn-содержащих «пальцев» a2_4g2, AGT и др. Способность к димеризации LFY, АРЗ, PI и AG (арабидопсис)
AP2/EREBP Несколько повторов из приблизительно 70 аминокислот GCC — АР2 (арабидопсис)
GTl-a/GT-2 4а-спирали GATG(A/T)GATA, GTG(A/G)(A/T) и др. Способность к олигомеризации GT-1 и GT-2 (арабидопсис)
TGA1
TGA2
TGA3
TGA4
TGA5
TGA6
Рис. 1.2. Формирование гомо- и гетеродимеров транскрипционными
факторами TGA у арабидопсиса.
Белки TGА относятся к транскрипционным факторам типа bZIP. Обладая похожими
лейциновыми молниями, эти белки способны образовывать все варианты как гомо-,
так и гетеродимеров.
щих белков не принимает непосредственного участия в контроле
гомеозисных процессов. Так, мутации кукурузного гена KNOTTED 1
(первого клонированного гена растений, кодирующего гомео-
доменсодержащий белок; подробнее см. часть II, гл. 3) приводят к
значительному изменению листовой пластинки, но не способству-
ют ее преобразованию в какой-либо другой дифференцированный
орган.
Характерной особенностью всех MADS-белков является круп-
ный ДНК-связывающий домен, обеспечивающий распознавание
10-нуклеотидного мотива CC(A/T)6GG (впрочем, более строгая
специфичность в пределах указанного мотива, по-видимому, конт-
ролируется другими районами молекулы). Кроме того, в белках
этой группы часто присутствует кератиноподобный домен, обеспе-
чивающий их способность к димеризации. Судя по имеющимся
данным, все MADS-белки проявляют транскрипционную актив-
ность исключительно в форме димеров, состоящих из двух одина-
ковых (АР1/АР1, AG/AG) или же разных (AP3/PI) субъединиц.
Наконец, особого внимания заслуживает тот факт, что некоторые
MADS-белки цветковых растений непосредственно вовлечены в
контроль гомеозисных процессов (см. часть II, гл. 5).
Наряду с транскрипционными факторами, которые четко соот-
ветствуют приведенной классификации, известны многочисленные
белки, обладающие нестандартной структурой. Так, у арабидопси-
27
са и моркови обнаружено семейство транскрипционных факторов,
одновременно содержащих и гомеодомен, и лейциновую молнию.
Эти белки, получившие обозначение HD-Zip, специфически рас-
познают 9-нуклеотидные последовательности CAAT(A/T)ATTG
или CAAT(G/C)ATTG.
Чаще всего в конкретной промоторной области содержится не-
сколько элементов, совместно обеспечивающих необходимую ре-
гуляцию транскрипции. Так, у высших растений в промоторе гена
RBCS (о функции соответствующего продукта см. с. 90) присутст-
вует около 20 различных элементов. Кроме того, у большинства
мозаичных генов на эффективность транскрипции влияет не толь-
ко промотор, но и нуклеотидные последовательности, локализо-
ванные в пределах первого интрона.
Мы уже видели, что эффективность транскрипции рДНК су-
щественно зависит от степени метилирования промотора. Похо-
жая зависимость продемонстрирована у многих растений и в отно-
шении генов, кодирующих различные белки. Особого внимания
заслуживают интереснейшие результаты, недавно полученные с
использованием арабидопсиса. У этого объекта описан мутант
ddml (от DNA demethylation), частично дефектный по метилиро-
ванию ДНК, а потому проявляющий устойчивую дерепрессию от-
дельных генов. Между тем подобная дерепрессия служит причи-
ной разнообразных фенотипических аномалий, которые могут на-
следоваться даже в отсутствие мутации ddml (рис. 1.3; отметим,
что гипометилированные состояния, затрагивающие обе цепи ДНК,
стабильно воспроизводятся при репликации, тем самым обеспечи-
вая свою сохранность в ряду генеративных поколений). В соответ-
ствии с этим гипометилированные хромосомные локусы растений
столь же доступны для генетического анализа, как и различные
ядерные мутации. Действительно, используя стандартные генети-
ческие методики, оказалось возможным картировать гипометили-
рованный локус, определяющий позднее цветение арабидопсиса.
Характерно, что данный локус совпадает по своему расположению
на карте с геном FWA, участвующим в контроле именно времени
цветения (см. часть II). К сожалению, в подобных случаях нельзя
использовать функциональный тест на аллелизм ввиду доминант-
ного проявления гипометилированных локусов.
Итак, устойчивое гипометилирование хромосомной ДНК часто
приводит к наследованию фенотипических аномалий, не обуслов-
ленных мутационными изменениями генома. Оказалось, что этот
эффект (обычно его называют длительной модификацией) может
Рис. 1.3. Наследование гипометилированного состояния, обусловленно-
го мутацией ddml.
Каждый ген изображен в виде линии. Количество символов, обозначенных звез-
дочками, означает степень метилирования ДНК. Усиленная экспрессия деметилиро-
ванного гена X показана жирными буквами.
28
Ген X * * * * DPMI
ГенХ**** DPMI
Индукция мутации ddml
Ген X * * * * ddml
ГенХ**** ddml
Постепенное деметилирование ДНК
I в ряду поколений
ГенХ * ddml
ГенХ * ddml
Ген X * * * * РРМ1
Скрещивание мутанта ddml
с растением дикого типа
ГенХ**** РРМ1
I
ГенХ * ddml „
---------- ------ Доминантное проявление
деметилированного состояния
Ген X * * * * DDM1 гена х в гибриде Fi
Самоопыление гибрида Fj
Ген X * DPMI Выщепление потомков, несущих
деметилированное состояние гена
----------- ------ X на фоне нормальной аллели гена
ГенХ * РРМ1 РРМ1
I
Стабильное наследование
гипо метилированного состояния
29
быть вызван не только мутациями типа ddml, но и другими воз-
действиями, включая:
использование деметилирующих агентов (например, 5-азаци-
тидина);
. трансформация растения антисмысловым вариантом гена
МЕТ1 (продуктом этого гена является цитозин-метилтранс-
фераза — ключевой фермент, осуществляющий метилирова-
ние ДНК).
Попытки усилить транскрипцию некого гена за счет интегра-
ции его дополнительных копий в геном часто приводят к обратно-
му результату. Обычно в основе такой ситуации лежит интенсив-
ное метилирование ДНК, затрагивающее все копии данного гена,
что резко ослабляет их совокупную транскрипцию. Подобный эф-
фект, получивший название сайленсинг или взаимная инактива-
ция, описан у многих цветковых растений, но слабо изучен, с
точки зрения своего механизма.
Транскрипция генов, кодирующих транспорт-
ные, малые ядерные и 58-рибосомную РНК. У вы-
сших растений, как и у всех эукариот, транскрипцию большинства
перечисленных генов осуществляет РНК-полимераза III. Этот
фермент специфически связывается со сложными ядерными про-
моторами, обладающими характерной двойной или тройной
структурой (рис. 1.4). При этом структурные гены отдельных
мяРНК (а именно — малых ядрышковых; см. с. 22) имеют оперон-
ную организацию, а потому не содержат собственных промоторов.
Более того, известны случаи, когда подобный оперон находится в
интронной области гена, кодирующего молекулу белка. Такие опе-
роны могут успешно экспрессироваться за счет активности РНК-
полимеразы II с образованием первичного транскрипта, в дальней-
шем расщепляемого на информационную и несколько малых яд-
рышковых РНК.
+ 1 ЬохА ЬохВ
+ 1
ЬохА
ЬохС
OCT PSE ТАТА^ +1____________________________________________
Рис. 1.4. Разнообразие промоторов, распознаваемых
РНК-полимеразой III.
Символом +1 показана точка инициации транскрипции; обозначения ЬохА, ЬохВ,
OCT, PSE и ТАТА соответствуют консервативным транскрипционным элементам.
30
Особого внимания заслуживают гены, кодирующие структуру
мяРНК U3. Если у животных и грибов каждый из этих генов транс-
крибируется РНК-полимеразой II, то в случае цветковых растений
соответствующую функцию обеспечивает РНК-полимераза III.
Данная ситуация является первым примером юго, что гомологич-
ные ядерные гены транскрибируются in vivo разными РНК-поли-
меразами.
Созревание ядерных РНК. У высших растений созревание
ядерных РНК, по-видимому, осуществляется по тем же принципи-
альным закономерностям, что и в случае животных и грибов. Этот
процесс может включать в себя следующие этапы:
. кэпирование и полиаденилирование подавляющего большин-
ства иРНК;
. сплайсинг транскриптов, обладающих интрон-экзонной
структурой;
расщепление полигенных транскриптов;
. модификация отдельных положений в составе некоторых
транскриптов;
. наращивание З'-конца у ядерных тРНК.
В настоящем разделе каждый из этих этапов будет рассмотрен
по отдельности.
Кэпирование и полиаденилирование иРНК. Для
всех эукариотических организмов (включая и высшие растения) ха-
рактерно кэпирование и полиаденилирование подавляющего боль-
шинства ядерных иРНК. Каждый из этих процессов предохраняет
молекулу иРНК от экзонуклеазного расщепления, а также заметно
повышает эффективность инициации трансляции (см. с. 36).
Кэпирование представляет собой характерную модификацию
5'-конца иРНК за счет присоединения к нему метилированного гуа-
нинового нуклеотида (m7Gppp) с образованием неканонической
связи 5'—5'. Данная модификация обеспечивается особым фермен-
том, получившим название гуанилилтрансферсза. При этом только
отдельные типы иРНК (например, некоторые вирусные транскрип-
ты) в норме не подвергаются кэпированию.
Полиаденилирование является сложным, многоступенчатым
процессом, обеспечивающим созревание З'-кснца иРНК. Судя по
данным, полученным для животных и грибов, этот процесс вклю-
чает в себя следующие тесно взаимосвязанные этапы:
распознавание особой (так называемой сигнальной) нуклео-
тидной последовательности, локализованной в З'-некодиру-
ющей области иРНК;
эндонуклеазное расщепление З'-конца иРНК на расстоянии
в приблизительно 30 нуклеотидов после сигнальной последо-
вательности;
наращивание зрелого З'-конца иРНК за счет нематричного
синтеза длинного поли(А)-тракта. Данный этап обеспечи-
вается мультисубъединичным ферменном поли(А)-полиме-
разой.
31
Вопрос о структуре сигнальных последовательностей, обуслов-
ливающих точные сайты полиаденилирования у высших растений,
все еще остается открытым. В некоторых случаях эти последова-
тельности представлены типичными сигналами полиаденилирова-
ния (5'-AAUAAA-3'), характерными для ядерных иРНК млекопи-
тающих. Однако многие гены растений не имеют подобного сигна-
ла, причем его искусственное введение не влияет на характер
полиаденилирования соответствующих иРНК. Таким образом, у
высших растений сигналами полиаденилирования могут служить
не только типичные для млекопитающих гексануклеотиды 5'-
AAUAAA-3', но и другие, пока еще невыявленные последователь-
ности.
Сплайсинг ядерных РНК. Судя по имеющимся данным,
ядерные гены растений характеризуются обилием интронов. Так, в
секвенированных фрагментах генома арабидопсиса доля мозаич-
ных генов составляет от 67 до 84 %, причем количество интронов
в одной открытой рамке считывания может достигать сорока двух.
Несмотря на свою многочисленность, ядерные интроны вы-
сших растений четко подразделяются на две большие группы.
Первую из них составляют короткие интроны, локализованные в
генах тРНК (см. с. 21). Эти интроны вырезаются из первичных
транскриптов за счет особого ферментного комплекса, получив-
шего название сплайсинг-эндонуклеаза. Впрочем, в отсутствие та-
кого фермента определенные незрелые тРНК способны к эффек-
тивному автосплайсингу.
Совсем иные интроны присутствуют в ядерных генах, кодиру-
ющих различные белки. Несмотря на вариабельность своих разме-
ров (от 33 до более чем 5000 н. п., в среднем же около 170 н. п.),
подобные интроны значительно обогащены нуклеотидами А/Т и в
целом обладают принципиально сходной структурой. Действитель-
но, в каждом таком интроне имеются три консервативные облас-
ти, абсолютно необходимые для правильного сплайсинга:
5'-граница интрона, представленная мотивом 5'-AG/GUAA-
GU-3' (приведена нуклеотидная последовательность на уров-
не первичного транскрипта; точное местоположение границы
показано косой чертой). В этом мотиве неизменным является
выделенный динуклеотид GU, соответствующий первым по-
ложениям интрона;
З'-граница интрона, образованная последовательностью 5'-
GCAG/G-3' (неизменный динуклеотид AG соответствует
двум последним положениям интрона);
третий, наиболее вариабельный мотив 5'-CUNAN-3', взаимо-
действующий с 5'-концом интрона в процессе формирования
характерной петлеобразной структуры (рис. 1.5). В этом мо-
тиве абсолютно незаменимый адениновый нуклеотид может
соседствовать с любыми двумя нуклеотидами.
Вырезание данных интронов обеспечивается сложной фермен-
тативной системой, получившей название сплайсосома. Основны-
32
Сайт присоединения 5'-конца интрона
5'-граница интрона
З'-граница интрона
mGpppGl AG| pGUAAGU—CUNAN—UnGCAGp |G | OH
-2-1 +I+2+3+4+5+6 I -4-3-2-I +1
2’OH
mGpppG| AG| OH
mGpppG| AG| p|G |OH
+
CUNAN—UnGCAG— OH
U 2’
G
AA
Рис. 1.5. Двухступенчатое вырезание интрона из ядерной иРНК.
А — на первом этапе сплайсинга происходит разрезание 5'-границы интрона с обра-
зованием петлеобразной структуры. При этом 5'-конец интрона ковалентно присо-
единяется через нетипичную 2х—5'-фосфодиэфирную связь к адениновому нуклеоти-
ду в составе последовательности CUNAN, где N может быть любым нуклеотидом;
Б — на втором этапе сплайсинга разрезается З'-интронная граница с последующим
лигированием обоих экзонов (изображены в виде прямоугольников). Вырезанный ин-
трон в дальнейшем деградирует.
ми ее компонентами служат нуклеопротеидные комплексы, содер-
жащие определенные мяРНК (либо одну — Ul, U2 или U5, либо
две — U4 и U6). С помощью этих молекул обе интронные грани-
цы оказываются сближенными друг с другом в удобной для сплай-
синга конфигурации (рис. 1.6; правильный выбор границ, принад-
лежащих одному и тому же интрону, по-видимому, обеспечивается
последовательным сканированием иРНК). Отметим, что рассмат-
риваемый интрон не может самостоятельно принять такую конфи-
гурацию ввиду отсутствия в нем взаимно комплементарных участ-
ков. Единственным исключением из этого правила является ин-
2 Генетика
33
Рис. 1.6. Сближение 5'- и З'-границ интрона за счет их комплементар-
ного взаимодействия с малыми ядрышковыми РНК U2, U5 и U6 (звез-
дочками помечены интрон-экзонные границы).
трон I группы (см. с. 95), обнаруженный у ряда водорослей и про-
стейших в составе генов 18S-pPHK.
В составе некоторых незрелых иРНК присутствуют отдельные
интроны с нечетко выраженными (криптическими) границами. В за-
висимости от своего конкретного строения каждая из этих границ
распознается с некой вероятностью, не достигающей, однако,
100 %. В подобной ситуации даже исходно идентичные транскрип-
ты могут сплайсироваться по-разному (одни — нормальным, дру-
гие — альтернативным способом) с образованием по меньшей мере
двух вариантов иРНК, успешно вовлекаемых в трансляцию. Так,
один из В-циклинов кукурузы в норме представлен двумя варианта-
ми, различающимися между собой по размеру важнейшего домена (в
результате альтернативного сплайсинга происходит вырезание не-
большого криптического интрона с укорочением открытой рамки
считывания на 21 кодирующий триплет). Необходимо подчеркнуть,
что в силу своей структурной дефектности короткие молекулы цик-
лина не могут участвовать в индукции клеточных делений. Таким
образом, одним из факторов, влияющих на митотическую актив-
ность клетки, является соотношение между нормальными и укоро-
ченными молекулами циклина. Судя по этим данным, альтернатив-
ный сплайсинг иРНК может играть весьма существенную роль при
регуляции развития растений.
У высших растений большинство секвенированных ядерных
интронов не несет никакой генетической информации. Однако в
составе отдельных интронов обнаружены кластеры из нескольких
генов мяРНК. Так, в первом интроне, локализованном в гене
HSC70 у риса, присутствует кластер из четырех генов мяРНК,
включая две копии гена U51.
Расщепление полигенных ядерных транскрип-
тов. Как уже было отмечено выше (см. с. 21), некоторые ядерные
34
РНК синтезируются в виде сквозных полигонных транскриптов и
лишь затем расщепляются на отдельные рибонуклеиновые молеку-
лы. В частности, эта закономерность характерна для 18S-, 5.8S- и
258-рибосомных, малых ядрышковых и (вероятно) отдельных
транспортных РНК. В каждом из перечисленных случаев расщеп-
ление первичного транскрипта обеспечивается специфическими
эндорибонуклеазами.
Следует подчеркнуть, что в разрезании первичных транскрип-
тов, считанных с оперонов 18S—5.8S—25S, важную роль играют
не только определенные белки, но и малые ядрышковые РНК U3,
U8, U14 и U17. Таким образом, молекулярный аппарат рассматри-
ваемого процесса представлен многокомпонентными рибонуклео-
протеидными комплексами, отдаленно напоминающими сплайсо-
сому.
Модификация отдельных положений в составе
ядерных транскриптов. Для некоторых ядерных транскрип-
тов характерна модификация отдельных нуклеотидов. В частнос-
ти, этот процесс продемонстрирован для ряда транспортных и ри-
босомных РНК. Так, у высших растений зрелая молекула 25S-
рРНК содержит отдельные модифицированные нуклеотиды,
подвергшиеся метилированию по 2-0-положению рибозы или же
рибозилированию по пятому положению урацила (в последнем
случае происходит превращение урацила в псевдоуридин, сокра-
щенно обозначаемый как гР). При этом выбор конкретных моди-
фицируемых нуклеотидов обеспечивается комплементарным взаи-
модействием между незрелой молекулой 25S рРНК и соответству-
ющими малыми ядрышковыми РНК (рис. 1.7).
25S рРНК
мяРНК R1
мяРНК R2
25S рРНК
CUAGAGGUGUC AG АА- У
|AGUA|u6uU(5u(5(5a(5a6uCUU-5'
S'50.,
GCCAC GCUA?
I I I I I Illi
3-C GUGUvPCGGU-5’
2816
Рис. 1.7. Участие малых ядрышковых РНК (мяРНК) в модификации от-
дельных нуклеотидов в молекулах рРНК у высших растений (на приме-
ре кукурузы).
А — специфическое метилирование рРНК по 2-0-положению рибозы (отмечено
звездочкой) происходит на расстоянии в 5 нуклеотидов от участка комплементарнос-
ти с последовательностью AGUA (заключена в рамку) в составе мяРНК R1; Б — вза-
имодействуя с мяРНК R2, молекула рРНК образует «карман» из двух неспаренных
нуклеотидов. При этом специфическому псевдоуридилированию (т. е. превращению
остатка урацила в псевдоуридин — *Р) подвергается первый со стороны 5'-конца не-
спаренный нуклеотид, находящийся в данном кармане.
35
Наращивание З'-конца у ядерных тРНК. У всех
эукариотических организмов (включая и высшие растения) ядер-
ные гены тРНК не кодируют З'-концевого тринуклеотида ССА.
Этот три нуклеотид присоединяется к каждой молекуле тРНК уже
пост-транскрипционно за счет активности тРНК-нуклеотидил-
трансферазы.
Трансляция ядерных иРНК. Судя по имеющимся данным, ци-
топлазматический аппарат белкового синтеза (именно он обеспечи-
вает трансляцию ядерных иРНК) характеризуется у высших расте-
ний принципиально такой же организацией, что и в случае других
эукариот. Этот факт подтвержден многочисленными исследования-
ми с использованием искусственной системы трансляции на основе
незрелых зародышей пшеницы. Следует особо подчеркнуть, что
рассматриваемая система является одной из наиболее разработан-
ных применительно к эукариотическим объектам.
Функционирующая цитоплазматическая рибосома представле-
на двумя субъединицами (большой и малой; табл. 1.4), каждая из
которых имеет сложную структуру и состоит из многочисленных
белков, взаимодействующих с «каркасом» из рРНК. Эти субъеди-
ницы исходно формируются в ядре и лишь затем перемещаются в
цитоплазму, где остаются в свободном (диссоциированном) состоя-
нии, пока не будут вовлечены в процесс белкового синтеза.
Важнейшим моментом инициации трансляции является распоз-
навание 5'-конца молекулы иРНК. Этот процесс обеспечивается
комплексом, содержащим малую (40S) рибосомную субъединицу,
инициаторную метиониновую тРНК, а также вспомогательный
фактор eIF-2 вместе со связанной молекулой ГТФ. В дальнейшем
становится возможным присоединение большой (60S) субъедини-
цы с формированием целой рибосомы и запуском биосинтеза
белка. При этом необходимо особо отметить, что эффективность
инициации зависит от серии дополнительных полипептидов, спе-
цифически распознающих кэпированный (5') и полиаденилиро-
ванный (3') концы иРНК. Таким образом, именно зрелые молеку-
лы иРНК преимущественно обслуживаются цитоплазматическими
рибосомами. Впрочем, подобная закономерность имеет достаточ-
но общий характер и не оказывает регуляторного эффекта на экс-
прессию ядерных генов.
Таблица 1.4
Цитоплазматические рибосомы высших растений
Характеризуемый комплекс Коэффициент седиментации Типы рибосомных РНК Количество рибосомных белков
Целая рибосома 80S 5S, 5.8S, 18S, 25S -80
Большая субъединица 60S 5S, 5.8S, 25S -50
Малая субъединица 40S 18S -30
36
Таблица 1.5
Цитоплазматический генетический код у арабидопсиса
Кодон Аминокисл ота Кодоновый индекс* Кодон Аминокисл ота Кодоновый индекс* Кодон Аминокисл ота Кодоновый индекс* Кодон Аминокисл ота Кодоновый индекс*
UUU Phe 496 UCU Ser 586 UAU Туг 300 UGU Cys 263
UUC » 787 исс » 316 UAC » 540 UGC » 242
UUA Leu 252 UCA » 392 UAA ter 31 UGA ter 39
UUG » 629 UCG » 195 UAG » 15 UGG Trp 321
сии » 735 CCU Pro 533 CAU His 274 CGU Arg 366
сис » 548 ссс » 213 САС » 315 CGC » 111
CUA » 245 ССА » 524 САА Gin 551 CGA » 132
CUG » 240 CCG » 223 CAG » 593 CGG » 90
AUU Не 795 ACU Thr 627 AAU Asn 463 AGU Ser 346
AUC » 838 АСС » 507 ААС » 744 AGC » 341
AUA » 250 АСА » 461 ААА Lys 728 AGA Arg 461
AUG Met 846 ACG » 206 AAG » 1204 AGG » 430
GUU Vai 910 GCU Ala 1151 GAU Asp 1004 GGU Gly 899
GUC » 543 GCC » 460 GAC » 709 GGC » 307
GUA » 192 GCA » 491 GAA Glu 907 GGA » 860
GUG » 608 GCG » 272 GAG » 1096 GGG » 276
Представлен суммарный кодоновый индекс для 81 ядерного гена.
Таблица 1.6
Принцип неоднозначного соответствия между
кодоном и антикодоном
Первое положение антикодо- на Третье положение кодона
и A, G
С G
А и
G с, и
Между тем для ряда растительных ядерных генов показаны
тонкие регуляторные механизмы на уровне элонгации полипептид-
ной цепи. В первую очередь это относится к генам, резко усили-
вающим свою экспрессию в ответ на травматическое повреждение
и/или гипоксию (см. часть VI). Ведущую роль в такой регуляции
играет белок EF-la, т. е. a-субъединица трансляционного фактора
элонгации 1.
Генетический код высших растений (применительно к ядерным
иРНК) полностью совпадает с универсальным при соблюдении
принципа неоднозначного соответствия (табл. 1.5; 1.6). При этом
многие синонимичные кодоны используются в одних и тех же
генах с весьма неодинаковой частотой. Особого внимания заслу-
живает устойчивая корреляция между количеством конкретного
белка и частотой синонимичных кодонов, заканчивающихся на С
или G (предполагают, что именно эти кодоны являются трансляци-
онно оптимальными). Таким образом, кодоновый состав конкрет-
ной рамки считывания, по-видимому, оптимизирован в соответст-
вии с необходимым уровнем трансляции.
К настоящему времени спектры цитоплазматических тРНК ис-
следованы у высших растений еще недостаточно подробно (в осо-
бенности это касается различных изоакцепторных тРНК). Тем не
менее среди пула метиониновых тРНК выявлена особая форма,
специфично участвующая в процессе инициации трансляции. На-
конец, у некоторых высших растений описаны отдельные супрес-
сорные тРНК (так, у пшеницы известна аргининовая тРНК, спо-
собная эффективно транслировать нонсенс-кодон UGA).
1.1.4. МОБИЛЬНЫЕ ГЕНЕТИЧЕСКИЕ ЭЛЕМЕНТЫ РАСТЕНИЙ
Характерной особенностью мобильных генетических элемен-
тов (иначе называемых транспозонами) является их способность к
перемещению в геноме. В соответствии с механизмами этого пере-
мещения мобильные элементы эукариот принято подразделять на
две большие группы.
1. Мобильные элементы I класса, миграция которых происходит
путем возникновения новых геномных копий при сохранении ста-
38
рой. Подобный процесс, получивший название репликативной
транспозиции, осуществляется за счет активности обратной транс-
криптазы с использованием молекул РНК в качестве матриц. По
аналогии с ретровирусами, имеющими сходный механизм воспроиз-
ведения, мобильные элементы этого класса обычно называют рет-
ротранспозонами.
2. Мобильные элементы II класса, в основе перемещения ко-
торых лежит так называемая нерепликативная транспозиция, состоя-
щая в вырезании и реинтеграции самой исходной копии. Поскольку
этот механизм не требует наличия промежуточной РНК-матрицы,
соответствующие мобильные элементы получили название ДНК-
транспозоны.
Ретротранспозоны растений. Типичные представители рет-
ротранспозонов обладают характерными структурными особен-
ностями. В первую очередь такой отличительной чертой являются
длинные концевые повторы (LTR от long terminal repeats), фланки-
рующие внутреннюю область мобильного элемента и расположен-
ные в прямой ориентации по отношению друг к другу (рис. 1.8). У
разных видов размеры длинных концевых повторов могут сущест-
венно варьировать (от 115 п. н. у риса до 2.4 т. п. н. у Lilium henryi),
при этом оба повтора в составе одного и того же ретротранспозо-
на обычно имеют высокий уровень гомологии. Наконец, многие
элементы данного класса полностью лишены длинных концевых
повторов, в связи с чем принято различать так называемые LTR-со-
держащие и LTR-несодержащие ретротранспозоны.
LTR-содержащие ретротранспозоны. Их внутренняя
область, как правило, представляет собой один единственный ген
POL. Этот ген кодирует длинную полипептидную молекулу (polypro-
tein), отдельные домены которой впоследствии отщепляются друг
от друга и становятся самостоятельными функционально различ-
ными белками. Таким образом, продуктами гена POL являются
А
Tntl (Tyl/copia)
-frl U3>|R|»|—I Gag Prot Endo RT RNaseH]—|>U3 |R|№E>-
de/1 -46(Ty3/gypsy)
4>| U3 |r||B|—1 Gag Ргщ
RT RNaseH
Endo]—[УЗ7
Рис. 1.8. Структура LTR-содержащего ретротранспозона.
Полномерная копия LTR-содержащего ретротранспозона фланкирована длинными
прямыми повторами (темные прямоугольники) и несет в своей внутренней области
одну открытую рамку считывания. Конкретная последовательность белков, кодируе-
мых этой рамкой считывания, может быть: А — Gag—Prot—Endo—RT/RNaseH
(группа Tyl/copia-подобных элементов) или Б— Gag—Prot—RT/RNaseH—Endo
(группа Ty3/gypsy-noflo6Hbix элементов).
39
сразу несколько белковых активностей, в число которых обычно
входят:
. ДНК-связывающий полипептид, гомологичный Gag-белкам
дрожжей и дрозофилы (см. ниже);
протеиназа Prot, расщепляющая единый продукт гена POL
на самостоятельные функционально активные домены;
эндонуклеаза Endo, способная встраивать в геном новые
копии ретротранспозона и в связи с этим обычно называемая
интегразой;
. высококонсервативный полипептид, совмещающий функции
обратной транскриптазы (RT от reverse transcriptase) и РНКа-
зыН.
Взаимное расположение вышеперечисленных доменов в составе
гена POL может быть несколько различным. В соответствии с этим
все LTR-содержащие ретротранспозоны принято подразделять на
две группы, получившие свое обозначение от наиболее изученных
представителей в геномах дрожжей и дрозофилы (табл. 1.7):
Таблица 1.7
Ретротранспозоны растений
Название транспозона Объект Кол-во копий Размер транспозона, п. н. Размер LTR, п. н.
(исходная ст Ретротра руктура продукт; нспозоны типа 1 1 гена POL: Gag- 'у 1/copia —Prot—Endo—R Т—RNaseH)
Bsl Кукуруза 1—5 3203 302
Hopscotch » 7 4828 231
PREM-2 » > 10 000 9439 1307
Tos3-1 Рис >30 5.2 т.п.н. 115
BARE-1 Ячмень До 35 000 12 088 1829
Wis2-1A Пшеница >100 8.6 т. п. н. 1755
Tai Арабидопсис 1—3 5.2 т.п.н. 514
Tntl Табак > 100 5334 610
Ttol-1 » 30—300 5300 574
Tstl Картофель 1 5060 285
PDR1 Горох 50 5 т. п. н. 156
Tmsl Люцерна ? 401 120
TPE1 Pinus elliottii > 100 >4.8 т.п.н. 7
Ретротранспозоны типа Ty3/gypsy
(исходная структура продукта гена POL: Gag—Prot—RT—RNaseH—Endo)
Magellan Кукуруза 7
Zeon-1 » > 1200
del 1-46 Lylium henryi > 13 000
IFG1 Pinus radiata 10 000
5.7 т.п.н.
7313 п.н.
9345 п.н.
5.9 т.п.н.
341 п.н.
649/663 п.н.
2.4 т. п. н.
333 п.н.
40
группа Tyl/copia-подобных элементов (последовательность
доменов: Gag—Prot—Endo—RT/RNAseH). Транспозоны
этой группы широко распространены у эукариот и к настоя-
щему времени обнаружены у более чем 100 видов растений,
начиная от одноклеточных водорослей и кончая обоими
классами цветковых;
группа ТуЗ^урзу-подобных элементов (последовательность
доменов: Gag—Prot—RT/RNAseH—Endo) исследована у рас-
тений в значительно меньшей степени. Отдельные предста-
вители этой группы обнаружены у цветковых и голосемен-
ных.
Судя по своей организации, LTR-содержащие ретротранспозо-
ны очень близки интегрированному генетическому материалу рет-
ровирусов и отличаются от него лишь отсутствием гена ENV, ко-
дирующего структурный белок вирусной капсиды. В соответствии
с этим типичные ретротранспозоны, по-видимому, являются де-
фектными ретровирусами, утратившими стадию инфекционных
внеклеточных частиц и превратившимися в весьма своеобразные
элементы хозяйского генома. В пользу такого вывода свидетельст-
вует и репликативный механизм перемещения ретротранспозонов,
основанный на процессе обратной транскрипции.
Миграция ретротранспозона начинается с образования его пол-
норазмерного транскрипта. На расстоянии нескольких нуклеоти-
дов от левого LTR к транскрипту может присоединяться компле-
ментарная праймерная молекула (в большинстве случаев — мети-
ониновая тРНК), З'-конец которой служит затравкой для обратной
транскриптазы (рис. 1.9). Соответствующая ферментативная актив-
ность обеспечивается белком RT/RNAseH, предварительно транс-
лируемым с других транскриптов того же мобильного элемента.
Синтезируемая при этом «-» цепь новой ДНК-копии ретротранс-
позона содержит в непосредственной близости от правого LTR пу-
ринбогатую последовательность, в области которой происходит
инициация синтеза «+» цепи. В дальнейшем новая двухцепочечная
ДНК-копия мобильного элемента интегрирует в геном за счет ак-
тивности эндонуклеазы Endo, также кодируемой самим ретротранс-
позоном. Процесс интеграции сопровождается асимметричным
раскрытием сайта мишени с образованием, как правило, 5-нукле-
отидных «липких» концов, в результате чего по краям новой ге-
номной копии ретротранспозона возникает прямая дупликация
этого сайта.
Процессу обратной транскрипции свойственна достаточно вы-
сокая частота ошибок. По этой причине большая часть новых ге-
номных копий ретротранспозонов содержит в своих функциональ-
но значимых участках разнообразные мутации, а потому уже не
способна к самостоятельному перемещению. Неудивительно, что
при таком механизме воспроизведения подавляющее большинство
полностью отсеквенированных ретротранспозонов оказываются
дефектными.
41
Транскрипт элемента Cin4
---------ЛТП-----------
_________ч । ц_________ Обратная транскриптаза
Двухнитевой разрыв ДНК W Внедрение транскрипта
с образованием липких концов W в двухнитевую брешь
_________LLJLL1 ----'
Т Синтез кДНК с использованием
транскрипта в качестве матрицы
Лигирование однонитевого разрыва
TTTTTTI11 1 1
Т Репаративное застраивание
однонитевой бреши
11111
JLLLLL
Cin4
АААААА ТГ||!
ТТТТТТ I i i 1 I________
Рис. 1.9. Предполагаемая схема репликативной транспозиции элемента
Cin4 у кукурузы.
42
К настоящему времени у растений известны лишь единичные
примеры функционально активных ретротранспозонов, к числу
которых относятся элементы Tntl и Ttol табака. Первый из них,
исходно описанный по своей спонтанной инсерции в ген нитрат
редуктазы, представлен более чем 100 копиями и сохраняет спо-
собность к перемещению даже в гетерологичной системе (в араби-
допсисе). Типичная репликативная транспозиция характерна и для
элемента Ttol, однако она может быть выявлена только в культи-
вируемых клетках. Между тем в нормально выращиваемых расте-
ниях все копии этого транспозона (от 30 до 300 у разных линий)
остаются практически неподвижными. Подобный эффект, по-ви-
димому, связан с дифференциальной транскрипцией элемента
Ttol, чрезвычайно слабой в обычных условиях, но резко возрастаю-
щей при введении клеток в культуру. Активное перемещение
этого элемента наблюдается и в трансгенных растениях риса. Судя
по своей подвижности в гетерологичных системах, ретротранспо-
зоны Tntl и Ttol способны к перемещению в достаточно автоном-
ном режиме, не требующем каких-либо дополнительных актив-
ностей (без учета «хозяйских» ферментативных систем, обеспечи-
вающих экспрессию самого гена POL).
В отличие от функционально активных элементов Tntl и Ttol,
подавляющее большинство остальных ретротранспозонов расте-
ний не способно к автономному перемещению в силу своей дефект-
ности. Тем не менее даже для таких неактивных элементов описа-
ны отдельные случаи мобильности. В частности, несмотря на де-
лению всего домена, кодирующего обратную транскриптазу,
свойственный кукурузе транспозон Bsl обнаружен в качестве
спонтанной инсерции в гене ADH1. Это перемещение, по-видимо-
му, было обеспечено некой обратной транскриптазой, кодируемой
либо определенными последовательностями самого «хозяйского»
генома, либо пока еще невыявленными полноценными копиями
ретротранспозонов. Наконец, нельзя исключить, что подвижность
неавтономных элементов обеспечивается за счет комплементарно-
го взаимодействия между отдельными копиями, дефектными по
разным доменам гена POL. Учитывая достаточно высокую копий-
ность ретротранспозонов (до 35 тысяч в случае элемента BARE-1
у ячменя), вероятность такого взаимодействия представляется до-
статочно высокой.
В геномах некоторых растений (например, кукурузы, лилии и
арабидопсиса) обнаружены последовательности, гомологичные
гену POL, но лишенные длинных концевых повторов. В соответ-
ствии со своей структурой, такие последовательности получили
название LTR-несодержащих ретротранспозонов или LINE- (от
long interspersed elements) элементов. Каждый из этих элементов
несет на своем правом конце небольшой (как правило, 6-11-нук-
леотидный) олиго-А тракт, весьма напоминающий полиаденилиро-
ванный З'-конец эукариотических иРНК. Таким образом, LINE-
элементы, скорее всего, представляют собой геномные копии раз-
43
личных иРНК, считанных с внутренних областей ретротранспозо-
нов. Следует отметить, что отдельные копии близкородственных
LINE-элементов могут существенно варьировать по длине (от 1.1
до 6.6 т. п. н. в случае семейства Cin4 у кукурузы) за счет различ-
ной протяженности своих левых концов. Этот эффект, по-видимому,
связан с гипотетическим механизмом интеграции, предполагаю-
щим комплементарное взаимодействие между внутренней об-
ластью транскрипта (или его ДНК-копии) и случайным олигонук-
леотидным сайтом мишени. Вместе с тем конкретный механизм
возникновения LINE-элементов остается практически неизучен-
ным не только у растений, но и у других эукариот. Однако, учиты-
вая достаточно высокую копийность LTR-несодержащих ретро-
транспозонов (до 250 тысяч в случае элемента Del2 у Lilium specio-
sum), этот механизм должен быть весьма эффективным. Такое
предположение подтверждается описанными случаями реплика-
тивной транспозиции отдельных LINE-элементов (например, Cin4-1
у кукурузы).
Процесс обратной транскрипции, по-видимому, лежит в основе
перемещения не только LTR-содержащих ретротранспозонов и
LINE-элементов, но и целого ряда других транскрибируемых по-
следовательностей. В силу своей высокой гетерогенности и отно-
сительно небольших размеров такие последовательности получили
обозначение ретрогенов или SINE- (от short interspersed elements)
элементов. Поскольку ни один из известных представителей этого
класса не кодирует структуру обратной транскриптазы, реплика-
тивная транспозиция SINE-элементов должна представлять собой
исключительно пассивный (неавтономный) процесс.
Несмотря на широкую представленность SINE-элементов в ге-
номе млекопитающих (более 500 тысяч так называемых Alu-пов-
торов), аналогичные последовательности растений в течение дли-
тельного времени оставались неизвестными. Однако недавно в
геноме риса удалось выявить относительно небольшое семейство
(около 100 копий) слабо гетерогенных Alu-подобных повторов
p-SINEl, каждый из которых имеет в длину приблизительно 125 н. п.
Судя по тому, что внутренние области этих повторов содержат
мозаичный промотор для РНК-полимеразы III, элемент p-SINEl,
по-видимому, является фрагментом некого гена, исходно кодирую-
щего структуру тРНК. Различная локализация повторов p-SINEl в
геномах нескольких близкородственных видов риса свидетельству-
ет о мобильности отдельных копий этого элемента в эволюцион-
ной истории рода Oryza.
Итак, ретротранспозоны растений представляют собой весьма
гетерогенную группу мобильных генетических элементов, общей
чертой которых служит репликативный характер транспозиции.
Первыми элементами, освоившими такой механизм перемещения,
по-видимому, являлись интегрированные копии генетического ма-
териала ретровирусов, впоследствии давшие начало LTR-содержа-
щим ретротранспозонам. Кодируемая ретротранспозонами обрат-
44
ная транскриптаза оказалась способной использовать в качестве
матриц разнообразные полиаденилированные транскрипты гена
POL, что постепенно привело к возникновению широкого спектра
LINE-элементов. Наконец, аналогичные процессы, по-видимому,
могли происходить и на других типах транскриптов, в результате
чего сформировались относительно короткие SINE-элементы. Не-
смотря на свою, как правило, очень низкую степень мобильности,
ретротранспозоны растений могут составлять весьма существен-
ную часть генома.
ДНК-транспозоны растений. В отличие от ретротранспозо-
нов, использующих репликативный принцип перемещения, свой-
ственные растениям мобильные элементы II класса мигрируют за
счет вырезания (эксцизии) и последующего встраивания (реинтег-
рации) в геном. В основе подобного механизма лежит характерная
структура ДНК-транспозонов и прежде всего — их инвертирован-
ные концевые повторы (TIR, от terminal inverted repeats), абсолют-
но необходимые для подвижности отдельной копии элемента
(рис. 1.10). Кроме того, непосредственно к инвертированным кон-
цевым повторам обычно примыкают достаточно протяженные об-
ласти, содержащие многократно повторенный олигонуклеотидный
мотив. Эти области, получившие название субтерминальных, также
En/Spm
Ас
1 1000 2000 3000 4000 4565
MuDR
TPase
1 1000 2000 3000 4000 4942
।____________।___________i____________i____________i___________i
MUR-A MUR-B
Рис. 1.10. Структура ДНК-содержащих транспозонов кукурузы En/Spm,
Ас и MuDR.
Каждая полномерная копия ДНК-транспозона содержит инвертированные концевые
повторы (показаны черными треугольниками), а также несет в своей внутренней об-
ласти структурные гены белков, непосредственно обслуживающих транспозицию.
Сайты инициации и направление транскрипции показаны маленькими стрелками.
Экзонные участки заштрихованы для каждого продукта по-своему.
45
a
У---- к "I GTACCTTA-----У
3'---CATGGAATr 1 ----У
У----GTACCTTA fc—GTACCTTA---У
3’--CATGGAAtF—п 1CATGGAAT--5'
Q У--GTACCTTA*^ х GTACCTTA--У
У---CATGGAAT / ^CATGGAAT—У
3'--CAT
У---GTACCTTTA ТАССТТА------У
У---CATGGA GATGGAAT----У
У----GTACCTTta ТАССТТА-----У
У----CATGG АА ATGG ААТ-----У
У----GTACCTTtaTACCTTA----У
У----CATGGAAatATGGAAT----У
У GTACCTTTACCTTA 3’
3' CATGGAAATGGAAT У
У----GTACCTTTATACCTTA---У
У----CATGGAAATATGGAAT---У
У----GTACCTCTACCTTA--3'
У----CATGGAGATGGAAT---У
Рис. 1.11. Миграция ДНК-транспозона Ds у кукурузы.
а — интеграция транспозона в область двунитевого разрыва с липкими концами. В
результате такого процесса происходит дупликация сайта мишени по краям интегри-
рованного транспозона; б — вырезание транспозона с репаративным застраиванием
образовавшейся бреши по механизму возможной смены матрицы (гипотеза); в — вы-
резание транспозона с застраиванием образовавшейся бреши по механизму промежу-
точных шпилек (гипотеза). 1 — внесение разрывов в ДНК; 2—4 — образовавшиеся
однонитевые участки подвергаются частичной деградации (соответствующие нукле-
отиды обведены кружками), после чего застраиваются до «тупых концов» с возмож-
46
необходимы для транспозиции, однако ни они, ни инвертирован-
ные концевые повторы сами по себе не способны обеспечить мо-
бильность элемента. Действительно, для осуществления успешной
транспозиции концевые районы элемента должны быть распозна-
ны особым белком, получившим название транспозазы. Структура
этого белка кодируется геном TNP, локализованным во внутрен-
ней области самого мобильного элемента. В соответствии с этим
полноценные копии ДНК-транспозонов способны перемещаться в
автономном режиме, не требующем каких-либо дополнительных
активностей (если не учитывать «хозяйские» ферментативные сис-
темы, обеспечивающие экспрессию гена TNP). Большинство функ-
ционально активных копий сохраняет свою способность к авто-
номному перемещению и в гетерологичных системах.
Транспозиция представляет собой сочетание тесно взаимосвя-
занных процессов вырезания и последующей реинтеграции мо-
бильного элемента. Однако ознакомление с этими процессами
удобнее проводить в обратном порядке, начиная со встраивания
ДНК-транспозона в новый для него участок генома, называемый
сайтом мишени. Подобное встраивание обычно сопряжено с
асимметричным раскрытием сайта мишени, в результате чего по
краям интегрированной копии мобильного элемента возникают
короткие прямые повторы (рис. 1.11, а). В то время как размер
сайтов мишени является для одного и того же ДНК-транспозона
строго постоянной величиной, их нуклеотидная последователь-
ность может варьировать в весьма широких пределах.
Если процесс интеграции ДНК-транспозонов представляется
вполне понятным, то механизм их вырезания пока остается неяс-
ным. Показано, что точная эксцизия элемента, сопровождающаяся
полным восстановлением исходного сайта мишени, происходит у
растений чрезвычайно редко. В подавляющем большинстве случа-
ев на месте мигрировавшего элемента обнаруживают характерный
«след», представляющий собой две видоизмененные копии исход-
ного сайта мишени. Следует отметить, что один и тот же мобиль-
ный элемент в ходе независимых актов своей транспозиции может
оставлять в хромосомной ДНК несколько типов «следов» строго
ной сменой матрицы; 5—7 — лигирование двунитевых разрывов, оставшихся после
ухода Ds-элемента. В зависимости от того, какие конкретные процессы происходили
на этапах 2—4, структура лигируемых концов может оказываться несколько различ-
ной. По этой причине независимые транспозиции одного и того же Ds-элемента при-
водят к возникновению различных вариантов «следов». Так, в случае смены матрицы
образующийся «след» будет нести два дополнительных нуклеотида (показаны строч-
ными буквами)', 8 — внесение разрывов в ДНК; 9—10 — свободные концы каждого
хромосомного фрагмента замыкаются друг на друга с образованием шпильки; И—
14 — асимметричное раскрывание шпилек (точки разрывов показаны крупными
стрелками) с последующим лигированием обоих хромосомных фрагментов. По-
скольку образовавшиеся свободные концы могут подвергнуться разным вариантам
укорочения (маленькие стрелки), независимо возникающие «следы» также оказыва-
ются несколько различными.
47
определенной структуры. На основании этих данных для Ds-эле-
мента кукурузы построены две возможные модели эксцизии.
Согласно одной из них (рис. 1.11, б), первый этап эксцизии со-
стоит в нанесении однонитевых разрывов точно по 5'-концам дуп-
лицированного сайта мишени. В результате такой эндонуклеазной
атаки транспозон оказывается вырезанным из хромосомы вместе с
двумя однонитевыми фрагментами, которые в дальнейшем подвер-
гаются полной или частичной деградации. Между тем аналогичные
однонитевые фрагменты, остающиеся в составе хромосомной
ДНК, укорачиваются на один нуклеотид, а затем с помощью репа-
ративного синтеза достраиваются до так называемых «тупых» кон-
цов. Лигирование этих концов приводит к восстановлению целост-
ности хромосомы, которая теперь лишена мобильного элемента, а
вместо исходного сайта мишени содержит новую 14-нуклеотидную
последовательность. Вместе с тем процесс достраивания одного из
однонитевых фрагментов может сопровождаться случайной сме-
ной матрицы, в результате чего соответствующий фрагмент (а
вместе с ним и весь оставляемый транспозоном «след») удлинится
на дополнительный динуклеотид. Таким образом, данная схема
эксцизии предполагает возможность образования двух типов «сле-
дов» разного размера.
В соответствии с альтернативной моделью (рис. 1.11, в), эксци-
зия Ds-элемента происходит в результате однонитевых разрывов,
возникающих со сдвигом в один нуклеотид в непосредственной
близости от концов самого транспозона. В области этих разрывов
комплементарные нити хромосомной ДНК замыкаются друг на
друга с образованием петлеобразных структур, которые затем под-
вергаются асимметричному раскрытию и, наконец, взаимному ли-
гированию с восстановлением целостности хромосомы. Характер-
но, что область лигирования содержит локальные неспаренности,
в дальнейшем репарируемые либо по одной, либо по другой цепи
и в связи с этим опять-таки ведущие к образованию двух типов
«следов».
Итак, обе предложенные модели в равной степени способны
объяснить формирование двух типов «следов» в независимых
актах транспозиции одного и того же Ds-элемента. В настоящее
время отсутствуют данные, позволяющие сделать выбор между
этими моделями. Впрочем, реальный механизм эксцизии Ds-эле-
мента вполне может совмещать отдельные этапы обеих рассмот-
ренных выше схем.
Вырезанные копии некоторых ДНК-транспозонов (в частности,
Ac-, Mui- и Ми 1.7-элементов кукурузы) иногда удается обнару-
жить в виде экстрахромосомных ковалентно замкнутых колец. Ос-
тается неясным, чему соответствуют такие кольца: промежуточной
фазе, закономерно возникающей в ходе миграции элемента, или
же некому продукту аномальной эксцизии. В любом случае выре-
занные ДНК-транспозоны, по-видимому, остаются во внехромо-
сомном состоянии весьма непродолжительное время и быстро
48
вступают в процесс реинтеграции. Вероятно, этому способствует
тесный физический контакт, временно возникающий между ис-
ходным (донорным) и новым (акцепторным) сайтами локализации
транспозона. Следует отметить, что оба сайта, как правило, распо-
ложены в пределах одной и той же хромосомы на относительно
небольшом расстоянии друг от друга.
Мигрировавшая копия мобильного элемента фланкирована
прямыми дупликациями нового (акцепторного) сайта мишени и
может быть вовлечена в аналогичные циклы транспозиции. Как
уже было отмечено, подобные циклы закономерно воспроизводят-
ся даже при искусственном перенесении функционально активно-
го ДНК-транспозона в другие виды растений, не имеющие собст-
венных мобильных элементов II класса. Этот факт убедительно
свидетельствует о том, что все ключевые этапы транспозиции (в
том числе распознавание концевых районов элемента, а также на-
несение специфических разрывов в процессе эксцизии и реинтег-
рации) непосредственно осуществляются самой транспозазой.
Действительно, продукт гена TNP связывается in vitro с инверти-
рованными концевыми повторами, особенно эффективно — с суб-
концевыми областями соответствующего элемента. Между тем на-
личие эндонуклеазной активности не удалось показать ни для
одной из исследованных транспозаз.
Генетические последствия транспозиции состоят не только в
физическом перемещении мобильного элемента, но и в изменении
экспрессии генов, локализованных в области старого и нового
сайтов мишени. Так, встраивание ДНК-транспозона в промотор-
ную или кодирующую область функционально активного гена
обычно приводит к образованию дефектной (мутантной) аллели,
характеризующейся типичным рецессивным проявлением. В свою
очередь интегрированная копия мобильного элемента способна к
последующей эксцизии, что обеспечивает высокую нестабиль-
ность такой мутантной аллели. Учитывая тот факт, что оставляе-
мые ДНК-транспозонами «следы» имеют весьма небольшие разме-
ры и в некоторых случаях даже не нарушают открытую рамку счи-
тывания, эксцизия мобильного элемента может проявляться как
реверсия мутантной аллели к псевдонормальному состоянию.
Именно высокая нестабильность определенных мутантных алле-
лей обычно служит формальной генетической основой для выявле-
ния мобильных генетических элементов.
Несмотря на принципиальное сходство механизма перемеще-
ния у всех ДНК-транспозонов, различные представители этого
класса характеризуются рядом специфических черт. В первую оче-
редь такая специфика связана с различной структурой инвертиро-
ванных концевых повторов, служащих сайтами распознавания для
соответствующих транспозаз. Именно поэтому структура конце-
вых областей положена в основу современной классификации
ДНК-транспозонов. Согласно этой классификации, свойственные
растениям мобильные элементы II класса принято подразделять на
49
ДНК-транспозоны растений
Таблица 1.8
Название транспо- зона Автономность перемещения Объект Кол-во копий Размер транспозона Размер и структура TIR, п. н.
Ас + Транспозоны типа Кукуруза Ас (дупликация с: 0—2 айта мишени 8 п. н 4565 п.н. I.) 11 5' CAGGGATGAAA*
Ds — (дефектная » >50 До 30 т. п. н. 3Z TAGGGATGAAA То же
Bg копия Ac) + » ? 4869 п. н. 5 CAGGG
rDT — » До 20 704 п.н. 14 5х CAGTGTTTTAAATC
ТатЗ + Львиный зев 25—30 3629 п. н. 12 3х CAATGTATTAAATC TAAAGATGTGAA
Slide-124 + Табак Много 3733 п.н. 8 TAATGCT
dTnpl — Nicotiana 1—2 565 п.н. 14 5х CAGTGCCGGCTCAA
Tstl plumbaginifolia Картофель >10 736 п.н. 11 3х CAAGGGCGGCTCAA 5х CAGGGGCGTAT
Ips-r — Горох ? 0.8 т. п. н. 12 3х CAGAGGCGTAT TAGGGGTGGCAA
Tagl ? Арабидопсис 0—3 3299 п.н. 22 CAATGTTTTCACG...
Tpcl — Петрушка ? 927 п.н. 11 5х TAGGG . TGTAAA
dTphl — Петуния >50 283 п.н. 12 12 3х TAGGGCTGTAAA CAGGGGCGGAGC
Gulliver ? Хламидомонада 12 12 т. п.н. 15 CAGGGGTCGTATCTT
En/Spm
Транспозоны типа En/Spm (дупликация сайта мишени 3 п. н.)
Кукуруза I 0—2 I 8287 п.н. I 13
CACTACAAGAAAA
I/dSpm — (дефектная копия En/Spm) » >50 0.9—8.3 т. п. н. То же
МРП ? » ? 9 т. п.н. 13 CACTACCGGATT
ТпгЗ — Рис Много 1536 п.н. 13 5* CACTAGAAGGGAT У CACTAGTACAGAT
Taml + Львиный зев 15—20 15 т. п.н. 13 САСТАСААСАААА
Tam2, 3, 4... — (дефектная копия Taml) » » До 10 До 7 т. п. н. 13—14 САСТАСААСААААА
Tgml — Соя До 50 3.5 т. п.н. 13 CACTATTAGAAAA
Pisl ? Горох > 100 2.5 т. п. н. 12 CACTACGCCAAA
Tpnl ? Myrabilis >50 6412 п.н. 28 CACTACAAGAAAAA...
Транспозоны типа Ми (дупликация сайта мишени 9 п. н.)
MuDR + Кукуруза 0—2 4942 п. н. Около 220 п. н.
Mui, 2, 3... — (дефектная копия MuDR) » До 50 1—2 т. п.н. То же
Прочие типы ДНК-транспозонов
Tati — Арабидопсис > 4 431 п.н. 13 TGTGGATGTCGGA
Stowaway — Многие виды ? 80—323 п.н. И CTCCCTCCGTT**
цветковых
Tourist — Многие виды однодольных 1000—50000 125—142 п.н. 14 GGCCTTGTTCGGT**
Cin2 — Кукуруза 4 1213 п.н. Отсутствуют
Cin3 — » Много 1771 п.н. 624 п. н.
♦ Жирным шрифтом выделены нуклеотидные положения, не совпадающие у 5'- и 3'-повторов TIR.
** Приведен консенсусный мотив, значительно варьирующий у разных копий мобильного элемента.
несколько основных групп, получивших свое обозначение от наи-
более изученных представителей в геноме кукурузы (табл. 1.8):
группа Ас-подобных элементов, для которых характерны ко-
роткие инвертированные концевые повторы (5—15 п.н.),
содержащие консервативный мотив 5Z-CAGGGATGAAA-3Z;
группа En/Spm-подобных элементов, концевые области ко-
торых представлены короткими (преимущественно 13 п.н.)
инвертированными повторами, начинающимися с мотива 5Z-
САСТА-3'. По этой причине En/Spm-подобные транспозоны
часто называют САСТА-элементами;
Mu-подобные элементы, резко выделяющиеся среди всех
ДНК-транспозонов своими длинными концевыми повторами
(около 220 п. н.).
В последнее время у высших растений обнаружено несколько
неавтономных ДНК-транспозонов, не входящих ни в одну из вы-
шеперечисленных групп. К их числу относятся: СтЗ-элемент ку-
курузы (содержит длинные концевые повторы, но не имеет гомо-
логии с транспозонами Mu-группы), а также три ДНК-транспозона
(Tati из генома арабидопсиса, Tourist и Stowaway из генома куку-
рузы), для каждого из которых характерны уникальные концевые
области. Таким образом, инвертированные концевые повторы,
входящие в состав разных ДНК-транспозонов, могут существенно
отличаться друг от друга как по своим размерам, так и по конкрет-
ной нуклеотидной последовательности.
Следует отметить, что каждый тип инвертированных концевых
повторов специфически распознается определенной транспозазой,
кодируемой внутренней областью того же самого мобильного эле-
мента. В свою очередь каждый тип транспозаз использует сайты
мишени строго определенного размера. В соответствии с этим ос-
новные группы ДНК-транспозонов отличаются друг от друга не
только структурой своих инвертированных концевых повторов, но
и нуклеотидными последовательностями гена TNP, а также разме-
ром используемых сайтов мишени.
Структура любого мобильного элемента может быть нарушена
разнообразными мутациями, блокирующими его функциональную
активность. В зависимости от своей локализации мутации такого
рода способны приводить к двум типам эффектов. Так, мутантные
копии ДНК-транспозонов, несущие повреждения в гене TNP, ко-
дируют дефектную транспозазу, а потому утрачивают способность
к автономному перемещению. Вместе с тем подобные копии со-
храняют полностью нормальные концевые области и могут мигри-
ровать при наличии в геноме хотя бы одной функционально ак-
тивной аллели гена TNP. Следует отметить, что способность к
пассивной транспозиции сохраняется у таких копий даже при за-
мещении их внутренних областей любыми неродственными после-
довательностями (например, некими селективными или репортер-
ными генами). Эта особенность мобильных элементов II класса
широко используется при проведении транспозонного мутагенеза
52
(см. ниже). В отличие от мутаций по гену TNP, дефектность ин-
вертированных концевых повторов приводит к полной неподвиж-
ности элемента. Между тем подобный элемент несет в своей внут-
ренней области нормальную аллель гена транспозазы, способную
обеспечивать пассивное перемещение родственных неавтономных
копий.
Таким образом, каждый тип ДНК-транспозонов может быть
представлен в геноме по меньшей мере тремя вариантами:
полноценные мобильные элементы, способные к автономно-
му перемещению даже в гетерологичной системе;
неавтономные элементы, мобильность которых может быть
обеспечена только за счет функционально активной транс-
позазы, кодируемой другими копиями данного транспозона;
полностью неподвижные элементы, способные тем не ме-
нее активировать транспозицию родственных неавтономных
копий.
При этом в основе успешной транспозиции может лежать ком-
плементарное взаимодействие между неподвижными и неавтоном-
ными копиями даже при полном отсутствии функционально ак-
тивных элементов.
Ас-элемент кукурузы. У высших растений к числу наибо-
лее исследованных ДНК-транспозонов относится Ас-элемент ку-
курузы (табл. 1.8), а также его разнообразные неавтономные
копии, получившие название Ds-элементов. Описанные Барбарой
Мак-Клинток еще в 1947 г., они стали первыми транспозонами,
выявленными у живых существ.
Концевые области Ас-элемента представлены 11-нуклеотидны-
ми инвертированными повторами, неидентичными по своему перво-
му положению (5Z-CAGGGATGAAA-3Z — 3Z-AAAGTAGGGAT-5Z).
Замещение этих повторов на аналогичные области другого Ас-по-
добного транспозона (ТатЗ-элемента львиного зева; 7 совпадающих
положений из 11) приводит к полной утрате мобильности. Таким
образом, несмотря на свою неидентичность, инвертированные кон-
цевые повторы Ас-элемента абсолютно необходимы для его переме-
щения.
Большую роль в обеспечении мобильности Ас-элемента играют
и его субтерминальные области. Каждая из них имеет в длину при-
близительно 240 п. н. и содержит многократно повторенные моти-
вы AAACGG, организованные в небольшие кластеры. Искусствен-
ное укорочение этих областей приводит к пропорциональному ос-
лаблению мобильности элемента вплоть до ее полной утраты.
Подобный эффект представляется вполне логичным, поскольку
именно субтерминальные области служат сайтами преимуществен-
ного присоединения молекул транспозазы. Минимальный размер
каждой из этих областей, необходимый для обеспечения транспо-
зиции, составляет около 100 п. н.
Несмотря на свое структурное сходство (наличие инвертиро-
ванных концевых повторов, а также весьма похожих субтерми-
53
нальных областей), левый (5х) и правый (3х) концы Ас-элемента,
по-видимому, не являются взаимозаменяемыми. Действительно,
искусственно сконструированные копии, фланкированные двумя
одинаковыми 5х- или З'-концами, абсолютно неспособны к пере-
мещению. Причины подобного эффекта остаются неясными.
Внутренняя область Ас-элемента кодирует одну крупную поли-
пептидную молекулу, состоящую из 807 аминокислот. Соответст-
вующий ген TNP имеет мозаичную структуру, а его продукт обна-
руживается в ядре в виде крупных филаментоподобных агрегатов.
Судя по своей способности обеспечивать мобильность неавтоном-
ных Ds-элементов, этот продукт является функционально актив-
ной транспозазой. N-концевой сегмент транспозазы (около 200
аминокислот) содержит 3 сигнала ядерной локализации, каждый
из которых вполне достаточен для импорта белка в ядро. В состав
этого же сегмента входит и двухкомпонентный ДНК-связывающий
домен (остатки 159—206). Остальная часть молекулы, по-видимо-
му, отвечает за образование агрегатов, которые являются функци-
онально активным состоянием транспозазы. В то время как целый
ряд делеций в гене TNP полностью инактивирует транспозазу, от-
сутствие 102 N-концевых аминокислот не только не нарушает, но
даже усиливает ее функцию.
Свойственная Ас-элементу транспозаза обладает низким срод-
ством к его инвертированным концевым повторам. Вместе с тем
она эффективно связывается с гексануклеотидами 5X-AAACGG-3X,
многократно повторенными в его субтерминальных областях.
Таким образом, специфическое распознавание Ас-элемента, по-
видимому, начинается с кооперативного присоединения молекул
транспозазы к каждой из его субтерминальных областей. Предпо-
лагают, что связанные с ДНК молекулы транспозазы активно агре-
гируют друг с другом, в результате чего концевые районы элемента
оказываются тесно сближенными (рис. 1.12). В дальнейшем для
осуществления транспозиции необходимо специфическое распоз-
навание инвертированных концевых повторов, а также их взаимо-
действие с новым (акцепторным) сайтом мишени. Хотя конкрет-
ные механизмы этих процессов остаются неизвестными, не вызы-
вает сомнений тот факт, что транспозиция Ас-элемента тесно
связана с репликацией хромосомной ДНК и происходит либо в
ходе, либо сразу после S-периода. Действительно, в том случае,
если бы эксцизия элемента осуществлялась еще до удвоения хромо-
сом, обе сестринские хроматиды были бы лишены соответствую-
щей копии. Между тем эксцизия ДНК-транспозонов всегда проис-
ходит только в одной из двух сестринских хроматид. Предполагают,
что подобный эффект связан с асимметричным метилированием
сестринских копий Ас-элемента. В пользу такого предположения
свидетельствует несколько фактов. Прежде всего, молекулы транс-
позазы способны связываться только с неметилированными повто-
рами 5X-AAACGG-3X. Во-вторых, деметилирование хромосомной
ДНК приводит к резкому повышению частоты транспозиции. В-треть-
54
Рис. 1.12. Сближение границ ДНК-транспозона En/Spm за счет агрега-
ции белков Тпр.
Белки ТпрА связываются с субтерминальными повторами (изображены в виде ма-
леньких треугольников) и агрегируют друг с другом, тесно сближая концевые инвер-
тированные повторы. В свою очередь тесно сближенные инвертированные повторы
(крупные треугольники) распознаются белком TnpD, осуществляющим вырезание
транспозона.
их, по меньшей мере для З'-конца Ас-элемента характерна сущес-
твенная асимметричность в плане ориентации субтерминальных
повторов. Таким образом, учитывая общую недометилированность
новых цепей ДНК, сестринские копии Ас-элемента должны всту-
пать во взаимодействие с молекулами транспозазы разными свои-
ми цепями (рис. 1.13). При этом способность (компетентность)
конкретной копии к транспозиции, по-видимому, зависит от пре-
имущественной ориентации неметилированных З'-субтерминаль-
ных повторов.
Одной из характерных особенностей Ас- и Ds-элементов явля-
ется их способность индуцировать хромосомные разрывы. Именно
это свойство легло в основу обозначения Ds (от dissociation). Как
оказалось, все Ds-элементы можно подразделить на две следующие
группы:
Ds-элементы I типа, часто вызывающие разрывы хромосом,
но проявляющие низкую мобильность;
55
Компетентность
к транспозиции
— Транспозаза
— Неметилированная цепь
Метилированная цепь
------> Ас <----------
Рис. 1.13. Роль недометилированности новых цепей ДНК в определе-
нии компетентности двух сестринских копий ДНК-транспозона Ас.
Молекулы транспозазы связываться только с неметилированными повторами 5'-
AAACGG-3' (изображены в виде стрелок). Поэтому после репликации у каждой из
сестринских копий элемента Ас распознается лишь новая (недометилированная)
цепь. Более того, рассматриваемые копии транспозона оказываются распознанными
по разным своим цепям. По-видимому, именно вследствие этого способность к ми-
грации (компетентность) свойственна только одной из двух сестринских копий транс-
позона Ас.
Ds-элементы II типа, редко вызывающие хромосомные раз-
рывы, но зато способные к эффективной транспозиции.
Судя по результатам молекулярного анализа, Ds-элементы II
типа представляют собой типичные неавтономные копии, фланки-
рованные стандартными 5х- и З'-концами. Такие копии получили
название «простых». Между тем Ds-элементы I типа имеют гораз-
до более сложную структуру. В то время как некоторые из них
содержат сразу по несколько концевых районов, другие являются
тесно сцепленными копиями противоположно ориентированных
Ас- или простых Ds-элементов. Предполагают, что разные вариан-
ты таких структур вполне могут различаться между собой по кон-
кретным механизмам возникновения хромосомных разрывов. Тем
не менее в основе всех этих механизмов, по-видимому, лежит
процесс аномальной транспозиции. Как оказалось, простейшая
транспозоноподобная структура, обеспечивающая высокую часто-
ту хромосомных разрывов, представляет собой стандартные 5х- и
З'-концы Ас-элемента, расположенные не в обычной (инвертиро-
ванной), а в прямой ориентации по отношению друг к другу. В
этой аномальной ситуации компетентными к транспозиции, по-ви-
димому, оказываются 5х- и Зх-концы, локализованные в разных
сестринских хроматидах. Вовлечение таких концов в процесс
56
транспозиции может приводить к образованию дицентрической
хромосомы, разрываемой в ходе последующих делений. Следует
подчеркнуть, что Ds-элементы I типа в силу своей неавтономности
могут участвовать в подобной аномальной транспозиции (т. е. ин-
дуцировать разрывы хромосом) только в присутствии полноцен-
ных Ас-копий. В соответствии с этим Ас-элементы способны
обеспечивать не только собственное перемещение, но и актива-
цию хромосомных разрывов, обусловленных Ds-элементами I
типа. Именно это обстоятельство послужило основой для обозна-
чения Ас (от activation).
En/Spm-элемент кукурузы. В отличие от Ас- и Ds-эле-
ментов, первый представитель САСТА-транспозонов кукурузы
был независимо описан двумя исследователями. В связи с этим он
получил сразу два названия: Еп (от Enhancer) и Spm (от Suppres-
sor-mutator), а потому обычно обозначается как En/Spm. Инвер-
тированные концевые повторы данного элемента образованы
идентичными 13-нуклеотидными последовательностями 5'-САС-
TACAAGAAAA-3', абсолютно необходимыми для обеспечения
его мобильности. Отсутствие в этой последовательности всего
лишь двух первых нуклеотидов резко снижает частоту транспози-
ции. 5Z- и З'-субтерминальные области En/Spm-элемента имеют
различную длину (приблизительно 180 и 300 п.н. соответственно)
и в сумме содержат 24 копии слабо гетерогенного 12-нуклеотид-
ного мотива 5Z-TAAGAGTGTCGG-3Z. С внутренней области пол-
ноценного En/Spm-элемента считывается один крупный транс-
крипт, преобразующийся в результате альтернативного сплайсинга
в две матричные РНК размером 2.4 и 6 т. п. н. Продуктами этих
мРНК являются белки ТпрА и TnpD соответственно.
Молекулы белка ТпрА эффективно связываются с неметилиро-
ванными копиями субтерминального мотива, а также содержат в
своем С-концевом домене типичные сигналы, отвечающие за обра-
зование агрегатов. Судя по своей полной неспособности связы-
ваться с инвертированными концевыми повторами, эти молекулы,
по-видимому, выполняют лишь вспомогательную роль, обеспечи-
вая тесное сближение концов элемента. Таким образом, функцио-
нально активной транспозазой в случае En/Spm-элемента, скорее
всего, является белок TnpD. Вместе с тем у этого белка пока не
удалось выявить ни ДНК-связывающей, ни эндонуклеазной актив-
ности.
Итак, внутренняя область элемента En/Spm кодирует двухкомпо-
нентную систему белков, способную обеспечивать его автономное
перемещение даже в других видах растений (например, в табаке,
картофеле и арабидопсисе). Различные делеции, затрагивающие
структуру этой области, приводят к возникновению разнообразных
неавтономных копий, получивших обозначение I/dSpm.
Mu-элементы кукурузы получили свое название от на-
блюдаемого в их присутствии очень высокого уровня инсерцион-
ного мутагенеза (до 10-4 на ген, на поколение). Этот эффект свя-
57
зан не только с активным перемещением Mu-элементов, но и с их
способностью к постепенному повышению своей копийности за
счет так называемой дупликативной транспозиции (не путать с
репликативной транспозицией!). В основе данного явления лежат
два следующих процесса (рис. 1.14):
стандартная нерепликативная транспозиция Ми-элемента,
приводящая к возникновению двунитевой бреши в месте его
исходной локализации;
репарация возникшей двунитевой бреши за счет однонитево-
го участка ДНК из состава сестринской хроматиды (или го-
мологичной хромосомы, если она также несет Mu-элемент в
соответствующем положении).
Эти процессы приводят к тому, что на месте мигрировавшей
копии Mu-элемента происходит восстановление ее первоначаль-
ной структуры. Теперь в геноме наряду с «исходной» (восстанов-
ленной) копией транспозона присутствует еще и «новая» (мигри-
ровавшая) копия. В дальнейшем каждая из них способна к анало-
гичным актам дупликативной транспозиции, в результате чего
копийность Mu-элемента может возрастать в несколько раз всего
за одно генеративное поколение. По этой же причине подавляю-
щее большинство (до 90 %) гибридов F2, полученных в скрещива-
ниях между Mu-содержащими и Mu-несодержащими линиями,
несут в своих геномах хотя бы одну копию Mu-элемента. Таким
---------1 Ми |-------//---------
---------1 Ми |-------//---------
Появление бреши в одном из гомологов
вследствие транспозиции Ми-элемента
1 Ми F
Мй~|-
Застраивание бреши за счет
гомологичной рекомбинации
Полное восстановление мигрировавшей
копии транспозона
-------1 Mu F
-------1 ми I
Рис. 1.14. Дупликативная транспозиция Ми-элемента.
58
образом, наследование активно перемещающихся Ми-элементов
обычно осуществляется по неменделевскому типу.
Характерной структурной особенностью всех Ми-элементов
являются их длинные инвертированные концевые повторы (при-
близительно 220 п. н.), имеющие достаточно высокий уровень го-
мологии между разными копиями. Между тем структура внутрен-
ней области Mu-элементов может быть совершенно разной. Так,
полноценные копии, получившие обозначение MuDR, содержат в
своей внутренней области два независимо транскрибируемых мо-
заичных гена MUDR-А и MUDR-В. Судя по тому, что продукт
гена MUDR-А обладает существенной гомологией с прокариоти-
ческими транспозазами, именно ему отводится основная роль в
перемещении Mu-элементов. В пользу такого предположения сви-
детельствует и тот факт, что крупные делеции в гене MUDR-A
приводят к полному подавлению транспозиции. Функция белка,
кодируемого геном MUDR-В, остается неизвестной.
В отличие от полноценных копий, неавтономные Ми-элементы
(Ми1-Ми8, МиА и др.), как правило, содержат в своих внутренних
областях некие абсолютно неродственные друг другу последова-
тельности, полностью замещающие собой гены MUDR-А и
MUDR-В. В большинстве случаев происхождение этих последова-
тельностей остается неясным.
Итак, основными отличительными чертами ДНК-транспозонов
растений являются:
наличие, как правило, коротких инвертированных повторов,
фланкирующих мобильный элемент;
способность к нерепликативной транспозиции путем выреза-
ния исходной копии элемента с последующей реинтеграцией
в геном. Все основные этапы этого процесса, по-видимому,
осуществляются высоко специфичной транспозазой, кодируе-
мой внутренней областью самого мобильного элемента. В
некоторых случаях мобильный элемент несет информацию
не только о самой транспозазе, но и о неких возможно вспо-
могательных белках;
наличие неавтономных ДНК-транспозонов, представляющих
собой разнообразные делеционные варианты полноценных
копий.
На этом фоне резко выделяются Mu-элементы кукурузы, отли-
чающиеся от остальных ДНК-транспозонов растений сразу по не-
скольким параметрам. В частности, Mu-элементы содержат длин-
ные инвертированные концевые повторы, способны к дупликатив-
ной транспозиции, а также могут замещать свою внутреннюю
область на различные совершенно неродственные друг другу по-
следовательности.
Биологическая роль транспозонов. До сих пор отсутствует
единое мнение о том, какова биологическая роль мобильных эле-
ментов. Многие авторы рассматривают транспозоны в качестве ти-
пичных представителей так называемой эгоистичной ДНК (selfish
59
DNA), не выполняющей никаких других функций, кроме своего
собственного воспроизведения. Эта гипотеза хорошо согласуется с
полным отсутствием каких-либо фенотипических различий (не
считая возможности возникновения новых инсерционных мутаций
и их последующих реверсий) между индивидуальными растения-
ми, содержащими и несодержащими мобильные элементы. С дру-
гой стороны, многие авторы отводят транспозонам определенную
роль в молекулярных процессах эволюции. Действительно, разбро-
санные по геному копии мобильных элементов представляют
собой вполне вероятные мишени для гомеологичной рекомбинации,
способной приводить к широкому спектру хромосомных перест-
роек. Кроме того, встраивание транспозона в ту или иную промо-
торную область может инактивировать часть ее регуляторных ком-
понентов и тем самым существенно изменить характер экспрессии
соответствующего гена. Оставляемые ДНК-транспозонами «следы»
приводят к изменению исходных сайтов мишени, а потому также
могут играть определенную роль в эволюционных процессах. На-
конец, кодируемая ретротранспозонами обратная транскриптаза,
по-видимому, может быть вовлечена в процесс дупликации различ-
ных транскрибируемых последовательностей и тем самым созда-
вать исходный материал для возникновения новых генов.
Вне зависимости от истинной роли мобильных элементов
чрезвычайно любопытен тот факт, что оба модельных объекта, яв-
ляющихся у растений источниками автономно перемещающихся
ДНК-транспозонов (кукуруза и львиный зев), относятся к культур-
ным формам. Действительно, геном львиного зева содержит как
минимум 2 семейства подобных генетических элементов (Taml и
ТатЗ), а геном кукурузы — по меньшей мере 4 (Ac, Bg, En/Spm и
MuDR). Между тем дикорастущим видам, как правило, свойствен-
ны лишь неавтономные (дефектные) ДНК-транспозоны. Вполне
вероятно, что в геномах дикорастущих видов присутствуют и пока
еще не выявленные полноценные копии мобильных элементов. В
этом случае, судя по неподвижности дефектных копий, полноцен-
ные ДНК-транспозоны, по всей видимости, должны быть инакти-
вированы некими хозяйскими регуляторными системами. Таким
образом, нельзя исключить, что столь ярко выраженная актив-
ность ДНК-транспозонов, наблюдаемая у львиного зева и кукуру-
зы, является побочным эффектом искусственного отбора.
1.13. САТЕЛЛИТНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ
Эукариотический геном, как правило, содержит целый ряд
многократно повторенных нуклеотидных последовательностей,
несколько отличающихся от основной массы хромосомной ДНК
по соотношению между А—Т и G—С парами. В ходе фракциони-
рования геномной ДНК в градиенте плотности (например, в гради-
енте хлорида цезия) подобные последовательности образуют более
60
«легкие» или более «тяжелые» добавочные зоны, а потому получи-
ли общее название сателлитная ДНК, Как оказалось, сателлит-
ные повторы характеризуются неслучайной локализацией и тесно
ассоциированы с гетерохроматиновыми областями. По мере разви-
тия конкретных представлений о структурно-функциональной ор-
ганизации генома некоторые типы сателлитных последовательнос-
тей оказались выделенными во вполне самостоятельные классы. В
частности, подобную эволюцию уже претерпели теломерные и
прицентромерные повторы, а также отдельные представители мо-
бильных генетических элементов. В связи с этим понятие сател-
литная ДНК постепенно утрачивает свой первоначальный смысл
и в настоящее время обычно используется для обозначения мно-
гократно повторенных некодирующих последовательностей, функ-
ция которых пока еще остается неизвестной.
Даже в пределах одного и того же генома сателлитные после-
довательности растений обычно представляют собой весьма неод-
нородную группу. Так, в геноме ржи подробно охарактеризованы
по меньшей мере 8 различных типов сателлитных повторов разме-
ром от 120 до 3500 п.н. Каждый тип подобных повторов обычно
локализуется далеко не во всех гетерохроматиновых областях, а
потому может служить весьма удобным молекулярным маркером
определенных хромосом. Кроме того, многим сателлитным после-
довательностям свойственна высокая видовая специфичность, что
существенно облегчает идентификацию хромосом у отдаленных
гибридов. Вместе с тем некоторые сателлитные повторы оказыва-
ются достаточно консервативными даже у относительно далеких
видов (например, у ржи, пшеницы, ячменя и овса). Любопытной
чертой многих сателлитных последовательностей является увели-
чение их копийности при введении клеток растения в культуру.
Механизм и биологический смысл этого явления остаются неиз-
вестными.
В состав хромосомной ДНК эукариот наряду с разнообразными
сателлитными последовательностями входят очень короткие (2—
4-нуклеотидные) мотивы, получившие название микросателлитов.
Такого рода мотивы, обнаруженные в геномах растений, живот-
ных и грибов, обычно представлены многочисленными тандемно
повторенными копиями, проявляющими достаточно высокий уро-
вень гетерогенности. В соответствии с этим микросателлитные
кластеры можно использовать в качестве удобных молекулярных
маркеров для построения высоконасыщенных генетических карт.
Подобный подход получил широкое распространение в генетике
млекопитающих и начинает все более успешно использоваться по
отношению к растениям. Так, для риса, несущего в своем геноме
от 5 до 10 тысяч микросателлитных копий, удалось выявить 120
независимых микросателлитных маркеров, охватывающих все 12
хромосом. В силу своей высокой гетерогенности некоторые из
этих маркеров существуют в виде по меньшей мере 25 различных
аллельных состояний.
61
1.1.6. ОСОБЕННОСТИ ОРГАНИЗАЦИИ РАСТИТЕЛЬНЫХ ГЕНОМОВ
В настоящее время полноценные данные о структуре расти-
тельных геномов почти полностью отсутствуют. В первую оче-
редь это связано с крупными размерами растительных геномов и
сложностью их полного секвенирования. Поэтому имеющиеся
сведения о принципах организации растительного генома, как
правило, получены при изучении разнородных и несцепленных
генов. Тем не менее с 1997 г. появились первые эксперименты,
позволившие с определенной уверенностью говорить о структуре
протяженных участков генома растений. Это стало возможным
после успешного секвенирования крупного внутреннего района
(около 1900 т. п. н.) 4-й хромосомы арабидопсиса. Указанный
район составляет около 2 % всего генома арабидопсиса, а потому
вполне может быть использован для оценки общей структуры
растительного генома.
Как показал анализ данного района, в его состав входит 206
ранее идентифицированных и 183 гипотетических гена (в сумме
389), что в пересчете на весь геном арабидопсиса дает порядка
21 000 генов. В геноме арабидопсиса гены локализованы на отно-
сительно небольшом расстоянии друг от друга, в среднем не пре-
вышающем 5 т. п. н. При этом не выявлено ни одного достоверно-
го случая перекрывающихся генов.
Наибольшую долю среди всех 206 идентифицированных генов
составляют гены, вовлеченные в контроль первичного или вторич-
ного метаболизма (32 %). Подобная ситуация, по-видимому, отра-
жает сложность метаболизма растений, изначально ориентирован-
ных на автотрофный тип питания. Вторая по многочисленности
группа (15 %) представлена генами, кодирующими разнообразные
транскрипционные белки. Обилие генов такого рода типично для
всех эукариот. Наконец, еще одна крупная группа генов (14 %)
вовлечена в контроль защитных реакций растения на неблагопри-
ятные условия внешней среды. Учитывая особенности жизненной
стратегии растений (см. Введение), многочисленность и этой груп-
пы генов выглядит вполне закономерной.
Начиная с 1997 г., темпы секвенирования генома арабидопсиса
неуклонно растут. Так, к середине 1999 г. удалось секвенировать
уже не менее 15 % генома, а через несколько лет (ориентировочно
в 2002—2003 гг.) данный научный проект должен быть полностью
завершен. В соответствии с этим уже совсем недалек тот день,
когда появятся первые точные сведения об организации раститель-
ного генома.
Как мы видели, арабидопсис характеризуется одним из на-
именьших геномов среди всех цветковых растений. По сравнению
с арабидопсисом многие виды растений (особенно однодольные)
имеют приблизительно в 100 раз более крупные геномы. Подобная
ситуация может быть интерпретирована двумя способами. Во-пер-
вых, можно предполагать, что геномы разного размера содержат
62
разное количество генов. В этом случае геном табака или лилей-
ных должен содержать приблизительно в 100 раз больше генов по
сравнению с арабидопсисом. Такое предположение представляется
весьма маловероятным. Во-вторых, различие геномов у разных
видов растений можно объяснять неодинаковой копийностью тех
или иных повторов на фоне приблизительно постоянного количества
кодирующих последовательностей. С этим предположением хоро-
шо согласуется тот факт, что компактный геном арабидопсиса со-
держит очень мало повторов (всего около 10 %), в то время как у
лилейных повторами представлена большая часть генома. В этом
плане следует напомнить, что целый ряд повторяющихся последо-
вательностей встречается в крупных растительных геномах в коли-
честве нескольких тысяч и даже миллионов копий. Таким обра-
зом, резкие различия в размере геномов, по-видимому, связаны у
растений с различной копийностью повторяющихся последова-
тельностей. При этом следует отметить, что особенно крупные ге-
номы, как правило, характерны для однодольных, которые рас-
сматриваются многими авторами в качестве более прогрессивной
ветви покрытосеменных по сравнению с двудольными. В соответ-
ствии с этим нельзя исключить, что увеличение размера генома
играло определенную роль в эволюции растений.
Важной особенностью высших растений является полное от-
сутствие ядерных или цитоплазматических плазмид (не считая ге-
нетического материала вирусов, попадающего в клетку при инфек-
ции). Это препятствует получению автономно поддерживающихся
векторов, необходимых для стабильной и строго контролируемой
трансформации высших растений. Впрочем, определенные надеж-
ды связывают с небольшими автономными плазмидами, обнару-
женными у некоторых водорослей, динофлагеллят и эвглен.
Глава 1.2
ГЕНЕТИЧЕСКИЙ МАТЕРИАЛ ПЛАСТИД
У современных фотосинтезирующих эукариот пластидная
ДНК (плДНК), как правило, представлена многокопийной кольце-
вой молекулой размером от 120 до 290 т. п. н. В большинстве слу-
чаев эта молекула содержит два протяженных инвертированных
повтора (IRa и IRb от inverted repeats), разделяющих ее на две
неравные уникальные области (LSC и SSC от large single сору и
small single copy соответственно; рис. 1.15, А). Длинные IR-повто-
ры являются хорошим субстратом для внутримолекулярной реком-
бинации, в результате которой уникальные области плДНК оказы-
ваются в инвертированной ориентации по отношению друг к другу
(рис. 1.15, Б). Таким образом, плДНК обычно представлена смесью
63
Рис. 1.15. Кольцевая структура пластидной ДНК.
А — структура пластидной ДНК у печеночника Marchantia polymorpha. Инвертиро-
ванные повторы IRah IRB(изображены в виде двух жирных дуг) разделяют пластид-
ную ДНК на два неравных участка SSC и LSC. Все гены, отмеченные с внутренней
стороны карты, транскрибируются по часовой стрелке. Все гены, отмеченные снару-
жи от карты, транскрибируются против часовой стрелки. В обозначении пластидных
генов тРНК опущена аббревиатура tm, поэтому ген tmA(UGC) приводится как A(UGC)
и т. д. Мозаичные гены помечены звездочкой; Б — возникновение изомерных вари-
антов пластидной ДНК за счет внутримолекулярной рекомбинации по инвертирован-
ным повторам (для удобства концы этих повторов маркированы латинскими буквами).
64
двух типов изомерных колец, различающихся между собой взаим-
ной ориентацией LSC- и SSC-областей.
Для некоторых высших растений (в том числе для табака, риса,
кукурузы, американской черной сосны и печеночника Marchantia
polymorpha), водорослей (Chlorella vulgaris, Odontella sinensis, Por-
phyra purpurea, Cyanophora paradoxa и Guillardia theta), а также фо-
тотрофных простейших (Euglena gracilis) удалось провести полное
секвенирование плДНК. Как показали полученные результаты, у
всех проанализированных видов в составе плДНК содержатся мно-
гочисленные гены, обслуживающие функционирование собствен-
ной органеллы. В соответствии со своим назначением данные гены
могут быть распределены на две следующие группы:
1) гены «домашнего хозяйства» пластид;
2) гены белков, непосредственно вовлеченных в процесс фото-
синтеза.
Соответствующие пластидные гены характеризуются высоко
консервативным взаимным расположением у подавляющего боль-
шинства фотосинтезирующих эукариот. Следует подчеркнуть, что
эта закономерность распространяется лишь на те виды, плДНК
которых содержит оба инвертированных повтора. Между тем для
эвгленовых, отдельных водорослей и некоторых высших растений
(в том числе для многих бобовых и большинства голосеменных)
типична плДНК, несущая всего лишь один IR-повтор и одновре-
менно обладающая резко измененным порядком генов. Судя по
этим данным, наличие двух протяженных инвертированных повто-
ров, по-видимому, обеспечивает относительную эволюционную
стабильность плДНК. Предполагают, что подобный эффект обус-
ловлен способностью IR-повторов связывать практически весь пул
рекомбинационных белков и тем самым сводить внутримолекуляр-
Таблица 1.9
Молекулярные характеристики пластидной ДНК
Представитель Размер пластидной ДНК, т.п.н. Размер IR-повтора, т.п.н.
Эвгленовые
Astasia* 73 0
Euglena 130—152 0
Красные водоросли
Cyanophora 127—136 10—11
Griffithsia 178 0
Криптофиты
Cyanophora 127—136 10—11
Guillardia 118 6
3 Генетика
65
Таблица 1.9 (продолжение)
Представитель Размер пластидной ДНК, т.п. и. Размер IR-повтора, т.п. и.
Бурые водоросли
Dictyota 123 5
Pylaeiella 191** 5
Диатомовые водоросли
Coscinodiscus 118 9
Cyclotella 128 17
Odontella 118 9
Желто-зеленые водоросли
Vaucheria 1 124 1 1 6
Золотистые водоросли
Ochromonas Olisthodiscus 121 150 15 22
Зеленые водоросли
Chlamydomonas 195—292 20—41
Chlorella 120—174 0—21
Codium 89 0
Spyrogyra 130 0
Мохообразные
Marchantia 121 10
Physcomitrella 122 9
П апоротникообразные
Папоротники (50 видов) I | 140—160 1 1 10—24
Голосеменные
Хвойные (7 видов) 120—130 0
Gingko 158 17
Покрытосеменные (цветковые)
470 родов из 96 семейств 130—160 10—30
Бобовые (18 родов) 120—130 0
Conopholis* (заразиховые) 50 0
Epiphagus* (заразиховые) 71 24
Pelargonium, Geranium 200—220 70—80
* Бесхлорофильные формы, вторично перешедшие к гетеротрофному типу
питания.
** У бурых водорослей пластидная ДНК разделена на две неравные по размеру
кольцевые молекулы.
66
ные перестройки лишь к обратимой инверсии LSC- и SSC-облас-
тей. Вместе с тем размер и структура самой IR-области могут
варьировать у разных фотосинтезирующих эукариот в достаточно
широких пределах (табл. 1.9).
Кольцевая пластидная ДНК очень близка по своей организации
типичному нуклеоиду прокариот. Этот факт, а также многочис-
ленные другие данные убедительно свидетельствуют в пользу сим-
биогенетического происхождения пластид из фототрофных бакте-
рий (см. гл. 1.4). В соответствии с этим для обозначения пластид-
ных генов обычно используется стандартная прокариотическая
номенклатура.
1.2.1. ГЕНЫ «ДОМАШНЕГО ХОЗЯЙСТВА» ПЛАСТИД
Пластидное «домашнее хозяйство» включает в себя соответст-
вующие репликативный, транскрипционный и трансляционный
аппараты. В то время как ДНК-полимеразный комплекс пластид,
по-видимому, кодируется исключительно ядерными генами, от-
дельные компоненты транскрипционного и трансляционного аппа-
ратов детерминированы самой плДНК. Генетический контроль
этих компонентов будет рассмотрен в следующих разделах.
Области ori пластидной ДНК. Несмотря на свое внешнее сход-
ство с нуклеоидами бактерий, кольцевая молекула плДНК реплици-
руется по весьма своеобразному механизму (рис. 1.16). Репликация
пластидной ДНК начинается с образования двух локальных распле-
тений (петель), как правило удаленных друг от друга на расстояние
в несколько тысяч нуклеотидных пар. В каждой из этих петель осу-
ществляется однонаправленный синтез ДНК, приводящий к даль-
нейшему вытеснению одной из цепей. Такие структуры принято на-
зывать петлями вытеснения или D-петлями (от displacement). Обе
растущие D-петли постепенно сближаются друг с другом, а затем
сливаются с образованием характерной 6-структуры, в которой син-
oriB 23S ori A 16S
Рис. 1.16. Инициация репликации пластидной ДНК.
А — образование двух D-петель, растущих по направлению друг к другу, Б — слия-
ние двух D-петель с образованием 0-структуры, одновременно растущей в обоих
противоположных направлениях (стрелками показаны направления репликации).
67
тез ДНК происходит уже на обеих цепях. В дальнейшем каждый из
двух ДНК-полимеразных комплексов огибает всю кольцевую моле-
кулу плДНК с образованием ее двух дочерних копий. В свою оче-
редь каждая из этих копий может продолжить процесс репликации
по механизму катящегося кольца.
Исходные D-петли формируются в двух областях ori (от origin
of replication), получивших обозначения oriA и опВ. У табака ми-
нимальные размеры oriA- и oriB-областей составляют 82 и 243
п. н. соответственно. Характерно, что в непосредственной близо-
сти от сайта инициации репликации каждая из этих областей
способна формировать достаточно крупную шпильку, а также со-
держит короткие прямые повторы (рис. 1.17). Вместе с тем кон-
кретный молекулярный механизм распознавания пластидных ori
остается неизвестным.
Как правило, области ori локализуются в пределах оперона ггп
(см. с. 72), входящего в состав инвертированного повтора IRA. При
этом для многих высших растений (в том числе для табака и горо-
G
G G
G G
CG
CG
ТА
GC
GC
С А
GC
GC
G&
CG
CG
Т С
АТ
GC
GC
CGGGTGAGATCCAATGTAGATCCAACTTTCGATTCACTCGTG TCTCTTCTCGA
5’
~Т G
1gG
ТА
АТ
GC
agc
А С
ТАТ
GC
GT
АТ
A G
gatt
GC
GC
atgtt
A
gcctg
GC
GC
AT
AT
C
A A
AT
AATATTATTATAGCCTGTCTCTGTAAGGTGAGApT AT
............— Rl~".......... GC
GGAATTTATCCTTTATTTTGTCCTTTCCATTCACT gg
_________________________ TA
...................... R1 R2]&
CGGATTTCTTCCGTTTCATCGATTTTGTCCGGATCCCACCTTT CTGTTTCTATT
R2 R2 3'
TTTCTCCTCACTTTCCACCCTTTCTTCTGTTT
Т С
Т /
С
А
Рис. 1.17. Структура шпилек, формирующихся в областях oriA (А) и
oriB (Я) пластидной ДНК табака.
Подчеркнуты короткие прямые повторы; стрелкой показано направление реплика-
ции.
68
Таблица 1.10
Копийность пластидной ДНК
Объект Копийность плДНК в одном нуклеоиде Количество нуклеоидов в пластиде Копийность плДНК в пластиде
Хламидомонада -15 -5 -80
Эвглена 3—15 20—30 100—300
Цветковые растения (пропластиды) Цветковые растения 1 1 1
(хлоропласты) 2—5 12—25 -60
ха) характерна консервативная локализация oriA -в спейсерном
районе между генами 23S- и 16S-pPHK. Конкретная локализация
области oriB менее консервативна. Наконец, у некоторых расте-
ний (например, у ослинника) плДНК содержит 4 ori: по 2 в каж-
дом IR-повторе. Появление дополнительных ori отмечено и в куль-
туре клеток табака.
Недифференцированные пластиды способны к интенсивному
делению. У высших растений этот процесс идет не только в ме-
ристематических, но и в уже дифференцирующихся (т. е. медлен-
но делящихся) клетках, а потому приводит к довольно быстрому
росту копийности пластид. Так, по мере развития листа шпината
количество пластид в одной клетке возрастает приблизительно в
10 раз и достигает от 150 до 200 (одновременно резко увеличива-
ется копийность пластидной ДНК; табл. 1.10). Все гены, контроли-
рующие деление пластид, обычно имеют ядерную локализацию.
Единственным исключением из этого правила являются две откры-
тые рамки считывания, недавно обнаруженные в составе плДНК у
Chlorella vulgaris. Данные рамки считывания высоко гомологичны
генам minD и minE, вовлеченным в генетический контроль кле-
точного деления у Е. coli. Таким образом, в основе деления плас-
тид и бактерий могут лежать принципиально сходные молекуляр-
ные механизмы.
Гены транскрипционных белков. Транскрипция пластидных
генов обеспечивается двумя типами РНК-полимераз, одна из кото-
рых кодируется ядром растительной клетки (см. с. 92), в то время
как другая — самой плДНК.
Собственная РНК-полимераза пластид обладает типичными
прокариотическими чертами и очень близка соответствующему
ферменту Е. coli. Основное различие между этими белками состо-
ит в том, что их минимальные комплексы образованы у эубакте-
рий тремя типами субъединиц (а2РР'), а у пластид — четырьмя
(a2PPzP"; N- и С-концевые фрагменты эубактериальной Р'-субъ-
единицы представлены в пластидах двумя самостоятельными поли-
пептидами Р' и Р"). В соответствии с прокариотической номенкла-
турой, пластидные гены, кодирующие структуру четырех вышепе-
69
речисленных субъединиц РНК-полимеразы, получили обозначение
гроА, гроВ, rpoCl и гроС2. При этом гены rpoB, rpoCl и гроС2
организованы в виде единого оперона rif, картирующегося вдали
от гена гроА (рис. 1.15, А).
Минимальный транскрипционный комплекс а2РР'Р" характе-
рен лишь для недифференцированных этиопластов. Между тем
при наличии освещения к этому комплексу присоединяется по
меньшей мере 8 дополнительных субъединиц, по-видимому коди-
руемых ядерными генами. Таким образом, функционирование соб-
ственной РНК-полимеразы пластид находится под двойным кон-
тролем и обеспечивается не только самой плДНК, но и генетичес-
ким материалом ядра.
Известно, что минимальный комплекс прокариотической РНК-
полимеразы сам по себе не может распознавать промоторные об-
ласти и приобретает эту способность лишь после присоединения
о-субъединицы. Такая же закономерность характерна и для собст-
венной РНК-полимеразы пластид. При этом особого внимания за-
служивает тот факт, что все обнаруженные в пластидах о-субъеди-
ницы кодируются исключительно ядерными генами (у арабидопси-
са их выявлено по меньшей мере три: SIG-A, SIG-B и SIG-C).
Несмотря на ядерный контроль, продукты генов SIG проявляют
высокую гомологию с о-субъединицами цианобактерий и эффек-
тивно распознают типичные промоторы прокариот. Таким обра-
зом, ядерная локализация генов SIG по всей видимости является
результатом перемещения части генетического материала пластид
в ядро (см. гл. 1.4).
Единственные кандидаты на роль пластидных генов, кодирую-
щих структуру транскрипционных факторов, обнаружены в плДНК
у красных водорослей и криптофитов. В данном случае речь идет о
двух открытых рамках считывания, гомологичных гену ompR (про-
дукт этого гена является транскрипционным фактором, специфи-
чески обеспечивающим экспрессию белков-поринов у E.coli).
Гены трансляционного аппарата пластид. Пластидный аппа-
рат белкового синтеза находится под двойным генетическим кон-
тролем. Действительно, в то время как одни компоненты этого
аппарата кодируются ядерными генами, другие (в том числе весь
пул рибосомных и транспортных РНК, а также приблизительно
треть рибосомных белков) детерминированы самой плДНК. На-
стоящий раздел посвящен рассмотрению соответствующих плас-
тидных генов.
Гены рРНК. Собственные рибосомы пластид резко отлича-
ются от цитоплазматических по целому ряду параметров (табл. 1.11).
Прежде всего в состав пластидной рибосомы входит значительно
меньшее количество белков, что приводит к заметному снижению
ее коэффициента седиментации (70S вместо 80S). Кроме того,
пластидная рибосома, как правило, содержит четыре типа рРНК,
три из которых (23S и 5S в большой субъединице, а также 16S —
в малой) характерны для эубактерий. Эти данные свидетельствуют
70
Таблица 1.11
Отличительные характеристики йластидных рибосом
Цитоплазматические рибосомы Пластидные рибосомы
Объект коэффици- ент седиментации количество рибосомных белков типы рРНК* специфическая чувствительность к антибиотикам коэффициент седиментации количество рибосомных белков типы рРНК* специфическая чувствительность к антибиотикам
Е. coli 70S (50S + 30S) 55 (34 + 21) 5S и 23S, 16S Хлорамфеникол, макролидные и аминогликозидные антибиотики — — — —
Хламидомо- нада 80S (60S + 40S) ? 5S, 5.8S и 25S, 18S Циклогексимид, анизомицин 70S (-40S + 50S) 64 (31 +33) 5S и 23S 16S Хлорамфеникол, макролидные и аминогликозидные антибиотики
Цветковые растения 80S (60S + 40S) ~80 (-50 + ~30) 5S, 5.8S и 25S, 18S То же 70S (30S + 50S) 57—65 (22—26 + + 35—39) 4.5S, 5S и 23S, 16S То же
* В верхней и нижней строчках приведены типы рРНК, характерные для большой и малой субъединиц соответственно.
о принципиальном сходстве пластидных и эубактериальных рибо-
сом, что в свою очередь служит дополнительным подтверждением
симбиотической теории происхождения пластид (гл. 1.4).
Несмотря на свой эубактериальный план организации, пластид-
ная рибосома обладает целым рядом отличительных черт. В част-
ности, в состав ее большой субъединицы обычно входит весьма
своеобразная рРНК (4.5S), гомологичная З'-концу 23S-pPHK и не
обнаруженная ни в одном другом типе рибосом. Таким образом,
пластидная рибосома содержит не три, как в случае эубактерий, а
четыре типа рРНК (16S, 23S, 5S и 4.5S). Все перечисленные типы
рРНК кодируются собственными пластидными генами, организо-
ванными в единый оперон ггп (от ribosomal RNA). Как и у типич-
ных эубактерий, в спейсерных областях этого оперона находятся
гены изолейциновой и аланиновой тРНК: tml(GAU) и trnA соот-
ветственно. Таким образом, конкретная структура оперона ггп
обычно выглядит следующим образом: 16S, tml(GAU), trnA, 23S,
4.5S и 5S.
Как уже было отмечено, в ходе эволюции генетического мате-
риала пластид произошла дупликация одного из его районов с об-
разованием двух инвертированных повторов IRah IRb. Поскольку
область этой дупликации исходно захватила весь оперон ггп
(рис. 1.15, А), каждый из его генов обычно представлен в плДНК
двумя идентичными копиями.
Гены рибосомных белков. Пластидные рибосомы очень
близки эубактериальным не только по спектру своих рРНК, но и
практически по всему комплексу рибосомных белков. Это сходст-
во ярко проявляется на уровне общего количества белковых моле-
кул, входящих в состав как целой рибосомы, так и ее отдельных
субъединиц (табл. 1.11). Кроме того, оба типа рибосом обладают
похожими иммунологическими характеристиками, а также чувст-
вительны к одним и тем же антибиотикам. Наконец, для большин-
ства белков пластидной рибосомы показана высокая степень гомо-
логии с соответствующими полипептидами эубактерий. По этой
причине для обозначения различных белков, входящих в состав
пластидной рибосомы, используют ту же номенклатуру, что и для
их эубактериальных гомологов. Аналогичный принцип использу-
ется и по отношению к генам гр1 и rps (от ribosomal protein large
и ribosomal protein small), кодирующим белки большой и малой
субъединиц пластидной рибосомы.
Как уже было отмечено, трансляционный аппарат пластид на-
ходится у всех фотосинтезирующих эукариот под двойным генети-
ческим контролем. Эта закономерность полностью справедлива и
для белков пластидной рибосомы: в то время как некоторые из
них кодируются самой плДНК, другие детерминированы ядерным
генетическим материалом. В соответствии с современными взгля-
дами подобная ситуация сложилась в процессе симбиотического
возникновения растительных клеток, сопровождавшегося горизон-
тальным переносом многих пластидных генов в ядро (см. гл. 1.4).
72
При этом особого внимания заслуживает тот факт, что плДНК
всех высших растений (за исключением вторично утративших спо-
собность к фотосинтезу) содержит весьма консервативный набор
из приблизительно 20 генов rpl/rps. В частности, у целого ряда
видов (в том числе у кукурузы, риса и табака) соответствующие
наборы полностью совпадают (табл. 1.12, В). Отдельные вариации
данного набора могут состоять в отсутствии одного единственного
гена (например, гр122 у гороха), в замене одного гена на другой
(гр121 вместо rpsl 6 у печеночника Marchantia) или же в наличии
дополнительной дефектной копии одного гена (псевдоген гр123 у
риса). Судя по этим данным, горизонтальный перенос большинст-
ва rpl/rps-генов в ядро, по-видимому, происходил на ранних этапах
эволюции фототрофных эукариот, еще до появления основных
групп высших растений.
Несмотря на свое эубактериальное происхождение, пластидные
гены грПб и rpsl6, как правило, имеют мозаичную структуру. Экс-
прессия этих генов предусматривает сплайсинг соответствующих
иРНК. Мозаичная структура характерна и для гена rpsl2, который
у многих видов организован весьма оригинальным образом. Дан-
ный ген представлен двумя автономными сегментами (5z-rpsl2 и
З'-rps 12), локализованными в плДНК на большом удалении друг от
друга. Таким образом, для образования цельного рибосомного
белка S12 необходим транс-сплайсинг между двумя транскрипта-
ми, независимо считанными с сегментов 5'-rpsl2 и З'-rps 12 (см.
с. 98).
Гены трансляционных факторов. Подавляющее боль-
шинство трансляционных факторов, специфически обслуживаю-
щих функционирование пластидных рибосом, кодируется ядерны-
ми генами. Типичным исключением из этого правила служит плас-
тидный ген infA, продуктом которого является фактор инициации
трансляции IF-1 (табл. 1.12, Г).
Гены тРНК. Несмотря на свое эубактериальное происхожде-
ние, система пластидных тРНК обладает рядом отличительных
особенностей. В первую очередь это проявляется в существенно
меньшем разнообразии пластидных тРНК по сравнению с их
эубактериальными аналогами (около 30 вместо 45—50 в случае
Е. coli и Bacillus subtilis). Исходя из принципа неоднозначного со-
ответствия (см. с. 38) столь узкий спектр тРНК не должен обес-
печивать трансляцию всех смысловых кодонов, встречающихся в
составе пластидных рамок считывания. Действительно, у многих
фотосинтезирующих эукариот ни один тип пластидных тРНК не
может при соблюдении этого принципа распознавать кодоны
CUU/C(Leu), CCU/C(Pro), GCU/C(Ala) и CGC/A/G(Arg). Между
тем отдельные пластидные тРНК способны полностью игнориро-
вать третье положение кодона, а потому успешно транслируют не
2, как в случае неоднозначного соответствия, а 4 синонимичных
триплета (табл. 1.13). Подобный принцип кодон—антикодонового
взаимодействия получил название «два из трех». Используя этот
73
Таблица 1.12
Пластидные гены высших растении
Ген Продукт Объект*
М. pol. | | P.thu. | N. tab. Е. vir. 1 О. sat. Z. mays
гроА А. Гены субъед а-субъединица иниц Р 4- НК-пол 4- имеразь 4- I 4- 4-
гроВ РНК-полимеразы Р-субъединица + 4- 4- 4- 4-
rpoCl РНК-полимеразы р'-субъединица +*’ 4- 4-" — 4- 4-
гроС2 РНК-полимеразы Р"-субъединица 4- 4- 4- — 4- 4-
16S РНК-полимеразы Б. Гены 16S-pPHK эибосом 4-4- шых PH 4- [К 4- 4-
23S 23S-pPHK 4-4- 4- 4-4- -Н- 4- 4-
5S 5S-pPHK 4-4- 4- 4-4- 4-4- 4- 4-
4.5S 4.5S-pPHK 4-4- 4- 4-4- 4-4- 4- 4-
гр12 В. Гены pi Рибосомный белок L2 ибосом! +" <ых бел: 4- КОВ 4-"4-" 4- 4- 4*
гр14 » » L14 4- 4- 4- — 4- 4-
гр16 » » L16 +" 4- 4-" 4- 4- 4-
гр120 » » L20 4- 4- 4- 4- 4- 4-
гр121 » » L21 4- — — — — —
гр122 » » L22 4- 4- 4-4- — 4- 4-
гр123 » » L23 4- 4- 4-4- — 4- 4-
гр132 » » L32 4- 4- 4- — 4- 4-
гр133 » » L33 4- 4- 4- 4- 4- 4-
гр136 » » L36 4- 4- 4- 4- 4- 4-
rps2 » » S2 4- 4- 4- 4- 4- 4-
rps3 » » S3 4- 4- 4- 4- 4- 4-
rps4 » » S4 4- 4- 4- 4- 4- 4*
rps7 » » S7 4- 4- 4-4- 4- 4- 4-
rps8 » » S8 4- 4- 4- 4- 4- 4-
rpsll » » S11 4- 4- 4- 4- 4- 4-
rpsl2 » » S12 +" 4- 4-"4-" 4- 4- 4-
rpsl4 » » S14 4- 4- 4- 4- 4- 4-
rpsl5 » » S15 4- 4- 4- — 4- 4-
rpsl6 » » S16 — 4- 4-" — 4- 4-
rpsl8 » » S18 + 4- 4- 4- 4- 4-
rpsl9 » » S19 4- 4" 4-4- 4- 4- 4-
Г. Гены трансляционных факторов
infA | Фактор инициации IF-1 I + | + I + | + I + | +
74
Таблица 1.12 (продолжение)
Ген Продукт Объект*
М. pol. | Р. thu. | N. tab. | Е. vir. О. sat. Z. mays
Д. Гены т] ранспортных РНК
trnA tPHKai*(UGC) +"+” +” +"+" — 4-"4-" 4-’Ч"
tmC tPHKc>!(GCA) + + + — 4- 4-
tmD tPHKa’₽(GUC) + + + 4- 4- 4-
trnE tPHK0I“(UUC) + + + + 4- 4-
tmF TPHKphe(GAA) + + + + 4- 4-
trnG tPHK0|x(UCC) +” +" +" — 4-" 4-"
tmG tPHKG'^GCC) + + + — 4- 4-
tmH tPHKh“(GUG) + 4-4- + + 4-4- 4-4-
trnl tPHKIIc(GAU) +"+" +" +"+" +"+" 4-" 4-" 4-" 4-"
trnl tPHKIIc(CAU) + 4-4- ++ — -Н- 4-4-
tmK tPHKl!”(UUU) +" +" +" — 4-" 4-"
tmL tPHKu“(CAA) + + ++ + 4-4- 4-4-
OtrnL tPHKu“(UAA) +' 4- 4- 4-'
trnL tPHKu“(UAG) — + — — 4- 4-
tmM tPHKm«(CAU) + + + + 4- 4-
trnfM TPHKfMa(CAU) + + + + 4- 4-
tmN tPHKa’"(GUU) ++ + ++ + 4-4- 4-4-
tmP tPHK^GGG) + + + + — —
trnP tPHK^UGG) — + — — 4- 4-
tmQ tPHKci"(UUG) + + + 4- 4- 4-
tmR tPHK-^UCU) + + + — 4- 4-
tmR tPHK^KACG) ++ + 4-4- -Н- -Н- 4-4-
trnR tPHK^CCCG) + — — — — —
tmS tPHKs“(UGA) + + + 4- 4- 4-
tmS tPHK^GCU) + ++ + — 4- 4-
tmS tPHKs“(GGA) + + + 4- 4- 4-
trnT tPHK^UGU) + + + — 4- 4-
trnT tPHK^GGU) + ++ + — 4- 4-
tmV tPHKv*'(GAC) ++ + 4-4- — -Н- 4-4-
tmV tPHKVjI(UAC) +" 4- +" — 4-" 4-"
tmW tPHKTip(CCA) + + + 4- 4- 4-
tmY TPHKT>r(GUA) + + 4- 4- 4- 4-
E. Гены, контролирующие биосинтез фотосинтетических пигментов
chlB Субъединица прото- хлорофиллид редуктазы + + — — — —
chlL То же + + — — — —
chlN » » + + — — — —
Ж. Гены, кодирующие белковые компоненты фотосистемы I
psaA Апопротеин А1 + + + — 4- 4-
psaB Апопротеин А2 + + + — 4- 4-
75
Таблица 1.12 (продолжение)
Ген Продукт Объект*
М. pol. Р. thu. N. tab. Е. vir. 0. sat. Z. mays
psaC Субъединица VII + + + — + +
psal » VIII + + + — + +
psaJ » IX + + + — + +
psaM » M 3. Гены, кодирующие бел1 + совые к + омпоне! 4ТЫ фО1 'осистек 4Ы II —
psbA Белок DI + + + — + +
psbB Апопротеин СР-47 + + + — + +
psbC Апопротеин Р6 + + + — + +
psbD Белок D2 + + + — + +
psbE а-субъединица цитохрома ^559 + + + — + +
psbF р-субъединица цитохрома ^559 + + + — + +
psbH Фосфобелок весом 10 кДа + + + — + +
psbl Субъединица I + + + — + +
psbJ » J + + + — + +
psbK » К + + + — + +
psbL » L + + + — + +
psbM » М + + + — + +
psbN » N + + + — + +
psbT » Т + + + — + +
И. Гены, кодирующие белки пластидной электронно-транспортной цепи
petA Цитохром f +
petB Цитохром b6 +"
petD Субъединица IV комплекса цитохром b6-f +"
petG Субъединица V комплекса цитохром b6-f +
petL Субъединица комплекса цитохром b6-f +
ccsA Белок, обеспечивающий биогенез цитохрома с +
К. Гены пластидной АТФ-синтетазы
atpA а-субъединица комплекса CF1
atpB Р-субъединица комплекса CF1
atpE е-субъединица комплекса CFj
atpF Субъединица I комплекса CF0
76
Таблица 1.12 (продолжение)
Ген Продукт Объект*
М. pol. Р. thu. N. tab. Е. vir. О. sat. Z. mays
atpH atpl Субъединица III комплекса CF0 Субъединица IV комплекса CF0 + + + + + + — + + + +
Л. Гены пластидной НАД • Н-дегидрогеназы
ndhA ndhB Субъединица 1 » 2 4." — +" — + + +
ndhC » 3 + — + — + +
ndhD » 4 + — + — + +
ndhE » 4L + — + — + +
ndhF » 5 + — + — + +
ndhG » 6 + — + — + +
ndhH Субъединица весом 49 кДа + — + — + +
ndhl » I + — + — + +
ndhJ » J + — + — + +
ndhK » К + — + — + +
M. Гены, кодирующие структуру
рибулозо-1.5-бисфосфат-карбоксилазы/оксигеназы
rbcL 1 Большая субъединица 1 + 1 + 1 - 1 + 1 +
Н. Гены, контролирующие иные функции
accD Фермент биосинтеза + + + + + +
жирных кислот
clpP Протеаза + + + + + +
cysA Белок сульфат- + — — — — —
транспортного комплекса
cysT Тот же + — — — — —
matK Матураза + + + + + +
О. Открытые рамки считывания неизвестной функции (общее количество)
orf I ? I 30 I I 13 I I I 23
* Представлены данные, полученные для видов с полностью секвенированной
пластидной ДНК: М. pol. — Marchantia polymorpha (печеночник); Р. thu. — Pinus
thunbergii (американская черная сосна); N. tab. — Nicotiana tabacum (табак);
E. vir. — Epiphagus virginiana (заразиха — бесхлорофильное цветковое расте-
ние, вторично перешедшее к паразитизму); О. sat. — Oryza sativa (рис);
Z. mays — Zea mays (кукуруза). ' — мозаичные гены, несущие интроны I груп-
пы; " — мозаичные гены, несущие интроны II группы; ++ — гены, дуплицирован-
ные в составе IR-повторов;----отсутствие генов.
77
Таблица 1.13
Пластидный генетический код у печеночника Marchantia polymorpba
Кодон тРНК» Кодоновый индекс Кодон тРНК» Кодоновый индекс Кодон тРНК» Кодоновый индекс Кодон тРНК» Кодоновый индекс
UUU Phe (GAA) 1547 UCU Ser (GGA) 628 UAU Туг (GUA) 826 UGU Cys (GCA) 219
UUC » 97 UCC » 71 UAC » 95 UGC » 41
UUA Leu (UAA) 1867 UCA Ser (UGA) 359 UAA ter 84 UGA ter 2
UUG Leu (UCG) 203 UCG » 48 UAG » 5 UGG Trp (CCA) 441
сии Leu (UAG) 524 ecu Pro (GGG) 477 CAU His (GUG) 388 CGU Arg (ACG) 357
CUC » 25 CCC » 39 CAC » 62 CGC » 47
CUA » 143 CCA Pro (UGG) 367 CAA Gin (UUG) 887 CGA Arg (CCG) 258
CUG » 25 CCG » 49 CAG » 53 CGG » 22
AUU He (GAU) 1519 ACU Thr (GGU) 616 AAU Asn (GUU) 1256 AGU Ser (GCU) 414
AUC » 101 ACC » 57 AAC » 175 AGC » 46
AUA » 708 АСА Thr (UGU) 499 AAA Lys (UUU) 1764 AGA Arg (UCU) 382
AUG Met (CAU) 430 ACG » 42 AAG » 78 AGG » 24
fMet (CAU) 91
GUU Vai (GAC) 648 GCU Ala (UGC) 779 GAU Asp (GUC) 735 GGU Gly (GCC) 627
GUC » 47 GCC » 66 GAC » 72 GGC » 82
GUA Vai (UAC) 450 GCA » 452 GAA Glu (UUC) 1133 GGA Gly (UCC) 678
GUG » 48 GCG » 50 GAG » 85 GGG » 88
♦ В графе «тРНК» приведены соответствующие аминокислота и антикодон.
принцип наряду со стандартной схемой «неоднозначного соответ-
ствия», пластидный аппарат белкового синтеза способен функци-
онировать даже при столь узком разнообразии тРНК.
Весь пул пластидных тРНК кодируется приблизительно 30 раз-
личными генами tm (от transfer RNA; табл. 1.12, Д), локализован-
ными в самой плДНК. Подавляющее большинство этих генов
представлено в плДНК одной единственной копией. Данное пра-
вило не распространяется лишь на отдельные гены tm, подвергши-
еся дупликации в составе инвертированных повторов IRA и IRB.
Как уже было отмечено, исходная дупликация, приведшая к обра-
зованию IR-повторов, целиком захватила оперон ггп. В соответст-
вии с этим практически все фотосинтезирующие эукариоты (за
исключением вторично утративших IR-повторы) содержат в своей
плДНК по две копии генов trnl(GAU) и trnA, являющихся обыч-
ными компонентами данного оперона. Следует подчеркнуть, что у
разных видов IR-повторы могут включать в себя не только сам
оперон ггп, но и непосредственно примыкающие к нему области,
весьма различные по своей длине. По этой причине общее коли-
чество дуплицированных генов trn может несколько варьировать и
достигать в отдельных случаях (например, у табака) даже семи:
tml(CAU), trnL(CAA), tmV(GAC), tml(GAU), trnA, tmR(ACG) и
tmN. Наконец, в плДНК некоторых фотосинтезирующих эукариот
обнаружены дефектные копии отдельных генов trn (псевдоген tmP
у печеночника Marchantia polymorpha).
Несмотря на то что каждому пластидному гену tm можно по-
ставить в соответствие весьма сходный с ним эубактериальный го-
молог, между этими генами имеется ряд существенных отличий.
Так, в подавляющем большинстве случаев пластидные гены tm не
содержат З'-концевого тринуклеотида ССА, который присоединя-
ется к молекуле тРНК уже посттранскрипционно. Единичные ис-
ключения из этого правила описаны для плДНК некоторых водо-
рослей, в том числе для генов trnl(GAU), tmA(UGC), tmG(UCC) и
tmM у хлореллы. Кроме того, для многих пластидных генов trn
характерна интрон-экзонная структура (см. раздел 1.2.3).
1.22. ГЕНЫ, НЕПОСРЕДСТВЕННО КОНТРОЛИРУЮЩИЕ
ПРОЦЕСС ФОТОСИНТЕЗА
Фотосинтез является фундаментальным биологическим процес-
сом, в ходе которого энергия солнечного света используется для
превращения неорганических веществ (как правило, СО2 и Н2О) в
различные типы углеводов. Поскольку синтезированные углеводы
в дальнейшем могут быть преобразованы в любые органические
соединения, подобный тип питания получил название фототроф-
ного.
Весь спектр молекулярных процессов фотосинтеза принято
подразделять на две фазы: световую и темновую. В течение пер-
79
вой из них (т. е. при непосредственном освещении) энергия сол-
нечного света поглощается фотосинтетическими пигментами и
передается на особые реакционные центры, получившие название
фотосистем 1 и //. Подобные центры способны эффективно пре-
образовывать поглощенную солнечную энергию в химическую, в
результате чего инициируется серия окислительно-восстанови-
тельных реакций с образованием АТФ, а также восстановленной
формы НАД (НАД • Н). В свою очередь эти соединения расходу-
ются на восстановление свободного СО2 и его присоединение к
акцепторной органической молекуле. Последний этап может про-
исходить и в отсутствие света, а потому получил название темно-
вой фазы фотосинтеза.
У всех фототрофных эукариот молекулярный аппарат фо-
тосинтеза имеет достаточно сходную организацию. В первую оче-
редь это проявляется в высокой консервативности ключевого
фотосинтетического фермента (рибулозо-1.5-бисфосфат-карбо-
ксилазы/оксигеназы), способного присоединять молекулы СО2 к
пятичленному акцепторному углеводу — рибулозо-1.5-бисфосфа-
ту. Высокая степень сходства характерна и для основных фото-
синтетических пигментов, которые у всех фототрофных эукариот
представлены различными формами хлорофилла (рис. 1.18, А;
табл. 1.14). Наконец, весьма консервативными являются и многие
другие комплексы, осуществляющие различные этапы фотосинте-
за (см. ниже).
По многим чертам своего фотосинтетического аппарата фото-
трофные эукариоты весьма напоминают цианобактерий (табл. 1.14).
Судя по этим данным, именно цианобактерии, скорее всего, явились
эволюционными предшественниками пластид (см. гл. 1.4). Как уже
было отмечено, в ходе симбиотического происхождения пластид
многие гены исходного фототрофного эндосимбионта подверглись
горизонтальному переносу в ядро. В результате этого процесса одни
комплексы функционально взаимосвязанных генов целиком мигри-
ровали в ядро, в то время как другие оказались в той или иной степе-
ни распределенными между пластидной и ядерной ДНК. Таким об-
разом, у всех фототрофных эукариот молекулярный аппарат фото-
синтеза находится под двойным контролем со стороны как ядерных,
так и собственно пластидных генов.
Гены, контролирующие световую фазу фотосинтеза. Световая
фаза фотосинтеза обслуживается несколькими молекулярными
комплексами, весьма консервативными у большинства фототроф-
ных эукариот. К числу этих комплексов относятся:
. ферментативные системы, осуществляющие биосинтез ос-
новных фотосинтетических пигментов;
а белковые компоненты светособирающих антенн;
а фотосистемы I и II, способные преобразовывать поглощен-
ную солнечную энергию в химическую;
а система транспорта возбужденных электронов, обеспечиваю-
щая поляризацию внутренних мембран хлоропласта;
80
Хлорофилл а Хлорофилл b Р-каротин
Рис. 1.18. Фотосинтетические пигменты растений: хлорофиллы (А) и
каротиноиды (Я).
. комплекс пластидной АТФ-синтетазы;
. комплекс пластидной НАД • Н-дегидрогеназы.
Генетический контроль каждого из вышеперечисленных комп-
лексов будет рассмотрен нами по отдельности.
Гены, контролирующие биосинтез основных фо-
тосинтетических пигментов. Как уже было отмечено, ос-
новные фотосинтетические пигменты представлены у всех фото-
трофных эукариот различными формами хлорофилла (рис. 1.18, А;
81
Таблица 1.14
Основные фотосинтетические пигменты
Организмы Хлорофиллы Кароти- ноиды Фикобили- протеины
а b с d
Высшие растения + + — — + —
Зеленые водоросли + + — — + —
Эвгленовые + + — — + —
Бурые водоросли + — + — + —
Диатомовые водоросли + — + — + —
Золотистые водоросли + — + — + —
Желто-зеленые водоросли + — + — + —
Динофлагелляты + — + — + —
Криптофиты + — + — + +
Красные водоросли + — — + + +
Цианобактерии + — — — + +
табл. 1.14). Несмотря на свое структурное сходство, эти пигменты
существенно отличаются друг от друга своими спектрами погло-
щения, а потому придают разную окраску дифференцированным
хлоропластам. Так, хлорофиллы а и Ь, присущие эвгленовым, зе-
леным водорослям и высшим растениям, обеспечивают зеленую
окраску вышеперечисленных организмов. Между тем замена хло-
рофилла b на с-форму (например, у золотистых, желто-зеленых,
диатомовых и бурых водорослей, а также динофлагеллят) приво-
дит к различным оттенкам желтого или коричневого цвета. Нако-
нец, сочетание хлорофиллов а и d с фикобилинами (еще одним
типом фотосинтетических пигментов, подробнее см. гл. 1.4) опре-
деляет характерную окраску красных водорослей.
Структурное сходство различных форм хлорофилла предпо-
лагает единую схему их биосинтеза (рис. 1.19). При этом подавля-
ющее большинство генов, непосредственно контролирующих био-
синтез хлорофилла, имеет ядерную локализацию. Типичными ис-
ключениями из данного правила являются пластидные гены сЫВ,
chlL и chlN (от chlorophyll), кодирующие различные субъединицы
свето-независимой протохлорофиллид редуктазы. Этот фермент,
обеспечивающий конститутивный синтез хлорофилла у голосе-
менных, печеночников и многих водорослей, полностью отсутст-
вует у всех цветковых растений (табл. 1.12, Е). Наконец, следует
отметить, что одним из ранних предшественников тетрапирроль-
ных группировок (в том числе гема и всех форм хлорофилла) яв-
ляется 8-аминолевулиновая кислота, которая в свою очередь обра-
зуется из глутаминового остатка пластидной глутамил-тРНК. В со-
ответствии с этим пластидный ген trnE(UUC) также участвует в
непосредственном контроле биосинтеза хлорофилла.
Весьма существенную роль в первичном поглощении света иг-
рают и различные каротиноиды (рис. 1.18, Я), являющиеся естес-
82
Дивинил протохлорофиллид -----► Хлорофилл с2
Моновинил протохлорофиллид ---► Хлорофилл С|
Хлорофиллид а
Геранилгеранил хлорофиллид а
Хлорофилл а
Хлорофилл d
Хлорофилл b
Рис. 1.19. Общая схема биосинтеза хлорофиллов.
твенными компонентами практически любой светособирающей
антенны. Тем не менее основная функция этих молекул, по-види-
мому, состоит в фотопротекции, т. е. в поглощении избытка со-
лнечной энергии, представляющего собой серьезную опасность
для клетки. Действительно, многочисленные мутанты, полностью
лишенные каротиноидов, как правило, сохраняют нормальную
способность к фотосинтезу, но проявляют повышенную чувстви-
тельность (вплоть до гибели) в условиях интенсивного освеще-
ния. Кроме того, в разнообразных светособирающих антеннах
каротиноиды обычно представлены существенно меньшим коли-
чеством молекул, нежели различные формы хлорофилла. Так, в
состав антенн, обеспечивающих функционирование фотосистемы
II у цветковых растений, входят 7 хлорофиллов а, 5 хлорофиллов
b и лишь 2 молекулы каротиноидов. Обратное соотношение
между каротиноидами и хлорофиллами (4:1) характерно лишь
для внемембранных светособирающих комплексов динофлагел-
лят. В соответствии с этим каротиноиды обычно относят не к
основным, а лишь к вспомогательным фотосинтетическим пиг-
ментам.
83
Гены, кодирующие белковые компоненты фото-
систем. Фотосистема I представлена у фототрофных эукариот
крупным мультисубъединичным комплексом, включающим в себя
по меньшей мере 12 каталитических, регуляторных и структурных
белков. Соответствующие гены, получившие обозначение psa (от
photosystem I), приблизительно поровну распределены между
пластидной и ядерной ДНК (табл. 1.12, Ж). При этом многие ядер-
ные гены PSA (например, PSAD, PSAE, PSAF, PSAH и PSAL у
диплоидных видов Nicotiana) подверглись дупликации, а потому
образуют небольшие высоко гомологичные семейства. Так, гены
PSAD и PSAE присутствуют в геноме Nicotiana sylvestris в виде
двух близких друг другу копий, а ген PSAH — в виде трех.
Двойной генетический контроль весьма характерен и для бел-
ков, входящих в состав фотосистемы II. Действительно, примерно
две трети всех генов psb (от ghotosystem II), кодирующих различ-
ные белки этой фотосистемы, локализованы в самой пластидной
ДНК, в то время как остальные оказались перенесенными в ядро.
Подобная ситуация характерна для всех исследованных высших
растений (табл. 1.12, 3).
Гены, кодирующие белки светособирающих ан-
тенн. Каждая фотосистема тесно ассоциирована с особыми пиг-
ментно-белковыми комплексами, получившими название светосо-
бирающих антенн. В зависимости от своего молекулярного состава
подобные комплексы могут быть подразделены на две следующие
группы:
хлорофиллсодержащие антенны, свойственные всем группам
фотосинтезирующих эукариот;
. фикобилинсодержащие антенны (фикобилисомы), характер-
ные только для красных водорослей и криптофитов.
Несмотря на свое внешнее разнообразие (рис. 1.20), все хлоро-
филлсодержащие антенны имеют достаточно сходный состав даже
у представителей таксономически удаленных групп. Действитель-
но, типичными компонентами подобных антенн являются опреде-
ленные формы хлорофилла (а/b или а/с), каротиноиды, а также
небольшое семейство весьма консервативных хлорофилл-связыва-
ющих белков. Судя по этим данным, различные типы хлорофилл-
содержащих антенн, по-видимому, возникли в результате последо-
вательной дивергенции одного и того же исходного светособираю-
щего комплекса.
Весь спектр антенных хлорофиллсвязывающих белков нахо-
дится под ядерным генетическим контролем. При этом соответст-
вующие гены, количество которых обычно варьирует от 10 до 20
на геном, гомологичны друг другу не только в пределах одного
вида, но и среди всех фотосинтезирующих эукариот (рис. 1.21).
Следует отметить, что у высших растений, зеленых водорослей и
эвгленовых подобные гены дивергировали на два достаточно близ-
ких семейства, каждое из которых кодирует антенные белки, об-
служивающие только один тип фотосистем.
84
Таблица 1.15
Пластидная АТФ-синтетаза растении
Обозначение комплекса Субъединичный состав АТФ-синтетазы
Е. coli пластид
для бактерий. а а(П)*
CFj для пластид Р Р(П)
Y У(Я)
8 8 (Я)
е е(П)
Fo для бактерий, а CF0—IV (П)
CF0 для пластид b CF0—I (П)
с CF0—III (П) CF0—II (Я)
* В скобках указана локализация соответствующе-
го гена: П — в пластидной ДНК, Я — в ядерной.
Гены белковых компонентов электронно-транс-
портной цепи. Белковые компоненты пластидной электронно-
транспортной цепи также находятся под двойным генетическим
контролем. При этом в плДНК высших растений обычно присут-
ствуют 4 гена pet (petA, petB, petD и petG; от photosyntesis electron
transport), кодирующие различные субъединицы цитохрома b6/f.
Гены пластидной АТФ-синтетазы. Пластидная АТФ-
синтетаза очень близка бактериальной. Это проявляется не только
в существенном сходстве субъединичной организации обоих фер-
ментов (табл. 1.15), но и в высоком уровне гомологии между соот-
ветствующими друг другу полипептйдами. Вместе с тем мембран-
ный домен пластидной АТФ-синтетазы (CF0, рис. 1.22) образован
не тремя, как у бактерий, а четырьмя белками. Таким образом,
структура всей пластидной АТФ-синтетазы кодируется девятью ге-
нами atp (от ATP-synthetase), шесть из которых (atpA, atpB, atpE,
atpF, atpH и atpl) обычно локализованы в самой плДНК, а осталь-
ные три — в ядре. При этом у большинства высших растений
пластидные гены atp организованы в виде двух оперонов: atpB—
atpE и atpA—atpF—atpH—atpl.
Гены пластидной НАД • Н-дегидрогеназы. Всоставэтого
мультисубъединичного комплекса обычно входит 11 белков, кото-
рые у большинства высших растений кодируются самой плДНК.
Между тем у всех исследованных водорослей плДНК полностью ли-
шена соответствующих генов (ndh, от NADH-dehydrogenase). Сход-
ная ситуация типична и для голосеменных, однако в этом случае (на-
пример, у американской черной сосны) в составе плДНК содержит-
ся несколько псевдогенов ndh. Таким образом, у водорослей и
голосеменных все субъединицы пластидной НАД-Н-дегидрогеназы,
по-видимому, кодируются ядерными генами.
85
220 230
Рис. 1.20. Сходная организация хлорофилл-содержащих белков в составе светособирающих антенн у цветковых растений (горох, А) и
рафидофитовых водорослей (Heterosigma carterae, Б).
Показано пространственное расположение ключевых трансмембранных участков хлорофилл-содержащих белков. Латинскими буквами обозначены различ-
ные аминокислоты, наиболее консервативные положения выделены черным цветом. Молекулы хлорофилла изображены в виде схематичных порфириновых
колец.
210
Рис. 1.20 (продолжение).
ц
Isochrysis galbana Fcpl
Odontella sinensis Fcpl
Phaeodactylum tricomutum FcpB
Phaeodactylum tricomutum FcpA
Phaeodactylum tricomutum FcpC
Macrocystis pyrifera Fcp6
Macrocystis pyrifera Fcpl
Macrocystis pyrifera Fcp3
Laminaria saccharina Fcpl
Giraudyopsis stellifera Fcpl
Heterosigma carterae Fcpl
Heterosigma carterae Fcp2
Amphidinium carterae iPcp 1
Amphidinium carterae iPcp4
Guillardia theta Cacl
Guillardia theta Cac2
Porphyridium cruentum Lhcal
Porphyridium cruentum Lhca2 ---------
Lycopersicon esculentum Lhcb3*l
Lycopersicon esculentum Lhcb1*2
Pinus sylvestris Lhcbl*2
Lemna gibba Lhcb2
Licopersicon esculentum Lhcb2*l
Polystrichum munitum Lhcb
Physcomitrella patens Lhcb
Euglena gracilis Lhcb4
Euglena gracilis Lhcbl
Chlorarachnion sp. 621 Lhc-1
Chlorarachnion sp. 621 Lhc-2
Chlamydomonas reinhardtii Lhcb
Chlamydomonas moewusii Lhcb
Dunaliella salina Lhcb
Dunaliella tertiolecta Lhcbl Chla/b
Lycopersicon esculentum Lhcb5
Mantoniella squamata Lhcl
Mantoniella squamata Lhc2
Mantoniella squamata Lhc4
Lycopersicon esculentum Lhca3
Lycopersicon esculentum Lhca2
Lycopersicon esculentum Lhca4
Volvox carterae Lhca
Chlamydomonas stellata Lhca
Chlamydomonas reinhardtii Lhca
Lycopersicon esculentum Lhcal
Lycopersicon esculentum Lhcb6a
Arabidopsis thalianna Lhcb4
Euglena gracilis Lhca38
Euglena gracilis Lhca35
Рис. 1.21. Единое эволюционное древо хлорофиллсодержащих белков,
свойственных разным фотосинтезирующим эукариотам (обозначения Chi
a/b и СЫ а/с соответствуют хлорофилл а/с- и хлорофилл а/Ь-содержа-
щим белкам).
88
Рис. 1.22. Структура пластидной АТФ-синтетазы (CF0 и CFj— транс-
мембранный и надмембранный домены соответственно).
Гены, контролирующие темновую фазу фотосинтеза. Фермен-
тативные системы, обслуживающие темновую фазу фотосинтеза,
способны улавливать газообразный СО2 и обеспечивать его вклю-
чение в состав органических молекул. Практически все компонен-
ты данной системы кодируются ядерными генами. Единственным
исключением из этого правила является рибулозо-1.5-бисфосфат-
карбоксилаза/оксигеназа (RuBisCO), осуществляющая присоеди-
нение молекулы СО2 к акцепторному углеводу рибулозо-1.5-бис-
фосфату (рис. 1.23). Функционально активная RuBisCO представ-
ляет собой крупный гетеромерный комплекс, в состав которого
Карбоксилирование Гидролиз
’cH2OPOj- *СО2 ‘cH2OPOj“ Н2О
2с=о | __ но-с-‘со2 |
н-с-он Зс=о
4| 4|
н-с-он н-с-он
5СН2ОРО?- 5сн2оро|-
Рибулозо-1,5-бисфосфат
Промежуточное
нестойкое соединение
’cHjOPOj-
НО-С-*СО£
in
+
3СО2
н-с-он
5СН2ОРО32“
2 молекулы
3-фосфоглицерата
Рис. 1.23. Присоединение молекулы СО2 к акцепторному углеводу рибу-
лозо-1,5-бисфосфату за счет активности RuBisCO.
89
входят два типа субъединиц: 8 больших и 8 малых. Именно эти
субъединицы и могут кодироваться плДНК.
Структурный ген большой субъединицы RuBisCO (rbcL, от Ru-
BisCO large) имеет пластидную локализацию у всех фототрофных
эукариот за исключением динофлагеллят. Этот ген полностью сек-
венирован у более чем 2000 видов, а потому считается самым изу-
ченным у фотосинтезирующих организмов. Как показал большой
объем накопленных данных, кодирующая последовательность гена
rbcL характеризуется высокой степенью консервативности, что
убедительно свидетельствует о близости происхождения всех
типов пластид. Вместе с тем у представителей различных таксонов
пластидный ген rbcL может существенно варьировать по своему
интрон-экзонному строению.
У эндосимбиотических динофлагеллят из рода Symbiodinium
большая субъединица RuBisCO кодируется по меньшей мере двумя
ядерными генами. Один из членов этого мини-семейства содержит
в своей рамке считывания три полномерные кодирующие последо-
вательности RBCL, отделенные друг от друга двумя идентичными
69-нуклеотидными участками. Продуктом подобного гена, по-ви-
димому, является сквозная полипротеиновая молекула, которая в
дальнейшем подвергается протеолитическому расщеплению с обра-
зованием трех почти одинаковых субъединиц. Между тем второй
представитель этого же мини-семейства содержит только одну, но
сильно дивергировавшую последовательность RBCL.
Локализация гена RBCS, кодирующего малую (small) субъеди-
ницу RuBisCO, строго коррелирует со спектром основных фото-
синтетических пигментов. Так, для фототрофных эукариот, ис-
пользующих при фотосинтезе хлорофиллы а и b (т. е. для высших
растений, зеленых водорослей и эвгленовых), характерно наличие
весьма многочисленного семейства ядерных генов RBCS. Между
тем у всех эукариотических организмов, обладающих иными пиг-
ментными комплексами (в том числе у золотистых, желто-зеле-
ных, бурых, диатомовых и красных водорослей, а также крипто-
фитов и динофлагеллят), структурный ген малой субъединицы Ru-
BisCO локализован в самой плДНК.
В случае своей совместной пластидной локализации гены rbcL
и rbcS, как правило, составляют единый оперон. У золотистой во-
доросли Olisthodiscus luteus оба данных гена оказались встроенны-
ми в оперон ггп, а потому подверглись дупликации в составе ин-
вертированных повторов IRah IRb.
1.23. ОБЩЕЕ КОЛИЧЕСТВО ПЛАСТИДНЫХ ГЕНОВ
Итак, современные зеленые растения обычно содержат в своей
плДНК весьма консервативный набор из приблизительно 100
генов, участвующих (совместно с генетическим материалом ядра)
в контроле трех следующих функций.
90
1. Транскрипция пластидных генов. Со стороны пластид дан-
ная функция обеспечивается 4 генами гро, кодирующими различ-
ные субъединицы собственной РНК-полимеразы.
2. Автономный синтез белка. В контроле этого процесса при-
нимают участие:
. как правило, две копии оперона ггп, каждая из которых вклю-
чает в себя 4 гена рРНК;
около 20 генов rpl/rps, кодирующих белки пластидных рибо-
сом;
. ген infA, продуктом которого является трансляционный фак-
тор IF-1;
. приблизительно 30 генов тРНК.
3. Функционирование фотосинтетического аппарата. Данный
процесс обеспечивается примерно 40 пластидными генами.
Вместе с тем любая пластидная ДНК содержит довольно мно-
гочисленные открытые рамки считывания, функциональная роль
которых остается неизвестной. Некоторые из этих рамок характе-
ризуются высокой степенью консервативности, что убедительно
свидетельствует о значимости их продуктов. Тем не менее, учиты-
вая отсутствие соответствующих мутантов или гомологичных
генов с уже известными функциями, установить роль подобных
рамок считывания пока не представляется возможным.
Таким образом, у большинства зеленых растений суммарное
количество пластидных генов (включая открытые рамки считыва-
ния длиной не менее 30 кодонов) колеблется в пределах от ПО до
120. Данная закономерность не выполняется только у форм, вто-
рично утративших способность к фотосинтезу, а потому перешед-
ших к гетеротрофному типу питания. В этом случае (например, у
паразитического цветкового растения Epifagus virginiana и род-
ственного эвглене гетеротрофного простейшего Astasia longa)
наблюдается потеря существенной части плДНК, в том числе
практически всех генов, непосредственно контролирующих моле-
кулярный аппарат фотосинтеза. Между тем большинство генов
«домашнего хозяйства» пластид не только остаются в составе
плДНК, но и продолжают успешно экспрессироваться. Судя по
этим данным функциональная активность некоторых пластидных
генов абсолютно необходима для зеленых растений вне зависимос-
ти от наличия или отсутствия фотосинтеза. Одним из наиболее
вероятных претендентов на столь важную роль является пластид-
ный ген tmE(UUC), кодирующий структуру глутаминовой тРНК.
Как мы уже видели, эта молекула вовлечена в биосинтез всех тет-
рапиррольных соединений, к числу которых относятся не только
различные формы хлорофилла, но и незаменимые компоненты
фито- и цитохромов.
91
1.2.4. ЭКСПРЕССИЯ ПЛАСТИДНЫХ ГЕНОВ
Яркой отличительной чертой пластидных генов служит не
только эубактериальный план их организации (иногда в комплексе
с интрон-экзонной структурой), но и весьма своеобразная схема
экспрессии. В соответствии с этой схемой основная регуляция ге-
нетического материала пластид происходит на пост-транскрипци-
онном уровне, а именно — на стадии белкового синтеза. Кроме
того, экспрессия некоторых пластидных генов предполагает нали-
чие такого специфического этапа, как редактирование РНК.
Настоящий раздел посвящен молекулярным процессам, обеспе-
чивающим экспрессию пластидных генов. Из всего спектра этих
процессов только два (транскрипция и трансляция) находятся под
двойным генетическим контролем, в то время как все остальные,
по-видимому, определяются исключительно ядром.
Транскрипция пластидных генов. Как мы уже видели (см.
с. 70), плДНК содержит 4 гена гро, продуктами которых являются
различные субъединицы собственной РНК-полимеразы пластид.
Этот белок очень близок соответствующему ферменту Е. coli и эффек-
тивно распознает типичные бактериальные промоторы (рис. 1.24, А).
Между тем у некоторых высших растений, вторично утративших
способность к фотосинтезу (например, у паразитического вида Epi-
fagus virginiana или у ряда бесхлорофильных мутантов табака), от-
сутствует часть пластидной ДНК, включая функционально незаме-
нимый ген гроВ. Подобные делеции приводят к полной инактивации
собственной РНК-полимеразы пластид. Тем не менее даже у таких
растений отдельные пластидные гены сохраняют достаточно высо-
кий уровень транскрипционной активности. Как оказалось, промо-
торные области этих генов содержат 10-нуклеотидный мотив, су-
щественно отличный от канонических транскрипционных последо-
вательностей эубактерий (рис. 1.24, Б). Судя по этим данным у
высших растений в транскрипции пластидных генов, по-видимому,
участвует не только собственная РНК-полимераза, но и некий нерод-
ственный ей фермент, структура которого кодируется генетическим
материалом ядра. Действительно, в геноме арабидопсиса обнаружен
ген RPOZ, кодирующий мономерную РНК-полимеразу митохондри-
ального или фагового типа. Продукт данного гена успешно импор-
тируется в пластиды и обеспечивает транскрипцию с неканоничес-
ких промоторов.
В соответствии со своей структурой промоторы всех пластид-
ных генов подразделяются на три следующие группы:
. канонические эубактериальные промоторы, распознаваемые
собственной РНК-полимеразой пластид. Промоторы этой
группы обеспечивают транскрипцию подавляющего боль-
шинства пластидных генов, непосредственно контролирую-
щих процесс фотосинтеза;
. неканонические промоторы, обслуживаемые ядерно кодиру-
емой РНК-полимеразой. Такие промоторы свойственны не-
92
rpo;
TTGACA
-35
TATAAT.
-10
ATAGAAT^AA
A
G
Рис. 1.24. Структура пластидных промоторов, обслуживаемых собствен-
ной (А) и ядерно кодируемой (К) РНК-полимеразами.
Ключевые промоторные области изображены в виде черных прямоугольников. Ниже
представлены соответствующие нуклеотидные последовательности с их положением
по отношению к сайту начала транскрипции (показан стрелкой, а также жирными
точками над конкретными нуклеотидами). На каждом рисунке обозначены субъеди-
ницы РНК-полимеразы.
скольким пластидным локусам, в том числе rif-оперону, вклю-
чающему в себя гены rpoB, rpoCl и гроС2;
. универсальные промоторы, которые содержат оба типа регу-
ляторных последовательностей, а потому успешно распозна-
ются обеими РНК-полимеразами. Подобные промоторы ха-
рактерны для большинства генов «домашнего хозяйства»
пластид.
На основании этой классификации предложена следующая
схема транскрипции пластидных генов. В еще недифференциро-
ванных пластидах, получивших название пропластиды, функцио-
нирует только один тип РНК-полимеразы, а именно — продукт
ядерного гена RPOZ. В силу своей транскрипционной специфич-
ности этот фермент способен обеспечивать экспрессию лишь
генов «домашнего хозяйства» пластид. В дальнейшем, по мере
накопления соответствующих белковых продуктов (в том числе
собственной РНК-полимеразы), начинают транскрибироваться и
остальные пластидные гены, непосредственно контролирующие
молекулярный аппарат фотосинтеза. Таким образом, транскрип-
ционная система пластид функционирует по каскадному прин-
ципу.
Наиболее резкое (приблизительно 100-кратное) усиление тран-
скрипционной активности плДНК наблюдается в процессе био-
генеза хлоропластов при действии света на этиолированные про-
ростки. Между тем на более поздних этапах дифференцировки
пластид наблюдается прямо противоположный эффект. Эта зако-
номерность подробно описана для крахмалсодержащих пластид
{амилопластов), свойственных гетеротрофной клеточной линии
клена Acer pseudoplatanus. В таких амилопластах происходит не-
равномерное метилирование плДНК, в результате чего одни плас-
тидные гены (в том числе 16S и psbA) продолжают нормально
93
транскрибироваться, в то время как другие (например, rbcL, atpA,
atpB, atpE и psaA) подвергаются практически полной репрессии.
Как оказалось, весьма сходная ситуация характерна для хромо-
пластов томата и перца. Судя по этим данным частичное метили-
рование плДНК может играть существенную роль в преобразова-
нии хлоропластов в транскрипционно неактивные формы пластид.
Транскрипция пластидных генов подвержена заметной регуля-
ции и непосредственно в дифференцированных хлоропластах. По-
добная регуляция имеет скоординированный характер и тесно
приурочена к естественной смене светлого и темного периода
суток. Для большинства пластидных генов максимальная транс-
крипционная активность приходится на темное время суток, и
прежде всего — на предрассветные часы. С началом интенсивного
освещения транскрипционный уровень плДНК заметно понижает-
ся, что, впрочем, не препятствует активной экспрессии пластид-
ных генов (см. с. 109—ПО).
В целом на разных стадиях развития пластид транскрипцион-
ная активность плДНК обычно варьирует не более чем в 100 раз.
Между тем в процессе биогенеза хлоропластов количество некото-
рых белков, кодируемых самой плДНК, способно возрастать в го-
раздо большей степени (по меньшей мере на 5 порядков). Судя по
этим данным экспрессия пластидных генов преимущественно регу-
лируется не на транскрипционном уровне.
Как уже было отмечено, многие пластидные гены организова-
ны в виде оперонов. В большинстве случаев эти опероны очень
близки эубактериальным, что дополнительно свидетельствует в
пользу симбиогенетического происхождения пластид (гл. 1.4).
Созревание пластидных РНК. Экспрессия пластидных генов
не требует кэпирования и полиаденилирования транскриптов. Тем
не менее многие пластидные РНК претерпевают процесс созрева-
ния, состоящий из одного или нескольких этапов. К числу таких
этапов относятся:
сплайсинг транскриптов, обладающих интрон-экзонной струк-
турой;
формирование зрелых концов у транскриптов;
редактирование некоторых иРНК;
посттранскрипционное наращивание З'-конца у большинст-
ва тРНК.
В настоящем разделе каждый из этих этапов будет рассмотрен
по отдельности.
Сплайсинг пластидных РНК. Несмотря на эубактери-
альный план организации, многие пластидные гены характеризу-
ются наличием интронов. По сравнению со своими ядерными ана-
логами эти интроны обладают рядом существенных отличий, и
прежде всего — способностью к автосплайсингу (в том числе in
vitro). Действительно, вырезание пластидных интронов происхо-
дит исключительно за счет их автокаталитической активности без
участия каких-либо ферментов белковой природы. Эта же особен-
94
ность характерна и для многих митохондриальных генов, причем
не только у растений, но и у представителей других царств эука-
риот.
Автокаталитическая активность пластидных интронов обуслов-
лена сложностью их структуры. Так, наряду с консервативными
границами 5'-GU—AG-3' (последняя может существенно варьиро-
вать) каждый пластидный интрон содержит ряд взаимно компле-
ментарных последовательностей, способных образовывать в моле-
куле РНК достаточно стабильные шпильки (рис. 1.25). Подобные
вторичные структуры обеспечивают тесное сближение обеих ин-
трон-экзонных границ, что является абсолютно необходимым ус-
ловием автосплайсинга. Кроме того, в начальной области любого
пластидного интрона локализована короткая последовательность
IGS (от internal guide sequence), комплементарная З'-концевому
участку предыдущего экзона. Взаимодействие между двумя этими
участками способствует правильному выбору 5'-интрон-экзонной
границы (рис. 1.25).
В зависимости от своих структурно-функциональных особен-
ностей все пластидные (а также митохондриальные) интроны
могут быть подразделены на два следующих класса:
интроны I группы, способные вырезаться в виде линейного
фрагмента или ковалентно замкнутого кольца;
интроны II группы, вырезающиеся в виде петли.
Пластидные интроны I группы имеют весьма консервативную
вторичную структуру, как правило представленную девятью двух-
цепочечными участками (рис. 1.25, А). Сплайсинг первичного
транскрипта, несущего подобный интрон, осуществляется в два
этапа (рис. 1.26, А). На первом из них происходит разрезание гра-
ницы между 5'-концом интрона и предыдущим экзоном за счет
нуклеофильной атаки со стороны З'-ОН-группы свободного гуани-
нового нуклеотида. В результате такой атаки сам гуаниновый нук-
леотид оказывается присоединенным к 5'-концу соответствующего
интрона, в то время как вышеупомянутая ОН-группа переносится
на З'-конец предыдущего экзона. В дальнейшем эта группа атакует
вторую границу того же интрона, что обеспечивает его оконча-
тельное вырезание из молекулы РНК и ковалентное соединение
соседних экзонов. Наконец, вырезанный интронный участок
может претерпевать еще одну автокаталитическую реакцию, при-
водящую к его замыканию в кольцо.
У многих фотосинтезирующих эукариот (включая высшие рас-
тения) пластидная ДНК содержит только один интрон I группы,
локализованный в гене trnL(UAA). Будучи характерным еще для
цианобактерий, данный интрон, по-видимому, присутствовал и в
генетическом материале исходного фототрофного симбионта. У
красных водорослей, эвгленовых и некоторых криптофитов плас-
тидный ген trnL(UAA) утратил свою мозаичную структуру, в ре-
зультате чего плДНК этих организмов оказалась полностью ли-
шенной интронов I группы. Напротив, в случае зеленых водоро-
95
(1)
(3)и
и
С
и : а
с : с
а : и
с
и :
а : и
с : G
и • А А а : и
и
ид (4)
А
А
А
U
G
СА (2)
с
и G G А А А
G
U
U
8: g (5)
А и : А
U G
gauuauaaaauacaa
U U UGGCAU
G
G А
A G G G G
GU
А (6)
CUAAUAUUaUAUGUU
с
G
_________ и
jc A A G A Uf G
239
82
IGS
|А AU AUGG А - 3’
¥ - G С G и и С и|
Б
А
А
: и
: G
G
и
: g
С
G
G
С
U
С
A A G С С G
U
А С С U U U
U С С С U
и
С
U
А
Рис. 1.25. Вторичная структура пластидных интронов.
А — обобщенная структура пластидных интронов I группы; Б — структура пластид-
ных интронов II группы на примере второго интрона гена rps 12 у печеночника Mar-
chant ia. Выделен ключевой адениновый нуклеотид, участвующий в образовании ха-
рактерной петлеобразной структуры, свойственной вырезанному интрону. Цифрами
в круглых скобках обозначены номера консервативных шпилек; стрелками показаны
границы интрона.
96
слей подобные интроны обычно присутствуют не только в гене
tmL(UAA), но и в ряде других. Следует подчеркнуть, что конкрет-
ная локализация таких интронов может существенно варьировать
даже у весьма близкородственных форм. Особенно ярко это про-
является в структуре пластидного гена 23S, который у разных
видов хламидомонад может нести интроны по меньшей мере в 12
различных положениях. В основе данной ситуации, по-видимому,
лежит мобильность интронов I группы и их способность встраи-
ваться в исходно немозаичные гены. С таким предположением
вполне согласуется тот факт, что многие интроны этой группы
содержат открытую рамку считывания, продуктом которой являет-
ся та или иная сайт-специфическая эндонуклеаза. Как оказалось,
подобные генетические элементы действительно способны генери-
ровать свои новые копии, но только в гомологичных генах, еще не
имеющих мозаичного строения. При этом механизм, обеспечиваю-
щий встраивание интронов I группы в негомологичные гены, пока
остается неизвестным.
Намного чаще в составе плДНК присутствуют интроны II группы
(рис. 1.25, Б). Подобные интроны, как правило, содержат шесть
А Б
Рис. 1.26. Общая схема вырезания пластидных интронов I (А) и II (Б)
группы.
Интронные области показаны волнистой линией, экзонные — прямой, В обоих слу-
чаях сплайсинг осуществляется в два этапа по автокаталитическому принципу: на
первом этапе происходит разрезание 5'-границы интрона, а на втором — З'-границы
с последующим лигированием обоих экзонов. Точка лигирования изображена в виде
незаштрихованного кружка. Прочие пояснения в тексте.
4 Генетика
97
внутренних шпилек, только одна из которых (а именно — пятая) ха-
рактеризуется высокой консервативностью нуклеотидного состава.
Особого внимания заслуживает последняя (шестая) шпилька. Имен-
но в ней локализован неспаренный адениновый нуклеотид, способ-
ный своей 2'-ОН-группой осуществлять нуклеофильную атаку 5'-
интронной границы и тем самым инициировать процесс автосплай-
синга (рис. 1.26, Б). В результате такой атаки вырезаемый интрон
ковалентно присоединяется 5'-концом к вышеупомянутому адени-
новому нуклеотиду, принимая при этом характерную форму петли.
Не все вторичные структуры, присущие интронам II группы,
одинаково необходимы для автосплайсинга. Так, у разных видов
эвглен многие пластидные интроны сохраняют автокаталитичес-
кую активность, несмотря на отсутствие сразу четырех шпилек (со
второй по пятую). Столь резкое структурное отличие позволяет
некоторым авторам выделять подобные интроны в самостоятель-
ную III группу.
В некоторых случаях вторичные структуры пластидного интро-
на удерживаются особым белком, получившим название матураза
(от maturation — созревание). Этот белок не имеет какой-либо
нуклеазной активности, а потому выполняет исключительно вспо-
могательную функцию. Вместе с тем инактивация матуразы часто
приводит к подавлению автосплайсинга ввиду неспособности кон-
кретного интрона самостоятельно принимать необходимую вто-
ричную структуру. Следует подчеркнуть, что каждый такой интрон
взаимодействует со строго определенной матуразой, которая обыч-
но кодируется его собственной нуклеотидной последователь-
ностью. Возможно, некие матуразоподобные белки участвуют в
вырезании и других пластидных интронов. В пользу такого пред-
положения свидетельствуют ядерные мутации crs (от chloroplast
RNA splicing), блокирующие у кукурузы сплайсинг некоторых
пластидных транскриптов. Впрочем, конкретные причины подоб-
ного нарушения остаются неизвестными.
Итак, в процессе автосплайсинга каждый пластидный интрон
тесно сближает свои границы, что обеспечивает правильное со-
единение соседних экзонов одного и того же незрелого транскрип-
та. Между тем в отдельных случаях лигируемые друг с другом эк-
зоны могут исходно принадлежать двум разным молекулам РНК.
Это явление, получившее название транс-сплайсинг, подробно
описано для гена rpsl2. Как мы уже видели, данный ген часто
представлен двумя автономными сегментами (5'-rpsl2 и З'-rps 12),
локализованными в плДНК на большом удалении друг от друга.
При этом два соответствующих транскрипта способны вступать в
комплементарное взаимодействие друг с другом (рис. 1.27) с обра-
зованием вторичных структур, весьма характерных для интронов
II группы. В результате такого взаимодействия инициируется ти-
пичный автокаталитический процесс, приводящий к вырезанию
«гибридного» (фрагментированного) интрона и соединению двух
исходно самостоятельных транскриптов в один.
98
У
(3)
80
и
и
и
и
и
и
А
и
А
А
А
А
А
А
U
43 28
g:
а :
и
G
с
и
СА
(4)
а : и
и: а
и: а
g : с _ .,
g : ccgu: а
А
А
G
G
А
‘CU A A A AAAAUU AUU AUU
GAUUUUUUUAAUA UAA
' С CG G
G
, А
АААСАА
UUUGUU
С
371—\ А
X G
\ с
IG
ACAUAU
: : : : : G
У-AGUGUAUl
(1)
I 94
: а4
а : и
а : и
а : и
с : G
* л
А
с
G
А
G ___
AAGCCGUAU:А
UUUGGCAU GA
и
G
A A A G U G А С A AuUuA GGU
yUUbAbuGUuUAUUCAA
8 (0
(5)
А А
G X
и: а
а: и
А А
а : и
g : с
Рис. L27. Транс-сплайсинг у Marchantia polymorpha в отношении перво-
го интрона пластидного гена rpsl2.
иРНК гена rpsl2 представлена в виде двух самостоятельных транскриптов (5'- и У-
rpsl2), способных вступать в комплементарное взаимодействие. При этом формиру-
ются вторичные структуры, характерные для интронов II группы ( цифрами в скобках
обозначены номера консервативных шпилек, стрелками показаны границы «гибрид-
ного» интрона).
Еще более сложная ситуация характерна для пластидного гена
psaAl у Chlamidomonas reinhardtii. Этот ген представлен в плДНК
тремя фрагментами, каждый из которых транскрибируется неза-
висимо от остальных. Таким образом, по ходу нормальной экс-
прессии данного гена процесс транс-сплайсинга должен осуществ-
ляться дважды. Особого внимания заслуживает тот факт, что для
соединения 1-го и 2-го экзонов между собой необходима вспомо-
99
гательная молекула РНК, кодируемая пластидным геном tscA (от
trans-splicing chloroplast). Данная молекула способна одновремен-
но вступать в комплементарное взаимодействие с обоими транс-
криптами и обеспечивать формирование вторичных структур, прису-
щих интронам II группы (рис. 1.28). В соответствии с этим продукт
гена tsal можно рассматривать в качестве пластидного аналога
мяРНК (см с. 33).
В случае высших растений общее количество пластидных ин-
тронов характеризуется высокой степенью консервативности и,
как правило, равно приблизительно 20 (табл. 1.12). Между тем у
других фототрофных эукариот соответствующий показатель может
варьировать в очень широких пределах. В этом плане наиболее
контрастные различия наблюдаются между красными водорослями
(отсутствие мозаичной структуры у всех пластидных генов) и раз-
нообразными эвгленами (по меньшей мере 160 интронов II и III
типа в плДНК у Euglena gracilis).
Пластидные интроны эвглен характеризуются не только своей
многочисленностью, но в ряде случаев и весьма необычной орга-
низацией. Действительно, у этих фотосинтезирующих простейших
один пластидный интрон может располагаться непосредственно
внутри другого. Такие генетические элементы предложено назы-
вать твинтронами (от twice intron). Сплайсинг твинтронсодержа-
щих транскриптов, как правило, осуществляется в две стадии. При
этом сначала происходит автокаталитическое вырезание внутрен-
Рис. 1.28. Транс-сплайсинг у Chlamydomonas reinhardtii в отношении
первого интрона пластидного гена psaAl.
Римскими цифрами обозначены консервативные шпильки, характерные для интро-
нов II группы. Вспомогательный транскрипт tscA выделен жирной линией. Прочие
пояснения в тексте.
100
него интрона, и лишь затем — наружного. Такой порядок автосп-
лайсинга, по-видимому, связан с тем, что внутренний интрон
обычно локализован в пределах одной из вторичных структур на-
ружного, а потому препятствует ее нормальному формированию.
В плДНК Euglena gracilis присутствуют по меньшей мере 15
подобных генетических элементов, причем некоторые из них (на-
пример, psbCi4, т. е. четвертый интрон в гене рсЬС) имеют еще
более сложную структуру. Дело в том, что внутренняя область дан-
ного твинтрона содержит структурный ген собственной матуразы
(matl; от maturase), для которого также характерно мозаичное
строение. В соответствии с этим вырезание твинтрона psbCi4 осу-
ществляется не в 2, а в 3 последовательные стадии:
автокаталитическое удаление двух интронов, локализован-
ных в кодирующей области гена matl. По завершении этого
процесса становится возможным синтез функционально ак-
тивной матуразы;
взаимодействие матуразы со вторичными структурами внут-
реннего интрона, что приводит к его вырезанию;
автокаталитическое удаление внешнего интрона.
Итак, независимо от своей конкретной структуры большинство
пластидных интронов способно к автокаталитическому выреза-
нию, не требующему каких-либо дополнительных активностей.
Подобный процесс, по-видимому, не оказывает существенного ре-
гуляторного влияния на экспрессию пластидных генов.
Формирование зрелых концов у пластидных
транскриптов. Как мы уже отмечали, многие пластидные гены
имеют оперонную организацию, а потому исходно транскрибируют-
ся в виде длинных, полигонных молекул РНК. В дальнейшем такие
молекулы претерпевают одну или несколько эндонуклеазных атак с
образованием серии более мелких транскриптов. Этот процесс по-
дробно исследован у шпината для оперона psbB—psbH—petB—
petD (рис. 1.29). В данном случае первичный транскрипт расщепля-
ется на четыре самостоятельные иРНК, соответствующие каждому
из перечисленных выше генов. При этом необходимые разрезы
могут наноситься в любой последовательности, что в свою очередь
приводит к широкому спектру промежуточных продуктов.
Образовавшиеся моногенные транскрипты обычно подвергают-
ся дальнейшим структурным изменениям, в том числе созреванию
З'-конца. Для многих пластидных РНК ведущую роль в этом про-
цессе играют короткие инвертированные повторы, локализован-
ные в З'-некодирующей области транскрипта. Взаимодействуя друг с
другом, такие повторы способны формировать небольшую шпиль-
ку, которая распознается специфическими рибонуклеазами. Дан-
ный ферментативный комплекс успешно расщепляет молекулу
РНК непосредственно после шпильки, в результате чего образует-
ся зрелый З'-конец пластидного транскрипта. Подобная структура
З'-конца, по-видимому, необходима для обеспечения стабильности
молекулы (см с. 104).
101
psbB
Рис. 1.29. Расщепление полигенного пластидного транскрипта psbB—
psbH—petB—petD у шпината.
Полигонный пластидный транскрипт psbB—psbH—petB—petD подвергается серии
эндонуклеазных атак (показаны жирными стрелками) с образованием четырех са-
мостоятельных молекул иРНК. Кроме того, созревание иРНК petB и petD требует
осуществления сплайсинга. Все перечисленные процесы могут происходить в любой
очередности. Слева или же справа от каждого транскрипта представлена его длина в
т. п. н.
Вполне вероятно, что неким закономерным преобразованиям
подвержены и 5'-концы пластидных РНК. Так, в случае с Chlamy-
domonas reinhardtii 5'-конец транскрипта psbA обычно укорачива-
ется примерно на 55 нуклеотидов. К сожалению, функциональная
роль подобного преобразования до сих пор остается неизвестной.
В частности, нельзя исключить, что данное укорочение транс-
крипта является побочным результатом успешной инициации транс-
ляции (см с. 106).
Редактирование пластидных РНК. У высших расте-
ний некоторые типы пластидных иРНК оказываются вовлеченны-
ми в весьма своеобразный процесс, затрагивающий структуру от-
дельных пиримидиновых оснований (табл. 1.16). Каждое из этих
оснований претерпевает определенную химическую модифика-
цию, а потому преобразуется из одного варианта пиримидина в
другой (у мхов и печеночников возможны оба типа превращений,
в то время как у остальных высших растений только из С в U).
Данный процесс частично изменяет нуклеотидную последователь-
ность транскрипта, а вместе с ней и соответствующую генетичес-
102
кую информацию. Это явление, получившее название редактиро-
вание РНК, описано и для других органелл. Действительно, анало-
гичной модификации подвержены все митохондриальные иРНК
растений (см. с. 129), а также некоторые ядерные транскрипты
позвоночных. При этом митохондриальные РНК слизевиков и три-
паносом способны редактироваться за счет иного механизма,
предусматривающего встраивание или вырезание отдельных пири-
мидиновых нуклеотидов.
В процессе своего редактирования нуклеотидные последо-
вательности пластидных иРНК могут претерпевать весьма сущест-
венную оптимизацию. В ряде случаев это проявляется в образо-
вании инициаторного кодона AUG, отсутствующего в составе
первичного транскрипта (табл. 1.16). Между тем у печеночника
Marchantia кодирующая область транскрипта rbcL исходно пре-
рвана двумя преждевременными нонсенс-кодонами, каждый из ко-
торых успешно редактируется в смысловой триплет. Наконец, для
некоторых пластидных иРНК описано превращение одних смыс-
ловых кодонов в другие. Отражаясь на структуре соответствующих
Таблица 1.16
Редактирование пластидных иРНК
Транс- крипт гена Объект Количество редактируемых положений
с-> и и -> С
atpA Табак 2 0
atpF » 1 0
гр12 Кукуруза 1* 0
гроВ » 4 0
Ячмень 4 0
Рис 3 0
Табак 2 0
psbL » 1* 0
Красный перец 1* 0
Шпинат 1 0
petB Кукуруза 1 0
Табак 1 0
ndhA Кукуруза 44 0
ndhB » 6 0
Ячмень 9 0
Табак 2 0
ndhD » 1* 0
Шпинат 1* 0
Львиный зев 1* 0
rbcL 1 Печеночник Marchantia 13 7
* В результате редактирования формируется инициатор-
ный кодон (ACG -> AUG).
103
белковых молекул, подобные события, по-видимому, играют зна-
чительную роль в регуляции экспрессии пластидных генов. С
таким предположением хорошо согласуется тканеспецифичный
характер редактирования, наблюдаемый по отношению к транс-
криптам psbL.
Как уже было отмечено, типичным результатом редактирова-
ния пластидных иРНК является превращение отдельных остатков
С в U. Конкретный механизм подобного превращения остается
неизвестным. Тем не менее вполне вероятно, что в его основе
лежит простое дезаминирование цитозина (именно этот механизм
обеспечивает редактирование ядерного транскрипта ароВ у позво-
ночных). Неясным остается и то, каким образом осуществляется
выбор модифицируемых оснований.
Процесс редактирования, по-видимому, предшествует сплай-
сингу. В пользу такого предположения свидетельствует тот факт,
что среди полностью отредактированных пластидных транскрип-
тов могут присутствовать и несплайсированные варианты.
До сих пор все известные случаи редактирования пластидных
иРНК касаются исключительно высших растений. Возможно, это
указывает на приспособительную роль данного процесса при вы-
ходе растений на сушу.
Наращивание З'-конца пластидных тРНК. Мы уже
видели, что в большинстве случаев пластидные гены trn не содер-
жат З'-концевого тринуклеотида ССА, который присоединяется к
молекуле тРНК уже посттранскрипционно. В этом плане пластид-
ные тРНК весьма похожи на свои ядерные гомологи. Единичные
исключения из данного правила описаны для некоторых водоро-
слей, в том числе для генов tml(GAU), tmA(UGC), tmG(UCC) и
tmM у хлореллы.
Стабильность пластидных РНК. Стабильность РНК является
одним из основных факторов, способных регулировать экспрес-
сию пластидных генов. Действительно, на разных этапах развития
фототрофного организма время полужизни некоторых пластидных
транскриптов может варьировать по меньшей мере в сотни раз. К
сожалению, конкретные механизмы этой регуляции остаются не-
ясными. Вместе с тем не вызывает сомнения тот факт, что ключе-
вые регуляторные события осуществляются на концевых областях
каждого транскрипта.
Стабильность З'-концов пластидных РНК. Как уже было
отмечено, большинство зрелых пластидных РНК содержат в своей
З'-некодирующей области характерную шпильку, образованную
двумя инвертированными повторами. Принято считать, что подоб-
ная вторичная структура эффективно предохраняет З'-конец тран-
скрипта от разрушающего действия рибонуклеаз. Пожалуй, наибо-
лее убедительно этот вывод продемонстрирован на примере Chlamy-
domonas reinhardtii с использованием направленного мутагенеза
пластидного гена atpB. Оказалось, что замена вышеупомянутого
гена на его синтетическую аллель, полностью лишенную З'-конце-
104
вых инвертированных повторов, приводит к быстрой деградации со-
ответствующей иРНК. Вместе с тем нормальная стабильность тран-
скрипта atpB может наблюдаться и в отсутствие его З'-концевых ин-
вертированных повторов, если они замещены на протяженный по-
лигуаниновый участок (данная нуклеотидная последовательность
характеризуется in vitro высокой устойчивостью к действию 3'->5'
экзорибонуклеаз). Судя по этим данным стабильность пластидного
транскрипта в значительной степени определяется структурой его
З'-некодирующей области.
Наличие З'-концевой шпильки не обеспечивает постоянную
стабильность пластидного транскрипта. Действительно, в опреде-
ленных условиях (например, в темноте) такая шпилька эффектив-
но распознается специфическими белковыми комплексами, резко
дестабилизирующими зрелый З'-конец молекулы РНК. В частности,
у шпината З'-концевая шпилька пластидного транскрипта petD
служит сайтом связывания по меньшей мере трех различных бел-
ков, один из которых (а именно, полипептид с молекулярной мас-
сой 41 кДа) представляет собой ядерно-кодируемую эндорибонук-
леазу. Данный фермент расщепляет внутреннюю область шпильки,
после чего З'-конец молекулы РНК становится доступным для
серии дополнительных эндо- и экзорибонуклеазных атак. Особого
внимания заслуживает тот факт, что укороченный З'-конец плас-
тидного транскрипта может подвергнуться интенсивному полиа-
денилированию с образованием длинного (до нескольких сотен
нуклеотидов) поли(А)-богатого «хвоста». В свою очередь этот
«хвост» эффективно распознается крупными 3'—>5' экзорибонук-
леазными комплексами, осуществляющими быструю деградацию
всей молекулы РНК. Таким образом, полиаденилирование плас-
тидных транскриптов играет не стабилизирующую, а наоборот,
деструктивную роль.
Для разных типов пластидных РНК молекулярный состав бел-
ковых комплексов, участвующих в дестабилизации З'-концевой
шпильки, может существенно различаться. Эта особенность, веро-
ятно, является одной из причин, обеспечивающих дифференциаль-
ную экспрессию пластидных генов.
Стабильность 5'-концов пластидных иРНК. Нахо-
дясь в свободном состоянии, большинство зрелых пластидных
иРНК подвержены быстрой деградации за счет рибонуклеазной
атаки своего 5'-конца. Подобная атака оказывается весьма мало-
эффективной лишь в том случае, если конкретный транскрипт
быстро вступает в непосредственное взаимодействие с пластидны-
ми рибосомами. Таким образом, стабильность пластидных иРНК
находится в тесной зависимости от уровня их трансляции. Эта за-
висимость будет подробно рассмотрена в следующем разделе.
Трансляция пластидных иРНК. Пластидный аппарат белково-
го синтеза обладает не только типично бактериальными чертами
(см. с. 70), но и рядом весьма характерных особенностей. Прежде
всего к числу таких особенностей принадлежит своеобразный
105
этап, предшествующий инициации трансляции и состоящий в рас-
познавании 5'-концов пластидных иРНК. Пожалуй, наиболее по-
дробно данный этап исследован на примере Chlamydomonas rein-
hardtii. У этого объекта 5'-конец транскрипта psbA способен при-
нимать вторичную структуру, активно распознаваемую крупным
белковым комплексом (рис. 1.30, А). В свою очередь только рас-
познанные транскрипты оказываются доступными для рибосом и
могут быть вовлечены в процесс инициации трансляции.
Следует подчеркнуть, что упомянутый выше комплекс успешно
взаимодействует с транскриптом psbA только в ответ на интенсив-
ное освещение. В соответствии с этим синтез белка, кодируемого
геном psbA, находится в тесной зависимости от светового режима:
данный процесс активно идет в освещенных пластидах, но резко
A-U
U-A
A-U
A-U
A-U
A-U
U-Aj----1
y-GUACCAUOCUUUUAAUAGAAOCUUGAAUUUAUAAAU C|GGAG|AAAUUAAAACUUUAAAAAAAUUAACAUAUQ-3'
Рис. 1.30. Трансляционная регуляция экспрессии пластидного гена
psbA у Chlamydomonas reinhardtii.
А — 5'-некодирующая область пластидного транскрипта psbA содержит характерную
шпильку, способную распознаваться крупным белковым комплексом. Ключевым
компонентом этого комплекса является белок с молекулярной массой 47 кДа (RB47).
В отсутствие освещения данный белок находится в окисленной форме и не способен
взаимодействовать с 5'-концевой шпилькой транскрипта psbA. Однако под действи-
ем света происходит восстановление рассматриваемого белка с резким увеличением
сродства к этой шпильке. В свою очередь распознавание 5'-некодирующей области
транскрипта psbA является обязательным условием инициации трансляции, а потому
играет решающую регуляторную роль в экспрессии соответствующего пластидного
гена; Б — тонкая структура 5'-некодирующей области транскрипта psbA у Chlamy-
domonas reinhardtii. Непосредственно за характерной шпилькой располагается мотив
GGAG (обведен рамкой), близкий последовательности Шайна-Далгарно. Инициа-
торный кодон AUG (подчеркнут) находится в составе консервативной АС-богатой
последовательности, необходимой для правильной инициации трансляции.
106
ослабевает с наступлением темноты. Сходный регуляторный меха-
низм, по-видимому, характерен и для других пластидных иРНК.
Судя по результатам биохимического анализа различные типы
пластидных иРНК обслуживаются разными белковыми комплекса-
ми. В пользу того же предположения свидетельствуют и ядерные
мутанты, дефектные по трансляции отдельных пластидных иРНК.
При этом вполне вероятно, что весь молекулярный аппарат рас-
познавания находится под исключительно ядерным контролем.
Как уже было отмечено, распознанный 5'-конец пластидной
иРНК активно вовлекается в процесс белкового синтеза и прежде
всего становится доступным для рибосом. Для некоторых транс-
криптов успешность такого взаимодействия определяется мотивом
GGAGG, гомологичным последовательности Шайна-Далгарно
(рис. 1.30, Б). Однако, судя по данным направленного мутагенеза у
Chlamydomonas reinhardtii, в большинстве случаев структура подо-
бного мотива практически не влияет на эффективность инициации
трансляции. В этом плане особого внимания заслуживает тот
факт, что многие пластидные иРНК (особенно у Euglena gracilis)
вообще не содержат указанного мотива. Таким образом, вопрос об
участках первичного связывания пластидных рибосом пока остает-
ся открытым.
Еще одной яркой чертой пластидного аппарата трансляции
является его низкая эффективность по отношению к отдельным
полигенным иРНК. Так, у Chlamydomonas reinhardtii дигенный
транскрипт petB—petD способен принимать вторичную структуру,
перекрывающую доступ к участкам связывания рибосом. Не под-
вергаясь расщеплению на две самостоятельные иРНК, подобный
транскрипт не может участвовать в процессе белкового синтеза. В
соответствии с этим пластидный аппарат трансляции, по-видимо-
му, проявляет наибольшую эффективность по отношению к моно-
тонным иРНК.
Пластидные инициаторные кодоны обычно представлены трип-
летами AUG (следует напомнить, что в некоторых случаях эти
триплеты образуются посттранскрипционно за счет редактирова-
ния незрелой иРНК; см. с. 102). Каждый такой кодон является
частью консервативной AC-богатой последовательности (рис. 1.30,
£*), играющей важную роль при выборе сайта инициации трансля-
ции. Действительно, вне этого контекста (т. е. определенного нук-
леотидного окружения) пластидные кодоны AUG, как правило, ут-
рачивают свою инициаторную активность. Между тем в присутст-
вии нормального контекста различные мутации инициаторного
кодона обычно не полностью блокируют трансляцию, а лишь при-
водят к ее заметному ослаблению. Так, у Chlamydomonas reinhar-
dtii инициаторный кодон транскрипта petA может быть заменен
по меньшей мере на 5 неканонических триплетов (AUU, ACG,
ACC, ACU и UUC), способных обеспечивать хотя бы очень ни-
зкий уровень трансляции. Кроме того, неканонические инициа-
торные кодоны могут присутствовать и в составе нормальных
107
пластидных иРНК (например, триплет UUG в транскрипте infA у
Chlorella vulgaris). Весьма характерно, что все варианты инициа-
торных триплетов обслуживаются типичной для прокариот фор-
мил-метиониновой тРНК, структура которой определяется отдель-
ным пластидным геном tmfM(CAU). Таким образом, конкретный
сайт инициации трансляции детерминирован в пластидной иРНК
не столько соответствующим кодоном, сколько его нуклеотидным
окружением.
Мы уже видели, что многие компоненты пластидного аппарата
трансляции (а именно ряд рибосомных белков, подавляющее боль-
шинство трансляционных факторов, а также все типы аминоацил-
тРНК-синтетаз) кодируются генетическим материалом ядра, а по-
тому синтезируются на цитоплазматических рибосомах. Каждый
такой полипептид обычно содержит N-концевую сигнальную по-
следовательность, которая способствует его перемещению из ци-
топлазмы в пластиды. В отличие от перечисленных белков любые
молекулы РНК, по-видимому, не могут участвовать в аналогичном
перемещении. Возможно, по этой причине весь пул пластидных
тРНК (приблизительно 30 типов, включая инициаторную формил-
метиониновую тРНК) кодируется не ядром, а собственным генети-
ческим материалом органеллы. Как уже было отмечено, столь
узкий спектр тРНК не мог бы обеспечивать трансляцию при стро-
гом соблюдении принципа «неоднозначного соответствия». Дейст-
вительно, несмотря на высокую обогащенность АТ-парами, плас-
тидные рамки считывания несут в своем составе все варианты
смысловых триплетов, а потому должны обслуживаться по мень-
шей мере 32 различными тРНК. В основе рассматриваемой ситуа-
ции лежит способность отдельных пластидных тРНК (например,
аланиновой) полностью игнорировать третье положение кодона и
таким образом распознавать 4 синонимичных триплета. Во всем
же остальном пластидный генетический код вполне соответствует
универсальным закономерностям (см. табл. 1.13).
Благодаря высокому содержанию АТ-пар пластидные рамки счи-
тывания заметно обогащены различными кодонами, несущими в
последнем положении либо тиминовый, либо адениновый нуклео-
тид. В случае голосеменных и цветковых растений суммарная доля
таких кодонов определяется общим нуклеотидным соотношением,
типичным для данной плДНК. Только для двух наиболее эффектив-
но экспрессирующихся генов (а именно psbA и rbcL) показано сла-
бое отклонение от этой закономерности за счет предпочтительного
использования триплетов, оканчивающихся на цитозин. Между тем
у многих водорослей, а также печеночника Marchantia подобная
предпочтительность распространяется на большинство пластидных
рамок считывания и в целом носит ярко выраженный характер.
Вступая во взаимодействие с конкретной иРНК, пластидные
рибосомы успешно защищают ее 5'-конец от экзонуклеазной
атаки. Между тем в неблагоприятных для трансляции условиях
(например, при отсутствии освещения или дефектности распозна-
108
ющих белковых комплексов) пластидные иРНК оказываются сво-
бодными от рибосом и быстро деградируют со своего З'-конца.
Судя по этим данным успешность инициации трансляции относит-
ся к числу важнейших факторов, определяющих стабильность
пластидных иРНК.
Общая схема экспрессии пластидных генов. Итак, экспрессия
генетического материала пластид является сложным многоступен-
чатым процессом, испытывающим регуляторное влияние со сторо-
ны широкого спектра факторов. Первая стадия этого процесса,
по-видимому, осуществляется особой ядерно-кодируемой РНК-по-
лимеразой, обеспечивающей избирательную транскрипцию плас-
тидных генов «домашнего хозяйства» (см. с. 92). На данном этапе
еще недифференцированная пластида приобретает весь спектр не-
обходимых ей транспортных и рибосомных РНК. Между тем судь-
ба образовавшихся иРНК (в том числе пластидных транскриптов
rpo, rpl, rps, infA и некоторых других) во многом определяется
наличием или отсутствием освещения. Этот фактор слабо влияет
на созревание пластидных иРНК, однако имеет решающее значе-
ние для регуляции их стабильности. Так, при отсутствии достаточ-
ного освещения большинство пластидных иРНК оказывается неза-
щищенным от действия экзорибонуклеаз, а потому подвергается
интенсивной деградации. Тем не менее, благодаря остаточной ак-
тивности распознающих белковых комплексов, 5'-концы отдель-
ных иРНК даже при этих условиях могут избегать разрушения и
становиться доступными для рибосом (см. с. 106).
Следует подчеркнуть, что каждая отдельная пластида не фор-
мируется в клетке de novo, а возникает в процессе деления анало-
гичных пред существующих органелл. В соответствии с этим любая
недифференцированная пластида обычно содержит хотя бы неко-
торое количество нормальных рибосом, доставшихся ей «по на-
следству». Таким образом, даже при полном отсутствии света
пластидный аппарат белкового синтеза способен транслировать
отдельные иРНК, тем самым поддерживая определенный количес-
твенный уровень полипептидных компонентов «домашнего хозяй-
ства». Одни из таких полипептидов (а именно, продукты генов rpl
и rps) идут на сборку новых рибосом, в то время как другие (про-
дукты генов гроА, гроВ, rpoCl и гроС2) являются субъединицами
собственной РНК-полимеразы пластид. Впоследствии этот фер-
мент тоже включается в транскрипцию, обслуживая своей актив-
ностью практически весь спектр пластидных генов (см. с. 93).
Совместно функционируя в одних и тех же органеллах, два
типа РНК-полимераз (ядерно-кодируемая и собственно пластид-
ная) способны обеспечивать успешную транскрипцию плДНК
даже в течение темного времени суток. Однако при этих условиях
значительное большинство пластидных иРНК оказывается нерас-
познанным и быстро деградирует под действием различных нукле-
аз (см. с. 106). Подобная ситуация весьма характерна для недиф-
ференцированных пластид, но резко изменяется в ответ на интен-
109
сивное освещение. Прежде всего в присутствии света весь пул
пластидных иРНК становится доступным для рибосом и эффек-
тивно вовлекается в процесс белкового синтеза. При этом транс-
лируемые иРНК обычно избегают взаимодействия с нуклеазами, а
потому способны проявлять достаточно высокую стабильность. В
итоге попавшие под освещение пластиды столь резко (по меньшей
мере на два порядка) усиливают синтез своих белков, что больше
не нуждаются в высоком уровне транскрипции и могут ее сущест-
венно ослаблять.
Как мы неоднократно отмечали, многие пластидные комплек-
сы (в том числе рибосомы, АТФ-синтетаза, RuBisCO и др.) содер-
жат в своем составе хотя бы одну субъединицу, структура которой
определяется не плДНК, а генетическим материалом ядра. В подо-
бных случаях функционально взаимосвязанные пластидные и
ядерные гены обычно обладают согласованным характером эксп-
рессии. Таким образом, освещенная пластида быстро накапливает
весь спектр необходимых ей белковых молекул (как своих собст-
венных, так и кодируемых ядром) и начинает превращаться в фун-
кционально активный хлоропласт. В дальнейшем в зависимости от
тканевой принадлежности данной клетки возможен запуск и дру-
гих регуляторных механизмов, способствующих преобразованию
хлоропластов в иные типы дифференцированных пластид (напри-
мер, лейко- или хромопласты; см. с. 93—94).
У многих фототрофных эукариот пластиды наследуются только
по материнскому типу (впрочем, для некоторых голосеменных и
цветковых растений описана прямо обратная закономерность). В
соответствии с этим любые пластидные маркёры обычно характери-
зуются строго однородительским наследованием. Достаточно сход-
ный эффект может быть вызван определенными ингибиторами бел-
кового синтеза (например, спектиномицином), способными необра-
тимо инактивировать весь пул пластидных рибосом. В подобных
случаях дефектные пластиды уже не могут возобновить трансляцию,
а потому оказываются лишенными всего разнообразия собственных
белков. С другой стороны, такие пластиды сохраняют вполне нор-
мальную способность к делению (данная функция целиком контро-
лируется ядерными генами) и служат началом все новым и новым
поколениям трансляционно дефектных органелл. В конечном итоге
вновь формирующиеся ткани и органы растения содержат лишь ано-
мальные пластиды и проявляют типичный альбинизм. Более того,
участвуя в скрещиваниях в качестве женского родителя, такое рас-
тение-альбинос передает своим генеративным потомкам функцио-
нально дефектные (хотя и генетически нормальные) пластиды, что
обеспечивает стабильное «наследование» данного признака по ма-
теринскому типу. Подобный эффект, недавно описанный у кресто-
цветных, получил название наследуемая инактивация пластидных
рибосом. Аналогичная картина может быть вызвана и некоторыми
ядерными мутациями, способными инактивировать пластидный
трансляционный аппарат.
ПО
Глава 1.3
ГЕНЕТИЧЕСКИЙ АППАРАТ МИТОХОНДРИЙ
По сравнению с пластидным генетическим материалом мито-
хондриальная ДНК (мтДНК) фототрофных эукариот характеризу-
ется гораздо большим разнообразием. В первую очередь это каса-
ется размеров мтДНК, варьирующих от приблизительно 16 т.п.н.
у Chlamydomonas reinhardtii до 2400 т. п. н. в случае сетчатой дыни
(табл. 1.17). Даже у представителей одного и того же семейства
тыквенных данный параметр может различаться по меньшей мере
в 7 раз. В целом же высшие растения, по-видимому, обладают наи-
более крупными вариантами митохондриальной ДНК среди всех
эукариотических организмов. При этом следует учесть, что боль-
шая часть митохондриального генома растений образована различ-
ными некодирующими последовательностями.
Очень заметные различия распространяются и на структуру
мтДНК. Так, у большинства исследованных водорослей генетичес-
кий материал митохондрий представлен многочисленными кольце-
выми молекулами размером не более 80 т. п. н. (впрочем, у целого
ряда объектов, включая Chlamydomonas reinhardtii, С. smithii, Pan-
dorina morum и Ochromonas danica, мтДНК имеет не кольцевую, а
линейную структуру). Между тем крупная митохондриальная ДНК
высших растений часто содержит значительное количество протя-
женных повторов, а потому способна вступать в различные акты
внутри- и межмолекулярной рекомбинации с образованием широ-
кого спектра сосуществующих продуктов (рис. 1.31). В соответствии
с этим картирование митохондриального генома растений обычно
представляет собой весьма непростую задачу.
Особого внимания заслуживают кольцевые и линейные плазми-
ды, факультативно встречающиеся в митохондриях некоторых
растений (табл. 1.18). Пожалуй, наиболее подробно такие гене-
тические элементы исследованы на примере совместно наследую-
щихся плазмид S1 и S2 из митохондрий кукурузы. Каждая из этих
плазмид представляет собой двухцепочечный линейный фрагмент
ДНК, несущий на обоих концах идентичные инвертированные
повторы (TIR, от terminal inverted repeats). В свою очередь 5'-ко-
нец указанного повтора ковалентно присоединен к тирозиновому,
треониновому или сериновому остатку особой белковой молеку-
лы, выполняющей функцию «теломера» линейной плазмиды. Дело
в том, что перечисленные выше аминокислоты выступают в качес-
тве своеобразной «затравки», предоставляющей свою гидроксиль-
ную группу для синтеза комплементарной цепи. В результате тако-
го процесса каждая новая цепь синтезируется без б'-концевых не-
хваток, обычно возникающих при репликации линейной ДНК (см.
раздел 1.1.1). Аналогичный механизм воспроизведения, по-видимо-
му, справедлив и для других линейных плазмид кукурузы.
111
Таблица 1.17
Молекулярные характеристики митохондриальной ДНК растении
Объект Характеристики основной митохондриальной ДНК
размер молекулы (т.п.н.) структура молекулы
Chlamydomonas reinhardtii 16 Линейная
С. pitchmanni 16 Кольцевая
С. smithi 17 Линейная
С. eugametos 23 Кольцевая
Porphyra purpurea 36 »
Scenedesmus obliquus 45 »
Rhodomonas salina 48 »
Prototheca wickerhamii 55 »
Chlorella pyrenoidosa 80 »
Дикая редька 218 »
Арбуз 330 »
Арабидопсис 367 »
Кукуруза 570 »
Сетчатая дыня 2400 »?
Характерно, что TIR-последовательности расположены не
только на концах линейных плазмид S1 и S2, но и в различных
участках основного митохондриального генома. В соответствии с
этим указанные плазмиды способны переходить в интегрирован-
ное состояние, тем самым еще более усложняя структуру мтДНК.
Наконец, в митохондриях некоторых высших растений могут при-
сутствовать автономно воспроизводящиеся плазмиды, образован-
ные одноцепочечными или двухцепочечными молекулами РНК.
Характерно, что эти плазмиды не обладают какой-либо гомоло-
гией с остальными компонентами митохондриального генома.
К настоящему времени для некоторых водорослей (Chondrus
crispus, Porphyra purpurea, Rhodomonas salina, Prototheca wickerha-
mii, Chlamydomonas eugametos и C. reinhardtii), а также высших рас-
тений (в том числе для печеночника Marchantia polymorpha и араби-
допсиса) проведено полное секвенирование митохондриальной
ДНК. Судя по полученным результатам у разных объектов в составе
мтДНК содержится от 25 (Chlamydomonas reinhardtii) до 104 (Mar-
chantia polymorpha) генов, обслуживающих функционирование соб-
ственной органеллы. В соответствии со своим назначением данные
гены могут быть распределены на две следующие группы:
1) гены «домашнего хозяйства» митохондрий;
2) гены белков, непосредственно вовлеченных в процесс окис-
лительного фосфорилирования.
Как оказалось, спектры митохондриальных генов могут сущест-
венно варьировать даже у близкородственных форм. Еще в боль-
шей степени изменчива локализация конкретных генов в составе
мтДНК. Так, ни один из 25 митохондриальных генов Chlamydomo-
112
1
>5
у
J5
Рис. 1.31. Разнообразие кольцевых молекул, возника-
ющих в результате внутримолекулярной рекомбина-
ции в пределах митохондриальной ДНК кукурузы.
Для каждого типа кольцевых молекул показаны размер в т. п. н.,
а также взаимное расположение пронумерованных повторов.
Таблица 1.18
Митохондриальные ДНК-содержащие плазмиды
высших растений
Объект Название плазмиды Характеристики плазмиды
размер (т. п. и.) структура
Кукуруза — 1.9 Кольцевая
— 1.5 »
— 1.4 Линейная
2.3L 2.3 »
2.1L 2.1 »
S1 6.4 »
S2 5.4
R1 7.4 »
R2 5.4 »
Теосинте D1 7.4 »
D2 5.4 »
Сорго — 2.3 »
— 1.7 »
— 1.4 »
N1 5.8 Кольцевая
N2 5.4 »
Бобы Р1 1.7 Линейная
Р2 1.7 »
РЗ 1.5 »
Фасоль — 1.9 »
Подсолнечник Р1 1.4 »
Р2 1.8 »
РЗ 1.8 »
nas reinhardtii не находится в том же окружении, что и его гомолог
в случае родственного вида С. eugametos. В основе подобной ситу-
ации, по-видимому, лежит высокая рекомбинационная активность
мтДНК, обусловленная наличием коротких (в случае хламидомо-
над) повторяющихся последовательностей.
В соответствии с современными представлениями о симбиоге-
нетическом происхождении митохондрий (см. гл. 1.4) кольцевые
молекулы мтДНК являются производными бактериального нуклео-
ида. По этой причине для обозначения митохондриальных генов
обычно используется стандартная прокариотическая символика.
13.1. ГЕНЫ «ДОМАШНЕГО ХОЗЯЙСТВА» МИТОХОНДРИЙ
Во многих группах эукариот «домашнее хозяйство» митохонд-
рий находится под преимущественно ядерным контролем (в ти-
пичном случае только отдельные компоненты трансляционного
114
аппарата кодируются собственным генетическим материалом орга-
неллы). Эта же закономерность вполне справедлива и в отноше-
нии фотосинтезирующих эукариот. Однако у некоторых из них в
составе мтДНК присутствуют дополнительные гены, способные
кодировать структуру своеобразных полимераз. Соответствующие
митохондриальные гены будут рассмотрены в следующих разде-
лах.
Гены репликативного аппарата митохондрий. К настоящему
времени процесс репликации митохондриальной ДНК исследован
крайне слабо. Судя по спектру кодирующих последовательностей,
локализованных в самой мтДНК (табл. 1.19), ферментативный ап-
парат этого процесса обычно находится под исключительно ядер-
ным контролем. Тем не менее у красной водоросли Porphyra pur-
purea описан митохондриальный ген, продукт которого напомина-
ет собой типичную фаговую ДНК-полимеразу. Аналогичная
активность кодируется открытой рамкой считывания urf3, локали-
зованной у кукурузы в составе линейной плазмиды S1. Наконец, у
некоторых фотосинтезирующих эукариот (включая Porphyra pur-
purea, Chlamidomonas reinhardtii, Oenothera berberiana и Vicia faba)
в составе мтДНК присутствует структурный ген обратной транс-
криптазы. К сожалению, конкретные функции всех перечислен-
ных генов пока остаются неизвестными.
Гены транскрипционного аппарата митохондрий. Принято
считать, что весь митохондриальный аппарат транскрипции обыч-
но кодируется генетическим материалом ядра. Единственное ис-
ключение из этого правила (среди фототрофных эукариот) описа-
но для линейной плазмиды S2 из митохондрий кукурузы. Данная
плазмида содержит открытую рамку считывания urfl, продуктом
которой является мономерная РНК-полимераза фагового типа.
Функциональная роль этого фермента остается неясной.
Гены трансляционного аппарата митохондрий. Как уже было
отмечено, митохондриальный аппарат белкового синтеза находит-
ся под двойным генетическим контролем. При этом у разных фо-
тосинтезирующих эукариот одни и те же компоненты трансля-
ционного аппарата митохондрий могут кодироваться различными
генетическими системами. Настоящий раздел посвящен рассмот-
рению соответствующих митохондриальных генов.
Гены рибосомных РНК. Митохондриальные рибосомы
фотосинтезирующих эукариот заметно отличаются от своих ци-
топлазматических и пластидных аналогов. В частности, рибосомы
данного класса характеризуются своеобразной чувствительностью
к антибиотикам, а также широким варьированием коэффициента
седиментации (табл. 1.20). Весьма примечателен и спектр мито-
хондриальных рРНК. Как и у прочих эукариотических организ-
мов, его основой являются два варианта молекул: 26S в большой
субъединице рибосом и 18S — в малой. Однако у высших расте-
ний и некоторых зеленых водорослей (включая Prototheca wicker-
hamii и Nephroselmis olivacea) в большой субъединице митохонд-
115
Таблица 1.19
Митохондриальные гены растений
Ген Объект*
Продукт С. сп. Р. риг. R. sal. С. eug. С. rei. Р. wic. М. pol. A.tha
А. Гены рибосомных РНК
ГГП18 ггп26 18S-pPHK 26S-pPHK + + + + +" +" +” + + +
ггп5 5S-pPHK + ? ? — — — + + +
Б. Гены рибосомных белков
гр12 Рибосомный белок L2 — — — — — — + +
гр15 » » L5 — — + — — + + +
гр16 » » L6 — — + — — + + —
rpl 14 » » L14 — — + — — — — —
грПб » L16 + — + — — + + +
rpsl » » SI — — — — — — + —
rps2 » » S2 — — + — — + + —
rps3 » » S3 + + + — — + + +
rps4 » » S4 — — + — — + + +
rps7 » » S7 — — — — — + + +
rps8 » » S8 — — — — — — + —
rpslO » » S10 — — — — — + + —
rpsl 1 » » Sil + + + — — + + —
rpsl2 » » S12 + + + — — + + +
rpsl3 » » S13 — — + — — + + —
rps 14 » » S14 — — + — — + + +
rpsl9 » » S19 — — + — — + + +
В. Гены транспортных РНК
trnA tPHKai* + + + — — + + —
trnC тРНКсУ’ + + + — — + + +
trnD тРНКА’₽ + + + — — + + +
trnE tPHK°'“ + + + — — + + +
trnF tPHK1^ + + + — — + + —
trnGl тРНК°'у + + + — — + + +
tmG2 » + + — — — + + —
trnH тРНКн“ + + + — — + + +
trnll тРНК,1е + + + — — + — +
tmI2 » — — + — — + — —
trnKl тРНК1*1 + + — — — + + +
trnK2 » — +
trnLl tPHKu“ + + + — — + + —
116
Таблица 1.19 (продолжение)
Ген Объект*
Продукт С. сп. Р. pur. R. sal. С. eug. С. rei. Р. wic. М. pol. A. tha
trnL2 tPHKu“ + 4- 4- + 4-
trnMl tPHKm“ + + + + + + 4- —
trnM2 » — — 4- — — 4- — —
trnfM тРНК™" 4- 4- — + — — 4- +
trnN тРНКАя| 4- 4- 4- — — 4- 4- +
trnP тРНКРго + 4- 4- — — 4- + 4-
trnQ тРНК01" + 4- + 4- 4- 4- 4- 4-
trnRl тРНКАг8 4- 4- + — — + 4- —
trnR2 » + 4- + — — 4- + —
trnR3 » — — 4- — — — + —
trnSl tPHKs« + + + — — 4- 4- 4-
trnS2 » — 4- + — — + 4- 4-
trnS3 » — +
trnS4 » — +
trnT тРНК11" — — — — — 4- + 4-
trnV тРНК™ + + — — — 4- 4- —
trnW тРНКТг₽ + + 4- + 4- 4- + +
trnYl тРНК1* + 4- + — — 4- 4- +
trnY2 » Г. Гены, кодирующи е фер^ [ентатг [вный ; аппара т ЦИКЛ а КреС ica +
sdhB II субъединица сукци- нат-дегидрогеназы + + — — — + + —
sdhC IV субъединица сук- цинат-дегидрогеназы + + + — — + + —
sdhD VII субъединица сук- цинат-дегидрогеназы Д. Гены бел koi + зых ко + мпоне! + ггов дь 1хател1 >НОЙ Ц( + гпи + —
nadl Субъединица НАД • Н- дегидрогеназы + + + + + + + +
nad2 Тот же + + 4- 4- 4- 4- 4- 4-
nad3 » » + + + — — + 4- +
nad4 » » 4- + 4- 4- 4- 4- + 4-
nad4L » » + + 4- — — 4- 4- 4-
nad5 » » + + • + + + + 4- +
nad6 » » + + 4- 4- + + 4- 4-
nad7 » » — — + — — 4- 4- +
nad8 » » — — 4- — — — — —
nad9 » » — — + — — 4- 4- +
117
Таблица 1.19 (продолжение)
Ген Объект*
Продукт С. cri. Р. pur. R.sal. С. eug. С. rei. Р. wic. М. pol. A. tha
nadlO Субъединица НАД • Н- дегидрогеназы — — + — — — — —
nadl 1 То же — — + — — — — —
cob Апоцитохром b + + + + + + + +
ccb Белки, обеспечива- ющие биогенез цитохрома с — — — — — + + +
coxl I субъединица цитохром-оксидазы + + + + + + + +
cox2 II субъединица цитохром-оксидазы + + + — — + + +
cox3 III субъединица цитохром-оксидазы + + + — — + + +
Е. Гены митохондриальной АТФ-синтетазы
atpl а-субъединица комплекса CFj — — + — — + + +
atp6 ^-субъединица комплекса CF} + + + — — + + +
atp8 Е-субъединица комплекса CFj — + + — — + + +
atp9 Субъединица I комплекса CF0 + + + — — + + +
Ж. Гены, контролирующие иные функции
Обратная
транскриптаза ?
ДНК-полимераза ?
Открытые рамки считывания неизвестной функции (общее количество)
orf | ?
| 16 | 8 | 4 | 7 | 0 | 5 | 23 | 2
* Представлены данные, полученные для видов с полностью секвенированной
митохондриальной ДНК: С. cri. — Chondrus crispus (красная водоросль); Р. риг. —
Porphyra purpurea (красная водоросль); R. sal. — Rhodomonas salina (красная водо-
росль); С. eug. — Chlamydomonas eugametos (зеленая водоросль); C.rei. — Chla-
mydomonas reinhardtii (зеленая водоросль); Р. wic. — Prototheca wickerhamii (зеле-
ная водоросль); М. pol. — Marchantia polymorpha (печеночник); A. tha. — Arabi-
dopsis thaliana; " — ген рибосомной РНК представлен фрагментированной фор-
мой.
118
Таблица 1.20
Сравнительная характеристика митохондриальных рибосом растений
Тип рибосом Коэффициент седиментации Типы рибосомных РНК Специфическая чувствительность к антибиотикам
Цитоплазматичес- 80S 5S. 5.8S и 25S; Циклогексимид,
кие рибосомы (60S + 40S) 18S анизомицин
Пластидные 70S 4.5S, 5S и 23S; Хлорамфеникол,
рибосомы (50S + 30S) 16S макролидные и аминогликозидные антибиотики
Митохондриаль- Варьирует. 5S и 26S; Хлорамфеникол
ные рибосомы У кукурузы: 78S (60S + 44S) 18S (или фрагментиро- ванные молекулы) и макролидные антибиотики
риальных рибосом присутствует еще и третий тип рРНК с коэф-
фициентом седиментации 5S. Кроме того, у многих зеленых водо-
рослей молекулы митохондриальных рРНК расчленены на не-
сколько самостоятельных фрагментов (подобная ситуация описана
и для отдельных простейших).
Все типы митохондриальных рРНК кодируются собственным
генетическим материалом органеллы. У высших растений соответ-
ствующие гены получили обозначение ггп18, ггп26 и гт5 (от ribo-
somal RNA; табл. 1.19, А). Более сложная ситуация типична для
многих исследованных водорослей (в частности, для хламидомо-
над). У этих объектов стандартные митохондриальные рРНК со-
ставлены из нескольких фрагментов, каждый из которых кодиру-
ется отдельным геном. Хотя количество таких фрагментов может
существенно варьировать даже у близкородственных форм, исход-
ная структура рибосомных РНК остается весьма консервативной
(рис. 1.32). Более того, «соседствующие» фрагменты вступают друг
с другом в физический контакт за счет взаимной комплементар-
ности своих концевых районов. Структурные гены подобных
рРНК принято обозначать как ml или rns (от ribosomal RNA large
или ribosomal RNA small) с добавлением цифры или буквы, отра-
жающей расположение конкретного фрагмента в составе полно-
ценной рибонуклеиновой молекулы.
Гены рибосомных белков. У многих эукариотических
организмов белки митохондриальных рибосом кодируются исклю-
чительно ядерными генами. Аналогичная ситуация описана и для
ряда зеленых водорослей, включая Chlamydomonas eugametos,
С. reinhardtii и Pedinomonas minor. Между тем у красных водоро-
слей Chondrus crispus и Porphyra purpurea отдельные гены rpl/rps
локализованы в самой мтДНК. Наконец, митохондриальный геном
криптомонад, золотистых водорослей и высших растений обычно
несет более десяти генов rpl/rps (табл. 1.19, Б).
119
E. coli
Сг
Се
Li L2a
Lj L2 L3 L4
Рис. 1.32. Взаимное соответствие между цельными и фрагментированными рибосомными РНК.
А — 23S-pPHK Е. coli в сравнении с фрагментированными рРНК в составе большой субъединицы пластидных рибосом в случае Chlamydomonas reinhardtii (Сг)
и Chlamydomonas eugametos (Се). Отдельные фрагменты рРНК обозначены латинской буквой L и соответствующим порядковым номером; Б — 16S-pPHK Е. coli
в сравнении с фрагментированными рРНК в составе малой субъединицы пластидных рибосом в случае Chlamydomonas reinhardtii (Сг) и Chlamydomonas euga-
metos (Се). Отдельные фрагменты рРНК обозначены латинской буквой S и соответствующим порядковым номером.
Гены тРНК. Разнообразие тРНК, кодируемых собственным
генетическим материалом митохондрий, может варьировать в
очень широких пределах (табл. 1.19, В). Так, если у зеленых водо-
рослей Chlamydomonas reinhardtii и Chlorogonium elongatum в со-
ставе мтДНК присутствует всего по 4 гена trn (а именно, trnQ,
trnW, tmM и tmfM), то для печеночника Marchantia соответствую-
щее количество равно 30. Однако в любом случае столь узкий
спектр тРНК не может обеспечивать трансляцию всех вариантов
смысловых кодонов (даже у Marchantia отсутствуют митохондри-
альные гены для изолейциновой и треониновой тРНК). В основе
данной ситуации лежит способность митохондрий успешно им-
портировать недостающие варианты тРНК из цитоплазмы. Реаль-
ность этого процесса подтверждена для многих цветковых расте-
ний. Таким образом, митохондриальный пул тРНК (в отличие от
пластидного) находится под двойным генетическим контролем со
стороны не только своей собственной органеллы, но и ядра.
Следует подчеркнуть, что различные гены tm, локализованные
в мтДНК одного и того же фототрофного организма, могут иметь
Таблица 1.21
Митохондриальные тРНК картофеля
Изоакцепторные тРНК Количество типов изоакцепторных тРНК
импортируе- мые из цитоплазмы собственно митохондри- альные продукты митохондриальных генов пластидного происхождения
тРНКА|а 1 — —
тРНКАг* 2 — —
тРНКА1п — 1 1
тРНКА1₽ — 1 —
тРНКс*’ — 1 —
тРНК01» — 1 —
тРНК01" — 1 —
тРНК01* — 1 —
тРНКн“ — — 1
тРНК1к 1 1 —
тРНКи“ 5 — —
тРНК1-*5 — 1 —
тРНК™11 — 1 —
тРНКМа — — 1
тРНКР1>с — 1 —
тРНКРго — 1 —
тРНК5'1 — 1 1
тРНК1111 2 — —
тРНКтф — — 1
тРНКт*г — 1 —
тРНКУа1 — 2 —
121
весьма неодинаковое происхождение. Некоторые из них являются
компонентами собственного генетического материала митохонд-
рии, оставшегося в «наследство» еще от исходного гетеротрофно-
го эндосимбионта. Такие гены имеют достаточно высокое (60—80 %),
но все же неполное сходство с соответствующими гомологами
эубактерий. Между тем у многих растений отдельные митохондри-
альные гены trn очень близки своим пластидным эквивалентам
(табл. 1.21). Данные гены, по-видимому, оказались перенесенными
в мтДНК вместе с фрагментами пластидного генетического мате-
риала. Принято считать, что подобные события происходили в
эволюции высших растений неоднократно. Действительно, если
одни «пластидные» гены tm присутствуют в мтДНК у широкого
спектра растений (например, ген trnW(CCA) характерен для мито-
хондрий фасоли, ослинника, картофеля, пшеницы и кукурузы), то
другие — лишь у отдельных исследованных видов. Наконец, у пе-
ченочника Marchantia среди 29 митохондриальных генов trn нет
ни одного, характеризующегося пластидным происхождением.
Таким образом, утрата многих собственно митохондриальных
генов trn компенсируется у высших растений двумя различными
способами:
> замещение отсутствующих генов на их пластидные гомологи;
> импорт недостающих тРНК из цитоплазмы.
1.3.2. ГЕНЫ, НЕПОСРЕДСТВЕННО КОНТРОЛИРУЮЩИЕ
ПРОЦЕСС КЛЕТОЧНОГО ДЫХАНИЯ
Клеточное дыхание является фундаментальным биологическим
процессом, по ходу которого низкомолекулярные органические
вещества (в типичном случае — пировиноградная кислота) пре-
терпевают полное окисление до СО2 и Н2О. Высвобождаемая при
этом химическая энергия идет на образование молекул АТФ, ис-
пользуемых организмом по мере возникающей необходимости.
Подобный тип дыхания возможен лишь при наличии молекуляр-
ного кислорода, а потому называется аэробным.
Процессы аэробного дыхания принято подразделять на два по-
следовательных этапа. На первом из них (т. е. по ходу цикла Креб-
са; рис. 1.33) проходит окисление пировиноградной кислоты с об-
разованием углекислого газа и восстановленной формы НАД. В
дальнейшем перенесенные на НАД высокоэнергетичные электро-
ны передаются молекулам О2 с формированием мембранного по-
тенциала, используемого для синтеза АТФ. Данный этап получил
название окислительное фосфорилирование.
У всех фотосинтезирующих эукариот молекулярный аппарат
аэробного дыхания находится под двойным генетическим контро-
лем. Действительно, если одни компоненты этого аппарата коди-
руются ядерным геномом, то другие (преимущественно белки, об-
служивающие процесс окислительного фосфорилирования) детер-
122
П /О
СН1-С—Сх Пировиноградная к-та
ЧОН
NAD4-
NADH
сн3
%zO-
nadh, у .о
—Uri2““C
> чо-
▼ '•vuj
у Ацетил-кофермент A
"-CoA 0 q-
I H x.O
"(У
CoA
n ^Щавелевоуксусная к-та
%-с-сн2-ср
°z 6н °"
/4 Яблочная к-та
nad:
О;
Зо-
лимо иная к-та
-О
Н2О
ЛЭ
ГАОНП\ФуМар0,а,К'Та
v Янтарная к-та
FT H X)
XC-C-C-C*
“Oz H Кофермент A
Кофермент A jO
Изолимонная
к-та
V’
^C-CH2-C-C-C^°
-oz h6h0’
NAD*
АТР
ADP' / °<^ „TT
H2O C CH2 CH2 c
"° CoA
Сукцинил-кофермент A qq,
NADH
СО2
гС-СН2-СН2-С-С
6 °-
а-Кетоглюкотаровая
к-та
NAD+
NADH
h
Рис. 1.33. Цикл Кребса.
минированы собственной ДНК митохондрий. Настоящий раздел
посвящен рассмотрению соответствующих митохондриальных
генов.
Гены, кодирующие ферментативный аппарат цикла Кребса.
У подавляющего большинства эукариотических организмов (вклю-
чая и фототрофные) ферментативный аппарат цикла Кребса нахо-
дится под ядерным контролем. Единственным исключением из
этого правила являются отдельные субъединицы сукцинатдегидро-
геназы, кодируемые митохондриальной ДНК у красных водоро-
слей и печеночника Marchantia (гены sdhB, sdhC и sdhD, от succi-
123
nate dehydrogenase; табл. 1.19, Г). Следует подчеркнуть, что эти же
белки участвуют и в транспорте возбужденных электронов.
Гены белков, обслуживающих процесс окислительного фос-
форилирования. Процесс окислительного фосфорилирования об-
служивается двумя системами белковых молекул:
. система транспорта возбужденных электронов (дыхательная
цепь), обеспечивающая поляризацию внутренних мембран
митохондрии;
. комплекс митохондриальной АТФ-синтетазы.
Генетический контроль каждой из перечисленных выше систем
будет рассмотрен нами по отдельности.
Гены белковых компонентов дыхательной цепи.
Белковые компоненты дыхательной цепи находятся под двойным
генетическим контролем, характер которого значительно варьиру-
ет у разных фотосинтезирующих эукариот (табл. 1.19, Д). Так, в
случае различных хламидомонад (включая С. eugametos, С. тое-
wusii, С. reinhardtii и С. smithi) большинство соответствующих
генов имеет ядерную локализацию. При этом собственная ДНК
митохондрий кодирует структуру только семи белков дыхательной
цепи:
. пять субъединиц НАД • Н-дегидрогеназного комплекса (гены
nadl, nad2, nad4, nad5 и nad6; от NADH-dehydrogenase);
. апоцитохром b (ген cob, от apocytochrome b; следует отме-
тить, что данный ген имеет митохондриальную локализацию
у подавляющего большинства эукариот);
> I субъединица цитохромоксидазы (ген coxl; от cytochrome
oxidase 1).
В отличие от хламидомонад исследованные высшие растения
характеризуются митохондриальным генетическим контролем по
отношению к приблизительно 20 белкам дыхательной цепи, вклю-
чая (табл. 1.19, Д)\
. девять субъединиц НАД • Н-дегидрогеназного комплекса (ге-
ны nadl, nad2, nad3, nad4, nad4L, nad5, nad6, nad7 и nad9);
. апоцитохром b (ген cob);
> пять белков, участвующих в биогенезе цитохрома с (гены
ccb; от cytochrome с biogenesis);
. все три субъединицы цитохромоксидазы (гены coxl, сох2 и
сохЗ).
У некоторых фотосинтезирующих эукариот (например, у красных
водорослей Porphyra purpurea, Cyanidium caldarium и Chondrus
crispus, криптофита RhodomonaS salina и печеночника Marchantia
polymorpha) в составе митохондриальной ДНК присутствуют и
гены sdh, кодирующие различные субъединицы сукцинатдегидро-
геназы. Как уже было отмечено, данный фермент участвует не
только в цикле Кребса, но и в последующем транспорте возбуж-
денных электронов. В соответствии с этим митохондриальные
гены sdh также вовлечены в генетический контроль дыхательной
цепи.
124
Таблица 1.22
Митохондриальная АТФ-синтетаза растении
Обозначение комплекса Субъединичный состав АТФ-синтетазы
Е. coli пластид
Fj для бактерий CFj для митохондрий Fo для бактерий CF0 для митохондрий а Р Y 5 е а b с а (Я или М)* ₽(Я) у(Я) 8 (Я) е(Я) МЯ) ингибитор АТФазы (Я) Субъединица 6 (М) Ь(Я) Субъединица 9 (М)
* В скобках указана локализация соответствующего гена: М — в митохонд-
риальной ДНК, Я — в ядерной.
Гены митохондриальной АТФ-синтетазы. По свое-
му субъединичному строению митохондриальная АТФ-синтетаза
растений заметно отличается от эквивалентного комплекса бакте-
рий или пластид. Действительно, ее мембранный домен (CF0) со-
держит 4 дополнительные субъединицы, не характерные для бак-
териальных АТФ-синтетаз. Таким образом, с учетом пяти- или
шестисубъединичного домена CFj митохондриальная АТФ-синте-
таза растений включает в себя не менее 12 различных белков
(табл. 1.22). При этом только 4 соответствующих гена (atpl, atp6,
atp9, а по последним данным — и atp8; от ATP-synthetase) лока-
лизованы в составе мтДНК.
У некоторых исследованных водорослей количество митохонд-
риальных генов atp не достигает и четырех. Особенно ярко это
проявляется в случае различных хламидомонад, характеризующих-
ся ядерным контролем по отношению ко всему комплексу мито-
хондриальной АТФ-синтетазы. Между тем у красных водорослей
в составе мтДНК обычно присутствуют 3 гена atp (а именно —
atp6, atp8 и atp9).
Судя по аминокислотной последовательности своих крупных
субъединиц (а и 0) митохондриальная АТФ-синтетаза наиболее
близка соответствующему комплексу родоспирилл. Вполне веро-
ятно, что именно эти или родственные им бактерии являлись про-
кариотическими эндосимбионтами, впоследствии преобразовав-
шимися в современные митохондрии эукариот.
125
1.33. ОБЩЕЕ КОЛИЧЕСТВО МИТОХОНДРИАЛЬНЫХ ГЕНОВ
Как уже было отмечено, у разных фотосинтезирующих эукариот
суммарное количество митохондриальных генов может варьировать
в очень широких пределах. При этом весь спектр подробно изучен-
ных мтДНК можно подразделить на два следующих класса.
1. Небольшие мтДНК хламидомонадного типа, отличительны-
ми чертами которых являются:
. фрагментированность генов, кодирующих структуру 26S- и
18S-pPHK. В случае Chlamydomonas reinhardtii суммарное
количество таких фрагментов (rnl и ms) достигает 14;
. отсутствие структурного гена 5S-pPHK;
. как правило, полное отсутствие генов rpl/rps;
. очень малое количество генов trn (обычно лишь tmQ, tmW,
tmM и tmfM);
. консервативный набор из 7 генов, кодирующих различные
компоненты дыхательной цепи (nadl, nad2, nad4, nad5, nad6,
cob и coxl);
. отсутствие генов atp.
Таким образом, суммарное количество генов, локализованных
в митохондриальной ДНК хламидомонадного типа (с учетом всех
протяженных рамок считывания и автономно транскрибируемых
фрагментов ml и ms), обычно варьирует в пределах от 25 до 35.
2 . Крупные митохондриальные геномы, типичные для высших
растений и многих водорослей. К числу наиболее характерных
особенностей таких мтДНК относятся:
. нефрагментированность структурных генов 26S- и 18S-pPHK;
. наличие гена rm5, продуктом которого является 5S-pPHK (во-
прос о присутствии этого гена в составе мтДНК у красных во-
дорослей Porphyra purpurea и Chondrus crispus остается спор-
ным);
. присутствие хотя бы нескольких генов rpl/rps (до 16 у Mar-
chan tia);
> значительное количество генов trn (до 30 у Marchantia);
. довольно широкий спектр генов (как правило, около 20), ко-
дирующих различные компоненты дыхательной цепи;
по меньшей мере 3 гена atp (atpl, atp6, atp9, а возможно и
atp8).
В целом митохондриальная ДНК этого класса содержит (с уче-
том всех протяженных рамок считывания) свыше 50 генов, а в слу-
чае печеночника Marchantia — даже немногим более 100.
У некоторых фотосинтезирующих эукариот в составе мтДНК
присутствуют отдельные гены, способные контролировать иные
процессы, нежели митохондриальная трансляция или клеточное
дыхание (табл. 1.19, Ж). Однако реальные функции этих генов до
сих пор остаются неизвестными.
126
13.4. ЭКСПРЕССИЯ МИТОХОНДРИАЛЬНЫХ ГЕНОВ
К настоящему времени экспрессия митохондриальных генов
исследована у фотосинтезирующих эукариот недостаточно по-
дробно. Полученные отрывочные данные позволяют составить
лишь общее представление об этом процессе.
Транскрипция митохондриальных генов. Каждый из
генов, локализованных в митохондриальной ДНК цветковых расте-
ний, обычно отделен от соседних кодирующих последовательностей
по меньшей мере несколькими тысячами нуклеотидных пар, а пото-
му представляет собой автономно транскрибируемую единицу. Ти-
пичным исключением из этого правила является двухкомпонентный
оперон ггп 18—rm5, характерный для многих исследованных расте-
ний. В отдельных случаях в состав указанного оперона могут вхо-
дить и первые экзоны гена nad5 (см. с. 128—129).
Промоторные области большинства митохондриальных генов
содержат тетрануклеотидный мотив 5'-CRTA-3' (рис. 1.34; R соот-
ветствует тиминовому или адениновому нуклеотиду), необходимый
для успешной инициации транскрипции. Именно этот мотив, по-
видимому, служит ключевой регуляторной последовательностью,
специфически распознаваемой митохондриальной РНК-полимера-
зой. Как уже было отмечено, у эукариотических организмов транс-
крипционный Жшарат митохондрий обычно находится под ядер-
ным генетическим контролем. Действительно, у ряда цветковых
растений (например, у горчицы и арабидопсиса) идентифицирован
ядерный ген RPOY, белковый продукт которого представляет
собой односубъединичную РНК-полимеразу фагового типа, спо-
собную эффективно мигрировать в митохондрии.
Для некоторых митохондриальных генов характерно наличие
сразу нескольких структурно сходных промоторных участков.
Так, у кукурузы ген atp9 находится под контролем по меньшей
мере шести функционально активных CRTA-содержащих промо-
торов. Между тем промоторы отдельных митохондриальных генов
(например, ггп26 и ггп 18) имеют совсем иную нуклеотидную струк-
туру. Судя по данным, полученным для Zea perrensis, транскрип-
А RAaaNNGCRTAtARtRagt
Б RARAANTRACRTAT
В AA(T/A)(A/T)NCRTAAGAGA
Рис. 1.34. Структура митохондриальных промоторов у пшеницы (А), ку-
курузы (Я) и двудольных растений (В).
Подчеркнут консервативный мотив CRT А, где R соответствует тиминовому или аде-
ниновому нуклеотиду. Точка начала транскрипции отмечена жирной буквой. Слабо
консервативные положения выделены строчными буквами.
127
ция подобных генов тоже зависит от некого ядерно кодируемого
белка. Однако вопрос о конкретных функциях этого белка (т. е.
является ли он самостоятельной РНК-полимеразой или всего лишь
вспомогательным транскрипционным фактором) остается неяс-
ным.
Созревание митохондриальных РНК. Процесс созревания ми-
тохондриальных транскриптов может включать в себя несколько
стадий, в частности:
. сплайсинг первичных транскриптов;
> формирование зрелых 5Z- и З'-концов молекул РНК;
> редактирование транскриптов;
> наращивание З'-конца у митохондриальных тРНК.
Каждая из перечисленных стадий будет рассмотрена нами по
отдельности. При этом многие обсуждаемые модели (например,
молекулярные механизмы автосплайсинга), по-видимому, соответ-
ствуют пластидным (раздел 1.2.4).
Сплайсинг митохондриальных РНК. Разные виды фо-
тосинтезирующих эукариот заметно отличаются друг от друга по
спектру митохондриальных интронов. Так, среди низших расте-
ний встречаются формы, для которых характерно:
> полное отсутствие митохондриальных интронов (Chlamydo-
monas reinhardtii);
> наличие в мтДНК только интронов I группы (многие виды
хламидомонад, Chlorogonium elongatum и Prototheca wicker-
hami);
> наличие митохондриальных интронов как I, так и II группы
(Scenedesmus obliquus и бурая водоросль Pylaiella littoralis).
Между тем у высших растений практически все мозаичные
гены, локализованные в митохондриальной ДНК, содержат только
интроны II группы. Единственным исключением из этого правила
является интрон I группы, присутствующий в гене coxl у некото-
рых покрытосеменных (например, у Peperomia polybotrya, семей-
ство перцевые). Предполагают, что данный интрон появился у выс-
ших растений в результате горизонтального переноса из митохонд-
рий грибов. Судя по крайне гетерогенной локализации этого
интрона в пределах гена coxl подобный горизонтальный перенос
осуществлялся независимо в различных группах покрытосемен-
ных.
Остановимся более подробно на интронах II группы, присущих
митохондриальной ДНК цветковых растений. В зависимости от
видовой принадлежности объекта количество и конкретная лока-
лизация таких интронов могут варьировать в широких пределах.
Судя по этим данным митохондриальные интроны II группы спо-
собны проявлять определенную мобильность, т. е. перемещаться в
новые сайты мтДНК или же исчезать из области своего исходного
расположения.
У большинства цветковых растений митохондриальные гены
nadl, nad2 и nad5 разделены не несколько сегментов, транскриби-
128
руемых независимо друг от друга. В соответствии с этим экспрес-
сия перечисленных генов осуществляется за счет транс-сплайсин-
га, обеспечивающего ковалентное соединение исходно самостоя-
тельных молекул РНК (рис. 1.35). Особого внимания заслуживает
фрагментированный интрон, формирующийся в процессе транс-
сплайсинга иРНК гена nad5. Если у пшеницы, петунии и араби-
допсиса этот интрон образован двумя автономными фрагментами,
то в случае ослинника его структура оказывается еще более слож-
ной. Действительно, центральная область данного интрона, содер-
жащая характерные шпильки I—IV, кодируется отдельно от ос-
тальных участков гена nad5. Таким образом, рассматриваемый ин-
трон формируется не двумя, а тремя автономными фрагментами
РНК.
Фрагментированный интрон гена nadl содержит открытую
рамку считывания, продуктом которой является типичная матура-
за. Это единственный пример митохондриальной матуразы у всех
исследованных цветковых растений.
К настоящему времени фрагментированные интроны не обна-
ружены в составе митохондриальных генов nadi, nad2 и nad5 ни у
мохообразных (Marchantia polymorpha, Anthoceras crispillus и Iso-
etos lacustris), ни у папоротников (Osmunda regalis, Asplenium
nidus и Marsilea drummondii), ни у хвощей (Equisetum telmateia).
Судя по этим данным образование подобных интронов произошло
на поздних этапах эволюции сосудистых растений.
Формирование зрелых 5Z- и З'-концов митохонд-
риальных РНК. По ходу своего созревания определенные ми-
тохондриальные транскрипты цветковых растений подвержены
серии экзо- и эндорибонуклеазных атак. Этот процесс, ведущий к
формированию зрелых концов транскриптов, пока изучен очень
слабо. Предполагают, что молекулярным сигналом зрелого З'-кон-
ца является двойная или одинарная шпилька, типичная для многих
митохондриальных транскриптов кукурузы, риса, сорго, гороха,
петунии и ослинника (рис. 1.35).
Как уже было отмечено, для подавляющего большинства мито-
хондриальных генов (в случае цветковых растений) не характерна
оперонная организация. Тем не менее определенные гены экспрес-
сируются с образованием полицистронных транскриптов (напри-
мер, rml8—rm5—nad5). Процессинг такого транскрипта включает
в себя серию эндонуклеазных атак, расщепляющих молекулу пер-
вичной РНК на моноцистронные фрагменты (рис. 1.35). Весь комп-
лекс ферментов, обслуживающих процесс подобного расщепления,
по-видимому, находится под ядерным генетическим контролем.
Экспрессия митохондриальных генов не требует кэпирования и
полиаденилирования образующихся транскриптов.
Редактирование митохондриальных РНК. Очень
многие митохондриальные транскрипты (в том числе практически
весь спектр иРНК) подвержены у высших растений интенсивному
редактированию. Этот процесс предполагает не только типичное
5 Генетика
129
Рис. 1.35. Механизмы, обеспечивающие созревание митохондриальных транскриптов у цветковых растений.
Сплайсинг митохондриальных иРНК показан двойными черными треугольниками. В отдельных случаях (например, в отношении второго интрона в изображен-
ной молекуле иРНК) этот процесс осуществляется по механизму транс-сплайсинга. Вырезание отдельных РНК из полигонных транскриптов происходит за счет
особых эндонуклеаз (одинарные черные, а также двойные черно-белые треугольники). В формировании зрелого З'-конца у митохондриальной иРНК важную роль
играет соответствующая шпилька, предотвращающая дальнейшее экзонуклеазное расщепление молекулы. Наконец, возможные сайты редактирования показаны
латинскими буквами е.
для пластид преобразование С -» U, но и возможность обратной
химической модификации (U -» С). В зависимости от модифици-
рованного сайта результатом редактирования митохондриальных
РНК могут служить следующие эффекты:
формирование правильного инициаторного кодона AUG, от-
сутствующего в первичном транскрипте;
образование правильного нонсенс-кодона;
превращение одних смысловых кодонов в другие;
. оптимизация нуклеотидного состава в 5'-некодирующей об-
ласти иРНК;
формирование взаимно комплементарных участков РНК, не-
обходимых для стабилизации вторичной структуры транс-
крипта (например, при автосплайсинге). В этом плане про-
цесс редактирования митохондриальных РНК, по-видимому,
предшествует автосплайсингу;
оптимизация структуры тРНК и т. д.
Наращивание З'-конца митохондриальных тРНК.
У всех исследованных цветковых растений митохондриальные
гены tm не кодируют З'-концевого тринуклеотида ССА. Этот три-
нуклеотид присоединяется к каждой молекуле тРНК посттранс-
крипционно с помощью соответствующего ядерно-кодируемого
фермента.
Трансляция митохондриальных иРНК. Процесс инициации
трансляции изучен для митохондриальных иРНК цветковых расте-
ний недостаточно подробно. В частности, до сих пор остается не-
ясной структура участков первичного связывания рибосом (эта
проблема дополнительно осложняется тем, что у высших растений
3'-конец митохондриальной 18S-pPHK не имеет существенной го-
мологии с нуклеотидной последовательностью Шайна-Далгарно).
Тем не менее инициирующим кодоном, как правило, является ка-
нонический тринуклеотид AUG. Во многих случаях этот тринук-
леотид формируется только в процессе редактирования иРНК.
Мы уже видели, что многие типы митохондриальных тРНК им-
портируются из цитоплазмы. При этом в составе одной и той же
митохондрии могут присутствовать изоакцепторные тРНК, имею-
щие различное происхождение. Так, у печеночника Marchantia на-
ряду с собственно митохондриальной валиновой тРНКиАС имеется
и импортируемая из цитоплазмы тРНКААС.
Судя по многочисленным данным импортируемые в митохонд-
рию тРНК отличаются от своих цитоплазматических эквивалентов
лишь метилированностью определенного положения (в случае 4
вариантов лейциновых тРНК у фасоли таким положением являет-
ся G18). В соответствии с этим метилирование цитоплазматичес-
ких тРНК может играть важную роль в регуляции их импорта в
митохондрию. Более того, к успешному импорту способны только
аминоацилированные тРНК. Действительно, точковая мутация
(U70 -» С70), препятствующая аминоацилированию аланиновой
тРНК арабидопсиса, приводит к неспособности данной молекулы
131
мигрировать из цитоплазмы в митохондрии. Между тем даже зна-
чительные изменения, затрагивающие структуру антикодоновой
петли тРНК, не вызывают подобного эффекта.
Известно, что свойственный митохондриям генетический код
несколько отличается от универсального. Эта закономерность
вполне справедлива и в отношении фотосинтезирующих эукариот.
Действительно, их митохондриальные триплеты CGG соответству-
ют не аргинину, а триптофану. Кроме того, у красных, золотистых
и диатомовых водорослей, а также криптомонад нонсенс-триплет
UGA является значащим и кодирует триптофан. В этом плане ми-
тохондрии перечисленных водорослей напоминают собой соответ-
ствующие органеллы животных и грибов.
Глава 1.4
СИМБИОТИЧЕСКОЕ ПРОИСХОЖДЕНИЕ
ПЛАСТИД И МИТОХОНДРИЙ
В предыдущих разделах мы уже неоднократно отмечали разно-
образные свидетельства в пользу симбиотического происхождения
митохондрий и пластид. Настоящая глава призвана обобщить эти
свидетельства, дополнив их по мере необходимости вспомогатель-
ными данными.
Итак, в соответствии с современными взглядами исходными
предшественниками митохондрий и пластид служили определен-
ные бактерии, вступившие в эндосимбиоз с гипотетическими «хо-
зяйскими» клетками. Впоследствии такие эндосимбионты утрати-
ли значительную часть своего генетического материала (в том
числе за счет его перемещения в ядро), сохранив за собой лишь
строго ограниченный круг функций. Подобная схема представля-
ется особенно убедительной в случае пластид. Действительно, в
пользу симбиотического происхождения пластид свидетельствует
целый ряд фактов, в том числе:
1. Прокариотический план организации пластидной ДНК. Как
мы видели, собственный генетический материал пластид всегда
имеет кольцевую структуру, напоминающую собой бактериальный
нуклеоид. Только у некоторых бурых водорослей плДНК разделе-
на на две неравные кольцевые молекулы (133 и 58 т. п. н. в случае
Pylaiella littoralis).
2. Высокая гомология пластидных и бактериальных генов.
Многие пластидные гены проявляют более чем 70 %-ную гомоло-
гию со своими бактериальными эквивалентами, что убедительно
свидетельствует об их эволюционном родстве.
3. Оперонная организация пластидных генов. Многие пластид-
ные гены не только очень близки своим бактериальным гомоло-
132
гам, но и сохранили исходную оперонную организацию. В част-
ности, эта черта наиболее ярко прослеживается на примере плас-
тидных оперонов rm, rif и S10 (рис. 1.36). Вместе с тем в процессе
своей эволюции значительная часть плДНК претерпела многочис-
ленные перестройки, особенно интенсивные на фоне отсутствия
одного из IR-повторов.
4. Варьирование спектра пластидных генов. Как мы видели,
высшие растения обычно содержат в своей плДНК консерватив-
ный набор из приблизительно 100 генов (без учета открытых
рамок считывания с еще невыясненными функциями). Подавляю-
щее большинство этих генов вовлечено в контроль всего лишь
трех следующих процессов:
. транскрипция пластидных генов;
трансляция пластидных иРНК;
> собственно фотосинтез.
Между тем у красных водорослей и криптофитов количество
пластидных генов оказывается заметно более высоким и может
достигать по меньшей мере 150 (табл. 1.23). В частности, в плДНК
перечисленных объектов содержатся почти все гены rpl/rps, коди-
рующие структуру пластидных рибосомных белков. Аналогичная
ситуация прослеживается и в случае генов psa/psb. Наконец, мно-
гие пластидные гены рассматриваемых организмов не связаны с
обеспечением транскрипции, трансляции или фотосинтеза, а кон-
тролируют совсем иные функции (например, отдельные этапы
биосинтеза аминокислот; табл. 1.22, Н). Таким образом, красные
водоросли и криптофиты, по-видимому, соответствуют наиболее
ранним этапам эволюции фотосинтезирующих эукариот, когда
значительная часть исходно пластидных генов еще не подверглась
перемещению в ядро.
5. Бактериальное происхождение ядерных генов, кодирующих
пластидные белки. Многие гены, мигрировавшие из плДНК в ядро,
не изменили свою исходную функцию и продолжают кодировать
белковые компоненты пластид. Несмотря на ядерную локализацию,
такие гены обычно сохраняют высокую гомологию со своими бакте-
риальными эквивалентами (разумеется, без учета соответствующих
регуляторных областей). В частности, это ярко прослеживается на
примере ядерных генов SIG, кодирующих а-субъединицы собствен-
ной РНК-полимеразы пластид.
6. Сходство фотосинтетического аппарата цианобактерий и
пластид. Цианобактерии и пластиды очень близки между собой
по многим компонентам фотосинтетического аппарата. В частно-
сти, это сходство ярко прослеживается на примере основных фо-
тосинтетических пигментов. Действительно, и у цианобактерий, и
у пластид подобными пигментами являются определенные формы
хлорофилла (см. табл. 1.14, рис. 1.18). Вместе с тем цианобактерии
обладают еще одним типом основных фотосинтетических пигмен-
тов, а именно — разнообразными фикобилинами, отсутствую-
щими у подавляющего большинства растений. В отличие от хло-
133
Рис. 1.36. Структурное
сходство между пластид-
ными оперонами ггп, rif
и S10 у печеночника Mar-
chantia polymorpha и их
эквивалентами у Е. coli.
Соответствующие друг другу
гены М. polymorpha и Е. coli
изображены в виде черных
прямоугольников. Исходно
бактериальные гены, утра-
ченные пластидной ДНК
М. polymorpha (т. е. перене-
сенные в ядро), представле-
ны незакрашенными прямо-
угольниками. Локализация
промоторов показана стрел-
ками. Интронные области
пластидных генов выделены
пятнистой раскраской. Гены
S14 и S4 сохранили у М. poly-
morpha свою пластидную ло-
кализацию, но оказались в
других участках плДНК.
Рис. 1.37. Структура молекулы фико-
билина на примере фикоэритробили-
на.
Пояснения в тексте.
рофиллов пигменты этого класса
представляют собой открытую
тетрапиррольную группу, кова-
лентно связанную с цистеиновым
остатком специфического белка
(рис. 1.37). Подобные молекулы,
совмещающие в себе и белковую,
Н О
И С—J 11
IT /-• ^ТТ 1 >NH
Н3С—СП— "^5—И
Ы С—ч
|~5nh
ноос-сн2-сн2—।
ниис—сн2—сн2 И С*— I 5n
NH
Н3С-
Н2С=СН-
О
и фикобилиновую компоненты, получили название фикобилипро-
теины.
Белковые компоненты различных фикобилипротеинов (в том
числе а- и Р-субъединицы фикоэритрина, фикоцианина и аллофи-
коцианина) проявляют между собой значительную гомологию. При
этом каждый из перечисленных белков характеризуется опреде-
ленным набором ковалентно связанных фикобилинов. Тесно взаи-
модействуя друг с другом, различные фикобилипротеины форми-
руют основу особых светособирающих антенн, получивших назва-
ние фикобилисом. Кроме того, в состав любой фикобилисомы
входит ряд линкерных белков, не вовлеченных в процесс поглоще-
ния света, но обеспечивающих структурную целостность всего
комплекса.
Как уже было отмечено, фикобилины не характерны для по-
давляющего большинства фотосинтезирующих эукариот. Вместе с
тем эти пигменты являются обязательными компонентами фото-
синтетического аппарата красных водорослей и криптофитов.
Более того, у перечисленных организмов имеются типичные фико-
билисомы, причем структурные гены соответствующих фикоби-
липротеинов обычно локализованы в самой пластидной ДНК. При
этом а- и Р-субъединицы одного и того же фикобилинсодержаще-
го белка кодируются соседними генами, организованными в еди-
ный оперон. Так, у красной водоросли Aglaothamnion neglectum в
составе плДНК присутствуют по меньшей мере 3 подобных оперо-
на, каждый из которых кодирует отдельный тип фикобилипроте-
инов. Между тем линкерные белки фикобилисом обычно находят-
ся под ядерным контролем.
Итак, судя по спектру фотосинтетических пигментов пластиды
красных водорослей и криптофитов очень близки к цианобакте-
риям и, вероятно, произошли именно от этой группы прокариот.
Действительно, пластиды некоторых криптофитов (например, в
случае Cyanophora paradoxa) долгое время рассматривались в ка-
честве особых симбиотических организмов и даже получили са-
мостоятельное название: цианеллы. Принято считать, что в про-
цессе эволюции подобные внутриклеточные структуры утратили
систему фикобилисом и дали начало другим, более специализиро-
135
Таблица 1.23
Гены, локализованные в пластидной ДНК
Ген Продукт Объект*
С. par. G. the. Р. риг. О. sin. | С. vul. | В. gra. | М. pol. | Р. thu. | N. tab. Е. vir. | О. sat. Z. mays
А. Гены субъединиц PH К-полимераз: ы
ГроА а-субъединица + + + + + + + + + — + +
РНК-полимеразы
гроВ 3-субъединица + + + + + + + + + — + +
РНК-полимеразы 4
rpoCl Р'-субъединица + + + + + + + + + — + +
РНК-полимеразы
гроС2 Р"-субъединица + + + + 4- + + + + — + +
РНК-полимеразы
Б. Гены рибосомных РНК
16S 16S-pPHK + + + + + + + + + + + +
23S 23S-pPHK + + + + + + + + + + + +
5S 5S-pPHK + + + + + + + + + + + +
4.5S 4.5S-pPHK — — — — — — + + + + + +
В. Гены рибосомных белков
rpll Рибосомный белок L1 + + + + — — — — — — — —
гр12 » » L2 + + + + + + + + + + + +
гр!3 » » L3 + + + + — — — — — — — —
гр!4 » » L4 — + + + — — — — — — — —
гр15 » » L5 + + + + + + — — — — — —
гр!6 » » L6 + + + + — — — — — — — —
гр19 Рибосомный белок L9
rpll 1 » » Lil
rpll2 » » L12
грПЗ » » L13
rpll4 » » L14
rpll6 » » L16
rpll8 » » L18
rpll9 » » L19
rp!20 » » L20
rp!21 » » L21
rpl22 » » L22
rp!23 » » L23
rpl24 » » L24
rp!27 » » L27
rp!28 » » L28
rp!29 » » L29
rpl31 » » L31
rp!32 » » L32
rp!33 » » L33
rp!34 » » L34
rp!35 » » L35
rp!36 » » L36
rpsl » » SI
rps2 » » S2
rps3 » » S3
rps4 » » S4
rps5 » » S5
rps6 » » S6
rps7 » » S7
rps8 » » S8
rps9 » » S9
1 I + I+ +I++I l + l 1 1 1 l + l 1 I + I+ + +I 1 + + + + + + + + + + I++I I+ + +I + I 1 + + 1 1 1 1 I+ + + +I 1 + + 1 1 1 1 I++I I+ + +I + I 1 + +1 1 1 1 I++I + I 1 + + 1 1 1 1 1 1 1 1 + + 1 1 + 1 + + 1 1 1 1 1 + + 1 1 + 1 + + + 1 1 + + 1 IIIII+II+IIIIIIIII+II+I+++II++I + + + + + + + + + I++I I+ + +I + I 1 + + 1 1 1 1 I++I + I 1 + + 1 1 1 1
Таблица 1.23 (продолжение)
Ген Продукт Объект*
C. par. G. the. P. pur. 0. sin. C. vul. E. gra. M. pol. P. thu. N. tab. E. vir. 0. sat. Z. mays
rpslO Рибосомный белок S10 + 4- + + — — — — — — — —
rpsll » » Sil + + + + + + + + + + + +
rpsl 2 » » S12 + + + + + + + + + + + +
rpsl3 » » S13 + + + + — — — — — — —— ——
rpsl4 » » S14 + + + + + + + + + + + +
rpsl5 » » S15 — — — — — — + + + —- + +
rpsl6 » » S16 + + + + — — — + + — + +
rpsl7 » » S17 + + + + — — — — — — — —
rpsl8 » » S18 + + + + + + + + + + + +
rpsl9 » » S19 + + + + + + + + + + + +
rps20 » » S20 + + + + — — — — — — — —
Г. Гены трансляционных факторов
infA Фактор инициации IF-1 — — — — + — + + + + +
infB » » IF-2 — + + — — — — — — — —
infC » » IF-3 — — + — — — — — — — —
tsf Фактор элонгации EF-Ts — + + — — — — — — — —
tufA » » EF-Tu + + + + + + — — — — —
Д. Гены транспортных РНК (общее количество)
tmA-| Пластидные тРНК** I (35) I I I I 31 (33)1 I 31 (35) I 31 (36) I 29 (36) I 17 (19) I 30 (38) I 30 (38)
tmY I I I I I I I I I I I I I
Е. Гены, контролирующие биосинтез фотосинтетических пигментов
chlB
Субъединица протохло-
рофиллид редуктазы
chll chlL chlN pbsA Тот же » » » » Гем оксигеназа + + + 1 + + + Ж. п + + + гны, код + ирующие + белки 4 + + + + шкобилисом 1 - +1 — — — —
apcA а-субъединица аллофикоцианина + — + —
apcB |3-субъединица аллофикоцианина + — +
apcD у-субъединица аллофикоцианина + — +
apcE Линкерный пептид фикобилисомы + — +
apcF Субъединица В-18 аллофикоцианина + — +
cpcA а-субъединица фикоцианина + — +
cpcB (3-субъединица фикоцианина + — +
cpcG Линкерный пептид фикобилисомы + — +
cpeA а-субъединица фикоэритрина — — + — — — — — — —
cpeB р-субъединица фикоэритрина 3. Ге ны, КОДИ + рующие белковы е компо? генты фотосистем 1Ы I
psaA Апопротеин А1 + + + + + + 1 + + + — + +
psaB 1 1 » А2 1 1 + 1 1 + 1 1 + 1 1 + + 1 + 1 + 1 1 — 1 + 1 +
Таблица 1.23 (продолжение)
Ген Продукт Объект*
С. par. G. the. Р. pur. 0. sin. С. vul. Е. gra. М. pol. Р. thu. N. tab. Е. vir. 0. sat. Z. mays
psaC Субъединица VII 4- + + + + + + + + — + +
psaD » II — + + + — — — — — — — —
psaE » IV + + + + — — — — — — — —
psaF » III + + + + — — — — — — — —
psal » VIII + + + + + — + + + — + +
psaJ » IX + + + + + + + + + — + +
psaK » X — + +
psaL » XI — + + + — — — — — — — —
psaM » M + + + + + + + +. — — — —
И. Гены, кодирующие белковые компоненты фотосистемы II
psbA Белок DI + + + + + + + + + — + +
psbB Апопротеин CP-47 + + + + + + + + + — + +
psbC » P6 + + + + + + + + + — + +
psbD Белок D2 + + + + + + + + + — + +
psbE а-субъединица + + + + + + + + + — + +
цитохрома b5S9
psbF (3-субъединица + + + + + + + + + — + +
цитохрома bS59
psbH Фосфобелок весом 10 кДа + + + + + + + + + — + +
psbl Субъединица I + + — + + + + + + — + +
psbJ » J + + + + + + + + + — + +
psbK » К + + + + + + + + + — + +
psbL » L + + + + + + + + + — + +
psbM » М + — — — + — + + + — + +
psbN » N + + + + + + + + + — + +
psbT » Т + + + + + + + + + — + +
psbU
psbV
psbX
psbY
» U
Субъединица V
» X
» Y
К. Гены, кодирующие белки пластидной электронно-транспортной цепи
petA Цитохром f + + + + + — + + + — + +
petB » b6 + + + + + + + + + — + +
petD Субъединица IV + + + + + — + + + — + +
комплекса цитохром b6-f
petF Ферредоксин + + + + —
petG Субъединица V + + + + + + + + + — + +
комплекса цитохром b6-f
petJ Цитохром сб — — +
petL Субъединица комплекса + + + + + — + + + — + +
цитохром b6-f
ccsA Белок, обеспечивающий + + + + + — + + + — + +
биогенез цитохрома с
ftrB Р-субъединица — + + —
ферредоксин редуктазы
Л. Гены пластидной АТФ-синтетазы
atpA
atpB
atpD
а-субъединица
комплекса CFj
Р-субъединица
комплекса CF,
5-субъединица
комплекса CFj
Таблица 1.23 (продолжение)
Ген Продукт Объект*
C. par. G. the. P. pur. 0. sin. C. vul. E. gra. M. pol. P. thu. N. tab. E. vir. 0. sat. Z. mays
atpE e-субъединица комплекса CFj + + + + + + + + + — + +
atpF Субъединица I комплек- са CF0 + + + + + + + + + — + +
atpG » II комплекса CF0 + + + + —
atpH » III комплекса CF0 + + + + + + + + + — + +
atpl » IV комплекса CF0 — + + + + + + + + — + +
M. Гены пластидной НАД * Н-дегидрогеназы
ndhA Субъединица 1 — — — — — —— + — + — + +
ndhB » 2 — — — — — — + — + — + +
ndhC » 3 — — — — — — + — + — + +
ndhD » 4 — — — — — — + — + — + +
ndhE » 4L — — — — — — + — + — + +
ndhF » 5 — — — — — — + — + — + +
ndhG » 6 — — — — — — + — + — + +
ndhH » весом 49 кДа — — — — — — + — + — + +
ndhl » I — — — — — — + — + — + +
ndhJ » J — — — — — — + — + — + +
ndhK » К — — — — — — + — + — + +
Н. Гены, кодирующие структуру рибулозо-1.5-бисфосфат-карбоксилазы/оксигеназы
rbcL
rbcS
Большая субъединица
Малая субъединица
ассА Фермент биосинтеза жирных кислот
ассВ accD асрР argB Тот же » » » » Фермент биосинтеза аргинина
сагА Фермент биосинтеза пиримидинов
clpC clpP crtE АТФ-зависимая протеаза Протеаза Фермент биосинтеза изопренов
cysA Белок сульфаттранс- портного комплекса
cysT Белок сульфаттранс- портного комплекса
dnaB dnaK fabH ДНК-геликаза Шаперон типа Hsp70 Фермент биосинтеза жирных кислот
ftsH Белок, вовлеченный в деление пластиды
ftsW glnB Тот же Фермент биосинтеза глутамина
gltB Фермент биосинтеза глутамина
groEL Шаперон весом 60 кДа
groES Шаперон весом 10 кДа
О. Гены, контролирующие иные функции
+ + + + + + + + + + + + + + + + + + + + + 1+ 1 II + 11+ 1 1 11+ 1 l + ll 1 + + + + II 1 II 1 III 1 1 III 1 Illi 1 + + + + 1 l + ll 1 1 + 1 1 1 III 1 II 1 II + + 1 l + ll 1 1 +1 1 1 III 1 II 1 II + + II 1 II 1 III 1 1 1+1 1 11+1 1
Ген Продукт
С. par. G. the. Р. pur. О. sin.
hemA Глутамил-тРНК + — — —
hisS редуктаза Гистидил-тРНК — — + —
hlpA синтетаза Гистоноподобный белок — + — —
ilvB Фермент биосинтеза — + + —
ilvH изолейцин-валина Тот же + +
lipB mat К Фермент биосинтеза жирных кислот Матураза
minD Белок, вовлеченный в — + — —
minE деление пластиды Тот же +
nadA Фермант биосинтеза + — — —
pdhA пиридина а-субъединица пируват — — + —
pdhB дегидрогеназы Р-субъединица пируват — — + —
pgmA дегидрогеназы Фосфоглицерат мутаза — — + —
pheT Фермент биосинтеза — — + —
preA фенилаланина Фермент системы + — + —
rne модификации белков Рибонуклеаза Е — + + —
Таблица 1.23 (продолжение)
Объект*
С. VU1. Е. gra. М. pol. Р. thu. N. tab. Е. vir. О. sat. Z. mays
+ + + + + +
+ — — — — — — —
+ —
secA Субъединица системы — + + + — — — — — — — —
мембранного транспор-
та белков
secY Тот же + + + + — — — — — — — —
thiG Фермент синтеза — — + + — — — — — — — —
тиамина
trpA Фермент биосинтеза — — + — — — — — — — — —
триптофана
trpG Тот же + — + —
trxA Тиоредоксин — — + — — — — — — — — —
* Представлены данные, полученные для видов с полностью секвенированной пластидной ДНК: С. par. — Cyanophora paradoxa (крип*
тофит); G. the. — Guillardia theta (криптофит); P. pup. — Porphyra purpurrea (красная водоросль); О. sin. — Odontella sinensis (диатомовая
водоросль); C. vul. — Chlorella vulgaris (зеленая водоросль); E. gra. — Euglena gracilis (эвглена); M. pol. — Marchantia polymorpha (пече-
ночник); P. thu. — Pinus thunbergii (американская черная сосна); N. tab. — Nicotiana tabacum (табак); E. vir. — Epiphagus virginiana
(заразиха — бесхлорофильное цветковое растение вторично перешедшее к паразитизму); О. sat. — Oryza sativa (рис); Z. mays — Zea mays
(кукуруза).
♦♦ Показано количество генов, кодирующих разные тРНК. В скобках приведено количество генов с учетом дуплицированных в составе
инвертированных повторов.
Таблица 1.24
Количество пластидных мембран у разных фотосинтезирующих эукариот
Тип фотосинтетичес- ких пигментов Количество пластидных мембран
2 3 4
Хлорофиллы а и b Высшие растения, Зеленые водоросли Эвгленовые —
Хлорофиллы а и с Динофла- гелляты Золотистые, желто-зеле- ные, бурые и диатомо- вые водоросли, крипто- фиты
Хлорофиллы and, а также фикобилины Красные водоросли — —
ванным вариантам пластид, использующим для фотосинтеза толь-
ко различные формы хлорофилла. Возникновение таких вариан-
тов пластид послужило основой для появления широкого спектра
водорослей и, наконец, всех высших растений.
7. Количество пластидных мембран. Каждая пластида отделена
от окружающей цитоплазмы несколькими слоями мембран, коли-
чество которых варьирует у разных объектов (табл. 1.24). Так, у выс-
ших растений и некоторых водорослей (а именно зеленых и крас-
ных) в составе пластид имеется всего по две мембраны, причем
наружная (т. е. отделяющая цитоплазму от стромы; рис. 1.38,
А), по-видимому, исходно являлась компонентом хозяйской
клетки;
внутренняя (т. е. изолирующая строму от содержимого тила-
коидов) первоначально «принадлежала» симбиотической ци-
анобактерии.
Между тем у большинства эукариотических организмов, ис-
пользующих при фотосинтезе хлорофиллы а и с, количество плас-
тидных мембран равно не двум, а четырем. Подобная ситуация,
скорее всего, сложилась в результате вторичного эндосимбиоза
(рис. 1.38, Б). В пользу такого предположения свидетельствует ор-
ганизация пластид у криптофита Guillardia theta. У этого объекта
между второй и третьей пластидными мембранами имеется не-
большое пространство, по-видимому, представляющее собой оста-
ток первичной хозяйской клетки. Действительно, в указанном
пространстве находится рудиментарное ядро, получившее назва-
ние нуклеоморф и содержащее три очень короткие хромосомы
(суммарный размер всего 515 т.п.н.). При этом немногочислен-
ные гены, локализованные в составе нуклеоморфных хромосом
(например, rps4, ftsZ и eif2a), вовлечены в контроль пластидных
функций.
Итак, в соответствии с современными представлениями наибо-
лее древними фотосинтезирующими эукариотами являются крас-
ные водоросли. Пластиды этих организмов, по-видимому, возни-
146
Гипотетическая
хозяйская клетка’
Фототрофная
•эндосимбиотическая
бактерия
Красные водоросли,
зеленые водоросли
и высшие растения
Рис. 1.38. Симбиотическое происхождение пластид в различных груп-
пах фотосинтезирующих эукариот.
А — первичный эндосимбиоз, приведший к формированию фотосинтезирующих
эукариот с двуслойными пластидными мембранами; Б — возникновение вторичного
эндосимбиоза с образованием пластид, окруженных четырьмя слоями мембран; В —
вторичная утрата одной из четырех пластидных мембран.
147
кли непосредственно из симбиотических цианобактерий, а потому
характеризуются ярко выраженными примитивными чертами (в
частности, очень большим количеством генов и сохранением сис-
темы фикобилисом). Кроме того, такие пластиды отделены от ци-
топлазмы всего лишь двумя слоями мембран.
Дальнейшая эволюция пластид, по-видимому, шла различными
путями. Так, в случае зеленых водорослей и высших растений
пластиды полностью утратили фикобилиновую систему, лишились
значительной части собственного генетического материала, но со-
хранили двухслойность своих мембранных структур. Между тем
все остальные группы фотосинтезирующих эукариот возникли за
счет вторичного эндосимбиоза, в результате которого из красных
водорослей первоначально сформировались фикобилинсодержа-
щие четырехмембранные пластиды, типичные для криптофитов.
Впоследствии, т. е. в процессе становления желто-зеленых, золо-
тистых, бурых и диатомовых водорослей, подобные пластиды ут-
ратили фикобилиновую систему, а в ряде случаев (у динофлагел-
лят) — один из четырех мембранных слоев. Таким образом, не-
смотря на принципиальную общность своего происхождения,
пластиды разных фотосинтезирующих эукариот имеют различную
эволюционную историю.
Многие из перечисленных фактов хотя бы частично справедли-
вы и в отношении митохондрий. Однако существенная специфика
митохондриальной ДНК (как правило, очень малый размер или,
напротив, обилие различных повторяющихся последовательно-
стей) значительно сужает возможности эволюционного анализа.
Тем не менее на основании всего комплекса имеющихся данных (в
первую очередь судя по структуре крупных субъединиц АТФ-син-
тетазы) принято считать, что эволюционными предшественниками
митохондрий служили симбиотические родоспириллы.
Каждый пластидный или митохондриальный ген, подвергший-
ся перемещению в ядро, обычно сохраняет свою исходную функ-
цию и продолжает обслуживать лишь органеллы соответствующе-
го типа. Таким образом, растениям свойственны многочисленные
пары функционально близких ядерно-кодируемых белков, один из
которых импортируется в митохондрии, в то время как другой —
в пластиды. Типичным примером подобных белков являются мо-
носубъединичные РНК-полимеразы фагового типа, осуществляю-
щие транскрипцию либо пластидных, либо митохондриальных
генов. Эта закономерность не распространяется лишь на отдель-
ные аминоацил-тРНК-синтетазы (например, на метионил- и гисти-
дил-тРНК-синтетазы у арабидопсиса), способные функциониро-
вать в обоих типах органелл.
148
ЗАКЛЮЧЕНИЕ
Итак, генетический материал растений организован пример-
но по тем же закономерностям, что и у других эукариот. Весьма
похожи и механизмы экспрессии генов. Однако особого внима-
ния заслуживает тот факт, что у растений неизвестны какие-либо
ре1улярные перестройки генетического материала, сопровожда-
ющие развитие животных и грибов. Возможно, именно в этом со-
стоит основная причина тотипотентности многих растительных
клеток.
Завершая наш краткий обзор, остановимся на некоторых мето-
дах современной генетики развития растений. В этом плане ведущая
роль принадлежит мутационному анализу, т. е. поиску всевозмож-
ных мутантов с аномальным развитием одних и тех же структур (на-
пример, цветков у львиного зева). В дальнейшем полученные мутан-
ты вовлекаются в скрещивание друг с другом для проведения теста
на аллелизм. В результате такого анализа можно выявить отдельные
группы комплементации, каждая из которых представлена мутанта-
ми по одному и тому же гену. При этом исходная совокупность му-
тантов обычно подразделяется на несколько (а иногда и на мно-
жество) групп комплементации, что убедительно свидетельствует о
сложности данной программы развития. Однако отдельные гены,
контролирующие подобную программу, могут случайно оставаться
невыявленными даже при массовом получении мутантов. В соответ-
ствии с этим возникает принципиальный вопрос: как же определить
действительное количество генов, контролирующих некую про-
грамму развития?
Пытаясь ответить на этот вопрос, необходимо учитывать, что
все возникающие мутации являются редкими, независимыми и
случайными событиями, а потому подчиняются закономерностям
распределения Пуассона. В соответствии с этими закономерностя-
ми вероятность обнаружения некого «нового» гена (т. е. любого из
интересующих нас генов, пока еще не затронутых мутациями)
очень высока на первых этапах анализа, но неуклонно снижается
с увеличением выборки уже исследованных мутантов. Особенно
ярко это проявляется в тех случаях, когда на фоне многих выяв-
ленных генов остаются неизвестными лишь единичные (действи-
тельно, в подобной ситуации подавляющее большинство получен-
ных мутаций будет аллельно уже известным). Таким образом, на-
чиная с определенного момента каждый из выявленных генов
будет представлен уже не одной, а несколькими мутантными алле-
лями. Особого внимания заслуживают ситуации, когда по любому
из этих генов описано не менее 6 независимо полученных мута-
ций. В этом случае принято считать, что с 95 %-ной вероятностью
выявлена вся совокупность генов, контролирующих данную про-
грамму развития (другими словами — остаются неизвестными не
более 5 % генов).
149
Известны генетические программы развития, в которых переда-
ча воспринятого сигнала осуществляется по нескольким автоном-
но функционирующим путям. Однако даже столь сложные про-
граммы можно успешно анализировать с использованием простых
генетических приемов (рис. 1.39). Прежде всего блокирование од-
ного из сигнальных путей приводит в такой ситуации только к
частичному ослаблению ответа. Сходное фенотипическое прояв-
А (33.3% ответа)
ИТОГО:
—► ► ► ► X (0 % ответа) 66.6 % ответа
(33.3% ответа)
Б (33.3% ответа)
ИТОГО:
X —► —► X —► (0% ответа) 66.6% ответа
— ► —► —► (33.3% ответа)
В —► X (0 % ответа)
ИТОГО:
— ► —► ► *• X ► (0 % ответа) 33.3 % ответа
(33.3% ответа)
Р —► X (0 % ответа)
ИТОГО:
— ► —► ► ► X ► (0 % ответа) q % ответа
— ► —► х (0% ответа)
Рис. 1.39. Генетический анализ сложных программ развития с нескольки-
ми автономно функционирующими путями передачи сигнала (каждая
стрелка означает отдельный этап, контролируемый соответствующим
геном).
Допустим, что каждый из трех автономно функционирующих сигнальных путей вно-
сит одинаковый вклад в реализацию одной и той же программы развития. В этом слу-
чае: А — блокирование любого из трех сигнальных путей в результате мутации (х) должно
приводить к ослаблению суммарного ответа на треть; Б — наличие двух или несколь-
ких блоков в одном и том же сигнальном пути (у соответствующих двойных или мно-
жественных мутантов) должно вызывать такой же фенотипический эффект; В — для
всех двойных мутантов, одновременно дефектных по двум автономным сигнальным
путям, должно быть характерно ослабление суммарного ответа на две трети; Г — на-
конец, у множественных мутантов, дефектных по всем автономным сигнальным
путям, обслуживающим одну и ту же программу развития, должно наблюдаться пол-
ное отсутствие ответа.
150
ление должно быть свойственно и всем двойным мутантам, де-
фектным по разным этапам одного и того же пути. Между тем
объединение мутаций, блокирующих разные сигнальные пути,
приводит к суммарному (аддитивному) эффекту. При этом у мно-
жественных мутантов, дефектных по каждому из имеющихся
путей, наблюдается полное подавление программы. Таким обра-
зом, с помощью вышеописанных подходов можно выявлять конк-
ретные гены, контролирующие автономные сигнальные пути.
Еще один важный вопрос заключается в том, в какой очеред-
ности функционируют молекулы, обслуживающие данную про-
грамму. Оказалось, что и этот вопрос можно решать генетически-
ми методами. Дело в том, что для любой мутации характерна оп-
ределенная плейотропия, т. е. множественность фенотипических
проявлений. Специфика подобных проявлений зависит от целого
ряда факторов и прежде всего от того, какой из генов был затро-
нут и сколь серьезен соответствующий дефект. Неудивительно,
что многие мутации, блокирующие разные этапы одного и того же
сигнального пути, заметно различаются между собой по спектру
плейотропных проявлений. Объединяя такие мутации в одном ге-
нотипе, нетрудно выяснить, какой из двух этапов является более
ранним (именно на этом этапе происходит прерывание програм-
мы, вследствие чего двойной мутант должен обладать соответству-
ющим фенотипом; рис. 1.40).
Итак, используя двойные и множественные мутанты, можно ус-
пешно выявлять не только автономные сигнальные пути, но и кон-
кретные последовательности этапов. Между тем подавляющее
большинство высших растений очень неудобны для массового
получения мутантов в силу своей диплоидности и продолжитель-
ного жизненного цикла. Кроме того, у всех цветковых растений (а
именно среди них встречаются виды с относительно коротким
жизненным циклом) генетическая трансформация не приводит к
встраиванию строго по гомологии, что исключает возможность на-
правленного мутагенеза. В соответствии с этим наряду со стан-
дартными схемами химического и транспозонного мутагенеза в от-
А —► X Проявление 1
Б X -> Проявление 2
В X —► —► X —► Проявление 1
Рис. 1.40. Использование генетического анализа для выяснения очеред-
ности различных этапов одной и той же программы развития (показа-
ны стрелками).
Блокирование некой программы развития на разных этапах (Ан Б) может приводить
к различным плейотропным проявлениям. Между тем у двойного мутанта, одновре-
менно дефектного по обоим из этих этапов, реальное блокирование программы про-
исходит на первом из них. По этой причине у такого двойного мутанта должно наблю-
даться именно Проявление 1 (В).
151
ношении высших растений широко применяются методы обрат-
ной генетики, например:
1. Скрининг геномной ДНК в поисках гомологии с уже извест-
ными генами, контролирующими развитие у эукариот.
2. Выявление генов, экспрессирующихся только в конкретных
структурах растения или на строго определенных этапах развития
(данный подход основан на поиске дифференциально синтезируе-
мых транскриптов).
3. Поиск белков, специфически связывающихся с промоторной
областью данного гена. В дальнейшем у каждого из этих белков
определяют аминокислотную последовательность, а на ее основа-
нии (учитывая универсальность генетического кода) искусственно
синтезируют предполагаемый структурный ген. В свою очередь
подобную искусственную конструкцию можно использовать в ка-
честве зонда для поиска реального гена в составе геномной ДНК.
С помощью этого подхода можно прослеживать сигнальные пути
(точнее, их транскрипционно регулируемые этапы), «перемеща-
ясь» по направлению к началу.
4. Выявление промоторных последовательностей (и соответст-
вующих генов), специфично распознающихся данным транскрип-
ционным белком. Этот подход позволяет установить, какие конк-
ретные гены обеспечивают контроль более поздних этапов в дан-
ной программе развития.
5. Использование дигибридной системы транскрипции для вы-
явления генов, продукты которых непосредственно взаимодейству-
ют между собой. Этот подход особенно удобен для поиска различ-
ных белков, взаимодействующих друг с другом в составе сложных
регуляторных комплексов и т. п.
Как уже было отмечено выше, первым этапом любой генети-
ческой программы служит рецепция внешнего или же внутреннего
сигнала. Между тем поиск рецепторных белков может значитель-
но осложняться множеством методических проблем (в частности,
далеко не все белки, связывающиеся с некой сигнальной моле-
кулой, действительно являются рецепторами). По этой причине
рецепторная функция белка может считаться убедительно дока-
занной только при соблюдении трех условий. В первую очередь
выделенный белок должен быть способен к специфическому вос-
приятию сигнала в системе in vitro. Кроме того, мутации по струк-
турному гену этого белка должны обусловливать нечувствитель-
ность организма к соответствующему сигналу. Наконец, усиленная
экспрессия данного гена (точнее, его нормальной аллели) должна
приводить к пропорциональному усилению биологического от-
вета.
Итак, современная генетика развития опирается на целый арсе-
нал очень тонких и универсальных методов. Однако, несмотря на
свою универсальность, эти методы оказываются удобными далеко
не для всех высших растений. Дело в том, что лишь немногие
растения соответствуют всему набору требований, предъявляемых
152
к модельному объекту. Напомним, что к числу подобных требова-
ний относятся:
1. Возможность отбора мутантов на гаплоидном уровне. К со-
жалению, это требование не выполняется у подавляющего боль-
шинства высших растений, за исключением лишь мохообразных,
а также искусственно полученных гаплоидных форм.
2. Регулярное половое размножение на фоне истинной дипло-
идности. Все апомиктные и полиплоидные формы, столь широко
распространенные среди растений, очень неудобны для генетичес-
кого анализа.
3. Короткий жизненный цикл. Увы, у многих растений этот па-
раметр исчисляется годами, что резко ограничивает возможности
генетических подходов.
4. Небольшой геном с малым количеством повторов. В этом
плане очень многие растения (например, большинство однодоль-
ных, горох, табак и др.) неудобны в силу крупного генома, затруд-
няющего работу с хромосомной ДНК.
5. Способность к эффективной трансформации. В противном
случае оказывается невозможным использовать широкий спектр
молекулярно-генетических подходов, таких как:
введение ДНК-транспозонов для инсерционного мутагенеза,
инактивация генов за счет антисмысловых РНК,
анализ тканеспецифичности промоторов с использованием
маркерных генов,
увеличение дозы гена и т. п.
6. Способность к эффективной регенерации из клеточных куль-
тур. При отсутствии этой способности невозможно отбирать мутан-
ты на уровне отдельных клеток, а также использовать агробактери-
альную систему трансформации (даже в том случае, если сама транс-
формация осуществляется с высокой эффективностью).
7. Возможность замещать отдельные гены растения на искусст-
венно созданные конструкции за счет гомологичной интеграции в
хромосому. Как уже было отмечено выше, это условие не выпол-
няется у подавляющего большинства высших растений, что ис-
ключает возможность направленного мутагенеза.
8. Хорошая генетическая изученность объекта (т. е. наличие раз-
нообразных мутантов, а также насыщенных генетических карт).
До недавнего времени среди высших растений не было извест-
но ни одного объекта, отвечающего всем перечисленным требова-
ниям. В соответствии с этим интенсивное изучение развития па-
раллельно велось на нескольких растительных объектах (в том
числе на кукурузе, горохе, томатах, львином зеве, моркови и ара-
бидопсисе), относительно удобных, с точки зрения молекулярной
генетики. Однако с обнаружением того, что ключевые механизмы
развития очень сходны у всех исследованных растений, основное
внимание генетиков постепенно сконцентрировалось на арабидоп-
сисе. Именно этот объект стал модельным в современной генетике
растений.
153
Вместе с тем отдельные аспекты развития, специфичные для
некоторых групп растений, продолжают исследовать и на других
объектах. Так, формирование азотфиксирующих клубеньков изу-
чают на разных бобовых растениях. В этом плане традиционным
модельным объектом долгое время являлся горох посевной. Одна-
ко целый ряд негативных моментов (например, очень крупный
геном, а также низкая способность к трансформации и регенера-
ции) вынуждают генетиков переключаться с гороха на новые пер-
спективные объекты наподобие лядвенцев. Таким образом, появ-
ление новых модельных объектов в генетике развития растений
вполне возможно и в настоящее время.
Совсем недавно в число вероятных претендентов на ведущую
роль в генетике развития высших растений вошли и некоторые
мохообразные, например Physcomitrella patens. Дело в том, что у
этих объектов основная жизненная стадия представлена гаплоид-
ным гаметофитом, что резко упрощает методику отбора мутантов.
Более того, для данного вида характерна высокая способность к
трансформации, а главное — к направленному мутагенезу за счет
гомологичного встраивания привнесенных фрагментов ДНК. В
частности, с использованием этого подхода удалось впервые инак-
тивировать хромосомный ген FTSZ, контролирующий деление
пластид (в результате подобной манипуляции в каждой из клеток
мутанта вместо нескольких мелких пластид сохраняется одна
большая). Очевидно, что в ближайшем будущем список аналогич-
ных мутаций, затрагивающих многие неисследованные гены, будет
значительно расширен, открывая тем самым новые горизонты мо-
лекулярной генетики развития высших растений.
ЛИТЕРАТУРА
Bancroft I. et al. Analysis of 1,9 Mb of contiguous sequence from chromosome 4 of
Arabidopsis thaliana 8 Nature. 1998. Vol. 391. P. 485—488.
Gillham N. W. Organelle genes and genomes. N. Y.; Oxford: University Press, 1994.
424 p.
Kunze R., Saedler H., Lonning W.-E. Plant transposable elements 8 Advances in Bota-
nical Research. 1997. Vol. 27. P. 331—470.
ЧАСТЬ II
ГЕНЕТИЧЕСКИЕ ОСНОВЫ РАЗВИТИЯ
РАСТЕНИЙ ОТ СЕМЕНИ ДО СЕМЕНИ
Глава II. 1
ЭМБРИОНАЛЬНОЕ РАЗВИТИЕ
Жизненный путь растения включает несколько стадий: эмбрио-
генез, вегетативное развитие, генеративное развитие и старение,
которое заканчивается гибелью растения. У цветковых растений
гаметофит развивается на спорофите, который защищает гамето-
фит от неблагоприятных воздействий факторов внешней среды.
Гаплофаза начинается после мейоза и образовавшиеся споры про-
ходят через митоз, где мужская клетка дифференцируется в пыль-
цевое зерно, а женская — в зародышевый мешок. Мужской и жен-
ский гаметофиты развиваются из специализированных клеток в
репродуктивном органе — цветке. В завязи формируется женский
гаметофит, в тычинке — мужской. У цветковых растений имеет
место двойное оплодотворение, результатом которого является
формирование диплоидного зародыша и триплоидного эндоспер-
ма. С этого момента начинается стадия эмбриогенеза, которая
продолжается до момента прорастания семени. Из семени развива-
ется проросток, который дает начало растению. Растение прохо-
дит вегетативную фазу развития с формированием побегов и кор-
ней. Переключение развития на генеративную стадию сопровожда-
ется формированием меристем соцветия и самих соцветий. Для
генеративной фазы развития характерно формирование цветка,
который является местом образования гамет. Гаметы после слия-
ния запускают следующий цикл развития (рис. II. 1). Следует отме-
тить, что последовательные события частично перекрываются во
времени. Однако программы, контролирующие их в функциональ-
ном отношении, независимы. Доказательством этого служит ана-
лиз большого числа мутантов, у которых блокированы разные
этапы эмбриогенеза.
155
формирование
органов
Формирование спор
Формирование гамет
пестик
цветок
материнская
мегаспора мегаспора
семяпочка
меиоз
митоз
опыление
ты чинк
зерн
(п)
восьмиядерный
зародышевый
мешок (п)
пыльцевой материнская микроспоры пыльцевое
мешок микроспора (п)
побеговая меристема
сеянец
прорастание
корневая меристема
точка роста) ЭНдосперм оплодотворенное
семядоля " к ядро эндосперма
Зп)
пестик
СГгаметофит
(п)
- —столбик
завязь
(п)
оплодотворение
клетки
сперми
ыльцева
трубка
яйцеклетка
покоящееся семя развивающийся оплодотворенная
зародыш зигота (2п)
Эмбриогенез
Рис. П.1. Жизненный цикл высших растений.
П.1.1. ХАРАКТЕРИСТИКА СТАДИЙ ЭМБРИОГЕНЕЗА
Эмбриогенез растений разделяют на стадии: проэмбрио, глобу-
ла, сердце (рис. II.2). Стадию торпедо, которую часто выделяют,
обычно не относят к эмбриогенезу, она соответствует стадии со-
зревания. Наиболее подробно эмбриогенез описан у арабидопсиса,
на примере которого он будет рассмотрен далее.
Уже первое деление зиготы характеризуется асимметричностью.
Оно приводит к образованию двух неравных клеток, судьба кото-
рых в дальнейшем различна. При этом маленькая терминальная
клетка дает начало зародышу, а большая базальная — гипофизу и
суспензору. Таким образом, для зародыша характерно наличие
апикально-базальной оси симметрии (рис. II.2).
Полярность, возникающая уже на первых этапах развития зиго-
ты, поддерживается и передается дочерним клеткам. Предполага-
ется, что в этом процессе участвуют асимметрично расположен-
Стадия
глобула
Стадия
торпедо
Рис. II.2. Стадии эмбриогенеза арабидопсиса.
а — апикальная клетка; б — базальная клетка; в — суспензор; г — гипофиз; д —се-
мядоля; г — апикальная (вегетативная) меристема; ж — оболочка семени; з — эн-
досперм; и — корневая меристема.
157
ные ионные каналы и белки-носители, присутствующие в мембра-
не, которые и генерируют внутриклеточные потоки ионов.
Полярность зиготы хорошо изучена на примере морской бурой
водоросли Fucus. Эта крупная водоросль выбрасывает в окружаю-
щую среду тысячи свободно живущих спермиев и яйцеклеток. Оп-
лодотворенная яйцеклетка первоначально имеет округлую форму
и лишена полярности. Однако через 18 часов зигота поляризуется
и асимметрично делится, в результате чего формируется неболь-
шая базальная клетка, из которой формируется структура, служа-
щая для прикрепления водоросли к субстрату, и апикальная боль-
шая клетка, из которой развивается таллом. Ключом к пониманию
механизма поляризации зиготы служит обнаруженный небольшой
электрический ток, проходящий через клетку. Ток генерируется и
поддерживается благодаря пассивному переносу ионов Са2+ в ба-
зальный полюс и активной утечке Са2+ из апикального полюса.
Этот факт доказывает асимметричное распределение кальциевых
каналов и насосов в плазматической мембране. Такой ток при-
водит к электрофоретическому перемещению внутриклеточных
компонентов, обладающих зарядом. В результате происходит на-
копление секреторных пузырьков в базальной части и отложение
полисахаридов в этом участке клеточной стенки. Описанные изме-
нения в неполярной клетке Fucus вызываются градиентом света и
силой тяжести и приводят к неравномерности распределения
ионов Са2+. Аналогичные градиенты существуют во многих тканях,
обладающих полярным ростом, например корнях, пыльцевых
трубках и т.д.
Апикальная клетка арабидопсиса делится с формированием 4-,
8-, 16-клеточного зародыша. 4-клеточный зародыш состоит из
двух основных слоев: верхнего и нижнего, которые сохраняются в
течение всего эмбриогенеза (рис. II.3). Из верхнего слоя в дальней-
шем формируются побеговая апикальная меристема (ПАМ) и верх-
няя часть семядолей. Из нижнего слоя в свою очередь формируют-
ся три слоя, которые в литературе получили название: апикальный,
центральный и базальный домены. Из апикального домена форми-
руется нижняя часть семядолей, из центрального — гипокотиль, а
из базального — корневая апикальная меристема (КАМ), из кото-
рой образуется корень (рис. П.З).
Деление базальной клетки приводит к формированию гипо-
физа и суспензора. Гипофиз дает начало корневому чехлику и не-
подвижному центру корня (см. гл. II.4). Суспензор, как правило,
состоит из 7—10 клеток. У арабидопсиса он состоит из одной
большой клетки. Обычно суспензор выполняет роль якоря, соеди-
няющегося с тканью спорофита, за счет которого он и питается
(аналогия с пуповиной). Суспензор сохраняется до стадии Торпедо
или сердце, а затем отмирает. На стадии сердце зародыш уже
сформирован и имеет билатеральную симметрию.
Итак, при формировании зародыша происходит изменение
скорости и направления деления, появление асимметрии и диф-
158
Эмбриогенез
2-клеточный 8-клеточный Зародыш на Проросток
зародыш зародыш стадии сердце
Рис. П.З. Стадии формирования проростка.
а — апикальная клетка; б — базальная клетка; с — апикальный (верхний) домен;
д — нижний домен; е — гипофиз; ж — суспензор; з — семядоли; и —побеговая апи-
кальная меристема; к, л —два слоя, которые произошли как результат деления клеток
нижнего домена; м — гипокотиль; н — корень; о —корневой чехлик.
ференциация тканей и органов. Перемещения клеток, как у жи-
вотных, не происходит. В процессе развития зародыша накап-
ливаются питательные вещества. Созревание зародыша закан-
чивается тем, что его органы сформированы, ткани теряют
воду, уменьшается метаболическая активность и наступает пе-
риод покоя.
Интересно отметить, что зародыш в определенных условиях
может развиваться без окружающих тканей. Доказательством
этого служат работы по культивированию in vitro, где можно ини-
циировать развитие зародыша из оплодотворенной яйцеклетки.
ЦИТОГЕНЕТИЧЕСКАЯ ХАРАКТЕРИСТИКА ЗАРОДЫША
К моменту отделения семени от материнского растения заро-
дыш уже дифференцирован на три основные части: апекс корня,
апекс побега и семядоли (одна или две). Степень дифференциро-
ванности зародыша разная — у злаков он полностью дифференци-
рован, а у орхидных — практически нет. В последнем случае, на-
пример у Vanda sandariana, можно выделить только три гистологи-
ческие зоны: меристематическую, паренхимную и суспензорную.
159
Объем ядер и клеток паренхимной зоны отличается от меристем-
ной, обнаружена корреляция между объемом ядра и количеством
ДНК. Ядра в этой зоне можно подразделить на классы с 2 С, 4 С,
8 С и более ДНК. У покрытосеменных с хорошо развитым заро-
дышем в его клетках также отмечена эндоредупликация хромосом.
Очень часто эндоредупликация хромосом сопровождается поли-
плоидизацией. Полиплоидизация ядер характерна для дифферен-
цирующихся и уже сформировавшихся тканей, например щитка,
гипокотиля, мезокотиля и семядолей. Именно в семядолях наблю-
дали тетраплоидные митозы, есть данные о полиплоидизации в
клетках семядолей. Например, у гороха Pisum sativum, по данным
цитофотометрии, уже через сутки после проращивания семян ядра
эпидермальных клеток содержали 4п, а ядра гиподермальных кле-
ток — от 2 до 4п, причем ббльшую часть составляли тетраплоид-
ные клетки. Наружные запасающие клетки содержали от 4 до 8п,
а внутренние — от 8 до 16п. После прорастания процессы эндоре-
дупликации и полиплоидизации продолжаются, и к 12-му дню
большинство клеток паренхимы полиплоидны. Таким образом, в
зародыше одновременно присутствуют как диплоидные, так и по-
липлоидные клетки.
Метод гибридизации ДНК—РНК показал, что в основном раз-
личные последовательности ДНК в ядрах полиплоидных клеток
встречаются с той же частотой, что и у диплоидных, т. е., как
правило, происходит эндорепликация всего генома, а не избира-
тельная амплификация отдельных последовательностей. Однако
полиплоидизация наблюдается не у всех видов. Так, у Lactuca sa-
tiva все клетки семядолей имеют 2п.
К зародышу прилегает суспензор — короткоживущее диффе-
ренцированное образование. Строение суспензора крайне вариа-
бельно у разных видов. Чем хуже развит зародыш, тем сильнее
развиты клетки суспензора, т. е. он, вероятно, может выполнять
роль эндосперма. Если исходно сформировавшийся зародыш абор-
тируется, то клетки суспензора могут преобразовываться в него.
Таким образом, в норме зародыш репрессирует морфогенетичес-
кий потенциал суспензора. В клетках суспензора чаще всего про-
ходит эндорепликация хромосом, и уровень копийности может до-
стигать 128 С и даже 1024 С, часто встречаются политенные хро-
мосомы. Выявлены интересные закономерности — если суспензор
составляет нить клеток (9—13 клеток), то содержание ДНК мень-
ше всего в первой клетке, которая находится ближе к зародышу,
далее количество ДНК увеличивается, а затем, к концу, опять сни-
жается. Увеличение уровня ДНК не всегда кратно п, что объяс-
няют дифференциальной репликацией ДНК. Высокая степень по-
липлоидизации ДНК в суспензоре, особенно на стадии сердце,
связана с высокой метаболической активностью и соответствует
функции «выкармливания» зародыша. Показана дифференциаль-
ная транскрипция определенных участков политенных хромосом и
локальное накопление экстракопий ДНК, приводящее к образова-
ло
нию пуффов. Обнаружена экстрасателлитная ДНК, которая далее
в растениях не встречается. Относительное содержание рДНК в
суспензоре ниже, чем в ДНК побегов и корня, т. е. в клетках сус-
пензора она недорепяицирована.
Итак, полиплоидизация широко распространена в тканях
растений. Только 20 % его клеток строго диплоидны. Полипло-
идия — это не обязательное свойство дифференцированных
клеток, а скорее, последствие дифференцировки. Умножение ге-
нетического материала зародыша важно для его функциональ-
ной активности.
11.13. ГЕНЫ, ЭКСПРЕССИРУЮЩИЕСЯ В РАННЕМ ЭМБРИОГЕНЕЗЕ
Для изучения молекулярно-генетических основ эмбриогенеза
необходимо получение и анализ мутантов по отдельным этапам
эмбриогенеза, а также анализ дифференциальной экспрессии спе-
цифических для эмбриогенеза генов, клонирование и изучение их
функций.
Гены, экспрессирующиеся в эмбриогенезе у цветковых расте-
ний, можно разбить на несколько групп:
1) гены «домашнего хозяйства» — экспрессируются конститу-
тивно в процессе всей жизни растения, в том числе и в зародыше;
2) эмбриоспецифические гены, которые можно подразделить на
гены раннего эмбриогенеза,
гены, экспрессирующиеся в процессе созревания зародыша,
> гены, экспрессирующиеся в позднем эмбриогенезе и захва-
тывающие процесс прорастания семени (рис. II.4).
Часто сложно приурочить экспрессию гена к определенной из
вышеназванных стадий, так как сами стадии значительно перекры-
ваются.
Одним из первых эмбриоспецифических генов, экспрессия ко-
торого была обнаружена в раннем эмбриогенезе, является ген
АТМ1 (от Arabidopsis thaliana meristem L1). Ген экспрессируется
только в апикальной клетке зародыша сразу после первого асим-
метричного деления зиготы и продолжает экспрессироваться до
стадии восьмиклеточного зародыша. На последующих стадиях ха-
рактер ее экспрессии меняется, и после стадии Торпедо ее можно
наблюдать только в первом слое клеток (L1). Судя по характеру
своей экспрессии данный ген вовлечен в контроль клеточной диф-
ференцировки и в формирование апикально-базальной оси сим-
метрии зародыша. Этот ген является самым ранним молекулярным
маркером растительного эмбриогенеза.
На более поздней стадии эмбриогенеза, когда уже сформирова-
ны семядоли, у сои обнаружена экспрессия гена KUNITZ (KTI),
который контролирует синтез трипсинового ингибитора протеаз.
Основное место его экспрессии — район апекса зародыша, в се-
мядолях она отсутствует. Экспрессия гена KTI тканеспецифична и
6 Генетика
161
Рис. II.4. Гены, экспрессирующиеся в эмбриогенезе.
1 — гены домашнего хозяйства (house—keeping); 2 — эмбриоспецифические гены;
2а — гены раннего эмбриогенеза; 26 — гены этапа созревания; 2в —гены, экспрес-
сирующиеся в позднем эмбриогенезе и захватывающие прорастание семян.
имеет волновой характер. Выявлены фрагменты промотора, ко-
торые определяют экспрессию гена в определенной части —
эмбриоапикальной или радиальной. Тканеспецифичность экспрес-
сии этого гена свидетельствует о наличии определенных транс-
крипционных факторов в разных частях зародыша, которые взаи-
модействуют со специфическими промоторными элементами этого
гена.
П.1.4. ГЕНЫ, ЭКСПРЕССИРУЮЩИЕСЯ
В ПРОЦЕССЕ СОЗРЕВАНИЯ ЗАРОДЫША
Запасные белки, синтезирующиеся в семенах, составляют ос-
новную их часть и являются главным источником питания для
прорастающих семян. Например, у бобовых 20—40 % сухого веса
семян составляют белки, у злаков — 7—16 %. В регуляции синте-
за запасных белков принимает участие более 20 генов.
Запасные белки синтезируются в ядре, как белки-предшествен-
ники с N-терминальным сигнальным пептидом. Основное место их
внутриклеточной локализации — это эндоплазматический ретику-
лум или вакуоли, поэтому в эндомембране они модифицируются,
освобождаясь от сигнального пептида. Запасные белки аккумули-
руются в эндосперме у злаков и в семядолях у двудольных расте-
ний. Наибольшее их накопление происходит между 10—20 днем
после опыления. В этот период половина всей мРНК вовлечена в
синтез запасных белков.
162
В семядолях двудольных экспрессируются гены, контролирую-
щие синтез таких белков, как легумины, вицилины, фазеолины и
др. В строении этих генов много общих черт. Показано, что их
регуляторные области имеют высокий процент гомологии. Нали-
чие гомологичных областей предполагает общие механизмы регу-
ляции их экспрессии. Гены, которые контролируют синтез запас-
ных белков, перенесенных с помощью агротрансформации в
табак, хорошо экспрессируются в гетерологичной системе.
В эндосперме однодольных экспрессируются гены, которые
контролируют синтез таких белков, как зеины, глиадины, глюте-
нины. Эти белки относят к группе проламинов.
Наиболее изучены зеиновые гены кукурузы, которые составля-
ют целое семейство. Выделяют 4 типа зеиновых генов: а, 0, у и
5, которые взаимодействуют друг с другом. Это эндосперм-специ-
фичные гены, экспрессию которых изучали в гетерологичной
системе табака. Для анализа промоторной области использован
делеционный анализ и метод агротрансформации с маркерным
геном GUS. Анализ промотора показал наличие универсальной
последовательности, характерной для всех зеиновых генов. Эта
последовательность гомологична энхансерной, обнаруженной у
вирусов, животных и в промоторах других эндосперм-специфич-
ных генов, например в гене, контролирующем синтез сахаросин-
тазы у кукурузы. Зеиновые гены имеют две ТАТА последователь-
ности в промоторной области, которые расположены на расстоянии
900 п. о. одна от другой. Еще одна сигнальная последователь-
ность (AGGA), найдена в промоторах у всех зеиновых генов, с
которых транскрибируется два типа РНК длиной 900 и 1800 нук-
леотидов. AGGA-последовательность соответствует СААТ-после-
довательности, обнаруженной практически во всех эукариотичес-
ких генах, в том числе и в растительных, за исключением зеино-
вых генов. В зеиновых генах обнаружена также консервативная
последовательность TCCACGTAGA в положении -333 -318 до
старта транскрипции, с которой специфически связываются бел-
ковые факторы. Недавно в зеиновых генах была обнаружена еще
одна последовательность — 5'-TGTAAAG-3', которая обозначена
как Р-box (проламиновый) и является точкой взаимодействия с
регуляторными белками. Регуляторные белки, взаимодействую-
щие с этой последовательностью, получили название PBF (prola-
min box-binding factor). Эти белки относят к новому классу регу-
ляторных белков.
Ген, вовлеченный в регуляцию дифференциальной транскрип-
ции зеиновых генов, обозначается как О-2 в соответствии с му-
тацией, полученной по этому гену, — opaque-2. Ген О-2 был кло-
нирован и стало ясно, что он имеет высокий процент гомологии с
онкогенами V-JIN, V-FOS и дрожжевым геном, кодирующим
транскрипционный фактор GCN4. Белки, кодируемые этими гена-
ми, относятся к ZIP транскрипционным факторам. Таким образом,
продукт гена О-2 является транскрипционным фактором, связы-
163
вающимся с промоторной областью зеиновых генов и регули-
рующим их экспрессию. Показано, что этот полипептид может ак-
тивировать транскрипцию и других генов запасных белков, а
также узнавать иные последовательности в промоторе, например
GACATGTC.
Учитывая сходство генов, контролирующих синтез запасных
белков, предполагают, что в эволюции они произошли путем дуп-
ликации от одного общего предка. Гены этого семейства чаще
всего сцеплены и расположены в виде блоков в одной группе сцеп-
ления. У пшеницы описано девять главных и несколько минорных
локусов, контролирующих синтез запасных белков. Эти гены рас-
положены в двух группах сцепления. Как правило, каждый ген,
контролирующий синтез запасных белков у растений, представлен
серией множественных аллелей.
Особую группу представляют гены, которые экспрессируются в
алейроновом слое. Алейроновый слой характерен для семян зла-
ков и образуется из внешнего слоя эндосперма. Белки, специфи-
чески экспрессируемые в алейроновом слое, разрушают эндо-
сперм, снабжая пищей развивающийся зародыш. Эти белки явля-
ются различными гидролазами, в том числе и амилазами.
Наиболее изучены гены, контролирующие синтез амилаз. В на-
стоящее время описано три класса амилазных генов:
> L-AMYL3 — экспрессируется только в алейроновом слое
эндосперма;
> L-AMYL1 и L-AMYL2 — экспрессируются в алейроновом
слое прорастающих семян.
Показано, что экспрессия гена L-AMYL2 находится под стро-
гим контролем гиббереллиновой кислоты (ГК). Это одна из пер-
вых моделей, где наиболее полно изучена и доказана роль фито-
гормонов в регуляции экспрессии генов (см. часть III, гл. 1).
11.1.5. МУТАНТЫ ПО ЭМБРИОГЕНЕЗУ
Для получения мутантов по эмбриогенезу используют традици-
онную схему (рис. II.5, см. вкл.). Семена обрабатывают мутагеном
или облучают, затем их проращивают. Анализируя вновь образо-
вавшиеся семена в стручках растений Ml или проращивая их,
проводят отбор мутантов в расщепляющемся потомстве М2. Му-
танты по эмбриогенезу можно разбить по крайней мере на три
группы, для которых характерны:
1. Нарушения на ранних этапах деления зиготы и формирова-
ния эмбрио. Мутации проявляются в М2 на уровне проростков.
2. Эмбриональные летали, которые проявляются в стручках на
растениях Ml. Это самый большой класс мутантов, характеризую-
щийся нарушениями в аккумуляции пигмента и запасных веществ.
3. Нарушение покоя семян, которое проявляется как прораста-
ние семян в стручке на растениях Ml.
164
В настоящее время используют и другие методы для получения
мутаций. Например, облучают пыльцу и проводят учет мутаций в
поколении Ml. Кроме того, активно используют транспозонный
или Т-ДНК мутагенез, особенно у легко трансформируемых видов.
Лишенную онкогенов Ti-плазмиду в последние годы активно ис-
пользуют для получения мутаций. Т-ДНК, встраиваясь в геном рас-
тения, выключает ген, а по утрате функции можно легко отбирать
мутанты. Этот метод замечателен также тем, что позволяет сразу
клонировать соответствующий мутантный ген, так как он содер-
жит заведомо известную последовательность. В настоящее время
таким способом получено множество новых мутаций у растений и
соответствующие гены клонированы.
Мутанты раннего эмбриогенеза. Известна группа мутантов, у
которых затронуты различные аспекты организации тела зароды-
ша. По оси зародыш можно разделить на 3 части:
. апикальная, содержащая семядоли и побеговую апикальную
меристему;
. центральная, содержащая гипокотиль;
. базальная, которая содержит корневую апикальную мерис-
тему.
Возникает вопрос, насколько взаимосвязано развитие этих
трех районов? Если генетический контроль формирования каждо-
го района осуществляется независимо, то развитие одной части
зародыша не должно влиять на другую, т. е. экспрессия генов в
каждом районе зародыша будет осуществляться независимо.
Рассмотрим мутанты, характеризующиеся специфическими из-
менениями в разных частях зародыша (табл. II. 1, рис. II.6).
Ген GURKE (GK) действует на уровне семядолей и апикальной
меристемы. У мутантов, в зависимости от аллельного состояния, в
разной степени редуцирован апикальный район — отсутствуют
семядоли и побеговая апикальная меристема. Как правило, у му-
тантных проростков в апикальной зоне формируется неорганизо-
ванная клеточная масса. У некоторых аллельных вариантов на-
блюдается редукция гипокотиля. Мутантный фенотип начинает
проявляться на стадии сердце и затрагивает верхний слой, кото-
рый формируется из апикальной клетки. Только на более поздних
стадиях возможны нарушения в центральном домене нижнего
Таблица II. I
Мутации, затрагивающие развитие зародыша арабидопсиса
Место возникновения мутации Ген (символ) Число аллелей
Апикальный район (семядоли и GURKE (GK) 9
черешки семядолей, ПАМ)
Центральный район (гипокотиль) FACKEL (FK) 5
Центральный и базальные районы MONOPTEROS (МР) 11
(гипокотиль и корень)
Апикальный и базальный районы GNOM (GM) 15
165
a
Рис. II.6. Мутации арабидопсиса, затрагивающие различные части про-
ростка.
а — норма; б — мутация gurk; в — мутация fackel; г — мутация monopteros; д —
мутация gnom; отсутствие определенного участка проростка заштриховано.
слоя. Судя по анализу мутантов ген GK может контролировать
развитие двух районов: апикального и центрального. Однако, по
мнению многих исследователей, эффект гена GK на центральный
район является вторичным, а основное его место действия — апи-
кальная меристема и семядоли. Постэмбриональное развитие этих
мутантов изучено in vitro. Показано, что у растений в асептичес-
ких условиях формировались аномальные листья, стебли и цветки.
166
Ген FACKEL (FK) действует на уровне центрального района. У
мутантов отсутствует гипокотиль, в результате чего семядоли
«сидят» прямо на корневой части. У мутантов нарушена структура
семядолей и их количество, которое может быть больше двух. У
проростков нормально развита корневая система.
Ген MONOPTEROS (МР) действует в центральной и базальной
частях зародыша. У мутанта отсутствует гипокотиль и корни. Эта
мутация по своему проявлению комплементарна мутации gurk, ко-
торая характеризуется отсутствием верхней части проростка. Коли-
чество семядолей у мутанта шр варьирует от одной до двух. У мутан-
та шр первые деления зиготы проходят без нарушений вплоть до
8-клеточного зародыша. Изменения отмечены лишь начиная со ста-
дии перехода сердце к стадии Торпедо в нижнем слое зародыша и в
начале гипофиза и не затрагивают верхнего слоя зародыша.
Ген GNOM (GM) действует на уровне апикального и базального
районов проростка. У мутанта редуцированы апикальная побеговая
и корневая меристемы, а также сильно изменены семядоли. У мутан-
та gnom первое деление характеризуется формированием двух оди-
наковых клеток вместо терминальной и базальной, как это имеет
место у форм дикого типа. Для gnom характерны нарушения и по-
следующих делений. С использованием Т-ДНК мутагенеза ген GNOM
клонирован. Показано, что он имеет высокий процент гомологии с
дрожжевым геном SEC7, кодирующим секреторный белок. Ген
GNOM экспрессируется не только в эмбриогенезе, но и на других
стадиях жизненного цикла растения. Предполагается, что этот ген
не вовлечен в регуляцию клеточного цикла в эмбриогенезе, скорее
всего, это ген, формирующий характер деления.
Анализ мутантов показал, что мутация, затрагивающая одну
часть зародыша, как правило, не проявляется в другой его
части. Таким образом, экспрессия «эмбриональных» генов про-
странственно-специфична, а клетки, формирующие определен-
ные домены зародыша, автономны. Все описанные мутации яв-
ляются ядерными и рецессивными.
Важным вопросом генетики развития является: что первич-
но — дифференцировка клеток или морфогенез? Можно считать
доказанным, что дифференциация тканей происходит раньше и
независимо от морфогенеза, а критическая точка (chekpoint) до-
стигается только тогда, когда клетка начинает дифференцировать-
ся. Пока это не произошло, т. е. клетка тотипотентна, ее судьба не
определена. Частью какой ткани и какого органа станет данная
клетка, определится только после ее дифференцировки. Доказа-
тельством этому послужил анализ серии мутантов.
Мутант raspberry был получен с помощью Т-ДНК мутагенеза
у арабидопсиса. У него потеряна способность к переходу от ста-
дии глобула к стадии сердце, при этом первая стадия долго сохра-
няется. Как сказано выше, дифференциация тканей начинается на
стадии глобула. Нарушения на этой стадии приводят к серьезным
аномалиям в развитии зародыша. У мутанта отсутствуют семядоли
167
и часть гипокотиля, расширен район суспензора. Таким образом,
нарушения в момент дифференциации тканей приводят к крити-
ческим изменениям в формировании зародыша.
Другой пример, у мутантов keule (keu) и knolle (kn) также на-
рушена дифференцировка тканей. В частности, у мутанта knolle
нарушена дифференциация эпидермальных и проводящих тканей.
В результате у мутантных зародышей эпидермальная ткань отсут-
ствует, а проводящая ткань состоит из аномально крупных клеток,
при этом сам зародыш выглядит округлым. В результате таких на-
рушений зародыш сильно изменен и характеризуется отсутствием
апикальной и базальной части. У другого мутанта keule отмечены
нарушения в эпидермальной ткани — эпидермальные клетки раз-
дуты. Однако даже столь незначительное нарушение в дифферен-
цировке тканей приводит к тому, что измененный зародыш приоб-
ретает ненормально округлые очертания.
Итак, нарушения в дифференцировке тканей приводят к на-
рушениям в морфогенезе.
Мутанты позднего эмбриогенеза. Для понимания процесса эм-
бриогенеза большое значение имеет анализ мутаций по генам LEC,
которые экспрессируются на поздней стадии эмбриогенеза. Мута-
ция leafy cotyledons (led) у арабидопсиса получена на основе хими-
ческого мутагенеза. У этих мутантов семядоли проростков имеют
листоподобное строение, так как на их поверхности из протодер-
мального слоя формируются трихомы (рис. II.7). Трихомы — это
маркер постэмбрионального развития, и формируются они только
на поверхности листа, стебля и цветков. Кроме того, у мутанта в тка-
нях семядолей обнаружены характерные для листа мезофильные
клетки — устьица, а в клетках семядолей отсутствуют запасные
белки. Для мутантов также характерно раннее прорастание и потеря
А
Рис. И.7. Плейотропный эффект мутации led на развитие зародыша.
А — дикий тип; Б — мутант led.
168
стадии покоя семян. Другой мутант — 1ес2 — имеет такой же фено-
тип, но у него не нарушена стадия покоя и аккумуляция запасных
белков в тканях семядолей. Гены LEC функционируют в норме не-
зависимо на стадии созревания. Анализ мутантов показал, что в
норме гены LEC контролируют формирование семядолей, аккуму-
ляцию запасных белков, поддержание покоя семян. Кроме того,
гены LEC супрессируют проявление признаков листа (наличие три-
хом, мезофила, устьиц) в эмбриогенезе. Итак, гены LEC регулируют
широкий кругэмбриоспецифических программ. Анализ этих мутан-
тов позволил предположить, что семядоли в процессе эволюции
произошли из листьев и являются модифицированными листьями.
Следует добавить, что мутанты этого класса, например fusca у ара-
бидопсиса, чувствительны к АБК (абсцизовой кислоте).
Ген FUS3 (FUSCA 3) также действует на поздней стадии эм-
бриогенеза. Рецессивная мутация по этому гену приводит к акку-
муляции антоциана в семенах, а сами семена имеют измененную
морфологию. Кроме того, у мутантов не накапливаются запасные
белки в семядолях, нарушен ответ на свет. В целом фенотип этих
мутантов сходен с фенотипом 1ес. В отличие от мутантов 1ес у
мутанта fus3 трихомы появляются на семядолях проростков при
условии, если проростки выращивать in vitro. Кроме того, у мутан-
та fus3 не изменен гипокотиль, а семядоли тоньше и более вытя-
нуты, чем у мутантов 1ес.
В ходе генетического анализа было показано, что в процессе раз-
вития ген LEC1 действует раньше генов LEC2 и FUS, и мутация по
гену LEC1 вызывает большее число нарушений в эмбриогенезе. Все
перечисленные гены характеризуются взаимодействием в эмбриоге-
незе, которое можно представить в виде следующей схемы:
Стадия торпедо
Г
Законченный нормальный эмбриогенез
LEC2 Подавление признаков листа на семядолях
/ /
LEC1 /
/у* Подавление прорастания ◄--------j
FUS3—► Активация поздних программ w !
।
Изменение уровня АБК *-----ABI 3
Стадия созревания
169
Продуктом гена LEC1 является транскрипционный фактор, ко-
торый регулирует экспрессию генов LEC2 и FUS3. Показано, что
гены группы LEC и ABI3 регулируют развитие семени через раз-
ные пути, предотвращая потерю таких функций, как способность
к «высыханию» и «покою семян». Мутанты по гену ABI3 также
характеризуются чувствительностью к АБК и нарушением покоя
семян (более подробно см. часть III). Двойной контроль важней-
ших процессов у растений является широко распространенным яв-
лением. То, что разные гены с одинаковыми функциями могут
«подстраховывать» друг друга, эволюционно оправдано и является
одним из принципов адаптации растений.
Итак, основными факторами, лимитирующими дифференци-
ровку зародыша, являются:
. скорость деления клеток;
> асимметричность в делении;
> полярность клеток.
Как показал анализ мутантов, затрагивающих структуру заро-
дыша, каждый его район формируется автономно, а мутация, за-
трагивающая одну часть зародыша, не влияет на другую. Диффе-
ренциация тканей происходит раньше и независимо от морфоге-
неза. Пока клетка не дифференцирована, ее судьба не определена.
Глава II.2
РАЗВИТИЕ ПОБЕГОВЫХ АПИКАЛЬНЫХ МЕРИСТЕМ
Меристемы — это очаг недифференцированных клеток, спо-
собных к активному делению. У растений выделяют несколько
типов меристем — апикальные (недетерминированные), детерми-
нированные и интеркалярные. Остановимся на характеристике
апикальных меристем, которые выполняют следующие функции:
поддержание меристемы,
формирование органов.
П.2.1. СТРУКТУРА ПОБЕГОВЫХ
АПИКАЛЬНЫХ МЕРИСТЕМ (ПАМ)
ПАМ, или в английской транскрипции SAM (от Shoot Apical
Meristem), — это небольшая группа клеток, которые формируют-
ся из верхнего слоя апикальной клетки в эмбриогенезе на стадии
глобула-сердце и сохраняются в постэмбриональном развитии. Это
мелкие клетки с плотной цитоплазмой.
Побеговая апикальная меристема у цветковых растений имеет
размер в среднем 100 мМ в диаметре и включает 800—1200 кле-
170
ток. У арабидопсиса ПАМ много меньше и включает 50—70 кле-
ток (рис. II.8, а).
ПАМ по структуре подразделяют на 3 зоны, каждая из которых
имеет свои цитологические характеристики (рис.II.8, б). Цен-
тральная зона (ЦЗ) находится на дистальном конце и содержит
инициальные медленно делящиеся клетки с выпуклыми ядрами.
Клетки в этой зоне функционируют по типу стволовых у живот-
ных и служат источником клеток для других зон меристемы.
Клетки периферической зоны (ПЗ) окружают центральную
зону в виде наружной трубы. Скорость митоза в этой зоне много
выше, чем в ЦЗ. Из клеток этой зоны формируются латеральные
органы, например листовые зачатки (примордии). Формирование
листовых примордиев, из которых развиваются листья, происхо-
дит на фланкирующих участках этой зоны.
В основании ЦЗ расположена зона РИБ (подстилающая зона\
которая является границей между недифференцированными и
дифференцированными клетками. Клетки зоны РИБ делятся с вы-
сокой скоростью и формируют центральную часть побега — сте-
бель. Деления в ПЗ и РИБ зонах приводят к продвижению зоны
Побеговая апикальная
Рис. II.8. Структура апекса и побеговой апикальной меристемы.
а — апекс, включающий побеговую меристему и листовые примордии; б — зоны и
слои побеговой апикальной меристемы; ЦЗ — центральная зона; ПЗ — периферичес-
кая зона; РИБ зона; Л1,Л2 — туника; ЛЗ — корпус; в — организация вегетативной
меристемы.
171
ПАМ вверх, в то время как старые клетки остаются внизу, что
способствует росту стебля вверх.
В свою очередь каждую зону подразделяют на три слоя: Л1, Л2,
ЛЗ (рис. IL8, в). В слое Л1 клетки делятся антиклинально (парал-
лельно поверхности), что обеспечивает рост тканей в длину. В
слое Л2 клетки делятся также антиклинально, оба слоя вместе
формируют тунику и служат основой для образования тканей эпи-
дермиса и мезофилла. В слое ЛЗ деления происходят в двух на-
правлениях — параллельно и перпендикулярно поверхности (ан-
тиклинально и периклинально). Периклинальное деление способ-
Б
Рис. II.9. Формирование вторичных меристем растения.
А — модульная организация растения и формирование пазушных почек; Б —форми-
рование цветочной меристемы; В — формирование цветочной меристемы приморди-
ев; ЦАМ— цветочная апикальная меристема; ПАМ — побеговая апикальная меристе-
ма; остальные обозначения, как на рис. II.8.
172
ствует увеличению числа слоев и росту тканей в ширину. Из слоя
ЛЗ формируется основная и проводящая ткань. Все три слоя учас-
твуют в формировании листьев, стебля, цветков, т. е. основных ор-
ганов растения. Так, например, в листе из слоя Л1 формируется
эпидермис, из слоя Л2 — субэпидермальные клетки, а централь-
ные ткани, формирующие жилки листа, образуются из слоя ЛЗ.
Таким образом, в ПАМ наблюдается два типа деления клеток:
медленное в ЦЗ, которое поддерживает постоянное деление кле-
ток, и быстрое в ПЗ и зоне РИБ, что приводит к формированию
основных органов растения. Кроме того, в ПАМ клетки делятся в
разных направлениях: параллельно и перпендикулярно поверхно-
сти, что способствует формированию листовых зачатков.
В течение вегетативного развития в ПАМ формируются новые
меристемы и листовые зачатки. После инициации каждого нового
листа в его пазухах формируется вторичная меристема, из которой
образуются боковые побеги (рис. II.9).
При переходе к репродуктивной фазе развития ПАМ изменяет
свою активность и назначение и формирует уже не листовые, а
цветочные (флоральные) меристемы ЩАМ) (рис. II.9). Цветочные
меристемы имеют измененную форму, количество клеток в ней
увеличено. Кроме того, ПАМ и ЦАМ имеют разную судьбу:
ПАМ — это недетерминированные меристемы, которые дают на-
чало большому числу органов, а ЦАМ — это детерминированные
меристемы, из которых образуются в центре цветка пестики и ты-
чинки, характеризующиеся детерминированным ростом. Из опре-
деленных участков флоральной меристемы на строго определен-
ном растоянии друг от друга формируются зачатки органов цветка.
Тип клеточного деления (параллельно или перпендикулярно
поверхности) определяет форму органа, а число клеточных деле-
ний — его размер. Различные сочетания направления, скорости
и числа делений обеспечивают формирование органов растения,
которые различаются по морфологии и размеру. Анализ мута-
ций, затрагивающих меристему, показал, что различные спосо-
бы деления клетки генетически контролируются независимо.
Наиболее значимый вопрос — как клетки определяют свою
судьбу и узнают, как и когда им делиться. Сегодня уже можно с
уверенностью сказать, что клетки обмениваются сигналами и
«твердо знают», что делают соседние клетки, и ведут себя в соот-
ветствии со своим положением.
П.2.2. МУТАНТЫ С НАРУШЕНИЯМИ
ПОБЕГОВЫХ АПИКАЛЬНЫХ МЕРИСТЕМ
Проанализируем мутанты арабидопсиса, которые характеризу-
ются нарушениями деления клеток в ПАМ. Процесс ее формиро-
вания нарушен у мутантов stm (shoot meristemless), wus (wus-
chell), zll (zwill), pnh (pinhead), civ (clavata) и др., а также у всех
173
перечисленных мутантов она в той или иной степени редуцирова-
на. У большинства описанных мутантов ПАМ уменьшена, у мутан-
тов civ — увеличена. Соответствующие гены экспрессируются на
всех стадиях развития растения и только у мутантов zll и pnh экс-
прессия соответствующих генов обнаружена только в эмбриогене-
зе (рис. 11.10).
Однако, несмотря на разный характер их экспрессии, эффект
описанных генов одинаков и определяет размер меристем.
Гены STM. Ген STM1 вовлечен в инициацию ПАМ и ее поддер-
жание. По этому локусу получена серия рецессивных мутаций, ко-
торые в разной степени характеризуются или полной редукцией,
или только уменьшением размера ПАМ. У гомозиготы stm-1 ПАМ
полностью редуцирована, однако сам зародыш развивается нор-
мально. Проявление мутантного фенотипа можно зарегистриро-
вать уже на 4-й день после прорастания. Если у форм дикого типа
начиная со стадии Торпедо при последующем формировании про-
ростка конфигурация клеток изменяется, то у мутанта клетки
ПАМ не отличаются от клеток семядолей и гипокотиля. Эти ре-
зультаты указывают на то, что у мутанта нарушения в формирова-
нии ПАМ начинаются на стадии Торпедо.
Драматические изменения обнаруживаются у мутантов на 14-й
день после прорастания. На гипокотиле сразу под семядолями
формируется вырост, похожий на опухоль, из которого образуется
пучок листьев, имеющих ненормальную форму. При этом почки с
нормальным филотаксисом не формируются. Важно отметить, что
мутация не затрагивает другие типы меристем (корневые, вторич-
ные), поэтому листья, формирующиеся из вторичных меристем,
гипокотиль и корень развиваются нормально.
У мутантов по гену STM обнаружено нарушение в развитии
цветка, у них изменено количество и форма пестиков. Мутация не
затрагивает число чашелистиков, лепестков и тычинок. Таким об-
разом, этот ген влияет на инициацию и поддержание центральной
зоны ПАМ и определяет, какие клетки будут участвовать в форми-
ровании органов растений.
Гены CLV. Мутации по генам CLAVATA1 (CLV1) и CLAVATA3
(CLV3) фенотипически проявляются как увеличение размеров по-
беговых и цветочных меристем, в отличие от ранее описанной му-
тации stm. У clv-1 ПАМ увеличена почти в 1000 раз по сравнению
с диким типом (рис. 11.11). У мутанта изменена и ЦАМ, что при-
водит к увеличению числа всех органов цветка и в конечном итоге
к развитию недетерминированного цветка, у которого в центре со-
храняется масса недифференцированных клеток (рис. 11.12). Му-
тация clv-З приводит к такому же фенотипу. Фенотип двойных
мутантов clv-i и clv-З идентичен таковому для каждого из иден-
тичных мутантов. Следовательно, оба гена контролируют один и
тот же биохимический путь. Их предполагаемая функция — кон-
троль дифференцировки клеток в ПАМ и ЦАМ, т. е. продукт
этого гена выступает как репрессор клеточных делений и способ-
174
Этапы развития
Формирование
ПАМ
Поддержание
ПАМ
------------>
Поддержание
ЦАМ
PNH, ZLL
STM, WUS
CLV1.2.3
Рис. 11.10. Гены, контролирующие развитие меристем.
Обозначения, как на рис.П.9.
Рис. 11.11. Строение побеговых апикальных меристем (ПАМ).
А — дикий тип; Б — мутант civ; 1,2 — листовые зачатки; 3 — недифференциро-
ванные стволовые клетки; 4 — район формирования органов проростка.
Рис. 11.12. Цветок арабидобсиса.
А — дикий тип; Б — мутант civ, у которого изменено число чашелистиков, лепест-
ков, тычинок и пестиков.
175
ствует переходу стволовых клеток к формированию листовых за-
чатков и цветочных меристем.
Ген ZLL. Мутация по гену ZLL (ZWILLE) приводит к формиро-
ванию проростков с нарушенным развитием апикальной меристе-
мы. У таких проростков на месте ПАМ формируется лист или фраг-
мент листа. Другая часть проростка, а именно семядоли, гипокотиль
и корень, остается без изменения. Следовательно, ген ZLL требуется
только для развития ПАМ. На ранних стадиях эмбриогенеза (до ста-
дии Торпедо) не найдено различий между зародышами у дикого типа
и мутантов zll. В обоих случаях в центре ПАМ между семядолями
формируются мелкие клетки с крупным ядром и небольшими ваку-
олями. Окружающие клетки, которые уже частично дифференциро-
ваны, характеризуются более крупным размером и ярко выраженны-
ми вакуолями. Однако на более поздней стадии у проростков zll
клетки ПАМ оказываются более крупными и вакуолизированными,
чем у проростков дикого типа, и мало отличаются по фенотипу от
дифференцированных клеток. У мутантов zll была изучена экспрес-
сия гена STM как маркера эмбриогенеза. Экспрессия гена STM у му-
тантов zll была нормальной на ранних стадиях эмбриогенеза. Одна-
ко на его поздних стадиях характер экспрессии этого гена значи-
тельно изменился. Ген STM практически не экспрессировался в
центре ПАМ, но его экспрессия была обнаружена в небольшой груп-
пе латеральных клеток, что объясняет сходство мутантов zll и stm по
фенотипу. Ген STM в эмбриогенезе экспрессируется раньше гена
ZLL, причем STM подавляет его.
Ген WUS. У мутантов wus отсутствует способность формиро-
вать ПАМ в эмбриогенезе или ПАМ формируется с сильными на-
рушениями и имеет плоскую конфигурацию. В постэмбриональ-
ном развитии ПАМ инициируются вторично, но тем не менее ор-
ганы формируются аберрантные, а у цветков редуцировано число
центральных органов. У мутантов часто можно наблюдать форми-
рование новых ПАМ, возникающих вместо органов из вторичных
меристем, что приводит к формированию большого числа адвен-
тивных побегов. У мутанта wus клетки в районе апекса больше и
более вакуолизированные, чем у форм дикого типа. Предполагае-
мые функции гена WUS связаны с поддержанием клеточного деле-
ния, сохранением функции стволовых клеток и с инициацией
формирования меристем. Ген WUS контролирует соотношение
дифференцированных и недифференцированных меток между
центральной и периферическими зонами.
П.23. ХАРАКТЕРИСТИКА ГЕНОВ,
КОНТРОЛИРУЮЩИХ РАЗВИТИЕ ПАМ
Ген арабидопсиса CLV1 клонирован. Кодируемый им белок яв-
ляется трансмембранной рецепторной киназой. На N-конце белка
имеется сигнальный пептид, необходимый для трансмембранного
176
транспорта внеклеточного домена. Внеклеточный домен белка
Clv-1 включает 15 сайтов гликозилирования и состоит из 21 лей-
цинбогатого повтора (LRR-), которые вовлечены в белок—белок
взаимодействия. Внутриклеточный домен характеризуется наличи-
ем всех консервативных аминокислотных остатков, присущих
серин-треониновым протеинкиназам. Белок Clv-1 действует как
мультимер, и анализ структуры позволяет отнести его к типичным
сигнальным пептидам с функцией рецептора. Следует отметить,
что характер повторов CLV1 и структура белка в целом соответ-
ствуют рецептору гликопротеинового гормона животных. Кроме
того, CLV1 сходен по структуре с семейством R-генов — ХА-21,
CF-9, РТО, контролирующих устойчивость растений к патогенам
(см. часть VI). Часть из них (РТО, CF9) кодирует рецепторы, от-
носящиеся к классу серин-треониновых киназ. Ген CLV1 локали-
зован на 1-й хромосоме между генами GA1 и API.
Найден высокий процент гомологии гена CLV1 с генами жи-
вотных IL-1, NF и TOLL, где IL-1 и NF кодируют синтез белка,
участвующего в иммунном ответе, а ген TOLL — в развитии.
Предполагается, что белки, кодируемые этими генами, могут учас-
твовать в передаче сигнала между клетками, что особенно важно
для растений, у которых отсутствует клеточная миграция. Значе-
ние этих аналогий заключается в том, что домен LRR, который
имеется у всех перечисленных белков, вовлечен в процесс переда-
чи сигнала через белок—белковое взаимодействие. Согласно
одной из гипотез, эти белки являются компонентами клеточной
стенки и могут взаимодействовать, связываясь с белками соседних
клеток и передавая сигнал о направлении дифференцировки клет-
ки и ее будущей судьбе. Эта гипотеза подтверждается результата-
ми, полученными при изучении экспрессии гена CLV1. Его экс-
прессия обнаружена в центральной зоне ПАМ, где находятся ство-
ловые клетки, и в центральной части органообразующих районов
в ЛЗ, но отсутствует в слое Л1 и Л2. У мутанта clv-1 недифферен-
цированные клетки можно найти во всех слоях, в том числе в Л1
и Л2. Это предполагает, что продукт гена CLV1 имеет неавтоном-
ную клеточную функцию и может участвовать в передаче сигнала.
Однако возможно, что белок способен сам транспортироваться от
клетки к клетке между клеточными слоями. Такие примеры у рас-
тений уже описаны. Например, ген KNOTTED 1 транскрибируется
в клетках корпуса, а его белок обнаружен в клетках туники. Пред-
полагается, что этот белок может двигаться через плазмодесму в
листовых мезофильных клетках. Вероятно, такая клеточная ком-
муникация у растений в пограничных клетках широко распростра-
нена и играет важную роль в регуляции клеточного деления и диф-
ференцировки.
Если продукт гена CLV1 является компонентом в пути переда-
чи сигнала, то следует предположить наличие и других компонен-
тов этого каскада. Кандидатами на эту роль могут служить продук-
ты генов CLV2, CLV3 и WUS.
177
В ходе генетического анализа показано, что мутации wus и clv-1,
clv-4 взаимодействуют по типу эпистаза, а у двойных мутантов
clv-1/wus обнаружен фенотип wus. В качестве одного из объясне-
ний этого эффекта можно предположить, что ген CLV1 негативно
регулирует ген WUS, а фенотип мутанта clv-1 является следствием
гиперактивности гена WUS. Возможно также, что CLV1 функци-
онирует в центральной зоне меристем, которая формируется с
участием гена WUS. Согласно этой схеме, ген WUS является ми-
шенью для гена CLV1.
Ген STM — один из первых изученных генов, экспрессирующий-
ся в нескольких клетках в центральной части побеговой апикальной
меристемы. Его экспрессия обнаружена на ранней стадии глобулы.
Ген STM клонирован по гомологии с геном кукурузы
KNOTTED1. Ген KNOTTEDl — это гамеобокссодержащий ген
(о структуре таких генов будет говориться подробно). Ген STM
также отнесен к гомеобокссодержащим генам.
Мутации civ и stm при совмещении в одном генотипе способ-
ны ослаблять эффекты, вызываемые каждой из них. Из этого сле-
дует, что потерю функции одного из соответствующих генов
можно компенсировать исчезновением активности другого. Таким
образом, создается впечатление, что ген STM не нужен для разви-
тия меристем. Возникает вопрос, а зачем нужны растению такие
гены? Фенотип двойных мутантов позволяет ответить на этот во-
прос. Двойные мутанты civ stm способны формировать очень ва-
риабельные по размеру меристемы. Таким образом, оба этих гена
необходимы для поддержания нормального размера меристем, т. е.
для регуляции количества клеточных делений.
Еще один ген, мутации по которому приводят к мутантным фе-
нотипам, сходным с clvl, — ген NAM (от No Apical Meristem)
был клонирован у петунии. Мутанты по этому гену не образовыва-
ли ПАМ, но формировали многочисленные адвентивные почки.
Из почек формировались растения с аберрантными цветками,
число лепестков в которых могло быть увеличено от 5 (норма) до
10, причем многие органы были сросшимися. Как показал анализ
экспрессии гена NAM, соответствующий белок присутствует в эм-
бриогенезе и находится в клетках, которые окружают формирую-
щуюся ПАМ. Характер экспрессии этого гена сохраняется при ве-
гетативном развитии растения, и белок гена NAM окружает клет-
ки ПАМ и ЦАМ. Позже продукт гена NAM обнаруживается
вокруг развивающейся семяпочки. Таким образом, этот ген экс-
прессируется на границе делящихся и неделящихся клеток, спо-
собствует формированию меристем и локально репрессирует кле-
точное деление между ПАМ и формирующимся листом.
Итак, если продукт гена STM является маркером центральных
клеток ПАМ и требуется для поддержания меристем, заставляя
клетки делиться, то продукт гена NAM — маркер между делящи-
мися в центральной зоне и неделящимися клетками на фланге ме-
ристем, где формируются органы.
178
Ген ZLL также клонирован. Этот ген кодирует белок, состоя-
щий из 988 аминокислот. N-терминальный район (1—123 а. к.)
данного белка обогащен пролином и не имеет гомологии с извес-
тными белками. Последовательность аминокислот от 124-й до 988
имеет 75%-ную гомологию с продуктом гена AGO1 (AGRONAU-
ТЕ1), который контролирует развитие листа у арабидопсиса (см.
часть II, гл. 3).
Ген ZLL является членом новой группы последовательностей и
консервативен среди растений и животных. Судя по тому, что ген
ZLL отличается от других генов этого семейства в N-терминаль-
ном районе, именно этот район вовлечен в контроль ZLL-специ-
фической функции. MPHK ZLL найдена в проваскулярных клет-
ках и в клетках апекса. Экспрессия ZLL может определять судьбу
стволовых клеток и ингибировать дифференциацию побеговых ме-
ристем. Возможно, что продукт гена ZLL способен к перемеще-
нию по клеткам апекса.
Итак, роль гена ZLL заключается в поддержании популяции
стволовых клеток в недифференцированном состоянии в процессе
перехода от стадии эмбрионального развития к процессу форми-
рования органов.
Исходя из анализа мутантов процесс формирования побеговых
меристем можно разделить на два этапа. На первом этапе на ста-
дии глобулы апикальные клетки специализируются как предшест-
венники побеговых меристем и инициируют экспрессию гена
STM. На более позднем этапе эмбриогенеза, когда ПАМ уже раз-
делена на центральную зону, где находятся стволовые клетки, и
периферическую, где инициируются примордии органов, начина-
ется экспрессия гена ZLL, который подавляет дифференцировку
стволовых клеток. При отсутствии его активности все апикальные
клетки, включая и стволовые, начинают дифференцироваться.
В клетках апекса экспрессируются и другие гены, многие из
которых типичны для делящихся клеток. Типичные продукты этих
генов — это гистоны, рибосомные белки, дезоксиуридинтрифос-
фатаза, которая является важным энзимом метаболизма ДНК. Дез-
оксиуридинтрифосфат регулирует включение дезоксиуридина в
ДНК, тем самым контролируя деградацию хлоропластной ДНК.
Показано, что экспрессия этих генов в апексе зоноспецифична,
так, гены НЗ и Н2В экспрессируются в ПЗ, а гены, контролирую-
щие синтез дезоксиуридинтрифосфатазы, — во всех ’зонах слоя
Л1.
Итак, для морфогенеза растений важным является тип и число
клеточных делений. Для нормального развития растения побего-
вые апикальные меристемы должны иметь строго выдержанную
конструкцию — определенный размер, форму, определенную ве-
личину и форму клеток.
Таким образом, постэмбриональное развитие высших расте-
ний связано с повторяющимся формированием органов через
реорганизацию стволовых клеток в ПАМ, которая формируется
179
после закладки основных тканей, семядолей и гипокотиля в эм-
бриогенезе. Органы инициируются на периферии побеговых
апикальных меристем, тогда как в центральной зоне стволовые
клетки поддерживаются в недифференцированном состоянии. В
ПАМ экспрессируется группа генов, часть из которых регули-
рует поддержание популяции стволовых клеток в недифферен-
цированном состоянии, тогда как другие приводят к дифферен-
цировке клеток с последующим формированием органов.
Ген STM (от Shoot Meristem Less) регулирует поддержание ство-
ловых клеток в недифференцированном состоянии и ингибирует
их переход к инициации листовых примордиев.
Ген WUS (от Wushel) необходим для поддержания клеточного
деления в меристематическом центре, а мутация wus приводит к
терминации меристематической активности.
В противоположность генам STM и WUS, ген CLV1 регулиру-
ет формирование органов и репрессирует клеточные деления.
Гены STM и CLV1 являются антагонистами и комплементарно ре-
гулируют баланс между недифференцированными и дифференци-
рованными клетками в ответ на эндо- и экзогенные факторы. В
ходе генетического анализа показано, что ген WUS регулируется
генами STM и CLV1.
Ген ZLL (от ZWILLE) требуется для поддержания центрально-
периферической организации ПАМ. Его экспрессия является кри-
тической точкой в самореорганизации ПАМ, которая приводит к
формированию органов. Ген ZLL необходим для поддержания
стволовых клеток в развивающихся побеговых меристемах в не-
дифференцированном состоянии в течение перехода от эмбрио-
нального развития к постэмбриональному формированию органов.
Ген STM экспрессируется в течение эмбриогенеза до начала
экспрессии гена ZLL и является эпистатичным по отношению к
нему.
Анализ вышеперечисленных мутантов показал, что в меристе-
мах в эмбриогенезе происходит переход клеток из недифференци-
рованного к дифференцированному состоянию.
Огромную роль в определении «судьбы» клетки играет способ
деления и ее положение по отношению к соседним клеткам.
«Судьба» клетки также в значительной степени зависит от клеточ-
ной стенки, так как сигналы, поступающие через плазмодесму,
могут быть источником информации для клеточной идентичности.
Примером этому являются трансмембранные белки, кодируемые,
например, геном CLAVATA1, характеризующиеся наличием LRR
доменов, которые вовлечены в белок—белковые взаимодействия с
рецепторами соседних клеток и способны транспортироваться от
клетки к клетке.
Для регуляции экспрессии генов в ПАМ необходимо присутст-
вие индукторов и репрессоров.
180
Глава II. 3
РАЗВИТИЕ ЛИСТА
Из апикальной меристемы развиваются все типы побегов. Базо-
вой единицей растения служит модуль, включающий лист, междо-
узлие и пазушную почку, которая возникает в «остром» углу. Из
пазушной почки формируется лист и стебель. Она потенциально
может дать начало новой ветви или целому растению. Эта почка
активируется, как правило, в случае гибели основной побеговой
меристемы.
Активность вегетативных побеговых меристем приводит к
увеличению числа одинаковых модулей (узлов). Каждый модуль
обладает определенной степенью автономности, т. е. растение
можно сравнить с колонией, например губок или кораллов
(рис. 11.13). Модули соединены друг с другом основной и прово-
дящей тканями.
Каждый модуль возникает как вздутие определенного размера
на апикальной меристеме, причем внешние условия могут изме-
нить форму вздутия, не затрагивая все растение. У растений, также
как и у животных, существуют механизмы, регулирующие образо-
вание подобных вздутий (зачатков). Вздутия образуются на рассто-
янии 1мм друг от друга (рис. 11.14). Предшественники каждого но-
вого узла проявляются как последовательно возникающие вздутия,
которые образуются вблизи кончика меристемы и в состав каждо-
го вздутия входит до 100 клеток. Такие вздутия называются листо-
выми зачатками (примордиями), которые возникают на фланге
ПАМ (рис. 11.14). Повторяющийся тип роста — модули свидетель-
ствует о том, что клетки должны «чувствовать» расстояние от
предшествующего узла.
Положение листовых зачатков определяет будущее расположе-
ние листьев и называется филлотаксисом. Наиболее часто встре-
чается спиральный филлотаксис. Предложена модель, объясняю-
щая филлотаксис, согласно которой в каждом вздутие вырабаты-
вается диффундирующее вещество «морфоген», которое подавляет
развитие следующего вздутия. Интенсивность действия этого ве-
щества пропорциональна его концентрации. Заложение нового
узла происходит там, где концентрация морфогена, постепенно
уменьшающаяся по мере удаления от предыдущего, достигает оп-
ределенного порогового уровня. Пока сложно сказать что-либо о
молекулярных механизмах действия морфогенов, следует только
предполагать, что в их качестве могут выступать определенные
фитогормоны. Предполагают, что индукторами инициации листа
является комбинация ауксинов и цитокининов, или одних цитоки-
нинов. Так, у мутанта арабидопсиса cyrl, характеризующегося ус-
тойчивостью к цитокинину, формируется лишь несколько листьев,
или же они не формируются вообще.
181
1
Рис. 11.13. Модульное строение растения.
1 — побеговая апикальная меристема (ПАМ); 2 — интеркалярные (вставочные) ме-
ристемы; 3 — пазушная почка; 4 — модуль, состоящий из листа, междоузлия и па-
зушной почки.
Развитие листа можно разделить на три стадии:
образование листового зачатка;
образование оси листа;
образование листовой пластинки.
Группа клеток, которая инициирует развитие листа, располо-
жена сразу в трех слоях апикальной меристемы (LI, L2 и L3).
Каждый слой участвует в формировании определенной ткани
листа. Так, у двудомных растений из клеток слоя L1 формируется
182
Рис. 11.14. Схема образования листовых зачатков (1, 2, 3, 4 и т. д.)
из апикальной меристемы.
эпидермис, а из L2 и L3 — внутренние ткани. Из клеток слоя L3
формируются ткани, выстилающие внутреннюю часть органов и
жилки листа. Количество клеток, вовлеченных в формирование
листового примордия, варьирует у разных видов. У арабидопсиса в
формировании листа участвуют от 5 до 10 клеток в каждом слое.
Количество клеток, формирующих лист, генетически детермини-
ровано. Описаны мутации, например, forever young (fey) у ара-
бидопсиса, ведущие к формированию более крупных листовых
зачатков. Это приводит к истощению меристемы после форми-
рования нескольких листьев. Значительно меньшее по сравнению
с диким типом число клеток вовлечено в формирование зачатка
у мутанта кукурузы narrow sheath. Эта мутация характеризуется
плейотропным эффектом. Инициация листа происходит за счет
изменения полярности и скорости клеточного деления, т. е. на
первых этапах развития листа формируется новый тип клеточного
деления. Например, у гороха инициация листа начинается с более
активного периклинального деления клеток. При этом происходит
переориентация целлюлозных микрофибрилл в составе клеточных
стенок, что приводит к изменению полярности клеток.
Так как листовые зачатки развиваются из апикальной меристе-
мы (ПАМ), то нет ничего удивительного в том, что у мутантов с
нарушением развития ПАМ развиваются измененные по сравне-
нию с диким типом листья. Например, у арабидопсиса мутация
revoluta (rev) приводит к нарушению развития апикальной мерис-
темы, в результате чего происходит редукция вторичных почек и
увеличивается размер листьев и органов цветка.
Формирование листовых зачатков связано с изменением экс-
прессии генов KN1 (Knotted 1) у кукурузы и гена KNAT1 у араби-
допсиса. Эти гены относят к классу 1 KNOX генов, которые регу-
лируют процессы развития растений.
183
IL3.1. МУТАЦИИ KNOTTED
Лист у однодольных в норме содержит листовую пластинку и
влагалище, их соединение разграничено каймой, которую называ-
ют лигулой. Таким образом, лигула как бы разделяет лист на две
части. Деление клеток, дифференцировка и удлинение листа осу-
ществляются от верхушки к основанию. В настоящее время полу-
чено большое число мутаций, затрагивающих развитие листа. Наи-
больший интерес представляет мутация Knotted (Knl), описанная
у кукурузы в 1990 г. Особый интерес к этому гену связан с тем,
что он содержит гомеобокс, типичный для генов каскадной регу-
ляции развития у дрозофилы. Это один из первых генов подобного
типа, описанных у растений. Мутация Knl первично действует на
лигулу, центральные и боковые жилки, изменяя клеточное деление
и дифференцировку тканей листа. Однако в некоторых аллельных
вариантах затронута и другая часть листа — влагалище. У мутант-
ных растений лигула часто смещена со своего нормального поло-
жения, либо вообще может отсутствовать.
У растений описаны и другие мутации, затрагивающие структу-
ру лигулы, но эффект мутации Knl уникален. В результате этой
мутации группа клеток продолжает делиться и окружает клетки,
которые уже дифференцированы. Группы делящихся клеток фоку-
сируются вдоль боковых жилок и оказываются разбросанными по
листу, формируя узлы «knots», в расположении которых отмечает-
ся симметрия (рис. 11.15). В этих районах часто наблюдают акку-
муляцию лигнина, а на гистологических срезах эти участки напо-
минают лигулу. Мутация по гену KN1 доминантна. Описано более
10 аллелей этого гена, фенотипически различающихся между
собой, выявлены различия между гомозиготами и гетероаллельны-
ми комбинациями.
Нозерн гибридизация (от Northern blot) показала, что ген KN1
экспрессируется в апикальных вегетативных и флоральных мерис-
темах, его экспрессия также обнаружена в боковых меристемах, в
проводящей и паренхимальной тканях, но не обнаружена в листе
и цветке. У мутантов Knl соответствующая мРНК обнаружена в
боковых жилках листа. Это первый ген, исследованный у цветко-
вых растений, экспрессия которого коррелирует с инициацией ор-
ганов и необходима для регуляции клеточных делений.
Ген KN1 относят к молекулярным маркерам ПАМ и других
меристем. Предполагают, что экспрессия этого гена в меристеме
приводит к появлению сигнала, который определяет судьбу клеток
и координирует дифференцировку листа. Экспрессия мутантного
гена приводит к задержке дифференцировки клеток листа. Веро-
ятно, в норме ген KN1 участвует в поддержании клеточных деле-
ний и его экспрессия ингибируется к моменту дифференциации
органов, например, листовых зачатков.
Структура гена KN1. Ген KN1 был клонирован на основе
транспозонного мутагенеза. Сиквенс ДНК показал, что ген KN1
184
Узлы (knots)
Рис. 11.15. Мутация knottedl у кукурузы.
А — лист дикого типа; Б — мутант knotted, характеризующийся формированием
узлов (knots) на поверхности листа и смещением лигулы.
кодирует белок, содержащий гомеодомен. Обычно, гомеодомен
содержит 61 аминокислоту, из которых 4 инвариантных, и 8 кон-
сервативных. У гена KN1 оказалось также 4 инвариантных, но 6
консервативных аминокислот. Кодирующая часть гена включает 4
интрона, а кодируемый белок содержит 359 аминокислот. Белок
включает PEST-последовательность, которая является сигналом
для быстрой деградации белка и характерна для транскрипцион-
ных факторов.
У кукурузы на основе гомологии с геном KN1 клонировано
большое количество генов, содержащих гомеобокс, которые име-
ют разную степень гомологии. С использованием этой модели (ку-
куруза — хорошо изученный генетический объект, имеющий на-
сыщенные генетические карты) удалось показать, что все гомео-
бокссодержащие гены разбросаны по разным группам сцепления.
Известно, что у насекомых и млекопитающих гомеобокссодержа-
185
щие гены организованы в кластеры и экспрессируются в эмбрио-
генезе последовательно. У растений это не так, или, может быть,
пока такие кластеры не обнаружены. Однако разброс регулятор-
ных генов по геному у растения кажется оправданным. Во-первых,
у растений очень короткий эмбриогенез, но развитие происходит
в течение всей жизни из меристем. Во-вторых, у растений в тече-
ние их жизненного цикла все время происходит реорганизация ге-
нома, например, за счет полиплоидии и других перестроек, кото-
рые могут разрушить кластер регуляторных генов.
Экспрессия гена KN1 изучена в гетерологичной системе — у
табака. У трансгенных растений обнаружено появление множест-
венных побегов в области центральной жилки. Кроме того, эти
растения характеризовались потерей апикального доминирования
и аномальным развитием листа. Важно отметить, что изменение
уровня экспрессии гена KN1 приводит к изменению морфологии
листа, что свидетельствует о роли гена KN1 не только в процессе
инициации листовых зачатков, но и в организации структуры
листа, который приобретает уродливые очертания с гофрирован-
ной поверхностью. Аналогичные результаты были получены для
других двудольных растений — томатов, арабидопсиса.
Анализ 12 различных мутантных аллелей Кп1 показал, что из-
менения в гене, как правило, не связаны с нарушением в кодируе-
мой области, а являются результатом инсерции транспозонов в об-
ласть интронов (рис. 11.16). Так, мутации Knl-2FII и Kn-Imm яв-
ляются результатом инсерции Ds2, Mui- или Ми8-элементов,
размером в 1 т. п. н. в район третьего интрона. Спонтанная мута-
ция Кп1-О — результат тандемной дупликации 17 т. п.н. района,
который включает полностью кодирующую часть гена. Потеря од-
ного повтора приводит к нормальному фенотипу.
Долгое время не удавалось получить мутацию с потерей функции
гена KN1. Недавно с помощью химического мутагенеза были полу-
чены рецессивные мутантные аллели, отобранные по потере функ-
ции доминантной аллели KN1 у гетерозиготных растений. Для этого
было проанализировано 28 000 гетерозиготных (Knl/knl) пророст-
ков по признаку: неспособность формировать узелки в области цен-
тральной жилки. В результате было получено 12 мутантных расте-
ний, которые характеризовались значительно измененным фено-
типом по сравнению с исходной формой. Полученные мутанты в
зависимости от фенотипа разделили на три группы:
1) для мутантов 1-го типа характерна потеря большого числа
меристем соцветий. В результате у растений не хватает ветвей и
колосков в мужских соцветиях;
2) у мутантов 2-го типа значительно изменен процесс форми-
рования пестика. У таких растений появляется множество пести-
ков, которые создают эффект «пестик в пестике», при этом они
сливаются и формируется крупный пестик с большим количест-
вом шелковых нитей, торчащих из початка. Эта мутация напоми-
нает мутацию agamous у арабидопсиса (см. часть II, гл. 5);
186
Knl-0204
Kn 1-0167 (Mu7)
-H—
ATG TAG ATG TAG
Б
Рис. 11.16. Структура гена Knl.
A — аллель Knl-0 и ее дериваты — результат тандемной дупликации;
7 — экзоны; 2 — толщина указывает размер дупликации; 3 — места встраивания
транспозона; Knl-0204, Knl-0167 — инсерция Ми7-элемента, Knl-0174 — Mui,
Knl-0169 — Mu8; Б — инсерции, которые приводят к Knl мутациям (Knl-2F11 —
результатинсерции В52-элемента; Knl-mum's и Mui или Ми8 —место встраивания
транспозона).
3) у мутантов 3-го типа образуется увеличенное количество
листьев.
Анализ мутантов подтвердил, что ген KN1 играет значительную
роль в поддержании апикальной меристемы, которая участвует в
формировании разных органов растения.
У мутантов проанализирована структура гена и показано, что
часть из них содержит транзиции оснований, у других нарушен
сплайсинг. Кроме того, выявлены растения с нонсенс-мутациями
nl, которые формировали белок значительно меньшего размера по
сравнению с нормой. У одного из мутантов отсутствовала PEST-
последовательность.
По гомологии с KN1 кукурузы клонированы гены KNAT1 и
KNAT2 арабидопсиса. Сравнительный анализ экспрессии выявил
аналогичный характер в ПАМ, но экспрессия генов KNAT1 и
KNAT2 практически не обнаружена в других меристемах. Кроме
того, гены KNAT экспрессируются в периферической зоне ПАМ,
187
в месте, где формируются листовые зачатки. Экспрессия этих
генов в трансгенных растениях приводила к формированию расте-
ний с сильно морщинистыми листьями.
Таким образом, гены KNAT1 и KNAT2, в норме, также как и
KN1, активируют клеточное деление, репрессируя клеточную
дифференцировку. Гены KN1, KNAT1 и KNAT2 действуют на
уровне меристем и оказывают свое влияние на развитие листа.
Это неудивительно, так как листовые зачатки развиваются из
апикальных меристем.
П.З.2. ДРУГИЕ МУТАЦИИ ЛИСТА
В течение онтогенеза на растении развиваются различные по
морфологии листья (рис. 11.17). В эмбриогенезе формируются, как
правило, 2 семядоли, функция которых сводится к аккумуляции
запасных веществ, необходимых для развития зародыша. В семя-
долях экспрессируется определенная группа генов, например гены
синтеза запасных белков. Первые настоящие листья, их называют
ювенильными, формируются после прорастания семени. Они обыч-
но меньше по размеру и более просто организованы, чем лист
взрослого растения, но, как правило, значительно крупнее семядо-
В
А А Ах
?! ЖМ
Рис. 11.17. Тип листа на различных стадиях развития растения.
А — Delphinium ajacis; В — Ipomea caerulea; С — Arabidopsis thaliana.
188
1 2 3
Рис. 11.18. Тип листа на различных стадиях развития арабидопсиса.
1 — эмбриогенез; 2 — ювенильная стадия; 3 — репродуктивная стадия или стадия
взрослого растения.
лей. У ювенильных листьев появляются трихомы. По сравнению с
семядолями у этих листьев изменено жилкование и отсутствуют
запасные белки. Иной тип листа образуется на растении во время
перехода к цветению.
В течение жизни растение формирует в основном листья трех
классов: ювенильные, переходные и листья, характерные для взрос-
лого растения (рис. 11.18). У некоторых видов количество классов
может быть большим, например, до восьми у Pseudopanax crassifoli-
us. Наиболее впечатляющий пример — это драматическое измене-
ние типа листа в процессе онтогенеза у эвкалипта (Eucalyptus albi-
па). В процессе перехода от ювенильной фазы к репродуктивной
лист за счет исчезновения воскового налета и опушения меняется
от серо-голубого опушенного до темно-зеленого глянцевого, а его
форма — от ланцетовидной до рассеченной.
Большинство описанных различий генетически детерминиро-
вано и их проявление регулируется в процессе онтогенеза. Приме-
рами признаков листа, регулируемых в онтогенезе, являются нали-
чие и толщина восковой кутикулы, опушение. Физиологический
статус растения и внешние воздействия также вносят существен-
ный вклад в морфологию листа. Количественные признаки, харак-
теризующие лист, изменяются от листа к листу, контролируются
полигенно и также зависят от факторов внешней среды.
Возникает вопрос — какова генетическая природа описанных
различий?
У кукурузы и арабидопсиса выделено наибольшее количество
мутаций по развитию и типу листа, которые можно разделить на
две группы, затрагивающие инициацию органа (organ initiation) и
его идентичность (organ identity). Для первой группы мутаций
(organ initiation) характерно изменение морфологии листа на всех
стадиях развития растения. Гены, контролирующие такие измене-
ния, вовлечены в регуляцию перехода от ювенильной к вегетатив-
ной и репродуктивной фазам развития.
189
К генам первой группы можно отнести ген Viviparous (VP8) и
гены, контролирующие биосинтез гиббереллина (ГК) — Dwarf 1
(DI), Dwarf 3 (D3), Dwarf 5 (D5) и Anther ear (AN1). Для мутантов
по этим генам характерно длительное формирование листьев юве-
нильного типа. Экзогенное применение ГК фенотипически суп-
рессирует эффект мутаций. Это означает, что у мутантов редуци-
рован уровень ГК. Таким образом, ГК регулирует переход от веге-
тативной фазы развития к репродуктивной, в которой отсутствуют
ювенильные листья. Анализ мутантов показал, что ГК не единст-
венный фактор, вовлеченный в этот процесс.
Ген VP8 контролирует фактор, который необходим для пере-
хода к цветению. Однако ген VP8 не оказывает непосредственного
влияния на время перехода к цветению, а удлиняет вегетативную
фазу развития. Следует напомнить, что каждая фаза развития рас-
тения характеризуется определенным типом листа.
На рис. 11.19 (см. вкл.) представлена модель формирования
листа, описывающая различный морфогенетический тип листа, за-
висящий от фазы развития растения. На рисунке видно, что у му-
танта ampl (altered meristem program 1) ускоренная программа
инициации развития листа приводит к формированию бблыиего
числа ювенильных листьев и трансформации части листьев в семя-
доли. Мутант psd (paused) характеризуется задержкой развития
листьев, которая приводит к полному отсутствию ювенильных
листьев. У мутанта hasty на месте формирования ювенильных
листьев развиваются взрослые листья. Причиной таких изменений
является сокращение времени прохождения ювенильной фазы.
У второй группы мутаций (organ identity) затронуты только ста-
дие-специфические признаки. Гены, контролирующие эти измене-
ния, необходимы для формирования листа, морфологически ха-
рактерного для определенной фазы. Их экспрессия зависит от эн-
догенных сигналов.
Ко второй группе относятся мутации по генам Teogod 1 (ТР1),
Teopod 2 (ТР2), Teopod 3 (ТРЗ), Comgrass (CG), Glossy 15 (GL15),
которые выделены у кукурузы. У мутантов затронуты такие при-
знаки, как морфология листовой пластинки, восковой налет, нали-
чие трихом и опушение. Например, листья доминантного мутанта
Тр2 морфологически и анатомически имеют промежуточный тип
между ювенильной и взрослой стадиями, при этом не затрагивает-
ся время вступления в определенную фазу развития. Таким обра-
зом, ген ТР2 контролирует независимую программу формирования
листа, типичного для ювенильной фазы развития. В отличие от
гена ТР2, ген GL15 действует раньше, он контролирует признаки
эпидермиса, характерные для ювенильных листьев и репрессирует
аналогичные признаки у взрослых листьев. Ген GL15 клонирован;
показано, что он кодирует белок со значительной гомологией с
белком гена АРЕТ ALA 2 (см. часть II, гл. 5). Потеря функции гена
GL15 приводит к трансформации эпидермиса, характерного для
ювенильного листа в эпидермис «взрослого» листа. Таким обра-
190
зом, функция гена GL15 заключается в регуляции развития эпи-
дермиса листа.
Гомеозисный ген OSH1, который отвечает за форму и морфоло-
гию листовой пластинки, описан у риса. Основной эффект этого
гена связан с изменением направления ориентации деления в слоях
L1—L3. У мутанта в процессе формирования листа в его тканях
вместо антиклинальных делений происходят периклинальные деле-
ния. Для выяснения его роли использовали агробактериальную транс-
формацию, а вектор включал структурную часть гена OSH1, кото-
рую сшивали с промотором гена PRIa, контролирующим синтез бел-
ков PR (pathogen-related), выполняющих защитную функцию у
табака. Такой промотор активируется только в ответ на атаку пато-
гена, т. е. экспрессия гена с таким промотором зависит от факторов
внешней среды. Полученные растения имели морщинистые, дольча-
тые листья. Гистологический анализ показал, что в апексе примор-
дия репрессирован рост латеральной части листовой пластинки, в
результате чего наблюдается асимметричный рост. Кроме того, у
растений наблюдали ингибирование роста боковых жилок.
ДНК—РНК гибридизация (Northern blot) показала, что химер-
ный ген PRIa-OSHl незначительно экспрессируется в побеговой
апикальной меристеме молодых листовых зачатков и не экспресси-
руется в развитых листьях. Выявленные изменения являются резуль-
татом нарушения типа деления — периклинального вместо анти-
клинального в мезофильных клетках, что приводит к разрушению
мезофильного слоя, из которого дифференцируются проводящие
ткани. Таким образом, данная мутация является результатом изме-
нения клеточного деления, что приводит к изменению дифференци-
ровки и развития листа, а ген OSH1 соответственно определяет мор-
фологию листа.
Таким образом, анализ мутантов показал, что процессы ини-
циации листа (organ initiation) и собственно формирование
листа (organ identity) генетически контролируются независимо.
Координированная экспрессия двух групп генов и определяет
время появления определенного типа листа.
ПАМ играют немаловажную роль в инициации листовых за-
чатков, так как мутации, затрагивающие формирование ПАМ,
приводят к формированию измененных листьев. Ярким приме-
ром является мутация по гену KN1, функция которого заключа-
ется в поддержании клеток ПАМ в недифференцированном со-
стоянии, с одной стороны, и репрессией процессов дифференци-
ровки — с другой. Именно гены класса KNOX1 участвуют в
передаче сигаала на пути инициации и формирования листа от
семядолей до листьев, в основе которых лежит единая структура.
Образование листа начинается с изменения ориентации и ско-
рости клеточных делений в LI, L2 и L3 слоях. Скорость деле-
ния, которая в конечном итоге определяет размер листа и на-
правление клеточных делений, генетически детерминированы
независимо.
191
Известно, что органы цветка — это также видоизмененные
листья (см. часть II, гл. 5). Семядоли также произошли из листьев.
Доказательством этого служит анализ мутантов, у которых семядо-
ли превращены в листья (гены LEC1, LEC2, FUS3). Вероятно,
одни и те же гены могут регулировать или репрессировать форми-
рование определенных тканей в зависимости от стадии развития
растения.
Глава II. 4
РАЗВИТИЕ КОРНЯ
Корень — осевой орган, обладающий радиальной симметрией,
он способен к длительному росту благодаря деятельности корне-
вой апикальной меристемы (КАМ), которая находится на его дис-
тальном конце и покрыта корневым чехликом. Боковыми органа-
ми корня являются корни 1-го и 2-го порядка, которые образуются
из внутренних тканей.
После делений в меристеме корня клетки переходят к росту
растяжением, дифференцируются и функционируют. В корне вы-
деляют следующие зоны: деление, растяжение, поглощение (зона
корневых волосков), вся остальная часть корня относится к зоне
проведения.
Корень включает три главные тканевые системы: эпидермис,
проводящую (васкулярную) ткань, которая состоит из флоэмы и
ксилемы, и основная ткань, состоящая из эндодермы, кортекса и
перицикла. Корневой чехлик часто выделяют как самостоятель-
ную ткань.
У арабидопсиса корень устроен более просто. Он состоит из
одноклеточных слоев эпидермиса, кортекса, эндодермы и пери-
цикла, которые окружают центральную стелу. Кортекс и слой эн-
додермы, как правило, содержат по 8 клеток (рис. 11.20, см. вкл.).
Корень цветковых семенных растений формируется в зароды-
ше из КАМ, которая образуется из нижнего слоя апикальной клет-
ки. На конце КАМ располагаются инициальные клетки, из кото-
рых формируются основные ткани. Каждое деление инициальной
клетки сопровождается образованием двух дочерних клеток, одна из
которых становится частью ткани корня, а другая занимает свое
место в меристеме как инициальная клетка. Например, первое ан-
тиклинальное деление кортекс/эндодермальной инициальной клет-
ки приводит к формированию двух дочерних клеток. Затем клетка
«будущей» ткани делится периклинально с образованием одной
клетки, из которой будет формироваться эндодермальная ткань и
второй, которая инициирует ткани кортекса. Инициальные клетки
располагаются в 3 слоя по 4 клетки в каждом. Инициальные клет-
192
ки окружают митотически неактивные клетки, которые формиру-
ют неподвижный центр. Неподвижный центр и центральная часть
корневого чехлика формируются из гипофиза, который в свою
очередь образуется из базальной клетки зародыша.
Ткани корня развиваются из четырех инициальных (стволовых)
клеток:
колумелла (columella) развитие корневого чехлика;
. перицикл/васкулярных инициалий;
. клетки, из которых развивается эпидермис;
кортекс/эндодермальный инициалий.
В корне легко прослеживаются продольные ряды клеток, кото-
рые берут начало от стволовых клеток в дистальном конце корня
и формируются в результате повторных делений в меристемати-
ческом районе. В этой линейной клеточной ассамблее каждая верх-
няя клетка дифференциально более продвинута, чем нижняя.
П.4.1. РАДИАЛЬНЫЙ РИСУНОК КОРНЯ
Определение типа ткани, которая формируется в концентри-
ческом круге клеток, является фундаментальным вопросом в раз-
витии корня. Существует несколько теорий, объясняющих ради-
альное строение корня. Одна из них — это теория гистогенов,
согласно которой каждая инициальная клетка приводит к форми-
рованию только одного, определенного типа тканей. Как альтер-
нативная первой рассматривается теория позиционной инфор-
мации, согласно которой наиболее важное место в определении
судьбы инициальных клеток занимает их место нахождения по от-
ношению к соседним клеткам. Важную роль в доказательстве по-
зиционной теории сыграл метод, позволяющий с помощью лазера
«убивать» единичную клетку (laser ablation). Так, если «убить»
клетки неподвижного центра, то они позиционно замещаются
клетками васкулярных инициалий. Анализ экспрессии маркерных
генов показал, что вновь образовавшиеся клетки приобретают ха-
рактеристики клеток неподвижного центра. Аналогично, если
«убить» кортико-эпидермальные иницИалии, то они будут заме-
щаться клетками перицикла. Такое позиционное переключение
клеток одного типа на соседние говорит о том, что место клетки
и ее окружение значительно более важно для определения ее судь-
бы, чем то, из какой инициальной клетки она произошла.
Более строгие доказательства позиционной теории были полу-
чены при анализе мутантов fass и tonneaw (ton) у арабидопсиса. У
этих мутантов нарушен характер клеточных делений в корневых
меристемах. В результате неорганизованных делений у мутантов
увеличено число клеток в слоях и число самих слоев. Если линей-
ность, т. е. происхождение, определяет тканеспецифический рису-
нок, то у мутантов должна быть нарушена организация слоев. Од-
нако у мутантов fass и ton сохраняется типичный радиальный ри-
7 Генетика
193
сунок. Таким образом, инициальные клетки при определении
«своей судьбы» требуют информации от уже дифференцирован-
ных соседних клеток, чтобы, согласно сигналу, определить на-
правление своей дальнейшей дифференцировки.
Пролить свет на причину радиального строения корня позво-
лил анализ мутантов с измененным тканевым строением корня.
Выделены мутанты, у которых нарушено второе асимметричное
деление кортекс/эндодермальной инициальной клетки. Это рецес-
сивные мутации, где у shr (short root) потеряны эндодермальные
клетки, а у scr (scarecrow), потерян слой между эпидермисом и
перициклом. У обоих мутантов кортекс/эндодермальные инициа-
лии делятся антиклинально, а периклинальное деление, которое
увеличивает число слоев, отсутствует. Хотя оба мутанта сходны,
так как имеют только один слой основной ткани, у них выявлены
значительные различия между собой.
У мутанта shr потеряны признаки, характеризующие эндодер-
мальную ткань. Это означает, что ген SHR контролирует форми-
рование этой ткани. Мутант scr имеет характеристики как эндо-
дермальной ткани, так и ткани кортекса. Это означает, что ген
SCR вовлечен в регуляцию асимметричного клеточного деления
кортекс/эндодермальной инициальной клетки.
Ген SCR клонирован с помощью Т-ДНК мутагенеза и показано,
что кодируемый им белок несет специфические домены, свойст-
венные транскрипционным факторам. Ген SCR экспрессируется в
кортекс/эндодермальной инициальной клетке до начала асиммет-
ричного деления. Таким образом, он играет ключевую роль в регу-
ляции асимметричного деления, которое необходимо для форми-
рования радиального строения корня. Белок, кодируемый геном
SCR, может функционировать как димер или мультимер. Он имеет
домен, характерный для bZIP белков, с двумя лейцинбогатыми
повторами (LRRs).
В большинстве случаев для мутации, приводящей к потере
асимметричного деления, свойственно формирование двух одина-
ковых дочерних клеток, которые выполняют одинаковую функ-
цию. У мутанта scr формируются гетерогенные клетки, которые
имеют характеристики кортекса и эпидермиса и выполняют смешан-
ные функции. Это означает, что ген SCR вовлечен только в конт-
роль асимметричного деления и его функция не связана с клеточ-
ной спецификацией. Возможно, что функция гена SCR связана с
контролем полярности клеток, поскольку он начинает экспресси-
роваться до второго деления, которое приводит к асимметричному
делению клеток и способствует радиальной организации корня.
Анализ мутанта shr показал, что ген SHR контролирует фор-
мирование только эндодермальной ткани, так как мутант имеет
клетки только кортекса, а у двойного мутанта fass shr не форми-
руются эндодермальные клетки.
Итак, тканевой рисунок корня формируется в результате появ-
ления сигнала, который поступает от соседних более дифференци-
194
рованных тканей к недифференцированным. Однако рисунок не
всех тканей корня может быть объяснен такой простой схемой.
Так, неподвижный центр и центральная часть корневого чехлика
не имеют радиального строения, а представлены апикально-ба-
зальным строением.
Мутанты с нарушением развития гипофиза — hobbit и bomba-
dil — являются деталями. Они погибают или на стадии проростка,
или на стадии взрослого растения. Полученные результаты указы-
вают на возможность участия также гипофиза в функционирова-
нии корневых меристем.
П.4.2. РОЛЬ НЕПОДВИЖНОГО ЦЕНТРА В РАЗВИТИИ КОРНЯ
У арабидопсиса инициальные клетки окружают неподвижный
центр, состоящий из 4 клеток, роль которых в морфогенезе корня
долгое время была непонятна. Применение метода лазерного облу-
чения в совокупности с генетическим анализом позволило разгадать
тайну этих клеток. Уничтожение с помощью лазера одной клетки
неподвижного центра приводит к прекращению деления инициаль-
ных клеток, которые непосредственно контактируют с погибшей
клеткой. Полученный эффект, например, может быть связан только
с близлежащими клетками кортекса и не распространяется на дру-
гие клетки. В этом, случае не происходит «блокирования» митоти-
ческих делений в целом. Полученные результаты свидетельствуют о
том, что индивидуальные клетки неподвижного центра способству-
ют делению только клеток кортекса в одном кольце. Для изучения
дальнейшей судьбы «блокированных» клеток использовали специ-
фические маркеры, свойственные только клеткам кортекса. В клет-
ках кортекса содержатся крупные крахмальные зерна, которые от-
сутствуют в клетках соответствующих инициалий. После облучения
крахмальные зерна были обнаружены в вышележащих элонгирую-
щих инициалиях. Таким образом, дифференциация инициалий кор-
текса продолжается после облучения.
Итак, гипотетически неподвижный центр может выполнять
следующие функции:
1) независимо участвовать в регуляции обоих процессов: диф-
ференцировки и деления;
2) регулировать деление, предотвращая дифференцировку;
3) ингибировать дифференцировку, которая требует деления;
модель 1 модель 2
дифференцировка деление деление
1
дифференцировка
модель 3
1
дифференцировка
деление
195
Для выбора одной из трех возможностей был проведен анализ
трех неаллельных мутантов арабидопсиса: с4761, с4976 и сб044. У
этих мутантов не нарушена структура корневой меристемы, но по-
теряна постэмбриональная способность к делению. У мутантов,
также как и у дикого типа, крахмальные зерна отсутствуют в ини-
циалиях колумелла, но присутствуют в дочерних клетках. Эти ре-
зультаты указывают на то, что статус инициалий не зависит от
клеточного деления. Лазерное облучение клеток неподвижного
центра у мутантов привело к аккумуляции крахмальных зерен в
инициальных клетках колумеллы. Неподвижный центр контро-
лирует дифференцировку ее инициальных клеток в отсутствие
клеточного деления. Итак, клеточное деление клеток кортекса не
является необходимым для ингибирования дифференцировки. При
этом неподвижный центр ингибирует дифференцировку в контак-
тирующих с ним инициальных клетках кортекса.
Генетическим доказательством влияния неподвижного центра
на дифференцировку других инициальных клеток стал анализ му-
тации в гене HOBBIT (НВТ). У мутанта hbt в эмбриогенезе нару-
шено деление клеток неподвижного центра и кортекса. В резуль-
тате у мутанта hbt формируется нефункциональный неподвижный
центр и аберрантный кортекс. Таким образом, без функциональ-
ного неподвижного центра статус инициальных клеток не поддер-
живается.
Важно: сводится ли первичная функция неподвижного центра
к негативной регуляции дифференцировки независимо от клеточ-
ного деления (модель 1), или он регулирует клеточное деление
через дифференциацию (модель 3)? Результаты экспериментов с
использованием облучения ядер показали, что неподвижный центр
не прямо регулирует клеточные деления, а первично ингибирует
клеточную дифференцировку (модель 3).
Итак, в меристеме корня арабидопсиса позиционные сигаа-
лы поступают из уже дифференцированных клеток и определя-
ют направление дифференцировки клеток. Клетки, которые
контактируют с неподвижным центром, поддерживаются в ини-
циальном состоянии. Баланс между двумя антагонистическими
сигналами является механизмом, который приводит к формиро-
ванию определенной структуры в корневой меристеме.
Побеговая меристема, как уже обсуждалось в гл. 2, также содер-
жит зону, где клеточные деления редуцированы. Этот район регули-
рует скорость деления или клеточную дифференцировку. Мутанты
clavata (civ) характеризуются сверхпролиферацией клеток в цент-
ральной зоне побеговой меристемы. Ген CLV1 контролирует рецеп-
торную серин-треониновую киназу, причем образование комплекса
между рецептором и лигандом требуется или для дифференцировки
клеток, или для ингибирования клеточного деления в меристеме.
Анализ корневых меристем показал, что центральные клетки конт-
ролируют клеточную дифференцировку чаще, чем характер клеточ-
ных делений. В корне происходит ингибирование дифференциров-
196
ки в одноклеточном слое, которое в первую очередь зависит от кон-
такта с соседними клетками. Эти результаты позволяют провести
аналогию с контролем клеточной дифференцировки у дрозофилы,
где взаимодействие лиганд—рецептор NOTCH—DELTA репресси-
рует дифференцировку нейробластов.
Итак, клетки неподвижного центра ингибируют дифферен-
цировку окружающих клеток. На уровне единичных клеток про-
ходит дифференцировка, сравнимая с дифференциацией ней-
робластов у дрозофилы. Характер формирования меристемы
корня контролируется балансом между сигналами, ингибирую-
щими дифференцировку и сигналами, которые определяют
«судьбу» клетки.
11.43. ФОРМИРОВАНИЕ КЛЕТОК РАЗЛИЧНОГО ТИПА
В ТКАНЯХ КОРНЯ
Важный вопрос в клеточной биологии — это понимание того,
как формируются клетки разного типа и, особенно, как из одной
клетки развиваются по-разному дифференцированные клетки.
Наиболее интересная модель, позволяющая осветить данный
вопрос — это анализ клеток эпидермиса корня. У большинства
видов растений корневой эпидермис состоит из клеток двух типов:
клетки, которые формируют корневые волоски и клетки, не фор-
мирующие корневых волосков. Первые произошли от трихобла-
стов, вторые — из атрихобластов. Рисунок клеток двух типов варьи-
рует у разных видов. Так, у однодольных эпидермальная клетка
делится асимметрично с формированием маленькой клетки, диф-
ференцирующейся в корневые волоски, и большой, которая фор-
мирует несколько «безволосковых» клеток. У других каждая вновь
формирующаяся клетка способна к дифференцировке клеток обоих
типов. Третья группа, которая включает арабидопсис и другие
крестоцветные, характеризуется тем, что у них трихобласты фор-
мируются в щели между лежащими кортикальными клетками (по-
зади антиклинальной клеточной стенки), тогда как атрихобласты
развиваются над кортикальными клетками (позади периклиналь-
ных кортикальных клеток) (рис. 11.21). Простая корреляция между
позицией клеток и их типом дифференцировки в эпидермисе
предполагает наличие латерального сигнала между кортикальными
и эпидермальными клетками. В какое время развития эпидермиса
происходит передача сигнала? Трихобласты и атрихобласты раз-
личаются цитологически уже в меристеме корня, что указывает на
раннюю клеточную специализацию.
Однако клеточная пластичность также имеет место при диффе-
ренцировке эпидермальных клеток. Так, например, гормоны могут
индуцировать формирование корневых волосков из атрихобластов.
У арабидопсиса были выделены мутанты с нарушенным харак-
тером дифференцировки эпидермальных клеток. У двух из них
197
Рис. 11.21. Формирование корневых волосков в корнях арабидопсиса.
transparent testa glabra (ttg) и glabra 2 (gl2) корневые волоски
формировались из всех клеток эпидермиса (рис. 11.22). Таким об-
разом, гены TTG и GL2 подавляют формирование корневых во-
лосков. Показано, что ген GL2 кодирует гомеодоменсодержащий
белок, и экспрессируется в эпидермальных клетках, неспособных
формировать волоски. Таким образом, гены TTG и GL2 кодируют
транскрипционные факторы, которые экспрессируются только в
определенных клетках эпидермиса корня. Ген TTG действует на
более ранней стадии развития и регулирует экспрессию гена GL2.
Следует отметить, что обнаружен эффект действия генов TTG и
GL2 на трихомы (эпидермальные волоски на побегах) у арабидоп-
сиса, что свидетельствует о перекрывающемся генетическом конт-
роле развития эпидермиса в побегах и корнях. Скорее всего, гены
Рис. 11.22. Корни проростка арабидопсиса дикого типа (а) и мутанта
gl2
198
TTG
Рис. 11.23. Генетический контроль путей дифференцировки клеток эпи-
дермиса в корнях арабидопсиса.
RHD6 — мутант арабидопсиса, у которого корневые волоски не формируются. По-
яснения в тексте.
TTG и GL2 кодируют общие эпидермальные транскрипционные
факторы, которые играют различную роль в клеточной дифферен-
цировке у побегов и корней.
Анализ другого типа мутантов выявил роль гормонов ауксина и
этилена на формирование корневых волосков. Ген CTR1 (от Con-
stitutive Triple Response 1) кодирует Raf-подобную протеинкиназу
и негативно регулирует этиленовый путь передачи сигнала (см.
часть III, гл. 1). У этилен-чувствительного мутанта Ctrl формиру-
ются волоски из эпидермальных клеток, которые в норме являют-
ся «безволосковыми». «Безволосковый» фенотип обнаружен у
dwarf (dwr) мутантов, у ауксинустойчивых мутантов (ахг2), что
указывает на роль этилена и ауксина в регуляции формирования
волосков. Кроме того, показано увеличение количества волосков у
арабидопсиса дикого типа при воздействии ЦПК (аминоциклопро-
пан-1-карбоксиловая кислота) — предшественника в биосинтезе
этилена, и ингибировании этого процесса при использовании ин-
гибиторов биосинтеза этилена. Исходя из вышесказанного, экс-
прессия генов TTG и GL2 могла бы регулироваться гормонами.
Однако, как показали исследования, ауксин и этилен способству-
ют росту волосков после того, как эпидермальные клетки уже за-
кончили дифференцировку и, следовательно, ауксин/этиленовый
путь не регулирует экспрессию генов TTG и GL2.
Таким образом, как показано на схеме (рис. 11.23), формиро-
вание и рост корневых волосков регулируется двумя независи-
мыми путями.
199
П.4.4. КОНТРОЛЬ МОРФОГЕНЕЗА КОРНЕЙ
Корни имеют простую структуру, поэтому их часто используют
как модель для изучения морфогенеза.
Один из важных вопросов в генетике развития — как связано
клеточное деление с размером и формой органов. Ответом на этот
вопрос послужил анализ корнеобразования у трансгенных расте-
ний арабидопсиса, экспрессирующих ген, регулирующий митоти-
ческий цикл (cyclin gene), находящимся под сильным промотором
35S вируса мозаики цветной капусты (CaMV). Корни таких расте-
ний характеризовались увеличенной скоростью клеточного деле-
ния, которая приводила к увеличению числа клеток и в целом
корня. Все описанные изменения не приводили к изменению его
формы. Таким образом, увеличение числа клеток не приводит к
изменению формы корня. Однако активность клеточного деления
может в некоторых случаях требоваться для образования органов.
Примером этому может служить анализ мутантов rmll и rml2 (root-
meristem less) у арабидопсиса. Мутанты характеризовались нор-
мальным корнеобразованием в эмбриогенезе, но постэмбриональ-
ное развитие корня у них было редуцировано, что приводило к
развитию чрезвычайно маленьких корней. Таким образом, ген
RML требуется для активации клеточных делений в апикальных
клетках корня, при достижении ими определенного размера. Ана-
лиз других мутантов, у которых нарушена форма корня, внес до-
полнительные данные в понимание молекулярных механизмов
морфогенеза у растений. Например, у мутантов cobra и root epi-
dermal blebbing главный морфологический дефект касается чрез-
мерной выпуклости эпидермиса, у мутанта sabre обнаружено не-
нормальное расширение клеток первичного кортекса; мутант
lion’s tail имеет ненормально расширенные клетки стелы. У всех
перечисленных мутантов нарушена морфология корня. Эти ре-
зультаты позволяют утверждать, что морфогенез корня — это
сложный процесс и контролируется он большим числом генов.
В заключение следует еще раз подчеркнуть, что основную
роль в морфогенезе корня играет позиционный контроль, кото-
рый определяет направление дифференцировки. Это заключе-
ние может быть неожиданным, так как имеется строгая корре-
ляция между происхождением клеток от определенных инициа-
лий и последующей структурой корня у многих видов, в том
числе и у арабидопсиса. Однако примеры генетического анали-
за (анализ мутантов) и физических методов (лазерное облучение
единичных клеток) показали, что «история» клеток или тканей
в меньшей степени важна, чем их позиция в определении пути
дифференцировки.
200
Глава IL 5
ГЕНЕТИКА РАЗВИТИЯ ЦВЕТКА
Меристемы цветка разделяют на генеративные, из которых фор-
мируются соцветия (I от inflorescence), и цветковые, образующие
органы цветка (F от flower). В разных типах меристем функциони-
руют различные группы генов. Некоторые из них работают в обеих
типах меристем. Гены, необходимые для формирования меристем
определенного типа, называют генами идентичности меристем. Они
вызывают переход от формирования генеративных меристем, или
меристем соцветия, к формированию цветковых меристем. Гены
идентичности органов цветка, или типа органов цветка, определяют
развитие в определенном месте того или иного типа органов цветка:
чашелистиков, лепестков, тычинок или пестиков (карпел).
Процесс развития цветка можно разделить на две фазы:
. переход от вегетативного развития растения к генеративному,
или репродуктивному, определяется взаимодействием ряда
внешних (длина светового дня, температура, питание) и внут-
ренних факторов;
. органогенез индивидуальных цветочных почек представляет
собой последовательность событий, которые в основном
контролируются генетической системой растения.
Вторую фазу разделяют на множество отдельных стадий. На
стадии 1 становится различимым возникающий примордий цветка
(рис. 11.24). На стадии 2 он увеличивается в размере и становится
похожим на глобулу. На стадии 3 возникают зачатки (примордии)
Рис. 11.24. Апекс соцветия арабидопсиса дикого типа.
а — схема (вид сбоку в разрезе): ЧШ — чашелистики; ГМ — генеративная меристе-
ма; 1 — цветковая меристема становится видимой; 2 — цветковая меристема стано-
вится шарообразной; 3 — становятся видимыми примордии чашелистиков (ЧШ). Раз-
витие цветка, начиная с инициации цветковой меристемы до раскрытия цветка, раз-
делено на 12 стадий; б — сканирующая электронная микроскопия (вид сверху). В
центре расположена генеративная меристема, по периферии — цветочные примор-
дии на разных стадиях развития.
201
чашелистиков. На стадии 4 примордии чашелистиков увеличива-
ются в размере и полностью покрывают примордий цветка. После-
дующее развитие цветка тоже разделено на стадии, вплоть до мо-
мента раскрытия цветка, которому соответствует стадия 13.
Излюбленными объектами молекулярно-генетических исследо-
ваний процессов развития цветка являются арабидопсис, или резу-
ховидка Таля (Arabidopsis thaliana) из семейства крестоцветных
(Cruciferae) (рис. 11.25, а, см. вкл.), или (Brassicaceae), и львиный
зев (Antirrhinum majus) из семейства норичниковых (Scrophulari-
daceae) (рис. 11.25, б, см. вкл.). С использованием этих двух моде-
лей было показано, что генетические системы развития цветка
очень консервативны для столь филогенетически отдаленных
видов растений. Пожалуй, это одно из наиболее важных открытий
последних лет в области биологии развития. Молекулярно-генети-
ческие исследования генов развития цветка начинаются также для
таких видов растений, как петуния, табак, томаты, кукуруза.
После прорастания семян арабидопсиса вегетативная меристе-
ма формирует листья, разделенные короткими междоузлиями и
расположенные по спирали. Базальная часть растения, таким об-
разом, имеет форму розетки. После вегетативной фазы апикальная
меристема реорганизуется в генеративную меристему, которая сна-
чала формирует несколько небольших стеблевых листьев, разде-
Рис. 11.26. Схематическое изображение растений арабидопсиса (а) и
львиного зева (б) дикого типа.
РЛ — розеточные листья; ГП — генеративный побег; ПС — первичное соцветие;
ВС — вторичные соцветия, в основании которых находятся прицветные листья (ПЛ).
Листья и цветки расположены по спирали. Цветки изображены как белые кружки, со-
цветия как черные кружки; Л — листья; Ц — цветки; ПЦ — прицветники.
202
Рис. 11.27. Схематическое изображение цветков арабидопсиса (a, в, д')
и львиного зева (б, г) дикого типа.
ЧШ — чашелистики; ЛП — лепестки; ТЧ — тычинки; КП — карпелы; ЛП(в) — верх-
ние лепестковые доли; ЛП(н) — нижние лепестковые доли; Г — трубкообразная часть
венчика. Диаграмма (в) и вид сбоку в «разрезе» (д) цветка арабидопсиса дикого типа,
демонстрирующие 4 мутовки органов цветка: Ml — органы первой мутовки; М2 —
органы второй мутовки; М3 — органы третьей мутовки; М4 — органы четвертой му-
товки. Диаграмма цветка львиного зева дикого типа (г). Верхние лепестки: ДЛ—дор-
сальный лепесток; ЛЛ — латеральный лепесток; ПЦ — прицветники; СТ — стериль-
ная тычинка; ВТ — вентральная тычинка; ЛТ — латеральная тычинка.
ленных длинными междоузлиями и также располагающихся по
спирали. Затем генеративная меристема образует цветковые ме-
ристемы, также располагающиеся по спирали. Каждая цветковая
меристема развивается в единичный цветок, формируя концентри-
ческие круги органов цветка четырех типов: чашелистики, лепес-
тки, тычинки, карпелы. Таким образом, растение арабидопсиса
состоит из базальной розетки листьев и соцветия (рис. 11.26, а).
Растения львиного зева развиваются несколько по-другому. Сна-
чала вегетативная меристема образует побег с супротивными листь-
ями, разделенными длинными междоузлиями, каждая пара листьев
под прямым углом к предыдущей. После вегетативной фазы эта ме-
ристема превращается в генеративную меристему, или меристему
соцветия, которая формирует значительно меньшие по размерам
203
листья, или прицветники. Прицветники располагаются по спирали и
разделены короткими междоузлиями. В основании каждого при-
цветника располагается цветковая меристема (рис. 11.26, б).
Цветки дикого типа как арабидопсиса (рис. 11.27, а, в, б), так и
львиного зева (рис. 11.27, б, г) состоят из четырех мутовок, или
концентрических кругов, органов цветка. Наружная, или первая,
мутовка — это чашелистики; вторая мутовка — лепестки; третья
мутовка — тычинки и, наконец, четвертая, в центре цветка, —
карпелы. Цветок арабидопсиса имеет четыре чашелистика, четыре
лепестка, шесть тычинок и пестик, состоящий из двух сросшихся
карпел. Цветок львиного зева состоит из пяти чашелистиков, пяти
лепестков, четырех тычинок (сначала формируются пять тычиноч-
ных примордиев, но один из них атрофируется на ранних стадиях
развития) и пестика с двумя сросшимися карпелами. Основания
всех лепестков срастаются, образуя трубкообразную часть венчи-
ка. Цветки различаются и по типу симметрии: цветок львиного
зева — зигоморфный, т. е. имеет только одну ось зеркальной сим-
метрии, в то время как цветок арабидопсиса имеет две оси сим-
метрии.
П.5.1. МУТАЦИИ АРАБИДОПСИСА, ВЛИЯЮЩИЕ
НА ВРЕМЯ ИНДУКЦИИ ЦВЕТЕНИЯ
Время перехода растения от вегетативного роста к цветению
очень важно для успешного формирования семян при наиболее
благоприятных для этого климатических условиях. Поэтому мно-
гие растения выработали способность переходить к цветению в
определенный период года в ответ на определенные условия окру-
жающей среды. На процесс индукции цветка влияет множество
внешних факторов, наиболее важные из которых — длина дня
(фотопериод) и кратковременное воздействие низких температур
(вернализация). Предполагают, что при вернализации происходит
изменение степени метилирования ДНК в клетках апекса побегов.
Среди разных видов цветковых растений можно выделить:
длиннодневные растения, переходящие к цветению при длин-
ном световом дне (например, пшеница, овес, рожь, репа; обыч-
но это растения из зон с умеренным климатом);
короткодневные растения, переходящие к цветению при ко-
ротком дне (например, кукуруза, рис, сорго и другие расте-
ния из тропических регионов);
нейтральнодневные растения, индукция цветения у которых
не зависит от длины светового дня, или фотопериода.
Наибольшее количество мутантов, влияющих на время перехо-
да растения к цветению, известно для арабидопсиса и гороха.
Гены позднего перехода к цветению. При определенной длине
дня время перехода к цветению для арабидопсиса довольно ста-
бильно, что позволило выбрать мутации, влияющие на время цве-
204
тения. При таком скрининге были выявлены мутации почти в 20
генах (табл. II.2). Еще около десятка генов, затрагивающих цвете-
ние, было выявлено в исследованиях другого рода в основном
среди генов, которые вовлечены в регуляцию светом или фитогор-
монами. Как видно из табл. 11.2» большинство мутаций вызывает
задержку перехода к цветению (будем называть таких мутантов
«позднецветущие мутанты»). Можно выделить два класса таких
мутантов.
1. Переходящие к цветению независимо от длины дня и верна-
лизации. К этой группе относятся мутации по генам CONSTANS (СО),
GIGANTEA (GI) и FHA. Сюда же часто относят и мутанты по
генам FD, FE, FT, FWA, хотя мутанты по этим генам демонстри-
руют некоторую зависимость времени перехода к цветению от фо-
топериода.
Таблица II.2
Гены арабидопсиса, влияющие на процесс перехода к цветению
Мутация
Возможная функция и продукт
Гены позднего цветения:
Путь длинного дня
Минимальный ответ на фотопери-
од и вернализацию constans (со),
gigantea (gi), carbohydrate accumu-
lation mutant (caml), fha (cry2),
Ihy
Более выраженный ответ на фото-
период и минимальный ответ на
вернализацию fd, fe, ft, fwa
Вызывают переход к цветению в ответ на
индуктивный фотопериод [СО и LHY
кодируют факторы транскрипции, FHA
(CRY2) — рецептор синего цвета, G1 —
неизвестный белок]
Вызывают переход к цветению в ответ на
индуктивный фотопериод (FT имеет
гомологию с TFL1)
Автономный, или конститутивный, путь
Ответ на фотопериод и вернализа- Регуляция автономных путей перехода к
цию fca, fpa, luminidependens (Id), цветению (LD кодирует фактор
fve, FRIGIDA (FRI), FLC транскрипции, FCA напоминает белки,
связывающиеся с РНК)
Гиббереллиновый путь
Условные мутации: позднее цвете-
ние при неиндуктивном фотопери-
оде gibberelic acid 1 (gal), gibbere-
lic acid insensitive (gai)
Условные мутации: позднее цвете-
ние при длинном дне: при преры-
вании темновой фазы фотоперио-
да или при низкой интенсивности
света phytochrome A (phyA)
Участие в синтезе или восприятии
гиббереллина, необходимого для перехода
к цветению при коротком дне (GA1
кодирует фермент биосинтеза
гиббереллина, GA1 — член нового
семейства факторов транскрипции)
Участие в «измерении» длины дня и ночи
205
Таблица II.2 (продолжение)
Мутация
Возможная функция и продукт
Гены раннего цветения:
(PHY А — лабильная форма фитохрома)
Путь длинного дня
Независимые от фотопериода
early flowering 3 (elf3), constitutive
photomorphogenic (copl), de-etiola-
ted 1 (detl), de-etiolated- 2 (det2)
Участие в «измерении» длины дня и ночи,
репрессия перехода к цветению (СОР1
является транскрипционным репрессором,
DET1 — неизвестный ядерный белок,
DET2 кодирует фермент синтеза
брассинолида, ELF3 — неизвестный белок)
Автономный, или конститутивный, путь
Более выраженный ответ на фото-
период phytochrome В (phy В), ter-
minal flower 1 (till), early in short
days4 (esd4), early flowering 1
(elfl), early flowering 2 (elf2)
Репрессия автономных путей перехода к
цветению (TFL1 похож на белки живот-
ных, связывающиеся с фосфатидилэтанол-
амином, ESD4 — неизвестный белок,
PHY В — стабильная форма фитохрома)
Гиббереллиновый путь
Ответ на фотопериод spindly (spy)
SPY кодирует ацетилглюкозамин
трансферазу, модифицирующую белки
«Репрессор цветения»
Выпадение вегетативной фазы em-
bryonic flower 1 (emfl) embryonic
flower 2 (em£2)
Необходимы для ювенильной фазы
вегетативного развития
2. Быстрее переходящие к цветению при длинном дне и верна-
лизации. К этой группе относятся мутации по генам FCA, FPA,
FVE, FY и LUMINIDEPENDENS (LD). Предполагают, что гены
этих двух групп функционируют в двух различных генетических
путях перехода растения к цветению. Считается, что гены первой
группы действуют в пути перехода к цветению, зависимом от фо-
топериода, его также называют путь длинного дня. Гены второй
группы — в так называемом автономном, или конститутивном,
пути перехода к цветению (рис. 11.28). Частичная вырожденность
этих путей, а также существование пути перехода к цветению, в
котором задействован фитогормон гиббереллин (см. ниже), и пути
вернализации объясняет, почему не выявлены одиночные мутации,
полностью предотвращающие цветение.
Существование этих частично вырожденных путей подтвержда-
ется фенотипами двойных мутантов: растения с двумя мутациями
по генам из одной группы переходят к цветению приблизительно
тогда же, когда и каждый из одиночных мутантов. Однако расте-
ния с двумя мутантными генами из разных групп переходят к цве-
тению значительно позже, чем каждое из родительских растений.
206
Репрессор цветения
EMFI, EMF2
Рис. 11.28. Модель, описывающая взаимодействие генов времени цветения у арабидопсиса.
1 — индуцибельный эффект; 2 — репрессивный эффект.
Конструктивный! I Путь длинного
Мутанты по гену первой группы G1, а также по недавно выяв-
ленному гену позднего цветения САМ1 (CARBOHYDRATE AC-
CUMULATION MUTANT) накапливают больше крахмала, чем
растения дикого типа или другие позднецветущие мутанты. Веро-
ятно, эти гены участвуют в транспорте углеводов в меристему, ко-
торый рассматривается как один из факторов, влияющих на время
перехода к цветению. Ген первой группы СО клонирован на осно-
вании его положения на генетической карте. Его продукт похож
на известные транскрипционные факторы с двумя цинковыми
пальцами, на С-конце белка также имеется предположительный
домен ядерной локализации белка. В растениях, культивируемых
при длинном дне, обнаруживается больше РНК СО, т. е. экспрес-
сия гена СО регулируется длиной дня. Мутанты со имеют феноти-
пическое проявление, если их выращивать при длинном, но не при
коротком, дне (рис. 11.29). Трансгенные растения с множественны-
Рис. 11.29. Влияние длины дня и гена СО на цветение арабидопсиса.
а — длинный день и аллель СО дикого типа; б — короткий день или мутант со (как
при длинном, так и при коротком дне).
208
ми копиями гена СО раньше переходят к цветению при коротком
дне, т. е. сверхэкспрессия этого гена приводит к противоположно-
му фенотипу. СО является членом генного семейства арабидопси-
са, его гомологи картированы для родственной Brassica nigra. По-
добные семейства генов имеются также как у длиннодневных, так
и у короткодневных культивируемых злаков.
Недавно клонировали еще несколько генов этой группы. Ген
FHA (он же — CRY2), вероятно, кодирует рецептор синего света,
кодируемый им белок очень похож на криптохром. Фенотип му-
тантов fha свидетельствует о том, что синий свет, по крайней мере
частично, необходим в пути перехода к цветению, зависимом от
фотопериода. Криптохром 2 является позитивным регулятором
гена СО, экспрессия которого также регулируется длиной дня. Ген
FT, по-видимому, кодирует белок, похожий на белок Tfll и белки,
связывающиеся с фосфатидилэтаноламином (см. ниже). Причиной
мутации Ihy является сверхэкспрессия транскрипционного факто-
ра класса MYB, очень похожего на фактор, кодируемый геном
ССА1. Мутация Ihy выражается не только в задержке цветения, не
зависящей от фотопериода, но и в нарушении циркадных ритмов.
Таким образом, вероятно, циркадные часы необходимы растению
для контроля, зависимого от фотопериода перехода к цветению.
Конститутивная экспрессия в трансгенных растениях гена ССА1
(Circadian Clock Associated 1), кодирующего транскрипционный
фактор класса MYB, тоже приводит к задержке цветения.
Физиологические эксперименты и молекулярный анализ пе-
речисленных генов позволили предложить спекулятивную мо-
дель того, как путь длинного дня регулирует время цветения.
Вероятно, взаимодействие световых сигналов с циркадными ча-
сами является тем механизмом, который позволяет растениям
чувствовать, в условиях длинного или короткого дня они нахо-
дятся. Поскольку ген FHA кодирует рецептор синего света, а про-
дукт гена LHY нарушает функционирование циркадных часов,
можно предположить, что совместное действие генов FHA и LHY
необходимо для распознавания растением условий длинного дня.
В таких условиях повышается уровень экспрессии гена СО, что в
свою очередь приводит к активации гена идентичности меристем
LEAFY (см. ниже).
Клонированы и два гена, относящиеся ко второй группе. Ген
LD, вероятно, кодирует ядерный белок, относящийся к новому,
еще не охарактеризованному типу белков-регуляторов транскрип-
ции. Количество РНК LD не зависит от длины дня, и мутанты
имеют фенотипическое проявление как при длинном, так и при
коротком дне. Продукт гена FCA локализован в ядре и содержит
два домена, связывающиеся с РНК, а также домен WW, который
вовлечен во взаимодействия между белками (рис. II.30). Кодируе-
мый им продукт напоминает гены-регуляторы развития других ор-
ганизмов, в частности, дрозофилы. Особенностью таких генов яв-
ляется то, что они регулируют сплайсинг других генов, и он тоже
209
Tea-1
ATG RRM1 RRM2 I WW TGA
| I-----------------------1 I-----1 P/G I Qj_J Q |
Рис. 11.30. Интрон-экзонная структура FCA.
Ген, длиной 8.1 т.п.о., содержит 21 экзон. Последовательности экзонов изображены
как черные прямоугольники, последовательности интронов — как линия; RRM1 и
RRM2 — последовательности, распознающие РНК (от англ. RNA recognation motif);
P/G — последовательность, богатая глицином и пролином; Q — последовательность,
богатая глютамином; WW — домен WW. Интрон 3 входит в состав транскриптов а и
р. Показано положение мутации fca*l, выражающейся в замене кодона глютамина
САА на стоп-кодон ТА А. Заштрихованные области интронов 13 и 14 отсутствуют
в транскрипте 5.
регулируется. По крайней мере второе справедливо и для FCA:
обнаружено четыре различных транскрипта гена, являющихся ре-
зультатом альтернативного сплайсинга. Поскольку белок Fea свя-
зывается с РНК, его функция, вероятно, связана с посттранскрип-
ционной регуляцией генов. Активность FCA, по-видимому, зави-
сит от белка, связывающегося с доменом WW. Таким образом,
первые три клонированных гена позднего цветения участвуют в
регуляции экспрессии других генов.
Большинство описанных выше мутантов было изолировано для
экотипов арабидопсиса, которые являются раннецветущими. Для
арабидопсиса известны также и позднецветущие экотипы. При
скрещивании таких разных экотипов было показано, что в боль-
шинстве случаев позднее цветение определяет один доминантный
ген FRIGIDA (FRI). Присутствие аллели FRIGIDA приводит к фено-
типу, похожему на фенотип мутантов fca и Id. Вероятно, FRIGIDA
является негативным регулятором в том же самом пути, который по-
зитивно регулируют FCA и LD. На определенном генетическом
фоне вернализация может полностью подавлять задержку цветения,
определяемую аллелями FRIGIDA. Доминантные аллели этого гена,
вызывающие задержку цветения, вероятно, широко распространены
в дикорастущих популяциях арабидопсиса. Считается, что они поз-
воляют растению переходить к цветению раньше или позже в зави-
симости от температуры. Хотя мутации fca и Id приводят к тому же
фенотипу, что и FRIGIDA, эти мутации не были обнаружены в при-
родных популяциях. Возможно, в природных условиях эти мутации
приводят к понижению жизнеспособности растений.
Гены раннего перехода к цветению. У арабидопсиса обнару-
жено и несколько мутаций, вызывающих переход к цветению на
более ранней стадии развития, чем это наблюдается для дикого
типа. Крайний вариант представляют собой рецессивные мутации
в двух локусах EMBRYONIC FLOWER, emfl и emft. Сразу после
210
прорастания без фазы вегетативного роста мутанты emf начинают
цвести. Вероятно, гены EMF необходимы для фазы вегетативного
развития, или же для ингибирования репродуктивного роста. Му-
танты emf плейотропны, у них формируются и аномальные листья
и цветки. Мутации emf эпистатируют над мутациями позднего цве-
тения, и их проявление не зависит от фотопериода.
У других раннецветущих мутантов наблюдается короткая фаза
вегетативного роста. Многие из таких мутантов тоже плейотроп-
Рис. 11.31. Схема мутантных соцветий и соцветий дикого типа араби-
допсиса {а—г) и львиного зева (д—з).
а — соцветие арабидопсиса дикого типа; б — соцветие мутанта Ify; в — соцветие му-
танта apl; г — соцветие мутанта till; д — соцветие львиного зева дикого типа; е — со-
цветие мутанта По; ж — соцветие мутанта sgua; з — соцветие мутанта сеп; ПГМ — по-
беговая генеративная меристема; Цв — цветок; ПЦ— прицветник; П/Цв — прицвет-
ник/цветок; СЦ — соцветие; ТЦ — терминальное соцветие; ВГМ — внутренняя гене-
ративная меристема; ПЛ — прилистник.
211
ны. Например, мутации spindly (spy) и elongated приводят к ран-
нему цветению и чрезмерной элонгации клеток. У мутантов по
гену EARLY FLOWERING 3 (ELF3) затронуты и циркадные
ритмы. Известно, что индуктивный фотопериод вызывает переход
к цветению только в том случае, если свет и темнота распределе-
ны по соответствующим фазам циркадного ритма. ELF3 — первый
известный ген растений, влияющий как на циркадные ритмы, так
и на ответ на фотопериод. Мутанты elf3 цветут рано и независимо
от длины дня. Переход к цветению других раннецветущих мутан-
тов арабидопсиса зависит от фотопериода. Мутанты early in short
days 4 (esd4) переходят к цветению, сформировав два листа при
длинном дне, и четыре листа при коротком дне. Мутанты early
flowering 2 (elf2) похожи на early in short days 4, но фаза вегета-
тивного роста у них несколько длиннее.
Ген TERMINAL FLOWER 1 (TFL1, рис. 11.31) участвует в оп-
ределении как времени цветения, так и идентичности меристемы
побега. У мутантов tfll развивается меньше вегетативных листьев,
и соцветие, заканчивающееся терминальным цветком, образуется
несколько раньше, чем у растений дикого типа. Таким образом,
ген TFL1 может участвовать в ингибировании репродуктивной
программы развития. К этому гену мы еще вернемся позднее.
ПЛ.2. ГЕНЫ ИДЕНТИЧНОСТИ ЦВЕТКОВЫХ МЕРИСТЕМ
Основное событие при индукции цветка — это активация не-
большой группы генов, которые необходимы для превращения ге-
неративной меристемы в цветковую меристему. У мутантов по
этим генам вместо цветков развиваются побеги, побегоподобные
структуры или цветки с чертами побегов. Для арабидопсиса к
таким генам идентичности цветковых меристем (перевод англ,
flower meristem identity genes) относятся гены LEAFY (LFY),
APETALA1 (API), CAULIFLOWER (CAL), APETALA2 (AP2),
UNUSUAL FLORAL ORGANS (UFO) и некоторые другие (табл. П.З).
Для львиного зева это гены FLORICAULA (FLO), SQUAMOSA
(SQUA), FIMBRIATA (ЯМ).
Мутации по гену арабидопсиса LEAFY (LFY) обычно облада-
ют наибольшим фенотипическим проявлением (рис. 11.31). Даже
самые слабые аллели Ify превращают базальные цветки во вторич-
ные генеративные побеги, которые образуются в пазухах неболь-
ших околоплодных листьев, похожих на прицветники. Образую-
щиеся позднее цветки характеризуются несколькими признаками
побегов: их органы наружной мутовки напоминают околоплодные
листья, в пазухах которых иногда образуются вторичные цветки,
расстояние между мутовками в них увеличено, расположение орга-
нов цветка близко к спиральному. У мутантов изредка образующиеся
аномальные цветки состоят из наружной мутовки чашелистиков и
внутренних мутовок чашелистикоподобных и карпелоподобных
212
Таблица II.3
Гомологичные гены арабидопсиса и львиного зева,
затрагивающие процесс развития цветка
Ген Продукты генов Фенотипы мутантов
арабидоп- сис львиный зев
Гень , контролир ующие размер и инициаш по цветковой меристемы
TFL1 CEN (См. табл. II.2) Превращение генеративной меристемы в цветковую, терминальный цветок (CEN)
LFY FLO Фактор транскрипции? Превращение цветков в соцветия, для Ify — частично
API SQUA Домен MADS apl — цветки внутри орга- нов первой мутовки, squa — вместо цветков образуются соцветия
CAL 7 » » Усиление фенотипа apl
UFO FIM F-бокс Замена первых цветков вторичными соцветиями; изменение размеров и количества органов цветка
CL VI 7 Трансмембранная киназа-рецептор Увеличенные меристемы, больше органов цветка
CLV2 ? «Лейциновая застежка» Увеличенное количество карпел
API SQUA Гены типа органов цветка Домен MADS apl — прицветники вместо чашелистиков, измененные лепестки, squa — изменен- ные органы внутренних мутовок
AP2 7 Домен АР2 Карпелы вместо чашелисти- ков, тычинки вместо лепест- ков
AG PLENA Домен MADS Лепестки вместо тычинок, новые цветки вместо карпел
AP3 DEFA » » Чашелистики вместо лепест-
PI GLO » » ков, карпелы вместо тычинок похожи на АРЗ и DEF А
7 SEP 7 Похож на DEF А
SUP 7 Регулятор транскрипции, белок с цинковыми пальцами Больше тычинок, меньше карпел
Гены, контролирующие симметрию цветка
— CYC Неизвестный белок с Радиальная симметрия вместо
DICH сигналом ядерной локализации 7 билатеральной Усиление фенотипа CYC
213
органов. Лепестки и тычинки у таких цветков отсутствуют, т. е.
LFY играет роль не только в определении судьбы цветковой ме-
ристемы, но и в возникновении лепестков и тычинок.
Гомологом гена LFY у львиного зева является ген FLORICAU-
LA (FLO). У мутантов flo на месте цветков формируются генера-
тивные побеги (рис. 11.31). Они отличаются от цветков четырьмя
основными признаками:
1) органы цветка заменяются прицветниками;
2) увеличивается длина междоузлий;
3) расположение органов близко в спиральному;
4) меристема характеризуется недетерминированным ростом.
Так проявляется одно из различий между этими дальнерод-
ственными видами двудольных растений: фенотипический эф-
фект мутации flo у львиного зева выражен гораздо сильнее, чем
мутации Ify у арабидопсиса. Таким образом, у арабидопсиса дол-
жен существовать ген, способный частично дублировать функцию
гена LFY.
Если мутантные по FLO растения долго культивировать в ма-
леньком горшке, иногда у них развиваются терминальные структуры
с карпелоподобными органами. Значит, у мутантов flo иногда могут
быть восстановлены некоторые аспекты программы развития цвет-
ка, но только некоторые, так как, например, формирование лепест-
ков и тычинок у таких мутантов обнаружить не удавалось. Цветки
львиного зева, как и большинства двудольных растений, образуются
в пазухах видоизмененных листьев — прицветников. У цветков ара-
бидопсиса дикого типа прицветников нет, а у аномальных цветков
мутантов Ify — есть. Мутанты Ify и flo, как и многие другие, о кото-
рых пойдет речь в этой главе, являются:
1) гомеозисные мутанты, поскольку их фенотип выражается в
замене одной структуры цветка на другую, — генеративный, или
соцветный, побег;
2) гетерохронические мутанты, поскольку они приводят к пов-
торению более ранней программы развития растения, иначе гово-
ря, к временным изменениям в процессе развития.
У мутантов арабидопсиса по гену APETALA1 (API) по край-
ней мере несколько базальных цветков замещается генеративными
побегами. В основании таких генеративных побегов не формиру-
ется лист, как это характерно для побегов дикого типа (рис. 11.31,
в). Апикальные цветки мутантов apl заменяются сложными детер-
минированными структурами, в которых на одном цветоносе раз-
вивается несколько цветков. Происходит это следующим образом:
в осях органов первой мутовки (чашелистиков, вместо которых
развиваются листообразные органы) возникают вторичные цветко-
вые меристемы, которые формируют вторичные цветки. В осях
органов первой мутовки таких вторичных цветков в свою очередь
образуются новые цветочные меристемы — третичные или более
высокого порядка, тоже дающие начало новым цветкам. Лепестки
у мутантов apl обычно не образуются.
214
Итак, оба гена API и LFY необходимы для превращения гене-
ративной меристемы в цветковую и обладают вырожденными, т. е.
частично взаимозаменяемыми, активностями. Подтверждается это
и фенотипом двойных мутантов apl Ify, у которых все цветочные
примордии развиваются как генеративные побеги. Более того, фе-
нотипические различия между слабыми и сильными аллелями как
Ify, так и apl, исчезают у двойных мутантов.
Гомологом гена API у львиного зева является ген SQUAMOSA
(SQUA). Как и в случае пары генов LFY/FLO, мутации squa обыч-
но обладают более выраженным фенотипом, чем apl. На месте
цветков у них, как правило, развиваются генеративные побеги
(рис. 11.31, ж), хотя изредка формируются и цветки, варьирующие
по фенотипу от почти нормальных до крайне измененных. Как и
для двойных мутантов apl Ify, аллели flo значительно усиливают
фенотип мутантов squa, и двойные мутанты иногда полностью те-
ряют способность формировать цветки.
Из подобных наблюдений можно заключить, что гены идентич-
ности меристем у арабидопсиса и львиного зева функционируют
сходным образом, хотя в их экспрессии и функции имеются неко-
торые важные различия. Активность генов идентичности меристем
и их взаимодействие с продуктами других генов могут варьировать
с возрастом, при изменении условий окружающей среды, а также
различаться для разных видов растений. В результате этого даже
одна и та же мутация может приводить к развитию растений с
различающимися фенотипами. Например, карпелоподобные
структуры у мутантов Ify чаще формируются на поздних этапах
развития соцветия и у мутантов, культивируемых при длинном
дне. Карпелоидные структуры у мутантов flo также изредка обра-
зуются только у очень старых растений.
Хотя экспрессия генов FLO/LFY и SQUA/AP1 может быть инду-
цирована независимо друг от друга, очевидно, что наличие актив-
ности только одного из этих генов недостаточно для развития нор-
мальных цветков. Однако оставалось неясным, достаточно ли ин-
дукции активности одного из этих генов для того, чтобы вызвать
нормальное развитие цветка у растений дикого типа. Ответ на этот
вопрос был получен путем конструирования трансгенных растений,
в которых химерные гены, состоящие из кодирующих последова-
тельностей генов LFY или API и конститутивного промотора p35S
вируса мозаики цветной капусты (ВМЦК), экспрессируются во всех
тканях, включая меристемы побегов. У таких трансгенных растений
в местах, где у растений дикого типа развиваются побеги и эктопи-
ческие цветки, которые по фенотипу очень близки к цветкам дикого
типа. Процесс развития цветка у трансгенных растений с эктопичес-
кой экспрессией LFY или API зависит от присутствия другого гена
пары, поскольку цветки растений с генотипом p35S::LFY apl имеют
фенотип мутантов apl (вторичные цветки, меньшее количество ле-
пестков, формирование листоподобных органов вместо чашелисти-
ков), а цветки растений p35S::APl Ify имеют фенотип мутантов Ify
215
(отсутствие лепестков и тычинок, спиральное расположение орга-
нов). Таким образом, каждый из этих генов способен индуцировать
активность другого гена этой пары в тех местах, где в норме не на-
блюдается их экспрессия, для формирования нормальных цветков
необходимо комбинирование активностей обоих этих генов.
На фенотип мутантов apl влияет ген арабидопсиса CAULI-
FLOWER (CAL). У двойных мутантов cal «цветки» похожи на
структуры, развивающиеся вместо единичных цветков у цветной
капусты Brassica oleracea var botrytis (отсюда происходит и назва-
ние гена — CAULIFLOWER). Клетки, которые обычно дают на-
чало цветковой меристеме, у таких мутантов ведут себя как клетки
генеративной меристемы и формируют множество дополнитель-
ных меристем, расположенных спирально. Гомозиготы по мутаци-
ям cal фенотипически не отличаются от растений дикого типа, что
свидетельствует о способности гена API заменять утраченную ак-
тивность CAL. Цветковые меристемы, которые формируются у му-
тантов apl, ведут себя как генеративные меристемы у двойных
мутантов apl cal, что свидетельствует о способности продукта
CAL заменять API при формировании цветковых меристем. И на-
оборот, поскольку органы первой и второй мутовок у мутантов
apl не способны развиваться нормально, продукт CAL не может
заменять API при формировании чашелистиков и лепестков.
Таким образом, функции продуктов API и CAL частично выро-
ждены, или взаимозаменяемы. В то же время мутации cal не влия-
ют на фенотип мутантов Ify или двойных мутантов apl Ify. Пока
еще не ясно, есть ли гомолог гена CAL у львиного зева.
Еще несколько генетических локусов по крайней мере немного
влияют на судьбу цветковой меристемы. Хотя мутанты по гену
арабидопсиса APETALA2 (АР2) и имеют цветки без признаков
генеративного соцветия, в двойных мутантах apl ар2, а также Ify
ар2 проявляется роль гена АР2 в формировании цветковой мерис-
темы. Более того, при совмещении apl и ар2 в двойных мутантах
наблюдается синергидный эффект: органы в мутантных цветках
располагаются по спирали, что характерно для побегов, а количес-
тво цветков, развивающихся на одном цветоносе, еще увеличива-
ется. Вероятно, АР2 может функционировать в процессе развития
меристем при отсутствии активностей LFY или API.
Ген арабидопсиса UNUSUAL FLORAL ORGANS (UFO), как и
LFY — важный активатор генов идентичности органов цветка. Му-
танты ufo имеют черты как мутантов по генам идентичности цветко-
вых меристем, так и генов идентичности органов цветка (см. раздел
с одноименным названием). Первые несколько цветков у них заме-
няются вторичными соцветиями. Как вторичные соцветия, так и ос-
новное соцветие у них заканчиваются карпелоидными или сепалоид-
ными (чашелистикообразными) структурами. Цветки таких вторич-
ных соцветий характеризуются различными типами гомеозисных
изменений в первых трех мутовках органов. Наиболее сильно при
этом изменяются органы второй и третьей мутовок, в которых ле-
216
пестки и тычинки заменяются химерными органами, состоящими из
тканей чашелистиков, тычинок, карпел, а также филаментозных
элементов. В основании многих цветков формируются прицветники
или филаментозные структуры. Кроме того, мутанты ufo характе-
ризуются уменьшением количества органов второй и третьей муто-
вок. Мутовчатое расположение органов у них выражено менее
четко, и иногда трудно сказать, к какой мутовке относится тот или
иной орган. Кроме того, у мутантов ufo нередко формируются при-
цветники без образования побегов или цветков в их пазухах. Разно-
образие фенотипа мутантов свидетельствует о множественности
функций гена UFO в развитии генеративной и цветковой меристем.
Гену UFO приписываются следующие функции:
установление кругового, или мутовчатого, характера форми-
рования органов цветка;
участие в контроле детерминированности развития цветка;
активация генов типа органов цветка APETALA3 и PISTILA-
ТА (см. далее), необходимых для развития лепестков и тычи-
нок;
определение границ между мутовками органов внутри цве-
точного зачатка.
Мутации в гене LFY в основном эпистатируют над мутациями
ufo, что свидетельствует о возможном участии обоих генов в
одном пути передачи сигнала. Чтобы проверить, справедливо ли
предположение о том, что ген UFO может являться медиатором
между геном идентичности меристем LFY и геном типа органов
цветка АРЗ, растения арабидопсиса были трансформированы кон-
струкциями с химерным геном из кодирующей последовательно-
сти гена UFO, слитой с конститутивным промотором p35S ВМЦК.
В цветках таких трансгенных растений инициация экспрессии
гена АРЗ происходила преждевременно и в местах, где у дикого
типа этот ген не экспрессируется.
Таким образом, ген UFO и в самом деле является регулятором
гена АРЗ. В цветках растений p35S::UFO Ify не формируются нор-
мальные лепестки и тычинки. Ген UFO, по-видимому, способен
нормально функционировать только при наличии активности гена
LFY. Более вероятно, что ген UFO является частично вырожден-
ным ко-регулятором, действующим вместе с геном LFY, а не про-
сто медиатором между генами идентичности меристем и генами
типа органов цветка.
Мутанты ufo похожи на мутанты по гену львиного зева FIM-
BRIATA (FIM). Вероятно, эти гены являются гомологами. Фено-
тип мутантных по гену FIM цветков зависит от силы мутантной
аллели. Цветки fim имеют лепестки с полосами тканей чашели-
стиков ббльших или меньших размеров. Такие полосы чаще всего
располагаются в срединной части нижних лепестков. Иногда в па-
зухах второй мутовки чашелистиков развиваются вторичные цвет-
ки. В цветках сильного мутанта fim 62 тычинки часто заменяются
карпелами, сливающимися с карпелами четвертой мутовки. Край-
217
нее выражение мутантного фенотипа fim 62 — недетерминиро-
ванные цветки, состоящие из чашелистиков. Мутанты по генам
UFO и FIM формируют цветки, очень сильно варьирующие по фе-
нотипу, что справедливо для всех аллелей обоих генов.
Мутации в локусе арабидопсиса TERMINAL FLOWER 1 (TFL1),
о котором уже говорилось ранее, приводят к фенотипу, противо-
положному таковому для мутаций по генам идентичности цветко-
вой меристемы. Апикальная и латеральная меристемы соцветия у
них заменяются цветковыми меристемами (рис. 11.31, г). Кроме
того, как тоже упоминалось ранее, мутанты tfll цветут раньше
растений дикого типа. В отличие от растений арабидопсиса дико-
го типа, имеющих недетерминированное соцветие с множеством
цветков и вторичными и третичными соцветиями, мутанты tfll
имеют детерминированное первичное соцветие всего лишь с не-
сколькими цветками и не образуют вторичных соцветий. Соцветие
заканчивается аномальным цветком, состоящим из двух-трех не-
полных цветков. Похоже, вторичные меристемы соцветия у мутантов
tfll заменяются меристемами цветка, а первичная генеративная
меристема превращается в 2—3 смежные цветковые меристемы.
Можно предположить, что ген TFL1 необходим для поддержания
функциональности, или компетентности, цветковой меристемы,
хотя, по-видимому, он активен и в вегетативной фазе развития.
TFL1 также играет роль в негативной регуляции экспрессии генов
LFY и API в апикальных и латеральных меристемах, хотя такая
регуляция может осуществляться и опосредованно.
Гомологом гена TFL1 у львиного зева является ген CENTRO-
RADIALIS (CEN). В норме соцветия львиного зева, как и араби-
допсиса, являются недетерминированными: цветки образуются в
латеральных положениях, и никогда не формируется терминаль-
ный, или апикальный, цветок, который был бы последним цветком
в соцветии. При этом гены FLO, LFY, SQUA и API экспрессиру-
ются в латеральных меристемах, но не в апикальной части соцве-
тия. Однако в апексах меристемы мутантов сеп, как и tfll, образу-
ются терминальные цветки (рис. 11.31, з). Как и ожидалось, выше-
перечисленные гены экспрессируются в апексах меристем этих
мутантов. Более того, условия окружающей среды, которые усили-
вают фенотип Ify, например короткий день, ослабляют фенотип
tfll. Таким образом, гены CEN и TFL1, по-видимому, являются
антагонистами генов, индуцирующих развитие цветка, и, возмож-
но, могут предотвращать их экспрессию в апексе соцветия. На ос-
нове анализа фенотипов двойных мутантов предполагают, что
TFL1 является антагонистом генов LFY, API и АР2. Мутации Ify
частично супрессируют tfll, двойные мутанты Ify apl или Ify ар2
характеризуются более выраженным супрессирующим эффектом
на фенотип tfll. Терминальный цветок мутантов сеп обладает ра-
диальной симметрией: все его лепестки напоминают вентральные
лепестки цветков дикого типа. Количество органов цветка сеп и
их филотаксис (расположение) очень вариабельны.
218
ПЛ.3. МОЛЕКУЛЯРНАЯ ХАРАКТЕРИСТИКА ГЕНОВ,
КОНТРОЛИРУЮЩИХ ИДЕНТИЧНОСТЬ ЦВЕТКОВОЙ МЕРИСТЕМЫ
Ген львиного зева FLO был клонирован одним из первых генов,
влияющих на развитие цветка. Для его клонирования использова-
ли мутант flo-613, образующий генеративные соцветия вместо
цветков. Однако гомозиготы по flo-613 изредка формировали нор-
мальные цветки. Из семян этих цветков развивались растения ди-
кого типа. Значит, мутация flo-613 генетически нестабильна и
иногда ревертировала к аллели дикого типа. Реверсия коррелиро-
вала с эксцизией транспозона ТатЗ (рис. 11.32) и, следовательно,
мутантный фенотип был обусловлен инсерцией этого мобильного
элемента в ген FLO. Таким образом, ген FLO был клонирован с
использованием последовательности транспозона ТатЗ в качестве
пробы. На рис. 11.32, а можно видеть, что у всех ревертантов к
дикому типу при использовании клонированного фрагмента гена
дт мутанты ревертанты
1 2 3 к листья сц пц лп кп
рмрмрм нерв чш тч
б в
Рис. 11.32. Рестрикционный полиморфизм ДНК мутантов арабидопсиса.
а — рестрикционный полиморфизм ДНК мутантов По и ревертантов к дикому типу
(ДТ) при гибридизации с последовательностью клонированного гена FLO. Указана
длина фрагмента с инсерцией 7.5 т.п.о.; б — рестрикционный полиморфизм ДНК му-
тантной аллели squa 293 (jk) и трех независимых ревертантов к дикому типу Qj); в —
экспрессия РНК гена SQOA в различных органах растения львиного зевадикого
типа; Kt— корень;,н — самые нижние листья растения;^/? — средние листья, располо-
женные в середине вегетативного побега; в — верхние листья, примыкающие к соцве-
тию; сц — соцветие; пц — прицветники; чш — чашелистики; лп — лепестки; тч —
тычинки; кп — карпелы.
219
FLO как пробы для гибридизации появлялся фрагмент длиной
4 т. п. о. Такой же длиной обладал гибридизовавшийся с FLO
фрагмент исходного растения дикого типа, использованного для
транспозонового мутагенеза. При этом у некоторых ревертантов
сохранялся фрагмент длиной 7.5 т. п. о., такой же, как и у мутанта
flo-613. Вероятно, среди ревертантов были как гетерозиготные,
так и гомозиготные растения.
Однако при гибридизации ДНК мутантных растений среди них
тоже были выявлены гетерозиготы, у которых присутствовали оба
фрагмента. Так, при секвенировании сайта эксцизии ТатЗ из ге-
терозиготы с фенотипом flo обнаружили инсерцию 8 пар основа-
ний. Таким образом, неточная эксцизия ТатЗ приводила к изме-
нению рамки считывания, и мутантный фенотип сохранялся.
В сайте эксцизии у ревертанта отмечены замены двух пар ос-
нований, и не обнаружены инсерции или делеции нуклеотидов. В
потомстве от самоопыления всех гетерозиготных ревертантов име-
ются растения дикого типа и мутанты в соотношении 3:1. Потом-
ство большинства гомозиготных ревертантов состояло только из
растений дикого типа.
Мутация flo-613, как и многие другие гомеозисные мутации
львиного зева, использованные для клонирования генов развития
цветка и о которых пойдет речь в этой главе, была получена в
массивном эксперименте по транспозоновому мутагенезу. Расте-
ния львиного зева с высокоактивными мобильными элементами
Tam (от Transposone of Antirrhinum majus) выращивали при тем-
пературе 15 °C. Именно при этой температуре для мобильных эле-
ментов группы Tam наблюдается наибольшая частота транспози-
ций. Многие из 26 000 потомков Ml этих растений, полученных
при самоопылении, содержали рецессивные мутации в гетерози-
готном состоянии. Такие рецессивные мутации можно было вы-
явить в следующем поколении М2 после самоопыления растений
Ml. И в самом деле, среди 80 000 растений М2 было обнаружено
более 15 независимых гомеозисных мутаций, затрагивающих раз-
витие цветка.
Ген арабидопсиса LFY был клонирован по гомологии с геном
львиного зева FLO. В отличие от многих других гомеозисных
генов, затрагивающих развитие цветка, FLO и LFY, похоже, уни-
кальные гены и не являются членами генного семейства. Кодируе-
мые ими белки были на 70 % гомологичны друг другу и не обла-
дали значительной гомологией ни с одним из известных на момент
их клонирования белков. Наличие богатого пролином домена на
N-конце и кислой области в центральной части белка свидетель-
ствуют о том, что, вероятно, они могут служить активаторами
транскрипции. Подтверждается это и тем, что белок Lfy локализо-
ван в основном в ядре. Характер их экспрессии очень похож. РНК
FLO и LFY начинает накапливаться в закладывающихся зачатках
цветка на границе цветочной меристемы и не обнаруживается в
генеративной меристеме. В момент приобретения цветочными ме-
220
ристемами морфологических различий (стадии 1 и 2) экспрессия
усиливается в равной степени по всему молодому зачатку цветка.
На стадиях 3 и 4, когда индуцируется экспрессия генов идентич-
ности органов, РНК FLO и LFY уже практически не обнаружива-
ется в центре начинающего формироваться цветка. Из известных
генов они первыми начинают экспрессироваться в клетках, из ко-
торых затем сформируется цветок (рис. 11.33).
Однако в характере экспрессии FLO и LFY есть одно важное
отличие, помогающее понять, как развиваются меристемы. Разли-
чие является следствием того, что у цветка львиного зева есть при-
цветники, а у цветка арабидопсиса их нет. Ген FLO экспрессиру-
ется как в примордиях прицветников, так и в цветковых меристе-
мах. В то же время для гена LFY не наблюдается экспрессия в
клетках, окружающих цветковые меристемы, и, вероятно, соответ-
ствующих клеткам львиного зева, из которых образуются прицвет-
ники. У мутантов ify на месте цветков дикого типа без прицветни-
ков образуются генеративные побеги или «цветки» с околоплод-
ными листьями, которые можно отождествлять с прицветниками.
Значит, продукт LFY дикого типа подавляет инициацию или обра-
зование прицветников. Предполагают, что ген LFY влияет на судь-
бу группы клеток на периферии цветочной меристемы: в цветках
дикого типа все или большинство этих клеток формируют цветоч-
ную меристему, тогда как у мутантов Ify эти клетки дают начало
Генеративная
Рис. 11.33. Схематическое изображение генеративного побега арабидоп-
сиса и начальные этапы экспрессии генов, регулирующие развитие
цветка.
Области, в которых инициируется экспрессия генов LFY, API, AG, TFL1, заштри-
хованы по-разному.
221
меристеме и примордию прицветника. В этом отношении мутант
Ify похож на дикий тип растений таких видов, как Antirrhinum
majus, у которых из одного зачатка образуются меристема цветка
и прицветник. Считается, что наличие прицветников — эволюци-
онно более древний признак.
Насколько универсальны охарактеризованные механизмы ин-
дукции цветка? Пока что на этот вопрос ответить не просто. По-
хоже, что для табака, который является более близким родствен-
ником львиного зева, чем арабидопсис, индукция развития цветко-
вой меристемы происходит по-другому. Гены табака Nicotiana
tabacum NFL1 и NFL2, гомологи генов FLO и LFY, транскрибиру-
ются во время как вегетативного, так и репродуктивного развития
растений. Их экспрессия не инициируется во время индукции
цветка, как это характерно для генов FLO и LFY. Возможно, это
связано с тем, что табак имеет терминальный цветок, в то время
как соцветия львиного зева и арабидопсиса не детерминированы.
Трансгенные растения арабидопсиса, в которых конститутивно экс-
прессируется ген LFY, тоже имеют терминальный цветок. В гено-
мах диплоидных растений львиного зева и арабидопсиса имеется
только одна копия гена FLO или LFY. Табак же является аллотет-
раплоидом, и каждый из его диплоидных геномов содержит по
одной копии гомологичного FLO/LFY гена.
Ген львиного зева SQUA был клонирован с использованием в
качестве пробы гена DEF из этого же растения, содержащего
MADS-бокс (MADS-бокс — это последовательность ДНК, коди-
рующая домен MADS. Он получил свое название от четырех кло-
нированных первыми генов с этим боксом: МСМ1, AGAMOUS,
DEFICIENS, SRF. Домен MADS представляет собой консерватив-
ную область белков — факторов транскрипции, участвующую в
связывании с ДНК (подробнее об этом см. далее). По гомологии с
DEF было выделено 9 независимых генов львиного зева. Один из
клонов при гибридизации геномных блотов по Саузерну проявлял
рестрикционный полиморфизм для ДНК дикого типа и нестабиль-
ной мутации squa-293 (рис. 11.32, б). Ревертанты SQUA имели
фрагмент ДНК такой же длины, как и растения дикого типа.
Ген арабидопсиса API был клонирован как новый член семей-
ства генов, содержащих MADS-бокс.
Белки Squa и Apl характеризуются 68%-ной гомологией. На-
личие в этих белках домена MADS предполагает, что они могут
специфически связываться с ДНК и функционировать как актива-
торы транскрипции. РНК SQUA и API индуцируется в молодых
цветочных примордиях, как только они становятся видимыми на
границе генеративной меристемы (чуть позже, чем РНК FLO и
LFY). На стадиях 1 и 2 РНК SQUA и API однородно экспресси-
руется по всему примордию цветка (рис. II.33), на стадии 3 экс-
прессия снижается в двух внутренних мутовках, и затем РНК API
обнаруживается только в примордиях чашелистиков и лепестков.
РНК SQUA, кроме того, менее интенсивно экспрессируется и в
222
примордиях прицветников и карпел. В вегетативных органах, за
исключением самых верхних листьев, примыкающих к соцветию,
РНК SQUA не обнаруживается (рис. 11.32, в).
Ген SQUA экспрессируется в мутантах flo, а ген FLO — в му-
тантах squa. Таким образом, FLO и SQUA активируются незави-
симо друг от друга. Подобным образом, ген LFY экспрессируется
в мутантах apl. Фенотип двойных мутантов flo squa и lfy apl вы-
ражен значительно сильнее, чем фенотип одиночных мутантов по
этим генам, что также свидетельствует о независимом и синергид-
ном действии этих генов в процессе формирования цветковой ме-
ристемы и о частичной вырожденности их активностей.
Ген LFY не только необходим для формирования цветка, но и
достаточен для определения идентичности цветка, т. е. развития
меристемы как цветковой меристемы. Основной побег трансген-
ных растений p35S::LFY с конститутивной экспрессией этого гена
переходит к цветению раньше, чем растения дикого типа, а вто-
ричные побеги превращаются в цветки. Хотя ген API экспресси-
руется несколько позднее, чем LFY, он тоже необходим для ини-
циации развития цветка. Конститутивная экспрессия трансгена
p35S::APl тоже ускоряет переход растения к цветению и приводит
к образованию цветков на месте вторичных побегов. По-видимо-
му, гены LFY/AP1 и FLO/SQUA оказывают наибольшее влияние
на инициацию цветковых меристем. Однако в этот процесс вносят
определенный вклад и другие гены.
Ген арабидопсиса CAULIFLOWER очень похож на ген API,
что и было использовано для его клонирования. Как и API, ген
CAL тоже кодирует белок с доменом MADS, и, следовательно,
тоже может являться активатором транскрипции. Последователь-
ности белков Cal и Apl имеют гомологию 70 %. Внутри домена
MADS они различаются только пятью аминокислотными остатка-
ми из 56, т. е. оба белка, вероятно, узнают похожие последователь-
ности ДНК и участвуют в регуляции сходных генов. Таким обра-
зом, функциональная вырожденность этих генов, обнаруживаемая
в генетических исследованиях, подтверждается их структурным
сходством. Однако, хотя данные молекулярного анализа хорошо
согласуются с фактом функциональной вырожденности генов CAL
и API, они не дают ответа на вопрос, почему CAL может только
частично заменять API.
Ген CAL начинает экспрессироваться в примордиях цветков
одновременно с геном API, и затем тоже обнаруживается только в
примордиях двух наружных мутовок органов. В отличие от API,
РНК которого накапливается в больших количествах в процессе
развития лепестков и чашелистиков, РНК CAL в примордиях этих
органов обнаруживается лишь в небольших количествах. Возмож-
но, именно поэтому CAL неспособен заменить API при формиро-
вании лепестков и чашелистиков. Какова же роль гена CAL в раз-
витии цветка? Данные молекулярного анализа свидетельствуют о
том, что в двойных мутантах apl cal концентрация РНК LFY
223
очень сильно редуцирована, в то время как в мутантах apl она не
отличается от таковой для дикого типа. Таким образом, функция
CAL может заключаться в поддержании активности гена LFY. Ве-
роятно, поэтому и фенотип тройных мутантов Ify apl cal не отли-
чается от фенотипа двойных мутантов Ify apl: если ген LFY инак-
тивирован, ген CAL уже неспособен влиять на его активность.
Соцветия цветной капусты Brassica oleracea var. botrytis и ка-
пусты-брокколи Brassica oleracea var. italica представляют собой
одну из аномалий развития цветка. Как и многие другие разновид-
ности используемой для еды капусты — такие, как капуста бело-
кочанная и краснокочанная, брюссельская, листовая, — обе эти
разновидности тоже произошли от Brassica oleracea дикого типа.
Как известно, Brassica и арабидопсис относятся к одному семейст-
ву — крестоцветных, и их соцветия дикого типа и фенотипа cau-
liflower морфологически очень похожи. При исследовании двух
достаточно отдаленных видов растений, арабидопсиса и львиного
зева оказалось, что механизмы, контролирующие развитие цветка,
у них довольно консервативны. Гомологи почти всех клонирован-
ных генов есть у обоих видов, и типы их экспрессии очень похо-
жи. Следовательно, не должно быть сюрпризом то, что молекуляр-
ная основа фенотипа cauliflower у арабидопсиса и близкородст-
венной Brassica oleracea var. botrytis могут быть идентичны. Чтобы
проверить, так ли это на самом деле, были клонированы гомологи
гена CAL — bobCAL из цветной капусты, boiCAL из брокколи и
boCAL из Brassica oleracea дикого типа. Как оказалось, открытая
рамка считывания гена bobCAL прерывается стоп-кодоном в пятом
экзоне, и соответствующий мутантный белок имеет молекулярный
вес 17 кДа вместо белка дикого типа с молекулярным весом
30 кДа. В гене boiCAL не обнаружили подобный стоп-кодон, од-
нако, в нем имеется делеция кодонов пяти аминокислотных остат-
ков, а также аминокислотные замены в двух из трех кодонах, ко-
торые изменены у мутанта арабидопсиса cal-1. Таким образом, эти
данные свидетельствуют в пользу того, что фенотипы соцветий
цветной капусты и брокколи по крайней мере частично обуслов-
лены мутациями в гене CAL.
Ген львиного зева FIM был клонирован с использованием ме-
тода транспозоновой мишени. Мутанты fim 619 и fim 620 с инсер-
цией мобильных элементов были получены в описанном выше эк-
сперименте по мутагенезу. Ген арабидопсиса UFO был клонирован
по гомологии с геном FIM: фрагмент гена FIM почти полной
длины использовали как пробу для гибридизациии с геномной
библиотекой арабидопсиса. Нуклеотидные последовательности
генов FIM и UFO обладают значительной степенью гомологии. В
то же время последовательности этих генов не обнаруживают зна-
чительного сходства с какими-либо другими нуклеотидными по-
следовательностями, имеющимися в базах данных. Оба гена, FIM
и UFO, активируются в молодых цветковых меристемах раньше
генов типа органов цветка. Инициация их экспрессии наблюдается
224
в центре цветковой меристемы, и затем эта область «расходится»
в стороны и превращается в кольцо, в центре которого РНК FIM
или UFO уже не обнаруживаются. Еще позднее экспрессия этих
генов ограничивается небольшой областью между мутовками ле-
пестков и других органов. UFO работает только в области между
чашелистиками и лепестками, в то время как ген FIM экспресси-
руется как между мутовками чашелистиков и лепестков, так и
между мутовками лепестков и тычинок.
Между гомологами FIM/UFO, как и в случае другой пары
FLO/LFY, обнаруживаются и другие различия. У цветков мутантов
ufo, как и у мутантов lfy, образуются прицветники. Таким обра-
зом, одной из функций генов LFY и UFO является подавление
образования прицветников. Подобной функцией не обладают их
гомологи FLO и FIM. Ген UFO начинает действовать чуть раньше,
чем ген FIM. Транскрипты UFO обнаруживаются на более ранней
стадии, чем транскрипты FIM.
Мутации ufo выражаются в изменении размеров, количества и
закладки органов цветка, а также в их слиянии. Это говорит о том,
что ген UFO участвует в регуляции клеточных делений и пролифе-
рации органов. Подтверждается это и фенотипом трансгенных
растений арабидопсиса с геном UFO, слитым с конститутивным
промотором p35S ВМЦК: в цветках таких растений развивается
больше лепестков и тычинок, при этом общее количество лепест-
ков и тычинок может быть как больше, так и меньше восьми, а
количество репродуктивных органов может достигать шестнадца-
ти (против шести в цветках дикого типа). Гены UFO/FIM характе-
ризуются наличием F-бокса, который имеется также в генах, кон-
тролирующих синтез таких белков, как циклин А, циклин F и
Cdc4, вовлеченных в контроль клеточного цикла у дрожжей. Не-
которые белки с F-боксом, например Met3op и GRR1 дрожжей,
функционируют как ингибиторы транскрипции. Белок Fim связы-
вается с белками семейства Fap (от EIM-associated proteins), кото-
рые очень напоминают белки Skpl дрожжей и человека. Послед-
ние образуют комплексы с белками, содержащими F-бокс, вызы-
вая деградацию белков и развитие клеточного цикла. Ген FIM
играет также ключевую роль в активации генов идентичности
цветковой меристемы.
Гены CEN и TFL1 активируются в зрелых соцветиях дикого
типа чуть ниже верхней части апикальной меристемы соцветия
(рис. II.33). РНК TFL1 также обнаруживается в латеральных гене-
ративных меристемах и по всей длине генеративного стебля.
Таким образом, вероятно, работа гена TFL1 в генеративном стебле
приводит к задержке перехода к цветению. Ген CEN экспрессиру-
ется в генеративном стебле очень слабо. Вероятно, поэтому мута-
ции сеп, в отличие от мутаций tfl, не влияют на время перехода к
цветению. Экспрессия гена TFL1 в апикальной меристеме ингиби-
рует работу в ней генов LFY и API, а гена CEN ингибирует экс-
прессию гена FLO и таким образом предотвращает развитие апек-
8 Генетика
225
Рис. 11.34. Схематическое изображение начальных этапов развития гене-
ративной меристемы мутанта сеп (а) и растений львиного зева дикого
типа (б).
1 — момент закладки цветковых меристем; 2 и 3 — апекс генеративной меристемы
через 2 и 6 дней с момента закладки цветковых меристем. Цветковые меристемы по-
казаны черным цветом, вегетативные — белым, апикальные меристемы — точками.
Прицветники не показаны. В мутанте сеп ген FLO после некоторой задержки акти-
вируется в апикальной меристеме. В растениях дикого типа экспрессия FLO индуци-
рует экспрессию CEN. В субапикальной зоне (сигнал от FLO показан стрелками,
зона экспрессии GEN заштрихована). Активация CEN ингибирует экспрессию FLO
в апикальной меристеме.
са побега как цветочной меристемы (рис. 11.34). Неожиданным ре-
зультатом анализа взаимодействия CEN с другими генами оказа-
лось то, что ген FLO в свою очередь необходим для экспрессии
CEN в апикальной меристеме. В мутантных по FLO растениях, у
которых формируется нефункциональная РНК FLO, РНК CEN не
обнаруживается.
Итак, гены, о которых говорилось выше, необходимы для ус-
пешного перехода к цветению. Можно выделить две группы
таких генов: гены, влияющие на время индукции цветения, и
гены идентичности цветковых меристем.
113.4. ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ ТИПА ОРГАНОВ ЦВЕТКА
После инициации цветковых меристем активируются гены
типа (или идентичности) органов цветка. Генетические исследо-
вания мутаций, влияющих на тип органов цветка, позволили со-
здать модель, согласно которой для развития четырех типов орга-
226
Рис. 11.35. Модель развития цветка АВС.
Цифрами 1 — 4 указаны области соответствующих мутовок цветка. В первой мутовке
функционирует только активность А и формируются чашелистики (ЧШ). Совместное
действие активностей А и В во второй мутовке приводит к формированию лепестков
(ЛП), активностей В и С в третьей мутовке — к формированию тычинок (ТЧ). В чет-
вертой мутовке функционирует только активность С и формируются карпелы (КП).
При этом активность генов А в первой и второй мутовках подавляет экспрессию в них
генов функции С, а активность генов С в третьей и четвертой мутовках подавляет экс-
прессию в них генов функции А.
нов цветка необходимы три гомеозисные функции, или активно-
сти. Их назвали А, В и С. Каждая из этих активностей функцио-
нирует в двух смежных мутовках: А — в мутовках 1 и 2, В — в
мутовках 2 и 3, С — в мутовках 3 и 4. Таким образом, только
активность А в первой мутовке определяет развитие чашелисти-
ков, только активность С в четвертой мутовке — развитие карпел.
Комбинирование активностей АВ и ВС определяет развитие ле-
пестков и тычинок соответственно в мутовках 3 и 4. Модель также
предполагает, что А и С являются антагонистами, т. е. активность
А в мутовках 1 и 2 препятствует активности С, а активность С в
мутовках 3 и 4 — А (рис. 11.35 и 11.36).
Модель была создана на основе анализа мутаций арабидопсиса
и львиного зева, затрагивающих тип органов цветка. Мутации в
четырех генах арабидопсиса — APETALA2 (хромосома 4), PISTI-
LATA (хромосома 5), APETALA3 (хромосома 3) и AGAMOUS
(хромосома 4) — приводили к трем различным фенотипам. У му-
тантов по гену APETALA2 почти всегда вместо чашелистиков
формировались карпелы, а вместо лепестков — тычинки. Мута-
ции в генах PISTILATA и APETALA3 приводили к формирова-
нию чашелистиков вместо лепестков и карпел вместо тычинок.
Мутации по гену AGAMOUS приводили к образованию лепестков
вместо тычинок и чашелистиков вместо карпел, при этом внутри
цветка всегда развивались добавочные лепестки и чашелистики
(рис. 11.37). Те же три фенотипа наблюдали и для мутантов льви-
ного зева по мере включения в число генов, отвечающих за функ-
цию А. Из модели не ясно, достаточно ли перечисленных генов
227
Ml М2 М3 M4
Дикий тип
Мутант а
Мутант b
Мутант с
Мутант ab
_J....в
А | С
ЧШ ЛП ТЧ КП
-J ,-В ...1_
______с______
КП ТЧ ТЧ кп
А I С
чшчл кп кп
в
I А I
ЧШ лп лп чш...
I с I
кп кп кп кп
Мутант be J А|
ЧШ ЧШ ЧШ ЧШ ...
Мутант ас В |
Л ЛП/ ЛП/ Л ...
ТЧ ТЧ
Мутант abc |________________________
Л Л Л Л ...
Рис. 11.36. Схемы образования органов цветка для одиночных, двойных
и тройных мутантов.
ЛГиТЧ — органы цветка, характеризующиеся признаками как лепестков, так и ты-
чинок; Л — лист, обладающий некоторыми характеристиками карпел. Цветки всех
мутантов, включающих мутацию ag. Остальные обозначения, как на рис. 11.35.
Рис. 11.37. Цветки мутантов арабидопсиса по генам идентичности типа
органов цветка.
а — дикий тип; б — мутант ар2; в — мутант pi; г — мутант ag; д — двойной мутант
ар2 ag; е — двойной мутант ар2 арЗ; ж — двойной мутант pi ag; з — тройной му-
тант ар2 арЗ ag.
228
229
для определения каждого из типов органов цветка. Например, как
сказано выше, для каждой из функций А и В у арабидопсиса не-
обходимо по крайней мере два гена. Опыты с трансгенными рас-
тениями (см. ниже) помогают получить ответ на этот вопрос.
Мутации по гену арабидопсиса APETALA2 (АР2) (функция А)
приводят к изменению типа органов двух внутренних мутовок и,
кроме того, влияют на положение и количество органов всех му-
товок цветка. Обобщенный фенотип цветков мутантов ар2 таков:
карпелы в первой и четвертой мутовках, и тычинки во второй и
третьей мутовках (рис. 11.36 и 11.37, б). Значит, вместо чашелисти-
ков у таких мутантов формируются карпелы, а вместо лепест-
ков — тычинки. Фенотип цветков у мутантов по аллелям ар2-2
таков: срединные органы первой мутовки обычно развиваются, как
карпелы, при этом латеральные органы первой мутовки либо от-
сутствуют, либо развиваются, как листоподобные или карпелоид-
ные структуры. Органы второй мутовки у мутанта ар2-2 не разви-
ваются, так как не инициируются примордии этих органов. Хотя
органы третьей мутовки у них обычно тоже не развиваются, все же
иногда формируются фертильные тычинки. Карпелы четвертой
мутовки часто не сливаются соответствующим образом и нередко
имеют извилистую форму. Кроме того, у мутантов ар2 изменена
морфология семенной кожуры. У мутантов по температурочувст-
вительной аллели ар2-1 обычно изменены только два наружных
круга органов: органы первой мутовки развиваются как листья или
характеризуются признаками листьев, а органы второй мутовки
отсутствуют или похожи на тычинки. Таким образом, при частич-
ной потере функции в первой мутовке образуются органы, харак-
теризующиеся признаками листьев. Большинство мутантов ар2
влияет на количество органов первой, второй и третьей мутовок и
на места инициации их примордиев.
В отличие от арабидопсиса, для львиного зева до сих пор не
обнаружены рецессивные мутации, характеризующиеся потерей
функции А. Однако подобным фенотипом обладают мутанты, ко-
торые первоначально были названы ovulata. В отличие от других
гомеозисных мутаций, затрагивающих развитие цветка, мутации
ovulata являются полудоминантными. Мутанты по гену петунии
BLIND по фенотипу похожи на мутантов арабидопсиса по аллелю
ар2-1: их чашелистики обладают признаками карпел, а лепестки
превращаются в стаминоидные органы.
Мутации по гену арабидопсиса APETALA1 (API) (функция А)
влияют на две отдельные фазы развития цветка: инициация цвет-
ковой меристемы и определение типа органов цветка (как и ген
АР2, см. выше). Кроме влияния на тип меристемы, о чем речь шла
раньше, мутанты apl характеризуются наличием дефектов в двух
наружных кругах органов. Органы первой мутовки у мутанта apl-1
либо не развиваются вовсе, либо представляют собой листоподоб-
ные структуры. Органы второй мутовки обычно отсутствуют, их
примордии не образуются. У мутантов по другим аллелям apl ор-
230
ганы второй мутовки, если они образуются, часто характеризуются
признаками листьев, тычинок и/или лепестков. При этом мутанты
по слабым аллелям apl характеризуются измененными органами
первой и второй мутовок, но не проявляют дефектов в развитии
цветковой меристемы. Следовательно, функции API в формирова-
нии цветковой меристемы и определении типа органов цветка
могут быть мутационно разделены. Генетические данные показы-
вают, что API участвует не только в инициации генеративной ме-
ристемы и определении типа органов цветка, но и в промежуточ-
ном этапе инициации примордиев органов.
APETALA3 и PISTILATA представляют собой два отдельных
гена арабидопсиса с функцией В и картируются в разных хромо-
сомах. При этом фенотипы мутантов по этим генам очень схожи.
У мутантов арЗ и pi вместо лепестков и тычинок формируются
чашелистики и карпелы соответственно (рис. 11.34 и 11.35, в). У
сильных мутантов арЗ и pi клетки, которые обычно дают начало
органам третьей мутовки, большей частью инкорпорированы в
увеличенный центральный геницей.
Фенотипы мутантов львиного зева по генам DEFICIENS (DEF)
и GLOBOSA (GLO) очень похожи на таковые мутантов арабидоп-
сиса арЗ и pi (рис. 11.37). Для львиного зева известен и еще один
ген, приводящий к подобному фенотипу, — SEPALOIDEA (SEP).
У мутантов def и gio нормально происходит закладка примордиев
органов второй и третьей мутовок, но из них развиваются не ле-
пестки и тычинки, как у растений дикого типа, а иные органы.
При этом такие мутанты часто не имеют карпел в четвертой му-
товке, хотя нормальные фертильные карпелы образуются в третьей
мутовке, т. е. гены DEF и GLO не являются необходимыми для
формирования карпел. Предполагают, что белки Def и Gio необ-
ходимы не только для определения типа органов второй и третьей
мутовок, но также играют роль в сохранении меристематической
активности в центре цветка.
Мутанты по гену DEF идентифицированы и морфологически, и
генетически охарактеризованы еще в начале века. Тогда были опи-
саны 3 классические аллели этого гена (морфоаллели), которые
различаются по степени дифференцированности органов цветка.
Мутация defslobifcra (def-glo, рис. 11.37) характеризуется наиболее
измененным фенотипом цветков. Органы второй мутовки в них
почти неотличимы от органов первой мутовки, органы четвертой
мутовки или не развиваются совсем или сливаются с органами
третьей мутовки.
Мутанты deffch,oranlha (def-chl, рис. 11.37) и defhicotianoidcs (def-nic,
рис. 11.37) имеют цветки с чашелистикообразными органами вто-
рой мутовки. Тычинки мутанта def-chl внешне очень напоминают
тычинки цветков дикого типа, но содержат семяпочки. В то же
время органы третьей мутовки мутантов def-nic морфологически
сходны с карпелами, но у некоторых из них не формируются се-
мяпочки. На морфологические характеристики мутантов по этим
231
аллелям влияют условия окружающей среды, а также генетичес-
кий фон. Функции гена DEF в формировании лепестков и тычи-
нок могут быть мутационно разделены. Например, цветки мутан-
тов по недавно охарактеризованной аллели def-23 имеют лепест-
ки, похожие на лепестки цветков дикого типа, тогда как органы
третьей мутовки у них превращаются в карпелы практически в той
же степени, как у мутантов def-glo. Следовательно, ген DEF обла-
дает различными и разделимыми функциями в различных органах
и даже частях органов цветка.
Ген петунии FLORAL BINDING PROTEIN 1 (FBP1) является
гомологом генов функции В львиного зева и арабидопсиса GLO и
PI (табл. II.4). Мутанты по гену FBP1 характеризуются тем же фе-
нотипом, что и мутанты gio и pi, т. е. гомеозисной трансформа-
цией лепестков в чашелистики и тычинок в карпелы. Такой же
фенотип имеют и мутанты def и арЗ. Однако мутации по гену
петунии GREEN PETAL (GP), вероятному гомологу генов DEF и
АРЗ, влияют только на лепестки, хотя РНК GP характеризуется
тем же характером экспрессии, что и РНК DEF и АРЗ. Вероятно,
это различие в фенотипах мутантов связано с наличием у петунии
третьего гена функции В, в то время как у арабидопсиса для нор-
мальной активности функции В достаточно только двух генов.
Третий ген петунии pMADS2, или FBP3, как и FBP2, также харак-
теризуется значительным уровнем гомологии с генами GLO и Р1 и
тоже экспрессируется в развивающихся лепестках и тычинках
(табл. II.4). Интересно отметить, что петуния принадлежит к тому
же подклассу Asteridae, что и львиный зев и, таким образом, со-
Таблица 11.4
Некоторые гомологичные гены идентичности органов цветка
разных видов растении
Подкласс Семейство Вид | Ген
Гены, похожие на PISTILATA/GLOBOSA
Asteridae Scrophulariaceae Antirrhinum majus GLO
Solanaceae Petunia hybrida FPB1 PMADS2*
Nicotiana tabacum NTGLO
Oleaceae Syringa vulgaris SvPI
Dillenidae Brassicaceae Arabidopsis thaliana PI
Caryophillidae Caryophillaceae Silene latifolia SLM2
Ranunculidae Papaveraceae Papaver nudicaule PnPI-1 PnPI-2
Fumariaceae Dicentra eximia DePl
Ranunculaceae Caltha pal us tris CpPI
Ranunculus bulbosus RbPI-1 RbPI-2
232
Таблица 11,4 (продолжение)
Подкласс Семейство Вид Ген
Magnoliidae Magnoliaceae Delphinium ajacis Michelia figo DaPI MfPI
Commelinidae Piperaceae Poaceae Liriodendron tulipifera Peperomia hirta Piper magnificum Oryza sativa LtPI PhPI PmPI-1 PmPI-2 OsMADS2
Asteridae Гены, похожие на Scrophulariaceae APETALA3/DEFICIENS Antirrhinum majus OsMADS4 DEF
Dillenidae Solanaceae Asteraceae Oleaceae Brassicaceae Lycopersicon ecsulentum cv. Celebrity Lycopersicon ecsulentum cv. Tiny Tim Petunia hybrida Solarium tuberosum Nicotiana tabacum Argyroxiphium sandwicense Syringa vulgaris Arabidopsis thaliana LeAP3 TM6 PM ADS 1 STDEF PD2 NTDEF AsAP3 SvAP3 AP3
Caryophillidae Caryophillaceae Brassica oleraceae var. Botrytis Brassica oleraceae var. Italica Silene latifolia ВоЬАРЗ ВоИАРЗ Boi2AP3 SLM3
Rosidae Polygonaceae Fabaceae Di an thus caryophillus Rumex acetosa Medicago sativa CMB2 RADI RAD2 NMH7
Ranunculidae Buxaceae Papaveraceae Pachysandra terminalis Papaver californicum PtAP3-l PtAP3-2 РсАРЗ
Magnoliidae Furnari aceae Ranunculaceae Magnoliaceae Papaver nudicaule Dicentra eximia Caltha palustris Ranunculus bulbosus Michelia figo РпАРЗ-1 PnAP3-2 DeAP3 СрАРЗ RbAP3 MfAP3
Commelinidae Piperaceae Poaceae Liriodendron tulipifera Peperomia hirta Zea mays LtAP3 PhAP3 SILKY-1
♦ PMADS2 = FBP3, PMADS1 = GP.
233
стоит в более близком родстве с львиным зевом, чем арабидопсис,
принадлежащий к подклассу Dillenidae. Вероятно, потеря актив-
ности гена GP в спецификации тычинок и приобретение третьего
гена функции В является поздним эволюционным приобретением.
Мутации в гене арабидопсиса функции С AGAMOUS (AG) вы-
ражаются в изменении типа органов двух внутренних мутовок. Ор-
ганы третьей мутовки развиваются, как лепестки, а органы четвер-
той мутовки заменяются новым цветком и повторяют структуру
первичного цветка. Таким образом, фенотип цветка ag можно изо-
бразить как (чашелистик, лепесток, лепесток)п (рис. 11.35 и 11.37,
г). Ген AG дикого типа, таким образом, не только участвует в
определении идентичности репродуктивных органов, но и подав-
ляет недетерминированный рост цветковой меристемы. Во многих
отношениях изменения фенотипа цветка у мутантов ag и ар2 про-
тивоположны друг другу. У мутантов ар2 органы околоцветника
заменены репродуктивными органами, в то время как у мутантов
ag репродуктивные органы заменены органами околоцветника.
Функции гена AG в формировании органов третьей мутовки и де-
терминированной меристемы цветка могут быть мутационно раз-
делены. Генетическая модель идентичности органов цветка была
создана на основе анализа одиночных мутантов по генам, описан-
ным выше, поэтому фенотипы мутантов по этим генам в основном
согласуются с данной моделью. Соответствие реальных фенотипов
двойных мутантов фенотипам, предсказанным согласно модели,
является ее хорошей проверкой.
Так, фенотипы двойных мутантов подтверждают антагонистич-
ные взаимоотношения между функциями А и С. У двойных мутан-
тов по активностям А и В (ар2 арЗ или ар2 pi) во всех четырех
мутовках «работает» только активность С (ген AG). Все органы
таких мутантных цветков напоминают карпелы. У двойных му-
тантов по активностям В и С (pi ag или арЗ ag) функционирует
только активность А, и органы всех четырех мутовок цветка раз-
виваются как чашелистики (рис. 11.35, ж). Карпелы и тычинки, ко-
торые часто образуются в двух внешних мутовках органов единич-
ных мутантов ар2, развиваются как листоподобные органы и ты-
чинкоподобные лепестки у двойных мутантов по активностям А и
С ag ар2 (рис. 11.35, д). Значит, ген AG в самом деле функциони-
рует при определении типа органов двух внешних мутовок цветков
у мутантов ар2. Фенотип двойных мутантов ag ар2 особенно ин-
тересен, так как для них, согласно модели в первой и четвертой
мутовках органов, не работает ни одна из активностей, определя-
ющих тип органов цветка. Органы, развивающиеся в мутовках
двойных мутантов ag ар2, в самом деле обладают многими призна-
ками листьев: формой и цветом, проводящей системой, наличием
губчатого мезофила, прилистников, разветвленных трихом и мед-
ленным старением. Все это — признаки вегетативных листьев, но
не органов цветка. Таким образом, отсутствие всех трех активно-
стей — А, В и С — приводит к образованию листьев. На основа-
234
нии этого логично предположить, что функция этих активно-
стей — превращать листья в различные органы цветка. И в самом
деле, все органы цветков тройных мутантов по генам всех трех
активностей развиваются как листья (рис. 11.35, з).
Такие недавно полученные генетические данные очень инте-
ресны в историческом аспекте: еще в 1790 г. Гете предположил,
что все 4 типа органов цветка представляют собой модифициро-
ванные листья. Он использовал гомеозисные вариации у растений
для создания модели, объясняющей происхождение различных
типов органов цветка. Термин гомеозис предложил У. Бэтсон. Го-
меозисные мутанты, т. е. мутанты, у которых на месте нормально-
го органа развивается орган другого типа, впервые были описаны
для растений. Ранние описания мутантов, у которых вместо тычи-
нок развиваются дополнительные лепестки, обнаруживаются еще
во времена Древней Греции и Древнего Рима. Похожие описания
можно встретить и в китайских рукописях более чем тысячелет-
ней давности, и в книгах садоводов эпохи Возрождения. Начиная
с середины XVIII в. Линней и Гете пытались использовать такие
мутанты (и похожие, но ненаследуемые аномалии развития) для
изучения процессов развития растений.
Органы второй и третьей мутовок мутантов ag ар2 обладают при-
знаками как лепестков, так и тычинок: гены функции В позволяют
этим органам развиваться и как лепестки, и как тычинки, а актив-
ности А и С, которые бы могли определить направление развития
этих органов, отсутствуют. Двойной мутант ag ар2 также проясняет
тот факт, почему у мутантов ар2 не инициируется большинство при-
мордиев органов второй и третьей мутовок. То, что у двойного му-
танта ag ар2 количество органов цветка почти такое же, как в цветке
дикого типа, указывает на то, что активность AG в мутантах ар2
приводит к неспособности инициации этих органов.
Зная, что при отсутствии всех трех активностей вместо органов
цветка образуются листья, можно объяснить ранее загадочный фе-
нотип мутации ар2-1. Модель развития цветка предполагает, что
ген АР2 играет роль в определении типа органов первой и второй
мутовок цветка, а также в репресии активности гена AG в этих
мутовках. Если предположить, что эти активности можно разде-
лить, то при отсутствии в первой мутовке первой активности и
наличии второй должны формироваться листья, как это и наблю-
дается для мутанта ар2-1.
П.53. МОЛЕКУЛЯРНЫЙ АНАЛИЗ ГЕНОВ,
КОНТРОЛИРУЮЩИХ ТИП ОРГАНОВ ЦВЕТКА
Одним из первых генов этой группы был клонирован ген ара-
бидопсиса функции С AGAMOUS с использованием Т-ДНК ин-
серционного мутагенеза. Доказательство того, что был клонирован
именно ген AG, было получено при трансформации гомозиготного
235
no ag-2 растения конструкцией с клонированным геном. Трансген-
ные растения ag-2, содержащие клонированный ген, имели нор-
мальные цветки. Дополнительное подтверждение было получено
при секвенировании мутантов ag. Продукт гена AG характеризует-
ся наличием домена MADS. Как и другие белки с доменом MADS,
белок Ag способен связываться с определенными нуклеотидными
последовательностями ДНК и, вероятно, является фактором транс-
крипции. В подтверждение генетических данных показано, что
РНК AG специфически накапливается в двух внутренних мутов-
ках органов. Ген AG начинает экспрессироваться в начале стадии
3 развития цветка, когда становятся различимыми примордии ча-
шелистиков. Уже на этой ранней стадии РНК AG специфично ло-
кализована в клетках, из которых сформируются тычинки и кар-
пелы. AG экспрессируется одинаково по всему объему примордиев
тычинок и карпел. Однако на поздних стадиях развития цветка
РНК AG обнаруживается лишь в клетках определенных типов. В
тычинках РНК AG не обнаруживается в пыльцевых зернах и в
спорогенной ткани, из которой возникают пыльцевые зерна. В се-
мяпочках РНК AG локализована преимущественно в эндотелиуме
(слое клеток, который окружает эмбриональную сумку) и не обна-
руживается в эмбриональной сумке и интегументе зрелых семяпо-
чек. В гомозиготе по аллели ар2-2 РНК AG экспрессируется во
всех четырех мутовках органов, в гомозиготе по аллели ар2-1 —
во второй, третьей и четвертой мутовках, что находится в полном
соответствии с фенотипами этих мутантов.
По гомологии с геном AG был изолирован его гомолог из льви-
ного зева — ген PLENA (PLE). Белки Ag и Р1е идентичны на
64 %, характер их экспрессии сходен. Ген PLE оказался интере-
сен тем, что инсерции мобильных элементов в нем могут приво-
дить к двум противоположным фенотипам — рецессивной конвер-
сии половых органов в периант (собственно plena) и доминантной
конверсии перианта в половые органы (фенотип ovulata). В трех
из четырех проанализированных мутантов pie с фенотипом ovula-
ta обнаружили инсерцию мобильного элемента ТатЗ во втором
интроне. Два мутанта — ple-625 (фенотип plena) и ple-627 (быв-
шая мутация ovulata, фенотип ovulata) — содержали инсерции
ТатЗ на расстоянии всего 80 п. о. друг от друга, но ориентация
мобильного элемента была различной. У мутанта с фенотипом
plena совпадали направления транскрипции гена и находящегося
внутри него транспозона, у мутанта с фенотипом ovulata ориента-
ция транспозона была противоположной (рис. 11.38, а). У мутанта
с фенотипом plena не обнаруживается транскрипта PLE. У мутан-
та с фенотипом ovulata транскрипт PLE обнаружен во всех четы-
рех мутовках цветка, а также во всех проанализированных тканях:
листьях, стеблях, корнях (рис. 11.38, б, в). Значит, эктопическая
экспрессия гена PLE у львиного зева приводит к образованию кар-
пел и тычинок в первой и второй мутовках цветка. Однако такой
экспрессии недостаточно для развития полностью нормальных ор-
236
ple-625
a
Мутовки
о
л Соиветие_
р Р 0
б
Рис. П.38. Структура гена PLE у мутантов ple.62S и ple-627
в.~Лоложение и ориентация инсерции ТатЗ у мутантов Ые-67Х /л
pie-627 (фенотип ovulata). Последовательность ТатЗ показана Г!>гНОТИП Plena) и
ны* стрелки, демонстрирующие направление транскрипции ™^.?езаштРихов‘™-
прямоугольниками обозначены экзоны, интроны представлен» ».лП03°на' ^еРпь1ми
ленькая черная стрелка показывает направление транскрипции **»•
распознавания эндонуклеазой рестрикции HindIJL £v —энлош^! - ca«™
EcoRV; б — экспрессия РНК в соцветиях дикого типа и ЩтантахЫА " Р®стРикции
Plena и ovulata; л — листья, дт — РНК из растений дикого тип!» Фенотипом
фенотипом plena, о — из растений с фенотипом ovulata; в~37'„’р ~ “Растений с
ках растений дикого типа и растений с фенотипом ovulata »„ Р сия РНк в «вет-
“ ~ прицветники.
танов: например, в карпелах первой мутовки мугантп» . л.
пом ovulata не развиваются семена. Кроме того если Фен°™-
тивности С приводит в формированию дополнитёлкм^1707^ ак'
Цветке, эктопическая экспрессия активности С не cnm Мутовок в
Уменьшением количества мутовок. Можно понять 1 ровождается
наруживается транскрипт pie в мутантах с *ено’тип^Му .Не об'
транскрипция прерывается в области терминатопа ₽,е: его
транспозона ТатЗ. ра тРаискрипции
237
Ген DEFICIENS (DEF), как и другие гомеозисные гены, во-
влеченные в процесс развития цветка, характеризуется наличием
MADS-бокса. Мутация def-gli представляла собой инсерцию мо-
бильного элемента ТатЗ в третьем интроне, def-chl несла делецию
внутри домена MADS, def-nic была точковой мутацией в промо-
торной области гена. В домене MADS обнаружена последователь-
ность, узнаваемая кальмодулинзависимыми протеин-киназами, т. е.
активность белка Def, вероятно, зависит от его фосфорилирова-
ния. Белок Def характеризовался неожиданно небольшими разме-
рами (для того, чтобы функционировать как фактор транскрип-
ции) и отсутствием структурных черт, необходимых для активации
транскрипции (например, кислого домена). В соответствии с
этими данными предполагали, что DEF функционирует в комплек-
се с другими белками.
И в самом деле, вскоре был клонирован ген GLOBOSA (GLO),
продукт которого взаимодействует с продуктом гена DEF.
Ген арабидопсиса функции В APETALA3 был клонирован с
использованием гомологичного гена львиного зева (DEF) как
пробы. Как и ген AG, продукт гена АРЗ содержит домен MADS и,
по-видимому, является фактором транскрипции. В трансгенных
растениях арабидопсиса клонированный ген полностью компле-
ментировал мутации арЗ.
Второй ген арабидопсиса функции В PISTILATA (PI) тоже был
клонирован по гомологии с геном львиного зева GLO. Как и АРЗ,
PI характеризуется наличием домена MADS.
Характер экспрессии генов DEF и GLO, а также их гомологов
АРЗ и Р1, очень похож. Их РНК начинает обнаруживаться в мо-
мент закладки примордиев чашелистиков в области между этими
примордиями и центром меристемы и накапливается в клетках, из
которых впоследствии образуются примордии лепестков и тычи-
нок. В момент инициации их экспрессии РНК DEF и Р1 обнару-
живаются также в клетках четвертой мутовки. Таким образом, не-
смотря на значительные различия в размерах меристем цветков
львиного зева и арабидопсиса, активация генов функции В у них
происходит на одной и той же стадии развития. Далее экспрессия
генов функции В сохраняется на высоком уровне в период возни-
кновения примордиев лепестков и тычинок и их развития в зрелые
органы. Результаты анализа экспрессии генов DEF и GLO в цвет-
ках дикого типа и мутантов def и gio можно суммировать следую-
щим образом.
1. Индукция экспрессии этих генов происходит независимо,
низкий начальный уровень экспрессии наблюдали как в цветках
дикого типа, так и в цветках гомозигот по нуль-аллелям def-gli и
gio-75.
2. Для высокого уровня транскрипции обоих генов необходимо
наличие небольшого количества белков Def и Gio. Высокий уро-
вень транскрипции обоих генов не наблюдается как для мутантов
def, так и для мутантов gio. Нестабильные мутации def-gli и glo-1
238
при эксцизии мобильных элементов ревертируют к дикому типу,
что приводит к секторному повышению уровня транскрипции
обоих генов DEF и GLO в ревертантном секторе. Мутация def-chl
картируется в промоторной области и сильно понижает уровень
транскрипции гена DEF, но не гена GLO, поскольку белок Def
совершенно нормален.
3. Как белки Def и Gio, так и белки АрЗ и Pi взаимодействуют
друг с другом и способны связываться с ДНК только в форме ге-
теродимера.
4. Промоторы этих генов содержат последовательность ДНК,
узнаваемую доменом MADS, т. е. эти гены способны к авторегуля-
ции экспрессии.
Ген арабидопсиса функции A APETALA1, как уже говорилось
выше, клонирован как новый ген семейства генов с MADS-бок-
сом. Генетические данные, свидетельствующие о том, что ген API
активен во время двух различных стадий развития цветка, отража-
ются в двухфазном характере экспрессии API. На ранних стадиях
развития цветка он экспрессируется одинаково по всему примор-
дию, однако позже РНК API накапливается в примордиях чаше-
листиков и лепестков и не обнаруживается в клетках, из которых
сформируются тычинки и карпелы. Интересно, что ген AG начи-
нает активироваться в примордиях органов двух внутренних муто-
вок сразу же после того, как в них перестает экспрессироваться
API. Кроме того, API эктопически экспрессируется во внутрен-
них мутовках мутантов ag и двойных мутантов ag ар2. Таким об-
разом, ген AG, вероятно, является негативным пространственным
регулятором API в двух внутренних мутовках цветков дикого
типа. Значит, API, который играет роль в активации AG в свою
очередь негативно регулируется этим же геном.
Ген арабидопсиса функции A APETALA2 клонирован с ис-
пользованием Т-ДНК в качестве пробы дня скрининга банка ге-
номной ДНК мутанта, возникшего вследствие инсерции Т-ДНК.
Когда его клонировали, в базах данных не обнаружили значитель-
ной гомологии этого гена с какими-либо генами с известной функ-
цией. Важной особенностью белка Ар2 является наличие двух
повторов из 68 аминокислотных остатков, получивших название
домен АР2. Вероятно, коровая область домена АР2 способна фор-
мировать амфипатическую спираль. В других белках, связываю-
щихся с ДНК, амфипатические спирали часто служат для взаимо-
действия между белками, приводящего к более эффективному свя-
зыванию олигомеров белков с ДНК, или для непосредственного
связывания белка с ДНК. Кроме того, в белке Ар2 вне домена АР2
имеется предположительный сигнал его ядерной локализации,
кислая область и богатая серином область. На основании комплек-
са перечисленных структурных особенностей белка Ар2 предпо-
ложили, что он является регулятором транскрипции. В соответст-
вии с фенотипом мутантов ар2, проявляющих изменения органов
всех четырех мутовок, РНК АР2 накапливается во всех мутовках
239
развивающихся цветков. РНК АР2 обнаруживается также в стеб-
лях, листьях и корнях. Однако у мутантов ар2 не было обнаруже-
но фенотипических изменений в вегетативной фазе развития.
Белок Ар'2 обнаруживается только в цветках и корнях, вероятно,
это свидетельствует о возможности его трансляционной или
посттрансляционной регуляции. Во втором интроне гена AG иден-
тифицирована последовательность, с которой связывается белок
Ар2 (как вы помните, АР2 репрессирует экспрессию AG в чаше-
листиках и лепестках цветков дикого типа). Белок Ар2, обнаружи-
ваемый в цветках и корнях, фосфорилирован, и, вероятно, его
способность связываться с другими белками регулируется путем
фосфорилирования.
Клонированы четыре гена табака, продукты которых содержат
домен, гомологичный домену АР2. Эти белки были названы
EREBPs (ethylene responsive element binding proteins). В экспери-
ментах in vitro было показано, что наличие в них домена АР2 (его
также называют домен EREBP, поскольку он несколько отличает-
ся от домена АР2) необходимо и достаточно для их связывания с
ДНК. Предполагают, что белки EREBPs регулируют экспрессию
генов на уровне транскрипции. Клонировано два гена арабидопси-
са, белки которых также содержат домен АР2. Это AINTEGU-
MENTA — ген, регулирующий развитие цветка и необходимый
для формирования семяпочек, и TINY — ген, подавляющий про-
лиферацию клеток в вегетативном и генеративном развитии при
его сверхэкспрессии в трансгенных растениях.
Предполагают, что АР2 играет роль в вегетативном развитии, и
что его активность в листьях и стеблях может быть генетически
вырождена. Гены арабидопсиса, которые содержат домен АР2,
были названы RAP2.1—RAP2.12 (related to АР2). Они кодируют
белки, разделенные на два класса на основании гомологии с доме-
ном АР2 или доменом EREBP. Гены RAP2 дифференциально эк-
спрессируются в цветках, листьях, стеблях, генеративных стеблях,
корнях. Экспрессия по крайней мере трех генов RAP2 в вегетатив-
ных органах растений регулируется геном АР2. Значит, и в самом
деле, в отличие от других гомеозисных генов развития цветка, АР2
функционирует как в вегетативном, так и в генеративном развитии
растений.
11.5.6. ГЕНЫ С MADS-БОКСОМ
В 1990 г. появились публикации, сообщившие о клонировании
первых гомеозисных генов растений, AG арабидопсиса и DEF
львиного зева. На основе нуклеотидных последовательностей этих
генов были предсказаны аминокислотные последовательности их
продуктов. Оказалось, что N-конец кодируемых ими белков имеет
значительную гомологию с доменом, связывающимся с ДНК чело-
века SRF (от serum response factor), и гена МСМ1 (от minichromo-
240
98
81
92 |------------------------------------------GRM6 (Ceratopteris)
---------1 I GRM7 (Ceratopteris)
। ОРМ1 (Ophioglossum)
37
CRM6
CRM1
AGL12
TM8
TM3
11 GRM2 (Ceratopteris)
П-----------------GRM4 (Ceratopteris)
j*----------------GRM5 (Ceratopteris)
1 GRM1 (Ceratopteris)
---------------------------------AGL12 (Arabidopsis)
|t5AU(Picea) |-------------------
-------------AGL14 (Arabidopsis)
I------------DEFH24 (Antirrhinum)
I _________I----TOBMADS1 (Nicotiana)
“Ц 1 TM3 (Lycoparsicon)
I------------SAMADSA (Sinapsis)
----------1 bAL2 (Piceal
----------Г ZAG2 (Zea)
L ZMM1 (Zea)
[AG (Arabidopsis)
BAG1 (Brassica)
' |—OSMADS3 (Oryza)
I----------ZMM2(Zea)
----ZAGl(Zea)
SLM1 (Silene)
RAP1 (Rumax)
AGL1 (Arabidopsis)
AGL5 (Arabidopsis)
_r PAGL1 (Petunia)
FBP6 (Petunia)
— PLE (Antirrhinum)
— GAG2 (Panax)
j-NAGI (Nicotiana)
1— PMADS3 (Petunia)
-----TAG I (Lycopersicon)
AGL11 (Arabidopsis)
-----FBP7 (Petunia)
—FBP11 (Petunia)
4
100
100
TM8 (Lycoporsicon)
-----------AGL17 (Arabidopsis)
*AGL15 (Arabidopsis)
-------AGL15-2_BN (Brassica)
—AGL15-1_BN (Brassica)
j— BO API (Brassica)
Л-АР1 (Arabidopsis)
I—SAMADSC (Sinapis)
BOBCAL (Brassica)
— BOCAL (Brassica)
—CAL (Arabidopsis)
OSMADS4 (Oryza)
- GRM3 (Ceratopteris)
4-----OSMADS2 (Oryza)__________________________
--------PI (Arabidopsis)
--------SLM2 (Silene)
—PMADS2 (Petunia)
--------GLO (Antirrhinum)
FBP1 (Petunia)
NTGLO (Nicotiana)
---------NMH7 (Medicago)
“LM3 (Silene)
— RADI (Rumex)
RAD2 (Rumex)
PMADS1 (Petunia)
—STDEF (Solanum)
DEF (Antirrhinum)
AP3 (Arabidopsis)
r PD2 (Solanum)
I TMG (Lycopersicon)
-------------CMB2 (Dianthus)
।___I------*— POTM1J (Solanum)
J 1-----------SLM5 (Silene)
E- SAMADSB (Sinapis)
AGL8 (Arabidopsis)
^ЙУ"
- IDALI (Picea) |
_____f-ZAG3(Zea)
*— ZAG3(Zeaj
__I------------AGL6 (Arabidopsis)
1 AGL13 (Arabidopsis)
i-------ZMM8 (Zea)
“I OSMADS1 (Oryza)
----ZMM3 (Zea)
----DEFH49 (Antirrhinum)
-AGL3 (Arabidopsis)
PRNADS1 (Pinus) 1
?BP2 (Petunia)
TM5 (Lycopersicon)
---------ZMM7 (Zea)
ZMM6(Zea)
— OM1 (Aranda)
-CMB1 (Dianthus)
AGL2 (Arabidopsis)
AGL4 (Arabidopsis)
Рис. 11.40. Филогенетическое древо белков с доменом MADS.
В скобках указан род растений, из которых выделены соответствующие гены. Гены
голосеменных растений указаны в рамке, гены папоротников — курсивам. Все ос-
тальные гены выделены из покрытосеменных растений. Подсемейства объединены
скобками в правой части рисунка.
AGL17
AGL15
CRM3
GLO
DEF
SQUA
AGL6
AGL2
N М I К С
Рис. 11.39. Схема строения генов высших растений, содержащих домен
MADS.
В белках растений домен MADS часто следует за первым метионином, но некоторые
белки на N-конце имеют дополнительный домен N. N—N-бокс, кодирующий N-тер-
минальный домен; М — MADS-бокс, кодирующий домен MADS; I — слабо консер-
вативная область / (intervening), разделяющая MADS-бокс и К-бокс; К — К-бокс, ко-
дирующий домен К (Keratin-like), который имеет сходство со спиральной структурой
каратина; С — С-бокс, кодирующий С-терминальный домен.
some maintenance) дрожжей. Ген SRF вовлечен в индуцируемой
сывороткой контроль транскрипции протоонкогена млекопитаю-
щих c-fos, ген МСМ1 участвует в регуляции типа спаривания у
дрожжей Saccharomyces cerevisiae. Гомологичный участок ДНК
назвали MADS-бокс, а соответствующий ему домен белка —
домен MADS (производное от названий этих четырех генов:
МСМ1, AG, DEF, SRF). Гены с MADS-боксом обнаружены и у
организмов других таксономических групп, например, у насеко-
мых и земноводных. Большинство клонированных гомеозисных
генов развития цветка относится к семейству генов с MADS-бок-
сом. Структура белков с доменом MADS свидетельствует о том,
что они являются факторами транскрипции.
Гены растений из семейства MADS вне MADS-бокса не имеют
существенной гомологии с генами МСМ1 и SRF. В белках расте-
ний домен MADS из 56 аминокислот часто следует сразу за метио-
нином, кодируемым инициаторным кодоном. Как и многие другие
факторы транскрипции эукариот, белки с доменом MADS имеют
модульную структуру. Все белки с доменом MADS семенных рас-
тений очень похожи и включают также домен I (от intervening),
домен К (от Keratin-like, его структура напоминает структуру спи-
раль-спирального домена кератина) и С-терминальный домен
(рис. 11.39). Домен MADS является наиболее консервативной об-
ластью таких белков. Его основная функция — соединение с
ДНК, хотя он также играет роль в димеризации и связывании с
другими белками. Домен I следует сразу за доменом MADS. Для
некоторых белков арабидопсиса показано, что этот домен необхо-
дим для селективного связывания определенных MADS-белков с
определенными участками ДНК. Последовательность домена К,
который отсутствует во всех известных к настоящему времени
белках MADS животных и грибов, говорит о том, что он способен
формировать амфипатическую спираль. Предполагают, что такая
амфипатическая спираль взаимодействует с подобной структурой
другого содержащего домен К белка, приводя к их димеризации.
Наиболее вариабельной областью как по длине, так и в нуклеотид-
ной последовательности, является С-домен на С-конце белков
MADS. Функции этого домена пока неизвестны.
9 Генетика
241
Белки SRF и МСМ1 являются факторами транскрипции и свя-
зываются с нуклеотидной последовательностью CC(A/T)6GG, на-
званной CArG-бокс. С такими последовательностями связываются,
в частности, и гетеродимеры, кодируемые генами DEF/GLO, AP3/PI
и гомодимеры, кодируемые генами AG, API. Многие из гомеозис-
ных генов развития цветка экспрессируются более чем в одном
типе органов цветка. Вероятно, морфологические различия между
разными органами цветка могут быть следствием регуляции одним
геном различных групп генов в разных органах, как это описано
для МСМ1. Ген МСМ1 экспрессируется в гаплоидных клетках
дрожжей обоих типов спаривания: МАТа и МАТа. Однако, бла-
годаря взаимодействию гена МСМ1 с другими факторами в
клетках противоположных типов спаривания, этот ген влияет на
экспрессию разных генов. В клетках типа спаривания МАТа его
продукт активирует a-специфичные гены. В клетках типа спа-
ривания МАТа комплекс МСМ1/МАТа1 активирует а-специ-
фичные гены, связываясь с их промоторами, в то время как ком-
плекс МСМ1/МАТа2 связывается с промоторами а-специфичных
генов и репрессирует их.
Кроме перечисленных генов арабидопсиса с MADS-боксом,
при гибридизации ДНК по Саузерну в мягких условиях у араби-
допсиса был выявлен еще ряд генов этого семейства. Клонировано
уже более 40 генов арабидопсиса с MADS-боксом, многие из них
называют AGL (от AGamous Like). Предполагают, что они выпол-
няют разнообразные функции в процессе развития растений. На-
пример, гены AGL2, AGL4, AGL9 начинают экспрессироваться на
стадии 2 развития цветка, их рассматривают как кандидаты на
роль генов-мишеней действия генов идентичности цветковых ме-
ристем или регуляторов генов типа органов цветка. Ген AGL5, экс-
прессия которого зависит от гена AG и инициируется вскоре после
инициации AG, может быть геном-мишенью гена AG. Гены AGL11
и AGL13 экспрессируются в семяпочках и, вероятно, необходимы
для их нормального развития. По-видимому, гены данного семей-
ства участвуют не только в процессе развития цветка. Так, ген
AGL8 экспрессируется в генеративной меристеме, но не в мерис-
темах цветков, AGL15 — во время развития эмбриона и AGL12 — в
корнях. Ген FLF (от FLOWERING LOCUS F) кодирует репрессор
цветения. Вероятно, он является связующим звеном между авто-
номным путем перехода к цветению и путем вернализации, так
как его экспрессия регулируется генами обоих путей.
Хотя исследование функций генов этого семейства еще только
начинается, уже клонировано их множество с MADS-боксом как
двудольных растений, так и однодольных (кукуруза, рис, сорго,
орхидеи) и голосеменных (ель, сосна) растений. На основании го-
мологии между ними они разделены на ряд подсемейств (табл. II.4,
рис. 11.40, см. вкл.). Недавно сообщили также о клонировании
генов с MADS-боксом лептоспорангиевого папоротника Ceratopte-
ris pteroides и гомолога одного из этих генов из эуспорангиевого
242
папоротника Ophioglossum pedunculosum, что позволяет строить
предположения о происхождении и ко-эволюции органов цветка и
генов идентичности меристем/органов цветка. Гены папоротников
в молекулярном эволюционном древе не являются членами ни од-
ного из известных подсемейств генов с MADS-боксом семенных
растений и формируют новые подсемейства. MADS-гены семен-
ных растений, вероятно, эволюционировали путем дупликации
и изменения таких предковых генов. Появление новых органов
семенных растений, например, семяпочек и семян, сопровожда-
лось появлением новых подсемейств MADS-генов.
113.7. КАДАСТРОВЫЕ ГЕНЫ
Мутация по гену арабидопсиса SUPERMAN (SUP) приводит к
формированию дополнительных тычинок, развивающихся внутри
увеличенной четвертой мутовки. Количество дополнительных ты-
чинок может варьировать, при этом в центре мутантных по SUP
цветков обычно формируются карпелоидные структуры. Наиболее
простая интерпретация фенотипа sup, с точки зрения модели
идентичности органов цветка, состоит в том, что SUP препятству-
ет активности генов функции В в четвертой мутовке. Такие гены,
которые пространственно регулируют активность генов типа орга-
нов цветка, называют кадастровыми генами. Вероятно, ген SUP
является исключительно кадастровым геном: он не обладает ак-
тивностью, необходимой для определения типа органов цветка.
Фенотипы двойных мутантов sup арЗ и sup pi, цветки которых не
отличаются от цветков одиночных мутантов арЗ и pi, подтвержда-
ют это предположение. Поскольку ген SUP подавляет активность
генов функции В в четвертой мутовке, в мутантах по генам В уже
не имеет значения, активен он или нет. Данные молекулярного
анализа подтверждают генетические данные, демонстрируя, что
экспрессия АРЗ и Р1 в мутантных по sup цветках распространяет-
ся в четвертую мутовку.
Мутации по гену арабидопсиса LEUNIG усиливают фенотип
мутантов ар2 в двойных мутантах leunig ар2. Одиночные мутанты
leunig тоже имеют фенотип, близкий к фенотипу ар2, но выра-
женный слабее. Органы первой мутовки цветков leunig имеют
признаки тычинок и карпел, во второй мутовке развиваются ста-
миноидные органы. Цветки двойных мутантов leunig ag выглядят
так же, как цветки мутантов ag, т. е. ag эпистатирует над leunig.
Считается, что LEUNIG — негативный регулятор гена AG в пер-
вых двух мутовках цветка. Таким образом, LEUNIG является вто-
рым кадастровым геном арабидопсиса.
Многие гены, играющие роль в определении типа органов цвет-
ка, например, API, АР2, AG, в то же время являются и кадастро-
выми генами. Кроме функций определения типа органов цветка,
многие из них влияют также на детерминированность меристемы.
243
Так, потеря функции С у мутантов AG выражается в недетермини-
рованнном апикальном росте. И наоборот, избыток функции С у
мутантов по активности А в некоторых случаях приводит к умень-
шению количества мутовок в цветке. Мутации по активности В
иногда приводят к образованию цветков только с тремя мутовка-
ми, это позволяет предположить, что детерминированность мерис-
темы у них активируется преждевременно. И наоборот, избыток
активности В у мутантов sup уменьшает детерминированность ме-
ристемы и приводит к формированию дополнительных мутовок.
Другими словами, гены типа органов цветка способны решать, ста-
нет ли группа клеток примордием органа или будет продолжать
развиваться как меристема. Например, группа клеток, которая
стала бы примордиями чашелистиков в цветках дикого типа, в му-
тантных цветках ag продолжает вести себя как меристема и неде-
терминированно формирует примордии новых и новых органов
цветка.
Ген арабидопсиса SUPERMAN был клонирован с использова-
нием метода «прогулки по хромосоме». Как и для других генов
арабидопсиса, доказательства того, что клонированный ген соот-
ветствовал гену SUP, были получены путем комплементации транс-
геном мутаций sup и при секвенировании аллелей дикого типа и
мутантных аллелей sup. Белок Sup содержит домен с цинковыми
пальцами типа Cys2 His2. Цинковые пальцы этого типа имеются в
нескольких известных факторах транскрипции. На С-конце белка
имеется последовательность, богатая серином и пролином. Счита-
ется, что у дрозофилы подобные последовательности активны при
активации или репрессии транскрипции. Рядом с этой последова-
тельностью имеется предположительный сигнал ядерной локализа-
ции белка. В белке Sup также имеется последовательность, спо-
собная формировать спираль-спиральную структуру и состоящая
из двух перекрывающихся зон «лейциновой застежки». Все эти
данные свидетельствуют в пользу того, что белок Sup является
фактором транскрипции.
РНК SUP впервые обнаруживается в области границы между
третьей и четвертой мутовками на стадии 3 развития цветка после
инициации генов функций В и С. На более поздних стадиях РНК
SUP обнаруживается во внутренней части примордиев тычинок,
смежной с примордиями чашелистиков. Затем, на стадии 9, РНК
SUP обнаруживается в развивающихся семяпочках. Ранее на осно-
вании генетических данных полагали, что ген SUP негативно регу-
лирует инициацию экспрессии гена АРЗ в четвертой мутовке. Дан-
ные молекулярного анализа показали несостоятельность этого
предположения. Сейчас считается, что ген SUP функционирует в
сохранении уже установившейся границы между смежными груп-
пами клеток третьей и четвертой мутовок.
244
II3.8. АКТИВАЦИЯ И РЕГУЛЯЦИЯ ГЕНОВ,
КОНТРОЛИРУЮЩИХ ТИП ОРГАНОВ ЦВЕТКА
Из молекулярно-генетических исследований генов, контроли-
рующих тип органов цветка, можно получить информацию о том,
как взаимодействуют эти гены. Однако остается неясным, как они
активируются и как регулируется их экспрессия. По-видимому, ре-
гуляторами генов типа органов цветка являются гены идентично-
сти цветковых меристем и кадастровые гены. Инактивация генов
идентичности цветковых меристем приводит к полной или частич-
ной трансформации цветков в побеги с листьями, что свидетельст-
вует об ослаблении или исчезновении экспрессии генов типа орга-
нов цветка. Активация генов функции В у арабидопсиса и львино-
го зева зависит от экспрессии генов FLO и LFY. Даже если у
мутантов flo и Ify изредка образуются «цветки», они состоят толь-
ко из чашелистиков и карпел. И в самом деле, транскрипты гена
львиного зева DEF функции В обычно не обнаруживаются в му-
тантах flo. Однако, похоже, что активация гена DEF геном FLO
является непрямой, так как уровень экспрессии гена FLO в
третьей мутовке очень низок в тот момент, когда начинает экс-
прессироваться ген DEF.
В меристемах мутантов flo в норме не обнаруживаются и транс-
крипты гена PLE функции С, хотя они присутствуют в изредка обра-
зующихся «карпелоидных цветках». Таким образом, ген FLO, веро-
ятно, участвует в активации гена PLE, но он иногда может активиро-
ваться и без его участия. Как и для гена DEF, активация гена PLE
геном FLO, вероятно, является непрямой, так как в момент, когда
начинает экспрессироваться ген PLE, ген FLO экспрессируется в
центральной части меристемы на очень низком уровне.
У мутантов арабидопсиса Ify экспрессия обоих генов функции
В, АРЗ и Р1, сильно редуцирована, т. е. формально ген LFY можно
рассматривать как позитивный регулятор этих генов. В мутантах
Ify также редуцирована и экспрессия гена AG, хотя роль LFY в
активации этого гена в значительной мере может брать на себя ген
API. Ген AG активен в поздних «цветках» мутантов Ify. У двой-
ных мутантов Ify apl характер экспрессии гена AG полностью на-
рушается. И, хотя начальные этапы активации экспрессии гена AG
не изменены у мутантов apl, у двойного мутанта apl cal активация
гена AG происходит со значительной временной задержкой.
Таким образом, комплексное действие генов идентичности
цветковых меристем приводит к активации генов функций В и С.
При этом не совсем понятно, каким образом одинаково экспрес-
сирующиеся по всему объему цветочного примордия гены LFY и
API приводят к специфичной для отдельных мутовок экспрессии
генов типа органов цветка. Кроме того, гены идентичности цвет-
ковых меристем начинают экспрессироваться значительно раньше,
чем гены типа органов цветка, что может свидетельствовать о не-
прямом действии первых на индукцию последних. Возможно, гены
245
идентичности меристем активируют гены типа органов цветка при
участии таких генов, как FIM львиного зева и его гомолог у ара-
бидопсиса UFO. Ген FIM активируется раньше, чем гены типа ор-
ганов цветка, но после генов идентичности меристем. Как ген
FLO, так и ген SQUA необходимы для нормальной экспрессии
гена FIM. В свою очередь ген FIM играет важную роль в актива-
ции генов типа органов цветка. У мутантов fim редуцирована экс-
прессия как гена DEF класса В, так и гена PLE класса С. В мутан-
тах ufo, как и в мутантах Ify, ген идентичности органов цветка
АРЗ экспрессируется значительно слабее, а конститутивная экс-
прессия АРЗ в трансгенных растениях Ify или ufo уменьшает де-
фекты в развитии лепестков и тычинок.
Другие возможные медиаторы между этими двумя группами
генов — такие гены арабидопсиса, как AGL2 (AGamous Like),
AGL4 и AGL9. Их экспрессия инициируется после активации
генов LFY и API, но раньше активации генов АРЗ, PI и AG.
Однако, по-видимому, гены типа органов цветка могут в свою
очередь регулировать экспрессию генов идентичности цветковых
меристем. Например, предполагают, что ген FLO в третьей мутов-
ке негативно регулируется генами функций В и С. И в самом деле,
у мутантов в функции В и С ген TLO экспрессируется в третьей
мутовке. Считается также, что экспрессия гена API в третьей и
четвертой мутовках подавляется геном AG.
Каким образом регулируется экспрессия генов идентичности
органов цветка? Недавно описан регуляторный ген арабидопсиса
CURLY LEAF (CLF), который необходим для репрессии транс-
крипции гена AG в листьях, стеблях генеративного соцветия и
цветках. Листья мутантов elf закручиваются вверх, по направле-
нию к центральной жилке. Кроме того, чашелистики мутантных
цветков имеют признаки карпел, а лепестки — признаки тычинок.
Такие фенотипы очень близки к фенотипам трансгенных растений
арабидопсиса с эктопической экспрессией гена AG. И в самом
деле, РНК AG экспрессируется в зрелых листьях мутантов clf-2 и
не экспрессируется в листьях растений дикого типа.
В растениях дикого типа РНК AG не обнаруживается в генера-
тивных стеблях, генеративных и цветочных меристемах. РНК AG
в норме начинает экспрессироваться в центре цветковых меристем
на стадиях 3 и 4 развития цветка. Затем, AG активируется в при-
мордиях тычинок и карпел в центре цветка и не работает в при-
мордиях чашелистиков и тычинок. В мутантах clf-2 AG нормально
экспрессируется на ранних стадиях развития цветка, т. е. ген CLF
не нужен для инициации нормального характера экспрессии AG.
Однако на поздних стадиях развития цветка AG эктопически ак-
тивируется в развивающихся лепестках. Кроме того, РНК AG об-
наружена в генеративном стебле и в цветоножках. Как уже гово-
рилось выше, гены АР2 и LUG тоже необходимы для репрессии
гена AG. Однако CLF функционирует на более поздних стадиях
развития цветка, чем АР2 и LUG. Поэтому и фенотип цветков elf
246
выражен слабее, чем цветков ар2 и lug. В мутантах ар2 РНК AG
присутствует во всех мутовках цветочных меристем, начиная со
стадии 3 развития цветка. В мутантах lug характер экспрессии
гена AG очень напоминает таковой мутантов ар2, но уровень экс-
прессии РНК AG в первой и второй мутовках ниже, чем у мутан-
тов ар2.
В цветках мутантов elf-2 на ранних этапах развития цветка ха-
рактер экспрессии РНК AG такой же, как и у дикого типа, и лишь
позднее, начиная со стадии 9, РНК AG обнаруживается в лепестках
и в генеративном стебле. Таким образом, ген CLF, вероятно, не тре-
буется для инициации нормального характера экспрессии гена AG,
а необходим для его поддержания на более поздних этапах развития.
Мутация арабидопсиса clf-2 была получена в экспериментах по
транспозоновому мутагенезу с использованием мобильных элемен-
тов кукурузы Ас и Ds. Инсерция элемента Ds в последовательность
гена CLF позволила клонировать его с использованием метода транс-
позоновой мишени. Аминокислотная последовательность продукта
гена CLF проявляла значительную гомологию с белком, кодируемым
геном дрозофилы ENHANCER OF ZESTE [E(z)]. Ген E(z) является
членом группы регуляторных генов Polycomb, которые, вероятно,
могут влиять на структуру хроматина. Большинство из генов этой
группы кодируют различающиеся по структуре хромосомные белки.
Их функцией является сохранение стабильного характера экспрес-
сии генов-мишеней путем их репрессии. Мутации таких генов у дро-
зофилы приводят к эктопической экспрессии гомеозисных генов-
селекторов, например, кластера генов BITHORAX, на поздних ста-
диях эмбриогенеза.
Ген арабидопсиса CLF и ген дрозофилы E(z) обладают значи-
тельной степенью гомологии и, по-видимому, имеют сходные фун-
кции как негативные регуляторы экспрессии гомеозисных генов.
Тем более неожиданными являются различия между их генами-ми-
шенями. Наиболее хорошо охарактеризованные гены-мишени
генов Polycomb — это гомеозисные гены, контролирующие иден-
тичность сегментов в эмбриональном развитии дрозофилы. Ми-
шенью гена CLF является гомеозисный ген AG, контролирующий
идентичность органов цветка во время генеративного развития
взрослых растений. Более того, гомеозисные гены дрозофилы ко-
дируют белки с гомеодоменом, а белок AG является членом семей-
ства регуляторных белков с доменом MADS. Таким образом, веро-
ятно, системы сохранения характера экспрессии гомеозисных
генов путем их негативной регуляции генами группы Polycomb
эволюционировали независимо у животных и растений. Однако
возможно, что гены дрозофилы с MADS-боксом и гены растений
с гомеобоксом тоже регулируются генами группы Polycomb.
Ген CLF является первым охарактеризованным геном расте-
ний, принадлежащим к группе Polycomb. Обнаружение этого гена
У растений еще раз подтверждает, что генетические системы регу-
ляции развития растений и животных являются весьма консерва-
247
тивными. По-видимому, у растений, как и у животных, имеются и
другие гены — гены группы Polycomb. Некоторые из них могут
негативно регулировать гены-мишени и в эмбриональном разви-
тии. Недавно был охарактеризован ген арабидопсиса FERTILIZA-
TION-INDEPENDENT ENDOSPERM (FIE), который принадлежит
к группе генов Polycomb с мотивом WD и необходим для ингиби-
рования развития эндосперма до момента оплодотворения. Как из-
вестно, в процессе двойного оплодотворения у растений один
сперматозоид сливается с яйцеклеткой, в результате чего форми-
руется эмбрион. Второй сперматозоид сливается с клетками цент-
рального ядра, в результате чего формируется эндосперм. У мутан-
тов fie эндосперм начинает развиваться без оплодотворения как
результат деления клеток центрального ядра.
Сделаны первые шаги и на пути характеристики генов-мише-
ней гомеозисных генов развития цветка. Поскольку гомеозисные
гены кодируют факторы транскрипции, их функцией, по-видимо-
му, является регуляция группы генов, необходимых для образова-
ния определенного органа. До настоящего времени охарактеризо-
ваны лишь очень немногие из генов-мишеней гомеозисных генов
каких-либо организмов. Несколько кандидатов на роль генов-ми-
шеней гомеозисных генов развития цветка были предложены в ос-
новном базируясь на изменении характера их экспрессии у гомео-
зисных мутантов.
Первый ген арабидопсиса, для которого были представлены
веские доказательства его непосредственной регуляции гомеозис-
ным геном — это ген NAP. N-конец предположительного белка
Nap содержал домен NAC, названный так по трем охарактеризо-
ванным первыми генам этого семейства (NAM, ATAF1-2, CUC2).
Поскольку обнаруженный при скрининге ген индуцировался при
активации AP3/PI и имел гомологию с генами семейства NAC, он
был назван NAP (NAC-LIKE, ACTIVATED BY AP3/PI). Как ген
петунии NAM (NO APICAL MERISTEM), так и ген арабидопсиса
CUC2 (CUP-SHAPED COTYLEDONS 2) функционируют в разви-
тии апикальной меристемы побега и в разделении семядолей и
органов цветка. Анализ баз данных свидетельствует о том, что ара-
бидопсис обладает семейством генов с доменом NAC, состоящим
по меньшей мере из 22 генов. Интересно, что подобные нуклео-
тидные последовательности обнаружены только у растений.
Какова же функция гена NAP? Для окончательного ответа на
этот вопрос необходимо получить мутанты пар с полной потерей
его функции. Имеющиеся данные позволяют предположить, что
NAP функционирует в переходе от развития органов путем кле-
точных делений к развитию путем увеличения объема клеток.
Как известно, животные, в отличие от растений, при развитии
используют такие стратегии, как миграция и дифференциальная
адгезия клеток. Растения пошли по другому пути: в их развитии
основными «морфогенетическими инструментами» являются деле-
ния клеток и экспансия, или увеличение объема, клеток. В моло-
248
дых развивающихся органах клетки делятся часто. По мере созре-
вания органов клеточные деления происходят редко или прекра-
щаются совсем, и рост органов происходит за счет увеличения
объема клеток. «На границе» между этими двумя способами разви-
тия органов растений, по-видимому, и работает ген NAP.
Конститутивная экспрессия гена NAP ингибирует экспансию
клеток, влияя на фенотип органов цветка, в особенности лепест-
ков и тычинок, и не влияя на вегетативное развитие растений. В
растениях арабидопсиса дикого типа с трансгеном 35S::NAP боль-
шинство цветков имело короткие лепестки и тычинки. У мутантов
арЗ-З экспрессия трансгена 35S::NAP приводила к укорочению
всех органов цветка, при этом органы второй и третьей мутовки не
приобретали различимых признаков лепестков и тычинок. Таким
образом, конститутивная экспрессия гена NAP приводит к эффек-
там, специфичным для цветка, т. е., по-видимому, имеющиеся в
цветке кофакторы необходимы для стабильности или активности
продукта NAP.
113.9. РАСТЕНИЯ, ТРАНСГЕННЫЕ ПО ГЕНАМ
ТИПА ОРГАНОВ ЦВЕТКА
Генетические исследования выявили множество генов, необхо-
димых для определения типа органов цветка. Однако с использо-
ванием только генетического анализа невозможно выяснить, до-
статочно ли этих генов для приписываемой им активности, или же
они функционируют во взаимодействии с новыми, еще неизвест-
ными, генами. Чтобы определить, достаточно ли активности гена
AG для функции С, были получены трансгенные растения араби-
допсиса, табака, томатов и петунии, в которых гомолог гена AG из
каждого из этих видов конститутивно экспрессировался под силь-
ным промотором p35S вируса мозаики цветной капусты. Результа-
ты таких экспериментов отчетливо показали, что экспрессия гена
AG в цветке достаточна для превращения чашелистиков и лепест-
ков в карпелы и тычинки соответственно.
Гомологи гена AG присутствуют в таксономически отдаленных
видах двудольных, а также в однодольных растениях. Способны ли
гомологи гена AG из одного вида растений успешно функциони-
ровать в других видах? В экспериментах с трансгенными растени-
ями получен ответ и на этот вопрос. Гомолог гена AG из Brassica
napus BAG способен продуцировать ожидаемый фенотип, когда он
экспрессируется в трансгенном табаке. Таким образом, белок Bag
способен распознавать и регулировать промоторы генов-мишеней
в растении, принадлежащем к другому семейству. Более того,
трансгенные растения табака характеризовались двумя новыми фе-
нотипическими чертами, которые было невозможно предсказать,
исходя только из генетических данных. Внутри развивающихся
тычинок не формировались пыльцевые зерна, а в карпелах семя-
249
почки трансформировались в карпелоподобные структуры. В эк-
спериментах по гибридизации РНК in situ было показано, что
РНК AG в норме не обнаруживается в определенных типах кле-
ток. То, что отсутствие экспрессии AG в клетках определенных
типов в пыльниках и семяпочках имеет функциональное значение,
подтверждается аберрантным развитием этих тканей при эктопи-
ческой экспресии в них гена AG.
Мутации по недавно описанному гену арабидопсиса BELLI
(BEL1), или просто BELL, приводят к аналогичному фенотипу —
развитию карпел на месте семяпочек. Ген AG экспрессируется во
всех тканях деформированных семяпочек мутантов bell. Предпо-
лагают, что BELL является репрессором экспрессии AG в семя-
почках. Ген BELL клонирован, он кодирует белок с гомеодоме-
ном. У других организмов белки, содержащие гомеодомен, часто
взаимодействуют с белками с доменом MADS. Например, белок с
доменом MADS дрожжей Saccharomyces cerevisiae МСМ1 взаимо-
действует с гомеобелком МАТа2 в процессе репрессии генов, спе-
цифичных для типа спаривания а. Можно предположить, что
белок Bell тоже взаимодействует с одним или несколькими белка-
ми с доменом MADS, активными при развитии цветков.
При экспрессии гена AG в антисмысловой ориентации удалось
разделить функции гена группы В в определении типа органов
цветка и детерминированности цветковой меристемы. Все транс-
генные растения с антисмысловой конструкцией формировали
аномальные цветки, которые разделили на 3 класса.
1. Фенокопии описанного цыше мутанта ag-1: цветки с неде-
терминированной меристемой и измененными органами.
2. Цветки с недетерминированной меристемой и частично из-
мененными репродуктивными органами.
3. Цветки с нормальными тычинками и карпелами, но с неде-
терминированной цветковой меристемой внутри слившихся кар-
пел четвертой мутовки.
Существование измененных цветков третьего типа показывает,
что нарушение функции гена AG может касаться только детерми-
нированности цветковой меристемы и не затрагивать определение
типа органов. Цветки всех трансформантов, экспрессировавших
антисмысловую РНК гена AG, имели недетерминированную ме-
ристему цветка, и только часть из них, в которых экспрессия РНК
AG подавлялась более эффективно, характеризовалась изменени-
ем типа органов цветка. Таким образом, вероятно, для поддержа-
ния детерминированности цветковой меристемы требуется более
высокий уровень экспрессии AG, чем для спецификации типа ор-
ганов двух внутренних мутовок.
Цветки второго типа имели органы третьей мутовки с призна-
ками чашелистиков и карпел. Большинство органов дополнитель-
ных внутренних мутовок развивалось у них как тычинкообразные
лепестки и чашелистикообразные карпелы. Иногда в дополнитель-
ных внутренних мутовках формировались функциональные ты-
250
чинки и карпелы, дававшие немного семян. Таким образом, в
трансформантах второго типа уровень экспрессии AG может быть
близок к пороговому для спецификации идентичности тычинок и
карпел, но недостаточным для определения детерминированности
меристемы цветка.
Первые четыре мутовки цветков третьего типа трансгенных
растений с антисмысловой последовательностью гена AG похожи
на органы цветка дикого типа. Цветки фертильны, хотя дают лишь
небольшое количество семян. Иногда такие цветки имели гинецей
не из двух, а из трех-четырех слившихся карпел. На срезах можно
было увидеть, что внутри гинецея развивался еще один цветок.
Такой вторичный цветок состоял только из одной-двух дополни-
тельных мутовок тычинок с пыльниками, формирующими пыльцу,
и карпел с морфологически нормальными семяпочками. Внутри
вторичных цветков всегда развивались дополнительные органы
цветков в стенках карпел, часто внутри гинецея формировались
третичные цветки. Такой фенотип авторы назвали Матрешка
(Matryoshka). Внутри третичного гинецея тоже могли формиро-
ваться дополнительные органы. Таким образом, меристема цвет-
ков третьего типа потенциально является столь же недетерминиро-
ванной, как и меристема мутантов ag. По-видимому, ген AG в
цветках Matryoshka экспрессируется в достаточной степени для
спецификации типа органов цветка, но недостаточно для того
чтобы регулировать детерминированность цветковой меристемы.
Трансгенные растения, конститутивно экспрессирующие гены
АРЗ и PI функции В, интересны в плане понимания роли этих
генов в формировании лепестков и тычинок. Цветки растений, в
которых конститутивно экспрессируется ген АРЗ, напоминают
цветки мутантов superman: в них тоже развиваются дополнитель-
ные мутовки тычинок. По-видимому, конститутивно экспрессиру-
ющийся ген АРЗ способен взаимодействовать с геном PI, который
в норме экспрессируется в четвертой мутовке только короткий от-
резок времени. В результате такого взаимодействия в цветке раз-
виваются дополнительные тычинки. Конститутивно экспрессирую-
щийся ген АРЗ позитивно регулирует в четвертой мутовке не толь-
ко экспрессию гена PI, но и химерного репортерного гена с
промотором АРЗ. Однако конститутивная экспрессия АРЗ не из-
меняет нормального развития чашелистиков, вероятно, потому что
ген PI не экспрессируется в первой мутовке.
Однако растения, конститутивно экспрессирующие оба гена
АРЗ и PI, имеют цветки с лепестками вместо чашелистиков, как и
предсказывает модель. Значит, двух этих генов достаточно для
нормальной активности функции В. Конститутивная экспрессия
АРЗ в мутантах lfy подтверждает предположение, что LFY являет-
ся регулятором АРЗ. Трансген АРЗ уменьшает дефекты развития
цветков у мутантов lfy.
Имея в распоряжении мутанты арабидопсиса по генам функций
А, В и С, а также трансгенные растения, конститутивно экспрес-
251
сирующие гены этих функций, можно получать растения с любым
из пяти типов органов в каждой из мутовок. Например, в первой
мутовке могут формироваться чашелистики у растений дикого
типа, лепестки и тычинки у растений с эктопической экспрессией
генов PI и АРЗ функции В, и мутантных по гену ар2 функции А,
листья у двойных мутантов по генам функций А и С. Таким обра-
зом, на основе генетической модели развития цветка можно без-
ошибочно предсказывать, какие органы разовьются в каждой из
мутовок двойных или тройных мутантов по гомеозисным генам
или линий с эктопической экспрессией этих генов. Это является
блестящим экспериментальным подтверждением данной модели.
Итак, генетические и молекулярно-генетические исследова-
ния демонстрируют, что в процессе развития цветка в сложной
сети функционирует множество регуляторных генов. Многие из
них взаимодействуют друг с другом. Взаимодействие может на-
блюдаться на всех уровнях, от транскрипционного уровня до
взаимодействия между белками, и быть как позитивным, так и
негативным. Некоторые гены, такие как TFL1 и API, функцио-
нируют более чем на одной стадии развития цветка, т. е., вероят-
но, один белок способен взаимодействовать с различными фак-
торами на разных стадиях развития, и регулировать различные
гены. Некоторые из генов могут играть роль как в развитии
цветка, так и в вегетативном развитии растений.
Исследования развития цветка подтверждают правильность
предположения о том, что в процессе развития цветка араби-
допсиса и львиного зева функционируют сходные гены. Уже
клонированы и охарактеризованы пары гомологов для боль-
шинства генов развития цветка арабидопсиса и львиного зева,
клонированы и гомологи этих генов из других видов растений.
Таким образом, вероятно, значительная часть регуляторной
сети генов развития цветка является консервативной для всех
растений.
Однако, каким же образом консервативная сеть генов может
приводить к такому огромному разнообразию цветков? Одно из
возможных объяснений заключается в том, что гомологичные гены
у разных растений функционируют не абсолютно идентичным об-
разом. И в самом деле, для каждой пары гомологов львиного зева
и арабидопсиса наблюдаются некоторые различия. Например, у
мутантов львиного зева flo вместо цветков формируются генера-
тивные побеги, т. е. наблюдается полная конверсия цветков в гене-
ративные побеги. В то же время мутанты арабидопсиса Ify форми-
руют структуры, имеющие признаки как цветков, так и генератив-
ных побегов. У мутантов петунии gp лепестки превращаются в
чашелистики, но тычинки остаются практически нормальными, в
то время как гомологичные мутанты арабидопсиса и львиного зева
влияют на тип органов как второй, так и третьей мутовок. Можно
представить себе множество способов, которыми достигаются раз-
личия в действии гомологичных генов. К примеру, они могут вза-
252
имодействовать с разными факторами или по-разному связываться
с несколько различающимися последовательностями ДНК.
Вторая возможность для достижения разнообразия — возникно-
вение нового гена или исчезновение гена с определенной функцией.
Примерами таких изменений Moiyr быть мутанты tfll арабидопсиса
и сеп львиного зева. Если гены TFL1 или CEN не работают (что эк-
вивалентно исчезновению функции), растения формируют терми-
нальный цветок. Возможно, у растений с терминальными цветками
нет функции, эквивалентной функции TFL1/CEN.
Путем инактивации некоторых генов петунии и томатов, содер-
жащих MADS-бокс, были выявлены новые гомеозисные функции,
которые не были обнаружены у арабидопсиса и львиного зева при
химическом и транспозоновом мутагенезе. Ген томатов ТМ5 и его
гомолог у петунии FBP2 экспрессируется в трех внутренних му-
товках, и органы всех трех мутовок имеют дефекты у мутантов
tm5 и fbp2. Фенотипы мутантных цветков томатов и петунии слег-
ка различаются, однако в обоих случаях лепестки превращаются
в чашелистикоподобные или листоподобные органы, а в центре
цветка развиваются дополнительные мутовки органов новых цвет-
ков. Таким образом, гены ТМ5 и FBP2 играют роль в определении
типа органов цветка и детерминированности цветковой мери-
стемы.
Уже известные факты, касающиеся развития цветка, ставят ог-
ромное количество вопросов и предлагают пути для получения отве-
тов на эти вопросы. Каким образом внутренние и внешние сигналы
регулируют возникновение генеративной меристемы и индуцируют
цветение? Клонирование генов EMF, генов позднего цветения и дру-
гих будет началом исследований в этом направлении. Как регулиру-
ются гены цветковой меристемы? Каким образом гены идентично-
сти меристем и другие гены регулируют гомеозисные гены развития
цветка? С какими факторами взаимодействуют эти гены? Какие
гены являются мишенью действия регуляторных генов?
Молекулярно-генетические исследования развития цветка про-
двигаются вперед очень быстрыми темпами (первые гомеозисные
гены растений, функционирующие в развитии цветка, были клони-
рованы в 1990 г.), поэтому можно надеяться, что ответы на многие
из этих вопросов будут получены уже в самые ближайшие годы. И
конечно, это не только расширит наши знания в области биологии
развития, но и обязательно приведет к еще большему количеству
новых, более сложных, вопросов.
ЗАКЛЮЧЕНИЕ
В процессе развития растения происходит переключение путей
развития. Такое переключение может наблюдаться на клеточном
уровне, например, когда две дочерние клетки, возникшие в резуль-
тате неравного деления, дифференцируются по-разному; оно может
253
происходить при дифференцировке органов, например, при пере-
ходе к цветению. Если клетка вступила на определенный путь раз-
вития она, как правило, в норме следует по этому «нормальному»
пути. Так, листовые зачатки не станут почками или стеблями при
условии, что не возникнут повреждения или произойдет мутация,
приводящая к появлению аномалий развития. Однако такие случаи
крайне редки, поэтому можно предположить, что на определенном
этапе растительные клетки детерминированы в отношении их
дальнейшей судьбы. Степень детерминированности, если она и
есть, то не сравнима с таковой у животных или насекомых, напри-
мер, имагинальные диски, предназначенные для образования раз-
личных частей тела у взрослой мухи, закладываются на очень ран-
ней стадии развития, где клетки уже детерминированы и сохраня-
ют это состояние на протяжении многих клеточных поколений. У
растений неэквивалентное деление зиготы способствует установ-
лению полярности в зародыше, а основное разделение тела расте-
ния на корень и побег закладывается уже на самых ранних стадиях
развития, при этом меристемы корня и побега в процессе развития
остаются стабильными структурами. Итак, можно предположить,
что детерминация существует и ориентация клеточного деления
играет критическую роль в определении «судьбы» клетки. Однако
у арабидопсиса получены мутанты, характеризующиеся нарушени-
ем первого клеточного деления, что никак не отражается на раз-
витии зародыша растения и проростка в дальнейшем.
Кроме того, существующие элементы детерминации у растений
обратимы в силу тотипотентности растительных клеток. В экспе-
риментах in vitro показано, что любая клетка (если она не потеря-
ла ядра) способна к дедифференцировке с последующей вторич-
ной дифференцировкой, уже в другом направлении, приводящей к
формированию целого растения. Для определения судьбы клетки у
растений наиболее важным является ее положение по отношению
к соседним клеткам и влияние внешнего градиента факторов
таких, как приток фитогормонов, свет и геотропизм. Ярким при-
мером являются опыты с облучением единичных клеток корня,
когда гибель инициальной клетки, детерминированной для разви-
тия определенной ткани, приводит к позиционному переключению
дифференцировки клеток на соседние.
Таким образом, позиционные сигналы, поступающие от диф-
ференцированных клеток, определяют направление дифференци-
ровки соседних клеток. Еще мало известно о природе сигналов,
которые передаются от клетки к клетке. Вероятно, в первую оче-
редь, речь может идти о диффузных сигналах, типа продукта гена
KN1 или CLV1, которыми клетки могут обмениваться. В целом,
как показали опыты in vitro, для растительных клеток характерна
большая пластичность и направление дифференцировки в значи-
тельной степени зависит от эндогенных и экзогенных факторов.
ЛИТЕРАТУРА
Amasino R. M. Control of flowering time in plants U Current Opinion in Genetics and
Development. 1996. Vol. 6. P. 480-^87.
Coen E., Meyerowitz E. The war of the whorls: genetic interactions controlling flower
development II Nature. 1991. Vol. 353. P. 31—37.
Coupland G. Genetic and environmental control of flowering time in Arabidopsis II
Trends in Genetics. 1995. Vol. 11. P. 393—397.
Goldberg R. B., Genaro de Paiva, Yadegari R. Plant Embryogenesis: Zygote to
Seed II Science. 1994. Vol. 266, N 6. P. 605—614.
Hong M. The unfolding drama of flower development: recent result from genetic and
molecular analyses II Genes and Development. 1994. Vol. 8. P. 745—756.
Kerstetter R. A., Poethig R. S. The Specification of Leaf Identity during Shoot Deve-
lopment // Annu. Rev. Cell Dev. Biol. 1998. Vol. 14. P. 373—398.
Lyndon R. F., Francis D. Plant and organ development II Plant Molecular Biology.
1992. Vol. 19. P. 51—68.
Poethig R. S. Leaf Morphogenesis in Flowering Plants II The Plant Cell. 1997. Vol. 9.
P. 1077—1087.
Running M. P. Plant development: Making asymmetric flowers // Current Biology.
1997. Vol. 7. P. Dispatch R89—R91.
Schiefelbein J. W., Masucci J. D., Wang H. Building a Root: The Control of Patter-
ning and Morphogenesis during Root Development U The Plant Cell. 1997. Vol. 9.
P. 1089—1098.
Taylor С. B. Plant Vegetative Development: From Seed and Embryo to Shoot and
Root // The Plant Cell. 1997. Vol. 9. P. 981—988.
Weigel D., Clark S. E. Sizing up the floral meristem II Plant Physiology. 1996.
Vol. 112. P. 5—10.
Weigel D., Meyerowitz E. M. The ABC of floral homeotic genes II Cell. 1994. Vol. 78.
P. 203—209.
Yanofsky M. F. Floral meristems to floral organs: Genes controlling early events in
Arabidopsis flower development II Annual Rev. of Plant Physiology and Plant Mo-
lecular Biology. 1995. Vol. 46. P. 167—188.
ЧАСТЬ III
СИГНАЛЬНАЯ РЕГУЛЯЦИЯ
РАЗВИТИЯ РАСТЕНИЙ
Упорядоченные изменения, столь характерные для развития,
могут происходить только при наличии регуляторных механизмов,
обеспечивающих координацию роста и дифференцировки расте-
ния. В растении работают регуляторные системы, координирую-
щие рост и развитие отдельных частей, т. е. осуществляющие про-
странственную координацию. Кроме того, существует временная
координация развития, определяющая правильную последователь-
ность событий на всех уровнях организации, например, переход от
вегетативного роста к цветению. Пространственная и временная
координация развития контролируется генетически (см. часть II),
однако для регуляции экспрессии генов необходимы эндогенные и
экзогенные сигналы. К эндогенным сигналам относят фитогормо-
ны, которые осуществляют пространственную координацию разви-
тия. Геотропизм, свет — это экзогенные сигналы, осуществляю-
щие временную координацию развития.
Сигнал {стимул) взаимодействует с рецептором, находящимся
в растении, и вызывает в нем серию процессов, которые приводят
в конечном итоге к наблюдаемой реакции. Последовательность
процессов, получившая название путь передачи сигнала (от англ,
signal transdaction pathway), может быть представлена следующим
образом: сигнал —> восприятие (рецептор) —> передача —> реакция.
Большинство растений характеризуется фототрофным типом пи-
тания, поэтому свет — это самый важный экзогенный сигнал, ко-
торый контролирует развитие растения.
Исходя из сказанного, в данной части будет рассмотрена роль
фитогормонов {эндогенный сигнал) и света {экзогенный) в регуля-
ции развития у растений.
256
Глава Ш.1
БИОСИНТЕЗ И МЕХАНИЗМ ДЕЙСТВИЯ
ГОРМОНОВ
Слово гормон впервые было использовано физиологами живот-
ных для обозначения вещества, которое синтезируется в особых
железах (железах внутренней секреции) и затем переносится
током крови или лимфы в другие части тела, где его крайне низ-
кие концентрации оказывают специфическое физиологическое
действие. Фитогормоны в некотором отношении не соответствуют
классическому представлению о гормонах, выработанному на ос-
нове исследований гормонов животных. Гормон животного пред-
ставляет собой вещество, синтезирующееся в одном специальном
органе, железе, и выделяющееся из нее, чтобы оказать типичное и,
как правило, специфическое влияние на некотором расстоянии от
места синтеза. В случае фитогормонов мы не всегда можем про-
вести такую четкую границу между местом их синтеза и местом их
действия, хотя существует немало экспериментальных данных,
свидетельствующих о том, что и фитогормоны обычно оказывают
свое действие не там, где они синтезируются. Еще одно различие
между гормонами животных и растений заключается в том, что
если большая часть гормонов животных оказывает специфическое
действие, то фитогормоны вызывают широкий спектр ответных
реакций в зависимости от типа органов и тканей, на которые они
действуют. По этой причине фитогормоны часто называют други-
ми терминами, такими, как регуляторы роста или ростовые ве-
щества. Но все же, несмотря на рассмотренные сложности, наи-
более приемлемым нам кажется название фитогормон, так как
оно подразумевает, что эти вещества активны в крайне низких
концентрациях и что во многих случаях они регулируют процессы
в тканях, удаленных от места их синтеза.
В 1937 г. Вент и Тимон опубликовали свою знаменитую книгу
«Фитогормоны». В то время термин фитогормоны ассоциировался
только с ауксином. Вскоре к ауксинам были присоединены гиббе-
реллин или гиббереллиновая кислота (ГК), этилен, цитокинин и
абсцизовая кислота (АБК), которые стали называть классической
пятеркой. В настоящее время достигнут значительный прогресс в
их изучении. Получены мутанты по биосинтезу и сигнальной транс-
дукции, для ряда гормонов выделены рецепторы и уточнены пути
передачи гормонального сигнала, описаны гены, регулируемые
гормонами и многие из них клонированы. В настоящее время опи-
саны новые классы гормонов — брассиностероиды и системин.
Остановимся на характеристике наиболее известных и значи-
мых для растения фитогормонов:
. производные аминокислот — ауксины,
> нуклеотиды — цитокинины,
257
. полиизопрены — гиббереллины, АБК,
. непредельные углеводороды — этилен.
Каждый гормон действует как система, которая включает фер-
менты, кофакторы, ингибиторы и рецепторы.
Ш.1.1. АУКСИНЫ
Ауксин — один из наиболее интенсивно изучаемых фитогор-
монов. Центральное место среди ауксинов занимает индол ил-3-ук-
сусная кислота (ИУК), тогда как прочие ауксины биогенетически
связаны с ИУК и легко в нее превращаются. ИУК в растении может
подвергаться ферментативному расщеплению с помощью фермен-
тативной системы ИУК-оксидаз или переводиться в неактивные свя-
занные формы (коньюгаты), взаимодействуя с глюкозидами, пепти-
дами, некоторыми сахарами. Оба процесса приводят к созданию
градиента свободной ИУК. Для ауксинов характерен полярный
транспорт, осуществляемый специальной транспортной системой,
молекулярный механизм работы которой практически не изучен.
Физиологические функции ауксинов весьма разнообразны. Они
стимулируют рост клеток растяжением, участвуют в регуляции апи-
кального доминирования, фото- и геотропизма, вторичного роста
стебля в толщину, а также других морфогенетических процессов.
Истоки исследований механизма действия ауксина восходят к
трудам Ч. Дарвина и впервые описаны в его книге «О способности
растений к движению». Ч. Дарвин исследовал явление фототро-
пизма — изгибание органов растения в ответ на одностороннее
освещение. Дарвин писал, что имеется фактор, который передает-
ся от верхушки стебля вниз, что и заставляет колиоптиль злака
изгибаться. Впервые этот фактор был выделен в 1926 г. Вентом и
получил название ауксин (от греч. auxcin — расти).
Химически это вещество идентифицировано как ИУК. Вместе
с тем, в растении есть и другие ауксины, например индолы.
Биосинтез. У большинства цветковых растений ИУК синте-
зируется двумя путями из триптофана через индолилпировино-
градную кислоту (ИПиК): триптофан -» индолилпировиноградная
кислота (ИПиК) —» 3-индолилуксусный альдегид (ИУА-д) —> ИУК
(фасоль, капуста, тыква).
Для некоторых видов растений (табак, томаты, ячмень, овес)
показано, что ИУК синтезируется по пути: триптофан -> трипта-
мин —> 3-индолилуксусный альдегид (ИУА-д) -» ИУК.
Еще один путь описан только у крестоцветных: 3-индолацето-
нитрил (ИАН) -> ИУК. Индолацетонитрил может синтезироваться
тремя путями:
1) триптофан -» индолилацетальдоксим -» индол ацетонитрил;
2) деградация глюкобрасицина (glucobrassicina), но только на
определенных стадиях развития;
3) через антранилат, как описано у арабидопсиса и кукурузы.
258
Описанные пути биосинтеза имеют преимущества у вышепере-
численных видов, но при определенных условиях они могут быть
взаимозаменяемы (рис. III. 1). Уточнение путей биосинтеза ИУК
стало возможным только при использовании генетических подхо-
дов, а именно после получения мутантов, затрагивающих разные
этапы синтеза.
До 1990 г. не было выделено мутантов с измененным уровнем
ИУК или ее метаболитов. Действительно, трудно представить себе
растение с блоком в биосинтезе ИУК, так как этот гормон принима-
ет участие во многих процессах, затрагивающих рост и развитие
растения. Первые подобные мутанты были получены при биосинте-
зе триптофана, наличие которых позволило доказать, что синтез
ИУК у растений происходит не только через триптофан. Мутант огр
(orange pericarp) у кукурузы являлся ауксотрофом по триптофану и
характеризовался изменением в биосинтезе триптофана, так как му-
тация затронула структуру Р-синтазы, одного из ферментов биосин-
теза триптофана. Однако уровень свободной ИУК у этого мутанта
был в 50 раз выше, чем у контрольных растений. Мутанты с дефек-
том синтеза триптофана (trpl-1, trp2-l и trp3-l) (от triptofan) полу-
чены и у арабидопсиса. Они характеризовались сверхпродукцией
конъюгатов ИУК и антранилата, а уровень ИУК был практически не
изменен. Мутант trp2-l также аккумулировал индолы. Показано,
что у мутанта trpl-1 блокирован второй этап в биосинтезе трипто-
фана, а соответствующая мутация произошла по гену, кодирующему
синтез антранилат-фосфорибозилтрансферазы. Для растений trp ха-
рактерно снижение роста, изменение морфологии листа и снижение
фертильности. Таким образом, впервые описание триптофановых
мутантов дало возможность показать, что предшественником в био-
синтезе ИУК может быть не только триптофан, но и индолы.
В 1994 г. были выделены гены, контролирующие синтез ИУК
через 3-индолацетонитрил (ИАН), который, как уже было показа-
но, может быть предшественником в биосинтезе ИУК. Вскоре
были клонированы четыре гена NIT1-NIT4, кодирующие нитрила-
зу, которая гидролизует ИАН. ИАН оказывает ауксинподобный
эффект при ее добавлении экзогенно к проросткам арабидопсиса.
Мутанты арабидопсиса по генам NIT1-NIT4 были изолированы по
устойчивости к ИАН. Гены NIT1-NIT4 экспрессируются на раз-
ных стадиях жизненного цикла и могут быть взаимозаменяемы в
случае мутации в одном из них. Таким образом, гены NIT способ-
ны «подстраховывать» друг друга, что объясняет трудность полу-
чения ауксотрофных по ауксину растений.
NIT1-NIT4 — это небольшое семейство генов, три из которых
локализованы на третьей хромосоме арабидопсиса. Показано, что
их экспрессия зависит от факторов внешней среды. Гены имеют
типичную для эукариот экзон-интронную структуру.
Ген NIT1 экспрессируется в течение всего развития растения,
но его продукты не обнаружены в стручках и семенах. NIT2 наи-
более активно экспрессируется в период цветения, в том числе, в
259
Хоризмат —► фенил анилин, торазин
Антранилат
Синтаза
(amt-1, MTR)
Антранилат
Антранилат-
фосфорибозил-
трансфераза
(trpl) ▼
5-фосфорибозилантранилат
ФР-антранилат-
изомераза
1 -(о-карбоксифениламино)-1 -
диоксирибулоза 5-Ф
Конъюгаты
индол-3 бутировой кислоты
Гидролазы ДА
конъюгатов
ИБК v
Синтазы
конъюгатов
ИБК
И н до л-глицерол-
фосфат синтаза
Индол-З-глицерол фосфат
(ИГФ)
Триптофан
синтаза а
(trp3)
Триптофан
синтаза р
(trp2, огр)
Триптофан
соон
Гидролазы
конъюгатов
(ИУК)
Синтазы
конъюгатов
(ИУК)
пировиноградная Конъюгаты
кислота ИУК
Триптофан
А*' аминотрансфераза
(rty?)
Рис. III. 1. Схема биосинтеза ИУК у растений.
Триптофаннезависимый путь (справа). триптофанзависимый путь (слева).
260
стручках и семенах. Промоторная область NIT-генов богата А + Т
последовательностями, которые составляют 71.8 % и несет ТАТА-
и СААТ-боксы.
Один из первых мутантов, затрагивающих процесс коньюгиро-
вания, — ilrl — был изолирован у арабидопсиса по способности
формировать длинные корни на среде с ингибирующей рост кон-
центрацией ИУК-лейцина (от IAA Leucin Resistant). Ген ILR1 ко-
дирует ИУК-аминогидролазу, которая высвобождает ИУК из ИУК-
лейциновых конъюгатов. Он является одним из шести членов се-
мейства генов, продукты которых гидролизуют ИУК-конъюгаты.
Для белков этих генов характерно наличие лидерной гидрофобной
последовательности, на N-конце имеется KDEL (—His—Asp—
Glu—Ьеи)-последовательность, с помощью которой белок заяко-
ривается в эндоплазматическом ретикулуме (ЭР). О месте локали-
зации ИУК-конъюгатов известно пока мало, предполагают, что это
может быть цитозоль. К мутантам с нарушениями метаболизма
ауксинов относится мутант арабидопсиса iar3 (от IAA Alanin Re-
sistant), который выделен по устойчивости к ИУК-аланину. Оба
гена картированы на хромосоме 1.
В 1994 г. у кукурузы был клонирован ген IAG LU, который
контролирует первый этап в образовании конъюгата с ИУК. Ген
кодирует фермент P-D-глюкозилтрансферазу. Гомологичный ген
найден у многих видов растений.
Итак, анализ мутантов, нарушающих метаболизм ауксина,
показал, что в растении существует множество путей, регулиру-
ющих уровень ауксина в растениях. Это несколько путей био-
синтеза ИУК и конъюгация гормона. В процесс поддержания
ауксинового гомеостаза вовлечено множество генов, что указы-
вает на важность этого гормона в развитии растения. Множест-
венность контроля ауксинового гомеостаза объясняет трудность,
а практически и невозможность получения полностью ауксот-
рофных ауксиновых мутантов.
Мутанты. Для изучения генетического контроля метаболизма и
функции ауксинов используют ауксиновые мутанты.
Выделяют 2 типа гормональных мутантов.
1). Мутанты с нарушением синтеза. Такие мутанты называют
гормонзависимыми или гормондефицитными (deficient). Характер-
ной чертой мутантов этой группы является восстановление нор-
мального фенотипа при добавлении гормона, т. е. имеется возмож-
ность получать фенокопии дикого типа. Гормондефицитные, их
еще называют гормонзависимые мутанты, используют для изуче-
ния путей биосинтеза соответствующих гормонов.
2)< Мутанты с нарушением чувствительности к гормону. Среди
них выделяют устойчивые и чувствительные формы: устойчивые ха-
рактеризуются способностью роста на максимальных концентраци-
ях гормона, в то время как чувствительные формы не способны
расти на более низких концентрациях гормона по сравнению с
диким типом, при этом ткани или целые растения погибают.
261
В иностранной литературе чувствительные формы называют
«sensitive» мутанты, а устойчивые — «resistant» мутанты. У мутан-
тов с нарушением чувствительности уровень гормона, как прави-
ло, не нарушен и экзогенное применение гормонов не приводит к
получению фенокопий дикого типа.
Дня поиска и получения мутантов с измененной чувствитель-
ностью к ауксину in vitro используют несколько путей.
Один из них сводится к подбору концентрации гормона, ле-
тальной для растений дикого типа. В дальнейшем избранную кон-
центрацию используют для поиска устойчивых к ауксину форм.
Другой подход связан с поиском чувствительных к ауксину расте-
ний, для которых летальной является более низкая концентрация
гормона, чем для растений дикого типа. В таких экспериментах
чаще всего используют синтетические аналоги ПУК: нафтилуксус-
ную кислоту (НУК) и 2,4-дихлорфеноксиуксусную кислоту (2,4-Д).
Однако активность ИУК ниже, чем НУК и 2,4-Д. Это обусловлено
ее быстрым разрушением с помощью ИУК-оксидазы. В свою оче-
редь активность 2,4-Д по сравнению с НУК выше, что обусловле-
но медленной инактивацией 2,4-Д.
Таким образом, по активности ауксины можно выстроить в
следующий ряд: ИУК < НУК < 2,4-Д.
Для получения устойчивых мутантов обычно используют высо-
кие концентрации 2,4-Д. Отбор можно производить на уровне
протопластов по реакции гиперполяризации мембран. У мутантов
с нарушенной (увеличенной) чувствительностью реакция гиперпо-
ляризации проявляется при увеличении концентрации 2,4-Д в де-
сятки раз по сравнению с протопластами, выделенными из расте-
ний дикого типа. Чаще отбор проводят на уровне тканей (каллус
или суспензионные культуры), а у растений с мелкими семенами
(у арабидопсиса) отбор можно проводить на стадии прорастания и
формирования проростка. При анализе устойчивых к ауксину му-
тантов оказалось, что у многих из них нарушен геотропизм и ре-
акция на воздействие светом, поэтому отбор устойчивых к ауксину
мутантов можно проводить также среди форм с нарушенным гео-
тропизмом и реакцией на свет (рис. III.2).
Самое большое количество ауксиновых мутантов получено у
арабидопсиса, табака и томатов. Наиболее распространенная
схема эксперимента включает следующие этапы:
1) обработка семян мутагеном (этилметилсульфонатом);
2) помещение их на среду с 2,4-Д;
3) отбор растений по способности прорастать на среде с 2,4-Д.
В одном из таких экспериментов из 150000 обработанных семян
арабидопсиса 13 могли расти на среде с 2,4-Д с концентрацией
2 мг/л. Как правило, частота мутации составляет 1 х 10-4. Фенотип
отобранных растений отличается от контроля (табл. III. 1).
Ауксиновые мутанты, как правило, меньше по размеру, с ма-
ленькими сморщенными листьями, укороченным черешком, за-
медленной геотропической реакцией, плохо развитой корневой
262
g
правильное
направление
роста корней
Рис. III.2. Схема отбора «ауксиновых» мутантов по измененной реак-
ции на гравиотропизм (g) и свет (св).
Семена арабидопсиса проращивают на агаровой пластинке. После прорастания
семян пластинку поворачивают. У проростков дикого типа корень изгибается по на-
правлению вниз, а у мутантов ориентация нарушается и корень продолжает расти
практически параллельно поверхности.
системой; с повышенной кустистостью и недоразвитием сосудис-
той системы.
Характеристика «ауксиновых» мутантов. Большая
группа устойчивых к ауксину мутантов арабидопсиса получила
обозначение ахг (от auxin-resistans). Ахг-мутанты различались по
степени устойчивости и отнесены к трем локусам — AXR1, AXR2,
AXR3. Показано, что мутанты с меньшей устойчивостью характери-
зуются меньшим числом морфологических нарушений. Наибольшее
количество мутантов получено по локусу AXR1 (более 20), который
включает пять разных аллелей. Все они имеют одинаковый фено-
тип, наследуемый как рецессивный и моногенный признак. Ген
AXR1 обладает плейотропным эффектом и локализован в первой
хромосоме. Для мутантов axrl характерно недоразвитие сосудистой
системы, дефекты в развитии листьев, цветков, нарушен геотро-
пизм, укорочен гипокотиль и стебель. Взрослые растения мутанта
axrl имели мелкие скрученные листья с укороченным черешком и
слабо ветвящиеся корни с нарушенным геотропизмом. Растения
формировали мелкие цветки с пониженной фертильностью. Эта му-
тация названа «тяжелый карлик». У мутанта не изменено количест-
во ИУК. Кроме того, у мутантных растений изменена реакция на
трансформацию Agrobacterium rhizogenes: у трансгенных растений
вместо волосатых корней формировались волосатые опухоли. Для
263
Таблица III. 1
Ауксиновые мутанты
Мутант Объект Морфологические и физиологические изменения Предполагаемое нарушение
ts-l, Nicotiana Ауксотрофность по ауксинам, Нарушение
ts-2, ts-3 plumbagi- nifolia условное проявление при высокой температуре; ингибирование роста боковых и придаточных корней, ts-l- и ts-2- автостерильность биосинтеза ауксинов
giant Lemna gibba Повышение уровня ауксинов в 100 раз, снижение уровня конъюгатов ауксинов, увеличение размера Нарушение в систе- ме высвобождения ИУК из конъюгатов
surl, Arabidopsis Повышение уровня ИУК и ее surl — нарушение
sur2 thaliana конъюгатов, мелкие поникающие семядоли, сильно удлиненный гипо- котиль, нарушение связи между клетками стелы, коры и эпидерми- са, повышенное количество боко- вых и придаточных корней, снижен- ное число листьев, этиолированные проростки не образуют апикаль- ного крючка, отсутствие соцветий биосинтеза ауксинов; sur2 — нарушение высвобождения аук- синов из конъюгатов
trp2-l, trp3-l A. thaliana Повышенный уровень конъюгатов ИУК, снижение роста, закрученные листья, снижение фертильности Нарушение биосин- теза триптофана
Orp Zea mais Повышение уровня конъюгатов ауксинов То же
ilrl A. thaliana Нечувствительность к ИУК и ИУК- лицину. Ген клонирован. Белок Ilrl участвует в расщеплении конъюга- тов ИУК Нарушение в систе- ме расщепления ауксиновых конъю- гатов
iar3 » » Нечувствительность к ИУК и ИУК- аланину. Ген клонирован. Белок 1агЗ участвует в расщеплении конъюгатов ИУК То же
nitl » » Нечувствительность к индолацето- нитрилу. Ген клонирован. Продук- том гена является нитрилаза Нарушение в системе превращения индола- цетонитрила в ИУК
auxl, aux2, aux3 agri, agr2, agr3 » » Устойчивость к ауксинам и этиле- ну, нарушение геотропизма корней Нарушение транспорта ауксинов
pirl, pir2 » » Устойчивость к ингибиторам транспорта ауксинов То же
hlsl » » Пониженная чувствительность к этилену. Изменен характер экс- прессии ауксининдуцируемых генов То же
264
Таблица Ш.1 (продолжение)
Мутант Объект Морфологические и физиологические изменения Предполагаемое нарушение
tir3 A.thaliana Снижена чувствительность к инги- биторам транспорта ауксинов. Пониженное количество боковых корней, изменено апикальное доминирование, длина корня Нарушение транспорта ауксинов
axrl ахг2 ахгЗ » » Устойчивость к ауксинам, наруше- ние геотропизма корней, замедлен- ная реакция на изменение направ- ления силы тяжести, снижение удлинения гипокотиля у этиолиро- ванных проростков, мелкие цветки, снижение количества пыльцы Повышенная устойчивость к ИУК, НУК, 2,4-Д; нарушение геотропиз- ма корней и побегов, отсутствие корневых волосков. Устойчивость к этилену и АБК Повышенная устойчивость к аукси- нам, карлик, отсутствие апикаль- ного доминирования, нарушение геотропизма корней, большое коли- чество придаточных корней Нарушение в пути передачи сигнала при ответе на ауксины Нарушение рецепции ауксинов, этилена, АБК Нарушение рецепции ауксинов
ахг4 » » Устойчивость к ауксину. Нару- шение геотропизма корней Нарушение в пути передачи сигнала при ответе на ауксин
sari, sar2 » » Супрессия мутации axrl. Понижен- ная длина стебля, изменение морфо- логиии листьев Нарушение в том же пути передачи сигна- ла, где действует бе- лок Axrlпри ответе на ауксин
tirl » » Снижена чувствительность к аук- синам, изменена длина гипокотиля и корня, мало боковых корней. Ген клонирован. Белок Tirl имеет убиквитинсвязывающий домен Нарушение в пути передачи сигнала при ответе на ауксин
nph4 » » Нарушение фото- и геотропизма Нарушение в пути пе- редачи сигнала транс- дукции при ответе на ауксин
mp » » Отсутствие у проростка гипокотиля и первичного корня Нарушение в пути пе- редачи сигнала транс- дукции при ответе на ауксин в раннем эмбриогенезе
bdl » » Отсутствие у проростка первичного корня и иногда — гипокотиля ?
265
Таблица 111.1 (продолжение)
Мутант Объект Морфологические и физиологические изменения П редп слагаемое нарушение
shy2 A. thaliana Снижена длина гипокотиля, мало боковых корней, замедление геотро- пической реакции. Ген клонирован, относится к семейству AUX/IAA ауксининдуцируемых генов Нарушение в пути пе- редачи сигнала при ответе на ауксин
msgl » » Понижена чувствительность к аук- сину. Отсутствие изгиба гипокоти- ля при обработке ауксином, нару- шение фототропизма То же
eirl » » Понижена чувствительность к аук- сину, этилену. Отсутствие экспрес- сии ауксининдуцируемых генов в зоне роста корня Нарушение рецепции ауксинов
agel, age2 » » Повышена чувствительность к ИУК. Нарушен геотропизм корней То же
dwf » » Повышена устойчивость к ауксинам, нарушение геотропизма Нарушение в пути передачи сигнала при ответе на ауксин и рецепция ауксинов
dgt Lycoper- sicon peru via- num Повышена устойчивость к аукси- нам, пониженное количество аук- синсвязывающих белков, снижение длины гипокотиля, снижение индук- ции ауксином продукции этилена, нарушение геотропизма, слабое развитие сосудистой системы То же
agr Hordeum vulgare Повышена устойчивость к ИУК, нарушение геотропизма Нарушение в пути передачи сигнала при ответе на ауксин
жественная устойчивость в ряду 2,4-Д, НУК, ИУК, а также к цито-
кинину.
Ген AXR1 кодирует белок, состоящий из 540 аминокислот, с
молекулярным весом 60 кДа, который подобен N-терминальной
убиквитинактивирующей части энзима El Е. coli (ubiquitin-activa-
ting). Как известно, убиквитины участвуют в АТФ-зависимом про-
теолизе. Убиквитин присоединяется к боковой цепи белков, созда-
вая мультиэнзимный протеолитический комплекс, что способству-
ет быстрому их протеолизу. Такие комплексы характерны для
клеток эукариот, вовлеченных в стрессовый ответ. Роль гена
AXR1 в убиквитиновом пути неизвестна. Маловероятно, что про-
дукт этого гена непосредственно действует как Е1-энзим, так как
белок Axrl составляет только 1/2 размера белка El Е. coli и не
имеет активных цистеиновых остатков. Предполагается, что белок
Axrl может только модифицировать энзимы в убиквитиновом
266
пути. Таким образом, ген AXR1 может кодировать и регулировать
короткоживущие белки, предполагая их роль в быстрой передаче
сигнала при ИУК-воздействии. Гены такого типа широко распро-
странены в растении. Экспрессия гена AXR1 обнаружена во мно-
гих тканях.
Выделены мутации по другим локусам AXR—AXR2, AXR3.
Доминантная мутация Ахг2 приводит к 10-кратной устойчивости к
2,4-Д и 65-кратной к ИУК. По сравнению с мутантом axrl у му-
танта ахг2 корни устойчивы также к.этилену и АБК. Ген AXR2
локализован во 2-й хромосоме. Для мутанта ахг2 характерно сни-
жение роста и изменение геотропизма корней и побегов.
ахгЗ тоже доминантная мутация. Мутантные растения характе-
ризуются карликовым фенотипом с нарушением апикального до-
минирования, формированием большого количества адвентивных
корней. У мутанта ахгЗ также нарушен геотропизм.
При трансформации ахг2 и ахгЗ мутантных растений штамма-
ми дикого типа Agrobacterium rhizogenes выявлен нормальный фе-
нотип — волосатый корень.
Ауксинустойчивый мутант арабидопсиса tirl (от transport inhi-
bitor response), выделенный по чувствительности к ингибиторам
транспорта ауксина, характеризуется нарушением ряда ауксинре-
гулируемых ростовых процессов: снижением роста гипокотиля и
пониженным количеством боковых корней. Продуктом гена TIR1
является белок, содержащий серию лейцинбогатых повторов
(LRR), а также консервативный мотив, названный F-боксом. F-
бокс характерен для многих убиквитинсвязывающих белков, учас-
твующих в регуляции клеточного цикла, например, для белка
дрожжей Grrl и человеческого белка Skp2, с которыми белок Tirl
имеет высокий процент гомологии. Было показано, что белок Tirl
необходим для развития ответа на ауксин и является важным ком-
понентом в регуляции ауксином клеточного цикла. Можно пред-
положить, что реакция на ауксин зависит от модификации ключе-
вого регуляторного белка убиквитином. Двойной мутант tirlaxrl
характеризуется еще более сильным нарушением роста. Эти ре-
зультаты говорят о том, что продукты генов TIR1 и AXR1 могут
функционировать в одном пути ответа на ауксин.
Еще один тип ауксиновых мутантов, которые резко отличаются
от мутантов axrl — это мутации по гену AUX1. У более чем 50
проанализированных мутантов auxl наблюдается лишь ослабле-
ние корневого геотропизма и формирования боковых корней.
Таким образом, мутация затрагивает только корневую систему.
Ген AUX1 (от Auxin) кодирует высокогидрофобный полипеп-
тид с мембранной локализацией. Сравнительный анализ этого
белка выявил высокий уровень гомологии с транспортным белком
пермеазой грибов, предполагая роль белка Auxl в транспорте аук-
сина.
Сильным снижением роста характеризуется ауксинустойчивый
мутант арабидопсиса mp (monopteros), у проростков которого не
267
развивается гипокотиль и первичный корень (этот мутант уже был
описан в части II). При изучении эмбриогенеза мутантов показано,
что продукт гена МР принимает основное участие в определении
направления деления и роста клеток вдоль вертикальной оси и,
таким образом, — в определении базально-апикального рисунка
развития. Фенотипически похож на тр ауксинустойчивый мутант
арабидопсиса bdl (от bodenlos), у проростков которого не образу-
ется первичный корень, а иногда — гипокотиль. Эмбриогенез у
мутанта bdl нарушен уже на стадии первых двух клеток: при деле-
нии апикальной клетки ось деления ориентирована не в верти-
кальной, а в горизонтальной плоскости. Двойной мутант bdl mp
также не имеет гипокотиля и первичного корня. Очевидно, про-
дукты обоих генов участвуют при формировании эмбриорисунка,
контролируемого ауксином.
Недавно был выделен мутант арабидопсиса shy2 (от short hypo-
cotil) с нарушением удлинения гипокотиля, сниженным количест-
вом боковых корней и замедленной гравитропической реакцией
(рис. III.3). Показано, что ген SHY2 кодирует ранее обнаруженный
белок 1ааЗ, который является членом семейства ауксининдуцируе-
мых генов Aux/IAA (см. далее).
В 1995 г. изолирована еще одна интересная мутация у араби-
допсиса — sur (от superroot). Это рецессивная мутация, локализо-
ванная на 2-й хромосоме, описана в семи аллельных вариантах.
Мутантные растения характеризовались небольшими поникшими
семядолями, длинным гипокотилем, нарушением соотношения
между клетками стеллы, увеличенным количеством придаточных и
боковых корней, редуцированным числом листьев и отсутствием
соцветий. Когда мутантные растения выращивали в темноте, у них
отсутствовал «апикальный изгиб» (когда проростки проращивают
в темноте, то у них верхняя часть — нераскрытые семядоли —
наклонены по отношению к гипокотилю под углом 30°), характер-
ный для этиолированных проростков. При обработке проростков
дикого типа экзогенным ауксином получены растения с феноти-
пом мутантов sur.
Рис. Ш.З. Формирование латеральных корней у арабидопсиса.
А — дикий тип, В — shy 2-2, С — shy 2-2, D — shy 2-24.
268
Сходный фенотип имели и растения, трансформированные гена-
ми синтеза ПУК (tmsl и tms2) Agrobacterium tumefaciens. Как пока-
зал хроматографический анализ для мутанта surl характерен увели-
ченный уровень ИУК и конъюгатов, у мутанта sur2 повышенный
уровень ИУК коррелирует с пониженным уровнем ее конъюгатов.
Показано, что у мутантов уровень свободной ИУК уменьшается в
процессе роста, также как у дикого типа, но уровень конъюгатов по-
вышается, что указывает на то, что конъюгирование ИУК является
механизмом регуляции уровня гормона в процессе развития расте-
ний. Ген SUR1 пока не клонирован, но анализ его экспрессии в со-
четании с анализом двойных мутантов surlsur2 показал, что ген
SUR1 регулирует уровень биосинтеза ИУК. Анализ мутаций типа
surl говорит о важной роли ауксина в стимуляции и развитии боко-
вых корней. Вероятно, ИУК индуцирует закладку меристематичес-
ких зачатков, из которых в дальнейшем формируются корни.
У арабидопсиса кроме мутации sur описаны и другие мутанты
(iar3, ilrl), которые характеризуются измененным уровнем ИУК и
ИУК-конъюгатов. Эти мутации относят к гормонодефицитным му-
тантам (см. с. 261). Другой гормонодефицитный мутант rty имеет
значительно измененный фенотип: увеличено число боковых и
придаточных корней, отсутствует «апикальный изгиб» при прора-
щивании в темноте. Кроме того, мутант rty характеризуется пони-
кающими семядолями, листьями и стерильностью. Фенокопию
этой мутации можно получить при добавлении экзогенной ИУК к
растениям арабидопсиса дикого типа. Ген RTY кодирует тирозин-
аминотрансферазу, которая регулирует уровень свободной ИУК.
Тирозин-аминотрансфераза может регулировать уровень ИУК
через синтез, конъюгацию или деградацию.
Среди «ауксиновых» мутантов выделяют отдельный класс с на-
рушением транспорта ауксина. К этому классу относят один из
первых изученных ауксиновых мутантов — мутант auxl, описан-
ный выше. В дальнейшем был выявлен еще один ауксинустойчи-
вый мутант арабидопсиса с нарушенным геотропизмом — аих2.
Показано, что мутации auxl и аих2 аллельны, а растения auxl и
аих2 обладают разным уровнем устойчивости к ауксинам. Позже
были выявлены еще три мутанта арабидопсиса с нарушениями гра-
витропизма корней — agri, agr2 и agr3. Мутант agri характери-
зовался агравитропическим ростом корней и побегов, agr2 — за-
медленной гравитропической реакцией, agr3 — противоположно
направленным гравитропизмом. Мутанты agri и agr2 не отлича-
лись от растений дикого типа по устойчивости к ауксинам, тогда
как мутант agr3 обладал пониженной устойчивостью к 2,4-Д. Все
три мутации оказались аллельны ранее описанной мутации auxl.
Ген AGRI кодирует белок, который является членом семейства
мембранных белков, гомологичных некоторым транспортным бел-
кам из мембран бактерий.
Несколько мутантов с нарушением транспорта ауксинов были
идентифицированы по изменению чувствительности к ингиби-
269
торам транспорта ауксина нафтилфталамовой кислоте (NPA) и
1,2,3-трийодбензойной кислоте (TIBА), воздействие которых на
растения индуцирует у них морфологические изменения. Мутанты
арабидопсиса pirl и pir2 обладают повышенной устойчивостью к
NPA и TIBA.
Еще один мутант из этой группы — мутант арабидопсиса tir3
(от transport inhibitor response) характеризуется резким снижением
количества боковых корней. Кроме того, у растений tir3 отмечено
пониженное апикальное доминирование, снижение длины корня и
уменьшение количества соцветий. Предполагаемая функция про-
дукта гена TIR3 — участие в базальном транспорте ауксинов.
Итак, в настоящее время известно много «ауксиновых» мутан-
тов, которые широко используются для изучения метаболизма,
физиологических функций и механизмов действия ауксинов
(табл. III.1). Ббльшую часть из них составляют мутанты с измене-
ниями в рецепции и транспорте ауксинов. Для большинства изу-
ченных ауксиновых мутантов характерны специфические изме-
нения морфогенеза: нарушено удлинение стебля и корня, апи-
кальное доминирование, образование боковых и придаточных
корней, формирование сосудистой системы, корневых волосков,
изменена морфология листьев, нарушены фото- и геотропизм.
Это свидетельствует о ключевой роли ауксинов в контроле соот-
ветствующих морфогенетических процессов. Благодаря изуче-
нию ауксиновых мутантов, подтверждена роль ауксинов в таких
процессах, как формирование базально-апикального рисунка в
раннем эмбриогенезе, формирование корневых волосков, рост ги-
покотиля, тропизм. Ауксин регулирует удлинение и дифференци-
ровку клеток, клеточное деление. Наличие ауксиновых мутантов
позволило клонировать некоторые «ауксиновые» гены и продви-
нуться в изучении молекулярных механизмов действия ауксинов.
Рецепция и действие на клетку. Поверхность каждой клет-
ки — это мозаика из рецепторов. Рецепторы могут быть углевод-
ной и белковой природы. Они избирательно связываются с опре-
деленными молекулами и передают воспринятый сигнал внутрь
клетки, где уже и принимается решение: что делать?
Работы по выделению и изучению рецепторов гормонов у расте-
ний интенсивно ведутся, начиная с 1970 г. В настоящее время мемб-
ранные белки, связывающиеся с ауксином, обнаружены как у одно-
дольных, так и у двудольных растений. Однако далеко не во всех
случаях доказано, что обнаруженные белки являются рецепторами.
Поиск ауксиновых рецепторов основан на анализе высокоспеци-
фичного связывания ауксинов растительными мембранами.
Открытие «ауксиновых» рецепторов явилось важным этапом в
изучении молекулярных механизмов действия гормона. В настоя-
щее время выделено несколько групп ауксинсвязывающих белков
(табл. III.2).
Наиболее изученным среди ауксинсвязывающих белков явля-
ются белки АВР (от Auxin Binding Protein). Первые работы по
270
Таблица Ш.2
Ауксинсвязывающие белки
Молекулярная масса. кДа Материал Функция
40—42 Плазмалемма цукинии Интегральные белки; входят в ка- честве субъединиц в состав комп- лексов с молекулярной массой 87—300 кДа
31 Растворимая фракция Гомология с ферментом глутати-
25 24 культуры клеток подсол- нечника он-S-трансферазой
60 58 23 Колеоптиль кукурузы Р-глюкозидаза-изоформа АВР1
выделению соответствующих белков были выполнены на кукурузе.
Для этих белков определено 3 места локализации:
мембраны эндоплазматического ретикулума;
тонопласты;
. цитоплазматические мембраны.
Количество белка АВР коррелирует с зонами интенсивного
роста. Показано, что в местах роста растения обнаруживается наи-
большее количество белка. Около 90 % всего количества АВР ло-
кализовано в эндоплазматическом ретикулуме. Белок полностью
отсутствует в ядре, в вакуолях и в пластидах, но найден в аппарате
Гольджи.
У кукурузы идентифицировано 5 генов АВР. Ген АВР1 локали-
зован в 3-й хромосоме, состоит из 5 экзонов и 4 интронов и имеет
длину 794 п. о. Белок АВР имеет массу 22 кДа и способен к диме-
ризации. N-концевая гидрофобная последовательность содержит
38 аминокислотных остатков и может выполнять функцию сиг-
нального пептида для переноса АВР через мембрану эндоплазма-
тического ретикулума (ЭПР). Последовательность имеет сайт гли-
козилирования (—Asp33 —Thr —Thr), который может гликозили-
роваться олигосахаридом. Гексапептидная последовательность в
N-терминальном конце была идентифицирована как сайт связыва-
ния с ИУК (His—Arg—His—Ser—Cys—Glu). На С-конце обнару-
жена KDEL-последовательность (Lys—Asp—Glu—Leu), которая
является сигнальной последовательностью для заякоривания белка
в просвете ЭПР.
Гомолог гена АВР1 был клонирован у других видов, включая
табак, землянику и арабидопсис. У арабидопсиса выявлен один ген
АВР1, тогда как у земляники и кукурузы — это небольшое муль-
тигенное семейство.
Какова функция рецептора ИУК? Известно, что ИУК, липо-
фильная молекула, с одной стороны, может диффундировать в
клетку и действовать внутри клетки. С другой стороны, ИУК
271
может вызывать гиперполяризацию протопластов, действуя на
плазматическую мембрану, что предполагает наличие мембран-ло-
кализованного рецептора. Наличие KDEL-последовательности
указывает на локализацию АВР в ЭПР. Возникает вопрос, почему
АВР находится в ЭПР, а не на плазматической мембране? Дня
объяснения предложена следующая схема: после воздействия ИУК
АВР выходит из ЭПР (ИУК может вызывать секрецию АВР, инду-
цируя «отстригание» KDEL-последовательности) и секретируется
на мембрану. Мембранная форма АВР связывает ауксины с высо-
кой аффинностью и способствует гиперполяризации мембраны за
счет усиления транспорта через нее протонов. Это очень хорошо
объясняется гипотезой «кислого роста», которая была предложена
еще в 1922 г. Согласно гипотезе, ауксин стимулирует Н+-АТФазу
в плазматической мембране, что приводит к выкачиванию прото-
нов через мембрану и закислению клеточной стенки. В результате
усиливается активность кислых гидролаз, которые осуществляют
гидролиз сшивок внутри клеточной стенки. Увеличивается плас-
тичность клеточной стенки, она размягчается и клетка за счет тур-
горного давления растягивается, осуществляется ее рост.
Показано, что АВР, находясь в просвете ЭПР, не связывает аук-
сины, а ЭПР является только местом его накопления. Аналогичные
белки, которые накапливаются в ЭПР и вызывают гиперполяриза-
цию мембраны, обнаружены также у других видов растений. Белок
Nt-ABP табака также имеет мотив KDEL-последовательности и
имеет гомологию с белком АВР кукурузы. Показано, что белок Nt-
ABP кодируется двумя генами. У арабидопсиса обнаружен белок
ER-АВР с высокой гомологией к белку АВР кукурузы. К этой группе
относится также белок Capsicum annuum CaER-ABP.
В настоящее время у разных видов идентифицирована большая
группа ИУК-связывающих белков. У цукинии из цитоплазматичес-
кой мембраны выделены белки с молекулярным весом 40—42 кДа,
которые оказались субъединицами комплекса с молекулярным
весом от 87 до 300 кДа.
Еще один ИУК-связывающий белок с молекулярным весом
60 кДа, выделенный из кукурузы, имеет сходство с Р-глюкозида-
зой, которая расщепляет комплекс гормон + глюкоза. Показано,
что этот белок высоко специфичен к цитокинин-глюкозидам. Осо-
бенно много этого белка в корнях, где синтезируется цитокинин.
Таким образом, ауксин может связываться с цитокинин Р-глюко-
зидазой, репрессируя работу фермента. В результате в клетке на-
капливается свободный цитокинин, что и приводит к изменению
баланса ауксин-цитокинин. Известно, что именно соотношение
ауксин/цитокинин контролирует этапы дифференцировки. Таким
образом, ауксин может регулировать уровень цитокинина.
У подсолнечника в растворимой фракции идентифицированы
ИУК-связывающие белки с молекулярным весом 31, 25 и 24 кДа,
которые характеризуются большим сходством. Два из них, 31 и
24 кДа, были идентифицированы, как Р-1-З-глюконазы.
272
У вигны идентифицирован ИУК-связывающий белок с молеку-
лярной массой 40 кДа, который характеризуется наличием последо-
вательности His-Arg-His-Ser-Cys-Glu в ауксинсвязывающем сайте.
Этот белок был идентифицирован как глютатионзависимая фор-
мальдегид-дегидрогеназа. Этот фермент широко распространен у
растений, животных, грибов и бактерий. Предполагают, что этот
фермент играет критическую роль в детоксикации формальдегида, а
также обладает алкогольдегидрогеназной активностью, которая не-
эффективна с этанолом, как субстратом, но эффективна с длинной
цепью спирта. Показано, что алкогольдегидрогеназа способна также
окислять формальдегид в глютатионзависимой реакции.
Еще один ИУК-связывающий белок, с молекулярным весом
25 кДа, был идентифицирован как глютатион-Б-трансфераза
(GST) и выделен из клеток подсолнечника. У арабидопсиса выде-
лен гомологичный белок с молекулярным весом 24 кДа и иденти-
фицирован он также как GST. У растений функция GST связана с
детоксикацией гербицидов.
1. GST осуществляет конъюгирование глютатиона с ИУК и тем
самым модулирует активность и уровень ИУК.
2. ИУК связывается с GST с помощью вторичного неэнзимати-
ческого сайта и тем самым модулирует активность GST.
3. GST может действовать на уровень ростовых регуляторов,
таких, как жасмоновая кислота (ЖК), модифицируя ее путь био-
синтеза.
4. GST, контролируя клеточный уровень глютатиона, может ре-
гулировать уровень Н2О2 и тем самым влиять на развитие. Так,
показано, что добавление GST в суспензионную культуру моркови
может переключать развитие с соматического эмбриогенеза на
пролиферацию.
Итак, некоторые АВР идентифицированы как белки с фер-
ментативной активностью, предполагая, что связывание ИУК с
ферментами приводит к модификации их активности.
Гены-мишени. Сигнал, переданный с ауксинового рецептора,
способен позитивно или негативно регулировать экспрессию опре-
деленных генов. Такие гены назвали ауксинрегулируемыми или ге-
нами-мишенями. Регуляция может осуществляться как быстро (в
течение нескольких минут), соответствующие гены названы ранни-
ми, так и медленно (спустя час и более после воздействия аукси-
ном), такие гены принято называть поздними (табл. Ш.З).
Гены, позитивно-регулируемые ИУК. SAUR (от Small
Auxin-up RNA) — это семейство небольших генов, впервые иден-
тифицированных у сои. Сейчас эти гены клонированы у вигны,
арабидопсиса и гороха. Экспрессия SAUR-генов увеличивается в
25—60 раз через 25 мин после применения ИУК. Увеличение экс-
прессии SAUR-генов является следствием увеличения уровня их
транскрипции. Это заключение сделано на основании того, что
SAUR-гены также индуцируются после воздействия ингибитора
белкового синтеза — циклогексимида. Это предполагает наличие
10 Генетика
273
Таблица 111.3
Ауксинрегулируемые гены
Ген Материал Время, через которое активируется геи Продукт гена
Позитивно-регули- Гипокотиль сои 30 мин р24
руемые GH2-4
GH3 » » 30 мин Не известен
SAURs » » 2—5 мин » »
AUX22 » » 15 мин » »
AUX28 » » 30 мин » »
PS-IAA4 Гипокотиль гороха 10—15 мин » »
PS-IAA 5
ARG1 ARG2 Гипокотиль манго 1 ч Десатураза жирных кислот
PAR-A PAR-B PAR-C Протопласт мезофилла табака 10—20 мин Ядерный белок (р24) Глютатион-S- трансфераза р24
ARC-A Суспензия культуры клеток табака (BY-2) <1 ч Семейство G- белков с доменом WD40
ACC Цукиния 2ч АСС-синтаза
SARI SAR2 Негативно-регули- Цветоложе клубники То же 12 ч Не известен
руемые
SAR5 2 ч » »
ADR6 Гипокотиль сои 4 ч Белок семени
ADR11 ADR12
белка-репрессора, который может регулировать их экспрессию.
Транскрипция SAUR-генов либо контролируется быстро обрати-
мым репрессором, либо компенсируется короткоживущими рибо-
нуклеазами.
SAUR-гены образуют кластер из 5 гомологичных генов, не со-
держащих интронов, и разделенных интервалом в 1.25 т. п. н.
Каждому гену соответствует мРНК размером 0.5 т. п. н. и пептид
массой 9—10 кДа. В промоторах SAUR-генов обнаружен высоко-
консервативный мотив, который относится к NDE/DUE-элементу,
способному активно связываться с ядерными белками. Кроме того,
З'-район содержит DST-элемент, который участвует в стабилиза-
ции мРНК. Только один из генов SAUR содержит TGA-1 подоб-
ный элемент, который относится к ауксинрегулируемым. Транс-
крипты SAUR-генов локализованы в районах элонгации стебля.
274
Гены семейства GH (от Glycinia hypocotyle) — GH1, GH2,
GH3, GH4 — найдены у сои и арабидопсиса.
Ген GH1 имеет 2 интрона, ему соответствует мРНК размером
2.4 т. п. н., которая кодирует пептид в 593 аминокислоты, что со-
ответствует молекулярному весу 70 кДа. Ген GH1 содержит 6 эк-
зонов. Открытая рамка считывания гена GH2/4 соответствует белку
теплового шока, кодируемого геном Gmhsp26-A (у сои).
Промоторы генов этого семейства содержат три мотива, харак-
терные для многих генов, отвечающих на воздействие ауксина.
Это — TGA или CREB-подобные элементы, находящиеся на рас-
стоянии 450 п. о. от начала (старта) транскрипции и относящиеся
к ауксинрегулируемым элементам AuxRE (от Auxin Responsive
Elements) (рис. III.4). Один из этих мотивов [TGACGTGGCG
(сайт-2) — TGA2 в позиции -234] идентичен инвертированному
Нех-1 элементу в гистоновом промоторе пшеницы. Еще один
Hex-подобный элемент [TGACGTAA (сайт-1) — TGAJ находится
в позиции -86, очень близко к сайту транскрипции. Оба этих эле-
мента хорошо связывают белки. Последний сайт [TGACGC (сайт-
3) — TGAJ находится в позиции -236 и может связывать более
чем один белок. В промоторе гена GH3, кроме трех TGA-элемен-
тов, которые функционируют независимо, имеются еще два
AuxRE — D1 и D4. Оба содержат консервативную последователь-
ность TGTCTC, которая находится в ауксининдуцибельном фраг-
менте. Кроме того, оба элемента содержат конститутивный эле-
мент, который в D1-элементе перекрывается с консервативной
последовательностью, а в П4-элементе находится от него на опре-
деленном расстоянии. В отсутствии ауксина TGTCTC элемент
репрессирован, при добавлении ИУК он дерепрессируется и акти-
вируется (рис.Ш.5), т. е. два элемента в промоторе гена GH3
имеют композиционную структуру, разный уровень регуляции и
могут регулироваться по схеме репрессия—дерепрессия, которая
свойственна многим генам млекопитающих. О наличии белкового
репрессора свидетельствует тот факт, что циклогексимид не по-
давляет, а, наоборот, стимулирует появление мРНК этих генов.
„TGACGcag” „TGACGTGG” „TGACGaa”
TGA3 TGA2 TGAI ATG
gccctcgtgtctcctcaataagctacacaatttgaaacatacacgcaatcctttgtctcaataagttccactca
Рис. Ш.4. Схема строения промотора GH3 гена сои.
Пояснения в тексте.
275
G4T —(^^AAGACTCTCCTCCOTGTCTl
Рис. IIL5. Схема композиционной организации AuxRe (ауксин-индуци-
руемый элемент) в промоторе СНЗ гена сои.
Промотор регулируется по типу «репрессия—дерепрессия», TGTCTC —консерва-
тивный элемент, который может перекрываться (D1) или не перекрываться с консти-
тутивным элементом (D4 и G4T), регулируемым ИУК. В отсутствии ИУК TGTCTC —
репрессирован.
Показано, что ядерные белки связываются с конститутивными
элементами — D1 и D4. Один из сайтов D1 имеет последователь-
ность, подобную G-box-сайту для связывания транскрипционных
факторов типа bZIP. Так как конститутивные элементы в D1 и D4
различаются, то можно предположить, что они связываются с раз-
ными транскрипционными факторами. Таким образом, уровень
экспрессии в определенных клетках может определяться наличием
и концентрацией специфических транскрипционных факторов.
В промоторе гена GH3 найден еще один ауксинотвечающий
элемент в позиции -321, который идентичен промотору гена 5
A. tumefaciens, а также промоторам генов rolB и rolC A. rhizoge-
nes. Промоторы этих генов также ауксининдуцируемые.
К самым раннерегулируемым генам, экспрессия которых наблюда-
ется уже через несколько минут после воздействия ИУК и не требует
дополнительного синтеза белка de novo, относятся гены арабидоп-
сиса AUX22, AUX28 и гены гороха PS-IAA 4, PS-IAA 5, которые в
литературе получили обозначение AUX/IAA (ауксинрегулируемые).
Короткоживущие белки Аих22 и Аих28 имеют высококонсер-
вативные гомологичные участки длиной от 7 до 33 аминокислот-
ных остатков характеризуются периодом полураспада 68 мин и от-
носятся к короткоживущим белкам. Например, индукция синтеза
мРНК этих генов начинается через 5 мин после воздействия ИУК,
а пик экспрессии наблюдается уже через 10 мин. В промоторе
этих генов выявлено 8 сайтов связывания с белками. Структура
этих мотивов представлена на рисунке (рис. III.6). As-1 или Нех-
элементы подобны по структуре ауксинотвечающему элементу и
соответствуют В2 мотиву. G-box (мотив В1) — место связывания
с белком, предположительно с фактором транскрипции. G-box-
элемент найден у многих регулируемых растительных генов таких,
как RBS (контролирует синтез рибулозо-6-дифосфаткарбоксила-
зы), CHS (контролирует синтез халкон-синтазы) и других. В не-
276
-800 -700 -600 -500 -400
I I I I I
нИНг41————
D4 D3 D2 Di C2 Cl
-300 -200 -100 +1
B2 Bl A2 Al
D ------ -- C----------В------A -------
A1 -54AAGGTGATCATAGAGCATATTATAACCFCAGTGAAAACTAATGG
ACTATTCCACTAGTATCT CGTATAAT T CACTTTT GATT ACC
A2 -113 TGCC AC AC A AATC AATTAACTGAATGCTTAG AGAG AG
AATAACGGTGTGTTTAGTT
В1 -270 TCACACATTCCT CCACGTGT CACAAA
GTGTAAGGAGGTGCACAGTGT
B2 -370 CTTGTCGTCA
GAACAGCAGT
Cl -463 TGAAAACAGTGAGTTA
ACTTTTG T CACTCAAT
C2 -552 AATAATAATAATAATAAATA
TTATTATTATT ATTA TTTA T
DI -635 TCTACAGTTACTAGC
AGATGTCAATGATCG
D2 -716 ATTTATATAAAT
TAAATATATTTA
D3 -760 TATTT GCTTAA
ATAAACGAATT
D4 -818 ACC AATTATAATTGTT GTT AA ATCC A AAG ATG AATAGTGCTGT
TGGTTAATATTAACAACAATTTAGGTTTCTACTT ATCACGACA
Рис. III.6. Схема промотрра гена AUX22 сои.
Промотор условно разделен на районы А, В, С, D. Квадратами обозначены сайты вза-
имодействия ДНК-белок, нуклеотидная последовательность которых представлена
ниже; +1 — старт инициации транскрипции; сайт В2 — соответствует As-1 и Нех-
элементам; В1—G-box; Al—ТАТА последовательности. Остальные пояснения в
тексте.
2Т1
скольких копиях эта последовательность представлена в промото-
ре гена 35S вируса мозаики цветной капусты, нопалин- и октопин-
синтазных генах агробактерий, в гене, регулируемом АБК — ЕМ
(от Embryo Maturation). Сайты С-1, С-2, D-2, D-3 — (А—Т-бога-
тые районы) аналогичны последовательностям, найденным в
генах, экспрессирующихся в эмбриогенезе, и генах, отвечающих
на ранение. D-1- и D-4-подобные элементы выявлены и в других
генах, отвечающих на ауксин.
Ауксининдуцируемые гены PS-IAA 4 и PS-IAA 5 изолированы
у гороха. Это члены большого семейства генов, кодирующие ко-
роткоживущие протеины, период жизни которых составляет 6—
8 мин. Все эти белки имеют консервативный Раа-связывающий
домен, найденный у прокариотических транскрипционных факто-
ров. Экспрессия этих генов индуцируется циклогексимидом. Эти
факты предполагают существование короткоживущих репрессо-
ров, которые контролируют экспрессию ИУК-индуцируемых генов
PS-IAA 4 и PS-IAA 5.
В промоторе генов гороха PS-IAA 4 и PS-IAA 5 идентифици-
рован ауксинотвечающий элемент. Делеционный анализ выявил
чувствительный элемент, придающий этому гену ауксинчувстви-
тельность. Этот элемент содержит сайты для связывания с белками,
консервативен и присутствует в других ИУК-регулируемых генах.
Показано, что мутации по ауксинрегулируемым генам приводят к
множественным изменениям фенотипа мутантного растения.
Функция генов семейства AUX/IAA не установлена. Однако в
1997 г. были описаны гены ARF (от Auxin Response Factor), кото-
рые кодируют транскрипционные факторы, способные связывать-
ся с промоторами ауксинрегулируемых генов, в том числе и с про-
моторами семейства генов AUX/IAA.
В белках генов ARF найдено два С-терминальных домена, спо-
собных взаимодействовать с белками, которые кодируются ИУК-
индуцируемыми генами.
Так, мутант по эмбриогенезу — monopteros (mp) — характери-
зуется нарушениями в транспорте ауксина, имеет нарушения в
дифференциации проводящей ткани и нарушения в формировании
апикально-базальной оси симметрии. Ген МР относится к семей-
ству ARF-генов, а именно идентифицирован как ARF5 ген.
. В 1999 г. у арабидопсиса описана новая мутация shy2 (рис. III.7).
Мутанты shy2 формировали короткий гипокотиль, имеющий оди-
наковый размер при развитии в темноте и на свету, имели гофри-
рованные листья и характеризовались ранним цветением. Мутация
shy2 была выделена при скрининге супрессоров для фитохромде-
фицитных мутантов hy2 или phyB (см. далее). Показано, что ген
SHY2 относится к семейству AUX/IAA генов, он идентифициро-
ван как ген IAA3 и играет центральную роль в ауксинрегулируе-
мом росте корней, геотропизме и росте латеральных корней. Опи-
санный ранее мутант по гену AXR3 также относится к семейству
ауксинрегулируемых генов AUX/IAA.
278
Рис. III.7. Фенотипы мутантов shy2.
Проростки росли на среде MSO на свету 7 дней (А—В), на белом свету 25 дней
(Е—-F), в темноте 7 дней (K—Q). А, Е, К—-дикий тип; B,F,L — sby2-2; Л Q — 14-
и 35-дневные трансгенные проростки дикого типа, несущие мутантный ген sby2-2.
Используя культуру мезофилла табака, была изолирована еще
группа ауксинрегулируемых генов: PAR-A, PAR-B, PAR-C. Транс-
крипты этих генов обнаруживаются спустя 10 мин после воздейст-
вия на растение экзогенным синтетическим аналогом ауксина.
Анализ последовательности ДНК выявил наличие гомологии между
генами PAR-A и PAR-C. Продуктом обоих генов является белок
р24. Методами иммунохимии была выявлена ядерная локализация
этого белка. Существует предположение, что р24 может быть во-
влечен в регуляцию транскрипции некоторых генов.
Экспрессия гена PAR-B индуцировалась синтетическим анало-
гом ауксина. Продукт этого гена обнаруживает сходство с фермен-
279
том глутатион-Б-трансферазой. Вероятно, продукт гена PAR-B в
растении может выполнять функции глутатион-Б-трансферазы и
осуществлять детоксикацию ауксина как ксенобиотика.
К числу ранних генов, позитивно-регулируемых ИУК, относится
ген ARC-A, который выделен из суспензии культуральных клеток
табака BY2 (от Bright Yellow). Ген ARC-A начинает экспрессиро-
ваться менее чем через час, после воздействия ауксином на культуру
этих клеток. Продукт гена — белок Агс-А и относится к семейству
(3-субъединиц гетеротримерных G-белков. Экспрессия этого гена
индуцируется только ауксинами, обработка другими гормонами, а
также воздействие стрессом не влияет на его экспрессию. Белковые
субъединицы содержат серии повторов, состоящих из сорока ами-
нокислот (WD40-noBTopbi). Различные белки, содержащие WD40
повторы, осуществляют в клетке передачу сигнала через аденилат-
циклазную систему и участвуют в регуляции сплайсинга РНК, регу-
ляции клеточного цикла, регуляции транскрипции.
Важной особенностью этих белков является их способность
взаимодействовать с семейством специфических TDR-белков и
формировать белковый комплекс, который участвует в регуляции
деления клетки.
Ген GH2/4 индуцируется ИУК через ocs-подобный элемент. Этот
элемент относится к семейству последовательностей as-1, nos-1, ocs,
которые транскрипционно регулируются в некоторых агробактери-
альных генах. Ocs-подобный элемент содержит два четко очерчен-
ных связывающих сайта (ACGT) для растительных bZIP протеинов.
Связывание обоих сайтов требуется для экспрессии этого гена.
Промотор гена GH2/4 первый, для которого показано наличие
функционального ocs-элемента TGATGAAAGAGATTACGTAA.
Ocs-элемент активируется не только ИУК, но и другими расти-
тельными гормонами, а также стресс-индуцирующими агентами.
Предполагается, что ocs-элементы являются маркерами в пути пе-
редачи сигнала при стрессовых воздействиях, который отличается
от ауксинспецифического сигнального каскада. Этот вывод сделан
исходя из того, что в других ИУК-регулируемых генах ocs-подоб-
ные элементы отсутствуют. В пользу этого вывода свидетельствует
анализ ауксиннечувствительного мутанта томатов dgt. У этого му-
танта ингибирована экспрессия генов Aux/IAA, SAUR, но активно
экспрессируется ген GH2/4. Эти результаты говорят о наличии
двух разных путей передачи ауксинового сигнала.
Разные ткани и органы характеризуются разными механизмами
ответа на ауксин. Это означает, что специфические ткани в разных
органах могут иметь один и более разных рецепторов, путей переда-
чи сигналов и ауксининдуцибельных транскрипционных факторов.
Недавно было показано, что при воздействии ИУК индуцирует-
ся экспрессия гена CDC2, контролирующего синтез протеинкина-
зы — ключевого регуляторного компонента клеточного цикла, ко-
торый экспрессируется у растений в меристемах и в районах ак-
тивной клеточной пролиферации. Например, показано, что у
280
Таблица 111.4
Органо- и тканеспецифичная экспрессия генов, регулируемых ауксином
Орган растения GH3 GH3 + ИУК SAUR SAURs + ИУК
Корень в. к. в. > э.,к.,с. — —
Гипокотиль: — В. > Э..К..С. — +/- э.,к.
нижняя зона
Гипокотиль: — В. > Э..К..С. э.,к. Э.,к.
зона растяжения
Гипокотиль: — v(x), э.,к.,с. V(x) V(x)
верхняя зона
Эпикотиль — в. > э.,к.,с. э.,к. э.,к.
Семядоли — в. > т. — —-
Первичная листовая — в. > т. — +/- т.
почка
Цветок: цветоложе в. в. > т. — —-
Семяпочка и. и. — —-
Завязь т. т. — —•
Пестик — т. — —
Пыльник — в. > т. — —-
Лепестки 1 в. > т. в. > т. — —-
в. — васкулярная ткань, v(x) — развивающиеся ксилемные элементы, э. ___
эпидермис, с. — сердцевина, и. — интегумент, к. — кортекс, т. — во всех тканях
+/----низкий уровень,------не обнаружено.
редиса индуцируемая ИУК экспрессия CDC2 приводила к увеличе-
нию числа боковых корней. На горохе в корнях проростков ин-
дукция CDC2 наступает через 10 мин после воздействия ИУК. Эти
строгие корреляции между экспрессией CDC2 и компетентностью
клеток к делению предполагают, что по крайней мере ауксиновый
эффект в клеточном делении может быть результатом изменения
экспрессии генов CDC2, так как наблюдается быстрое после ин-
дукции накопление мРНК CDC2. Предполагается, что это прямой
эффект ИУК, а не вторичный.
В отличие от позитивно-регулируемых, гены, регулируемые не-
гативно, снижают уровень экспрессии после воздействия ауксина.
Гены ADR6, ADR11 и ADR12 относятся к числу поздних генов и
негативно регулируются ауксином.
К генам, экспрессия которых подавляется ауксином, можно от-
нести также:
. ингибитор протеиназы-2 (proteinas inhibitor) (картофель);
. 2 гена земляники (SAR), которые кодируют пролин- и трео-
нинбогатые белки, но их функция неизвестна.
Органо- и тканеспецифическая экспрессия ауксин регулиру-
емых генов. GH3 и SAUR была изучена с помощью трансгенных
растений-промоторин, которых подшивали к гену GUS. При от-
281
сутствии экзогенного ауксина накопление мРНК GH3 и интенсив-
ность транскрипции была ниже, если вообще не отсутствовала, в
большинстве органов сои (табл. III.4). Гибридизация in situ пока-
зала низкий уровень экспрессии GH3 в корнях и проводящей
ткани. Высокий уровень экспрессии обнаружен в развивающихся
флоральных органах, включая лепестки, чашелистики, завязь, се-
мяпочку, в проводящей ткани цветоложа. Добавление ауксина к
молодым проросткам значительно увеличивало количество мРНК
GH3 в различных органах, включая гипокотиль, эпикотиль, семя-
доли. В каждом органе мРНК GH3 было в большем количестве, но
при использовании ауксина лимитировано в проводящей ткани.
В отличие от гена GH3, гены SAUR экспрессируются в зоне
элонгации гипокотилей и эпикотилей. мРНК SAUR-генов было
значительно меньше, но она не отсутствовала вообще в семядолях,
верхней и нижней части гипокотиля и корнях (табл. III.4). Гибри-
дизация in situ показала, что транскрипты SAUR локализованы в
эпидермальных клетках, в клетках кортекса, но в меньшем коли-
честве или вообще отсутствовали в проводящих тканях.
Итак, гены GH3 и SAUR экспрессируются в различных органах
и тканях, и по-разному реагируют на ауксин. Ауксин только повы-
шает уровень экспрессии генов SAUR по сравнению с контролем.
Невысокий уровень экспрессии гена GH3 был отмечен в пророст-
ках сои, исключая корни. Однако после применения ауксина, его
экспрессия отмечена во всех органах.
SAUR-транскрипты присутствовали в большом количестве в
зонах элонгации, т. е. существует корреляция между SAUR-экс-
прессией и ауксининдуцибельной элонгацией. Это позволяет пред-
полагать, что в процессе геотропизма концентрация ауксина или
чувствительность к нему изменена в верхней и нижней частях ги-
покотиля.
Ген GH3 экспрессируется практически во всех органах после
добавления ауксина, это означает, что для его экспрессии нужен
более высокий уровень ауксина, чем для генов SAUR.
Таким образом, гены SAUR и GH3 вовлечены в разные процес-
сы, индуцируемые ауксином, хотя в некоторых случаях, они могут
перекрываться.
Показано, что гены семейства SAUR контролируют геотро-
пизм, при этом их экспрессия определяется уровнем ИУК. Так,
проростки сои, которые росли в вертикальной ориентации, пока-
зали равномерное распределение SAUR-транскриптов в цилиндре
эпидермальных и кортикальных клеток. После реориентации про-
ростков сои в горизонтальное положение через 20 мин транскрип-
ты SAUR быстро перераспределялись. Так, в цилиндре количество
мРНК SAUR уменьшалось почти вполовину. Эти результаты ука-
зывают, что гены SAUR контролируют геотропизм, а эндогенное
изменение концентрации ауксина регулирует их экспрессию.
Итак, ауксины не действуют на одну ткань или орган, а дейст-
вуют, практически, во всех тканях. Экспрессия генов GH3 и
282
SAUR контролируется в процессе развития дискретно в специфи-
ческих тканях, GH3 — в цветках, SAUR — в проростках.
Итак, с момента, прошедшего с открытия действия ауксина на
растение, исследования в этой области прошли через несколько
пиков. Первый был связан с изучением физиологического эффекта
гормона на растения и его применения на практике. Ауксин и его
аналоги широко используют в экспериментах с культивируемыми
клетками in vitro. Манипулируя концентрацией ауксина в сочета-
нии с цитокинином можно индуцировать многие процессы морфо-
генеза in vitro.
Второй пик исследований связан с изучением биосинтеза аук-
сина, успех которого связан с выделением мутантов, затрагиваю-
щих биосинтез ауксина. Стало понятно как регулируется уровень
гормона в клетке и как изменение его количества влияет на рост
и развитие растения.
Третий пик относится целиком к последнему десятилетию и
связан с молекулярно-генетическими аспектами восприятия и пе-
редачи ауксинового сигнала.
III.1.2. ЦИТОКИНИНЫ
Цитокинины были обнаружены более 40 лет назад в ходе ис-
следований регуляции деления растительных клеток. Миллером и
Скугом было показано, что для индукции деления растительные
клетки нуждаются в особой группе веществ, названных авторами
цитокининами. Дальнейшие исследования показали, что и многие
другие процессы, как на клеточном, так и на тканевом и организ-
менном уровнях, контролируются цитокининами.
На организменном уровне цитокинины контролируют ге-
нетическую программу побегообразования. Так, их повышенная
концентрация вызывает снятие апикального доминирования и при-
водит к значительному усилению ветвления побега. Кроме того,
цитокинины стимулируют прорастание семян, повышают устойчи-
вость растения к неблагоприятным воздействиям, тормозят рост
стебля в длину, тормозят рост листовых зачатков и в то же время
замедляют старение листьев. Характерный фенотип растений с по-
вышенным уровнем цитокининов получил название цитокинино-
вый синдром, они характеризуются сильно ветвящимися низкорос-
лыми побегами.
На клеточном уровне цитокинины активируют деление кле-
ток, стимулируя их переход из фазы G2 в фазу митоза, влияют на
их рост растяжением в паренхимных тканях и увеличивают ско-
рость использования в клетках семян запасных веществ.
На субклеточном уровне цитокинины стимулируют репли-
кацию ДНК, синтез всех типов РНК (за счет увеличения активно-
сти РНК-полимераз), стимулируют формирование мембранного
аппарата хлоропластов, их рост и деление; в клетках семядолей
283
стимулируют образование митохондрий и шероховатого ЭПР; уве-
личивают активность ряда ферментов, играют роль в мембранном
транспорте и т.д.
Биосинтез. Цитокинины синтезируются главным образом в
корнях и, в незначительной степени, в других частях растения.
Было обнаружено, что цитокинины представлены целым семейст-
вом близкородственных веществ — производных аденина с раз-
личными замещающими группами у атома № 6. В организме раз-
личные формы цитокининов могут легко переходить друг в друга,
однако растения характеризуются как особым для каждого вида
набором цитокининов, так и местом их локализации. В раститель-
ном организме существуют два варианта сйнтеза цитокининов:
синтез de novo и гидролиз тРНК. Основной путь биосинтеза цито-
кининов — синтез de novo — осуществляется с помощью фермен-
та изопентилтрансферазы из аденозинмонофосфата и изопентенил
пирофосфата (рис. III.8).
Изопентилтрансфераза является главным лимитирующим фак-
тором в биосинтезе цитокининов, поэтому факторы, контролиру-
ющие уровень активности этого фермента, становятся одними из
важнейших регуляторов цитокининзависимых процессов.
Прогресс в области исследования метаболизма цитокинина был
сделан в 1976 г., когда у арабидопсиса был клонирован ген
ATART2, кодирующий аденин-фосфорибозилтрансферазу. Про-
дукт этого гена был высокоспецифичен к цитокининам и играл
основную роль в превращении основных цитокининов в соответст-
вующие нуклеотиды. Это был первый клонированный ген расте-
ний, продукт которого вовлечен в цитокининовый метаболизм. До
этого был известен только бактериальный ген ipt, чей продукт ка-
тализировал первый этап в биосинтезе цитокинина.
Концентрация цитокининов в растительных клетках определя-
ется не только скоростью их синтеза, но и скоростью инактива-
ции. Поэтому факторы, принимающие участие в контроле инакти-
вации цитокининов, также играют значительную роль в регуляции
развития растений. К таким факторам относятся ферменты, участ-
вующие в одном из двух важнейших путей инактивации цитокини-
нов — их деградации (распаде) или соединении с другими низко-
молекулярными веществами.
Деградация цитокининов осуществляется под действием фер-
мента цитокининоксидазы, которая отщепляет специфическую
группу атома № 6 с освобождением аденина. Было показано, что
различные цитокинины обладают различной степенью устойчиво-
сти к воздействию. Так, наиболее легко распадается изопентила-
денин, а также зеатин, в то время кинетин и дегидрозеатин прак-
тически не подвержены воздействию цитокининоксидазы и явля-
ются основными видами цитокининов в клетках с высоким
уровнем цитокининоксидазы (рис. III.9). Другие типы фитогормо-
нов оказывают воздействие на интенсивность деградации цитоки-
нинов: так, ауксины ускоряют ее, а абсцизовая кислота, наоборот,
284
Изопентил-трансфераза
сн3
Изопентанил-
аденин
риботид
Изопентаниладенин
риботид
Транс-зеатин риботид Транс-зеатин риботид
1
Дигидрозеатин
риботид
I
Дигидрозеатин
риботид
Изопентанил
аденин
Рис. III.8. Схема биосинтеза цитокинина.
Пояснения в тексте.
285
HN
н
Кинетин
СН2ОН
СН2ОН
Дигидрозеатин
Рис. Ш.9. Основные виды цитокининов.
подавляет этот процесс. Очевидно, что уровень активности цито-
кининоксидазы играет важную роль во всех цитокининзависимых
процессах развития растений, однако, к настоящему времени этот
путь регуляции изучен очень слабо. Тем не менее получены дан-
ные о том, что скорость деградации цитокининов различна в раз-
личных тканях, а также в одних и тех же тканях растения на раз-
ных этапах онтогенеза.
Вторым вариантом инактивации цитокининов является их со-
единение с другими низкомолекулярными веществами, такими как
сахара или аминокислоты. Особенно часто встречаются цитоки-
нин-глюкозиды, содержащие цитокинин, связанный с остатком
глюкозы. Такие соединения обладают низкой физиологической ак-
тивностью и используются растением в качестве неактивной транс-
портной или запасной формы гормона. Активная форма цитоки-
нина может легко выщепляться из такого соединения с помощью
соответствующих ферментов. Так, в случае цитокинин-глюкозидов
таким ферментом является глюкозидаза.
Таким образом, существует несколько путей регуляции уровня
цитокининов, сводящихся к регуляции скорости синтеза или де-
градации гормона. Для изучения этих процессов используют му-
тантные формы с измененным уровнем цитокининов.
Мутанты. Как и мутации по другим гормонам, цитокининовые
мутации можно разделить на два основных класса. К первому от-
носятся мутанты по уровню гормона. Обычно эти мутанты отно-
сятся к типу потери функции, с помощью обработки экзогенными
цитокининами можно восстановить у них нормальный фенотип.
Такие мутации связаны с нарушениями в генетическом контроле
биосинтеза цитокининов, а также их распада или инактивации.
Однако, как правило, не удается выявить, на каком именно этапе
синтеза или деградации цитокинина произошло нарушение. Ко
второму классу относятся мутанты чувствительности к цитокини-
ну. Эти мутации связаны с нарушениями в процессах рецепции и
передачи воспринятого сигнала.
Мутации с измененным уровнем гормона. К сожа-
лению, было получено очень немного мутантных форм с наруше-
ниями уровня цитокининов. В первую очередь это объясняется не-
286
жизнеспособностью растений с резкими нарушениями цитокини-
нового статуса (табл. Ш.5).
Описан мутант арабидопсиса, названный ampl (от altered me-
ristem program) и характеризующийся нарушениями в филлотакси-
се, измененным количеством семядолей, ослабленным апикальным
доминированием, нарушениями в морфологии цветка, а также за-
медленным старением. Уровень цитокининов у этого мутанта по-
вышен в 4—6 раз. Поскольку данная мутация рецессивна, был сде-
лан вывод о том, что она затрагивает либо один из ферментов,
участвующих в деградации цитокинина, либо какой-то негативный
регулятор его синтеза.
Мутантные формы с увеличением уровня цитокининов более
чем в 100 раз были описаны у мха Physcomitrella pattens. У мхов
повышенная концентрация цитокининов выражается в сверхпро-
дукции гаметофоров, например, у мутантов ove (от overproduc-
tion). Предполагается, что данные мутации затрагивают путь нега-
тивной регуляции синтеза цитокининов.
Для одной из мутаций по уровню цитокининов, ЬшЗ (A. thalia-
па) был определен конкретный молекулярный этап, на котором
произошло нарушение. Как оказалось, мутация затронула фермент
аденинфосфорибозилтрансферазу, осуществляющую превращение
бензиладенина в аденин, который может быть затем использован
для синтеза цитокининов.
Мутанты по чувствительности к цитокинину. Второй класс ци-
токининовых мутантов, также немногочисленный, представлен
группой мутантов по чувствительности к цитокинину. У этих му-
тантов (ckrl, cyrl, stpl и zea3) затронуты различные этапы вос-
приятия или передачи сигнала. Для таких мутантов также очень
трудно определить конкретный этап, на котором произошло нару-
шение.
Типичной мутацией устойчивости к цитокинину можно назвать
доминантную мутацию суг (от cytokinin response) у арабидопсиса.
Мутантные по этому локусу растения in vitro были устойчивы к
цитокининам в низких концентрациях и характеризовались отсут-
ствием ингибирования главного корня и корневых волосков.
Другая мутация чувствительности к цитокинину, обнаруженная
у редиса и названная cyt (от cytokinin), проявляется фенотипичес-
ки в неспособности формировать корнеплодоподобные структуры
при выращивании верхушек побегов in vitro на средах, содержа-
щих цитокинины. В норме на таких средах в ответ на воздействие
экзогенного цитокинина на месте среза побега образуется плотное
образование, напоминающее корнеплод, однако мутантные формы
таких структур образовывать неспособны. Способность формиро-
вать корнеплодоподобную структуру наследуется как доминант-
ный, монотонный признак.
Таким образом, по сравнению с ауксиновыми мутантами, класс
цитокининовых мутантов немногочислен (табл. III.5). Однако с их
помощью показано, что чувствительность растений к цитокинину
287
Таблица II 1.5
Цитокининовые мутанты растений
Тип мутан- тов Вид Локус Фенотип Предполагаемая функция
Мутанты Мох OVE-A, Сверхпродукция Фермент, участ-
уровня (Physcomi- OVE-B, гаметофоров вующий в нега-
гормона trella patens) OVE-C тивной регуля- ции синтеза цитокининов
Арабидоп- сис АМР1 АТАРТ2 Измененное количест- во семядолей, нарушения апикаль- ного доминирования, морфологии цветка, филлотаксиса Нормальный побег, мужская стерильность Фермент дегра- дации цитоки- нина или нега- тивной регуля- ции его синтеза Аденинфосфо- рибозилтранс- фераза
Соя DL-1, DL-2 Аномалии роста, хло- розы, клеверный лист 7
Мутанты Арабидоп- CKR-1 Отсутствие «цитоки- Различные эта-
по чув- ствитель- ности сис CYR-1 DET-1, DET-2 нинового корневого синдрома» Уменьшенные размеры семядолей и листьев, уменьшенное количество листьев, пониженные уровни хлорофилла и анто- циана, стерильность Деэтиолированные в темноте проростки пы передачи си- гнала от рецеп- тора до «пунк- та» запуска физиологичес- кой реакции 7 ?
Редис CYT Неспособность форми- ровать корнеплодопо- добные структуры in vitro 7
Табак HL-1, HL-2 «Привыкшие» к отсут- ствию цитокинина в культуральной среде ткани листа 7
Кукуруза ZEA3 Уменьшенное количест- во листьев, понижен уровень хлорофилла 7
— функция неизвестна.
288
может контролироваться генетически. Нарушения апикального до-
минирования и корнеобразования, происходящие наряду с измене-
нием уровня цитокининов у мутантов, подтверждают участие цито-
кинина в контроле этих процессов.
Рецепция к цитокининам и передача сигнала. У арабидопсиса
была получена мутация по гену СКН, продукт которого, возмож-
но, является рецептором цитокининов. Сверхэкспрессия этого
гена в культуре ткани вызывает цитокининовый синдром (быстрое
деление клеток и образование побегов) в условиях отсутствия
экзогенного цитокинина в среде. Продукт данного гена представ-
ляет собой двукомпонентную гистидиновую киназу, гомологичную
продукту гена ETR1 (см. далее), который является рецептором
этилена (рис. III. 10). Оба белка обладают гистидинкиназным доме-
ном (светлый прямоугольник на схеме) с сайтом фосфорилирова-
ния гистидина, доменом связывания с лигандом (овал) и несколь-
кими трансмембранными доменами (темные прямоугольники).
Таким образом, предполагается, что продукт гена СКП может вы-
полнять рецепторные функции и передавать сигнал внутрь клетки.
В таком случае, мутантный фенотип объясняется способностью
клетки при сверхэкспрессии данного локуса реагировать на более
низкие концентрации цитокинина и вызывать ответную реакцию
(т. е. цитокининовый синдром) даже при нормальном уровне цито-
кининов.
Хотя о большинстве этапов цитокининовой сигнальной транс-
дукции практически ничего неизвестно, установлено, что в эти
процессы вовлечены киназы и фосфатазы. Их участие в передаче
сигнала подтверждается тем фактом, что экспрессия цитокининза-
висимых генов подавляется под действием ингибиторов протеин-
киназ и фосфатаз.
Гены-мишени. Описано более 40 генов, экспрессия которых
контролируется цитокининами как на транскрипционном, так и на
посттранскрипционном уровне (табл. III.6).
Показано, что под действием экзогенного цитокинина интен-
сивность транскрипции цитокининзависимых генов увеличивается
Рис. ШЛО. Схема строения рецепторов цитокининов (CKR1) и этилена
(ETR1).
Пояснения в тексте.
289
в несколько раз. Так, для генов (PALL, CHS, CHI), кодирующих
ферменты, которые участвуют в биосинтезе антоцианина у араби-
допсиса, отмечено цитокининзависимое усиление транскрипции
более чем в 10 раз.
Действие цитокининов отражается и на посттранскрипционном
уровне экспрессии. После выращивания растений арабидопсиса на
среде с цитокининами избирательно повышается стабильность не-
которых мРНК. Так, стабильность мРНК, кодирующей малую
субъединицу рибулозо-1,5-бифосфат карбоксилазы/оксигеназы
(rbcS), а также мРНК хлорофиллсвязывающего полипептида (cab),
неодинакова при различных концентрациях цитокининов. Цито-
кининовая обработка увеличивает стабильность транскриптов rbcS
и cab при помещении растений в темноту, причем скорость транс-
крипции других генов не изменяется.
Кроме позитивной регуляции цитокининами экспрессии генов
на транскрипционном и посттранскрипционном уровне описаны
примеры и отрицательной регуляции. Так, в присутствии цитоки-
нинов и ауксинов более чем в 10 раз снижается количество транс-
криптов гена, кодирующего Р-глюканазу.
Отмечена также клеточная специфичность в экспрессии цито-
кинрегулируемых генов. Транскрипция гена Cde25 усиливается
цитокинином избирательно в отдельных тканях главного корня,
причем образующаяся пространственная специфичность активнос-
ти Cde25 является важным элементом пространственной регуля-
ции деления клеток в течение процессов развития растений.
Цитокинины могут увеличивать скорость клеточного деления,
индуцируя экспрессию гена CycD, который кодирует циклин D-
типа. Известно, что циклин D-типа играет важную роль при пере-
ходе от стадии G1 в клеточном цикле.
Итак, цитокинины являются одним из важнейших классов фи-
тогормонов, регулирующим различные процессы развития расте-
ний на организменном, тканевом и клеточном уровнях (в том
числе индукцию клеточного деления). При избытке цитокининов у
растений проявляется цитокининовый синдром', низкорослость
и подавление апикального доминирования. Описаны основные
пути регуляции уровня цитокининов — изменение скорости
синтеза и изменение скорости инактивации. Нарушения раз-
личных этапов этих путей приводят к получению мутантов по
уровню цитокининов. В пути передачи сигнала в ответ на цито-
кинин участвуют различные протеинкиназы и фосфатазы. Ре-
цептором к цитокининам, возможно, является двухкомпонент-
ная гистидинкиназа. Причиной появления мутантов устойчивос-
ти к цитокининам являются нарушения на различных этапах
передачи или восприятия сигнала. Под действием цитокининов
регулируется экспрессия генов, принимающих участие в контро-
ле разнообразных процессов развития и физиологических про-
цессов. Цитокинины регулируют активность генов как на транс-
крипционном, так и на посттранскрипционном уровнях.
290
Таблица III.6
Список генов, экспрессия которых увеличивается под действием цитокинина
Вид растений, ткань Ген Концент- рация цито- кинина, мМ Время, через которое происходит увеличение экспрессии Другие факторы
Cucurbita pepo L. (этиолированные се- мядоли) RBCL. RBCS 50 В 2—3 раза, 48 ч, посттранскрипцион- ный контроль Свет
Nicotiana tabacum L. (суспензионная культура) CAB, RBCS 0.5 В 10 раз, 9 дней, посттранскрипцион- ный контроль »
Lenina gibba L. (растения) CAB, RBCS 0.5—3 В 4.9 раза, 24 ч, посттранскрипцион- ный контроль »
Cucumis sativus L. (этиолированные се- мядоли) CAB, RBCS 5 В 3 раза, 6 ч, посттранскрипцион- ный контроль »
Nicotiana tabacum L. (ipt трансгенные растения, листья) RBCL Трех- кратное увеличение В 2—4 раза, Н., посттранскрипцион- ный контроль »
Lupinus luteus L. (этиолированные се- мядоли) CAB 22 24 ч, Н., посттранскрипцион- ный контроль Свет, АБК
Triticum aestivum L. (сеянцы) WPK4 10—100 В 10 раз, 1.5—9 ч Свет, питание
Arabidopsis thaliana L. (растения) CAB. CHS 45 В 7 раз, 10 дней, посттранскрипцион- ный контроль Свет
A. thaliana L. (расте- ния) PALI, CHS. CHI. DFR 0.44—22 В 1.4—56 раз, 3 ч, транскрипционный и посттранскрип- ционный контроль »
A. thaliana L. (корни) Cde25 1 В 1.8 раз, 3 дня Ауксин, АБК
Nicotiana tabacum L. (протопласты)
A thaliana L. (суспензионная культура) CycD 1.2 В 4 раза, 4 ч Ауксин, сахароза, нитраты
Sesbania rostrata (корни) SrENOD2 до 10 В 4—5 раз, 4 ч. посттранскрипцион- ный контроль Nod фактор
Medicago sativa L. ENOD12A до 10 2—4 дня, Н. То же
(корни)
Nicotiana tabacum L. (листья) PR1 20 Н., 40 ч Салицило- вая кисло- та, ранение
Chenopodium rub- NADPH-DH 1 Н., 2 ч —
rum L. (суспензион- ная культура)
Н. — не изучено.
291
Ш.13. ГИББЕРЕЛЛИНЫ
Гиббереллины — это группа тетрациклических карбоновых
кислот, относящихся к классу дитерпенов. К 1994 г. из высших
растений и культуры гриба Gibberella fujikuroi было выделено
94 типа гиббереллина, но лишь немногие из них обладают физио-
логической активностью. Гиббереллины, или вещества с гибберел-
линоподобной активностью, найдены у многих представителей
покрытосеменных, голосеменных, а также у ряда папоротников и
грибов (рис. III.И). Гиббереллины синтезируются в молодых расту-
щих тканях растений, где эти вещества присутствуют в свободной
и связанной формах. Конъюгаты гиббереллинов могут быть пред-
ставлены О-ацетатами, O-P-D-глюкопиранозидами, P-D-глико-
зиловыми эфирами, пропиловыми сложными эфирами; кроме
того, данные гормоны могут связываться с белками. По своему
действию гормоны, в том числе и гибберелловая кислота (ГК), по-
ливалентны.
На организменном уровне гиббереллины активируют удли-
нение междоузлий, увеличивают их количество, индуцируют цве-
тение, влияют (усиливают) на пигментацию венчика, активируют
завязывание и развитие плодов, стимулируют прорастание семян
(рис. III. 12, см. вкл.).
На клеточном уровне они активируют растяжение, деление
клеток, стимулируя их переход из фазы G1 в S.
На субклеточном уровне гиббереллины активируют транс-
порт Са2+ через плазматическую мембрану и мембрану ЭПС, пони-
жают pH внутри клетки, влияют на ориентацию микротрубочек,
изменяют метаболизм фосфатидилхолина, стимулируют растяже-
ние клеточной стенки, влияют на экспрессию генов.
Для более подробного изучения метаболизма гиббереллинов
применяются генетические модели, связанные с выделением и изу-
чением гормональных мутантов.
Мутанты и биосинтез. Гиббереллиновые мутанты представля-
ют собой одну из наиболее многочисленных групп гормональных
мутантов, поскольку изменение уровня или чувствительности к ГК
не летально и легко наблюдается. Они описаны у 18 видов расте-
ний. Идентификация и отбор мутации основаны на изменении
таких признаков, как длина междоузлий, проявление пола, покой
семян и др.
Гиббереллиновые мутанты высших растений являются мощным
инструментом для изучения метаболизма и функций фитогормона.
Мутанты по уровню (синтезу) гормона. Мутанты с
нарушенным синтезом гиббереллинов используются для выясне-
ния того, какие процессы развития регулируются эндогенными
гиббереллинами и какие из множества гиббереллинов обладают
биологической активностью. Эти мутанты также служат основой
для большинства широко используемых биотестов на активность
гиббереллинподобных веществ. Кроме того, данную группу мутан-
292
н2с СН3СООН
НО СН2СН2ОН
Мевалоновая кислота Изопентенил-
пирофосфат
PKj (активный)
I
ГК8 (неактивный)
ГК 19 (неактивный)
Рис. III. 11. Основные этапы биосинтеза гиббереллинов.
Пояснения в тексте.
293
тов можно использовать для уточнения мест синтеза и функциони-
рования гиббереллинов (рис. III. 11). Использование предшествен-
ников в биосинтезе позволяет выявить, какая из энзиматических
активностей изменена в мутанте. Все мутанты, как правило, имеют
карликовый (dwarf) фенотип и с помощью ГК можно получить
фенокопии дикого типа.
Мутанты синтеза ГК описаны у многих растений. К ним отно-
сятся мутанты кукурузы — dl—d5, ап; арабидопсиса — gal—ga5;
гороха — le (le*), na, Is; риса — dx, d?; томатов — Ve-182, Ve-270,
Ve-335, gibl—gib3. Однако биохимические дефекты изучены не у
всех из них (табл. III.7).
Использование предшественников в биосинтезе ГК в биотестах
по восстановлению фенотипа «dwarf» показало, что ГК, является
самой активной формой.
Мутанты dwarf 1, 2, 3, 5 (кукуруза) использованы для характе-
ристики путей биосинтеза ГК, а именно, детерминации определен-
ных этапов в этой цепи биосинтеза.
Например, у кукурузного мутанта dl нарушена гидролизация на
этапе ГК20—ГК,, а ген D1 контролирует синтез ЗР-гидроксилазы.
У d5 мутанта блокирован ранний этап биосинтеза ГК. Показано,
что дефект связан с конверсией пирофосфата к энт-каурену, кото-
рый катализируется энт-кауренсинтазой.
Ген D3 расположен на 3-й хромосоме и контролирует этап пе-
рехода альдегида ГК12 к ГК53. Продукт гена D3 имеет гидролазную
активность и представляет собой микросомальную монооксигена-
зу. Белок гена D3 имеет Fe-связывающий цитозиновый домен, ко-
торый характерен для всех цитохром-Р450 белков. С-терминаль-
ный домен, состоящий из 175 аминокислот, имеет до 20 % гомо-
логии с описанными цитохром-Р450 белками. В пользу того, что
белок гена D3 относится к цитохром-Р450 белкам, указывает его
зависимость от НАДФН, являющегося составной частью цито-
хром-Р450-зависимых энзимов.
У арабидопсиса также получена серия мутантов с измененным
уровнем ГК. Мутация ga4 приводит к фенотипу «полукарлик». У
мутанта можно восстановить фенотип при применении ГК. Про-
дукт гена GA4 блокирует конверсию предшественника к 30-гид-
роксилазе, уменьшая уровень ГК,, ГК8 и ГК,, и повышая уровень
ГК19, ГК20 и ГК,. Редуцированный уровень 30-гидроксилазы при-
водит к фенотипу «полукарлик».
Продукт гена GA4 сходен по аминокислотной последователь-
ности с флавон-3-гидролазой и с 1-аминоциклопропан-1-карбо-
ксилат-оксидазой, каждый из которых одинаков у разных видов
растений. На основе сходства последовательностей предполагает-
ся, что ген GA4 кодирует гидролазу, вовлеченную в биосинтез ГК.
Основными у арабидопсиса являются ГК, и ГК4, которые эф-
фективны в процессе элонгации стебля. Синтез ГК3 в арабидоп-
сисе не происходит, однако экзогенное применение ГК3 приво-
дит к элонгации стебля. ГК3 присутствует в низких концентраци-
294
ях в вегетативных тканях у кукурузы, где он синтезируется из
ГКэд через ГК^.
В мутантах ga5 арабидопсиса редуцирована продукция С19 гиб-
береллинов, что указывает на роль соответствующего белка гена
GA5 в окислении метильной группы при С-20. Ген GA5 кодирует
гиббереллин-20-оксидазу.
Мутанты gal имеют низкий уровень активности энт-каурен-
синтазы и восстанавливают нормальный фенотип при экзогенном
использовании энт-каурена. Продукт гена GA1 обладает значи-
тельным сходством с растительными терпен-циклазами. Показа-
но, что ген GAj кодирует фермент энт-кауренсинтазу А, который
катализирует циклизацию геранилпирофосфата к пирофосфату.
Ген GA1 имеет высокий процент сходства с геном ANTHER
EARI (AN1) кукурузы. Оба белковых продукта имеют аспартат-
богатый мотив DxDDTA. Этот мотив также присутствует в неко-
торых бактериальных терпен-циклазах, что предполагает его не-
обходимость для каталитической активности соответствующих
ферментов. Наконец, в обоих белках имеется N-терминальная
последовательность, которая характерна для белков хлороплас-
тов. Показано, что эти белки действительно транспортируются в
хлоропласты, а энт-кауренсинтаза обнаруживается в хлоропласт-
ных фракциях.
Таким образом, на основе изучения мутантов описан путь био-
синтеза ГК у разных видов, который можно разделить на 3 фазы.
1. Мевалоновая кислота—энт-каурен. В процессе этого этапа
проходит два этапа циклизации GGPP (геранилпирофосфата) с
формированием пирофосфата и затем энт-каурена.
2. Энт-каурен подвергается нескольким окислительным реак-
циям и в результате формируется альдегид ГК12.
3. Последний этап реакции окисления и гидролиза приводит к
формированию различных гиббереллинов из альдегида ГК12, в том
числе и ГКГ
Последняя стадия различна в разных растениях и в результате
разные виды растений характеризуются разными комбинациями
ГК.
Мутанты по чувствительности к ГК. Мутанты по измененному
ответу на гормон имеют большое значение, так как приводят к
выявлению генов и их продуктов, кодирующих или рецепторы,
или компоненты на пути передачи сигнала. Мутанты могут быть
получены с помощью химического мутагенеза и транспозонного
мутагенеза. Сейчас у растений этими методами выявлены гены, ко-
торые являются компонентами путей передачи гормонального сиг-
нала (табл. III.7).
Мутанты по чувствительности к гиббереллину могут быть под-
разделены на три группы:
карлики и полукарлики (dwarf и semidwarf);
растения с сильно удлиненными и утонченными побегами
«slender»;
295
Таблица III. 7
«Гиббереллиновые» мутанты растений
Тип мутантов Вид Мутация Фенотип Предполагаемая функция
Мутанты Кукуруза dl Карлик Зр- гидроксилаза
уровня гор- d2, d3 » Ферменты перехода
мона ГК12-альдегида в ГК53
монооксигеназа
d5 » энт-кауренсинтаза
an » ?
Арабидоп- gal—ga3 Невсхожие ?
сис семена,
карлики
ga4 То же Зр-гидроксилаза
ga5 » ?
Горох na » Синтез ГК12 из ЭКК
le » ЗР-гидроксилаза
Is » Кауренсинтаза А
побегов
Ih » ?
Томаты gibl-gib3 » ?
ve-182 » Энт-кауренсинтаза
ve-270 Синтез ГК12 из ЭКК
ve-335 Синтез каурена
Рис dx » » »
dy » ЗР-гидроксилаза
Мутанты Кукуруза D8, D9, » Различные этапы пере-
по чувстви- Mpll дачи сигнала от рецеп-
тельности тора ГК до «пункта»
Пшеница Rhtl, Rht2 » запуска физиологичес-
Арабидоп- Gal » кой реакции
сис
spy slender*
Горох d Карлик
la cry5la slender
Томаты d Карлик
procera slender
Ячмень sin »
♦ slender — тонкий, стройный, ? — функция неизвестна.
растения без существенных фенотипических отличий от ди-
кого типа.
К первой группе относятся формы кукурузы, несущие доми-
нантные мутации — D8, D9, Mpll — пшеницы, маркированные
полудоминантными мутациями — Rhtl, Rht2 — и арабидопсиса,
маркированные полудоминантной мутацией — Gal, а также фор-
мы гороха и томатов с рецессивными мутациями — d.
296
Ко второй группе относятся формы, несущие рецессивные му-
тации: spy арабидопсиса, sin ячменя, ргосега томатов. Кроме
того, фенотип slender имеет двойной мутант сгуЧа гороха.
К третьей группе относятся формы ячменя, маркированные до-
минантными мутациями G-42 и G-52. У семян этих растений
после обработки экзогенным гиббереллином слабее, чем у дикого
типа, повышаются уровни а-амилазы и фосфатазы.
Независимо от принадлежности к той или иной группе, мута-
ции чувствительности к гиббереллину затрагивают гены, кодирую-
щие некоторые элементы сети передачи сигнала от гормона до
«пункта» запуска физиологической реакции.
Таким образом, гиббереллиновые мутанты описаны у многих
видов, принадлежащих к разным систематическим группам.
Гиббереллиновые мутанты растений разных видов имеют сход-
ные изменения фенотипа, что говорит о единстве функций гиб-
береллинов у них.
Механизмы действия гиббереллинов. Описаны белки с гиббе-
реллинсвязывающей активностью, но среди них нет четкого кан-
дидата на роль рецептора. Согласно одним данным, гиббереллино-
вые рецепторы локализованы только в плазматической мембране,
согласно другим — приурочены к ядру, но для них всех характер-
но большее сродство к активным гиббереллинам, чем к неактив-
ным. Предполагается участие в этом процессе кальмодулина и
ионов Са2+.
Многие гормоны стимулируют изменение уровня Са2+. Показа-
но, что ГК может увеличивать его содержание в алейроновом слое.
Предполагается, что Са2+ в комбинации с кальмодулином или
кальмодулинподобными белками вовлечен в координацию ответа
алейроновых клеток к ГК и АБК.
Гены-мишени. Известны как позитивно-, так и негативно-регу-
лируемые гиббереллином гены. Примерами позитивно регулируемых
генов могут служить гены, контролирующие синтез а-амилазы, хал-
консинтазы (CHS), ген у-TIP, кодирующий белок и функциониру-
ющий как водный канал. Негативно-регулируются гиббереллином
гены, контролирующие синтез алкогольдегидрогеназы и ингибито-
ров а-амилазы и протеаз. Регуляция экспрессии этих генов осу-
ществляется гиббереллином не напрямую, а через соответствую-
щие транскрипционные факторы.
ГК и рост стебля. ГК стимулируют разные процессы в расте-
нии и одной из главных мишеней действия является стебель, кото-
рый удлиняется при воздействии ГК. Одними из первых генов с
известной функцией, которые регулируются ГК в течение элонга-
ции стебля — это синтез тубулинов.
Так, через 6 ч после воздействия ГК3, уровень транскриптов а-
и Р-тубулиновых генов увеличивается в 5—6 раз и продолжает уве-
личиваться в течение 24 ч. Элонгация стебля и транскрипция мРНК
тубулиновых генов ингибируется АБК и циклогексимидом. Это
означает, что для экспрессии тубулиновых генов требуется допол-
297
нительный синтез белка. Эти результаты предполагают, что воз-
можна не прямая регуляция этих генов ГК, а через транскрипци-
онные факторы, которые могут быть компонентами в пути переда-
чи сигнала. Кроме того, используя метод ПЦР в элонгирующих
стеблях ГК-дефицитных мутантах gal арабидопсиса были иден-
тифицированы 2 кДНКовых клона, которые регулируются после
воздействия ГК. Другой пример, внутренний протеин (y-Tip), при-
сутствующий в вегетативных тканях, также регулируется ГК. Ко-
личество y-TIP мРНК увеличивается через 8 и 24 ч после воздей-
ствия ГК. Это значит, что ГК через регуляцию экспрессии гена
y-TIP может стимулировать транспорт Н2О в вакуоли, генерируя
тургор.
ГК и гены антоцианового пути биосинтеза. ГК индуцирует эк-
спрессию генов антоцианового пути биосинтеза. Халкон-синта-
за — продукт гена CHS (от Chaicone synthase) в норме экспресси-
руется в лепестках. Если цветок поместить в условия in vitro, то
уровень мРНК CHS падает, но опять может увеличиться при до-
бавлении ГК. ГК-регулируемая транскрипция гена CHS чувстви-
тельна к циклогексимиду, свидетельствующая о том, что ген CHS
регулируется через транскрипционный фактор.
Ген CHI (от Chaicone isomerase), кодирующий халкон-изомера-
зу, также регулируется ГК на уровне транскрипции. Два других
гена, контролирующих дигидрофлавонол-4-редуктазу (dihidrofla-
vonol-4 reductase), которые действуют на более позднем этапе син-
теза антоциана, также регулируются ГК. Известно, что экспрессия
антоциановых генов регулируется транскрипционными факторами
типа helix—loop—helix (спираль—петля—спираль). Скорее всего,
ГК может регулировать гены антоцианового пути биосинтеза через
регуляцию этих транскрипционных факторов.
ГК-регулируемая экспрессия генов в алейроновом слое. Гены,
кодирующие а-амилазу, протеазы, (З-глюканазу и глобин-1, регули-
руются ГК и ингибируются АБК. Алкогольдегидрогеназа и проте-
иназный ингибитор а-амилазы ингибируются ГК. Таким образом,
алейроновый слой является моделью для изучения экспрессии
генов, регулируемых гормонами-антагонистами ГК и АБК.
Характеристика а-амилазных генов. У злаков клетки алейро-
нового слоя и протопласты синтезируют а-амилазу в ответ на воз-
действие ГК, при этом значительно увеличивается уровень соот-
ветствующих мРНК. Показано, что увеличение количества мРНК
а-амилазы является следствием увеличения уровня транскрипции,
которая может быть подавлена АБК. Этот процесс чувствителен к
циклогексимиду, свидетельствуя о том, что для транскрипции ами-
лазных генов требуется дополнительный синтез белка. У злаков
а-амилаза кодируется семейством генов, но не все гены этого се-
мейства регулируются ГК. Анализ промоторной области генов, ре-
гулируемых ГК с помощью репортерного гена GUS, позволил
идентифицировать цис-элементы в промоторе, которые необходи-
мы для высокого уровня ГК- и АБК-регулируемой экспрессии.
298
В гене (X-AMY2/54 (овес) выявлен ГК- и АБК-регулируемый
элемент, который находится в положении -289 перед стартом
транскрипции. Этот участок консервативен практически для всех
генов, регулируемых АБК и ГК, составляет 21 п. о. и обозначен
как GARE (GA-response element) — UTAACAUANTCYGG (где
U = A/G, Y = С/Т и N = A/C/T/G). Исключение составили гены
GASII у ячменя и GAS В (GATHEPSIN) у пшеницы, которые не
содержат этого мотива. В последующих экспериментах было пока-
зано, что ГК-регулируемые гены имеют в промоторной области
GARC (ГК-регулируемый комплекс).
Более тонкий функциональный анализ а-амилазного промото-
ра показал, что GARC содержит пиримидиновый, ТААСААА- и
ТАТС-САС-боксы, которые необходимы для ГК ответа. Эти эле-
менты относятся к цис-элементам и они одинаковы у ГК-регули-
руемых генов (рис. III. 13).
Важной ступенью в понимании молекулярных механизмов гор-
мональной регуляции а-амилазных генов является выявление транс-
действующих регуляторных факторов, которые взаимодействуют с
цис-элементами в ГК-регулируемом комплексе. Идентификация
транс-элементов привела к выявлению факторов, которые взаи-
модействуют с GARC-последовательностями и регулируют экспрес-
сию а-амилазных генов. Показано, что GARC цис-последователь-
ности в алейроновом слое пшеницы и ячменя являются местом
взаимодействия с транскрипционными факторами, которые связы-
ваются непосредственно с последовательностями TAACAGA и
ТАТССАТ. Эти транскрипционные факторы относятся к семейству
МуЬ-белков.
Известно, что Myb-белки регулируют различные аспекты мор-
фогенеза у растений: антоциановый биосинтез, дифференцировку
трихом листа, ответ на стресс, дифференцировку клеток эпидер-
миса. Выделены и охарактеризованы кДНКовые клоны GAmyb,
которые контролируют синтез Myb-белков и играют критическую
роль в ГК-регулируемой экспрессии а-амилазных генов. При ана-
лизе экспрессии генов MYB в алейроновом слое, используя в ка-
честве зонда пробу С1 MYB-гена (С1 — ген антоцианового пути
биосинтеза), удалось выявить 3 различных класса мРНК, как нега-
тивно-регулируемыми ГК, так и позитивно-регулируемых.
Pyrimidine box ТААСААА box ТАТССАС box
-171 | | | | | | -115
CYCCTTTTGA...........ATAACAACTC........CATATCCACTGG
GARC
Рис. III. 13. Схема промоторной области а-амилазных генов.
GARC — область в промоторе а-амилазных генов, содержащая последовательно-
сти необходимые для связывания с Myb-генами. Пояснения в тексте.
299
Показано, что Myb-белки чаще связываются с последователь-
ностью ТААСААА-бокса, мутация в этой последовательности
приводит к отсутствию взаимодействия ДНК—белок, а также ре-
дуцирует ГК-регулируемую экспрессию а-амилазного гена.
Можно предложить модель экспрессии гена а-амилазы в ответ
на ГК. ГК связывается с рецептором в плазматической мембране,
активирует передачу сигнала, в результате наблюдается экспрессия
MYB-гена (рис. III. 14).
ГК + Р
Комплекс ГК с рецептором
ГК МуЬ-ген
иРНК
МуЬ-белок
I
— GARC
a-amylase gene
ген a-amylase
иРНК
Белок
Разрушение запасных белков
Рис. III. 14. Модель экспрессии генов а-амилазы в ответ на ГК.
Пояснения в тексте.
300
В трансгенных растениях ген MYB под сильным конститутив-
ным промотором (35S) может экспрессироваться без ГК. Скорее
всего, в алейроновом слое существуют разные транскрипционные
факторы, которые могут связываться с цис-элементами и регули-
ровать экспрессию генов а-амилазы без ГК. Однако транскрипци-
онные факторы присутствуют в лимитирующем количестве, так
как уровни экспрессии MYB-гена с гиббереллином и 35S MYB-
гена без него несравнимы, в первом случае экспрессия значитель-
но выше. На присутствие различных Myb-факторов указывает на-
личие нескольких последовательностей в промоторе ГК-регулиру-
емых генов.
Другие ГК-регулируемые гены, кодирующие ЕП (1-3,1 -4)-£-
глюканазу (ячмень) и катепсин-В (пшеница), также содержат в
промоторной области Myb-связывающие сайты. Например, в про-
моторе генов, контролирующих синтез е- и Р-глюканаз находится
последовательность ТААСААСС, которая сходна с МуЬ-связыва-
ющим сайтом гена а-амилазы ячменя и последовательностью GA-
ACCGAA, обнаруженной в гене катепсина-В у пшеницы.
Как было сказано выше, использование циклогексимида — ин-
гибитора синтеза белка, показало, что для активации транскрип-
ции а-амилазного гена необходим дополнительный синтез белка,
которым, как теперь уже понятно, является транскрипционный
фактор МуЬ. В отличие от а-амилазного гена, экспрессия MYB-
генов индуцируется циклогексимидом, т. е. белковый синтез не
нужен для индукции их ГК. MYB-гены — это одни из первых
генов в регулируемом ГК-пути передачи сигнала.
Продукты MYB-генов. Анализ продуктов MYB-генов показал,
что их структура высококонсервативна и сходна со многими ДНК-
связывающими транскрипционными факторами, найденными у на-
секомых, дрожжей, растений и др. Так, у животных и насекомых
Myb-домен включает 3 несовершенных повтора длиной в 51—
53 а. к. Белок, кодируемый геном MYB, подобно другим myb-бел-
кам растений, также содержит ДНК-связывающий домен и myb-
домен с несовершенными повторами (Rl, R2, R3). Каждый из R-
повторов содержит 3 спирали, которые являются точкой контакта
с последовательностью AACNG. R1 непосредственно не участвует
в связывании, но играет важную роль в стабилизации комплекса.
Пока нет доказательств, что белки, кодируемые генами MYB,
участвуют в ГК-регулируемой элонгации стебля и в цветении, но в
пигментации венчика цветка, которая регулируется ГК, они участ-
вуют. Экспрессия генов, кодирующих халкон-синтазу, халкон-
флавон-изомеразу и дегидрофлаванол 4-редуктазу, координирован-
но индуцируется ГК при развитии окраски венчика цветка. Ген
MYB петунии (MYB-PH3) имеет последовательности, высокого-
мологичные гену MYB ячменя, который экспрессируется в эпи-
дермальных клетках лепестков петунии и узнает консенсусные
последовательности ТААСТААСАААА. Промотор этого гена пе-
тунии содержит 2 Myb-РЬЗ связывающих сайта. Таким образом,
301
скорее всего, ген MYB-PH3 выполняет такую же функцию, как
другие гены семейства MYB, и экспрессируется в соответствии с
той же моделью. Эксперименты с циклогексимидом показали, что
для экспрессии гена CHS, который регулируется ГК, требуется
синтез белка, так же как и для экспрессии а-амилазных генов.
Выявлен один из компонентов в пути передачи сигнала и ГК
ответа — это фосфатаза. Показано, что ингибитор фосфатазы —
окадаевая кислота — блокирует эффект ГК и подавляет экспрес-
сию а-амилазных генов. Отсюда сделано предположение, что фос-
фатаза играет критическую роль в ГК-трансдукционном пути и яв-
ляется одним из ранних компонентов пути передачи «гибберелли-
нового» сигнала.
Итак, ГК стимулирует экспрессию гидролаз (а-амилазы), ко-
торые разлагают запасные белки, что способствует прораста-
нию семени. АБК блокирует эффект ГК, сохраняя покой семян
и подавляя экспрессию а-амилазных генов. Антагонистический
эффект двух гормонов (ГК и АБК) может быть связан с экспрес-
сией общих Myb-белков, которые взаимодействуют с гормонами
на конкурентной основе.
III. 1.4. АБСЦИЗОВАЯ КИСЛОТА
Абсцизовая кислота (АБК) была открыта в 1950 г., а выделена
в 1963 г. Ф. Уореном из листьев березы. Это сесквитерпен с ос-
новным путем синтеза из мевалоной кислоты через фарнезилпиро-
фосфат (путь С15). Второй путь его синтеза считают запасным и
активирующимся при стрессе из каратиноидов через ксантофилл
(путь С40).
Основное место синтеза АБК — листья и корневой чехлик.
Она присутствует в клетке как в свободной форме, так и в виде
конъюгатов с глюкозой. Образование конъюгатов — это способ
регуляции уровня АБК. Однако образующиеся глюкозиды являют-
ся ее транспортной формой, которая проходит по флоэме и кси-
леме. Продукт распада АБК — фазиевая кислота — может подав-
лять фотосинтез, особенно в случае водного стресса.
Основная функция АБК — обеспечение развития и покоя
семян, закрытие устьиц, адаптация к стрессу. АБК связана не
только с покоем семян, но и с покоем клубней, почек. Именно ее
накопление обеспечивает состояние «спячки» в зимний период.
Снижение уровня АБК является сигналом к пробуждению.
АБК называют гормоном-антагонистом ИУК, цитокининов,
ГК, так как она тормозит реакции, которые вызывают эти гормо-
ны. Например, АБК тормозит дифференцировку хлоропластов,
которую активирует цитокинин.
Мутанты. АБК играет важную роль в регуляции последних ста-
дий эмбриогенеза — созревания и покоя семян. Для многих видов
однодольных и двудольных выявлен пик уровня АБК на этих ста-
302
этих стадиях. Выделен целый ряд мутантов с нарушением покоя
семян, которые прорастают прямо на материнских растениях.
Такие мутанты называют живородящими. К ним относят мутанты
vp(2—9) (от viviparous) у кукурузы и мутанты aba (от АВА —
abscisic acid) у арабидопсиса. Для них характерен редуцированный
уровень АБК. Другой тип мутантов выделен по чувствительности
к АБК. У этих мутантов не редуцирован уровень АБК, а обработ-
ка экзогенной АБК не приводит к получению фенокопий дикого
типа. Кроме того, мутанты по чувствительности к АБК характери-
зуются плейотропным эффектом (табл. III.8).
Мутанты с измененным уровнем (deficient) АБК.
Мутанты по уровню АБК выделяют по измененному фенотипу:
1) wilty — быстрое увядание;
2) viviparous, dormancy — сокращение покоя семян.
Эти признаки коррелируют с уменьшением уровня АБК, свиде-
тельствуя о том, что мутация произошла в генах, которые вовлече-
ны в ее биосинтез. Полученные мутанты, как правило, рецессив-
ные и моногенные. С помощью экзогенной АБК у мутанта можно
получить фенокопии дикого типа. Сегодня многие из мутантов с
измененным уровнем АБК можно расположить в цепи ее биосин-
теза АБК (рис. III. 15).
Мутанты с дефектом биосинтеза АБК выделены у разных
видов. У арабидопсиса АБК-дефицитные мутанты aba характе-
ризуются измененным уровнем кислоты как в семени, так и у
взрослого растения. У кукурузы большинство охарактеризованных
мутантов vp имеют дефект в синтезе не только АБК, но и кароти-
ноидов, т. е. у них блокированы первые этапы синтеза. У мутантов
(la (flacca). sit (sitiens) (томаты), dr (droppy) (картофель) и abal
(табак) блокирован последний(е) этап(ы) биосинтеза АБК, кото-
рый^) может регулироваться ферментами, требующими молиб-
деновый кофактор, что особенно свойственно для мутанта ячменя
лаг 2а.
Таким образом, анализ вышеперечисленных мутантов показал,
что уровень АБК играет важную роль в сохранении покоя семян и
ингибировании их прорастания. Уменьшение ее количества у му-
тантов приводит к нарушению покоя семян и их прорастанию на
материнском растении. Однако не только количество АБК являет-
ся лимитирующим фактором сохранения покоя семян. Нарушение
на этой стадии можно наблюдать у мутантов с нормальным коли-
чеством АБК, но с нарушенной чувствительностью к гормону.
Мутанты по чувствительности к АБК. АБК-нечувст-
вительные мутанты отбирают по способности расти на высоких
концентрациях АБК (в 10 раз выше нормы) (табл. III.8).
Общей характеристикой этих мутантов является нарушение
покоя семян, однако уровень АБК практически не изменен. Боль-
шая группа мутантов выделена у арабидопсиса и обозначена, как
АБК-устойчивые: abil, abi2, аЫЗ (от abscisic acid insensitive).
Сравним эти мутанты по некоторым признакам:
303
Таблица Ш.8
Мутанты по чувствительности к АБК
Вид Мутация Доминант- ность/рецес- сивность Фенотип Продукт гена
Zea mays vpl P Нечувствительность к АБК Специфичный для семян транс- крипционный фактор
rea P То же —
Craterostig- ma plantagi- neum Cdt-1 Д Устойчив к АБК на уровне каллуса Регуляторная РНК или корот- кий полипептид
Arabidopsis thaliana Abil ПД Нечувствительность к АБК Протеинфосфатаза 2С
Abi2 ПД То же То же
abi3 p » » Специфичный для семян транс- крипционный фактор
abi 4/5 p » » —
eral p Г иперчувствител ь- ность к АБК Р-субъединица фарнезил транс- феразы
era 2/3 gca 1/8 p То же Нечувствительность к АБК —
Axr2 Д Устойчивость к аук- сину, этилену и АБК —
jarl p Устойчивость к MeJa и гиперчув- ствительность к АБК —
jin4 p То же —
bril p Устойчив к брасси- ностероидам и ги- перчувствителен к АБК —
sax p Гиперчувствитель- ность к ауксину и АБК —
Nicotiana ibal p Устойчив к аукси- Молибденсодер-
plumbagini- folia (abalX ну, цитокинину и АБК жащий кофактор биосинтеза
Примечание: Д — доминантность, ПД — полудоминантность, Р — рецессив-
ность.
304
Мутагенизиро-
вание семян
Мутантный сектор
в апикальной
меристеме
Семена
из мутантного из немутант-
сектора ного сектора
25% m/m 50% m/+
Рис. II.5. Схема получения мутантов у арабидопсиса.
т — мутант, + — дикий тип.
А В С D
Рис. 11.19. Модель развития листа.
А—дикий тип; В — мутант ampl; С — мутант psd; D — мутант hasty; серый цвет —
семядоли; зеленый — ювенильные листья; красный — «взрослые» листья, находящи-
еся на репродуктивной фазе развития.
- стела
- перицикл
- эндодермис
- кортекс
- эпидермис
- корневой чехлик
] - центральные клетки
| - инициальные клетки
| - эпидерминальные клетки
I - инициальные клетки
1223 корневого чехлика
□ - центральный район
корневого чехлика
Рис. 11.20. Строение корня арабидопсиса.
Клеточная организация корня арабидопсиса (я) и промеристемный район корня
арабидопсиса (б); 1 — направление деления; 2 — направление вторичного деления.
Рис. 11.25. Цветки дикого типа арабидопсиса (я) и львиного зева (б).
Рис. III. 12. Схема реакций растений на гиббереллин {ГК).
К — контроль, ГК — воздействие гиббереллином.
Формирование
Опадание листьев
Старение цветков
женских цветков
Рис. III. 16. Схема реакции растений на этилен (С2Н4).
К — контроль, без этилена, С2Н4 — обработка этиленом.
Mevalonic acid
Famesyl pyrophosphate (C15)
[Carotenoids]
vp2
vp5
vp7
vp9
Zeaxanthin (С40)
! aba
V
Antheraxanthin
! aba
all-trans-Violaxanthin
9’-cis-Neoxanthin (C40)
Xanthoxin (Cl5)
ABA-alcohol
ABA-aldehyde
flacca
sitiens
droopy
abal
4 r nar2a
ABA
‘OH
COOH
О
Рис. III. 15. Схема биосинтеза АБК.
Пояснения в тексте.
у мутантов abil и abi2 выражена склонность к увяданию, и
они имеют wilty-фенотип;
все три мутанта различаются по чувствительности к высоким
концентрациям АБК;
выявлены различия по аккумуляции пролина. Так, уровень
пролина не возрастает при экзогенной обработке АБК у abil
и abi2, тогда как мутант аЫЗ накапливает пролин. Мутант
аЫЗ устойчив к засухе и характеризуется нарушением акку-
муляции запасных белков;
ген ABI3 экспрессируется только в течение развития семян,
ABI1 и 2, в том числе и в процессе вегетативного роста.
11 Генетика
305
Изучение единичных и двойных мутантов abi показало, что
гены ABI1 и 2 определяют один путь ответа на АБК, a ABI3 функ-
ционирует отдельно, но параллельно регуляторному пути первых.
Мутации по генам VP (их около 18) выделены у кукурузы
независимо и картированы в 7 различных локусах. Мутанты
легко выделяются фенотипически по прорастанию на початке и
по белой окраске зерен. Практически у всех мутантов vp изме-
нен уровень АБК, т. е. у мутанта vp при добавлении экзогенной
АБК можно получить фенокопии дикого типа. Для мутантов vp
характерно нарушение первых стадий биосинтеза АБК. У мутан-
та vpl, в отличие от других мутантов vp, количество АБК не
изменено.
Остановимся более подробно на мутантах чувствительности abi
и vpl. Оба локуса VP1 (кукуруза) и ABI3 (арабидопсис) активны
в семенах. У мутанта аЫЗ не выявлено никаких изменений в веге-
тативных тканях, а у мутанта vpl ингибирован синтез антоциана в
алейроновом слое. Ген ABI3 экспрессируется в семенах до их про-
растания, а также в молодых проростках, причем его экспрессия
обнаружена только в определенных органах проростка — семядо-
лях и гипокотиле. Мутанты аЫЗ и vpl имеют одинаковый АБК-
чувствительный фенотип, но уровень АБК у них не отличается от
форм дикого типа. Аллельные варианты abi-мутанта аЫЗ—4,
аЫЗ—3, аЫЗ—5 имеют те же характеристики.
Ген ABI3 локализован на 3-й хромосоме в позиции 235 сМ,
содержит 2688 п. о. Ген ABI3 имеет 5 интронов. Белок содержит
720 аминокислот. Компьютерный анализ выявил 87 % гомологии
с продуктом гена VP1, что говорит о высоком уровне гомологии,
исходя из того, что кукуруза — это однодольное растение, а ара-
бидопсис — двудольное, и они филогенетически далеко отстоят
друг от друга.
В N-терминальной части белок АЫЗ имеет домен с Gin-, Pro-,
Ser-, Thr-богатыми последовательностями, названными PEST-no-
следовательностью, характерной для многих известных транскрип-
ционных факторов. В гене ABI3 обнаружен ДНК-связывающий
домен.
Теперь проанализируем ген VP1 у кукурузы. Он в геноме куку-
рузы представлен в виде одной копии. Анализ структуры белка
показал, что он имеет ряд особенностей: N-терминальный конец
заряжен отрицательно, содержит 170 аминокислот и сигнальную
PEST-последовательность, которая несколько раз повторена. В
этой области найдена наибольшая гомология с геном ABI3. С-тер-
минальный конец заряжен положительно. N- и С-концы разделены
120 аминокислотами с нейтральным зарядом. Незаряженная сред-
няя часть белка содержит повторы, разделенные фенилаланином и
не способна образовывать спираль, а заряженные концы образуют
а-спираль. Продукт гена VP1, также как ABI3, отнесен к транск-
рипционным активаторам. Делеция в области N-домена приводит
к потере способности активировать ряд генов.
306
Возможные рецепторы. В настоящее время известны только
претенденты на роль рецепторов АБК.
У арабидопсиса выделен белок с рецепторными характеристи-
ками, а ген, контролирующий его синтез, обозначен как RPK1 (от
Receptor-like Protein Kinase). Ген имеет длину 1952 п. о. с откры-
той рамкой считывания в 1623 п.о. и кодирует пептид в 540 ами-
нокислот. Он содержит 4 домена, которые обнаружены у всех ки-
назных рецепторов:
амино-терминальный сигнальный домен;
домен с пятью экстраклеточными лейцинбогатыми повторами;
. транс-мембранный домен;
. цитоплазматический протеин-киназный домен.
Ген экспрессируется в цветках, стебле, листьях, корнях и инду-
цируется через 1 ч после воздействия АБК. Кроме того, экспрес-
сия этого гена индуцируется такими стрессовыми факторами, как
высокая концентрация соли, потеря воды, низкие температуры,
что предполагает его участие в ответе на стресс.
Гены-мишени. Гены, регулируемые АБК, представлены в
табл. III.9. Отличительной особенностью этих генов является на-
личие в промоторной области АБК-регулируемых последователь-
ностей, которые получили название ABRC (АБК-регулируемый
комплекс) (табл. III.9).
Так, у пшеницы, АБК регулирует экспрессию гена ЕМ (от Em-
bryo Maturation), который активируется на последних этапах раз-
вития семян. Этот ген относят к семейству LEA-генов. Lea-белки
накапливаются при высыхании семян, а в вегетативных тканях при
стрессовых воздействиях, особенно в период засухи и заморозков.
Lea-белки защищают клетку при потере воды, поддерживая струк-
туру белков и мембран. Они связывают воду и действуют как мо-
Таблица III.9
Цис-действующие элементы промоторов,
вовлеченных в активацию экспрессии генов АБК
Ген (вид) Элемент Последовательность*
Rab 16 (hbc) Motif I Motif III GTACGTGGC GCCGCGTGGC
Em (пшеница) Emla Emlb ACACGTGGC ACACGTGCC
HVA22 (ячмень) ABRE3 CE1 GCCACGTACA TGCCACCGG
HVA1 (ячмень) ABRE2 CE3 CCTACGTGGC ACGCGTGTCCTC
С1 (кукуруза) Sph CGTGTCGTCCATGCAT
CdeT27-45 (Cratero- stigma plantagineum) — AAGCCCAAATTTCACAGCCCGATAACCG
* Последовательность ACGT в пределах G-бокса подчеркнута.
307
лекулярные шапероны. Экспрессия гена ЕМ обнаружена через
5 мин после воздействия АБК. Ген ЕМ содержит 1800 п. о. и ко-
дирует небольшой белок, который включен в защиту зародыша от
высыхания в период потери воды. Промоторная область содержит
G-бокс с двумя мотивами ЕМ 1а и EMlb, необходимыми для регу-
ляции АБК.
Другой тип цис-активирующего элемента Sph-мотив обнаружен
в промоторе гена С1 кукурузы, который также регулируется АБК.
Ген С1 участвует в регуляции биосинтеза антоциана в алейроно-
вом слое семян кукурузы. С1 кодирует транскрипционный фактор,
который относится к семейству Myb-транскрипционных факто-
ров, имеет структуру спираль—петля—спираль (helix—loop—
helix) и регулирует экспрессию структурных генов биосинтеза ан-
тоциана.
Как правило, для АБК-индуцируемой экспрессии недостаточно
одного АВRE-элемента. Гены, экспрессирующиеся под воздейст-
вием гормона, содержат АБК-регулируемый комплекс (ABRC),
который, кроме ABRE, содержит другие цис-элементы. Например,
промотор гена ЕМ представлен ЕМ1- и ЕМ2- элементами. ACGT
является основной коровой последовательностью, входящей в со-
став цис-элементов. Таким образом, различные цис-элементы
могут входить в ABRC и участвовать в передаче сигнала при воз-
действии АБК.
Важным моментом в понимании молекулярных механизмов ре-
гуляции с помощью АБК является выявление транс-факторов, ко-
торые взаимодействуют с цис(с1з)-элементами в АБК-регулируе-
мом комплексе.
Обнаружен белок, который активно связывается с элементами
G-бокс комплекса гена ЕМ. Ген, который контролирует обна-
руженный белок, обозначен EmBPl (от Embryo Maturation Binding
Protein). Экспрессия этого гена обнаружена не только в семенах,
но в корнях и в листьях. Описанные у растений белки, которые
взаимодействуют с G-боксом, содержат домен типа «лейциновая
молния» и их относят к транскрипционным факторам семейства
bZip. Следует добавить, что экспрессия генов, содержащих G-
бокс, регулируются УФ, анаэробиозом, светом.
Ген ЕтВР-1 имеет высокую гомологию с дрожжевым геном
GCN4. Гены этого семейства имеют консервативный домен с лей-
цинбогатыми повторами, который может быть повторен несколько
раз. Белки bZip-типа функционируют как димеры при взаимодей-
ствии с ДНК. Для них характерен полиморфизм, определяемый их
структурой. В случае гетерозиготности, гетеродимерный белок
может обеспечить вариабельность за счет того, что в отличие от
гомодимера может связываться с разными регуляторными последо-
вательностями.
Для индукции транскрипции гена ЕМ, кроме АБК, которая ре-
гулирует его экспрессию через bZip-транскрипционный фактор
EmBPl, необходим также VP1 ген.
308
В промоторе гена ЕМ обнаружено несколько цис-элементов,
специфичных и необходимых для регуляции геном VP1. Показано,
что некоторые из них перекрываются с АБК-отвечающими эле-
ментами.
Промоторная область гена С1 также содержит мотив (TCGTC-
CATGCATGCAC), который необходим для регуляции геном VP1.
Таким образом, ген VP1, активирует два разных гена — С1 и ЕМ,
экспрессия которых в свою очередь регулируется АБК.
Однако в белке гена VP1 не обнаружен домен, который непо-
средственно может взаимодействовать с ДНК, поэтому ген VP1
относят к коактиваторам. Следовательно, белок гена VP1 для ре-
гуляции генов С1 и ЕМ должен предварительно вступить в физи-
ческий контакт с другим транскрипционным фактором. Возмож-
но, что такой мишенью является транскрипционный фактор Em
ВР1. Таким образом, транскрипционные факторы могут взаимо-
действовать друг с другом, регулируя разные процессы в клетке.
Итак, ген VP1 непосредственно не регулируется АБК, а синер-
гетически взаимодействует с ней, регулируя экспрессию гена С1 и
ЕМ в течение развития семян.
Анализ структуры белка, кодируемого генами типа VP1, вы-
явил, что N-терминальный домен необходим для активации транс-
крипции. Vpl/Abi-3-подобные белки отнесены к мультифункцио-
нальным факторам, которые интегрируют АБК и другие регуля-
торные сигналы в процессе созревания семени.
Итак, АБК может участвовать в нескольких путях передачи
сигнала, некоторые компоненты которых уже описаны. В каскад
передачи сигнала вовлечены транскрипционные факторы типа
bZip и активатора транскрипции VP1, который усиливает эффект
АБК.
Ген АВП кодирует структуру белка, состоящего из 434 амино-
кислот, белок имеет сходство с 2С серин/треонин-протеин-фосфа-
тазой. Показано, что белок Abil содержит Са2+, связывающий сайт,
что свидетельствует о его взаимодействии с Са2+ и участие в АБК-
регулируемом закрытии устьиц, осмотическом стрессе.
Таким образом, продукт гена АВП — это кальций-зависимая-
протеин-фосфатаза, которая может в ответ на АБК стимули-
ровать фосфорилирование белков. Продукт гена ABI2 имеет
80 % гомологии с геном АВП и является также протеин-фосфа-
тазой 2С.
Следует добавить про роль гена ABI3 в регуляции экспрессии
генов семейства LEC (см. часть II). Считают, что ген ABI3 участ-
вует в регуляции генов LEC2 и FUS3, осуществляя двойственный
контроль основных программ развития растений.
Таким образом, физиологический, биохимический, генетичес-
кий и молекулярный подходы позволили выявить роль АБК в про-
цессе развития семян.
309
ПЫЛ. ЭТИЛЕН
Этилен (С2Н4) — газообразный гормон растений, один из наи-
более хорошо изученных фитогормонов, играет большую роль в
управлении процессами развития и в реакциях на различные
стрессы и поражение патогенами. Кроме растений, биосинтез эти-
лена обнаружен у грибов.
Участие этилена в регуляции роста растения было открыто в
1901 г. в Санкт-Петербургском университете Д. Н. Нелюбовым,
который установил, что, содержащий этилен светильный газ, вы-
зывает изменения в росте проростков гороха. Сходный эффект по-
казал в 20-е годы Ф. Денни (США) при изучении созревания пло-
дов под воздействием этилена.
Физиологические эффекты: наиболее характерной ре-
акцией на этилен является так называемый тройной ответ у этио-
лированных проростков двудольных:
ингибирование роста эпикотиля (или гипокотиля);
усиление расширения клеток эпикотиля (гипокотиля) и
корня в радиальном направлении — в результате обработан-
ные этиленом проростки выглядят более короткими и толс-
тыми по сравнению с контролем;
. диагеотропический рост корня (параллельно поверхности
почвы) и усиление апикального изгиба, который в литерату-
ре называют «апикальный крючок».
Подавление роста растений в длину при обработке этиленом
может объясняться тем, что этилен оказывает тормозящее воздей-
ствие на транспорт ауксинов. Этим же можно объяснить наруше-
ние ориентации растения по отношению к свету и силе тяжести,
например, усиление изгиба «апикального крючка», эпинастичес-
кие изгибы листовых черешков.
Одним из известных физиологических эффектов этилена явля-
ется стимуляция созревания плодов и старения листьев, а также
опадения листьев, цветков и плодов (рис. III.16, см. вкл.). При воз-
действии этилена на ткань в ней возрастает активность пектиназы
и целлюлазы, в результате нарушаются межклеточные связи. Клет-
ки становятся чувствительными к этилену только на определенной
стадии развития растений. Так, на ювенильной стадии клетки не
реагируют на этилен. Он участвует также в ответе растения на
различные повреждения и способен включать системы защиты
растений от патогенов, индуцируя синтез ферментов, разрушаю-
щих клеточную стенку грибов (хитиназы, глюконазы), а также ре-
гулировать синтез фитоалексинов.
Биосинтез этилена осуществляется только в интактных клет-
ках растений и грибов, в бесклеточной системе он не идет. Пред-
положительно, ферментативный комплекс, осуществляющий био-
синтез этилена, локализуется на поверхности мембраны.
Этилен в клетках синтезируется из метионина, исходными ве-
ществами для биосинтеза также могут быть Р-аланин и линолено-
310
вая кислота (рис. III. 17). Лимитирующими этапами в биосинтезе
этилена являются:
1) превращение S-аденозил-метионина (SAM) в 1-аминоцик-
лопропан-карбоксиловую кислоту (АСС), реакция катализируется
АСС-синтазой;
1 -аминоциклопропан-
1-карбоновая кислота (АЦПК)
АЦПК-
оксидаза
Н2С=СН2
СО2
НСООН
NH3
Этилен
Рис. III. 17. Схема биосинтеза этилена.
Пояснения в тексте.
311
2) превращение ACC в С2Н4, С02, NH3 и муравьиную кислоту;
реакция катализируется АСС-оксидазой.
Показано, что количество обоих ферментов в растении повы-
шается при старении, созревании плодов, а также при различных
стрессах. Гены, контролирующие синтез ACC-синтазы и АСС-ок-
сидазы, клонированы у многих растений. ACC-синтаза кодируется
мультигенным семейством, каждый из членов которого активиру-
ется различными индукторами (стрессы различной природы, гор-
мональные сигналы: ауксины, цитокинины, сам этилен).
С использованием метионина, меченного С14, показано, что мо-
лекула С2Н4 образуется из СЗ и С4 атомов этих веществ, атом С1
идет на образование СО2, С2 — на образование муравьиной кис-
лоты. Из С5 образуется СН3-8-аденозин, из которого в клетке
вновь синтезируется метионин, поскольку уровень свободного ме-
тионина в клетке низок, требуется его регенерация.
Кроме свободного метионина, для синтеза этилена могут ис-
пользоваться пептиды, содержащие метионин; такие пептиды на-
капливаются в стареющих тканях, где идет интенсивный синтез
этилена.
Образование этилена может осуществляться также из 2-хлор-
этилфосфоновой кислоты (этефона), которая широко использует-
ся в практике как регулятор роста растений. Под действием ще-
лочного pH клеточного сока из этефона образуется этилен:
он-
С1—СН2—СН2—РО32-------- Н2С—СН2 + Cl- + HPOf.
Уровень биосинтеза этилена в растении зависит от многих ус-
ловий.
1. Уровень биосинтеза этилена различен в различных тканях и
органах: например, в побегах наибольший уровень биосинтеза на-
блюдается в апикальной меристеме и узлах, меньше — в междоуз-
лиях. Он также зависит от фазы развития — наиболее высокий
уровень продукции С2Н4 в созревающих плодах и стареющих
листьях.
2. Зависимость биосинтеза этилена от внешних факторов:
свет: у этиолированных проростков красный свет усиливает
биосинтез С2Н4, дальний красный свет — снижает; таким
образом, фитохромы участвуют в регуляции биосинтеза эти-
лена;
температура: при повышении или снижении температуры
уровень биосинтеза С2Н4 снижается;
механический стресс (изгибание, трение) резко повы-
шает уровень биосинтеза этилена;
3. Зависимость биосинтеза этилена от фитогормонов: обработ-
ка растения ауксином в несколько десятков раз повышает уровень
биосинтеза С2Н4. Некоторые физиологические эффекты ауксинов
(например, стимуляция цветения и опадения листьев) обусловлены
312
реакцией растения на повышенный уровень этилена. Кроме того,
С2Н4 стимулирует свой собственный синтез, приток этилена извне
повышает синтез этилена в ткани, что имеет значение для синхро-
низации многих процессов, например, листопада, созревания пло-
дов.
Мутанты по этилену. Известно несколько этиленовых мутан-
тов у арабидопсиса и томата.
Этиленовые мутанты арабидопсиса были идентифицированы по
изменению тройного ответа у этиолированных проростков. По ха-
рактеру этих изменениий мутанты можно разбить на три группы.
1. Мутанты конститутивного ответа характеризуются
тем, что тройной ответ развивается даже при отсутствии экзоген-
ного этилена. У проростков наблюдается снижение удлинения ги-
покотиля и корня, усиление изгиба «апикального крючка». У
взрослых растений — снижение роста в длину, утолщение стебля
и корня, мелкие размеры и поникшие листья, сокращение времени
цветения, компактные соцветия. К этой группе относятся мутанты
etol, eto2, eto3, Ctrl.
Мутанты etol, 2, 3 (от etylen overproduction) — мутанты co
сверхпродукцией этилена, при обработке ингибиторами биосинте-
за этилена у них наблюдается отсутствие тройного ответа.
У мутанта Ctrl (от constitutive triple response) тройной ответ
развивается независимо от ингибиторов; предположительно нару-
шение наблюдается на одном из этапов передачи сигнала при воз-
действии этилена.
2.Мутанты, нечувствительные к этилену легко иден-
тифицируются при обработке этиолированных проростков этиле-
ном. В отличие от проростков дикого типа, у них не наблюдается
снижения роста. У разных мутантов отмечена разная степень сниже-
ния чувствительности. К этой группе относятся мутанты Etrl, Etr2,
Ein4, ein2, ein3, einS, ein6, ein7, ainl, etil, eirl, hlsl.
Мутации Etrl, Etr2 (от etylen resistant) и Ein4 (от etylen insen-
sitive) доминантны, характеризуются высокой степенью снижения
чувствительности. Наблюдается плейотропный эффект: подавле-
ние удлинения гипокотиля и корня у проростков, стебля и корня
у взрослых растений, замедленное старение, снижение перокси-
дазной активности. Наличие плейотропного эффекта позволяет
предположить, что эти гены действуют на ранних этапах ответа на
этилен и их продукты являются рецепторами или первыми компо-
нентами каскада сигнальной трансдукции.
Мутация ein2 — рецессивная, у мутантов наблюдается сильное
снижение чувствительности к этилену.
У мутантов Etrl и ein2 биосинтез этилена повышен соответст-
венно в 5 и 10 раз, по-видимому, это связано с нарушением систе-
мы обратной связи в регуляции биосинтеза этилена.
Мутации ein3, 5, 6, 7, ainl, etil рецессивны, характеризуются
более слабым фенотипическим проявлением по сравнению с вы-
шеописанными.
313
3. Мутанты с нарушением отдельных реакций в
тройном ответе: hlsl и eirl. У мутанта hlsl (от hookless) не
наблюдается усиления изгиба «апикального крючка» при обработ-
ке этиленом. У мутанта eirl (от etylen insensitive root) не наблю-
дается сокращение длины корня (табл. III. 10).
Этиленовые мутанты томата идентифицированы по нарушению
созревания плодов (табл. III. 11).
Nr (от never ripe) — полудоминантная мутация. Для мутантов
характерен плейотропный эффект: отсутствие тройного ответа у
проростков, у взрослых растений — быстрое сбрасывание цвет-
ков, резкое замедление созревания плодов. Наличие плейотропно-
го эффекта позволяет предположить, что ген NR контролирует
один из первых этапов реакции на этилен.
Мутации rin (от ripening ingibitor) и nor (от non-ripening) —
рецессивные, растения характеризуются нормальным тройным от-
ветом и нормальным фенотипом взрослых растений; созревание
плодов резко замедленно. По-видимому, гены действуют на более
поздних стадиях реакции на этилен.
Таблица III. 10
Мутанты арабидопсиса по чувствительности к этилену
Обозначе- ние мутации Фенотип Продукт
Etrl Нечувствительность проростков к этилену. Отсутствие индукции эти- лензависимых генов Двухкомпонентная гистидин- киназа (рецептор этилена)
ein2 Нечувствительность проростков к этилену. Устойчивость к бактериаль- ным патогенам. Повышенный уро- вень этилена
ein 3—7 Нечувствительность проростков к этилену —
ain 1 Нечувствительность проростков к этилену. Нечувствительность к АСС —
eti Нечувствительность проростков к этилену —
eir 1 Нечувствительность корней к этилену —
eto 1—3 Сверхпродукция этилена. Конститу- тивный ответ на этилен —
ctr 1 Конститутивный ответ на этилен. Активация всех этилензависимых генов Серин-треониновая киназа, схожая с киназами семей- ства Raf (МАРККК). Негативно регулирует ответ на этилен
his 1 Нечувствительность апикального крючка к этилену N-ацетил трансфераза. Участвует в синтезе или транспорте ауксина
314
Таблица III. 11
Мутации, затрагивающие этилензависимое созревание плодов у томатов
Обозначение мутации Фенотип Функция
Nr (Never ripe) Отсрочено созревание плодов. Нечувствитель- ность этиолированных проростков к этилену. Отсутствие экспрессии этилензависимых генов Рецепция этилена на всех стадиях развития. Гомоло- гичен рецептору этилена Etrl у арабидопсиса
rin (ripening inhibitor) Отсрочено созревание плодов Рецепция этилена во время созревания плодов
nor (non-ripening) То же То же
epi Ускорено созревание плодов. Конститутивный ответ на этилен —
Изучение эпистатических взаимодействий между мутациями, на-
рушающими реакцию на этилен у арабидопсиса, позволило пред-
положить возможный порядок действия генов. Мутации Etrl, Ein4,
Etr2 полностью эпистатируют Ctrl, ein2,3,5,6,7, у двойных мутан-
тов не наблюдается аддитивности мутантных фенотипов. Таким об-
разом, гены ETR1, ETR2, EIN4 действуют перед генами CTR1, EIN2,
3, 5, 6, 7. Показано, что гены EIN2, 3, 5, 6, 7 действуют после генов
CTR1. Мутации Etrl и ein2 эпистатируют etol,2. Таким образом,
нечувствительные мутанты нечувствительны и к эндогенному этиле-
ну. У мутанта eirl наблюдается неполный эпистаз с мутацией Ctrl,
корень средний по фенотипу; возможно, ген EIR1 контролирует не-
зависимый путь передачи сигнала.
Рецепторы. Клонированы некоторые гены, контролирующие
реакцию на этилен у арабидопсиса: ETR1, CTR1, EIN2, EIN3,
HLS1.
Предположительно, этиленовый рецептор представляет собой
Си2+- или 2п2+-содержащий металлопротеин ввиду сродства олефи-
нов, к которым относится и этилен, к металлам. Это предположе-
ние подтверждается тем, что СО, который связывается с металло-
протеинами у животных (гемоглобин и т. д.), обладает слабой эти-
леноподобной активностью у растений. Кроме того, известно, что
связывание этилена с металлами блокируется СО2, одновременно
СО2 действует как ингибитор этилена во многих биологических
процессах (например, тормозит этилензависимое изгибание «апи-
кального крючка»). Для действия этилена требуется кислород, воз-
можно, он обеспечивает окисление металлсодержащих комплек-
сов, необходимое для связывания этилена.
Предполагаемыми кандидатами на роль этиленового рецептора
могут быть продукты генов ETR1 и ETR2, которые действуют пер-
выми при реакции на этилен.
315
Ген ETR1 кодирует белок, схожий с бактериальной двухкомпо-
нентной гистидиновой киназой. Аминотерминальная область со-
держит три гидрофобных участка, которые пронизывают мембра-
ну. С-конец имеет сходство с гистидиновой киназой и с регулятор-
ным доменом бактериальной двухкомпонентной рецепторной
системы, с помощью которой бактерии воспринимают хемосен-
сорные сигналы. Так, у Е. coli было обнаружено по крайней мере
50 различных двухкомпонентных систем. Двухкомпонентные сис-
темы состоят из сенсорного элемента и связанного с ним регуля-
тора ответа (рис. III. 18). При восприятии сигнала сенсорным эле-
ментом происходит автофосфорилирование консервативного ос-
татка гистидина в гистидинкиназном домене. Затем эта фосфатная
группа переносится на консервативный остаток аспартата в вос-
принимающем домене регулятора ответа, который и осуществляет
регуляцию активности внешнего домена двухкомпонентной систе-
мы. По аминокислотной последовательности продукта гена ETR1
было установлено, что он содержит сенсорный элемент, соединен-
ный с воспринимающим доменом регулятора ответа, и, таким об-
разом, представляет собой типичную двухкомпонентную систему.
Белок Etrl также имеет N-концевой домен с тремя гидрофоб-
ными участками, пронизывающими мембрану, С-концевой и ки-
назный домены. Белок Etrl встречается в виде димера, связанного
дисульфидным мостиком. Многие Hys-киназы бактерий димеризу-
ются при связывании лиганда, но не с помощью S-S связи; у Etrl
эта связь является важной для нормального функционирования,
так как при сайт-специфическом мутагенезе при замене Cys 4 и 6
белок не работает. При трансформации дрожжей аллелью дикого
типа Etrl клетки начинают связывать этилен, при трансформации
мутантной аллелью связывания не наблюдается. Это подтверждает
А Сенсор Эффектор
Рис. III. 18. Схема этиленового рецептора.
А — двукомпонентная сигнальная система бактерий, содержащая сенсор и эффек-
тор; Б — схема структуры этиленового рецептора: 1 — N-конец белка, воспринима-
ющий сигнал; 2 — гистидиновый остаток в киназном домене; 3 — домен, содержа-
щий остаток аспаралиновой кислоты, на которой переносится фосфат с гистидина.
316
предположение о том, что белок Etrl является этиленовым рецеп-
тором. Предполагается, что гидрофильный С-концевой домен об-
разует временный комплекс с металлом.
Локус ETR1 представлен в виде небольшого семейства генов, в
которое входят ETR1, 2, а также ERS, имеющий 67 % гомологии с
ETR1 (с делецией большей части С-концевого домена). Как пока-
зано в ходе генетического анализа, ген ERS также действует перед
CTR1.
Таким образом, имеется семейство этиленовых рецепторов,
которые могут частично замещать друг друга; это объясняет тот
факт, что мутант Etrl арабидопсиса сохраняет способность свя-
зывать этилен (20 % от того, что связывает дикий тип), а при
трансформации дрожжей мутантным геном связывание отсутст-
вует вообще.
Передача сигнала. При связывании этилена происходит авто-
фосфорилирование гистидиновой киназы, кодируемой геном
ETR1, и запускается каскад фосфорилирования. Одним из участ-
ников каскада является продукт гена CTR1 — серин/треониновая
протеинкиназа, принадлежащая к семейству Raf-киназ. Raf-кина-
зы были впервые выделены из клеток животных. Гены, кодирую-
щие Raf-киназы, имеют гомологию с одной из разновидностей рет-
ровирусов. Онкогенные формы белков Raf могут содержать только
киназный каталитический домен. Различные Raf-киназы из клеток
животных имеют три высококонсервативных домена. CR1-домен
содержит участок связывания с Ras-белками. Домен CR2 является
мишенью для автофосфорилирования или фосфорилирования дру-
гими серин/треониновыми киназами. Наконец, домен CR3, распо-
ложенный на С-конце, является киназным каталитическим доме-
ном. С-конец белка Ctrl высокогомологичен домену CR3, однако
N-конец имеет весьма ограниченное сходство с Raf-белками.
Белок Ctrl, в частности, не имеет мотивов цинковых пальцев и
Ras-связывающего участка, характерных для CR2 домена.
Raf-белки являются частью каскада консервативных протеин-
киназ, участвующих в передаче сигнала ряда гормонов и каскадов,
регулирующих процессы развития. Рецепторы для этих сигналов
взаимодействуют с Raf-белками не напрямую, а посредством не-
больших ГТФ-связывающих белков — Ras-белков. Не исключено,
что в растительных клетках CTR1 может регулироваться непо-
средственно белком Etrl.
Белок Raf-1 животных, имеющий высокую гомологию с CTR1,
способен фосфорилировать только одну мишень — протеинкиназу
МЕК, причем Raf-1 узнает свою мишень только по четвертичной
структуре. Активированная МЕК в свою очередь фосфорилирует
тирозиновый й треониновый остатки MAP-киназы. Активирован-
ная МАР фосфорилирует большое количество мишеней, включая
целый ряд транскрипционных факторов. Показано, что узнавание
белка МЕК происходит за счет С-терминального (киназного) доме-
на Raf, имеющего высокую гомологию с соответствующим доменом
317
CTRl. Поиск гомолога для белка МЕК у арабидопсиса привел к вы-
явлению такого гомологичного белка, при подавлении экспрессии
которого с помощью антисмысловых РНК проявляется фенотип, ти-
пичный для растений с нечувствительностью к этилену.
Таким образом, на сегодняшний день удалось выявить основ-
ные ключевые элементы этиленовой сигнальной трансдукции.
Сравнительный анализ этих компонентов у различных видов рас-
тений продемонстрировал высокую консервативность всех элемен-
тов этиленовой сигнальной трансдукции.
На основании анализа компоненов этиленовой сигнальной
трансдукции была предложена следующая ее модель (рис. III. 19).
1. Рецепторами к этилену являются члены семейства ETR1-
генов. Связывание этилена осуществляется за счет его взаимодей-
ствия с ионом металла, связанного гидрофобным (трансмембран-
ным) доменом. Связывание этилена приводит к изменению кон-
формации этого домена и соответственно изменяет скорость
трансфосфорилирования между субъединицами рецептора.
2. Изменение конформации ETR1 прямо или через посредни-
ков влияет на активность CTR1-киназы.
3. CTR1 регулирует активность продуктов генов EIN2 и EIN3,
возможно, через каскад МАР-киназ.
Таким образом, в передаче этиленового сигнала в клетках
арабидопсиса принимают участие сигнальные системы как про-
кариотического (гистидиновая протеинкиназа—ETR1—рецеп-
тор этилена), так и эукариотического типа (репрессор передачи
сигнала CTR1, серин/треониновая протеинкиназа, относящаяся
к MAP-киназному каскаду). Цепочка последующих этапов пере-
дачи сигнала еще мало изучена.
Гены-мишени. Показано, что этилен активирует экспрессию
некоторых генов — это гены, связанные с биосинтезом этилена, а
также гены, вовлеченные в защитные реакции при поражении па-
тогенами — реакции SAR и HR (см. часть VII). Реакция HR пред-
ставляет собой первичную реакцию растения на патоген, включает
образование локальных некрозов в месте проникновения патогена.
В эту реакцию входят:
1) рецепция сигнала патогена;
2) активация синтеза антимикробных веществ, например акти-
вация пероксидаз, в результате чего усиливается синтез перекисей;
3) укрепление клеточных стенок за счет усиления синтеза лиг-
нина, окисления некоторых белков клеточной стенки;
4) активация синтеза сигнальных молекул — салициловой кис-
лоты (SA), жасмоновой кислоты (JA), липидных пероксидов и
т. д. — это необходимо для активации экспрессии генов, вовлечен-
ных в защитную реакцию, и развития системной защитной реак-
ции в растении.
Реакция SAR принципиально не отличается от HR, она вклю-
чает в себя те же реакции и преследует ту же цель, но это уже
системная реакция во всем растении. Реакции HR и SAR развива-
318
Рис. III. 19. Гипотетическая схема передачи этиленового сигнала у рас-
тений.
ETR1 —димерный белок рецептора этилена. CTR — блокатор этиленовой програм-
мы, который инактивируется сигналом с ETR1. Пунктиром показана предполагаемая
передача сигнала на трансфакторы, которые в результате этого приобретают способ-
ность взаимодействовать с регуляторными элементами этилензависимых генов и
вследствие этого включать их активность. Звездочкой помечены фосфорилирование
гистидина (Г) в составе гистидиновой протеинкиназы и перенос фосфатной группы
на остаток аспарагеновой кислоты (А) в молекуле эффектора.
319
ются при поражении растений специфическими расами патогена,
несущими определенную аллель одного из генов AVR, растение
при этом должно нести определенную аллель одного из R генов —
это эволюционно сложившееся взаимодействие «ген на ген».
Показано, что этилен индуцирует усиление экспрессии многих
генов, вовлеченных в защитные реакции.
1. Гены некоторых PR (patogen-related) белков — это всевоз-
можные ферменты, разрушающие клеточные стенки патогена, на-
пример хитиназы, Р-1,3-глюконазы.
2. Ген PAL (фенилаланил-аммоний-лиаза) — ключевой фер-
мент в синтезе SA-салициловой кислоты, которая является одной
из основных сигнальных молекул в реакциях SAR и HR, а также
обладает антимикробным действием.
3. Ген гидроксипролинбогатого белка клеточной стенки, кото-
рый имеет значение для укрепления клеточной стенки, образуя
межмолекулярные сшивки.
Активации этих генов не обнаружено у нечувствительных к
этилену мутантов.
У многих генов, экспрессия которых активируется этиленом, в
промоторной области имеется элемент ERE (etylene-response ele-
ment) — последовательность 47 п.о., содержащая 2 GCC-бокса
(GCCGCC). С помощью сайт-специфического мутагенеза показа-
но, что наличие этих элементов необходимо и достаточно для
транскрипционного контроля этих генов с помощью этилена.
Обнаружены белки, связывающиеся с этиленрегулируемыми по-
следовательностями этих генов, которые, вероятно, относятся к
трансфакторам. У табака были выделены белки Erebs (Ere-bin-
ding), которые содержат консервативную последовательность в 59
аминокислот, необходимую для взаимодействия с ДНК. Вероятно,
эти белки могут быть мишенью для вышеописанного каскада.
Глава 111,2
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ ФОТОМОРФОГЕНЕЗА
В отличие от других эукариотических организмов, подавляю-
щее большинство растений характеризуется фототрофным типом
питания. Поэтому неудивительно, что свет принадлежит к числу
наиболее значимых факторов внешней среды, прямо или косвенно
регулирующих практически все стороны жизнедеятельности расте-
ния. Это обстоятельство позволяет с легкостью выявлять влияние
света на различные морфогенетические процессы, протекающие в
растительном организме. Однако столь широкая регуляторная
роль света, приводящая к одновременному запуску большого коли-
чества биологических программ, существенно затрудняет изучение
320
специфических молекулярных механизмов фотоморфогенеза. Рас-
смотрению именно этих механизмов и будет посвящена данная
глава.
В настоящее время вычленяют три основных параметра осве-
щения, каждый из которых способен осуществлять запуск доста-
точно автономной программы биологического ответа. Этими пара-
метрами являются:
. интенсивность освещения. Этот фактор является клю-
чевым для запуска так называемых собственно фотоморфо-
генетических ответов, к которым относятся прорастание
семян, замедление роста побега в длину, развитие листовых
пластинок, а также биогенез хлоропластов;
< направленность светового потока. Восприятие
этого параметра приводит к проявлению реакции фототро-
пизма (изгибанию побеговых структур растения по направле-
нию к источнику света), что обеспечивает режим наилучше-
го освещения;
< продолжительность светового дня. Этот фактор
играет ключевую роль в регуляции так называемого фотопе-
риодизма растений, что чрезвычайно важно для запуска цве-
тения (см. гл. V.2).
Наличие трех относительно независимых программ биологи-
ческого ответа на освещение свидетельствует о существенном раз-
личии их молекулярных механизмов. В соответствии с этим гене-
тический контроль каждой из трех перечисленных программ будет
рассмотрен по отдельности.
Ш.2.1. ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ
СОБСТВЕННО ФОТОМОРФОГЕНЕЗА
Первые данные, свидетельствующие о специфике морфогене-
тического ответа растений на свет, были получены еще в ЗО-е
годы XX столетия. Значительные успехи в этой области были
обусловлены удачным выбором экспериментальной модели. Такой
моделью оказались различные стадии развития так называемых
этиолированных растений, т. е. растений, исходно выращиваемых
в полной темноте. В этих условиях влажные семена характеризу-
ются замедленной всхожестью, а образующиеся из них проростки
отличаются сильно удлиненным побегом, неразвитыми листовыми
пластинками, отсутствием биогенеза хлоропластов и синтеза хло-
рофилла. В случае двудольных такие проростки дополнительно
характеризуются загнутым апексом и сложенными семядолями.
Ввиду неспособности этиолированных проростков к фотосинтезу,
их культивирование ведут в присутствии необходимых органичес-
ких веществ (сахаров). В том случае, если этиолированные про-
ростки продолжают выращивать в полной темноте, образуются
взрослые растения, которые наряду с вышеперечисленными осо-
12 Генетика
321
бенностями проявляют ярко выраженное апикальное доминирова-
ние и неспособность к цветению. Воздействуя дневным светом на
влажные семена, либо на этиолированные растения, можно вызы-
вать быструю нормализацию морфогенеза. При этом для индукции
подобных процессов требуется различная интенсивность освеще-
ния: самыми высокочувствительными ответами оказались рас-
прямление апекса и раскрытие семядолей (у двудольных), а также
частичное замедление роста побега. Чувствительность этих реак-
ций настолько высока, что для их запуска достаточно даже очень
слабого освещения, равного в случае этиолированных проростков
риса всего 1/10 вспышки светлячка на площади 10 м2.
Очевидно, что столь чувствительные процессы очень удобны не
только для детального изучения закономерностей нормального фо-
томорфогенеза, но и для выявления мутантов, дефектных по тем
или иным компонентам фотоморфогенетического аппарата. По-
добные мутанты могут обладать двумя весьма различными типами
фенотипических проявлений. С одной стороны, мутационное по-
вреждение фотоморфогенетического аппарата может приводить к
блокированию нормальных реакций растения на свет, в результате
чего несмотря на освещение мутантные проростки остаются этио-
лированными (рис. 111.20, А). В случае арабидопсиса, являющегося
модельным объектом генетики растений, подобные мутанты по-
лучили название hy (от hypocotyle) в соответствии с быстро уд-
линяющимся гипокотилем. С другой стороны, рассматриваемое
мутационное повреждение может приводить к запуску фотомор-
фогенетических программ в отсутствие освещения (рис. Ш.20, Б).
Соответствующие мутанты арабидопсиса принято называть сор
(от constitutive photomorphogenesis) или det (от de-etiolated).
Таким образом, методы выделения мутантов по фотоморфоге-
нетическим процессам сводятся
к отбору проростков, обладаю-
щих пониженной чувствитель-
ностью к свету или же, напро-
тив, проявляющих конститутив-
ный фотоморфогенез. Широкое
использование этих очень про-
Рис. Ш.20. Фенотипы мутантов
арабидопсиса с нарушениями нор-
мального фотоморфогенеза.
А — мутанты типа hy характеризуются
нечувствительностью к свету определен-
ного диапазона и выглядят как этиолиро-
ванные проростки; Б — проростки му-
тантов типа сор и det способны к относи-
тельно нормальному морфогенезу (т. е. к
раскрытию семядолей, медленному росту
гипокотиля и биогенезу хлоропластов)
даже в абсолютной темноте.
322
Таблица 111.12
Мутанты по фотоморфогенезу у арабидопсиса
Характер дефекта Световой диапазон Обозначение мутантов
Нечувствительность к свету Нормальный фотоморфоге- нез вне зависимости от на- личия света Красный свет Дальний красный свет Синий свет Красный и дальний красный свет Красный, дальний красный и синий свет hy3, redl, pef2, pef3 hy8, fhyl, fhy3 hy4 pefl hy5 cop/det/fiis
стых методов позволило выделить множество фотоморфогенети-
ческих мутантов арабидопсиса (табл. III. 12).
Как оказалось, нормализацию морфогенетических процессов у
этиолированных проростков дикого типа можно индуцировать с
помощью не только дневного света, но и отдельных компонентов
его спектра. Особенно эффективным в этом плане является крас-
ный свет с длиной волны 640—690 нм. Свет других диапазонов
(синего, зеленого и ультрафиолетового) также обладает сущест-
венной, но все же меньшей морфогенетической активностью. Про-
ращивая семена под действием света строго определенного диапа-
зона, можно отбирать мутантные проростки, дефектные в плане
восприятия соответствующего излучения. Используя подобный
подход для арабидопсиса, удалось получить целый ряд мутантов
hy, нечувствительных к свету строго определенной области спект-
ра, но полностью нормальных в плане восприятия излучений дру-
гих диапазонов (табл. III. 13). Судя по этим данным, в раститель-
ных клетках имеется несколько относительно автономных систем,
специфически реагирующих на свет определенной области спектра.
Система фитохромов. Как мы уже видели, излучение красного
диапазона является одним из наиболее значимых факторов, спо-
собных индуцировать фотоморфогенез у растений. Однако, не-
смотря на высокую морфогенетическую активность красного
света, его действие может быть подавлено с помощью дополни-
тельного облучения растений так называемым дальним красным
светом с длиной волны в диапазоне 710—750 нм. Впервые этот
факт был продемонстрирован на семенах латука, прорастание ко-
торых предварительно индуцировали импульсом красного света.
Дополнительное облучение семян дальним красным светом сразу
после индуцирующего импульса полностью снимало эффект пред-
варительной индукции (рис. III.21). Таким образом, фотоморфоге-
нетический ответ (прорастание семян), обусловленный первона-
323
Таблица III. 13
Типичные фотообратимые ответы на красный свет
Таксономическая группа Объект Стадия развития Фотообратимый эффект красного света
Покрытосеменные Латук Семена Индукция прорастания
Овес Этиолированные проростки Развертывание листа
Горчица Проростки Образование и развитие листьев
Горох Взрослые растения Ослабление роста междоузлий
Голосеменные Сосна Проростки Усиление синтеза хлорофилла
Папоротники Onoclea Молодой гаметофит Индукция роста
Мхи Polytri- Прорастающие Индукция деления
chum споры пластид
Зеленые водоросли Mougeotia Взрослый гаметофит Ориентация пластид по направлению к свету
чальным импульсом красного света, оказывается обратимым под
действием последующего облучения дальним красным светом. По-
добные морфогенетические ответы, получившие название фото-
обратимых, широко распространены в различных систематичес-
ких группах (табл. IIL21), что, по-видимому, свидетельствует о
принципиальном сходстве фундаментальных механизмов фото-
морфогенеза у всех растений.
Наличие фотообратимого морфогенеза у растений предполага-
ет существование у них специальных рецепторных молекул, спо-
собных, дифференциально воспринимать световое излучение раз-
ных диапазонов. В настоящее время выявлено несколько классов
А Б
Рис. III.21. Действие красного и дальнего красного света на прорастаю-
щие семена латука.
Л — облучение красным светом резко усиливает прорастание семян; Б — дополни-
тельное облучение семян дальним красным светом снимает индуцирующий эффект,
вызванный предыдущим воздействием.
324
Рис. III.22. Структура хромофорного остатка, ковалентно присоединен-
ного к апопротеидной части молекулы фитохрома.
таких молекул. Прежде всего хорошо известны фоторецепторы,
входящие в состав светоулавливающих антенн фотосинтетическо-
го аппарата. Они служат для передачи поглощенной световой
энергии на реакционный центр, в котором физические последст-
вия поглощения света (возбуждение электронов в рецепторной мо-
лекуле) переводятся в серию окислительно-восстановительных ре-
акций, приводящих к образованию новых химических связей. К
числу рецепторов такого рода относятся фотосинтетические пиг-
менты в первую очередь различные типы хлорофилла. Мутации по
генам, контролирующим биосинтез хлорофиллов, приводят к по-
явлению желто-зеленых, желтых или полностью белых растений,
морфогенез которых (за исключением развития хлоропластов) в
целом остается ненарушенным. Таким образом, в фотообратимой
регуляции морфогенеза растений задействованы другие рецепто-
ры, отличные от хлорофиллов.
Первые рецепторы, непосредственно вовлеченные в фотообра-
тимую регуляцию морфогенеза у растений, были обнаружены в
1959 г. и получили название фитохромов. Молекула фитохрома
представляет собой хромопротеид, состоящий из полипептидной
части (апопротеида) весом приблизительно 125 кДа и открытой
тетрапиррольной группы (хромофора), которая ковалентно присо-
единена к апопротеиду через тиоэфирную связь, образованную с
цистеиновым остатком (рис. III.22). Апопротеидная часть молеку-
лы фитохрома уложена в виде двух дисковидных доменов прибли-
зительно одинакового размера. При этом N-концевой домен несет
ковалентно присоединенный хромофор, а С-концевой — обеспе-
чивает образование гомодимерных комплексов, в которых, судя по
данным электронной микроскопии, две идентичные субъединицы
фитохрома расположены «крест-накрест» по отношению друг к
другу (рис. III.23).
Общепринято, что разнообразные рецепторные молекулы ха-
рактеризуются некими конформационными или химическими пре-
вращениями, обусловленными взаимодействием рецептора с соот-
ветствующим агентом. В наиболее типичном случае для молекулы
фитохрома подобным агентом является красный свет с длиной
325
Рис. III.23. Димерная организация моле-
f кул фитохрома.
( т \ Пояснения в тексте.
/ ПВ \ J
( ху волны в диапазоне 640—690 нм. При
I ( \--------- попадании квантов красного света на
\| !в ) \ хромофор, выполняющий роль свето-
\ / улавливающей антенны, происходит
J изменение его химической структуры,
-------------------которое заключается в перераспреде-
лении двойных связей и образовании новых одиночных. Возник-
шая активированная форма хромофора оказывается достаточно
стабильной и, по-видимому, вызывает небольшое конформацион-
ное изменение апопротеида. Такое предположение основано на
том, что некоторые моноклональные антитела к апопротеиду об-
ладают разным сродством по отношению к активированной и не-
активированной формам фитохрома. В свою очередь конформаци-
онное изменение апопротеида, по-видимому, играет существенную
роль в дальнейшей передаче воспринятого сигнала.
Изменение химической структуры хромофора, возникающее
под действием квантов красного света, приводит не только к кон-
формационным превращениям апопротеида, но и к сдвигу спектра
поглощения молекулы. При этом максимум поглощения активиро-
ванного фитохрома приходится на дальний красный свет с длиной
волны в диапазоне 710—750 нм. Поглотив кванты такого света,
активированный хромофор восстанавливает изначальную хи-
мическую структуру, что в свою очередь обусловливает возврат
апопротеида к исходной конформации. Таким образом, в ответ на
попеременное облучение красным и дальним красным светом мо-
лекула фитохрома претерпевает циклические фотохимические из-
менения, переходя из нормального состояния в активированное, и
наоборот (в соответствии со спектрами поглощения молекулы, эти
состояния принято обозначать Рг и Pfr; от phytochrome red и far
red):
красный свет
р< ^ Prf
дальний красный свет
Каждый из указанных переходов представляет собой достаточ-
но сложный и многоэтапный процесс. Таким образом, излучения
красного и дальнего красного диапазона являются антагонистами
в плане своего воздействия на молекулы фитохрома. Именно этот
антагонизм лежит в основе фотообратимых морфогенетических
ответов у растений.
Благодаря высокой растворимости фитохрома, его фотохими-
ческие изменения могут быть выявлены не только in vivo, но и in
326
vitro, а потому служат очень простыми и удобными показателями
наличия соответствующих молекул в той или иной фракции лиза-
та. Указанная особенность существенно облегчила разработку
высокоэффективных методов очистки фитохрома. В свою очередь
это позволило установить аминокислотную последовательность
N-конца его апопротеидной части, а затем по правилам генетичес-
кого кода определить кодирующую ее нуклеотидную последова-
тельность. Использовав соответствующий искусственно синтези-
рованный зонд, удалось клонировать полномерный ген арабидоп-
сиса, кодирующий апопротеидную часть молекулы фитохрома.
Как оказалось, в геноме арабидопсиса имеется 5-членное семейст-
во родственных генов PHYA—PHYE, кодирующих 5 типов фитох-
ромов, для которых характерна достаточно высокая (50—85 %)
гомология аминокислотного состава.
Гены PHYB, PHYD и PHYE кодируют апопротеидные части
трех наиболее близких друг другу типов фитохромов (В, D и Е
соответственно). Несмотря на высокий уровень гомологии (80—
85 % аминокислотного состава), эти белки не способны к полной
функциональной взаимозамене. Подобный вывод основан на фе-
нотипе мутантов ЬуЗ, которые, будучи дефектными только по
структуре фитохрома В, характеризуются резким ослаблением
морфогенетического ответа на красную часть спектра. Судя по
этим данным, именно фитохром В является у растений основным
фоторецептором, способным индуцировать морфогенез в ответ на
освещение красного диапазона. В пользу высокой фоторецептор-
ной активности фитохрома В свидетельствует и тот факт, что
сверхэкспрессия гена PHYB приводит к резкому усилению всех
морфогенетических ответов на красный свет, а в конечном итоге
к карликовости взрослых растений. В отличие от фитохрома В,
продукты генов PHYD и PHYE, по-видимому, обладают низкой
фотоморфогенетической активностью. Конкретные функции этих
молекул остаются неизвестными.
Продукт гена PHYC обладает всего лишь 50%-ной гомологией
с апопротеидными частями других типов фитохромов. Мутанты по
этому гену еще не получены. Однако, судя по тому, что его сверх-
экспрессия в этиолированных проростках табака приводит к уси-
ленному развитию семядолей в ответ на излучение красного диа-
пазона, фитохром С является хотя и малоэффективным, но вполне
функциональным фоторецептором. Особого внимания заслужива-
ет тот факт, что на уровне взрослых растений подобная сверхэкс-
прессия обусловливает заметное увеличение размеров как листо-
вых пластинок, так и побегов. Между тем, как мы уже видели,
результатом аналогичной сверхэкспрессии гена PHYB является
ярко выраженная карликовость. Таким образом, фитохромы В и
С, по-видимому, отвечают за запуск различных морфогенетичес-
ких программ, независимо индуцируемых красным светом.
Ген PHYA кодирует апопротеидную часть фитохрома А, для
которой также характерна 50%-ная гомология аминокислотного
327
состава со всеми остальными типами фитохромов. Уникальной
фотохимической особенностью фитохрома А является то, что его
активация происходит под действием дальнего красного освеще-
ния, в то время как красный свет не оказывает заметного эффекта.
Эта особенность позволяет предположить, что продукт гена PHYA
принимает участие в запуске неких фотоморфогенетических отве-
тов растения, индуцируемых дальней красной областью спектра.
Действительно, облучение этиолированных проростков арабидоп-
сиса исключительно дальним красным светом оказывается вполне
достаточным для запуска некоторых наиболее чувствительных фо-
томорфогенетических ответов, таких как частичное замедление
роста гипокотиля, распрямление апекса и раскрытие семядолей.
Мутанты hy8, дефектные по апопротеидной части фитохрома А,
даже при длительном воздействии дальнего красного света остают-
ся этиолированными, но при этом характеризуются вполне нор-
мальной морфогенетической реакцией на излучения других диапа-
зонов. Следует отметить, что аналогичный фенотип свойствен
также мутантам fhyl и fhy3. Однако, судя по тому, что у этих
мутантов обнаружен полностью функциональный фитохром А, со-
ответствующие гены кодируют некие молекулы, которые обеспе-
чивают не восприятие, а передачу морфогенетического сигнала,
индуцированного дальним красным светом. Таким образом, систе-
ма фитохрома А отвечает за специфическое развертывание наибо-
лее чувствительных морфогенетических процессов (таких как рас-
прямление апекса, раскрытие семядолей и частичное замедление
роста гипокотиля) в ответ на дальний красный свет.
Характерно, что транскрипция гена PHYA негативно регулиру-
ется светом, а активированные молекулы фитохрома А подверга-
ются быстрой деградации. В связи с этим продукт гена PHYA,
составляющий до 95 % всех молекул фитохрома в этиолирован-
ных проростках, почти полностью исчезает при освещении, а по-
тому часто называется фотолабильным или «темновым» фитохро-
мом. Все другие типы фитохромов являются фотостабильными
(«световыми»), а их экспрессия в проростках остается на относи-
тельно постоянном и невысоком уровне. По этой причине подав-
ляющее большинство биохимических исследований фитохромов
выполнено именно на продукте гена PHYA.
До сих пор остается неясным вопрос о молекулярных основах
противоположного функционального отношения фитохромов А и
В к красному и дальнему красному свету. Судя по тому, что нор-
мальные С-концевые домены всех типов фитохромов являются
вполне взаимозаменяемыми и не оказывают практически никакого
влияния на характер функционирования рекомбинантных моле-
кул, фоторецепторные свойства фитохрома в основном определя-
ются его N-концевым доменом. Действительно, рекомбинантные
молекулы, состоящие из N-концевого домена фитохрома В и С-кон-
цевого домена фитохрома А, успешно активируются красным све-
том, в то время как продукт обратной генно-инженерной конст-
328
рукции (N-PHYA::C-PHYB) — дальним красным светом. Однако
все исследованные к настоящему времени природные варианты
фитохрома А содержат в 793 положении (начало С-концевого до-
мена) остаток аланина, в то время как для остальных типов фито-
хрома в соответствующем положении характерен исключительно
глицин. Таким образом, точные данные о генетическом контроле
фоторецепторных различий между фитохромами А и В типа пока
отсутствуют.
Функционирование каждого рецептора предполагает не только
специфическое распознавание некого агента, но и дальнейшую пе-
редачу воспринятого сигнала с последующим запуском тех или
иных программ биологического ответа. В этом плане принято раз-
личать непосредственно фоточувствительную и регуляторную ак-
тивности фитохрома. Судя по результатам мутационного анализа,
наиболее существенную роль в определении фоточувствительной
функции фитохрома играют цистеиновый остаток, служащий для
присоединения хромофора, а также 5 соседних высококонсерва-
тивных аминокислот. Мутационные замены по этим положениям
приводят либо к неспособности дефектного апопротеида присо-
единять хромофорную часть (особенно в случае замены цистеино-
вого остатка), либо к различным нарушениям фотохимических
свойств рецепторной молекулы. Вместе с тем у арабидопсиса по-
лучен целый ряд рецессивных миссенс-мутаций по генам PHYA и
PHYB, приводящих к полной инактивации соответствующего фи-
тохрома, несмотря на его нормальную фоточувствительность. От-
дельные мутации такого рода, по-видимому, затрагивают процесс
димеризации фитохромных субъединиц, в то время как подавляю-
щее большинство блокирует дальнейшую передачу воспринятого
сигнала. Поскольку подобные мутации локализуются преимущест-
венно в С-концевом домене между положениями 681 и 840, пред-
полагают, что именно этот участок играет важную роль в контроле
регуляторной функции фитохрома.
Особого внимания заслуживает тот факт, что мутантные алле-
ли генов PHY, обусловливающие нарушение регуляторной функ-
ции фитохрома, обладают доминантным проявлением при своей
сверхэкспрессии в трансгенных растениях дикого типа. Подобный
эффект, по-видимому, свидетельствует о том, что дефектные и
нормальные молекулы фитохрома конкурируют друг с другом за
связь с некими факторами, участвующими в дальнейшей передаче
сигнала и имеющимися в клетке в ограниченном количестве. При
этом многочисленные дефектные молекулы фитохрома связывают
почти весь пул сигнальных факторов, в результате чего нормаль-
ные фоторецепторы уже не могут выполнить свою регуляторную
функцию. Судя по данным делеционного анализа, участок связыва-
ния с такого рода сигнальными факторами находится в пределах
N-концевого домена апопротеида. Вместе с тем конкретный меха-
низм осуществления регуляторной функции фитохрома остается
неясным. Показано, что С-концевой домен различных типов фи-
329
тохрома (особенно фитохромоподобного белка массой 84.2 кДа из
цианобактерии Synechocystis) слабо гомологичен двухкомпонент-
ным гистидин-киназным рецепторам бактерий. Кроме того, С-конец
фитохрома, обнаруженного у мха Ceratodon purpureus, имеет су-
щественную гомологию с эукариотическими серин/треониновыми
или тирозиновыми протеинкиназами, причем соответствующий
белок действительно проявляет киназную активность in vivo. Судя
по этим данным, можно предполагать, что регуляторная функция
фитохрома обеспечивается за счет реализации его собственной
протеинкиназной активности, однако такое предположение пока
не может считаться доказанным.
Как мы видели, среди всех типов фитохромов основная фото-
морфогенетическая роль принадлежит продуктам генов PHYB и
PHYA. Одиночные мутанты по этим генам проявляют специфичес-
кую потерю чувствительности либо только к красному, либо толь-
ко к дальнему красному свету. Вместе с тем у арабидопсиса полу-
чены мутанты hyl, hy2 и hy6, дефектные по морфогенетическим
ответам на красную и дальнюю красную области спектра одновре-
менно. Как оказалось, подобный фенотип связан с инактивацией
фитохромов и А, и В типа, причем упомянутые рецепторные мо-
лекулы не содержат никаких нарушений в своих апопротеидных
частях, но не способны улавливать свет ввиду отсутствия необхо-
димых хромофоров. Судя по этим данным, мутанты hyl, hy2 и hy6
дефектны по неким этапам биосинтеза хромофорных группиро-
вок. Подобный вывод подтверждается полным восстановлением
нормальной фоточувствительности у мутантов hyl, hy2 и hy6 при
их опрыскивании раствором биливердина 1Ха (данное соединение
является непосредственным предшественником фитохромобилина,
который служит в качестве хромофорного остатка в молекулах
фитохрома А). Вопрос о том, какие конкретные хромофорные
группировки входят в состав фитохромов В, С, D и Е типа, оста-
ется открытым ввиду слишком низкого содержания этих рецепто-
ров в растительных тканях.
В соответствии с тем, что гены PHY обнаружены не только у
представителей различных групп растений, но даже у цианобакте-
рий (Synechocystis), возникновение фитохрома следует связывать
с самыми ранними этапами эволюции фотосинтезирующих орга-
низмов. У зеленых водорослей гены PHY могут быть представлены
либо одной единственной копией (Mougeatia scalaris), либо не-
большими семействами слабо дивергировавших генов, причем у
некоторых видов (например, Chlamydomonas reinhardtii) обнару-
жить фитохром пока не удается. У высших растений гены PHY,
как правило, организованы в небольшие семейства, в которых ди-
вергенция на функционально различные типы фитохрома (прежде
всего А и В типа), по-видимому, началась лишь на уровне древо-
видных папоротников. В настоящее время все исследованные виды
покрытосеменных содержат свойственное арабидопсису семейство
PHYA—PHYE, конкретная структура которого может варьировать
330
от 5 до 13 копий за счет дупликации или выпадения отдельных
членов, а также появления новых вариантов (например, PHYF у
пасленовых). Судя по тому, что сверхэкспрессия гена PHY1, кло-
нированного из папоротника Adiantum capillus-veneris, не приво-
дит к повышению фоточувствительности трансгенных растений
арабидопсиса, фитохромы покрытосеменных сильно дивергирова-
ли в функциональном плане от предковой формы.
Система криптохрома. Не только красный свет, но и синяя
часть спектра также обладает собственными морфогенетическими
эффектами. Прежде всего под действием синего света этиолиро-
ванные проростки арабидопсиса проявляют типичную морфогене-
тическую реакцию, заключающуюся в существенном замедлении
роста гипокотиля, распрямлении апекса и раскрытии семядолей.
Такого рода ответ специфически нарушен у мутантов hy4, сохра-
няющих нормальную чувствительность к излучениям красного и
дальнего красного диапазона. Судя по этим данным, у растений
имеется автономная фоторецепторная система, действующая неза-
висимо от системы фитохромов и способная воспринимать синюю
часть спектра.
Применение метода инсерционного мутагенеза позволило кло-
нировать ген HY4. Фотостабильный белковый продукт данного
гена (масса 75 кДа) оказался существенно гомологичным фотоли-
азе — одному из ферментов репарационной системы про- и эука-
риот, использующему энергию солнечного света для расщепления
пиримидиновых димеров в ДНК. Как и фотолиаза, этот белок
несет два химически различных хромофорных остатка (в случае
арабидопсиса — производные флавина и птерина), способные вы-
полнять роль светоулавливающих антенн. Вместе с тем собствен-
ной фотолиазной активностью продукт гена HY4 не обладает.
Таким образом, у растений был выявлен хромопротеид, претенду-
ющий на роль специфического рецептора синего света, принима-
ющего участие в запуске морфогенетических программ. Этот хро-
мопротеид получил название криптохром.
Наличие существенной гомологии с фотолиазой само по себе
еще не является строгим доказательством того, что молекулы
криптохрома действительно выполняют функции фоторецепторов,
а не передатчиков уже воспринятого сигнала. В связи с этим сле-
дует особо остановиться на экспериментах, позволивших доказать
непосредственно фоторецепторную роль криптохрома. Прежде
всего спектр поглощения криптохрома не ограничен только синим
светом, но частично захватывает области зеленого и ближнего уль-
трафиолетового (UV-А) излучений. Эти данные хорошо согласу-
ются с тем, что у мутантов hy4 одновременно нарушены морфоге-
нетические реакции на свет зеленого, синего и ближнего ультра-
фиолетового диапазонов. Кроме того, конститутивная экспрессия
нормальной аллели гена HY4 в трансгенных растениях арабидоп-
сиса или табака приводит к пропорциональному повышению их
чувствительности к синему свету, что проявляется в резком подав-
331
лении роста, усилении биосинтеза антоцианов, а также целом ряде
прочих светорегулируемых реакций. Этот факт свидетельствует о
том, что продукт гена HY4 является основным лимитирующим
фактором системы восприятия синего света при избытке всех ос-
тальных ее компонентов. Подобный эффект достаточно сложен
для интерпретации, если предполагать, что функция криптохрома
сводится лишь к дальнейшей передаче уже воспринятого сигнала.
Напротив, в том случае, если молекулы криптохрома служат не-
посредственными рецепторами синего света, логичным результа-
том увеличения их количества должно являться пропорциональное
усиление ответа. В соответствии с этим продукт гена HY4 (новое
обозначение — CRY1) действительно можно рассматривать в ка-
честве фоторецепторной молекулы. Следует отметить, что все
ранее выявленные фоторецепторы, способные поглащать кванты
синего света (например, хлорофиллы и фотолиазы), эффективно
воспринимают излучения и других диапазонов. Таким образом,
криптохром оказался первым охарактеризованным рецептором си-
него света у живых существ.
К настоящему времени у арабидопсиса получено несколько де-
сятков рецессивных и полудоминантных мутаций, нарушающих
морфогенетическую реакцию проростка на свет синего диапазона;
все они относятся исключительно к группе комплементации hy4
(cryl). Этот факт указывает на отсутствие каких-либо специфи-
ческих макромолекул, задействованных только в системе крипто-
хрома и обеспечивающих дальнейшую передачу воспринятого фо-
томорфогенетического сигнала.
Несмотря на свою функциональную автономность, продукт
гена CRY1 испытывает определенное влияние со стороны других
фоторецепторных систем растения. Это влияние проявляется в
том, что полная инактивация фитохромной системы (например, у
двойных мутантов арабидопсиса hy8 hy3, дефектных по фитохро-
мам А и В одновременно) приводит к двухкратному ослаблению
морфогенетической реакции проростков на свет синего диапазона.
Таким образом, системы крипто- и фитохрома способны к некому
взаимодействию, механизм которого остается неизвестным.
Ген CRY1 обычно обнаруживается в одной копии у всех расте-
ний, начиная уже с водорослей (Chlamydomonas reinhardtii и крас-
ная водоросль Corallia elongata). При поиске родственных ему
генов следует учитывать существенную (до 40 %) гомологию
между криптохромом и собственными фотолиазами растений, ко-
дируемыми генами PHR (от photo-reactivation). При этом четкой
отличительной особенностью генов криптохрома служит наличие
в их кодирующей последовательности дополнительного С-конце-
вого фрагмента, существенно варьирующего у разных видов, но
полностью отсутствующего у фотолиаз. Недавно у арабидопсиса
выявлен ген РНН1, продукт которого обладает 50%-ной гомо-
логией с криптохромом и несет по меньшей мере 2 хромофорных
остатка. Судя по тому, что данный хромопротеид не имеет фото-
332
лиазной активности и содержит характерный для криптохрома С-кон-
цевой фрагмент, ген РНН1 также можно рассматривать в качестве
члена семейства генов CRY. Вместе с тем продукт гена РНН1 быс-
тро деградирует на свету и не способен компенсировать отсут-
ствие функционально активного криптохрома у мутантов hy4
(cryl). Функции этого хромопротеида остаются неизвестными,
возможно, он представляет собой еще один тип фоторецепторов у
растений.
Прочие фоторецепторные системы. Круг фоторецепторов,
обеспечивающих запуск морфогенетических программ у растений,
по-видимому, не ограничен только фито- и криптохромами. Подоб-
ный вывод основан на том, что типичные фотоморфогенетические
ответы могут быть получены при использовании исключительно
дальнего ультрафиолетового (UV-В) света, не воспринимаемого
продуктами генов PHY и CRY. Таким образом, растения обладают
по крайней мере еще одной системой рецепторов, специфически
реагирующих на дальнее ультрафиолетовое освещение. Природа и
механизм функционирования подобных рецепторов остаются не-
известными.
Сигнальные молекулы в системах фотоморфогенетического
ответа. Как мы видели, запуск фотоморфогенетических ответов у
растений может обеспечиваться по меньшей мере тремя классами
рецепторных молекул: фитохромами, криптохромами, а также ги-
потетическим рецептором дальнего ультрафиолетового света.
Между тем перечисленные фоторецепторы не обладают сродством
к ДНК, а потому не способны непосредственно регулировать транс-
крипцию генов, вовлеченных в реализацию морфогенетического
ответа. В соответствии с этим растения должны обладать системой
(или несколькими системами) сигнальных молекул, обеспечиваю-
щих передачу морфогенетического сигнала с активированных фо-
торецепторов. Мутанты, дефектные по этим молекулам, должны
характеризоваться определенными морфогенетическими отклоне-
ниями, несмотря на наличие полностью нормальных фоторецепто-
ров всех трех классов. Действительно, у арабидопсиса получен
целый ряд мутантов такого рода (табл. III. 12):
мутанты fhyl и fhy3, проявляющие пониженную чувстви-
тельность к дальнему красному свету;
мутанты redl, pef2 и pef3, обладающие ослабленной чувст-
вительностью к красному свету;
мутанты pefl, одновременно дефектные по морфогенетичес-
ким реакциям на красный и дальний красный свет;
мутанты hy5, остающиеся этиолированными при действии света
всех диапазонов, кроме дальнего ультрафиолетового (UV-B);
мутанты сор/det/fus, проявляющие конститутивный фото-
морфогенез даже в полной темноте.
Судя по фенотипу мутантов fhyl и fhy3 (неспособность прояв-
лять морфогенетические ответы на излучения только дальней крас-
ной области спектра), продукты соответствующих генов являются
333
компонентами некого автономного сигнального пути, специфичес-
ки обслуживающего фитохром А. При этом особого внимания за-
служивает тот факт, что мутации fhyl способны блокировать
лишь часть морфогенетических ответов, в норме индуцируемых
дальним красным светом. Подобные данные свидетельствуют о
том, что передача сигнала с активированных молекул фитохрома
А, по-видимому, происходит по нескольким относительно незави-
симым путям.
В отличие от мутаций по генам FHY1 и FHY3, мутация redl
обусловливает пониженную чувствительность проростков исклю-
чительно по отношению к красному свету. Судя по результатам
теста на аллелизм, эта мутация не затрагивает ни один из извест-
ных генов арабидопсиса, контролирующих структуру фитохрома
В (HY3, HY1, HY2 и HY6). Таким образом, фенотип мутанта
redl, по-видимому, связан с нарушением функций не самого фи-
тохрома В, а некой молекулы, отвечающей за передачу морфоге-
нетического сигнала с фоторецепторов только этого типа. Вполне
вероятно, что компонентами того же сигнального пути служат и
продукты генов PEF2 и PEF3. Мутанты по этим генам, исходно
отобранные по способности к раннему цветению (phytochrome-
signalling early flowering, см. ниже), также проявляют пониженную
чувствительность только к красному свету.
Существование независимых сигнальных путей для фитохро-
мов А и В типа (рис. III.24) хорошо согласуется с данными о
том, что указанные фоторецепторные молекулы имеют различ-
ную локализацию в клетке. Действительно, в то время как фитох-
ром А является исключительно цитоплазматическим белком, про-
дукт гена PHYB не только содержит сигналы ядерной локализа-
ции, но и обнаружен в ядре. В соответствии с этим нельзя
исключить, что молекулы фитохрома В способны оказывать не-
Тип излучения Рецепторные Сигнальные
молекулы молекулы
Красный свет—► Фитохром В —► Redl, Pef2 и Pef3
J^Pefl
КрасХйИсвег—► Фитохром A—►Fhyl и Fhy3 /
Ну5, Detl —► Cop/Det/Fus —► ?
Синий свет —► Криптохром
Дальний
ультрафиолетовый-----?
свет
Рис. III.24. Система передачи фотоморфогенетических сигналов.
Пояснения в тексте.
334
посредственное влияние на функционирование неких транскрип-
ционных комплексов, контролирующих экспрессию светорегули-
руемых генов.
Характерной особенностью единственного известного мутанта
по гену PEF1 является пониженная чувствительность одновремен-
но к красной и дальней красной областям спектра. Как мы видели,
сходный фенотип характерен для мутантов hyl, hy2 и hy6, пол-
ностью дефектных по фитохромам А и В за счет блока в биосин-
тезе хромофорных группировок. Однако мутация pefl не затраги-
вает ни одного из соответствующих генов HY, а ее проявление не
может быть скомпенсировано экзогенным биливердином IXfl (см.
выше). Таким образом, в норме продукт гена PEF1, по-видимому,
обеспечивает передачу морфогенетических сигналов, независимо
поступающих с фитохромов А и В типа (рис. III.24).
Мутации hy5 привлекли к себе повышенный интерес благодаря
своей способности вызывать у проростков существенное ослабле-
ние морфогенетических реакций на свет всех диапазонов, кроме
дальнего ультрафиолетового. Подобный фенотип свидетельствует
о том, что продукт гена HY5, по-видимому, является ключевой
сигнальной молекулой, обслуживающей не только все типы фи-
тохромов, но и криптохромы (рис. III.24). Судя по нуклеотидной
последовательности гена HY5, кодируемый ею белок представляет
собой транскрипционный фактор типа bZip и, вероятно, является
у растений первой молекулой, включающейся в передачу фото-
морфогенетических сигналов на транскрипционном уровне. Ана-
лизируя возможные механизмы такой передачи, следует учиты-
вать, что активация определенных фоторецепторов (например,
фитохрома А) способна вызывать не полное, а лишь частичное
проявление морфогенетического ответа. В соответствии с этим
транскрипционная специфичность (или активность) продукта гена
HY5 должна существенно варьировать в зависимости от того, с
каких фоторецепторов поступили исходные сигналы. К сожале-
нию, конкретные гены, регулирующиеся транскрипционным фак-
тором HY5, до сих пор остаются неизвестными. Тем не менее осо-
бого внимания заслуживает тот факт, что мутации hy5 обладают
широким спектром плейотропных проявлений, затрагивающих в
частности раневые ответы и гравитропизм корня. Таким образом,
продукт гена HY5 вовлечен в регуляцию генов, прямо или косвен-
но контролирующих морфогенез растений под действием не толь-
ко света, но и других внешних факторов, таких как сила тяжести
и механические раздражения.
Отличительной чертой еще одного типа мутантов, дефектных
не по восприятию, а по реализации фотоморфогенетического сиг-
нала, является их способность проявлять элементы нормального
морфогенеза даже в полной темноте. Многочисленные мутанты
такого рода исходно получили различные обозначения: сор (от
constitutive photomorphogenic), det (от deethiolated) и fus (от
fusca — «темно-пурпурный»; данное название происходит от ин-
335
тенсивной антоциановой пигментации семядолей, часто сопровож-
дающей конститутивный морфогенез проростка). Функциональ-
ный тест на аллелизм позволил распределить перечисленные му-
танты по 14 генам (DET1—DET3, СОР1—СОРИ), при этом боль-
шинство мутаций fus оказалось аллелями генов СОР.
Рецессивность мутаций cop/det/fus свидетельствует о том, что
продукты соответствующих генов участвуют в негативной регуля-
ции морфогенеза. Справедливость такого предположения подтвер-
ждается тем, что сверхэкспрессия нормальной аллели гена СОР1
приводит к пропорциональному ослаблению морфогенетического
ответа на освещение. Напротив, дефектность какого-либо из рас-
сматриваемых белков вызывает автоматический запуск морфогене-
тических программ независимо от наличия или отсутствия света.
Таким образом, растения, по-видимому, содержат некий пока еще
неизвестный фактор, служащий непосредственным активатором
фотоморфогенетического ответа и находящийся под негативным
контролем со стороны генов COP/DET/FUS. Продукты этих генов
в свою очередь инактивируются сигналами, поступающими с фо-
торецепторных молекул. Подобная схема хорошо согласуется с
результатами анализа двойных мутантов генотипа hy cop/det/fus.
Мутанты такого рода обычно проявляют конститутивный фото-
морфогенез, что свидетельствует о функционировании продуктов
генов COP/DET/FUS на более поздних этапах по сравнению не
только с фоторецепторными молекулами, но и с транскрипцион-
ным фактором HY5 (рис. III.24). Единственным исключением из
этого правила служат двойные мутанты hy5 detl, псевдонормаль-
ный фенотип которых указывает на возможность совместного
функционирования обоих полипептидов на одном и том же этапе
передачи фотоморфогенетического сигнала.
Конкретные функции белков, кодируемых генами СОР/DET/
FUS, остаются неясными. Среди четырех клонированных генов
данной группы (СОР1, СОР9, COP11/HJS6 и DET1) только ген
СОР1 обладает существенной гомологией с ранее известными по-
следовательностями. Продукт этого гена содержит сигналы ядер-
ной локализации и многочисленные повторы W-40, свойственные
Ь-тримерным G-белкам, а также проявляет существенную гомоло-
гию с субъединицей TAFn80 транскрипционного фактора TFIID
дрозофилы. Следует особо отметить тот факт, что ядерная локали-
зация характерна для продукта гена СОР1 только при отсутствии
света, в ответ же на освещение все молекулы данного белка миг-
рируют в цитоплазму. Таким образом, ген СОР1, по-видимому, ко-
дирует некий транскрипционный фактор, осуществляющий нега-
тивный контроль морфогенеза, но утрачивающий эту способность
при поступлении фотоморфогенетических сигналов на продукт
гена HY5. Судя по наличию аллель-специфического взаимодейст-
вия между отдельными мутациями hy5 и copl, соответствующие
полипептидные молекулы могут вступать друг с другом в непос-
редственный контакт.
336
Нерешенным остается и вопрос о том, в какой последователь-
ности действуют продукты генов COP/DET/FUS. Прежде всего это
связано со сходством фенотипического проявления многих мута-
ций cop/det/fus, что препятствует анализу двойных мутантов. Тем
не менее для ряда мутантов, характеризующихся определенными
фенотипическими различиями между собой, подобный анализ ока-
зался возможным. Его результаты свидетельствуют о том, что из
всех белков, кодируемых генами COP/DET/FUS, первым в реали-
зацию фотоморфогенетического сигнала, по-видимому, включает-
ся продукт гена DET1 (рис. III.24). Мутации по этому гену облада-
ют широким спектром плейотропных проявлений и обусловлива-
ют запуск не только фотоморфогенетического, но и других, в том
числе стрессовых, ответов. Таким образом, продукт гена DET1
прямо или косвенно вовлечен в негативную регуляцию целого ряда
биологических программ.
Как показал реверсионный анализ мутантной аллели detl-1,
свойственное ей проявление может быть частично подавлено с по-
мощью рецессивных межгенных супрессорных мутаций, которые
получили обозначение ted («det» наоборот). Особого внимания за-
служивает тот факт, что супрессорные эффекты мутаций ted рас-
пространяются только на морфологические проявления аллели
detl-1, не влияя на обусловленные ею стрессовые ответы. В соот-
ветствии с этим продукт гена DET1, по-видимому, осуществляет
передачу фотоморфогенетического и стрессовых сигналов по неза-
висимым друг от друга путям. Судя по результатам теста на алле-
лизм, мутации ted могут возникать в генах HY5 и HY1, а также по
меньшей мере в трех ранее неизвестных генах, получивших обо-
значения TED1—TED3. Следует отметить, что ни одна из этих
мутаций не способна исправлять непосредственный молекулярный
дефект, обусловленный аллелью detl-1 (нарушение сплайсинга со-
ответствующей пре-мРНК). Таким образом, механизм подобной
супрессии, по-видимому, основан на физическом или функцио-
нальном взаимодействии продукта гена DET1 с белками, кодируе-
мыми генами HY5, HY1 и TED1—TED3.
Предполагаемое взаимодействие между продуктами генов
DET1 и HY5 представляется вполне возможным, поскольку оба
полипептида имеют ядерную локализацию и функционируют либо
на одних и тех же, либо на соседних этапах передачи фотоморфо-
генетического сигнала (рис. III.24). Гораздо труднее поддается
объяснению супрессорный эффект мутаций hyl. Непосредствен-
ным результатом этих мутаций является блок в биосинтезе хромо-
форных группировок типа биливердина, что ведет к полной инак-
тивации фитохромов (см. выше). Однако подобная инактивация
вряд ли может служить причиной супрессорного эффекта мутаций
hyl, поскольку его проявление наблюдается в темноте, т. е. при
тех условиях, когда все системы фоторецепторов, в том числе и
фитохромы, остаются незадействованными. Таким образом, клю-
чевое различие между мутантом detl-1 и ревертантами detl-1 hyl
337
состоит в том, что исходный мутант содержит хотя и неактивиро-
ванные, но вполне нормальные молекулы фитохромов. Само нали-
чие этих молекул, по-видимому, способно оказывать существенное
влияние на функционирование неких полипептидов, участвующих
в передаче фотоморфогенетического сигнала наряду с продуктом
гена DET1. Вполне вероятно, что гены TED1—TED3, мутации по
которым также обладают супрессорным эффектом по отношению
к аллели detl-1, кодируют полипептиды именно такого рода.
Вопрос о том, какова конкретная последовательность дальней-
шей передачи фотоморфогенетического сигнала, остается откры-
тым. В первую очередь это связано с тем, что некоторые продукты
генов COP/DET/FUS (например, гена СОР9) участвуют в образова-
нии крупных (более 560 кДа) мультисубъединичных комплексов,
структура которых меняется при освещении. Возможно, подобные
комплексы включают в себя продукты и других генов СОР/DET/
FUS и играют ключевую роль в негативной регуляции морфогене-
за. Вместе с тем, судя по аддитивности эффектов, оказываемых
мутациями сор2, сорЗ, сор4, det2 и det3, дальнейшая передача фо-
томорфогенетического сигнала может осуществляться по несколь-
ким относительно автономным путям.
Ш.2.2. ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ ФОТОТРОПИЗМА
Следует отметить, что освещение может вызывать у растений
не только типичные морфогенетические ответы, но и изгибание
побега по направлению к источнику света. Подобную реакцию,
обеспечивающую наиболее оптимальное освещение растения, при-
нято называть фототропизмом. Как оказалось, фототропная реак-
ция может быть индуцирована только излучениями зеленого, сине-
го (преимущественно) и ближнего ультрафиолетового диапазонов.
Такая специфика фототропного ответа позволяет предположить,
что за его индукцию отвечают продукты генов CRY. Тем не менее
мутанты hy4, лишенные функционально активного криптохрома и
в связи с этим полностью дефектные по типичным морфогенети-
ческим реакциям на синий свет, проявляют совершенно нормаль-
ный фототропизм. Судя по этим данным, у растений имеется авто-
номная фоторецепторная система, активируемая той же областью
спектра, что и система криптохрома, но специфически обеспечи-
вающая запуск фототропного ответа.
Отдельные компоненты системы фототропного ответа у ара-
бидопсиса удалось маркировать мутациями nph (от non-phototropic
hypocotyl), специфически блокирующими фототропизм этиолиро-
ванных проростков при полном сохранении всех прочих фотомор-
фогенетических реакций. Идентифицировано 4 гена (NPH1 —
NPH4), мутации в которых обладают подобным проявлением.
Продукт гена NPH1 представляет собой плазматический белок
весом около 120 кДа, к которому присоединяются по меньшей
338
мере 2 хромофорных остатка. Образующийся при этом хромопро-
теид способен улавливать свет зеленого, синего, а также ближнего
ультрафиолетового диапазонов и, по-видимому, является рецеп-
торной молекулой в системе фототропного ответа. Следует отме-
тить, что продукт гена NPH1 не имеет гомологии ни с фито-, ни с
криптохромами и в связи с этим может рассматриваться в качестве
представителя самостоятельной группы фоторецепторов у расте-
ний. Запуск фототропного ответа связан с активацией некой ки-
назной активности, обусловливающей интенсивное фосфорилиро-
вание продукта гена NPH1. Судя по тому, что это фосфорилирова-
ние не нарушено у мутантов nph2—nph4, соответствующие гены,
скорее всего, контролируют не первичные фоторецепторные реак-
ции, а дальнейшую передачу воспринятого сигнала.
Ш.23. ОБЩАЯ СХЕМА БИОЛОГИЧЕСКИХ ОТВЕТОВ
НА ОСВЕЩЕНИЕ
Как уже было отмечено, дневной свет включает в себя широ-
кую гамму излучений, в том числе относящихся к синей, красной
и дальней красной областям спектра. Поэтому суммарная морфо-
генетическая активность естественного освещения определяется
не только его интенсивностью, но и конкретным соотношением
между его вышеперечисленными составляющими.
Оказавшись во влажной почве или напочвенной подстилке,
семена обычно прорастают в условиях почти полного отсутствия
света. Образовавшиеся при этом проростки первое время также
развиваются при резкой недостаточности освещения, что приво-
дит к интенсивному удлинению побегов. Вскоре удлиняющиеся
побеги выходят на поверхность, где встречаются с гораздо более
мощным световым потоком. Вместе с тем поверхность почвы,
как правило, сильно затенена уже имеющимся растительным по-
кровом, молекулы хлорофилла которого поглощают большую
часть излучений синего и красного диапазона. Таким образом,
наблюдаемое здесь освещение характеризуется относительно не-
высокой интенсивностью, а также существенным преобладанием
дальнего красного света, весьма малоэффективного в морфогене-
тическом отношении. В соответствии с этим дальнейший фото-
морфогенетический ответ проростков находится в четкой зависи-
мости от жизненной стратегии вида. Так, даже невысокая осве-
щенность, сопровождающаяся преимущественной активацией
фитохрома А, может оказаться вполне достаточной для пророст-
ков теневыносливого растения. Это проявится в запуске всех фо-
томорфогенетических программ, включая резкое снижение тем-
пов роста побегов, ослабление апикального доминирования, пол-
ное развитие листовых пластинок и биогенез хлоропластов.
Однако в случае проростков светолюбивого вида, те же условия
освещения могут оказаться достаточными лишь для распрямления
339
апекса и раскрытия семядолей (у двудольных), а также для час-
тичного снижения интенсивности роста побегов. Вместе с тем
темпы удлинения побегов останутся достаточно высокими, чтобы
обеспечить быстрый выход проростков из зоны затенения на пря-
мой солнечный свет. Этот процесс будет сопровождаться направ-
ленным изгибанием побега за счет фототропической реакции на
хотя и ослабленную, но все же присутствующую синюю область
спектра. Таким образом, частичный морфогенетический ответ,
проявляющийся у светолюбивых растений в условиях затенения,
имеет важное адаптивное значение и носит название синдрома
избегания тени. Развитие этого синдрома позволяет растению ус-
пешно достичь зоны оптимального освещения, где за счет акти-
вации основных фоторецепторных молекул (фитохрома В и
криптохрома) произойдет запуск всех фотоморфогенетических
программ.
ЗАКЛЮЧЕНИЕ
Итак, в этой главе мы рассмотрели несколько сигналов, играю-
щих важнейшую роль в регуляции развития растений. Независимо
от своего происхождения (внутреннего, в случае гормонов, или
внешнего, в случае света), эти сигналы воспринимаются и действу-
ют по одному и тому же молекулярному принципу. Данный прин-
цип часто называют медленным биологическим ответом; в его ос-
нове лежит дифференциальная экспрессия ряда генов в ответ на
восприятие строго определенного сигнала. Широкое использова-
ние растениями именно медленных биологических ответов пред-
ставляется вполне логичным. Действительно, обладая прочными
клеточными стенками, растение не может активно реагировать на
изменения внешней среды, а вынуждено лишь приспосабливаться
к ним. Таким образом, вся система биологического ответа у расте-
ний теснейшим образом взаимосвязана со спецификой их жизнен-
ной стратегии.
Каковы же основные принципы изучения биологических ответов
у растений? Эти принципы (применительно к гормональной систе-
ме) сформулированы известным немецким биологом Д. Е. Шеллом.
Он выдвинул четыре стратегии для изучения молекулярно-генети-
ческой основы гормонального действия и предложил создать мо-
дель, в которой действием гормонов можно было бы манипулиро-
вать на уровне растения. Изолировать мутанты, с нарушением в гор-
мональном метаболизме и клонировать соответствующие гены.
Изолировать гормонсвязывающие белки и клонировать гены, кото-
рые контролируют синтез соответствующего рецептора, а также вы-
делить гены-мишени, экспрессия которых находится под контролем
гормонов.
Таким образом, задачи, поставленные для доказательства роли
гормонов в развитии растений, практически выполнены.
340
Бактериальные гены биосинтеза гормонов использовали как
прекрасный источник для моделирования метаболизма гормонов
у растений (см. часть V). С помощью Т-ДНК генов можно, во-
первых, изменять эндогенное содержание и активность фитогор-
монов; во-вторых, использование различных промоторов, в том
числе тканеспецифических, позволяет изменять уровень экспрес-
сии гормональных генов, что все вместе влияет на морфологию
растения, его фенотип. Использование этой модели позволило
ответить на многие вопросы, связанные с ролью гормонов в мор-
фогенезе и доказать их роль в дифференцировке растений. Так,
основываясь на результатах этих экспериментов удалось пока-
зать.
1. В растениях присутствует гормонрегулируемая система. По-
вышение уровня ИУК и цитокинина может происходить до опре-
деленного порога, после которого клетка с ним не справляется и
погибает.
2. Поддержание уровня гормонов осуществляется: за счет регу-
ляции скорости синтеза (вероятно возможна регуляция конечным
продуктом); за счет конъюгации. <
3. Сверхуровень ИУК и цитокинина приводит к появлению
«гормонального синдрома», который затрагивает апикальное до-
минирование, корнеообразование, формирование ксилемы, кле-
точное деление, лигнификацию и др.
4. В растении имеются клетки, не отвечающие на гормоны, т. е.
реакция на гормоны зависит от компетентности клеток, определя-
емой рецепторной системой.
5. ИУК и цитокинины регулируют рост растений на основе их
взаимодействия, в том числе с этиленом.
Вероятно, в ближайшее время удастся получить трансгенные
растения с измененным уровнем и чувствительностью по другим
гормонам. Гиббереллин, этилен, АБК, цитокинин и ауксин отно-
сят к основным гормонам и называют «классической пятеркой». В
настоящий момент уже достигнут некоторый прогресс в изучении
биосинтеза и механизма действия этих гормонов. Получена серия
мутантов по чувствительности к гормонам, анализ которых под-
твердил, что основные процессы развития растений регулируются
фитогормонами. Показано, что гены, которые определяют ключе-
вые моменты развития растений, являются мишенями для гормо-
нов. Для этилена и частично для ауксина изучен путь передачи
сигнала: известен рецептор и первые этапы этого каскада. В бли-
жайшие годы будет секвенирован геном арабидопсиса и функции
генов, вовлеченных в биосинтез гормонов и сигнальную трансдук-
цию станут более понятными.
Важно подчеркнуть, что действие каждого отдельного фитогор-
мона связано в единую гормональную систему. Связь осуществля-
ется как на уровне метаболизма фитогормонов, так и в процессе
механизма их действия. Например, повышение концентрации аук-
сина приводит к возрастанию синтеза этилена.
341
Возрастание концентрации этилена тормозит полярный транс-
порт ИУК и увеличивает его связывание, т. е. уменьшается уровень
ауксина (обратная связь). Высокий уровень этилена повышает со-
держание АБК, что в свою очередь тормозит синтез этилена. Ци-
токинин способствует повышению уровня ИУК и гиббереллина.
Например, в экспериментах с клеточными культурами in vitro с
трансгенными растениями показано, что соотношение ауксин/ци-
токинин является критическим фактором во многих процессах
развития растений.
Сегодня мы мало знаем о молекулярной природе таких взаимо-
действий. Однако фенотипы некоторых ауксин-чувствительных
мутантов указывают на то, что в передаче сигнала у разных гормо-
нов могут быть задействованы одни и те же компоненты. Напри-
мер, мутанты auxl, axrl и ахг2 характеризуются чувствитель-
ностью сразу к нескольким гормонам. Единичная мутация в одном
из генов AUX1, AXR1 или AXR2 приводит к нарушению ответа к
нескольким гормонам одновременно.
Другим объяснением взаимодействия гормонов может быть тот
факт, что гены AUX1, AXR1 и AXR2 контролируют синтез бел-
ков, которые участвуют в передаче более, чем одного гормональ-
ного сигнала. Например, у животных вторичные мессенджеры,
такие как Са2+ и инозитол 1,4,5-трифосфат, требуются для переда-
чи более, чем одного сигнала.
Кроме того, возможно, что чувствительность к одному гормону
регулируется другим гормоном. Например, уровень этиленового
рецептора может позитивно регулироваться ауксином. Об этом
свидетельствует тот факт, что ауксинустойчивый мутант также ус-
тойчив к этилену, так как чувствительность к этилену находится
под контролем ауксина. И действительно, эксперименты с мутан-
том auxl показали, что в корнях арабидопсиса чувствительность к
этилену увеличивается при воздействии низкой концентрации аук-
сина.
Другой тип гормонального взаимодействия — это регуляция
уровня одного гормона другим. Например, ауксин может регулиро-
вать уровень этилена, стимулируя его синтез во многих раститель-
ных тканях. Кроме того, ГК может регулировать уровень ауксина.
Так, у мутантов гороха dwarf уровень ИУК значительно ниже, чем
у форм дикого типа.
342
По спектру действия все фитогормоны поливалентны, так как
они оказывают влияние на синтез нуклеиновых кислот, белков,
осуществляя регуляцию на всех уровнях биосинтеза.
Итак, нет сомнения в том, что фитогормоны являются ключе-
выми эндогенными сигнальными молекулами, которые регулируют
экспрессию большинства генов, контролирующих развитие расте-
ний.
ЛИТЕРАТУРА
Кулаева О. Н. Этилен в жизни растений # Соросовский образовательный журнал.
1998. № 11. С. 78—84.
Bartel В. Auxin Biosynthesis # Annu. Rev. Plant Physiol. Plant Mol. Biol. 1997. N 48.
P. 51—66.
Brzobohaty B., Moore I., Palme K. Cytokinin metabolism: implications for regulation
of plant growth and development # Plant Mol. Biol. 1994. N 26. P. 1483—1497.
Casal J. J. Phytochromes, cryptochromes, phototropin: photoreceptor interactions in
plants U Photochem. Photobiol. 2000. Vol. 71, N 1. P. 1—11.
D’Agostino I. B., Kieber J. Molecular mechanisms of cytokinin action // Siologia Plan*
tarum. 1997. N 100. P. 505—519.
Ecker J. R. The Ethylene Signal Transduction Pathway in Plants # Science. 1995. Vol.
268, N 5. P. 667—675.
Girudat J., Parcy F., Bertauche N., Gosti F., Leung J. Current advances in abscisic
acid action and signalling # Plant Mol. Biol. 1994. N 26. P. 1557—1577.
Hedden P., Kamiya Y. Gibberellin Biosynthesis: Enzymes, Genes and Their Regulati-
on # Annu. Rev. Plant Physiol. Plant Mol. Biol. 1997. N 48. P. 431—460.
Hooley R. Gibberellins: perception, transduction and responses # Plant Mol. Biol. 1994.
N 26. P. 1529—1555.
Hooley R. Auxin Signaling: Homing in with Targeted Genetics # The Plant Cell. 1998.
Vol. 10. P. 1581—1584.
Kakimoto T. CKI1, a Histidine Kinase Homolog Implicated in Cytokinin Signal Trans-
duction U Science. 1996. Vol. 274, N 8. P. 982—985.
Kieber J. J. The Ethylene Response Pathway in Arabidopsis # Annu. Rev. Plant Phy-
siol. Plant Mol. Biol. 1997. N 48. P. 277—296.
Klee H., Estelle M. Molecular Genetic Approaches to Plant Hormone Biology # Annu.
Rev. Plant Physiol. Plant Mol. Biol. 1991. N 42. P. 529—551.
Lange T. Molecular biology of gibberellin synthesis # Planta. 1998. N 204. P. 409—
419.
Leung J., Giraudat J. Abscisic Acid Signal Transduction # Annu. Rev. Plant Physiol.
Plant Mol. Biol. 1998. N 49. P. 199—222.
Ostin A., Kowalyczk M., Bhalerao R. P., Sandberg G. Metabolism of Indole-3-Acetic
Acid in Arabidopsis U Plant Physiol. 1998. N 118. P. 285—296.
Taylor С. B. GA Signaling: Genes and GTPases # The Plant Cell. 1998. Vol. 10 (2).
P. 131—134.
Whitelam G. C., Patel S., Devlin P. F. Phytochromes and photomorphogenesis in Ara-
bidopsis # Philos. Trans. R. Soc. bond. B. Biol. Sci. 1998. Vol. 29. P. 1445—1453.
ЧАСТЬ IV
МУТУАЛИСТИЧЕСКИЕ СИМБИОЗЫ
(генетическая интеграция растений
и микроорганизмов)
Мутуалистические (взаимовыгодные) отношения с микроор-
ганизмами играют важную роль в жизни растений. За их счет обес-
печивается минеральное питание, защита от патогенов и расти-
тельноядных животных, адаптация к стрессам, а в определенной
степени — и регуляция развития растений (табл. IV. 1). В вы-
полнении этих функций участвуют различные внутриклеточные
симбионты (клубеньковые бактерии, эндомикоризные грибы), эн-
дофиты, населяющие ткани надземных и подземных органов (азот-
фиксаторы Acetobacter и Azoarcus или токсинобразующие спо-
рыньевые грибы), а также эктосимбионты, обитающие на поверх-
ности растений. Хотя многие из этих взаимодействий не являются
для хозяина строго обязательными, в реальных экологических ус-
ловиях, когда растения испытывают дефицит основных элементов
питания и подвергаются действию различных стрессов, их выжива-
ние в очень большой степени зависит от образования симбиозов с
микроорганизмами.
Генетически наиболее изучены симбиозы, образуемые бобовы-
ми растениями и клубеньковыми бактериями (ризобиями). Ризо-
бии (грамотрицательные бактерии родов Azorhizobium, Bradyrhi-
zobium, Rhizobium, Sinorhizobium) являются факультативными
растительными симбионтами, которые легко культивируются ех
planta и доступны для изучения всеми современными генетически-
ми и молекулярными методами. При взаимодействии с хозяевами
ризобии индуцируют процесс клубенькообразования, который
тесно связан с основными функциями растений — цитодифферен-
цировкой и органогенезом, азотным и углеродным обменом, защи-
той от патогенов и регуляцией развития. Поэтому бобово-ризо-
биальный симбиоз — это очень удобная модель для разработки
ряда фундаментальных проблем биологии и генетики растений.
Большие возможности для изучения генетики бобово-ризоби-
ального симбиоза создает то, что его образование является весьма
344
Таблица IV. 1
Основные микробио-растительные симбиозы
Роль в жизни растений Механизм Наиболее изученные симбионты
Минеральное питание Фиксация N2 Ассимиляция питательных веществ из почвы Rhizobium, Bradyrhizobium, Frankia, Anabaena (внутрикле- точные симбионты), Acetobacter, Azoarcus (эндофиты), Azospirillum (эктосимбионты) Микоризные грибы, фосфат- растворяющие бактерии
Защита от рас- тительноядных животных Синтез токсинов Эндофитные микроорганизмы: грибы-аскомицеты (сем. Clavi- cepitaceae); коринеформные бактерии (Clavibacter)
Защита от па- тогенов Ингибирование патогенов (синтез антибиотиков, кон- куренция за питательные субстраты); активация защитных систем Эндосимбиотические (ризобии) и ассоциативные (PGPR) бактерии; эктомикоризные грибы
Адаптация к стрессам Накопление пролина, адсорбция тяжелых металлов Ассоциативные ризобактерии (PGPR)
Регуляция развития Модификация развития корней Образование новых органов* Эктомикоризные грибы Ризобии, Frankia
* Образование недифференцированных структур (опухолей) в результате де-
дифференцировки и пролиферации клеток наблюдаются и при взаимодействии
растений с некоторыми патогенами (Agrobacterium, Pseudomonas).
специфичным: большинство растений способно формировать сим-
биоз лишь с определенными формами ризобий (Medicago, Melilo-
tus, Trigonella — c Rhizobium meliloti; Trifolium — c R. legumino-
sarum bv. trifolii; Pisum и Vicia — c R. 1. bv. viceae). Образование
симбиоза ограничено почти исключительно семейством бобовых;
единственным небобовым, способным к симбиозу с ризобиями, яв-
ляется тропическое растение Parasponia (сем. Ulmaceae). Кроме
того, для бобовых характерно и высокое внутривидовое варьиро-
вание по специфичности симбиоза, которое позволяет анализиро-
вать ее с использованием стандартных методов генетики растений.
Поэтому большинство работ по генетике бобово-ризобиального
симбиоза направлено на анализ механизмов, определяющих спе-
цифичность взаимодействия бобовых растений с ризобиями.
Важным стимулом для изучения бобово-ризобиального симби-
оза является его большая практическая значимость: целый ряд бо-
345
бовых (например, соя, люцерна, горох, арахис) относится к числу
ключевых сельскохозяйственных культур, выращивание которых
на экологически безопасном «биологическом» азоте является очень
актуальной задачей. Эффективность взаимодействия бобовых с
ризобиями может быть достаточно точно измерена (количество за-
фиксированного из атмосферы азота, продуктивность растений),
что открывает возможности для проведения селекционно-генети-
ческих работ, направленных на повышение симбиотической ак-
тивности.
В настоящее время все большее внимание уделяется генетичес-
кому изучению микориз — симбиозов, возникающих при колони-
зации грибами корней растений. Микоризы — самые распростра-
ненные микробно-растительные симбиозы: их образует около
90 % видов наземных растений. При этом грибы играют роль по-
средников между растением и почвой, поставляя хозяину большую
часть необходимых ему питательных веществ. Обычно микориз-
ные симбиозы разделяют на два типа: эндомикоризу и эктомикори-
зу. В случае эндомикоризы гифы гриба (микобионта) проникают
внутрь клеток растения (фитобионта). Этот процесс происходит
во внутреннем кортексе корня и обычно сопровождается клеточ-
ной дифференцировкой обоих партнеров. При образовании экто-
микоризы гриб колонизирует лишь наружный кортекс и не прони-
кает в растительные клетки, хотя взаимодействие сопровождается
выраженными морфологическими и гистологическими изменения-
ми как растительного корня, так и грибного мицелия.
Наиболее широко распространена и изучена неспецифическая
форма эндомикоризы — везикулярно-арбускулярная микориза
(ВАМ), которую формирует большинство наземных растений. Воз-
будителями ВАМ являются грибы-зигомицеты из порядка Glo-
males, для которых образование симбиоза является облигатной
стадией жизненного цикла: вне растения эти грибы стабильно
существуют лишь в форме покоящихся спор. Для растений-хозяев
образование ВАМ может быть как облигатным, так и факульта-
тивным. Наиболее важен этот симбиоз для многолетних форм, а
также для растений со слабо развитыми корневыми волосками и
низкой поглотительной способностью корней.
Эктомикориза, в отличие от ВАМ, факультативна для обоих
партнеров. Ее возбудителями являются различные базидиомицеты,
реже аскомицеты, отдельные виды зигомицетов и несовершенных
грибов. Большинство этих грибов — сапротрофы, которые актив-
но растут в почве или на растительных остатках, а иногда прояв-
ляют фитопатогенные свойства. Растениями-хозяевами эктомико-
ризных грибов являются деревянистые двудольные и голосемянные
растения, многие из которых доминируют в лесных сообществах
умеренных широт (в основном представители сем. сосновых, ки-
парисных, буковых, березовых, липовых, вязовых, ивовых).
Микоризы значительно менее доступны для генетического изу-
чения, чем бобово-ризобиальный симбиоз. В случае ВАМ это свя-
346
зано с невозможностью культивирования ex planta гломусовых
грибов, а в случае эктомикоризы — со сложностью эксперимен-
тального изучения многолетних растений. Кроме того, взаимодей-
ствие растений и микоризных грибов обычно является малоспеци-
фичным. Так, штаммы Glomus могут формировать ВАМ с пред-
ставителями всех типов наземных растений, а на корнях ели
Дугласа (Pseudotsuga menziezi) обнаружены представители 2000 (!)
видов эктомикоризных грибов. Тем не менее даже предваритель-
ные данные о генетическом контроле микориз представляют боль-
шой интерес, так как они являются наиболее древними формами
растительно-микробного взаимодействия, на основе которых воз-
никали все другие его формы.
Генетический анализ растительно-микробных симбиозов имеет
ряд существенных особенностей по сравнению с анализом свобод-
ноживущих организмов. При взаимодействии с микробами у рас-
тения часто проявляются признаки, которыми оно не обладало в
свободноживущем состоянии (например, способность питаться
молекулярным азотом у бобовых при симбиозе с ризобиями или
токсичность у злаковых при симбиозе со спорыньевыми грибами).
Проявление этих признаков является результатом комплементар-
ного взаимодействия растительных и микробных генов, в ходе ко-
торого осуществляется их тонкая перекрестная регуляция, проис-
ходит перенос между партнерами генных продуктов, а иногда и
отдельных генов.
Таким образом, с генетической точки зрения, образование сим-
биоза должно рассматриваться как результат объединения генов
партнеров в стабильные функциональные единицы, т. е. формиро-
вания надорганизменных генетических систем. Основными функ-
циями этих систем являются:
. сигнальные (регуляторные) взаимодействия,
. морфогенез симбиотических структур,
. метаболическая интеграция партнеров.
Генетический контроль этих функций и будет рассмотрен в
данном разделе книги.
Глава IV. 1
СИГНАЛЬНЫЕ ВЗАИМОДЕЙСТВИЯ
Образование любого микробно-растительного симбиоза осно-
вано на обмене партнеров молекулярными сигналами. На самых
ранних этапах происходит выделение сигнальных молекул в окру-
жающую среду (дистантные взаимодействия), а затем начинаются
поверхностные (контактные) взаимодействия партнеров. Результа-
том этих взаимодействий является избирательная активация или
347
репрессия симбиотических генов, которые контролируют взаим-
ное узнавание партнеров, их метаболическую активность, а также
взаимную регуляцию роста и размножения.
IV.1.1. ДЕЙСТВИЕ РАСТИТЕЛЬНЫХ СИГНАЛОВ
НА МИКРОСИМБИОНТОВ
Бобово-ризобиальный симбиоз. Развитие этого симбиоза на-
чинается с того, что флавоноиды, выделяемые семенами и корня-
ми бобовых растений, активируют у ризобий гены вирулентности,
которые обычно называют nod-генами (от nodulation — клубень-
кообразование). Под контролем этих генов ризобии синтезируют
липо-хито-олигосахаридные Nod-факторы, которые инициируют
ранние стадии развития клубеньков у бобовых (рис. IV. 1).
К настоящему времени у ризобий найдено около 50 nod-генов,
мутации в которых нарушают способность формировать клубеньки.
Одни из этих генов являются «общими» (структурно гомологичны-
ми и функционально взаимозаменяемыми) для всех ризобий, а дру-
гие — специфичны для каждого вида или даже штамма. Мутации
«общих» nod-генов (nodA, nodB, nodC) приводят к нарушению
самой ранней стадии развития симбиоза — скручивания корневых
волосков, тогда как при мутациях генов хозяйской специфичности
(nodH, nodP, nodQ, nodZ, nodX) обычно нарушаются более позд-
ние стадии взаимодействия, связанные с формированием инфекци-
онной нити и возникновением клубеньковой меристемы.
Индукция nod-генов была подробно изучена с помощью бакте-
риальных штаммов, у которых проведено их слияние с репортер-
ным геном lacZ (структурный ген 0-гадактозидазы из Escherichia
coli). При использовании такой генетической конструкции экс-
прессия изучаемого nod-гена может регистрироваться по возраста-
нию 0-галактозидазной активности. Было показано, что на первом
этапе взаимодействия флавоноиды, выделяемые в почву семенами
или корнями бобовых, взаимодействуют с бактериальным белком
NodD, который в результате приобретает способность активиро-
вать транскрипцию остальных nod-генов. nodD — единственный
конститутивно работающий ген вирулентности ризобий, тогда как
экспрессия других nod-генов является индуцибельной.
Важно отметить, что nodD-зависимая активация ризобиальных
генов вирулентности не является строго специфичной. Например,
флавоноиды клевера могут активировать nod-гены ризобий люцер-
ны (R. meliloti), а флавоноиды люцерны — nod-гены ризобий кле-
вера (R. leguminosarum bv. trifolii), хотя наиболее сильная индук-
ция происходит все-таки при взаимодействии «гомологичных»
партнеров. При сравнении других бобовых специфичность флаво-
ноидной индукции nod-генов выражена более четко. Например, у
сои наиболее сильными индукторами nod-генов гомологичных ри-
зобий (В. japonicum, S. fredii) являются изофлавоны дайдзеин и
348
Изофлавоны (дайдзеин)
Флавоны (лютеолин) Флаваноны (гесперетин)
/Ян
сн
сн
чсн
//
сн
(СНг)3
СН
II
СН
(СНЖ
сн3
Рис. IV. 1. Сигнальное взаимодействие бобо-
вых растений с ризобиями на ранних стади-
ях развития симбиоза.
А — активация nod-генов ризобий под действием рас-
тительных флавоноидов; Б — контролируемый nod-
генами синтез липо-хито-олигосахаридных Nod-фак-
торов, которые инициируют ранние симбиотические
реакции у растений.
349
генистеин, подавляющие активность nod-генов ризобий люцерны
и клевера.
Молекулярные механизмы nodD-зависимой активации генов
вирулентности изучены весьма подробно. Ген nodD является пред-
ставителем широко распространенного у бактерий семейства регу-
ляторов транскрипции, куда относятся такие хорошо изученные
гены, как lysR и агаС. В структуре белка NodD выявлено два до-
мена: наиболее консервативный N-концевой, который связывается
с ДНК, и менее консервативный С-концевой, который предполо-
жительно взаимодействует с флавоноидами (рис. IV.2, А). Белок
NodD функционирует в составе внутренней мембраны ризобиаль-
ной клетки, через которую проникают флавоноиды. Взаимодейст-
вуя с ними, белок NodD изменяет свою конформацию, в результа-
те чего становится возможным его связывание с консервативной
последовательностью „nod-box”, расположенной в промоторах ин-
дуцибельных генов вирулентности (рис. IV.2, Б). В результате об-
легчается посадка на эти промоторы РНК-полимеразы и индуциру-
ется транскрипция.
Важно отметить, что корни и семена бобовых обычно выделя-
ют целый «букет» разнообразных флавоноидов, одни из которых
являются активаторами, а другие — ингибиторами nod-генов. Для
быстрорастущих ризобий (Rhizobium, Sinorhizobium) активатора-
ми обычно являются флавоны, а ингибиторами изофлавоны, тогда
как у медленнорастущих ризобий (Bradyrhizobum) — напротив,
А
NH2-| I I Р-СООН
Связывание с ,,nod-box” Взаимодействие с флавоноидами
Рис. IV.2. Структура и функции регуляторного белка NodD ризобий.
А — основные домены белка; Б — связывание белка, интегрированного во внутрен-
нюю мембрану, с промоторной последовательностью „nod-box” (F — растительный
фл аво но ид-эффектор).
350
изофлавоны активируют, а флавоны подавляют транскрипцию
nod-генов. Разные флавоноиды конкурируют за взаимодействие с
С-концевым доменом белка NodD, и его способность связываться
с последовательностью „nod-box” определяется как качественным
составом растительных экссудатов, так и количественным соотно-
шением в них различных флавоноидов-эффекторов. Кроме того,
ризобии обладают системами катаболизма флавоноидов, от актив-
ности которых в значительной степени зависит экспрессия nod-
генов. Таким образом, на примере данного взаимодействия видно,
что даже простейший сигнальный процесс довольно сложен: он
включает не только синтез и выделение сигнала, но и его транс-
порт в клетку-мишень, модификацию (процессинг), рецепцию и,
наконец, индукцию регуляторного эффекта.
Везикулярно-арбускулярная микориза (ВАМ). Активация расте-
нием факторов вирулентности микросимбионта наблюдается и на
ранних стадиях взаимодействия растений с гломусовыми грибами.
Корневые экссудаты растения-хозяина стимулируют прорастание
спор Glomus и образование первичных гифов, которые инфициру-
ют корень. Путем инкубирования спор G. mosseae на корнях Lac-
tuca sativa, покрытых различными фильтрами, было показано, что
сигнальные факторы, стимулирующие прорастание спор, имеют
молекулярную массу не более 500 Да. Определенную роль в про-
растании спор играют выделяемые корнями флавоноиды: при их
действии доля прорастающих спор увеличивается от 60 до 90 %, а
длина первичной гифы от 8—9 до 12—13 мм. Однако в случае
ВАМ флавоноиды не оказывают столь ярко выраженного действия
на вирулентность симбионта, как в случае бобово-ризобиального
симбиоза.
IV.1.2. ДЕЙСТВИЕ МИКРОБНЫХ СИГНАЛОВ НА РАСТЕНИЕ
Продуктом действия генов вирулентности является синтез Nod-
факторов, способность к которому — уникальное свойство ризо-
бий. Эти факторы представляют собой модифицированные липо-
хито-олигосахариды, которые состоят из 3—6 остатков N-ацетил-
глюкозамина и радикала ненасыщенной жирной кислоты (16—20
атомов углерода). Биосинтез этих факторов включает следующие
стадии (рис. IV.3).
1. Полимерзиция N-ацетилглюкозамина с образованием 1-4-Р-
гликозидных связей. Эта реакция, катализируемая белком NodC,
приводит к образованию олигомеров хитина.
2. Деацетилирование «нередуцирующего» концевого остатка
глюкозамина в положении R1 (катализируется белком NodB) и
последующее присоединение к атому N жирнокислотного остатка
(катализируется белком NodA).
3. Модификации образовавшегося липо-хито-олигосахарида:
атомы водорода на «редуцирующем» и «нередуцирующем» концах
351
замещаются на различные радикалы (фукозил, сульфат, метил,
ацетил и др.).
Важно отметить, что эти стадии биосинтеза Nod-фактора кон-
тролируются разными группами nod-генов: синтез коровой части
происходить под контролем «общих» nod-генов, а его модифика-
ция — под контролем генов хозяйской специфичности. Однако
эти процессы частично перекрываются во времени: например, ме-
тилирование положения R2 на «нередуцирующем» конце или фу-
козилирование положения R6 на «редуцирующем» конце может
происходить во время или даже до присоединения жирнокислот-
ного остатка.
Очищенные Nod-факторы в концентрации 10'8—10'12 М ини-
циируют ранние стадии формирования симбиоза: скручивание
корневых волосков, закладку клубеньковой меристемы, а у неко-
торых бобовых (люцерна) даже начальные стадии гистогенеза клу-
бенька. У Vicia sativa уже 5—10 мин воздействия Nod-факторов
на корни достаточно для деформации корневых волосков, которая
проявляется через 1 ч, а через 3 ч в восприимчивых зонах корня
может деформироваться большинство корневых волосков. Первы-
ми биохимическими реакциями, которые вызывают Nod-факторы,
являются деполяризация клеточной мембраны корневого волоска
(происходит через 10 мин после инокуляции), а также модуляция
ионных потоков в клетках эпидермиса.
Важно отметить, что Nod-факторы являются теми сигналами,
которые в значительной степени определяют специфичность всего
симбиотического взаимодействия. Наибольшую роль в определе-
нии специфичности играют модификации Nod-фактора, осуществ-
ляемые под контролем генов хозяйской специфичности. Так, суль-
фатирование положения R6 на «редуцирующем конце», характер-
ное для ризобий люцерны (R. meliloti) необходимо для индукции
симбиотических реакций у «гомологичного» хозяина (люцерны),
тогда как отсутствие сульфатной группы необходимо для индук-
ции этих реакций у вики. При мутациях, инактивирующих белок
NodH, который катализирует сульфатирование, R. meliloti утрачи-
вает вирулентность по отношению к люцерне, но приобретает ви-
рулентность к вике, симбионты которой (R. leguminosarum bv. vi-
сеае) лишены гена nodH.
Рис. IV.3. Биосинтез Nod-факторов ризобий.
1 — полимеризация N-ацетилглюкозамина с образованием олигомеров хитина (ката-
лизируется белком NodC); 2 — деацетилирование олигомеров хитина (катализирует-
ся белком NodB); 3 — присоединение радикала ненасыщенной жирной кислоты (R1)
с образованием липо-хито-олигосахаридного Nod-фактора (катализируется белком
Nod А); 4 — модификации Nod-фактора путем замещения атомов водорода в положе-
ниях R2-R7 (катализируются белками-продуктами генов хозяйской специфичности).
Возможные замещения: R2 — метил; R3, R4 — карбамоил; R5 — карбамоил или аце-
тил; R6 — сульфат, ацетил, фукозил, метилфукозил, ацетилметилфукозил или суль-
фометилфукозил; R7 — арабинозил. А — нередуцирующий конец; Б — редуцирую-
щий конец Nod-фактора.
352
I2
13 Генетика
353
Другой пример участия модификации Nod-фактора в контроле
хозяйской специфичности — это ацетилирование положения R6
на «редуцирующем конце», катализируемое геном nodX. Такая мо-
дификация обеспечивает клубеньковым бактериям гороха (R. 1е-
guminosarum bv. viceae) способность инфицировать «афганские»
горохи, которые невосприимчивы к инокуляции, благодаря гомо-
зиготности по аллели sym2. При переносе nodX в лишенные его
штаммы они приобретают способность синтезировать ацетили-
рованный Nod-фактор и формировать клубеньки на «афганских»
горохах. Довольно неожиданным оказалось то, что способность
преодолевать вут2-контролируемую устойчивость растений при-
обретается также при переносе в ризобии гена nodZ, который оп-
ределяет фукозилирование положения R6. Этот ген был выделен
из клубеньковых бактерий сои, которые инфицируют широкий
круг бобовых и способны вызывать ранние симбиотические реак-
ции (например, деформацию корневых волосков) у «афганских»
Горохов.
Одна из гипотез, которые объясняют связь структуры Nod-фак-
тора и специфичности клубенькообразования, состоит в том, что
модификации фактора определяют его устойчивость к действию
растительных хитиназ. Было показано, что корни бобовых синте-
зируют целый ряд хитиназ (а также и других литических фермен-
тов, расщепляющих хито-олигосахариды), устойчивость к кото-
рым зависит от структуры Nod-фактора. В то же время четкой
связи между устойчивостью Nod-факторов к хитиназам и специ-
фичностью симбиоза пока выявить не удалось. Возможно, что сиг-
налом, активирующим симбиотические реакции растения, являет-
ся не сам Nod-фактор, а продукты его процессинга, которые обра-
зуются в мембране или цитоплазме клетки-мишени под действием
литических ферментов.
Роль структуры Nod-фактора в определении специфичности
образования симбиоза не сводится только к модификациям поло-
жений R2—R7. Определенную роль в специфичности играет коли-
чество мономеров N-ацетилглюкозамина (зависит от аллельного
состояния гена nodC), а также длина и степень насыщенности
жирнокислотного остатка (зависит от генов nodEF). Важно отме-
тить, что каждый штамм ризобий продуцирует определенный
«букет» Nod-факторов, и специфичность к тому или иному расте-
нию зависит как от качественного состава этого «букета», так и от
количества каждого из его компонентов.
Большой интерес представляет вопрос о происхождении сиг-
нального взаимодействия ризобий с бобовыми и о его связи с дру-
гими морфогенетическими процессами у растений. С одной сторо-
ны, было показано, что Nod-факторы близки по структуре к оли-
госахаридам, которые играют важную роль в регуляции развития
растений. Поэтому логичным выглядит предположение о том, что
в процессе эволюции симбиоза ризобии «научились» имитировать
синтез этих растительных регуляторов. С другой стороны, Nod-
354
факторы по своей структуре близки к олигомерам хитина — ос-
новного компонента клеточной стенки грибов. Поэтому представ-
ляется возможным и то, что сигнальное взаимодействие ризобий с
бобовыми сформировалось на основе систем узнавания растения-
ми более древних грибных симбионтов, например эндомикориз-
ных грибов. Об этом свидетельствует наличие у бобовых ряда
«общих» генов, контролирующих развитие ВАМ и азотфиксирую-
щих клубеньков (см. с. 371—372).
IV.1.3. ПОВЕРХНОСТНЫЕ ВЗАИМОДЕЙСТВИЯ
МИКРОБНЫХ И РАСТИТЕЛЬНЫХ КЛЕТОК
Важной стадией образования симбиоза является адсорбция
клеток ризобий на поверхности корневых волосков. Она опреде-
ляется способностью растений синтезировать специальные гли-
копротеины (лектины), которые связываются с полисахаридами,
находящимися на поверхности бактерий. Изучение этого взаи-
модействия позволило в начале 80-х годов выдвинуть лектиновую
гипотезу, которая объясняла специфичность образования клу-
беньков как результат комплементарного взаимодействия поверх-
ностных структур бактериальных и растительных клеток по типу
«антиген—антитело» или «ключ к замку» (рис. IV.4).
Эта гипотеза в течение ряда лет являлась предметом оживлен-
ных дискуссий, так как была показана возможность достаточно
прочного прикрепления к корневым волоскам не только специ-
фичных (т. е. образующих клубеньки), но и неспецифичных штам-
Рис. IV.4. Лектиновая «гипотеза» контроля специфичности бобово-ри-
зобиального симбиоза.
а — перекрестно реагирующие антигены (ЭПС, ЛПС); б — растительный лектин;
КВ — корневой волосок; Б — бактериальная клетка.
355
Таблица IV.2
Передача клеверу способности к симбиозу с ризобиями гороха
при введении гена PSL, кодирующего корневой лектин гороха
Штамм Agrobacterium rhizo- genes, которым заражали кле- вер перед инокуляцией ризоби- ями (в скобках указан введен- ный вектор) % растений клевера, образовавших клубеньки с ризобиями Синтез лектина гороха корнями клевера
клевера гороха
LBA1334 100 5 ± 4.9 —
LBA1334 (pBinl9) 100 0 —
LBA1334 (pBinl9PSL) 100 70 ± 10.2 +
LBA1334 (pAGSPSL) 100 58 ± 11.3 +
мов. И лишь в конце 80-х годов удалось получить веские генети-
ческие доказательства в пользу участия лектинов в определении
симбиотической специфичности. С использованием специальных
штаммов агробактерий был осуществлен перенос в корни клевера
гена PSL, кодирующего синтез лектина гороха. В результате кле-
вер приобретал способность синтезировать гороховый лектин и
формировать клубеньки с ризобиями гороха (табл. IV.2). Эти дан-
ные представляют не только теоретический, но и практический
интерес, так как показывают возможность управления симбиоти-
ческой специфичностью.
Таким образом, в настоящее время мы можем говорить о су-
ществовании двух типов сигнального взаимодействия, участвую-
щих в определении специфичности бобово-ризобиального симби-
оза: дистантное взаимодействие (флавоноиды—Nod-факторы) и
контактное взаимодействие (лектины—полисахариды). Были пред-
приняты попытки выявить единый механизм определения специ-
фичности, для чего пытались доказать, что лектины выполняют
роль рецепторов Nod-факторов. Поначалу эта работа была успеш-
ной, так как удалось показать, что при переносе генов хозяйской
специфичности ризобий клевера (R. leguminosarum bv. trifolii) в
ризобии гороха (R. 1. bv. viceae) последние приобретали способ-
ность нодулировать клевер, а также связываться с клеверным лек-
тином (трифолиином). Однако в дальнейшем возможность фи-
зического связывания Nod-факторов с лектинами показать не
удалось, так что вопрос о соотношении двух систем контроля спе-
цифичности симбиоза остается открытым.
IV.1.4. ДИАЛОГ СИМБИОНТОВ
С ЗАЩИТНЫМИ СИСТЕМАМИ ХОЗЯИНА
Бобово-ризобиальный симбиоз. Обменявшись «букетами» мо-
лекулярных сигналов (флавоноиды и Nod-факторы) и осуществив
предварительный поверхностный контакт, растения и бактерии
356
начинают совместную «жизнь под землей», приводящую к глубо-
кой морфо-физиологической дифференцировке клеток и к фор-
мированию структурной основы симбиоза. При этом сигнальные
взаимодействия партнеров переходят в новую стадию, связанную с
регуляцией хозяином скорости размножения и численности кле-
ток симбионта. Такая регуляция очень важна, так как потенциаль-
ная скорость деления у бактериальных клеток намного выше, чем
у растительных. Неконтролируемое размножение эндосимбиоти-
ческих микробов часто оказывается вредным для хозяина, и его
способность строго контролировать размножение симбионта явля-
ется одним из ключевых отличий мутуалистического симбиоза от
паразитизма.
В начале 90-х годов было показано, что при образовании бобо-
во-ризобиального симбиоза у растения индуцируется ряд про-
цессов, которые весьма сходны с защитными реакциями, на-
блюдаемыми при внедрении патогенных микробов. Это синтез
флавоноидов, фенолов, хитиназ, каллозы и пероксидаз. Однако в
клубеньках эти реакции выражены не столь сильно, как при инфи-
цировании патогенами, и их результатом является не инактивация
микроорганизма, а регуляция его размножения и метаболической
активности. Это возможно потому, что в процессе развития сим-
биотической системы наблюдается тонкая регуляция симбионтом
защитных систем хозяина.
Балансировка отношений между партнерами определяется на-
личием у ризобий генов, благодаря которым происходит диалог с
защитными системами хозяина. Мутации в этих генах блокируют
развитие симбиоза, и вместо нормальных клубеньков образуются
псевдоклубеньки, которые не содержат инфекционных нитей с
бактериальными клетками и заполнены недифференцированной
тканью. Функцией этих генов является синтез различных компо-
нентов клеточной поверхности бактерий — кислых экзополисаха-
ридов — сукциноглюканов или ЭПС-1 (ехо-гены), нейтральных
экзополисахаридов — галактоглюканов или ЭПС-2 (ехр-гены), ли-
пополисахаридов (lps-гены) и циклических глюканов (ndv-гены).
В псевдоклубеньках, которые индуцируют мутанты ризобий,
дефектные по ехо-генам, резко усилены защитные реакции —
синтез фенольных соединений, пероксидаз, каллозы, а также лиг-
нификация клеточных стенок. Это показывает, что бактериальные
ЭПС либо подавляют иммунные системы хозяина, либо делают
бактерии устойчивыми к действию этих систем. Наиболее вероя-
тен первый механизм, так как репрессия защитных реакций про-
исходит уже на начальных стадиях развития инфекционной нити
и включает взаимодействие ризобиальных полисахаридов с ре-
цепторами растительных клеток. При отсутствии нормального
полисахарида эти рецепторы становятся мишенью для элиси-
торов (возможно, продуктов деградации растительной клеточной
стенки), которые запускают полномасштабный имунный ответ
(рис. IV.5).
357
- S ® - E R V- L
Рис. IV.5. Подавление защитных реакций у люцерны (Medicago sativa)
при взаимодействии с клубеньковыми бактериями Rhizobium meliloti.
S — супрессоры, Е — элиситоры, R — рецепторы, L — лиазы.
Везикулярно-арбускулярная микориза (ВАМ). Не менее ак-
тивный диалог между эндосимбионтом и защитными системами
хозяина происходит при взаимодействии растений с гломусовыми
грибами. При развитии мицелия Glomus в эпидермисе и кортексе
корня у растения индуцируются процессы, сходные с защитными
реакциями, которые наблюдаются при внедрении в корень пато-
генных грибов. К их числу относятся: модификация клеточной
стенки, индукция синтеза фитоалексинов, накопление каллозы и
патоген-регулируемых (PR) белков (пероксидаз, литических фер-
ментов).
Таким образом, в основе регуляции растениями развития грибов-
мутуалистов и защиты от грибов-патогенов лежат сходные механиз-
мы. В то же время при взаимодействии с мутуалистами и патогенами
эти механизмы действуют по-разному (табл. IV.3). При развитии
Glomus интенсивность защитных реакций, индуцируемых в тканях
корня, ниже, причем эти реакции менее продолжительны и более
дифференцированы во времени и пространстве, чем при патогенезе.
Так, при инфекции корневыми патогенами наблюдается резкая и од-
новременная индукция всех ферментов фенилпропаноидного пути
(PAL — фенилаланин-аммоний лиаза, CHI — халькон-изомераза,
CHS — халькон-синтаза, IFR — изофлавон-редуктаза), приводящая
к активации синтеза флавоноидных фитоалексинов. При развитии
ВАМ активируется лишь часть этих ферментов, причем менее ин-
тенсивно и на разных стадиях развития симбиоза. Литические фер-
менты растения (хитиназы, глюкозидазы) при развитии ВАМ акти-
вируются только на ранних стадиях, а затем их активность падает до
уровня, меньшего, чем у неинокулированных растений. При иноку-
ляции растений патогенными грибами подобного падения не наблю-
дается. Показано, что ответные реакции хозяина на проникновение
эндосимбионта подавляются сигнальными факторами, которые вы-
деляются ВАМ-грибом.
358
Таблица IV.3
Ответные реакции, индуцируемые при проникновении
в корни симбиотических грибов
Реакция Эндомикоризные грибы (Glomus) Патогены (Rhizoctonia)
Модификация клеточной стен- ки (ранние ста- дии инфекции) Синтез флавоно- идных фитоалек- синов* Накопление каллозы Синтез перокси- даз, хитиназ, глюконаз Синтез патоген- регулируемого белка PR-1 Слабое утолщение (без заметной структурной модификации); фенолы не накапливаются Слабое или замедленное возрас- тание концентрации флавонои- дов; PAL, CHI и CHS активны во время колонизации корня, PAL и CHS — при форми- ровании арбускул, IFR не активна На ранних стадиях отсутствует, наблюдается в небольших коли- чествах при формировании арбускул Происходит на ранних стадиях инфекции и отсутствует на стадии формирования арбускул Небольшое количество транс- криптов выявляется вблизи арбускул Сильное утолщение, образование папилл; накопление фенолов Резкое и быстрое возрас- тание концентрации фла- воноидов; одновременная индукция PAL, CHS, CHI и IFR Интенсивно происходит на ранних стадиях инфек- ции Происходит на всех стадиях инфекции Образуется много транс- криптов и белка без спе- цифической субклеточ- ной локализации
* PAL — фенилаланин-аммоний лиаза, CHI — халькон-изомераза, CHS —
халькон-синтаза, IFR — изофлавон-редуктаза.
Об отсутствии прямой связи между интенсивностью защитных
реакций и развитием микоризы говорят данные, полученные при
изучении трансгенных растений табака, которые содержат консти-
тутивный ген хитиназы. У них наблюдали повышенную устойчи-
вость к патогенному грибу Rhizoctonia solani, однако способность
формировать эндомикоризу не изменилась. Растительные мутации,
нарушающие развитие ВАМ, не влияют на устойчивость к пато-
генным грибам (Peronospora, Phytophthora), что говорит о разли-
чии механизмов взаимодействия растений с мутуалистическими и
паразитическими грибами.
IV.1.5. АВТОРЕГУЛЯЦИЯ ОБРАЗОВАНИЯ КЛУБЕНЬКОВ
В разделах IV. 1.1—IV. 1.4 мы рассмотрели обмен сигналами,
который происходит между растениями и микроорганизмами. Од-
нако сигнальные процессы, определяющие формирование симбио-
359
за, этим не ограничиваются, так как между разными органами рас-
тения-хозяина происходит обмен сигналами, направленный на ре-
гуляцию взаимодействия. В случае бобово-ризобиального симбио-
за этот сигналлинг обеспечивает весьма строгую регуляцию числа
клубеньков, что очень важно, так как позволяет растению избегать
избыточного клубенькообразования и тем самым экономить энер-
гию, которая при симбиозе всегда в дефиците.
Регуляция клубенькообразования у бобовых была подробно
изучена с помощью методики «расщепленного корня». Она заклю-
чается в том, что у 3—4-дневных проростков корни разрезают
вдоль, что дает возможность получить растения с 2 корнями. Если
у таких растений один из корней инокулировать ризобиями, то
образование клубеньков на втором корне резко замедляется (при
инокуляции второго корня через 1—2 сут после инокуляции пер-
вого корня) или полностью блокируется (через 3—4 сут после
первой инокуляции). Таким образом, бобовые способны к доста-
точно жесткой авторегуляции клубенькообразования, которая опо-
средована надземной частью т. е. имеет «системный» характер.
Мутации, нарушающие авторегуляцию образования клубень-
ков, получены у ряда бобовых. Их отбирают по фенотипу супер-
клубенькообразования (Nod*4), который заключается в повышении
числа клубеньков в 2—10 раз по сравнению с исходными растени-
ями. Обычно такие мутанты формируют клубеньки в присутствии
высоких доз нитратов, ингибирующих развитие симбиоза у расте-
ний «дикого типа» (фенотип Nts — от nitrate tolerant symbiosis). У
Nod44 мутантов общая нитрогеназная активность (вычисляемая на
1 растение) повышена, а специфическая нитрогеназная активность
(на единицу массы клубеньков) снижена. Важно отметить, что у
большинства Nod44 мутантов наблюдается снижение надземной
массы растений. Это обусловлено, по всей видимости, перерасхо-
дом энергии на образование большого числа азотфиксирующих
клубеньков. Таким образом, на примере данных мутантов видно,
что строгий контроль над количеством эндосимбионта является
важным условием поддержания мутуалистического характера от-
ношений партнеров. При ослаблении этого контроля отношения
могут переходить из мутуалистических в паразитарные, несмотря
на то что ключевой биохимический процесс, который лежит в ос-
нове симбиоза (фиксация N2), не нарушен.
Анализ Nod^-MyraHTOB позволил получить дополнительные до-
казательства того, что авторегуляция клубенькообразования носит
«системный» характер. Это было показано с использованием метода
прививок «корень/стебель». При прививке стеблей Nod^-мутантов
на корни растений «дикого типа» обычно наблюдается образова-
ние повышенного числа клубеньков, тогда как при проведении ре-
ципрокных прививок (стебель дикого типа на корень мутанта)
число клубеньков нормальное.
В дополнение к механизму системной авторегуляции клубень-
кообразования, у бобовых имеется и механизм локальной авторе-
360
гуляции, которая происходит на уровне обмена сигналами между
клубеньками и неинфицированными тканями корня. Мутации, на-
рушающие локальную авторегуляцию, обычно приводят к отсутст-
вию азотфиксации (фенотип Nod++Fix"), а фенотип, вызываемый
ими в опытах с прививками, зависит от корня растения. У гороха
посевного была получена линия, гомозиготная по двум разным
Nod++ мутациям: RisfixC (нарушена системная авторегуляция) и
RisfixV (нарушена локальная авторегуляция). Оказалось, что такая
линия образует в 10.3 раза больше клубеньков, чем исходный
сорт, тогда как исходные мутации повышали число клубеньков в
4.0 и в 5.7 раза соответственно. Таким образом, при нарушении
двух разных систем регуляции наблюдается аддитивное действие
мутаций в отношении числа клубеньков. У двойного мутанта масса
растений была снижена в 4 раза, тогда как у одиночных мутан-
тов — только в 1.5—2 раза.
Глава IV. 2
МОРФОГЕНЕЗ СИМБИОТИЧЕСКИХ СТРУКТУР
IV.2.1. БОБОВО-РИЗОБИАЛЬНЫЙ СИМБИОЗ
Образование хозяином специализированных структур (орга-
нов), содержащих микробные клетки, характерно для многих му-
туалистических симбиозов. Эти органы играют роль экологичес-
кой ниши для симбионта, структурной основы для обмена партне-
ров метаболитами, а также для контроля над численностью и
физиологической активностью симбионта. Выполнение всех этих
функций характерно для клубеньков бобовых. Во-первых, клу-
беньки являются высокоспецифичной экологической нишей для
ризобий: другие микробы проникают в них редко. Во-вторых, в
клубеньках создаются оптимальные условия для обмена партнеров
С- и N-соединениями, а также микроаэрофильные условия, необ-
ходимые для работы нитрогеназы. В-третьих, благодаря локали-
зации бактерий в клубеньках их численность и активность срав-
нительно легко регулируется в зависимости от внешних условий
(освещенность, влажность, присутствие связанного азота), а в не-
благоприятных условиях растение может «сбрасывать» ставшие
ненужными клубеньки.
Онтогенез клубенька. Наиболее подробно развитие клубень-
ков изучено для таких бобовых как горох, клевер, люцерна, соя,
вика (рис. IV.6). Их инфицирование ризобиями происходит через
корневые волоски, которые при этом резко скручиваются, прини-
мая форму «ручки зонтика» (стадия Нас, от hair curling). В месте
наиболее резкого сгиба волоска происходит локальное разруше-
361
Рис. IV.6. Инфицирование бобовых растений ризобиями.
1 — развитие инфекционной нити (А — скручивание корневых волосков, В — рост
инфекционной нити в кортексе, С — эндоцитоз ризобий в растительную цитоплаз-
му); 2 — формирование внутриклеточного симбиоза (А — стенка растительной клет-
ки, В — плазматическая мембрана, С — цитоплазма растительной клетки, D — мат-
рикс инфекционной нити, Е — инфекционная нить, F — инфекционная капля, G —
перибактероидные мембраны, Н — симбиосомы с бактероидами).
ние клеточной стенки, в котором участвуют литические ферменты
обоих партнеров. Плазматическая мембрана растительной клетки
при этом впячивается в цитоплазму, и бактерии проникают внутрь
корневого волоска. В результате вокруг бактериальных клеток об-
разуется особая полость — инфекционная нить (ИН), стенки кото-
рой по структуре сходны со стенками растительных клеток, а
внутреннее пространство заполнено полисахаридным матриксом,
который синтезируется как растительной клеткой, так и бактери-
ями (стадия Itf, от infection thread formation). Таким образом, дан-
ный процесс является результатом не активного внедрения бакте-
риальных клеток в корневые волоски, а, скорее, захвата последни-
ми микросимбионта.
Параллельно с инфицированием происходит закладка клубень-
ковой меристемы, связанная с дедифференцировкой и индукцией
пролиферации клеток кортекса корня (стадия Ccd, от cortical cell
division). ИН, которая через 2—3 сут после инокуляции достигает
основания корневого волоска, проникает в растущий клубенек, где
происходит ее разрастание и ветвление.
Ключевой стадией симбиоза является переход бактерий из ИН
в клетку растения-хозяина, происходящий путем эндоцитоза (ста-
дия Ваг, от bacterial release, рис. IV.6). При этом бактерии окружа-
ются особыми перибактероидными мембранами (ПБМ), которые
образуются из телец аппарата Гольджи и эндоплазматического ре-
тикулюма, а также содержат компоненты бактериального проис-
362
хождения. Число бактерий внутри ПБМ зависит от вида растений:
по 1 — у гороха, люцерны и клевера, по 5—10 — у сои, фасоли
и вигны. Это различие связано с тем, что у одних бобовых проли-
ферация бактерий останавливается немедленно после их эндоци-
тоза, а у других — бактерии проходят еще несколько делений вне
ИН. Бактериальная клетка (клетки), окруженная общей ПБМ, яв-
ляется элементарной структурно-функциональной единицей сим-
биоза, которая называется симбиосомой.
Некоторое время после выхода из ИН ризобии сохраняют свои
размеры и палочковидную форму, однако затем обычно превраща-
ются в особые симбиотические формы — бактероиды (стадия
Bad, от bacteroid differentiation). Последние имеют значительно
большие (в 3—5 раз) размеры, чем свободноживущие бактерии, а
их форма варьирует от шаро- и грушевидной (у клевера) до виль-
чатой или Х-образной (у гороха). Важно отметить, что диффе-
ренцировка бактерий связана с репрессией многих генов, необхо-
димых для автономного роста. По данным ряда авторов, эта ре-
прессия является столь глубокой, что бактероиды уже не могут
превращаться в свободноживущие клетки после отмирания клу-
беньков. В бактероидах синтезируется нитрогеназа, катализирую-
щая восстановление N2 в NH*, а также ряд других ферментов, не-
обходимых для обслуживания нитрогеназной реакции, после чего
в клубеньках начинается фиксация азота (стадия Nif, от nitrogen
fixation). Таким образом, бактероиды могут рассматриваться как
временные клеточные органеллы, функцией которых является
снабжение растений соединениями азота.
Клубенек представляет собой сложно устроенный орган расте-
ния, основными структурами которого являются:
инфицированная бактериями ткань, в которой происходит
фиксация N2;
проводящая ткань, по которой поступают растительные фо-
тосинтаты и выносятся продукты азотфиксации;
меристема, за счет которой происходит рост клубенька
(рис. IV.7).
Клубеньки бобовых обычно подразделяют на детерминирован-
ные (в них меристема существует лишь в течение нескольких
дней, а после ее исчезновения рост клубенька и обновление азот-
фиксирующей ткани прекращается) и недетерминированные (ме-
ристема функционирует в течение нескольких месяцев, обеспечи-
вая постоянное обновление азотфиксирующей ткани). Эти типы
клубеньков различаются по целому ряду морфо-физиологических
характеристик, причем для недетерминированных клубеньков ха-
рактерна более высокая степень дифференцированности как рас-
тительных, так и бактериальных клеток, чем для детерминирован-
ных (табл. IV.4). Детерминированные и недетерминированные клу-
беньки объединяет центральное расположение азотфиксирующей
ткани и периферическое расположение проводящих сосудов, что
позволяет отнести их к «стеблевому» типу (рис. IV.7, А, В).
363
Рис. IV.7. Основные типы азотфиксирующих клубеньков.
А — недетерминированный стеблевой (бобовые); В — детерминированный стебле-
вой (бобовые); С — корневой (небобовые актиноризные и некоторые бобовые расте-
ния). 1 — меристема; 2 — зона образования инфекционных нитей; 2—3 — интерзо-
на; 3 — зона азотфиксации; 4 — зона старения; рг— паренхима клубенька; V —
проводящие пучки; pd — перидерма.
Таблица IV.4
Характеристики недетерминированных и детерминированных
клубеньков бобовых
Признак Недетерминированные клубеньки Детерминированные клубеньки
Существование клубень- ковой меристемы П родолжител ьное (месяцы) Непродолжительное (дни)
Место инициации клу- беньковой меристемы Внутренний кортекс корня Наружный кортекс корня
Способ инфицирования тканей клубенька Инфекционные нити Инфекционные нити и деления инфицирован- ных клеток
Зональность клубенька Ярко выражена Отсутствует
Размер бактероидов Значительно крупнее, чем бактерии Варьирует, обычно немногим крупнее, чем бактерии
Число бактероидов в Один Несколько
симбиосоме
Поли-Р-гидрокси-буги- Отсутствует или накап- Накапливается в
рат в клубеньках ливается в малых коли- чествах больших количествах
Транспортная форма Обычно амиды Обычно уреиды
фиксированного азота
Бобовые Люцерна, клевер, горох Соя, фасоль, вигна
364
Однако разнообразие морфологии симбиоза далеко не исчер-
пывается детерминированным и недетерминированным типами
клубеньков. Для ряда бобовых (арахис, некоторые цезальпиниевые)
характерна принципиально иная, «корневая» структура клубеньков:
проводящие пучки расположены в центре, а азотфиксирующая
ткань — на периферии (рис. IV.7, С). Подобным образом органи-
зованы и клубеньки небобовых растений, образующих симбиоз с ак-
тиномицетами Frankia (деревянистые двудольные) и с ризобиями
(Parasponia). «Корневые» клубеньки возникают не из меристемы,
индуцируемой de novo в кортексе корня, а из примордиев боковых
корней, и, таким образом, данные клубеньки могут рассматриваться
как модифицированные корни. У тропических бобовых Sesbania и
Aeshynomene клубеньки формируются не только на корне, но и на
стебле, причем во втором случае не происходит образования мери-
стемы de novo и клубенек возникает из зачатка воздушного корня.
Еще более просто организован симбиоз у некоторых «прими-
тивных» бобовых из подсемейства цезальпиниевых. Многие из
них вообще не способны формировать клубеньки, однако образу-
ют очень тесные ассоциации со свободноживущими азотфиксато-
рами, которые активно колонизируют кортекс корня и даже могут
проникать внутрь растительных клеток. У тех растений, которые
клубеньки образуют, ризобии не выходят в растительную цито-
плазму, и азотфиксация происходит в ИН. По-видимому, такие
типы структурной организации симбиоза являются, с эволюцион-
ной точки зрения, исходными по отношению к механизму, при
котором происходит проникновение бактерий через корневой во-
лосок с последующим образованием новой меристемы, бактерои-
дов и симбиосом.
Симбиотические морфогены. В настоящее время активно изу-
чаются 2 группы «симбиотических» генов бобовых, которые конт-
ролируют развитие симбиоза. Гены первой группы выявляют с ис-
пользованием методов формальной генетики — путем получения и
анализа мутантов, у которых изменена симбиотическая активность.
Гены второй группы выявляют с использованием методов молеку-
лярной генетики — путем идентификации их продуктов (белков или
мРНК), которые активно синтезируются при симбиозе.
Формально-генетические методы. Для отбора мутан-
тов, дефектных по способности формировать клубеньки (фенотип
Nod") или индуцировать (поддерживать) их азотфиксирующую
активность (фенотип Fix"), растения, инокулированные ризобия-
ми, выращивают в безазотной среде. Мутанты отбирают по призна-
ку угнетенного роста, связанного с голоданием по азоту. Для этих
мутаций хорошо изучено проявление на тканевом и субклеточном
уровнях, что позволяет проследить последовательность процессов,
происходящих при морфогенезе активного клубенька (табл. IV.5).
Для выяснения места экспрессии генов, контролирующих клу-
бенькообразование, был использован метод прививок «корень/сте-
бель», т. е. изучали взаимодействие с ризобиями «химерных»
365
Таблица 1V.5
Гены бобовых, контролирующие основные стадии развития симбиоза
Этап и стадия развития Код Гены, контролирующие данную стадию (виды бобовых)*
Преинфекция
Индукция генов вирулент- ности ризобий Ngi Не выявлены
Деформация корневых во- лосков Нас SYM-8, SYM-9, SYM-10, SYM-19, SYM-30 (Ps), RJ,=NOD1 (Gm), RN1 (Ca), NN,, NN2 (Ms), SYM-3 (Ma)
Формирование клубенько- вой меристемы Ccd SYM-5 (Ps)
Инфицирование растении и развитие клубеньков
Формирование инфекцион? ных нитей Itf SYM-1, SYM-5 (Ma), R, T(Tp)
Авторегуляция образова- ния клубеньков Aut NOD3, SYM-28, SYM-29 (Ps), SYM-5 (Vf), NOD (Pv), NTSl=NOD-2 (Gm)
Эндоцитоз бактерий в рас- тительную цитоплазму Bar D, IP 1ДТр)
Дифференцировка бакте- роидов Bad SYM-31 (Ps), INp IN2, IN4, IN5 (Ms)
Функционирование клубеньков
Фиксация азота Nif Растительные мутанты с нарушением
Стабильность клубеньков Nop этой стадии, как правило, имеют фенотипы Bar", Bad" или Nop" SYM-13, SYM-26, SYM-27 (Ps)
♦ Са — Cicer arietinum, Gm — Glycine max, Ma — Meli lotus albus, Ms — Me-
dicago sativa, Ps — Pisum sativum, Tp — Trifolium pratense, Vf — Vicia faba. Му-
танты с нарушениями стадий Нас, Ccd, Itf имеют фенотип Nod", с нарушениями
стадий Bar, Bad, Nop — фенотип Fix", с нарушением стадии Aut — фенотип
Nod**.
растений, надземная часть которых имеет генотип дикого типа, а
корень — генотип мутанта, или наоборот. Оказалось, что боль-
шинство генов бобовых, мутации в которых нарушают образова-
ние клубеньков или азотфиксацию, функционируют в корне и
лишь некоторые из них — в стебле.
К настоящему времени у бобовых растений (горох, соя, клевер,
люцерна, фасоль, нут, арахис, кормовые бобы, вигна, донник, ляд-
венец) выявлено более 80 генов, участвующих в становлении и
функционировании симбиоза (табл. IV.5). Наибольшее число сим-
биотических мутантов и генов изучено у гороха посевного (Pisum
sativum), который является традиционным модельным объектом
для разработки ряда направлений генетики растений.
366
Важно отметить, что изучение спонтанных и индуцированных
мутантов позволяет выявлять разные спектры «симбиотических»
генов растений. Фенотипическое проявление мутантных аллелей,
выделенных путем анализа спонтанной изменчивости, как прави-
ло, может быть супрессировано при изменении генотипа микро-
симбионта или внешних условий (например, температуры). Так,
неспособность «афганского» гороха (генотип sym-2sym-2) к обра-
зованию клубеньков может быть преодолена штаммами R. legumi-
nosarum bv. viceae, содержащими ген nodX, а на определенном
генотипическом фоне — также и повышенной температурой. Сле-
довательно, спонтанные симбиотические мутации можно опреде-
лить как «физиологические», т. е. приводящие не к полной инак-
тивации, а лишь к изменению функции генов. По-видимому, такие
мутации поддерживаются отбором в процессе коэволюции партне-
ров как адаптивные к определенным условиям обитания хозяина.
Мутантные аллели, получаемые с помощью методов экспери-
ментального мутагенеза, обычно не супрессируются при изменении
генотипа микросимбионта или условий выращивания растений.
По-видимому, эти аллели возникают в результате полной инактива-
ции генов, т. е. являются результатом «структурных мутаций». Адап-
тивная ценность таких мутаций обычно мала и поэтому они редко
выявляются при анализе изменчивости растительных популяций.
Мутантные аллели, контролирующие неспособность растений
к образованию клубеньков (Nod~), являются, за редким исключе-
нием, рецессивными. В то же время аллели, контролирующие не-
способность к азотфиксации (Fix"), могут быть как рецессивными
(у гороха, клевера, люцерны), так и доминантными (у сои). Неко-
торые мутации, нарушающие развитие симбиоза, влияют на мор-
фологию корней и стеблей, скорость развития растений или их
фертильность. Мутанты фенотипа Nod** обычно формируют клу-
беньки в присутствии высоких доз нитратов, ингибирующих раз-
витие симбиоза у растений «дикого типа» (фенотип Nts, от nitrate
tolerant symbiosis).
Молекулярно-генетические методы. Большая группа
симбиотических генов бобовых выявлена путем идентификации
их продуктов — белков или мРНК, которые активно синтезируют-
ся при симбиозе. Эти гены (продукты) называют нодулинами (если
их синтез индуцируется de novo) или Nst-белками (если их синтез
существенно активируется в клубеньках по сравнению с корнями).
Клубенек-специфические белки обычно подразделяют на «ран-
ние» (активируются до начала азотфиксации) и «поздние» (акти-
вируются с началом или во время азотфиксации).
Для многих клубенек-специфических белков была выяснена
субклеточная локализация (цитозоль растительной клетки, пери-
бактероидная мембрана, стенка инфекционной нити; см. табл. IV.6)
или ферментативная активность (многие «поздние» нодулины яв-
ляются клубенек-специфическими изоформами ферментов азотно-
го или углеродного обмена; см. разд. IV.3.1). Так, ранний нодулин
367
Таблица IV.6
Ранние нодулины бобовых растений
Ген Растение Характеристика нодулина Локализация в клубеньке Предполагаемые функции
ENOD2 Горох, соя, вика, люцер- на, клевер Гидроксипро- линбогатый бе- лок типа экстен- синов клеточ- ной стенки Паренхима Формирование кислородного барьера
ENOD5 Горох Имеет сигналь- ные последова- тельности и пролинбогатый домен Зона инфекции и клетки, содер- жащие концы инфекционных нитей Участие в ин- фекционном процессе
ENOD12 Горох, фа- соль, лю- пин, маш, нут, бобы Имеет пролин- богатые участки Зона инфекции Построение кле- точных стенок и инфекцион- ных нитей
ENOD40 Горох, соя Структурно на- поминает РНК- регулятор Перицикл про- водящих пучков Гормональный баланс
ENOD5 активно синтезируется в паренхиме клубенька, участвуя в
формировании «кислородного барьера», a ENOD5 и ENOD12 на-
капливаются в стенках ИН. Нодулин N-26, который синтезируется
при эндоцитозе, обнаруживается в составе ПБМ. По-видимому,
эти белки непосредственно участвуют в формировании структур-
ной основы симбиоза. Конкретные функции этих белков будут
уточнены после того, как удастся получить мутации, специфичес-
ки инактивирующие их синтез.
Изучение генов, контролирующих развитие бобово-ризобиаль-
ного симбиоза, показало, что крупные стадии, выявляемые при ана-
лизе растений дикого типа, могут быть разделены на более мелкие
стадии, каждая из которых контролируется небольшим количеством
(или даже единичными) генами («элементарные стадии»). Последо-
вательность морфогенетических процессов, выявляемая при изуче-
нии мутантных и «диких» растений, в целом совпадает, однако есть
и исключения. Например, мутации, нарушающие системную авторе-
гуляцию клубенькообразования (стадия Aut), обычно сохраняют
способность к азотфиксации, хотя последняя индуцируется гораздо
позднее, чем авторегуляция. Из этого следует, что развитие симбио-
за состоит не из ряда строго последовательных стадий (каждая из ко-
торых начинается только после завершения всех предыдущих), а из
ряда параллельно идущих процессов, которые происходят в значи-
тельной степени независимо друг от друга.
Важно отметить, что для некоторых стадий развития симбиоза
не удалось получить растительные мутации, которые бы их блоки-
368
ровали. Так, все изученные Nod’ мутанты сохраняют способность
индуцировать экспрессию nod-генов ризобий (стадия Ngi, от nodu-
lation gene induction). Это может быть связано или с летальностью
таких мутаций для растений или с многокопийностью генов био-
синтеза флавоноидов. Все выявленные растительные мутанты фе-
нотипа Fix’ имеют либо нарушения формирования симбиосом
(стадии Ваг или Bad), либо стабильности эндосимбиотической
системы (стадия Nop, от nodule persistence). Растительных мутан-
тов, у которых была бы нарушена только стадия Nif, выявить не
удается. По-видимому, стадии Ngi и Nif могут анализироваться
лишь с использованием бактериальных мутантов.
IV2.2. МИКОРИЗА
Везикулярно-арбускулярная микориза (ВАМ). Морфоге-
нез. Развитие ВАМ включает три этапа:
1) преинфекционные взаимодействия,
2) формирование межклеточного мицелия,
3) развитие внутриклеточных симбиотических структур
(рис. IV.8).
Первый этап начинается с прорастания в почве спор гриба, кото-
рое индуцируется растительными экссудатами (разд. IV.1.1). Возни-
кающие при этом первичные гифы образуют на поверхности корня
специальные структуры прикрепления — апрессории. На втором
этапе из апрессория внутрь корня начинает расти инфекционная
гифа. Эта гифа проникает через эпидермис в ткани кортекса, где
ветвится и образует достаточно обильный мицелий. На третьем
этапе в местах тесного контакта мицелия с клетками внутреннего
кортекса гифы проникают в растительные клетки, где формируются
арбускулы — разветвленные впячивания сложной формы, которые
содержат гифу гриба, окруженную растительной плазмалеммой (пе-
риарбускулярной мембраной) и клеточной стенкой.
По своей структуре и функциям арбускулы аналогичны гаусто-
риям — специализированным выростам гифов паразитических
грибов, с помощью которых они извлекают питательные вещества
из клеток хозяина. Арбускулы являются местом наиболее интен-
сивного обмена партнеров метаболитами, в частности передачи в
растение фосфатов, поглощаемых грибом из почвы. Эта передача
может быть облегчена тем, что арбускулы являются эфемерными
структурами: они существуют в течение нескольких дней, после
чего лизируются клеткой-хозяином, а взамен них постоянно расту-
щие в кортексе гифы образуют новые арбускулы.
Важно отметить, что непосредственный контакт цитоплазмы
партнеров при образовании ВАМ никогда не наблюдается. Во-
первых, в арбускулах оба партнера сохраняют клеточные стенки.
Во-вторых, между клетками растительного и бактериального про-
исхождения образуется специальный слой матрикса (апопласт),
369
Рис. IV.8. Морфология везикулярно-арбускулярной микоризы.
А — основные стадии развития; С — увеличенная арбускула; В — микоризообразо-
вание у растений мутантного (Мус’1 и Мус"7) и «дикого» фенотипа.
который содержит полисахариды и ферменты как грибного, так и
растительного происхождения. Сходный по структуре погранич-
ный слой образуется между растительными клетками и межкле-
точными гифами гриба.
При формировании арбускул в растительных клетках наблюда-
ется целый ряд ультраструктурных изменений: уменьшается или
полностью исчезает вакуоль; пластиды деградируют, переходя в со-
стояние пропластид; ядро деформируется и хроматин переходит в
диффузное состояние, что говорит о его высокой транскрипцион-
ной активности. Резко возрастает число телец аппарата Гольджи,
которые участвуют в формировании периарбускулярной мембраны.
Таким образом, взаимодействие растений с ВАМ-грибами мор-
фологически организовано гораздо проще, чем бобово-ризобиаль-
ный симбиоз. Во-первых, при образовании ВАМ сохраняется фи-
370
зическая связь внутри- и межклеточных структур эндосимбионта,
которая утрачивается при образовании симбиосом (рис. IV.9). Во-
вторых, степень изоляции партнеров при образовании ВАМ на-
много выше, чем при образовании симбиоза с ризобиями. В-треть-
их, при образовании ВАМ у растения не возникают специальные
органы и взаимодействие ограничивается структурно оформивши-
мися контактами грибных гифов с растительными клетками.
Генетический контроль. В последние годы начались ра-
боты по выявлению растительных генов, контролирующих ВАМ.
Прямой отбор таких мутантов затруднен тем, что развитие ВАМ
не сопровождается образованием визуально различимых структур.
К счастью, оказалось, что для получения мутантов с нарушенным
развитием ВАМ может быть использован непрямой отбор: их вы-
являют среди ЫосГ-мутантов, не способных формировать клубень-
ки при инокуляции ризобиями. Например, у гороха выявлен целый
ряд генов (SYM-8, SYM-19, SYM-30 и др.), мутации в которых
обладают двойным эффектом: нарушают образование клубеньков
(фенотип Nod") и микоризацию корней (фенотип Мус").
Мутации, нарушающие развитие ВАМ, разделяют на две фе-
нотипические группы: Мус"1 и Мус"2 (рис. IV.8). Мутанты Мус"1
обычно выявляют среди Нас"-мутантов, не способных осуществ-
лять самую раннюю стадию развития клубенька, — скручивание
корневых волосков. У мутантов Мус*1 взаимодействие фито- и ми-
кобионта заканчивается формированием апрессориев, и гифы не
А В
Рис. IV.9. Соотношение внутри- и межклеточных структур эндосимби-
онта при развитии симбиоза.
А — утрата физической связи (бобово-ризобиальный симбиоз); В — сохранение фи-
зической связи (эндомикориза, актинориза).
371
проникают в ткани корня. Мутанты Мус”2 выявляют среди Inf-му-
тантов, у которых развитие клубенька блокировано на стадии фор-
мирования инфекционной нити. У этих мутантов при инокуляции
Glomus формируются как апрессории, так и межклеточный мице-
лий, однако арбускулы не образуются.
Растительные мутанты, дефектные по наиболее ранним стади-
ям развития ВАМ (индукция прорастания грибных спор, формиро-
вание апрессориев), пока выявить не удалось. Более того, иногда
Мус“-мутанты характеризуются повышенной активностью раннего
симбиотического взаимодействия: число образуемых апрессориев
у них повышено в 4—7 раз по сравнению с «диким типом».
Таким образом, развитие ВАМ и бобово-ризобиального симбио-
за контролируется рядом общих генов. Сходство механизмов фор-
мирования этих двух симбиозов было показано также и на молеку-
лярном уровне. Так, Nod-факторы, синтезируемые ризобиями на
ранних стадиях взаимодействия, стимулируют микоризацию кор-
ней. В ходе развития клубеньков и микоризы синтезируются общие
компоненты, в том числе ряд белков перибактериодной и периарбус-
кулярной мембран, а также «ранних» нодулинов (ENOD2, ENODI 1,
ENOD12, ENOD40) и некоторых фракций леггемоглобина. Однако
далеко не все нодулины, индуцируемые при образовании бобово-ри-
зобиального симбиоза, экспрессируются при развитии ВАМ.
При развитии микоризы растения синтезируют de novo опреде-
ленное количество белков, которые отсутствуют в неинокулиро-
ванных корнях (эти белки иногда называют микоризинами). Одна-
ко такие белки составляют лишь около 4 % общего белка корней,
тогда как в случае бобово-ризобиального симбиоза вновь синтези-
руемые белки (нодулины, Nst-белки) могут составлять более поло-
вины от общего пула белков зрелого клубенька. Кроме того, при
развитии микоризы не наблюдается репрессия синтеза белков, вы-
являемых в корнях неинокулированных растений, что характерно
для клубеньков бобовых. Таким образом, при развитии микоризы
дифференциальная экспрессия растительных генов выражена менее
ярко, чем при развитии бобово-ризобиального симбиоза.
Важно отметить, что ВАМ является намного более древней
формой микробно-растительного взаимодействия, чем бобово-ри-
зобиальный симбиоз (ВАМ возникла 400—450 млн лет назад, а
бобово-ризобиальный симбиоз — 60—70 млн лет назад). Очевид-
но, что часть генетической системы, контролирующей развитие
ВАМ, была «использована» растениями при эволюции азотфикси-
рующих клубеньков. Однако в процессе коэволюции бобовых рас-
тений с ризобиями возникали и дополнительные (по сравнению с
микоризой) стадии эндосимбиотического взаимодействия. Об этом
говорит то, что лишь часть растительных генов, контролирующих
развитие клубеньков, участвует в формировании ВАМ. Дополни-
тельные стадии, характерные для бобово-ризобиального симбиоза,
по-видимому, связаны со специфическими поверхностными кон-
тактами бактерий со стенками инфекционной нити и с перибакте-
372
роидными мембранами. Действительно, для бобово-ризобиального
симбиоза характерна намного меньшая степень изоляции партне-
ров, чем для ВАМ, так как в последнем случае на поверхности
арбускул сохраняется растительная клеточная стенка.
Эктомикориза. Образование эктомикоризы сопровождается
рядом морфологических изменений у обоих партнеров. У микоби-
онта образуются две структуры — мантия (чехол из густо спле-
тенных гифов, плотно прилегающих к поверхности корня) и сеть
Гартига (система гифов в тканях кортекса). У фитобионта наблю-
даются существенные модификации развития: образование боль-
шого числа боковых корней, редукция корневых волосков. Эти
изменения обеспечивают тесный контакт между стенками гифов и
растительных клеток и интенсивный обмен партнеров питатель-
ными веществами. В местах контакта грибных и растительных
клеточных стенок образуется матрикс, состоящий из полисахари-
дов и белков.
Возможность культивирования эктомикоризных грибов ex planta
позволила приступить к разработке их частной генетики и к выяв-
лению генов, контролирующих симбиотическое взаимодействие.
Наиболее интенсивные исследования проводятся на базидиомице-
те Pisolithus tinctorius, вступающем в симбиоз с эвкалиптом. По-
Таблица IV. 7
Развитие эктомикоризного симбиоза между
Eucaliptus и базидиомицетом Pisolithus tinctorius
Обозначе- ние стадии Происходящие процессы Гены (белки), активность которых выявлена
Germ Прорастание спор —
Pif Преинфекционный рост гифов —
Pib Преинфекционное ветвление гифов вблизи корня —
Adh Адгезия гифов на поверхности hydPt-1,* hydPt-2*
корня (гидрофобины), gp95,* SRAP,* эктомикоризин Е32*
Pen Проникновение гифов в корень Хитиназы, пероксидазы
Hgn Формирование сети Гартига SR-белки*
Lat Формирование боковых корней EgtubA-1 (тубулин), рагА (ауксин-индуцируемый ген)
Elong Удлинение клеток корня EgtubA-1 (тубулин)
Mer Прекращение деления меристематических клеток —
C-met Углеродный обмен Egidh-1 (изоцитрат- дегидрогеназа)
N-met Азотный обмен gdh-1 (глутамат-дегидрогеназа)
P-met Фосфорный обмен PtAcPh-1 (кислая фосфатаза)*
* Факторы, активируемые у микобионта.
373
лученные результаты позволили разделить образование эктомико-
ризного симбиоза на ряд этапов, которые связаны с дифференци-
альной экспрессией грибных и растительных генов (табл. IV.7).
У гриба Р. tinctorius выявлен ряд генных продуктов, синтез ко-
торых специфически регулируется при взаимодействии с растени-
ем-хозяином (рис. IV.10). Так, синтез ряда поверхностных белков
гриба индуцируется или, напротив, репрессируется при развитии
эктомикоризы. Среди них наиболее изучены гидрофобины — не-
большие по размеру, умеренно гидрофобные белки, богатые цис-
теином. Гидрофобины синтезируются многими мицелиальными
грибами при взаимодействии с растениями, а также при образова-
Поверхность корня
Рис. IV. 10. Дифференциальная экспрессия генов эктомикоризного гри-
ба Pisolithus tinctorius при взаимодействии с растениями эвкалипта.
Е32 — гидрофобии; gp95 — репрессируемый белок; CW — стенки грибных и расти-
тельных клеток.
374
нии плодовых тел и спор. Накапливаясь в клеточной стенке, эти
белки придают им гидрофобные свойства, необходимые для раз-
личных поверхностных взаимодействий.
Важную роль в образовании эктомикоризного симбиоза играют
фитогормоны, синтезируемые грибом. У базидиомицета Hebeloma
cylindrosporum был получен мутант, который синтезирует повы-
шенное количество индолилуксусной кислоты. Он значительно
превосходит исходный штамм по скорости колонизации растения-
хозяина (Pinus pinaster). В стебле и корнях растений, инокулиро-
ванных мутантом, содержание растворимых сахаров повышено, а
содержание крахмала снижено по сравнению с растениями, иноку-
лированными исходным штаммом. Транспорт фотосинтатов в ми-
целий мутанта происходит более интенсивно, чем в мицелий гриба
«дикого типа».
Глава IV. 3
МЕТАБОЛИЧЕСКАЯ ИНТЕГРАЦИЯ ПАРТНЕРОВ
Для многих симбиозов характерна глубокая метаболическая
интеграция партнеров, которая выражается в первую очередь в ус-
тановлении между ними тесных трофических связей (односторон-
них при антагонизме, обычно двусторонних при мутуализме).
Кроме того, при мутуалистических взаимодействиях один из парт-
неров (обычно хозяин) часто приобретает новые биохимические
функции, которые он не способен осуществлять самостоятельно.
IV3.1. БОБОВО-РИЗОБИАЛЬНЫЙ СИМБИОЗ
Главные физиологические проблемы, с которыми сталкивается
бобовое растение-хозяин при симбиозе с ризобиями, — это энер-
гетическое обеспечение процесса азотфиксации и утилизация ее
продуктов. Осуществление нитрогеназной реакции можно выра-
зить формулой:
N2 + 8Н+ + 8е~ + 16АТФ = 2NH3 + Н2 + 16АДФ + 16ФН.
Требуются затраты 7.3 г углеводов на 1 г фиксированного азота. С
учетом энергетических затрат на рост и поддержание структуры
клубенька, а также на ассимиляцию фиксированного азота, эти
затраты возрастают до 12.1 г углеводов. Поэтому функционирова-
ние эффективного симбиоза невозможно без тесного сопряжения
азотфиксации с процессом фотосинтеза, которое осуществляется
на уровне целого растения. На уровне самого клубенька метаболи-
ческая интеграция партнеров выражается в формировании общих
375
Рис. IV. 11. Интеграция метаболических путей растений и бактерий
в азотфиксирующем клубеньке.
ФЕП — фосфоенолпируват, ПБМ — перибактероидная мембрана.
путей С- и N-метаболизма (рис. IV. 11), в которых ключевую роль
играют клубенек-специфичные формы ряда растительных фермен-
тов (табл. IV.8).
Основной генетической стратегией, которая обеспечивает ме-
таболическую интеграцию партнеров, является дифференциальная
экспрессия генов, которая и приводит к образованию тех продук-
тов, функционирование которых необходимо для симбиоза. На-
пример, в бактероидах синтезируется нитрогеназа, катализирую-
щая восстановление N2, а в растительных клетках клубенька —
специфические изоформы ферментов азотного и углеродного об-
мена, которые участвуют в энергетическом обеспечении азотфик-
сации и в ассимиляции ее продуктов (табл. IV.8).
Метаболическая интеграция партнеров может быть связана и с
амплификацией бактериальных и растительных генов, обеспечива-
ющих мутуалистический характер взаимодействия. Для большин-
ства бобово-ризобиальных симбиозов характерна полиплоидность
как бактероидов, так и инфицированных растительных клеток, од-
нако избирательной амплификации каких-либо участков расти-
тельного и бактериального геномов показать не удалось.
Ферменты углеродного обмена. С-соединения, поступающие в
клубеньки, являются источниками энергии для азотфиксации и уг-
леродных «скелетов» для ассимиляции фиксированного азота.
Главная транспортная форма фотоассимилятов, поступающих в
клубеньки бобовых, — это сахароза. В клубеньках сахароза под-
вергается гидролизу до гексоз (глюкозы и фруктозы) при участии
376
Таблица IV.8
Растительные ферменты, специфичные для эффективных клубеньков
Фермент Растение Механизм усиления активности в клубеньках
Углеродный оба ден
Сахарозосинтаза Соя Синтез новой изоформы (ноду- лин N-100)
Малатдегидрогеназа Люпин, горох Синтез новых изоформ (нодули- нов) и/или усиление синтеза Nst-форм
Алкогольдегидрогена- за Люпин Синтез 4 новых изоформ (ноду- линов)
Л актатдегидрогеназа » Тот же
Фосфоенолпируват- карбоксилаза Горох, бобы, фа- соль, люпин, люцерна Синтез новой изоформы (ноду- лина), усиление синтеза Nst-формы
Фосфофруктокиназа Люпин Усиление синтеза Nst-формы
Азотный обмен
Глутаминсинтетаза Фасоль, соя, люцерна, горох, Синтез новой изоформы (ноду- лина), усиление синтеза Nst-формы
NADH-зависимая глу- таматсинтаза Фасоль, люпин Синтез новой формы (нодулина), усиление синтеза Nst-формы
Asp-аминотрансфера- за Люцерна, люпин, горох Усиление синтеза Nst-формы
Gln-зависимая аспара- Люпин, горох, Усиление синтеза Nst-форм AS1
гин-синтетаза люцерна, бобы, соя и AS2
Уриказа Соя, фасоль Синтез новой изоформы (ноду- лин N-35)
главным образом сахарозосинтазы (SS), гидролизующей сахарозу с
участием уридиндифосфата. В клубеньках сои SS составляет 3—
4 % от общего количества растворимых белков цитозоля. По ами-
нокислотной последовательности SS клубеньков сои на 73 % го-
мологична сахарозосинтазе кукурузы. Образующиеся в результате
гидролиза гексозы претерпевают обычный путь катаболизма —
гликолиз. Альтернативный путь — пентозофосфатный цикл, по-
видимому, имеет в клубеньках второстепенное значение. Показа-
но, что по меньшей мере один из ферментов гликолиза — фос-
фофруктокиназа — является Nst-белком.
Высокая активность ферментов гликолиза в цитоплазме расти-
тельных клеток клубенька может быть выявлена благодаря быст-
рому включению метки из гексоз в промежуточные продукты гли-
колиза. В процессе гликолиза центральную роль играет развилка
377
на уровне фосфоенолпирувата (РЕР). Ключевой является реакция
карбоксилирования РЕР, в результате которой образуется оксало-
ацетат (ОАА):
РЕР + нсо; ОАА + Рг
Реакцию катализирует фермент фосфоенолпируваткарбоксила-
за (РЕРС). Образовавшийся оксалоацетат восстанавливается в
малат в реакции, контролируемой малатдегидрогеназой (MDH) —
димерным ферментом с молекулярной массой субъединиц около
40 кДа, локализованным у сои преимущественно в инфицирован-
ных клетках клубенька:
ОАА + NADH2 = малат + NAD+.
Поскольку количество углерода в клубеньках является одним из
основных факторов, лимитирующих азотфиксацию, важное значе-
ние приобретает и нефотосинтетическая (темновая) фиксация СО2,
катализируемая РЕРС:
РЕР + СО2 = малат.
Эта реакция является источником 25 % атомов углерода, по-
ступающих в составе малата и других энергетических субстратов в
бактероиды. Таким образом, за счет работы РЕРС рециклизуется
существенная часть углекислоты, выделяемой при дыхании, кото-
рое в клубеньках происходит очень активно.
Количество РЕРС в клубеньках составляет до 1—2 % от обще-
го количества растворимых белков, причем активность этого фер-
мента может превосходить корневую в несколько десятков раз.
Это мономерный фермент с молекулярным весом около 100 кДа.
При анализе РЕРС из клубеньков гороха, люцерны, фасоли, люпи-
на и кормовых бобов были выявлены либо клубенек-стимулируе-
мые формы фермента, либо формы, являющиеся нодулинами.
Как иммунохимически, так и путем сравнения аминокислот-
ных последовательностей фермента, показана высокая гомология
РЕРС у ряда растений. Клонирование и анализ гена РЕРС люцер-
ны выявили его сложную интрон-экзонную структуру, причем по-
ложение интронов (не транскрибируемых участков ДНК) совпада-
ет с таковым у генов РЕРС некоторых С4-растений и растений с
метаболизмом по типу толстянковых.
Основным источником углерода, который поступает непосред-
ственно в бактероиды, являются дикарбоновые кислоты (в основ-
ном малат), что отличает бактероиды от свободноживущих ризо-
бий, потребляющих сахара. У бактерий имеется система dct-генов,
ответственных за транспорт дикарбоновых кислот. Она включает
ген dctA, который кодирует локализованную в мембране бактеро-
идов сукцинат-пермеазу, а также dctB/D, которые кодируют двух-
компонентную белковую систему, регулирующую транскрипцию
dctA. Поступивший в бактероиды малат вовлекается в реакции
цикла трикарбоновых кислот (ЦТК), являясь источником энергии
378
для азотфиксации и сопряженных с ней биохимических процес-
сов.
Ферменты азотного обмена. Образовавшийся в процессе азот-
фиксации аммоний поступает из бактероидов в цитоплазму расти-
тельных клеток клубенька и включается в их метаболизм. В пер-
вичной ассимиляции аммония ключевую роль играют ферменты
глутаматсинтазного цикла — глутаминсинтетеза (GS) и NADH-
зависимая глутаматсинтаза (NADH-GOGAT).
глутамат глутамат
NH4 GS ^NADH-GOGAT
глутамин 2-оксоглутарат
GS растений занимает ключевое место в утилизации NH* различ-
ного происхождения (образующийся при ассимиляции нитратов,
при азотфиксации или в результате различных катаболических ре-
акций — таких как фотодыхание, катаболизм аспарагина и уреидов
и т. д.). Многократное возрастание активности GS при клубенькооб-
разовании отмечено у многих бобовых. Показано, что фермент ло-
кализован преимущественно в цитоплазме, хотя небольшое его ко-
личество найдено в пластидах и в перибактероидной мембране.
GS, выделенная из клубеньков фасоли, представляет собой ок-
тамерный фермент, состоящий из субъединиц одинаковой молеку-
лярной массы — около 40 кДа. Выявлены три изофермента (GSN1,
GSN2 и GSL2), причем два первых локализованы в цитоплазме, а
третий — в пластидах инфицированных растительных клеток.
При этом клубенек-специфичной изоформой (нодулином) являет-
ся только GSN1, а точнее — лишь одна из ее субъединиц. В насто-
ящее время определена нуклеотидная последовательность генов,
кодирующих все 4 типа субъединиц GS у фасоли. Оказалось, что
3 из 4 генов имеют более 85 % гомологии друг с другом.
Вторым ферментом глутаматсинтазного цикла является NADH-
GOGAT, локализованная, в отличие от клубенек-специфической
GS, в пластидах растительных клеток. Таким образом, в клетках
клубенька обнаружено разобщение ферментов глутаматсинтазного
цикла (GS — в цитоплазме, a NADH-GOGAT — в пластидах).
Такое разобщение реакций единого цикла предполагает наличие
специального белка-транслокатора, переносящего глутамин из ци-
тозоля в пластиды.
Многие данные показывают, что именно реакция, катализируе-
мая NADH-GOGAT, является лимитирующей стадией в ассимиля-
ции фиксированного азота: активность NADH-GOGAT невысока
даже в эффективных клубеньках. В неэффективных же клубеньках
активность этого фермента, как и наличие ее мРНК, часто не удает-
ся зарегистрировать вообще. Клубеньковая NADH-GOGAT у люпи-
на, люцерны и гороха представлена одной молекулярной формой с
379
массой более 200 кДа, индуцирующейся при клубенькообразова-
нии. В клубеньках фасоли синтезируются два изофермента NADH-
GOGAT, один из которых является клубенек-стимулируемым.
Помимо глутамина главной транспортной формой азота у
большинства бобовых растений, произрастающих в умеренных
широтах (например, у гороха и люцерны), являются амиды — в
основном аспарагин. Эти бобовые часто выделяют в амидный тип.
У других бобовых (фасоль, соя, вигна) транспорт азота происхо-
дит в форме уреидов — аллантоина и аллантоиновой кислоты.
Эти бобовые относят к уреидному типу.
У амидных бобовых одним из важнейших ферментов ассимиля-
ции фиксированного азота является аспартатаминотрансфераза
(ААТ), которая катализирует реакцию образования аспартата —
предшественника аспарагина. ААТ выполняет и другие важные
функции в азотфиксирующих клубеньках: совместно с МДГ функ-
ционирует как малат-аспартатная челночная система переноса
восстановительных эквивалентов между цитоплазмой и клеточны-
ми компартментами, а также между растительной цитоплазмой и
бактероидами; регулирует распределение пулов азота и углерода
между партнерами.
У всех бобовых клубеньковая ААТ представлена двумя изофор-
мами — ААТ-1 и ААТ-2. У амидных бобовых формирование клу-
беньков сопровождается уменьшением количества ААТ-1, одно-
временно со значительным возрастанием ААТ-2, что позволяет
считать последнюю клубенек-стимулируемым белком. Существо-
вание белков, подобных ААТ-2, выявлено иммунохимически у
многих видов бобовых. Однако в зрелых клубеньках амидных бо-
бовых соотношение ААТ-1: ААТ-2 составляет примерно 30:70 %,
тогда как в клубеньках уреидных бобовых это соотношение обрат-
ное. Эти данные подтверждают важную роль ААТ-2 в ассимиля-
ции фиксированного азота у бобовых амидного типа.
Изофермент ААТ-2 является гомодимерной молекулой; моле-
кулярная масса ее субъединиц у люцерны, люпина и гороха состав-
ляет примерно 40—45 кДа. Показано, что изоферменты ААТ-1 и
ААТ-2 являются продуктами разных генов. У люцерны, люпина и
сои определены нуклеотидные последовательности клонов кДНК,
кодирующих ААТ-2. Изофермент ААТ-2 может быть представлен
несколькими формами, которые различаются по аминокислотному
составу, но являются аллельными продуктами одного и того же
гена. К настоящему времени клонирован ген ААТ-2 у люцерны и
изучена структура его промоторной области. Показано, что у горо-
ха ген, кодирующий ААТ-2, находится в первой группе сцепления.
Анализ внутриклеточной локализации различных форм ААТ
показал, что ААТ-2 является пластидным ферментом, локализо-
ванным преимущественно в инфицированных клетках клубеньков,
тогда как ААТ-1 находится в цитоплазме и, по-видимому, связана
с функционированием перибактероидной мембраны. Полученные
данные приводят к заключению об участии пластид не только в
380
углеродном метаболизме клубеньков, но также и в ассимиляции
фиксированного азота. Различная внутриклеточная локализация
ААТ-1 и ААТ-2 свидетельствует о разделении функций между
этими изоферментами: для ААТ-2 — это участие в формировании
пула аспарагина, идущего на транспорт, а для ААТ-1 — создание
малат-аспартатного челнока между растительной частью клубень-
ка и бактероидами.
Глутаминзависимая аспарагинсинтетаза (AS) катализирует био-
синтез аспарагина из аспартата и глутамина. Эта ферментативная
реакция имеет большое значение, в частности в клубеньках бобо-
вых растений амидного типа, у которых именно аспарагин являет-
ся главной транспортной формой азота. Показано многократное
возрастание активности AS в эффективных клубеньках по сравне-
нию с корнями и неэффективными клубеньками. Измерение ак-
тивности AS во фракциях, полученных после дифференциального
центрифугирования, выявило преимущественную локализацию
фермента в растительной цитоплазме.
У гороха выявлены два гена, кодирующие полипептиды AS, —
AS1 и AS2. Экспрессия генов, кодирующих AS1 и AS2, значитель-
но усиливается при образовании эффективных клубеньков: уро-
вень мРНК в клубеньках возрастает по сравнению с корнями в 20
раз для AS1 и в 5 раз — для AS2. Таким образом, AS1 и AS2
являются клубенек-стимулируемыми белками.
Как уже отмечалось, многие бобовые транспортируют в над-
земные органы фиксированный азот в форме уреидов — алланто-
ина и аллантоиновой кислоты. Биосинтез последних осуществля-
ется в ходе последовательных ферментативных реакций биосинте-
за и окисления пуринов, пространственно разобщенных между
собой: биосинтез пуринов происходит в инфицированных клет-
ках, тогда как их окисление — в неинфицированных.
Уриказа или нодулин N-35 осуществляет один из конечных
этапов биосинтеза уреидов — образование аллантоина путем
окисления мочевой кислоты, образующейся в ходе окисления пу-
ринов. В клубеньках сои уриказа составляет до 4 % от общего
количества белков цитоплазмы. Этот фермент локализован в пер-
оксисомах неинфицированных клеток, в которые из инфициро-
ванных клеток поступает мочевая кислота. По-видимому, именно
мочевая кислота является индуктором синтеза уриказы.
Заканчивая обзор данных о ферментах азотного и углеродного
обмена в клубеньках бобовых, отметим еще раз, что симбиотичес-
кая азотфиксация сопровождается индукцией или резким усилени-
ем активности целого ряда этих ферментов (табл. IV.8). Формиро-
вание общих путей метаболизма С- и N-соединений происходит
благодаря перекрестной регуляции и дифференциальной экспрес-
сии бактериальных и растительных генов. Выявлены существен-
ные различия в метаболизме клубеньков амидного и уреидного
типов. В клубеньках уреидных бобовых наиболее активны фер-
менты синтеза и окисления пуринов, а также биосинтеза глицина.
381
Важную роль в метаболизме этих клубеньков играют уриказа и,
вероятно, ферменты пентозофосфатного пути. В свою очередь в
амидтранспортирующих клубеньках были обнаружены более вы-
сокие активности AS, ААТ-2 и РЕРС.
Леггемоглобины. Важным условием функционирования клубень-
ка является поддержание в нем микроаэрофильных условий, так как
синтезируемая бактериями нитрогеназа быстро и необратимо инак-
тивируется молекулярным кислородом. Однако энергоемкий про-
цесс азотфиксации возможен лишь при высокой интенсивности
окислительного фосфорилирования, для чего необходимо поступ-
ление больших количеств О2 к бактериальным цитохромоксидазам.
Для решения возникающего «кислородного парадокса» растение
имеет два механизма:
образование диффузионного барьера — слоя тесно прилега-
ющих друг к другу клеток, который препятствует газообмену
клубенька с окружающей средой;
. синтез гемоглобинподобного белка (легоглобина), который
связывает О2 и обеспечивает его транспорт к симбиосомам.
Долгое время считалось, что синтез легоглобина является уни-
кальным свойством бобовых, которое могло возникнуть в резуль-
тате лишь очень редких генетических событий, например горизон-
тального переноса генов из животных в растения. Однако позднее
выяснилось, что гемоглобинподобные белки в небольших количес-
твах синтезируются практически у всех растений, выполняя, по-
видимому, роль сенсоров кислорода. Следовательно гены, кодиру-
ющие синтез легоглобина, могли быть получены бобовыми от их
предков путем обычного «вертикального» наследования. Кроме
того, гемоглобинподобные белки активно синтезируются в клу-
беньках небобовых растений, образующих симбиоз с актиноми-
цетами Frankia («актиноризные» растения) и с ризобиями (Paras-
ponia).
Как «симбиотические», так и «несимбиотические» гемоглоби-
ны кодируются у растений генами, содержащими 3 интрона, что
отличает их от генов гемоглобина позвоночных, которые содержат
2 интрона. Предполагается, что гены симбиотических гемоглоби-
нов возникли путем дупликации генов несимбиотических гемогло-
бинов. В процессе коэволюции растений с микробами-азотфикса-
торами происходила дивергенция этих генов, в первую очередь их
промоторных областей, что обусловило возможность очень актив-
ной экспрессии симбиотических гемоглобинов в клубеньках (где
они могут составлять до 30 % от общего количества белка). Бел-
ковые последовательности для симбиотических гемоглобинов рас-
тений короче, чем для несимбиотических (144—154 и 160—166
аминокислотных остатков соответственно). При сравнении разных
видов бобовых было показано, что вариабельность последователь-
ностей для симбиотических гемоглобинов выше, чем для несим-
биотических гемоглобинов. Это может быть связано с повышен-
ной скоростью эволюции симбиотических гемоглобинов.
382
BBS I
Nice Element
ACO ATG
Рис. IV. 12. Структура промотора гена легоглобина у бобового Sesbania rostrata.
BBS1 и BS2 — сайты связывания с бактериальными белками; Nice Element — последовательность, обеспечивающая интенсивную экспрессию гена Srgl3 в клу-
беньке.
Экспрессия генов легоглобина в клубеньках, по всей видимос-
ти, основана на обмене партнеров регуляторными сигнальными
факторами. Об этом говорит присутствие в промоторах генов ле-
гоглобина последовательностей, которые гомологичны некоторым
бактериальным промоторам и могут быть потенциальными мише-
нями для сигнальных молекул, поступающих в растительные клет-
ки от бактерий (рис. IV. 12). Удалось выявить бактериальные ДНК-
связывающие белки, которые взаимодействуют с промоторами
генов легоглобина бобовых.
IV3.2. МИКОРИЗА
Значение микоризы в жизни высших растений очень велико и
многообразно. Эндомикориза (ВАМ) является основным постав-
щиком в растения соединений фосфора, которые микобионт из-
влекает из труднорастворимых почвенных фосфатов. Эктомикори-
за — важнейший источник для растений связанного азота, а также
и других макроэлементов — фосфора, калия, кальция. Однако
экологическое значение микоризы не сводится к оптимизации ми-
нерального питания растений. Микоризные грибы могут защищать
корни растений от почвенных патогенов, а также стимулировать
рост хозяина за счет выработки фитогормонов и витаминов. Общим
итогом этих взаимодействий является повышение видового разно-
образия и продуктивности фитоценозов, которое четко коррелиру-
ет с численностью и разнообразием микоризных грибов, обитаю-
щих в почве.
Везикулярно-арбускулярная микориза (ВАМ). Тесная метабо-
лическая интеграция растений и микоризных грибов выявляется
при анализе их ферментативных активностей. При развитии ВАМ
в инфицированных грибом растительных клетках вблизи арбускул
синтезируется ряд ферментов, в том числе нейтральная фосфатаза
(она участвует в синтезе периарбускулярной мембраны) и АТФаза
(связана с протонной помпой, необходимой для транспорта ме-
таболитов между партнерами). Кроме того, вблизи арбускул наблю-
дается синтез а-тубулина, что свидетельствует о важной роли ци-
тоскелета в формировании внутриклеточных симбиотических
структур.
В инфекционных гифах на ранних стадиях симбиоза (образова-
ние апрессориев) синтезируются ферменты деградации клеточной
стенки (пектиназа, эндополигалактуроназа, целлюлаза), необходи-
мые для проникновения гриба в корень. На более поздних стадиях
развития в гифах весьма активна сукцинат-дегидрогеназа, которая
обусловливает высокую метаболическую активность гриба и может
служить хорошим гистохимическим маркером для его выявления в
тканях хозяина. Кроме того, в гифах гриба выявляются фосфатазы,
которые наиболее активны на поздних стадиях взаимодействия. Эти
фосфатазы связаны с синтезом и распадом полифосфатов, большое
384
количество которых выявляется в грибных вакуолях. Возможно, что
активация грибных фосфатаз связана с ассимиляцией почвенных
фосфатов, их метаболизмом и транспортом в растение.
Эктомикориза. Соединения азота, поставляемые эктомикориз-
ными грибами в растения, образуются при деструкции различных
почвенных соединений (гумус, пептиды, хитин) в процессе сапро-
трофного питания гриба. Важно отметить, что для бобовых, спо-
собных к симбиозу с ризобиями, образование эктомикоризы неха-
рактерно. По-видимому, образование эктомикоризы и азотфикси-
рующих клубеньков — это два альтернативных способа получения
азотных соединений двудольными растениями.
Метаболическая интеграция эктомикоризных грибов и расте-
ний наиболее подробно изучена на примере ассимиляции почвен-
ных пептидов (рис. IV. 13). Она включает следующие процессы:
1) деструкция пептидов литическими экзоферментами гриба;
2) поглощение мицелием образовавшихся аминокислот и оли-
гопептидов;
3) их транспорт в эндофитную часть мицелия — сеть Гартига
(он происходит посредством специальных везикул и облегчен тем,
что в мицелии часто отсутствует септирование, т. е. нет перегоро-
док между клетками);
Клетка гриба Клетка растения
Рис. IV. 13. Схема утилизации азотных соединений почвы эктомикори-
зой.
1 — низкоспецифичные мембранные переносчики аминокислот у грибов; 2 — вне-
клеточные протеолитические пептидазы грибов; 3 — мембранные переносчики оли-
гопептидов у грибов; 4 — мембранные переносчики аммония и нитрата у грибов; 5 —
система выброса азотсодержащих веществ из грибных гифов; 6,7 — мембранные пе-
реносчики аминокислот у растений; 8 — переносчики сахаров.
14 Генетика
385
4) активный выброс азотсодержащих соединений из гифов в
апопласт;
5) их поглощение растительными клетками.
Все эти процессы достаточно подробно охарактеризованы фи-
зиологически, и в настоящее время уже начаты работы по выявле-
нию грибных и растительных генов, обеспечивающих их метабо-
лическую интеграцию.
ЗАКЛЮЧЕНИЕ
Мутуалистические (взаимовыгодные) симбиозы с микроорганиз-
мами играют важную роль в жизни растений, обеспечивая их мине-
ральное питание, защиту от патогенов и растительноядных живот-
ных, а также адаптацию к стрессам. В процессе становления и функ-
ционирования симбиозов происходит тесное взаимодействие генов
партнеров, главным образом путем обмена регуляторными сигнала-
ми. Сигналлинг обеспечивает перекрестную регуляцию «симбиоти-
ческих» генов растений и бактерий, которые на время существова-
ния симбиоза объединяются в надорганизменную генетическую сис-
тему. Результатами действия этой системы являются, во-первых,
тесная метаболическая интеграция партнеров, во-вторых, строгая
регуляция хозяином скорости размножения симбионта и, в-третьих,
образование специальных симбиотических структур.
Наиболее подробно все эти процессы изучены на примере сим-
биоза бобовых растений с азотфиксирующими микроорганизма-
ми — клубеньковыми бактериями. Методология генетического
анализа, разработанная на модели бобово-ризобиального симбио-
за, в настоящее время широко используется для изучении широко-
го круга растительно-микробных систем (везикулярно-арбускуляр-
ная микориза, эктомикориза, симбиозы с эндофитными и ассоци-
ативными микроорганизмами).
На модели бобово-ризобиального симбиоза было показано, что
сигнальные взаимодействия растений и микроорганизмов весьма
разнообразны: они включают дистантные и контактные взаимо-
действия, которые осуществляются как на ранних, так и на позд-
них стадиях симбиоза. Более того, эти взаимодействия включают
не только обмен у партнеров регуляторными факторами, но также
и передачу сигналов между разными органами хозяина. Последняя
обеспечивает системную регуляцию симбиоза даже в тех случаях,
когда микросимбионт локализован в каком-то определенном рас-
тительном органе, например в корневом клубеньке.
Растительно-микробные симбиозы существенно варьируют по
сложности своей морфологической организации. В одних случаях
наблюдается образование сложно устроенных растительных орга-
нов (например, корневых клубеньков у бобовых и актиноризных
растений), в других случаях симбиоз ограничивается формирова-
нием структурно оформившихся контактов растительных и мик-
386
робных клеток (микориза). Однако в обоих случаях развитие
структурной основы симбиоза строго контролируется специальны-
ми растительными генами, большинство из которых экспрессиру-
ется только при взаимодействии с микроорганизмами и не участ-
вует в развитии «несимбиотических» органов растения. Таким об-
разом, формирование симбиоза — это особая стратегия развития,
которая эволюционно связана с общими морфогенетическими
программами, но оформилась главным образом в процессе коэво-
люции растений с микроорганизмами.
Метаболическая интеграция партнеров является наиболее изу-
ченной стороной взаимодействия, так как она самым тесным обра-
зом связана с «эффективностью симбиоза» — его вкладом в про-
дуктивность растений. Дифференциальная экспрессия генов, кото-
рая наблюдается в ходе метаболической интеграции растений и
бактерий, выражается в формировании единых биохимических
путей, по которым между партнерами перемещаются пластические
материалы и энергетические субстраты. Масштабы этих переме-
щений столь велики, что значительная часть круговорота веществ
и энергии в биоценозах приходится именно на растительно-мик-
робные симбиозы.
Таким образом, взаимодействие растений и симбиотических
микроорганизмов представляет собой комплекс генетических про-
цессов, которые осуществляются посредством тонких молекуляр-
ных взаимодействий, но при этом имеют глобальные экологичес-
кие последствия. Кроме того, эти взаимодействия находят все
более широкое применение в сельскохозяйственной практике
(увеличение продуктивности культурных растений, снижение
энергоемкости и повышение экологической безопасности сельско-
хозяйственного производства), что делает весьма актуальным их
дальнейшее изучение.
ЛИТЕРАТУРА
Генетика симбиотической азотфиксации с основами селекции / Под ред. И. А. Ти-
хоновича и Н. А. Проворова. СПб.: Наука, 1998. 194 с.
Кретович В. Л. Биохимия усвоения азота воздуха растениями. М.: Наука, 1994.
168 с.
Проворов Н. А. Эволюция генетических систем симбиоза у клубеньковых бакте-
рий 0 Генетика. 1996. Т. 32, № 8. С. 1029—1040.
Симаров Б. В., Аронштам А. А., Новикова Н. И. и др. Генетические основы се-
лекции клубеньковых бактерий. Л.: Агропромиздат, 1990. 192 с.
Douglas А. Е. Symbiotic interactions. Oxford etc., 1994. 148 p.
Spaink H. P. The molecular basis of infection and nodulation by rhizobia: the ins and
outs of sympathogenesis / Annu. Rev. Phytopathol. 1995. Vol. 33. P. 345—368.
ЧАСТЬ V
ВЗАИМОДЕЙСТВИЕ РАСТЕНИЙ
С АГРОБАКТЕРИЯМИ: КОНЦЕПЦИЯ
ГЕНЕТИЧЕСКОЙ КОЛОНИЗАЦИИ
В настоящее время взаимодействие растение—агробактерия
широко используется как в фундаментальных исследованиях, так
и в практике.
Агробактериальные векторы представляют собой уникальную
природную систему для введения чужеродных генов в растения,
которая гарантированно обеспечивает перенос и включение в
геном растительных клеток экзогенной ДНК без каких-либо пере-
строек. Использование агробактериальных векторов обеспечивает
высокую степень стабильности передачи в поколениях трансген-
ных растений введенных чужеродных генов.
Модель агробактерия—растение представляет огромный инте-
рес для изучения природного взаимодействия про- и эукариотичес-
ких организмов. Это уникальный пример генетической колониза-
ции, когда представители разных царств в процессе молекулярного
диалога завоевывают экологические ниши для обеспечения про-
цессов питания, роста и размножения.
Глава V.1
ХАРАКТЕРИСТИКА ОПУХОЛЕЙ,
ИНДУЦИРУЕМЫХ АГРОБАКТЕРИЯМИ
Полная характеристика растительных опухолей агробактери-
ального происхождения включает морфологические, цитологи-
ческие, биохимические, генетические и другие аспекты. Остано-
вимся на рассмотрении лишь тех феноменологических сторон
проблемы, знание которых необходимо для уяснения молекуляр-
но-генетических механизмов процесса индукции опухолей или,
388
иными словами, опухолевой трансформации растений агробакте-
риями. Опухолевая трансформация проявляется в гипертрофии,
возникающей после проникновения агробактерий в пораненные
участки (сайты) растений. Трансформация является результатом
стабильного ковалентного включения (инсерции или интеграции)
сегмента («transferred» или Т-ДНК) большой плазмиды (pTi —
tumor inducing или pRi — root inducing) бактерий в ядерную
ДНК растительной клетки. В отличие от большинства тканей,
взятых из нормальных растений, трансформированные ткани в
культуре in vitro в асептических (стерильных) условиях способны
неограниченно расти в отсутствие экзогенно добавленных аукси-
нов и цитокининов. Кроме того, трансформированные ткани
часто синтезируют одну или более групп соединений, названных
опинами, которые обычно не обнаруживаются в нетрансформи-
рованных растительных тканях.
Наиболее подробно изучены опухоли — корончатые галлы,
индуцируемые Agrobacterium tumefaciens. Они представляют собой
истинно злокачественные опухоли, которые могут расти в культу-
ральной среде в отсутствие стимуляторов роста — фитогормонов,
необходимых для роста нормальных тканей. Опухоли можно под-
держивать в течение многих лет in vitro, и при их использовании
они способны вызывать опухоли у здоровых растений. В приро-
дных условиях корончатые галлы образуются в месте соединения
корня со стеблем (у корневой шейки), откуда и произошло их
название корончатый галл (рис. V.1). Однако корончатые галлы
могут развиваться и на подземных частях растения, например на
корнях плодовых деревьев, и на надземных, например на стебле
винограда.
В лаборатории эти заболевания можно вызвать у здоровых рас-
тений экспериментально, путем инфицирования их бактериями.
Растения перед инокуляцией должны быть поранены, при этом
опухоли возникают в поврежденных сайтах растения, обычно на
стебле или листьях растения. При искусственном заражении к
опухолеобразованию в принципе могут перейти любые поранен-
ные органы растения, за исключением кончиков корешков и ме-
ристематических тканей стебля. Некоторые растения, например
виноградная лоза, могут погибнуть в результате заражения агро-
бактериями, другие становятся более чувствительными к неблаго-
приятным внешним условиям. Кроме целых растений в качестве
тест-объектов используются экспланты, например ломтики морко-
ви и кусочки других органов растений.
Корончато-галловые опухоли, вызываемые A. tumefaciens, были
первым описанным случаем неопластической трансформации у
растений. Ткани корончатых галлов содержат более высокие уров-
ни ауксина и цитокининов. Предполагалось, что это является при-
чиной автономного роста клеток корончатых галлов. Опухолевый
характер клеток корончатого галла проявляется также в том, что
корончатые галлы пригодны для трансплантации: способность
389
Рис. V.l. Генетическая трансформация растений
а — Agrobacterium tumefaciens, б — Agrobacterium zhizogenes.
опухолевых клеток корончатого галла к неограниченной пролифе-
рации сохраняется, если небольшая часть каллусной ткани, ли-
шенная бактерий, прививается на здоровом растении — прививка
развивается в опухоль, в то время как трансплантация нормальных
каллусных тканей не приводит к сверхросту.
Выявлено еще одно наследуемое изменение в клетках коронча-
тых галлов — это синтез опинов. Необычное для растений соеди-
390
нение, производное аргинина, обнаруженное лишь в определен-
ных опухолевых линиях, было названо октопином. Затем было
показано, что другими опухолевыми линиями синтезируется еще
одно соединение — нопалин, также производное аргинина. В зави-
симости от типа индуцируемого в опухоли опина штаммы A. tume-
faciens и находящиеся в них Ti-плазмиды получили соответствую-
щее обозначение — октопиновые или нопалиновые. Агробакте-
рии, индуцирующие опухоли, в которых не обнаруживается ни
нопалин, ни октопин, ранее обозначались как штаммы нулевого
типа. Позднее было показано, что в опухолях нулевого типа син-
тезируются опины третьего класса — агропины. Обнаружены
также и другие типы опинов. Поскольку все опины обнаруживают-
ся только в опухолевых клетках и отсутствуют в клетках нормаль-
ных растений или клетках растительных опухолей других типов,
то опины могут рассматриваться как специфические биохимичес-
кие маркеры для клеток корончатых галлов.
Опухоли, развивающиеся из одной или нескольких клеток,
быстро разрастаются в крупные образования, диаметр которых на
определенных видах деревьев может достигать одного метра. Ти-
пичная неорганизованная опухоль представляет собой более или
менее округлую дедифференцированную массу клеток (каллус),
которая может иметь гладкую или шероховатую поверхность, быть
паренхиматозной или одревесневшей. Иногда на периферии таких
опухолей формируются листовидные структуры (тератомы),
иногда — придаточные корни.
Нередко на зараженных растениях наблюдаются вторичные
опухоли, значительно удаленные от первичных. Обычно они обна-
руживаются выше первичной опухоли, что предполагает движение
бактерий или трансформирующего агента в направлении транспи-
рации.
Распространение Agrobacterium и других фитопатогенных бак-
терий по межклетникам и ксилеме является хорошо доказанным
фактом. Агробактерии могут передвигаться на большие дистанции
со значительной скоростью. Очевидно, это не является единствен-
ной причиной индукции вторичных опухолей.
Организацию опухолей, а именно форму, величину и характер
развития, определяют три фактора:
> штамм агробактерий,
< генотип растения-хозяина,
> физиологическое состояние инфицируемых растительных
клеток.
Кратко рассмотрим влияние этих факторов.
1. На чувствительном к большинству штаммов Agrobacterium
растении каланхоэ (Kalanehoe daigremontiana), которое часто ис-
пользуется в качестве модели в лабораторных условиях, показали,
что морфология опухоли четко зависит от бактерий-возбудителей.
Октопиновые штаммы агробактерий индуцируют на каланхоэ
круглые шероховатые неорганизованные опухоли, вокруг которых
391
может наблюдаться рост придаточных корней; нопалиновые штам-
мы — гладкие неорганизованные опухоли, из которых часто раз-
виваются листовидные структуры, тератомы. Индуцируемые атро-
пиновыми штаммами опухоли также характеризуются пролифе-
рацией придаточных корней, однако в отличие от октопиновых
опухолей они имеют тенденцию становиться некротическими зна-
чительно быстрее. В реальности, конечно, можно наблюдать и раз-
личные промежуточные формы корончатых галлов. Во всех ука-
занных случаях образуются дедифференцированные или слабо ор-
ганизованные опухоли. Однако определенное сочетание штамма
агробактерий и заражаемого растения может привести к образова-
нию крупных дифференцированных опухолей — тератом, кото-
рые содержат ткани беспорядочно растущих различных частей
растения, например неполноценных побегов, корней или листо-
видных структур.
Иногда можно выделить бактерии, которые содержат коинте-
граты октопиновой и нопалиновой плазмид. Такие штаммы экс-
прессируют гены обеих плазмид, поскольку индуцируемые ими
опухоли синтезировали и октопин, и нопалин. Однако штаммы,
несущие коинтеграты, индуцировали шероховатые опухоли на ка-
ланхоэ. Это говорит о том, что морфология нопалинового типа
является доминирующей. Штаммы, содержащие плазмиду Ri и ок-
топиновую Ti-плазмиду, индуцировали аберрантные опухоли с
корнями различного размера. Результаты экспериментов такого
типа показывают, что если две плазмиды агробактерий существуют
в одной клетке, то экспрессируются гены опухолеобразования
обеих плазмид, независимо от того, коинтегрированы плазмиды
или нет. Однако фенотипическое проявление индуцированной
опухоли чаще всего определяется только одной из двух плазмид.
Инфекция штаммами A. rhizogenes вызывает заболевание «бо-
родатый корень», характеризующееся образованием очень мелких
опухолей, на периферии которых обильно формируются как обыч-
ные, так и ветвящиеся адвентивные корни, откуда и произошло
название болезни. Ризогенные штаммы, возбудители бородатого
корня, индуцируют обильное образование корней, например на ка-
ланхоэ, но считаются слабо патогенными для табака, томата и
подсолнечника.
Оказалось, что штаммы A. rhizogenes способны утилизировать
октопин, а также другой опин — агропин. Опухолевые клетки
придаточных корней, образуемых при заражении A. rhizogenes,
синтезируют также опин, названный маннопином. По аналогии
между A. tumefaciens и A. rhizogenes было высказано предположе-
ние, что и в случае онкогенности по типу бородатого корня моле-
кулярным этиологическим агентом опухолеобразования должна
являться плазмида. Наиболее изученный штамм A. rhizogenes А4,
первоначально выделенный из природно инфицированных роз, ко-
торые проявляют симптомы бородатого корня, содержит по край-
ней мере одну большую (120 МДа) плазмиду, что указывало на
392
возможность участия крупной плазмиды в формировании этого
синдрома у растений.
2. Зависимость морфогенетического ответа на трансформацию
от генотипа растения. Проявление признаков агробактериальной
трансформации исследовано у многих видов растений с целью изу-
чения межвидовой и внутривидовой изменчивости по способности
к трансформации.
Приведем несколько примеров. Среди 24 генотипов сои выяв-
лена изменчивость по чувствительности к трансформации штам-
мом А348 A. tumefaciens. В качестве критерия чувствительности
использовали сырой вес опухоли. К высокочувствительным отне-
сены 3 генотипа, у которых вес опухоли был более 15 мг. У 10
генотипов, обозначенных как среднечувствительные, вес опухоли
был не менее 5 мг и не более 15 мг. К слабочувствительным отне-
сены 11 генотипов, вес образующейся на них опухоли не превы-
шал 5 мг. Два генотипа, ответ которых не отличался от реакции на
ранение у контрольных растений, были отнесены к нечувствитель-
ным.
17 генотипов сои (Glycine max) различались по ответу на транс-
формацию штаммами A. tumefaciens А208 и А281. Процент опухо-
леобразования между генотипами в ответ на штамм А208 варьи-
ровал от 0 до 100 %. Растения сортов Arksoy и Ransom формиро-
вали в сайте инокуляции опухоли < 3 мм в диаметре, но с высокой
частотой (30 % опухолеобразования). Наиболее чувствительным к
трансформации штаммом А208 оказался сорт Peking, у которого
на всех инокулированных растениях (100 % опухолеобразования)
появились крупные опухоли диаметром 1 см. К трансформации
штаммом А281 генотипы сои оказались нечувствительными. Опу-
холи появились на растениях только 3 генотипов (Arksoy, Ransom
и PI 398.580) с низкой частотой (1—10 % опухолеобразования).
Показано, что ответ на трансформацию штаммом А281 контроли-
руется у сои 2 генами.
При трансформации различных генотипов люцерны Medicago
sativa штаммом A. tumefaciens А281 были выявлены различия по
количеству продуцируемых трансгенных растений. Только у гено-
типа С2—4 с 20%-ной эффективностью появились трансгенные
регенеранты. На эксплантах генотипа А70-34 и эксплантах череш-
ков генотипа RA3 трансгенные растения не появились.
При изучении способности к трансформации штаммом A. tu-
mefaciens LBA4404 клубневых дисков, листьев и междоузлий про-
ростков 12 сортов картофеля (Solanum tuberosum L.), различаю-
щихся по способности к побегообразованию в условиях in vitro,
была обнаружена корреляция (г = 0.59) между способностью сорта
к регенерации и трансформации (по количеству регенерировав-
ших побегов). Так, сорт Maris Piper, не образующий побегов при
регенерации, не формировал и трансгенных регенерантов на всех
типах эксплантов. А сорт Desiree показал наивысшую способность
и к регенерации, и к трансформации. Аналогичные результаты,
393
подтверждающие тесную связь между способностью конкретного
генотипа (на примере картофеля и гороха) к регенерации и транс-
формации, ранее были получены автором с коллегами.
Автором этой главы были выявлены также достоверные разли-
чия между 5 линиями гороха и 6 штаммами агробактерий по спо-
собности к трансформации, а именно по наличию и величине опу-
холи. Выделены формы гороха, характеризующиеся нетипичным
морфогенетическим ответом на инокуляцию штаммами А281
(A. tumefaciens) и 8196 (A. rhizogenes). Так, у проростков и экс-
плантов сорта Sparkle и полученных на его основе мутантов по
клубенькообразованию в ответ на штамм 8196 наблюдалось фор-
мирование крупных опухолей практически без корней. При этом
опухоли, индуцированные штаммом 8196 и супервирулентным
штаммом А281, почти не различались по величине. Аналогичные
результаты получены Роббсом с соавторами. В их работе у неко-
торых линий гороха трансформация штаммом A. rhizogenes R1000
вызывала нетипичное для него опухолеобразование вместо борода-
того корня, а отдельные линии формировали корни в сайте иноку-
ляции в ответ на заражение штаммом В6 A. tumefaciens.
Итак, существуют различия по чувствительности к трансфор-
мации как между видами, так и между разными генотипами
(внутривидовая изменчивость). Генотип растения-хозяина опре-
деляет не только наличие ответа на онкотрансформацию, но и
характер морфологической реакции.
3. В определенном физиологическом состоянии клеток опухо-
ли образуются более интенсивно. Молодые ткани растений легче
поддаются искусственному заражению агробактериями и легче
формируют опухоли, чем старые. Число и развитие придаточных
корней на опухолевых побегах, например каланхоэ, существенно
зависит от облиственности растения. О значении физиологическо-
го состояния клеток говорят и результаты опытов с инфицирова-
нием различных частей и тканей растения, в которых показана
зависимость характера опухолеобразования от места расположе-
ния опухоли на растении. Хорошо известно, что концентрация
ростовых гормонов различна в разных тканях и органах растения.
Поэтому неудивительно, что опухоли часто могут быть индуциро-
ваны только в определенных органах и что последствия инокуля-
ции агробактериями могут варьировать в зависимости от возраста
и условий роста, а также от сайта инокуляции. Отсюда следует,
что сравнительное изучение способности к опухолеобразованию у
различных штаммов агробактерий должно проводиться в строго
выровненных условиях.
Глава V.2
ИНДУКЦИЯ КОРОНЧАТЫХ ГАЛЛОВ
Патогенный процесс индукции корончатых галлов сложен —
он складывается из нескольких этапов и требует участия ряда фак-
торов. В общих чертах он заключается в следующем: агробактерии,
которые содержат специфические опухолеродные (Ti) плазмиды,
проникая через поврежденную (раневую) ткань, заражают расте-
ние, плазмидная ДНК передается в растительную клетку, и фрагмент
Ti-плазмиды (Т-ДНК) встраивается в хромосому растительной клет-
ки, экспрессия привнесенных генов приводит к индукции опухоле-
образования. Корончатый галл обильно образуется на хозяйских
растениях при 27 °C, но этот процесс часто предотвращается при
температуре выше 30 °C, даже в том случае, если бактерии, хозяй-
ское растение и сама опухоль могут расти при более высокой темпе-
ратуре. Постоянное присутствие жизнеспособных бактерий не тре-
буется для опухолевого роста; нормальные опухоли образуются,
даже если убить бактерии высокой температурой через два дня
после инфекции. Агробактериальная система очень эффективна.
Так, эксперименты на стеблях каланхоэ показали, что при 25 °C
весь процесс индукции опухоли занимает не более 20 ч. Использова-
ние мутантов, дефектных по синтезу целлюлозных фибрилл агро-
бактерий, которые сохранили способность прикрепляться к расти-
тельным клеткам, но легко могут быть отмыты водой, позволило
уточнить минимальное время, необходимое для индукции опухоли.
Оказалось, что индукция осуществляется в интервале между 4 и
8 часами после инокуляции пораненного растения агробактериями.
В экспериментах по индукции корончатых галлов было показа-
но, что раневое повреждение потенциального хозяина существенно
для процесса трансформации. Все попытки индуцировать первич-
ные опухоли путем нанесения агробактерий на неповрежденный
эпидермис остаются безуспешными. Корончатый галл индуцируется
только в свежепораненных тканях, причем место повреждения со-
храняет восприимчивость примерно два дня. Клетки Agrobacterium
проникают в межклеточные пространства и в поврежденные клетки
растения, наполненные раневым экссудатом, где бактерии размно-
жаются и взаимодействуют с соседними здоровыми растительными
клетками, стимулируя их деление. Далее бактерии прикрепляются к
клетке в точках, называемых опухолевые сайты. По-видимому, под
влиянием бактерий растительная клетка приобретает компетент-
ность. Рана представляет собой «входные ворота» в ткани растения,
однако простого проникновения бактерии в межклетники и тесного
контакта их с прилегающими клетками недостаточно для индукции
опухоли.
Следствием поранения у большинства растений является не
только начало клеточных делений вокруг раны, но и передиффе-
395
ренцировка клеток, в ходе которой клетки приобретают готов-
ность к трансформации. Существенным моментом в процессе за-
ражения растений агробактериями с последующим «запуском» ме-
ханизма, приводящего к образованию опухоли, является узнавание
клеток. Природа рецепторов на поверхности растительных клеток,
с которыми связываются агробактерии, неизвестна. Прикрепление
бактерий дикого типа к поверхности клеток растения сопровожда-
ется бактериальным синтезом целлюлозных фибрилл, контролиру-
емых хромосомными генами и формированием больших агрегатов
бактерий на поверхности растительных клеток.
V.2.I. КРУГ ХОЗЯЕВ
Agrobacterium имеет очень широкий круг растений-хозяев и
может инфицировать по существу все двудольные растения. Дол-
гое время считалось, что однодольные растения не чувствительны
к агробактериальной инфекции. Это не совсем так. В настоящее
время показано, что при соблюдении определенных условий агро-
бактерии могут инфицировать однодольные растения, в частности
представителей таких семейств, как Amaryllidaceae, Liliaceae, Gra-
mineae, Iridaceae и некоторых других. Однако существуют опреде-
ленные вариации круга хозяев для различных штаммов Agrobacte-
rium: некоторые штаммы способны вызывать галлообразование на
отдельных видах растений, но не инфицируют другие. Различные
сорта одного и того же растения также могут иметь различную
чувствительность к данному бактериальному штамму.
Связывание A. tumefaciens с клеткой хозяина может быть одним
из факторов, определяющих круг хозяев. Предполагается, что ви-
рулентные клетки агробактерий связываются со специфичными
сайтами на клеточной стенке чувствительных растений. Однако
прикрепление бактерий вряд ли является единственным этапом
опухолеобразования, на котором может проявляться устойчивость
растений к инфекции A. tumefaciens. Так, некоторые однодоль-
ные растения, не образующие корончатых галлов, способны свя-
зывать клетки агробактерий. В большинстве случаев, когда уда-
лось доказать факт агробактериального инфицирования одно-
дольных, перенос Т-ДНК не сопровождался опухолевым ростом,
что затрудняло тестирование. Еще одним фактором, препятству-
ющим инфицированию однодольных агробактериями, возможно,
является отсутствие в клетках растений низкомолекулярных ин-
дукторов вирулентности Agrobacterium, например ацетосиринго-
на, которые обычно присутствуют в клеточном соке при поране-
нии двудольных растений. Во всяком случае инфицирование од-
нодольных агробактериями в присутствии индукторов повышало
эффективность переноса Т-ДНК в растения.
396
N.22. РЕГЕНЕРАЦИЯ РАСТЕНИЙ ИЗ ОПУХОЛЕВЫХ КЛЕТОК
Как известно, одно из основных свойств растений, отличающих
их от остальных представителей живого, — это тотипотентность
растительных клеток, которая выражается в возможности регенера-
ции целого организма из отдельной соматической клетки или орга-
на. Опухолевые клетки также сохраняют способность к дифферен-
цировке, однако регенерация фенотипически нормального целого
растения из клеток корончатого галла практически невозможна.
В некоторых случаях удавалось регенерировать целые растения
из клеток корончатых галлов и наблюдать передачу опухолевых
признаков в мейозе, однако, как правило, это относится лишь к
таким опухолевым свойствам, как синтез опинов, а не гормононе-
зависимый рост. В отличие от корончатых галлов трансформиро-
ванные клетки бородатого корня легко поддаются регенерации,
гены Т-ДНК проходят через мейоз и эмбриогенез и дают в потомстве
растения нормального фенотипа. Характерными признаками синд-
рома бородатого корня, кроме способности к регенерации, являют-
ся также высокая скорость роста корней в культуре ткани. У расте-
ний-регенерантов уменьшено апикальное доминирование в корнях
и стеблях, скручены и укорочены листья и изменен геотропизм. Об-
наружено еще одно интересное отличие клеток бородатого корня от
корончатых галлов: кончики корней и протопласты Lotus cornicula-
tus, трансформированные некоторыми штаммами A. rhizogenes,
проявляли в 100—1000 раз более высокую чувствительность к экзо-
генному ауксину, чем нормальные клетки.
Таким образом, суммируя, можно отметить, что у многих видов
растений опухоли корончатых галлов могут развиваться либо в ано-
мальные карликовые побеги (тератомы), либо в дедифференциро-
ванный каллус (неорганизованные опухоли). У некоторых видов рас-
тений опухоли всегда неорганизованные. Опухоли, индуцированные
A. rhizogenes, формируют придаточные корни либо проявляют не-
организованный рост. После открытия переноса Т-ДНК было уста-
новлено, что для конкретного вида растений морфология опухоли
определяется только типом плазмиды, присутствующей в индуциру-
ющем бактериальном штамме, и генотипом растения. Обычно нопа-
линовые Ti-плазмиды вызывают тератомы, октопиновые Ti-плазми-
ды индуцируют неорганизованные опухоли. Различная морфология
опухолей корончатых галлов соответствует тем формам, которые
можно наблюдать для нормальных тканей табака при манипулиро-
вании уровнями экзогенного ауксина и цитокинина.
V.2.3. ОНКОГЕННЫЕ ПЛАЗМИДЫ
Традиционно природные изоляты рода Agrobacterium разделе-
ны на виды в зависимости от их патогенности для растений. A. tu-
mefaciens и A. rubi обычно индуцируют неорганизованные опухо-
397
ли,или тератомы, A. rhizogenes вызывает пролиферацию придаточ-
ных корней, а штаммы A. radiobacter авирулентны. Другой часто
используемый способ классификации основан на различиях в
типах опинов, которые синтезируются в опухоли, индуцируемой
данным штаммом. Существует не менее шести различных классов
опинов, и некоторые опухоли продуцируют опины более чем од-
ного класса. Агробактерии способны утилизировать опины в ка-
честве источника углерода, азота и энергии. Все эти свойства —
синтез и деградация опинов, индукция опухолей различного типа —
зависят в основном от плазмидных генов агробактерий. Следова-
тельно, классификация, основанная на этих признаках, имеет,
скорее, историческое значение, а не отражает истинное эволюци-
онное родство агробактерий.
Иногда используют более узкую классификацию Agrobacteri-
um, основанную на круге растений-хозяев, поражаемых штаммами
агробактерий. Большинство штаммов инфицируют широкий круг
двудольных растений. Некоторые штаммы способны инфициро-
вать только ограниченный круг хозяев, например только виноград-
ную лозу. Однако и такой признак, как круг хозяев, в большинстве
случаев зависит не от штамма, а от плазмиды и, следовательно, не
годится для классификации.
Во всех вирулентных штаммах A. tumefaciens, A. rubi и A. rhi-
zogenes были обнаружены плазмиды размером от 95 до 156 МДа
(140—240 т. п. н.).
Подробная информация о структуре плазмид Agrobacterium
получена путем их рестрикционного или физического картирова-
ния. Использование блоггинг-гибридизации рестрикционных фраг-
ментов Ti-плазмид в сочетании с данными по их картированию
позволяет идентифицировать общие последовательности Ti-плаз-
мид различных типов. Идентификация таких участков имеет важ-
ное значение, поскольку именно консервативные области отвечают
за онкогенность. В результате исследований обнаружено четыре
основных области гомологии между октопиновой и нопалиновой
плазмидами. Две консервативные (области А и D) вовлечены в он-
когенность, еще одна (В) соответствует области контроля репли-
кации плазмиды, в то время как последняя (С) кодирует функции
конъюгативного переноса (рис.У.2). Анализ инсерционных и де-
леционных мутаций позволил построить функциональную карту
плазмиды нопалинового типа pTi С58 и связать ее с рестрикцион-
ной картой (рис. V.3). В результате генетического анализа прежде
всего локализовано несколько областей, существенных для онко-
генности. Большой район плазмиды от 131.6 до 18 МДа, согласно
общепринятой ориентации карты, может быть делетирован без поте-
ри онкогенности. Эта делеция начинается в правом конце Т-ДНК и
тянется дальше вправо. Несущественный для онкогенности сег-
мент Т-ДНК лежит как раз вне области гомологии плазмид окто-
пинового и нопалинового типов и отвечает за синтез нопалина в
опухоли. Между тем некоторые делеции и инсерции в Т-ДНК вли-
398
Т-ДНК
Т-ДНК
Рис. V.2. Нопалиновая и октопиновая Ti-плазмиды (A.tumefaciens).
Около 30 % (~ 200 кв) гомологичны в нопалиновой и октопиновой плазмиде; Т-ДНК
(~ 23 т. п. н.) — область, переносимая в растение, несет онкогены и гены синтеза и
катаболизма опинов (A). Vir — область вирулентности (D); Тга— гены коныогатив-
ного переноса (Q; OriV — область репликации плазмиды (Я).
Рис. V.3. Карта нопалиновой Ti-плазмиды pTiC58.
Заштрихованы области А, В, С и D, консервативные у октопиновых и нопалиновых
плазмид. Флажками отмечены правая и левая границы Т-ДНК.
399
яли на онкогенность. Этот факт был первым генетическим доказа-
тельством того, что Т-ДНК действительно играет роль в установ-
лении и поддержании опухолевого состояния трансформирован-
ных растительных клеток.
Итак, Ti-плазмиды отвечают за следующие генетические при-
знаки:
1) индукция корончато-галловых опухолей,
2) специфичность синтеза опинов в трансформированных рас-
тительных клетках,
3) катаболизм специфичных опинов,
4) конъюгативный перенос Ti-плазмид между бактериями.
Т-ДНК представляет наиболее подробно охарактеризованную
область Ti-плазмиды, встраиваемую в хромосомы растений. Это
неудивительно, так как именно к этой области в первую очередь
были обращены интересы генетиков. Патогенный процесс обра-
зования корончатых галлов достаточно сложен и определяется
целым рядом других генов Ti-плазмиды. В то время как размер
Ti-плазмиды равен 90—160 МДа (она способна кодировать 150—
200 белков), Т-область составляет всего 5—8 % Ti-плазмиды и ко-
дирует 10—15 белков.
Итак, в Ti-плазмиде обнаружены две высококонсервативные
области, мутации в которых влияют на онкогенность. Однако
роль этих областей не равнозначна. Гены Т-области функциони-
руют в трансформированных растительных клетках, мутации в
них влияют на фенотип опухоли, характер гормононезависимого
роста. Гены другой консервативной области также необходимы
для опухолеобразования, однако работают в клетках бактерий в
момент инфекции. Исходя из этого следует различать два типа
функций опухолеобразования — онкогенность, за которую отве-
чают гены Т-ДНК, и вирулентность, кодируемую генами vir-об-
ласти (а также некоторыми хромосомными генами). Изучение
функций вирулентности и онкогенности составляет основу по-
нимания молекулярных механизмов опухолеобразования у рас-
тений, индуцируемого агробактериями.
V.2.4. ОПИНЫ И КОНЦЕПЦИЯ
«ГЕНЕТИЧЕСКОЙ КОЛОНИЗАЦИИ»
Типы опинов. В опухолевых растительных клетках коронча-
тых галлов и бородатого корня присутствуют необычные произ-
водные аминокислот, которые отсутствуют как в клетках здоровых
растений, так и в клетках агробактерий. Первое из этих соедине-
ний — лизопин — было обнаружено еще в 1956 г. в ткани корон-
чатого галла и определено как N2-(D-1-карбоксиэтил)-Ь-лизин.
Затем были обнаружены октопин [N2-(D-1-карбоксиэтил)-Ь-арги-
нин], нопалин [Ы2-(1,3-дикарбоксипропил)-Ь-аргинин] и их про-
изводные. Позднее были также найдены агропин и агроцинопины.
400
Опухоли, вызываемые A. rhizogenes, также характеризуются син-
тезом своих специфичных производных аминокислот. Эти низко-
молекулярные метаболиты, специфичные для растительных опухо-
лей и составившие новый класс биологически активных веществ,
получили общее название опины. Метаболизм опинов является ха-
рактерной особенностью агробактериальных опухолей. Важные
сведения для разгадки метаболической природы этих соединений
были получены в экспериментах, в которых доказано, что природа
продуцируемых опухолями опинов детерминируется не растением-
хозяином, а бактерией. В ходе этих исследований обнаружены по
меньшей мере две формы патогенных бактерий, различия между
которыми основаны на метаболизме двух аргининовых производ-
ных — октопина и нопалина, ранее обнаруженных в тканях ко-
рончатых галлов.
Еще один важный факт заключался в том, что каждый бакте-
риальный штамм способен расти в присутствии только одного из
опинов как источника углерода и азота. Бактерии усваивают толь-
ко то соединение, которое синтезирует индуцированная данным
штаммом опухоль. На основании полученных сведений было сде-
лано предположение, что бактерия может вводить в растительную
клетку новую генетическую информацию, в том числе ген, опреде-
ляющий синтез октопина или нопалина. Опухоли начинают синтез
опинов уже в возрасте нескольких дней и продолжают продуциро-
вать их в высоких концентрациях даже тогда, когда опухолевая
ткань не содержит жизнеспособных бактериальных клеток.
Таким образом, именно Ti- или Ri-плазмиды определяют
способность конкретного штамма Agrobacterium специфично
детерминировать синтез того или иного опина в опухолевых
клетках растений. По этому признаку изученные к тому времени
Ti-плазмиды были разделены на три основных типа: октопино-
вый, нопалиновый и агропиновый.
Недавно были открыты соединения, получившие название лей-
цинопин, N2-( 1,3-дикарбоксипропил)-Ь-лейцин, аспарагинопин и
глутаминопин, сукцинамопин, витопин. Предполагается, что су-
ществует еще большее разнообразие опинов, которые до установ-
ления их химической природы и разработки методов идентифика-
ции предложено называть «криптопинами», а соответствующие
плазмиды — «криптопиновыми», предполагая, что тип соответст-
вующего опина удастся установить в будущем.
В настоящее время опины считаются надежными маркерами
корончатых галлов, позволяющими отличить бактериальные опу-
холи от генетических опухолей, которые не продуцируют опинов.
Биосинтез опинов. Опины являются производными обычных
участников метаболизма — аминокислот и различных кетокислот
или сахаров. Синтез опинов зависит от ферментов опинсинтаз,
специфичных для типа опухоли. В случае опухолей октопинового
и нопалинового типов этими ферментами являются октопинсинта-
за (другое название лизопиндегидрогеназа LpDH) и нопалинсинта-
401
за (нопалин-дегидрогеназа, NpDH) соответственно. Оба фермента
достаточно хорошо изучены в биохимическом отношении. LpDH
представляет собой белок, состоящий из одной субъединицы с мо-
лекулярной массой 39 кДа. NpDH состоит из четырех одинаковых
субъединиц с молекулярной массой 40 кДа. В настоящее время
получен ряд доказательств того, что синтез всех опинов октопино-
вого семейства катализируется единственным ферментом — окто-
пинсинтазой. Катализируемое октопинсинтазой присоединение
пировиноградной кислоты к различным аминокислотным остаткам
при участии в качестве кофактора НАДФ Н приводит к образова-
нию опинов октопинового ряда. В зависимости от того, какая ами-
нокислота вступает в реакцию восстановительной конденсации с
пируватом (L-лизин, L-аргинин, L-орнитин или L-гистидин), обра-
зуются соответственно лизопин, октопин, октопиновая кислота
или гистопин. Нопалин и нопалиновая кислота, которые по своей
структуре сходны с октопином, также образуются в результате
восстановительной конденсации аминокислоты и а-кетоглютаро-
вой кислоты, зависимой от фермента нопалинсинтазы, при учас-
тии кофактора НАД Н. Предшественником нопалина является ар-
гинин, а нопалиновой кислоты — орнитин.
Биосинтез агропина, детерминируемый октопиновыми Ti-плаз-
мидами, происходит in vivo путем лактонизации маннопина, кото-
рый присутствует во всех агропинсодержащих опухолях. Так же как
октопин или нопалин, маннопин может синтезироваться in vivo
в реакции восстановительной конденсации (между D-маннозой и L-
глутамином). Таким образом, реакция восстановительной конденса-
ции между аминокислотой и углеводным соединением является
одним из этапов синтеза трех наиболее известных типов опинов.
Агроцинопины А и В, детерминируемые нопалиновыми Ti-плаз-
мидами, и агроцинопины С и D, детерминируемые атропиновыми
Ti-плазмидами, предположительно являются производными саха-
ров. Агроцинопины С и D отличаются от агроцинопинов А и В тем,
что не содержат пентозного сахара.
Таким образом, опины трех основных известных классов имеют
общую структурную формулу:
HOOCRHC-NH-CHR1COOH.
Точная химическая структура опинов установлена для предста-
вителей октопинового, нопалинового и атропинового семейств.
Интерес представляет тот факт, что некоторые из синтезируе-
мых в опухолевых клетках опинов активно секретируются, в част-
ности, секретируемыми являются октопин и нопалин, а также
одно из фосфорилированных соединений агроцинопин А. Доказа-
но, что секреция октопина и нопалина из клеток опухоли генети-
чески детерминирована Ti-плазмидами и определяется одним из
генов Т-ДНК (геном 6а).
Катаболизм опинов агробактериями. Вскоре после того, как
была доказана зависимость специфичности синтеза опинов в клет-
402
ках опухоли от типа бактериального штамма, индуцировавшего
опухоль, было обнаружено, что штаммы A. tumefaciens способны
осуществлять катаболизм опинов с той же специфичностью. На-
пример, штаммы агробактерий, индуцирующие синтез октопина в
корончатых галлах, могут селективно использовать этот продукт,
но не нопалин. Показано, что гены катаболизма опинов, т. е. гены,
определяющие утилизацию опинов агробактериями, так же как
гены синтеза этих соединений, локализуются на Ti-плазмидах.
Опины являются субстратами для катаболитных ферментов,
кодируемых Ti-плазмидами. Биохимические исследования пути
деградации октопина и лизопина показали, что процесс деграда-
ции включает два основных этапа: активный транспорт в клетки
бактерий и гидролиз молекулы опина на исходные аминокислоту
и а-кетокислоту. В клетках плазмидосодержащих бактерий обна-
ружены соответствующие этим этапам ферменты: октопинпермеа-
за и октопиноксидаза. Деградация опинов штаммами агробакте-
рий, несущими Ti-плазмиду дикого типа, индуцибельна. Деграда-
ция опинов октопинового семейства может быть индуцирована
октопином, лизопином и октопиновой кислотой, тогда как D-гис-
топин не является индуктором деградации. Интересно, что нопа-
лин не является ни субстратом, ни индуктором октопинпермеазы,
тогда как нопалин-пермеаза после специфической индукции нопа-
лином способна осуществлять транспорт октопина. Система дегра-
дации является общей для всех опинов октопинового семейства,
поскольку мутанты с нарушенной способностью деградации окто-
пина одновременно теряли способность утилизировать лизопин,
октопиновую кислоту и гистопин, тогда как реверсия восстанавли-
вала сразу все эти функции.
Деградация агропина штаммами агробактерий, несущими Ti-плаз-
миды октопинового или агропинового типа, также индуцибельна,
причем агропин индуцирует транспорт через клеточную стенку
синтетических молекул, полученных в реакции восстановительной
конденсации глутаминовой кислоты и гексозы, в том числе манно-
пцна. Маннопин индуцирует свое собственное поглощение бакте-
риями, а также поглощение производных глюкозы и галактозы,
которые, однако, не являются индукторами. Маннопин не является
индуктором утилизации агропина. Видимо, деградация агропина
включает два независимо индуцируемых этапа.
Орнитин является промежуточным продуктом деградации окто-
пина и нопалина, продукты распада орнитина представляют источ-
ник углерода для бактерий. Оказалось, что клетки A. tumefaciens
расщепляют орнитин двумя отдельными способами. Один из этих
путей кодируется плазмидой pTiC58, а другой — хромосомой.
Хромосома кодирует орнитиндегидрогеназу, которая предположи-
тельно является катаболитным ферментом. Поскольку агробакте-
рии обитают в почве и в корончатых галлах растений, каждый из
путей катаболизма орнитина может включаться в тот тип метабо-
лизма, к которому адаптирована в данный момент бактерия.
403
Деградация нопалина и нопалиновой кислоты, видимо, проис-
ходит по аналогичному пути. Гены пос локализуются в области
размером 14.4 т. п. н., примыкающей к правому концу Т-ДНК. Эти
гены дают возможность бактерии расти с использованием нопали-
на и L-орнитина в качестве источников углерода и азота. Гены,
ответственные за катаболизм нопалина (порС), катаболизм орни-
тина (огпС) и поглощение нопалина бактериями (nopU), были
идентифицированы путем инсерционного мутагенеза с помощью
транспозона Тп5. Мутанты порС были также дефектны по нопали-
ноксидазе, ферменту, отвечающему за образование свободного ар-
гинина из нопалина. Кроме того, пос-область кодирует синтез пе-
риплазматического белка nl, индуцируемого нопалином. Белок nl
имеет молекулярную массу 30 кДа и освобождается из бактериаль-
ной клетки при осмотическом шоке. Таким образом, функциони-
рование генов этой области обеспечивает содержащим плазмиду
бактериям следующие фенотипические свойства:
1) способность использовать нопалин в качестве единственного
источника углерода и азота (порС);
2) способность расти на среде с нопалином как единственным
источником азота (nopN);
3) поглощение нопалина (nopU);
4) способность утилизировать L-орнитин (огпС);
5) синтез периплазматического белка N1, индуцируемый нопа-
лином;
6) синтез нопалиноксидазы.
В результате анализа мутаций было идентифицировано три гене-
тических локуса посВ, посС и посА, отвечающих за продукцию
белка N1, нопалиноксидазы и катаболизм орнитина соответственно.
Многие инсерции Тп5 влияли сразу на несколько фенотипических
признаков, причем наблюдался полярный эффект мутаций. Это по-
зволило выдвинуть гипотезу, согласно которой пос-гены pTiC58
объединены в единый оперон и считываются справа налево. Показа-
но, что кроме нопалиноксидазной активности эта область Ti-плаз-
миды кодирует также неизвестные ранее аргиназную и орнитинцик-
лодезаминазную активности. Интересна ситуация в случае бактерий
A. rhizogenes. В штаммах A. rhizogenes маннопинового типа функции
вирулентности и утилизации опинов, так же как и в случае Ti-плаз-
мид, сцеплены и локализованы на Ri-плазмиде. В штаммах A. rhizo-
genes агропинового типа гены деградации опинов не сцеплены.
Катаболизм агропина определяется Ri-плазмидой, тогда как
гены катаболизма маннопина, маннопиновой и атропиновой кис-
лот локализованы на присутствующих в клетках A. rhizogenes
плазмидах меньшего размера. Большинство изученных штаммов
A. rhizogenes содержат также третью плазмиду, представляющую
собой коинтеграт первых двух. В этой ситуации, однако, некото-
рые штаммы A. rhizogenes не способны утилизировать опины,
синтез которых они индуцируют в клетках опухоли, что связано с
потерей соответствующих плазмид.
404
Катаболизм аргинина. Непосредственным продуктом деграда-
ции октопина и нопалина является аргинин. Следовательно, можно
предполагать, что штаммы A. tumefaciens должны использовать
аргинин в качестве источника азота, что обеспечивается хромо-
сомными генами. Кроме кодируемого хромосомой пути метабо-
лизма аргинина был обнаружен эффективный дополнительный
путь утилизации аргинина, кодируемый Ti-плазмидой. Бесплаз-
мидный вариант этого штамма (С58С1) не способен утилизировать
аргинин в качестве единственного источника углерода. Когда в
штамм С58С1 вводили Ti-плазмиду октопинового или нопалино-
вого типа, деградация аргинина индуцировалась октопином или
нопалином соответственно. Такие штаммы были способны утили-
зировать аргинин только в присутствии индуцирующих концентра-
ций октопина или нопалина.
Конъюгативный перенос плазмид. Двумя важными факторами
для сохранения и распространения отдельных плазмид в бактери-
альных популяциях являются селективные преимущества, придава-
емые плазмидами их хозяевам, и способность плазмид к распростра-
нению путем конъюгации. Большинство крупных плазмид являют-
ся самотрансмиссивными, т. е. процесс переноса определяется
плазмидными Тга-генами. Оказалось, что свойство вирулентности
Ti-плазмид способно переходить от вирулентного штамма бакте-
рий к невирулентному при совместном заражении одного расте-
ния, т. е. in planta, и что онкогенность, таким образом, может быть
передана непатогенному реципиентному штамму, который в ре-
зультате приобретает способность вызывать опухоли. Перенос
может происходить даже между очень отдаленными штаммами
Agrobacterium, что делает маловероятной хромосомную локализа-
цию генов, ответственных за вирулентность. Конъюгативный пере-
нос Ti-плазмид in planta происходит намного более эффективно,
чем in vitro, за счет индукции опинами. Таким образом, особен-
ностью конъюгационной системы Ti-плазмид является ее репрес-
сированность в норме, вследствие чего этот плазмидный признак
долго не обнаруживался, хотя еще до открытия Ti-плазмид было
установлено, что онкогенность может передаваться от Опс+ к Опс~-
бактериям на поверхности корончатых галлов. Оказалось, что
опины не просто дерепрессируют перенос Ti-плазмид, но осущест-
вляют дерепрессию специфично, tra-гены, необходимые для пере-
носа плазмиды, тесно взаимодействуют с метаболизмом опинов,
поскольку индуцируются только опинами соответствующего типа.
Это имеет определенный смысл, поскольку в присутствии своих
субстратов катаболитная плазмида будет быстро распространяться
в смешанной популяции онкогенных и неонкогенных бактерий.
Конъюгативная активность октопиновых Ti-плазмид обеспечи-
вается присутствием октопина, лизопина и октопиновой кислоты,
хотя только октопин способен стимулировать конъюгационный
перенос Ti-плазмид октопинового типа. Химические аналоги ок-
топина (например, нороктопин) не являются индукторами, а неко-
405
торые аминокислоты (метионин, цистеин, цистин) ингибируют tra-
функцию. Изучение регуляторных мутантов по катаболизму окто-
пина показало, что по своей конъюгативной активности они рас-
пределяются на несколько классов. Одни мутанты конститутивны
по обоим процессам, другие только по одному из них, т. е., явля-
ясь конститутивными по катаболизму октопина, они остаются ин-
дуцируемыми по переносу плазмиды, или наоборот. Существова-
ние таких мутантов может быть объяснено на основе схемы, со-
гласно которой функции катаболизма опинов и функции переноса
детерминированы отдельными оперонами, но контролируются
общим геном-регулятором. Такая же схема действует в отношении
ряда плазмид нопалинового типа, однако процесс индукции конъюга-
ционных переносов Ti-плазмид весьма специфичен. Для Ti-плаз-
мид нопалинового и атропинового типов ситуация оказалась не
такой, как это предполагали вначале по аналогии с октопиновыми
плазмидами. Перенос нопалиновых плазмид индуцируется агроци-
нопинами А и В, но не нопалином, хотя оба этих опина образуют-
ся в одних и тех же опухолевых тканях. В качестве индуктора
конъюгативного переноса атропиновых плазмид выступают агро-
цинопины С и D, а не агропин, являющийся основным опином
опухолей атропинового типа. Агропин не может также вызвать пе-
ренос октопиновых плазмид. Тот факт, что нопалин не стимулиру-
ет перенос Ti-плазмид этого типа и что регуляторные мутанты по
катаболизму нопалина не являются конститутивными по переносу
плазмиды, также служит доказательством независимости регуля-
ции катаболизма нопалина и конъюгативного переноса.
Таким образом, изложенные данные кратко можно свести к
следующему. Патогенные штаммы Agrobacterium индуцируют
опухолевый рост у растений и заставляют их посредством перено-
са генетической информации от бактерий к растениям синтезиро-
вать специфические соединения — опины. Бактерии в свою оче-
редь обладают способностью специфически утилизировать опины в
качестве источника углерода и азота. Оба этих свойства агробак-
терий зависят от присутствующих в их клетках патогенных плаз-
мид. Опины являются не только субстратом катаболизма агробак-
терий, но и индуктором трансмиссивности Ti-плазмид, т. е. спо-
собствуют распространению этих плазмид в популяции.
Концепция «генетической колонизации». Изучение опинов
началось со структурного уровня. Позже была исследована физио-
логическая роль опинов, в результате чего стало ясно, что корон-
чатый галл — это природный, пример генетических манипуляций,
которыми A. tumefaciens «порабощает» биосинтетическую ма-
шину растения таким образом, чтобы «построить» для себя эко-
логическую нишу. Сразу после первого сообщения о присутствии
необычных аминокислот в тканях корончатых галлов был иден-
тифицирован еще ряд соединений как специфических маркеров
опухолевых клеток. Оказалось также, что уровень синтеза некото-
рых аминокислот, в том числе аргинина, возрастает в результате
406
инфекции примерно в тысячу раз в месте повреждения. Ассоциа-
ция опухолеобразующих бактерий с растением приводит, таким
образом, к превращению одной или нескольких обычных амино-
кислот в источник питания для одних лишь инфицирующих бак-
терий.
Однако значение опинов не ограничивается только питатель-
ными потребностями агробактерий. Опины играют также сущест-
венную роль в индукции переноса опухолеродных плазмид из кле-
ток в клетки, из вирулентных штаммов в авирулентные, что,
вероятно, ведет к распространению возбудителя этой болезни и
увеличению масштабов заражения. Таким образом, в данном слу-
чае имеется пример особого, совершенно неожиданного рода па-
разитизма: паразит (бактерия) не просто использует питательные
вещества хозяина (растения), но и изменяет его обмен веществ
путем введения новой генетической информации в геном своего
хозяина. Таким необычным путем паразит достигает двух целей: с
одной стороны, он получает возможность влиять на метаболизм
хозяина, направляя его в русло, выгодное самим бактериям, с дру-
гой стороны, он достигает селективного преимущества над конку-
рирующими организмами. Описанные необычные фитопатогенные
взаимоотношения между Agrobacterium и растительными клетка-
ми получили название генетическая колонизация. Они представля-
ют пример генетической инженерии эукариотического организма,
осуществляемой не в лаборатории руками исследователя, а самой
природой.
Таким образом, концепция генетической колонизации (опи-
новая концепция) базируется на том, что гены Ti-плазмид учас-
твуют в синтезе опинов и их деградации и обеспечивают селек-
тивные преимущества Ti-содержащим бактериям.
Экологическое значение опинов для выживания содержа-
щих вирулентные плазмиды агробактерий очевидно — синтез
опинов и их катаболизм играли, видимо, центральную роль в
эволюции Ti-плазмид.
Совокупность всех приведенных фактов, сформулированная
в виде концепции генетической колонизации, дает основание
считать, что Ti-плазмиды представляют собой природные векто-
ры для клеток высших растений, которые в процессе эволюции
приобрели свойства, обеспечивающие селективные преимущест-
ва несущим их бактериям.
V.2.5. СТРУКТУРА Т-ДНК И ЕЕ ПЕРЕНОС В РАСТЕНИЯ
В основе образования опухолей типа корончатых галлов у рас-
тений лежат генетические процессы: перенос из клеток агробакте-
рий в растительные клетки генов плазмидного происхождения,
входящих в состав Т-ДНК, экспрессия которых обеспечивает опу-
холевый рост трансформированных клеток растений, а также все
407
другие изменения метаболизма, характерные для агробактериаль-
ных опухолей. В этой связи возникают вопросы: что представляет
собой Т-ДНК, т. е. какова ее структура, каким образом осущест-
вляется перенос Т-ДНК в растения и какова ее дальнейшая судьба
в клетках растений, какие гены отвечают за процессы вырезания
Т-ДНК, переноса ее из клеток агробактерий в растения и стабиль-
ное поддержание и наследование Т-ДНК, какие элементы самой
Т-ДНК определяют ее перенос в растения, экспрессия каких генов
Т-ДНК и каким образом приводит к опухолевой пролиферации
трансформированных клеток и наблюдаемым в них биохимичес-
ким изменениям. В данном разделе будет рассмотрена часть этих
вопросов, касающаяся способа переноса Т-ДНК в растения и
включения ее в геном растительных клеток, затем будут рассмот-
рены проблемы экспрессии генов Т-ДНК и их роли в образовании
опухолей.
Т-ДНК как некий генетический элемент, способный переме-
щаться из одного генетического окружения в другое, можно срав-
нить с бактериальными транспозонами, лизогенизирующими бак-
териофагами, перемещающимися элементами дрожжей и живот-
ных и т.п. Однако общим в этих явлениях представляется лишь
сама способность перемещаться, различий же гораздо больше.
Первое и главное различие состоит в том, что перенос Т-ДНК осу-
ществляется не внутри одного генома, не между организмами од-
ного или близкородственных видов, как в случае других мигриру-
ющих элементов, а между эволюционно далекими видами — пара-
зитирующими бактериями и высшими растениями. Это, пожалуй,
пока что единственный изученный случай регулярного горизон-
тального переноса генов между про- и эукариотами. Что же каса-
ется переноса Т-ДНК, то его вряд ли можно сравнивать с переме-
щением других мигрирующих элементов. Согласно существующим
представлениям, в основе переноса Т-ДНК лежит механизм, напо-
минающий, скорее, мобилизацию бактериальных плазмид при
конъюгации. Ключевыми моментами являются взаимодействие аг-
робактерий с клетками растений, структура Т-ДНК и ее границ,
ферменты и соответствующие им гены переноса Т-ДНК.
Термин перенос Т-ДНК будет использоваться для обозначения не
только непосредственно переноса Т-ДНК в растительные клетки, но
и ее включения в растительный геном, а процессинг Т-ДНК — для
обозначения этапов, подготавливающих Т-ДНК к переносу через
бактериальную мембрану. Большая часть излагаемых сведений о пе-
реносе Т-ДНК получена в результате идентификации цис-действую-
щих элементов в пределах и вблизи Т-ДНК в Ti -плазмиде и из ана-
лиза стыков Т-ДНК/растительная ДНК.
Структурная организация Т-ДНК. Для октопиновых и нопа-
линовых Ti-плазмид Т-область детально изучена как физически,
так и функционально; ее протяженность около 23 т. п. н. На осно-
вании данных блоттинг-гибридизации и электронно-микроскопи-
ческого гетеродуплексного анализа показано, что последователь-
408
ность Т-области, размером 8—9 т. п. н., является высококонсерва-
тивной и общей для плазмид как октопинового, так и нопалиново-
го типа. Определение нуклеотидных последовательностей ДНК
подтвердило, что эта общая Т-ДНК примерно на 90 % гомологич-
на в Ti-плазмидах октопинового и нопалинового типов.
В процессе индукции опухоли Т-ДНК переносится в клетки
растения и интегрируется с растительной ядерной ДНК. Экспрес-
сия генов Т-ДНК обеспечивает растительным клеткам способность
к опухолевому, т. е. фитогормононезависимому росту, однако гене-
тический анализ мутаций в Т-области октопиновых и нопалино-
вых плазмид показал, что ни один из генов Т-ДНК не является
абсолютно необходимым для опухолеобразования: каждый из
опс-генов Т-ДНК в отдельности влияет лишь на фенотип опухоли.
Одновременные мутации всех опс-генов полностью нарушают опу-
холеобразование, но не влияют на перенос и интеграцию Т-ДНК.
Для переноса Т-ДНК необходимы гены vir-области, но сама vir-
область никогда не присутствует в опухолевых клетках. Детальный
анализ геномной ДНК некоторых нопалиновых линий опухоли с
помощью гибридизации показал, что механизм интеграции Т-ДНК
является довольно точным, поскольку в корончатых галлах всегда
присутствовал один и тот же непрерывный сегмент Ti-плазмиды.
Некоторые линии содержат единственную копию Т-ДНК, тогда
как в других Т-ДНК присутствует во многих копиях на раститель-
ную клетку, организованных в виде тандемных повторов. Изучение
нескольких октопиновых опухолей показало, что октопиновая Т-
ДНК более вариабельна. В геноме опухоли всегда присутствовал
левый сегмент или TL-ДНК протяженностью около 13т.п.н.,
включающий консервативную часть Т-ДНК. Кроме того, часто при-
сутствует правая область или TR-ДНК, которая содержит последо-
вательности, примыкающие к TL-области, но отделенные от нее в
Ti-плазмиде небольшим участком, не входящим в состав Т-ДНК.
В некоторых опухолевых линиях TR-ДНК амплифицирована до
20 копий, тогда как TL-ДНК присутствует в одной-двух копиях.
TL-ДНК может быть также частью тандемной структуры.
Последовательности Ti-плазмиды, фланкирующие Т-ДНК
(пограничные или концевые области), играют важную роль в
этом процессе и содержат несовершенные прямые повторы по
24—25 п. н. (рис. V.4).
На особую функцию этих повторов указывает их консерватив-
ность у плазмид октопинового и нопалинового типа. Сам концевой
повтор не включается в растительную ДНК, но граница Т-ДНК/ра-
стительная ДНК проходит либо рядом с повтором, либо захваты-
вает крайние нуклеотиды повтора. Анализ нуклеотидных последо-
вательностей показал, что стык обычно возникает в пределах
фланкирующей последовательности либо на расстоянии не более
100 п.н. от нее. Делеция левой границы Т-ДНК не влияет на опу-
холеобразование, но удаление правой пограничной области приво-
дит практически к полной утрате вирулентности. Показано, что
409
TGGCAGGATATATTGNNTGTAAAC
I I
TGACAGGATATATTGNNNNNGGTAAAC
Правая граница
О О О □
Ti-плазмида
Перенос
и интеграция
Т-ДНК
□ □□□□□□□□□ □□□□□□□□
Растительная ДНК Растительная ДНК
□□□□□□□□□□ □□□□□□□□
Рис. V.4. Схема строения левой и правой границы Т-ДНК.
Т-ДНК на концах имеет идентичные повторы по 25 п. н. каждый. Правый повтор не-
обходим для переноса и интеграции. При интеграции Т-ДНК в растительном геноме
в месте стыка остается точно 2 п. н. от правого повтора, но длина участка левого по-
втора варьирует и может быть короче правого.
делеция правого повтора или его части приводит к потере способ-
ности Т-ДНК включаться в растительную ДНК. Следовательно,
этот повтор стимулирует ориентированный перенос Т-ДНК влево
от этого сайта.
Учитывая важную роль концов Т-области в переносе Т-ДНК,
можно предположить, что любой сегмент ДНК, встроенный
между этими концами, может быть перенесен в растения как
часть Т-ДНК.
Так, в результате инсерции Т7 в локус синтеза нопалина была
получена Ti-плазмида, способная осуществлять перенос чужерод-
ной ДНК в растения в составе Т-ДНК и при этом индуцировать
корончатый галл. Анализ ДНК, выделенной из этих опухолей, по-
казал, что Т-область, содержащая Тп7, передавалась в клетки рас-
тений как единый сегмент ДНК длиной 38 т. п. н. без заметных
перестроек. Таким образом, любая последовательность ДНК, кова-
лентно встроенная между концами Т-области, может быть перене-
сена в растительные клетки при трансформации. Существенным
является тот факт, что ни одна из встроек транспозона не наруша-
ла переноса Т-ДНК. Это свидетельствовало о том, что перенос
Т-ДНК и включение ее в геном растения, вероятно, кодируются
генами за пределами Т-области.
Локализация Т-ДНК в растительном геноме. Генетический
анализ растений, регенерированных из трансформированной
410
ткани, показал случайную интеграцию Т-ДНК на хромосомном
уровне. Однако Т-ДНК может быть локализована более чем в
одном генетическом локусе. Множественные копии Т-ДНК могут
быть обнаружены в независимых сайтах либо сцеплены в виде
тандемных повторов. Т-ДНК из двух различных бактерий могут
быть перенесены в одну и ту же растительную клетку.
В трансформированных линиях аберрантные структуры Т-ДНК
обнаруживаются в геноме растений с довольно высокой частотой
(до 40 %).
Усилитель переноса — overdrive. Тонкий структурный анализ
правой границы октопиновой Ti-области и соседних с ней после-
довательностей обнаружил элемент из 24 п. н., который усиливает
эффективность переноса Т-ДНК. Этот элемент, названный overd-
rive, или ускоренная передача, локализуется на расстоянии около
17 п. н. вправо от обоих правых концевых повторов (TL-В и TR-D)
в октопиновой плазмиде pTiA6NC и состоит из следующей обоб-
щенной последовательности:
... 5' ТААПурТПиР N ЦТГТПурТ N ТГТТТГТТТГ 3' ...
Аналогичная последовательность расположена по соседству с
правой границей TL-ДНК pRiA4, менее консервативная последо-
вательность может быть найдена справа от правого концевого по-
втора нопалиновой плазмиды pTiT37. Синтетический overdrive
функционален в любой ориентации, даже если слегка отодвинут
от своей нормальной позиции. Предполагают, что overdrive резко
усиливает взаимодействие между правой границей и соответст-
вующими Vir-белками наиболее вероятно на этапе процессинга
Т-ДНК, поскольку overdrive локализован вне Т-ДНК и должен,
таким образом, действовать до вырезания копии Т-ДНК. Экспери-
менты с Agrobacterium и Е. coli свидетельствуют, что overdrive
действительно необходим для эффективного процессинга Т-ДНК в
ее природной конфигурации, стимулируя образование Т-цепей.
Присутствие последовательности overdrive вблизи правого кон-
цевого повтора 25 п. н. объясняет более высокую эффективность
инициации переноса правой границей по сравнению с фрагмента-
ми левой границы. Система концевой повтор/overdrive представля-
ет собой сайт-специфическую систему инверсии и промоторно-
энхансерную систему.
Анализ стыков Т-ДНК/растительная ДНК. К настоящему
времени клонированы и секвенированы различные фрагменты, со-
держащие место соединения Т-ДНК/растительная ДНК. Из сравне-
ния секвенированных стыков следовало, что правая граница Т-ДНК
определяется, видимо, очень точно: она локализуется внутри или
на расстоянии не более 10 п.н. от правого концевого повтора.
Стык левой границы более вариабелен.
Сравнительный анализ нуклеотидной последовательности ге-
номной ДНК табака до и после инсерции Т-ДНК показал, что в
результате этого события могут происходить значительные пере-
411
стройки ДНК-мишени. Наиболее значительная перестройка — это
прямая дупликация последовательности мишени на левом и пра-
вом концах Т-ДНК. Кроме этого, рядом с повтором часто образу-
ются делеции и инсерции меньшего размера. Такой характер пере-
строек мишени предполагает, что инсерция Т-ДНК, скорее всего,
является многостадийным процессом рекомбинации, включающим
локальные события репликации и репарации, осуществляемые
ферментами клетки-хозяина.
Процессинг Т-ДНК. Существуют две возможности переноса
Т-ДНК.
1. Целая плазмида может транспортироваться через бактери-
альную и растительную клеточные мембраны. Т-ДНК стабильно
интегрируется в растительный геном, а остаток Ti-плазмиды теря-
ется.
2. В бактериальной клетке Т-ДНК может вырезаться или копи-
роваться с Ti-плазмиды и только эта часть переносится в расти-
тельную клетку.
Хотя механизм переноса Т-ДНК еще малоизвестен, уже полу-
чены некоторые результаты, которые могут пролить свет на собы-
тия начального этапа переноса — процессинг Т-ДНК.
Показано, что сайт разрезания вблизи левой нопалиновой гра-
ницы может находиться максимум в пределах 50 п. н. влево или
вправо от последовательности 25 п.н. К правому концу Т-ДНК
ковалентно прикреплен белок. Результатом процессинга, таким
образом, является свободная молекула Т-ДНК с прикрепленным
белком(ами) к ее правому концу и остаток Ti-плазмиды, несущей
белок(ки), связанный с левой границей.
На каждой из границ обнаружено образование концевых надре-
зов (ников) и одноцепочечной Т-ДНК. Через 4—12 ч после индук-
ции Vir-генов в позиции после третьего-четвертого нуклеотида в
концевом повторе 25 п. н. образуются надрезы в нижней цепи Т-ДНК
(рис. V.5).
После индукции Vir-генов образуются одноцепочечные линей-
ные молекулы Т-ДНК, соответствующие полярности нижней цепи
(Т-цепи).
Вырезание Т-ДНК из Ti-плазмиды может иметь аналогию с
консервативной транспозицией или сайт-специфической реком-
бинацией (или инверсией) в бактериях. Наблюдаемая репликация
одноцепочечной ДНК, стимулируемая концевыми надрезами, имеет
сходство с процессингом ДНК для конъюгативного переноса
между бактериями, а также с репликацией одноцепочечных бакте-
риофагов. В пользу конъюгативной модели свидетельствуют дан-
ные, согласно которым локусы mob и опТ трансмиссивной плаз-
миды широкого круга хозяев, необходимые для ее передачи между
грамотрицательными бактериями, могут также стимулировать ее
перенос в клетки растений. В этой связи высказано предположе-
ние, что каждый концевой надрез может служить ориджином (точ-
кой начала) репликации. В соответствии с этим вновь синтезируе-
412
Первый разрез
Е.уЛ1Ц\иУЛУ1ЦМЦМЦМГ
g^^»HaasBsg
БТ|У.У|»мТ^ийНВаийИМЬ|
Ядро растительной клетки
Рис. V.5. Схема вырезания Т-ДНК из Ti-плазмиды.
Пояснения в тексте.
413
мая Т-цепь, возникающая у правой границы, могла бы протянуться
через левую границу, которая сама стимулирует еще один раунд
синтеза. Чтобы высвободить вновь синтезируемую цепь, должен
существовать какой-то механизм, поддерживающий надрезанное
состояние ДНК. Так, при репликации одноцепочечной ДНК фага
фХ 174 для этой цели служит белок А. После надрезания он оста-
ется ковалентно прикрепленным к 5'-концу замещенной нити и
образует комплекс с репликационным аппаратом. Когда реплика-
ционная вилка возвращается к началу, белок А вводит другой над-
рез и высвобождает замещенную цепь. В этой связи интересно, что
область правого конца Т-ДНК узнается РНК-полимеразой и белка-
ми VirDI и VirD2 и что белок VirD2 может быть ковалентно свя-
зан с 5'-концом Т-цепи.
Не очевидна роль двуцепочечных молекул Т-ДНК, вырезаемых
из Ti-плазмиды, в строго репликативном механизме. Можно пред-
ставить, что белок VirDI вводит специфичный надрез верхней
цепи только как побочный продукт. Альтернативно границы могут
преимущественно разрезаться в верхней цепи во время подготовки
ДНК к механической или эндонуклеотической деградации напро-
тив или вблизи надреза в нижней цепи. Один из Путей объединить
эти две точки зрения состоит в том, чтобы предположить, что за
вырезанием Т-ДНК из Ti-плазмиды следует синтез одноцепочеч-
ной ДНК по механизму катящегося кольца, начиная от Т-ДНК. Од-
нако, чтобы объяснить все данные, следует предположить, что ос-
тавшаяся часть Ti-плазмиды (после вырезания Т-ДНК) может
также генерировать одноцепочечную ДНК.
Все известные данные говорят о том, что в растительную клетку
переносится либо одно-, либо двухцепочечная линейная Т-ДНК.
Это находится в соответствии с локализацией концов Т-ДНК в опу-
холевых линиях, ДНК которых секвенирована. Данные о том, что
одноцепочечную ДНК можно использовать для трансформации, де-
лают разумной возможность переноса одноцепочечной ДНК в клет-
ки растений.
Vir-гены и перенос Т-ДНК. Мутации вне Т-ДНК, влияющие
на вирулентность, локализованы либо в бактериальной хромосоме,
либо в области вирулентности Ti-плазмиды. Соответствующие
гены отвечают за ранние события трансформации.
Хромосомные гены вирулентности. Ранний этап трансформа-
ции — это прикрепление бактерий к растительным клеткам. Пред-
полагают, что прикрепление является предпосылкой переноса
Т-ДНК в клетки растения: во-первых, образование опухоли виру-
лентными бактериями можно ингибировать путем преинокуляции
ткани растения авирулентным штаммом, который еще сохранил
способность к прикреплению; во-вторых, некоторые авирулент-
ные хромосомные мутанты дефектны по их способности контак-
тировать с растительными клетками. Хромосомная область виру-
лентности октопинового штамма А6 содержит два различных, но
сцепленных локуса размером 1.5 и 5 т. п. н., названных chvA и
414
chvB соответственно. Инсерции транспозона в эти локусы приво-
дят к авирулентности и дефектности по прикреплению. Эти локу-
сы экспрессируются конститутивно. Мутанты по каждому локусу
обнаруживают плейотропный эффект, что, видимо, связано с из-
менениями клеточной стенки. Мутанты chvB утратили 2-0-D-nno-
кан, нормально обнаруживаемый в фильтратах культуры и водно-
фенольных экстрактах A. tumefaciens дикого типа. Еще одна хро-
мосомная мутация pscA, приводящая к авирулентности, связана с
изменением состава полисахаридов и дефектом в образовании
целлюлозных фибрилл. Недавно идентифицированы гены Rhizobi-
um meliloti ndvA и ndvB, гомологичные генам PSC. Как оказалось,
эти локусы функционально взаимозаменяемы с таковыми у A. tu-
mefaciens и существенны для образования клубеньков. Аналогич-
ная ситуация с хромосомными генами синтеза экзополисахаридов
Agrobacterium pscA и Rhizobium ехоС. Таким образом, первые
этапы патогенных и симбиотических взаимодействий Agrobacteri-
um и Rhizobium с растительными клетками одинаковы.
Анализ мутантов свидетельствует, что кроме Т-ДНК для он-
когенности необходима протяженная область Ti-плазмиды около
35 т. п. н., обозначенная как vir-область и содержащая шесть раз-
личных групп комплементации — virA, virB, virC, virD, virE и virG
(рис. V.6). Мутации в этих локусах полностью подавляют (virA, В,
D и G) либо значительно снижают (virC и Е) вирулентность.
Высокая степень гомологии октопиновой и нопалиновой Ti-плаз-
мид в пределах vir-области вместе с их комплементарностью и
взаимозаменяемостью свидетельствуют, что обе области очень
сходны. Нопалиновая vir-область pTiC58 обнаруживает такую же
общую организацию, как и более изученная октопиновая vir-об-
ласть. Все нопалиновые vir-локусы имеют свои аналоги в октопи-
новой vir-области, и направления транскрипции всех vir-локусов
сохранены.
Регуляция экспрессии vir-области. Vir-локусы Ti-плазмиды
транскрипционно активируются в ответ на сигнальные молекулы,
продуцируемые клетками растений.
Локусы вирулентности организованы в единый регулон, индук-
ция которого растительными клетками контролируется позитив-
ными регуляторными элементами, кодируемыми virA и virG.
Локусы virA и virG. Мутации virA нарушают индукцию ос-
тальных vir-локусов. Моноцистронный локус virA кодирует белок
92 кДа и конститутивно транскрибируется на низком уровне. Му-
тации virG элиминируют индукцию генов vir. Напротив, вирулен-
тность агробактерии повышается, если локус virG генетически мо-
дифицирован или амплифицирован. Этот локус содержит одну от-
крытую рамку считывания, кодирующую белок около 30 кДа.
Анализ транскриптов показал, что с гена virG октопиновой плаз-
миды образуется две различные матрицы; одна конститутивная,
другая — индуцибельная. Локус virG нопалиновой Ti-плазмиды,
видимо, экспрессируется только конститутивно.
415
Локус virA virB virG virC virD virE
Длина (т.п.н.) 2 9.5 1 2 4.5 2
Белок VirA VirB 1-3 VirG VirC 1-2 VirDI,D2 VirE2
Конститу- тивность Низкая Низкая
Индуци- бильность Высокая Высокая Высокая Высокая Высокая
Место ло- кализации Функция Мембрана Рецептор для ацето- сирингона S_ Мембрана Цито- плазма Индуци- рует транс- Цито- плазма Цито- плазма Цито- плазма Мембрана
оонф кри др> vir [ПЦИЮ тих генов
-М-Д
АТП- связы- вающий белок ? Может связывать overdrive после- дова- тельность Эндо- нуклеаза; вырезает Т-ДНК i ss связы- вающий белок
Рис. V.6. Схема Vir-района Ti-плазмиды.
Vir А, В, G, С, D, Е — локусы vlr-района, которые участвуют в вырезании, переносе
и интеграции Т-ДНК в растения. Черные стрелки указывают направление траскрип-
ции соответствующих локусов; заштрихованные стрелки указывают функцию соот-
ветствующего белка; ? — функция неизвестна. Остальные пояснения к схеме даны в
тексте.
Анализ последовательности локусов virG и virA показал, что
продукты этих двух генов близкородственны белкам бактериаль-
ных двухкомпонентных позитивных систем регуляции ompR/envZ
и ntrC/ntrB. Таким образом, видимо, прокариоты используют один
и тот же принцип двухкомпонентной регуляции для позитивного
ответа на различные внешние стимулы. Предложена модель, со-
гласно которой продукт гена virA (мембраносвязанный хеморе-
416
цепторный белок, переносящий внеклеточный сигнал) после взаи-
модействия с сигнальной молекулой трансформирует продукт гена
virG в форму, активирующую транскрипцию остальных vir-локу-
сов. В промоторной области различных vir-генов найдены консер-
вативные последовательности, которые играют позитивную роль в
регуляции генов вирулентности.
Показано, что белок VirA является гистидиновой протеинкина-
зой, способной к аутофосфорилированию, он дважды пронизывает
внутреннюю мембрану бактериальной клетки. Фосфорилирован-
ная форма VirA выступает в качестве донора фосфата для белка
VirG. В отсутствие индуктора С-терминальный домен белка VirA
взаимодействует с его N-терминальным доменом, ингибируя ки-
назную активность. Стимуляция ацетосирингоном и/или сахарами
вызывает автофосфорилирование VirA, что приводит к конфор-
мационным его изменениям, позволяющим фосфорилировать
VirG. Фосфорилированный VirG связывается с 12-нуклеотидной
последовательностью vir-бокса, находящейся выше по течению
относительно промотора, и активирует транскрипцию остальных
vir-генов. Индукция vir-генов обратима, что очень важно для пато-
гена: в случае, если хозяин — больной и нежизнеспособный орга-
низм, перенос Т-ДНК не осуществляется.
Ряд локусов регулируется также и другими факторами. Выделе-
ны спонтанные хромосомные мутанты, так называемые ros (rough
surface), у которых гены virG и virD экспрессируются на высоком
конститутивном уровне. Мутанты ros характеризуются необычной
морфологией колоний, которые имеют грубую поверхность в ре-
зультате утраты главного внеклеточного полисахарида. Таким об-
разом, транскрипцию гена virD могут контролировать два незави-
симых промотора. Для одного промотора необходимо присутствие
растительного индуктора и продуктов Vira и VirG, тогда как дру-
гой функционирует в условиях, вызываемых ros-мутацией.
Экспрессия vir-генов специфично активируется метаболитами
растительных клеток, присутствующими в экссудатах множества
культур растительных клеток. Индукция не требует растительно-
бактериального контакта и опосредуется фенольными соедине-
ниями, названными ацетосирингон (AS, 4-ацетил-2,6-диметок-
сифенол) и а-гидроксиацетосирингон (ОН-AS). Показано, что
родственные соединения, такие как синапиновая кислота, также
индуцируют экспрессию генов vir.
Продукция AS и ОН-AS стимулируется поранением ткани рас-
тения, для этого необходим активный метаболизм растительных
клеток. Синтез ацетосирингона может быть частью ответа расти-
тельной клетки на поранение, поскольку эти соединения, видимо,
являются продуктами пути биосинтеза шикимовой кислоты.
Агробактерии могут перемещаться в направлении повышения
концентрации фенольных соединений. Интересно, что хемотаксис
в направлении AS определяется Ti-плазмидой, зависит от генов
virA и virG и проявляется при концентрации, которая приблизи-
15 Генетика
417
тельно в 100 раз меньше, чем это необходимо для эффективной
индукции vir-генов. Это означает, что AS действует на двух этапах
атаки паразита: при низких концентрациях AS направляет бакте-
рии в сторону пораненных растительных клеток. Вблизи расти-
тельных клеток большие концентрации AS вызывают экспрессию
vir-генов и в конечном счете перенос Т-ДНК в растение.
Одной из причин нечувствительности однодольных растений к
агробактериальной инфекции является, видимо, отсутствие в экссу-
датах их тканей низкомолекулярных индукторов вирулентности, по-
добных ацетосирингону. Недавно, правда, в экстрактах проростков
и семян пшеницы и овса был обнаружен низкомолекулярный поли-
пептид, способный выполнять ту же роль — индуцировать экспрес-
сию vir-генов агробактерий.
Область вирулентности агробактериальных плазмид кодирует
функции, необходимые для осуществления процессинга Т-ДНК в
бактериальной клетке. Экспрессия большинства vir-генов носит
индуцибельный характер, регулируется продуктами самих же vir-
генов и зависит от взаимодействий агробактерий с клетками рас-
тений. Более углубленное изучение отдельных генов вирулентнос-
ти позволило установить их конкретную роль в этом процессе.
Рассмотрим некоторые vir-локусы, роль которых в переносе Т-ДНК
уже установлена. В клетках агробактерий, растущих в присутст-
вии ацетосирингона, индуцируется синтез более 10—15 различных
белков, кодируемых vir-генами Ti-плазмид, а также несколькими
генами вне области вирулентности.
Локус virB наиболее протяженный в vir-области. Определена
полная нуклеотидная последовательность локуса virB из октопи-
новой плазмиды pTiA6NC. Этот локус представляет собой единый
оперон, включающий И открытых рамок считывания. В системе
in vitro обнаружен протеолитический процессинг белка VirB9.
Многие продукты генов virB имеют сигналы секреции, сходные с
сигнальными последовательностями экскретируемых бактериаль-
ных белков, что свидетельствует об их мембранной локализации.
Белок VirBll, продукт одного из 11 генов оперона virB, необ-
ходим для транспорта Т-ДНК из бактерии в растение. Показано,
что VirBll является АТФазой, обладающей способностью к авто-
фосфорилированию и локализованной на внутренней мембране
клеток бактерий. В составе этого белка находится нуклеотидсвя-
зывающая последовательность, нарушение которой приводит к
авирулентности бактерий. Функции других белков VirB неясны,
но локализация большого количества этих белков на бактериаль-
ной оболочке или внутренней мембране позволяет предположить,
что, возможно, они формируют канал, через который проходит
Т-ДНК.
Локус virC. Накоплено несколько косвенных доказательств,
что этот локус может влиять на эффективность переноса Т-ДНК.
Мутации в локусе virC приводят к изменению круга хозяев: на
некоторых растениях мутанты virC являются авирулентными, но
418
вирулентны на других растениях-хозяевах. Анализ нуклеотидной
последовательности гена virC выявил две открытые рамки считы-
вания, обозначенные как virCl и virC2, кодирующие белки около
25.7 кДа. Белки VirCl плазмид pTiC58 и pTiA6NC идентичны по
87.4 % аминокислотных остатков. В гене virC2 есть два мотива
значительной гомологии (84.6 и 78.5 %) с геном virCl, разделен-
ных вариабельным сегментом из 41 аминокислотного остатка.
Только два нуклеотида разделяют стоп-кодон virCl от стартового
кодона virC2, указывая на возможность трансляционной спарен-
ности этих двух генов. Предполагают, что VirC может увеличивать
эффективность процесса переноса.
Локус virD кодирует несколько продуктов. Один из них явля-
ется двухкомпонентной топоизомеразой/эндонуклеазой. Область
Т-ДНК фланкирована несовершенными прямыми повторами дли-
ной 25 н. п. Эти последовательности являются сайтами узнавания
эндонуклеазы VirD, режущей точно между 3 и 4 основаниями по-
втора. Белок VirD2 ковалентно присоединяется к 5'-концу Т-нити;
он содержит сигнал ядерной локализации (NLS) около С-конца.
NLS важен для опухолеобразования.
Локус virE. Сведения о функциях этого локуса противоречивы,
видимо, в связи с тем, что различные экспериментаторы используют
разные растения. Показано, что мутанты virE являются авирулент-
ными на некоторых растениях, а на других индуцируют опухоли.
Локус virE представляет собой оперон, включающий две рамки
считывания virEl и virE2, кодирующие соответственно белки раз-
мером 7 и 60 кДа.
Продукт гена virE является белком, связывающимся с однони-
тевой ДНК, он защищает Т-ДНК в процессе переноса. В составе
белка VirE2 обнаружен сигнал ядерной локализации.
Без белка VirE2 однонитевая Т-ДНК остается в цитоплазме и
не транспортируется в ядро растительной клетки. В ядре табака
идентифицирован белок с молекулярной массой 42 кДа (р42), спе-
цифически присоединяющийся к NLS белка VirD2. Предполагает-
ся, что р42 помогает доставить Т-ДНК в ядро.
Локус virF. Область 5 т. п. н. pTiB6S3, содержащая локус virF,
влияет на эффективность трансформации. Предполагают, что про-
дукт этого гена участвует в разрушении фитоалексинов — ве-
ществ, которые выполняют защитные функции в растении при
стрессовых воздействиях.
V.2.6. ЭКСПРЕССИЯ ГЕНОВ Т-ДНК В РАСТЕНИЯХ
Т-ДНК транскрибируется в растительных клетках ферментами
растения-хозяина. Транскрипты Т-ДНК полиаденилированы, кэ-
пированы, т. е. имеют особенности эукариотических матриц.
В октопиновой опухоли корончатого галла табака с TL-ДНК
транскрибируется восемь различных, четко идентифицируемых
419
полиаденилированных мРНК, тогда как более длинная нопалино-
вая Т-ДНК кодирует по крайней мере тринадцать транскриптов.
Были также картированы и охарактеризованы пять полиаденили-
рованных транскриптов, определяемых октопиновой TR-ДНК.
Первые гены Т-ДНК, структура и транскрипция которых были
изучены в деталях, — это гены, контролирующие синтез октопин-
синтаз и нопалинсинтаз. Определение нуклеотидной последова-
тельности ДНК позволило идентифицировать кодирующую об-
ласть и определить на нуклеотидном уровне сайты инициации и
полиаденилирования мРНК. Доступность генов Т-ДНК для клони-
рования, возможность манипулирования ими in vitro и введения
измененных генов в растения позволяет сравнительно легко про-
водить делеционный анализ структуры генов Т-ДНК. В результате
удалось идентифицировать важные регуляторные участки и опре-
делись их нуклеотидную последовательность для ряда генов Т-ДНК.
Были установлены полные нуклеотидные последовательности ок-
топиновой TL-ДНК и TR-ДНК.
Перед точкой старта синтеза мРНК идентифицирован ТАТА-
блок или блок Гольдберга-Хогнесса. Расстояние от этой последо-
вательности до сайта инициации транскрипции около 30 п. н., что
позволяет отнести ее к типично эукариотическим промоторам. Транс-
крипты Т-ДНК начинаются в строго определенных положениях, за
исключением октопинового «транскрипта 4», который, видимо,
может начинаться с любого из двух альтернативных сайтов, каж-
дому из которых на соответствующем расстоянии предшествует
ТАТА-бокс.
Нетранслируемые З'-области каждого из генов Т-ДНК содер-
жат одну или более последовательностей, идентичных (либо отли-
чающихся только одним основанием) сигналу полиаденилирова-
ния ААТААА. Для гена октопинсинтазы и гена транскрипта 4 об-
наружены множественные сайты полиаденилирования.
Для каждого гена первый АУГ-кодон, встречающийся после
сайта транскрипционного старта, находится в фазе с открытой
рамкой считывания и служит сигналом инициации трансляции.
Ни один из генов Т-ДНК не содержит интронов, что не являет-
ся аргументом против эукариотического характера Т-ДНК, по-
скольку многие ядерные гены растений также не имеют интрон-
ных последовательностей, например гены пектина сои, глиадина
пшеницы и зеина кукурузы.
Для установления связи между транскриптами Т-ДНК, выявля-
емыми в опухолевых клетках, с их функциями в процессе индук-
ции опухолевого фенотипа использовали транспозоновый мутаге-
нез. Удалось выделить два класса мутантов — не влияющих или
влияющих на морфологию опухоли.
В первый класс попали мутанты, для которых характерно фор-
мирование типичной опухоли, но отсутствует синтез опинов. В
нопалиновой Т-ДНК мутация затронула гены, контролирующие
синтез нопалинсинтазы и агроцинопинсинтазы.
420
Во второй класс попали мутанты, у которых нарушено формиро-
вание опухоли. Т-область и vir-область вносят свой вклад в наруше-
ние фитогормонального баланса при опухолеобразовании. Обнару-
жение синтеза некоторых фитогормонов клетками агробактерий
послужило одним из первых указаний на важную роль фитогормо-
нов в процессе образования опухоли. Было замечено, что вирулент-
ные штаммы A. tumefaciens способны продуцировать цитокинины
транс-зеатинового типа и ауксин-индолилуксусную кислоту (ИУК).
Корреляция между онкогенностью и продукцией фитогормонов до-
казана в многочисленных опытах по элиминации Ti-плазмид из кле-
ток агробактерий. Ген синтеза ИУК в клетках агробактерий локали-
зован в vir-области Ti-плазмиды. Был получен мутант бесплазмид-
ного штамма A. tumefaciens, у которого уровень продукции ИУК
был снижен практически до нуля. Анализ продуктов синтеза в нор-
мальном и мутантном штаммах показал, что хромосомные гены аг-
робактерий контролируют превращение триптофана в индолпиру-
ват, а гены, локализованные на Ti-плазмиде, контролируют заклю-
чительный этап — превращение индолпирувата в ИУК. Показано,
что ген, контролирующий синтез ИУК (iaa Р), локализуется в vir-об-
ласти Ti-плазмиды.
В плазмидах нопалинового типа pTiT37 и pTiC58 идентифициро-
вали локус tzs, отвечающий за синтез транс-зеатина из клеток агро-
бактерий. Анализ нуклеотидной последовательности показал, что
существует гомология между геном tzs и геном tmr (ipt) из Т-области.
Разумеется, гормононезависимый рост корончатых галлов нельзя
объяснять исключительно способностью агробактерий продуциро-
вать ауксин и цитокинин хотя бы потому, что гормононезависи-
мый рост опухолевых клеток продолжается и в отсутствии бакте-
рии-возбудителя. Возможно, что кодируемый Ti-плазмидой синтез
фитогормонов играет важную роль на ранних стадиях индукции
опухолевого роста. В пользу этого предположения свидетельствует
тот факт, что экспрессия гена tzs в клетках агробактерий индуци-
руется аналогично генам вирулентности Ti-плазмид. Однако в
штаммах агробактерий октопинового типа не обнаружен синтез
цитокининов и не найдено соответствующего гена. Возможно, его
экспрессия может влиять на круг хозяев, заражаемых несущим
этот ген штаммом. Воздействие фитогормонов, синтезируемых в
бактериях, на рост растительных клеток может происходить сле-
дующим образом. Индукция корончатого галла, как известно,
может эффективно происходить только в зоне раневой поверх-
ности ткани растения. Повреждение ткани растения само по себе
обычно приводит к клеточным делениям вокруг раневой поверх-
ности, что, вероятно, является важным условием трансформации.
В неинфицированных тканях клеточные деления прекращаются
после нескольких раундов, в то время как в тканях, зараженных
агробактериями, они продолжаются.
Вполне вероятно, что секретируемые агробактериями фито-
гормоны действуют на растительные клетки таким образом, что
421
индуцированные поранением клеточные деления продолжаются
до тех пор, пока Т-область Ti-плазмиды переносится в растение
и не начинается экспрессия опс-генов Т-ДНК в растительных
клетках. Кроме того, считают, что ауксины, вырабатываемые
бактерией, способствуют размягчению клеточной стенки расте-
ния, что способствует более легкому проникновению Т-ДНК.
Глава V.3
ЭКСПРЕССИЯ ГЕНОВ Т-ДНК
AGROBACTERIUM TUMEFACIENS
В ТРАНСГЕННЫХ РАСТЕНИЯХ
Гены Tmsl и Tms2: продукты, функция, экспрессия.
Предположение о том, что гены 1 и 2 (tmsl = iaa М и tms2 = iaa Н
соответственно от tumour morphology shooty или indolyl acetic
acid) Ti-плазмиды A. tumefaciens участвуют в биосинтезе индолил-
уксусной кислоты (ИУК) — фитогормона ауксина — в трансфор-
мированных клетках растений, было высказано достаточно давно.
Показано, что растения табака, трансформированные штаммом с
геном 1, содержат в 500—1000 раз больше индолил-3-ацетамида,
чем контрольные растения. Таким образом, было выдвинуто пред-
положение, что ген 1 участвует в накоплении индолил-3-ацетами-
да (ИАМ) в клетках. Так как в этих растениях ИАМ не превра-
щался в ИУК, токсичную для растений в высокой концентрации,
растения, трансгенные по гену 1, росли и развивались нормальным
образом. Дальнейшие работы подтвердили, что ген 1 кодирует
триптофанмонооксигеназу, которая превращает триптофан в ин-
долил-3-ацетамид. Это первая стадия уникального двухступенчато-
го процесса биосинтеза ИУК, который имеется у растительных
патогенов. Затем ИАМ гидролизуется в ИУК ферментом индоли-
лацетамидгидролазой (продуктом гена 2). В качестве субстрата
амидогидролаза может использовать также индолил-3-ацетонит-
рил, 7а-нафталенацетамид, конъюгаты ИУК с глюкозой и миоино-
зитолом. Таким образом, функция амидогидролазы состоит в пре-
вращении веществ с низкой ауксиновой активностью в соединения
с высокой ауксиновой активностью. Этот двухэтапный путь био-
синтеза ауксина гораздо проще предполагаемого пути синтеза аук-
сина у растений (рис. V.7).
При трансформации декапитированных растений и листовых
дисков табака штаммами A. tumefaciens, несущими только ген 1
или только ген 2, опухолеобразования не наблюдалось. Однако в
том случае, если ген 1 был поставлен под контроль одного из
сильных промоторов (например, 19S или 35S вируса мозаики
цветной капусты), у трансформированных такой конструкцией
422
Триптофан
nh4
сн2-сн-соон
---------►
Триптофан-2
монооксигеназа
Н
Индол-З-ацетамид
Индол-З-ацетамид
гидролаза
И ндолилуксусная
кислота (ИУК)
Рис. V.7. Бактериальный путь биосинтеза ауксина.
Пояснения в тексте.
растений было значительно увеличено содержание ИУК. Аномаль-
ный фенотип этих растений (проявляющих так называемый аукси-
новый эффект) приведен в табл. V.I. В том случае, если растения
табака (декапитированные проростки или листовые диски) зара-
жали конструкциями, несущими гены 1 и 2 вместе, трансформиро-
ванные ткани также отличались от контроля (табл. V.1). В некото-
рых работах гены 1 и 2 ставили под контроль различных диффе-
ренциально регулируемых промоторов, в том числе промотора
гена маннопин-синтазы (mas) A. tumefaciens, который в основном
экспрессируется в корнях, или с промотором картофеля ST-LS1,
экспрессирующимся в листьях и стеблях, и этими конструкциями
трансформировали растения. Результаты трансформации приведе-
ны в табл. V.I. Как правило, растения, трансформированные подоб-
ными конструкциями, имели аномальный фенотип, но увеличение
количества ИУК было отмечено лишь в некоторых случаях.
Итак, в растениях существует регулирующая ИУК система,
которая поддерживает концентрацию ИУК на нетоксичном или
физиологически оптимальном уровне. Связывание ИУК явля-
ется одним из регуляторных механизмов, способствующих под-
держанию стационарного пула ИУК во время роста и развития
растения.
Эти выводы основаны на том, что содержание ИУК в трансген-
ных по генам 1 и 2 растениях табака только слегка увеличивалось,
тогда как уровни конъюгатов (связанных форм) ИУК были значи-
423
Таблица V.l
Фенотипические особенности трансгенных растении табака, содержащих
гены биосинтеза ауксина под контролем различных промоторов
Трансген Фенотипические признаки
tmsl Нормальный фенотип
P19S CaMV-tmsl Аномальный фенотип: высокие концентрации ИУК, апи- кальное доминирование, поникшие листья ланцетовидной формы, усиленное образование ксилемы и флоэмы, интен- сивное формирование придаточных корней
Pmasl'-tmsl Аномальный фенотип: уменьшены высота растений и диа- метр стебля, маленькие листья, усилено формирование бо- ковых корней
PST-LSl-tmsl Аномальный фенотип, как в Pmasl'-trnsl
tms2 Нормальный фенотип
tmsl + tms2 1. Нормальный фенотип, повышена чувствительность к НАМ, увеличено содержание свободной и связанной ИУК 2. Аномальный фенотип: уменьшены длина междоузлий и диаметр стебля, увеличено количество элементов ксилемы, узкие листья, формирование многочисленных придаточных корней, усиление образования боковых корней и подавле- ние роста пазушных почек, цветение отсрочено, мало цвет- ковых почек, цветки с гетеростилией, резко снижено образо-
вание пыльцы и семян, всхожесть полученных семян -40 %
P35S CaMV- Растения двух типов: с нормальным или аномальным фено-
tmsl + tms2 типом (увеличен уровень свободной и связанной ИУК, низ- кие растения с маленькими листьями, задержка сроков цве- тения, лигнификация ксилемы)
tmsl + P35S Аномальный фенотип: уменьшение числа узлов, маленькие
CaMV-tms2 листья, снижение общей биомассы; формирование мно- жества придаточных корней на стебле, угнетение роста па- | зушных побегов
тельно повышены. Аномальный фенотип трансгенных по генам 1
и 2 растений, где был использован сильный промотор транскрипта
35S (P35S) или 19S (P19S) вируса мозаики цветной капусты, види-
мо, можно объяснить тем, что защитные механизмы поддержания
баланса фитогормонов растения не могут справиться с таким боль-
шим подъемом концентрации ИУК.
Ген tmr: продукт, функция, экспрессия. Все природ-
ные цитокинины — производные аденина, отличающиеся друг от
друга лишь по составу боковой цепи (замещение в положении
№ 6), которая и определяет их биологическую активность. Наибо-
лее активной формой любого цитокинина считается его свободное
основание. Первая ступень биосинтеза цитокинина включает при-
соединение изопентенильной боковой цепи к 5'-АМФ:
2-изопентенил-пирофосфат + 5'-АМФ = изопентениладенозин-
5'-монофосфат (ИПА) + пирофосфат.
424
У A. tumefaciens эта реакция катализируется изопентенилтранс-
феразой, которая кодируется геном tmr (от tumour morphology rooty)
(ipt, или ген 4, по номеру транскрипта) (рис. V.8). Данная стадия
считается скорость-лимитирующей в процессе биосинтеза цитоки-
нинов, так как ИПА не накапливается в трансгенных растениях,
экспрессирующих ген tmr. Последующие этапы превращения ИПА
в биологически активные цитокинины осуществляются фермента-
ми, присутствующими у растений.
В экспериментах по трансформации растений векторными
Ti-плазмидами было показано, что только штаммы с геном tmr
могли вызывать образование опухоли без помощи других генов Т-ДНК
при заражении, например у растений табака. При этом опухоли
Аденозин-5-монофосфат тРНК
НОСН2 /О
%-.
НО1 ’он
Рис. V.8. Бактериальный путь биосинтеза цитокинина.
Пояснения в тексте.
425
табака на среде без гормонов формировали многочисленные побе-
ги. Много работ посвящено трансформации растений и эксплан-
тов (декапитированных проростков, сегментов стебля, листовых
дисков) табака векторными штаммами агробактерий, содержащи-
ми ген tmr под контролем различных промоторов, в том числе:
промоторов генов белков теплового шока (HS 6871) сои, а также
промотора гена 35S CaMV. Результаты некоторых работ приведе-
ны в табл. V.2. Как правило, растения характеризовались наличи-
ем цитокининового синдрома (недоразвитие корневой системы,
интенсивный рост пазушных почек, карликовость) и увеличением
уровня цитокининов.
С увеличением уровня цитокининов у трансгенных растений
наблюдалось также увеличение концентрации ИУК, что является
проявлением механизма защиты растения при нарушении гормо-
нального баланса.
Используя растения табака — соматические мозаики по экс-
прессии гена tmr, характеризующиеся формированием цветковых
и вегетативных почек на листьях, удалось доказать, что цитокини-
ны могут непосредственно влиять на развитие элементов цветка и
снижать экспрессию трех гомеозисных цветковых генов, гомоло-
Таблица V.2
Фенотипические особенности трансгенных растений табака, содержащих
ген биосинтеза цитокинина под контролем различных промоторов
Трансген Фенотипические признаки
tmr (ipt) Аномальный «побеговый» фенотип растений: укороченные и утолщенные побеги с маленькими, плотными, толстыми и морфологически измененными листьями; взрослые растения имеют курчавые листья, короткие междоузлия, сильно ветвят- ся в верхней части; неполная блокировка пазушных почек и быстрый их рост, задержка цветения, увеличение размера листьев, быстрое накопление биомассы
P35S CaMV-ipt Отсутствие трансгенных растений; усиленный органогенез побегов, повышение уровней цитокининов (особенно зеа- тина) в трансформированных тканях, ингибирование корне- образования
HSP70-ipt Короткие ярко-зеленые растения с недоразвившейся корне-
(D. melanogaster) вой системой, усиленным ростом пазушных почек. После теп- лового шока: увеличение содержания цитокининов и хлоро- филла в листьях и стеблях
HSP70-ipt У растений замедлено развитие корневой системы, уменьше-
(Zea mays) ны размер и число листьев, задержка роста, усиленный рост побегов из пазушных почек, увеличено содержание цитокини- нов. После теплового шока фенотип не изменился
HSP-ipt (соя) Короткие растения с крупными боковыми побегами, сильно замедлено старение листьев. После теплового шока: увеличе- ние концентраций цитокининов, интенсивный рост побегов из пазушных почек
426
гичных гомеозисным генам DEFA, GLO и PLENA Antirrhinum
majus.
Другие гены Т-ДНК: продукты, функция, экспрес-
сия. Роль этих генов гораздо менее изучена. Ген 5 (по номеру
транскрипта), присутствующий в Т-ДНК некоторых штаммов Ag-
robacterium tumefaciens, также считается онкогеном. Продукт
этого гена, видимо, способен превращать триптофан в индолил-3-
лактат — слабый аналог ауксина, который действует как антаго-
нист ауксина, связываясь с сайтами связывания (рецепторами)
этого фитогормона. Экспрессия гена 5 в трансформированных
тканях зависит от соотношения ауксин/цитокинин; она индуциру-
ется ауксином и подавляется высокими уровнями цитокининов. На
основании этого полагают, что продукт гена 5 модифицирует ро-
стовые характеристики растительных опухолей, индуцированных
Т-ДНК. Регуляция экспрессии гена 5 носит пространственный и
временной характер. Он сильно экспрессируется в каллусах и
стеблях трансформированных растений, слабее — в листьях. Уда-
лось также показать, что ген 5 экспрессируется на всех стадиях
развития зародышей моркови, но особенности экспрессии имеют
стадиоспецифический характер. При делеции гена 5 в Т-ДНК, не-
сущей гены 1, 2 или 4, и трансформации такой конструкцией рас-
тений табака наблюдается формирование более крупной опухоли,
чем в случае наличия гена 5. При заражении различных растений
штаммами A. tumefaciens с плазмидами, несущими только ген 5,
формирования опухолей не наблюдалось.
В Т-ДНК Ti-плазмид выделяют также локус tml (от tumour
morphology large); мутация в этом локусе вызывает образование
больших опухолей у трансформированных растений. Первона-
чально в составе этого локуса выделяли два гена: 6а и 6Ь. Сейчас
показано, что ген 6а (ген ons) отвечает за секрецию опинов и,
таким образом, в настоящее время только ген 6Ь считается онко-
геном. Предполагают, что ген 6Ь участвует каким-то образом в
регуляции концентрации цитокинина в трансформированных клет-
ках и, таким образом, аналогичен гену 5 в регуляции другого важ-
ного фитогормона. Возможно, этот ген модифицирует чувстви-
тельность растительных тканей к цитокининам. Штаммы на осно-
ве Ti-плазмид, несущих только онкоген 6Ь, могли индуцировать
опухоли на растениях каланхоэ, табаков (Nicotiana rustica, N. gla-
uca), винограда. Гиперэкспрессия этого гена у трансформирован-
ного N. tabacum приводила к образованию почек на зараженных
листовых дисках. Из трансгенных тканей, интенсивно растущих in
vitro, формировались укорененные растения-регенеранты. Эти
растения характеризовались некоторыми морфологическими изме-
нениями, в частности у них было нарушено апикальное доминиро-
вание, и из пазушных почек в верхней части стебля развивались
многочисленные боковые побеги. Точная функция продукта этого
онкогена пока не определена, но ряд авторов сходится во мнении,
что он способен или снижать активность цитокининов, или сни-
427
жать чувствительность клеток растений к цитокининам, или про-
тиводействовать ингибированию клеточных делений высокими
концентрациями ауксина за счет снижения чувствительности к
нему клеток, сохраняя клетки в недифференцированном состоя-
нии.
Исследована экспрессия одновременно нескольких генов Т-ДНК
в самых разных их сочетаниях в трансгенных растениях разных
видов. Однако взаимодействие между генами Т-ДНК делало ответ
растения на трансформацию достаточно сложным для интерпрета-
ции. Поэтому введение конструкций с отдельными генами из Т-ДНК
в растительный геном гораздо более удобно как подход для изуче-
ния роли гормональных сигналов в морфогенезе.
Необходимо помнить, что экспрессия введенных генов варьи-
рует в зависимости от сайта интеграции, т. е. существует эффект
положения. Ответ на введение онкогенов Т-ДНК зависит также
от растительного генома и от множества других факторов, в том
числе от состава сред для культивирования эксплантов и от ус-
ловий окружающей среды.
V.3.I. ЭКСПРЕССИЯ ГЕНОВ Т-ДНК Ri-ПЛАЗМИД
AGROBACTERIUM RHIZOGENES
В ТРАНСГЕННЫХ РАСТЕНИЯХ ТАБАКА
Синдром «бородатого корня». Интеграция Т-ДНК Ri-плазми-
ды Agrobacterium rhizogenes вносит гены Т-ДНК в растительный
геном, и их экспрессия приводит к образованию «бородатых кор-
ней». Очевидны их отличия от контрольных, нормальных, корней:
быстрее растут, сильно ветвятся, являются плагиотропными, а не
положительно геотропными (как обычные корни), т. е. они растут
горизонтально и вверх, а не вниз.
Несмотря на то что у A. tumefaciens и A. rhizogenes сходны
структура их Ti- и Ri-плазмид, а также молекулярные механиз-
мы переноса Т-ДНК в клетки растения и интеграция ее в расти-
тельный геном, физиологические основы заболеваний «корон-
чатый галл» и «бородатый корень» различны.
Так, если «корончатые галлы» появляются в результате сверх-
продукции фитогормонов ауксина и цитокинина, которая опреде-
ляется генами Т-ДНК A. tumefaciens, то «бородатые корни» обра-
зуются, по-видимому, вследствие повышения чувствительности
трансформированных клеток к эндогенным гормонам. Далее, от-
дельные трансформированные корни, эксплантированные из «бо-
родатых корней», имеют клональное происхождение и не содер-
жат нетрансформированных клеток в отличие от опухолей, инду-
цированных A. tumefaciens.
И наконец, в отличие от «корончатых галлов» из «бородатых
корней» можно регенерировать целые фертильные растения, со-
держащие полную Т-ДНК. Причем значительное число культур-
428
ных трансгенных растений можно регенерировать только из куль-
туры бородатых корней. Указано на следующие характерные осо-
бенности растений, регенерировавших из культуры бородатых
корней:
сморщенные, напоминающие вафли, листья;
часто рассеченная листовая пластинка;
. мощные стебли с укороченными междоузлиями;
нарушенное апикальное доминирование у стеблей и корней;
. очень сильно развитая плагиотропная корневая система;
. интенсивное образование придаточных корней;
увеличение количества цветков у растений, а часто и образо-
вание меньшего количества пыльцы и семян по сравнению с
нормальными растениями.
Протопласты, полученные из растений-регенерантов, в 30—
1000 раз более чувствительны к ИУК, чем контрольные. По-види-
мому, высокая чувствительность к ауксину может быть связана с
высокой способностью клеток, трансформированных A. rhizoge-
nes, к корнеобразованию.
Имеет место несомненное преимущество использования Ri-(a
не Ti-) плазмиды в качестве хелперной плазмиды в векторных сис-
темах для переноса генов в растения — в этом случае нет необхо-
димости создавать авирулентные хелперные плазмиды с делениями
онкогенов, так как из культуры бородатых корней можно доста-
точно легко регенерировать интактные растения. Опухоли, вызы-
ваемые A. tumefaciens, явно вредны для растений-хозяев, тогда как
придаточные корни и мощная корневая система, образование
которых индуцирует A. rhizogenes, часто имеют адаптивное значе-
ние. В частности, мощная корневая система растений-трансфор-
мантов обеспечивает лучшее заякоривание в почве, засухоустойчи-
вость, возможность лучшего взаимодействия с почвенными гриба-
ми микоризы; растения-регенеранты часто растут быстрее и в
целом развиваются лучше, чем контрольные.
Экспрессия генов rolA, roIB и roIC в трансгенных растениях.
За спонтанное корнеобразование у трансформированных растений
отвечают три гена из Т-ДНК (TL Т-ДНК у Ri-плазмид атропиново-
го типа), обозначенные rolA, roIB и roIC (от root locus). Именно
совместная экспрессия этих генов Ri-плазмиды приводит к данно-
му патологическому состоянию. Однако при экспрессии по от-
дельности, гены rol вызывают различные аномалии развития, ха-
рактерные для каждого из них. Гены rol располагаются в централь-
ных районах Ri Т-ДНК, имеющих лишь частичную гомологию у
плазмид разных типов. Показано, что кодирующие последователь-
ности генов rol являются уникальными и не соответствуют ни
одной из известных последовательностей генов.
Следует отметить интересную особенность: фрагмент Т-ДНК
Ri-плазмиды только с одним геном roIB мог индуцировать корне-
образование у табака и каланхоэ, тогда как гены rolA и roIC по
отдельности могли вызывать корнеобразование лишь у табака,
429
причем гораздо менее эффективно. Таким образом, именно ген
го1В обеспечивает вирулентность.
Получены трансгенные растения, экспрессирующие одиночные
гены го! и их различные сочетания с целью определения роли каж-
дого из этих генов в формировании сложного синдрома бородато-
го корня.
Гиперэкспрессия гена го1С приводит к общей ювенилизации
(цитокининподобному эффекту), хотя одновременно стимулирует
также пролиферацию корней. Продукт гена го1В в высокой кон-
центрации приводит к раннему некрозу тканей (ауксинподобному
эффекту). Показано, что уровень экспрессии генов rol варьирует в
разных органах, разных видах растений и в разных растениях од-
ного вида в зависимости от их возраста и жизненного состояния.
Особенности тканеспецифической экспрессии генов rol приведе-
ны в табл. V.3. Изменение экспрессии генов rol при замене их
собственных промоторов на промотор транскрипта 35S вируса мо-
заики цветной капусты вызывает новые особенности развития. Ви-
Таблица V.3
Фенотипические особенности трансгенных растений табака,
экспрессирующих гены Rol под контролем различных промоторов
Трансген Фенотипические признаки
го1А Морщинистые листья, компактные соцветия, уменьшение длины междоузлий, увеличение размера цветков, увеличение рылец пестиков, интенсивное образование корней культурами ткани листьев; мужская стерильность; ингибирование накоп- ления связанной формы полиамина; задержка старения; не- стабильный фенотип с реверсией к норме у боковых побегов
rolB Измененная морфология листа, увеличение размера цветков, рылец пестиков, гетеростилия, усиленное образование прида- точных корней на стебле; высокая чувствительность к аукси- ну протопластов табака
35S CaMV-rolB Некротические каллусы (из культуры корней) без побегооб- разования или растения с закругленными листьями с много- численными некротическими зонами и гетеростилией
rolC Изменение морфологии листа, сильное ветвление стебля, на- рушено апикальное доминирование, уменьшен размер междо- узлий, маленькие цветки, фертильность снижена; раннее за- цветание
35S CaMV-rolC «Кустистые карлики», увеличено число побегов и листьев, листья маленькие, светло-зеленые, ланцетовидные, цветки ма- ленькие; мало пыльцы, мужская стерильность; усилено обра- зование и рост корней in vitro, стимуляция клеточного деле- ния и замедление элонгации клеток
го!А + rolB + rolC Синдром «бородатый корень»: нарушение апикального доми- нирования, сморщенные эпинастические листья, уменьшение длины междоузлий, маленькие цветки, уменьшено количество семян
430
димо, продукты разных генов го! имеют разные мишени действия
или же качественно различное влияние на одну и ту же мишень.
Экспрессия генов го! изменяет внутриклеточные концентрации
фитогормонов и/или чувствительность к нескольким раститель-
ным гормонам. Показано, что у трансформированных растений
изменяется содержание таких фитогормонов, как цитокинины,
абсцизовая кислота (АБК), гиббереллины и ауксин (ИУК). Рас-
пространено мнение, что спонтанное корнеобразование у транс-
формированных растений происходит не вследствие активности
ауксиновых генов в TR-ДНК и не из-за изменения баланса эндо-
генных гормонов, а, скорее, вследствие повышения чувствитель-
ности клеток к ауксину. За это повышение чувствительности и
могут отвечать гены TL-ДНК. Таким образом, продукты генов TL-ДНК
могут играть роль в сигнальной трансдукции растительных гормо-
нов, а гены синтеза ауксина из TR-ДНК играют вспомогательную
роль, обеспечивая концентрацию ИУК, необходимую для запуска
дифференциации клеток, если эндогенного ауксина для этого не-
достаточно.
На ауксиноподобный эффект генов Т-ДНК Ri-плазмиды указы-
вает интенсивный рост придаточных корней в месте инфекции. В
ряде работ исследователи задавались следующим вопросом: все ли
клеточные реакции на ауксин могут избирательно изменяться под
влиянием продуктов генов rol? В работе с мезофилльными прото-
пластами табака, выделенными из трансгенных по генам го! расте-
ний, было показано, что экспрессия гена го1В, в частности, влияла
на гиперполяризацию протопластов, но не влияла на деление по-
лученных из протопластов клеток (оба процесса являются клеточ-
ными ответами на ауксин). Аналогичные результаты получены с
целыми растениями и проростками табака. Каждый из генов го!В
и rolC влиял лишь на часть ауксиновых или цитокининовых соот-
ветственно реакций. Таким образом, только некоторые клеточные
ответы на фитогормоны могут избирательно изменяться под влия-
нием продуктов генов rol.
Показано, что продукт гена го1В является тирозин-фосфатазой,
которая локализуется на плазматической мембране. Таким обра-
зом, белок RolB участвует в каскаде реакций, определяющих
трансдукцию ауксинового сигнала, что и объясняет повышенную
чувствительность трансгенных по гену го1В растительных тканей к
ауксину.
Определение функции продукта гена rolC требует проведения
дальнейших экспериментов.
Что касается продукта гена го1А, его молекулярная активность
сейчас пока неизвестна. Установлено, что он увеличивает чувстви-
тельность к ауксину во время цветения и может стимулировать
корнеобразование и рост корней.
Об остальных ORF в составе Т-ДНК Ri-плазмиды A. rhizogenes
известно немного. Так, фенотипический эффект трансформации
табака ORF13 под промотором 35S вируса мозаики цветной капус-
431
ты (CaMV) проявлялся в укорочении междоузлий, деформации
листьев, мужской стерильности и снижении апикального домини-
рования. У измененных таким образом растений табака наблюдал-
ся ненормально высокий уровень активности орнитин-декарбокси-
лазы.
Подводя итог, можно сказать, что фенотип трансгенных по
генам rol растений, скорее всего, обусловлен изменением (увели-
чением) чувствительности клеток растений к фитогормонам,
что, возможно, и определяет плейотропный эффект действия
генов rol.
V3.2. ПРОИСХОЖДЕНИЕ ОНКОГЕНОВ Т-ДНК АГРОБАКТЕРИЙ
Прокариотическая Agrobacterium вводит сегмент своей Ti-плаз-
миды в геном растения, где он экспрессируется. Для этого Т-ДНК
снабжена всеми сигналами, необходимыми для экспрессии в новом
хозяине. Но как эта единица ДНК с эукариотическими сигналами
экспрессии стала частью Ti-плазмиды? Возможно, что Т-ДНК воз-
никла из прокариотического сегмента ДНК и позже приобрела
рецепторы для растительных сигналов транскрипции и трансляции.
Альтернативно агробактерия могла захватить эти гены Т-ДНК из
растения.
Доказательством, что гены Т-ДНК имеют прокариотическое
происхождение, является то, что те же области Т-ДНК, которые
экспрессируются в растительной клетке, также транскрибируются
и транслируются в A. tumefaciens и в Е. coli. Это означает, что
гены Т-области также содержат прокариотические сигналы и, сле-
довательно, она первоначально была прокариотической и эволю-
ционировала по пути возможного функционирования в эукариоти-
ческих растительных клетках. Однако известно, что типичные
эукариотические последовательности иногда также могут транс-
крибироваться РНК-полимеразой Е. coli.
Более убедительное свидетельство в пользу прокариотического
происхождения генов tms 1 и tms 2 Т-ДНК можно найти при срав-
нении их с генами других бактерий. Гены Т-ДНК tms 1 и tms 2
участвуют в биосинтезе индолил-3-уксусной кислоты преимущест-
венно через индол-3-ацетамид. Существует несколько биосинтети-
ческих путей синтеза ИУК, известных в растениях, но только в
единичных случаях индол-3-ацетамид может быть интермедиатом.
Как правило, идентифицированные пути биосинтеза осуществля-
ются через индолацетальдегид или индолацетонитрил. Путь с
индол-3-ацетамидом в качестве интермедиата известен у Pseudo-
monas savastonoi, бактерии, вызывающей опухолевые пролифера-
ции у олив и олеандра. Эти гены, контролирующие синтез ИУК,
экспрессируются в самой Pseudomonas, но не переносятся в клет-
ки растений. Поскольку бактерии легко обмениваются генетичес-
кой информацией даже между неродственными видами, гены син-
432
теза ИУК, локализованные на плазмиде Р. savastonoi, и Ti-плаз-
мидные гены могут иметь общее происхождение.
В пользу эукариотического происхождения генов Т-ДНК сви-
детельствует гомология Т-ДНК A. rhizogenes с ДНК нетрансфор-
мированных клеток Nicotiana glauca. Это первое свидетельство
того, что растительные гены могли быть перенесены в Agrobacte-
rium и теперь используются на пользу бактерии, что сравнимо с
приобретением хозяйских онкогенов некоторыми РНК-содержа-
щими вирусами животных. В подтверждение подобной аналогии
недавно было обнаружено существование клеточного гена, облада-
ющего потенциальной онкогенной активностью у растений. При
возникновении опухолей у растений в результате мутации в норме
неактивный онкоген активируется, что и приводит к опухолевому
фенотипу. Показано также, что этот ген проявляет онкогенную
функцию, сходную с tmr-локусом Т-ДНК и способен комплемен-
тировать его. Последовательности, гомологичные онкогенам бак-
терии, обнаружены также у моркови и редиса.
Хотя пока сложно ответить на вопрос, возникла ли Т-ДНК из
прокариотических или эукариотических последовательностей, но
очень возможно, что Т-ДНК бактерий все же является частью
нашей диеты.
ЗАКЛЮЧЕНИЕ
Агробактериальная индукция опухолей у двудольных растений
представляет собой уникальный пример горизонтального переноса
генов между таксономически далекими видами. Взаимоотношения
агробактерий с растениями представляют собой особый вид пара-
зитизма, когда бактерии не просто используют питательные ве-
щества растения-хозяина, а заставляют растительные клетки изме-
нить свой метаболизм и синтезировать те вещества, а именно —
опины, которые необходимы агробактериям. Такое изменение
происходит на генетическом уровне путем трансформации расти-
тельных клеток, когда в результате агробактериальной инфекции
в растительные клетки вводятся гены из агробактерий, превраща-
ющие эти клетки в опухолевые и одновременно предоставляющие
им новый биосинтетический путь — путь продукции опинов. В
свою очередь только вирулентные агробактерии способны катабо-
лизировать специфичный для них тип опинов. Таким образом, аг-
робактерии сами создают условия для своего размножения. При
этом отдельные бактерии, непосредственно инфицирующие расти-
тельную клетку, вероятно, погибают, создавая экологическую
нишу для остальной популяции агробактерий. Кроме того, опины
играют роль стимуляторов распространения признака онкогеннос-
ти в популяции агробактерий.
Чрезвычайно интересен механизм переноса генов из агробакте-
рий в растения. Хотя многое пока остается неясным, уже можно вы-
433
делить некоторые этапы этого процесса. Важным звеном является
узнавание клеточной стенки растительных клеток агробактериями и
их последующее прикрепление, которое зависит, во-первых, от при-
сутствия в клеточной стенке определенных компонентов, а во-вто-
рых, от способности агробактерий узнавать эти компоненты и при-
крепляться к клеточной стенке растений. Описанная способность
определяется хромосомными генами агробактерий, некоторые из
которых уже идентифицированы. Ключевой этап опухолеобразова-
ния — это перенос сегмента агробактериальной ДНК, Т-ДНК, в рас-
тительную клетку и включение ее в геном растения. Сама Т-ДНК и
гены, определяющие ее перенос, локализованы на плазмидах агро-
бактерий. Последнее обстоятельство является еще одним подтверж-
дением важной роли плазмид в генетических процессах у бактерий:
известно, что многие жизненно важные гены бактерий, которые, од-
нако, нужны бактериям не постоянно, а в исключительных обстоя-
тельствах, например гены устойчивости к антибиотикам, находятся
в составе плазмид. Механизм переноса Т-ДНК в растения пока еще
до конца не изучен. В настоящее время можно предположить, что он
подобен переносу ДНК плазмид при бактериальной конъюгации.
Недавние результаты анализа нуклеотидных последовательностей
около стыков между растительной ДНК и Т-ДНК обнаружили гомо-
логию растительной ДНК по обеим сторонам от сайта интеграции и
наружным относительно точек вырезания Т-ДНК областям плаз-
мидной ДНК агробактерий. Это показывает, что Т-ДНК встраивает-
ся в растительный геном по механизму, сходному с гомологичной
рекомбинацией. В геном растения может встраиваться несколько
копий Т-ДНК. Этот процесс целиком зависит от бактериальных
плазмидных генов — генов вирулентности, занимающих целую об-
ласть плазмиды. Однако клетки растений также не являются пассив-
ными, они выделяют в окружающую среду вещества, которые в малых
концентрациях индуцируют хемотаксис агробактерий в сторону
растительных клеток, а в более высоких концентрациях индуциру-
ют экспрессию генов вирулентности агробактерий. Такие сигналь-
ные молекулы сообщают агробактериям о том, что в растительных
клетках активно происходят жизненные процессы, и именно такие
растительные клетки компетентны для агробактериальной транс-
формации.
Т-ДНК встраивается в геном растительной клетки случайным
образом. Границы Т-ДНК и полярность ее переноса определяются
специфическими нуклеотидными последовательностями вблизи
концов Т-ДНК, а все остальные этапы переноса зависят только от
плазмидных или хромосомных генов вирулентности.
Последнее звено опухолеобразования — это изменение мета-
болизма трансформированной растительной клетки в результате
функционирования онкогенов Т-ДНК. Одно из таких измене-
ний — синтез опинов, контролируемый генами Т-ДНК. Однако,
хотя роль опинов для самих бактерий чрезвычайно велика, их
синтез не является причиной опухолевого роста, а лишь следст-
434
вием агробактериальной трансформации. Истинными онкогенами
для растительных клеток являются гены биосинтеза фитогормо-
нов, ауксинов и цитокининов, локализованные в Т-ДНК. Экс-
прессия этих генов приводит к неограниченной пролиферации
трансформированных растительных клеток. Как известно, сами
агробактерии продуцируют фитогормоны и секретируют их в ок-
ружающую среду (эти процессы зависят не от Т-ДНК, а от дру-
гих бактериальных генов). На этом этапе выделяемые агробакте-
риями фитогормоны могут стимулировать деление растительных
клеток и тем самым способствовать их переходу в компетентное
состояние. Тот факт, что гормононезависимый рост трансфор-
мированных растительных клеток не зависит от присутствия аг-
робактерий, неопровержимо доказывает главную роль онкогенов
Т-ДНК в поддержании опухолевого состояния трансформирован-
ных клеток.
Изучение взаимодействия растений с агробактериями имеет
большое теоретическое значение, так как знание молекулярных и
генетических механизмов индукции опухоле- или корнеобразова-
ния важно для понимания процессов дифференцировки у расте-
ний. Благодаря способности агробактерий переносить чужеродную
ДНК в геном растений, в последние годы объектом особого инте-
реса стало получение трансгенных растений. С практической
точки зрения этот подход используют с целью улучшения расте-
ний путем введения в их геном отдельных генов. Кроме того, он-
котрансформацию растительных тканей можно использовать для
получения гормональных мутантов, так как Т-ДНК агробактерий
несет в себе серию генов, вовлеченных в метаболизм гормонов,
которые и обеспечивают изменение путей дифференцировки транс-
формированных тканей.
И последнее, что привлекает широкое внимание к явлению аг-
робактериальных опухолей у растений, — это возможность ис-
пользования данного явления в целях генной инженерии растений.
Уникальная способность агробактерий осуществлять перенос Т-ДНК
в геном растений может использоваться и уже интенсивно исполь-
зуется для конструирования векторных систем введения экзоген-
ной генетической информации в высшие растения, что имеет
большое значение при проведении как фундаментальных, так и
прикладных исследований.
ЛИТЕРАТУРА
Дрейпер Дж., Скотт Р., Армитадж Ф. и др. Генная инженерия растений. Лабора-
торное руководство / Под ред. Дж. Дрейпера и др. М.: Мир. 1991. 408 с.
Лутова Л. А., Павлова 3. Б., Иванова М. М. Агробактериальная трансформация
как способ изменения гормонального метаболизма у высших растений В Гене-
тика. 1998. Т. 34, № 2. С. 165—182.
Пирузян Э. С. Андрианов В. М. Плазмиды агробактерий и генетическая инжене-
рия растений. М.: Наука. 1985. 289 с.
435
Cangelosi G. A., Ankenbauer R. G., Nester E. W. Sugars induce the Agrobacterium
virulence genes through a periplasmic binding protein and a transmembrane signal
protein # Proc. Natl Acad. Sci. USA. 1990. Vol. 87. P. 6708—6712.
Gaudin V., Vrain Т.» Jouanin L. Bacterial genes modifying hormonal balances in
plant В Plant Physiol. Biochem. 1994. Vol. 32. P. 11—29.
Gelvin S. Crown gall disease and hairy root disease (Review) # Plant Physiol. 1990.
Vol. 92. P. 281—285.
Joos H., Timmerman B., Van Montagu M., Schell J. Genetic analysis of transfer and
stabilisation of Agrobacterium DNA in plant cell В EMBO J. 1983. Vol.2.
P. 2151—2160.
Klee H., Romano C. The roles of phytohormones in development as studied in trans-
genic plants В Critical Rev. in Plant Sciences. 1994. Vol. 13. P. 311—324.
Otten L., Canady J., Gerard J.-C. et al. Evolution of Agrobacterium and their Ti
plasmids — a review В Mol. Plant Microbe Interactions. 1992. Vol. 5. P. 279—287.
Schmulling T., Fladung М.» Grossmann K., Schell J. Hormonal content and sensitivity
of transgenic tobacco and potato plants expressing single rol genes of A. rhizogenes
T-DNA. В Plant J. 1993. Vol.3. P. 371—382.
Spena A., Schmulling T., Koncz С.» Schell J. Independent and synergistic activity of
rol A, В and C loci in stimulating abnormal growth in plants В EMBO J. 1987.
Vol. 6. P. 3891—3899.
Stachel S. E., Nester E. W. The genetic and transcriptional organisation of the vir
region of the A6 Ti-plasmid of A. tumefaciens В EMBO J. 1986. Vol. 5. P. 1445—
1454.
Van Larebeke N., E. G. Holsters M. et al. Large plasmid in A. Tumefaciens essential
for crown gall-inducing ability В Nature. 1974. Vol. 252. P. 169—170.
Zupan J. R., Zambryski P. Transfer of T-DNA from Agrobacterium to the plant cell В
Plant Phys. 1995. Vol. 107. P. 1041—1047.
ЧАСТЬ VI
МОЛЕКУЛЯРНАЯ ГЕНЕТИКА
ВЗАИМОДЕЙСТВИЯ ВЫСШИХ РАСТЕНИЙ
С ФИТОПАТОГЕННЫМИ
МИКРООРГАНИЗМАМИ
Успех существования разнородных организмов в общей среде
обитания во многом определяется способностью одних организмов
противостоять негативному влиянию других, в том числе организ-
мов — возбудителей заболеваний.
Патогенез — процесс, при котором один организм {патоген)
угнетает другой {хозяин) и вызывает тем самым его гибель. Харак-
тер взаимоотношений растений и микроорганизмов базируется на
двух ключевых понятиях: устойчивость и восприимчивость. Со-
гласно решению Британской федерации фитопатологов, принято-
му в 1973 г., устойчивость — это способность растения выдер-
живать или противостоять действию повреждающего либо пато-
генного фактора, или возможность снижать это действие. Как мы
видим, данное определение не отражает конкретных причин ус-
тойчивости растения, и тем самым оно вносит в специальную ли-
тературу некоторую терминологическую путаницу. Поэтому в по-
следнее время термин устойчивость используют одновременно с
его антонимом восприимчивость, как бы подразумевая тем самым,
что оба явления являются на самом деле полярными проявлениями
действия одних и тех же механизмов, определяющих проникнове-
ние патогена, и колонизацию им растения-хозяина с последующим
размножением.
Исходя из этого, очевидно, что результат конкретного взаимо-
действия растения и его патогена складывается из множества фак-
торов и проявляется в разных вариантах. Подобная многовариант-
ность позволяет построить иерархическую схему (рис. VI. 1), кото-
рая отражает разные уровни защитных систем в пределах одного
растения. Более того, эта же схема демонстрирует и ступени, ко-
торые прошли в процессе длительной совместной эволюции выс-
шие растения и их микробные патогены.
Первая ступень прочно занята явлением, носящим название ви-
довой иммунитет по Н. И. Вавилову, в англоязычной литературе
437
Рис. VI. 1. Типы реакции растения на поражение патогеном и их иерар-
хические взаимоотношения.
оно получило название нехозяйская устойчивость (nonhost resis-
tance). Видовой иммунитет выражается в том, что любой вид рас-
тения устойчив к подавляющему количеству видов микроорганиз-
мов, потенциально опасных для растения. Это означает, что либо
растение изначально не подходит патогену в качестве жертвы, в
связи с особенностями своего анатомического строения или из-за
наличия/отсутствия определенных метаболитов, либо на самых
ранних этапах заражения патоген индуцирует мощный защитный
ответ растения. Такие микроорганизмы являются для данного вида
растения непатогенными, т. е. неспособными вызывать заболева-
ния, а растение соответственно не является видом-хозяином.
Лишь некоторые виды микроорганизмов приноровились обхо-
дить видовой иммунитет растения, пройдя длительный процесс
адаптации к растению. В конце концов они стали патогенными и
вирулентными, т. е. способными поражать данный вид растения.
На этом этапе эволюции растения теряют видовой иммунитет к
такому микробу и становятся восприимчивыми к патогену, т. е.
возникает явление совместимости растения и патогена.
Вид — это совокупность форм, различающихся по огромному
ряду признаков, в том числе и по признаку патогенности (микро-
организмы) или восприимчивости (растения). Поэтому в пределах
вида возникают растения, восстановившие свою способность про-
тивостоять заболеванию. Этот тип устойчивости получил название
сортоспецифической устойчивости, так как это явление наиболее
438
ярко выражено у разных сортов культурных растений. Патоген
при взаимодействии с растением, обладающим устойчивостью, те-
ряет вирулентность и становится авирулентным, а комбинация
растение—патоген — несовместимой. Часто различия между вос-
приимчивыми и устойчивыми растениями обусловлены работой
лишь одного гена.
На основе сортоспецифической устойчивости может развиться
вторичная, сортоспецифическая восприимчивость, выражающаяся
в способности определенных групп особей внутри вида патогена
преодолевать специфическую устойчивость сорта. Подобные груп-
пы носят название рас у грибных и штаммов или патоваров — у
бактериальных патогенов.
Проблема устойчивости/восприимчивости растений не ограни-
чивается лишь классификацией типов устойчивости. Существует
также целый ряд физиологических, генетических и эпидемиологи-
ческих параметров, существенно влияющих на характер взаимо-
действия растения и микроба, которые будут рассмотрены позднее
на конкретных примерах. Во вступительной же части следует от-
метить, что контакт между растением и патогеном может происхо-
дить на разных стадиях жизненного цикла. Так, инфекционным
агентом гриба могут являться как вегетативные споры, так и гифы
мицелия; проростки и зрелые растения в свою очередь могут обла-
дать разным уровнем устойчивости к одному и тому же патогену.
Глава VI. 1
РАЗНООБРАЗИЕ ФИТОПАТОГЕННЫХ
МИКРООРГАНИЗМОВ
Круг организмов-возбудителей болезней высших растений
очень широк и включает в себя такие неродственные организмы,
как вирусы, бактерии, грибы и даже беспозвоночные животные.
Подобное разнообразие жизненных форм возбудителей вызывает
серьезные затруднения в изложении материала, поскольку трудно
объединить вместе механизмы устойчивости растений, например к
бактериям и насекомым. Поэтому автор сознательно пошел на ог-
раничение спектра рассматриваемых возбудителей заболеваний,
избрав в качестве «жертв изложения» бактерии и грибы, традици-
онно обозначаемые в фитопатологической литературе термином
патоген. Своего рода оправданием такого выбора является тот
факт, что в механизмах устойчивости растений к этим микроорга-
низмам гораздо больше совпадений, нежели кажется на первый
взгляд. Последующие разделы как раз и посвящены тому, как био-
логия развития и размножения патогена отражается на его способ-
ности заражать растения.
439
Прежде всего взаимоотношения между растением и возбуди-
телем заболевания определяются типом питания патогена. Не-
кротрофные патогены прежде убивают растительные клетки и
лишь затем переваривают их содержимое. Биотрофные патогены,
наоборот, стараются сохранить растительную клетку живой как
можно более долгое время, получая от нее органическую пищу.
Таким образом, если некротрофные патогены размножаются на
органических остатках, то биотрофные успевают пройти в живом
растении несколько циклов размножения, прежде чем заболевание
становится очевидным и гибельным для растения.
Известно огромное количество бактериальных видов, вызываю-
щих характерные заболевания высших растений: мокрые или
сухие гнили, рак, вилт (увядание) и другие; перечисление всех
видов фитопатогенов — задача невозможная. Поэтому мы ограни-
чимся рассмотрением лишь некоторых видов грамотрицательных
бактерий, активно используемых в последнее время в эксперимен-
тах в качестве модельных объектов (табл. VI. 1, рис. VI.2), а имен-
но принадлежащих к родам Erwinia, Pseudomonas и Xanthomonas.
С другими представителями грамотрицательных бактерий, активно
поражающих растения, вы уже встречались в других разделах
этого учебника — это Agrobacterium tumefaciens и A. rhizogenes.
Бактериальная клетка свободно перемещается в пространстве
при помощи жгутиков, одного или нескольких. В отличие от гри-
бов бактерии не способны активно заражать растения. Однако
бактериальные клетки обладают положительным хемотаксисом по
отношению к растению и достаточно малы для того, чтобы прони-
кать в ткани растения через устьица и другие естественные поры
или поранения. Конечным пунктом назначения для фитопатоген-
ных бактерий является межклеточное пространство, или апо-
Таблица VI. 1
Примеры некоторых модельных грамотрицательных фитопатогенных бактерий
Патоген Растение-хозяин Заболевание
Некротрофные
Erwinia carotovora Е. chrysanthemi Е. amylovora Е. stewartii Картофель, табак, сенполия Биотрофные Яблоня, груша Кукуруза Мокрые гнили Бактериальный ожог Вилт
Ralstonia solanacearum Томаты, табак »
Xanthomonas campestris Перец, томаты, капуста Пятнистость листьев, гниль
Pseudomonas syringae Томаты, арабидопсис, бобовые То же
440
Agrobacterium Галлы Бородатый корень
000 f
Corynebacterium oatt Кольцевая гниль Увядание о ft Пятнистость плодов
Erwinia Гниль Увядание /ПГ Мокрая гниль
Pseudomonas Пятнистость листьев Галлы й t® Ожог
Xanthomonas Пятнистость листьев Гнили Рак
Рис. VI.2. Некоторые роды бактерий и заболевания, вызываемые ими
при заражении растений.
пласт. Это означает, что ни одна бактериальная клетка не являет-
ся внутриклеточным патогеном.
Большинство грибов являются строгими сапрофитами (т. е. пи-
таются мертвыми органическими остатками) и не более 10 % из
100 000 описанных видов способны колонизировать растения; еще
меньшее количество видов способно вызывать заболевания расте-
ний. Кроме того, из 300 000 описанных видов растений фитопато-
генные грибы поражают лишь ограниченное число.
Эволюция грибных фитопатогенов хорошо просматривается на
примере усиления специализации патогена на определенных видах
растений. На первой ступени специализации находятся факульта-
тивные патогены, в норме существующие как сапрофиты. Однако
они способны заражать ослабленные или поврежденные растения.
441
Факультативные патогены характеризуются обычно широким кру-
гом хозяев и низкой вирулентностью, вызывая слабые симптомы
заболевания. Следующая ступень представлена настоящими пато-
генами, которые обитают на здоровых растениях, но при опреде-
ленных обстоятельствах (например, при размножении) способных
покинуть их. Такие патогены составляют основную массу возбуди-
телей болезней растений, они более специализированы и вирулен-
тны. Кроме того, у представителей этой группы патогенов хорошо
развиты различные приспособления, помогающие проникать в ин-
тактные растительные ткани. И наконец, наивысший уровень спе-
циализации демонстрируют облигатные патогены, для которых
наличие живого растения-хозяина является обязательным услови-
ем существования на всех стадиях жизненного цикла.
Жизненный цикл грибов складывается из последовательного
формирования спор, как вегетативных, так и генеративных для
грибов с половым размножением, их прорастания и формирования
мицелия. Инфекционным началом, т. е. жизненной стадией, пора-
жающей растения, как правило, являются споры. Однако в ряде
случаев заражение растений может осуществляться гифами мице-
лия.
Глава VI. 2
РАСПОЗНАВАНИЕ РАСТЕНИЯ
И ПРОНИКНОВЕНИЕ ПАТОГЕНА
Грибы и бактерии обладают положительным хемотаксисом по
отношению к растению, а точнее, к веществам, которые растение
постоянно выделяет в окружающую его среду (почву, воду). Извест-
но, что многие низкомолекулярные метаболиты: сахара, амино-
кислоты, некоторые органические кислоты привлекают грибные
споры и бактерий, т. е. обладают аттрагирующим действием. За
это они и получили название аттрактантов. В свою очередь су-
ществуют вещества, отпугивающие патогены — репелленты. И ат-
трактанты, и репелленты распознаются патогеном при помощи
специальных рецепторов, расположенных на мембранах или в пе-
риплазматическом пространстве. Сигнал, полученный рецептором,
передается по клетке и поддерживает работу жгутиков, при помо-
щи которых подвижная спора (зооспора) гриба или бактерии пе-
ремещается. Клетки, лишенные жгутиков, способны только к пас-
сивному транспорту.
Механизмы трансформации химического сигнала в энергию
движения лучше всего изучены на бактериях — кишечной палоч-
ке Escherichia coli и возбудителе сальмонеллеза Salmonella typhi-
murium и подробно описаны в других изданиях.
442
Следующим этапом является проникновение патогена внутрь
растения. Заражение растений бактериями происходит пассивно,
как правило, через уже существующие повреждения покровных
тканей хозяина. Процесс активного проникновения в ткани расте-
ния характерен для грибных патогенов.
Прежде всего заражение растения может осуществляться зоо-
спорами, как это характерно для представителей классов Оотусе-
tes, Chytridiomycetes, Plasmodiophoromycetes. Особенностями сво-
бодно перемещающихся зооспор являются один или два жгутика,
отсутствие клеточной стенки и наличие сократительной вакуоли
для выравнивания тургорного давления внутри клетки. Достигнув
поверхности растения, зооспора претерпевает значительные мор-
фологические изменения, этот процесс получил название инцис-
тирование (рис. VI.3). При инцистировании зооспора теряет жгу-
тики и сократительную вакуоль, в течение первых 5—10 мин об-
разует толстую клеточную стенку, выделяет адгезионный матрикс,
с помощью которого прикрепляется к поверхности растения. В
ряде случаев формируется также дополнительная оболочка цисты.
Как только начинается формирование клеточной стенки, споры
прочно прикрепляются к поверхности растения. Способность к
адгезии у зооспор возрастает мгновенно (например, у разных
видов Phytophthora этот процесс занимает не более 1—2 мин).
Прочно к растению прикрепляются только те клетки, которые ус-
пели это сделать в течение 3—4 мин после начала инцистирова-
ния. У опоздавших клеток адгезионный матрикс сохраняется, но
прикрепление оказывается непрочным и клетки смываются с по-
верхности растения.
Для неподвижных спор также показана способность к адгезии.
У Magnaporthe grisea (патоген риса) адгезионный материал содер-
жится в периплазматическом пространстве споры, между плазма-
леммой и клеточной стенкой в районе апекса. Освобождение адге-
Рис. VI.3. Распознавание растения и инцистирование зооспор грибного
патогена.
1 — зооспора, 2 — растительный сигнал, 3 — спора, 4 — оболочка споры, 5 — обо-
лочка цисты, 6 — адгезионный матрикс.
443
знойного матрикса происходит при гидратации споры, а не запус-
кается контактом с поверхностью растения.
После прикрепления споры начинается ее прорастание в гифу.
Описаны метаболиты растений, инициирующие этот процесс. На-
пример, уже описанный в других разделах учебника гормон этилен
запускает не только созревание плодов банана и авокадо, но и
спор поражающих их грибов (Collelotrichum gloeosporioides и
С. musae). Нарушения в синтезе этилена, например у трансформи-
рованных растений томатов, полностью блокировали прорастание
спор и инфицирование плодов. Единожды начавшись, прораста-
ние спор более не нуждается в сигналах. Рост гифы поддержива-
ется за счет питательных веществ споры, содержимое цитоплазмы
при росте гифы упорядоченно перемещается вслед за растущим
апексом.
Зародышевая гифа — прекрасное приспособление для поиска
удобных потенциальных сайтов проникновения как у грибов с не-
подвижными спорами, так и с зооспорами. Гифа «ощупывает» ес-
тественные неровности растительной поверхности, ориентируя
свой рост в соответствии с ними благодаря наличию в мембране
специфических механочувствительных ионных каналов. Напри-
мер, ржавчинные грибы способны опознавать устьица растений
или их пластиковые реплики и формировать в ответ специализи-
рованные органы — аппрессории. При этом крепкая связь между
растением и грибом продолжает не только сохраняться, но и игра-
ет ключевую роль. Например, мутанты Magnaporthe grisea, у кото-
рых нарушены гидрофобные свойства мембраны, а значит и кон-
такт с растительной поверхностью, не способны формировать ап-
прессории и проникать в ткани растения. Направленность роста
гифы зависит также и от химических факторов типа градиента
ионов водорода, растительных эксудатов, воды.
Проникновение грибного патогена в растительные ткани про-
исходит либо прямо через кутикулу и периклинальную стенку эпи-
дермальной клетки или межклеточные сочленения, либо через на-
туральные отверстия — устьица. В зависимости от типа проник-
новения наблюдают разные инфекционные структуры. Некоторая
иллюстрация разнообразия описываемого процесса показана на
рис. VI.4. Основной фактор проникновения — высокое тургорное
давление внутри инфекционной нити. Выравнивание давления
внутри гифы и снаружи останавливает процесс проникновения
гриба. Высокое тургорное давление на кончике гифы создается за
счет распада гликогена. У многих грибов повышению давления
способствует также отложение в клеточных стенках гриба пигмен-
та меланина. Отложенный вокруг аппрессория меланин обеспечи-
вает приток воды, так как он препятствует транспорту осмотичес-
ких веществ, но способствует току воды. О важности меланина
говорит следующий факт. Мутанты Collelotrichum, дефектные по
синтезу меланина, теряют свою патогенность, тогда как искусст-
венное добавление пигмента или его предшественников восстанав-
444
Рис. VI‘4. Разнообразие механизмов проникновения гриба внутрь расте-
ния.
а — зооспоры Pseudoperonospora humuli обладают положительным хемотаксисом по
отношению к устьицам, прикрепившаяся в этом районе спора инцистируется и фор-
мирует гифу, которая и прорастает через устьице; б — ржавчинные грибы на стадии
дикариона инвазируют устьица и прорастают в гифы. Направление роста зародыше-
вых гиф контролируется рельефом растительной поверхности. Гифы опознают усть-
ичные клетки и формируют над порой аппрессорий. Из аппрессория развивается про-
никающая гифа, которая раздвигает пору и проникает вовнутрь; в — на стадии моно-
кариона ржавчинные грибы, наоборот, проникают внутрь растения напрямую.
Слабодифференцированный аппрессорий проросшей базидиоспоры пробуравливает
кутикулу и клеточные стенки; внутри растительной клетки образуется характерное
вздутие, от которого отрастают многочисленные гифы; г — прорастание спор Erysi-
phe graminis заканчивается формированием внутри клетки гаустории с характерными
пальцевидными отростками; д — для Venturia inaegualis и Rhynchosporium secalis ха-
рактерен субкутикулярный рост гиф (между кутикулой и эпидермальными клетками).
ливает «разрушительную» силу гриба. Именно поэтому химичес-
кие соединения, блокирующие синтез меланина у грибов, широко
используются в сельскохозяйственной практике в качестве фунги-
цидов. Сочетание распада гликогена и синтеза меланина позволя-
ет, например, грибу Magnaporthe grisea развивать на кончике гифы
давление до 8.0 МПа (80 бар).
445
Глава VI. 3
НЕСПЕЦИФИЧЕСКИЕ ФАКТОРЫ ПАТОГЕННОСТИ
БАКТЕРИЙ И ГРИБОВ
VI3.1. ГИДРОЛИТИЧЕСКИЕ ФЕРМЕНТЫ
В последнем разделе мы уже вплотную подошли к рассмотре-
нию факторов, определяющих способность патогена заражать рас-
тения, а именно определили роль тургорного давления. Какие же
еще факторы, общие для любого микробного фитопатогена, игра-
ют значительную роль в патогенезе?
Растительная клетка и целое растение окружены прочными
покровами — клеточными стенками и кутикулой. Патогенам при-
ходится не только проникать через эти заслоны, но и разрушать
их, чтобы добраться до содержимого клеток. Для осуществления
этих задач микроорганизмы синтезируют и секретируют наружу
большое количество разнообразных гидролитических ферментов,
разрушающих целлюлозу, кутин, пектин, ксилоглюканы и другие
полимеры растений.
Гидролитические ферменты бактерий могут считаться важны-
ми факторами патогенности по крайней мере для некротрофных
бактерий, таких как Erwinia carotovora, Е. chrysanthemi, Pseudo-
monas viridiflava. Эти бактерии поражают широкий ряд растений,
и зачастую внешние условия в патогенезе могут значить больше,
нежели видовая принадлежность растения. Эти ферменты (полига-
лактуроназы, пектатлиазы и др.) разрушают пектин первичных
клеточных стенок и срединных пластинок, вызывая гибель клеток
и мацерацию (расползание) тканей, что и является первичными
симптомами заболевания. Бактерия может синтезировать как один
фермент (пектатлиаза Ре! у Р. viridiflava), так и комплекс гидро-
лаз, для каждой из которых описан ряд изозимов (Ре1-изозимы
Е. carotovora и Е. chryzanthemi). Поэтому часто мутации по отдель-
ным генам изозимов, как правило, не снижают патогенности бак-
терий. Интересно, что спектр изозимов часто зависит от видовой
принадлежности растения-хозяина, а активности отдельных изози-
мов — от температуры, уровня кислорода, наличия азотных соеди-
нений и ряда других факторов. Описано по крайней мере три ре-
гуляторных белка — KdgR, PecS и РесТ, контролирующих эксп-
рессию структурных генов ферментов у бактерий.
Гидролитические ферменты грибов способны разрушать не
только пектин, но и остальные полимеры клеточных стенок, и по
отношению к субстрату подразделяют их на целлюлазы, ксилоглю-
каназы, пектолитические ферменты, протеиназы и кутиназы. Все
эти группы ферментов обнаружены как у фитопатогенов, так и у
строгих сапрофитов, так как именно они участвуют в разложении
органического материала. Поэтому вряд ли гидролитические фер-
446
менты можно считать ключевым фактором патогенности или виру-
лентности, отличающим патогенов от непатогенов.
Важной особенностью грибных ферментов является индуци-
бельность. Синтез практически всех перечисленных ферментов
активируется субстратом. Негативная регуляция синтеза фермен-
тов осуществляется глюкозой и другими моно- и дисахарами по
принципу «обратной связи». Дизрупция гена, кодирующего тот
или иной фермент, как правило, не приводит к потере вирулент-
ности гриба. Это происходит из-за того, что некоторые ферменты,
например целлюлазы и ксилоглюканазы, могут заменять друг
друга, так как тип расщепляемых ими связей одинаков в обоих
полимерах-субстратах. Кроме того, для многих грибных гидролаз
также обнаружены многочисленные изоформы, а значит и не-
сколько кодирующих их генов. Поэтому мутация по одному гену
может компенсироваться работой родственных по функции генов.
И наконец, помимо обычного спектра ферментов, синтезируемых
грибом постоянно, обнаружены ферменты, синтез которых проис-
ходит только в растительных тканях in planta.
Таким образом, гидролитические ферменты не столько конт-
ролируют патогенность и вирулентность гриба, сколько облегча-
ют процесс проникновения патогена внутрь растения и обеспечи-
вают разложение органических полимеров растительной клетки.
VL3J. НЕСПЕЦИФИЧЕСКИЕ ТОКСИНЫ ПАТОГЕНОВ
Те или иные заболевания растений, возможно, есть всего лишь
следствие гибели растительных клеток под действием токсических
веществ, вырабатываемых некротрофным патогеном. Поэтому
способность некротрофных патогенов к синтезу токсинов рас-
сматривается как важный фактор их вирулентности и патогеннос-
ти. Токсины представляют собой низкомолекулярные вещества
разной химической природы. Их губительное воздействие на рас-
тительный организм, как правило, связано со способностью взаи-
модействовать с определенными компонентами растительных кле-
ток, чаще всего с разнообразными ферментами. Чувствительность
ферментов-мишеней к токсинам и определяет степень восприим-
чивости целого растения к тому или иному заболеванию.
Тестируются патотоксины довольно просто — препарат нано-
сят на растения или добавляют в почву, или в растительные пита-
тельные среды. Классическими признаками токсинов являются по-
теря клетками электролитов, тканями — хлорофилла и образова-
ние некрозов, т. е. повторение симптомов, которые характерны
для заболевания, индуцированного патогеном, — продуцентом
токсина.
Различают два типа токсинов — неспецифические и специфи-
ческие. Неспецифические токсины нарушают функционирование
определенных ферментативных систем вне зависимости от видо-
447
вой принадлежности растения и синтезируются разными изолята-
ми патогена, независимо от вида поражаемого растения. Большин-
ство известных токсинов грибов и практически все токсины бак-
терий неспецифичны.
Бактерии способны синтезировать разнообразные по структуре
и, очевидно, механизмам действия неспецифические токсины. Гены,
ответственные за синтез токсинов, обычно расположены на бакте-
риальной хромосоме, но известно несколько токсинов с плазмидной
локализацией кодирующих их генов (например, коронатин, синте-
зируемый разными патоварами Pseudomonas syringae).
Основные мишени действия бактериальных токсинов являются
различные ферменты и мембраны растительных клеток, они при-
ведены в табл. VI.2. Особенно интересен токсин Р. syringae коро-
натин, структура которого приведена на рис. VI.5. По своему хи-
мическому строению и, как было недавно показано, механизму
действия этот токсин обладает сходством с жасмонатами — гор-
монами растений, coi-мутанты (coronatine-insensitive) арабидопси-
са, нечувствительные к коронатину, характеризуются мужской
стерильностью, повышенной устойчивостью к Р. syringae и, что
самое главное, являются нечувствительными к гормону. Более
того, обработка растений дикого типа коронатином приводит к
экспрессии в растении генов, находящихся под контролем этого
гормона.
Показано, что один и тот же патоген способен одновременно
синтезировать сразу несколько типов токсинов, причем токсины у
неродственных видов патогенов часто совпадают по своей хими-
ческой структуре. Очевидно, токсины обладают некими свойства-
ми, способствующими выживанию бактерии-продуцента. Напри-
Таблица VI.2
Токсины Ps. syringae
Токсин Патовар Структура Действие Симптом
Сирингоми- цин Р. syringae Циклический липодепсипептид Образует поры в плазмалемме Некрозы
Сирингопеп- тин Тот же Та же То же »
Коронатин Р. tomato, glycinea Поликетид и ци- клическая амино- кислота Имитирует дейст- вие жасмонатов Хлорозы
Тагетитоксин Р. tagetis Гемитиокетан Ингибитор полиме- разы хлоропласт- ной РНК »
Фазеолоток- син Р. phaseolico- la Сульфодиамино- фосфинил три- пептид Ингибитор орни- тинкарбоилтрансфе- разы »
Табтоксин Р. tabaci р-лактамдипеп- тид Ингибитор глута- минсинтетазы »
448
Жасмонаты
Коронатин
Рис. VI.5. Химическая структура жасмонатов и их биологического ана-
лога коронатина — неспецифического бактериального токсина.
Коронатин, неспецифический токсин Pseudomonas syringae, по химическому строе-
нию и биологическому действию является аналогом растительных гормонов жасмо-
натов. Мутантные растения арабидопсиса coil, устойчивые к коронатину, обладают
измененной чувствительностью к жасмонатам.
мер, многие бактериальные токсины обладают антимикробной
активностью и, возможно, необходимы для сдерживания роста
других патогенов в зараженных тканях. Т. е. токсины, выраба-
тываемые одним патогеном, могут препятствовать заселению рас-
тения другими микроорганизмами, в том числе и другими бакте-
риями.
Кроме патотоксинов, у бактериальных патогенов различают
экстрацеллюлярные (внеклеточные) полисахариды (ЭП), которые
формируют слизистые капсулы. Считается, что они должны защи-
щать свободноживущие бактерии от разнообразных внешних воз-
действий. Их участие в патогенезе описывают следующими воз-
можностями:
> поддержание высокой влажности в межклеточном простран-
стве;
. изменения активности (доступности) антимикробных соеди-
нений или сигналов, индуцирующих защитные реакции рас-
тения;
. закупорка ксилемы и/или индукция увядания (вилта).
Химическая структура и механизмы действия некоторых наи-
более хорошо изученных грибных неспецифических токсинов
приведены на рис. VI.6 и в табл. VI.3. Как правило, грибные ток-
сины также изменяют метаболизм растительной клетки, меняя ак-
тивность базовых процессов, таких как транспорт ионов через
мембраны.
Например, Н+-АТФаза является мембранным белком и играет
ключевую роль в поддержании электрохимического градиента в
клетке, контролируя АТФ-зависимый транспорт протонов через
мембраны. Этот фермент является сайтом действия фузикокци-
на — основного токсина грибного патогена миндаля и персика Fu-
16 Генетика
449
он
Церкоспорин
Рис. VL6. Неспецифические токсины фитопатогенных грибов.
sicoccum amygdali. Его активация грибным токсином связана со
способностью фузикокцина обеспечивать конститутивную актив-
ность фермента. В результате постоянного действия АТФазы уси-
ливается импорт ионов и молекул воды устьичными клетками, что
приводит к необратимому открыванию устьиц и увяданию листьев,
характерному для этого заболевания. С-терминальный регулятор-
ный домен АТФазы ассоциирован с белком 14-3-3 суперсемейст-
ва. Эти белки выполняют разнообразные функции, в том числе
регулируют уровень фосфорилирования клеточных белков. Экспе-
рименты на дрожжах, трансформированных генами АТФазы и
белка 14-3-3 арабидопсиса, показали, что фузикокцин связывается
с белком 14-3-3 суперсемейства и изменяет, вероятно, тем самым
уровень фосфорилирования Н+-АТФазы. Интересно, что при нали-
чии белков 14-3-3 суперсемейства у всех высших растений только
ограниченный круг растений поражается F. amygdali. Подобный
факт свидетельствует о том, что существуют дополнительные,
пока неизвестные факторы, отвечающие за подобное ограничение
круга хозяев.
450
Таблица VI.3
Неспецифические токсины фигопатогенных грибов
Токсин Патоген Мишень Структура
Фузикокцин Fusicoccum amygdali АТФаза (плазмалемма) Карбодицикли- ческий тритерпен
Тентоксин Alternaria altemata f.sp. Хлоропластный фактор 1-АТФаза (хлоропласт) Циклический пептид
Офиоболины Cochliobolus spp. Плазмалемма Сесквитерпен
Церкоспорин Cercospora spp. Фотореактивация, образо- вание синглетного кисло- рода и супероксиданиона Полипептид
Сиродесми- ны Phoma lingam (Leptosphaeria maculans) Неизвестна Эпиполитио- диоксидпипе- разин
Церато-уль- мин Ophiostoma ulmi » Полипептид
Другой неспецифичный токсин — тентоксин — синтезирует-
ся грибом Altemaria altemata, патогеном с широким кругом хозяев.
Этот токсин интересен тем, что затрагивает другой базовый про-
цесс, протекающий в растительной клетке, — транспорт электро-
нов при фотофосфорилировании. У восприимчивых растений этот
циклический трипептид вызывает хлороз проростков и ингибирует
рост растений. Мишенью тентоксина является аР-субъединичный
комплекс хлоропластного фактора 1. Чувствительность Р-субъеди-
ницы к тентоксину определяется наличием аспартата в положении
83, замена аспартата на глутамин приводит к нечувствительности.
Кроме того, для связывания Р-субъединицы необходимо наличие
а-субъединицы.
Группа фитотоксичных сесквитерпенов — офиоболинов —
синтезируется грибами рода Cochliobolus на определенной стадии
жизненного цикла, к настоящему времени описано около 20 вари-
антов токсина. Предположительно, этот токсин действует на мем-
браны клеток.
Довольно интересным является церкоспорин — неспецифичес-
кий токсин некоторых видов Cercospora. Это темно-красное высо-
кореактивное соединение, которое под действием света приводит
к образованию синглетного кислорода и супероксиданиона. Эти
соединения разрушают клеточные мембраны и крайне токсичны
для клеток (подробнее см. раздел о реакции СВЧ). Имеется ряд
данных о прямом участии церкоспорина в развитии болезни. На-
пример, для появления симптомов заболевания на инфицирован-
ном растении последнее необходимо облучить светом. Кроме того,
синтез токсина у мутантов С. kikuchii в культуре in vitro тесно
коррелирует с их патогенностью на листьях сои.
Токсин сиродесмин также представлен семейством родствен-
ных соединений и синтезируется грибом Phoma lingam (Leptospha-
451
eria maculans), вызывающим хорошо известное заболевание «чер-
ная ножка» у Brassica napus и других крестоцветных. Популяции
этого патогена по признаку патогенности четко распадаются на
две группы: агрессивную и неагрессивную. Сиродесмины синтези-
руются только представителями агрессивной группы. Обработка
семядолей чувствительных к заболеванию растений токсином
ведет к развитию характерных симптомов заболевания. Сиродес-
мины обнаруживаются в высоких концентрациях в тканях зара-
женных чувствительных растений, но не устойчивых. Мутанты
Р. lingam, неспособные к синтезу токсина, не теряют патогеннос-
ти, однако обладают меньшей агрессивностью — площадь некро-
зов, образующихся после заражения ими, значительно ниже по
сравнению с изолятами дикого типа. Характер действия сиродес-
минов неизвестен.
Гриб Ophiostoma ulmi, поражающий вяз, синтезирует неспеци-
фический токсин церато-ульмин. Это полипептид массой около
8 кДа и состоит из 75 аминокислот. Этот полипептид гидрофобен
и обладает свойствами сурфактанта. Ген, кодирующий церато-уль-
мин, был клонирован и секвенирован; по своим свойствам этот
белок принадлежит к семейству грибных гидрофобинов, входящих
в состав клеточной стенки гриба. В низких концентрациях токсин
вызывает характерные симптомы заболевания (потеря электроли-
тов, увядание), однако ряд данных отрицает роль токсина в разви-
тии заболевания. Так, мутанты по гену, кодирующему токсин, об-
ладают такой же вирулентностью, что и изолят дикого типа.
Глава VI.4
ВИДОВОЙ ИММУНИТЕТ И ФАКТОРЫ,
ОТВЕТСТВЕННЫЕ ЗА ЕГО ФОРМИРОВАНИЕ
Видовой иммунитет как основополагающее свойство любого
растения впервые был предложен Н. И. Вавиловым. Было высказа-
но предположение, что в основе видовой устойчивости растения
лежат некоторые его особенности, не привлекающие патогена,
препятствующие его проникновению или не поддерживающие его
развитие в растительных тканях. Благодаря этим особенностям
инфицирование нехозяйского растения, если оно и происходит,
настолько быстро блокируется, что его результаты никак не про-
являются на макроскопическом уровне и зараженное растение
внешне ничем не отличается от незараженного. Важное свойство
видового иммунитета состоит в конститутивности, т. е. механизмы,
ответственные за его формирование, активны в растении постоян-
но, независимо от того, произошло заражение или нет. Какие же
факторы могут способствовать формированию видового имму-
452
нитета? Возможные варианты ответа следующие: структурные
особенности покровных тканей и клеточных стенок растения, на-
личие в нем постоянно синтезируемых антимикробных соедине-
ний и, наоборот, отсутствие в растительных тканях необходимых
питательных соединений.
VI.4.1. СТРУКТУРНЫЕ БАРЬЕРЫ
И ПИЩЕВАЯ ПРИГОДНОСТЬ РАСТЕНИЙ
К структурным барьерам относят клеточные стенки растений и
кутикулу, роль которых очевидна уже из раздела, посвященного
проникновению патогенов. Они являются надежным заслоном на
пути бактериальных и многих грибных патогенов, не обладающих
специальным аппаратом активного проникновения. Но и для гри-
бов с активным типом проникновения в растительные ткани пре-
одолимы далеко не все барьеры. Например, возбудитель серой
плесени винограда гриб Botrytis cinerea поражает ягоды, преодоле-
вая кутикулу толщиной в 2.3—3.0 мкм. Исследования на интакт-
ных фрагментах изолированной кутикулы показали, что, несмотря
на 70—80 %-ное прорастание конидий и формирование аппрессо-
рия, только 1—2 конидии на 3500 способны реально пронизывать
кутикулу. При этом неважно, из какого именно сорта винограда
кутикула была выделена. Обработка растений силиконом повыша-
ет устойчивость одно- и двудольных растений к возбудителю муч-
нистой росы или пиликуляриоза риса (Pyricularia grisea), так как
силикон частично встраивается в растительные стенки, повышая
их прочность.
Пригодность того или иного растения в качестве хозяина для
патогена также может быть причиной видового иммунитета. Свя-
зано это с отсутствием в растении определенных веществ, необхо-
димых патогену для роста и развития, либо с наличием токсичных
для патогена веществ. Последняя группа растительных метаболи-
тов наиболее хорошо изучена, поэтому ее описание дано отдельно.
В этом разделе собраны сведения о растительных метаболитах,
способствующих росту и развитию патогена.
Еще в 50-е годы было показано, что ауксотрофные мутанты
фитопатогенных бактерий и грибов могут обладать пониженной
вирулентностью. Например, мутанты разных видов фитопатоген-
ных грибов с потребностью в холине, рибофлавине, некоторых
аминокислотах или азотистых оснований являются полностью
авирулентными. Восстановить вирулентность гриба можно путем
добавления в питательные среды соответствующих метаболитов
или экстрактов тканей растения-хозяина. Аналогичный эффект
достигается также при нанесении этих же веществ на поверхность
растения. Множество подобных факторов позволило сформулиро-
вать питательно-тормозящую гипотезу патогенеза (nutrition-inhibi-
tion hypothesis of pathogenecity). Согласно ей, одним из условий
453
проявления патогенности является соответствие между питатель-
ными потребностями патогена и адекватной концентрацией росто-
вых факторов в растении-хозяине. При отсутствии ростовых фак-
торов или их низкой концентрации развитие патогена задержива-
ется, вследствие чего проявляется устойчивость растения. Одним
из примеров такого рода ростовых факторов являются раститель-
ные стерины.
Еще в 60-е годы было показано, что грибы рода Phytophthora и
их родственники из рода Pythium (грибы-оомицеты семейства Pyt-
hiaceae) не способны к самостоятельному синтезу стеринов — ве-
ществ, входящих в состав клеточных мембран любой эукарио-
тической клетки. Классический пример стерина — холестерин,
который доминирует в животных клетках. Подобные ему соедине-
ния — ситостерин, стигмастерин и эргостерин — участвуют в
формировании клеточных мембран у растений и грибов соответст-
венно (рис. VI.7). Искусственное удаление стеринов из мембраны
приводит к значительным нарушениям в ее функционировании.
Так, многочисленные мутанты растений и грибов с нарушениями
в составе мембранных стеринов обладают пониженной жизнеспо-
собностью.
Блок синтеза стеринов у питиевых грибов связан с отсутствием
некоторых ключевых ферментов. Однако грибы способны погло-
щать стерины из питательной среды и трансформировать их в не-
обходимые соединения. Таким образом, при росте на субстратах,
Рис. VI.7. Примеры наиболее распространенных стеринов.
454
содержащих стерины, грибы перерабатывают их и используют для
построения клеточных мембран, а также для синтеза других ве-
ществ стериновой природы, в частности полового гормона. Отсут-
ствие стеринов в питательном субстрате компенсируется в мемб-
ранах грибов за счет специфических 20-углеродных жирных кис-
лот фитофторолов, стабилизирующих мембраны. Однако грибы,
выросшие при недостатке стеринов, более чувствительны к внеш-
ним агентам (температура, фитоалексины, токсины). Наиболее
стерин-чувствительными являются процессы бесполого и полового
размножения гриба, которые протекают только в присутствии сте-
ринов. Так, при росте на синтетических средах, в которых нет
стеринов, гриб не содержит их в плазмалемме и образует неболь-
шое количество зооспорангиев, неспособных к прорастанию зоо-
спорами. Эти зооспорангии являются аномальными. Внесение в
культуральные среды стеринов обеспечивает появление некоторо-
го количества нормальных зооспорангиев.
Максимальным стимулирующим действием обладают рас-
тительные стерины (ситостерин, стигмастерин), меньше — холе-
стерин. Экстракт, полученный из клубней картофеля, действует
аналогично ситостерину, что неудивительно, так как ситостерин
составляет более 50 % стеринов картофеля. Таким образом, боль-
шим соответствием потребностям гриба Р. infestans обладают сте-
рины растительного происхождения. Наличие стеринов в среде
сказывается и на физиологической активности патогена. Р. infe-
stans, выращенный в присутствии ситостерина, на два порядка ин-
тенсивнее распространяется по поверхности инфицированных
ломтиков клубней, глубже проникает во внутренние слои, актив-
нее образует споры по сравнению с мицелием, который рос в ус-
ловиях дефицита стеринов, и гораздо слабее индуцирует синтез
защитных веществ фитоалексинов (см. раздел, посвященный СВЧ).
Высокие концентрации холестерина позволяют несовместимым
расам гриба преодолевать даже барьер специфической устойчи-
вости.
Признаки роста и размножения фитофторы в условиях дефи-
цита стеринов совпадают с таковыми при росте на устойчивых
растениях, а именно отмечают низкую скорость роста, слабую ин-
тенсивность спороношения и отсутствие полового размножения.
Поэтому одной из причин устойчивости растений картофеля к фи-
тофторозу может быть измененный состав стеринов в растении.
Это предположение было экспериментально доказано авторами.
В частности, были получены растения картофеля и томатов с из-
менениями в синтезе стеринов, которые обладали высоким уров-
нем устойчивости к заболеванию.
455
VL4.2. НЕСПЕЦИФИЧЕСКИЕ ТОКСИНЫ РАСТЕНИЙ
И УСТОЙЧИВОСТЬ К ПАТОГЕНАМ
Растения синтезируют широкий спектр вторичных метаболи-
тов, обладающих антимикробным действием. Некоторые из этих
соединений синтезируются здоровыми растениями конститутивно
(независимо от заражения) и находятся в растении в биологически
активных формах. Другие, например цианистые гликозиды, хра-
нятся в клетке в виде неактивных предшественников и активиру-
ются только при повреждении тканей или атаке патогена. Система
активации таких «протоксинов» обычно включает в себя ряд фер-
ментов, появляющихся только в момент повреждения или нападе-
ния. Подобные соединения было предложено называть фитоанти-
сипинами (phytoanticipin). Коренным отличием фитоантисипинов
от фитоалексинов и других защитных веществ, синтезируемых
растительными клетками при заражении патогеном, является их
постоянное присутствие в растении на протяжении всего его
цикла вегетации. Фитоантисипины по степени изученности во
многом уступают индуцибельным защитным веществам растений,
но именно они представляют собой один из первых химических
барьеров на пути проникновения патогена.
Несмотря на различия в химической структуре и механизмах
синтеза, фитоантисипины имеют ряд общих свойств. Все они, как
правило, локализованы вне цитоплазмы растительных клеток в ва-
куолях или органеллах. Распределение веществ по растению часто
тканеспецифично, но отмечена тенденция к их накоплению во
внешних клеточных слоях растительных органов. Конкретная
природа фитоантисипинов и их количество в клетках во многом
зависят от таксономической принадлежности растения-хозяина,
его возраста и условий произрастания.
Изучение механизмов синтеза и действия фитоантисипинов
стало возможным в результате получения разнообразных мутантов
растений, неспособных синтезировать эти соединения, и иденти-
фикации патогенов, способных противостоять их токсическому
действию. Рассмотрим основные классы фитоантисипинов.
Сапонины широко распространены в растительном царстве.
Представлены они тремя классами гликозидов и различаются по
химической структуре агликона (тритерпены, стероиды, стероид-
ные гликоалкалоиды). Наиболее известные представители всех
трех классов изображены на рис. VI.8. Наиболее изученными явля-
ются тритерпеноидные сапонины овсов авенацины (А-1, А-2 и В-2),
которые локализованы в корнях растений, причем в максималь-
ных концентрациях — в эпидермальных клетках.
Авенацины гликозилированы по одному сайту в СЗ-положении и
существуют в растении в активной форме. Они представляют осо-
бый интерес в связи с устойчивостью овсов к грибу Gaeumannomy-
ces graminis var. tritici, корневому патогену пшеницы и ячменя, чув-
ствительному в свою очередь к авенацинам. Патовар G. graminis var
456
Рис. VL8. Примеры растительных сапонинов.
Стрелками указаны сайты-мишени действия ферментов детоксикации сапонинов,
glu — глюкоза, gal — галактоза, ага — арабиноза, rha — рамноза, xyl — ксилоза,
Me — метиловая группа.
avenae, поражающий овес, не чувствителен к действию авенацинов.
Означает ли это, что наличие авенацинов в корнях растений и обес-
печивает устойчивость овса к G. graminis var. tritici? Для ответа на
этот вопрос мало получить растения, не продуцирующие авенацины,
и проверить их устойчивость к патогену. Необходимым этапом ис-
следования является изучение совместного наследования способ-
ности к синтезу токсина и устойчивости к патогену.
Направленный поиск среди природных видов овса выявил один
диплоидный вид овса Avena longiglumis, не синтезирующий авена-
цин А-1 и восприимчивый к G. graminis var. tritici. К сожалению,
457
этот вид не скрещивается с другим диплоидным видом овса, что не
позволяет выяснить, как наследуются способность к синтезу аве-
нацинов и устойчивость к патогену. Однако с помощью химичес-
кого мутагенеза недавно были получены мутанты A. strigosa, не
синтезирующие авенацин А-1. Эти мутанты обладали повышенной
восприимчивостью как к G. graminis var. tritici, так и к G. graminis
var. avenae, а также к ряду других корневых патогенов, таких как
Fusarium avenaceum, F. culmorum и F. graminearum. И, хотя гене-
тический анализ устойчивости пока не окончен, эти факты свиде-
тельствуют о том, что авенацины по крайней мере являются одним
из факторов, ограничивающих круг возможных патогенов овса.
Представителями двух других классов сапонинов являются аве-
накозиды Ли В (стероидные сапонины) и а-томатин (стероидный
гликоалкалоид). Авенакозиды гликозилированы по СЗ-сайту и
несут дополнительный остаток глюкозы в положении С26, в ре-
зультате чего являются биологически неактивными протоксинами.
Отщепление глюкозного остатка при повреждении тканей под
действием глюкозилгидролаз превращает авенакозиды в активные
26-деглюкоавенацины А и В. а-томатин гликозилирован только по
СЗ-положению и присутствует в растениях томатов в активной
форме.
Сапонины обладают способностью взаимодействовать со сте-
ринами плазматических мембран грибных патогенов и лизировать
их. Существуют виды грибов, устойчивые к действию сапонинов и
способные поражать растения, синтезирующие эти вещества. Это
означает, что существуют механизмы преодоления мембранолити-
ческого действия сапонинов.
Так, патоген томатов Alternaria solani преодолевает токсичес-
кое действие сапонинов путем понижения кислотности среды в
сайте заражения — при низких значениях pH сапонины теряют
сродство к стеринам. У грибов, принадлежащих к родам Pythium
и Phytophthora, стерины в мембранах заменены ненасыщенными
жирными кислотами — фитофторолами, выполняющими те же
функции стабилизаторов мембран, но не обладающие сродством к
сапонинам. Поэтому эти патогены не чувствительны к сапонинам.
Экспериментальные данные о роли а-томатина в формирова-
нии устойчивости к грибам были получены на Fusarium solani.
Этот патоген в норме поражает зрелые плоды томатов, содержа-
ние а-томатина в которых относительно мало. Мутанты F. solani с
нарушениями в синтезе стеринов, как следствие содержащие по-
ниженное количество стеринов в мембранах, более агрессивны и
поражают зеленые плоды, хотя последние содержат а-томатин в
высоких концентрациях. Эти же мутанты обладают повышенной
устойчивостью к этому токсину. Анализ потомства от скрещива-
ния мутантов и дикого типа показал, что способность поражать
зеленые плоды, низкое содержание стеринов в грибах и нечувстви-
тельность к а-томатину наследуются совместно, что однозначно
свидетельствует о роли мембранных стеринов в устойчивости
458
гриба к а-томатину и о важности а-томатина как основного фак-
тора устойчивости томатов к F. solani.
Описан еще один механизм устойчивости грибных патогенов к
сапонинам — детоксикация с помощью специальных ферментов.
Ряд патогенов овса и томатов синтезируют специфические глико-
зилгидролазы, отщепляющие углеводные остатки от агликона.
Гидролиз молекулы приводит к потере последней способности
связывать мембранные стерины и, как следствие, к потере токсич-
ности. Так, патоген овса G. graminis var. avenae синтезирует фер-
мент авенациназу, удаляющую две терминальные молекулы D-глю-
козы в молекуле авенацина А-1. Мутанты по гену, кодирующему
авенациназу, теряли одновременно устойчивость к сапонину и
способность поражать растения овса, оставаясь тем не менее пато-
генными для пшеницы, не содержащей сапонины. Таким образом,
гликозилгидролазы могут быть одним из факторов, определяющим
круг потенциальных растений-хозяев патогена.
Интересно, что у патогена томатов Septoria lycopersici был об-
наружен фермент томатиназа, гомологичный авенациназе, кото-
рый отщепляет концевые молекулы глюкозы от а-томатина, инак-
тивируя токсин. Сравнение аминокислотных последовательностей
белков выявило высокий процент гомологии белков (68 %).
а-томатин может инактивироваться и другим способом. У Fu-
sarium oxysporum lycopersici недавно был выделен белок массой
50 кДа, специфически расщепляющий связь между агликоном и
углеводным остатком. Отсутствие данных по аминокислотной по-
следовательности фермента пока не позволяет определить, к како-
му классу ферментов принадлежит данный белок.
Ферментативной детоксикации подвержены также и стероид-
ные гликозиды, несущие дополнительный остаток глюкозы в поло-
жении С26 (рис. VI.8). Фермент авенакозидаза, ответственный за
последовательное удаление остатков глюкозы в положении СЗ,
присутствует как в клетках овса, так и у патогена листьев овса
Septoria avenae. Различаются растительный и грибной ферменты,
расщепляемыми ими связями.
Более 2000 видов растений способны выделять при поврежде-
нии или заражении цианистую кислоту (HCN). Будучи дыхатель-
ным ядом, HCN токсична для подавляющего большинства организ-
мов и считается фактором защиты не только от патогенов, но и от
насекомых и травоядных животных. Выделение HCN является ре-
зультатом ферментативного разрушения нетоксичных предшест-
венников, обычно цианогенных гликозидов, осуществляемого фер-
ментами растений. Общая схема образования HCN приведена на
рис. VI.9. Интактные растения, как правило, свободной цианистой
кислоты не содержат. Это связано с тканевой и клеточной ком-
партментализацией цианогенных гликозидов. В наиболее высоких
концентрациях цианогенные гликозиды содержатся во внешних
клеточных слоях. В пределах клетки гликозиды и гидролизирую-
щие их ферменты разделены тонопластом.
459
CN CN
R'-C-R2 ----► R1—C—R2 + D-glu
O—D-glu OH
Цианогенный а-Гидроксинитрил
глюкозид
R‘ R2
C + HCN
II
Альдегид
или кетон
Рис. VI.9. Общая схема образования цианистой кислоты из цианоген-
ных гликозидов.
R1 и R2 — радикалы, O-D-glu — глюкоза.
В интактных растениях цианогенные предшественники отделены от гидролитичес-
ких ферментов, как правило, тонопластом. При повреждении тканей гидролиз начи-
нается с ферментативного отщепления углеводного остатка с образованием а-гидро-
ксинитрила, который затем превращается в кислоту и альдегид или кетон.
Всего описано более 50 типов цианогликозидов растительного
происхождения, общее их количество составляет около 300. Био-
синтез цианогликозидов включает в себя образование гидрокси-
нитрила из предшественников аминокислот и их гликозилирова-
ние с образованием конечного продукта. Хорошо известными при-
мерами цианогликозидов являются: амигдалин, придающий горечь
горькому миндалю и семенам других розоцветных; линамарин и
лотаустралин, обнаруженные у кассавы, гевеи, лотуса, белого кле-
вера и многих других видов, дуррин сорго и многие другие циано-
гликозиды зерновых.
Известно, что некоторые растения с высоким содержанием
цианогликозидов более устойчивы к определенным грибным пато-
генам, нежели растения с низким содержанием этих веществ. И,
хотя четкая корреляция между уровнем цианогликозидов и сте-
пенью устойчивости растений не показана, существует мнение о
том, что устойчивость некоторых грибов к HCN является факто-
ром их патогенности на растениях-продуцентах цианогликозидов.
Некоторые грибы, например патоген гевеи Microcyelus uleis, ус-
тойчивы к HCN благодаря способности к цианид-устойчивому ды-
ханию. Другие патогены цианогенных растений синтезируют циа-
нидгидратазу, ранее известную как формамид гидролиаза, которая
превращает цианистую кислоту в формамид. Этот фермент обна-
ружен только у грибов как патогенных, так и сапрофитных. У бак-
терий и растений подобные ферменты отсутствуют.
Впервые циан ид гидратаза была обнаружена у Stemphylium
loti, патогена Lotus comiculatus, однако наиболее изученными яв-
ляются цианидгидралазы Gloecercospora sorghi (патоген сорго) и
Fusarium lateritium (патоген сладкого картофеля). Эти ферменты
гомологичны (75 % идентичности по аминокислотным последо-
вательностям) и представляют собой мультимеры белка массой
45 кДа с высоким сродством к цианиду. Гомологичный белок
Klebsiella pneumoniae — нитрилаза — участвует в детоксикации
гербицида бромоксинила (3,5-дибромо-4-гидроксибензонитрила)
460
и обладает 35 % идентичности по аминокислотным последова-
тельностям.
Другой класс фитоантисипинов — глюкозинолаты — пред-
ставлен серосодержащими глюкозидами, синтезирующимися рас-
тениями семейства Cruciferae. Так же как и сапонины, и циано-
глюкозиды, продукты энзиматической деградации глюкозинолатов
токсичны для многих грибов.
Гликозинолаты в зависимости от структуры боковой цепи бы-
вают алифатическими, ароматическими и индольными. Активны-
ми продуктами распада под действием тиоглюкозидазы являются
нестабильные агликоны. Будучи высокореактивными, они образу-
ют в конечном итоге токсичные соединения. Например, алифати-
ческие глюкозинолаты распадаются до изотиоцианатов, нитрилов
и тиоционатов (рис. VI. 10), токсичных in vitro для широкого круга
грибов. Механизмы их действия неизвестны.
Таким образом, высшие растения обладают врожденным им-
мунитетом к подавляющему большинству потенциально пато-
генных микроорганизмов. Этот иммунитет складывается из раз-
личных структурных и метаболических особенностей растения.
Первой преградой на пути проникновения патогена являют-
ся покровные ткани растения и клеточные стенки. Этот барьер
практически не преодолим для ряда патогенов, и только случай-
ное поранение или повреждение покровов открывает доступ
большинству патогенов в межклеточное пространство. Именно
там в действие вступают защитные системы химической приро-
ды. Недостаток определенных веществ, необходимых патогену
S—p-D-glu
NOSOJ
Н2О Т иоглюкозидаза
ySH
\ + D-glu,
NOSOJ
R-N-C-S R-C-S R—S—C=N
Изотиоцианат Нитрил Тиоцианат
Рис. VI. 10. Общая схема гидролиза алифатических глюкозинолатов.
R — радикал, D-glu — D-глюкоза. Глюкозинолаты активируются в ответ на повреж-
дение клетки растительным ферментом тиоглюкозидазой. Нестабильные агликоны
распадаются на ряд токсических продуктов (изотиоцианаты, нитрилы, тиоцианаты).
461
для нормального роста и развития, предотвращает рост пато-
гена в растении и потому является одним из факторов устой-
чивости. Пищевая зависимость такого рода слабо изучена у
фитопатогенных микроорганизмов, но она открывает большие
возможности в области создания растений, устойчивых к специ-
фическим заболеваниям.
Высшие растения обладают также целым набором вторичных
метаболитов — фитоантисипинов, обладающих фунгицидным
действием. Они синтезируются растением в течение всего жиз-
ненного цикла независимо от того, подверглось ли оно атаке пато-
геном или нет. Как правило, наиболее богаты фитоантисипинами
внешние клеточные слои растительных органов. Очевидно, вкупе
с другими особенностями покровных тканей (кутикула и т. д.) фи-
тоантисипины представляют один из первых химических барь-
еров на пути проникновения патогена, поддерживая тем самым
нечувствительность растений к потенциальному патогену. Прак-
тически все фитоантисипины, за исключением стероидных и три-
терпеноидных сапонинов, являются неактивными предшествен-
никами фунгитоксичных соединений, образующихся при по-
вреждении клеток под действием специальных растительных
ферментов (табл. VI.4). В норме фитоантисипины и гидролизую-
щие их ферменты содержатся в разных клеточных компартмен-
тах, фитоантисипины в вакуоли, ферменты — в цитоплазме
(рис. VI.11). Интересно, что независимо от химической структуры
антисипина, гидролизирующие их ферменты у разных видов рас-
тений гомологичны. Это позволяет предположить для них сущест-
вование в прошлом общей предковой формы.
Таблица VI.4
Конститутивные защитные вещества растений и способы инактивации их
грибными патогенами
Предшественник токсина Продукт с фунгицидной активностью Растительные ферменты- активаторы предшественников Основной способ детоксикации
Тритерпеноид- ные сапонины и стероидные гли- коалкалоиды Тритерпеноидные сапонины и стеро- идные гликоалка- лоиды Нет СЗ-специфичные сапонин и гликозил- гидролазы; струк- тура мембраны
Стероидные сапонины С26-деглюкозили- рованные сапони- ны С26/С28-Р-специ- фичные глюкозил- гидролазы Тот же
Цианогенные Цианистая кисло- Р-гликозил гидро- Цианид гидратазы;
гликозиды та. HCN лазы; а-гидроки- нитриллиазы цианид-устойчивое дыхание
Глюкозинолаты Изотиоцианаты, нитрилы, тиоциа- наты Тиоглюкозидазы Неизвестны
462
• - фитоантисипины
Рис. VI. 11. Пространственное распределение фитоантисипинов и гидро-
лизующих их ферментов в растительной клетке.
В некоторых случаях доказано, что способность растения
синтезировать те или иные антисипины обусловливает его ус-
тойчивость к определенным патогенам. В то же время описан
ряд грибных патогенов, способных тем или иным способом
инактивировать токсины растений. Общие механизмы детокси-
кации антисипинов грибами также приведены в табл. VI.4.
Глава VI.5
СПЕЦИФИЧЕСКАЯ УСТОЙЧИВОСТЬ
И ВОСПРИИМЧИВОСТЬ РАСТЕНИЙ
Сорто- и расоспецифические взаимодействия между растения-
ми и их патогенами являются ключевыми для фитопатологии —
науки, изучающей механизмы, лежащие в основе устойчивости
или восприимчивости высших растений к болезням. Зародившись
в середине XIX в., долгое время фитопатология занималась описа-
ниями микроорганизмов, вызывающих заболевания растений, фик-
сировала симптомы и сопутствующие болезням физиологические
и биохимические изменения, происходящие в растении. Накопле-
ние многочисленных данных позволило в середине XX в. сделать
качественный скачок — были найдены первые эксперименталь-
ные модели для изучения генетики устойчивости высших растений
к болезням. А именно, было показано, что устойчивость сорта яв-
463
ляется результатом сочетания действия определенных генов расте-
ния и патогена. Дифференциальная реакция различных сортов
льна в ответ на заражение разными расами гриба — возбудителя
ржавчины льна — позволила сформулировать А. Флору гипотезу
«ген—на—ген». Последующие исследования показали, что эта ги-
потеза верна для большинства видов растений и их патогенов. Эти
исследования позволили говорить о существовании у обоих орга-
низмов определенных генов, экспрессия которых определяет
исход взаимодействия. Такие гены получили название генов ус-
тойчивости у растений и генов вирулентности или авирулент-
ности у микроорганизмов. В настоящее время многие из этих
генов клонированы, охарактеризованы продукты некоторых из
них и определены их функции. На основе этих данных была сфор-
мулирована первая в фитопатологии стройная система, которая
описывает молекулярно-генетические процессы, протекающие при
взаимодействии растений с микроорганизмами-возбудителями за-
болеваний. В настоящее время теория геноспецифичных взаимо-
действий может быть дополнена и другими примерами.
Специфика реакции разных сортов растения на один и тот же
генотип патогена, или, наоборот, одного и того же сорта на раз-
ные генотипы патогена связана со способностью определенных его
генотипов синтезировать специфические токсины или со способ-
ностью растения узнавать специфические метаболиты патогена, не
являющиеся токсичными. Первый вариант взаимоотношений ха-
рактерен для некротрофных патогенов, синтезирующих хозяин-
специфичные токсины {ХСТ), т. е. вещества, токсичные только для
узкого круга хозяев. Гибель растительных клеток при таком взаи-
модействии является следствием их чувствительности к токсину,
синтезируемому патогеном. Второй вариант, наоборот, основан на
том, что растительные клетки узнают о проникновении патогена и
гибнут раньше, чем патоген успевает проникнуть в соседние клет-
ки. Этот вариант носит название реакции сверхчувствительности
{СВЧ) и характерен для устойчивых растений.
VI3.1. ХОЗЯИН-СПЕЦИФИЧНЫЕ ТОКСИНЫ (ХСТ) ГРИБОВ
Все известные хозяин-специфичные токсины (ХСТ) являются
вторичными метаболитами, и характерны они для грибных патоге-
нов. Как правило, они не обязательны для нормального существо-
вания патогена или его размножения, но создают более благопри-
ятные условия для колонизации растительных тканей. Характер
взаимодействия патогена и растения-хозяина в зависимости от их
способности синтезировать ХСТ и чувствительности к ХСТ при-
веден в табл. VI.5.
Несмотря на разную химическую природу, все ХСТ обладают
рядом общих черт. Прежде всего токсичность этих соединений
проявляется при очень низких концентрациях, хотя диапазон спе-
464
Таблица VI.5
Варианты взаимодействия разных сортов растения с расами
патогена, различающимся по способности синтезировать ХСТ
Растение Сорт 1 Сорт 2
Патоген (ХСТ-устойчивый) (ХСТ-чувствител ьн ый)
1 (ХСТ+) Устойчивость Гибель
2 (ХСТ-) » Устойчивость
цифичности их действия варьирует более чем в 1000 раз. Будучи
низкомолекулярными соединениями, они экскретируются грибом
в растительные ткани и переносятся на некоторое расстояние. Общие
симптомы, вызываемыми ХСТ, не отличаются от симптомов не-
специфичных токсинов, которые описаны выше: утечка электро-
литов из клетки, ингибирование роста корней, развитие хлорозов
и некрозов растительных тканей.
Зачастую ХСТ приобретают токсичность только в определен-
ных условиях, например свет может выступать в качестве супрес-
сора токсина, не меняя при этом степени чувствительности расте-
ния к заболеванию, как например в случае с AM-токсином Alter-
naria altemata. Токсическое действие многих токсинов может быть
аннулировано ингибиторами синтеза РНК или белка. Эти факты
свидетельствуют о том, что токсичность ХСТ может быть опосре-
дована метаболизмом растительной клетки, в частности синтети-
ческими процессами, протекающими в ней.
Наиболее изученными являются ХСТ, синтезируемые представи-
телями двух родов — Alternaria и Cochliobolus (старое название —
Helmintosporium или Bipolaris). Эти грибы — факультативные сап-
рофиты, успешно поражающие стареющие или ослабленные расте-
ния. Вряд ли широкий спектр ХСТ является отличительным призна-
ком именно этих двух видов. Известны специфичный Ptr-токсин Ру-
renophora tritici-repentis, PM-токсин Phyllosticta maydis. Возможно,
что выделение ХСТ у Alternaria и Cochliobolus более технически
осуществимо, нежели чем у других видов, и вскоре список ХСТ-про-
дуцирующих грибов увеличится. Пока же мы остановимся именно
на этих двух видах.
Активное изучение Т-токсина Cochliobolus heterostrophus нача-
лось в связи с эпифитотией (массовым заболеванием) южной лис-
товой гнили кукурузы в США в 1970 г. Эпифитотия была связана
с широким распространением в 60-х годах сортов кукурузы на ос-
нове Т-типа цитоплазматической мужской стерильности (ЦМС),
так как она значительно облегчала процесс получения межлиней-
ных гибридов кукурузы. К 1970 г. большинство посевов кукурузы
принадлежало к Т-типу ЦМС, что в сочетании с климатическими
условиями того года создало благоприятные условия для распро-
странения болезни.
465
Как оказалось позднее, Т-ЦМС растения кукурузы активно по-
ражаются расой Т гриба Cochliobolus heterostrophus. Раса Т синте-
зирует Т-токсин (известен также как НМТ-токсин или ВМТ-ток-
син) (рис. VI. 12). Раса 0 Т-токсин не синтезирует и слабо поража-
ет растения кукурузы независимо от типа цитоплазмы растений.
Синтез Т-токсина контролируется одним локусом Toxl, содер-
жащим 2 гена ТОХ1А и ТОХ1В. Гены не сцеплены между собой
и присутствуют только в расах Toxl* фенотипа. Ген ТОХ1А коди-
рует фермент поликетидсинтазу, а ген ТОХ1В — декарбоксилазу,
очевидно принимающих участие в синтезе Т-токсина.
Т-токсин активен в концентрации -10 пМ в клетках кукурузы
ЦМС Т-типа и -10 иМ — в клетках с нормальной цитоплазмой.
Мишенью для действия Т-токсина являются митохондрии. Дело в
том, что ЦМС Т-типа обусловлена потерей значительного фраг-
Т-токсин
НС-токсин
Рис. VI. 12. Структура некоторых грибных хозяин-специфичных токси-
нов (ХСТ).
466
мента митохондриальной ДНК. В результате такой перестройки у
Т-ЦМС растений образуется гибридная рамка считывания T-URF13,
кодирующая белок Urfl3 размером 13 кДа. Белок Urfl3 локализу-
ется во внутренней мембране митохондрий и в присутствии Т-ток-
сина полимеризуется и формирует в мембране поры, через кото-
рые происходит утечка метаболитов. Об этом свидетельствуют
эксперименты на Е. coli, дрожжах и клетках табака, трансформи-
рованных химерным геном T-URF13, упомянутые трансформанты
приобретают несвойственную им чувствительность к токсину. Дру-
гим доказательством роли белка Urf 13 является тот факт, что фер-
тильность пыльцы Т-ЦМС растений может восстанавливаться
двумя ядерными генами RF1 и RF2, однако структура митохондри-
альной ДНК у таких растений не восстанавливается. Также у них
не исчезает чувствительность к Т-токсину.
Другой представитель рода Cochliobolus — С. victoriae извес-
тен как возбудитель гнили овса, также вызывавший массовые эпи-
фитотии в США в 1930-х годах. Интересно, что этот патоген стал
экономически значимым в результате успешных селекционных
работ по устойчивости овса к другому патогену Puccinia coronata,
до той поры считавшемуся основным патогеном овса. В ходе этих
работ ген РС2, обеспечивающий устойчивость овса к Р. coronata,
был интродуцирован в сорта культурного овса, которые и получи-
ли широкое распространение в стране. Однако оказалось, что
именно эти сорта наиболее подвержены патогенному воздействию
со стороны С. victoriae, до тех пор не представлявшим опасности
для сельского хозяйства. Данный пример является весьма поучи-
тельным, так как наглядно демонстрирует, что «удаление» одного
патогена из биоценоза расчищает путь другим патогенам.
Токсин С. victoriae получил название викторин (рис. VI. 12), ге-
нетический контроль его синтеза, равно как и лежащие в его ос-
нове биохимические реакции, пока неизвестны.
Генетический анализ показал, что ген HV1 (Vb), отвечающий
за восприимчивость растений к С. victoriae, либо тесно сцеплен с
геном РС2, либо восприимчивость к патогену является побочным
эффектом гена РС2.
Викторин необратимо связывается с отдельными субъединица-
ми глициндекарбоксилазы — фермента, состоящего из 42 субъеди-
ниц четырех типов. Этот ферментативный комплекс локализован
в митохондриях и играет важную роль в процессе фотодыхания.
Эксперименты с интактными клетками и клеточными препарата-
ми показали, что специфичность действия викторина связана с его
накоплением в митохондриях восприимчивых к заболеванию рас-
тений, однако, как это связано с работой гена HV1, неизвестно.
Предположение о том, что ген HV1 кодирует одну из субъединиц
ферментативного комплекса столь же вероятно, как и то, что он
контролирует транспорт и накопление викторина в клетке.
В пределах вида Cochliobolus carbonum выделяется раса 1, син-
тезирующая НС-токсин (рис. VI. 12) и поражающая растения куку-
467
рузы с генотипом hmlhml. Доминантная аллель гена НМ1 обеспе-
чивает устойчивость растений как к самому патогену, так и к его
НС-токсину. НС-токсин — единственный пример ХСТ с изучен-
ным биосинтезом.
Синтез НС-токсина контролируется одним локусом ТОХ2
(рис. VI. 13), в состав которого входят по две копии генов ТОХА и
HTS1. Ген HTS1 кодирует открытую рамку считывания в 15.7 т. п. н.,
не содержит интронов и кодирует фермент НС-токсин синтазу
массой 570 кДа. Ген ТОХА расположен левее Htsl, содержит три
интрона и кодирует мРНК размером 2.1 т.п.н. Гидрофобный
белок, продукт этого гена, предположительно участвует в экскре-
ции НС-токсина из клетки, защищая тем самым патоген от его
собственного токсина. Третий ген ТОХС, необходимый для синте-
за НС-токсина, представлен в локусе тремя копиями и кодирует
белок, который гомологичен Р-субъединице синтазы жирных кис-
лот дрожжей и других филаментозных грибов. Очевидно, функция
этого белка связана с синтезом жирно-кислотного остатка НС-ток-
сина. Все эти гены обнаружены только у тех изолятов, которые
синтезируют НС-токсин (Тох2+-изоляты).
НС-токсин интересен тем, что не обладает прямым цитотокси-
ческим действием. У восприимчивых растений кукурузы с геноти-
пом hmlhml он ингибирует рост корней, проявляет цитостатичес-
кий эффект, нарушает синтез хлорофилла. Кроме того, этот ток-
син взаимодействует напрямую с наследственным аппаратом
клетки, изменяя структуру хроматина. Мишенью действия НС-токси-
на является фермент гистон деацетилаза, обратимо деацилирую-
щая коровые гистоны НЗ и Н4. Взаимодействие фермента с токси-
ном приводит к инактивации фермента и накоплению ацетилиро-
ванных гистонов. Известно, что степень ацетилирования гистонов
определяет укладку хроматина и регулирует уровень транскрипции
генов, локализованных в данном районе хроматина.
Устойчивость растений кукурузы с генотипами HMlhml или
НМ1НМ1 к НС-токсину связана с их способностью инактивиро-
вать токсин с помощью фермента НС-токсин редуктазы, кодируе-
мой геном устойчивости НМ1.
Таким образом, мы рассмотрели некоторые примеры токси-
нов, вырабатываемых фитопатогенными микроорганизмами.
Характерной особенностью микробов, которые синтезируют
токсины, является некротрофный тип питания, при котором ги-
т.п.н. 220 220 50 50
СЗ Al/Hl С2 А2/Н2 С1
Рис. VI. 13. Организация локуса ТОХ2 у С. carbonum (штамм SB111).
Локус ТОХ2 состоит из 2 копий генаТохА (А1 и А2), 2 копий гена Htsl (Hl и Н2)
и 3 копий гена ТохС (Cl, С2 и СЗ). Расстояние между генами указаны в т. п. н.
468
бель растительных клеток представляет собой первый и необ-
ходимый этап заражения. Токсины тем самым являются основ-
ным фактором патогенности некротрофов. Токсины различают-
ся между собой как по химической структуре и сайтам-мише-
ням, так и специфичности взаимодействия с ними. Наряду с
неспецифическими токсинами, свойственными бактериям и гри-
бам, многие грибные фитопатогены продуцируют ХСТ, ограничи-
вающие диапазон потенциальных хозяев до отдельных сортов или
генотипов растений. Биохимические основы действия токсинов
кроются в их способности взаимодействовать с метаболизмом рас-
тительной клетки, нарушая отдельные его этапы. Конкретная
«точка приложения» каждого токсина уникальна. Специфичность
действия ХСТ связана с чувствительностью растений, которая
обычно контролируется одним геном и обеспечивает тем самым
восприимчивость растения к заболеванию.
VI.5.2. РЕАКЦИЯ СВЕРХЧУВСТВИТЕЛЬНОСТИ (СВЧ)
Геноспецифичные взаимодействия растения и патогена лежат в
основе еще одного механизма устойчивости растений, носящего
название реакции сверхчувствительности (СВЧ) (hypersensitive
response, HR). Реакция СВЧ представляет собой быструю локаль-
ную гибель растительных клеток в месте инфекции вместе с пато-
геном, что в конечном итоге обеспечивает устойчивость целого
растения. Именно этот тип устойчивости исторически носит также
название сорта- или расоспецифической устойчивости. Само на-
звание показывает, что устойчивость такого рода возможна только
при контакте определенных сортов растений с определенными ра-
сами грибного или штаммами бактериального патогена.
Реакции СВЧ предшествует распознавание микробного патоге-
на растением, более того, именно распознавание является ключе-
вым моментом реакции. Выбор у растительных клеток невелик —
либо они быстро распознают «незванного гостя» и погибают вмес-
те с ним, позволив тем самым выжить растению в целом, либо
мирится с ним, но мирное сосуществование длится недолго и
заканчивается гибелью всего растения. Именно стадия распознава-
ния определяет, почему одни сорта (генотипы) растений устойчи-
вы к заболеванию, а другие — нет. И связано это с работой спе-
цифических генов устойчивости растений (R-генов) и генов авиру-
лентности патогена (avr-генов).
Разные патогены обладают характерными «приметами», по ко-
торым и распознаются растительными клетками. Такими «приме-
тами» являются химические соединения, синтезируемые микроор-
ганизмом; они получили название элиситоров (от англ, глагола to
elicit — вызывать, в данном случае реакцию СВЧ). Как правило,
элиситоры секретируются микробной клеткой во внеклеточное
пространство и способны вызывать реакцию СВЧ даже в отсутст-
469
вии патогена. Одни и те же элиситоры могут присутствовать у
разных рас или штаммов (генотипов) патогенов одного вида, и
тогда они классифицируются как неспецифические элиситоры.
Если же элиситор характерен только для одного генотипа патоге-
на, то он является специфическим. Синтез специфических элиси-
торов контролируется генами авирулентности (avr-генами).
Элиситоры узнаются растительной клеткой благодаря разнооб-
разным рецепторам, специфически «настроенным» на определен-
ный тип элиситора. Предположительно их рецепторы находятся
на плазмалемме или в цитоплазме клеток. Образование комплекса
элиситор—рецептор запускает в клетке каскад реакций, результа-
том которых является синтез широкого спектра веществ, токсич-
ных как для микроорганизма, так и для растительных клеток. Раз-
нообразные гены устойчивости (R-гены) растений кодируют либо
рецепторы элиситоров, либо молекулы, передающие сигнал о ре-
цепции ниже по цепочке. Важным свойством генов устойчивости
является их доминантность, т. е. признак устойчивости проявляет-
ся как у гомозигот RR, так и у гетерозигот Rr.
Таким образом, различия между сортами по устойчивости к од-
ному возбудителю или между разными генотипами патогена по
способности заражать растения определенного генотипа базируют-
ся на работе ограниченного количества генов, продукты которых
комплементарны друг другу.
Специфические элиситоры. Начнем наше знакомство со специ-
фической устойчивостью с группы патогенов, продуцирующих спе-
цифические элиситоры. Это наиболее простой и наиболее изучен-
ный вариант взаимодействия, биологический смысл которого отра-
жен в табл. VI.6. При заражении патогеном, несущим активный
Таблица VI.6
Реакция растений при заражении патогенами, продуцирующими
специфические элиситоры
^*^***^^^ Растение Патоген ' Сорт 1 (rirl) Сорт 2 (Rlr или R1R1)
Раса 0 Болезнь Болезнь
Раса 1 (avrl) » СВЧ
Примечание. В комбинациях растение—патоген с комплементарными генами
(R1—avrl) развивается реакция СВЧ и растение не заражается. Раса 1 патогена
(avrl) вырабатывает специфический сигнал, узнаваемый растением с соответствую-
щим геном устойчивости (R1). Данная комбинация генотипов называется несовмес-
тимой. Во всех остальных комбинациях патоген успешно заражает растение (со-
вместимые комбинации). Таким образом, секреция элиситора — признак авиру-
лентных рас (штаммов) патогена. Отсутствие активной аллели avr-гена позволяет
патогену успешно поражать растение с генотипом RR и Rr. Растения, не имеющие
R-генов, поражаются всеми расами патогена, независимо от наличия активной ал-
лели avr-гена.
470
Таблица VI. 7
Клонированные гены авирулентносги патогенов
Вид патогена-продуцента Avr-ген Белковый продукт
Cladosporium fulvum С. fulvum Rhynchosporium secalis Magnaporthe grisea Pseudomonas syringae AVR4 AVR9 NIP1 AVR2-YAMO AVRD Элиситор » Токсин-элиситор ? Ферменты, осуществля- ющие синтез сиринго- лидов (элиситоров)
? — отражение отсутствия данных о функциональной природе
элиситора.
Avr-ген, устойчивым оказывается только то растение, которое спо-
собно узнавать элиситор, что кодируется соответствующим R-геном.
Именно эта комбинация генотипов патогена и хозяина является не-
совместимой. Во всех остальных случаях патоген совместим с хозя-
ином, и реакция СВЧ не запускается, а растение гибнет.
Табл. VI.7 содержит список наиболее исследованных к настоя-
щему времени специфических элиситоров фитопатогенов и коди-
рующих их генов.
Первым клонированным грибным геном авирулентности стал
ген AVR9 патогена томатов Cladosporium fulvum. Расы гриба, не-
сущие ген AVR9, вызывали реакцию СВЧ у сортов, обладающих
геном устойчивости CF9. Для томатов и С. fulvum известны и дру-
гие пары комплементарных генов: AVR2-CF2, AVR4-CF4 и т.д.
Из культуральной среды соответствующих генотипов гриба были
выделены небольшие пептиды Avr4 и Avr9, которые при нанесе-
нии их на растения с генотипом CF4 и CF9 соответственно вызы-
вали образование некрозов. Гены AVR9 и AVR4 были клонирова-
ны. Убедительным доказательством их участия в развитии реакции
СВЧ послужили эксперименты по трансформации рас гриба, виру-
лентных для CF9- и СР4-сортов фрагментами ДНК, соответствую-
щими генам AVR9 и AVR4, в результате чего расы теряли способ-
ность заражать упомянутые сорта томатов. Дальнейшие исследова-
ния показали, что гены AVR9 и AVR4 кодируют пре-пропротеины
из 63 и 135 аминокислот соответственно. За развитие реакции
СВЧ ответственны лишь небольшие фрагменты этих молекул —
пептид из 18 аминокислот для гена AVR4 и пептид из 23 амино-
кислот для гена AVR9. Оба протеина являются цистеинбогатыми,
и дисульфидные связи играют важную роль в поддержании кон-
формации молекул. Созревание пре-пропротеина происходит под
действием протеаз грибного и растительного происхождения.
Сравнение разных рас патогена показало, что все вирулентные
расы С. fulvum обладают гомологами гена AVR4. Отсутствие ак-
тивности гена связано с точечными мутациями, которые в боль-
471
шинстве случаев приводят к замещению одного из восьми остат-
ков цистеина, необходимых для поддержания пространственной
конформации элиситора. Среди прочих мутаций описана также и
мутация, приводящая к сдвигу рамки считывания. Мутантные ал-
лели гена AVR4 транскрибируются, но их продукты обладают на-
рушенной конформацией и не узнаются антителами на пептид
Avr4 и соответственно рецепторами растительных клеток.
Совершенно иная ситуация сложилась для гена AVR9 — этот
ген отсутствует у изолятов, вирулентных для СР9-сортов. Элиси-
тор Avr9 содержит 6 остатков цистеина. Для определения вклада
отдельных аминокислотных остатков в элиситорную активность
молекулы были проведены эксперименты по мутагенезу in vitro.
Для этого на основе реакции полимеразной цепной реакции были
синтезированы последовательности гена AVR9 с различными за-
менами. Эти последовательности были встроены в вектор на осно-
ве вируса X картофеля под промотор гена белка оболочки вируса.
Полученными трансформантами заражали растения томатов с ге-
нотипом CF9 и CF0. Оказалось, что единичные аминокислотные
замены в структуре пептида Avr9 могут не только снижать его
элиситорную активность, но и существенно ее повышать. Часть
конструкций была использована в дальнейшем для определения
сайтов связывания белка Avr9 в растительной клетке.
У гриба Magnaporthe grisea, поражающего рис, было идентифи-
цировано несколько генов авирулентности: AVR1-CO39, AVR1-
М201, AVR1-MARA, AVRl-Tsuy, AVR1-YAM0 и AVR2-YAMO,
которые обеспечивают устойчивость сортов риса СО39, М201,
Maratelli, Tsuyuake и Yashiro-mochi соответственно. Ген AVR2-
YAMO был локализован и клонирован. Трансформация гриба, ви-
рулентного для сорта Yashiro-mochi, фрагментом ДНК размером
6.5 т. п. н., несущим ген AVR2-YAM0, привела к потере вирулен-
тности у трансформантов. Ген AVR2-YAM0 кодирует белок из
223 аминокислот, функция белка неизвестна, и не обнаружено-го-
мологии по аминокислотной последовательности с известными на
сегодня белками. Однако небольшой фрагмент молекулы гомоло-
гичен активному центру нейтральных цинковых протеаз (Zn-npo-
теазы). Более того, у некоторых вирулентных изолятов М. grisea
были обнаружены точечные замены в активном центре молекулы
Avr2-YAMO. Однако пока еще неизвестно, обладает ли элиситор
Avr2-YAMO протеазной активностью. Показано также, что боль-
шинство патогенов риса и родственных ему злаков Digitaria и Реп-
nisetum содержат последовательности, гомологичные гену AVR2-
YAMO.
Ген NIP1 Rhynchosporium secalis, патогена ячменя, кодирует
небольшой пептид массой менее 10 кДа. Семейство белков Nip (от
necrosis-inducing peptides) было обнаружено в Культуральных
фильтратах гриба и в зараженных растениях, их характеристикой
является индукция образования некрозов как у восприимчивых,
так и у устойчивых растений ячменя, т. е. Nip-белки являются,
472
скорее, токсинами. Однако у растений ячменя с генотипом RRS1
белок Nipl специфически активирует реакцию СВЧ. Фрагмент
ДНК, соответствующий гену NIP1, был клонирован. Его встройка
в геном гриба, вирулентного для RRS1-сортов, привела к потере
вирулентности. И наоборот, дезрупция гена NIP1 восстанавливала
вирулентность гриба. Эти данные однозначно говорят о том, что
ген NIP1 определяет специфичность взаимодействия патогена с
сортами ячменя, несущими ген RRS1, комплементарным которому
он является. Таким образом, согласно современной терминологии,
ген NIP1 является геном авирулентности AVRRRS1. Расы гриба,
способные поражать растения с генотипом RRS1, либо содержат
изменения в нуклеотидной последовательности гена AVRRRS1,
либо лишены его вовсе.
Изучение бактериальных факторов, вызывающих развитие ре-
акции СВЧ у растений, проводилось в двух направлениях: получе-
ние мутантов бактерий, неспособных вызывать реакцию СВЧ у ус-
тойчивых растений, и получение мутантов, неспособных заражать
восприимчивые растения. В итоге было показано, что для индук-
ции реакции СВЧ бактериальная клетка должна обладать двумя
компонентами: генами авирулентности, ответственными за синтез
элиситоров, и специальной системой секреции элиситоров из
клетки в клетку, так как специфические элиситоры бактерий ни-
когда не секретируются в межклеточное пространство.
Функции Avr-белков, кодируемых avr-генами, за небольшим
исключением, у фитопатогенных бактерий не установлены
(табл.У1.7). Возможно, что они являются элиситорами, взаи-
модействующими в растительной клетке с рецепторами и запуска-
ющими каскад реакций, или участвуют в синтезе элиситоров.
Известно, что ген avrD (Р. syringae pv. tomato) кодирует фермент,
участвующий в синтезе сиринголидов 1- и 2-лактонов, различаю-
щихся длиной жирно-кислотного остатка (рис. VI.14). Аналогич-
ный лактон [лактон М-(3-оксогексаноил)-Ь-гомосерина] водной
бактерии Vibrio fischeri регулирует синтез экзоферментов, связы-
ваясь со специфическими транскрипционными активаторами; счи-
тается, что лактоны могут участвовать в регуляции плотности по-
пуляций бактерий, будучи межклеточ-
ными химическими сигналами. Ген
avrBS2 (Xanthomonas campestris pv.
vesicatoria) кодирует белок, обладаю-
щий сходством с агропинсинтазой
Agrobacterium tumefaciens и глицеро-
фосфорил-фосфодиэстеразой Е. coli.
Роль avr-генов в синтезе элисито-
ров была подтверждена эксперимента-
Рис. VL14. Специфические элиситоры
фитопатогенов (сиринголид 1, сиринго-
лид 2).
473
ми по трансформации кишечной палочки Е. coli. В норме эта бак-
терия не поражает растения и не вызывает появления видимых
некрозов. Но если в клетки E.coli перенести плазмиды, несущие
активные avr-гены, то при нанесении бактерий на растения на-
блюдается образование некрозов по типу реакции СВЧ.
Бактериальные Avr-белки не обнаруживаются ни в культураль-
ной среде, в которой рос патоген, ни в межклеточном пространст-
ве растительных тканей. Они также не являются токсинами в пря-
мом смысле этого слова. Искусственная инфильтрация бактери-
альных AVR-белков в межклеточное пространство растительных
тканей не запускает реакцию СВЧ. Для активации реакции СВЧ
Avr-белки должны появиться в цитоплазме растительных клеток.
Это было показано с помощью следующего эксперимента.
Растения арабидопсиса (Arabidopsis thaliana) поражаются раз-
личными микробами, в том числе бактерией Р. syringae pv. maculico-
1а. Расы бактериального патогена, несущие ген avrRPMl или avrB,
вызывают реакцию СВЧ на растениях с генотипом RPM1RPM1 или
RPMlrpml. Растения с генотипом rpmlrpml восприимчивы к па-
тогену. На основе растений rpmlrpml были получены трансген-
ные растения арабидопсиса [rpmlrpml+avrB], которых затем
скрестили с нетрансформированными растениями RPM1RPM1-
Полученные гибриды F, [RPMlrpml+avrB], оказались нежизне-
способными, так как проростки погибали на 10-й день в результа-
те обширного некроза семядолей. Это означает, что белок AvrB
вызывает некротическую реакцию только при прямом попадании в
цитоплазму растительной клетки.
Перенос бактериальных Avr-белков или образующихся с их
помощью специфических элиситоров осуществляется посредст-
вом Hrp-системы секреции (от hypersensitive response and patho-
genecity), нарушения в работе которой приводят к потере бакте-
риями патогенности (рис. VI. 15). Контролируется работа системы
многочисленными hrp-генами, объединенными в большие клас-
теры, часто длиной в 20—40 т. п. н. Интактный кластер Нгр-генов
является обязательным условием патогенности бактерии. Экс-
прессия hrp-генов обнаружена в клетках бактерий только на ми-
нимальных средах; она не зависит от каких-либо растительных
метаболитов. Нгр-белки не секретируются в культуральную среДУ-
Многие hrp-гены клонированы и сиквенированы, их продукты
обладают разной функциональной активностью. Помимо струк-
турных Hrp-белков, обнаружены Нгр-белки, регулирующие экс-
прессию hrp- и avr-генов. Более того, экспериментально дока-
зано, что экспрессия avr-генов полностью контролируется интакт-
ным Нгр-кластером генов. Некоторые из Hrp-белков обладают
АТФазной активностью. Возможно, что некоторые Нгр-белки ло-
кализованы на внутренней и внешней мембранах бактериальной
клетки, формируя «ворота» или канал для. транспорта белков.
Неизвестно, какая аминокислотная последовательность является
сигнальной для белков, транспортирующихся по этому типу, но
474
Бактериальная клетка
Растительная клетка
Рис. VI. 15. Предполагаемая схема переноса факторов авирулентности
бактерий в растительную клетку.
предполагают, что она локализована в N-концевой части моле-
кулы.
Интересно, что выявлен высокий уровень гомологии нуклео-
тидных и аминокислотных последовательностей hrp-генов у раз-
ных штаммов и видов бактерий. Например, известно 9 hrp-генов
фитопатогенов, гомологичных inv-генам Salmonella, mxi-генам
Shigella, уор-генам Yersinia и генам других бактерий, вызывающим
различные болезни у животных. Кроме того, отмечают высокий
уровень гомологии некоторых hrp-генов генам, контролирующим
работу жгутикового аппарата бактерий. Недавно было показано,
что белок НгрА является структурным белком Нгр-пилей — тон-
ких выростов на поверхности бактериальных клеток Р. syringae
pv. tomato (штамм DC3000). В связи с этим было высказано пред-
положение, что подобные выросты являются своеобразным кана-
лом для передачи факторов авирулентности в растительную клет-
ку. Отмечается также гомология между Нгр-пилями патогенов и
специальными пилями A. tumefaciens, по которым, возможно, про-
исходит транспорт Т-ДНК в растительную клетку.
Неспецифические элиситоры. Существование неспецифичес-
ких элиситоров связано с тем, что они необходимы для нормаль-
ного функционирования патогена. Известные на сегодня неспеци-
фические элиситоры синтезируются грибами, а точнее, разными
видами фитофторы (Phytophthora megasperma, Р. infestans и др.).
Неспецифические элиситоры обладают разной химической приро-
дой. Например, давно известны олигосахарины — олигомеры N-аце-
тилглюкозамина или глюкозы, образующиеся при гидролизе высо-
475
p-1,6
a
I. Glc->6Glc-»6Glc-»6Glc-»6Glc
A - 3 3
Активный элиситор т T
Glc Glc
p-1,6
G-G-G......G-G-G
fG^.
G
rG
G
• -G-G-G
II.
G —> G —> G —> G —> G
T T
G G
0-1.3<
0-1,3<
G
9
I?
G-G-G-
~ 0-1.3 G
Р-ЭНДО-
глюканаза
III.
Неактивный элиситор
G —> G —> G —> G —> G
t t
G G
Клеточная стенка
грибного патогена
G-> G-> G-> G-> G
t t
G G
IV.
Г9 9
p-1,3 < Ф G
Ig
G -► G -> G -> G -> G
t t
G G
G
9
.9
Рис. VI. 16. Неспецифические элиситоры фитофторы Phytophthora me-
gasperma.
а — образование олигосахаринов под действием Р-эндоглюканазы; б — арахидоно-
вая и эйкозопентаеновая кислоты.
комолекулярных глюканов или хитина клеточных стенок гриба
(рис. VI.16). Далеко не каждый «обломок» глюканов или хитина
обладает элиситорной активностью. Активность молекулы зависит
от количества мономеров и их пространственного расположения.
Например, из пяти гептаглюканов, приведенных на рис. VI. 16,
только первый обладает активностью элиситора. Образуются оли-
госахарины под действием гидролитических ферментов (хитиназ и
глюканаз), выделяемых как растением, так и самим патогеном.
Элиситорной активностью обладают также полиненасыщенные
С20-жирные кислоты 5,8,11,14-эйкозатетраеновая (арахидоновая)
и 5,8,11,14,17-эйкозапентаеновая (эйкозапентаеновая) кислоты
(рис. VI. 16) — важные компоненты фосфолипидов плазмалеммы
грибных клеток. Будучи продуктами гидролиза клеточных стенок
или мембран, неспецифические элиситоры выделяются микроор-
ганизмом в окружающую среду постоянно как в зараженном рас-
тении, так и при сапрофитном росте. Секреция элиситоров типа
олигосахаринов и арахидоновой кислоты является нормальным
побочным следствием жизнедеятельности и роста микроорганиз-
ма, и гены, мутации по которым приводили бы к прекращению
476
секреции, неизвестны. Скорее всего, подобные мутации снижают
жизнеспособность патогена, поэтому соответствующие мутанты и
не обнаружены.
Не так давно у фитофторовых грибов были описаны белки,
обладающие элиситорной активностью, — элиситины. Характер-
ными особенностями этих белков являются:
низкая молекулярная масса — после процессинга масса белков
составляет всего 10 кДа, и состоят они из 98 аминокислот;
высокое содержание в клеточных стенках гриба и в культу-
ральной среде;
способность вызывать развитие некрозов и системной устой-
чивости растений табака к последующим заражениям (см.
гл. VI.6).
Элиситорная активность элиситинов выявляется по их способ-
ности вызывать развитие некрозов при нанесении на листовую
пластинку или при добавлении в раствор, в который помещены
растения или черешки изолированных листьев. Способ обработки
растения имеет значение в случае а-элиситинов — эта группа эли-
ситинов вызывает образование некрозов только при непосредст-
венной инокуляции листовых пластинок, так как а-элиситины не
транспортируются по сосудам растений. В отличие от а-элисити-
нов, Р-элиситины вызывают некротизацию как при нанесении на
листья, так и при добавлении в раствор. Кроме того, а- и Р-элиси-
тины характеризуются особенностями первичной структуры и раз-
ными изоэлектрическими точками — а-элиситины являются кис-
лыми белками (pH 4.5—5.0), а Р-элиситины — основными (pH
7.5—8.5). Элиситины также неспецифичны по своему действию и
синтезируются разными расами фитофторы.
В геноме различных фитофторовых грибов были обнаружены
тандемно расположенные последовательности, кодирующие эли-
ситины (например, PARA1 у Р. parasitica и др.). Функции элисити-
нов в организме гриба неизвестны, однако гомология с токсином
Ceratocystis ulmi и гидрофоринами других грибов позволяет пред-
полагать их участие в формировании репродуктивных органов
(воздушный мицелий, плодовые тела, конидии и др.). Показано,
что отсутствие элиситинов в культуральной среде замедляет ско-
рость роста мицелия и, в случае отдельных протестированных изо-
лятов, сопровождается неспособностью гриба к формированию
конидий и ооспор. Сравнение первичных аминокислотных после-
довательностей элиситинов различного происхождения показало
их высокую эволюционную консервативность. Анализ вторичной
структуры белков выявил структурную гомологию этих белков и
фосфолипазы А2. Неизвестно, обладают ли элиситины аналогич-
ной ферментативной активностью, ясно лишь, что их рецепция
растительными клетками приводит к защелачиванию экстрацел-
люлярного матрикса и последующей утечке электролитов.
Таким образом, фитофторовые грибы содержат целый ряд не-
специфических индукторов реакции СВЧ. Как сказывается неспе-
477
цифичность элиситора на конечном этапе взаимодействия патоге-
на с растением? Наличие любого R-гена придает растению устой-
чивость ко всем расам патогена, продуцирующим неспецифичес-
кий элиситор. Восприимчивым фенотипом обладают растения с
генотипом гг. Однако мы знаем, что явление расоспецифической
устойчивости растений к фитофторозу не только существует, но и
широко используется в селекции. В чем же заключается причина
специфичности?
Дело в том, что помимо элиситоров фитофтора продуцирует
супрессоры элиситоров — вещества, которые, по-видимому, спо-
собны блокировать рецепторы неспецифических элиситоров за
счет сходной химической структуры. Например, у фитофторовых
грибов описаны супрессоры — олигомеры глюкозы, напоминаю-
щие по строению олигосахариновые элиситоры. Конкуренция за
связывание рецепторов глюканов лишает растительную клетку
возможности узнавать патоген и реагировать на него. Это подтвер-
ждается экспериментально. Если обработать растения грибным эк-
страктом, содержащим супрессоры, то они приобретают воспри-
имчивость к патогенам, в норме невирулентным для него. Отличи-
тельная черта супрессоров — их специфичность для разных рас
патогена. Поэтому при взаимодействии комлементарных геноти-
пов (раса 1 — сорт R1) наблюдается не реакция СВЧ, а, наоборот,
заболевание (табл. VI.8). Поэтому гены, контролирующие синтез
супрессоров, правильнее было бы называть генами вирулентности.
Таким образом, элиситоры являются индукторами устойчивос-
ти у растений. Тем не менее способность к синтезу элиситоров не
была утрачена патогенами в ходе эволюции. Это означает, что
первоначально элиситоры не являлись индукторами реакции СВЧ,
а были необходимы для нормальной жизнедеятельности микроор-
ганизмов.
Например, неспецифические элиситоры типа олигосахаридов
или жирных кислот являются продуктами гидролиза клеточных
Таблица VI.8
Реакция растений при заражении патогенами, продуцирующими
специфические супрессоры элиситоров
"" —^^Растение Патоген ’ Сорт 1 (гг) Сорт 2 (R1) Сорт 3 (R2) Сорт 4 (R1/R2)
Раса 0 Болезнь СВЧ СВЧ СВЧ
Раса 1 (VIR1) » Болезнь » »
Раса 2 (VIR2) » СВЧ Болезнь »
Раса 1. 2 (VIR1/VIR2) » » СВЧ Болезнь
Примечание. Продукты R-генов обеспечивают узнавание неспецифических
элиситоров, характерных для всех рас патогена, VIR-гены патогена отвечают за
синтез супрессоров неспецифических элиситоров, блокирующих узнавание элиси-
тора и индукцию реакции СВЧ. Таким образом, способность к синтезу супрессоров
является признаком вирулентных рас патогена.
478
стенок патогена (высокомолекулярных глюканов, хитина) или
фосфолипидов клеточных мембран. Значительно сложнее опре-
делить роль элиситинов. Они могут быть необходимы патогену
при сапрофитном росте или во время инфекции. Так, изоляты
Р. parasitica, не синтезирующие элиситин паразитицеин, обладают
пониженной скоростью роста in vitro. Изоляты, не синтезирующие
элиситинов, не патогенны для растений табака и томатов и не об-
разуют спор как вегетативных, так и генеративных. Анализ струк-
туры капсицеина выявил некоторую гомологию элиситина фосфо-
липазе А2, более того, капсицеин обладает фосфолипазной актив-
ностью. Однако неизвестно, как соотносится фосфолипазная
активность с жизнедеятельностью гриба. О гомологии элиситинов
некоторым мембранным белкам других грибов уже упоминалось
выше. Судя по имеющимся данным, элиситины необходимы для
нормального роста и размножения грибов, тогда как их элиситор-
ная активность является побочной.
О позитивной (с точки зрения патогена) роли специфических
элиситоров пока лишь можно строить предположения. О возмож-
ной протеазной активности белка Avr2-YAMO уже говорилось
выше. Nip-белки R. secalis могут быть общими факторами пато-
генности не только благодаря своей токсичности. Так, мутанты, у
которых ген Nipl нарушен, обладают пониженной вирулент-
ностью на растениях с генотипом RRS1, что говорит о том, что
белок Nipl участвует в инфекционном процессе. И наконец, спе-
цифические элиситоры могут также участвовать в базовых метабо-
лических процессах грибной клетки. Например, распространен-
ность изолятов гриба С. fulvum, лишенных гена AVR9, ограничена
определенными географическими регионами в Европе, за пределы
которых они не выходят. Тогда как изоляты, выделенные из раз-
ных географических областей, содержат ген AVR9. Возможно, что
отсутствие этого гена снижает общую жизнеспособность гриба.
Экспрессия гена AyR9 наблюдается только в растительных тка-
нях (in planta) и в условиях голодания по азоту. Замена данного
гена на ген устойчивости к антибиотику гигромицину снижает па-
тогенность гриба. В промоторной части гена AyR9 были обнару-
жены GATA-боксы, идентичные сайтам узнавания транскрипци-
онных факторов, которые регулируют активность генов в условиях
азотного голодания. Все эти данные говорят о том, что продукт
гена AVR9, возможно, участвует в азотном метаболизме и оказы-
вает определенное влияние на патогенность гриба. Таким образом,
очевидно, изначально гены авирулентности кодировали различные
белки, участвующие в метаболизме клетки или необходимые для
нормального прохождения инфекционного процесса. В таком слу-
чае элиситорная активность кодируемых ими продуктов возникла
гораздо позднее, и связана она с эволюцией растительного генома.
Рецепция элиситоров и гены устойчивости растений. Каждо-
му гену авирулентности патогена соответствует определенный ген
устойчивости растения. Специфичность взаимодействия напрямую
479
связана с белковыми продуктами, кодируемыми данными генами.
В последнее время накопилось значительное количество экспери-
ментальных данных, позволяющих утверждать, что R-гены отвеча-
ют за рецепцию элиситоров или передачу сигнала от рецептора к
эффекторным системам растительных клеток.
Как происходит рецепция элиситоров? Ответить на этот во-
прос позволяют два экспериментальных подхода. Первый состоит
в том, чтобы локализовать на плазмалемме растительных клеток
белки-рецепторы элиситоров. Второй подход предусматривает де-
тальное изучение известных R-генов, включая их клонирование,
определение нуклеотидных последовательностей и изучение функ-
ций кодируемого продукта.
На поверхности растительных плазмалемм удалось локализо-
вать сайты, с высокой специфичностью связывающие меченые
элиситоры. Так, на плазмалемме клеток сои Glycine max был об-
наружен белок Р34 размером 34 кДа, связывающий сиринголиды,
причем эффективность связывания вещества строго коррелирует с
элиситорной активностью протестированных соединений. Этот
белок синтезируется в виде препротеина из 379 ак, который затем
подвергается протеолизу с образованием белка Р34. Р34 в свою
очередь может расщепляться до белка Р32 массой 32 кДа, оба
белка обладают способностью связывать сиринголид. Однако вряд
ли эти белки ответственны за специфичность взаимодействия. Во-
первых, белок Р34 синтезируется не только устойчивыми растени-
ями сои с генотипом RPG4, но и восприимчивыми. Во-вторых,
гомологи белка Р34 были обнаружены у неустойчивых растений
сои, томатов. Таким образом, белок Р34 является реальным канди-
датом на роль рецептора сиринголидов как у чувствительных, так
и у устойчивых растений сои, но специфичность реакции СВЧ,
вероятно, определяется взаимодействием продуктом RPG4 гена,
функция которого пока нам неизвестна.
При поиске специфических сайтов связывания элиситора Avr9
было показано, что белки-рецепторы элиситора также расположе-
ны на плазмалеммах как устойчивых (CF9), так и неустойчивых
(CF0) растений томатов. В эксперимент были вовлечены также
мутантные варианты пептида Avr9, синтезированные на основе
мутагенеза in vitro. Варианты белка Avr9, характеризующиеся по-
ниженной элиситорной активностью, в одинаковой степени хуже
связывались с рецепторами как из устойчивых, так и из восприим-
чивых клеток. Таким образом, одинаковая эффективность связы-
вания элиситора Avr9 не может объяснить разную реакцию расте-
ний CF9- и CFO-генотипов на элиситор. Очевидно, и в случае с
комбинацией генотипов AVR9-Cf9 устойчивость обеспечивается
не рецепцией элиситора, а различиями в механизмах передачи
полученного сигнала.
Клонирование и секвенирование ряда R-генов растений (табл. VI.9),
активно проводимое последние годы, не отрицает возможности
участия на ранних этапах рецепции элиситоров продуктов R-генов.
480
Таблица VI.9
Перечень клонированных генов устойчивости растений
Вид рас- тения R-ген Патоген AVR-ген Структура R-белка Локализация R-белка
Томат CF2 Cladosporium AVR2 LRR TM Мембрана
CF4 fulvum Тот же AVR4 LRR TM »
CF5 » » AVR5 LRR TM »
CF9 » » AVR9 LRR TM »
РТО Pseudomonas avrPTO PK »
FEN syringae Тот же ? PK Цитоплазма
PRF » » ? LZ NBS LRR »
I2C Fusarium ? NBS LRR »
Рис ХА21 oxysporum Xanthomonas avrXa21 LRR TM PK Мембрана
Лен L6 oryzae Melamspora lini AL6 TIR NBS Цитоплазма
Араби- RPP5 Peronospora ? LRR TIR NBS »
допсис RPM1 parasitica Psedomonas avrRPM 1 LRR LZ NBS LRR »
RPS2 syringae avrRPT2 LZ NBS LRR »
Примечание. Сокращения LZ, РК, ТМ, LRR, TIR, NBS обозначают различные
функциональные домены R-белков. Подробная характеристика доменов дана в тек-
сте. ? означает, что комплементарный ген авирулентности не идентифицирован.
Растительные R-белки обладают рядом сходных свойств. В част-
ности, они представляют собой комбинации из нескольких функ-
циональных доменов.
Домен NBS (от nucleotide binding domen) представляет собой
аминокислотную последовательность, обладающую высоким срод-
ством к трифосфатнуклеотидам. Этот домен присутствует во всех
белках, связывающих гуанидил- и аденозилтрифосфаты (ГТФ,
АТФ).
Домен LRR (от leucine rich repeats) является многократным
(20—25 раз) повторением лейцинбогатого мотива из 24 аминокис-
лот. Регулярное расположение остатков лейцина, а также пролина
и аспарагина способствует возникновению контактов между раз-
ными LRR-доменами и обеспечивает белок-белковые взаимодейст-
вия, характерные для множества регуляторных процессов. Именно
этот домен является наиболее подходящим кандитатом на роль ре-
цепторного домена для R-белков. Кроме того, способность к
белок-белковым взаимодействиям важна и при передаче сигнала
от рецептора к ядру. И наконец, некоторые из LRR-повторов
могут быть необходимы для поддержания правильной конформа-
ции R-белка.
17 Генетика 481
Домен LZ (от leucine zip), или домен типа «лейциновой мол-
нии», обнаружен у двух продуктов R-генов (RPS2, RPM1) и белка
Prf. Для этого домена характерны повторы типа XXXYXXL, где
L — остаток лейцина, Y — любая гидрофобная аминокислота,
X — любая аминокислота. За счет подобных повторов на поверх-
ности белковой молекулы формируется ряд из остатков лейцина,
обеспечивающих контакт с аналогичным доменом другой белко-
вой молекулы. Таким образом, оба лейцинбогатых домена (LRR и
LZ) участвуют в образовании белковых гомо- и гетеродимеров, об-
ладающих, в частности, различными регуляторными функциями.
Трансмембранный домен ТМ (от transmembrane domain) обес-
печивает мембранную локализацию белка. В его отсутствие
белок расположен в цитоплазме. Трансмембранный домен (один
или несколько) присутствует у всех белков, локализованных на
мембране, в частности, у рецепторов различных химических сиг-
налов.
Домен РК (от protein kinase) характерен для всех серин-трео-
нин протеинкиназ, регулирующих с помощью фосфорилирования
уровень активности цитоплазматических белков.
И наконец, TIR (Toll — Interleukin-1 Ресер1ог)-подобный домен
обладает гомологией белку Toll дрозофилы и рецептору интер-
лейкина-1 (IL-1R) млекопитающих, участвующих в регуляции кле-
точных процессов. Оба белка, Toll и IL-1R обеспечивают рецеп-
цию сигналов и активацию белков Rel-семейства транскрипцион-
ных факторов.
Рассмотрим некоторые наиболее изученные примеры R-белков
растений.
Белок Ха21, обеспечивающий расоспецифическую устойчи-
вость риса к патогену Xanthomonas oryzae pv. oryzae, принадлежит
к классу рецепторных протеинкиназ, так как содержит три основ-
ных домена — рецепторный (LRR), трансмембранный (ТМ) и
протеинкиназный (РК). У риса идентифицировано семь гомологов
гена ХА21, составляющих мультигенное семейство ХА21 генов.
Было предположено, что мультикопийность гена может обеспечи-
вать расоспецифичность узнавания патогена. Для анализа этого
предположения были получены трансгенные растения риса, несу-
щие отдельные гены семейства ХА21, и проанализирована их ус-
тойчивость к 8 различным расам патогена. Пять из семи гомологов
ХА21 не изменяли уровень восприимчивости трансгенных расте-
ний по сравнению с ^трансформированным восприимчивым кон-
тролем, и только два гена группы XA21D (XA21D и XA21F) при-
давали растениям такой же спектр устойчивости, как и у сортов
риса с генотипом ХА21, причем уровень устойчивости у трансген-
ных растений был промежуточным между восприимчивым и ус-
тойчивым (ХА21) сортами. По данным сиквенса генов, расхожде-
ние между генами обоих групп произошло примерно 50 млн лет
назад и, вполне возможно, что выше упомянутые 5 генов уже не
участвуют в контроле защитных реакций растения. Таким обра-
482
зом, локус ХА21 риса содержит лишь два функционально актив-
ных гена устойчивости ХА21 и XA21D.
Предполагаемая открытая рамка считывания гена XA21D коди-
рует рецептор-подобную молекулу, лишенную трансмембранного
и киназного доменов, которые характерны для изученного ранее
гена ХА21. Укорочение продукта происходит из-за наличия в гене
ретротранспозона Retrofit, отделяющего LRR-домен от трансмем-
бранного и киназного доменов. При этом оба фрагмента гена, рас-
положенные по обе стороны ретротранспозона, в высокой степени
(более 99 %) гомологичны гену ХА21.
Белок Xa21D состоит из 612 ак и по своей структуре гомоло-
гичен белку SLG, который участвует в контроле самонесовмести-
мости растений, и ингибитору полигалактуроназ, секретируемым
растением во внеклеточное пространство. Таким образом, продукт
гена XA21D может также секретироваться во внеклеточное прост-
ранство и связывать белки, синтезируемые патогеном, что и обес-
печивает частичную устойчивость трансгенных растений; т.е.
LRR-домен отвечает за распознавание патогена. Это предположе-
ние подтверждается также и другими фактами. Сравнение нуклео-
тидных последовательностей LRR-доменов генов ХА21 и XA21D
при 99.1 % идентичности показало высокую долю несинонимич-
ных замен аминокислот в домене по сравнению с синонимичными.
В обычных белках несинонимичная замена аминокислоты приво-
дит к потере активности белка, поэтому у гомологичных белков
доля синонимичных замен гораздо выше, чем несинонимичных.
Высокий процент несинонимичных замен (более 50 %) характе-
рен и для других систем распознавания патогена. Очевидно, что
мутации в LRR-доменах могут быть основой для эволюции систем
распознавания патогена.
Белок Xa21D интересен также и тем, что для индукции реакции
СВЧ достаточно только LRR-домена. В связи с этим возможны две
гипотезы, объясняющие различия между генами-гомологами ХА21.
Если ген XA21D является результатом дупликации полноразмер-
ного гена ХА21 с последующей инсерцией ретротранспозона, то из-
начально белок Ха21 состоял из трех доменов и функционировал
одновременно как рецептор и как киназа. Если же объединение
трансмембранного и киназного доменов с лейцинбогатым доменом
произошло в результате эксцизии ретротранспозона, то гены ХА21
и XA21D являются прекрасным примером эволюции R-генов по-
средством комбинаторики различных функциональных доменов.
Каким образом лейцинбогатый домен обеспечивает рецепцию
лиганда? Показано, что белки, несущие сходные области лейцин-
богатых повторов, способны к димеризации друг с другом. Более
того, специфика лейциновых повторов обеспечивает высокую сте-
пень рецепции определенных лигандов. Остается лишь один во-
прос — как белок Xa21D, не обладающий протеинкиназной
активностью, передает сигнал о рецепции другим белкам. У мле-
копитающих известно большое количество подобных систем ре-
483
цепции. В отсутствии лиганда рецептор в свободной форме нахо-
дится вне клетки. В мембране расположены белки, обладающие
ферментативной активностью, но не способные связывать лиганд.
Рецепторы связывают лиганд благодаря одним лейцинбогатым рай-
онам и мембранные белки — благодаря другим. Образование оли-
гомера лиганд—рецептор—мембранный белок активирует фер-
ментативный домен мембранных белков, передающий сигнал ци-
топлазматическим белкам. Таким же образом могут обеспечивать
рецепцию сигнала и его передачу полноразмерный и усеченный
варианты белка Ха21 (рис. VI. 17). Но в таком случае следует при-
знать, что бактериальный патоген Xanthomonas oryzae pv. oryzae
секретирует элиситоры не посредством системы Нгр-транспорта, а
во внеклеточное пространство, как грибы.
Аналогичный белку Xa21D тип белков представляют собой
белки Cf2 и Cf9. Они оба состоят из лейцинбогатых повторов и
трансмембранного домена. Причем в белке выявляется высококон-
сервативная область LRR-повторов, которая, скорее всего, отвеча-
ет за димеризацию Cf-белков друг с другом или дополнительными
компонентами системы, и вариабельная область повторов, кото-
рая, вероятно, осуществляет рецепцию лиганда.
Совершенно иной тип R-белка и по строению, и по выполняе-
мым функциям характерен для пары комплементарных генов
Рис. VI. 17. Гипотетическая схема взаимодействия белков Ха21 и
Xa21D при рецепции патогена.
Укороченный белок Xa21D лишен трансмембранного и киназного доменов, однако
способен связывать лиганд (элиситор патогена). Рецепция лиганда стимулирует обра-
зование комплекса с полноразмерным белком Ха21, активацию его протеинкиназного
домена и передачу сигнала. В результате активации реакции СВЧ растение обладает
частичной устойчивостью к патогену Xanthomonas oryzae pv. oryzae.
484
PTO/AvrPTO. Ген РТО обеспечивает устойчивость томатов к бак-
териальному патогену Pseudomonas syringae pv. tomato, несущему
ген авирулентности AvrPTO. Кодирует ген РТО серин/треонин ки-
назу, на 80 % идентичную киназе, кодируемой геном FEN, прида-
ющим томатам устойчивость к инсектициду фентиону (чувстви-
тельность к фентиону приводит к образованию некрозов). Оба
гена принадлежат к одному семейству генов, тесно сцеплены и
локализованы в хромосоме 5. Оба гена были привнесены в сорта
культурных томатов из дикорастущего вида Lycopersicon pimpinel-
lifolium, устойчивого ко всем штаммам патогена, несущим соот-
ветствующий ген авирулентности. Мутагенез, проведенный на ос-
нове устойчивого сорта томатов, показал, что для проявления ус-
тойчивости к патогену и инсектициду необходим дополнительный
белок, кодируемый геном PRF (от Pseudomonas resistance and fen-
thion sensitivity). Этот белок содержит лейцинбогатые повторы
(LRR-домен), лейциновую молнию (домен LZ) и нуклеотид-связы-
вающий NBS-домен. Ген PRF присутствует в геноме как устойчи-
вых, так и неустойчивых растений томатов, но сам по себе устой-
чивости не придает.
С помощью двугибридной системы в PTO/avrPTO-зависимой
системе передачи сигнала удалось идентифицировать еще несколь-
ко компонентов. Это белки Pti (Pto-interacting proteins), также обла-
дающие серин/треонин киназной активностью. В частности, белок
Pti 1 является специфическим субстратом для фосфорилирования
белком Pto, но не Fen, очевидно, именно на этой стадии происходит
разделение путей передачи сигналов, индуцированных патогеном и
инсектицидом. В настоящее время предполагается следующая схема
активации PTO/avrPTO-зависимой системы индукции реакции СВЧ
(рис. VI. 18). Согласно ей, комплекс белков Pto/Prf осуществляет ре-
цепцию сигнала AvrPto, в результате чего происходит активация ки-
назы Pto. Дальнейшее фосфорилирование киназ Pti 1 и Pti5 запуска-
ет в клетках растения реакцию СВЧ.
Как следует из приведенной схемы, в формировании реакции
СВЧ участвуют не только продукты R-генов, но и множество дру-
гих белков, каждый из которых кодируется своим геном. Поэтому
неудивительно, что помимо R-генов было обнаружено много
генов (табл. VI.10), мутации в которых блокируют развитие реак-
ции СВЧ, как например мутации в гене PRF ведут к блоку устой-
чивости на основе avrPTO-PTO-системы. Эти локусы получили
название RDR (от required for disease resistance). Изучение rdr-му-
тантов открывает новые перспективы для изучения различных эта-
пов трансдукции сигнала.
Другим методом идентификации белков-компонентов пути пе-
редачи сигнала является поиск генов, экспрессия которых наблю-
дается только при несовместимых взаимодействиях растения и па-
тогена. Например, для модельного объекта генетики растений ара-
бидопсиса также было показано существование реакции СВЧ.
Растения экотипа Columbia (Col-О) устойчивы к бактерии Pseudo-
485
Элиситор AvrPto
Формирование
некрозов
Рис. VI. 18. Предполагаемая схема рецепции и передачи сигнала с учас-
тием PTO/AvrPTO-зависимой системы.
Согласно гипотезе, комплекс белков Pto/Prf расположен на внутренней стороне плаз-
малеммы и связывает белок AvrPto. Связывание лиганда сопровождается автофосфо-
рилированием Pto и фосфорилированием киназ Ptil и Pti5. Активированные киназы
индуцируют образование вторичных сигналов, запускающих реакцию СВЧ и образо-
вание некрозов. Аналогичный результат — образование некрозов вызывает обработ-
ка растений инсектицидом фентионом, чувствительность к которому связана с бел-
ком Fen, однако экспрессии СВЧ-специфичных генов в данном случае не наблюдается.
monas syringae pv. maculicola, несущей ген авирулентности avrRPT2
или avrRPMl (AvrB), за счет работы генов RPS2 и RPM1 соответ-
ственно. У растений генотипа RPS2 были выделены гены AIG1 и
AIG2 (avrRPT2-induced genes), экспрессия которых наблюдалась
только при заражении растений штаммом с соответствующим
геном авирулентности в первые 24 ч после заражения. Заражение
растений штаммами, несущими некомплементарный ген авирулен-
тности (avrRPMl), не индуцировало транскрипции этих генов,
что, возможно, говорит о различиях в путях передачи сигнала от
соответствующих рецепторов. Ген AIG1 представлен в геноме ара-
бидопсиса единственной копией, ген AIG2, наоборот, небольшим
семейством гомологичных генов. Функциональной гомологии
предполагаемых продуктов генов AIG1 и AIG2 известным белкам
установить не удалось. Гены AIG1 и AIG2 локализованы в 1-й и
3-й хромосомах арабидопсиса соответственно.
486
Таблица VI. 10
Примеры RDR-локусов, участвующих в развитии реакции СВЧ
Растение RDR-локус R-ген Патоген Локализация гена
Томаты RCR-1, RCR-2, RCR-3, RCR-5 CF-9/CF-2 Cladopsorium fulvum Неизвестна
» PRF PTO/FEN Pseudomonas sy- ringae pv. tomato Тесно сцеплен с PTO/FEN
Ячмень RAR1, RAR2 MLA-12 Erisypse graminis f. sp. hordei RAR1 не сцеп- лен, RAR2 сцеп- лен с MLA-12
» ROR1, ROR2 mlo Тот же Не сцеплены с mlo
Арабидоп- NDR1 RPM1 P. syringae (avrB) Не сцеплен
сис » RPS2 P. syringae (avrRPT2) » »
» RPP Peronospora para- sitica » »
То же NIM1 RPP P. parasitica » »
» EDS1 RPP Тот же Неизвестно
Однако совместное заражение растений арабидопсиса штамма-
ми, несущими ген avrRPT2, avrRPMl или оба гена одновременно,
показало, что две системы распознавания, возможно, взаимодейст-
вуют между собой (табл. VI. 11). Так, мутация в гене RPS2 блоки-
ровала распознавание штаммов, экспрессирующих одновременно
оба гена авирулентности, несмотря на наличие в геноме растения
функционально активного гена RPM1. Инактивация гена avrRPT2
путем инсерции в ген транспозона Tn5Q восстанавливала спо-
собность растений генотипа RPMl/rps2 распознавать патоген
[avrRPMl +avrRPT2::Q]. И наоборот, инактивация гена RPM1 при
наличии активной аллели гена RPS2 не сказывалась на способно-
сти растений распознавать штамм [avrRPMl +avrRPT2], зато зависе-
Таблица VI. 11
Реакция растений арабидопсиса на заражение штаммами Р. syringae
в зависимости от генотипа патогена
Генотип растения Генотип штамма Р. syringae
avr avrRpml avrRPT2 avrRPMl+ avrRPT2 AvrRPMl+ AvrRPT2::Q
RPM1/RPS2 — + 5 ч + 21 ч + 21 ч + 5 ч
RPMl/rps2 — + 5 ч — — + 5 ч
rpmlnull/RPS2 — — + 6 ч + 6 ч —
Примечание. Генотип растений и штаммов подробно описан в тексте. — отсут-
ствие реакции СВЧ, что приводит к поражению растений. + 5 ч — время, необхо-
димое для появления некрозов, формирующихся в результате реакции СВЧ.
487
ла напрямую от активности гена avrRPT2. Эта серия эксперимен-
тов демонстрирует, что ЯР82-АугЕРТ2-зависимая система переда-
чи сигнала, очевидно, доминирует над RPMl-AvrRPMl-зависи-
мой, что, возможно, связано со способностью белка Rpml связы-
вать АугРРТ2-зависимый сигнал, что препятствует связыванию
сигнала, зависящего от гена AvrRPMl. Или же перекрестное взаи-
модействие двух систем распознавания происходит на уровне сиг-
налов, наличие которых определяется генами авирулентности.
Пока неизвестно, какой из гипотез следует отдать предпочтение,
следует лишь добавить, что любое взаимодействие должно проис-
ходить вне патогена.
Эволюция системы ген—на—ген представляет отдельный инте-
рес в практическом и теоретическом плане. Специальные исследо-
вания, проведенные на разных растениях, показали, что R-гены,
во-первых, представлены сериями аллелей, во-вторых, расположе-
ны в геноме в виде крупных кластеров генов и, в-третьих, разные
виды растений содержат гомологичные последовательности. На-
пример, при гибридизации фрагмента ДНК, соответствующего ло-
кусу РТО томатов, с геномной ДНК 6 видов двудольных и 5 видов
однодольных растений было выявлено наличие гомологичных по-
следовательностей во всех исследуемых видах. Отдельный кластер
R-генов может определять устойчивость растения к одному пато-
гену (локусы L льна, MLA ячменя, RP1 кукурузы и др.) или к
разным — например, у картофеля гены, определяющие устойчи-
вость к вирусу X (RX) и расе 1 фитофторы (R1), судя по резуль-
татам генетического картирования, расположены в одном локусе.
Более того, в этот же локус попадает один из генов, отвечающий
за неспецифическую устойчивость картофеля к фитофторозу. Учи-
тывая эти факты, а также высокую консервативность R-генов, наи-
более приемлемой гипотезой эволюции R-генов считается эволю-
ция на основе дупликации предкового гена и специализация до-
черних копий по отношению к отдельным патогенам за счет
точечных мутаций и внутригенных перестроек и рекомбинаций.
Некоторые варианты возникновения новых R-генов показаны на
рис. VI. 19.
Специальные молекулярно-генетические исследования показа-
ли, что в преобладающем большинстве случаев гены устойчивости
представлены сериями аллелей и присутствуют в геноме как ус-
тойчивых, так и восприимчивых сортов культурных растений. Ус-
тойчивость растения к заболеванию определяется доминантными
аллелями R-генов, а восприимчивость — рецессивными. Транс-
формация восприимчивых растений доминантными аллелями R-re-
нов приводит к формированию у трансгенных растений устойчи-
вости к соответствующим возбудителям заболеваний. Возникновение
серии рецессивных аллелей, вероятнее всего, связано с мутациями
или перестройками в R-гене. Так, с помощью химического мутаге-
неза для гена RPS2 получено три мутантные аллели с точечными
миссенс- и нонсенс-мутациями, для гена RPM1 — четыре. Выяв-
488
Рекомбинанты
R3
Родитель А
Родитель Б
R1 R2
R1 R5 R6
ИЛЛИ । 1.ч 1'1
R4 R2 R3
ms_____vzzz___еея
Родитель А
Родитель А
Родитель Б
R1 R2 R3
ВНЯ [ZZZ4
R1 R2 R3
б Рекомбинанты
ЯЯДЯ ЕйГТ) СЯЯ
R4 RY R3
R1
R2 R3
W/A ...
Рекомбинанты
МЕЗ____EZ3____
RZ R3
в
Рис. VI. 19. Варианты возникновения новых R-генов в результате пере-
строек в R-локусе.
а — пересортировка генов; б — образование нового гена у гетерозигот; в — образо-
вание нового гена у гомозигот в результате неравного кроссинговера.
ленная в природных популяциях рецессивная аллель rpsl01N несет
инсерцию в 10 нуклеотидах, что приводит к сдвигу рамки считы-
вания и образованию неполного и неактивного белка. Рецессивные
аллели pto и fen были обнаружены и у культурного томата Lyco-
persicon esculentum. Кодируемые ими белки высоко идентичны
продуктам доминантных аллелей и отличаются всего тремя амино-
кислотными заменами в консервативных положениях Vai22, Pro73 и
Ala157 (Pto) или Ala159 (Fen). Более того, киназы pto и fen обладают
способностью к автофосфорилированию in vitro. Очевидно, при-
чина восприимчивости растений, обладающих рецессивными алле-
лями, в данном случае связана с изменениями во взаимодействии
мутантных киназ pto и fen с другими белками, участвующими в
передаче сигнала.
Наличие серии гомологов в локусе, ответственном за устойчи-
вость растения к заболеванию, характерно для большинства иссле-
дованных растений. Например, одно из экономически значимых
заболеваний томатов — увядание — вызывается заражением рас-
тений грибным патогеном Fusarium oxysporum f. sp. lycopersici.
489
90 т. п. н.
12С
Рис. VI.20. Структура локуса I2C томатов.
Локус I2C, ответственный за устойчивость томатов к патогену Fusarium oxysporum
f. sp. lycopersici (paca 2), состоит из 7 гомологичных генов, только один из которых
(гомолог Е) является функционально активным R-геном.
Описано три расы возбудителя: раса 1, 2 и 3. Доминантный локус
I2C придает томатам устойчивость к расе 2 патогена, он располо-
жен в 11-й хромосоме и состоит из 7 гомологов, образующих
фрагмент ДНК длиной 90 т. п. н. (рис. VI.20). Гомологи располо-
жены на расстоянии 8—10 т. п. н. друг от друга и обозначены бук-
вами А—G. Функциональным геном I2C является гомолог Е, про-
дукт его представляет собой полипептид из 1266 аминокислот и
принадлежит к классу NBS-LRR-LZ-содержащих R-белков. Кроме
того, гомологичные последовательности были обнаружены у тома-
та и в других хромосомах. Сравнение гена I2C и его гомологов из
других хромосом по участку, кодирующему LRR-домен, показало,
что функционально активные и неактивные гомологи различаются
количеством лейцинбогатых повторов, что, возможно, сказывается
на конфигурации белка и его способности осуществлять необхо-
димые взаимодействия. Этот факт подтверждается тем, что извес-
тно несколько мутантных аллелей некоторых R-генов с увеличен-
ным или уменьшенным количеством лейцинбогатых повторов.
Кстати, высокая консервативность R-генов позволяет выявлять
их гомологи с помощью молекулярно-генетических методов. На-
пример, амплификация ДНК с праймерами на консервативные до-
мены R-генов типа кодирующих лейцинбогатые повторы или дру-
гие домены позволила выявить последовательности ДНК сои, го-
мологичные генам N (устойчивость табака к вирусу табачной
мозаики), L6 (устойчивость льна к ржавчине), RPM1 и RPS2 (ус-
тойчивость арабидопсиса к Pseudomonas spp.). Эти последователь-
ности, названные RGA (от resistance gene analogs), локализуются в
разных группах сцепления,“в том числе и в локусах, где уже лока-
лизованы гены устойчивости сои RMD, RPS2 и RJ2 и представле-
ны кластерами (рис. VI.21). Последовательности RGA могут быть
как уже известными или новыми функциональными R-генами, так
и неактивными гомологами, на основе которых и происходит быс-
трая эволюция защитных систем высших растений.
490
Таким образом, белки-продукты R-генов обладают рядом фун-
кциональных доменов, способных участвовать в белок-белковых
взаимодействиях, в частности в узнавании белковых сигналов и
передаче сигнала. R-белки могут находиться в цитоплазме, мемб-
ране или занимать трансмембранное положение. Предполагается,
что R-белки, локализованные в мембране, могут участвовать в уз-
навании элиситоров грибных патогенов, поскольку последние не
проникают в клетку; цитоплазматические R-белки — узнавать
элиситоры патогенных бактерий, которые обладают способностью
проникать в растительную клетку благодаря Нгр-системе секре-
ции. Кроме того, цитоплазматические R-белки, вероятно, прини-
мают участие в процессе передачи сигнала от рецептора к ядру.
а
С2 DI Н J L М Nl Р
RGA4
RGA9
RGA1
RGA6
..RGA3
/RGA2
\RGA5
'RGAl
"1821
--RGA1
RGAr‘RGA6--RGAl
A450J
RGA6
50.5
RGA3
RGA2
RGA5
RGA1
К375
Рис. VI.21. Локализация локусов RGA на хро-
мосомах сои.
а — распределение локусов по разным хромосомам; б —
тесное сцепление некоторых локусов RGA с ранее иден-
тифицированными генами устойчивости сои RPS2, RMD
и RJ2.
RGA1
491
Развитие реакции СВЧ. Итак, растительная клетка обладает
способностью распознавать патоген по специфическим веществам,
выделяемым им во внеклеточное пространство. Передача этого
сигнала от молекулы-рецептора до клеточного ядра, где индуциру-
ется активность многих генов, носит название сигнальной транс-
дукции. В ходе многочисленных исследований сформировалось
два методических подхода для изучения этапов сигнальной транс-
дукции. Первый подход генетический, так как заключается в изу-
чении мутантов растений, у которых передача сигнала нарушена.
Такие мутанты при наличии активной аллели R-гена восприимчи-
вы к заболеванию, вызываемому патогеном с комплементарным
геном авирулентности. Примеры подобного рода генов уже были
описаны в разделе, посвященном генам устойчивости (например,
RDR-гены), а также будут рассмотрены в других разделах.
Второй подход заключается в идентификации веществ, синтез
или метаболизм которых изменяется при заражении растений не-
совместимыми патогенами. К настоящему времени описано боль-
шое количество подобных соединений. Мы рассмотрим лишь не-
которые, самые общие изменения, происходящие в растении при
заражении: начальные этапы передачи сигнала, окислительный
взрыв, синтез антимикробных соединений, усиление клеточных
стенок и гибель клеток.
Для биохимического исследования начальных этапов передачи
сигнала от рецептора к первичным молекулам-посредникам чаще
всего используют клеточные культуры растений, позволяющие ис-
следовать такие параметры как изменение мембранного потенциа-
ла клеток или работу ионных каналов в клетках растений при
рецепции патогена. Имеющиеся к настоящему времени сведения
позволяют описывать события в следующей последовательности.
Очевидно, наиболее ранним событием после рецепции элиси-
тора является обратимое фосфорилирование белков. Так, грибные
элиситоры вызывают быстрое и временное фосфорилирование
белков в суспензионных культурах петрушки и сои. Ингибиторы
протеинкиназ блокируют это фосфорилирование, а заодно и ин-
дукцию защитных реакций. О центральной роли фосфорилирова-
ния свидетельствует также и тот факт, что продукты некоторых
клонированных R-генов (РТО, ХА21 и др.) обладают киназной ак-
тивностью и активируют работу других белков, запуская тем
самым реакцию СВЧ. R-белки, лишенные киназного домена, оче-
видно, взаимодействуют с клеточными киназами аналогично тому,
как киназа Pto воспринимает сигнал от LRR-содержащего белка
Prf. Фосфорилирование вовлечено не только в ранние этапы пере-
дачи сигнала, но и в более поздние. В растительной клетке сущес-
твуют целые цепочки реакций, где фосфорилирование одних про-
теинкиназ активирует работу других протеинкиназ и т. д.
Помимо фосфорилирования в работу вовлечены и другие сис-
темы. Прежде всего обработка элиситорами стимулирует ион-
траспортные процессы на мембранах. В частности, клетки начина-
492
ют накапливать в цитоплазме ионы Са2+ и Н+ и терять К+ и СГ.
В результате внутриклеточное содержимое закисляется, а pH
среды, окружающей клетку, наоборот, возрастает. Эти изменения
происходят очень быстро и занимают от 2 до 5 мин после добав-
ления элиситора. Результаты обработки клеток ингибиторами ион-
ных каналов или искусственного повышения концентрации соот-
ветствующих ионов свидетельствуют о том, что ионные потоки не-
обходимы для нормальной реализации реакции СВЧ. Изменения
во внутриклеточном содержании ионов связаны с активацией ра-
боты разнообразных ион-транспортных каналов с помощью фос-
форилирования, так как ингибиторы протеинкиназ предотвраща-
ют возникновение ионных потоков. Это фосфорилирование обра-
тимо, а конститутивная работа, например, мембранной Н-АТФазы
в трансгенных растениях табака приводит к спонтанному возник-
новению некрозов. Более того, некоторые метаболиты патогенов
(фузикокцин, Nipl) токсичны именно благодаря тому, что активи-
руют растительные Н-АТФазы.
Особое значение в индукции и поддержании реакции СВЧ от-
водится ионам Са2+. В норме основная масса кальция хранится в
клетках в связанной форме в специальных кальциевых депо. Од-
нако уже в первые минуты после заражения уровень свободного
Са2+ в клетках резко возрастает. Ионы Са2+ являются вторичным
мессенжером эукариотической клетки и регулируют активность
многих ферментов, например протеинкиназ, и экспрессию генов.
В частности, обработка клеток сои грибным элиситором или зара-
жение патогеном индуцирует экспрессию генов SCAM-4 и SCAM-5,
кодирующих специфические изоформы кальмодулина — белка,
специфически связывающего Са2+, в течение первых 30 мин. Ин-
дукция генов зависит от высокого уровня внутриклеточного каль-
ция. Предотвращение накопления свободного Са2+ с помощью ин-
гибиторов Са-каналов или сверхсинтеза кальмодулина приводит к
торможению СВЧ-ответа.
Следующее по времени изменение в клетке — образование
большого количества форм активного кислорода. Это явление
получило название «окислительного взрыва». В окислительном
взрыве выделяют две фазы. Первая происходит у всех растений,
независимо от наличия активных аллелей R-генов, т. е. и у устой-
чивых, и у восприимчивых уже в первые минуты после заражения.
Вторая фаза наблюдается только у устойчивых растений при несов-
местимых комбинациях, и именно она является СВЧ-специфичной.
Реализуется вторая фаза окислительного взрыва только через не-
сколько часов после рецепции. На модельной системе с участием
генов РТО и avrPto было показано, что оба этих компонента необхо-
димы для индукции второй стадии окислительного взрыва, характер-
ной для несовместимых комбинаций растения и патогена. Так только
у трансгенных растений томатов, несущих доминантную аллель гена
РТО под конститутивным промотором гена 35S вируса табачной мо-
заики, под действием патогена с avrPTO-генотипом наблюдалось об-
493
Г идропероксидный
радикал
но;
О2
О1
2Н
Молекулярный Супероксид-
кислород анион
Супероксид
дисмутаза
е-* Н2О2
Перекись
водорода
Fe3+
Пероксидаза
Каталаза
е~
ОН’
► Н2О
Н+ Н+
Гидроксильный Вода
радикал
Реакция
Фентиона
Fe2+
Рис. VI.22. Схема возникновения высокореакционных форм кислорода
в растительных клетках при реакции СВЧ.
разование активных форм кислорода, характерных для реакции
СВЧ. Таким же действием обладает и ген FEN в присутствии фен-
тиона.
У растений были описаны следующие активные формы кисло-
рода (рис. VI.22). Первым было показано появление супероксидно-
го аниона О’, в образовании которого принимает участие НАДФН-
оксидаза, мультимерный комплекс, гомологичный НАДФН-оксидазе
нейтрофилов животных. Активация этого комплекса происходит
за счет Са-зависимого фосфорилирования цитоплазматических
компонентов и их перемещения в плазмалемму. О’ быстро разла-
гается до HjOj, что может происходить произвольно или с участи-
ем фермента супероксиддисмутазы. Перекись водорода может
также синтезироваться с помощью оксалатоксидаз на более позд-
них стадиях реакции СВЧ. В отличие от О; перекись водорода
способна проникать через мембраны, так как не несет заряда. Оба
соединения являются среднереакционными и приводят к клеточ-
ным повреждениям за счет преобразования в более активные
формы кислорода. Так, при низком pH О’ протонируется и пре-
вращается в гидропероксид-радикал НО*, он менее полярен и
также может проходить через мембраны и взаимодействовать с
жирными кислотами, вызывая образование липидных пероксидов.
Таким образом, НО2 может разрушать мембраны и активизировать
ряд реакций, связанных с липидными пероксидами. В свою оче-
редь Н2О2 в присутствии ионов Fe (II) образует гидроксильный
радикал НО’ с высокими разрушающими способностями. НО* спо-
собен вызывать перекисное окисление липидов, которое единож-
ды начавшись, становится автономным. Если Н2О2 проникает в
высоких концентрациях в ядро, то, взаимодействуя с ионами ме-
таллов, может вызвать фрагментацию ДНК. Кроме того, Н2О2 уси-
494
ливает механическую прочность растительных клеточных стенок,
предупреждая дальнейшее проникновение патогена, за счет окис-
ления фенолов, в том числе лигнина, и образования межмолеку-
лярных связей у белков-экстенсинов, содержащихся в стенках.
Н2О2 активирует синтез салициловой кислоты, необходимой для
формирования приобретенного иммунитета (см. гл. VI.6). Участие
Н2О2 в СВЧ-ответе подтверждается экспериментами на трансген-
ных растениях. Сверхэкспрессия гена, кодирующего фермент глю-
козоксидазу, генерирующую перекись водорода, значительно по-
вышает устойчивость трансгенного картофеля к бактериальному
(Erwinia carotovora) и грибному (Phytophthora infestans) патогенам.
В норме инактивация Н2О2 до воды осуществляется фермен-
том каталазой. Инактивация гена каталазы (CAT1AS), участвую-
щей в разложении перекиси до воды и молекулярного кислорода,
приводит к резкому повышению уровня перекиси водорода в
клетках табака при интенсивном освещении. Это в свою очередь
стимулирует синтез салициловой кислоты и этилена — вторич-
ных сигналов, необходимых для развития реакции СВЧ и имму-
низации растений. Показано также, что развитие реакции СВЧ
сопровождается в клетках ингибированием каталазной активнос-
ти, так как салициловая кислота способна связываться с катала-
зой и инактивировать фермент, что позволяет поддерживать ис-
ходный высокий уровень перекиси водорода в клетках. Таким
образом, возникает замкнутый цикл «перекись водорода—сали-
циловая кислота—перекись водорода», необходимый для поддер-
жания реакции СВЧ.
Разложение перекиси водорода осуществляется также много-
численными пероксидазами и аскорбатпероксидазами. Эти фер-
менты считаются неспецифическими защитными соединениями и
участвуют в ответе растения на многие стрессовые факторы, вклю-
чая заражение патогеном. У Stilosanthes humilis идентифицирова-
но 4 гена, кодирующих пероксидазы: SHPX2, 5, 6 и 12. Для всех
генов характерна тканеспецифичная экспрессия, однако для двух
из них — SHPX2 и 6 — отмечено значительное повышение уров-
ня транскрипции при заражении растений патогеном Collelotric-
hum gloesporioides и при механическом поранении.
Сродство аскорбатпероксидазы к перекиси водорода намного
выше, чем у каталазы. Этот фермент локализован в цитоплазме,
хлоропластах и митохондриях. Причем при заражении растений
патогеном уровень мРНК цитоплазматической формы фермента
возрастает, а подавление активности наблюдается через 12 ч после
появления первых некрозов. Подавление активности фермента
связано с супрессией трансляции мРНК, механизм которой пока
неизвестен. Возможно, что подавление аскорбатпероксидазной ак-
тивности обеспечивает накопление перекиси водорода, необходи-
мой для роста некротических пятен.
В конечном итоге заражение растения несовместимым патоге-
ном запускает синтез в растительной клетке большого количества
495
разнообразных веществ (белков и вторичных метаболитов) с анти-
микробной активностью.
Классическим примером СВЧ-специфичных белков являются
PR-белки (от pathogenesis related proteins). Очень часто о наступ-
лении реакций” СВЧ в экспериментах судят по появлению именно
этой группы белков.
PR-белки были впервые описаны в 1970 г. двумя независимыми
группами исследователей как белки, специфически синтезируемые
растениями табака при заражении вирусом табачной мозаики
(ВТМ). При дальнейших исследованиях было показано, что анало-
гичные белки синтезируются также и при заражении растений
микробными патогенами. Первоначально было описано три фун-
даментальных свойства PR-белков: устойчивость к действию про-
теаз, растворимость при низких значениях pH и внеклеточная ло-
кализация. Благодаря этим особенностям PR-белки удалось вычле-
нить из широкого круга белков, синтез которых индуцируется
заражением. Белки были охарактеризованы и были клонированы
гены, их кодирующие. Наряду с кислыми формами PR-белков
(растворяющимися при низких значениях pH) были обнаружены
их гомологи с изоэлектрической точкой 7.0 и выше, которые ло-
кализуются внутри клетки в вакуолях.
Современные группы PR-белков включают в себя по нескольку
изоформ, обладающих одинаковыми функциональными особен-
ностями (табл. VI. 12). Соответственно гены, кодирующие PR-бел-
ки, собраны в мультигенные семейства. Для части PR-белков
удалось установить функции. Так, для белков группы PR-1 харак-
терна антигрибная активность по отношению к некоторым гри-
бам-оомицетам — помимо антигрибной активности белка PR-1 in
vitro, трансформация растений табака соответствующим геном по-
высила устойчивость к некоторым патогенам. Причина токсично-
Таблица VI. 12
Некоторые PR-белки растений
Группа Белок Биологическая активность Изоэлектри- ческая точка Молекулярная масса, кДа
PR-1 1а — 15.5
1b Фунгицидная 4.5 15.5
1с 4.5 15.0
PR-2 2а (2) Эндо-0-1,3-глюканаза 4.4 35
2b (N) 4.7 36
2с (О) 4.8 37
PR-3 За (Р) Эндо-0-1,3-хитиназа 5.3 28
3b (Q) 5.8 29
PR-5 R Фунгицидная 6.9 24
S 7.5 24
496
сти PR-1 белков пока неизвестна. Белки, принадлежащие к группе
PR-3, являются Р-1,3-хитиназами и разрушают хитин грибных па-
тогенов в экспериментах in vitro. Трансгенные растения, конститу-
тивно экспрессирующие хитиназу, также обладают повышенной
устойчивостью к отдельным патогенам. Тоже можно сказать и о
белках PR-2. Белки PR-2 обладают |3- 1,3-глюканазной актив-
ностью и расщепляют глюкановые полимеры клеточных стенок
растений и некоторых грибов-оомицетов. Таким образом, часть
PR-белков участвует в защитном ответе растения, лизируя клеточ-
ные стенки патогенов, что повышает чувствительность последних
к растительным токсинам. При этом первыми в дело вступают кис-
лые изоформы, синтез которых запускается заражением. Эти белки
локализованы в межклеточном пространстве. Гибель раститель-
ных клеток приводит к усилению литических процессов, так как
из вакуолей высвобождаются основные изоформы, которые обла-
дают более высокой литической активностью по сравнению с кис-
лыми формами. Довольно интересным является то, что защитный
эффект PR-белков возрастает при одновременной работе разных
семейств белков. Так, совместное действие глюканаз и хитиназ не-
измеримо эффективнее, чем действие этих ферментов по отдель-
ности. Семейство генов, кодирующих белки PR-4, на основе нук-
леотидных последовательностей родственно генам WIN1, WIN2 и
гену прогевеина, экспрессия которых запускается механическим
поранением растения. Для части белков PR-4 характерно наличие
хитин-связывающего домена, подобного доменам белков СВР-N и
СВР-20. Эти белки способны in vitro ингибировать рост мицелия
Trichoderma harzianum, Т. viride и Fusarium solani, причем эффек-
тивность белков резко возрастает в комплексе с хитиназами или
глюканазами. Как и в случае с белками PR-1, причины фунгицид-
ной активности белков PR-4 неизвестны. Семейство белков PR-5
также обладает фунгицидной активностью, природа которой неиз-
вестна. Показано, что белки PR-5 гомологичны томатину, осмоти-
нам и перматинам — белкам, участвующим в защите растения от
засыхания и грибных патогенов. Два гомологичных ему белка
АР24 и NP24 табака и томатов соответственно лизируют кончики
гиф гриба Phytophthora infestans. Показано, что конститутивная
экспрессия табачного гена осмотина в картофеле повысила устой-
чивость трансгенных растений к Р. infestans.
Таким образом, очевидно, что PR-белки являются важным ком-
понентом защитных систем растения, так как обладают рядом ан-
тимикробных свойств. Более того, возможно, что отдельные
формы PR-белков участвуют и в процессах морфогенеза растений.
Например, активность некоторых PR-генов регулируется этиле-
ном. Однако максимально эффективное использование «мощнос-
ти» системы PR-белков по крайнем мере при заражении растений
возможно только при активной работе всех семейств этих белков.
Второй обязательный критерий реакции СВЧ — синтез разно-
образных фитоалексинов — вторичных метаболитов растений,
497
токсичных для микроорганизмов. В отличие от токсинов, которые
синтезируются и присутствуют в растениях постоянно (фитоани-
тисипины), фитоалексины появляются в них только при зараже-
нии. По своей химической структуре фитоалексины чрезвычайно
разнородны, и в одном растении может одновременно синтезиро-
ваться несколько видов фитоалексинов. Однако в определенной
степени можно проследить зависимость химической структуры со-
единения от таксономической принадлежности растения. Напри-
мер, для картофеля характерны фитоалексины сесквитерпеноид-
ной природы, для бобовых — изофлавоноиды, фитоалексины ин-
дольной природы встречаются у крестоцветных и т. д. С учетом
химической структуры фитоалексинов выделяют несколько клю-
чевых ферментов фенилпропаноидного пути биосинтеза, общего
для всех фитоалексинов, таких как фенилаланиламмонийлиаза
(ФАЛ), 4-кумаратсинтаза (4-КС) и специфические ферменты, от-
ветственные за конечную структуру продукта у конкретного вида
растения, например хальконсинтаза и изофлавонредуктаза бобо-
вых, пиносилвинсинтаза хвойных и др. Синтез фитоалексинов за-
пускается рецепцией патогена или его элиситорами и протекает в
живых клетках растений, окружающих зону проникновения. Фи-
тоалексины диффундируют по ткани на небольшие расстояния и
накапливаются в зоне мертвых клеток в очень высоких концентра-
циях. Таким образом, образование некрозов приводит к тому, что
вокруг патогена формируется пространство, не только лишенное
каких-либо питательных веществ, но и заполненное токсичными
метаболитами. Кроме того, накопление фитоалексинов наблюда-
ется также при поранении растений или обработке их УФ-лучами.
Активация ферментов синтеза фитоалексинов происходит за
счет активации экспрессии генов, кодирующих эти ферменты. На-
пример, при заражении корней сои зооспорами Phytophthora me-
gasperma f. sp. glycinea при несовместимых комбинациях мРНК,
соответствующие генам фенилаланиламмонийлиазы (ФАЛ) и халь-
консинтазы (ХС), появляются в цитоплазме клеток уже через 1—
2 ч, а фитоалексины — через 7 ч. В совместимых комбинациях
уровень транскрипции этих генов на первых этапах заражения из-
меняется крайне незначительно и повышается не ранее, чем через
9 ч после заражения. Такая же динамика индукции генов наблюда-
ется и в других системах «хозяин—патоген». Более того, наиболее
раннее по времени появление транскриптов генов наблюдается в
тканях, прилегающих к зоне поражения. Так, при инфекции рас-
тений мРНК генов, кодирующих КС и ФАЛ, появляется во всех
клетках, окружающих сайт проникновения. Таким образом, эф-
фективность синтеза фитоалексинов напрямую связана со способ-
ностью элиситоров индуцировать активность определенных генов.
При клонировании генов синтеза фитоалексинов было обнару-
жено существование мультигенных семейств. Например, у сосны
было выявлено 5 генов пиносилвинсинтазы, участвующей в синте-
зе стилбенового фитоалексина пиносилвина: PST-1, -2, -3, -4 и -5.
498
По аминокислотным последовательностям среди PST-генов на-
блюдается высокая степень гомологии — более 95 %, основные
же различия касаются промоторных областей гомологов. Так, на-
ивысший уровень индуцибельности под действием УФ или элиси-
тора Botrytis cinerea характерен для промотора гена PST-1, кото-
рый, очевидно, и отвечает за синтез фитоалексина при заражении
или УФ-стрессе. Этот же промотор отвечает и за тканеспецифич-
ный синтез пиносилвина в проводящих тканях растения. Мульти-
генное семейство генов CHS, кодирующих фермент хальконсинта-
зу, было выявлено у бобовых (Phaseolus vulgaris), где на гаплоид-
ный геном приходится от 6 до 8 генов CHS. Обработка клеток
элиситором активирует транскрипцию лишь некоторых из них и
приводит к накоплению 5—9 различных транскриптов, кодирую-
щих набор изоферментов молекулярной массой 42—43 кДа и изо-
электрической точкой 6—7. Тогда как механическое поранение
индуцирует появление в клетках совершенно иного набора белков
CHS. У арабидопсиса обнаружено семейство генов, кодирующих
ФАЛ. Гены PALI и PAL2 одинаково экспрессируются в разных
тканях растения и при различных внешних воздействиях, экспрес-
сия же гена PAL3 совершенно иная. В частности, она очень низка
при всех опробованных условиях. Кроме того, у гена PAL3 при
низкой степени гомологии известным PAL-генам имеется допол-
нительный интрон и отсутствует ряд мотивов в промоторной об-
ласти, характерный для всех ферментов фенилпропаноидного
пути биосинтеза.
Важно отметить тот факт, что синтез фитоалексинов, также
как и других защитных соединений, происходит и при совмести-
мых комбинациях у восприимчивых растений. Основной биологи-
ческий смысл реакции СВЧ — локализация патогена и прекраще-
ние его распространения, и эти задачи намного эффективнее ре-
шать на ранних этапах взаимодействия. У устойчивых растений
некрозы представляют собой зоны мертвой ткани растения, в ко-
торой надежно заключен патоген. В совместимых комбинациях
скорость индукции реакции СВЧ намного отстает от скорости
распространения патогена, и поэтому некрозы, наблюдаемые на
восприимчивых растениях, являются лишь запоздалым ответом на
патоген, который уже инфицировал расположенные соседние с не-
кротическими пятнами живые клетки растения.
Несмотря на то что фитоалексины были обнаружены более
полувека назад, причины их токсичности до сих пор неизвестны.
Долгое время считалось, что именно с появлением фитоалексинов
связана гибель растительных клеток, и фитоалексины рассматри-
вались как один из факторов, ответственных за образование не-
крозов. Однако более поздние исследования показали, что синтез
фитоалексинов и гибель клеток являются независимыми события-
ми. Интересно также и то, что у арабидопсиса были обнаружены
мутанты, не синтезирующие основной фитоалексин камалексин
(pad-мутанты), но не все из них при этом теряли устойчивость.
499
Вероятно, фитоалексины, так же как и PR-белки, являются лишь
частью общего защитного ответа растения.
Наряду с индукцией синтеза PR-белков и фитоалексинов, зара-
жение растений патогенами вызывает синтез токсичных пепти-
дов — тионинов и дефензинов.
Тионины — низкомолекулярные цистеинбогатые белки, облада-
ющие высоким сродством к фосфолипидам мембран. К настоящему
времени описано довольно значительное число тионинов: THI2.1
арабидопсиса, DM-AMP1 георгина, висконсины омелы, а-гордоти-
онин ячменя и др. Различные представители этого типа раститель-
ных белков обладают значительной аминокислотной и структурной
гомологией. Остатки цистеина в консервативных положениях под-
держивают определенную конформацию молекулы за счет дисуль-
фидных связей, способствуя ее контакту с мембранами клеток, и,
возможно, с другими цистеинбогатыми белками. Аналогичные кон-
формационные центры характерны и для других белков, взаимодей-
ствующих с мембранами.
Синтез тионинов в растении регулируется рядом факторов.
В интактных растениях тионины обнаруживаются в различных ор-
ганах (семенах, листьях, стеблях и т.д.). Экспрессия генов, коди-
рующих тионины, находится под контролем растительного гормо-
на жасмоновой кислоты, его аналога коронатина, а также нитрата
серебра и сорбитола. Кроме того, активный синтез тионинов про-
текает в темноте, в этиолированных растениях. Облучение види-
мым светом ингибирует темновой синтез тионинов, но одновре-
менное заражение растений патогеном способно предотвратить
ингибирование. Анализ регуляторных областей генов показал на-
личие ряда позитивно и негативно регулируемых элементов.
Синтезируются тионины в виде белков-предшественников с N-тер-
минальным сигнальным пептидом и С-терминальным доменом, со-
держащим большое количество кислых аминокислот. Предшест-
венники подвергаются протеолизу со стороны специфического
фермента, оба концевых домена удаляются и зрелые белки накап-
ливаются в вакуолях. Некоторые исследователи считают, что
С-концевой домен предшественников тионинов предохраняет рас-
тительные клетки от токсичного действия тионинов, так как отри-
цательный заряд этого домена препятствует взаимодействию с
фосфолипидами мембраны.
Взаимодействие происходит за счет полярности зарядов моле-
кул — позитивно заряженной молекулы тионина и отрицательно
заряженных фосфолипидов мембраны. Обработка клеток тиони-
нами ведет к структурным изменениям липидного бислоя (форми-
рованию пор или агрегации фосфолипидов) и утечке электроли-
тов. Неспецифичность связывания мембран тионинами ведет к
тому, что тионины токсичны in vitro не только для бактерий и
грибов, но и для любой клетки, в том числе для клеток млекопи-
тающих. Токсичность тионинов in vitro позволяет рассматривать
их как очередной фактор защиты растений от патогенов. Однако
500
для окончательного вывода требуется анализ активности этих со-
единений in vivo. Именно с этой целью рядом исследователей
были получены трансгенные растения, сверхсинтезирующие бел-
ки-тионины. Как правило, устойчивость трансгенных растений к
тестируемым патогенам была выше, чем у контрольных, нетранс-
формированных растений. Так, сверхсинтез тионина арабидопси-
са THI2.1 повысил устойчивость восприимчивого экотипа Colum-
bia (Col-2) к Fusarium oxysporum f. sp. matthiolae. Трансгенные
растения подавляли рост грибных гиф, более того, доля гиф с ано-
малиями на таких растениях была гораздо выше. При этом в рас-
тениях не был обнаружен синтез PR-белков и других антимикроб-
ных метаболитов. Конститутивная экспрессия в растениях табака
гена, кодирующего а-тионин эндосперма ячменя, повысила их ус-
тойчивость к Pseudomonas syringae pv. tabaci 153 и P. syringae pv.
syringae
Растительные дефензины (старое название у-тионины) являются
растительными аналогами дефензинов насекомых, сарафотоксина
змей, токсина скорпиона, эндотелинов человека и многих других
белков. Перечисленные белки являются короткими полипептида-
ми различной длины и характеризуются отсутствием гомологии.
Но, несмотря на значительные структурные различия между ними,
сравнительный анализ выявил три уровня сходства дефензинов:
1) способность к изменению мембранного потенциала;
2) наличие общего мотива, образующего а-спираль, поддержи-
ваемую дисульфидными связями;
3) наличие сходной организации генов.
Токсичность дефензинов связывают со способностью изменять
мембранный потенциал клеток. Известно, что дефензины не вызы-
вают структурных изменений мембран. Высказываются предпо-
ложения о том, что их токсичное действие опосредовано рецепто-
рами. В частности, показано, что у-1- и у-2-зеатионины кукурузы
способны быстро и обратимо ингибировать работу натриевых ка-
налов.
Дефензины синтезируются растением в отчет на бактериальную
или грибную инфекцию. Так, у шпината (Spinacia oleracea cv. Ma-
tador) было выделено семь белков (So-Dl—7), которые в концен-
трациях менее 20 тМ подавляли рост грамположительных (Clavi-
bacter michiganensis) и грамотрицательных (Ralstonia solanacea-
rum) бактерий и таких грибов, как Fusarium culmorum, F. solani,
Bipolaris maydis и Colletotrichum lagenarium. Эти белки преиму-
щественно локализованы в эпидермальных клетках и субэпидер-
мальной области побегов. В листьях редиса идентифицировано 2
гомологичных белка массой 5 kDa, которые накапливаются в рас-
тении при грибном заражении Alternaria brassicicola. Кодирующие
их кДНК-последовательности были клонированы. Специальные
исследования показали, что эти дефензины накапливаются не
только в зоне заражения и вокруг нее, но и в здоровых тканях
далеко от сайта инфекции. Активация этих генов происходит
501
также как и в случае с тионинами, под действием жасмонатов, а
также этилена.
У арабидопсиса было обнаружено два подсемейства генов, ко-
дирующих дефензины. Ген PDF2.3, относящийся к первому подсе-
мейству, конститутивно экспрессируется в проростках, розетке
листьев, цветках и стручках, его активность не регулируется жас-
монатами, салициловой кислотой или фитопатогенными грибами.
Экспрессия гена второго подсемейства, PDF1.2, наоборот, зависит
от гормонов и патогенов и по спектру регуляторных факторов на-
поминает ген THI2.1, кодирующий тионин.
Помимо накопления в клетках разнообразных соединений с ан-
тимикробными свойствами при реакции СВЧ происходит укрепле-
ние формирования дополнительных механических барьеров, пре-
пятствующих распространению патогена по тканям. Во-первых,
некротические зоны окружаются слоем перидермы, а в самой зоне
происходит интенсивное накопление токсичных для патогена ве-
ществ. В результате этого патоген не только лишается источника
питательных веществ, но и испытывает давление со стороны рас-
тения. Во-вторых, живые клетки усиливают механическую проч-
ность своих клеточных стенок. Так, при реакции СВЧ наблюдает-
ся лигнификация клеточных стенок. Усиление синтеза лигнина,
суберина, каллозы, входящих в состав клеточных стенок растения,
также является следствием повышения активности ферментов фе-
нилпропаноидного пути, в частности фермента ФАЛ. Активность
специфических ферментов синтеза лигнина, например циннамил-
алкогольдегидрогеназы и других фенолов, сопряжена с актив-
ностью других ферментов фенилпропаноидного пути и регулиру-
ется на уровне транскрипции генов. Лигнификация клеточных сте-
нок не только повышает механическую прочность, но и затрудняет
лизис клеточных стенок гидролитическими ферментами патогена.
Дополнительную прочность и эластичность клеточным стенкам
придают также специфические гидроксипролинбогатые белки эк-
стенсины. Они составляют основную часть гидроксипролинбога-
тых белков, имеющихся в растительной клетке, и обладают рядом
уникальных черт.
В состав экстенсинов входит большое количество основных
аминокислот серина, тирозина, лизина, валина и особенно гидрок-
сипролина (Нур). Для экстенсинов характерна регулярно повторя-
ющаяся структура из остатка серина и четырех остатков гидрок-
сипролина — Ser-(Hyp)“. Благодаря этим повторам, белки облада-
ют определенной пространственной конформацией типа стержня.
Отдельные молекулы экстенсинов способны образовывать связи
между собой, за счет которых формируется прочная трехмерная
сеть. Образованию связей способствуют остатки тирозина, участ-
вующие в формировании изодитирозиновых сшивок (Туг-Туг) под
действием перекиси водорода.
Синтезируются экстенсины в виде мономерных пролинбогатых
белков в ответ на механическое поранение или заражение патоге-
502
Рис. VI.23. Формирование экстенсивной сети при реакции СВЧ.
В норме синтез экстенсинов в клетке протекает на базовом уровне. При заражении
патогеном или поранении происходят быстрая полимеризация экстенсинов клеточ-
ной стенки с образованием трехмерной сети и индукция дополнительного синтеза эк-
стенсинов. Превращение пролина в гидроксипролин и гликозилирование белка про-
исходит в мембранах ЭПР.
ном. По ходу синтеза молекула экстенсина в цистернах аппарата
Гольджи претерпевает гидроксилирование остатков пролина и два
типа гликозилирования — присоединение к остатку серина от од-
ного до трех молекул галактозы (Ser-O-Gal^) и трех-четырех ос-
татков арабинозы к гидроксипролину (Нур-О-Ага^). Образова-
ние изодитирозиновых сшивок происходит лишь при заражении
растения патогенов, так как именно в этом случае в растении по-
вышается уровень перекиси водорода (рис. VI.23).
Клонирована серия генов, кодирующих экстенсины. Было по-
казано, что индукция отдельных генов этого семейства осуществ-
ляется механическим поранением и/или рецепцией элиситора па-
тогена.
Вторичные эндогенные индукторы реакции СВЧ. По ходу
развертывания в клетке реакции СВЧ происходит усиление силы
503
сигнала и увеличение длительности его действия за счет синтеза
дополнительных индукторов экспрессии СВЧ-зависимых генов.
К числу таких индукторов относятся салициловая (СК) и жасмо-
новая кислоты (ЖК) и ее метиловый эфир метилжасмонат (МЖ),
которые уже упоминались в разделах выше.
Синтез СК в растении начинается с превращения фенилалани-
на в trans-коричную кислоту, которое осуществляется ферментом
фенилаланиламмонийлиаза (ФАЛ) (рис. VI.24). Дальнейшее пре-
вращение коричной кислоты происходит через образование бен-
зойной кислоты и ее гидроксилирования в положении С-2, послед-
няя реакция катализируется ЦитР450-зависимой гидроксилазой.
Ключевое значение СК в развитии реакции СВЧ подтверждает-
ся многочисленными экспериментальными данными. Прежде всего
уровень кислоты и ее конъюгатов в растении резко возрастает при
заражении растений различными несовместимыми патогенами. Э?го
увеличение по времени опережает такие процессы, как синтез
PR-белков и системная иммунизация. Кроме того, экзогенная об-
работка растений СК приводит к синтезу белков, специфичных
для реакции СВЧ, в частности различных семейств г ._____?в.
В результате обработки растений СК или ее аналогами 4 п-я-хпо.
роизоникотиновой кислотой (ИНК) или бензотиадиазолк/м (БТ)
возрастает устойчивость растений к патогенам. Среди других про-
цессов, запускаемых СК, следует также упомянуть переключение
клеток на альтернативную систему дыхания, при которой энергия
lOO-Glu
Конъюгат
бензойной
кислоты
кислота
Рис. VI.24. Схема синтеза салициловой кислоты.
ФАЛ — фенилаланиламмонийлиаза, ВА2Н — гидроксилаза бензойной кислоты,
NahG — салицилатгидроксилаза, Glu — остаток глюкозы.
504
выделяется в виде тепла. Именно это свойство аспирина (произ-
водного СК) широко используется в медицине.
Выявлено несколько белков, взаимодействующих с СК. Боль-
шинство этих белков являются Fe-содержащими, к ним, в частнос-
ти, относится каталаза SABP (от salicylic acid binding protein). СК
при взаимодействии с каталазой инактивирует ее, в результате чего
в клетках возрастает содержание перекиси водорода. Она инактиви-
рует также и аскорбатпероксидазу. Кроме того, СК стимулирует об-
разование свободных радикалов, вызывающих окисление белков и
запускающих перекисное окисление липидов. Аналоги ИНК и БТ
также обладают антикаталазной и антипероксидазной активностью.
Таким образом, помимо функции позитивного регулятора активно-
сти СВЧ-специфичных генов, СК способствует накоплению в клет-
ках активных форм кислорода. Интересно, что накопление пере-
киси водорода в высоких концентрациях запускает ряд локальных
реакций, таких как гибель клеток, экспрессия защитных генов и
синтез СК. Тем самым создается замкнутый круг, в котором данная
кислота способствует окислительному взрыву, а окислительный
взрыв — ее накоплению. Возможно, что неоднократное повторение
этого цикла значительно увеличивает мощность сигнала, изначаль-
но принятого растительной клеткой, а значит, и эффективность от-
вета на него.
По мере затухания реакции СВЧ свободная СК переводится в
форму конъюгатов с глюкозой (P-O-D-глюкозилсалициловая кис-
лота). Обратный гидролиз конъюгатов приводит вновь к повыше-
нию уровня свободной кислоты, причем эта реакция протекает на-
много быстрее, чем синтез de novo.
Ряд экспериментов указывает на то, что неспособность расте-
ний к накоплению СК может вызывать потерю устойчивости. На
арабидопсисе было показано, что снижение в растении ее уровня
затрагивает расоспецифическую устойчивость. Так, при трансфор-
мации растений табака и арабидопсиса геном nahG, кодирующим
салицилатгидроксилазу Pseudomonas putida, у трансгенных расте-
ний СК переводится в форму биологически неактивных соеди-
нений. У этих растений не происходит накопления свободной СК,
практически не наблюдается экспрессия PR-генов, понижена ус-
тойчивость к заражению, и совсем не развивается иммунитет к
повторным заражениям. Растения арабидопсиса, трансформиро-
ванные геном nahG, при заражении несовместимыми расами Phy-
tophthora parasitica или штаммами Pseudomonas syringae активно
поражаются патогеном, в отличие от нетрансформированных изо-
генных растений. Этот эффект снимается экзогенно добавленной
СК и ее аналогами ИНК и БТ, которые имитируют действие СК,
но не являются субстратом для NahG-гидроксилазы. К потере ус-
тойчивости приводит также инактивация фермента ФАЛ, первого
фермента синтеза салициловой кислоты и других фенольных со-
единений. Так, предобработка растений арабидопсиса ингибито-
ром фермента ФАЛ также приводила к поражению растений в
505
норме несовместимыми патогенами. Тот факт, что синтез ФАЛ у
nahG-трансгенных растений восстанавливается под действием
ИНК и БТ, говорит о существовании позитивной регуляции актив-
ности фермента со стороны СК.
Жасмоновая кислота (ЖК) и ее метиловый эфир (МЖ) явля-
ются циклопропановыми производными линоленовой кислоты
(рис. VI.5) и широко распространены в растительном мире. Перво-
начально эти соединения были описаны как летучие компоненты
некоторых растений, масло которых используется в парфюмерной
промышленности. Позднее было показано участие жасмоновой
кислоты и ее эфира в регуляции процессов роста и старения рас-
тений. И наконец, имеются данные, свидетельствующие о участии
этих соединений в регуляции устойчивости растений к различным
стрессам, в частности при механическом повреждении растений и
поражении их фитофагом или патогеном.
Синтез ЖК начинается с гидролиза фосфолипидов мембран
под дейстием липаз и освобождением линоленовой кислоты
(рис. VI.25). Окисление линоленовой кислоты при участии липо-
оксигеназы приводит к формированию 13-гидропероксилинолено-
вой кислоты. Дальнейшие превращения гидропероксилиноленовой
кислоты включают в себя дегидратацию, циклизацию и три этапа
Р-окисления, в результате которых образуется 7-изожасмоновая
кислота. Многие производные ЖК, в том числе метиловый эфир,
являются биологически активными веществами. Например, анало-
ги жасмонатов животного происхождения — эйкозаноиды, лей-
котриены и простагландины участвуют в ответе клетки на различ-
ные стрессы, в частности при воспалительных процессах. Объеди-
нение жасмоновой кислоты и ее метилового эфира под общим
названием «жасмонаты» связано с одинаковым биологическим
действием этих соединений. Единственное отличие МЖ заключа-
ется в его летучести — МЖ способен распространяться по возду-
ху и оказывать влияние не только на соседние клетки, но и на
соседние растения.
Уровень ЖК в тканях растения зависит от возраста растения,
стадии развития и типа органов. Однако он резко возрастает в
ответ на механическое повреждение растения или на обработку
растений элиситорами. Одновременно с накоплением ЖК в клет-
ках снижается содержание линоленовой кислоты, а также наблю-
дается активация ферментов, участвующих в гидролизе фосфоли-
пидов. В свою очередь инактивация липооксигеназы способна не
только предотвращать накопление жасмонатов, но и блокировать
реакцию СВЧ. Так, трансформация растений табака геном липо-
оксигеназы в антисмысловой ориентации показала, что трансген-
ные растения утратили устойчивость к вирулентным изолятам Phy-
tophthora parasitica var. nicotianae. Эти данные свидетельствуют о
том, что при биотическом стрессе накопление жасмонатов проис-
ходит за счет синтеза de novo из фосфолипидов мембран, а не за
счет гидролиза многочисленных конъюгатов.
506
Элиситор
Ш1
Рецептор
Липаза
ФосфоЛИПИДЫ:
Линолевая кислота
Липоксигеназа
13-гидропероксилинолевая кислота
| Алленоксидсинтаза
12,13-эпоксиоктадекатриеновая
кислота
Алленоксидциклаза
12-оксифитодиеновая кислота
Редуктаза
I окисление (хЗ)
Жасмоновая кислота
Катаболиты
(метиловый эфир, конъюгаты)
Рис. VI.25. Схема синтеза жасмонатов при рецепции патогена.
Образование жасмоновой кислоты и ее производных из фосфолипидов плазмалем-
мы протекает под действием ряда ферментов, активируемых сигналом о заражении
растения.
Ключевая роль в стресс-индуцируемом синтезе жасмонатов
принадлежит нескольким ферментам и прежде всего лирооксиге-
назе, которая кодируется у растений семейством LOX (lipoxygena-
5е)-генов. Например, у арабидопсиса было идентифицировано два
гена ATLOX1 и ATLOX2. Ген ATLOX1 экспрессируется ткане-
специфично в разных органах (листьях, корнях, бутонах, молодых
проростках), причем в корнях и проростках уровень экспрессии
наиболее высокий. Продукт гена ATLOX1 локализован в цито-
плазме. Экспрессия гена ATLOX2, наоборот, наиболее высока в
листьях и бутонах и низка в семенах, корнях и стеблях, для фер-
507
мента показана хлоропластная локализация. Инактивация гена
ATLOX2 препятствует накоплению жасмонатов при поранении
растений, поэтому, вероятно, именно этот ген кодирует липоокси-
геназу, появляющуюся в клетках в ответ на повреждения.
Второй ключевой фермент синтеза жасмонатов — алленоксид-
синтаза, кодируемая у арабидопсиса уникальным геном AOS.
Сверхэкспрессия этого гена в растениях картофеля приводит к на-
коплению жасмонатов, и именно эта ферментативная активность
является скорость-лимитирующей в синтезе жасмонатов.
Жасмонаты играют важную роль в регуляции различных про-
цессов высших растений и регулируют экспрессию различных
генов. По характеру изменений, связанных с работой генов, все
жасмонат-регулируемые гены распадаются на две группы. При
кратковременном действии жасмонатов (менее 24 ч) одни гены
активируются жасмонатами, а другие — репрессируются. Функци-
ональное значение белков, кодирующихся жасмонат-регулируе-
мыми генами, позволяет определить закономерность подобного
контроля. Так, гены, находящиеся под негативным контролем жас-
монатов, как правило, кодируют белки, необходимые для фото-
синтеза и т.д., но не влияющие на жизнеспособность клеток. На-
пример, кратковременная обработка растений жасмонатами при-
водит к подавлению синтеза белков, участвующих в процессе
фотосинтеза, как ядерных, так и хлоропластных.
Под позитивным контролем жасмонатов находятся гены, про-
дукты которых появляются в ответ на различные стрессы (водный
дефицит, повреждения, заражение патогеном или вредителем).
Так, при обработке жасмонатами синтезируются запасные белки
семян (Vsp), белки позднего эмбрионального развития (Lea) и дру-
гие, связанные с дефицитом воды. Обработка жасмонатами стиму-
лирует также синтез белков, характерных для защитных реакций
растения: тионины, экстенсины, ферменты синтеза фенолов и фи-
тоалексинов. Интересно, что жасмонаты стимулируют активность
липоксигеназы, способствуя повышению своей концентрации в
клетках. Среди многочисленных ЛР (jasmonate-induced j>roteins)-
генов особо следует отметить белок Rip60 (Jip60). Этот белок от-
ветственен за общее подавление процессов трансляции в клетках,
подвергнутых длительной обработке жасмонатами (более 24 ч).
Белок Rip60 вызывает деградацию полисом. Обработка растений
жасмонатами свыше 48 ч приводит к их гибели.
Обнаружена также группа генов, активность которых не зави-
сит от жасмонатов. К ней принадлежат так называемые «house-ke-
eping genes», кодирующие белки, которые необходимы для под-
держания жизнеспособности клетки, например актин и тубулин.
Ярким доказательством участия жасмонатов в формировании
устойчивости растений являются такие факты, как повышение ус-
тойчивости картофеля к фитофторозу при обработке жасмоната-
ми, или повышенная восприимчивость мутанта томатов, неспособ-
ного к синтезу жасмонатов, к фитофагу Manduca sexta. Мутанты
508
арабидопсиса, дефектные по синтезу жасмонатов, не накапливают
этих соединений при повреждениях, что сопровождается отсутст-
вием экспрессии жасмонат-индуцируемых генов и высоким уров-
нем восприимчивости к грибным патогенам.
В ходе изложения этого параграфа неоднократно упоминалось,
что синтез жасмонатов запускается поранением растения, механи-
ческим или из-за действия фитофагов (животных и насекомых).
В то же время для остальных участников реакции СВЧ подобная
индукция не характерна. Связано это с тем, что жасмонат-зависи-
мые изменения в клетках при заражении патогеном представляет
собой отдельную ветвь метаболических реакций, больше связан-
ных с механическими повреждениями. Активация синтеза жасмо-
натов при заражении микробными патогенами связана, вероятно, с
активацией фосфолипаз и окислительным взрывом, в результате
которого происходит окисление жирных кислот. Жасмоновая кис-
лота является одним из факторов индукции иммунитета растений
к повторным заражениям, поэтому жасмонат-регулируемые изме-
нения должны в какой-то мере перекрываться с другими сигналь-
ными системами. Существует перекрывание салицилат- и жасмо-
нат-зависимых путей регуляции активности генов. Обе системы
регуляции могут действовать как синергично, так и антагонистич-
но. Например, обработка растений риса ИНК повышает уровень
жасмонатов и жасмонат-инуцибельных белков. А у растений тома-
тов накопление СК сопровождается репрессией жасмонат-зависи-
мой экспрессии генов ингибиторов протеиназ. Очевидно, у расте-
ний существует контроль за балансом СК и ЖК.
VI.53. ЗАПРОГРАММИРОВАННАЯ ГИБЕЛЬ КЛЕТОК
Существование и развитие целого растения непрерывно связа-
но с гибелью части составляющих его клеток. За счет отмирания
отдельных органов и клеток в растении формируются защитные
структуры типа корневого чехлика и коры, проводящие сосуды
флоэмы и ксилемы, отмирание клеток сопровождает прорастание
пыльцевых трубок в пестике и т.д. Гибель клеток индуцируется и
различными внешними воздействиями, в частности контактом с
патогеном. Из перечисленного следует, что гибель клеток занима-
ет важное место в морфогенезе высшего растения и в его реакции
на внешнюю среду и является запрограммированным, а не случай-
ным событием. Это явление получило название запрограммиро-
ванной гибели клеток (ЗГК, grogrammed cell death, PCD) и рас-
сматривается как отдельный процесс, контролирующийся геноти-
пом растения.
У животных уже давно активно изучается сходное явление ги-
бели клеток — апоптоз. Для клеток, претерпевающих апоптоз,
характерны фрагментация ДНК, конденсация и фрагментация
ядра, конденсация цитоплазмы, фрагментация мембран. У живот-
509
ных апоптоз рассматривается как средство избавления от лишних
клеток при нормальном морфогенезе и как реакция на отдельные
заболевания. Недавние исследования подтверждают морфологи-
ческое тождество изменений, происходящих в гибнущих клетках
животных и растений по крайней мере в отдельных случаях.
В предыдущих разделах уже немало говорилось о роли гибели
клеток при реакции СВЧ, которая сводится к локализации патогена
в зоне его проникновения. Исследования последних лет подтверж-
дают, что этот процесс не зависит от синтеза многочисленных ток-
сичных веществ типа фитоалексинов или PR-белков, а запускается
контактом с патогеном и является автономным. Удобную модель для
изучения генетического контроля ЗГК, связанного с реакцией СВЧ,
представляют мутанты растений, спонтанно образующие некрозы
в отсутствии патогена. Некоторые из этих мутантов перечислены
в табл. VI. 13 (раздел VI.6.3).
Некротические пятна, образующиеся при реакции СВЧ, фор-
мируются в сайте проникновения патогена и имеют четко очер-
ченные границы. В отличие от них, спонтанные некрозы, образуе-
мые мутантными растениями, имеют четко определенные размеры,
но возникают в произвольных местах (мутанты по инициации не-
крозов), либо вообще не имеют границ и, единожды возникнув,
медленно распространяются по растению (мутанты по развитию
некрозов). Соответственно у мутантов по инициации, вероятнее
всего, нарушены ранние этапы некрозообразования, возможно
этапы рецепции или передачи сигнала, а мутанты по развитию не-
крозов дефектны по способности останавливать некротизацию
тканей. В частности, предполагают, что инициация некрозооб-
разования связана с отсутствием в мутантных растениях факторов-
ингибиторов этого процесса, а вовлечение в процесс все новые
клетки, расположенные по соседству с некрозом, связано с нали-
чием дополнительного негативного пути регуляции на уровне
«гибнущая клетка — живая клетка».
Очень часто спонтанные некрозы формируются у мутантных
растений только на определенных стадиях развития, под действи-
ем гормонов, определенного светового режима или температуры.
Это говорит о существовании дополнительных факторов регуля-
ции некрозообразования, что открывает новые возможности для
изучения ЗГК, связанной с морфогенезом растений.
Мутанты растений со спонтанным образованием некрозов.
У кукурузы выявлено около 32 подобных мутантов, причем 23 му-
тации обладают доминантным проявлением, и у большей части му-
тантов нарушения затрагивают инициацию некрозообразования.
При картировании мутаций был показан интересный феномен —
часть мутаций по своему положению на генетических картах со-
впадает с локализацией R-генов, в частности с локусом RP1, от-
ветственным за устойчивость к ржавчинному грибу Puccinia sorghi.
При этом различные аллели rpl, помимо спонтанного некрозооб-
разования, обеспечивают разный уровень чувствительности к пато-
510
гену. Эти данные позволяют предположить, что одной из причин
появления некрозов являются нарушения функционирования R-
белков. Отмечено, что в локусе RP1 кукурузы с высокой частотой
наблюдается прохождение неравного кроссинговера.
Мутация llsl (lethal leaf spot) была получена у кукурузы в ре-
зультате транспозонного мутагенеза. На мутантных растениях по-
являются прогрессирующие некрозы, напоминающие реакцию рас-
тения на заражение Cochliobolus carbonum. Эта мутация относится
к классу мутаций по развитию некрозов и проявляется на опреде-
ленных стадиях развития растения, а также в результате некото-
рых внешних воздействий (укол иглой). Кроме того, для появле-
ния некрозов необходим красный свет, что подразумевает участие
фотодыхания и активных форм кислорода. Высокореакционные
формы кислорода уже давно рассматриваются как фактор индук-
ции гибели клеток. Предположительно, мутантные llsl растения
имеют пониженный уровень устойчивости к активным формам
кислорода, а белок Llsl в норме может либо ингибировать их дей-
ствие, либо участвовать в их нейтрализации. Клонирование фраг-
мента гена LLS1 показало, что белковый продукт является диок-
сигеназой и может участвовать в детоксикации продуктов гибели
клеток. Ген LLS1 является консервативным у одно- и двудольных
растений — сходная последовательность была обнаружена у ара-
бидопсиса.
Интересная группа некрозообразующих мутантов была обнару-
жена у арабидопсиса. Помимо образования СВЧ-подобных некро-
зов в отсутствие патогена у мутантов отмечалась одновременная
индукция локальной и системной устойчивости к изолятам патоге-
на, в норме вирулентных для растений дикого типа. Образование
некрозов в свою очередь стимулировало повышение общей устой-
чивости растения, за что этот класс мутаций получил название Isd
(lesions-stimulating disease resistance). Например, рецессивная му-
тация Isdl приводит к формированию на растениях постоянно
растущих некрозов в ответ на заражение различными патогенами,
обработку салициловой кислотой или ее аналогами, индуцирую-
щими системный иммунитет, но не реагирует на бактерии, убитых
нагреванием или механическое поранение. Продукт интактного
гена LSD1 является белком с характерным доменом «цинковые
пальцы» и участвует в контроле распространения некроза.
Сходным фенотипическим проявлением обладает мутация acdl
(accelerated cell death), но, в отличие от Isdl, мутантные растения
реагируют также на механическое поранение иглой и на инокуля-
цию раствором сульфата магния. Кроме того, мутация acdl на
провокационном фоне проявляется только на первичных листьях,
а мутация Isdl — на всех листьях розетки. Мутации не аллельны,
уровень ферментов, инактивирующих супероксидрадикал, у соот-
ветствующих мутантов не изменен, поэтому, вероятно, белок ACD1
в норме обеспечивает иной вариант негативного контроля разви-
тия некрозов.
511
Кроме того, некрозообразующие мутанты описаны у риса, яч-
меня и сои. У риса мутация si (Sekiguchi lesions) с рецессивным
проявлением приводит к образованию распространяющихся не-
крозов, напоминающим СВЧ-некрозы при заражении авирулент-
ным изолятом Bipolaris oryzae. Их образование индуцируется ави-
рулентными изолятами Puccinia orysae и химическими соедине-
ниями (гипохлорит, пентахлорфенол, органофосфаты). Подобно
мутациям гр1 кукурузы, эта мутация также картирована в специ-
фическом локусе R риса.
Уникальным примером являются некоторые мутации mlo ячме-
ня. Ген MLO придает растениям устойчивость ко всем известным
расам гриба-возбудителя мучнистой росы Erysiphe graminis, но аб-
солютно не меняет чувствительности растений ко всем другим па-
тогенам. Функции нормального гена MLO до сих пор не определе-
ны, но для mlo-мутантов характерно утолщение клеточной стенки
и дополнительное отложение каллозы в местах проникновения ин-
фекционной гифы гриба. Тканеспецифическое спонтанное утол-
щение клеточных стенок может происходить у mlo-мутантов и в
отсутствие патогена. И хотя образование некрозов не свойственно
этому процессу, у mlo-мутантов при низких температурах в асеп-
тических условиях возможно возникновение некрозов, причем
размеры некрозов зависят от генетического фона и от конкретной
аллели mlo. Однако, mlo-зависимые некрозы не повышают уро-
вень устойчивости растений к заражениям.
Спонтанные некрозы затрагивают не только листья растения.
У сои обнаружена мутация rn (root necrosis), которая вызывает не-
кроз корней. Причем у мутантных растений наблюдается повыше-
ние уровня устойчивости к вирулентному патогену и индукция
синтеза защитных белков и фитоалексинов. На листьях мутация гп
не проявляется
Сверхэкспрессия в растении определенных генов также приво-
дит к образованию спонтанных некрозов. Например, образование
некрозов происходит при совместной экспрессии в растении ком-
плементарных генов авирулентности и устойчивости (AVR9-CF9,
белок оболочки вируса табачной мозаики-N).
Трансгенные растения табака, экспрессирующие ген бактерио-
опсина Halobacterium halobium, формируют спонтанные некрозы и
одновременно устойчивы к бактериальным и грибным патогенам.
Образование некрозов связано с активностью бактериоопсина, ра-
ботающего как протонная помпа — единичные точковые мутации
в кодирующей части гена блокируют как работу помпы, так и об-
разование некрозов. Таким образом, еще раз подтверждается зна-
чимость ионных каналов на ранних этапах развития реакции СВЧ.
Интересно, что температура 30 °C ингибирует образование некро-
зов, а низкие температуры приводят к неограниченному увеличе-
нию в размерах некротических пятен.
Экспрессия в растительных клетках гена холерного токсина
также приводит к некротизации тканей и повышению общего
512
уровня устойчивости растений. Поскольку известно, что мишенью
действия холерного токсина в животных клетках являются G-белки
и протонная помпа, активация которых приводит к обезвожива-
нию, то еще раз подтверждается участие этих белков в реакции
СВЧ.
Другой пример системы, участвующей в индукции некрозов, —
убиквитин-зависимая система деградации белков. Экспрессия в
растениях табака модифицированного гена убиквитина приводит к
индукции некрозообразования и, в сочетании с нормальной ал-
лелью гена N (устойчивость к вирусу табачной мозаики), изменяет
фенотип некрозов.
И наконец, при большом разнообразии генов, нарушения в ко-
торых ведут к образованию некрозов, обнаружены гены-супрессо-
ры lsd-мутаций. Мутации в этих генах на фоне мутантных аллелей
Isd восстанавливают нормальный фенотип растения, за что и полу-
чили название phx (phoenix). Супрессорные мутации могут проис-
ходить как в самом гене LSD, так и в других генах, phx-мутации
различаются по силе действия и по-разному влияют на устойчи-
вость растения к биотрофным и некротрофным патогенам. Так,
наиболее сильные мутации phx2, phx3 и phxll-1 подавляют ус-
тойчивость растений к авирулентному штамму Pseudomonas syrin-
gae pv. tomato как на фоне мутации lsd5, так и в ее отсутствие.
Уровень устойчивости может быть восстановлен обработкой ана-
логами салициловой кислоты. Остальные, более слабые мутации
phx, супрессирующие проявление мутации lsd5, не влияют на ус-
тойчивость растений. Очевидно, эти две группы phx-мутаций ком-
пенсируют действие мутации lsd5 за счет разных механизмов. Так,
белки Phx2 и Phx3, очевидно, вступают в действие на ранних эта-
пах реакции СВЧ и контролируют различные процессы. Тогда как
остальные PHX-гены, вероятно, ответственны за исправления, свя-
занные с самыми ранними проявлениями мутации lsd5, и не вовле-
чены в реакцию устойчивости. Тем не менее ни одна мутация phx
не блокирует проявление реакции СВЧ полностью, что, очевидно,
говорит о существовании множества факторов-индукторов СВЧ.
Индукторы СВЧ-зависимой запрограммированной гибели
клеток. Что же известно о сигналах, запускающих гибель клеток
при СВЧ? Во-первых, ими могут быть высокореакционные формы
кислорода, образующиеся на ранних этапах реакции СВЧ. Напри-
мер, известно, что у клетки, благодаря работе ферментов-антиок-
сидантов, существует определенный порог чувствительности к пе-
рекиси водорода и другим формам кислорода. В частности, низкие
концентрации перекиси водорода индуцируют транскрипцию
генов, кодирующих антиоксиданты, активность которых может ог-
раничивать рост некротического пятна. Нарушения активности
ферментов, инактивирующих высокореактивные формы кислоро-
да (супероксиддисмутаз, каталаз и других), могут привести к не-
способности растения ограничивать распространение некрозов по
тканям. Тогда как высокие концентрации активных форм кисло-
18 Генетика
513
Рис. VI.26. Ключевые этапы передачи сигнала при индукции реакции СВЧ в растительной клетке.
Внеклеточная или внутриклеточная рецепция элиситора активирует работу ионных каналов. Приток ионов Са2+ и изменение баланса ионов К* и Na* активиру-
ют работу клеточных киназ и оксидазного комплекса, генерирующего высокореакционные формы кислорода. В результате активации экспрессии СВЧ-специ-
фичных генов происходит укрепление клеточных стенок и развитие локальной и системной устойчивости.
рода, образующиеся при заражении растения несовместимыми па-
тогенами, просто убивают растительные клетки.
О значении СВЧ-зависимой гибели клеток тем не менее не все
ясно. Обнаружен мутант арабидопсиса dndl, у которого, несмотря
на отсутствие некрозов при заражении, тем не менее сохранился
исходный уровень расоспецифической устойчивости к авирулент-
ным штаммам Р. syringae. Способность к развитию иммунитета к
повторным заражениям у этого мутанта также не затронута. Веро-
ятно, в норме белок Dndl является негативным регулятором ЗГК,
но не затрагивает другие стороны реакции устойчивости. Актив-
ность Dndl при этом должна предшествовать синтезу СК. Нару-
шения в гене одновременно могут приводить к накоплению в клет-
ке и веществ-супрессоров гибели клеток. Таким образом, ген
DND1 участвует в контроле распространения некрозов. Аналогич-
ными dndl мутации являются мутации cim (constitutive immunity)
арабидопсиса. На примере этих двух мутантов видно, что эффек-
тивное противостояние патогену возможно и в отсутствие ярко-
выраженного некрозообразования.
Итак, мы подробно разобрали этапы реакции СВЧ. Постара-
емся суммировать полученные сведения и нарисовать общую
картину индукции и развития реакции сверхчувствительности
(рис.¥1.26).
Реакция СВЧ запускается при контакте растения с несовмес-
тимым биотрофным патогеном благодаря рецепции специаль-
ных молекул-элиситоров, секретируемых патогеном. Это мотут
быть продукты его метаболизма (фрагменты клеточных стенок,
жирные кислоты, белки), одинаковые у всех рас и штаммов па-
тогена, или специфические молекулы — продукты активности
специфических Avr-генов. Улавливание элиситоров осущест-
вляется белками-рецепторами, которые передают сигнал в ядро,
где активируется транскрипция ряда генов. Этапы рецепции и
передачи сигнала еще не до конца расшифрованы, однако из-
вестно, что важную роль в них играют ионные каналы, высоко-
реакционные формы кислорода, продукты R-генов и т.д. При
передаче сигнала происходит постоянное разветвление и усиле-
ние сигнала. В частности, синтезируются различные вторичные
сигналы, запускающие только часть защитных реакций (запро-
граммированную гибель клеток, синтез фитоалексинов, PR-бел-
ков, экстенсинов, лигнификацию клеточных стенок и т.д.). Их
совместное действие обеспечивает формирование всего спектра
изменений, характерных для реакции СВЧ. Ключевыми вторич-
ными сигналами являются высокореакционные формы кислоро-
да, салициловая и жасмоновая кислоты. Также очень важно,
что в результате реакции СВЧ формируется системный иммуни-
тет растения к повторным заражениям.
515
Глава VI. 6
СИСТЕМНЫЙ ПРИОБРЕТЕННЫЙ ИММУНИТЕТ
РАСТЕНИЙ
Системная приобретенная устойчивость (systemic acquired re-
sistance, SAR), или приобретенный иммунитет — защитная реак-
ция растений, обеспечивающая их устойчивость к повторным за-
ражениям. В отличие от иммунитета животных, где защитные
функции выполняют специализированные клетки — лимфоциты,
у растений при первичном заражении в состояние боевой готов-
ности приходит каждая клетка, даже та, которая не была затрону-
та инфекцией, что и нашло отражение в названии этого типа ус-
тойчивости — системный иммунитет.
Сигналом для развития SAR-реакции в растении является пер-
вичное заражение биотрофным патогеном. Главное условие — фор-
мирование в результате такого поражения некрозов. Внешне реак-
ция SAR выглядит как реакции СВЧ, только скорость ее развития
гораздо выше, да и спектр патогенов, к которым растение становит-
ся устойчивым, значительно шире. Проявляется иммунитет в виде
повышенной устойчивости всего растения к повторному зара-
жению, причем не только возбудителем первичного заболевания, а
широким кругом грибных, бактериальных, вирусных патогенов и
насекомых-фитофагов. В отличие от иммунитета животных, SAR-
реакция растений неспецифична. Длительность такого иммунитета
составляет от нескольких недель после первичного заражения до не-
скольких месяцев, затем она постепенно угасает. Существуют хими-
ческие вещества, которые обладают способностью иммунизировать
растение, это салициловая кислота и ее аналоги.
В результате SAR-реакции геноспецифичные взаимодействия
растения и патогена могут полностью изменяться. Известны при-
меры, когда при повторном заражении растений совместимые ком-
бинации превращались в несовместимые. И наоборот, когда по
каким-либо причинам развитие SAR-реакции невозможно, несо-
вместимые комбинации трансформируются в совместимые.
SAR-реакция была впервые описана более 100 лет назад, но
активное изучение ее началось совсем недавно. А связано это с
тем, что впервые были найдены качественные признаки, характер-
ные только для этой защитной реакции. Таким признаком стал
набор SAR-специфичных белков.
VI.6.1. МОЛЕКУЛЯРНЫЕ МАРКЕРЫ SAR-РЕАКЦИИ
Системный приобретенный иммунитет связан с экспрессией
ряда специфичных генов, которые получили название SAR-генов,
что и позволяет вычленить эту реакцию из набора защитных реак-
516
ций растения. Разработаны две модели для изучения SAR-реакции
растений — табак Nicotiana tabacum и арабидопсис Arabidopsis
thaliana.
Белок признается SAR-специфичным в том случае, если его на-
личие или активность тесно связаны с поддержанием состояния ус-
тойчивости. Анализ SAR-специфичных белков показал, что многие
из них принадлежат к группе PR-белков, характерных для реакции
СВЧ. У табака, например, к SAR-белкам относятся следующие PR-
белки: PR-1 (PR-la, PR-lb, PR-1 с), Р-1,3-глюканазы (PR-2a, PR-2b,
PR-2c, PR-Q'), хитиназы классов II и III (PR-За и PR-ЗЬ), гевеин-по-
добные белки (PR-4a и PR-4b), томатин-подобные белки (PR-5a, PR-
5b). Специфическим является семейство основных белков SAR 8.2. У
арабидопсиса SAR-белками являются белки PR-1, PR-2 и PR-5.
Экспрессия SAR-специфичных генов в ответ на бактериальное,
грибное или вирусное заражение обнаружена у множества дву-
дольных растений, однако уровень экспрессии, так же как и гомо-
логия между соответствующими генами у разных видов растений,
неодинакова. Например, у растений огурца ген, кодирующий
белок PR-1, экспрессируется слабо, тогда как у растений араби-
допсиса и табака этот белок является доминирующим среди SAR-
специфичных белков.
Ряд генов, гомологичных SAR-генам двудольных, был обнару-
жен у однодольных растений. Так, гомологи семейства генов PR-1
были обнаружены у кукурузы и ячменя (RPM-гены), более того, у
кукурузы синтезируются дополнительные PR-белки, отсутствую-
щие у двудольных. Однако для однодольных пока не разработаны
экспериментальные модели для изучения реакции SAR, что ос-
ложняет возможность идентификации SAR-специфичных белков.
Кроме PR-белков, при SAR-реакции индуцируется синтез бел-
ков, отличных от реакции СВЧ. Например, в растениях наблюда-
ется синтез ингибиторов сериновых протеаз — белков, блокирую-
щих действие пищеварительных ферментов насекомых-фитофагов.
Именно с ингибиторами сериновых протеаз связывают устойчи-
вость растений к этой группе организмов. Ингибирование протео-
литических ферментов приводит к накоплению в пищеваритель-
ном тракте непереваренной пищи, что активирует чувствительные
к растяжению рецепторы стенок кишечника и вызывает чувство
насыщения у насекомого. Экспрессия генов, кодирующих ингиби-
торы протеаз, индуцируется механическими повреждениями расте-
ния и контролируется небольшим пептидом из 18 аминокислот —
систем ином.
VI.62. ИНДУКТОРЫ SAR-РЕАКЦИИ
Образование салициловой кислоты (СК) и ее роль в реакции
СВЧ мы подробно рассматривали выше. Наряду с этим, существу-
ет огромное количество данных о том, что СК играет ключевую
517
роль в индукции системного иммунитета. Во-первых, экзогенная
обработка растений этой кислотой или ее аналогами вызывает раз-
витие SAR-реакции. Мутантные растения, не способные к накоп-
лению СК, как правило, лишены способности к иммунизации. Это
подтверждают трансгенные растения табака, несущие бактериаль-
ный ген nahG, продукт которого отвечает за перевод свободной
СК в неактивный катехол. Многочисленные мутанты арабидопси-
са, у которых нарушен ее синтез, также лишены системного имму-
нитета.
Но является ли СК первичным сигналом, запускающим реак-
цию SAR? Можем ли мы предположить, что, накапливаясь в клет-
ках во время реакции СВЧ, свободная СК перемещается затем по
всему растению по флоэме и вызывает развитие SAR-реакции? Ис-
следования показали, что при первичном заражении во флоэмном
соке растений накапливается значительное количество СК. Она
синтезируется в зараженных листьях и переносится по флоэме в
неинфицированные ткани, но лишь на небольшое расстояние. Это
очевидно, так как у химерных растений табака, где привой дикого
типа привит на nahG-трансформированный подвой, инокуляция
подвоя не вызывает накопления СК во флоэме, что не мешает по-
явлению у привоя SAR-специфичных белков и иммунитета к по-
вторному заражению. Были получены также растения табака,
трансформированные геном холерного токсина. Экспрессия этого
гена приводит к спонтанному образованию некрозов, которое со-
провождается накоплением СК. Прививки между трансформиро-
ванными растениями и растениями дикого типа показали, что, не-
смотря на высокий уровень кислоты в трансформированном под-
вое, нетрансформированный привой не стал более устойчивым к
повторным заражениям. Таким образом, СК является локальным
сигналом, передающимся лишь на небольшие расстояния. А на-
копление СК в неинфицированных тканях, скорее всего, связано
с синтезом de novo. И лишь после того, как СК синтезировалась,
она в свою очередь активирует работу СВЧ- и SAR-специфичных
генов. Избыток СК переводится в форму неактивных конъюгатов.
Однако важным свойством системного иммунитета является
его быстрота — при повторных заражениях некрозы появляются
на растениях раньше, чем при первичном. Существует следующее
объяснение этого явления, и основано оно также на поведении
СК. Как упоминалось выше, инактивация избытка кислоты проис-
ходит за счет ее обратимого гликозилирования. Неактивные конъ-
югаты СК с глюкозой откладываются в межклеточном пространст-
ве. Очевидно, повторное заражение растений приводит к активно-
му высвобождению данной кислоты из конъюгатов с последующей
диффузией в клетки, где и активируются защитные системы. Этот
процесс занимает гораздо меньше времени, чем синтез de novo.
Среди множества низкомолекулярных соединений был обнару-
жен ряд искусственно синтезированных индукторов SAR-реакции.
Эти вещества обладают тремя признаками:
518
1) не обладают прямым антимикробным действием;
2) обеспечивают системную устойчивость к тому же спектру
патогенов, что и заражение патогеном;
3) индуцируют экспрессию тех же SAR-генов, что и заражение
патогеном.
К настоящему времени к реальным индукторам SAR-реакции у
растений, помимо СК, можно отнести 2,6-дихлороизоникотино-
вую кислоту и ее метиловый эфир (оба соединения принято обоз-
начать ИНК), а также синтетическое вещество S-метиловый эфир
бензо-(1,2,3)-тиадиазол-7-карботиоловой кислоты (БТ). Ни ИНК,
ни БТ не обладают антибиотическим действием, оба индуцируют
SAR-специфичные гены и обеспечивают иммунитет растений к
широкому спектру патогенов. Это означает, что эти соединения,
особенно БТ, могут быть использованы в практических целях для
«иммунизации» полевых растений. Однако механизм их действия,
очевидно, иной по сравнению с СК. Обработка растений этими
соединениями не повышает уровня свободной салициловой кисло-
ты в растениях дикого типа, поэтому они индуцируют SAR-реак-
цию у nahG-растений табака. Возможно, что ИНК и БТ действуют
Рис. VI.27. Схема действия салициловой кислоты при заражении расте-
ния.
Заражение несовместимым патогеном приводит к формированию СВЧ-специфич-
ных некрозов. Некротизации предшествует синтез сигнала неизвестной химической
природы (/), который за счет флоэмного транспорта переносится по растению и ин-
дуцирует накопление салициловой кислоты (2) (СК) как в инфицированных, так и не-
инфицированных тканях. Избыток СК переводится в форму конъюгатов с глюкозой,
которые при вторичном поражении растения гидролизуются до свободной СК. Повы-
шение уровня СК влечет за собой активацию SAR-специфичных генов и развитие сис-
темного иммунитета.
519
Рис. VI.28. Схема действия жасмонатов при заражении растений патоге-
ном.
Механическое поранение или нападение фитофага вызывает гидролиз фосфолипи-
дов клеточных мембран (7) с образованием жасмоновой кислоты (2) и метилжасмо-
ната (3) — гормонов, индуцирующих синтез системина и ингибиторов сериновых
протеаз. Жасмонаты транспортируются по флоэме в незатронутые части растения,
метилжасмонат способен также переноситься по воздуху и индуцировать ответ у со-
седних неповрежденных растений.
независимо от СК или являются сигналами, действующими вслед
за ней.
Можно предположить следующую картину действия СК (рис. VI.27).
При первичном заражении растений патогеном образуется сигнал
незвестной химической природы, который запускает ее синтез,
причем этот сигнал переносится по флоэме по всему растению.
СК вызывает локальный синтез различных антимикробных ве-
ществ (фитоалексинов, фенолов, PR-белков), а также стимулирует
укрепление клеточных стенок. Избыток этой кислоты переводится
в неактивные конъюгаты с глюкозой. При повторном заражении
патогеном конъюгаты разрушаются с освобождением СК, которая
вновь запускает защитные реакции растения.
Еще одно отличие SAR-устойчивости от реакции СВЧ заклю-
чается в ее неспецифичности. SAR-реакция выражается в устойчи-
вости растений не только к различным патогенам, но и вредите-
лям. Не случайно дополнительным молекулярным маркером SAR-
520
реакции является синтез ингибиторов сериновых протеаз — бел-
ков, инактивирующих протеолитические ферменты пищеваритель-
ного тракта животных. Известно, что непосредственный контроль
за экспрессией генов ингибиторов протеаз осуществляет неболь-
шой пептид системин. А экспрессия кодирующего его гена нахо-
дится в свою очередь под контролем жасмонатов. СК не влияет на
активность ингибиторов протеаз. Поэтому в качестве дополни-
тельного сигнала SAR-реакции следует отметить жасмонаты, тем
более, что МЖ — летучее соединение и способно активировать
защитные реакции не только в соседних тканях, но и в интактных
соседних растениях (рис. VI.28). МЖ способен обеспечивать кон-
такт между особями одной популяции. Повторим еще раз, что жас-
монаты ответственны за уровень устойчивости растения к поране-
ниям, вызванным случайными причинами или фитофагами, и не
влияют на экспрессию ряда СВЧ- и SAR-генов, поэтому нельзя
назвать жасмонаты ключевыми сигнальными молекулами SAR-pe-
акции. Скорее всего, оба индуктора — СК и жасмонаты — регу-
лируют отдельные метаболические процессы и работают в расте-
нии параллельно.
VI.6.3. МУТАНТЫ РАСТЕНИЙ С НАРУШЕНИЯМИ SAR-РЕАКЦИИ
Наибольшая коллекция SAR-мутантов получена на арабидопси-
се. Описанные в литературе мутанты обладают либо конститутив-
ным SAR-иммунитетом, т. е. для его развития не требуется первич-
ное заражение, либо обладают нарушениями в развитии SAR-реак-
ции; перечень известных мутантов приведен в табл. VI. 13.
Большинство мутаций, затрагивающих реакцию системного
иммунитета, обладают плейотропным проявлением и наиболее
часто сопровождаются спонтанным образованием СВЧ-подобных
некрозов в отсутствии патогена. Поэтому на этих мутантах изуча-
ется также генетический контроль гибели клеток при реакции
СВЧ, так называемой запрограммированной гибели клеток (ЗГК).
Более подробно о этой группе мутантов рассказано в соответству-
ющем разделе учебника. Расчленение процессов, лежащих в осно-
ве СВЧ- и SAR-реакций, с помощью мутантов, у которых наруше-
ны только отдельные этапы, поможет установить, насколько эти
процессы связаны друг с другом и установить причинно-следствен-
ные связи.
К группе мутантов, спотанно образующих некрозы в отсутст-
вие патогена и обладающих конститутивной SAR-реакцией, отно-
сятся мутанты lsdl-lsd7 (lesions stimulating disease) и acd2 (accele-
rated cell death). Помимо спонтанного образования некрозов, для
этих мутантов характерны высокий уровень СК, конститутивная
экспрессия SAR-специфичных генов и устойчивость к патогенам.
Для установления роли СК в образовании СВЧ-зависимых не-
крозов был проведен ряд экспериментов. Мутанты арабидопсиса
521
Таблица VI. 13
Характеристика SAR-мутантов арабидопсиса
Мута- ция Экотип Мутаген Хромосома — проявление мутации Уровень СК Дополнительная характеристика
acd2-2 Col-0 Мутанты с ЭМС конститутивной 4-рецессивная реакцией S Высокий >AR Спонтанные некрозы
cim2 » » ?-доминантная » Нет спонтанных
cim3 » » ?-доминантная » некрозов То же
cprl » ?-рецессивная » ?
Isdl Ws-0 Т-ДНК 4-рецессивная » Спонтанные некрозы
lsd2 Col-0 ЭМС ?-доминантная » » »
lsd3 Ws-0 Т-ДНК ?-рецессивная » » »
lsd4 » » ?-доминантная » » »
Isd5 » » ?-рецессивная » » »
lsd6 Col-0 ЭМС 1-доминантная » » »
lsd7 » » ?-доминантная » » »
nahG Col-0 Мутанты ( Трансфор- : нарушениями в 4-доминантная реакции Sj Низкий AR Восстанавливается
ndrl Col-0 мация Облучение 3-рецессивная ? обработкой ИНК То же
niml Ws-0 Т-ДНК 1-рецессивная Норма Нечувствительные к
nprl Col-0 ЭМС ?-рецессивная ? СК и ИНК То же
Примечание. ЭМС — этилметансульфонат, СК — салициловая кислота,
ИНК — изоникотиновая кислота. Col-О и Ws-0 — экотипы растений Columbia и
Wasilewskaya.
со спонтанным образованием некрозов (Isd, cim, acd и др.) скре-
щивали с трансгенными nahG-растениями, у которых блокирован
этап накопления СК. Если у гибридов F, признак спонтанного не-
крозообразования проявлялся, то белок, кодируемый соответству-
ющим геном, вступает в действие раньше, чем СК. Если же у гиб-
ридов Fj спонтанное некрозообразование отсутствует, то продукт
гена действует позже СК. На основании полученных данных была
предложена схема действия, в которой выделяются СК-зависимые
и СК-независимые этапы (рис. VI.29). Аналогичное изучение фе-
нотипа двойных мутантов (например, lsdl/lsd2) позволило устано-
вить порядок действия продуктов генов.
Наряду с мутантами, обладающими конститутивным SAR-им-
мунитетом, обнаружен ряд генов, мутации в которых у арабидоп-
сиса приводят к потере способности формировать SAR-ответ.
Описаны и другие мутации, затрагивающие признак устойчи-
вости. Мутация в гене NDR1 (от non-race-specific disease resistan-
522
Зараженные
ткани
срг! ?
__ lsd2
Контакт isd4
Isdl
Isd6_________
ndrl? ..... ।---|
cPrl?Kohr niml
ciml NahG j nprl
cim3 Салициловая IЭкспрессия Локальная
кислота | SAR-генов устойчивость
растения с -> -> Некрозы -> ->
патогеном
Рис. VI.29. Гипотетическая последовательность действия генов при пе-
редаче сигнала при SAR-реакции.
Некротизация тканей, вызванная первичным заражением, активирует локальную
(вверху) и системную (внизу) реакции устойчивости растения. Оба процесса регули-
руются салициловой кислотой, так как блокированы у растений, экспрессирующих
ген салицилатгидроксилазы NahG. Образование спонтанных некрозов у мутантов
Isdl и lsd6 зависит от уровня салициловой кислоты, что предполагает наличие регу-
ляции по типу обратной связи. Искусственные аналоги салициловой кислоты изони-
котиновая кислота (ИНК) и бензотиазол (ВТК) способны восстанавливать реакцию
S AR у мутантов niml и nprl. Отмечены мутации в генах, инактивация которых блоки-
рует различные этапы сигнальной трансдукции.
се) приводит к неспецифической восприимчивости к вирулентным
и авирулентным штаммам Pseudomonas syringae и Peronospora pa-
rasitica и неспособности развивать SAR-иммунитет.
Мутант ndrl-1 (от non-race specific disease resistance) чувстви-
телен к патогенам, несущим гены авирулентности, причем без из-
менений в реакции СВЧ. Эта мутация позволяет генетически отде-
лить реакцию СВЧ от устойчивости к патогенам. Устойчивость
мутанта можно восстановить обработкой ИНК, в связи с чем можно
предположить, что продукт соответствующего гена работает до на-
копления СК.
Инактивация гена NPR1 (non-expresser of PR-genes) приводит
к неспособности растений развивать SAR-устойчивость после об-
работки ИНК. Обнаружена прямая корреляция между уровнем эк-
спрессии гена NPR1 и степенью устойчивости растений к Р. syrin-
gae и Р. parasitica. Сверхэкспрессия гена NPR1 не оказывает нега-
тивного эффекта на растения, а повышает их неспецифический
системный иммунитет.
Мутации eds (enhanced disease susceptibility) поддерживают
рост бактерий в тканях растения, даже если изначальная концент-
рация патогена была слишком низка для эффективного заражения.
Некоторые мутации eds аллельны nprl.
523
Мутация niml (noninducible immunity) также приводит к повы-
шению восприимчивости растений. Мутанты niml способны акку-
мулировать СК, но не развивают SAR-иммунитет, что связано с
нарушениями в передаче сигнала после СК. Несколько независи-
мых мутаций в гене Niml обладают разной степенью нарушений в
передаче сигнала. Секвенирование гена выявило области высокой
степени гомологии белка Niml белкам подкласса 1кВа-транс-
крипционных ингибиторов, обнаруженных у различных живот-
ных. Белок 1кВа связывает транскрипционный фактор NF-кВ. У
животных NF-кВЛкВ-зависимый путь передачи сигнала связан с
ответом на различные стимулы, в том числе и на заражение раз-
личными патогенами, и активирует синтез интерлейкинов (IL-1,
-2, -6, -8). Например, у трансгенных мышей инактивация этого
пути сигнальной трансдукции приводит к повышению восприим-
чивости к различным бактериальным и вирусным инфекциям. А у
дрозофилы с активностью аналогичного комплекса связан синтез
различных антигрибных белков. Возможно, что активация SAR-
устойчивости с помощью белка Niml также связана с взаимодей-
ствиями с NF-кВ-зависимыми транскрипционными факторами. В
пользу этого предположения говорит и тот факт, что у некоторых
R-белков растений (N, L6, RPP5) есть домены TIR, гомологичные
рецептору IL-1 млекопитающих и белку Toll дрозофилы. Тогда
Niml-зависимая система передачи сигнала является примером
универсального защитного ответа клетки, в котором Niml являет-
Рис. VI.30. Общая схема формирования системного приобретенного им-
мунитета у высших растений.
Образование некрозов при первичном заражении растения сопровождается синте-
зом сигнала, индуцирующего накопление салициловой кислоты (СК), экспрессию
SAR-специфичных генов и, как следствие, развитие системного иммунитета.
524
ся ингибитором транспорта транскрипционного фактора в ядро.
Так как инактивация ингибитора у мутантов niml приводит к от-
сутствию экспрессии SAR-специфичных генов, то белок, ингиби-
руемый Niml, является негативным регулятором их транскрипции.
Таким образом, при заражении растений биотрофным пато-
геном индуцируется ряд защитных реакций, в результате кото-
рых образуются некрозы. Образование некрозов приводит к по-
вышению устойчивости растения к последующему заражению
широким спектром патогенов (pnc.VI.30). Это явление, по-
лучившее название системного приобретенного иммунитета
(SAR), проявляется в быстрой индукции защитных реакций, на-
поминающих реакцию СВЧ. Значительная роль в иммунизации
принадлежит специфическим сигналам, образующимся при
первичном заражении и способным «иммунизировать» расти-
тельные ткани, не контактирующие с патогеном. Последователь-
ный синтез сигнальных молекул и их действие носят название
сигнальной трансдукции. К настоящему времени мы знаем о су-
ществовании двух регуляторных молекул в SAR-реакции — СК
и ЖК. Но не знаем ничего о первичных сигналах, запускающих
их синтез.
Глава VI. 7
РЕГУЛЯТОРНЫЕ ЭЛЕМЕНТЫ
И ТРАНСКРИПЦИОННЫЕ ФАКТОРЫ,
ОТВЕТСТВЕННЫЕ ЗА ИНДУКЦИЮ ГЕНОВ
ПРИ РЕАКЦИЯХ СВЕРХЧУВСТВИТЕЛЬНОСТИ
И СИСТЕМНОГО ИММУНИТЕТА
У высших растений существует большое количество различных
систем распознавания биотрофных патогенов и ранних этапов пе-
редачи сигнала. Однако более поздние этапы сигнальной транс-
дукции одинаковы, о чем свидетельствует хотя бы сходный набор
соединений, синтезируемых при СВЧ- или SAR-ответе. Соответст-
венно у растений должны существовать универсальные механизмы
индукции синтеза этих соединений, а именно транскрипционные
факторы и cis-регуляторные элементы, обеспечивающие экспрес-
сию соответствующих генов. Некоторые патоген-чувствительные
cis-элементы и связывающиеся с ними транскрипционные факто-
ры описаны.
Некоторые PR-гены содержат элиситор-чувствительный эле-
мент TTGACC, в частности этот элемент входит в W-бокс промо-
тора гена PR-1 петрушки (этот ген гомологичен семейству генов
PR-10 табака). Белки, связывающиеся с W-боксом, содержат моти-
вы типа «цинковых пальцев» и принадлежат к семейству WRKY-
525
транскрипционных факторов растений. Уровень транскрипции
генов, кодирующих эти ДНК-связывающие белки, также регулиру-
ется грибными элиситорами, что подтверждает их участие в акти-
вации синтеза PR-белков.
Кроме того, многие PR-гены и другие стресс-индуцибельные
гены содержат ТСА-элемент из 10 нуклеотидов (ТСАТСТТСТТ), с
которым связывается ядерный белок массой 40 кДа. Связывание
белка с промоторной областью также зависит и от уровня в клетке
СК. Однако участие этого элемента в регуляции экспрессии генов
пока не доказано. В промоторной области гена RP-2d, принадле-
жащего к описываемой группе генов, был обнаружен дополнитель-
ный салицилат-чувствительный элемент из 25 н. п., содержащий
последовательность TCGACC, аналогичную выше упомянутому
элементу TTGACC. Так как экспрессия обеих групп генов зависит
от СК, то, возможно, эти элементы и соответствующие им WRKY-
факторы участвуют в салицилат-зависимой активации генов.
Другой охарактеризованный салицилат-зависимый cis-элемент
as-1 (activator sequence-1, или ocs-1) был обнаружен в промоторах
генов 35S вируса мозаики цветной капусты, nos и ocs Agrobacteri-
um и некоторых растительных стресс-индуцируемых генах. Неко-
торые представители семейства TGA bZIP-транскрипционных
факторов табака и арабидопсиса способны связывать as-1. Кроме
того, у арабидопсиса был обнаружен белок с «цинковыми пальца-
ми», связывающий последовательность, соседнюю с as-1, что по-
вышает сродство транскрипционных факторов TGA к as-1. Также
связывание элемента as-1 зависит от степени фосфорилирования
транскрипционных факторов.
Промоторы многих этилен-регулируемых PR-генов содержат
консервативный GCC-бокс (TAAGAGCCGCC), с которым специ-
фически взаимодействуют EREBP (ethylene-responsible element bin-
ding protein)-6enKH. Экспрессия EREBP-белков запускается этиле-
ном. Кроме того, некоторые белки томатов, взаимодействующие
с РТО-киназой (Pti 4, Pti 5, Pti 6), обладают обширной гомологией
с EREBP-белками и связывают GCC-бокс. Возможно, именно
на примере этих белков прослеживается связь между активностью
R-белка, фосфорилированием и активацией СВЧ-специфичных
генов. Интересно также, что EREBP-белки табака и белки Pti4/5/6
гомологичны белку APETALA2 арабидопсиса, участвующему в кон-
троле развития цветка и семени.
PRM-гены кукурузы являются гомологами PR-генов, обнару-
женных ранее у двудольных. В промоторе гена PRM5 обнаружен
специфический элиситор-чувствительный 20 н. п.-элемент ERE
(elicitor-responsible element), содержащий мотив AATTGACC,
сходный с таковыми у других патоген-индуцируемых генов. Кроме
того, для успешной активации гена необходимо наличие энхансер-
ной последовательности, расположенной левее ERE-элемента.
Также показано, что экспрессия гена под действием элиситора не-
возможна при инактивации протеинкиназной активности в клет-
526
ках, что непосредственно указывает на роль фосфорилирования
белков в контроле экспрессии соответствующих генов.
Ген PR-1 является модельным для изучения регуляции экспресии
генов, специфичных для СВЧ и SAR-реакций. Функциональный
анализ экспрессии гена глюкуронидазы под фрагментами промото-
ра гена PR-1, а также действием ИНК позволил выявить несколько
регуляторных элементов. Прежде всего 10-кратное усиление актив-
ности гена, характерное для интактного промотора или его фраг-
мента в 815 н. п., теряется наполовину при уменьшении промотор-
ной области до 698 н. п., дальнейшее уменьшение промотора (612 н. п.
и меньше) приводит к полной потери индуцибельности. В промото-
ре обнаружены сайты узнавания для транскрипционных факторов,
содержащих лейциновые молнии, и NF-kappa В. Показано также,
что под действием ИНК в промоторной области гена характерным
образом изменяется структура хроматина.
В настоящее время наибольшее внимание уделяется поиску фак-
торов, активирующих гены ферментов фенилпропаноидного пути,
и соответственно районам генов, ответственных за их индукцию.
В частности, тестирование отдельных соединений, образующихся
на ранних этапах реакции СВЧ, направлено на поиск промежу-
точных метаболитов-индуктуров генов синтеза фитоалексинов.
Среди таких соединений уже можно назвать перекись водорода, ин-
дуцирующую транскрипцию генов ФАЛ (PALI) и глютатион-S-
трансферазы (GST), участвующих в синтезе фитоалексинов у араби-
допсиса.
Слияние отдельных районов промотора гена, экспрессия кото-
рого изучается, со структурной частью репортерного гена Р-глюку-
ронидазы (gus) с последующей трансформацией, полученной кон-
струкцией растений, позволяет изучать влияние этих районов
промотора на специфичность и эффективность экспрессии генов.
Например, с помощью подобного подхода были выявлены фраг-
менты промотора гена изофлавонредуктазы люцерны, ответствен-
ные за индукцию транскрипции под действием элиситоров. Регуля-
ция генов под действием убиквитина, очевидно, связана с наличи-
ем в их промоторах G-бокса (CACGTG), связывающегося GBP с
семейством bZIP транскрипционных факторов. G-бокс присутст-
вует, например, в промоторных областях генов, кодирующих ФАЛ
и КС, и, возможно, опосредующих индукцию этих генов светом и
элиситорами. Другой элиситор-чувствительный cis-регуляторный
элемент, часто встречающийся в промоторах генов ферментов фе-
нилпропаноидного пути синтеза, — Н-бокс (ССТАСС). Связываю-
щиеся с ним белки Кар-1 и Кар-2 выделены из клеток фасоли.
Под действием элиситоров наблюдается резкое возрастание актив-
ности этих белков в ядерной фракции. В клетках сои был обнару-
жен белок G/Hbp-1, принадлежащий к семейству bZIP транскрип-
ционных факторов, который специфически связывает как G-бокс
в промоторе гена хитиназы CHS 15, так и лежащий рядом с ним
Н-бокс. И, хотя уровень синтеза этого белка под действием элиси-
527
торов не меняется, G/Hbp-1 подвергается резкому фосфорилирова-
нию, при котором сродство к связыванию промотора CHS 15 уве-
личивается. Кроме того, Н- и G-боксы очень сходны с МуЬ- и
Мус-сайтами и могут узнаваться растительными МуЬ- и Мус-подоб-
ными транскрипционными факторами. Например, при заражении
растений табака вирусом мозаики или обработке салициловой
кислотой активируется ген МуЫ. В промоторе гена PR-1 табака
присутствуют Мус- и Myb-сайты и рекомбинантный белок МуЫ
способен связывать Н-подобный Myb-сайт. Эти данные говорят о
том, что продукт гена МуЫ, возможно, кодирует регуляторную
молекулу, активирующую синтез PR-белков.
ЗАКЛЮЧЕНИЕ
Итак, мы рассмотрели целый спектр реакций, контролирую-
щих взаимодействие высших растений с разнообразными патоген-
ными микроорганизмами.
Взаимодействие растения с патогеном начинается со взаимного
распознавания «партнеров» и их пространственного сближения.
Сближение осуществляется либо пассивно, когда патоген случайно
попадает на растение с током воды, воздуха или переносчика, либо
активно с помощью специального двигательного аппарата (жгути-
ки). В обоих случаях патоген распознает потенциальное растение-
хозяин благодаря секреции последним характерных химических со-
единений. Рецепции этих соединений запускают процесс заражения
растения и проникновения патогена в межклеточное или периплаз-
матическое (между клеточной мембраной и клеточной стенкой)
пространство. В процессе проникновения важную роль играют гид-
ролитические ферменты микроорганизма и особенности строения
покровных тканей и клеточных стенок растения. Покровные ткани
растения представляют собой первый, структурный барьер на пути
проникновения патогена.
Некротрофные патогены вызывают образование некротических
пятен на растении вследствие синтеза токсинов различной хими-
ческой природы. Секретируемые ими гидролитические ферменты
необходимы для разложения органических остатков. Токсины фи-
топатогенных микроорганизмов могут быть как неспецифичными,
так и хозяин-специфичными, т. е. в результате их действия гибнут
только определенные генотипы растений.
Биотрофные патогены, наоборот, стараются сохранить жизнь
растительной клетке. Это довольно сложно, так как растение об-
ладает способностью распознавать патоген и отвечать на его при-
сутствие специфической реакцией локальной гибели клеток (реак-
ция СВЧ). В качестве характерных «примет» растение ориентиру-
ется на компоненты клетки микроорганизма (жирные кислоты,
фрагменты клеточных стенок) или специфические пептиды, свой-
ственные только отдельным расам патогена. В последнем случае
528
Рис. VI.31. Интегральная схема защитных механизмов растений.
индукция реакции СВЧ контролируется специфическими генами
авирулентности и устойчивости.
Образование некрозов при заражении биотрофным патогеном
сопровождается развитием иммунитета к повторным заболевани-
ям, вызываемым разными патогенами, а также вирусами и фитофа-
гами.
Общим принципом «химического» варианта защиты от патоге-
нов является снижение пищевой ценности растения. Это происхо-
дит под действием заражения при реакциях СВЧ или SAR, когда
в клетке в огромных количествах накапливаются фитоалексины,
токсины, гидролитические ферменты и т.д. Для многих растений
характерен конститутивный синтез токсинов (фитоантисипинов).
Очевидно, этот же принцип возможен и при формировании видо-
вого иммунитета растений, когда в растении отсутствуют вещест-
ва, необходимые для роста и развития патогена.
Различные механизмы устойчивости действуют в пределах од-
ного растения и представляют собой разные уровни противостоя-
ния патогену (рис. VI.31). Поэтому при анализе устойчивости каж-
дой конкретной комбинации «растение—возбудитель заболева-
ния» необходимо учитывать интегральный признак устойчивости.
529
ЛИТЕРАТУРА
Dangl J. L., Dietrich R. A., Richberg M. H. Death Don't Have No Mercy: Cell Death
Sograms in Plant-Microbe Interactions # The Plant Cell. 1996. Vol 8. P. 1793—
1807.
Greenberg J. T. Programmed cell death: A way of life for plants # Proc. Nat. Acad.
Sci. USA. 1996. Vol.93. P. 12094—12097.
Kiessig D. F, Malamy J. The salicylic acid signal in plants # Plant Molecular Biology.
1994. Vol. 26. P. 1439—1458.
Knogge W. Fungal infection of plants # The Plant Cell. 1996. Vol. 8. P. 1711—1722.
Mansom M. D., Armitage J. P., Hoch J. A., Macnab R. M. Bacterial locomotion and
signal transduction // J. Bacteriol. 1998. Vol. 180 (85). P. 1009—1022.
Osbourn A. E. Preformed antimicrobial compounds and plant defense against fungal
attack В The Plant Cell. 1996. Vol. 8. P. 1821—1831.
Ryals J. A., Neuenschwander U. H., Willits M. G., Molina A., Steiner H-Y.,
Hunt M. D. Systemic Acquired Resistance # The Plant Cell. 1996. Vol. 8. P. 1809—
1819.
Varner J. E., Lin L.-S. Plant Cell Wall Architecture # Cell. 1989. Vol. 56. P. 231—
239.
Walton J. D. Host-selective toxins: agents of compatibility # The Plant Cell. 1996.
Vol. 8. P. 1723—1733.
ЗАКЛЮЧЕНИЕ
Развитие сложно организованного взрослого растения из зиго-
ты, происходящее строго упорядоченно, представляет собой одну
из самых интересных и захватывающих проблем биологии. Тот
факт, что процессы развития контролируются генетически, само-
очевиден, так как получены мутации, затрагивающие все стороны
и свойства развития растений: морфологические, например форма
листа, корня, физиологические, такие как время цветения и про-
должительность периода покоя семян. Таким образом, несомнен-
но, что характер (тип) развития каждого индивидуального расте-
ния определяется его генотипом.
В процессе развития растений происходит клеточная диффе-
ренцировка, именно этот процесс ответственен за формирование
тканей и органов. В основе дифференцировки клеток лежит диф-
ференциальная активность генов. Это означает, что не все гены,
входящие в состав генома, активны на протяжении всего жизнен-
ного цикла растения. Например, гены, контролирующие развитие
цветка, как правило, не экспрессируются во время вегетативной
фазы развития растения. Дифференциальная активность генов,
таким образом, подразумевает наличие регуляторной системы,
контролирующей последовательность работы генов в зависимости
от стадии развития растения.
Мы знаем, что развитие цветкового растения состоит из ряда
последовательных стадий. Оно начинается с дифференцировки
корня и побега зародыша, затем появляются зачатки органов и,
наконец, дифференцируются ткани внутри органов. На эти изме-
нения накладываются ключевые этапы развития, такие как пере-
ход к цветению или покою семян. В результате исследований ге-
нетического контроля развития растений стало очевидным, что
каждый этап контролируется большим числом регуляторных
генов, составляющих сложную сеть, в которой отдельные элемен-
ты тесно взаимодействуют друг с другом. В частности, исследова-
ния гомеозисных мутантов арабидопсиса привели к созданию мо-
дели «АВС». Очень важен тот факт, что отдельные элементы этой
531
сети могут контролировать сразу несколько этапов. Например,
гены TFL1 и API могут участвовать в более чем одном этапе раз-
вития цветка. Это означает, что один и тот же регуляторный белок
на разных этапах развития способен взаимодействовать с различ-
ными генами и осуществлять различные функции, а мутации, за-
трагивающие разные участки такого регуляторного гена, могут об-
ладать независимым фенотическим проявлением. Таким образом,
изучение функций регуляторных генов у растений невозможно без
получения и вовлечения в анализ как можно более широкого спектра
мутантов.
Строгий порядок смены последовательных стадий онтогенеза
является одной из поразительных черт развития. .На примере раз-
вития цветка, а именно возникновения различных его частей (ле-
пестки, тычинки, карпеллы), особенно очевидна «цепная реакция»
событий, при которой завершение одной стадии является сигна-
лом для начала следующей. Изучение разнообразных мутантов
арабидопсиса с нарушениями в развитии цветка позволило сфор-
мулировать гипотезу о каскадной регуляции этих процессов^ на
транскрипционном уровне.
Важным в генетике развития растений остается вопрос о детер-
минации дифференцировки. Так, уже первое деление зиготы у
растений приводит к формированию двух неэквивалентных кле-
ток, судьба которых в эмбриогенезе растений различна. Таким об-
разом, с одной стороны, основное разделение на корень и побег
происходит практически сразу и сохраняется при нормальном раз-
витии растения вплоть до его естественной гибели, что говорит в
пользу существования детерминации. С другой стороны, для рас-
тительных клеток характерна высокая пластичность. Под влияни-
ем стресса клетки способны возвращаться в недифференцирован-
ное состояние и повторно проходить дифференцировку в направ-
лении, кардинально отличающемся от первичного. Особенно
наглядно это демонстрируют эксперименты в культуре изолиро-
ванных органов и тканей. Подобная пластичность, вероятно, свя-
зана с прикрепленным образом жизни растений, и, казалось бы,
отрицает существование детерминации в развитии. Многочислен-
ные исследования на мутантах арабидопсиса, а также эксперимен-
ты с растительными клетками in vitro позволили прийти к некото-
рому соглашению по этому вопросу. Основную роль в определении
судьбы клетки (другими словами, детерминации ее дифференци-
ровки) играет ее положение относительно соседних клеток. Пози-
ционная информация, поступающая от соседей, определяет на-
правление дифференцировки клетки. Природа сигналов, осущест-
вляющих передачу информации от клетки к клетке, в настоящее
время мало известна. Однако в качестве примеров уже сейчас
можно привести продукт гена CLV1, которым обмениваются со-
седние клетки.
Очевидно, что разнообразие регуляторных молекул, ответст-
венных за различные этапы развития, описать практически невоз-
532
можно. Тем не менее стоит отметить основные факторы, без кото-
рых развитие растения просто невозможно.
Трудно переоценить роль гормонов в регуляции дифференци-
ровки растения. Гормональное воздействие на растение способно
полностью изменить направление его развития. Многочисленные
мутации, затрагивающие биосинтез или рецепцию гормонов, при-
водят к потере растением способности проходить определенные
этапы развития. Например, индукция образования почек и корней
в тканях каллуса происходит под влиянием ауксинов и цитокини-
нов, индукция цветения находится под влиянием гиббереллинов.
Совместное действие гиббереллинов и абсцизовой кислоты опре-
деляет состояние покоя семян. Подобные макроскопические изме-
нения в состоянии клеток растения также являются результатом
дифференциальной активности генов, экспрессия которых нахо-
дится под контролем гормонов.
В настоящее время достигнут значительный прогресс в изучении
биосинтеза и механизмах действия и транспорта гормонов. Анализ
огромного количества гормональных мутантов растений подтвердил
тот факт, что основные процессы развития растений контролируют-
ся гормонами. Для некоторых ключевых гормонов, относящихся к
классической «пятерке», изучен путь передачи сигнала.
Однако не только гормоны регулируют развитие растений. В
настоящее время увеличивается число молекул, обладающих сиг-
нальной функцией. Так, значительная роль в регулировке развития
и дифференцировки отводится брассиностероидам — новому
классу стероидных гормонов растений, жасмоновой кислоте, оли-
госахаринам. Важным открытием в области генетики развития
растений является обнаружение генов, обладающих неавтономной
клеточной функцией (например, KNOTTED 1, CLV1), продукты
которых способны транспортироваться от клетки к клетке, пере-
давая сигнал. Наличие подобной клеточной коммуникации в пог-
раничных клетках также, вероятно, играет значительную роль в
регуляции дифференцировки.
Отдельно стоит отметить свет как один из основных абиоти-
ческих факторов, определяющих развитие растений. В этом плане
растение располагает целым рядом генетических систем, обес-
печивающих надлежащие реакции на освещение. Как показал
анализ этих систем, каждый тип воспринимаемых сигналов (на-
пример, свет дальнего красного, красного, синего или дальнего
фиолетового диапазона) распознается особыми рецепторными мо-
лекулами. В дальнейшем воспринятые сигналы передаются через
молекулы-посредники на серию транскрипционных факторов, за-
пускающих или же подавляющих транскрипцию светорегулируе-
мых генов. При этом принципиальный механизм световой регуля-
ции состоит в подавлении активности молекул Cop/Det/Fus, обес-
печивающих негативную регуляцию фотоморфогенеза. Сходный
принцип «репрессии репрессоров» характерен у высших растений
и для других сигнальных систем.
533
Простота организации высших растений, а именно, отсутствие
специализированной иммунной системы, предоставляет также
уникальную возможность для изучения взаимоотношений расте-
ний с симбиотическими и патогенными микроорганизмами. Эво-
люционное становление симбиотических или патогенных систем
сопровождалось специализацией геномов обоих организмов. При
развитии подобных систем часть генов, ответственных за проявле-
ние признака, будь то формирование симбиоза или устойчивость,
оказывается как бы вынесенной за пределы растения — в геном
микроорганизма. Это дает дополнительные возможности контроля
за эффективностью взаимодействия за счет модификации не толь-
ко генома растения, но и генома микроорганизма.
Существование высших растений в природе неразрывно свя-
зано с реакциями приспособления к постоянно меняющимся ус-
ловиям внешней среды, в том числе и к микроорганизмам, кото-
рые воздействуют на растение на протяжении всего жизненного
цикла. Это воздействие может быть как негативным, как в случае
с многочисленными возбудителями заболеваний, так и позитив-
ным, способствующим взаимному выживанию партнеров в общей
экологической нише. Тем не менее, независимо от варианта вза-
имодействия, патогенез и симбиоз обладают рядом общих харак-
теристик и, очевидно, представляют собой разные эволюционные
ступени развития. Помимо сугубо практического значения, оба
типа взаимодействия вызывают глубокий интерес исследователей
тем, что предоставляют уникальные модели для изучения призна-
ков, определяемых функционированием двух неродственных
генетических систем (геномов) растения и микроорганизма. Ши-
рокий арсенал методов современной генетики позволяет в насто-
ящее время не только идентифицировать ключевые этапы взаи-
модействия организмов и гены, их контролирующие, но и на-
правленно изменять генетические системы партнеров с целью
более эффективного симбиоза или повышения устойчивости рас-
тений к заболеваниям.
Подводя итоги, следует подчеркнуть, что, с точки зрения био-
логии развития, растения относятся к числу организмов с ярко
выраженным «регуляторным» типом онтогенеза. По сравнению с
другими многоклеточными организмами они характеризуются наи-
более высоким адаптивным потенциалом, возможно именно поэто-
му растения доминируют в биосфере. Однако степень интегриро-
ванности организма у растений выражена меньше, чем у живот-
ных. Интегрирующие функции у растений выполняет в основном
просто устроенная гормональная система.
В настоящее время молекулярно-генетические исследования
развития растений привели к возникновению двух крупных блоков
данных:
*1) о генах, контролирующих собственно морфогенетические
процессы (цитодифференцировка, органогенез, эмбриональное и
репродуктивное развитие);
534
2) о генах-регуляторах, которые контролируют биосинтез,
транспорт, рецепцию и действие фитогормонов и света.
Некоторые из этих генов изучены весьма подробно. Поэтому
одной из важнейших задач генетики растений является объедине-
ние данных блоков и создание на этой основе целостной картины
молекулярно-генетического контроля развития. Другой задачей яв-
ляется выяснение того, насколько молекулярно-генетические ме-
ханизмы развития, изученные пока на ограниченном спектре мо-
дельных объектов (арабидопсис, табак, томаты), являются универ-
сальными для всех высших растений. Анализ второго вопроса
позволит подойти к выяснению путей эволюции систем развития:
какие морфогенетические процессы были наиболее древними, в
какой последовательности происходило усложнение систем разви-
тия.
ОГЛАВЛЕНИЕ
Стр.
Предисловие....................................................... 3
Введение.......................................................... 6
Литература........................................................ 12
ЧАСТЬ I. ОСОБЕННОСТИ ОРГАНИЗАЦИИ И ЭКСПРЕССИИ ГЕНЕ-
ТИЧЕСКОГО МАТЕРИАЛА РАСТЕНИЙ (О. Н. Тиходеев) .... 13
Глава 1.1. Ядерный генетический материал растении................. 14
1.1.1. Геномные последовательности, обеспечивающие стабильность
хромосомного набора........................................ 16
1.1.2. Ядерные гены........................................ 19
1.1.3. Экспрессия ядерных генов............................ 22
1.1.4. Мобильные генетические элементы растений............ 38
1.1.5. Сателлитные последовательности....................... 60
1.1.6. Особенности организации растительных геномов......... 62
Глава 1.2. Генетический материал пластид......................... 63
1.2.1. Гены «домашнего хозяйства» пластид................... 67
1.2.2. Гены, непосредственно контролирующие процесс фотосинтеза 79
1.2.3. Общее количество пластидных генов.................... 90
1.2.4. Экспрессия пластидных генов.......................... 92
Глава 1.3. Генетический аппарат митохондрий..................... 111
1.3.1. Гены «домашнего хозяйства» митохондрий.............. 114
1.3.2. Гены, непосредственно контролирующие процесс клеточного
дыхания.................................................... 122
1.3.3. Общее количество митохондриальных генов............. 126
1.3.4. Экспрессия митохондриальных генов................... 127
Глава 1.4. Симбиотическое происхождение пластид и митохондрий ... 132
Заключение ..................................................... 149
Литература...................................................... 154
ЧАСТЬ II. ГЕНЕТИЧЕСКИЕ ОСНОВЫ РАЗВИТИЯ РАСТЕНИЙ ОТ
СЕМЕНИ ДО СЕМЕНИ........................................... 155
Глава II. I. Эмбриональное развитие (Л. А.Лутова)............... 155
II. 1.1. Характеристика стадий эмбриогенеза................ 157
II. 1.2. Цитогенетическая характеристика зародыша ......... 159
536
II. 1.3. Гены, экспрессирующиеся в раннем эмбриогенезе......... 161
II. 1.4. Гены, экспрессирующиеся в процессе созревания зародыша 162
И. 1.5. Мутанты по эмбриогенезу................................ 164
Глава П.2. Развитие побеговых апикальных меристем (Л. А. Лутова) . . . 170
П.2.1. Структура побеговых апикальных меристем (ПАМ)......... 170
II.2.2. Мутанты с нарушениями побеговых апикальных меристем . . 173
II.2.3. Характеристика генов, контролирующих развитие ПАМ ... 176
Глава II.3. Развитие листа (Л. А. Лутова)........................... 181
II.3.1. Мутации knotted........................................ 184
II.3.2. Другие мутации листа.................................. 188
Глава II.4. Развитие корня (Л. А. Лутова)........................... 192
П.4.1. Радиальный рисунок корня................................ 193
II.4.2. Роль неподвижного центра в развитии корня ............. 195
П.4.3. Формирование клеток различного типа в тканях корня .... 197
II.4.4. Контроль морфогенеза корней............................ 200
Глава II.5. Генетика развития цветка (С. О. Шишкова)................ 201
II.5.1. Мутации арабидопсиса, влияющие на время индукции цветения 204
II.5.2. Гены идентичности цветковых меристем.................. 212
II.5.3. Молекулярная характеристика генов, контролирующих иден-
тичность цветковой меристемы................................. 219
II.5.4. Генетический контроль типа органов цветка.............. 226
II.5.5. Молекулярный анализ генов, контролирующих тип органов
цветка....................................................... 235
II.5.6. Гены с MADS-боксом.................................... 240
II.5.7. Кадастровые гены...................................... 243
II.5.8. Активация и регуляция генов, контролирующих тип органов
цветка....................................................... 245
II.5.9. Растения, трансгенные по генам типа органов цветка .... 249
Заключение ......................................................... 253
Литература.......................................................... 255
ЧАСТЬ Ш. СИГНАЛЬНАЯ РЕГУЛЯЦИЯ РАЗВИТИЯ РАСТЕНИЙ . . 256
Глава III.I. Биосинтез и механизм действия гормонов (Л. А. Лутова) . . . 257
III. 1.1. Ауксины............................................... 258
III . 1.2. Цитокинины........................................... 283
II I. 1.3. Гиббереллины......................................... 292
II 1.1.4. Абсцизовая кислота.................................... 302
III. 1.5. Этилен............................................... 310
Глава III.2. Генетический контроль фотоморфогенеза (О. Н.Тиходеев) . . 320
III.2 .1. Генетический контроль собственно фотоморфогенеза .... 321
III .2.2. Генетический контроль фототропизма................... 338
Ш.2.3. Общая схема биологических ответов на освещение.. 339
Заключение .......................................................... 340
Литература........................................................... 343
ЧАСТЬ IV. МУТУАЛИСТИЧЕСКИЕ СИМБИОЗЫ (генетическая инте-
грация растений и микроорганизмов) (Н. А. Проворов, И. А. Тихоно-
вич) .................................................... 344
Глава IV. 1. Сигнальные взаимодействия............................... 347
IV . 1.1. Действие растительных сигналов на микросимбионтов . . . 348
IV. 1.2. Действие микробных сигналов на растение............... 351
537
IV . 1.3. Поверхностные взаимодействия микробных и растительных
клеток.................................................... 355
I V. 1.4. Диалог симбионтов с защитными системами хозяина .... 356
IV . 1.5. Авторегуляция образования клубеньков .............. 359
Глава IV.2. Морфогенез симбиотических структур..................... 361
IV. 2.1. Бобово-ризобиальный симбиоз......................... 361
IV.2 .2. Микориза............................................ 369
Глава IV. 3. Метаболическая интеграция партнеров................... 375
IV .3.1. Бобово-ризобиальный симбиоз......................... 375
I V.3.2. Микориза............................................ 384
Заключение ........................................................ 386
Литература......................................................... 387
ЧАСТЬ V. ВЗАИМОДЕЙСТВИЕ РАСТЕНИЙ С АГРОБАКТЕРИЯМИ:
КОНЦЕПЦИЯ ГЕНЕТИЧЕСКОЙ КОЛОНИЗАЦИИ (Л. А. Лугова) 388
Глава V.I. Характеристика опухолей, индуцируемых агробактериями . . 388
Глава V.2. Индукция корончатых галлов.............................. 395
V. 2.1. Круг хозяев.......................................... 396
V.2 .2. Регенерация растений из опухолевых клеток............ 397
V.2. 3. Онкогенные плазмиды.................................. 397
V.2 .4. Опины и концепция «генетической колонизации»......... 400
V. 2.5. Структура Т-ДНК и ее перенос в растения.............. 407
V.2 .6. Экспрессия генов Т-ДНК в растениях................... 419
Глава V.3. Экспрессия генов Т-ДНК Agrobacterium tumefaciens в транс-
генных растениях........................................... 422
V.3. I. Экспрессия генов Т-ДНК Ri-плазмид Agrobacterium rhizogenes
в трансгенных растениях табака............................ 428
V.3.2 . Происхождение онкогенов Т-ДНК агробактерий........... 432
Заключение......................................................... 433
Литература......................................................... 435
ЧАСТЬ VI. МОЛЕКУЛЯРНАЯ ГЕНЕТИКА ВЗАИМОДЕЙСТВИЯ ВЫС-
ШИХ РАСТЕНИЙ С ФИТОПАТОГЕННЫМИ МИКРООРГА-
НИЗМАМИ (Л. Т. Ходжайова) .................................... 437
Глава V1.1. Разнообразие фитопатогенных микроорганизмов............ 439
Глава VI.2. Распознавание растения и проникновение патогена... 442
Глава VI. 3. Неспецифические факторы патогенности бактерий и грибов 446
VI. 3.1. Гидролитические ферменты............................ 446
VI .3.2. Неспецифические токсины патогенов................... 447
Глава VI.4. Видовой иммунитет и факторы, ответственные за его формиро-
вание ..................................................... 452
VI. 4.1. Структурные барьеры и пищевая пригодность растений . . . 453
VI.4 .2. Неспецифические токсины растений и устойчивость к патоге-
нам ...................................................... 456
Глава VI. 5. Специфическая устойчивость и восприимчивость растений . 463
VI.5. 1. Хозяин-специфичные токсины (ХСТ) грибов.............. 464
VI.5 .2. Реакция сверхчувствительности (СВЧ)................. 469
VI. 5.3. Запрограммированная гибель клеток................... 509
538
Глава VI. 6. Системный приобретенный иммунитет растений....... 516
VI.6 .1. Молекулярные маркеры SAR-реакции............... 516
VI.6. 2. Индукторы SAR-реакции........................... 517
VI.6.3 . Мутанты растений с нарушениями SAR-реакции...... 521
Глава VI. 7. Регуляторные элементы и транскрипционные факторы, ответ-
ственные за индукцию генов при реакциях сверхчувствительности
н системного иммунитета................................... 525
Заключение.................................................... 528
Литература.................................................... 530
ЗАКЛЮЧЕНИЕ.................................................... 531
Научное издание
Людмила Алексеевна Лугова,
Николай Александрович Проворов,
Олег Николаевич Тиходеев,
Игорь Анатольевич Тихонович,
Лола Тельмановна Ходжайова,
Светлана Олеговна Шишкова
ГЕНЕТИКА РАЗВИТИЯ РАСТЕНИЙ
Редактор издательства И. Л. Песенко
Художник Л. А. Яценко
Технический редактор Е. И. Егорова
Корректоры Л. М. Бова, О. И. Буркова, Ю. Б. Григорьева, Н. И. Журавлева
и И. А. Крайнева
Компьютерная верстка Е. М. Сальниковой
Лицензия № 020297 от 23 июня 1997 г.
Сдано в набор 30.03.2000. Подписано к печати 30.06.2000. Формат 60 х 90 У^.
Бумага офсетная. Гарнитура Таймс. Печать офсетная. Усл. печ. л. 34.5.
Уч.-изд. л. 38.3. Тираж 1000 экз. Тип. зак. № 3167. С 139
Санкт-Петербургская издательская фирма «Наука» РАН
199034, Санкт-Петербург, Менделеевская лин., 1
Санкт-Петербургская типография «Наука» РАН
199034, Санкт-Петербург, 9 лин., 12